ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПРЕДСТАВЛЕННЫЙ В ЭЛЕКТРОННОМ ВИДЕ
Перечень последовательностей с названием файла “4244PCT_sequence_listing.txt”, созданный 13 июня 2013 года, и размером 1499 килобайт подается в машиночитаемой форме одновременно с настоящим описанием. Перечень последовательностей является частью настоящего описания и включен в данный документ посредством ссылки во всей своей полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее раскрытие относится к области молекулярной биологии. Предусматриваются новые гены, которые кодируют пестицидные белки. Эти пестицидные белки и последовательности нуклеиновой кислоты, которые их кодируют, применимы в приготовлении пестицидных составов и в получении трансгенных растений, устойчивых к вредителям.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Биологический контроль насекомых-вредителей, имеющих сельскохозяйственное значение, с применением микробного агента, такого как грибы, бактерии или другие виды насекомых, представляет не оказывающую негативного влияния на окружающую среду и коммерчески привлекательную альтернативу синтетическим химическим пестицидам. В целом можно сказать, что применение биопестицидов приводит к меньшему риску загрязнения и неблагоприятных воздействий на окружающую среду, и биопестициды обеспечивают большую специфичность по отношению к мишени, чем та, которая характерна для традиционных химических инсектицидов широкого спектра действия. Кроме того, зачастую производство биопестицидов стоит дешевле и, вследствие этого, улучшается экономически эффективный выход продукции для широкого спектра сельскохозяйственных культур.
Определенные виды микроорганизмов из рода Bacillus, как известно, обладают пестицидной активностью против ряда насекомых-вредителей, в том числе Lepidoptera, Diptera, Coleoptera, Hemiptera и других. Bacillus thuringiensis (Bt) и Bacillus popilliae входят в число наиболее успешных средств биологического контроля, обнаруженных к настоящему времени. Патогенность в отношении насекомых также приписывалась штаммам B. larvae, B. lentimorbus, B. sphaericus и B. cereus. Микробные инсектициды, в частности полученные от штаммов Bacillus, сыграли важную роль в сельском хозяйстве как альтернатива химическому контролю вредителей.
Были разработаны культурные растения с улучшенной устойчивостью к насекомым при помощи генной инженерии культурных растений для выработки пестицидных белков от Bacillus. Например, с помощью генной инженерии были разработаны растения кукурузы и хлопчатника для выработки пестицидных белков, выделенных из штаммов Bt. Эти сельскохозяйственные культуры, разработанные при помощи генной инженерии, в настоящее время широко применяются в сельском хозяйстве и предоставляют фермеру не оказывающую негативного влияния на окружающую среду альтернативу традиционным способам контроля насекомых. В то время как они были признаны очень коммерчески успешными, эти разработанные при помощи генной инженерии устойчивые к насекомым культурные растения обеспечивают устойчивость только к узкому диапазону экономически важных насекомых-вредителей. В некоторых случаях, насекомые могут развивать устойчивость к различным инсектицидным соединениям, что повышает необходимость в идентификации альтернативных средств биологического контроля для контроля вредителей.
Соответственно, остается необходимость в новых пестицидных белках с различными диапазонами инсектицидной активности против насекомых-вредителей, например, инсектицидных белках, которые активны против ряда насекомых из отряда Lepidoptera и отряда Coleoptera, в том числе, без ограничения, насекомых-вредителей, которые развили устойчивость к существующим инсектицидам.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Предусматриваются композиции и способы обеспечения пестицидной активности у бактерий, растений, растительных клеток, тканей и семян. Композиции включают молекулы нуклеиновой кислоты, кодирующие последовательности пестицидных и инсектицидных полипептидов, векторы, содержащие такие молекулы нуклеиновой кислоты, и клетки-хозяева, содержащие векторы. Композиции также включают последовательности пестицидных полипептидов и антитела к таким полипептидам. Последовательности нуклеиновой кислоты можно применять в ДНК-конструкциях или кассетах экспрессии для трансформации и экспрессии в организмах, в том числе микроорганизмах и растениях. Нуклеотидные или аминокислотные последовательности могут представлять собой синтетические последовательности, которые были разработаны для экспрессии в организме, в том числе, без ограничения, микроорганизме или растении. Композиции также включают трансформированные бактерии, растения, растительные клетки, ткани и семена.
В частности, предусматриваются выделенные или рекомбинантные молекулы нуклеиновой кислоты, кодирующие полипептиды инсектицидный белок-1A Alcaligenes и инсектицидный белок-1B Alcaligenes (AfIP-1A и AfIP-1B), в том числе аминокислотные замены, делеции, вставки, и их фрагменты, и их комбинации. Дополнительно, охватываются аминокислотные последовательности, соответствующие полипептидам AfIP-1A и AfIP-1B. Предусматриваются выделенная или рекомбинантная молекула нуклеиновой кислоты, способная кодировать полипептид AfIP-1A с SEQ ID NO: 2, а также аминокислотные замены, делеции, вставки, его фрагменты и его комбинации. Также предусматриваются выделенная или рекомбинантная молекула нуклеиновой кислоты, способная кодировать полипептид AfIP-1B с SEQ ID NO: 4, а также аминокислотные замены, делеции, вставки, его фрагменты и его комбинации. Также охватываются последовательности нуклеиновой кислоты, которые комплементарны последовательности нуклеиновой кислоты согласно вариантам осуществления или которые гибридизуются с последовательностью согласно вариантам осуществления. Также предусматриваются выделенные или рекомбинантные полипептиды AfIP-1A с SEQ ID NO: 2, а также аминокислотные замены, делеции, вставки, их фрагменты и их комбинации. Также предусматриваются выделенные или рекомбинантные полипептиды AfIP-1B с SEQ ID NO: 4, а также аминокислотные замены, делеции, вставки, их фрагменты и их комбинации.
Предусматриваются способы получения полипептидов и применения данных полипептидов для контроля или уничтожения чешуекрылых, жесткокрылых, нематодных, грибковых, полужесткокрылых и/или двукрылых вредителей. Трансгенные растения согласно вариантам осуществления экспрессируют одну или несколько пестицидных последовательностей, раскрытых в данном документе. В различных вариантах осуществления трансгенное растение дополнительно содержит один или несколько дополнительных генов для устойчивости к насекомым, например, один или несколько дополнительных генов для контроля жесткокрылых, чешуекрылых, полужесткокрылых или нематодных вредителей. Специалисту в данной области техники будет понятно, что трансгенное растение может содержать какой-либо ген, обеспечивающий агрономический признак, представляющий интерес.
Также включены способы выявления нуклеиновых кислот и полипептидов согласно вариантам осуществления в образце. Предусматривается набор для выявления присутствия полипептида AfIP-1A и/или AfIP-1B или выявления присутствия нуклеотидной последовательности, кодирующей полипептид AfIP-1A и/или AfIP-1B, в образце. Набор может предусматриваться вместе со всеми реагентами и контрольными образцами, необходимыми для проведения способа выявления предполагаемого средства, а также с инструкциями для применения.
Композиции и способы согласно вариантам осуществления применимы для получения организмов с улучшенной устойчивостью или переносимостью вредителей. Эти организмы и композиции, содержащие организмы, подходят для сельскохозяйственных целей. Композиции согласно вариантам осуществления также применимы для выработки измененных или улучшенных белков, которые обладают пестицидной активностью, или для выявления присутствия полипептидов AfIP-1A и AfIP-1B или нуклеиновых кислот в продуктах или организмах.
Настоящим раскрытием охватываются следующие варианты осуществления.
1. Рекомбинантная молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1A.
2. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 1, где полипептид AfIP-1A получен от штамма Alcaligenes faecalis.
3. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 2, где штамм Alcaligenes faecalis представляет собой DDMC P4G7, депонированный под № доступа NRRL B-50625.
4. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 1, 2 или 3, где полипептид AfIP-1A содержит аминокислотный мотив, представленный положениями 100-107 из SEQ ID NO: 257.
5. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 4, где полипептид AfIP-1A дополнительно содержит какой-либо один или несколько аминокислотных мотивов, представленных положениями 15-26 из SEQ ID NO: 257, положениями 33-53 из SEQ ID NO: 257 и положениями 71-84 из SEQ ID NO: 257.
6. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4 или 5, где полипептид AfIP-1A по меньшей мере на 80% идентичен аминокислотной последовательности c SEQ ID NO: 2.
7. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5 или 6, где полипептид AfIP-1A по меньшей мере на 80% идентичен аминокислотной последовательности c SEQ ID NO: 2 и содержит аминокислотный мотив, представленный положениями 100-107 из SEQ ID NO: 257.
8. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 7, где полипептид AfIP-1A дополнительно содержит какой-либо один или несколько аминокислотных мотивов, представленных положениями 15-26 из SEQ ID NO: 257, положениями 33-53 из SEQ ID NO: 257, положениями 71-84 из SEQ ID NO: 257 и положениями 100-107 из SEQ ID NO: 257.
9. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5, 6, 7 или 8, где полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 255, где Xaa в положении 6 представляет собой Ile или Thr; Xaa в положении 7 представляет собой Ala или Val; Xaa в положении 9 представляет собой Glu или Gly; Xaa в положении 13 представляет собой Ile или Val; Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr; Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr; Xaa в положении 23 представляет собой Thr или Ala; Xaa в положении 24 представляет собой Ile или Leu; Xaa в положении 30 представляет собой Asn или Ser; Xaa в положении 33 представляет собой Val или Ile; Xaa в положении 35 представляет собой Gly или Asn; Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp; Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr; Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr; Xaa в положении 41 представляет собой Gly, Cys или Gln; Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr; Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp; Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp; Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp; Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 47 представляет собой Gly, Leu или Phe; Xaa в положении 48 представляет собой Asp, Asn, Leu или Phe; Xaa в положении 49 представляет собой Lys, Leu или Phe; Xaa в положении 50 представляет собой Asp, Leu или Phe; Xaa в положении 51 представляет собой Lys, Leu или Phe; Xaa в положении 52 представляет собой Glu, Leu или Phe; Xaa в положении 53 представляет собой Ile, Leu или Phe; Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe; Xaa в положении 55 представляет собой Pro, Leu или Phe; Xaa в положении 56 представляет собой Ser или Leu; Xaa в положении 57 представляет собой Gln, Glu, Leu или Phe; Xaa в положении 58 представляет собой Ile, Val, Leu или Phe; Xaa в положении 60 представляет собой Gly, Leu или Phe; Xaa в положении 61 представляет собой Thr, Ile или Phe; Xaa в положении 62 представляет собой Ile, Val, Leu или Phe; Xaa в положении 64 представляет собой Lys, Glu, Leu или Phe; Xaa в положении 65 представляет собой Asp, Leu или Phe; Xaa в положении 67 представляет собой Asp или Glu; Xaa в положении 68 представляет собой Ser или Thr; Xaa в положении 73 представляет собой Ser или Ala; Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr; Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr; Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr; Xaa в положении 96 представляет собой Val или Ile; Xaa в положении 101 представляет собой Trp, Phe или Tyr; Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val; Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr; Xaa в положении 111 представляет собой Asp или Asn; Xaa в положении 113 представляет собой Leu или Ser; Xaa в положении 115 представляет собой Val или Ile; Xaa в положении 116 представляет собой Lys или Glu; Xaa в положении 120 представляет собой Asn или Lys; Xaa в положении 121 представляет собой Tyr, Leu или Phe; Xaa в положении 122 представляет собой Thr, Leu или Phe; Xaa в положении 123 представляет собой Val, Leu, Phe или Asn; Xaa в положении 124 представляет собой Ile, Ser, Leu или Phe; Xaa в положении 125 представляет собой Lys, Leu, Phe или Met; Xaa в положении 126 представляет собой Lys, Leu или Phe; Xaa в положении 128 представляет собой Gly, Leu или Phe; Xaa в положении 129 представляет собой Gly, Leu или Phe; Xaa в положении 130 представляет собой Ser, Leu или Phe; Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr; Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp; Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr; Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; и Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr; и где 1-14 аминокислот, необязательно, удалены с N-конца полипептида.
10. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5, 6, 7 или 8, где полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 256, где Xaa в положении 6 представляет собой Ile или Thr; Xaa в положении 7 представляет собой Ala, Met или Val; Xaa в положении 8 представляет собой Thr или Asp; Xaa в положении 9 представляет собой Glu, Leu или Gly; Xaa в положении 10 представляет собой Glu или Asn; Xaa в положении 11 представляет собой Ser или Val; Xaa в положении 12 представляет собой Lys или Glu; Xaa в положении 13 представляет собой Ile или Val; Xaa в положении 14 представляет собой Arg или Gln; Xaa в положении 16 представляет собой Tyr или Gln; Xaa в положении 17 представляет собой Ala или Ser; Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr; Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr; Xaa в положении 23 представляет собой Thr, Glu или Ala; Xaa в положении 24 представляет собой Ile или Leu; Xaa в положении 26 представляет собой Val или Ser; Xaa в положении 27 представляет собой Val или Glu; Xaa в положении 29 представляет собой Ser или Met; Xaa в положении 30 представляет собой Asn, Asp или Ser; Xaa в положении 31 представляет собой Phe или Ile; Xaa в положении 32 представляет собой Lys или Glu; Xaa в положении 33 представляет собой Val или Ile; Xaa в положении 34 представляет собой Glu или Lys; Xaa в положении 35 представляет собой Gly или Asn; Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp; Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr; Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr; Xaa в положении 41 представляет собой Gly, Cys или Gln; Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr; Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp; Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp; Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp; Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 47 представляет собой Gly, Leu или Phe; Xaa в положении 48 представляет собой Asp, Asn, Leu или Phe; Xaa в положении 49 представляет собой Lys, Leu или Phe; Xaa в положении 50 представляет собой Asp, Ser, Leu или Phe; Xaa в положении 51 представляет собой Lys, Asn, Leu или Phe; Xaa в положении 52 представляет собой Glu, Leu или Phe; Xaa в положении 53 представляет собой Ile, Leu или Phe; Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe; Xaa в положении 55 представляет собой Pro, Ser, Leu или Phe; Xaa в положении 56 представляет собой Ser, Asp или Leu; Xaa в положении 57 представляет собой Gln, Thr, Glu, Leu или Phe; Xaa в положении 58 представляет собой Ile, Val, Leu или Phe; Xaa в положении 60 представляет собой Gly, Lys, Leu или Phe; Xaa в положении 61 представляет собой Thr, Ile или Phe; Xaa в положении 62 представляет собой Ile, Lys, Val, Leu или Phe; Xaa в положении 64 представляет собой Lys, Ser, Glu, Leu или Phe; Xaa в положении 65 представляет собой Asp, Ser, Leu или Phe; Xaa в положении 66 представляет собой Glu или Gly; Xaa в положении 67 представляет собой Asp, Thr или Glu; Xaa в положении 68 представляет собой Ser, Lys или Thr; Xaa в положении 69 представляет собой Tyr или Ser; Xaa в положении 70 представляет собой Thr или Lys; Xaa в положении 73 представляет собой Ser или Ala; Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr; Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr; Xaa в положении 77 представляет собой Glu или Ala; Xaa в положении 78 представляет собой Asn или Asp; Xaa в положении 79 представляет собой Ala или Thr; Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr; Xaa в положении 86 представляет собой Gly или Lys; Xaa в положении 88 представляет собой Ser или Glu; Xaa в положении 89 представляет собой Leu или Ile; Xaa в положении 91 представляет собой Asp или His; Xaa в положении 92 представляет собой Gly или Asp; Xaa в положении 95 представляет собой Leu или Trp; Xaa в положении 96 представляет собой Val, Leu или Ile; Xaa в положении 97 представляет собой Phe или Ala; Xaa в положении 98 представляет собой Glu или Thr; Xaa в положении 100 представляет собой Tyr или Lys; Xaa в положении 101 представляет собой Trp, Phe или Tyr; Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val; Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr; Xaa в положении 106 представляет собой Ser или Ala; Xaa в положении 111 представляет собой Asp, His или Asn; Xaa в положении 112 представляет собой Glu или Ser; Xaa в положении 113 представляет собой Leu или Ser; Xaa в положении 114 представляет собой Thr или Ser; Xaa в положении 115 представляет собой Val или Ile; Xaa в положении 116 представляет собой Lys, Thr или Glu; Xaa в положении 117 представляет собой Asp или Glu; Xaa в положении 118 представляет собой Lys или Asp; Xaa в положении 119 представляет собой Glu или Asn; Xaa в положении 120 представляет собой Asn или Lys; Xaa в положении 121 представляет собой Tyr, Leu или Phe; Xaa в положении 122 представляет собой Thr, Lys, Leu или Phe; Xaa в положении 123 представляет собой Val, Ile, Leu, Phe или Asn; Xaa в положении 124 представляет собой Ile, Ser, Asp, Leu или Phe; Xaa в положении 125 представляет собой Lys, Leu, Phe или Met; Xaa в положении 126 представляет собой Lys, Glu, Leu или Phe; Xaa в положении 128 представляет собой Gly, Leu или Phe; Xaa в положении 129 представляет собой Gly, Asn, Leu или Phe; Xaa в положении 130 представляет собой Ser, Ile, Leu или Phe; Xaa в положении 131 представляет собой Pro или Ser; Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr; Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp; Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr; Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr; Xaa в положении 142 представляет собой Val или Cys; Xaa в положении 143 представляет собой Val или Ile; Xaa в положении 145 представляет собой Lys или Val; и Xaa в положении 146 представляет собой Ser или Gly; и где 1-14 аминокислот, необязательно, удалены с N-конца полипептида.
11. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5, 6, 7 или 8, где полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 257, где Xaa в положении 6 представляет собой Ile, Thr, Leu, Met, Val или Ser; Xaa в положении 7 представляет собой Ala, Met, Val, Leu, Ile или Gly; Xaa в положении 8 представляет собой Thr, Asp, Ser или Glu; Xaa в положении 9 представляет собой Glu, Leu, Gly, Asp, Ala, Ile, Val или Met; Xaa в положении 10 представляет собой Glu, Asn, Asp или Gln; Xaa в положении 11 представляет собой Ser, Val, Thr, Ile, Leu или Met; Xaa в положении 12 представляет собой Lys, Glu, Arg или Asp; Xaa в положении 13 представляет собой Ile, Val, Leu или Met; Xaa в положении 14 представляет собой Arg, Gln, Lys или Asn; Xaa в положении 16 представляет собой Tyr, Gln, Trp, Phe или Asn; Xaa в положении 17 представляет собой Ala, Ser, Gly или Thr; Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr; Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr; Xaa в положении 23 представляет собой Thr, Glu, Ala, Ser, Asp или Gly; Xaa в положении 24 представляет собой Ile, Leu, Val или Met; Xaa в положении 26 представляет собой Val, Ser, Ile, Leu, Met или Thr; Xaa в положении 27 представляет собой Val, Glu, Ile, Leu, Met или Asp; Xaa в положении 29 представляет собой Ser, Met, Thr, Ile, Leu или Val; Xaa в положении 30 представляет собой Asn, Asp, Ser, Glu, Gln или Thr; Xaa в положении 31 представляет собой Phe, Ile, Leu, Val или Met; Xaa в положении 32 представляет собой Lys, Glu, Arg или Asp; Xaa в положении 33 представляет собой Val, Ile, Leu или Met; Xaa в положении 34 представляет собой Glu, Lys, Asp или Arg; Xaa в положении 35 представляет собой Gly или Asn; Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp; Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr; Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr; Xaa в положении 41 представляет собой Gly, Cys или Gln; Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr; Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp; Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp; Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp; Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 47 представляет собой Gly, Leu или Phe; Xaa в положении 48 представляет собой Asp, Asn, Glu, Gln, Leu или Phe; Xaa в положении 50 представляет собой Asp, Ser, Glu, Thr, Leu или Phe; Xaa в положении 51 представляет собой Lys, Asn, Arg, Gln, Leu или Phe; Xaa в положении 52 представляет собой Glu, Leu или Phe; Xaa в положении 53 представляет собой Ile, Leu или Phe; Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe; Xaa в положении 55 представляет собой Pro, Ser, Thr, Leu или Phe; Xaa в положении 56 представляет собой Ser, Asp, Thr, Glu или Leu; Xaa в положении 57 представляет собой Gln, Thr, Glu, Asn, Ser, Asp, Leu или Phe; Xaa в положении 58 представляет собой Ile, Val, Leu, Met или Phe; Xaa в положении 60 представляет собой Gly, Lys, Ala или Arg; Xaa в положении 61 представляет собой Thr, Ile или Phe; Xaa в положении 62 представляет собой Ile, Lys, Val, Leu, Met, Arg или Phe; Xaa в положении 64 представляет собой Lys, Ser, Glu, Arg, Thr, Asp, Leu или Phe; Xaa в положении 65 представляет собой Asp, Ser, Glu, Thr, Leu или Phe; Xaa в положении 66 представляет собой Glu, Gly, Asp или Ala; Xaa в положении 67 представляет собой Asp, Thr, Glu или Ser; Xaa в положении 68 представляет собой Ser, Lys, Thr или Arg; Xaa в положении 69 представляет собой Tyr, Ser, Trp, Phe или Thr; Xaa в положении 70 представляет собой Thr, Lys, Ser или Arg; Xaa в положении 73 представляет собой Ser, Ala, Thr или Gly; Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr; Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr; Xaa в положении 77 представляет собой Glu, Ala, Asp или Gly; Xaa в положении 78 представляет собой Asn, Asp, Gln или Glu; Xaa в положении 79 представляет собой Ala, Thr, Gly или Ser; Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr; Xaa в положении 86 представляет собой Gly, Lys, Ala или Arg; Xaa в положении 88 представляет собой Ser, Glu, Thr или Asp; Xaa в положении 89 представляет собой Leu, Ile, Val или Met; Xaa в положении 91 представляет собой Asp, His или Glu; Xaa в положении 92 представляет собой Gly, Asp, Ala или Glu; Xaa в положении 95 представляет собой Leu, Trp, Ile, Val, Met, Phe или Tyr; Xaa в положении 96 представляет собой Val, Leu, Ile или Met; Xaa в положении 97 представляет собой Phe, Ala или Gly; Xaa в положении 98 представляет собой Glu, Thr, Asp или Ser; Xaa в положении 100 представляет собой Tyr, Lys, Trp или Arg; Xaa в положении 101 представляет собой Trp, Phe или Tyr; Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val; Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr; Xaa в положении 106 представляет собой Ser, Ala, Thr или Gly; Xaa в положении 111 представляет собой Asp, His, Asn, Glu или Gln; Xaa в положении 112 представляет собой Glu, Ser, Asp или Thr; Xaa в положении 113 представляет собой Leu, Ser, Ile, Val, Met или Thr; Xaa в положении 114 представляет собой Thr или Ser; Xaa в положении 115 представляет собой Val, Ile, Val или Met; Xaa в положении 116 представляет собой Lys, Thr, Glu, Arg, Ser или Asp; Xaa в положении 117 представляет собой Asp или Glu; Xaa в положении 118 представляет собой Lys, Asp, Arg или Glu; Xaa в положении 119 представляет собой Glu, Asn, Asp или Gln; Xaa в положении 120 представляет собой Asn, Lys, Asp или Arg; Xaa в положении 121 представляет собой Tyr, Leu или Phe; Xaa в положении 122 представляет собой Thr, Lys, Ser, Arg, Leu или Phe; Xaa в положении 123 представляет собой Val, Ile, Leu, Met, Phe или Asn; Xaa в положении 124 представляет собой Ile, Ser, Asp, Leu, Val Met, Thr, Glu или Phe; Xaa в положении 125 представляет собой Lys, Leu, Phe или Met; Xaa в положении 126 представляет собой Lys, Glu, Arg, Asp, Leu или Phe; Xaa в положении 128 представляет собой Gly, Leu или Phe; Xaa в положении 129 представляет собой Gly, Asn, Ala, Gln, Leu или Phe; Xaa в положении 130 представляет собой Ser, Ile, Thr, Leu, Val, Met или Phe; Xaa в положении 131 представляет собой Pro, Ser или Thr; Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr; Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp; Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr; Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr; Xaa в положении 142 представляет собой Val, Cys, Ile, Leu или Met; Xaa в положении 143 представляет собой Val, Ile; Leu или Met; Xaa в положении 145 представляет собой Lys, Val, Arg, Ile, Leu или Met; и Xaa в положении 146 представляет собой Ser, Gly, Thr или Ala; и где 1-14 аминокислот, необязательно, удалены с N-конца полипептида.
12. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11, где рекомбинантная молекула нуклеиновой кислоты содержит полинуклеотид с SEQ ID NO: 1 или SEQ ID NO: 93, его фрагмент или комплементарную ему последовательность.
13. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11, где полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 2 или SEQ ID NO: 94, или ее фрагмент.
14. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11, где рекомбинантная молекула нуклеиновой кислоты гибридизуется при жестких условиях с полинуклеотидом с SEQ ID NO: 1.
15. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11, где рекомбинантная молекула нуклеиновой кислоты содержит полинуклеотид с SEQ ID NO: 1 или SEQ ID NO: 93.
16. Трансгенное растение или его потомство, содержащие рекомбинантную молекулу нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15.
17. Трансгенное растение или его потомство, стабильно трансформированные рекомбинантной молекулой нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15.
18. Трансгенное растение согласно варианту осуществления 16 или 17, где трансгенное растение является однодольным.
19. Трансгенное растение согласно варианту осуществления 16 или 17, где трансгенное растение является двудольным.
20. Трансгенное растение согласно варианту осуществления 16, 17, 18 или 19, дополнительно содержащее один или несколько дополнительных трансгенных признаков.
21. Трансгенное растение согласно варианту осуществления 20, где один или несколько дополнительных трансгенных признаков выбраны из устойчивости к насекомым, устойчивости к гербицидам, устойчивости к грибам, устойчивости к вирусам или переносимости стрессов, устойчивости к заболеваниям, мужской стерильности, силы стебля, повышенной урожайности, модифицированных видов крахмала, улучшенного профиля масел, сбалансированного содержания аминокислот, высокого содержания лизина или метионина, повышенной усвояемости, улучшенного качества волокон и переносимости засухи.
22. Кассета экспрессии, содержащая рекомбинантную молекулу нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 и одну или несколько регуляторных последовательностей, функционально связанных с ней и управляющих экспрессией полипептида AfIP-1A.
23. Трансгенное растение, содержащее кассету экспрессии согласно варианту осуществления 22.
24. Трансгенная растительная клетка, содержащая кассету экспрессии согласно варианту осуществления 22.
25. Семя, зерно или продукт их переработки из трансгенного растения согласно варианту осуществления 23 или его потомства, где семя, зерно или продукт их переработки содержат рекомбинантную молекулу нуклеиновой кислоты.
26. Семя согласно варианту осуществления 25, где на семя было нанесено одно или несколько средств обработки семян.
27. Семя согласно варианту осуществления 26, где одно или несколько средств обработки семян выбраны из гербицида, инсектицида, фунгицида, ингибитора прорастания, усилителя прорастания, регулятора роста растения, бактерицида и нематоцида.
28. Способ экспрессии в растении молекулы нуклеиновой кислоты, кодирующей полипептид AfIP-1A, причем способ включает получение растения, способного экспрессировать молекулы нуклеиновой кислоты, кодирующие полипептид AfIP-1A, из трансформированной растительной клетки, содержащей кассету экспрессии согласно пункту 22.
29. Трансгенное растение, полученное по способу согласно варианту осуществления 28.
30. Семя, зерно или продукт их переработки из трансгенного растения согласно варианту осуществления 29.
31. Трансгенное растение согласно варианту осуществления 29, где трансгенное растение дополнительно содержит один или несколько дополнительных трансгенных признаков.
32. Трансгенное растение согласно варианту осуществления 31, где один или несколько дополнительных трансгенных признаков выбраны из устойчивости к насекомым, устойчивости к гербицидам, устойчивости к грибам, устойчивости к вирусам, переносимости стрессов, устойчивости к заболеваниям, мужской стерильности, силы стебля, повышенной урожайности, модифицированных видов крахмала, улучшенного профиля масел, сбалансированного содержания аминокислот, высокого содержания лизина или метионина, повышенной усвояемости, улучшенного качества волокон, цветения, развития колоса и семени, улучшения эффективности использования азота, измененной реактивности в отношении азота, устойчивости к засухе или ее переносимости, устойчивости к холоду или его переносимости, устойчивости к солям или их переносимости и повышенной урожайности при стрессе.
33. Трансгенное растение согласно варианту осуществления 31 или 32, где трансгенное растение является однодольным.
34. Трансгенное растение согласно варианту осуществления 31 или 32, где трансгенное растение является двудольным.
35. Рекомбинантный полипептид AfIP-1A.
36. Рекомбинантный полипептид AfIP-1A согласно варианту осуществления 35, где полипептид AfIP-1A получен из штамма Alcaligenes faecalis.
37. Рекомбинантный полипептид AfIP-1A согласно варианту осуществления 36, где штамм Alcaligenes faecalis представляет собой DDMC P4G7, депонированный под № доступа NRRL B-50625.
38. Рекомбинантный полипептид AfIP-1A согласно варианту осуществления 35, 36 или 37, где полипептид AfIP-1A содержит аминокислотный мотив, представленный положениями 100-107 из SEQ ID NO: 257.
39. Рекомбинантный полипептид AfIP-1A согласно варианту осуществления 38, дополнительно содержащий какой-либо один или несколько аминокислотных мотивов, представленных положениями 15-26 из SEQ ID NO: 257, положениями 33-53 из SEQ ID NO: 257 и положениями 71-84 из SEQ ID NO: 257.
40. Рекомбинантный полипептид AfIP-1A согласно варианту осуществления 35, 36, 37, 38 или 39, где полипептид по меньшей мере на 80% идентичен аминокислотной последовательности с SEQ ID NO: 2.
41. Рекомбинантный полипептид AfIP-1A согласно варианту осуществления 35, 36, 37, 38 или 39, где полипептид по меньшей мере на 80% идентичен аминокислотной последовательности с SEQ ID NO: 2, и аминокислотный мотив представлен положениями 100-107 из SEQ ID NO: 257.
42. Рекомбинантный полипептид AfIP-1A согласно варианту осуществления 41, где полипептид AfIP-1A дополнительно содержит какой-либо один или несколько аминокислотных мотивов, представленных положениями 15-26 из SEQ ID NO: 257, положениями 33-53 из SEQ ID NO: 257 и положениями 71-84 из SEQ ID NO: 257.
43. Рекомбинантный полипептид AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41 или 42, где полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 255, где Xaa в положении 6 представляет собой Ile или Thr; Xaa в положении 7 представляет собой Ala или Val; Xaa в положении 9 представляет собой Glu или Gly; Xaa в положении 13 представляет собой Ile или Val; Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr, Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr; Xaa в положении 23 представляет собой Thr или Ala; Xaa в положении 24 представляет собой Ile или Leu; Xaa в положении 30 представляет собой Asn или Ser; Xaa в положении 33 представляет собой Val или Ile; Xaa в положении 35 представляет собой Gly или Asn; Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp; Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr; Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr; Xaa в положении 41 представляет собой Gly, Cys или Gln; Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr; Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp; Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp; Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp; Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 47 представляет собой Gly, Leu или Phe; Xaa в положении 48 представляет собой Asp, Asn, Leu или Phe; Xaa в положении 49 представляет собой Lys, Leu или Phe; Xaa в положении 50 представляет собой Asp, Leu или Phe; Xaa в положении 51 представляет собой Lys, Leu или Phe; Xaa в положении 52 представляет собой Glu, Leu или Phe; Xaa в положении 53 представляет собой Ile, Leu или Phe; Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe; Xaa в положении 55 представляет собой Pro, Leu или Phe; Xaa в положении 56 представляет собой Ser или Leu; Xaa в положении 57 представляет собой Gln, Glu, Leu или Phe; Xaa в положении 58 представляет собой Ile, Val, Leu или Phe; Xaa в положении 60 представляет собой Gly, Leu of Phe; Xaa в положении 61 представляет собой Thr, Ile или Phe; Xaa в положении 62 представляет собой Ile, Val, Leu или Phe; Xaa в положении 64 представляет собой Lys, Glu, Leu или Phe; Xaa в положении 65 представляет собой Asp, Leu или Phe; Xaa в положении 67 представляет собой Asp или Glu; Xaa в положении 68 представляет собой Ser или Thr; Xaa в положении 73 представляет собой Ser или Ala; Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr; Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr; Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr; Xaa в положении 96 представляет собой Val или Ile; Xaa в положении 101 представляет собой Trp, Phe или Tyr; Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val; Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr; Xaa в положении 111 представляет собой Asp или Asn; Xaa в положении 113 представляет собой Leu или Ser; Xaa в положении 115 представляет собой Val или Ile; Xaa в положении 116 представляет собой Lys или Glu; Xaa в положении 120 представляет собой Asn или Lys; Xaa в положении 121 представляет собой Tyr, Leu или Phe; Xaa в положении 122 представляет собой Thr, Leu или Phe; Xaa в положении 123 представляет собой Val, Leu, Phe или Asn; Xaa в положении 124 представляет собой Ile, Ser, Leu или Phe; Xaa в положении 125 представляет собой Lys, Leu, Phe или Met; Xaa в положении 126 представляет собой Lys, Leu или Phe; Xaa в положении 128 представляет собой Gly, Leu или Phe; Xaa в положении 129 представляет собой Gly, Leu или Phe; Xaa в положении 130 представляет собой Ser, Leu или Phe; Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr; Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp; Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr; Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; и Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr; и где 1-14 аминокислот, необязательно, удалены с N-конца полипептида.
44. Рекомбинантный полипептид AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41 или 42, где полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 256, где Xaa в положении 6 представляет собой Ile или Thr; Xaa в положении 7 представляет собой Ala, Met или Val; Xaa в положении 8 представляет собой Thr или Asp; Xaa в положении 9 представляет собой Glu, Leu или Gly; Xaa в положении 10 представляет собой Glu или Asn; Xaa в положении 11 представляет собой Ser или Val; Xaa в положении 12 представляет собой Lys или Glu; Xaa в положении 13 представляет собой Ile или Val; Xaa в положении 14 представляет собой Arg или Gln; Xaa в положении 16 представляет собой Tyr или Gln; Xaa в положении 17 представляет собой Ala или Ser; Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr; Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr; Xaa в положении 23 представляет собой Thr, Glu или Ala; Xaa в положении 24 представляет собой Ile или Leu; Xaa в положении 26 представляет собой Val или Ser; Xaa в положении 27 представляет собой Val или Glu; Xaa в положении 29 представляет собой Ser или Met; Xaa в положении 30 представляет собой Asn, Asp или Ser; Xaa в положении 31 представляет собой Phe или Ile; Xaa в положении 32 представляет собой Lys или Glu; Xaa в положении 33 представляет собой Val или Ile; Xaa в положении 34 представляет собой Glu или Lys; Xaa в положении 35 представляет собой Gly, Lys или Asn; Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp; Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr; Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr; Xaa в положении 41 представляет собой Gly, Cys или Gln; Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr; Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp; Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp; Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp; Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 47 представляет собой Gly, Leu или Phe; Xaa в положении 48 представляет собой Asp, Asn, Leu или Phe; Xaa в положении 49 представляет собой Lys, Leu или Phe; Xaa в положении 50 представляет собой Asp, Ser, Leu или Phe; Xaa в положении 51 представляет собой Lys, Asn, Leu или Phe; Xaa в положении 52 представляет собой Glu, Leu или Phe; Xaa в положении 53 представляет собой Ile, Leu или Phe; Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe; Xaa в положении 55 представляет собой Pro, Ser, Leu или Phe; Xaa в положении 56 представляет собой Ser, Asp или Leu; Xaa в положении 57 представляет собой Gln, Thr, Glu, Leu или Phe; Xaa в положении 58 представляет собой Ile, Val, Leu или Phe; Xaa в положении 60 представляет собой Gly, Lys, Leu или Phe; Xaa в положении 61 представляет собой Thr, Ile или Phe; Xaa в положении 62 представляет собой Ile, Lys, Val, Leu или Phe; Xaa в положении 64 представляет собой Lys, Ser, Glu, Leu или Phe; Xaa в положении 65 представляет собой Asp, Ser, Leu или Phe; Xaa в положении 66 представляет собой Glu или Gly; Xaa в положении 67 представляет собой Asp, Thr или Glu; Xaa в положении 68 представляет собой Ser, Lys или Thr; Xaa в положении 69 представляет собой Tyr или Ser; Xaa в положении 70 представляет собой Thr или Lys; Xaa в положении 73 представляет собой Ser или Ala; Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr; Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr; Xaa в положении 77 представляет собой Glu или Ala; Xaa в положении 78 представляет собой Asn или Asp; Xaa в положении 79 представляет собой Ala или Thr; Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr; Xaa в положении 86 представляет собой Gly или Lys; Xaa в положении 88 представляет собой Ser или Glu; Xaa в положении 89 представляет собой Leu или Ile; Xaa в положении 91 представляет собой Asp или His; Xaa в положении 92 представляет собой Gly или Asp; Xaa в положении 95 представляет собой Leu или Trp; Xaa в положении 96 представляет собой Val, Leu или Ile; Xaa в положении 97 представляет собой Phe или Ala; Xaa в положении 98 представляет собой Glu или Thr; Xaa в положении 100 представляет собой Tyr или Lys; Xaa в положении 101 представляет собой Trp, Phe или Tyr; Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val; Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr; Xaa в положении 106 представляет собой Ser или Ala; Xaa в положении 111 представляет собой Asp, His или Asn; Xaa в положении 112 представляет собой Glu или Ser; Xaa в положении 113 представляет собой Leu или Ser; Xaa в положении 114 представляет собой Thr или Ser; Xaa в положении 115 представляет собой Val или Ile; Xaa в положении 116 представляет собой Lys, Thr или Glu; Xaa в положении 117 представляет собой Asp или Glu; Xaa в положении 118 представляет собой Lys или Asp; Xaa в положении 119 представляет собой Glu или Asn; Xaa в положении 120 представляет собой Asn или Lys; Xaa в положении 121 представляет собой Tyr, Leu или Phe; Xaa в положении 122 представляет собой Thr, Lys, Leu или Phe; Xaa в положении 123 представляет собой Val, Ile, Leu, Phe или Asn; Xaa в положении 124 представляет собой Ile, Ser, Asp, Leu или Phe; Xaa в положении 125 представляет собой Lys, Leu, Phe или Met; Xaa в положении 126 представляет собой Lys, Glu, Leu или Phe; Xaa в положении 128 представляет собой Gly, Leu или Phe; Xaa в положении 129 представляет собой Gly, Asn, Leu или Phe; Xaa в положении 130 представляет собой Ser, Ile, Leu или Phe; Xaa в положении 131 представляет собой Pro или Ser; Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr; Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp; Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr; Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr; Xaa в положении 142 представляет собой Val или Cys; Xaa в положении 143 представляет собой Val или Ile; Xaa в положении 145 представляет собой Lys или Val; и Xaa в положении 146 представляет собой Ser или Gly; и где 1-14 аминокислот, необязательно, удалены с N-конца полипептида.
45. Рекомбинантный полипептид AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41 или 42, где полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 257, где Xaa в положении 6 представляет собой Ile, Thr, Leu, Met, Val или Ser; Xaa в положении 7 представляет собой Ala, Met, Val, Leu, Ile или Gly; Xaa в положении 8 представляет собой Thr, Asp, Ser или Glu; Xaa в положении 9 представляет собой Glu, Leu, Gly, Asp, Ala, Ile, Val или Met; Xaa в положении 10 представляет собой Glu, Asn, Asp или Gln; Xaa в положении 11 представляет собой Ser, Val, Thr, Ile, Leu или Met; Xaa в положении 12 представляет собой Lys, Glu, Arg или Asp; Xaa в положении 13 представляет собой Ile, Val, Leu или Met; Xaa в положении 14 представляет собой Arg, Gln, Lys или Asn; Xaa в положении 16 представляет собой Tyr, Gln, Trp, Phe или Asn; Xaa в положении 17 представляет собой Ala, Ser, Gly или Thr; Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr; Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr; Xaa в положении 23 представляет собой Thr, Glu, Ala, Ser, Asp или Gly; Xaa в положении 24 представляет собой Ile, Leu, Val или Met; Xaa в положении 26 представляет собой Val, Ser, Ile, Leu, Met или Thr; Xaa в положении 27 представляет собой Val, Glu, Ile, Leu, Met или Asp; Xaa в положении 29 представляет собой Ser, Met, Thr, Ile, Leu или Val; Xaa в положении 30 представляет собой Asn, Asp, Ser, Glu, Gln или Thr; Xaa в положении 31 представляет собой Phe, Ile, Leu, Val или Met; Xaa в положении 32 представляет собой Lys, Glu, Arg или Asp; Xaa в положении 33 представляет собой Val, Ile, Leu или Met; Xaa в положении 34 представляет собой Glu, Lys, Asp или Arg; Xaa в положении 35 представляет собой Gly или Asn; Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp; Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr; Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr; Xaa в положении 41 представляет собой Gly, Cys или Gln; Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr; Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp; Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp; Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp; Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 47 представляет собой Gly, Leu или Phe; Xaa в положении 48 представляет собой Asp, Asn, Glu, Gln, Leu или Phe; Xaa в положении 50 представляет собой Asp, Ser, Glu, Thr, Leu или Phe; Xaa в положении 51 представляет собой Lys, Asn, Arg, Gln, Leu или Phe; Xaa в положении 52 представляет собой Glu, Leu или Phe; Xaa в положении 53 представляет собой Ile, Leu или Phe; Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe; Xaa в положении 55 представляет собой Pro, Ser, Thr, Leu или Phe; Xaa в положении 56 представляет собой Ser, Asp, Thr, Glu, Leu; Xaa в положении 57 представляет собой Gln, Thr, Glu, Asn, Ser, Asp, Leu или Phe; Xaa в положении 58 представляет собой Ile, Val, Leu, Met или Phe; Xaa в положении 60 представляет собой Gly, Lys, Ala или Arg; Xaa в положении 61 представляет собой Thr, Ile или Phe; Xaa в положении 62 представляет собой Ile, Lys, Val, Leu, Met, Arg или Phe; Xaa в положении 64 представляет собой Lys, Ser, Glu, Arg, Thr, Asp, Leu или Phe; Xaa в положении 65 представляет собой Asp, Ser, Glu, Thr, Leu или Phe; Xaa в положении 66 представляет собой Glu, Gly, Asp или Ala; Xaa в положении 67 представляет собой Asp, Thr, Glu или Ser; Xaa в положении 68 представляет собой Ser, Lys, Thr или Arg; Xaa в положении 69 представляет собой Tyr, Ser, Trp, Phe или Thr; Xaa в положении 70 представляет собой Thr, Lys, Ser или Arg; Xaa в положении 73 представляет собой Ser, Ala, Thr или Gly; Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr; Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr; Xaa в положении 77 представляет собой Glu, Ala, Asp или Gly; Xaa в положении 78 представляет собой Asn, Asp, Gln или Glu; Xaa в положении 79 представляет собой Ala, Thr, Gly или Ser; Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr; Xaa в положении 86 представляет собой Gly, Lys, Ala или Arg; Xaa в положении 88 представляет собой Ser, Glu, Thr или Asp; Xaa в положении 89 представляет собой Leu, Ile, Val или Met; Xaa в положении 91 представляет собой Asp, His или Glu; Xaa в положении 92 представляет собой Gly, Asp, Ala или Glu; Xaa в положении 95 представляет собой Leu, Trp, Ile, Val, Met, Phe или Tyr; Xaa в положении 96 представляет собой Val, Leu, Ile или Met; Xaa в положении 97 представляет собой Phe, Ala или Gly; Xaa в положении 98 представляет собой Glu, Thr, Asp или Ser; Xaa в положении 100 представляет собой Tyr, Lys, Trp или Arg; Xaa в положении 101 представляет собой Trp, Phe или Tyr; Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val; Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr; Xaa в положении 106 представляет собой Ser, Ala, Thr или Gly; Xaa в положении 111 представляет собой Asp, His, Asn, Glu или Gln; Xaa в положении 112 представляет собой Glu, Ser, Asp или Thr; Xaa в положении 113 представляет собой Leu, Ser, Ile, Val, Met или Thr; Xaa в положении 114 представляет собой Thr или Ser; Xaa в положении 115 представляет собой Val, Ile, Val или Met; Xaa в положении 116 представляет собой Lys, Thr, Glu, Arg, Ser или Asp; Xaa в положении 117 представляет собой Asp или Glu; Xaa в положении 118 представляет собой Lys, Asp, Arg или Glu; Xaa в положении 119 представляет собой Glu, Asn, Asp или Gln; Xaa в положении 120 представляет собой Asn, Lys, Asp или Arg; Xaa в положении 121 представляет собой Tyr, Leu или Phe; Xaa в положении 122 представляет собой Thr, Lys, Ser, Arg, Leu или Phe; Xaa в положении 123 представляет собой Val, Ile, Leu, Met, Phe или Asn; Xaa в положении 124 представляет собой Ile, Ser, Asp, Leu, Val Met, Thr, Glu или Phe; Xaa в положении 125 представляет собой Lys, Leu, Phe или Met; Xaa в положении 126 представляет собой Lys, Glu, Arg, Asp, Leu или Phe; Xaa в положении 128 представляет собой Gly, Leu или Phe; Xaa в положении 129 представляет собой Gly, Asn, Ala, Gln, Leu или Phe; Xaa в положении 130 представляет собой Ser, Ile, Thr, Leu, Val, Met или Phe; Xaa в положении 131 представляет собой Pro, Ser или Thr; Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr; Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp; Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr; Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr; Xaa в положении 142 представляет собой Val, Cys, Ile, Leu или Met; Xaa в положении 143 представляет собой Val, Ile; Leu или Met; Xaa в положении 145 представляет собой Lys, Val, Arg, Ile, Leu или Met; и Xaa в положении 146 представляет собой Ser, Gly, Thr или Ala; и где 1-14 аминокислот, необязательно, удалены с N-конца полипептида.
46. Рекомбинантный полипептид AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 или 45, где полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 2 или SEQ ID NO: 94, или ее фрагмент.
47. Рекомбинантный полипептид AfIP-1A, содержащий аминокислотную последовательность с SEQ ID NO: 2 или SEQ ID NO: 94.
48. Рекомбинантный полипептид AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 или 45, где полипептид AfIP-1A кодируется полинуклеотидом с SEQ ID NO: 1 или SEQ ID NO: 93.
49. Рекомбинантный полипептид AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 47, 48 или 49, где полипептид AfIP-1A содержит одно или несколько свойств, выбранных из:
a) аминокислотного мотива, представленного положениями 15-26 из SEQ ID NO: 257;
b) аминокислотного мотива, представленного положениями 33-53 из SEQ ID NO: 257;
c) аминокислотного мотива, представленного положениями 71-84 из SEQ ID NO: 257;
d) аминокислотного мотива, представленного положениями 100-107 из SEQ ID NO: 257;
e) фунгицидной активности;
f) инсектицидной активности;
g) рассчитанного молекулярного веса от приблизительно 12 кДа до приблизительно 18 кДа.
50. Трансгенное растение, способное экспрессировать рекомбинантный полинуклеотид, кодирующий полипептид AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49.
51. Трансгенное растение согласно варианту осуществления 50, где трансгенное растение является однодольным.
52. Трансгенное растение согласно варианту осуществления 50, где трансгенное растение является двудольным.
53. Трансгенное растение согласно варианту осуществления 50, где трансгенное растение экспрессирует один или несколько дополнительных трансгенных признаков.
54. Композиция, содержащая пестицидно эффективное количество рекомбинантного полипептида AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49.
55. Композиция согласно варианту осуществления 54, дополнительно содержащая подходящий с точки зрения сельского хозяйства носитель.
56. Композиция согласно варианту осуществления 55, где носитель выбран из порошка, дуста, пеллет, гранул, распыляемого раствора, эмульсии, коллоидного вещества и раствора.
57. Композиция согласно варианту осуществления 56, дополнительно содержащая один или несколько гербицидов, инсектицидов или фунгицидов.
58. Композиция согласно варианту осуществления 57, где один или несколько инсектицидов представляют собой пестицидные белки.
59. Композиция согласно варианту осуществления 58, где один или несколько пестицидных белков выбраны из белка Cry1, белка Cry2, белка Cry3, белка Cry4, белка Cry5, белка Cry6, белка Cry7, белка Cry8, белка Cry9, белка Cry15, белка Cry22, белка Cry23, белка Cry32, белка Cry34, белка Cry35, белка Cry36, белка Cry37, белка Cry43, белка Cry46, белка Cry51, белка Cry55, бинарного токсина Cry, белка Cyt, токсина VIP, белка SIP, инсектицидной липазы, инсектицидной хитиназы и белка змеиного яда.
60. Способ контроля популяции гриба-вредителя, включающий приведение в контакт популяции гриба-вредителя с фунгицидно эффективным количеством рекомбинантного полипептида AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49.
61. Способ защиты растения от грибного вредителя, включающий экспрессию в растении или его клетке полинуклеотида, кодирующего пестицидно эффективное количество рекомбинантного полипептида AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49.
62. Рекомбинантная молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1B.
63. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 62, где молекула нуклеиновой кислоты получена от штамма Alcaligenes faecalis.
64. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 63, где штамм Alcaligenes faecalis представляет собой DDMC P4G7, депонированный под № доступа NRRL B-50625.
65. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 62, 63 или 64, где полипептид AfIP-1B содержит аминокислотный мотив, представленный положениями 358-365 из SEQ ID NO: 259.
66. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 65, где полипептид AfIP-1B дополнительно содержит какой-либо один или несколько аминокислотных мотивов, представленных положениями 105-115 из SEQ ID NO: 259, положениями 133-144 из SEQ ID NO: 259, положениями 177-184 из SEQ ID NO: 259 и положениями 511-520 из SEQ ID NO: 259.
67. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65 или 66, где полипептид AfIP-1B по меньшей мере на 90% идентичен аминокислотной последовательности с SEQ ID NO: 4.
68. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65 или 66, где полипептид AfIP-1B по меньшей мере на 90% идентичен аминокислотной последовательности с SEQ ID NO: 4, и аминокислотный мотив представлен положениями 358-365 из SEQ ID NO: 259.
69. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 68, где полипептид AfIP-1B дополнительно содержит какой-либо один или несколько аминокислотных мотивов, представленных положениями 105-115 из SEQ ID NO: 259, положениями 133-144 из SEQ ID NO: 259, положениями 177-184 из SEQ ID NO: 259 и положениями 511-520 из SEQ ID NO: 259.
70. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65, 66, 67, 68 или 69, где полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 258, где Xaa в положении 2 представляет собой Asp или Gly; Xaa в положении 12 представляет собой Met или Leu; Xaa в положении 34 представляет собой Ile или Leu; Xaa в положении 38 представляет собой Ile или Leu; Xaa в положении 42 представляет собой Glu или Asp; Xaa в положении 43 представляет собой Ile или Leu; Xaa в положении 53 представляет собой Tyr или Phe; Xaa в положении 55 представляет собой Tyr или Phe; Xaa в положении 71 представляет собой Gly или Cys; Xaa в положении 82 представляет собой Val или Met; Xaa в положении 86 представляет собой Val или Leu; Xaa в положении 94 представляет собой Tyr или Phe; Xaa в положении 97 представляет собой Ile или Leu; Xaa в положении 101 представляет собой Tyr или Phe; Xaa в положении 103 представляет собой Ile, Leu, Gly, Val, Trp, Phe, Thr, Cys, Glu или Arg; Xaa в положении 105 представляет собой Met, Gly, Val, Leu, Trp, Phe, Pro, Thr, Cys, Asn, Gln или Arg; Xaa в положении 106 представляет собой Ile или Leu; Xaa в положении 108 представляет собой Gly, Ala, Leu, Val, Ile, Met, Trp, Phe, Ser, Thr, Cys, Tyr, Asn, Gln, Asp, Lys или His; Xaa в положении 109 представляет собой Ile, Leu, Ala, Val, Leu, Met, Trp, Phe, Pro, Cys, Asn или Glu; Xaa в положении 110 представляет собой Glu, Gly, Ala, Val, Leu, Met, Trp, Ser, Thr, Cys, Tyr, Asp, Arg или His; Xaa в положении 111 представляет собой Tyr, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Thr, Cys, Asp, Glu, Lys, Arg или His; Xaa в положении 115 представляет собой Asp или Glu; Xaa в положении 119 представляет собой Val или Ala; Xaa в положении 134 представляет собой Ser или Leu; Xaa в положении 137 представляет собой Val, Phe, Ala, Leu, Trp, Pro, Ser, Cys, Asp, Glu или Arg; Xaa в положении 139 представляет собой Glu или Asp; Xaa в положении 141 представляет собой Phe, Val, Leu, Ile, Trp, Ser или Cys; Xaa в положении 144 представляет собой Ala или Val; Xaa в положении 148 представляет собой Ser, Phe или Thr; Xaa в положении 152 представляет собой Ile или Thr; Xaa в положении 155 представляет собой Asp или Glu; Xaa в положении 179 представляет собой Gly, Val, Trp, Ser, Cys или Arg; Xaa в положении 181 представляет собой Ile, Val или Leu; Xaa в положении 182 представляет собой Trp, Gly, Ala, Val, Leu, Met, Ser, Cys, Glu или Arg; Xaa в положении 188 представляет собой Val или Leu; Xaa в положении 196 представляет собой Lys или Glu; Xaa в положении 197 представляет собой Thr или Ser; Xaa в положении 201 представляет собой Trp, Cys или Phe; Xaa в положении 202 представляет собой Lys или Asn; Xaa в положении 203 представляет собой Tyr или Phe; Xaa в положении 208 представляет собой Glu или Asp; Xaa в положении 214 представляет собой Ile или Leu; Xaa в положении 220 представляет собой Ile или Leu; Xaa в положении 224 представляет собой Tyr или Phe; Xaa в положении 234 представляет собой Glu или Asp; Xaa в положении 235 представляет собой Val или Leu; Xaa в положении 270 представляет собой Ile или Val; Xaa в положении 296 представляет собой Lys или Glu; Xaa в положении 298 представляет собой Ala или Glu; Xaa в положении 299 представляет собой Glu или Gly; Xaa в положении 300 представляет собой Ile или Val; Xaa в положении 305 представляет собой Asp или Glu; Xaa в положении 308 представляет собой Lys или Asn; Xaa в положении 317 представляет собой Ala или Ser; Xaa в положении 323 представляет собой Glu или Asp; Xaa в положении 335 представляет собой Glu или Asp; Xaa в положении 343 представляет собой Asp или Glu; Xaa в положении 352 представляет собой Glu или Asp; Xaa в положении 359 представляет собой Glu, Gly, Ala, Val, Leu, Trp, Phe, Pro, Ser, Thr, Lys или Arg; Xaa в положении 360 представляет собой Asn, Gly, Val, Leu, Ile, Met, Phe, Pro, Thr, Asn, Asp, Lys, Arg или His; Xaa в положении 361 представляет собой Ser, Gly, Val, Leu или Glu; Xaa в положении 363 представляет собой Asp, Gly, Leu, Ile, Trp или Ser; Xaa в положении 364 представляет собой Val, Pro, Ser, Thr, Asn, Gln, Asp, Glu или Lys; Xaa в положении 365 представляет собой Leu, Gly, Ala, Val, Ile, Trp, Phe, Pro, Ser, Thr, Cys, Tyr, Gln, Asp, Glu, Arg или His; Xaa в положении 367 представляет собой Glu или Lys; Xaa в положении 368 представляет собой Gly или Asp; Xaa в положении 370 представляет собой Ile или Val; Xaa в положении 373 представляет собой Arg или Ser; Xaa в положении 374 представляет собой Asn или Lys; Xaa в положении 377 представляет собой Leu или Ile; Xaa в положении 384 представляет собой Thr или Ala; Xaa в положении 385 представляет собой Ile или Ser; Xaa в положении 388 представляет собой Asp или Glu; Xaa в положении 393 представляет собой Tyr или Phe; Xaa в положении 398 представляет собой Ala или Val; Xaa в положении 414 представляет собой Tyr или Phe; Xaa в положении 418 представляет собой Ile или Leu; Xaa в положении 419 представляет собой Ser или Asn; Xaa в положении 423 представляет собой Val или Leu; Xaa в положении 425 представляет собой Glu или Val; Xaa в положении 427 представляет собой Ile или Val; Xaa в положении 434 представляет собой Met или Thr; Xaa в положении 481 представляет собой Glu или Asp; Xaa в положении 495 представляет собой Asp или Glu; Xaa в положении 509 представляет собой Phe, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Cys, Tyr, Asn, Asp, Glu или Arg; Xaa в положении 512 представляет собой Asn, Ser, Gly, Ala, Leu, Met, Trp, Phe, Ser, Thr, Cys, Gln или Arg; Xaa в положении 514 представляет собой Glu, Gly, Ile, Asp или Arg; Xaa в положении 516 представляет собой Gly, Ala, Val, Met, Pro, Thr, Asn, Gln, Asp, Glu или Lys; Xaa в положении 519 представляет собой Leu, Gly, Ala, Val, Met, Phe, Pro, Tyr, Gln, Asp, Lys или Arg; Xaa в положении 526 представляет собой Val или Leu; Xaa в положении 530 представляет собой Ile или Leu; Xaa в положении 533 представляет собой Val или Ala; Xaa в положении 536 представляет собой Ile или Leu; Xaa в положении 538 представляет собой Tyr или Phe; Xaa в положении 543 представляет собой Tyr или Phe; Xaa в положении 544 представляет собой Lys или Arg; Xaa в положении 547 представляет собой Tyr или Phe; Xaa в положении 550 представляет собой Tyr или Phe; Xaa в положении 552 представляет собой Asn или Ser; Xaa в положении 558 представляет собой Phe или Leu; Xaa в положении 600 представляет собой Met или Val; Xaa в положении 602 представляет собой Met или Ile; Xaa в положении 607 представляет собой Asp или Gly; Xaa в положении 610 представляет собой Thr или Lys; Xaa в положении 612 представляет собой Ile или Thr; Xaa в положении 613 представляет собой Leu или Pro; Xaa в положении 615 представляет собой Asn или Asp; Xaa в положении 619 представляет собой Lys или Arg; Xaa в положении 625 представляет собой Tyr или Phe; Xaa в положении 629 представляет собой Lys или Asn; Xaa в положении 631 представляет собой Ile, Val или Leu; Xaa в положении 633 представляет собой Trp или Phe; Xaa в положении 646 представляет собой Gln или Arg; Xaa в положении 661 представляет собой Asn или Ser; Xaa в положении 683 представляет собой Thr или Ala; Xaa в положении 696 представляет собой Glu, Asp или Gln;; Xaa в положении 700 представляет собой Ser или Gly; и Xaa в положении 702 представляет собой Phe или Ser; и где 1-25 аминокислот, необязательно, удалены с C-конца полипептида.
71. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65, 66, 67, 68 или 69, где полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 4, где нативные аминокислоты в положениях 1-35 из SEQ ID NO: 4 замещены нативными аминокислотами из SEQ ID NO: 20 в соответствующем положении SEQ ID NO: 4.
72. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65, 66, 67, 68 или 69, где полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 259, где Xaa в положении 2 представляет собой Asp или Gly; Xaa в положении 12 представляет собой Met, Leu, Ile или Val; Xaa в положении 34 представляет собой Ile или Leu; Xaa в положении 38 представляет собой Ile или Leu; Xaa в положении 42 представляет собой Glu или Asp; Xaa в положении 43 представляет собой Ile или Leu; Xaa в положении 53 представляет собой Tyr или Phe; Xaa в положении 55 представляет собой Tyr или Phe; Xaa в положении 71 представляет собой Gly, Cys или Ala; Xaa в положении 82 представляет собой Val или Met; Xaa в положении 86 представляет собой Val или Leu; Xaa в положении 94 представляет собой Tyr или Phe; Xaa в положении 97 представляет собой Ile или Leu; Xaa в положении 101 представляет собой Tyr или Phe; Xaa в положении 103 представляет собой Ile, Leu, Gly, Val, Trp, Phe, Thr, Cys, Glu или Arg; Xaa в положении 105 представляет собой Met, Gly, Val, Leu, Trp, Phe, Pro, Thr, Cys, Asn, Gln или Arg; Xaa в положении 106 представляет собой Ile или Leu; Xaa в положении 108 представляет собой Gly, Ala, Leu, Val, Ile, Met, Trp, Phe, Ser, Thr, Cys, Tyr, Asn, Glu, Asp, Lys или His; Xaa в положении 109 представляет собой Ile, Leu, Ala, Val, Leu, Met, Trp, Phe, Pro, Cys, Asn или Glu; Xaa в положении 110 представляет собой Glu, Gly, Ala, Val, Leu, Met, Trp, Ser, Thr, Cys, Tyr, Asp, Arg или His; Xaa в положении 111 представляет собой Tyr, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Thr, Cys, Asp, Glu, Lys, Arg или His; Xaa в положении 115 представляет собой Asp или Glu; Xaa в положении 119 представляет собой Val, Ala, Ile или Leu; Xaa в положении 134 представляет собой Ser или Leu; Xaa в положении 137 представляет собой Val, Phe, Ala, Leu, Trp, Pro, Ser, Cys, Asp, Glu или Arg; Xaa в положении 139 представляет собой Glu или Asp; Xaa в положении 141 представляет собой Phe, Val, Leu, Ile, Trp, Ser или Cys; Xaa в положении 144 представляет собой Ala, Val, Gly, Ile, Leu или Met; Xaa в положении 148 представляет собой Ser, Phe, Thr или Trp; Xaa в положении 152 представляет собой Ile, Thr, Leu, Val, Met или Ser; Xaa в положении 155 представляет собой Asp или Glu; Xaa в положении 179 представляет собой Gly, Val, Trp, Ser, Cys или Arg; Xaa в положении 181 представляет собой Ile, Val, Met или Leu; Xaa в положении 182 представляет собой Trp, Gly, Ala, Val, Leu, Met, Ser, Cys, Glu или Arg; Xaa в положении 188 представляет собой Val или Leu; Xaa в положении 196 представляет собой Lys или Glu; Xaa в положении 197 представляет собой Thr или Ser; Xaa в положении 201 представляет собой Trp, Cys, Tyr или Phe; Xaa в положении 202 представляет собой Lys, Asn или Arg; Xaa в положении 203 представляет собой Tyr или Phe; Xaa в положении 208 представляет собой Glu или Asp; Xaa в положении 214 представляет собой Ile или Leu; Xaa в положении 220 представляет собой Ile или Leu; Xaa в положении 224 представляет собой Tyr или Phe; Xaa в положении 234 представляет собой Glu или Asp; Xaa в положении 235 представляет собой Val или Leu; Xaa в положении 270 представляет собой Ile, Val, Leu или Met; Xaa в положении 296 представляет собой Lys или Glu; Xaa в положении 298 представляет собой Ala, Glu, Gly или Asp; Xaa в положении 299 представляет собой Glu, Gly, Asp или Ala; Xaa в положении 300 представляет собой Ile, Val, Ile или Met; Xaa в положении 305 представляет собой Asp или Glu; Xaa в положении 308 представляет собой Lys или Asn; Xaa в положении 317 представляет собой Ala, Ser, Gly или Thr; Xaa в положении 323 представляет собой Glu или Asp; Xaa в положении 335 представляет собой Glu или Asp; Xaa в положении 343 представляет собой Asp или Glu; Xaa в положении 352 представляет собой Glu или Asp; Xaa в положении 359 представляет собой Glu, Gly, Ala, Val, Leu, Trp, Phe, Pro, Ser, Thr, Lys или Arg; Xaa в положении 360 представляет собой Asn, Gly, Val, Leu, Ile, Met, Phe, Pro, Thr, Asn, Asp, Lys, Arg или His; Xaa в положении 361 представляет собой Ser, Gly, Val, Leu или Glu; Xaa в положении 363 представляет собой Asp, Gly, Leu, Ile, Trp или Ser; Xaa в положении 364 представляет собой Val, Pro, Ser, Thr, Asn, Gln, Asp, Glu или Lys; Xaa в положении 365 представляет собой Leu, Gly, Ala, Val, Ile, Trp, Phe, Pro, Ser, Thr, Cys, Tyr, Gln, Asp, Glu, Arg или His; Xaa в положении 367 представляет собой Glu или Lys; Xaa в положении 368 представляет собой Gly или Asp; Xaa в положении 370 представляет собой Ile, Val, Leu или Met; Xaa в положении 373 представляет собой Arg или Ser; Xaa в положении 374 представляет собой Asn, Lys, Gln или Arg; Xaa в положении 377 представляет собой Leu, Ile, Val или Met; Xaa в положении 384 представляет собой Thr, Ala, Ser или Gly; Xaa в положении 385 представляет собой Ile, Ser, Leu, Val, Met или Thr; Xaa в положении 388 представляет собой Asp или Glu; Xaa в положении 393 представляет собой Tyr, Phe или Trp; Xaa в положении 398 представляет собой Ala или Val; Xaa в положении 414 представляет собой Tyr или Phe; Xaa в положении 418 представляет собой Ile или Leu; Xaa в положении 419 представляет собой Ser, Asn, Thr или Gln; Xaa в положении 423 представляет собой Val или Leu; Xaa в положении 425 представляет собой Glu или Val; Xaa в положении 427 представляет собой Ile или Val; Xaa в положении 434 представляет собой Met или Thr; Xaa в положении 481 представляет собой Glu или Asp; Xaa в положении 495 представляет собой Asp или Glu; Xaa в положении 509 представляет собой Phe, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Cys, Tyr, Asn, Asp, Glu или Arg; Xaa в положении 512 представляет собой Asn, Ser, Gly, Ala, Leu, Met, Trp, Phe, Ser, Thr, Cys, Gln или Arg; Xaa в положении 514 представляет собой Glu, Gly, Ile, Asp или Arg; Xaa в положении 516 представляет собой Gly, Ala, Val, Met, Pro, Thr, Asn, Gln, Asp, Glu или Lys; Xaa в положении 519 представляет собой Leu, Gly, Ala, Val, Met, Phe, Pro, Tyr, Gln, Asp, Lys или Arg; Xaa в положении 526 представляет собой Val или Leu; Xaa в положении 530 представляет собой Ile или Leu; Xaa в положении 533 представляет собой Val или Ala; Xaa в положении 536 представляет собой Ile или Leu; Xaa в положении 538 представляет собой Tyr, Phe или Trp; Xaa в положении 543 представляет собой Tyr или Phe; Xaa в положении 544 представляет собой Lys или Arg; Xaa в положении 547 представляет собой Tyr или Phe; Xaa в положении 550 представляет собой Tyr, Phe или Trp; Xaa в положении 552 представляет собой Asn, Ser, Gln или Thr; Xaa в положении 558 представляет собой Phe или Leu; Xaa в положении 600 представляет собой Met или Val; Xaa в положении 602 представляет собой Met, Ile, Leu или Val; Xaa в положении 607 представляет собой Asp или Gly; Xaa в положении 610 представляет собой Thr, Lys, Ser или Arg; Xaa в положении 612 представляет собой Ile или Thr; Xaa в положении 613 представляет собой Leu или Pro; Xaa в положении 615 представляет собой Asn или Asp; Xaa в положении 619 представляет собой Lys или Arg; Xaa в положении 625 представляет собой Tyr, Phe или Trp; Xaa в положении 629 представляет собой Lys или Asn; Xaa в положении 631 представляет собой Ile, Val, Leu или Met; Xaa в положении 633 представляет собой Trp или Phe; Xaa в положении 646 представляет собой Gln или Arg; Xaa в положении 661 представляет собой Asn или Ser; Xaa в положении 683 представляет собой Thr, Ala, Ser или Gly; Xaa в положении 696 представляет собой Glu, Asp или Gln; Xaa в положении 700 представляет собой Ser или Gly; и Xaa в положении 702 представляет собой Phe или Ser; и где 1-25 аминокислот, необязательно, удалены с C-конца полипептида.
73. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 70, где полипептид AfIP-1B дополнительно содержит одну или несколько аминокислотных замен нативной аминокислоты из SEQ ID NO: 20 в соответствующем положении SEQ ID NO: 4.
74. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 72, где полипептид AfIP-1B дополнительно содержит одну или несколько аминокислотных замен нативной аминокислоты из SEQ ID NO: 20 в соответствующем положении SEQ ID NO: 4.
75. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73, содержащая полинуклеотид с SEQ ID NO: 3 или SEQ ID NO: 75, его фрагмент или комплементарную ему последовательность.
76. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73, где полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 4 или SEQ ID NO: 76, или ее фрагмент.
77. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73, где рекомбинантная молекула нуклеиновой кислоты гибридизируется при жестких условиях с полинуклеотидом с SEQ ID NO: 3.
78. Рекомбинантная молекула нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 или 73, где рекомбинантная молекула нуклеиновой кислоты содержит полинуклеотид с SEQ ID NO: 3 или SEQ ID NO: 75.
79. Трансгенное растение или его потомство, содержащие рекомбинантную молекулу нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77 или 78.
80. Трансгенное растение или его потомство, стабильно трансформированные рекомбинантной молекулой нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77 или 78.
81. Трансгенное растение согласно варианту осуществления 79 или 80, где трансгенное растение является однодольным.
82. Трансгенное растение согласно варианту осуществления 79 или 80, где трансгенное растение является двудольным.
83. Трансгенное растение согласно варианту осуществления 79 или 80, дополнительно содержащее один или несколько дополнительных трансгенных признаков.
84. Трансгенное растение согласно варианту осуществления 83, где один или несколько дополнительных трансгенных признаков выбраны из устойчивости к насекомым, устойчивости к гербицидам, устойчивости к грибам, устойчивости к вирусам или переносимости стрессов, устойчивости к заболеваниям, мужской стерильности, силы стебля, повышенной урожайности, модифицированных видов крахмала, улучшенного профиля масел, сбалансированного содержания аминокислот, высокого содержания лизина или метионина, повышенной усвояемости, улучшенного качества волокон и переносимости засухи.
85. Кассета экспрессии, содержащая рекомбинантную молекулу нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77 или 78, где нуклеиновая кислота функционально связана с одной или несколькими регуляторными последовательностями, управляющими экспрессией полипептида AfIP-1B.
86. Трансгенное растение, содержащее кассету экспрессии согласно варианту осуществления 85.
87. Растительная клетка, содержащая кассету экспрессии согласно варианту осуществления 85.
88. Семя, зерно или продукт их переработки из трансгенного растения согласно варианту осуществления 86 или его потомства, где семя, зерно или продукт их переработки содержат рекомбинантную молекулу нуклеиновой кислоты.
89. Семя согласно варианту осуществления 88, где на семя было нанесено одно или несколько средств обработки семян.
90. Семя согласно варианту осуществления 89, где одно или несколько средств обработки семян выбраны из гербицида, инсектицида, фунгицида, ингибитора прорастания, усилителя прорастания, регулятора роста растения, бактерицида и нематоцида.
91. Способ экспрессии в растении полинуклеотида, кодирующего полипептид AfIP-1B, включающий получение растения, способного экспрессировать молекулы нуклеиновой кислоты, кодирующие полипептид AfIP-1B, из трансформированной растительной клетки, соедржащей кассету экспрессии согласно пункту 85.
92. Трансгенное растение, полученное по способу согласно варианту осуществления 91.
93. Семя, зерно или продукты их переработки из трансгенного растения согласно варианту осуществления 92.
94. Трансгенное растение согласно варианту осуществления 92, где трансгенное растение дополнительно содержит один или несколько дополнительных трансгенных признаков.
95. Трансгенное растение согласно варианту осуществления 94, где один или несколько дополнительных трансгенных признаков выбраны из устойчивости к насекомым, устойчивости к гербицидам, устойчивости к грибам, устойчивости к вирусам, переносимости стрессов, устойчивости к заболеваниям, мужской стерильности, силы стебля, повышенной урожайности, модифицированных видов крахмала, улучшенного профиля масел, сбалансированного содержания аминокислот, высокого содержания лизина или метионина, повышенной усвояемости, улучшенного качества волокон, цветения, развития колоса и семени, улучшения эффективности использования азота, измененной реактивности в отношении азота, устойчивости к засухе или ее переносимости, устойчивости к холоду или его переносимости, устойчивости к солям или их переносимости и повышенной урожайности при стрессе.
96. Трансгенное растение согласно варианту осуществления 94 или 95, где трансгенное растение является однодольным.
97. Трансгенное растение согласно варианту осуществления 94 или 95, где трансгенное растение является двудольным.
98. Рекомбинантный полипептид AfIP-1B.
99. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 98, где полипептид AfIP-1B получен из штамма Alcaligenes faecalis.
100. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 99, где штамм Alcaligenes faecalis представляет собой DDMC P4G7, депонированный под № доступа NRRL B-50625.
101. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 98, 99 или 100, где полипептид AfIP-1B содержит аминокислотный мотив, представленный положениями 358-365 из SEQ ID NO: 259.
102. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 101, дополнительно содержащий какой-либо один или несколько аминокислотных мотивов, представленных положениями 105-115 из SEQ ID NO: 259, положениями 133-144 из SEQ ID NO: 259, положениями 177-184 из SEQ ID NO: 259 и положениями 511-520 из SEQ ID NO: 259.
103. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101 или 102, где полипептид AfIP-1B по меньшей мере на 90% идентичен аминокислотной последовательности с SEQ ID NO: 4.
104. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101 или 102, где полипептид AfIP-1B по меньшей мере на 90% идентичен аминокислотной последовательности с SEQ ID NO: 4, и аминокислотный мотив представлен положениями 358-365 из SEQ ID NO: 259.
105. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 104, где полипептид AfIP-1B дополнительно содержит какой-либо один или несколько аминокислотных мотивов, представленных положениями 105-115 из SEQ ID NO: 259, положениями 133-144 из SEQ ID NO: 259, положениями 177-184 из SEQ ID NO: 259 и положениями 511-520 из SEQ ID NO: 259.
106. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102 или 103, где полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 258, где Xaa в положении 2 представляет собой Asp или Gly; Xaa в положении 12 представляет собой Met или Leu; Xaa в положении 34 представляет собой Ile или Leu; Xaa в положении 38 представляет собой Ile или Leu; Xaa в положении 42 представляет собой Glu или Asp; Xaa в положении 43 представляет собой Ile или Leu; Xaa в положении 53 представляет собой Tyr или Phe; Xaa в положении 55 представляет собой Tyr или Phe; Xaa в положении 71 представляет собой Gly или Cys; Xaa в положении 82 представляет собой Val или Met; Xaa в положении 86 представляет собой Val или Leu; Xaa в положении 94 представляет собой Tyr или Phe; Xaa в положении 97 представляет собой Ile или Leu; Xaa в положении 101 представляет собой Tyr или Phe; Xaa в положении 103 представляет собой Ile, Leu, Gly, Val, Trp, Phe, Thr, Cys, Glu или Arg; Xaa в положении 105 представляет собой Met, Gly, Val, Leu, Trp, Phe, Pro, Thr, Cys, Asn, Gln или Arg; Xaa в положении 106 представляет собой Ile или Leu; Xaa в положении 108 представляет собой Gly, Ala, Leu, Ile, Met, Trp, Phe, Ser, Thr, Cys, Tyr, Asn, Asp, Lys или His; Xaa в положении 109 представляет собой Ile, Leu, Ala, Val, Leu, Met, Trp, Phe, Pro, Cys, Asn или Glu; Xaa в положении 110 представляет собой Glu, Gly, Ala, Val, Leu, Met, Trp, Ser, Thr, Cys, Tyr, Asp или His; Xaa в положении 111 представляет собой Tyr, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Thr, Cys, Asp, Glu, Lys, Arg или His; Xaa в положении 115 представляет собой Asp или Glu; Xaa в положении 119 представляет собой Val или Ala; Xaa в положении 134 представляет собой Ser или Leu; Xaa в положении 137 представляет собой Val, Phe, Ala, Leu, Trp, Pro, Ser или Cys; Xaa в положении 139 представляет собой Glu или Asp; Xaa в положении 141 представляет собой Phe, Leu, Ile, Trp, Ser или Cys; Xaa в положении 144 представляет собой Ala или Val; Xaa в положении 148 представляет собой Ser, Phe или Thr; Xaa в положении 152 представляет собой Ile или Thr; Xaa в положении 155 представляет собой Asp или Glu; Xaa в положении 179 представляет собой Gly, Val, Trp, Ser, Cys или Arg; Xaa в положении 181 представляет собой Ile, Val или Leu; Xaa в положении 182 представляет собой Trp, Gly, Ala, Val, Leu, Met, Ser, Cys, Glu или Arg; Xaa в положении 188 представляет собой Val или Leu; Xaa в положении 196 представляет собой Lys или Glu; Xaa в положении 197 представляет собой Thr или Ser; Xaa в положении 201 представляет собой Trp, Cys или Phe; Xaa в положении 202 представляет собой Lys или Asn; Xaa в положении 203 представляет собой Tyr или Phe; Xaa в положении 208 представляет собой Glu или Asp; Xaa в положении 214 представляет собой Ile или Leu; Xaa в положении 220 представляет собой Ile или Leu; Xaa в положении 224 представляет собой Tyr или Phe; Xaa в положении 234 представляет собой Glu или Asp; Xaa в положении 235 представляет собой Val или Leu; Xaa в положении 270 представляет собой Ile или Val; Xaa в положении 296 представляет собой Lys или Glu; Xaa в положении 298 представляет собой Ala или Glu; Xaa в положении 299 представляет собой Glu или Gly; Xaa в положении 300 представляет собой Ile или Val; Xaa в положении 305 представляет собой Asp или Glu; Xaa в положении 308 представляет собой Lys или Asn; Xaa в положении 317 представляет собой Ala или Ser; Xaa в положении 323 представляет собой Glu или Asp; Xaa в положении 335 представляет собой Glu или Asp; Xaa в положении 343 представляет собой Asp или Glu; Xaa в положении 352 представляет собой Glu или Asp; Xaa в положении 359 представляет собой Glu, Gly, Ala, Val, Leu, Trp, Phe, Ser, Thr, Lys или Arg; Xaa в положении 360 представляет собой Asn, Gly, Val, Leu, Met, Phe, Pro, Thr, Asn, Asp, Lys или His; Xaa в положении 361 представляет собой Ser, Gly, Val, Leu или Glu; Xaa в положении 363 представляет собой Asp, Gly, Trp или Ser; Xaa в положении 364 представляет собой Val, Pro, Ser, Thr, Asn, Glu или Lys; Xaa в положении 365 представляет собой Leu, Gly, Ala, Val, Ile, Trp, Phe, Pro, Ser, Thr, Gln, Glu, Arg или His; Xaa в положении 367 представляет собой Glu или Lys; Xaa в положении 368 представляет собой Gly или Asp; Xaa в положении 370 представляет собой Ile или Val; Xaa в положении 373 представляет собой Arg или Ser; Xaa в положении 374 представляет собой Asn или Lys; Xaa в положении 377 представляет собой Leu или Ile; Xaa в положении 384 представляет собой Thr или Ala; Xaa в положении 385 представляет собой Ile или Ser; Xaa в положении 388 представляет собой Asp или Glu; Xaa в положении 393 представляет собой Tyr или Phe; Xaa в положении 398 представляет собой Ala или Val; Xaa в положении 414 представляет собой Tyr или Phe; Xaa в положении 418 представляет собой Ile или Leu; Xaa в положении 419 представляет собой Ser или Asn; Xaa в положении 423 представляет собой Val или Leu; Xaa в положении 425 представляет собой Glu или Val; Xaa в положении 427 представляет собой Ile или Val; Xaa в положении 434 представляет собой Met или Thr; Xaa в положении 481 представляет собой Glu или Asp; Xaa в положении 495 представляет собой Asp или Glu; Xaa в положении 509 представляет собой Phe, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Cys, Tyr, Asn, Asp, Glu или Arg; Xaa в положении 512 представляет собой Asn, Ser, Gly, Ala, Leu, Met, Trp, Phe, Ser, Thr, Cys, Gln или Arg; Xaa в положении 514 представляет собой Glu, Asp или Arg; Xaa в положении 516 представляет собой Gly, Ala, Val, Met, Pro, Thr, Asn, Gln, Asp, Glu или Lys; Xaa в положении 519 представляет собой Leu, Gly, Ala, Val, Met, Phe, Pro, Tyr, Gln, Asp или Lys; Xaa в положении 526 представляет собой Val или Leu; Xaa в положении 530 представляет собой Ile или Leu; Xaa в положении 533 представляет собой Val или Ala; Xaa в положении 536 представляет собой Ile или Leu; Xaa в положении 538 представляет собой Tyr или Phe; Xaa в положении 543 представляет собой Tyr или Phe; Xaa в положении 544 представляет собой Lys или Arg; Xaa в положении 547 представляет собой Tyr или Phe; Xaa в положении 550 представляет собой Tyr или Phe; Xaa в положении 552 представляет собой Asn или Ser; Xaa в положении 558 представляет собой Phe или Leu; Xaa в положении 600 представляет собой Met или Val; Xaa в положении 602 представляет собой Met или Ile; Xaa в положении 607 представляет собой Asp или Gly; Xaa в положении 610 представляет собой Thr или Lys; Xaa в положении 612 представляет собой Ile или Thr; Xaa в положении 613 представляет собой Leu или Pro; Xaa в положении 615 представляет собой Asn или Asp; Xaa в положении 619 представляет собой Lys или Arg; Xaa в положении 625 представляет собой Tyr или Phe; Xaa в положении 629 представляет собой Lys или Asn; Xaa в положении 631 представляет собой Ile, Val или Leu; Xaa в положении 633 представляет собой Trp или Phe; Xaa в положении 646 представляет собой Gln или Arg; Xaa в положении 661 представляет собой Asn или Ser; Xaa в положении 683 представляет собой Thr или Ala; Xaa в положении 696 представляет собой Glu, Asp или Gln; Xaa в положении 700 представляет собой Ser или Gly; и Xaa в положении 702 представляет собой Phe или Ser; и где 1-25 аминокислот, необязательно, удалены с C-конца полипептида.
107. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105 или 106, где полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 4, где нативные аминокислоты в положениях 1-35 из SEQ ID NO: 4 замещены нативными аминокислотами из SEQ ID NO: 20 в соответствующем положении SEQ ID NO: 20.
108. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102 или 103, где полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 259, где Xaa в положении 2 представляет собой Asp или Gly; Xaa в положении 12 представляет собой Met, Leu, Ile или Val; Xaa в положении 34 представляет собой Ile или Leu; Xaa в положении 38 представляет собой Ile или Leu; Xaa в положении 42 представляет собой Glu или Asp; Xaa в положении 43 представляет собой Ile или Leu; Xaa в положении 53 представляет собой Tyr или Phe; Xaa в положении 55 представляет собой Tyr или Phe; Xaa в положении 71 представляет собой Gly, Cys или Ala; Xaa в положении 82 представляет собой Val или Met; Xaa в положении 86 представляет собой Val или Leu; Xaa в положении 94 представляет собой Tyr или Phe; Xaa в положении 97 представляет собой Ile или Leu; Xaa в положении 101 представляет собой Tyr или Phe; Xaa в положении 103 представляет собой Ile, Leu, Gly, Val, Trp, Phe, Thr, Cys, Glu или Arg; Xaa в положении 105 представляет собой Met, Gly, Val, Leu, Trp, Phe, Pro, Thr, Cys, Asn, Gln или Arg; Xaa в положении 106 представляет собой Ile или Leu; Xaa в положении 108 представляет собой Gly, Ala, Leu, Ile, Met, Trp, Phe, Ser, Thr, Cys, Tyr, Asn, Asp, Lys или His; Xaa в положении 109 представляет собой Ile, Leu, Ala, Val, Leu, Met, Trp, Phe, Pro, Cys, Asn или Glu; Xaa в положении 110 представляет собой Glu, Gly, Ala, Val, Leu, Met, Trp, Ser, Thr, Cys, Tyr, Asp или His; Xaa в положении 111 представляет собой Tyr, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Thr, Cys, Asp, Glu, Lys, Arg или His; Xaa в положении 115 представляет собой Asp или Glu; Xaa в положении 119 представляет собой Val, Ala, Ile или Leu; Xaa в положении 134 представляет собой Ser или Leu; Xaa в положении 137 представляет собой Val, Phe, Ala, Leu, Trp, Pro, Ser или Cys; Xaa в положении 139 представляет собой Glu или Asp; Xaa в положении 141 представляет собой Phe, Leu, Ile, Trp, Ser или Cys; Xaa в положении 144 представляет собой Ala, Val, Gly, Ile, Leu или Met; Xaa в положении 148 представляет собой Ser, Phe, Thr или Trp; Xaa в положении 152 представляет собой Ile, Thr, Leu, Val, Met или Ser; Xaa в положении 155 представляет собой Asp или Glu; Xaa в положении 179 представляет собой Gly, Val, Trp, Ser, Cys или Arg; Xaa в положении 181 представляет собой Ile, Val, Met или Leu; Xaa в положении 182 представляет собой Trp, Gly, Ala, Val, Leu, Met, Ser, Cys, Glu или Arg; Xaa в положении 188 представляет собой Val или Leu; Xaa в положении 196 представляет собой Lys или Glu; Xaa в положении 197 представляет собой Thr или Ser; Xaa в положении 201 представляет собой Trp, Cys, Tyr или Phe; Xaa в положении 202 представляет собой Lys, Asn или Arg; Xaa в положении 203 представляет собой Tyr или Phe; Xaa в положении 208 представляет собой Glu или Asp; Xaa в положении 214 представляет собой Ile или Leu; Xaa в положении 220 представляет собой Ile или Leu; Xaa в положении 224 представляет собой Tyr или Phe; Xaa в положении 234 представляет собой Glu или Asp; Xaa в положении 235 представляет собой Val или Leu; Xaa в положении 270 представляет собой Ile, Val, Leu или Met; Xaa в положении 296 представляет собой Lys или Glu; Xaa в положении 298 представляет собой Ala, Glu, Gly или Asp; Xaa в положении 299 представляет собой Glu, Gly, Asp или Ala; Xaa в положении 300 представляет собой Ile, Val, Ile или Met; Xaa в положении 305 представляет собой Asp или Glu; Xaa в положении 308 представляет собой Lys или Asn; Xaa в положении 317 представляет собой Ala, Ser, Gly или Thr; Xaa в положении 323 представляет собой Glu или Asp; Xaa в положении 335 представляет собой Glu или Asp; Xaa в положении 343 представляет собой Asp или Glu; Xaa в положении 352 представляет собой Glu или Asp; Xaa в положении 359 представляет собой Glu, Gly, Ala, Val, Leu, Trp, Phe, Ser, Thr, Lys или Arg; Xaa в положении 360 представляет собой Asn, Gly, Val, Leu, Met, Phe, Pro, Thr, Asn, Asp, Lys или His; Xaa в положении 361 представляет собой Ser, Gly, Val, Leu или Glu; Xaa в положении 363 представляет собой Asp, Gly, Trp или Ser; Xaa в положении 364 представляет собой Val, Pro, Ser, Thr, Asn, Glu или Lys; Xaa в положении 365 представляет собой Leu, Gly, Ala, Val, Ile, Trp, Phe, Pro, Ser, Thr, Gln, Glu, Arg или His; Xaa в положении 367 представляет собой Glu или Lys; Xaa в положении 368 представляет собой Gly или Asp; Xaa в положении 370 представляет собой Ile, Val, Leu или Met; Xaa в положении 373 представляет собой Arg или Ser; Xaa в положении 374 представляет собой Asn, Lys, Gln или Arg; Xaa в положении 377 представляет собой Leu, Ile, Val или Met; Xaa в положении 384 представляет собой Thr, Ala, Ser или Gly; Xaa в положении 385 представляет собой Ile, Ser, Leu, Val, Met или Thr; Xaa в положении 388 представляет собой Asp или Glu; Xaa в положении 393 представляет собой Tyr, Phe или Trp; Xaa в положении 398 представляет собой Ala или Val; Xaa в положении 414 представляет собой Tyr или Phe; Xaa в положении 418 представляет собой Ile или Leu; Xaa в положении 419 представляет собой Ser, Asn, Thr или Gln; Xaa в положении 423 представляет собой Val или Leu; Xaa в положении 425 представляет собой Glu или Val; Xaa в положении 427 представляет собой Ile или Val; Xaa в положении 434 представляет собой Met или Thr; Xaa в положении 481 представляет собой Glu или Asp; Xaa в положении 495 представляет собой Asp или Glu; Xaa в положении 509 представляет собой Phe, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Cys, Tyr, Asn, Asp, Glu или Arg; Xaa в положении 512 представляет собой Asn, Ser, Gly, Ala, Leu, Met, Trp, Phe, Ser, Thr, Cys, Gln или Arg; Xaa в положении 514 представляет собой Glu, Asp или Arg; Xaa в положении 516 представляет собой Gly, Ala, Val, Met, Pro, Thr, Asn, Gln, Asp, Glu или Lys; Xaa в положении 519 представляет собой Leu, Gly, Ala, Val, Met, Phe, Pro, Tyr, Gln, Asp или Lys; Xaa в положении 526 представляет собой Val или Leu; Xaa в положении 530 представляет собой Ile или Leu; Xaa в положении 533 представляет собой Val или Ala; Xaa в положении 536 представляет собой Ile или Leu; Xaa в положении 538 представляет собой Tyr, Phe или Trp; Xaa в положении 543 представляет собой Tyr или Phe; Xaa в положении 544 представляет собой Lys или Arg; Xaa в положении 547 представляет собой Tyr или Phe; Xaa в положении 550 представляет собой Tyr, Phe или Trp; Xaa в положении 552 представляет собой Asn, Ser, Gln или Thr; Xaa в положении 558 представляет собой Phe или Leu; Xaa в положении 600 представляет собой Met или Val; Xaa в положении 602 представляет собой Met, Ile, Leu или Val; Xaa в положении 607 представляет собой Asp или Gly; Xaa в положении 610 представляет собой Thr, Lys, Ser или Arg; Xaa в положении 612 представляет собой Ile или Thr; Xaa в положении 613 представляет собой Leu или Pro; Xaa в положении 615 представляет собой Asn или Asp; Xaa в положении 619 представляет собой Lys или Arg; Xaa в положении 625 представляет собой Tyr, Phe или Trp; Xaa в положении 629 представляет собой Lys или Asn; Xaa в положении 631 представляет собой Ile, Val, Leu или Met; Xaa в положении 633 представляет собой Trp или Phe; Xaa в положении 646 представляет собой Gln или Arg; Xaa в положении 661 представляет собой Asn или Ser; Xaa в положении 683 представляет собой Thr, Ala, Ser или Gly; Xaa в положении 696 представляет собой Glu, Asp или Gln; Xaa в положении 700 представляет собой Ser или Gly; и Xaa в положении 702 представляет собой Phe или Ser;
и где 1-25 аминокислот, необязательно, удалены с C-конца полипептида.
109. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 106, где полипептид AfIP-1B дополнительно содержит одну или несколько аминокислотных замен нативной аминокислоты из SEQ ID NO: 20 в соответствующем положении SEQ ID NO: 4.
110. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 108, где полипептид AfIP-1B дополнительно содержит одну или несколько аминокислотных замен нативной аминокислоты из SEQ ID NO: 20 в соответствующем положении SEQ ID NO: 4.
111. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108 или 109, где полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 4 или SEQ ID NO: 76, или ее фрагмент.
112. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108 или 109, где полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 4 или SEQ ID NO: 76.
113. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108 или 109, где полипептид AfIP-1B кодируется полинуклеотидом с SEQ ID NO: 3 или SEQ ID NO: 75.
114. Рекомбинантный полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112 или 113, имеющий одно или несколько свойств, выбранных из
a) аминокислотного мотива, представленного положениями 101-105 из SEQ ID NO: 259;
b) аминокислотного мотива, представленного положениями 133-144 из SEQ ID NO: 259;
c) аминокислотного мотива, представленного положениями 177-184 из SEQ ID NO: 259;
d) аминокислотного мотива, представленного положениями 358-365 из SEQ ID NO: 259;
e) аминокислотного мотива, представленного положениями 511-520 из SEQ ID NO: 259;
f) фунгицидной активности;
g) инсектицидной активности и
h) рассчитанного молекулярного веса от приблизительно 72,5 кДа до приблизительно 80 кДа.
115. Трансгенное растение, способное экспрессировать рекомбинантный полинуклеотид, кодирующий полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114.
116. Трансгенное растение согласно варианту осуществления 115, где трансгенное растение является однодольным.
117. Трансгенное растение согласно варианту осуществления 115, где трансгенное растение является двудольным.
118. Трансгенное растение согласно варианту осуществления 115, где трансгенное растение экспрессирует один или несколько дополнительных трансгенных признаков.
119. Композиция, содержащая пестицидно эффективное количество рекомбинантного полипептида AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114.
120. Композиция согласно варианту осуществления 119, дополнительно содержащая подходящий с точки зрения сельского хозяйства носитель.
121. Композиция согласно варианту осуществления 120, где носитель выбран из порошка, дуста, пеллет, гранул, распыляемого раствора, эмульсии, коллоидного вещества и раствора.
122. Композиция согласно варианту осуществления 119, дополнительно содержащая один или несколько гербицидов, инсектицидов или фунгицидов.
123. Композиция согласно варианту осуществления 122, где один или несколько инсектицидов представляют собой пестицидные белки.
124. Композиция согласно варианту осуществления 123, где один или несколько пестицидных белков выбраны из белка Cry1, белка Cry2, белка Cry3, белка Cry4, белка Cry5, белка Cry6, белка Cry7, белка Cry8, белка Cry9, белка Cry15, белка Cry22, белка Cry23, белка Cry32, белка Cry34, белка Cry35, белка Cry36, белка Cry37, белка Cry43, белка Cry46, белка Cry51, белка Cry55, бинарного токсина Cry, белка Cyt, токсина VIP, белка SIP, инсектицидной липазы, инсектицидной хитиназы и белка змеиного яда.
125. Способ контроля популяции гриба-вредителя, включающий приведение в контакт популяции гриба-вредителя с фунгицидно эффективным количеством рекомбинантного полипептида AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114.
126. Способ защиты растения от гриба-вредителя, включающий экспрессию в растении или его клетке полинуклеотида, кодирующего пестицидно эффективное количество рекомбинантного полипептида AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114.
127. Композиция, содержащая инсектицидно эффективное количество
a) рекомбинантного полипептида AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49 или полипептида с SEQ ID NO: 18 и
b) рекомбинантного полипептида AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114 или полипептида с SEQ ID NO: 20.
128. Способ подавления роста или уничтожения насекомого-вредителя, включающий приведение в контакт насекомого-вредителя с композицией согласно варианту осуществления 127.
129. Способ контроля популяции насекомого-вредителя, устойчивого к пестицидному белку, включающий приведение в контакт популяции устойчивого насекомого-вредителя с композицией согласно варианту осуществления 127.
130. Способ контроля популяции насекомого-вредителя, устойчивого к пестицидному белку, согласно варианту осуществления 129, где пестицидный белок выбран из Cry1Ac, Cry1Ab, Cry1A.105, Cry1Ac, Cry1F, Cry1Fa2, Cry1F, Cry2Ab, Cry3A, mCry3A, Cry3Bb1, Cry34Ab1, Cry35Ab1, Vip3A, Cry9c, eCry3.1Ab и CBI-Bt.
131. Биологически чистая культура штамма Alcaligenes faecalis DDMC P4G7, депонированного под № доступа NRRL B-50625.
132. Способ выделения полипептида AfIP-1A или полипептида AfIP-1B, обладающих пестицидной активностью, из штамма Alcaligenes faecalis, включающий
a) получение белкового клеточного лизата из бактериального изолята;
b) скрининг белкового клеточного лизата в отношении пестицидной активности и
c) выделение пестицидного белка из белкового клеточного лизата.
133. Рекомбинантный рецептор к полипептиду с SEQ ID NO: 2, SEQ ID NO: 4, SEQ ID NO: 18 или SEQ ID NO: 20.
134. Способ идентификации полипептида AfIP-1A или полипептида AfIP-1B в биологическом образце, включающий приведение в контакт биологического образца с рецептором согласно варианту осуществления 133.
135. Выделенное антитело или его антигенсвязывающий участок, где антитело специфично связывается с полипептидом AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49.
136. Способ выявления полипептида AfIP-1A в биологическом образце, включающий приведение в контакт белка с антителом согласно варианту осуществления 135.
137. Способ выделения полипептида AfIP-1A в биологическом образце, включающий приведение в контакт белка с антителом согласно варианту осуществления 135.
138. Выделенное антитело или его антигенсвязывающий участок, где антитело специфично связывается с полипептидом AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114.
139. Способ выявления полипептида AfIP-1B в биологическом образце, включающий приведение в контакт белка с антителом согласно варианту осуществления 138.
140. Способ выделения полипептида AfIP-1B в биологическом образце, включающий приведение в контакт белка с антителом согласно варианту осуществления 138.
141. Трансгенное растение или его потомство, содержащие рекомбинантную молекулу нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, или рекомбинантную молекулу нуклеиновой кислоты, кодирующую полипептид с SEQ ID NO: 18; и рекомбинантную молекулу нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75 или 76, или рекомбинантную молекулу нуклеиновой кислоты, кодирующую полипептид с SEQ ID NO: 20.
142. Трансгенное растение или его потомство, стабильно трансформированные рекомбинантной молекулой нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, или рекомбинантной молекулой нуклеиновой кислоты, кодирующей полипептид с SEQ ID NO: 18; и рекомбинантной молекулой нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77 или 78, или рекомбинантной молекулой нуклеиновой кислоты, кодирующей полипептид с SEQ ID NO: 20.
143. Трансгенное растение или его потомство согласно варианту осуществления 141 или 142, где трансгенное растение является однодольным.
144. Трансгенное растение или его потомство согласно варианту осуществления 141 или 142, где трансгенное растение является двудольным.
145. Трансгенное растение или его потомство согласно варианту осуществления 141 или 142, где растение выбрано из ячменя, кукурузы, овса, риса, ржи, сорго, газонной травы, сахарного тростника, пшеницы, люцерны, банана, брокколи, фасоли, капусты, канолы, моркови, маниока, цветной капусты, сельдерея, цитруса, хлопчатника, тыквы, эвкалипта, льна, чеснока, винограда, лука, салата-латука, гороха, арахиса, перца, картофеля, тополя, ананаса, подсолнечника, сафлора, сои, земляники, сахарной свеклы, батата, табака, декоративного томата, кустарника, ореха, нута, голубиного гороха, разновидностей проса, хмеля и пастбищных трав.
146. Трансгенное растение или его потомство согласно варианту осуществления 141 или 142, дополнительно содержащие один или несколько дополнительных трансгенных признаков.
147. Трансгенное растение согласно варианту осуществления 146, где один или несколько дополнительных трансгенных признаков выбраны из устойчивости к насекомым, устойчивости к гербицидам, устойчивости к грибам, устойчивости к вирусам, переносимости стрессов, устойчивости к заболеваниям, мужской стерильности, силы стебля, повышенной урожайности, модифицированных видов крахмала, улучшенного профиля масел, сбалансированного содержания аминокислот, высокого содержания лизина или метионина, повышенной усвояемости, улучшенного качества волокон, цветения, развития колоса и семени, улучшения эффективности использования азота, измененной реактивности в отношении азота, устойчивости к засухе или ее переносимости, устойчивости к холоду или его переносимости, устойчивости к солям или их переносимости и повышенной урожайности при стрессе.
148. ДНК-конструкция, содержащая рекомбинантную молекулу нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, или рекомбинантную молекулу нуклеиновой кислоты с SEQ ID NO: 17, где нуклеиновая кислота функционально связана с одной или несколькими регуляторными последовательностями, управляющими экспрессией полипептида AfIP-1A или полипептида с SEQ ID NO: 18; и рекомбинантную молекулу нуклеиновой кислоты согласно варианту осуществления 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77 или 78, или рекомбинантную молекулу нуклеиновой кислоты с SEQ ID NO: 19, где нуклеиновая кислота функционально связана с одной или несколькими регуляторными последовательностями, управляющими экспрессией полипептида AfIP-1B или полипептида с SEQ ID NO: 20.
149. Трансгенное растение, содержащее ДНК-конструкцию согласно варианту осуществления 148.
150. Растительная клетка, содержащая ДНК-конструкцию согласно варианту осуществления 148.
151. Семя, зерно или продукт их переработки из трансгенного растения согласно варианту осуществления 149, где семя, зерно или продукт их переработки содержат рекомбинантную молекулу нуклеиновой кислоты согласно варианту осуществления 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, или рекомбинантную молекулу нуклеиновой кислоты с SEQ ID NO: 17, и рекомбинантную молекулу нуклеиновой кислоты согласно 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77 или 78, или рекомбинантную молекулу нуклеиновой кислоты с SEQ ID NO: 19.
152. Семя согласно варианту осуществления 151, где на семя было нанесено одно или несколько средств обработки семян.
153. Способ экспрессии в растении полинуклеотида, кодирующего инсектицидный белок, причем способ включает получение растения, способного экспрессировать молекулы нуклеиновой кислоты, кодирующие полипептид AfIP-1A и полипептид AfIP-1B, из трансформированной растительной клетки, содержащей кассету экспрессии согласно пункту 22 и кассету экспрессии согласно пункту 85.
154. Трансгенное растение, полученное по способу согласно варианту осуществления 153.
155. Семя, зерно или продукт их переработки из трансгенного растения согласно варианту осуществления 154.
156. Трансгенное растение согласно варианту осуществления 154, где трансгенное растение дополнительно содержит один или несколько дополнительных трансгенных признаков.
157. Трансгенное растение, способное экспрессировать по меньшей мере один полинуклеотид, кодирующий полипептид AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49 и полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114.
158. Способ защиты растения от насекомого-вредителя, включающий экспрессию в растении или его клетке инсектицидно эффективного количества полипептида AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49 и полипептида AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114.
159. Способ контроля популяции насекомого-вредителя, включающий приведение в контакт популяции насекомого-вредителя с инсектицидно эффективным количеством полипептида AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49 и полипептида AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114.
160. Способ подавления роста или уничтожения насекомого-вредителя, включающий приведение в контакт насекомого-вредителя с композицией, содержащей инсектицидно эффективное количество полипептида AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49 и полипептида AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114.
161. Способ контроля популяции насекомого-вредителя, устойчивого к пестицидному белку, включающий приведение в контакт популяции насекомого-вредителя с инсектицидно эффективным количеством полипептида AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49 и полипептида AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114.
162. Способ контроля заражения насекомыми отряда Lepidoptera и/или Coleoptera у трансгенного растения и обеспечения управления устойчивостью насекомых к пестицидам, включающий экспрессию в растении инсектицидно эффективного количества
a) полипептида AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49 и полипептида AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114; и
b) по меньшей мере одного инсектицидного белка, обладающего отличающимся механизмом действия по сравнению с полипептидом AfIP-1A и полипептидом AfIP-1B.
163. Способ согласно варианту осуществления 162, где инсектицидный белок из b) включает белок Cry с инсектицидным действием в отношении насекомых отряда Lepidoptera и/или Coleoptera.
164. Способ снижения вероятности возникновения устойчивости насекомых отряда Lepidoptera и/или Coleoptera к трансгенным растениям, экспрессирующим в растениях инсектицидные белки для контроля видов насекомых, включающий
a) экспрессию полинуклеотида, кодирующего полипептид AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 и полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114; и
b) экспрессию полинуклеотида, кодирующего по меньшей мере один инсектицидный белок, обладающий отличающимся механизмом действия по сравнению с полипептидом AfIP-1A и полипептидом AfIP-1B из a).
165. Способ согласно варианту осуществления 164, где инсектицидный белок из b) представляет собой белок Cry.
166. Способ контроля популяции насекомого-вредителя, включающий приведение в контакт популяции насекомого-вредителя с инсектицидно эффективным количеством рекомбинантного полипептида, содержащего аминокислотную последовательность с SEQ ID NO: 18, и рекомбинантного полипептида, содержащего аминокислотную последовательность с SEQ ID NO: 20.
167. Способ подавления роста или уничтожения насекомого-вредителя, включающий приведение в контакт насекомого-вредителя с композицией, содержащей инсектицидно эффективное количество рекомбинантного полипептида, содержащего аминокислотную последовательность с SEQ ID NO: 18, и рекомбинантного полипептида, содержащего аминокислотную последовательность с SEQ ID NO: 20.
168. Способ контроля популяции насекомого-вредителя, устойчивого к пестицидному белку, включающий приведение в контакт популяции насекомого-вредителя с инсектицидно эффективным количеством рекомбинантного полипептида, содержащего аминокислотную последовательность с SEQ ID NO: 18, и рекомбинантного полипептида, содержащего аминокислотную последовательность с SEQ ID NO: 20.
169. Способ защиты растения от насекомого-вредителя, включающий экспрессию в растении или его клетке полинуклеотида, кодирующего рекомбинантный полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 18, и рекомбинантный полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 20.
170. Трансгенное растение или его потомство, содержащие рекомбинантную молекулу нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты с SEQ ID NO: 17, и рекомбинантную молекулу нуклеиновой кислоты, содержащую последовательность нуклеиновой кислоты с SEQ ID NO: 19.
171. Трансгенное растение или его потомство, стабильно трансформированные рекомбинантной молекулой нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты с SEQ ID NO: 17, и рекомбинантной молекулой нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты с SEQ ID NO: 19.
172. Трансгенное растение или его потомство согласно варианту осуществления 170 или 171, где трансгенное растение является однодольным.
173. Трансгенное растение или его потомство согласно варианту осуществления 170 или 171, где трансгенное растение является двудольным.
174. Трансгенное растение или его потомство согласно варианту осуществления 170 или 171, где трансгенное растение выбрано из ячменя, кукурузы, овса, риса, ржи, сорго, газонной травы, сахарного тростника, пшеницы, люцерны, банана, брокколи, фасоли, капусты, канолы, моркови, маниока, цветной капустой, сельдерея, цитруса, хлопчатника, тыквы, эвкалипта, льна, чеснока, винограда, лука, салата-латука, гороха, арахиса, перца, картофеля, тополя, ананаса, подсолнечника, сафлора, сои, земляники, сахарной свеклы, батата, табака, декоративного томата, кустарника, ореха, нута, голубиного гороха, разновидностей проса, хмеля и пастбищных трав.
175. Трансгенное растение или его потомство согласно варианту осуществления 170 или 171, дополнительно содержащие один или несколько дополнительных трансгенных признаков.
176. Кассета экспрессии, содержащая
a) рекомбинантную молекулу нуклеиновой кислоты, кодирующую полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 18, где нуклеиновая кислота функционально связана с одним или несколькими регуляторными последовательностями, управляющими экспрессией полипептида с SEQ ID NO: 18; и
b) рекомбинантную молекулу нуклеиновой кислоты, кодирующую полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 20, где нуклеиновая кислота функционально связана с одной или несколькими регуляторными последовательностями, управляющими экспрессией полипептида с SEQ ID NO: 20.
177. Трансгенное растение, содержащее кассету экспрессии согласно варианту осуществления 176.
178. Растительная клетка, содержащая кассету экспрессии согласно варианту осуществления 176.
179. Семя, зерно или продукт их переработки из трансгенного растения согласно варианту осуществления 177, где семя, зерно или продукт переработки содержат рекомбинантную молекулу нуклеиновой кислоты.
180. Семя согласно варианту осуществления 179, где на семя было нанесено одно или несколько средств обработки семян.
181. Способ экспрессии в растении инсектицидного белка, включающий
(a) вставку в растительную клетку молекулы нуклеиновой кислоты, кодирующей инсектицидный белок с SEQ ID NO: 18, и молекулы нуклеиновой кислоты, кодирующей инсектицидный белок с SEQ ID NO: 20;
(b) получение трансформированной растительной клетки, содержащей последовательность нуклеиновой кислоты из стадии (a); и
(c) получение из трансформированной растительной клетки растения, способного экспрессировать молекулу нуклеиновой кислоты, кодирующую инсектицидные белки.
182. Трансгенное растение, полученное по способу согласно варианту осуществления 181.
183. Семя или зерно трансгенного растения согласно варианту осуществления 182.
184. Трансгенное растение согласно варианту осуществления 182, где трансгенное растение дополнительно содержит один или несколько дополнительных трансгенных признаков.
185. Трансгенное растение, способное экспрессировать по меньшей мере один полинуклеотид, кодирующий инсектицидный полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 18, и инсектицидный полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 20.
186. Способ контроля популяции насекомого-вредителя, включающий приведение в контакт популяции насекомого-вредителя с инсектицидно эффективным количеством рекомбинантного инсектицидного полипептида, содержащего аминокислотную последовательность с SEQ ID NO: 18, и рекомбинантного инсектицидного полипептида, содержащего аминокислотную последовательность с SEQ ID NO: 20.
187. Способ подавления роста или уничтожения насекомого-вредителя, включающий приведение в контакт насекомого-вредителя с инсектицидно эффективным количеством рекомбинантного инсектицидного полипептида, содержащего аминокислотную последовательность с SEQ ID NO: 18, и рекомбинантного инсектицидного полипептида, содержащего аминокислотную последовательность с SEQ ID NO: 20.
188. Способ контроля популяции насекомого-вредителя, устойчивого к пестицидному белку, включающий приведение в контакт популяции насекомого-вредителя с пестицидно эффективным количеством рекомбинантного полипептида, содержащего аминокислотную последовательность с SEQ ID NO: 18, и рекомбинантного инсектицидного полипептида, содержащего аминокислотную последовательность с SEQ ID NO: 20.
189. Способ защиты растения от насекомого-вредителя, включающий экспрессию в растении или его клетке по меньшей мере одного полинуклеотида, кодирующего инсектицидный полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 18, и инсектицидный полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 20.
190. Способ контроля заражения насекомыми из отряда Lepidoptera и/или Coleoptera у трансгенного растения и обеспечения управления устойчивостью насекомых к пестицидам, включающий экспрессию в растении по меньшей мере одного полинуклеотида, кодирующего по меньшей мере два различных инсектицидных белка, обладающих отличающимися механизмами действия, где один из по меньшей мере двух инсектицидных белков включает инсектицидный полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 18, и рекомбинантный инсектицидный полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 20, инсектицидный в отношении насекомых из отряда Lepidoptera и/или Coleoptera.
191. Способ согласно варианту осуществления 190, где один из по меньшей мере двух инсектицидных белков содержит белок Cry, инсектицидный по отношению к насекомым из отряда Lepidoptera и/или Coleoptera.
192. Способ уменьшения вероятности возникновения устойчивости видов насекомых из отряда Lepidoptera и/или Coleoptera к трансгенным растениям, экспрессирующим в растениях инсектицидные белки для контроля видов насекомых, включающий экспрессию по меньшей мере одного полинуклеотида, кодирующего первый инсектицидный полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 18, и инсектицидный полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 20, инсектицидный в отношении видов насекомых, в комбинации со вторым инсектицидным белком, обладающим отличающимся механизмом действия по сравнению с первым инсектицидным белком.
193. Средства для эффективного управления устойчивостью насекомых из отряда Lepidoptera и/или Coleoptera к пестицидам, включающие совместную экспрессию на высоком уровне в трансгенных растениях двух или более инсектицидных белков, токсичных для насекомых из отряда Lepidoptera и/или Coleoptera, при этом каждых из которых характеризуется отличающимся механизмом осуществления его активности применительно к уничтожению, где один из двух или более инсектицидных белков включает инсектицидный полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 18, и рекомбинантный инсектицидный полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 20, и один из двух или более инсектицидных белков включает белок Cry.
194. Белок слияния, содержащий рекомбинантный полипептид AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49.
195. Белок слияния, содержащий рекомбинантный полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114.
196. Белок слияния, содержащий рекомбинантный полипептид AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 или 49 и рекомбинантный полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113 или 114.
197. Белок слияния, представленный формулой, выбранной из группы, состоящей из
R1-L-R2, R2-L- R1, R1- R2 или R2- R1,
где
R1 представляет собой рекомбинантный полипептид AfIP-1A согласно варианту осуществления 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50, или полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 18;
R2 представляет собой рекомбинантный полипептид AfIP-1B согласно варианту осуществления 98, 99, 100, 101, 102, 103, 104, 105, 106,
107, 108, 109, 110, 111, 112, 113 или 114, или полипептид, содержащий аминокислотную последовательность
с SEQ ID NO: 20, и
L представляет собой линкерный сегмент.
198. Белок слияния согласно варианту осуществления 197, где L представляет собой полипептидный линкер.
199. Белок слияния согласно варианту осуществления 197, где L представляет собой полипептид EEKKN (SEQ ID NO: 153).
200. Белок слияния согласно какому-либо одному или нескольким вариантам осуществления 197, 198 или 199, где R1 представляет собой рекомбинантный полипептид AfIP-1A с SEQ ID NO: 2 или SEQ ID NO: 94, и R2 представляет собой рекомбинантный полипептид AfIP-1B с SEQ ID NO: 4 или SEQ ID NO: 76.
201. Применение трансгенного растения согласно одному или нескольким вариантам осуществления 16-21, 23, 24, 29, 31-34, 79-84, 86, 92, 94-97, 115-118, 141-147, 149, 154, 156, 157, 170-175, 177, 182, 184 или 185 для получения пищевых или кормовых продуктов.
202. Способ получения пищевого или кормового продукта, включающий получение указанного пищевого или указанного кормового продукта из трансгенного растения согласно одному или нескольким вариантам осуществления 16-21, 23, 24, 29, 31-34, 79-84, 86, 92, 94-97, 115-118, 141-147, 149, 154, 156, 157, 170-175, 177, 182, 184 или 185, или его семени или зерна, или его потомства.
203. Пестицидная композиция, содержащая микроорганизм или вещество, выбранное по меньшей мере из одного из:
пестицидно активной Alcaligenes;
микроорганизма, который, как известно, заселяет фитосферу одного или нескольких растений, представляющих интерес, трансформированного полинуклеотидом, кодирующим полипептид AfIP-1A по пункту 1-15, и полинуклеотидом, кодирующим полипептид AfIP-1B по пункту 62-78;
части или продукта переработки пестицидно активной Alcaligenes и
части или продукта переработки микроорганизма, трансформированного полинуклеотидом, кодирующим полипептид AfIP-1A по пункту 1-15, и полинуклеотидом, кодирующим полипептид AfIP-1B по пункту 62-78.
204. Композиция по пункту 203, дополнительно содержащая подходящий с точки зрения сельского хозяйства носитель.
205. Композиция по пункту 202 или 203, где пестицидно активная Alcaligenes представляет собой штамм Alcaligenes faecalis.
206. Композиция по пункту 205, где штамм Alcaligenes faecalis представляет собой DDMC P4G7, депонированный под № доступа NRRL B-50625.
207. Композиция по пункту 203 или 204, где микроорганизм, который, как известно, заселяет фитосферу одного или нескольких растений, представляющих интерес, представляет собой Pseudomonas, Erwinia, Serratia, Klebsiella, Xanthomonas, Streptomyces, Rhizobium, Rhodopseudomonas, Methylius, Agrobacterium, Acetobacter, Lactobacillus, Arthrobacter, Azotobacter, Leuconostoc, а также Alcaligenes, Saccharomyces, Cryptococcus, Kluyveromyces, Sporobolomyces, Rhodotorula и Aureobasidium.
208. Способ контроля популяции вредителя, включающий приведение в контакт популяции вредителя с композицией по пункту 203, 204, 205 или 206.
209. Способ подавления роста или уничтожения насекомого-вредителя, включающий приведение в контакт насекомого-вредителя с композицией по пункту 203, 204, 205 или 206.
210. Способ контроля популяции насекомого-вредителя, устойчивого к пестицидному белку, включающий приведение в контакт популяции устойчивого насекомого-вредителя с композицией по пункту 203, 204, 205 или 206.
211. Способ защиты растения от вредителя, включающий нанесение профилактически эффективного количества композиции по пункту 203, 204, 205 или 206.
212. Способ по пункту 208, 209, 210 или 211, где композицию наносят в виде микробного распыляемого раствора.
213. Способ по пункту 212, где микробный распыляемый раствор представляет собой распыляемый раствор для внекорневого применения.
214. Способ по пункту 208, 209, 210 или 211, где композицию наносят в качестве средства обработки семян.
215. Способ по пункту 214, где композиция дополнительно содержит одно или несколько средств обработки семян, выбранных из гербицида, инсектицида, фунгицида, ингибитора прорастания, усилителя прорастания, регулятора роста растения, бактерицида и нематоцида.
216. Способ по пункту 215, где композицию наносят на возделываемую площадь, растение и/или почву.
217. Способ идентификации Cry3A-перекрестной устойчивости к инсектицидным белкам, включающий скрининг колонии WCRW, устойчивой к mCry3A, в отношении Cry3A-перекрестной устойчивости к инсектицидным белкам.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фигуре 1 показано выравнивание аминокислотной последовательности AfIP-1A-31 (SEQ ID NO: 2) с Slin6118 (SEQ ID NO: 14), FGTW-51 (SEQ ID NO: 18), AfIP-1A-49677 (SEQ ID NO: 786), AfIP-1A-27066 (SEQ ID NO: 32), AfIP-1A_19209 (SEQ ID NO: 778) и AfIP-1A-33585 (SEQ ID NO: 36). Отличия аминокислот между AfIP-1A-31 (SEQ ID NO: 2) и близкими гомологами AfIP-1A-49677 (SEQ ID NO: 786), AfIP-1A-27066 (SEQ ID NO: 32), AfIP-1A_19209 (SEQ ID NO: 778) и AfIP-1A-33585 (SEQ ID NO: 36) отмечены штриховкой. Идентичность аминокислот между AfIP-1A-31 (SEQ ID NO: 2) и Slin6118 (SEQ ID NO: 14) и/или FGTW-51 (SEQ ID NO: 18) отмечена подчеркиванием.
На фигуре 2A-2C показано выравнивание аминокислотной последовательности AfIP-1B-32 (SEQ ID NO: 4) с Slin6117 (SEQ ID NO: 16) и FGTW-52 (SEQ ID NO: 20), AfIP-1B-27066 (SEQ ID NO: 34), AfIP-1B-33585 (SEQ ID NO: 38), AfIP-1B-19209 (SEQ ID NO: 780), AfIP-1B-49677 (SEQ ID NO: 788) и AfIP-1B-43161 (SEQ ID NO: 784). Идентичность аминокислот между AfIP-1B-32 (SEQ ID NO: 4) и Slin6117 (SEQ ID NO: 16) и/или FGTW-52 (SEQ ID NO: 20) отмечена подчеркиванием.
На фигуре 3A-3C показано выравнивание аминокислотных последовательностей: AfIP-1A-31 (SEQ ID NO: 2); близкородственных активных ортологов из Alcaligenes faecalis ; AfIP-1A-15554 (SEQ ID NO: 22), AfIP-1A-27066 (SEQ ID NO: 26) и AfIP-1A-33585 (SEQ ID NO: 30); отдаленно родственного активного гомолога FGTW-51 (SEQ ID NO: 18) и отдаленно родственных эгеролизин-подобных белков: Slin6118_GI_284040949_Aegerolysin_S_linguale (SEQ ID NO: 14), GI_115390458_A_terreus (SEQ ID NO: 124), GI_119487614_N_fischeri (SEQ ID NO: 125), GI_121709507_A_clavatus (SEQ ID NO: 126), GI_145230219_A_niger (SEQ ID NO: 127), GI_145256342_A_niger (SEQ ID NO: 128), GI_152985646_P_aeruginosa_aegerolysin (SEQ ID NO: 130), GI_15595320_P_aeruginosa (SEQ ID NO: 131), GI_158524422_R_australe (SEQ ID NO: 132), GI_169772307_A_oryzae (SEQ ID NO: 133), GI_169777319_A_oryzae (SEQ ID NO: 134), GI_169785219_A_oryzae (SEQ ID NO: 135), GI_186897694_H_annosum (SEQ ID NO: 136), GI_2292820_C_bifermentans (SEQ ID NO: 137), GI_2292821_C_bifermentans (SEQ ID NO: 138), GI_24636240_A_aegerita_Aegerolysin (SEQ ID NO: 139), GI_26112720_B_vulgaris (SEQ ID NO: 140), GI_46507636_L_multiflorum (SEQ ID NO: 141), GI_54312022_P_ostreatus_pleurotolysin (SEQ ID NO: 142), GI_60461919_P_ostretus_ostreolysin(SEQ ID NO: 143), GI_67522192_A_nidulans (SEQ ID NO: 144), GI_70985747_A_fumigatus_hemolysin (SEQ ID NO: 145), GI_90639437_T_versicolor (SEQ ID NO: 146) и GI_238581050_M_perniciosa (SEQ ID NO: 147. Мотив 1 (а.к. 15-26), мотив 2 (а.к. 33-53), мотив 3 (а.к. 71-84) и мотив 4 (а.к. 100-107) из SEQ ID NO: 2 подчеркнуты.
На фигуре 4 показано выравнивание аминокислотной последовательности AfIP-1B-32 (SEQ ID NO: 4) и FGTW-52 (SEQ ID NO: 20) и соответствие аминокислот из SEQ ID NO: 20 аминокислотам из SEQ ID NO: 4.
На фигуре 5 показано выравнивание аминокислотной последовательности AfIP-1A-31 (SEQ ID NO: 2), FGTW-51 (SEQ ID NO: 18), Slin6118_GI_284040949_Aegerolysin_S_linguale (SEQ ID NO: 14) и Cry34-подобных белков: Cry34Aa2_AAK64560 (SEQ ID NO: 119), Cry34Ab1_AAG41671 (SEQ ID NO: 120), Cry34Ac1_AAG50118 (SEQ ID NO: 121), Cry34Ac2_AAK64562 (SEQ ID NO: 122), Cry34Ba1_AAK64566 (SEQ ID NO: 123), GI_49175503_Bt_Cry34A_подобный (SEQ ID NO: 148).
На фигуре 6 показано выравнивание аминокислотной последовательности AfIP-1A-31 (SEQ ID NO: 2), FGTW-51 (SEQ ID NO: 18), Slin6118_GI_284040949_Aegerolysin_S_linguale (SEQ ID NO: 14) и белка Cry3A с SEQ ID NO: 276.
На фигуре 7 показано выравнивание аминокислотной последовательности AfIP-1B-32 (SEQ ID NO: 4) и белка Cry3A с SEQ ID NO: 276.
На фигуре 8 показана противогрибковая активность AfIP-1A-31 (SEQ ID NO: 2) и AfIP-1B-32 (SEQ ID NO: 4) отдельно и вместе против патогенных грибов Fusarium virguliforme (FVR), Fusarium oxysporum (FOS), Fusarium graminearum (FGR), Colletotrichum graminicola (CGR) и Exserohilum turcicum (ETC).
На фигуре 9 показаны результаты теста эффективности в теплице применительно к T0-растениям PHP51688. Ось Y 'балл' представляет собой балл повреждения узлов кукурузным жуком (CRWNIS), где 0 обозначает отсутствие повреждения, 2 обозначает два поврежденных узла.
На фигуре 10 показаны результаты c применением T1 трансгенного объекта PHP51688. Ось Y 'балл' представляет собой балл повреждения узлов кукурузным жуком (CRWNIS), где 0 обозначает отсутствие повреждения, 2 обозначает два поврежденных узла.
На фигуре 11 показаны результаты теста эффективности в теплице применительно к T0-растениям PHP53521. Ось Y 'балл' представляет собой балл повреждения узлов кукурузным жуком (CRWNIS), где 0 обозначает отсутствие повреждения, 2 обозначает два поврежденных узла.
На фигуре 12 показана стратегия ПЦР-мутагенеза, применяемая для получения вариантов AfIP-1A-31 с несколькими аминокислотными заменами в мотиве 2 (пример 25), вариантов AfIP-1A-31 с несколькими аминокислотными заменами в мотиве 5 (пример 26) и вариантов AfIP-1A-31 с несколькими аминокислотными заменами в мотиве 2 и мотиве 5 (пример 27).
На фигуре 13 показана стратегия ПЦР-мутагенеза, применяемая для получения вариантов AfIP-1B-32 с несколькими аминокислотными заменами в мотиве 5 (пример 28).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следует понимать, что настоящее раскрытие не ограничивается конкретными описанными методиками, протоколами, клеточными линиями, родами и реагентами, в связи с этим они могут варьировать. Также следует понимать, что терминология, применяемая в данном документе, предназначена лишь для описания конкретных вариантов осуществления и не подразумевается как ограничивающая объем настоящего раскрытия.
Применяемые в данном документе формы единственного числа включают ссылки на множественное число, если контекст явно не предписывает иное. Так, например, ссылка на "клетку" включает множество таких клеток и ссылка на "белок" включает ссылку на один или несколько белков или их эквивалентов, известных специалистам в данной области техники, и т.д. Все технические и научные термины, применяемые в данном документе, имеют то же самое значение, как обычно понимается специалистом в области техники, к которой принадлежит настоящее раскрытие, если явно не указано иное.
Настоящее раскрытие представляет композиции и способы контроля вредителей. Способы включают трансформацию организмов последовательностями нуклеиновой кислоты, кодирующими полипептиды AfIP-1A и/или AfIP-1B. В частности, последовательности нуклеиновой кислоты согласно вариантам осуществления применимы для получения растений и микроорганизмов, которые обладают пестицидной активностью. Таким образом, предусматриваются трансформированные бактерии, растения, растительные клетки, растительные ткани и семена. Композиции представляют собой пестицидные нуклеиновые кислоты и белки из видов бактерий. Последовательности нуклеиновой кислоты находят применение в конструировании векторов экспрессии для последующей трансформации организмов, представляющих интерес, в качестве зондов для выделения других гомологичных (или частично гомологичных) генов и для создания измененных полипептидов AfIP-1A и AfIP-1B при помощи способов, известных в данной области техники, таких как сайт-направленный мутагенез, замена доменов или ДНК-шаффлинг. Полипептиды AfIP-1A и AfIP-1B находят применение в контроле или уничтожении популяций чешуекрылых, жесткокрылых, двукрылых, грибковых, полужесткокрылых и нематодных вредителей и для получения композиций с пестицидной активностью. Насекомые-вредители, представляющие интерес, включают без ограничения виды из отряда Lepidoptera, в том числе без ограничения: моль капустную, например, Helicoverpa zea Boddie; соевую совку, например, Pseudoplusia includens Walker и бобовую гусеницу, например, Anticarsia gemmatalis Hübner, и виды из отряда Coleoptera, в том числе без ограничения западного кукурузного жука (Diabrotica virgifera) - WCRW, южного кукурузного жука (Diabrotica undecimpunctata howardi) - SCRW и северного кукурузного жука (Diabrotica barberi) - NCRW.
Под “пестицидным токсином” или “пестицидным белком”, как применяется в настоящем документе, подразумевают токсин, который обладает токсической активностью в отношении одного или нескольких вредителей, в том числе без ограничения представителей отряда Lepidoptera, Diptera, Hemiptera и Coleoptera или типа Nematoda, или белок, который характеризуется гомологией с таким белком. Пестицидные белки были выделены из организмов, в том числе, например, Bacillus sp., Pseudomonas sp., Photorhabdus sp., Xenorhabdus sp., Clostridium bifermentans и Paenibacillus popilliae. Пестицидные белки включают без ограничения: инсектицидные белки из Pseudomonas sp., такие как PSEEN3174 (Monalysin; (2011) PLoS Pathogens 7:1-13); из штамма CHA0 и Pf-5 Pseudomonas protegens (ранее fluorescens) (Pechy-Tarr, (2008) Environmental Microbiology 10:2368-2386; № доступа в GenBank EU400157); из Pseudomonas Taiwanensis (Liu, et al., (2010) J. Agric. Food Chem., 58:12343-12349) и из Pseudomonas pseudoalcligenes (Zhang, et al., (2009) Annals of Microbiology 59:45-50 и Li, et al., (2007) Plant Cell Tiss. Organ Cult. 89:159-168); инсектицидные белки из Photorhabdus sp. и Xenorhabdus sp. (Hinchliffe, et al., (2010) The Open Toxinology Journal, 3:101-118 и Morgan, et al., (2001) Applied and Envir. Micro. 67:2062-2069); патент США № 6048838 и патент США № 6379946; полипептид PIP-1 из публикации заявки на патент США с серийным номером 13792861; полипептид AfIP-1A и/или AfIP-1B из публикации заявки на патент США с серийным номером 13/800233; полипептид PHI-4 из публикации заявки на патент США с серийным номером 13/839702 и δ-эндотоксины, в том числе, без ограничения, классы генов δ-эндотоксинов Cry1, Cry2, Cry3, Cry4, Cry5, Cry6, Cry7, Cry8, Cry9, Cry10, Cry11, Cry12, Cry13, Cry14, Cry15, Cry16, Cry17, Cry18, Cry19, Cry20, Cry21, Cry22, Cry23, Cry24, Cry25, Cry26, Cry27, Cry 28, Cry 29, Cry 30, Cry31, Cry32, Cry33, Cry34, Cry35, Cry36, Cry37, Cry38, Cry39, Cry40, Cry41, Cry42, Cry43, Cry44, Cry45, Cry 46, Cry47, Cry49, Cry 51 и Cry55, и гены цитолитических cyt1 и cyt2 B. thuringiensis. Представители этих классов инсектицидных белков B. thuringiensis включают без ограничения Cry1Aa1 (№ доступа AAA22353); Cry1Aa2 (№ доступа AAA22552); Cry1Aa3 (№ доступа BAA00257); Cry1Aa4 (№ доступа CAA31886); Cry1Aa5 (№ доступа BAA04468); Cry1Aa6 (№ доступа AAA86265); Cry1Aa7 (№ доступа AAD46139); Cry1Aa8 (№ доступа I26149); Cry1Aa9 (№ доступа BAA77213); Cry1Aa10 (№ доступа AAD55382); Cry1Aa11 (№ доступа CAA70856); Cry1Aa12 (№ доступа AAP80146); Cry1Aa13 (№ доступа AAM44305); Cry1Aa14 (№ доступа AAP40639); Cry1Aa15 (№ доступа AAY66993); Cry1Aa16 (№ доступа HQ439776); Cry1Aa17 (№ доступа HQ439788); Cry1Aa18 (№ доступа HQ439790); Cry1Aa19 (№ доступа HQ685121); Cry1Aa20 (№ доступа JF340156); Cry1Aa21 (№ доступа JN651496); Cry1Aa22 (№ доступа KC158223); Cry1Ab1 (№ доступа AAA22330); Cry1Ab2 (№ доступа AAA22613); Cry1Ab3 (№ доступа AAA22561); Cry1Ab4 (№ доступа BAA00071); Cry1Ab5 (№ доступа CAA28405); Cry1Ab6 (№ доступа AAA22420); Cry1Ab7 (№ доступа CAA31620); Cry1Ab8 (№ доступа AAA22551); Cry1Ab9 (№ доступа CAA38701); Cry1Ab10 (№ доступа A29125); Cry1Ab11 (№ доступа I12419); Cry1Ab12 (№ доступа AAC64003); Cry1Ab13 (№ доступа AAN76494); Cry1Ab14 (№ доступа AAG16877); Cry1Ab15 (№ доступа AAO13302); Cry1Ab16 (№ доступа AAK55546); Cry1Ab17 (№ доступа AAT46415); Cry1Ab18 (№ доступа AAQ88259); Cry1Ab19 (№ доступа AAW31761); Cry1Ab20 (№ доступа ABB72460); Cry1Ab21 (№ доступа ABS18384); Cry1Ab22 (№ доступа ABW87320); Cry1Ab23 (№ доступа HQ439777); Cry1Ab24 (№ доступа HQ439778); Cry1Ab25 (№ доступа HQ685122); Cry1Ab26 (№ доступа HQ847729); Cry1Ab27 (№ доступа JN135249); Cry1Ab28 (№ доступа JN135250); Cry1Ab29 (№ доступа JN135251); Cry1Ab30 (№ доступа JN135252); Cry1Ab31 (№ доступа JN135253); Cry1Ab32 (№ доступа JN135254); Cry1Ab33 (№ доступа AAS93798); Cry1Ab34 (№ доступа KC156668); Cry1Ab-подобный (№ доступа AAK14336); Cry1Ab-подобный (№ доступа AAK14337); Cry1Ab-подобный (№ доступа AAK14338); Cry1Ab-подобный (№ доступа ABG88858); Cry1Ac1 (№ доступа AAA22331); Cry1Ac2 (№ доступа AAA22338); Cry1Ac3 (№ доступа CAA38098); Cry1Ac4 (№ доступа AAA73077); Cry1Ac5 (№ доступа AAA22339); Cry1Ac6 (№ доступа AAA86266); Cry1Ac7 (№ доступа AAB46989); Cry1Ac8 (№ доступа AAC44841); Cry1Ac9 (№ доступа AAB49768); Cry1Ac10 (№ доступа CAA05505); Cry1Ac11 (№ доступа CAA10270); Cry1Ac12 (№ доступа I12418); Cry1Ac13 (№ доступа AAD38701); Cry1Ac14 (№ доступа AAQ06607); Cry1Ac15 (№ доступа AAN07788); Cry1Ac16 (№ доступа AAU87037); Cry1Ac17 (№ доступа AAX18704); Cry1Ac18 (№ доступа AAY88347); Cry1Ac19 (№ доступа ABD37053); Cry1Ac20 (№ доступа ABB89046); Cry1Ac21 (№ доступа AAY66992); Cry1Ac22 (№ доступа ABZ01836); Cry1Ac23 (№ доступа CAQ30431); Cry1Ac24 (№ доступа ABL01535); Cry1Ac25 (№ доступа FJ513324); Cry1Ac26 (№ доступа FJ617446); Cry1Ac27 (№ доступа FJ617447); Cry1Ac28 (№ доступа ACM90319); Cry1Ac29 (№ доступа DQ438941); Cry1Ac30 (№ доступа GQ227507); Cry1Ac31 (№ доступа GU446674); Cry1Ac32 (№ доступа HM061081); Cry1Ac33 (№ доступа GQ866913); Cry1Ac34 (№ доступа HQ230364); Cry1Ac35 (№ доступа JF340157); Cry1Ac36 (№ доступа JN387137); Cry1Ac37 (№ доступа JQ317685); Cry1Ad1 (№ доступа AAA22340); Cry1Ad2 (№ доступа CAA01880); Cry1Ae1 (№ доступа AAA22410); Cry1Af1 (№ доступа AAB82749); Cry1Ag1 (№ доступа AAD46137); Cry1Ah1 (№ доступа AAQ14326); Cry1Ah2 (№ доступа ABB76664); Cry1Ah3 (№ доступа HQ439779); Cry1Ai1 (№ доступа AAO39719); Cry1Ai2 (№ доступа HQ439780); Cry1A-подобный (№ доступа AAK14339); Cry1Ba1 (№ доступа CAA29898); Cry1Ba2 (№ доступа CAA65003); Cry1Ba3 (№ доступа AAK63251); Cry1Ba4 (№ доступа AAK51084); Cry1Ba5 (№ доступа ABO20894); Cry1Ba6 (№ доступа ABL60921); Cry1Ba7 (№ доступа HQ439781); Cry1Bb1 (№ доступа AAA22344); Cry1Bb2 (№ доступа HQ439782); Cry1Bc1 (№ доступа CAA86568); Cry1Bd1 (№ доступа AAD10292); Cry1Bd2 (№ доступа AAM93496); Cry1Be1 (№ доступа AAC32850); Cry1Be2 (№ доступа AAQ52387); Cry1Be3 (№ доступа ACV96720); Cry1Be4 (№ доступа HM070026); Cry1Bf1 (№ доступа CAC50778); Cry1Bf2 (№ доступа AAQ52380); Cry1Bg1 (№ доступа AAO39720); Cry1Bh1 (№ доступа HQ589331); Cry1Bi1 (№ доступа KC156700); Cry1Ca1 (№ доступа CAA30396); Cry1Ca2 (№ доступа CAA31951); Cry1Ca3 (№ доступа AAA22343); Cry1Ca4 (№ доступа CAA01886); Cry1Ca5 (№ доступа CAA65457); Cry1Ca6 [1] (№ доступа AAF37224); Cry1Ca7 (№ доступа AAG50438); Cry1Ca8 (№ доступа AAM00264); Cry1Ca9 (№ доступа AAL79362); Cry1Ca10 (№ доступа AAN16462); Cry1Ca11 (№ доступа AAX53094); Cry1Ca12 (№ доступа HM070027); Cry1Ca13 (№ доступа HQ412621); Cry1Ca14 (№ доступа JN651493); Cry1Cb1 (№ доступа M97880); Cry1Cb2 (№ доступа AAG35409); Cry1Cb3 (№ доступа ACD50894); Cry1Cb-подобный (№ доступа AAX63901); Cry1Da1 (№ доступа CAA38099); Cry1Da2 (№ доступа I76415); Cry1Da3 (№ доступа HQ439784); Cry1Db1 (№ доступа CAA80234); Cry1Db2 (№ доступа AAK48937); Cry1Dc1 (№ доступа ABK35074); Cry1Ea1 (№ доступа CAA37933); Cry1Ea2 (№ доступа CAA39609); Cry1Ea3 (№ доступа AAA22345); Cry1Ea4 (№ доступа AAD04732); Cry1Ea5 (№ доступа A15535); Cry1Ea6 (№ доступа AAL50330); Cry1Ea7 (№ доступа AAW72936); Cry1Ea8 (№ доступа ABX11258); Cry1Ea9 (№ доступа HQ439785); Cry1Ea10 (№ доступа ADR00398); Cry1Ea11 (№ доступа JQ652456); Cry1Eb1 (№ доступа AAA22346); Cry1Fa1 (№ доступа AAA22348); Cry1Fa2 (№ доступа AAA22347); Cry1Fa3 (№ доступа HM070028); Cry1Fa4 (№ доступа HM439638); Cry1Fb1 (№ доступа CAA80235); Cry1Fb2 (№ доступа BAA25298); Cry1Fb3 (№ доступа AAF21767); Cry1Fb4 (№ доступа AAC10641); Cry1Fb5 (№ доступа AAO13295); Cry1Fb6 (№ доступа ACD50892); Cry1Fb7 (№ доступа ACD50893); Cry1Ga1 (№ доступа CAA80233); Cry1Ga2 (№ доступа CAA70506); Cry1Gb1 (№ доступа AAD10291); Cry1Gb2 (№ доступа AAO13756); Cry1Gc1 (№ доступа AAQ52381); Cry1Ha1 (№ доступа CAA80236); Cry1Hb1 (№ доступа AAA79694); Cry1Hb2 (№ доступа HQ439786); Cry1H-подобный (№ доступа AAF01213); Cry1Ia1 (№ доступа CAA44633); Cry1Ia2 (№ доступа AAA22354); Cry1Ia3 (№ доступа AAC36999); Cry1Ia4 (№ доступа AAB00958); Cry1Ia5 (№ доступа CAA70124); Cry1Ia6 (№ доступа AAC26910); Cry1Ia7 (№ доступа AAM73516); Cry1Ia8 (№ доступа AAK66742); Cry1Ia9 (№ доступа AAQ08616); Cry1Ia10 (№ доступа AAP86782); Cry1Ia11 (№ доступа CAC85964); Cry1Ia12 (№ доступа AAV53390); Cry1Ia13 (№ доступа ABF83202); Cry1Ia14 (№ доступа ACG63871); Cry1Ia15 (№ доступа FJ617445); Cry1Ia16 (№ доступа FJ617448); Cry1Ia17 (№ доступа GU989199); Cry1Ia18 (№ доступа ADK23801); Cry1Ia19 (№ доступа HQ439787); Cry1Ia20 (№ доступа JQ228426); Cry1Ia21 (№ доступа JQ228424); Cry1Ia22 (№ доступа JQ228427); Cry1Ia23 (№ доступа JQ228428); Cry1Ia24 (№ доступа JQ228429); Cry1Ia25 (№ доступа JQ228430); Cry1Ia26 (№ доступа JQ228431); Cry1Ia27 (№ доступа JQ228432); Cry1Ia28 (№ доступа JQ228433); Cry1Ia29 (№ доступа JQ228434); Cry1Ia30 (№ доступа JQ317686); Cry1Ia31 (№ доступа JX944038); Cry1Ia32 (№ доступа JX944039); Cry1Ia33 (№ доступа JX944040); Cry1Ib1 (№ доступа AAA82114); Cry1Ib2 (№ доступа ABW88019); Cry1Ib3 (№ доступа ACD75515); Cry1Ib4 (№ доступа HM051227); Cry1Ib5 (№ доступа HM070028); Cry1Ib6 (№ доступа ADK38579); Cry1Ib7 (№ доступа JN571740); Cry1Ib8 (№ доступа JN675714); Cry1Ib9 (№ доступа JN675715); Cry1Ib10 (№ доступа JN675716); Cry1Ib11 (№ доступа JQ228423); Cry1Ic1 (№ доступа AAC62933); Cry1Ic2 (№ доступа AAE71691); Cry1Id1 (№ доступа AAD44366); Cry1Id2 (№ доступа JQ228422); Cry1Ie1 (№ доступа AAG43526); Cry1Ie2 (№ доступа HM439636); Cry1Ie3 (№ доступа KC156647); Cry1Ie4 (№ доступа KC156681); Cry1If1 (№ доступа AAQ52382); Cry1Ig1 (№ доступа KC156701); Cry1I-подобный (№ доступа AAC31094); Cry1I-подобный (№ доступа ABG88859); Cry1Ja1 (№ доступа AAA22341); Cry1Ja2 (№ доступа HM070030); Cry1Ja3 (№ доступа JQ228425); Cry1Jb1 (№ доступа AAA98959); Cry1Jc1 (№ доступа AAC31092); Cry1Jc2 (№ доступа AAQ52372); Cry1Jd1 (№ доступа CAC50779); Cry1Ka1 (№ доступа AAB00376); Cry1Ka2 (№ доступа HQ439783); Cry1La1 (№ доступа AAS60191); Cry1La2 (№ доступа HM070031); Cry1Ma1 (№ доступа FJ884067); Cry1Ma2 (№ доступа KC156659); Cry1Na1 (№ доступа KC156648); Cry1Nb1 (№ доступа KC156678); Cry1-подобный (№ доступа AAC31091); Cry2Aa1 (№ доступа AAA22335); Cry2Aa2 (№ доступа AAA83516); Cry2Aa3 (№ доступа D86064); Cry2Aa4 (№ доступа AAC04867); Cry2Aa5 (№ доступа CAA10671); Cry2Aa6 (№ доступа CAA10672); Cry2Aa7 (№ доступа CAA10670); Cry2Aa8 (№ доступа AAO13734); Cry2Aa9 (№ доступа AAO13750); Cry2Aa10 (№ доступа AAQ04263); Cry2Aa11 (№ доступа AAQ52384); Cry2Aa12 (№ доступа ABI83671); Cry2Aa13 (№ доступа ABL01536); Cry2Aa14 (№ доступа ACF04939); Cry2Aa15 (№ доступа JN426947); Cry2Ab1 (№ доступа AAA22342); Cry2Ab2 (№ доступа CAA39075); Cry2Ab3 (№ доступа AAG36762); Cry2Ab4 (№ доступа AAO13296); Cry2Ab5 (№ доступа AAQ04609); Cry2Ab6 (№ доступа AAP59457); Cry2Ab7 (№ доступа AAZ66347); Cry2Ab8 (№ доступа ABC95996); Cry2Ab9 (№ доступа ABC74968); Cry2Ab10 (№ доступа EF157306); Cry2Ab11 (№ доступа CAM84575); Cry2Ab12 (№ доступа ABM21764); Cry2Ab13 (№ доступа ACG76120); Cry2Ab14 (№ доступа ACG76121); Cry2Ab15 (№ доступа HM037126); Cry2Ab16 (№ доступа GQ866914); Cry2Ab17 (№ доступа HQ439789); Cry2Ab18 (№ доступа JN135255); Cry2Ab19 (№ доступа JN135256); Cry2Ab20 (№ доступа JN135257); Cry2Ab21 (№ доступа JN135258); Cry2Ab22 (№ доступа JN135259); Cry2Ab23 (№ доступа JN135260); Cry2Ab24 (№ доступа JN135261); Cry2Ab25 (№ доступа JN415485); Cry2Ab26 (№ доступа JN426946); Cry2Ab27 (№ доступа JN415764); Cry2Ab28 (№ доступа JN651494); Cry2Ac1 (№ доступа CAA40536); Cry2Ac2 (№ доступа AAG35410); Cry2Ac3 (№ доступа AAQ52385); Cry2Ac4 (№ доступа ABC95997); Cry2Ac5 (№ доступа ABC74969); Cry2Ac6 (№ доступа ABC74793); Cry2Ac7 (№ доступа CAL18690); Cry2Ac8 (№ доступа CAM09325); Cry2Ac9 (№ доступа CAM09326); Cry2Ac10 (№ доступа ABN15104); Cry2Ac11 (№ доступа CAM83895); Cry2Ac12 (№ доступа CAM83896); Cry2Ad1 (№ доступа AAF09583); Cry2Ad2 (№ доступа ABC86927); Cry2Ad3 (№ доступа CAK29504); Cry2Ad4 (№ доступа CAM32331); Cry2Ad5 (№ доступа CAO78739 ); Cry2Ae1 (№ доступа AAQ52362); Cry2Af1 (№ доступа ABO30519); Cry2Af2 (№ доступа GQ866915); Cry2Ag1 (№ доступа ACH91610); Cry2Ah1 (№ доступа EU939453); Cry2Ah2 (№ доступа ACL80665); Cry2Ah3 (№ доступа GU073380); Cry2Ah4 (№ доступа KC156702); Cry2Ai1 (№ доступа FJ788388); Cry2Aj (№ доступа ); Cry2Ak1 (№ доступа KC156660); Cry2Ba1 (№ доступа KC156658); Cry3Aa1 (№ доступа AAA22336); Cry3Aa2 (№ доступа AAA22541); Cry3Aa3 (№ доступа CAA68482); Cry3Aa4 (№ доступа AAA22542); Cry3Aa5 (№ доступа AAA50255); Cry3Aa6 (№ доступа AAC43266); Cry3Aa7 (№ доступа CAB41411); Cry3Aa8 (№ доступа AAS79487); Cry3Aa9 (№ доступа AAW05659); Cry3Aa10 (№ доступа AAU29411); Cry3Aa11 (№ доступа AAW82872); Cry3Aa12 (№ доступа ABY49136); Cry3Ba1 (№ доступа CAA34983); Cry3Ba2 (№ доступа CAA00645); Cry3Ba3 (№ доступа JQ397327); Cry3Bb1 (№ доступа AAA22334); Cry3Bb2 (№ доступа AAA74198); Cry3Bb3 (№ доступа I15475); Cry3Ca1 (№ доступа CAA42469); Cry4Aa1 (№ доступа CAA68485); Cry4Aa2 (№ доступа BAA00179); Cry4Aa3 (№ доступа CAD30148); Cry4Aa4 (№ доступа AFB18317); Cry4A-подобный (№ доступа AAY96321); Cry4Ba1 (№ доступа CAA30312); Cry4Ba2 (№ доступа CAA30114); Cry4Ba3 (№ доступа AAA22337); Cry4Ba4 (№ доступа BAA00178); Cry4Ba5 (№ доступа CAD30095); Cry4Ba-подобный (№ доступа ABC47686); Cry4Ca1 (№ доступа EU646202); Cry4Cb1 (№ доступа FJ403208); Cry4Cb2 (№ доступа FJ597622); Cry4Cc1 (№ доступа FJ403207); Cry5Aa1 (№ доступа AAA67694); Cry5Ab1 (№ доступа AAA67693); Cry5Ac1 (№ доступа I34543); Cry5Ad1 (№ доступа ABQ82087); Cry5Ba1 (№ доступа AAA68598); Cry5Ba2 (№ доступа ABW88931); Cry5Ba3 (№ доступа AFJ04417); Cry5Ca1 (№ доступа HM461869); Cry5Ca2 (№ доступа ZP_04123426); Cry5Da1 (№ доступа HM461870); Cry5Da2 (№ доступа ZP_04123980); Cry5Ea1 (№ доступа HM485580); Cry5Ea2 (№ доступа ZP_04124038); Cry6Aa1 (№ доступа AAA22357); Cry6Aa2 (№ доступа AAM46849); Cry6Aa3 (№ доступа ABH03377); Cry6Ba1 (№ доступа AAA22358); Cry7Aa1 (№ доступа AAA22351); Cry7Ab1 (№ доступа AAA21120); Cry7Ab2 (№ доступа AAA21121); Cry7Ab3 (№ доступа ABX24522); Cry7Ab4 (№ доступа EU380678); Cry7Ab5 (№ доступа ABX79555); Cry7Ab6 (№ доступа ACI44005); Cry7Ab7 (№ доступа ADB89216); Cry7Ab8 (№ доступа GU145299); Cry7Ab9 (№ доступа ADD92572); Cry7Ba1 (№ доступа ABB70817); Cry7Bb1 (№ доступа KC156653); Cry7Ca1 (№ доступа ABR67863); Cry7Cb1 (№ доступа KC156698); Cry7Da1 (№ доступа ACQ99547); Cry7Da2 (№ доступа HM572236); Cry7Da3 (№ доступа KC156679); Cry7Ea1 (№ доступа HM035086); Cry7Ea2 (№ доступа HM132124); Cry7Ea3 (№ доступа EEM19403); Cry7Fa1 (№ доступа HM035088); Cry7Fa2 (№ доступа EEM19090); Cry7Fb1 (№ доступа HM572235); Cry7Fb2 (№ доступа KC156682); Cry7Ga1 (№ доступа HM572237); Cry7Ga2 (№ доступа KC156669); Cry7Gb1 (№ доступа KC156650); Cry7Gc1 (№ доступа KC156654); Cry7Gd1 (№ доступа KC156697); Cry7Ha1 (№ доступа KC156651); Cry7Ia1 (№ доступа KC156665); Cry7Ja1 (№ доступа KC156671); Cry7Ka1 (№ доступа KC156680); Cry7Kb1 (№ доступа BAM99306); Cry7La1 (№ доступа BAM99307); Cry8Aa1 (№ доступа AAA21117); Cry8Ab1 (№ доступа EU044830); Cry8Ac1 (№ доступа KC156662); Cry8Ad1 (№ доступа KC156684); Cry8Ba1 (№ доступа AAA21118); Cry8Bb1 (№ доступа CAD57542); Cry8Bc1 (№ доступа CAD57543); Cry8Ca1 (№ доступа AAA21119); Cry8Ca2 (№ доступа AAR98783); Cry8Ca3 (№ доступа EU625349); Cry8Ca4 (№ доступа ADB54826); Cry8Da1 (№ доступа BAC07226); Cry8Da2 (№ доступа BD133574); Cry8Da3 (№ доступа BD133575); Cry8Db1 (№ доступа BAF93483); Cry8Ea1 (№ доступа AAQ73470); Cry8Ea2 (№ доступа EU047597); Cry8Ea3 (№ доступа KC855216); Cry8Fa1 (№ доступа AAT48690); Cry8Fa2 (№ доступа HQ174208); Cry8Fa3 (№ доступа AFH78109); Cry8Ga1 (№ доступа AAT46073); Cry8Ga2 (№ доступа ABC42043); Cry8Ga3 (№ доступа FJ198072); Cry8Ha1 (№ доступа AAW81032); Cry8Ia1 (№ доступа EU381044); Cry8Ia2 (№ доступа GU073381); Cry8Ia3 (№ доступа HM044664); Cry8Ia4 (№ доступа KC156674); Cry8Ib1 (№ доступа GU325772); Cry8Ib2 (№ доступа KC156677); Cry8Ja1 (№ доступа EU625348); Cry8Ka1 (№ доступа FJ422558); Cry8Ka2 (№ доступа ACN87262); Cry8Kb1 (№ доступа HM123758); Cry8Kb2 (№ доступа KC156675); Cry8La1 (№ доступа GU325771); Cry8Ma1 (№ доступа HM044665); Cry8Ma2 (№ доступа EEM86551); Cry8Ma3 (№ доступа HM210574); Cry8Na1 (№ доступа HM640939); Cry8Pa1 (№ доступа HQ388415); Cry8Qa1 (№ доступа HQ441166); Cry8Qa2 (№ доступа KC152468); Cry8Ra1 (№ доступа AFP87548); Cry8Sa1 (№ доступа JQ740599); Cry8Ta1 (№ доступа KC156673); Cry8-подобный (№ доступа FJ770571); Cry8-подобный (№ доступа ABS53003); Cry9Aa1 (№ доступа CAA41122); Cry9Aa2 (№ доступа CAA41425); Cry9Aa3 (№ доступа GQ249293); Cry9Aa4 (№ доступа GQ249294); Cry9Aa5 (№ доступа JX174110); Cry9Aa-подобный (№ доступа AAQ52376); Cry9Ba1 (№ доступа CAA52927); Cry9Ba2 (№ доступа GU299522); Cry9Bb1 (№ доступа AAV28716); Cry9Ca1 (№ доступа CAA85764); Cry9Ca2 (№ доступа AAQ52375); Cry9Da1 (№ доступа BAA19948); Cry9Da2 (№ доступа AAB97923); Cry9Da3 (№ доступа GQ249293); Cry9Da4 (№ доступа GQ249297); Cry9Db1 (№ доступа AAX78439); Cry9Dc1 (№ доступа KC156683); Cry9Ea1 (№ доступа BAA34908); Cry9Ea2 (№ доступа AAO12908); Cry9Ea3 (№ доступа ABM21765); Cry9Ea4 (№ доступа ACE88267); Cry9Ea5 (№ доступа ACF04743); Cry9Ea6 (№ доступа ACG63872); Cry9Ea7 (№ доступа FJ380927); Cry9Ea8 (№ доступа GQ249292); Cry9Ea9 (№ доступа JN651495); Cry9Eb1 (№ доступа CAC50780); Cry9Eb2 (№ доступа GQ249298); Cry9Eb3 (№ доступа KC156646); Cry9Ec1 (№ доступа AAC63366); Cry9Ed1 (№ доступа AAX78440); Cry9Ee1 (№ доступа GQ249296); Cry9Ee2 (№ доступа KC156664); Cry9Fa1 (№ доступа KC156692); Cry9Ga1 (№ доступа KC156699); Cry9-подобный (№ доступа AAC63366); Cry10Aa1 (№ доступа AAA22614); Cry10Aa2 (№ доступа E00614); Cry10Aa3 (№ доступа CAD30098); Cry10Aa4 (№ доступа AFB18318); Cry10A-подобный (№ доступа DQ167578); Cry11Aa1 (№ доступа AAA22352); Cry11Aa2 (№ доступа AAA22611); Cry11Aa3 (№ доступа CAD30081); Cry11Aa4 (№ доступа AFB18319); Cry11Aa-подобный (№ доступа DQ166531); Cry11Ba1 (№ доступа CAA60504); Cry11Bb1 (№ доступа AAC97162); Cry11Bb2 (№ доступа HM068615); Cry12Aa1 (№ доступа AAA22355); Cry13Aa1 (№ доступа AAA22356); Cry14Aa1 (№ доступа AAA21516); Cry14Ab1 (№ доступа KC156652); Cry15Aa1 (№ доступа AAA22333); Cry16Aa1 (№ доступа CAA63860); Cry17Aa1 (№ доступа CAA67841); Cry18Aa1 (№ доступа CAA67506); Cry18Ba1 (№ доступа AAF89667); Cry18Ca1 (№ доступа AAF89668); Cry19Aa1 (№ доступа CAA68875); Cry19Ba1 (№ доступа BAA32397); Cry19Ca1 (№ доступа AFM37572); Cry20Aa1 (№ доступа AAB93476); Cry20Ba1 (№ доступа ACS93601); Cry20Ba2 (№ доступа KC156694); Cry20-подобный (№ доступа GQ144333); Cry21Aa1 (№ доступа I32932); Cry21Aa2 (№ доступа I66477); Cry21Ba1 (№ доступа BAC06484); Cry21Ca1 (№ доступа JF521577); Cry21Ca2 (№ доступа KC156687); Cry21Da1 (№ доступа JF521578); Cry22Aa1 (№ доступа I34547); Cry22Aa2 (№ доступа CAD43579); Cry22Aa3 (№ доступа ACD93211); Cry22Ab1 (№ доступа AAK50456); Cry22Ab2 (№ доступа CAD43577); Cry22Ba1 (№ доступа CAD43578); Cry22Bb1 (№ доступа KC156672); Cry23Aa1 (№ доступа AAF76375); Cry24Aa1 (№ доступа AAC61891); Cry24Ba1 (№ доступа BAD32657); Cry24Ca1 (№ доступа CAJ43600); Cry25Aa1 (№ доступа AAC61892); Cry26Aa1 (№ доступа AAD25075); Cry27Aa1 (№ доступа BAA82796); Cry28Aa1 (№ доступа AAD24189); Cry28Aa2 (№ доступа AAG00235); Cry29Aa1 (№ доступа CAC80985); Cry30Aa1 (№ доступа CAC80986); Cry30Ba1 (№ доступа BAD00052); Cry30Ca1 (№ доступа BAD67157); Cry30Ca2 (№ доступа ACU24781); Cry30Da1 (№ доступа EF095955); Cry30Db1 (№ доступа BAE80088); Cry30Ea1 (№ доступа ACC95445); Cry30Ea2 (№ доступа FJ499389); Cry30Fa1 (№ доступа ACI22625); Cry30Ga1 (№ доступа ACG60020); Cry30Ga2 (№ доступа HQ638217); Cry31Aa1 (№ доступа BAB11757); Cry31Aa2 (№ доступа AAL87458); Cry31Aa3 (№ доступа BAE79808); Cry31Aa4 (№ доступа BAF32571); Cry31Aa5 (№ доступа BAF32572); Cry31Aa6 (№ доступа BAI44026); Cry31Ab1 (№ доступа BAE79809); Cry31Ab2 (№ доступа BAF32570); Cry31Ac1 (№ доступа BAF34368); Cry31Ac2 (№ доступа AB731600); Cry31Ad1 (№ доступа BAI44022); Cry32Aa1 (№ доступа AAG36711); Cry32Aa2 (№ доступа GU063849); Cry32Ab1 (№ доступа GU063850); Cry32Ba1 (№ доступа BAB78601); Cry32Ca1 (№ доступа BAB78602); Cry32Cb1 (№ доступа KC156708); Cry32Da1 (№ доступа BAB78603); Cry32Ea1 (№ доступа GU324274); Cry32Ea2 (№ доступа KC156686); Cry32Eb1 (№ доступа KC156663); Cry32Fa1 (№ доступа KC156656); Cry32Ga1 (№ доступа KC156657); Cry32Ha1 (№ доступа KC156661); Cry32Hb1 (№ доступа KC156666); Cry32Ia1 (№ доступа KC156667); Cry32Ja1 (№ доступа KC156685); Cry32Ka1 (№ доступа KC156688); Cry32La1 (№ доступа KC156689); Cry32Ma1 (№ доступа KC156690); Cry32Mb1 (№ доступа KC156704); Cry32Na1 (№ доступа KC156691); Cry32Oa1 (№ доступа KC156703); Cry32Pa1 (№ доступа KC156705); Cry32Qa1 (№ доступа KC156706); Cry32Ra1 (№ доступа KC156707); Cry32Sa1 (№ доступа KC156709); Cry32Ta1 (№ доступа KC156710); Cry32Ua1 (№ доступа KC156655); Cry33Aa1 (№ доступа AAL26871); Cry34Aa1 (№ доступа AAG50341); Cry34Aa2 (№ доступа AAK64560); Cry34Aa3 (№ доступа AAT29032); Cry34Aa4 (№ доступа AAT29030); Cry34Ab1 (№ доступа AAG41671); Cry34Ac1 (№ доступа AAG50118); Cry34Ac2 (№ доступа AAK64562); Cry34Ac3 (№ доступа AAT29029); Cry34Ba1 (№ доступа AAK64565); Cry34Ba2 (№ доступа AAT29033); Cry34Ba3 (№ доступа AAT29031); Cry35Aa1 (№ доступа AAG50342); Cry35Aa2 (№ доступа AAK64561); Cry35Aa3 (№ доступа AAT29028); Cry35Aa4 (№ доступа AAT29025); Cry35Ab1 (№ доступа AAG41672); Cry35Ab2 (№ доступа AAK64563); Cry35Ab3 (№ доступа AY536891); Cry35Ac1 (№ доступа AAG50117); Cry35Ba1 (№ доступа AAK64566); Cry35Ba2 (№ доступа AAT29027); Cry35Ba3 (№ доступа AAT29026); Cry36Aa1 (№ доступа AAK64558); Cry37Aa1 (№ доступа AAF76376); Cry38Aa1 (№ доступа AAK64559); Cry39Aa1 (№ доступа BAB72016); Cry40Aa1 (№ доступа BAB72018); Cry40Ba1 (№ доступа BAC77648); Cry40Ca1 (№ доступа EU381045); Cry40Da1 (№ доступа ACF15199); Cry41Aa1 (№ доступа BAD35157); Cry41Ab1 (№ доступа BAD35163); Cry41Ba1 (№ доступа HM461871); Cry41Ba2 (№ доступа ZP_04099652); Cry42Aa1 (№ доступа BAD35166); Cry43Aa1 (№ доступа BAD15301); Cry43Aa2 (№ доступа BAD95474); Cry43Ba1 (№ доступа BAD15303); Cry43Ca1 (№ доступа KC156676); Cry43Cb1 (№ доступа KC156695); Cry43Cc1 (№ доступа KC156696); Cry43-подобный (№ доступа BAD15305); Cry44Aa (№ доступа BAD08532); Cry45Aa (№ доступа BAD22577); Cry46Aa (№ доступа BAC79010); Cry46Aa2 (№ доступа BAG68906); Cry46Ab (№ доступа BAD35170); Cry47Aa (№ доступа AAY24695); Cry48Aa (№ доступа CAJ18351); Cry48Aa2 (№ доступа CAJ86545); Cry48Aa3 (№ доступа CAJ86546); Cry48Ab (№ доступа CAJ86548); Cry48Ab2 (№ доступа CAJ86549); Cry49Aa (№ доступа CAH56541); Cry49Aa2 (№ доступа CAJ86541); Cry49Aa3 (№ доступа CAJ86543); Cry49Aa4 (№ доступа CAJ86544); Cry49Ab1 (№ доступа CAJ86542); Cry50Aa1 (№ доступа BAE86999); Cry50Ba1 (№ доступа GU446675); Cry50Ba2 (№ доступа GU446676); Cry51Aa1 (№ доступа ABI14444); Cry51Aa2 (№ доступа GU570697); Cry52Aa1 (№ доступа EF613489); Cry52Ba1 (№ доступа FJ361760); Cry53Aa1 (№ доступа EF633476); Cry53Ab1 (№ доступа FJ361759); Cry54Aa1 (№ доступа ACA52194); Cry54Aa2 (№ доступа GQ140349); Cry54Ba1 (№ доступа GU446677); Cry55Aa1 (№ доступа ABW88932); Cry54Ab1 (№ доступа JQ916908); Cry55Aa2 (№ доступа AAE33526); Cry56Aa1 (№ доступа ACU57499); Cry56Aa2 (№ доступа GQ483512); Cry56Aa3 (№ доступа JX025567); Cry57Aa1 (№ доступа ANC87261); Cry58Aa1 (№ доступа ANC87260); Cry59Ba1 (№ доступа JN790647); Cry59Aa1 (№ доступа ACR43758); Cry60Aa1 (№ доступа ACU24782); Cry60Aa2 (№ доступа EAO57254); Cry60Aa3 (№ доступа EEM99278); Cry60Ba1 (№ доступа GU810818); Cry60Ba2 (№ доступа EAO57253); Cry60Ba3 (№ доступа EEM99279); Cry61Aa1 (№ доступа HM035087); Cry61Aa2 (№ доступа HM132125); Cry61Aa3 (№ доступа EEM19308); Cry62Aa1 (№ доступа HM054509); Cry63Aa1 (№ доступа BAI44028); Cry64Aa1 (№ доступа BAJ05397); Cry65Aa1 (№ доступа HM461868); Cry65Aa2 (№ доступа ZP_04123838); Cry66Aa1 (№ доступа HM485581); Cry66Aa2 (№ доступа ZP_04099945); Cry67Aa1 (№ доступа HM485582); Cry67Aa2 (№ доступа ZP_04148882); Cry68Aa1 (№ доступа HQ113114); Cry69Aa1 (№ доступа HQ401006); Cry69Aa2 (№ доступа JQ821388); Cry69Ab1 (№ доступа JN209957); Cry70Aa1 (№ доступа JN646781); Cry70Ba1 (№ доступа ADO51070); Cry70Bb1 (№ доступа EEL67276); Cry71Aa1 (№ доступа JX025568); Cry72Aa1 (№ доступа JX025569); Cyt1Aa (№ доступа GenBank X03182); Cyt1Ab (№ доступа GenBank X98793); Cyt1B (№ доступа GenBank U37196); Cyt2A (№ доступа GenBank Z14147) и Cyt2B (№ доступа GenBank U52043).
Примеры δ-эндотоксинов также включают без ограничения белки Cry1A из патентов США №№ 5880275 и 7858849; токсин DIG-3 или DIG-11 (варианты белков cry с N-концевой делецией α-спирали 1 и/или α-спирали 2, такие как Cry1A, Cry3A) из патентов США №№ 8304604, 8304605 и 8476226; Cry1B из заявки на патент США с серийным номером 10/525318; Cry1C из патента США № 6033874; Cry1F из патентов США №№ 5188960 и 6218188; химеры Cry1A/F из патентов США №№ 7070982; 6962705 и 6713063); белок Cry2, такой как белок Cry2Ab из патента США № 7064249); белок Cry3A, в том числе, без ограничения, разработанный гибридный инсектицидный белок (eHIP), созданный путем слияния уникальных комбинаций вариабельных участков и консервативных блоков по меньшей мере двух различных белков Cry (публикация заявки на патент США №2010/0017914); белок Cry4; белок Cry5; белок Cry6; белки Cry8 из патентов США №№ 7329736, 7449552, 7803943, 7476781, 7105332, 7378499 и 7462760; белок Cry9, такой как представители семейств Cry9A, Cry9B, Cry9C, Cry9D, Cry9E и Cry9F; белок Cry15 из Naimov, et al., (2008) Applied and Environmental Microbiology, 74:7145-7151; Cry22, белок Cry34Ab1 из патентов США №№ 6127180, 6624145 и 6340593; белок CryET33 и cryET34 из патентов США №№ 6248535, 6326351, 6399330, 6949626, 7385107 и 7504229; гомологи CryET33 и CryET34 из публикации заявки на патент США № 2006/0191034, 2012/0278954 и PCT публикации № WO 2012/139004; белок Cry35Ab1 из патентов США №№ 6083499, 6548291 и 6340593; белок Cry46, белок Cry51, бинарный токсин Cry; TIC901 или родственный токсин; TIC807 из публикации заявки на патент США № 2008/0295207; ET29, ET37, TIC809, TIC810, TIC812, TIC127, TIC128 из PCT US 2006/033867; AXMI-027, AXMI-036 и AXMI-038 из патента США № 8236757; AXMI-031, AXMI-039, AXMI-040, AXMI-049 из патента США № 7923602; AXMI-018, AXMI-020 и AXMI-021 из WO 2006/083891; AXMI-010 из WO 2005/038032; AXMI-003 из WO 2005/021585; AXMI-008 из публикации заявки на патент США № 2004/0250311; AXMI-006 из публикации заявки на патент США № 2004/0216186; AXMI-007 из публикации заявки на патент США № 2004/0210965; AXMI-009 из публикации заявки на патент США № 2004/0210964; AXMI-014 из публикации заявки на патент США № 2004/0197917; AXMI-004 из публикации заявки на патент США № 2004/0197916; AXMI-028 и AXMI-029 из WO 2006/119457; AXMI-007, AXMI-008, AXMI-0080rf2, AXMI-009, AXMI-014 и AXMI-004 из WO 2004/074462; AXMI-150 из патента США № 8084416; AXMI-205 из из публикации заявки на патент США №2011/0023184; AXMI-011, AXMI-012, AXMI-013, AXMI-015, AXMI-019, AXMI-044, AXMI-037, AXMI-043, AXMI-033, AXMI-034, AXMI-022, AXMI-023, AXMI-041, AXMI-063 и AXMI-064 из публикации заявки на патент США № 2011/0263488; AXMI-R1 и родственные белки из публикации заявки на патент США № 2010/0197592; AXMI221Z, AXMI222z, AXMI223z, AXMI224z и AXMI225z из WO 2011/103248; AXMI218, AXMI219, AXMI220, AXMI226, AXMI227, AXMI228, AXMI229, AXMI230 и AXMI231 из WO 2011/103247; AXMI-115, AXMI-113, AXMI-005, AXMI-163 и AXMI-184 из патента США № 8334431; AXMI-001, AXMI-002, AXMI-030, AXMI-035 и AXMI-045 из публикации заявки на патент США № 2010/0298211; AXMI-066 и AXMI-076 из публикации заявки на патент США № 2009/0144852; AXMI128, AXMI130, AXMI131, AXMI133, AXMI140, AXMI141, AXMI142, AXMI143, AXMI144, AXMI146, AXMI148, AXMI149, AXMI152, AXMI153, AXMI154, AXMI155, AXMI156, AXMI157, AXMI158, AXMI162, AXMI165, AXMI166, AXMI167, AXMI168, AXMI169, AXMI170, AXMI171, AXMI172, AXMI173, AXMI174, AXMI175, AXMI176, AXMI177, AXMI178, AXMI179, AXMI180, AXMI181, AXMI182, AXMI185, AXMI186, AXMI187, AXMI188, AXMI189 из патента США № 8318900; AXMI079, AXMI080, AXMI081, AXMI082, AXMI091, AXMI092, AXMI096, AXMI097, AXMI098, AXMI099, AXMI100, AXMI101, AXMI102, AXMI103, AXMI104, AXMI107, AXMI108, AXMI109, AXMI110, AXMI111, AXMI112, AXMI114, AXMI116, AXMI117, AXMI118, AXMI119, AXMI120, AXMI121, AXMI122, AXMI123, AXMI124, AXMI1257, AXMI1268, AXMI127, AXMI129, AXMI164, AXMI151, AXMI161, AXMI183, AXMI132, AXMI138, AXMI137 из публикации заявки на патент США № 2010/0005543, белки cry, такие как Cry1A и Cry3A, имеющие модифицированные протеолитические сайты, из патента США № 8319019; белок-токсин Cry1Ac, Cry2Aa и Cry1Ca из штамма VBTS 2528 Bacillus thuringiensis из публикации заявки на патент США № 2011/0064710. Другие белки Cry хорошо известны специалисту в данной области техники (см. Crickmore, et al., "Bacillus thuringiensis toxin nomenclature" (2011), на сайте lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/, доступ к которому можно получить во всемирной сети Интернет с применением префикса "www"). Инсектицидная активность белков Cry хорошо известна специалисту в данной области техники (обзор см. у van Frannkenhuyzen, (2009) J. Invert. Path. 101:1-16). Применение белков Cry в качестве признаков трансгенного растения хорошо известно специалисту в данной области техники, и Cry-трансгенные растения, в том числе, без ограничения, растения, экспрессирующие Cry1Ac, Cry1Ac+Cry2Ab, Cry1Ab, Cry1A.105, Cry1F, Cry1Fa2, Cry1F+Cry1Ac, Cry2Ab, Cry3A, mCry3A, Cry3Bb1, Cry34Ab1, Cry35Ab1, Vip3A, mCry3A, Cry9c и CBI-Bt, были разрешены контролирующими органами (см., Sanahuja, (2011) Plant Biotech Journal 9:283-300 и CERA. (2010) GM Crop Database Center for Environmental Risk Assessment (CERA), ILSI Research Foundation, Washington D.C. at cera-gmc.org/index.php?action=gm_crop_database, доступ к которым можно получить во всемирной сети Интернет с применением префикса “www”). В растениях также может экспрессироваться два или более пестицидных белков, хорошо известных специалисту в данной области техники, таких как Vip3Ab и Cry1Fa (US2012/0317682); Cry1BE и Cry1F (US2012/0311746); Cry1CA и Cry1AB (US2012/0311745); Cry1F и CryCa (US2012/0317681); Cry1DA и Cry1BE (US2012/0331590); Cry1DA и Cry1Fa (US2012/0331589); Cry1AB и Cry1BE (US2012/0324606); Cry1Fa и Cry2Aa, и Cry1I и Cry1E (US2012/0324605); Cry34Ab/35Ab и Cry6Aa (US20130167269); Cry34Ab/VCry35Ab и Cry3Aa (US20130167268); и Cry3A и Cry1Ab или Vip3Aa (US20130116170). Пестицидные белки также включают инсектицидные липазы, в том числе липидацильные гидролазы из патента США № 7491869 и холестериноксидазы, например, из Streptomyces (Purcell et al. (1993) Biochem Biophys Res Commun 15:1406-1413). Пестицидные белки также включают токсины VIP (вегетативные инсектицидные белки) из патентов США №№ 5877012, 6107279, 6137033, 7244820, 7615686 и 8237020 и т.п. Другие белки VIP хорошо известны специалисту в данной области техники (см. lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/vip.html, доступ к которому можно получить во всемирной сети Интернет с применением префикса "www"). Пестицидные белки также включают белки токсинового комплекса (TC), которые можно получить от организмов, таких как Xenorhabdus, Photorhabdus и Paenibacillus (см., патенты США №№ 7491698 и 8084418). Некоторые TC-белки обладают “самостоятельной” инсектицидной активностью, а другие TC-белки усиливают активность самостоятельных токсинов, производимых тем же заданным организмом. Токсичность “самостоятельного” TC-белка (от Photorhabdus, Xenorhabdus или Paenibacillus, например) может усиливаться при помощи одного или нескольких TC-белков, “усилителей”, полученных от организма-источника из другого рода. Существуют три основных типа TC-белков. Как изложено в данном документе, белки класса A (“белок A”) представляют собой самостоятельные токсины. Белки класса B (“белок B”) и белки класса C (“белок C”) усиливают токсичность белков класса A. Примеры белков класса A представляют собой TcbA, TcdA, XptA1 и XptA2. Примеры белков класса B представляют собой TcaC, TcdB, XptB1Xb и XptC1Wi. Примеры белков класса C представляют собой TccC, XptC1Xb и XptB1Wi. Пестицидные белки также включают белки яда пауков, змей и скорпионов. Примеры пептидов яда пауков включают, без ограничения, пептиды ликотоксин-1 и его мутантные формы (патент США № 8334366).
В некоторых вариантах осуществления полипептиды AfIP-1A и AfIP-1B включают аминокислотные последовательности, выведенные из последовательностей нуклеиновой кислоты полной длины, раскрытых в данном документе, и аминокислотные последовательности, которые короче, чем последовательности полной длины, либо вследствие применения альтернативного сайта инициации, расположенного ниже, либо вследствие процессинга, дающего более короткий белок, обладающий пестицидной активностью. Процессинг может происходить в организме, в котором экспрессируется белок, или во вредителе после проглатывания белка.
Таким образом, в данном документе предусмотрены новые выделенные или рекомбинантные последовательности нуклеиновой кислоты, которые обеспечивают пестицидную активность. Также предусмотрены аминокислотные последовательности полипептидов AfIP-1A и AfIP-1B. Белок, полученный в результате трансляции генов этих полипептидов AfIP-1A и AfIP-1B в клетках, обеспечивает возможность контроля или уничтожения вредителей, которые проглатывают их.
Бактериальные штаммы
Один аспект относится к бактериальным штаммам, которые экспрессируют полипептид AfIP-1A и/или полипептид AfIP-1B. В некоторых вариантах осуществления бактериальный штамм представляет собой штамм Alcaligenes faecalis. В некоторых вариантах осуществления бактериальный штамм представляет собой биологически чистую культуру штамма SS44C4 Alcaligenes faecalis, депонированного 1 декабря 2011 года под номером доступа NRRLB-50613 в коллекции культур службы сельскохозяйственных исследований (NRRL), 1815 North University Street, Пеория, Иллинойс 61604, (nrrl.ncaur.usda.gov, доступ к которому можно получить во всемирной сети Интернет с применением префикса "www"). Депонирование будет обеспечиваться согласно условиям Будапештского договора о международном признании депонирования микроорганизмов для целей патентной процедуры. Эти депонирования сделаны только для удобства специалистов в данной области техники и это не является признанием того, что депонирование требуется согласно §112 статьи 35 U.S.C. Доступ к этому депонированию будет предоставляться во время нахождения заявки на рассмотрении Комиссара по патентам и товарным знакам, и лица, определенные Комиссаром, обладают правом на это по первому требованию. Сразу после одобрения каких-либо пунктов формулы в настоящей заявке, Заявитель(и) будут делать общедоступными, согласно § 1.808 статьи 37 C.F.R., образец(образцы) депонирования в коллекции культур службы сельскохозяйственных исследований (NRRL), 1815 North University Street, Пеория, Иллинойс 61604. Это депонирование будет обеспечиваться в депозитарии NRRL, который является общедоступным депозитарием, в течение периода 30 лет, или 5 лет после самого последнего запроса, или в течение имеющего законную силу времени действия патента, в зависимости от того, какой срок является белее длинным, и будет замещаться, если в течение данного периода оно станет нежизнеспособным. Эти депонирования безоговорочно и без ограничения или условий будут общедоступны после выдачи патента. Дополнительно, Заявитель(и) удовлетворили все требования §§1.801-1.809 статьи 37 C.F.R., в том числе предоставление отчета о жизнеспособности образца при депонировании. Заявитель(и) не обладают полномочиями отказываться от каких-либо ограничений, налагаемых законом, относительно передачи биологического материала или его транспортировки в коммерческих целях. Заявитель(и) не отказывается от признания какого-либо нарушения своих прав, предоставляемых согласно настоящему патентному документу. Однако следует понимать, что доступность депонирования не является разрешением для осуществления заявленного изобретения на практике с ограничением патентных прав, предоставляемых государственным регулированием.
Молекулы нуклеиновой кислоты и их варианты и фрагменты
Один аспект относится к выделенным или рекомбинантным молекулам нуклеиновой кислоты, содержащим последовательности нуклеиновой кислоты, кодирующие полипептиды AfIP-1A и AfIP-1B или их биологически активные части, а также к молекулам нуклеиновой кислоты, подходящим для применения в качестве гибридизационных зондов для идентификации молекул нуклеиновой кислоты, кодирующих белки с участками гомологии последовательностей. Применяемый в данном документе термин “молекула нуклеиновой кислоты” относится к молекулам ДНК (например, рекомбинантной ДНК, кДНК, геномной ДНК, пластидной ДНК, митохондриальной ДНК), и молекулам РНК (например, мРНК), и аналогам ДНК или РНК, полученным с применением аналогов нуклеотидов. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но, предпочтительно, представляет собой двухцепочечную ДНК.
“Выделенная” молекула нуклеиновой кислоты (или ДНК) применяется в данном документе для обозначения последовательности нуклеиновой кислоты (или ДНК), которая больше не находится в своей естественной среде, например, находится in vitro. “Рекомбинантная” молекула нуклеиновой кислоты (или ДНК) применяется в данном документе для обозначения последовательности нуклеиновой кислоты (или ДНК), которая находится в рекомбинантной бактериальной или растительной клетке-хозяине. В некоторых вариантах осуществления “выделенная” или “рекомбинантная” нуклеиновая кислота не содержит последовательности (предпочтительно, последовательности, кодирующие белок), которые в естественных условиях фланкируют нуклеиновую кислоту (т.е. последовательности, расположенные на 5'- и 3'-концах нуклеиновой кислоты) в геномной ДНК организма, из которого получена нуклеиновая кислота. Для целей настоящего раскрытия “выделенные” или “рекомбинантные”, при применения для обозначения молекул нуклеиновой кислоты, исключает выделенные хромосомы. Например, в различных вариантах осуществления рекомбинантная молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1A и/или AfIP-1B, может содержать менее приблизительно 5 т.о., 4 т.о., 3 т.о., 2 т.о., 1 т.о., 0,5 т.о. или 0,1 т.о. последовательностей нуклеиновой кислоты, которые в естественных условиях фланкируют молекулу нуклеиновой кислоты в геномной ДНК клетки, из которой получена нуклеиновая кислота.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1A или AfIP-1B, имеет одно или несколько изменений в последовательности нуклеиновой кислоты по сравнению с нативной или геномной последовательностью нуклеиновой кислоты. В некоторых вариантах осуществления изменение в нативной или геномной последовательности нуклеиновой кислоты включает без ограничения: изменения в последовательности нуклеиновой кислоты вследствие вырожденности генетического кода; изменения в последовательности нуклеиновой кислоты вследствие аминокислотной замены, вставки, делеции и/или добавления по сравнению с нативной или геномной последовательностью; удаление одного или нескольких интронов; делецию одного или нескольких регуляторных участков, расположенных выше или ниже; и делецию 5'- и/или 3'-нетранслируемого участка, ассоциированного с геномной последовательностью нуклеиновой кислоты. В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1A или AfIP-1B, представляет собой последовательность, отличающуюся от геномной.
Предполагается ряд полинуклеотидов, которые кодируют полипептиды AfIP-1A и/или AfIP-1B или родственные белки. Такие полинуклеотиды применимы для получения полипептидов AfIP-1A и/или AfIP-1B в клетках-хозяевах, если они функционально связаны с подходящим промотором, терминатором транскрипции и/или последовательностями полиаденилирования. Такие полинуклеотиды также применимы в качестве зондов для выделения гомологичных или фактически гомологичных полинуклеотидов, которые кодируют полипептиды AfIP-1A и/или AfIP-1B или родственные белки.
Одним источником полинуклеотидов, которые кодируют полипептиды AfIP-1A и/или AfIP-1B или родственные белки, является штамм Alcaligenes faecalis, который содержит полинуклеотид AfIP-1A с SEQ ID NO: 1, кодирующий полипептид AfIP-1A с SEQ ID NO: 2, и/или полинуклеотид AfIP-1B с SEQ ID NO: 3, кодирующий полипептид AfIP-1B с SEQ ID NO: 4. Эти полинуклеотидные последовательности были выделены из хозяина Alcaligenes faecalis, и они, таким образом, подходят для экспрессии кодируемых полипептидов AfIP-1A и/или AfIP-1B в других бактериальных хозяевах. Например, SEQ ID NO: 1 и SEQ ID NO: 3 можно применять для экспрессии белков AfIP-1A и AfIP-1B в бактериальных хозяевах, которые включают, без ограничения, бактериальные клетки-хозяева Agrobacterium, Bacillus, Escherichia, Salmonella, Pseudomonas и Rhizobium. Полинуклеотиды также применимы в качестве зондов для выделения гомологичных или фактически гомологичных полинуклеотидов, которые кодируют полипептиды AfIP-1A и/или AfIP-1B или родственные белки. Такие зонды можно применять для идентификации гомологичных или фактически гомологичных полинуклеотидов, полученных от Alcaligenes или других родственных бактерий.
Полинуклеотиды, которые кодируют полипептид AfIP-1A и/или полипептид AfIP-1B, можно также синтезировать de novo, исходя из последовательности полипептида AfIP-1A и/или AfIP-1B. Последовательность гена полинуклеотида можно вывести, исходя из последовательности полипептида AfIP-1A и/или AfIP-1B, благодаря применению генетического кода. Компьютерные программы, такие как “BackTranslate” (GCG™ Package, Acclerys, Inc., Сан-Диего, Калифорния), можно применять для перевода пептидной последовательности в соответствующую нуклеотидную последовательность, кодирующую пептид. Примеры последовательностей полипептида AfIP-1A и/или AfIP-1B, которые можно применять для получения соответствующих нуклеотидных кодирующих последовательностей, включают, без ограничения, полипептид AfIP-1A с последовательностью SEQ ID NO: 2 и полипептид AfIP-1B с последовательностью SEQ ID NO: 4. Кроме того, можно разрабатывать синтетические последовательности полинуклеотида AfIP-1A и/или AfIP-1B по настоящему раскрытию таким образом, что они будут экспрессироваться в растениях. В патенте США № 5500365 описан способ синтеза генов растения для улучшения уровня экспрессии белка, кодируемого синтезированным геном. Этот способ относится к модификации последовательностей структурных генов экзогенного трансгена, что приводит к их более эффективной транскрипции, процессингу, трансляции и экспрессии в растении. Свойства генов, которые хорошо экспрессируются в растениях, включают удаление последовательностей, которые могут вызывать нежелательный сплайсинг интронов или полиаденилирование у кодирующего участка генного транскрипта, при этом в существенной мере сохраняется аминокислотная последовательность токсичной части инсектицидного белка. Аналогичный способ для получения усиленной экспрессии трансгенов в однодольных растениях раскрыт в патенте США № 5689052.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1A, представляет собой полинуклеотид с последовательностью, изложенной в SEQ ID NO: 1, и его варианты, фрагменты и комплементарные ему последовательности. “Комплементарная последовательность” применяется в данном документе для обозначения последовательности нуклеиновой кислоты, которая в достаточной степени комплементарна заданной последовательности нуклеиновой кислоты, так что она может гибридизоваться с заданной последовательностью нуклеиновой кислоты с образованием тем самым стабильного дуплекса. “Варианты полинуклеотидной последовательности” применяется в данном документе для обозначения последовательности нуклеиновой кислоты, которая за исключением вырожденности генетического кода, кодирует один тот же полипептид. В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1B, представляет собой молекулу нуклеиновой кислоты с последовательностью, изложенной в SEQ ID NO: 3. Соответствующие аминокислотные последовательности для полипептидов AfIP-1A или AfIP-1B, кодируемых этими последовательностями нуклеиновой кислоты, изложены в SEQ ID NO: 2 и SEQ ID NO: 4, соответственно.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1A или AfIP-1B, представляет собой последовательность нуклеиновой кислоты, отличающуюся от геномной. Применяемые в данном документе “последовательность нуклеиновой кислоты, отличающаяся от геномной“ или “молекула нуклеиновой кислоты, отличающаяся от геномной” относятся к молекуле нуклеиновой кислоты, которая имеет одно или несколько изменений в последовательности нуклеиновой кислоты по сравнению с нативной или геномной последовательностью нуклеиновой кислоты. В некоторых вариантах осуществления изменение по отношению к нативной или геномной молекуле нуклеиновой кислоты включает без ограничения: изменения в последовательности нуклеиновой кислоты, обусловленные вырожденностью генетического кода; оптимизацию кодонов последовательности нуклеиновой кислоты для экспрессии в растениях; изменения в последовательности нуклеиновой кислоты для введения по меньшей мере одной аминокислотной замены, вставки, делеции и/или добавления по сравнению с нативной или геномной последовательностью; удаление одного или нескольких интронов, ассоциированных с геномной последовательностью нуклеиновой кислоты; вставку одного или нескольких гетерологичных интронов; делецию одного или нескольких регуляторных участков, расположенных выше или ниже, ассоциированных с геномной последовательностью нуклеиновой кислоты; вставку одного или нескольких гетерологичных регуляторных участков, расположенных выше или ниже; делецию 5'- и/или 3'-нетранслируемого участка, ассоциированного с геномной последовательностью нуклеиновой кислоты; вставку гетерологичного 5'- и/или 3'-нетранслируемого участка и модификацию сайта полиаденилирования. В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, представляет собой кДНК. В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, представляет собой синтетическую последовательность нуклеиновой кислоты.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1A, представляет собой полинуклеотид с нуклеотидной последовательностью, кодирующей полипептид, содержащий аминокислотную последовательность, по меньшей мере на 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности с SEQ ID NO: 2, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784, где полипептид обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1A, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 2, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784, где полипептид AfIP-1A имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 2, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784, и полипептид AfIP-1A обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1A, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 2, где полипептид AfIP-1A имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 2, и полипептид AfIP-1A обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1A, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 28, где полипептид AfIP-1A имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 28, и полипептид AfIP-1A обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1A, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 32, где полипептид AfIP-1A имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 32, и полипептид AfIP-1A обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1A, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 36, где полипептид AfIP-1A имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 36, и полипептид AfIP-1A обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1A, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 778, где полипептид AfIP-1A имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 778, и полипептид AfIP-1A обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1A, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 782, где полипептид AfIP-1A имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 782, и полипептид AfIP-1A обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1A, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 784, где полипептид AfIP-1A имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 784, и полипептид AfIP-1A обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1A, содержащий аминокислотную последовательность с SEQ ID NO: 2, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784, имеющей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60 или 61 аминокислотную замену по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 2, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1A, содержащий аминокислотную последовательность с SEQ ID NO: 2, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60 или 61 аминокислотную замену по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 2.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1A, содержащий аминокислотную последовательность с SEQ ID NO: 255, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60 или 61 аминокислотную замену в положениях, обозначенных Xaa, по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 2.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1A, содержащий аминокислотную последовательность с SEQ ID NO: 256, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60 или 61 аминокислотную замену в положениях, обозначенных Xaa, по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 2.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1A, содержащий аминокислотную последовательность с SEQ ID NO: 257, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60 или 61 аминокислотную замену в положениях, обозначенных Xaa, по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 2.
В некоторых вариантах осуществления молекула нуклеиновой кислоты кодирует полипептид AfIP-1A, имеющий по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60 или 61 аминокислотную замену, в любой комбинации, по сравнению с SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784.
В некоторых вариантах осуществления молекула нуклеиновой кислоты кодирует полипептид AfIP-1A, имеющий 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60 или 61 аминокислотную замену, в любой комбинации, в остатках, обозначенных Xaa, в SEQ ID NO: 257 по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 2.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1A, представляет собой полинуклеотид, имеющий нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 255, где Xaa в положении 6 представляет собой Ile или Thr; Xaa в положении 7 представляет собой Ala или Val; Xaa в положении 9 представляет собой Glu или Gly; Xaa в положении 13 представляет собой Ile или Val; Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr; Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr; Xaa в положении 23 представляет собой Thr или Ala; Xaa в положении 24 представляет собой Ile или Leu; Xaa в положении 30 представляет собой Asn или Ser; Xaa в положении 33 представляет собой Val или Ile; Xaa в положении 35 представляет собой Gly или Asn; Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp; Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr; Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr; Xaa в положении 41 представляет собой Gly, Cys или Gln; Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr; Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp; Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp; Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp; Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 47 представляет собой Gly, Leu или Phe; Xaa в положении 48 представляет собой Asp, Asn, Leu или Phe; Xaa в положении 49 представляет собой Lys, Leu или Phe; Xaa в положении 50 представляет собой Asp, Leu или Phe; Xaa в положении 51 представляет собой Lys, Leu или Phe; Xaa в положении 52 представляет собой Glu, Leu или Phe; Xaa в положении 53 представляет собой Ile, Leu или Phe; Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe; Xaa в положении 55 представляет собой Pro, Leu или Phe; Xaa в положении 56 представляет собой Ser или Leu; Xaa в положении 57 представляет собой Gln, Glu, Leu или Phe; Xaa в положении 58 представляет собой Ile, Val, Leu или Phe; Xaa в положении 60 представляет собой Gly, Leu of Phe; Xaa в положении 61 представляет собой Thr, Ile или Phe; Xaa в положении 62 представляет собой Ile, Val, Leu или Phe; Xaa в положении 64 представляет собой Lys, Glu, Leu или Phe; Xaa в положении 65 представляет собой Asp, Leu или Phe; Xaa в положении 67 представляет собой Asp или Glu; Xaa в положении 68 представляет собой Ser или Thr; Xaa в положении 73 представляет собой Ser или Ala; Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr; Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr; Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr; Xaa в положении 96 представляет собой Val или Ile; Xaa в положении 101 представляет собой Trp, Phe или Tyr; Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val; Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr; Xaa в положении 111 представляет собой Asp или Asn; Xaa в положении 113 представляет собой Leu или Ser; Xaa в положении 115 представляет собой Val или Ile; Xaa в положении 116 представляет собой Lys или Glu; Xaa в положении 120 представляет собой Asn или Lys; Xaa в положении 121 представляет собой Tyr, Leu или Phe; Xaa в положении 122 представляет собой Thr, Leu или Phe; Xaa в положении 123 представляет собой Val, Leu, Phe или Asn; Xaa в положении 124 представляет собой Ile, Ser, Leu или Phe; Xaa в положении 125 представляет собой Lys, Leu, Phe или Met; Xaa в положении 126 представляет собой Lys, Leu или Phe; Xaa в положении 128 представляет собой Gly, Leu или Phe; Xaa в положении 129 представляет собой Gly, Leu или Phe; Xaa в положении 130 представляет собой Ser, Leu или Phe; Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr; Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp; Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr; Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; и Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr; и где 1-14 аминокислот, необязательно, удалены с N-конца полипептида.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1A, представляет собой полинуклеотид, имеющий нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 256, где Xaa в положении 6 представляет собой Ile или Thr; Xaa в положении 7 представляет собой Ala, Met или Val; Xaa в положении 8 представляет собой Thr или Asp; Xaa в положении 9 представляет собой Glu, Leu или Gly; Xaa в положении 10 представляет собой Glu или Asn; Xaa в положении 11 представляет собой Ser или Val; Xaa в положении 12 представляет собой Lys или Glu; Xaa в положении 13 представляет собой Ile или Val; Xaa в положении 14 представляет собой Arg или Gln; Xaa в положении 16 представляет собой Tyr или Gln; Xaa в положении 17 представляет собой Ala или Ser; Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr; Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr; Xaa в положении 23 представляет собой Thr, Glu или Ala; Xaa в положении 24 представляет собой Ile или Leu; Xaa в положении 26 представляет собой Val или Ser; Xaa в положении 27 представляет собой Val или Glu; Xaa в положении 29 представляет собой Ser или Met; Xaa в положении 30 представляет собой Asn, Asp или Ser; Xaa в положении 31 представляет собой Phe или Ile; Xaa в положении 32 представляет собой Lys или Glu; Xaa в положении 33 представляет собой Val или Ile; Xaa в положении 34 представляет собой Glu или Lys; Xaa в положении 35 представляет собой Gly или Asn; Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp; Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr; Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr; Xaa в положении 41 представляет собой Gly, Cys или Gln; Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr; Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp; Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp; Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp; Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 47 представляет собой Gly, Leu или Phe; Xaa в положении 48 представляет собой Asp, Asn, Leu или Phe; Xaa в положении 49 представляет собой Lys, Leu или Phe; Xaa в положении 50 представляет собой Asp, Ser, Leu или Phe; Xaa в положении 51 представляет собой Lys, Asn, Leu или Phe; Xaa в положении 52 представляет собой Glu, Leu или Phe; Xaa в положении 53 представляет собой Ile, Leu или Phe; Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe; Xaa в положении 55 представляет собой Pro, Ser, Leu или Phe; Xaa в положении 56 представляет собой Ser, Asp или Leu; Xaa в положении 57 представляет собой Gln, Thr, Glu, Leu или Phe; Xaa в положении 58 представляет собой Ile, Val, Leu или Phe; Xaa в положении 60 представляет собой Gly, Lys, Leu или Phe; Xaa в положении 61 представляет собой Thr, Ile или Phe; Xaa в положении 62 представляет собой Ile, Lys, Val, Leu или Phe; Xaa в положении 64 представляет собой Lys, Ser, Glu, Leu или Phe; Xaa в положении 65 представляет собой Asp, Ser, Leu или Phe; Xaa в положении 66 представляет собой Glu или Gly; Xaa в положении 67 представляет собой Asp, Thr или Glu; Xaa в положении 68 представляет собой Ser, Lys или Thr; Xaa в положении 69 представляет собой Tyr или Ser; Xaa в положении 70 представляет собой Thr или Lys; Xaa в положении 73 представляет собой Ser или Ala; Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr; Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr; Xaa в положении 77 представляет собой Glu или Ala; Xaa в положении 78 представляет собой Asn или Asp; Xaa в положении 79 представляет собой Ala или Thr; Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr; Xaa в положении 86 представляет собой Gly или Lys; Xaa в положении 88 представляет собой Ser или Glu; Xaa в положении 89 представляет собой Leu или Ile; Xaa в положении 91 представляет собой Asp или His; Xaa в положении 92 представляет собой Gly или Asp; Xaa в положении 95 представляет собой Leu или Trp; Xaa в положении 96 представляет собой Val, Leu или Ile; Xaa в положении 97 представляет собой Phe или Ala; Xaa в положении 98 представляет собой Glu или Thr; Xaa в положении 100 представляет собой Tyr или Lys; Xaa в положении 101 представляет собой Trp, Phe или Tyr; Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val; Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr; Xaa в положении 106 представляет собой Ser или Ala; Xaa в положении 111 представляет собой Asp, His или Asn; Xaa в положении 112 представляет собой Glu или Ser; Xaa в положении 113 представляет собой Leu или Ser; Xaa в положении 114 представляет собой Thr или Ser; Xaa в положении 115 представляет собой Val или Ile; Xaa в положении 116 представляет собой Lys, Thr или Glu; Xaa в положении 117 представляет собой Asp или Glu; Xaa в положении 118 представляет собой Lys или Asp; Xaa в положении 119 представляет собой Glu или Asn; Xaa в положении 120 представляет собой Asn или Lys; Xaa в положении 121 представляет собой Tyr, Leu или Phe; Xaa в положении 122 представляет собой Thr, Lys, Leu или Phe; Xaa в положении 123 представляет собой Val, Ile, Leu, Phe или Asn; Xaa в положении 124 представляет собой Ile, Ser, Asp, Leu или Phe; Xaa в положении 125 представляет собой Lys, Leu, Phe или Met; Xaa в положении 126 представляет собой Lys, Glu, Leu или Phe; Xaa в положении 128 представляет собой Gly, Leu или Phe; Xaa в положении 129 представляет собой Gly, Asn, Leu или Phe; Xaa в положении 130 представляет собой Ser, Ile, Leu или Phe; Xaa в положении 131 представляет собой Pro или Ser; Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr; Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp; Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr; Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr; Xaa в положении 142 представляет собой Val или Cys; Xaa в положении 143 представляет собой Val или Ile; Xaa в положении 145 представляет собой Lys или Val; и Xaa в положении 146 представляет собой Ser или Gly; и где 1-14 аминокислот, необязательно, удалены с N-конца полипептида.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1A, представляет собой полинуклеотид, имеющий нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 257, где Xaa в положении 6 представляет собой Ile, Thr, Leu, Met, Val или Ser; Xaa в положении 7 представляет собой Ala, Met, Val, Leu, Ile или Gly; Xaa в положении 8 представляет собой Thr, Asp, Ser или Glu; Xaa в положении 9 представляет собой Glu, Leu, Gly, Asp, Ala, Ile, Val или Met; Xaa в положении 10 представляет собой Glu, Asn, Asp или Gln; Xaa в положении 11 представляет собой Ser, Val, Thr, Ile, Leu или Met; Xaa в положении 12 представляет собой Lys, Glu, Arg или Asp; Xaa в положении 13 представляет собой Ile, Val, Leu или Met; Xaa в положении 14 представляет собой Arg, Gln, Lys или Asn; Xaa в положении 16 представляет собой Tyr, Gln, Trp, Phe или Asn; Xaa в положении 17 представляет собой Ala, Ser, Gly или Thr; Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr; Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr; Xaa в положении 23 представляет собой Thr, Glu, Ala, Ser, Asp или Gly; Xaa в положении 24 представляет собой Ile, Leu, Val или Met; Xaa в положении 26 представляет собой Val, Ser, Ile, Leu, Met или Thr; Xaa в положении 27 представляет собой Val, Glu, Ile, Leu, Met или Asp; Xaa в положении 29 представляет собой Ser, Met, Thr, Ile, Leu или Val; Xaa в положении 30 представляет собой Asn, Asp, Ser, Glu, Gln или Thr; Xaa в положении 31 представляет собой Phe, Ile, Leu, Val или Met; Xaa в положении 32 представляет собой Lys, Glu, Arg или Asp; Xaa в положении 33 представляет собой Val, Ile, Leu или Met; Xaa в положении 34 представляет собой Glu, Lys, Asp или Arg; Xaa в положении 35 представляет собой Gly или Asn; Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp; Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr; Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr; Xaa в положении 41 представляет собой Gly, Cys или Gln; Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr; Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp; Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp; Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp; Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 47 представляет собой Gly, Leu или Phe; Xaa в положении 48 представляет собой Asp, Asn, Glu, Gln, Leu или Phe; Xaa в положении 50 представляет собой Asp, Ser, Glu, Thr, Leu или Phe; Xaa в положении 51 представляет собой Lys, Asn, Arg, Gln, Leu или Phe; Xaa в положении 52 представляет собой Glu, Leu или Phe; Xaa в положении 53 представляет собой Ile, Leu или Phe; Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe; Xaa в положении 55 представляет собой Pro, Ser, Thr, Leu или Phe; Xaa в положении 56 представляет собой Ser, Asp, Thr, Glu или Leu; Xaa в положении 57 представляет собой Gln, Thr, Glu, Asn, Ser, Asp, Leu или Phe; Xaa в положении 58 представляет собой Ile, Val, Leu, Met или Phe; Xaa в положении 60 представляет собой Gly, Lys, Ala или Arg; Xaa в положении 61 представляет собой Thr, Ile или Phe; Xaa в положении 62 представляет собой Ile, Lys, Val, Leu, Met, Arg или Phe; Xaa в положении 64 представляет собой Lys, Ser, Glu, Arg, Thr, Asp, Leu или Phe; Xaa в положении 65 представляет собой Asp, Ser, Glu, Thr, Leu или Phe; Xaa в положении 66 представляет собой Glu, Gly, Asp или Ala; Xaa в положении 67 представляет собой Asp, Thr, Glu или Ser; Xaa в положении 68 представляет собой Ser, Lys, Thr или Arg; Xaa в положении 69 представляет собой Tyr, Ser, Trp, Phe или Thr; Xaa в положении 70 представляет собой Thr, Lys, Ser или Arg; Xaa в положении 73 представляет собой Ser, Ala, Thr или Gly; Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr; Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr; Xaa в положении 77 представляет собой Glu, Ala, Asp или Gly; Xaa в положении 78 представляет собой Asn, Asp, Gln или Glu; Xaa в положении 79 представляет собой Ala, Thr, Gly или Ser; Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr; Xaa в положении 86 представляет собой Gly, Lys, Ala или Arg; Xaa в положении 88 представляет собой Ser, Glu, Thr или Asp; Xaa в положении 89 представляет собой Leu, Ile, Val или Met; Xaa в положении 91 представляет собой Asp, His или Glu; Xaa в положении 92 представляет собой Gly, Asp, Ala или Glu; Xaa в положении 95 представляет собой Leu, Trp, Ile, Val, Met, Phe или Tyr; Xaa в положении 96 представляет собой Val, Leu, Ile или Met; Xaa в положении 97 представляет собой Phe, Ala или Gly; Xaa в положении 98 представляет собой Glu, Thr, Asp или Ser; Xaa в положении 100 представляет собой Tyr, Lys, Trp или Arg; Xaa в положении 101 представляет собой Trp, Phe или Tyr; Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val; Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr; Xaa в положении 106 представляет собой Ser, Ala, Thr или Gly; Xaa в положении 111 представляет собой Asp, His, Asn, Glu или Gln; Xaa в положении 112 представляет собой Glu, Ser, Asp или Thr; Xaa в положении 113 представляет собой Leu, Ser, Ile, Val, Met или Thr; Xaa в положении 114 представляет собой Thr или Ser; Xaa в положении 115 представляет собой Val, Ile, Val или Met; Xaa в положении 116 представляет собой Lys, Thr, Glu, Arg, Ser или Asp; Xaa в положении 117 представляет собой Asp или Glu; Xaa в положении 118 представляет собой Lys, Asp, Arg или Glu; Xaa в положении 119 представляет собой Glu, Asn, Asp или Gln; Xaa в положении 120 представляет собой Asn, Lys, Asp или Arg; Xaa в положении 121 представляет собой Tyr, Leu или Phe; Xaa в положении 122 представляет собой Thr, Lys, Ser, Arg, Leu или Phe; Xaa в положении 123 представляет собой Val, Ile, Leu, Met, Phe или Asn; Xaa в положении 124 представляет собой Ile, Ser, Asp, Leu, Val Met, Thr, Glu или Phe; Xaa в положении 125 представляет собой Lys, Leu, Phe или Met; Xaa в положении 126 представляет собой Lys, Glu, Arg, Asp, Leu или Phe; Xaa в положении 128 представляет собой Gly, Leu или Phe; Xaa в положении 129 представляет собой Gly, Asn, Ala, Gln, Leu или Phe; Xaa в положении 130 представляет собой Ser, Ile, Thr, Leu, Val, Met или Phe; Xaa в положении 131 представляет собой Pro, Ser или Thr; Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr; Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp; Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr; Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr; Xaa в положении 142 представляет собой Val, Cys, Ile, Leu или Met; Xaa в положении 143 представляет собой Val, Ile, Leu или Met; Xaa в положении 145 представляет собой Lys, Val, Arg, Ile, Leu или Met; и Xaa в положении 146 представляет собой Ser, Gly, Thr или Ala; и где 1-14 аминокислот, необязательно, удалены с N-конца полипептида.
В некоторых вариантах осуществления молекулы нуклеиновой кислоты кодируют полипептид AfIP-1A, имеющий нуклеотидную последовательность, кодирующую полипептид, содержащий один или несколько аминокислотных мотивов, выбранных из: i) аминокислот 15-26 из SEQ ID NO: 2, аминокислот 15-26 из SEQ ID NO: 255, аминокислот 15-26 из SEQ ID NO: 256 или аминокислот 15-26 из SEQ ID NO: 257, ii) аминокислот 33-53 из SEQ ID NO: 2, аминокислот 33-53 из SEQ ID NO: 255, аминокислот 33-53 из SEQ ID NO: 256 или аминокислот 33-53 из SEQ ID NO: 257, iii) аминокислот 71-84 из SEQ ID NO: 2, аминокислот 71-84 из SEQ ID NO: 255, аминокислот 71-84 из SEQ ID NO: 256 или аминокислот 71-84 из SEQ ID NO: 257 и iv) аминокислот 100-107 из SEQ ID NO: 2, аминокислот 100-107 из SEQ ID NO: 255, аминокислот 100-107 из SEQ ID NO: 256 или аминокислот 100-107 из SEQ ID NO: 257. В некоторых вариантах осуществления аминокислотный мотив, необязательно, может иметь делецию одной или нескольких аминокислот в пределах мотива, вставку одной или нескольких аминокислот в пределах мотива или их комбинации. В некоторых вариантах осуществления молекулы нуклеиновой кислоты кодируют полипептид AfIP-1A, имеющий нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотный мотив, представленный положениями 100-107 из SEQ ID NO: 257, где по меньшей мере одна аминокислота в положениях 100-107 из SEQ ID NO: 257 не является идентичной аминокислотам в положениях 100-107 из SEQ ID NO: 18.
В некоторых вариантах осуществления молекулы нуклеиновой кислоты кодируют полипептид AfIP-1A, имеющий нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 2
В некоторых вариантах осуществления молекулы нуклеиновой кислоты кодируют полипептид AfIP-1A, имеющий нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 2, и где полипептид содержит один или несколько аминокислотных мотивов, выбранных из: i) аминокислот 15-26 из SEQ ID NO: 2, аминокислот 15-26 из SEQ ID NO: 255, аминокислот 15-26 из SEQ ID NO: 256 или аминокислот 15-26 из SEQ ID NO: 257, ii) аминокислот 33-53 из SEQ ID NO: 2, аминокислот 33-53 из SEQ ID NO: 255, аминокислот 33-53 из SEQ ID NO: 256 или аминокислот 33-53 из SEQ ID NO: 257, iii) аминокислот 71-84 из SEQ ID NO: 2, аминокислот 71-84 из SEQ ID NO: 255, аминокислот 71-84 из SEQ ID NO: 256 или аминокислот 71-84 из SEQ ID NO: 257 и iv) аминокислот 100-107 из SEQ ID NO: 2, аминокислот 100-107 из SEQ ID NO: 255, аминокислот 100-107 из SEQ ID NO: 256 или аминокислот 100-107 из SEQ ID NO: 257.
В некоторых вариантах осуществления иллюстративные молекулы нуклеиновой кислоты кодируют полипептид AfIP-1A с SEQ ID NO: 2, SEQ ID NO: 6, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 94, SEQ ID NO: 96, SEQ ID NO: 98, SEQ ID NO: 100, SEQ ID NO: 152, SEQ ID NO: 301, SEQ ID NO: 302, SEQ ID NO: 303, SEQ ID NO: 304, SEQ ID NO: 305, SEQ ID NO: 306, SEQ ID NO: 307, SEQ ID NO: 308, SEQ ID NO: 309, SEQ ID NO: 310, SEQ ID NO: 311, SEQ ID NO: 502, SEQ ID NO: 503, SEQ ID NO: 504, SEQ ID NO: 505, SEQ ID NO: 506, SEQ ID NO: 507, SEQ ID NO: 508, SEQ ID NO: 509, SEQ ID NO: 510, SEQ ID NO: 511, SEQ ID NO: 512, SEQ ID NO: 513, SEQ ID NO: 514, SEQ ID NO: 515, SEQ ID NO: 516, SEQ ID NO: 517, SEQ ID NO: 518, SEQ ID NO: 519, SEQ ID NO: 520, SEQ ID NO: 521, SEQ ID NO: 522, SEQ ID NO: 523, SEQ ID NO: 524, SEQ ID NO: 525, SEQ ID NO: 526, SEQ ID NO: 527, SEQ ID NO: 528, SEQ ID NO: 529, SEQ ID NO: 530, SEQ ID NO: 531, SEQ ID NO: 532, SEQ ID NO: 533, SEQ ID NO: 534, SEQ ID NO: 535, SEQ ID NO: 536, SEQ ID NO: 537, SEQ ID NO: 538, SEQ ID NO: 539, SEQ ID NO: 540, SEQ ID NO: 541, SEQ ID NO: 542, SEQ ID NO: 543, SEQ ID NO: 544, SEQ ID NO: 545, SEQ ID NO: 590, SEQ ID NO: 591, SEQ ID NO: 592, SEQ ID NO: 593, SEQ ID NO: 594, SEQ ID NO: 595, SEQ ID NO: 596, SEQ ID NO: 597, SEQ ID NO: 598, SEQ ID NO: 599, SEQ ID NO: 600, SEQ ID NO: 601, SEQ ID NO: 602, SEQ ID NO: 603, SEQ ID NO: 604, SEQ ID NO: 605, SEQ ID NO: 606, SEQ ID NO: 607, SEQ ID NO: 608, SEQ ID NO: 609, SEQ ID NO: 610, SEQ ID NO: 611, SEQ ID NO: 612, SEQ ID NO: 613, SEQ ID NO: 614, SEQ ID NO: 615, SEQ ID NO: 616, SEQ ID NO: 617, SEQ ID NO: 618, SEQ ID NO: 648, SEQ ID NO: 649, SEQ ID NO: 650, SEQ ID NO: 651, SEQ ID NO: 652, SEQ ID NO: 653, SEQ ID NO: 654, SEQ ID NO: 655, SEQ ID NO: 656, SEQ ID NO: 657, SEQ ID NO: 658, SEQ ID NO: 659, SEQ ID NO: 660, SEQ ID NO: 661, SEQ ID NO: 662, SEQ ID NO: 663, SEQ ID NO: 664, SEQ ID NO: 778, SEQ ID NO: 782 и SEQ ID NO: 786, а также аминокислотные замены, делеции, вставки, и их фрагменты, и их комбинации.
В некоторых вариантах осуществления молекулы нуклеиновой кислоты кодируют полипептид AfIP-1A из таблицы 13, таблицы 14, таблицы 18, таблицы 19, таблицы 20, таблицы 31, таблицы 35, таблицы 37 и/или таблицы 38, комбинации его аминокислотных замен и его делеции и/или вставки.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1B, представляет собой полинуклеотид с нуклеотидной последовательностью, кодирующей полипептид, содержащий аминокислотную последовательность, по меньшей мере на 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичную аминокислотной последовательности с SEQ ID NO: 4, где полипептид обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1B, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO 784 и SEQ ID NO: 788, где полипептид AfIP-1B имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO 784 и SEQ ID NO: 788, и полипептид AfIP-1B обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1B, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 4, где полипептид AfIP-1B имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 4, и полипептид AfIP-1B обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1B, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 30, где полипептид AfIP-1B имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 30, и полипептид AfIP-1B обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1B, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 34, где полипептид AfIP-1B имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 34, и полипептид AfIP-1B обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1B, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 38, где полипептид AfIP-1B имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 38, и полипептид AfIP-1B обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1B, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 780, где полипептид AfIP-1B имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 780, и полипептид AfIP-1B обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1B, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 784, где полипептид AfIP-1B имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 784, и полипептид AfIP-1B обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1B, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 788, где полипептид AfIP-1B имеет по меньшей мере одно аминокислотное изменение по сравнению с SEQ ID NO: 788, и полипептид AfIP-1B обладает пестицидной активностью.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1B, содержащий аминокислотную последовательность с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO 784 и SEQ ID NO: 788, имеющие 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 аминокислотных замен по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO 784 и SEQ ID NO: 788.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1B, содержащий аминокислотную последовательность с SEQ ID NO: 4, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 аминокислотных замен по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 4.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1B, содержащий аминокислотную последовательность с SEQ ID NO: 258, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 аминокислотных замен в положениях, обозначенных Xaa, по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 4.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, отличающаяся от геномной, кодирует полипептид AfIP-1B, содержащий аминокислотную последовательность с SEQ ID NO: 259, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 аминокислотных замен в положениях, обозначенных Xaa, по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 4.
В некоторых вариантах осуществления молекула нуклеиновой кислоты кодирует полипептид AfIP-1B, имеющий 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 аминокислотных замен, в любой комбинации, по сравнению с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO 784 и SEQ ID NO: 788.
В некоторых вариантах осуществления молекула нуклеиновой кислоты кодирует полипептид AfIP-1B, имеющий 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 аминокислотных замен, в любой комбинации, в остатках, обозначенных Xaa, в SEQ ID NO: 259 по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 4.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1B, представляет собой полинуклеотид, имеющий нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 258, где Xaa в положении 2 представляет собой Asp или Gly; Xaa в положении 12 представляет собой Met или Leu; Xaa в положении 34 представляет собой Ile или Leu; Xaa в положении 38 представляет собой Ile или Leu; Xaa в положении 42 представляет собой Glu или Asp; Xaa в положении 43 представляет собой Ile или Leu; Xaa в положении 53 представляет собой Tyr или Phe; Xaa в положении 55 представляет собой Tyr или Phe; Xaa в положении 71 представляет собой Gly или Cys; Xaa в положении 82 представляет собой Val или Met; Xaa в положении 86 представляет собой Val или Leu; Xaa в положении 94 представляет собой Tyr или Phe; Xaa в положении 97 представляет собой Ile или Leu; Xaa в положении 101 представляет собой Tyr или Phe; Xaa в положении 103 представляет собой Ile, Leu, Gly, Val, Trp, Phe, Thr, Cys, Glu или Arg; Xaa в положении 105 представляет собой Met, Gly, Val, Leu, Trp, Phe, Pro, Thr, Cys, Asn, Gln или Arg; Xaa в положении 106 представляет собой Ile или Leu; Xaa в положении 108 представляет собой Gly, Ala, Leu, Val, Ile, Met, Trp, Phe, Ser, Thr, Cys, Tyr, Asn, Gln, Asp, Lys или His; Xaa в положении 109 представляет собой Ile, Leu, Ala, Val, Leu, Met, Trp, Phe, Pro, Cys, Asn или Glu; Xaa в положении 110 представляет собой Glu, Gly, Ala, Val, Leu, Met, Trp, Ser, Thr, Cys, Tyr, Asp, Arg или His; Xaa в положении 111 представляет собой Tyr, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Thr, Cys, Asp, Glu, Lys, Arg или His; Xaa в положении 115 представляет собой Asp или Glu; Xaa в положении 119 представляет собой Val или Ala; Xaa в положении 134 представляет собой Ser или Leu; Xaa в положении 137 представляет собой Val, Phe, Ala, Leu, Trp, Pro, Ser, Cys, Asp, Glu или Arg; Xaa в положении 139 представляет собой Glu или Asp; Xaa в положении 141 представляет собой Phe, Val, Leu, Ile, Trp, Ser или Cys; Xaa в положении 144 представляет собой Ala или Val; Xaa в положении 148 представляет собой Ser, Phe или Thr; Xaa в положении 152 представляет собой Ile или Thr; Xaa в положении 155 представляет собой Asp или Glu; Xaa в положении 179 представляет собой Gly, Val, Trp, Ser, Cys или Arg; Xaa в положении 181 представляет собой Ile, Val или Leu; Xaa в положении 182 представляет собой Trp, Gly, Ala, Val, Leu, Met, Ser, Cys, Glu или Arg; Xaa в положении 188 представляет собой Val или Leu; Xaa в положении 196 представляет собой Lys или Glu; Xaa в положении 197 представляет собой Thr или Ser; Xaa в положении 201 представляет собой Trp, Cys или Phe; Xaa в положении 202 представляет собой Lys или Asn; Xaa в положении 203 представляет собой Tyr или Phe; Xaa в положении 208 представляет собой Glu или Asp; Xaa в положении 214 представляет собой Ile или Leu; Xaa в положении 220 представляет собой Ile или Leu; Xaa в положении 224 представляет собой Tyr или Phe; Xaa в положении 234 представляет собой Glu или Asp; Xaa в положении 235 представляет собой Val или Leu; Xaa в положении 270 представляет собой Ile или Val; Xaa в положении 296 представляет собой Lys или Glu; Xaa в положении 298 представляет собой Ala или Glu; Xaa в положении 299 представляет собой Glu или Gly; Xaa в положении 300 представляет собой Ile или Val; Xaa в положении 305 представляет собой Asp или Glu; Xaa в положении 308 представляет собой Lys или Asn; Xaa в положении 317 представляет собой Ala или Ser; Xaa в положении 323 представляет собой Glu или Asp; Xaa в положении 335 представляет собой Glu или Asp; Xaa в положении 343 представляет собой Asp или Glu; Xaa в положении 352 представляет собой Glu или Asp; Xaa в положении 359 представляет собой Glu, Gly, Ala, Val, Leu, Trp, Phe, Pro, Ser, Thr, Lys или Arg; Xaa в положении 360 представляет собой Asn, Gly, Val, Leu, Ile, Met, Phe, Pro, Thr, Asn, Asp, Lys, Arg или His; Xaa в положении 361 представляет собой Ser, Gly, Val, Leu или Glu; Xaa в положении 363 представляет собой Asp, Gly, Leu, Ile, Trp или Ser; Xaa в положении 364 представляет собой Val, Pro, Ser, Thr, Asn, Gln, Asp, Glu или Lys; Xaa в положении 365 представляет собой Leu, Gly, Ala, Val, Ile, Trp, Phe, Pro, Ser, Thr, Cys, Tyr, Gln, Asp, Glu, Arg или His; Xaa в положении 367 представляет собой Glu или Lys; Xaa в положении 368 представляет собой Gly или Asp; Xaa в положении 370 представляет собой Ile или Val; Xaa в положении 373 представляет собой Arg или Ser; Xaa в положении 374 представляет собой Asn или Lys; Xaa в положении 377 представляет собой Leu или Ile; Xaa в положении 384 представляет собой Thr или Ala; Xaa в положении 385 представляет собой Ile или Ser; Xaa в положении 388 представляет собой Asp или Glu; Xaa в положении 393 представляет собой Tyr или Phe; Xaa в положении 398 представляет собой Ala или Val; Xaa в положении 414 представляет собой Tyr или Phe; Xaa в положении 418 представляет собой Ile или Leu; Xaa в положении 419 представляет собой Ser или Asn; Xaa в положении 423 представляет собой Val или Leu; Xaa в положении 425 представляет собой Glu или Val; Xaa в положении 427 представляет собой Ile или Val; Xaa в положении 434 представляет собой Met или Thr; Xaa в положении 481 представляет собой Glu или Asp; Xaa в положении 495 представляет собой Asp или Glu; Xaa в положении 509 представляет собой Phe, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Cys, Tyr, Asn, Asp, Glu или Arg; Xaa в положении 512 представляет собой Asn, Ser, Gly, Ala, Leu, Met, Trp, Phe, Ser, Thr, Cys, Gln или Arg; Xaa в положении 514 представляет собой Glu, Gly, Ile, Asp или Arg; Xaa в положении 516 представляет собой Gly, Ala, Val, Met, Pro, Thr, Asn, Gln, Asp, Glu или Lys; Xaa в положении 519 представляет собой Leu, Gly, Ala, Val, Met, Phe, Pro, Tyr, Gln, Asp, Lys или Arg; Xaa в положении 526 представляет собой Val или Leu; Xaa в положении 530 представляет собой Ile или Leu; Xaa в положении 533 представляет собой Val или Ala; Xaa в положении 536 представляет собой Ile или Leu; Xaa в положении 538 представляет собой Tyr или Phe; Xaa в положении 543 представляет собой Tyr или Phe; Xaa в положении 544 представляет собой Lys или Arg; Xaa в положении 547 представляет собой Tyr или Phe; Xaa в положении 550 представляет собой Tyr или Phe; Xaa в положении 552 представляет собой Asn или Ser; Xaa в положении 558 представляет собой Phe или Leu; Xaa в положении 600 представляет собой Met или Val; Xaa в положении 602 представляет собой Met или Ile; Xaa в положении 607 представляет собой Asp или Gly; Xaa в положении 610 представляет собой Thr или Lys; Xaa в положении 612 представляет собой Ile или Thr; Xaa в положении 613 представляет собой Leu или Pro; Xaa в положении 615 представляет собой Asn или Asp; Xaa в положении 619 представляет собой Lys или Arg; Xaa в положении 625 представляет собой Tyr или Phe; Xaa в положении 629 представляет собой Lys или Asn; Xaa в положении 631 представляет собой Ile, Val или Leu; Xaa в положении 633 представляет собой Trp или Phe; Xaa в положении 646 представляет собой Gln или Arg; Xaa в положении 661 представляет собой Asn или Ser; Xaa в положении 683 представляет собой Thr или Ala; Xaa в положении 696 представляет собой Glu, Asp или Gln; Xaa в положении 700 представляет собой Ser или Gly; и Xaa в положении 702 представляет собой Phe или Ser; и где 1-25 аминокислот, необязательно, удалены с C-конца полипептида.
В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1B, представляет собой полинуклеотид, имеющий нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность с SEQ ID NO: 259, где Xaa в положении 2 представляет собой Asp или Gly; Xaa в положении 12 представляет собой Met, Leu, Ile или Val; Xaa в положении 34 представляет собой Ile или Leu; Xaa в положении 38 представляет собой Ile или Leu; Xaa в положении 42 представляет собой Glu или Asp; Xaa в положении 43 представляет собой Ile или Leu; Xaa в положении 53 представляет собой Tyr или Phe; Xaa в положении 55 представляет собой Tyr или Phe; Xaa в положении 71 представляет собой Gly, Cys или Ala; Xaa в положении 82 представляет собой Val или Met; Xaa в положении 86 представляет собой Val или Leu; Xaa в положении 94 представляет собой Tyr или Phe; Xaa в положении 97 представляет собой Ile или Leu; Xaa в положении 101 представляет собой Tyr или Phe; Xaa в положении 103 представляет собой Ile, Leu, Gly, Val, Trp, Phe, Thr, Cys, Glu или Arg; Xaa в положении 105 представляет собой Met, Gly, Val, Leu, Trp, Phe, Pro, Thr, Cys, Asn, Gln или Arg; Xaa в положении 106 представляет собой Ile или Leu; Xaa в положении 108 представляет собой Gly, Ala, Leu, Val, Ile, Met, Trp, Phe, Ser, Thr, Cys, Tyr, Asn, Glu, Asp, Lys или His; Xaa в положении 109 представляет собой Ile, Leu, Ala, Val, Leu, Met, Trp, Phe, Pro, Cys, Asn или Glu; Xaa в положении 110 представляет собой Glu, Gly, Ala, Val, Leu, Met, Trp, Ser, Thr, Cys, Tyr, Asp, Arg или His; Xaa в положении 111 представляет собой Tyr, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Thr, Cys, Asp, Glu, Lys, Arg или His; Xaa в положении 115 представляет собой Asp или Glu; Xaa в положении 119 представляет собой Val, Ala, Ile или Leu; Xaa в положении 134 представляет собой Ser или Leu; Xaa в положении 137 представляет собой Val, Phe, Ala, Leu, Trp, Pro, Ser, Cys, Asp, Glu или Arg; Xaa в положении 139 представляет собой Glu или Asp; Xaa в положении 141 представляет собой Phe, Val, Leu, Ile, Trp, Ser или Cys; Xaa в положении 144 представляет собой Ala, Val, Gly, Ile, Leu или Met; Xaa в положении 148 представляет собой Ser, Phe, Thr или Trp; Xaa в положении 152 представляет собой Ile, Thr, Leu, Val, Met или Ser; Xaa в положении 155 представляет собой Asp или Glu; Xaa в положении 179 представляет собой Gly, Val, Trp, Ser, Cys или Arg; Xaa в положении 181 представляет собой Ile, Val, Met или Leu; Xaa в положении 182 представляет собой Trp, Gly, Ala, Val, Leu, Met, Ser, Cys, Glu или Arg; Xaa в положении 188 представляет собой Val или Leu; Xaa в положении 196 представляет собой Lys или Glu; Xaa в положении 197 представляет собой Thr или Ser; Xaa в положении 201 представляет собой Trp, Cys, Tyr или Phe; Xaa в положении 202 представляет собой Lys, Asn или Arg; Xaa в положении 203 представляет собой Tyr или Phe; Xaa в положении 208 представляет собой Glu или Asp; Xaa в положении 214 представляет собой Ile или Leu; Xaa в положении 220 представляет собой Ile или Leu; Xaa в положении 224 представляет собой Tyr или Phe; Xaa в положении 234 представляет собой Glu или Asp; Xaa в положении 235 представляет собой Val или Leu; Xaa в положении 270 представляет собой Ile, Val, Leu или Met; Xaa в положении 296 представляет собой Lys или Glu; Xaa в положении 298 представляет собой Ala, Glu, Gly или Asp; Xaa в положении 299 представляет собой Glu, Gly, Asp или Ala; Xaa в положении 300 представляет собой Ile, Val, Ile или Met; Xaa в положении 305 представляет собой Asp или Glu; Xaa в положении 308 представляет собой Lys или Asn; Xaa в положении 317 представляет собой Ala, Ser, Gly или Thr; Xaa в положении 323 представляет собой Glu или Asp; Xaa в положении 335 представляет собой Glu или Asp; Xaa в положении 343 представляет собой Asp или Glu; Xaa в положении 352 представляет собой Glu или Asp; Xaa в положении 359 представляет собой Glu, Gly, Ala, Val, Leu, Trp, Phe, Pro, Ser, Thr, Lys или Arg; Xaa в положении 360 представляет собой Asn, Gly, Val, Leu, Ile, Met, Phe, Pro, Thr, Asn, Asp, Lys, Arg или His; Xaa в положении 361 представляет собой Ser, Gly, Val, Leu или Glu; Xaa в положении 363 представляет собой Asp, Gly, Leu, Ile, Trp или Ser; Xaa в положении 364 представляет собой Val, Pro, Ser, Thr, Asn, Gln, Asp, Glu или Lys; Xaa в положении 365 представляет собой Leu, Gly, Ala, Val, Ile, Trp, Phe, Pro, Ser, Thr, Cys, Tyr, Gln, Asp, Glu, Arg или His; Xaa в положении 367 представляет собой Glu или Lys; Xaa в положении 368 представляет собой Gly или Asp; Xaa в положении 370 представляет собой Ile, Val, Leu или Met; Xaa в положении 373 представляет собой Arg или Ser; Xaa в положении 374 представляет собой Asn, Lys, Gln или Arg; Xaa в положении 377 представляет собой Leu, Ile, Val или Met; Xaa в положении 384 представляет собой Thr, Ala, Ser или Gly; Xaa в положении 385 представляет собой Ile, Ser, Leu, Val, Met или Thr; Xaa в положении 388 представляет собой Asp или Glu; Xaa в положении 393 представляет собой Tyr, Phe или Trp; Xaa в положении 398 представляет собой Ala или Val; Xaa в положении 414 представляет собой Tyr или Phe; Xaa в положении 418 представляет собой Ile или Leu; Xaa в положении 419 представляет собой Ser, Asn, Thr или Gln; Xaa в положении 423 представляет собой Val или Leu; Xaa в положении 425 представляет собой Glu или Val; Xaa в положении 427 представляет собой Ile или Val; Xaa в положении 434 представляет собой Met или Thr; Xaa в положении 481 представляет собой Glu или Asp; Xaa в положении 495 представляет собой Asp или Glu; Xaa в положении 509 представляет собой Phe, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Cys, Tyr, Asn, Asp, Glu или Arg; Xaa в положении 512 представляет собой Asn, Ser, Gly, Ala, Leu, Met, Trp, Phe, Ser, Thr, Cys, Gln или Arg; Xaa в положении 514 представляет собой Glu, Gly, Ile, Asp или Arg; Xaa в положении 516 представляет собой Gly, Ala, Val, Met, Pro, Thr, Asn, Gln, Asp, Glu или Lys; Xaa в положении 519 представляет собой Leu, Gly, Ala, Val, Met, Phe, Pro, Tyr, Gln, Asp, Lys или Arg; Xaa в положении 526 представляет собой Val или Leu; Xaa в положении 530 представляет собой Ile или Leu; Xaa в положении 533 представляет собой Val или Ala; Xaa в положении 536 представляет собой Ile или Leu; Xaa в положении 538 представляет собой Tyr, Phe или Trp; Xaa в положении 543 представляет собой Tyr или Phe; Xaa в положении 544 представляет собой Lys или Arg; Xaa в положении 547 представляет собой Tyr или Phe; Xaa в положении 550 представляет собой Tyr, Phe или Trp; Xaa в положении 552 представляет собой Asn, Ser, Gln или Thr; Xaa в положении 558 представляет собой Phe или Leu; Xaa в положении 600 представляет собой Met или Val; Xaa в положении 602 представляет собой Met, Ile, Leu или Val; Xaa в положении 607 представляет собой Asp или Gly; Xaa в положении 610 представляет собой Thr, Lys, Ser или Arg; Xaa в положении 612 представляет собой Ile или Thr; Xaa в положении 613 представляет собой Leu или Pro; Xaa в положении 615 представляет собой Asn или Asp; Xaa в положении 619 представляет собой Lys или Arg; Xaa в положении 625 представляет собой Tyr, Phe или Trp; Xaa в положении 629 представляет собой Lys или Asn; Xaa в положении 631 представляет собой Ile, Val, Leu или Met; Xaa в положении 633 представляет собой Trp или Phe; Xaa в положении 646 представляет собой Gln или Arg; Xaa в положении 661 представляет собой Asn или Ser; Xaa в положении 683 представляет собой Thr, Ala, Ser или Gly; Xaa в положении 696 представляет собой Glu, Asp или Gln; Xaa в положении 700 представляет собой Ser или Gly; и Xaa в положении 702 представляет собой Phe или Ser; и где 1-25 аминокислот, необязательно, удалены с C-конца полипептида.
В некоторых вариантах осуществления молекулы нуклеиновой кислоты кодируют полипептид AfIP-1B, имеющий нуклеотидную последовательность, кодирующую полипептид, содержащий один или несколько аминокислотных мотивов, выбранных из i) аминокислот 105-115 из SEQ ID NO: 4, аминокислот 105-115 из SEQ ID NO: 258 или аминокислот 105-115 из SEQ ID NO: 259, ii) аминокислот 133-141 из SEQ ID NO: 4, аминокислот 133-141 из SEQ ID NO: 258 или аминокислот 133-141 из SEQ ID NO: 259, iii) аминокислот 177-184 из SEQ ID NO: 4, аминокислот 177-184 из SEQ ID NO: 258 или аминокислот 177-184 из SEQ ID NO: 259, iv) аминокислот 358-365 из SEQ ID NO: 4, аминокислот 358-365 из SEQ ID NO: 258 или аминокислот 358-365 из SEQ ID NO: 259 и v) аминокислот 511-520 из SEQ ID NO: 4, аминокислот 511-520 из SEQ ID NO: 258 или аминокислот 511-520 из SEQ ID NO: 259. В некоторых вариантах осуществления аминокислотный мотив, необязательно, может иметь делецию одной или нескольких аминокислот в пределах мотива, вставку одной или нескольких аминокислот в пределах мотива или их комбинации.
В некоторых вариантах осуществления молекулы нуклеиновой кислоты кодируют полипептид AfIP-1B, имеющий нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 4.
В некоторых вариантах осуществления молекулы нуклеиновой кислоты кодируют полипептид AfIP-1B, имеющий нуклеотидную последовательность, кодирующую полипептид, содержащий аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 4, и где полипептид содержит один или несколько аминокислотных мотивов, выбранных из: i) аминокислот 105-115 из SEQ ID NO: 4, аминокислот 105-115 из SEQ ID NO: 258 или аминокислот 105-115 из SEQ ID NO: 259, ii) аминокислот 133-141 из SEQ ID NO: 4, аминокислот 133-141 из SEQ ID NO: 258 или аминокислот 133-141 из SEQ ID NO: 259, iii) аминокислот 177-184 из SEQ ID NO: 4, аминокислот 177-184 из SEQ ID NO: 258 или аминокислот 177-184 из SEQ ID NO: 259, iv) аминокислот 358-365 из SEQ ID NO: 4, аминокислот 358-365 из SEQ ID NO: 258 или аминокислот 358-365 из SEQ ID NO: 259 и v) аминокислот 511-520 из SEQ ID NO: 4, аминокислот 511-520 из SEQ ID NO: 258 или аминокислот 511-520 из SEQ ID NO: 259.
В некоторых вариантах осуществления иллюстративные молекулы нуклеиновой кислоты кодируют полипептид AfIP-1B с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 88, SEQ ID NO: 90, SEQ ID NO: 92, SEQ ID NO: 323, SEQ ID NO: 324, SEQ ID NO: 325, SEQ ID NO: 326, SEQ ID NO: 327, SEQ ID NO: 328, SEQ ID NO: 329, SEQ ID NO: 330, SEQ ID NO: 331, SEQ ID NO: 332, SEQ ID NO: 333, SEQ ID NO: 334, SEQ ID NO: 335, SEQ ID NO: 336, SEQ ID NO: 337, SEQ ID NO: 338, SEQ ID NO: 339, SEQ ID NO: 340, SEQ ID NO: 341, SEQ ID NO: 342, SEQ ID NO: 343, SEQ ID NO: 344, SEQ ID NO: 345, SEQ ID NO: 346, SEQ ID NO: 347, SEQ ID NO: 348, SEQ ID NO: 349, SEQ ID NO: 350, SEQ ID NO: 351, SEQ ID NO: 352, SEQ ID NO: 353, SEQ ID NO: 354, SEQ ID NO: 355, SEQ ID NO: 356, SEQ ID NO: 357, SEQ ID NO: 358, SEQ ID NO: 359, SEQ ID NO: 360, SEQ ID NO: 361, SEQ ID NO: 362, SEQ ID NO: 363, SEQ ID NO: 364, SEQ ID NO: 365, SEQ ID NO: 366, SEQ ID NO: 367, SEQ ID NO: 368, SEQ ID NO: 369, SEQ ID NO: 370, SEQ ID NO: 371, SEQ ID NO: 372, SEQ ID NO: 373, SEQ ID NO: 374, SEQ ID NO: 375, SEQ ID NO: 376, SEQ ID NO: 377, SEQ ID NO: 378, SEQ ID NO: 379, SEQ ID NO: 380, SEQ ID NO: 381, SEQ ID NO: 382, SEQ ID NO: 383, SEQ ID NO: 384, SEQ ID NO: 385, SEQ ID NO: 386, SEQ ID NO: 387, SEQ ID NO: 388, SEQ ID NO: 389, SEQ ID NO: 390, SEQ ID NO: 687, SEQ ID NO: 688, SEQ ID NO: 689, SEQ ID NO: 690, SEQ ID NO: 691, SEQ ID NO: 692, SEQ ID NO: 693, SEQ ID NO: 694, SEQ ID NO: 695, SEQ ID NO: 696, SEQ ID NO: 697, SEQ ID NO: 698, SEQ ID NO: 699, SEQ ID NO:700, SEQ ID NO: 701, SEQ ID NO: 702, SEQ ID NO: 703, SEQ ID NO: 704, SEQ ID NO: 705, SEQ ID NO: 706, SEQ ID NO: 707, SEQ ID NO: 708, SEQ ID NO: 780, SEQ ID NO 784 и SEQ ID NO: 788, а также аминокислотные замены, делеции, вставки и их фрагменты.
В некоторых вариантах осуществления молекулы нуклеиновой кислоты кодируют полипептид AfIP-1B из таблицы 22, таблицы 24, таблицы 33 и/или таблицы 39, комбинации его аминокислотных замен и его делеции и/или вставки.
Также предусмотрены молекулы нуклеиновой кислоты, которые кодируют продукты транскрипции и/или трансляции, которые впоследствии подвергаются сплайсингу с образованием, в конечном итоге, функциональных полипептидов AfIP-1A или AfIP-1B. Сплайсинг может осуществляться in vitro или in vivo, и он может включать цис- или транс-сплайсинг. Субстратом для сплайсинга могут быть полинуклеотиды (например, РНК-транскрипты) или полипептиды. Примером цис-сплайсинга полинуклеотида является ситуация, когда интрон, вставленный в кодирующую последовательность, удаляется и два фланкирующих экзонных участка соединяются с образованием последовательности, кодирующей полипептид AfIP-1A и/или AfIP-1B. Примером транс-сплайсинга будет ситуация, когда полинуклеотид кодируется с разделением кодирующей последовательности на два или более фрагментов, которые могут транскрибироваться раздельно, а затем соединяться с образованием пестицидной кодирующей последовательности полной длины. Применение последовательности энхансера сплайсинга, которую можно вводить в конструкт, может облегчать сплайсинг, как цис-, так и транс-сплайсинг полипептидов (патенты США №№ 6365377 и 6531316). Таким образом, в некоторых вариантах осуществления полинуклеотиды напрямую не кодируют полипептид AfIP-1A и/или AfIP-1B полной длины, а кодируют фрагмент или фрагменты полипептида AfIP-1A и/или AfIP-1B. Эти полинуклеотиды можно применять для экспрессии функционального полипептида AfIP-1A и/или AfIP-1B посредством механизма, включающего сплайсинг, при этом сплайсинг может происходить на уровне полинуклеотида (например, интрон/экзон) и/или полипептида (например, интеин/экстеин). Это может применяться, например, при контроле экспрессии пестицидной активности, поскольку функциональный пестицидный полипептид будет экспрессироваться только в том случае, если все требуемые фрагменты экспрессируются в среде, которая обеспечивает возможность процессов сплайсинга с образованием функционального продукта. В другом примере введение одной или нескольких последовательностей вставок в полинуклеотид может облегчать рекомбинацию с полинуклеотидом с низкой гомологией; применение интрона или интеина для последовательности вставки облегчает удаление вставочной последовательности, что тем самым восстанавливает функцию кодируемого варианта.
Молекулы нуклеиновой кислоты, которые являются фрагментами этих последовательностей нуклеиновой кислоты, кодирующих полипептиды AfIP-1A и/или AfIP-1B, также охватываются вариантами осуществления. Применяемый в данном документе “фрагмент” относится к части последовательности нуклеиновой кислоты, кодирующей полипептид AfIP-1A и/или AfIP-1B. Фрагмент последовательности нуклеиновой кислоты может кодировать биологически активную часть полипептида AfIP-1A и/или AfIP-1B, или он может представлять собой фрагмент, который можно применять в качестве гибридизационного зонда или ПЦР-праймера с применением раскрытых ниже способов. Молекулы нуклеиновой кислоты, которые являются фрагментами последовательности нуклеиновой кислоты, кодирующей полипептид AfIP-1A, содержат по меньшей мере приблизительно 150, 180, 210, 240, 270, 300, 330 или 360 смежных нуклеотидов или вплоть до количества нуклеотидов, присутствующих в последовательности нуклеиновой кислоты полной длины, кодирующей полипептид AfIP-1A, раскрытый в данном документе, в зависимости от предполагаемого применения. “Смежные нуклеотиды” применяется в данном документе для обозначения нуклеотидных остатков, которые непосредственно прилегают друг к другу. Фрагменты последовательности нуклеиновой кислоты согласно вариантам осуществления будут кодировать фрагменты белка, которые сохраняют биологическую активность полипептида AfIP-1A и, вследствие этого, сохраняют инсектицидную активность. “Сохранять активность AfIP-1A” применяется в данном документе для обозначения полипептида, обладающего по меньшей мере приблизительно 10%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 70%, 80%, 90%, 95% или большей инсектицидной активностью полипептида полной длины AfIP-1A с SEQ ID NO: 2 отдельно или ассоциированного с полипептидом AfIP-1B с SEQ ID NO: 4. В одном варианте осуществления инсектицидная активность представляет собой активность в отношении Lepidoptera. Молекулы нуклеиновой кислоты, которые являются фрагментами последовательности нуклеиновой кислоты, кодирующей полипептид AfIP-1B, содержат по меньшей мере приблизительно 225, 450, 600, 750, 900, 1050, 1200, 1350, 1500, 1650, 1800, 1950 или 2100 смежных нуклеотидов или вплоть до количества нуклеотидов, присутствующих в последовательности нуклеиновой кислоты полной длины, кодирующей полипептид AfIP-1B, раскрытый в данном документе, в зависимости от предполагаемого применения. Фрагменты последовательности нуклеиновой кислоты согласно вариантам осуществления будут кодировать фрагменты белка, которые сохраняют биологическую активность полипептида AfIP-1B и, вследствие этого, сохраняют инсектицидную активность. “Сохранять активность AfIP-1B” применяется в данном документе для обозначения полипептида, обладающего по меньшей мере приблизительно 10%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 70%, 80%, 90%, 95% или большей инсектицидной активностью полипептида полной длины AfIP-1B с SEQ ID NO: 4 отдельно или ассоциированного с полипептидом AfIP-1A с SEQ ID NO: 2. В одном варианте осуществления инсектицидная активность направлена против вида чешуекрылого. В одном варианте осуществления инсектицидная активность направлена против вида из отряда Hemiptera.
В некоторых вариантах осуществления фрагмент последовательности нуклеиновой кислоты, кодирующей полипептид AfIP-1A, кодирующий биологически активную часть белка, будет кодировать по меньшей мере приблизительно 15, 20, 30, 50, 75, 100, 125 смежных аминокислот или вплоть до общего количества аминокислот, присутствующих в полипептиде полной длины AfIP-1A согласно вариантам осуществления. В некоторых вариантах осуществления фрагмент характеризуется N-концевым и/или C-концевым усечением по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или более аминокислот с N-конца и/или C-конца относительно SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784 или их вариантов, например, путем протеолиза, вставки старт-кодона, делеции кодонов, кодирующих удаляемые аминокислоты, с одновременной вставкой стоп-кодона или путем вставки стоп-кодона в кодирующую последовательность. В некоторых вариантах осуществления фрагменты, охваченные в данном документе, получены в результате удаления N-концевых 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более аминокислот с N-конца относительно SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784 или их вариантов, например, путем протеолиза или путем вставки старт-кодона в кодирующую последовательность. В некоторых вариантах осуществления фрагменты, охваченные в данном документе, получены в результате удаления N-концевых 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 аминокислот относительно SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784 или их вариантов, например, путем протеолиза или путем вставки старт-кодона в кодирующую последовательность.
В некоторых вариантах осуществления фрагмент последовательности нуклеиновой кислоты, кодирующей полипептид AfIP-1B, кодирующий биологически активную часть белка, будет кодировать по меньшей мере приблизительно 75, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650 или 700 смежных аминокислот или вплоть до общего количества аминокислот, присутствующих в полипептиде полной длины AfIP-1B согласно вариантам осуществления. В некоторых вариантах осуществления фрагмент характеризуется N-концевым и/или C-концевым усечением по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или более аминокислот с N-конца и/или C-конца относительно SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO 784 и SEQ ID NO: 788 или их вариантов, например, путем протеолиза, вставки старт-кодона, делеции кодонов, кодирующих удаляемые аминокислоты, с одновременной вставкой стоп-кодона, или путем вставки стоп-кодона в кодирующую последовательность. В некоторых вариантах осуществления фрагменты, охваченные в данном документе, получены в результате удаления N-концевых 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более аминокислот с N-конца относительно SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO 784 и SEQ ID NO: 788 или их вариантов, например, путем протеолиза или путем вставки старт-кодона в кодирующую последовательность. В некоторых вариантах осуществления фрагменты, охваченные в данном документе, получены в результате удаления 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 аминокислот с C-конца относительно SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO 784 и SEQ ID NO: 788 или их варианты, например, путем протеолиза или путем удаления кодонов, кодирующих удаляемые аминокислоты, с одновременной вставкой стоп-кодона или путем вставки стоп-кодона в кодирующую последовательность.
В некоторых вариантах осуществления полипептид AfIP-1A кодируется последовательностью нуклеиновой кислоты, достаточно гомологичной с последовательностью нуклеиновой кислоты с SEQ ID NO: 1, SEQ ID NO: 27, SEQ ID NO: 31 или SEQ ID NO: 35. “Достаточно гомологичный” применяется в данном документе для обозначения аминокислотной последовательности или последовательности нуклеиновой кислоты, последовательность которой по меньшей мере на приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологична эталонной последовательности с применением одной из программ выравнивания, описанных в данном документе, с использованием стандартных параметров. Специалист в данной области техники поймет, что эти значения можно соответствующим образом скорректировать для определения соответствующей гомологии белков, кодируемых двумя последовательностями нуклеиновой кислоты, принимая во внимание вырожденность кодонов, аминокислотное сходство, расположение рамки считывания и т.п. В некоторых вариантах осуществления гомология последовательностей определяется в отношении последовательности полной длины полинуклеотида, кодирующего полипептид AfIP-1A, или в отношении последовательности полной длины полипептида AfIP-1A. В некоторых вариантах осуществления последовательность полипептида AfIP-1A является по меньшей мере на приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной при сравнении с SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO 778, SEQ ID NO: 782 или SEQ ID NO: 786. В некоторых вариантах осуществления идентичность последовательностей определяется в отношении последовательности полной длины полинуклеотида, кодирующего полипептид AfIP-1A, или в отношении последовательности полной длины полипептида AfIP-1A. В некоторых вариантах осуществления идентичность последовательностей рассчитывают с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию. В некоторых вариантах осуществления идентичность последовательностей рассчитывают по всей длине полипептида с применением алгоритма ClustalW в модуле ALIGNX пакета программ NTI Program Suite (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию.
В некоторых вариантах осуществления полипептиды AfIP-1B кодируются последовательностью нуклеиновой кислоты, достаточно гомологичной с последовательностью нуклеиновой кислоты с SEQ ID NO: 3, SEQ ID NO: 29, SEQ ID NO: 33 или SEQ ID NO: 37. “Достаточно гомологичный” применяется в данном документе для обозначения аминокислоты или последовательности нуклеиновой кислоты, последовательность которой по меньшей мере на приблизительно 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологична эталонной последовательности с применением одной из программ выравнивания, описанных в данном документе, с использованием стандартных параметров. Специалист в данной области техники поймет, что эти значения можно соответствующим образом скорректировать для определения соответствующей идентичности белков, кодируемых двумя последовательностями нуклеиновой кислоты, принимая во внимание вырожденность кодонов, аминокислотное сходство, расположение рамки считывания и т.п. В некоторых вариантах осуществления гомология последовательностей определяется в отношении последовательности полной длины полинуклеотида, кодирующего полипептид AfIP-1B, или в отношении последовательности полной длины полипептида AfIP-1B. В некоторых вариантах осуществления последовательность полипептида AfIP-1B является по меньшей мере на приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной при сравнении с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO: 788. В некоторых вариантах осуществления идентичность последовательности определяется в отношении последовательности полной длины полинуклеотида, кодирующего полипептид AfIP-1B, или в отношении последовательности полной длины полипептида AfIP-1B. В некоторых вариантах осуществления идентичность последовательности рассчитывают с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию. В некоторых вариантах осуществления идентичность последовательностей рассчитывают по всей длине полипептида с применением алгоритма ClustalW в модуле ALIGNX пакета программ NTI Program Suite (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию.
Для определения процентной идентичности двух аминокислотных последовательностей или двух последовательностей нуклеиновой кислоты осуществляют выравнивание последовательностей для целей оптимального сравнения. Процентная идентичность двух последовательностей является функцией количества идентичных положений, имеющихся в обеих последовательностях (т.е. процентная идентичность=количество идентичных положений/общее количество положений (например, перекрывающихся положений)×100). В одном варианте осуществления две последовательности имеют одинаковую длину. В другом варианте осуществления сравнение проводят по всей протяженности эталонной последовательности (например, по всей протяженности одной из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 90, SEQ ID NO: 92, SEQ ID NO: 323, SEQ ID NO: 324, SEQ ID NO: 325, SEQ ID NO: 326, SEQ ID NO: 327, SEQ ID NO: 328, SEQ ID NO: 329, SEQ ID NO: 330, SEQ ID NO: 331, SEQ ID NO: 27, SEQ ID NO: 31 или SEQ ID NO: 35, по всей протяженности одной из SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784, по всей протяженности одной из SEQ ID NO: 3, SEQ ID NO: 29, SEQ ID NO: 33 или SEQ ID NO: 37, по всей протяженности одной из SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788). Процентную идентичность двух последовательностей можно определить с применением методик, аналогичных описанным ниже, которые допускают наличие гэпов или их отсутствие. При расчете процентной идентичности, как правило, подсчитывают точные совпадения.
Определение процентной идентичности двух последовательностей можно выполнять с применением математического алгоритма. Неограничивающим примером математического алгоритма, используемого для сравнения двух последовательностей, является алгоритм Karlin and Altschul, (1990) Proc. Natl. Acad. Sci. USA 87:2264, в модификации согласно Karlin and Altschul, (1993) Proc. Natl. Acad. Sci. USA 90:5873-5877. Такой алгоритм внедрен в программы BLASTN и BLASTX от Altschul, et al., (1990) J. Mol. Biol. 215:403. Поиски нуклеотидных последовательностей в BLAST можно выполнять с помощью программы BLASTN, балл=100, длина слова=12, с получением последовательностей нуклеиновой кислоты, гомологичных пестицидным молекулам нуклеиновой кислоты согласно вариантам осуществления. Поиски белковых последовательностей в BLAST можно выполнять с помощью программы BLASTX, балл=50, длина слова=3, с получением аминокислотных последовательностей, гомологичных молекулам белка согласно вариантам осуществления. Для получения выравниваний с введением гэпов для целей сравнения можно использовать Gapped BLAST (в BLAST 2.0), как описано в Altschul, et al., (1997) Nucleic Acids Res. 25:3389. В качестве альтернативы, можно применять PSI-Blast для осуществления итерационного поиска, который выявляет отдаленные связи между молекулами. См., Altschul, et al., (1997) выше. При использовании программ BLAST, Gapped BLAST и PSI-Blast можно применять параметры по умолчанию соответствующих программ (например, BLASTX и BLASTN). Выравнивание можно проводить вручную с помощью просмотра.
Другим неограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм ClustalW (Higgins, et al., (1994) Nucleic Acids Res. 22:4673-4680). ClustalW сравнивает последовательности и выравнивает всю протяженность аминокислотной последовательности или ДНК-последовательности, и, таким образом, он может предоставлять данные о консервативности последовательностей для полной аминокислотной последовательности. Алгоритм ClustalW применяется в нескольких коммерчески доступных пакетах программного обеспечения для анализа ДНК/аминокислотных последовательностей, таких как модуль ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния). После выравнивания аминокислотных последовательностей с помощью ClustalW можно оценивать процентную идентичность аминокислотных последовательностей. Неограничивающим примером программного обеспечения, применимого для анализа выравниваний ClustalW, является GENEDOC™. GENEDOC™ (Karl Nicholas) обеспечивает оценку сходства и идентичности аминокислотных (или ДНК) последовательностей между несколькими белками. Другим неограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм Myers and Miller, (1988) CABIOS 4:11-17. Такой алгоритм внедрен в программу ALIGN (версия 2.0), которая является частью GCG Wisconsin Genetics Software Package, версия 10 (доступна от Accelrys, Inc., 9685 Scranton Rd., Сан-Диего, Калифорния, США). При использовании программы ALIGN для сравнения аминокислотных последовательностей можно применять таблицу весов замен остатков PAM120, штраф за продолжение гэпа 12 и штраф за открытие гэпа 4.
Другим неограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм Needleman and Wunsch, (1970) J. Mol. Biol. 48(3):443-453, использующий программное обеспечение GAP, версия 10, для определения идентичности и сходства последовательностей с применением следующих параметров по умолчанию: % идентичности и % сходства для последовательности нуклеиновой кислоты с применением GAP Weight (штраф за открытие гэпа) 50 и Length Weight (штраф за продолжение гэпа) 3, и матрицы замен nwsgapdna.cmpii; % идентичности или % сходства для аминокислотной последовательности с применением штрафа за открытие гэпа 8 и штрафа за продолжение гэпа 2, и матрицы замен BLOSUM62. Также можно применять эквивалентные программы. “Эквивалентная программа” применяется в данном документе для обозначения любой программы для сравнения последовательностей, которая для любых двух исследуемых последовательностей генерирует выравнивание, характеризующееся идентичными совпадениями нуклеотидов и идентичной процентной идентичностью последовательности при сравнении с соответствующим выравниванием, сгенерированным с помощью GAP, версия 10.
Варианты осуществления также охватывают молекулы нуклеиновой кислоты, кодирующие варианты полипептида AfIP-1A и AfIP-1B. “Варианты” последовательностей нуклеиновой кислоты, кодирующих полипептид AfIP-1A и AfIP-1B, включают последовательности, которые кодируют полипептиды AfIP-1A и AfIP-1B, раскрытые в данном документе, но которые отличаются консервативными заменами, обусловленными вырожденностью генетического кода, а также последовательности, которые являются достаточно идентичными, как обсуждается выше. Встречающиеся в природе аллельные варианты можно идентифицировать с применением хорошо известных методик молекулярной биологии, таких как полимеразная цепная реакция (ПЦР) и методика гибридизации, как изложено выше. Вариантные последовательности нуклеиновой кислоты также включают синтетически полученные последовательности нуклеиновой кислоты, которые были получены, например, с применением сайт-направленного мутагенеза, но которые все еще кодируют полипептиды AfIP-1A и AfIP-1B, раскрытые, как обсуждается ниже.
Настоящее раскрытие предусматривает выделенные или рекомбинантные полинуклеотиды, которые кодируют любые полипептиды AfIP-1A и AfIP-1B, раскрытые в данном документе. Специалисты в данной области техники легко поймут, что вследствие вырожденности генетического кода существует множество нуклеотидных последовательностей, кодирующих полипептиды AfIP-1A и AfIP-1B согласно настоящему раскрытию. Таблица 1 представляет собой таблицу кодонов, которая представляет синонимичные кодоны для каждой аминокислоты. Например, все кодоны AGA, AGG, CGA, CGC, CGG и CGU кодируют аминокислоту аргинин. Таким образом, в каждом положении в нуклеиновых кислотах согласно настоящему раскрытию, в котором аргинин обозначен кодоном, кодон может быть изменен на любой из соответствующих кодонов, описанных выше, без изменения кодируемого полипептида. Понятно, что U в последовательности РНК соответствует T в последовательности ДНК.
Специалист, к тому же, поймет, что изменения можно вводить путем мутирования последовательностей нуклеиновой кислоты, что ведет к изменениям в аминокислотной последовательности кодируемого полипептида AfIP-1A и AfIP-1B, без изменения биологической активности белка. Таким образом, вариантные молекулы нуклеиновой кислоты можно создавать путем введения одной или нескольких нуклеотидных замен, добавлений и/или делеций в соответствующую последовательность нуклеиновой кислоты, раскрытую в данном документе, так что одна или несколько аминокислотных замен, добавлений или делеций вводятся в кодируемый белок. Мутации можно вводить при помощи стандартных методик, таких как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. Такие вариантные последовательности нуклеиновой кислоты также охватываются настоящим раскрытием.
В качестве альтернативы, вариантные последовательности нуклеиновой кислоты можно получать путем введения мутаций случайным образом по всей или части кодирующей последовательности, как, например, путем сайт-насыщающего мутагенеза, и полученных мутантов можно подвергать скринингу в отношении способности обеспечивать пестицидную активность для идентификации мутантов, которые сохраняют активность. После мутагенеза кодируемый белок можно экспрессировать рекомбинантным способом, и активность белка можно определять с применением стандартных методик анализа.
Полинуклеотиды согласно настоящему раскрытию и их фрагменты, необязательно, применяются в качестве субстратов для ряда реакций рекомбинации и рекуррентной рекомбинации, в дополнение к стандартным способам клонирования, изложенным, например, в Ausubel, Berger and Sambrook, т.е. получение дополнительных гомологов пестицидных полипептидов и их фрагментов с требуемыми свойствами. Известен ряд таких реакций, в том числе разработанные авторами настоящего изобретения и их сотрудниками. Способы получения варианта какой-либо нуклеиновой кислоты, приведенной в данном документе, включают рекуррентную рекомбинацию такого полинуклеотида со вторым (или большим количеством) полинуклеотидом, таким образом, получение библиотеки вариантных полинуклеотидов также представляет собой варианты осуществления согласно настоящему раскрытию, также как и полученные библиотеки, клетки, содержащие библиотеки и любой рекомбинантный полинуклеотид, полученный такими способами. Дополнительно, такие способы необязательно включают отбор вариантного полинуклеотида из таких библиотек на основе пестицидной активности, как есть, где такую рекуррентную рекомбинацию осуществляют in vitro или in vivo.
Ряд протоколов создания разнообразия, в том числе протоколы рекуррентной рекомбинации нуклеиновых кислот, доступны и полностью описаны в уровне техники. Методики можно применять отдельно и/или в комбинации для получения одного или нескольких вариантов нуклеиновой кислоты или набора нуклеиновых кислот, а также вариантов кодируемых белков. По отдельности и вместе эти методики обеспечивают надежные, широко используемые способы создания диверсифицированных нуклеиновых кислот и наборов нуклеиновых кислот (в том числе, например, библиотек нуклеиновых кислот), применимых, например, для конструирования или быстрой эволюции нуклеиновых кислот, белков, метаболических путей, клеток и/или организмов с новыми и/или улучшенными характеристиками.
Хотя в ходе следующего обсуждения для ясности делают разграничение и классификацию, будет принято во внимание, что методики часто не являются взаимоисключающими. Более того, различные способы можно применять по отдельности или в комбинации, одновременно или последовательно, для получения доступа к различным вариантам последовательностей.
Результатом любой из методик создания разнообразия, описанных в данном документе, может быть создание одной или нескольких нуклеиновых кислот, которые можно подвергнуть отбору или скринингу в отношении нуклеиновых кислот, имеющих требуемые свойства или обеспечивающих их, или нуклеиновых кислот, которые кодируют белки, имеющие требуемые свойства или обеспечивающие их. После диверсификации посредством одного или нескольких способов, описанных в данном документе или иным образом доступных специалисту в данной области техники, любые получаемые нуклеиновые кислоты можно подвергать отбору в отношении требуемой активности или свойства, например, пестицидной активности или такой активности при требуемом pH и т.д. Это может включать идентификацию любой активности, которую можно выявить, например, в автоматизированном или автоматизируемом формате, посредством любого из анализов, известных из уровня техники, см., например, обсуждение скрининга в отношении инсектицидной активности, ниже. Можно оценивать ряд связанных (или даже несвязанных) свойств последовательно или одновременно, на усмотрение специалиста-практика.
Описание ряда методик создания разнообразия для создания модифицированных последовательностей нуклеиновой кислоты, например, последовательностей, кодирующих полипептиды, обладающие пестицидной активностью, или их фрагменты, можно найти в следующих публикациях и литературе, процитированной в них: Soong, et al., (2000) Nat Genet 25(4):436-439; Stemmer, et al., (1999) Tumor Targeting 4:1-4; Ness, et al., (1999) Nat Biotechnol 17:893-896; Chang, et al., (1999) Nat Biotechnol 17:793-797; Minshull and Stemmer, (1999) Curr Opin Chem Biol 3:284-290; Christians, et al., (1999) Nat Biotechnol 17:259-264; Crameri, et al., (1998) Nature 391:288-291; Crameri, et al., (1997) Nat Biotechnol 15:436-438; Zhang, et al., (1997) PNAS USA 94:4504-4509; Patten, et al., (1997) Curr Opin Biotechnol 8:724-733; Crameri, et al., (1996) Nat Med 2:100-103; Crameri, et al., (1996) Nat Biotechnol 14:315-319; Gates, et al., (1996) J Mol Biol 255:373-386; Stemmer, (1996) “Sexual PCR and Assembly PCR” в: The Encyclopedia of Molecular Biology. VCH Publishers, New York. pp. 447-457; Crameri and Stemmer, (1995) BioTechniques 18:194-195; Stemmer, et al., (1995) Gene, 164:49-53; Stemmer, (1995) Science 270: 1510; Stemmer, (1995) Bio/Technology 13:549-553; Stemmer, (1994) Nature 370:389-391 и Stemmer, (1994) PNAS USA 91:10747-10751.
Мутационные способы создания разнообразия включают, например, сайт-направленный мутагенез (Ling, et al., (1997) Anal Biochem 254(2):157-178; Dale, et al., (1996) Methods Mol Biol 57:369-374; Smith, (1985) Ann Rev Genet 19:423-462; Botstein and Shortle, (1985) Science 229:1193-1201; Carter, (1986) Biochem J 237:1-7 и Kunkel, (1987) “The efficiency of oligonucleotide directed mutagenesis” в Nucleic Acids & Molecular Biology (Eckstein and Lilley, eds., Springer Verlag, Berlin)); мутагенез с применением урацил-содержащих шаблонов (Kunkel, (1985) PNAS USA 82:488-492; Kunkel, et al., (1987) Methods Enzymol 154:367-382 и Bass, et al., (1988) Science 242:240-245); олигонуклеотид-направленный мутагенез (Zoller and Smith, (1983) Methods Enzymol 100:468-500; Zoller and Smith, (1987) Methods Enzymol 154:329-350 (1987); Zoller and Smith, (1982) Nucleic Acids Res 10:6487-6500), мутагенез фосфоротиоат-модифицированной ДНК (Taylor, et al., (1985) Nucl Acids Res 13:8749-8764; Taylor, et al., (1985) Nucl Acids Res 13:8765-8787 (1985); Nakamaye and Eckstein, (1986) Nucl Acids Res 14:9679-9698; Sayers, et al., (1988) Nucl Acids Res 16:791-802 и Sayers, et al., (1988) Nucl Acids Res 16:803-814); мутагенез с применением дуплексной ДНК с брешью (Kramer, et al., (1984) Nucl Acids Res 12:9441-9456; Kramer and Fritz, (1987) Methods Enzymol 154:350-367; Kramer, et al., (1988) Nucl Acids Res 16:7207 и Fritz, et al., (1988) Nucl Acids Res 16:6987-6999).
Дополнительные подходящие способы включают точечную репарацию ошибочно спаренных оснований (Kramer, et al., (1984) Cell 38:879-887), мутагенез с применением штаммов-хозяев с недостаточностью репарации (Carter, et al., (1985) Nucl Acids Res 13:4431-4443 и Carter, (1987) Methods in Enzymol 154:382-403), делеционный мутагенез (Eghtedarzadeh and Henikoff, (1986) Nucl Acids Res 14:5115), рестрикцию-отбор и рестрикцию-очистку (Wells, et al., (1986) Phil Trans R Soc Lond A 317:415-423), мутагенез посредством полного синтеза гена (Nambiar, et al., (1984) Science 223:1299-1301; Sakamar and Khorana, (1988) Nucl Acids Res 14:6361-6372; Wells, et al., (1985) Gene 34:315-323 и Grundström, et al., (1985) Nucl Acids Res 13:3305-3316), репарацию двухцепочечных разрывов (Mandecki, (1986) PNAS USA, 83:7177-7181, и Arnold, (1993) Curr Opin Biotech 4:450-455). Дополнительные подробности многих из вышеуказанных способов можно найти в Methods Enzymol, том 154, в котором также описаны применимые средства контроля для поиска и устранения проблем в случае различных способов мутагенеза.
Дополнительные подробности, касающиеся различных способов создания разнообразия, можно найти в следующих патентах США, публикациях и заявках согласно PCT и публикациях EPO: патент США № 5723323, патент США № 5763192, патент США № 5814476, патент США № 5817483, патент США № 5824514, патент США № 5976862, патент США № 5605793, патент США № 5811238, патент США № 5830721, патент США № 5834252, патент США № 5837458, WO 1995/22625, WO 1996/33207, WO 1997/20078, WO 1997/35966, WO 1999/41402, WO 1999/41383, WO 1999/41369, WO 1999/41368, EP 752008, EP 0932670, WO 1999/23107, WO 1999/21979, WO 1998/31837, WO 1998/27230, WO 1998/27230, WO 2000/00632, WO 2000/09679, WO 1998/42832, WO 1999/29902, WO 1998/41653, WO 1998/41622, WO 1998/42727, WO 2000/18906, WO 2000/04190, WO 2000/42561, WO 2000/42559, WO 2000/42560, WO 2001/23401 и PCT/US01/06775.
Нуклеотидные последовательности согласно вариантам осуществления также могут применяться для выделения соответствующих последовательностей из других организмов, в частности других бактерий, в частности, видов рода Alcaligenes и, более конкретно, штамма Alcaligenes faecalis. Таким образом, такие способы как ПЦР, гибридизация и т.п., можно применять для идентификации таких последовательностей на основе гомологии их последовательности с последовательностями, изложенными в данном документе. Вариантами изобретения охватываются последовательности, выбранные на основе идентичности последовательности с полными последовательностями, изложенными в данном документе, или их фрагментами. Такие последовательности включают последовательности, которые являются ортологами раскрытых последовательностей. Термин "ортологи" относится к генам, происходящим от общего предкового гена и выявляемым у различных видов вследствие видообразования. Гены, обнаруживаемые у различных видов, считаются ортологами, если их нуклеотидные последовательности и/или кодируемые ими белковые последовательности имеют существенную степень идентичности, как определено в других разделах в данном документе. Функции ортологов часто являются высоко консервативными среди видов.
При ПЦР-подходе олигонуклеотидные праймеры можно сконструировать для применения в ПЦР-реакциях для амплификации соответствующих последовательностей ДНК из кДНК или геномной ДНК, извлеченных из какого-либо организма, представляющего интерес. Способы конструирования ПЦР-праймеров и ПЦР-клонирования в целом известны из уровня техники и раскрыты в Sambrook, et al., (1989) Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Plainview, New York), в дальнейшем "Sambrook". См. также Innis, et al., eds. (1990) PCR Protocols: A Guide to Methods and Applications (Academic Press, New York); Innis and Gelfand, eds. (1995) PCR Strategies (Academic Press, New York); и Innis and Gelfand, eds. (1999) PCR Methods Manual (Academic Press, New York). Известные способы ПЦР включают, без ограничений, способы с применением парных праймеров, гнездовых праймеров, одиночных специфичных праймеров, вырожденных праймеров, ген-специфических праймеров, вектор-специфических праймеров, частично несовпадающих праймеров и т.п.
Для идентификации потенциальных полипептидов AfIP-1A и AfIP-1B из коллекций бактерий, лизаты бактериальных клеток можно подвергать скринингу с антителами, вырабатываемыми против полипептида AfIP-1A или AfIP-1B, с применением способов вестерн-блоттинга и/или ELISA. Этот тип анализов можно проводить высокопроизводительным образом. Положительные образцы можно дополнительно анализировать при помощи различных методик, таких как очистка и идентификация белков при помощи антител. Способы получения антител хорошо известны из уровня техники, как обсуждается ниже.
В качестве альтернативы, для идентификации гомологов полипептидов AfIP-1A и AfIP-1B можно применять способ идентификации белков на основе масс-спектрометрии с применением протоколов из литературных источников (Scott Patterson, (1998), 10.22, 1-24, Current Protocol in Molecular Biology, опубликованный John Wiley & Son Inc). Точнее говоря, способ идентификации белков на основе LC-MS/MS применяют для установления связи MS-данных указанных клеточных лизатов или образцов, обогащенных молекулами с требуемым молекулярным весом (вырезанных из геля SDS-PAGE с полосками с молекулярным весом, соответствующим полипептидам AfIP-1A и AfIP-1B), с информацией о последовательности AfIP-1A и AfIP-1B (например, SEQ ID NO: 2, SEQ ID NO: 4)) и их гомологов. Любое совпадение в пептидных последовательностях указывает на возможность наличия гомологичных белков в образцах. Дополнительные методики (очистки белка и методики молекулярной биологии) можно применять для выделения белка и идентификации последовательностей гомологов.
В способах гибридизации для скрининга кДНК или геномных библиотек можно применять всю или часть последовательности пестицидной нуклеиновой кислоты. Способы для конструирования таких кДНК или геномных библиотек, в целом, известны из уровня техники и раскрыты в Sambrook and Russell, (2001), выше. Так называемые гибридизационные зонды могут представлять собой фрагменты геномной ДНК, фрагменты кДНК, фрагменты РНК или другие олигонуклеотиды, и они могут быть помечены детектируемой группой, такой как 32P, или любым другим детектируемым маркером, таким как другие радиоактивные изотопы, флуоресцентным соединением, ферментом или кофактором фермента. Зонды для гибридизации можно получать путем мечения синтетических олигонуклеотидов, основанных на известной последовательности нуклеиновой кислоты, кодирующей полипептид AfIP-1A или AfIP-1B, раскрытой в данном документе. Дополнительно можно применять вырожденные праймеры, разработанные на основе консервативных нуклеотидных или аминокислотных остатков в последовательности нуклеиновой кислоты или кодируемой аминокислотной последовательности. Зонд, как правило, содержит участок последовательности нуклеиновой кислоты, который гибридизуется при жестких условиях по меньшей мере с приблизительно 12, по меньшей мере с приблизительно 25, по меньшей мере с приблизительно 50, 75, 100, 125, 150, 175 или 200 смежными нуклеотидами последовательности нуклеиновой кислоты, кодирующей полипептид AfIP-1A или AfIP-1B согласно настоящему раскрытию или его фрагмент или вариант. Способы получения зондов для гибридизации, в целом, известны из уровня техники и раскрыты в Sambrook and Russell, (2001), выше, включенном в данный документ посредством ссылки.
Например, полную последовательность нуклеиновой кислоты, кодирующей полипептид AfIP-1A или AfIP-1B, раскрытую в данном документе, или одну или несколько ее частей можно применять в качестве зонда, способного специфично гибридизоваться с соответствующими последовательностями нуклеиновой кислоты, кодирующими последовательности, подобные полипептиду AfIP-1A или AfIP-1B, и матричными РНК. Для достижения специфичной гибридизации при различных условиях такие зонды включают последовательности, которые являются уникальными, и, предпочтительно, состоят по меньшей мере из приблизительно 10 нуклеотидов в длину и по меньшей мере из приблизительно 20 нуклеотидов в длину. Такие зонды можно применять для амплификации соответствующих пестицидных последовательностей из выбранного организма с помощью ПЦР. Эту методику можно применять для выделения дополнительных кодирующих последовательностей из требуемого организма или в качестве диагностического анализа для определения присутствия кодирующих последовательностей в организме. Методики гибридизации включают гибридизационный скрининг высеянных ДНК-библиотек (либо бляшек, либо колоний; см., например, Sambrook, et al., (1989) Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.).
Гибридизацию таких последовательностей можно проводить в жестких условиях. “Жесткие условия” или “жесткие условия гибридизации” применяется в данном документе для обозначения условий, при которых зонд будет гибридизоваться со своей целевой последовательностью в явно большей степени, чем с другими последовательностями (например, по меньшей мере в 2 раза больше по сравнению с фоном). Жесткие условия являются зависимыми от последовательности и будут отличаться при различных обстоятельствах. Путем контроля жесткости условий гибридизации и/или отмывки можно идентифицировать целевые последовательности, которые на 100% комплементарны зонду (гомологичное зондирование). В качестве альтернативы, условия жесткости можно отрегулировать так, чтобы они допускали некоторое ошибочное спаривание в последовательностях с тем, чтобы выявлять более низкие степени сходства (гетерологичное зондирование). В целом, длина зонда составляет менее приблизительно 1000 нуклеотидов, предпочтительно менее 500 нуклеотидов в длину.
Как правило, жесткие условия будут такими, при которых концентрация солей составляет менее приблизительно 1,5 M ионов Na, как правило, концентрация ионов Na (или других солей) составляет приблизительно 0,01-1,0 M при pH 7,0-8,3, а температура составляет по меньшей мере приблизительно 30°C для коротких зондов (например, 10-50 нуклеотидов) и по меньшей мере приблизительно 60°C для длинных зондов (например, более 50 нуклеотидов). Жесткие условия также могут быть достигнуты с помощью добавления дестабилизирующих средств, таких как формамид. Иллюстративные условия низкой жесткости включают гибридизацию в буферном растворе с 30-35% формамида, 1 M NaCl, 1% SDS (додецилсульфата натрия) при 37°C и отмывку в 1× - 2×SSC (20×SSC=3,0 M NaCl/0,3 M цитрата тринатрия) при 50-55°C. Иллюстративные условия умеренной жесткости включают гибридизацию в 40-45% формамиде, 1,0 M NaCl, 1% SDS при 37°C и отмывку в 0,5× - 1×SSC при 55-60°C. Иллюстративные условия высокой жесткости включают гибридизацию в 50% формамиде, 1 M NaCl, 1% SDS при 37°C и отмывку в 0,1×SSC при 60-65°C. Необязательно, отмывочные буферы могут содержать от приблизительно 0,1% до приблизительно 1% SDS. Длительность гибридизации, в целом, составляет менее приблизительно 24 часов, обычно от приблизительно 4 до приблизительно 12 часов.
Специфичность, как правило, является функцией отмывок после гибридизации, причем критическими факторами являются ионная сила и температура конечного отмывочного раствора. Для гибридов ДНК-ДНК Tm можно приблизительно рассчитать из уравнения Meinkoth and Wahl, (1984) Anal. Biochem. 138:267-284: Tm=81,5°C+16,6 (log M)+0,41 (% GC) - 0,61 (% форм.) - 500/л; где M представляет собой молярность одновалентных катионов, % GC представляет собой процентную долю гуанозиновых и цитозиновых нуклеотидов в ДНК, % форм. представляет собой процентную долю формамида в растворе для гибридизации, и L представляет собой длину гибрида в парах оснований. Tm представляет собой температуру (при определенной ионной силе и pH), при которой 50% комплементарной целевой последовательности гибридизируется с идеально совпадающим зондом. Tm снижают на приблизительно 1°C для каждого 1% неправильного спаривания; таким образом, Tm, условия гибридизации и/или отмывки можно отрегулировать для гибридизации с последовательностями с требуемой идентичностью. Например, если необходимы последовательности, идентичные на ≥90%, Tm можно снизить на 10°C. Обычно, выбирают жесткие условия так, чтобы они были на приблизительно 5°C ниже температурной точки плавления (Tm) для конкретной последовательности и комплементарной ей последовательности при определенной ионной силе и pH. Однако при условиях сильной жесткости может применяться гибридизация и/или отмывка при температуре на 1, 2, 3 или 4°C ниже температурной точки плавления (Tm); при условиях умеренной жесткости может применяться гибридизация и/или отмывка при температуре на 6, 7, 8, 9 или 10°C ниже температурной точки плавления (Tm); при условиях низкой жесткости может применяться гибридизация и/или отмывка при температуре на 11, 12, 13, 14, 15 или 20°C ниже температурной точки плавления (Tm). С использованием уравнения, состава раствора для гибридизации и отмывки и требуемой Tm, специалисты поймут, что изменения жесткости растворов для гибридизации и/или отмывки являются по сути описанными. Если требуемая степень неправильного спаривания приводит к Tm меньше 45°C (водный раствор) или 32°C (раствор формамида), предпочтительно увеличивать концентрацию SSC так, чтобы можно было применять более высокую температуру. Обширное руководство по гибридизации нуклеиновых кислот приведено в Tijssen, (1993) Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Acid Probes, Part I, Chapter 2 (Elsevier, N.Y.); и Ausubel, et al., eds. (1995) Current Protocols in Molecular Biology, Chapter 2 (Greene Publishing and Wiley-Interscience, New York). См., Sambrook, et al., (1989) Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.).
Белки и их варианты и фрагменты
Полипептиды AfIP-1A и AfIP-1B также охвачены настоящим раскрытием. “Инсектицидный белок-1A Alcaligenes“, “полипептид AfIP-1A” или “белок AfIP-1A”, применяемые в данном документе взаимозаменяемо, относится к полипептиду, обладающему пестицидной активностью, в том числе, без ограничения, фунгицидной активностью, и инсектицидной активностью, либо отдельно, либо связанной с полипептидом AfIP-1B, против одного или нескольких насекомых-вредителей из отрядов Lepidoptera и/или Coleoptera, и достаточно гомологичному белку с SEQ ID NO: 2. Предполагается ряд полипептидов AfIP-1A. Одним источником полинуклеотидов, которые кодируют полипептид AfIP-1A или родственные белки, является штамм Alcaligenes faecalis, который содержит полинуклеотид с SEQ ID NO: 1, SEQ ID NO: 27, SEQ ID NO: 31, SEQ ID NO: 35, SEQ ID NO: 777, SEQ ID NO: 781 или SEQ ID NO 785, кодирующий полипептид AfIP-1A с SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784, соответственно. “Инсектицидный белок-1B Alcaligenes“, “полипептид AfIP-1B” или “белок AfIP-1B”, применяемые в данном документе взаимозаменяемо, относится к полипептиду, обладающему пестицидной активностью, в том числе, без ограничения, фунгицидной активностью, и инсектицидной активностью, либо отдельно, либо связанной с полипептидом AfIP-1A, против одного или нескольких насекомых-вредителей из отрядов Lepidoptera и/или Coleoptera, и достаточно гомологичному белку с SEQ ID NO: 4. Предполагается ряд полипептидов AfIP-1B. Одним источником полинуклеотидов, которые кодируют полипептид AfIP-1B или родственные белки, является штамм Alcaligenes faecalis, который содержит полинуклеотид с SEQ ID NO: 3, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 37, SEQ ID NO: 779, SEQ ID NO: 783 или SEQ ID NO: 787, кодирующий полипептид AfIP-1B с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788, соответственно.
В некоторых вариантах осуществления полипептид AfIP-1A достаточно гомологичен аминокислотной последовательности с SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784. “Достаточно гомологичный” применяется в данном документе для обозначения аминокислотной последовательности, последовательность которой по меньшей мере на приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологична эталонной последовательности с применением одной из программ выравнивания, описанных в данном документе, с использованием стандартных параметров. Специалист в данной области техники поймет, что эти значения можно соответствующим образом скорректировать для определения соответствующей гомологии белков, принимая во внимание аминокислотное сходство и т.п. В некоторых вариантах осуществления гомология последовательности определяется относительно последовательности полной длины полипептида AfIP-1A. В некоторых вариантах осуществления последовательность полипептида AfIP-1A является по меньшей мере на приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной при сравнении с SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784. В некоторых вариантах осуществления идентичность последовательности определяется относительно последовательности полной длины полипептида AfIP-1A. В некоторых вариантах осуществления идентичность последовательностей рассчитывают с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию. В некоторых вариантах осуществления идентичность последовательностей рассчитывают по всей длине полипептида с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию.
В некоторых вариантах осуществления полипептид AfIP-1B достаточно гомологичен аминокислотной последовательности с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788. “Достаточно гомологичный” применяется в данном документе для обозначения аминокислотной последовательности, последовательность которой по меньшей мере на приблизительно 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более гомологична эталонной последовательности с применением одной из программ выравнивания, описанных в данном документе, с использованием стандартных параметров. Специалист в данной области поймет, что эти значения можно соответствующим образом скорректировать для определения соответствующей идентичности белков, принимая во внимание аминокислотное сходство и т.п. В некоторых вариантах осуществления последовательность полипептида AfIP-1B является по меньшей мере на приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более идентичной при сравнении с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788. В некоторых вариантах осуществления идентичность последовательности определяется относительно последовательности полной длины полипептида AfIP-1B. В некоторых вариантах осуществления идентичность последовательностей рассчитывают с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию. В некоторых вариантах осуществления идентичность последовательностей рассчитывают по всей длине полипептида с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию.
Применяемые в данном документе термины “белок”, “пептидная молекула” или “полипептид” включают любую молекулу, которая содержит пять или более аминокислот. Из уровня техники хорошо известно, что белок, пептид или полипептидные молекулы могут подвергаться модификации, в том числе посттрансляционным модификациям, таким как, без ограничения, образование дисульфидных связей, гликозилирование, фосфорилирование или олигомеризация. Таким образом, применяемые в данном документе термины “белок”, “пептидная молекула” или “полипептид” включают любой белок, который модифицирован посредством какого-либо биологического или небиологического процесса. Термины “аминокислота” и “аминокислоты” относятся к встречающимся в природе L-аминокислотам.
“Рекомбинантный белок” применяется в данном документе для обозначения белка, который более не находится в своей естественной среде, например, in vitro или в рекомбинантной бактериальной или растительной клетке-хозяине. Полипептид AfIP-1A или AfIP-1B, который фактически не содержит клеточный материал, включает препараты белка, имеющие менее приблизительно 30%, 20%, 10% или 5% (по сухому весу) непестицидного белка (также называемого в данном документе “загрязняющий белок”).
“Фрагменты” или “биологически активные части” включают фрагменты полипептида, содержащие аминокислотные последовательности, достаточно идентичные полипептиду AfIP-1A или AfIP-1B и которые проявляют инсектицидную активность. “Фрагменты” или “биологически активные части” полипептидов AfIP-1A включают фрагменты, содержащие аминокислотные последовательности, достаточно идентичные аминокислотной последовательности, изложенной в SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784, соответственно, в том числе, без ограничения, SEQ ID NO: 6 и SEQ ID NO: 152 и которые проявляют инсектицидную активность. Биологически активная часть полипептида AfIP-1A может представлять собой полипептид, который состоит, например, из 10, 25, 50, 75, 100, 125, 132 или более аминокислот в длину. Такие биологически активные части можно получать при помощи рекомбинантных методик и оценивать в отношении инсектицидной активности. Как применяется здесь, фрагмент содержит по меньшей мере 8 смежных аминокислот полипептида AfIP-1A. В некоторых вариантах осуществления фрагмент полипептида AfIP-1A содержит по меньшей мере 8 смежных аминокислот из SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784. В некоторых вариантах осуществления фрагмент содержит по меньшей мере 8 смежных аминокислот из SEQ ID NO: 2. В некоторых вариантах осуществления фрагмент содержит по меньшей мере 8 смежных аминокислот из SEQ ID NO: 18. “Фрагменты” или “биологически активные части” полипептида AfIP-1B включают фрагменты, содержащие аминокислотные последовательности, достаточно идентичные аминокислотной последовательности, изложенной в SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788, соответственно, в том числе, без ограничения, аминокислоты 1-380 из SEQ ID NO: 4 и аминокислоты 381-703 из SEQ ID NO: 4, и которые проявляют инсектицидную активность. Биологически активная часть полипептида AfIP-1B может представлять собой полипептид, который имеет длину, например, 10, 25, 50, 75, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650 или более аминокислот. Такие биологически активные части можно получать при помощи рекомбинантных методик и оценивать в отношении инсектицидной активности. Как применяется здесь, фрагмент содержит по меньшей мере 8 смежных аминокислот полипептида AfIP-1B. В некоторых вариантах осуществления фрагмент содержит по меньшей мере 8 смежных аминокислот из SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788. В некоторых вариантах осуществления фрагмент содержит по меньшей мере 8 смежных аминокислот из SEQ ID NO: 4. В некоторых вариантах осуществления фрагмент содержит по меньшей мере 8 смежных аминокислот из SEQ ID NO: 20.
В некоторых вариантах осуществления фрагмент полипептида AfIP-1A характеризуется N-концевым и/или C-концевым усечением по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или более аминокислот с N-конца и/или C-конца относительно SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784, или их вариантов, в том числе без ограничения SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 94, SEQ ID NO: 96, SEQ ID NO: 98, SEQ ID NO: 100, SEQ ID NO: 152, SEQ ID NO: 301, SEQ ID NO: 302, SEQ ID NO: 303, SEQ ID NO: 304, SEQ ID NO: 305, SEQ ID NO: 306, SEQ ID NO: 307, SEQ ID NO: 308, SEQ ID NO: 309, SEQ ID NO: 310, SEQ ID NO: 311, SEQ ID NO: 502, SEQ ID NO: 503, SEQ ID NO: 504, SEQ ID NO: 505, SEQ ID NO: 506, SEQ ID NO: 507, SEQ ID NO: 508, SEQ ID NO: 509, SEQ ID NO: 510, SEQ ID NO: 511, SEQ ID NO: 512, SEQ ID NO: 513, SEQ ID NO: 514, SEQ ID NO: 515, SEQ ID NO: 516, SEQ ID NO: 517, SEQ ID NO: 518, SEQ ID NO: 519, SEQ ID NO: 520, SEQ ID NO: 521, SEQ ID NO: 522, SEQ ID NO: 523, SEQ ID NO: 524, SEQ ID NO: 525, SEQ ID NO: 526, SEQ ID NO: 527, SEQ ID NO: 528, SEQ ID NO: 529, SEQ ID NO: 530, SEQ ID NO: 531, SEQ ID NO: 532, SEQ ID NO: 533, SEQ ID NO: 534, SEQ ID NO: 535, SEQ ID NO: 536, SEQ ID NO: 537, SEQ ID NO: 538, SEQ ID NO: 539, SEQ ID NO: 540, SEQ ID NO: 541, SEQ ID NO: 542, SEQ ID NO: 543, SEQ ID NO: 544, SEQ ID NO: 545, SEQ ID NO: 590, SEQ ID NO: 591, SEQ ID NO: 592, SEQ ID NO: 593, SEQ ID NO: 594, SEQ ID NO: 595, SEQ ID NO: 596, SEQ ID NO: 597, SEQ ID NO: 598, SEQ ID NO: 599, SEQ ID NO: 600, SEQ ID NO: 601, SEQ ID NO: 602, SEQ ID NO: 603, SEQ ID NO: 604, SEQ ID NO: 605, SEQ ID NO: 606, SEQ ID NO: 607, SEQ ID NO: 608, SEQ ID NO: 609, SEQ ID NO: 610, SEQ ID NO: 611, SEQ ID NO: 612, SEQ ID NO: 613, SEQ ID NO: 614, SEQ ID NO: 615, SEQ ID NO: 616, SEQ ID NO: 617, SEQ ID NO: 618, SEQ ID NO: 648, SEQ ID NO: 649, SEQ ID NO: 650, SEQ ID NO: 651, SEQ ID NO: 652, SEQ ID NO: 653, SEQ ID NO: 654, SEQ ID NO: 655, SEQ ID NO: 656, SEQ ID NO: 657, SEQ ID NO: 658, SEQ ID NO: 659, SEQ ID NO: 660, SEQ ID NO: 661, SEQ ID NO: 662, SEQ ID NO: 663 и SEQ ID NO: 664, например, путем протеолиза, путем вставки старт-кодона, путем делеции кодонов, кодирующих удаляемые аминокислоты, и одновременной вставки старт-кодона и/или вставки стоп-кодона.
В некоторых вариантах осуществления фрагменты полипептида AfIP-1A, охваченные в данном документе, получены в результате удаления N-концевых 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более аминокислот относительно SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784 и их вариантов, в том числе без ограничения SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 94, SEQ ID NO: 96, SEQ ID NO: 98, SEQ ID NO: 100, SEQ ID NO: 152, SEQ ID NO: 301, SEQ ID NO: 302, SEQ ID NO: 303, SEQ ID NO: 304, SEQ ID NO: 305, SEQ ID NO: 306, SEQ ID NO: 307, SEQ ID NO: 308, SEQ ID NO: 309, SEQ ID NO: 310, SEQ ID NO: 311, SEQ ID NO: 502, SEQ ID NO: 503, SEQ ID NO: 504, SEQ ID NO: 505, SEQ ID NO: 506, SEQ ID NO: 507, SEQ ID NO: 508, SEQ ID NO: 509, SEQ ID NO: 510, SEQ ID NO: 511, SEQ ID NO: 512, SEQ ID NO: 513, SEQ ID NO: 514, SEQ ID NO: 515, SEQ ID NO: 516, SEQ ID NO: 517, SEQ ID NO: 518, SEQ ID NO: 519, SEQ ID NO: 520, SEQ ID NO: 521, SEQ ID NO: 522, SEQ ID NO: 523, SEQ ID NO: 524, SEQ ID NO: 525, SEQ ID NO: 526, SEQ ID NO: 527, SEQ ID NO: 528, SEQ ID NO: 529, SEQ ID NO: 530, SEQ ID NO: 531, SEQ ID NO: 532, SEQ ID NO: 533, SEQ ID NO: 534, SEQ ID NO: 535, SEQ ID NO: 536, SEQ ID NO: 537, SEQ ID NO: 538, SEQ ID NO: 539, SEQ ID NO: 540, SEQ ID NO: 541, SEQ ID NO: 542, SEQ ID NO: 543, SEQ ID NO: 544, SEQ ID NO: 545, SEQ ID NO: 590, SEQ ID NO: 591, SEQ ID NO: 592, SEQ ID NO: 593, SEQ ID NO: 594, SEQ ID NO: 595, SEQ ID NO: 596, SEQ ID NO: 597, SEQ ID NO: 598, SEQ ID NO: 599, SEQ ID NO: 600, SEQ ID NO: 601, SEQ ID NO: 602, SEQ ID NO: 603, SEQ ID NO: 604, SEQ ID NO: 605, SEQ ID NO: 606, SEQ ID NO: 607, SEQ ID NO: 608, SEQ ID NO: 609, SEQ ID NO: 610, SEQ ID NO: 611, SEQ ID NO: 612, SEQ ID NO: 613, SEQ ID NO: 614, SEQ ID NO: 615, SEQ ID NO: 616, SEQ ID NO: 617, SEQ ID NO: 618, SEQ ID NO: 648, SEQ ID NO: 649, SEQ ID NO: 650, SEQ ID NO: 651, SEQ ID NO: 652, SEQ ID NO: 653, SEQ ID NO: 654, SEQ ID NO: 655, SEQ ID NO: 656, SEQ ID NO: 657, SEQ ID NO: 658, SEQ ID NO: 659, SEQ ID NO: 660, SEQ ID NO: 661, SEQ ID NO: 662, SEQ ID NO: 663 и SEQ ID NO: 664, например, путем протеолиза или путем вставки старт-кодона, путем делеции кодонов, кодирующих удаляемые аминокислоты, и одновременной вставки старт-кодона.
В некоторых вариантах осуществления фрагменты полипептида AfIP-1A, охваченные в данном документе, получены в результате удаления N-концевых 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14, аминокислот относительно SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784 и их вариантов, в том числе без ограничения SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 94, SEQ ID NO: 96, SEQ ID NO: 98, SEQ ID NO: 100, SEQ ID NO: 152, SEQ ID NO: 301, SEQ ID NO: 302, SEQ ID NO: 303, SEQ ID NO: 304, SEQ ID NO: 305, SEQ ID NO: 306, SEQ ID NO: 307, SEQ ID NO: 308, SEQ ID NO: 309, SEQ ID NO: 310, SEQ ID NO: 311, SEQ ID NO: 502, SEQ ID NO: 503, SEQ ID NO: 504, SEQ ID NO: 505, SEQ ID NO: 506, SEQ ID NO: 507, SEQ ID NO: 508, SEQ ID NO: 509, SEQ ID NO: 510, SEQ ID NO: 511, SEQ ID NO: 512, SEQ ID NO: 513, SEQ ID NO: 514, SEQ ID NO: 515, SEQ ID NO: 516, SEQ ID NO: 517, SEQ ID NO: 518, SEQ ID NO: 519, SEQ ID NO: 520, SEQ ID NO: 521, SEQ ID NO: 522, SEQ ID NO: 523, SEQ ID NO: 524, SEQ ID NO: 525, SEQ ID NO: 526, SEQ ID NO: 527, SEQ ID NO: 528, SEQ ID NO: 529, SEQ ID NO: 530, SEQ ID NO: 531, SEQ ID NO: 532, SEQ ID NO: 533, SEQ ID NO: 534, SEQ ID NO: 535, SEQ ID NO: 536, SEQ ID NO: 537, SEQ ID NO: 538, SEQ ID NO: 539, SEQ ID NO: 540, SEQ ID NO: 541, SEQ ID NO: 542, SEQ ID NO: 543, SEQ ID NO: 544, SEQ ID NO: 545, SEQ ID NO: 590, SEQ ID NO: 591, SEQ ID NO: 592, SEQ ID NO: 593, SEQ ID NO: 594, SEQ ID NO: 595, SEQ ID NO: 596, SEQ ID NO: 597, SEQ ID NO: 598, SEQ ID NO: 599, SEQ ID NO: 600, SEQ ID NO: 601, SEQ ID NO: 602, SEQ ID NO: 603, SEQ ID NO: 604, SEQ ID NO: 605, SEQ ID NO: 606, SEQ ID NO: 607, SEQ ID NO: 608, SEQ ID NO: 609, SEQ ID NO: 610, SEQ ID NO: 611, SEQ ID NO: 612, SEQ ID NO: 613, SEQ ID NO: 614, SEQ ID NO: 615, SEQ ID NO: 616, SEQ ID NO: 617, SEQ ID NO: 618, SEQ ID NO: 648, SEQ ID NO: 649, SEQ ID NO: 650, SEQ ID NO: 651, SEQ ID NO: 652, SEQ ID NO: 653, SEQ ID NO: 654, SEQ ID NO: 655, SEQ ID NO: 656, SEQ ID NO: 657, SEQ ID NO: 658, SEQ ID NO: 659, SEQ ID NO: 660, SEQ ID NO: 661, SEQ ID NO: 662, SEQ ID NO: 663 и SEQ ID NO: 664. В некоторых вариантах осуществления усечение составляет первые 4 аминокислоты SEQ ID NO: 2, в результате чего получают полипептид AfIP-1A с аминокислотами 5-146 из SEQ ID NO: 2. В некоторых вариантах осуществления усечение составляет первые 14 аминокислот SEQ ID NO: 2, в результате чего получают полипептид AfIP-1A с аминокислотами 15-146 из SEQ ID NO: 2. В некоторых вариантах осуществления усеченный полипептид AfIP-1A представляет собой полипептид с SEQ ID NO: 6 или SEQ ID NO: 152.
В некоторых вариантах осуществления фрагмент полипептида AfIP-1B характеризуется N-концевым и/или C-концевым усечением по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25 или более аминокислот с N-конца и/или C-конца относительно SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788, или их вариантов, в том числе без ограничения SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 88, SEQ ID NO: 90, SEQ ID NO: 92, SEQ ID NO: 323, SEQ ID NO: 324, SEQ ID NO: 325, SEQ ID NO: 326, SEQ ID NO: 327, SEQ ID NO: 328, SEQ ID NO: 329, SEQ ID NO: 330, SEQ ID NO: 331, SEQ ID NO: 332, SEQ ID NO: 333, SEQ ID NO: 334, SEQ ID NO: 335, SEQ ID NO: 336, SEQ ID NO: 337, SEQ ID NO: 338, SEQ ID NO: 339, SEQ ID NO: 340, SEQ ID NO: 341, SEQ ID NO: 342, SEQ ID NO: 343, SEQ ID NO: 344, SEQ ID NO: 345, SEQ ID NO: 346, SEQ ID NO: 347, SEQ ID NO: 348, SEQ ID NO: 349, SEQ ID NO: 350, SEQ ID NO: 351, SEQ ID NO: 352, SEQ ID NO: 353, SEQ ID NO: 354, SEQ ID NO: 355, SEQ ID NO: 356, SEQ ID NO: 357, SEQ ID NO: 358, SEQ ID NO: 359, SEQ ID NO: 360, SEQ ID NO: 361, SEQ ID NO: 362, SEQ ID NO: 363, SEQ ID NO: 364, SEQ ID NO: 365, SEQ ID NO: 366, SEQ ID NO: 367, SEQ ID NO: 368, SEQ ID NO: 369, SEQ ID NO: 370, SEQ ID NO: 371, SEQ ID NO: 372, SEQ ID NO: 373, SEQ ID NO: 374, SEQ ID NO: 375, SEQ ID NO: 376, SEQ ID NO: 377, SEQ ID NO: 378, SEQ ID NO: 379, SEQ ID NO: 380, SEQ ID NO: 381, SEQ ID NO: 382, SEQ ID NO: 383, SEQ ID NO: 384, SEQ ID NO: 385, SEQ ID NO: 386, SEQ ID NO: 387, SEQ ID NO: 388, SEQ ID NO: 389, SEQ ID NO: 390, SEQ ID NO: 687, SEQ ID NO: 688, SEQ ID NO: 689, SEQ ID NO: 690, SEQ ID NO: 691, SEQ ID NO: 692, SEQ ID NO: 693, SEQ ID NO: 694, SEQ ID NO: 695, SEQ ID NO: 696, SEQ ID NO: 697, SEQ ID NO: 698, SEQ ID NO: 699, SEQ ID NO:700, SEQ ID NO: 701, SEQ ID NO: 702, SEQ ID NO: 703, SEQ ID NO: 704, SEQ ID NO: 705, SEQ ID NO: 706, SEQ ID NO: 707 и SEQ ID NO: 708, например, путем протеолиза, путем вставки старт-кодона, путем делеции кодонов, кодирующих удаляемые аминокислоты, и одновременной вставки старт-кодона и/или вставки стоп-кодона.
В некоторых вариантах осуществления фрагменты полипептида AfIP-1B, охваченные в данном документе, получены в результате удаления 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или более аминокислот с C-конца относительно SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788 и их вариантов, в том числе без ограничения SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 88, SEQ ID NO: 90, SEQ ID NO: 92, SEQ ID NO: 323, SEQ ID NO: 324, SEQ ID NO: 325, SEQ ID NO: 326, SEQ ID NO: 327, SEQ ID NO: 328, SEQ ID NO: 329, SEQ ID NO: 330, SEQ ID NO: 331, SEQ ID NO: 332, SEQ ID NO: 333, SEQ ID NO: 334, SEQ ID NO: 335, SEQ ID NO: 336, SEQ ID NO: 337, SEQ ID NO: 338, SEQ ID NO: 339, SEQ ID NO: 340, SEQ ID NO: 341, SEQ ID NO: 342, SEQ ID NO: 343, SEQ ID NO: 344, SEQ ID NO: 345, SEQ ID NO: 346, SEQ ID NO: 347, SEQ ID NO: 348, SEQ ID NO: 349, SEQ ID NO: 350, SEQ ID NO: 351, SEQ ID NO: 352, SEQ ID NO: 353, SEQ ID NO: 354, SEQ ID NO: 355, SEQ ID NO: 356, SEQ ID NO: 357, SEQ ID NO: 358, SEQ ID NO: 359, SEQ ID NO: 360, SEQ ID NO: 361, SEQ ID NO: 362, SEQ ID NO: 363, SEQ ID NO: 364, SEQ ID NO: 365, SEQ ID NO: 366, SEQ ID NO: 367, SEQ ID NO: 368, SEQ ID NO: 369, SEQ ID NO: 370, SEQ ID NO: 371, SEQ ID NO: 372, SEQ ID NO: 373, SEQ ID NO: 374, SEQ ID NO: 375, SEQ ID NO: 376, SEQ ID NO: 377, SEQ ID NO: 378, SEQ ID NO: 379, SEQ ID NO: 380, SEQ ID NO: 381, SEQ ID NO: 382, SEQ ID NO: 383, SEQ ID NO: 384, SEQ ID NO: 385, SEQ ID NO: 386, SEQ ID NO: 387, SEQ ID NO: 388, SEQ ID NO: 389, SEQ ID NO: 390, SEQ ID NO: 687, SEQ ID NO: 688, SEQ ID NO: 689, SEQ ID NO: 690, SEQ ID NO: 691, SEQ ID NO: 692, SEQ ID NO: 693, SEQ ID NO: 694, SEQ ID NO: 695, SEQ ID NO: 696, SEQ ID NO: 697, SEQ ID NO: 698, SEQ ID NO: 699, SEQ ID NO:700, SEQ ID NO: 701, SEQ ID NO: 702, SEQ ID NO: 703, SEQ ID NO: 704, SEQ ID NO: 705, SEQ ID NO: 706, SEQ ID NO: 707 и SEQ ID NO: 708, например, путем протеолиза или путем вставки старт-кодона, путем делеции кодонов, кодирующих удаляемые аминокислоты, и одновременной вставки старт-кодона.
В некоторых вариантах осуществления фрагменты полипептида AfIP-1B, охваченные в данном документе, получены в результате удаления 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 аминокислот с C-конца относительно SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788 и их вариантов, в том числе без ограничения SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 88, SEQ ID NO: 90, SEQ ID NO: 92, SEQ ID NO: 323, SEQ ID NO: 324, SEQ ID NO: 325, SEQ ID NO: 326, SEQ ID NO: 327, SEQ ID NO: 328, SEQ ID NO: 329, SEQ ID NO: 330, SEQ ID NO: 331, SEQ ID NO: 332, SEQ ID NO: 333, SEQ ID NO: 334, SEQ ID NO: 335, SEQ ID NO: 336, SEQ ID NO: 337, SEQ ID NO: 338, SEQ ID NO: 339, SEQ ID NO: 340, SEQ ID NO: 341, SEQ ID NO: 342, SEQ ID NO: 343, SEQ ID NO: 344, SEQ ID NO: 345, SEQ ID NO: 346, SEQ ID NO: 347, SEQ ID NO: 348, SEQ ID NO: 349, SEQ ID NO: 350, SEQ ID NO: 351, SEQ ID NO: 352, SEQ ID NO: 353, SEQ ID NO: 354, SEQ ID NO: 355, SEQ ID NO: 356, SEQ ID NO: 357, SEQ ID NO: 358, SEQ ID NO: 359, SEQ ID NO: 360, SEQ ID NO: 361, SEQ ID NO: 362, SEQ ID NO: 363, SEQ ID NO: 364, SEQ ID NO: 365, SEQ ID NO: 366, SEQ ID NO: 367, SEQ ID NO: 368, SEQ ID NO: 369, SEQ ID NO: 370, SEQ ID NO: 371, SEQ ID NO: 372, SEQ ID NO: 373, SEQ ID NO: 374, SEQ ID NO: 375, SEQ ID NO: 376, SEQ ID NO: 377, SEQ ID NO: 378, SEQ ID NO: 379, SEQ ID NO: 380, SEQ ID NO: 381, SEQ ID NO: 382, SEQ ID NO: 383, SEQ ID NO: 384, SEQ ID NO: 385, SEQ ID NO: 386, SEQ ID NO: 387, SEQ ID NO: 388, SEQ ID NO: 389, SEQ ID NO: 390, SEQ ID NO: 687, SEQ ID NO: 688, SEQ ID NO: 689, SEQ ID NO: 690, SEQ ID NO: 691, SEQ ID NO: 692, SEQ ID NO: 693, SEQ ID NO: 694, SEQ ID NO: 695, SEQ ID NO: 696, SEQ ID NO: 697, SEQ ID NO: 698, SEQ ID NO: 699, SEQ ID NO:700, SEQ ID NO: 701, SEQ ID NO: 702, SEQ ID NO: 703, SEQ ID NO: 704, SEQ ID NO: 705, SEQ ID NO: 706, SEQ ID NO: 707 и SEQ ID NO: 708.
В некоторых вариантах осуществления фрагмент полипептида AfIP-1B представляет собой аминокислоты 1-380 из SEQ ID NO: 4. В некоторых вариантах осуществления фрагмент полипептида AfIP-1B представляет собой аминокислоты 381-703 из SEQ ID NO: 4. Из уровня техники хорошо известно, что полинуклеотид, кодирующий усеченный полипептид, можно разрабатывать с добавлением старт-кодона на N-конце, такого как ATG, кодирующего метионин или метионин, за которым следует аланин. Из уровня техники также хорошо известно, что в зависимости от того, в каком хозяине экспрессируется полипептид, метионин может представлять собой часть, отрезаемую при полном процессинге.
В некоторых вариантах осуществления также предусмотрены фрагменты, биологически активные части SEQ ID NO: 18 и/или SEQ ID NO: 20, а также их аминокислотные замены, делеции и/или вставки, и их можно использовать при практическом осуществлении способов согласно настоящему раскрытию.
Применяемые в данном документе “варианты” относятся к белкам или полипептидам, имеющим аминокислотную последовательность, которая по меньшей мере на приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична исходной аминокислотной последовательности.
В некоторых вариантах осуществления полипептид AfIP-1A по меньшей мере на приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичен со всей длиной аминокислотной последовательности с SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784. В некоторых вариантах осуществления полипептид AfIP-1A по меньшей мере на приблизительно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичен со всей длиной аминокислотной последовательности с SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784. В некоторых вариантах осуществления полипептид AfIP-1A по меньшей мере на приблизительно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичен со всей длиной аминокислотной последовательности с SEQ ID NO: 2. В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность, по меньшей мере на 50% идентичную аминокислотной последовательности с SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784, где полипептид обладает инсектицидной активностью и/или пестицидной активностью. В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784, где полипептид обладает инсектицидной активностью и/или пестицидной активностью. В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 2, где полипептид обладает инсектицидной активностью и/или пестицидной активностью. В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность, по меньшей мере на 85% идентичную аминокислотной последовательности с SEQ ID NO: 2, где полипептид обладает инсектицидной активностью и/или пестицидной активностью. В некоторых вариантах осуществления инсектицидный полипептид по меньшей мере на приблизительно 50%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичен со всей длиной аминокислотной последовательности с SEQ ID NO: 18.
В некоторых вариантах осуществления полипептид AfIP-1A содержит один или несколько аминокислотных мотивов, выбранных из: i) аминокислот 15-26 из SEQ ID NO: 2, аминокислот 15-26 из SEQ ID NO: 255, аминокислот 15-26 из SEQ ID NO: 256 или аминокислот 15-26 из SEQ ID NO: 257, ii) аминокислот 33-53 из SEQ ID NO: 2, аминокислот 33-53 из SEQ ID NO: 255, аминокислот 33-53 из SEQ ID NO: 256 или аминокислот 33-53 из SEQ ID NO: 257, iii) аминокислот 71-84 из SEQ ID NO: 2, аминокислот 71-84 из SEQ ID NO: 255, аминокислот 71-84 из SEQ ID NO: 256 или аминокислот 71-84 из SEQ ID NO: 257 и iv) аминокислот 100-107 из SEQ ID NO: 2, аминокислот 100-107 из SEQ ID NO: 255, аминокислот 100-107 из SEQ ID NO: 256 или аминокислот 100-107 из SEQ ID NO: 257. В некоторых вариантах осуществления аминокислотный мотив, необязательно, может иметь делецию одной или нескольких аминокислот в пределах мотива, вставку одной или нескольких аминокислот в пределах мотива или их комбинации. В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотный мотив, представленный положениями 100-107 из SEQ ID NO: 257, где по меньшей мере одна аминокислота в положениях 100-107 из SEQ ID NO: 257 не является идентичной аминокислотам в положениях 100-107 из SEQ ID NO: 18.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность, по меньшей мере на 50% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784. В некоторых вариантах осуществления идентичность последовательностей рассчитывают по всей длине полипептида с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784. В некоторых вариантах осуществления идентичность последовательностей рассчитывают по всей длине полипептида с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784. В некоторых вариантах осуществления идентичность последовательностей рассчитывают по всей длине полипептида с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность, по меньшей мере на 95% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784. В некоторых вариантах осуществления идентичность последовательностей рассчитывают по всей длине полипептида с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность, по меньшей мере на 50% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784, и он содержит один или несколько аминокислотных мотивов, выбранных из: i) аминокислот 15-26 из SEQ ID NO: 2, аминокислот 15-26 из SEQ ID NO: 255, аминокислот 15-26 из SEQ ID NO: 256 или аминокислот 15-26 из SEQ ID NO: 257, ii) аминокислот 33-53 из SEQ ID NO: 2, аминокислот 33-53 из SEQ ID NO: 255, аминокислот 33-53 из SEQ ID NO: 256 или аминокислот 33-53 из SEQ ID NO: 257, iii) аминокислот 71-84 из SEQ ID NO: 2, аминокислот 71-84 из SEQ ID NO: 255, аминокислот 71-84 из SEQ ID NO: 256 или аминокислот 71-84 из SEQ ID NO: 257 и iv) аминокислот 100-107 из SEQ ID NO: 2, аминокислот 100-107 из SEQ ID NO: 255, аминокислот 100-107 из SEQ ID NO: 256 или аминокислот 100-107 из SEQ ID NO: 257.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотный мотив, представленный положениями 100-107 из SEQ ID NO: 256, где по меньшей мере одна аминокислота в положениях 100-107 из SEQ ID NO: 256 не является идентичной аминокислотам в положениях 101-107 из SEQ ID NO: 18.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782 или SEQ ID NO: 784, и он содержит один или несколько аминокислотных мотивов, выбранных из: i) аминокислот 15-26 из SEQ ID NO: 2, аминокислот 15-26 из SEQ ID NO: 255, аминокислот 15-26 из SEQ ID NO: 256 или аминокислот 15-26 из SEQ ID NO: 257, ii) аминокислот 33-53 из SEQ ID NO: 2, аминокислот 33-53 из SEQ ID NO: 255, аминокислот 33-53 из SEQ ID NO: 256 или аминокислот 33-53 из SEQ ID NO: 257, iii) аминокислот 71-84 из SEQ ID NO: 2, аминокислот 71-84 из SEQ ID NO: 255, аминокислот 71-84 из SEQ ID NO: 256 или аминокислот 71-84 из SEQ ID NO: 257 и iv) аминокислот 100-107 из SEQ ID NO: 2, аминокислот 100-107 из SEQ ID NO: 255, аминокислот 100-107 из SEQ ID NO: 256 или аминокислот 100-107 из SEQ ID NO: 257.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотный мотив, представленный положениями 100-107 из SEQ ID NO: 257, где по меньшей мере одна аминокислота в положениях 100-107 из SEQ ID NO: 257 не является идентичной аминокислотам в положениях 100-107 из SEQ ID NO: 18.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 255, где Xaa в положении 6 представляет собой Ile или Thr; Xaa в положении 7 представляет собой Ala или Val; Xaa в положении 9 представляет собой Glu или Gly; Xaa в положении 13 представляет собой Ile или Val; Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr; Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr; Xaa в положении 23 представляет собой Thr или Ala; Xaa в положении 24 представляет собой Ile или Leu; Xaa в положении 30 представляет собой Asn или Ser; Xaa в положении 33 представляет собой Val или Ile; Xaa в положении 35 представляет собой Gly или Asn; Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp; Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr; Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr; Xaa в положении 41 представляет собой Gly, Cys или Gln; Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr; Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp; Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp; Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp; Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 47 представляет собой Gly, Leu или Phe; Xaa в положении 48 представляет собой Asp, Asn, Leu или Phe; Xaa в положении 49 представляет собой Lys, Leu или Phe; Xaa в положении 50 представляет собой Asp, Leu или Phe; Xaa в положении 51 представляет собой Lys, Leu или Phe; Xaa в положении 52 представляет собой Glu, Leu или Phe; Xaa в положении 53 представляет собой Ile, Leu или Phe; Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe; Xaa в положении 55 представляет собой Pro, Leu или Phe; Xaa в положении 56 представляет собой Ser или Leu; Xaa в положении 57 представляет собой Gln, Glu, Leu или Phe; Xaa в положении 58 представляет собой Ile, Val, Leu или Phe; Xaa в положении 60 представляет собой Gly, Leu или Phe; Xaa в положении 61 представляет собой Thr, Ile или Phe; Xaa в положении 62 представляет собой Ile, Val, Leu или Phe; Xaa в положении 64 представляет собой Lys, Glu, Leu или Phe; Xaa в положении 65 представляет собой Asp, Leu или Phe; Xaa в положении 67 представляет собой Asp или Glu; Xaa в положении 68 представляет собой Ser или Thr; Xaa в положении 73 представляет собой Ser или Ala; Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr; Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr; Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr; Xaa в положении 96 представляет собой Val или Ile; Xaa в положении 101 представляет собой Trp, Phe или Tyr; Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val; Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr; Xaa в положении 111 представляет собой Asp или Asn; Xaa в положении 113 представляет собой Leu или Ser; Xaa в положении 115 представляет собой Val или Ile; Xaa в положении 116 представляет собой Lys или Glu; Xaa в положении 120 представляет собой Asn или Lys; Xaa в положении 121 представляет собой Tyr, Leu или Phe; Xaa в положении 122 представляет собой Thr, Leu или Phe; Xaa в положении 123 представляет собой Val, Leu, Phe или Asn; Xaa в положении 124 представляет собой Ile, Ser, Leu или Phe; Xaa в положении 125 представляет собой Lys, Leu, Phe или Met; Xaa в положении 126 представляет собой Lys, Leu или Phe; Xaa в положении 128 представляет собой Gly, Leu или Phe; Xaa в положении 129 представляет собой Gly, Leu или Phe; Xaa в положении 130 представляет собой Ser, Leu или Phe; Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr; Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp; Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr; Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; и Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr; и где 1-14 аминокислот, необязательно, удалены с N-конца полипептида.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 255, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 аминокислотных замен, в любой комбинации, в остатках, обозначенных Xaa, в SEQ ID NO: 255 по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 2.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 255, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или 29 аминокислотных замен, в любой комбинации, в остатках, обозначенных Xaa, в SEQ ID NO: 255 по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 2.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 256, где Xaa в положении 6 представляет собой Ile или Thr; Xaa в положении 7 представляет собой Ala, Met или Val; Xaa в положении 8 представляет собой Thr или Asp; Xaa в положении 9 представляет собой Glu, Leu или Gly; Xaa в положении 10 представляет собой Glu или Asn; Xaa в положении 11 представляет собой Ser или Val; Xaa в положении 12 представляет собой Lys или Glu; Xaa в положении 13 представляет собой Ile или Val; Xaa в положении 14 представляет собой Arg или Gln; Xaa в положении 16 представляет собой Tyr или Gln; Xaa в положении 17 представляет собой Ala или Ser; Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr; Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr; Xaa в положении 23 представляет собой Thr, Glu или Ala; Xaa в положении 24 представляет собой Ile или Leu; Xaa в положении 26 представляет собой Val или Ser; Xaa в положении 27 представляет собой Val или Glu; Xaa в положении 29 представляет собой Ser или Met; Xaa в положении 30 представляет собой Asn, Asp или Ser; Xaa в положении 31 представляет собой Phe или Ile; Xaa в положении 32 представляет собой Lys или Glu; Xaa в положении 33 представляет собой Val или Ile; Xaa в положении 34 представляет собой Glu или Lys; Xaa в положении 35 представляет собой Gly или Asn; Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp; Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr; Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr; Xaa в положении 41 представляет собой Gly, Cys или Gln; Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr; Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp; Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp; Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp; Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 47 представляет собой Gly, Leu или Phe; Xaa в положении 48 представляет собой Asp, Asn, Leu или Phe; Xaa в положении 49 представляет собой Lys, Leu или Phe; Xaa в положении 50 представляет собой Asp, Ser, Leu или Phe; Xaa в положении 51 представляет собой Lys, Asn, Leu или Phe; Xaa в положении 52 представляет собой Glu, Leu или Phe; Xaa в положении 53 представляет собой Ile, Leu или Phe; Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe; Xaa в положении 55 представляет собой Pro, Ser, Leu или Phe; Xaa в положении 56 представляет собой Ser, Asp или Leu; Xaa в положении 57 представляет собой Gln, Thr, Glu, Leu или Phe; Xaa в положении 58 представляет собой Ile, Val, Leu или Phe; Xaa в положении 60 представляет собой Gly, Lys, Leu или Phe; Xaa в положении 61 представляет собой Thr, Ile или Phe; Xaa в положении 62 представляет собой Ile, Lys, Val, Leu или Phe; Xaa в положении 64 представляет собой Lys, Ser, Glu, Leu или Phe; Xaa в положении 65 представляет собой Asp, Ser, Leu или Phe; Xaa в положении 66 представляет собой Glu или Gly; Xaa в положении 67 представляет собой Asp, Thr или Glu; Xaa в положении 68 представляет собой Ser, Lys или Thr; Xaa в положении 69 представляет собой Tyr или Ser; Xaa в положении 70 представляет собой Thr или Lys; Xaa в положении 73 представляет собой Ser или Ala; Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr; Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr; Xaa в положении 77 представляет собой Glu или Ala; Xaa в положении 78 представляет собой Asn или Asp; Xaa в положении 79 представляет собой Ala или Thr; Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr; Xaa в положении 86 представляет собой Gly или Lys; Xaa в положении 88 представляет собой Ser или Glu; Xaa в положении 89 представляет собой Leu или Ile; Xaa в положении 91 представляет собой Asp или His; Xaa в положении 92 представляет собой Gly или Asp; Xaa в положении 95 представляет собой Leu или Trp; Xaa в положении 96 представляет собой Val, Leu или Ile; Xaa в положении 97 представляет собой Phe или Ala; Xaa в положении 98 представляет собой Glu или Thr; Xaa в положении 100 представляет собой Tyr или Lys; Xaa в положении 101 представляет собой Trp, Phe или Tyr; Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val; Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr; Xaa в положении 106 представляет собой Ser или Ala; Xaa в положении 111 представляет собой Asp, His или Asn; Xaa в положении 112 представляет собой Glu или Ser; Xaa в положении 113 представляет собой Leu или Ser; Xaa в положении 114 представляет собой Thr или Ser; Xaa в положении 115 представляет собой Val или Ile; Xaa в положении 116 представляет собой Lys, Thr или Glu; Xaa в положении 117 представляет собой Asp или Glu; Xaa в положении 118 представляет собой Lys или Asp; Xaa в положении 119 представляет собой Glu или Asn; Xaa в положении 120 представляет собой Asn или Lys; Xaa в положении 121 представляет собой Tyr, Leu или Phe; Xaa в положении 122 представляет собой Thr, Lys, Leu или Phe; Xaa в положении 123 представляет собой Val, Ile, Leu, Phe или Asn; Xaa в положении 124 представляет собой Ile, Ser, Asp, Leu или Phe; Xaa в положении 125 представляет собой Lys, Leu, Phe или Met; Xaa в положении 126 представляет собой Lys, Glu, Leu или Phe; Xaa в положении 128 представляет собой Gly, Leu или Phe; Xaa в положении 129 представляет собой Gly, Asn, Leu или Phe; Xaa в положении 130 представляет собой Ser, Ile, Leu или Phe; Xaa в положении 131 представляет собой Pro или Ser; Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr; Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp; Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr; Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr; Xaa в положении 142 представляет собой Val или Cys; Xaa в положении 143 представляет собой Val или Ile; Xaa в положении 145 представляет собой Lys или Val; и Xaa в положении 146 представляет собой Ser или Gly; и где 1-14 аминокислот, необязательно, удалены с N-конца полипептида.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 256, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 аминокислотных замен, в любой комбинации, в остатках, обозначенных Xaa, в SEQ ID NO: 256 по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 2.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 256, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или 29 аминокислотных замен, в любой комбинации, в остатках, обозначенных Xaa, в SEQ ID NO: 256 по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 2.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 257, где Xaa в положении 6 представляет собой Ile, Thr, Leu, Met, Val или Ser; Xaa в положении 7 представляет собой Ala, Met, Val, Leu, Ile или Gly; Xaa в положении 8 представляет собой Thr, Asp, Ser или Glu; Xaa в положении 9 представляет собой Glu, Leu, Gly, Asp, Ala, Ile, Val или Met; Xaa в положении 10 представляет собой Glu, Asn, Asp или Gln; Xaa в положении 11 представляет собой Ser, Val, Thr, Ile, Leu или Met; Xaa в положении 12 представляет собой Lys, Glu, Arg или Asp; Xaa в положении 13 представляет собой Ile, Val, Leu или Met; Xaa в положении 14 представляет собой Arg, Gln, Lys или Asn; Xaa в положении 16 представляет собой Tyr, Gln, Trp, Phe или Asn; Xaa в положении 17 представляет собой Ala, Ser, Gly или Thr; Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr; Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr; Xaa в положении 23 представляет собой Thr, Glu, Ala, Ser, Asp или Gly; Xaa в положении 24 представляет собой Ile, Leu, Val или Met; Xaa в положении 26 представляет собой Val, Ser, Ile, Leu, Met или Thr; Xaa в положении 27 представляет собой Val, Glu, Ile, Leu, Met или Asp; Xaa в положении 29 представляет собой Ser, Met, Thr, Ile, Leu или Val; Xaa в положении 30 представляет собой Asn, Asp, Ser, Glu, Gln или Thr; Xaa в положении 31 представляет собой Phe, Ile, Leu, Val или Met; Xaa в положении 32 представляет собой Lys, Glu, Arg или Asp; Xaa в положении 33 представляет собой Val, Ile, Leu или Met; Xaa в положении 34 представляет собой Glu, Lys, Asp или Arg; Xaa в положении 35 представляет собой Gly или Asn; Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp; Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr; Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr; Xaa в положении 41 представляет собой Gly, Cys или Gln; Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr; Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp; Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp; Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp; Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 47 представляет собой Gly, Leu или Phe; Xaa в положении 48 представляет собой Asp, Asn, Glu, Gln, Leu или Phe; Xaa в положении 50 представляет собой Asp, Ser, Glu, Thr, Leu или Phe; Xaa в положении 51 представляет собой Lys, Asn, Arg, Gln, Leu или Phe; Xaa в положении 52 представляет собой Glu, Leu или Phe; Xaa в положении 53 представляет собой Ile, Leu или Phe; Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe; Xaa в положении 55 представляет собой Pro, Ser, Thr, Leu или Phe; Xaa в положении 56 представляет собой Ser, Asp, Thr, Glu или Leu; Xaa в положении 57 представляет собой Gln, Thr, Glu, Asn, Ser, Asp, Leu или Phe; Xaa в положении 58 представляет собой Ile, Val, Leu, Met или Phe; Xaa в положении 60 представляет собой Gly, Lys, Ala или Arg; Xaa в положении 61 представляет собой Thr, Ile или Phe; Xaa в положении 62 представляет собой Ile, Lys, Val, Leu, Met, Arg или Phe; Xaa в положении 64 представляет собой Lys, Ser, Glu, Arg, Thr, Asp, Leu или Phe; Xaa в положении 65 представляет собой Asp, Ser, Glu, Thr, Leu или Phe; Xaa в положении 66 представляет собой Glu, Gly, Asp или Ala; Xaa в положении 67 представляет собой Asp, Thr, Glu или Ser; Xaa в положении 68 представляет собой Ser, Lys, Thr или Arg; Xaa в положении 69 представляет собой Tyr, Ser, Trp, Phe или Thr; Xaa в положении 70 представляет собой Thr, Lys, Ser или Arg; Xaa в положении 73 представляет собой Ser, Ala, Thr или Gly; Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr; Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr; Xaa в положении 77 представляет собой Glu, Ala, Asp или Gly; Xaa в положении 78 представляет собой Asn, Asp, Gln или Glu; Xaa в положении 79 представляет собой Ala, Thr, Gly или Ser; Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr; Xaa в положении 86 представляет собой Gly, Lys, Ala или Arg; Xaa в положении 88 представляет собой Ser, Glu, Thr или Asp; Xaa в положении 89 представляет собой Leu, Ile, Val или Met; Xaa в положении 91 представляет собой Asp, His или Glu; Xaa в положении 92 представляет собой Gly, Asp, Ala или Glu; Xaa в положении 95 представляет собой Leu, Trp, Ile, Val, Met, Phe или Tyr; Xaa в положении 96 представляет собой Val, Leu, Ile или Met; Xaa в положении 97 представляет собой Phe, Ala или Gly; Xaa в положении 98 представляет собой Glu, Thr, Asp или Ser; Xaa в положении 100 представляет собой Tyr, Lys, Trp или Arg; Xaa в положении 101 представляет собой Trp, Phe или Tyr; Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val; Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr; Xaa в положении 106 представляет собой Ser, Ala, Thr или Gly; Xaa в положении 111 представляет собой Asp, His, Asn, Glu или Gln; Xaa в положении 112 представляет собой Glu, Ser, Asp или Thr; Xaa в положении 113 представляет собой Leu, Ser, Ile, Val, Met или Thr; Xaa в положении 114 представляет собой Thr или Ser; Xaa в положении 115 представляет собой Val, Ile, Val или Met; Xaa в положении 116 представляет собой Lys, Thr, Glu, Arg, Ser или Asp; Xaa в положении 117 представляет собой Asp или Glu; Xaa в положении 118 представляет собой Lys, Asp, Arg или Glu; Xaa в положении 119 представляет собой Glu, Asn, Asp или Gln; Xaa в положении 120 представляет собой Asn, Lys, Asp или Arg; Xaa в положении 121 представляет собой Tyr, Leu или Phe; Xaa в положении 122 представляет собой Thr, Lys, Ser, Arg, Leu или Phe; Xaa в положении 123 представляет собой Val, Ile, Leu, Met, Phe или Asn; Xaa в положении 124 представляет собой Ile, Ser, Asp, Leu, Val Met, Thr, Glu или Phe; Xaa в положении 125 представляет собой Lys, Leu, Phe или Met; Xaa в положении 126 представляет собой Lys, Glu, Arg, Asp, Leu или Phe; Xaa в положении 128 представляет собой Gly, Leu или Phe; Xaa в положении 129 представляет собой Gly, Asn, Ala, Gln, Leu или Phe; Xaa в положении 130 представляет собой Ser, Ile, Thr, Leu, Val, Met или Phe; Xaa в положении 131 представляет собой Pro, Ser или Thr; Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr; Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp; Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr; Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr; Xaa в положении 142 представляет собой Val, Cys, Ile, Leu или Met; Xaa в положении 143 представляет собой Val, Ile; Leu или Met; Xaa в положении 145 представляет собой Lys, Val, Arg, Ile, Leu или Met; и Xaa в положении 146 представляет собой Ser, Gly, Thr или Ala; и где 1-14 аминокислот, необязательно, удалены с N-конца полипептида.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 257, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59 или 60 аминокислотных замен, в любой комбинации, в остатках, обозначенных Xaa, в SEQ ID NO: 257 по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 2.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 257, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 или 29 аминокислотных замен, в любой комбинации, в остатках, обозначенных Xaa, в SEQ ID NO: 257 по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 2.
В некоторых вариантах осуществления иллюстративные полипептиды AfIP-1A кодируются полинуклеотидной последовательностью, изложенной в SEQ ID NO: 1, SEQ ID NO: 5, SEQ ID NO: 27, SEQ ID NO: 31, SEQ ID NO: 35, SEQ ID NO: 39, SEQ ID NO: 41, SEQ ID NO: 43, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 49, SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 55, SEQ ID NO: 57, SEQ ID NO: 59, SEQ ID NO: 61, SEQ ID NO: 63, SEQ ID NO: 65, SEQ ID NO: 67, SEQ ID NO: 69, SEQ ID NO: 71, SEQ ID NO: 73, SEQ ID NO: 93, SEQ ID NO: 95, SEQ ID NO: 97, SEQ ID NO: 99, SEQ ID NO: 151, SEQ ID NO: 312, SEQ ID NO: 313, SEQ ID NO: 314, SEQ ID NO: 315, SEQ ID NO: 316, SEQ ID NO: 317, SEQ ID NO: 318, SEQ ID NO: 319, SEQ ID NO: 320, SEQ ID NO: 321, SEQ ID NO: 322, SEQ ID NO: 546, SEQ ID NO: 547, SEQ ID NO: 548, SEQ ID NO: 549, SEQ ID NO: 550, SEQ ID NO: 551, SEQ ID NO: 552, SEQ ID NO: 553, SEQ ID NO: 554, SEQ ID NO: 555, SEQ ID NO: 556, SEQ ID NO: 557, SEQ ID NO: 558, SEQ ID NO: 559, SEQ ID NO: 560, SEQ ID NO: 561, SEQ ID NO: 562, SEQ ID NO: 563, SEQ ID NO: 564, SEQ ID NO: 565, SEQ ID NO: 566, SEQ ID NO: 567, SEQ ID NO: 568, SEQ ID NO: 569, SEQ ID NO: 570, SEQ ID NO: 571, SEQ ID NO: 572, SEQ ID NO: 573, SEQ ID NO: 574, SEQ ID NO: 575, SEQ ID NO: 576, SEQ ID NO: 577, SEQ ID NO: 578, SEQ ID NO: 579, SEQ ID NO: 580, SEQ ID NO: 581, SEQ ID NO: 582, SEQ ID NO: 583, SEQ ID NO: 584, SEQ ID NO: 585, SEQ ID NO: 586, SEQ ID NO: 587, SEQ ID NO: 588, SEQ ID NO: 589, SEQ ID NO: 619, SEQ ID NO: 620, SEQ ID NO: 621, SEQ ID NO: 622, SEQ ID NO: 623, SEQ ID NO: 624, SEQ ID NO: 625, SEQ ID NO: 626, SEQ ID NO: 627, SEQ ID NO: 628, SEQ ID NO: 629, SEQ ID NO: 630, SEQ ID NO: 631, SEQ ID NO: 632, SEQ ID NO: 633, SEQ ID NO: 634, SEQ ID NO: 635, SEQ ID NO: 636, SEQ ID NO: 637, SEQ ID NO: 638, SEQ ID NO: 639, SEQ ID NO: 640, SEQ ID NO: 641, SEQ ID NO: 642, SEQ ID NO: 643, SEQ ID NO: 644, SEQ ID NO: 645, SEQ ID NO: 646, SEQ ID NO: 647, SEQ ID NO: 665, SEQ ID NO: 666, SEQ ID NO: 667, SEQ ID NO: 668, SEQ ID NO: 669, SEQ ID NO: 670, SEQ ID NO: 671, SEQ ID NO: 672, SEQ ID NO: 673, SEQ ID NO: 674, SEQ ID NO: 675, SEQ ID NO: 676, SEQ ID NO: 677, SEQ ID NO: 678, SEQ ID NO: 679, SEQ ID NO: 680, SEQ ID NO: 681, SEQ ID NO:777, SEQ ID NO:781, SEQ ID 785 и SEQ ID NO:789.
В некоторых вариантах осуществления полипептид AfIP-1A кодируется полинуклеотидной последовательностью с SEQ ID NO: 1, SEQ ID NO 316, SEQ ID NO: 321, SEQ ID NO; 322 или SEQ ID NO: 789.
В некоторых вариантах осуществления иллюстративные полипептиды AfIP-1A являются изложенными в SEQ ID NO: 2, SEQ ID NO: 6, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 94, SEQ ID NO: 96, SEQ ID NO: 98, SEQ ID NO: 100, SEQ ID NO: 152, SEQ ID NO: 301, SEQ ID NO: 302, SEQ ID NO: 303, SEQ ID NO: 304, SEQ ID NO: 305, SEQ ID NO: 306, SEQ ID NO: 307, SEQ ID NO: 308, SEQ ID NO: 309, SEQ ID NO: 310, SEQ ID NO: 311, SEQ ID NO: 502, SEQ ID NO: 503, SEQ ID NO: 504, SEQ ID NO: 505, SEQ ID NO: 506, SEQ ID NO: 507, SEQ ID NO: 508, SEQ ID NO: 509, SEQ ID NO: 510, SEQ ID NO: 511, SEQ ID NO: 512, SEQ ID NO: 513, SEQ ID NO: 514, SEQ ID NO: 515, SEQ ID NO: 516, SEQ ID NO: 517, SEQ ID NO: 518, SEQ ID NO: 519, SEQ ID NO: 520, SEQ ID NO: 521, SEQ ID NO: 522, SEQ ID NO: 523, SEQ ID NO: 524, SEQ ID NO: 525, SEQ ID NO: 526, SEQ ID NO: 527, SEQ ID NO: 528, SEQ ID NO: 529, SEQ ID NO: 530, SEQ ID NO: 531, SEQ ID NO: 532, SEQ ID NO: 533, SEQ ID NO: 534, SEQ ID NO: 535, SEQ ID NO: 536, SEQ ID NO: 537, SEQ ID NO: 538, SEQ ID NO: 539, SEQ ID NO: 540, SEQ ID NO: 541, SEQ ID NO: 542, SEQ ID NO: 543, SEQ ID NO: 544, SEQ ID NO: 545, SEQ ID NO: 590, SEQ ID NO: 591, SEQ ID NO: 592, SEQ ID NO: 593, SEQ ID NO: 594, SEQ ID NO: 595, SEQ ID NO: 596, SEQ ID NO: 597, SEQ ID NO: 598, SEQ ID NO: 599, SEQ ID NO: 600, SEQ ID NO: 601, SEQ ID NO: 602, SEQ ID NO: 603, SEQ ID NO: 604, SEQ ID NO: 605, SEQ ID NO: 606, SEQ ID NO: 607, SEQ ID NO: 608, SEQ ID NO: 609, SEQ ID NO: 610, SEQ ID NO: 611, SEQ ID NO: 612, SEQ ID NO: 613, SEQ ID NO: 614, SEQ ID NO: 615, SEQ ID NO: 616, SEQ ID NO: 617, SEQ ID NO: 618, SEQ ID NO: 648, SEQ ID NO: 649, SEQ ID NO: 650, SEQ ID NO: 651, SEQ ID NO: 652, SEQ ID NO: 653, SEQ ID NO: 654, SEQ ID NO: 655, SEQ ID NO: 656, SEQ ID NO: 657, SEQ ID NO: 658, SEQ ID NO: 659, SEQ ID NO: 660, SEQ ID NO: 661, SEQ ID NO: 662, SEQ ID NO: 663, SEQ ID NO: 664, SEQ ID NO: 778, SEQ ID NO: 782 и SEQ ID NO: 784.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO; 2, SEQ ID NO; 305, SEQ ID NO; 310 или SEQ ID NO: 311.
В некоторых вариантах осуществления иллюстративные полипептиды AfIP-1A представляют собой полипептиды, показанные в таблице 13, таблице 14, таблице 18, таблице 19, таблице 20, таблице 31, таблице 35, таблице 37, и/или таблице 38, и любые комбинации их аминокислотных замен, а также делеций и/или вставок, и их фрагменты.
В некоторых вариантах осуществления полипептид AfIP-1A не имеет аминокислотную последовательность с SEQ ID NO: 18.
В некоторых вариантах осуществления полипептид AfIP-1A имеет расчетный молекулярный вес от приблизительно 8 кДа до приблизительно 18 кДа, от приблизительно 10 кДа до приблизительно 18 кДа, от приблизительно 12 кДа до приблизительно 18 кДа, от приблизительно 14 кДа до приблизительно 18 кДа, от приблизительно 15 кДа до приблизительно 17 кДа или от приблизительно 15,5 кДа до приблизительно 16,5 кДа.
В некоторых вариантах осуществления полипептид AfIP-1A обладает модифицированными физическими свойствами. Применяемый в данном документе термин “физическое свойство” относится к какому-либо параметру, который подходит для описания физико-химических характеристик белка. Применяемое в данном документе выражение “физическое свойство, представляющее интерес” и “свойство, представляющее интерес” применяются взаимозаменяемо для обозначения физических свойств белков, которые исследуются и/или модифицируются. Примеры физических свойств включают без ограничения суммарный поверхностный заряд и распределение зарядов на поверхности белка, суммарную гидрофобность и распределение гидрофобных остатков на поверхности белка, плотность поверхностного заряда, плотность гидрофобности поверхности, общее число поверхностных ионизируемых групп, поверхностное натяжение, размер белка и его распределение в растворе, температуру плавления, теплоемкость и второй вириальный коэффициент. Примеры физических свойств также включают без ограничения растворимость, фолдинг, стабильность и усвояемость. В некоторых вариантах осуществления полипептид AfIP-1A обладает повышенной усвояемостью протеолитических фрагментов в кишечнике насекомого. Модели для переваривания при помощи искусственного желудочного сока известны специалисту в данной области техники (Fuchs, R.L. and J.D. Astwood. Food Technology 50: 83-88, 1996; Astwood, J.D., et al Nature Biotechnology 14: 1269-1273, 1996; Fu TJ et al J. Agric Food Chem. 50: 7154-7160, 2002).
В некоторых вариантах осуществления полипептид AfIP-1B по меньшей мере на приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичен со всей длиной аминокислотной последовательности с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788. В некоторых вариантах осуществления полипептид AfIP-1B по меньшей мере на приблизительно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичен со всей длиной аминокислотной последовательности с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788. В некоторых вариантах осуществления полипептид AfIP-1B по меньшей мере на приблизительно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичен со всей длиной аминокислотной последовательности с SEQ ID NO: 4. В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность, по меньшей мере на 50% идентичную аминокислотной последовательности с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788, где полипептид обладает инсектицидной активностью и/или пестицидной активностью. В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO: 788, где полипептид обладает инсектицидной активностью и/или пестицидной активностью. В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности с SEQ ID NO: 4, где полипептид обладает инсектицидной активностью и/или пестицидной активностью. В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность, по меньшей мере на 95% идентичную аминокислотной последовательности с SEQ ID NO: 4, где полипептид обладает инсектицидной активностью и/или пестицидной активностью. В некоторых вариантах осуществления инсектицидный полипептид по меньшей мере на приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичен со всей длиной аминокислотной последовательности с SEQ ID NO: 20.
В некоторых вариантах осуществления полипептид AfIP-1B содержит один или несколько аминокислотных мотивов, выбранных из: i) аминокислот 105-115 из SEQ ID NO: 4, аминокислот 105-115 из SEQ ID NO: 258 или аминокислот 105-115 из SEQ ID NO: 259, ii) аминокислот 133-144 из SEQ ID NO: 4, аминокислот 133-144 из SEQ ID NO: 258 или аминокислот 133-144 из SEQ ID NO: 259, iii) аминокислот 177-184 из SEQ ID NO: 4, аминокислот 177-184 из SEQ ID NO: 258 или аминокислот 177-184 из SEQ ID NO: 259, iv) аминокислот 358-365 из SEQ ID NO: 4, аминокислот 358-365 из SEQ ID NO: 258 или аминокислот 358-365 из SEQ ID NO: 259 и v) аминокислот 511-520 из SEQ ID NO: 4, аминокислот 511-520 из SEQ ID NO: 258 или аминокислот 511-520 из SEQ ID NO: 259. В некоторых вариантах осуществления аминокислотный мотив, необязательно, может иметь делецию одной или нескольких аминокислот в пределах мотива, вставку одной или нескольких аминокислот в пределах мотива или их комбинации.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотный мотив, представленный положениями аминокислот 358-365 из SEQ ID NO: 259, где по меньшей мере одна аминокислота в положениях 358-365 из SEQ ID NO: 259 не идентична аминокислотам в положениях 358-365 из SEQ ID NO: 20.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность, по меньшей мере на 50% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788. В некоторых вариантах осуществления идентичность последовательностей рассчитывают по всей длине полипептида с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788. В некоторых вариантах осуществления идентичность последовательностей рассчитывают по всей длине полипептида с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788. В некоторых вариантах осуществления идентичность последовательностей рассчитывают по всей длине полипептида с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность, по меньшей мере на 95% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788. В некоторых вариантах осуществления идентичность последовательностей рассчитывают по всей длине полипептида с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность, по меньшей мере на 50% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788, и он содержит один или несколько аминокислотных мотивов, выбранных из: i) аминокислот 105-115 из SEQ ID NO: 4, аминокислот 105-115 из SEQ ID NO: 258 или аминокислот 105-115 из SEQ ID NO: 259, ii) аминокислот 133-144 из SEQ ID NO: 4, аминокислот 133-144 из SEQ ID NO: 258 или аминокислот 133-144 из SEQ ID NO: 259, iii) аминокислот 177-184 из SEQ ID NO: 4, аминокислот 177-184 из SEQ ID NO: 258 или аминокислот 177-184 из SEQ ID NO: 259, iv) аминокислот 358-365 из SEQ ID NO: 4, аминокислот 358-365 из SEQ ID NO: 258 или аминокислот 358-365 из SEQ ID NO: 259 и v) аминокислот 511-520 из SEQ ID NO: 4, аминокислот 511-520 из SEQ ID NO: 258 или аминокислот 511-520 из SEQ ID NO: 259.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788, и он содержит один или несколько аминокислотных мотивов, выбранных из: i) аминокислот 105-115 из SEQ ID NO: 4, аминокислот 105-115 из SEQ ID NO: 258 или аминокислот 105-115 из SEQ ID NO: 259, ii) аминокислот 133-144 из SEQ ID NO: 4, аминокислот 133-144 из SEQ ID NO: 258 или аминокислот 133-144 из SEQ ID NO: 259, iii) аминокислот 177-184 из SEQ ID NO: 4, аминокислот 177-184 из SEQ ID NO: 258 или аминокислот 177-184 из SEQ ID NO: 259, iv) аминокислот 358-365 из SEQ ID NO: 4 или аминокислот 358-365 из SEQ ID NO: 258, аминокислот 358-365 из SEQ ID NO: 259 и v) аминокислот 511-520 из SEQ ID NO: 4, аминокислот 511-520 из SEQ ID NO: 258 или аминокислот 511-520 из SEQ ID NO: 259.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность, по меньшей мере на 95% идентичную аминокислотной последовательности, изложенной в SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788, и он содержит один или несколько аминокислотных мотивов, выбранных из: i) аминокислот 105-115 из SEQ ID NO: 4, аминокислот 105-115 из SEQ ID NO: 258 или аминокислот 105-115 из SEQ ID NO: 259, ii) аминокислот 133-144 из SEQ ID NO: 4, аминокислот 133-144 из SEQ ID NO: 258 или аминокислот 133-144 из SEQ ID NO: 259, iii) аминокислот 177-184 из SEQ ID NO: 4, аминокислот 177-184 из SEQ ID NO: 258 или аминокислот 177-184 из SEQ ID NO: 259, iv) аминокислот 358-365 из SEQ ID NO: 4, аминокислот 358-365 из SEQ ID NO: 258 или аминокислот 358-365 из SEQ ID NO: 259 и v) аминокислот 511-520 из SEQ ID NO: 4, аминокислот 511-520 из SEQ ID NO: 258 или аминокислот 511-520 из SEQ ID NO: 259.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 258, где Xaa в положении 2 представляет собой Asp или Gly; Xaa в положении 12 представляет собой Met или Leu; Xaa в положении 34 представляет собой Ile или Leu; Xaa в положении 38 представляет собой Ile или Leu; Xaa в положении 42 представляет собой Glu или Asp; Xaa в положении 43 представляет собой Ile или Leu; Xaa в положении 53 представляет собой Tyr или Phe; Xaa в положении 55 представляет собой Tyr или Phe; Xaa в положении 71 представляет собой Gly или Cys; Xaa в положении 82 представляет собой Val или Met; Xaa в положении 86 представляет собой Val или Leu; Xaa в положении 94 представляет собой Tyr или Phe; Xaa в положении 97 представляет собой Ile или Leu; Xaa в положении 101 представляет собой Tyr или Phe; Xaa в положении 103 представляет собой Ile, Leu, Gly, Val, Trp, Phe, Thr, Cys, Glu или Arg; Xaa в положении 105 представляет собой Met, Gly, Val, Leu, Trp, Phe, Pro, Thr, Cys, Asn, Gln или Arg; Xaa в положении 106 представляет собой Ile или Leu; Xaa в положении 108 представляет собой Gly, Ala, Leu, Val, Ile, Met, Trp, Phe, Ser, Thr, Cys, Tyr, Asn, Gln, Asp, Lys или His; Xaa в положении 109 представляет собой Ile, Leu, Ala, Val, Leu, Met, Trp, Phe, Pro, Cys, Asn или Glu; Xaa в положении 110 представляет собой Glu, Gly, Ala, Val, Leu, Met, Trp, Ser, Thr, Cys, Tyr, Asp, Arg или His; Xaa в положении 111 представляет собой Tyr, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Thr, Cys, Asp, Glu, Lys, Arg или His; Xaa в положении 115 представляет собой Asp или Glu; Xaa в положении 119 представляет собой Val или Ala; Xaa в положении 134 представляет собой Ser или Leu; Xaa в положении 137 представляет собой Val, Phe, Ala, Leu, Trp, Pro, Ser, Cys, Asp, Glu или Arg; Xaa в положении 139 представляет собой Glu или Asp; Xaa в положении 141 представляет собой Phe, Val, Leu, Ile, Trp, Ser или Cys; Xaa в положении 144 представляет собой Ala или Val; Xaa в положении 148 представляет собой Ser, Phe или Thr; Xaa в положении 152 представляет собой Ile или Thr; Xaa в положении 155 представляет собой Asp или Glu; Xaa в положении 179 представляет собой Gly, Val, Trp, Ser, Cys или Arg; Xaa в положении 181 представляет собой Ile, Val или Leu; Xaa в положении 182 представляет собой Trp, Gly, Ala, Val, Leu, Met, Ser, Cys, Glu или Arg; Xaa в положении 188 представляет собой Val или Leu; Xaa в положении 196 представляет собой Lys или Glu; Xaa в положении 197 представляет собой Thr или Ser; Xaa в положении 201 представляет собой Trp, Cys или Phe; Xaa в положении 202 представляет собой Lys или Asn; Xaa в положении 203 представляет собой Tyr или Phe; Xaa в положении 208 представляет собой Glu или Asp; Xaa в положении 214 представляет собой Ile или Leu; Xaa в положении 220 представляет собой Ile или Leu; Xaa в положении 224 представляет собой Tyr или Phe; Xaa в положении 234 представляет собой Glu или Asp; Xaa в положении 235 представляет собой Val или Leu; Xaa в положении 270 представляет собой Ile или Val; Xaa в положении 296 представляет собой Lys или Glu; Xaa в положении 298 представляет собой Ala или Glu; Xaa в положении 299 представляет собой Glu или Gly; Xaa в положении 300 представляет собой Ile или Val; Xaa в положении 305 представляет собой Asp или Glu; Xaa в положении 308 представляет собой Lys или Asn; Xaa в положении 317 представляет собой Ala или Ser; Xaa в положении 323 представляет собой Glu или Asp; Xaa в положении 335 представляет собой Glu или Asp; Xaa в положении 343 представляет собой Asp или Glu; Xaa в положении 352 представляет собой Glu или Asp; Xaa в положении 359 представляет собой Glu, Gly, Ala, Val, Leu, Trp, Phe, Pro, Ser, Thr, Lys или Arg; Xaa в положении 360 представляет собой Asn, Gly, Val, Leu, Ile, Met, Phe, Pro, Thr, Asn, Asp, Lys, Arg или His; Xaa в положении 361 представляет собой Ser, Gly, Val, Leu или Glu; Xaa в положении 363 представляет собой Asp, Gly, Leu, Ile, Trp или Ser; Xaa в положении 364 представляет собой Val, Pro, Ser, Thr, Asn, Gln, Asp, Glu или Lys; Xaa в положении 365 представляет собой Leu, Gly, Ala, Val, Ile, Trp, Phe, Pro, Ser, Thr, Cys, Tyr, Gln, Asp, Glu, Arg или His; Xaa в положении 367 представляет собой Glu или Lys; Xaa в положении 368 представляет собой Gly или Asp; Xaa в положении 370 представляет собой Ile или Val; Xaa в положении 373 представляет собой Arg или Ser; Xaa в положении 374 представляет собой Asn или Lys; Xaa в положении 377 представляет собой Leu или Ile; Xaa в положении 384 представляет собой Thr или Ala; Xaa в положении 385 представляет собой Ile или Ser; Xaa в положении 388 представляет собой Asp или Glu; Xaa в положении 393 представляет собой Tyr или Phe; Xaa в положении 398 представляет собой Ala или Val; Xaa в положении 414 представляет собой Tyr или Phe; Xaa в положении 418 представляет собой Ile или Leu; Xaa в положении 419 представляет собой Ser или Asn; Xaa в положении 423 представляет собой Val или Leu; Xaa в положении 425 представляет собой Glu или Val; Xaa в положении 427 представляет собой Ile или Val; Xaa в положении 434 представляет собой Met или Thr; Xaa в положении 481 представляет собой Glu или Asp; Xaa в положении 495 представляет собой Asp или Glu; Xaa в положении 509 представляет собой Phe, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Cys, Tyr, Asn, Asp, Glu или Arg; Xaa в положении 512 представляет собой Asn, Ser, Gly, Ala, Leu, Met, Trp, Phe, Ser, Thr, Cys, Gln или Arg; Xaa в положении 514 представляет собой Glu, Gly, Ile, Asp или Arg; Xaa в положении 516 представляет собой Gly, Ala, Val, Met, Pro, Thr, Asn, Gln, Asp, Glu или Lys; Xaa в положении 519 представляет собой Leu, Gly, Ala, Val, Met, Phe, Pro, Tyr, Gln, Asp, Lys или Arg; Xaa в положении 526 представляет собой Val или Leu; Xaa в положении 530 представляет собой Ile или Leu; Xaa в положении 533 представляет собой Val или Ala; Xaa в положении 536 представляет собой Ile или Leu; Xaa в положении 538 представляет собой Tyr или Phe; Xaa в положении 543 представляет собой Tyr или Phe; Xaa в положении 544 представляет собой Lys или Arg; Xaa в положении 547 представляет собой Tyr или Phe; Xaa в положении 550 представляет собой Tyr или Phe; Xaa в положении 552 представляет собой Asn или Ser; Xaa в положении 558 представляет собой Phe или Leu; Xaa в положении 600 представляет собой Met или Val; Xaa в положении 602 представляет собой Met или Ile; Xaa в положении 607 представляет собой Asp или Gly; Xaa в положении 610 представляет собой Thr или Lys; Xaa в положении 612 представляет собой Ile или Thr; Xaa в положении 613 представляет собой Leu или Pro; Xaa в положении 615 представляет собой Asn или Asp; Xaa в положении 619 представляет собой Lys или Arg; Xaa в положении 625 представляет собой Tyr или Phe; Xaa в положении 629 представляет собой Lys или Asn; Xaa в положении 631 представляет собой Ile, Val или Leu; Xaa в положении 633 представляет собой Trp или Phe; Xaa в положении 646 представляет собой Gln или Arg; Xaa в положении 661 представляет собой Asn или Ser; Xaa в положении 683 представляет собой Thr или Ala; Xaa в положении 696 представляет собой Glu, Asp или Gln; Xaa в положении 700 представляет собой Ser или Gly; и Xaa в положении 702 представляет собой Phe или Ser; и где 1-25 аминокислот, необязательно, удалены с C-конца полипептида.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 258, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69 или 70 аминокислотных замен, в любой комбинации, в остатках, обозначенных Xaa, в SEQ ID NO: 258 по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 4.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 258, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или 35 аминокислотных замен, в любой комбинации, в остатках, обозначенных Xaa, в SEQ ID NO: 258 по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 4.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 259, где Xaa в положении 2 представляет собой Asp или Gly; Xaa в положении 12 представляет собой Met, Leu, Ile или Val; Xaa в положении 34 представляет собой Ile или Leu; Xaa в положении 38 представляет собой Ile или Leu; Xaa в положении 42 представляет собой Glu или Asp; Xaa в положении 43 представляет собой Ile или Leu; Xaa в положении 53 представляет собой Tyr или Phe; Xaa в положении 55 представляет собой Tyr или Phe; Xaa в положении 71 представляет собой Gly, Cys или Ala; Xaa в положении 82 представляет собой Val или Met; Xaa в положении 86 представляет собой Val или Leu; Xaa в положении 94 представляет собой Tyr или Phe; Xaa в положении 97 представляет собой Ile или Leu; Xaa в положении 101 представляет собой Tyr или Phe; Xaa в положении 103 представляет собой Ile, Leu, Gly, Val, Trp, Phe, Thr, Cys, Glu или Arg; Xaa в положении 105 представляет собой Met, Gly, Val, Leu, Trp, Phe, Pro, Thr, Cys, Asn, Gln или Arg; Xaa в положении 106 представляет собой Ile или Leu; Xaa в положении 108 представляет собой Gly, Ala, Leu, Val, Ile, Met, Trp, Phe, Ser, Thr, Cys, Tyr, Asn, Glu, Asp, Lys или His; Xaa в положении 109 представляет собой Ile, Leu, Ala, Val, Leu, Met, Trp, Phe, Pro, Cys, Asn или Glu; Xaa в положении 110 представляет собой Glu, Gly, Ala, Val, Leu, Met, Trp, Ser, Thr, Cys, Tyr, Asp, Arg или His; Xaa в положении 111 представляет собой Tyr, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Thr, Cys, Asp, Glu, Lys, Arg или His; Xaa в положении 115 представляет собой Asp или Glu; Xaa в положении 119 представляет собой Val, Ala, Ile или Leu; Xaa в положении 134 представляет собой Ser или Leu; Xaa в положении 137 представляет собой Val, Phe, Ala, Leu, Trp, Pro, Ser, Cys, Asp, Glu или Arg; Xaa в положении 139 представляет собой Glu или Asp; Xaa в положении 141 представляет собой Phe, Val, Leu, Ile, Trp, Ser или Cys; Xaa в положении 144 представляет собой Ala, Val, Gly, Ile, Leu или Met; Xaa в положении 148 представляет собой Ser, Phe, Thr или Trp; Xaa в положении 152 представляет собой Ile, Thr, Leu, Val, Met или Ser; Xaa в положении 155 представляет собой Asp или Glu; Xaa в положении 179 представляет собой Gly, Val, Trp, Ser, Cys или Arg; Xaa в положении 181 представляет собой Ile, Val, Met или Leu; Xaa в положении 182 представляет собой Trp, Gly, Ala, Val, Leu, Met, Ser, Cys, Glu или Arg; Xaa в положении 188 представляет собой Val или Leu; Xaa в положении 196 представляет собой Lys или Glu; Xaa в положении 197 представляет собой Thr или Ser; Xaa в положении 201 представляет собой Trp, Cys, Tyr или Phe; Xaa в положении 202 представляет собой Lys, Asn или Arg; Xaa в положении 203 представляет собой Tyr или Phe; Xaa в положении 208 представляет собой Glu или Asp; Xaa в положении 214 представляет собой Ile или Leu; Xaa в положении 220 представляет собой Ile или Leu; Xaa в положении 224 представляет собой Tyr или Phe; Xaa в положении 234 представляет собой Glu или Asp; Xaa в положении 235 представляет собой Val или Leu; Xaa в положении 270 представляет собой Ile, Val, Leu или Met; Xaa в положении 296 представляет собой Lys или Glu; Xaa в положении 298 представляет собой Ala, Glu, Gly или Asp; Xaa в положении 299 представляет собой Glu, Gly, Asp или Ala; Xaa в положении 300 представляет собой Ile, Val, Ile или Met; Xaa в положении 305 представляет собой Asp или Glu; Xaa в положении 308 представляет собой Lys или Asn; Xaa в положении 317 представляет собой Ala, Ser, Gly или Thr; Xaa в положении 323 представляет собой Glu или Asp; Xaa в положении 335 представляет собой Glu или Asp; Xaa в положении 343 представляет собой Asp или Glu; Xaa в положении 352 представляет собой Glu или Asp; Xaa в положении 359 представляет собой Glu, Gly, Ala, Val, Leu, Trp, Phe, Pro, Ser, Thr, Lys или Arg; Xaa в положении 360 представляет собой Asn, Gly, Val, Leu, Ile, Met, Phe, Pro, Thr, Asn, Asp, Lys, Arg или His; Xaa в положении 361 представляет собой Ser, Gly, Val, Leu или Glu; Xaa в положении 363 представляет собой Asp, Gly, Leu, Ile, Trp или Ser; Xaa в положении 364 представляет собой Val, Pro, Ser, Thr, Asn, Gln, Asp, Glu или Lys; Xaa в положении 365 представляет собой Leu, Gly, Ala, Val, Ile, Trp, Phe, Pro, Ser, Thr, Cys, Tyr, Gln, Asp, Glu, Arg или His; Xaa в положении 367 представляет собой Glu или Lys; Xaa в положении 368 представляет собой Gly или Asp; Xaa в положении 370 представляет собой Ile, Val, Leu или Met; Xaa в положении 373 представляет собой Arg или Ser; Xaa в положении 374 представляет собой Asn, Lys, Gln или Arg; Xaa в положении 377 представляет собой Leu, Ile, Val или Met; Xaa в положении 384 представляет собой Thr, Ala, Ser или Gly; Xaa в положении 385 представляет собой Ile, Ser, Leu, Val, Met или Thr; Xaa в положении 388 представляет собой Asp или Glu; Xaa в положении 393 представляет собой Tyr, Phe или Trp; Xaa в положении 398 представляет собой Ala или Val; Xaa в положении 414 представляет собой Tyr или Phe; Xaa в положении 418 представляет собой Ile или Leu; Xaa в положении 419 представляет собой Ser, Asn, Thr или Gln; Xaa в положении 423 представляет собой Val или Leu; Xaa в положении 425 представляет собой Glu или Val; Xaa в положении 427 представляет собой Ile или Val; Xaa в положении 434 представляет собой Met или Thr; Xaa в положении 481 представляет собой Glu или Asp; Xaa в положении 495 представляет собой Asp или Glu; Xaa в положении 509 представляет собой Phe, Gly, Ala, Val, Leu, Ile, Met, Trp, Ser, Cys, Tyr, Asn, Asp, Glu или Arg; Xaa в положении 512 представляет собой Asn, Ser, Gly, Ala, Leu, Met, Trp, Phe, Ser, Thr, Cys, Gln или Arg; Xaa в положении 514 представляет собой Glu, Gly, Ile, Asp или Arg; Xaa в положении 516 представляет собой Gly, Ala, Val, Met, Pro, Thr, Asn, Gln, Asp, Glu или Lys; Xaa в положении 519 представляет собой Leu, Gly, Ala, Val, Met, Phe, Pro, Tyr, Gln, Asp, Lys или Arg; Xaa в положении 526 представляет собой Val или Leu; Xaa в положении 530 представляет собой Ile или Leu; Xaa в положении 533 представляет собой Val или Ala; Xaa в положении 536 представляет собой Ile или Leu; Xaa в положении 538 представляет собой Tyr, Phe или Trp; Xaa в положении 543 представляет собой Tyr или Phe; Xaa в положении 544 представляет собой Lys или Arg; Xaa в положении 547 представляет собой Tyr или Phe; Xaa в положении 550 представляет собой Tyr, Phe или Trp; Xaa в положении 552 представляет собой Asn, Ser, Gln или Thr; Xaa в положении 558 представляет собой Phe или Leu; Xaa в положении 600 представляет собой Met или Val; Xaa в положении 602 представляет собой Met, Ile, Leu или Val; Xaa в положении 607 представляет собой Asp или Gly; Xaa в положении 610 представляет собой Thr, Lys, Ser или Arg; Xaa в положении 612 представляет собой Ile или Thr; Xaa в положении 613 представляет собой Leu или Pro; Xaa в положении 615 представляет собой Asn или Asp; Xaa в положении 619 представляет собой Lys или Arg; Xaa в положении 625 представляет собой Tyr, Phe или Trp; Xaa в положении 629 представляет собой Lys или Asn; Xaa в положении 631 представляет собой Ile, Val, Leu или Met; Xaa в положении 633 представляет собой Trp или Phe; Xaa в положении 646 представляет собой Gln или Arg; Xaa в положении 661 представляет собой Asn или Ser; Xaa в положении 683 представляет собой Thr, Ala, Ser или Gly; Xaa в положении 696 представляет собой Glu, Asp или Gln; Xaa в положении 700 представляет собой Ser или Gly; и Xaa в положении 702 представляет собой Phe или Ser; и где 1-25 аминокислот, необязательно, удалены с C-конца полипептида.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 259, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69 или 70 аминокислотных замен, в любой комбинации, в остатках, обозначенных Xaa, в SEQ ID NO: 259 по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 4.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 259, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или 35 аминокислотных замен, в любой комбинации, в остатках, обозначенных Xaa, в SEQ ID NO: 259 по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 4.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 277, где Xaa в положении 8 представляет собой Ile или Val; Xaa в положении 14 представляет собой Ile или Val; Xaa в положении 16 представляет собой Val или Ile; Xaa в положении 30 представляет собой Leu или Ile; Xaa в положении 43 представляет собой Ile или Val; Xaa в положении 47 представляет собой Met или Ile; Xaa в положении 50 представляет собой Lys или Arg; Xaa в положении 52 представляет собой Gln или Asn; Xaa в положении 56 представляет собой Thr или Ser; Xaa в положении 62 представляет собой Gly или Ala; Xaa в положении 63 представляет собой Thr или Ser; Xaa в положении 64 представляет собой Ile или Leu; Xaa в положении 73 представляет собой Ser или Thr; Xaa в положении 75 представляет собой Ile или Val; Xaa в положении 76 представляет собой Ala или Ser; Xaa в положении 81 представляет собой Ala или Ser; Xaa в положении 83 представляет собой Ala или Ser; Xaa в положении 99 представляет собой Val или Leu; Xaa в положении 122 представляет собой Val или Ile; Xaa в положении 135 представляет собой Leu или Val; Xaa в положении 139 представляет собой Glu или Asp; Xaa в положении 158 представляет собой Met или Val; Xaa в положении 160 представляет собой Glu или Asp; Xaa в положении 162 представляет собой Val или Leu; Xaa в положении 164 представляет собой Ser или Ala; Xaa в положении 166 представляет собой Gln или Asn; Xaa в положении 171 представляет собой Ser или Thr; Xaa в положении 173 представляет собой Gly или Ala; Xaa в положении 176 представляет собой Leu или Met; Xaa в положении 185 представляет собой Met или Ile; Xaa в положении 191 представляет собой Glu или Asp; Xaa в положении 192 представляет собой Met или Ile; Xaa в положении 208 представляет собой Glu или Asp; Xaa в положении 210 представляет собой Ser или Thr; Xaa в положении 216 представляет собой Ser или Ala; Xaa в положении 217 представляет собой Ser или Ala; Xaa в положении 220 представляет собой Ile или Val; Xaa в положении 233 представляет собой Ser или Thr; Xaa в положении 236 представляет собой Glu или Asp; Xaa в положении 241 представляет собой Ala или Ser; Xaa в положении 243 представляет собой Ala или Ser; Xaa в положении 263 представляет собой Ser или Ala; Xaa в положении 264 представляет собой Phe или Tyr; Xaa в положении 265 представляет собой Ala или Ser; Xaa в положении 268 представляет собой Ser или Thr; Xaa в положении 270 представляет собой Ile или Leu; Xaa в положении 288 представляет собой Ile или Leu; Xaa в положении 292 представляет собой Leu или Val; Xaa в положении 309 представляет собой Lys или Arg; Xaa в положении 313 представляет собой Ser или Thr; Xaa в положении 317 представляет собой Ala или Ser; Xaa в положении 318 представляет собой Leu или Ile; Xaa в положении 323 представляет собой Glu или Asp; Xaa в положении 332 представляет собой Leu или Met; Xaa в положении 344 представляет собой Lys или Arg; Xaa в положении 347 представляет собой Ile или Leu; Xaa в положении 357 представляет собой Val или Leu; Xaa в положении 367 представляет собой Glu или Asp; Xaa в положении 393 представляет собой Tyr или Phe; Xaa в положении 404 представляет собой Ser или Ala; Xaa в положении 410 представляет собой Met или Leu; Xaa в положении 415 представляет собой Met или Leu; Xaa в положении 417 представляет собой Glu или Asp; Xaa в положении 442 представляет собой Thr или Ser; Xaa в положении 449 представляет собой Ala или Ser; Xaa в положении 454 представляет собой Leu или Met; Xaa в положении 455 представляет собой Asp или Glu; Xaa в положении 461 представляет собой Ser или Ala; Xaa в положении 465 представляет собой Val или Ile; Xaa в положении 468 представляет собой Ser или Ala; Xaa в положении 475 представляет собой Val или Ile; Xaa в положении 481 представляет собой Glu или Asp; Xaa в положении 486 представляет собой Val или Ile; Xaa в положении 490 представляет собой Phe или Tyr; Xaa в положении 496 представляет собой Glu или Asp; Xaa в положении 520 представляет собой Leu или Met; Xaa в положении 526 представляет собой Ile или Val; Xaa в положении 530 представляет собой Ile или Val; Xaa в положении 536 представляет собой Ile или Val; Xaa в положении 538 представляет собой Tyr или His; Xaa в положении 545 представляет собой Ala или Ser; Xaa в положении 550 представляет собой Tyr или Phe; Xaa в положении 559 представляет собой Ser или Ala; Xaa в положении 562 представляет собой Ile или Met; Xaa в положении 564 представляет собой Met или Val; Xaa в положении 574 представляет собой Ile или Val; Xaa в положении 585 представляет собой Arg или Lys; Xaa в положении 588 представляет собой Leu или Ile; Xaa в положении 592 представляет собой Met или Val; Xaa в положении 603 представляет собой Lys или Arg; Xaa в положении 617 представляет собой Ser или Thr; Xaa в положении 634 представляет собой Arg или Lys; Xaa в положении 643 представляет собой Ala или Ser; Xaa в положении 666 представляет собой Thr или Ser; Xaa в положении 667 представляет собой Leu или Val; Xaa в положении 685 представляет собой Arg или Lys; Xaa в положении 687 представляет собой Ile или Met; и Xaa в положении 690 представляет собой Thr или Ser.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 277, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69 или 70 аминокислотных замен, в любой комбинации, в остатках, обозначенных Xaa, в SEQ ID NO: 277 по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 4.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 277, имеющую 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или 35 аминокислотных замен, в любой комбинации, в остатках, обозначенных Xaa, в SEQ ID NO: 277 по сравнению с нативной аминокислотой в соответствующем положении SEQ ID NO: 4.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 4, где в положении 8 аминокислота представляет собой Ile, Val, Leu или Met; в положении 12 аминокислота представляет собой Met, Leu, Ile или Val; в положении 14 аминокислота представляет собой Ile, Val, Leu или Met; в положении 16 аминокислота представляет собой Val, Ile, Leu или Met; в положении 30 аминокислота представляет собой Leu, Ile, Val или Met; в положении 42 аминокислота представляет собой Glu или Asp; в положении 43 аминокислота представляет собой Ile, Val, Leu или Met; в положении 47 аминокислота представляет собой Met, Ile, Leu или Val; в положении 50 аминокислота представляет собой Lys или Arg; в положении 52 аминокислота представляет собой Gln или Asn; в положении 56 аминокислота представляет собой Thr или Ser; в положении 62 аминокислота представляет собой Gly или Ala; в положении 63 аминокислота представляет собой Thr или Ser; в положении 64 аминокислота представляет собой Ile, Leu, Val или Met; в положении 71 аминокислота представляет собой Gly, Cys или Ala; в положении 73 аминокислота представляет собой Ser или Thr; в положении 75 аминокислота представляет собой Ile, Val, Leu или Met; в положении 76 аминокислота представляет собой Ala, Ser, Gly или Thr; в положении 81 аминокислота представляет собой Ala, Ser, Gly или Thr; в положении 83 аминокислота представляет собой Ala, Ser, Gly или Thr; в положении 99 аминокислота представляет собой Val, Leu, Ile или Met; в положении 115 аминокислота представляет собой Asp или Glu; в положении 119 аминокислота представляет собой Val, Ala, Ile или Leu; в положении 122 аминокислота представляет собой Val, Ile, Leu или Met; в положении 135 аминокислота представляет собой Leu, Val, Ile или Met; в положении 139 аминокислота представляет собой Glu или Asp; в положении 144 аминокислота представляет собой Ala, Val, Gly, Ile, Leu или Met; в положении 148 аминокислота представляет собой Ser, Phe, Thr или Trp; в положении 152 аминокислота представляет собой Ile, Thr, Leu, Val, Met или Ser; в положении 155 аминокислота представляет собой Asp или Glu; в положении 158 аминокислота представляет собой Met, Val, Ile или Leu; в положении 160 аминокислота представляет собой Glu или Asp; в положении 162 аминокислота представляет собой Val, Leu, Ile или Met; в положении 164 аминокислота представляет собой Ser, Ala, Thr или Gly; в положении 166 аминокислота представляет собой Gln или Asn; в положении 171 аминокислота представляет собой Ser или Thr; в положении 173 аминокислота представляет собой Gly или Ala; в положении 176 аминокислота представляет собой Leu, Met, Ile или Val; в положении 181 аминокислота представляет собой Ile, Val, Ile или Met; в положении 185 аминокислота представляет собой Met, Ile, Leu или Val; в положении 191 аминокислота представляет собой Glu или Asp; в положении 192 аминокислота представляет собой Met, Ile, Leu или Val; в положении 197 аминокислота представляет собой Thr или Ser; в положении 201 аминокислота представляет собой Trp, Cys или Tyr; в положении 202 аминокислота представляет собой Lys, Asn или Arg; в положении 208 аминокислота представляет собой Glu или Asp; в положении 210 аминокислота представляет собой Ser или Thr; в положении 216 аминокислота представляет собой Ser, Ala, Thr или Gly; в положении 217 аминокислота представляет собой Ser, Ala, Thr или Gly; в положении 220 аминокислота представляет собой Ile, Val, Leu, Met, Ile или Val; в положении 233 аминокислота представляет собой Ser или Thr; в положении 234 аминокислота представляет собой Glu или Asp; в положении 236 аминокислота представляет собой Glu или Asp; в положении 241 аминокислота представляет собой Ala, Ser, Gly или Thr; в положении 243 аминокислота представляет собой Ala, Ser, Gly или Thr; в положении 263 аминокислота представляет собой Ser, Ala, Thr или Gly; в положении 264 аминокислота представляет собой Phe, Tyr или Trp; в положении 265 аминокислота представляет собой Ala, Ser, Gly или Thr; в положении 268 аминокислота представляет собой Ser или Thr; в положении 270 аминокислота представляет собой Ile, Leu, Val или Met; в положении 288 аминокислота представляет собой Ile, Leu, Val или Met; в положении 292 аминокислота представляет собой Leu, Val, Ile или Met; в положении 298 аминокислота представляет собой Ala, Glu, Gly или Asp; в положении 299 аминокислота представляет собой Glu, Gly, Asp или Ala; в положении 300 аминокислота представляет собой Ile, Val, Ile или Met; в положении 305 аминокислота представляет собой Asp или Glu; в положении 309 аминокислота представляет собой Lys или Arg; в положении 313 аминокислота представляет собой Ser или Thr; в положении 317 аминокислота представляет собой Ala, Ser, Gly или Thr; в положении 318 аминокислота представляет собой Leu, Ile, Val или Met; в положении 323 аминокислота представляет собой Glu или Asp; в положении 332 аминокислота представляет собой Leu, Met, Ile или Val; в положении 335 аминокислота представляет собой Glu или Asp; в положении 344 аминокислота представляет собой Lys или Arg; в положении 347 аминокислота представляет собой Ile, Leu, Val или Met; в положении 352 аминокислота представляет собой Glu или Asp; в положении 357 аминокислота представляет собой Val, Leu, Ile или Met; в положении 367 аминокислота представляет собой Glu или Asp; в положении 370 аминокислота представляет собой Ile, Val, Leu или Met; в положении 374 аминокислота представляет собой Asn, Lys, Gln или Arg; в положении 377 аминокислота представляет собой Leu, Ile, Val или Met; в положении 384 аминокислота представляет собой Thr, Ala, Ser или Gly; в положении 385 аминокислота представляет собой Ile, Ser, Leu, Val, Met или Thr; в положении 388 аминокислота представляет собой Asp или Glu; в положении 393 аминокислота представляет собой Tyr или Phe; в положении 404 аминокислота представляет собой Ser, Ala, Thr или Gly; в положении 410 аминокислота представляет собой Met или Leu; в положении 415 аминокислота представляет собой Met или Leu; в положении 417 аминокислота представляет собой Glu или Asp; в положении 419 аминокислота представляет собой Ser, Asn, Thr или Gln; в положении 442 аминокислота представляет собой Thr или Ser; в положении 449 аминокислота представляет собой Ala, Ser, Gly или Thr; в положении 454 аминокислота представляет собой Leu, Met, Ile или Val; в положении 455 аминокислота представляет собой Asp или Glu; в положении 461 аминокислота представляет собой Ser, Ala, Thr или Gly; в положении 465 аминокислота представляет собой Val, Ile, Leu или Met; в положении 468 аминокислота представляет собой Ser, Ala, Thr или Gly; в положении 475 аминокислота представляет собой Val, Ile, Leu или Met; в положении 481 аминокислота представляет собой Glu или Asp; в положении 486 аминокислота представляет собой Val, Ile, Leu или Met; в положении 490 аминокислота представляет собой Phe, Tyr или Trp; в положении 495 аминокислота представляет собой Asp или Glu; в положении 496 аминокислота представляет собой Glu или Asp; в положении 520 аминокислота представляет собой Leu, Met, Ile или Val; в положении 526 аминокислота представляет собой Ile, Val, Leu или Met; в положении 530 аминокислота представляет собой Ile, Val, Leu или Met; в положении 536 аминокислота представляет собой Ile, Val, Leu или Met; в положении 538 аминокислота представляет собой Tyr или Phe аминокислота представляет собой; в положении 545 аминокислота представляет собой Ala, Ser, Gly или Thr; в положении 550 аминокислота представляет собой Tyr или Phe; в положении 552 аминокислота представляет собой Asn, Ser, Gln или Thr; в положении 559 аминокислота представляет собой Ser, Ala, Thr или Gly; в положении 562 аминокислота представляет собой Ile или Met; в положении 564 аминокислота представляет собой Met, Val, Ile или Leu; в положении 574 аминокислота представляет собой Ile, Val, Leu или Met; в положении 585 аминокислота представляет собой Arg или Lys; в положении 588 аминокислота представляет собой Leu, Ile, Val или Met; в положении 592 аминокислота представляет собой Met, Val, Ile или Leu; в положении 602 аминокислота представляет собой Met, Ile, Leu или Val; в положении 603 аминокислота представляет собой Lys или Arg; в положении 610 аминокислота представляет собой Thr, Lys, Ser или Arg; в положении 617 аминокислота представляет собой Ser или Thr; в положении 619 аминокислота представляет собой Lys или Arg; в положении 625 аминокислота представляет собой Tyr, Phe или Trp; в положении 631 аминокислота представляет собой Ile, Val, Leu или Met; в положении 634 аминокислота представляет собой Arg или Lys; в положении 643 аминокислота представляет собой Ala, Ser, Gly или Thr; в положении 666 аминокислота представляет собой Thr или Ser; в положении 667 аминокислота представляет собой Leu, Val, Ile или Met; в положении 683 аминокислота представляет собой Thr, Ala, Ser или Gly; в положении 685 аминокислота представляет собой Arg или Lys; в положении 687 аминокислота представляет собой Ile или Met; в положении 690 аминокислота представляет собой Thr или Ser; и в положении 696 аминокислота представляет собой Glu или Asp.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 4, где 1-70 аминокислотных положений SEQ ID NO: 4 замещены аминокислотой в соответствующем положении SEQ ID NO: 20, как показано на выравнивании аминокислотных последовательностей SEQ ID NO: 4 и SEQ ID NO: 20 на фигуре 4.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 4, где 1-35 аминокислотных положений SEQ ID NO: 4 замещены аминокислотой в соответствующем положении SEQ ID NO: 20, как показано на выравнивании аминокислотных последовательностей SEQ ID NO: 4 и SEQ ID NO: 20 на фигуре 4.
В некоторых вариантах осуществления иллюстративные полипептиды AfIP-1B кодируются полинуклеотидной последовательностью, изложенной в SEQ ID NO: 3, SEQ ID NO: 29, SEQ ID NO: 33 или SEQ ID NO: 37, SEQ ID NO: 75, SEQ ID NO: 77, SEQ ID NO: 79, SEQ ID NO: 81, SEQ ID NO: 83, SEQ ID NO: 85, SEQ ID NO: 87, SEQ ID NO: 89, SEQ ID NO: 91, SEQ ID NO: 391, SEQ ID NO: 392, SEQ ID NO: 393, SEQ ID NO: 394, SEQ ID NO: 395, SEQ ID NO: 396, SEQ ID NO: 397, SEQ ID NO: 398, SEQ ID NO: 399, SEQ ID NO: 401, SEQ ID NO: 402, SEQ ID NO: 403, SEQ ID NO: 404, SEQ ID NO: 405, SEQ ID NO: 406, SEQ ID NO: 407, SEQ ID NO: 408, SEQ ID NO: 409, SEQ ID NO: 410, SEQ ID NO: 411, SEQ ID NO: 412, SEQ ID NO: 413, SEQ ID NO: 414, SEQ ID NO: 415, SEQ ID NO: 416, SEQ ID NO: 417, SEQ ID NO: 418, SEQ ID NO: 419, SEQ ID NO: 420, SEQ ID NO: 421, SEQ ID NO: 422, SEQ ID NO: 423, SEQ ID NO: 424, SEQ ID NO: 425, SEQ ID NO: 426, SEQ ID NO: 427, SEQ ID NO: 428, SEQ ID NO: 429, SEQ ID NO: 430, SEQ ID NO: 431, SEQ ID NO: 432, SEQ ID NO: 433, SEQ ID NO: 434, SEQ ID NO: 435, SEQ ID NO: 436, SEQ ID NO: 437, SEQ ID NO: 438, SEQ ID NO: 439, SEQ ID NO: 440, SEQ ID NO: 441, SEQ ID NO: 442, SEQ ID NO: 443, SEQ ID NO: 444, SEQ ID NO: 445, SEQ ID NO: 446, SEQ ID NO: 447, SEQ ID NO: 448, SEQ ID NO: 449, SEQ ID NO: 450, SEQ ID NO: 451, SEQ ID NO: 452, SEQ ID NO: 453, SEQ ID NO: 454, SEQ ID NO: 455, SEQ ID NO: 456, SEQ ID NO: 457, SEQ ID NO: 458, SEQ ID NO: 709, SEQ ID NO: 710, SEQ ID NO: 71, SEQ ID NO: 712, SEQ ID NO: 713, SEQ ID NO: 714, SEQ ID NO: 715, SEQ ID NO: 716, SEQ ID NO: 717, SEQ ID NO: 718, SEQ ID NO: 719, SEQ ID NO: 720, SEQ ID NO: 721, SEQ ID NO: 722, SEQ ID NO: 723, SEQ ID NO: 724, SEQ ID NO: 725, SEQ ID NO: 726, SEQ ID NO: 727, SEQ ID NO: 728, SEQ ID NO: 729, SEQ ID NO: 730, SEQ ID NO:779, SEQ ID NO: 783, SEQ ID NO: 785 и SEQ ID NO:790.
В некоторых вариантах осуществления полипептид AfIP-1B кодируется полинуклеотидной последовательностью с SEQ ID NO: 3, SEQ ID NO: 392, SEQ ID NO: 433, SEQ ID NO: 446 или SEQ ID NO: 790.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 4, SEQ ID NO: 324, SEQ ID NO: 365 или SEQ ID NO: 446.
В некоторых вариантах осуществления полипептид AfIP-1B включает варианты, где аминокислота, которая является частью сайта протеолитического расщепления, заменена на другую аминокислоту для устранения или изменения протеолитического расщепления по этому сайту. В некоторых вариантах осуществления протеолитическое расщепление происходит под действием протеазы в кишечнике насекомого. В других вариантах осуществления протеолитическое расщепление происходит под действием растительной протеазы в трансгенном растении.
В некоторых вариантах осуществления иллюстративные полипептиды AfIP-1B представляют собой полипептиды, показанные в таблице 22, таблице 24, таблице 33 и/или таблице 39, и любые комбинации их аминокислотных замен, а также делеций и/или вставок, и их фрагменты.
В некоторых вариантах осуществления полипептид AfIP-1B не имеет аминокислотную последовательность с SEQ ID NO: 20.
В некоторых вариантах осуществления полипептид AfIP-1B имеет расчетный молекулярный вес от приблизительно 65 кДа до приблизительно 85 кДа, от приблизительно 67,5 кДа до приблизительно 82,5 кДа, от приблизительно 72,5 кДа до приблизительно 80 кДа, от приблизительно 75 кДа до приблизительно 77,5 кДа или от приблизительно 75,5 кДа до приблизительно 76,5 кДа.
В некоторых вариантах осуществления полипептид AfIP-1B обладает модифицированными физическими свойствами. Применяемый в данном документе термин “физическое свойство” относится к какому-либо параметру, который подходит для описания физико-химических характеристик белка. Применяемое в данном документе выражение “физическое свойство, представляющее интерес” и “свойство, представляющее интерес” применяются взаимозаменяемо для обозначения физических свойств белков, которые исследуются и/или модифицируются. Примеры физических свойств включают без ограничения суммарный поверхностный заряд и распределение зарядов на поверхности белка, суммарную гидрофобность и распределение гидрофобных остатков на поверхности белка, плотность поверхностного заряда, плотность гидрофобности поверхности, общее число поверхностных ионизируемых групп, поверхностное натяжение, размер белка и его распределение в растворе, температуру плавления, теплоемкость и второй вириальный коэффициент. Примеры физических свойств также включают без ограничения растворимость, фолдинг, стабильность и усвояемость. В некоторых вариантах осуществления полипептид AfIP-1B обладает повышенной усвояемостью протеолитических фрагментов в кишечнике насекомого. Модели для переваривания при помощи искусственного желудочного сока известны специалисту в данной области техники (Fuchs, R.L. and J.D. Astwood. Food Technology 50: 83-88, 1996; Astwood, J.D., et al Nature Biotechnology 14: 1269-1273, 1996; Fu TJ et al. J. Agric Food Chem. 50: 7154-7160, 2002).
В некоторых вариантах осуществления полипептид AfIP-1B кодируется молекулой нуклеиновой кислоты, которая гибридизируется при жестких условиях с молекулой нуклеиновой кислоты с SEQ ID NO: 4, SEQ ID NO: 29, SEQ ID NO: 33, SEQ ID NO: 35, SEQ ID NO: 779, SEQ ID NO:783, SEQ ID NO:787 или SEQ ID NO: 790.
В некоторых вариантах осуществления варианты включают полипептиды, которые отличаются по аминокислотной последовательности вследствие мутагенеза. Вариантные белки, охваченные настоящим раскрытием, являются биологически активными, то есть они продолжают обладать требуемой биологической активностью (т.е. пестицидной активностью) нативного белка. В некоторых вариантах осуществления вариант будет обладать по меньшей мере приблизительно 10%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80% или более инсектицидной активности нативного белка. В некоторых вариантах осуществления варианты могут обладать усиленной активностью по сравнению с нативным белком.
Бактериальные гены довольно часто имеют несколько метиониновых инициаторных кодонов поблизости от стартового сайта открытой рамки считывания. Зачастую, инициация трансляции в одном или нескольких из этих старт-кодонов будет приводить к образованию функционального белка. Эти старт-кодоны могут включать кодоны ATG. Однако бактерии, такие как Bacillus sp., также распознают кодон GTG в качестве старт-кодона, и белки, трансляция которых инициируется по кодонам GTG, в качестве первой аминокислоты содержат метионин. В редких случаях, трансляция в бактериальных системах может инициироваться по кодону TTG, хотя в этом случае TTG кодирует метионин. Кроме того, зачастую a priori не определяют, какой из этих кодонов естественным образом используется в бактерии. Таким образом, понятно, что применение одного из переменных метиониновых кодонов может также приводить к образованию пестицидных белков. Эти пестицидные белки охватываются настоящим раскрытием и могут применяться в способах согласно настоящему раскрытию. Будет понятно, что при экспрессии в растениях будет необходимо изменить переменный старт-кодон на ATG для полноценной трансляции.
В другом аспекте полипептид AfIP-1A и/или AfIP-1B может экспрессироваться в виде белка-предшественника с вставочной последовательностью, которая катализирует многостадийный, посттрансляционный сплайсинг белка. Сплайсинг белка включает вырезание вставочных последовательностей из полипептида с одновременным соединением фланкирующих последовательностей с получением нового полипептида (Chong, et al., (1996) J. Biol. Chem., 271:22159-22168). Эта вставочная последовательность или элемент сплайсинга белка, они называются интеинами, которые катализируют свое собственное вырезание посредством трех согласованных реакций на N-концевой и C-концевой границах сплайсинга: ацильную перестройку N-концевого цистеина или серина; реакцию переэтерификации между двумя концами с образованием разветвленного сложноэфирного или тиоэфирного промежуточного соединения и расщепление пептидной связи, сопряженное с образованием кольца C-концевым аспарагином интеина с высвобождением интеина (Evans, et al., (2000) J. Biol. Chem., 275:9091-9094. Выяснение механизма сплайсинга белка привело к ряду применений, связанных с интеинами (Comb и соавт., патент США № 5496714; Comb и соавт., патент США № 5834247; Camarero and Muir, (1999) J. Amer. Chem. Soc. 121:5597-5598; Chong, et al., (1997) Gene 192:271-281, Chong, et al., (1998) Nucleic Acids Res. 26:5109-5115; Chong, et al., (1998) J. Biol. Chem. 273:10567-10577; Cotton, et al., (1999) J. Am. Chem. Soc. 121:1100-1101; Evans, et al., (1999) J. Biol. Chem. 274:18359-18363; Evans, et al., (1999) J. Biol. Chem. 274:3923-3926; Evans, et al., (1998) Protein Sci. 7:2256-2264; Evans, et al., (2000) J. Biol. Chem. 275:9091-9094; Iwai and Pluckthun, (1999) FEBS Lett. 459:166-172; Mathys, et al., (1999) Gene 231:1-13; Mills, et al., (1998) Proc. Natl. Acad. Sci. USA 95:3543-3548; Muir, et al., (1998) Proc. Natl. Acad. Sci. USA 95:6705-6710; Otomo, et al., (1999) Biochemistry 38:16040-16044; Otomo, et al., (1999) J. Biolmol. NMR 14:105-114; Scott, et al., (1999) Proc. Natl. Acad. Sci. USA 96:13638-13643; Severinov and Muir, (1998) J. Biol. Chem. 273:16205-16209; Shingledecker, et al., (1998) Gene 207:187-195; Southworth, et al., (1998) EMBO J. 17:918-926; Southworth, et al., (1999) Biotechniques 27:110-120; Wood, et al., (1999) Nat. Biotechnol. 17:889-892; Wu, et al., (1998a) Proc. Natl. Acad. Sci. USA 95:9226-9231; Wu, et al., (1998b) Biochim Biophys Acta 1387:422-432; Xu, et al., (1999) Proc. Natl. Acad. Sci. USA 96:388-393; Yamazaki, et al., (1998) J. Am. Chem. Soc., 120:5591-5592). Относительно применения интеинов в растительных трансгенах, см. Yang, et al., (Transgene Res 15:583-593 (2006)) и Evans, et al., (Annu. Rev. Plant Biol. 56:375-392 (2005)).
В другом аспекте полипептид AfIP-1A и/или AfIP-1B может кодироваться двумя отдельными генами, при этом интеин белка-предшественника берет начало из двух генов, он называется сплит-интеин, и две части предшественника соединяются при образовании пептидной связи. Это образование пептидной связи осуществляется при помощи транс-сплайсинга, опосредованного интеином. Для этой цели, первая и вторая кассета экспрессии, содержащие два отдельных гена, дополнительно кодируют интеины, способные опосредовать транс-сплайсинг белков. При помощи транс-сплайсинга белки и полипептиды, кодируемые первым и вторым фрагментами, могут быть связаны посредством образования пептидной связи. Интеины транс-сплайсинга можно выбирать из ядерного генома или генома органелл различных организмов, в том числе эукариот, архебактерий и эубактерий. Интеины, которые могут применяться, перечислены на сайте neb.com/neb/inteins.html, доступ к которому можно получить во всемирной сети Интернет с применением префикса "www"). Нуклеотидную последовательность, кодирующую интеин, можно разделять на 5'- и 3'-часть, которые кодируют 5'- и 3'-часть интеина, соответственно. Части последовательности, которые не являются необходимыми для интеин-сплайсинга (например, домен хоминг-эндонуклеазы), могут быть удалены. Интеин-кодирующая последовательность расщепляется, так что 5'- и 3'-части способны к транс-сплайсингу. Для выбора подходящего сайта расщепления интеин-кодирующей последовательность можно следовать соображениям, опубликованным у Southworth, et al., (1998) EMBO J. 17:918-926. При конструировании первой и второй кассеты экспрессии 5' интеин-кодирующую последовательность соединяют с 3'-концом первого фрагмента, кодирующего N-концевую часть полипептида AfIP-1A или AfIP-1B, а 3' интеин-кодирующую последовательность соединяют с 5'-концом второго фрагмента, кодирующего C-концевую часть полипептида AfIP-1A или AfIP-1B.
В целом, партнеров для транс-сплайсинга можно разрабатывать с применением любого сплит-интеина, в том числе каких-либо встречающихся в природе или искусственно расщепленных сплит-интеинов. Известны несколько встречающихся в природе сплит-интеинов, например: сплит-интеин гена DnaE PCC6803 Synechocystis sp. (см., Wu, et al., (1998) Proc Natl Acad Sci USA. 95(16):9226-31 и Evans, et al., (2000) J Biol Chem. 275(13):9091-4 и гена DnaE из Nostoc punctiforme (см., Iwai, et al., (2006) FEBS Lett. 580(7):1853-8). Интеины, не относящиеся к сплит-интеинам, были искусственно расщеплены в лаборатории с созданием новых сплит-интеинов, например: искусственно расщепленный интеин Ssp DnaB (см. Wu, et al., (1998) Biochim Biophys Acta. 1387:422-32), и расщепленный интеин Sce VMA (см., Brenzel, et al., (2006) Biochemistry. 45(6):1571-8), и искусственно расщепленный грибной мини-интеин (см., Elleuche, et al., (2007) Biochem Biophys Res Commun. 355(3):830-4). Также доступны базы данных по интеинам, в которых перечислены известные интеины (см., например, базу данных, доступную в режиме реального времени на сайте: bioinformatics.weizmann.ac.il/˜pietro/inteins/Inteinstable.html, доступ к которому можно получить во всемирной сети Интернет с применением префикса "www").
Встречающиеся в природе интеины, не относящиеся к сплит-интеинам, могут обладать эндонуклеазной или другой ферментативной активностью, которую, как правило, можно удалять при разработке искусственно расщепленного сплит-интеина. Такие мини-интеины или минимизированные сплит-интеины хорошо известны из уровня техники и, как правило, они состоят из менее 200 аминокислотных остатков (см. Wu, et al., (1998) Biochim Biophys Acta. 1387:422-32). Подходящие сплит-интеины могут иметь другие полипептидные элементы, обеспечивающие очистку, добавляемые к их структуре, при условии, что такие элементы не ингибируют сплайсинг сплит-интеина, или их добавляют таким способом, позволяющим им быть удаленными перед сплайсингом. Сообщалось о сплайсинге белка с применением белков, которые включают бактериальные интеин-подобные (BIL) домены (см., Amitai, et al., (2003) Mol Microbiol. 47:61-73) и самопроцессирующиеся домены hedgehog (Hog) (последние при объединении с интеинами называют суперсемейство Hog/интеин или семейство HINT (см. Dassa, et al., (2004) J Biol Chem. 279:32001-7), и такие домены, которые можно также применять для получения искусственно расщепленных интеинов. В частности, не подвергающиеся сплайсингу представители таких семейств можно модифицировать при помощи методик молекулярной биологии для введения или восстановления активности сплайсинга в таких родственных разновидностях. Последние исследования показывают, что сплайсинг можно наблюдать, когда обеспечивают реакцию N-концевого компонента сплит-интеина с C-концевым компонентом сплит-интеина, при этом в естественных условиях он не является его “партнером”; например, сплайсинг наблюдали при использовании партнеров, которые всего на 30-50% гомологичны “естественному” сплайсинг-партнеру (см. Dassa, et al., (2007) Biochemistry. 46(1):322-30). Было показано, что другие такие смеси несовместимых партнеров сплит-интеинов не реагируют друг с другом (см. Brenzel, et al., (2006) Biochemistry. 45(6):1571-8). Однако в пределах компетенции специалиста в соответствующей области техники определить, может ли конкретная пара полипептидов связываться друг с другом с обеспечением функционального интеина, с применением стандартных способов и без использования изобретательских навыков.
В другом аспекте полипептид AfIP-1A и/или AfIP-1B представляет собой вариант с круговыми перестановками. В определенных вариантах осуществления полипептид AfIP-1A представляет собой вариант с круговыми перестановками полипептида с SEQ ID NO: 2, SEQ ID NO: 6, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782, SEQ ID NO: 784, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 94, SEQ ID NO: 96, SEQ ID NO: 98, SEQ ID NO: 100, SEQ ID NO: 152, SEQ ID NO: 301, SEQ ID NO: 302, SEQ ID NO: 303, SEQ ID NO: 304, SEQ ID NO: 305, SEQ ID NO: 306, SEQ ID NO: 307, SEQ ID NO: 308, SEQ ID NO: 309, SEQ ID NO: 310, SEQ ID NO: 311, SEQ ID NO: 502, SEQ ID NO: 503, SEQ ID NO: 504, SEQ ID NO: 505, SEQ ID NO: 506, SEQ ID NO: 507, SEQ ID NO: 508, SEQ ID NO: 509, SEQ ID NO: 510, SEQ ID NO: 511, SEQ ID NO: 512, SEQ ID NO: 513, SEQ ID NO: 514, SEQ ID NO: 515, SEQ ID NO: 516, SEQ ID NO: 517, SEQ ID NO: 518, SEQ ID NO: 519, SEQ ID NO: 520, SEQ ID NO: 521, SEQ ID NO: 522, SEQ ID NO: 523, SEQ ID NO: 524, SEQ ID NO: 525, SEQ ID NO: 526, SEQ ID NO: 527, SEQ ID NO: 528, SEQ ID NO: 529, SEQ ID NO: 530, SEQ ID NO: 531, SEQ ID NO: 532, SEQ ID NO: 533, SEQ ID NO: 534, SEQ ID NO: 535, SEQ ID NO: 536, SEQ ID NO: 537, SEQ ID NO: 538, SEQ ID NO: 539, SEQ ID NO: 540, SEQ ID NO: 541, SEQ ID NO: 542, SEQ ID NO: 543, SEQ ID NO: 544, SEQ ID NO: 545, SEQ ID NO: 590, SEQ ID NO: 591, SEQ ID NO: 592, SEQ ID NO: 593, SEQ ID NO: 594, SEQ ID NO: 595, SEQ ID NO: 596, SEQ ID NO: 597, SEQ ID NO: 598, SEQ ID NO: 599, SEQ ID NO: 600, SEQ ID NO: 601, SEQ ID NO: 602, SEQ ID NO: 603, SEQ ID NO: 604, SEQ ID NO: 605, SEQ ID NO: 606, SEQ ID NO: 607, SEQ ID NO: 608, SEQ ID NO: 609, SEQ ID NO: 610, SEQ ID NO: 611, SEQ ID NO: 612, SEQ ID NO: 613, SEQ ID NO: 614, SEQ ID NO: 615, SEQ ID NO: 616, SEQ ID NO: 617, SEQ ID NO: 618, SEQ ID NO: 648, SEQ ID NO: 649, SEQ ID NO: 650, SEQ ID NO: 651, SEQ ID NO: 652, SEQ ID NO: 653, SEQ ID NO: 654, SEQ ID NO: 655, SEQ ID NO: 656, SEQ ID NO: 657, SEQ ID NO: 658, SEQ ID NO: 659, SEQ ID NO: 660, SEQ ID NO: 661, SEQ ID NO: 662, SEQ ID NO: 663, SEQ ID NO: 664, SEQ ID NO: 778, SEQ ID NO: 782 и SEQ ID NO: 786.
В определенных вариантах осуществления полипептид AfIP-1B представляет собой вариант с круговыми перестановками полипептида с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788, SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 88, SEQ ID NO: 90, SEQ ID NO: 92, SEQ ID NO: 323, SEQ ID NO: 324, SEQ ID NO: 325, SEQ ID NO: 326, SEQ ID NO: 327, SEQ ID NO: 328, SEQ ID NO: 329, SEQ ID NO: 330, SEQ ID NO: 331, SEQ ID NO: 332, SEQ ID NO: 333, SEQ ID NO: 334, SEQ ID NO: 335, SEQ ID NO: 336, SEQ ID NO: 337, SEQ ID NO: 338, SEQ ID NO: 339, SEQ ID NO: 340, SEQ ID NO: 341, SEQ ID NO: 342, SEQ ID NO: 343, SEQ ID NO: 344, SEQ ID NO: 345, SEQ ID NO: 346, SEQ ID NO: 347, SEQ ID NO: 348, SEQ ID NO: 349, SEQ ID NO: 350, SEQ ID NO: 351, SEQ ID NO: 352, SEQ ID NO: 353, SEQ ID NO: 354, SEQ ID NO: 355, SEQ ID NO: 356, SEQ ID NO: 357, SEQ ID NO: 358, SEQ ID NO: 359, SEQ ID NO: 360, SEQ ID NO: 361, SEQ ID NO: 362, SEQ ID NO: 363, SEQ ID NO: 364, SEQ ID NO: 365, SEQ ID NO: 366, SEQ ID NO: 367, SEQ ID NO: 368, SEQ ID NO: 369, SEQ ID NO: 370, SEQ ID NO: 371, SEQ ID NO: 372, SEQ ID NO: 373, SEQ ID NO: 374, SEQ ID NO: 375, SEQ ID NO: 376, SEQ ID NO: 377, SEQ ID NO: 378, SEQ ID NO: 379, SEQ ID NO: 380, SEQ ID NO: 381, SEQ ID NO: 382, SEQ ID NO: 383, SEQ ID NO: 384, SEQ ID NO: 385, SEQ ID NO: 386, SEQ ID NO: 387, SEQ ID NO: 388, SEQ ID NO: 389, SEQ ID NO: 390, SEQ ID NO: 687, SEQ ID NO: 688, SEQ ID NO: 689, SEQ ID NO: 690, SEQ ID NO: 691, SEQ ID NO: 692, SEQ ID NO: 693, SEQ ID NO: 694, SEQ ID NO: 695, SEQ ID NO: 696, SEQ ID NO: 697, SEQ ID NO: 698, SEQ ID NO: 699, SEQ ID NO:700, SEQ ID NO: 701, SEQ ID NO: 702, SEQ ID NO: 703, SEQ ID NO: 704, SEQ ID NO: 705, SEQ ID NO: 706, SEQ ID NO: 707 и SEQ ID NO: 708.
Разработка способов с применением рекомбинантной ДНК обеспечивала возможность исследовать эффекты транспозиции последовательностей на фолдинг, структуру и функцию белка. Подход, применяемый при создании новых последовательностей, напоминает то, что происходит у встречающихся в природе пар белков, которые связываются посредством линейной реорганизации их аминокислотных последовательностей (Cunningham, et al., (1979) Proc. Natl. Acad. Sci. U.S.A. 76:3218-3222; Teather and Erfle, (1990) J. Bacteriol. 172:3837-3841; Schimming, et al., (1992) Eur. J. Biochem. 204:13-19; Yamiuchi and Minamikawa, (1991) FEBS Lett. 260:127-130; MacGregor, et al., (1996) FEBS Lett. 378:263-266). Первое in vitro применение данного типа перестановки у белков описали Goldenberg and Creighton (J. Mol. Biol. 165:407-413, 1983). При создании варианта с круговыми перестановками новый N-конец выбирают во внутреннем сайте (точечный разрыв) оригинальной последовательности, при этом новая последовательность имеет такой же порядок аминокислот как и оригинальная от точечного разрыва до тех пор, пока она не достигает аминокислоты, которая находится в оригинальном C-конце или вблизи него. В этой точке новая последовательность соединяется, либо напрямую, либо через дополнительную часть последовательности (линкер), с аминокислотой, которая находится на оригинальном N-конце или вблизи него, и новая последовательность продолжается с такой же последовательностью, что и оригинальная до тех пор, пока она не достигнет точки, которая находится в аминокислоте, которая была N-концевой по отношению к сайту точечного разрыва, или вблизи него, причем этот остаток образует новый C-конец цепи. Длину аминокислотной последовательности линкера можно выбирать эмпирически, или исходя из информации о структуре, или путем применения комбинации двух этих подходов. Если информация о структуре является недоступной, можно получить небольшие серии линкеров для тестирования с применением разработки, длина которой варьирует для охвата диапазона от 0 до 50 Å и последовательность которой выбрана таким образом, чтобы соответствовать доступности поверхностных групп (гидрофильность, Hopp and Woods, (1983) Mol. Immunol. 20:483-489; Kyte and Doolittle, (1982) J. Mol. Biol. 157:105-132; площади поверхности, доступной воздействию растворителя, Lee and Richards, (1971) J. Mol. Biol. 55:379-400) и способности принимать необходимую конформацию без нарушения конфигурации пестицидного полипептида (конформационно подвижный; Karplus and Schulz, (1985) Naturwissenschaften 72:212-213). При условии, что при трансляции средняя длина остатка составляет 2,0-3,8 Å, это будет означать, что длина, подлежащая тестированию, будет составлять от 0 до 30 остатков, при этом предпочтительным диапазоном является 0-15 остатков. Примером такой эмпирической серии будет конструирование линкеров с применением кассетной последовательность, такой как Gly-Gly-Gly-Ser, повторяемой n раз, где n составляет 1, 2, 3 или 4. Специалисты в данной области техники будут понимать, что существует множество таких последовательностей, варьирующих в длину или по составу, которые могут служить в качестве линкеров с таким первичным соображением, что они не являются ни чрезмерно длинными, ни чрезмерно короткими (см. также Sandhu, (1992) Critical Rev. Biotech. 12:437-462); причем если они являются слишком длинными, энтропийные эффекты, вероятно, будут дестабилизировать трехмерную укладку и также могут делать фолдинг кинетически невыполнимым, а если они являются слишком короткими, они, вероятно, будут дестабилизировать молекулу вследствие скручивающей или стерической деформации. Специалисты, разбирающиеся в анализе информации о структуре белка, будут понимать, что расстояние между концами цепей, определяемое как расстояние между c-альфа атомами углерода, можно применять для определения длины применяемой последовательности или по меньшей мере для ограничения числа возможностей, которые требуется протестировать при эмпирическом отборе линкеров. Они также будут понимать, что иногда бывает так, что положения концов полипептидной цепи являются нечеткими в структурных моделях, полученных с помощью данных рентгеноструктурного анализа или ядерной магнитно-резонансной спектроскопии, и если складывается такая ситуация, следовательно, ее необходимо принимать во внимание для правильной оценки длины требуемого линкера. На основании остатков, положение которых четко определено, выбирают два остатка, которые близки по последовательности к концам цепи, и расстояние между их c-альфа атомами углерода используют для расчета приблизительной длины для линкера между ними. С использованием расчетной длины в качестве предварительных данных, далее отбирают линкеры в пределах диапазона количества остатков (из расчета длины остатка 2-3,8 Å). Эти линкеры можно составлять из оригинальной последовательности, укороченной или удлиненной, в случае необходимости, и, в случае удлинения, можно выбирать дополнительные остатки, которые являются гибкими и гидрофильными, как описано выше; или, необязательно, оригинальная последовательность может замещаться с применением серии линкеров, причем одним примером является подход с использованием кассеты Gly-Gly-Gly-Ser, упомянутой выше; или, необязательно, можно применять комбинацию оригинальной последовательности и новой последовательности, имеющей подходящую общую длину. Последовательности пестицидных полипептидов, способных к фолдингу с образованием биологически активных состояний, можно получать путем соответствующего отбора начальных (амино-конец) и концевых (карбоксильный конец) положений внутри оригинальной полипептидной цепи, при этом с применением линкерной последовательности, как описано выше. Амино- и карбоксильные концы выбирают из общего участка последовательности, называемого участок точечного разрыва, с применением рекомендаций, описанных ниже. Новую аминокислотную последовательность, таким образом, получают путем отбора амино- и карбоксильных концов из одного участка точечного разрыва. Во многих случаях выбор новых концов будет таким, что оригинальное положение карбоксильного конца непосредственно предшествует положению амино-конца. Однако специалисты в данной области техники поймут, что выбор концов в каком-либо месте в пределах участка может оказывать действие, и что он, фактически, будет приводить либо к удалению, либо к добавлению к амино- или карбоксильным частям новой последовательности. Основным положением молекулярной биологии является то, что первичная аминокислотная последовательность белка обуславливает фолдинг в трехмерную структуру, необходимую для проявления его биологической функции. Специалистам в данной области техники известны способы для получения и интерпретации информации о трехмерной структуре с применением рентгеноструктурного анализа одиночных кристаллов белка или ядерной магнитно-резонансной спектроскопии растворов белка. Примеры информации о структуре, которая подходит для идентификации участков точечного разрыва, включают расположение и тип вторичной структуры белка (альфа и 3-10 спирали, параллельные и антипараллельные бета-слои, обращения или повороты цепи и петли; Kabsch and Sander, (1983) Biopolymers 22:2577-2637; степень доступности для растворителя аминокислотных остатков, масштаб и тип взаимодействий остатков друг с другом (Chothia, (1984) Ann. Rev. Biochem. 53:537-572) и статическое и динамическое распределение конформаций на протяжении полипептидной цепи (Alber and Mathews, (1987) Methods Enzymol. 154:511-533). В некоторых случаях известна дополнительная информация о доступности для растворителя остатков; причем одним примером является сайт посттрансляционного прикрепления углеводов, который обязательно находится на поверхности белка. Если экспериментальная информация о структуре не доступна или ее невозможно получить, также доступны способы для анализа первичной аминокислотной последовательности с тем, чтобы делать прогнозы о третичной и вторичной структуре белка, доступности растворителя и наличия поворотов и петель. Для эмпирического определения доступности поверхностных групп также иногда применимы биохимические способы, если прямые способы определения структуры невозможны; например, применение идентификации сайтов деполимеризации после ограниченного протеолиза для того, чтобы делать заключение о доступности поверхностных групп (Gentile and Salvatore, (1993) Eur. J. Biochem. 218:603-621). Таким образом, путем применения либо информации о структуре, полученной экспериментальным путем, либо прогностических способов (например, Srinivisan and Rose, (1995) Proteins: Struct., Funct. & Genetics 22:81-99) проводят исследование исходной аминокислотной последовательности для классификации участков в отношении того, важны ли они для поддержания вторичной и третичной структуры. Нахождения последовательностей в участках, которые, как известно, участвуют в периодической вторичной структуре (альфа и 3-10 спирали, параллельные и антипараллельные бета-слои) следует избегать. Аналогично, участки аминокислотной последовательности, которые, как наблюдается или прогнозируется, обладают низкой степенью доступности для действия растворителя, наиболее вероятно, являются частью так называемого гидрофобного ядра белка, и их следует также избегать при выборе амино- или карбоксильных концов. В отличие от этого, участки, которые, как известно или прогнозируется, находятся в поверхностных поворотах или петлях, и, в частности, участки, о которых известно, что они не требуются для биологической активности, являются предпочтительными сайтами для расположения противоположных концов полипептидной цепи. Предпочтительные непрерывные участки аминокислотной последовательности, основанные на вышеприведенных критериях, называют участком точечного разрыва. Полинуклеотиды, кодирующие полипепиды AfIP-1A или AfIP-1B с круговыми перестановками с новым N-концом/C-концом, которые содержат линкерный участок, отделяющий оригинальный C-конец и N-конец, фактически, можно получать по способу, описанному в Mullins, et al., (1994) J. Am. Chem. Soc. 116:5529-5533. Несколько стадий амплификации посредством полимеразной цепной реакции (ПЦР) применяют для перестройки последовательности ДНК, кодирующей первичную аминокислотную последовательность белка. Полинуклеотиды, кодирующие полипепиды AfIP-1A или AfIP-1B с круговыми перестановками с новым N-концом/C-концом, которые содержат линкерный участок, отделяющий оригинальный C-конец и N-конец, можно получать на основании способа тандемных повторов, описанного в Mullins, et al., (1992) J. Am. Chem. Амплификацию посредством полимеразной цепной реакции (ПЦР) новых генов N-конца/C-конца проводят с применением ДНК-шаблона с тандемными повторами.
В другом аспекте предусмотрены белки слияния, в аминокислотную последовательность которых включена аминокислотная последовательность, содержащая полипептид AfIP-1A, в том числе без ограничения полипептид с SEQ ID NO: 2, SEQ ID NO: 6, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 94, SEQ ID NO: 96, SEQ ID NO: 98, SEQ ID NO: 100, SEQ ID NO: 152, SEQ ID NO: 301, SEQ ID NO: 302, SEQ ID NO: 303, SEQ ID NO: 304, SEQ ID NO: 305, SEQ ID NO: 306, SEQ ID NO: 307, SEQ ID NO: 308, SEQ ID NO: 309, SEQ ID NO: 310, SEQ ID NO: 311, SEQ ID NO: 502, SEQ ID NO: 503, SEQ ID NO: 504, SEQ ID NO: 505, SEQ ID NO: 506, SEQ ID NO: 507, SEQ ID NO: 508, SEQ ID NO: 509, SEQ ID NO: 510, SEQ ID NO: 511, SEQ ID NO: 512, SEQ ID NO: 513, SEQ ID NO: 514, SEQ ID NO: 515, SEQ ID NO: 516, SEQ ID NO: 517, SEQ ID NO: 518, SEQ ID NO: 519, SEQ ID NO: 520, SEQ ID NO: 521, SEQ ID NO: 522, SEQ ID NO: 523, SEQ ID NO: 524, SEQ ID NO: 525, SEQ ID NO: 526, SEQ ID NO: 527, SEQ ID NO: 528, SEQ ID NO: 529, SEQ ID NO: 530, SEQ ID NO: 531, SEQ ID NO: 532, SEQ ID NO: 533, SEQ ID NO: 534, SEQ ID NO: 535, SEQ ID NO: 536, SEQ ID NO: 537, SEQ ID NO: 538, SEQ ID NO: 539, SEQ ID NO: 540, SEQ ID NO: 541, SEQ ID NO: 542, SEQ ID NO: 543, SEQ ID NO: 544, SEQ ID NO: 545, SEQ ID NO: 590, SEQ ID NO: 591, SEQ ID NO: 592, SEQ ID NO: 593, SEQ ID NO: 594, SEQ ID NO: 595, SEQ ID NO: 596, SEQ ID NO: 597, SEQ ID NO: 598, SEQ ID NO: 599, SEQ ID NO: 600, SEQ ID NO: 601, SEQ ID NO: 602, SEQ ID NO: 603, SEQ ID NO: 604, SEQ ID NO: 605, SEQ ID NO: 606, SEQ ID NO: 607, SEQ ID NO: 608, SEQ ID NO: 609, SEQ ID NO: 610, SEQ ID NO: 611, SEQ ID NO: 612, SEQ ID NO: 613, SEQ ID NO: 614, SEQ ID NO: 615, SEQ ID NO: 616, SEQ ID NO: 617, SEQ ID NO: 618, SEQ ID NO: 648, SEQ ID NO: 649, SEQ ID NO: 650, SEQ ID NO: 651, SEQ ID NO: 652, SEQ ID NO: 653, SEQ ID NO: 654, SEQ ID NO: 655, SEQ ID NO: 656, SEQ ID NO: 657, SEQ ID NO: 658, SEQ ID NO: 659, SEQ ID NO: 660, SEQ ID NO: 661, SEQ ID NO: 662, SEQ ID NO: 663, SEQ ID NO: 664, SEQ ID NO: 778, SEQ ID NO: 782, SEQ ID NO: 784 и его активные фрагменты.
В другом аспекте предусмотрены белки слияния, в аминокислотную последовательность которых включена аминокислотная последовательность, содержащая полипептид AfIP-1B, в том числе без ограничения полипептид с SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784 или SEQ ID NO:788, SEQ ID NO: 76, SEQ ID NO: 78, SEQ ID NO: 80, SEQ ID NO: 82, SEQ ID NO: 84, SEQ ID NO: 86, SEQ ID NO: 88, SEQ ID NO: 90, SEQ ID NO: 92, SEQ ID NO: 323, SEQ ID NO: 324, SEQ ID NO: 325, SEQ ID NO: 326, SEQ ID NO: 327, SEQ ID NO: 328, SEQ ID NO: 329, SEQ ID NO: 330, SEQ ID NO: 331, SEQ ID NO: 332, SEQ ID NO: 333, SEQ ID NO: 334, SEQ ID NO: 335, SEQ ID NO: 336, SEQ ID NO: 337, SEQ ID NO: 338, SEQ ID NO: 339, SEQ ID NO: 340, SEQ ID NO: 341, SEQ ID NO: 342, SEQ ID NO: 343, SEQ ID NO: 344, SEQ ID NO: 345, SEQ ID NO: 346, SEQ ID NO: 347, SEQ ID NO: 348, SEQ ID NO: 349, SEQ ID NO: 350, SEQ ID NO: 351, SEQ ID NO: 352, SEQ ID NO: 353, SEQ ID NO: 354, SEQ ID NO: 355, SEQ ID NO: 356, SEQ ID NO: 357, SEQ ID NO: 358, SEQ ID NO: 359, SEQ ID NO: 360, SEQ ID NO: 361, SEQ ID NO: 362, SEQ ID NO: 363, SEQ ID NO: 364, SEQ ID NO: 365, SEQ ID NO: 366, SEQ ID NO: 367, SEQ ID NO: 368, SEQ ID NO: 369, SEQ ID NO: 370, SEQ ID NO: 371, SEQ ID NO: 372, SEQ ID NO: 373, SEQ ID NO: 374, SEQ ID NO: 375, SEQ ID NO: 376, SEQ ID NO: 377, SEQ ID NO: 378, SEQ ID NO: 379, SEQ ID NO: 380, SEQ ID NO: 381, SEQ ID NO: 382, SEQ ID NO: 383, SEQ ID NO: 384, SEQ ID NO: 385, SEQ ID NO: 386, SEQ ID NO: 387, SEQ ID NO: 388, SEQ ID NO: 389, SEQ ID NO: 390, SEQ ID NO: 687, SEQ ID NO: 688, SEQ ID NO: 689, SEQ ID NO: 690, SEQ ID NO: 691, SEQ ID NO: 692, SEQ ID NO: 693, SEQ ID NO: 694, SEQ ID NO: 695, SEQ ID NO: 696, SEQ ID NO: 697, SEQ ID NO: 698, SEQ ID NO: 699, SEQ ID NO:700, SEQ ID NO: 701, SEQ ID NO: 702, SEQ ID NO: 703, SEQ ID NO: 704, SEQ ID NO: 705, SEQ ID NO: 706, SEQ ID NO: 707 и SEQ ID NO: 708 и его активные фрагменты.
Способы разработки и конструирования белков слияния (и кодирующих их полинуклеотидов) известны специалистам в данной области техники. Полинуклеотиды, кодирующие полипептид AfIP-1A и/или AfIP-1B, можно слить с сигнальными последовательностями, которые будут управлять локализацией полипептида AfIP-1A и/или AfIP-1B в конкретных компартментах прокариотической или эукариотической клетки и/или управлять секрецией полипептида AfIP-1A и/или AfIP-1B согласно вариантам осуществления из прокариотической или эукариотической клетки. Например, в E. coli, может потребоваться направить экспрессию белка в периплазматическое пространство. Примеры сигнальных последовательностей или белков (или их фрагментов), с которыми можно сливать полипептид AfIP-1A и/или AfIP-1B с тем, чтобы направлять экспрессию полипептида в периплазматическое пространство бактерий, включают без ограничения сигнальную последовательность pelB, сигнальную последовательность белка, связывающего мальтозу (MBP), MBP, сигнальную последовательность ompA, сигнальную последовательность B-субъединицы периплазматического неустойчивого к нагреванию энтеротоксина E. coli и сигнальную последовательность щелочной фосфатазы. Для конструирования белков слияния коммерчески доступны несколько векторов, которые будут управлять локализацией белка, такие как серия векторов pMAL (в частности, серия pMAL-p), доступная от New England Biolabs. В определенном варианте осуществления полипептид AfIP-1A и/или AfIP-1B можно сливать с сигнальной последовательностью пектатлиазы pelB для увеличения эффективности экспрессии и очистки таких полипептидов у грам-отрицательных бактерий (см., патенты США №№ 5576195 и 5846818). Слияния пластидный транзитный пептид растения/полипептид хорошо известны из уровня техники (см. патент США № 7193133). Апопластные транзитные пептиды, такие как сигнальная последовательность секреторной альфа-амилазы риса или ячменя, также хорошо известны из уровня техники. Пластидный транзитный пептид, главным образом, сливают со стороны N-конца с полипептидом, подлежащим нацеливанию (например, партнер слияния). В одном варианте осуществления белок слияния состоит, фактически, из пластидного транзитного пептида и полипептида AfIP-1A или AfIP-1B, подлежащего нацеливанию. В другом варианте осуществления белок слияния состоит из пластидного транзитного пептида и полипептида, подлежащего нацеливанию. В таких вариантах осуществления пластидный транзитный пептид, предпочтительно, находится на N-конце белка слияния. Однако дополнительные аминокислотные остатки могут находиться на N-конце относительно пластидного транзитного пептида при условии, что белок слияния по меньшей мере частично нацеливается на пластиду. В определенном варианте осуществления пластидный транзитный пептид находится на N-концевой половине, N-концевой трети или N-концевой четверти белка слияния. Большая часть или весь пластидный транзитный пептид, как правило, вырезается из белка слияния после вставки в пластиду. Положение расщепления может слегка варьировать между видами растений, на различных стадия развития растения, в результате специфических внутриклеточных условий или конкретной комбинации применяемого транзитного пептида/партнера слияния. В одном варианте осуществления сайт расщепления пластидного транзитного пептида является однородным, так что сайт расщепления является идентичным в группе белков слияния. В другом варианте осуществления сайт расщепления пластидного транзитного пептида не является гомогенным, так что сайт расщепления варьирует на 1-10 аминокислот в группе белков слияния. Пластидный транзитный пептид можно рекомбинантно сливать со вторым белком одним из нескольких путей. Например, сайт распознавания рестрикционной эндонуклеазы можно вводить в нуклеотидную последовательность транзитного пептида в положении, соответствующем его C-терминальному концу, и такой же или совместимый сайт можно вводить способами генной инженерии в нуклеотидную последовательность белка, подлежащего нацеливанию, по его N-терминальному концу. При разработке этих сайтов нужно заботиться о том, чтобы кодирующие последовательности транзитного пептида и второго белка содержались "в рамке" для обеспечения синтеза требуемого белка слияния. В некоторых случаях предпочтительным может быть удаление инициаторного метионинового кодона второго белка при введении нового сайта рестрикции. Введение сайтов распознавания рестрикционной эндонуклеазы в обе исходные молекулы и их последующее связывание посредством методик с использованием рекомбинантной ДНК может приводить к добавлению одной или нескольких дополнительных аминокислот между транзитным пептидом и вторым белком. Это, как правило, не влияет на нацеливающую активность, поскольку сайт расщепления транзитного пептида остается доступным и функционирование второго белка не изменится при добавлении этих дополнительных аминокислот по его N-концу. В качестве альтернативы, специалист в данной области техники может создать точный сайт расщепления между транзитным пептидом и вторым пептидом (с наличием инициирующего метионина или без него) с применением синтеза генов (Stemmer, et al., (1995) Gene 164:49-53) или аналогичных способов. В дополнение, слияние транзитного пептида может намеренно включать аминокислоты ниже сайта расщепления. Аминокислоты на N-конце зрелого белка могут воздействовать на способность транзитного пептида нацеливать белки в пластиды и/или эффективность расщепления после импорта белков. Это может зависеть от белка, подлежащего нацеливанию. См., например, Comai, et al., (1988) J. Biol. Chem. 263(29):15104-9.
В некоторых вариантах осуществления предусмотрены белки слияния, содержащие полипептид AfIP-1A и полипептид AfIP-1B, соединенные аминокислотным линкером.
В некоторых вариантах осуществления предусмотрены белки слияния, представленные формулой, выбранной из группы, состоящей из:
R1-L-R2, R2-L- R1, R1- R2 или R2- R1,
где R1 представляет собой полипептид AfIP-1A или полипептид с SEQ ID NO: 18, R2 представляет собой полипептид AfIP-1B или полипептид с SEQ ID NO: 20. Полипептид R1 слит либо напрямую, либо через линкерный (L) сегмент с полипептидом R2. Термин "непосредственно" обозначает слияния, в которых полипептиды соединены без пептидного линкера. Таким образом, “L” представляет собой химическую связь или полипептидный сегмент, с которым оба R1 и R2 слиты в рамке, наиболее часто L представляет собой линейный пептид, с которым R1 и R2 связаны посредством амидных связей, связывающих карбокси-конец R1 с амино-концом L и карбокси-конец L с амино-концом R2. Под "слиты в рамке" подразумевается, что между рамками считывания R1 и R2 отсутствуют сайты терминации трансляции или разрыв. Связывающая группа (L) представляет собой обычно полипептид от 1 до 500 аминокислот в длину. Линкеры, соединяющие две молекулы, предпочтительно, разрабатывают так, (1) чтобы они давали возможность двум молекулам сворачиваться и действовать независимо друг от друга, (2) чтобы они не характеризовались склонностью к развитию упорядоченной вторичной структуры, которая может негативно воздействовать на функциональные домены двух белков, (3) чтобы они имели минимальную гидрофобную или зарядную характеристику, которая влияет на функциональные домены белка, и (4) чтобы они обеспечивали стерическое разделение R1 и R2, так что R1 и R2 могли одновременно взаимодействовать со своими соответствующими рецепторами на одной клетке. Как правило поверхностные аминокислоты в гибких участках белка включают Gly, Asn и Ser. В сущности, любая комбинация аминокислотных последовательностей, содержащих Gly, Asn и Ser, как ожидается, будет удовлетворять вышеуказанным критериям для линкерной последовательности. Другие нейтральные аминокислоты, такие как Thr и Ala, также можно применять в линкерной последовательности. Дополнительные аминокислоты также можно включать в линкеры, поскольку добавление уникальных сайтов рестрикции в линкерную последовательность улучшает конструирование слияний.
В некоторых вариантах осуществления линкеры содержат последовательности, выбранные из группы с формулами: (Gly3Ser)n, (Gly4Ser)n, (Gly5Ser)n, (GlynSer)n или (AlaGlySer)n, где n представляет собой целое число. Одним примером очень гибкого линкера является спейсерный участок, богатый (GlySer), присутствующий в белке pIII нитевидных бактериофагов, например, бактериофагов M13 или fd (Schaller, et al., 1975). Этот участок обеспечивает длинный гибкий спейсерный участок между двумя доменами поверхностного белка pIII. Также включены линкеры, в состав которых входит последовательность распознавания эндопептидазы. Такой сайт расщепления может быть очень важным для отделения индивидуальных компонентов слияния для определения того, являются ли они правильным образом свернуты и активны in vitro. Примеры различных эндопептидаз включают без ограничения плазмин, энтерокиназу, калликреин, урокиназу, тканевой активатор плазминогена, клострипаин, химозин, коллагеназу, протеазу яда гадюки Рассела, фермент расщепления постпролина, протеазу V8, тромбин и фактор Xa. В некоторых вариантах осуществления линкер содержит аминокислоты EEKKN (SEQ ID NO: 153) из мультигенного экспрессионного "проводника" (MGEV), который расщепляется протеазами вакуолей, как раскрыто в публикации заявки на патент США № 2007/0277263. В других вариантах осуществления пептидные линкерные сегменты из шарнирного участка тяжелой цепи иммуноглобулинов IgG, IgA, IgM, IgD или IgE обеспечивают угловое взаимодействие между прикрепленными полипептидами. Особенно применимыми являются такие шарнирные участки, в которых цистеины замещены на серины. Линкеры согласно настоящему раскрытию включают последовательности, полученные из шарнирного участка IgG гамма 2b мыши, в котором цистеины были заменены на серины. Белки слияния не ограничиваются формой, размером или числом используемых линкерных последовательностей и единственным требованием для линкера является то, что функционально он негативно не влияет на фолдинг и функционирование отдельных молекул слияния.
В другом аспекте предусмотрены химерные полипептиды, которые получают путем соединения двух или более частей генов, которые изначально кодируют отдельные инсектицидные белки от различных видов, с получением химерного гена. Трансляция химерного гена приводит к единому химерному пестицидному полипептиду с участками, мотивами или доменами, полученными из каждого из оригинальных полипептидов. В определенных вариантах осуществления химерный белок содержит части, мотивы или домены полипептида AfIP-1A и FGTW-51 (SEQ ID NO: 18) в любой комбинации. В определенных вариантах осуществления химерный белок содержит части, мотивы или домены полипептида AfIP-1B и FGTW-52 (SEQ ID NO: 20) в любой комбинации. В определенных вариантах осуществления химерный белок содержит части, мотивы или домены полипептида AfIP-1A с SEQ ID NO: 2 и FGTW-51 (SEQ ID NO: 18) в любой комбинации. В определенных вариантах осуществления химерный белок содержит части, мотивы или домены полипептида AfIP-1B с SEQ ID NO: 4 и FGTW-52 (SEQ ID NO: 20) в любой комбинации.
Понятно, что последовательности ДНК можно изменять различными способами, и что эти изменения могут приводить к последовательностям ДНК, кодирующим белки с аминокислотными последовательностями, отличающимися от тех, которые кодируют пестицидный белок дикого типа (или нативный). В некоторых вариантах осуществления полипептид AfIP-1A можно изменять различными способами, в том числе аминокислотными заменами, делециями, усечениями и вставками одной или нескольких аминокислот, включая до 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40 45, 50, приблизительно 55, 60, 65, 70, 75, 80, 85, 90, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145 или более аминокислотных замен, делеций и/или вставок или их комбинаций относительно SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782, SEQ ID NO: 786, SEQ ID NO: 255, SEQ ID NO: 256 или SEQ ID NO: 257. В некоторых вариантах осуществления полипептид AfIP-1A содержит делецию 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или более аминокислот с N-конца полипептида AfIP-1A относительно аминокислотного положения из SEQ ID NO: 2, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 778, SEQ ID NO: 782, SEQ ID NO: 786, SEQ ID NO: 255, SEQ ID NO: 256 или SEQ ID NO: 257 (например, SEQ ID NO: 6, SEQ ID NO: 149).
В некоторых вариантах осуществления полипептид AfIP-1B можно изменять различными способами, в том числе аминокислотными заменами, делециями, усечениями и вставками одной или нескольких аминокислот, включая до 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40 45, 50, приблизительно 55, 60, 65, 70, 75, 80, 85, 90, 100, 105, 110, 115, 120, 125, 130, 135, 140, 145 или более аминокислотных замен, делеций и/или вставок или их комбинаций относительно SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784, SEQ ID NO: 788, SEQ ID NO: 258 или SEQ ID NO: 259. В некоторых вариантах осуществления полипептид AfIP-1B содержит делецию 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или более аминокислот с C-конца полипептида AfIP-1B относительно аминокислотного положения из SEQ ID NO: 4, SEQ ID NO: 30, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 780, SEQ ID NO: 784, SEQ ID NO: 788, SEQ ID NO: 258 или SEQ ID NO: 259.
Способы таких манипуляций, как правило, известны из уровня техники. Например, варианты аминокислотной последовательности полипептида AfIP-1A или AfIP-1B можно получать при помощи мутаций в ДНК. Это также можно осуществлять при помощи одной из нескольких форм мутагенеза и/или путем направленной эволюции. В некоторых аспектах изменения, закодированные в аминокислотной последовательности, не будут существенно влиять на функцию белка. Такие варианты будут обладать требуемой пестицидной активностью. Однако понятно, что способность полипептида AfIP-1A и AfIP-1B обеспечивать пестицидную активность можно улучшать путем применения таких методик в композициях согласно настоящему раскрытию.
Например, можно делать консервативные аминокислотные замены по одному или нескольким прогнозируемым несущественным аминокислотным остаткам. “Несущественный” аминокислотный остаток представляет собой остаток, который можно изменять по сравнению с последовательностью дикого типа полипептида AfIP-1A или AfIP-1B без изменения биологической активности. “Консервативная аминокислотная замена” представляет собой замену, при которой аминокислотный остаток замещен на аминокислотный остаток, имеющий аналогичную боковую цепь. Семейства аминокислотных остатков, имеющие аналогичные боковые цепи, были определены в уровне техники. Эти семейства включают: аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин); кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота); полярными отрицательно заряженными остатками и их амидами (например, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин); незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин); небольшими алифатическими неполярными или слегка полярными остатками (например, аланин, серин, треонин, пролин, глицин); неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан); крупными алифатическими неполярными остатками (например, метионин, лейцин, изолейцин, валин, цистин); бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин); ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин); крупными ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан).
Аминокислотные замены можно проводить в неконсервативных участках, которые сохраняют функцию. В целом, такие замены не следует проводить для консервативных аминокислотных остатков или для аминокислотных остатков, находящихся в консервативном мотиве, где такие остатки являются существенными для активности белка. Примеры остатков, которые являются консервативными и которые могут быть существенными для активности белка включают, например, остатки, которые идентичны у всех белков, содержащихся в выравнивании аналогичных или родственных токсинов с последовательностями согласно вариантам осуществления (например, остатки, которые идентичны при выравнивании гомологичных белков). Примеры остатков, которые являются консервативными, но которые могут позволять консервативные аминокислотные замены и сохранять активность, включают, например, остатки, которые характеризуются только консервативными заменами у всех белков, содержащихся в выравнивании аналогичных или родственных токсинов с последовательностями согласно вариантам осуществления (например, остатки, которые характеризуются только консервативными заменами у всех белков, содержащихся в выравнивании гомологичных белков). Однако специалист в данной области техники поймет, что функциональные варианты могут иметь незначительные консервативные или неконсервативные изменения в консервативных остатках. Указания в отношении подходящих аминокислотных замен, которые не влияют на биологическую активность белка, представляющего интерес, можно найти в модели Dayhoff, et al., (1978) Atlas of Protein Sequence and Structure (Natl. Biomed. Res. Found., Washington, D.C.), включенной в данный документ посредством ссылки.
При осуществлении таких изменений можно учитывать индекс гидропатичности аминокислот. Важность индекса гидропатичности аминокислот в обеспечении согласованной биологической функции белка, в целом, понятна из уровня техники (Kyte and Doolittle, (1982) J Mol Biol. 157(1):105-32). Признается, что относительная гидропатичность аминокислоты вносит вклад во вторичную структуру полученного в результате белка, что, в свою очередь, определяет взаимодействие белка с другими молекулами, например, ферментами, субстратами, рецепторами, ДНК, антителами, антигенами и т.п.
Из уровня техники известно, что определенные аминокислоты можно замещать другими аминокислотами, имеющими аналогичный индекс или балл гидропатичности, и в результате это все еще приводит к белку с аналогичной биологической активностью, т.е. по-прежнему получают белок с аналогичной биологической функцией. Каждой аминокислоте был присвоен индекс гидропатичности на основании ее гидрофобности и зарядных характеристик (Kyte and Doolittle, там же). Они являются следующими: изолейцин (+4,5); валин (+4,2); лейцин (+3,8); фенилаланин (+2.8); цистеин/цистин (+2,5); метионин (+1,9); аланин (+1,8); глицин (-0,4); треонин (-0,7); серин (-0,8); триптофан (-0,9); тирозин (-1,3); пролин (-1,6); гистидин (-3,2); глутамат (-3,5); глутамин (-3,5); аспартат (-3,5); аспарагин (-3,5); лизин (-3,9) и аргинин (-4,5). При осуществлении таких изменений предпочтительной является замена аминокислот, индексы гидропатичности которых находятся в пределах до +2, особенно предпочтительной с индексами в пределах до +1 и наиболее предпочтительной с индексами в пределах до +0,5.
Из уровня техники также понятно, что замену подобных аминокислот можно эффективно проводить на основании гидрофильности. В патенте США № 4554101 заявляется, что наибольшая локальная средняя гидрофильность белка, определяемая гидрофильностью смежных аминокислот, коррелирует с биологическим свойством белка.
Как подробно описано в патенте США № 4554101, аминокислотным остаткам были присвоены следующие значения гидрофильности: аргинин (+3,0); лизин (+3,0); аспартат (+3,0.+0,1); глутамат (+3,0.+0,1); серин (+0,3); аспарагин (+0,2); глутамин (+0,2); глицин (0); треонин (-0,4); пролин (-0,5.+0,1); аланин (-0,5); гистидин (-0,5); цистеин (-1,0); метионин (-1,3); валин (-1,5); лейцин (-1,8); изолейцин (-1,8); тирозин (-2,3); фенилаланин (-2,5); триптофан (-3,4).
В качестве альтернативы изменения можно производить в белковой последовательности многих белков на амино- или карбокси-конце без существенного воздействия на активность. Они могут включать вставки, делеции или изменения, введенные при помощи современных молекулярных способов, таких как ПЦР, в том числе амплификации посредством ПЦР, которые изменяют или расширяют последовательность, кодирующую белок, посредством включения последовательностей, кодирующих аминокислоты, в олигонуклеотиды, используемые при амплификации посредством ПЦР. В качестве альтернативы, добавленные белковые последовательности могут включать последовательности, кодирующие весь белок, например, такие, которые обычно применяются в области техники для получения белковых слияний. Такие белки слияния часто применяются для (1) усиления экспрессии белка, представляющего интерес, (2) введения связывающего домена, ферментативной активности или эпитопа для облегчения чего-либо из очистки белка, выявления белка или других экспериментальных применений, известных из уровня техники, (3) нацеливания секреции или трансляции белка во внутриклеточную органеллу, такую как периплазматическое пространство грам-отрицательных бактерий, митохондрии или хлоропласты растений или эндоплазматический ретикулум эукариотических клеток, причем последнее зачастую приводит к гликозилированию белка.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 2, имеющую аминокислотные замены относительно нативной аминокислоты из SEQ ID NO: 2 по одному или нескольким остаткам, выбранным из положений 6, 7, 8, 9, 10, 11, 12, 13, 16, 17, 19, 20, 23, 24, 26, 27, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 48, 50, 51, 54, 55, 56, 57, 58, 60, 62, 66, 65, 66, 67, 68, 69, 70, 73, 74, 76, 77, 78, 79, 82, 86, 88, 89, 91, 92, 95, 96, 97, 98, 100, 101, 104, 105, 106, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 122, 12, 124, 126, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 142, 143, 145 и 146 из SEQ ID NO: 2.
В некоторых вариантах осуществления полипептид AfIP-1A содержит аминокислотную последовательность с SEQ ID NO: 2, имеющую одну или несколько аминокислотных замен относительно нативной аминокислоты из SEQ ID NO: 2 в 1-29 остатках, выбранных из положений 6, 7, 8, 9, 10, 11, 12, 13, 14, 16, 17, 19, 20, 23, 24, 26, 27, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 50, 51, 54, 55, 56, 57, 58, 60, 61, 62, 64, 65, 66, 67, 68, 69, 70, 73, 74, 76, 77, 78, 79, 82, 86, 88, 89, 91, 92, 95, 96, 97, 98, 100, 101, 104, 105, 106, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 122, 123, 124, 125, 126, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 142, 143, 145 и 146 из SEQ ID NO: 2.
В некоторых вариантах осуществления полипептид AfIP-1B содержит аминокислотную последовательность с SEQ ID NO: 4, имеющую одну или несколько аминокислотных замен относительно нативной аминокислоты из SEQ ID NO: 4 в одном или нескольких остатках, выбранных из положений 2, 12, 42, 71, 82, 115, 119, 139, 144, 148, 152, 155, 181, 197, 201, 202, 208, 234, 270, 298, 299, 300, 305, 308, 317, 323, 335, 343, 352, 370, 374, 377, 384, 385, 388, 393, 419, 481, 495, 538, 550, 552, 602, 610, 619, 625, 629, 631, 683 и 696 из SEQ ID NO: 4.
В определенных вариантах осуществления замена представляет собой замену аланином нативной аминокислоты в указанном положении(ях). Также охвачены последовательности нуклеиновой кислоты, кодирующие вариантный белок или полипептид.
Вариантные нуклеотидные и аминокислотные последовательности согласно настоящему раскрытию также охватывают последовательности, полученные в результате методик, связанных с мутациями и рекомбинациями, такими как шаффлинг ДНК. При такой процедуре один или несколько различных кодирующих участков полипептида AfIP-1A или AfIP-1B можно применять для создания нового полипептида AfIP-1A или AfIP-1B, обладающего требуемыми свойствами. Таким образом, библиотеки рекомбинантных полинуклеотидов создают из популяции полинуклеотидов с родственными последовательностями, включающих участки последовательности, которые имеют в существенной степени идентичные последовательности и могут подвергаться гомологичной рекомбинации in vitro или in vivo. Например, с использованием этого подхода, мотивы с последовательностями, кодирующими домен, представляющий интерес, можно подвергать шаффлингу между пестицидным геном и другими известными пестицидными генами с получением нового гена, кодирующего белок с улучшенным свойством, представляющим интерес, таким как повышенная инсектицидная активность. Стратегии для такого ДНК-шаффлинга известны из уровня техники. См., например, Stemmer, (1994) Proc. Natl. Acad. Sci. USA 91:10747-10751; Stemmer, (1994) Nature 370:389-391; Crameri, et al., (1997) Nature Biotech. 15:436-438; Moore, et al., (1997) J. Mol. Biol. 272:336-347; Zhang, et al., (1997) Proc. Natl. Acad. Sci. USA 94:4504-4509; Crameri, et al., (1998) Nature 391:288-291; и патенты США №№ 5605793 и 5837458.
Замена доменов или шаффлинг представляет собой другой механизм создания измененных полипептидов AfIP-1A или AfIP-1B. Можно поводить замену доменов между полипептидами AfIP-1A или AfIP-1B, что дает гибридные или химерные токсины с улучшенной пестицидной активностью или спектром мишеней. Способы получения рекомбинантных белков и тестирования их в отношении пестицидной активности хорошо известны из уровня техники (см., например, Naimov, et al., (2001) Appl. Environ. Microbiol. 67:5328-5330; de Maagd, et al., (1996) Appl. Environ. Microbiol. 62:1537-1543; Ge, et al., (1991) J. Biol. Chem. 266:17954-17958; Schnepf, et al., (1990) J. Biol. Chem. 265:20923-20930; Rang, et al., 91999) Appl. Environ. Microbiol. 65:2918-2925).
Как ДНК-шаффлинг, так и сайт-направленный мутагенез применяли для определения полипептидных последовательностей, которые обладают пестицидной активностью. В примерах 8 и 11 ДНК-шаффлинг применяли для получения библиотеки из активных вариантов путем рекомбинации разнообразия, присутствующего в AfIP-1A-31 (SEQ ID NO: 2) и AfIP-1B-32 (SEQ ID NO: 4), соответственно. Специалист в данной области техники сможет применять сравнения с другими белками или функциональные анализы для дальнейшего определения мотивов. Для тестирования вариаций этих мотивов можно применять высокопроизводтельный скрининг для определения роли специфических остатков. Принимая во внимание данные о некоторых мотивах, затем можно определять требования касательно функционального белка. Данные о мотивах позволяют квалифицированному специалисту разработать вариации последовательностей, которые не будут влиять на функцию.
Выравнивание гомологов, а именно гомологов AfIP-1A и гомологов AfIP-1B (фигура 1 и 3, и фигура 2, соответственно), позволило идентифицировать остатки, которые являются высококонсервативными среди естественных гомологов в данном семействе (фигура 1). В примере 9 и 12 насыщающий мутагенез применяли для осуществления и тестирования замен в выбранных аминокислотных положениях в мотивах по консервативным остаткам. Эти мутанты тестировали в отношении активности и идентифицировали ряд активных замен, не присутствующих у гомологов, что дает понимание функциональных ограничений по этим остаткам.
Композиции
Также охвачены композиции, содержащие полипептид AfIP-1A и/или AfIP-1B. В некоторых вариантах осуществления композиция содержит полипептид AfIP-1A. В некоторых вариантах осуществления композиция содержит полипептид AfIP-1B. В некоторых вариантах осуществления композиция содержит полипептид AfIP-1A и полипептид AfIP-1B. В некоторых вариантах осуществления композиция содержит белок слияния AfIP-1A / AfIP-1B.
Антитела
Также охвачены антитела к полипептиду AfIP-1A или AfIP-1B согласно вариантам осуществления или к его вариантам или фрагментам. Антитела согласно настоящему раскрытию включают поликлональные и моноклональные антитела, а также их фрагменты, которые сохраняют их способность связываться с белками AfIP-1A или AfIP-1B, обнаруженными в кишечнике насекомого. Говорится, что антитело, моноклональное антитело или его фрагмент способны связывать молекулу, если они способны специфично реагировать с молекулой, тем самым связывать молекулу с антителом, моноклональным антителом или его фрагментом. Как подразумевается, термин "антитело" (Ab) или "моноклональное антитело" (Mab) включает интактные молекулы, а также их фрагменты, или связывающие участки, или домены (такие как, например, фрагменты Fab и F(ab)2), которые способны связывать гаптен. Такие фрагменты, как правило, получают при помощи протеолитического расщепления, например, с помощью папаина или пепсина. В качестве альтернативы, гаптен-связывающие фрагменты можно получить посредством применения технологии рекомбинантной ДНК или при помощи синтетической химии. Способы получения антител согласно настоящему раскрытию, как правило, известны из уровня техники. Например, см., Antibodies, A Laboratory Manual, Ed Harlow and David Lane (eds.) Cold Spring Harbor Laboratory, N.Y. (1988), а также процитированные в нем литературные источники. Стандартные справочные работы, излагающие общие принципы иммунологии, включают: Klein, J. Immunology: The Science of Cell-Noncell Discrimination, John Wiley & Sons, N.Y. (1982); Dennett, et al., Monoclonal Antibodies, Hybridoma: A New Dimension in Biological Analyses, Plenum Press, N.Y. (1980) и Campbell, "Monoclonal Antibody Technology," в Laboratory Techniques in Biochemistry and Molecular Biology, Vol. 13, Burdon, et al., (eds.), Elsevier, Amsterdam (1984). См. также патенты США №№ 4196265; 4609893; 4713325; 4714681; 4716111; 4716117 и 4720459. Антитела к полипептиду AfIP-1A или к полипептиду AfIP-1B или их антиген-связывающим частям можно получать при помощи ряда методик, в том числе традиционных методик с применением моноклональных антител, например, стандартной методики гибридизации с соматической клеткой согласно Kohler and Milstein, (1975) Nature 256:495. Также можно использовать другие методики получения моноклонального антитела, такие как вирусная или онкогенная трансформация B-лимфоцитов. Животная система для получения гибридом представляет собой мышиную систему. Из уровня техники известны протоколы и методики иммунизации для выделения спленоцитов иммунизированных животных для слияния. Также известны партнеры для слияния (например, клетки миеломы мыши) и процедуры слияния. Антитело и моноклональное антитело согласно настоящему раскрытию можно получить при помощи использования полипептида AfIP-1A или полипептида AfIP-1B в качестве антигенов.
Предусматривается набор для выявления присутствия полипептида AfIP-1A или полипептида AfIP-1B, или выявления присутствия нуклеотидной последовательности, кодирующей полипептид AfIP-1A или полипептид AfIP-1B, в образце. В одном варианте осуществления в наборе имеются реагенты на основе антитела для выявления присутствия полипептида AfIP-1A или полипептида AfIP-1B в образце ткани. В другом варианте осуществления в наборе имеются меченные зонды из нуклеиновой кислоты, применяемые для выявления присутствия одного или нескольких полинуклеотидов, кодирующих полипептид(ы) AfIP-1A или полипептид(ы) AfIP-1B. В наборе также имеются соответствующие реагенты и контрольные образцы для проведения способа выявления, а также инструкции для применения набора.
Идентификация и выделение рецепторов
Также охвачены рецепторы к полипептиду AfIP-1A и/или AfIP-1B согласно вариантам осуществления или к его вариантам или фрагментам. Способы идентификации рецепторов, хорошо известные из уровня техники (см. Hofmann, et. al., (1988) Eur. J. Biochem. 173:85-91; Gill, et al., (1995) J. Biol. Chem. 27277-27282), можно использовать для идентификации и выделения рецептора, который распознает полипептиды AfIP-1A и/или AfIP-1B с применением мембранных пузырьков из щеточной каемки восприимчивых насекомых. В дополнение к способу радиоактивного мечения, приведенному в процитированных литературных источниках, полипептид AfIP-1A и/или AfIP-1B можно метить с помощью флуоресцентного красителя и других обычных меток, таких как стрептавидин. Мембранные пузырьки из щеточной каемки (BBMV) восприимчивых насекомых, таких как соевая совка и щитники, можно получать в соответствии с протоколами, приведенными в ссылочных документах, и разделять на геле SDS-PAGE, и переносить на подходящую мембрану. Меченые полипептиды AfIP-1A и/или AfIP-1B можно инкубировать с подвергнутой блоттингу мембраной BBMV, и при этом меченые полипептиды AfIP-1A и/или AfIP-1B можно идентифицировать при помощи меченых репортеров. Идентификацию белковой полоски(полосок), которые взаимодействуют с полипептидами AfIP-1A и/или AfIP-1B, можно выявлять при помощи определения последовательности N-концевых аминокислотных остатков в газовой фазе или способа идентификации белков на основе масс-спектрометрии (Patterson, (1998) 10.22, 1-24, Current Protocol in Molecular Biology published by John Wiley & Son Inc). После идентификации белка соответствующий ген можно клонировать из библиотеки геномной ДНК или кДНК восприимчивых насекомых, и сродство связывания можно измерять непосредственно при помощи полипептидов AfIP-1A и/или AfIP-1B. Рецепторную функцию в отношении инсектицидной активности у полипептидов AfIP-1A и/или AfIP-1B можно подтвердить путем осуществления при помощи типа RNAi способа нокаута гена (Rajagopal, et al., (2002) J. Biol. Chem. 277:46849-46851).
Нуклеотидные конструкции, кассеты и векторы экспрессии
Применение термина "нуклеотидные конструкции" в данном документе не предназначено ограничивать варианты осуществления нуклеотидными конструкциями, содержащими ДНК. Специалисты в данной области техники поймут, что нуклеотидные конструкции, в частности полинуклеотиды и олигонуклеотиды, состоящие из рибонуклеотидов и комбинаций рибонуклеотидов и дезоксирибонуклеотидов, также можно применять в способах, раскрытых в данном описании. Нуклеотидные конструкции, нуклеиновые кислоты и нуклеотидные последовательности согласно вариантам осуществления дополнительно охватывают все комплементарные формы таких конструкций, молекул и последовательностей. Кроме того, нуклеотидные конструкции, нуклеотидные молекулы и нуклеотидные последовательности согласно вариантам осуществления охватывают все нуклеотидные конструкции, молекулы и последовательности, которые можно использовать в способах согласно вариантам осуществления для трансформации растений, в том числе, без ограничения, состоящие из дезоксирибонуклеотидов, рибонуклеотидов и их комбинаций. Такие дезоксирибонуклеотиды и рибонуклеотиды имеют в составе как встречающиеся в природе молекулы, так и синтетические аналоги. Нуклеотидные конструкции, нуклеиновые кислоты и нуклеотидные последовательности согласно вариантам осуществления также охватывают все формы нуклеотидных конструкций, в том числе, без ограничения, одноцепочечные формы, двуцепочечные формы, шпильки, структуры "стебель-и-петля" и т.п.
Дополнительный вариант осуществления относится к трансформированному организму, такому как организм, выбранный из растительных клеток или клеток насекомых, бактерий, дрожжей, бакуловируса, простейших, нематод и водорослей. Трансформированный организм содержит молекулу ДНК согласно вариантам осуществления, кассету экспрессии, содержащую молекулу ДНК, или вектор, содержащий кассету экспрессии, которые могут быть стабильно встроенными в геном трансформированного организма.
Последовательности согласно вариантам осуществления предусмотрены в составе конструкций ДНК для экспрессии в организме, представляющем интерес. Конструкции будут включать 5' и 3' регуляторные последовательности, функционально связанные с последовательностью согласно вариантам осуществления. Применяемый в данном документе термин "функционально связанные" относится к функциональной связи между промотором и второй последовательностью, где последовательность промотора инициирует и опосредует транскрипцию последовательности ДНК, соответствующей второй последовательности. Как правило, функционально связанный означает, что связанные последовательности нуклеиновой кислоты являются смежными и, при необходимости, соединяют два кодирующих белок участка в одной рамке считывания. Конструкция может дополнительно содержать по меньшей мере один дополнительный ген, подлежащий введению в организм путем котрансформации. В качестве альтернативы, дополнительный ген(ы) могут предусматриваться в нескольких конструкциях ДНК.
Такая ДНК-конструкция снабжена несколькими сайтами рестрикции для вставки последовательности гена полипептида AfIP-1A и/или AfIP-1B, транскрипция которой будет регулироваться регуляторными участками. ДНК-конструкция может дополнительно содержать гены селектируемых маркеров.
В направлении транскрипции 5'-3' ДНК-конструкция, как правило, будет включать: участок инициации транскрипции и трансляции (т.е. промотор), последовательность ДНК согласно вариантам осуществления и участок терминации транскрипции и трансляции (т.е. участок терминации), функционирующие в организме, служащем хозяином. Участок инициации транскрипции (т.е. промотор) может быть нативным, аналогичным, чужеродным или гетерологичным относительно организма-хозяина и/или последовательности согласно вариантам осуществления. Кроме того, промотор может быть природной последовательностью или, в качестве альтернативы, синтетической последовательностью. Применяемый в данном документе термин "чужеродный" указывает на то, что промотор не найден в нативном организме, в который введен промотор. Если промотор является "чужеродным" или "гетерологичным" относительно последовательности согласно вариантам осуществления, предполагается, что промотор не является нативным или встречающимся в природе промотором для функционально связанной последовательности согласно вариантам осуществления. Применяемый в данном документе химерный ген содержит кодирующую последовательность, функционально связанную с участком инициации транскрипции, который является гетерологичным для кодирующей последовательности. Если промотор является нативной или природной последовательностью, экспрессия функционально связанной последовательности изменена по сравнению с экспрессией дикого типа, что приводит к изменению фенотипа.
В некоторых вариантах осуществления ДНК-конструкция может также включать последовательность транскрипционного энхансера. Применяемый в данном документе термин “энхансер” относится к последовательности ДНК, которая может стимулировать активность промотора и которая может представлять собой характерный элемент промотора или гетерологичный элемент, вставленный для повышения уровня или тканевой специфичности промотора. Из уровня техники известны различные энхансеры, например, также могут применяться интроны со свойствами улучшения генной экспрессии в растениях (публикация заявки на патент США № 2009/0144863, интрон убиквитина (т.е. интрон 1 убиквитина маиса (см., например, последовательность NCBI S94464)), омега-энхансер или омега-штрих-энхансер (Gallie, et al., (1989) Molecular Biology of RNA ed. Cech (Liss, New York) 237-256 и Gallie, et al., (1987) Gene 60:217-25), энхансер CaMV 35S (см., например, Benfey, et al., (1990) EMBO J. 9:1685-96) и энхансеры из патента США № 7803992, каждый из которых включен посредством ссылки. Приведенный выше перечень транскрипционных энхансеров не предназначен для ограничения. В вариантах осуществления можно применять любой подходящий транскрипционный энхансер.
Участок терминации может быть нативным относительно участка инициации транскрипции, может быть нативным относительно функционально связанной последовательности ДНК, представляющей интерес, может быть нативным относительно растения-хозяина или может быть получен из другого источника (т.e. чужеродный или гетерологичный для промотора, последовательности, представляющей интерес, растения-хозяина или какой-либо их комбинации).
Подходящие участки терминации доступны из Ti-плазмиды A. tumefaciens, такие как участки терминации генов октопинсинтазы и нопалинсинтазы. См. также Guerineau, et al., (1991) Mol. Gen. Genet. 262:141-144; Proudfoot, (1991) Cell 64:671-674; Sanfacon, et al., (1991) Genes Dev. 5:141-149; Mogen, et al., (1990) Plant Cell 2:1261-1272; Munroe, et al., (1990) Gene 91:151-158; Ballas, et al., (1989) Nucleic Acids Res. 17:7891-7903 и Joshi, et al., (1987) Nucleic Acid Res. 15:9627-9639.
При необходимости нуклеиновую кислоту можно оптимизировать для усиления экспрессии в организме-хозяине. Таким образом, если организм-хозяин является растением, для усиления экспрессии можно синтезировать синтетические нуклеиновые кислоты с применением кодонов, предпочтительных для растений. См., например, Campbell and Gowri, (1990) Plant Physiol. 92:1-11 в отношении обсуждения использования кодонов, предпочтительных для хозяина. Например, хотя последовательности нуклеиновой кислоты согласно вариантам осуществления могут экспрессироваться как у видов однодольных, так и двудольных растений, последовательности можно модифицировать с учетом специфических предпочтений кодов и предпочтений по содержанию GC у однодольных или двудольных, если было показано, что предпочтения отличаются (Murray et al. (1989) Nucleic Acids Res. 17:477-498). Таким образом, кодон, предпочтительный для маиса, для конкретной аминокислоты можно установить из известных генных последовательностей маиса. Использование кодонов маисом для 28 генов из растений маиса приведено в таблице 4 из Murray, et al., выше. Из уровня техники доступны способы синтеза генов, предпочтительных для растений. См., например, патенты США №№ 5380831 и 5436391, и Murray, et al., (1989) Nucleic Acids Res. 17:477-498, и Liu H et al. Mol Bio Rep 37:677-684, 2010, включенные в данный документ посредством ссылки. Таблицу использования кодонов Zea maize также можно найти на сайте kazusa.or.jp/codon/cgi-bin/showcodon.cgi?species=4577, доступ к которому можно получить с применением префикса www. В таблице 2 показан анализ оптимальных кодонов маиса (адаптировано из Liu H et al. Mol Bio Rep 37:677-684, 2010).
В некоторых вариантах осуществления рекомбинантная молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1A или AfIP-1B, имеет кодоны, оптимизированные для маиса. В некоторых вариантах осуществления оптимизированная для маиса рекомбинантная молекула нуклеиновой кислоты, кодирующая полипептид AfIP-1A или AfIP-1B, выбрана из, но без ограничения, SEQ ID NO: 278, SEQ ID NO: 279, SEQ ID NO: 280, SEQ ID NO: 281, SEQ ID NO: 282, SEQ ID NO: 283, SEQ ID NO: 284, SEQ ID NO: 285, SEQ ID NO: 286, SEQ ID NO: 287, SEQ ID NO: 288, SEQ ID NO: 289, SEQ ID NO: 290, SEQ ID NO: 291, SEQ ID NO: 292, SEQ ID NO: 293, SEQ ID NO: 294, SEQ ID NO: 295, SEQ ID NO: 296, SEQ ID NO: 297, SEQ ID NO: 298, SEQ ID NO: 299 и SEQ ID NO: 300.
Известны дополнительные модификации последовательностей для усиления экспрессии гена у клеточного хозяина. Они включают устранение последовательностей, кодирующих ложные сигналы полиаденилирования, сигналы сайта сплайсинга экзонов и интронов, транспозон-подобные повторы и другие хорошо изученные последовательности, которые могут быть вредны для экспрессии гена. Содержание GC в последовательности можно скорректировать до уровней, средних для данного клеточного хозяина, рассчитываемых с учетом известных генов, экспрессируемых в клетке-хозяине. Применяемый в данном документе термин "клетка-хозяин" относится к клетке, которая содержит вектор и которая поддерживает репликацию и/или экспрессию предполагаемых векторов экспрессии. Клетки-хозяева могут быть прокариотическими клетками, такими как E. coli, или эукариотическими клетками, такими как клетки дрожжей, насекомых, амфибий или млекопитающих, или клетками однодольных или двудольных растений. Примером клетки-хозяина, относящейся к однодольному растению, является клетка-хозяин маиса. Если возможно, последовательность модифицируют для того, чтобы избежать образования предсказанных шпилечных вторичных структур мРНК.
Кассеты экспрессии могут дополнительно содержать 5'-лидерные последовательности. Такие лидерные последовательности могут способствовать усилению трансляции. Из уровня техники известны трансляционные лидерные последовательности, и они включают лидерные последовательности пикорнавирусов, например, лидерную последовательность EMCV (5'-некодирующий участок генома вируса энцефаломиокардита) (Elroy-Stein et al., (1989) Proc. Natl. Acad. Sci. USA 86:6126-6130); лидерные последовательности потивирусов, например, лидерная последовательность TEV (вирус гравировки табака) (Gallie, et al., (1995) Gene 165(2):233-238), лидерная последовательность MDMV (вирус карликовой мозаики кукурузы) и белок, связывающий тяжелую цепь иммуноглобулина человека (BiP) (Macejak, et al., (1991) Nature 353:90-94); нетранслируемую лидерную последовательность из мРНК белка оболочки вируса мозаики люцерны (AMV RNA 4) (Jobling, et al., (1987) Nature 325:622-625); лидерную последовательность вируса табачной мозаики (TMV) (Gallie, et al., (1989) в Molecular Biology of RNA, ed. Cech (Liss, New York), pp. 237-256) и лидерную последовательность вируса хлорозной мозаичности маиса (MCMV) (Lommel, et al., (1991) Virology 81:382-385). См. также Della-Cioppa, et al., (1987) Plant Physiol. 84:965-968. Такие конструкции могут также содержать “сигнальную последовательность” или “лидерную последовательность” для облегчения сопряженного с трансляцией или посттрансляционного транспорта пептида в определенные внутриклеточные структуры, такие как хлоропласт (или другая пластида), эндоплазматический ретикулум или аппарат Гольджи
Применяемая в данном документе “сигнальная последовательность” относится к последовательности, которая, как известно или как ожидается, приводит к сопряженному с трансляцией или посттрансляционному транспорту пептида через клеточную мембрану. У эукариот это, как правило, подразумевает секрецию в пузырьках аппарата Гольджи, при этом происходит некоторое гликолизирование. Инсектицидные токсины бактерий зачастую синтезируются в виде протоксинов, которые активируются под действием протеолиза в кишечнике целевого вредителя (Chang, (1987) Methods Enzymol. 153:507-516). В некоторых вариантах осуществления сигнальная последовательность расположена в нативной последовательности или может быть получена из последовательности согласно вариантам осуществления. Применяемая в данном документе “лидерная последовательность” относится к любой последовательности, которая при трансляции приводит к аминокислотной последовательности, способной запускать сопряженный с трансляций транспорт пептидной цепи во внутриклеточную органеллу. Таким образом, это включает лидерные последовательности, нацеливающие транспорт и/или гликозилирование путем перехода в эндоплазматический ретикулум, перехода в вакуоли, пластиды, в том числе хлоропласты, митохондрии и т.п. Кодируемые в ядре белки, нацеленные в компартмент полости тилакоида хлоропластов, имеют характерный двойной транзитный пептид, состоящий из сигнального пептида, нацеливающего на строму, и сигнального пептида, нацеливающего на полость. Информация для нацеливания на строму находится в ближайшей к амино-концу части транзитного пептида. Сигнальный пептид, нацеливающий на строму, находится в ближайшей к карбокси-концу части транзитного пептида и содержит всю информацию для нацеливания на полость. Последние исследования по протеомике хлоропластов высших растений добились успеха в идентификации многочисленных кодируемых в ядре белков полости (Kieselbach et al. FEBS LETT 480:271-276, 2000; Peltier et al. Plant Cell 12:319-341, 2000; Bricker et al. Biochim. Biophys Acta 1503:350-356, 2001), из которых сигнальный пептид, нацеливающий на полость, может потенциально применяться в соответствии с настоящим раскрытием. О приблизительно 80 белках из Arabidopsis, а также гомологичных белках из шпината и гороха огородного сообщается в Kieselbach et al., Photosynthesis Research, 78:249-264, 2003. В частности, в таблице 2 этой публикации, которая включена в настоящее описание посредством ссылки, раскрыто 85 белков из полости хлоропласта, идентифицированных по их номеру доступа (см. также публикацию заявки на патент США 2009/09044298). В дополнение, опубликованная недавно предварительная версия генома риса (Goff et al, Science 296:92-100, 2002) является подходящим источником для информации о сигнальном пептиде, нацеливающим на полость, который можно применять в соответствии с настоящим раскрытием.
Подходящие транзитные пептиды хлоропластов (CTP), хорошо известные специалисту в данной области техники, также включают химерные CTP, содержащие без ограничения N-концевой домен, центральный домен или C-концевой домен от CTP из 1-дезокси-D ксилоза-5-фосфатсинтазы Oryza sativa, супероксиддисмутазы Oryza sativa, синтазы растворимого крахмала Oryza sativa, NADP-зависимого фермента, действующего на яблочную кислоту, Oryza sativa, фосфо-2-дегидро-3-дезоксигептонатальдолазы 2 Oryza sativa, L-аскорбатпероксидазы 5 Oryza sativa, фосфоглюкан-вода-дикиназы Oryza sativa, ssRUBISCO Zea Mays, бета-глюкозидазы Zea Mays, малатдегидрогеназы Zea Mays, тиоредоксина M-типа Zea Mays из патентной публикации США 2012/0304336).
В некоторых вариантах осуществления полипептиды AfIP-1A и AfIP-1B экспрессируются из отдельных генов, причем квалифицированный специалист будет понимать, что два компонента могут быть функционально связаны с различными сигналами внутриклеточного нацеливания обсуждаемого выше типа, так что полипептиды AfIP-1A и AfIP-1B экспрессируются и/или хранятся в различных внутриклеточных компартментах. В некоторых вариантах осуществления один из полипептидов AfIP-1A или AfIP-1B может экспрессироваться с помощью химерного гена, в котором кодирующая последовательность функционально связана с пластидным транзитным пептидом, так что полипептид локализуется в пластиде [например в зеленой ткани, хлоропласте], тогда как другой полипептид экспрессируется с применением нацеливающего сигнала, так что полипептид расположен в вакуоли, апопласте или цитоплазме. Таким образом, AfIP-1A и AfIP-1B в интактной клетке разделены, но собираются вместе, если клеточные мембраны нарушаются, например, вследствие действия насекомых, грибов или других патогенов.
Ген полипептида AfIP-1A и/или AfIP-1B, подлежащего нацеливанию в хлоропласт, можно оптимизировать для экспрессии в хлоропласте с учетом отличий по использованию кодонов между растительным ядром и этой органеллой. Таким образом, нуклеиновые кислоты, представляющие интерес, можно синтезировать с применением кодонов, предпочтительных для хлоропласта. См., например, патент США № 5380831, включенный в данный документ посредством ссылки.
При получении кассеты экспрессии с различными фрагментами ДНК можно проводить манипуляции так, чтобы получить последовательности ДНК в надлежащей ориентации и, при необходимости, в надлежащей рамке считывания. С этой целью, для соединения фрагментов ДНК можно использовать адаптеры или линкеры, или можно задействовать другие манипуляции для обеспечения подходящих сайтов рестрикции, удаления избыточной ДНК, удаления сайтов рестрикции и т.п. С этой целью можно задействовать мутагенез in vitro, репарацию с помощью праймеров, рестрикцию, отжиг, повторные замены, например, транзиции и трансверсии.
При практическом осуществлении вариантов осуществления можно применять ряд промоторов. Промоторы можно выбирать, исходя из требуемого результата. Нуклеиновые кислоты можно комбинировать с конститутивными, специфичными в отношении ткани, индуцируемыми или другими промоторами для экспрессии в организме-хозяине. Подходящие конститутивные промоторы для применения в растительной клетке-хозяине включают, например, коровый промотор промотора Rsyn7 и другие конститутивные промоторы, раскрытые в WO 1999/43838 и патенте США № 6072050; коровый промотор CaMV 35S (Odell, et al., (1985) Nature 313:810-812); промотор актина риса (McElroy, et al., (1990) Plant Cell 2:163-171); убиквитина (Christensen, et al., (1989) Plant Mol. Biol. 12:619-632 и Christensen, et al., (1992) Plant Mol. Biol. 18:675-689); pEMU (Last, et al., (1991) Theor. Appl. Genet. 81:581-588); MAS (Velten, et al., (1984) EMBO J. 3:2723-2730); ALS (патент США № 5659026) и т.п. Другие конститутивные промоторы включают, например, раскрытые в патентах США №№ 5608149; 5608144; 5604121; 5569597; 5466785; 5399680; 5268463; 5608142 и 6177611.
В зависимости от требуемого результата, может быть полезно экспрессировать ген при помощи индуцируемого промотора. Особый интерес для регуляции экспрессии нуклеотидных последовательностей согласно вариантам осуществления у растений представляют собой индуцируемые ранением промоторы. Такие индуцируемые ранением промоторы могут реагировать на повреждение, вызванное питанием насекомого, и они включают ген ингибитора протеиназы картофеля (pin II) (Ryan, (1990) Ann. Rev. Phytopath. 28:425-449; Duan, et al., (1996) Nature Biotechnology 14:494-498); wun1 и wun2, патент США № 5428148; win1 и win2 (Stanford, et al., (1989) Mol. Gen. Genet. 215:200-208); системин (McGurl, et al., (1992) Science 225:1570-1573); WIP1 (Rohmeier, et al., (1993) Plant Mol. Biol. 22:783-792; Eckelkamp, et al., (1993) FEBS Letters 323:73-76); ген MPI (Corderok, et al., (1994) Plant J. 6(2):141-150) и т.п., включенные в данный документ посредством ссылки.
Кроме того, в способах и нуклеотидных конструкциях согласно вариантам осуществления можно использовать индуцируемые патогеном промоторы. Такие индуцируемые патогеном промоторы включают промоторы из патоген-связанных белков (PR-белки), которые индуцируются после заражения патогеном; например, PR-белки, SAR-белки, бета-1,3-глюканаза, хитиназа и т.д. См., например, Redolfi, et al., (1983) Neth. J. Plant Pathol. 89:245-254; Uknes, et al., (1992) Plant Cell 4: 645-656 и Van Loon, (1985) Plant Mol. Virol. 4:111-116. См. также WO 1999/43819, включенную в данный документ посредством ссылки.
Представляют интерес промоторы, которые экспрессируются локально в месте заражения патогеном или рядом с ним. См., например, Marineau, et al., (1987) Plant Mol. Biol. 9:335-342; Matton, et al., (1989) Molecular Plant-Microbe Interactions 2:325-331; Somsisch, et al., (1986) Proc. Natl. Acad. Sci. USA 83:2427-2430; Somsisch, et al., (1988) Mol. Gen. Genet. 2:93-98 и Yang, (1996) Proc. Natl. Acad. Sci. USA 93:14972-14977. См. также Chen, et al., (1996) Plant J. 10:955-966; Zhang, et al., (1994) Proc. Natl. Acad. Sci. USA 91:2507-2511; Warner, et al., (1993) Plant J. 3:191-201; Siebertz, et al., (1989) Plant Cell 1:961-968; патент США № 5750386 (индуцируемый нематодами) и ссылочные документы, процитированные в них. Особый интерес представляет индуцируемый промотор для гена маиса PRms, экспрессия которого индуцируется патогеном Fusarium moniliforme (см., например, Cordero et al. Mol. Plant Path. 41:189-200).
Регулируемые химическими веществами промоторы можно использовать для модуляции экспрессии гена в растении посредством применения экзогенного химического регулятора. В зависимости от цели промотор может представлять собой индуцируемый химическим веществом промотор, при этом применение химического вещества индуцирует экспрессию гена, или репрессируемый химическим веществом промотор, при этом применение химического вещества подавляет экспрессию гена. Индуцируемые химическими веществами промоторы известны из уровня техники, и они включают без ограничения промотор In2-2 маиса, который активируется антидотами к бензолсульфонамидным гербицидам, промотор GST маиса, который активируется гидрофобными электрофильными соединениями, которые применяются в качестве предвсходовых гербицидов, и промотор PR-1a табака, который активируется салициловой кислотой. Другие регулируемые химическими веществами промоторы, представляющие интерес, включают чувствительные к стероидам промоторы (см., например, индуцируемый глюкокортикоидом промотор в Schena, et al., (1991) Proc. Natl. Acad. Sci. USA 88:10421-10425 и McNellis, et al., (1998) Plant J. 14(2):247-257), а также индуцируемые тетрациклинами и репрессируемые тетрациклинами промоторы (см., например, Gatz, et al., (1991) Mol. Gen. Genet. 227:229-237 и патенты США №№ 5814618 и 5789156), включенные в данный документ посредством ссылки.
Промоторы, активные преимущественно в определенной ткани, можно использовать для нацеливания улучшенной экспрессии полипептида AfIP-1A и/или AfIP-1B в конкретной растительной ткани. Промоторы, активные преимущественно в определенной ткани, включают промоторы, обсуждаемые в Yamamoto, et al., (1997) Plant J. 12(2):255-265; Kawamata, et al., (1997) Plant Cell Physiol. 38(7):792-803; Hansen, et al., (1997) Mol. Gen Genet. 254(3):337-343; Russell, et al., (1997) Transgenic Res. 6(2):157-168; Rinehart, et al., (1996) Plant Physiol. 112(3):1331-1341; Van Camp, et al., (1996) Plant Physiol. 112(2):525-535; Canevascini, et al., (1996) Plant Physiol. 112(2):513-524; Yamamoto, et al., (1994) Plant Cell Physiol. 35(5):773-778; Lam, (1994) Results Probl. Cell Differ. 20:181-196; Orozco, et al., (1993) Plant Mol Biol. 23(6):1129-1138; Matsuoka, et al., (1993) Proc Natl. Acad. Sci. USA 90(20):9586-9590 и Guevara-Garcia, et al., (1993) Plant J. 4(3):495-505. В случае необходимости, такие промоторы можно модифицировать с получением слабой экспрессии.
Промоторы, активные преимущественно в листьях, известны из уровня техники. См., например, Yamamoto, et al., (1997) Plant J. 12(2):255-265; Kwon, et al., (1994) Plant Physiol. 105:357-67; Yamamoto, et al., (1994) Plant Cell Physiol. 35(5):773-778; Gotor, et al., (1993) Plant J. 3:509-18; Orozco, et al., (1993) Plant Mol. Biol. 23(6):1129-1138 и Matsuoka, et al., (1993) Proc. Natl. Acad. Sci. USA 90(20):9586-9590.
Известны промоторы, активные преимущественно в корнях, или промоторы, специфические в отношении корней, и их можно выбирать из многих доступных из литературы или выделенных de novo из различных совместимых видов. См., например, Hire, et al., (1992) Plant Mol. Biol. 20(2):207-218 (специфичный в отношении корней сои ген глутаминсинтетазы); Keller and Baumgartner, (1991) Plant Cell 3(10):1051-1061 (специфичный в отношении корней регуляторный элемент в гене GRP 1.8 фасоли); Sanger, et al., (1990) Plant Mol. Biol. 14(3):433-443 (специфичный в отношении корней ген маннопинсинтазы (MAS) Agrobacterium tumefaciens) и Miao, et al., (1991) Plant Cell 3(1):11-22 (клон кДНК полной длины, кодирующий цитозольную глутаминсинтазу (GS), которая экспрессируется в корнях и корневых клубеньках сои). Смотрите также Bogusz et al. (1990) Plant Cell 2(7):633-641, где описаны два промотора, специфические в отношении корней, выделенные из генов гемоглобина от азотфиксирующего растения Parasponia andersonii, не относящегося к бобовым, и родственного растения Trema tomentosa, не относящегося к бобовым и не являющегося азотфиксирующим. Промоторы этих генов были связаны с репортерным геном β-глюкуронидазы и введены как в Nicotiana tabacum, не относящийся к бобовым, так и в бобовое Lotus corniculatus, и при этом в обоих случаях специфичная в отношении корней активность промотора сохранялась. Leach и Aoyagi (1991) описывают свой анализ промоторов, обеспечивающих высокий уровень экспрессии генов roIC и roID Agrobacterium rhizogenes, индуцирующих разрастание корней (см. Plant Science (Limerick) 79(1):69-76). Они пришли к выводу, что в этих промоторах энхансер и ДНК-детерминанты, активные преимущественно в определенной ткани, разделены. Teeri et al. (1989) применяли слияние гена с lacZ для того, чтобы показать, что ген из T-ДНК Agrobacterium, кодирующий октопинсинтазу, является особенно активным в эпидермисе кончика корня, и что ген TR2' является специфическим в отношении корней в интактном растении и стимулируется при ранении в ткани листа, что является особенно требуемой комбинацией характеристик для применения с инсектицидным или ларвицидным геном (смотрите EMBO J. 8(2):343-350). Ген TR1', слитый с nptII (неомицинфосфотрансфераза II), продемонстрировал аналогичные характеристики. Дополнительные промоторы, активные преимущественно в корнях, включают промотор гена VfENOD-GRP3 (Kuster et al. Biol. 29(4):759-772) и промотор rolB (Capana, et al., (1994) Plant Mol. Biol. 25(4):681-691. См. также патенты США №№ 5837876; 5750386; 5633363; 5459252; 5401836; 5110732 и 5023179. Регуляторные последовательности, активные преимущественно в корнях Arabidopsis thaliana, раскрыты в US 20130117883.
Промоторы, “активные преимущественно в семени”, включают как промоторы, “специфические в отношении семени” (промоторы, которые активны во время развития семени, такие как промоторы запасных белков семени), так и промоторы “прорастания семени” (промоторы, которые активны во время прорастания семени). См. Thompson, et al., (1989) BioEssays 10:108, включенную в настоящий документ посредством ссылки. Такие промоторы, активные преимущественно в семени, включают без ограничения Cim1 (индуцируемый цитокинином транскрипт); cZ19B1 (19 кДа зеин маиса) и milps (мио-инозитол-1-фосфатсинтаза); (см. патент США № 6225529, включенный в настоящий документ посредством ссылки). Гамма-зеин и Glb-1 представляют собой специфические в отношении эндосперма промоторы. Для двудольных промоторы, специфические в отношении семени, включают без ограничения промотор гена ингибитора трипсина Кунитца 3 (KTi3) (Jofuku and Goldberg, (1989) Plant Cell 1:1079-1093), β-фазеолина бобов, напина, β-конглицинина, глицинина 1, лектина сои, круциферина и т.п. Для однодольных растений промоторы, специфические в отношении семени, включают без ограничения промоторы из генов 15 кДа зеина маиса, 22 кДа зеина, 27 кДа зеина, g-зеина, waxy, shrunken 1, shrunken 2, глобулина 1 и т.д. См. также WO 2000/12733, где раскрыты промоторы, активные преимущественно в семени, из генов end1 и end2; включенную в данный документ посредством ссылки. У двудольных, промоторы, специфические в отношении семени, включают без ограничения промотор гена белков семенной оболочки из Arabidopsis, pBAN; а также промоторы генов раннего развития семян из Arabidopsis, p26, p63 и p63tr (патенты США №№ 7294760 и 7847153). Промотор, который имеет “преимущественную” экспрессию в конкретной ткани, экспрессируется в такой ткани в большей степени, чем по меньшей мере в одной другой растительной ткани. Для некоторых промоторов, активных преимущественно в определенной ткани, показана экспрессия почти исключительно в конкретной ткани.
Если требуется низкий уровень экспрессии, будут применяться слабые промоторы. Как правило, применяемый в данном документе термин "слабый промотор" относится к промотору, который управляет экспрессией кодирующей последовательности на низком уровне. Под низким уровнем экспрессии подразумевают уровни от приблизительно 1/1000 транскриптов до приблизительно 1/100000 транскриптов, до приблизительно 1/500000 транскриптов. В качестве альтернативы, понятно, что термин “слабые промоторы” также охватывает промоторы, которые управляют экспрессией только в небольшом количестве клеток и не управляют в других, при этом обеспечивается общий низкий уровень экспрессии. Если промотор управляет экспрессией с неприемлемо высокими уровнями, части промоторной последовательности можно удалить или модифицировать для снижения уровней экспрессии.
Такие слабые конститутивные промоторы включают, например, коровый промотор промотора Rsyn7 (WO 1999/43838 и патент США № 6072050), коровый промотор 35S CaMV и т.п. Другие конститутивные промоторы включают, например, раскрытые в патентах США №№ 5608149; 5608144; 5604121; 5569597; 5466785; 5399680; 5268463; 5608142 и 6177611, включенные в данный документ посредством ссылки.
Приведенный выше перечень промоторов не предназначен для ограничения. В вариантах осуществления можно применять любой подходящий промотор.
Как правило, кассета экспрессии будет содержать ген селектируемого маркера для отбора трансформированных клеток. Гены селектируемых маркеров используют для отбора трансформированных клеток или тканей. Гены маркеров включают гены, кодирующие устойчивость к антибиотику, такие как гены, кодирующие неомицинфосфотрансферазу II (NEO) и гигромицинфосфотрансферазу (HPT), а также гены, обеспечивающие устойчивость к гербицидным соединениям, таким как глуфосинат аммония, бромоксинил, имидазолиноны и 2,4-дихлорфеноксиацетат (2,4-D). Дополнительные примеры генов подходящих селектируемых маркеров включают без ограничения гены, кодирующие устойчивость к хлорамфениколу (Herrera Estrella, et al., (1983) EMBO J. 2:987-992); метотрексату (Herrera Estrella, et al., (1983) Nature 303:209-213 и Meijer, et al., (1991) Plant Mol. Biol. 16:807-820); стрептомицину (Jones, et al., (1987) Mol. Gen. Genet. 210:86-91); спектиномицину (Bretagne-Sagnard, et al., (1996) Transgenic Res. 5:131-137); блеомицину (Hille, et al., (1990) Plant Mol. Biol. 7:171-176); сульфонамиду (Guerineau, et al., (1990) Plant Mol. Biol. 15:127-136); бромоксинилу (Stalker, et al., (1988) Science 242:419-423); глифосату (Shaw, et al., (1986) Science 233:478-481 и патентные заявки США с серийными номерами 10/004357 и 10/427692); фосфинотрицину (DeBlock, et al., (1987) EMBO J. 6:2513-2518). См., как правило, Yarranton, (1992) Curr. Opin. Biotech. 3:506-511; Christopherson, et al., (1992) Proc. Natl. Acad. Sci. USA 89:6314-6318; Yao, et al., (1992) Cell 71:63-72; Reznikoff, (1992) Mol. Microbiol. 6:2419-2422; Barkley, et al., (1980) в The Operon, pp. 177-220; Hu, et al., (1987) Cell 48:555-566; Brown, et al., (1987) Cell 49:603-612; Figge, et al., (1988) Cell 52:713-722; Deuschle, et al., (1989) Proc. Natl. Acad. Sci. USA 86:5400-5404; Fuerst, et al., (1989) Proc. Natl. Acad. Sci. USA 86:2549-2553; Deuschle, et al., (1990) Science 248:480-483; Gossen, (1993) Ph.D. Thesis, University of Heidelberg; Reines, et al., (1993) Proc. Natl. Acad. Sci. USA 90:1917-1921; Labow, et al., (1990) Mol. Cell. Biol. 10:3343-3356; Zambretti, et al., (1992) Proc. Natl. Acad. Sci. USA 89:3952-3956; Baim, et al., (1991) Proc. Natl. Acad. Sci. USA 88:5072-5076; Wyborski, et al., (1991) Nucleic Acids Res. 19:4647-4653; Hillenand-Wissman, (1989) Topics Mol. Struc. Biol. 10:143-162; Degenkolb, et al., (1991) Antimicrob. Agents Chemother. 35:1591-1595; Kleinschnidt, et al., (1988) Biochemistry 27:1094-1104; Bonin, (1993) Ph.D. Thesis, University of Heidelberg; Gossen, et al., (1992) Proc. Natl. Acad. Sci. USA 89:5547-5551; Oliva, et al., (1992) Antimicrob. Agents Chemother. 36:913-919; Hlavka, et al., (1985) Handbook of Experimental Pharmacology, Vol. 78 (Springer-Verlag, Berlin) и Gill, et al., (1988) Nature 334:721-724. Такие раскрытия включены в данный документ посредством ссылки.
Приведенный выше перечень селектируемых маркерных генов не предназначен быть ограничивающим. Любой ген селектируемого маркера можно применять в вариантах осуществления.
Трансформация растений
Способы согласно вариантам осуществления включают введение полипептида или полинуклеотида в растение. Применяемое в данном документе "введение" означает представление растению полинуклеотида или полипептида таким способом, что последовательность проникает внутрь клетки растения. Способы согласно вариантам осуществления не зависят от конкретного способа введения полинуклеотида или полипептида в растение, за ограничением того, что полинуклеотид или полипептиды проникают внутрь по меньшей мере одной клетки растения. Из уровня техники известны способы введения полинуклеотида и/или полипептидов в растения, в том числе без ограничений способы стабильной трансформации, способы временной трансформации и способы трансформации, опосредованной вирусами.
Применяемая в данном документе "стабильная трансформация" означает, что нуклеотидная конструкция, введенная в растение, интегрируется в геном растения и может наследоваться его потомством. Применяемая в данном документе "временная трансформация" означает, что полинуклеотид вводится в растение и не интегрируется в геном растения, или в растение вводится полипептид. Применяемое в данном документе “растение” относится к целым растениям, органам растения (например, листьям, стеблям, корням и т.д.), семенам, растительным клеткам, частям растения для вегетативного размножения, зародышам и их потомству. Растительные клетки могут быть дифференцированными или недифференцированными (например клетками каллюса, клетками суспензионных культур, протопластами, клетками листьев, клетками корней, клетками флоэмы и пыльцой).
Протоколы трансформации, а также протоколы для введения нуклеотидных последовательностей в растения могут варьировать в зависимости от типа растения или растительной клетки, т.е. однодольных или двудольных, на которые нацелена трансформация. Подходящие способы введения нуклеотидных последовательностей в растительные клетки и последующей вставки в геном растения включают микроинъекцию (Crossway, et al., (1986) Biotechniques 4:320-334), электропорацию (Riggs, et al., (1986) Proc. Natl. Acad. Sci. USA 83:5602-5606), трансформацию, опосредованную Agrobacterium (патенты США №№ 5563055 и 5981840), прямой перенос генов (Paszkowski, et al., (1984) EMBO J. 3:2717-2722) и баллистическое ускорение частиц (см., например, патенты США №№ 4945050; 5879918; 5886244 и 5932782; Tomes, et al., (1995) в Plant Cell, Tissue, and Organ Culture: Fundamental Methods, ed. Gamborg and Phillips, (Springer-Verlag, Berlin) и McCabe, et al., (1988) Biotechnology 6:923-926) и трансформацию Lecl (WO 00/28058). Что касается трансформации картофеля, см. Tu, et al., (1998) Plant Molecular Biology 37:829-838 и Chong, et al., (2000) Transgenic Research 9:71-78. Дополнительные процедуры трансформации можно найти у Weissinger, et al., (1988) Ann. Rev. Genet. 22:421-477; Sanford, et al., (1987) Particulate Science and Technology 5:27-37 (лук); Christou, et al., (1988) Plant Physiol. 87:671-674 (соя); McCabe, et al., (1988) Bio/Technology 6:923-926 (соя); Finer and McMullen, (1991) в Vitro Cell Dev. Biol. 27P:175-182 (соя); Singh, et al., (1998) Theor. Appl. Genet. 96:319-324 (соя); Datta, et al., (1990) Biotechnology 8:736-740 (рис); Klein, et al., (1988) Proc. Natl. Acad. Sci. USA 85:4305-4309 (маис); Klein, et al., (1988) Biotechnology 6:559-563 (маис); патенты США №№ 5240855; 5322783 и 5324646; Klein, et al., (1988) Plant Physiol. 91:440-444 (маис); Fromm, et al., (1990) Biotechnology 8:833-839 (маис); Hooykaas-Van Slogteren, et al., (1984) Nature (London) 311:763-764; патент США № 5736369 (злаки); Bytebier, et al., (1987) Proc. Natl. Acad. Sci. USA 84:5345-5349 (Liliaceae); De Wet, et al., (1985) в The Experimental Manipulation of Ovule Tissues, ed. Chapman, et al., (Longman, New York), pp. 197-209 (пыльца); Kaeppler, et al., (1990) Plant Cell Reports 9:415-418 и Kaeppler, et al., (1992) Theor. Appl. Genet. 84:560-566 (трансформация, опосредованная вискерами); D'Halluin, et al., (1992) Plant Cell 4:1495-1505 (электропорация); Li, et al., (1993) Plant Cell Reports 12:250-255 и Christou and Ford, (1995) Annals of Botany 75:407-413 (рис); Osjoda, et al., (1996) Nature Biotechnology 14:745-750 (трансформация маиса с помощью Agrobacterium tumefaciens); все из которых включены в данный документ посредством ссылки.
В определенных вариантах осуществления последовательности согласно вариантам осуществления можно предоставлять растению с применением ряда способов временной трансформации. Такие способы временной трансформации включают без ограничения введение полипептида AfIP-1A и/или AfIP-1B или его вариантов и фрагментов непосредственно в растение или введение транскрипта полипептида AfIP-1A и/или AfIP-1B в растение. Такие способы включают, например, микроинъекцию или бомбардировку частицами. См., например, Crossway, et al., (1986) Mol Gen. Genet. 202:179-185; Nomura, et al., (1986) Plant Sci. 44:53-58; Hepler, et al., (1994) Proc. Natl. Acad. Sci. 91:2176-2180 и Hush, et al., (1994) The Journal of Cell Science 107:775-784, все из которых включены в данный документ посредством ссылки. В качестве альтернативы, полинуклеотидом полипептида AfIP-1A и/или AfIP-1B можно временно трансформировать растение с применением методик, известных из уровня техники. Такие методики включают систему вирусного вектора и преципитацию полинуклеотида таким способом, который исключает последующее высвобождение ДНК. Таким образом, может происходить транскрипция ДНК, связанной с частицами, но частота, с которой она высвобождается для интеграции в геном, в значительной степени снижена. Такие способы включают применение частиц, покрытых полиэтиленимином (PEI; № по кат. Sigma P3143).
Из уровня техники известны способы нацеленной вставки полинуклеотида в специфическое расположение в геноме растения. В одном варианте осуществления вставку полинуклеотида в требуемое положение в геноме выполняют с использованием системы сайт-специфической рекомбинации. См., например, WO 1999/25821, WO 1999/25854, WO 1999/25840, WO 1999/25855 и WO 1999/25853, все из которых включены в данный документ с помощью ссылки. Вкратце, полинуклеотид согласно вариантам осуществления может содержаться в кассете для переноса, фланкированной двумя неидентичными сайтами рекомбинации. Кассету для переноса вводят в растение, имеющее в своем геноме стабильно встроенный целевой сайт, фланкированный двумя неидентичными сайтами рекомбинации, которые соответствуют сайтам кассеты для переноса. Обеспечивают подходящую рекомбиназу, и кассета для переноса интегрируется в целевой сайт. Полинуклеотид, представляющий интерес, таким образом, интегрируют в специфическое хромосомное положение в геноме растения.
Векторы для трансформации растений могут состоять из одного или нескольких ДНК-векторов, необходимых для достижения трансформации растения. Например, общепринятой практикой в области техники является использование векторов для трансформации растений, которые состоят из более одного смежного сегмента ДНК. В уровне техники эти векторы зачастую называют “бинарными векторами”. Бинарные векторы, а также векторы с плазмидами-помощниками наиболее часто применяются при трансформации, опосредованной Agrobacterium, при этом размер и сложность сегментов ДНК, необходимых для достижения эффективной трансформация, являются очень большими, и предпочтительным является разделение функций на отдельных молекулах ДНК. Бинарные векторы, как правило, содержат плазмидный вектор, который содержит действующие в цис-положении последовательности, требуемые для переноса Т-ДНК (как, например, левой границы и правой границы), селектируемый маркер, который разрабатывают таким образом, что он может экспрессироваться в растительной клетке, и “ген, представляющий интерес” (ген, разработанный таким образом, что он может экспрессироваться в растительной клетке, из которой требуется получить трансгенные растения). Также в этом плазмидном векторе присутствуют последовательности, требуемые для репликации в бактериях. Действующие в цис-положении последовательности расположены так, чтобы обеспечить возможность эффективного переноса в растительные клетки и экспрессии в них. Например, ген селектируемого маркера и пестицидного гена расположены между левой и правой границами. Часто второй плазмидный вектор содержит действующие в транс-положении факторы, которые опосредуют перенос T-ДНК из Agrobacterium в растительные клетки. Эта плазмида часто содержит функции вирулентности (гены Vir), что обеспечивает возможность заражения растительных клеток Agrobacterium и перенос ДНК путем расщепления по граничным последовательностям и переноса ДНК, опосредованного vir, как понятно из уровня техники (Hellens and Mullineaux, (2000) Trends in Plant Science 5:446-451). Несколько типов штаммов Agrobacterium (например, LBA4404, GV3101, EHA101, EHA105 и т.п.) можно применять для трансформации растений. Второй плазмидный вектор не является необходимым для трансформации растений другими способами, такими как бомбардировка микрочастицами, микроинъекция, электропорация, с помощью полиэтиленгоиколя и т.д.
В целом, способы трансформации растений включают перенос гетерологичной ДНК в целевые растительные клетки (например, незрелые или зрелые зародыши, суспензионные культуры, недифференцированный каллюс, протопласты и т.д.), с последующим применением соответствующего отбора с максимальным пороговым значением (в зависимости от гена селектируемого маркера) для выделения трансформированных растительных клеток из группы нетрансформированной клеточной массы. После интеграции гетерологичной чужеродной ДНК в растительные клетки затем применяют соответствующий отбор с максимальным пороговым значением в среде для уничтожения нетрансформированных клеток и отделения и размножения предположительно трансформированных клеток, которые переживают эту обработку с отбором, посредством регулярного переноса на свежую среду. При помощи продолжающегося пассирования и проверки при помощи соответствующего отбора идентифицируют и размножают клетки, которые трансформированы плазмидным вектором. Затем можно применять молекулярные и биохимические способы для подтверждения присутствия интегрированного гетерологичного гена, представляющего интерес, в геноме трансгенного растения.
Эксплантаты, как правило, переносят в свежую порцию той же среды и культивируют обычным способом. Впоследствии трансформированные клетки дифференцируются в побеги после помещения в среду для регенерации, дополненную средством отбора с максимальным пороговым значением. Побеги затем переносят на селективную среду для выращивания растений с получением укоренившихся побегов или саженцев. Затем трансгенный саженец выращивают до зрелого растения и получают фертильные семена (например, Hiei, et al., (1994) The Plant Journal 6:271-282; Ishida, et al., (1996) Nature Biotechnology 14:745-750). Эксплантаты, как правило, переносят на свежую порцию той же среды и культивируют обычным способом. Общее описание методик и способов для получения трансгенных растений приведены в Ayres and Park, (1994) Critical Reviews in Plant Science 13:219-239 и Bommineni and Jauhar, (1997) Maydica 42:107-120. Поскольку трансформированный материал содержит множество клеток, как трансформированные, так и нетрансформированные клетки присутствуют в любой части подвергнутого воздействию целевого каллюса или ткани, или группы клеток. Возможность уничтожать нетрансформированные клетки и обеспечивать размножение трансформированных клеток приводит в результате к трансформированным растительным культурам. Зачастую, возможность удаления нетрансформированных клеток является ограничивающим фактором для быстрого получения трансформированных растительных клеток и успешного выращивания трансгенных растений.
Из клеток, которые были трансформированы, можно вырастить растения в соответствии с традиционными способами. См., например, McCormick, et al., (1986) Plant Cell Reports 5:81-84. Эти растения затем можно выращивать и либо опылять такой же трансформированной линией, либо другой линией, и идентифицировать полученный гибрид с конститутивной или индуцируемой экспрессией требуемой фенотипической характеристики. Можно вырастить два или более поколений для того, чтобы убедиться в том, что экспрессия требуемой фенотипической характеристики стабильно поддерживается и наследуется, а затем собрать семена, чтобы убедиться в том, что экспрессия требуемой фенотипической характеристики была достигнута.
Нуклеотидные последовательности согласно вариантам осуществления можно обеспечить в растении при помощи контакта растения с вирусом или вирусными нуклеиновыми кислотами. Как правило, такие способы включают встраивание нуклеотидной конструкции, представляющей интерес, в вирусную молекулу ДНК или РНК. Понятно, что рекомбинантные белки согласно вариантам осуществления можно первоначально синтезировать как часть вирусного полипротеина, который позже может быть процессирован путем протеолиза in vivo или in vitro с образованием требуемого полипептида AfIP-1A и/или AfIP-1B. Также понятно, что такой вирусный полипротеин, содержащий по меньшей мере часть аминокислотной последовательности полипептида AfIP-1A и/или AfIP-1B согласно вариантам осуществления, может обладать требуемой пестицидной активностью. Такие вирусные полипротеины и нуклеотидные последовательности, которые их кодируют, охвачены вариантами осуществления. Способы получения растений с нуклеотидными конструкциями и продукции кодируемых белков в растениях, которые включают вирусные молекулы ДНК или РНК, известны из уровня техники. См., например, патенты США №№ 5889191; 5889190; 5866785; 5589367 и 5316931; включенные в данный документ посредством ссылки.
Способы трансформации хлоропластов известны из уровня техники. См., например, Svab, et al., (1990) Proc. Natl. Acad. Sci. USA 87:8526-8530; Svab and Maliga, (1993) Proc. Natl. Acad. Sci. USA 90:913-917; Svab and Maliga, (1993) EMBO J. 12:601-606. Способ основан на доставке генной пушкой ДНК, содержащей селектируемый маркер, и нацеливания ДНК в геном пластид с помощью гомологичной рекомбинации. Кроме того, трансформацию пластид можно осуществлять трансактивацией молчащего трансгена, находящегося в пластидах, путем экспрессии, осуществляемой преимущественно в определенной ткани, РНК-полимеразы, кодируемой ядерным геномом и функционирующей в пластиде. О такой системе сообщали в McBride, et al., (1994) Proc. Natl. Acad. Sci. USA 91:7301-7305.
Варианты осуществления дополнительно относятся к материалу для размножения трансформированного растения согласно вариантам осуществления, в том числе без ограничения семенам, клубням, клубнелуковицам, луковицам, листьям и черенкам корней и побегов.
Варианты осуществления можно применять для трансформации любых видов растений, в том числе без ограничения однодольных и двудольных. Примеры растений, представляющих интерес, включают без ограничений кукурузу (Zea mays), Brassica sp. (например, B. napus, B. rapa, B. juncea), в частности виды Brassica, пригодные в качестве источников растительного масла, люцерну (Medicago sativa), рис (Oryza sativa), рожь (Secale cereale), сорго (Sorghum bicolor, Sorghum vulgare), просо (например, пеннисетум рогозовидный (Pennisetum glaucum), просо культурное (Panicum miliaceum), щетинник итальянский (Setaria italica), просо пальчатое (Eleusine coracana)), подсолнечник (Helianthus annuus), сафлор (Carthamus tinctorius), пшеницу (Triticum aestivum), сою (Glycine max), табак (Nicotiana tabacum), картофель (Solanum tuberosum), разновидности арахиса (Arachis hypogaea), хлопчатник (Gossypium barbadense, Gossypium hirsutum), сладкий картофель (Ipomoea batatus), маниок (Manihot esculenta), кофейное дерево (Coffea spp.), кокосовую пальму (Cocos nucifera), ананас (Ananas comosus), цитрусовые деревья (Citrus spp.), шоколадное дерево (Theobroma cacao), чайный куст (Camellia sinensis), банан (Musa spp.), авокадо (Persea americana), инжир (Ficus casica), гуаву (Psidium guajava), манго (Mangifera indica), маслину (Olea europaea), папайю (Carica papaya), кешью (Anacardium occidentale), макадамию (Macadamia integrifolia), миндаль (Prunus amygdalus), разновидности сахарной свеклы (Beta vulgaris), сахарный тростник (Saccharum spp.), разновидности овса, ячмень, овощи, декоративные растения и хвойные деревья.
Овощи включают томаты (Lycopersicon esculentum), латук (например, Lactuca sativa), зеленую фасоль (Phaseolus vulgaris), лимскую фасоль (Phaseolus limensis), разновидности гороха (Lathyrus spp.) и представителей рода Cucumis, таких как огурец (C. sativus), канталупа (C. cantalupensis) и дыня мускусная (C. melo). Декоративные растения включают азалию (Rhododendron spp.), гортензию (Macrophylla hydrangea), гибискус (Hibiscus rosasanensis), виды роз (Rosa spp.), виды тюльпанов (Tulipa spp.), виды нарциссов (Narcissus spp.), разновидности петунии (Petunia hybrida), гвоздику (Dianthus caryophyllus), паунсеттию (Euphorbia pulcherrima) и хризантему. Хвойные, которые можно использовать при практическом осуществлении вариантов осуществления, включают, например, виды сосны, такие как сосна ладанная (Pinus taeda), сосна Эллиота (Pinus elliotii), сосна желтая (Pinus ponderosa), сосна скрученная широкохвойная (Pinus contorta) и сосна лучистая (Pinus radiata); псевдотсугу Мензиса (Pseudotsuga menziesii); тсугу канадскую (Tsuga canadensis); ель белую (Picea glauca); секвойю (Sequoia sempervirens); виды пихты, такие как пихта миловидная (Abies amabilis) и пихта бальзамическая (Abies balsamea), и виды туйи, такие как туя гигантская (Thuja plicata) и каллитропсис нутканский (Chamaecyparis nootkatensis). Растения согласно вариантам осуществления включают культурные растения (например, кукурузу, люцерну, подсолнечник, Brassica, сою, хлопчатник, сафлор, арахис, сорго, пшеницу, просо, табак т.д.), такие как растения кукурузы и сои.
Разновидности газонной травы включают без ограничения: мятлик однолетний (Poa annua); плевел многоцветковый (Lolium multiflorum); мятлик сплюснутый (Poa compressa); овсяницу красную Чуинга (Festuca rubra); полевицу тонкую (Agrostis tenuis); полевицу болотную (Agrostis palustris); житняк пустынный (Agropyron desertorum); житняк гребенчатый (Agropyron cristatum); овсяницу длиннолистную (Festuca longifolia); мятлик луговой (Poa pratensis); ежу сборную (Dactylis glomerata); плевел многолетний (Lolium perenne); овсяницу красную (Festuca rubra); полевицу белую (Agrostis alba); мятлик обыкновенный (Poa trivialis); овсяницу овечью (Festuca ovina); костер безостый (Bromus inermis); овсяницу тростниковую (Festuca arundinacea); тимофеевку луговую (Phleum pratense); полевицу собачью (Agrostis canina); бескильницу расставленную (Puccinellia distans); пырей Смита (Agropyron smithii); свинорой пальчатый (Cynodon spp.); узкобороздник однобокий (Stenotaphrum secundatum); зойсию (Zoysia spp.); гречку заметную (Paspalum notatum); аксонопус афинский (Axonopus affinis); эремохлою змеехвостую (Eremochloa ophiuroides); кикуйю (Pennisetum clandesinum); паспалум влагалищный (Paspalum vaginatum); москитную траву (Bouteloua gracilis); бизонову траву (Buchloe dactyloids); боковой овес (Bouteloua curtipendula).
Растения, представляющие интерес, включают зерновые растения, которые дают семена, представляющие интерес, масличные растения и бобовые растения. Семена, представляющие интерес, включают семена зерновых культур, таких как кукуруза, пшеница, ячмень, рис, сорго, рожь, просо и т.д. Масличные растения включают хлопчатник, сою, сафлор, подсолнечник, Brassica, маис, люцерну, пальму, кокосовую пальму, лен, клещевину, маслину и т.д. Бобовые растения включают разновидности бобов и разновидности гороха. Бобы включают гуар, рожковое дерево, пажитник, сою, обыкновенную фасоль, вигну китайскую, золотистую фасоль, лимскую фасоль, стручковую фасоль, чечевицу, турецкий горох и т.д.
Оценка трансформации растений
После введения гетерологичной чужеродной ДНК в растительные клетки трансформацию или интеграцию гетерологичного гена в геном растения подтверждают при помощи различных способов, таких как анализ нуклеиновых кислот, белков и метаболитов, связанных с интегрированным геном.
ПЦР-анализ представляет собой быстрый способ скрининга трансформированных клеток, ткани или побегов в отношении присутствия встроенного гена на ранней стадии перед высаживанием в почву (Sambrook and Russell, (2001) Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY). ПЦР проводят с применением олигонуклеотидных праймеров, специфичных к гену, представляющему интерес, или к исходным последовательностям вектора на основе Agrobacterium и т.д.
Трансформацию растений можно подтвердить с помощью Саузерн-блот анализа геномной ДНК (Sambrook and Russell, (2001) выше). В целом, общую ДНК экстрагируют из трансформанта, разрезают соответствующими ферментами рестрикции, фракционируют в агарозном геле и переносят на нитроцеллюлозную или найлоновую мембрану. Затем мембрану или “блот” анализируют с помощью зонда, например, целевого фрагмента ДНК с радиоактивной меткой 32P для подтверждения интеграции внедренного гена в геном растения в соответствии со стандартными методиками (Sambrook and Russell, (2001) выше).
При нозерн-блот анализе РНК выделяют из специфических тканей трансформанта, фракционируют в агарозном геле, содержащем формальдегид, и переносят на найлоновый фильтр в соответствии со стандартными методиками, которые обычно применяются в области техники (Sambrook and Russell, (2001) выше). Экспрессию РНК, кодируемую пестицидным геном, затем тестировали при помощи гибридизации фильтра с радиоактивным зондом, полученным из пестицидного гена, посредством способов, известных из уровня техники (Sambrook and Russell, (2001) выше).
Вестерн-блот, биохимические анализы и подобные можно проводить в отношении трансгенных растений для подтверждения присутствия белка, кодируемого пестицидным геном, при помощи стандартных методик (Sambrook and Russell, 2001, выше), с применением антител, которые связываются с одним или несколькими эпитопами, присутствующими на полипептиде AfIP-1A или AfIP-1B.
Пакетирование признаков в трансгенном растении
Трансгенные растения могут содержать пакет из одного или нескольких инсектицидных полинуклеотидов, раскрытых в данном документе, с одним или несколькими дополнительными полинуклеотидами, приводящими к продукции или подавлению нескольких полипептидных последовательностей. Трансгенные растения, содержащие пакеты из полинуклеотидных последовательностей, можно получить либо при помощи традиционных способов селекции, либо посредством способов генной инженерии, либо применяя и то, и другое. Эти способы включают без ограничений размножение индивидуальных линий, при этом каждая содержит полинуклеотид, представляющий интерес, трансформацию трансгенного растения, содержащего ген, раскрытый в данном документе, добавочным геном и котрансформацию генами одной растительной клетки. Применяемый в данном документе термин “пакетированый” включает состояние, при котором несколько признаков присутствуют в одном растении (т.е. оба признака внедрены в ядерный геном, один признак внедрен в ядерный геном и один признак внедрен в геном пластиды или оба признака внедрены в геном пластиды). В одном неограничивающем примере “пакетированные признаки” включают молекулярный пакет, где последовательности физически прилегают одна к другой. Применяемый в данном документе "признак" относится к фенотипу, обусловленному конкретной последовательностью или группами последовательностей. Котрансформацию генов можно проводить с применением единых векторов для трансформации, содержащих несколько генов, или векторов, которые отдельно несут несколько генов. Если последовательности пакетированы с помощью генетической трансформации растений, то полинуклеотидные последовательности, представляющие интерес, можно комбинировать в любое время и в любом порядке. Признаки можно вводить одновременно в протоколе котрансформации с полинуклеотидами, представляющими интерес, предусматривающем любую комбинацию кассет для трансформации. Например, если будут вводиться две последовательности, то две последовательности могут содержаться в отдельных кассетах для трансформации (транс) или содержаться в одной кассете для трансформации (цис). Экспрессия последовательностей может управляться одним промотором или различными промоторами. В определенных случаях может потребоваться введение кассеты для трансформации, которая будет подавлять экспрессию полинуклеотида, представляющего интерес. Ее можно комбинировать с любой комбинацией других кассет супрессии или кассет сверхэкспрессии для получения требуемой комбинации признаков в растении. Дополнительно понятно, что полинуклеотидные последовательности можно пакетировать в требуемом геномном расположении с применением системы сайт-специфической рекомбинации. См., например, WO 1999/25821, WO 1999/25854, WO 1999/25840, WO 1999/25855 и WO 1999/25853, все из которых включены в данный документ с помощью ссылки.
В некоторых вариантах осуществления полинуклеотиды, кодирующие полипептиды AfIP-1A и/или AfIP-1B, раскрытые в данном документе, отдельно или пакетированные с одним или несколькими признаками устойчивости к насекомым, можно пакетировать с одним или несколькими дополнительными признаками, влияющими на затраты (например, устойчивость к гербициду, устойчивость к грибам, устойчивость к вирусам, переносимость стрессов, устойчивость к заболеваниям, мужская стерильность, сила стебля и т.п.), или признаками, влияющими на выход (например, повышенная урожайность, модифицированные разновидности крахмала, улучшенный профиль масел, сбалансированные аминокислоты, высокое содержание лизина или метионина, повышенная усвояемость, улучшенное качество волокон, устойчивость к засухе и т.п.). Таким образом, варианты осуществления полинуклеотида можно применять для обеспечения полного пакета агротехнических признаков, обеспечивающих улучшенное качество сельскохозяйственной культуры, с возможностью гибкого и экономически эффективного контроля любого количества сельскохозяйственных вредителей.
Трансгены, пригодные для пакетирования, без ограничения включают следующие.
1. Трансгены, которые обеспечивают устойчивость к насекомым или заболеваниям и которые кодируют:
(A) Гены устойчивости растения к заболеваниям. Защита растений часто активируется посредством специфического взаимодействия между продуктом гена устойчивости к заболеваниям (R) у растения и продукта соответствующего гена авирулентности (Avr) у патогена. Сорт растений можно трансформировать при помощи клонированного гена устойчивости для разработки растений, которые устойчивы к специфическим штаммам патогена. См., например, Jones, et al., (1994) Science 266:789 (клонирование гена Cf-9 томата, обеспечивающего устойчивость к Cladosporium fulvum); Martin, et al., (1993) Science 262:1432 (ген Pto томата, обеспечивающий устойчивость к Pseudomonas syringae pv. tomato, кодирует протеинкиназу); Mindrinos, et al., (1994) Cell 78:1089 (ген RSP2 Arabidopsis, обеспечивающий устойчивость к Pseudomonas syringae), McDowell and Woffenden, (2003) Trends Biotechnol. 21(4):178-83 и Toyoda, et al., (2002) Transgenic Res. 11(6):567-82. Растение, устойчивое к заболеванию, представляет собой растение, которое более устойчиво к патогену, чем растение дикого типа.
(B) Гены, кодирующие белок Bacillus thuringiensis, его производное или синтетический полипептид, смоделированный на его основе. См., например, Geiser, et al., (1986) Gene 48:109, которые раскрывают клонирование и нуклеотидную последовательность гена дельта-эндотоксина Bt. Кроме того, молекулы ДНК, кодирующие гены дельта-эндотоксина, можно приобрести в Американской коллекции типовых культур (Роквилл, Мэриленд), например, под номерами доступа ATCC® 40098, 67136, 31995 и 31998. Другие неограничивающие примеры трансгенов Bacillus thuringiensis, разработанных при помощи методик генной инженерии, приведены в следующих патентах и заявках на патент и тем самым включены посредством ссылки для этой цели: патенты США №№ 5188960; 5689052; 5880275; 5986177; 6023013, 6060594, 6063597, 6077824, 6620988, 6642030, 6713259, 6893826, 7105332; 7179965, 7208474; 7227056, 7288643, 7323556, 7329736, 7449552, 7468278, 7510878, 7521235, 7544862, 7605304, 7696412, 7629504, 7705216, 7772465, 7790846, 7858849 и WO 1991/14778; WO 1999/31248; WO 2001/12731; WO 1999/24581 и WO 1997/40162.
Гены, кодирующие пестицидные белки, можно также пакетировать в том числе без ограничения: с инсектицидными белками из Pseudomonas sp., такими как PSEEN3174 (Monalysin, (2011) PLoS Pathogens, 7:1-13), из штамма CHA0 и Pf-5 Pseudomonas protegens (ранее fluorescens) (Pechy-Tarr, (2008) Environmental Microbiology 10:2368-2386: № доступа в GenBank EU400157); из Pseudomonas Taiwanensis (Liu, et al., (2010) J. Agric. Food Chem. 58:12343-12349) и из Pseudomonas pseudoalcligenes (Zhang, et al., (2009) Annals of Microbiology 59:45-50 и Li, et al., (2007) Plant Cell Tiss. Organ Cult. 89:159-168); инсектицидными белками из Photorhabdus sp. и Xenorhabdus sp. (Hinchliffe, et al., (2010) The Open Toxinology Journal 3:101-118 и Morgan, et al., (2001) Applied and Envir. Micro. 67:2062-2069); патент США № 6048838 и патент США № 6379946; полипептидом PIP-1 из публикации заявки на патент США с серийным номером 13/792861; полипептидом AfIP-1A и/или AfIP-1B из публикации заявки на патент США с серийным номером 13/800233; полипептидом PHI-4 из публикации заявки на патент США с серийным номером 13/839702 и δ-эндотоксинами, в том числе без ограничения классами генов δ-эндотоксинов Cry1, Cry2, Cry3, Cry4, Cry5, Cry6, Cry7, Cry8, Cry9, Cry10, Cry11, Cry12, Cry13, Cry14, Cry15, Cry16, Cry17, Cry18, Cry19, Cry20, Cry21, Cry22, Cry23, Cry24, Cry25, Cry26, Cry27, Cry 28, Cry 29, Cry 30, Cry31, Cry32, Cry33, Cry34, Cry35, Cry36, Cry37, Cry38, Cry39, Cry40, Cry41, Cry42, Cry43, Cry44, Cry45, Cry 46, Cry47, Cry49, Cry 51 и Cry55, и генами цитолитических cyt1 и cyt2 B. thuringiensis. Представители этих классов инсектицидных белков B. thuringiensis включают без ограничения Cry1Aa1 (№ доступа AAA22353); Cry1Aa2 (№ доступа № доступа AAA22552); Cry1Aa3 (№ доступа BAA00257); Cry1Aa4 (№ доступа CAA31886); Cry1Aa5 (№ доступа BAA04468); Cry1Aa6 (№ доступа AAA86265); Cry1Aa7 (№ доступа AAD46139); Cry1Aa8 (№ доступа I26149); Cry1Aa9 (№ доступа BAA77213); Cry1Aa10 (№ доступа AAD55382); Cry1Aa11 (№ доступа CAA70856); Cry1Aa12 (№ доступа AAP80146); Cry1Aa13 (№ доступа AAM44305); Cry1Aa14 (№ доступа AAP40639); Cry1Aa15 (№ доступа AAY66993); Cry1Aa16 (№ доступа HQ439776); Cry1Aa17 (№ доступа HQ439788); Cry1Aa18 (№ доступа HQ439790); Cry1Aa19 (№ доступа HQ685121); Cry1Aa20 (№ доступа JF340156); Cry1Aa21 (№ доступа JN651496); Cry1Aa22 (№ доступа KC158223); Cry1Ab1 (№ доступа AAA22330); Cry1Ab2 (№ доступа AAA22613); Cry1Ab3 (№ доступа AAA22561); Cry1Ab4 (№ доступа BAA00071); Cry1Ab5 (№ доступа CAA28405); Cry1Ab6 (№ доступа AAA22420); Cry1Ab7 (№ доступа CAA31620); Cry1Ab8 (№ доступа AAA22551); Cry1Ab9 (№ доступа CAA38701); Cry1Ab10 (№ доступа A29125); Cry1Ab11 (№ доступа I12419); Cry1Ab12 (№ доступа AAC64003); Cry1Ab13 (№ доступа AAN76494); Cry1Ab14 (№ доступа AAG16877); Cry1Ab15 (№ доступа AAO13302); Cry1Ab16 (№ доступа AAK55546); Cry1Ab17 (№ доступа AAT46415); Cry1Ab18 (№ доступа AAQ88259); Cry1Ab19 (№ доступа AAW31761); Cry1Ab20 (№ доступа ABB72460); Cry1Ab21 (№ доступа ABS18384); Cry1Ab22 (№ доступа ABW87320); Cry1Ab23 (№ доступа HQ439777); Cry1Ab24 (№ доступа HQ439778); Cry1Ab25 (№ доступа HQ685122); Cry1Ab26 (№ доступа HQ847729); Cry1Ab27 (№ доступа JN135249); Cry1Ab28 (№ доступа JN135250); Cry1Ab29 (№ доступа JN135251); Cry1Ab30 (№ доступа JN135252); Cry1Ab31 (№ доступа JN135253); Cry1Ab32 (№ доступа JN135254); Cry1Ab33 (№ доступа AAS93798); Cry1Ab34 (№ доступа KC156668); Cry1Ab-подобный (№ доступа AAK14336); Cry1Ab-подобный (№ доступа AAK14337); Cry1Ab-подобный (№ доступа AAK14338); Cry1Ab-подобный (№ доступа ABG88858); Cry1Ac1 (№ доступа AAA22331); Cry1Ac2 (№ доступа AAA22338); Cry1Ac3 (№ доступа CAA38098); Cry1Ac4 (№ доступа AAA73077); Cry1Ac5 (№ доступа AAA22339); Cry1Ac6 (№ доступа AAA86266); Cry1Ac7 (№ доступа AAB46989); Cry1Ac8 (№ доступа AAC44841); Cry1Ac9 (№ доступа AAB49768); Cry1Ac10 (№ доступа CAA05505); Cry1Ac11 (№ доступа CAA10270); Cry1Ac12 (№ доступа I12418); Cry1Ac13 (№ доступа AAD38701); Cry1Ac14 (№ доступа AAQ06607); Cry1Ac15 (№ доступа AAN07788); Cry1Ac16 (№ доступа AAU87037); Cry1Ac17 (№ доступа AAX18704); Cry1Ac18 (№ доступа AAY88347); Cry1Ac19 (№ доступа ABD37053); Cry1Ac20 (№ доступа ABB89046); Cry1Ac21 (№ доступа AAY66992); Cry1Ac22 (№ доступа ABZ01836); Cry1Ac23 (№ доступа CAQ30431); Cry1Ac24 (№ доступа ABL01535); Cry1Ac25 (№ доступа FJ513324); Cry1Ac26 (№ доступа FJ617446); Cry1Ac27 (№ доступа FJ617447); Cry1Ac28 (№ доступа ACM90319); Cry1Ac29 (№ доступа DQ438941); Cry1Ac30 (№ доступа GQ227507); Cry1Ac31 (№ доступа GU446674); Cry1Ac32 (№ доступа HM061081); Cry1Ac33 (№ доступа GQ866913); Cry1Ac34 (№ доступа HQ230364); Cry1Ac35 (№ доступа JF340157); Cry1Ac36 (№ доступа JN387137); Cry1Ac37 (№ доступа JQ317685); Cry1Ad1 (№ доступа AAA22340); Cry1Ad2 (№ доступа CAA01880); Cry1Ae1 (№ доступа AAA22410); Cry1Af1 (№ доступа AAB82749); Cry1Ag1 (№ доступа AAD46137); Cry1Ah1 (№ доступа AAQ14326); Cry1Ah2 (№ доступа ABB76664); Cry1Ah3 (№ доступа HQ439779); Cry1Ai1 (№ доступа AAO39719); Cry1Ai2 (№ доступа HQ439780); Cry1A-подобный (№ доступа AAK14339); Cry1Ba1 (№ доступа CAA29898); Cry1Ba2 (№ доступа CAA65003); Cry1Ba3 (№ доступа AAK63251); Cry1Ba4 (№ доступа AAK51084); Cry1Ba5 (№ доступа ABO20894); Cry1Ba6 (№ доступа ABL60921); Cry1Ba7 (№ доступа HQ439781); Cry1Bb1 (№ доступа AAA22344); Cry1Bb2 (№ доступа HQ439782); Cry1Bc1 (№ доступа CAA86568); Cry1Bd1 (№ доступа AAD10292); Cry1Bd2 (№ доступа AAM93496); Cry1Be1 (№ доступа AAC32850); Cry1Be2 (№ доступа AAQ52387); Cry1Be3 (№ доступа ACV96720); Cry1Be4 (№ доступа HM070026); Cry1Bf1 (№ доступа CAC50778); Cry1Bf2 (№ доступа AAQ52380); Cry1Bg1 (№ доступа AAO39720); Cry1Bh1 (№ доступа HQ589331); Cry1Bi1 (№ доступа KC156700); Cry1Ca1 (№ доступа CAA30396); Cry1Ca2 (№ доступа CAA31951); Cry1Ca3 (№ доступа AAA22343); Cry1Ca4 (№ доступа CAA01886); Cry1Ca5 (№ доступа CAA65457); Cry1Ca6 [1] (№ доступа AAF37224 ); Cry1Ca7 (№ доступа AAG50438); Cry1Ca8 (№ доступа AAM00264); Cry1Ca9 (№ доступа AAL79362); Cry1Ca10 (№ доступа AAN16462); Cry1Ca11 (№ доступа AAX53094); Cry1Ca12 (№ доступа HM070027); Cry1Ca13 (№ доступа HQ412621); Cry1Ca14 (№ доступа JN651493); Cry1Cb1 (№ доступа M97880); Cry1Cb2 (№ доступа AAG35409); Cry1Cb3 (№ доступа ACD50894 ); Cry1Cb-like (№ доступа AAX63901); Cry1Da1 (№ доступа CAA38099); Cry1Da2 (№ доступа I76415); Cry1Da3 (№ доступа HQ439784); Cry1Db1 (№ доступа CAA80234 ); Cry1Db2 (№ доступа AAK48937 ); Cry1Dc1 (№ доступа ABK35074); Cry1Ea1 (№ доступа CAA37933); Cry1Ea2 (№ доступа CAA39609); Cry1Ea3 (№ доступа AAA22345); Cry1Ea4 (№ доступа AAD04732); Cry1Ea5 (№ доступа A15535); Cry1Ea6 (№ доступа AAL50330); Cry1Ea7 (№ доступа AAW72936); Cry1Ea8 (№ доступа ABX11258); Cry1Ea9 (№ доступа HQ439785); Cry1Ea10 (№ доступа ADR00398); Cry1Ea11 (№ доступа JQ652456); Cry1Eb1 (№ доступа AAA22346); Cry1Fa1 (№ доступа AAA22348); Cry1Fa2 (№ доступа AAA22347); Cry1Fa3 (№ доступа HM070028); Cry1Fa4 (№ доступа HM439638); Cry1Fb1 (№ доступа CAA80235); Cry1Fb2 (№ доступа BAA25298); Cry1Fb3 (№ доступа AAF21767); Cry1Fb4 (№ доступа AAC10641); Cry1Fb5 (№ доступа AAO13295); Cry1Fb6 (№ доступа ACD50892); Cry1Fb7 (№ доступа ACD50893); Cry1Ga1 (№ доступа CAA80233); Cry1Ga2 (№ доступа CAA70506); Cry1Gb1 (№ доступа AAD10291); Cry1Gb2 (№ доступа AAO13756); Cry1Gc1 (№ доступа AAQ52381); Cry1Ha1 (№ доступа CAA80236); Cry1Hb1 (№ доступа AAA79694); Cry1Hb2 (№ доступа HQ439786); Cry1H-подобный (№ доступа AAF01213); Cry1Ia1 (№ доступа CAA44633); Cry1Ia2 (№ доступа AAA22354); Cry1Ia3 (№ доступа AAC36999); Cry1Ia4 (№ доступа AAB00958); Cry1Ia5 (№ доступа CAA70124); Cry1Ia6 (№ доступа AAC26910); Cry1Ia7 (№ доступа AAM73516); Cry1Ia8 (№ доступа AAK66742); Cry1Ia9 (№ доступа AAQ08616); Cry1Ia10 (№ доступа AAP86782); Cry1Ia11 (№ доступа CAC85964 ); Cry1Ia12 (№ доступа AAV53390); Cry1Ia13 (№ доступа ABF83202); Cry1Ia14 (№ доступа ACG63871); Cry1Ia15 (№ доступа FJ617445); Cry1Ia16 (№ доступа FJ617448); Cry1Ia17 (№ доступа GU989199); Cry1Ia18 (№ доступа ADK23801); Cry1Ia19 (№ доступа HQ439787); Cry1Ia20 (№ доступа JQ228426); Cry1Ia21 (№ доступа JQ228424); Cry1Ia22 (№ доступа JQ228427); Cry1Ia23 (№ доступа JQ228428); Cry1Ia24 (№ доступа JQ228429); Cry1Ia25 (№ доступа JQ228430); Cry1Ia26 (№ доступа JQ228431); Cry1Ia27 (№ доступа JQ228432); Cry1Ia28 (№ доступа JQ228433); Cry1Ia29 (№ доступа JQ228434); Cry1Ia30 (№ доступа JQ317686); Cry1Ia31 (№ доступа JX944038); Cry1Ia32 (№ доступа JX944039); Cry1Ia33 (№ доступа JX944040); Cry1Ib1 (№ доступа AAA82114); Cry1Ib2 (№ доступа ABW88019); Cry1Ib3 (№ доступа ACD75515); Cry1Ib4 (№ доступа HM051227); Cry1Ib5 (№ доступа HM070028); Cry1Ib6 (№ доступа ADK38579); Cry1Ib7 (№ доступа JN571740); Cry1Ib8 (№ доступа JN675714); Cry1Ib9 (№ доступа JN675715); Cry1Ib10 (№ оступа JN675716); Cry1Ib11 (№ доступа JQ228423); Cry1Ic1 (№ доступа AAC62933); Cry1Ic2 (№ доступа AAE71691); Cry1Id1 (№ доступа AAD44366); Cry1Id2 (№ доступа JQ228422); Cry1Ie1 (№ доступа AAG43526); Cry1Ie2 (№ доступа HM439636); Cry1Ie3 (№ доступа KC156647); Cry1Ie4 (№ доступа KC156681); Cry1If1 (№ доступа AAQ52382); Cry1Ig1 (№ доступа KC156701); Cry1I-подобный (№ доступа AAC31094); Cry1I-подобный (№ доступа ABG88859); Cry1Ja1 (№ доступа AAA22341); Cry1Ja2 (№ доступа HM070030); Cry1Ja3 (№ доступа JQ228425); Cry1Jb1 (№ доступа AAA98959); Cry1Jc1 (№ доступа AAC31092); Cry1Jc2 (№ доступа AAQ52372); Cry1Jd1 (№ доступа CAC50779); Cry1Ka1 (№ доступа AAB00376); Cry1Ka2 (№ доступа HQ439783); Cry1La1 (№ доступа AAS60191); Cry1La2 (№ доступа HM070031); Cry1Ma1 (№ доступа FJ884067); Cry1Ma2 (№ доступа KC156659); Cry1Na1 (№ доступа KC156648); Cry1Nb1 (№ доступа KC156678); Cry1-подобный (№ доступа AAC31091); Cry2Aa1 (№ доступа AAA22335); Cry2Aa2 (№ доступа AAA83516); Cry2Aa3 (№ доступа D86064); Cry2Aa4 (№ доступа AAC04867); Cry2Aa5 (№ доступа CAA10671); Cry2Aa6 (№ доступа CAA10672); Cry2Aa7 (№ доступа CAA10670); Cry2Aa8 (№ доступа AAO13734); Cry2Aa9 (№ доступа AAO13750 ); Cry2Aa10 (№ доступа AAQ04263); Cry2Aa11 (№ доступа AAQ52384); Cry2Aa12 (№ доступа ABI83671); Cry2Aa13 (№ доступа ABL01536); Cry2Aa14 (№ доступа ACF04939); Cry2Aa15 (№ доступа JN426947); Cry2Ab1 (№ доступа AAA22342); Cry2Ab2 (№ доступа CAA39075); Cry2Ab3 (№ доступа AAG36762); Cry2Ab4 (№ доступа AAO13296 ); Cry2Ab5 (№ доступа AAQ04609); Cry2Ab6 (№ доступа AAP59457); Cry2Ab7 (№ доступа AAZ66347); Cry2Ab8 (№ доступа ABC95996); Cry2Ab9 (№ доступа ABC74968); Cry2Ab10 (№ доступа EF157306); Cry2Ab11 (№ доступа CAM84575); Cry2Ab12 (№ доступа ABM21764); Cry2Ab13 (№ доступа ACG76120); Cry2Ab14 (№ доступа ACG76121); Cry2Ab15 (№ доступа HM037126); Cry2Ab16 (№ доступа GQ866914); Cry2Ab17 (№ доступа HQ439789); Cry2Ab18 (№ доступа JN135255); Cry2Ab19 (№ доступа JN135256); Cry2Ab20 (№ доступа JN135257); Cry2Ab21 (№ доступа JN135258); Cry2Ab22 (№ доступа JN135259); Cry2Ab23 (№ доступа JN135260); Cry2Ab24 (№ доступа JN135261); Cry2Ab25 (№ доступа JN415485); Cry2Ab26 (№ доступа JN426946); Cry2Ab27 (№ доступа JN415764); Cry2Ab28 (№ доступа JN651494); Cry2Ac1 (№ доступа CAA40536); Cry2Ac2 (№ доступа AAG35410); Cry2Ac3 (№ доступа AAQ52385); Cry2Ac4 (№ доступа ABC95997); Cry2Ac5 (№ доступа ABC74969); Cry2Ac6 (№ доступа ABC74793); Cry2Ac7 (№ доступа CAL18690); Cry2Ac8 (№ доступа CAM09325); Cry2Ac9 (№ доступа CAM09326); Cry2Ac10 (№ доступа ABN15104); Cry2Ac11 (№ доступа CAM83895); Cry2Ac12 (№ доступа CAM83896); Cry2Ad1 (№ доступа AAF09583); Cry2Ad2 (№ доступа ABC86927); Cry2Ad3 (№ доступа CAK29504); Cry2Ad4 (№ доступа CAM32331); Cry2Ad5 (№ доступа CAO78739 ); Cry2Ae1 (№ доступа AAQ52362); Cry2Af1 (№ доступа ABO30519); Cry2Af2 (№ доступа GQ866915); Cry2Ag1 (№ доступа ACH91610); Cry2Ah1 (№ доступа EU939453); Cry2Ah2 (№ доступа ACL80665); Cry2Ah3 (№ доступа GU073380); Cry2Ah4 (№ доступа KC156702); Cry2Ai1 (№ доступа FJ788388); Cry2Aj (№ доступа ); Cry2Ak1 (№ доступа KC156660); Cry2Ba1 (№ доступа KC156658); Cry3Aa1 (№ доступа AAA22336); Cry3Aa2 (№ доступа AAA22541); Cry3Aa3 (№ доступа CAA68482); Cry3Aa4 (№ доступа AAA22542); Cry3Aa5 (№ доступа AAA50255); Cry3Aa6 (№ доступа AAC43266); Cry3Aa7 (№ доступа CAB41411); Cry3Aa8 (№ доступа AAS79487); Cry3Aa9 (№ доступа AAW05659); Cry3Aa10 (№ доступа AAU29411); Cry3Aa11 (№ доступа AAW82872); Cry3Aa12 (№ доступа ABY49136 ); Cry3Ba1 (№ доступа CAA34983); Cry3Ba2 (№ доступа CAA00645); Cry3Ba3 (№ доступа JQ397327); Cry3Bb1 (№ доступа AAA22334); Cry3Bb2 (№ доступа AAA74198); Cry3Bb3 (№ доступа I15475); Cry3Ca1 (№ доступа CAA42469); Cry4Aa1 (№ доступа CAA68485); Cry4Aa2 (№ доступа BAA00179); Cry4Aa3 (№ доступа CAD30148); Cry4Aa4 (№ доступа AFB18317); Cry4A-подобный (№ доступа AAY96321); Cry4Ba1 (№ доступа CAA30312); Cry4Ba2 (№ доступа CAA30114); Cry4Ba3 (№ доступа AAA22337); Cry4Ba4 (№ доступа BAA00178); Cry4Ba5 (№ доступа CAD30095); Cry4Ba-подобный (№ доступа ABC47686); Cry4Ca1 (№ доступа EU646202); Cry4Cb1 (№ доступа FJ403208); Cry4Cb2 (№ доступа FJ597622); Cry4Cc1 (№ доступа FJ403207); Cry5Aa1 (№ доступа AAA67694); Cry5Ab1 (№ доступа AAA67693); Cry5Ac1 (№ доступа I34543); Cry5Ad1 (№ доступа ABQ82087); Cry5Ba1 (№ доступа AAA68598); Cry5Ba2 (№ доступа ABW88931); Cry5Ba3 (№ доступа AFJ04417); Cry5Ca1 (№ доступа HM461869); Cry5Ca2 (№ доступа ZP_04123426); Cry5Da1 (№ доступа HM461870); Cry5Da2 (№ доступа ZP_04123980); Cry5Ea1 (№ доступа HM485580); Cry5Ea2 (№ доступа ZP_04124038); Cry6Aa1 (№ доступа AAA22357); Cry6Aa2 (№ доступа AAM46849); Cry6Aa3 (№ доступа ABH03377); Cry6Ba1 (№ доступа AAA22358); Cry7Aa1 (№ доступа AAA22351); Cry7Ab1 (№ доступа AAA21120); Cry7Ab2 (№ доступа AAA21121); Cry7Ab3 (№ доступа ABX24522); Cry7Ab4 (№ доступа EU380678); Cry7Ab5 (№ доступа ABX79555); Cry7Ab6 (№ доступа ACI44005); Cry7Ab7 (№ доступа ADB89216); Cry7Ab8 (№ доступа GU145299); Cry7Ab9 (№ доступа ADD92572); Cry7Ba1 (№ доступа ABB70817); Cry7Bb1 (№ доступа KC156653); Cry7Ca1 (№ доступа ABR67863); Cry7Cb1 (№ доступа KC156698); Cry7Da1 (№ доступа ACQ99547); Cry7Da2 (№ доступа HM572236); Cry7Da3 (№ доступа KC156679); Cry7Ea1 (№ доступа HM035086); Cry7Ea2 (№ доступа HM132124); Cry7Ea3 (№ доступа EEM19403); Cry7Fa1 (№ доступа HM035088); Cry7Fa2 (№ доступа EEM19090); Cry7Fb1 (№ доступа HM572235); Cry7Fb2 (№ доступа KC156682); Cry7Ga1 (№ доступа HM572237); Cry7Ga2 (№ доступа KC156669); Cry7Gb1 (№ доступа KC156650); Cry7Gc1 (№ доступа KC156654); Cry7Gd1 (№ доступа KC156697); Cry7Ha1 (№ доступа KC156651); Cry7Ia1 (№ доступа KC156665); Cry7Ja1 (№ доступа KC156671); Cry7Ka1 (№ доступа KC156680); Cry7Kb1 (№ доступа BAM99306); Cry7La1 (№ доступа BAM99307); Cry8Aa1 (№ доступа AAA21117); Cry8Ab1 (№ доступа EU044830); Cry8Ac1 (№ доступа KC156662); Cry8Ad1 (№ доступа KC156684); Cry8Ba1 (№ доступа AAA21118); Cry8Bb1 (№ доступа CAD57542); Cry8Bc1 (№ доступа CAD57543); Cry8Ca1 (№ доступа AAA21119); Cry8Ca2 (№ доступа AAR98783); Cry8Ca3 (№ доступа EU625349); Cry8Ca4 (№ доступа ADB54826); Cry8Da1 (№ доступа BAC07226); Cry8Da2 (№ доступа BD133574); Cry8Da3 (№ доступа BD133575); Cry8Db1 (№ доступа BAF93483); Cry8Ea1 (№ доступа AAQ73470); Cry8Ea2 (№ доступа EU047597); Cry8Ea3 (№ доступа KC855216); Cry8Fa1 (№ доступа AAT48690); Cry8Fa2 (№ доступа HQ174208); Cry8Fa3 (№ доступа AFH78109); Cry8Ga1 (№ доступа AAT46073); Cry8Ga2 (№ доступа ABC42043); Cry8Ga3 (№ доступа FJ198072); Cry8Ha1 (№ доступа AAW81032); Cry8Ia1 (№ доступа EU381044); Cry8Ia2 (№ доступа GU073381); Cry8Ia3 (№ доступа HM044664); Cry8Ia4 (№ доступа KC156674); Cry8Ib1 (№ доступа GU325772); Cry8Ib2 (№ доступа KC156677); Cry8Ja1 (№ доступа EU625348); Cry8Ka1 (№ доступа FJ422558); Cry8Ka2 (№ доступа ACN87262); Cry8Kb1 (№ доступа HM123758); Cry8Kb2 (№ доступа KC156675); Cry8La1 (№ доступа GU325771); Cry8Ma1 (№ доступа HM044665); Cry8Ma2 (№ доступа EEM86551); Cry8Ma3 (№ доступа HM210574); Cry8Na1 (№ доступа HM640939); Cry8Pa1 (№ доступа HQ388415); Cry8Qa1 (№ доступа HQ441166); Cry8Qa2 (№ доступа KC152468); Cry8Ra1 (№ доступа AFP87548); Cry8Sa1 (№ доступа JQ740599); Cry8Ta1 (№ доступа KC156673); Cry8-подобный (№ доступа FJ770571); Cry8-подобный (№ доступа ABS53003); Cry9Aa1 (№ доступа CAA41122); Cry9Aa2 (№ доступа CAA41425); Cry9Aa3 (№ доступа GQ249293); Cry9Aa4 (№ доступа GQ249294); Cry9Aa5 (№ доступа JX174110); Cry9Aa-подобный (№ доступа AAQ52376); Cry9Ba1 (№ доступа CAA52927); Cry9Ba2 (№ доступа GU299522); Cry9Bb1 (№ доступа AAV28716); Cry9Ca1 (№ доступа CAA85764); Cry9Ca2 (№ доступа AAQ52375); Cry9Da1 (№ доступа BAA19948); Cry9Da2 (№ доступа AAB97923); Cry9Da3 (№ доступа GQ249293); Cry9Da4 (№ доступа GQ249297); Cry9Db1 (№ доступа AAX78439); Cry9Dc1 (№ доступа KC156683); Cry9Ea1 (№ доступа BAA34908); Cry9Ea2 (№ доступа AAO12908); Cry9Ea3 (№ доступа ABM21765); Cry9Ea4 (№ доступа ACE88267); Cry9Ea5 (№ доступа ACF04743); Cry9Ea6 (№ доступа ACG63872 ); Cry9Ea7 (№ доступа FJ380927); Cry9Ea8 (№ доступа GQ249292); Cry9Ea9 (№ доступа JN651495); Cry9Eb1 (№ доступа CAC50780); Cry9Eb2 (№ доступа GQ249298); Cry9Eb3 (№ доступа KC156646); Cry9Ec1 (№ доступа AAC63366); Cry9Ed1 (№ доступа AAX78440); Cry9Ee1 (№ доступа GQ249296); Cry9Ee2 (№ доступа KC156664); Cry9Fa1 (№ доступа KC156692); Cry9Ga1 (№ доступа KC156699); Cry9-подобный (№ доступа AAC63366); Cry10Aa1 (№ доступа AAA22614); Cry10Aa2 (№ доступа E00614); Cry10Aa3 (№ доступа CAD30098); Cry10Aa4 (№ доступа AFB18318); Cry10A-подобный (№ доступа DQ167578); Cry11Aa1 (№ доступа AAA22352); Cry11Aa2 (№ доступа AAA22611); Cry11Aa3 (№ доступа CAD30081); Cry11Aa4 (№ доступа AFB18319); Cry11Aa-подобный (№ доступа DQ166531); Cry11Ba1 (№ доступа CAA60504); Cry11Bb1 (№ доступа AAC97162); Cry11Bb2 (№ доступа HM068615); Cry12Aa1 (№ доступа AAA22355); Cry13Aa1 (№ доступа AAA22356); Cry14Aa1 (№ доступа AAA21516); Cry14Ab1 (№ доступа KC156652); Cry15Aa1 (№ доступа AAA22333); Cry16Aa1 (№ доступа CAA63860); Cry17Aa1 (№ доступа CAA67841); Cry18Aa1 (№ доступа CAA67506); Cry18Ba1 (№ доступа AAF89667); Cry18Ca1 (№ доступа AAF89668); Cry19Aa1 (№ доступа CAA68875); Cry19Ba1 (№ доступа BAA32397); Cry19Ca1 (№ доступа AFM37572); Cry20Aa1 (№ доступа AAB93476); Cry20Ba1 (№ доступа ACS93601); Cry20Ba2 (№ доступа KC156694); Cry20-подобный (№ доступа GQ144333); Cry21Aa1 (№ доступа I32932); Cry21Aa2 (№ доступа I66477); Cry21Ba1 (№ доступа BAC06484); Cry21Ca1 (№ доступа JF521577); Cry21Ca2 (№ доступа KC156687); Cry21Da1 (№ доступа JF521578); Cry22Aa1 (№ доступа I34547); Cry22Aa2 (№ доступа CAD43579); Cry22Aa3 (№ доступа ACD93211); Cry22Ab1 (№ доступа AAK50456); Cry22Ab2 (№ доступа CAD43577); Cry22Ba1 (№ доступа CAD43578); Cry22Bb1 (№ доступа KC156672); Cry23Aa1 (№ доступа AAF76375); Cry24Aa1 (№ доступа AAC61891); Cry24Ba1 (№ доступа BAD32657); Cry24Ca1 (№ доступа CAJ43600); Cry25Aa1 (№ доступа AAC61892); Cry26Aa1 (№ доступа AAD25075); Cry27Aa1 (№ доступа BAA82796); Cry28Aa1 (№ доступа AAD24189); Cry28Aa2 (№ доступа AAG00235); Cry29Aa1 (№ доступа CAC80985); Cry30Aa1 (№ доступа CAC80986); Cry30Ba1 (№ доступа BAD00052); Cry30Ca1 (№ доступа BAD67157); Cry30Ca2 (№ доступа ACU24781); Cry30Da1 (№ доступа EF095955); Cry30Db1 (№ доступа BAE80088); Cry30Ea1 (№ доступа ACC95445); Cry30Ea2 (№ доступа FJ499389); Cry30Fa1 (№ доступа ACI22625 ); Cry30Ga1 (№ доступа ACG60020); Cry30Ga2 (№ доступа HQ638217); Cry31Aa1 (№ доступа BAB11757); Cry31Aa2 (№ доступа AAL87458); Cry31Aa3 (№ доступа BAE79808); Cry31Aa4 (№ доступа BAF32571); Cry31Aa5 (№ доступа BAF32572); Cry31Aa6 (№ доступа BAI44026); Cry31Ab1 (№ доступа BAE79809); Cry31Ab2 (№ доступа BAF32570); Cry31Ac1 (№ доступа BAF34368); Cry31Ac2 (№ доступа AB731600); Cry31Ad1 (№ доступа BAI44022); Cry32Aa1 (№ доступа AAG36711); Cry32Aa2 (№ доступа GU063849); Cry32Ab1 (№ доступа GU063850); Cry32Ba1 (№ доступа BAB78601); Cry32Ca1 (№ доступа BAB78602); Cry32Cb1 (№ доступа KC156708); Cry32Da1 (№ доступа BAB78603); Cry32Ea1 (№ доступа GU324274); Cry32Ea2 (№ доступа KC156686); Cry32Eb1 (№ доступа KC156663); Cry32Fa1 (№ доступа KC156656); Cry32Ga1 (№ доступа KC156657); Cry32Ha1 (№ доступа KC156661); Cry32Hb1 (№ доступа KC156666); Cry32Ia1 (№ доступа KC156667); Cry32Ja1 (№ доступа KC156685); Cry32Ka1 (№ доступа KC156688); Cry32La1 (№ доступа KC156689); Cry32Ma1 (№ доступа KC156690); Cry32Mb1 (№ доступа KC156704); Cry32Na1 (№ доступа KC156691); Cry32Oa1 (№ доступа KC156703); Cry32Pa1 (№ доступа KC156705); Cry32Qa1 (№ доступа KC156706); Cry32Ra1 (№ доступа KC156707); Cry32Sa1 (№ доступа KC156709); Cry32Ta1 (№ доступа KC156710); Cry32Ua1 (№ доступа KC156655); Cry33Aa1 (№ доступа AAL26871); Cry34Aa1 (№ доступа AAG50341); Cry34Aa2 (№ доступа AAK64560); Cry34Aa3 (№ доступа AAT29032); Cry34Aa4 (№ доступа AAT29030); Cry34Ab1 (№ доступа AAG41671); Cry34Ac1 (№ доступа AAG50118); Cry34Ac2 (№ доступа AAK64562); Cry34Ac3 (№ доступа AAT29029); Cry34Ba1 (№ доступа AAK64565); Cry34Ba2 (№ доступа AAT29033); Cry34Ba3 (№ доступа AAT29031); Cry35Aa1 (№ доступа AAG50342); Cry35Aa2 (№ доступа AAK64561); Cry35Aa3 (№ доступа AAT29028); Cry35Aa4 (№ доступа AAT29025); Cry35Ab1 (№ доступа AAG41672); Cry35Ab2 (№ доступа AAK64563); Cry35Ab3 (№ доступа AY536891); Cry35Ac1 (№ доступа AAG50117); Cry35Ba1 (№ доступа AAK64566); Cry35Ba2 (№ доступа AAT29027); Cry35Ba3 (№ доступа AAT29026); Cry36Aa1 (№ доступа AAK64558); Cry37Aa1 (№ доступа AAF76376 ); Cry38Aa1 (№ доступа AAK64559); Cry39Aa1 (№ доступа BAB72016); Cry40Aa1 (№ доступа BAB72018); Cry40Ba1 (№ доступа BAC77648); Cry40Ca1 (№ доступа EU381045); Cry40Da1 (№ доступа ACF15199); Cry41Aa1 (№ доступа BAD35157); Cry41Ab1 (№ доступа BAD35163); Cry41Ba1 (№ доступа HM461871); Cry41Ba2 (№ доступа ZP_04099652); Cry42Aa1 (№ доступа BAD35166); Cry43Aa1 (№ доступа BAD15301); Cry43Aa2 (№ доступа BAD95474); Cry43Ba1 (№ доступа BAD15303); Cry43Ca1 (№ доступа KC156676); Cry43Cb1 (№ доступа KC156695); Cry43Cc1 (№ доступа KC156696); Cry43-подобный (№ доступа BAD15305); Cry44Aa (№ доступа BAD08532); Cry45Aa (№ доступа BAD22577); Cry46Aa (№ доступа BAC79010); Cry46Aa2 (№ доступа BAG68906); Cry46Ab (№ доступа BAD35170); Cry47Aa (№ доступа AAY24695); Cry48Aa (№ доступа CAJ18351); Cry48Aa2 (№ доступа CAJ86545); Cry48Aa3 (№ доступа CAJ86546); Cry48Ab (№ доступа CAJ86548); Cry48Ab2 (№ доступа CAJ86549); Cry49Aa (№ доступа CAH56541); Cry49Aa2 (№ доступа CAJ86541); Cry49Aa3 (№ доступа CAJ86543); Cry49Aa4 (№ доступа CAJ86544); Cry49Ab1 (№ доступа CAJ86542); Cry50Aa1 (№ доступа BAE86999); Cry50Ba1 (№ доступа GU446675); Cry50Ba2 (№ доступа GU446676); Cry51Aa1 (№ доступа ABI14444); Cry51Aa2 (№ доступа GU570697); Cry52Aa1 (№ доступа EF613489); Cry52Ba1 (№ доступа FJ361760); Cry53Aa1 (№ доступа EF633476); Cry53Ab1 (№ доступа FJ361759); Cry54Aa1 (№ доступа ACA52194); Cry54Aa2 (№ доступа GQ140349); Cry54Ba1 (№ доступа GU446677); Cry55Aa1 (№ доступа ABW88932); Cry54Ab1 (№ доступа JQ916908); Cry55Aa2 (№ доступа AAE33526); Cry56Aa1 (№ доступа ACU57499); Cry56Aa2 (№ доступа GQ483512); Cry56Aa3 (№ доступа JX025567); Cry57Aa1 (№ доступа ANC87261); Cry58Aa1 (№ доступа ANC87260); Cry59Ba1 (№ доступа JN790647); Cry59Aa1 (№ доступа ACR43758); Cry60Aa1 (№ доступа ACU24782); Cry60Aa2 (№ доступа EAO57254); Cry60Aa3 (№ доступа EEM99278); Cry60Ba1 (№ доступа GU810818); Cry60Ba2 (№ доступа EAO57253); Cry60Ba3 (№ доступа EEM99279); Cry61Aa1 (№ доступа HM035087); Cry61Aa2 (№ доступа HM132125); Cry61Aa3 (№ доступа EEM19308); Cry62Aa1 (№ доступа HM054509); Cry63Aa1 (№ доступа BAI44028); Cry64Aa1 (№ доступа BAJ05397); Cry65Aa1 (№ доступа HM461868); Cry65Aa2 (№ доступа ZP_04123838); Cry66Aa1 (№ доступа HM485581); Cry66Aa2 (№ доступа ZP_04099945); Cry67Aa1 (№ доступа HM485582); Cry67Aa2 (№ доступа ZP_04148882); Cry68Aa1 (№ доступа HQ113114); Cry69Aa1 (№ доступа HQ401006); Cry69Aa2 (№ доступа JQ821388); Cry69Ab1 (№ доступа JN209957); Cry70Aa1 (№ доступа JN646781); Cry70Ba1 (№ доступа ADO51070); Cry70Bb1 (№ доступа EEL67276); Cry71Aa1 (№ доступа JX025568); Cry72Aa1 (№ доступа JX025569).
Примеры δ-эндотоксинов также включают без ограничения белки Cry1A из патентов США №№ 5880275 и 7858849; токсин DIG-3 или DIG-11 (варианты белков cry с N-концевой делецией α-спирали 1 и/или α-спирали 2, такие как Cry1A) из патентов США №№ 8304604 и 8304605, Cry1B из заявки на патент США с серийным номером 10/525318; Cry1C из патента США № 6033874; Cry1F из патентов США №№ 5188960, 6218188; химеры Cry1A/F из патентов США №№ 7070982; 6962705 и 6713063); белок Cry2, такой как белок Cry2Ab из патента США № 7064249); белок Cry3A, в том числе без ограничения разработанный гибридный инсектицидный белок (eHIP), созданный путем слияния уникальных комбинаций вариабельных участков и консервативных блоков по меньшей мере двух различных белков Cry (публикация заявки на патент США №2010/0017914); белок Cry4; белок Cry5; белок Cry6; белки Cry8 из патентов США №№ 7329736, 7449552, 7803943, 7476781, 7105332, 7378499 и 7462760; белок Cry9, такой как представители семейств Cry9A, Cry9B, Cry9C, Cry9D, Cry9E и Cry9F; белок Cry15 из Naimov, et al., (2008) Applied and Environmental Microbiology 74:7145-7151; белок Cry22, белок Cry34Ab1 из патентов США №№ 6127180, 6624145 и 6340593; белок CryET33 и CryET34 из патентов США № 6248535, 6326351, 6399330, 6949626, 7385107 и 7504229; гомологи CryET33 и CryET34 из публикации заявки на патент США № 2006/0191034, 2012/0278954 и PCT публикации № WO 2012/139004; белок Cry35Ab1 из патентов США №№ 6083499, 6548291 и 6340593; белок Cry46, белок Cry 51, бинарный токсин Cry; TIC901 или родственный токсин; TIC807 из US 2008/0295207; ET29, ET37, TIC809, TIC810, TIC812, TIC127, TIC128 из PCT US 2006/033867; AXMI-027, AXMI-036 и AXMI-038 из патента США № 8236757; AXMI-031, AXMI-039, AXMI-040, AXMI-049 из US7923602; AXMI-018, AXMI-020 и AXMI-021 из WO 2006/083891; AXMI-010 из WO 2005/038032; AXMI-003 из WO 2005/021585; AXMI-008 из US 2004/0250311; AXMI-006 из US 2004/0216186; AXMI-007 из US 2004/0210965; AXMI-009 из US 2004/0210964; AXMI-014 из US 2004/0197917; AXMI-004 из US 2004/0197916; AXMI-028 и AXMI-029 из WO 2006/119457; AXMI-007, AXMI-008, AXMI-0080rf2, AXMI-009, AXMI-014 и AXMI-004 из WO 2004/074462; AXMI-150 из патента США № 8084416; AXMI-205 из US20110023184; AXMI-011, AXMI-012, AXMI-013, AXMI-015, AXMI-019, AXMI-044, AXMI-037, AXMI-043, AXMI-033, AXMI-034, AXMI-022, AXMI-023, AXMI-041, AXMI-063 и AXMI-064 из US 2011/0263488; AXMI-R1 и родственные белки из US 2010/0197592; AXMI221Z, AXMI222z, AXMI223z, AXMI224z и AXMI225z из WO 2011/103248; AXMI218, AXMI219, AXMI220, AXMI226, AXMI227, AXMI228, AXMI229, AXMI230 и AXMI231 из WO11/103247; AXMI-115, AXMI-113, AXMI-005, AXMI-163 и AXMI-184 из патента США № 8334431; AXMI-001, AXMI-002, AXMI-030, AXMI-035 и AXMI-045 из US 2010/0298211; AXMI-066 и AXMI-076 из US20090144852; AXMI128, AXMI130, AXMI131, AXMI133, AXMI140, AXMI141, AXMI142, AXMI143, AXMI144, AXMI146, AXMI148, AXMI149, AXMI152, AXMI153, AXMI154, AXMI155, AXMI156, AXMI157, AXMI158, AXMI162, AXMI165, AXMI166, AXMI167, AXMI168, AXMI169, AXMI170, AXMI171, AXMI172, AXMI173, AXMI174, AXMI175, AXMI176, AXMI177, AXMI178, AXMI179, AXMI180, AXMI181, AXMI182, AXMI185, AXMI186, AXMI187, AXMI188, AXMI189 из патента США № 8318900; AXMI079, AXMI080, AXMI081, AXMI082, AXMI091, AXMI092, AXMI096, AXMI097, AXMI098, AXMI099, AXMI100, AXMI101, AXMI102, AXMI103, AXMI104, AXMI107, AXMI108, AXMI109, AXMI110, AXMI111, AXMI112, AXMI114, AXMI116, AXMI117, AXMI118, AXMI119, AXMI120, AXMI121, AXMI122, AXMI123, AXMI124, AXMI1257, AXMI1268, AXMI127, AXMI129, AXMI164, AXMI151, AXMI161, AXMI183, AXMI132, AXMI138, AXMI137 из US 2010/0005543; белки Cry, такие как Cry1A и Cry3A, имеющие модифицированные протеолитические сайты, из патента США № 8319019; а также белок-токсин Cry1Ac, Cry2Aa и Cry1Ca из штамма VBTS 2528 Bacillus thuringiensis из публикации заявки на патент США № 2011/0064710. Другие белки Cry хорошо известны специалисту в данной области техники (см. Crickmore, et al., "Bacillus thuringiensis toxin nomenclature" (2011), на сайте lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/, доступ к которому можно получить во всемирной сети Интернет с применением префикса "www"). Инсектицидная активность белков Cry хорошо известна специалисту в данной области техники (обзор см. у van Frannkenhuyzen, (2009) J. Invert. Path. 101:1-16). Применение белков Cry в качестве признаков трансгенного растения хорошо известно специалисту в данной области техники, и Cry-трансгенные растения, в том числе без ограничения Cry1Ac, Cry1Ac+Cry2Ab, Cry1Ab, Cry1A.105, Cry1F, Cry1Fa2, Cry1F+Cry1Ac, Cry2Ab, Cry3A, mCry3A, Cry3Bb1, Cry34Ab1, Cry35Ab1, Vip3A, mCry3A, Cry9c и CBI-Bt, получили разрешение контролирующих органов (см., Sanahuja, (2011) Plant Biotech Journal 9:283-300 и CERA (2010) GM Crop Database Center for Environmental Risk Assessment (CERA), ILSI Research Foundation, Washington D.C. на сайте cera-gmc.org/index.php?action=gm_crop_database, доступ к которому можно получить во всемирной сети Интернет с применением префикса "www"). В растениях также может экспрессироваться два или более пестицидных белков, хорошо известных специалисту в данной области техники, таких как Vip3Ab и Cry1Fa (US2012/0317682), Cry1BE и Cry1F (US2012/0311746), Cry1CA и Cry1AB (US2012/0311745), Cry1F и CryCa (US2012/0317681), Cry1DA и Cry1BE (US2012/0331590), Cry1DA и Cry1Fa (US2012/0331589), Cry1AB и Cry1BE (US2012/0324606) и Cry1Fa и Cry2Aa, Cry1I или Cry1E (US2012/0324605). Пестицидные белки также включают инсектицидные липазы, в том числе липидацильные гидролазы из патента США № 7491869 и холестериноксидазы, такие как из Streptomyces (Purcell et al. (1993) Biochem Biophys Res Commun 15:1406-1413). Пестицидные белки также включают токсины VIP (вегетативные инсектицидные белки) из патентов США №№ 5877012, 6107279, 6137033, 7244820, 7615686 и 8237020 и т.п. Другие белки VIP хорошо известны специалисту в данной области техники (см. lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/vip.html, доступ к которому можно получить во всемирной сети Интернет с применением префикса "www"). Пестицидные белки также включают белки токсинового комплекса (TC), которые можно получить от организмов, таких как Xenorhabdus, Photorhabdus и Paenibacillus (см. патенты США №№ 7491698 и 8084418). Некоторые TC-белки обладают “самостоятельной” инсектицидной активностью, а другие TC-белки усиливают активность самостоятельных токсинов, производимых тем же заданным организмом. Токсичность “самостоятельного” TC-белка (от Photorhabdus, Xenorhabdus или Paenibacillus, например) может усиливаться при помощи одного или нескольких TC-белков, “усилителей”, полученных от организма-источника из другого рода. Существуют три основных типа TC-белков. Как изложено в данном документе, белки класса A (“белок A”) представляют собой самостоятельные токсины. Белки класса B (“белок B”) и белки класса C (“белок C”) усиливают токсичность белков класса A. Примеры белков класса A представляют собой TcbA, TcdA, XptA1 и XptA2. Примеры белков класса B представляют собой TcaC, TcdB, XptB1Xb и XptC1Wi. Примеры белков класса C представляют собой TccC, XptC1Xb и XptB1Wi. Пестицидные белки также включают белки яда пауков, змей и скорпионов. Примеры пептидов яда пауков включают без ограничения пептиды ликотоксин-1 и его мутантные формы (патент США № 8334366).
(C) Полинуклеотид, кодирующий специфический для насекомых гормон или феромон, такой как экдистероид и ювенильный гормон, его вариант, миметик, основанный на нем, или его антагонист или агонист. См., например, раскрытие Hammock, et al., (1990) Nature 344:458, экспрессии в бакуловирусе клонированной эстеразы ювенильного гормона, деактиватора ювенильного гормона.
(D) Полинуклеотид, кодирующий специфический для насекомых пептид, который при экспрессии нарушает физиологию насекомого, на которого оказывают воздействие. Например, см. раскрытия Regan, (1994) J. Biol. Chem. 269:9 (экспрессионное клонирование приводит к ДНК, кодирующей рецептор диуретического гормона насекомых); Pratt, et al., (1989) Biochem. Biophys. Res. Comm. 163:1243 (аллостатин, идентифицированный у Diploptera puntata); Chattopadhyay, et al., (2004) Critical Reviews in Microbiology 30(1):33-54; Zjawiony, (2004) J Nat Prod 67(2):300-310; Carlini и Grossi-de-Sa, (2002) Toxicon 40(11):1515-1539; Ussuf, et al., (2001) Curr Sci. 80(7):847-853 и Vasconcelos and Oliveira, (2004) Toxicon 44(4):385-403. См. также патент США № 5266317, Tomalski, et al., в котором раскрываются гены, кодирующие специфические для насекомых токсины.
(E) Полинуклеотид, кодирующий фермент, ответственный за гипернакопление монотерпена, сесквитерпена, стероида, гидроксамовой кислоты, производного фенилпропаноида или другой небелковой молекулы с инсектицидной активностью.
(F) Полинуклеотид, кодирующий фермент, вовлеченный в модификацию, в том числе посттрансляционную модификацию, биологически активной молекулы; например, гликолитический фермент, протеолитический фермент, липолитический фермент, нуклеаза, циклаза, трансаминаза, эстераза, гидролаза, фосфатаза, киназа, фосфорилаза, полимераза, эластаза, хитиназа и глюканаза, либо натуральные, либо синтетические. См. PCT заявку WO 1993/02197 от имени Scott, et al., в которой раскрыта нуклеотидная последовательность гена каллазы. Молекулы ДНК, которые содержат последовательности, кодирующие хитиназу, можно получить, например, из ATCC® под номерами доступа 39637 и 67152. См. также Kramer, et al., (1993) Insect Biochem. Molec. Biol. 23:691, где показана нуклеотидная последовательность кДНК, кодирующей хитиназу табачного бражника, и Kawalleck, et al., (1993) Plant Molec. Biol. 21:673, где представлена нуклеотидная последовательность гена уби-4-2 полиубиквитина петрушки, и патенты США №№ 6563020; 7145060 и 7087810.
(G) Полинуклеотид, кодирующий молекулу, которая стимулирует сигнальную трансдукцию. Например, см. раскрытие в Botella, et al., (1994) Plant Molec. Biol. 24:757, нуклеотидных последовательностей клонов кДНК кальмодулина маша, и Griess, et al., (1994) Plant Physiol. 104:1467, где представлена нуклеотидная последовательность клона кДНК кальмодулина маиса.
(H) Полинуклеотид, кодирующий пептид с гидрофобным моментом. См. PCT заявку WO 1995/16776 и патент США № 5580852, раскрывающие пептидные производные тахиплезина, которые ингибируют грибные патогены растений) и PCT заявку WO 1995/18855 и патент США № 5607914 (раскрывает синтетические противомикробные пептиды, которые обеспечивают устойчивость к заболеваниям).
(I) Полинуклеотид, кодирующий мембранную пермеазу, каналообразователь или блокатор каналов. Например, см. раскрытие в Jaynes, et al., (1993) Plant Sci. 89:43, гетерологичной экспрессии аналога цекропин-бета литического пептида для придания трансгенным растениям табака устойчивости к Pseudomonas solanacearum.
(J) Ген, кодирующий вирусный инвазивный белок или сложный токсин, полученный из него. Например, накопление белков вирусной оболочки в трансформированных растительных клетках придает устойчивость к вирусной инфекции и/или развитию заболевания, вызванного вирусом, из которого получен ген белка оболочки, а также родственными вирусами. См. Beachy, et al., (1990) Ann. Rev. Phytopathol. 28:451. Устойчивость, опосредованная белком оболочки, была обеспечена у трансформированных растений в отношении вируса мозаики люцерны, вируса мозаики огурца, вируса полосчатости табака, вируса X картофеля, вируса Y картофеля, вируса гравировки табака, вируса погремковости табака и вируса табачной мозаики. Id.
(K) Ген, кодирующий антитело, специфичное в отношении насекомого, или иммунотоксин, полученный из него. Таким образом, антитело, нацеленное на критическую метаболическую функцию в кишечнике насекомого, будет инактивировать фермент, на который оказывается воздействие, с уничтожением насекомого. Ср. Taylor, et al., Abstract #497, SEVENTH INT'L SYMPOSIUM ON MOLECULAR PLANT-MICROBE INTERACTIONS (Edinburgh, Scotland, 1994) (ферментативная инактивация в трансгенном табаке посредством выработки одноцепочеченых фрагментов антител).
(L) Ген, кодирующий антитело, специфическое в отношении вируса. См., например, Tavladoraki, et al., (1993) Nature 366:469, где показано, что трансгенные растения, экспрессирующие гены рекомбинантного антитела, защищены от нападения вируса.
(M) Полинуклеотид, кодирующий белок, останавливающий развитие, вырабатываемый в природе патогеном или паразитом. Таким образом, грибные эндо-альфа-1,4-D-полигалактуроназы облегчают грибную колонизацию и высвобождение питательных веществ растения путем солюбилизации гомо-альфа-1,4-D-галактуроназы клеточной стенки растения. См. Lamb, et al., (1992) Bio/Technology 10:1436. Клонирование и определение характеристик гена, который кодирует белок, ингибирующий эндополигалактуроназу бобов, описан в Toubart, et al., (1992) Plant J. 2:367.
(N) Полинуклеотид, кодирующий белок, останавливающий развитие, вырабатываемый в природе растением. Например, Logemann, et al., (1992) Bio/Technology 10:305, показали, что трансгенные растения, экспрессирующие ген ячменя, инактивирующий рибозимы, обладали повышенной устойчивостью к грибковым заболеваниям.
(O) Гены, вовлеченные в реакцию системной приобретенной устойчивости (SAR) и/или гены, связанные с патогенезом. Briggs, (1995) Current Biology 5(2), Pieterse and Van Loon, (2004) Curr. Opin. Plant Bio. 7(4):456-64 и Somssich, (2003) Cell 113(7):815-6.
(P) Противогрибковые гены (Cornelissen and Melchers, (1993) Pl. Physiol. 101:709-712, и Parijs, et al., (1991) Planta 183:258-264, и Bushnell, et al., (1998) Can. J. of Plant Path. 20(2):137-149. Также см. публикации заявок на патент США №№ 09/950933; 11/619645; 11/657710; 11/748994; 11/774121 и патенты США №№ 6891085 и 7306946. Киназы, подобные рецептору LysM, для восприятия фрагментов хитина, как первый этап в защитной реакции растения против грибов-патогенов (US 2012/0110696).
(Q) Гены системы детоксикации, такие как кодирующие фумонизин, беауверицин, монилиформин и зеараленон и их структурно родственные производные. Например, см. патенты США №№ 5716820; 5792931; 5798255; 5846812; 6083736; 6538177; 6388171 и 6812380.
(R) Полинуклеотид, кодирующий цистатин и ингибиторы цистеинпротеиназы. См. патент США № 7205453.
(S) Гены дефенсинов. См. WO 2003/000863 и патенты США №№ 6911577; 6855865; 6777592 и 7238781.
(T) Гены, обеспечивающие устойчивость к нематодам. См., например, PCT заявку WO 1996/30517; PCT заявку WO 1993/19181, WO 2003/033651 и Urwin, et al., (1998) Planta 204:472-479, Williamson, (1999) Curr Opin Plant Bio. 2(4):327-31; патенты США №№ 6284948 и 7301069 и гены miR164 (WO 2012/058266).
(U) Гены, которые обеспечивают устойчивость к корневой гнили, вызываемой Phytophthora, такие как Rps 1, Rps 1-a, Rps 1-b, Rps 1-c, Rps 1-d, Rps 1-e, Rps 1-k, Rps 2, Rps 3-a, Rps 3-b, Rps 3-c, Rps 4, Rps 5, Rps 6, Rps 7 и другие гены Rps. См., например, Shoemaker, et al., Phytophthora Root Rot Resistance Gene Mapping in Soybean, Plant Genome IV Conference, San Diego, Calif. (1995).
(V) Гены, которые обеспечивают устойчивость к бурой стеблевой гнили, такие как описаны в патенте США № 5689035, включенном посредством ссылки с этой целью.
(W) Гены, которые обеспечивают устойчивость к Colletotrichum, такие как описанные в публикации заявки на патент США US 2009/0035765, включенной посредством ссылки с этой целью. Они включают локус Rcg, который можно использовать как конверсию одного локуса.
2. Трансгены, которые обеспечивают устойчивость к гербициду, например:
(A) Полинуклеотид, кодирующий устойчивость к гербициду, который ингибирует конус нарастания или меристему, такому как имидазолинон или сульфонилмочевина. Иллюстративные гены в этой категории кодируют мутантный фермент ALS и AHAS, как описано, например, у Lee, et al., (1988) EMBO J. 7:1241 и Miki, et al., (1990) Theor. Appl. Genet. 80:449, соответственно. См. также патенты США №№ 5605011; 5013659; 5141870; 5767361; 5731180; 5304732; 4761373; 5331107; 5928937 и 5378824; заявку на патент США с серийным номером 11/683737 и международную публикацию WO 1996/33270.
(B) Полинуклеотид, кодирующий белок для устойчивости к глифосату (устойчивость придают мутантные гены 5-енолприрувил-3-фосфошикиматсинтазы (EPSP) и aroA, соответственно) и другим фосфоносоединениям, таким как глуфосинат (гены фосфинотрицин-ацетилтрансферазы (PAT) и фосфинотрицин-ацетилтрансферазы (bar) Streptomyces hygroscopicus), и пиридинокси- или феноксипропионовым кислотам и циклогексонам (гены, кодирующие ингибитор ACCазы). См., например, патент США № 4940835, Shah, et al., в котором раскрыта нуклеотидная последовательность формы EPSPS, которая может обеспечивать устойчивость к глифосату. В патенте США № 5627061, Barry, et al., также описаны гены, кодирующие ферменты EPSPS. См. также патенты США №№ 6566587; 6338961; 6248876 B1; 6040497; 5804425; 5633435; 5145783; 4971908; 5312910; 5188642; 5094945, 4940835; 5866775; 6225114 B1; 6130366; 5310667; 4535060; 4769061; 5633448; 5510471; Re. 36449; RE 37287 E и 5491288 и международные публикации EP 1173580; WO 2001/66704; EP 1173581 и EP 1173582, которые включены в данный документ посредством ссылки для данной цели. Устойчивость к глифосату также придается растениям, которые экспрессируют ген, кодирующий фермент глифосат-оксидорудектазу, как более подробно описано в патентах США №№ 5776760 и 5463175, которые включены в данный документ посредством ссылки с этой целью. Кроме того, устойчивость к глифосату может придаваться растениям посредством сверхэкспрессии генов, кодирующих глифосат-N-ацетилтрансферазу. См., например, патенты США №№ 7462481; 7405074 и публикация заявки на патент США № US 2008/0234130. Молекулу ДНК, кодирующую мутантный ген aroA, можно получить под номером доступа ATCC® 39256, а нуклеотидная последовательность мутантного гена раскрыта в патенте США № 4769061, Comai. В заявке EP № 0333033, Kumada, et al., и патенте США № 4975374, Goodman, et al., раскрыты нуклеотидные последовательности генов глутаминсинтетазы, которая обеспечивает устойчивость к гербицидам, таким как L-фосфинотрицин. Нуклеотидная последовательность гена фосфинотрицин-ацетилтрансферазы представлена в заявках EP №№ 0242246 и 0242236, Leemans, et al.,; De Greef, et al., (1989) Bio/Technology 7:61, где описано получение трансгенных растений, которые экспрессируют химерные bar-гены, кодирующие фосфинотрицин-ацетилтрансферазную активность. См. также патенты США №№ 5969213; 5489520; 5550318; 5874265; 5919675; 5561236; 5648477; 5646024; 6177616 B1 и 5879903, которые включены в данный документ посредством ссылки с этой целью. Иллюстративные гены, обеспечивающие устойчивость к феноксипропионовым кислотам и циклогексонам, таким как сетоксидим и галоксифоп, представляют собой гены Acc1-S1, Acc1-S2 и Acc1-S3, описанные у Marshall, et al., (1992) Theor. Appl. Genet. 83:435.
(C) Полинуклеотид, кодирующий белок, обеспечивающий устойчивость к гербициду, который ингибирует фотосинтез, такому как триазин (гены psbA и gs+) и бензонитрил (ген нитрилазы). Przibilla, et al., (1991) Plant Cell 3:169, описывают трансформацию Chlamydomonas с помощью плазмид, кодирующих мутантные гены psbA. Нуклеотидные последовательности генов нитрилазы раскрыты в патенте США № 4810648, Stalker, и молекулы ДНК, содержащие эти гены, доступны под номерами доступа ATCC® 53435, 67441 и 67442. Клонирование и экспрессия ДНК, кодирующей глутатион-S-трансферазу, описана у Hayes, et al., (1992) Biochem. J. 285:173.
(D) Полинуклеотид, кодирующий белок, обеспечивающий устойчивость к синтазе ацетогидроксикислот, которая, как было обнаружено, делает растения, которые экспрессируют этот фермент, устойчивыми к нескольким типам гербицидов, был введен в ряд растений (см., например, Hattori, et al., (1995) Mol Gen Genet. 246:419). Другие гены, которые обеспечивают устойчивость к гербицидам, включают: ген, кодирующий химерный белок цитохрома P4507A1 крысы и NADPH-цитохром P450-оксидоредуктазу дрожжей (Shiota, et al., (1994) Plant Physiol 106:17), гены, кодирующие глутатионредуктазу и супероксиддисмутазу (Aono, et al., (1995) Plant Cell Physiol 36:1687), и гены, кодирующие различные фосфотрансферазы (Datta, et al., (1992) Plant Mol Biol 20:619).
(E) Полинуклеотид, кодирующий устойчивость к гербициду, нацеленному на протопорфириноген-оксидазу (protox), которая необходима для образования хлорофилла. Фермент protox служит в качестве мишени для ряда гербицидных соединений. Эти гербициды также ингибируют рост всех присутствующих различных видов растений, вызывая их полное разрушение. Разработка растений, содержащих измененную protox-активность, которые устойчивы к этим гербицидам, описана в патентах США №№ 6288306 B1; 6282837 B1 и 5767373 и международной публикации WO 2001/12825.
(F) Ген aad-1 (изначально из Sphingobium herbicidovorans) кодирует белок арилоксиалканоат-диоксигеназу (AAD-1). Признак обеспечивает переносимость гербицидов на основе 2,4-дихлорфеноксиуксусной кислоты и арилоксифеноксипропионата (обычно называемых “фоп”-гербициды, таких как квизалофоп). Ген aad-1, сам по себе, обеспечивающий переносимость гербицидов у растений, впервые был раскрыт в WO 2005/107437 (см. также US 2009/0093366). Ген aad-12, полученный от Delftia acidovorans, который кодирует белок арилоксиалканоат-диоксигеназу (AAD-12), обеспечивающий переносимость гербицидов на основе 2,4-дихлорфеноксиуксусной кислоты и пиридилоксиацетата посредством инактивации нескольких гербицидов с арилоксиалканоатным фрагментом, в том числе фенокси-ауксина (например, 2,4-D, MCPA), а также видов пиридилокси-ауксина (например, флуроксипир, триклопир).
(G) Полинуклеотид, кодирующий устойчивую к гербициду дикамба-монооксигеназу, раскрытый в публикации заявки на патент США 2003/0135879, для придания переносимости дикамба.
(H) Полинуклеотидная молекула, кодирующая бромоксинилнитрилазу (Bxn), раскрытая в патенте США № 4810648, для придания переносимости бромоксинила.
(I) Полинуклеотидная молекула, кодирующая фитоен (crtl), описанный в Misawa, et al., (1993) Plant J. 4:833-840 и в Misawa, et al., (1994) Plant J. 6:481-489, для переносимости норфлуразона.
3. Трансгены, которые придают зерну измененные характеристики или вносят в них вклад
Например:
(A) Измененные жирные кислоты, например, посредством следующего.
(1) Подавления стеароил-ACP для повышения содержания стеариновой кислоты в растении. См. Knultzon, et al., (1992) Proc. Natl. Acad. Sci. USA 89:2624 и WO 1999/64579 (Гены для изменения липидных профилей в кукурузе ("Genes to Alter Lipid Profiles in Corn")).
(2) Повышения содержания олеиновой кислоты посредством модификации гена FAD-2 и/или снижения содержания линоленовой кислоты посредством модификации гена FAD-3 (см. патенты США №№ 6063947; 6323392; 6372965 и WO 1993/11245).
(3) Изменения содержания конъюгированных линоленовой или линолевой кислоты, например, как в WO 2001/12800.
(4) Изменения LEC1, AGP, Dek1, Superal1, mi1 ps, различных генов Ipa, таких как Ipa1, Ipa3, hpt или hggt. Например, см. WO 2002/42424, WO 1998/22604, WO 2003/011015, WO 2002/057439, WO 2003/011015, патенты США №№ 6423886, 6197561, 6825397 и публикации заявки на патент США №№ US 2003/0079247, US 2003/0204870 и Rivera-Madrid, et al., (1995) Proc. Natl. Acad. Sci. 92:5620-5624.
(5) Генов, кодирующих дельта-8-десатуразу для получения длинноцепочечных полиненасыщенных жирных кислот (патенты США №№ 8058571 и 8338152), дельта-9 десатуразу для снижения содержания насыщенных жиров (патент США № 8063269), ∆6-десатуразу примулы для улучшения профилей омега-3-жирных кислот.
(6) Выделенных нуклеиновых кислот и белков, ассоциированных с регуляцией метаболизма липидов и сахаров, в частности, белок липидного метаболизма (LMP), применяемых в способах получения трансгенных растений и модуляции уровней запасных веществ семени, в том числе липидов, жирных кислот, видов крахмала или запасных белков семени, и их применения в способах модуляции размера семени, количества семян, веса семян, длины корней и размера листьев растений (EP 2404499).
(7) Изменения экспрессии белка, индуцируемого сахарами 2 (HSI2), с высоким уровнем экспрессии в растении для повышения или снижения экспрессии HSI2 в растении. Повышение экспрессии HSI2 повышает содержание масла, тогда как понижение экспрессии HSI2 снижает восприимчивость к абсцизовой кислоте и/или повышает устойчивость к засухе (публикация заявки на патент США № 2012/0066794).
(8) Экспрессии цитохрома b5 (Cb5) отдельно или вместе с FAD2 для модуляции содержания масла в семени растения, в частности, для повышения уровней омега-3-жирных кислот и улучшения соотношения омега-6- к омега-3-жирным кислотам (публикация заявки на патент США № 2011/0191904).
(9) Молекул нуклеиновой кислоты, кодирующих wrinkled1-подобные полипептиды для модуляции метаболизма сахаров (патент США № 8217223).
(B) Измененное содержание фосфора, например, посредством следующего.
(1) Введения гена, кодирующего фитазу, при этом будет улучшаться распад фитата, что приводит к большему количеству свободного фосфата в трансформированном растении. Например, см. Van Hartingsveldt, et al., (1993) Gene 127:87, относительно раскрытия нуклеотидной последовательности гена фитазы Aspergillus niger.
(2) Модуляции гена, который снижает содержание фитата. У маиса это, например, можно осуществлять при помощи клонирования, а затем повторного введения ДНК, ассоциированной с одним или несколькими аллелями, такими как аллели LPA, идентифицированные у мутантов маиса, характеризующихся низкими уровнями фитиновой кислоты, как, например, в WO 2005/113778, и/или посредством изменения активности инозитолкиназы, как в WO 2002/059324, публикации заявки на патент США № 2003/0009011, WO 2003/027243, публикации заявки на патент США № 2003/0079247, WO 1999/05298, патенте США № 6197561, патенте США № 6291224, патенте США № 6391348, WO 2002/059324, публикации заявки на патент США № 2003/0079247, WO 1998/45448, WO 1999/55882, WO 2001/04147.
(C) Измененные углеводы, на которые воздействовали, например, посредством изменения гена, кодирующего фермент, который воздействует на паттерн ветвления крахмала, или гена, изменяющего тиоредоксин, такого как NTR и/или TRX (см. патент США № 6531648, который включен посредством ссылки с этой целью), и/или нокаута гамма-зеина или использования мутанта, такого как cs27, или TUSC27, или en27 (см. патент США № 6858778 и публикацию заявки на патент США № 2005/0160488, публикацию заявки на патент США № 2005/0204418, которые включены посредством ссылки с этой целью). См. Shiroza, et al., (1988) J. Bacteriol. 170:810 (нуклеотидная последовательность мутантного гена фруктозилтрансферазы Streptococcus), Steinmetz, et al., (1985) Mol. Gen. Genet. 200:220 (нуклеотидная последовательность гена левансахаразы Bacillus subtilis), Pen, et al., (1992) Bio/Technology 10:292 (получение трансгенных растений, которые экспрессируют альфа-амилазу Bacillus licheniformis), Elliot, et al., (1993) Plant Molec. Biol. 21:515 (нуклеотидные последовательности генов инвертазы томата), Søgaard, et al., (1993) J. Biol. Chem. 268:22480 (сайт-направленный мутагенез гена альфа-амилазы ячменя) и Fisher, et al., (1993) Plant Physiol. 102:1045 (фермент разветвления крахмала эндосперма маиса II), WO 1999/10498 (улучшенная усвояемость и/или экстракция крахмала благодаря модификации UDP-D-ксилоза-4-эпимеразы, Fragile 1 и 2, Ref1, HCHL, C4H), патент США № 6232529 (способ получения семян с высоким содержанием масла путем модификации уровней крахмала (AGP)). Гены модификации жирных кислот, упомянутые в данном документе, также можно применять для воздействия на содержание и/или состав крахмала благодаря взаимосвязи путей метаболизма крахмала и масла.
(D) Измененное содержание или состав антиоксидантов, как, например, изменение токоферола или токотриенолов. Например, см. патент США № 6787683, публикацию заявки на патент США № 2004/0034886 и WO 2000/68393, предусматривающие манипуляцию с уровнями антиоксидантов, и WO 2003/082899 благодаря изменению гомогентизатгеранил-геранилтрансферазы (hggt).
(E) Измененные незаменимые аминокислоты семян. Например, см. патент США № 6127600 (способ повышения накопления незаменимых аминокислот в семенах), патент США № 6080913 (бинарные способы повышения накопления незаменимых аминокислот в семенах), патент США № 5990389 (высокое содержание лизина), WO 1999/40209 (изменение аминокислотного состава семян), WO 1999/29882 (способы для изменения содержания аминокислот в белках), патент США № 5850016 (изменение аминокислотного состава семян), WO 1998/20133 (белки с повышенными уровнями незаменимых аминокислот), патент США № 5885802 (высокое содержание метионина), патент США № 5885801 (высокое содержание треонина), патент США № 6664445 (растительные ферменты биосинтеза аминокислот), патент США № 6459019 (повышенное содержание лизина и треонина), патент США № 6441274 (бета-субъединица растительной триптофансинтазы), патент США № 6346403 (ферменты метаболизма метионина), патент США № 5939599 (высокое содержание серы), патент США № 5912414 (повышенное содержание метионина), WO 1998/56935 (растительные ферменты биосинтеза аминокислот), WO 1998/45458 (сконструированный белок семени, имеющий более высокую процентную долю незаменимых аминокислот), WO 1998/42831 (повышенное содержание лизина), патент США № 5633436 (повышение содержания серосодержащих аминокислот), патент США № 5559223 (синтетические запасные белки с определенной структурой, содержащие программируемые уровни незаменимых аминокислот для улучшения питательной ценности растений), WO 1996/01905 (повышенное содержание треонина), WO 1995/15392 (повышенное содержание лизина), публикацию заявки на патент США № 2003/0163838, публикацию заявки на патент США № 2003/0150014, публикацию заявки на патент США № 2004/0068767, патент США № 6803498, WO 2001/79516.
4. Гены, контролирующие мужскую стерильность
Доступно несколько способов обеспечения генетической мужской стерильности, как, например, несколько мутантных генов в отдельных положениях в пределах генома, которые придают мужскую стерильность, как раскрыто в патентах США №№ 4654465 и 4727219, Brar, et al., и хромосомные транслокации, как описано Patterson в патенте США №№ 3861709 и 3710511. В дополнение к этим способам, Albertsen, et al. в патенте США № 5432068 описывают систему ядерной мужской стерильности, которая включает: идентификацию гена, который важен для мужской фертильности; сайленсинг этого нативного гена, который важен для мужской фертильности; удаление нативного промотора из гена, важного для мужской фертильности, и замещение его на индуцируемый промотор; вставку этого полученного с помощью генной инженерии гена обратно в растение и, таким образом, создание растения, которое характеризуется мужской стерильностью, поскольку индуцируемый промотор не “включен”, в результате чего ген мужской фертильности не транскрибируется. Фертильность восстанавливают посредством индуцирования или “включения” промотора, который, в свою очередь, обеспечивает транскрипцию гена, который придает мужскую фертильность.
(A) Введение гена деацетилазы под контролем промотора, специфического в отношении тапетума, и с применением химического N-Ac-PPT (WO 2001/29237).
(B) Введение различных промоторов, специфических в отношении тычинок (WO 1992/13956, WO 1992/13957).
(C) Введение барназы или гена барстара (Paul, et al., (1992) Plant Mol. Biol. 19:611-622).
Дополнительные примеры систем и генов ядерной мужской и женской стерильности см. также в патентах США №№ 5859341; 6297426; 5478369; 5824524; 5850014 и 6265640, все из которых тем самым включены посредством ссылки.
5. Гены, которые создают сайт для сайт-специфической интеграции ДНК
Подразумевается введение сайтов FRT, которые можно применять в системе FLP/FRT, и/или сайтов Lox, которые можно применять в системе Cre/Loxp. Например, см. Lyznik, et al., (2003) Plant Cell Rep 21:925-932 и WO 1999/25821, которые тем самым включены посредством ссылки. Другие системы, которые можно применять, включают рекомбиназу Gin из фага Mu (Maeser, et al., (1991) Vicki Chandler, The Maize Handbook ch. 118 (Springer-Verlag 1994), рекомбиназу Pin из E. coli (Enomoto, et al., 1983) и систему R/RS из плазмиды pSRi (Araki, et al., 1992).
6. Гены, которые воздействуют на устойчивость к абиотическому стрессу
В том числе, без ограничения, на цветение, развитие колоса и семени, улучшение эффективности использования азота, измененную реактивность в отношении азота, устойчивость к засухе или ее переносимость, устойчивость к холоду или его переносимость, а также устойчивость к солям или их переносимость и повышенную урожайность при стрессе.
(A) Например, см.: WO 2000/73475, где эффективность использования воды изменена благодаря изменению малата; патенты США №№ 5892009, 5965705, 5929305, 5891859, 6417428, 6664446, 6706866, 6717034, 6801104, WO 2000/060089, WO 2001/026459, WO 2001/035725, WO 2001/034726, WO 2001/035727, WO 2001/036444, WO 2001/036597, WO 2001/036598, WO 2002/015675, WO 2002/017430, WO 2002/077185, WO 2002/079403, WO 2003/013227, WO 2003/013228, WO 2003/014327, WO 2004/031349, WO 2004/076638, WO 199809521.
(B) WO 199938977, описывающая гены, в том числе гены CBF, и факторы транскрипции, эффективные при ослаблении негативных эффектов замораживания, высокого содержания солей и засухи на растения, а также обеспечивающие другие положительные эффекты на фенотип растения.
(C) Публикация заявки на патент США № 2004/0148654 и WO 2001/36596, где в растениях изменяется содержание абсцизовой кислоты, что приводит к улучшенному фенотипу растения, такому как повышенная урожайность и/или повышенная переносимость абиотического стресса.
(D) WO 2000/006341, WO 2004/090143, патенты США №№ 7531723 и 6992237, где экспрессия цитокинина модифицируется, что приводит к растениям с повышенной переносимостью стрессов, как, например, переносимость засухи и/или повышенная урожайность. Также см. WO 2002/02776, WO 2003/052063, JP 2002/281975, патент США № 6084153, WO 2001/64898, патент США № 6177275 и патент США № 6107547 (улучшение использования азота и измененная реактивность в отношении азота).
(E) Что касается изменения содержания этилена, см. публикацию заявки на патент США № 2004/0128719, публикацию заявки на патент США № 2003/0166197 и WO 2000/32761.
(F) Что касается растительных факторов транскрипции или транскрипционных регуляторов, связанных с реакцией на абиотический стресс, см., например, публикацию заявки на патент США № 2004/0098764 или публикацию заявки на патент США № 2004/0078852.
(G) Гены, которые повышают экспрессию вакуолярной пирофосфатазы, такие как AVP1 (патент США № 8058515), для повышенной урожайности; нуклеиновая кислота, кодирующая полипептиды HSFA4 или HSFA5 (фактор теплового шока класса A4 или A5), полипептид белка транспортера олигопептидов (OPT4-подобный); пластохрон-2-подобный полипептид (PLA2-подобный) или Wuschel-родственный гомеобокс 1-подобный полипептид (WOX1-подобный) (публикация заявки на патент США № US 2011/0283420).
(H) Подавление полинуклеотидов, кодирующих белки поли-(АДФ-рибоза)-полимеразы (PARP) для модуляции запрограммированной клеточной смерти (патент США № 8058510), для повышения силы.
(I) Полинуклеотид, кодирующий полипептиды DTP21 для обеспечения устойчивости к засухе (публикация заявки на патент США № US 2011/0277181).
(J) Нуклеотидные последовательности, кодирующие белки ACC синтазы 3 (ACS3) для модуляции развития, модуляции реакции на стресс и модуляции переносимости стрессов (публикация заявки на патент США № US 2010/0287669).
(K) Полинуклеотиды, которые кодируют белки, которые обеспечивают фенотип переносимости засухи (DTP), для обеспечения устойчивости к засухе (WO 2012/058528).
(L) Гены токоферолциклазы (TC) для обеспечения переносимости засухи и солей (публикация заявки на патент США № 2012/0272352).
(M) Белки семейства протеаз, нацеленные на CAAX-концевые амонокислоты, для придания переносимости стрессов (патент США № 8338661).
(N) Мутации в гене, кодирующем SAL1, характеризовались повышенной переносимостью стрессов, в том числе характеризовались повышенной устойчивостью к засухе (публикация заявки на патент США № 2010/0257633).
(O) Экспрессия последовательности нуклеиновой кислоты, кодирующей полипептид, выбранный из группы, состоящей из: полипептида GRF, RAA1-подобного полипептида, полипептида SYR, полипептида ARKL и полипептида YTP, усиливающих признаки, связанные с урожайностью (публикация заявки на патент США № 2011/0061133).
(P) Модуляция экспрессии в растении нуклеиновой кислоты, кодирующей полипептид трегалоза-фосфатфосфатазу (TPP) класса III для улучшения признаков, связанных с урожайностью, у растений, в частности, повышения урожайности семян (публикация заявки на патент США № 2010/0024067).
Другие гены и факторы транскрипции, которые воздействуют на рост и агрономические признаки растений, такие как урожайность, цветение, рост растения и/или структуру растения, можно вводить или интрогрессировать в растения, см., например, WO 1997/49811 (LHY), WO 1998/56918 (ESD4), WO 1997/10339 и патент США № 6573430 (TFL), патент США № 6713663 (FT), WO 1996/14414 (CON), WO 1996/38560, WO 2001/21822 (VRN1), WO 2000/44918 (VRN2), WO 1999/49064 (GI), WO 2000/46358 (FR1), WO 1997/29123, патент США № 6794560, патент США № 6307126 (GAI), WO 1999/09174 (D8 и Rht) и WO 2004/076638 и WO 2004/031349 (факторы транскрипции).
7. Гены, которые обеспечивают повышенную урожайность
(A) Трансгенное культурное растение, трансформированное при помощи нуклеиновой кислоты, кодирующей 1-аминоциклопропан-1-карбоксилатдезаминаза-подобный полипептид (ACCDP), где экспрессия последовательности нуклеиновой кислоты в культурном растении приводит к повышенному росту корней, и/или повышенной урожайности, и/или повышенной переносимости стрессов под влиянием факторов среды у растения, по сравнению с разновидностью дикого типа растения (патент США № 8097769).
(B) Сверхэкспрессия гена белков "цинковых пальцев" маиса (Zm-ZFP1) с применением промотора, активного преимущественно в семенах, как было показано, усиливает рост растения, увеличивает количество зерен и общий вес зерен на растение (публикация заявки на патент США № 2012/0079623).
(C) Конститутивная сверхэкспрессия белка с доменом границ латеральных органов (LOB) (Zm-LOBDP1) маиса, как было показано, увеличивает количество зерен и общий вес зерен на растение (публикация заявки на патент США № 2012/0079622).
(D) Улучшение признаков, связанных с урожайностью, у растений посредством модуляции экспрессии у растения нуклеиновой кислоты, кодирующей VIM1 (вариант с метилированием 1)-подобный полипептид или VTC2-подобный (GDP-L-галактоза-фосфорилаза) полипептид, или полипептид DUF1685, или ARF6-подобный (восприимчивый к ауксину фактор) полипептид (WO 2012/038893).
(E) Модуляция экспрессии в растении нуклеиновой кислоты, кодирующей Ste20-подобный полипептид или его гомолог, придает растениям повышенную урожайность относительно контрольных растений (EP 2431472).
(F) Гены, кодирующие полипептиды нуклеозиддифосфаткиназы (NDK) и их гомологи для модификации строения корня растения (публикация заявки на патент США № 2009/0064373).
8. Гены, которые обеспечивают усвояемость растения
(A) Изменение уровня ксилана, присутствующего в клеточной стенке растения, посредством модуляции экспрессии ксилансинтазы (патент США № 8173866).
В некоторых вариантах осуществления пакетированный признак может представлять собой признак или трансгенный объект, который получил разрешение контролирующих органов, в том числе без ограничения является трансгенным объектом из таблицы 4A-4F.
Пшеница Triticum aestivum
Соя Glycine max L.
Соя Glycine max L.
Подсолнечник Helianthus annuus
Люцерна Medicago sativa
Рис Oryza sativa
Маис Zea mays L.
Маис Zea mays L.
Маис Zea mays L.
Маис Zea mays L.
Маис Zea mays L.
Маис Zea mays L.
Другие трансгенные объекты, разрешенные контролирующими органами, хорошо известны специалисту в данной области техники и их можно найти на сайте Центра оценки риска для окружающей среды (cera-gmc.org/?action=gm_crop_database, доступ к которому можно получить с применением префикса www) и на сайте Международной службы по приобретению агробиотехнологических приложений (isaaa.org/gmapprovaldatabase/default.asp, доступ к которому можно получить с применением префикса www).
Сайленсинг генов
В некоторых вариантах осуществления пакетированный признак может представлять собой форму, применяемую для сайленсинга одного или нескольких полинуклеотидов, представляющих интерес, что приводит к супрессии одного или нескольких целевых полипептидов вредителя. В некоторых вариантах осуществления сайленсинг достигается благодаря применению супрессионной ДНК-конструкции.
В некоторых вариантах осуществления один или несколько полинуклеотидов, кодирующих полипептиды из полипептидов AfIP-1A, полипептидов AfIP-1B, FGTW-51 (SEQ ID NO: 18) и FGTW-52 (SEQ ID NO: 20) или их фрагментов или вариантов, могут быть пакетированы с одним или несколькими полинуклеотидами, кодирующими один или несколько полипептидов, характеризующихся инсектицидной активностью или агрономическими признаками, изложенными выше, и, необязательно, может дополнительно включать один или несколько полинуклеотидов, предусмотренных для сайленсинга генов одного или нескольких целевых полинуклеотидов, как обсуждается ниже.
“Супрессионная ДНК-конструкция” представляет собой рекомбинантную ДНК-конструкцию, которая при трансформации или стабильной интеграции в геном растения приводит к “сайленсингу” целевого гена в растении. Целевой ген может быть эндогенным или трансгенным по отношению к растению. “Сайленсинг”, применяемый в данном документе по отношению к целевому гену, обычно относится к супрессии уровней мРНК или белка/фермента, экспрессируемого целевым геном, и/или уровня активности фермента или функциональности белка. Выражение "супрессия" включает в себя понижение, снижение, ухудшение, уменьшение, ингибирование, устранение и предотвращение. “Сайленсинг” или “сайленсинг генов” не указывает специфический механизм, а включает без ограничения антисмысловую супрессию, косупрессию, вирусную супрессию, шпильковую супрессию, супрессию типа "стебель-петля", подходы, основанные на RNAi, и подходы, основанные на малых РНК.
Супрессионная ДНК-конструкция может содержать участок, происходящий от целевого гена, представляющего интерес, и может содержать всю или часть последовательности нуклеиновой кислоты смысловой нити (или антисмысловой нити) целевого гена, представляющего интерес. В зависимости от подхода, который будет использоваться, участок может быть на 100% идентичным или менее, чем на 100% идентичным (например, по меньшей мере на 50% или на любое целое число от 51% до 100% идентичным) всей или части смысловой нити (или антисмысловой нити) гена, представляющего интерес.
Супрессионные ДНК-конструкции хорошо известны из уровня техники, легко конструируются, как только целевой ген, представляющий интерес, выбран, и включают без ограничения конструкции косупрессии, конструкции антисмысловой супрессии, конструкции вирусной супрессии, конструкции шпильковой супрессии, конструкции супрессии типа "стебель-петля", конструкции, вырабатывающие двухцепочечные РНК, и, в более общем смысле, конструкции RNAi (РНК-интерференции) и конструкции малых РНК, такие как конструкции миРНК (малая интерферирующая РНК) и конструкции miRNA (микроРНК).
“Антисмысловое ингибирование” относится к продуцированию антисмысловых РНК-транскриптов, способных супрессировать экспрессию целевого белка.
“Антисмысловая РНК” относится к РНК-транскрипту, который комплементарен всему или части целевого первичного транскрипта или мРНК и который блокирует экспрессию фрагмента целевой выделенной нуклеиновой кислоты (патент США № 5107065). Комплементарность антисмысловой РНК может быть с любой частью конкретного генного транскрипта, т.е. с 5'-некодирующей последовательностью, 3'-некодирующей последовательностью, интронами или кодирующей последовательностью.
"Косупрессия" относится к выработке смысловых РНК-транскриптов, способных супрессировать экспрессию целевого белка. ”Смысловая” РНК относится к РНК-транскрипту, который включает мРНК и может быть транслирован в белок в пределах клетки или in vitro. Ранее конструкции косупрессии у растений разрабатывались с упором на сверхэкспрессию последовательностей нуклеиновой кислоты, имеющих гомологию с нативной мРНК, в смысловой ориентации, что приводит к снижению уровней всех РНК, имеющих гомологию со сверхэкспрессированной последовательностью (см., Vaucheret, et al., (1998) Plant J. 16:651-659 и Gura, (2000) Nature 404:804-808).
В другом варианте описывается применение последовательностей растительных вирусов для управления супрессией проксимальных последовательностей, кодирующих мРНК (PCT публикация WO 1998/36083).
В недавней работе было описано применение “шпильковых” структур, которые включают всю или часть, последовательности, кодирующей мРНК, в комплементарной ориентации, что приводит к потенциальной структуре “стебель-петля” у экспрессированной РНК (PCT публикация WO 1999/53050). В данном случае стебель формируется полинуклеотидами, соответствующими гену, представляющему интерес, в смысловой или в антисмысловой ориентации по отношению к промотору, а петля формируется несколькими полинуклеотидами гена, представляющего интереса, которые не имеют комплементарной цепи в конструкции. Это повышает частоту косупрессии или сайленсинга в регенерированных трансгенных растениях. Обзор шпильковой супрессии см. в Wesley, et al., (2003) Methods in Molecular Biology, Plant Functional Genomics: Methods and Protocols 236:273-286.
Конструкция, в которой стебель образован по меньшей мере 30 нуклеотидами из гена, который подлежит супрессии, и петля образована случайной нуклеотидной последовательностью, также эффективно применялась для супрессии (PCT публикация WO 1999/61632).
Также было описано применение последовательностей поли-T и поли-A для получения стебля в структуре "стебель-петля" (PCT публикация WO 2002/00894).
Еще один вариант включает применение синтетических повторов для содействия образованию стебля в структуре "стебель-петля". Трансгенные организмы, полученные с такими фрагментами рекомбинантной ДНК, как было показано, обладают сниженными уровнями белка, кодируемого нуклеотидным фрагментом, который образует петлю, как описано в РСТ публикации WO 2002/00904.
РНК-интерференция относится к процессу, специфичному для последовательности посттранскрипционного сайленсинга генов у животных, который опосредован короткими интерферирующими РНК (миРНК) (Fire, et al., (1998) Nature 391:806). Соответствующий процесс у растений обычно называют посттранскрипционным сайленсингом генов (PTGS) или РНК-сайленсингом и также называют подавлением у грибов. Процесс посттранскрипционного сайленсинга генов считается эволюционно-консервативным механизмом клеточной защиты, применяющимся для предотвращения экспрессии чужеродных генов, и он широко распространен у различных представителей растительного мира и типов животных (Fire, et al., (1999) Trends Genet. 15:358). Такая защита от экспрессии чужеродных генов могла развиться в ответ на выработку двухцепочечных РНК (дцРНК), полученных в результате вирусной инфекции или в результате случайной интеграции транспозонных элементов в геном хозяина, путем клеточного ответа, который специфически разрушает гомологичную одноцепочечную РНК вирусной геномной РНК. Присутствие дцРНК в клетках вызывает RNAi-ответ через механизм, который полностью еще не охарактеризован.
Присутствие длинных дцРНК в клетках стимулирует активность фермента рибонуклеазы III, называемого “дайсер”. Дайсер вовлекается в процессинг дцРНК с образованием коротких фрагментов дцРНК, называемых малыми интерферирующими РНК (миРНК) (Berstein et al., Nature 409:363, 2001). Короткие интерферирующие РНК, полученные в результате активности дайсера, как правило, имеют длину от приблизительно 21 до приблизительно 23 нуклеотидов и включают дуплексы из приблизительно 19 пар оснований (Elbashir et al., Genes Dev. 15:188). Кроме того, дайсер был вовлечен в вырезание 21- и 22-нуклеотидных малых временных РНК (stRNA) из РНК-предшественника консервативной структуры, которые вовлечены в контроль на уровне трансляции (Hutvagner, et al., (2001) Science 293:834). Для RNAi-ответа также характерен эндонуклеазный комплекс, обычно называемый комплексом РНК-индуцированного сайленсинга (RISC), который опосредует расщепление одноцепочечной РНК, последовательность которой комплементарна антисмысловой цепи дуплекса миРНК. Расщепление целевой РНК происходит в середине участка, комплементарного антисмысловой цепи дуплекса миРНК (Elbashir et al., Genes Dev. 15:188). Кроме того, РНК-интерференция также может подразумевать сайленсинг генов, опосредованный малыми РНК (например, miRNA), предположительно посредством клеточных механизмов, которые регулируют структуру хроматина и тем самым предотвращают транскрипцию последовательностей целевых генов (см., например, Allshire, (2002) Science 297:1818-1819; Volpe, et al., (2002) Science 297:1833-1837; Jenuwein, (2002) Science 297:2215-2218 и Hall, et al., (2002) Science 297:2232-2237). Таким образом, молекулы miRNA согласно настоящему раскрытию можно применять для опосредования сайленсинга генов путем взаимодействия с РНК-транскриптами или, иначе, взаимодействия с конкретными генными последовательностями, где такое взаимодействие приводит к сайленсингу генов либо на транскрипционном, либо на посттранскрипционном уровне.
Дополнительно предусмотрены способы и композиции, которые обеспечивают возможность увеличения RNAi, полученной с помощью элемента сайленсинга. В таких вариантах осуществления в способах и композициях используется первый полинуклеотид, содержащий элемент сайленсинга для целевой последовательности вредителя, функционально связанный с промотором, активным в растительной клетке; и второй полинуклеотид, содержащий усиливающий супрессию элемент, содержащий целевую последовательность вредителя или ее активный вариант или фрагмент, функционально связанную с промотором, активным в растительной клетке. Объединенная экспрессия элемента сайленсинга с усиливающим супрессию элементом ведет к увеличению амплификации ингибиторных РНК, вырабатываемых на основе элемента сайленсинга сверх того уровня, который достигается при экспрессии только элемента сайленсинга самого по себе. В дополнение к увеличенной амплификации специфических видов RNAi самих по себе, способы и композиции дополнительно обеспечивают возможность выработки отличной группы видов RNAi, которые могут улучшать эффективность нарушения экспрессии целевого гена. Таким образом, когда усиливающий супрессию элемент экспрессируется в растительной клетке в комбинации с элементом сайленсинга, способы и композиции могут обеспечивать возможность системной выработки RNAi по всему растению; выработку больших количеств RNAi, чем можно было бы наблюдать в случае только конструкции элемента сайленсинга отдельно; и улучшенную загрузку RNAi во флоэму растения, таким образом, обеспечивается лучший контроль насекомых, питающихся флоэмой, при помощи подхода с RNAi. Таким образом, различные способы и композиции обеспечивают улучшенные способы доставки ингибиторных РНК целевому организму. См., например, публикацию заявки на патент США 2009/0188008.
Применяемый в данном документе “усиливающий супрессию элемент” включает полинуклеотид, содержащий целевую последовательность, подлежащую супрессии, или ее активный фрагмент или вариант. Понятно, что усиливающий супрессию элемент не должен быть идентичным целевой последовательности, а скорее, усиливающий супрессию элемент может содержать вариант целевой последовательности, при условии, что последовательность усиливающего супрессию элемента в достаточной степени идентична целевой последовательность, чтобы обеспечить возможность повышенного уровня RNAi, вырабатываемых на основе элемента сайленсинга, сверх того уровня, который достигается при экспрессии только элемента сайленсинга. Аналогично, усиливающий супрессию элемент может содержать фрагмент целевой последовательность, где фрагмент имеет достаточную длину, чтобы обеспечить возможность повышенного уровня RNAi, вырабатываемых на основе элемента сайленсинга, сверх того уровня, который достигается при экспрессии только элемента сайленсинга.
Понятно, что можно использовать несколько усиливающих супрессию элементов из одной целевой последовательности, или из различных целевых последовательностей, или из различных участков одной целевой последовательности. Например, используемые усиливающие супрессию элементы могут включать фрагменты целевой последовательности, полученные из другого участка целевой последовательности (т.е. из 3'UTR, кодирующей последовательности, интрона и/или 5'UTR). Кроме того, усиливающий супрессию элемент может содержаться в кассете экспрессии, как описано в данном документе в другом месте, и в определенных вариантах осуществления усиливающий супрессию элемент находится на одном или на другом ДНК-векторе или конструкции, по отношению к элементу сайленсинга. Усиливающий супрессию элемент может быть функционально связан с промотором, раскрытым в данном документе. Понятно, что усиливающий супрессию элемент может экспрессироваться конститутивно, или, в качестве альтернативы, он может вырабатываться способом, зависящим от стадии, с использованием различных индуцируемых, или активных преимущественно в определенной ткани, или регулируемых развитием промоторов, которые обсуждаются в данном документе в другом месте.
В определенных вариантах осуществления при использовании как элемента сайленсинга, так и усиливающего супрессию элемента системная выработка RNAi происходит по всему растению. В дополнительных вариантах осуществления растение или части растения согласно настоящему раскрытию имеют повышенную нагрузку RNAi во флоэме растения, чем можно было наблюдать при экспрессии конструкции элемента сайленсинга отдельно, и, таким образом, обеспечивается лучший контроль насекомых, питающихся флоэмой, при помощи подхода с использованием RNAi. В определенных вариантах осуществления растения, части растения и растительные клетки согласно настоящему раскрытию можно дополнительно охарактеризовать, как обеспечивающие возможность выработки разнообразных видов RNAi, которые могут улучшать эффективность нарушения экспрессии целевого гена.
В определенных вариантах осуществления объединенная экспрессия элемента сайленсинга и усиливающего супрессию элемента повышает концентрацию ингибиторных РНК в растительной клетке, растении, части растения, растительной ткани или флоэме сверх того уровня, который достигается при экспрессии элемента сайленсинга отдельно.
Применяемый в данном документе “повышенный уровень ингибиторных РНК” включает какое-либо статистически значимое повышение уровня RNAi, вырабатываемых в растении, обладающем объединенной экспрессией при сравнении с подходящим контрольным растением. Например, повышение уровня RNAi в растении, части растения или растительной клетке может включать по меньшей мере приблизительно 1%, приблизительно 1%-5%, приблизительно 5%-10%, приблизительно 10%-20%, приблизительно 20%-30%, приблизительно 30%-40%, приблизительно 40%-50%, приблизительно 50%-60%, приблизительно 60-70%, приблизительно 70%-80%, приблизительно 80%-90%, приблизительно 90%-100% или большее повышение уровня RNAi в растении, части растения, растительной клетке или флоэме при сравнении с подходящим контролем. В других вариантах осуществления повышение уровня RNAi в растении, части растения, растительной клетке или флоэме может включать по меньшей мере приблизительно 1-кратное, приблизительно 1-кратное - 5-кратное, приблизительно 5-кратное - 10-кратное, приблизительно 10-кратное - 20-кратное, приблизительно 20-кратное - 30-кратное, приблизительно 30-кратное - 40-кратное, приблизительно 40-кратное - 50-кратное, приблизительно 50-кратное - 60-кратное, приблизительно 60-кратное - 70-кратное, приблизительно 70-кратное - 80-кратное, приблизительно 80-кратное - 90-кратное, приблизительно 90-кратное - 100-кратное или большее повышение уровня RNAi в растении, части растения, растительной клетке или флоэме при сравнении с подходящим контролем. Примеры объединенной экспрессии элемента сайленсинга с усиливающим супрессию элементом для контроля щитников и Lygus можно найти в публикации заявки на патент США 2011/0301223 и публикации заявки на патент США 2009/0192117.
Некоторые варианты осуществления относятся к понижающей регуляции экспрессии целевых генов у видов насекомых-вредителей при помощи интерферирующих молекул рибонуклеиновой кислоты (РНК). В PCT публикации WO 2007/074405 описаны способы ингибирования экспрессии целевых генов у беспозвоночных вредителей, в том числе колорадского картофельного жука. В PCT публикации WO 2005/110068 описаны способы ингибирования экспрессии целевых генов у беспозвоночных вредителей, в том числе, в частности, у западного кукурузного жука, в качестве средств контроля заражения насекомыми. Кроме того, в PCT публикации WO 2009/091864 описаны композиции и способы супрессии целевых генов из видов насекомых-вредителей, в том числе вредителей из рода Lygus. Молекулы нуклеиновой кислоты, в том числе RNAi для нацеливания на H-субъединицу вакуолярной АТФазы, пригодны для контроля популяции и заражения жесткокрылыми вредителями, как описано в публикации заявки на патент США 2012/0198586. В PCT публикации WO 2012/055982 описана рибонуклеиновая кислота (РНК или двухцепочечная РНК), которая ингибирует или обеспечивает понижающую регуляцию экспрессии целевого гена, который кодирует: рибосомальный белок насекомого, такой как рибосомальный белок L19, рибосомальный белок L40 или рибосомальный белок S27A; субъединицу протеасомы насекомого, такую как белок Rpn6, Pros 25, белок Rpn2, белок бета 1 субъединицы протеасомы или белок бета 2 Pros; β-коатомер COPI-везикулы насекомого, γ-коатомер COPI-везикулы, β'-коатомерный белок или ζ-коатомер COPI-везикулы; белок тетраспанин 2 A насекомого, который представляет собой предполагаемый белок трасмембранного домена; белок насекомого, принадлежащий к семейству актина, такой как актин 5C; белок убиквитин-5E насекомого; белок Sec23 насекомого, который представляет собой активатор ГТФазы, вовлеченной во внутриклеточный транспорт белков; белок "crinkled" насекомого, который представляет собой нестандартный миозин, который вовлечен в двигательную активность; белок "crooked neck" насекомого, который вовлечен в регуляцию ядерного альтернативного сплайсинга мРНК; белок G-субъединицы вакуолярной H+-АТФазы насекомого и Tbp-1 насекомого, такой как Tat-связывающий белок. В публикациях заявок на патент США 2012/029750, US 20120297501 и 2012/0322660 описаны интерферирующие рибонуклеиновые кислоты (РНК или двухцепочечная РНК), которые функционируют при поглощении видами насекомых-вредителей с понижающей регуляцией экспрессии целевого гена в указанном насекомом-вредителе, где РНК содержит по меньшей мере один элемент сайленсинга, где элемент сайленсинга представляет собой участок двухцепочечной РНК, содержащий гибридизованные комплементарные цепи, из которых одна цепь содержит или состоит из последовательности нуклеотидов, которая по меньшей мере частично комплементарна целевой нуклеотидной последовательности в пределах целевого гена. В публикации заявки на патент США 2012/0164205 описаны потенциальные мишени для интерферирующих двухцепочечных рибонуклеиновых кислот для подавления беспозвоночных вредителей, в том числе: гомологичная последовательность Chd3, гомологичная последовательность бета-тубулина, гомологичная последовательность 40 кДа V-АТФазы, гомологичная последовательность EF1α, гомологичная последовательность субъединицы p28 протеосомы 26S, гомологичная последовательность эпоксидгидролазы ювенильного гормона, гомологичная последовательность белка хлоридных каналов, зависимых от набухания, гомологичная последовательность белка глюкоза-6-фосфат-1-дегидрогеназы, гомологичная последовательность белка Act42A, гомологичная последовательность фактора 1 АДФ-рибозилирования, гомологичная последовательность белка фактора транскрипции IIB, гомологичные последовательности хитиназы, гомологичная последовательность фермента, конъюгирующего убиквитин, гомологичная последовательность глицеральдегид-3-фосфатдегидрогеназы, гомологичная последовательностьубиквитина B, гомолог эстеразы ювенильного гормона и гомологичная последовательность альфа-тубулина.
Применение в пестицидном контроле
Из уровня техники известны общие способы использования штаммов, содержащих последовательность нуклеиновой кислоты согласно вариантам осуществления или ее вариант, в пестицидном контроле или при разработке других организмов в качестве пестицидных агентов. См., например, патент США № 5039523 и EP 0480762 2.
Могут быть выбраны хозяева-микроорганизмы, которые, как известно, заселяют "фитосферу" (филлоплан, филлосферу, ризосферу и/или ризоплан) одной или нескольких сельскохозяйственных культур, представляющих интерес. Эти микроорганизмы выбирают таким образом, чтобы они могли успешно конкурировать в конкретной среде с микроорганизмами дикого типа, обеспечивать стабильное поддержание и экспрессию гена, экспрессирующего полипептид AfIP-1A и/или AfIP-1B, и, желательно, обеспечивать улучшенную защиту пестицида от разрушения и инактивации в окружающей среде.
Такие микроорганизмы включают бактерии, водоросли и грибы. Особенный интерес представляют микроорганизмы, такие как бактерии, например, Pseudomonas, Erwinia, Serratia, Klebsiella, Xanthomonas, Streptomyces, Rhizobium, Rhodopseudomonas, Methylius, Agrobacterium, Acetobacter, Lactobacillus, Arthrobacter, Azotobacter, Leuconostoc и Alcaligenes, грибы, в частности дрожжи, например, Saccharomyces, Cryptococcus, Kluyveromyces, Sporobolomyces, Rhodotorula и Aureobasidium. Особый интерес представляют такие виды бактерий фитосферы как Pseudomonas syringae, Pseudomonas fluorescens, Pseudomonas chlororaphis, Serratia marcescens, Acetobacter xylinum, Agrobacteria, Rhodopseudomonas spheroides, Xanthomonas campestris, Rhizobium melioti, Alcaligenes entrophus, Clavibacter xyli и Azotobacter vinelandii и виды дрожжей фитосферы, такие как Rhodotorula rubra, R. glutinis, R. marina, R. aurantiaca, Cryptococcus albidus, C. diffluens, C. laurentii, Saccharomyces rosei, S. pretoriensis, S. cerevisiae, Sporobolomyces roseus, S. odorus, Kluyveromyces veronae и Aureobasidium pollulans. Особый интерес представляют пигментированные микроорганизмы. Организмы-хозяева, представляющие особый интерес, включают дрожжи, такие как Rhodotorula spp., Aureobasidium spp., Saccharomyces spp. (такие как S. cerevisiae), Sporobolomyces spp., организмы филлоплана, такие как Pseudomonas spp. (такие как P. aeruginosa, P. fluorescens, P. chlororaphis), Erwinia spp., и Flavobacterium spp., и другие такие организмы, в том числе Agrobacterium tumefaciens, E. coli, Bacillus subtilis, Bacillus cereus и т.п.
Гены, кодирующие полипептиды AfIP-1A и/или AfIP-1B согласно вариантам осуществления, можно вводить в микроорганизмы, которые размножаются на растениях (эпифиты) для доставки полипептидов AfIP-1A и/или AfIP-1B к потенциальным целевым вредителям. Эпифиты, например, могут представлять собой грам-положительные или грам-отрицательные бактерии.
Бактерии, колонизирующие корни, например, можно выделять из растений, представляющих интерес, при помощи способов, известных из уровня техники. А именно, штамм Bacillus cereus, который колонизирует корни, можно выделять из корней растения (см., например, Handelsman et al. (1991) Appl. Environ. Microbiol. 56:713-718). Гены, кодирующие полипептиды AfIP-1A и/или AfIP-1B согласно вариантам осуществления, можно вводить в Bacillus cereus, колонизирующую корни, при помощи стандартных способов, известных из уровня техники.
Гены, кодирующие полипептиды AfIP-1A и/или AfIP-1B, можно вводить, например, в Bacillus, колонизирующую корни, посредством электротрансформации. А именно, гены, кодирующие полипептиды AfIP-1A и/или AfIP-1B, можно клонировать в челночный вектор, например, pHT3101 (Lerecius, et al., (1989) FEMS Microbiol. Letts. 60:211-218. При помощи челночного вектора pHT3101, содержащего кодирующую последовательность конкретного гена полипептида AfIP-1A и/или AfIP-1B, можно, например, трансформировать Bacillus, колонизирующую корни, посредством электропорации (Lerecius, et al., (1989) FEMS Microbiol. Letts. 60:211-218).
Системы экспрессии можно разрабатывать таким образом, что полипептиды AfIP-1A и/или AfIP-1B секретируются снаружи цитоплазмы грам-отрицательных бактерий, таких как, например, E. coli. Преимущества в секреции полипептидов AfIP-1A и/или AfIP-1B являются следующими: (1) устранение потенциальных цитотоксических эффектов экспрессированных полипептидов AfIP-1A и/или AfIP-1B; и (2) улучшение эффективности очистки полипептида AfIP-1A и/или AfIP-1B, в том числе без ограничения, повышение эффективности выделения и очистки белка на объем клеточного бульона и снижения времени и/или затрат на восстановление и очистку на индивидуальный белок.
Полипептиды AfIP-1A и/или AfIP-1B можно создавать так, чтобы они секретировались E. coli, например, путем слияния подходящего сигнального пептида E. coli с амино-терминальным концом полипептида AfIP-1A и/или AfIP-1B. Сигнальные пептиды, распознаваемые E. coli, можно найти в белках, которые, как уже известно, секретируются E. coli, например, белок OmpA (Ghrayeb, et al., (1984) EMBO J, 3:2437-2442). OmpA представляет собой главный белок внешней мембраны E. coli, и, таким образом, полагают, что его сигнальный пептид является эффективным в процессе транслокации. Также сигнальный пептид OmpA не нужно модифицировать перед процессингом, как может быть в случае других сигнальных пептидов, например, сигнального пептида липопротеинов (Duffaud, et al., (1987) Meth. Enzymol. 153:492).
Полипептиды AfIP-1A и/или AfIP-1B согласно вариантам осуществления можно ферментировать в бактерии-хозяине, а полученные бактерии обрабатывать и использовать в виде микробных распыляемых растворов тем же способом, что и штаммы Bt, которые применялись в виде инсектицидных распыляемых растворов. В случае полипептида(ов) AfIP-1A и/или AfIP-1B, которые секретируются Bacillus, сигнал секреции удаляют или подвергают мутации с применением методик, известных из уровня техники. Такие мутации и/или делеции предотвращают секрецию полипептида(ов) AfIP-1A и/или AfIP-1B в ростовую среду во время процесса ферментации. Полипептиды AfIP-1A и/или AfIP-1B остаются в пределах клетки, и клетки затем обрабатывают для получения инкапсулированных полипептидов AfIP-1A и/или AfIP-1B. Для этой цели можно применять любой подходящий микроорганизм. Pseudomonas применяли для экспрессии Bt-токсинов в качестве инкапсулированных белков, и полученные клетки обрабатывали и распыляли в качестве инсектицида (Gaertner, et al., (1993), в: Advanced Engineered Pesticides, ed. Kim).
В качестве альтернативы, полипептиды AfIP-1A и/или AfIP-1B получали путем введения гетерологичного гена в клетку-хозяина. Экспрессия гетерологичного гена приводит, прямо или опосредованно, к выработке и сохранению пестицида внутри клетки. Эти клетки затем обрабатывают при условиях, которые продлевают активность токсина, вырабатываемого в клетке, когда клетку наносят на среду целевого вредителя(ей). Полученный продукт сохраняет токсичность токсина. Эти инкапсулированные естественным образом полипептиды AfIP-1A и/или AfIP-1B затем можно составлять в соответствии с традиционными методиками для нанесения на среду пребывания целевого вредителя, например, в почву, воду и на листву растений. См., например, EPA 0192319 и ссылочные документы, процитированные в нем.
Пестицидные композиции
В некоторых вариантах осуществления активные ингредиенты можно наносить в форме композиции и можно наносить на возделываемую площадь или растение, подлежащее обработке, одновременно или последовательно с другими соединениями. Эти соединения могут представлять собой удобрения, средства борьбы с сорняками, криопротекторы, поверхностно-активные вещества, детергенты, пестицидные мыла, масла, применяемые во время состояния покоя, полимеры и/или составы с носителем с замедленным высвобождением или биоразлагаемым носителем, который обеспечивает длительное дозирование в целевой области после однократного нанесения состава. Они также могут представлять собой селективные гербициды, химические инсектициды, вируциды, микробоциды, амебоциды, пестициды, фунгициды, бактерициды, нематоциды, моллюскоциды или смеси из нескольких этих препаратов, при необходимости, вместе с дополнительными приемлемыми с точки зрения сельского хозяйства носителями, поверхностно-активными веществами или адъювантами, способствующими нанесению, традиционно используемыми в области техники, связанной с получением составов. Подходящие носители и адъюванты могут быть твердыми или жидкими и соответствуют веществам, обычно используемым в технологии составления, например, природным или регенерированным минеральным веществам, растворителям, диспергирующим веществам, смачивающим средствам, веществам, придающим клейкость, связующим или удобрениям. Аналогично, составы можно готовить в виде съедобных “приманок” или формировать в “ловушки” для вредителей, что обеспечивает питание или заглатывание целевым вредителем пестицидного состава.
Способы нанесения активного ингредиента или агрохимической композиции, которая содержит по меньшей мере один из полипептидов AfIP-1A и/или AfIP-1B, вырабатываемых штаммами бактерий, включают нанесение на листья, покрытие семян и внесение в почву. Количество нанесений и норма нанесения зависит от интенсивности заражения соответствующим вредителем.
Композицию можно составлять в виде порошка, дуста, пеллеты, гранулы, распыляемого раствора, эмульсии, коллоидного вещества, раствора и т.п., и ее можно приготовить при помощи таких традиционных способов как сушка, лиофилизация, гомогенизация, экстракция, фильтрация, центрифугирование, осаждение или концентрирование культуры клеток, содержащих полипептид. Во всех таких композициях, которые содержат по меньшей мере один такой пестицидный полипептид, полипептид может присутствовать в концентрации от приблизительно 1% до приблизительно 99% по весу.
Чешуекрылых, двукрылых вредителей, вредителей настоящих клопов, нематодных, полужесткокрылых или жесткокрылых вредителей можно уничтожать или снижать их количество в указанной области при помощи способов согласно настоящему раскрытию, или средства можно наносить профилактически на область окружающей среды для предотвращения заражения восприимчивым вредителем. Предпочтительно, вредитель заглатывает пестицидно эффективное количество полипептида или контактирует с ним. Применяемое в данном документе “пестицидно эффективное количество” относится к количеству пестицида, которое может приводить к гибели по меньшей мере одного вредителя или к заметно сниженному росту, питанию или нормальному физиологическому развитию вредителя. Это количество будет варьировать в зависимости от таких факторов, как, например, специфических целевых вредителей, подлежащих контролю, специфической среды, местоположения, растения, культуры или сельскохозяйственного сайта, подлежащего обработке, условий окружающей среды и способа, нормы, концентрации, стабильности и количества внесений пестицидно-эффективной полипептидной композиции. Составы также могут варьировать в зависимости от климатических условий, экологических соображений и/или частоты нанесения и/или тяжести заражения вредителями.
Описанные пестицидные композиции можно получать путем составления либо суспензии бактериальных клеток, кристаллов и/или спор, либо выделенного белкового компонента с требуемым носителем, приемлемым с точки зрения сельского хозяйства. Композиции можно составлять перед введением с помощью надлежащих способов, таких как лиофилизация, сублимационная сушка, высушивание, или в водном носителе, среде или подходящем растворителе, таком как солевой раствор или другой буфер. Составленные композиции могут находиться в форме дуста, или гранулированного материала, или суспензии в масле (растительном или минеральном), или водной эмульсии или эмульсии масло/вода, или в виде смачиваемого порошка, или в комбинации с каким-либо другим материалом носителя, подходящим для сельскохозяйственного применения. Подходящие носители, приемлемые с точки зрения сельского хозяйства, могут быть твердыми или жидкими и хорошо известны из уровня техники. Термин “приемлемый с точки зрения сельского хозяйства носитель” охватывает все адъюванты, инертные компоненты, диспергирующие вещества, поверхностно-активные вещества, вещества, придающие клейкость, связующие и т.д., которые обычно применяются в технологии составления пестицидов; причем они хорошо известны специалистам по составлению пестицидов. Составы можно смешивать с одним или несколькими твердыми или жидкими адъювантами и готовить при помощи различных способов, например, путем равномерного перемешивания, смешивания и/или размалывания пестицидной композиции с подходящими адъювантами с применением традиционных методик составления. Подходящие составы и способы нанесения описаны в патенте США № 6468523, включенном в данный документ посредством ссылки. Растения можно также обрабатывать одной или несколькими химическими композициями, в том числе одним или несколькими гербицидами, инсектицидами или фунгицидами. Иллюстративные химические композиции включают следующее. Гербициды для фруктов/овощей: атразин, бромацил, диурон, глифосат, линурон, метрибузин, симазин, трифлуралин, флуазифоп, глуфосинат, галосульфурон от Gowan, паракват, пропизамид, сетоксидим, бутафенацил, галосульфурон, индазифлам; инсектициды для фруктов/овощей: альдикарб, Bacillus thuriengiensis, карбарил, карбофуран, хлорпирифос, циперметрин, дельтаметрин, диазинон, малатион, абамектин, цифлутрин/бета-цифлутрин, эсфенвалерат, лямбда-цигалотрин, ацеквиноцил, бифеназат, метоксифенозид, новалурон, кромафенозид, тиаклоприд, динотефуран, флуакрипирим, толфенпирад, клотианидин, спиродиклофен, гамма-цигалотрин, спиромезифен, спиносад, ринаксипир, циазипир, спинотерам, трифлумурон, спиротетрамат, имидаклоприд, флубендиамид, тиодикарб, метафлумизон, сульфоксафлор, цифлуметофен, цианопирафен, имидаклоприд, клотианидин, тиаметоксам, спиноторам, тиодикарб, флоникамид, метиокарб, эмамектин-бензоат, индоксакарб, фортиазат, фенамифос, кадусафос, пирипроксифен, фенбутатин-оксид, гекстиазокс, метомил, 4-[[(6-хлорпиридин-3-ил)метил](2,2-дифторэтил)амино]фуран-2(5H)-он; фунгициды для фруктов/овощей: карбендазим, хлороталонил, EBDC, сера, тиофанат-метил, азоксистробин, цимоксанил, флуазинам, фосетил, ипродион, крезоксим-метил, металаксил/мефеноксам, трифлоксистробин, этабоксам, ипроваликарб, трифлоксистробин, фенгексамид, окспоконазола фумарат, циазофамид, фенамидон, зоксамид, пикоксистробин, пираклостробин, цифлуфенамид, боскалид; гербициды для злаков: изопротурон, бромоксинил, иоксинил, фенокси-соединения, хлорсульфурон, клодинафоп, диклофоп, дифлуфеникан, феноксапроп, флорасулам, флуроксипир, метсульфурон, триасульфурон, флукарбазон, иодосульфурон, пропоксикарбазон, пиколинафен, мезосульфурон, бефлубутамид, пиноксаден, амидосульфурон, тифенсульфурон-метил, трибенурон, флупирсульфурон, сульфосульфурон, пирасульфотол, пироксулам, флуфенацет, тралкоксидим, пироксасульфон; фунгициды для злаков: карбендазим, хлороталонил, азоксистробин, ципроконазол, ципродинил, фенпропиморф, эпоксиконазол, крезоксим-метил, квиноксифен, тебуконазол, трифлоксистробин, симеконазол, пикоксистробин, пираклостробин, димоксистробин, протиоконазол, флуоксастробин; инсектициды для злаков: диметоат, лямбда-цигалотрин, дельтаметрин, альфа-циперметрин, β-цифлутрин, бифентрин, имидаклоприд, клотианидин, тиаметоксам, тиаклоприд, ацетамиприд, динетофуран, хлорпирифос, метамидофос, оксидеметон-метил, пиримикарб, метиокарб; гербициды для маиса: атразин, алахлор, бромоксинил, ацетохлор, дикамба, клопиралид, (S-)диметенамид, глуфосинат, глифосат, изоксафлутол, (S-)метолахлор, мезотрион, никосульфурон, примисульфурон, римсульфурон, сулькотрион, форамсульфурон, топрамезон, темботрион, сафлуфенацил, тиенкарбазон, флуфенацет, пироксасульфон; инсектициды для маиса: карбофуран, хлорпирифос, бифентрин, фипронил, имидаклоприд, лямбда-цигалотрин, тефлутрин, тербуфос, тиаметоксам, клотианидин, спиромезифен, флубендиамид, трифлумурон, ринаксипир, дельтаметрин, тиодикарб, β-цифлутрин, циперметрин, бифентрин, люфенурон, трифлуморон, тефлутрин, тебупиримфос, этипрол, циазипир, тиаклоприд, ацетамиприд, динетофуран, авермектин, метиокарб, спиродиклофен, спиротетрамат; фунгициды для маиса: фенитропан, тирам, протиоконазол, тебуконазол, трифлоксистробин; гербициды для риса: бутахлор, пропанил, азимсульфурон, бенсульфурон, цигалофоп, даимурон, фентразамид, имазосульфурон, мефенацет, оксазикломефон, пиразосульфурон, пирибутикарб, квинклорак, тиобенкарб, инданофан, флуфенацет, фентразамид, галосульфурон, оксазикломефон, бензобициклон, пирифталид, пеноксулам, биспирибак, оксадиаргил, этоксисульфурон, претилахлор, мезотрион, тефурилтрион, оксадиазон, феноксапроп, пиримисульфан; инсектициды для риса: диазинон, фенитротион, фенобукарб, монокротофос, бенфуракарб, бупрофезин, динотефуран, фипронил, имидаклоприд, изопрокарб, тиаклоприд, кромафенозид, тиаклоприд, динотефуран, клотианидин, этипрол, флубендиамид, ринаксипир, дельтаметрин, ацетамиприд, тиаметоксам, циазипир, спиносад, спиноторам, эмамектин-бензоат, циперметрин, хлорпирифос, картап, метамидофос, этофенпрокс, триазофос, 4-[[(6-хлорпиридин-3-ил)метил](2,2-дифторэтил)амино]фуран-2(5H)-он, карбофуран, бенфуракарб; фунгициды для риса: тиофанат-метил, азоксистробин, карпропамид, эдифенфос, феримзон, ипробенфос, изопротиолан, пенцикурон, пробеназол, пироквилон, трициклазол, трифлоксистробин, диклоцимет, феноксанил, симеконазол, тиадинил; гербициды для хлопчатника: диурон, флуометурон, MSMA, оксифлуорфен, прометрин, трифлуралин, карфентразон, клетодим, флуазифоп-бутил, глифосат, норфлуразон, пендиметалин, пиритиобак-натрий, трифлоксисульфурон, тепралоксидим, глуфосинат, флумиоксазин, тидиазурон; инсектициды для хлопчатника: ацефат, альдикарб, хлорпирифос, циперметрин, дельтаметрин, малатион, монокротофос, абамектин, ацетамиприд, эмамектин бензоат, имидаклоприд, индоксакарб, лямбда-цигалотрин, спиносад, тиодикарб, гамма-цигалотрин, спиромезифен, пиридалил, флоникамид, флубендиамид, трифлумурон, ринаксипир, бета-цифлутрин, спиротетрамат, клотианидин, тиаметоксам, тиаклоприд, динетофуран, флубендиамид, циазипир, спиносад, спиноторам, гамма-цигалотрин, 4-[[(6-хлорпиридин-3-ил)метил](2,2-дифторэтил)амино]фуран-2(5H)-он, тиодикарб, авермектин, флоникамид, пиридалил, спиромезифен, сульфоксафлор, профенофос, триазофос, эндосульфан; фунгициды для хлопчатника: этридиазол, металаксил, квинтозен; гербициды для сои: алахлор, бентазон, трифлуралин, хлоримурон-этил, хлорансулам-метил, феноксапроп, фомесафен, флуазифоп, глифосат, имазамокс, имазаквин, имазетапир, (S-)метолахлор, метрибузин, пендиметалин, тепралоксидим, глуфосинат; инсектициды для сои: лямбда-цигалотрин, метомил, паратион, тиокарб, имидаклоприд, клотианидин, тиаметоксам, тиаклоприд, ацетамиприд, динетофуран, флубендиамид, ринаксипир, циазипир, спиносад, спиноторам, эмамектин-бензоат, фипронил, этипрол, дельтаметрин, β-цифлутрин, гамма- и лямбда-цигалотрин, 4-[[(6-хлорпиридин-3-ил)метил](2,2-дифторэтил)амино]фуран-2(5H)-он, спиротетрамат, спинодиклофен, трифлумурон, флоникамид, тиодикарб, бета-цифлутрин; фунгициды для сои: азоксистробин, ципроконазол, эпоксиконазол, флутриафол, пираклостробин, тебуконазол, трифлоксистробин, протиоконазол, тетраконазол; гербициды для сахарной свеклы: хлоридазон, десмедифам, этофумезат, фенмедифам, триаллат, клопиралид, флуазифоп, ленацил, метамитрон, квинмерак, циклоксидим, трифлусульфурон, тепралоксидим, квизалофоп; инсектициды для сахарной свеклы: имидаклоприд, клотианидин, тиаметоксам, тиаклоприд, ацетамиприд, динетофуран, дельтаметрин, β-цифлутрин, гамма/лямбда-цигалотрин, 4-[[(6-хлорпиридин-3-ил)метил](2,2-дифторэтил)амино]фуран-2(5H)-он, тефлутрин, ринаксипир, циаксипир, фипронил, карбофуран; гербициды для канолы: клопиралид, диклофоп, флуазифоп, глуфосинат, глифосат, метазахлор, трифлуралин, этаметсульфурон, квинмерак, квизалофоп, клетодим, тепралоксидим; фунгициды для канолы: азоксистробин, карбендазим, флудиоксонил, ипродион, прохлораз, винклозолин; инсектициды для канолы: карбофурановые фосфороорганические соединения, пиретроиды, тиаклоприд, дельтаметрин, имидаклоприд, клотианидин, тиаметоксам, ацетамиприд, динетофуран, β-цифлутрин, гамма и лямбда-цигалотрин, тау-флувалериат, этипрол, спиносад, спиноторам, флубендиамид, ринаксипир, циазипир, 4-[[(6-хлорпиридин-3-ил)метил](2,2-дифторэтил)амино]фуран-2(5H)-он.
В некоторых вариантах осуществления гербицид представляет собой атразин, бромацил, диурон, хлорсульфурон, метсульфурон, тифенсульфурон-метил, трибенурон, ацетохлор, дикамба, изоксафлутол, никосульфурон, римсульфурон, пиритиобак-натрий, флумиоксазин, хлоримурон-этил, метрибузин, квизалофоп, S-метолахлор, гексазинон или их комбинации.
В некоторых вариантах осуществления инсектицид представляет собой эсфенвалерат, хлорантранилипрол, метомил, индоксакарб, оксамил или их комбинации.
Пестицидная и инсектицидная активность
“Вредитель” включает без ограничений насекомых, грибы, бактерии, нематод, клещей, иксодовых клещей и т.п. Насекомые-вредители включают насекомых, выбранных из отрядов Coleoptera, Diptera, Hymenoptera, Lepidoptera, Mallophaga, Homoptera, Hemiptera, Orthroptera, Thysanoptera, Dermaptera, Isoptera, Anoplura, Siphonaptera, Trichoptera и т.д., в частности Lepidoptera и Coleoptera.
Специалистам в данной области техники будет понятно, что не все соединения в равной степени эффективны против всех вредителей. Соединения согласно вариантам осуществления проявляют активность против насекомых-вредителей, которые могут включать экономически важных вредителей агрономических, лесных, тепличных продуктов, продуктов питомников декоративных растений, продуктов пищи и волокнистых продуктов, продуктов, связанных со здоровьем людей и животных, продуктов, связанных с домашней и коммерческой структурой, товаров для дома и продуктов для хранения.
Личинки из отряда Lepidoptera включают без ограничения совок, подгрызающих совок, пядениц и гелиотин семейства Noctuidae Spodoptera frugiperda JE Smith (совка травяная); S. exigua Hübner (совка малая); S. litura Fabricius (табачная совка, гусеница, пожирающая соцветия); Mamestra configurata Walker (совка Берта); M. brassicae Linnaeus (совка капустная); Agrotis ipsilon Hufnagel (совка-ипсилон); A. orthogonia Morrison (совка прямоугольная); A. subterranea Fabricius (совка зернистая); Alabama argillacea Hübner (совка хлопковая американская); Trichoplusia ni Hübner (совка ни); Pseudoplusia includens Walker (соевая совка); Anticarsia gemmatalis Hübner (гусеница вельветовых бобов); Hypena scabra Fabricius (совка клеверная); Heliothis virescens Fabricius (табачная листовертка); Pseudaletia unipuncta Haworth (совка луговая); Athetis mindara Barnes and Mcdunnough (шершавая совка); Euxoa messoria Harris (чернобокая гусеница совки); Earias insulana Boisduval (совка хлопковая египетская); E. vittella Fabricius (совка пятнистая); Helicoverpa armigera Hübner (совка щетинконогая резедовая); H. zea Boddie (совка кукурузная или хлопковая совка); Melanchra picta Harris (совка); Egira (Xylomyges) curialis Grote (цитрусовая совка); огневки, чехлоноски, бабочки, строящие паутинные гнезда, конусные бабочки и вредители, скелетирующие листья, из семейства Pyralidae Ostrinia nubilalis Hübner (огневка кукурузная); Amyelois transitella Walker (гусеницы, повреждающие рубчики цитрусовых); Anagasta kuehniella Zeller (огневка мельничная); Cadra cautella Walker (огневка сухофруктовая); Chilo suppressalis Walker (желтая рисовая огневка); C. partellus (сорговая огневка); Corcyra cephalonica Stainton (огневка рисовая); Crambus caliginosellus Clemens (огневка кукурузная); C. teterrellus Zincken (огневка мятликовая); Cnaphalocrocis medinalis Guenée (листовертка рисовая); Desmia funeralis Hübner (виноградная листовертка); Diaphania hyalinata Linnaeus (дынная огневка); D. nitidalis Stoll (огневка огурцов-пикули); Diatraea grandiosella Dyar (огневка кукурузная юго-западная), D. saccharalis Fabricius (огневка сахарного тростника); Eoreuma loftini Dyar (мексиканская рисовая огневка); Ephestia elutella Hübner (огневка зерновая (какао)); Galleria mellonella Linnaeus (большая восковая моль); Herpetogramma licarsisalis Walker (огневка-травянка); Homoeosoma electellum Hulst (огневка подсолнечниковая); Elasmopalpus lignosellus Zeller (малая кукурузная огневка); Achroia grisella Fabricius (малая восковая моль); Loxostege sticticalis Linnaeus (луговой мотылек); Orthaga thyrisalis Walker (чайная моль); Maruca testulalis Geyer (огневка акациевая); Plodia interpunctella Hübner (моль индийская мучная); Scirpophaga incertulas Walker (стеблевая рисовая огневка); Udea rubigalis Guenée (огневка ржаво-коричневая); и листовертки, листовертки-почкоеды, плодожорки и гусеницы-вредители плодов семейства Tortricidae Acleris gloverana Walsingham (западная черноголовая листовертка); A. variana Fernald (восточная черноголовая листовертка); Archips argyrospila Walker (листовертка плодовых деревьев); A. rosana Linnaeus (европейская листовертка) и другие виды Archips, Adoxophyes orana Fischer von Rösslerstamm (листовертка сетчатая); Cochylis hospes Walsingham (полосатая подсолнечниковая моль); Cydia latiferreana Walsingham (лещинная плодожорка); C. pomonella Linnaeus (яблонная плодожорка); Platynota flavedana Clemens (листовертка изменчивая); P. stultana Walsingham (листовертка всеядная); Lobesia botrana Denis & Schiffermüller (листовертка европейская виноградная); Spilonota ocellana Denis & Schiffermüller (листовертка почковая); Endopiza viteana Clemens (листовертка виноградная); Eupoecilia ambiguella Hübner (листовертка гроздевая); Bonagota salubricola Meyrick (листовертка бразильская яблочная); Grapholita molesta Busck (плодожорка восточная персиковая); Suleima helianthana Riley (листовертка подсолнечниковая); Argyrotaenia spp.; Choristoneura spp.
Другие выбранные сельскохозяйственные вредители из порядка Lepidoptera включают в себя без ограничения Alsophila pometaria Harris (осенний плодовый червь); Anarsia lineatella Zeller (моль фруктовая полосатая); Anisota senatoria J.E. Smith (сатурния оранжевая дубовая); Antheraea pernyi Guérin-Méneville (китайский дубовый шелкопряд); Bombyx mori Linnaeus (тутовый шелкопряд); Bucculatrix thurberiella Busck (кривоусая хлопковая моль); Colias eurytheme Boisduval (люцерновая желтушка); Datana integerrima Grote & Robinson (хохлатка ореховая); Dendrolimus sibiricus Tschetwerikov (сибирский шелкопряд), Ennomos subsignaria Hübner (пяденица ильмовая); Erannis tiliaria Harris (пяденица липовая); Euproctis chrysorrhoea Linnaeus (шелкопряд золотистый); Harrisina americana Guérin-Méneville (пироморфида американская); Hemileuca oliviae Cockrell (гусеница бабочки-сатурнии); Hyphantria cunea Drury (американская белая бабочка); Keiferia lycopersicella Walsingham (томатная моль); Lambdina fiscellaria fiscellaria Hulst (пяденица гемлоковая восточная); L. fiscellaria lugubrosa Hulst (пяденица гемлоковая западная); Leucoma salicis Linnaeus (волнянка ивовая); Lymantria dispar Linnaeus (непарный шелкопряд); Manduca quinquemaculata Haworth (бражник пятиточечный, томатный бражник); M. sexta Haworth (томатный бражник, табачный бражник); Operophtera brumata Linnaeus (пяденица зимняя); Paleacrita vernata Peck (пяденица весенняя); Papilio cresphontes Cramer (парусник кресфонтес, «апельсиновая собака»); Phryganidia californica Packard (коконопряд кольчатый калифорнийский); Phyllocnistis citrella Stainton (цитрусовая мушка-минер); Phyllonorycter blancardella Fabricius (моль-пестрянка плодовая нижнесторонняя); Pieris brassicae Linnaeus (белянка капустная большая); P. rapae Linnaeus (белянка капустная малая); P. napi Linnaeus (белянка брюквенная); Platyptilia carduidactyla Riley (пальцекрылка артишоковая); Plutella xylostella Linnaeus (моль капустная); Pectinophora gossypiella Saunders (розовый коробочный червь); Pontia protodice Boisduval & Leconte (клетчатая белянка); Sabulodes aegrotata Guenée (всеядная пяденица); Schizura concinna J.E. Smith (хохлатка); Sitotroga cerealella Olivier (моль ячменная ангумуазская); Thaumetopoea pityocampa Schiffermuller (походный шелкопряд сосновый); Tineola bisselliella Hummel (моль комнатная); Tuta absoluta Meyrick (томатная моль); Yponomeuta padella Linnaeus (горностаевая моль плодовая); Heliothis subflexa Guenée; Malacosoma spp. и Orgyia spp.
Представляют интерес личинки и имаго из отряда Coleoptera, в том числе долгоносики из семейств Anthribidae, Bruchidae и Curculionidae (в том числе без ограничения: Anthonomus grandis Boheman (долгоносик хлопковый); Lissorhoptrus oryzophilus Kuschel (долгоносик рисовый водяной); Sitophilus granarius Linnaeus (долгоносик амбарный); S. oryzae Linnaeus (долгоносик рисовый); Hypera punctata Fabricius (долгоносик точечный); Cylindrocopturus adspersus LeConte (долгоносик подсолнечниковый стеблевой); Smicronyx fulvus LeConte (красный долгоносик подсолнечника); S. sordidus LeConte (серый долгоносик подсолнечника); Sphenophorus maidis Chittenden (долгоносик маисовый)); земляные блошки, блошки, корневые черви, листоеды, картофельные жуки и листовые минеры семейства Chrysomelidae (в том числе без ограничения: Leptinotarsa decemlineata Say (колорадский жук); Diabrotica virgifera virgifera LeConte (западный кукурузный жук); D. barberi Smith and Lawrence (северный кукурузный жук); D. undecimpunctata howardi Barber (южный кукурузный жук); Chaetocnema pulicaria Melsheimer (земляная кукурузная блошка); Phyllotreta cruciferae Goeze (блошка крестоцветная); Phyllotreta striolata (полосатая блошка); Colaspis brunnea Fabricius (листоед виноградный); Oulema melanopus Linnaeus (пьявица красногрудая); Zygogramma exclamationis Fabricius (подсолнечниковый листоед)); жуки семейства Coccinellidae (в том числе без ограничения: Epilachna varivestis Mulsant (мексиканская фасолевая коровка)); хрущи и другие жуки из семейства Scarabaeidae (в том числе без ограничения: Popillia japonica Newman (хрущик японский); Cyclocephala borealis Arrow (дупляк северный, хрущ); C. immaculata Olivier (дупляк южный, хрущ); Rhizotrogus majalis Razoumowsky (нехрущ майский); Phyllophaga crinita Burmeister (хрущ); Ligyrus gibbosus De Geer (жук морковный)); кожееды из семейства Dermestidae; проволочники из семейства Elateridae, Eleodes spp., Melanotus spp.; Conoderus spp.; Limonius spp.; Agriotes spp.; Ctenicera spp.; Aeolus spp.; короеды из семейства Scolytidae и жуки из семейства Tenebrionidae.
Представляют интерес имаго и незрелые особи отряда Diptera, в том числе минирующие мушки Agromyza parvicornis Loew (кукрузная минирующая мушка); галлицы (в том числе без ограничения SEQ ID NO: 90, SEQ ID NO: 92, SEQ ID NO: 323, SEQ ID NO: 324, SEQ ID NO: 325, SEQ ID NO: 326, SEQ ID NO: 327, SEQ ID NO: 328, SEQ ID NO: 329, SEQ ID NO: 330, SEQ ID NO: 331,: Contarinia sorghicola Coquillett (галлица сорговая); Mayetiola destructor Say (гессенская муха); Sitodiplosis mosellana Géhin (оранжевая зерновая галлица); Neolasioptera murtfeldtiana Felt, (подсолнечниковая галлица)); плодовые мушки (Tephritidae), Oscinella frit Linnaeus (плодовые мушки); цветочные мухи (в том числе без ограничения SEQ ID NO: 90, SEQ ID NO: 92, SEQ ID NO: 323, SEQ ID NO: 324, SEQ ID NO: 325, SEQ ID NO: 326, SEQ ID NO: 327, SEQ ID NO: 328, SEQ ID NO: 329, SEQ ID NO: 330, SEQ ID NO: 331,: Delia platura Meigen (муха ростковая); D. coarctata Fallen (муха озимая) и другие Delia spp., Meromyza americana Fitch (американская меромиза); Musca domestica Linnaeus (комнатная муха); Fannia canicularis Linnaeus, F. femoralis Stein (малые комнатные мухи); Stomoxys calcitrans Linnaeus (жигалка осенняя)); мухи полевые, жигалки, мухи мясные, Chrysomya spp.; Phormia spp. и другие мухи-вредители надсемейства Muscoidea, слепни Tabanus spp.; носоглоточные оводы Gastrophilus spp.; Oestrus spp.; бычьи оводы Hypoderma spp.; пестряки Chrysops spp.; Melophagus ovinus Linnaeus (рунец овечий) и другие Brachycera, комары Aedes spp.; Anopheles spp.; Culex spp.; мошки Prosimulium spp.; Simulium spp.; мокрецы, москиты, сциариды и другие Nematocera.
В качестве насекомых, представляющих интерес, включены имаго и личинки из отрядов Hemiptera и Homoptera, такие как без ограничения хермесы из семейства Adelgidae, слепняки из семейства Miridae, цикады из семейства Cicadidae, цикадки, Empoasca spp.; из семейства Cicadellidae, насекомые надсемейства Fulgoroidea из семейств Cixiidae, Flatidae, Fulgoroidea, Issidae и Delphacidae, горбатки из семейства Membracidae, листоблошки из семейства Psyllidae, белокрылки из семейства Aleyrodidae, тли из семейства Aphididae, филлоксеры из семейства Phylloxeridae, мучнистые червецы из семейства Pseudococcidae, червецы из семейств Asterolecanidae, Coccidae, Dactylopiidae, Diaspididae, Eriococcidae Ortheziidae, Phoenicococcidae и Margarodidae, кружевницы из семейства Tingidae, щитники из семейства Pentatomidae, клопы-черепашки, Blissus spp.; и другие наземники из семейства Lygaeidae, пенницы из семейства Cercopidae, краевики из семейства Coreidae и красноклопы и красноклопы хлопковые из семейства Pyrrhocoridae.
Важные с точки зрения сельского хозяйства представители отряда Homoptera дополнительно включают без ограничения: Acyrthisiphon pisum Harris (тля гороховая); Aphis craccivora Koch (тля люцерновая); A. fabae Scopoli (тля свекловичная); A. gossypii Glover (тля хлопковая, тля бахчевая); A. maidiradicis Forbes (тля кукурузная корневая); A. pomi De Geer (тля яблонная); A. spiraecola Patch (тля зеленая цитрусовая); Aulacorthum solani Kaltenbach (тля картофельная обыкновенная); Chaetosiphon fragaefolii Cockerell (тля земляничная американская); Diuraphis noxia Kurdjumov/Mordvilko (тля ячменная); Dysaphis plantaginea Paaserini (тля яблонно-подорожниковая); Eriosoma lanigerum Hausmann (тля кровяная); Brevicoryne brassicae Linnaeus (тля капустная); Hyalopterus pruni Geoffroy (тля мучнистая сливовая); Lipaphis erysimi Kaltenbach (тля горчичная листовая); Metopolophium dirrhodum Walker (тля розанно-злаковая); Macrosiphum euphorbiae Thomas (тля картофельная большая); Myzus persicae Sulzer (тля оранжерейная, тля персиковая зеленая); Nasonovia ribisnigri Mosley (тля цикориево-смородиновая); Pemphigus spp. (тли корневые и тли галловые); Rhopalosiphum maidis Fitch (тля сорговая); R. padi Linnaeus (тля черемуховая обыкновенная); Schizaphis graminum Rondani (тля злаковая обыкновенная); Sipha flava Forbes (тля сахарного тростника желтая); Sitobion avenae Fabricius (большая злаковая тля); Therioaphis maculata Buckton (пятнистая люцерновая тля); Toxoptera aurantii Boyer de Fonscolombe (тля померанцевая) и T. citricida Kirkaldy (тля цитрусовая); Adelges spp. (хермесы); Phylloxera devastatrix Pergande (филлоксера гикори); Bemisia tabaci Gennadius (белокрылка табачная, белокрылка хлопковая); B. argentifolii Bellows & Perring (белокрылка магнолиевая); Dialeurodes citri Ashmead (белокрылка цитрусовая); Trialeurodes abutiloneus (белокрылка полосатокрылая) и T. vaporariorum Westwood (белокрылка тепличная); Empoasca fabae Harris (цикадка картофельная); Laodelphax striatellus Fallen (темная цикадка); Macrolestes quadrilineatus Forbes (цикадка астровая); Nephotettix cinticeps Uhler (цикадка зеленая); N. nigropictus Stål (цикадка рисовая); Nilaparvata lugens Stål (бурая цикадка); Peregrinus maidis Ashmead (цикадка кукурузная); Sogatella furcifera Horvath (цикадка белоспинная); Sogatodes orizicola Muir (дельфацид рисовый); Typhlocyba pomaria McAtee (цикадка яблонная); Erythroneoura spp. (цикадки виноградные); Magicicada septendecim Linnaeus (цикада семнадцатилетняя); Icerya purchasi Maskell (червец желобчатый австралийский); Quadraspidiotus perniciosus Comstock (щитовка калифорнийская); Planococcus citri Risso (мучнистый червец цитрусовый); Pseudococcus spp. (другие мучнистые червецы); Cacopsylla pyricola Foerster (медяница грушевая); Trioza diospyri Ashmead (листоблошка хурмовая).
Виды, представляющие интерес с точки зрения сельского хозяйства, из отряда Hemiptera включают без ограничения: Acrosternum hilare Say (щитник зеленый); Anasa tristis De Geer (клоп-ромбовик печальный); Blissus leucopterus leucopterus Say (клоп-черепашка); Corythuca gossypii Fabricius (кружевница хлопковая); Cyrtopeltis modesta Distant (клоп томатный); Dysdercus suturellus Herrich-Schäffer (красноклоп хлопковый); Euschistus servus Say (клоп коричневый вонючий); E. variolarius Palisot de Beauvois (щитник однопятнистый); Graptostethus spp. (комплекс клопов-наземников); Leptoglossus corculus Say (клоп-краевик сосновый); Lygus lineolaris Palisot de Beauvois (клоп луговой); L. Hesperus Knight (слепняк западный матовый); L. pratensis Linnaeus (клопик полевой); L. rugulipennis Poppius (клоп травяной); Lygocoris pabulinus Linnaeus (зеленый слепняк); Nezara viridula Linnaeus (зеленый овощной клоп); Oebalus pugnax Fabricius (клоп-щитник рисовый); Oncopeltus fasciatus Dallas (клоп молочайный большой); Pseudatomoscelis seriatus Reuter (клоп-слепняк хлопковый).
Кроме того, варианты осуществления могут быть эффективными против Hemiptera, например, Calocoris norvegicus Gmelin (клопик картофельный); Orthops campestris Linnaeus; Plesiocoris rugicollis Fallen (клоп яблонный северный); Cyrtopeltis modestus Distant (томатный клоп); Cyrtopeltis notatus Distant (клоп-слепняк); Spanagonicus albofasciatus Reuter (слепняк белоточечный); Diaphnocoris chlorionis Say (клоп-слепняк гледичии); Labopidicola allii Knight (слепняк луковый); Pseudatomoscelis seriatus Reuter (слепняк хлопковый); Adelphocoris rapidus Say (клоп быстрый); Poecilocapsus lineatus Fabricius (слепняк четырехлинейный); Nysius ericae Schilling (низиус вересковый); Nysius raphanus Howard (ложная черепашка); Nezara viridula Linnaeus (зеленый овощной клоп); Eurygaster spp.; Coreidae spp.; Pyrrhocoridae spp.; Tinidae spp.; Blostomatidae spp.; Reduviidae spp. и Cimicidae spp.
Также включены имаго и личинки из отряда Acari (клещи), такие как Aceria tosichella Keifer (галловый клещ пшеничный); Petrobia latens Müller (петробия многоядная); клещики паутинные и клещики красные семейства Tetranychidae, Panonychus ulmi Koch (красный плодовый клещ); Tetranychus urticae Koch (обыкновенный паутинный клещ); (T. mcdanieli McGregor (клещик Макданиела); T. cinnabarinus Boisduval (красный паутинный клещик); T. turkestani Ugarov & Nikolski (туркестанский паутинный клещик); плоские клещи семейства Tenuipalpidae, Brevipalpus lewisi McGregor (оранжевый клещ); ржавчинные и почковые клещи семейства Eriophyidae и другие клещи, питающиеся листьями, и клещи, важные для здоровья человека и животных, т.е. пылевые клещи семейства Epidermoptidae, железницы семейства Demodicidae, зерновые клещи семейства Glycyphagidae, иксодовые клещи отряда Ixodidae. Ixodes scapularis Say (черноногий клещ); I. holocyclus Neumann (австралийский паралитический клещ); Dermacentor variabilis Say (клещ иксодовый собачий); Amblyomma americanum Linnaeus (иксодовый клещ Amblyomma) и конские и чесоточные клещи семейств Psoroptidae, Pyemotidae и Sarcoptidae.
Представляющими интерес насекомыми-вредителями из отряда Thysanura являются, например, Lepisma saccharina Linnaeus (чешуйница); Thermobia domestica Packard (термобия).
Дополнительные охваченные вредители-артроподы включают: пауков из отряда Araneae, таких как Loxosceles reclusa Gertsch and Mulaik (бурый паук-отшельник) и Latrodectus mactans Fabricius (черная вдова), и многоножек из отряда Scutigeromorpha, таких как Scutigera coleoptrata Linnaeus (обыкновенная мухоловка).
Насекомое-вредитель, представляющее интерес, включает надсемейство щитников и других родственных насекомых, в том числе без исключения виды, принадлежащие к семейству Pentatomidae (Nezara viridula, Halyomorpha halys, Piezodorus guildini, Euschistus servus, Acrosternum hilare, Euschistus heros, Euschistus tristigmus, Acrosternum hilare, Dichelops furcatus, Dichelops melacanthus и Bagrada hilaris (клоп из рода Bagrada)), семейству Plataspidae (Megacopta cribraria - полушаровидный щитник) и семейству Cydnidae (Scaptocoris castanea - коричневый клоп-землекоп), и виды Lepidoptera, в том числе без исключения: моль капустная, например, Helicoverpa zea Boddie; соевая совка, например, Pseudoplusia includens Walker, и бобовая гусеница, например, Anticarsia gemmatalis Hübner.
Способы измерения пестицидной активности хорошо известны из уровня техники. См., например, Czapla and Lang, (1990) J. Econ. Entomol. 83:2480-2485; Andrews, et al., (1988) Biochem. J. 252:199-206; Marrone, et al., (1985) J. of Economic Entomology 78:290-293 и патент США № 5743477, все из которых включены в данный документ посредством ссылки во всей своей полноте. Как правило, белок смешивают и применяют в анализах питания. См., например, Marrone, et al., (1985) J. of Economic Entomology 78:290-293. Такие анализы могут включать приведение растений в контакт с одним или несколькими вредителями и определение способности растения выживать и/или вызывать гибель вредителей.
Нематоды включают паразитических нематод, таких как галловые, цистообразующие и ранящие нематоды, в том числе Heterodera spp., Meloidogyne spp. и Globodera spp.; в частности представителей цистообразующих нематод, в том числе без ограничения, Heterodera glycines (соевая цистообразующая нематода); Heterodera schachtii (цистообразующая нематода свеклы); Heterodera avenae (цистообразующая нематода злаков) и Globodera rostochiensis и Globodera pailida (цистообразующые нематоды картофеля). Ранящие нематоды включают Pratylenchus spp.
Средство для обработки семян
Для защиты и для повышения продукции урожая и улучшения технологий усовершенствования признаков дополнительные средства для обработки семян могут обеспечивать дополнительную гибкость культурных растений и экономически эффективный контроль против насекомых, сорняков и заболеваний. Семенной материал можно обрабатывать, как правило, обрабатывать поверхность с помощью композиции, содержащей комбинации химических или биологических гербицидов, антидотов гербицидов, инсектицидов, фунгицидов, ингибиторов и усилителей прорастания, питательных веществ, регуляторов и активаторов роста растений, бактерицидов, нематоцидов, авицидов и/или моллюскоцидов. Эти соединения, как правило, составляют, вместе с дополнительными носителями, поверхностно-активными веществами или адъювантами, способствующими нанесению, традиционно используемыми в области техники, связанной с получением составов. Покрытия можно наносить с помощью пропитки материала для размножения жидким составом или с помощью покрытия комбинированным влажным или сухим составом. Примеры различных типов соединений, которые можно применять в качестве средств для обработки семян, представлены в The Pesticide Manual: A World Compendium, C.D.S. Tomlin Ed., Published by the British Crop Production Council, который включен в данный документ посредством ссылки.
Некоторые средства для обработки семян, которые можно применять относительно семян культур, включают без ограничения один или несколько из абсцизовой кислоты, ацибензолар-S-метила, авермектина, амитрола, азаконазола, азоспириллума, азадирахтина, азоксистробина, Bacillus spp. (в том числе один или несколько из видов cereus, firmus, megaterium, pumilis, sphaericus, subtilis и/или thuringiensis), Bradyrhizobium spp. ( в том числе один или несколько из betae, canariense, elkanii, iriomotense, japonicum, liaonigense, pachyrhizi и/или yuanmingense), каптана, карбоксина, хитозана, клотианидина, меди, циазипира, дифеноконазола, этидиазола, фипронила, флудиоксонила, флуоксастробина, флуквинконазола, флуразола, флуксофенима, белка гарпина, имазалила, имидаклоприда, ипконазола, изофлавеноидов, липохитоолигосахарида, манкозеба, марганца, манеба, мефеноксама, металаксила, метконазола, миклобутанила, PCNB, пенфлуфена, пинециллума, пентиопирада, перметрина, пикоксистробина, протиоконазола, пираклостробина, ринаксипира, S-метолахлора, сапонина, седаксана, TCMTB, тебуконазола, тиабендазола, тиаметоксама, тиокарба, тирама, толклофос-метила, триадименола, триходермы, трифлоксистробина, тритиконазола и/или цинка. Покрытие семян PCNB, относящееся к номеру регистрации EPA 00293500419, содержит квинтозен и терразол. TCMTB называется 2-(тиоцианометилтио)бензотиазол.
Сорта семян и семена со специфическими трансгенными признаками можно тестировать для определения того, какие дополнительные средства обработки семян и нормы внесения могут дополнять такие сорта и трансгенные признаки для повышения урожайности. Например, сорт с хорошей потенциальной урожайностью, но восприимчивостью к пыльной головне, может выиграть от применения средства для обработки семян, которое обеспечивает защиту от пыльной головни, сорт с хорошей потенциальной урожайностью, но восприимчивостью к цистообразующим нематодам, может выиграть от применения средства обработки семян, которое обеспечивает защиту от цистообразующей нематоды и т.д. Аналогично, сорт, включающий трансгенный признак, обеспечивающий устойчивость к насекомым, может выиграть от второго механизма действия, придаваемого средством для обработки семян, сорт, включающий трансгенный признак, придающий устойчивость к гербициду, может выиграть от средства обработки семян с антидотом, который повышает устойчивость растений к такому гербициду и т.д. К тому же, хорошее укоренение и ранняя всхожесть, которые являются результатом правильного применения средства для обработки семян, могут приводить к более эффективному использованию азота, лучшей способности переносить засуху и общего повышения потенциальной урожайности сорта или сортов, содержащих определенный признак, в комбинации со средством для обработки семян.
Способы уничтожения насекомого-вредителя и контроля популяции насекомых
В некоторых вариантах осуществления предусмотрены способы уничтожения насекомого-вредителя, включающие приведение в контакт насекомого-вредителя, либо одновременно, либо последовательно, с инсектицидно эффективным количеством рекомбинантного полипептида AfIP-1A и/или AfIP-1B. В некоторых вариантах осуществления предусмотрены способы уничтожения насекомого-вредителя, включающие приведение в контакт насекомого-вредителя с инсектицидно эффективным количеством рекомбинантного пестицидного белка с SEQ ID NO: 18 и/или белка с SEQ ID NO: 20 или его варианта.
В некоторых вариантах осуществления предусмотрены способы контроля популяции насекомого-вредителя, включающие приведение в контакт популяции насекомого-вредителя, либо одновременно, либо последовательно, с инсектицидно эффективным количеством рекомбинантных полипептидов AfIP-1A и AfIP-1B. В некоторых вариантах осуществления предусмотрены способы контроля популяции насекомого-вредителя, включающие приведение в контакт популяции насекомого-вредителя с инсектицидно эффективным количеством рекомбинантного пестицидного белка с SEQ ID NO: 18 и/или белка с SEQ ID NO: 20 или его варианта. Применяемые в данном документе “контроль популяции вредителя” или “контролировать вредителя” относятся к какому-либо эффекту в отношении вредителя, который приводит к ограничению вреда, который вызывает вредитель. Контроль вредителя включает без ограничений уничтожение вредителя, подавление развития вредителя, изменение плодовитости или роста вредителя таким образом, что вредитель оказывает меньше вреда в отношении растения, снижение количества производимого потомства, получение менее приспособленных вредителей, получение вредителей, более восприимчивых к нападению хищников или удержание вредителей от поедания растения.
В некоторых вариантах осуществления предусмотрены способы контроля популяции насекомого-вредителя, устойчивого к пестицидному белку, включающие приведение в контакт популяции насекомого-вредителя, либо одновременно, либо последовательно, с инсектицидно эффективным количеством рекомбинантного полипептида AfIP-1A и AfIP-1B. В некоторых вариантах осуществления предусмотрены способы контроля популяции насекомого-вредителя, устойчивого к пестицидному белку, включающие приведение в контакт популяции насекомого-вредителя с инсектицидно эффективным количеством рекомбинантного пестицидного белка с SEQ ID NO: 18 и/или белка с SEQ ID NO: 20 или его варианта.
В некоторых вариантах осуществления предусмотрены способы защиты растения от насекомого-вредителя, включающие экспрессию в растении или его клетке рекомбинантного полинуклеотида, кодирующего полипептид AfIP-1A и AfIP-1B. В некоторых вариантах осуществления предусмотрены способы защиты растения от насекомого-вредителя, включающие экспрессию в растении или его клетке рекомбинантного полинуклеотида, кодирующего пестицидный белок с SEQ ID NO: 18 и/или белок с SEQ ID NO: 20 или их варианты.
Колония WCRW, устойчивого к Cry3A
Также предусмотрена отобранная в лаборатории колония западного кукурузного жука (WCRW), устойчивого к Cry3A, с повышенной переносимостью модифицированного очищенного белка Cry3A (mCry3A) (US 7030295) и трансгенных объектов маиса, экспрессирующих высокие уровни mCry3A. В некоторых вариантах осуществления уровень переносимости/устойчивости к mCry3A у колонии WCRW, устойчивой к Cry3A, составлял RR>90, исходя из значений LC50 в биологических анализах, основанных на применении определенного рациона. Уровень выживания от личинок до имаго на трансгенных объектах маиса, экспрессирующих высокие уровни mCry3A, составлял >60% относительно отрицательных контрольных обработок изолинии. Сообщали о колониях WCRW, устойчивого к Cry3A, отобранных против трансгенного объекта маиса (MIR604) с уровнем экспрессии mCry3A в корнях (мкг mCry3A/г сухого веса) 23,55-27,07 для MIR604-B и 16,29-21,18 для MIR604-C (US EPA 2010) (Meihls, L., et al., Journal of Economic Entomology 104:1045-1054 (2011). Колония WCRW, устойчивого к Cry3A, полученная с помощью MIR604, имеет уровень выживания от личинок до имаго ~40% относительно изолинии, не относящейся к Bt, что приводит к низкому уровню переносимости/устойчивости к mCry3A после 10 поколений отбора (RR=15,4, исходя из LC50).
В некоторых вариантах осуществления предусмотрены способы применения колонии WCRW, устойчивого к Cry3A, согласно настоящему раскрытию для тестирования устойчивости к Cry3A и перекрестной устойчивости к Cry3A у инсектицидных белков, в том числе без исключения белков Cry и молекул дцРНК. В некоторых вариантах осуществления предусмотрены способы применения колонии WCRW, устойчивого к Cry3A, согласно настоящему раскрытию для тестирования устойчивости к Cry3A и перекрестной устойчивости к Cry3A применительно к полипептидам AfIP-1A и полипептидам AfIP-1B согласно настоящему раскрытию. В некоторых вариантах осуществления предусмотрены способы применения колонии WCRW, устойчивого к Cry3A, согласно настоящему раскрытию для тестирования устойчивости к Cry3A как часть стратегии управления устойчивостью к насекомым (IRM).
В некоторых вариантах осуществления предусмотрены способы применения колонии WCRW, устойчивого к Cry3A, согласно настоящему раскрытию для проведения скрининга в отношении перекрестной устойчивости к Cry3A применительно к инсектицидным белкам. В некоторых вариантах осуществления предусмотрены способы применения колонии WCRW, устойчивого к Cry3A, согласно настоящему раскрытию для проведения скрининга полипептидов AfIP-1A и полипептидов AfIP-1B в отношении перекрестной устойчивости к Cry3A.
В некоторых вариантах осуществления предусмотрены способы применения молекулярных маркеров, основанные на анализах транскриптома, для выявления насекомых, устойчивых к Cry3A.
Стратегии управления устойчивостью насекомых (IRM)
Было доказано, что экспрессия δ-эндотоксинов B. thuringiensis в трансгенных растениях кукурузы является эффективным средством контроля важных с точки зрения сельского хозяйства насекомых-вредителей (Perlak, et al., 1990; 1993). Однако возникли насекомые, которые устойчивы к δ-эндотоксинам B. thuringiensis, экспрессирующимся в трансгенных растениях. Такая устойчивость, если она станет широко распространенной, будет явно ограничивать коммерческое значение идиоплазмы, содержащей гены, кодирующие такие δ-эндотоксины B. thuringiensis.
Одним способом повышения эффективности трансгенных инсектицидов против целевых вредителей и одновременного снижения развития устойчивых к инсектицидам вредителей является применение полученных нетрансгенных (т.е. с неинсектицидным белком) рефугиев (раздел неинсектицидных сельскохозяйственных культур/ кукурузы) для применения трансгенных сельскохозяйственных культур, вырабатывающих один инсектицидный белок, активный против целевых вредителей. Управление по охране окружающей среды Соединенных Штатов (epa.gov/oppbppdl/biopesticides/pips/bt_corn_refuge_2006.htm, доступ к которому можно получить с применением префикса www) публикует требования по применению трансгенных сельскохозяйственных культур, вырабатывающих один Bt-белок, активный против целевых вредителей. В дополнение, Национальная ассоциация кукурузоводов на своем веб-сайте: (ncga.com/insect-resistance-management-fact-sheet-bt-corn, доступ к которому можно получить с применением префикса www) также предлагает аналогичные руководства, касающиеся требований к рефугиям. Из-за потерь, обусловленных насекомыми в пределах зоны регуфиев, более крупные рефугии могут снижать общую урожайность.
Другим способом повышения эффективности трансгенных инсектицидов против целевых вредителей и одновременного снижения развития устойчивых к инсектицидам вредителям будет хранилище инсектицидных генов, которые эффективны против групп насекомых-вредителей и которые проявляют свои эффекты посредством отличающихся механизмов действия.
Экспрессия в растении двух или большего числа инсектицидных композиций, токсичных для одного вида насекомых, при этом каждый инсектицид экспрессируется на эффективных уровнях, будет представлять собой другой способ для достижения контроля развития устойчивости. Это основано на принципе, что эволюция устойчивости к двум отдельным механизмам действия значительно менее вероятна, чем только к одному. Roush, например, описывает стратегию двух токсинов, также называемую "создание пирамиды" или "пакетирование," для управления инсектицидными трансгенными сельскохозяйственными культурами. (The Royal Society. Phil. Trans. R. Soc. Lond. B. (1998) 353:1777-1786). Пакетирование или создание пирамиды из двух различных белков, каждый из которых эффективен против целевых вредителей и при этом отсутствует перекрестная устойчивость или она невелика, может обеспечивать возможность применения меньшего рефугия. Управление по охране окружающей среды США требует существенно меньший (как правило 5%) структурированный рефугий для высаживания кукурузы, не являющейся Bt, чем для продуктов с одним признаком (как правило 20%). Существуют различные способы обеспечения эффектов IRM рефугия, в том числе различные геометрические паттерны высаживания в полях и смеси семян "в мешке", как дополнительно обсуждается у Roush.
В некоторых вариантах осуществления полипептиды AfIP-1A и AfIP-1B согласно настоящему раскрытию применимы в качестве стратегии управления устойчивостью насекомых в комбинации (т.е. в составе пирамиды) с другими пестицидными белками, включающими без ограничения Bt-токсины, инсектицидные белки Xenorhabdus sp. или Photorhabdus sp. и т.п.
Предусмотрены способы контроля заражения насекомыми отряда Lepidoptera и/или Coleoptera трансгенного растения, которые обеспечивают управление устойчивостью насекомых, включают экспрессию в растении по меньшей мере двух различных инсектицидных белков, имеющих отличающиеся механизмы действия.
В некоторых вариантах осуществления способы контроля заражения насекомыми из отряда Lepidoptera и/или Coleoptera трансгенного растения и обеспечения управления устойчивостью насекомых применительно по меньшей мере к одному из инсектицидных белков включают полипептид AfIP-1A и AfIP-1B, инсектицидный в отношении насекомых из отряда Lepidoptera и/или Coleoptera.
В некоторых вариантах осуществления способы контроля заражения насекомыми из отряда Lepidoptera и/или Coleoptera трансгенного растения и обеспечения управления устойчивостью насекомых применительно по меньшей мере к одному из инсектицидных белков предусматривают белок с SEQ ID NO: 18 и/или белок с SEQ ID NO: 20 или их варианты, инсектицидные в отношении насекомых из отряда Lepidoptera и/или Coleoptera.
В некоторых вариантах осуществления способы контроля заражения насекомыми из отряда Lepidoptera и/или Coleoptera трансгенного растения и обеспечения управления устойчивостью насекомых включают экспрессию в трансгенном растении полипептида AfIP-1A и AfIP-1B и белка Cry, инсектицидных в отношении насекомых из отряда Lepidoptera и/или Coleoptera, причем они имеют отличающиеся механизмы действия.
В некоторых вариантах осуществления способы контроля заражения насекомыми из отряда Lepidoptera и/или Coleoptera трансгенного растения и обеспечения управления устойчивостью насекомых включают экспрессию в трансгенном растении белка с SEQ ID NO: 18 и/или белка с SEQ ID NO: 20 или их вариантов и белка Cry, инсектицидных в отношении насекомых из отряда Lepidoptera и/или Coleoptera, причем они имеют отличающиеся механизмы действия.
Также предусмотрены способы снижения вероятности появления устойчивости у насекомых из отряда Lepidoptera и/или Coleoptera к трансгенным растениям, экспрессирующим в растениях инсектицидные белки для контроля видов насекомых, включающие экспрессию полипептидов AfIP-1A и AfIP-1B, инсектицидных в отношении видов насекомых, в комбинации со вторым белком, инсектицидным в отношении вида насекомого, причем они имеют отличающиеся механизмы действия.
Также предусмотрены способы снижения вероятности появления устойчивости у насекомых из отряда Lepidoptera и/или Coleoptera к трансгенным растениям, экспрессирующим в растениях инсектицидные белки для контроля вида насекомого, включающие экспрессию белка с SEQ ID NO: 18 и/или белка с SEQ ID NO: 20 или их вариантов, инсектицидных в отношении вида насекомого, в комбинации со вторым белком, инсектицидным в отношении вида насекомого, причем они имеют отличающиеся механизмы действия.
Также предусмотрены средства для эффективного управления устойчивостью насекомых из отряда Lepidoptera и/или Coleoptera к трансгенным растениям, включающие совместную экспрессию на высоких уровнях в растениях двух или более инсектицидных белков, токсичных для насекомых из отряда Lepidoptera и/или Coleoptera, но при этом каждый характеризуется отличающимся механизмом осуществления его активности применительно к уничтожению, где два или более инсектицидных белка включают полипептид AfIP-1A и AfIP-1B и белок Cry. Также предусмотрены средства для эффективного управления устойчивостью насекомых из отряда Lepidoptera и/или Coleoptera к трансгенным растениям, включающие совместную экспрессию на высоких уровнях в растениях двух или более инсектицидных белков, токсичных для насекомых из отряда Lepidoptera и/или Coleoptera, но при этом каждый характеризуется отличающимся механизмом осуществления его активности применительно к уничтожению, где два или более инсектицидных белка включают белок с SEQ ID NO: 18 и/или белок с SEQ ID NO: 20 или их варианты и белок Cry.
В дополнение, предусмотрены способы получения разрешения контролирующих органов для выращивания или коммерческой реализации растений, экспрессирующих белки, инсектицидные в отношении насекомых из отряда Lepidoptera и/или Coleoptera, включающие стадию обращения, предоставления или ссылки на данные анализов связывания белков насекомых, показывающих, что полипептид AfIP-1A и AfIP-1B не конкурирует с сайтами связывания белков Cry у таких насекомых. В дополнение, предусмотрены способы получения разрешения контролирующих органов для выращивания или коммерческой реализации растений, экспрессирующих белки, инсектицидные в отношении насекомых из отряда Lepidoptera и/или Coleoptera, включающие стадию обращения, предоставления или ссылки на данные анализов связывания белков насекомых, показывающих, что белок с SEQ ID NO: 18 и/или белок с SEQ ID NO: 20 или их варианты не конкурируют с сайтами связывания для белков Cry у таких насекомых.
Способы повышения урожайности растения
Предусмотрены способы повышения урожайности. Способы включают получение растения или растительной клетки, экспрессирующих полинуклеотид, кодирующий пестицидную полипептидную последовательность, раскрытую в данном документе, и выращивание растения или его семени в поле, зараженном вредителем, против которого полипептид обладает пестицидной активностью. В некоторых вариантах осуществления полипептид обладает пестицидной активностью против чешуекрылого, жесткокрылого, двукрылого, полужесткокрылого или нематодного вредителя, и поле заражено чешуекрылым, полужесткокрылым, жесткокрылым, двукрылым или нематодным вредителем.
Как определяется в данном документе, “урожайностью” растения называют качество и/или количество биомассы, продуцируемой растением. Применяемая в данном документе “биомасса” относится к любому измеренному продукту растения. Увеличением продукции биомассы является любое улучшение урожайности измеренного продукта растения. Увеличение урожайности растения имеет несколько коммерческих применений. Например, повышение биомассы листьев растения может повышать урожайность листовых овощей для потребления человеком или животными. Кроме того, увеличение биомассы листьев можно применять для увеличения производства фармацевтических или промышленных продуктов растительного происхождения. Повышение урожайности может включать любое статистически значимое повышение, в том числе без ограничения, по меньшей мере 1% повышение, по меньшей мере 3% повышение, по меньшей мере 5% повышение, по меньшей мере 10% повышение, по меньшей мере 20% повышение, по меньшей мере 30% повышение, по меньшей мере 50% повышение, по меньшей мере 70% повышение, по меньшей мере 100% или большее повышение урожайности по сравнению с растением, не экспрессирующим пестицидную последовательность.
В определенных способах урожайность растения повышается в результате улучшенной устойчивости к вредителю растения, экспрессирующему полипептид AfIP-1A и AfIP-1B, раскрытый в данном документе. Экспрессия полипептида AfIP-1A и AfIP-1B приводит к сниженной способности вредителя к заражению растения или питанию на растении, таким образом, улучшая урожайность растения.
Способы переработки
Дополнительно предусмотрены способы переработки растения, части растения или семени с получением пищевого или кормового продукта из растения, части растения или семени, содержащих полипептид AfIP-1A и/или полипептид AfIP-1B. Растения, части растения или семена, представленные в данном документе, можно перерабатывать с получением масла, белковых продуктов и/или побочных продуктов, которые являются производными, полученными путем переработки, которые имеют коммерческое значение. Неограничивающие примеры включают трансгенные семена, содержащие молекулу нуклеиновой кислоты, кодирующую полипептид AfIP-1A и/или полипептид AfIP-1B, которые можно перерабатывать с получением соевого масла, соевых продуктов и/или соевых побочных продуктов.
"Переработка" относится к любым физическим и химическим способам, применяемым для получения какого-либо соевого продукта, и они включают без ограничения кондиционирование нагреванием, вальцевание и измельчение, экструзию, экстракцию растворителем или вымачивание в воде и экстракцию цельных или дробленых семян.
Следующие примеры представлены для иллюстрирования, а не для ограничения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пример 1 - Идентификация инсектицидного белка, активного против западного кукурузного жука, из штамма DDMC P4G7
Инсектицидные белки AfIP-1A-31 и AfIP-1B-32 идентифицировали при помощи очистки белка, секвенирования N-концевых аминокислот и ПЦР-клонирования из бактериального штамма DDMC P4G7 следующим образом. Инсектицидную активность против западного кукурузного жука (Diabrotica virgifera virgifera, WCRW) получали из клеточного лизата DDMC P4G7, выращенного на бульоне Луриа (LB) и культивированного в течение ночи при 28°C.
Биологические анализы с западным кукурузным жуком (WCRW) проводили с применением образцов клеточных лизатов, смешанных с расплавленной легкоплавкой питательной средой для WCRW (Southland Products Inc., Лейк Виллидж, Арканзас) в 96-луночном формате. Новорожденных Diabrotica virgifera virgifera помещали в каждую лунку 96-луночного планшета. Анализ проводили в течение четырех дней при 25°C и затем проводили оценку смертности насекомых и остановку роста насекомых. Баллами отмечали как погибших, с тяжелой остановкой (небольшой рост или отсутствие роста, но живые), с остановкой (рост до второй личиночной стадии, но не эквивалентные контролям) или отсутствие активности. Образцы, демонстрирующие смертность или тяжелую остановку изучали дополнительно.
Геномную ДНК экстрагировали с применением набора для бактериальной геномной ДНК GenElute™ (Sigma). 16S рибосомальные последовательности получали посредством полимеразной цепной реакции с применением набора для ПЦР HF advantage (Clontech) и 16S консервативных ПЦР-праймеров AGAGTTTGATCCTGGCTCAG (16SFOR) (SEQ ID NO: 7) и ACGGCTACCTTGTTACGACTT (16SREV) (SEQ ID NO: 8)). ДНК-продукты этой реакции подвергали секвенированию концов в 96-луночных планшетах с применением набора для секвенирования ABI BigDye™ terminator версии 3.1 Prism. После очистки на основе этанола продукты реакции циклического секвенирования разделяли и выявляли на автоматическом секвенаторе Life Technologies™ ABI 3730xl и индивидуальные последовательности извлекали из секвенатора. Последовательность гена 16s рРНК применяли в качестве запрашиваемой последовательности для поиска FastA (Wisconsin Package версия 9.0, Genetics Computer Group, Мадисон, Висконсин) в GenBank в отношении подобных последовательностей. На основании последовательности гена рРНК штамм идентифицировали как Alcaligenes faecalis. Штамм DDMC P4G7 Alcaligenes faecalis депонировали 3 января 2012 года под номером доступа NRRL B-50625 в коллекции культур службы сельскохозяйственных исследований (NRRL), 1815 North University Street, Пеория, Иллинойс 61604, (nrrl.ncaur.usda.gov, доступ к которому можно получить во всемирной сети Интернет с применением префикса "www").
Клеточный осадок из полученной в течение ночи культуры из одной колонии DDMC P4G7 лизировали с применением двух проходов в клеточном дезинтеграторе серии TS (Constant Systems Inc.). Просветленный экстракт фракционировали с помощью 40% сульфата аммония и осажденный белок удаляли путем центруфугирования. Концентрацию сульфата аммония повышали до 80% насыщения, осажденный белок удаляли путем центрифугирования. Фракцию осадка растворяли в 20 мМ Na MOPS, pH 7,1, 10 мМ NaCl, центрифугировали и обессоливали в 20 мМ MOPS pH 7,1, 10 мМ NaCl с применением обессоливающей колонки GE HiPrep 26/10. Обессоленный экстракт загружали на анионообменную колонку 20 мл Ceramic HyperD® Q (Pall) подходящего размера. Линейный градиент в колонке объемом 7,5 осуществляли от 0 до 300 мМ NaCl. Фракции из анионообменной колонки Ceramic HyperD® Q тестировали в отношении WCRW в пестицидном биологическом анализе, описанном выше. Пул, активный в отношении WCRW, полученный с помощью Hyper D, концентрировали, обессоливали и загружали на 22 мл колонку с гидроксиапатитом (тип 1 гидроксиапатит Bio-Rad) и градиент с объемом слоя 15 обеспечивали с от 0 до 150 мМ фосфата натрия, pH 6,8. Фракции, активные в отношении WCRW, концентрировали с помощью 10 кДа спиновых фильтров и загружали на колонку Superdex® 200, уравновешенную 100 мМ бикарбонатом аммония. Фракции, полученные после хроматографии на Superdex® 200, снова подвергали анализу в отношении активности по отношению к WCRW. На этой стадии было обнаружено, что смешивание двух компонентов или фракций требуется для поддержания высокого уровня активности против WCRW, что указывает на то, что может требоваться более одного белка. Каждый из идентифицированных пулов с компонентом, активным в отношении WCRW, загружали на 0,8 мл колонку ProSwift® SAX (Dionex) и объемный градиент колонки 60 начинали от 0 до 220 мМ NaCl, pH 6,2. Фракции еще раз анализировали в отношении активности против WCRW в присутствии или в отсутствие второго компонента. Компоненты, активные в отношении WCRW, дополнительно очищали, что приводило к одиночным полоскам при электрофорезе с гелем LDS. Прогнозировали, что более крупный компонент, обозначенный в данном документе как AfIP-1B-32, составляет приблизительно 76 кДа, и прогнозировали, что меньший компонент, обозначенный в данном документе как fIP-1A-31, составляет приблизительно 16 кДа. Индивидуальные компоненты демонстрировали инсектицидную активность только при более высоких концентрациях при индивидуальной оценке, но комбинация AfIP-1A-31 с AfIP-1B-32 подавляла рост личинок WCRW при концентрациях ~ в 100 раз меньших.
Для определения последовательности белка AfIP-1A-31 и AfIP-1B-32 проводили секвенирование N-конца и масс-спектрометрию. Часть геля LDS, соответствующую полоскам 76 кДа и 16 кДа, обесцвечивали, и вырезали, и подвергали как секвенированию N-конца, так и идентификации с помощью MS. Расщепленные белки для идентификации с помощью MS получали из обесцвеченных вырезанных полосок геля. Вырезанные полоски геля восстанавливали с помощью DTT и затем алкилировали с помощью йодацетамида. После расщепления трипсином в течение ночи образцы подвергали анализу LCMS.
Анализ жидкостной хроматографии-танденмной масс-спектрометрии (LC-MS/MSMS) для расщепленных трипсином пептидов проводили с применением электрораспыления на масс-спектрометре LTQ Orbitrap XL™ (Thermo Scientific, Сан-Хосе, Калифорния), соединенном с системой для нано-LC Eksigent NanoLC-1D Plus™ (Eksigent, Дублин, Калифорния).
Аминокислотные последовательности определяли для N-концевых частей AfIP-1A-31 и AfIP-1B-32. Белки, представляющие интерес, переносили на мембрану PVDF и помещали в картридж Procise, чтобы подвергнуть химическому превращению в PTH (фенилтиогидантоиновые) аминокислоты в секвенаторе белка Applied Biosystems® Procise® 494 (Applied Biosystems®, Калифорния).
Полученную N-концевую аминокислотную последовательность подвергали поиску BLAST против лабораторной базы данных (Bacteria-Plus), которая включала все бактериальные белковые последовательности и последовательности кератина из неизбыточной базы данных NCBI (nr) и лабораторных белковых последовательностей. Поиск в базе данных малых нуклеотидных последовательностей осуществляли с контигами, полученными на основании геномной последовательности штамма DDMC P4G7 Alcaligenes faecalis. Контиги, полученные для этого штамма, описаны в примере 2. Контиги DDMC P4G7 также транслировали с получением белков из открытой рамки считывания (ORF) с применением программного обеспечения EMBOSS getorf.
Пример 2 - Геномное секвенирование AfIP-1A-31 и AfIP-1B-32
Выделенную геномную ДНК из штамма DDMC P4G7 Alcaligenes faecalis получали в соответствии с протоколом конструирования библиотеки, разработанным Illumina®, и секвенировали с применением Illumina® Genome Analyzer IIx. Собирали последовательности контигов нуклеиновых кислот и получали открытые рамки считывания.
Для участков аминокислотной последовательности, идентифицированных для AfIP-1A-31 и AfIP-1B-32 при помощи секвенирования N-конца и секвенирования с использованием LC-MS/MS/MS (описано в примере 1), проводили поиск против белков, предсказанных по открытым рамкам считывания (ORF) при сборках контигов. Пептиды демонстрировали совершенное совпадение с двумя смежными ORF, называемыми ORF101 и ORF105, которые соответствовали AfIP-1A-31 и AfIP-1B-32, соответственно. ORF101 и ORF105 считывались в одном направлении и были разделены 11 парами оснований. Выше ORF101 следующая ORF (265) считывается в обратном направлении. Ниже ORF105 было 3 ORF, считывание которых также происходит в обратном направлении. По-видимому, ORF 101 и 105 кодируют AfIP-1A-31 и AfIP-1B-32 и образуют единый оперон.
Кодирующие последовательности применяли для разработки следующих праймеров для клонирования кодирующей последовательности AfIP-1A-31: GCTGAGGACTTACATATGACTGC (Orf101FOR) (SEQ ID NO: 9) и CTTCTATGTCCAGGATCCTCTCCCTTAGG (Orf101REV) (SEQ ID NO: 10). Этот клон получали посредством полимеразной цепной реакции с применением набора HF Advantage® PCR (Clontech) и геномной ДНК из DDMC P4G7 в качестве шаблона. Полученную ДНК лигировали в pET-14a (Novagen®) с применением сайтов NdeI/XhoI. Клонированную последовательность подтверждали секвенированием.
Кодирующую последовательность применяли для разработки следующих праймеров для клонирования гена AfIP-1B-32: GGAGAAACATATGGACATAGAAGCTAAATCC (Orf105FOR) (SEQ ID NO: 11) и GGAGGATCCCTGAGTTTCAGGCC (Orf105REV) (SEQ ID NO: 12). Условия анализа ступенчатой ПЦР (универсальный набор GenomeWalker™ (BD Biosciences) применяли с набором для ПЦР Advantage®-HF. Полученную ДНК лигировали в pET-14a (Novagen®) с применением сайтов NdeI/XhoI. Клонированную последовательность подтверждали секвенированием.
На основе результатов секвенирования ДНК и белка полинуклеотидная последовательность AfIP-1A-31 показана как SEQ ID NO: 1, а полипептидная последовательность как SEQ ID NO: 2. Полинуклеотидная последовательность AfIP-1B-32 представлена как SEQ ID NO: 3, а полипептидная последовательность как SEQ ID NO: 4. Усеченный на N-конце (4 аминокислоты) полипептид AfIP-1A-31 также идентифицировали из штамма DDMC P4G7 Alcaligenes faecalis, который представлен как SEQ ID NO: 6, и, как было обнаружено, обладает инсектицидной активностью в отношении WCRW при комбинировании с белком AfIP-1B-32 (SEQ ID NO: 4). Полинуклеотидную последовательность, имеющую кодон ATG (SEQ ID NO:5), кодирующий AfIP-1A-31 с 4 усеченными аминокислотами на N-конце с Met, добавленным на N-конце (SEQ ID NO: 6), синтезировали и экспрессировали в E. coli, подтверждая инсектицидную активность в отношении WCRW при комбинировании с белком AfIP-1B-32 (SEQ ID NO: 4).
Пример 3 - Геномная последовательность и анализ гомологии AfIP-1A-31 и AfIP-1B-32
Генную идентичность можно определить посредством проведения поисков BLAST (средство поиска основного локального выравнивания; Altschul, et al., (1993) J. Mol. Biol. 215:403-410; см. также ncbi.nlm.nih.gov/BLAST/, доступ к которому можно получить с применением префикса www) с параметрами по умолчанию относительно сходства с последовательностями, которые содержатся в публично доступной базе данных BLAST "nr" (содержащей все неизбыточные CDS трансляции из GenBank, последовательности, полученные на основании 3-мерной структуры базы данных белков Brookhaven, последней главной версии базы данных белковых последовательностей SWISS-PROT, баз данных EMBL и DDBJ). Полинуклеотидные последовательности SEQ ID NO: 1 и SEQ ID NO: 3 анализировали.
AfIP-1A-31 (SEQ ID NO: 2) показал отдаленную гомологию с эгеролизин-подобными белками, которые имеют № ID по Pfam F06355 (ссылка на базу данных Pfam: en.wikipedia.org/wiki/Pfam, доступ к которой можно получить с применением префикса www). Близкие гомологи AfIP-1B-32 (SEQ ID NO: 3) не были идентифицированы. Отдаленные гомологи, гипотетический белок Slin_6118 (эталонная последовательность в NCBI: YP_003390879.1) и гипотетический белок Slin_6117 (эталонная последовательность в NCBI: YP_003390878.1), идентифицировали из Spirosoma linguale (обозначены в данном документе как Slin6118 и Slin6117). Кодирующая последовательность Spirosoma linguale имеет последовательность ДНК, изложенную в SEQ ID NO: 13, и аминокислотная последовательность, обозначенная как Slin6118, изложена в SEQ ID NO: 14. Аминокислотная последовательность Slin6118 (SEQ ID NO: 14) на 43% идентична и на 61% сходна с AfIP-1A-31 (SEQ ID NO: 2). Последовательность ДНК Slin6117 изложена как SEQ ID NO: 15, а аминокислотная последовательность как SEQ ID NO: 16. Аминокислотная последовательность Slin6117 (SEQ ID NO: 16) на 36% идентична и на 60% сходна с AfIP-1B-32 (SEQ ID NO: 2).
Поиск в базах данных метагеномных последовательностей DOE-JGI (img.jgi.doe.gov/cgi-bin/m/main.cgi, доступ к которому можно получить с использованием префикса www) относительно последовательностей нуклеиновой кислоты, кодирующих белки, относящиеся к Pfam Pf06355, привел к идентификации FGTW-51 из последовательностей, ассоциированных с последовательностями выращивающего грибы термита-рабочего (FGTW). Гипотетический ген № ID 2066809079 в FGTW_contig30527 (SEQ ID NO:17) кодировал прогнозируемый эроглизин-подобный белок, обозначенный в данном документе как FGTW-51 (SEQ ID NO: 18). Прогнозируемая аминокислотная последовательность FGTW-51 (SEQ ID NO: 18) на 46% идентична и на 61% сходна с AfIP-1A-31 (SEQ ID NO: 2). 152 нуклеотида ниже гена FGTW-51 представляли собой гипотетический ген № ID 2066809078 (SEQ ID NO: 19), кодирующий гипотетический белок, обозначенный в данном документе как FGTW-52 (SEQ ID NO: 20), который на 48% идентичен и на 69% сходен с AfIP-1B-32 (SEQ ID NO: 4). На ФИГ. 1 показано выравнивание аминокислотных последовательностей AfIP-1A-31 (SEQ ID NO: 2) с Slin6118 (SEQ ID NO: 14) и FGTW-51 (SEQ ID NO: 18). На ФИГ. 2 показано выравнивание аминокислотных последовательностей AfIP-1B-32 (SEQ ID NO: 4) с Slin6117 (SEQ ID NO: 16) и FGTW-52 (SEQ OD NO: 20). Кроме того, таблицы, суммирующие глобальную идентичность, представлены в таблице 5A и таблице 5B. Значения процентной идентичности и сходства рассчитывали с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen™ Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию.
Пример 4 - Экспрессия рекомбинантных белков AfIP-1A-31 и AfIP-1B-32 в E. coli
Кодирующие последовательности AfIP-1A-31 и AfIP-1B-32 синтезировали и клонировали в вектор pET24 (Novagen®) как с нативным стоп-кодоном (TAA), SEQ ID NO: 1 и SEQ ID NO: 2, соответственно, так и со стоп-кодоном, удаленным для трансляции C-конца с добавлением 6x-гистидиновой метки. Последовательность AfIP-1A-31 с гистидиновой меткой изложена как SEQ ID NO: 23, и AfIP-1B-32 с гистидиновой меткой изложена как SEQ ID NO: 25. Этими четырьмя векторами трансформировали клетки E. coli. Массовые культуры выращивали до O.D.280 нм~0,5 и затем культуры индуцировали с помощью изопропил-β-D-1-тиогалактопиранозида (IPTG) и обеспечивали возможность роста в течение 16 часов при 16°C. Клеточные осадки лизировали с помощью реагента ¼ B-PER (ThermoScientific), 50 мМ Tris, pH 8,0, и эндонуклеазы OmniCleave™, и лизоцима Ready-Lyse™ (Epicentre®). После лизирования растворы центрифугировали и супернатант из культур с конструкциями pET24 AfIP-1A-31 и pET24 AfIP-1B-32 с нативными стоп-кодонами осаждали с помощью 30% сульфата аммония, центрифугировали и супернатант осаждали с помощью 80% сульфата аммония. Лизаты, подвергнутые анализу с применением WCRW, были активными. Такую же процедуру производили для конструкций pET24 AfIP-1A-31 и AfIP-1B-32 с C-концевой 6x-гистидиновой меткой за исключением того, что лизат дополнительно очищали через колонку со смолой Talon™ (ThermoScientific). Белок с His-меткой элюировали при помощи 150 мМ имидазола в PBS. Имидазол удаляли из образца с применением обессоливающей колонки PD-10 (GE Healthcare), уравновешенной PBS. Лизаты, подвергнутые анализу с применением WCRW, были активны в случае присутствия как AfIP-1A-31 (SEQ ID NO: 2 или SEQ ID NO: 24 (с His-меткой)), так и AfIP-1B-32 (SEQ ID NO: 4 или SEQ ID NO: 26 (с His-меткой)).
Пример 5 - Анализы очищенных белков с использованием Coleoptera
Биологические анализы-скрининги инсектицидной активности проводили с очищенным рекомбинантным AfIP-1A-31 с C-концевой His-меткой (SEQ ID NO: 24) и AfIP-1B-32 с C-концевой His-меткой (SEQ ID NO: 26) для оценки эффектов инсектицидного белка на личинок разновидности Coleoptera, в том числе западного кукурузного жука (Diabrotica virgifera) - WCRW, южного кукурузного жука (Diabrotica undecimpunctata howardi) - SCRW, северного кукурузного жука (Diabrotica barberi) - NCRW, при этом анализы питания Coleoptera проводили на искусственном рационе, содержащем инсектицидный белок. Инсектицидные белки включали в искусственный рацион, специфический для жесткокрылых (Southland Products Inc., Лейк Виллидж, Арканзас). Одну новорожденную личинку помещали в каждую лунку для питания ad libitum в течение 4 дней. Результаты выражали как положительные в отношении личинок реакции, такие как остановка развития и/или смерть. Результаты выражали как отрицательные, если личинки были подобны отрицательному контролю, который питался рационом, в котором использовался только вышеуказанный буфер. Для определения LC50 и IC50 инсектицидных полипептидов AfIP-1A-31 (с His-меткой, SEQ ID NO: 24) и AfIP-1B-32 (с His-меткой, SEQ ID NO: 26) в отношении западного кукурузного жука (Diabrotica virgifera) AfIP-1A-31 анализировали в серии разведений от 250 ppm до 0,1 ppm, при этом AfIP-1B-32 поддерживали при 250 ppm, и, наоборот, AfIP-1B-32 анализировали в серии разведений от 250 ppm до 0,1 ppm, при этом AfIP-1A-31 поддерживали при 250 ppm. Одну новорожденную личинку помещали в каждую лунку для питания ad libitum в течение 4 дней. Каждый биологический анализ выполняли в восьми повторностях при каждой дозе и биологический анализ повторяли трижды. Результаты выражали как LC50 для смертности и/или IC50 посредством взвешивания выживших личинок при каждой концентрации белка. Результаты анализов с применением WCRW для инсектицидных полипептидов AfIP-1A-31 (SEQ ID NO: 2) и AfIP-1B-32 (SEQ ID NO: 4) при разведении одного компонента, тогда как второй компонент поддерживают при 250 ppm, показаны в таблице 6.
Анализ AfIP-1A-31 и AfIP-1B-32 с применением WCRW
(+AfIP-1B-32 из расчета 250 ppm)
(+AfIP-1A-31 из расчета 250 ppm)
В дополнение, также определяли IC50 и LC50 при равном массовом соотношении AfIP-1A-31 и AfIP-1B-32 и двукратном серийном разведении от 240 ppm AfIP-1A-31 вместе с 240 ppm AfIP-1B-32 с PBS и в случае рациона насекомого для каждого белка для западного кукурузного жука (Diabrotica virgifera) - WCRW, южного кукурузного жука (Diabrotica undecimpunctata howardi) - SCRW, северного кукурузного жука (Diabrotica barberi) - NCRW. Результаты анализов с применением WCRW, NCRW и SCRW для инсектицидных полипептидов AfIP-1A-31 (SEQ ID NO: 2) и AfIP-1B-32 (SEQ ID NO: 4) при равном массовом соотношении показаны в таблице 7.
Для дополнительной оценки инсектицидной активности AfIP-1A-31 и AfIP-1B-32 анализ с применением WCRW проводили при различных соотношениях концентраций (таблица 8) с применением матрицы разведений для каждого белка от 128 ppm до 0,06 ppm (от 7951 нМ до 3,7 нМ для AfIP-1A-31 и от 1671 нМ до 0,8 нМ для AfIP-1B-32). Определяли балл каждой комбинации разведений в отношении уничтожения или остановки развития. Активность тяжелой остановки развития наблюдали вплоть до ~1 ppm для каждого компонента, и тяжелую остановку развития наблюдали в случае концентрации ниже 0,1 ppm, когда второй компонент был насыщающим (таблица 8).

Для дополнительной оценки инсектицидной активности AfIP-1A-31 и AfIP-1B-32 отдельно проводили анализ с применением WCRW при различных концентрациях с применением матрицы разведений для каждого белка от 10000 ppm до 156 ppm (концентрацию белка в исходном растворе определяли с помощью BCA) для AfIP-1A-31 и от 6000 ppm до 94 ppm (концентрацию белка в исходном растворе определяли с помощью BCA) для AfIP-1B-32. Определяли балл каждого разведения в отношении уничтожения или остановки развития. Остановку развития постоянно наблюдали при концентрации 625 ppm или выше для AfIP-1A-31 отдельно и при концентрации 3000 ppm для AfIP-1B-32 отдельно (таблица 9).
Пример 6 - Анализы очищенных белков с применением Lepidoptera
Биологические анализы-скрининги инсектицидной активности проводили с очищенным рекомбинантным AfIP-1A-31 с C-концевой His-меткой (SEQ ID NO: 24) и AfIP-1B-32 с C-концевой His-меткой (SEQ ID NO: 26) для оценки эффектов инсектицидных белков на личинок разновидности Lepidoptera.
Анализы питания Lepidoptera проводили на искусственном рационе, содержащем белки AfIP-1A-31 (SEQ ID NO: 24) и AfIP-1B-32 (SEQ ID NO: 26) с равным массовым соотношением в PBS. Белки наносили на поверхность искусственного рациона, специфического для чешуекрылых (Southland Products), в лунках при уровне 0, 31,25 ppm, 62, 5 ppm, 125 ppm, 250 ppm, 500 ppm и 1000 ppm и давали высохнуть. Инсектицидные полипептиды AfIP-1A-31 и AfIP-1B-32 тестировали в отношении активности против соевой совки (SBL, Pseudoplusia includens), бобовой гусеницы (VBC, Anticarsia gemmatalis), огневки кукурузной (ECB, Ostrinia nubilalis), хлопковой совки (CEW, Helicoverpa zea), кукурузной листовой совки (FAW, Spodoptera frugiperda) и совки-ипсилон (BCW, Agrotis ipsilon). 2-3 новорожденные личинки помещали в каждую лунку для питания ad libitum в течение 3 дней. Каждый биологический анализ проводили с 4 повторностями при каждой дозе. Результаты выражали как положительные в отношении личинок реакции, такие как остановка развития и/или смерть. Результаты выражали как отрицательные, если личинки были подобны отрицательному контролю, который питался рационом, к которому был применен только вышеуказанный буфер. Личинкам, которые имели размер, подобный контролям, присваивали балл 0, личинкам, которые демонстрировали слабую остановку развития, давали балл 1, личинкам, которые демонстрировали серьезную остановку, давали балл 2 и личинкам, которые погибли, давали балл 3. Аналогично, комбинированные AfIP-1A-31 (с His-меткой, SEQ ID NO: 24) и AfIP-1B-32 (с His-меткой, SEQ ID NO: 26) не демонстрировали инсектицидной активности при протестированных концентрациях против огневки кукурузной (ECB, Ostrinia nubilalis), хлопковой совки (CEW, Helicoverpa zea), кукурузной листовой совки (FAW, Spodoptera frugiperda) и совки-ипсилон (BCW, Agrotis ipsilon). Инсектицидная активность комбинированных AfIP-1A-31 (с His-меткой, SEQ ID NO: 24) и AfIP-1B-32 (с His-меткой, SEQ ID NO: 26) в отношении соевой совки (SBL, Pseudoplusia includens) и бобовой гусеницы (VBC, Anticarsia gemmatalis) показана в таблице 10.
Пример 7 - Идентификация гомологов AfIP-1A-31 и AfIP-1B-32 из других штаммов Alcaligenes faecalis
Шесть дополнительных штаммов Alcaligenes faecalis, ATCC®_15554™, ATCC®_27066™, ATCC®_33585™, ATCC®_19209™, ATCC®_49677 и ATCC®_43161 получали из Американской коллекции типовых культур (ATCC®) (10801 University Boulevard, Манассасс, VA 20110) и гомологи AfIP-1A-31 и AfIP-1B-32 идентифицировали при помощи способа, аналогичного описанным в примерах 1-3. Гомологи белков обозначали как AfIP-1A-15554 (SEQ ID NO: 28), AfIP-1B-15554 (SEQ ID NO: 30), AfIP-1A-27066 (SEQ ID NO: 32), AfIP-1B-27066 (SEQ ID NO: 34), AfIP-1A-33585 (SEQ ID NO: 36), AfIP-1B-33585 (SEQ ID NO: 38), AfIP-1A-19209 (SEQ ID NO: 778), AfIP-1B-19209 (SEQ ID NO: 780), AfIP-1A-49677 (SEQ ID NO: 786), AfIP-1B-49677 (SEQ ID NO: 788), AfIP-1A-43161 (SEQ ID NO: 782) и AfIP-1B-43161 (SEQ ID NO: 784), соответственно. Последовательности нуклеиновой кислоты, кодирующие гомологи, представляют собой SEQ ID NO: 27 (AfIP-1A-15554), SEQ ID NO: 29 (AfIP-1B-15554), SEQ ID NO: 31 (AfIP-1A-27066), SEQ ID NO: 33 (AfIP-1B-27066), SEQ ID NO: 35 (AfIP-1A-33585), SEQ ID NO: 37 (AfIP-1B-33585), SEQ ID NO: 777 (AfIP-1A-19209), SEQ ID NO: 779 (AfIP-1B-19209), SEQ ID NO: 785 (AfIP-1A-49677), SEQ ID NO: 787 (AfIP-1B-49677), SEQ ID NO: 781 (AfIP-1A-43161) и SEQ ID NO: 783 (AfIP-1B-43161), соответственно. AfIP-1A-31 (SEQ ID NO: 2) и гомологи AfIP-1A из ATCC®_15554™ и ATCC®_43161 были идентичны, за исключением делеции на C-конце AfIP-1B-15554 (SEQ ID NO: 29). Отличия аминокислот между AfIP-1A-31 (SEQ ID NO: 2) и гомологами из штамма Alcaligenes faecalis AfIP-1A-49677 (SEQ ID NO: 786), AfIP-1A-27066 (SEQ ID NO: 32), AfIP-1A-19209 (SEQ ID NO: 778), AfIP-1A-33585 (SEQ ID NO: 36) показаны на выравнивании последовательностей на фигуре 1. Отличия аминокислот между AfIP-1B-32 (SEQ ID NO: 4) и гомологами из штамма Alcaligenes faecalis AfIP-1B-27066 (SEQ ID NO: 34), AfIP-1B-33585 (SEQ ID NO: 38), AfIP-1B-19209 (SEQ ID NO: 780), AfIP-1B-49677 (SEQ ID NO: 788) и AfIP-1B-43161 (SEQ ID NO: 784) показаны на выравнивании последовательностей на фигуре 2. Таблицы, суммирующие идентичность, представлены в таблице 11A и таблице 11B. Значения процентной идентичности и подобия рассчитывали с применением алгоритма ClustalW в модуле ALIGNX® пакета программ Vector NTI® (Invitrogen Corporation, Карлсбад, Калифорния) со всеми параметрами по умолчанию.
Пример 8 - Создание вариантов AfIP-1A-31 с несколькими аминокислотными заменами
Для создания вариантов AfIP-1A-31 с несколькими изменениями аминокислот две библиотеки (AfIP-1A-31LE и AfIP-1A-31HE) получали посредством введения инъекцией олигонуклеотидов, несущих два набора изменений аминокислот, перечисленных в таблице 12, с применением стандартных протоколов, как описано в литературе (Statzman-Engwall, et al., (2005) Metabolic Engineering 7:27-37). После трансформации клеток E. coli 96 колоний отбирали для каждой библиотеки и культивировали в 96-луночных планшетах для экспрессии белка. Клеточные лизаты получали с помощью реагента для экстракции белка B-PER® от Thermo Scientific (3747 N Meridian Rd, Рокфорд, Иллинойс, США 61101) и подвергали скринингу в отношении инсектицидной активности по отношению к WCRW после смешивания с очищенным AfIP-1B-32. Параллельно, секвенировали ДНК активных вариантов AfIP-1A-31.
Дизайн библиотеки AfIP-1A-31 LE и HE
GCTTATGCGCAATGGRTTGAAATTACCCTGTTCGTTGTTAAC SEQ ID NO: 155
GAAATAAGTCCCAGCSAGRTCGAGGGCACCRTCATCAAAGACGAA SEQ ID NO: 165
SEQ ID NO: 167
После объединения данных биологического анализа и секвенирования для дальнейшего комбинирования выбирали панель активных клонов с различными степенями и комбинациями внедренных мутаций, как описано в таблице 13. В таблице 13 показаны мутировавшие положения и аминокислоты дикого типа в таких положениях AfIP-1A-31 (SEQ ID NO: 2) и аминокислотные замены в таких положениях в вариантах AfIP-1A-31.
Затем разрабатывали варианты AfIP-1A-31 и синтезировали гены (GenScript, Пискатавей, Нью-Джерси 08854, США), включающие различные комбинации мутаций, идентифицированных из подвергнутых шаффлингу библиотек из таблицы 13. Гены вариантов AfIP-1A-31 клонировали в клетки E. coli и вариантные полипептиды AfIP-1A-31 очищали с применением набора для очистки с аффиностью к His-метке, как описано ранее. Вариантные полипептиды AfIP-1A-31 анализировали на действие против WCRW после комбинирования с 100 ppm очищенного AfIP-1B-32 (с His-меткой, SEQ ID NO: 26) (200 ppm AfIP-1A-31). В таблице 14 показаны последовательности для вариантных полипептидов AfIP-1A-31, которые демонстрировали инсектицидную активность против WCRW. В таблице 14 показаны мутировавшие положения и аминокислоты дикого типа в таких положениях AfIP-1A-31 (SEQ ID NO: 2) и аминокислотные замены в таких положениях в вариантах AfIP-1A-31.
Аминокислотные изменения выбранных активных мутантов AfIP-1A-31
Активные варианты с комбинированными мутациями из AfIP-1A-31
Пример 9 - Идентификация аминокислотных положений, влияющих на стабильность и функцию белка AfIP-1A-31
Выравнивание белковых последовательностей: AfIP-1A-31 (SEQ ID NO: 2); активных близкородственных ортологов Alcaligenes faecalis; AfIP-1A-15554 (SEQ ID NO: 28), AfIP-1A-27066 (SEQ ID NO: 32) и AfIP-1A-33585 (SEQ ID NO: 36); отдаленно родственного активного гомолога FGTW-51 (SEQ ID NO: 18); отдаленно родственного неактивного гомолога Slin6118 (SEQ ID NO: 14) и нескольких эгеролизин-подобных белков показано на фигуре 3. Особенности вторичной структуры AfIP-1A-31 (SEQ ID NO: 2) определяли с применением программы “Peptide Structure” в системе SeqWeb v3.1.2 и выбранные структурные свойства в соответствии с прогнозами Гарньера-Осгуторпа-Робинсона показаны выше выравнивания фигуры 1. На основании выравнивания было идентифицировано пять консервативных мотивов AfIP-1A-31, аминокислоты 15-26 из SEQ ID NO: 2 (мотив 1), аминокислоты 33-53 из SEQ ID NO: 2 (мотив 2), аминокислоты 71-84 из SEQ ID NO: 2 (мотив 3), аминокислоты 100-107 из SEQ ID NO: 2 (мотив 4) и аминокислоты 132-140 из SEQ ID NO: 2 (мотив 5) из AfIP-1A-31 (SEQ ID NO: 1).
Для дополнительного определения промежутка последовательности в пределах этих пяти выбранных мотивов и их роли в инсектицидной активности аминокислоты 19 и 20 (в мотиве 1), аминокислоты 36, 37, 38, 39, 40, 41, 42, 43, 44, 45 и 46 (мотив 2), аминокислоты 74, 75, 76, 82 (мотив 3), аминокислоты 101, 104, 105 (мотив 4) и аминокислоты 132-140 (мотив 5) из AfIP-1A-31 (SEQ ID NO: 2) отбирали для насыщающего мутагенеза. Насыщающий мутагенез разрабатывали для выбранного положения мотивов с применением олигонуклеотидов мутагенеза, как показано в таблице 15 для мотивов 1, 3 и 4, таблице 16 для мотива 2 и таблице 17 для мотива 5. Мутантов получали с применением вырожденных олигонуклеотидов для каждого сайта с применением стратегии ПЦР сшивания и спасения двух перекрывающихся фрагментов N-конца (без мутации) и C-конца (с мутациями) для каждого сайта с применением стратегии ПЦР сшивания и спасения двух перекрывающихся фрагментов гена N-конца (без мутации) и C-конца (с мутациями)). В таблице 18 показаны аминокислотные замены, идентифицированные в каждом положении мотивов 1, 3 и 4, которые были подвергнуты мутагенезу, были идентифицированы аминокислотные замены, которые экспрессируют растворимый белок в клеточном лизате, и вариации последовательности в пределах мотивов, которые обеспечивают сохранение инсектицидной активности. В таблице 19 показаны аминокислотные замены, идентифицированные в каждом положении мотива 2, которые были подвергнуты мутагенезу, аминокислотные замены, которые экспрессируют растворимый белок в клеточном лизате, и вариации последовательности в пределах мотивов, которые обеспечивают сохранение инсектицидной активности (> 10 на шкале из 18). В таблице 20 показаны аминокислотные замены, идентифицированные в каждом положении мотива 5, которые были подвергнуты мутагенезу, аминокислотные замены, которые экспрессируют растворимый белок в клеточном лизате, и вариации последовательности в пределах мотивов, которые обеспечивают сохранение инсектицидной активности (> 10 на шкале из 18).
SEQ ID NO: 272
V,W,Y
W,Y
T,V,W
V,W
T,V,W,Y
V,W,Y
V,W,Y
W,Y
Q,R,S,T,V,Y
R,S,T,V,Y
R,S,T,V,W,Y
W,Y
R,S,T,V,W,Y
V,W,Y
S,T,V,W
V,W
W
R,S,T,W
S,T,W
V,W,Y
W,Y
Пример 10 - Получение дополнительных вариантов AfIP-1A-31
Полинуклеотиды, кодирующие дополнительные варианты AfIP-1A-31, синтезировали как описано ранее для применения в кристаллографии белков и других исследованиях.
A36G (н.к. SEQ ID NO: 93) (а.к. SEQ ID NO: 94)
V115I (н.к. SEQ ID NO: 95) (а.к. SEQ ID NO: 96)
I20M & I138M (н.к. SEQ ID NO: 97) (а.к. SEQ ID NO: 98)
I20M & T135M (н.к. SEQ ID NO: 99) (а.к. SEQ ID NO: 100)
Эти варианты AfIP-1A-31 экпрессировали в E. coli, как описано выше, и было обнаружено, что очищенные лизаты обладают инсектицидной активностью при комбинации с AfIP-1B-32.
Пример 11 - Получение вариантов AfIP-1B-32 с несколькими аминокислотными заменами
Для внедрения изменений аминокислот в AfIP-1B-32 получали две библиотеки (AfIP-1B-32LE и AfIP-1B-32HE) посредством введения инъекцией олигонуклеотидов, несущих два набора изменений аминокислот, показанных в таблице 21, с применением стандартного протокола, как описано в литературе (Statzman-Engwall, et al., (2005) Metabolic Engineering 7:27-37). Конструкции трансформировали в клетки E. coli, 96 колоний отбирали для каждой библиотеки и культивировали в 96-луночных планшетах для экспрессии белка. Клеточные лизаты получали с помощью реагента для экстракции белка B-PER® от Thermo Scientific (3747 N Meridian Rd, Рокфорд, Иллинойс, США 61101) и анализировали в отношении действия против WCRW после смешивания с очищенным AfIP-1A-31 (с His-меткой, SEQ ID NO: 24). Параллельно проводили секвенирование ДНК у данных клонов. После объединения данных биологического анализа и секвенирования выбирали панель активных клонов с различными количествами внедренных мутаций, как перечислено в таблице 22.
Дизайн библиотеки AfIP-1B-32 LE и HE
Аминокислотные изменения выбранных активных мутантов AfIP-1B-32
Пример 12 - Идентификация аминокислотных положений, влияющих на стабильность и функцию белка AfIP-1B-32
Выравнивание белковых последовательностей: AfIP-1B-32 (SEQ ID NO: 4); активных близкородственных ортологов Alcaligenes faecalis; AfIP-1B-15554 (SEQ ID NO: 30), AfIP-1B-27066 (SEQ ID NO: 34) и AfIP-1B-33585 (SEQ ID NO: 38); отдаленно родственного активного гомолога FGTW-52 (SEQ ID NO: 20); отдаленно родственного гомолога Slin6117 (SEQ ID NO: 16); показано на фигуре 3. Особенности вторичной структуры AfIP-1B-32 (SEQ ID NO: 2) определяли с применением программы Garnier (EMBOSS Explorer) (Garnier, et al., (1978) J. Mol. Biol. 120:97-120). На основании выравнивания пяти консервативных мотивов AfIP-1B-32, аминокислоты 105-115 из SEQ ID NO: 4 (мотив 1), аминокислоты 133-141 из SEQ ID NO: 4 (мотив 2), аминокислоты 177-184 из SEQ ID NO: 4 (мотив 3), аминокислоты 358-365 из SEQ ID NO: 4 (мотив 4) и аминокислоты 511-520 из SEQ ID NO: 4 (мотив 5) (мотивы заключены в рамку на фигуре 3) активного белка (AfIP-1B-32 (SEQ ID NO: 4) не были идентифицированы.
Для дополнительного определения промежутка последовательности в пределах пяти выбранных мотивов и их роли в пестицидной активности аминокислоты I103, M105, G108, I109, E110 и Y111 из мотива 1, аминокислоты V137, F141 из мотива 2, аминокислоты G179, W182 из мотива 3, аминокислоты E359, N360, S361, D363, V364 и L365 из мотива 4 и аминокислоты F109, N512, F514, G516 и L519 из мотивы 5 из AfIP-1B-32 (SEQ ID NO: 4) отбирали для насыщающего мутагенеза. Насыщающий мутагенез разрабатывали для каждого положения мотивов с применением олигонуклеотидов для мутагенеза, как показано в таблице 23. В таблице 24 показаны аминокислотные замены, идентифицированные в каждом положении, которые были подвергнуты мутагенезу, аминокислотные замены, которые приводят к экспрессии растворимого белка в клеточном лизате, и вариации последовательности в пределах мотивов, которые обеспечивают сохранение инсектицидной активности (>10 на шкале из 18).
SEQ ID NO: 234
SEQ ID NO: 236
SEQ ID NO: 238
SEQ ID NO: 240
SEQ ID NO: 242
SEQ ID NO: 244
SEQ ID NO: 246
SEQ ID NO: 248
SEQ ID NO: 250
SEQ ID NO: 252
Пример 13 - Обработка AfIP-1A-31 и AfIP-1B-32 трипсином и кишечной жидкостью WCRW
Среднюю кишку вырезали у 100 личинок WCRW третьего возраста и помещали в 200 мкл PBS на лед. Суспензию центрифугировали при 20000 g в течение 15 минут и супернатант разделяли на аликвоты и замораживали при - 80°C перед применением. Два микролитра кишечной жидкости инкубировали с 15 мкг AfIP-1A-31 или AfIP-1B-32 в 20 мкл PBS при 30°C в течение 2 часов. AfIP-1A-31 и AfIP-1B-32 также трипсинизировали посредством встряхивания с трипсином-сефарозой (Pierce) при 37°C в течение 2 часов. После расщепления расщепленный белок выделяли посредством помещения раствора смола+образец в спиновый фильтр и сбора фильтрата. Расщепленные образцы оценивали с помощью SDS PAGE и N-концы продуктов расщепления после расщепления определяли посредством анализа последовательности по Эдману. Главный полученный продукт после обработки AfIP-1A-31 трипсином или кишечной жидкостью имел аминокислоты AYAQWIEI (а.к. 1-8 из SEQ ID NO: 2) на его N-конце. Синтезировали полинуклеотид (SEQ ID NO: 151), кодирующий полипептид AfIP-1A-31, имеющий делецию первых 14 аминокислот, с предшествующим инициаторным метионином (SEQ ID NO: 152), экспрессировали в E. coli, и обнаружили, что он обладает инсектицидной активностью при комбинации с AfIP-1B-32 (SEQ ID NO: 4 или SEQ ID NO: 26). Второстепенные полученные продукты AfIP-1A-31 с аминокислотной последовательностью DIATEESK (a.к. 5-12 из SEQ ID NO: 2) на его N-конце или аминокислотной последовательностью EESKI (a.к. 9-13 из SEQ ID NO: 2) на его N-конце после расщепления трипсином также были выявлены. Расщепление трипсином или кишечной жидкостью AfIP-1B-32 (SEQ ID NO: 4) приводило к двум основным продуктам. Одна форма, соответствующая полоске ~42 кДа, представляла собой N-концевую часть AfIP-1B-32 (SEQ ID NO: 4). Секвенирование по Эдману показало, что N-концевая аминокислотная последовательность представляла собой MDIEAKSINPLMG (а.к. I-13 из SEQ ID NO: 4). Другой продукт мигрировал как полоска в геле ~38 кДа. Он представляет собой C-концевую часть AfIP-1B-32, начинающуюся с GVRTISLDSSS (а.к. 381-703 из SEQ ID NO: 4). Трипсинизированные или расщепленные кишечной жидкостью AfIP-1A-31 (SEQ ID NO: 2) и AfIP-1B-32 (SEQ ID NO: 4) включали в рацион новорожденных WCRW, и, как было обнаружено, они обладали такой же ингибиторной активностью, что и нерасщепленные AfIP-1A-31 (SEQ ID NO: 2) и AfIP-1B-32 (SEQ ID NO: 4).
Пример 14 - Отсутствие перекрестной устойчивости к полипептиду AfIP-1A-31 и полипептиду AfIP-1B-32 у линии WCRW, устойчивой к mCry3A
Для определения того, были ли насекомые, устойчивые к белкам Cry, перекрестно устойчивыми к AfIP-1A-31 и AfIP-1B-32, личинок западного кукурузного жука (WCRW, Diabrotica virgifera virgifera), чувствительных или устойчивых к mCry3A, обрабатывали AfIP-1A-31 и AfIP-1B-32. На фигуре 6 показано выравнивание аминокислотной последовательности AfIP-1A-31 (SEQ ID NO: 2), FGTW-51 (SEQ ID NO: 18), Slin6118_GI_284040949_Aegerolysin_S_linguale (SEQ ID NO: 14) и белок Cry3A с SEQ ID NO: 276. На фигуре 7 показано выравнивание аминокислотной последовательности AfIP-1B-32 (SEQ ID NO: 4) и белок Cry3A с SEQ ID NO: 276. AfIP-1A-31 (SEQ ID NO: 2) и белок Cry3A с SEQ ID NO: 276 идентичны только на 2,5%, тогда как AfIP-1B-32 (SEQ ID NO: 4) и белок Cry3A с SEQ ID NO: 276 идентичны только на 12,3%, что указывает на то, что белки являются неродственными.
Колонию, устойчивую к Cry3A, основывали посредством сбора приблизительно 9000 имаго западного кукурузного жука с полей в трех штатах (возле Шампейна, Иллинойс; Мейсвилл, Айова и Клей-Сентер, Небраска) в августе и сентябре 2009 года. Жуков из каждого местоположения по отдельности помещали в клетку в лаборатории и приблизительно 30000-50000 яиц собирали из каждой их этих трех колоний. Яйца хранили при 10°C в течение 6 месяцев и затем инкубировали при 25°C до тех пор, пока не наблюдали начало вылупления. Яйца отмывали от почвы в апреле 2010 года с применением сита с размером ячейки 60 меш, затем яйцами заражали сеянцы маиса и выращивали их до имаго (5000-6000 жуков из каждой колонии). Массовые скрещивания проводили с помощью приблизительно 1400-2000 самцов из каждой колонии, собранной в поле, с аналогичным числом самок, с отсутствием диапаузы (ND), из колонии инсектария Pioneer, которая берет начало из Брукингса, Южная Дакота. Интрогрессия признака отсутствия диапаузы устраняет обязательную диапаузу и обеспечивает более быстрый цикл при отборе популяций кукурузного жука. Яйцам F1, полученных из каждого скрещивания, обеспечивали вылупление без периода диапаузы, и ими заражали сеянцы маиса и выращивали их до имаго F1. Все имаго F1 от всех трех скрещиваний объединяли в клетках для яйцекладки для получения комбинированных яиц F2. Яйцами F2 затем заражали сеянцы маиса и их выращивали до имаго F2. Этот процесс давал начало колонии Cry3A-Res.
Колонию Cry3A-Res вначале отбирали в ноябре 2010 года с яйцами от поколения F3 после интрогрессии признака отсутствия диапаузы. Приблизительно 346500 яйцами F3 заражали саженцы маиса, содержащие трансгенный объект с высоким уровнем экспрессии mCry3A (экспрессия mCry3A >10000 частей на миллион от общего белка в корнях T0), при этом средний уровень вылупления составлял 19%. Всего 210 насекомых дожило до взрослого состояния во время этого первоначального отбора на устойчивость при помощи длительного воздействия трансгенного объекта, экспрессирующего mCry3A. Уровень выживания от яиц до имаго на трансгенном объекте составлял 0,06%. Этот процесс приводил к жукам F3 из колонии Cry3A-Res после одного отбора, как показано в таблице 25. Изолинию без отбора (Iso-CK) выращивали на сеянцах маиса, не являющихся Bt, в каждом поколении. Всех выживших животных F3 собирали в клетки для яйцекладки для спаривания и получения яиц F4 после первого отбора. Яйцами F4 и яйцами F5 заражали сеянцы кукурузы, не являющейся Bt, для выращивания и увеличения популяции. Приблизительно 72000 яиц F6 заражали сеянцы маиса, содержащие трансгенный объект с высоким уровнем экспрессии mCry3A (экспрессия mCry3A >20000 частей на миллион от общего белка в корнях T0) для второго отбора. Дополнительные отборы повторяли на F7, F8, F10, F12 и F14 с применением трансгенного объекта маиса с высоким уровнем экспрессии mCry3A (экспрессия mCry3A >10000 частей на миллион от общего белка в корнях T0). Дополнительные отборы проводили на поколении F14-H и более поздних поколениях с применением трансгенного объекта маиса с высоким уровнем экспрессии mCry3A (>30000 частей на миллион mCry3A от общего белка в корнях). В таблице 25 показано, что после шести поколений отбора выживание F14 на mCry3A при сравнении с растением, не являющимся Bt, составило 64,6%, которое было в >400 раз выше, чем соответствующее выживание при первом отборе (0,15%) с аналогичным уровнем экспрессии. После трех поколений отбора (в F3, F6, F7) соотношение устойчивости (RR) к mCry3A у колонии Cry3A-Res было в >90 раз выше, исходя из LC50 (концентрация, летальная для 50% особей, тестирование с применением личинок F8), как показано в таблице 25.
Таблица 25
№
** Яйцами F6-H и F14-H заражали трансгенные объекты mCry3A с более высокой экспрессией mCry3A, чем у трансгенных объектов, применяемых в других отборах.
Жуков F11 колонии Cry3A-Res применяли для проведения возвратных массовых скрещиваний с восприимчивой лабораторной колонией WCRW для тестирования наследования устойчивости. Яйца от устойчивых гомозигот (R), гетерозигот F1 (RS) и восприимчивых гомозигот (S) применяли для тестирования доминантности устойчивости (h=0,20-0,21), исходя из 12-дневного выживания на трансгенном объекте кукурузы с высоким уровнем экспрессии mCry3A относительно семян кукурузы, не являющейся Bt. Анализ результатов 12-дневного относительного выживания у F1 возвратных скрещиваний колоний R и S указывал, что устойчивость к mCry3A у трансгенных объектов mCry3A наследовалась аутосомно и была не полностью рецессивной (h<0,5), как показано в таблице 26.
Анализы транскриптома Cry3A-Res относительно других колоний WCRW и отдельных особей показали, что две проанализированные отдельные особи Cry3A-Res (Cry3A-Res-1 и Cry3A-Res-2) можно отделить от восприимчивой изолинии WCRW (Iso-CK) или других эталонных колоний. Молекулярные маркеры, основанные на анализах транскриптома, можно применять для выявления отдельных особей Cry3A-Res.
Колонии WCRW, устойчивые к Cry34/35, разрабатывали как описано у Lefko, et al., ((2008), J. Appl. Entomol. 132:189-204) посредством отборов на маисе, содержащем трансгенный объект DAS-59122-7. Соотношение устойчивости к Cry34/35, исходя из EC50, было ~500-кратным (Nowatzki, et al., (2008), J. Appl. Entomol. 132:177-188). После приблизительно 10 отборов проводили регулярные отборы на семенах DAS-59122-7 через каждые 2-3 поколения с общим количеством более 20 отборов перед проведением анализов на перекрестную устойчивость. Яйца Rochelle-S из линии, устойчивой к Cry34/35 (RH39 Sel. F23), применяли для анализов на перекрестную устойчивость.
Биологические анализы с внедрением стандартизированного рациона для WCRW использовали для оценки эффектов инсектицидных белков на личинок WCRW. Инсектицидные белки объединяли со специфическим искусственным рационом для WCRW (Bioserve Diabrotica) для создания рациона для биологического анализа. На основе результатов анализа по определению диапазона тестируемые концентрации составляли 1-256 ppm для полипептида AfIP-1A-31, полипептида AfIP-1B-32 и mCry3A или Cry34/35 для восприимчивой линии WCRW, полипептида AfIP-1A-31, полипептида AfIP-1B-32 для устойчивых линий и 63-2000 ppm для mCry3A для линии, устойчивой к Cry3A. Новорожденных личинок WCRW помещали на планшеты, содержащие рацион для биологического анализа и инсектицидный белок, с 4 или 5 повторами для обработки каждой концентрацией в течение 3 дней (в случае Cry3A-R) или 4 дней (в случае Cry34/35-R) после начала каждого биологического анализа, оценивали смертность и число серьезных остановок развития и объединяли как общий ответ для расчета ингибирования 50% отдельных особей (IC50) на основе пробит-анализа. Соотношение устойчивости (RR) рассчитывали, исходя из IC50 каждого белка в отношении восприимчивой и устойчивой линии WCRW:
RR=IC50 устойчивой линии/IC50 восприимчивой линии
В таблице 27 показано, что линии WCRW, устойчивые к mCry3A или Cry34/35, не были перекрестно устойчивыми к полипептиду AfIP-1A-31 и полипептиду AfIP-1B-32 (RR=0,74 или 1,7-кратное, соответственно).
Пример 15 - Фунгицидная активность полипептида AfIP-1A-31 или полипептида AfIP-1B-32
Противогрибковую активность AfIP-1A-31 и AfIP-1B-32 по отдельности и вместе против грибковых патогенов Fusarium virguliforme (FVR), Fusarium oxysporum (FOS), Fusarium graminearum (FGR), Colletotrichum graminicola (CGR) и Exserohilum turcicum (ETC) оценивали с применением стандартного анализа на планшетах, как описано в патенте США № 7772370. Кратко, новые культуры получали раз в две недели для поддержания постоянного запаса спор. Споры получали от культур возрастом 2-4 недели и споры количественно определяли с применением гемоцитометра, разбавляли до требуемой концентрации с помощью среды анализа (¼× картофельно-декстрозный бульон). Полипептиды AfIP-1A-31 и AfIP-1B-32 при различных концентрациях добавляли в планшеты из расчета 50 мкл/лунка в случае стандартного планшета для анализа или 25 мкл/лунка в случае планшета с половинным объемом лунок. Для начала анализа затем добавляли равный объем среды с грибными спорами из расчета концентрации, в 2 раза превышающей вышеуказанные концентрации. Планшеты герметизировали с помощью газопроницаемой мембраны (Breathe-Easy™, № по кат. BEM-1, Diversified Biotech, Бостон, Массачусетс) и обеспечивали возможность протекания анализа в теменоте при 28°C в течение 24-48 часов. После периода инкубации планшеты помещали под инвертированный микроскоп и каждую лунку обследовали и оценивали по шкале 0-4, в соответствии со следующими параметрами: 0=отсутствует ингибирование роста грибов при сравнении с отрицательным контролем, 0,5=легкое ингибирование (общий рост меньше, чем у отрицательного контроля, но рост из индивидуальных спор не обособлен), 1=легкое ингибирование (общий рост меньше, чем у отрицательного контроля, но рост из индивидуальных спор выражен, хотя и не достаточно конфлюэнтный), 2=умеренное ингибирование (рост из 1 споры можно легко идентифицировать и он существенно менее обилен, чем у отрицательного контроля; рост из каждой споры имеет тенденцию выглядеть сферическим), 3=сильное ингибирование (споры прорастали, но рост ограничен несколькими ветвями коротких гиф), 4= полное ингибирование (споры не прорастали). См., например, Duvick, et al., (1992) J. Biol. Chem. 267:18814-18820. На фигуре 8 показан уровень противогрибковой активности AfIP-1A-31 и AfIP-1B-32 по отдельности и вместе. Каждый из AfIP-1A-31 и AfIP-1B-32 независимо продемонстрировал противогрибковую активность.
Пример 16 - Временная экспрессия полипептида AfIP-1A-31 и полипептида AfIP-1B-32 в фасоли кустовой Phaseolus vulgaris
Оба гена AfIP-1A-31 (SEQ ID NO: 1) и AfIP-1B-32 (SEQ ID NO: 3) клонировали в векторы временной экспрессии, каждый под контролем вирусного промотора 35S и терминатора из гена фазеолина при помощи инфильтрации агробактерий, как описано (Kapila, et. al., (1997) Plant Science 122:101-108), для введения суспензии клеток Agrobacterium в растительные клетки интактных тканей для подтверждения экспрессии трансгена растительного происхождения. Кратко, проводили инфильтрацию агробактериями молодых саженцев фасоли кустовой (обыкновенная фасоль, Phaseolus vulgaris) при помощи нормализованных культур бактериальных культур тестируемых и контрольных штаммов. Ткань листьев собирали через 4 дня после инфильтрации агробактериями, лиофилизировали и растирали в порошок. Временную экспрессию белка обоих AfIP-1A-31 (SEQ ID NO: 2) и AfIP-1B-32 (SEQ ID NO: 4) подтверждали посредством вестерн-анализа.
Пример 17 - Экспрессия полипептида AfIP-1A-31 и полипептида AfIP-1B-32 в дрожжах
Кодирующие последовательности AfIP-1A-31 и AfIP-1B-32 вставляли в плазмиды для экспрессии в дрожжах p413GDP для конститутивной экспрессии и p415GAL1 для индуцируемой галактозой экспрессии. Отдельные штаммы дрожжей получали путем трансформации штамма BY4742 (ATCC®, Манассас, Вирджиния) с помощью p413GDP:AfIP-1A-31 и p413GPD:AfIP-1B-32 (ATCC®, Манассас, Вирджиния). Трансформированные колонии отбирали на среде без гистидина (MP Biochemicals, Солон, Огайо) и выращивали при 28°C. Затем штамм p413GDP:AfIP-1A-31 трансформировали при помощи конструкции экспрессии p415GAL1:AfIP-1B-32. Штамм p413GPD:AfIP-1B-32 трансформировали при помощи конструкции экспрессии p415GAL1:AfIP-1A-31. Трансформированные колонии, содержащие обе плазмиды, отбирали на средах одновременно без гистидина и лейцина (MP Biochemicals, Солон, Огайо). Аналогичное число колоний получали в присутствии или отсутствии 2% галактозы, что указывает на то, что токсичность, ассоциированная с одновременной экспрессией AfIP-1A-31 и AfIP-1B-32 в дрожжах, отсутствовала. Присутствие обеих плазмид подтверждали посредством расщепления ферментами рестрикции. Культуры выращивали в среде, содержащей галактозу (MP Biochemicals, Солон, Огайо) при 28°C. Очищенные лизаты получали посредством лизиса осадков дрожжевых клеток при помощи реагента для экстракции дрожжевых белков Y-PER (Thermo Scientific, Рокфорд, Иллинойс) после центрифугирования. Присутствие обоих белков подтверждали посредством вестерн-блот анализа. Также было показано, что очищенные лизаты обеспечивают токсичность в отношении WCRW, опосредованную AfIP-1A-31-AfIP-1B-32.
Пример 18 - Совместное введение полипептида AfIP-1A-31 и полипептида FGTW-52 в анализе с применением WCRW
Белок AfIP-1A-31 комбинировали с белком FGTW-52 для определения можно ли заменять бинарную пару и поддерживать инсектицидную активность в анализе с применением WCRW. В этом эксперименте применяли неочищенные лизаты от E. coli, экспрессирующей FGTW-51 (концентрация общего белка=79 мг/мл) или FGTW-52 (концентрация общего белка=64 мг/мл), и комбинировали их с 0,2 мг/мл очищенного AfIP-1A-31 или AfIP-1B-32. В таблице 28 показано, что белки AfIP-1A-31 и FGTW-52 вместе поддерживали инсектицидную активность.
Пример 19 - Последовательное кормление полипептидом AfIP-1A-31/ полипептидом AfIP-1B-32 в анализе с применением WCRW
Для определения того, требуется ли одновременное присутствие обоих белков для инсектицидной активности в отношении WCRW, личинок второй стадии помещали на рацион для кукурузного жука, содержащий 150 ppm AfIP-1A-31 или 150 ppm AfIP-1B-32 или 150 ppm AfIP-1A-31 вместе с 150 ppm AfIP-1B-32 (положительный контроль) или без инсектицидного белка (отрицательный контроль). После 24 часов воздействия всех личинок переводили на рацион, не содержащий токсин, на 24 часа. Личинок, на которых предварительно воздействовали только AfIP-1A-31, затем переводили на рацион, содержащий 150 ppm AfIP-1B-32 на дополнительные 24 часа. Личинок, на которых воздействовали только AfIP-1B-32 в день 1, переводили на рацион, содержащий 150 ppm AfIP-1A-31 после дня 2. Личинок положительного и отрицательного контроля содержали на рационе без инсектицидного белка. Рост личинок оценивали через 72 часов после начала эксперимента. Результаты, суммированые в таблице 29, показывают, что существует стойкое взаимодействие AfIP-1B-32 с его целью в WCRW. Неожиданно, результаты указывают на то, что одновременное присутствие обоих белков не является необходимым для токсичности в отношении личинок WCRW.
Пример 20 - Конструкции белка слияния полипептидов AfIP-1A-31/AfIP-1B-32
Конструировали векторы экспрессии на основе pBET24 E. coli, содержащие: молекулу нуклеиновой кислоты (SEQ ID NO: 1), кодирующую AfIP-1A-31 (SEQ ID NO: 2); молекулу нуклеиновой кислоты, кодирующую белковый линкер (таблица 30), и молекулу нуклеиновой кислоты (SEQ ID NO: 3), кодирующую AfIP-1B-32 (за исключением N-концевого метионина с SEQ ID NO: 4), или молекулу нуклеиновой кислоты (SEQ ID NO: 25), кодирующую AfIP-1B-32 с поли-His-меткой (за исключением N-концевого метионина с SEQ ID NO: 26); которые кодируют белки слияния, как указано в таблице 30. Белки слияния из таблицы 30 экспрессировали в E. coli и, было обнаружено, что очищенные лизаты обладают инсектицидной активностью.
SEQ ID NO: 102
SEQ ID NO: 113
SEQ ID NO: 104
SEQ ID NO: 114
SEQ ID NO: 106
SEQ ID NO: 115
SEQ ID NO: 108
SEQ ID NO: 116
SEQ ID NO: 110
SEQ ID NO: 117
SEQ ID NO: 112
SEQ ID NO: 118
Пример 21 - Конструкция вектора экспрессии для совместной экспрессии AfIP-1A-31 и AfIP-1B-32 в растениях
Конструировали растительный вектор экспрессии, PHP51886, включающий кассету первого трансгена, содержащую молекулу нуклеиновой кислоты, которая включает промотор гена металлотионеина (RM2) маиса (патент США № 7214854), функционально связанный с молекулой нуклеиновой кислоты, кодирующей вариант полипептида AfIP-1A-31 с SEQ ID NO: 94, и кассету второго трансгена, содержащую молекулу нуклеиновой кислоты, которая включает промотор, 5'-нетранслируемый экзон и первый интрон гена убиквитина (Ubi-1) маиса (Christensen, et al., (1992) Plant Mol. Biol. 18:675-689 и Christensen and Quail, (1996) Transgenic Res. 5:213-218), функционально соединенные с молекулой нуклеиновой кислоты, кодирующей вариант полипептида AfIP-1B-32 с SEQ ID NO: 76. На фигуре 9 показаны результаты теста эффективности в теплице в отношении T0-растений PHP51688. Ось Y 'балл' представляет собой балл повреждения узлов кукурузным жуком (CRWNIS), где 0 обозначает отсутствие повреждения, 2 обозначает два поврежденных узла. На фигуре 10 показаны результаты c применением T1 трансгенного объекта PHP51688.
Пример 22 - Конструкция вектора экспрессии для экспрессии белка слияния AfIP-1A-31/AfIP-1B-32 в растениях
Конструировали растительный вектор экспрессии, PHP53521, включающий кассету трансгена, содержащую молекулу нуклеиновой кислоты (SEQ ID NO: 253), которая включает промотор, 5'-нетранслируемый экзон и первый интрон гена убиквитина (Ubi-1) маиса (Christensen, et al., (1992) Plant Mol. Biol. 18:675-689 и Christensen and Quail, (1996) Transgenic Res. 5:213-218), функционально связанные с молекулой нуклеиновой кислоты, кодирующей вариант AfIP-1B-32 с SEQ ID NO: 76, линкер мультигенного экспрессионного "проводника" (MGEV) (Glu Glu Lys Lys Asn (SEQ ID NO: 153)) и вариант AfIP-1A-31 с SEQ ID NO: 94 (за исключением N-концевого Met), слитый в рамке считывания, который кодирует белок слияния AfIP-1A-31/AfIP-1B-32 с SEQ ID NO: 254. На фигуре 11 показаны результаты теста эффективности в теплице в отношении T0-растений PHP53521. Ось Y 'балл' представляет собой балл повреждения узлов кукурузным жуком (CRWNIS), где 0 обозначает отсутствие повреждения, 2 обозначает два поврежденных узла.
Пример 23 - Варианты AfIP-1A-31 с модифицированными физическими свойствами
Для идентификации вариантов AfIP-1A-31 с модифицированными физическими свойствами создали серию вариантов посредством сайт-направленного мутагенеза с применением набора для высокоточной ПЦР Phusion® (New England Biolabs®, № по каталогу E0553S) в соответствии с инструкциями производителя. Вкратце, двуцепочечный ДНК-шаблон денатурируют при высокой температуре и затем праймеры, специфические относительно последовательности, гибридизуют с сайтами, фланкирующими целевую последовательность и продлевают при помощи высокоточной ДНК-полимеразы Thermo Scientific® Phusion®. Этот вновь синтезированный продукт затем становился дополнительным шаблоном для последующих циклов амплификации с применением праймера с определенной специфичностью. Получали варианты AfIP-1A-31 со следующими заменами одной аминокислоты, как описано выше: G47L, G47F, D48L, D48F, K49L, K49F, D50L, D50F, K51L, K51F, E52L, E52F, I53L, I53F, S54L, S54F, P55L, P55F, S56L, Q57L, Q57F, I58L, I58F, N59L, N59F, G60L, G60F, T61L, T61F, I62L, I62F, K64L, K64F, D565L, D65F, Y121L, Y121F, Y122L, T122F, V123L, V123F, V123N, I124L, I124F, K125L, K125F, K125M, K126L, K126F, G127l, G127F, G128L, G128F, G129L, G129F, S130L и S130F. Полученные варианты AfIP-1A-31 экспрессировались в E. coli в качестве белков с His-меткой и проводили их скрининг в виде очищенных лизатов в отношении инсектицидной активности против WCRW. Было обнаружено, что полученные варианты AfIP-1A-31 обладают инсектицидной активностью против WCRW, большей чем 10 согласно шкале из 18, за исключением N59L, N59F, G127L и G127P. Варианты AfIP-1A-31, идентифицированные в таблице 31, отбирали для дальнейшего тестирования физических свойств полученных полипептидов AfIP-1A. В таблице 31 показаны аминокислотная замена, праймеры для мутагенеза, применяемые в первой ПЦР-реакции, и полинуклеотидная последовательность, кодирующая соответствующий полипептид AfIP-1A.
SEQ ID NO:732
SEQ ID NO: 733
SEQ ID NO: 732
SEQ ID NO: 733
SEQ ID NO: 732
SEQ ID NO: 734
SEQ ID NO: 732
SEQ ID NO: 734
SEQ ID NO: 736
SEQ ID NO: 737
SEQ ID NO: 736
SEQ ID NO: 737
SEQ ID NO: 739
SEQ ID NO: 740
SEQ ID NO: 742
SEQ ID NO: 743
SEQ ID NO: 742
SEQ ID NO: 743
SEQ ID NO: 745
SEQ ID NO:746
SEQ ID NO: 745
SEQ ID NO: 746
Пример 24 - Варианты AfIP-1B-32 с модифицированными физическими свойствами
Серию вариантов AfIP-1B-32 с модифицированными физическими свойствами создавали при помощи способов мутагенеза, как описано ранее в примере 9. Кратко, разрабатывали олигонуклеотиды (таблица 32) для введения следующих мутаций: I34L, I38L, I43L, Y53F, Y55F, V86L, Y94F, I97L, Y101F, I103L, I106L, I109L, I181L, V188L, W201F, Y203F, I214L, I220L, Y224F, V235L, Y414F, I418L, V423L, V526L, I530L, I536L, Y538F, Y543F, Y547F, Y550F, Y625F, I631L и W633F по сравнению с SEQ ID NO: 4 (AfIP-1B-32). Конструировали четыре индивидуальные библиотеки посредством смешивания фрагментов гена фрагментированного AfIP-1B-32 (SEQ ID NO: 4) с объединенными олигонуклеотидами в соотношении 15:1, 10:1, 7,5:1 и 3,75:1, и гены полной длины собирали при помощи ПЦР-реакций (Statzman-Engwall, et al., (2005) Metabolic Engineering 7:27-37. Четыре библиотеки экспрессировали в E. coli и приблизительно 1500 изолятов подвергали скринингу в виде очищенных лизатов в отношении инсектицидной активности против WCRW, как описано ранее в примере 1. Изоляты с инсектицидной активностью против WCRW больше 10 согласно шкале из 18 секвенировали для определения идентичности изменений аминокислот (таблица 33). Кроме идентифицированных выше разработанных аминокислотных замен следующие случайные изменения аминокислот S134L, K196E, I270V, K296E, E367K, G368D, R373S, A398V, E425V, I427V, M434T, N512S, V533A, K544R, F558L, M600V, D607G, I612T, L613P, N615D, Q646R, N661S, S700G и F702S по сравнению с SEQ ID NO: 4 (AfIP-1B-32) также были идентифицированы у некоторых из вариантов. Ни один из секвенированнных активных вариантов не содержал разработанные аминокислотные замены I34L и I43L.
Пример 25 - Варианты AfIP-1A-31 с несколькими аминокислотными заменами в мотиве 2
Варианты AfIP-1A-31 с несколькими выбранными аминокислотными заменами в мотиве 2 получали с применением праймера для мутагенеза мотива 2-Comb-R (ACCTTCTACTTTGAAGTTTGAGTTA SEQ ID NO: 382), спаренного с праймером для мутагенеза T7-F (TAATACGACTCACTATAGGG SEQ ID NO: 683), и праймера для мутагенеза pETR (ATCCGGATATAGTTCCTCCTTTCAG SEQ ID NO: 684), спаренного с вырожденным праймером для мутагенеза мотива 2-Comb-F (TAACTCAAACTTCAAAGTAGAAGGTDCGTWCVTSARGTGGGGAAAGTTCCATVTSSCCGGAGATAAAGACAAGGAAATAAGTCC SEQ ID NO: 685), с применением стратегии ПЦР сшивания и спасения двух перекрывающихся фрагментов N-конца (без мутации) и C-конца (с мутациями), как проиллюстрировано на фигуре 12.
Праймер для мутагенеза мотива 2-Comb-F (SEQ ID NO: 685) разрабатывали так, чтобы он был частично вырожденным в остатках 37, 38, 39, 45 и 46 мотива 2, соответствующего SEQ ID NO: 2 (AfIP-1A-31), что приводило к выбранным аминокислотным заменам в каждом остатке. В таблице 34 показан кодон для каждого остатка в положении 36-46 относительно SEQ ID NO: 2 и возможные полученные аминокислоты. В таблице 34 нативная аминокислота обозначена жирным шрифтом и подчеркнута.
Библиотеки спасенных мутантов клонировали в векторы экспрессии E. coli, 384 индивидуальных изолятов экспрессировали в E. coli и клеточные лизаты подвергали скринингу в инсектицидном анализе с применением WCRW, как описано ранее. Соответствующие изоляты, имеющие балл 10 или больше из 18 в скрининге с применением WCRW, подвергали секвенированию ДНК для определения аминокислотной последовательности вариантных полипептидов. В таблице 35 для каждого варианта AfIP-1A-31 показаны аминокислотные замены, идентифицированные в мотиве 2 (аминокислоты 36-46), и те замены, которые были активны в инсектицидном анализе с применением WCRW, имея минимальный балл 10 или больше из 18. В таблице 35 аминокислотные замены в мотиве 2 по сравнению с AfIP-1A-31 (SEQ ID NO: 2) отмечены жирным шрифтом и подчеркнуты.
S=C или G
S=C или G
SEQ ID NO: 535
Пример 26 - Варианты AfIP-1A-31 с несколькими аминокислотными заменами в мотиве 5
Варианты мотива 5 AfIP-1A-31 с несколькими выбранными аминокислотными заменами в мотиве 5 получали с применением праймера для мутагенеза T7-F (TAATACGACTCACTATAGGG SEQ ID NO: 683) и вырожденного праймера для мутагенеза мотива 5-Comb-F (GTGGTGCTCGAGGGATTTTTTGACAACAGTAATGWASABWTYGCCCGHCGHCSMCGHTGGGCTACCGCCACCTTTTTTAATC SEQ ID NO: 686), как показано на фигуре 12.
Праймер для мутагенеза мотива 5-Comb-F разрабатывали так, чтобы он был частично вырожденным по остаткам 132, 133, 134, 135, 137, 138 и 139 мотива 5, соответствующего SEQ ID NO: 2 (AfIP-1A-31), что приводило к выбранным аминокислотным заменам по каждому остатку. В таблице 36 показан кодон для каждого остатка в положении 132-140 относительно SEQ ID NO: 2 и возможные полученные аминокислоты. В таблице 36 нативная аминокислота обозначена жирным шрифтом и подчеркнута.
Библиотеки спасенных мутантов клонировали в векторы экспрессии E. coli, 480 индивидуальных изолятов экспрессировали в E. coli и клеточные лизаты подвергали скринингу в инсектицидном анализе с применением WCRW, как описано ранее. Соответствующие изоляты, имеющие балл 10 или больше из 18 в скрининге с применением WCRW, подвергали секвенированию ДНК для определения аминокислотной последовательности вариантных полипептидов. В таблице 37 для каждого варианта AfIP-1A-31 показаны аминокислотные замены, идентифицированные в мотиве 5 (аминокислоты 132-140), которые были активны в инсектицидном анализе с применением WCRW, имея минимальный балл 10 или больше из 18. В таблице 37 аминокислотные замены в мотиве 5 по сравнению с AfIP-1A-31 (SEQ ID NO: 2) отмечены жирным шрифтом и подчеркнуты.
S=C или G
W=A или T
S=C или G
Пример 27 - Варианты AfIP-1A-31 с несколькими аминокислотными заменами в мотиве 2 и мотиве 5
Варианты AfIP-1A-31 с несколькими выбранными аминокислотными заменами в мотиве 2 и мотиве 5 получали с применением вырожденного праймера для мутагенеза мотива 5-Comb-F (SEQ ID NO: 686), спаренного с вырожденным праймером для мутагенеза мотива 2-Comb-F (SEQ ID NO: 685), как показано на фигуре 12.
Библиотеки спасенных мутантов клонировали в векторы экспрессии E. coli, 672 индивидуальных изолятов экспрессировали в E. coli и клеточные лизаты подвергали скринингу в инсектицидном анализе с применением WCRW, как описано ранее. Соответствующие изоляты, имеющие балл 10 или больше из 18 в инсектицидном скрининге с применением WCRW, подвергали секвенированию ДНК для определения аминокислотной последовательности вариантных полипептидов. В таблице 38 для каждого варианта AfIP-1A-31 показаны аминокислотные замены, идентифицированные в мотиве 2 (аминокислоты 36-46) и в мотиве 5 (а.к. 132-140), которые были активны в инсектицидном анализе с применением WCRW, имея минимальный балл 10 или больше из 18. В таблице 38 аминокислотные замены в мотиве 2 и мотиве 5 по сравнению с AfIP-1A-31 (SEQ ID NO: 2) отмечены жирным шрифтом и подчеркнуты.
Пример 28 - Варианты AfIP-1B-32 с несколькими аминокислотными заменами в мотиве 5
Варианты AfIP-1B-32 с несколькими выбранными аминокислотными заменами в мотиве 5 получали посредством ПЦР с применением вырожденного праймера для мутагенеза 032-combo5-F ACCGCCTGGAACGAAATTGGTBNSTTGCGCNKCGCGSRGCTTVHSCTGGGCNDSCTCATTGGGGATCAGTCAGTAAGCAG (SEQ ID NO: 749) и праймера pET3' (SEQ ID NO: 750). Продукт ПЦР-реакции мутагенеза затем смешивали с ПЦР-продуктом, полученным в результате продления праймеров 032-Nco-F (SEQ ID NO: 747) и 032-combo-R (SEQ ID NO:748), собирали и освобождали посредством ПЦР, и клонировали в векторы экспрессии как показано на фигуре 13.
Праймер для мутагенеза 032-combo5-F (SEQ ID NO: 749) разрабатывали так, чтобы он был частично вырожденным по остаткам 509, 512, 514, 516 и 519 мотива 5, соответствующего SEQ ID NO: 4 (AfIP-1B-32), что приводило к выбранным аминокислотным заменам по каждому остатку. В таблице 39 показан кодон для каждого остатка в положении 509, 512, 514, 516 и 519 относительно SEQ ID NO: 4 и возможные полученные аминокислоты. В таблице 39 нативная аминокислота обозначена жирным шрифтом и подчеркнута.
Библиотеки спасенных мутантов клонировали в векторы экспрессии E. coli, 1900 индивидуальных изолятов экспрессировали в E. coli и клеточные лизаты подвергали скринингу в инсектицидном анализе с применением WCRW, как описано ранее. Соответствующие изоляты, имеющие балл 10 или больше из 18 в скрининге с применением WCRW, подвергали секвенированию ДНК для определения аминокислотной последовательности вариантных полипептидов. В таблице 40 для каждого варианта AfIP-1B-32 показаны аминокислотные замены, идентифицированные в мотиве 5 (аминокислоты 509-519), которые были активны в инсектицидном анализе с применением WCRW, имея минимальный балл 10 или больше из 18. В таблице 40 аминокислотные замены в мотиве 5 по сравнению с AfIP-1B-32 (SEQ ID NO: 4) отмечены жирным шрифтом и подчеркнуты.
N=G, A, T или C
S=C или G
K=G или T
R=A или G
H=A, C или T
S=C или G
D=A, G или T
S=C или G
Пример 29 - Трансформация маиса, опосредованная Agrobacterium
Для трансформации маиса, опосредованной Agrobacterium, с помощью AfIP-1A-31 и AfIP-1B-32 использовали способ Zhao (патент США № 5981840 и международная патентная публикация № WO 1998/32326, содержание которых тем самым включено в данный документ посредством ссылки). Кратко, незрелые зародыши выделяли из маиса и зародыши приводили в контакт с суспензией Agrobacterium, где бактерии были способны переносить AfIP-1A-31 и AfIP-1B-32 по меньшей мере в одну клетку меньшей мере одного из незрелых зародышей (стадия 1: стадия инфицирования). На этой стадии незрелые зародыши погружали в суспензию Agrobacterium для инициации инокуляции. Зародыши в течение определенного времени культивировали совместно с Agrobacterium (стадия 2: стадия совместного культивирования). Незрелые зародыши культивировали на твердой среде после стадии инфицирования. После периода совместного культивирования предполагалась необязательная стадия покоя. На этой стадии покоя зародыши инкубировали в присутствии по меньшей мере одного антибиотика, который, как известно, ингибирует рост Agrobacterium, без добавления средства для отбора растительных трансформантов (стадия 3: стадия покоя). Незрелые зародыши культивировали на твердой среде с антибиотиком, но без селективного средства, для исключения Agrobacterium и для обеспечения фазы покоя для инфицированных клеток. Затем, инокулированные зародыши культивировали на среде, содержащей средство для отбора, и извлекали растущий трансформированный каллюс (стадия 4: стадия отбора). Незрелые зародыши культивировали на твердой среде со средством для отбора, что приводило к выборочному росту трансформированных клеток. Затем каллюс регенерировали в растения (стадия 5: стадия регенерации), и каллюсы, выращенные на селективной среде, культивировали на твердой среде для регенерации растений.
Для выявления белков AfIP-1A-31 и AfIP-1B-32 в ткани листьев 4 лиофилизированных листовых штампа/образца растирали в порошок и ресуспендировали в 100 мкл PBS, содержащего 0,1% Tween 20 (PBST), 1% бета-меркаптоэтанола, содержащего 1 таблетку/7 мл ингибитора протеиназы complete Mini (Roche 1183615301). Суспензию обрабатывали ультразвуком в течение 2 минут и затем центрифугировали при 4°C, 20000 g в течение 15 минут. К супернатанту добавляли аликвоту из 1/3 объема 3X NuPAGE® LDS буфера для образца (Invitrogen™ (CA, USA), 1% B-ME, содержащего 1 таблетку/7 мл ингибитора протеиназы complete Mini. Реакционную смесь нагревали при 80°C в течение 10 минут и затем центрифугировали. Образец супернатанта загружали на гели 4-12% Bis-Tris Midi с подвижным буфером MES в соответствии с инструкциями производителя (Invitrogen™) и переносили на нитроцеллюлозную мембрану с применением устройства iBlot® (Invitrogen™). Нитроцеллюлозную мембрану инкубировали в PBST, содержащем 5% порошка обезжиренного молока, в течение 2 часов перед инкубацией в течение ночи с очищенным с помощью аффинной хроматографии антителом кролика к AfIP-1A-31 и очищенным с помощью аффинной хроматографии антителом кролика к AfIP-1B-32 из расчета 1:20000 в PBST на протяжении ночи. Мембрану три раза промывали PBST и затем инкубировали в PBST в течение 15 минут, а затем дважды по 5 минут перед инкубацией в течение 2 часов в PBST с антителом козы к Ig кролика, конъюгированным с HRP, из расчета 1:20000 в течение 3 часов. Выявленные белки визуализировали с применением реагентов для вестерн-блоттинга ECL (GE Healthcare, № по кат. RPN2106) и пленки Kodak® Biomax® MR. Для выявления белков AfIP-1A-31, AfIP-1B-32 в корнях корни лиофилизировали и 2 мг порошка на образец ресуспендировали в LDS, добавляли 1% B-ME, содержащего 1 таблетку/7 мл ингибитора протеиназы Complete Mini. Реакционную смесь нагревали при 80°C в течение 10 минут и затем центрифугировали при 4°C, 20000g в течение 15 минут. Образец супернатанта загружали на гели 4-12% Bis-Tris Midi с подвижным буфером MES в соответствии с инструкциями производителя (Invitrogen™) и переносили на нитроцеллюлозную мембрану с применением устройства iBlot® (Invitrogen™). Нитроцеллюлозную мембрану инкубировали в PBST, содержащем 5% порошка обезжиренного молока, в течение 2 часов перед инкубацией в течение ночи с очищенным с помощью аффинной хроматографии поликлональным антителом кролика к AfIP-1A-31 и очищенным с помощью аффинной хроматографии поликлональным антителом кролика к AfIP-1B-32 из расчета 1:20000 в PBST на протяжении ночи. Мембрану трижды промывали PBST и затем инкубировали в PBST в течение 15 минут, а затем дважды по 5 минут перед инкубацией в течение 2 часов в PBST с антителом козы к Ig кролика, конъюгированным с HRP, из расчета 1:20000 в течение 3 часов. Связанные с антителом инсектицидные белки выявляли с применением реагентов для вестерн-блоттинга ECL™ (GE Healthcare, № по кат. RPN2106) и пленки Kodak® Biomax® MR.
Пример 30 - Трансформация посредством бомбардировки частицами и регенерация трансгенных растений
Незрелые зародыши маиса из тепличных растений-доноров бомбардировали плазмидой, содержащей нуклеотидную последовательность, кодирующую инсектицидный белок. Початки очищали от листовой обвертки и подвергали поверхностной стерилизации в 30% отбеливателе Clorox® вместе с 0,5% моющим средством Micro в течение 20 минут, и ополаскивали два раза стерильной водой. Незрелые зародыши вырезали и помещали рубчиком вниз (щитком вверх), 25 зародышей на планшет, в среду 560Y на 4 часа и затем выравнивали в пределах целевой зоны на 2,5 см при подготовке к бомбардировке. ДНК плазмидного вектора, содержащую нуклеотидную последовательность, кодирующую инсектицидный белок, функционально связанный с промотором, осаждали на 1,1 мкм (средний диаметр) вольфрамовые гранулы с применением процедуры преципитации с CaCl2 следующим образом: 100 мкл подготовленных частиц вольфрама в воде; 10 мкл (1 мкг) ДНК в буфере Tris EDTA (1 мкг общей ДНК); 100 мкл 2,5 M CaCl2 и 10 мкл 0,1 M спермидина.
Каждый реагент добавляли последовательно к суспензии частиц вольфрама, которую при этом поддерживали на вортексе для множества пробирок. Конечную смесь подвергали непродолжительной ультразвуковой обработке и инкубировали при постоянном перемешивании вихревой мешалкой в течение 10 минут. После периода осаждения пробирки недолго центрифугировали, жидкость удаляли, промывали с помощью 500 мл 100% этанола и центрифугировали в течение 30 секунд. Жидкость вновь удаляли и к конечному осадку частиц вольфрама добавляли 105 мкл 100% этанола. Для бомбардировки генной пушкой частицы вольфрама/ДНК недолго обрабатывали ультразвуком и вносили 10 мкл на центр каждого макроносителя, и давали высохнуть приблизительно 2 минуты перед бомбардировкой. Планшеты с образцами бомбардировали на уровне №4 с помощью генной пушки. Все образцы получали однократный выстрел при 650 фунтах/кв. дюйм, при этом общее количество аликвот, взятых из каждой пробирки с полученными частицами/ДНК, составляло десять.
После бомбардировки зародыши выдерживали на среде 560Y в течение 2 дней, затем переносили на среду для отбора 560R, содержащую 3 мг/л биалафоса, и пересевали каждые 2 недели. Через приблизительно 10 недель отбора каллюсные клоны, устойчивость которых была выявлена в результате отбора, переносили в среду 288J для инициирования регенерации растений. После созревания соматических зародышей (2-4 недели) хорошо развитые соматические зародыши переносили на среду для проращивания и переносили в освещаемую комнату для культивирования. Спустя приблизительно 7-10 дней развивающиеся сеянцы переносили в безгормональную среду 272V в пробирках на 7-10 дней до хорошего укоренения сеянцев. Затем растения переносили во вставки в лотки (эквивалентны горшку на 2,5 дюйма), содержащие почвенную горшечную смесь, и выращивали в течение 1 недели в вегетационной камере, впоследствии выращивали в течение дополнительных 1-2 недель в теплице, затем переносили в горшки Classic 600 (1,6 галлона) и выращивали до зрелости. За растениями вели наблюдение и проводили оценку в отношении экспрессии модифицированных AfIP-1A-31 и IP032 с помощью анализов, известных из уровня техники, таких как, например, иммунологические анализы и вестерн-блоттинг.
Трансгенные растения маиса, положительные в отношении экспрессии инсектицидных белков, тестировали на пестицидную активность с применением стандартных биологических анализов, известных из уровня техники. Такие способы включали, например, биологические анализы с иссечением корня и биологические анализы целого растения. См., например, публикацию заявки на патент США № US 2003/0120054 и международную публикацию № WO 2003/018810.
Среда для бомбардировки (560Y) содержала 4,0 г/л основных солей N6 (SIGMA C-1416), 1,0 мл/л витаминной смеси Эрикссона (1000X SIGMA-1511), 0,5 мг/л тиамина-HCl, 120,0 г/л сахарозы, 1,0 мг/л 2,4-D и 2,88 г/л L-пролина (доведенных до объема с помощью D-I H2O после доведения pH до 5,8 с помощью KOH); 2,0 г/л Gelrite (добавленного после доведения до объема с помощью D-I H2O) и 8,5 мг/л нитрата серебра (добавленного после стерилизации среды и охлаждения до комнатной температуры). Cреда для отбора (560R) содержала 4,0 г/л основных солей N6 (SIGMA C-1416), 1,0 мл/л витаминной смеси Эрикссона (1000X SIGMA-1511), 0,5 мг/л тиамина-HCl, 30,0 г/л сахарозы и 2,0 мг/л 2,4-D (доведенных до объема с помощью D-I H2O после доведения pH до 5,8 с помощью KOH); 3,0 г/л Gelrite (добавленного после доведения до объема с помощью D-I H2O) и 0,85 мг/л нитрата серебра и 3,0 мг/л биалафоса (оба из которых добавлены после стерилизации среды и охлаждения до комнатной температуры).
Среда для регенерации растений (288J) содержала 4,3 г/л солей по MS (GIBCO 11117-074), 5,0 мл/л исходного раствора витаминов по MS (0,100 г никотиновой кислоты, 0,02 г/л тиамина-HCL, 0,10 г/л пиридоксина-HCL и 0,40 г/л глицина, доведенных до объема с помощью очищенной D-I H2O) (Murashige and Skoog (1962) Physiol. Plant. 15:473), 100 мг/л миоинозитола, 0,5 мг/л зеатина, 60 г/л сахарозы и 1,0 мл/л 0,1 мМ абсцизовой кислоты (доведенных до объема с помощью очищенной D-I H2O после доведения pH до 5,6); 3,0 г/л Gelrite (добавленного после доведения до объема с помощью D-I H2O), и 1,0 мг/л индолилуксусной кислоты, и 3,0 мг/л биалафоса (добавленных после стерилизации среды и охлаждения до 60°C). Безгормональная среда (272V) содержала 4,3 г/л солей по MS (GIBCO 11117-074), 5,0 мл/л исходного раствора витаминов по MS (0,100 г/л никотиновой кислоты, 0,02 г/л тиамина-HCL, 0,10 г/л пиридоксина-HCL и 0,40 г/л глицина, доведенных до объема с помощью очищенной D-I H2O), 0,1 г/л миоинозитола и 40,0 г/л сахарозы (доведенных до объема с помощью очищенной D-I H2O после доведения pH до 5,6); и 6 г/л бактоагара (добавленного после доведения до объема с помощью очищенной D-I H2O), ее стерилизовала и охлаждали до 60°C.
Приведенное выше описание различных проиллюстрированных вариантов осуществления согласно настоящему раскрытию не подразумевается как исчерпывающее или для ограничения настоящего изобретения точной раскрытой формой. Хотя специфические варианты осуществления и примеры, касающиеся настоящего изобретения, описаны в данном документе для иллюстративных целей, в пределах объема настоящего изобретения возможны различные эквивалентные модификации, как будет понятно специалистам в данной области техники. Представленные в данном документе идеи настоящего изобретения можно применять для других целей, отличающихся от примеров, описанных выше. Настоящее изобретение можно осуществлять на практике при помощи способов, отличающихся, в частности, от описанных в вышеизложенном описании и примерах. В свете вышеизложенных идей возможны многочисленные модификации и вариации настоящего изобретения, и, следовательно, они находятся в пределах объема прилагаемой формулы изобретения.
Эти и другие изменения можно делать в настоящем изобретении в свете вышеизложенного подробного описания. В целом, в следующей формуле изобретения используемые термины не должны рассматриваться как ограничивающие настоящее изобретение специфическими вариантами осуществления, раскрытыми в описании и формуле изобретения.
Определенные идеи, связанные с полинуклеотидами и полипептидами AfIP-1A и AfIP-1B, были раскрыты в предварительной заявке на патент США № 61/675950, поданной 26 июля 2012 года, предварительной заявке на патент США № 61/739468, поданной 19 декабря 2012 года, и предварительной заявке на патент США № 61/779457, поданной 13 марта 2013 года, раскрытия которых включены в данный документ посредством ссылки в их полноте.
Полное раскрытие каждого процитированного документа (в том числе патенты, патентные заявки, журнальные статьи, рефераты, руководства, книги или другие раскрытия) в Предпосылках изобретения, Подробном описании и Примерах включено в данный документ посредством ссылки во всей их полноте.
Вышеприведенные примеры предложены, чтобы обеспечить обычных специалистов в данной области техники полным раскрытием и описанием того, как осуществлять и применять заявленное изобретение, и не предусматривает ограничение объема, который рассматривается в связи с настоящим изобретением. Были сделаны попытки обеспечения точности в отношении применяемых чисел (например количества, температуры, концентрации и т.д.), но могут предусматриваться некоторые экспериментальные ошибки и отклонения. Если не указано иное, части представляют собой части по весу, молекулярный вес представляет собой средний молекулярный вес; температура приведена в градусах по Цельсию и давление является атмосферным или практически атмосферным.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ РЕЦЕПТОРА ИНТЕРЛЕЙКИНА 36 (IL-36R) | 2016 |
|
RU2745898C2 |
| НОВЫЕ БЕЛКИ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ НАСЕКОМЫХ | 2015 |
|
RU2740313C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНЫХ РАССТРОЙСТВ | 2014 |
|
RU2763796C2 |
| АНТИГЕННЫЕ ПОЛИПЕПТИДЫ НА ОСНОВЕ ПОСЛЕДОВАТЕЛЬНОСТИ OspA | 2019 |
|
RU2816208C2 |
| АНТИ-TIGIT АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2817838C2 |
| ПЕПТИДНЫЕ АНТАГОНИСТЫ ПЕПТИДНЫХ ГОРМОНОВ ИЗ СЕМЕЙСТВА КАЛЬЦИТОНИНА (CGRP) И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2742826C2 |
| ВАКЦИННЫЕ КОНСТРУКТЫ И ИХ ПРИМЕНЕНИЯ ПРОТИВ ИНФЕКЦИЙ СТАФИЛОКОККА | 2017 |
|
RU2766354C2 |
| Слитые молекулы, происходящие от Cholix-токсина, для пероральной доставки биологически активных нагрузок | 2015 |
|
RU2723178C2 |
| АНТИГЕННЫЕ ПОЛИПЕПТИДЫ НА ОСНОВЕ ПОСЛЕДОВАТЕЛЬНОСТИ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОГО ВИРУСА | 2019 |
|
RU2807992C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ ADAM9, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2783619C2 |


































































































































































































































































































































































































































































































































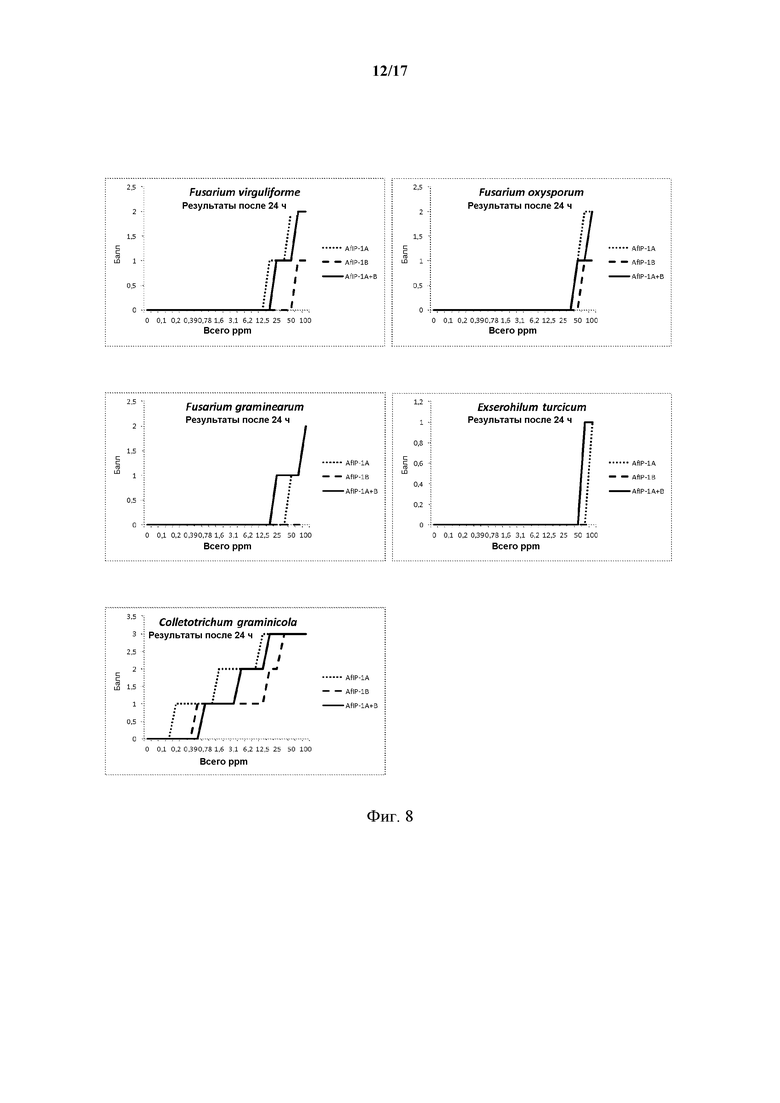





Изобретение относится к области биохимии, в частности к выделенному полипептиду, обладающему фунгицидной активностью против грибковых патогенов Fusarium virguliforme, Fusarium oxysporum, Fusarium graminearum, Colletotrichum graminicola и Exserohilum turcicum и инсектицидной активностью против насекомого, выбранного из западного кукурузного жука, соевой совки и бобовой гусеницы, композиции, его содержащей, а также к выделенной молекуле нуклеиновой кислоты, его кодирующей. Также раскрыты трансгенное растение и его семя, кассета экспрессии, а также ДНК-конструкция, содержащие вышеуказанную выделенную молекулу нуклеиновой кислоты. Изобретение также относится к способу экспрессии в растении полинуклеотида, кодирующего инсектицидный белок, к способу защиты растения от насекомого-вредителя, а также к способу подавления роста насекомого-вредителя с использованием вышеуказанной композиции. Изобретение позволяет эффективно бороться с насекомыми и грибковыми патогенами. 20 н. и 8 з.п. ф-лы, 13 ил., 40 табл., 30 пр.
1. Выделенная молекула нуклеиновой кислоты, кодирующая полипептид, обладающий по меньшей мере 80% идентичностью со всей длиной аминокислотной последовательности с SEQ ID NO: 2, где полипептид обладает фунгицидной активностью против грибковых патогенов Fusarium virguliforme (FVR), Fusarium oxysporum (FOS), Fusarium graminearum (FGR), Colletotrichum graminicola (CGR) и Exserohilum turcicum (ETC) и обладает инсектицидной активностью против насекомого, выбранного из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
2. Выделенная молекула нуклеиновой кислоты по п. 1, где полипептид характеризуется аминокислотной последовательностью SEQ ID NO: 257,
где
Xaa в положении 6 представляет собой Ile, Thr, Leu, Met, Val или Ser;
Xaa в положении 7 представляет собой Ala, Met, Val, Leu, Ile или Gly;
Xaa в положении 8 представляет собой Thr, Asp, Ser или Glu;
Xaa в положении 9 представляет собой Glu, Leu, Gly, Asp, Ala, Ile, Val или Met;
Xaa в положении 10 представляет собой Glu, Asn, Asp или Gln;
Xaa в положении 11 представляет собой Ser, Val, Thr, Ile, Leu или Met;
Xaa в положении 12 представляет собой Lys, Glu, Arg или Asp;
Xaa в положении 13 представляет собой Ile, Val, Leu или Met;
Xaa в положении 14 представляет собой Arg, Gln, Lys или Asn;
Xaa в положении 16 представляет собой Tyr, Gln, Trp, Phe или Asn;
Xaa в положении 17 представляет собой Ala, Ser, Gly или Thr;
Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr;
Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr;
Xaa в положении 23 представляет собой Thr, Glu, Ala, Ser, Asp или Gly;
Xaa в положении 24 представляет собой Ile, Leu, Val или Met;
Xaa в положении 26 представляет собой Val, Ser, Ile, Leu, Met или Thr;
Xaa в положении 27 представляет собой Val, Glu, Ile, Leu, Met или Asp;
Xaa в положении 29 представляет собой Ser, Met, Thr, Ile, Leu или Val;
Xaa в положении 30 представляет собой Asn, Asp, Ser, Glu, Gln или Thr;
Xaa в положении 31 представляет собой Phe, Ile, Leu, Val или Met;
Xaa в положении 32 представляет собой Lys, Glu, Arg или Asp;
Xaa в положении 33 представляет собой Val, Ile, Leu или Met;
Xaa в положении 34 представляет собой Glu, Lys, Asp или Arg;
Xaa в положении 35 представляет собой Gly или Asn;
Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp;
Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr;
Xaa в положении 41 представляет собой Gly, Cys или Gln;
Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr;
Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp;
Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp;
Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp;
Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 47 представляет собой Gly, Leu или Phe;
Xaa в положении 48 представляет собой Asp, Asn, Glu, Gln, Leu или Phe;
Xaa в положении 50 представляет собой Asp, Ser, Glu, Thr, Leu или Phe;
Xaa в положении 51 представляет собой Lys, Asn, Arg, Gln, Leu или Phe;
Xaa в положении 52 представляет собой Glu, Leu или Phe;
Xaa в положении 53 представляет собой Ile, Leu или Phe;
Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe;
Xaa в положении 55 представляет собой Pro, Ser, Thr, Leu или Phe;
Xaa в положении 56 представляет собой Ser, Asp, Thr, Glu или Leu;
Xaa в положении 57 представляет собой Gln, Thr, Glu, Asn, Ser, Asp, Leu или Phe;
Xaa в положении 58 представляет собой Ile, Val, Leu, Met или Phe;
Xaa в положении 60 представляет собой Gly, Lys, Ala или Arg;
Xaa в положении 61 представляет собой Thr, Ile или Phe;
Xaa в положении 62 представляет собой Ile, Lys, Val, Leu, Met, Arg или Phe;
Xaa в положении 64 представляет собой Lys, Ser, Glu, Arg, Thr, Asp, Leu или Phe;
Xaa в положении 65 представляет собой Asp, Ser, Glu, Thr, Leu или Phe;
Xaa в положении 66 представляет собой Glu, Gly, Asp или Ala;
Xaa в положении 67 представляет собой Asp, Thr, Glu или Ser;
Xaa в положении 68 представляет собой Ser, Lys, Thr или Arg;
Xaa в положении 69 представляет собой Tyr, Ser, Trp, Phe или Thr;
Xaa в положении 70 представляет собой Thr, Lys, Ser или Arg;
Xaa в положении 73 представляет собой Ser, Ala, Thr или Gly;
Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr;
Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 77 представляет собой Glu, Ala, Asp или Gly;
Xaa в положении 78 представляет собой Asn, Asp, Gln или Glu;
Xaa в положении 79 представляет собой Ala, Thr, Gly или Ser;
Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr;
Xaa в положении 86 представляет собой Gly, Lys, Ala или Arg;
Xaa в положении 88 представляет собой Ser, Glu, Thr или Asp;
Xaa в положении 89 представляет собой Leu, Ile, Val или Met;
Xaa в положении 91 представляет собой Asp, His или Glu;
Xaa в положении 92 представляет собой Gly, Asp, Ala или Glu;
Xaa в положении 95 представляет собой Leu, Trp, Ile, Val, Met, Phe или Tyr;
Xaa в положении 96 представляет собой Val, Leu, Ile или Met;
Xaa в положении 97 представляет собой Phe, Ala или Gly;
Xaa в положении 98 представляет собой Glu, Thr, Asp или Ser;
Xaa в положении 100 представляет собой Tyr, Lys, Trp или Arg;
Xaa в положении 101 представляет собой Trp, Phe или Tyr;
Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val;
Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr;
Xaa в положении 106 представляет собой Ser, Ala, Thr или Gly;
Xaa в положении 111 представляет собой Asp, His, Asn, Glu или Gln;
Xaa в положении 112 представляет собой Glu, Ser, Asp или Thr;
Xaa в положении 113 представляет собой Leu, Ser, Ile, Val, Met или Thr;
Xaa в положении 114 представляет собой Thr или Ser;
Xaa в положении 115 представляет собой Val, Ile, Val или Met;
Xaa в положении 116 представляет собой Lys, Thr, Glu, Arg, Ser или Asp;
Xaa в положении 117 представляет собой Asp или Glu;
Xaa в положении 118 представляет собой Lys, Asp, Arg или Glu;
Xaa в положении 119 представляет собой Glu, Asn, Asp или Gln;
Xaa в положении 120 представляет собой Asn, Lys, Asp или Arg;
Xaa в положении 121 представляет собой Tyr, Leu или Phe;
Xaa в положении 122 представляет собой Thr, Lys, Ser, Arg, Leu или Phe;
Xaa в положении 123 представляет собой Val, Ile, Leu, Met, Phe или Asn;
Xaa в положении 124 представляет собой Ile, Ser, Asp, Leu, Val, Met, Thr, Glu или Phe;
Xaa в положении 125 представляет собой Lys, Leu, Phe или Met;
Xaa в положении 126 представляет собой Lys, Glu, Arg, Asp, Leu или Phe;
Xaa в положении 128 представляет собой Gly, Leu или Phe;
Xaa в положении 129 представляет собой Gly, Asn, Ala, Gln, Leu или Phe;
Xaa в положении 130 представляет собой Ser, Ile, Thr, Leu, Val, Met или Phe;
Xaa в положении 131 представляет собой Pro, Ser или Thr;
Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr;
Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp;
Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr;
Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr;
Xaa в положении 142 представляет собой Val, Cys, Ile, Leu или Met;
Xaa в положении 143 представляет собой Val, Ile, Leu или Met;
Xaa в положении 145 представляет собой Lys, Val, Arg, Ile, Leu или Met; или
Xaa в положении 146 представляет собой Ser, Gly, Thr или Ala;
и где 1-14 аминокислот, необязательно, удалены с N-конца полипептида.
3. Выделенная молекула нуклеиновой кислоты по п. 1, кодирующая полипептид, обладающий по меньшей мере 80% идентичностью со всей длиной аминокислотной последовательности с SEQ ID NO:2, содержащей аминокислотную замену, выбранную из активных замен, представленных в Таблице 13, Таблице 14, Таблице 18, Таблице 19, Таблице 20, Таблице 31, Таблице 35, Таблице 37 и Таблице 38, где полипептид обладает фунгицидной активностью против грибковых патогенов Fusarium virguliforme (FVR), Fusarium oxysporum (FOS), Fusarium graminearum (FGR), Colletotrichum graminicola (CGR) и Exserohilum turcicum (ETC) и обладает инсектицидной активностью против насекомого, выбранного из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
4. Выделенная молекула нуклеиновой кислоты по п. 3, кодирующая полипептид, обладающий по меньшей мере 80% идентичностью со всей длиной аминокислотной последовательности, где полипептид содержит аминокислотную последовательность SEQ ID NO:255,
где
Xaa в положении 6 представляет собой Ile или Thr;
Xaa в положении 7 представляет собой Ala или Val;
Xaa в положении 9 представляет собой Glu или Gly;
Xaa в положении 13 представляет собой Ile или Val;
Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr;
Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr;
Xaa в положении 23 представляет собой Thr или Ala;
Xaa в положении 24 представляет собой Ile или Leu;
Xaa в положении 30 представляет собой Asn или Ser;
Xaa в положении 33 представляет собой Val или Ile;
Xaa в положении 35 представляет собой Gly или Asn;
Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp;
Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr;
Xaa в положении 41 представляет собой Gly, Cys или Gln;
Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr;
Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp;
Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp;
Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp;
Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 47 представляет собой Gly, Leu или Phe;
Xaa в положении 48 представляет собой Asp, Asn, Leu или Phe;
Xaa в положении 49 представляет собой Lys, Leu или Phe;
Xaa в положении 50 представляет собой Asp, Leu или Phe;
Xaa в положении 51 представляет собой Lys, Leu или Phe;
Xaa в положении 52 представляет собой Glu, Leu или Phe;
Xaa в положении 53 представляет собой Ile, Leu или Phe;
Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe;
Xaa в положении 55 представляет собой Pro, Leu или Phe;
Xaa в положении 56 представляет собой Ser или Leu;
Xaa в положении 57 представляет собой Gln, Glu, Leu или Phe;
Xaa в положении 58 представляет собой Ile, Val, Leu или Phe;
Xaa в положении 60 представляет собой Gly, Leu или Phe;
Xaa в положении 61 представляет собой Thr, Ile или Phe;
Xaa в положении 62 представляет собой Ile, Val, Leu или Phe;
Xaa в положении 64 представляет собой Lys, Glu, Leu или Phe;
Xaa в положении 65 представляет собой Asp, Leu или Phe;
Xaa в положении 67 представляет собой Asp или Glu;
Xaa в положении 68 представляет собой Ser или Thr;
Xaa в положении 73 представляет собой Ser или Ala;
Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr;
Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr;
Xaa в положении 96 представляет собой Val или Ile;
Xaa в положении 101 представляет собой Trp, Phe или Tyr;
Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val;
Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr;
Xaa в положении 111 представляет собой Asp или Asn;
Xaa в положении 113 представляет собой Leu или Ser;
Xaa в положении 115 представляет собой Val или Ile;
Xaa в положении 116 представляет собой Lys или Glu;
Xaa в положении 120 представляет собой Asn или Lys;
Xaa в положении 121 представляет собой Tyr, Leu или Phe;
Xaa в положении 122 представляет собой Thr, Leu или Phe;
Xaa в положении 123 представляет собой Val, Leu, Phe или Asn;
Xaa в положении 124 представляет собой Ile, Ser, Leu или Phe;
Xaa в положении 125 представляет собой Lys, Leu, Phe или Met;
Xaa в положении 126 представляет собой Lys, Leu или Phe;
Xaa в положении 128 представляет собой Gly, Leu или Phe;
Xaa в положении 129 представляет собой Gly, Leu или Phe;
Xaa в положении 130 представляет собой Ser, Leu или Phe;
Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr;
Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp;
Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr;
Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; или
Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr.
5. Выделенная молекула нуклеиновой кислоты по п. 1, кодирующая полипептид, выбранный из группы, состоящей из SEQ ID NO:2, SEQ ID NO: 6, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 94, SEQ ID NO: 96, SEQ ID NO: 98, SEQ ID NO: 100, SEQ ID NO: 152, SEQ ID NO: 301, SEQ ID NO: 302, SEQ ID NO: 303, SEQ ID NO: 304, SEQ ID NO: 305, SEQ ID NO: 306, SEQ ID NO: 307, SEQ ID NO: 308, SEQ ID NO: 309, SEQ ID NO: 310, SEQ ID NO: 311, SEQ ID NO: 502, SEQ ID NO: 503, SEQ ID NO: 504, SEQ ID NO: 505, SEQ ID NO: 506, SEQ ID NO: 507, SEQ ID NO: 508, SEQ ID NO: 509, SEQ ID NO: 510, SEQ ID NO: 511, SEQ ID NO: 512, SEQ ID NO: 513, SEQ ID NO: 514, SEQ ID NO: 515, SEQ ID NO: 516, SEQ ID NO: 517, SEQ ID NO: 518, SEQ ID NO: 519, SEQ ID NO: 520, SEQ ID NO: 521, SEQ ID NO: 522, SEQ ID NO: 523, SEQ ID NO: 524, SEQ ID NO: 525, SEQ ID NO: 526, SEQ ID NO: 527, SEQ ID NO: 528, SEQ ID NO: 529, SEQ ID NO: 530, SEQ ID NO: 531, SEQ ID NO: 532, SEQ ID NO: 533, SEQ ID NO: 534, SEQ ID NO: 535, SEQ ID NO: 536, SEQ ID NO: 537, SEQ ID NO: 538, SEQ ID NO: 539, SEQ ID NO: 540, SEQ ID NO: 541, SEQ ID NO: 542, SEQ ID NO: 543, SEQ ID NO: 544, SEQ ID NO: 545, SEQ ID NO: 590, SEQ ID NO: 591, SEQ ID NO: 592, SEQ ID NO: 593, SEQ ID NO: 594, SEQ ID NO: 595, SEQ ID NO: 596, SEQ ID NO: 597, SEQ ID NO: 598, SEQ ID NO: 599, SEQ ID NO: 600, SEQ ID NO: 601, SEQ ID NO: 602, SEQ ID NO: 603, SEQ ID NO: 604, SEQ ID NO: 605, SEQ ID NO: 606, SEQ ID NO: 607, SEQ ID NO: 608, SEQ ID NO: 609, SEQ ID NO: 610, SEQ ID NO: 611, SEQ ID NO: 612, SEQ ID NO: 613, SEQ ID NO: 614, SEQ ID NO: 615, SEQ ID NO: 616, SEQ ID NO: 617, SEQ ID NO: 618, SEQ ID NO: 648, SEQ ID NO: 649, SEQ ID NO: 650, SEQ ID NO: 651, SEQ ID NO: 652, SEQ ID NO: 653, SEQ ID NO: 654, SEQ ID NO: 655, SEQ ID NO: 656, SEQ ID NO: 657, SEQ ID NO: 658, SEQ ID NO: 659, SEQ ID NO: 660, SEQ ID NO: 661, SEQ ID NO: 662, SEQ ID NO: 663, SEQ ID NO: 664, SEQ ID NO: 778, SEQ ID NO: 782 и SEQ ID NO: 786.
6. Устойчивое к вредителям трансгенное растение, стабильно трансформированное выделенной молекулой нуклеиновой кислоты по любому из пп. 1-5, где вредитель выбран из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
7. Кассета экспрессии, содержащая выделенную молекулу нуклеиновой кислоты по любому из пп. 1-5 и одну или несколько регуляторных последовательностей, функционально связанных с ней и управляющих экспрессией полипептида, где полипептид обладает фунгицидной активностью против грибковых патогенов Fusarium virguliforme (FVR), Fusarium oxysporum (FOS), Fusarium graminearum (FGR), Colletotrichum graminicola (CGR) и Exserohilum turcicum (ETC) и обладает инсектицидной активностью против насекомого, выбранного из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
8. Устойчивое к вредителям трансгенное растение, содержащее кассету экспрессии по п. 7, где вредитель выбран из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
9. Устойчивое к вредителям семя трансгенного растения по п. 8, отличающееся тем, что семя содержит выделенную молекулу нуклеиновой кислоты по любому из пп. 1-5, где вредитель выбран из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
10. Выделенный полипептид, обладающий по меньшей мере 80% идентичностью со всей длиной аминокислотной последовательности с SEQ ID NO: 2, где полипептид обладает фунгицидной активностью против грибковых патогенов Fusarium virguliforme (FVR), Fusarium oxysporum (FOS), Fusarium graminearum (FGR), Colletotrichum graminicola (CGR) и Exserohilum turcicum (ETC) и обладает инсектицидной активностью против насекомого, выбранного из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
11. Выделенный полипептид по п. 10, отличающийся тем, что полипептид характеризуется аминокислотной последовательностью SEQ ID NO:257,
где
Xaa в положении 6 представляет собой Ile, Thr, Leu, Met, Val или Ser;
Xaa в положении 7 представляет собой Ala, Met, Val, Leu, Ile или Gly;
Xaa в положении 8 представляет собой Thr, Asp, Ser или Glu;
Xaa в положении 9 представляет собой Glu, Leu, Gly, Asp, Ala, Ile, Val или Met;
Xaa в положении 10 представляет собой Glu, Asn, Asp или Gln;
Xaa в положении 11 представляет собой Ser, Val, Thr, Ile, Leu или Met;
Xaa в положении 12 представляет собой Lys, Glu, Arg или Asp;
Xaa в положении 13 представляет собой Ile, Val, Leu или Met;
Xaa в положении 14 представляет собой Arg, Gln, Lys или Asn;
Xaa в положении 16 представляет собой Tyr, Gln, Trp, Phe или Asn;
Xaa в положении 17 представляет собой Ala, Ser, Gly или Thr;
Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr;
Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr;
Xaa в положении 23 представляет собой Thr, Glu, Ala, Ser, Asp или Gly;
Xaa в положении 24 представляет собой Ile, Leu, Val или Met;
Xaa в положении 26 представляет собой Val, Ser, Ile, Leu, Met или Thr;
Xaa в положении 27 представляет собой Val, Glu, Ile, Leu, Met или Asp;
Xaa в положении 29 представляет собой Ser, Met, Thr, Ile, Leu или Val;
Xaa в положении 30 представляет собой Asn, Asp, Ser, Glu, Gln или Thr;
Xaa в положении 31 представляет собой Phe, Ile, Leu, Val или Met;
Xaa в положении 32 представляет собой Lys, Glu, Arg или Asp;
Xaa в положении 33 представляет собой Val, Ile, Leu или Met;
Xaa в положении 34 представляет собой Glu, Lys, Asp или Arg;
Xaa в положении 35 представляет собой Gly или Asn;
Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp;
Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr;
Xaa в положении 41 представляет собой Gly, Cys или Gln;
Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr;
Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp;
Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp;
Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp;
Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 47 представляет собой Gly, Leu или Phe;
Xaa в положении 48 представляет собой Asp, Asn, Glu, Gln, Leu или Phe;
Xaa в положении 50 представляет собой Asp, Ser, Glu, Thr, Leu или Phe;
Xaa в положении 51 представляет собой Lys, Asn, Arg, Gln, Leu или Phe;
Xaa в положении 52 представляет собой Glu, Leu или Phe;
Xaa в положении 53 представляет собой Ile, Leu или Phe;
Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe;
Xaa в положении 55 представляет собой Pro, Ser, Thr, Leu или Phe;
Xaa в положении 56 представляет собой Ser, Asp, Thr, Glu, Leu;
Xaa в положении 57 представляет собой Gln, Thr, Glu, Asn, Ser, Asp, Leu или Phe;
Xaa в положении 58 представляет собой Ile, Val, Leu, Met или Phe;
Xaa в положении 60 представляет собой Gly, Lys, Ala или Arg;
Xaa в положении 61 представляет собой Thr, Ile или Phe;
Xaa в положении 62 представляет собой Ile, Lys, Val, Leu, Met, Arg или Phe;
Xaa в положении 64 представляет собой Lys, Ser, Glu, Arg, Thr, Asp, Leu или Phe;
Xaa в положении 65 представляет собой Asp, Ser, Glu, Thr, Leu или Phe;
Xaa в положении 66 представляет собой Glu, Gly, Asp или Ala;
Xaa в положении 67 представляет собой Asp, Thr, Glu или Ser;
Xaa в положении 68 представляет собой Ser, Lys, Thr или Arg;
Xaa в положении 69 представляет собой Tyr, Ser, Trp, Phe или Thr;
Xaa в положении 70 представляет собой Thr, Lys, Ser или Arg;
Xaa в положении 73 представляет собой Ser, Ala, Thr или Gly;
Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr;
Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 77 представляет собой Glu, Ala, Asp или Gly;
Xaa в положении 78 представляет собой Asn, Asp, Gln или Glu;
Xaa в положении 79 представляет собой Ala, Thr, Gly или Ser;
Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr;
Xaa в положении 86 представляет собой Gly, Lys, Ala или Arg;
Xaa в положении 88 представляет собой Ser, Glu, Thr или Asp;
Xaa в положении 89 представляет собой Leu, Ile, Val или Met;
Xaa в положении 91 представляет собой Asp, His или Glu;
Xaa в положении 92 представляет собой Gly, Asp, Ala или Glu;
Xaa в положении 95 представляет собой Leu, Trp, Ile, Val, Met, Phe или Tyr;
Xaa в положении 96 представляет собой Val, Leu, Ile или Met;
Xaa в положении 97 представляет собой Phe, Ala или Gly;
Xaa в положении 98 представляет собой Glu, Thr, Asp или Ser;
Xaa в положении 100 представляет собой Tyr, Lys, Trp или Arg;
Xaa в положении 101 представляет собой Trp, Phe или Tyr;
Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val;
Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr;
Xaa в положении 106 представляет собой Ser, Ala, Thr или Gly;
Xaa в положении 111 представляет собой Asp, His, Asn, Glu или Gln;
Xaa в положении 112 представляет собой Glu, Ser, Asp или Thr;
Xaa в положении 113 представляет собой Leu, Ser, Ile, Val, Met или Thr;
Xaa в положении 114 представляет собой Thr или Ser;
Xaa в положении 115 представляет собой Val, Ile, Val или Met;
Xaa в положении 116 представляет собой Lys, Thr, Glu, Arg, Ser или Asp;
Xaa в положении 117 представляет собой Asp или Glu;
Xaa в положении 118 представляет собой Lys, Asp, Arg или Glu;
Xaa в положении 119 представляет собой Glu, Asn, Asp или Gln;
Xaa в положении 120 представляет собой Asn, Lys, Asp или Arg;
Xaa в положении 121 представляет собой Tyr, Leu или Phe;
Xaa в положении 122 представляет собой Thr, Lys, Ser, Arg, Leu или Phe;
Xaa в положении 123 представляет собой Val, Ile, Leu, Met, Phe или Asn;
Xaa в положении 124 представляет собой Ile, Ser, Asp, Leu, Val, Met, Thr, Glu или Phe;
Xaa в положении 125 представляет собой Lys, Leu, Phe или Met;
Xaa в положении 126 представляет собой Lys, Glu, Arg, Asp, Leu или Phe;
Xaa в положении 128 представляет собой Gly, Leu или Phe;
Xaa в положении 129 представляет собой Gly, Asn, Ala, Gln, Leu или Phe;
Xaa в положении 130 представляет собой Ser, Ile, Thr, Leu, Val, Met или Phe;
Xaa в положении 131 представляет собой Pro, Ser или Thr;
Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr;
Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp;
Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr;
Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr;
Xaa в положении 142 представляет собой Val, Cys, Ile, Leu или Met;
Xaa в положении 143 представляет собой Val, Ile, Leu или Met;
Xaa в положении 145 представляет собой Lys, Val, Arg, Ile, Leu или Met; или
Xaa в положении 146 представляет собой Ser, Gly, Thr или Ala;
и где 1-14 аминокислот, необязательно, удалены с N-конца полипептида.
12. Выделенный полипептид по п. 10, отличающийся тем, что полипептид содержит аминокислотную замену, выбранную из активных замен, представленных в Таблице 13, Таблице 14, Таблице 18, Таблице 19, Таблице 20, Таблице 31, Таблице 35, Таблице 37 и Таблице 38, где полипептид обладает фунгицидной активностью против грибковых патогенов Fusarium virguliforme (FVR), Fusarium oxysporum (FOS), Fusarium graminearum (FGR), Colletotrichum graminicola (CGR) и Exserohilum turcicum (ETC) и обладает инсектицидной активностью против насекомого, выбранного из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
13. Выделенный полипептид по п. 12, отличающийся тем, что полипептид содержит аминокислотную последовательность SEQ ID NO:255,
где
Xaa в положении 6 представляет собой Ile или Thr;
Xaa в положении 7 представляет собой Ala или Val;
Xaa в положении 9 представляет собой Glu или Gly;
Xaa в положении 13 представляет собой Ile или Val;
Xaa в положении 19 представляет собой Trp, Glu, Phe, Ile, His, Asn или Tyr;
Xaa в положении 20 представляет собой Ile, Val, Ala, Cys, Glu, Phe, Gly, Met, Asn, Gln, Arg, Ser или Thr;
Xaa в положении 23 представляет собой Thr или Ala;
Xaa в положении 24 представляет собой Ile или Leu;
Xaa в положении 30 представляет собой Asn или Ser;
Xaa в положении 33 представляет собой Val или Ile;
Xaa в положении 35 представляет собой Gly или Asn;
Xaa в положении 36 представляет собой Ala, Gly, Asp, Glu, Phe, Gly, Ile, Leu, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 37 представляет собой Tyr, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Pro, Arg, Ser, Thr, Val или Trp;
Xaa в положении 38 представляет собой Leu, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 39 представляет собой Arg, Lys, Cys, Asp, Glu, Phe, Gly, Ile, Lys, Leu, Met, Asn, Pro, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 40 представляет собой Trp, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Tyr;
Xaa в положении 41 представляет собой Gly, Cys или Gln;
Xaa в положении 42 представляет собой Lys, Cys, Glu, His, Leu, Met, Asn, Gln, Arg или Thr;
Xaa в положении 43 представляет собой Phe, Tyr, Ala, Cys, Glu, Ile, Leu, Met, Gln, Ser, Val или Trp;
Xaa в положении 44 представляет собой His, Ala, Asp, Glu, Gly, Lys, Leu, Met, Asn, Pro, Glu, Arg, Ser, Thr, Val, Trp;
Xaa в положении 45 представляет собой Val, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Trp;
Xaa в положении 46 представляет собой Pro, Ala, Cys, Asp, Glu, Gly, His, Lys, Leu, Met, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 47 представляет собой Gly, Leu или Phe;
Xaa в положении 48 представляет собой Asp, Asn, Leu или Phe;
Xaa в положении 49 представляет собой Lys, Leu или Phe;
Xaa в положении 50 представляет собой Asp, Leu или Phe;
Xaa в положении 51 представляет собой Lys, Leu или Phe;
Xaa в положении 52 представляет собой Glu, Leu или Phe;
Xaa в положении 53 представляет собой Ile, Leu или Phe;
Xaa в положении 54 представляет собой Ser, Thr, Leu или Phe;
Xaa в положении 55 представляет собой Pro, Leu или Phe;
Xaa в положении 56 представляет собой Ser или Leu;
Xaa в положении 57 представляет собой Gln, Glu, Leu или Phe;
Xaa в положении 58 представляет собой Ile, Val, Leu или Phe;
Xaa в положении 60 представляет собой Gly, Leu или Phe;
Xaa в положении 61 представляет собой Thr, Ile или Phe;
Xaa в положении 62 представляет собой Ile, Val, Leu или Phe;
Xaa в положении 64 представляет собой Lys, Glu, Leu или Phe;
Xaa в положении 65 представляет собой Asp, Leu или Phe;
Xaa в положении 67 представляет собой Asp или Glu;
Xaa в положении 68 представляет собой Ser или Thr;
Xaa в положении 73 представляет собой Ser или Ala;
Xaa в положении 74 представляет собой Cys, Ala, Asp, Glu, Gly, His, Ile, Lys, Leu, Asn, Pro, Gln, Arg, Ser, Thr или Tyr;
Xaa в положении 76 представляет собой Arg, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 82 представляет собой Gly, Glu, Asn, Trp или Tyr;
Xaa в положении 96 представляет собой Val или Ile;
Xaa в положении 101 представляет собой Trp, Phe или Tyr;
Xaa в положении 104 представляет собой Pro, Ala, Phe, Gly, His, Met, Gln, Arg или Val;
Xaa в положении 105 представляет собой Trp, Asp, Phe, Ile, Leu или Tyr;
Xaa в положении 111 представляет собой Asp или Asn;
Xaa в положении 113 представляет собой Leu или Ser;
Xaa в положении 115 представляет собой Val или Ile;
Xaa в положении 116 представляет собой Lys или Glu;
Xaa в положении 120 представляет собой Asn или Lys;
Xaa в положении 121 представляет собой Tyr, Leu или Phe;
Xaa в положении 122 представляет собой Thr, Leu или Phe;
Xaa в положении 123 представляет собой Val, Leu, Phe или Asn;
Xaa в положении 124 представляет собой Ile, Ser, Leu или Phe;
Xaa в положении 125 представляет собой Lys, Leu, Phe или Met;
Xaa в положении 126 представляет собой Lys, Leu или Phe;
Xaa в положении 128 представляет собой Gly, Leu или Phe;
Xaa в положении 129 представляет собой Gly, Leu или Phe;
Xaa в положении 130 представляет собой Ser, Leu или Phe;
Xaa в положении 132 представляет собой Ser, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Val, Trp или Tyr;
Xaa в положении 133 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Trp;
Xaa в положении 134 представляет собой Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 135 представляет собой Thr, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr;
Xaa в положении 136 представляет собой Gly, Ala, Cys, Asp, Glu, Phe, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 137 представляет собой Asn, Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Pro, Glu, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 138 представляет собой Ile, Ala, Cys, Asp, Glu, Phe, Gly, His, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr;
Xaa в положении 139 представляет собой Phe, Ala, Cys, Asp, Glu, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val, Trp или Tyr; или
Xaa в положении 140 представляет собой Ile, Ala, Cys, Phe, His, Leu, Met, Asn, Gln, Thr, Val или Tyr.
14. Выделенный полипептид по п. 10, выбранный из группы, состоящей из SEQ ID NO:2, SEQ ID NO: 6, SEQ ID NO: 28, SEQ ID NO: 32, SEQ ID NO: 36, SEQ ID NO: 40, SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 52, SEQ ID NO: 54, SEQ ID NO: 56, SEQ ID NO: 58, SEQ ID NO: 60, SEQ ID NO: 62, SEQ ID NO: 64, SEQ ID NO: 66, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 72, SEQ ID NO: 74, SEQ ID NO: 94, SEQ ID NO: 96, SEQ ID NO: 98, SEQ ID NO: 100, SEQ ID NO: 152, SEQ ID NO: 301, SEQ ID NO: 302, SEQ ID NO: 303, SEQ ID NO: 304, SEQ ID NO: 305, SEQ ID NO: 306, SEQ ID NO: 307, SEQ ID NO: 308, SEQ ID NO: 309, SEQ ID NO: 310, SEQ ID NO: 311, SEQ ID NO: 502, SEQ ID NO: 503, SEQ ID NO: 504, SEQ ID NO: 505, SEQ ID NO: 506, SEQ ID NO: 507, SEQ ID NO: 508, SEQ ID NO: 509, SEQ ID NO: 510, SEQ ID NO: 511, SEQ ID NO: 512, SEQ ID NO: 513, SEQ ID NO: 514, SEQ ID NO: 515, SEQ ID NO: 516, SEQ ID NO: 517, SEQ ID NO: 518, SEQ ID NO: 519, SEQ ID NO: 520, SEQ ID NO: 521, SEQ ID NO: 522, SEQ ID NO: 523, SEQ ID NO: 524, SEQ ID NO: 525, SEQ ID NO: 526, SEQ ID NO: 527, SEQ ID NO: 528, SEQ ID NO: 529, SEQ ID NO: 530, SEQ ID NO: 531, SEQ ID NO: 532, SEQ ID NO: 533, SEQ ID NO: 534, SEQ ID NO: 535, SEQ ID NO: 536, SEQ ID NO: 537, SEQ ID NO: 538, SEQ ID NO: 539, SEQ ID NO: 540, SEQ ID NO: 541, SEQ ID NO: 542, SEQ ID NO: 543, SEQ ID NO: 544, SEQ ID NO: 545, SEQ ID NO: 590, SEQ ID NO: 591, SEQ ID NO: 592, SEQ ID NO: 593, SEQ ID NO: 594, SEQ ID NO: 595, SEQ ID NO: 596, SEQ ID NO: 597, SEQ ID NO: 598, SEQ ID NO: 599, SEQ ID NO: 600, SEQ ID NO: 601, SEQ ID NO: 602, SEQ ID NO: 603, SEQ ID NO: 604, SEQ ID NO: 605, SEQ ID NO: 606, SEQ ID NO: 607, SEQ ID NO: 608, SEQ ID NO: 609, SEQ ID NO: 610, SEQ ID NO: 611, SEQ ID NO: 612, SEQ ID NO: 613, SEQ ID NO: 614, SEQ ID NO: 615, SEQ ID NO: 616, SEQ ID NO: 617, SEQ ID NO: 618, SEQ ID NO: 648, SEQ ID NO: 649, SEQ ID NO: 650, SEQ ID NO: 651, SEQ ID NO: 652, SEQ ID NO: 653, SEQ ID NO: 654, SEQ ID NO: 655, SEQ ID NO: 656, SEQ ID NO: 657, SEQ ID NO: 658, SEQ ID NO: 659, SEQ ID NO: 660, SEQ ID NO: 661, SEQ ID NO: 662, SEQ ID NO: 663, SEQ ID NO: 664, SEQ ID NO: 778, SEQ ID NO: 782 и SEQ ID NO: 786.
15. Фунгицидная композиция, обладающая активностью против Fusarium virguliforme (FVR), Fusarium oxysporum (FOS), Fusarium graminearum (FGR), Colletotrichum graminicola (CGR) и Exserohilum turcicum (ETC), содержащая эффективное количество выделенного полипептида по любому из пп. 10-14.
16. Инсектицидная композиция, обладающая активностью против насекомого, выбранного из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis), содержащая инсектицидно-эффективное количество выделенного полипептида по любому из пп. 10-14.
17. Способ подавления роста насекомого-вредителя, включающий приведение в контакт насекомого-вредителя с композицией по п. 16, где насекомое-вредитель выбрано из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
18. Способ снижения популяции насекомого-вредителя, устойчивого к пестицидному белку, включающий приведение в контакт популяции устойчивого насекомого-вредителя с композицией по п. 16, где насекомое-вредитель выбрано из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
19. Устойчивое к вредителям трансгенное растение, содержащее выделенную молекулу нуклеиновой кислоты по любому из пп. 1-5, где кодируемый полипептид проявляет активность против насекомого, выбранного из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
20. Устойчивое к вредителям семя трансгенного растения по п. 19, отличающееся тем, что семя содержит выделенную молекулу нуклеиновой кислоты по любому из пп. 1-5, где вредитель выбран из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
21. ДНК-конструкция, обеспечивающая устойчивость растения к вредителям, выбранным из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis), содержащая выделенную молекулу нуклеиновой кислоты по любому из пп. 1-5, функционально связанную с одной или несколькими регуляторными последовательностями, управляющими экспрессией полипептида, обладающего фунгицидной активностью против грибковых патогенов Fusarium virguliforme (FVR), Fusarium oxysporum (FOS), Fusarium graminearum (FGR), Colletotrichum graminicola (CGR) и Exserohilum turcicum (ETC) и обладающего инсектицидной активностью против насекомого, выбранного из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
22. Устойчивое к вредителям трансгенное растение, содержащее ДНК-конструкцию по п. 21, где вредитель выбран из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
23. Устойчивое к вредителям семя трансгенного растения по п. 22, отличающееся тем, что семя содержит выделенную молекулу нуклеиновой кислоты по любому из пп. 1-5, где вредитель выбран из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
24. Способ экспрессии в растении полинуклеотида, кодирующего инсектицидный белок полипептида, причем способ включает получение растения, способного экспрессировать молекулы нуклеиновой кислоты, кодирующие полипептид, из трансформированной растительной клетки, содержащей кассету экспрессии по п. 7, где полипептид обладает фунгицидной активностью против грибковых патогенов Fusarium virguliforme (FVR), Fusarium oxysporum (FOS), Fusarium graminearum (FGR), Colletotrichum graminicola (CGR) и Exserohilum turcicum (ETC) и обладает инсектицидной активностью против насекомого, выбранного из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
25. Способ защиты растения от насекомого-вредителя, включающий экспрессию в растении или его клетке инсектицидно-эффективного количества полипептида по любому из пп. 10-14, где насекомое-вредитель выбрано из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
26. Способ снижения популяции насекомого-вредителя, включающий приведение в контакт популяции насекомого-вредителя с инсектицидно-эффективным количеством полипептида по любому из пп. 10-14, где насекомое-вредитель выбрано из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
27. Способ подавления роста насекомого-вредителя, включающий приведение в контакт насекомого-вредителя с композицией, содержащей инсектицидно-эффективное количество полипептида по любому из пп. 10-14, где насекомое-вредитель выбрано из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
28. Способ снижения популяции насекомого-вредителя, устойчивого к пестицидному белку, включающий приведение в контакт популяции насекомого-вредителя с инсектицидно-эффективным количеством полипептида по любому из пп. 10-14, где насекомое-вредитель выбрано из западного кукурузного жука, соевой совки (SBL, Pseudoplusia includes) и бобовой гусеницы (VBC, Anticarsia gemmatalis).
| BARLOY F | |||
| et al., Cloning and sequencing of three new putative toxin genes from Clostridium bifermentans CH18, Gene, 1998, 12, 211(2), pp.293-299 | |||
| WO 2008142036 A2, 27.11.2008 | |||
| WO 2004002223 A2, 08.01.2004 | |||
| СПОСОБЫ ТРАНСФОРМАЦИИ РАСТЕНИЙ ДЛЯ ЭКСПРЕССИИ ДЕЛЬТА-ЭНДОТОКСИНОВ BACILLUS THURINGIENSIS | 1999 |
|
RU2234531C2 |
Авторы
Даты
2018-09-13—Публикация
2013-07-26—Подача