[0001] Настоящая заявка испрашивает приоритет по предварительной заявке на патент США № 62/652210, поданной 3 апреля 2018 года, полное содержание которой включено в данный документ посредством ссылки.
[0002] Настоящая заявка содержит перечень последовательностей, который был подан в электронном виде в формате с кодировкой ASCII и настоящим включен посредством ссылки во всей своей полноте. Копия указанного файла с кодировкой ASCII, созданная 18 марта 2019 года, имеет название 2019-03-18_01121-0033-00PCT_SL.txt, и ее размер составляет 370862 байта.
[0003] Даже несмотря на многочисленные успехи в области вакцинологии, необходимы новые открытия для защиты людей от многих опасных для жизни инфекционных заболеваний. Многие лицензированные на данный момент вакцины основаны на технологиях десятилетней давности для получения живых аттенуированных или инактивированных убитых патогенов, которые несут в себе проблемы безопасности и во многих случаях стимулируют лишь кратковременные слабые иммунные ответы, что требует введения нескольких доз. Хотя достижения в генетической и биохимической инженерии сделали возможной разработку терапевтических средств для лечения трудноизлечимых заболеваний, эти пути применения в области вакцинологии не были полностью реализованы. Технологии рекомбинантных белков теперь позволяют разработку оптимальных антигенов. Кроме того, наночастицы все чаще демонстрируют потенциал для оптимального представления антигенов и нацеленной доставки лекарственных средств. Было показано, что наночастицы с множественными прикрепленными антигенами обладают повышенной авидностью связывания, обеспечиваемой поливалентным отображением их молекулярных грузов, и способностью более эффективно преодолевать биологические барьеры благодаря их наноскопическому размеру. Ферритиновые наночастицы Helicobacter pylori (H. pylori), слитые с белком, представляющим собой гемагглютинин (HA) вируса гриппа, позволили улучшить стабильность антигена и повысить иммуногенность на мышиных моделях гриппа (см. Kanekiyo et al., Nature 499:102-106 (2013)). Этот слитый белок самоорганизовался в октаэдрически-симметричную наночастицу с 8 тримерными шиповидными отростками из НА с получением устойчивого иммунного ответа в различных доклинических моделях при применении с адъювантом.
[0004] Лайм-боррелиоз представляет собой зоонозное заболевание, вызываемое некоторыми видами бактерий из рода Borrelia, и передается людям и собакам при укусе инфицированного клеща Ixodes spp. Болезнь Лайма является глобальной проблемой общественного здравоохранения, при этом случаи заболевания зарегистрированы в умеренном климате Европы, Северной Америки и Азии. Белок А внешней поверхности (OspA) Borrelia является основным антигеном, вызывающим иммунный ответ. Существует по меньшей мере семь различных серотипов (серотипы 1-7) OspA, которые обнаружены у Borrelia во всем мире. Во всем мире существуют различные геновиды Borrelia, поэтому иммунитет к одному геновиду может не обеспечивать иммунитет к другим бактериям, которые также могут вызывать Лайм-боррелиоз. Кроме того, локализованные ареалы клещей, являющихся носителями Borrelia, означают, что серотип OspA, связанный с болезнью Лайма у пациентов в одном географическом регионе, может не быть связан с болезнью Лайма у пациентов в другом географическом регионе.
[0005] В настоящем документе представлен набор новых полипептидов, наночастиц, композиций, способов и путей применения, включающих полипептиды OspA. Модифицированный полипептид OspA был разработан для обеспечения защиты от инфекции Borrelia с пониженным риском стимуляции аутоиммунной реакции. Кроме того, были разработаны самоадъювантные антигенные полипептиды, включающие полипептид OspA и ферритин, где иммуностимулирующие фрагменты, такие как адъюванты, были непосредственно химически присоединены к антигенному полипептиду. Прямая конъюгация иммуностимулирующего фрагмента с антигенным полипептидом позволяет осуществлять нацеленную совместную доставку иммуностимулирующего фрагмента и полипептида OspA в виде единого макромолекулярного объекта, что может значительно снизить потенциал системной токсичности, которая вызывает опасения в случае традиционных вакцин, которые содержат антигены и иммуностимулирующие молекулы, такие как адъюванты, в виде отдельных молекул. Совместная доставка иммуностимулирующих фрагментов вместе с полипептидами OspA в виде макромолекулярного объекта и их поливалентное представление может также уменьшить общую дозу, необходимую для обеспечения защиты, снижая производственные расходы и затраты.
КРАТКОЕ ОПИСАНИЕ
[0006] Целью настоящего раскрытия является обеспечение композиций, наборов, способов и применений, которые способны обеспечить одно или несколько преимуществ, обсуждаемых выше, или по меньшей мере предоставить общественности полезный выбор. Соответственно, в данном документе раскрыты следующие варианты осуществления.
[0007] Вариант осуществления 1 представляет собой антигенный полипептид на основе последовательности OspA, содержащий полипептид OspA серотипа 1 из Borrelia, где полипептид не содержит последовательность под SEQ ID NO: 77.
[0008] Вариант осуществления 2 представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 1, где полипептид не имеет трансмембранного домена или части трансмембранного домена.
[0009] Вариант осуществления 3 представляет собой антигенный полипептид на основе последовательности OspA по любому из предыдущих вариантов осуществления, где полипептид является нелипидированным.
[0010] Вариант осуществления 4 представляет собой антигенный полипептид на основе последовательности OspA по любому из предыдущих вариантов осуществления, где имеется по меньшей мере одна аминокислотная замена относительно последовательности под SEQ ID NO: 77, где замена снижает идентичность с SEQ ID NO: 78 или является неконсервативной и не приводит к более высокой идентичности с SEQ ID NO: 78.
[0011] Вариант осуществления 5 представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 4, где замена снижает идентичность с SEQ ID NO: 78.
[0012] Вариант осуществления 6 представляет собой антигенный полипептид на основе последовательности OspA по любому из предыдущих вариантов осуществления, где одна или несколько аминокислот из SEQ ID NO: 77 заменены соответствующей(соответствующими) аминокислотой(аминокислотами) из OspA серотипа, отличного от серотипа 1.
[0013] Вариант осуществления 7 представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 6, где OspA серотипа, отличного от серотипа 1, представляет собой OspA серотипа 2, 3, 4, 5, 6 или 7.
[0014] Вариант осуществления 8 представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 6, где каждая из аминокислот из SEQ ID NO: 77 заменена соответствующими аминокислотами из OspA серотипа 2, 3, 4, 5, 6 или 7.
[0015] Вариант осуществления 9 представляет собой антигенный полипептид на основе последовательности OspA по любому из предыдущих вариантов осуществления, где полипептид дополнительно содержит модификацию для снижения или устранения гликозилирования.
[0016] Вариант осуществления 10 представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 9, где модификация включает замену по меньшей мере одного аспарагина.
[0017] Вариант осуществления 11 представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 10, где по меньшей мере один аспарагин включает любой один, два, три или более из N71, N190, N202 и N251 из OspA серотипа 1.
[0018] Вариант осуществления 12 представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 11, где по меньшей мере один аспарагин включает N71, N190, N202 и N251 из OspA серотипа 1.
[0019] Вариант осуществления 13 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 10-12, где один или несколько аспарагинов заменены глутамином.
[0020] Вариант осуществления 14 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 10-13, где полипептид не имеет сайта N-гликозилирования.
[0021] Вариант осуществления 15 представляет собой антигенный полипептид на основе последовательности OspA по любому из предыдущих вариантов осуществления, где OspA получен из Borrelia burgdorferi, Borrelia mayonii, Borrelia afzelii, Borrelia garinii или Borrelia bavariensis.
[0022] Вариант осуществления 16 представляет собой антигенный полипептид на основе последовательности OspA по любому из предыдущих вариантов осуществления, содержащий последовательность с по меньшей мере 85%, 90%, 95%, 97%, 98%, 99%, 99,5% или 100% идентичностью с последовательностью под любым из SEQ ID NO: 1, 3, 4 или 53.
[0023] Вариант осуществления 17 представляет собой антигенный полипептид на основе последовательности OspA по любому из предыдущих вариантов осуществления, содержащий последовательность под любым из SEQ ID NO: 1-10 или 12-76.
[0024] Вариант осуществления 18 представляет собой антигенный полипептид на основе последовательности OspA по любому из предыдущих вариантов осуществления, включающий эктодомен OspA.
[0025] Вариант осуществления 19 представляет собой антигенный полипептид на основе последовательности OspA по любому из предыдущих вариантов осуществления, содержащий последовательность с по меньшей мере 85%, 90%, 95%, 97%, 98%, 99%, 99,5% или 100% идентичностью с последовательностью под любым из SEQ ID NO: 94-102.
[0026] Вариант осуществления 20 представляет собой антигенный полипептид на основе последовательности OspA по любому из предыдущих вариантов осуществления, дополнительно включающий белок ферритин.
[0027] Вариант осуществления 21 представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 20, где ферритин содержит мутацию с заменой экспонированной на поверхности аминокислоты на цистеин.
[0028] Вариант осуществления 22 представляет собой антигенный полипептид на основе последовательности OspA, содержащий полипептид OspA и ферритин, где ферритин содержит мутацию с заменой экспонированной на поверхности аминокислоты на цистеин.
[0029] Вариант осуществления 23 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 20-22, где ферритин содержит одну или несколько из мутаций E12C, S26C, S72C, A75C, K79C, S100C и S111C ферритина из H. pylori или одну или несколько соответствующих мутаций в ферритине, отличном от ферритина из H. pylori, как определено посредством попарного или структурного выравнивания.
[0030] Вариант осуществления 24 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 20-22, где ферритин включает мутацию E12C ферритина из H. pylori или соответствующую мутацию в ферритине, отличном от ферритина из H. pylori, как определено посредством попарного или структурного выравнивания.
[0031] Вариант осуществления 25 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 20-22, где ферритин включает мутацию S26C ферритина из H. pylori или соответствующую мутацию в ферритине, отличном от ферритина из H. pylori, как определено посредством попарного или структурного выравнивания.
[0032] Вариант осуществления 26 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 20-22, где ферритин включает мутацию S72C ферритина из H. pylori или соответствующую мутацию в ферритине, отличном от ферритина из H. pylori, как определено посредством попарного или структурного выравнивания.
[0033] Вариант осуществления 27 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 20-22, где ферритин включает мутацию A75C ферритина из H. pylori или соответствующую мутацию в ферритине, отличном от ферритина из H. pylori, как определено посредством попарного или структурного выравнивания.
[0034] Вариант осуществления 28 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 20-22, где ферритин включает мутацию K79C ферритина из H. pylori или соответствующую мутацию в ферритине, отличном от ферритина из H. pylori, как определено посредством попарного или структурного выравнивания.
[0035] Вариант осуществления 29 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 20-22, где ферритин включает мутацию S100C ферритина из H. pylori или соответствующую мутацию в ферритине, отличном от ферритина из H. pylori, как определено посредством попарного или структурного выравнивания.
[0036] Вариант осуществления 30 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 20-22, где ферритин включает мутацию S111C ферритина из H. pylori или соответствующую мутацию в ферритине, отличном от ферритина из H. pylori, как определено посредством попарного или структурного выравнивания.
[0037] Вариант осуществления 31 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 20-30, включающий один или несколько иммуностимулирующих фрагментов, связанных с ферритином посредством экспонированной на поверхности аминокислоты, где необязательно экспонированная на поверхности аминокислота представляет собой цистеин, полученный в результате мутации.
[0038] Вариант осуществления 31a представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 31, где иммуностимулирующий фрагмент является агонистом TLR2, где необязательно агонист представляет собой PAM2CSK4, FSL-1 или PAM3CSK4.
[0039] Вариант осуществления 31b представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 31, где иммуностимулирующий фрагмент является агонистом TLR7/8, где необязательно агонист представляет собой однонитевую РНК, имидазохинолин, аналог нуклеозида, 3M-012 или SM7/8a.
[0040] Вариант осуществления 31c представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 31, где иммуностимулирующий фрагмент является агонистом TLR9, где необязательно агонист представляет собой олигодезоксинуклеотид (ODN) CpH, ODN, содержащий один или несколько 6-мерных мотивов CpG, содержащих 5'-пурин (Pu)-пиримидин (Py)-C-G-Py-Pu 3', ODN, содержащий последовательность под SEQ ID NO: 210, или ISS-1018.
[0041] Вариант осуществления 31d представляет собой белок ферритин по варианту осуществления 31c, где агонист TLR9 включает остов, содержащий фосфоротиоатные связи.
[0042] Вариант осуществления 31e представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 31, где иммуностимулирующий фрагмент является агонистом STING, где необязательно агонист представляет собой циклический динуклеотид (CDN), cdA, cdG, cAMP-cGMP и 2'-5',3'-5' cGAMP или DMXAA.
[0043] Вариант осуществления 32 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 20-31e, где ферритин содержит мутацию с заменой экспонированного на поверхности аспарагина на отличную от аспарагина аминокислоту, где необязательно аспарагин находится в положении 19 ферритина из H. pylori или в аналогичном положении в ферритине, отличном от ферритина из H. pylori, как определено посредством попарного или структурного выравнивания.
[0044] Вариант осуществления 33 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 20-32, где ферритин содержит мутацию с заменой внутреннего цистеина на отличную от цистеина аминокислоту, где необязательно внутренний цистеин находится в положении 31 ферритина из H. pylori или в положении, которое соответствует положению 31 ферритина из H. pylori, как определено посредством парного или структурного выравнивания.
[0045] Вариант осуществления 34 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 20-33, где антигенный полипептид на основе последовательности OspA содержит пептидный линкер между полипептидом OspA и ферритином.
[0046] Вариант осуществления 35 представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 34, где пептидный линкер является N-концевым по отношению к ферритину.
[0047] Вариант осуществления 35a представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 34, где пептидный линкер является C-концевым по отношению к ферритину.
[0048] Вариант осуществления 36 представляет собой антигенный полипептид на основе последовательности OspA по любому из предыдущих вариантов осуществления, где ферритин включает аминокислотную последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с любой из SEQ ID NO: 201-207 или 211-215.
[0049] Вариант осуществления 36a представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 36, включающий аминокислотную последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с любой из SEQ ID NO: 201.
[0050] Вариант осуществления 36b представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 36, включающий аминокислотную последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с любой из SEQ ID NO: 202.
[0051] Вариант осуществления 36c представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 36, включающий аминокислотную последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с любой из SEQ ID NO: 203.
[0052] Вариант осуществления 36d представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 36, включающий аминокислотную последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с SEQ ID NO: 215.
[0053] Вариант осуществления 36e представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 36, включающий аминокислотную последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с SEQ ID NO: 204.
[0054] Вариант осуществления 36f представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 36, включающий аминокислотную последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с SEQ ID NO: 205.
[0055] Вариант осуществления 36g представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 36, включающий аминокислотную последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с SEQ ID NO: 206.
[0056] Вариант осуществления 36h представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 36, включающий аминокислотную последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с SEQ ID NO: 207.
[0057] Вариант осуществления 36i представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 36, включающий аминокислотную последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с SEQ ID NO: 211.
[0058] Вариант осуществления 36j представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 36, включающий аминокислотную последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с SEQ ID NO: 212.
[0059] Вариант осуществления 36k представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 36, включающий аминокислотную последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с SEQ ID NO: 213.
[0060] Вариант осуществления 36l представляет собой антигенный полипептид на основе последовательности OspA по варианту осуществления 36, включающий аминокислотную последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с SEQ ID NO: 214.
[0061] Вариант осуществления 37 представляет собой ферритиновую частицу, содержащую антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 20-36l.
[0062] Вариант осуществления 38 представляет собой антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 1-19, дополнительно включающий белок лумазинсинтазу.
[0063] Вариант осуществления 39 представляет собой лумазинсинтазную частицу, содержащую антигенный полипептид на основе последовательности OspA по варианту осуществления 38.
[0064] Вариант осуществления 40 представляет собой композицию, содержащую антигенный полипептид на основе последовательности OspA, ферритиновую частицу или лумазинсинтазную частицу по любому из предыдущих вариантов осуществления, дополнительно содержащую фармацевтически приемлемый носитель.
[0065] Вариант осуществления 41 представляет собой композицию по варианту осуществления 40, дополнительно содержащую адъювант, где необязательно адъювант представляет собой AF03.
[0066] Вариант осуществления 42 представляет собой композицию по варианту осуществления 40 или 41, которая содержит первый и второй антигенный полипептид на основе последовательности OspA, где первый и второй антигенные полипептиды на основе последовательности OspA включают полипептиды OspA различных серотипов.
[0067] Вариант осуществления 43 представляет собой композицию по варианту осуществления 42, содержащую один, два, три, четыре, пять, шесть или семь антигенных полипептидов на основе последовательности OspA, выбранных из антигенного полипептида на основе последовательности OspA, содержащего полипептид OspA серотипа 1; антигенного полипептида на основе последовательности OspA, содержащего полипептид OspA серотипа 2; антигенного полипептида на основе последовательности OspA, содержащего полипептид OspA серотипа 3; антигенного полипептида на основе последовательности OspA, содержащего полипептид OspA серотипа 4; антигенного полипептида на основе последовательности OspA, содержащего полипептид OspA серотипа 5; антигенного полипептида на основе последовательности OspA, содержащего полипептид OspA серотипа 6; и антигенного полипептида на основе последовательности OspA, содержащего полипептид OspA серотипа 7.
[0068] Вариант осуществления 44 представляет собой композицию по варианту осуществления 43, содержащую антигенный полипептид на основе последовательности OspA, содержащий полипептид OspA серотипа 1; антигенный полипептид на основе последовательности OspA, содержащий полипептид OspA серотипа 2; антигенный полипептид на основе последовательности OspA, содержащий полипептид OspA серотипа 3; антигенный полипептид на основе последовательности OspA, содержащий полипептид OspA серотипа 4; антигенный полипептид на основе последовательности OspA, содержащий полипептид OspA серотипа 5; и антигенный полипептид на основе последовательности OspA, содержащий полипептид OspA серотипа 7.
[0069] Вариант осуществления 45 представляет собой антигенный полипептид на основе последовательности OspA, ферритиновую частицу, лумазинсинтазную частицу или композицию по любому из вариантов осуществления 1-44 для применения в способе индукции иммунного ответа в отношении Borrelia или для защиты субъекта от болезни Лайма.
[0070] Вариант осуществления 46 представляет собой способ индукции иммунного ответа в отношении Borrelia или защиты субъекта от болезни Лайма, включающий введение субъекту любого одного или нескольких из антигенного полипептида на основе последовательности OspA, ферритиновой частицы, лумазинсинтазной частицы или композиции по любому из вариантов осуществления 1-44.
[0071] Вариант осуществления 47 представляет собой антигенный полипептид на основе последовательности OspA, ферритиновую частицу, лумазинсинтазную частицу, композицию или способ по любому из вариантов осуществления 45-46, где субъект является человеком.
[0072] Вариант осуществления 47a представляет собой антигенный полипептид на основе последовательности OspA, ферритиновую частицу, лумазинсинтазную частицу, композицию или способ по любому из вариантов осуществления 45-46, где субъект представляет собой млекопитающее, где необязательно млекопитающее является приматом или одомашненным млекопитающим, где дополнительно необязательно примат представляет собой отличного от человека примата, обезьяну, макака, макака-резуса или яванского макака, или человекообразную обезьяну, или одомашненное млекопитающее представляет собой собаку, кролика, кота, лошадь, овцу, корову, козу, верблюда или осла.
[0073] Вариант осуществления 48 представляет собой набор, содержащий любой один или несколько из антигенного полипептида на основе последовательности OspA, ферритиновой частицы, лумазинсинтазной частицы и композиций по вариантам осуществления 1-44, необязательно с инструкциями по применению для иммунизации субъектов против болезни Лайма.
[0074] Вариант осуществления 49 представляет собой нуклеиновую кислоту, кодирующую антигенный полипептид на основе последовательности OspA по любому из вариантов осуществления 1-36l, где необязательно нуклеиновая кислота представляет собой РНК.
[0075] Дополнительные цели и преимущества будут частично изложены в последующем описании и частично будут понятны из описания, или их можно будет установить при осуществлении на практике. Цели и преимущества будут реализованы и достигнуты посредством элементов и комбинаций, конкретно указанных в прилагаемой формуле изобретения.
[0076] Следует понимать, что как предшествующее общее описание, так и следующее подробное описание являются лишь иллюстративными и пояснительными и не ограничивают формулу изобретения.
[0077] В прилагаемых графических материалах, которые включены в настоящее описание и составляют его часть, проиллюстрированы несколько вариантов осуществления, и вместе с описанием они служат для объяснения принципов, описанных в данном документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0078] На фиг. 1A-1D показаны иллюстративные схемы наночастиц OspA-ферритин. Фиг. 1A. OspA генетически слит с ферритином с образованием слитого белка. Последовательности OspA и ферритина разделены глицин-сериновым линкером (-GS-). Фиг. 1B. Показана структура эктодомена OspA. С-конец, где OspA присоединяется к ферритину, обозначен звездочкой. Фиг. 1C. Иллюстративная ферритиновая наночастица, состоящая из 24 мономеров ферритина из H. pylori. Фиг. 1D. Иллюстративная наночастица слитого белка OspA-ферритин. Показаны ферритин (светло-серый), расположение глицин-серинового линкера (GS) и OspA (темно-серый и черный) (n: количество субъединиц).
[0079] На фиг. 2A-2D показаны экспрессия и очистка иллюстративных наночастиц OspA-ферритин. Фиг. 2A. Профиль эксклюзионной хроматографии (SEC) иллюстративной наночастицы OspA-ферритин, очищенной на колонке с суперозой 6. Фиг. 2B. Гель для SDS-PAGE с очищенными иллюстративными наночастицами OspA-ферритин из клеток линии Expi293. Фиг. 2C. Профиль динамического светорассеяния (DLS) иллюстративных наночастиц OspA-ферритин. Радиус составляет 13 нм, %Pd (мера нормализованной полидисперсности) составляет 7,4, а масса составляет 100%. Фиг. 2D. Составное изображение иллюстративной наночастицы OspA-ферритин, построенное на основе усреднения по классу микрофотографий 318 частиц, полученных с помощью трансмиссионного электронного микроскопа при 67000-кратном увеличении. Ферритиновые наночастицы выглядят под трансмиссионным электронным микроскопом как концентрированное кольцеобразное уплотнение с полым центром. Каждая наночастица окружена множеством коротких форм, соответствующих OspA, которые выглядят округлыми или слегка продолговатыми.
[0080] На фиг. 3A-3B показано образование наночастиц OspA альтернативного серотипа в E. coli. Фиг. 3A. Биохимический анализ с помощью SDS-PAGE наночастиц OspA-ферритин серотипов 1-5 и 7, очищенных с помощью эксклюзионной хроматографии. Фиг. 3B. Трансмиссионная электронная микроскопия наночастиц OspA-ферритин серотипов 1-5 и 7 (98000x).
[0081] На фиг. 4 показано сравнение иммуногенности и устойчивости иллюстративных наночастиц OspA-ферритин серотипа 1 с RECOMBITEK® Lyme (жидкая суспензия очищенного белка A внешней поверхности (OspA) Borrelia burgdorferi). Мышей линии C3H (n=5) иммунизировали внутримышечно с помощью 1 мкг наночастиц OspA-ферритин+адъювант Ribi (Sigma adjuvant system, № по каталогу S6322-1vl) или RECOMBITEK® Lyme на неделе 0 и неделе 4. Ответ с образованием антител оценивали посредством измерения титров в конечной точке с помощью ELISA через 2 недели после 2-ой иммунизации (неделя 6) и через 21 неделю после 2-ой иммунизации (неделя 25) каждой композицией.
[0082] На фиг. 5A-5C представлена информация, относящаяся к иллюстративным наночастицам OspA-ферритин, где полипептид OspA модифицирован по эпитопу OspA серотипа 1, который характеризуется гомологией с фрагментом последовательности человеческого функционально-ассоциированного антигена-1 лейкоцитов (hLFA-1). Фиг 5A. Структура, демонстрирующая расположение сайта гомологии с LFA-1 (аминокислоты 165-173 из SEQ ID NO: 83) в пределах эктодомена OspA. Фиг. 5B. Дендрограмма, демонстрирующая взаимосвязь аминокислот OspA 165-173 из SEQ ID NO: 83 (OspA B. burgdorferi серотипа 1) с соответствующими последовательностями в hLFA-1 и других видов и серотипов Borrelia. Фиг. 5C. Сегмент из девяти аминокислот (нонапептид) по аминокислотам 165-173 из SEQ ID NO: 83 (отмечен как "OspA") сравнивается с соответствующими нонапептидами из OspA серотипа 2 и серотипа 3 ("S2" (SEQ ID NO: 79) и "S3" (SEQ ID NO: 80) соответственно), рационально разработанным заменяющим нонапептидом ("RD2"; SEQ ID NO: 81) и соответствующим нонапептидом из hLFA-1 (SEQ ID NO: 78). На фиг. 5C раскрыты SEQ ID NO 77, 79-81 и 78 соответственно в порядке встречаемости. Фиг. 5D. Мышей линии C3H (n=5) иммунизировали внутримышечно (IM) на неделе 0 и неделе 4 с дозами наночастиц OspA серотипа 1-ферритин, составляющими 1 мкг, с адъювантом AddaVaxTM (наноэмульсия типа масло-в-воде на основе сквалена; доступна в InvivoGen, № по каталогу vac-adx-10). Последовательность OspА включала сайт гомологии с hLFA-1 дикого типа (т.е. аминокислоты 165-173 из SEQ ID NO: 83; "Sero1") или заменяющей последовательностью следующим образом: SEQ ID NO: 81 ("RD"); SEQ ID NO: 80 ("замена Sero 3"); SEQ ID NO: 79 ("замена Sero 2"). Ответ с образованием антител оценивали по титру в конечной точке, измеренному с помощью ELISA через 2 недели после 2-ой иммунизации указанными конструкциями.
[0083] На фиг. 6A-6B представлена информация, относящаяся к иллюстративным наночастицам OspA-ферритин, конъюгированным с иллюстративным иммуностимулирующим фрагментом: агонистом TLR 7/8 (3M-012). Фиг. 6A. Применяли стратегию 2-стадийной клик-химии для присоединения 3M-012 к ферритину. DBCO-PEG4-малеимидный линкер сначала присоединяли к экспонированному на поверхности цистеину на ферритине. После удаления избытка линкера добавляли азид-3M-012. Фиг. 6B. Мышей линии C3H (n=5) иммунизировали внутримышечно с помощью 1 мкг указанной композиции на неделях 0 и 4 и анализировали через 2 недели. "Конъюгат" означает конъюгированную наночастицу OspA-ферритин-3M-012. "Добавка" означает неконъюгированную смесь одних и тех же наночастиц OspA-ферритин, вводимых с 29 нг или 20 мкг 3M-012 или алюминиевых квасцов. 29 нг "добавленной" смеси наночастиц OspA-ферритин и 3M-012 представляют собой молярный эквивалент количества 3M-012 на конъюгированной наночастице.
[0084] На фиг. 7A-7C представлена информация, относящаяся к иллюстративным наночастицам OspA-ферритин, конъюгированным с иллюстративным иммуностимулирующим фрагментом: ISS-1018 CpG (SEQ ID NO: 210). Фиг. 7A. Применяли стратегию 2-стадийной клик-химии для присоединения CPG к ферритину. DBCO-PEG4-малеимидный линкер сначала присоединяли к экспонированному на поверхности цистеину на ферритине. После удаления избытка линкера добавляли азид-CpG. На фиг. 7A раскрыта SEQ ID NO: 228. Фиг. 7B. Биохимический анализ CpG-конъюгации с помощью SDS-PAGE в геле демонстрирует изменение молекулярного веса после конъюгации с CpG с 92% наночастиц OspA-ферритин, конъюгированных с CpG. Фиг. 7C. Мышей линии C3H (n=5) иммунизировали внутримышечно с помощью 1 мкг указанной композиции и на неделях 0 и 4 и анализировали через 2 недели. "Конъюгат" означает конъюгированную наночастицу OspA-ферритин-CPG. "Добавка" означает неконъюгированную смесь одних и тех же наночастиц OspA-ферритин, вводимых с 339 нг или 50 мкг CpG или алюминиевых квасцов. 339 нг "добавленной" смеси наночастиц OspA-ферритин и CPG представляют собой молярный эквивалент количества CpG на конъюгированной наночастице.
[0085] На фиг. 8A-8F сравниваются ответы с образованием антител на серотип 1 (фиг. 8A), серотип 2 (фиг. 8B), серотип 3 (фиг. 8C), серотип 4 (фиг. 8D), серотип 5 (фиг. 8E) и серотип 7 (фиг. 8F) после введения моновалентных соответствующих по серотипу наночастиц OspA-ферритин (1 мкг на дозу) ("моновалентных") с адъювантом, представляющим собой алюминиевые квасцы, или гексавалентной композиции, содержащей каждый из типов частиц, содержащих OspA серотипа 1-ферритин, OspA серотипа 2-ферритин, OspA серотипа 3-ферритин, OspA серотипа 4-ферритин, OspA серотипа 5-ферритин и OspA серотипа 7-ферритин по 1 мкг каждого на дозу с адъювантом Alum ("гексавалентным"). Мышей линии C3H (n=5) иммунизировали внутримышечно на неделях 0 и 4 и ответ с образованием антител оценивали по титру в конечной точке, измеренному с помощью ELISA через 2 недели. Планшеты для ELISA покрывали белком OspA конкретного серотипа.
[0086] На фиг. 9A-9G показаны ответы с образованием антител у мышей на серотип 1 (фиг. 9A), серотип 2 (фиг. 9B), серотип 3 (фиг. 9C), серотип 4 (фиг. 9D), серотип 5 (фиг. 9E), серотип 6 (фиг. 9F) и серотип 7 (фиг. 9G), наблюдаемые у мышей после введения конъюгированных и неконъюгированных гексавалентных композиций на основе наночастиц OspA-ферритин. Гексавалентные композиции содержали каждый из типов наночастиц, содержащих OspA серотипа 1-ферритин, OspA серотипа 2-ферритин, OspA серотипа 3-ферритин, OspA серотипа 4-ферритин, OspA серотипа 5-ферритин и OspA серотипа 7-ферритин, как описано для фиг. 8A-F, за исключением того, что "гексавалентная наночастица-CPG" и "гексавалентная наночастица-3M-012" означают, что наночастицы были химически конъюгированы с CPG и 3M-012 (см. фиг. 7A и 6A и прилагаемое описание). Ответ с образованием антител оценивали по титру в конечной точке, измеренному с помощью ELISA через 2 недели. Планшеты для ELISA покрывали белком OspA конкретного серотипа.
[0087] На фиг. 10A-10G показаны ответы с образованием антител на серотипы 1-7 соответственно у обезьян-резусов (n=3 на группу) на гексавалентные композиции на основе наночастиц OspA-ферритин, которые были описаны для фиг. 9A-G, за исключением того, что дозы составляли в целом 60 мкг (10 мкг каждого серотипа) и содержали неконъюгированный адъювант AF03. Обезьян иммунизировали внутримышечно на неделе 0 и неделе 6. Ответ с образованием антител анализировали через 2 недели после иммунизации по титру в конечной точке, измеренному с помощью ELISA. RECOMBITEK® Lyme применяли в качестве эталона для сравнения при дозе 10 мкг. Для всех экспериментов планшет для ELISA покрывали белком OspA серотипа, указанного на каждой панели.
[0088] На фиг. 10H-10N показаны ответы с образованием антител на серотипы 1-7 соответственно у обезьян-резусов (n=3 на группу) на гексавалентные композиции на основе наночастиц OspA-ферритин, которые были описаны для фиг. 10A-G, за исключением того, что адъювант AF03 не применяли и наночастицы вместо этого конъюгировали с 3M-012 или CpG (см. фиг. 6A и 7A и прилагаемое описание). Дозы в целом составляли 60 мкг (10 мкг каждого серотипа). Обезьян иммунизировали внутримышечно на неделе 0 и неделе 6. Ответ с образованием антител анализировали через 2 недели после иммунизации по титру в конечной точке, измеренному с помощью ELISA. Для всех экспериментов планшет для ELISA покрывали белком OspA серотипа, указанного на каждой панели.
[0089] На фиг. 11 показаны результаты тестирования композиций на основе конъюгированных с 3M-012 наночастиц OspA-ферритин при заражении клещом. Мышей иммунизировали дозой указанных композиций, составляющей 1 мкг, на неделе 0 и неделе 4. Моновалентная композиция содержала 1 мкг наночастиц OspA-ферритин серотипа 1, конъюгированных с 3M-012. Композиция на основе "гексавалентной наночастицы-3M-012" была такой, как описано для фиг. 9A-G. Контрольная частица не содержала полипептид OspA. Мышей заражали 5-6 клещами, инфицированными штаммом N40 Borrelia burgdorferi (серотип 1), в течение 5 суток через две недели после второй иммунизации и умерщвляли через две недели. Образцы тканей из сердца, голеностопного сустава и уха культивировали в среде BSK с антибиотиками против B. burgdorferi в течение 6 недель. Отрицательные в отношении инфекции образцы тестировали с помощью ПЦР в отношении присутствия B. burgdorferi. Положительный в отношении инфекции образец был положительным либо по культуре, либо по ПЦР.
[0090] На фиг. 12 представлено подтверждение конъюгации наночастиц OspA-ферритин с агонистом TLR 7/8 3M-012 с помощью масс-спектрометрии. На верхней панели показаны неконъюгированные, а на нижней панели показаны конъюгированные конструкции. Данные демонстрируют изменение массы на 586,69 Да, что соответствует добавлению 3M-012.
[0091] На фиг. 13 показан ответ с образованием антител у мышей на негликозилированный мутантный OspA-ферритин (NG-RD) по сравнению с гликозилированным аналогом (RD), измеренный с помощью ELISA в серии разбавлений, как показано. RD=SEQ ID NO: 52. NG-RD=SEQ ID NO: 53. Мышей вакцинировали дозами, составляющими 1 мкг, на неделе ноль и неделе 4.
[0092] На фиг. 14 показан ответ с образованием антител у мышей на OspA-ферритин (SEQ ID NO: 52). Мутантный по гликозилированию OspA-ферритин N>Q (SEQ ID NO: 53) и мутантный по гликозилированию OspA-ферритин S/T>A (SEQ ID NO: 63) сравнивали с RECOMBITEK® Lyme и отрицательными (преиммунными) контролями, как измерено с помощью ELISA в серии разбавлений, как показано.
[0093] На фиг. 15A-15E показана очистка и характеристика конструкций OspA, содержащих различные линкеры (GS, линкер Gly-Ser; GS1, линкер Gly-Gly-Gly-Ser (SEQ ID NO: 226); GS2, линкер под SEQ ID NO: 91; GS5, линкер под SEQ ID NO: 92; последовательности конструкций представляли собой SEQ ID NO: 53 и 60-62, соответственно). Фиг 15A. Окрашивание с помощью кумасси очищенных конструкций OspA, содержащих указанные линкеры. На фиг. 15A раскрыты SEQ ID NO 226 и 91-92 соответственно, в порядке встречаемости. Фиг. 15B. Динамическое светорассеяние (DLS) наночастицы OspA-ферритин, содержащей GS1 (SEQ ID NO: 60). Фиг. 15C. DLS наночастицы OspA-ферритин, содержащей GS2 (SEQ ID NO: 61). Фиг. 15D. Электронная микрофотография (EM) наночастицы OspA-ферритин, содержащей GS5 (SEQ ID NO: 62). Фиг. 15E. DLS наночастицы OspA-ферритин, содержащей GS5 (SEQ ID NO: 62).
[0094] На фиг. 16 показан ответ с образованием антител у мышей на конструкции OspA-ферритин, содержащие различные линкеры (конструкция с линкером 1X GGGS (SEQ ID NO: 226), SEQ ID NO: 60; конструкция с линкером 2x GGGS (SEQ ID NO: 91), SEQ ID NO: 61; конструкция с линкером 5X GGGS (SEQ ID NO: 92), SEQ ID NO: 62), по сравнению с RECOMBITEK® Lyme и отрицательными (преиммунными) контролями, как измерено с помощью ELISA в серии разбавлений, как показано.
[0095] На фиг. 17A-17C показана характеристика конструкции лумазинсинтаза-OspA серотипа 4 (SEQ ID NO: 18). Фиг 17A. Данные DLS. Фиг. 17B. Гель с кумасси указанных фракций 22-64 при эксклюзионной хроматографии следовых количеств (SEC). Фиг. 17C. Данные EM.
[0096] На фиг. 18 показан ответ с образованием антител у мышей на конструкцию OspA серотипа 4-ферритин (SEQ ID NO: 4) и конструкцию OspA серотипа 4-лумазинсинтаза (SEQ ID NO: 18) с алюминиевыми квасцами или без них.
[0097] На фиг. 19A-19C показана характеристика конструкции OspA серотипа 1-лумазинсинтаза (SEQ ID NO: 12). Фиг 19A. Данные EM. Фиг. 19B. Гель с кумасси указанных фракций 20-40 при SEC следовых количеств. Фиг. 19C. Данные DLS.
[0098] На фиг. 20A-20C показана характеристика конструкции OspA серотипа 2-лумазинсинтаза (SEQ ID NO: 16). Фиг 20A. Данные EM. Фиг. 20B. Гель с кумасси указанных фракций 27-56 при SEC следовых количеств. Фиг. 20C. Данные DLS.
[0099] На фиг. 21A-21B показана характеристика конструкции OspA серотипа 3-лумазинсинтаза (SEQ ID NO: 17). Фиг 21A. Гель с кумасси указанных фракций 23-39 при SEC следовых количеств. Фиг. 21B. Данные DLS.
[00100] На фиг. 22A-22C показана характеристика конструкции OspA серотипа 5-лумазинсинтаза (SEQ ID NO: 19). Фиг 22A. Данные EM. Фиг. 22B. Гель с кумасси указанных фракций 22-38 при SEC следовых количеств. Фиг. 22C. Данные DLS.
[00101] На фиг. 23A-23C показана характеристика конструкции OspA серотипа 7-лумазинсинтаза (SEQ ID NO: 21). Фиг 23A. Данные EM. Фиг. 23B. Гель с кумасси указанных фракций 20-38 при SEC следовых количеств. Фиг. 23C. Данные DLS.
[00102] На фиг. 24A-24G показаны ответы с образованием антител на серотипы 1-7 соответственно у мышей линии C3H (n=5 на группу) на гептавалентные композиции на основе наночастиц OspA-ферритин по 1 мкг каждого типа наночастиц OspA-ферритин, соответствующих серотипам 1-7 OspA (в целом 7 мкг), к которым в качестве адъюванта были добавлены либо алюминиевые квасцы, либо AF03, или на RECOMBITEK® Lyme. Для всех экспериментов планшет для ELISA покрывали белком OspA серотипа, указанного на каждой панели как "S X", где X представляет собой номер серотипа.
[00103] На фиг. 25 показана динамика титра антител в конечной точке у обезьян-резусов. Обезьян иммунизировали внутримышечно на неделе 0 и неделе 6 либо гексавалентной вакциной OspA-ферритин (содержащей OspA серотипов 1, 2, 3, 4, 5 и 7 в отдельных наночастицах) с адъювантом AF03, либо RECOMBITEK®. Планшет для ELISA покрывали белком OspA серотипа 1.
ПОДРОБНОЕ ОПИСАНИЕ
[00104] В данном документе предусмотрены новые антигены для вакцинации против болезни Лайма. Болезнь Лайма вызывают бактерии, принадлежащие комплексу Borrelia burgdorferi sensu lato (s.l.) (в данном документе называемые "Borrelia"). Антигены, описанные в данном документе, включают антигенные полипептиды, слитые белки, наночастицы и композиции, которые можно применять как таковые или с неконъюгированным адъювантом для вакцинации субъектов против болезни Лайма. Слитые белки могут включать антигенные полипептиды, слитые с ферритином. Ферритин может представлять собой ферритин дикого типа или может включать одну или несколько мутаций, например, мутацию с заменой экспонированной на поверхности аминокислоты на цистеин таким образом, что иммуностимулирующие фрагменты могут быть непосредственно конъюгированы со сконструированным экспонированным на поверхности цистеином. Цистеин, полученный в результате такой мутации способен устранять или снижать потребность в отдельно вводимом адъюванте, а также потенциально снижать количество адъюванта/иммуностимулирующего фрагмента, необходимого, чтобы вызвать иммунный ответ на антиген. Также предусмотрены нуклеиновые кислоты, которые кодируют антигенные полипептиды, описанные в данном документе.
Определения
[00105] Применяемый в данном документе термин "адъювант" относится к веществу или среде-носителю, которые неспецифически усиливают иммунный ответ на антиген. Адъюванты могут включать без ограничения суспензию минералов (например, алюминиевые квасцы, гидроксид алюминия или фосфат), на которых адсорбируется антиген; эмульсию типа вода-в-масле или масло-в-воде, в которой раствор антигена эмульгируется в минеральном масле или в воде (например, неполный адъювант Фрейнда). Иногда включают убитые микобактерии (например, полный адъювант Фрейнда) для дополнительного усиления антигенности. В качестве адъювантов также можно применять иммуностимулирующие олигонуклеотиды (например, см. патенты США №№ 6194388, 6207646, 6214806, 6218371, 6239116, 6339068, 6406705 и 6429199). Адъюванты также могут включать биологические молекулы, такие как агонисты Toll-подобного рецептора (TLR) и костимулирующие молекулы. Адъювант можно вводить в виде отдельной молекулы в композиции или ковалентно связанным (конъюгированным) с модифицированным ферритином или антигенным полипептидом на основе последовательности ферритина.
[00106] Применяемый в данном документе термин "антиген" относится к средству, которое вызывает иммунный ответ, и/или к средству, связываемому Т-клеточным рецептором (например, когда оно представляется с помощью молекулы МНС) или антителом (например, продуцируемым В-клеткой) при экспонировании или введении в организм. В некоторых вариантах осуществления антиген вызывает гуморальный ответ (например, включающий образование антигенспецифических антител) в организме. В качестве альтернативы или дополнительно, в некоторых вариантах осуществления антиген вызывает клеточный ответ (например, с участием T-клеток, рецепторы которых специфически взаимодействуют с антигеном) в организме. Конкретный антиген может вызывать иммунный ответ у одного или нескольких представителей целевого организма (например, мышей, кроликов, приматов, людей), но не у всех представителей вида целевого организма. В некоторых вариантах осуществления антиген вызывает иммунный ответ у по меньшей мере приблизительно 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% представителей вида целевого организма. В некоторых вариантах осуществления антиген связывается с антителом и/или Т-клеточным рецептором и может индуцировать или не индуцировать конкретный физиологический ответ в организме. В некоторых вариантах осуществления, например, антиген может связываться с антителом и/или с Т-клеточным рецептором in vitro, независимо от того, происходит ли такое взаимодействие in vivo. В некоторых вариантах осуществления антиген реагирует с продуктами специфического гуморального или клеточного иммунитета, в том числе с индуцируемыми гетерологичными иммуногенами. Антигены включают антигенные белки-ферритины, включающие полипептид ферритина (например, включающий одну или несколько мутаций) и полипептид не на основе ферритина, описанные в данном документе.
[00107] Применяемые в данном документе термины "ферритин" или "белок ферритин" относятся к белку с выявляемой идентичностью последовательности с ферритином из H. pylori (SEQ ID NO: 208 или 209) или другим ферритином, обсуждаемым в данном документе, таким как ферритин P. furiosus, ферритин Trichoplusia ni или человеческий ферритин, который служит для хранения железа, например, внутриклеточно или в тканях, или для переноса железа в кровотоке. Такие иллюстративные ферритины, в том числе те, которые встречаются в виде двух полипептидных цепей, известные как тяжелая и легкая цепи (например, ферритин T. ni и человеческий ферритин), подробно обсуждаются ниже. В некоторых вариантах осуществления ферритин включает последовательность с по меньшей мере 15%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или 99,5% идентичностью с последовательностью ферритина, раскрытой в данном документе, например, в таблице 1 (таблица последовательностей). Ферритин может представлять собой фрагмент полноразмерной встречающейся в природе последовательности. Применяемый в данном документе термин "ферритин дикого типа" относится к ферритину, последовательность которого состоит из встречающейся в природе последовательности. Ферритины также включают полноразмерный ферритин или фрагмент ферритина с одним или несколькими отличиями его аминокислотной последовательности от ферритина дикого типа.
[00108] Применяемый в данном документе термин "мономер ферритина" относится к одной молекуле ферритина (или, если применимо, к одной тяжелой или легкой цепи ферритина), которая не была собрана с другими молекулами ферритина. "Ферритиновый мультимер" содержит несколько ассоциированных мономеров ферритина. "Белок ферритин" включает мономерный ферритин и мультимерный ферритин.
[00109] Применяемый в данном документе термин "ферритиновая частица" относится к ферритину, который самоорганизовался в глобулярную форму. Ферритиновые частицы иногда называют "ферритиновыми наночастицами" или просто "наночастицами". В некоторых вариантах осуществления ферритиновая частица содержит 24 мономера ферритина (или, если применимо, 24 полных тяжелых и легких цепей).
[00110] Применяемый в данном документе термин "гибридный ферритин" относится к ферритину, включающему ферритин из H. pylori с аминоконцевым удлинением из ферритина лягушки-быка. Иллюстративная последовательность, применяемая в качестве аминоконцевого удлинения из ферритина лягушки-быка, представлена как SEQ ID NO: 217. В гибридном ферритине аминоконцевое удлинение из ферритина лягушки-быка может быть слито с ферритином из H. pylori таким образом, что сайты присоединения иммуностимулирующих фрагментов равномерно распределяются на поверхности ферритиновой частицы. Применяемый в данном документе термин "линкер лягушки-быка" представляет собой линкер, содержащий последовательность под SEQ ID NO: 217. Гибридный ферритин также иногда называют "bfpFerr" или "bfp-ферритин". Любая из конструкций, включающих последовательность лягушки-быка, может быть предусмотрена без последовательности лягушки-быка, например, без линкера или с альтернативным линкером. Иллюстративные линкерные последовательности лягушки-быка предусмотрены в таблице 1. Если в таблице 1 показан линкер лягушки-быка, та же конструкция может быть получена без линкера или с альтернативным линкером.
[00111] Применяемый в данном документе термин "гликозилирование" относится к добавлению сахаридного звена к белку.
[00112] Применяемый в данном документе термин "иммунный ответ" относится к ответу клетки иммунной системы, такой как В-клетка, Т-клетка, дендритная клетка, макрофаг или полиморфноядерный лейкоцит, на стимул, такой как антиген или вакцина. Иммунный ответ может включать любую клетку организма, участвующую в защитном ответе хозяина, включая, например, эпителиальную клетку, которая секретирует интерферон или цитокин. Иммунный ответ включает без ограничения врожденный и/или адаптивный иммунный ответ. Применяемый в данном документе термин "защитный иммунный ответ" относится к иммунному ответу, который защищает субъекта от инфекции (например, предупреждает инфекцию или предупреждает развитие заболевания, связанного с инфекцией). Способы измерения иммунных ответов хорошо известны из уровня техники и включают, например, измерение пролиферации и/или активности лимфоцитов (таких как B- или Т-клетки), секреции цитокинов или хемокинов, воспаления, образования антител и т.п. "Ответ с образованием антител" представляет собой иммунный ответ, при котором образуются антитела.
[00113] Применяемый в данном документе термин "иммуностимулирующий фрагмент" относится к фрагменту, который ковалентно присоединяется к ферритину или антигенному полипептиду на основе последовательности ферритина и который способен активировать компонент иммунной системы (либо отдельно, либо при присоединении к ферритину или антигенному полипептиду на основе последовательности ферритина). Иллюстративные иммуностимулирующие фрагменты включают агонистов toll-подобных рецепторов (TLR), например, TLR 4, 7, 8 или 9. В некоторых вариантах осуществления иммуностимулирующий фрагмент представляет собой адъювант.
[00114] Применяемый в данном документе термин "набор" относится к упакованному набору связанных компонентов, таких как одно или несколько соединений или композиций и один или несколько связанных материалов, таких как растворители, растворы, буферы, инструкции или высушивающие средства.
[00115] Применяемый в данном документе термин "N-гликан" относится к сахаридной цепи, присоединенной к белку по амидному азоту остатка N (аспарагина) белка. Таким образом, N-гликан образуется в процессе N-гликозилирования. Этот гликан может представлять собой полисахарид.
[00116] Применяемый в данном документе термин "эктодомен OspA" относится к приблизительно аминокислотным остаткам 27-273 OspA B. burgdorferi (UniProt, № доступа P0CL66) или к соответствующим положениям его гомолога, идентифицированным посредством попарного или структурного выравнивания. Дополнительные примеры эктодоменов OspA включают положения 27-X любой из SEQ ID NO: 83-89, где X представляет собой C-концевое положение релевантной последовательности, где необязательно C-концевой Lys опущен. В некоторых вариантах осуществления эктодомен дополнительно содержит на своем N-конце 26-ой остаток или 25-ый и 26-ой остатки соответствующей полноразмерной последовательности дикого типа; в SEQ ID NO: 83-89 25-ый и 26-ой остатки представляют собой Asp и Glu. Следующие дополнительные примеры эктодоменов OspA включают любую из SEQ ID NO: 94-102, где необязательно N-концевые 1, 2 или 3 остатка (Met-Asp-Glu) опущены, где дополнительно необязательно C-концевой Lys опущен.
[00117] Применяемый в данном документе термин "трансмембранный домен OspA" относится к приблизительно аминокислотным остаткам 2-24 OspA B. burgdorferi (UniProt, № доступа P0CL66) или к соответствующим положениям его гомолога, идентифицированным посредством попарного или структурного выравнивания.
[00118] Применяемый в данном документе термин "самоадъювантный" относится к композиции или полипептиду, включающим ферритин и иммуностимулирующий фрагмент, непосредственно конъюгированный с ферритином таким образом, что ферритин и иммуностимулирующий фрагмент находятся в составе одного молекулярного объекта. Антигенный полипептид на основе последовательности ферритина, включающий отличный от ферритина полипептид, может быть конъюгирован с иммуностимулирующим фрагментом с образованием самоадъювантного полипептида.
[00119] Применяемый в данном документе термин "антигенный полипептид на основе последовательности OspA" относится к полипептиду, включающему весь OspA или часть OspA достаточной длины, чтобы полипептид был антигенным по отношению к OspA. Полноразмерный OspA включает трансмембранный домен и эктодомен, определенные ниже. Антигенность может быть признаком последовательности OspA как части конструкции, дополнительно содержащей гетерологичную последовательность, такую как ферритин или белок лумазинсинтаза. То есть, если OspA является частью конструкции, дополнительно содержащей гетерологичную последовательность, тогда достаточно, чтобы конструкция могла служить в качестве антигена, который генерирует антитела к OspA независимо от того, способна ли на это последовательность OspA без гетерологичной последовательности.
[00120] "Антигенный полипептид на основе последовательности ферритина" и "антигенный белок ферритин" применяются в данном документе взаимозаменяемо для обозначения полипептида, включающего ферритин и полипептид, отличный от ферритина, такой как OspA, достаточной длины, чтобы молекула была антигенной по отношению к полипептиду, отличному от ферритина. Антигенный полипептид на основе последовательности ферритина может дополнительно содержать иммуностимулирующий фрагмент. Антигенность может быть признаком последовательности, отличной от последовательности ферритина, как части более крупной конструкции. То есть достаточно, чтобы конструкция могла служить в качестве антигена против полипептида, отличного от ферритина, независимо от того, способен ли на это полипептид, отличный от ферритина, без ферритина (и иммуностимулирующего фрагмента, если применимо). В некоторых вариантах осуществления отличный от ферритина полипептид представляет собой полипептид OspA, и в этом случае антигенный полипептид на основе последовательности ферритина также представляет собой "антигенный полипептид на основе последовательности OspA". Однако, в качестве уточнения, "антигенный полипептид на основе последовательности OspA" не обязательно должен включать ферритин. Термин "антигенный полипептид" применяется в данном документе для обозначения полипептида, который представляет собой антигенный полипептид на основе последовательности ферритина или антигенный полипептид на основе последовательности OspA, или их обоих. В настоящем изобретении описаны последовательности нуклеиновых кислот и аминокислотные последовательности, характеризующиеся определенной степенью идентичности с данной последовательностью нуклеиновой кислоты или аминокислотной последовательностью, соответственно (эталонная последовательность).
[00121] "Идентичность последовательностей" двух последовательностей нуклеиновых кислот указывает на процентное содержание нуклеотидов, которые являются идентичными в двух последовательностях. "Идентичность последовательностей" двух аминокислотных последовательностей указывает на процентное содержание аминокислот, которые являются идентичными в двух последовательностях.
[00122] Термины "идентичный %", "% идентичности" или подобные термины предназначены для обозначения, в частности, процентного содержания нуклеотидов или аминокислот, которые являются идентичными при оптимальном выравнивании в сравниваемых последовательностях. Указанное процентное содержание является чисто статистическим, и различия между двумя последовательностями могут быть, но не обязательно, случайным образом распределены по всей длине сравниваемых последовательностей. Сравнение двух последовательностей обычно осуществляют посредством сравнения указанных последовательностей после оптимального выравнивания относительно сегмента или "окна сравнения", чтобы идентифицировать локальные участки соответствующих последовательностей. Оптимальное выравнивание для сравнения можно осуществлять вручную или с помощью алгоритма поиска локальной гомологии по Smith and Waterman, 1981, Ads App. Math. 2, 482, с помощью алгоритма поиска локальной гомологии по Neddleman and Wunsch, 1970, J. Mol. Biol. 48, 443, с помощью алгоритма поиска совпадений по Pearson and Lipman, 1988, Proc. Natl Acad. Sci. USA 88, 2444, или с помощью компьютерных программ, в которых применяются указанные алгоритмы (GAP, BESTFIT, FASTA, BLAST P, BLAST N и TFASTA в пакете программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Drive, Мэдисон, Висконсин).
[00123] Процент идентичности получают посредством определения количества идентичных положений, в которых сравниваемые последовательности совпадают, деления этого количества на количество сравниваемых положений (например, количество положений в эталонной последовательности) и умножения этого результата на 100.
[00124] В некоторых вариантах осуществления степень идентичности дана для участка, который составляет по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90% или приблизительно 100% от полной длины эталонной последовательности. Например, если эталонная последовательность нуклеиновой кислоты состоит из 200 нуклеотидов, то степень идентичности дана для по меньшей мере приблизительно 100, по меньшей мере приблизительно 120, по меньшей мере приблизительно 140, по меньшей мере приблизительно 160, по меньшей мере приблизительно 180 или приблизительно 200 нуклеотидов, в некоторых вариантах осуществления для непрерывных нуклеотидов. В некоторых вариантах осуществления степень идентичности дана для полной длины эталонной последовательности.
[00125] Последовательности нуклеиновых кислот или аминокислотные последовательности, характеризующиеся определенной степенью идентичности с данной последовательностью нуклеиновой кислоты или аминокислотной последовательностью соответственно, могут иметь по меньшей мере одно функциональное свойство данной указанной последовательности, например, и в некоторых случаях функционально эквивалентны данной указанной последовательности. Одно важное свойство включает способность действовать в качестве цитокина, в частности, при введении субъекту. В некоторых вариантах осуществления последовательность нуклеиновой кислоты или аминокислотная последовательность, характеризующаяся определенной степенью идентичности с данной последовательностью нуклеиновой кислоты или аминокислотной последовательностью, функционально эквивалентна данной указанной последовательности.
[00126] Применяемый в данном документе термин "субъект" относится к любому представителю царства животных. В некоторых вариантах осуществления "субъект" относится к людям. В некоторых вариантах осуществления "субъект" относится к отличным от человека животным. В некоторых вариантах осуществления субъекты включают без ограничения млекопитающих, птиц, рептилий, амфибий, рыб, насекомых и/или червей. В определенных вариантах осуществления отличный от человека субъект представляет собой млекопитающее (например, грызуна, мышь, крысу, кролика, обезьяну, собаку, кошку, овцу, крупный рогатый скот, примата и/или свинью). В некоторых вариантах осуществления субъект может представлять собой трансгенное животное, животное, полученное с помощью способов генетической инженерии, и/или клон. В определенных вариантах осуществления настоящего изобретения субъект представляет собой взрослого, подростка или младенца. В некоторых вариантах осуществления применяются термины "индивидуум" или "пациент", и подразумевается, что они взаимозаменяемы с термином "субъект".
[00127] Применяемый в данном документе термин "экспонированная на поверхности" аминокислота относится к аминокислотному остатку в белке (например, ферритине) с боковой цепью, которая способна контактировать с молекулами растворителя, когда белок находится в своей нативной трехмерной конформации после мультимеризации, если применимо. Таким образом, например, в случае ферритина, который образует 24-мер, экспонированный на поверхности аминокислотный остаток представляет собой остаток, боковая цепь которого способна контактировать с растворителем, когда ферритин собирается как 24-мер, например, как ферритиновый мультимер или ферритиновая частица.
[00128] Применяемые в данном документе термины "вакцинация" или "вакцинировать" относятся к введению композиции, предназначенной для генерации иммунного ответа, например, на фактор, вызывающий заболевание. Вакцинацию можно осуществлять до, во время и/или после контакта с фактором, вызывающим заболевание, и/или развития одного или нескольких симптомов и, в некоторых вариантах осуществления до, во время и/или вскоре после контакта с фактором. В некоторых вариантах осуществления вакцинация включает многократное введение композиции для вакцинации с соответствующими интервалами времени.
Полипептиды OspA
[00129] Предусмотрены полипептиды OspA, которые могут быть антигенными при введении отдельно, с адъювантом в виде отдельной молекулы и/или как часть наночастицы (например, ферритиновой частицы или лумазинсинтазной частицы), которая может быть самоадъювантной. В некоторых вариантах осуществления полипептид OspA включает модифицированный белок А внешней поверхности (OspA) из Borrelia. OspA существует в ряде серотипов, как определено по их реактивности с моноклональными антителами к различным эпитопам OspA (см. Wilske et al., J Clin Microbio 31(2):340-350 (1993)). Эти серотипы коррелируют с различными геновидами бактерий Borrelia. В некоторых вариантах осуществления OspA представляет собой любой из серотипов 1-7. В некоторых вариантах осуществления OspA получен из Borrelia burgdorferi, Borrelia mayonii, Borrelia afzelii, Borrelia garinii или Borrelia bavariensis. В некоторых вариантах осуществления OspA представляет собой OspA Borrelia burgdorferi. В некоторых вариантах осуществления Borrelia может переноситься клещом рода Ixodes. В некоторых вариантах осуществления Borrelia представляет собой Borrelia burgdorferi, Borrelia mayonii, Borrelia afzelii, Borrelia garinii или Borrelia bavariensis.
[00130] В некоторых вариантах осуществления полипептид OspA представляет собой полипептид OspA серотипа 1, такой как эктодомен OspA серотипа 1. В литературе сообщалось о том, что эпитоп OspA серотипа 1 по аминокислотам 165-173 из SEQ ID NO: 83 обладает гомологией с фрагментом последовательности человеческого функционально-ассоциированного антигена-1 лейкоцитов (hLFA-1), т.е. SEQ ID NO: 78 (см. Gross, D.M., et al., Science 281(5377): p. 703-6 (1998)). Аминокислоты 165-173 из SEQ ID NO: 83 показаны как выделенный нонапептид в SEQ ID NO: 77 и называются сайтом гомологии с hLFA-1. SEQ ID NO: 83 представляет собой иллюстративную последовательность OspА серотипа 1 дикого типа, которая применяется в данном документе в качестве эталонной последовательности при обсуждении аминокислотных положений в OspA. Этот сайт гомологии может играть роль в развитии артрита Лайма, в том числе устойчивого к антибиотикам артрита Лайма. В данном документе описаны антигенные полипептиды на основе последовательности OspA, включающие модифицированный полипептид OspA серотипа 1 из Borrelia, где модифицированный OspA не включает последовательность под SEQ ID NO: 77. Такие полипептиды при применении для индукции образования антител могут характеризоваться улучшенной безопасностью, например, пониженным риском запуска аутоиммунного ответа. В некоторых вариантах осуществления полипептид OspA серотипа 1 имеет одну или несколько модификаций, которые снижают идентичность с hLFA-1. Охватывается любая модификация для снижения гомологии с SEQ ID NO: 78, для снижения идентичности с SEQ ID NO: 78 или для введения одной или нескольких неконсервативных замен относительно SEQ ID NO: 78. В некоторых вариантах осуществления предусмотрен антигенный полипептид, содержащий полипептид OspA серотипа 1 из Borrelia, где полипептид не содержит последовательность под SEQ ID NO: 77. В некоторых вариантах осуществления антигенный полипептид включает эктодомен OspA серотипа 1, где эктодомен не включает последовательность под SEQ ID NO: 77. В некоторых вариантах осуществления антигенный полипептид OspA серотипа 1 включает последовательность с по меньшей мере 85%, 90%, 95%, 97%, 98%, 99%, 99,5% или 100% идентичностью с последовательностью под любым из SEQ ID NO: 94-102.
[00131] "Снижение гомологии" охватывает снижение идентичности последовательностей и/или снижение сходства последовательностей, где каждый представитель ряда аминокислот, перечисленных в качестве консервативных замен в таблице ниже, считается подобным указанному исходному остатку и другим представителям ряда; например, первая строка таблицы указывает на то, что аланин, валин, лейцин и изолейцин схожи друг с другом, а восьмая строка указывает на то, что аланин и глицин схожи друг с другом. Сходство не является переходным, поэтому, например, изолейцин и глицин не считаются сходными. В некоторых вариантах осуществления модифицированный OspA включает белок OspA серотипа 1 с пониженной гомологией с hLFA-1 по сравнению с OspA серотипа 1 дикого типа. В некоторых вариантах осуществления модифицированный OspA включает OspA серотипа 1, включающий модификацию любой одной или нескольких аминокислот из SEQ ID NO: 77. В некоторых вариантах осуществления модификация в SEQ ID NO: 77 представляет собой неконсервативную аминокислотную замену. Неконсервативная замена является заменой, отличной от консервативных замен, показанных в следующей таблице.
Таблица 3. Консервативные аминокислотные замены
остаток
замены
Phe, норлейцин
Met; Ala; Phe
Ala, норлейцин
[00132] В некоторых вариантах осуществления одна или несколько аминокислот из SEQ ID NO: 77 заменены соответствующей(соответствующими) аминокислотой(аминокислотами) из OspA серотипа, отличного от серотипа 1, например, из OspA серотипа 2, 3, 4, 5, 6 или 7. В некоторых вариантах осуществления каждая из аминокислот из SEQ ID NO: 77 заменена соответствующей(соответствующими) аминокислотой(аминокислотами) из OspA серотипа 2, 3, 4, 5, 6 или 7. В некоторых вариантах осуществления аминокислоты из SEQ ID NO: 77 заменены соответствующими аминокислотами из серотипа 2 (S2, SEQ ID NO: 79) или серотипа 3 (S3, SEQ ID NO: 80).
[00133] В некоторых вариантах осуществления модифицированный OspA включает SEQ ID NO: 81. В некоторых вариантах осуществления модифицированный OspA включает SEQ ID NO: 82. SEQ ID NO: 81 и 82 предназначены для замены SEQ ID NO: 77 и тем самым снижают гомологию с SEQ ID NO: 78.
[00134] В некоторых вариантах осуществления полипептид представляет собой полноразмерный OspA (например, включающий трансмембранный домен и эктодомен, который может включать или не включать модификацию для снижения гомологии с hLFA-1, как описано в данном документе).
[00135] В некоторых вариантах осуществления полипептид не имеет трансмембранного домена. В некоторых вариантах осуществления полипептид не имеет части трансмембранного домена, например, N-концевых 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 аминокислот из последовательности OspА дикого типа. В некоторых вариантах осуществления полипептид не имеет сегмента, включающего аминокислоту 17 OspA серотипа 1 или соответствующее положение его гомолога, как идентифицировано посредством попарного или структурного выравнивания. В некоторых вариантах осуществления полипептид не имеет по меньшей мере аминокислот 1-17 OspA, такого как OspA серотипа 1, или аналогичных аминокислот в его гомологе, как идентифицировано посредством попарного или структурного выравнивания. В некоторых вариантах осуществления полипептид не имеет по меньшей мере 18, 19, 20, 21, 22, 23 или 24 N-концевых аминокислот OspA, такого как OspA серотипа 1, или аналогичных аминокислот в его гомологе, как идентифицировано посредством попарного или структурного выравнивания. В некоторых вариантах осуществления полипептид не имеет аминокислот 1-25 OspA, такого как OspA серотипа 1, или аналогичных аминокислот в его гомологе, как идентифицировано посредством попарного или структурного выравнивания. В некоторых вариантах осуществления полипептид не имеет аминокислот 1-26 OspA серотипа 1, или аналогичных аминокислот в его гомологе, как идентифицировано посредством попарного или структурного выравнивания. Во избежание сомнений отсутствие трансмембранного домена не требует отсутствия в полипептиде N-концевого метионина; например, полипептид, в котором первый остаток представляет собой метионин, а второй остаток соответствует остатку 26 OspA дикого типа, за которым следуют остатки, соответствующие 27-му, 28-му и т.д. остаткам OspA дикого типа, считается не имеющим трансмембранного домена. В некоторых вариантах осуществления полипептид, включающий OspA, не имеет сайта липидирования, такого как сайт липидирования, содержащийся в трансмембранном домене OspA серотипа 1 дикого типа. В некоторых вариантах осуществления полипептид не имеет цистеина 17 OspA серотипа 1. В некоторых вариантах осуществления полипептид не содержит цистеин, который соответствует любому из положений 1-25 OspA дикого типа, например, любой из SEQ ID NO: 83-89. В некоторых вариантах осуществления полипептид не имеет или имеет замену по цистеину 17 OspA серотипа 1. В некоторых вариантах осуществления полипептид не имеет по меньшей мере части трансмембранного домена OspА дикого типа таким образом, что он не имеет сайта липидирования. В некоторых вариантах осуществления полипептид не имеет аминокислот, которые выравниваются с аминокислотами 1-17 OspA серотипа 1.
[00136] В некоторых вариантах осуществления полипептид не содержит пальмитоильную группу. В некоторых вариантах осуществления полипептид не содержит диацилглицериновую группу. В некоторых вариантах осуществления полипептид является нелипидированным. В некоторых вариантах осуществления полипептид не имеет сайта липидирования. В некоторых вариантах осуществления этот сайт липидирования содержится в трансмембранном домене. В некоторых вариантах осуществления сайт липидирования, который удален, представляет собой цистеин 17 OspA серотипа 1. В некоторых вариантах осуществления полипептид не имеет или имеет замену по цистеину 17 OspA серотипа 1.
[00137] В некоторых вариантах осуществления удаление сайта липидирования OspA и/или трансмембранного домена или его части, и/или отсутствие пальмитоильной и/или диацилглицериновой группы позволяет упростить очистку белка, например, за счет улучшения растворимости белка, и/или делает белок более пригодным для очистки с помощью таких методик, как ионообменная и другие формы хроматографии.
[00138] В некоторых вариантах осуществления полипептид включает лидерную последовательность млекопитающих (также известную как сигнальная последовательность). В некоторых вариантах осуществления лидерная последовательность млекопитающих приводит к секреции полипептида при экспрессии в клетках млекопитающих.
[00139] В некоторых вариантах осуществления полипептид не имеет сайта гликозилирования. Модификации с удалением сайтов гликозилирования подробно описаны в данном документе. Полипептиды OspA в соответствии с настоящим изобретением могут включать любую такую модификацию, которая может быть объединена с любыми другими модификациями, описанными в данном документе, включая модификации сайта гомологии с hLFA-1 и/или делецию части или всего трансмембранного домена. В некоторых вариантах осуществления полипептид не включает SEQ ID NO: 77 (например, имеет пониженную гомологию с hLFA-1a) и имеет модификации для снижения гликозилирования, и/или не имеет трансмембранного домена.
1. Модификация гликозилирования
[00140] N-связанное гликозилирование представляет собой присоединение гликана к амидному азоту остатка аспарагина (Asn; N) белка. Процесс присоединения приводит к образованию гликозилированного белка. Гликозилирование может происходить по любому остатку аспарагина в белке, который доступен и распознается гликозилирующими ферментами после трансляции белка, и наиболее часто встречается в доступных аспарагинах, которые являются частью сайта NXS/TX, где второй аминокислотный остаток после аспарагина представляет собой серин или треонин. Паттерн гликозилирования, отличный от человеческого, может сделать полипептид нежелательно реактогенным при применении для индукции образования антител. Кроме того, гликозилирование полипептида, который обычно не гликозилируется, может изменить его иммуногенность. Например, гликозилирование может маскировать важные иммуногенные эпитопы в белке. Таким образом, для снижения или устранения гликозилирования либо остатки аспарагина, либо остатки серина/треонина можно модифицировать, например, посредством замены на другую аминокислоту.
[00141] В некоторых вариантах осуществления полипептид, включающий OspA, является модифицированным для снижения или устранения гликозилирования. В некоторых вариантах осуществления один или несколько сайтов N-гликозилирования в OspA удалены. В некоторых вариантах осуществления удаление сайта N-гликозилирования снижает гликозилирование OspA. В некоторых вариантах осуществления полипептид характеризуется пониженным гликозилированием относительно OspA дикого типа, такого как OspA серотипа 1 дикого типа. В некоторых вариантах осуществления удаление сайтов N-гликозилирования устраняет гликозилирование OspA.
[00142] В некоторых вариантах осуществления один или несколько аспарагинов в OspA заменены отличной от аспарагина аминокислотой. В некоторых вариантах осуществления каждый аспарагин в OspA заменен на отличную от аспарагина аминокислоту. Любая природная или неприродная аминокислота, обнаруженная в белках, например, глутамин, может быть применена для замены аспарагина. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования модифицирует сайт гликозилирования NXS/TX (где второй остаток после N представляет собой S или T). В некоторых вариантах осуществления первый X в сайте NXS/TX не представляет собой пролин, и/или второй X в сайте NXS/TX не представляет собой пролин. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования представляет собой замену N на Q. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования представляет собой замену S/T на A.
[00143] Ниже приводится подробное обсуждение положений, которые можно модифицировать для снижения или устранения гликозилирования. Номера положений относятся к положениям в полноразмерных последовательностях OspA, предусмотренных как SEQ ID NO: 83-89. Следует понимать, что номера положений должны быть соответствующим образом скорректированы в случае частичных и модифицированных последовательностей OspA (например, если N-концевая делеция приводит к общему укорочению на 25 аминокислотных остатков, то номера положений следует уменьшить на 25).
[00144] В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает замену любого одного или нескольких из N20, N71, N190, N202 и N251 из OspA серотипа 1 (SEQ ID NO: 83). В некоторых вариантах осуществления модификация включает модификации по каждому из N71, N190, N202 и N251 из OspA серотипа 1. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает одну или несколько из N20Q, N71Q, N190Q, N202Q или N251Q OspA серотипа 1. Соответствующие аминокислоты можно найти в OspA различных серотипов посредством парного выравнивания. Таким образом, в некоторых вариантах осуществления остатки аспарагина, замененные в OspA серотипов 2-7, представляют собой аминокислотные остатки, которые выравниваются с N20, N71, N190, N202 и N251 из OspA серотипа 1. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает замену любого одного или нескольких остатков Ser или Thr в положении 22, 73, 192, 204 и 253 OspA серотипа 1. В некоторых вариантах осуществления модификация включает замену одного или нескольких остатков Ser или Thr в положении 22, 73, 192, 204 и 253 OspA серотипа 1 на аланин.
[00145] В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает замены любого одного или нескольких из N20, N71, N141, N164, N202 и N205 из OspA серотипа 2 (SEQ ID NO: 84). В некоторых вариантах осуществления модификация включает модификации по каждому из N20, N71, N141, N164, N202 и N205 из OspA серотипа 2. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает одну или несколько из N20Q, N71Q, N141Q, N164Q, N202Q или N205Q OspA серотипа 2. Аналогичные аминокислоты можно найти в OspA различных серотипов посредством парного выравнивания. Таким образом, в некоторых вариантах осуществления остатки аспарагина, замененные в OspA серотипов 1 или 3-7, представляют собой аминокислотные остатки, которые выравниваются с N20, N71, N141, N164, N202 и N205 OspA серотипа 2. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает замену любого одного или нескольких остатков Ser или Thr в положении 22, 73, 143, 166, 204 и 207 OspA серотипа 2. В некоторых вариантах осуществления модификация включает замену одного или нескольких остатков Ser или Thr в положении 22, 73, 143, 166, 204 и 207 OspA серотипа 2 на аланин.
[00146] В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает замены любого одного или нескольких из N20, N71, N95, N141, N191 и N203 из OspA серотипа 3 (SEQ ID NO: 85). В некоторых вариантах осуществления модификация включает модификации по каждому из N20, N20, N71, N95, N141, N191 и N203 из OspA серотипа 3. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает одну или несколько из N20Q, N71Q, N95Q, N141Q, N191Q или N203Q OspA серотипа 3. Аналогичные аминокислоты можно найти в OspA различных серотипов посредством парного выравнивания. Таким образом, в некоторых вариантах осуществления остатки аспарагина, замененные в OspA серотипов 1-2 или 4-7, представляют собой аминокислотные остатки, которые выравниваются с N20, N20, N71, N95, N141, N191 и N203 из OspA серотипа 3. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает замену любого одного или нескольких остатков Ser или Thr в положении 22, 73, 97, 143, 193 и 205 OspA серотипа 3. В некоторых вариантах осуществления модификация включает замену одного или нескольких остатков Ser или Thr в положении 22, 73, 97, 143, 193 и 205 OspA серотипа 3 на аланин.
[00147] В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает замены любого одного или нескольких из N20, N71, N141, N202, N205, и N219 из OspA серотипа 4 (SEQ ID NO: 86). В некоторых вариантах осуществления модификация включает модификации по каждому из N20, N71, N141, N202, N205 и N219 из OspA серотипа 4. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает одну или несколько из N20Q, N71Q, N141Q, N202Q, N205Q или N219Q OspA серотипа 4. Аналогичные аминокислоты можно найти в OspA различных серотипов посредством парного выравнивания. Таким образом, в некоторых вариантах осуществления остатки аспарагина, замененные в OspA серотипов 1-3 или 5-7, представляют собой аминокислотные остатки, которые выравниваются с N20, N71, N141, N202, N205 и N219 из OspA серотипа 4. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает замену любого одного или нескольких остатков Ser или Thr в положении 22, 73, 143, 204, 207 и 221 OspA серотипа 4. В некоторых вариантах осуществления модификация включает замену одного или нескольких остатков Ser или Thr в положении 22, 73, 143, 204, 207 и 221 OspA серотипа 4 на аланин.
[00148] В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает замены любого одного или нескольких из N20, N71 и N141 из OspA серотипа 5. (Определенные серотипы, в том числе серотипы 5-7, содержат меньше сайтов гликозилирования, чем определенные другие последовательности OspА, такие как последовательности OspА серотипа 1). В некоторых вариантах осуществления модификация включает модификации по каждому из N20, N71 и N141 из OspA серотипа 5 (SEQ ID NO: 87). В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает одну или несколько из N20Q, N71Q или N141Q OspA серотипа 5. Аналогичные аминокислоты можно найти в OspA различных серотипов посредством парного выравнивания. Таким образом, в некоторых вариантах осуществления остатки аспарагина, замененные в OspA серотипов 1-4 или 6-7, представляют собой аминокислотные остатки, которые выравниваются с N20, N71 и N141 из OspA серотипа 5. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает замену любого одного или нескольких остатков Ser или Thr в положении 22, 73 и 143 OspA серотипа 5. В некоторых вариантах осуществления модификация включает замену одного или нескольких остатков Ser или Thr в положении 22, 73 и 143 OspA серотипа 5 на аланин.
[00149] В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает замены любого одного или нескольких из N20, N71 и N141 из OspA серотипа 6 (SEQ ID NO: 88). В некоторых вариантах осуществления модификация включает модификации по каждому из N20, N71 и N141 из OspA серотипа 6. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает одну или несколько из N20Q, N71Q или N141Q OspA серотипа 6. Аналогичные аминокислоты можно найти в OspA различных серотипов посредством парного выравнивания. Таким образом, в некоторых вариантах осуществления остатки аспарагина, замененные в OspA серотипов 1-5 или 7, представляют собой аминокислотные остатки, которые выравниваются с N20, N71 и N141 из OspA серотипа 6. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает замену любого одного или нескольких остатков Ser или Thr в положении 22, 73 и 143 OspA серотипа 6. В некоторых вариантах осуществления модификация включает замену одного или нескольких остатков Ser или Thr в положении 22, 73 и 143 OspA серотипа 6 на аланин.
[00150] В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает замены любого одного или нескольких из N20, N71, N141 и N191 из OspA серотипа 7 (SEQ ID NO: 89). В некоторых вариантах осуществления модификация включает модификации по каждому из N20, N71, N141 и N191 из OspA серотипа 7. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает одну или несколько из N20Q, N71Q, N141Q или N191Q OspA серотипа 7. Аналогичные аминокислоты можно найти в OspA различных серотипов посредством парного выравнивания. Таким образом, в некоторых вариантах осуществления остатки аспарагина, замененные в OspA серотипов 1-6, представляют собой аминокислотные остатки, которые выравниваются с N20, N71, N141 и N191 из OspA серотипа 7. В некоторых вариантах осуществления модификация для снижения или устранения гликозилирования включает замену любого одного или нескольких остатков Ser или Thr в положении 22, 73, 143 и 193 OspA серотипа 7. В некоторых вариантах осуществления модификация включает замену одного или нескольких остатков Ser или Thr в положении 22, 73, 143 и 193 OspA серотипа 7 на аланин.
Антигенные полипептиды на основе последовательности OspA, включающие полипептид OspA и ферритин или лумазинсинтазу
[00151] В некоторых вариантах осуществления предусмотрен антигенный полипептид, включающий полипептид OspA и ферритин или лумазинсинтазу. Следует понимать, что такие антигенные полипептиды на основе последовательности OspA, раскрытые в данном документе, являются антигенными по отношению к компоненту OspA, например, их можно вводить млекопитающему, такому как человек, для индукции образования антител к OspA. Ферритиновый компонент антигенного полипептида может представлять собой ферритин дикого типа из любого вида или ферритин из любого вида, который включает одну или несколько мутаций, как описано в данном документе. В некоторых вариантах осуществления антигенный полипептид содержит аминокислоты из любой из SEQ ID NO: 1-76. В некоторых вариантах осуществления антигенный полипептид включает последовательность с по меньшей мере 85%, 90%, 95%, 97%, 98%, 99%, 99,5% или 100% идентичностью с последовательностью под любым из SEQ ID NO: 1-76. Лумазинсинтазный компонент антигенного полипептида может представлять собой лумазинсинтазу из любого вида.
[00152] В некоторых вариантах осуществления антигенный полипептид включает лидерную последовательность млекопитающих (также известную как сигнальная последовательность). В некоторых вариантах осуществления лидерная последовательность млекопитающих приводит к секреции антигенного полипептида при экспрессии в клетках млекопитающих.
1. Компонент, представляющий собой полипептид OspА
[00153] Антигенный полипептид на основе последовательности OspA может включать любой из модифицированных полипептидов OspA, описанных в данном документе.
[00154] Например, в некоторых вариантах осуществления компонент OspА антигенного полипептида на основе последовательности OspA включает эктодомен OspA. В некоторых вариантах осуществления эктодомен OspA получен из любого из серотипов 1, 2, 3, 4, 5, 6 или 7. Иллюстративные последовательности OspА дикого типа предусмотрены как SEQ ID NO: 83-89. Их 25 N-концевых аминокислот могут быть удалены, например, для удаления сайта липидирования. Номера доступа для иллюстративных последовательностей OspА также предусмотрены в примерах. В некоторых вариантах осуществления эктодомен получен из Borrelia burgdorferi, Borrelia mayonii, Borrelia afzelii, Borrelia garinii или Borrelia bavariensis. В некоторых вариантах осуществления эктодомен получен из Borrelia burgdorferi.
[00155] В некоторых вариантах осуществления эктодомен представляет собой эктодомен дикого типа.
[00156] В некоторых вариантах осуществления эктодомен представляет собой модифицированный эктодомен, например, эктодомен, модифицированный для снижения гликозилирования. Вводное обсуждение гликозилирования предусмотрено в предыдущем разделе и для краткости здесь не повторяется. Компонент OspА антигенного полипептида на основе последовательности OspA может включать любую из модификаций, описанных в данном документе, для снижения или устранения гликозилирования, включая без ограничения удаление одного или нескольких сайтов N-гликозилирования в эктодомене, например, посредством аминокислотных замен, как подробно обсуждается в данном документе.
[00157] В некоторых вариантах осуществления эктодомен OspA присутствует как часть большей последовательности OspA в антигенном полипептиде, например, включая часть трансмембранного домена или весь трансмембранный домен. В некоторых вариантах осуществления эктодомен OspA присутствует в полноразмерной последовательности OspА в антигенном полипептиде. В некоторых вариантах осуществления полноразмерная последовательность OspA представляет собой полноразмерную последовательность OspA дикого типа. В некоторых вариантах осуществления антигенный полипептид не включает трансмембранный домен.
[00158] Любые из модификаций, обсуждаемых выше, можно комбинировать в антигенном полипептиде. В некоторых вариантах осуществления антигенный полипептид включает по меньшей мере одну модификацию для снижения гликозилирования и по меньшей мере одну дополнительную модификацию, описанную в данном документе.
[00159] В некоторых вариантах осуществления эктодомен OspA антигенного полипептида представляет собой любой из модифицированных эктодоменов OspA, описанных в разделе B выше.
[00160] Любой из эктодоменов OspA (или последовательность, включающую эктодомен OspA, такой как полноразмерный OspA), описанных в данном документе, можно объединить в антигенный полипептид с любым из ферритинов, описанных ниже.
2. Ферритиновый компонент
[00161] В некоторых вариантах осуществления охватываются слитый белок, включающий антигенный полипептид на основе последовательности OspA, описанный в данном документе, и ферритин. Ферритин в антигенном полипептиде может быть дикого типа или включать одну или несколько мутаций (см. следующий раздел). В некоторых вариантах осуществления ферритин получен из бактерий, насекомых, грибов, птиц или млекопитающих. В некоторых вариантах осуществления ферритин является человеческим. В некоторых вариантах осуществления ферритин является бактериальным. В некоторых вариантах осуществления ферритин представляет собой ферритин Trichoplusia ni (PDB: 1Z6O_X, SEQ ID NO: 211 и 212).
[00162] В некоторых вариантах осуществления ферритин представляет собой легкую цепь и/или тяжелую цепь ферритина. В некоторых вариантах осуществления ферритин представляет собой тяжелую цепь человеческого ферритина (FTH1, ID № гена: 2495) или легкую цепь человеческого ферритина (FTL, ID № гена: 2512). В некоторых вариантах осуществления ферритин представляет собой мультимерный белок, называемый в данном документе "ферритиновой частицей" или "ферритиновой наночастицей", содержащий в целом 24 субъединицы тяжелой цепи ферритина и легкой цепи ферритина.
[00163] В некоторых вариантах осуществления антигенный полипептид на основе последовательности OspA включает легкую цепь ферритина и полипептид OspA. В некоторых вариантах осуществления антигенный полипептид включает тяжелую цепь ферритина и полипептид OspA. В некоторых вариантах осуществления антигенный полипептид, включающий легкую цепь ферритина и полипептид OspA, может собираться с тяжелой цепью ферритина, которая не связана с отличным от ферритина полипептидом. В некоторых вариантах осуществления антигенный полипептид, включающий тяжелую цепь ферритина и полипептид OspA, может собираться с легкой цепью ферритина, которая не связана с отличным от ферритина полипептидом. Ферритин, не связанный с отличным от ферритина полипептидом, может называться "голым ферритином".
[00164] В некоторых вариантах осуществления антигенный полипептид, включающий тяжелую цепь ферритина и полипептид OspA, может собираться с антигенным полипептидом, включающим легкую цепь ферритина и полипептид OspA, чтобы обеспечить экспрессию 2 одинаковых или разных антигенов на одной ферритиновой частице. В некоторых вариантах осуществления 2 разных антигена кодируются одним возбудителем инфекции. В некоторых вариантах осуществления 2 разных антигена кодируются 2 разными возбудителями инфекции, например, Borrelia других серотипов или видов.
[00165] В некоторых вариантах осуществления антигенный полипептид, включающий тяжелую цепь ферритина и полипептид OspA, может собираться с антигенным полипептидом, включающим легкую цепь ферритина и полипептид OspA, с получением бивалентной композиции. В некоторых вариантах осуществления ферритин представляет собой ферритин из H. pylori (см. SEQ ID NO: 90 для иллюстративной последовательности ферритина из H. pylori дикого типа, включающей удлинение из 8 аминокислот из ферритина лягушки-быка на своем N-конце). В некоторых вариантах осуществления более низкая гомология последовательностей между ферритином из H. pylori (или другими бактериальными ферритинами) и человеческим ферритином может снижать потенциал аутоиммунитета при применении в качестве платформы для конструирования антигенных полипептидов (см. Kanekiyo et al., Cell 162, 1090-1100 (2015)).
[00166] В некоторых вариантах осуществления ферритин представляет собой ферритин Pyrococcus furiosus (NCBI seq WP_011011871.1), необязательно с одной или несколькими мутациями, описанными в данном документе.
[00167] В некоторых вариантах осуществления ферритин включает последовательность, характеризующуюся более чем 70%, более чем 75%, более чем 80%, более чем 85%, более чем 90%, более чем 95%, более чем 97%, более чем 98% или более чем 99% идентичностью с ферритином дикого типа.
[00168] В некоторых вариантах осуществления ферритин представляет собой ферритин насекомых. В некоторых вариантах осуществления ферритин представляет собой ферритин Trichoplusia Ni (PDB: 1Z6O_X, SEQ ID NO: 211 и 212), необязательно с одной или несколькими мутациями, описанными в данном документе.
Мутации ферритина
[00169] В некоторых вариантах осуществления ферритин содержит одну или несколько мутаций, раскрытых в данном документе. В некоторых вариантах осуществления одна или несколько мутаций включают изменения аминокислотной последовательности ферритина дикого типа и/или вставку, например, на N- или С-конце. В некоторых вариантах осуществления одна, две, три, четыре, пять или более различных аминокислот в ферритине мутированы по сравнению с ферритином дикого типа (в некоторых вариантах осуществления в дополнение к любой N-концевой вставке). Одна или несколько мутаций способны изменить функциональные свойства ферритина, например, как подробно обсуждается ниже. Как правило, мутация просто относится к различию в последовательности (такому как замещенный, добавленный или удаленный аминокислотный остаток или остатки) относительно соответствующего ферритина дикого типа.
(1) Цистеин для конъюгации
[00170] В некоторых вариантах осуществления ферритин мутирован для обеспечения химического механизма конъюгации иммуностимулирующего фрагмента и/или полипептида, отличного от ферритина. Это может быть достигнуто с помощью мутации с заменой экспонированной на поверхности отличной от цистеина аминокислоты на цистеин. Во избежание сомнений такая формулировка как "замена экспонированной на поверхности аминокислоты на цистеин" обязательно подразумевает, что экспонированная на поверхности аминокислота в последовательности дикого типа или премутационной последовательности не представляет собой цистеин. Другой подход для обеспечения химического механизма конъюгации иммуностимулирующего фрагмента или полипептида, отличного от ферритина, заключается во включении сегмента из аминокислот, такого как линкер, N- или C-терминально относительно ферритина, где сегмент из аминокислот содержит цистеин. В некоторых вариантах осуществления этот цистеин (независимо от того, заменяет ли он аминокислоту, экспонированную на поверхности или в N- или C-концевом линкере) является непарным, что означает, что он не имеет подходящего цистеина-партнера для образования дисульфидной связи. В некоторых вариантах осуществления этот цистеин не изменяет вторичную структуру ферритина. В некоторых вариантах осуществления этот цистеин не изменяет третичную структуру ферритина.
[00171] В некоторых вариантах осуществления этот цистеин можно применять для конъюгации средств, таких как иммуностимулирующие фрагменты, с ферритином. В некоторых вариантах осуществления этот цистеин обеспечивает свободную тиольную группу, которая является реакционноспособной. В некоторых вариантах осуществления средства, конъюгированные с этим цистеином на ферритине, экспонированы на поверхности собранной ферритиновой частицы. В некоторых вариантах осуществления этот цистеин способен взаимодействовать с молекулами и клетками субъекта после введения в ходе сборки ферритиновой частицы.
[00172] В некоторых вариантах осуществления присутствие этого цистеина обеспечивает конъюгацию одного или нескольких иммуностимулирующих фрагментов, например, адъювантов. В некоторых вариантах осуществления конъюгация иммуностимулирующего фрагмента не происходила бы в отсутствие этого цистеина.
[00173] В некоторых вариантах осуществления отличная от цистеина аминокислота, которая заменена на цистеин, выбрана из E12, S72, A75, K79, S100 и S111 из ферритина H. pylori. Таким образом, в некоторых вариантах осуществления экспонированная на поверхности аминокислота, которая заменена на цистеин, представляет собой аминокислотный остаток, который соответствует E12, S26, S72, A75, K79, S100 или S111 из ферритина H. pylori. Аналогичные аминокислоты можно найти в ферритине, отличном от ферритина из H. pylori, посредством парного или структурного выравнивания. В некоторых вариантах осуществления отличная от цистеина аминокислота, которая заменена на цистеин, выбрана из аминокислоты, которая соответствует S3, S19, S33, I82, A86, A102 и A120 из легкой цепи человеческого ферритина. В некоторых вариантах осуществления экспонированная на поверхности аминокислота, подлежащая замене на цистеин, выбрана на основании понимания того, что если бы нативная аминокислота была заменена на цистеин, она была бы реакционноспособна в собранном ферритиновом мультимере или ферритиновой частице, и/или что этот цистеин не нарушает стабильность ферритинового мультимера или ферритиновой частицы, и/или что этот цистеин не приводит к снижению уровней экспрессии ферритина.
[00174] В некоторых вариантах осуществления ферритин включает мутацию E12C. В некоторых вариантах осуществления остаток E12C можно применять для конъюгации средств (например, иммуностимулирующих фрагментов и/или полипептидов, отличных от ферритина) с ферритином. В некоторых вариантах осуществления остаток E12C обеспечивает свободную тиольную группу, которая является реакционноспособной. В некоторых вариантах осуществления средства, конъюгированные с остатком E12C на мономерах ферритина, экспрессируются на поверхности собранного ферритинового мультимера или ферритиновой частицы. В некоторых вариантах осуществления двадцать четыре остатка E12C (по одному из каждого мономера) присутствуют на поверхности ферритинового мультимера или ферритиновой частицы.
[00175] В некоторых вариантах осуществления ферритин включает мутацию S26C. В некоторых вариантах осуществления остаток S26C можно применять для конъюгации средств (например, иммуностимулирующих фрагментов и/или полипептидов, отличных от ферритина) с ферритином. В некоторых вариантах осуществления остаток S26C обеспечивает свободную тиольную группу, которая является реакционноспособной. В некоторых вариантах осуществления средства, конъюгированные с остатком S26C на мономерах ферритина, экспрессируются на поверхности собранного ферритинового мультимера или ферритиновой частицы. В некоторых вариантах осуществления двадцать четыре остатка S26C (по одному из каждого мономера) присутствуют на поверхности ферритинового мультимера или ферритиновой частицы.
[00176] В некоторых вариантах осуществления ферритин включает мутацию S72C. В некоторых вариантах осуществления остаток S72C можно применять для конъюгации средств (например, иммуностимулирующих фрагментов и/или полипептидов, отличных от ферритина) с ферритином. В некоторых вариантах осуществления остаток S72C обеспечивает свободную тиольную группу, которая является реакционноспособной. В некоторых вариантах осуществления средства, конъюгированные с остатком S72C на мономерах ферритина, экспрессируются на поверхности собранного ферритинового мультимера или ферритиновой частицы. В некоторых вариантах осуществления двадцать четыре остатка S72C (по одному из каждого мономера) присутствуют на поверхности ферритинового мультимера или ферритиновой частицы.
[00177] В некоторых вариантах осуществления ферритин включает мутацию A75C. В некоторых вариантах осуществления остаток A75C можно применять для конъюгации средств (например, иммуностимулирующих фрагментов и/или полипептидов, отличных от ферритина) с ферритином. В некоторых вариантах осуществления остаток A75C обеспечивает свободную тиольную группу, которая является реакционноспособной. В некоторых вариантах осуществления средства, конъюгированные с остатком A75C на мономерах ферритина, экспрессируются на поверхности собранного ферритинового мультимера или ферритиновой частицы. В некоторых вариантах осуществления двадцать четыре остатка A75C (по одному из каждого мономера) присутствуют на поверхности ферритинового мультимера или ферритиновой частицы.
[00178] В некоторых вариантах осуществления ферритин включает мутацию K79C. В некоторых вариантах осуществления остаток K79C можно применять для конъюгации средств (например, иммуностимулирующих фрагментов и/или полипептидов, отличных от ферритина) с ферритином. В некоторых вариантах осуществления остаток K79C обеспечивает свободную тиольную группу, которая является реакционноспособной. В некоторых вариантах осуществления средства, конъюгированные с остатком K79C на мономерах ферритина, экспрессируются на поверхности собранного ферритинового мультимера или ферритиновой частицы. В некоторых вариантах осуществления двадцать четыре остатка K79C (по одному из каждого мономера) присутствуют на поверхности ферритинового мультимера или ферритиновой частицы.
[00179] В некоторых вариантах осуществления ферритин включает мутацию S100C. В некоторых вариантах осуществления остаток S100C можно применять для конъюгации средств (например, иммуностимулирующих фрагментов и/или полипептидов, отличных от ферритина) с ферритином. В некоторых вариантах осуществления остаток S100C обеспечивает свободную тиольную группу, которая является реакционноспособной. В некоторых вариантах осуществления средства, конъюгированные с остатком S100C на мономерах ферритина, экспрессируются на поверхности собранного ферритинового мультимера или ферритиновой частицы. В некоторых вариантах осуществления двадцать четыре остатка S100C (по одному из каждого мономера) присутствуют на поверхности ферритинового мультимера или ферритиновой частицы.
[00180] В некоторых вариантах осуществления ферритин включает мутацию S111C. В некоторых вариантах осуществления остаток S111C можно применять для конъюгации средств (например, иммуностимулирующих фрагментов и/или полипептидов, отличных от ферритина) с ферритином. В некоторых вариантах осуществления остаток S111C обеспечивает свободную тиольную группу, которая является реакционноспособной. В некоторых вариантах осуществления средства, конъюгированные с остатком S111C на мономерах ферритина, экспрессируются на поверхности собранного ферритинового мультимера или ферритиновой частицы. В некоторых вариантах осуществления двадцать четыре остатка S111C (по одному из каждого мономера) присутствуют на поверхности ферритинового мультимера или ферритиновой частицы.
(2) Удаление внутреннего цистеина
[00181] В некоторых вариантах осуществления ферритин содержит мутацию с заменой внутреннего цистеина на отличную от цистеина аминокислоту. Удаление нативного внутреннего остатка цистеина может гарантировать наличие только одного неспаренного цистеина в мономере ферритина, что позволяет избежать нежелательных реакций, таких как образование дисульфидных связей, и может привести к более стабильному и эффективному результату (например, представлению адъюванта). В некоторых вариантах осуществления C31 из ферритина H. pylori заменен на отличную от цистеина аминокислоту. В некоторых вариантах осуществления C31 из ферритина H. pylori заменен на серин (C31S), хотя можно применять любой отличный от цистеина остаток, например, аланин, глицин, треонин или аспарагин. Аналогичные аминокислоты можно найти в ферритине, отличном от ферритина H. pylori, посредством парного или структурного выравнивания. Таким образом, в некоторых вариантах осуществления внутренний цистеин, который заменен на отличную от цистеина аминокислоту, представляет собой аминокислотный остаток, который выравнивается с C31 из ферритина H. pylori. Иллюстративные последовательности ферритина, демонстрирующие мутацию C31S, показаны в SEQ ID NO: 201-207. В некоторых вариантах осуществления, когда в ферритине присутствует более одного внутреннего цистеина, два или более (например, каждый) внутренних цистеина заменены на отличную от цистеина аминокислоту, такую как серин, или аминокислоту, выбранную из серина, аланина, глицина, треонина или аспарагина.
(3) Гликозилирование
[00182] Гликозилирование, совместимое с человеческим гликозилированием, может способствовать безопасности и эффективности рекомбинантных лекарственных продуктов. Разрешение регулирующих органов может зависеть от демонстрации соответствующего гликозилирования как критического атрибута качества (см. Zhang et al., Drug Discovery Today 21(5):740-765 (2016)). N-гликаны могут образовываться в результате гликозилирования боковых цепей аспарагина и могут различаться по структуре у людей и других организмов, таких как бактерии и дрожжи. Таким образом, может быть желательно уменьшить или устранить гликозилирование, отличное от человеческого гликозилирования, и/или образование N-гликанов в ферритине в соответствии с настоящим изобретением. В некоторых вариантах осуществления контроль гликозилирования ферритина улучшает эффективность и/или безопасность композиции, особенно при применении для вакцинации человека.
[00183] В некоторых вариантах осуществления ферритин мутирован для ингибирования образования N-гликана. В некоторых вариантах осуществления мутированный ферритин характеризуется пониженным гликозилированием по сравнению с соответствующим ему ферритином дикого типа.
[00184] В некоторых вариантах осуществления ферритин содержит мутацию с заменой экспонированного на поверхности аспарагина на отличную от аспарагина аминокислоту. В некоторых вариантах осуществления экспонированный на поверхности аспарагин представляет собой N19 из ферритина H. pylori или находится в положении, которое соответствует положению 31 ферритина H. pylori, как определено посредством парного или структурного выравнивания. В некоторых вариантах осуществления мутирование такого аспарагина, например, N19 из ферритина H. pylori, снижает гликозилирование ферритина. В некоторых вариантах осуществления мутация заменяет аспарагин на глутамин. В некоторых вариантах осуществления ферритин представляет собой ферритин из H. pylori, включающий мутацию N19Q. SEQ ID NO: 201-207 представляют собой иллюстративные последовательности ферритина, включающие мутации N19Q.
[00185] Млекопитающее, подвергшееся воздействию гликозилированного белка, полученного в бактериях или дрожжах, может генерировать иммунный ответ на гликозилированный белок, потому что паттерн гликозилирования данного белка у бактерий или дрожжей может отличаться от паттерна гликозилирования того же белка у млекопитающих. Таким образом, некоторые гликозилированные терапевтические белки могут не подходить для получения в бактериях или дрожжах.
[00186] В некоторых вариантах осуществления снижение гликозилирования ферритина за счет мутации аминокислоты облегчает получение белка в бактериях или дрожжах. В некоторых вариантах осуществления снижение гликозилирования ферритина снижает возможность проявления нежелательных эффектов у млекопитающих при введении мутантного ферритина, который экспрессируется в бактериях или дрожжах. В некоторых вариантах осуществления реактогенность мутантного ферритина, полученного в бактериях или дрожжах, у субъекта-человека ниже, поскольку гликозилирование снижено. В некоторых вариантах осуществления частота ответов с гиперчувствительностью у субъектов-людей ниже после лечения мутантным ферритином с пониженным гликозилированием по сравнению с ферритином дикого типа.
[00187] В некоторых вариантах осуществления у субъекта деградация композиции, содержащей мутантный ферритин с пониженным гликозилированием, происходит медленнее по сравнению с композицией, содержащей ферритин дикого типа, или композицией, содержащей соответствующий ферритин с гликозилированием дикого типа. В некоторых вариантах осуществления композиция, содержащая мутантный ферритин с пониженным гликозилированием, характеризуется пониженным клиренсом у субъекта по сравнению с композицией, содержащей ферритин дикого типа, или композицией, содержащей соответствующий ферритин с гликозилированием дикого типа. В некоторых вариантах осуществления композиция, содержащая мутантный ферритин с пониженным гликозилированием, характеризуется более длительным периодом полужизни в сыворотке крови по сравнению с ферритином дикого типа или композицией, содержащей соответствующий ферритин с гликозилированием дикого типа.
(4) Комбинации мутаций
[00188] В некоторых вариантах осуществления ферритин включает более одного типа мутаций, описанных в данном документе. В некоторых вариантах осуществления ферритин содержит одну или несколько мутаций, независимо выбранных из мутации для снижения гликозилирования, мутации для удаления внутреннего цистеина и мутации для образования экспонированного на поверхности цистеина. В некоторых вариантах осуществления ферритин содержит мутацию для снижения гликозилирования, мутацию для удаления внутреннего цистеина и мутацию для образования экспонированного на поверхности цистеина.
[00189] В некоторых вариантах осуществления ферритин включает мутацию N19Q, мутацию C31S и мутацию для образования экспонированного на поверхности цистеина. В некоторых вариантах осуществления ферритин включает мутацию N19Q, мутацию C31S и мутацию E12C. В некоторых вариантах осуществления ферритин включает мутацию N19Q, мутацию C31S и мутацию S72C. В некоторых вариантах осуществления ферритин включает мутацию N19Q, мутацию C31S и мутацию A75C. В некоторых вариантах осуществления ферритин включает мутацию N19Q, мутацию C31S и мутацию K79C. В некоторых вариантах осуществления ферритин включает мутацию N19Q, мутацию C31S и мутацию S100C. В некоторых вариантах осуществления ферритин включает мутацию N19Q, мутацию C31S и мутацию S111C. В некоторых вариантах осуществления ферритин включает мутации, соответствующие любой из упомянутых выше групп мутаций, где соответствующие мутации изменяют N на Q, C на S и отличную от цистеина экспонированную на поверхности аминокислоту на цистеин в положениях, определенных посредством парного выравнивания аминокислотной последовательности ферритина с аминокислотной последовательностью ферритина из H. pylori (SEQ ID NO: 208 или 209).
[00190] Иллюстративные ферритины, включающие более одного типа мутаций, представлены под SEQ ID NO: 201-207.
3. Структурное выравнивание
[00191] Как обсуждается в данном документе, положения мутаций, соответствующие положениям мутаций, описанным по отношению к данному полипептиду (например, ферритину из H. pylori), можно идентифицировать посредством попарного или структурного выравнивания. Структурное выравнивание релевантно в случае крупных семейств белков, таких как ферритин, где белки характеризуются сходной структурой, несмотря на значительную вариацию последовательностей, и многие представители семейства были структурно охарактеризованы, а также его можно применять для идентификации соответствующих положений в различных вариантах других полипептидов, описанных в данном документе, таких как полипептиды Borrelia (например, OspA). База данных "Protein databank" (PDB) содержит 3D-структуры многих ферритинов, включая перечисленные ниже с их номерами доступа.
[00192] 2jd6, 2jd7 - PfFR - Pyrococcus furiosus. 2jd8 - PfFR+Zn. 3a68 - soFR из гена SferH4 - соя. 3a9q - soFR из гена SferH4 (мутантного). 3egm, 3bvf, 3bvi, 3bvk, 3bvl - HpFR - Heliobacter pylori. 5c6f - HpFR (мутантный) + Fe. 1z4a, 1vlg - FR - Thermotoga maritime. 1s3q, 1sq3, 3kx9 - FR - Archaeoglubus fulgidus. 1krq - FR - Campylobacter jejuni. 1eum - EcFR - Escherichia coli. 4reu - EcFR+Fe. 4xgs - EcFR (мутантный) + Fe2O2. 4ztt - EcFR (мутантный) + Fe2O+Fe2+Fe+O2. 1qgh - LiFR - Listeria innocua. 3qz3 - VcFR - Vibrio cholerae. 3vnx - FR - Ulva pertusa. 4ism, 4isp, 4itt, 4itw, 4iwj, 4iwk, 4ixk, 3e6s - PnmFR - смешанный род Pseudo-nitschia. 4zkh, 4zkw, 4zkx, 4zl5, 4zl6, 4zlw, 4zmc - PnmFR (мутантный) + Fe. 1z6o - FR - Trichoplusia ni. 4cmy - FR+Fe - Chlorobaculum tepidum. Легкая цепь ферритина (FTL). 1lb3, 1h96 - mFTL - мышь. 1rcc, 1rcd, 1rci - bFTL+тартрат+Mg. 1rce, 1rcg - bFTL+тартрат+Mn. 3noz, 3np0, 3np2, 3o7r - hoFTL (мутантный) - лошадь. 3o7s, 3u90 - hoFTL. 4v1w - hoFTL - cryo EM. 3rav, 3rd0 - hoFTL+барбитурат. Легкие цепи ферритина+тяжелые цепи ферритина: 5gn8 - hFTH+Ca.
[00193] Структурное выравнивание включает идентификацию соответствующих остатков в двух (или более) полипептидных последовательностях посредством (i) моделирования структуры первой последовательности с применением известной структуры второй последовательности или (ii) сравнения структур первой и второй последовательностей, где обе известны, и идентификацию остатка в первой последовательности, расположенного наиболее сходно с представляющим интерес остатком во второй последовательности. Соответствующие остатки идентифицируют с помощью некоторых алгоритмов на основе минимизации расстояния между альфа-атомами углерода в перекрывающихся структурах (например, какой набор парных альфа-атомов углерода обеспечивает минимизированное среднеквадратичное отклонение для выравнивания). При идентификации положений в ферритине, отличном от ферритина из H. pylori, соответствующих положениям, описанным по отношению к ферритину из H. pylori, ферритин из H. pylori может представлять собой "вторую" последовательность. Если представляющий интерес ферритин, отличный от ферритина из H. pylori, не имеет доступной известной структуры, но является близкородственным по отношению к другому ферритину, отличному от ферритина из H. pylori, который имеет известную структуру по сравнению с ферритином из H. pylori, то может быть наиболее эффективным моделирование представляющего интерес ферритина, отличного от ферритина из H. pylori, с применением известной структуры близкородственного ферритина, отличного от ферритина из H. pylori, а затем сравнение этой модели со структурой ферритина из H. pylori для идентификации необходимого соответствующего остатка в представляющем интерес ферритине. Имеется обширная литература по структурному моделированию и выравниванию; иллюстративные раскрытия включают US 6859736; US 8738343; и раскрытия, которые цитируются в Aslam et al., Electronic Journal of Biotechnology 20 (2016) 9-13. Для обсуждения моделирования структуры на основании известной родственной структуры или структур см., например, Bordoli et al., Nature Protocols 4 (2009) 1-13, и цитируемые в нем ссылки.
4. Лумазинсинтаза
[00194] В некоторых вариантах осуществления антигенный полипептид включает белок лумазинсинтазу (см. Ra et al., Clin Exp Vaccine Res 3:227-234 (2014)). В некоторых вариантах осуществления этот белок представляет собой лумазинсинтазу серотипа 1, 2, 3, 4, 5, 6 или 7. Иллюстративные последовательности лумазинсинтазы предусмотрены как SEQ ID NO: 216 и 219. В некоторых вариантах осуществления лумазинсинтаза включает последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с SEQ ID NO: 216 или 219. Лумазинсинтазы способны образовывать структуры более высокого порядка, например, лумазинсинтазную частицу из 60 субъединиц. Иллюстративные лумазинсинтазы представляют собой лумазинсинтазу Aquifex aeolicus и лумазинсинтазу E. coli. Лумазинсинтаза может быть расположена С-терминально относительно OspA (например, последовательность, включающая эктодомен OspA, такой как полноразмерный OspA) и может быть отделена от OspA посредством линкера, как обсуждается в данном документе. Иллюстративные антигенные полипептиды, включающие белок лумазинсинтазу, представляют собой SEQ ID NO: 12-21. В некоторых вариантах осуществления антигенный полипептид включает последовательность с 80%, 85%, 90%, 95%, 98% или 99% идентичностью с любой из SEQ ID NO: 12-21.
5. Линкер
[00195] В некоторых вариантах осуществления ферритин или лумазинсинтаза объединены (например, слиты) с OspA (например, с последовательностью, включающей эктодомен OspA, такой как полноразмерный OspA) посредством линкера.
[00196] В некоторых вариантах осуществления линкер отделяет аминокислотную последовательность полипептида, отличного от ферритина (например, OspA), от аминокислотной последовательности ферритина. Можно применять любой линкер. В некоторых вариантах осуществления линкер представляет собой пептидный линкер, который может способствовать экспрессии антигенного полипептида на основе последовательности ферритина в виде слитого белка (например, из одной открытой рамки считывания). В некоторых вариантах осуществления линкер представляет собой глицин-сериновый линкер. В некоторых вариантах осуществления глицин-сериновый линкер представляет собой GS, GGGS (SEQ ID NO: 226), 2XGGGS (SEQ ID NO: 91) (т.е. GGGSGGGS (SEQ ID NO: 91)) или 5XGGGS (SEQ ID NO: 92). Линкер может быть расположен N- или C-терминально относительно ферритина.
[00197] В некоторых вариантах осуществления длина линкера составляет 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот. В некоторых вариантах осуществления длина линкера составляет приблизительно 2-4, 2-6, 2-8, 2-10, 2-12 или 2-14 аминокислот. В некоторых вариантах осуществления длина линкера составляет по меньшей мере 15 аминокислот. В некоторых вариантах осуществления длина линкера составляет по меньшей мере 25 аминокислот. В некоторых вариантах осуществления длина линкера составляет по меньшей мере 30 аминокислот. В некоторых вариантах осуществления длина линкера составляет по меньшей мере 35 аминокислот. В некоторых вариантах осуществления длина линкера составляет по меньшей мере 40 аминокислот. В некоторых вариантах осуществления длина линкера составляет менее 60 аминокислот или равна 60 аминокислотам. В некоторых вариантах осуществления длина линкера составляет менее 50 аминокислот или равна 50 аминокислотам. В некоторых вариантах осуществления длина линкера составляет приблизительно 16, 28, 40, 46 или 47 аминокислот. В некоторых вариантах осуществления линкер является гибким. В некоторых вариантах осуществления линкер включает цистеин, например, для применения в качестве сайта для конъюгации иммуностимулирующего фрагмента (например, адъюванта); иллюстративный линкер, включающий цистеин, предусмотрен как SEQ ID NO: 225. В некоторых вариантах осуществления линкер включает последовательность с по меньшей мере 75%, 80%, 85%, 90% или 95% идентичностью с SEQ ID NO: 225 и дополнительно включает цистеин, соответствующий цистеину в SEQ ID NO: 225. В некоторых вариантах осуществления линкер включает по меньшей мере 25 аминокислот (например, 25-60 аминокислот), где цистеин расположен в положении, варьирующем от 8-ой аминокислоты с N-конца до 8-ой аминокислоты с С-конца, или в пределах 10 аминокислот от центрального остатка или связи с линкером.
[00198] В некоторых вариантах осуществления линкер включает аминокислоты глицин (G) и/или серин (S). В некоторых вариантах осуществления линкер включает аминокислоты глицин (G), серин (S), аспарагин (N) и/или аланин (A) и необязательно цистеин, или состоит из них, как обсуждалось выше. В некоторых вариантах осуществления линкер включает аминокислотную последовательность с по меньшей мере 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% идентичностью с SEQ ID NO: 222. В некоторых вариантах осуществления линкер представляет собой ggggsggggsggggsg (SEQ ID No: 220), ggsgsgsnssassgassggasggsggsg (SEQ ID No: 221), ggsgsassgasasgssngsgsgsgsnssassgassggasggsggsg (SEQ ID No: 222) или GS. В некоторых вариантах осуществления линкер представляет собой FR1 (SEQ ID NO: 223) или FR2 (SEQ ID NO: 224).
[00199] В некоторых вариантах осуществления ферритин включает ферритин из H. pylori с аминоконцевым удлинением из ферритина лягушки-быка (который будет называться гибридным ферритином). В некоторых вариантах осуществления этот гибридный ферритин образует мультимеры с сайтами присоединения полипептида, отличного от ферритина, равномерно распределенными по поверхности (см. Kanekiyo 2015). В некоторых вариантах осуществления N-концевые слитые белки с гибридным ферритином обеспечивают представление полипептида, отличного от ферритина, на поверхности ферритиновой наночастицы. В некоторых вариантах осуществления полипептид, отличный от ферритина, представляет собой вирусный или бактериальный полипептид. В некоторых вариантах осуществления ферритин включает глутамат в положении, соответствующем положению 13 из SEQ ID NO: 208 (гибридный ферритин, который включает этот глутамат), или в положении 6 в SEQ ID NO: 209 (ферритин из H. pylori дикого типа, в котором в положении 6 находится изолейцин). Считается, что в комбинации с линкером лягушки-быка этот глутамат сохраняет консервативный солевой мостик, обнаруженный в ферритинах человека и лягушки-быка (6R и 14E как в легкой цепи человеческого ферритина, так и в ферритинах лягушки-быка с меньшим количеством субъединиц). См. Kanekiyo et al., Cell 162, 1090-1100 (2015)).
[00200] В некоторых вариантах осуществления антигенный полипептид на основе последовательности OspA связан с ферритином посредством цистеин-тромбин-гистидинового линкера. В некоторых вариантах осуществления этот линкер применяется непосредственно для конъюгации фрагмента (например, иммуностимулирующего фрагмента или полипептида, отличного от ферритина) с ферритином с помощью клик-химии. Иллюстративная последовательность, включающая цистеин-тромбин-гистидиновый линкер, представляет собой SEQ ID NO: 218. Клик-химия, подходящая для реакций конъюгации с участием цистеин-тромбин-гистидинового линкера, обсуждается выше.
[00201] В некоторых вариантах осуществления линкер, содержащий цистеин в качестве сайта конъюгации для иммуностимулирующего фрагмента, такого как адъювант, применяется в конструкции, содержащей молекулу ферритина, не имеющую непарного экспонированного на поверхности цистеина, или в конструкции, содержащей молекулу ферритина, содержащую неспаренный экспонированный на поверхности цистеин.
[00202] В некоторых вариантах осуществления конструкция не включает линкер. В некоторых вариантах осуществления конструкция включает один линкер. В некоторых вариантах осуществления конструкция включает два линкера или более двух линкеров.
6. Иммуностимулирующие фрагменты; адъюванты; конъюгированные полипептиды
[00203] В некоторых вариантах осуществления полипептид, отличный от ферритина (например, полипептид OspA), и/или иммуностимулирующий фрагмент, такой как адъювант, присоединяются к экспонированной на поверхности аминокислоте в ферритине или линкере. В некоторых вариантах осуществления экспонированная на поверхности аминокислота представляет собой цистеин, например, полученный в результате мутации, обсуждаемой выше. В некоторых вариантах осуществления экспонированная на поверхности аминокислота представляет собой лизин, аспартат или глутамат. Процедуры конъюгации с применением глутаральдегида (для конъюгации лизина с линкером, несущим аминогруппу, или фрагментом) или карбодиимида (например, 1-циклогексил-3-(2-морфолин-4-ил-этил)карбодиимида или 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC; EDAC) для конъюгации аспартата или глутамата с линкером, несущим аминогруппу, или фрагментом, или лизина с линкером, несущим аминогруппу, или фрагментом) описаны, например, в главе 4 в Holtzhauer, M., Basic Methods for the Biochemical Lab, Springer 2006, ISBN 978-3-540-32785-1, доступном в сети Интернет по адресу atspringer.com.
[00204] В некоторых вариантах осуществления иммуностимулирующий фрагмент, такой как адъювант, присоединен к экспонированной на поверхности аминокислоте в ферритине. В некоторых вариантах осуществления более чем один иммуностимулирующий фрагмент, такой как адъювант, присоединен к экспонированной на поверхности аминокислоте в ферритине. В некоторых вариантах осуществления двадцать четыре иммуностимулирующих фрагмента присоединены к ферритиновому мультимеру или ферритиновой частице (например, по одному фрагменту для каждого мономера в частице с ферритином из H. pylori). В некоторых вариантах осуществления с множеством иммуностимулирующих фрагментов, присоединенных к ферритиновой наночастице, все иммуностимулирующие фрагменты идентичны. В некоторых вариантах осуществления с множеством иммуностимулирующих фрагментов, присоединенных к ферритиновой наночастице, все иммуностимулирующие фрагменты не идентичны.
Типы иммуностимулирующих фрагментов; адъюванты
[00205] Любой иммуностимулирующий фрагмент, который может быть присоединен к экспонированной на поверхности аминокислоте (например, цистеину), можно применять в ферритинах (или линкерах) в соответствии с настоящим изобретением. В некоторых вариантах осуществления иммуностимулирующий фрагмент является B-клеточным агонистом.
[00206] В некоторых вариантах осуществления иммуностимулирующий фрагмент не является гидрофобным. В некоторых вариантах осуществления иммуностимулирующий фрагмент является гидрофильным. В некоторых вариантах осуществления иммуностимулирующих фрагмент является полярным. В некоторых вариантах осуществления иммуностимулирующий фрагмент способен к образованию водородной связи или ионной связи, например, содержит донор водородной связи, акцептор водородной связи, катионный фрагмент или анионный фрагмент. Фрагмент считается катионным или анионным, если он будет ионизироваться в водном растворе при физиологически релевантном pH, таком как pH 6, 7, 7,4 или 8.
[00207] В некоторых вариантах осуществления иммуностимулирующий фрагмент представляет собой адъювант. В некоторых вариантах осуществления адъювант включает молекулярный паттерн, связанный с патогеном (PAMP). В некоторых вариантах осуществления адъювант является агонистом Toll-подобного рецептора (TLR) или стимулятором агониста генов интерферонов (STING). В некоторых вариантах осуществления адъювант активирует передачу сигнала TLR в B- и/или T-клетках. В некоторых вариантах осуществления адъювант регулирует адаптивный иммунный ответ.
(1) Агонисты TLR2
[00208] В некоторых вариантах осуществления иммуностимулирующий фрагмент является агонистом TLR2. В некоторых вариантах осуществления иммуностимулирующий фрагмент стимулирует передачу сигнала TLR2. В некоторых вариантах осуществления иммуностимулирующий фрагмент представляет собой синтетический низкомолекулярный лиганд TLR2. В некоторых вариантах осуществления иммуностимулирующий фрагмент является синтетическим низкомолекулярным агонистом передачи сигнала TLR2.
[00209] В некоторых вариантах осуществления агонист TLR2 представляет собой PAM2CSK4, FSL-1 или PAM3CSK4.
(2) Агонисты TLR7/8
[00210] В некоторых вариантах осуществления иммуностимулирующий фрагмент является агонистом TLR7 и/или TLR8 (т.е. агонистом по меньшей мере одного из TLR7 и TLR8). В некоторых вариантах осуществления иммуностимулирующий фрагмент стимулирует передачу сигнала TLR7 и/или TLR8. В некоторых вариантах осуществления иммуностимулирующий фрагмент представляет собой синтетический низкомолекулярный лиганд TLR7 и/или TLR8. В некоторых вариантах осуществления иммуностимулирующий фрагмент является синтетическим низкомолекулярным агонистом передачи сигнала TLR7 и/или TLR8.
[00211] В некоторых вариантах осуществления агонист TLR7 и/или TLR8 представляет собой однонитевую РНК (ssRNA). В некоторых вариантах осуществления агонист TLR7 и/или TLR8 представляет собой имидазохинолин. В некоторых вариантах осуществления агонист TLR7 и/или TLR8 представляет собой аналог нуклеозида.
[00212] В некоторых вариантах осуществления агонист TLR7 и/или TLR8 является имидазохинолинаминовым агонистом Toll-подобного рецептора (TLR), таким как 3M-012 (3M Pharmaceuticals). Структура свободного 3M-012 представляет собой:
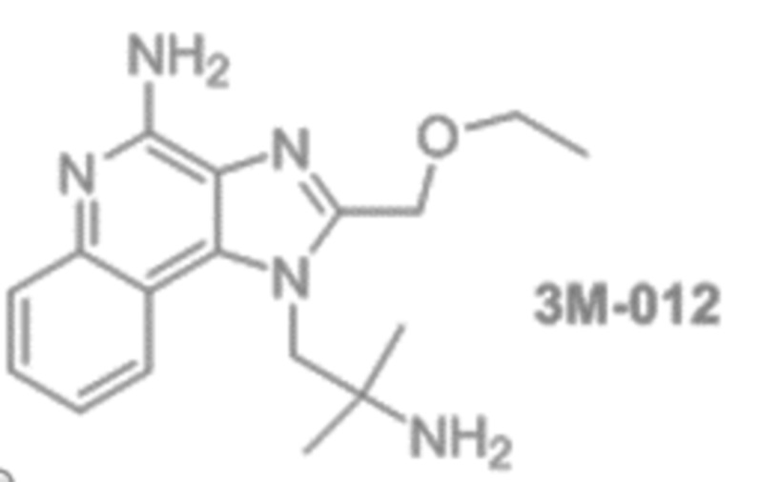 .
.
Следует понимать, что иммуностимулирующий фрагмент, такой как 3M-012 или любой фрагмент, обсуждаемый в данном документе, может быть конъюгирован с ферритином посредством замещения соответствующего периферического атома фрагмента (например, водорода) связью с ферритином, описанным в данном документе, например, по атому серы экспонированного на поверхности цистеина или по линкеру, присоединенному к такому атому серы. Таким образом, при конъюгации с ферритином структура иммуностимулирующего фрагмента будет немного отличаться от структуры свободной молекулы.
[00213] В некоторых вариантах осуществления агонист TLR7 и/или TLR8 представляет собой SM7/8a. Структура свободного SM7/8a представляет собой:
 .
.
[00214] См., например, Lynn et al., Nat Biotechnol. 2015 Nov; 33(11):1201-10. doi: 10.1038/nbt.3371.
(3) Агонисты TLR9
[00215] В некоторых вариантах осуществления иммуностимулирующий фрагмент является агонистом TLR9. В некоторых вариантах осуществления иммуностимулирующий фрагмент стимулирует передачу сигнала TLR9. В некоторых вариантах осуществления иммуностимулирующий фрагмент представляет собой синтетический низкомолекулярный лиганд TLR9. В некоторых вариантах осуществления иммуностимулирующий фрагмент является синтетическим низкомолекулярным агонистом передачи сигнала TLR9.
[00216] В некоторых вариантах осуществления агонист TLR9 представляет собой олигодезоксинуклеотид CpG (ODN). В некоторых вариантах осуществления агонист TLR9 представляет собой неметилированный ODN CpG. В некоторых вариантах осуществления ODN CpG включает частичный или полный фосфоротиоатный (PS) остов вместо природного фосфодиэфирного (PO) остова, обнаруженного в обычной ДНК.
[00217] В некоторых вариантах осуществления ODN CpG представляет собой ODN класса B, который включает один или несколько 6-мерных мотивов CpG, содержащих 5'-пурин (Pu)-пиримидин (Py)-C-G-Py-Pu-3'; имеет полностью фосфоротиоатный (т. е. PS-модифицированный) остов, и его длина составляет 18-28 нуклеотидов. В некоторых вариантах осуществления ODN CpG включает последовательность под SEQ ID NO: 210, необязательно содержащую фосфоротиоатные связи в остове.
[00218] В некоторых вариантах осуществления агонист TLR9 включает иммуностимулирующую последовательность (ISS). В некоторых вариантах осуществления агонист TLR9 представляет собой ISS-1018 (Dynavax) (SEQ ID NO: 210).
(4) Агонисты STING
[00219] В некоторых вариантах осуществления иммуностимулирующий фрагмент является агонистом STING (стимулятор белка генов интерферонов, также известный как стимулятор IFN эндоплазматического ретикулума). В некоторых вариантах осуществления иммуностимулирующий фрагмент стимулирует передачу сигнала STING. В некоторых вариантах осуществления иммуностимулирующий фрагмент представляет собой синтетический низкомолекулярный лиганд STING. В некоторых вариантах осуществления иммуностимулирующий фрагмент является синтетическим низкомолекулярным агонистом передачи сигнала STING.
[00220] В некоторых вариантах осуществления агонист STING представляет собой циклический динуклеотид (CDN). См., например, Danilchanka et al., Cell 154:962-970 (2013). Иллюстративные CDN включают cdA, cdG, cAMP-cGMP и 2'-5',3'-5'-cGAMP (структуры см. в Danilchanka et al.). Агонисты STING также включают синтетические агонисты, такие как DMXAA
 .
.
Конъюгированные полипептиды, отличные от ферритина
[00221] В некоторых вариантах осуществления антигенный полипептид на основе последовательности OspA конъюгирован с экспонированной на поверхности аминокислотой в ферритине. В некоторых вариантах осуществления антигенный полипептид на основе последовательности OspA является антигенным как таковой, тогда как в некоторых вариантах осуществления антигенный полипептид на основе последовательности OspA является антигенным, поскольку связан с ферритином.
7. Конъюгация
[00222] В некоторых вариантах осуществления экспонированный на поверхности цистеин применяется для конъюгации иммуностимулирующего фрагмента, такого как адъювант или антигенный полипептид на основе последовательности OspA, с ферритином. В некоторых вариантах осуществления экспонированный на поверхности цистеин применяется для конъюгации линкера с ферритином, при этом линкер может быть впоследствии конъюгирован с иммуностимулирующим фрагментом, таким как адъювант, или антигенным полипептидом на основе последовательности OspA. В некоторых вариантах осуществления экспонированный на поверхности цистеин обеспечивает химический механизм для реакций конъюгации для присоединения адъюванта, линкера или антигенного полипептида на основе последовательности OspA.
[00223] В некоторых вариантах осуществления получают биоконъюгаты, где иммуностимулирующий фрагмент, такой как адъювант, или антигенный полипептид на основе последовательности OspA связаны с ферритином после восстановления неспаренного экспонированного на поверхности цистеина в ферритине. Неспаренный экспонированный на поверхности цистеин представляет собой цистеин, у которого отсутствует цистеин-партнер в подходящем положении для образования дисульфидной связи. В некоторых вариантах осуществления неспаренный цистеин включает свободную тиольную боковую цепь.
Типы химии конъюгации
[00224] Для конъюгации иммуностимулирующего фрагмента, такого как адъювант, или антигенного полипептида на основе последовательности OspA с ферритином можно применять любой тип химии, например, посредством осуществления реакции с участием экспонированной на поверхности аминокислоты, такой как цистеин, или другой аминокислоты, такой как Lys, Glu или Asp.
[00225] В некоторых вариантах осуществления конъюгацию осуществляют с применением клик-химии. Применяемый в данном документе термин "клик-химия" относится к реакции между парой функциональных групп, которые быстро и селективно реагируют (т. е. "клик") друг с другом. В некоторых вариантах осуществления клик-химию можно осуществлять в мягких водных условиях. В некоторых вариантах осуществления в реакции клик-химии применяется преимущество цистеина на поверхности ферритина, такого как цистеин, возникающий в результате мутации экспонированной на поверхности аминокислоты, для осуществления клик-химии с применением функциональной группы, которая способна реагировать с цистеином.
[00226] Из уровня техники известны различные реакции, удовлетворяющие критериям клик-химии, и специалист в данной области техники может применять любую из ряда опубликованных методик (см., например, Hein et al., Pharm Res 25(10):2216-2230 (2008)). Можно применять широкий спектр коммерчески доступных реагентов для клик-химии, например, от Sigma Aldrich, Jena Bioscience или Lumiprobe. В некоторых вариантах осуществления конъюгацию осуществляют с применением клик-химии, как описано в примерах ниже.
[00227] В некоторых вариантах осуществления реакция клик-химии происходит после восстановления ферритина.
[00228] В некоторых вариантах осуществления клик-химия может представлять собой 1-стадийную клик-реакцию. В некоторых вариантах осуществления клик-химия может представлять собой 2-стадийную клик-реакцию.
[00229] В некоторых вариантах осуществления реакция(реакции) включает(включают) клик-химию без участия металла. В некоторых вариантах осуществления реакция(реакции) включает(включают) тиол-малеимидный и/или дисульфидный обмен.
Клик-химия без участия металла
[00230] Клик-химию без участия металла можно применять для реакций конъюгации во избежание потенциального окисления белков. Клик-химию без участия металла применяли для образования конъюгатов антител (см van Geel et al., Bioconjugate Chem. 2015, 26, 2233−2242).
[00231] В некоторых вариантах осуществления клик-химию без участия металла применяют в реакциях для присоединения адъюванта к ферритину. В некоторых вариантах осуществления конъюгацию без участия меди применяют в реакциях для присоединения адъюванта к ферритину. В некоторых вариантах осуществления в клик-химии без участия металла применяют бицикло[6.1.0]нонин (BCN). В некоторых вариантах осуществления в клик-химии без участия металла применяют дибензоазациклооктин (DBCO). В некоторых вариантах осуществления BCN или DBCO реагируют с азидной группой.
[00232] DBCO характеризуется высокой специфичностью к азидным группам за счет стимулируемой напряжением клик-реакции в отсутствие катализатора, что приводит к высокому выходу стабильного триазола. В некоторых вариантах осуществления DBCO реагирует с азидом в отсутствие медного катализатора.
[00233] В некоторых вариантах осуществления клик-химию без участия металла применяют в 1-стадийной клик-реакции. В некоторых вариантах осуществления клик-химию без участия металла применяют в 2-стадийной клик-реакции.
Тиол-малеимидный и дисульфидный обмен
[00234] Ферритины, описанные в данном документе, могут включать цистеин, включающий тиол, также известный как сульфгидрил, который доступен для реакции с реагирующими с сулфгидрилом химическими группами (или который можно сделать доступным посредством восстановления). Таким образом, цистеин обеспечивает хемоселективную модификацию с добавлением иммуностимулирующего фрагмента, такого как адъювант, к ферритину. В основных условиях цистеин будет депротонирован с образованием тиолатного нуклеофила, который способен реагировать с мягкими электрофилами, такими как малеимиды и йодацетамиды. Реакция цистеина с малеимидом или йодацетамидом приводит к образованию связи углерод-сера.
[00235] В некоторых вариантах осуществления реагирующая с сульфгидрилом химическая группа реагирует с экспонированным на поверхности цистеином или цистеином в линкере ферритина. В некоторых вариантах осуществления реагирующая с сульфгидрилом химическая группа представляет собой галогенацетил, малеимид, азиридин, акрилоил, арилирующее средство, винилсульфон, пиридилдисульфид или TNB-тиол.
[00236] В некоторых вариантах осуществления реагирующая с сульфгидрилом химическая группа конъюгирует с сульфгидрилом цистеина посредством алкилирования (т.е. образования тиоэфирной связи). В некоторых вариантах осуществления реагирующая с сульфгидрилом химическая группа конъюгирует с сульфгидрилом цистеина посредством дисульфидного обмена (т.е. образования дисульфидной связи).
[00237] В некоторых вариантах осуществления реакция для конъюгации иммуностимулирующего фрагмента, такого как адъювант, с ферритином, представляет собой реакцию тиола с малеимидом.
[00238] В некоторых вариантах осуществления реагирующая с сульфгидрилом химическая группа представляет собой малеимид. В некоторых вариантах осуществления реакция малеимида с цистеином приводит к образованию стабильной тиоэфирной связи, например, которая является необратимой. В некоторых вариантах осуществления малеимид не реагирует с тирозинами, гистидинами или метионинами в ферритине. В некоторых вариантах осуществления непрореагировавшие малеимиды гасят по окончанию реакции посредством добавления свободного тиола, например, в избытке.
[00239] В некоторых вариантах осуществления реакция для конъюгации иммуностимулирующего фрагмента, такого как адъювант, с ферритином, представляет собой тиол-дисульфидный обмен, также известный как дисульфидный обмен. В некоторых вариантах осуществления реакция включает образование смешанного дисульфида, содержащего часть исходного дисульфида. В некоторых вариантах осуществления исходный дисульфид представляет собой цистеин, встроенный в ферритин посредством мутации экспонированной на поверхности аминокислоты или добавления N-концевого линкера.
[00240] В некоторых вариантах осуществления реагирующая с сульфгидрилом химическая группа представляет собой пиридилдитиол. В некоторых вариантах осуществления реагирующая с сульфгидрилом химическая группа представляет собой TNB-тиольную группу.
Линкеры
[00241] В некоторых вариантах осуществления иммуностимулирующий фрагмент, такой как адъювант, или антигенный полипептид на основе последовательности OspA присоединены к ферритину посредством линкера, который ковалентно связан с экспонированной на поверхности аминокислотой, такой как цистеин. В некоторых вариантах осуществления линкер включает полиэтиленгликоль, например, PEG-линкер. В некоторых вариантах осуществления полиэтиленгликолевый (например, PEG) линкер усиливает растворимость в воде и эффективность лигирования ферритина, связанного с иммуностимулирующим фрагментом, таким как адъювант. Длина PEG-линкера составляет 2-18 PEG, например, PEG4, PEG5, PEG6, PEG7, PEG8, PEG9, PEG10, PEG11, PEG12, PEG13, PEG14, PEG15, PEG16, PEG17 и PEG18.
[00242] В некоторых вариантах осуществления линкер содержит малеимид. В некоторых вариантах осуществления линкер содержит компоненты иммуностимулирующего фрагмента, представляющего собой (ISM)-линкер-малеимид. В некоторых вариантах осуществления ISM-линкер-малеимид конъюгируют с ферритином в 1-стадийной реакции клик-химии посредством осуществления реакции малеимида с цистеином в ферритине. В некоторых вариантах осуществления ISM из адъювант-линкер-малеимида представляет собой SM7/8a. В некоторых вариантах осуществления линкер из ISM-линкер-малеимида представляет собой PEG4. В некоторых вариантах осуществления ISM-линкер-малеимид представляет собой SM7/8a-PEG4-малеимид.
[00243] В некоторых вариантах осуществления протокол 2-стадийной клик-химии применяют с линкером, включающим реагирующую с сульфгидрилом химическую группу на одном конце и реагирующую с амином группу на другом конце. В таком протоколе 2-стадийной клик-химии реагирующая с сульфгидрилом химическая группа реагирует с цистеином в ферритине, тогда как реагирующая с амином группа реагирует с реагентом, присоединенным к ISM. Таким образом, ISM конъюгируют с ферритином с помощью набора из 2 реагентов для клик-химии.
[00244] В некоторых вариантах осуществления протокола 2-стадийной клик-химии реагирующая с сульфгидрилом химическая группа представляет собой малеимид. В некоторых вариантах осуществления протокола 2-стадийной клик-химии малеимид реагирует с цистеином, встроенным в ферритин посредством мутации экспонированной на поверхности аминокислоты или добавления N-концевого линкера.
[00245] В некоторых вариантах осуществления протокола 2-стадийной клик-химии реагирующая с амином группа представляет собой DBCO. В некоторых вариантах осуществления протокола 2-стадийной клик-химии DBCO реагирует с азидной группой, присоединенной к ISM.
[00246] В некоторых вариантах осуществления применяется малеимид-линкер-DBCO. В некоторых вариантах осуществления малеимид-линкер-DBCO конъюгируют с ферритином после восстановления ферритина. В некоторых вариантах осуществления малеимид-линкер-реагент конъюгируют с ферритином посредством реакции малеимида с цистеином в ферритине на первой стадии. В некоторых вариантах осуществления DBCO применяется для связывания с ISM, присоединенным к азиду. В некоторых вариантах осуществления ISM, связанный с азидом, представляет собой ISS-1018. В некоторых вариантах осуществления адъювант, связанный с азидом, представляет собой 3M-012 или CpG.
[00247] В некоторых вариантах осуществления к ISM добавляют линкер с реакционноспособной группой. В некоторых вариантах осуществления линкер представляет собой PEG4-азидный линкер или PEG4-малеимидный линкер.
[00248] В некоторых вариантах осуществления PEG4-азидный линкер конъюгирован с 3M-012. Иллюстративная структура 3M-012, конъюгированного с PEG4-азидным линкером, представляет собой:
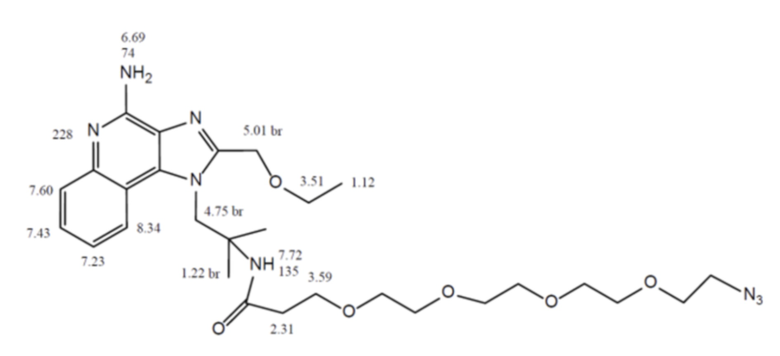
[00249] В некоторых вариантах осуществления PEG4-азидный линкер конъюгирован с SM7/8a. Иллюстративная структура SM7/8a, конъюгированного с PEG4-азидным линкером, представляет собой:
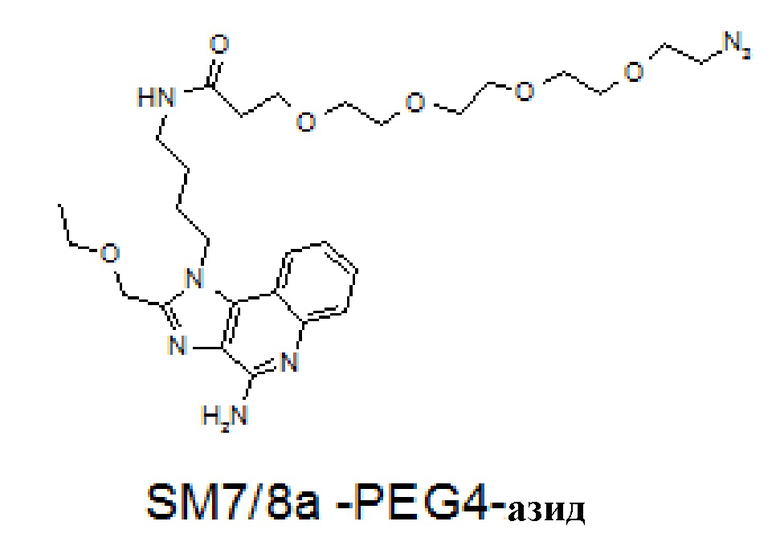
[00250] В некоторых вариантах осуществления PEG4-малеимидный линкер конъюгирован с SM7/8a. Иллюстративная структура SM7/8a, конъюгированного с PEG4-малеимидным линкером, представляет собой:
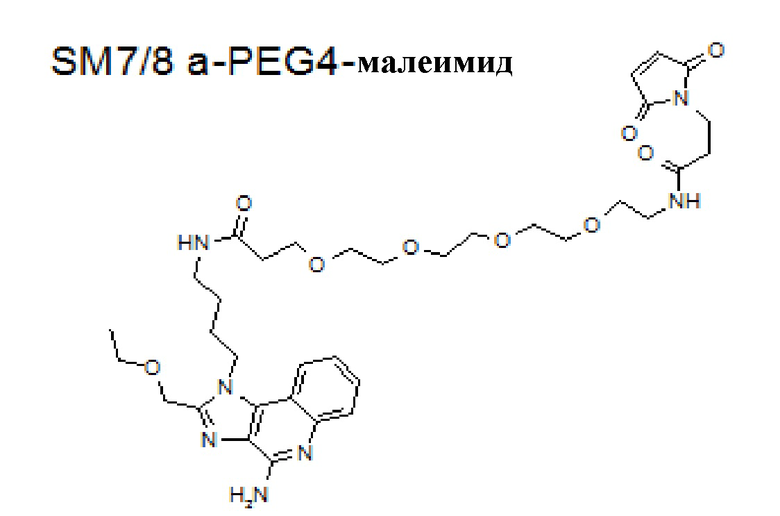
[00251] В некоторых вариантах осуществления азидная группа конъюгирована с ISS-1018. Иллюстративная структура ISS-1018, конъюгированного с NHS-эфир-азидным линкером, представляет собой:
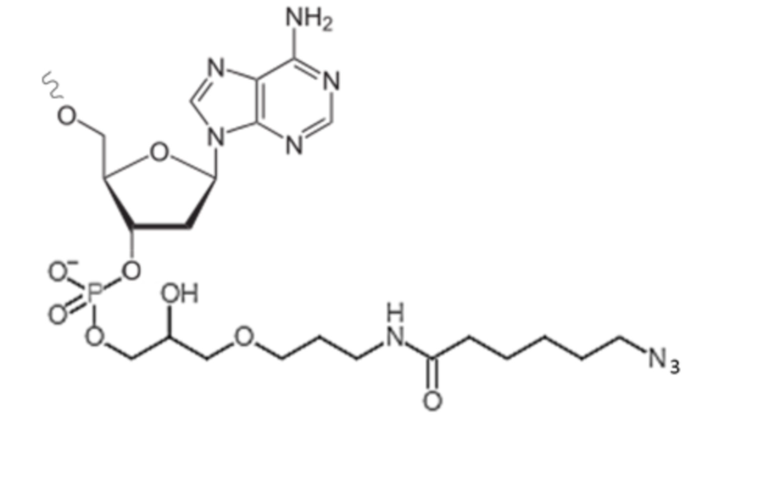
Иллюстративные композиции, наборы, нуклеиновые кислоты, пути применения и способы
[00252] В некоторых вариантах осуществления предусмотрена композиция, содержащая любой один или несколько из антигенных полипептидов, описанных в данном документе, и фармацевтически приемлемую среду-носитель, адъювант или вспомогательное вещество.
[00253] В некоторых вариантах осуществления антигенный полипептид или композицию, описанные в данном документе, вводят субъекту, такому как человек, для иммунизации против инфекции, вызываемой Borrelia, например, болезни Лайма. В некоторых вариантах осуществления антигенный полипептид, описанный в данном документе, вводят субъекту, такому как человек, для индукции защитного иммунного ответа на будущую инфекцию Borrelia. В некоторых вариантах осуществления вводят полипептид, включающий модифицированный полипептид OspA серотипа 1, как описано в данном документе. В некоторых вариантах осуществления вводят антигенный полипептид, включающий OspA и ферритин, как описано в данном документе.
[00254] В некоторых вариантах осуществления защитный иммунный ответ снижает частоту госпитализации. В некоторых вариантах осуществления защитный иммунный ответ снижает частоту возникновения острой или хронической болезни Лайма, включая воспаление суставов, неврологическое симптомы, когнитивные дефициты или нарушения сердечного ритма.
[00255] В некоторых вариантах осуществления композиция содержит полипептид OspA серотипа 1. В некоторых вариантах осуществления композиция содержит полипептид OspA серотипа 2. В некоторых вариантах осуществления композиция содержит полипептид OspA серотипа 3. В некоторых вариантах осуществления композиция содержит полипептид OspA серотипа 4. В некоторых вариантах осуществления композиция содержит полипептид OspA серотипа 5. В некоторых вариантах осуществления композиция содержит полипептид OspA серотипа 6. В некоторых вариантах осуществления композиция содержит полипептид OspA серотипа 7. В некоторых вариантах осуществления композиция содержит только один полипептид OspA. В некоторых вариантах осуществления композиция содержит один или несколько OspA серотипа 1, 2, 3, 4, 5, 6 и 7.
[00256] В некоторых вариантах осуществления композиция содержит более одного полипептида OspA, например, OspA более одного серотипа. В некоторых вариантах осуществления такая композиция обеспечивает вакцинацию против нескольких типов Borrelia, например, одного, двух, трех, четырех, пяти, шести или семи из серотипов 1-7. Поскольку серотипы OspA связаны с геновидами Borrelia (см. Wilske 1993), вакцинация такой композицией, содержащей OspA нескольких серотипов, может обеспечивать иммунитет к ряду бактерий, которые способны вызывать болезнь Лайма.
[00257] В некоторых вариантах осуществления композиция, содержащая OspA нескольких серотипов, обеспечивает иммунитет против Borrelia, которая экспрессирует OspA различных серотипов. Например, как это обсуждается в разделе "Примеры", наблюдалось, что композиция, содержащая полипептиды OspA серотипов 1-5 и 7, способна индуцировать образование антител, которые распознают OspA серотипа 6. В некоторых вариантах осуществления такая композиция обеспечивает иммунитет против нескольких геновидов Borrelia.
[00258] В некоторых вариантах осуществления композиция содержит OspA двух различных серотипов. В некоторых вариантах осуществления поливалентная композиция содержит OspA трех различных серотипов. В некоторых вариантах осуществления поливалентная композиция содержит OspA четырех различных серотипов. В некоторых вариантах осуществления поливалентная композиция содержит OspA пяти различных серотипов. В некоторых вариантах осуществления поливалентная композиция содержит OspA шести различных серотипов. В некоторых вариантах осуществления поливалентная композиция содержит OspA семи различных серотипов.
[00259] В некоторых вариантах осуществления композиция содержит OspA серотипа 1 и любой один или несколько из OspA серотипов 2-7. В некоторых вариантах осуществления композиция содержит OspA серотипа 2 и любой один или несколько из OspA серотипов 1 и 3-7. В некоторых вариантах осуществления композиция содержит OspA серотипа 3 и любой один или несколько из OspA серотипов 1-2 и 4-7. В некоторых вариантах осуществления композиция содержит OspA серотипа 4 и любой один или несколько из OspA серотипов 1-3 и 5-7. В некоторых вариантах осуществления композиция содержит OspA серотипа 5 и любой один или несколько из OspA серотипов 1-4 и 6-7. В некоторых вариантах осуществления композиция содержит OspA серотипа 6 и любой один или несколько из OspA серотипов 1-5 и 7. В некоторых вариантах осуществления композиция содержит OspA серотипа 7 и любой один или несколько из OspA серотипов 1-6. В некоторых вариантах осуществления композиция содержит по меньшей мере 2, 3, 4, 5 или 6 полипептидов OspA серотипов 1-5 и 7.
[00260] В некоторых вариантах осуществления предусмотрены любые один или несколько из антигенных полипептидов или композиций, описанных в данном документе, для применения для иммунизации против инфекции, вызываемой Borrelia, например, болезни Лайма. В некоторых вариантах осуществления предусмотрены любые один или несколько из антигенных полипептидов или композиций, описанных в данном документе, для применения для индукции защитного иммунного ответа на будущую инфекцию Borrelia. В некоторых вариантах осуществления любые один или несколько из антигенных полипептидов или композиций, описанных в данном документе, предназначены для применения у млекопитающего, такого как примат (например, отличный от человека примат, такой как обезьяна (например, макак, такой как макак-резус или яванский макак) или человекообразная обезьяна), грызун (например, мышь или крыса) или одомашненное млекопитающее (например, собака, кролик, кот, лошадь, овца, корова, коза, верблюд или осел).
1. Адъюванты
[00261] Адъювант можно вводить субъекту вместе с антигенными полипептидами, описанными в данном документе, где такое введение приводит к более высокому титру антител к OspA у субъекта по сравнению с введением OspA без адъюванта. Адъювант может способствовать более раннему, более сильному или более устойчивому иммунному ответу на OspA.
[00262] В некоторых вариантах осуществления композиция содержит один адъювант. В некоторых вариантах осуществления композиция содержит более одного адъюванта. В некоторых вариантах осуществления композиция не содержит адъювант.
[00263] В некоторых вариантах осуществления адъювант включает алюминий. В некоторых вариантах осуществления адъювант представляет собой фосфат алюминия. В некоторых вариантах осуществления адъювант представляет собой алюминиевые квасцы (Alyhydrogel '85 2%; Brenntag, № по каталогу 21645-51-2).
[00264] В некоторых вариантах осуществления адъювант представляет собой органический адъювант. В некоторых вариантах осуществления адъювант представляет собой адъювант на основе масла. В некоторых вариантах осуществления адъювант включает наноэмульсию типа масло-в-воде.
[00265] В некоторых вариантах осуществления адъювант включает сквален. В некоторых вариантах осуществления адъювант, включающий сквален, представляет собой Ribi (Sigma adjuvant system, № по каталогу S6322-1vl), AddaVaxTM (наноэмульсия типа масло-в-воде на основе сквалена), MF59, AS03 или AF03 (см. US9703095). В некоторых вариантах осуществления адъювант, включающий сквален, представляет собой наноэмульсию.
[00266] В некоторых вариантах осуществления адъювант включает полимер полиакриловой кислоты (PAA). В некоторых вариантах осуществления адъювант, включающий PAA, представляет собой SPA09 (см. WO 2017218819).
[00267] В некоторых вариантах осуществления адъювант включает неметаболизируемые масла. В некоторых вариантах осуществления адъювант представляет собой неполный адъювант Фрейнда (IFA).
[00268] В некоторых вариантах осуществления адъювант включает неметаболизируемые масла и убитую Mycobacterium tuberculosis. В некоторых вариантах осуществления адъювант представляет собой полный адъювант Фрейнда (CFA).
[00269] В некоторых вариантах осуществления адъювант представляет собой липополисахарид. В некоторых вариантах осуществления адъювант представляет собой монофосфорил A (MPL или MPLA).
2. Субъекты
[00270] В некоторых вариантах осуществления субъект представляет собой млекопитающее. В некоторых вариантах осуществления субъект является человеком.
[00271] В некоторых вариантах осуществления субъект является взрослым (в возрасте 18 лет или старше). В некоторых вариантах осуществления субъектом является ребенок или подросток (в возрасте младше 18 лет). В некоторых вариантах осуществления субъектом является пожилой человек (в возрасте старше 60 лет). В некоторых вариантах осуществления субъект является взрослым не пожилого возраста (в возрасте от 18 лет или старше до 60 лет или старше).
[00272] В некоторых вариантах осуществления субъекту осуществляют более одного введения композиции. В некоторых вариантах осуществления бустерное введение улучшает иммунный ответ.
[00273] В некоторых вариантах осуществления любые один или несколько из антигенных полипептидов или композиций, описанных в данном документе, предназначены для применения у млекопитающего, такого как примат (например, отличный от человека примат, такой как обезьяна (например, макак, такой как макак-резус или яванский макак) или человекообразная обезьяна), грызун (например, мышь или крыса) или одомашненное млекопитающее (например, собака, кролик, кот, лошадь, овца, корова, коза, верблюд или осел).
[00274] В некоторых вариантах осуществления композиция составлена подходящим образом для предполагаемого пути введения. Примеры подходящих путей введения включают внутримышечный, внутрикожный, подкожный, интраназальный, пероральный или трансдермальный.
[00275] В некоторых вариантах осуществления субъекту осуществляют более одного введения композиции. В некоторых вариантах осуществления бустерное введение улучшает иммунный ответ.
3. Фармацевтические композиции
[00276] В различных вариантах осуществления предусмотрена фармацевтическая композиция, содержащая антигенный полипептид на основе последовательности ферритина, описанный в данном документе, и/или родственные объекты. В некоторых вариантах осуществления фармацевтическая композиция представляет собой иммуногенную композицию (например, вакцину), способную вызывать иммунный ответ, такой как защитный иммунный ответ против Borrelia.
[00277] Например, в некоторых вариантах осуществления фармацевтические композиции могут содержать один или несколько из следующего: (1) антигенный белок ферритин, включающий (i) мутацию с заменой экспонированной на поверхности аминокислоты на цистеин, и (ii) антигенный полипептид на основе последовательности OspA; (2) антигенный белок ферритин, включающий (i) мутацию с заменой экспонированной на поверхности аминокислоты на цистеин, и иммуностимулирующий фрагмент, связанный с цистеином; и (ii) антигенный полипептид на основе последовательности OspA; (3) антигенный белок ферритин, включающий (i) экспонированный на поверхности цистеин, (ii) пептидный линкер N-терминально относительно белка ферритина и (iii) антигенный полипептид на основе последовательности OspA N-терминально относительно пептидного линкера; (4) антигенный белок ферритин, включающий (i) мутацию с заменой экспонированной на поверхности аминокислоты на цистеин, и иммуностимулирующий фрагмент, связанный с цистеином, (ii) мутацию с заменой внутреннего цистеина в положении 31 ферритина из H. pylori или мутацию с заменой внутреннего цистеина в положении, которое аналогично положению 31 ферритина, отличного от ферритина из H. pylori, как определено посредством парного или структурного выравнивания, на отличную от цистеина аминокислоту, (iii) мутацию с заменой экспонированного на поверхности аспарагина на отличную от аспарагина аминокислоту, и (iv) антигенный полипептид на основе последовательности OspA; или (5) ферритиновую частицу, содержащую любой из вышеупомянутых белков-ферритинов.
[00278] В некоторых вариантах осуществления в настоящем изобретении предусмотрены фармацевтические композиции, содержащие антитела или другие средства, родственные антигенным полипептидам, описанным в данном документе. В одном варианте осуществления фармацевтическая композиция содержит антитела, которые связываются с и/или конкурируют с антигенным полипептидом, описанным в данном документе. В качестве альтернативы, антитела способны распознавать вирусные частицы или бактерии, содержащие компонент антигенного полипептида, описанного в данном документе, представляющий собой полипептид, отличный от ферритина.
[00279] В некоторых вариантах осуществления фармацевтические композиции, описанные в данном документе, вводят отдельно или в комбинации с одним или несколькими средствами для усиления иммунного ответа, например, с адъювантом, описанным выше. В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит адъювант, описанный выше.
[00280] В некоторых вариантах осуществления фармацевтическая композиция дополнительно содержит фармацевтически приемлемый носитель или вспомогательное вещество. Применяемый в данном документе термин "носитель" относится к разбавителю, адъюванту, вспомогательному веществу или среде-носителю, с которыми вводят фармацевтическую композицию. В иллюстративных вариантах осуществления носители могут включать стерильные жидкости, такие как, например, вода и масла, в том числе масла нефтяного, животного, растительного или синтетического происхождения, такие как, например, арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. В некоторых вариантах осуществления носители представляют собой или включают один или несколько твердых компонентов. Фармацевтически приемлемые носители также могут включать без ограничения солевой раствор, буферный солевой раствор, декстрозу, глицерин, этанол и их комбинации. Применяемый в данном документе термин вспомогательное вещество относится к любому нетерапевтическому средству, которое можно включить в фармацевтическую композицию, например, для обеспечения или содействия достижению необходимой консистенции или стабилизирующего эффекта. Подходящие фармацевтические вспомогательные вещества включают без ограничения крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропилен, гликоль, воду, этанол и т.п. В различных вариантах осуществления фармацевтическая композиция является стерильной.
[00281] В некоторых вариантах осуществления фармацевтическая композиция содержит незначительные количества смачивающих или эмульгирующих средств или буферных средств для доведения pH. В некоторых вариантах осуществления фармацевтические композиции могут содержать любую из множества добавок, таких как стабилизаторы, буферы или консерванты. Кроме того, можно включать вспомогательные, стабилизирующие, загущающие, смазывающие и окрашивающие средства.
[00282] В различных вариантах осуществления фармацевтическая композиция может быть составлена для соответствия любому требуемому способу введения. Например, фармацевтическая композиция может иметь форму растворов, суспензий, эмульсии, капель, таблеток, пилюль, пеллет, капсул, капсул, содержащих жидкости, желатиновых капсул, порошков, составов с замедленным высвобождением, суппозиториев, эмульсий, аэрозолей, спреев, суспензий, лиофилизированного порошка, замороженной суспензии, высушенного порошка или любую другую форму, подходящую для применения. Общие соображения по составлению и изготовлению фармацевтических средств можно найти, например, в Remington's Pharmaceutical Sciences, 19th ed., Mack Publishing Co., Easton, PA, 1995; включенном в данный документ посредством ссылки.
[00283] Фармацевтическую композицию можно вводить любым путем введения. Пути введения включают, например, пероральный, интрадермальный, внутримышечный, интраперитонеальный, внутривенный, подкожный, интраназальный, чресслизистый, эпидуральный, сублингвальный, интраназальный, интрацеребральный, интравагинальный, трансдермальный, ректальный, посредством интратрахеальной инстилляции, бронхиальной инстилляции, ингаляции, или местный. Введение может быть локальным или системным. В некоторых вариантах осуществления введение осуществляют перорально. В другом варианте осуществления введение осуществляют посредством парентеральной инъекции. В некоторых случаях введение приводит к высвобождению антигенного полипептида на основе последовательности ферритина, описанного в данном документе, в кровоток. Способ введения может быть оставлен на усмотрение практикующего специалиста.
[00284] В некоторых вариантах осуществления фармацевтическая композиция подходит для парентерального введения (например, внутривенного, внутримышечного, интраперитонеального и подкожного). Такие композиции могут быть составлены, например, в виде растворов, суспензий, дисперсий, эмульсий и т.п. Они также могут быть изготовлены в форме стерильных твердых композиций (например, лиофилизированной композиции), которые могут быть растворены или суспендированы в стерильной инъекционной среде непосредственно перед применением. Например, парентеральное введение можно осуществлять путем инъекции. В таких вариантах осуществления инъекционные препараты получают в общепринятых формах, т.е. либо в виде жидких растворов или суспензий, твердых форм, подходящих для растворения или суспендирования в жидкости перед инъекцией, либо в виде эмульсий. В некоторых вариантах осуществления инъекционные растворы и суспензии получают из стерильных порошков, лиофилизированных порошков или гранул.
[00285] В дополнительном варианте осуществления фармацевтическую композицию составляют для доставки посредством ингаляции (например, для прямой доставки в легкие и дыхательную систему). Например, композиция может иметь форму назального спрея или любого другого известного аэрозольного состава. В некоторых вариантах осуществления препараты для ингаляционной или аэрозольной доставки содержат множество частиц. В некоторых вариантах осуществления такие препараты могут характеризоваться средним размером частиц, составляющим приблизительно 1, приблизительно 2, приблизительно 3, приблизительно 4, приблизительно 5, приблизительно 6, приблизительно 7, приблизительно 8, приблизительно 9, приблизительно 10, приблизительно 11, приблизительно 12 или приблизительно 13 микрон. В некоторых вариантах осуществления препараты для ингаляционной или аэрозольной доставки составлены в виде сухого порошка. В некоторых вариантах осуществления препараты для ингаляционной или аэрозольной доставки составлены в виде влажного порошка, например, посредством включения смачивающего средства. В некоторых вариантах осуществления смачивающее средство выбрано из группы, состоящей из воды, солевого раствора или другой жидкости с физиологическим значением pH.
[00286] В некоторых вариантах осуществления фармацевтическую композицию в соответствии с настоящим изобретением вводят в виде капель в носовую или ротовую полость. В некоторых вариантах осуществления доза может содержать множество капель (например, 1-100, 1-50, 1-20, 1-10, 1-5 и т.д.).
[00287] Фармацевтическую композицию по настоящему изобретению можно вводить в любой дозе, подходящей для достижения требуемого результата. В некоторых вариантах осуществления требуемый результат представляет собой индукцию длительного адаптивного иммунного ответа против патогена, такого как источник полипептида, отличного от ферритина, присутствующего в антигенном полипептиде на основе последовательности ферритина, присутствующем в композиции. В некоторых вариантах осуществления требуемый результат представляет собой снижение интенсивности, тяжести, частоты и/или задержки проявления одного или нескольких симптомов инфекции. В некоторых вариантах осуществления требуемый результат представляет собой ингибирование или предупреждение инфекции. Необходимая доза будет варьироваться от субъекта к субъекту в зависимости от вида, возраста, веса и общего состояния субъекта, тяжести подлежащей предупреждению или лечению инфекции, конкретной применяемой композиции и способа ее введения.
[00288] В некоторых вариантах осуществления фармацевтические композиции в соответствии с настоящим изобретением вводят в виде одной или нескольких доз. В некоторых вариантах осуществления фармацевтические композиции вводят несколькими дозами, вводимыми в разные дни (например, прайм-буст стратегии вакцинации). В некоторых вариантах осуществления фармацевтическую композицию вводят как часть бустерного режима.
[00289] В различных вариантах осуществления фармацевтическую композицию вводят совместно с одним или несколькими дополнительными терапевтическими средствами. Совместное введение не требует одновременного введения терапевтических средств, если время их введения таково, что фармакологические активности дополнительного терапевтического средства и активного(активных) ингредиента(ингредиентов) в фармацевтической композиции перекрываются во времени, тем самым оказывая комбинированный терапевтический эффект. Как правило, каждое средство будут вводить в дозе и в соответствии с графиком, установленными для данного средства.
4. Нуклеиновая кислота/РНК
[00290] Также предусмотрена нуклеиновая кислота, кодирующая антигенный полипептид на основе последовательности OspA, описанный в данном документе. В некоторых вариантах осуществления нуклеиновая кислота представляет собой мРНК. Любая нуклеиновая кислота, способная подвергаться трансляции, в результате которой образуется полипептид, считается мРНК для целей настоящего изобретения.
5. Наборы
[00291] В данном документе также представлены наборы, содержащие один или несколько антигенных полипептидов, нуклеиновых кислот, антигенных ферритиновых частиц, антигенных лумазинсинтазных частиц, композиций или фармацевтических композиций, описанных в данном документе. В некоторых вариантах осуществления набор дополнительно содержит один или несколько из растворителя, раствора, буфера, инструкций или высушивающего средства.
* * *
[00292] Это описание и иллюстративные варианты осуществления не должны рассматриваться как ограничивающие. Для целей настоящего описания и прилагаемой формулы изобретения, если не указано иное, все числа, выражающие количества, процентные доли или пропорциональные доли и другие числовые значения, применяемые в описании и формуле изобретения, следует понимать как модифицируемые во всех случаях термином "приблизительно" в той степени, в которой они еще не были модифицированы. "Приблизительно" указывает на степень вариации, которая не оказывает существенного влияния на свойства описанного заявленного объекта, например, в пределах 10%, 5%, 2% или 1%. Соответственно, если не указано иное, числовые параметры, изложенные в следующем описании и прилагаемой формуле изобретения, являются примерными значениями, которые могут варьироваться в зависимости от требуемых свойств, которые должны быть получены. В крайнем случае, а не в качестве попытки ограничить применение доктрины эквивалентов к объему формулы изобретения, каждый числовой параметр должен по меньшей мере толковаться с учетом количества сообщаемых значащих цифр и применения обычных методик округления.
[00293] Следует отметить, что, как применяется в данном описании и прилагаемой формуле изобретения, форма единственного числа, а также любое применение любого слова в единственном числе включают объекты во множественном числе, если только однозначно и недвусмысленно не ограничены одним объектом. Применяемый в данном документе термин "включать" и его грамматические варианты не предназначены для ограничения, так что перечисление элементов в списке не исключает другие подобные элементы, которые могут быть заменены или добавлены к перечисленным элементам. Термин "или" применяется во включительном смысле, т.е. эквивалентно "и/или", если в контексте не указано иное.
Таблица 1 (таблица последовательностей): Описание последовательностей
("Ферритин" относится к ферритину из H. pylori, необязательно с одной или несколькими мутациями, если не указано иное)
Ключ для последовательностей 1-102:
Лидерные последовательности иногда подчеркнуты
Модифицированный сайт LFA-1 выделен курсивом и подчеркнут (если присутствует)
Мутации, отличные от модифицированного сайта LFA-1, выделены жирным шрифтом и подчеркнуты волнистой линией
Линкер подчеркнут двойной линией
Последовательность лягушки-быка выделена курсивом и подчеркнута волнистой линией (если присутствует)
Последовательность тяжелой цепи человеческого ферритина выделена жирным шрифтом (если присутствует)
Трансмембранный домен выделен курсивом (если присутствует)
Сайт липидирования выделен жирным шрифтом, курсивом и подчеркнут(если присутствует)
NTITVQQYDS NGTKLEGSAV EITKLDEIKN ALK
(штамм WP_011703777.1)
DTITVQKYDS AGTNLEGTAV EIKTLDELKN ALK
(штамм CAA56549.1)
ENTITVQNYN RAGNALEGSP AEIKDLAELK AALK
(штамм WP_011187157.1)
DTITVQKYDS AGTNLEGNAV EIKTLDELKN ALK
(штамм CAA59727.1)
EDTITVQKYD SAGTNLEGKA VEITTLEKLK DALK
(штамм CAA45010.1)
EDTITVQRYD SAGTNLEGKA VEITTLKELK NALK
(штамм CAA56547.1)
IFDKKLLGIDV
IYDRNGRVELDEIPKPPKEWESPLKAFEAAYEHEKFISKSIYELAALAEEEKDYSTRAFL
EWFINEQVEEEASVKKILDKLKFAKDSPQILFMLDKELSARAPKLPGLLMQGGE
ПРИМЕРЫ
[00294] Следующие примеры предусмотрены для иллюстрации определенных раскрытых вариантов осуществления и не должны рассматриваться как ограничивающие объем этого раскрытия каким-либо образом.
1. Получение антигенных полипептидов OspA-ферритин
[00295] Получали антигенные полипептиды, включающие OspA и ферритин.
[00296] OspA синтезировали с помощью Genescript из следующих последовательностей: Последовательность с ID в NBCI WP_010890378.1 штамма B31 (серотип 1) Borrelia burgdorferi, последовательность в NCBI Borrelia afzelii штамма PKO (серотип 2): WP_011703777.1, штамма PBr (серотип 3) Borrelia garinii с номером доступа GenBank CAA56549.1, последовательность с ID в NCBI WP_011187157.1 Borrelia bavariensis (серотип 4), Borrelia garinii (серотип 5) с номером доступа GenBank CAA59727.1, Borrelia garinii (серотип 6) с номером доступа GenBank: CAA45010.1 и Borrelia garinii (серотип 7) с номером доступа в GenBank CAA56547.1. Ферритин из H. pylori со вставленной N-концевой последовательностью ферритина лягушки-быка синтезировали с помощью Genescript, при этом последовательность ферритина лягушки-быка сходна с последовательностью ферритина лягушки-быка из предыдущего исследования (см. Kanekiyo, M., et al., Cell 162(5):1090-100 (2015)). Вектор pet21a применяли для экспрессии как His-меченого OspA, так и наночастиц OspA-ферритин в E. coli. Вектор экспрессии млекопитающих, сходный с применяемым ранее, применяли для экспрессии в клетках Expi293 (см. Xu, L., et al., Science 358(6359):85-90 (2017)).
[00297] Наночастицы OspA-ферритин создавали посредством генетического слияния эктодомена OspA с аминоконцом ферритина с получением антигенного полипептида (фиг. 1A). OspA представляет собой липопротеин с молекулярным весом 31 кДа со структурой, представляющей собой протяженный β-слой, состоящий из 21 последовательной антипараллельной β-цепи с только одной карбоксиконцевой α-спиралью (фиг. 1B) (см. Kitahara, R., et al., Biophys J 102(4):916-26 (2012)). Карбоксиконец OspA также имеет необычно большую полость (~200A), которая представляет собой сайт, совместимый для связывания с ферритином с помощью последовательности глицин-серин (фиг. 1B). 24 субъединицы ферритина спонтанно собираются в полую сферическую наночастицу (фиг. 1C). Ферритин, применяемый в этом исследовании, содержит аминоконцевую последовательность ферритина лягушки-быка, слитую с ферритином Helicobacter pylori с образованием химеры, минимально родственной человеческому ферритину (см. Kanekiyo 2015). Аминоконцевая последовательность ферритина лягушки-быка радиально выступает из ядра наночастицы (см. Trikha, J., et al. J Mol Biol 248(5):949-67 (1995)), облегчая равномерное представление OspA на поверхности наночастиц.
[00298] В структуру ферритина были внесены три дополнительных изменения для улучшения его функциональности: N19Q, C31S и S111C. Замена N19Q привела к удалению потенциального аминоконцевого сайта гликозилирования. Замена S111C приводит к встраиванию в ферритин экспонированного на поверхности цистеина, который можно применять для конъюгации адъювантов, например, с помощью клик-химии. Наконец, цистеин 31 был модифицирован до серина таким образом, чтобы только один цистеин мог быть модифицирован посредством конъюгации. Отображение OspA на поверхности наночастиц обеспечивает образование 24-мерной антигенной наночастицы (фиг. 1D).
[00299] Для очистки от E. coli авторы настоящего изобретения применяли BL21 Star (DE3) (Invitrogen, № по каталогу C601003). Авторы настоящего изобретения индуцировали образование белка с помощью 100 мкМ IPTG в течение ночи при 16°C. Клеточный осадок лизировали с помощью обработки ультразвуком в буфере Tris, pH 8, 50 мМ NaCl. Стерилизованный с помощью фильтра супернатант очищали на колонке для анионообменной хроматографии (HiTrap Q HP, GE) посредством сбора наночастиц OspA-ферритин из фильтрата. Затем эндотоксин удаляли посредством экстракции с помощью 1% Triton X114, которую повторяли 6 раз. Затем водную фазу концентрировали с применением фильтра Amicon 100 MW с отсечкой по молекулярному весу (Millipore, № по каталогу UFC910096), а затем наночастицы дополнительно очищали на колонке для препаративной SEC со 120 мл суперозы 6 при 4°C. Для очистки из культуры клеток млекопитающих клетки Expi293 трансфицировали плазмидной ДНК с применением реагента для трансфекции FectoPRO (Polyplus, № по каталогу 116-100) в соответствии с инструкциями производителя. Трансфицированные клетки культивировали, а в день 5 собирали и фильтровали супернатант. Следовали протоколам без эндотоксинов с применением реагентов без эндотоксинов и стеклянной посуды. Гранулы Q Sepharose Fast flow (GE, № по каталогу 17-0510-01) получали с 50 мМ Tris с pH7, 50 мМ NaCl и добавляли в стерилизованный с помощью фильтра супернатант посредством самотека. Фильтрат собирали и концентрировали до 4 мл с применением фильтра Amicon 100 MW с отсечкой по молекулярному весу . Затем наночастицы дополнительно очищали на колонке для препаративной SEC со 120 мл суперозы 6 при комнатной температуре.
[00300] Для очистки His6-меченого (SEQ ID NO: 227) OspA OspA серотипа 1, 4, 5 и 7 очищали от E.coli BL21 (DE3) (Invitrogen, № по каталогу C600003), а OspA серотипа 2 и 3 очищали от клеток Expi293. Этих конструкции не имели трансмембранного домена, содержащего С-концевую His6-метку (SEQ ID NO: 227), а в остальном они были дикого типа. Для очистки от E. coli образование белка индуцировали с помощью 500 мкМ IPTG в течение 5 часов и клетки осаждали и замораживали при -20°C. Осадок ресуспендировали в 1% Triton в буфере TBS с полным ингибитором протеаз (Sigma-Aldrich, № по каталогу 11697498001) и обрабатывали ультразвуком для лизиса клеток. Супернатант стерилизовали с помощью фильтра. В случае культуры клеток млекопитающих супернатант собирали в день 5 после трансфекции и стерилизовали с помощью фильтра. Супернатант пропускали через колонку GE HiTrap HP объемом 5 мл (№ по каталогу 17-5248-02), присоединенную к AKTA Pure FPLC. Колонку промывали, загружали и снова промывали с помощью 20 мМ имидизола в TBS. Конечный белок элюировали с помощью 250 мМ имидизола в TBS.
[00301] Слитый с ферритином OspA серотипа 1 из штамма B31 B. burgdorferi экспрессировали в трансформированной линии эпителиальных клеток почки человека Expi293 (фиг. 2A-2D; SEQ ID NO: 52). Образование наночастиц и чистоту белка подтверждали с помощью эксклюзионной колоночной хроматографии (SEC) и SDS-PAGE (фиг. 2A и 2B соответственно). Анализ с помощью SEC позволил выявить единственный симметричный пик ожидаемого времени удерживания (фиг. 2A).
[00302] Также осуществляли анализ с помощью динамического светорассеяния (DLS). Очищенные наночастицы загружали в черный 384-луночный планшет с прозрачным дном (Corning, № по каталогу 3540) в концентрации ~0,4 мкг/мл. Образцы считывали с помощью DynaPro Plater Reader II (Wyatt) при контрольной температуре 25°C. С помощью DLS регистрировали размер частиц, составляющий 13 нм, с низкой полидисперсностью (7,4%), которые являются чистыми и не содержат агрегатов (фиг. 2C). Удаление трансмембранного домена OspA (aa 1-25), содержащего сайт липидирования, облегчило очистку. Последовательность OspA содержит четыре потенциальных сайта аминосвязанного гликозилирования, и OspA-ферритин, очищенный из клеток млекопитающих, мигрировал с более высоким молекулярным весом, соответствующим добавлению гликанов (фиг. 2В).
[00303] На наночастицах OspA-ферритин осуществляли визуализацию негативного окрашивания с помощью трансмиссионной электронной микроскопии и анализ усреднения класса 2D (фиг. 2D). Образец наночастиц OspA-ферритин разбавляли 300-кратно в 1xTBS и визуализировали над слоем непрерывного углерода, поддерживаемого нитроцеллюлозой на медной сетке c 400 меш. Сетки получали посредством нанесения 3 мкл суспензии образца на очищенную сетку, промокания фильтровальной бумагой и немедленного окрашивания уранилформиатом. Электронную микроскопию осуществляли с применением электронного микроскопа FEI Tecnai T12, оборудованного камерой FEI Eagle 4k x 4K CCD. Изображения с большим увеличением получали при увеличении 67000 (0,16 нм/пиксель). Изображения получали при номинальной недофокусировке от -1,9 мкм до -0,8 мкм и дозах электронов, составляющих ~30 e-/Å2. Отдельные частицы на изображениях с большим увеличением 67000x отбирали с применением протоколов автоматического отбора (см. Lander, G.C., et al., J Struct Biol, 166(1):95-102 (2009)). Стратегию выравнивания без эталона применяли на основе пакета для обработки XMIPP (см. Sorzano, C.O., et al., J Struct Biol 148(2): p. 194-204 (2004)). Алгоритмы в этом пакете позволяют выравнивать отобранные частицы и сортировать их по группам или классам на основании сходства частиц друг с другом.
[00304] Ферритиновая наночастица выглядела как концентрированное кольцеобразное уплотнение с полым центром посередине (фиг. 2D). Каждая наночастица была окружена многочисленными короткими однородными шиповидными отростками OspA, имеющими слегка продолговатую форму. Частицы имеют общий диаметр в диапазоне от ~194-220 Å с ферритиновым ядром диаметром 125 Å. Шиповидные отростки были однородными по размеру, форме и ориентации на поверхности частицы, и их длина составляла до 45 Å. Шиповидные отростки OspA характеризовались шириной ~30 Å и сужались до минимальной плотности на глицин-сериновом линкере ферритина.
[00305] Когда в 2002 году производство вакцины LYMErixTM было прекращено, возникли опасения, что вакцина содержала эпитоп (аминокислоты 165-173 из SEQ ID NO: 83) с гомологией с нонапептидным сегментом (SEQ ID NO: 78) из человеческого функционально-ассоциированного антигена-1 лейкоцитов (hLFA-1, см. Gross, D.M., et al., Science 281(5377): p. 703-6 (1998)) (фиг. 5A). Аминокислоты 165-173 из SEQ ID NO: 83 называются сайтом гомологии с hLFA-1. Серотип 1 OspA является единственным серотипом, который характеризуется этой гомологией последовательностей (фиг. 5B). Чтобы избежать любых потенциальных проблем, связанных с этой последовательностью, сайт гомологии hLFA-1 заменяли либо на соответствующие нонапептидные последовательности OspA серотипа 2 (SEQ ID NO: 79) или серотипа 3 (SEQ ID NO: 80), либо встраивали точечные замены, которые снижали сходство с hLFA-1 и были предназначены для предотвращения образования антител, которые связываются с hLFA-1 (RD2, SEQ ID NO: 81) (фиг. 5C). В случае точечных замен заменяли экспонированные на поверхности аминокислоты для снижения сходства с hLFA-1, тем самым устраняя или минимизируя дестабилизацию структуры, представляющей собой β-слой.
[00306] Иммуногенность наночастиц hLFA-1 с модифицированным сайтом гомологии с hLFA-1 тестировали на мышах для сравнения иммунного ответа по сравнению с наночастицей OspA-ферритин без такой модификации (фиг. 5D). Титры антител, индуцированных наночастицами с модифицированным сайтом гомологии с hLFA-1, были устойчивыми и существенно не отличались от наночастиц с немодифицированным сайтом гомологии с hLFA-1.
2. Характеристика иммуногенности наночастиц OspA-ферритин
[00307] Для оценки иммуногенности наночастиц OspA-ферритин мышей линии C3H дважды иммунизировали наночастицами OspA серотипа 1-ферритин в присутствии адъюванта Ribi или RECOMBITEK® Lyme (жидкая суспензия очищенного белка A внешней поверхности (OspA) из Borrelia burgdorferi), собачьей вакциной, в которой OspA является полноразмерным, липидированным, рекомбинантным и относится к серотипу 1 (фиг. 4). Мышей линии C3H/HeN вакцинировали внутримышечно на неделе ноль и неделе 4. ELISA осуществляли с применением сыворотки крови через 2 недели после введения 2-ой дозы. Ribi (Sigma adjuvant system, № по каталогу S6322-1vl) ресуспендировали в 1 мл PBS и встряхивали в течение 1 минуты, а затем добавляли в равном объеме к антигену перед иммунизацией.
[00308] Ответ с образованием антител определяли с применением твердофазного иммуноферментного анализа (ELISA) рекомбинантного OspA. Вкратце, 96-луночные планшеты покрывали с помощью 1 мкг/мл OspA-His, разбавленного в PBS, и инкубировали в течение ночи при 4°C. OspA-His удаляли и планшеты блокировали 5% обезжиренным молоком, растворенным в PBST. После удаления блокирующего реагента добавляли первичные образцы сыворотки крови после серийного разбавления в PBST. Первичные образцы добавляли в равном объеме к блокирующему раствору для получения конечной концентрации блокирующего раствора, составляющей 50%. После инкубации в течение 1 часа планшеты промывали с помощью PBST и инкубировали с козьим антителом к мышиному IgG , вторичным антителом, связанным с HRP (разбавление 1: 5000 в блокирующем растворе), в течение 1 часа при комнатной температуре. Вторичное антитело удаляли посредством аспирации и промывали, а планшеты инкубировали с субстратом пероксидазы Sure Blue TMB (KPL, Гейтерсберг, Мэриленд), а затем с равным объемом стоп-раствора (0,5 н. серная кислота). Оптическую плотность измеряли при 450 нм.
[00309] Иммунизация с помощью наночастиц OspA-ферритин приводила к индукции титров в конечной точке в 4,4 раза выше, чем при применении RECOMBITEK® Lyme на шестой неделе (p<0,001). Титр антител на неделе 25 также был значительно выше, чем при применении RECOMBITEK® Lyme (p < 0,005) (фиг. 4).
3. Мутанты по гликозилированию; оценка эффективности
[00310] Для оценки защитной эффективности этих наночастиц OspA-ферритин применяли модель заражения, при которой иммунизированных или контрольных мышей инфицировали клещами, несущими B. burgdorferi (см. Rosa, P.A., et al. Nat Rev Microbiol 3(2): p. 129-43 (2005)).
[00311] Мышей линии C3H/HeN вакцинировали внутримышечно с помощью либо 1 мкг наночастиц OspA-ферритин, смешанных с AddaVaxTM 1:1, либо 1 мкг ферритиновых наночастиц. Мышей вакцинировали на неделе ноль и неделе 4. Наночастицу OspA серотипа 1-ферритин с рационально разработанными модификациями сайта гомологии с hLFA-1 и модификациями для удаления всех потенциальных сайтов N-гликозилирования (SEQ ID NO: 53) применяли для иммунизации мышей, поскольку природный бактериально экспрессируемый OspA не гликозилирован в этих положениях. Последовательность содержала следующие замены N>Q для предотвращения гликозилирования: N71Q, N190Q, N202Q и N251Q. Ее иммуногенность была сходна с иимуногенностью гликозилированной наночастицы (фиг. 13).
[00312] Мутантов по гликозилированию OspA-ферритин также тестировали, когда серин/треонины в сайтах гликозилирования были мутированы в аланин (SEQ ID NO: 63). Как эта конструкция, так и конструкция N>Q, описанная выше, обеспечивали сильный иммунный ответ по сравнению с наночастицами OspA-ферритин с сайтами гликозилирования дикого типа (SEQ ID NO: 52) и превосходили контроль, представляющий собой RECOMBITEK® Lyme (фиг. 14).
[00313] В дополнительном эксперименте по оценке защитной эффективности наночастиц OspA-ферритин на модели заражения клещами личинок клещей Ixodes scapularis получали из Национального исследовательского и образовательного центра по изучению клещей Университета штата Оклахома (Стиллуотер, Оклахома). Нимф, инфицированных B. burgdorferi, получали, давая неинфицированным личинкам кормиться до насыщения на мышах линии SCID, инфицированных штаммом N40 B. burgdorferi. Набухших личинок собирали и обеспечивали им линьку с превращением в нимф в течение 4-6 недель при комнатной температуре и высокой относительной влажности. Распространенность инфекции B. burgdorferi у откормленных личинок определяли посредством культивирования части выздоровевших клещей из каждой партии.
[00314] Мышей иммунизировали дважды дозами наночастиц OspA-ферритин, составляющими 1 мкг (SEQ ID NO: 53), с адъювантом AddaVaxTM или ферритином в качестве контроля на неделе 0 и неделе 4, а группу сравнения иммунизировали параллельно с помощью RECOMBITEK® Lyme. Мышей заражали на неделе 6 (т.е. через 2 недели после введения второй дозы вакцины), позволяя 5-6 клещам на нимфальной стадии, инфицированным B. burgdorferi , кормиться до насыщения. Откормленных нимф собирали и анализировали в отношении инфекции B. burgdorferi посредством культивирования в среде BSK. Через две недели после заражения мышей умерщвляли и анализировали в отношении инфекции B. burgdorferi с помощью культуры тканей уха, голеностопного сустава и культуры тканей сердца. Присутствие B. burgdorferi определяли посредством наблюдения за культурами с помощью темнопольной микроскопии. Мышь считали инфицированной B. burgdorferi, если с помощью темнопольной микроскопии было обнаружено, что одна или несколько культур органов являются положительными в отношении инфекции. Отрицательные культуры также тестировали с помощью ПЦР, специфической в отношении B. burgdorferi.
[00315] Мышей умерщвляли через две недели. Образцы тканей из сердца, голеностопного сустава и уха культивировали в среде BSK с антибиотиками против B. burgdorferi в течение 6 недель. Отрицательные в отношении инфекции образцы тестировали с помощью ПЦР на предмет присутствия B. burgdorferi. Все отрицательные в отношении инфекции культуры также были отрицательными по ПЦР. Защиту рассчитывали как процент неинфицированных мышей.
[00316] Композиция, содержащая наночастицы OspA-ферритин и адъювант AddaVaxTM, не демонстрировала инфекции (0/4) в отличие от ферритина в качестве отрицательного контроля, при применении которого были инфицированы 4 из 5 животных (таблица 2; p<0,01).
Таблица 2. Защитная эффективность наночастиц OspA-ферритин
4. Оценка эффективности наночастиц OspA-ферритин, конъюгированных с иммуностимулирующими фрагментами
[00317] Самоадъювантную конструкцию получали посредством конструирования цистеина (S111C) на поверхности ферритиновой наночастицы, что позволяет осуществлять прямую конъюгацию иммуностимулирующих фрагментов, таких как агонисты TLR (фиг. 6A) или CpG (SEQ ID NO: 210; ISS-1018, фиг. 7A), с помощью клик-химии. Процедура прямой конъюгации была следующей: Материал, полученный из млекопитающих, восстанавливали для удаления цистеинилирования с помощью 10 мМ TCEP (Amresco K831-10G) в 50 мМ Tris с pH 8,5 в течение 1 часа. Затем белок подвергали диализу в 100 мМ Трис с pH 8, 50 мМ NaCl для удаления TCEP. Материал, полученный из E. coli , не нуждается в восстановлении. DBCO-PEG4-малеимидный линкер (Sigma-Aldrich, № по каталогу 760676-5mg) ресуспендировали при 5 мг/мл в DMSO. Добавляли 2,5 мг линкера к 3 мг белка в объеме 10 мл (конечная концентрация DMSO составляла 5%). Линкер инкубировали с восстановленным белком в течение 30 минут при комнатной температуре. Фильтр-концентратор Ambicon 100 MW с отсечкой по молекулярному весу применяли для удаления избытка линкера посредством замены буфера (Millipore, № по каталогу UFC910096). Азид-PEG4-3M-012 (синтезированный самостоятельно) и азид-CPG (ISS-1018, синтезированный в IDT по индивидуальному заказу ) применяли на заключительной стадии клик-химии. 0,5 мг адъюванта добавляли к 0,5 мг белка на заключительной стадии конъюгации и инкубировали при 37°C в течение 6 часов, а затем при 4°C в течение ночи. Избыток адъюванта удаляли посредством замены буфера с применением фильтра-концентратора Ambicon 100 MW с отсечкой по молекулярному весу. Эффективность конъюгации подтверждали с помощью масс-спектрометрии в случае 3M-012 и анализа с помощью SDS-PAGE в случае CPG.
[00318] Применяли агонист TLR 7/8 3M-012, который, как ранее было показано, усиливает ответы с образованием антител при непосредственной конъюгации с белком Gag HIV (см. Wille-Reece, U., et al., Proc Natl Acad Sci U S A 102(42): p. 15190-4 (2005)). Подход с применением двухстадийной клик-химии применяли для присоединения 3M-012 к наночастице под SEQ ID NO: 53. Сначала DBCO-PEG4-малеимидный линкер соединяли с цистеином, а затем добавляли модифицированный 3M-012 с PEG4-азидным линкером посредством азид-алкиновых циклоприсоединений без участия меди (фиг. 6A). Эффективность конъюгации, составляющую > 99%, подтверждали с помощью масс-спектрометрии с изменением массы на 587 дальтон (фиг. 12). В дополнение к азиду-3M-012 также успешно добавляли азид-CPG (фиг. 7A), для которого конъюгация могла быть подтверждена сдвигом в геле (фиг. 7B).
[00319] Наблюдали почти полную конъюгацию ферритина, что свидетельствует о том, что большинство наночастиц несет 24 молекулы агонистов. Затем у мышей оценивали иммуногенность конъюгированных наночастиц OspA-ферритин. Мышей линии C3H/HeN вакцинировали внутримышечно на неделе ноль и неделе 4. ELISA осуществляли с применением сыворотки крови через 2 недели после введения 2-ой дозы. Добавляли алюминиевые квасцы (Alyhydrogel '85 2%; Brenntag, № по каталогу 21645-51-2) в равном объеме к антигену перед иммунизацией. Ribi (Sigma adjuvant system, № по каталогу S6322-1vl) ресуспендировали в 1 мл PBS и встряхивали в течение 1 минуты, а затем добавляли в равном объеме к антигену перед иммунизацией.
[00320] Мыши, иммунизированные частицами, конъюгированными с 3M-012, проявляли в 4,5 раза более высокие ответы с образованием антител к OspA, чем неконъюгированный материал (фиг. 6B, p < 0,05). Ответы с образованием антител, индуцированные частицами, конъюгированными с 3M-012, были выше, чем в случае частиц, смешанных с молярным эквивалентом количества 3M-012 (29 нг), и сравнимы с частицами, смешанными с 1000-кратно более высокой дозой (20 мкг) 3M-012 или стандартного адъюванта, представляющего собой алюминиевые квасцы (Alyhydrogel '85 2%; Brenntag, № по каталогу 21645-51-2).
[00321] Сходное усиление образования антител наблюдали с CPG-конъюгированной наночастицей OspA-ферритин (SEQ ID NO: 53) с 6,3-кратным повышением иммунного ответа по сравнению с неконъюгированными частицами и 4,7-кратным повышением по сравнению с эквивалентным количеством неконъюгированного CPG, смешанного с наночастицами (фиг. 7C).
[00322] Таким образом, нацеленная доставка адъюванта, конъюгированного с наночастицей OspA-ферритин, позволяет существенно снизить количество адъюванта с одновременной стимуляцией эффективного и специфического ответа с образованием антител.
5. Оценка иммуногенности наночастиц OspA-ферритин, включающих различные серотипы
[00323] В то время как OspA серотипа 1 штамма B. burgdorferi вызывает заболевание в Соединенных Штатах, B. afzelii (серотип 2), B. garinii (серотип 3, 5, 6, 7) и B. bavariensis (серотип 4) вызывают заболевание в Европе, Азии и других местах. Для получения композиции с широкой перекрестной защитой наночастицы OspA-ферритин разрабатывали для серотипов 1, 2, 3, 4, 5 и 7. (SEQ ID NO: 1, 5, 6, 7, 8 и 10). Эти частицы экспрессировали и очищали от E. coli с применением анионообменной и эксклюзионной хроматографии (фиг. 3A). Все антигенные полипептиды OspA-ферритин характеризуются ожидаемым молекулярным весом, составляющим 47 кДа, и DLS-анализ и трансмиссионная электронная микроскопия также подтвердили образование всех шести наночастиц OspA (фиг. 3B).
[00324] Композицию из шести компонентов получали посредством объединения каждого из серотипов 1-5 и 7 наночастиц OspA-ферритин в эквимолярных пропорциях.
[00325] Иммуногенность этой композиции из шести компонентов (т.е. гексавалентной) с алюминиевыми квасцами сравнивали у мышей с частицами одного серотипа (т.е. моновалентными) с тем же адъювантом (фиг. 8A-8F). Моновалентную композицию давали в дозе, составляющей 1 мкг, а гексавалентную композицию давали в дозе, составляющей 1 мкг для каждого серотипа (в целом доза составляла 6 мкг). Добавляли алюминиевые квасцы (Alyhydrogel '85 2%; Brenntag, № по каталогу 21645-51-2) в равном объеме к антигену перед иммунизацией. Композиция из шести компонентов индуцировала устойчивый ответ с образованием антител ко всем шести серотипам OspA 1-5 и 7. Более того, ответ на контроль одного серотипа был аналогичен смеси, что указывает на отсутствие интерференции в комбинации шести серотипов. Улучшенный иммунный ответ наблюдали против серотипа 4 с гексавалентной композицией по сравнению с композицией из одного компонента (см. фиг. 8D, серотип 4).
[00326] После установления того, что гексавалентная композиция была иммуногенной, а в некоторых случаях превосходила моновалентную композицию, получали конъюгаты 3М-012 и CpG каждой из шести наночастиц OspA-ферритин. Две конъюгированные композиции из шести компонентов создавали посредством объединения шести наночастиц OspA-ферритин, конъюгированных с 3M-012 и, отдельно, посредством объединения шести наночастиц OspA-ферритин, конъюгированных с CpG. CpG-конъюгированные и 3M-012-конъюгированные гексавалентные композиции демонстрировали значительное повышение ответа с образованием антител у мышей по сравнению с неконъюгированной гексавалентной композицией для всех семи серотипов OspA, обнаруженных во всем мире (фиг. 9A-9G), что указывает на то, что гексавалентный состав также обеспечивает защиту против серотипа 6, даже если в композиции не было полипептида OspA серотипа 6.
[00327] При тестировании на отличных от человека приматах (NHP [обезьяны-резусы]) гексавалентная композиция на основе наночастиц (неконъюгированных) с адъювантом AF03 превзошла контроль RECOMBITEK® Lyme с 11-200-кратным повышением титра Ab ко всем семи циркулирующим серотипам Borrelia (фиг. 10A-10G). Как и у мышей, гексавалентная композиция индуцировала ответ с образованием Ab с высоким титром в присутствии адъюванта. Композиции, конъюгированные с 3M-012 и CpG, индуцировали ответ, сходный с ответом при применении контроля RECOMBITEK® Lyme у NHP (сравните фигуры 10A-G и 10H-N соответственно). Титры антител в случае гексавалентной вакцины у NHP были устойчивыми до 19 недель после бустерной дозы и сохраняли преимущество над контролем RECOMBITEK® Lyme (фиг. 25).
[00328] Конъюгированные композиции также тестировали на модели заражения клещами. Мышей вакцинировали дозой антигенов, составляющей 1 мкг, на неделе 0 и неделе 4. Моновалентная композиция содержала 1 мкг наночастиц OspA-ферритин серотипа 1, конъюгированных с 3M-012. Гексавалентная композиция содержала OspA серотипов 1, 2, 3, 4, 5 и 7 по 1 мкг каждого, конъюгированного с 3M-012. Мышей заражали 5-6 клещами, инфицированными штаммом N40 Borrelia burgdorferi (серотип 1), в течение 5 суток через две недели после второй иммунизации и умерщвляли через две недели. Образцы тканей из сердца, голеностопного сустава и уха культивировали в среде BSK с антибиотиками против B. burgdorferi в течение 6 недель. Отрицательные в отношении инфекции образцы тестировали с помощью ПЦР в отношении присутствия B. burgdorferi. Положительные в отношении инфекции образцы были положительными либо по культуре, либо по ПЦР (фиг. 11).
[00329] Авторы настоящего изобретения дополнительно протестировали гептавалентную вакцину, содержащую все семь серотипов, на мышах. Мышей иммунизировали внутримышечно на неделе 0 и неделе 4 гептавалентными композициями на основе наночастиц OspA-ферритин по 1 мкг каждой из наночастиц OspA-ферритин, соответствующих серотипам 1-7 OspA (в целом 7 мкг), к которым в качестве адъюванта были добавлены либо алюминиевые квасцы, либо AF03, или с помощью RECOMBITEK® Lyme (доза составляла 1 мкг). Ответ с образованием антител анализировали через 2 недели после иммунизации по титру в конечной точке, измеренному с помощью ELISA. Был продемонстрирован устойчивый иммунный ответ по сравнению с RECOMBITEK® (фиг. 24A-G).
[00330] Таким образом, наночастицы OspA-ферритин индуцировали ответы с высоким титром антител на семь основных серотипов. Кроме того, семикомпонентная вакцина-кандидат против болезни Лайма позволяет контролировать глобальное распространение болезни Лайма.
6. Характеристика конструкций OspA-ферритин с различными гибкими линкерами
[00331] Тестировали семь различных линкеров для обеспечения гибкости между OspA и ферритином. Конструкции варьировались от одной до пяти последовательностей GGGS (SEQ ID NO: 226). Различные линкерные конструкции очищали и формировали наночастицы одинакового размера.
[00332] Все конструкции OspA-линкер-ферритин, содержащие линкеры GS1 (GGGS (SEQ ID NO: 226)), GS2 (SEQ ID NO: 91) или GS5 (SEQ ID NO: 92), могли быть экспрессированы (фиг. 15A) и демонстрировали согласованные профили DLS (фиг. 15B, 15C и 15E) и EM (фиг. 15D).
[00333] Кроме того, все другие линкерные конструкции GGGS (SEQ ID NO: 226) (линкер 1x GGGS (SEQ ID NO: 226) [SEQ ID NO: 60], линкер 2x GGGS (SEQ ID NO: 91) [SEQ ID NO: 61] и линкер 5x GGGS (SEQ ID NO: 92) [SEQ ID NO: 62]) демонстрировали сильные иммунные ответы у мышей линии C3H (фиг. 16).
7. Характеристика наночастиц лумазинсинтаза-OspA
[00334] Другую наночастицу, лумазинсинтазу из Aquifex aeolicus, исследовали в отношении антигенного проявления OspA. Частицы OspA-лумазинсинтаза, содержащие различные серотипы, легко очищали от клеток E. coli с помощью анионообменной и эксклюзионной хроматографии. Конструкции получали и характеризовали как содержащие OspA серотипа 1 (SEQ ID NO: 12, фиг. 19A-19C); OspA серотипа 2 (SEQ ID NO: 16, фиг. 20A-20C); OspA серотипа 3 (SEQ ID NO: 17, фиг. 21A-21B); OspA серотипа 4 (SEQ ID NO: 18, фиг. 17A-17C); OspA серотипа 5 (SEQ ID NO: 19, фиг. 22A-22C) и OspA серотипа 7 (SEQ ID NO: 21, фиг. 23A-23C). Частицы OspA-лумазинсинтаза образовывали частицу размером 15,8 нм по ЕМ и были однородными по размеру по DLS.
[00335] Частицы OspA серотипа 4-лумазинсинтаза (SEQ ID NO: 18) тестировали у мышей в отношении иммуногенности (фиг. 18). Частицы OspA-лумазинсинтаза с алюминиевыми квасцами и без них обеспечивали сильный иммунный ответ, который проявлялся по меньшей мере столь же устойчиво, как и в случае сходной наночастицы OspA серотипа 4-ферритин (SEQ ID NO: 7).
[00336] Таким образом, антигенные полипептиды, содержащие лумазинсинтазу и полипептид OspA, также можно применять для индукции ответов с образованием антител к OspA.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> SANOFI
<120> Антигенные полипептиды на основе последовательности OspA
<130> 01121-0033-00PCT
<140>
<141>
<150> 62/652,210
<151> 2018-04-03
<160> 228
<170> PatentIn версия 3.5
<210> 1
<211> 425
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 1
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Thr Leu
130 135 140
Glu Gly Gln Leu Ser Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val
245 250 255
Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val
260 265 270
Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp
275 280 285
Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His
290 295 300
Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn
305 310 315 320
Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His
325 330 335
Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu
340 345 350
Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys
355 360 365
Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu
370 375 380
Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu
385 390 395 400
Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val
405 410 415
Lys Gly Ile Ala Lys Ser Arg Lys Ser
420 425
<210> 2
<211> 425
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 2
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Asp Leu
130 135 140
Lys Gly Glu Leu Ser Ser Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val
245 250 255
Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val
260 265 270
Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp
275 280 285
Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His
290 295 300
Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn
305 310 315 320
Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His
325 330 335
Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu
340 345 350
Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys
355 360 365
Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu
370 375 380
Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu
385 390 395 400
Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val
405 410 415
Lys Gly Ile Ala Lys Ser Arg Lys Ser
420 425
<210> 3
<211> 425
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 3
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Thr Leu
130 135 140
Glu Gly Lys Val Ala Asn Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val
245 250 255
Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val
260 265 270
Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp
275 280 285
Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His
290 295 300
Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn
305 310 315 320
Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His
325 330 335
Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu
340 345 350
Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys
355 360 365
Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu
370 375 380
Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu
385 390 395 400
Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val
405 410 415
Lys Gly Ile Ala Lys Ser Arg Lys Ser
420 425
<210> 4
<211> 425
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 4
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu
130 135 140
Glu Gly Thr Leu Thr Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val
245 250 255
Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val
260 265 270
Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp
275 280 285
Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His
290 295 300
Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn
305 310 315 320
Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His
325 330 335
Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu
340 345 350
Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys
355 360 365
Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu
370 375 380
Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu
385 390 395 400
Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val
405 410 415
Lys Gly Ile Ala Lys Ser Arg Lys Ser
420 425
<210> 5
<211> 425
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 5
Met Asp Glu Lys Asn Ser Ala Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Lys
20 25 30
Ala Thr Val Asp Lys Ile Glu Leu Lys Gly Thr Ser Asp Lys Asp Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Thr Lys Asp Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ala Asp Asp Leu Ser Lys Thr Thr Phe Glu Leu Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Arg Lys Val Ser Ser Lys Asp Lys
85 90 95
Thr Ser Thr Asp Glu Met Phe Asn Glu Lys Gly Glu Leu Ser Ala Lys
100 105 110
Thr Met Thr Arg Glu Asn Gly Thr Lys Leu Glu Tyr Thr Glu Met Lys
115 120 125
Ser Asp Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Asn Phe Thr Leu
130 135 140
Glu Gly Lys Val Ala Asn Asp Lys Val Thr Leu Glu Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Glu Ile Ala Lys Ser Gly Glu Val Thr Val
165 170 175
Ala Leu Asn Asp Thr Asn Thr Thr Gln Ala Thr Lys Lys Thr Gly Ala
180 185 190
Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys
195 200 205
Thr Thr Gln Leu Val Phe Thr Lys Gln Asp Thr Ile Thr Val Gln Lys
210 215 220
Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Thr Ala Val Glu Ile Lys
225 230 235 240
Thr Leu Asp Glu Leu Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val
245 250 255
Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val
260 265 270
Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp
275 280 285
Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His
290 295 300
Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn
305 310 315 320
Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His
325 330 335
Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu
340 345 350
Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys
355 360 365
Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu
370 375 380
Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu
385 390 395 400
Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val
405 410 415
Lys Gly Ile Ala Lys Ser Arg Lys Ser
420 425
<210> 6
<211> 426
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 6
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Glu Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Glu Lys Ala Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ser Gln Asp Leu Asn Gln Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Arg Lys Val Asn Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Asp Lys Gly Lys Leu Ser Glu Lys
100 105 110
Val Val Thr Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys
115 120 125
Asn Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu
130 135 140
Glu Gly Thr Leu Thr Asp Gly Gly Glu Thr Lys Leu Thr Val Thr Glu
145 150 155 160
Gly Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Ile Thr
165 170 175
Val Ala Leu Asn Asp Thr Glu Thr Thr Pro Ala Asp Lys Lys Thr Gly
180 185 190
Glu Trp Lys Ser Asp Thr Ser Thr Leu Thr Ile Ser Lys Asn Ser Gln
195 200 205
Lys Pro Lys Gln Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln
210 215 220
Asn Tyr Asn Arg Ala Gly Asn Ala Leu Glu Gly Ser Pro Ala Glu Ile
225 230 235 240
Lys Asp Leu Ala Glu Leu Lys Ala Ala Leu Lys Gly Ser Glu Ser Gln
245 250 255
Val Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln
260 265 270
Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser
275 280 285
Trp Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp
290 295 300
His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu
305 310 315 320
Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu
325 330 335
His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His
340 345 350
Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile
355 360 365
Lys Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala
370 375 380
Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile
385 390 395 400
Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr
405 410 415
Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
420 425
<210> 7
<211> 425
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 7
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Ser Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ser Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Asn Ser Lys Asp Lys
85 90 95
Ser Ser Ile Glu Glu Lys Phe Asn Ala Lys Gly Glu Leu Ser Glu Lys
100 105 110
Thr Ile Leu Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys
115 120 125
Ser Asp Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Ala Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Lys Thr Thr Leu Lys Val Thr Glu Gly
145 150 155 160
Thr Val Val Leu Ser Lys His Ile Pro Asn Ser Gly Glu Ile Thr Val
165 170 175
Glu Leu Asn Asp Ser Asn Ser Thr Gln Ala Thr Lys Lys Thr Gly Lys
180 185 190
Trp Asp Ser Asn Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys
195 200 205
Thr Lys Asn Ile Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln Lys
210 215 220
Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Asn Ala Val Glu Ile Lys
225 230 235 240
Thr Leu Asp Glu Leu Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val
245 250 255
Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val
260 265 270
Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp
275 280 285
Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His
290 295 300
Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn
305 310 315 320
Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His
325 330 335
Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu
340 345 350
Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys
355 360 365
Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu
370 375 380
Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu
385 390 395 400
Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val
405 410 415
Lys Gly Ile Ala Lys Ser Arg Lys Ser
420 425
<210> 8
<211> 426
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 8
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Glu Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Thr Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ala Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Ile Ser Glu Lys
100 105 110
Thr Ile Val Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Asp Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Thr Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Gly Lys Thr Thr Leu Lys Val Thr Glu
145 150 155 160
Gly Thr Val Val Leu Ser Lys Asn Ile Leu Lys Ser Gly Glu Ile Thr
165 170 175
Val Ala Leu Asp Asp Ser Asp Thr Thr Gln Ala Thr Lys Lys Thr Gly
180 185 190
Lys Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Gln
195 200 205
Lys Thr Lys Asn Leu Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln
210 215 220
Lys Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Lys Ala Val Glu Ile
225 230 235 240
Thr Thr Leu Glu Lys Leu Lys Asp Ala Leu Lys Gly Ser Glu Ser Gln
245 250 255
Val Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln
260 265 270
Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser
275 280 285
Trp Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp
290 295 300
His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu
305 310 315 320
Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu
325 330 335
His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His
340 345 350
Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile
355 360 365
Lys Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala
370 375 380
Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile
385 390 395 400
Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr
405 410 415
Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
420 425
<210> 9
<211> 426
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 9
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Thr
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Glu
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Thr Asp Lys Ser Lys Val Lys
50 55 60
Ser Thr Ile Ala Asp Asp Leu Ser Gln Thr Lys Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Gly Lys Gly Glu Thr Ser Glu Lys
100 105 110
Thr Ile Val Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Asp Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Thr Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Gly Lys Thr Thr Leu Lys Val Thr Glu
145 150 155 160
Gly Thr Val Val Leu Ser Lys Asn Ile Leu Lys Ser Gly Glu Ile Thr
165 170 175
Ala Ala Leu Asp Asp Ser Asp Thr Thr Arg Ala Thr Lys Lys Thr Gly
180 185 190
Lys Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Gln
195 200 205
Lys Thr Lys Asn Leu Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln
210 215 220
Arg Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Lys Ala Val Glu Ile
225 230 235 240
Thr Thr Leu Lys Glu Leu Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln
245 250 255
Val Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln
260 265 270
Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser
275 280 285
Trp Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp
290 295 300
His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu
305 310 315 320
Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu
325 330 335
His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His
340 345 350
Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile
355 360 365
Lys Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala
370 375 380
Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile
385 390 395 400
Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr
405 410 415
Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
420 425
<210> 10
<211> 426
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 10
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Glu
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Ala Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ala Asp Asp Leu Ser Gln Thr Lys Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Asp Lys Gly Lys Leu Ser Glu Lys
100 105 110
Val Val Thr Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Gln
115 120 125
Asn Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Ser Leu Thr Leu
130 135 140
Glu Gly Thr Leu Thr Ala Asp Gly Glu Thr Lys Leu Thr Val Glu Ala
145 150 155 160
Gly Thr Val Thr Leu Ser Lys Asn Ile Ser Glu Ser Gly Glu Ile Thr
165 170 175
Val Glu Leu Lys Asp Thr Glu Thr Thr Pro Ala Asp Lys Lys Ser Gly
180 185 190
Thr Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Lys Asn Ser Gln
195 200 205
Lys Thr Lys Gln Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln
210 215 220
Lys Tyr Asn Thr Ala Gly Thr Lys Leu Glu Gly Ser Pro Ala Glu Ile
225 230 235 240
Lys Asp Leu Glu Ala Leu Lys Ala Ala Leu Lys Gly Ser Glu Ser Gln
245 250 255
Val Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln
260 265 270
Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser
275 280 285
Trp Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp
290 295 300
His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu
305 310 315 320
Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu
325 330 335
His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His
340 345 350
Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile
355 360 365
Lys Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala
370 375 380
Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile
385 390 395 400
Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr
405 410 415
Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
420 425
<210> 11
<211> 265
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 11
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Ser Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ser Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Asn Ser Lys Asp Lys
85 90 95
Ser Ser Ile Glu Glu Lys Phe Asn Ala Lys Gly Glu Leu Ser Glu Lys
100 105 110
Thr Ile Leu Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys
115 120 125
Ser Asp Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Ala Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Lys Thr Thr Leu Lys Val Thr Glu Gly
145 150 155 160
Thr Val Val Leu Ser Lys His Ile Pro Asn Ser Gly Glu Ile Thr Val
165 170 175
Glu Leu Asn Asp Ser Asn Ser Thr Gln Ala Thr Lys Lys Thr Gly Lys
180 185 190
Trp Asp Ser Asn Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys
195 200 205
Thr Lys Asn Ile Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln Lys
210 215 220
Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Asn Ala Val Glu Ile Lys
225 230 235 240
Thr Leu Asp Glu Leu Lys Asn Ala Leu Lys Cys Leu Val Pro Arg Gly
245 250 255
Ser Leu Glu His His His His His His
260 265
<210> 12
<211> 408
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 12
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Thr Leu
130 135 140
Glu Gly Gln Leu Ser Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Gly Gly Ser Met Gln
245 250 255
Ile Tyr Glu Gly Lys Leu Thr Ala Glu Gly Leu Arg Phe Gly Ile Val
260 265 270
Ala Ser Arg Phe Asn His Ala Leu Val Asp Arg Leu Val Glu Gly Ala
275 280 285
Ile Asp Cys Ile Val Arg His Gly Gly Arg Glu Glu Asp Ile Thr Leu
290 295 300
Val Arg Val Pro Gly Ser Trp Glu Ile Pro Val Ala Ala Gly Glu Leu
305 310 315 320
Ala Arg Lys Glu Asp Ile Asp Ala Val Ile Ala Ile Gly Val Leu Ile
325 330 335
Arg Gly Ala Thr Pro His Phe Asp Tyr Ile Ala Ser Glu Val Ser Lys
340 345 350
Gly Leu Ala Asn Leu Ser Leu Glu Leu Arg Lys Pro Ile Thr Phe Gly
355 360 365
Val Ile Thr Ala Asp Thr Leu Glu Gln Ala Ile Glu Arg Ala Gly Thr
370 375 380
Lys His Gly Asn Lys Gly Trp Glu Ala Ala Leu Ser Ala Ile Glu Met
385 390 395 400
Ala Asn Leu Phe Lys Ser Leu Arg
405
<210> 13
<211> 408
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 13
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Asp Leu
130 135 140
Lys Gly Glu Leu Ser Ser Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Gly Gly Ser Met Gln
245 250 255
Ile Tyr Glu Gly Lys Leu Thr Ala Glu Gly Leu Arg Phe Gly Ile Val
260 265 270
Ala Ser Arg Phe Asn His Ala Leu Val Asp Arg Leu Val Glu Gly Ala
275 280 285
Ile Asp Cys Ile Val Arg His Gly Gly Arg Glu Glu Asp Ile Thr Leu
290 295 300
Val Arg Val Pro Gly Ser Trp Glu Ile Pro Val Ala Ala Gly Glu Leu
305 310 315 320
Ala Arg Lys Glu Asp Ile Asp Ala Val Ile Ala Ile Gly Val Leu Ile
325 330 335
Arg Gly Ala Thr Pro His Phe Asp Tyr Ile Ala Ser Glu Val Ser Lys
340 345 350
Gly Leu Ala Asn Leu Ser Leu Glu Leu Arg Lys Pro Ile Thr Phe Gly
355 360 365
Val Ile Thr Ala Asp Thr Leu Glu Gln Ala Ile Glu Arg Ala Gly Thr
370 375 380
Lys His Gly Asn Lys Gly Trp Glu Ala Ala Leu Ser Ala Ile Glu Met
385 390 395 400
Ala Asn Leu Phe Lys Ser Leu Arg
405
<210> 14
<211> 408
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 14
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Thr Leu
130 135 140
Glu Gly Lys Val Ala Asn Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Gly Gly Ser Met Gln
245 250 255
Ile Tyr Glu Gly Lys Leu Thr Ala Glu Gly Leu Arg Phe Gly Ile Val
260 265 270
Ala Ser Arg Phe Asn His Ala Leu Val Asp Arg Leu Val Glu Gly Ala
275 280 285
Ile Asp Cys Ile Val Arg His Gly Gly Arg Glu Glu Asp Ile Thr Leu
290 295 300
Val Arg Val Pro Gly Ser Trp Glu Ile Pro Val Ala Ala Gly Glu Leu
305 310 315 320
Ala Arg Lys Glu Asp Ile Asp Ala Val Ile Ala Ile Gly Val Leu Ile
325 330 335
Arg Gly Ala Thr Pro His Phe Asp Tyr Ile Ala Ser Glu Val Ser Lys
340 345 350
Gly Leu Ala Asn Leu Ser Leu Glu Leu Arg Lys Pro Ile Thr Phe Gly
355 360 365
Val Ile Thr Ala Asp Thr Leu Glu Gln Ala Ile Glu Arg Ala Gly Thr
370 375 380
Lys His Gly Asn Lys Gly Trp Glu Ala Ala Leu Ser Ala Ile Glu Met
385 390 395 400
Ala Asn Leu Phe Lys Ser Leu Arg
405
<210> 15
<211> 408
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 15
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu
130 135 140
Glu Gly Thr Leu Thr Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Gly Gly Ser Met Gln
245 250 255
Ile Tyr Glu Gly Lys Leu Thr Ala Glu Gly Leu Arg Phe Gly Ile Val
260 265 270
Ala Ser Arg Phe Asn His Ala Leu Val Asp Arg Leu Val Glu Gly Ala
275 280 285
Ile Asp Cys Ile Val Arg His Gly Gly Arg Glu Glu Asp Ile Thr Leu
290 295 300
Val Arg Val Pro Gly Ser Trp Glu Ile Pro Val Ala Ala Gly Glu Leu
305 310 315 320
Ala Arg Lys Glu Asp Ile Asp Ala Val Ile Ala Ile Gly Val Leu Ile
325 330 335
Arg Gly Ala Thr Pro His Phe Asp Tyr Ile Ala Ser Glu Val Ser Lys
340 345 350
Gly Leu Ala Asn Leu Ser Leu Glu Leu Arg Lys Pro Ile Thr Phe Gly
355 360 365
Val Ile Thr Ala Asp Thr Leu Glu Gln Ala Ile Glu Arg Ala Gly Thr
370 375 380
Lys His Gly Asn Lys Gly Trp Glu Ala Ala Leu Ser Ala Ile Glu Met
385 390 395 400
Ala Asn Leu Phe Lys Ser Leu Arg
405
<210> 16
<211> 408
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 16
Met Asp Glu Lys Asn Ser Ala Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Lys
20 25 30
Ala Thr Val Asp Lys Ile Glu Leu Lys Gly Thr Ser Asp Lys Asp Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Thr Lys Asp Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ala Asp Asp Leu Ser Lys Thr Thr Phe Glu Leu Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Arg Lys Val Ser Ser Lys Asp Lys
85 90 95
Thr Ser Thr Asp Glu Met Phe Asn Glu Lys Gly Glu Leu Ser Ala Lys
100 105 110
Thr Met Thr Arg Glu Asn Gly Thr Lys Leu Glu Tyr Thr Glu Met Lys
115 120 125
Ser Asp Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Asn Phe Thr Leu
130 135 140
Glu Gly Lys Val Ala Asn Asp Lys Val Thr Leu Glu Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Glu Ile Ala Lys Ser Gly Glu Val Thr Val
165 170 175
Ala Leu Asn Asp Thr Asn Thr Thr Gln Ala Thr Lys Lys Thr Gly Ala
180 185 190
Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys
195 200 205
Thr Thr Gln Leu Val Phe Thr Lys Gln Asp Thr Ile Thr Val Gln Lys
210 215 220
Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Thr Ala Val Glu Ile Lys
225 230 235 240
Thr Leu Asp Glu Leu Lys Asn Ala Leu Lys Gly Gly Gly Ser Met Gln
245 250 255
Ile Tyr Glu Gly Lys Leu Thr Ala Glu Gly Leu Arg Phe Gly Ile Val
260 265 270
Ala Ser Arg Phe Asn His Ala Leu Val Asp Arg Leu Val Glu Gly Ala
275 280 285
Ile Asp Cys Ile Val Arg His Gly Gly Arg Glu Glu Asp Ile Thr Leu
290 295 300
Val Arg Val Pro Gly Ser Trp Glu Ile Pro Val Ala Ala Gly Glu Leu
305 310 315 320
Ala Arg Lys Glu Asp Ile Asp Ala Val Ile Ala Ile Gly Val Leu Ile
325 330 335
Arg Gly Ala Thr Pro His Phe Asp Tyr Ile Ala Ser Glu Val Ser Lys
340 345 350
Gly Leu Ala Asn Leu Ser Leu Glu Leu Arg Lys Pro Ile Thr Phe Gly
355 360 365
Val Ile Thr Ala Asp Thr Leu Glu Gln Ala Ile Glu Arg Ala Gly Thr
370 375 380
Lys His Gly Asn Lys Gly Trp Glu Ala Ala Leu Ser Ala Ile Glu Met
385 390 395 400
Ala Asn Leu Phe Lys Ser Leu Arg
405
<210> 17
<211> 409
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 17
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Glu Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Glu Lys Ala Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ser Gln Asp Leu Asn Gln Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Arg Lys Val Asn Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Asp Lys Gly Lys Leu Ser Glu Lys
100 105 110
Val Val Thr Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys
115 120 125
Asn Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu
130 135 140
Glu Gly Thr Leu Thr Asp Gly Gly Glu Thr Lys Leu Thr Val Thr Glu
145 150 155 160
Gly Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Ile Thr
165 170 175
Val Ala Leu Asn Asp Thr Glu Thr Thr Pro Ala Asp Lys Lys Thr Gly
180 185 190
Glu Trp Lys Ser Asp Thr Ser Thr Leu Thr Ile Ser Lys Asn Ser Gln
195 200 205
Lys Pro Lys Gln Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln
210 215 220
Asn Tyr Asn Arg Ala Gly Asn Ala Leu Glu Gly Ser Pro Ala Glu Ile
225 230 235 240
Lys Asp Leu Ala Glu Leu Lys Ala Ala Leu Lys Gly Gly Gly Ser Met
245 250 255
Gln Ile Tyr Glu Gly Lys Leu Thr Ala Glu Gly Leu Arg Phe Gly Ile
260 265 270
Val Ala Ser Arg Phe Asn His Ala Leu Val Asp Arg Leu Val Glu Gly
275 280 285
Ala Ile Asp Cys Ile Val Arg His Gly Gly Arg Glu Glu Asp Ile Thr
290 295 300
Leu Val Arg Val Pro Gly Ser Trp Glu Ile Pro Val Ala Ala Gly Glu
305 310 315 320
Leu Ala Arg Lys Glu Asp Ile Asp Ala Val Ile Ala Ile Gly Val Leu
325 330 335
Ile Arg Gly Ala Thr Pro His Phe Asp Tyr Ile Ala Ser Glu Val Ser
340 345 350
Lys Gly Leu Ala Asn Leu Ser Leu Glu Leu Arg Lys Pro Ile Thr Phe
355 360 365
Gly Val Ile Thr Ala Asp Thr Leu Glu Gln Ala Ile Glu Arg Ala Gly
370 375 380
Thr Lys His Gly Asn Lys Gly Trp Glu Ala Ala Leu Ser Ala Ile Glu
385 390 395 400
Met Ala Asn Leu Phe Lys Ser Leu Arg
405
<210> 18
<211> 408
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 18
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Ser Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ser Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Asn Ser Lys Asp Lys
85 90 95
Ser Ser Ile Glu Glu Lys Phe Asn Ala Lys Gly Glu Leu Ser Glu Lys
100 105 110
Thr Ile Leu Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys
115 120 125
Ser Asp Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Ala Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Lys Thr Thr Leu Lys Val Thr Glu Gly
145 150 155 160
Thr Val Val Leu Ser Lys His Ile Pro Asn Ser Gly Glu Ile Thr Val
165 170 175
Glu Leu Asn Asp Ser Asn Ser Thr Gln Ala Thr Lys Lys Thr Gly Lys
180 185 190
Trp Asp Ser Asn Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys
195 200 205
Thr Lys Asn Ile Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln Lys
210 215 220
Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Asn Ala Val Glu Ile Lys
225 230 235 240
Thr Leu Asp Glu Leu Lys Asn Ala Leu Lys Gly Gly Gly Ser Met Gln
245 250 255
Ile Tyr Glu Gly Lys Leu Thr Ala Glu Gly Leu Arg Phe Gly Ile Val
260 265 270
Ala Ser Arg Phe Asn His Ala Leu Val Asp Arg Leu Val Glu Gly Ala
275 280 285
Ile Asp Cys Ile Val Arg His Gly Gly Arg Glu Glu Asp Ile Thr Leu
290 295 300
Val Arg Val Pro Gly Ser Trp Glu Ile Pro Val Ala Ala Gly Glu Leu
305 310 315 320
Ala Arg Lys Glu Asp Ile Asp Ala Val Ile Ala Ile Gly Val Leu Ile
325 330 335
Arg Gly Ala Thr Pro His Phe Asp Tyr Ile Ala Ser Glu Val Ser Lys
340 345 350
Gly Leu Ala Asn Leu Ser Leu Glu Leu Arg Lys Pro Ile Thr Phe Gly
355 360 365
Val Ile Thr Ala Asp Thr Leu Glu Gln Ala Ile Glu Arg Ala Gly Thr
370 375 380
Lys His Gly Asn Lys Gly Trp Glu Ala Ala Leu Ser Ala Ile Glu Met
385 390 395 400
Ala Asn Leu Phe Lys Ser Leu Arg
405
<210> 19
<211> 409
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 19
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Glu Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Thr Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ala Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Ile Ser Glu Lys
100 105 110
Thr Ile Val Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Asp Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Thr Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Gly Lys Thr Thr Leu Lys Val Thr Glu
145 150 155 160
Gly Thr Val Val Leu Ser Lys Asn Ile Leu Lys Ser Gly Glu Ile Thr
165 170 175
Val Ala Leu Asp Asp Ser Asp Thr Thr Gln Ala Thr Lys Lys Thr Gly
180 185 190
Lys Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Gln
195 200 205
Lys Thr Lys Asn Leu Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln
210 215 220
Lys Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Lys Ala Val Glu Ile
225 230 235 240
Thr Thr Leu Glu Lys Leu Lys Asp Ala Leu Lys Gly Gly Gly Ser Met
245 250 255
Gln Ile Tyr Glu Gly Lys Leu Thr Ala Glu Gly Leu Arg Phe Gly Ile
260 265 270
Val Ala Ser Arg Phe Asn His Ala Leu Val Asp Arg Leu Val Glu Gly
275 280 285
Ala Ile Asp Cys Ile Val Arg His Gly Gly Arg Glu Glu Asp Ile Thr
290 295 300
Leu Val Arg Val Pro Gly Ser Trp Glu Ile Pro Val Ala Ala Gly Glu
305 310 315 320
Leu Ala Arg Lys Glu Asp Ile Asp Ala Val Ile Ala Ile Gly Val Leu
325 330 335
Ile Arg Gly Ala Thr Pro His Phe Asp Tyr Ile Ala Ser Glu Val Ser
340 345 350
Lys Gly Leu Ala Asn Leu Ser Leu Glu Leu Arg Lys Pro Ile Thr Phe
355 360 365
Gly Val Ile Thr Ala Asp Thr Leu Glu Gln Ala Ile Glu Arg Ala Gly
370 375 380
Thr Lys His Gly Asn Lys Gly Trp Glu Ala Ala Leu Ser Ala Ile Glu
385 390 395 400
Met Ala Asn Leu Phe Lys Ser Leu Arg
405
<210> 20
<211> 409
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 20
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Thr
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Glu
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Thr Asp Lys Ser Lys Val Lys
50 55 60
Ser Thr Ile Ala Asp Asp Leu Ser Gln Thr Lys Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Gly Lys Gly Glu Thr Ser Glu Lys
100 105 110
Thr Ile Val Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Asp Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Thr Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Gly Lys Thr Thr Leu Lys Val Thr Glu
145 150 155 160
Gly Thr Val Val Leu Ser Lys Asn Ile Leu Lys Ser Gly Glu Ile Thr
165 170 175
Ala Ala Leu Asp Asp Ser Asp Thr Thr Arg Ala Thr Lys Lys Thr Gly
180 185 190
Lys Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Gln
195 200 205
Lys Thr Lys Asn Leu Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln
210 215 220
Arg Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Lys Ala Val Glu Ile
225 230 235 240
Thr Thr Leu Lys Glu Leu Lys Asn Ala Leu Lys Gly Gly Gly Ser Met
245 250 255
Gln Ile Tyr Glu Gly Lys Leu Thr Ala Glu Gly Leu Arg Phe Gly Ile
260 265 270
Val Ala Ser Arg Phe Asn His Ala Leu Val Asp Arg Leu Val Glu Gly
275 280 285
Ala Ile Asp Cys Ile Val Arg His Gly Gly Arg Glu Glu Asp Ile Thr
290 295 300
Leu Val Arg Val Pro Gly Ser Trp Glu Ile Pro Val Ala Ala Gly Glu
305 310 315 320
Leu Ala Arg Lys Glu Asp Ile Asp Ala Val Ile Ala Ile Gly Val Leu
325 330 335
Ile Arg Gly Ala Thr Pro His Phe Asp Tyr Ile Ala Ser Glu Val Ser
340 345 350
Lys Gly Leu Ala Asn Leu Ser Leu Glu Leu Arg Lys Pro Ile Thr Phe
355 360 365
Gly Val Ile Thr Ala Asp Thr Leu Glu Gln Ala Ile Glu Arg Ala Gly
370 375 380
Thr Lys His Gly Asn Lys Gly Trp Glu Ala Ala Leu Ser Ala Ile Glu
385 390 395 400
Met Ala Asn Leu Phe Lys Ser Leu Arg
405
<210> 21
<211> 409
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 21
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Glu
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Ala Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ala Asp Asp Leu Ser Gln Thr Lys Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Asp Lys Gly Lys Leu Ser Glu Lys
100 105 110
Val Val Thr Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Gln
115 120 125
Asn Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Ser Leu Thr Leu
130 135 140
Glu Gly Thr Leu Thr Ala Asp Gly Glu Thr Lys Leu Thr Val Glu Ala
145 150 155 160
Gly Thr Val Thr Leu Ser Lys Asn Ile Ser Glu Ser Gly Glu Ile Thr
165 170 175
Val Glu Leu Lys Asp Thr Glu Thr Thr Pro Ala Asp Lys Lys Ser Gly
180 185 190
Thr Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Lys Asn Ser Gln
195 200 205
Lys Thr Lys Gln Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln
210 215 220
Lys Tyr Asn Thr Ala Gly Thr Lys Leu Glu Gly Ser Pro Ala Glu Ile
225 230 235 240
Lys Asp Leu Glu Ala Leu Lys Ala Ala Leu Lys Gly Gly Gly Ser Met
245 250 255
Gln Ile Tyr Glu Gly Lys Leu Thr Ala Glu Gly Leu Arg Phe Gly Ile
260 265 270
Val Ala Ser Arg Phe Asn His Ala Leu Val Asp Arg Leu Val Glu Gly
275 280 285
Ala Ile Asp Cys Ile Val Arg His Gly Gly Arg Glu Glu Asp Ile Thr
290 295 300
Leu Val Arg Val Pro Gly Ser Trp Glu Ile Pro Val Ala Ala Gly Glu
305 310 315 320
Leu Ala Arg Lys Glu Asp Ile Asp Ala Val Ile Ala Ile Gly Val Leu
325 330 335
Ile Arg Gly Ala Thr Pro His Phe Asp Tyr Ile Ala Ser Glu Val Ser
340 345 350
Lys Gly Leu Ala Asn Leu Ser Leu Glu Leu Arg Lys Pro Ile Thr Phe
355 360 365
Gly Val Ile Thr Ala Asp Thr Leu Glu Gln Ala Ile Glu Arg Ala Gly
370 375 380
Thr Lys His Gly Asn Lys Gly Trp Glu Ala Ala Leu Ser Ala Ile Glu
385 390 395 400
Met Ala Asn Leu Phe Lys Ser Leu Arg
405
<210> 22
<211> 435
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 22
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Thr Leu
130 135 140
Glu Gly Gln Leu Ser Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Met Thr Thr Ala
245 250 255
Ser Thr Ser Gln Val Arg Gln Asn Tyr His Gln Asp Ser Glu Ala Ala
260 265 270
Ile Asn Arg Gln Ile Asn Leu Glu Leu Tyr Ala Ser Tyr Val Tyr Leu
275 280 285
Ser Met Ser Tyr Tyr Phe Asp Arg Asp Asp Val Ala Leu Lys Asn Phe
290 295 300
Ala Lys Tyr Phe Leu His Gln Ser His Glu Glu Arg Glu His Ala Glu
305 310 315 320
Lys Leu Met Lys Leu Gln Asn Gln Arg Gly Gly Arg Ile Phe Leu Gln
325 330 335
Asp Ile Lys Lys Pro Asp Cys Asp Asp Trp Glu Ser Gly Leu Asn Ala
340 345 350
Met Glu Cys Ala Leu His Leu Glu Lys Asn Val Asn Gln Ser Leu Leu
355 360 365
Glu Leu His Lys Leu Ala Thr Asp Lys Asn Asp Pro His Leu Cys Asp
370 375 380
Phe Ile Glu Thr His Tyr Leu Asn Glu Gln Val Lys Ala Ile Lys Glu
385 390 395 400
Leu Gly Asp His Val Thr Asn Leu Arg Lys Met Gly Ala Pro Glu Ser
405 410 415
Gly Leu Ala Glu Tyr Leu Phe Asp Lys His Thr Leu Gly Asp Ser Asp
420 425 430
Asn Glu Ser
435
<210> 23
<211> 435
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 23
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Asp Leu
130 135 140
Lys Gly Glu Leu Ser Ser Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Met Thr Thr Ala
245 250 255
Ser Thr Ser Gln Val Arg Gln Asn Tyr His Gln Asp Ser Glu Ala Ala
260 265 270
Ile Asn Arg Gln Ile Asn Leu Glu Leu Tyr Ala Ser Tyr Val Tyr Leu
275 280 285
Ser Met Ser Tyr Tyr Phe Asp Arg Asp Asp Val Ala Leu Lys Asn Phe
290 295 300
Ala Lys Tyr Phe Leu His Gln Ser His Glu Glu Arg Glu His Ala Glu
305 310 315 320
Lys Leu Met Lys Leu Gln Asn Gln Arg Gly Gly Arg Ile Phe Leu Gln
325 330 335
Asp Ile Lys Lys Pro Asp Cys Asp Asp Trp Glu Ser Gly Leu Asn Ala
340 345 350
Met Glu Cys Ala Leu His Leu Glu Lys Asn Val Asn Gln Ser Leu Leu
355 360 365
Glu Leu His Lys Leu Ala Thr Asp Lys Asn Asp Pro His Leu Cys Asp
370 375 380
Phe Ile Glu Thr His Tyr Leu Asn Glu Gln Val Lys Ala Ile Lys Glu
385 390 395 400
Leu Gly Asp His Val Thr Asn Leu Arg Lys Met Gly Ala Pro Glu Ser
405 410 415
Gly Leu Ala Glu Tyr Leu Phe Asp Lys His Thr Leu Gly Asp Ser Asp
420 425 430
Asn Glu Ser
435
<210> 24
<211> 435
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 24
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Thr Leu
130 135 140
Glu Gly Lys Val Ala Asn Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Met Thr Thr Ala
245 250 255
Ser Thr Ser Gln Val Arg Gln Asn Tyr His Gln Asp Ser Glu Ala Ala
260 265 270
Ile Asn Arg Gln Ile Asn Leu Glu Leu Tyr Ala Ser Tyr Val Tyr Leu
275 280 285
Ser Met Ser Tyr Tyr Phe Asp Arg Asp Asp Val Ala Leu Lys Asn Phe
290 295 300
Ala Lys Tyr Phe Leu His Gln Ser His Glu Glu Arg Glu His Ala Glu
305 310 315 320
Lys Leu Met Lys Leu Gln Asn Gln Arg Gly Gly Arg Ile Phe Leu Gln
325 330 335
Asp Ile Lys Lys Pro Asp Cys Asp Asp Trp Glu Ser Gly Leu Asn Ala
340 345 350
Met Glu Cys Ala Leu His Leu Glu Lys Asn Val Asn Gln Ser Leu Leu
355 360 365
Glu Leu His Lys Leu Ala Thr Asp Lys Asn Asp Pro His Leu Cys Asp
370 375 380
Phe Ile Glu Thr His Tyr Leu Asn Glu Gln Val Lys Ala Ile Lys Glu
385 390 395 400
Leu Gly Asp His Val Thr Asn Leu Arg Lys Met Gly Ala Pro Glu Ser
405 410 415
Gly Leu Ala Glu Tyr Leu Phe Asp Lys His Thr Leu Gly Asp Ser Asp
420 425 430
Asn Glu Ser
435
<210> 25
<211> 435
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 25
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu
130 135 140
Glu Gly Thr Leu Thr Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Met Thr Thr Ala
245 250 255
Ser Thr Ser Gln Val Arg Gln Asn Tyr His Gln Asp Ser Glu Ala Ala
260 265 270
Ile Asn Arg Gln Ile Asn Leu Glu Leu Tyr Ala Ser Tyr Val Tyr Leu
275 280 285
Ser Met Ser Tyr Tyr Phe Asp Arg Asp Asp Val Ala Leu Lys Asn Phe
290 295 300
Ala Lys Tyr Phe Leu His Gln Ser His Glu Glu Arg Glu His Ala Glu
305 310 315 320
Lys Leu Met Lys Leu Gln Asn Gln Arg Gly Gly Arg Ile Phe Leu Gln
325 330 335
Asp Ile Lys Lys Pro Asp Cys Asp Asp Trp Glu Ser Gly Leu Asn Ala
340 345 350
Met Glu Cys Ala Leu His Leu Glu Lys Asn Val Asn Gln Ser Leu Leu
355 360 365
Glu Leu His Lys Leu Ala Thr Asp Lys Asn Asp Pro His Leu Cys Asp
370 375 380
Phe Ile Glu Thr His Tyr Leu Asn Glu Gln Val Lys Ala Ile Lys Glu
385 390 395 400
Leu Gly Asp His Val Thr Asn Leu Arg Lys Met Gly Ala Pro Glu Ser
405 410 415
Gly Leu Ala Glu Tyr Leu Phe Asp Lys His Thr Leu Gly Asp Ser Asp
420 425 430
Asn Glu Ser
435
<210> 26
<211> 435
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 26
Met Asp Glu Lys Asn Ser Ala Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Lys
20 25 30
Ala Thr Val Asp Lys Ile Glu Leu Lys Gly Thr Ser Asp Lys Asp Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Thr Lys Asp Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ala Asp Asp Leu Ser Lys Thr Thr Phe Glu Leu Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Arg Lys Val Ser Ser Lys Asp Lys
85 90 95
Thr Ser Thr Asp Glu Met Phe Asn Glu Lys Gly Glu Leu Ser Ala Lys
100 105 110
Thr Met Thr Arg Glu Asn Gly Thr Lys Leu Glu Tyr Thr Glu Met Lys
115 120 125
Ser Asp Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Asn Phe Thr Leu
130 135 140
Glu Gly Lys Val Ala Asn Asp Lys Val Thr Leu Glu Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Glu Ile Ala Lys Ser Gly Glu Val Thr Val
165 170 175
Ala Leu Asn Asp Thr Asn Thr Thr Gln Ala Thr Lys Lys Thr Gly Ala
180 185 190
Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys
195 200 205
Thr Thr Gln Leu Val Phe Thr Lys Gln Asp Thr Ile Thr Val Gln Lys
210 215 220
Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Thr Ala Val Glu Ile Lys
225 230 235 240
Thr Leu Asp Glu Leu Lys Asn Ala Leu Lys Gly Ser Met Thr Thr Ala
245 250 255
Ser Thr Ser Gln Val Arg Gln Asn Tyr His Gln Asp Ser Glu Ala Ala
260 265 270
Ile Asn Arg Gln Ile Asn Leu Glu Leu Tyr Ala Ser Tyr Val Tyr Leu
275 280 285
Ser Met Ser Tyr Tyr Phe Asp Arg Asp Asp Val Ala Leu Lys Asn Phe
290 295 300
Ala Lys Tyr Phe Leu His Gln Ser His Glu Glu Arg Glu His Ala Glu
305 310 315 320
Lys Leu Met Lys Leu Gln Asn Gln Arg Gly Gly Arg Ile Phe Leu Gln
325 330 335
Asp Ile Lys Lys Pro Asp Cys Asp Asp Trp Glu Ser Gly Leu Asn Ala
340 345 350
Met Glu Cys Ala Leu His Leu Glu Lys Asn Val Asn Gln Ser Leu Leu
355 360 365
Glu Leu His Lys Leu Ala Thr Asp Lys Asn Asp Pro His Leu Cys Asp
370 375 380
Phe Ile Glu Thr His Tyr Leu Asn Glu Gln Val Lys Ala Ile Lys Glu
385 390 395 400
Leu Gly Asp His Val Thr Asn Leu Arg Lys Met Gly Ala Pro Glu Ser
405 410 415
Gly Leu Ala Glu Tyr Leu Phe Asp Lys His Thr Leu Gly Asp Ser Asp
420 425 430
Asn Glu Ser
435
<210> 27
<211> 436
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 27
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Glu Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Glu Lys Ala Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ser Gln Asp Leu Asn Gln Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Arg Lys Val Asn Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Asp Lys Gly Lys Leu Ser Glu Lys
100 105 110
Val Val Thr Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys
115 120 125
Asn Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu
130 135 140
Glu Gly Thr Leu Thr Asp Gly Gly Glu Thr Lys Leu Thr Val Thr Glu
145 150 155 160
Gly Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Ile Thr
165 170 175
Val Ala Leu Asn Asp Thr Glu Thr Thr Pro Ala Asp Lys Lys Thr Gly
180 185 190
Glu Trp Lys Ser Asp Thr Ser Thr Leu Thr Ile Ser Lys Asn Ser Gln
195 200 205
Lys Pro Lys Gln Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln
210 215 220
Asn Tyr Asn Arg Ala Gly Asn Ala Leu Glu Gly Ser Pro Ala Glu Ile
225 230 235 240
Lys Asp Leu Ala Glu Leu Lys Ala Ala Leu Lys Gly Ser Met Thr Thr
245 250 255
Ala Ser Thr Ser Gln Val Arg Gln Asn Tyr His Gln Asp Ser Glu Ala
260 265 270
Ala Ile Asn Arg Gln Ile Asn Leu Glu Leu Tyr Ala Ser Tyr Val Tyr
275 280 285
Leu Ser Met Ser Tyr Tyr Phe Asp Arg Asp Asp Val Ala Leu Lys Asn
290 295 300
Phe Ala Lys Tyr Phe Leu His Gln Ser His Glu Glu Arg Glu His Ala
305 310 315 320
Glu Lys Leu Met Lys Leu Gln Asn Gln Arg Gly Gly Arg Ile Phe Leu
325 330 335
Gln Asp Ile Lys Lys Pro Asp Cys Asp Asp Trp Glu Ser Gly Leu Asn
340 345 350
Ala Met Glu Cys Ala Leu His Leu Glu Lys Asn Val Asn Gln Ser Leu
355 360 365
Leu Glu Leu His Lys Leu Ala Thr Asp Lys Asn Asp Pro His Leu Cys
370 375 380
Asp Phe Ile Glu Thr His Tyr Leu Asn Glu Gln Val Lys Ala Ile Lys
385 390 395 400
Glu Leu Gly Asp His Val Thr Asn Leu Arg Lys Met Gly Ala Pro Glu
405 410 415
Ser Gly Leu Ala Glu Tyr Leu Phe Asp Lys His Thr Leu Gly Asp Ser
420 425 430
Asp Asn Glu Ser
435
<210> 28
<211> 435
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 28
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Ser Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ser Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Asn Ser Lys Asp Lys
85 90 95
Ser Ser Ile Glu Glu Lys Phe Asn Ala Lys Gly Glu Leu Ser Glu Lys
100 105 110
Thr Ile Leu Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys
115 120 125
Ser Asp Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Ala Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Lys Thr Thr Leu Lys Val Thr Glu Gly
145 150 155 160
Thr Val Val Leu Ser Lys His Ile Pro Asn Ser Gly Glu Ile Thr Val
165 170 175
Glu Leu Asn Asp Ser Asn Ser Thr Gln Ala Thr Lys Lys Thr Gly Lys
180 185 190
Trp Asp Ser Asn Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys
195 200 205
Thr Lys Asn Ile Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln Lys
210 215 220
Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Asn Ala Val Glu Ile Lys
225 230 235 240
Thr Leu Asp Glu Leu Lys Asn Ala Leu Lys Gly Ser Met Thr Thr Ala
245 250 255
Ser Thr Ser Gln Val Arg Gln Asn Tyr His Gln Asp Ser Glu Ala Ala
260 265 270
Ile Asn Arg Gln Ile Asn Leu Glu Leu Tyr Ala Ser Tyr Val Tyr Leu
275 280 285
Ser Met Ser Tyr Tyr Phe Asp Arg Asp Asp Val Ala Leu Lys Asn Phe
290 295 300
Ala Lys Tyr Phe Leu His Gln Ser His Glu Glu Arg Glu His Ala Glu
305 310 315 320
Lys Leu Met Lys Leu Gln Asn Gln Arg Gly Gly Arg Ile Phe Leu Gln
325 330 335
Asp Ile Lys Lys Pro Asp Cys Asp Asp Trp Glu Ser Gly Leu Asn Ala
340 345 350
Met Glu Cys Ala Leu His Leu Glu Lys Asn Val Asn Gln Ser Leu Leu
355 360 365
Glu Leu His Lys Leu Ala Thr Asp Lys Asn Asp Pro His Leu Cys Asp
370 375 380
Phe Ile Glu Thr His Tyr Leu Asn Glu Gln Val Lys Ala Ile Lys Glu
385 390 395 400
Leu Gly Asp His Val Thr Asn Leu Arg Lys Met Gly Ala Pro Glu Ser
405 410 415
Gly Leu Ala Glu Tyr Leu Phe Asp Lys His Thr Leu Gly Asp Ser Asp
420 425 430
Asn Glu Ser
435
<210> 29
<211> 436
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 29
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Glu Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Thr Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ala Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Ile Ser Glu Lys
100 105 110
Thr Ile Val Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Asp Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Thr Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Gly Lys Thr Thr Leu Lys Val Thr Glu
145 150 155 160
Gly Thr Val Val Leu Ser Lys Asn Ile Leu Lys Ser Gly Glu Ile Thr
165 170 175
Val Ala Leu Asp Asp Ser Asp Thr Thr Gln Ala Thr Lys Lys Thr Gly
180 185 190
Lys Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Gln
195 200 205
Lys Thr Lys Asn Leu Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln
210 215 220
Lys Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Lys Ala Val Glu Ile
225 230 235 240
Thr Thr Leu Glu Lys Leu Lys Asp Ala Leu Lys Gly Ser Met Thr Thr
245 250 255
Ala Ser Thr Ser Gln Val Arg Gln Asn Tyr His Gln Asp Ser Glu Ala
260 265 270
Ala Ile Asn Arg Gln Ile Asn Leu Glu Leu Tyr Ala Ser Tyr Val Tyr
275 280 285
Leu Ser Met Ser Tyr Tyr Phe Asp Arg Asp Asp Val Ala Leu Lys Asn
290 295 300
Phe Ala Lys Tyr Phe Leu His Gln Ser His Glu Glu Arg Glu His Ala
305 310 315 320
Glu Lys Leu Met Lys Leu Gln Asn Gln Arg Gly Gly Arg Ile Phe Leu
325 330 335
Gln Asp Ile Lys Lys Pro Asp Cys Asp Asp Trp Glu Ser Gly Leu Asn
340 345 350
Ala Met Glu Cys Ala Leu His Leu Glu Lys Asn Val Asn Gln Ser Leu
355 360 365
Leu Glu Leu His Lys Leu Ala Thr Asp Lys Asn Asp Pro His Leu Cys
370 375 380
Asp Phe Ile Glu Thr His Tyr Leu Asn Glu Gln Val Lys Ala Ile Lys
385 390 395 400
Glu Leu Gly Asp His Val Thr Asn Leu Arg Lys Met Gly Ala Pro Glu
405 410 415
Ser Gly Leu Ala Glu Tyr Leu Phe Asp Lys His Thr Leu Gly Asp Ser
420 425 430
Asp Asn Glu Ser
435
<210> 30
<211> 436
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 30
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Thr
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Glu
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Thr Asp Lys Ser Lys Val Lys
50 55 60
Ser Thr Ile Ala Asp Asp Leu Ser Gln Thr Lys Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Gly Lys Gly Glu Thr Ser Glu Lys
100 105 110
Thr Ile Val Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Asp Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Thr Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Gly Lys Thr Thr Leu Lys Val Thr Glu
145 150 155 160
Gly Thr Val Val Leu Ser Lys Asn Ile Leu Lys Ser Gly Glu Ile Thr
165 170 175
Ala Ala Leu Asp Asp Ser Asp Thr Thr Arg Ala Thr Lys Lys Thr Gly
180 185 190
Lys Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Gln
195 200 205
Lys Thr Lys Asn Leu Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln
210 215 220
Arg Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Lys Ala Val Glu Ile
225 230 235 240
Thr Thr Leu Lys Glu Leu Lys Asn Ala Leu Lys Gly Ser Met Thr Thr
245 250 255
Ala Ser Thr Ser Gln Val Arg Gln Asn Tyr His Gln Asp Ser Glu Ala
260 265 270
Ala Ile Asn Arg Gln Ile Asn Leu Glu Leu Tyr Ala Ser Tyr Val Tyr
275 280 285
Leu Ser Met Ser Tyr Tyr Phe Asp Arg Asp Asp Val Ala Leu Lys Asn
290 295 300
Phe Ala Lys Tyr Phe Leu His Gln Ser His Glu Glu Arg Glu His Ala
305 310 315 320
Glu Lys Leu Met Lys Leu Gln Asn Gln Arg Gly Gly Arg Ile Phe Leu
325 330 335
Gln Asp Ile Lys Lys Pro Asp Cys Asp Asp Trp Glu Ser Gly Leu Asn
340 345 350
Ala Met Glu Cys Ala Leu His Leu Glu Lys Asn Val Asn Gln Ser Leu
355 360 365
Leu Glu Leu His Lys Leu Ala Thr Asp Lys Asn Asp Pro His Leu Cys
370 375 380
Asp Phe Ile Glu Thr His Tyr Leu Asn Glu Gln Val Lys Ala Ile Lys
385 390 395 400
Glu Leu Gly Asp His Val Thr Asn Leu Arg Lys Met Gly Ala Pro Glu
405 410 415
Ser Gly Leu Ala Glu Tyr Leu Phe Asp Lys His Thr Leu Gly Asp Ser
420 425 430
Asp Asn Glu Ser
435
<210> 31
<211> 436
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 31
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Glu
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Ala Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ala Asp Asp Leu Ser Gln Thr Lys Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Asp Lys Gly Lys Leu Ser Glu Lys
100 105 110
Val Val Thr Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Gln
115 120 125
Asn Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Ser Leu Thr Leu
130 135 140
Glu Gly Thr Leu Thr Ala Asp Gly Glu Thr Lys Leu Thr Val Glu Ala
145 150 155 160
Gly Thr Val Thr Leu Ser Lys Asn Ile Ser Glu Ser Gly Glu Ile Thr
165 170 175
Val Glu Leu Lys Asp Thr Glu Thr Thr Pro Ala Asp Lys Lys Ser Gly
180 185 190
Thr Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Lys Asn Ser Gln
195 200 205
Lys Thr Lys Gln Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln
210 215 220
Lys Tyr Asn Thr Ala Gly Thr Lys Leu Glu Gly Ser Pro Ala Glu Ile
225 230 235 240
Lys Asp Leu Glu Ala Leu Lys Ala Ala Leu Lys Gly Ser Met Thr Thr
245 250 255
Ala Ser Thr Ser Gln Val Arg Gln Asn Tyr His Gln Asp Ser Glu Ala
260 265 270
Ala Ile Asn Arg Gln Ile Asn Leu Glu Leu Tyr Ala Ser Tyr Val Tyr
275 280 285
Leu Ser Met Ser Tyr Tyr Phe Asp Arg Asp Asp Val Ala Leu Lys Asn
290 295 300
Phe Ala Lys Tyr Phe Leu His Gln Ser His Glu Glu Arg Glu His Ala
305 310 315 320
Glu Lys Leu Met Lys Leu Gln Asn Gln Arg Gly Gly Arg Ile Phe Leu
325 330 335
Gln Asp Ile Lys Lys Pro Asp Cys Asp Asp Trp Glu Ser Gly Leu Asn
340 345 350
Ala Met Glu Cys Ala Leu His Leu Glu Lys Asn Val Asn Gln Ser Leu
355 360 365
Leu Glu Leu His Lys Leu Ala Thr Asp Lys Asn Asp Pro His Leu Cys
370 375 380
Asp Phe Ile Glu Thr His Tyr Leu Asn Glu Gln Val Lys Ala Ile Lys
385 390 395 400
Glu Leu Gly Asp His Val Thr Asn Leu Arg Lys Met Gly Ala Pro Glu
405 410 415
Ser Gly Leu Ala Glu Tyr Leu Phe Asp Lys His Thr Leu Gly Asp Ser
420 425 430
Asp Asn Glu Ser
435
<210> 32
<211> 426
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 32
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Thr Leu
130 135 140
Glu Gly Gln Leu Ser Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Met Leu Ser Glu
245 250 255
Arg Met Leu Lys Ala Leu Asn Asp Gln Leu Asn Arg Glu Leu Tyr Ser
260 265 270
Ala Tyr Leu Tyr Phe Ala Met Ala Ala Tyr Phe Glu Asp Leu Gly Leu
275 280 285
Glu Gly Phe Ala Asn Trp Met Lys Ala Gln Ala Glu Glu Glu Ile Gly
290 295 300
His Ala Leu Arg Phe Tyr Asn Tyr Ile Tyr Asp Arg Asn Gly Arg Val
305 310 315 320
Glu Leu Asp Glu Ile Pro Lys Pro Pro Lys Glu Trp Glu Ser Pro Leu
325 330 335
Lys Ala Phe Glu Ala Ala Tyr Glu His Glu Lys Phe Ile Ser Lys Ser
340 345 350
Ile Tyr Glu Leu Ala Ala Leu Ala Glu Glu Glu Lys Asp Tyr Ser Thr
355 360 365
Arg Ala Phe Leu Glu Trp Phe Ile Asn Glu Gln Val Glu Glu Glu Ala
370 375 380
Ser Val Lys Lys Ile Leu Asp Lys Leu Lys Phe Ala Lys Asp Ser Pro
385 390 395 400
Gln Ile Leu Phe Met Leu Asp Lys Glu Leu Ser Ala Arg Ala Pro Lys
405 410 415
Leu Pro Gly Leu Leu Met Gln Gly Gly Glu
420 425
<210> 33
<211> 426
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 33
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Asp Leu
130 135 140
Lys Gly Glu Leu Ser Ser Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Met Leu Ser Glu
245 250 255
Arg Met Leu Lys Ala Leu Asn Asp Gln Leu Asn Arg Glu Leu Tyr Ser
260 265 270
Ala Tyr Leu Tyr Phe Ala Met Ala Ala Tyr Phe Glu Asp Leu Gly Leu
275 280 285
Glu Gly Phe Ala Asn Trp Met Lys Ala Gln Ala Glu Glu Glu Ile Gly
290 295 300
His Ala Leu Arg Phe Tyr Asn Tyr Ile Tyr Asp Arg Asn Gly Arg Val
305 310 315 320
Glu Leu Asp Glu Ile Pro Lys Pro Pro Lys Glu Trp Glu Ser Pro Leu
325 330 335
Lys Ala Phe Glu Ala Ala Tyr Glu His Glu Lys Phe Ile Ser Lys Ser
340 345 350
Ile Tyr Glu Leu Ala Ala Leu Ala Glu Glu Glu Lys Asp Tyr Ser Thr
355 360 365
Arg Ala Phe Leu Glu Trp Phe Ile Asn Glu Gln Val Glu Glu Glu Ala
370 375 380
Ser Val Lys Lys Ile Leu Asp Lys Leu Lys Phe Ala Lys Asp Ser Pro
385 390 395 400
Gln Ile Leu Phe Met Leu Asp Lys Glu Leu Ser Ala Arg Ala Pro Lys
405 410 415
Leu Pro Gly Leu Leu Met Gln Gly Gly Glu
420 425
<210> 34
<211> 426
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 34
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Thr Leu
130 135 140
Glu Gly Lys Val Ala Asn Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Met Leu Ser Glu
245 250 255
Arg Met Leu Lys Ala Leu Asn Asp Gln Leu Asn Arg Glu Leu Tyr Ser
260 265 270
Ala Tyr Leu Tyr Phe Ala Met Ala Ala Tyr Phe Glu Asp Leu Gly Leu
275 280 285
Glu Gly Phe Ala Asn Trp Met Lys Ala Gln Ala Glu Glu Glu Ile Gly
290 295 300
His Ala Leu Arg Phe Tyr Asn Tyr Ile Tyr Asp Arg Asn Gly Arg Val
305 310 315 320
Glu Leu Asp Glu Ile Pro Lys Pro Pro Lys Glu Trp Glu Ser Pro Leu
325 330 335
Lys Ala Phe Glu Ala Ala Tyr Glu His Glu Lys Phe Ile Ser Lys Ser
340 345 350
Ile Tyr Glu Leu Ala Ala Leu Ala Glu Glu Glu Lys Asp Tyr Ser Thr
355 360 365
Arg Ala Phe Leu Glu Trp Phe Ile Asn Glu Gln Val Glu Glu Glu Ala
370 375 380
Ser Val Lys Lys Ile Leu Asp Lys Leu Lys Phe Ala Lys Asp Ser Pro
385 390 395 400
Gln Ile Leu Phe Met Leu Asp Lys Glu Leu Ser Ala Arg Ala Pro Lys
405 410 415
Leu Pro Gly Leu Leu Met Gln Gly Gly Glu
420 425
<210> 35
<211> 426
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 35
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu
130 135 140
Glu Gly Thr Leu Thr Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Met Leu Ser Glu
245 250 255
Arg Met Leu Lys Ala Leu Asn Asp Gln Leu Asn Arg Glu Leu Tyr Ser
260 265 270
Ala Tyr Leu Tyr Phe Ala Met Ala Ala Tyr Phe Glu Asp Leu Gly Leu
275 280 285
Glu Gly Phe Ala Asn Trp Met Lys Ala Gln Ala Glu Glu Glu Ile Gly
290 295 300
His Ala Leu Arg Phe Tyr Asn Tyr Ile Tyr Asp Arg Asn Gly Arg Val
305 310 315 320
Glu Leu Asp Glu Ile Pro Lys Pro Pro Lys Glu Trp Glu Ser Pro Leu
325 330 335
Lys Ala Phe Glu Ala Ala Tyr Glu His Glu Lys Phe Ile Ser Lys Ser
340 345 350
Ile Tyr Glu Leu Ala Ala Leu Ala Glu Glu Glu Lys Asp Tyr Ser Thr
355 360 365
Arg Ala Phe Leu Glu Trp Phe Ile Asn Glu Gln Val Glu Glu Glu Ala
370 375 380
Ser Val Lys Lys Ile Leu Asp Lys Leu Lys Phe Ala Lys Asp Ser Pro
385 390 395 400
Gln Ile Leu Phe Met Leu Asp Lys Glu Leu Ser Ala Arg Ala Pro Lys
405 410 415
Leu Pro Gly Leu Leu Met Gln Gly Gly Glu
420 425
<210> 36
<211> 426
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 36
Met Asp Glu Lys Asn Ser Ala Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Lys
20 25 30
Ala Thr Val Asp Lys Ile Glu Leu Lys Gly Thr Ser Asp Lys Asp Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Thr Lys Asp Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ala Asp Asp Leu Ser Lys Thr Thr Phe Glu Leu Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Arg Lys Val Ser Ser Lys Asp Lys
85 90 95
Thr Ser Thr Asp Glu Met Phe Asn Glu Lys Gly Glu Leu Ser Ala Lys
100 105 110
Thr Met Thr Arg Glu Asn Gly Thr Lys Leu Glu Tyr Thr Glu Met Lys
115 120 125
Ser Asp Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Asn Phe Thr Leu
130 135 140
Glu Gly Lys Val Ala Asn Asp Lys Val Thr Leu Glu Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Glu Ile Ala Lys Ser Gly Glu Val Thr Val
165 170 175
Ala Leu Asn Asp Thr Asn Thr Thr Gln Ala Thr Lys Lys Thr Gly Ala
180 185 190
Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys
195 200 205
Thr Thr Gln Leu Val Phe Thr Lys Gln Asp Thr Ile Thr Val Gln Lys
210 215 220
Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Thr Ala Val Glu Ile Lys
225 230 235 240
Thr Leu Asp Glu Leu Lys Asn Ala Leu Lys Gly Ser Met Leu Ser Glu
245 250 255
Arg Met Leu Lys Ala Leu Asn Asp Gln Leu Asn Arg Glu Leu Tyr Ser
260 265 270
Ala Tyr Leu Tyr Phe Ala Met Ala Ala Tyr Phe Glu Asp Leu Gly Leu
275 280 285
Glu Gly Phe Ala Asn Trp Met Lys Ala Gln Ala Glu Glu Glu Ile Gly
290 295 300
His Ala Leu Arg Phe Tyr Asn Tyr Ile Tyr Asp Arg Asn Gly Arg Val
305 310 315 320
Glu Leu Asp Glu Ile Pro Lys Pro Pro Lys Glu Trp Glu Ser Pro Leu
325 330 335
Lys Ala Phe Glu Ala Ala Tyr Glu His Glu Lys Phe Ile Ser Lys Ser
340 345 350
Ile Tyr Glu Leu Ala Ala Leu Ala Glu Glu Glu Lys Asp Tyr Ser Thr
355 360 365
Arg Ala Phe Leu Glu Trp Phe Ile Asn Glu Gln Val Glu Glu Glu Ala
370 375 380
Ser Val Lys Lys Ile Leu Asp Lys Leu Lys Phe Ala Lys Asp Ser Pro
385 390 395 400
Gln Ile Leu Phe Met Leu Asp Lys Glu Leu Ser Ala Arg Ala Pro Lys
405 410 415
Leu Pro Gly Leu Leu Met Gln Gly Gly Glu
420 425
<210> 37
<211> 427
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 37
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Glu Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Glu Lys Ala Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ser Gln Asp Leu Asn Gln Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Arg Lys Val Asn Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Asp Lys Gly Lys Leu Ser Glu Lys
100 105 110
Val Val Thr Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys
115 120 125
Asn Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu
130 135 140
Glu Gly Thr Leu Thr Asp Gly Gly Glu Thr Lys Leu Thr Val Thr Glu
145 150 155 160
Gly Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Ile Thr
165 170 175
Val Ala Leu Asn Asp Thr Glu Thr Thr Pro Ala Asp Lys Lys Thr Gly
180 185 190
Glu Trp Lys Ser Asp Thr Ser Thr Leu Thr Ile Ser Lys Asn Ser Gln
195 200 205
Lys Pro Lys Gln Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln
210 215 220
Asn Tyr Asn Arg Ala Gly Asn Ala Leu Glu Gly Ser Pro Ala Glu Ile
225 230 235 240
Lys Asp Leu Ala Glu Leu Lys Ala Ala Leu Lys Gly Ser Met Leu Ser
245 250 255
Glu Arg Met Leu Lys Ala Leu Asn Asp Gln Leu Asn Arg Glu Leu Tyr
260 265 270
Ser Ala Tyr Leu Tyr Phe Ala Met Ala Ala Tyr Phe Glu Asp Leu Gly
275 280 285
Leu Glu Gly Phe Ala Asn Trp Met Lys Ala Gln Ala Glu Glu Glu Ile
290 295 300
Gly His Ala Leu Arg Phe Tyr Asn Tyr Ile Tyr Asp Arg Asn Gly Arg
305 310 315 320
Val Glu Leu Asp Glu Ile Pro Lys Pro Pro Lys Glu Trp Glu Ser Pro
325 330 335
Leu Lys Ala Phe Glu Ala Ala Tyr Glu His Glu Lys Phe Ile Ser Lys
340 345 350
Ser Ile Tyr Glu Leu Ala Ala Leu Ala Glu Glu Glu Lys Asp Tyr Ser
355 360 365
Thr Arg Ala Phe Leu Glu Trp Phe Ile Asn Glu Gln Val Glu Glu Glu
370 375 380
Ala Ser Val Lys Lys Ile Leu Asp Lys Leu Lys Phe Ala Lys Asp Ser
385 390 395 400
Pro Gln Ile Leu Phe Met Leu Asp Lys Glu Leu Ser Ala Arg Ala Pro
405 410 415
Lys Leu Pro Gly Leu Leu Met Gln Gly Gly Glu
420 425
<210> 38
<211> 426
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 38
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Ser Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ser Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Asn Ser Lys Asp Lys
85 90 95
Ser Ser Ile Glu Glu Lys Phe Asn Ala Lys Gly Glu Leu Ser Glu Lys
100 105 110
Thr Ile Leu Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys
115 120 125
Ser Asp Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Ala Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Lys Thr Thr Leu Lys Val Thr Glu Gly
145 150 155 160
Thr Val Val Leu Ser Lys His Ile Pro Asn Ser Gly Glu Ile Thr Val
165 170 175
Glu Leu Asn Asp Ser Asn Ser Thr Gln Ala Thr Lys Lys Thr Gly Lys
180 185 190
Trp Asp Ser Asn Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys
195 200 205
Thr Lys Asn Ile Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln Lys
210 215 220
Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Asn Ala Val Glu Ile Lys
225 230 235 240
Thr Leu Asp Glu Leu Lys Asn Ala Leu Lys Gly Ser Met Leu Ser Glu
245 250 255
Arg Met Leu Lys Ala Leu Asn Asp Gln Leu Asn Arg Glu Leu Tyr Ser
260 265 270
Ala Tyr Leu Tyr Phe Ala Met Ala Ala Tyr Phe Glu Asp Leu Gly Leu
275 280 285
Glu Gly Phe Ala Asn Trp Met Lys Ala Gln Ala Glu Glu Glu Ile Gly
290 295 300
His Ala Leu Arg Phe Tyr Asn Tyr Ile Tyr Asp Arg Asn Gly Arg Val
305 310 315 320
Glu Leu Asp Glu Ile Pro Lys Pro Pro Lys Glu Trp Glu Ser Pro Leu
325 330 335
Lys Ala Phe Glu Ala Ala Tyr Glu His Glu Lys Phe Ile Ser Lys Ser
340 345 350
Ile Tyr Glu Leu Ala Ala Leu Ala Glu Glu Glu Lys Asp Tyr Ser Thr
355 360 365
Arg Ala Phe Leu Glu Trp Phe Ile Asn Glu Gln Val Glu Glu Glu Ala
370 375 380
Ser Val Lys Lys Ile Leu Asp Lys Leu Lys Phe Ala Lys Asp Ser Pro
385 390 395 400
Gln Ile Leu Phe Met Leu Asp Lys Glu Leu Ser Ala Arg Ala Pro Lys
405 410 415
Leu Pro Gly Leu Leu Met Gln Gly Gly Glu
420 425
<210> 39
<211> 427
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 39
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Glu Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Thr Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ala Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Ile Ser Glu Lys
100 105 110
Thr Ile Val Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Asp Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Thr Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Gly Lys Thr Thr Leu Lys Val Thr Glu
145 150 155 160
Gly Thr Val Val Leu Ser Lys Asn Ile Leu Lys Ser Gly Glu Ile Thr
165 170 175
Val Ala Leu Asp Asp Ser Asp Thr Thr Gln Ala Thr Lys Lys Thr Gly
180 185 190
Lys Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Gln
195 200 205
Lys Thr Lys Asn Leu Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln
210 215 220
Lys Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Lys Ala Val Glu Ile
225 230 235 240
Thr Thr Leu Glu Lys Leu Lys Asp Ala Leu Lys Gly Ser Met Leu Ser
245 250 255
Glu Arg Met Leu Lys Ala Leu Asn Asp Gln Leu Asn Arg Glu Leu Tyr
260 265 270
Ser Ala Tyr Leu Tyr Phe Ala Met Ala Ala Tyr Phe Glu Asp Leu Gly
275 280 285
Leu Glu Gly Phe Ala Asn Trp Met Lys Ala Gln Ala Glu Glu Glu Ile
290 295 300
Gly His Ala Leu Arg Phe Tyr Asn Tyr Ile Tyr Asp Arg Asn Gly Arg
305 310 315 320
Val Glu Leu Asp Glu Ile Pro Lys Pro Pro Lys Glu Trp Glu Ser Pro
325 330 335
Leu Lys Ala Phe Glu Ala Ala Tyr Glu His Glu Lys Phe Ile Ser Lys
340 345 350
Ser Ile Tyr Glu Leu Ala Ala Leu Ala Glu Glu Glu Lys Asp Tyr Ser
355 360 365
Thr Arg Ala Phe Leu Glu Trp Phe Ile Asn Glu Gln Val Glu Glu Glu
370 375 380
Ala Ser Val Lys Lys Ile Leu Asp Lys Leu Lys Phe Ala Lys Asp Ser
385 390 395 400
Pro Gln Ile Leu Phe Met Leu Asp Lys Glu Leu Ser Ala Arg Ala Pro
405 410 415
Lys Leu Pro Gly Leu Leu Met Gln Gly Gly Glu
420 425
<210> 40
<211> 427
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 40
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Thr
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Glu
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Thr Asp Lys Ser Lys Val Lys
50 55 60
Ser Thr Ile Ala Asp Asp Leu Ser Gln Thr Lys Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Gly Lys Gly Glu Thr Ser Glu Lys
100 105 110
Thr Ile Val Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Asp Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Thr Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Gly Lys Thr Thr Leu Lys Val Thr Glu
145 150 155 160
Gly Thr Val Val Leu Ser Lys Asn Ile Leu Lys Ser Gly Glu Ile Thr
165 170 175
Ala Ala Leu Asp Asp Ser Asp Thr Thr Arg Ala Thr Lys Lys Thr Gly
180 185 190
Lys Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Gln
195 200 205
Lys Thr Lys Asn Leu Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln
210 215 220
Arg Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Lys Ala Val Glu Ile
225 230 235 240
Thr Thr Leu Lys Glu Leu Lys Asn Ala Leu Lys Gly Ser Met Leu Ser
245 250 255
Glu Arg Met Leu Lys Ala Leu Asn Asp Gln Leu Asn Arg Glu Leu Tyr
260 265 270
Ser Ala Tyr Leu Tyr Phe Ala Met Ala Ala Tyr Phe Glu Asp Leu Gly
275 280 285
Leu Glu Gly Phe Ala Asn Trp Met Lys Ala Gln Ala Glu Glu Glu Ile
290 295 300
Gly His Ala Leu Arg Phe Tyr Asn Tyr Ile Tyr Asp Arg Asn Gly Arg
305 310 315 320
Val Glu Leu Asp Glu Ile Pro Lys Pro Pro Lys Glu Trp Glu Ser Pro
325 330 335
Leu Lys Ala Phe Glu Ala Ala Tyr Glu His Glu Lys Phe Ile Ser Lys
340 345 350
Ser Ile Tyr Glu Leu Ala Ala Leu Ala Glu Glu Glu Lys Asp Tyr Ser
355 360 365
Thr Arg Ala Phe Leu Glu Trp Phe Ile Asn Glu Gln Val Glu Glu Glu
370 375 380
Ala Ser Val Lys Lys Ile Leu Asp Lys Leu Lys Phe Ala Lys Asp Ser
385 390 395 400
Pro Gln Ile Leu Phe Met Leu Asp Lys Glu Leu Ser Ala Arg Ala Pro
405 410 415
Lys Leu Pro Gly Leu Leu Met Gln Gly Gly Glu
420 425
<210> 41
<211> 427
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 41
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Glu
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Ala Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ala Asp Asp Leu Ser Gln Thr Lys Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Asp Lys Gly Lys Leu Ser Glu Lys
100 105 110
Val Val Thr Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Gln
115 120 125
Asn Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Ser Leu Thr Leu
130 135 140
Glu Gly Thr Leu Thr Ala Asp Gly Glu Thr Lys Leu Thr Val Glu Ala
145 150 155 160
Gly Thr Val Thr Leu Ser Lys Asn Ile Ser Glu Ser Gly Glu Ile Thr
165 170 175
Val Glu Leu Lys Asp Thr Glu Thr Thr Pro Ala Asp Lys Lys Ser Gly
180 185 190
Thr Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Lys Asn Ser Gln
195 200 205
Lys Thr Lys Gln Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln
210 215 220
Lys Tyr Asn Thr Ala Gly Thr Lys Leu Glu Gly Ser Pro Ala Glu Ile
225 230 235 240
Lys Asp Leu Glu Ala Leu Lys Ala Ala Leu Lys Gly Ser Met Leu Ser
245 250 255
Glu Arg Met Leu Lys Ala Leu Asn Asp Gln Leu Asn Arg Glu Leu Tyr
260 265 270
Ser Ala Tyr Leu Tyr Phe Ala Met Ala Ala Tyr Phe Glu Asp Leu Gly
275 280 285
Leu Glu Gly Phe Ala Asn Trp Met Lys Ala Gln Ala Glu Glu Glu Ile
290 295 300
Gly His Ala Leu Arg Phe Tyr Asn Tyr Ile Tyr Asp Arg Asn Gly Arg
305 310 315 320
Val Glu Leu Asp Glu Ile Pro Lys Pro Pro Lys Glu Trp Glu Ser Pro
325 330 335
Leu Lys Ala Phe Glu Ala Ala Tyr Glu His Glu Lys Phe Ile Ser Lys
340 345 350
Ser Ile Tyr Glu Leu Ala Ala Leu Ala Glu Glu Glu Lys Asp Tyr Ser
355 360 365
Thr Arg Ala Phe Leu Glu Trp Phe Ile Asn Glu Gln Val Glu Glu Glu
370 375 380
Ala Ser Val Lys Lys Ile Leu Asp Lys Leu Lys Phe Ala Lys Asp Ser
385 390 395 400
Pro Gln Ile Leu Phe Met Leu Asp Lys Glu Leu Ser Ala Arg Ala Pro
405 410 415
Lys Leu Pro Gly Leu Leu Met Gln Gly Gly Glu
420 425
<210> 42
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 42
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Thr Leu
130 135 140
Glu Gly Gln Leu Ser Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Thr Gln Cys Asn
245 250 255
Val Asn Pro Val Gln Ile Pro Lys Asp Trp Ile Thr Met His Arg Ser
260 265 270
Cys Arg Asn Ser Met Arg Gln Gln Ile Gln Met Glu Val Gly Ala Ser
275 280 285
Leu Gln Tyr Leu Ala Met Gly Ala His Phe Ser Lys Asp Val Val Asn
290 295 300
Arg Pro Gly Phe Ala Gln Leu Phe Phe Asp Ala Ala Ser Glu Glu Arg
305 310 315 320
Glu His Ala Met Lys Leu Ile Glu Tyr Leu Leu Met Arg Gly Glu Leu
325 330 335
Thr Asn Asp Val Ser Ser Leu Leu Gln Val Arg Pro Pro Thr Arg Ser
340 345 350
Ser Trp Lys Gly Gly Val Glu Ala Leu Glu His Ala Leu Ser Met Glu
355 360 365
Ser Asp Val Thr Lys Ser Ile Arg Asn Val Ile Lys Ala Cys Glu Asp
370 375 380
Asp Ser Glu Phe Asn Asp Tyr His Leu Val Asp Tyr Leu Thr Gly Asp
385 390 395 400
Phe Leu Glu Glu Gln Tyr Lys Gly Gln Arg Asp Leu Ala Gly Lys Ala
405 410 415
Ser Thr Leu Lys Lys Leu Met Asp Arg His Glu Ala Leu Gly Glu Phe
420 425 430
Ile Phe Asp Lys Lys Leu Leu Gly Ile Asp Val
435 440
<210> 43
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 43
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Asp Leu
130 135 140
Lys Gly Glu Leu Ser Ser Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Thr Gln Cys Asn
245 250 255
Val Asn Pro Val Gln Ile Pro Lys Asp Trp Ile Thr Met His Arg Ser
260 265 270
Cys Arg Asn Ser Met Arg Gln Gln Ile Gln Met Glu Val Gly Ala Ser
275 280 285
Leu Gln Tyr Leu Ala Met Gly Ala His Phe Ser Lys Asp Val Val Asn
290 295 300
Arg Pro Gly Phe Ala Gln Leu Phe Phe Asp Ala Ala Ser Glu Glu Arg
305 310 315 320
Glu His Ala Met Lys Leu Ile Glu Tyr Leu Leu Met Arg Gly Glu Leu
325 330 335
Thr Asn Asp Val Ser Ser Leu Leu Gln Val Arg Pro Pro Thr Arg Ser
340 345 350
Ser Trp Lys Gly Gly Val Glu Ala Leu Glu His Ala Leu Ser Met Glu
355 360 365
Ser Asp Val Thr Lys Ser Ile Arg Asn Val Ile Lys Ala Cys Glu Asp
370 375 380
Asp Ser Glu Phe Asn Asp Tyr His Leu Val Asp Tyr Leu Thr Gly Asp
385 390 395 400
Phe Leu Glu Glu Gln Tyr Lys Gly Gln Arg Asp Leu Ala Gly Lys Ala
405 410 415
Ser Thr Leu Lys Lys Leu Met Asp Arg His Glu Ala Leu Gly Glu Phe
420 425 430
Ile Phe Asp Lys Lys Leu Leu Gly Ile Asp Val
435 440
<210> 44
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 44
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Thr Leu
130 135 140
Glu Gly Lys Val Ala Asn Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Thr Gln Cys Asn
245 250 255
Val Asn Pro Val Gln Ile Pro Lys Asp Trp Ile Thr Met His Arg Ser
260 265 270
Cys Arg Asn Ser Met Arg Gln Gln Ile Gln Met Glu Val Gly Ala Ser
275 280 285
Leu Gln Tyr Leu Ala Met Gly Ala His Phe Ser Lys Asp Val Val Asn
290 295 300
Arg Pro Gly Phe Ala Gln Leu Phe Phe Asp Ala Ala Ser Glu Glu Arg
305 310 315 320
Glu His Ala Met Lys Leu Ile Glu Tyr Leu Leu Met Arg Gly Glu Leu
325 330 335
Thr Asn Asp Val Ser Ser Leu Leu Gln Val Arg Pro Pro Thr Arg Ser
340 345 350
Ser Trp Lys Gly Gly Val Glu Ala Leu Glu His Ala Leu Ser Met Glu
355 360 365
Ser Asp Val Thr Lys Ser Ile Arg Asn Val Ile Lys Ala Cys Glu Asp
370 375 380
Asp Ser Glu Phe Asn Asp Tyr His Leu Val Asp Tyr Leu Thr Gly Asp
385 390 395 400
Phe Leu Glu Glu Gln Tyr Lys Gly Gln Arg Asp Leu Ala Gly Lys Ala
405 410 415
Ser Thr Leu Lys Lys Leu Met Asp Arg His Glu Ala Leu Gly Glu Phe
420 425 430
Ile Phe Asp Lys Lys Leu Leu Gly Ile Asp Val
435 440
<210> 45
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 45
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu
130 135 140
Glu Gly Thr Leu Thr Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Thr Gln Cys Asn
245 250 255
Val Asn Pro Val Gln Ile Pro Lys Asp Trp Ile Thr Met His Arg Ser
260 265 270
Cys Arg Asn Ser Met Arg Gln Gln Ile Gln Met Glu Val Gly Ala Ser
275 280 285
Leu Gln Tyr Leu Ala Met Gly Ala His Phe Ser Lys Asp Val Val Asn
290 295 300
Arg Pro Gly Phe Ala Gln Leu Phe Phe Asp Ala Ala Ser Glu Glu Arg
305 310 315 320
Glu His Ala Met Lys Leu Ile Glu Tyr Leu Leu Met Arg Gly Glu Leu
325 330 335
Thr Asn Asp Val Ser Ser Leu Leu Gln Val Arg Pro Pro Thr Arg Ser
340 345 350
Ser Trp Lys Gly Gly Val Glu Ala Leu Glu His Ala Leu Ser Met Glu
355 360 365
Ser Asp Val Thr Lys Ser Ile Arg Asn Val Ile Lys Ala Cys Glu Asp
370 375 380
Asp Ser Glu Phe Asn Asp Tyr His Leu Val Asp Tyr Leu Thr Gly Asp
385 390 395 400
Phe Leu Glu Glu Gln Tyr Lys Gly Gln Arg Asp Leu Ala Gly Lys Ala
405 410 415
Ser Thr Leu Lys Lys Leu Met Asp Arg His Glu Ala Leu Gly Glu Phe
420 425 430
Ile Phe Asp Lys Lys Leu Leu Gly Ile Asp Val
435 440
<210> 46
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 46
Met Asp Glu Lys Asn Ser Ala Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Lys
20 25 30
Ala Thr Val Asp Lys Ile Glu Leu Lys Gly Thr Ser Asp Lys Asp Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Thr Lys Asp Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ala Asp Asp Leu Ser Lys Thr Thr Phe Glu Leu Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Arg Lys Val Ser Ser Lys Asp Lys
85 90 95
Thr Ser Thr Asp Glu Met Phe Asn Glu Lys Gly Glu Leu Ser Ala Lys
100 105 110
Thr Met Thr Arg Glu Asn Gly Thr Lys Leu Glu Tyr Thr Glu Met Lys
115 120 125
Ser Asp Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Asn Phe Thr Leu
130 135 140
Glu Gly Lys Val Ala Asn Asp Lys Val Thr Leu Glu Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Glu Ile Ala Lys Ser Gly Glu Val Thr Val
165 170 175
Ala Leu Asn Asp Thr Asn Thr Thr Gln Ala Thr Lys Lys Thr Gly Ala
180 185 190
Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys
195 200 205
Thr Thr Gln Leu Val Phe Thr Lys Gln Asp Thr Ile Thr Val Gln Lys
210 215 220
Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Thr Ala Val Glu Ile Lys
225 230 235 240
Thr Leu Asp Glu Leu Lys Asn Ala Leu Lys Gly Ser Thr Gln Cys Asn
245 250 255
Val Asn Pro Val Gln Ile Pro Lys Asp Trp Ile Thr Met His Arg Ser
260 265 270
Cys Arg Asn Ser Met Arg Gln Gln Ile Gln Met Glu Val Gly Ala Ser
275 280 285
Leu Gln Tyr Leu Ala Met Gly Ala His Phe Ser Lys Asp Val Val Asn
290 295 300
Arg Pro Gly Phe Ala Gln Leu Phe Phe Asp Ala Ala Ser Glu Glu Arg
305 310 315 320
Glu His Ala Met Lys Leu Ile Glu Tyr Leu Leu Met Arg Gly Glu Leu
325 330 335
Thr Asn Asp Val Ser Ser Leu Leu Gln Val Arg Pro Pro Thr Arg Ser
340 345 350
Ser Trp Lys Gly Gly Val Glu Ala Leu Glu His Ala Leu Ser Met Glu
355 360 365
Ser Asp Val Thr Lys Ser Ile Arg Asn Val Ile Lys Ala Cys Glu Asp
370 375 380
Asp Ser Glu Phe Asn Asp Tyr His Leu Val Asp Tyr Leu Thr Gly Asp
385 390 395 400
Phe Leu Glu Glu Gln Tyr Lys Gly Gln Arg Asp Leu Ala Gly Lys Ala
405 410 415
Ser Thr Leu Lys Lys Leu Met Asp Arg His Glu Ala Leu Gly Glu Phe
420 425 430
Ile Phe Asp Lys Lys Leu Leu Gly Ile Asp Val
435 440
<210> 47
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 47
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Glu Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Glu Lys Ala Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ser Gln Asp Leu Asn Gln Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Arg Lys Val Asn Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Asp Lys Gly Lys Leu Ser Glu Lys
100 105 110
Val Val Thr Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys
115 120 125
Asn Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu
130 135 140
Glu Gly Thr Leu Thr Asp Gly Gly Glu Thr Lys Leu Thr Val Thr Glu
145 150 155 160
Gly Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Ile Thr
165 170 175
Val Ala Leu Asn Asp Thr Glu Thr Thr Pro Ala Asp Lys Lys Thr Gly
180 185 190
Glu Trp Lys Ser Asp Thr Ser Thr Leu Thr Ile Ser Lys Asn Ser Gln
195 200 205
Lys Pro Lys Gln Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln
210 215 220
Asn Tyr Asn Arg Ala Gly Asn Ala Leu Glu Gly Ser Pro Ala Glu Ile
225 230 235 240
Lys Asp Leu Ala Glu Leu Lys Ala Ala Leu Lys Gly Ser Thr Gln Cys
245 250 255
Asn Val Asn Pro Val Gln Ile Pro Lys Asp Trp Ile Thr Met His Arg
260 265 270
Ser Cys Arg Asn Ser Met Arg Gln Gln Ile Gln Met Glu Val Gly Ala
275 280 285
Ser Leu Gln Tyr Leu Ala Met Gly Ala His Phe Ser Lys Asp Val Val
290 295 300
Asn Arg Pro Gly Phe Ala Gln Leu Phe Phe Asp Ala Ala Ser Glu Glu
305 310 315 320
Arg Glu His Ala Met Lys Leu Ile Glu Tyr Leu Leu Met Arg Gly Glu
325 330 335
Leu Thr Asn Asp Val Ser Ser Leu Leu Gln Val Arg Pro Pro Thr Arg
340 345 350
Ser Ser Trp Lys Gly Gly Val Glu Ala Leu Glu His Ala Leu Ser Met
355 360 365
Glu Ser Asp Val Thr Lys Ser Ile Arg Asn Val Ile Lys Ala Cys Glu
370 375 380
Asp Asp Ser Glu Phe Asn Asp Tyr His Leu Val Asp Tyr Leu Thr Gly
385 390 395 400
Asp Phe Leu Glu Glu Gln Tyr Lys Gly Gln Arg Asp Leu Ala Gly Lys
405 410 415
Ala Ser Thr Leu Lys Lys Leu Met Asp Arg His Glu Ala Leu Gly Glu
420 425 430
Phe Ile Phe Asp Lys Lys Leu Leu Gly Ile Asp Val
435 440
<210> 48
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 48
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Ser Asp Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ser Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Asn Ser Lys Asp Lys
85 90 95
Ser Ser Ile Glu Glu Lys Phe Asn Ala Lys Gly Glu Leu Ser Glu Lys
100 105 110
Thr Ile Leu Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys
115 120 125
Ser Asp Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Ala Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Lys Thr Thr Leu Lys Val Thr Glu Gly
145 150 155 160
Thr Val Val Leu Ser Lys His Ile Pro Asn Ser Gly Glu Ile Thr Val
165 170 175
Glu Leu Asn Asp Ser Asn Ser Thr Gln Ala Thr Lys Lys Thr Gly Lys
180 185 190
Trp Asp Ser Asn Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys
195 200 205
Thr Lys Asn Ile Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln Lys
210 215 220
Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Asn Ala Val Glu Ile Lys
225 230 235 240
Thr Leu Asp Glu Leu Lys Asn Ala Leu Lys Gly Ser Thr Gln Cys Asn
245 250 255
Val Asn Pro Val Gln Ile Pro Lys Asp Trp Ile Thr Met His Arg Ser
260 265 270
Cys Arg Asn Ser Met Arg Gln Gln Ile Gln Met Glu Val Gly Ala Ser
275 280 285
Leu Gln Tyr Leu Ala Met Gly Ala His Phe Ser Lys Asp Val Val Asn
290 295 300
Arg Pro Gly Phe Ala Gln Leu Phe Phe Asp Ala Ala Ser Glu Glu Arg
305 310 315 320
Glu His Ala Met Lys Leu Ile Glu Tyr Leu Leu Met Arg Gly Glu Leu
325 330 335
Thr Asn Asp Val Ser Ser Leu Leu Gln Val Arg Pro Pro Thr Arg Ser
340 345 350
Ser Trp Lys Gly Gly Val Glu Ala Leu Glu His Ala Leu Ser Met Glu
355 360 365
Ser Asp Val Thr Lys Ser Ile Arg Asn Val Ile Lys Ala Cys Glu Asp
370 375 380
Asp Ser Glu Phe Asn Asp Tyr His Leu Val Asp Tyr Leu Thr Gly Asp
385 390 395 400
Phe Leu Glu Glu Gln Tyr Lys Gly Gln Arg Asp Leu Ala Gly Lys Ala
405 410 415
Ser Thr Leu Lys Lys Leu Met Asp Arg His Glu Ala Leu Gly Glu Phe
420 425 430
Ile Phe Asp Lys Lys Leu Leu Gly Ile Asp Val
435 440
<210> 49
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 49
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met
20 25 30
Ala Thr Val Glu Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Thr Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ala Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Ile Ser Glu Lys
100 105 110
Thr Ile Val Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Asp Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Thr Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Gly Lys Thr Thr Leu Lys Val Thr Glu
145 150 155 160
Gly Thr Val Val Leu Ser Lys Asn Ile Leu Lys Ser Gly Glu Ile Thr
165 170 175
Val Ala Leu Asp Asp Ser Asp Thr Thr Gln Ala Thr Lys Lys Thr Gly
180 185 190
Lys Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Gln
195 200 205
Lys Thr Lys Asn Leu Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln
210 215 220
Lys Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Lys Ala Val Glu Ile
225 230 235 240
Thr Thr Leu Glu Lys Leu Lys Asp Ala Leu Lys Gly Ser Thr Gln Cys
245 250 255
Asn Val Asn Pro Val Gln Ile Pro Lys Asp Trp Ile Thr Met His Arg
260 265 270
Ser Cys Arg Asn Ser Met Arg Gln Gln Ile Gln Met Glu Val Gly Ala
275 280 285
Ser Leu Gln Tyr Leu Ala Met Gly Ala His Phe Ser Lys Asp Val Val
290 295 300
Asn Arg Pro Gly Phe Ala Gln Leu Phe Phe Asp Ala Ala Ser Glu Glu
305 310 315 320
Arg Glu His Ala Met Lys Leu Ile Glu Tyr Leu Leu Met Arg Gly Glu
325 330 335
Leu Thr Asn Asp Val Ser Ser Leu Leu Gln Val Arg Pro Pro Thr Arg
340 345 350
Ser Ser Trp Lys Gly Gly Val Glu Ala Leu Glu His Ala Leu Ser Met
355 360 365
Glu Ser Asp Val Thr Lys Ser Ile Arg Asn Val Ile Lys Ala Cys Glu
370 375 380
Asp Asp Ser Glu Phe Asn Asp Tyr His Leu Val Asp Tyr Leu Thr Gly
385 390 395 400
Asp Phe Leu Glu Glu Gln Tyr Lys Gly Gln Arg Asp Leu Ala Gly Lys
405 410 415
Ala Ser Thr Leu Lys Lys Leu Met Asp Arg His Glu Ala Leu Gly Glu
420 425 430
Phe Ile Phe Asp Lys Lys Leu Leu Gly Ile Asp Val
435 440
<210> 50
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 50
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Thr
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Glu
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Thr Leu Glu Gly Glu Lys Thr Asp Lys Ser Lys Val Lys
50 55 60
Ser Thr Ile Ala Asp Asp Leu Ser Gln Thr Lys Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Gly Lys Gly Glu Thr Ser Glu Lys
100 105 110
Thr Ile Val Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Asp Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Thr Leu
130 135 140
Glu Gly Thr Leu Ala Ala Asp Gly Lys Thr Thr Leu Lys Val Thr Glu
145 150 155 160
Gly Thr Val Val Leu Ser Lys Asn Ile Leu Lys Ser Gly Glu Ile Thr
165 170 175
Ala Ala Leu Asp Asp Ser Asp Thr Thr Arg Ala Thr Lys Lys Thr Gly
180 185 190
Lys Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Gln
195 200 205
Lys Thr Lys Asn Leu Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln
210 215 220
Arg Tyr Asp Ser Ala Gly Thr Asn Leu Glu Gly Lys Ala Val Glu Ile
225 230 235 240
Thr Thr Leu Lys Glu Leu Lys Asn Ala Leu Lys Gly Ser Thr Gln Cys
245 250 255
Asn Val Asn Pro Val Gln Ile Pro Lys Asp Trp Ile Thr Met His Arg
260 265 270
Ser Cys Arg Asn Ser Met Arg Gln Gln Ile Gln Met Glu Val Gly Ala
275 280 285
Ser Leu Gln Tyr Leu Ala Met Gly Ala His Phe Ser Lys Asp Val Val
290 295 300
Asn Arg Pro Gly Phe Ala Gln Leu Phe Phe Asp Ala Ala Ser Glu Glu
305 310 315 320
Arg Glu His Ala Met Lys Leu Ile Glu Tyr Leu Leu Met Arg Gly Glu
325 330 335
Leu Thr Asn Asp Val Ser Ser Leu Leu Gln Val Arg Pro Pro Thr Arg
340 345 350
Ser Ser Trp Lys Gly Gly Val Glu Ala Leu Glu His Ala Leu Ser Met
355 360 365
Glu Ser Asp Val Thr Lys Ser Ile Arg Asn Val Ile Lys Ala Cys Glu
370 375 380
Asp Asp Ser Glu Phe Asn Asp Tyr His Leu Val Asp Tyr Leu Thr Gly
385 390 395 400
Asp Phe Leu Glu Glu Gln Tyr Lys Gly Gln Arg Asp Leu Ala Gly Lys
405 410 415
Ala Ser Thr Leu Lys Lys Leu Met Asp Arg His Glu Ala Leu Gly Glu
420 425 430
Phe Ile Phe Asp Lys Lys Leu Leu Gly Ile Asp Val
435 440
<210> 51
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 51
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Glu
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Ala Lys Ser Lys Ala Lys
50 55 60
Leu Thr Ile Ala Asp Asp Leu Ser Gln Thr Lys Phe Glu Ile Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Asp Lys Gly Lys Leu Ser Glu Lys
100 105 110
Val Val Thr Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Gln
115 120 125
Asn Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Ser Leu Thr Leu
130 135 140
Glu Gly Thr Leu Thr Ala Asp Gly Glu Thr Lys Leu Thr Val Glu Ala
145 150 155 160
Gly Thr Val Thr Leu Ser Lys Asn Ile Ser Glu Ser Gly Glu Ile Thr
165 170 175
Val Glu Leu Lys Asp Thr Glu Thr Thr Pro Ala Asp Lys Lys Ser Gly
180 185 190
Thr Trp Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Lys Asn Ser Gln
195 200 205
Lys Thr Lys Gln Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln
210 215 220
Lys Tyr Asn Thr Ala Gly Thr Lys Leu Glu Gly Ser Pro Ala Glu Ile
225 230 235 240
Lys Asp Leu Glu Ala Leu Lys Ala Ala Leu Lys Gly Ser Thr Gln Cys
245 250 255
Asn Val Asn Pro Val Gln Ile Pro Lys Asp Trp Ile Thr Met His Arg
260 265 270
Ser Cys Arg Asn Ser Met Arg Gln Gln Ile Gln Met Glu Val Gly Ala
275 280 285
Ser Leu Gln Tyr Leu Ala Met Gly Ala His Phe Ser Lys Asp Val Val
290 295 300
Asn Arg Pro Gly Phe Ala Gln Leu Phe Phe Asp Ala Ala Ser Glu Glu
305 310 315 320
Arg Glu His Ala Met Lys Leu Ile Glu Tyr Leu Leu Met Arg Gly Glu
325 330 335
Leu Thr Asn Asp Val Ser Ser Leu Leu Gln Val Arg Pro Pro Thr Arg
340 345 350
Ser Ser Trp Lys Gly Gly Val Glu Ala Leu Glu His Ala Leu Ser Met
355 360 365
Glu Ser Asp Val Thr Lys Ser Ile Arg Asn Val Ile Lys Ala Cys Glu
370 375 380
Asp Asp Ser Glu Phe Asn Asp Tyr His Leu Val Asp Tyr Leu Thr Gly
385 390 395 400
Asp Phe Leu Glu Glu Gln Tyr Lys Gly Gln Arg Asp Leu Ala Gly Lys
405 410 415
Ala Ser Thr Leu Lys Lys Leu Met Asp Arg His Glu Ala Leu Gly Glu
420 425 430
Phe Ile Phe Asp Lys Lys Leu Leu Gly Ile Asp Val
435 440
<210> 52
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 52
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys Ile Ile
130 135 140
Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Thr Leu Glu Gly
165 170 175
Gln Leu Ser Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val Glu Leu
195 200 205
Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala Trp Asn
210 215 220
Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln Tyr Asp
245 250 255
Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr Lys Leu
260 265 270
Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg Gln
275 280 285
Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn Lys
290 295 300
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser Tyr
305 310 315 320
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
325 330 335
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
340 345 350
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
355 360 365
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
370 375 380
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys Lys
385 390 395 400
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
405 410 415
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
420 425 430
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
435 440 445
Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 53
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 53
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Gln Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys Ile Ile
130 135 140
Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Thr Leu Glu Gly
165 170 175
Gln Leu Ser Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Gln Ile Ser Lys Ser Gly Glu Val Ser Val Glu Leu
195 200 205
Gln Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala Trp Asn
210 215 220
Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln Tyr Asp
245 250 255
Ser Gln Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr Lys Leu
260 265 270
Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg Gln
275 280 285
Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn Lys
290 295 300
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser Tyr
305 310 315 320
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
325 330 335
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
340 345 350
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
355 360 365
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
370 375 380
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys Lys
385 390 395 400
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
405 410 415
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
420 425 430
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
435 440 445
Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 54
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 54
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys Ile Ile
130 135 140
Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Thr Leu Glu Gly
165 170 175
Lys Val Ala Asn Glu Lys Thr Thr Leu Val Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val Glu Leu
195 200 205
Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala Trp Asn
210 215 220
Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln Tyr Asp
245 250 255
Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr Lys Leu
260 265 270
Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg Gln
275 280 285
Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn Lys
290 295 300
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser Tyr
305 310 315 320
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
325 330 335
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
340 345 350
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
355 360 365
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
370 375 380
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys Lys
385 390 395 400
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
405 410 415
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
420 425 430
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
435 440 445
Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 55
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 55
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Gln Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys Ile Ile
130 135 140
Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Thr Leu Glu Gly
165 170 175
Lys Val Ala Asn Glu Lys Thr Thr Leu Val Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Gln Ile Ser Lys Ser Gly Glu Val Ser Val Glu Leu
195 200 205
Gln Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala Trp Asn
210 215 220
Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln Tyr Asp
245 250 255
Ser Gln Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr Lys Leu
260 265 270
Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg Gln
275 280 285
Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn Lys
290 295 300
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser Tyr
305 310 315 320
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
325 330 335
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
340 345 350
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
355 360 365
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
370 375 380
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys Lys
385 390 395 400
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
405 410 415
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
420 425 430
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
435 440 445
Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 56
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 56
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys Ile Ile
130 135 140
Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu Glu Gly
165 170 175
Thr Leu Thr Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val Glu Leu
195 200 205
Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala Trp Asn
210 215 220
Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln Tyr Asp
245 250 255
Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr Lys Leu
260 265 270
Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg Gln
275 280 285
Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn Lys
290 295 300
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser Tyr
305 310 315 320
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
325 330 335
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
340 345 350
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
355 360 365
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
370 375 380
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys Lys
385 390 395 400
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
405 410 415
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
420 425 430
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
435 440 445
Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 57
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 57
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Gln Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys Ile Ile
130 135 140
Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu Glu Gly
165 170 175
Thr Leu Thr Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Gln Ile Ser Lys Ser Gly Glu Val Ser Val Glu Leu
195 200 205
Gln Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala Trp Asn
210 215 220
Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln Tyr Asp
245 250 255
Ser Gln Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr Lys Leu
260 265 270
Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg Gln
275 280 285
Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn Lys
290 295 300
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser Tyr
305 310 315 320
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
325 330 335
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
340 345 350
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
355 360 365
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
370 375 380
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys Lys
385 390 395 400
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
405 410 415
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
420 425 430
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
435 440 445
Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 58
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 58
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys Ile Ile
130 135 140
Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Asp Leu Lys Gly
165 170 175
Glu Leu Ser Ser Glu Lys Thr Thr Leu Val Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val Glu Leu
195 200 205
Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala Trp Asn
210 215 220
Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln Tyr Asp
245 250 255
Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr Lys Leu
260 265 270
Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg Gln
275 280 285
Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn Lys
290 295 300
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser Tyr
305 310 315 320
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
325 330 335
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
340 345 350
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
355 360 365
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
370 375 380
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys Lys
385 390 395 400
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
405 410 415
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
420 425 430
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
435 440 445
Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 59
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 59
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Gln Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys Ile Ile
130 135 140
Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Asp Leu Lys Gly
165 170 175
Glu Leu Ser Ser Glu Lys Thr Thr Leu Val Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Gln Ile Ser Lys Ser Gly Glu Val Ser Val Glu Leu
195 200 205
Gln Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala Trp Asn
210 215 220
Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln Tyr Asp
245 250 255
Ser Gln Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr Lys Leu
260 265 270
Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg Gln
275 280 285
Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn Lys
290 295 300
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser Tyr
305 310 315 320
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
325 330 335
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
340 345 350
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
355 360 365
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
370 375 380
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys Lys
385 390 395 400
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
405 410 415
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
420 425 430
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
435 440 445
Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 60
<211> 457
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 60
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Gln Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys Ile Ile
130 135 140
Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Thr Leu Glu Gly
165 170 175
Gln Leu Ser Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Gln Ile Ser Lys Ser Gly Glu Val Ser Val Glu Leu
195 200 205
Gln Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala Trp Asn
210 215 220
Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln Tyr Asp
245 250 255
Ser Gln Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr Lys Leu
260 265 270
Asp Glu Ile Lys Asn Ala Leu Lys Gly Gly Gly Ser Glu Ser Gln Val
275 280 285
Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val
290 295 300
Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp
305 310 315 320
Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His
325 330 335
Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn
340 345 350
Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His
355 360 365
Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu
370 375 380
Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys
385 390 395 400
Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu
405 410 415
Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu
420 425 430
Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val
435 440 445
Lys Gly Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 61
<211> 461
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 61
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Gln Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys Ile Ile
130 135 140
Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Thr Leu Glu Gly
165 170 175
Gln Leu Ser Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Gln Ile Ser Lys Ser Gly Glu Val Ser Val Glu Leu
195 200 205
Gln Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala Trp Asn
210 215 220
Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln Tyr Asp
245 250 255
Ser Gln Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr Lys Leu
260 265 270
Asp Glu Ile Lys Asn Ala Leu Lys Gly Gly Gly Ser Gly Gly Gly Ser
275 280 285
Glu Ser Gln Val Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu
290 295 300
Asn Glu Gln Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser
305 310 315 320
Met Ser Ser Trp Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe
325 330 335
Leu Phe Asp His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile
340 345 350
Ile Phe Leu Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser
355 360 365
Ala Pro Glu His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala
370 375 380
Tyr Glu His Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp
385 390 395 400
His Ala Ile Lys Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp
405 410 415
Tyr Val Ala Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu
420 425 430
Asp Lys Ile Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala
435 440 445
Asp Gln Tyr Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
450 455 460
<210> 62
<211> 473
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 62
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Gln Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys Ile Ile
130 135 140
Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Thr Leu Glu Gly
165 170 175
Gln Leu Ser Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Gln Ile Ser Lys Ser Gly Glu Val Ser Val Glu Leu
195 200 205
Gln Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala Trp Asn
210 215 220
Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln Tyr Asp
245 250 255
Ser Gln Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr Lys Leu
260 265 270
Asp Glu Ile Lys Asn Ala Leu Lys Gly Gly Gly Ser Gly Gly Gly Ser
275 280 285
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Glu Ser Gln Val
290 295 300
Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val
305 310 315 320
Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp
325 330 335
Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His
340 345 350
Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn
355 360 365
Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His
370 375 380
Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu
385 390 395 400
Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys
405 410 415
Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu
420 425 430
Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu
435 440 445
Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val
450 455 460
Lys Gly Ile Ala Lys Ser Arg Lys Ser
465 470
<210> 63
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 63
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn Gly Ala
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys Ile Ile
130 135 140
Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Thr Leu Glu Gly
165 170 175
Gln Leu Ser Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Asn Ile Ala Lys Ser Gly Glu Val Ser Val Glu Leu
195 200 205
Asn Asp Ala Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala Trp Asn
210 215 220
Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln Tyr Asp
245 250 255
Ser Asn Gly Ala Lys Leu Glu Gly Ser Ala Val Glu Ile Thr Lys Leu
260 265 270
Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg Gln
275 280 285
Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn Lys
290 295 300
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser Tyr
305 310 315 320
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
325 330 335
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
340 345 350
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
355 360 365
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
370 375 380
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys Lys
385 390 395 400
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
405 410 415
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
420 425 430
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
435 440 445
Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 64
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 64
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys Ile Ile
130 135 140
Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Val Leu Glu Gly
165 170 175
Thr Leu Thr Ala Glu Lys Thr Thr Leu Val Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val Glu Leu
195 200 205
Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala Trp Asn
210 215 220
Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln Tyr Asp
245 250 255
Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr Lys Leu
260 265 270
Asp Glu Ile Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg Gln
275 280 285
Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn Lys
290 295 300
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser Tyr
305 310 315 320
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
325 330 335
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
340 345 350
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
355 360 365
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
370 375 380
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys Lys
385 390 395 400
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
405 410 415
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
420 425 430
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
435 440 445
Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 65
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 65
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Ala Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Lys Ala Thr
50 55 60
Val Asp Lys Ile Glu Leu Lys Gly Thr Ser Asp Lys Asp Asn Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Thr Lys Asp Asp Lys Ser Lys Ala Lys Leu Thr
85 90 95
Ile Ala Asp Asp Leu Ser Lys Thr Thr Phe Glu Leu Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Arg Lys Val Ser Ser Lys Asp Lys Thr Ser
115 120 125
Thr Asp Glu Met Phe Asn Glu Lys Gly Glu Leu Ser Ala Lys Thr Met
130 135 140
Thr Arg Glu Asn Gly Thr Lys Leu Glu Tyr Thr Glu Met Lys Ser Asp
145 150 155 160
Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Asn Phe Thr Leu Glu Gly
165 170 175
Lys Val Ala Asn Asp Lys Val Thr Leu Glu Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Glu Ile Ala Lys Ser Gly Glu Val Thr Val Ala Leu
195 200 205
Asn Asp Thr Asn Thr Thr Gln Ala Thr Lys Lys Thr Gly Ala Trp Asp
210 215 220
Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys Thr Thr
225 230 235 240
Gln Leu Val Phe Thr Lys Gln Asp Thr Ile Thr Val Gln Lys Tyr Asp
245 250 255
Ser Ala Gly Thr Asn Leu Glu Gly Thr Ala Val Glu Ile Lys Thr Leu
260 265 270
Asp Glu Leu Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg Gln
275 280 285
Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn Lys
290 295 300
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser Tyr
305 310 315 320
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
325 330 335
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
340 345 350
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
355 360 365
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
370 375 380
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys Lys
385 390 395 400
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
405 410 415
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
420 425 430
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
435 440 445
Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 66
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 66
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Ala Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Lys Ala Thr
50 55 60
Val Asp Lys Ile Glu Leu Lys Gly Thr Ser Asp Lys Asp Gln Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Thr Lys Asp Asp Lys Ser Lys Ala Lys Leu Thr
85 90 95
Ile Ala Asp Asp Leu Ser Lys Thr Thr Phe Glu Leu Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Arg Lys Val Ser Ser Lys Asp Lys Thr Ser
115 120 125
Thr Asp Glu Met Phe Asn Glu Lys Gly Glu Leu Ser Ala Lys Thr Met
130 135 140
Thr Arg Glu Gln Gly Thr Lys Leu Glu Tyr Thr Glu Met Lys Ser Asp
145 150 155 160
Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Gln Phe Thr Leu Glu Gly
165 170 175
Lys Val Ala Asn Asp Lys Val Thr Leu Glu Val Lys Glu Gly Thr Val
180 185 190
Thr Leu Ser Lys Glu Ile Ala Lys Ser Gly Glu Val Thr Val Ala Leu
195 200 205
Gln Asp Thr Gln Thr Thr Gln Ala Thr Lys Lys Thr Gly Ala Trp Asp
210 215 220
Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys Thr Thr
225 230 235 240
Gln Leu Val Phe Thr Lys Gln Asp Thr Ile Thr Val Gln Lys Tyr Asp
245 250 255
Ser Ala Gly Thr Asn Leu Glu Gly Thr Ala Val Glu Ile Lys Thr Leu
260 265 270
Asp Glu Leu Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg Gln
275 280 285
Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn Lys
290 295 300
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser Tyr
305 310 315 320
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
325 330 335
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
340 345 350
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
355 360 365
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
370 375 380
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys Lys
385 390 395 400
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
405 410 415
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
420 425 430
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
435 440 445
Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 67
<211> 456
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 67
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met Ala Thr
50 55 60
Val Glu Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Asn Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Glu Lys Ala Asp Lys Ser Lys Ala Lys Leu Thr
85 90 95
Ile Ser Gln Asp Leu Asn Gln Thr Thr Phe Glu Ile Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Arg Lys Val Asn Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Asp Lys Gly Lys Leu Ser Glu Lys Val Val
130 135 140
Thr Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys Asn Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu Glu Gly
165 170 175
Thr Leu Thr Asp Gly Gly Glu Thr Lys Leu Thr Val Thr Glu Gly Thr
180 185 190
Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Ile Thr Val Ala
195 200 205
Leu Asn Asp Thr Glu Thr Thr Pro Ala Asp Lys Lys Thr Gly Glu Trp
210 215 220
Lys Ser Asp Thr Ser Thr Leu Thr Ile Ser Lys Asn Ser Gln Lys Pro
225 230 235 240
Lys Gln Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Asn Tyr
245 250 255
Asn Arg Ala Gly Asn Ala Leu Glu Gly Ser Pro Ala Glu Ile Lys Asp
260 265 270
Leu Ala Glu Leu Lys Ala Ala Leu Lys Gly Ser Glu Ser Gln Val Arg
275 280 285
Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn
290 295 300
Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser
305 310 315 320
Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala
325 330 335
Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu
340 345 350
Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys
355 360 365
Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln
370 375 380
His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys
385 390 395 400
Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln
405 410 415
His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu
420 425 430
Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys
435 440 445
Gly Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 68
<211> 456
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 68
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met Ala Thr
50 55 60
Val Glu Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Gln Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Glu Lys Ala Asp Lys Ser Lys Ala Lys Leu Thr
85 90 95
Ile Ser Gln Asp Leu Gln Gln Thr Thr Phe Glu Ile Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Arg Lys Val Asn Ser Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Asp Lys Gly Lys Leu Ser Glu Lys Val Val
130 135 140
Thr Arg Ala Gln Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys Asn Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu Glu Gly
165 170 175
Thr Leu Thr Asp Gly Gly Glu Thr Lys Leu Thr Val Thr Glu Gly Thr
180 185 190
Val Thr Leu Ser Lys Gln Ile Ser Lys Ser Gly Glu Ile Thr Val Ala
195 200 205
Leu Gln Asp Thr Glu Thr Thr Pro Ala Asp Lys Lys Thr Gly Glu Trp
210 215 220
Lys Ser Asp Thr Ser Thr Leu Thr Ile Ser Lys Asn Ser Gln Lys Pro
225 230 235 240
Lys Gln Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Asn Tyr
245 250 255
Asn Arg Ala Gly Asn Ala Leu Glu Gly Ser Pro Ala Glu Ile Lys Asp
260 265 270
Leu Ala Glu Leu Lys Ala Ala Leu Lys Gly Ser Glu Ser Gln Val Arg
275 280 285
Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn
290 295 300
Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser
305 310 315 320
Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala
325 330 335
Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu
340 345 350
Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys
355 360 365
Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln
370 375 380
His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys
385 390 395 400
Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln
405 410 415
His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu
420 425 430
Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys
435 440 445
Gly Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 69
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 69
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Asn Gly Ser
65 70 75 80
Gly Thr Leu Glu Gly Glu Lys Ser Asp Lys Ser Lys Ala Lys Leu Thr
85 90 95
Ile Ser Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Asn Ser Lys Asp Lys Ser Ser
115 120 125
Ile Glu Glu Lys Phe Asn Ala Lys Gly Glu Leu Ser Glu Lys Thr Ile
130 135 140
Leu Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys Ser Asp
145 150 155 160
Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Ala Leu Glu Gly
165 170 175
Thr Leu Ala Ala Asp Lys Thr Thr Leu Lys Val Thr Glu Gly Thr Val
180 185 190
Val Leu Ser Lys His Ile Pro Asn Ser Gly Glu Ile Thr Val Glu Leu
195 200 205
Asn Asp Ser Asn Ser Thr Gln Ala Thr Lys Lys Thr Gly Lys Trp Asp
210 215 220
Ser Asn Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asn Ile Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln Lys Tyr Asp
245 250 255
Ser Ala Gly Thr Asn Leu Glu Gly Asn Ala Val Glu Ile Lys Thr Leu
260 265 270
Asp Glu Leu Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg Gln
275 280 285
Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn Lys
290 295 300
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser Tyr
305 310 315 320
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
325 330 335
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
340 345 350
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
355 360 365
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
370 375 380
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys Lys
385 390 395 400
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
405 410 415
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
420 425 430
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
435 440 445
Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 70
<211> 455
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 70
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Ser Gln Gly Ser
65 70 75 80
Gly Thr Leu Glu Gly Glu Lys Ser Asp Lys Ser Lys Ala Lys Leu Thr
85 90 95
Ile Ser Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Asn Ser Lys Asp Lys Ser Ser
115 120 125
Ile Glu Glu Lys Phe Asn Ala Lys Gly Glu Leu Ser Glu Lys Thr Ile
130 135 140
Leu Arg Ala Gln Gly Thr Arg Leu Glu Tyr Thr Glu Ile Lys Ser Asp
145 150 155 160
Gly Thr Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Ala Leu Glu Gly
165 170 175
Thr Leu Ala Ala Asp Lys Thr Thr Leu Lys Val Thr Glu Gly Thr Val
180 185 190
Val Leu Ser Lys His Ile Pro Asn Ser Gly Glu Ile Thr Val Glu Leu
195 200 205
Gln Asp Ser Gln Ser Thr Gln Ala Thr Lys Lys Thr Gly Lys Trp Asp
210 215 220
Ser Gln Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Lys Lys Thr Lys
225 230 235 240
Asn Ile Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln Lys Tyr Asp
245 250 255
Ser Ala Gly Thr Asn Leu Glu Gly Asn Ala Val Glu Ile Lys Thr Leu
260 265 270
Asp Glu Leu Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg Gln
275 280 285
Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn Lys
290 295 300
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser Tyr
305 310 315 320
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
325 330 335
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
340 345 350
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
355 360 365
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
370 375 380
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys Lys
385 390 395 400
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
405 410 415
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
420 425 430
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
435 440 445
Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 71
<211> 456
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 71
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met Ala Thr
50 55 60
Val Glu Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn Gly Ser
65 70 75 80
Gly Thr Leu Glu Gly Glu Lys Thr Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ala Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Ile Ser Glu Lys Thr Ile
130 135 140
Val Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Asp Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Thr Leu Glu Gly
165 170 175
Thr Leu Ala Ala Asp Gly Lys Thr Thr Leu Lys Val Thr Glu Gly Thr
180 185 190
Val Val Leu Ser Lys Asn Ile Leu Lys Ser Gly Glu Ile Thr Val Ala
195 200 205
Leu Asp Asp Ser Asp Thr Thr Gln Ala Thr Lys Lys Thr Gly Lys Trp
210 215 220
Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Gln Lys Thr
225 230 235 240
Lys Asn Leu Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln Lys Tyr
245 250 255
Asp Ser Ala Gly Thr Asn Leu Glu Gly Lys Ala Val Glu Ile Thr Thr
260 265 270
Leu Glu Lys Leu Lys Asp Ala Leu Lys Gly Ser Glu Ser Gln Val Arg
275 280 285
Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn
290 295 300
Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser
305 310 315 320
Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala
325 330 335
Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu
340 345 350
Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys
355 360 365
Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln
370 375 380
His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys
385 390 395 400
Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln
405 410 415
His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu
420 425 430
Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys
435 440 445
Gly Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 72
<211> 456
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 72
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Met Ala Thr
50 55 60
Val Glu Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Gln Gly Ser
65 70 75 80
Gly Thr Leu Glu Gly Glu Lys Thr Asp Lys Ser Lys Val Lys Leu Thr
85 90 95
Ile Ala Glu Asp Leu Ser Lys Thr Thr Phe Glu Ile Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Ile Ser Glu Lys Thr Ile
130 135 140
Val Arg Ala Gln Gly Thr Arg Leu Glu Tyr Thr Asp Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Thr Leu Glu Gly
165 170 175
Thr Leu Ala Ala Asp Gly Lys Thr Thr Leu Lys Val Thr Glu Gly Thr
180 185 190
Val Val Leu Ser Lys Asn Ile Leu Lys Ser Gly Glu Ile Thr Val Ala
195 200 205
Leu Asp Asp Ser Asp Thr Thr Gln Ala Thr Lys Lys Thr Gly Lys Trp
210 215 220
Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Gln Lys Thr
225 230 235 240
Lys Asn Leu Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln Lys Tyr
245 250 255
Asp Ser Ala Gly Thr Asn Leu Glu Gly Lys Ala Val Glu Ile Thr Thr
260 265 270
Leu Glu Lys Leu Lys Asp Ala Leu Lys Gly Ser Glu Ser Gln Val Arg
275 280 285
Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn
290 295 300
Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser
305 310 315 320
Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala
325 330 335
Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu
340 345 350
Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys
355 360 365
Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln
370 375 380
His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys
385 390 395 400
Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln
405 410 415
His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu
420 425 430
Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys
435 440 445
Gly Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 73
<211> 456
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 73
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Thr Val Leu
35 40 45
Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Glu Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Gln Gly Ser
65 70 75 80
Gly Thr Leu Glu Gly Glu Lys Thr Asp Lys Ser Lys Val Lys Ser Thr
85 90 95
Ile Ala Asp Asp Leu Ser Gln Thr Lys Phe Glu Ile Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Gly Lys Gly Glu Thr Ser Glu Lys Thr Ile
130 135 140
Val Arg Ala Gln Gly Thr Arg Leu Glu Tyr Thr Asp Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Thr Leu Glu Gly
165 170 175
Thr Leu Ala Ala Asp Gly Lys Thr Thr Leu Lys Val Thr Glu Gly Thr
180 185 190
Val Val Leu Ser Lys Asn Ile Leu Lys Ser Gly Glu Ile Thr Ala Ala
195 200 205
Leu Asp Asp Ser Asp Thr Thr Arg Ala Thr Lys Lys Thr Gly Lys Trp
210 215 220
Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Gln Lys Thr
225 230 235 240
Lys Asn Leu Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln Arg Tyr
245 250 255
Asp Ser Ala Gly Thr Asn Leu Glu Gly Lys Ala Val Glu Ile Thr Thr
260 265 270
Leu Lys Glu Leu Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg
275 280 285
Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn
290 295 300
Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser
305 310 315 320
Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala
325 330 335
Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu
340 345 350
Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys
355 360 365
Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln
370 375 380
His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys
385 390 395 400
Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln
405 410 415
His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu
420 425 430
Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys
435 440 445
Gly Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 74
<211> 456
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 74
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Gly Met Thr Val Leu
35 40 45
Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Glu Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn Gly Ser
65 70 75 80
Gly Thr Leu Glu Gly Glu Lys Thr Asp Lys Ser Lys Val Lys Ser Thr
85 90 95
Ile Ala Asp Asp Leu Ser Gln Thr Lys Phe Glu Ile Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Gly Lys Gly Glu Thr Ser Glu Lys Thr Ile
130 135 140
Val Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Asp Ile Lys Ser Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Asp Phe Thr Leu Glu Gly
165 170 175
Thr Leu Ala Ala Asp Gly Lys Thr Thr Leu Lys Val Thr Glu Gly Thr
180 185 190
Val Val Leu Ser Lys Asn Ile Leu Lys Ser Gly Glu Ile Thr Ala Ala
195 200 205
Leu Asp Asp Ser Asp Thr Thr Arg Ala Thr Lys Lys Thr Gly Lys Trp
210 215 220
Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Val Asn Ser Gln Lys Thr
225 230 235 240
Lys Asn Leu Val Phe Thr Lys Glu Asp Thr Ile Thr Val Gln Arg Tyr
245 250 255
Asp Ser Ala Gly Thr Asn Leu Glu Gly Lys Ala Val Glu Ile Thr Thr
260 265 270
Leu Lys Glu Leu Lys Asn Ala Leu Lys Gly Ser Glu Ser Gln Val Arg
275 280 285
Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn
290 295 300
Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser
305 310 315 320
Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala
325 330 335
Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu
340 345 350
Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys
355 360 365
Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln
370 375 380
His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys
385 390 395 400
Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln
405 410 415
His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu
420 425 430
Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys
435 440 445
Gly Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 75
<211> 456
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 75
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Glu Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Ala Lys Ser Lys Ala Lys Leu Thr
85 90 95
Ile Ala Asp Asp Leu Ser Gln Thr Lys Phe Glu Ile Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Asp Lys Gly Lys Leu Ser Glu Lys Val Val
130 135 140
Thr Arg Ala Asn Gly Thr Arg Leu Glu Tyr Thr Glu Ile Gln Asn Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Ser Leu Thr Leu Glu Gly
165 170 175
Thr Leu Thr Ala Asp Gly Glu Thr Lys Leu Thr Val Glu Ala Gly Thr
180 185 190
Val Thr Leu Ser Lys Asn Ile Ser Glu Ser Gly Glu Ile Thr Val Glu
195 200 205
Leu Lys Asp Thr Glu Thr Thr Pro Ala Asp Lys Lys Ser Gly Thr Trp
210 215 220
Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Lys Asn Ser Gln Lys Thr
225 230 235 240
Lys Gln Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Lys Tyr
245 250 255
Asn Thr Ala Gly Thr Lys Leu Glu Gly Ser Pro Ala Glu Ile Lys Asp
260 265 270
Leu Glu Ala Leu Lys Ala Ala Leu Lys Gly Ser Glu Ser Gln Val Arg
275 280 285
Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn
290 295 300
Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser
305 310 315 320
Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala
325 330 335
Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu
340 345 350
Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys
355 360 365
Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln
370 375 380
His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys
385 390 395 400
Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln
405 410 415
His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu
420 425 430
Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys
435 440 445
Gly Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 76
<211> 456
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 76
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Met Asp
20 25 30
Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys Val Leu
35 40 45
Val Ser Lys Glu Lys Asp Lys Asp Gly Lys Tyr Ser Leu Glu Ala Thr
50 55 60
Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Gln Gly Ser
65 70 75 80
Gly Val Leu Glu Gly Val Lys Ala Ala Lys Ser Lys Ala Lys Leu Thr
85 90 95
Ile Ala Asp Asp Leu Ser Gln Thr Lys Phe Glu Ile Phe Lys Glu Asp
100 105 110
Gly Lys Thr Leu Val Ser Lys Lys Val Thr Leu Lys Asp Lys Ser Ser
115 120 125
Thr Glu Glu Lys Phe Asn Asp Lys Gly Lys Leu Ser Glu Lys Val Val
130 135 140
Thr Arg Ala Gln Gly Thr Arg Leu Glu Tyr Thr Glu Ile Gln Asn Asp
145 150 155 160
Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Ser Leu Thr Leu Glu Gly
165 170 175
Thr Leu Thr Ala Asp Gly Glu Thr Lys Leu Thr Val Glu Ala Gly Thr
180 185 190
Val Thr Leu Ser Lys Gln Ile Ser Glu Ser Gly Glu Ile Thr Val Glu
195 200 205
Leu Lys Asp Thr Glu Thr Thr Pro Ala Asp Lys Lys Ser Gly Thr Trp
210 215 220
Asp Ser Lys Thr Ser Thr Leu Thr Ile Ser Lys Asn Ser Gln Lys Thr
225 230 235 240
Lys Gln Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Lys Tyr
245 250 255
Asn Thr Ala Gly Thr Lys Leu Glu Gly Ser Pro Ala Glu Ile Lys Asp
260 265 270
Leu Glu Ala Leu Lys Ala Ala Leu Lys Gly Ser Glu Ser Gln Val Arg
275 280 285
Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu Asn Glu Gln Val Asn
290 295 300
Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Ser
305 310 315 320
Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala
325 330 335
Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu
340 345 350
Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys
355 360 365
Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln
370 375 380
His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Cys
385 390 395 400
Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln
405 410 415
His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu
420 425 430
Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys
435 440 445
Gly Ile Ala Lys Ser Arg Lys Ser
450 455
<210> 77
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 77
Tyr Val Leu Glu Gly Thr Leu Thr Ala
5
<210> 78
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 78
Tyr Val Ile Glu Gly Thr Ser Lys Gln
5
<210> 79
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 79
Phe Thr Leu Glu Gly Lys Val Ala Asn
5
<210> 80
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 80
Phe Ala Leu Glu Gly Thr Leu Thr Asp
5
<210> 81
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 81
Tyr Thr Leu Glu Gly Gln Leu Ser Asp
5
<210> 82
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 82
Tyr Asp Leu Lys Gly Glu Leu Ser Ser
5
<210> 83
<211> 273
<212> БЕЛОК
<213> Borreliella burgdorferi
<400> 83
Met Lys Lys Tyr Leu Leu Gly Ile Gly Leu Ile Leu Ala Leu Ile Ala
1 5 10 15
Cys Lys Gln Asn Val Ser Ser Leu Asp Glu Lys Asn Ser Val Ser Val
20 25 30
Asp Leu Pro Gly Glu Met Lys Val Leu Val Ser Lys Glu Lys Asn Lys
35 40 45
Asp Gly Lys Tyr Asp Leu Ile Ala Thr Val Asp Lys Leu Glu Leu Lys
50 55 60
Gly Thr Ser Asp Lys Asn Asn Gly Ser Gly Val Leu Glu Gly Val Lys
65 70 75 80
Ala Asp Lys Ser Lys Val Lys Leu Thr Ile Ser Asp Asp Leu Gly Gln
85 90 95
Thr Thr Leu Glu Val Phe Lys Glu Asp Gly Lys Thr Leu Val Ser Lys
100 105 110
Lys Val Thr Ser Lys Asp Lys Ser Ser Thr Glu Glu Lys Phe Asn Glu
115 120 125
Lys Gly Glu Val Ser Glu Lys Ile Ile Thr Arg Ala Asp Gly Thr Arg
130 135 140
Leu Glu Tyr Thr Gly Ile Lys Ser Asp Gly Ser Gly Lys Ala Lys Glu
145 150 155 160
Val Leu Lys Gly Tyr Val Leu Glu Gly Thr Leu Thr Ala Glu Lys Thr
165 170 175
Thr Leu Val Val Lys Glu Gly Thr Val Thr Leu Ser Lys Asn Ile Ser
180 185 190
Lys Ser Gly Glu Val Ser Val Glu Leu Asn Asp Thr Asp Ser Ser Ala
195 200 205
Ala Thr Lys Lys Thr Ala Ala Trp Asn Ser Gly Thr Ser Thr Leu Thr
210 215 220
Ile Thr Val Asn Ser Lys Lys Thr Lys Asp Leu Val Phe Thr Lys Glu
225 230 235 240
Asn Thr Ile Thr Val Gln Gln Tyr Asp Ser Asn Gly Thr Lys Leu Glu
245 250 255
Gly Ser Ala Val Glu Ile Thr Lys Leu Asp Glu Ile Lys Asn Ala Leu
260 265 270
Lys
<210> 84
<211> 273
<212> БЕЛОК
<213> Borreliella afzelii
<400> 84
Met Lys Lys Tyr Leu Leu Gly Ile Gly Leu Ile Leu Ala Leu Ile Ala
1 5 10 15
Cys Lys Gln Asn Val Ser Ser Leu Asp Glu Lys Asn Ser Ala Ser Val
20 25 30
Asp Leu Pro Gly Glu Met Lys Val Leu Val Ser Lys Glu Lys Asp Lys
35 40 45
Asp Gly Lys Tyr Ser Leu Lys Ala Thr Val Asp Lys Ile Glu Leu Lys
50 55 60
Gly Thr Ser Asp Lys Asp Asn Gly Ser Gly Val Leu Glu Gly Thr Lys
65 70 75 80
Asp Asp Lys Ser Lys Ala Lys Leu Thr Ile Ala Asp Asp Leu Ser Lys
85 90 95
Thr Thr Phe Glu Leu Phe Lys Glu Asp Gly Lys Thr Leu Val Ser Arg
100 105 110
Lys Val Ser Ser Lys Asp Lys Thr Ser Thr Asp Glu Met Phe Asn Glu
115 120 125
Lys Gly Glu Leu Ser Ala Lys Thr Met Thr Arg Glu Asn Gly Thr Lys
130 135 140
Leu Glu Tyr Thr Glu Met Lys Ser Asp Gly Thr Gly Lys Ala Lys Glu
145 150 155 160
Val Leu Lys Asn Phe Thr Leu Glu Gly Lys Val Ala Asn Asp Lys Val
165 170 175
Thr Leu Glu Val Lys Glu Gly Thr Val Thr Leu Ser Lys Glu Ile Ala
180 185 190
Lys Ser Gly Glu Val Thr Val Ala Leu Asn Asp Thr Asn Thr Thr Gln
195 200 205
Ala Thr Lys Lys Thr Gly Ala Trp Asp Ser Lys Thr Ser Thr Leu Thr
210 215 220
Ile Ser Val Asn Ser Lys Lys Thr Thr Gln Leu Val Phe Thr Lys Gln
225 230 235 240
Asp Thr Ile Thr Val Gln Lys Tyr Asp Ser Ala Gly Thr Asn Leu Glu
245 250 255
Gly Thr Ala Val Glu Ile Lys Thr Leu Asp Glu Leu Lys Asn Ala Leu
260 265 270
Lys
<210> 85
<211> 274
<212> БЕЛОК
<213> Borreliella garinii
<400> 85
Met Lys Lys Tyr Leu Leu Gly Ile Gly Leu Ile Leu Ala Leu Ile Ala
1 5 10 15
Cys Lys Gln Asn Val Ser Ser Leu Asp Glu Lys Asn Ser Val Ser Val
20 25 30
Asp Leu Pro Gly Gly Met Lys Val Leu Val Ser Lys Glu Lys Asp Lys
35 40 45
Asp Gly Lys Tyr Ser Leu Met Ala Thr Val Glu Lys Leu Glu Leu Lys
50 55 60
Gly Thr Ser Asp Lys Ser Asn Gly Ser Gly Val Leu Glu Gly Glu Lys
65 70 75 80
Ala Asp Lys Ser Lys Ala Lys Leu Thr Ile Ser Gln Asp Leu Asn Gln
85 90 95
Thr Thr Phe Glu Ile Phe Lys Glu Asp Gly Lys Thr Leu Val Ser Arg
100 105 110
Lys Val Asn Ser Lys Asp Lys Ser Ser Thr Glu Glu Lys Phe Asn Asp
115 120 125
Lys Gly Lys Leu Ser Glu Lys Val Val Thr Arg Ala Asn Gly Thr Arg
130 135 140
Leu Glu Tyr Thr Glu Ile Lys Asn Asp Gly Ser Gly Lys Ala Lys Glu
145 150 155 160
Val Leu Lys Gly Phe Ala Leu Glu Gly Thr Leu Thr Asp Gly Gly Glu
165 170 175
Thr Lys Leu Thr Val Thr Glu Gly Thr Val Thr Leu Ser Lys Asn Ile
180 185 190
Ser Lys Ser Gly Glu Ile Thr Val Ala Leu Asn Asp Thr Glu Thr Thr
195 200 205
Pro Ala Asp Lys Lys Thr Gly Glu Trp Lys Ser Asp Thr Ser Thr Leu
210 215 220
Thr Ile Ser Lys Asn Ser Gln Lys Pro Lys Gln Leu Val Phe Thr Lys
225 230 235 240
Glu Asn Thr Ile Thr Val Gln Asn Tyr Asn Arg Ala Gly Asn Ala Leu
245 250 255
Glu Gly Ser Pro Ala Glu Ile Lys Asp Leu Ala Glu Leu Lys Ala Ala
260 265 270
Leu Lys
<210> 86
<211> 273
<212> БЕЛОК
<213> Borreliella bavariensis
<400> 86
Met Lys Lys Tyr Leu Leu Gly Ile Gly Leu Ile Leu Ala Leu Ile Ala
1 5 10 15
Cys Lys Gln Asn Val Ser Ser Leu Asp Glu Lys Asn Ser Val Ser Val
20 25 30
Asp Leu Pro Gly Glu Met Lys Val Leu Val Ser Lys Glu Lys Asp Lys
35 40 45
Asp Gly Lys Tyr Ser Leu Met Ala Thr Val Asp Lys Leu Glu Leu Lys
50 55 60
Gly Thr Ser Asp Lys Ser Asn Gly Ser Gly Thr Leu Glu Gly Glu Lys
65 70 75 80
Ser Asp Lys Ser Lys Ala Lys Leu Thr Ile Ser Glu Asp Leu Ser Lys
85 90 95
Thr Thr Phe Glu Ile Phe Lys Glu Asp Gly Lys Thr Leu Val Ser Lys
100 105 110
Lys Val Asn Ser Lys Asp Lys Ser Ser Ile Glu Glu Lys Phe Asn Ala
115 120 125
Lys Gly Glu Leu Ser Glu Lys Thr Ile Leu Arg Ala Asn Gly Thr Arg
130 135 140
Leu Glu Tyr Thr Glu Ile Lys Ser Asp Gly Thr Gly Lys Ala Lys Glu
145 150 155 160
Val Leu Lys Asp Phe Ala Leu Glu Gly Thr Leu Ala Ala Asp Lys Thr
165 170 175
Thr Leu Lys Val Thr Glu Gly Thr Val Val Leu Ser Lys His Ile Pro
180 185 190
Asn Ser Gly Glu Ile Thr Val Glu Leu Asn Asp Ser Asn Ser Thr Gln
195 200 205
Ala Thr Lys Lys Thr Gly Lys Trp Asp Ser Asn Thr Ser Thr Leu Thr
210 215 220
Ile Ser Val Asn Ser Lys Lys Thr Lys Asn Ile Val Phe Thr Lys Glu
225 230 235 240
Asp Thr Ile Thr Val Gln Lys Tyr Asp Ser Ala Gly Thr Asn Leu Glu
245 250 255
Gly Asn Ala Val Glu Ile Lys Thr Leu Asp Glu Leu Lys Asn Ala Leu
260 265 270
Lys
<210> 87
<211> 274
<212> БЕЛОК
<213> Borreliella garinii
<400> 87
Met Lys Lys Tyr Leu Leu Gly Ile Gly Leu Ile Leu Ala Leu Ile Ala
1 5 10 15
Cys Lys Gln Asn Val Ser Ser Leu Asp Glu Lys Asn Ser Val Ser Val
20 25 30
Asp Leu Pro Gly Gly Met Lys Val Leu Val Ser Lys Glu Lys Asp Lys
35 40 45
Asp Gly Lys Tyr Ser Leu Met Ala Thr Val Glu Lys Leu Glu Leu Lys
50 55 60
Gly Thr Ser Asp Lys Asn Asn Gly Ser Gly Thr Leu Glu Gly Glu Lys
65 70 75 80
Thr Asp Lys Ser Lys Val Lys Leu Thr Ile Ala Glu Asp Leu Ser Lys
85 90 95
Thr Thr Phe Glu Ile Phe Lys Glu Asp Gly Lys Thr Leu Val Ser Lys
100 105 110
Lys Val Thr Leu Lys Asp Lys Ser Ser Thr Glu Glu Lys Phe Asn Glu
115 120 125
Lys Gly Glu Ile Ser Glu Lys Thr Ile Val Arg Ala Asn Gly Thr Arg
130 135 140
Leu Glu Tyr Thr Asp Ile Lys Ser Asp Gly Ser Gly Lys Ala Lys Glu
145 150 155 160
Val Leu Lys Asp Phe Thr Leu Glu Gly Thr Leu Ala Ala Asp Gly Lys
165 170 175
Thr Thr Leu Lys Val Thr Glu Gly Thr Val Val Leu Ser Lys Asn Ile
180 185 190
Leu Lys Ser Gly Glu Ile Thr Val Ala Leu Asp Asp Ser Asp Thr Thr
195 200 205
Gln Ala Thr Lys Lys Thr Gly Lys Trp Asp Ser Lys Thr Ser Thr Leu
210 215 220
Thr Ile Ser Val Asn Ser Gln Lys Thr Lys Asn Leu Val Phe Thr Lys
225 230 235 240
Glu Asp Thr Ile Thr Val Gln Lys Tyr Asp Ser Ala Gly Thr Asn Leu
245 250 255
Glu Gly Lys Ala Val Glu Ile Thr Thr Leu Glu Lys Leu Lys Asp Ala
260 265 270
Leu Lys
<210> 88
<211> 274
<212> БЕЛОК
<213> Borreliella burgdorferi
<400> 88
Met Lys Lys Tyr Leu Leu Gly Ile Gly Leu Ile Leu Ala Leu Ile Ala
1 5 10 15
Cys Lys Gln Asn Val Ser Ser Leu Asp Glu Lys Asn Ser Val Ser Val
20 25 30
Asp Leu Pro Gly Gly Met Thr Val Leu Val Ser Lys Glu Lys Asp Lys
35 40 45
Asp Gly Lys Tyr Ser Leu Glu Ala Thr Val Asp Lys Leu Glu Leu Lys
50 55 60
Gly Thr Ser Asp Lys Asn Asn Gly Ser Gly Thr Leu Glu Gly Glu Lys
65 70 75 80
Thr Asp Lys Ser Lys Val Lys Ser Thr Ile Ala Asp Asp Leu Ser Gln
85 90 95
Thr Lys Phe Glu Ile Phe Lys Glu Asp Gly Lys Thr Leu Val Ser Lys
100 105 110
Lys Val Thr Leu Lys Asp Lys Ser Ser Thr Glu Glu Lys Phe Asn Gly
115 120 125
Lys Gly Glu Thr Ser Glu Lys Thr Ile Val Arg Ala Asn Gly Thr Arg
130 135 140
Leu Glu Tyr Thr Asp Ile Lys Ser Asp Gly Ser Gly Lys Ala Lys Glu
145 150 155 160
Val Leu Lys Asp Phe Thr Leu Glu Gly Thr Leu Ala Ala Asp Gly Lys
165 170 175
Thr Thr Leu Lys Val Thr Glu Gly Thr Val Val Leu Ser Lys Asn Ile
180 185 190
Leu Lys Ser Gly Glu Ile Thr Ala Ala Leu Asp Asp Ser Asp Thr Thr
195 200 205
Arg Ala Thr Lys Lys Thr Gly Lys Trp Asp Ser Lys Thr Ser Thr Leu
210 215 220
Thr Ile Ser Val Asn Ser Gln Lys Thr Lys Asn Leu Val Phe Thr Lys
225 230 235 240
Glu Asp Thr Ile Thr Val Gln Arg Tyr Asp Ser Ala Gly Thr Asn Leu
245 250 255
Glu Gly Lys Ala Val Glu Ile Thr Thr Leu Lys Glu Leu Lys Asn Ala
260 265 270
Leu Lys
<210> 89
<211> 214
<212> БЕЛОК
<213> Borreliella garinii
<400> 89
Met Lys Lys Tyr Leu Leu Gly Ile Gly Leu Ile Leu Ala Leu Ile Ala
1 5 10 15
Cys Lys Gln Asn Val Ser Ser Leu Asp Glu Lys Asn Ser Val Ser Val
20 25 30
Asp Leu Pro Gly Glu Met Lys Val Leu Val Ser Lys Glu Lys Asp Lys
35 40 45
Asp Gly Lys Tyr Ser Leu Glu Ala Thr Val Asp Lys Leu Glu Leu Lys
50 55 60
Gly Thr Ser Asp Lys Asn Asn Gly Ser Gly Val Leu Glu Gly Val Lys
65 70 75 80
Ala Ala Lys Ser Lys Ala Lys Leu Thr Ile Ala Asp Asp Leu Ser Gln
85 90 95
Thr Lys Phe Glu Ile Phe Lys Glu Asp Gly Lys Thr Leu Val Ser Lys
100 105 110
Lys Val Thr Leu Lys Asp Lys Ser Ser Thr Glu Glu Lys Phe Asn Asp
115 120 125
Lys Gly Lys Leu Ser Glu Lys Val Val Thr Arg Ala Asn Gly Thr Arg
130 135 140
Leu Glu Tyr Thr Glu Ile Gln Asn Asp Gly Ser Gly Lys Ala Lys Glu
145 150 155 160
Val Leu Lys Ser Leu Thr Leu Glu Gly Thr Leu Thr Ala Asp Gly Glu
165 170 175
Thr Lys Leu Thr Glu Asn Thr Ile Thr Val Gln Lys Tyr Asn Thr Ala
180 185 190
Gly Thr Lys Leu Glu Gly Ser Pro Ala Glu Ile Lys Asp Leu Glu Ala
195 200 205
Leu Lys Ala Ala Leu Lys
210
<210> 90
<211> 173
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 90
Glu Ser Gln Val Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu
1 5 10 15
Asn Glu Gln Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser
20 25 30
Met Ser Ser Trp Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe
35 40 45
Leu Phe Asp His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile
50 55 60
Ile Phe Leu Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser
65 70 75 80
Ala Pro Glu His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala
85 90 95
Tyr Glu His Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp
100 105 110
His Ala Ile Lys Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp
115 120 125
Tyr Val Ala Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu
130 135 140
Asp Lys Ile Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala
145 150 155 160
Asp Gln Tyr Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
165 170
<210> 91
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 91
Gly Gly Gly Ser Gly Gly Gly Ser
5
<210> 92
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 92
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser
20
<210> 93
<211> 154
<212> БЕЛОК
<213> Aquifex aeolicus
<400> 93
Met Gln Ile Tyr Glu Gly Lys Leu Thr Ala Glu Gly Leu Arg Phe Gly
1 5 10 15
Ile Val Ala Ser Arg Phe Asn His Ala Leu Val Asp Arg Leu Val Glu
20 25 30
Gly Ala Ile Asp Cys Ile Val Arg His Gly Gly Arg Glu Glu Asp Ile
35 40 45
Thr Leu Val Arg Val Pro Gly Ser Trp Glu Ile Pro Val Ala Ala Gly
50 55 60
Glu Leu Ala Arg Lys Glu Asp Ile Asp Ala Val Ile Ala Ile Gly Val
65 70 75 80
Leu Ile Arg Gly Ala Thr Pro His Phe Asp Tyr Ile Ala Ser Glu Val
85 90 95
Ser Lys Gly Leu Ala Asn Leu Ser Leu Glu Leu Arg Lys Pro Ile Thr
100 105 110
Phe Gly Val Ile Thr Ala Asp Thr Leu Glu Gln Ala Ile Glu Arg Ala
115 120 125
Gly Thr Lys His Gly Asn Lys Gly Trp Glu Ala Ala Leu Ser Ala Ile
130 135 140
Glu Met Ala Asn Leu Phe Lys Ser Leu Arg
145 150
<210> 94
<211> 250
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 94
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Thr Leu
130 135 140
Glu Gly Gln Leu Ser Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys
245 250
<210> 95
<211> 250
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 95
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Asp Leu
130 135 140
Lys Gly Glu Leu Ser Ser Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys
245 250
<210> 96
<211> 250
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 96
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Thr Leu
130 135 140
Glu Gly Lys Val Ala Asn Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys
245 250
<210> 97
<211> 250
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 97
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu
130 135 140
Glu Gly Thr Leu Thr Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys
245 250
<210> 98
<211> 250
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 98
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Gln
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Thr Leu
130 135 140
Glu Gly Gln Leu Ser Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Gln Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Gln Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Gln Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys
245 250
<210> 99
<211> 250
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 99
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Gln
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Thr Leu
130 135 140
Glu Gly Lys Val Ala Asn Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Gln Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Gln Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Gln Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys
245 250
<210> 100
<211> 250
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 100
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Gln
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Phe Ala Leu
130 135 140
Glu Gly Thr Leu Thr Asp Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Gln Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Gln Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Gln Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys
245 250
<210> 101
<211> 250
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 101
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Gln
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Tyr Asp Leu
130 135 140
Lys Gly Glu Leu Ser Ser Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Gln Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Gln Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Gln Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys
245 250
<210> 102
<211> 250
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<220>
<221> ВАРИАНТ
<222> (48)..(48)
<223> /замена="Gln"
<220>
<221> MOD_RES
<222> (142)..(150)
<223> Любая аминокислота
<220>
<221> ВАРИАНТ
<222> (167)..(167)
<223> /замена="Gln"
<220>
<221> ВАРИАНТ
<222> (179)..(179)
<223> /замена="Gln"
<220>
<221> ВАРИАНТ
<222> (228)..(228)
<223> /замена="Gln"
<220>
<221> Сайт
<222> (1)..(250)
<223> /примечание="вариантам остатков, указанным в последовательности,
не отдается предпочтение перед остатками в аннотациях вариантов
положений»
<400> 102
Met Asp Glu Lys Asn Ser Val Ser Val Asp Leu Pro Gly Glu Met Lys
1 5 10 15
Val Leu Val Ser Lys Glu Lys Asn Lys Asp Gly Lys Tyr Asp Leu Ile
20 25 30
Ala Thr Val Asp Lys Leu Glu Leu Lys Gly Thr Ser Asp Lys Asn Asn
35 40 45
Gly Ser Gly Val Leu Glu Gly Val Lys Ala Asp Lys Ser Lys Val Lys
50 55 60
Leu Thr Ile Ser Asp Asp Leu Gly Gln Thr Thr Leu Glu Val Phe Lys
65 70 75 80
Glu Asp Gly Lys Thr Leu Val Ser Lys Lys Val Thr Ser Lys Asp Lys
85 90 95
Ser Ser Thr Glu Glu Lys Phe Asn Glu Lys Gly Glu Val Ser Glu Lys
100 105 110
Ile Ile Thr Arg Ala Asp Gly Thr Arg Leu Glu Tyr Thr Gly Ile Lys
115 120 125
Ser Asp Gly Ser Gly Lys Ala Lys Glu Val Leu Lys Gly Xaa Xaa Xaa
130 135 140
Xaa Xaa Xaa Xaa Xaa Xaa Glu Lys Thr Thr Leu Val Val Lys Glu Gly
145 150 155 160
Thr Val Thr Leu Ser Lys Asn Ile Ser Lys Ser Gly Glu Val Ser Val
165 170 175
Glu Leu Asn Asp Thr Asp Ser Ser Ala Ala Thr Lys Lys Thr Ala Ala
180 185 190
Trp Asn Ser Gly Thr Ser Thr Leu Thr Ile Thr Val Asn Ser Lys Lys
195 200 205
Thr Lys Asp Leu Val Phe Thr Lys Glu Asn Thr Ile Thr Val Gln Gln
210 215 220
Tyr Asp Ser Asn Gly Thr Lys Leu Glu Gly Ser Ala Val Glu Ile Thr
225 230 235 240
Lys Leu Asp Glu Ile Lys Asn Ala Leu Lys
245 250
<210> 103
<400> 103
000
<210> 104
<400> 104
000
<210> 105
<400> 105
000
<210> 106
<400> 106
000
<210> 107
<400> 107
000
<210> 108
<400> 108
000
<210> 109
<400> 109
000
<210> 110
<400> 110
000
<210> 111
<400> 111
000
<210> 112
<400> 112
000
<210> 113
<400> 113
000
<210> 114
<400> 114
000
<210> 115
<400> 115
000
<210> 116
<400> 116
000
<210> 117
<400> 117
000
<210> 118
<400> 118
000
<210> 119
<400> 119
000
<210> 120
<400> 120
000
<210> 121
<400> 121
000
<210> 122
<400> 122
000
<210> 123
<400> 123
000
<210> 124
<400> 124
000
<210> 125
<400> 125
000
<210> 126
<400> 126
000
<210> 127
<400> 127
000
<210> 128
<400> 128
000
<210> 129
<400> 129
000
<210> 130
<400> 130
000
<210> 131
<400> 131
000
<210> 132
<400> 132
000
<210> 133
<400> 133
000
<210> 134
<400> 134
000
<210> 135
<400> 135
000
<210> 136
<400> 136
000
<210> 137
<400> 137
000
<210> 138
<400> 138
000
<210> 139
<400> 139
000
<210> 140
<400> 140
000
<210> 141
<400> 141
000
<210> 142
<400> 142
000
<210> 143
<400> 143
000
<210> 144
<400> 144
000
<210> 145
<400> 145
000
<210> 146
<400> 146
000
<210> 147
<400> 147
000
<210> 148
<400> 148
000
<210> 149
<400> 149
000
<210> 150
<400> 150
000
<210> 151
<400> 151
000
<210> 152
<400> 152
000
<210> 153
<400> 153
000
<210> 154
<400> 154
000
<210> 155
<400> 155
000
<210> 156
<400> 156
000
<210> 157
<400> 157
000
<210> 158
<400> 158
000
<210> 159
<400> 159
000
<210> 160
<400> 160
000
<210> 161
<400> 161
000
<210> 162
<400> 162
000
<210> 163
<400> 163
000
<210> 164
<400> 164
000
<210> 165
<400> 165
000
<210> 166
<400> 166
000
<210> 167
<400> 167
000
<210> 168
<400> 168
000
<210> 169
<400> 169
000
<210> 170
<400> 170
000
<210> 171
<400> 171
000
<210> 172
<400> 172
000
<210> 173
<400> 173
000
<210> 174
<400> 174
000
<210> 175
<400> 175
000
<210> 176
<400> 176
000
<210> 177
<400> 177
000
<210> 178
<400> 178
000
<210> 179
<400> 179
000
<210> 180
<400> 180
000
<210> 181
<400> 181
000
<210> 182
<400> 182
000
<210> 183
<400> 183
000
<210> 184
<400> 184
000
<210> 185
<400> 185
000
<210> 186
<400> 186
000
<210> 187
<400> 187
000
<210> 188
<400> 188
000
<210> 189
<400> 189
000
<210> 190
<400> 190
000
<210> 191
<400> 191
000
<210> 192
<400> 192
000
<210> 193
<400> 193
000
<210> 194
<400> 194
000
<210> 195
<400> 195
000
<210> 196
<400> 196
000
<210> 197
<400> 197
000
<210> 198
<400> 198
000
<210> 199
<400> 199
000
<210> 200
<400> 200
000
<210> 201
<211> 173
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 201
Glu Ser Gln Val Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu
1 5 10 15
Asn Glu Gln Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Cys
20 25 30
Met Ser Ser Trp Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe
35 40 45
Leu Phe Asp His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile
50 55 60
Ile Phe Leu Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser
65 70 75 80
Ala Pro Glu His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala
85 90 95
Tyr Glu His Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp
100 105 110
His Ala Ile Lys Ser Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp
115 120 125
Tyr Val Ala Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu
130 135 140
Asp Lys Ile Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala
145 150 155 160
Asp Gln Tyr Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
165 170
<210> 202
<211> 173
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 202
Glu Ser Gln Val Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu
1 5 10 15
Asn Glu Gln Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser
20 25 30
Met Ser Ser Trp Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe
35 40 45
Leu Phe Asp His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile
50 55 60
Ile Phe Leu Asn Glu Asn Asn Val Pro Val Gln Leu Thr Cys Ile Ser
65 70 75 80
Ala Pro Glu His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala
85 90 95
Tyr Glu His Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp
100 105 110
His Ala Ile Lys Ser Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp
115 120 125
Tyr Val Ala Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu
130 135 140
Asp Lys Ile Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala
145 150 155 160
Asp Gln Tyr Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
165 170
<210> 203
<211> 173
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 203
Glu Ser Gln Val Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu
1 5 10 15
Asn Glu Gln Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser
20 25 30
Met Ser Ser Trp Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe
35 40 45
Leu Phe Asp His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile
50 55 60
Ile Phe Leu Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser
65 70 75 80
Cys Pro Glu His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala
85 90 95
Tyr Glu His Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp
100 105 110
His Ala Ile Lys Ser Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp
115 120 125
Tyr Val Ala Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu
130 135 140
Asp Lys Ile Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala
145 150 155 160
Asp Gln Tyr Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
165 170
<210> 204
<211> 173
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 204
Glu Ser Gln Val Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu
1 5 10 15
Asn Glu Gln Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser
20 25 30
Met Ser Ser Trp Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe
35 40 45
Leu Phe Asp His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile
50 55 60
Ile Phe Leu Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser
65 70 75 80
Ala Pro Glu His Cys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala
85 90 95
Tyr Glu His Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp
100 105 110
His Ala Ile Lys Ser Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp
115 120 125
Tyr Val Ala Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu
130 135 140
Asp Lys Ile Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala
145 150 155 160
Asp Gln Tyr Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
165 170
<210> 205
<211> 173
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 205
Glu Ser Gln Val Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu
1 5 10 15
Asn Glu Gln Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser
20 25 30
Met Ser Ser Trp Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe
35 40 45
Leu Phe Asp His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile
50 55 60
Ile Phe Leu Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser
65 70 75 80
Ala Pro Glu His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala
85 90 95
Tyr Glu His Glu Gln His Ile Ser Glu Cys Ile Asn Asn Ile Val Asp
100 105 110
His Ala Ile Lys Ser Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp
115 120 125
Tyr Val Ala Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu
130 135 140
Asp Lys Ile Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala
145 150 155 160
Asp Gln Tyr Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
165 170
<210> 206
<211> 173
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 206
Glu Ser Gln Val Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu
1 5 10 15
Asn Glu Gln Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser
20 25 30
Met Ser Ser Trp Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe
35 40 45
Leu Phe Asp His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile
50 55 60
Ile Phe Leu Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser
65 70 75 80
Ala Pro Glu His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala
85 90 95
Tyr Glu His Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp
100 105 110
His Ala Ile Lys Cys Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp
115 120 125
Tyr Val Ala Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu
130 135 140
Asp Lys Ile Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala
145 150 155 160
Asp Gln Tyr Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
165 170
<210> 207
<211> 173
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 207
Glu Ser Gln Val Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu
1 5 10 15
Asn Cys Gln Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser
20 25 30
Met Ser Ser Trp Ser Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe
35 40 45
Leu Phe Asp His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile
50 55 60
Ile Phe Leu Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser
65 70 75 80
Ala Pro Glu His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala
85 90 95
Tyr Glu His Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp
100 105 110
His Ala Ile Lys Ser Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp
115 120 125
Tyr Val Ala Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu
130 135 140
Asp Lys Ile Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala
145 150 155 160
Asp Gln Tyr Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
165 170
<210> 208
<211> 173
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 208
Glu Ser Gln Val Arg Gln Gln Phe Ser Lys Asp Ile Glu Lys Leu Leu
1 5 10 15
Asn Glu Gln Val Asn Lys Glu Met Asn Ser Ser Asn Leu Tyr Met Ser
20 25 30
Met Ser Ser Trp Cys Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe
35 40 45
Leu Phe Asp His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile
50 55 60
Ile Phe Leu Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser
65 70 75 80
Ala Pro Glu His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala
85 90 95
Tyr Glu His Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp
100 105 110
His Ala Ile Lys Ser Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp
115 120 125
Tyr Val Ala Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu
130 135 140
Asp Lys Ile Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala
145 150 155 160
Asp Gln Tyr Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
165 170
<210> 209
<211> 166
<212> БЕЛОК
<213> Helicobacter pylori
<400> 209
Leu Ser Lys Asp Ile Ile Lys Leu Leu Asn Glu Gln Val Asn Lys Glu
1 5 10 15
Met Asn Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Cys Tyr Thr
20 25 30
His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala Glu
35 40 45
Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn Asn
50 55 60
Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe Glu
65 70 75 80
Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His Ile
85 90 95
Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Ser Lys Asp
100 105 110
His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His Glu
115 120 125
Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile Gly
130 135 140
Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly Ile
145 150 155 160
Ala Lys Ser Arg Lys Ser
165
<210> 210
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический олигонуклеотид"
<400> 210
tgactgtgaa cgttcgagat ga 22
<210> 211
<211> 191
<212> БЕЛОК
<213> Trichoplusia ni
<400> 211
Thr Gln Cys Asn Val Asn Pro Val Gln Ile Pro Lys Asp Trp Ile Thr
1 5 10 15
Met His Arg Ser Cys Arg Asn Ser Met Arg Gln Gln Ile Gln Met Glu
20 25 30
Val Gly Ala Ser Leu Gln Tyr Leu Ala Met Gly Ala His Phe Ser Lys
35 40 45
Asp Val Val Asn Arg Pro Gly Phe Ala Gln Leu Phe Phe Asp Ala Ala
50 55 60
Ser Glu Glu Arg Glu His Ala Met Lys Leu Ile Glu Tyr Leu Leu Met
65 70 75 80
Arg Gly Glu Leu Thr Asn Asp Val Ser Ser Leu Leu Gln Val Arg Pro
85 90 95
Pro Thr Arg Ser Ser Trp Lys Gly Gly Val Glu Ala Leu Glu His Ala
100 105 110
Leu Ser Met Glu Ser Asp Val Thr Lys Ser Ile Arg Asn Val Ile Lys
115 120 125
Ala Cys Glu Asp Asp Ser Glu Phe Asn Asp Tyr His Leu Val Asp Tyr
130 135 140
Leu Thr Gly Asp Phe Leu Glu Glu Gln Tyr Lys Gly Gln Arg Asp Leu
145 150 155 160
Ala Gly Lys Ala Ser Thr Leu Lys Lys Leu Met Asp Arg His Glu Ala
165 170 175
Leu Gly Glu Phe Ile Phe Asp Lys Lys Leu Leu Gly Ile Asp Val
180 185 190
<210> 212
<211> 212
<212> БЕЛОК
<213> Trichoplusia ni
<400> 212
Ala Asp Thr Cys Tyr Asn Asp Val Ala Leu Asp Cys Gly Ile Thr Ser
1 5 10 15
Asn Ser Leu Ala Leu Pro Arg Cys Asn Ala Val Tyr Gly Glu Tyr Gly
20 25 30
Ser His Gly Asn Val Ala Thr Glu Leu Gln Ala Tyr Ala Lys Leu His
35 40 45
Leu Glu Arg Ser Tyr Asp Tyr Leu Leu Ser Ala Ala Tyr Phe Asn Asn
50 55 60
Tyr Gln Thr Asn Arg Ala Gly Phe Ser Lys Leu Phe Lys Lys Leu Ser
65 70 75 80
Asp Glu Ala Trp Ser Lys Thr Ile Asp Ile Ile Lys His Val Thr Lys
85 90 95
Arg Gly Asp Lys Met Asn Phe Asp Gln His Ser Thr Met Lys Thr Glu
100 105 110
Arg Lys Asn Tyr Thr Ala Glu Asn His Glu Leu Glu Ala Leu Ala Lys
115 120 125
Ala Leu Asp Thr Gln Lys Glu Leu Ala Glu Arg Ala Phe Tyr Ile His
130 135 140
Arg Glu Ala Thr Arg Asn Ser Gln His Leu His Asp Pro Glu Ile Ala
145 150 155 160
Gln Tyr Leu Glu Glu Glu Phe Ile Glu Asp His Ala Glu Lys Ile Arg
165 170 175
Thr Leu Ala Gly His Thr Ser Asp Leu Lys Lys Phe Ile Thr Ala Asn
180 185 190
Asn Gly His Asp Leu Ser Leu Ala Leu Tyr Val Phe Asp Glu Tyr Leu
195 200 205
Gln Lys Thr Val
210
<210> 213
<211> 174
<212> БЕЛОК
<213> Pyrococcus furiosus
<400> 213
Met Leu Ser Glu Arg Met Leu Lys Ala Leu Asn Asp Gln Leu Asn Arg
1 5 10 15
Glu Leu Tyr Ser Ala Tyr Leu Tyr Phe Ala Met Ala Ala Tyr Phe Glu
20 25 30
Asp Leu Gly Leu Glu Gly Phe Ala Asn Trp Met Lys Ala Gln Ala Glu
35 40 45
Glu Glu Ile Gly His Ala Leu Arg Phe Tyr Asn Tyr Ile Tyr Asp Arg
50 55 60
Asn Gly Arg Val Glu Leu Asp Glu Ile Pro Lys Pro Pro Lys Glu Trp
65 70 75 80
Glu Ser Pro Leu Lys Ala Phe Glu Ala Ala Tyr Glu His Glu Lys Phe
85 90 95
Ile Ser Lys Ser Ile Tyr Glu Leu Ala Ala Leu Ala Glu Glu Glu Lys
100 105 110
Asp Tyr Ser Thr Arg Ala Phe Leu Glu Trp Phe Ile Asn Glu Gln Val
115 120 125
Glu Glu Glu Ala Ser Val Lys Lys Ile Leu Asp Lys Leu Lys Phe Ala
130 135 140
Lys Asp Ser Pro Gln Ile Leu Phe Met Leu Asp Lys Glu Leu Ser Ala
145 150 155 160
Arg Ala Pro Lys Leu Pro Gly Leu Leu Met Gln Gly Gly Glu
165 170
<210> 214
<211> 183
<212> БЕЛОК
<213> Homo sapiens
<400> 214
Met Thr Thr Ala Ser Thr Ser Gln Val Arg Gln Asn Tyr His Gln Asp
1 5 10 15
Ser Glu Ala Ala Ile Asn Arg Gln Ile Asn Leu Glu Leu Tyr Ala Ser
20 25 30
Tyr Val Tyr Leu Ser Met Ser Tyr Tyr Phe Asp Arg Asp Asp Val Ala
35 40 45
Leu Lys Asn Phe Ala Lys Tyr Phe Leu His Gln Ser His Glu Glu Arg
50 55 60
Glu His Ala Glu Lys Leu Met Lys Leu Gln Asn Gln Arg Gly Gly Arg
65 70 75 80
Ile Phe Leu Gln Asp Ile Lys Lys Pro Asp Cys Asp Asp Trp Glu Ser
85 90 95
Gly Leu Asn Ala Met Glu Cys Ala Leu His Leu Glu Lys Asn Val Gln
100 105 110
Gln Ser Leu Leu Glu Leu His Lys Leu Ala Thr Asp Lys Asn Asp Pro
115 120 125
His Leu Cys Asp Phe Ile Glu Thr His Tyr Leu Asn Glu Gln Val Lys
130 135 140
Ala Ile Lys Glu Leu Gly Asp His Val Thr Asn Leu Arg Lys Met Gly
145 150 155 160
Ala Pro Glu Ser Gly Leu Ala Glu Tyr Leu Phe Asp Lys His Thr Leu
165 170 175
Gly Asp Ser Asp Gln Glu Ser
180
<210> 215
<211> 204
<212> БЕЛОК
<213> Homo sapiens
<400> 215
Met Asp Ser Lys Gly Ser Ser Gln Lys Gly Ser Arg Leu Leu Leu Leu
1 5 10 15
Leu Val Val Ser Asn Leu Leu Leu Pro Gln Gly Val Leu Ala Ser Ser
20 25 30
Gln Ile Arg Gln Asn Tyr Ser Thr Asp Val Glu Ala Ala Val Asn Ser
35 40 45
Leu Val Asn Leu Tyr Leu Gln Ala Ser Tyr Thr Tyr Leu Ser Leu Gly
50 55 60
Phe Tyr Phe Asp Arg Asp Asp Val Ala Leu Glu Gly Val Ser His Phe
65 70 75 80
Phe Arg Glu Leu Ala Glu Glu Lys Arg Glu Gly Tyr Glu Arg Leu Leu
85 90 95
Lys Met Gln Asn Gln Arg Gly Gly Arg Ala Leu Phe Gln Asp Ile Lys
100 105 110
Lys Pro Ala Glu Asp Glu Trp Gly Lys Thr Pro Asp Ala Met Lys Ala
115 120 125
Ala Met Ala Leu Glu Lys Lys Leu Asn Gln Ala Leu Leu Asp Leu His
130 135 140
Ala Leu Gly Ser Ala Arg Thr Asp Pro His Leu Cys Asp Phe Leu Glu
145 150 155 160
Thr His Phe Leu Asp Glu Glu Val Lys Leu Ile Lys Lys Met Gly Asp
165 170 175
His Leu Thr Asn Leu His Arg Leu Gly Gly Pro Glu Ala Gly Leu Gly
180 185 190
Glu Tyr Leu Phe Glu Arg Leu Thr Leu Lys His Asp
195 200
<210> 216
<211> 154
<212> БЕЛОК
<213> Aquifex aeolicus
<400> 216
Met Gln Ile Tyr Glu Gly Lys Leu Thr Ala Glu Gly Leu Arg Phe Gly
1 5 10 15
Ile Val Ala Ser Arg Phe Asn His Ala Leu Val Asp Arg Leu Val Glu
20 25 30
Gly Ala Ile Asp Cys Ile Val Arg His Gly Gly Arg Glu Glu Asp Ile
35 40 45
Thr Leu Val Arg Val Pro Gly Ser Trp Glu Ile Pro Val Ala Ala Gly
50 55 60
Glu Leu Ala Arg Lys Glu Asp Ile Asp Ala Val Ile Ala Ile Gly Val
65 70 75 80
Leu Ile Arg Gly Ala Thr Pro His Phe Asp Tyr Ile Ala Ser Glu Val
85 90 95
Ser Lys Gly Leu Ala Asn Leu Ser Leu Glu Leu Arg Lys Pro Ile Thr
100 105 110
Phe Gly Val Ile Thr Ala Asp Thr Leu Glu Gln Ala Ile Glu Arg Ala
115 120 125
Gly Thr Lys His Gly Asn Lys Gly Trp Glu Ala Ala Leu Ser Ala Ile
130 135 140
Glu Met Ala Asn Leu Phe Lys Ser Leu Arg
145 150
<210> 217
<211> 8
<212> БЕЛОК
<213> Неустановленное
<220>
<221> источник
<223> /примечание="Описание незивестного: Последовательность линкера
лягушки-быка"
<400> 217
Glu Ser Gln Val Arg Gln Gln Phe
5
<210> 218
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 218
Cys Leu Val Pro Arg Gly Ser Leu Glu His His His His His His
1 5 10 15
<210> 219
<211> 156
<212> БЕЛОК
<213> Escherichia coli
<400> 219
Met Asn Ile Ile Glu Ala Asn Val Ala Thr Pro Asp Ala Arg Val Ala
1 5 10 15
Ile Thr Ile Ala Arg Phe Asn Asn Phe Ile Asn Asp Ser Leu Leu Glu
20 25 30
Gly Ala Ile Asp Ala Leu Lys Arg Ile Gly Gln Val Lys Asp Glu Asn
35 40 45
Ile Thr Val Val Trp Val Pro Gly Ala Tyr Glu Leu Pro Leu Ala Ala
50 55 60
Gly Ala Leu Ala Lys Thr Gly Lys Tyr Asp Ala Val Ile Ala Leu Gly
65 70 75 80
Thr Val Ile Arg Gly Gly Thr Ala His Phe Glu Tyr Val Ala Gly Gly
85 90 95
Ala Ser Asn Gly Leu Ala His Val Ala Gln Asp Ser Glu Ile Pro Val
100 105 110
Ala Phe Gly Val Leu Thr Thr Glu Ser Ile Glu Gln Ala Ile Glu Arg
115 120 125
Ala Gly Thr Lys Ala Gly Asn Lys Gly Ala Glu Ala Ala Leu Thr Ala
130 135 140
Leu Glu Met Ile Asn Val Leu Lys Ala Ile Lys Ala
145 150 155
<210> 220
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 220
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
<210> 221
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 221
Gly Gly Ser Gly Ser Gly Ser Asn Ser Ser Ala Ser Ser Gly Ala Ser
1 5 10 15
Ser Gly Gly Ala Ser Gly Gly Ser Gly Gly Ser Gly
20 25
<210> 222
<211> 46
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 222
Gly Gly Ser Gly Ser Ala Ser Ser Gly Ala Ser Ala Ser Gly Ser Ser
1 5 10 15
Asn Gly Ser Gly Ser Gly Ser Gly Ser Asn Ser Ser Ala Ser Ser Gly
20 25 30
Ala Ser Ser Gly Gly Ala Ser Gly Gly Ser Gly Gly Ser Gly
35 40 45
<210> 223
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 223
Gly Gly Ser Gly Ser Ala Ser Ala Glu Ala Ala Ala Lys Glu Ala Ala
1 5 10 15
Ala Lys Ala Gly Gly Ser Gly Gly Ser Gly
20 25
<210> 224
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 224
Gly Gly Ser Gly Ser Ala Ser Ala Glu Ala Ala Ala Lys Glu Ala Ala
1 5 10 15
Ala Lys Glu Ala Ala Ala Lys Ala Ser Gly Gly Ser Gly Gly Ser Gly
20 25 30
<210> 225
<211> 47
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 225
Ser Gly Gly Gly Ser Gly Ser Ala Ser Ser Gly Ala Ser Ala Ser Gly
1 5 10 15
Ser Ser Cys Ser Gly Ser Gly Ser Gly Ser Ser Ser Ala Ser Ser Gly
20 25 30
Ala Ser Ser Gly Gly Ala Ser Gly Gly Gly Ser Gly Gly Ser Gly
35 40 45
<210> 226
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический пептид"
<400> 226
Gly Gly Gly Ser
1
<210> 227
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
Синтетическая 6xHis метка"
<400> 227
His His His His His His
5
<210> 228
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
интетический олигонуклеотид"
<400> 228
tgactgtgaa cgttcgagat g 21
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИГЕННЫЕ ПОЛИПЕПТИДЫ НА ОСНОВЕ ПОСЛЕДОВАТЕЛЬНОСТИ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОГО ВИРУСА | 2019 |
|
RU2807992C2 |
| ЛЕЧЕНИЕ И ПРОФИЛАКТИКА АЛЛЕРГИИ НА КЛЕЩЕЙ ДОМАШНЕЙ ПЫЛИ | 2019 |
|
RU2815386C2 |
| МУЛЬТИМЕРИЗУЮЩИЕСЯ ПОЛИПЕПТИДЫ, ПРОИСХОДЯЩИЕ ОТ ДОМЕНА С УКЛАДКОЙ ТИПА РУЛЕТ ОСНОВАНИЯ ПЕНТОНА АДЕНОВИРУСА | 2019 |
|
RU2820522C2 |
| МУТАНТЫ FIMH E. COLI И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2831010C1 |
| Выделенный модифицированный белок VPI капсида аденоассоциированного вируса 9 серотипа (AAV9), капсид и вектор на его основе | 2021 |
|
RU2825667C2 |
| АДЕНОВИРУСЫ И СПОСОБЫ ПРИМЕНЕНИЯ АДЕНОВИРУСОВ | 2019 |
|
RU2782528C1 |
| НЕ ТОКСИЧЕСКИЕ ПОЛИПЕПТИДЫ КЛОСТРИДИАЛЬНОГО НЕЙРОТОКСИНА ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ НЕВРОЛОГИЧЕСКИХ НАРУШЕНИЙ | 2020 |
|
RU2839368C1 |
| КОНСТРУКЦИИ ДНК-АНТИТЕЛ ДЛЯ ПРИМЕНЕНИЯ ПРОТИВ БОЛЕЗНИ ЛАЙМА | 2017 |
|
RU2813829C2 |
| ПОЛИПЕПТИД ДЛЯ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ ТРОМБОВ | 2019 |
|
RU2778566C1 |
| СКОНСТРУИРОВАННЫЙ БОТУЛИНИЧЕСКИЙ НЕЙРОТОКСИН | 2017 |
|
RU2789302C2 |
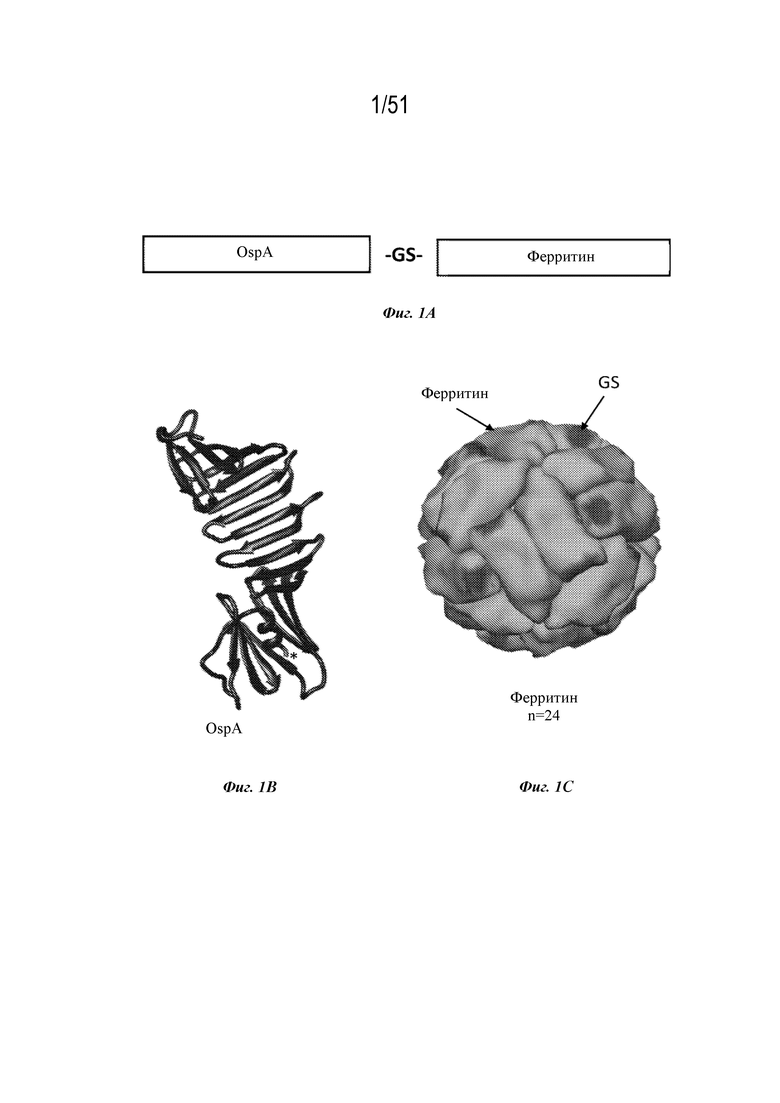
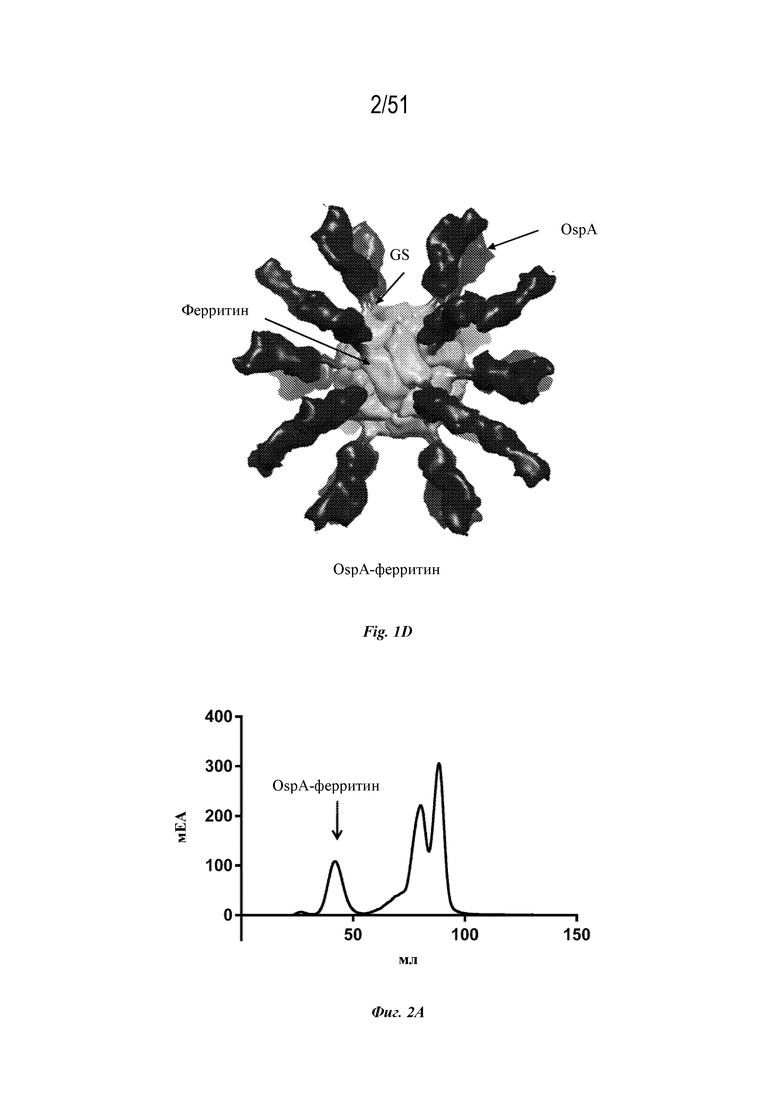
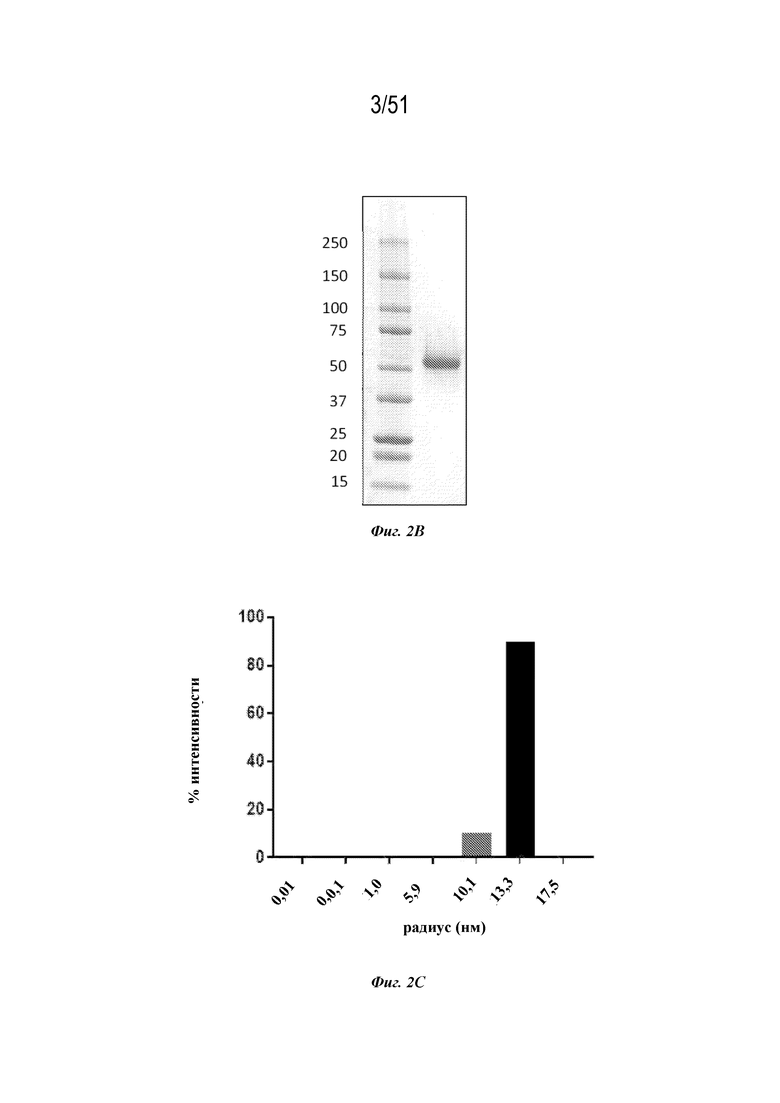
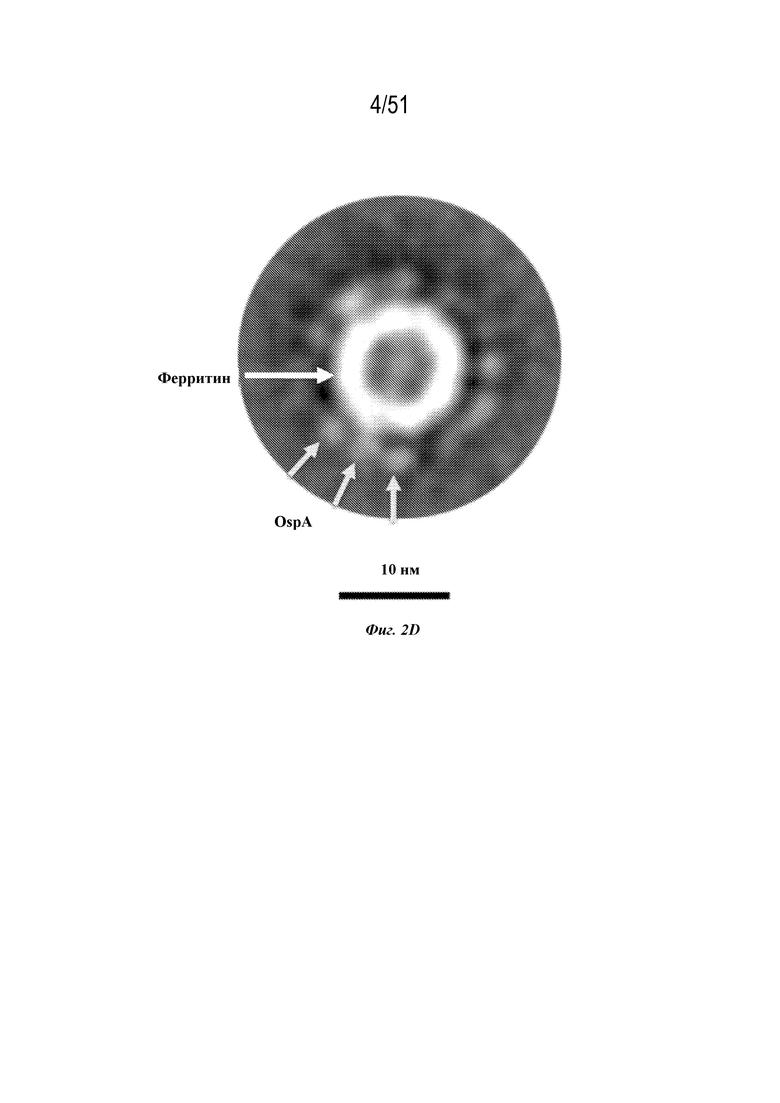


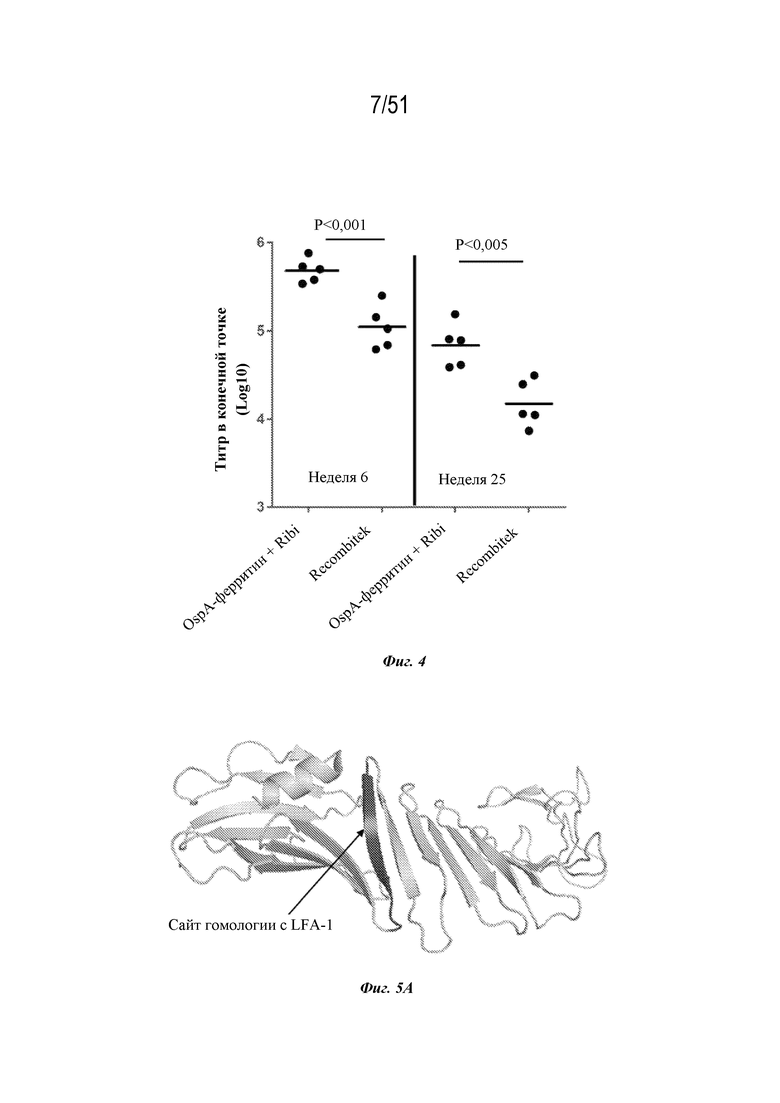
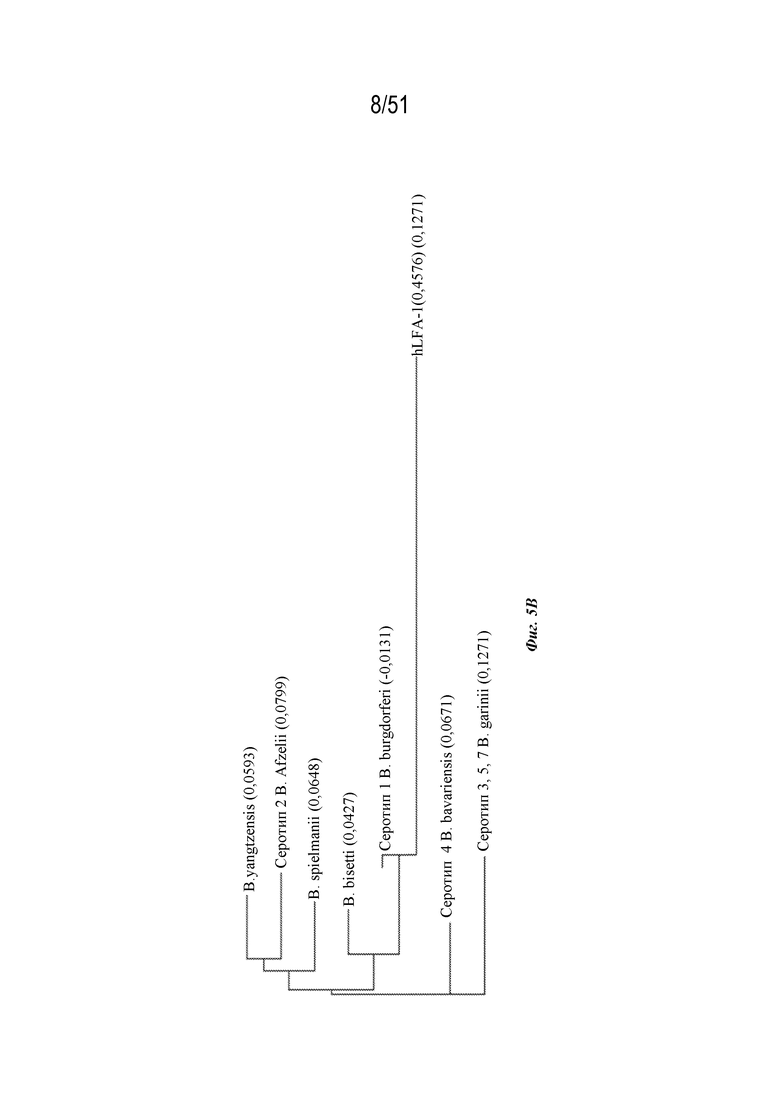
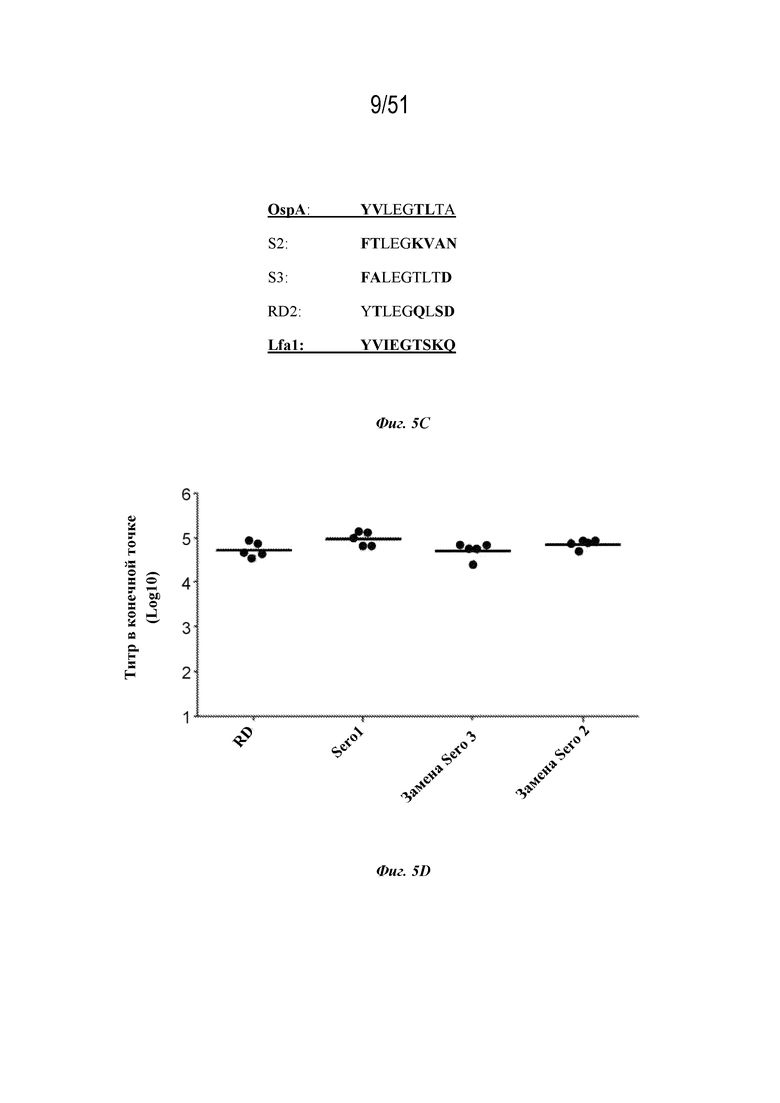
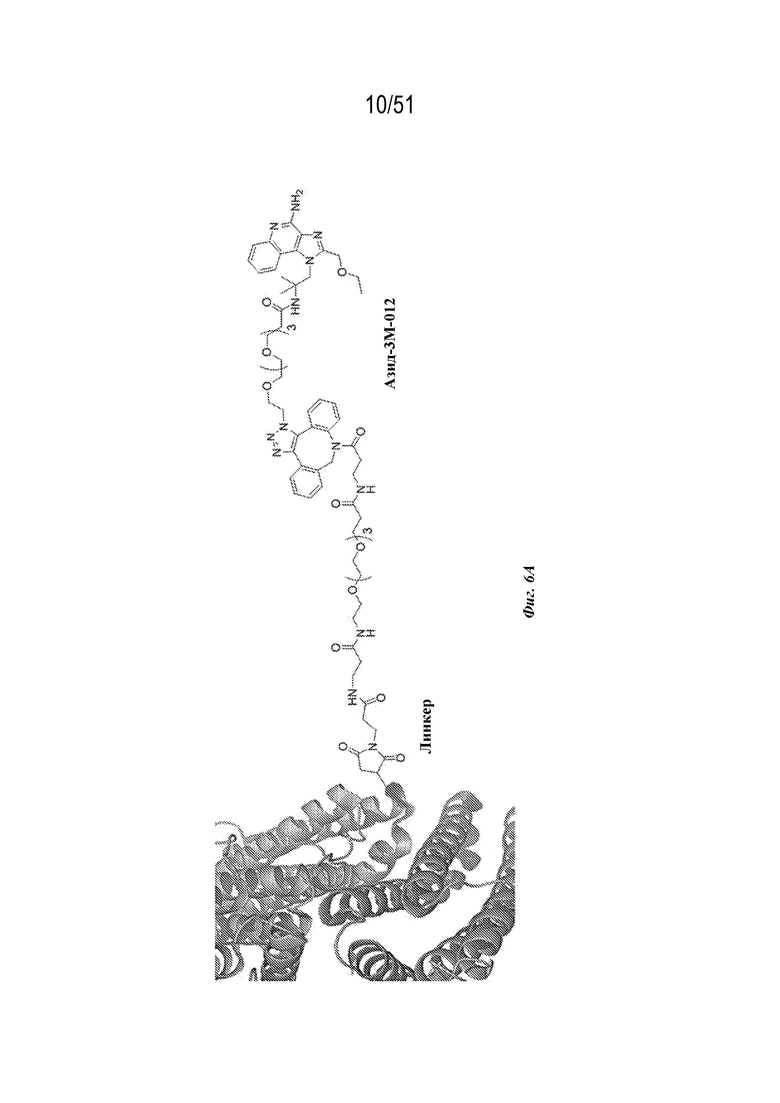
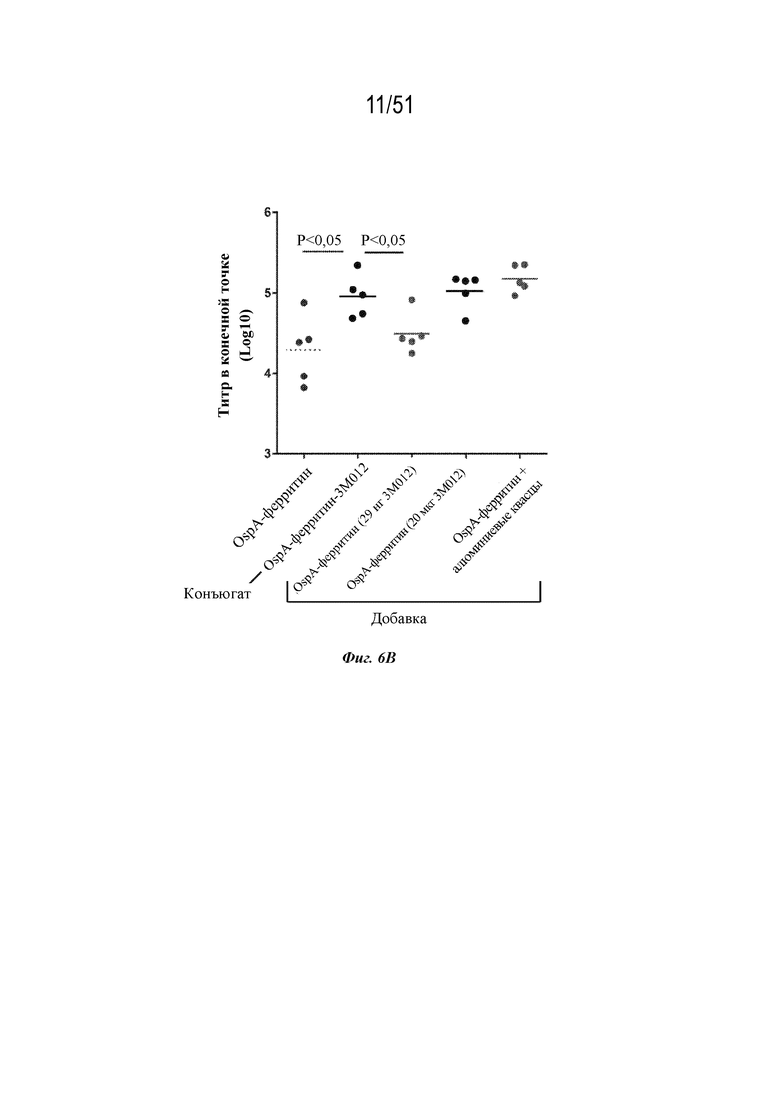
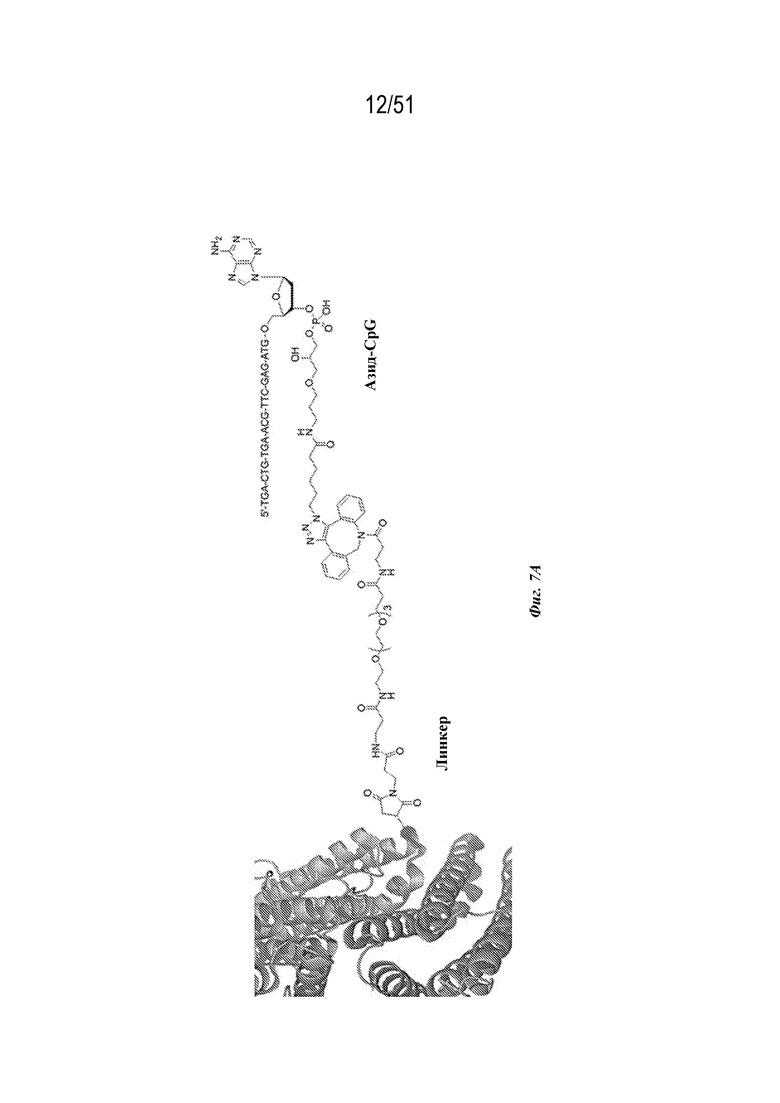
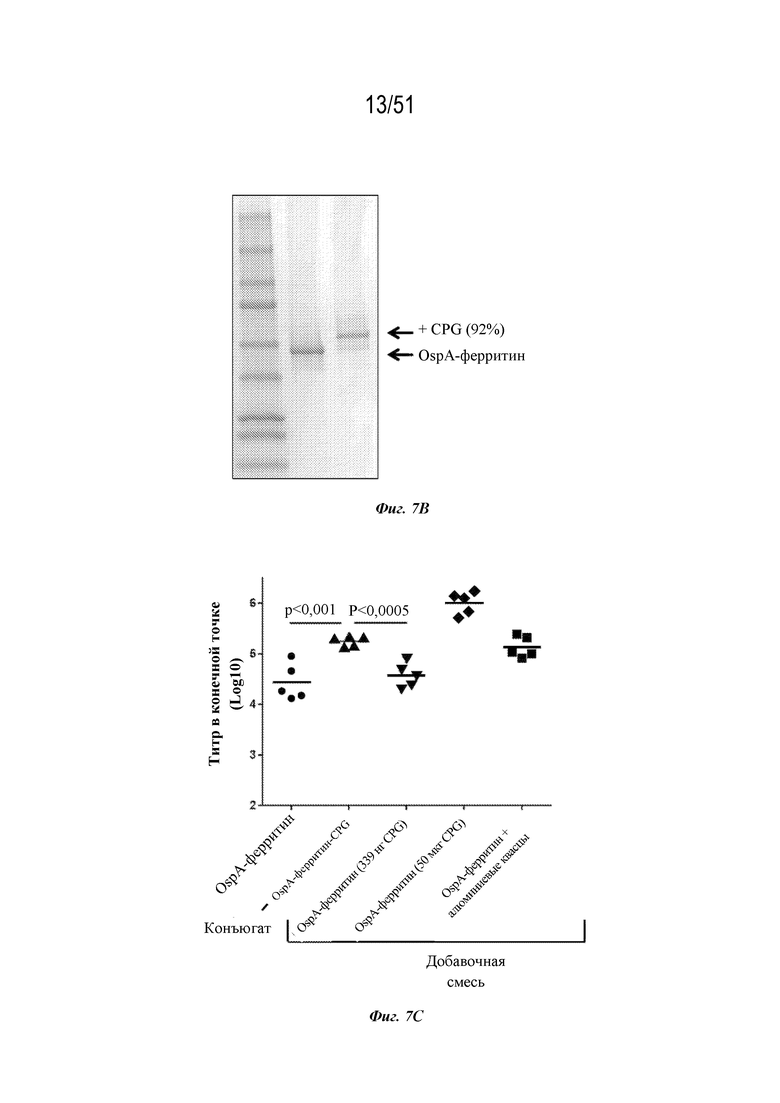
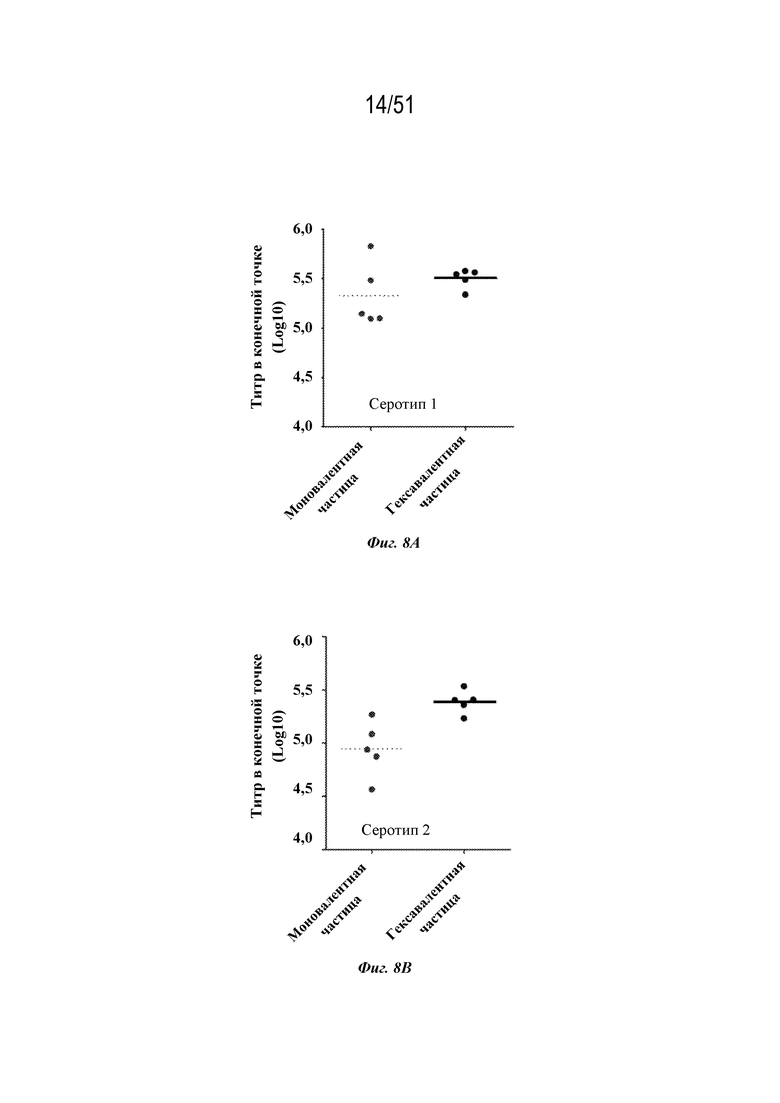
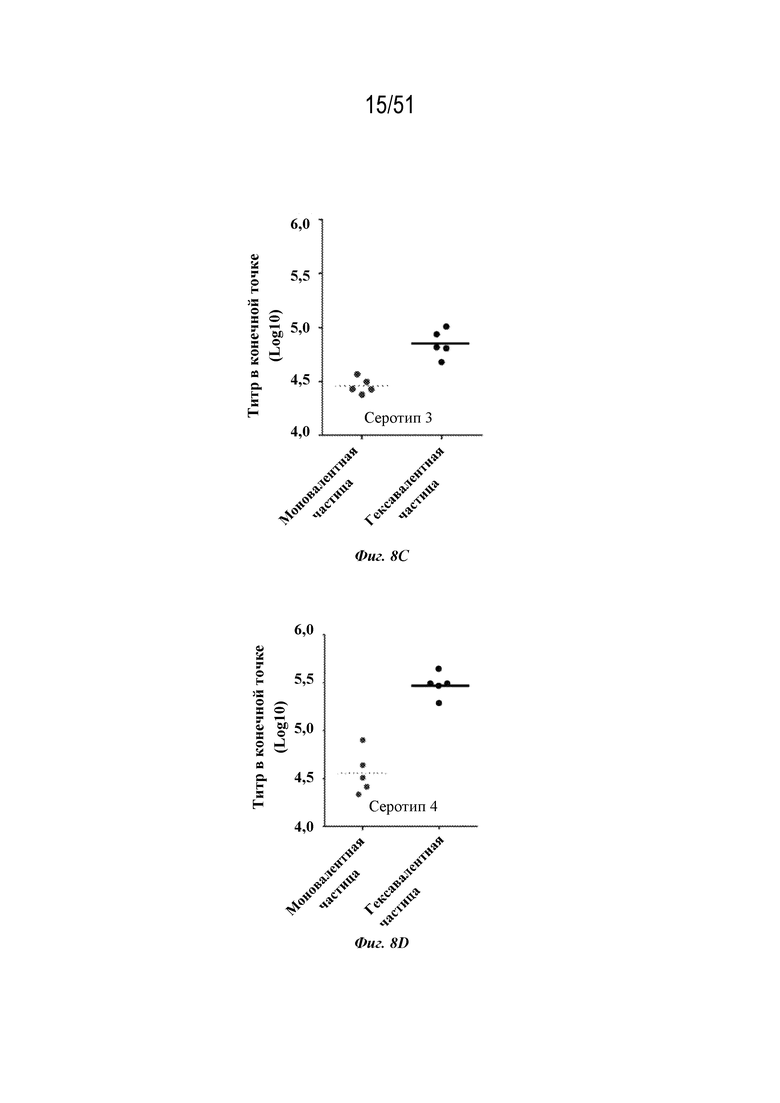
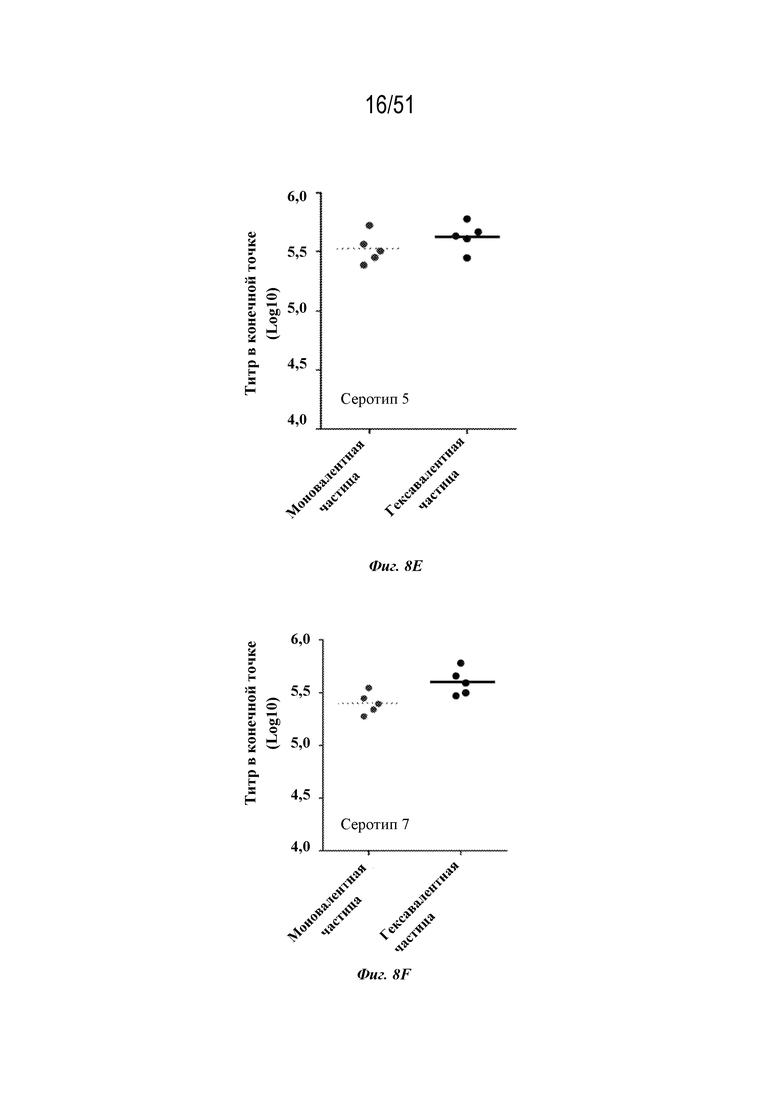
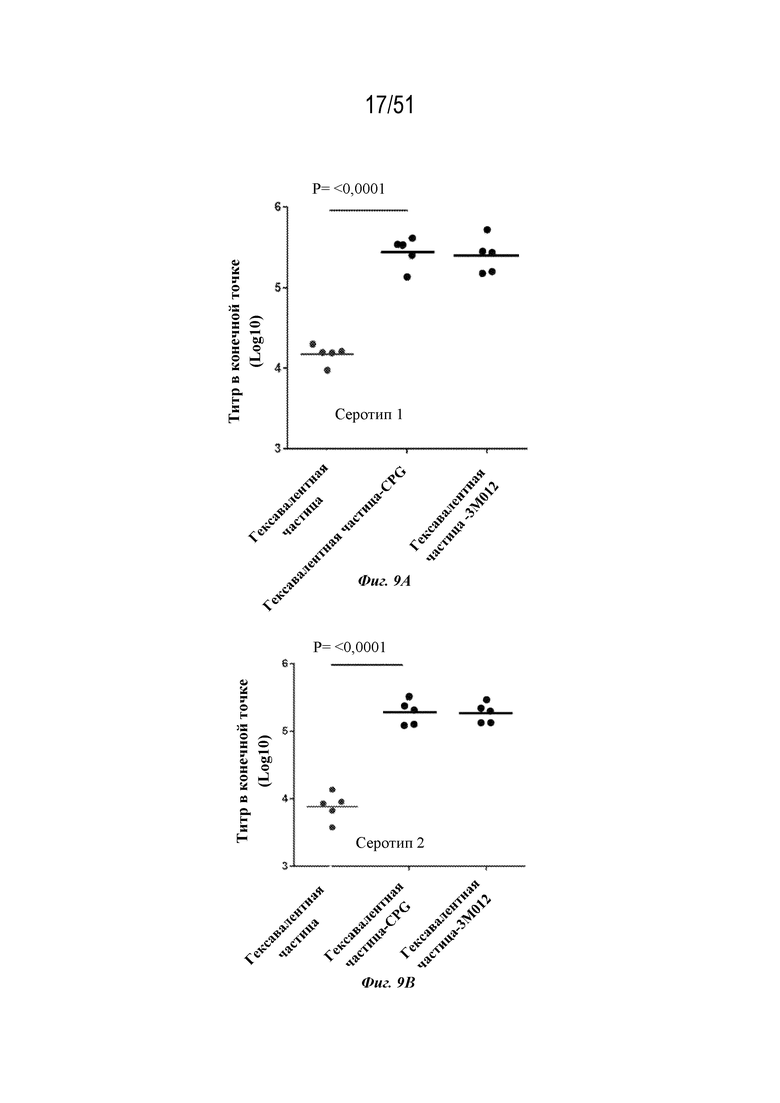
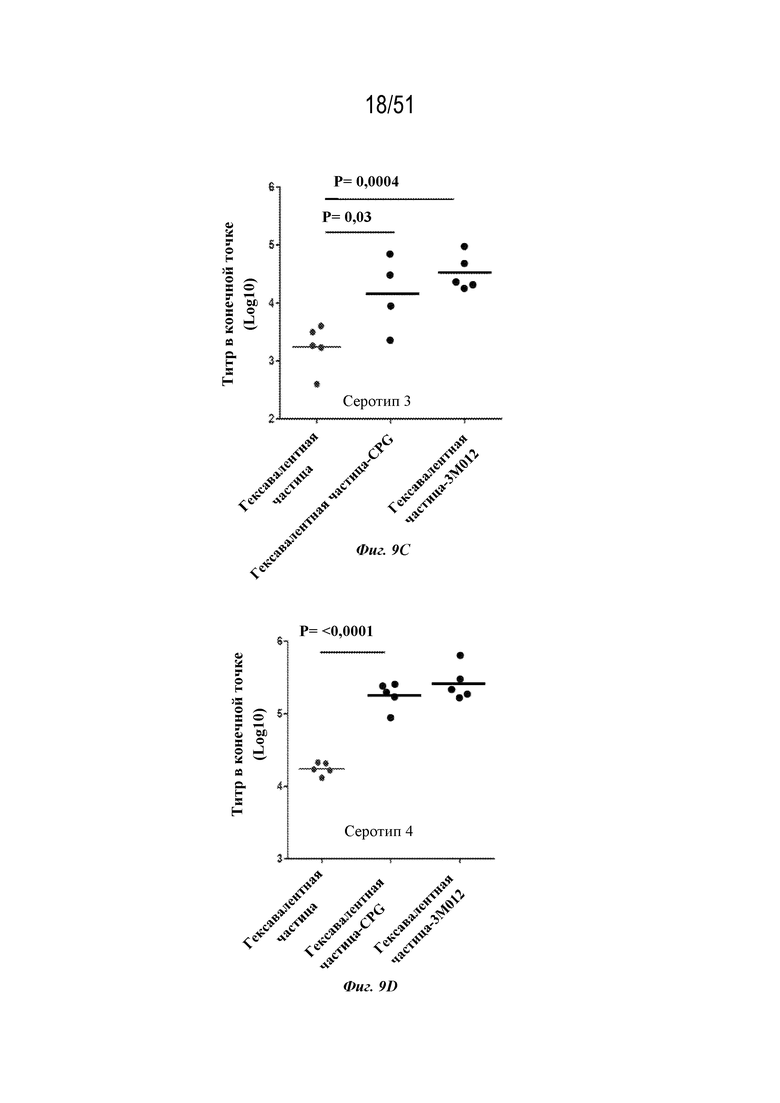
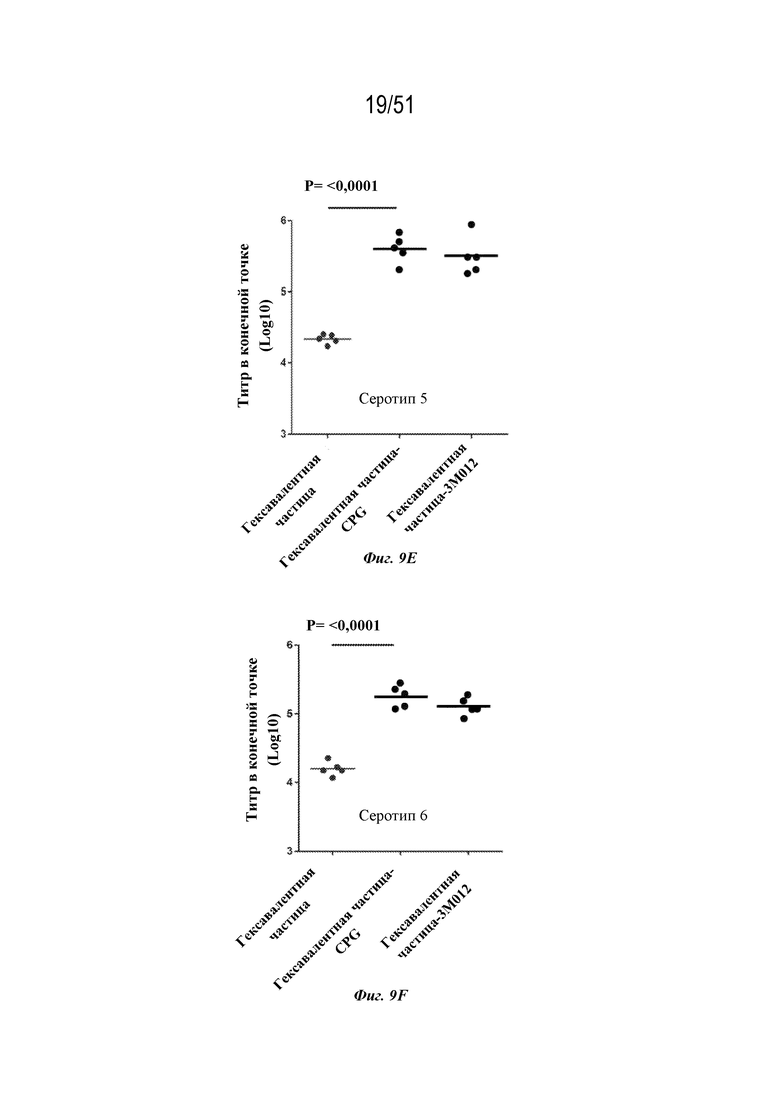
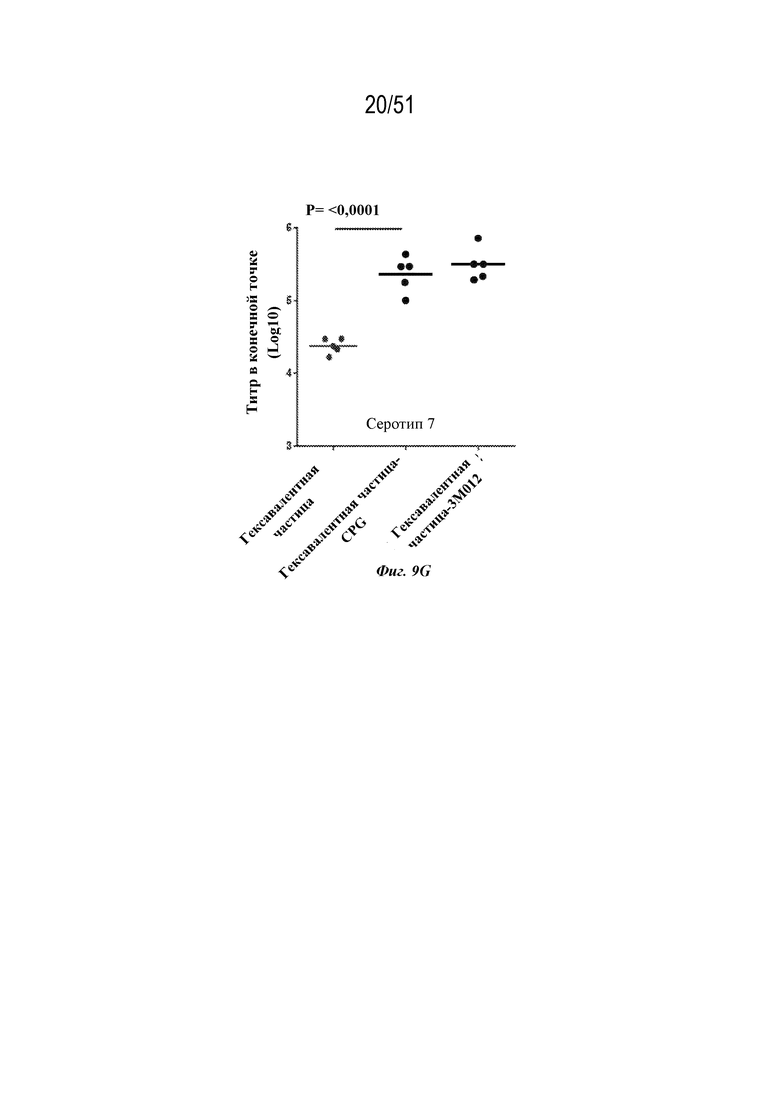

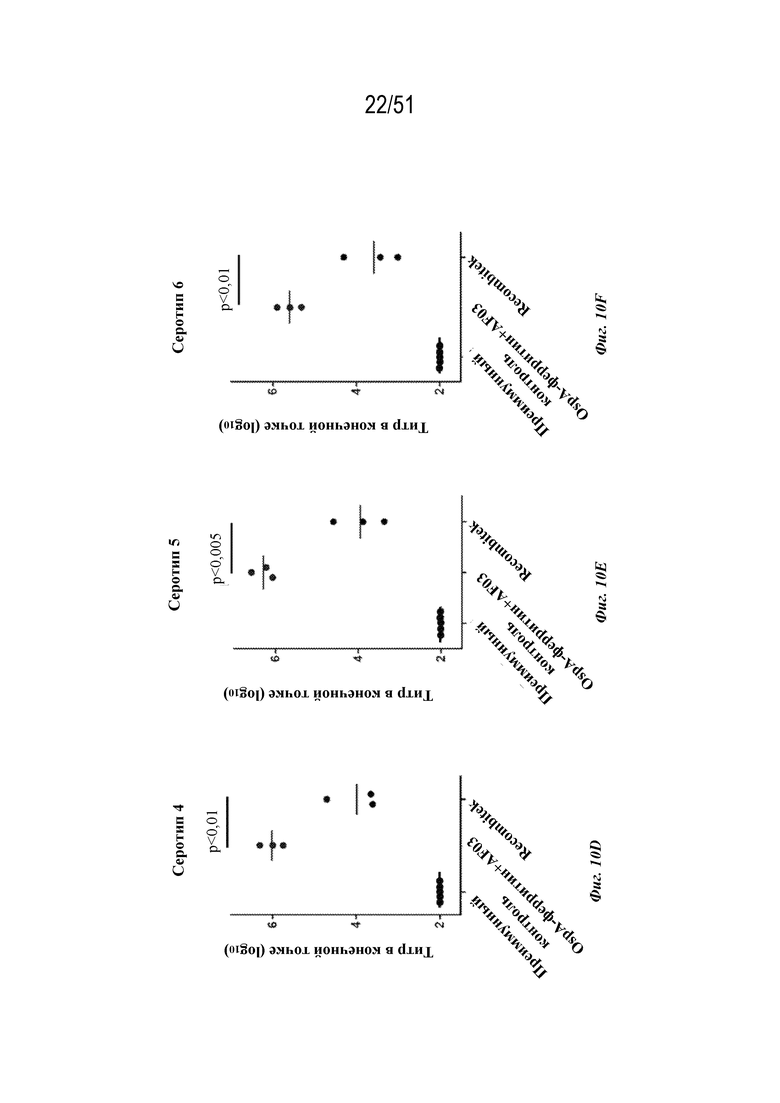

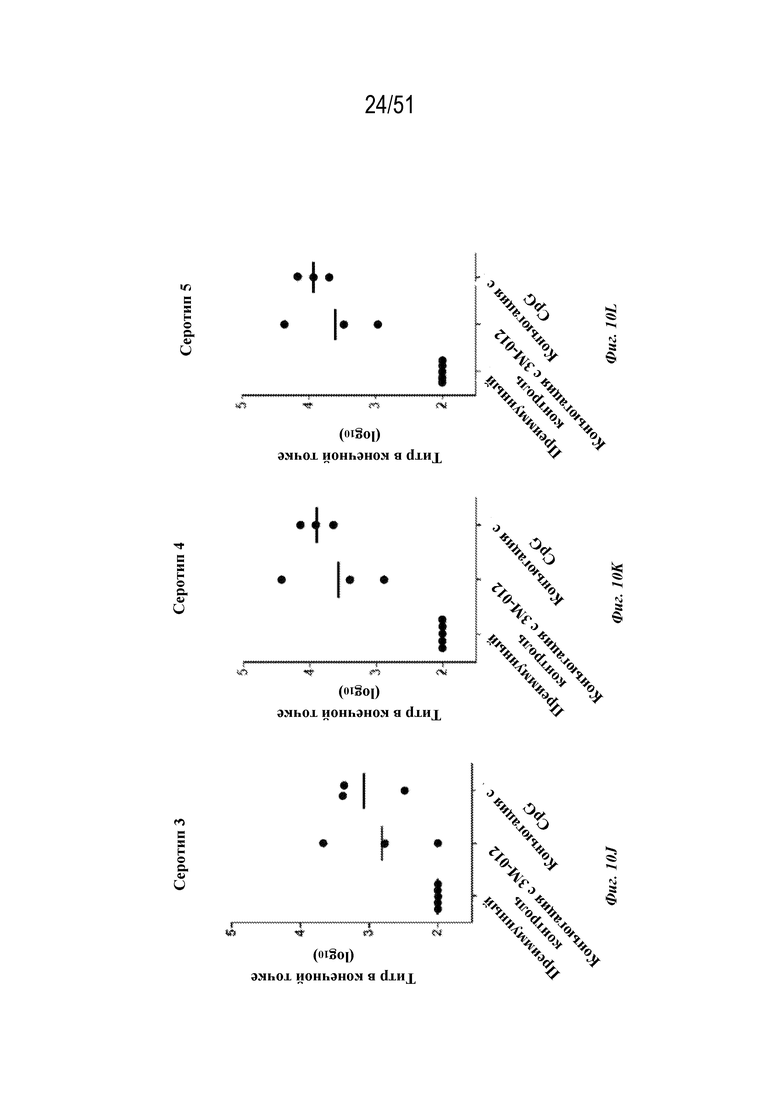
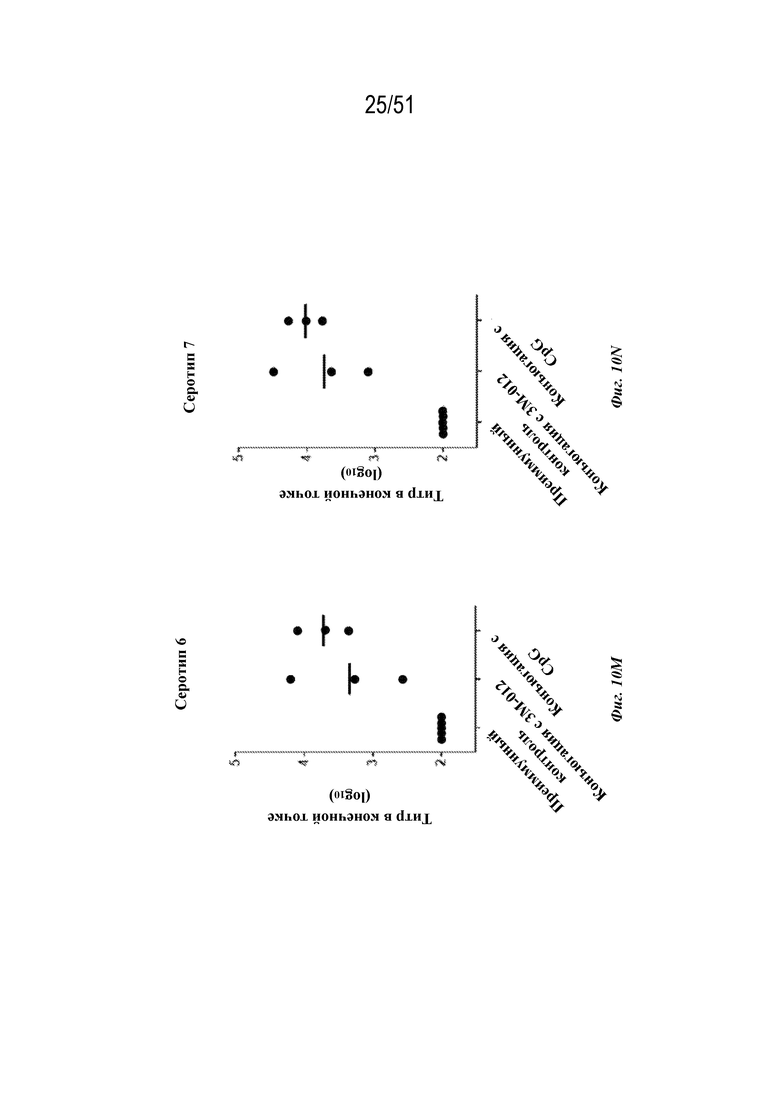
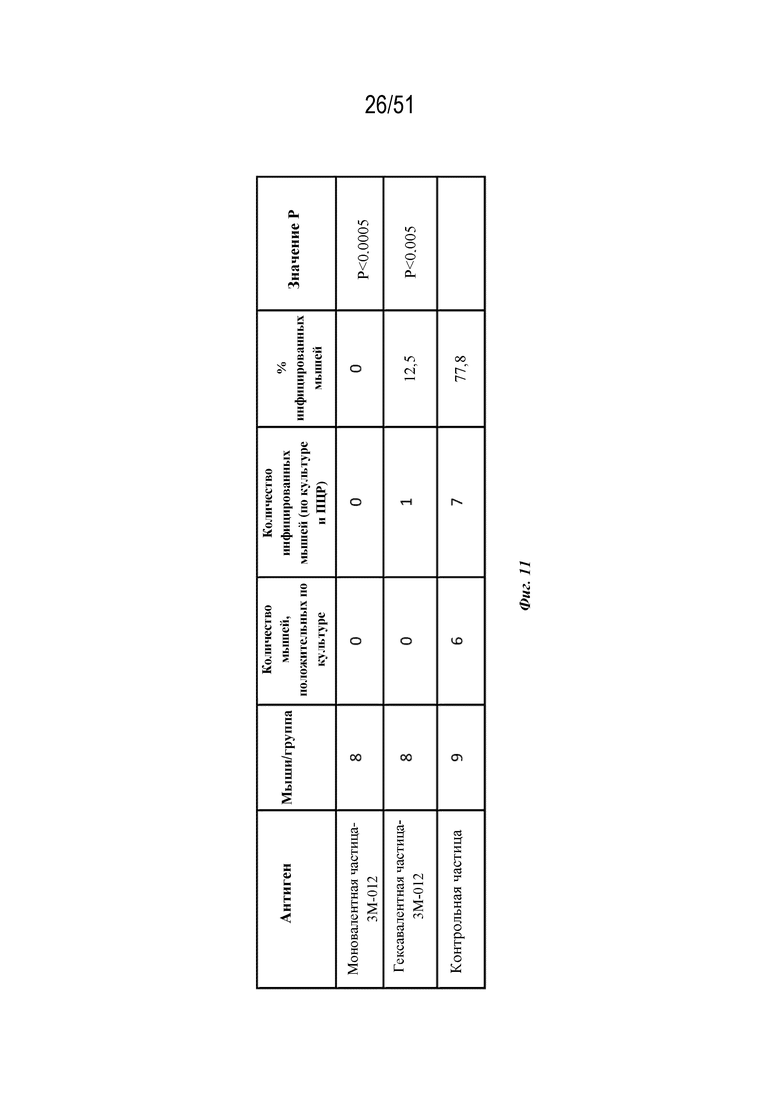
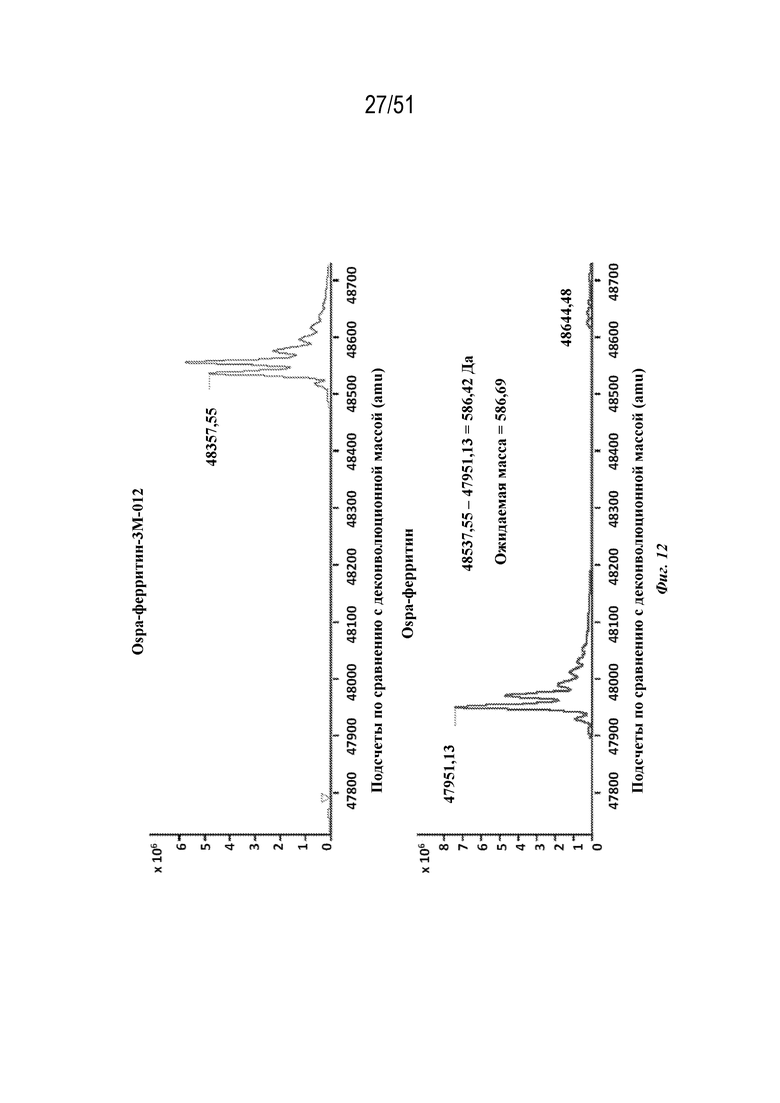
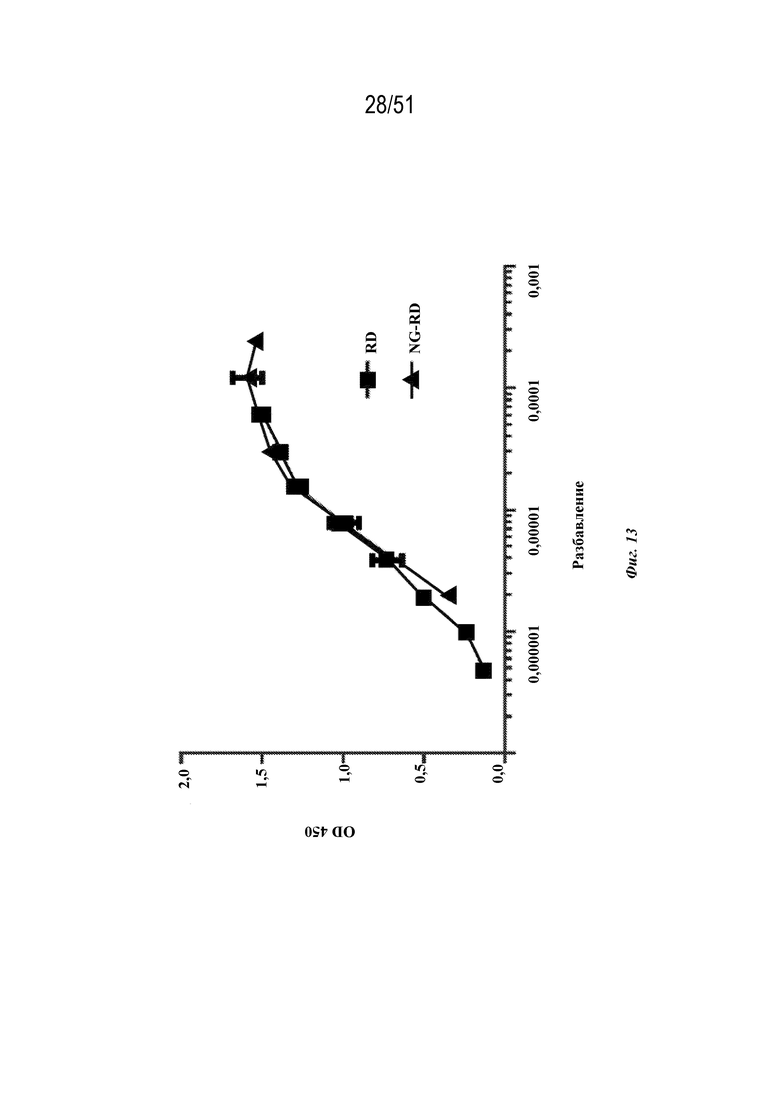
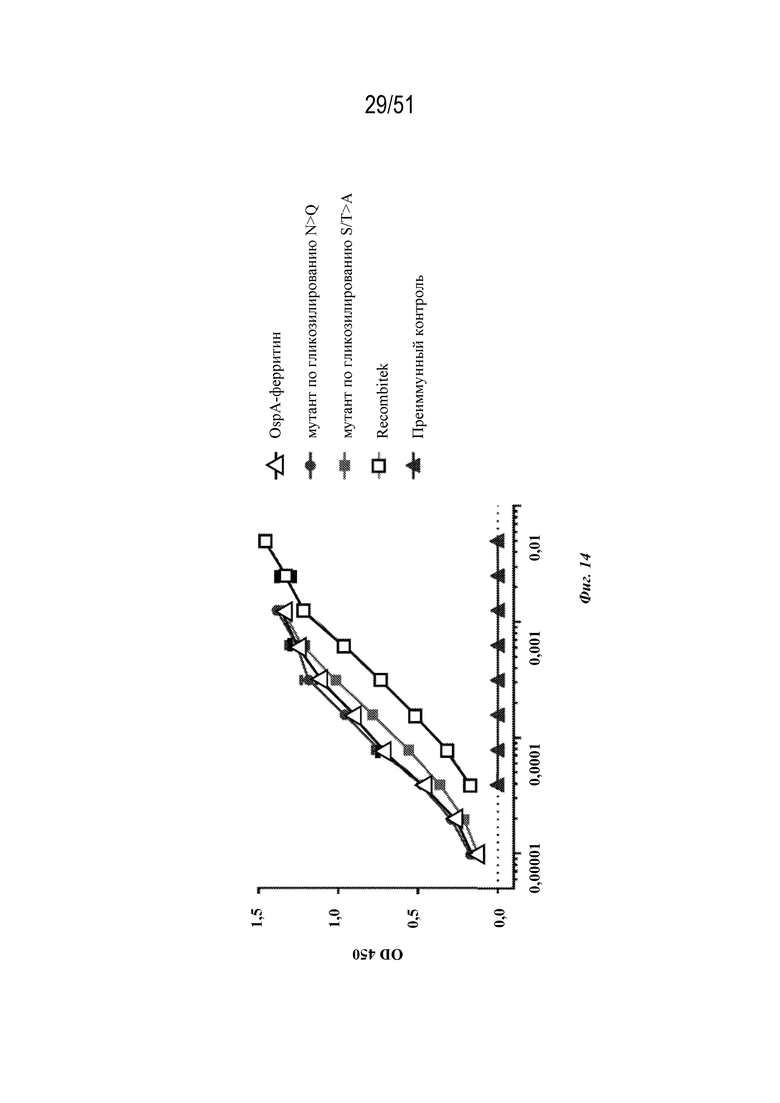
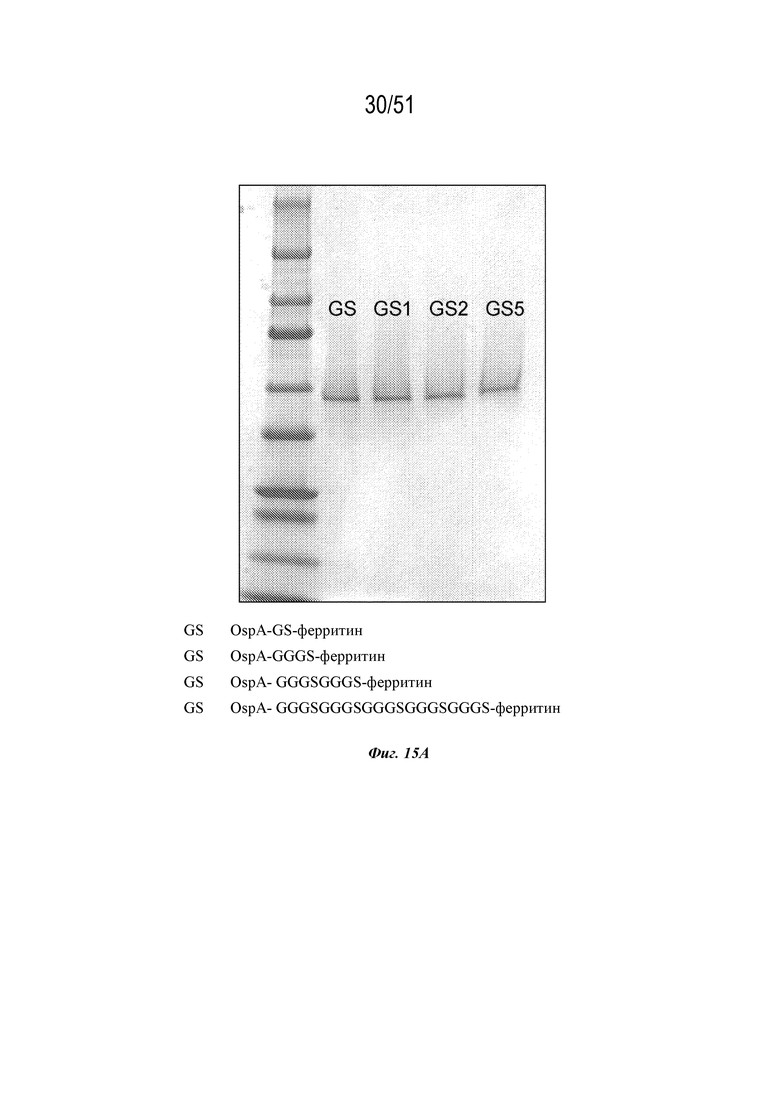
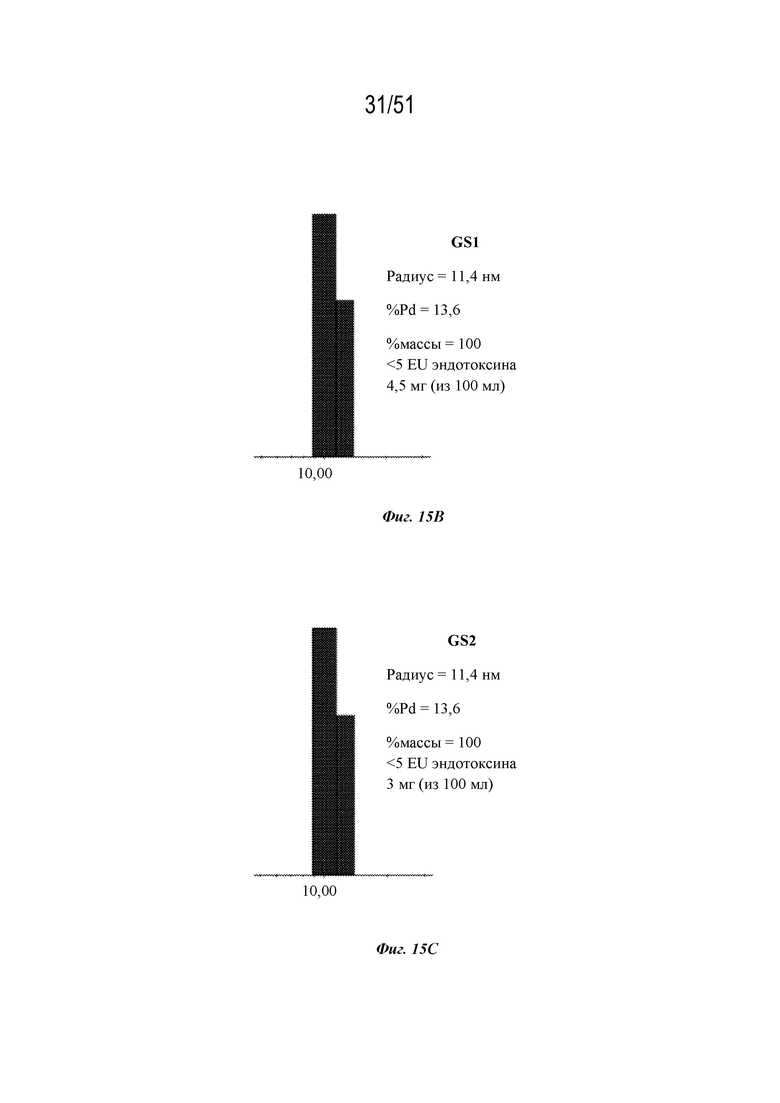

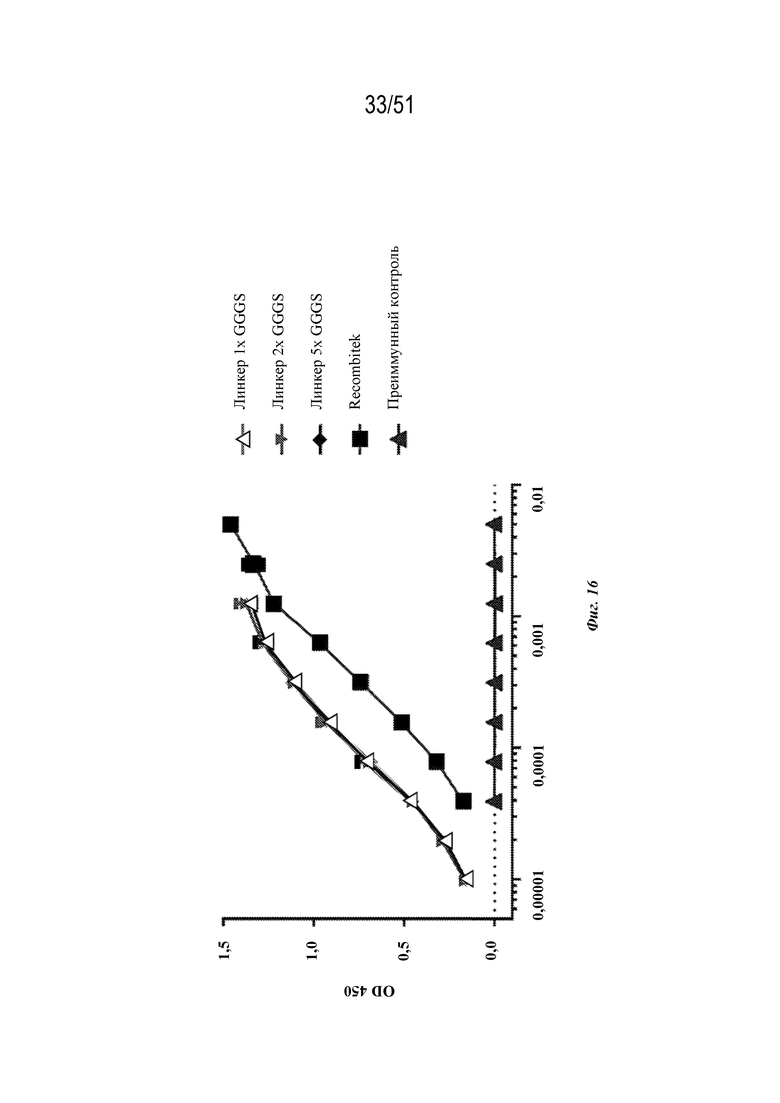
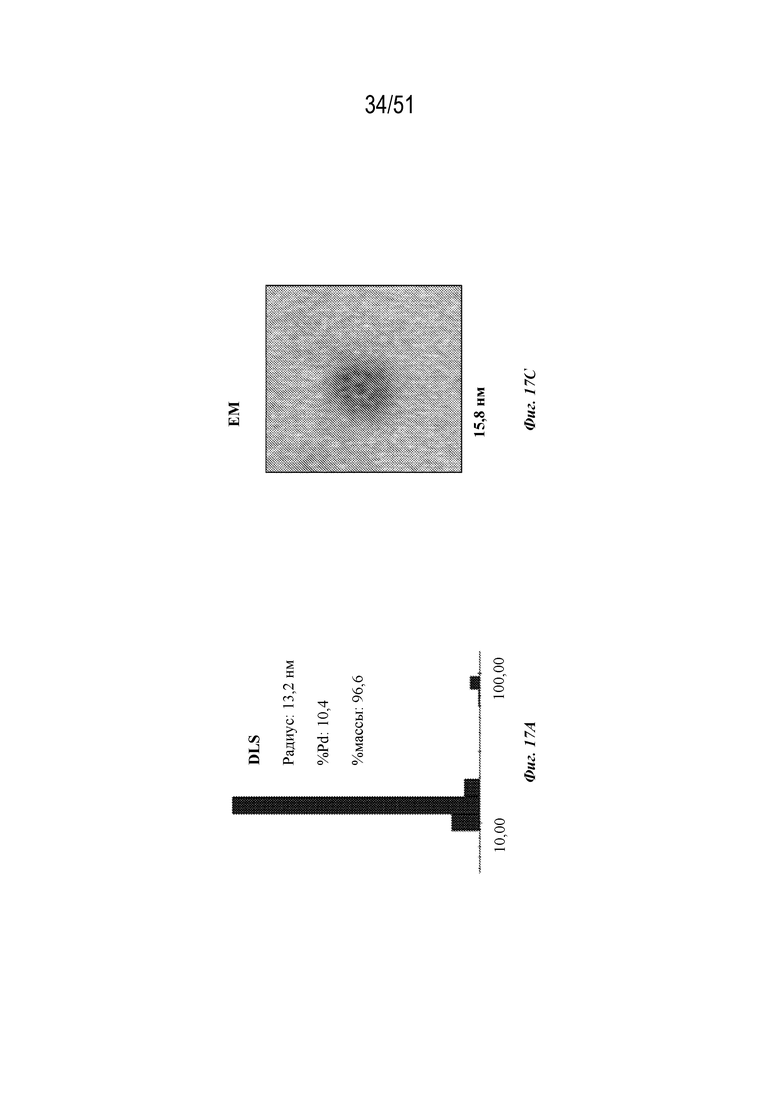
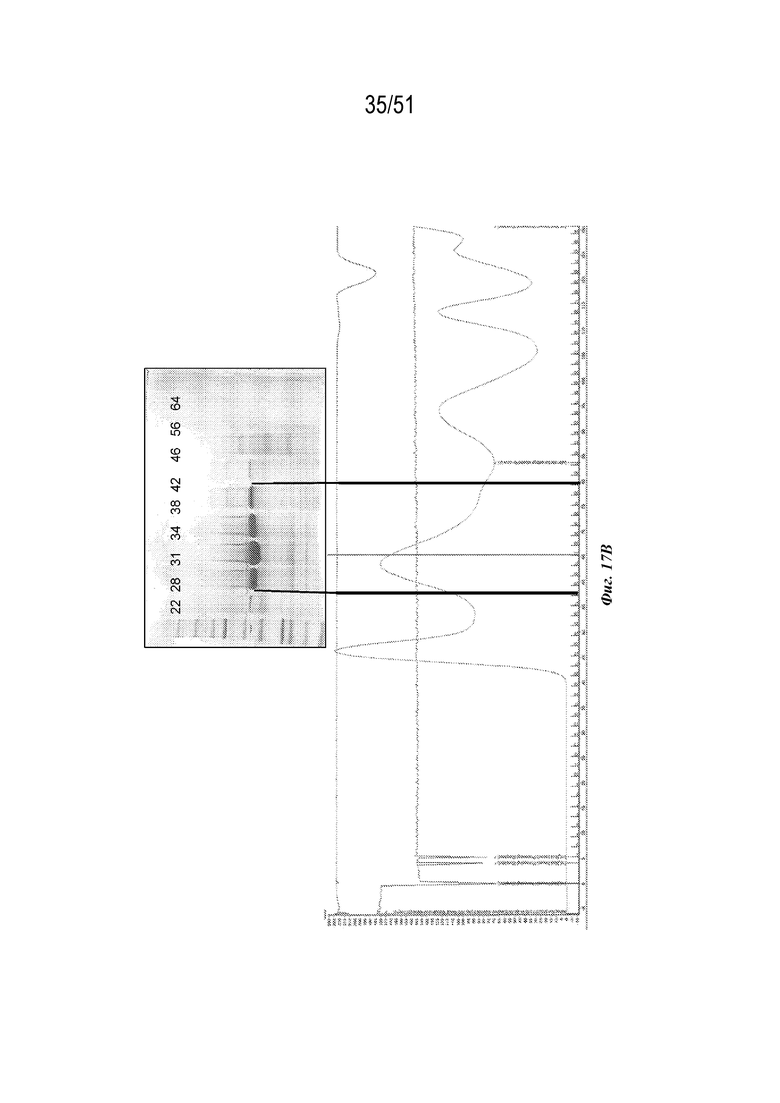
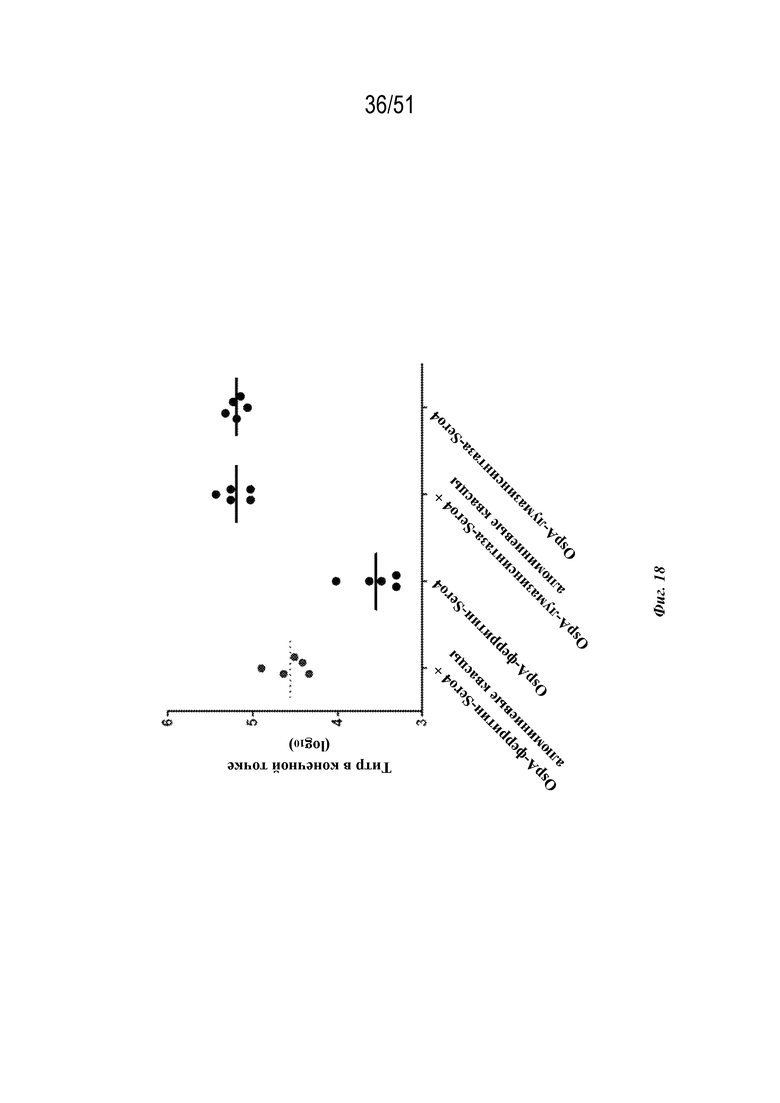
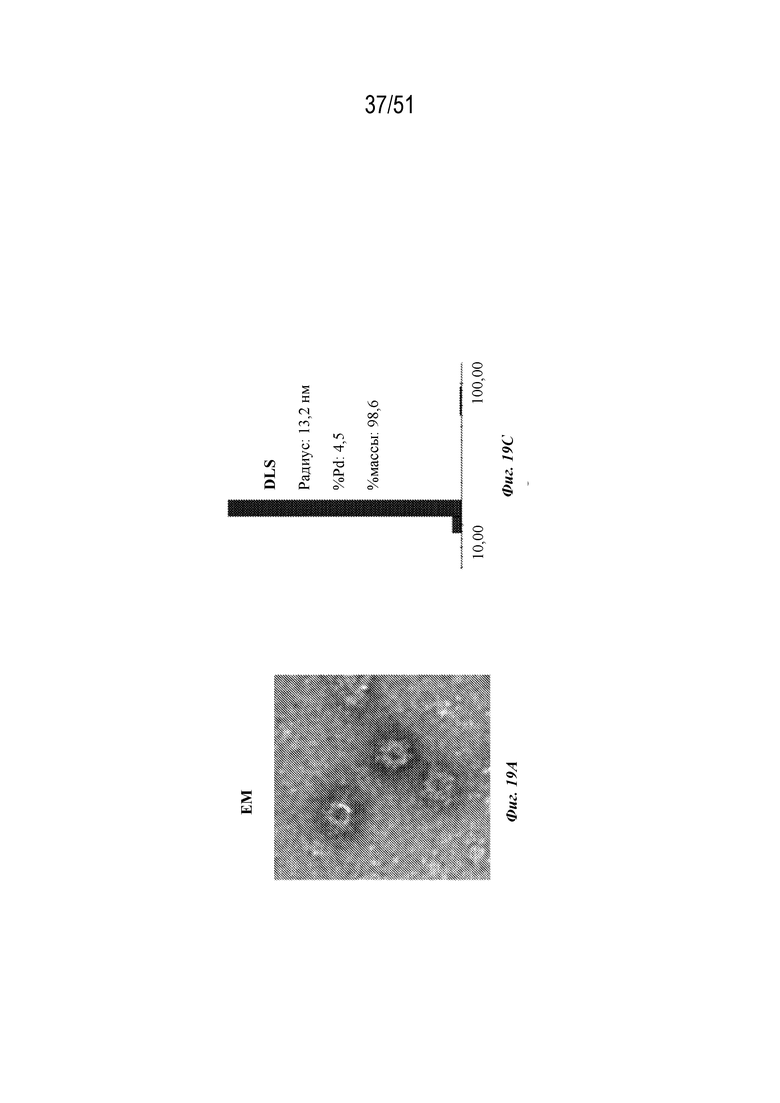
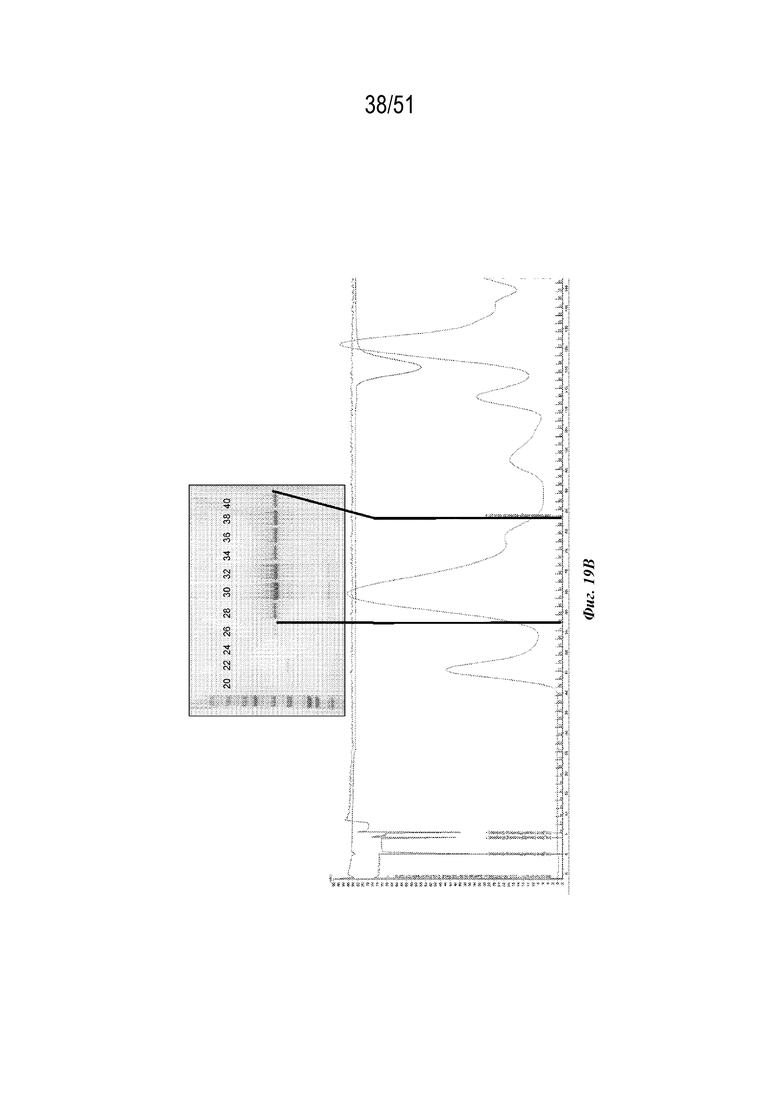
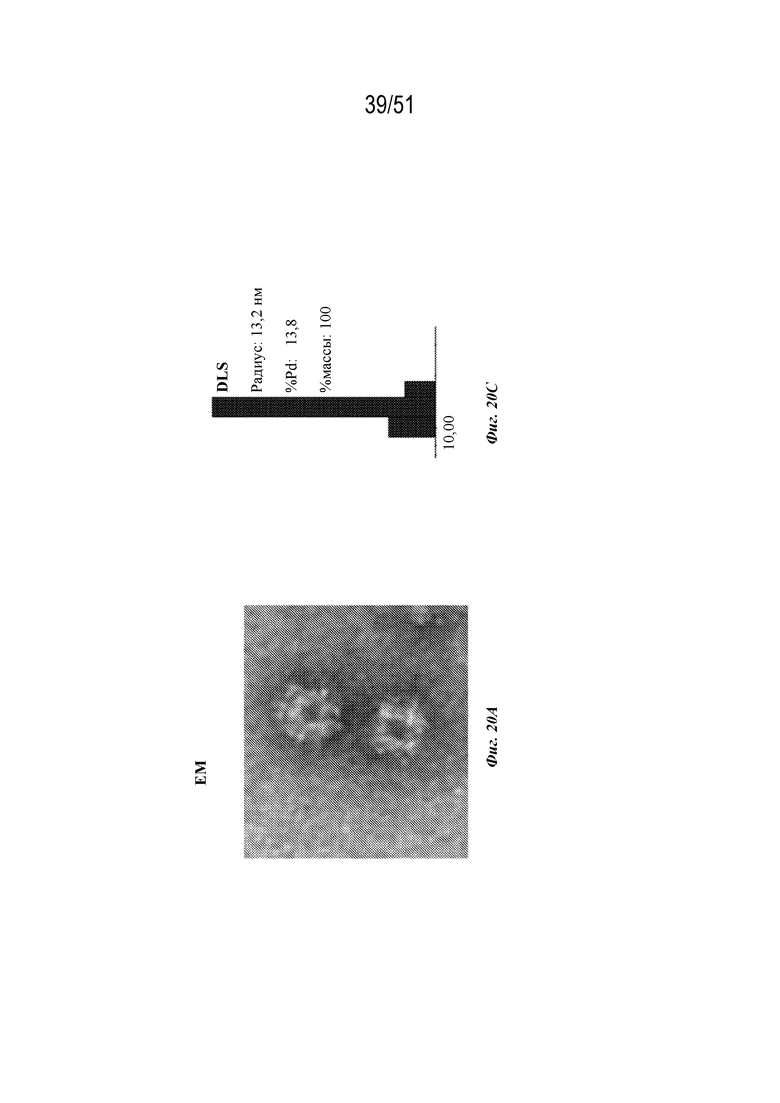
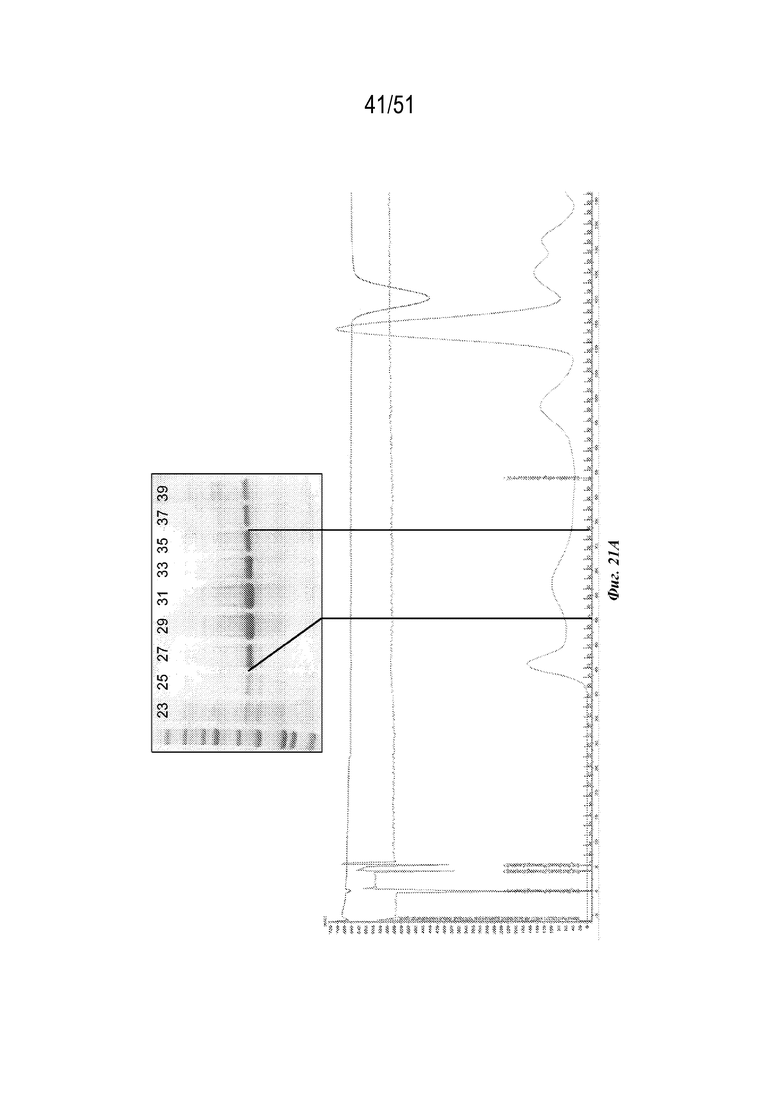
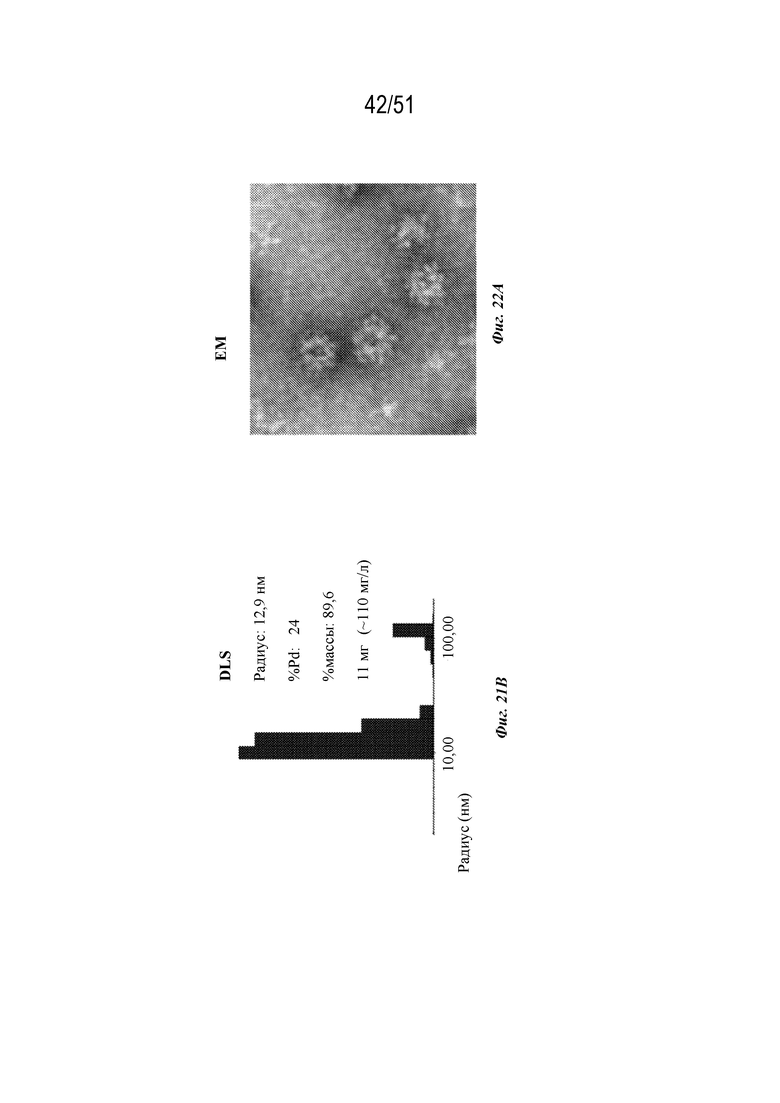
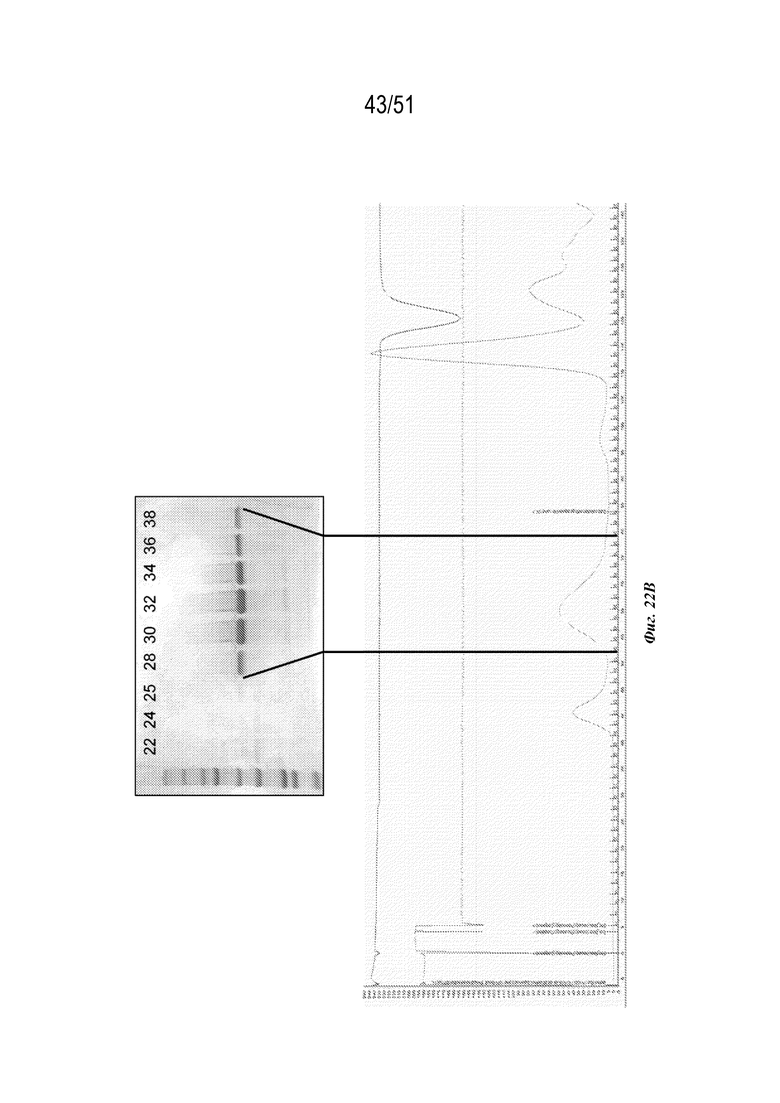
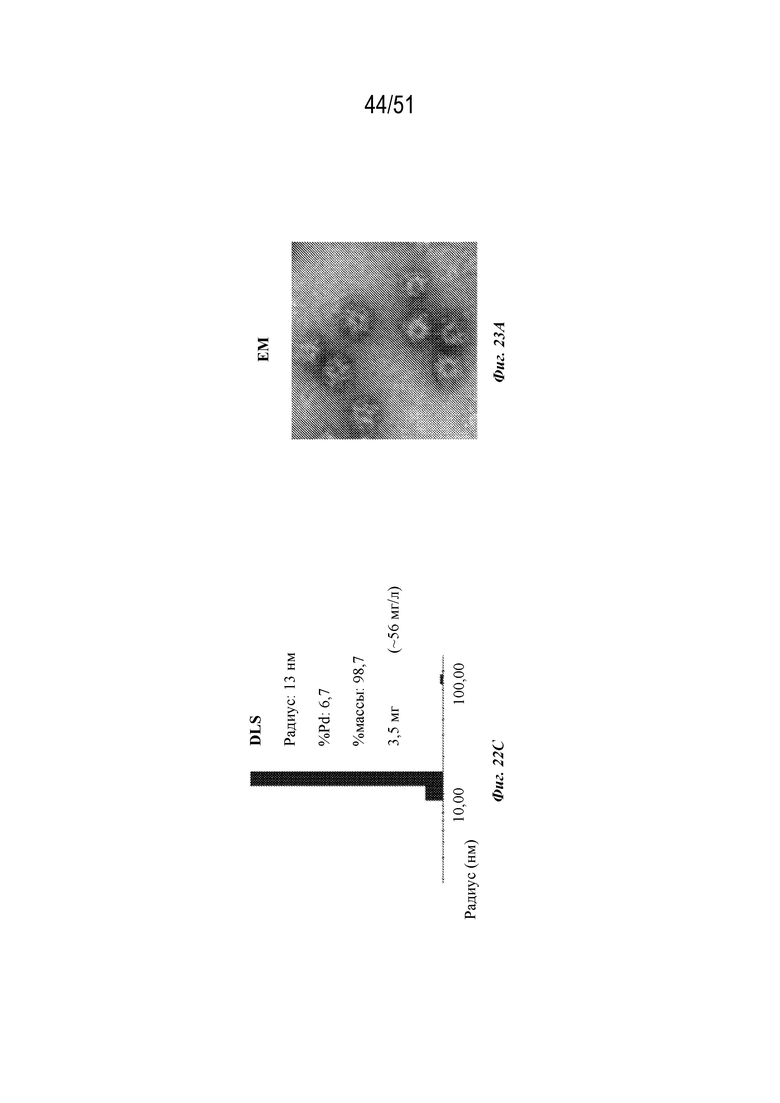
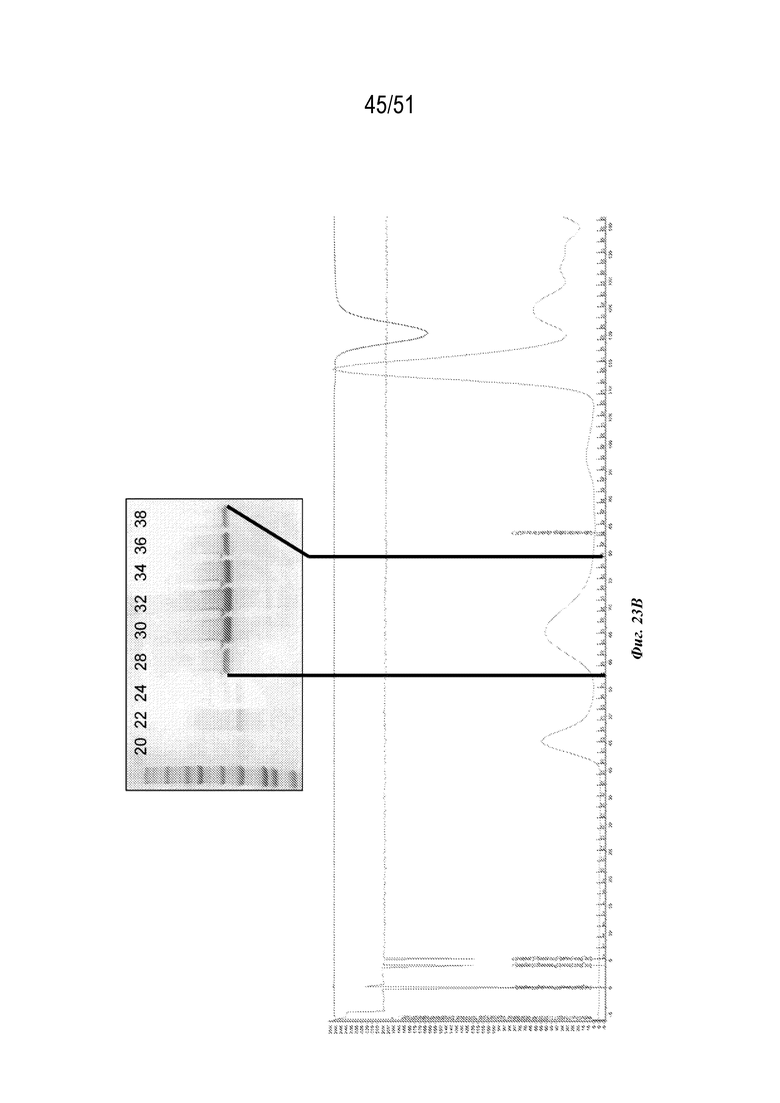
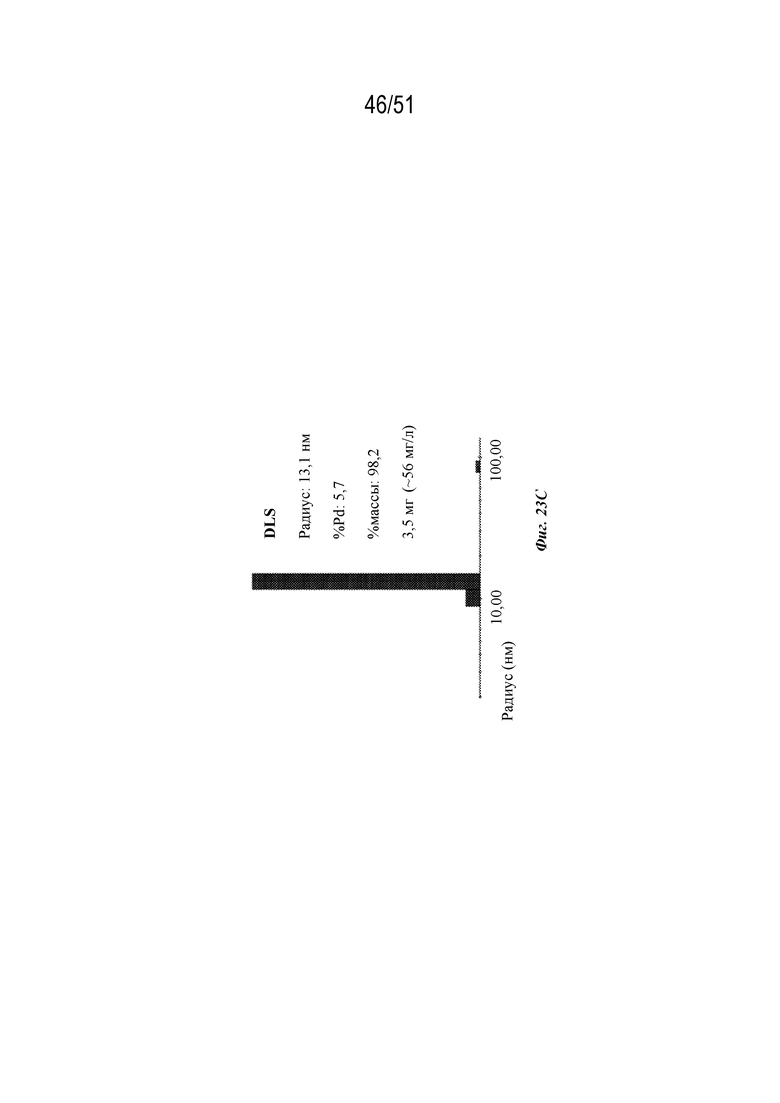

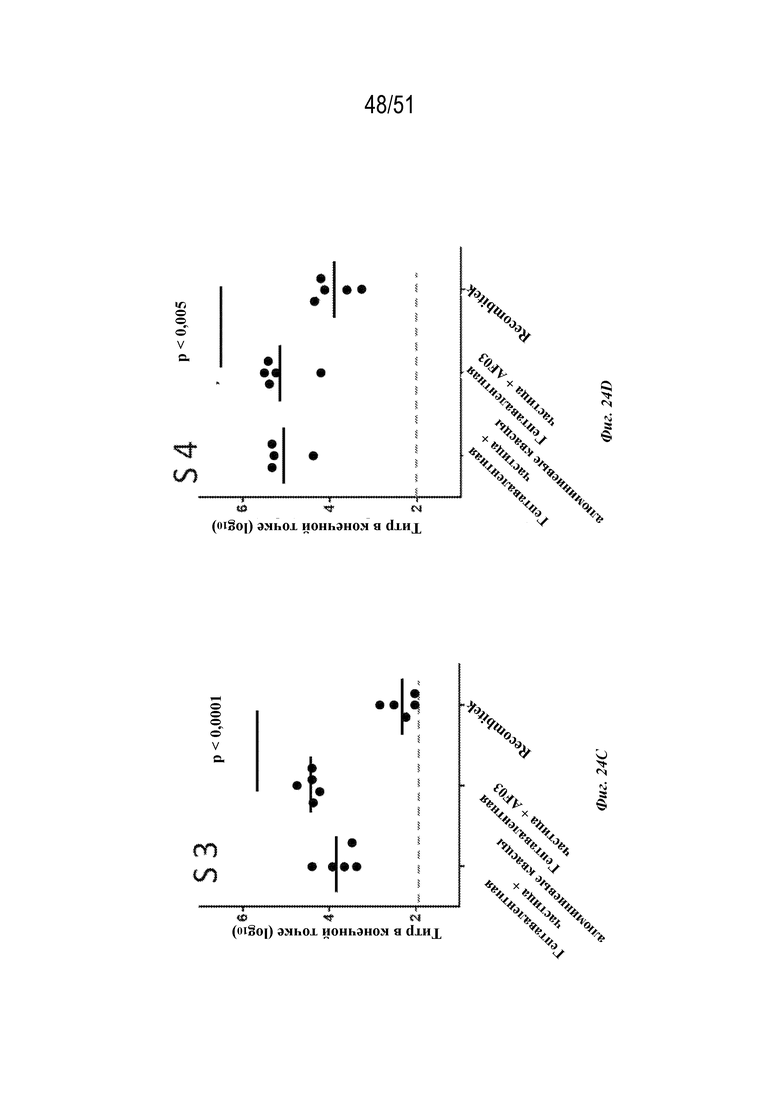
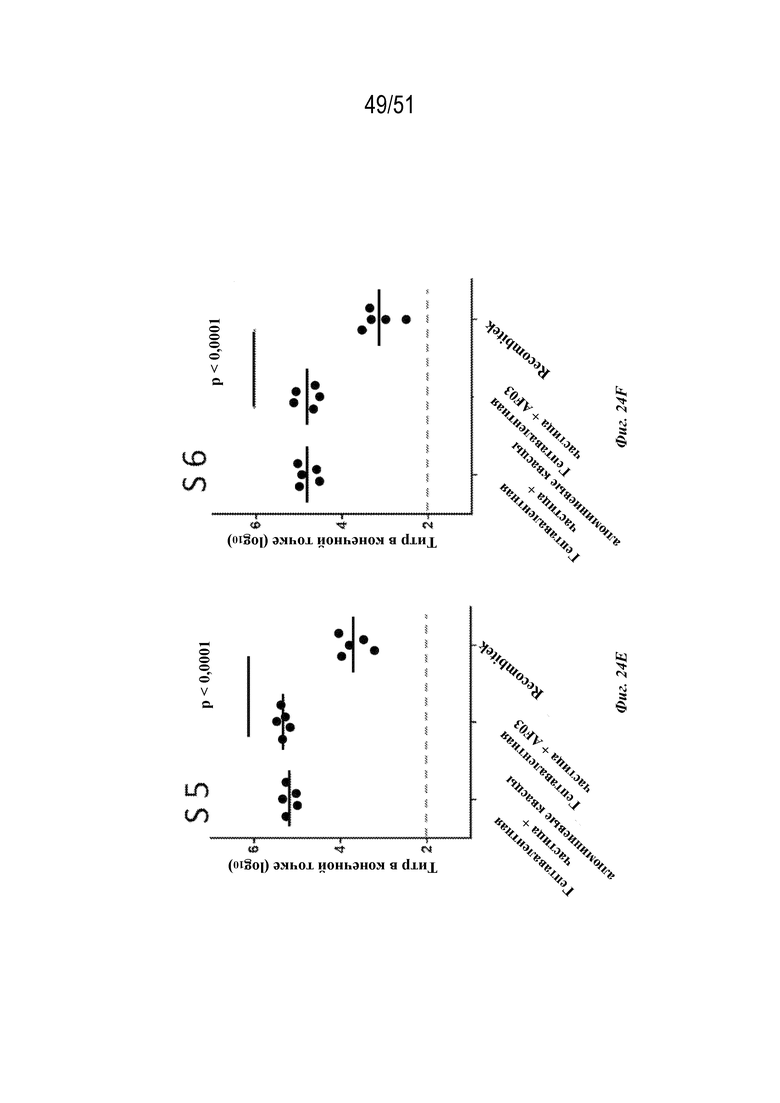

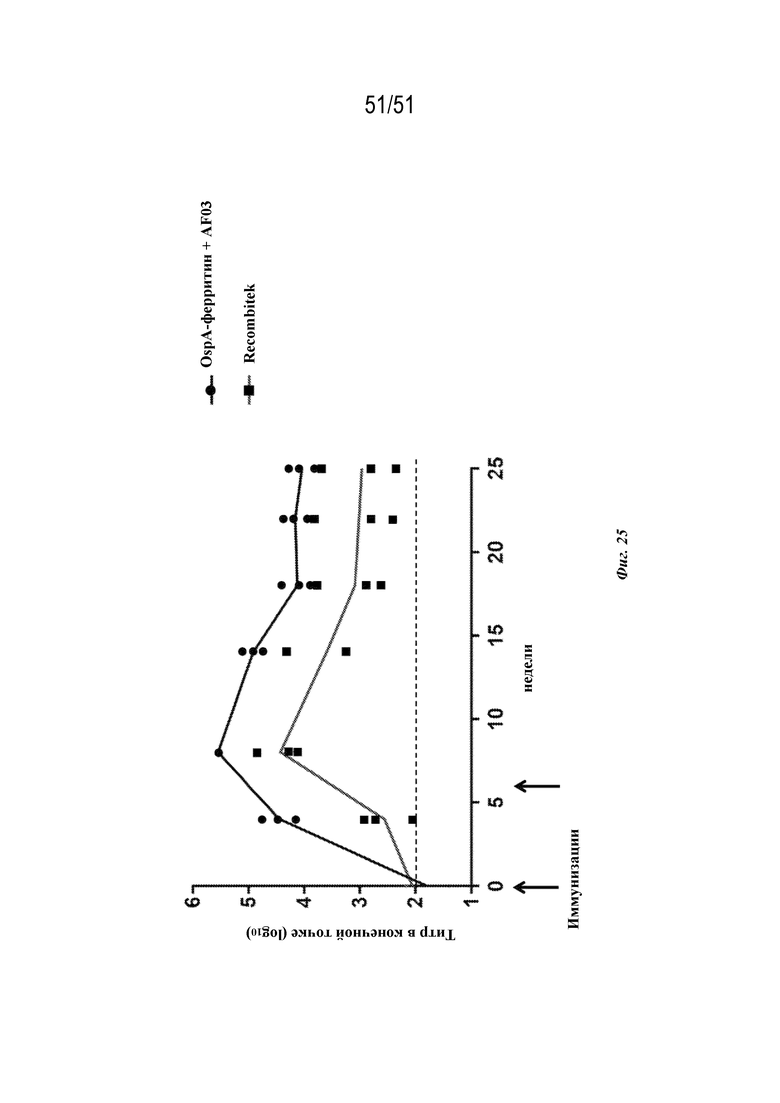
Группа изобретений относится к вакцинологии. Предложены антигенные полипептиды на основе последовательности OspA и белка ферритина и их применение для индукции иммунного ответа в отношении Borrelia или защиты субъекта от болезни Лайма. Также предложены нуклеиновая кислота, кодирующая антигенный полипептид, ферритиновая частица, композиция и способ для индукции иммунного ответа в отношении Borrelia или защиты субъекта от болезни Лайма. Изобретения обеспечивают самоадъювантные антигенные полипептиды для защиты от инфекции Borrelia с пониженным риском стимуляции аутоиммунной реакции, позволяют уменьшить общую дозу, необходимую для обеспечения защиты. 7 н. и 12 з.п. ф-лы, 25 ил., 3 табл., 7 пр.
1. Антигенный полипептид на основе последовательности OspA для индукции иммунного ответа в отношении Borrelia или защиты субъекта от болезни Лайма, содержащий полипептид OspA из Borrelia, где полипептид OspA из Borrelia не содержит последовательность SEQ ID NO: 77 и содержит последовательность, имеющую по меньшей мере 95% идентичности с последовательностью полипептида OspA согласно любой из SEQ ID NO: 1-10, 22-76, 83-89, в которой отсутствует трансмембранный домен или часть трансмембранного домена, или 94-102, и дополнительно содержит белок ферритин, содержащий последовательность, имеющую по меньшей мере 95% идентичности с SEQ ID NO: 90.
2. Антигенный полипептид на основе последовательности OspA по п. 1, где ферритин содержит мутацию с заменой экспонированной на поверхности аминокислоты на цистеин.
3. Антигенный полипептид на основе последовательности OspA для индукции иммунного ответа в отношении Borrelia или защиты субъекта от болезни Лайма, содержащий полипептид OspA из Borrelia и ферритин, где ферритин содержит последовательность, имеющую по меньшей мере 95% идентичности с SEQ ID NO: 90, и мутацию с заменой экспонированной на поверхности аминокислоты на цистеин, и полипептид OspA из Borrelia содержит последовательность, имеющую по меньшей мере 95% идентичности с последовательностью полипептида OspA согласно любой из SEQ ID NO: 1-10, 22-76, 83-89, в которой отсутствует трансмембранный домен или часть трансмембранного домена, или 94-102.
4. Антигенный полипептид на основе последовательности OspA по любому из пп. 1-3, где ферритин содержит одну или более из мутаций E11C, S25C, S71C, A74C, K78C, S99C и S110C, соответствующих последовательности SEQ ID NO: 209 ферритина из H. pylori, как определено посредством попарного или структурного выравнивания.
5. Антигенный полипептид на основе последовательности OspA по любому из пп. 1-4, содержащий один или более иммуностимулирующих фрагментов, связанных с ферритином посредством экспонированной на поверхности аминокислоты.
6. Антигенный полипептид на основе последовательности OspA по любому из пп. 1-5, где ферритин содержит мутацию с заменой экспонированного на поверхности аспарагина на отличную от аспарагина аминокислоту, где необязательно экспонированный на поверхности аспарагин находится в положении, соответствующем положению 18 последовательности SEQ ID NO: 209 ферритина из H. pylori, как определено посредством попарного или структурного выравнивания.
7. Антигенный полипептид на основе последовательности OspA по любому из пп. 1-6, где ферритин содержит мутацию с заменой внутреннего цистеина на отличную от цистеина аминокислоту, где необязательно внутренний цистеин находится в положении, соответствующем положению 30 последовательности SEQ ID NO: 209 ферритина из H. pylori, как определено посредством попарного или структурного выравнивания.
8. Ферритиновая частица для индукции иммунного ответа в отношении Borrelia или защиты субъекта от болезни Лайма, содержащая антигенный полипептид на основе последовательности OspA по любому из пп. 1-7, причем ферритиновая частица всего содержит 24 субъединицы ферритина.
9. Антигенный полипептид на основе последовательности OspA по любому из пп. 1-7, где полипептид OspA относится к одному из серотипов 1, 2, 3, 4, 5, 6 или 7.
10. Композиция для индукции иммунного ответа в отношении Borrelia или защиты субъекта от болезни Лайма, содержащая антигенный полипептид на основе последовательности OspA или ферритиновую частицу по любому из пп. 1-9, дополнительно содержащая фармацевтически приемлемый носитель.
11. Композиция по п. 10, дополнительно содержащая адъювант, где необязательно адъювант представляет собой AF03.
12. Композиция по п. 10 или 11, которая содержит первый и второй антигенный полипептид на основе последовательности OspA, где первый и второй антигенные полипептиды на основе последовательности OspA содержат полипептиды OspA различных серотипов.
13. Композиция по п. 12, содержащая один, два, три, четыре, пять, шесть или семь антигенных полипептидов на основе последовательности OspA, выбранных из антигенного полипептида на основе последовательности OspA, содержащего полипептид OspA серотипа 1; антигенного полипептида на основе последовательности OspA, содержащего полипептид OspA серотипа 2; антигенного полипептида на основе последовательности OspA, содержащего полипептид OspA серотипа 3; антигенного полипептида на основе последовательности OspA, содержащего полипептид OspA серотипа 4; антигенного полипептида на основе последовательности OspA, содержащего полипептид OspA серотипа 5; антигенного полипептида на основе последовательности OspA, содержащего полипептид OspA серотипа 6; и антигенного полипептида на основе последовательности OspA, содержащего полипептид OspA серотипа 7.
14. Композиция по п. 13, содержащая антигенный полипептид на основе последовательности OspA, содержащий полипептид OspA серотипа 1; антигенный полипептид на основе последовательности OspA, содержащий полипептид OspA серотипа 2; антигенный полипептид на основе последовательности OspA, содержащий полипептид OspA серотипа 3; антигенный полипептид на основе последовательности OspA, содержащий полипептид OspA серотипа 4; антигенный полипептид на основе последовательности OspA, содержащий полипептид OspA серотипа 5; и антигенный полипептид на основе последовательности OspA, содержащий полипептид OspA серотипа 7.
15. Антигенный полипептид на основе последовательности OspA, ферритиновая частица или композиция по любому из пп. 1-14 для применения в способе индукции иммунного ответа в отношении Borrelia или для защиты субъекта от болезни Лайма.
16. Способ индукции иммунного ответа в отношении Borrelia или защиты субъекта от болезни Лайма, включающий введение субъекту любого одного или более из антигенного полипептида на основе последовательности OspA, ферритиновой частицы или композиции по любому из пп. 1-14.
17. Антигенный полипептид на основе последовательности OspA, ферритиновая частица или композиция по любому из пп. 1-14 или способ по п. 16, где субъект является человеком.
18. Нуклеиновая кислота, кодирующая антигенный полипептид на основе последовательности OspA по любому из пп. 1-7 или 9.
19. Нуклеиновая кислота по п. 18, где нуклеиновая кислота представляет собой мРНК.
| WO 2015169271 A1, 12.11.2015 | |||
| KANEKIYO M | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Складная пожарная (штурмовая) лестница | 1923 |
|
SU499A1 |
| KANEKIYO M | |||
| et al | |||
| Rational Design of an Epstein-Barr Virus Vaccine Targeting the Receptor-Binding Site, CELL, 2015, v.162, no.5, p | |||
Авторы
Даты
2024-03-27—Публикация
2019-04-02—Подача