Настоящее изобретение относится к способу диагностики миелоидного новообразования, включающему определение присутствия мутантного аллеля гена кальретикулина. Также предметом настоящего изобретения являются геномные последовательности, последовательности кДНК, последовательности мРНК и белковые последовательности мутантного кальретикулина. Кроме того, изобретение относится к медицинским применениям ингибиторов мутантного кальретикулина.
Первичный миелофиброз (ПМФ), эссенциальная тромбоцитемия (ЭТ) и истинная полицитемия (ИП) представляют собой клональные гематологические расстройства, которые относятся к классическим BCR-ABL-негативным миелопролиферативным новообразованиям (МПН) (Campbell & Green, 2006). С момента открытия в 2005 г. соматической мутации в гене киназы JAK2 был достигнут огромный прогресс в области молекулярной диагностики, клинического ведения, лечения и молекулярного понимания МПН. Мутация с заменой валина на фенилаланин (V617F) конститутивно активирует киназу Jak2, приводя к повышенному фосфорилированию ее субстратов (Stat5, STAT3, Erk и т.д.) и приводя к повышенной реактивности цитокинов миелоидных клеток (Baxter et al., 2005; James et al., 2005; Kralovics et al., 2005; Levine et al., 2005). Вскоре последовало обнаружение дополнительных мутаций, таких как в экзоне 12 гена JAK2 при ИП (Scott ЭТ al., 2007) и в гене MPL рецептора тромбопоэтина при ПМФ и ЭТ (Pardanani ЭТ al., 2006; Pikman ЭТ al., 2006). Хотя эти три заболевания, относящиеся к MPN, различаются по своей клинической картине, они разделяют многие молекулярные, а также клинические признаки. Мутация JAK2-V617F имеется примерно в 95% случаев ИП, 60% ПМФ и 50% случаев ЭТ соответственно. Мутации в экзоне 12 гена JAK2 специфичны примерно для 3% случаев ИП, в то время как мутации MPL сводятся к ПМФ (5%) и ЭТ (3%). Во всех трех группах МПН имеется предрасположенность с различной степенью к тромбозам, кровотечению и лейкозному перерождению (Sverdlow et al., 2008). Несмотря на то, что пациенты могут оставаться в хронической фазе МПН в течение нескольких лет, прогрессирование заболевания происходит в форме вторичного миелофиброза при ИП и ЭТ, развитии ускоренной фазы с различной степенью панцитопении с последующим лейкозным перерождением, имеющим место во всех трех группах МПН (Sverdlow et al., 2008).
Соматические мутации накапливаются в течение всей клональной эволюции гемопоэтических стволовых клеток при МПН. Эти приобретенные генетические изменения могут представлять точечные мутации, хромосомные повреждения и эпигенетические дефекты, и все они могут вносить свой вклад в адекватность развивающегося клона (Klampfl et al., 2011; Kralovics, 2008). Эти мутации могут ускорить пролиферацию посредством различных механизмов, снизить потенциал дифференцировки предшественников или сделать их менее восприимчивыми к апоптозу. Мутации, влияющие на эти механизмы, были описаны в генах, таких как TЕТ2 (Delhommeau et al., 2009), EZH2 (Ernst et al., 2010), DNMT3A (Stegelmann et al., 2011), ASXL1 (Stein et al., 2011) и TP53 (Harutyunyan et al., 2011) при различных типах миелоидных новообразований, включая МПН (Milosevic & Kralovics, 2013). Однако до сих пор только мутации JAK2 и MPL рассматриваются как сильно ассоциированные с МПН, и они представляют собой самые полезные молекулярные маркеры МПН.
Несмотря на достигнутый прогресс в понимании молекулярного патогенеза МПН примерно у половины пациентов с ПМФ и ЭТ отсутствует молекулярный маркер для диагностики, поскольку эти пациенты являются негативными для обеих мутаций JAK2 и MPL.
Таким образом, технической проблемой, лежащей в основе настоящего изобретения, является обеспечение средств и способов диагностики миелоидного новообразования.
Следовательно, настоящее изобретение относится к способу оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный один или более мутантных аллелей гена кальретикулина.
Техническая проблема решается обеспечением вариантов осуществления, охарактеризованных в формуле изобретения.
Настоящее изобретение решает вышеуказанную техническую проблему, поскольку, как описано здесь ниже и в прилагаемых примерах, было с удивлением обнаружено, что у пациентов, страдающих миелоидным новообразованием, предпочтительно первичным миелофиброзом (ПМФ) и эссенциальной тромбоцитемией (ЭТ), имеются соматические мутации в гене кальретикулина (CALR). Еще одним неожиданным открытием было то, что эти соматические мутации в гене CALR, специфические для миелоидных клеток, у пациентов с МПН сильно ассоциированы с теми пациентами, которые являются негативными на обе мутации JAK2 и MPL (которые ранее описывались, как болезнетворные мутации при МПН). Как здесь показано, мутации CALR встречаются в 88% случаев ПМФ, и в 68% случаев ЭТ это двойные отрицательные на JAK2 и MPL. Таким образом, настоящее изобретение обеспечивает надежную диагностику миелоидных новообразований. Изобретение особенно пригодно для пациентов, для которых не существует надежных маркеров, таких как пациенты, которые являются отрицательными на мутации JAK2 и MPL.
Кроме того, было установлено, что представленные здесь соматические мутации в гене кальретикулина (CALR) приводят к образованию С-конца белка кальретикулина, который имеет совершенно другие характеристики по сравнению с белком кальретикулином дикого типа. Полагается, что эти другие характеристики вызывают или вносят свой вклад в развитие миелоидного новообразования, предпочтительно первичного миелофиброза (ПМФ) и эссенциальной тромбоцитемии (ЭТ).
Все мутации CALR, идентифицированные здесь, находятся в последнем экзоне 9, кодирующем С-концевые аминокислоты белка и преимущественно представляют мутации по типу инсерции/делеции. Большинство мутаций находилось в гетерозиготном состоянии, и они вызывали сдвиг рамки считывания на альтернативную рамку считывания (альтернативная рамка считывания 1, как показано на фигуре 3А). Этот сдвиг рамки считывания приводит к замене С-концевых отрицательно заряженных аминокислот (богатого аспарагиновой и глутаминовой кислотами) кальретикулина преимущественно положительно заряженным полипептидом, богатым аргинином и метионином. Кроме того, последние 4 аминокислоты кальретикулина (KDEL (SEQ ID NO: 1331)) содержат сигнал удерживания в эндоплазматическом ретикулуме. Этот сигнал отсутствует в мутантном кальретикулине, что позволяет предположить, что мутантный белок менее представлен в ЭР по сравнению с белком дикого типа. Поскольку отрицательно заряженный С-конец кальретикулина представляет Са2+-связывающий домен с низкой аффинностью и высокой емкостью, то предполагается, что Са2+-связывающая функция мутантного белка отсутствует. В данном документе было показано, что преобладающие мутации CALR представляют мутации типа 1 и типа 2, как здесь определено; смотри фиг. 3E. Следовательно, эти мутанты и их применение по настоящему изобретению являются более предпочтительным. Последовательности нуклеиновых кислот, кодирующих С-конец, и аминокислотная последовательность С-конца при мутациях CALR типа 1 и типа 2, показаны в SEQ ID NO:5-12. В настоящем документе раскрыты дополнительные мутации нуклеиновых кислот CALR типа 1 и типа 2.
Настоящее изобретение относится к следующим пунктам:
1. Способ оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный один или более мутантных аллелей гена кальретикулина.
2. Способ по п. 1,
где указанный один или более мутантных аллелей содержит нуклеиновую кислоту, кодирующую мутантный белок кальретикулин.
3. Способ по п. 2, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO:1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
4. Способ по пп. 2 или 3, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
5. Способ по любому из пп. 2-4, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
6. Способ по любому из пп. 2-5, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
7. Способ по любому из пп. 1-6, где указанный один или более мутантных аллелей гена кальретикулина находится в области, охватывающей экзон 9 гена кальретикулина.
8. Способ по любому из пп. 1-7, где указанный мутантный аллель содержит мутацию сдвига рамки считывания в гене кальретикулина дикого типа.
9. Способ по п. 8, где указанная мутация сдвига рамки считывания находится в экзоне 9 гена кальретикулина.
10. Способ по пп. 8 или 9, где указанная мутация сдвига рамки считывания представляет делецию одного нуклеотида или добавление двух нуклеотидов.
11. Способ по любому из пп. 8 или 9, где (1+(3×n0)) нуклеотидов делецировано из гена кальретикулина.
12. Способ по любому из пп. 8, 9 и 11, где 1, 4, 19, 22, 31, 34, 46, 52 нуклеотида делецированы.
13. Способ по любому из пп. 8, 9, 11 и 12,
где 1 нуклеотид делецирован и где 6 нуклеотидов инсерцированы;
где 2 нуклеотида делецированы и где 4 нуклеотида инсерцированы;
где 3 нуклеотида делецированы и где 5 нуклеотидов инсерцированы;
где 12 нуклеотидов делецированы и где 5 нуклеотидов инсерцированы;
где 18 нуклеотидов делецированы и где 11 нуклеотидов инсерцированы;
где 18 нуклеотидов делецированы и где 14 нуклеотидов инсерцированы;
где 20 нуклеотидов делецированы и где 1 нуклеотид инсерцирован;
где 28 нуклеотидов делецированы и где 6 нуклеотидов инсерцированы;
где 35 нуклеотидов делецированы и где 1 нуклеотид инсерцирован; или
где 36 нуклеотидов делецированы и где 2 нуклеотида инсерцированы.
14. Способ по пп. 8 или 9, где (2+(3×n0)) нуклеотидов инсерцированы в ген кальретикулина.
15. Способ по п. 14, где 5 нуклеотидов инсерцированы.
16. Способ по любому из пп. 1-15, где указанный ген кальретикулина содержит последовательность, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 290;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 289;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
17. Способ по любому из пп. 10-16, где указанный нуклеотид(ы) делецирован из и/или инсерцирован в экзоне 9 гена кальретикулина.
18. Способ по любому из пп. 9-17, где указанный экзон 9 гена кальретикулина содержит последовательность, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 436;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 435;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
19. Способ по любому из пп. 1-18, где указанный мутантный аллель содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288; 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137, 141, 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281, 285, 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
20. Способ по любому из пп. 1-19, где указанный мутантный аллель представляет ДНК, предпочтительно геномную ДНК.
21. Способ по п. 20, где присутствие указанной ДНК определяется секвенированием.
22. Способ оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный генный продукт.
23. Способ по п. 22,
где указанный один или более мутантных аллелей содержит нуклеиновую кислоту, кодирующую мутантный белок кальретикулин.
24. Способ по п. 23, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
25. Способ по пп. 23 или 24, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
26. Способ по любому из пп. 23-25, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислоты, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
27. Способ по любому из пп. 23-26, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
28. Способ по любому из пп. 22-27, где указанный аллель содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288; 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137, 141, 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281, 285, 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
29. Способ по любому из пп. 22-28, где указанный генный продукт содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO:4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO:3;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
30. Способ по любому из пп. 22-29, где указанный генный продукт содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3, 7, 11, 15, 19, 23, 27, 31, 35, 39, 43, 47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 91, 95, 99, 103, 107, 111, 115, 119, 123, 127, 131, 135, 139 или 143;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
31. Способ по любому из пп. 22-30, где указанный генный продукт содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 ил 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 293, 297, 301, 305, 309, 313, 317, 321, 325, 329, 333, 337, 341, 345, 349, 353, 357, 361, 365, 369, 373, 377, 381, 385, 389, 393, 397, 401, 405, 409, 413, 417, 421, 425, 429 или 433;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
32. Способ по любому из пп. 22-31, где указанный генный продукт содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 147, 151, 155, 159, 163, 167, 171, 175, 179, 183, 187, 191, 195, 199, 203, 207, 211, 215, 219, 223, 227, 231, 235, 239, 243, 247, 251, 255, 259, 263, 267, 271, 275, 279, 283 или 287;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
33. Способ по любому из пп. 22-28, где указанный генный продукт содержит полипептид, выбранный из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
34. Способ по любому из пп. 22-28 и 33, где указанный генный продукт содержит полипептид, выбранный из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
35. Способ по любому из пп. 22-28, 33 и 34, где указанный генный продукт содержит полипептид, выбранный из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
36. Способ по любому из пп. 22-28 и 33-35, где указанный генный продукт содержит полипептид, выбранный из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
37. Способ по любому из пп. 22-36, где указанный генный продукт представляет мРНК.
38. Способ по п. 37, где присутствие или количество указанной мРНК определяется ПЦР в режиме реального времени, ПЦР с обратной транскрипцией, полногеномным транскриптомным шот-ган секвенированием (секвенированием РНК), гибридизацией in situ или технологией микрочипов.
39. Способ по п. 38, где определение ПЦР в режиме реального времени и ПЦР с обратной транскрипцией дополнительно включает стадии:
(i) контактирование нуклеиновой кислоты в образце с одним или двумя олигонуклеотидами:
(ii) получение продукта амплификации, содержащего последовательность-мишень.
40. Способ по любому из пп. 22-28 и 33-36, где указанный генный продукт является белком.
41. Способ по п. 40, где присутствие или количество указанного белка определяется иммуногистохимией (IHC), иммуноанализом, методами на основе гель-электрофореза или блоттинга, IHC, масс-спектрометрией, проточной цитометрией или FACS.
42. Способ по любому из пп. 1-41, где указанный пациент является пациентом-человеком.
43. Способ по любому из пп. 1-42, где указанный образец представляет образец костного мозга.
44. Способ по любому из пп. 1-42, где указанный образец представляет образец крови.
45. Способ по пп. 43 или 44, где указанный образец костного мозга получают с помощью биопсии.
46. Способ по любому из пп. 1-45, дополнительно включающий введение ингибитора мутантного кальретикулина пациенту.
47. Нуклеиновая кислота, выбранная из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 2;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
48. Нуклеиновая кислота по п. 47, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 2, 6, 10, 14, 18, 22, 26, 30, 34, 38, 42, 46, 50, 54, 58, 62, 66, 70, 74, 78, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 122, 126, 130, 134, 138 или 142;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
49. Нуклеиновая кислота по пп. 47 или 48, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 292, 296, 300, 304, 308, 312, 316, 320, 324, 328, 332, 336, 340, 344, 348, 352, 356, 360, 364, 368, 372, 376, 380, 384, 388, 392, 396, 400, 404, 408, 412, 416, 420, 424, 428 или 432;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
50. Нуклеиновая кислота по пп. 47-49, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226, 230, 234, 238, 242, 246, 250, 254, 258, 262, 266, 270, 274, 278, 282 или 286;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
51. Нуклеиновая кислота по любому из пп. 47-50, где указанная нуклеиновая кислота является кДНК.
52. Нуклеиновая кислота, выбранная из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
53. Нуклеиновая кислота по п. 52, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3, 7, 11, 15, 19, 23, 27, 31, 35, 39, 43, 47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 91, 95, 99, 103, 107, 111, 115, 119, 123, 127, 131, 135, 139 или 143;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
54. Нуклеиновая кислота по пп. 52 или 53, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 293, 297, 301, 305, 309, 313, 317, 321, 325, 329, 333, 337, 341, 345, 349, 353, 357, 361, 365, 369, 373, 377, 381, 385, 389, 393, 397, 401, 405, 409, 413, 417, 421, 425, 429 или 433;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
55. Нуклеиновая кислота по пп. 52 или 54, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 147, 151, 155, 159, 163, 167, 171, 175, 179, 183, 187, 191, 195, 199, 203, 207, 211, 215, 219, 223, 227, 231, 235, 239, 243, 247, 251, 255, 259, 263, 267, 271, 275, 279, 283 или 287;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
56. Нуклеиновая кислота по любому из пп. 52-55, где указанная нуклеиновая кислота является мРНК.
57. Нуклеиновая кислота, выбранная из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
58. Нуклеиновая кислота по п. 57, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137 или 141;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
59. Нуклеиновая кислота по пп. 57 или 58, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
60. Нуклеиновая кислота по пп. 57 или 59, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281 или 285;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
61. Нуклеиновая кислота по любому из пп. 57-60, где указанная нуклеиновая кислота является геномной ДНК.
62. Белок, выбранный из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующуюся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
63. Белок по п. 62, где указанный белок выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
64. Белок по пп. 62 или 63, где указанный белок выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
65. Белок по любому из пп. 62-64, где указанный белок выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
66. Вакцина, содержащая белок по пп. 62 или 63.
67. Антитело, специфически связывающееся с белком по любому из пп. 62-65.
68. siРНК, специфически направленная на нуклеиновую кислоту по любому из пп. 52-56.
69. siРНК по п. 68, где указанная siРНК состоит из молекулы нуклеиновой кислоты, содержащей, по меньшей мере, десять смежных оснований.
70. siРНК по пп. 68 или 69, где до 10% смежных оснований являются некомплементарными.
71. siРНК по любому из пп. 68-70, где указанная siРНК дополнительно содержит, по меньшей мере, одно основание на 5’-конце и/или, по меньшей мере, одно основание на 3’-конце.
72. Ингибитор мутантного кальретикулина для применения в лечении миелоидного новообразования.
73. Способ лечения пациента с миелоидным новообразованием, включающий введение эффективного количества ингибитора мутантного кальретикулина пациенту.
74. Ингибитор по п. 72 или способ по пп. 46 или 73, где указанный мутантный кальретикулин представляет мутантный белок кальретикулин по любому из пп. 62-65.
75. Ингибитор по пп. 72 или 74 или способ по любому из пп. 56, 73 или 74, где указанный ингибитор представляет антитело.
76. Ингибитор по пп. 72 или 74 или способ по любому из пп. 56, 73 или 74, где указанный ингибитор выбран из группы, состоящей из внеклеточных партнеров по связыванию, небольших связывающих молекул, аптамеров и интрамеров.
77. Ингибитор по п. 72 или способ по пп. 46 или 73, где указанный мутантный кальретикулин представляет нуклеиновую кислоту по любому из пп. 52-56.
78. Ингибитор по пп. 72 или 77 или способ по любому из пп. 46, 73 и 77, где указанный ингибитор выбран из группы, состоящей из siРНК, miРНК, dsРНК, shРНК, stРНК и антисмысловых молекул.
79. Ингибитор по любому из пп. 72 и 74-78 или способ по любому из пп. 1-46 и 73-78, где указанное миелоидное новообразование является миелопролиферативным новообразованием.
80. Ингибитор по п. 79 или способ по п. 79, где указанное миелоидное новообразование является первичным миелофиброзом (ПМФ).
81. Ингибитор по п. 79 или способ по п. 79, где указанное миелоидное новообразование является эссенциальной тромбоцитемией (ЭТ).
82. Ингибитор по любому из пп. 72 и 74-78 или способ по любому из пп. 1-46 и 73-78, где указанное миелоидное новообразование является миелодиспластическим синдромом.
83. Ингибитор по п. 82 или способ по п. 82, где указанное миелоидное новообразование является рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T).
84. Ингибитор по любому из пп. 72 и 74-83 или способ по любому из пп. 73-83, где пациент, подвергающийся лечению, оценивается как страдающий миелоидным новообразованием или предрасположенный страдать миелоидным новообразованием по любому из пунктов из пп. 1-46.
85. Белок по пп. 62 или 63, антитело по п. 67, siРНК по любому из пп. 68-71 или ингибитор мутантного кальретикулина по любому из пп. 72-78 для применения в качестве лекарственного средства.
86. Вектор, содержащий нуклеиновую кислоту по любому из пп. 47-51 и 57-61.
87. Клетка-хозяин, содержащая нуклеиновую кислоту по любому из пп. 47-51 и 57-61, или вектор по п. 86.
88. Способ получения полипептида по пп. 62-65, где указанный способ включает культивирование клеток-хозяев по п. 87 в условиях, обеспечивающих экспрессию полипептида и выделение полученного полипептида из культуры.
Обнаружение представленных здесь мутаций CALR на уровне геномной ДНК, РНК, кДНК и белка является пригодным для диагностики миелоидного новообразования, например, имеется ли у пациента миелоидное новообразование, какой тип миелоидного новообразования и также определение специфических признаков заболевания.
Как здесь используется, термин «диагностика» относится, среди прочего, к определению природы заболевания или идентификации физиологической или патофизиологической причины, лежащей в основе симптома. Таким образом, «диагностика миелоидного новообразования» относится к определению: (а) имеется ли у пациента миелоидное новообразование и/или (b) какой тип(ы) миелоидного новообразования и/или (с) особенностей конкретного миелоидного новообразования. Диагностика может быть осуществлена, например, на основе изучения симптомов и/или проведения дополнительных анализов (например, цитогенетических или молекулярных анализов).
Выражения «оценка того, страдает ли пациент миелоидным новообразованием» и «диагностировать миелоидное новообразование» можно использовать здесь взаимозаменяемо. Диагностика также может включать или относиться к оценке того, насколько пациент предрасположен страдать миелоидным новообразованием, т.е. имеет ли пациент риск развития миелоидного новообразования.
Настоящее изобретение относится к способу оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный один или более мутантных аллелей гена кальретикулина.
Способы, обеспеченные здесь, могут включать стадию получения образца от пациента. «Получение» включает прием образца, который предоставляется третьей стороной. Так, например, кровь или костный мозг можно получить от пациента, поместить в соответствующий контейнер и затем предоставить для анализа.
Настоящее изобретение относится к способу оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- получение образца от пациента;
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный один или более мутантных аллелей гена кальретикулина.
Согласно настоящему изобретению пациент оценивается как «положительный» в отношении наличия миелоидного новообразования, если один или более мутантных аллелей гена кальретикулина присутствуют в образце, предпочтительно в образце крови от указанного пациента.
Как здесь используется, термин «миелоидное новообразование» относится к клоновым гематологическим заболеваниям, поражающим миелоидный росток крови, включая заболевания с хроническим и острым клиническим течением. Миелоидные новообразования включают миелопролиферативные новообразования, миелодиспластические синдромы и острые миелоидные лейкозы. Предпочтительно, здесь миелоидное новообразование представляет миелопролиферативное новообразование, в частности, первичный миелофиброз (ПМФ) или эссенциальную тромбоцитемию (ЭТ) или миелодиспластический синдром, в частности, рефрактерную анемию с кольцевыми сидеробластами и тромбоцитемией (RARS-T).
Таким образом, диагностика миелоидного новообразования может представлять дальнейшую диагностику подтипов заболевания. В других вариантах осуществления в диагностике используются дополнительные тесты в комбинации, например, биохимический анализ крови, цитология и генетический анализ. В зависимости от природы миелопролиферативного новообразования дополнительные диагностические анализы могут включать определение эритроцитарной массы (при полицитемии), аспирацию костного мозга и трепанобиопсию, определение уровня насыщения кислородом артериальной крови и уровня карбоксигемоглобина, уровня щелочной фосфатазы в нейтрофилах, витамин B12 (или способность к связыванию B12) и концентрацию уратов в сыворотке крови. Генетические тесты доказали свое все более возрастающее важное значение в диагностике.
Следующие анализы традиционно проводятся для диагностики следующих заболеваний. Смотри, например, Vardiman, et al. (2009). «The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes». Blood, 114 (5):937-51.
Хронический миелоидный лейкоз (CML)
При определении транслокации t(9, 22), филадельфийской хромосомы, BCR-ABL транслокации, которая имеет три точки разрыва:
• u-BCR-ABL (P230): приводит к CML с обычной нейтрофилией и базофилией;
• минорная BCR-ABL (P190): приводит к развитию CML, который имеет тенденцию перейти в острый лимфобластный лейкоз (ALL), как правило, предшественник B ALL и редко предшественник T ALL;
• мажорная BCR-ABL (P210): нормальная обычная точка разрыва.
Эссенциальная тромбоцитемия (ЭТ)
ЭТ связана с мутацией JAK2V617F не более чем в 55% случаев и с мутацией MPL (рецептор тромбопоэтина) не более чем в 5% случаев:
• клеточная фаза - повышенное количество крупных мегакариоцитов с фиброзом и небольшим увеличением других элементов костного мозга;
• фиброзная фаза - коллагеновый фиброз с отсутствием элементов костного мозга.
Эти нарушения все еще пересматриваются в соответствии с более специфическими генетическими мутациями, и как часто имеет место летальный исход пациентов на стадии фиброза костного мозга.
Истинная полицитемия (ИП)
ИП чаще всего ассоциируется с мутацией JAK2V617F в более чем 95% случаев, в то время как в остальных случаях имеется мутация в экзоне 12 гена JAK2:
• клеточная фаза - повышенное количество мегакариоцитов, которые сгруппированы в «кучки», утолщение коллагеновой ткани, позднее фиброз, выявляемый трехцветной окраской, и увеличение количества миелоидных и эритроидных предшественников;
• фиброзная фаза - коллагеновый фиброз с отсутствием элементов костного мозга.
Первичный миелофиброз (ПМФ)
ПМФ ассоциирован с мутацией JAK2V617F не более чем в 50% случаев, мутациями в экзоне 12 гена JAK2 в 1-2% случаев и мутацией MPL (рецептор тромбопоэтина) не более чем в 5% случаев:
• клеточная фаза - повышенное количество мегакариоцитов, которые сгруппированы в «кучки», утолщение коллагеновой ткани, позднее фиброз, выявляемый трехцветной окраской, и увеличение количества миелоидных предшественников;
• фиброзная фаза - коллагеновый фиброз с отсутствием элементов костного мозга.
Рефрактерная анемия с кольцевыми сидеробластами, связанная с выраженным тромбоцитозом (RARS-T), часто рассматривается в качестве миелоидного новообразования. Диагностика RARS-T традиционно может включать гематологию и цитологию, анализ костного мозга и отсутствие аномалий кариотипа, таких как del (5q), t(3; 3) (q21; q26) или inv(3) (q21; q26). Смотри публикацию Broseus et al. «Clinical features and course of refractory anemia with ring sideroblast associated with marked thrombocytosis», Haematologica, 9(7):1036-1041 (2012).
Не смотря на то, что тип миелоидного новообразования определяет диагностику и лечение, отдельные новообразования могут иметь специфические мутации, которые в дальнейшем определяют прогноз и курс лечения. Генетические маркеры являются особенно пригодными, поскольку часто они освещают лежащий в основе заболевания патогенез.
Определение присутствия одного (или более) мутантных аллелей гена кальретикулина или его генного продукта, как здесь описано, можно провести в качестве отдельного анализа. Альтернативно этот анализ может следовать или предшествовать анализу других маркеров для миелоидных новообразований, таких как мутации генов JAK2 и MPL. Например, пациенты с подозрением на то, что они страдают миелоидным новообразованием, таким как миелопролиферативное новообразование (и в частности, первичный миелофиброз (ПМФ) или эссенциальная тромбоцитемия (ЭТ)), могут быть тестированы, в первую очередь, в отношении мутации JAK2 (в частности, мутации V617F). Если они дают отрицательный результат на мутацию JAK2, то они могут быть тестированы на мутантный кальретикулин. Если затем они дают отрицательный результат в отношении мутантного кальретикулина, то можно провести анализ в отношении мутаций MPL, например, мутаций в экзоне 10 гена MPL. Конечно, могут быть определены дополнительные маркеры. Кроме того, здесь предусматриваются другие последовательности или схемы тестирования мутаций JAK2, мутантного кальретикулина и/или мутаций MPL и, необязательно, дополнительные маркеры. Например, после положительного теста на мутацию JAK2 может следовать тест на мутантный кальретикулин (и, наоборот) для дальнейшей диагностики или прогностической оценки миелоидного новообразования. Также предусматривается одновременное определение таких маркеров, как и одновременный анализ на мутацию(и) JAK2 и мутантный кальретикулин (и, необязательно, дополнительные маркеры) или одновременный анализ на мутацию(и) JAK2, мутантный кальретикулин и мутацию(и) MPL (и, необязательно, дополнительные маркеры). Предпочтительно, чтобы пациенты (или образцы от пациентов), страдающие миелоидным новообразованием или предрасположенные страдать миелоидным новообразованием, были отрицательными для обеих мутаций JAK2 и MPL, то есть мутации JAK2 и MPL отсутствуют у пациентов, которых оценивают в качестве страдающих миелоидным новообразованием или предрасположенных страдать миелоидным новообразованием по настоящему изобретению. Другими словами, пациенты (или образец от пациентов), которых оценивают в качестве страдающих миелоидным новообразованием или предрасположенных страдать миелоидным новообразованием по настоящему изобретению, предпочтительно имеют JAK2 и MPL дикого типа. Для дальнейшей диагностики предусматривается использование дополнительных маркеров/анализов. Например, можно использовать обычный анализ костного мозга. Такие дополнительные маркеры/анализ, такой как анализ костного мозга, могут быть использованы для подтверждения, например, положительного теста на мутантный кальретикулин или может следовать, например, отрицательный тест на мутантный кальретикулин.
Известны последовательности нуклеиновых кислот и аминокислотные последовательности JAK2 и MPL дикого типа, и они могут быть получены из соответствующих баз данных, таких как NCBI. Примеры последовательностей нуклеиновых кислот и аминокислотных последовательностей JAK2 дикого типа показаны в NM_004972.3 (кДНК JAK2) и NP_004963.1 (белок JAK2) соответственно. Примеры последовательностей нуклеиновых кислот и аминокислотных последовательностей MPL дикого типа показаны в NM_005373.2 (кДНК MPL) и NP_005364.1 (белок MPL).
Мутации JAK2 и MPL в миелоидных новообразованиях были описаны здесь выше. Такие мутации, например, V617F-мутация в JAK2 (мутация с заменой валина на фенилаланин в положении 617 в аминокислотной последовательности JAK2), мутации в экзоне 12 последовательности нуклеиновой кислоты, кодирующей JAK2 и/или мутации в экзоне 10 MPL.
Мутация с заменой валина на фенилаланин (V617F) раскрыта в публикациях Baxter et al., 2005; James et al., 2005; Kralovics et al., 2005; Levine et al., 2005). Мутации в экзоне 12 JAK2 при ИП и в гене рецептора тромбопоэтина MPL при ПМФ и ЭТ были раскрыты соответственно в публикации Scott et al., 2007 и Pardanani et al., 2006; Pikman et al., 2006. Все эти ссылки включены во всей их полноте в настоящее описание в качестве ссылки.
Присутствие мутаций JAK2 и MPL может быть исключено с использованием аллель-специфической ПЦР для JAK2-V617F (ссылка) и с помощью секвенирования по Сэнгеру экзона 12 JAK2 и экзона 10 MPL. Примерный протокол, который может быть использован в данном контексте, раскрыт Kralovics R., Teo S.S., Li S., Theocharides A., Buser A.S., Tichelli A., Skoda R.C. Приобретение мутации V617F из JAK2 является поздним генетическим событием в подгруппе пациентов с миелопролиферативными расстройствами. Blood. 2006, Aug 15;108(4):1377-80. Epub 2006 May 4, эта публикация включена в настоящее описание в качестве ссылки.
Следовательно, настоящее изобретение относится к новой группе пациентов с миелоидным новообразованием, которая оценивается как положительная на мутантный кальретикулин и отрицательная на мутантный JAK2 и мутантный MPL (или, другими словами, новая группа пациентов с миелоидным новообразованием оценивается как положительная на мутантный кальретикулин и положительная на JAK2 дикого типа и MPL дикого типа).
В предпочтительном варианте осуществления способы по настоящему изобретению включают:
- стадию определения присутствия белка JAK2 дикого типа или нуклеиновой кислоты JAK2 дикого типа в образце от пациента; и/или
- стадию определения присутствия белка MPL дикого типа или нуклеиновой кислоты MPL дикого типа в образце от пациента.
В особенно предпочтительном варианте осуществления способы по настоящему изобретению включают:
- стадию определения присутствия белка JAK2 дикого типа или нуклеиновой кислоты JAK2 дикого типа в образце от пациента; и
- стадию определения присутствия белка MPL дикого типа или нуклеиновой кислоты MPL дикого типа в образце от пациента.
Описанные выше стадии определения присутствия белка JAK2 дикого типа или нуклеиновой кислоты JAK2 дикого типа в образце от пациента и/или определения присутствия белка MPL дикого типа или нуклеиновой кислоты MPL дикого типа в образце от пациента, могут быть проведены до или после стадии определения присутствия одного или нескольких мутантных аллелей гена кальретикулина в образце от указанного пациента, как здесь представлено и определено.
Настоящее изобретение относится к способу оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента;
- определение присутствия белка JAK2 дикого типа или нуклеиновой кислоты JAK2 дикого типа в образце от пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный один или более мутантных аллелей гена кальретикулина.
Настоящее изобретение относится к способу оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента;
- определение присутствия белка MPL дикого типа или нуклеиновой кислоты MPL дикого типа в образце от пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный один или более мутантных аллелей гена кальретикулина.
Настоящее изобретение относится к способу оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента;
- определение присутствия белка JAK2 дикого типа или нуклеиновой кислоты JAK2 дикого типа в образце от пациента;
- определение присутствия белка MPL дикого типа или нуклеиновой кислоты MPL дикого типа в образце от пациента;
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный один или более мутантных аллелей гена кальретикулина.
Предпочтительно способ по изобретению относится исключительно к оценке того, страдает ли пациент миелоидным новообразованием.
Настоящее изобретение относится к способу оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный один или более мутантных аллелей гена кальретикулина.
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный один или более мутантных аллелей гена кальретикулина.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный один или более мутантных аллелей гена кальретикулина.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией, когда присутствует указанный один или более мутантных аллелей гена кальретикулина.
Способ, обеспеченный здесь, включает определение присутствия предпочтительно только одного мутантного аллеля гена кальретикулина в образце от пациента. Предпочтительно способ представляет способ в условиях in vitro. Представленные и раскрытые здесь мутации гена кальретикулина представляют соматические мутации. Эти мутации могут находиться в гомозиготном состоянии или гетерозиготном состоянии, предпочтительно в гетерозиготном состоянии.
Один или более мутантных аллелей гена кальретикулина может включать нуклеиновую кислоту, кодирующую мутантный белок кальретикулина. Мутантные белки кальретикулины, раскрытые и представленные здесь, характеризуются общей C-концевой аминокислотной последовательностью. Как следует, например, из таблицы 2 в примере, С-концы мутантных белков кальретикулинов имеют общую минимальную последовательность. Указанная общая минимальная последовательность представляет аминокислотную последовательность, показанную в SEQ ID NO: 4 и кодируется молекулами нуклеиновой кислоты, имеющими последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3.
Следовательно, мутантный белок кальретикулин, используемый по настоящему изобретению, выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
В одном варианте осуществления мутантный белок кальретикулин, используемый по настоящему изобретению, представляет:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3; или
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4.
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин представляет:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3; или
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин представляет:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин представляет:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3; или
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4.
Мутантные белки кальретикулины, обеспеченные и используемые здесь, имеют характерные С-концы, которые показаны в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 и 144. Данные С-концы включают аминокислотную последовательность, показанную в SEQ ID NO: 4.
Мутантный белок кальретикулин согласно вышеописанному может быть выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
В одном варианте осуществления мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144.
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144.
В данном документе было идентифицированы 36 типов мутантного белка кальретикулина (смотри таблицу 2, в которой показаны С-концы полноразмерных мутантных белков кальретикулинов). Данные мутантные белки объединены на основе их общего характерного С-конца, показанного в SEQ ID NO: 4. Полноразмерные последовательности мутантных белков кальретикулинов показаны в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, и 288.
Следовательно, мутантный белок кальретикулин, обеспеченный и используемый здесь, выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
В одном варианте осуществления мутантный белок кальретикулин, обеспеченный и используемый здесь, может быть выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288.
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288.
В данном документе было показано, что указанные мутации имеют место в экзоне 9 гена кальретикулина. Следовательно, последующее относится к мутациям в гене кальретикулина дикого типа и в его экзоне 9.
Ген кальретикулина дикого типа хорошо известен. Его последовательность нуклеиновой кислоты и аминокислотную последовательность можно получить из базы данных, такой как NCBI, под инвентарным номером NG_029662.1 (ген) и NP_004334.1 (белок).
Приведенная в качестве примера последовательность нуклеиновой кислоты гена кальретикулина дикого типа показана в SEQ ID NO: 289. Соответствующая аминокислотная последовательность показана в SEQ ID NO: 290.
Таким образом, ген кальретикулина дикого типа может содержать последовательность, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 290;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 289;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Один или более мутантных аллелей гена кальретикулина может находиться в области, охватывающей экзон 9 вышеописанного гена кальретикулина. Последовательность нуклеиновой кислоты экзона 9 гена кальретикулина дикого типа показана в SEQ ID NO: 435. Соответствующая аминокислотная последовательность дикого типа показана в SEQ ID NO: 436.
Согласно вышеприведенному экзон 9 гена кальретикулина дикого типа может содержать последовательность, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 436;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 435;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Как показано в настоящем документе (смотри, например, таблицу 2), обеспеченные здесь мутантные аллели генов кальретикулина содержат мутацию сдвига рамки считывания в гене кальретикулина дикого типа. Мутация сдвига рамки считывания может находиться в экзоне 9 гена кальретикулина дикого типа. За счет мутации сдвига рамки считывания, открытая рамка считывания гена кальретикулина дикого типа больше не используется, а используется альтернативная рамка считывания 1, которая приводит к возникновению характерного С-конца мутантных белков кальретикулинов (общая минимальная аминокислотная последовательность мутантных белков показана в SEQ ID NO: 4).
Мутация сдвига рамки считывания может быть вызвана делецией одного или более нуклеотидов, инсерцией двух или более нуклеотидов или комбинацией инсерции и делеции одного или более нуклеотидов, при условии, что мутантный белок содержит характерный С-конец (показанный в SEQ ID NO: 4) или его фрагмент.
Например, мутация сдвига рамки считывания представляет (или вызвана) делецию одного нуклеотида из кодирующей последовательности гена кальретикулина дикого типа, в частности, из его экзона 9, или инсерцию двух нуклеотидов в кодирующую последовательность гена кальретикулина дикого типа, в частности, в его экзон 9.
Например, (1+(3×n0)) нуклеотидов могут быть делецированы из гена кальретикулина (или из его экзона 9), в результате чего n0 может представлять любое натуральное число, включая нуль. Неограничивающие примеры количества нуклеотидов, которые могут быть делецированы из гена кальретикулина (или из его экзона 9) с получением нуклеиновой кислоты, кодирующей обеспеченные здесь мутантные белки кальретикулины, представляют 1, 4, 19, 22, 31, 34, 46, 52 нуклеотида.
Аналогично мутация сдвига рамки может представлять (или может быть вызвана) инсерцией двух нуклеотидов в кодирующую последовательность гена кальретикулина дикого типа, в частности, в его экзон 9. Следовательно, (2+(3×n0)) нуклеотидов могут быть инсерцированы в ген кальретикулина (или в его экзон 9), в результате чего n0 может представлять любое натуральное число, включая нуль. Например, 5 нуклеотидов могут быть инсерцированы в ген кальретикулина (или в его экзон 9) с получением нуклеиновой кислоты, кодирующей обеспеченные здесь мутантные белки кальретикулины.
Мутация сдвига рамки считывания также может быть вызвана комбинацией инсерции и делеции одного или более нуклеотидов в/из гена кальретикулина дикого типа (или в/из его экзона 9), при условии, что полученный мутантный белок содержит характерный С-конец (показанный в SEQ ID NO: 4) или его фрагмент.
Например, мутация сдвига рамки считывания может представлять (или может быть вызвана) делецию одного нуклеотида из кодирующей последовательности гена кальретикулина дикого типа, в частности, из экзона 9, и инсерцию шести нуклеотидов в кодирующую последовательность гена кальретикулин дикого типа, в частности, в его экзон 9.
Например, мутация сдвига рамки считывания может представлять (или может быть вызвана) делецию двух нуклеотидов из кодирующей последовательности гена кальретикулина дикого типа, в частности, из его экзона 9, и инсерцию четырех нуклеотидов в кодирующую последовательность гена кальретикулина дикого типа, в частности, в его экзон 9.
Например, мутация сдвига рамки считывания может представлять (или может быть вызвана) делецию трех нуклеотидов из кодирующей последовательности гена кальретикулина дикого типа, в частности, из его экзона 9, и инсерцию пяти нуклеотидов в кодирующую последовательность гена кальретикулина дикого типа, в частности, в его экзон 9.
Например, мутация сдвига рамки считывания может представлять (или может быть вызвана) делецию 12 нуклеотидов из кодирующей последовательности гена кальретикулина дикого типа, в частности, из его экзона 9, и инсерцию 5 нуклеотидов в кодирующую последовательность гена кальретикулина дикого типа, в частности, в его экзон 9.
Например, мутация сдвига рамки считывания может представлять (или может быть вызвана) делецию 18 нуклеотидов из кодирующей последовательности гена кальретикулина дикого типа, в частности, из его экзона 9, и инсерцию 11 нуклеотидов в кодирующую последовательность гена кальретикулина дикого типа, в частности, в его экзон 9.
Например, мутация сдвига рамки считывания может представлять (или может быть вызвана) делецию 18 нуклеотидов из кодирующей последовательности гена кальретикулина дикого типа, в частности, из его экзона 9, и инсерцию 14 нуклеотидов в кодирующую последовательность гена кальретикулина дикого типа, в частности, в его экзон 9.
Например, мутация сдвига рамки считывания может представлять (или может быть вызвана) делецию 20 нуклеотидов из кодирующей последовательности гена кальретикулина дикого типа, в частности, из его экзона 9, и инсерцию 1 нуклеотида в кодирующую последовательность гена кальретикулина дикого типа, в частности, в его экзон 9.
Например, мутация сдвига рамки считывания может представлять (или может быть вызвана) делецию 28 нуклеотидов из кодирующей последовательности гена кальретикулина дикого типа, в частности, из его экзона 9, и инсерцию 6 нуклеотидов в кодирующую последовательность гена кальретикулина дикого типа, в частности, в его экзон 9.
Например, мутация сдвига рамки считывания может представлять (или может быть вызвана) делецию 35 нуклеотидов из кодирующей последовательности гена кальретикулина дикого типа, в частности, из его экзона 9, и инсерцию 1 нуклеотида в кодирующую последовательность гена кальретикулина дикого типа, в частности, в его экзон 9.
Например, мутация сдвига рамки считывания может представлять (или может быть вызвана) делецию 36 нуклеотидов из кодирующей последовательности гена кальретикулина дикого типа, в частности, из его экзона 9, и инсерцию 2 нуклеотидов в кодирующую последовательность гена кальретикулина дикого типа, в частности, в его экзон 9.
Другие комбинации инсерции/делеции по изобретению, которые приводят к получению характерного С-конца мутантных белков кальретикулинов (общая минимальная аминокислотная последовательность мутантных белков показана в SEQ ID NO: 4) или его фрагмента, легко возможны.
В результате вышеописанных инсерций, делеций и комбинаций инсерций/делеций, сдвиг рамки считывания вводится в (кодирующую последовательность) ген кальретикулина дикого типа и, в частности, в его экзон 9. Следовательно, мутантный белок кальретикулин, раскрытый здесь и используемый по настоящему изобретению, содержит мутантный аминокислотный участок, кодируемый этими последовательностями мутантного экзона 9.
Следовательно, мутантный белок кальретикулин может быть выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
В одном варианте осуществления мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434.
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434.
Присутствие одного или более аллелей гена кальретикулина оценивается на геномном уровне, уровне мРНК или уровне белка.
Если присутствие одного или более мутантных аллелей гена кальретикулина оценивается на геномном уровне, то мутантный аллель может содержать или состоять из ДНК, предпочтительно геномной ДНК.
Например, мутантный аллель может содержать нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288; 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137, 141, 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281, 285, 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный мутантный аллель содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288; 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137, 141, 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281, 285, 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный мутантный аллель содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288; 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137, 141, 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281, 285, 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный мутантный аллель содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288; 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137, 141, 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281, 285, 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
В одном варианте осуществления указанный мутантный аллель содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288; 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137, 141, 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281, 285, 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431.
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный мутантный аллель содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288; 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137, 141, 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281, 285, 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный мутантный аллель содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288; 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137, 141, 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281, 285, 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный один или более мутантных аллелей гена кальретикулина,
где указанный один или более мутантных аллелей гена кальретикулина включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный мутантный аллель содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288; 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137, 141, 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281, 285, 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431.
Любые методы, обычно используемые для мутационных анализов, могут быть использованы по настоящему изобретению. Присутствие мутантного аллеля на геномном уровне можно определить, например, секвенированием (например, секвенированием по Сэнгеру, например двумерным секвенированием по Сэнгеру) и/или стратегиями детектирования на основе ПЦР, такими как анализ ПЦР с определением размеров продуктов (т.е. ПЦР с последующим анализом фрагментов, например, электрофорезом в агарозном геле (например, электрофорезом в агарозном геле высокой плотности)).
Детектирование мутации в нуклеиновой кислоте можно осуществить методами, известными в данной области, включая прямое секвенирование, идентификацию полиморфизма длин рестрикционных фрагментов (ПДРФ) геномной ДНК, метод случайно амплифицируемой полиморфной ДНК (RAPD), определение полиморфизма длин амплифицированных фрагментов (AFLP), полимеразную цепную реакцию (ПЦР), секвенирование ДНК, аллель-специфические олигонуклеотидные зонды (ASO), гибридизацию с ДНК-микрочипами или гранулами, плавление высокого разрешения (HRM), а также принцип метода TaqMan-зонда. Нуклеиновая кислота может представлять собой геномную ДНК, амплифицированную геномную ДНК, мРНК, кДНК или амплифицированную кДНК.
Секвенирование обычно осуществляют на специфически амплифицированных нуклеиновых кислотах. В анализе размера фрагментов, как правило, используются различия в размерах ампликонов после ПЦР. Плавление высокого разрешения (HRM) определяет мутации в ДНК с помощью точного измерения температуры плавления двухцепочечной ДНК. Gundry et al., «Amplicon Melting Analysis with Labeled Primers: A Closed-Tube Method for Differentiating Homozygotes and Heterozygotes», Clinical Chemistry, 49:396-406 (2003). Обычно пользователь будет использовать ПЦР для амплификации области ДНК, в которой находится интересующая мутация. Затем амплифицированную ДНК точно нагревают примерно от 50°С до примерно 95°С, пока не разделятся цепи. Этот процесс обычно контролируют с помощью флуоресцентных красителей.
В одном из подходов, который может быть здесь использован, применяется анализ размера фрагментов, с последующим секвенированием или без него. Как уже указывалось выше, ПЦР-анализы с применением, например, геномной ДНК мутантного кальретикулина в качестве матрицы, могут быть использованы для амплификации ДНК. Затем амплифицированная ДНК может быть подвергнута анализу фрагментов, например, с помощью электрофореза в агарозном геле.
Способы определения присутствия мутантного аллеля на уровне мРНК или уровня белка описаны ниже.
Для мРНК многие из тех же методов, которые используются для ДНК, могут быть выполнены после обратной транскрипции с получением кДНК. Другие методы включают ПЦР в режиме реального времени, ПЦР с обратной транскрипцией, полногеномное транскриптомное шот-ган секвенирование (секвенирование РНК), гибридизацию in situ или технологию микрочипов. ПЦР в режиме реального времени одновременно амплифицирует и детектирует интересующую последовательность. При использовании специфических праймеров и флуоресцентных меток можно отличить дикий тип и мутации.
Белки можно анализировать с помощью методов, которые включают иммуногистохимию (IHC), иммуноанализ, методы на основе гель-электрофореза или блоттинга, масс-спектрометрию, проточную цитометрию или FACS. Во многих методах контролируется связывание антитела или серии антител с интересующим белком для обнаружения различий между формами дикого типа и мутантными формами. Масс-спектрометрия детектирует различия в размере белка и его фрагментов, что предоставляет информацию о находящейся в основе последовательности. Например, можно использовать поликлональные антитела, которые специфически связываются с мутантным белком кальретикулином, как показано в примере 2.
В настоящем изобретении также используется преимущество определения присутствия генного продукта одного или более мутантных аллелей гена кальретикулина для диагностики миелоидного новообразования.
Настоящее изобретение относится к способу оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный генный продукт.
Способы, обеспеченные здесь, могут включать стадию получения образца от пациента.
Настоящее изобретение относится к способу оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- получение образца от указанного пациента;
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный генный продукт.
Способ, обеспеченный здесь, включает определение присутствия генного продукта, предпочтительно только одного мутантного аллеля гена кальретикулина в образце от пациента. Предпочтительно способ представляет способ в условиях in vitro.
Предпочтительно способ по настоящему изобретению относится исключительно к оценке того, страдает ли пациент миелоидным новообразованием.
Настоящее изобретение относится к способу оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием, когда присутствует указанный генный продукт.
Миелоидные новообразования включают миелопролиферативные новообразования и миелодиспластические синдромы. Предпочтительно здесь миелоидное новообразование представляет миелопролиферативное новообразование, в частности, первичный миелофиброз (ПМФ) или эссенциальную тромбоцитемию (ЭТ) или миелодиспластический синдром, в частности, рефрактерную анемию с кольцевыми сидеробластами и тромбоцитемией (RARS-T).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт.
Один или более мутантных аллелей могут содержать нуклеиновую кислоту, кодирующую мутантный белок кальретикулин.
Мутантный белок кальретикулин может быть выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислоты, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:4.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:4.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:4.
Мутантный белок кальретикулин может быть выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144.
Мутантный белок кальретикулин может быть выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин,
где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434.
Мутантный аллель может содержать нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288; 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137, 141, 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281, 285, 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Генный продукт может представлять мРНК. Например, генный продукт может представлять мРНК, кодирующую С-концевую аминокислотную последовательность обеспеченных здесь мутантных белков кальретикулинов.
Следовательно, генный продукт может содержать нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность с, по меньшей мере, 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO:4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3.
Указанный генный продукт может содержать нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3, 7, 11, 15, 19, 23, 27, 31, 35, 39, 43, 47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 91, 95, 99, 103, 107, 111, 115, 119, 123, 127, 131, 135, 139 или 143;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3, 7, 11, 15, 19, 23, 27, 31, 35, 39, 43, 47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 91, 95, 99, 103, 107, 111, 115, 119, 123, 127, 131, 135, 139 или 143;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3, 7, 11, 15, 19, 23, 27, 31, 35, 39, 43, 47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 91, 95, 99, 103, 107, 111, 115, 119, 123, 127, 131, 135, 139 или 143.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3, 7, 11, 15, 19, 23, 27, 31, 35, 39, 43, 47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 91, 95, 99, 103, 107, 111, 115, 119, 123, 127, 131, 135, 139 или 143;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3, 7, 11, 15, 19, 23, 27, 31, 35, 39, 43, 47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 91, 95, 99, 103, 107, 111, 115, 119, 123, 127, 131, 135, 139 или 143.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3, 7, 11, 15, 19, 23, 27, 31, 35, 39, 43, 47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 91, 95, 99, 103, 107, 111, 115, 119, 123, 127, 131, 135, 139 или 143;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3, 7, 11, 15, 19, 23, 27, 31, 35, 39, 43, 47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 91, 95, 99, 103, 107, 111, 115, 119, 123, 127, 131, 135, 139 или 143.
Генный продукт может содержать нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 147, 151, 155, 159, 163, 167, 171, 175, 179, 183, 187, 191, 195, 199, 203, 207, 211, 215, 219, 223, 227, 231, 235, 239, 243, 247, 251, 255, 259, 263, 267, 271, 275, 279, 283 или 287;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 147, 151, 155, 159, 163, 167, 171, 175, 179, 183, 187, 191, 195, 199, 203, 207, 211, 215, 219, 223, 227, 231, 235, 239, 243, 247, 251, 255, 259, 263, 267, 271, 275, 279, 283 или 287;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 147, 151, 155, 159, 163, 167, 171, 175, 179, 183, 187, 191, 195, 199, 203, 207, 211, 215, 219, 223, 227, 231, 235, 239, 243, 247, 251, 255, 259, 263, 267, 271, 275, 279, 283 или 287.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 147, 151, 155, 159, 163, 167, 171, 175, 179, 183, 187, 191, 195, 199, 203, 207, 211, 215, 219, 223, 227, 231, 235, 239, 243, 247, 251, 255, 259, 263, 267, 271, 275, 279, 283 или 287;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 147, 151, 155, 159, 163, 167, 171, 175, 179, 183, 187, 191, 195, 199, 203, 207, 211, 215, 219, 223, 227, 231, 235, 239, 243, 247, 251, 255, 259, 263, 267, 271, 275, 279, 283 или 287.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 147, 151, 155, 159, 163, 167, 171, 175, 179, 183, 187, 191, 195, 199, 203, 207, 211, 215, 219, 223, 227, 231, 235, 239, 243, 247, 251, 255, 259, 263, 267, 271, 275, 279, 283 или 287;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 147, 151, 155, 159, 163, 167, 171, 175, 179, 183, 187, 191, 195, 199, 203, 207, 211, 215, 219, 223, 227, 231, 235, 239, 243, 247, 251, 255, 259, 263, 267, 271, 275, 279, 283 или 287.
Генный продукт может содержать нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 293, 297, 301, 305, 309, 313, 317, 321, 325, 329, 333, 337, 341, 345, 349, 353, 357, 361, 365, 369, 373, 377, 381, 385, 389, 393, 397, 401, 405, 409, 413, 417, 421, 425, 429 или 433;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 293, 297, 301, 305, 309, 313, 317, 321, 325, 329, 333, 337, 341, 345, 349, 353, 357, 361, 365, 369, 373, 377, 381, 385, 389, 393, 397, 401, 405, 409, 413, 417, 421, 425, 429 или 433;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 293, 297, 301, 305, 309, 313, 317, 321, 325, 329, 333, 337, 341, 345, 349, 353, 357, 361, 365, 369, 373, 377, 381, 385, 389, 393, 397, 401, 405, 409, 413, 417, 421, 425, 429 или 433.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 293, 297, 301, 305, 309, 313, 317, 321, 325, 329, 333, 337, 341, 345, 349, 353, 357, 361, 365, 369, 373, 377, 381, 385, 389, 393, 397, 401, 405, 409, 413, 417, 421, 425, 429 или 433;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 293, 297, 301, 305, 309, 313, 317, 321, 325, 329, 333, 337, 341, 345, 349, 353, 357, 361, 365, 369, 373, 377, 381, 385, 389, 393, 397, 401, 405, 409, 413, 417, 421, 425, 429 или 433.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 293, 297, 301, 305, 309, 313, 317, 321, 325, 329, 333, 337, 341, 345, 349, 353, 357, 361, 365, 369, 373, 377, 381, 385, 389, 393, 397, 401, 405, 409, 413, 417, 421, 425, 429 или 433;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434; и
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 293, 297, 301, 305, 309, 313, 317, 321, 325, 329, 333, 337, 341, 345, 349, 353, 357, 361, 365, 369, 373, 377, 381, 385, 389, 393, 397, 401, 405, 409, 413, 417, 421, 425, 429 или 433.
Если генный продукт представляет мРНК, то присутствие или количество указанной мРНК можно определить обычными методами, такими как ПЦР в режиме реального времени, ПЦР с обратной транскрипцией, полногеномное транскриптомное шот-ган секвенирование (секвенирование РНК), гибридизацию in situ или технологию микрочипов.
Следовательно, определение методами на основе ПЦР, такими как ПЦР в режиме реального времени и ПЦР с обратной транскрипцией, дополнительно может включать стадии:
(i) контактирование нуклеиновой кислоты в образце с одним или двумя олигонуклеотидами; и
(ii) получение продукта амплификации, содержащего последовательность-мишень.
В настоящем документе обеспечены и используются примерные специфические для мутаций зонды и праймеры.
Примерами олигонуклеотидов (праймеров), используемых по настоящему изобретению, являются:
Прямой праймер: ACAACTTCCTCATCACCAACG (SEQ ID NO: 437)
и/или
Обратный праймер: GGCCTCAGTCCAGCCCTG (SEQ ID NO: 438)
Прямой праймер: GGCAAGGCCCTGAGGTGT (SEQ ID NO: 439)
и/или
Обратный праймер: GGCCTCAGTCCAGCCCTG (SEQ ID NO: 438).
Другие подходящие специфические для мутаций зонды и праймеры для применения в настоящем изобретении, могут, например, быть получены из последовательностей кДНК мутантного гена кальретикулина. Такие последовательности кДНК представлены и описаны ниже. Примеры последовательностей кДНК, которые можно использовать в данном контексте, показаны в SEQ ID NO: 2, 6, 10, 14, 18, 22, 26, 30, 34, 38, 42, 46, 50, 54, 58, 62, 66, 70, 74, 78, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 122, 126, 130, 134, 138, 142, 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226, 230, 234, 238, 242, 246, 250, 254, 258, 262, 266, 270, 274, 278, 282, или 286; 292, 296, 300, 304, 308, 312, 316, 320, 324, 328, 332, 336, 340, 344, 348, 352, 356, 360, 364, 368, 372, 376, 380, 384, 388, 392, 396, 400, 404, 408, 412, 416, 420, 424, 428 или 432.
Другие примеры последовательностей кДНК, которые могут быть использованы для конструирования специфических для мутаций зондов и праймеров, приведены в следующей таблице:
Последовательности мутационных соединений в последовательности кДНК CALR для конструирования специфических для мутаций зондов или праймеров для ПЦР.
Жирным шрифтом указаны границы делеционного события; подчеркнутые буквы указывают инсерцированные последовательности;
Жирным шрифтом и курсивом указаны варианты отдельных нуклеотидов.
Последующее относится к вариантам осуществления, где генный продукт представляет белок/полипептид.
Генный продукт может содержать полипептид, выбранный из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO:4.
Генный продукт может содержать полипептид, выбранный из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт представляет полипептид, выбранный из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт представляет полипептид, выбранный из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт представляет полипептид, выбранный из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт представляет полипептид, выбранный из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144.
Генный продукт может содержать полипептид, выбранный из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288.
Генный продукт может содержать полипептид, выбранный из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает первичным миелофиброзом или предрасположен страдать первичным миелофиброзом, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434.
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает эссенциальной тромбоцитемией или предрасположен страдать эссенциальной тромбоцитемией, когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434.
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к способу оценки того, страдает ли пациент рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T) или предрасположен страдать рефрактерной анемией с кольцевыми сидеробластами и тромбоцитемией (RARS-T), когда присутствует указанный генный продукт,
где указанный один или более мутантных аллелей включает нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше,
где указанный генный продукт выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433; и
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434.
Если генный продукт является белком, то присутствие или количество указанного белка можно определить обычными методами, например, иммуногистохимией (IHC), иммуноанализом, методами на основе гель-электрофореза или блоттинга, IHC, масс-спектрометрией, проточной цитометрией или FACS.
Поскольку мутации CALR вызывают сдвиг рамки считывания транслированного полипептида, то характерная С-концевая аминокислотная последовательность присутствует в мутированных белках кальретикулинах, как здесь описано и представлено. Эта характерная аминокислотная последовательность изменяет общий заряд белка. Она также изменяет подвижность мутированного кальретикулина при электрофорезе белков. Можно воспользоваться преимуществом данного различия в заряде и/или в паттерне подвижности для определения присутствия мутантного белка кальретикулина. Например, антитела, специфичные к мутантному белку кальретикулину, можно использовать для идентификации указанного мутантного белка, например, с помощью вестерн-иммуноблоттинга. Необязательно также антитела, специфичные к белку кальретикулину дикого типа, можно использовать (дополнительно) в качестве контроля. Такие антитела могут включать поликлональные и моноклональные антитела, которые могут быть получены с помощью обычных методик.
Предпочтительно, чтобы пациент был пациентом-человеком. Может иметь место подозрение о том, что пациент страдает миелоидным новообразованием, или может иметь место подозрение на то, что он/она предрасположены страдать миелоидным новообразованием.
Последующее относится к образцам, используемым по настоящему изобретению. Образец может представлять образец костного мозга, образец крови или образец слюны. Предпочтительно образец представляет образец крови. Образец крови, предпочтительно содержит гранулоциты периферической крови. Образец может быть получен от пациента с помощью обычных методик, например, биопсией.
Обеспеченный здесь выше способ может дополнительно включать введение ингибитора мутантного кальретикулина, как здесь определено выше, пациенту.
Последующее относится к кДНК, кодирующей обеспеченные здесь мутантные белки кальретикулины.
Настоящее изобретение относится к нуклеиновой кислоте, выбранной из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 2;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к нуклеиновой кислоте, выбранной из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 2, 6, 10, 14, 18, 22, 26, 30, 34, 38, 42, 46, 50, 54, 58, 62, 66, 70, 74, 78, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 122, 126, 130, 134, 138 или 142;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к нуклеиновой кислоте, выбранной из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226, 230, 234, 238, 242, 246, 250, 254, 258, 262, 266, 270, 274, 278, 282 или 286;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к нуклеиновой кислоте, выбранной из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 292, 296, 300, 304, 308, 312, 316, 320, 324, 328, 332, 336, 340, 344, 348, 352, 356, 360, 364, 368, 372, 376, 380, 384, 388, 392, 396, 400, 404, 408, 412, 416, 420, 424, 428 или 432;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Предпочтительно вышеуказанная нуклеиновая кислота представляет кДНК.
Последующее относится к мРНК, кодирующей обеспеченные здесь мутантные белки кальретикулины.
Настоящее изобретение относится к нуклеиновой кислоте, выбранной из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к нуклеиновой кислоте, выбранной из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3, 7, 11, 15, 19, 23, 27, 31, 35, 39, 43, 47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 91, 95, 99, 103, 107, 111, 115, 119, 123, 127, 131, 135, 139 или 143;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к нуклеиновой кислоте, выбранной из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 147, 151, 155, 159, 163, 167, 171, 175, 179, 183, 187, 191, 195, 199, 203, 207, 211, 215, 219, 223, 227, 231, 235, 239, 243, 247, 251, 255, 259, 263, 267, 271, 275, 279, 283 или 287;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к нуклеиновой кислоте, выбранной из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 293, 297, 301, 305, 309, 313, 317, 321, 325, 329, 333, 337, 341, 345, 349, 353, 357, 361, 365, 369, 373, 377, 381, 385, 389, 393, 397, 401, 405, 409, 413, 417, 421, 425, 429 или 433;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Вышеуказанная нуклеиновая кислота предпочтительно представляет мРНК.
Последующее относится к геномной ДНК, кодирующей обеспеченные здесь мутантные белки кальретикулины.
Настоящее изобретение относится к нуклеиновой кислоте, выбранной из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к нуклеиновой кислоте, выбранной из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137 или 141;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к нуклеиновой кислоте, выбранной из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281 или 285;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Настоящее изобретение относится к нуклеиновой кислоте, выбранной из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
Вышеуказанная нуклеиновая кислота предпочтительно представляет геномную ДНК.
Последующее относится к обеспеченным здесь мутантным белкам кальретикулинам.
Настоящее изобретение относится к белку, выбранному из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к белку, выбранному из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к белку, выбранному из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к белку, выбранному из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Значения терминов «полипептид», «белок» и «последовательность(и)/молекула(лы) нуклеиновой кислоты» хорошо известны в данной области и используются соответственно в контексте настоящего изобретения. Например, как здесь используется, термин «последовательность(и)/молекула(ы) нуклеиновой кислоты» относится ко всем формам встречающихся в природе или полученным рекомбинантно типам нуклеиновых кислот и/или последовательностям/молекулам нуклеиновых кислот, а также химически синтезированным последовательностям/молекулам нуклеиновых кислот. Данный термин также включает аналоги нуклеиновых кислот и производные нуклеиновых кислот. Термин «последовательность(и)/молекула(ы) нуклеиновой кислоты» может относиться к дезоксирибонуклеиновой кислоте (ДНК) и рибонуклеиновой кислоте (РНК). «Последовательность(и)/молекулу(ы) нуклеиновой кислоты» можно получить с использованием методологии химического синтеза, известной специалисту с обычной квалификацией в данной области, или с использованием рекомбинантной технологии, или можно выделить из природных источников или с помощью комбинаций указанных методов. ДНК и РНК могут необязательно содержать неприродные нуклеотиды и могут быть одноцепочечными или двухцепочечными. «Последовательность(и)/молекула(ы) нуклеиновой кислоты» относится также к смысловой и антисмысловой ДНК и РНК, т.е. нуклеотидная последовательность которых является комплементарной определенной последовательности нуклеотидов в ДНК и/или РНК. Кроме того, термин «последовательность(и)/молекула(ы) нуклеиновой кислоты» может относиться к ДНК или РНК, или их гибридам или любой их модификации, которые известны в данной области (смотри, например, патент США № 5525711, патент США № 4711955, патент США № 5792608 или ЕР 302175 в отношении примеров модификаций). Молекула(ы) нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, линейной или циклической, природной или синтетической, и без каких-либо ограничений по размеру. Например, молекула(ы) нуклеиновой кислоты может представлять геномную ДНК, кДНК, мРНК, антисмысловую РНК или ДНК, кодирующую такие РНК, или химеропласты (Colestrauss, Science (1996), 1386-1389). Указанная молекула(ы) нуклеиновой кислоты может находиться в форме плазмиды или вирусной ДНК или РНК. «Последовательность(и)/молекула(ы) нуклеиновой кислоты» может также относиться к олигонуклеотиду(ам), где включаются любые модификации, известные в данной области, такие как фосфотиоаты или пептидные нуклеиновые кислоты (ПНК).
Последовательность нуклеиновой кислоты с определенным уровнем идентичности с обеспеченными здесь человеческими последовательностями может быть идентифицирована специалистом в данной области с использованием методов, известных в данной области, например с помощью гибридизационных анализов или с помощью выравниваний, вручную или с помощью компьютерных программ, таких как упоминаются в настоящем документе ниже в отношении определения термина «гибридизация» и степени гомологии.
Последовательность нуклеиновой кислоты может быть, по меньшей мере, на 70% идентична последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 1. Более предпочтительно, последовательность нуклеиновой кислоты, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% идентична последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 1, где предпочтительными являются более высокие значения. Наиболее предпочтительно, чтобы последовательность нуклеиновой кислоты была, по меньшей мере, на 99% идентична последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 1.
Последовательность нуклеиновой кислоты может быть, по меньшей мере, на 70% идентична последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 2. Более предпочтительно, последовательность нуклеиновой кислоты, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% идентична последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 2, где предпочтительными являются более высокие значения. Наиболее предпочтительно, чтобы последовательность нуклеиновой кислоты была, по меньшей мере, на 99% идентична последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 2.
Последовательность нуклеиновой кислоты может быть, по меньшей мере, на 70% идентична последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 3. Более предпочтительно, последовательность нуклеиновой кислоты, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% идентична последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 3, где предпочтительными являются более высокие значения. Наиболее предпочтительно, чтобы последовательность нуклеиновой кислоты была, по меньшей мере, на 99% идентична последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 3.
Последовательность нуклеиновой кислоты может быть, по меньшей мере, на 70% идентична последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142, 143, 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286, 287, 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433.
Более предпочтительно последовательность нуклеиновой кислоты, по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% идентична последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142, 143, 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286, 287, 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433, где предпочтительными являются более высокие значения.
Наиболее предпочтительно последовательность нуклеиновой кислоты, по меньшей мере, на 99% идентична последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142, 143, 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286, 287, 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433.
Методы гибридизации для характеристики нуклеиновых кислот с определенным уровнем идентичности с последовательностями нуклеиновых кислот, обеспеченных здесь, хорошо известны в данной области; смотри, например, руководства Sambrook, Russell, «Molecular Cloning, A Laboratory Manual», Cold Spring Harbor Laboratory, N.Y. (2001); Ausubel, «Current Protocols in Molecular Biology», Green Publishing Associates and Wiley Interscience, N.Y. (1989). Как здесь используется, термины «гибридизация» или «гибридизуется» относятся к гибридизациям в жестких или нежестких условиях. Если не указано дополнительно, то условия предпочтительно являются нежесткими. Указанные условия гибридизации можно определить согласно обычным протоколам, описанным, например, в руководстве Sambrook (2001) выше; Ausubel (1989) выше, или Higgins and Hames (Eds.) «Nucleic acid hybridization, a practical approach» IRL Press Oxford, Washington DC, (1985). Определение условий находится в пределах квалификации специалиста в данной области, и они могут быть определены согласно протоколам, описанным в данной области. Таким образом, для определения только специфически гибридизующихся последовательностей, как правило, требуется жесткие условия гибридизации и промывки, например, такие как условия гибридизации высокой жесткости 0,1×SSC, 0,1% SDS при 65°С или 2×SSC, 60°C, 0,1% SDS. Условия гибридизации с низкой жесткостью для выявления гомологичных или не точно комплементарных последовательностей могут, например, быть установлены на 6×SSC, 1% SDS при 65°C. Как известно, длина зонда и состав нуклеиновой кислоты, предназначенной для определения, представляют собой дополнительные параметры условий гибридизации. В данном документе предусматривается, что нуклеиновая кислота может быть праймером или зондом, например, нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью нуклеиновой кислоты мутантного кальретикулина (или ее фрагментом, как здесь определено), или нуклеиновой кислоты, кодирующей мутантный белок кальретикулин (или кодирующей его С-конец), или экзона 9 мутантного кальретикулина и тому подобное, как здесь определено и представлено выше. Праймеры и зонды часто имеют длину в диапазоне 10-30 нуклеотидов. Таким образом, настоящее изобретение относится к нуклеиновой кислоте (например, праймеру или зонду), гибридизующейся в жестких условиях с комплементарной цепью нуклеиновой кислоты мутантного кальретикулина, как здесь определено и представлено выше, где длина указанной гибридизующейся нуклеиновой кислоты меньше, чем 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21 или 20 нуклеотидов, и больше, чем 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. Предпочтительно нуклеиновая кислота имеет длину от 10 до 35 нуклеотидов, более предпочтительно от 15 до 25 нуклеотидов, особенно предпочтительно имеет длину от 18 до 21, например, 18, 19, 20 или 21 нуклеотидов.
Согласно настоящему изобретению термины «гомология» или «процент гомологии» или «идентичный» или «процент идентичности» или «процентная идентичность» или «идентичность последовательностей» по отношению к двум или более последовательностям нуклеиновых кислот, относится к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми или которые имеют определенный процент нуклеотидов, которые одинаковы (по меньшей мере, 70%, 75%, 80%, 85%, наиболее предпочтительно, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% идентичность, наиболее предпочтительно, по меньшей мере, 99% идентичность), при сравнении и выравнивании на максимальное соответствие в окне сравнения (предпочтительно по всей длине), или по обозначенной области, как определено с использованием алгоритма сравнения последовательностей, известного в данной области техники, или ручным выравниванием и визуального осмотром. Последовательности, обладающие, например, от 75% до 90% или более идентичностью последовательностей могут рассматриваться как по существу идентичные. Такое определение также относится к последовательности, комплементарной анализируемой последовательности. Предпочтительно описываемая идентичность находится по области, которая имеет длину, по меньшей мере, примерно от 15 до 25 нуклеотидов, более предпочтительно, по области, которая имеет длину, по меньшей мере, примерно от 50 до 100 нуклеотидов и, наиболее предпочтительно, по всей длине. Специалисты, имеющие навыки в данной области, знают, как определить процент идентичности между/среди последовательностей с использованием, например, алгоритмов, основанных на компьютерной программе CLUSTALW (Thompson Nucl. Acids Res., 2 (1994) 4673-4680) или FASTDB (Brutlag Comp. App. Biosci., 6 (1990) 237-245), известных в данной области техники.
Несмотря на то, что в алгоритме FASTDB, как правило, при расчете не учитываются внутренние несовпадающие делеции или добавления в последовательности, то есть гэпы, это можно скорректировать вручную, чтобы избежать завышения в % идентичности. Однако в алгоритме CLUSTALW принимаются во внимание гэпы в последовательности при расчетах идентичности. Также для специалистов в данной области доступны алгоритмы BLAST и BLAST 2.0 (Altschul, (1997) Nucl. Acids Res., 25:3389-3402; Altschul (1993) J. Mol. Evol., 36:290-300; Altschul (1990) J. Mol. Biol., 215:403-410). В программе BLASTN для последовательностей нуклеиновых кислот по умолчанию используется длина слова (W) 11, ожидание (Е) 10, М = 5, N = 4 и сравнение обеих цепей. В алгоритме BLOSUM62 в матрице оценке (Henikoff (1989) PNAS 89: 10915) используются выравнивания (В) 50, ожидание (Е) 10, М = 5, N = 4 и сравнение обеих цепей.
Для того чтобы определить насколько нуклеотидный остаток в последовательности нуклеиновой кислоты соответствует определенному положению в нуклеотидной последовательности, например, SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142, 143, 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286, 287, 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 и 433 соответственно, специалист в данной области может использовать средства и методы, хорошо известные в данной области техники, например, выравнивание вручную или с помощью компьютерных программ, таких как программы, которые были упомянуты в настоящем документе выше. Например, BLAST 2.0, которая означает Basic Local Alignment Search Tool (Altschul (1997), смотри выше; Altschul (1993), смотри выше; Altschul (1990), смотри выше), можно использовать для поиска локальных выравниваний последовательностей. BLAST, как описано выше, обеспечивает выравнивания нуклеотидных последовательностей для определения сходства последовательностей. За счет локального характера выравниваний алгоритм BLAST особенно пригоден для определения точных совпадений или для выявления сходных последовательностей. Основной единицей выхода алгоритма BLAST является пара сегментов с максимальным сходством (HSP). HSP состоит из фрагментов двух последовательностей произвольной, но одинаковой длины, выравнивание которых является локально максимальным, и для которых оценка выравнивания соответствует или превышает порог или балл отсечения, установленный пользователем. Подходом алгоритма BLAST является поиск HSP между запрашиваемой последовательностью и последовательностью из базы данных, для оценки статистической значимости любых найденных совпадений, и для представления только тех совпадений, которые удовлетворяют выбранному пользователем порогу значимости. Параметр E устанавливает статистически значимое пороговое значение для представления совпадений с последовательностью из базы данных. E интерпретируется как верхняя граница ожидаемой частоты случайного появления HSP (или набора HSP) в контексте всего поиска в базе данных. Любая последовательность из базы данных, совпадение которой удовлетворяет E, представляется в выходной программе.
Аналогичные компьютерные методы с использованием BLAST (Altschul (1997), смотри выше; Altschul (1993), смотри выше; Altschul (1990), смотри выше) используются для поиска идентичных или родственных молекул в базах данных нуклеотидов, таких как GenBank или EMBL. Этот анализ проводится намного быстрее, чем основанные на мембранах гибридизации. Кроме того, чувствительность компьютерного поиска можно изменять для определения того, что любое конкретное совпадение классифицируется, как точное или подобное. Основой поиска является оценка продукта, которая определяется следующим образом:
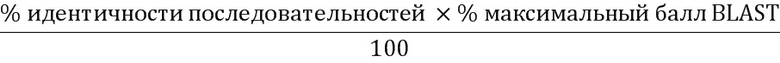
и здесь учитывается степень сходства между двумя последовательностями и длина совпадения последовательностей. Например, с баллом продукта 40, совпадение будет точным в пределах погрешности в 1-2%; и при 70, совпадение будет точным. Сходные молекулы обычно определяются путем отбора тех, которые показывают баллы продукта в пределах от 15 до 40, хотя, родственные молекулы могут быть идентифицированы и с более низкими баллами. Другим примером программы, способной генерировать выравнивания последовательностей, является компьютерная программа CLUSTALW (Thompson (1994) Nucl. Acids Res., 2:4673-4680) или FASTDB (Brutlag (1990) Comp. App. Biosci., 6:237-245), известные в данной области техники.
Разъяснения и определения, приведенные здесь выше в отношении термина «гомология/идентичность последовательностей нуклеиновых кислот», применяются, с соответствующими изменениями, по отношению к «аминокислотным последовательностям» обеспеченных здесь мутантных белков кальретикулинов, показанных в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 и 434, соответственно, как пояснено ниже.
Полипептид для использования по настоящему изобретению может обладать, по меньшей мере, 70% идентичностью/сходством с белками, имеющими аминокислотную последовательность, например, показанную в SEQ ID NO: 4 соответственно. Более предпочтительно полипептид обладает, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% идентичностью/сходством с белками, показанными в SEQ ID NO: 4 соответственно, где предпочтительными являются более высокие значения. Наиболее предпочтительно полипептид обладает, по меньшей мере, 99% гомологией с белком, показанным в SEQ ID NO: 4.
Полипептид для использования по настоящему изобретению может обладать, по меньшей мере, 70% идентичностью/сходством с белками, имеющими аминокислотную последовательность, например, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 и 434 соответственно. Более предпочтительно полипептид обладает, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% идентичностью/сходством с белками, показанными в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 и 434 соответственно, где предпочтительными являются более высокие значения. Наиболее предпочтительно полипептид обладает, по меньшей мере, 99% гомологией с белком, показанным в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 и 434 соответственно.
Не отступая от сущности настоящего изобретения, также можно использовать (функциональный) фрагмент(ы) или (функциональное) производное(ые) обеспеченных здесь полипептидов или белков, например, (функциональный) фрагмент(ы) или (функциональное) производное(ые) минимального C-конца мутантного кальретикулина, показанного в SEQ ID NO: 4. Также можно использовать (функциональный) фрагмент(ы) или (функциональное) производное(ые) обеспеченных здесь мутантных полипептидов или белков кальретикулинов, например, (функциональный) фрагмент(ы) или (функциональное) производное(ые) полипептида(ов), показанных в последовательностях SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430, и 434 соответственно.
Таким образом, (функциональный) фрагмент вышеуказанного здесь полипептида(в)/белка(ов), обеспеченных здесь и используемых по настоящему изобретению, может представлять любой из вышеуказанных специфических полипептидов, показанных в любой из последовательностей SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 и 434 соответственно, где одна или более аминокислот делецированы.
(Функциональное) производное вышеуказанного здесь полипептида(в)/белка(ов), обеспеченных здесь и используемых по настоящему изобретению, может представлять любой из вышеуказанных специфических полипептидов, показанных в последовательностях SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 и 434 соответственно, где одна или более аминокислот инсерцированы, добавлены или заменены.
Предпочтительно делеция, инсерция, добавление и/или замена одной или более аминокислот находится в С-конце обеспеченного здесь мутантного кальретикулина, т.е. в аминокислотной последовательности полипептида, показанного в SEQ ID NO:4.
Предпочтительно делеция, инсерция, добавление и/или замена одной или более аминокислот находится в С-конце обеспеченного здесь мутантного кальретикулина, т.е. в аминокислотной последовательности полипептидов, показанных в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144 соответственно.
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 аминокислот могут быть делецированы, инсерцированы, добавлены или заменены, предпочтительно в С-конце обеспеченного здесь мутантного кальретикулина, т.е. в аминокислотной последовательности полипептидов, показанных в SEQ ID NO:4.
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 5, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 аминокислот могут быть делецированы, предпочтительно из С-конца обеспеченного здесь мутантного кальретикулина, т.е. из аминокислотной последовательности полипептида, показанного в SEQ ID NO: 4.
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 аминокислот могут быть делецированы, инсерцированы, добавлены или заменены, предпочтительно в С-конце обеспеченного здесь мутантного кальретикулина, т.е. в аминокислотной последовательности полипептидов, показанных в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144 соответственно.
Термин «одна или более аминокислот делецированы» относится к (функциональным) фрагментам специфических мутантных белков кальретикулинов, обеспеченных здесь.
Предпочтительный (функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, состоит из 15-25 смежных аминокислот. Следовательно, (функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, состоит из 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 смежных аминокислот.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, предпочтительно состоит из 15-25 смежных аминокислот аминокислотной последовательности, показанной в SEQ ID NO: 4.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, предпочтительно состоит из 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 смежных аминокислот аминокислотной последовательности, показанной в SEQ ID NO: 4.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, предпочтительно состоит из 15-25 смежных аминокислот полипептидов, показанных в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144 соответственно.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, состоит из 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 смежных аминокислот полипептидов, показанных в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144 соответственно.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, может состоять, по меньшей мере, из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41 и до 42 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 4.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, может состоять, по меньшей мере, из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42 и до 43 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 32 или 112.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, может состоять, по меньшей мере, из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43 и до 44 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 8, 128, 132 или 144.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, может состоять, по меньшей мере, из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44 и до 45 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 12, 44, 136 или 140.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, может состоять, по меньшей мере, из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45 и до 46 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 16 или 124.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, может состоять, по меньшей мере, из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46 и вплоть до 47 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 24, 40, 76, 100 или 120.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, может состоять, по меньшей мере, из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47 и до 48 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 28, 36, 72, 84, 96 или 116.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, может состоять, по меньшей мере, из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 и до 49 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 20, 48, 60, 64, 68 или 80.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, может состоять, по меньшей мере, из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47,48, 49 и до 50 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 52 или 56.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, может состоять, по меньшей мере, из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47,48, 49, 50, 51 и до 52 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 92.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, может состоять, по меньшей мере, из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47,48, 49, 50, 51, 52 и до 53 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 88 или 104.
(Функциональный) фрагмент вышеуказанных полипептидов, обеспеченных и используемых по настоящему изобретению, может состоять, по меньшей мере, из 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47,48, 49, 50, 51, 52, 53 и до 54 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 108.
Фрагмент или производное, предпочтительно обладает такой же (или по существу такой же) биологической активностью, как и полноразмерный полипептид, из которого они получены, где полноразмерный полипептид имеет аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 и 434. В этом смысле фрагмент или производное представляют «функциональный» фрагмент или производное для использования в настоящем изобретении.
Обеспеченный здесь полипептид (показанный, например, в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430, и 434 соответственно) может иметь одну или более делецированных, инсерцированных, добавленных и/или замененных аминокислот при условии, что полипептид сохраняет по существу биологическую активность, характерную для полипептидов, из которых он получен.
Предпочтительно, чтобы любые такие делеции, инсерции, добавления и/или замены (в данном контексте особенно замены) были консервативными, т.е. аминокислоты замещались аминокислотами, имеющими одинаковые или сходные свойства. Например, гидрофобная аминокислота предпочтительно должна быть заменена другой гидрофобной аминокислотой и так далее.
«Биологическая активность», характерная для обеспеченных здесь полипептидов, может рассматриваться в качестве активности, которая вызывает (приводит к развитию) миелоидного новообразования, как здесь определено, такого как миелопролиферативное новообразование (в частности, первичный миелофиброз и эссенциальная тромбоцитемия).
Настоящее изобретение также относится к ингибиторам мутантного кальретикулина. Эти ингибиторы могут быть использованы в качестве лекарственного средства.
Термин «антагонист мутантного кальретикулина» или «ингибитор мутантного кальретикулина» в контексте настоящего изобретения означает соединение, способное полностью или частично предупреждать или снижать физиологическую активность и/или уровень экспрессии мутантного кальретикулина. Термины «антагонист» или «ингибитор» используются здесь взаимозаменяемо.
В контексте настоящего изобретения, указанный антагонист может, таким образом, предупредить, снизить, ингибировать или инактивировать физиологическую активность мутантного кальретикулина посредством связывания указанного соединения/вещества (т.е. антагониста/ингибитора) с указанным мутантным кальретикулином. Как здесь используется, термин «антагонист» также включает конкурентные антагонисты, (обратимые) неконкурентные антагонисты или необратимые антагонисты, как описано, в частности, в публикации Mutschler, «Arzneimittelwirkungen» (1986), Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart, Германия. Такое ингибирование может быть измерено определением числа оборотов субстрата.
«Антагонист» или «ингибитор» мутантного кальретикулина также может быть способен предупредить функционирование мутантного кальретикулина посредством предупреждения/снижения экспрессии молекулы нуклеиновой кислоты, кодирующей указанный мутантный кальретикулин. Таким образом, антагонист/ингибитор мутантного кальретикулина может привести к снижению уровня экспрессии мутантного кальретикулина (например, снижению уровня мРНК мутантного кальретикулина и/или мутантного белка кальретикулина); это может привести к пониженной активности мутантного кальретикулина. Пониженная активность и/или уровень экспрессии можно измерить/определить известными методами, которые также здесь описаны.
«Антагонист/ингибитор мутантного кальретикулина» может, например, интерферировать с транскрипцией гена(ов) мутантного кальретикулина, процессингом (например, сплайсингом, экспортом из ядра и т.п.) генного продукта(ов) (например, несплайсированной или частично сплайсированной мРНК) и/или трансляцией генного продукта (например, зрелой мРНК). «Антагонист/ингибитор мутантного кальретикулина» также может интерферировать с дальнейшей модификацией (например, гликозилированием или фосфорилированием) полипептида/белка, кодированного геном(ами) мутантного кальретикулина и, таким образом, полностью или частично ингибировать активность мутантного белка кальретикулина(ов), как здесь описано выше. Кроме того, «антагонист/ингибитор мутантного кальретикулина» может интерферировать с взаимодействиями мутантного белка кальретикулина(ов) с другими белками (так, например, интерферируя с активностью комплексов, включающих мутантный белок(и) кальретикулин(ы), или с его синтезом в общем, например, интерферируя со стадиями выше экспрессии мутантного кальретикулина или с сигнальными путями, в которых участвует мутантный кальретикулин. В зависимости от механизма действия, такие антагонисты могут, например, означать «секвестирующие антагонисты» или «сигнальные антагонисты».
В совокупности описанный здесь антагонист/ингибитор мутантного кальретикулина, следовательно, приводит к уменьшению или снижению уровня экспрессии и/или активности мутантного кальретикулина, и тем самым к снижению его вклада в развитие или пролиферацию миелоидного новообразования, как здесь определено.
Антагонист(ы) может представлять shРНК (малые РНК, образующие шпильки), siРНК (малые интерферирующие РНК), miРНК (микроРНК), dsРНК (двухцепочечная РНК), stРНК (малая временная РНК), антисмысловые молекулы, внеклеточные партнеры по связыванию, небольшие (связывающие) молекулы, аптамеры, интрамеры или молекулы антител, такие как полное антитело (иммуноглобулин), F(аb)-фрагмент, F(аb)2-фрагмент, одноцепочечное антитело, химерное антитело, антитело с привитым CDR, двухвалентное антитело-конструкция, синтетическое антитело, биспецифическое одноцепочечное антитело или кросс-реактивное клонированное антитело.
Настоящее изобретение относится к siРНК или shРНК, специфически направленным на нуклеиновую кислоту, кодирующую мутантный белок(и) кальретикулин(ы), в результате чего нуклеиновая, в частности, представляет мРНК, как определено в данном описании.
До 10% смежных оснований, обеспеченных здесь siРНК или shРНК, могут быть некомплементарными. siРНК может дополнительно содержать, по меньшей мере, одно основание, на 5’-конце и/или, по меньшей мере, одно основание, на 3’-конце.
Антагонист(ы)/ингибитор(ы), которые представляют нуклеиновые кислоты, такие как siРНК, shРНК, антисмысловые молекулы и т.п., могут быть легко получены известными методами с использованием, например, следующих последовательностей-мишеней. Например, siРНК, shРНК и тому подобное, используемые здесь, могут содержать или состоять из последовательности РНК, соответствующей одной из последовательностей-мишеней, приведенных ниже. Термин «последовательность РНК, соответствующая» в данном контексте означает, что последовательность РНК идентична одной из последовательностей-мишеней, приведенных ниже, за исключением того, что остатки тимидина (Т) в последовательности-мишени заменены остатками урацила (U). siРНК может состоять из молекулы нуклеиновой кислоты, содержащей, по меньшей мере, десять смежных оснований. Например, siРНК, shРНК и тому подобное могут содержать, по меньшей мере, десять смежных оснований в последовательности РНК, соответствующей одной из последовательностей-мишеней, приведенных ниже, как это определено выше. siРНК, shРНК и тому подобное могут состоять, по меньшей мере, из десяти смежных оснований в последовательности РНК, соответствующей одной из последовательностей-мишеней, приведенных ниже, как это определено выше.
siРНК, shРНК и тому подобное могут быть направлены на одну из последовательностей-мишеней, приведенных ниже. Эти последовательности относятся к последовательностям SEQ ID NO:476-SEQ ID NO:1309.
мутации
В данном документе предусматриваются антитела, которые специфически связываются с обеспеченным выше мутантным белком(и) кальретикулином. Такие антитела можно использовать для диагностических и терапевтических целей по настоящему изобретению. Например, антитела, направленные против С-концевого уникального полипептида мутированного кальретикулина, предлагают и обеспечивают диагностический тест для миелоидного новообразования. Также детектирование пептидов, полученных из этого уникального С-конца, с помощью масс-спектрометрии предлагает и обеспечивает диагностический тест для миелоидного новообразования. Предпочтительно такие антитела являются ингибиторами мутантного кальретикулина.
Например, антитела, используемые здесь, могут специфически связываться со следующим мутантным белком(ами) кальретикулином(ами), показанным в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 и 434 соответственно. В частности, такие антитела могут специфически связываться с С-концом мутантного белка(ами) кальретикулина(ов), например, с белками, показанными в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36 , 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144 соответственно.
В настоящем документе предусматривается, что антитела могут специфически связываться с (функциональными) фрагментами или (функциональными) производными мутантных белков кальретикулинов, как здесь определено, например, также с полипептидами, обладающими, по меньшей мере, 70% или более идентичностью с обеспеченным здесь мутантным белком(ами) кальретикулином(ами).
Следовательно, настоящее изобретение относится к применению данных антител в способах по настоящему изобретению. Таким образом, настоящее изобретение относится к применению описанного здесь выше антитела/антител, специфически связывающегося с или специфически распознающего один или более описанных и обеспеченных здесь полипептидов мутантных белков кальретикулинов для оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием.
Настоящее изобретение также относится к антителу/антителам, как здесь определено выше, или композиции, как здесь определено выше, содержащей указанное антитело/антитела, для получения диагностического набора для применения в способах по настоящему изобретению.
Антитело может представлять поликлональное антитело, моноклональное антитело, полное антитело (иммуноглобулин), F(аb)-фрагмент, F(аb)2-фрагмент, одноцепочечное антитело, химерное антитело, антитело привитым с CDR, двухвалентное антитело-конструкция, биспецифическое одноцепочечное антитело, синтетическое антитело или кросс-реактивное клонированное антитело и тому подобное.
Поликлональные или моноклональные антитела или другие антитела (полученные из них) обычно можно получить с использованием, среди прочего, стандартных протоколов иммунизации; смотри руководства Ed Harlow, David Lane, (December 1988), Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory; или Ed Harlow, David Lane, (December 1998), Portable Protocols (Using Antibodies): A Laboratory Manual 2nd edition, Cold Spring Harbor Laboratory.
Например, иммунизация может включать внутрибрюшинное или подкожное введение мутантного белка/полипептида кальретикулина (и/или его фрагментов, изоформ, гомологов и тому подобное), как здесь определено, млекопитающему (например, грызунам, таким как мыши, крысы, хомяки и т.п.). Предпочтительно используют фрагменты мутантного белка/полипептида, где фрагмент предпочтительно имеет С-конец (или его фрагмент), как здесь определено.
Предпочтительный фрагмент вышеуказанных полипептидов (т.е. мутантного белка/полипептида(ов) кальретикулина(ов)), обеспеченных здесь и используемых по настоящему изобретению, состоит из 15-25 смежных аминокислот. Следовательно, фрагмент вышеуказанных полипептидов, обеспеченных здесь и используемых по настоящему изобретению, предпочтительно состоит из 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 смежных аминокислот. Фрагмент вышеуказанных полипептидов, обеспеченных здесь и используемых по настоящему изобретению, предпочтительно состоит из 15-25 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 4. Фрагмент вышеуказанных полипептидов, обеспеченных здесь и используемых по настоящему изобретению, предпочтительно состоит из 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 4.
В качестве доказательства принципа фрагмент (RRKMSPARPRTSCREACLQGWTEA) использовали для получения поликлональных антител, которые специфически связываются с мутантным кальретикулином; смотри пример 2. Данный фрагмент состоит из 24 смежных аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 4. Такие поликлональные антитела могут быть использованы в качестве инструмента при проведении исследований и/или в диагностических методах, представленных здесь. Данный фрагмент мутантного белка кальретикулина (или другие фрагменты, обеспеченные и определенные здесь), можно использовать в качестве вакцины, как описано в данном документе ниже.
Способы получения и скрининга антител, которые специфически связываются с или специфически распознают мутантные полипептиды, известны в данной области техники. Например, антитела, распознающие мутантный белок, можно очистить аффинной хроматографией. Обычно используют ELISA для скрининга сывороток и/или количественного анализа фракций с аффинной колонки. Вестерн-блоттинг может быть использован для демонстрации того, что антитело может детектировать фактический интересующий белок и для оценки того, антитело распознает только интересующий белок или насколько оно перекрестно реагирует с другими белками.
Специалисты в данной области способны применить и адаптировать принципы настоящих документов для получения и валидации антител, специфически связывающихся с или специфически распознающих полипептиды, как здесь определено, в контексте настоящего изобретения.
Последующее относится к применению обеспеченных здесь мутантных белков кальретикулинов в качестве вакцины. Таким образом, мутантные белки кальретикулины функционируют в качестве антигенов. Следовательно, термины «мутантный белок кальретикулин» и «мутантные белки-антигены кальретикулины» и т.п., в последующем могут использоваться в настоящем описании взаимозаменяемо.
Согласно вышеизложенному, обеспеченные здесь мутантные белки кальретикулины можно использовать в качестве вакцины. Другими словами, обеспеченные здесь мутантные белки кальретикулины можно использовать в активной иммунизации. Таким образом, настоящее изобретение относится к мутантным белкам кальретикулинам, как здесь определено и обеспечено (или нуклеиновым кислотам (или векторам, содержащим их), кодирующим мутантные белки кальретикулины), как здесь определено и обеспечено, для применения в качестве вакцины. Мутантные белки кальретикулины, их фрагменты и производные были очень подробно описаны здесь выше. Данные пояснения и определения, с соответствующими изменениями, используются в этом контексте. Пригодные в качестве вакцины белки представляют, в частности, белки, содержащие или состоящие из С-конца обеспеченных здесь мутантных белков кальретикулинов, показанных в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40 , 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144 соответственно, а также их фрагменты. Особенно пригодными в этом контексте являются мутантные белки кальретикулины, которые содержат или включают минимальный С-конец, показанный в SEQ ID NO:4, или его фрагмент.
Настоящее изобретение относится к белку для применения в качестве вакцины, где белок выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
Настоящее изобретение относится к белку для применения в качестве вакцины, где белок выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(с) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(d) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а);
(e) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(d); и
(f) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (с) или (d).
Настоящее изобретение относится к белку для применения в качестве вакцины, как здесь определено выше, где белок состоит из 15 до 25 смежных аминокислот белка, как показано в SEQ ID NO: 4.
Предпочтительно фрагмент белка, показанного в SEQ ID NO: 4, содержащий или состоящий из 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40 аминокислот белка, показанного в SEQ ID NO:4, используется в качестве вакцины. Особенно предпочтительными являются фрагменты белка, показанного в SEQ ID NO: 4, содержащие или состоящие из 15 до 25 смежных аминокислот белка, показанного в SEQ ID NO: 4, для применения в качестве вакцины. Следовательно, фрагмент белка, показанного в SEQ ID NO: 4, содержащий или состоящий из 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 смежных аминокислот белка, показанного в SEQ ID NO: 4, применяется в качестве вакцины.
Такие фрагменты или производные белка, показанного в SEQ ID NO: 4, можно соединить с белками, такими как гемоцианин лимфы улитки (KLH), бычий сывороточный альбумин (BSA) или бактериальные токсоиды (например, столбнячный токсоид, дифтерийный токсоид), и использовать для иммунизации.
Вакцину можно использовать в лечении миелоидных новообразований, как здесь определено.
Следовательно, настоящее изобретение относится к способу профилактического или терапевтического лечения миелоидного новообразования, как здесь определено, включающему введение эффективного количества вакцины, как здесь определено выше, пациенту. Другими словами, настоящее изобретение относится к способу профилактического или терапевтического лечения миелоидного новообразования, как здесь определено, включающему введение эффективного количества мутантного белка кальретикулина, как здесь определено выше, пациенту.
Например, несмотря на то, что пациент в норме не будет реагировать на CALR, за счет аутотолерантности, многие из мутаций экзона 9 CALR вызывают сдвиг рамки считывания таким образом, что С-концевой участок мутантного CALR будет отличаться от CALR дикого типа, и, следовательно, не будет подвергаться аутотолерантности. Иммунизация мутантным полипептидом будет вызывать иммунный ответ против мутантного CALR. Следовательно, вакцина может быть использована в терапевтических целях для направленного воздействия на имеющийся рак.
Вакцину также можно использовать профилактически. Например, известно, что раковые опухоли могут мутировать, и у них может развиться способность к уклонению от иммунного ответа хозяина и противоракового лечения. Таким образом, у пациента с миелоидным новообразованием, который не имеет мутации CALR, или одну мутацию CALR, впоследствии могут развиться дополнительные мутации CALR. Иммунизация против других мутантных форм CALR может, следовательно, может обеспечить отбор таких CALR мутантов.
Мутанты CALR также могут использоваться для получения антител in vitro или в организме другого животного для применения в лечении пациента. Такой подход особенно пригоден, поскольку антитела могут быть получены против эпитопов, переносимых у пациента. Такие антитела также можно использовать для лечения, поскольку их титр можно точно контролировать, и антитело также можно конъюгировать с токсинами или радионуклидами для направленной терапии.
Примерный протокол для проведения активной иммунизации (или для применения вакцин, обеспеченных здесь выше), можно описать следующим образом:
например, мышей можно иммунизировать вакциной (например, пептидом, полученным из белка, показанного в SEQ ID NO: 4, или пептидом, который представляет собой фрагмент белка, показанного в SEQ ID NO: 4, где пептид связан с KLH или BSA), перед трансплантацией клеток костного мозга, экспрессирующих мутантный кальретикулин или кальретикулин дикого типа. Иммунизированных мышей-реципиентов можно облучить сублетальной или летальной дозой для обеспечения приживления или вообще не подвергать облучению. Трансплантированные клетки могут представлять собой смесь клеток, экспрессирующих мутантный кальретикулин или кальретикулин дикого типа. После трансплантации проводят наблюдение за иммунизированными мышами. Если иммунный ответ индуцируется против клеток, экспрессирующих мутантный кальретикулин, то предпочтительно будут приживаться клетки, экспрессирующие кальретикулин дикого типа. Обязательно используют контрольных мышей без иммунизации. Альтернативно иммунизацию можно провести после пересадки мышам смеси 50:50 (или в другом соотношении) клеток, экспрессирующих кальретикулин дикого типа/мутантный кальретикулин. Если иммунный ответ индуцирован против клеток, экспрессирующих мутантный кальретикулин, то соотношение 50:50 (или другое) будет меняться в сторону клеток, экспрессирующих кальретикулин дикого типа. Для сравнения используют контрольных мышей без иммунизации.
Настоящее изобретение относится к применению мутантного белка кальретикулина в качестве антигена, как здесь обеспечено и определено выше, и, необязательно адъюванта, для производства вакцинной композиции для лечения или профилактики миелоидного новообразования, как здесь определено.
Мутантный белок кальретикулин можно получить рекомбинантным способом (т.е. продуцировать в соответствующих клетках-хозяевах) или синтетическим способом (т.е. синтезировать химически). Рекомбинантная продукция мутантного белка кальретикулина описана в настоящем документе. Например, рекомбинантное получение может быть достигнуто с использованием любых методик молекулярного клонирования и рекомбинантной экспрессии, известных в данной области техники. Например, молекулу нуклеиновой кислоты, кодирующую мутантный белок кальретикулин, можно ввести в соответствующую клетку-хозяин, такую как бактерия, дрожжевая клетка (например, клетка Pichia), клетка насекомого или клетка млекопитающего (например, клетка СНО). Кодирующую молекулу нуклеиновой кислоты можно поместить в операбельной связи с промотором, способным эффективно воздействовать на экспрессию мутантного белка-антигена кальретикулина в клетке-хозяине. Мутантный белок кальретикулин, который экспрессируется в клетке-хозяине, можно легко очистить с использованием обычных методов очистки белков.
Например, нуклеотидная последовательность, показанная в SEQ ID NO: 1, 2 или 3, или последовательность нуклеиновой кислоты, кодирующая мутантный белок-антиген кальретикулин, показанная в SEQ ID NO: 4 или ее кодирующий фрагмент, такой как белок, состоящий из 15-25 смежных аминокислот белка, показанного в SEQ ID NO: 4, может быть клонирована в экспрессионный вектор и помещена в операбельной связи с температурно-чувствительным промотором. Экспрессионный вектор может быть введен в Escherichia coli и при тепловой индукции можно экспрессировать антиген. Клетки можно лизировать и тельца включения, где накапливается антиген, отделить центрифугированием. Рекомбинантный белок в тельцах включения солюбилизируют с использованием SDS или других солюбилизирующих агентов, известных в данной области, таких как мочевина, гуанидина гидрохлорид, холат натрия, таурохолат и дезоксихолат натрия. Согласно настоящему изобретению очищенный рекомбинантный мутантный белок кальретикулин объединяют с фармацевтически приемлемым носителем с получением вакцинной композиции.
Настоящее изобретение относится к иммуногенной композиции для обеспечения защитного действия у пациента от миелоидного новообразования, композиции, содержащей мутантный белок кальретикулин. Композиция может быть формулирована в виде вакцины для введения in vivo пациенту. Композиция может содержать адъювант, такой как гидроксид или фосфат алюминия.
Кроме того, настоящее изобретение относится к иммуногенной композиции, содержащей мутантный белок кальретикулин, как здесь определено выше, для применения в качестве лекарственного средства. Композиция, содержащая мутантный белок кальретикулин, как здесь определено выше, может использоваться для производства лекарственного средства для иммунизации хозяина или пациента против заболевания миелоидного новообразования.
Настоящее изобретение относится к вакцинной композиции, содержащей мутантный белок-антиген кальретикулин, как здесь определено (или относится к «вакцине на основе мутантного белка кальретикулина»), которая подходит для введения пациентам и способна защитить пациентов от развития миелоидного новообразования.
Термин «фармацевтически приемлемый носитель» включает любые и все растворители, дисперсионные среды, покрытия, адъюванты, стабилизирующие агенты, разбавители, консерванты, антибактериальные и противогрибковые агенты, изотонические агенты, агенты, замедляющие всасывание, и тому подобное. Разбавители могут включать воду, физиологический раствор, декстрозу, этанол, глицерин и тому подобное. Изотонические агенты могут включать, среди прочего, хлорид натрия, декстрозу, маннит, сорбит и лактозу. Стабилизаторы включают, среди прочего, альбумин.
Адъюванты, подходящие для применения в вакцинной композиции по настоящему изобретению, включают, не ограничиваясь несколькими группами адъювантов, такие как минеральные соли, например, квасцы, гидроксид алюминия, фосфат алюминия и фосфат кальция; поверхностно-активные вещества и микрочастицы, например, неионогенные блок-полимерные поверхностно-активные вещества (например, холестерин), виросомы, сапонины (например, Quil A, QS-21 и GPI-0100), протеосомы, иммуностимулирующие комплексы, кохлеаты, четвертичные амины (диметил диоктадецил аммоний бромид) (DDA), авридин, витамин А, витамин Е; бактериальные продукты, такие как адъювантная система RIBI (Ribi Inc.), скелет клеточной стенки Mycobacterum phlei (Detox®), мурамилдипептиды (MDP) и трипептиды (MTP), монофосфориллипид А, бацилла Кальметта-Герена, термолабильные энтеротоксины E. coli, холерный токсин, димиколат трегалозы, олигодезоксинуклеотиды CpG; цитокины и гормоны, например, интерлейкины (IL-1, IL-2, IL-6, IL-12, IL-15, IL-18), гранулоцитарно-макрофагальный колониестимулирующий фактор, дегидроэпиандростерон, 1,25-дигидроксивитамин D3; полианионы, например, декстран; полиакрилаты (например, полиметилметакрилат, карбопол 934Р); носители, например, столбнячный токсоид, дифтерийный токсоид, B-субъединица холерного токсина, мутантный термолабильный энтеротоксин энтеротоксигенных E.coli (rmLT), белки теплового шока; эмульсии масло-в-воде, такие как AMPHIGEN® (Hydronics, США) и эмульсии вода-в-масле, такие как, например, полный и неполный адъюванты Фрейнда.
Обеспеченный здесь мутантный белок-антиген кальретикулин и фармацевтически приемлемый носитель могут быть объединены любым удобным и практическим способом для получения вакцинной композиции, например, посредством смешивания, растворения, суспендирования, эмульгирования, капсулирования, абсорбции и т.п., и могут быть приготовлены в лекарственных формах, таких как таблетки, капсулы, порошок, сироп, суспензии, которые пригодны для инъекций, имплантаций, ингаляций, приема внутрь или тому подобное. Предпочтительно вакцина формулирована таким образом, что ее можно вводить пациентам инъекцией в дозе примерно от 0,1 до 5 мл, или предпочтительно примерно от 0,5 до 2,5 мл, или еще более предпочтительно в дозе примерно 1 мл. При необходимости фармацевтические композиции по настоящему изобретению должны быть обеспечены стерильными с использованием хорошо известных процедур.
Количество обеспеченного здесь мутантного белка-антигена кальретикулина в вакцинах должно быть эффективным для обеспечения иммунизации и, как правило, находится в пределах от 0,5 до 1000 пг на дозу.
Количество адъювантов, пригодных для использования в вакцинах, зависит от свойств используемого адъюванта. Например, когда в качестве адъюванта используют Quil А и холестерин, то обычно Quil А находится в количестве примерно 1-1000 пг на дозу; и холестерин, как правило, находится в количестве примерно 1-1000 пг на дозу.
Согласно настоящему изобретению вакцину можно вводить любыми известными путями, включая пероральный, интраназальный, мукозальный, местный, трансдермальный и парентеральный (например, внутривенный, внутрибрюшинный, внутрикожный, подкожный или внутримышечный). Введение также можно проводить с использованием безыгольных устройств для доставки агентов. Введение может быть достигнуто с использованием комбинации путей, например, первое введение проводят с использованием парентерального пути и последующее введение с использованием мукозального пути. Предпочтительные способы введения включают подкожные и внутримышечные введения.
Настоящее изобретение обеспечивает комбинированные вакцины и способы защиты пациентов введением таких комбинированных вакцин.
Настоящее изобретение относится к иммуногенному агенту, где иммуногенный агент представляет мутантный белок кальретикулин, как здесь определено и представлено выше. Указанный агент является эффективным для индукции иммунного ответа против мутантных белков кальретикулинов у пациента. Следовательно, иммуногенный агент можно использовать в лечении или профилактике миелоидного новообразования, как здесь определено.
Кроме того, настоящее изобретение относится к конъюгату, включающему иммуногенный агент, связанный с белком-носителем. Иммуногенный агент представляет мутантный белок кальретикулин, как здесь определено и представлено выше. Белок-носитель (такой как сывороточный альбумин и другие) может усиливать иммунный ответ. Конъюгат может представлять слитый белок, содержащий иммуногенный агент (т.е. мутантный белок кальретикулин, как здесь определено и представлено выше), слитый с белком-носителем. Агент также может быть связан с белком-носителем посредством химического сшивания. Агент может быть связан или слит с амино-концом белка-носителя. Агент может быть связан или слит с карбоксильным концом белка-носителя. Агент может быть связан или слит с внутренней частью белка-носителя. Многократные повторы или мультимеры агента могут присутствовать в конъюгате, таком как слитый белок. Агент может быть частью более длинного полипептида, который включает агент с другими аминокислотами. Агент может быть компонентом частицы. Частица может представлять липосому или микрочастицу. Агент можно эмульгировать или инкапсулировать в частицы, такие как липосомы или микрочастицы.
Присутствие уникального С-концевого полипептида в мутированных белках кальретикулинах, как здесь обеспечено, дает возможность нацеливаться на мутантный белок, оставляя белок дикого типа интактным. Поскольку аминокислотная последовательность, полученная из -1 рамки считывания экзона 9 кальретикулина, кодирует пептид, не показывающий гомологии с любым другим белком позвоночных, то против него можно получить ингибиторы, определенные выше (например, антитела (предпочтительно ингибирующие антитела), siРНК, shРНК или низкомолекулярные препараты), с терапевтическим эффектом. Например, С-концевая аминокислотная последовательность мутантного белка кальретикулина (такого как мутантный белок, полученный из альтернативной рамки считывания экзона 9) может быть использована для получения поликлональных и моноклональных антител (предпочтительно ингибирующих антител). Следовательно, мутантный кальретикулин, как здесь обеспечено, является ценной мишенью для иммунотерапии при миелоидных новообразованиях. Альтернативно иммунизация пациентов мутантным пептидом или рекомбинантными мутантными белками может быть использована в терапевтическом вмешательстве при миелоидных новообразованиях.
Было показано, что кальретикулин секретируется из клеток, и его можно детектировать в сыворотке. Кальретикулин также попадает на клеточную поверхность, где он обеспечивает «сигнал съешь меня» для фагоцитоза апоптотических клеток.
Следовательно, настоящее изобретение относится к ингибитору мутантного кальретикулина для применения в качестве лекарственного средства. Кроме того, настоящее изобретение относится к мутантному белку кальретикулину, как здесь обеспечено, антителам, специфически связывающимся с ним (предпочтительно ингибирующим антителам), нуклеиновым кислотам, как здесь обеспечено (в частности, нуклеиновым кислотам, кодирующим мутантный белок кальретикулин), siРНК, как здесь обеспечено, для применения в качестве лекарственного средства. Термины «лекарственное средство» и «фармацевтическая композиция» используются здесь взаимозаменяемо. Следовательно, определения и пояснения, приведенные здесь, в отношении «фармацевтических композиций», применяются, с соответствующими изменениями, к термину «лекарственное средство».
Настоящее изобретение относится к ингибитору мутантного кальретикулина для применения в лечении миелоидного новообразования.
Настоящее изобретение относится к способу лечения пациента с миелоидным новообразованием, включающему введение эффективного количества ингибитора мутантного кальретикулина пациенту.
Пациент, подлежащий лечению, представляет пациента, который оценивается как «положительный» по настоящему изобретению, то есть пациента, образец которого определен, как имеющий один или более мутантных аллелей гена кальретикулина.
Следовательно, настоящее изобретение относится к ингибитору мутантного кальретикулина для применения в лечении миелоидного новообразования, посредством чего лечится пациент, который страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда один или более мутантных аллелей гена кальретикулина (или его генный продукт) в образце от указанного пациента, определен как присутствующий.
Все определения и пояснения, приведенные здесь выше в отношении определения присутствия одного или более мутантных аллелей гена кальретикулина (или его генного продукта) в образце от указанного пациента, применяются, с соответствующими изменениями, в этом контексте.
Настоящее изобретение относится к способу лечения пациента с миелоидным новообразованием, включающему введение эффективного количества ингибитора мутантного кальретикулина пациенту, где способ дополнительно включает оценку того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, включающему:
- определение присутствия одного или более мутантных аллелей гена кальретикулина (или его генного продукта) в образце от указанного пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный один или более мутантных аллелей гена кальретикулина (или его генный продукт).
Все определения и пояснения, приведенные здесь выше в отношении определения присутствия одного или более мутантных аллелей гена кальретикулина (или его генного продукта) в образце от указанного пациента, применяются, с соответствующими изменениями, в этом контексте.
Мутантный кальретикулин может представлять мутантный белок кальретикулин, как здесь определено выше. Если мутантный кальретикулин является мутантным белком кальретикулином, то ингибитор может представлять собой антитело (предпочтительно ингибирующее антитело), внеклеточные партнеры по связыванию, небольшие связывающие молекулы, аптамеры или интрамеры.
Мутантный кальретикулин может представлять нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, как здесь определено выше. Если мутантный кальретикулин представляет такую нуклеиновую кислоту (предпочтительно мРНК, как здесь обеспечено и определено выше), то ингибитор может представлять siРНК, miРНК, dsРНК, shРНК, stРНК и антисмысловые молекулы.
Как упоминалось выше, миелоидное новообразование включает миелопролиферативное новообразование или миелодиспластический синдром. Примером миелопролиферативного новообразования является первичный миелофиброз (ПМФ). Предпочтительной является терапия миелопролиферативного новообразования, в частности, терапия первичного миелофиброза (ПМФ) или эссенциальной тромбоцитемии (ЭТ). Примером миелодиспластического синдрома, подвергающегося терапевтическому вмешательству по настоящему изобретению, является рефрактерная анемия с кольцевыми сидеробластами и тромбоцитемией (RARS-T).
Термины «лечение», «проводить лечение» и т.п. используются здесь для общего обозначения получения желаемого фармакологического и/или физиологического эффекта. Эффект может быть профилактическим в плане полной или частичной профилактики заболевания и/или побочного эффекта, возникшего за счет заболевания. Как здесь используется, термин «лечение охватывает любое лечение заболевания у субъекта, и включает: (а) предупреждение связанного заболевания у субъекта, который может быть предрасположен к развитию заболеванию; (b) подавление заболевания, т.е. остановку его развития или (с) ослабление заболевания, то есть регрессию заболевания.
Термины «индивидуум», «пациент» или «субъект» для целей настоящего изобретения включает как людей, так и других животных, в частности, млекопитающих, и другие организмы. Таким образом, способы применимы к терапии в гуманной медицине и к терапии в ветеринарии. Предпочтительно, «индивидуум», «пациент» или «субъект» представляет собой млекопитающее, и наиболее предпочтительно «индивидуум», «пациент» или «субъект» представляет собой человека.
Ингибитор мутантного кальретикулина можно вводить самостоятельно в качестве одного агента (т.е. в виде монотерапии) или в виде комбинированной терапии, например, с обычными препаратами, такими как гидроксимочевина или интерферон-альфа.
Фармацевтическую композицию формулируют и дозируют способом, согласующимся с доброкачественной медицинской практикой, с учетом клинического состояния каждого отдельного пациента, места доставки фармацевтической композиции, способа введения, схемы введения и других факторов, известных практикующим специалистам. «Эффективное количество» фармацевтической композиции, предназначенной для целей настоящего изобретения, таким образом, определяется с учетом указанных соображений.
Специалисту в данной области известно, что эффективное количество фармацевтической композиции, вводимое индивидууму, среди прочего, зависит от свойств соединения.
Например, если указанный ингибитор представляет собой небольшую молекулу, то общее (фармацевтически) эффективное количество ингибитора в фармацевтической композиции, вводимое перорально на дозу будет находиться в пределах примерно от 50 мг ингибитора в день до 1000 ингибитора мг в день пациенту, хотя, как было отмечено выше, это будет определяться по усмотрению врача. Более предпочтительно эта доза составляет 50 мг ингибитора в день, и наиболее предпочтительно для людей она находится в пределах примерно от 50 мг до 600 ингибитора мг в день. Например, ингибитор можно вводить в дозе 15 мг/кг массы тела в день. Если имеет место непрерывное введение, то, как правило, ингибитор вводят в дозе из расчета примерно от 50 мг в день до 600 мг в день. Также можно использовать мешок для раствора для внутривенного введения. На протяжении лечения необходимо проводить наблюдение за изменениями и интервал после лечения может варьировать с учетом возникающих ответных реакций в зависимости от получения желаемого эффекта. Конкретные количества могут быть определены с помощью обычных тестов, которые хорошо известны специалисту в данной области техники. На протяжении лечения необходимо проводить наблюдение за изменениями и интервал после лечения может варьировать с учетом возникающих ответных реакций в зависимости от получения желаемого эффекта. Конкретные количества можно определить с использованием обычных тестов, которые хорошо известны специалисту в данной области.
Введение обеспеченных здесь композиций может, среди прочего, включать введение два раза в день, один раз в день, через день, один раз в три дня, один раз в четыре дня, один раз в пять дней, один раз в неделю, один раз в две недели, один раз в три недели, один раз в месяц и т.д.
Например, если указанное соединение представляет полипептид или белок, то общее фармацевтически эффективное количество фармацевтической композиции, вводимой парентерально, на дозу будет находиться в пределах примерно от 1 мкг белка/кг массы пациента/день до 15 мг белка/кг массы пациента/день, хотя, как было отмечено выше, это будет определяться по усмотрению врача. Более предпочтительно эта доза составляет, по меньшей мере, 0,01 мг белка/кг/день, и наиболее предпочтительно для людей примерно от 0,01 до 1 мг белка/кг/день. Если введение является непрерывным, то, как правило, фармацевтическую композицию вводят в дозе из расчета примерно от 1 мкг/кг/ч до примерно 50 мкг/кг/ч, или 1-4 инъекций в сутки или посредством непрерывных подкожных инфузий, например, с использованием мининасоса. Также можно использовать мешок для внутривенного введения раствора. На протяжении лечения необходимо проводить наблюдение за изменениями и интервал после лечения может варьировать с учетом возникающих ответных реакций в зависимости от получения желаемого эффекта. Конкретные количества могут быть определены с помощью обычных тестов, которые хорошо известны специалисту в данной области техники.
Фармацевтические композиции по настоящему изобретению можно вводить перорально, ректально, парентерально, интрацистернально, интравагинально, внутрибрюшинно, местно (в виде порошков, мазей, капель или трансдермального пластыря), буккально или в виде орального или назального спрея.
Фармацевтические композиции по настоящему изобретению предпочтительно содержат фармацевтически приемлемый носитель. Под термином «фармацевтически приемлемый носитель» понимается нетоксичный твердый, полутвердый или жидкий наполнитель, разбавитель, инкапсулирующий материал или формообразующее вспомогательное вещество любого типа. Как здесь используется, термин «парентеральный» относится к способам введения, которые включают внутривенные, внутримышечные, внутрибрюшинные, интрастернальные, подкожные и внутрисуставные инъекции и инфузии.
Фармацевтическую композицию также соответствующим образом вводят с помощью систем с замедленным высвобождением. Подходящие примеры композиций с замедленным высвобождением включают полупроницаемые полимерные матрицы в виде формованных изделий, например, пленок или микрокапсул. Матрицы с замедленным высвобождением включают полилактиды (патент США № 3773919, EP 58481), сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата (Sidman U. et al., Biopolymers, 22:547-556 (1983)), поли-2-гидроксиэтилметакрилат (R. Langer et al., J. Biomed. Mater. Res., 15:167-277 (1981) и R. Langer, Chem. Tech., 12:98-105 (1982)), этиленвинилацетат (R. Langer et al., там же) или поли-D-(-)-3-гидроксимасляную кислоту (ЕР 133988). Фармацевтические композиции с замедленным высвобождением также включают включенное в липосомы соединение. Липосомы, содержащие фармацевтическую композицию, получают способами, известными сами по себе: DE 3218121; Epstein et al., Proc. Natl. Acad. Sci. (USA), 82:3688-3692 (1985); Hwang et al., Proc. Natl. Acad. Sci. (USA), 77:4030-4034 (1980); EP 52322; EP 36676; EP 88046; EP 143949; EP 142641; патентная заявка Японии 83-118008; патенты США № 4485045 и 4544545; и EP 102324. Как правило, липосомы представляют везикулы небольшого размера (примерно 200-800 Å) однослойного типа, в которых содержание липида выше, чем примерно 30 моль% холестерина, выбранные отношения корректируются для обеспечения оптимальной терапии.
Для парентерального введения фармацевтическая композиция, как правило, формулируется смешиванием ее с требуемой степенью чистоты, в разовой инъекционной форме (раствор, суспензия или эмульсия) с фармацевтически приемлемым носителем, то есть таким, который является нетоксичным для реципиентов в используемых дозах и концентрациях и совместимым с другими ингредиентами композиции.
Как правило, композиции получают равномерным и однородным смешиванием компонентов фармацевтической композиции с жидкими носителями или тонко измельченными твердыми носителями или обоими. Затем, если необходимо, продукт формуют в нужную формуляцию. Предпочтительно носитель представляет носитель для парентерального введения, более предпочтительно раствор, который является изотоническим с кровью реципиента. Примеры таких носителей включают воду, физиологический раствор, раствор Рингера и раствор декстрозы. Неводные носители, такие как нелетучие масла и этилолеат, также пригодны здесь, и также липосомы. Носитель соответственно содержит небольшие количества добавок, таких как вещества, повышающие изотоничность и химическую стабильность. Такие вещества являются нетоксичными для реципиентов в используемых дозах и концентрациях, и они включают буферы, такие как фосфат, цитрат, сукцинат, уксусную кислоту и другие органические кислоты или их соли; антиоксиданты, такие как аскорбиновая кислота; низкомолекулярные полипептиды (менее чем примерно десять остатков), например, полиаргинин или трипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутаминовая кислота, аспарагиновая кислота или аргинин; моносахариды, дисахариды и другие углеводы, включая целлюлозу или ее производные, глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахарные спирты, такие как маннит или сорбит; противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как полисорбаты, полоксамеры или ПЭГ.
Компоненты фармацевтической композиции, которые применяются для терапевтического введения, должны быть стерильными. Стерильность легко достигается фильтрацией через стерилизующие фильтрационные мембраны (например, мембраны 0,2 мкм). Терапевтические компоненты фармацевтической композиции, как правило, помещают в контейнер, имеющий стерильное входное отверстие, например, мешок или флакон для раствора для внутривенного введения, имеющий пробку, прокалываемую иглой для подкожных инъекций.
Компоненты фармацевтической композиции обычно будут храниться в однодозовых или многодозовых контейнерах, например, запаянных ампулах или флаконах, в виде водного раствора или в виде лиофилизированного препарата для последующего восстановления. В качестве примера лиофилизированного препарата флаконы емкостью 10 мл заполняют 5 мл стерилизованного фильтрацией 1% (мас./об.) водного раствора, и полученную смесь подвергают лиофилизации. Инфузионный раствор готовят восстановлением лиофилизированного соединения(й) с использованием бактериостатической воды для инъекций.
Целью лечения истинной полицитемии является снижение количества избыточных клеток крови. Лечение истинной полицитемии может включать флеботомию, химиотерапию с или без флеботомии, биологическую терапию с использованием интерферона-альфа или пегилированного интерферона-альфа и низких доз аспирина.
Лечение первичного миелофиброза у пациентов без признаков или симптомов заболевания, как правило, заключается в бдительном выжидании. У пациентов с первичным миелофиброзом могут иметь место признаки или симптомы анемии. Анемия обычно лечится с помощью переливания эритроцитов для облегчения симптомов и улучшения качества жизни. Кроме того, анемию можно лечить эритропоэтическими факторами роста, преднизоном, даназолом, талидомидом, леналидомидом или помалидомидом. Лечение первичного миелофиброза у пациентов с другими признаками или симптомами может включать направленную терапию руксолитинибом (ингибитор JAK1 и JAK2), химиотерапию, трансплантацию донорских стволовых клеток, лечение талидомидом, леналидомидом или помалидомидом, спленэктомию, локальную лучевую терапию селезенки, лимфатических узлов или других областей вне костного мозга, где образуются клетки крови, биологическую терапию с использованием интерферона-альфа или эритропоэтических факторов роста, или включение в клинические испытания других препаратов направленной терапии.
Лечение эссенциальной тромбоцитемии у пациентов моложе 60 лет, которые не имеют признаков или симптомов заболевания и с приемлемым количеством тромбоцитов, обычно заключается в бдительном выжидании. В некоторых случаях пациент может принимать аспирин с целью предупреждения образования тромбов. Лечение других пациентов может включать химиотерапию, терапию гидроксимочевиной, анагрелидом, биологическую терапию с использованием интерферона-альфа или пегилированного интерферон-альфа, аферез тромбоцитов.
JAK-связывающий ингибитор руксолитиниб является обещающим для медикаментозного и поддерживающего лечения. В 2011 г. руксолитиниб был одобрен Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов для применения в лечении миелофиброза с высоким и промежуточным риском; смотри Tefferi, March 22, 2012; Blood: 119 (12). Ostojic также сообщает, что руксолитиниб используется в лечении миелофиброза; смотри публикацию Ostojic, Therapeutics and Clinical Risk Management, 2012:8, 95-103.
Ингибиторы JAK, которые в настоящее время используются в клинических испытаниях для лечения миелопролиферативных новообразований, включают, помимо руксолитиниба, SAR302503, CYT387, лестауртиниб, SB1518, AZD1480, BMS911543, LY2784544, NS-018 и XL019; Tefferi, March 22, 2012; Blood: 119(12).
Приведенная в качестве примера формула руксолитиниба ((3R)-3-циклопентил-3-[4-(7H-пирроло[2,3-d]пиримидин-4-ил)пиразол-1-ил]пропаннитрил; торговое название Jakafi, Jakavi), представлена ниже:
При рефрактерной анемии с кольцевыми сидеробластами и тромбоцитозом могут потребоваться переливания крови и другая поддерживающая терапия для компенсации анемии, включая высокие дозы пиродоксина (витамина B6). Пересадка костного мозга также является вариантом лечения. RARS-T также может прогрессировать до развития лейкоза.
Использование вышеуказанных видов лечения предполагается для пациентов с положительным или отрицательным результатом на присутствие мутантного кальретикулина по настоящему изобретению, самостоятельно или в комбинации с препаратами (например, антителами), специфически нацеленными на мутантный кальретикулин. Следовательно, препараты (например, антитела), которые направлены на мутантный CALR, также могут быть пригодны в лечении, если они используются в виде монотерапии или в комбинации с другими видами лечения. Например, терапия интерфероном-альфа может быть использована для лечения пациентов с МПН (таких как пациенты с эссенциальной тромбоцитемией) с положительной реакцией на присутствие мутантного кальретикулина по настоящему изобретению.
Если, например, пациент тестирован как положительный на присутствие мутантного кальретикулина и мутацию(и) JAK2, то в этом случае предусматривается применение ингибитора(ов) JAK (например, руксолитиниба). В зависимости от клинических параметров (например, возраста, прогноза у пациента) также можно использовать дополнительные методы лечения, такие как трансплантация стволовых клеток, например, для пациента с положительным тестом на наличие мутантного кальретикулина.
Ингибиторы для применения по настоящему изобретению описаны и представлены здесь. Кроме того, в контексте настоящего изобретения предусматривается применение ингибиторов, которые будут получены еще в будущем, или известных соединений, которые будут испытаны на их ингибирующую активность.
Следовательно, настоящее изобретение относится к способу оценки активности молекулы-кандидата, в отношении которой имеется предположение о том, что она является ингибитором мутантного кальретикулина, как здесь определено и обеспечено, включающему стадии:
(a) контактирование клетки, ткани или животного, отличного от человека, содержащих мутантный кальретикулин, с указанной молекулой-кандидатом;
(b) детектирование снижения активности указанного мутантного кальретикулина; и
(c) отбор молекулы-кандидата, которая уменьшает активность указанного мутантного кальретикулина;
где снижение активности является показателем способности отобранной молекулы быть пригодной в лечении миелоидного новообразования, как здесь определено.
Также снижение уровня (экспрессии) может указывать на пригодные ингибиторы.
Настоящее изобретение относится к способу оценки активности молекулы-кандидата, в отношении которой имеется предположение о том, что она является ингибитором мутантного кальретикулина, как здесь определено и обеспечено, включающему стадии:
(a) контактирование клетки, ткани или животного, отличного от человека, содержащих мутантный кальретикулин, с указанной молекулой-кандидатом;
(b) детектирование снижения активности указанного мутантного кальретикулина; и
(c) отбор молекулы-кандидата, которая снижает уровень (экспрессию) указанного мутантного кальретикулина;
где снижение уровня (экспрессии) является показателем способности отобранной молекулы быть пригодной в лечении миелоидного новообразования, как здесь определено.
Мутантный кальретикулин может представлять любой из мутантных белков/полипептидов кальретикулинов, как здесь определено выше, или любую из нуклеиновых кислот (в частности, мРНК), как здесь определено выше, которые кодируют мутантные белки/полипептиды кальретикулины.
Мутантные белки кальретикулины могут содержать или состоять из аминокислотной последовательности полипептидов, показанных в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 и 434 соответственно. Также в данном контексте предусматривается применение фрагментов или производных этих белков, как здесь определено выше.
Нуклеиновые кислоты мутантного кальретикулина могут включать или состоять из нуклеиновых кислот, показанных в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142, 143, 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286, 287, 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 и 433 соответственно.
Кроме того, настоящее изобретение относится к применению нуклеиновой кислоты(от) (например, олигонуклеотида(ов), таких как праймер(ы)/пара(ы) праймеров или зонд(ы), как описано ниже) или антитела, способного детектировать присутствие одного или более мутантных аллелей гена кальретикулина или присутствия или количества генного продукта одного или более мутантных аллелей гена кальретикулина, как здесь определено для способов по настоящему изобретению, то есть для оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием.
Олигонуклеотид(ы) может иметь длину примерно от 15 до 100 нуклеотидов. Специалист в данной области, основываясь на его общих знаниях и пояснениях, приведенных здесь, может легко идентифицировать и/или получить олиго- или полинуклеотид, способный детектировать присутствие одного или более мутантных аллелей гена кальретикулина или присутствие или количество генного продукта одного или более мутантных аллелей гена кальретикулина, как здесь определено. Эти олиго- или полинуклеотиды могут быть использованы в качестве зонда(ов) или праймеров в обеспеченных здесь способах. Часто праймеры и/или зонды имеют длину от 10 до 30 нуклеотидов. Следовательно, настоящее изобретение относится к нуклеиновой кислоте(ам) (в частности: праймеру(ам) или зонду(ам)), способной детектировать присутствие одного или более мутантных аллелей гена кальретикулина или присутствие или количество генного продукта одного или более мутантных аллелей гена кальретикулина, как здесь определено, где указанная нуклеиновая кислота имеет длину меньше, чем 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21 или 20 нуклеотидов и больше, чем 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов. В предпочтительном варианте осуществления нуклеиновая кислота имеет длину от 10 до 35 нуклеотидов, более предпочтительно от 15 до 25 нуклеотидов, особенно предпочтительно длину от 18 до 21, например, 18, 19, 20 или 21 нуклеотидов. Данная нуклеиновая кислота(ы) может гибридизоваться в жестких условиях с комплементарной цепью нуклеиновой кислоты мутантного кальретикулина, как здесь определено и обеспечено выше.
Специалисту в данной области должны быть знакомы, например, компьютерные программы, которые могут быть полезными для идентификации соответствующих зондов/праймеров для применения в настоящем изобретении. Например, в данном контексте можно использовать последовательность(и) нуклеиновой кислоты приведенных в качестве примера кодирующих последовательностей, как здесь раскрыто (SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142, 143, 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286, 287, 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 и 433 соответственно).
Также последовательности, приведенные в следующей таблице ниже, могут быть использованы в этом контексте:
Последовательности мутационных соединений в последовательности кДНК CALR для конструирования специфических для мутаций зондов или праймеров для ПЦР.
Жирным шрифтом указаны границы делеционного события; подчеркнутые буквы указывают инсерцированные последовательности; жирным шрифтом указаны однонуклеотидные варианты.
Приведенные в качестве примера олигонуклеотиды (праймеры), обеспеченные здесь и используемые по настоящему изобретению, представляют:
Прямой праймер: ACAACTTCCTCATCACCAACG (SEQ ID NO: 437)
и/или
Обратный праймер: GGCCTCAGTCCAGCCCTG (SEQ ID NO: 438)
Прямой праймер: GGCAAGGCCCTGAGGTGT (SEQ ID NO: 439)
и/или
Обратный праймер: GGCCTCAGTCCAGCCCTG (SEQ ID NO: 438).
В одном варианте осуществления настоящее изобретение относится к трансгенной клетке или трансгенному животному, отличному от человека, имеющему нуклеиновую кислоту, как здесь описано и пояснено выше (или вектор, содержащий ее), например, нуклеиновую кислоту, содержащую, по меньшей мере, один или более мутантных аллелей гена кальретикулина, как здесь определено. Такая трансгенная клетка(и) или трансгенное животное(ы), отличное от человека, могут быть использованы для скрининга и/или валидации лекарственного средства для лечения миелоидного новообразования.
Как здесь используется в данном контексте, термин «клетка» также может включать множество клеток, а также клетки, находящиеся в ткани. Клетка, используемая в способе скрининга или валидации, может быть получена из образцов от (трансгенного) животного, отличного от человека, или человека, страдающего миелоидным новообразованием. Опухолевую клетку или клетку также можно получить из образцов пациентов (например, биопсийного материала), в частности, биопсийного материала/биопсийных материалов от пациента/субъекта, страдающего миелоидным новообразованием. Следовательно, клетка может представлять клетку человека. Вновь, такая клетка, используемая в способах скрининга или валидации по настоящему изобретению, может находиться в ткани или образце ткани, таком как биопсийный образец.
Используемое животное, отличное от человека, или клетка могут быть трансгенными или не трансгенными. «Трансгенные» в этом контексте, в частности, означают, что, по меньшей мере, один из мутантных кальретикулинов, как здесь описано или определено, (сверх)экспрессируется и/или, что активность, по меньшей мере, одного из мутантных кальретикулинов присутствует (или повышена).
Предпочтительное (трансгенное) животное, отличное от человека, или (трансгенная) клетка в контексте изобретения страдает миелоидным новообразованием.
Как здесь используется, термин «трансгенное животное, отличное от человека» или «трансгенная клетка» относится к животному, отличному от человека, или клетке, не являющейся человеческой, которые содержат генетический материал, отличный от генетического материала, соответствующего животному/клетке дикого типа. «Генетический материал» в данном контексте может представлять любой вид молекулы нуклеиновой кислоты или ее аналоги, например, молекулу нуклеиновой кислоты или ее аналоги, определенные здесь. «Отличный от» в данном контексте означает дополнительное или меньшее количество генетического материала по отношению к геному животного/клетки дикого типа, и/или реаранжированный генетический материал, то есть генетический материал, находящийся в другом локусе генома по отношению к геному животного/клетки дикого типа. Обзор примеров различных экспрессионных систем, которые будут использоваться для получения трансгенной клетки/животного, например, имеется в Methods in Enzymology 153 (1987), 385-516, Bitter et al. (Methods in Enzymology 153 (1987), 516-544) и Sawers et al. (Applied Microbiology and Biotechnology 46 (1996), 1-9), Billman-Jacobe (Current Opinion in Biotechnology 7 (1996), 500-4), Hockney (Trends in Biotechnology 12 (1994), 456-463), Griffiths et al., (Methods in Molecular Biology 75 (1997), 427-440).
В предпочтительном варианте осуществления изобретения (трансгенное) животное, отличное от человека, или (трансгенная) клетка получены от млекопитающего. Неограничивающие примеры (трансгенного) животного, отличного от человека, или полученной (трансгенной) клетки выбраны из группы, состоящей из мыши, крысы, кролика и морской свинки.
Настоящее изобретение также относится к вектору, содержащему молекулу нуклеиновой кислоты по настоящему изобретению.
Многие подходящие векторы известны специалистам в области молекулярной биологии, выбор которых должен зависеть от требуемой функции, и они включают плазмиды, космиды, вирусы, бактериофаги и другие векторы, обычно используемые в области генной инженерии. Методы, которые хорошо известны специалистам в данной области техники, могут быть использованы для конструирования различных плазмид и векторов; смотри, например, методики, описанные в руководстве Sambrook et al. (смотри выше) и Ausubel, Current Protocols in Molecular Biology, Green Publishing Associates and Wiley Interscience, N.Y. (1989), (1994). Альтернативно полинуклеотиды и векторы по изобретению могут быть восстановлены в липосомы для введения в клетки-мишени. Как будет подробнее обсуждено ниже, клонирующий вектор использовали для выделения отдельных последовательностей ДНК. Релевантные последовательности могут быть перенесены в экспрессионные векторы, когда требуется экспрессия определенного полипептида. Типичные клонирующие векторы включают pBluescript SK, pGEM, pUC9, pBR322 и pGBT9. Типичные экспрессионные векторы включают pTRE, PCAL-n-EK, PESP-1, pOP13CAT.
Предпочтительно указанный вектор содержит последовательность нуклеиновой кислоты, которая представляет собой регуляторную последовательность, операбельно связанную с указанной последовательностью нуклеиновой кислоты, определенной здесь.
Термин «регуляторная последовательность» относится к последовательностям ДНК, которые необходимы для осуществления экспрессии кодирующих последовательностей, с которыми они лигированы. Характер таких регуляторных последовательностей различается в зависимости от организма-хозяина. В прокариотах, регуляторные последовательности в основном включают промотор, сайт связывания рибосом и терминаторы. В эукариотах обычно регуляторные последовательности включают промоторы, терминаторы и в некоторых случаях, энхансеры, трансактиваторы или факторы транскрипции. Термин «регуляторная последовательность» предназначен для включения, как минимум, всех компонентов, присутствие которых необходимо для экспрессии, и может также включать дополнительные преимущественные компоненты.
Термин «операбельно связанный» относится к положению в непосредственном соседстве, в котором компоненты, описанные так, находятся в связи, позволяющей им функционировать предназначенным способом. Регуляторная последовательность, «операбельно связанная» с кодирующей последовательностью, лигирована таким образом, что экспрессия кодирующей последовательности достигается в условиях, совместимых с регуляторными последовательностями. В том случае, когда регуляторная последовательность представляет промотор, то специалисту в данной области должно быть понятно, что предпочтительно использовать двухцепочечную нуклеиновую кислоту.
Таким образом, указанный вектор предпочтительно представляет экспрессионный вектор. «Экспрессионный вектор» представляет собой конструкцию, которая может быть использована для трансформации выбранного хозяина и обеспечивает экспрессию кодирующей последовательности в выбранном хозяине. Экспрессионные векторы могут представлять, например, клонирующие векторы, бинарные векторы или интегрирующие векторы. Экспрессия включает транскрипцию молекулы нуклеиновой кислоты, предпочтительно в транслируемую мРНК. Регуляторные элементы, обеспечивающие экспрессию в прокариотических и/или эукариотических клетках, хорошо известны специалистам в данной области. В случае эукариотических клеток, то, как правило, они включают промоторы, обеспечивающие инициацию транскрипции и необязательно поли-A-сигналы, обеспечивающие терминацию и стабилизацию транскрипта. Возможные регуляторные элементы, обеспечивающие экспрессию в прокариотических клетках-хозяевах, включают, например, PL, lac, trp или tac-промотор в Е.coli, и примерами регуляторных элементов, обеспечивающих экспрессию в эукариотических клетках-хозяевах, являются промотор AOXI или GAL1 в дрожжах или CMV-, SV40-, RSV-промотор (вирус саркомы Рауса), CMV-энхансер, SV40-энхансер или интрон гена глобина в клетках млекопитающих или других животных.
Помимо элементов, ответственных за инициацию транскрипции, такие регуляторные элементы также могут включать сигналы терминации транскрипции, такие как SV40-поли-А-сайт или сайт tk-поли-А, вниз от полинуклеотида. Кроме того, в зависимости от используемой экспрессионной системы можно добавить лидерные последовательности, способные направлять полипептид в клеточный компартмент или секретировать его в среду, к кодирующей последовательности указанной последовательности нуклеиновой кислоты, и они хорошо известны в данной области; смотри также прилагаемые примеры. Лидерная последовательность(и) собирается в соответствующей фазе с последовательностью процессов трансляции, инициации и терминации, и предпочтительно, где лидерная последовательность способна направлять секрецию транслируемого белка или его фрагмента в периплазматическое пространство или внеклеточную среду. Необязательно гетерологичная последовательность может кодировать слитый белок, включающий N-концевой пептид для идентификации, придающий желаемые характеристики, например, стабильность или обеспечение простой очистки экспрессируемого рекомбинантного продукта; смотри выше. В данном контексте подходящие экспрессионные векторы известны в данной области, такие как экспрессионный вектор кДНК Окаяма-Берга, pСDV1 (Pharmacia), pCDM8, pRc/CMV, pcDNA1, pcDNA3 (In-vitrogene), pEF-DHFR, pEF-ADA or pEF-neo (Mack et al., PNAS (1995) 92, 7021-7025 and Raum et al., Cancer Immunol Immunother (2001) 50(3), 141-150) или pSPORT1 (GIBCO BRL).
Предпочтительно экспрессионные регуляторные последовательности представляют эукариотические промоторные системы в векторах, способных трансформировать или трансфектировать эукариотические клетки-хозяева, но также можно использовать регуляторные последовательности для прокариотических хозяев. После того, как вектор был включен в соответствующий хозяин, хозяин поддерживается в условиях, подходящих для экспрессии нуклеотидных последовательностей на высоком уровне, и если требуется, затем может следовать сбор и очистка полипептида по изобретению; смотри, например, прилагаемые примеры.
Альтернативная экспрессионная система, которая может использоваться для экспрессии взаимодействующего белка клеточного цикла, представляет собой систему насекомого. В одной такой системе используется вирус ядерного полиэдроза (NPV) Autographa саlifornica в качестве вектора для экспрессии чужеродных генов в клетках Spodoptera frugiperda или личинках Trichoplusia. Кодирующая последовательность указанной молекулы нуклеиновой кислоты, может быть клонирована в неэссенциальную область вируса, такую как ген полиэдрина, и помещена под контроль промотора полиэдрина. Успешное встраивание указанной кодирующей последовательности делает ген полиэдрина неактивным и производит рекомбинантный вирус, не имеющий белка оболочки. Затем эти рекомбинантные вирусы используются для инфицирования клеток S. frugiperda или личинок Trichoplusia, в которых может экспрессироваться слитый белок (Smith, J. Virol., 46 (1983); Engelhard et al. Proc. Natl. Acad. Sci. USA, 91 (1994), 3224-3227).
Дополнительные регуляторные элементы могут включать транскрипционные, а также трансляционные энхансеры. Предпочтительно вышеописанные векторы по изобретению содержат селектируемый маркер и/или маркер для оценки.
Селективные маркерные гены, подходящие для селекции трансформированных клеток и, например, растений и растительной ткани, хорошо известны специалистам в данной области, и они включают, например, придающие устойчивость к антиметаболитам в качестве основы селекции для dhfr, которые обеспечивают резистентность к метотрексату (Reiss, Plant Physiol. (Life Sci. Adv.) 13 (1994), 143-149); npt, который придает резистентность к аминогликозидным антибиотикам неомицину, канамицину и паромицину (Herrera-Estrella, EMBO J., 2 (1983), 987-995) и hygro, который придает резистентность к гигромицину (Marsh, Gene 32 (1984), 481-485). Были описаны другие селективные гены, а именно trpB, который позволяет клеткам утилизировать индол вместо триптофана; hisD, который позволяет клеткам утилизировать гистинол вместо гистидина (Hartman, Proc. Natl. Acad. Sci. USA 85 (1988), 8047); манноза-6-фосфат-изомераза, которая позволяет клеткам утилизировать маннозу (WO 94/20627) и ODC (орнитиндекарбоксилаза), которая придает резистентность к ингибитору орнитиндекарбоксилазы, 2-(дифторметил)-DL-орнитин, DFMO (McConlogue, 1987, In: Current Communications in Molecular Biology, Cold Spring Harbor Laboratory ed.) или дезаминаза из Aspergillus terreus, которая придает резистентность к бластицидину S (Tamura, Biosci. Biotechnol. Biochem. 59 (1995), 2336-2338)).
Подходящие маркеры для оценки также известны специалистам в данной области, и они являются промышленно доступными. Преимущественно указанный маркер представляет собой ген, кодирующий люциферазу (Giacomin, Pl. Sci. 116 (1996), 59-72; Scikantha, J. Bact., 178 (1996), 121), зеленый флуоресцентный белок (Gerdes, FEBS Lett., 389 (1996), 44-47) или бета-глюкуронидазу (Jefferson, EMBO J., 6 (1987), 3901-3907). Этот вариант осуществления особенно пригоден для простого и быстрого скрининга клеток, тканей и организмов, содержащих указанный вектор.
Как было описано выше, указанная молекула нуклеиновой кислоты может быть использована самостоятельно или в составе вектора для экспрессии полипептида по изобретению в клетках, например, для очистки, но также и для целей генной терапии. Молекулы нуклеиновой кислоты или векторы, содержащие последовательность(и) ДНК, кодирующую любой из вышеописанных полипептидов по изобретению, вводят в клетки, которые, в свою очередь, продуцируют интересующий полипептид. Генная терапия, которая основана на введении терапевтических генов в клетки с помощью методик ex vivo или in vitro, является одним из наиболее важных применений переноса генов. Подходящие векторы, способы или системы доставки генов для генной терапии in vitro или in vivo описаны в литературе и известны специалистам в данной области; смотри, например, Giordano, Nature Medicine, 2 (1996) 534-539; Schaper, Circ. Res., 79 (1996) 911-919; Anderson, Science, 256 (1992) 808-813; Verma, Nature, 389 (1994), 239; Isner, Lancet, 348 (1996), 370-374; Muhlhauser, Circ. Res., 77 (1995) 1077-1086; Onodera, Blood, 91 (1998) 30-36; Verma, Gene Ther., 5 (1998) 692-699; Nabel, Ann. N.Y. Acad. Sci., 811 (1997) 289-292; Verzeletti, Hum. Gene Ther., 9 (1998) 2243-51; Wang, Nature Medicine, 2 (1996) 714-716; WO 94/29469; WO 97/00957, патент США № 5580859; патент США № 5589466 или Schaper, Current Opinion in Biotechnology, 7 (1996) 635-640. Указанные молекулы нуклеиновых кислот и векторы можно сконструировать для прямого введения или для введения с использованием липосом или вирусных векторов (например, аденовирусных, ретровирусных) в клетку. Предпочтительно указанная клетка представляет собой клетку зародышевой линии, эмбриональную клетку или яйцеклетку, или полученные из них, наиболее предпочтительно указанная клетка представляет собой стволовую клетку. Примером эмбриональной стволовой клетки может быть, среди прочего, стволовая клетка, описанная в публикации Nagy, Proc. Natl. Acad. Sci. USA, 90 (1993) 8424-8428.
Настоящее изобретение также относится к хозяину, трансформированному или трансфектированному вектором по изобретению. Указанный хозяин может быть получен введением вышеописанного вектора по изобретению или вышеописанной молекулы нуклеиновой кислоты по изобретению хозяину. Присутствие, по меньшей мере, одного вектора или, по меньшей мере, одной молекулы нуклеиновой кислоты в хозяине может опосредовать экспрессию гена, кодирующего вышеописанные конструкции одноцепочечного антитела.
Описанная молекула нуклеиновой кислоты или вектор по изобретению, которые вводятся хозяину, могут интегрировать в геном хозяина или могут сохраняться экстрахромосомно.
Хозяин может представлять любую прокариотическую или эукариотическую клетку.
Термин «прокариот» подразумевает включение всех бактерий, которые могут быть трансформированы или трансфектированы молекулами ДНК или РНК, для экспрессии белка по изобретению. Прокариотические хозяева включают грамотрицательные, а также грамположительные бактерии, например, такие как E.coli, S. typhimurium, Serratia marcescens и Bacillus subtilis. Термин «эукариотический» означает включение клеток дрожжей, высших растений, насекомых и предпочтительно клеток млекопитающих. В зависимости от хозяина, используемого в процедуре рекомбинантной продукции, белок, кодируемый полинуклеотидом по настоящему изобретению, может быть гликозилированным или может быть негликозилированным. Особенно предпочтительным является использование плазмиды или вируса, содержащего кодирующую последовательность полипептида по изобретению, и генетически слитую с N-концевой FLAG-меткой и/или С-концевой His-меткой. Предпочтительно длина указанной FLAG-метки составляет примерно 4-8 аминокислот, наиболее предпочтительно 8 аминокислот. Вышеописанный полинуклеотид можно использовать для трансформации или трансфекции хозяина с использованием методик, хорошо известных специалистам с обычной квалификацией в данной области техники. Кроме того, методы получения слитых, операбельно связанных генов и их экспрессии, например в клетках млекопитающих и бактериях, хорошо известны в данной области (Sambrook, смотри выше).
Предпочтительно указанный хозяин представляет бактерию или клетку насекомого, гриба, растения или животного.
В частности, предусматривается, что указанный хозяин может представлять собой клетку млекопитающих. В частности, предпочтительные клетки-хозяева включают клетки СНО (яичника китайского хомячка), клетки COS, линии миеломных клеток типа SP2/0 или NS/0. Как показано в прилагаемых примерах, в качестве хозяев особенно предпочтительными являются клетки СНО.
Более предпочтительно, указанная клетка-хозяин представляет собой человеческую клетку или человеческую клеточную линию, например per.с6 (Kroos, Biotechnol. Prog., 2003, 19:163-168).
Таким образом, в дополнительном варианте осуществления настоящее изобретение относится к способу получения полипептида по изобретению, включающему культивирование хозяина по изобретению в условиях, обеспечивающих экспрессию полипептида по изобретению и выделение полученного полипептида из культуры.
Трансформированные хозяева могут быть размножены в ферментерах и культивированы в соответствии с методиками, известными в данной области, для достижения оптимального клеточного роста. Затем полипептид по изобретению выделяют из культуральной среды, клеточных лизатов или клеточных мембранных фракций. Выделение и очистка, например, полипептидов по изобретению, экспрессированных микробами, можно осуществить любыми обычными методами, например, такими как препаративные хроматографические разделения и иммунологические разделения, например, как разделения, включающие использование моноклональных или поликлональных антител, направленных, например, против метки (tag) полипептида по изобретению или как описано в прилагаемых примерах.
Условия культивирования хозяина, обеспечивающие экспрессию, известны в данной области как зависимые от системы хозяина и экспрессионной системы/экспрессионного вектора, используемых в таком способе. Параметры, которые должны быть изменены для достижения условий, обеспечивающих экспрессию рекомбинантного полипептида, известны в данной области. Таким образом, подходящие условия могут быть определены специалистом в данной области в отсутствие дополнительного изобретательского вклада.
После проведения экспрессии полипептид по изобретению может быть очищен согласно стандартным в данной области процедурами, включая осаждение сульфатом аммония, аффинные колонки, колоночную хроматографию, гель-электрофорез и тому подобное; смотри Scopes, «Protein Purification», Springer-Verlag, N.Y. (1982). Для фармацевтических применений предпочтительны по существу чистые полипептиды с гомогенностью, по меньшей мере, примерно 90-95% и наиболее предпочтительны с гомогенностью 98-99% или выше. После очистки, частично или до требуемой гомогенности, затем полипептид по изобретению можно использовать в терапевтических целях (в том числе экстракорпорально) или для разработки и проведения аналитических процедур. Кроме того, в прилагаемых примерах подробно описаны примеры методов выделения полипептида по изобретению из культуры.
Кроме того, настоящее изобретение относится к набору, пригодному для осуществления способов по настоящему изобретению, где набор включает нуклеиновую кислоту или антитело, способное детектировать присутствие одного или более мутантных аллелей гена кальретикулина или присутствия или количества генного продукта одного или более мутантных аллелей гена кальретикулина, как здесь определено. Также в настоящем документе предусмотрено применение описанного здесь набора для осуществления обеспеченных здесь способов.
Например, указанный набор может содержать соединение(я), необходимое для специфического определения присутствия одного или более мутантных аллелей гена кальретикулина или присутствия или количества генного продукта одного или более мутантных аллелей гена кальретикулина, как здесь определено. Кроме того, настоящее изобретение также относится к применению соединения(й), необходимого для специфического определения присутствия одного или более мутантных аллелей гена кальретикулина или присутствия или количества генного продукта одного или более мутантных аллелей гена кальретикулина, как здесь определено, для получения набора в целях осуществления способов по настоящему изобретению. На основе пояснений данного изобретения специалисту в данной области должно быть понятно, какое соединение(я) требуется для специфического определения присутствия одного или более мутантных аллелей гена кальретикулина или присутствия или количества генного продукта одного или более мутантных аллелей гена кальретикулина, как здесь определено. Например, такое соединение(я) может представлять «связывающую молекулу(ы)», как, например, антитело. В частности, такое соединение(я) может представлять (нуклеотидный) зонд(ы), праймер(ы) (пару(ы)), антитело(а) и/или аптамер(ы), специфические, по меньшей мере, для одного мутантного аллеля гена кальретикулина или для генного продукта, по меньшей мере, одного мутантного аллеля гена кальретикулина, как здесь определено. Набор (который должен быть получен в контексте) по настоящему изобретению может представлять собой диагностический набор. Как уже упоминалось выше, определение присутствия одного (или более) мутантных аллелей гена кальретикулина или его генного продукта, как здесь описано, можно осуществить в виде автономного анализа. Альтернативно данный анализ может следовать или предшествовать анализу других маркеров для миелоидных новообразований, таких как мутации JAK2 и MPL. Также предусматривается одновременное определение таких маркеров, как и одновременный анализ мутации(й) JAK2 и мутантного кальретикулина (и необязательно дополнительных маркеров), или одновременный анализ мутации(й) JAK2, мутантного кальретикулина и мутации(й) MPL (и необязательно дополнительных маркеров). Следовательно, в данном документе обеспечивается/предусматривается набор(ы) (или применения таких наборов), которые обеспечивают средства для таких последующих или одновременных анализов. Например, указанный набор может содержать, в дополнение к соединению(ям), необходимому для специфического определения присутствия (или количества) одного или более мутантных аллелей гена кальретикулина (или его генного продукта), соединение(я), необходимое для специфического определения присутствия мутаций JAK2 и/или MPL (и необязательно дополнительных маркеров), например, специфического антитела(л), (нуклеотидного) зонда(в), праймера(в) (пары (пар)), антитела(л) и/или аптамера(ов), обеспечивающих специфическое детектирование мутаций JAK2 и MPL (и необязательно дополнительных маркеров).
Набор (который должен быть получен в контексте) по настоящему изобретению может дополнительно содержать или быть обеспеченным инструкцией(и) по применению. Например, указанная инструкция(и) по применению может помочь специалисту в данной области (как) в определении присутствия одного или более мутантных аллелей гена кальретикулина или присутствия или количества генного продукта одного или более мутантных аллелей гена кальретикулина, как здесь определено, и/или (как) для диагностики миелоидного новообразования. Указанная инструкция(и) по применению может содержать указания по использованию или применению обеспеченных здесь способов или применений. Набор (который должен быть получен в контексте) по настоящему изобретению может дополнительно содержать вещества/химические соединения и/или оборудование, пригодное/необходимое для осуществления способов и применений по настоящему изобретению. Например, такие вещества/химические соединения и/или оборудование представляют растворители, разбавители и/или буферы для стабилизации и/или хранения соединения(й), необходимого для специфического определения присутствия одного или более мутантных аллелей гена кальретикулина или присутствия или количества генного продукта одного или более мутантных аллелей гена кальретикулина, как здесь определено.
Как здесь используются, термины «содержащий» и «включающий и их грамматические варианты должны быть приняты в качестве определения указанных признаков, целых чисел, стадий или компонентов, но не исключают добавление одного или более дополнительных признаков, целых чисел, стадий, компонентов или их групп. Данный термин включает термины «состоящий из» и «по существу состоящий из».
Таким образом, термины «содержащий»/«включающий»/«имеющий» означают, что может присутствовать любой дополнительный компонент (или также признаки, целые числа, стадии и тому подобное).
Термин «состоящий из» означает, что ни один дополнительный компонент не может присутствовать (или также признаки, целые числа, стадии и тому подобное).
Термин «состоящий по существу из» или его грамматические варианты, когда используются в данном документе, должны быть приняты в качестве определения указанных признаков, целых чисел, стадий или компонентов, но не исключают добавление одного или более дополнительных признаков, целых чисел, стадий, компонентов или их групп, но только если дополнительные признаки, целые числа, стадии, компоненты или их группы не оказывают существенного влияния на основные и новые характеристики заявленной композиции, устройства или способа.
Таким образом, термин «состоящий по существу из» означает, что могут присутствовать определенные дополнительные компоненты (или также признаки, целые числа, стадии и тому подобное), а именно те, которые не оказывают существенного влияния на основные характеристики композиции, устройства или способа. Другими словами, термин «состоящий по существу из» (который здесь может использоваться взаимозаменяемо с термином «по существу состоящий»), позволяет присутствие других компонентов в композиции, устройстве или способе в дополнении к обязательным компонентам (или также признаков, целых чисел, стадий и тому подобное), при условии, что основные характеристики устройства или способа существенно не изменяются в результате присутствия других компонентов.
Термин «способ» относится к способам, средствам, методикам и процедурам для осуществления данной задачи, включая, не ограничиваясь этим, такие способы, средства, методики и процедуры, либо известные, либо легко разработанные из известных способов, средств, методов и процедур практикующими специалистами в области химии, биологии и биофизики.
Как здесь используется, термин «выделенная» относится к композиции, которая была удалена из ее среды in vivo. Предпочтительно выделенные композиции или соединения по настоящему изобретению по существу не содержат других веществ (например, других белков или других соединений), которые присутствуют в их естественной среде (т.е. представляют очищенные или полуочищенные композиции или соединения).
Как здесь используется, термин «примерно» относится к ±10%.
Настоящее изобретение относится к следующим пунктам:
1. Способ оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- определение присутствия одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный один или более мутантных аллелей гена кальретикулина.
2. Способ по п. 1, где указанное миелоидное новообразование выбрано из группы, состоящей из первичного миелофиброза (ПМФ), эссенциальной тромбоцитемии (ЭТ) и рефрактерной анемии с кольцевыми сидеробластами и тромбоцитемией (RARS-T).
3. Способ по пп. 1 или 2,
где указанный один или более мутантных аллелей содержит нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(с) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(d) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а);
(e) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(d); и
(f) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (с) и (d).
4. Способ по п. 3, где указанный мутантный белок кальретикулина выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142,143, 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286, 287, 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432, 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430, 434;
(с) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430, 434;
(d) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а);
(e) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(d); и
(f) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (с) и (d).
5. Способ по любому из пп. 1-4, где указанный мутантный аллель содержит мутацию сдвига рамки считывания в экзоне 9 гена кальретикулина по сравнению с геном кальретикулина дикого типа, где указанная мутация сдвига рамки считывания представляет делецию одного нуклеотида или добавление двух нуклеотидов.
6. Способ по любому из пп. 1-5, где указанный мутантный аллель содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288; 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137, 141, 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281, 285, 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d);
где указанный мутантный аллель представляет ДНК, предпочтительно геномную ДНК.
7. Способ оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантных аллелей гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный генный продукт.
8. Способ по п. 7,
где указанный один или более мутантных аллелей содержит нуклеиновую кислоту, кодирующую мутантный белок кальретикулин, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(с) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(d) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а);
(e) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(d); и
(f) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (c) или (d).
9. Способ по пп. 7 или 8, где указанный мутантный белок кальретикулина выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142, 143, 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286, 287, 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(с) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(d) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а);
(e) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(f) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (с) или (d).
10. Способ по любому из пп. 7-9, где указанный генный продукт представляет мРНК или белок.
11. Нуклеиновая кислота, выбранная из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 2 или 3;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
12. Нуклеиновая кислота по п. 11, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142, 143, 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286, 287, 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с); и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
13. Белок, выбранный из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по пп. (а) или (b), в котором одна или более аминокислот делецированы, инсерцированы, добавлены или заменены;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в пп. (а) или (с);
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
14. Белок по п. 13, где указанный белок выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(с) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(d) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а);
(e) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(е); и
(f) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (с) или (d).
15. Белок по пп. 13 или 14, где указанный белок выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286, 287, 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(с) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288, 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(d) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а);
(e) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(d); и
(f) белок, обладающий, по меньшей мере, 70% идентичностью с белком по любому из пп. (а)-(e); и
(f) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (с) или (d).
16. Белок по пп. 13 или 14, такой как белок, состоящий из 15-25 смежных аминокислот белка, показанного в SEQ ID NO: 4, для применения в качестве вакцины.
17. Антитело, специфически связывающееся с белком по пп. 13 или 14.
18. Ингибитор мутантного кальретикулина для применения в лечении первичного миелофиброза (ПМФ), эссенциальной тромбоцитемии (ЭТ) или рефрактерной анемии с кольцевыми сидеробластами и тромбоцитемией (RARS-T) для применения в лечении первичного миелофиброза (ПМФ), эссенциальной тромбоцитемии (ЭТ) или рефрактерной анемии с кольцевыми сидеробластами и тромбоцитемией (RARS-T); или
белок для применения в качестве вакцины по п. 16 в лечении первичного миелофиброза (ПМФ), эссенциальной тромбоцитемии (ЭТ) или рефрактерной анемии с кольцевыми сидеробластами и тромбоцитемией (RARS-T);
где указанный мутантный кальретикулин представляет мутантный белок кальретикулин по любому из пп. 12-14.
19. Ингибитор по п. 18, где указанный ингибитор представляет собой ингибирующее антитело.
Настоящее изобретение дополнительно описано со ссылкой на следующие неограничивающие фигуры и примеры.
На фигурах показано:
Фигура 1.
Подтверждение мутаций гена CALR у 191 и 296 пациентов с помощью секвенирования по Сэнгеру
На фигуре приведены пики секвенирования по Сэнгеру. Буквы последовательности в рамках обозначают основания, которые потеряны в результате делеционных событий. На фиг. 1 показаны последовательности SEQ ID NO:1324-1327.
Фигура 2.
Частота мутаций CALR в миелоидных новообразованиях
A: Распределение мутаций JAK2, MPL и CALR в трех классических нозологических формах МПН. В: Частота пациентов с мутантным CALR в различных миелоидных новообразованиях показана темными столбцами. N, общее число пациентов, анализированных для каждой группы заболеваний. C: Распределение мутаций JAK2, MPL, CALR и SF3B1 у 24 пациентов с рефрактерной анемией с кольцевыми сидеробластами, ассоциированной с выраженным тромбоцитозом. ИП, истинная полицитемия; ЭТ, эссенциальная тромбоцитемия; ПМФ, первичный миелофиброз; dnAML, de novo AML: ХМЛ, хронический миелоидный лейкоз; МДС, миелодиспластический синдром; ХММЛ, хронический миеломоноцитарный лейкоз; RARS-T, рефрактерная анемия с кольцевыми сидеробластами, ассоциированная с выраженным тромбоцитозом.
Фигура 3.
Мутационный паттерн мутаций CALR у пациентов с МПН
Широкий черный столбик представляет экзон 9 CALR, узкий столбик - 3’ UTR гена, тонкая линия - интронные и межгенные области.
А: указана последовательность кДНК в начале и в конце экзона 9. Ниже последовательности кДНК представлены аминокислотные последовательности, полученные из трех альтернативных рамок считывания. B: три рамки считывания приводят к различным пептидным составам, особенно в отношении заряда аминокислот. C: обобщение по всем мутациям, детектированным у пациентов с МПН и их положению в экзоне 9 CALR. Столбики обозначают делеционные события, буквы, инсерционные последовательности. Независимые инсерции и делеции показаны выше над схемой экзона 9, комбинированные инсерционные/делеционные события ниже. D: конкретный пептидный состав CALR дикого типа и два наиболее часто детектированных типов мутаций. В, D: каждый прямоугольник представляет аминокислоту. Черные прямоугольники со знаком «-» представляют отрицательно заряженные аминокислоты, прямоугольники со знаком «+» представляют положительно заряженные аминокислоты. Скрещенные прямоугольники представляют собой стоп-кодоны. E: относительные частоты всех 36 типов мутаций, наблюдаемых в CALR.
На фиг. 3 показаны последовательности SEQ ID NO: 1328-1339.
Фигура 4.
Ассоциация мутаций CALR с однородительской дисомией и клональной иерархией у пациентов с многочисленными соматическими мутациями
Панель A: данные по генотипированию с использованием микрочипов Affymetrix SNP 6,0 показаны для трех образцов, которые более чем в 50% несли мутации CALR. Каждая точка представляет один SNP. На оси Х показано положение в геноме, на оси ординат показан аллельный статус SNP (гетерозиготные статус = аллельное различие 0). Данные микрочипирования показывают 19P однородительскую дисомию различных размеров в трех образцах. Прямоугольники указывают геномную область однородительской дисомии. Справа от каждого графика аллельных различий показаны результаты анализа фрагмента экзона 9 CALR для того же образца. В каждом случае нагрузка мутантного аллеля выше, чем нагрузка аллеля дикого типа. Панель B: клональные иерархии, полученные по результатам анализа колоний гемопоэтических клеток-предшественников. Пациент H_0191 (вверху) имел соматические мутации в общей сложности 4 генов. Как показано на гистограмме, 51% колоний имел мутации в CALR, GAB2 и METTL11B. Другая половина колоний (48%) имела мутации во всех четырех генах, указывая, что мутация в PHF16 была приобретена позднее и приводила к образованию субклона. Кроме того, одна колония, имеющая делецию одной п.н. в CALR, отличалась от делеции 52 п.н., что наблюдали в образце гранулоцитов и всех других колониях у этого пациента. Поскольку в этой колонии отсутствовали какие-либо другие мутации, наблюдаемые у пациента, то она представляет независимый клон, хотя, этот вывод основан только на одной колонии. H_0296 пациент (внизу) имел соматические мутации в CALR, PIK3R1 и C10ORF71. Все колонии, анализированные у этого пациента, содержали все три мутации. В одной колонии наблюдали делецию 18 п.н. в CALR в дополнение к делеции 1 п.н., наблюдаемых у этого пациента. Обе мутации находились в одном аллеле.
Фигура 5.
Клиническое значение мутаций CALR
Результаты анализа у пациентов с эссенциальной тромбоцитемией или первичным миелофиброзом стратифицировали согласно их соматической мутации. Группа A: анализ Каплана-Мейера общей выживаемости у пациентов с первичным миелофиброзом. Подгруппы сравнивали с помощью лог-рангового теста. Пациенты с миелофиброзом, несущие соматические мутации CALR, имели лучшую общую выживаемость, чем пациенты с мутацией JAK2-V617F [медианное значение 21,4 года (95% CI, 17,1-22,9) по сравнению с 11,0 годами (95% CI, 7,8-14,4) соответственно; P <0,001] или с мутацией MPL [медианное значение 8,2 года (95% CI, 2,0-не было достигнуто); P <0,001], в то время как никакого различия не наблюдали между 2 последними подгруппами. Группа B: анализ Каплана-Мейера общей выживаемости у пациентов с эссенциальной тромбоцитемией. Подгруппы сравнивали с помощью лог-рангового теста. Медианное значение для общей выживаемости не было достигнуто ни в одной подгруппе. Пациенты с мутацией CALR имели лучшую общую выживаемость по сравнению с пациентами, несущими мутацию JAK2-V617F. Общая выживаемость за 10 лет составляла 96,9% (95% CI, 91,7-98,8%) в первом случае против 91,1% (95% CI, 87,1-93,9%) во втором случае (р = 0,043). Группа C: суммарная частота тромбозов у больных с эссенциальной тромбоцитемией. Летальный исход в отсутствие интересующего события рассматривался как конкурирующее событие, и подгруппы сравнивали с использованием теста Пeпe и Мори. Пациенты, несущие мутации в экзоне 9 CALR, имели более низкую суммарную частоту тромбозов по сравнению с пациентами, несущими мутацию JAK2-V617F: суммарная частота за 10 лет равнялась 11,0% (95% CI, 6,3-17,1%) в первом случае против 21,0% (95 % CI, 16,6-25,7%) во втором случае (Р = 0,003).
Фигура 6.
Функциональный анализ мутации CALR типа 1
Панель A: жизнеспособность клеток Ba/F3, экспрессирующих пустой вектор (GFP), CALR дикого типа (CALR wt-GFP) или мутантный CALR (CALR del52-GFP), оценивали через 72 ч в присутствии возрастающих концентраций интерлейкина-3. RLU - относительные световые единицы. Короткие отрезки показывают стандартную ошибку среднего значения. Панель B: пролиферация клеток Ba/F3, экспрессирующих пустой вектор (GFP), CALR дикого типа (CALR wt-GFP) или мутантный CALR (CALR del52-GFP), в отсутствие интерлейкина-3, определяли в течение 7 суток. Короткие отрезки показывают стандартную ошибку среднего значения. Панель C: показана активация STAT5 в ответ на интерлейкин-3. Клетки Ba/F3, экспрессирующие пустой вектор (GFP), CALR дикого типа (wt) или мутантный CALR (del52), подвергали «голоданию» в течение 4 ч в бессывороточной среде, без внесения интерлейкина-3, и затем стимулировали в течение 20 мин интерлейкином-3 в концентрации от 100 пг/мл до 1 нг/мл, как было указано. Вестерн-блоттинг проводили на клеточных лизатах с антителами против pYSTAT5, STAT5 и CALR. Антитело против GAPDH использовали в качестве контроля нагрузки. Группа D: иммунофлуоресценцию анализировали против CALR (третья панель) и специфического маркера эндоплазматической ретикулума (калнексина, вторая панель), в клетках HEK293T, трансфектированных соответствующими конструкциями. CALR дикого типа локализуется совместно с калнексином в эндоплазматическом ретикулуме (последняя панель). Однако мутантный CALR не ограничивался локализацией в эндоплазматическом ретикулуме. Ядро окрашивали красителем DAPI (первая панель).
Фигура 7.
Чувствительность клеток Ba/F3 к SAR302503
Клетки Ba/F3, экспрессирующие пустой вектор (GFP), CALR дикого типа (CALR wt-GFP) или мутантный CALR (CALR del52-GFP), анализировали по определению жизнеспособности клеток через 48 ч в присутствии SAR302503 в снижающихся концентрациях. Для оценки относительной жизнеспособности относительные световые единицы нормализовали к ДМСО, который использовали в качестве контроля. Короткие отрезки показывают стандартную ошибку среднего значения.
Фигура 8.
Анализ вестерн-блоттингом проводили зондированием сывороток четырех иммунизированных мышей против лизатов клеток HEK293T, экспрессирующих мутантный CALR del52. На фигуре показано, что в сыворотках от всех четырех иммунизированных мышей отсутствовали антител против мутантного пептида кальретикулина до иммунизации - р (дорожки до иммунизации). Специфические антитела у мышей начинали продуцироваться после 2 бустерных доз.
Фигура 9.
Анализ вестерн-блоттингом проводили зондированием сывороток четырех иммунизированных мышей против лизатов клеток HEK293T, экспрессирующих Δэкзон 9 CALR. На фигуре показано, что в сыворотках от всех четырех иммунизированных мышей отсутствовали антител против Δэкзона 9 CALR в сыворотке крови до иммунизации (р) или после введения бустерных доз.
Фигура 10.
Анализ вестерн-блоттингом проводили зондированием сывороток четырех иммунизированных мышей против лизатов клеток HEK293T, экспрессирующих мутантный CALR del52. На фигуре показано, что в сыворотках от всех четырех иммунизированных мышей было больше специфических антител против мутантного кальретикулина после третьей бустерной дозы.
Примеры иллюстрируют изобретение.
Пример 1: соматические мутации кальретикулина при первичном миелофиброзе и эссенциальной тромбоцитемии
Материалы и методы
Выборка пациентов
Заявители обследовали пациентов с миелопролиферативными новообразованиями, отрицательными на филадельфийскую хромосому, в Медицинском университете Вены, Австрия и Отделении гематологической онкологии, Fondazione IRCCS Policlinico San Matteo, Павиа, Италия. Исследования были одобрены этическими комитетами обоих учреждений, и все пациенты давали информированное согласие в письменной форме. Диагноз истинной полицитемии, эссенциальной тромбоцитемии и первичного миелофиброза был поставлен согласно критериям Всемирной организации здравоохранения (Sverdlow et al., 2008).
Диагностические критерии
Диагноз истинной полицитемии, эссенциальной тромбоцитемии и первичного миелофиброза был поставлен согласно критериям, используемым на момент первого наблюдения, как сообщалось ранее (Passamonti et al., 2004). В 2002 году были приняты критерии Всемирной организации здравоохранения (ВОЗ) (Vardiman et al., 2002), а в 2008 году была проведена их ревизия (Sverdlow et al., 2008). Анализ мутаций JAK2 и MPL проводили, как описано ранее (Passamonti et al., 2010a; Rumi et al., 2013; Passamonti et al., 2011) в Павиа и, как указано ниже в Вене. Фиброз костного мозга оценивали полуколичественно, следуя европейским согласованным рекомендациям (Thiele et al., 2005). Тромботические события определяли, как подробно описано ранее (Marchioli et al., 2013). Пациенты получали лечение в соответствии с рекомендациями, которые были утверждены Европейской сетью по изучению лейкозов в 2011 г. (Barbui et al., 2011).
Оценка мутаций JAK2-V617F, JAK2-экзон 12 и MPL-W515L в Вене
Анализ аллель-специфической ПЦР использовали для детектирования мутации JAK2-V617F. Готовили смесь праймеров, состоящую из 4 мкМ общего прямого праймера (gtttcttAGTGCATCTTTATTATGGCAGA (SEQ ID NO:1340)), 2 мкМ обратного праймера, специфичного для аллеля дикого типа (TTACTCTCGTCTCCACAGAC (SEQ ID NO:1341)) и 2 мкМ обратного праймера, специфичного для мутантного аллеля (aaaTTACTCTCGTCTCCACAGAA (SEQ ID NO:1342)). Два обратных праймера метили флуоресцентной меткой с использованием 6-карбоксифлуоресцеина (6-FAM) на 5’-конце. Реакцию ПЦР проводили с использованием ДНК-полимеразы AmpliTaq Gold с буфером Gold и MgCl2 (Applied Biosystems), содержащим 1,1 мкл буфера 10× ПЦР-GOLD, 0,66 мкл 25 мМ MgCl2, 0,44 мкл 2,5 мМ dNTP, 1,4 мкл смеси праймеров, 0,05 мкл ДНК-полимеразы AmpliTaq Gold (5 Е/мкл), 6,36 мкл H2O и 1 мкл геномной ДНК (10 нг/мкл). ПЦР проводили следующим образом: 95°С в течение 5 мин - 36 × (94°С в течение 30 сек, 62,2°С в течение 30 сек, 72°C в течение 30 сек) - 72°С в течение 15 мин - 8°С выдерживание. Размер продуктов ПЦР определяли на анализаторе 3130×1 Genetic Analyzer (Applied Biosystems), и данные анализировали с использованием программного обеспечения Gene Mapper (Applied Biosystems).
Анализ, использованный для детектирования мутаций в экзоне 12 JAK2, был описан ранее (Li et al., 2008). Для тестирования MPL-W515L использовали следующую аллель-специфическую ПЦР. Готовили смесь праймеров, состоящую из 8 мкМ общего прямого праймера (GTTTCTTCCGAAGTCTGACCCTTTTTG (SEQ ID NO: 1343)), 4 мкМ обратного праймера, специфичного для аллеля дикого типа (GTAGTGTGCAGGAAACTGCC (SEQ ID NO:1344)) и 4 мкМ обратного праймера, специфичного для мутантного аллеля (AAAGTAGTGTGCAGGAAACTGCA (SEQ ID NO:1345)). Два обратных праймера метили флуоресцентной меткой с использованием 6-карбоксифлуоресцеина (6-FAM) на 5’-конце. Реакцию ПЦР проводили, как описано выше для мутации JAK-V617F. ПЦР проводили следующим образом: 95°С в течение 5 мин - 36 × (94°С в течение 30 сек, 62,2°С в течение 30 сек, 72°C в течение 30 сек) - 72°С в течение 15 мин - 8°С выдерживание. Размер продуктов ПЦР определяли на анализаторе 3130×1 Genetic Analyzer (Applied Biosystems), и данные анализировали с использованием программного обеспечения Gene Mapper (Applied Biosystems).
Полноэкзомное секвенирование
Геномную ДНК выделяли из гранулоцитов периферической крови (опухолевой ткани) и CD3+ Т-лимфоцитов (контрольная ткань) согласно стандартным процедурам. Получали библиотеку ДНК с использованием набора NEB Next DNA Sample Prep Kit (набор реагентов) (New England Biolabs, Ipswich, MA) и полноэкзомное обогащение проводили с использованием набора Sure Select Human All Exon (Agilent, Santa Clara, Калифорния) согласно инструкциям изготовителя. Библиотеки секвенировали на системе Illumina HiSeq2000 (Illumina, San Diego, Калифорния) согласно инструкциям изготовителя. Подробную информацию о параметрах подноэкзомного секвенирования смотри в дополнительной таблице 1.
Дополнительная таблица 1
образца
секвенирования
показания
покрытие
покрытые
Дополнительная таблица 2. Праймеры, использованные для анализа мутационного статуса CALR
Анализ полноэкзомным секвенированием
Данные секвенирования выравнивали против человеческого стандартного генома (hg18) с использованием программного обеспечения BWA v0.5.9 (Li& Durbin, 2009). Использовали набор инструментов для геномного анализа (GATK) v1.5 (McKenna et al., 2010) для пост-обработки выравниваний согласно методическим указаниям доброкачественной практики v3 из GATK. Данные по покрытию, представленные в дополнительной таблице 1, рассчитывали после обработки файлов выравнивания с помощью скрипта CalculateHsMetrics.jar производства Picard (http://picard.sourceforge.net). После обработки файлов выравнивания затем анализировали два варианта распознающих программ:
1. Использовали GATK United Genotyper (DePristo et al., 2011) для распознавания однонуклеотидных вариантов и небольших инсерций/делеций в образцах ДНК гранулоцитов. Предварительные списки вариантов затем обрабатывали с использованием программы Variant Quality Recalibrator (GATK) для получения перекалиброванных списков вариантов. Варианты были аннотированы с использованием ANNOVAR версии 2012-05-25 (Wang et al., 2010). Заявители отфильтровывали варианты, которые были обнаружены в кодирующих экзонах и которые оказывали влияние на аминокислотный состав белка, а также варианты в сайтах сплайсинга.
2. Использовали инструмент Varscan 2.3.2 (Koboldt et al., 2012) для распознавания соматических вариантов, сравнивая пост-обработанные выравнивания из образца ДНК гранулоцитов с выравниваниями из образца Т-лимфоцитов одного и того же пациента. Varscan использовали согласно инструкциям программиста. Инструмент Samtools 0.1.18 (Li et al., 2009) генерировал файлы mpileup, необходимые в качестве входных данных для Varscan. Varscan списки аннотировали ANNOVAR и отфильтровывали, как описано выше. Перекрывая списки вариантов, полученные из двух распознающих варианты программных цепочек, получали окончательный список вариантов. GATK обеспечивает балл вероятности варианта быть верным вариантом, который является баллом VQSLOD. Varscan обеспечивает р-значение для варианта быть соматическим. Основные требования к распознаванию окончательного однонуклеотидного варианта (SNV) заключались в том, чтобы варианты распознавались как программными цепочками, распознающими варианты, так и чтобы вариант в образце гранулоцитов не был классифицирован как вариант с «низким качеством» по GATK. Из всех SNV, попадающих в эту категорию, были распознаны те, которые имели балл VQSLOD > 0 и соматическое р-значение <0,05. Заявители также распознавали варианты с VQSLOD [-2; 0], но для них требовалось соматическое р-значение <0,01. Распознавание варианта инсерция/делеция является более сложным, чем распознавание SNV. Для того чтобы не пропустить верные варианты, заявители просто полагали необходимым, чтобы инсерцию/делецию можно было найти с помощью обоих программных цепочек. Для распознавания этих вариантов никаких дополнительных мер по качеству или р-значению не требовалось.
Секвенирование по Сэнгеру
Праймеры для секвенирования по Сэнгеру конструировали с использованием инструмента PrimerZ (http://ncbi36.genepipe.ncgm.sinica.edu.tw/primerz/beginDesign.do) или инструмента Primer3 (http://www.bioinformatics.nl/cgi-bin/primer3plus/primer3plus.cgi/). Последовательности праймеров приведены в дополнительной таблице 2.
ПЦР проводили с использованием реакционной смеси для постановки ПЦР AmpliTaq Gold 360 Mastermix (Applied Biosystems/Life Technologies, Paisley, Великобритания).
Для ПЦР использовали ступенчатую программу: 95°С, 5 мин - 10 × (94°С, 30 сек-67°С, 30 сек [-1°С на цикл] - 72°С, 30 сек) - 29 × ( 94°С, 30 сек-57°С, 30 сек - 72°С, 30 сек) - 72°С, 10 мин. 10°C, выдерживание. Для секвенирования по Сэнгеру использовали набор BigDye Terminator v3.1 Cycle Sequencing (Applied Biosystems) со следующей программой: 96°C, 1 мин - 25 раз (96°С, 10 сек - 50°С, 5 сек - 60°С, 4 мин) - 10°С выдерживание. Пики секвенирования получали на анализаторе 3130xl Genomic Analyzer (Genetic Analyzer) ((Applied Biosystems). Анализ последовательностей проводили с использованием программного обеспечения Sequencher Software 4.9 (Gene Codes, Ann Arbor, MI).
Анализ фрагментов ПЦР для обнаружения мутаций в экзоне 9 CALR
Праймеры конструировали для экзона 9 CALR и прямой праймер метили 6-FAM (дополнительная таблица 2). ПЦР проводили следующим образом: 95°С, 5 мин - 10 × (94°С, 30 сек-67°С, 30 сек [-1°С на цикл] - 72°С, 30 сек) - 29 × (94°С, 30 сек-57°С, 30 сек - 72°С, 30 сек) - 72°С, 10 мин. 10°C, выдерживание. Продукты ПЦР разводили 1:25 водой и их размер определяли на анализаторе 3130xl Genomic Analyzer (Genetic Analyzer) (Applied Biosystems). Полученные результаты анализировали с использованием Gene Mapper software version 4.0 (Applied Biosystems).
Субклонирование продуктов ПЦР
Продукты ПЦР субклонировали с использованием набора TOPO TA Cloning (Invitrogen/Life Technologies, Paisley, Великобритания), следуя инструкциям изготовителя, используя бактерии TOP-10. На следующий день собирали одиночные колоний бактерий и размножали культивированием в течение ночи. Плазмиды извлекали с использованием набора QIAprep Spin Mini Prep (Qiagen, Hilden, Германия). Реакцию секвенирования проводили с использованием набора v3.1 Cycle Sequencing (Applied Biosystems): 50-200 мкг плазмиды, 4 мкл праймера, 1 мкл смеси BigDye Terminator, 1 мкл буфера для секвенирования и вода для высокоэффективной жидкостной хроматографии до 10 мкл. Программа секвенирования представляла 96°С, 5 мин - 25 × (96°С, 1 мин - 50°С, 5 сек - 60° С, 4 мин) - 10°С выдерживание.
Микрочип-анализ SNP
Образцы ДНК обрабатывали и гибридизовали с микрочипами Genome-Wide Human SNP 6.0 (Affymetrix), следуя протоколу изготовителя. Первичные данные анализировали с использованием программного обеспечения Genotyping Console version 3.0.2 (Affymetrix). Образцы оценивали в отношении наличия хромосомных аберраций (делеции, добавлений и приобретенной однородительской дисомии), что имеется в программном обеспечении Genotyping Console.
Клонирование мутаций в экзоне 9 CALR
Мутантный CALR и CALR дикого типа амплифицировали из клона, полученного от Source Biosciences и клонировали в сайты XhoI и EcoRI в ретровирусной конструкции pMSCV-IRES-GFP. CALR дикого типа амплифицировали с использованием следующих праймеров -
(прямой праймер - ATGCCTCGAGCCGCCACCATGCTGCTATCCGTGCCGCTGCTGCTC (SEQ ID NO:1346) и обратный праймер - ATGCGAATTCCTACAGCTCGTCCTTGGCCTGGCC (SEQ ID NO:1347)).
Мутантный CALR амплифицировали в двух фрагментов с последующей гнездовой ПЦР -
(прямой праймер 1 - ATGCCTCGAGCCGCCACCATGCTGCTATCCGTGCCGCTGCTGCTC (SEQ ID NO:1346), обратный праймер 1 - CCTCATCATCCTCCTTGTCCTCTGCTCCTCGTCCTG (SEQ ID NO:1348),
прямой праймер 2 - CAGGACGAGGAGCAGAGGACAAGGAGGATGATGAGG (SEQ ID NO: 1349), обратный праймер 2 - ATGCCCGCGGCTAGGCCTCAGTCCAGCCCTGGAGG (SEQ ID NO:1350).
Получение вируса и трансдукция
Получали ретровирус и клетки трансдуцировали, как описано ранее (Zuber et al., 2013). Вкратце, клетки PlatE (75% слияние на чашке диаметром 10 см) трансфектировали 20 мкг соответствующего вирусного вектора с использованием набора для трансфекции с фосфатом кальция (Sigma #CAPHOS). Через 24 ч среду заменяли и супернатант с вирусом собирали на 36, 40, 44 и 60 ч после трансфекции. 1 млн. клеток Ba/F3 трансдуцировали свежим супернатантом с вирусом в 6-луночных планшетах центрифугированием (4 мкг/мл полибрена, 1350 g, 30 мин при 32°С), в каждой точке сбора вируса. Клетки анализировали на эффективность трансдукции проточной цитометрией через 48 ч после последней стадии трансдукции. Положительные на GFP клетки подвергали сортингу с использованием FACS и эффективность сортинга анализировали проточной цитометрией.
Анализ пролиферации и жизнеспособности
Для оценки жизнеспособности трансдуцированных клеток Ba/F3 в присутствии интерлейкина-3, клетки высевали в 96-луночные планшеты из расчета 5000 клеток на лунку в трех повторах с использованием серии разведений интерлейкина-3 (самая высокая концентрация 25 нг/ мл). Через 72 ч жизнеспособность клеток определяли с использованием набора CellTiter-Glo® Luminescent Cell Viability Assay (Promega).
Для определения пролиферацию клеток в отсутствие интерлейкина-3 клетки Ba/F3 высевали в 12-луночные планшеты из расчета 1000000 клеток на лунку в трех повторах и культивировали в течение 7 суток в полной среде RPMI (с добавлением 10% FCS, пенициллина/стрептомицина и L-глутамина) без интерлейкина-3. Каждые 24 ч подсчитывали количество клеток с помощью клеточного счетчика CASY® Cell Counter (Roche Innovatis).
Для определения чувствительности к ингибитору SAR302503 (Sanofi), клетки Ba/F3 высевали в 96-луночные планшеты из расчета 25000 клеток на лунку в трех повторах с использованием серии разведений SAR302503 (самая высокая концентрация 40 мкМ) и в присутствии 10 нг/мл интерлейкина-3. Через 48 ч определяли жизнеспособность клеток с помощью набора CellTiter-Glo® Luminescent Cell Viability Assay (Promega).
Стимуляция интерлейкином-3 и вестерн-блоттинг
Клетки Ba/F3 культивировали в полной среде RPMI (10% FCS, пенициллин/стрептомицин, L-глутамин) в присутствии 1 нг/мл интерлейкина-3. Клетки подвергали «голоданию» в бессывороточной среде без интерлейкина-3 в течение 4 ч. Стимуляцию проводили с соответствующей концентрацией интерлейкина-3 в течение 20 мин. Клетки осаждали центрифугированием и белок экстрагировали, как описано ранее (Corvinus et al., 2005). Вкратце, буфер для полной экстракции цельных клеток (содержащий ингибиторы протеазы и фосфатазы) добавляли к клеткам, и лизировали 3 последовательными циклами замораживания-оттаивания с жидким азотом. Лизаты собирали центрифугированием в течение 20 мин при 20000 g. Концентрацию белка измеряли с использованием реагента Брэдфорда. Вестерн-блоттинг проводили с использованием стандартных методик и 50 мкг белка загружали в лунку. Использовали следующие антитела - pYStat5 (Invitrogen, #71-6900), Stat5 (Santa Cruz, sc-836), кальретикулин (Millipore, MABT145), GAPDH (Santa Cruz, sc-32233), анти-кроличьи с пероксидазой хрена (GE, NA934) и анти-мышиные с пероксидазой хрена (GE, NA931).
Иммунофлуоресценция
Клетки HEK293T высевали на покровные стекла, покрытые 0,1% желатином, трансфектировали плазмидами CMV-CALR дикого типа и CMV-CALR del52 липофекцией (Invitrogen), следуя инструкциям изготовителя, в течение 24 ч. Визуализацию проводили окрашиванием ЭР с использованием анти-калнексин-антитела (ab31290, abcam); вторичного антимышиного антитела с AlexaFluor 546 (Invitrogen). Антитела к кальретикулину (MABT145, Millipore) использовали для окрашивания CALR; и вторичного анти-кроличьего антитела с AlexaFlour 594 (Invitrogen). Препараты визуализировали с использованием LSM780 (Carl Zeiss, Германия) с мультидетектором GaAsP и двух PMT. Микроотверстие устанавливали на 1 AU на каждом канале. Последовательно получали изображения, и выбирали каналы для уменьшения перекрывания. Изображения получали при увеличении 100× и анализировали с помощью ImageJ (NIH, открытый источник).
Статистический анализ
Статистический анализ проводили с использованием стандартных методов. Проверку гипотез проводили с использованием непараметрического подхода. Все тесты были двусторонние, и Р-значения считались статистически значимыми при значении ниже, чем 0,05. Использовали программы Microsoft Office Excel (Copyright Microsoft Corp), Stata 11.2 (Copyright StataCorp LP)) и R 2.15.2 (R Core Team, 2012) для управления и анализа данных. Суммарную частоту тромботических осложнений оценивали с использованием подхода конкурирующих рисков по методу Калбфляйша-Прентиса (Kalbfleisch & Prentice, 1980). Летальный исход в отсутствие интересующего события рассматривали как конкурирующее событие.
Результаты
Полноэкзомное секвенирование выявило повторяющиеся мутации CALR при ПМФ (первичном миелофиброзе)
Анализировали геномную ДНК из гранулоцитов периферической крови (опухолевая ткань) и CD3+ Т-лимфоцитов (контрольная ткань) от 6 пациентов с ПМФ с использованием полноэкзомного секвенирования. Независимая валидация детектированных вариантов с использованием классического секвенирования по Сэнгеру подтверждала наличие соматических мутаций в двух-двенадцати генах на одного пациента. Рекуррентно пораженным геном был только ген CALR, кодирующий кальретикулин. У двух пациентов были соматические делеции в экзоне 9 CALR. Субклонирование и секвенирование продуктов ПЦР показало, что у 191 пациента была делеция 52 п.н. и у 296 пациентов была делеция одной п.н. (фигура 1). Поскольку делеция 52 п.н. у 191 пациента была неправильно аннотирована как делеция одной п.н. в сочетании с однонуклеотидным вариантом с использованием распознающего варианты анализа программной цепочки, то выравнивание последовательностей пациента 191 повторно проводили вручную. Отмечали несовпадение результатов секвенирования, покрывающего сайт мутации. Неправильное выравнивание было результатом повторяющегося элемента в пораженной области генома. После установления этого факта проводили выравнивания последовательностей для остальных четырех пациентов и детектировали повторяющуюся инсерцию 5 п.н. у всех 4 пациентов. Мутации CALR, обнаруженные у пациентов полноэкзомным секвенированием, подтверждались как соматические с использованием секвенирования по Сэнгеру совпадающих образцов ДНК Т-лимфоцитов. Таким образом, у всех шести пациентов с ПМФ, анализированных полноэкзомным секвенированием, имели место инсерционные или делеционные соматические мутации в экзоне 9 CALR.
Частота мутаций в экзоне 9 CALR у пациентов с миелопролиферативным новообразованием (МПН)
Для установления частоты мутаций CALR при МПН когорту 896 пациентов с МНП подвергали скринингу на наличие инсерционных и делеционных мутаций в экзоне 9 CALR с использованием высокоразрешающего определения размеров продуктов ПЦР, меченных флуоресцентной меткой. Данная когорта включала 382 пациента с истинной полицитемией (ИП), 311 с эссенциальной тромбоцитемией (ЭТ) и 203 с первичным миелофиброзом (ПМФ) (таблица 1). Было идентифицировано 150 образцов с инсерциями или делециями в CALR (17%). Эти мутации были независимо подтверждены секвенированием по Сэнгеру. При ИП не наблюдали мутаций CALR. При ЭТ и ПМФ 78 (25%) и 72 (35%) пациентов имели мутации в CALR соответственно (таблица 1). Все пациенты были генотипированы по мутации JAK2-V617F. Пациентов с ИП с отрицательным результатом в отношении этой мутации тестировали на наличие мутаций в экзоне 12 JAK2. Пациентов с ЭТ и ПМФ с JAK2 дикого типа тестировали на наличие мутаций в экзоне 10 MPL.
Распределение мутаций JAK2, MPL и CALR в трех нозологических группах МПН представлено на фигуре 2А. Все пациенты с мутантным CALR имели JAK2 и MPL дикого типа. Таким образом, мутации в CALR достоверно ассоциировались с ЭТ (P=9,33×10-45) и ПМФ (P=1,71×10-44), которые представляли дикий тип для мутаций JAK2 и MPL. В целом у 67 пациентов с МПН тестировали дикий тип для JAK2 и MPL, а также для экзона 9 CALR. Из этих «тройных отрицательных» случаев образцы от 19 пациентов были секвенированы по Сэнгеру в отношении мутаций во всех 9 экзонах CALR, но никаких мутаций не было обнаружено.
Поскольку мутации CALR ассоциируются на высоком уровне с наличием JAK2 и MPL дикого типа при ЭТ или ПМФ, то тестировали еще 211 пациентов, попадающих в данную категорию заболеваний. В общей сложности из 289 пациентов с ЭТ с JAK2/MPL дикого типа у 195 пациентов имел место мутантный CALR (67%). Из объединенных 120 пациентов с ПМФ с JAK2/MPL дикого типа 105 пациентов несли мутацию в CALR (88%). У 150 пациентов с мутантным CALR, для которых была в наличии совпадающая ДНК Т-лимфоцитов, мутации были соматические.
Таблица 1. Сравнение мутаций JAK2, MPL и CALR при трех подтипах МПН (показано количество пациентов)
Частота мутаций CALR в других миелоидных злокачественных опухолях
Для исследования того, присутствуют ли мутации CALR в других миелоидных злокачественных опухолях, провели скрининг 254 пациентов с de novo ОМЛ, 45 с хроническим миелолейкозом, 73 с миелодиспластическим синдромом, 64 с хроническим миеломоноцитарным лейкозом и 24 с рефрактерной анемией с кольцевыми сидеробластами, ассоциированной выраженным тромбоцитозом, на мутации в экзоне 9 CALR. Несмотря на то, что у подавляющего большинства этих пациентов имел место экзон 9 CALR дикого типа, у трех пациентов с рефрактерной анемией с кольцевыми сидеробластами, ассоциированной выраженным тромбоцитозом, имелись мутации в CALR (фиг. 2В), которые все имели JAK2 и MPL дикого типа (фиг. 2С). Мутации в гене, кодирующем субъединицу B1 сплайсинг фактора 3 (SF3B1), имели место совместно с мутациями во всех трех генах. Из 524 здоровых субъектов у одного была делеция 3 п.н. в CALR.
Мутации CALR сдвига рамки считывания заменяют С-концевую аминокислотную последовательность на новый пептид, происходящий из альтернативной рамки считывания
В целом было обнаружено 36 различных типов мутаций в CALR, включая инсерции, делеции, а также комбинации делеций и инсерций/делеций с однонуклеотидными вариантами. Все наблюдаемые мутации приводят к сдвигу рамки считывания на альтернативную рамку считывания 1 CALR (фиг. 3А). Это приводит к заметному изменению аминокислотного состава С-конца мутантного белка CALR (фиг. 3В). С-конец, полученный из экзона 9 в CALR дикого типа, имеет высокий отрицательный заряд, в то время как пептиды мутантов, полученные из альтернативной рамки считывания 1, заряжены положительно. Поскольку альтернативная рамка считывания 2 имеет несколько стоп-кодонов, то мутации сдвига рамки считывания будут приводить к преждевременной терминации трансляции и усечению белка (фиг. 3В). У тестированных пациентов с МПН не наблюдали мутаций сдвига рамки считывания на альтернативную рамку считывания 2. Эти 36 типов мутаций представлены на фиг. 3C. За счет различных размеров и позиций мутационных прибавлений и потерь обнаруживали различное количество аминокислот в С-концевой области белка (таблица 2). Все мутации сдвига рамки генерируют новую С-концевую аминокислотную последовательность (таблица 2). Полноразмерные белковые последовательности всех мутантов показаны в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288. Последовательности кДНК около мутационных соединений приведены в таблице 3.
Таблица 2. С-концевые аминокислотные последовательности, обнаруженные после инсерционных/делеционных мутаций сдвига рамки считывания CALR, у пациентов с МПН. В таблице 2 представлены последовательности SEQ ID NO: 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 4, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 и 144 соответственно в порядке появления.
Таблица 3. Последовательности мутационных соединений в последовательности кДНК CALR для конструирования специфических для мутаций зондов или праймеров для ПЦР. В таблице 3 представлены последовательности SEQ ID NO 440-475 соответственно в порядке появления.
положениях
У пациентов с МПН были идентифицированы соматические мутации в гене CALR, специфические для миелоидных клеток. Мутации в высокой степени ассоциировались с теми пациентами, которые были негативными для обеих мутаций JAK2 и MPL (ранее описанные болезнетворные мутации при МПН). Поскольку мутации CALR обнаружены в 88% случаев ПМФ, и в 67% случаев ЭТ с двойным отрицательным результатом для JAK2 и MPL, то полагается, что мутации CALR заполнят большой пробел в диагностике JAK2/MPL-негативных ЭТ и ПМФ. Следовательно, на основании детектирования мутаций CALR на уровне геномной ДНК, РНК или кДНК предлагается важный диагностический тест для МПН.
Все выявленные мутации находятся в последнем экзоне 9 CALR, кодирующем С-концевые аминокислоты белка, и преимущественно представляют инсерционные/делеционные мутации. Подавляющее большинство мутаций находилось в гетерозиготном состоянии, и они вызывали сдвиг рамки считывания на одинаковую альтернативную рамку считывания. Такой сдвиг рамки считывания приводит к замене С-концевых отрицательно заряженных аминокислот (богатого аспарагиновой и глутаминовой кислотами) кальретикулина на преимущественно положительно заряженный полипептид, богатый аргинином и метионином. Кроме того, последние 4 аминокислоты кальретикулина (KDEL (SEQ ID NO: 1331)) содержат сигнал удерживания в эндоплазматическом ретикулуме. Этот сигнал отсутствует в мутантном кальретикулине, что позволяет предположить, что мутантный белок менее представлен в ЭР по сравнению с белком дикого типа. Поскольку отрицательно заряженный С-конец кальретикулина представляет Са2+-связывающий домен с низкой аффинностью и высокой емкостью, то предполагается, что Са2+-связывающая функция мутантного белка отсутствует.
Из всех случаев мутированного CALR мутации типа 1 (делеция 52 п.н.) и типа 2 (инсерция 5 п.н.) составляли 53% и 32% соответственно (фиг. 3D, E). Другие типы мутаций наблюдались с существенно более низкими частотами, многие детектировались в каждом случае только у одного пациента (фиг. 3Е). Поскольку все 36 мутаций имеют один тип и относятся к мутациям сдвига рамки считывания на альтернативную рамку считывания 1, то полученные в результате мутантные белки CALR имеют общую новую аминокислотную последовательность на С-конце (таблица 2). С-концевой пептид, происходящий из альтернативной рамки считывания 1, содержит ряд положительно заряженных аминокислот, тогда как С-конец CALR дикого типа в значительной степени является отрицательно заряженным (фиг. 3В). Кроме того, кальретикулин дикого типа содержит мотив удерживания в эндоплазматическом ретикулуме на С-конце (аминокислотная последовательность KDEL (SEQ ID NO: 1331)). С-концевая последовательность KDEL (SEQ ID NO: 1331) отсутствует во всех мутантных вариантах (таблица 2). В зависимости от типа мутации мутантные белки сохраняют различное количество отрицательно заряженных аминокислот кальретикулина дикого типа. Делеции 1 типа 52 п.н. элиминируют практически все отрицательно заряженные аминокислоты, в то время как инсерции 5 п.н. типа 2 сохраняют примерно половину отрицательно заряженных аминокислот (фиг. 3D). С учетом этих различий заявители предположили, что мутации типа 1 и типа 2 могут быть связаны с качественно различными фенотипами. Следовательно, было установлено, что делеции типа 1 достоверно встречались чаще при первичном миелофиброзе по сравнению с эссенциальной тромбоцитемией (P = 0,0007). Кроме того, обнаружили только 3 пациентов, гомозиготных по мутациям CALR, ассоциированных с однородительской дисомией хромосомы 19p, и во всех 3 случаях была инсерция 5 п.н. типа 2 (фиг. 4A).
Мутации CALR приобретаются в начале клональной эволюции и мутантные клоны являются стабильными
Для исследования того, когда приобретаютсяя мутации в гене CALR, рано или поздно в клональной истории пациента, анализировали колонии гемопоэтических предшественников от двух пациентов, для которых имелись мутационные профили по данным полноэкзомного секвенирования. Клональные иерархии пациентов H_0191 и H_0296 показаны на фиг. 4B. Было сделано заключение, что мутации в CALR возникают рано в основных клонах от двух тестированных пациентов.
Для 24 пациентов с мутантным геном CALR имелись образцы в период наблюдений, которые все дали положительный результат на наличие мутации.
Клиническое значение мутаций CALR
В целом, тестировали 1215 пациентов с эссенциальной тромбоцитемией или первичным миелофиброзом (таблица 4). Из них 63,4% несли мутации JAK2-V617F, 4,4% несли активирующие мутации в экзоне 10 MPL, 23,5% несли мутации в экзоне 9 CALR, и только у 8,8% отсутствовали вышеуказанные клональные маркеры. Следует отметить, что большинство из этих последних пациентов входило в подгруппу пациентов с эссенциальной тромбоцитемией. Использовали критерий суммы рангов Уилкоксона для сравнения гематологических показателей у пациентов, несущих различные мутантные гены. У пациентов с эссенциальной тромбоцитемией с мутацией CALR был более низкий уровень гемоглобина, более низкое содержание эритроцитов, а также более высокий уровень тромбоцитов на время постановки диагноза по сравнению с пациентами, несущими мутантный JAK2 (во всех случаях р<0,001). У пациентов с первичным миелофиброзом, несущих мутацию CALR, было более низкое количество эритроцитов (P = 0,027) и более высокое количество тромбоцитов (P<0,001), чем у пациентов с мутантным JAK2. Общая выживаемость и риск тромбозов анализировали только у пациентов, несущих мутацию в JAK2, MPL или CALR, т.е. имеющих клональный маркер. С учетом того, что мутационный статус не меняется со временем, все анализы выполняли после постановки первоначального диагноза. Поскольку 6 пациентов были исключены из-за недостаточного периода наблюдения, то в общей сложности были обследовано 1102 пациентов. Медианный период наблюдения для всей когорты пациентов с любым из трех мутированных генов составил 5,7 лет (в пределах 0-31 год). Как показано на фиг. 5А, имеется достоверная разница в общей выживаемости между 3 подгруппами пациентов с первичным миелофиброзом (р<0,001). Пациенты, несущие соматическую мутацию CALR, имели лучшую общую выживаемость, чем пациенты с мутацией JAK2 (р<0,001) или с мутацией MPL (р<0,001), в то время между последними двумя подгруппами пациентов разница отсутствовала. У пациентов с эссенциальной тромбоцитемией, которые имели существенно более высокую выживаемость, достоверная разница имела место только между пациентами с мутированным CALR и мутированным JAK2 (P = 0,043, фиг. 5B). В результате проведения многофакторного регрессионного анализа Кокса общей выживаемости, включающего в качестве ковариат тип миелоидных новообразований (эссенциальная тромбоцитемия по сравнению с первичным миелофиброзом), тип мутантного гена и когорта пациентов (Павиа в сравнении с Веной), было обнаружено, что первые два фактора являются независимыми прогностическими факторами. Как и следовало ожидать, первичный миелофиброз ассоциировался с более низкой общей выживаемостью по сравнению с эссенциальной тромбоцитемией (отношение рисков летального исхода 7,1, P<0,001, CI 4,9-10,2). Кроме того, тип мутантного гена имел независимое влияние на выживаемость. Фактически по сравнению с пациентами, несущими мутацию CALR, как пациенты с мутацией JAK2 (отношение рисков 3,1, р<0,001, CI 2,0-4,7), так и пациенты, несущие мутацию MPL (отношение рисков 3,5, P<0,001, CI 1,8-6,7), имели более высокий риск летального исхода. Суммарная частота тромбозов при эссенциальной тромбоцитемии рассчитывалась с подходом конкурирующего риска с летальным исходом по всем причинам в качестве конкурирующего события, и результаты представлены в таблице 5, в то время как фактические кривые показаны на фиг. 5С. Пациенты с эссенциальной тромбоцитемией, несущие мутации CALR, имели более низкий риск развития тромбозов, чем пациенты, несущие мутации JAK2 (P = 0,003), в то время как между другими подгруппами никаких достоверных различий не было обнаружено. Следует отметить, что подгруппа пациентов, несущих мутацию MPL, была небольшой.
Таблица 4. Описательные показатели для 1215 пациентов, использованных для установления клинического значения мутаций CALR
(n=770)
(n=53)
CALR
(n=285)
(n=107)
пациенты
(n=1215)
Таблица 5. Сравнение суммарной частоты тромбозов у пациентов с мутантными JAK2, MPL и CALR
частота
тромбозов
(CI 10-16,4)
(CI 16,6-25,7)
(CI 21,4-33)
(CI 2,3-22,3)
(CI 2,3-22,3)
(CI 4,4-38,1)
(CI 3,2-10,8)
(CI 6,3-17,1)
(CI 7,3-20)
Функциональный анализ мутации CALR типа 1
Для исследования функциональных эффектов мутантного CALR клонировали кДНК CALR дикого типа и мутации CALR типа 1 (делеция 52 п.н.) в ретровирусный экспрессионный вектор pMSCV-IRES-GFP. После получения ретровирусов и трансфекции кДНК CALR в интерлейкин-3-зависимую мышиную клеточную линию Ba/F3 проводили сортинг положительных на трансген клеток с использованием проточной цитометрии для GFP. Затем определяли интерлейкин-3-зависимую пролиферацию клеток. Клетки, экспрессирующие мутацию CALR типа 1, показывали интерлейкин-3-независимый рост и повышенную чувствительность к интерлейкину-3 (фиг. 6А). Когда определяли пролиферацию клеток в отсутствии интерлейкина-3, то делеция 52 п.н. CALR приводила к достоверному накоплению клеток (фиг.6В). Для исследования того, насколько независимость от интерлейкина-3 в мутантных клетках с делецией 52 п.н. CALR возникает в результате активации сигнального пути с участием JAK-STAT, определяли чувствительность клеток к ингибитору киназы JAK2 SAR302503. Как показано на фиг. 7, CALR дикого типа и CALR с делецией 52 п.н. проявляли примерно одинаковую чувствительность к SAR302503, на основании чего можно предположить, что интерлейкин-3-независимый рост клеток с мутантным CALR зависит от семейства киназ JAK2 или JAK, которые являются мишенью для SAR302503. Для подтверждения этой гипотезы исследовали фосфорилирование STAT5 в присутствии и в отсутствие интерлейкина-3 в контроле и трансфектированных клеточных линиях CALR. Было установлено повышенное фосфорилирование STAT5 в отсутствии интерлейкина-3 в мутанте CALR с делецией 52 п.н. и при концентрации интерлейкина-3 0,1 нг/мл (фиг. 6С). Таким образом, усиление активации сигнального пути JAK-STAT, вероятно, является ответственным за цитокин-независимый рост клеток, экспрессирующих мутантный CALR с делецией 52 п.н.
Иммунофлуоресцентную микроскопию использовали для определения локализации CALR дикого типа и мутантного CALR типа 1. При сверхэкспрессии в клетках НЕК, CALR дикого типа локализуется в эндоплазматическом ретикулуме (окрашенном на калнексин). В случае мутантного CALR типа 1 такая совместная локализация была выражена в меньшей степени, скорее всего, за счет отсутствия последовательности KDEL (SEQ ID NO:1331), из С-конца мутантного CALR (фиг. 6D).
Идентифицировали соматические мутации в гене CALR у пациентов с первичным миелофиброзом и эссенциальной тромбоцитемией. Мутации CALR являются взаимоисключающими с мутациями в обоих генах JAK2 и MPL. Не было обнаружено мутаций CALR при истинной полицитемии, миелопролиферативном новообразовании, которое специфически ассоциировано с мутациями JAK2. Мутации CALR представляют вторую по частоте мутацию после JAK2 при миелопролиферативных новообразованиях. Также исследовали пациентов с другими миелоидными новообразованиями, и мутации гена CALR обнаружили только в 12,5% случаев у пациентов с рефрактерной анемией с кольцевыми сидеробластами, ассоциированной с выраженным тромбоцитозом, типичным миелодиспластическим/миелопролиферативным новообразованием (Malcovati et al., 2009). Полученные данные подтверждают наличие причинно-следственной связи между мутациями CALR и избыточной продукцией тромбоцитов.
Поскольку мутации CALR встречаются примерно у 73% пациентов, которые не имеют изменений в генах JAK2 и MPL, то можно полагать, что они заполнят имеющийся в настоящее время пробел в молекулярной диагностике миелопролиферативных новообразований. В целом, только менее 10% пациентов, находящихся под наблюдением заявителей, с эссенциальной тромбоцитемией или первичным миелофиброзом не несут соматических мутаций JAK2, MPL или CALR. У некоторых из этих субъектов мутированный клон может быть слишком маленьким, чтобы его можно обнаружить с помощью имеющихся в настоящее время подходов. Редкие мутантных гены-регуляторы могут играть определенную роль у других пациентов, в то время как у некоторых пациентов может вообще отсутствовать клональное заболевание. Это особенно верно для пациентов с клиническим диагнозом эссенциальной тромбоцитемии, поскольку дифференциальная диагностика клонального и реактивного тромбоцитоза может быть затруднительна в отсутствии клонального маркера (Schafer, 2004). В общем, оценка мутаций CALR заметно улучшает имеющийся в настоящее время диагностический подход для эссенциальной тромбоцитемии или первичного миелофиброза, и она должна быть включена в критерии ВОЗ в отношении этих расстройств (Sverdlow et al., 2008)
Все идентифицированные мутации CALR представляли инсерцинные/делеционные мутации в последнем экзоне, кодирующем С-концевые аминокислоты белка. Подавляющее большинство мутаций находилось в гетерозиготном состоянии, и они вызывали сдвиг рамки считывания на одинаковую альтернативную рамку считывания. Такой сдвиг рамки считывания приводит к замене С-концевых отрицательно заряженных аминокислот кальретикулина на преимущественно положительно заряженный полипептид, богатый аргинином и метионином. Последние 4 аминокислоты кальретикулина (KDEL (SEQ ID NO: 1331)) содержат сигнал удерживания в эндоплазматическом ретикулуме. Этот сигнал отсутствует в мутантном кальретикулине. Следовательно, мутантный белок имеем измененную субклеточную локализацию. Поскольку отрицательно заряженный С-конец кальретикулина представляет Са2+-связывающий домен с низкой аффинностью и высокой емкостью, то предполагается, что Са2+-связывающая функция мутантного белка может быть нарушена. Присутствие пептидной последовательности, происходящей из альтернативной рамки считывания, в С-конце мутированного CALR предоставляет возможность для иммунологического направленного действия, поскольку он представляет собой специфический для злокачественной опухоли эпитоп.
Для дальнейшего анализа онкогенной активности мутантного кальретикулина, получали клетки Ba/F3 со сверхэкспрессией CALR дикого типа и мутантного CALR типа 1 (делеция 52 п.н. - del52). Интересно, что клетки Ba/F3 CALR del52 проявляли цитокин-независимую пролиферацию. Однако, рост клеток Ba/F3, экспрессирующих кальретикулин дикого типа и мутантный кальретикулин, одинаково подавлялся при обработке ингибитором киназы JAK2, на основании чего можно предположить о необходимости пути JAK-STAT в обеспечении индуцированной мутантным кальретикулином независимости от цитокинов. В соответствии, заявители смогли обнаружить повышенное фосфорилирование STAT5 в клетках Ba/F3 del52, как в отсутствии, так и присутствии стимуляции интерлейкином-3. Ранее было показано, что кальретикулин/Са2+/кальмодулин модулирует активность Stats. Комплекс кальретикулина с ERp57 в эндоплазматическом ретикулуме подавляет фосфорилирование и транскрипционную активность Stat3 в мышиных эмбриональных фибробластах (Coe et al., 2010). Кроме того, ингибирование Са2+/кальмодулин-зависимой киназа II гамма приводит к снижению уровней фосфорилированных Stat1, Stat3 и Stat5 (Si&Collins 2008). Интересно, что сверхэкспрессия кальретикулина ослабляет индуцированное интерфероном-альфа фосфорилирование Stat1, что приводит к развитию резистентности к интерферону (Yue et al., 2012). Необходимы дальнейшие исследования для выяснения механизма активации пути JAK-STAT мутантным кальретикулином в миелоидных клетках. Вовлеченностью сигнального пути JAK-STAT у CALR-положительных пациентов также можно объяснить эффективность терапии ингибитором JAK2 при первичном миелофиброзе. Однако результаты заявителей указывают на то, что ингибиторы JAK2 не могут быть селективными для клеток, экспрессирующих мутантный CALR, по сравнению с клетками дикого типа CALR.
Однако анализ клинического исхода является ретроспективным, его данные убедительно показывают, что CALR-положительные миелопролиферативные новообразования имеют более доброкачественное клиническое течение, чем соответствующие расстройства, связанные с мутацией JAK2 или MPL. За счет небольшого числа пациентов с мутированным MPL более надежными являются сравнения между пациентами с мутированным JAK2 и мутированным CALR. Наблюдения заявителей ясно показывают, что пациенты с мутированным CALR имеют более низкий риск развития тромбозов и лучшую общую выживаемость, чем пациенты с мутированным JAK2. Более низкая частота тромбоэмболических осложнений может быть связана с тем фактом, что у пациентов с мутированным CALR имеются более низкие уровни гемоглобина и более низкие количества эритроцитов. Более высокая общая выживаемость наблюдалась у пациентов как с первичным миелофиброзом, так и с эссенциальной тромбоцитемией, хотя эта тенденция была более выражена в первом случае, что подтверждает ранее сделанные выводы по пациентам с и без мутаций JAK2 (Campbell et al, 2006b; Rumi et al, 2013). С практической точки зрения, различное влияние мутантных генов может быть включено в существующие в настоящее время прогностические системы оценки для первичного миелофиброза и эссенциальной тромбоцитемии (Passamonti 2010b, Passamonti 2012), и также ими можно руководствоваться при принятии решений по лечению. Конкретнее, молекулярная характеристика CALR должна стать одним из важнейших компонентов клинического контроля эссенциальной тромбоцитемии и первичного миелофиброза в будущем.
Пример 2: Получение специфических антител к мутантному CALR у мышей
Мутации CALR, ассоциированные с МПН, имеют место в последнем экзоне гена (экзоне 9). Эти мутации представляют инсерции и/или делеции, которые приводят к мутации сдвига рамки считывания на очень специфическую альтернативную рамку считывания, что, в свою очередь, приводит к синтезу нового С-концевого пептида в мутанте. Поскольку все мутации приводят к образованию одинаковой альтернативной рамки считывания, то С-концевой пептид имеет одинаковую последовательность во всех мутантах по CALR.
Синтетический пептид с С-концевой последовательностью мутантного белка кальретикулина (последовательность - RRKMSPARPRTSCREACLQGWTEA-), конъюгированный с гемоцианином лимфы улитки (KLH), использовали для иммунизации четырех мышей C57BL/6 дикого типа.
Мыши получали 3 бустерные дозы после первичной иммунизации. Сыворотки мышей анализировали (до иммунизации и после введения бустерных доз) на наличие специфических антител к мутантному кальретикулину вестерн-блоттингом лизатов из клеток НЕК, которые сверэкспрессировали CALR del52 и искусственно полученный мутантный CALR, в котором отсутствует экзон 9 (Δэкзон9, в котором отсутствует мутантный пептид). Лизаты анализировали электрофорезом в 8% полиакриламидном геле и зондировали мышиной сывороткой. В качестве вторичного антитела использовали антимышиное антитело, конъюгированное с пероксидазой хрена (GE NA931). После введения второй бустерной дозы сыворотки от всех четырех мышей содержали специфические антитела к мутантному CALR, которые детектировали мутантный CALR del52 (фиг. 8), но не контрольный CALR с делецированным экзоном 9 (фиг. 9). Анти-кальретикулин-антитела (Millipore MABT145) использовали в качестве положительного контроля (Pos), которые распознают все три формы кальретикулина - дикого типа, мутантный del 52 и с делецирвоанным экзоном 9. Сигнал сывороток от всех четырех мышей был сильнее после введения третьей бустерной дозы (фиг. 10).
С-концевой пептид мутантного кальретикулина (упомянутый выше), является иммуногенным и может успешно использоваться для получения специфических антител, в частности, поликлональных антител против мутантного кальретикулина. Эти антитела могут использоваться в качестве реагентов для научно-исследовательских работ, а также в диагностических целях, как здесь раскрыто.
Настоящее изобретение относится к следующим нуклеотидным и аминокислотным последовательностям:
Последовательности, представленные здесь, частично доступны в базе данных NCBI и могут быть получены на сайте www at ncbi.nlm.nih.gov/sites/entrez?db=gene. Представленные последовательности также относятся к аннотированным и модифицированным последовательностям. Настоящее изобретение также обеспечивает методы и способы, в которых используются гомологичные последовательности, и также варианты сокращенных последовательностей, представленных здесь. Предпочтительно такие «варианты» представляют генетические варианты.
SEQ ID NO.1: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 18
SEQ ID NO.2: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 18
SEQ ID NO.3: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 18
SEQ ID NO.4: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 18
SEQ ID NO.5: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 1
SEQ ID NO.6: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 1
SEQ ID NO.7: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 1
SEQ ID NO.8: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 1
SEQ ID NO.9: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 2
SEQ ID NO.10: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 2
SEQ ID NO.11: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 2
SEQ ID NO.12: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 2
SEQ ID NO.13: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 3
SEQ ID NO.14: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 3
SEQ ID NO.15: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 3
SEQ ID NO.16: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 3
SEQ ID NO.17: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 4
SEQ ID NO.18: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 4
SEQ ID NO.19: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 4
SEQ ID NO.20: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 4
SEQ ID NO.21: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 5
SEQ ID NO.22: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 5
SEQ ID NO.23: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 5
SEQ ID NO.24: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 5
SEQ ID NO.25: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 6
SEQ ID NO.26: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 6
SEQ ID NO.27: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 6
SEQ ID NO.28: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 6
SEQ ID NO.29: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 7
SEQ ID NO.30: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 7
SEQ ID NO.31: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 7
SEQ ID NO.32: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 7
SEQ ID NO.33: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 8
SEQ ID NO.34: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 8
SEQ ID NO.35: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 8
SEQ ID NO.36: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 8
SEQ ID NO.37: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 9
SEQ ID NO.38: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 9
SEQ ID NO.39: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 9
SEQ ID NO.40: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 9
SEQ ID NO.41: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 10
SEQ ID NO.42: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 10
SEQ ID NO.43: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 10
SEQ ID NO.44: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 10
SEQ ID NO.45: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 11
SEQ ID NO.46: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 11
SEQ ID NO.47: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 11
SEQ ID NO.48: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 11
SEQ ID NO.49: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 12
SEQ ID NO.50: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 12
SEQ ID NO.51: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 12
SEQ ID NO.52: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 12
SEQ ID NO.53: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 13
SEQ ID NO.54: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 13
SEQ ID NO.55: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 13
SEQ ID NO.56: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 13
SEQ ID NO.57: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 14
SEQ ID NO.58: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 14
SEQ ID NO.59: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 14
SEQ ID NO.60: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 14
SEQ ID NO.61: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 15
SEQ ID NO.62: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 15
SEQ ID NO.63: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 15
SEQ ID NO.64: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 15
SEQ ID NO.65: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 16
SEQ ID NO.66: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 16
SEQ ID NO.67: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 16
SEQ ID NO.68: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 16
SEQ ID NO.69: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 17
SEQ ID NO.70: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 17
SEQ ID NO.71: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 17
SEQ ID NO.72: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 17
SEQ ID NO.73: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 19
SEQ ID NO.74: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 19
SEQ ID NO.75: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 19
SEQ ID NO.76: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 19
SEQ ID NO.77: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 20
SEQ ID NO.78: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 20
SEQ ID NO.79: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 20
SEQ ID NO.80: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 20
SEQ ID NO.81: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 21
SEQ ID NO.82: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 21
SEQ ID NO.83: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 21
SEQ ID NO.84: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 21
SEQ ID NO.85: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 22
SEQ ID NO.86: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 22
SEQ ID NO.87: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 22
SEQ ID NO.88: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 22
SEQ ID NO.89: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 23
SEQ ID NO.90: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 23
SEQ ID NO.91: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 23
SEQ ID NO.92: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 23
SEQ ID NO.93: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 24
SEQ ID NO.94: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 24
SEQ ID NO.95: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 24
SEQ ID NO.96: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 24
SEQ ID NO.97: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 25
SEQ ID NO.98: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 25
SEQ ID NO.99: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 25
SEQ ID NO.100: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 25
SEQ ID NO.101: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 26
SEQ ID NO.102: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 26
SEQ ID NO.103: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 26
SEQ ID NO.104: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 26
SEQ ID NO.105: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 27
SEQ ID NO.106: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 27
SEQ ID NO.107: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 27
SEQ ID NO.108: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 27
SEQ ID NO.109: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 28
SEQ ID NO.110: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 28
SEQ ID NO.111: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 28
SEQ ID NO.112: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 28
SEQ ID NO.113: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 29
SEQ ID NO.114: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 29
SEQ ID NO.115: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 29
SEQ ID NO.116: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 29
SEQ ID NO.117: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 30
SEQ ID NO.118: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 30
SEQ ID NO.119: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 30
SEQ ID NO.120: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 30
SEQ ID NO.121: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 31
SEQ ID NO.122: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 31
SEQ ID NO.123: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 31
SEQ ID NO.124: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 31
SEQ ID NO.125: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 32
SEQ ID NO.126: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 32
SEQ ID NO.127: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 32
SEQ ID NO.128: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 32
SEQ ID NO.129: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 33
SEQ ID NO.130: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 33
SEQ ID NO.131: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 33
SEQ ID NO.132: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 33
SEQ ID NO.133: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 34
SEQ ID NO.134: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 34
SEQ ID NO.135: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 34
SEQ ID NO.136: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 34
SEQ ID NO.137: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 35
SEQ ID NO.138: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 35
SEQ ID NO.139: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 35
SEQ ID NO.140: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 35
SEQ ID NO.141: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 36
SEQ ID NO.142: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 36
SEQ ID NO.143: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 36
SEQ ID NO.144: аминокислотная последовательность С-конца мутантного кальретикулина человека типа 36
SEQ ID NO.145: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 1
SEQ ID NO.146: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 1
SEQ ID NO.147: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 1
SEQ ID NO.148: аминокислотная последовательность мутантного кальретикулина человека типа 1
SEQ ID NO.149: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 2
SEQ ID NO.150: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 2
SEQ ID NO.151: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 2
SEQ ID NO.152: аминокислотная последовательность мутантного кальретикулина человека типа 2
SEQ ID NO.153: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 3
SEQ ID NO.154: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 3
SEQ ID NO.155: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 3
SEQ ID NO.156: аминокислотная последовательность мутантного кальретикулина человека типа 3
SEQ ID NO.157: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 4
SEQ ID NO.158: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 4
SEQ ID NO.159: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 4
SEQ ID NO.160: аминокислотная последовательность мутантного кальретикулина человека типа 4
SEQ ID NO.161: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 5
SEQ ID NO.162: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 5
SEQ ID NO.163: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 5
SEQ ID NO.164: аминокислотная последовательность мутантного кальретикулина человека типа 5
SEQ ID NO.165: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 6
SEQ ID NO.166: нуклеотидная последовательность, кодирующая С-конец мутантного кальретикулина человека типа 6
SEQ ID NO.167: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 6
SEQ ID NO.168: аминокислотная последовательность мутантного кальретикулина человека типа 6
SEQ ID NO.169: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 7
SEQ ID NO.170: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 7
SEQ ID NO.171: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 7
SEQ ID NO.172: аминокислотная последовательность мутантного кальретикулина человека типа 7
SEQ ID NO.173: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 8
SEQ ID NO.174: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 8
SEQ ID NO.175: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 8
SEQ ID NO.176: аминокислотная последовательность мутантного кальретикулина человека типа 8
SEQ ID NO.177: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 9
SEQ ID NO.178: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 9
SEQ ID NO.179: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 9
SEQ ID NO.180: аминокислотная последовательность мутантного кальретикулина человека типа 9
SEQ ID NO.181: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 10
SEQ ID NO.182: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 10
SEQ ID NO.183: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 10
SEQ ID NO.184: аминокислотная последовательность мутантного кальретикулина человека типа 10
SEQ ID NO.185: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 11
SEQ ID NO.186: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 11
SEQ ID NO.187: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 11
SEQ ID NO.188: аминокислотная последовательность мутантного кальретикулина человека типа 11
SEQ ID NO.189: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 12
SEQ ID NO.190: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 12
SEQ ID NO.191: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 12
SEQ ID NO.192: аминокислотная последовательность мутантного кальретикулина человека типа 12
SEQ ID NO.193: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 13
SEQ ID NO.194: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 13
SEQ ID NO.195: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 13
SEQ ID NO.196: аминокислотная последовательность мутантного кальретикулина человека типа 13
SEQ ID NO.197: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 14
SEQ ID NO.198: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 14
SEQ ID NO.199: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 14
SEQ ID NO.200: аминокислотная последовательность мутантного кальретикулина человека типа 14
SEQ ID NO.201: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 15
SEQ ID NO.202: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 15
SEQ ID NO.203: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 15
SEQ ID NO.204: аминокислотная последовательность мутантного кальретикулина человека типа 15
SEQ ID NO.205: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 16
SEQ ID NO.206: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 16
SEQ ID NO.207: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 16
SEQ ID NO.208: аминокислотная последовательность мутантного кальретикулина человека типа 16
SEQ ID NO.209: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 17
SEQ ID NO.210: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 17
SEQ ID NO.211: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 17
SEQ ID NO.212: аминокислотная последовательность мутантного кальретикулина человека типа 17
SEQ ID NO.213: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 18
SEQ ID NO.214: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 18
SEQ ID NO.215: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 18
SEQ ID NO.216: аминокислотная последовательность мутантного кальретикулина человека типа 18
SEQ ID NO.217: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 19
SEQ ID NO.218: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 19
SEQ ID NO.219: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 19
SEQ ID NO.220: аминокислотная последовательность мутантного кальретикулина человека типа 19
SEQ ID NO.221: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 20
SEQ ID NO.222: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 20
SEQ ID NO.223: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 20
SEQ ID NO.224: аминокислотная последовательность мутантного кальретикулина человека типа 20
SEQ ID NO.225: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 21
SEQ ID NO.226: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 21
SEQ ID NO.227: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 21
SEQ ID NO.228: аминокислотная последовательность мутантного кальретикулина человека типа 21
SEQ ID NO.229: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 22
SEQ ID NO.230: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 22
SEQ ID NO.231: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 22
SEQ ID NO.232: аминокислотная последовательность мутантного кальретикулина человека типа 22
SEQ ID NO.233: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 23
SEQ ID NO.234: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 23
SEQ ID NO.235: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 23
SEQ ID NO.236: аминокислотная последовательность мутантного кальретикулина человека типа 23
SEQ ID NO.237: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 24
SEQ ID NO.238: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 24
SEQ ID NO.239: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 24
SEQ ID NO.240: аминокислотная последовательность мутантного кальретикулина человека типа 24
SEQ ID NO.241: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 25
SEQ ID NO.242: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 25
SEQ ID NO.243: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 25
SEQ ID NO.244: аминокислотная последовательность мутантного кальретикулина человека типа 25
SEQ ID NO.245: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 26
SEQ ID NO.246: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 26
SEQ ID NO.247: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 26
SEQ ID NO.248: аминокислотная последовательность мутантного кальретикулина человека типа 26
SEQ ID NO.249: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 27
SEQ ID NO.250: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 27
SEQ ID NO.251: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 27
SEQ ID NO.252: аминокислотная последовательность мутантного кальретикулина человека типа 27
SEQ ID NO.253: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 28
SEQ ID NO.254: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 28
SEQ ID NO.255: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 28
SEQ ID NO.256: аминокислотная последовательность мутантного кальретикулина человека типа 28
SEQ ID NO.257: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 29
SEQ ID NO.258: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 29
SEQ ID NO.259: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 29
SEQ ID NO.260: аминокислотная последовательность мутантного кальретикулина человека типа 29
SEQ ID NO.261: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 30
SEQ ID NO.262: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 30
SEQ ID NO.263: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 30
SEQ ID NO.264: аминокислотная последовательность мутантного кальретикулина человека типа 30
SEQ ID NO.265: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 31
SEQ ID NO.266: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 31
SEQ ID NO.267: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 31
SEQ ID NO.268: аминокислотная последовательность мутантного кальретикулина человека типа 31
SEQ ID NO.269: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 32
SEQ ID NO.270: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 32
SEQ ID NO.271: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 32
SEQ ID NO.272: аминокислотная последовательность мутантного кальретикулина человека типа 32
SEQ ID NO.273: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 33
SEQ ID NO.274: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 33
SEQ ID NO.275: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 33
SEQ ID NO.276: аминокислотная последовательность мутантного кальретикулина человека типа 33
SEQ ID NO.277: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 34
SEQ ID NO.278: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 34
SEQ ID NO.279: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 34
SEQ ID NO.280: аминокислотная последовательность мутантного кальретикулина человека типа 34
SEQ ID NO.281: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 35
SEQ ID NO.282: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 35
SEQ ID NO.283: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 35
SEQ ID NO.284: аминокислотная последовательность мутантного кальретикулина человека типа 35
SEQ ID NO.285: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 36
SEQ ID NO.286: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 36
SEQ ID NO.287: нуклеотидная последовательность, кодирующая мутантный кальретикулин человека типа 36
SEQ ID NO.288: аминокислотная последовательность мутантного кальретикулина человека типа 36
SEQ ID NO.289: нуклеотидная последовательность, кодирующая кальретикулин человека дикого типа
SEQ ID NO.290: аминокислотная последовательность кальретикулина человека дикого типа
SEQ ID NO.291: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 1
SEQ ID NO.292: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин типа 1
SEQ ID NO.293: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин типа 1
SEQ ID NO.294: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 1
SEQ ID NO.295: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 2
SEQ ID NO.296: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 2
SEQ ID NO.297: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 2
SEQ ID NO.298: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 2
SEQ ID NO.299: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 3
SEQ ID NO.300: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 3
SEQ ID NO.301: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 3
SEQ ID NO.302: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 3
SEQ ID NO.303: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 4
SEQ ID NO.304: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 4
SEQ ID NO.305: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 4
SEQ ID NO.306: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 4
SEQ ID NO.307: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 5
SEQ ID NO.308: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 5
SEQ ID NO.309: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 5
SEQ ID NO.310: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 5
SEQ ID NO.311: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 6
SEQ ID NO.312: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 6
SEQ ID NO.313: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 6
SEQ ID NO.314: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 6
SEQ ID NO.315: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 7
SEQ ID NO.316: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 7
SEQ ID NO.317: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 7
SEQ ID NO.318: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 7
SEQ ID NO.319: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 8
SEQ ID NO.320: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 8
SEQ ID NO.321: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 8
SEQ ID NO.322: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 8
SEQ ID NO.323: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 9
SEQ ID NO.324: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 9
SEQ ID NO.325: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 9
SEQ ID NO.326: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 9
SEQ ID NO.327: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 10
SEQ ID NO.328: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 10
SEQ ID NO.329: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 10
SEQ ID NO.330: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 10
SEQ ID NO.331: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 11
SEQ ID NO.332: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 11
SEQ ID NO.333: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 11
SEQ ID NO.334: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 11
SEQ ID NO.335: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 12
SEQ ID NO.336: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 12
SEQ ID NO.337: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 12
SEQ ID NO.338: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 12
SEQ ID NO.339: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 13
SEQ ID NO.340: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 13
SEQ ID NO.341: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 13
SEQ ID NO.342: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 13
SEQ ID NO.343: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 14
SEQ ID NO.344: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 14
SEQ ID NO.345: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 14
SEQ ID NO.346: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 14
SEQ ID NO.347: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 15
SEQ ID NO.348: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 15
SEQ ID NO.349: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 15
SEQ ID NO.350: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 15
SEQ ID NO.351: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 16
SEQ ID NO.352: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 16
SEQ ID NO.353: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 16
SEQ ID NO.354: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 16
SEQ ID NO.355: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 17
SEQ ID NO.356: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 17
SEQ ID NO.357: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 17
SEQ ID NO.358: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 17
SEQ ID NO.359: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 18
SEQ ID NO.360: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 18
SEQ ID NO.361: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 18
SEQ ID NO.362: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 18
SEQ ID NO.363: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 19
SEQ ID NO.364: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 19
SEQ ID NO.365: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 19
SEQ ID NO.366: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 19
SEQ ID NO.367: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 20
SEQ ID NO.368: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 20
SEQ ID NO.369: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 20
SEQ ID NO.370: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 20
SEQ ID NO.371: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 21
SEQ ID NO.372: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 21
SEQ ID NO.373: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 21
SEQ ID NO.374: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 21
SEQ ID NO.375: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 22
SEQ ID NO.376: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 22
SEQ ID NO.377: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 22
SEQ ID NO.378: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 22
SEQ ID NO.379: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 23
SEQ ID NO.380: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 23
SEQ ID NO.381: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 23
SEQ ID NO.382: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 23
SEQ ID NO.383: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 24
SEQ ID NO.384: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 24
SEQ ID NO.385: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 24
SEQ ID NO.386: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 24
SEQ ID NO.387: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 25
SEQ ID NO.388: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 25
SEQ ID NO.389: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 25
SEQ ID NO.390: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 25
SEQ ID NO.391: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 26
SEQ ID NO.392: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 26
SEQ ID NO.393: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 26
SEQ ID NO.394: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 26
SEQ ID NO.395: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 27
SEQ ID NO.396: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 27
SEQ ID NO.397: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 27
SEQ ID NO.398: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 27
SEQ ID NO.399: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 28
SEQ ID NO.400: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 28
SEQ ID NO.401: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 28
SEQ ID NO.402: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 28
SEQ ID NO.403: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 29
SEQ ID NO.404: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 29
SEQ ID NO.405: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 29
SEQ ID NO.406: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 29
SEQ ID NO.407: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 30
SEQ ID NO.408: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 30
SEQ ID NO.409: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 30
SEQ ID NO.410: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 30
SEQ ID NO.411: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 31
SEQ ID NO.412: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 31
SEQ ID NO.413: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 31
SEQ ID NO.414: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 31
SEQ ID NO.415: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 32
SEQ ID NO.416: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 32
SEQ ID NO.417: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 32
SEQ ID NO.418: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 32
SEQ ID NO.419: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 33
SEQ ID NO.420: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 33
SEQ ID NO.421: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 33
SEQ ID NO.422: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 33
SEQ ID NO.423: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 34
SEQ ID NO.424: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 34
SEQ ID NO.425: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 34
SEQ ID NO.426: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 34
SEQ ID NO.427: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 35
SEQ ID NO.428: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 35
SEQ ID NO.429: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 35
SEQ ID NO.430: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 35
SEQ ID NO.431: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 36
SEQ ID NO.432: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 36
SEQ ID NO.433: нуклеотидная последовательность экзона 9, кодирующего мутантный кальретикулин человека типа 36
SEQ ID NO.434: аминокислотная последовательность, кодированная экзоном 9, мутантного кальретикулина человека типа 36
SEQ ID NO.435: нуклеотидная последовательность экзона 9, кодирующего кальретикулин человека дикого типа
SEQ ID NO.436: аминокислотная последовательность, кодированная экзоном 9, кальретикулина человека дикого типа
В следующей таблице приведены обобщенные данные обеспеченных и использованных здесь последовательностей SEQ ID NO.
последовательность)
мутантного кальретикулина
кальретикулина
Ссылки
Barbui T, Barosi G, Birgegard G, et al. Philadelphia-negative classical myeloproliferative neoplasms: critical concepts and management recommendations from European LeukemiaNet. J. Clin. Oncol. 2011; 29:761-70.
Baxter EJ, Scott LM, Campbell PJ, East C, Fourouclas N, Swanton S, Vassiliou GS, Bench AJ, Boyd EM, Curtin N, Scott MA, Erber WN, Green AR (2005) Acquired mutation of the tyrosine kinase JAK2 in human myeloproliferative disorders. Lancet, 365(9464): 1054-1061.
Campbell PJ, Green AR (2006a) The myeloproliferative disorders. N. Engl. J. Med., 355(23): 2452-2466.
Campbell PJ, Griesshammer M, Dohner K, et al. V617F mutation in JAK2 is associated with poorer survival in idiopathic myelofibrosis. Blood, 2006b; 107:2098-100.
Coe H, Jung J, Groenendyk J, Prins D, Michalak M. ERp57 modulates STAT3 signaling from the lumen of the endoplasmic reticulum. J. Biol. Chem., 2010; 285:6725-38.
Corvinus FM, Orth C, Moriggl R, et al. Persistent STAT3 activation in colon cancer is associated with enhanced cell proliferation and tumor growth. Neoplasia, 2005; 7:545-55.
Delhommeau F, Dupont S, Della Valle V, James C, Trannoy S, Masse A, Kosmider O, Le Couedic JP, Robert F, Alberdi A, Lecluse Y, Plo I, Dreyfus FJ, Marzac C, Casadevall N, Lacombe C, Romana SP, Dessen P, Soulier J, Viguie F, Fontenay M, Vainchenker W, Bernard OA (2009) Mutation in TET2 in myeloid cancers. N. Engl. J. Med., 360(22): 2289-2301.
DePristo MA, Banks E, Poplin R, Garimella KV, Maguire JR, Hartl C, Philippakis AA, del Angel G, Rivas MA, Hanna M, McKenna A, Fennell TJ, Kernytsky AM, Sivachenko AY, Cibulskis K, Gabriel SB, Altshuler D, Daly MJ (2011) A framework for variation discovery and genotyping using next-generation DNA sequencing data. Nat. Genet., 43(5): 491-498.
Ernst T, Chase AJ, Score J, Hidalgo-Curtis CE, Bryant C, Jones AV, Waghorn K, Zoi K, Ross FM, Reiter A, Hochhaus A, Drexler HG, Duncombe A, Cervantes F, Oscier D, Boultwood J, Grand FH, Cross NC (2010) Inactivating mutations of the histone methyltransferase gene EZH2 in myeloid disorders. Nat. Genet., 42(8): 722-726.
Harutyunyan A, Klampfl T, Cazzola M, Kralovics R (2011) p53 lesions in leukemic transformation. N. Engl. J. Med., 364(5): 488-490.
Kalbfleisch JD, Prentice RL. The statistical analysis of failure time data. New YorK: Wiley; 1980.
James C, Ugo V, Le Couedic JP, Staerk J, Delhommeau F, Lacout C, Garcon L, Raslova H, Berger R, Bennaceur-Griscelli A, Villeval JL, Constantinescu SN, Casadevall N, Vainchenker W (2005) A unique clonal JAK2 mutation leading to constitutive signalling causes polycythaemia vera. Nature, 434(7037):1144-1148.
Klampfl T, Harutyunyan A, Berg T, Gisslinger B, Schalling M, Bagienski K, Olcaydu D, Passamonti F, Rumi E, Pietra D, Jager R, Pieri L, Guglielmelli P, Iacobucci I, Martinelli G, Cazzola M, Vannucchi AM, Gisslinger H, Kralovics R (2011) Genome integrity of myeloproliferative neoplasms in chronic phase and during disease progression. Blood, 118(1): 167-176.
Koboldt DC, Zhang Q, Larson DE, Shen D, McLellan MD, Lin L, Miller CA, Mardis ER, Ding L, Wilson RK (2012) VarScan 2: somatic mutation and copy number alteration discovery in cancer by exome sequencing. Genome Res., 22(3): 568-576.
Kralovics R (2008) Genetic complexity of myeloproliferative neoplasms. Leukemia, 22(10): 1841-1848.
Kralovics R, Passamonti F, Buser AS, Teo SS, Tiedt R, Passweg JR, Tichelli A, Cazzola M, Skoda RC (2005) A gain-of-function mutation of JAK2 in myeloproliferative disorders. N. Engl. J. Med., 352(17): 1779-1790.
Levine RL, Wadleigh M, Cools J, Ebert BL, Wernig G, Huntly BJ, Boggon TJ, Wlodarska I, Clark JJ, Moore S, Adelsperger J, Koo S, Lee JC, Gabriel S, Mercher T, D'Andrea A, Frohling S, Dohner K, Marynen P, Vandenberghe P, Mesa RA, Tefferi A, Griffin JD, Eck MJ, Sellers WR, Meyerson M, Golub TR, Lee SJ, Gilliland DG (2005) Activating mutation in the tyrosine kinase JAK2 in polycythemia vera, essential thrombocythemia, and myeloid metaplasia with myelofibrosis. Cancer Cell, 7(4): 387-397.
Li H, Durbin R (2009) Fast and accurate short read alignment with Burrows-Wheeler transform. Bioinformatics, 25(14): 1754-1760.
Li H, Handsaker B, Wysoker A, Fennell T, Ruan J, Homer N, Marth G, Abecasis G, Durbin R (2009) The Sequence Alignment/Map format and SAMtools. Bioinformatics, 25(16): 2078-2079.
Li S, Kralovics R, De Libero G, Theocharides A, Gisslinger H, Skoda RC. Clonal heterogeneity in polycythemia vera patients with JAK2 exon12 and JAK2-V617F mutations. Blood, 2008; 111:3863-6.
Malcovati L, Della Porta MG, Pietra D, et al. Molecular and clinical features of refractory anemia with ringed sideroblasts associated with marked thrombocytosis. Blood, 2009; 114:3538-45.
Marchioli R, Finazzi G, Specchia G, et al. Cardiovascular events and intensity of treatment in polycythemia vera. N. Engl. J. Med., 2013; 368:22-33.
McKenna A, Hanna M, Banks E, Sivachenko A, Cibulskis K, Kernytsky A, Garimella K, Altshuler D, Gabriel S, Daly M, DePristo MA (2010) The Genome Analysis Toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data. Genome Res., 20(9): 1297-1303.
Milosevic JD, Kralovics R (2013) Genetic and epigenetic alterations of myeloproliferative disorders. Int. J .Hematol.
Pardanani AD, Levine RL, Lasho T, Pikman Y, Mesa RA, Wadleigh M, Steensma DP, Elliott MA, Wolanskyj AP, Hogan WJ, McClure RF, Litzow MR, Gilliland DG, Tefferi A (2006) MPL515 mutations in myeloproliferative and other myeloid disorders: a study of 1182 patients. Blood, 108(10): 3472-3476.
Passamonti F, Rumi E, Pungolino E, et al. Life expectancy and prognostic factors for survival in patients with polycythemia vera and essential thrombocythemia. Am. J. Med. 2004; 117(10):755-61.
Passamonti F, Rumi E, Pietra D, et al. A prospective study of 338 patients with polycythemia vera: the impact of JAK2 (V617F) allele burden and leukocytosis on fibrotic or leukemic disease transformation and vascular complications. Leukemia, 2010a; 24:1574-9.
Passamonti F, Cervantes F, Vannucchi AM, et al. A dynamic prognostic model to predict survival in primary myelofibrosis: a study by the IWG-MRT (International Working Group for Myeloproliferative Neoplasms Research and Treatment). Blood 2010b; 115:1703-8.
Passamonti F, Elena C, Schnittger S, et al. Molecular and clinical features of the myeloproliferative neoplasm associated with JAK2 exon 12 mutations. Blood, 2011; 117:2813-6.
Passamonti F, Thiele J, Girodon F, et al. A prognostic model to predict survival in 867 World Health Organization-defined essential thrombocythemia at diagnosis: a study by the International Working Group on Myelofibrosis Research and Treatment. Blood, 2012; 120:1197-201.
Pikman Y, Lee BH, Mercher T, McDowell E, Ebert BL, Gozo M, Cuker A, Wernig G, Moore S, Galinsky I, DeAngelo DJ, Clark JJ, Lee SJ, Golub TR, Wadleigh M, Gilliland DG, Levine RL (2006) MPLW515L is a novel somatic activating mutation in myelofibrosis with myeloid metaplasia. PLoS Med., 3(7): e270.
R Core Team. R: A language and environment for statistical computing.: R Foundation for Statistical Computing, Vienna, Austria.; 2012.
Rumi E, Pietra D, Guglielmelli P, et al. Acquired copy-neutral loss of heterozygosity of chromosome 1p as a molecular event associated with marrow fibrosis in MPL-mutated myeloproliferative neoplasms. Blood, 2013; 121:4388-95.
Schafer AI. Thrombocytosis. N Engl J Med 2004;350:1211-9.
Scott LM, Tong W, Levine RL, Scott MA, Beer PA, Stratton MR, Futreal PA, Erber WN, McMullin MF, Harrison CN, Warren AJ, Gilliland DG, Lodish HF, Green AR (2007) JAK2 exon 12 mutations in polycythemia vera and idiopathic erythrocytosis. N. Engl. J. Med., 356(5): 459-468.
Si J, Collins SJ. Activated Ca2+/calmodulin-dependent protein kinase IIgamma is a critical regulator of myeloid leukemia cell proliferation. Cancer Res., 2008; 68:3733-42.
Stegelmann F, Bullinger L, Schlenk RF, Paschka P, Griesshammer M, Blersch C, Kuhn S, Schauer S, Dohner H, Dohner K (2011) DNMT3A mutations in myeloproliferative neoplasms. Leukemia, 25(7): 1217-1219.
Stein BL, Williams DM, O'Keefe C, Rogers O, Ingersoll RG, Spivak JL, Verma A, Maciejewski JP, McDevitt MA, Moliterno AR (2011) Disruption of the ASXL1 gene is frequent in primary, post-essential thrombocytosis and post-polycythemia vera myelofibrosis, but not essential thrombocytosis or polycythemia vera: analysis of molecular genetics and clinical phenotypes. Haematologica, 96(10): 1462-1469.
Swerdlow S, Campo E, Harris N, Jaffe E, Pileri S, Stein H, Thiele J, Vardiman J (2008) WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, Lyon: International Agency for Research on Cancer.
Thiele J, Kvasnicka HM, Facchetti F, Franco V, van der Walt J, Orazi A. European consensus on grading bone marrow fibrosis and assessment of cellularity. Haematologica, 2005; 90:1128-32.
Wang K, Li M, Hakonarson H (2010) ANNOVAR: functional annotation of genetic variants from high-throughput sequencing data. Nucleic Acids Res., 38(16): e164.
Vardiman JW, Harris NL, Brunning RD. The World Health Organization (WHO) classification of the myeloid neoplasms. Blood, 2002; 100:2292-302.
Yue X, Wang H, Zhao F, et al. Hepatitis B virus-induced calreticulin protein is involved in IFN resistance. J. Immunol., 2012; 189:279-86.
Zuber J, McJunkin K, Fellmann C, et al. Toolkit for evaluating genes required for proliferation and survival using tetracycline-regulated RNAi. Nature biotechnology 2011; 29:79-83.
Все ссылки, приведенные в данном документе, полностью включены в качестве ссылки. Теперь при наличии полного описания изобретения специалисту в данной области должно быть понятно, что изобретение может быть выполнено в широком и эквивалентном диапазоне условий, параметров и тому подобное, не затрагивая сущность и объем изобретения или его любой вариант осуществления.
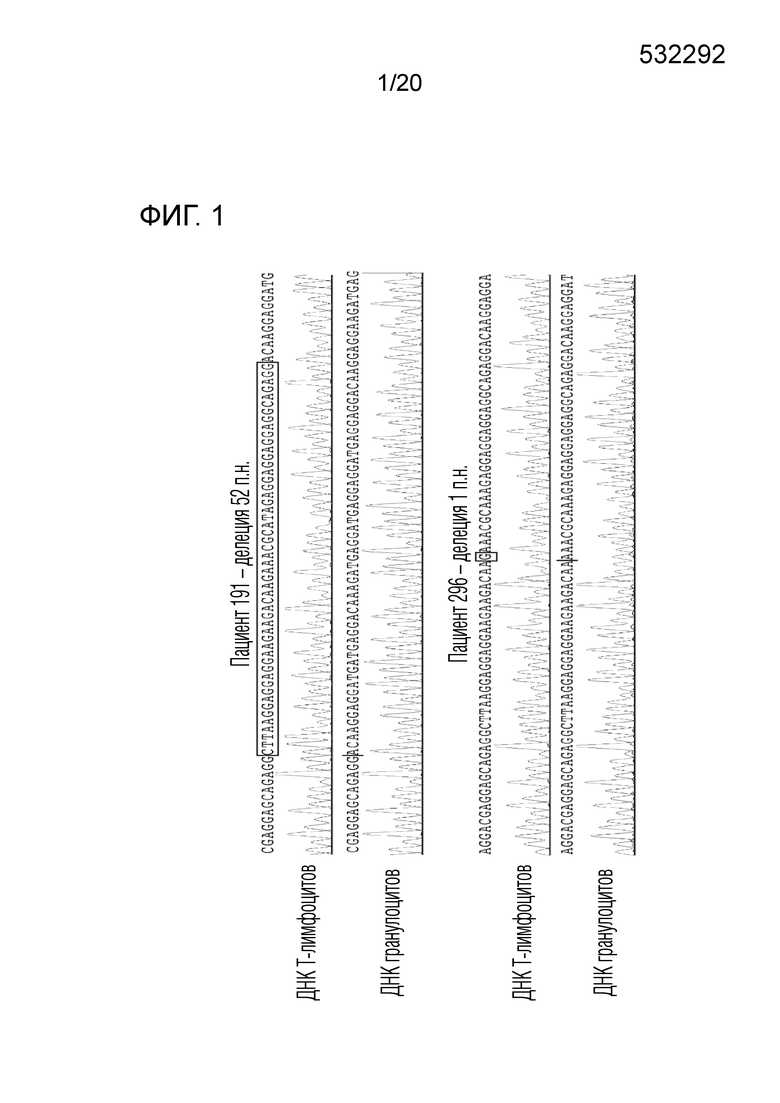
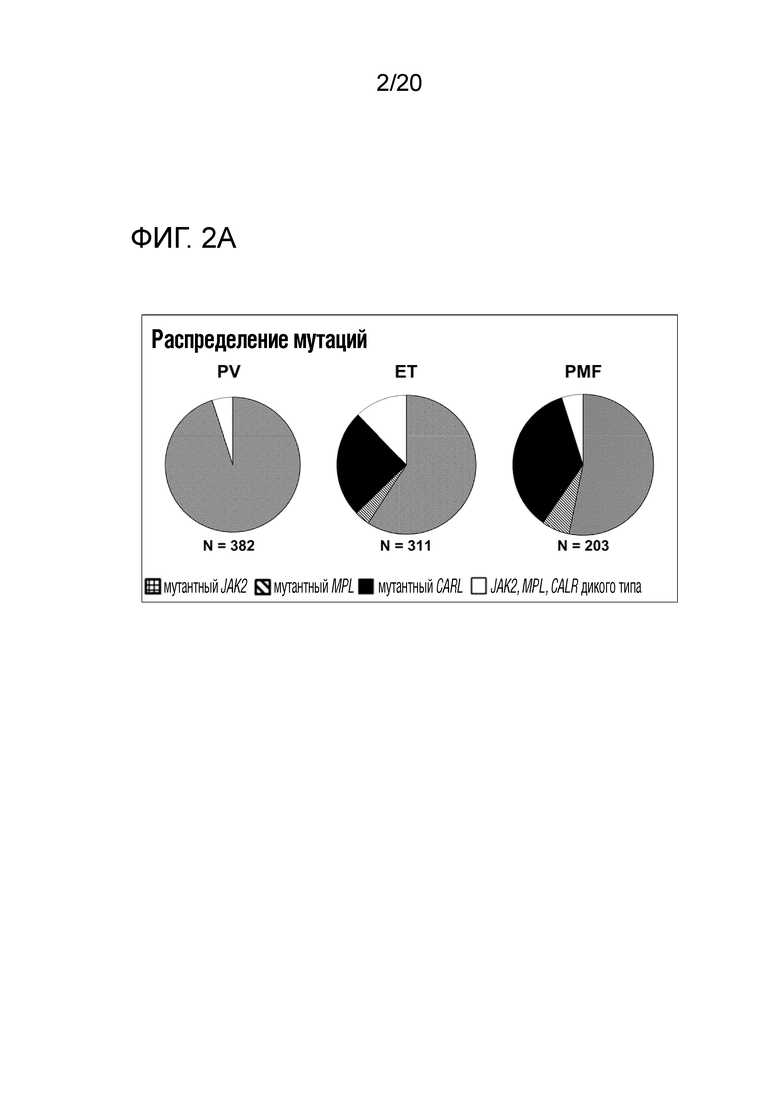
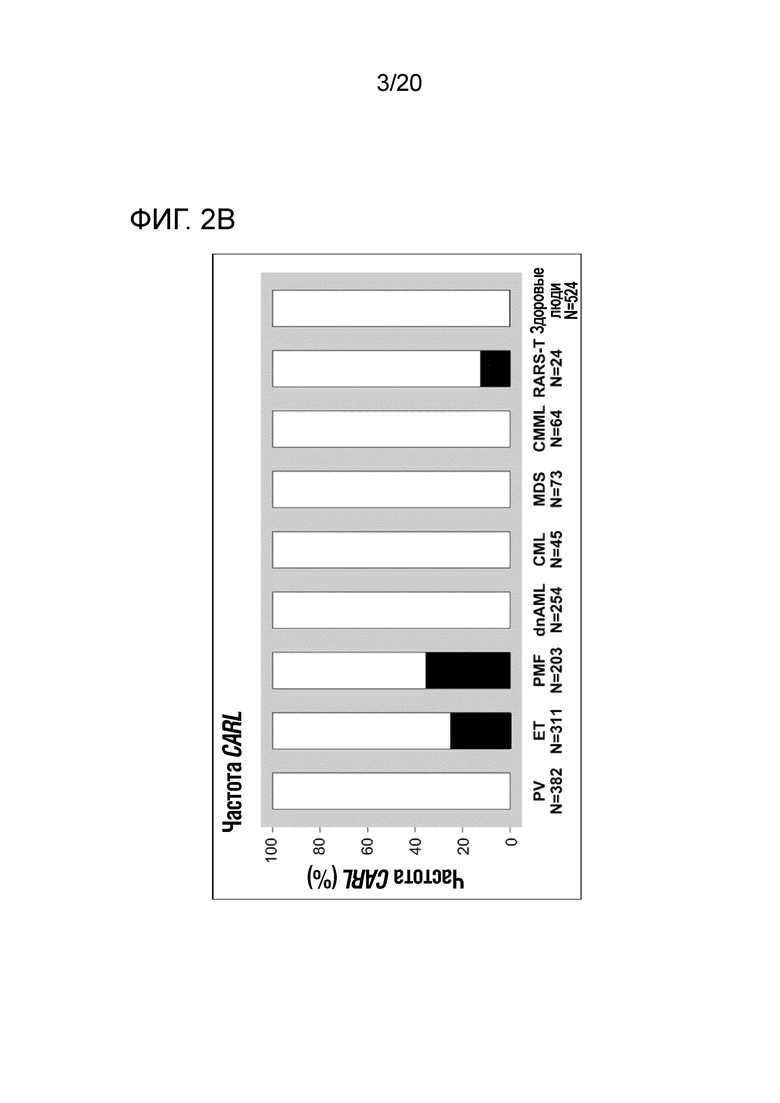
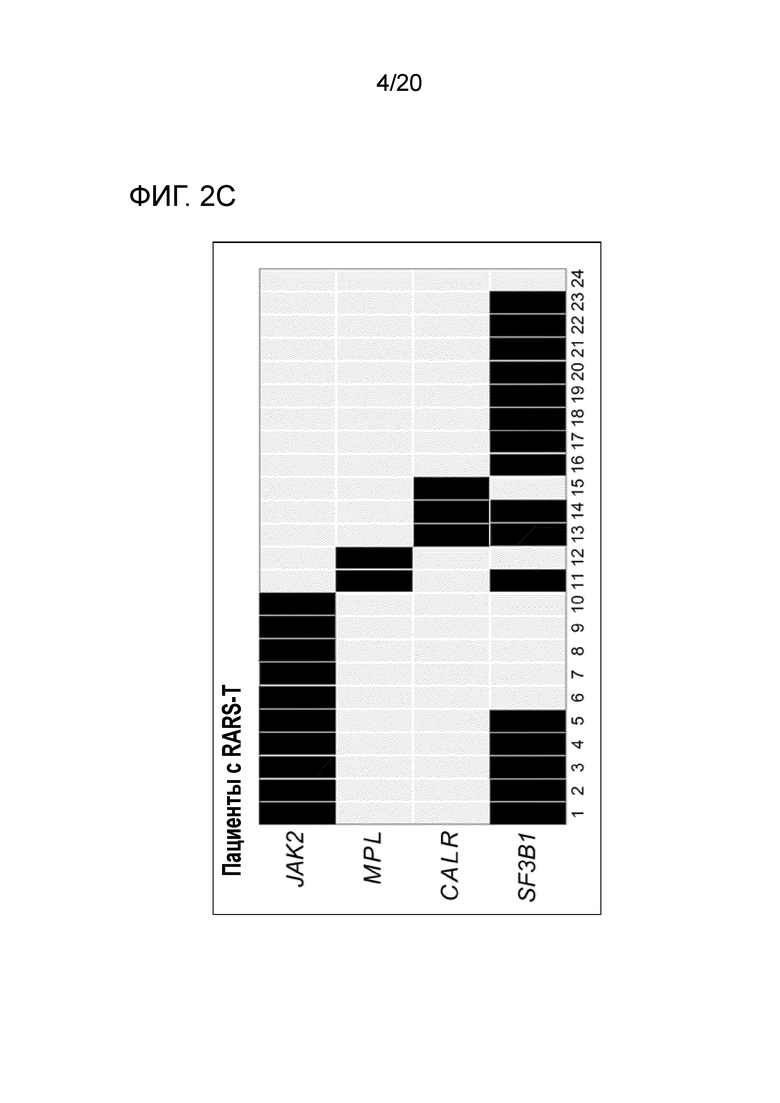
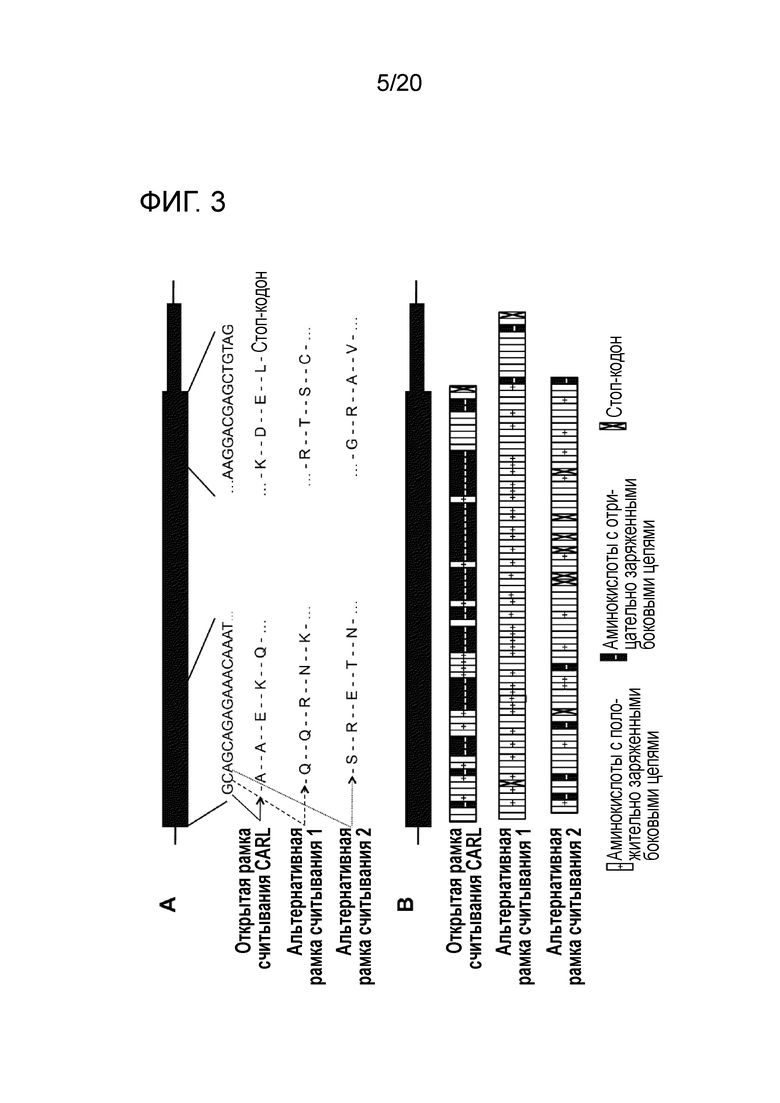
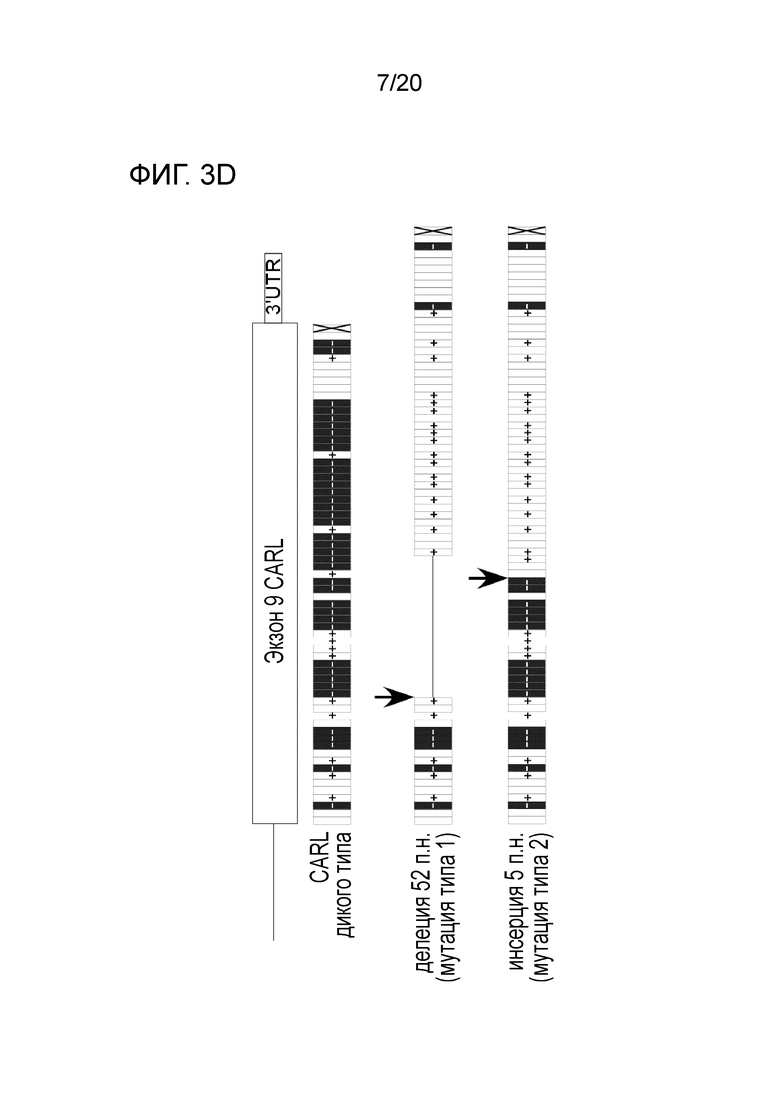
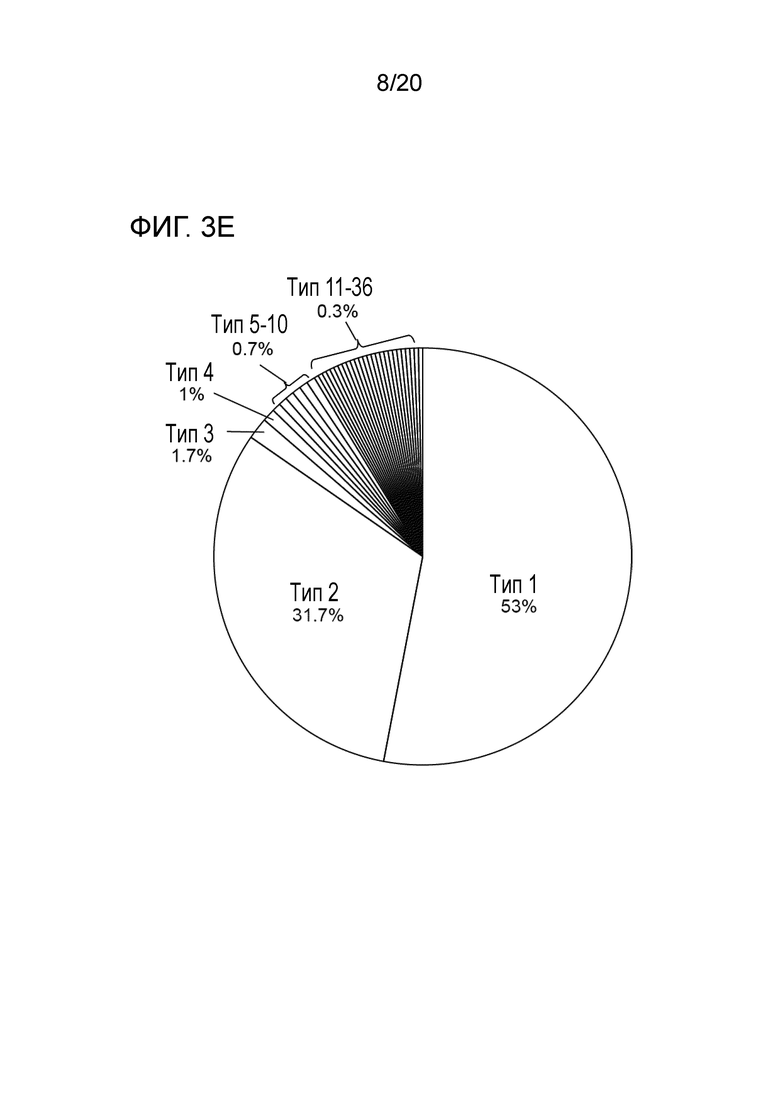
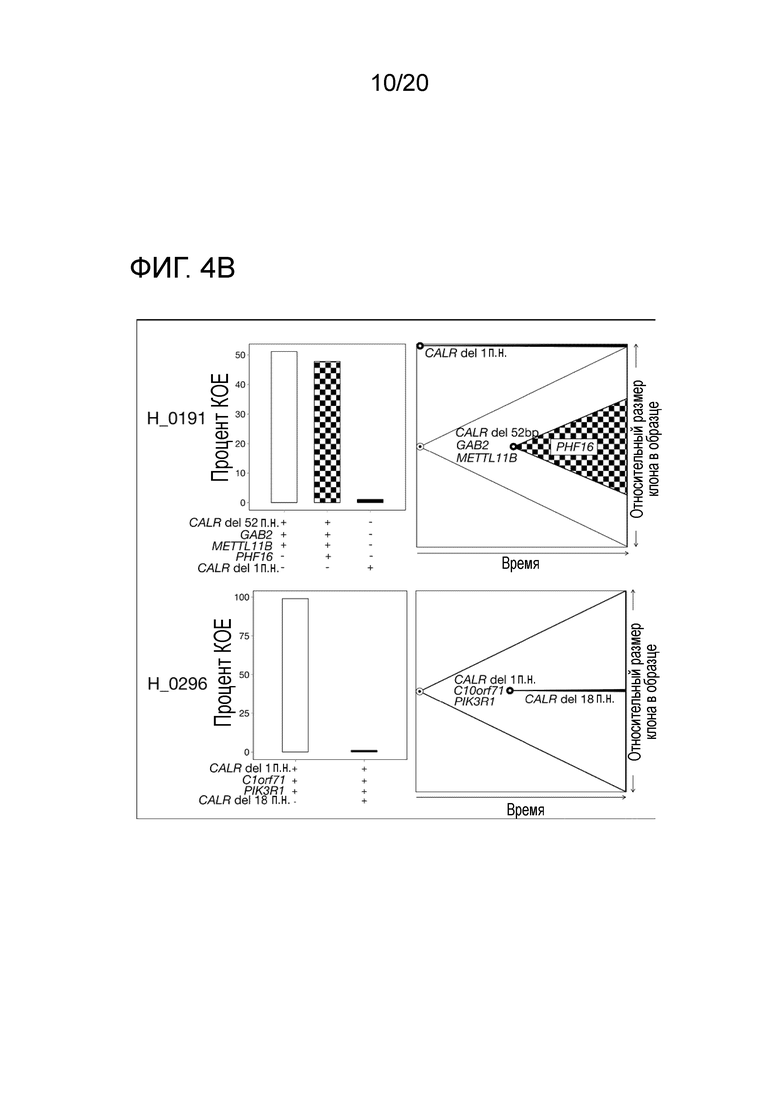
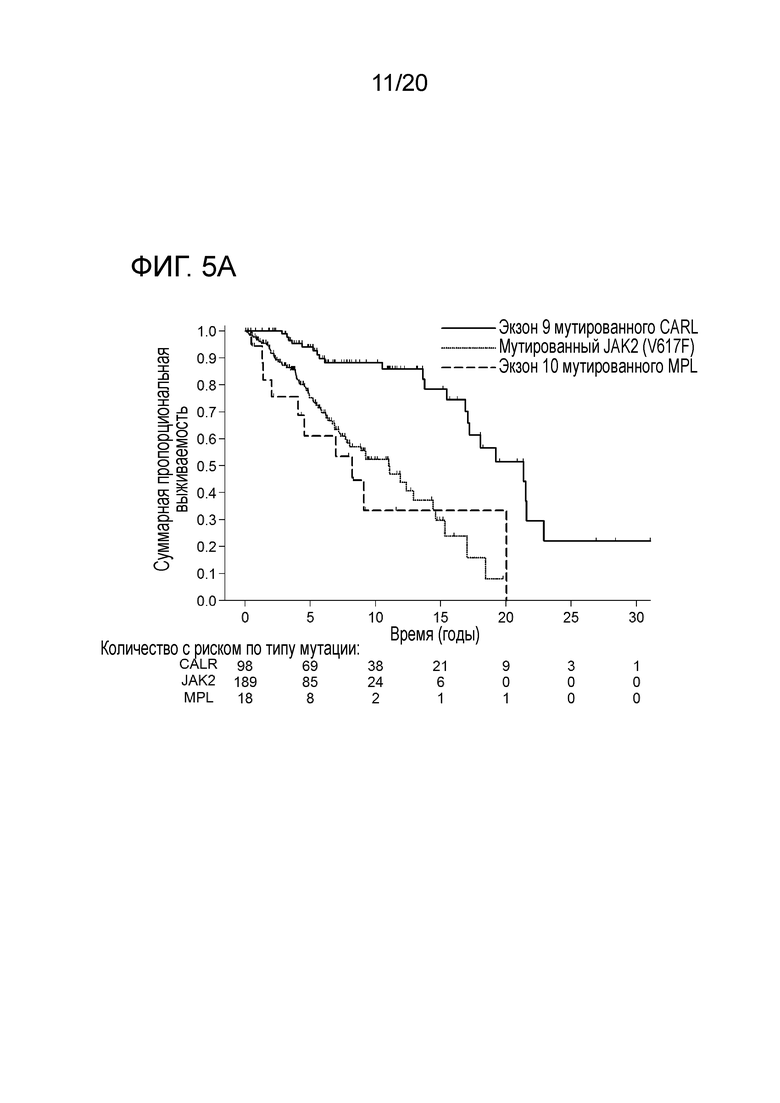
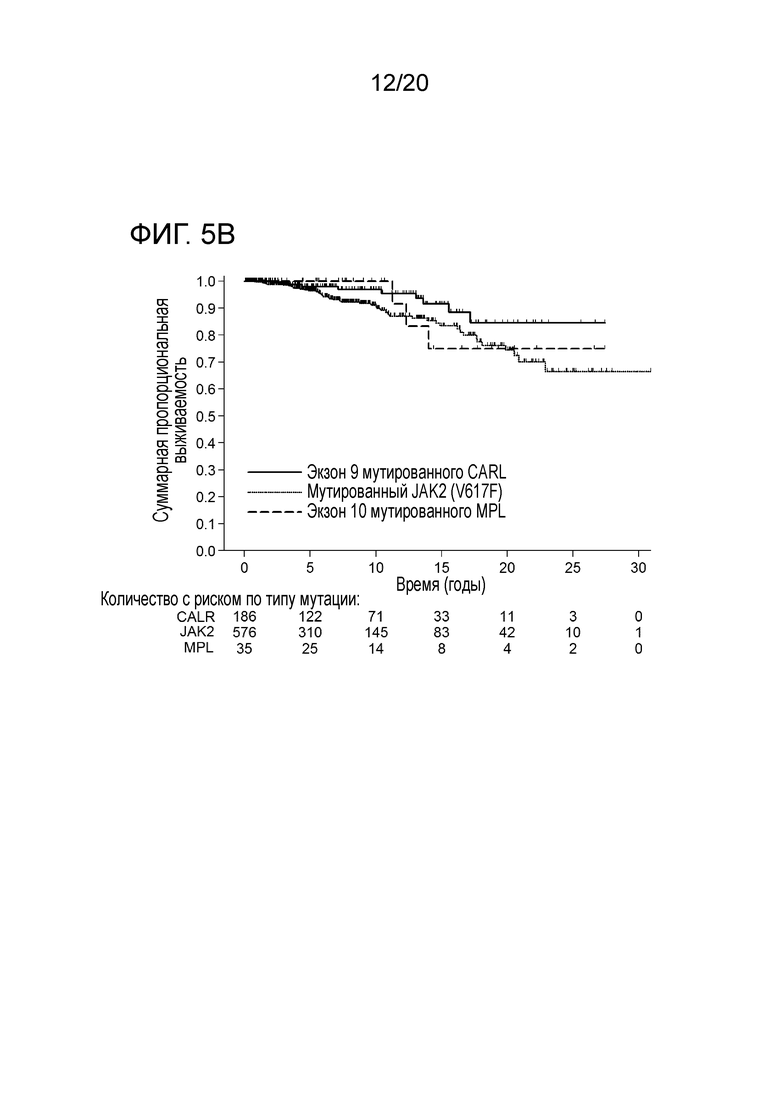
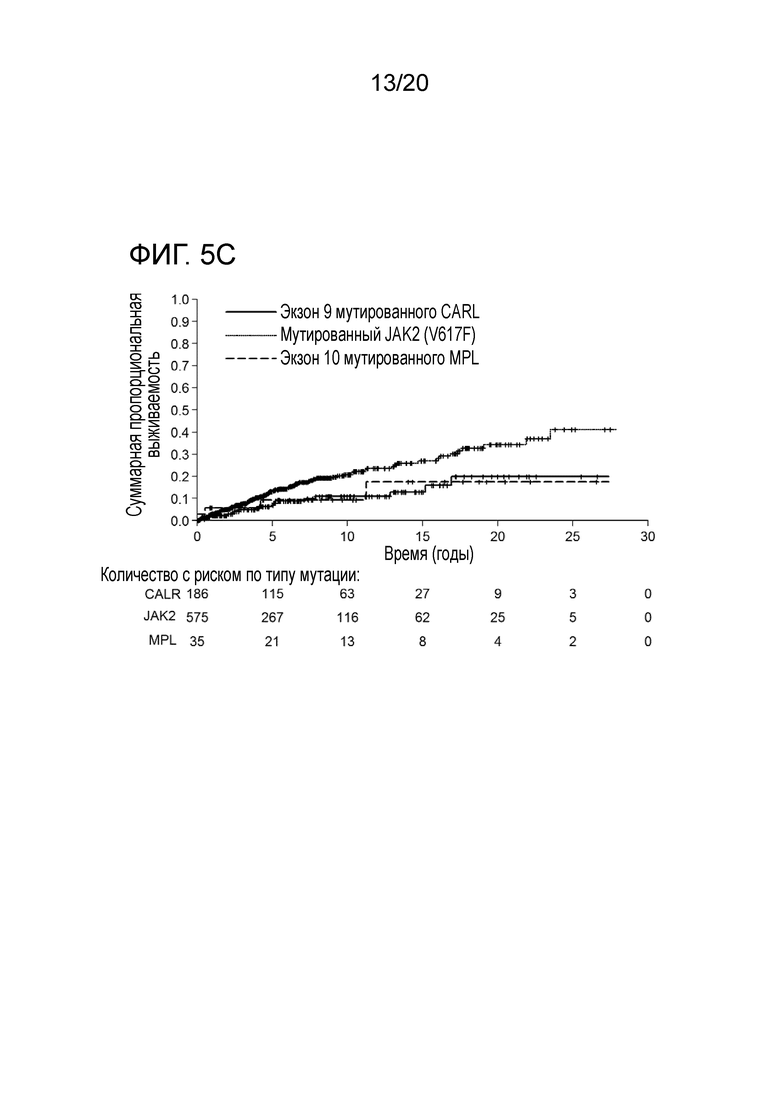
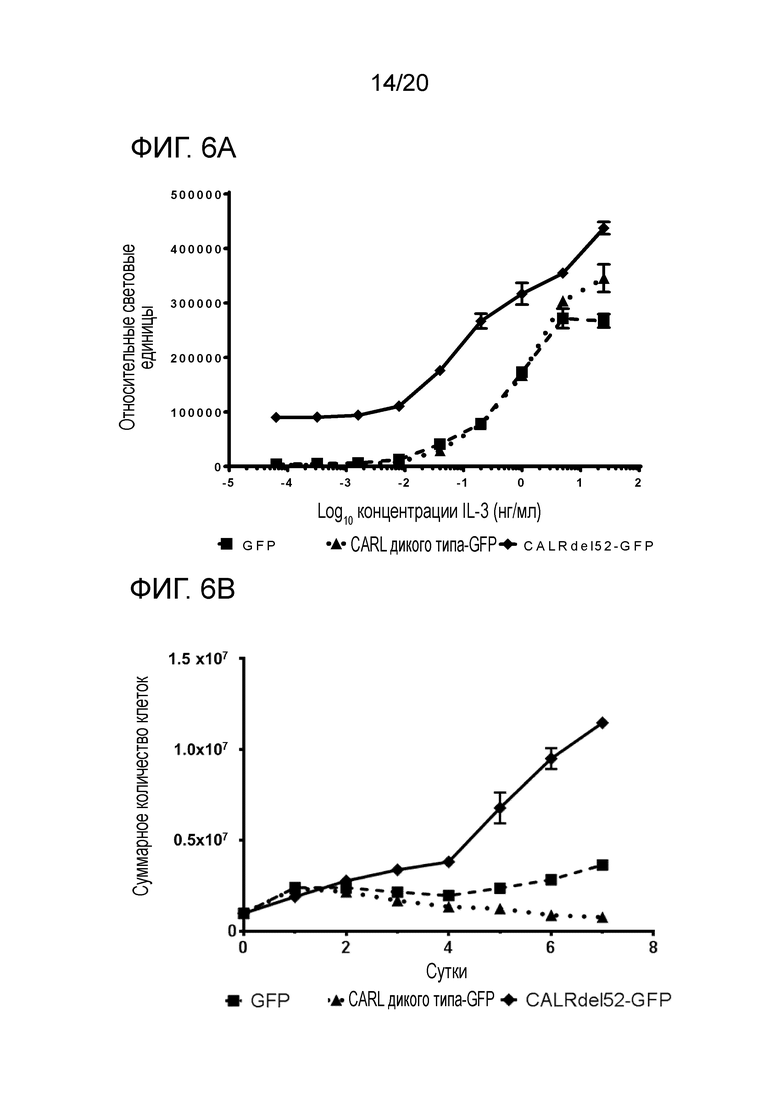
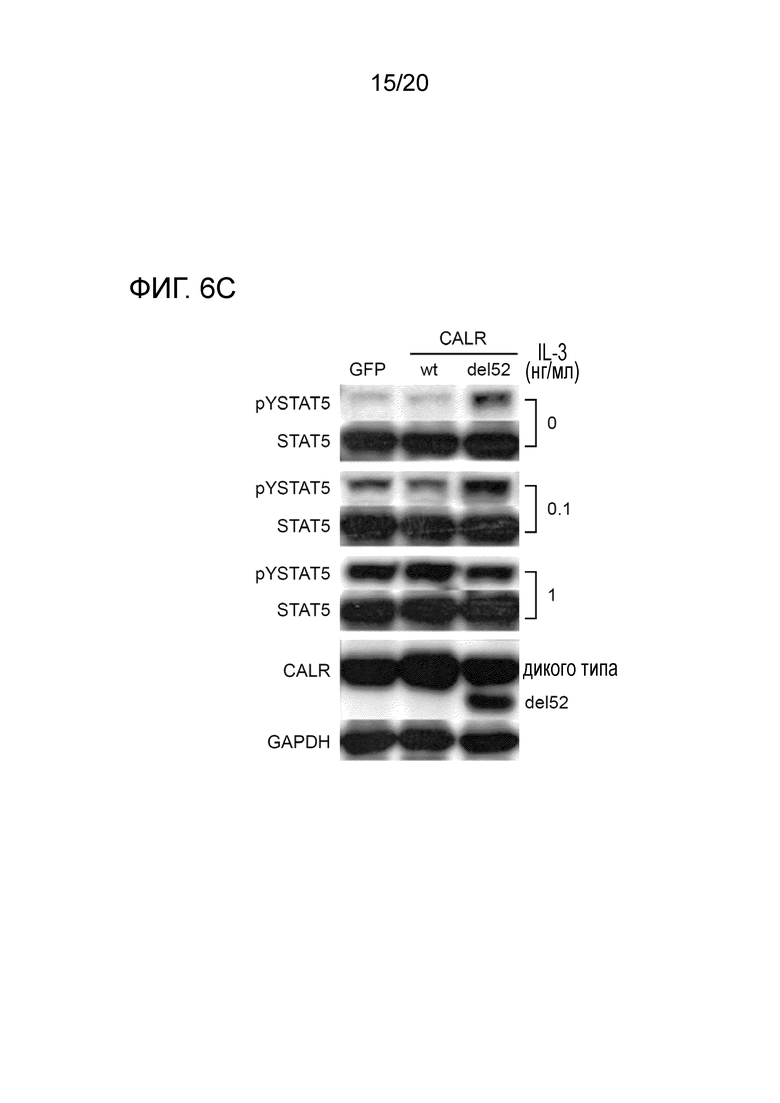
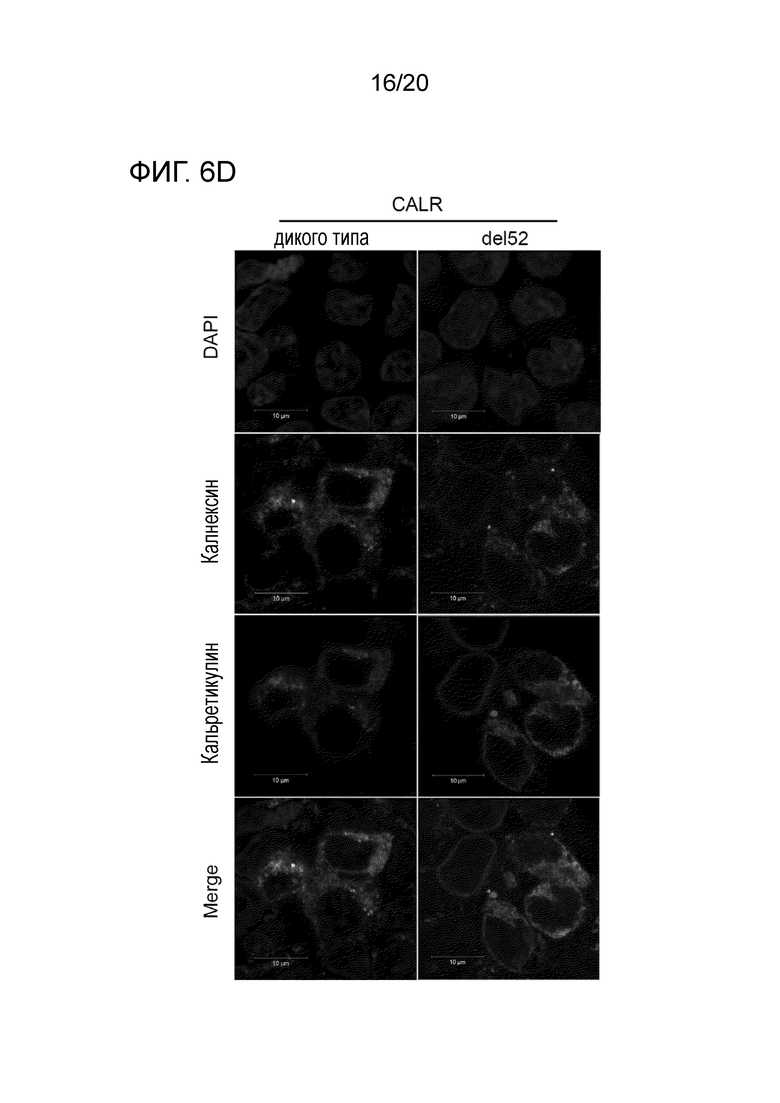
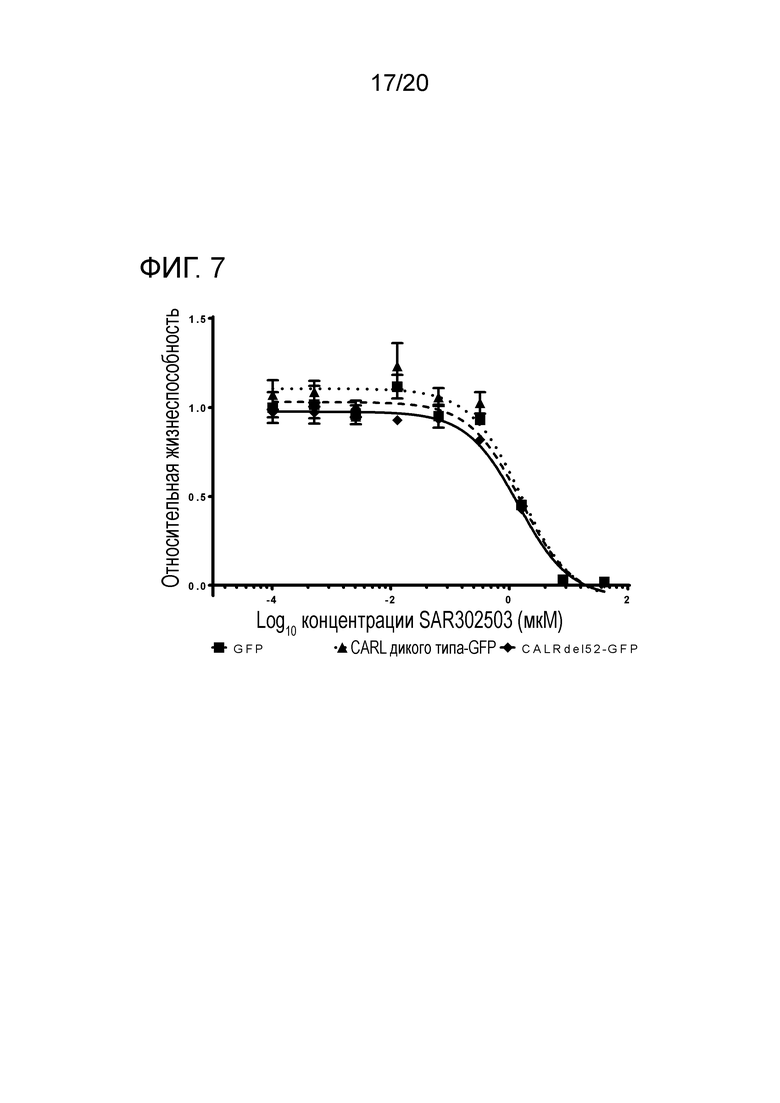
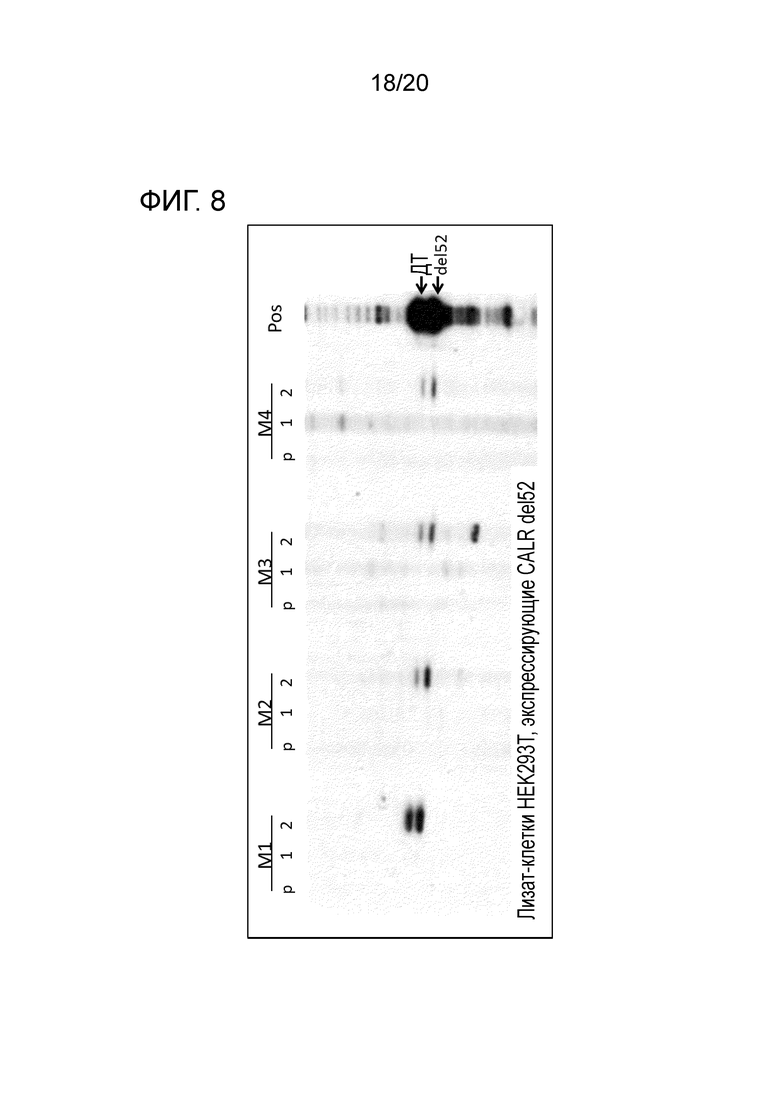
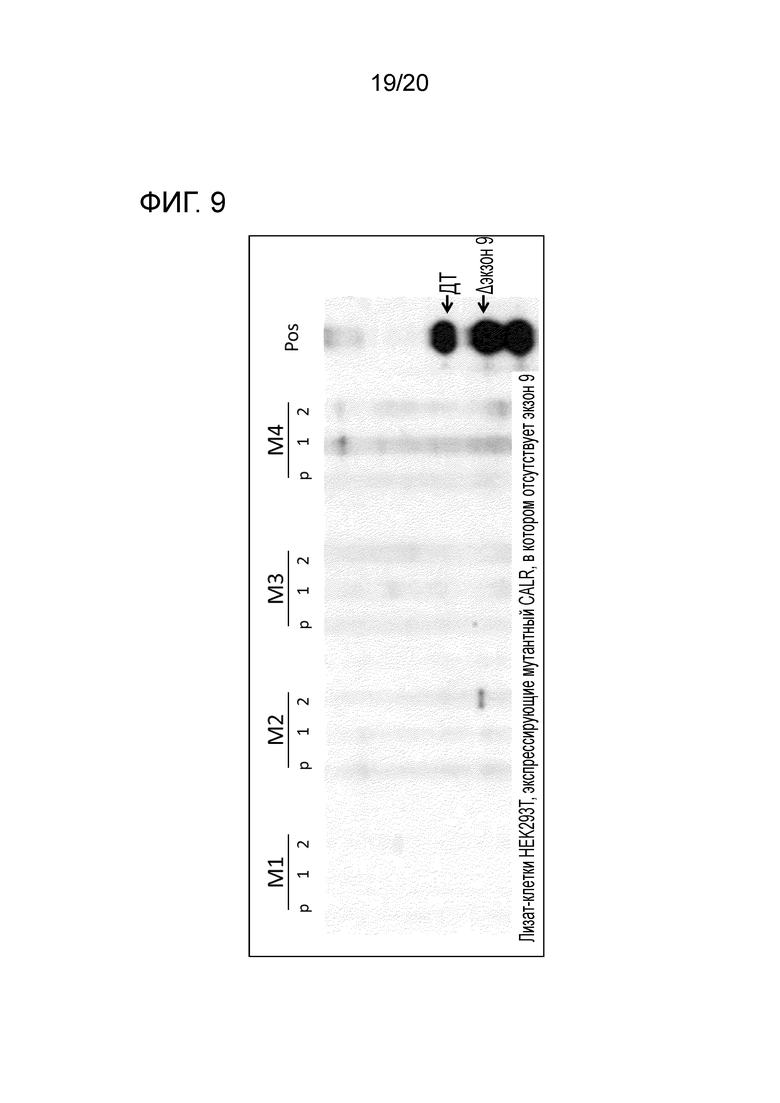
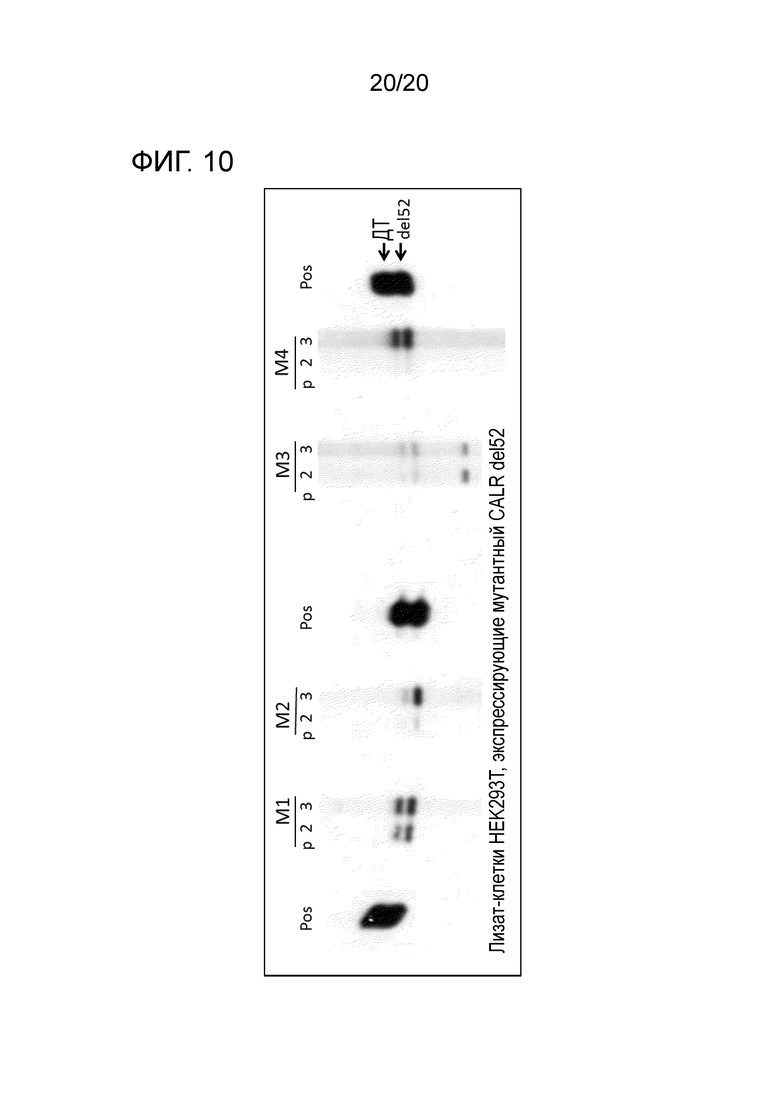
Изобретение относится к биотехнологии. Изобретение касается способа диагностики миелоидных новообразований. Способ включает определение присутствия мутантного аллеля гена кальретикулина. Если присутствует указанный один или более мутантных аллелей гена кальретикулина, то пациент страдает миелоидным новообразованием. Изобретение также включает геномные последовательности, последовательности кДНК, последовательности мРНК и белковые последовательности мутантного кальретикулина. 5 н. и 57 з.п. ф-лы, 10 ил., 5 табл., 2 пр.
1. Способ оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- определение присутствия одного или более мутантного аллеля гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный один или более мутантный аллель гена кальретикулина.
2. Способ по п. 1,
где указанный один или более мутантный аллель содержит нуклеиновую кислоту, кодирующую мутантный белок кальретикулин.
3. Способ по п. 2, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по п. (а) или (b), в котором одна или более аминокислота делецирована, инсерцирована, добавлена или заменена;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а) или (с);
(f) белок, обладающий по меньшей мере 70% идентичностью с белком по любому из пп. (а)-(е), и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
4. Способ по п. 2 или 3, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по п. (а) или (b), в котором одна или более аминокислота делецирована, инсерцирована, добавлена или заменена;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а) или (с);
(f) белок, обладающий по меньшей мере 70% идентичностью с белком по любому из пп. (а)-(е), и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
5. Способ по п. 2 или 3, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по п. (а) или (b), в котором одна или более аминокислота делецирована, инсерцирована, добавлена или заменена;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а) или (с);
(f) белок, обладающий по меньшей мере 70% идентичностью с белком по любому из пп. (а)-(е), и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
6. Способ по п. 2 или 3, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по п. (а) или (b), в котором одна или более аминокислота делецирована, инсерцирована, добавлена или заменена;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а) или (с);
(f) белок, обладающий по меньшей мере 70% идентичностью с белком по любому из пп. (а)-(е), и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
7. Способ по п. 1, где указанный один или более мутантный аллель гена кальретикулина находится в области, охватывающей экзон 9 гена кальретикулина.
8. Способ по п. 1, где указанный мутантный аллель содержит мутацию сдвига рамки считывания в гене кальретикулина дикого типа.
9. Способ по п. 8, где указанная мутация сдвига рамки считывания находится в экзоне 9 гена кальретикулина.
10. Способ по п. 8 или 9, где указанная мутация сдвига рамки считывания представляет делецию одного нуклеотида или добавление двух нуклеотидов.
11. Способ по п. 8 или 9, где (1+(3×n0)) нуклеотидов делецировано из гена кальретикулина.
12. Способ по п. 8 или 9, где 1, 4, 19, 22, 31, 34, 46, 52 нуклеотида делецированы.
13. Способ по п. 8 или 9,
где 1 нуклеотид делецирован и где 6 нуклеотидов инсерцированы;
где 2 нуклеотида делецированы и где 4 нуклеотида инсерцированы;
где 3 нуклеотида делецированы и где 5 нуклеотидов инсерцированы;
где 12 нуклеотидов делецированы и где 5 нуклеотидов инсерцированы;
где 18 нуклеотидов делецированы и где 11 нуклеотидов инсерцированы;
где 18 нуклеотидов делецированы и где 14 нуклеотидов инсерцированы;
где 20 нуклеотидов делецированы и где 1 нуклеотид инсерцирован;
где 28 нуклеотидов делецированы и где 6 нуклеотидов инсерцированы;
где 35 нуклеотидов делецированы и где 1 нуклеотид инсерцирован или
где 36 нуклеотидов делецированы и где 2 нуклеотида инсерцированы.
14. Способ по п. 8 или 9, где (2+(3×n0)) нуклеотидов инсерцированы в ген кальретикулина.
15. Способ по п. 14, где 5 нуклеотидов инсерцированы.
16. Способ по п. 1, где указанный ген кальретикулина содержит последовательность, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 290;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 289;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
17. Способ по п. 10, где указанный нуклеотид(ы) делецирован из и/или инсерцирован в экзоне 9 гена кальретикулина.
18. Способ по п. 9, где указанный экзон 9 гена кальретикулина содержит последовательность, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 436;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 435;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
19. Способ по п. 1, где указанный мутантный аллель содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288; 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137, 141, 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281, 285, 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
20. Способ по п. 1, где указанный мутантный аллель представляет ДНК, предпочтительно геномную ДНК.
21. Способ по п. 20, где присутствие указанной ДНК определяется секвенированием.
22. Способ оценки того, страдает ли пациент миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, где указанный способ включает:
- определение присутствия генного продукта одного или более мутантного аллеля гена кальретикулина в образце от указанного пациента; и
- оценку того, что указанный пациент страдает миелоидным новообразованием или предрасположен страдать миелоидным новообразованием, когда присутствует указанный генный продукт.
23. Способ по п. 22,
где указанный один или более мутантный аллель содержит нуклеиновую кислоту, кодирующую мутантный белок кальретикулин.
24. Способ по п. 23, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(а) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по п. (а) или (b), в котором одна или более аминокислота делецирована, инсерцирована, добавлена или заменена;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а) или (с);
(f) белок, обладающий по меньшей мере 70% идентичностью с белком по любому из пп. (а)-(е), и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
25. Способ по п. 23 или 24, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по п. (а) или (b), в котором одна или более аминокислота делецирована, инсерцирована, добавлена или заменена;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а) или (с);
(f) белок, обладающий по меньшей мере 70% идентичностью с белком по любому из пп. (а)-(е), и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
26. Способ по п. 23 или 24, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по п. (а) или (b), в котором одна или более аминокислота делецирована, инсерцирована, добавлена или заменена;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а) или (с);
(f) белок, обладающий по меньшей мере 70% идентичностью с белком по любому из пп. (а)-(е), и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислоты, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
27. Способ по п. 23 или 24, где указанный мутантный белок кальретикулин выбран из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по п. (а) или (b), в котором одна или более аминокислота делецирована, инсерцирована, добавлена или заменена;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а) или (с);
(f) белок, обладающий по меньшей мере 70% идентичностью с белком по любому из пп. (а)-(е), и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
28. Способ по п. 22, где указанный аллель содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140, 144, 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284, 288; 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137, 141, 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281, 285, 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
29. Способ по п. 22, где указанный генный продукт содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
30. Способ по п. 22, где указанный генный продукт содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3, 7, 11, 15, 19, 23, 27, 31, 35, 39, 43, 47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 91, 95, 99, 103, 107, 111, 115, 119, 123, 127, 131, 135, 139 или 143;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
31. Способ по п. 22, где указанный генный продукт содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 ил 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 293, 297, 301, 305, 309, 313, 317, 321, 325, 329, 333, 337, 341, 345, 349, 353, 357, 361, 365, 369, 373, 377, 381, 385, 389, 393, 397, 401, 405, 409, 413, 417, 421, 425, 429 или 433;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
32. Способ по п. 22, где указанный генный продукт содержит нуклеиновую кислоту, выбранную из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 147, 151, 155, 159, 163, 167, 171, 175, 179, 183, 187, 191, 195, 199, 203, 207, 211, 215, 219, 223, 227, 231, 235, 239, 243, 247, 251, 255, 259, 263, 267, 271, 275, 279, 283 или 287;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
33. Способ по п. 22, где указанный генный продукт содержит полипептид, выбранный из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2 или 3;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(c) белок по п. (а) или (b), в котором одна или более аминокислота делецирована, инсерцирована, добавлена или заменена;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а) или (с);
(f) белок, обладающий по меньшей мере 70% идентичностью с белком по любому из пп. (а)-(е), и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
34. Способ по п. 22, где указанный генный продукт содержит полипептид, выбранный из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 1, 2, 3, 5, 6, 7, 9, 10, 11, 13, 14, 15, 17, 18, 19, 21, 22, 23, 25, 26, 27, 29, 30, 31, 33, 34, 35, 37, 38, 39, 41, 42, 43, 45, 46, 47, 49, 50, 51, 53, 54, 55, 57, 58, 59, 61, 62, 63, 65, 66, 67, 69, 70, 71, 73, 74, 75, 77, 78, 79, 81, 82, 83, 85, 86, 87, 89, 90, 91, 93, 94, 95, 97, 98, 99, 101, 102, 103, 105, 106, 107, 109, 110, 111, 113, 114, 115, 117, 118, 119, 121, 122, 123, 125, 126, 127, 129, 130, 131, 133, 134, 135, 137, 138, 139, 141, 142 или 143;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(c) белок по п. (а) или (b), в котором одна или более аминокислота делецирована, инсерцирована добавлена или заменена;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а) или (с);
(f) белок, обладающий по меньшей мере 70% идентичностью с белком по любому из пп. (а)-(е); и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
35. Способ по п. 22, где указанный генный продукт содержит полипептид, выбранный из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 291, 292, 293, 295, 296, 297, 299, 300, 301, 303, 304, 305, 307, 308, 309, 311, 312, 313, 315, 316, 317, 319, 320, 321, 323, 324, 325, 327, 328, 329, 331, 332, 333, 335, 336, 337, 339, 340, 341, 343, 344, 345, 347, 348, 349, 351, 352, 353, 355, 356, 357, 359, 360, 361, 363, 364, 365, 367, 368, 369, 371, 372, 373, 375, 376, 377, 379, 380, 381, 383, 384, 385, 387, 388, 389, 391, 392, 393, 395, 396, 397, 399, 400, 401, 403, 404, 405, 407, 408, 409, 411, 412, 413, 415, 416, 417, 419, 420, 421, 423, 424, 425, 427, 428, 429, 431, 432 или 433;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(c) белок по п. (а) или (b), в котором одна или более аминокислота делецирована, инсерцирована, добавлена или заменена;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а) или (с);
(f) белок, обладающий по меньшей мере 70% идентичностью с белком по любому из пп. (а)-(е), и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
36. Способ по п. 22, где указанный генный продукт содержит полипептид, выбранный из группы, включающей:
(a) белок, кодированный молекулой нуклеиновой кислоты, имеющей последовательность нуклеиновой кислоты, показанную в SEQ ID NO: 145, 146, 147, 149, 150, 151, 153, 154, 155, 157, 158, 159, 161, 162, 163, 165, 166, 167, 169, 170, 171, 173, 174, 175, 177, 178, 179, 181, 182, 183, 185, 186, 187, 189, 190, 191, 193, 194, 195, 197, 198, 199, 201, 202, 203, 205, 206, 207, 209, 210, 211, 213, 214, 215, 217, 218, 219, 221, 222, 223, 225, 226, 227, 229, 230, 231, 233, 234, 235, 237, 238, 239, 241, 242, 243, 245, 246, 247, 249, 250, 251, 253, 254, 255, 257, 258, 259, 261, 262, 263, 265, 266, 267, 269, 270, 271, 273, 274, 275, 277, 278, 279, 281, 282, 283, 285, 286 или 287;
(b) белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(c) белок по п. (а) или (b), в котором одна или более аминокислота делецирована, инсерцирована, добавлена или заменена;
(d) белок, кодированный молекулой нуклеиновой кислоты, кодирующей белок, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(e) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, гибридизующейся в жестких условиях с комплементарной цепью молекул нуклеиновой кислоты, определенных в п. (а) или (с);
(f) белок, обладающий по меньшей мере 70% идентичностью с белком по любому из пп. (а)-(е), и
(g) белок, содержащий аминокислотную последовательность, кодированную нуклеиновой кислотой, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты, определенной в пп. (а), (d) или (e).
37. Способ по п. 22, где указанный генный продукт представляет мРНК.
38. Способ по п. 37, где присутствие или количество указанной мРНК определяется ПЦР в режиме реального времени, ПЦР с обратной транскрипцией, полногеномным транскриптомным шот-ган секвенированием (секвенированием РНК), гибридизацией in situ или технологией микрочипов.
39. Способ по п. 38, где определение ПЦР в режиме реального времени и ПЦР с обратной транскрипцией дополнительно включает стадии:
(i) контактирование нуклеиновой кислоты в образце с одним или двумя олигонуклеотидами;
(ii) получение продукта амплификации, содержащего последовательность-мишень.
40. Способ по п. 22, где указанный генный продукт является белком.
41. Способ по п. 40, где присутствие или количество указанного белка определяется иммуногистохимией (IHC), иммуноанализом, методами на основе гель-электрофореза или блоттинга, IHC, масс-спектрометрией, проточной цитометрией или FACS.
42. Способ по п. 1 или 22, где указанный пациент является пациентом-человеком.
43. Способ по п. 1 или 22, где указанный образец представляет образец костного мозга.
44. Способ по п. 1 или 22, где указанный образец представляет образец крови.
45. Способ по п. 43, где указанный образец костного мозга получают с помощью биопсии.
46. Способ по п. 44, где указанный образец костного мозга получают с помощью биопсии.
47. Способ по п. 1 или 22, дополнительно включающий введение ингибитора мутантного кальретикулина пациенту.
48. Нуклеиновая кислота, кодирующая мутантный белок кальретикулин, выбранная из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 2;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в пп. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d),
где присутствие указанной нуклеиновой кислоты в образце от пациента указывает на наличие у данного пациента миелоидного новообразования.
49. Нуклеиновая кислота по п. 48, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 2, 6, 10, 14, 18, 22, 26, 30, 34, 38, 42, 46, 50, 54, 58, 62, 66, 70, 74, 78, 82, 86, 90, 94, 98, 102, 106, 110, 114, 118, 122, 126, 130, 134, 138 или 142;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
50. Нуклеиновая кислота по п. 48 или 49, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 292, 296, 300, 304, 308, 312, 316, 320, 324, 328, 332, 336, 340, 344, 348, 352, 356, 360, 364, 368, 372, 376, 380, 384, 388, 392, 396, 400, 404, 408, 412, 416, 420, 424, 428 или 432;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
51. Нуклеиновая кислота по п. 48 или 49, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 146, 150, 154, 158, 162, 166, 170, 174, 178, 182, 186, 190, 194, 198, 202, 206, 210, 214, 218, 222, 226, 230, 234, 238, 242, 246, 250, 254, 258, 262, 266, 270, 274, 278, 282 или 286;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
52. Нуклеиновая кислота по п. 48 или 49, где указанная нуклеиновая кислота является кДНК.
53. Нуклеиновая кислота, кодирующая мутантный белок кальретикулин, выбранная из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d),
где присутствие указанной нуклеиновой кислоты в образце от пациента указывает на наличие у данного пациента миелоидного новообразования.
54. Нуклеиновая кислота по п. 53, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 3, 7, 11, 15, 19, 23, 27, 31, 35, 39, 43, 47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 91, 95, 99, 103, 107, 111, 115, 119, 123, 127, 131, 135, 139 или 143;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
55. Нуклеиновая кислота по п. 53 или 54, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 293, 297, 301, 305, 309, 313, 317, 321, 325, 329, 333, 337, 341, 345, 349, 353, 357, 361, 365, 369, 373, 377, 381, 385, 389, 393, 397, 401, 405, 409, 413, 417, 421, 425, 429 или 433;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
56. Нуклеиновая кислота по п. 53, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 147, 151, 155, 159, 163, 167, 171, 175, 179, 183, 187, 191, 195, 199, 203, 207, 211, 215, 219, 223, 227, 231, 235, 239, 243, 247, 251, 255, 259, 263, 267, 271, 275, 279, 283 или 287;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
57. Нуклеиновая кислота по п. 53 или 54, где указанная нуклеиновая кислота является мРНК.
58. Нуклеиновая кислота, кодирующая мутантный белок кальретикулин, выбранная из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d),
где присутствие указанной нуклеиновой кислоты в образце от пациента указывает на наличие у данного пациента миелоидного новообразования.
59. Нуклеиновая кислота по п. 58, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 92, 96, 100, 104, 108, 112, 116, 120, 124, 128, 132, 136, 140 или 144;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 93, 97, 101, 105, 109, 113, 117, 121, 125, 129, 133, 137 или 141;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
60. Нуклеиновая кислота по п. 58 или 59, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 294, 298, 302, 306, 310, 314, 318, 322, 326, 330, 334, 338, 342, 346, 350, 354, 358, 362, 366, 370, 374, 378, 382, 386, 390, 394, 398, 402, 406, 410, 414, 418, 422, 426, 430 или 434;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 291, 295, 299, 303, 307, 311, 315, 319, 323, 327, 331, 335, 339, 343, 347, 351, 355, 359, 363, 367, 371, 375, 379, 383, 387, 391, 395, 399, 403, 407, 411, 415, 419, 423, 427 или 431;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
61. Нуклеиновая кислота по п. 58 или 59, где указанная нуклеиновая кислота выбрана из группы, включающей:
(а) нуклеиновую кислоту, кодирующую полипептид, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 148, 152, 156, 160, 164, 168, 172, 176, 180, 184, 188, 192, 196, 200, 204, 208, 212, 216, 220, 224, 228, 232, 236, 240, 244, 248, 252, 256, 260, 264, 268, 272, 276, 280, 284 или 288;
(b) нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в SEQ ID NO: 145, 149, 153, 157, 161, 165, 169, 173, 177, 181, 185, 189, 193, 197, 201, 205, 209, 213, 217, 221, 225, 229, 233, 237, 241, 245, 249, 253, 257, 261, 265, 269, 273, 277, 281 или 285;
(c) нуклеиновую кислоту, гибридизующуюся в жестких условиях с комплементарной цепью нуклеиновой кислоты, определенной в п. (а) или (b);
(d) нуклеиновую кислоту, содержащую нуклеотидную последовательность по меньшей мере с 70% идентичностью с нуклеотидной последовательностью нуклеиновых кислот по любому из пп. (а)-(с), и
(e) нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая является вырожденной в результате свойства генетического кода по отношению к нуклеотидной
последовательности нуклеиновой кислоты по любому из пп. (а)-(d).
62. Нуклеиновая кислота по п. 58 или 59, где указанная нуклеиновая кислота является геномной ДНК.
| Baxter E | |||
| J | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| - Vol | |||
| Станок для нарезания зубьев на гребнях | 1921 |
|
SU365A1 |
| - n | |||
| Приспособление для включения и выключения электрического двигателя цементной мельницы, с целью предотвращения аварий и образования завалов приостановках обслуживающих ее транспортных и других механизмов | 1927 |
|
SU9464A1 |
| - P | |||
| УСТРОЙСТВО ДЛЯ УТИЛИЗАЦИИ ЭНЕРГИИ МОРСКИХ ВОЛН | 1924 |
|
SU1054A1 |
| Глузман Д | |||
| Ф., Скляренко Л | |||
| М., Надгорная В | |||
| А | |||
| Современная диагностика острых миелоидных лейкозов //Здоровье Украины | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| - n | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| - С | |||
| Пишущая машина | 1922 |
|
SU37A1 |
Авторы
Даты
2018-10-02—Публикация
2014-09-15—Подача