Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к средству для диагностики, профилактики или лечения миелопролиферативного новообразования.
Предпосылки создания изобретения
[0002]
У части пациентов с Philadelphia-отрицательными миелопролиферативными новообразованиями (MPN) нуклеотидная делеция или вставка обнаружена в экзоне 9 гена кальретикулина (CALR) (Непатентная литература 1 и 2). Уже было обнаружено, что мутантный белок CALR, продуцируемый мутантным геном CALR, имеет онкогенность, независимо вызывающую миелопролиферативное новообразование (MPN) путем постоянной активации рецептора тромбопоэтина (Непатентная литература 3-6).
[0003]
Мутация CALR гена, обнаруженная у MPN пациентов, представляет собой мутацию со сдвигом рамки, которая обязательно локализуется в последнем экзоне, и сдвиг в аминокислотной рамке считывания посредством мутации со сдвигом рамки всегда +1. Из этого следует, что последовательность, которой нет у дикого типа, присутствует на карбокси-конце мутантного CALR белка, и, в частности, 44 аминокислоты карбокси-конца являются общими для почти всех мутантных CALR белков. В качестве примера, Фиг. 1 показывает сравнение последовательностей карбокси-концов типа 52-нуклеотидной делеции (Del 52), которая является наиболее частой мутацией из мутаций гена CALR, обнаруженных у MPN пациентов, и типа 5-нуклеотидной вставки (Ins 5), которая является следующей наиболее частой мутацией, с соответствующей областью белка CALR дикого типа.
Поскольку мутантный белок CALR, вызывающий MPN, экспрессируется в опухолевых клетках, предположили возможность, что последовательность, специфическая для мутантного белка CALR, вызванного мутацией со сдвигом рамки считывания, станет маркером для диагноза или терапевтической мишенью в качестве неоантигена (Патентная литература 1 и 2).
Перечень цитируемых документов
Патентная литература
[0004]
Патентная литература 1: JP-A-2016-537012
Патентная литература 2: WO2016/087514A
Непатентная литература
[0005]
Непатентная литература 1: Klampfl T, Gisslinger H, Harutyunyan AS, et al., Somatic mutations of calreticulin in myeloproliferative neoplasms, The New England journal of medicine, 2013, 369: 2379-90
Непатентная литература 2: Nangalia J, Massie CE, Baxter EJ, et al., Somatic CALR mutations in myeloproliferative neoplasms with nonmutated JAK2, The New England journal of medicine, 2013, 369: 2391-405
Непатентная литература 3: Araki M, Yang Y, Masubuchi N, et al., Activation of the thrombopoietin receptor by mutant calreticulin in CALR-mutant myeloproliferative neoplasms, Blood, 2016, 127: 1307-16
Непатентная литература 4: Elf S, Abdelfattah NS, Chen E, et al., Mutant Calreticulin Requires Both Its Mutant C-terminus and the Thrombopoietin Receptor for Oncogenic Transformation, Cancer Discov., 2016, 6: 368-81
Непатентная литература 5: Marty C, Pecquet C, Nivarthi H, et al., Calreticulin mutants in mice induce an MPL-dependent thrombocytosis with frequent progression to myelofibrosis, Blood, 2016, 127: 1317-24
Непатентная литература 6: Vainchenker W, Kralovics R., Genetic basis and molecular pathophysiology of classical myeloproliferative neoplasms, Blood, 2017, 129: 667-79
Сущность изобретения
Техническая задача
[0006]
Однако было доказано, что антитело, которое распознает последовательность (неоантиген), специфическую для мутантного белка CALR, появляющегося в результате мутации со сдвигом рамки, не может правильно определить мутантный белок CALR в клеточном экстракте или на клеточной поверхности.
Соответственно, целью настоящего изобретения является обеспечение способов детекции, способных безошибочно обнаруживать мутантный ген CALR и белок MPN, средства для диагностики, профилактики или лечения MPN и способа скрининга для выявления терапевтического средства для лечения MPN.
Решение задачи
[0007]
Авторы настоящего изобретения также осуществили функциональный анализ мутантных белков CALR и в результате обнаружили, что многие из экспрессируемых мутантных белков CALR расщепляются в последовательности (Фиг. 1), специфической для мутантных белков, и что в значительной степени экспрессируется мутантные белки CALR, в которых большая часть последовательности, предполагаемая как неоантиген, утеряна. Соответственно, было получено антитело, которое специфически распознает существенно короткую аминокислотную последовательность, расположенную на амино-концевой стороне сайта расщепления в неоантигене, и было подтверждено, что расщепленные мутантные белки CALR экспрессировались не только в культивируемых клетках, но также в клетках периферической крови пациента и тромбоцитах пациента. Кроме того, было обнаружено, что при использовании этого антитела чувствительность детекции в отношении мутантного белка CALR на поверхности клетки значительно улучшается, и, кроме того, достигается превосходный терапевтический эффект в отношении MPN. На основе этих результатов было обнаружено, что для диагностики или лечения пациентов с MPN, имеющих мутацию гена CALR, могут быть разработаны фармацевтические продукты, демонстрирующие более высокую эффективность путем обнаружения или нацеливания не только на полноразмерный тип (тип без расщепления), но и на мутантные белки CALR, включая типы расщепления. Кроме того, были веские основания для предположения, что эффект фармацевтического продукта, нацеленного на последовательность, которая теряется в результате расщепления, может быть увеличен путем предотвращения расщепления мутантного белка CALR, и настоящее изобретение было осуществлено.
[0008]
Таким образом, настоящее изобретение обеспечивает следующее [1]-[14].
[0009]
[1] Антитело или его функциональный фрагмент, которое связывается с расщепленным мутантным белком CALR, включающее сайт распознавания антигена в (a) полипептидной цепи, состоящей из аминокислотной последовательности SEQ ID NO:1, или в (b) полипептидной цепи, состоящей из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в SEQ ID NO:1.
[2] Антитело или его функциональный фрагмент, которое связывается с расщепленным мутантным CALR белком в соответствии с аспектом [1], где антитело или его функциональный фрагмент выбирают из следующих (c), (d) и (e):
(c) антитело, в котором CDR1, CDR2 и CDR3 VH-цепи иммуноглобулина представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO:17, 18 и 19, соответственно, или аминокислотных последовательностей с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотных последовательностях SEQ ID NO:17, 18 и 19; и CDR1, CDR2 и CDR3 VL-цепи иммуноглобулина представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO:26, 27 и 28, соответственно, или аминокислотных последовательностей с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотных последовательностях SEQ ID NO:26, 27 и 28;
(d) антитело, в котором CDR1, CDR2 и CDR3 VH-цепи иммуноглобулина представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO:20, 21 и 22, соответственно, или аминокислотных последовательностей с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотных последовательностях SEQ ID NO:20, 21 и 22; и CDR1, CDR2 и CDR3 VL-цепи иммуноглобулина представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO:29, 30 и 31, соответственно, или аминокислотных последовательностей с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотных последовательностях SEQ ID NO:29, 30 и 31; и
(e) антитело, в котором CDR1, CDR2 и CDR3 VH-цепи иммуноглобулина представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO:23, 24 и 25, соответственно, или аминокислотных последовательностей с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотных последовательностях SEQ ID NO:23, 24 и 25; и CDR1, CDR2 и CDR3 VL-цепи иммуноглобулина представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO:32, 33 и 34, соответственно, или аминокислотных последовательностей с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотных последовательностях SEQ ID NO:32, 33 и 34.
[3] Антитело или его функциональный фрагмент, которое связывается с расщепленным мутантным CALR белком в соответствии с аспектом [1] или [2], выбранное из следующих (C), (D) и (E):
(C) антитело, содержащее VH-цепь иммуноглобулина, состоящую из аминокислотной последовательности SEQ ID NO:5, или аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:5, и VL-цепь иммуноглобулина, состоящую из аминокислотной последовательности SEQ ID NO:8, или аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:8;
(D) антитело, содержащее VH-цепь иммуноглобулина, состоящую из аминокислотной последовательности SEQ ID NO:6, или аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:6, и VL-цепь иммуноглобулина, состоящую из аминокислотной последовательности SEQ ID NO:9, или аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:9; и
(E) антитело, содержащее VH-цепь иммуноглобулина, состоящую из аминокислотной последовательности SEQ ID NO:7, или аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:7, и VL-цепь иммуноглобулина, состоящую из аминокислотной последовательности SEQ ID NO:10, или аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:10.
[4] Антитело или его функциональный фрагмент, которое конкурирует с антителом в соответствии с аспектом [2] или [3] за связывание с частью аминокислотной последовательности SEQ ID NO:1, в расщепленном мутантном белке CALR.
[5] Фармацевтическая композиция, включающая антитело или его функциональный фрагмент в соответствии с любым из аспектов [1]-[4].
[6] Фармацевтическая композиция в соответствии с аспектом [5], где фармацевтическая композиция представляет собой средство для диагностики, профилактики или лечения миелопролиферативного новообразования.
[7] Способ детекции связанного с миелопролиферативным новообразованием мутантного белка CALR, включающий детекцию следующего полипептида (a) или (b) в биологическом образце:
(a) полипептида, состоящего из аминокислотной последовательности SEQ ID NO:1; или
(b) полипептида, состоящего из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в SEQ ID NO:1.
[8] Способ детекции мутантного белка CALR в соответствии с аспектом [7], где детекция полипептида (a) или (b) является иммунологической детекцией с использованием антитела или его функционального фрагмента в соответствии с любым из аспектов [1]-[4].
[9] Способ скрининга на терапевтическое средство от миелопролиферативного новообразования, включающий скрининг для выявления лекарственного средства, которое связывается со следующим полипептидом (a) или (b):
(a) полипептидом, состоящим из аминокислотной последовательности SEQ ID NO:1; или
(b) полипептидом, состоящим из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в SEQ ID NO:1.
[10] Способ диагностики миелопролиферативного новообразования, включающий детекцию следующего полипептида (a) или (b) в биологическом образце:
(a) полипептида, состоящего из аминокислотной последовательности SEQ ID NO:1; or
(b) полипептида, состоящего из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в SEQ ID NO:1.
[11] Способ диагностики в соответствии с аспектом [10], где детекция полипептида (a) или (b) является иммунологической детекцией с использованием антитела или его функционального фрагмента в соответствии с любым из аспектов [1]-[4].
[12] Способ профилактики или лечения миелопролиферативного новообразования, включающий введение антитела или его функционального фрагмента в соответствии с любым из аспектов [1]-[4].
[13] Антитело или его функциональный фрагмент в соответствии с любым из аспектов [1]-[4] для применения в диагностике миелопролиферативного новообразования.
[14] Применение антитела или его функционального фрагмента в соответствии с любым из аспектов [1]-[4] для получения средства для диагностики миелопролиферативного новообразования.
Эффекты изобретения
[0010]
С использованием антитела, имеющего сайт распознавания антигена (эпитоп) в вышеуказанной полипептидной цепи (а) или (b), можно обнаружить мутантный белок CALR, вызванный расщеплением мутантного белка CALR, и значительно улучшить чувствительность детекции в отношении мутантного белка CALR на поверхности клетки. Соответственно, чувствительность детекции MPN значительно улучшается при использовании средства для диагностики MPN по настоящему изобретению. Кроме того, можно осуществлять специфическую профилактику или лечение MPN с использованием этого антитела. Кроме того, терапевтическое средство от MPN можно подвергнуть скринингу для выявления лекарственного средства, которое связывается с полипептидом (а) или (b).
Краткое описание чертежей
[0011]
[Фиг. 1] Фиг. 1 представляет диаграмму, показывающую характеристики мутантных белков CALR. Мутация гена CALR, ответственная за развитие у пациентов миелопролиферативных новообразований, представляет собой +1 мутацию со сдвигом рамки, и аминокислотая последовательность, характерная для мутантных белков, обнаружена в карбокси-концевой области мутантных белков CALR, продуцируемых в результате мутации. SP: сигнальная последовательность, N: N домен, и P: P домен. Стрелка указывает сайт, с которого начинаются аминокислотные последовательности, отличающиеся от последовательности дикого типа (WT).
[Фиг. 2] Фиг. 2 представляет диаграмму, показывающую антитела, которые распознают последовательности на амино-концевой стороне CALR белка и карбокси-концевой стороне мутантных белков CALR. Антитело, которое распознает последовательность на амино-концевой стороне CALR белка, является коммерчески доступным антителом (анти-CALR антитело), которое распознает аминокислотную последовательность на амино-концевой стороне сайта мутации мутантных белков CALR. Кроме того, антитело, которое распознает последовательность карбокси-конца каждого мутантного белка CALR, является коммерчески доступным антителом (антитело против мутантного CALR), которое распознает аминокислотную последовательность, которая является новообразованной на карбокси-концевой стороне CALR белка в результате мутации нуклеотидной последовательности.
[Фиг. 3] Фиг. 3 представляет диаграмму, показывающую результаты иммуноблот-анализа белков, секретируемых из UT-7/TPO клеток (Komatsu N. et al., Blood, 1996, 87, 4552-4556), с использованием антитела Фиг. 2. Поскольку vec представляет собой клетку, трансфицированную только вектором экспрессии, эндогенный CALR белок обнаруживается как в UT-7/TPO клетка/CALR (WT). В Del 52 типе и Ins 5 типе мутантный белок CALR, имеющий молекулярную массу меньше, чем у полноразмерного мутантного белка CALR, обнаруживаемого антителом против мутантного CALR, обнаруживается только анти-CALR антителом (звездочка на чертеже). В частности, поскольку полноразмерный мутантный белок CALR типа Ins 5 подвергается электрофорезу до по существу такого же положении, что и эндогенный CALR белок дикого типа, Ins 5 тип не может специфически обнаруживаться анти-CALR антителом.
[Фиг. 4] Фиг. 4 представляет схематическую диаграмму, показывающую белки, в которых FLAG-метки слиты с амино (N) концами и карбокси (C) концами типичных мутантных CALR белков, Del 52 типа и Ins 5 типа. Мутантный тип-специфические последовательности показаны черным цветом, а FLAG-метки показаны наклонными линиями.
[Фиг. 5] Фиг. 5 представляет график, показывающий результаты измерения количеств мутантных CALR белков на клеточных поверхностях методом проточной цитометрии с использованием анти-FLAG антитела. В клетках, экспрессирующих мутантный белок CALR, имеющий FLAG-метку на N-конце, на котором метка остается, независимо от присутствия или отсутствия расщепления, был обнаружен сильный сигнал по сравнению с клетками, в которых C-концевой FLAG отсечен в результате расщепления, происходящего в последовательности, специфической для мутантного белка CALR. При этом наблюдается разница, вызванная тем, что уровень экспрессии Del 52 типа ниже, чем уровень экспрессии Ins 5 типа.
[Фиг. 6] Фиг. 6 показывает антитело, которое распознает мутантный тип-специфическую последовательность на амино-концевой стороне сайта расщепления белка, продуцируемого в мутантный CALR белок-специфической последовательности (черный).
[Фиг. 7] Фиг. 7 показывает результаты анализа клеток методом проточной цитометрии, используемого на Фиг. 3, с использованием антитела Фиг. 6. Разница в распознавании, которая вызвана положениями, в которых слита FLAG-метка, исчезла. При этом наблюдается разница, заключающаяся в том, что уровень экспрессии Del 52 типа типа ниже, чем уровень экспрессии Ins 5 типа.
[Фиг. 8] Фиг. 8 представляет диаграмму, показывающую детекцию CALR белка расщепленного типа в клетках миелопролиферативного новообразования пациента. Клеточные экстракты, полученные из клеток пациента, анализировали методом иммуноблотинга с использованием антитела, которое распознает аминокислотную последовательность на амино-концевой стороне сайта расщепления белка, продуцируемого в мутантный CALR белок-специфической последовательности. В мононуклеарных клетках периферической крови и тромбоцитах пациентов с миелопролиферативным новообразованием, имеющих мутацию гена CALR, была обнаружена экспрессия расщепленного мутантного белка CALR, который может распознаваться антителом.
[Фиг. 9] Фиг. 9 представляет диаграмму, показывающую, что все из антител клона B3, C6 и G1 распознают полноразмерные и расщепленные мутантные CALR белки. Диаграмма показывает результаты иммуноблот-анализа белков, секретируемых из UT-7/TPO клеток, с использованием антитела клона B3 и антител клона C6 и G1. Как полноразмерные типы, Del 52 тип и Ins 5 тип, каждый слитый с FLAG-меткой ниже от сигнальной последовательности на амино-конце, так и расщепленные типы, имеющие более низкие молекулярные массы, также обнаруживались любым из B3, C6 и G1 антител, как в анти-FLAG антителе.
[Фиг. 10] Фиг. 10 представляет диаграмму, показывающую, что все из антител клона B3, C6 и G1 распознают мутантные CALR белки на клеточных поверхностях. Диаграмма показывает результаты измерения количеств мутантных CALR белков на клеточных поверхностях UT-7/TPO клеток, экспрессирующих мутантный CALR белок Del 52 типа или Ins 5 типа, слитый с FLAG-меткой, и UT-7/TPO/vec клеток, трансфицированных только вектором экспрессии, методом проточной цитометрии с использованием антитела клона B3 и антител клона C6 и G1. При этом, поскольку уровень экспрессии Del 52 типа ниже, чем уровень экспрессии Ins 5 типа, наблюдается разница в интенсивности сигнала из-за типа мутации.
[Фиг. 11] Фиг. 11 представляет график, показывающий результаты оценки активности связывания антител клона B3, C6 и G1 с мутантным белком CALR. Специфичность связывания антитела клона B3, антител клона C6 и G1 и крысиного IgG в качестве контроля с мутантным CALR белком Del 52 типа оценивали методом ELISA. Зависимое от концентрации специфическое связывание с мутантным белком CALR было обнаружено во всех антителах клона B3, C6 и G1.
[Фиг. 12] Фиг. 12 представляет график, показывающий результаты оценки силы связывания антитела клона B3 с антигеном, используемым для продукции антитела, методом поверхностного плазмонного резонанса. Силу связывания антитела клона B3 и антигена, используемого для продукции антитела, оценивали методом поверхностного плазмонного резонанса.
[Фиг. 13A] Фиг. 13A представляет диаграмму, показывающую результаты идентификации антиген-распознающих последовательностей антител клона B3, C6 и G1 методом иммуноблотинга. Белки, каждый содержащий аланин (A), заменяющий одну аминокислоту в мутантном белке CALR типа Del 52, показанном на диаграмме, экспрессировали и реактивность соответствующих антител в отношении белков оценивали методом иммуноблотинга. Интактный означает мутантный CALR белок Del 52 типа, не имеющий аминокислотной замены. Аминокислоты, обведенные жирной черной линией, представляют собой антигенные последовательности, используемые для продукции антител.
[Фиг. 13B] Фиг. 13B представляет диаграмму, показывающую результаты идентификации антиген-распознающих последовательностей антител клона B3, C6 и G1 методом ELISA. Реактивности соответствующих антител в отношении тех же белков, которые показаны на Фиг. 13A, оценивали методом ELISA. Интактный означает мутантный CALR белок Del 52 типа, на имеющий аминокислотной замены. Аминокислоты, обведенные жирной черной линией, представляют собой антигенные последовательности, используемые для продукции антител.
[Фиг. 14] Фиг. 14 представляет диаграмму, показывающую аминокислотные последовательности вариабельных областей тяжелой цепи антител (B3, C6 и G1) по настоящему изобретению.
[Фиг. 15] Фиг. 15 представляет диаграмму, показывающую аминокислотные последовательности вариабельных областей легкой цепи антител (B3, C6 и G1) по настоящему изобретению.
[Фиг. 16] Фиг. 16 представляет диаграмму, показывающую нуклеотидные последовательности вариабельных областей тяжелой цепи антител (B3, C6 и G1) по настоящему изобретению.
[Фиг. 17] Фиг. 17 представляет диаграмму, показывающую нуклеотидные последовательности вариабельных областей легкой цепи антител (B3, C6 и G1) по настоящему изобретению.
[Фиг. 18] Фиг. 18 представляет диаграмму, показывающую терапевтический эффект на MPN мышиную модель с использованием B3 мышиного химерного антитела. B3 химерное антитело или растворитель (PBS) вводили модельным мышам с миелопролиферативным новообразованием (CALR Del 52 мыши), полученным путем трансплантации гематопоэтических стволовых клеток, экспрессирующих мутантный CALR белок Del 52 типа, или контрольным мышам после трансплантации гематопоэтических стволовых клеток, трансфицированных контрольным вектором, каждую неделю, начиная с 9-й недели после трансплантации, и оценивали эффект подавления тромбоцитоза, характерного для мышиной модели миелопролиферативного новообразования.
Описание вариантов осуществления
[0012]
Полипептид (a) или (b) по настоящему изобретению, который используют в способе детекции связанного с MPN мутантного белка CALR, и используют в способе диагностики и в качестве мишени для профилактики или лечения MPN, представляет собой полипептид, остающийся на карбокси-концевой стороне после расщепления последовательности (44 аминокислоты, общие для мутантных CALR белков на Фиг. 1), специфической для мутантных CALR белков.
CALR белок дикого типа включает аминокислотную последовательность (SEQ ID NO:2), показанную на Фиг. 1. Кроме того, тип 52-нуклеотидной делеции (Del 52), который представляет собой наиболее часто встречающуюся мутацию среди мутаций гена CALR, включает аминокислотную последовательность (SEQ ID NO:3), показанную на Фиг. 1. Кроме того, тип 5-нуклеотидной вставки (Ins 5), который представляет собой следующую наиболее часто встречающуюся мутацию среди мутаций гена CALR, включает аминокислотную последовательность (SEQ ID NO:4), показанную на Фиг. 1. Кроме того, область, заключенная в рамку на Фиг. 1, представляет собой аминокислотную последовательность, общую для большинства мутантных CALR белков. Расщепленный мутантный белок CALR включает только 13 аминокислот на амино-концевой стороне этой общей области. Авторы настоящего изобретения обнаружили что эта общая область расщепляется с образованием расщепленных мутантных CALR белков, и что теряется бóльшая часть общей области из мутантных CALR белков.
[0013]
Полипептид (a) состоит из аминокислотной последовательности SEQ ID NO:1. Аминокислотная последовательность, имеющая делецию, замену или добавление одной-нескольких аминокислот, в виде полипептида (b) предпочтительно представляет собой аминокислотную последовательность, имеющую делецию, замену или добавление одной-четырех аминокислот, более предпочтительно аминокислотную последовательность, имеющую делецию, замену или добавление одной-трех аминокислот в SEQ ID NO:1. Более конкретно, аминокислотная последовательность, имеющая делецию трех аминокислот с карбокси-концевой стороны SEQ ID NO:1, является более предпочтительной. Кроме того, идентичность между аминокислотной последовательностью полипептида (b) и аминокислотной последовательностью SEQ ID NO:1 предпочтительно составляет 80% или больше, более предпочтительно 85% или больше и еще более предпочтительно 90% или больше.
[0014]
В способе детекции связанного с MPN мутантного белка CALR и в способе диагностики, профилактики или лечения MPN по настоящему изобретению используют антитело или его функциональный фрагмент, которое связывается с полипептидом (a) или (b) в биологическом образце.
[0015]
Антитело может представлять собой любое антитело, имеющее сайт распознавания антигена (эпитоп) в полипептидной цепи (a) или (b), и может связываться только с расщепленным мутантным белком CALR или может связываться как с расщепленным мутантным белком CALR, так и с полноразмерным мутантным белком CALR, и антитело предпочтительно представляет собой антитело, специфическое в отношении "мутантного белка CALR", которое связывается как с расщепленным мутантным белком CALR, так и с полноразмерным мутантным белком CALR. Конкретные примеры антитела включают антитела, выбранные из следующих (c), (d) и (e):
(c) антитело, в котором CDR1, CDR2 и CDR3 VH-цепи иммуноглобулина представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO:17, 18 и 19, соответственно, или аминокислотных последовательностей с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотных последовательностях SEQ ID NO:17, 18 и 19; и CDR1, CDR2 и CDR3 VL-цепи иммуноглобулина представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO:26, 27 и 28, соответственно, или аминокислотных последовательностей с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотных последовательностях SEQ ID NO:26, 27 и 28;
(d) антитело, в котором CDR1, CDR2 и CDR3 VH-цепи иммуноглобулина представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO:20, 21 и 22, соответственно, или аминокислотных последовательностей с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотных последовательностях SEQ ID NO:20, 21 и 22; и CDR1, CDR2 и CDR3 VL-цепи иммуноглобулина представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO:29, 30 и 31, соответственно, или аминокислотных последовательностей с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотных последовательностях SEQ ID NO:29, 30 и 31; and
(e) антитело, в котором CDR1, CDR2 и CDR3 VH-цепи иммуноглобулина представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO:23, 24 и 25, соответственно, или аминокислотных последовательностей с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотных последовательностях SEQ ID NO:23, 24 и 25; и CDR1, CDR2 и CDR3 VL-цепи иммуноглобулина представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO:32, 33 и 34, соответственно, или аминокислотных последовательностей с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотных последовательностях SEQ ID NO:32, 33 и 34.
[0016]
Аминокислотная последовательность, имеющая делецию, замену или добавление одной-нескольких аминокислот в каждой из аминокислотных последовательностей, соответственно представленных в SEQ ID NO:17-34, предпочтительно представляет собой аминокислотную последовательность, имеющую делецию, замену или добавление одной-четырех аминокислот, более предпочтительно аминокислотную последовательность, имеющую делецию, замену или добавление одной-трех аминокислот, и еще более предпочтительно аминокислотную последовательность, имеющую делецию, замену или добавление одной или двух аминокислот в SEQ ID NO:17-34. Кроме того, идентичность между каждой из аминокислотных последовательностей, соответственно представленных в SEQ ID NO:17-34, и аминокислотной последовательностью, имеющей делецию, замену или добавление одной-нескольких аминокислот соответствующей аминокислотной последовательности, предпочтительно составляет 80% или больше, более предпочтительно 85% или больше и еще более предпочтительно 90% или больше.
[0017]
Антитело, имеющее сайт распознавания антигена (эпитоп) в полипептидной цепи (a) или (b), еще более предпочтительно представляет собой антитело, выбранное из следующих (C), (D) и (E):
(C) антитело, содержащее VH-цепь иммуноглобулина, состоящую из аминокислотной последовательности SEQ ID NO:5, или аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:5, и VL-цепь иммуноглобулина, состоящую из аминокислотной последовательности SEQ ID NO:8, или аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:8;
(D) антитело, содержащее VH-цепь иммуноглобулина, состоящую из аминокислотной последовательности SEQ ID NO:6, или аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:6, и VL-цепь иммуноглобулина, состоящую из аминокислотной последовательности SEQ ID NO:9, или аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:9; и
(E) антитело, содержащее VH-цепь иммуноглобулина, состоящую из аминокислотной последовательности SEQ ID NO:7, или аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:7, и VL-цепь иммуноглобулина, состоящую из аминокислотной последовательности SEQ ID NO:10, или аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO:10.
[0018]
Аминокислотная последовательность, имеющая делецию, замену или добавление одной-нескольких аминокислот в каждой из аминокислотных последовательностей, соответственно представленных в SEQ ID NO:5-10, предпочтительно представляет собой аминокислотную последовательность, имеющую делецию, замену или добавление одной-десяти аминокислот, более предпочтительно аминокислотную последовательность, имеющую делецию, замену или добавление одной-восьми аминокислот, и еще более предпочтительно аминокислотную последовательность, имеющую делецию, замену или добавление одной-пяти аминокислот, в SEQ ID NO:5-10. Кроме того, идентичность между каждой из аминокислотных последовательностей, соответственно представленных в SEQ ID NO:5-10, и аминокислотной последовательностью, имеющей делецию, замену или добавление одной-нескольких аминокислот соответствующей аминокислотной последовательности SEQ ID NO:5-10, предпочтительно составляет 80% или больше, более предпочтительно 85% или больше и еще более предпочтительно 90% или больше.
[0019]
Антитело по настоящему изобретению включает последовательности каждой CDR антител (c)-(e) или последовательности VH области и VL области иммуноглобулина антител (C)-(E), и амино последовательности областей, отличных от этих областей, конкретно не ограничиваются. Соответственно, антитело по настоящему изобретению может представлять собой антитело млекопитающего, отличного от крысы, такое как человеческое антитело, или может представлять собой гуманизированное антитело. Более конкретно, антитело может представлять собой химерное антитело, содержащее вариабельные области тяжелой цепи и легкой цепи антитела млекопитающего, отличного от человека, например крысы, и константные области тяжелой цепи и легкой цепи человеческого антитела, и такое антитело можно получить путем лигирования ДНК, кодирующей вариабельную область крысиного антитела, с ДНК, кодирующей константную область человеческого антитела, включения этого в вектор экспрессии и введения вектора хозяину для продуцирования. Гуманизированное антитело также называют реконструированным человеческим антителом, и его получают путем трансплантации CDR антитела млекопитающего, отличного от человека, например крысиного антитела, в CDR человеческого антитела, и используемый для этого общий метод рекомбинации генов также известен. В конкретном примере последовательность ДНК, разработанная для лигирования CDR крысиного антитела с каркасной областью (FR) человеческого антитела, синтезируют из нескольких олигонуклеотидов, полученных таким образом, чтобы включать часть, перекрывающуюся с концевой частью, методом ПЦР. Полученную ДНК лигируют с ДНК, кодирующей константную область человеческого антитела, затем это включают в вектор экспрессии, и вектор экспрессии вводят хозяину для продуцирования гуманизированного антитела (см. публикацию Европейской патентной заявки № EP239400 и публикацию международной патентной заявки WO96/02576). FR человеческого антитела, которую лигируют через CDR, выбирают таким образом, чтобы CDR образовывала благоприятный антиген-связывающий сайт. При необходимости аминокислота из FR вариабельной области антитела может быть заменена так, чтобы CDR реконструированного человеческого антитела образовывала соответствующий антиген-связывающий сайт (Sato, K. et al., Cancer Res., 1993, 53, 851-856).
[0020]
Кроме того, способы получения человеческих антител также известны. Например, человеческие лимфоциты сенсибилизируют in vitro желаемым антигеном или клеткой, экспрессирующей желаемый антиген, и сенсибилизированные лимфоциты сливают с клетками миеломы человека, такими как U266, с получением желаемого человеческого антитела, обладающего активностью связывания с антигеном (см. JP-B-1-59878). Кроме того, желаемое человеческое антитело можно получить путем иммунизации трансгенного животного, имеющего весь репертуар генов человеческого антитела, желаемым антигеном (см. WO 93/12227, WO 92/03918, WO 94/02602, WO 94/25585, WO 96/34096 и WO 96/33735). Кроме того, также известен метод пэннинга для получения человеческого антитела с использованием библиотеки человеческих антител. Например, вариабельную область человеческого антитела экспрессируют в виде одноцепочечного антитела (scFv) на поверхности фага методом фагового дисплея, и можно выбрать фаг, который связывается с антигеном. Путем анализа гена выбранного фага можно определить последовательность ДНК, кодирующую вариабельную область человеческого антитела, которая связывается с антигеном. Если определена ДНК последовательность scFv, которая связывается с антигеном, человеческое антитело можно получить путем получения подходящего вектора экспрессии, содержащего эту последовательность. Такие способы уже хорошо известны, и можно сослаться на WO 92/01047, WO 92/20791, WO 93/06213, WO 93/11236, WO 93/19172, WO 95/01438 и WO 95/15388.
[0021]
Класс антитела конкретно не ограничивается, и включены антитела, имеющие любой из изотипов, такой как IgG, IgM, IgA, IgD и IgE. Принимая во внимание, например, простоту очистки, IgG является предпочтительным.
[0022]
Примеры функциональных фрагментов включают низкомолекулярные антитела, такие как фрагменты антител и модифицированные антитела. Конкретные примеры фрагментов антител включают Fab, Fab', F(ab')2, Fv, scFv и диатела.
[0023]
Кроме того, что касается антител по настоящему изобретению, антитело, которое используют для детекции полипептида (a) или (b), может представлять собой любое антитело, которое связывается с этими полипептидами. Альтернативно, антитело, которое используют для профилактики или лечения MPN, предпочтительно представляет собой антитело, которое связывается с полипептидом (a) или (b) и обладает цитотоксической активностью.
[0024]
Антитело, которое связывается с расщепленным мутантным белком CALR, может представлять собой любое антитело, которое связывается с полипептидной цепью, включающей последовательность, представленную в SEQ ID NO:1, и предпочтительно представляет собой антитело, которое конкурирует с по меньшей мере одним из вышеуказанных антител и их функциональных фрагментов за связывание с частью аминокислотной последовательности SEQ ID NO:1, в расщепленном мутантном белке CALR.
[0025]
В данном случае биологический образец, используемый в способе детекции, представляет собой, например, биологический образец, взятый у субъекта и включающий полипептид (а) или (b). В частности, примеры образцов включают цельную кровь, плазму, сыворотку, лимфоциты, лимфатическую жидкость, тромбоциты, мононуклеарные клетки, гранулоциты, жидкости организма, такие как слюна и моча, и образцы тканей (жидкость костного мозга и ткань костного мозга), полученные биопсией костного мозга.
[0026]
Примеры способа детекции полипептида (a) или (b) включают жидкостную хроматографию, масс-спектрометрию, иммунологический метод и метод, использующий молекулу с низкой или средней молекулярной массой, обладающую специфической связывающей способностью, или нуклеиновую кислоту, или производное нуклеиновой кислоты, и иммунологический метод предпочтителен с учетом его простоты и высокой чувствительности.
[0027]
Иммунологический способ предпочтительно представляет собой иммунологический способ с использованием антитела или его функционального фрагмента, включающего сайт распознавания антигена (эпитоп) в полипептидной цепи (a) или (b). Эпитоп в полипептидной цепи (a) или (b) может представлять собой любую последовательность, присутствующую в полипептидной цепи (a) или (b), и предпочтительно представляет собой пептид, включающий три или более последовательных аминокислот в полипептидной цепи (a) или (b), и более предпочтительно пептид, включающий пять или более последовательных аминокислот в полипептидной цепи (a) или (b).
[0028]
Антитело, используемое в иммунологическом способе, может быть любым антителом, полученным с использованием пептида, включающего, например, три или более последовательных аминокислот в полипептидной цепи (а) или (b), в качестве антигена, и может быть поликлональным антителом или моноклональным антителом, и предпочтительным является моноклональное антитело. Моноклональное антитело может быть получено, например, путем получения антитело-продуцирующих клеток путем сенсибилизации пептидом, включающим три или более последовательных аминокислот в полипептидной цепи (а) или (b), слияния антитело-продуцирующих клеток с миеломными клетками с получением гибридом, выбора клона, продуцирующего целевое антитело, и размножения этой клетки.
[0029]
В качестве иммунологического способа можно использовать, например, любой из иммунохроматографии, иммуноферментного анализа (EIA), радиоиммуноанализа (RIA), метода коагуляции, нефелометрии, проточной цитометрии, иммуноокрашивания тканей и иммуноблоттинга, такого как вестерн-блоттинг. В данном случае иммуноблоттинг представляет собой метод, в котором полипептид переносится на мембрану, и полипептид на мембране обнаруживается антителом. При детекции антитела, например, используют ферментную метку или флуоресцентную метку.
Если полипептид (а) или (b) обнаружен в биологическом образце, можно сделать вывод, что этот биологический образец является биологическим образцом, полученным от пациента с миелопролиферативным новообразованием.
[0031]
Средство для диагностики MPN по настоящему изобретению содержит антитело, имеющее сайт распознавания антигена (эпитоп) в полипептидной цепи (а) или (b). Это антитело предпочтительно представляет собой антитело, описанное выше.
Кроме того, средство для диагностики MPN по настоящему изобретению может включать, например, буфер и протокол измерения в дополнение к антителу.
[0032]
Фармацевтическая композиция, такая как средство для профилактики или лечения MPN, по настоящему изобретению по меньшей мере содержит описанное выше антитело и может быть получена путем формулирования вместе с фармацевтически приемлемым носителем, например, путем смешивания, растворения, эмульгирования, инкапсулирования или лиофилизации.
[0033]
MPN в качестве мишени для профилактики или терапии с использованием фармацевтической композиции по настоящему изобретению предпочтительно представляет собой MPN, в котором обнаружен мутантный CALR.
[0034]
Подходящие композиции для перорального введения представляют собой, например, жидкость, полученную растворением эффективного количества антитела по настоящему изобретению в разбавителе, таком как вода или физиологический раствор, капсулу, гранулу, порошок или таблетку, содержащие эффективное количество антитела в виде твердого вещества или гранулы, суспензию, полученную путем суспендирования эффективного количества антитела в соответствующей дисперсионной среде, и эмульсию, полученную путем диспергирования и эмульгирования раствора эффективного количества антитела в соответствующей дисперсионной среде.
[0035]
Для парентерального введения антитело по настоящему изобретению можно сформулировать в виде лекарственной формы, такой как раствор для инъекций, суспензия, эмульсия, крем, мазь, ингаляционная форма и суппозиторий, вместе с фармацевтически приемлемым растворителем, эксципиентом, связующим, стабилизатором, диспергатором и т.д. Для получения препарата для инъекций антитело по настоящему изобретению можно растворить в водном растворе, предпочтительно в физиологически совместимом буфере, таком как раствор Хенкса, раствор Рингера или физиологический солевой буферный раствор. Кроме того, фармацевтический продукт по настоящему изобретению может образовывать, например, суспензию, раствор или эмульсию в масляном или водном носителе. Альтернативно, антитело по настоящему изобретению получают в форме порошка, и водный раствор или суспензию можно получить с использованием стерильной воды или т.п. перед использованием. Для ингаляционного введения антитело по настоящему изобретению измельчают в порошок и смешивают с соответствующей основой, такой как лактоза или крахмал, с образованием порошковой смеси. Суппозиторий можно получить путем смешивания антитела по настоящему изобретению с обычной основой для суппозиториев, такой как масло какао. Кроме того, терапевтическое средство по настоящему изобретению может быть получено в виде композиции с замедленным высвобождением путем инкапсуляции с использованием полимерной матрицы или т.п.
[0036]
Способ скрининга на терапевтическое средство для MPN по настоящему изобретению отличается тем, что осуществляют скрининг на антитело, белок, молекулу с низкой или средней молекулярной массой, нуклеиновую кислоту или производное нуклеиновой кислоты, которое распознает полипептид (а) или (b). В частности, проиллюстрирована разработка лекарственного средства на основе антитела, обладающего антитело-зависимой цитотоксической активностью или комплемент-зависимой цитотоксической активностью, с использованием антитела, которое распознает полипептид (а) или (b). Вышеописанное антитело по настоящему изобретению является примером лекарственного средства на основе антитела, полученного методом скрининга по настоящему изобретению. В дополнение к этому, приведен пример разработки противоопухолевого средства, которое доставляет, например, соединение с низкой или средней молекулярной массой, нуклеиновую кислоту или производное нуклеиновой кислоты, или белок, обладающие цитотоксическим эффектом, конкретно в опухолевые клетки, путем получения соединения с низкой или средней молекулярной массой, нуклеиновой кислоты или производного нуклеиновой кислоты, или белка, которые специфически связываются с полипептидом (а) или (b).
Примеры
[0037]
Далее настоящее изобретение будет описано более подробно со ссылкой на примеры, но оно не ограничивается этими примерами.
[0038]
[Пример испытания 1]
(1) Материалы и метод испытания
[1] Анти-CALR антитело
Кроличье моноклональное антитело клон D3E6 (Cat# 12238), изготовитель Cell Signaling Technology, Inc.
[0039]
[2] Антитело против мутантного CALR
Мышиное моноклональное антитело клон CAL2 (Cat# DIA-CAL), изготовитель Dianova GmbH
[0040]
[3] Антитело, которое распознает мутантный белок CALR на амино-концевой стороне сайта расщепления
Синтезировали пептид, имеющий цистеин на карбокси-конце или амино-конце аминокислотной последовательности (RRMMRTKMR), включенной в SEQ ID NO:1, и конъюгировали с белком-носителем, гемоцианином лимфы улитки (KLH). Конъюгат использовали для иммунизации 8-недельных самок крыс WKY/Izm и после бустер-иммунизации собирали лимфоциты. Лимфоциты сливали с клетками мышиной миеломы SP2 методом PEG и получали гибридомы путем культивирования в селективной среде. Специфичность антитела в культуральном супернатанте определяли методом ELISA с использованием иммунизированного пептида или очищенного белка с получением гибридом (клоны B3, C6 и G1), продуцирующих антитела, которые связываются с мутантными CALR белками, включая расщепленный тип. Антитела (B3 антитело, C6 антитело и G1 антитело), продуцируемые этими гибридомами, очищали и использовали в испытаниях.
[0041]
[4] Метод испытания
Человеческую клеточную линию мегакариобластного лейкоза UT-7/TPO трансфицировали вектором, экспрессирующим мутантный CALR белок типа Del 52 или Ins 5, вектором, экспрессирующим CALR дикого типа в качестве контроля, или пустым вектором. Полученные UT-7/TPO/CALR Del 52 и UT-7/TPO/CALR Ins 5 клетки, неопластически пролиферирующие, UT-7/TPO/CALR (WT) клетки и UT-7/TPO/vec клетки, соответственно, высевали при плотности 6,0×105 клеток/мл в Opti-MEM среду (Thermo Fisher Scientific K.K., Cat# 31985070) и культивировали в 5% CO2 при 37°C в течение 32 часов. В данном случае UT-7/TPO/CALR WT и UT-7/TPO/vec клетки культивировали в среде, содержащей 10 нг/мл тромбопоэтина (TPO). Культуральные супернатанты получали путем удаления клеток из культуральных растворов центрифугированием (15000g × 10 мин, 4°C), каждую из полученных фракций подвергали термообработке в присутствии восстановителя, затем подвергали электрофорезу в полиакриламидном геле с додецилсульфатом натрия, переносили на поливинилиденфторидную (PVDF) мембрану методом электропереноса и подвергали взаимодействию с TBS-T раствором (0,1% Tween-20, 150 мМ хлорида натрия, 50 мМ Tris-HCl, pH 7,5), содержащим 5% снятого молока, при комнатной температуре в течение 1 часа с последующим взаимодействием при 4°C в течение ночи с 5% BSA/TBS-T раствором, содержащим антитело, которое распознает как дикий тип, так и мутантный тип (кроличье моноклональное антитело D3E6, Cell Signaling Technology, Inc., Cat# 12238), или коммерчески доступное антитело, которое распознает карбокси-концевую последовательность мутантного типа (мышиное моноклональное антитело CAL2, Dianova GmbH, Cat# DIA-CAL-250). После промывки TBS-T раствором осуществляли взаимодействие в растворе 5% снятого молока/TBS-T, содержащем пероксидаза-меченное анти-кроличье IgG антитело (Santa Cruz Biotechnology, Inc. Cat# sc-2030) или пероксидаза-меченное анти-мышиное IgG антитело (Santa Cruz Biotechnology, Inc. Cat# sc-2005), при комнатной температуре в течение 1 часа. PVDF мембрану промывали TBS-T раствором и затем подвергали взаимодействию с пероксидазным люминесцентным реагентом (Thermo Fisher Scientific K.K., Cat# 34094). Детекцию сигналов осуществляли с использованием преобразующего изображение устройства FUSION (изготовитель Vilber-Lourmat S.A.).
[0042]
Мутантный CALR белок Del 52 типа, имеющий гистидиновую метку, вставленную ниже от сигнальной последовательности на амино-конце, экспрессировали в HEK293T клетках и культуральный супернатант, содержащий секретированный мутантный белок CALR, получали центрифугированием (15000g × 10 мин, 4°C). Полученный супернатант наносили на HisTrap колонку (GE Healthcare, Cat# 17531901), колонку промывали буфером для очистки (0,3 M хлорида натрия, 25 мМ Tris-HCl, pH 7,4), содержащим 20 мМ имидазола, и мутантный белок CALR очищали буфером для очистки, содержащим 50 мМ имидазола. Очищенный белок подвергали взаимодействию с 2-нитро-5-тиоцианобензойной кислотой (NTCB) для цианирования цистеинового остатка и затем осуществляли фрагментацию в щелочных условиях. Массу фрагментов белка определяли с использованием времяпролетного масс-спектрометра с матрично-активированной лазерной десорбцией/ионизацией и сайт расщепления определяли из информации о пептидной последовательности мутантного CALR белка Del 52 типа.
[0043]
Мутантный CALR белок Del 52 типа или Ins 5 типа, меченный FLAG-меткой ниже от сигнальной последовательности на амино-конце или меченный FLAG-меткой на карбокси-конце, экспрессировали в UT-7/TPO клетках и клетки культивировали с использованием модифицированной Дульбекко среды Искова (IMDM), содержащей 10% фетальной бычьей инактивированной сыворотки, в 5% CO2 при 37°C. Клетки (1×105) в пролиферативной стадии промывали PBS (фосфатный буфер, содержащий 137 мМ хлорида натрия и 27 мМ хлорида калия) и затем подвергали взаимодействию с мышиным антителом к последовательности DYKDDDDK tag (FUJIFILM Wako Pure Chemical Corporation, Cat# 014-22383) или крысиным антителом против мутантного CALR, которое распознает амино-концевую сторону сайта расщепления, в 2% FBS/PBS растворе на льду в течение 30 минут. После взаимодействия клетки промывали 2% FBS/PBS раствором и затем подвергали взаимодействию с анти-мышиным IgG-Alexa Fluor 647 (Thermo Fisher Scientific K.K., Cat# A21235) и анти-крысиным IgG-Alexa Fluor 647 (Thermo Fisher Scientific K.K., Cat# A21247), соответственно, в качестве вторичных антител в 2% FBS/PBS растворе на льду в течение 30 минут. После завершения реакции клетки собирали центрифугированием и подвергали взаимодействию с PBS раствором, содержащим 2% параформальдегида, на льду в течение 15 минут. В завершение, клетки промывали путем добавления раствора 2% FBS/PBS, затем осуществляли центрифугирование (400g × 5 мин, 4°C) и супернатант сливали. Затем к клеткам добавляли 300 мл 2% FBS/PBS раствора и сигналы количественно определяли методом проточной цитометрии с использованием FACS Calibur (изготовитель BD biosciences).
[0044]
Человеческие мононуклеарные клетки периферической крови получали путем центрифугирования (500g × 10 мин, 4°C) периферической крови, собранной в пробирке Шпица, содержащей антикоагулянт, суспендирования полученной клеточной фракции в растворе PBS и последующего наложения суспензии на раствор для разделения лимфоцитов Lymphosep (MP biomedicals, каталожный номер 11444815), осуществляя центрифугирование (1500 об/мин 30 мин, комнатная температура), с получением лейкоцитарной пленки, добавляя раствор PBS к полученной лейкоцитарной пленке для ресуспендирования, затем осуществляя центрифугирование (1500 об/мин 10 мин, комнатная температура) и удаление супернатанта. Полученные мононуклеарные клетки периферической крови суспендировали в растворе RIPA (150 мМ хлорида натрия, 1 мМ EDTA, 1% NP-40, 1% дезоксихолата натрия, 2 мМ ортованадата натрия (V), 10 мМ β-глицерофосфорной кислоты, 1 мкг/мл апротинина, 2 мкг/мл E-64, 1 мкг/мл лейпептина, 0,67 мкг/мл бестатина, 0,67 мкг/мл пепстатина, 43,5 мкг/мл PMSF, 20 мМ трис-HCl, pH 7,4), а затем обрабатывали ультразвуком с последующим центрифугированием (15000 g × 15 мин, 4°C). Супернатант собирали в виде клеточного экстракта. Полученный клеточный экстракт подвергали термообработке в присутствии восстановителя, затем подвергали электрофорезу в полиакриламидном геле с додецилсульфатом натрия, переносили на поливинилиденфторидную (PVDF) мембрану методом электропереноса и подвергали взаимодействию с раствором TBS-T, содержащим 5% снятого молока, при комнатной температуре в течение 1 часа с последующим взаимодействием с 5% раствором BSA/TBS-T, содержащим крысиное антитело против мутантного CALR, которое распознает амино-концевую сторону сайта расщепления, при 4°C в течение ночи. После промывки раствором TBS-T осуществляли взаимодействие с раствором 5% снятого молока/TBS-T, содержащим пероксидаза-меченное анти-крысиное IgG антитело (Santa Cruz Biotechnology, Inc., Cat# sc-2006), при комнатной температуре в течение 1 часа. PVDF мембрану промывали раствором TBS-T и затем подвергали взаимодействию с пероксидазным люминесцентным реагентом. Детекцию сигналов осуществляли с использованием преобразующего изображение устройства FUSION.
[0045]
Тромбоциты получали центрифугированием периферической крови, собранной в пробирке Шпица, содержащей EDTA (500 г 10 мин, 4°C), подвергая полученный супернатант центрифугированию (500g × 10 мин, 4°C)) и промывая полученный осадок при помощи 500 мкл очищающего раствора для тромбоцитов (10 мМ цитрата натрия, 150 мМ хлорида натрия, 1 мМ EDTA, 1% декстрозы, pH 7,4) два раза. Полученные тромбоциты суспендировали в растворе RIPA и затем их обрабатывали ультразвуком с последующим центрифугированием (15000 g × 15 мин, 4°C). Супернатант собирали в виде клеточного экстракта. Полученный клеточный экстракт подвергали термообработке в присутствии восстановителя, затем подвергали электрофорезу в полиакриламидном геле с додецилсульфатом натрия, переносили на поливинилиденфторидную (PVDF) мембрану методом электропереноса и подвергали взаимодействию с раствором TBS-T, содержащим 5% снятого молока, при комнатной температуре в течение 1 часа с последующим взаимодействием с раствором 5% BSA/TBS-T, содержащим крысиное антитело против мутантного CALR (антитело B3), которое распознает амино-концевую сторону сайта расщепления, при 4°C в течение ночи. После промывки раствором TBS-T осуществляли взаимодействие с раствором 5% снятого молока/TBS-T, содержащим пероксидаза-меченное анти-крысиное IgG антитело (Santa Cruz Biotechnology, Inc. Cat# sc-2006), при комнатной температуре в течение 1 часа. PVDF мембрану промывали раствором TBS-T и затем подвергали взаимодействию с пероксидазным люминесцентным реагентом. Детекцию сигналов осуществляли с использованием преобразующего изображение устройства FUSION.
[0046]
(2) Результат
CALR белки, содержащиеся в культуральных супернатантах UT-7/TPO/CALR Del 52 и UT-7/TPO/CALR Ins 5 клеток, неопластически пролиферирующих, UT-7/TPO/CALR (WT) клеток в качестве контроля и UT-7/TPO/vec клеток, которые были получены путем трансфекции человеческой клеточной линии мегакариобластного лейкоза UT-7/TPO вектором, экспрессирующим мутантный CALR белок Del 52 типа или Ins 5 типа, вектором, экспрессирующим CALR дикого типа, и пустым вектором, соответственно, оценивали с использованием антитела, которое распознает как дикий тип, так и мутантный тип (моноклональное антитело D3E6, Cell Signaling Technology, Inc., Cat# 12238), и коммерчески доступного антитела, которое распознает карбокси-концевую последовательность мутантного типа (моноклональное антитело CAL2, Dianova GmbH, Cat# DIA-CAL-250) (Фиг. 2). В результате, иммуноблоттинг с использованием антитела (антитела B3), которое распознает белки CALR дикого типа и мутантного типа, выявил полосы, которые не могут распознаваться антителом к мутантному типу, в дополнение к эндогенному CALR, в клетках, экспрессирующих мутантный белок CALR (Фиг. 3).
[0047]
Из пептидных фрагментов, полученных фрагментацией с использованием NTCB на амино-концевой стороне от цистеинового остатка, пептидные фрагменты, обнаруженные только в расщепленном типе мутантного белка CALR (использовали Del 52 тип), имели молекулярную массу 25827,7 и 25418,4. В качестве сайтов расщепления мутантного CALR белка Del 52 типа, были идентифицированы сайт между 380-м метиониновым остатком и 381-м аргининовым остатком и сайт между 377-м метиониновым остатком и 378-м аргининовым остатком путем сравнения указанных выше численных значений и вычисленных молекулярных масс, определенных от положения расщепленного цистеинового остатка.
[0048]
Мутантный CALR белок Del 52 типа или Ins 5 типа, меченный FLAG-меткой ниже от сигнальной последовательности на амино-конце или меченный FLAG-меткой на карбокси-конце, экспрессировали в UT-7/TPO клетках и экспрессию мутантного белка CALR на поверхности клеток анализировали методом проточной цитометрии с использованием анти-FLAG антитела. В клетках, экспрессирующих мутантный белок CALR, имеющий FLAG-метку на амино-конце, наблюдали более сильный сигнал по сравнению с сигналом в клетках, экспрессирующих мутантный белок CALR, имеющий на карбокси-конце FLAG-метку (Фиг. 4 и 5). Затем осуществляли анализ клеточных линий методом проточной цитометрии, как показано на Фиг. 4 и 5, с использованием антитела, полученного в результате иммунизации пептидом, включающим последовательность, специфическую для амино-концевой стороны сайта расщепления мутантного белка CALR, что приводило к исчезновению разницы в количественном уровне детекции из-за положений вставки FLAG-метки (Фиг. 6 и 7). На основании этого результата было показано, что установление сайта распознавания антигена на карбокси-концевой стороне последовательности, специфической для мутантного белка CALR, остающегося после расщепления, является важным для создания более чувствительного испытательного реагента или более сильного терапевтического средства.
[0049]
Действительно, когда клеточные экстракты мононуклеарных клеток периферической крови и тромбоцитов, полученные от положительных на мутацию гена CALR пациентов, анализировали методом иммуноблоттинга с использованием антитела, специфического для аминоконцевой стороны сайта расщепления мутантного CALR, наблюдали экспрессию расщепленного мутантного белка CALR, как в клеточных линиях (Фиг. 8). Эти результаты показали, что такое же расщепление на самом деле происходит и в клетках пациента, и что установка сайта распознавания антигена на карбокси-концевой стороне, остающейся после расщепления, важна для создания более чувствительного испытательного реагента или более сильного терапевтического средства.
[0050]
[Пример испытания 2]
(1) Подтверждение, что три антитела распознают полноразмерные и расщепленные мутантные CALR белки
UT-7/TPO клетки, экспрессирующие мутантный CALR белок Del 52 типа или Ins 5 типа, имеющие FLAG-метку, вставленную ниже от сигнальной последовательности на амино-конце, культивировали и культуральные супернатанты, содержащие секретированные мутантные CALR белки, получали центрифугированием (1600g × 5 мин, 4°C). Полученные культуральные супернатанты каждый подвергали термообработке в присутствии SDS и восстановителя, затем подвергали электрофорезу в полиакриламидном геле с додецилсульфатом натрия, переносили на поливинилиденфторидную (PVDF) мембрану методом электропереноса и подвергали взаимодействию с раствором TBS-T, содержащим 5% снятого молока, при комнатной температуре в течение 1 часа с последующим взаимодействием с 5% раствором BSA/TBS-T, содержащим крысиное антитело, клон B3, C6 или G1, или мышиное антитело к последовательности DYKDDDDK tag (FUJIFILM Wako Pure Chemical Corporation, Cat# 014-22383), при 4°C в течение ночи. После промывки раствором TBS-T реакционные продукты подвергали взаимодействию с раствором 5% снятого молока/TBS-T, содержащим пероксидаза-меченное козлиное анти-крысиное IgG антитело (Jackson Immuno Research Inc., Cat# 112-035-003) или пероксидаза-меченное козлиное анти-мышиное IgG антитело (Jackson Immuno Research Inc., Cat# 115-035-003), при комнатной температуре в течение 1 часа. PVDF мембраны промывали раствором TBS-T и затем подвергали взаимодействию с пероксидазным люминесцентным реагентом. Детекцию сигналов осуществляли с использованием преобразующего изображение устройства FUSION.
В результате, как показано на Фиг. 9, было подтверждено, что антитела всех клонов B3, C6 и G1 распознают полноразмерные и расщепленные мутантные CALR белки.
[0051]
(2) Подтверждение, что три антитела распознают мутантные CALR белки на клеточных поверхностях
Мутантный CALR белок Del 52 типа или Ins 5 типа, меченный FLAG-меткой ниже от сигнальной последовательности на амино-конце, экспрессировали в UT-7/TPO клетках и клетки культивировали с использованием IMDM среды, содержащей 10% фетальной бычьей инактивированной сыворотки, в 5% CO2 при 37°C. Клетки (1×105) в пролиферативной стадии промывали PBS и затем подвергали взаимодействию с мышиным антителом к последовательности DYKDDDDK tag (FUJIFILM Wako Pure Chemical Corporation, Cat# 014-22383) или крысиным антителом клона B3, C6 или G1 в растворе 2% FBS/PBS на льду в течение 30 минут. После взаимодействия клетки промывали раствором 2% FBS/PBS и затем подвергали взаимодействию с анти-мышиным IgG-Alexa Fluor 647 (Thermo Fisher Scientific K.K., Cat# A21235) и анти-крысиным IgG-Alexa Fluor 647 (Thermo Fisher Scientific K.K., Cat# A21247), соответственно, в качестве вторичных антител в растворе 2% FBS/PBS на льду в течение 30 минут. После завершения реакции клетки собирали центрифугированием и подвергали взаимодействию с раствором PBS, содержащим 4% параформальдегида, на льду в течение 15 минут. В завершение, клетки промывали путем добавления раствора 2% FBS/PBS, затем осуществляли центрифугирование (400g × 5 мин, 4°C) и супернатант сливали. Затем к клеткам добавляли 300 мл раствора 2% FBS/PBS и сигналы количественно определяли методом проточной цитометрии с использованием FACS Calibur (изготовитель BD biosciences).
В результате, как показано на Фиг. 10, было подтверждено, что антитела всех клонов B3, C6 и G1 распознают мутантный белок CALR на клеточных поверхностях.
[0052]
[Пример испытания 3]
(Оценка авидности антитела к антигену)
(1) Оценка авидности к антигену методом ELISA
В ELISA планшет (Sumitomo Bakelite Co., Ltd., Cat# MS-8896F) добавляли 100 нг на лунку очищенного мутантного CALR белка Del 52 типа или BSA в качестве контроля и подвергали взаимодействию с PBS, содержащим 5 мг/мл BSA, при комнатной температуре в течение 1 часа. Лунки промывали PBS и затем подвергали взаимодействию с PBS, содержащим 0, 6,25, 12,5, 25, 50, 100, 200, 400 или 800 нг/мл антитела клона B3, C6 или G1, или крысиного IgG (Santa Cruz Biotechnology, Inc. Cat# 2026) и 5 мг/мл BSA, при комнатной температуре в течение 1 часа. Лунки промывали PBS и затем подвергали взаимодействию с PBS, содержащим 16 нг/мл пероксидаза-меченного козлиного анти-крысиного IgG антитела (Jackson Immuno Research Inc., Cat# 112-035-003) и 5 мг/мл BSA, при комнатной температуре в течение 1 часа. После промывки лунок раствором TBS-T в лунки добавляли раствор TMB (Nacalai Tesque, Cat# 05298-80) и оставляли для взаимодействия при комнатной температуре в течение 15 минут и затем в лунки добавляли 1 M водный раствор серной кислоты. Измеряли поглощение при 450 нм и 620 нм и определяли разность между поглощениями. Разницу в BSA в качестве контроля вычитали из каждой разности.
В результате, как показано на Фиг. 11, продемонстрировано, что антитела (B3, C6 и G1) по настоящему изобретению все связываются с мутантным белком CALR даже при низких концентрациях.
[0053]
(2) Оценка авидности к антигену методом поверхностного плазмонного резонанса
Сенсорные чипы (GE Healthcare, Cat# BR100530) для анализа методом поверхностного плазмонного резонанса загружали в анализатор поверхностного плазмонного резонанса Biacore T200 (GE Healthcare) и уравновешивали буфером HBS-EP (GE Healthcare, Cat# BR100669). Антитело клона B3, доведенное до концентрации 10 мкг/мл Ацетатом 5.5 (GE Healthcare, Cat# BR100352), было иммобилизовано с использованием набора для связывания аминов (GE Healthcare, Cat# BR100050) в иммобилизованном количестве 200 RU. Затем измеряли поверхностный плазмонный резонанс с использованием пептида, содержащего цистеин на амино-конце аминокислотной последовательности (RRMMRTKMR), включенной в SEQ ID NO:1, доведенного до концентраций 20, 10, 5, 2,5 и 1,25 нМ при помощи HBS-EP буфера, и константу диссоциации получали с использованием программы Biacore T200 Evaluation Software.
В результате, как показано на Фиг. 12, было продемонстрировано, что антитело по настоящему изобретению сильно связывается с мутантным белком CALR.
[0054]
[Пример испытания 4]
(Идентификация распознающего антиген сайта антитела)
Было подтверждено, что антитела клона B3, C6 и G1 распознают аминокислотную последовательность, используемую в качестве антигена, на мутантном белке CALR. Реактивность соответствующих антител против мутантных белков CALR, каждый из которых содержит аланин (A), заменяющий одну аминокислоту в каждом положении аминокислот, используемых в качестве антигена, и аминокислот вокруг него, оценивали методом иммуноблотинга (Фиг. 13A) и ELISA (Фиг. 13B).
[0055]
(1) Иммуноблотинг
Мутантные CALR белки Del 52 типа, каждый из которых содержит аланин (A), заменяющий одну аминокислоту в каждом положении аминокислот в области от 367-го треонина (T) до 378-го аргинина (R), или белок, не имеющий замен, экспрессировали в клетках HEK 293T и культуральные супернатанты, содержащие секретированные мутантные CALR белки, получали центрифугированием (1600g × 5 мин, 4°C). Полученные растворы белков каждый подвергали термообработке в присутствии SDS и восстановителя, подвергали электрофорезу в полиакриламидном геле с додецилсульфатом натрия, переносили на поливинилиденфторидную (PVDF) мембрану методом электропереноса и подвергали взаимодействию с раствором TBS-T, содержащим 5% снятого молока, при комнатной температуре в течение 1 часа с последующим взаимодействием с раствором 5% BSA/TBS-T, содержащим пероксидаза-меченное антитело клона B3, C6 или G1 или мышиное анти-CALR антитело (Abcam plc., Cat# ab22683), при 4°C в течение ночи. PVDF мембрану, которая взаимодействовала с мышиным анти-CALR антителом, промывали раствором TBS-T и затем подвергали взаимодействию с раствором 5% снятого молока/TBS-T, содержащим пероксидаза-меченное анти-мышиное IgG антитело (Jackson Immuno Research Inc., Cat# 115-035-003), при комнатной температуре в течение 1 часа. Затем все PVDF мембраны промывали раствором TBS-T и затем подвергали взаимодействию с пероксидазным люминесцентным реагентом (Thermo Fisher Scientific K.K., Cat# 34094). Детекцию сигналов осуществляли с использованием преобразующего изображение устройства FUSION (изготовитель Vilber-Lourmat S.A.).
В результате, как показано на Фиг. 13A, было продемонстрировано, что антитела по настоящему изобретению распознают сайт между 1-м аргинином и 9-м аргинином SEQ ID NO:1.
[0056]
(2) ELISA
ELISA планшет, с которым связывали мутантные CALR белки, полученные описанным выше способом, подвергали взаимодействию с PBS, содержащим 5 мг/мл BSA, при комнатной температуре в течение 1 часа. Лунки промывали PBS и затем подвергали взаимодействию с PBS, содержащим 200 нг/мл антитела клона B3, C6 или G1 или мышиного анти-CALR антитела (Santa Cruz Biotechnology, Inc., Cat# sc-373863) и 5 мг/мл BSA, при комнатной температуре в течение 1 часа. Лунки промывали PBS и затем подвергали взаимодействию с PBS, содержащим 16 нг/мл пероксидаза-меченного козлиного анти-крысиного IgG антитела (Jackson Immuno Research Inc., Cat# 112-035-003) или козлиного анти-мышиного IgG антитела (Santa Cruz Biotechnology, Inc., Cat# sc-2005) и 5 мг/мл BSA, при комнатной температуре в течение 1 часа. После промывки лунок раствором TBS-T в лунки добавляли раствор TMB и оставляли для взаимодействия при комнатной температуре в течение 15 минут и затем в лунки добавляли 1 M водный раствор серной кислоты. Измеряли поглощение при 450 нм и 620 нм и определяли разницу между поглощением.
В результате, как показано на Фиг. 13B, было продемонстрировано, что антитела по настоящему изобретению распознают сайт между 1-м аргинином и 9-м аргинином SEQ ID NO:1.
[0057]
[Пример испытания 5]
(Определение информации о последовательности антитела по настоящему изобретению)
В качестве информации о последовательности тяжелой цепи и легкой цепи антител (B3, C6 и G1) по настоящему изобретению, полноразмерные последовательности кДНК тяжелой цепи и легкой цепи определяли путем получения мРНК из клеток, продуцирующих антитела, с использованием набора PureLinc RNA Mini kit (Thermo Fisher Scientific K.K., Cat# 12183025), синтеза кДНК с использованием полученных мРНК в качесте матриц и праймеров для обратной транскрипции, специфических для тяжелой цепи и легкой цепи, путем быстрой амплификации концов кДНК, затем клонирования этих кДНК в плазмиды и анализа плазмид с использованием секвенирования по Сэнгеру.
Результаты показаны на Фиг. 14-17 и в SEQ ID NO:5-34.
[0058]
Фиг. 14 показывает аминокислотные последовательности вариабельных областей тяжелой цепи антител (B3, C6 и G1) по настоящему изобретению. Фиг. 15 показывает аминокислотные последовательности вариабельных областей легкой цепи антител (B3, C6 и G1) по настоящему изобретению. Фиг. 16 показывает нуклеотидные последовательности вариабельных областей тяжелой цепи антител (B3, C6 и G1) по настоящему изобретению. Фиг. 17 показывает нуклеотидные последовательности вариабельных областей легкой цепи антител (B3, C6 и G1) по настоящему изобретению.
[0059]
SEQ ID NO:5 представляет собой аминокислотную последовательность вариабельной области тяжелой цепи B3 антитела. SEQ ID NO:6 представляет собой аминокислотную последовательность вариабельной области тяжелой цепи C6 антитела. SEQ ID NO:7 представляет собой аминокислотную последовательность вариабельной области тяжелой цепи G1 антитела. SEQ ID NO:8 представляет собой аминокислотную последовательность вариабельной области легкой цепи B3 антитела. SEQ ID NO:9 представляет собой аминокислотную последовательность вариабельной области легкой цепи C6 антитела. SEQ ID NO:10 представляет собой аминокислотную последовательность вариабельной области легкой цепи G1 антитела.
SEQ ID NO:11 представляет собой нуклеотидную последовательность вариабельной области тяжелой цепи B3 антитела. SEQ ID NO:12 представляет собой нуклеотидную последовательность вариабельной области тяжелой цепи C6 антитела. SEQ ID NO:13 представляет собой нуклеотидную последовательность вариабельной области тяжелой цепи G1 антитела. SEQ ID NO:14 представляет собой нуклеотидную последовательность вариабельной области легкой цепи B3 антитела. SEQ ID NO:15 представляет собой нуклеотидную последовательность вариабельной области легкой цепи C6 антитела. SEQ ID NO:16 представляет собой нуклеотидную последовательность вариабельной области легкой цепи G1 антитела.
[0060]
SEQ ID NO:17 представляет собой аминокислотную последовательность CDR1 VH антитела B3. SEQ ID NO:18 представляет собой аминокислотную последовательность CDR2 VH антитела B3. SEQ ID NO:19 представляет собой аминокислотную последовательность CDR3 VH антитела B3. SEQ ID NO:20 представляет собой аминокислотную последовательность CDR1 VH антитела C6. SEQ ID NO:21 представляет собой аминокислотную последовательность CDR2 VH антитела C6. SEQ ID NO:22 представляет собой аминокислотную последовательность CDR3 VH антитела C6. SEQ ID NO:23 представляет собой аминокислотную последовательность CDR1 VH антитела G1. SEQ ID NO:24 представляет собой аминокислотную последовательность CDR2 VH антитела G1. SEQ ID NO:25 представляет собой аминокислотную последовательность CDR3 VH антитела G1. SEQ ID NO:26 представляет собой аминокислотную последовательность CDR1 VL антитела B3. SEQ ID NO:27 представляет собой аминокислотную последовательность CDR2 VL антитела B3. SEQ ID NO:28 представляет собой аминокислотную последовательность CDR3 VL антитела B3. SEQ ID NO:29 представляет собой аминокислотную последовательность CDR1 VL антитела C6. SEQ ID NO:30 представляет собой аминокислотную последовательность CDR2 VL антитела C6. SEQ ID NO:31 представляет собой аминокислотную последовательность CDR3 VL антитела C6. SEQ ID NO:32 представляет собой аминокислотную последовательность CDR1 VL антитела G1. SEQ ID NO:33 представляет собой аминокислотную последовательность CDR2 VL антитела G1. SEQ ID NO:34 представляет собой аминокислотную последовательность CDR3 VL антитела G1.
[0061]
[Пример испытания 6]
(Оценка терапевтического эффекта)
Химерное B3 антитело получали путем слияния вариабельных областей тяжелой цепи и легкой цепи антитела клона B3 и константных областей тяжелой цепи и легкой цепи соответствующего мышиного IgG2a и вводили модельным мышам с миелопролиферативным новообразованием, полученным путем прививки гематопоэтических стволовых клеток, экспрессирующих мутантный ген CALR типа Del 52, и оценивали терапевтический эффект химерного антитела.
Вектор экспрессии, содержащий B3 мышиный химерный ген тяжелой цепи и легкой цепи, лигированный с последовательностью гена, кодирующей вариабельную область тяжелой цепи антитела клона B3 и константную область мышиного IgG2a, или с последовательностью гена, кодирующей вариабельную область легкой цепи антитела клона B3 и константную область мышиного иммуноглобулина κ, трансфицировали в клетки ExpiCHO-S (Thermo Fisher Scientific K.K., Cat# A29127) и клетки культивировали с использованием среды для экспрессии ExpiCHO (Thermo Fisher Scientific K.K., Cat# A2910001) в 5% CO2 при 37°C в течение 10 дней. Культуральные супернатанты собирали центрифугированием (4000g × 30 мин, 4°C) и каждый наносили на колонку HiTrap Protein G HP (GE Healthcare, Cat# 29048581) для прикрепления химерного антитела к колонке, затем элюировали с использованием 0,1 M Глицина-HCl (pH 2,7). Элюируемые фракции, нейтрализованные 1 M Tris-HCl (pH 9,0), диализовали против PBS с получением B3 мышиного химерного антитела.
Для оценки терапевтического эффекта B3 мышиного химерного антитела использовали модельных мышей с трансплантированным костным мозгом. Клетки костного мозга очищали от бедренных костей конгенных мышей B6.CD45.1 в возрасте 8-10 недель (Sankyo Labo Service Corporation, Inc.) и c-kit-положительные клетки, меченные APC-меченным анти-c-kit антителом, выделяли, а также выделяли LSK клетки, являющиеся Ter119, CD4, CD8, Gr-1, CD45R, CD3e и CD11b-отрицательными и CD117 и Sca1-положительными. Клетки инфицировали ретровирусом, содержащим pMSCV-IRES-GFP вектор, экспрессирующий мутантный ген CALR типа Del 52, или контрольный вектор. Через 72 часа после заражения 4000 клеток LSK на мышь трансплантировали мышам C57BL/6J в возрасте от 8 до 10 недель (Oriental Yeast Co., Ltd.), дважды облученных излучением при 6 Грей. Через некоторое время подсчитывали число тромбоцитов в периферической крови с использованием автоматического многоканального счетчика клеток крови (Sysmex Corporation, Cat# pocH-100iV Diff). Через два месяца после трансплантации, после подтверждения тромбоцитоза, который является фенотипом миелопролиферативного новообразования, вызываемого экспрессией мутантного гена CALR, вводили B3 мышиное химерное антитело или растворитель (PBS) при 250 мкг на мышь каждую неделю через 9 недель после трансплантации, и оценивали эффект подавления тромбоцитоза, специфический для B3 мышиного химерного антитела.
В результате, как показано на Фиг. 18, антитело по настоящему изобретению показало отличный терапевтический эффект на MPN.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ДЗЮНТЕНДО ЭДЬЮКЕЙШНЕЛ ФАУНДЕЙШН
<120> АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТСЯ С РАСЩЕПЛЕННОЙ ФОРМОЙ МУТАНТНОГО
КАЛЬРЕТИКУЛИНА, И СРЕДСТВО ДЛЯ ДИАГНОСТИКИ, ПРОФИЛАКТИКИ ИЛИ
ЛЕЧЕНИЯ МИЕЛОПРОЛИФЕРАТИВНОГО НОВООБРАЗОВАНИЯ
<130> JUSM0023
<150> JP 2019-036119
<151> 2019-02-28
<160> 34
<170> PatentIn version 3.5
<210> 1
<211> 13
<212> Белок
<213> Homo sapiens
<400> 1
Arg Arg Met Met Arg Thr Lys Met Arg Met Arg Arg Met
1 5 10
<210> 2
<211> 417
<212> Белок
<213> Homo sapiens
<400> 2
Met Leu Leu Ser Val Pro Leu Leu Leu Gly Leu Leu Gly Leu Ala Val
1 5 10 15
Ala Glu Pro Ala Val Tyr Phe Lys Glu Gln Phe Leu Asp Gly Asp Gly
20 25 30
Trp Thr Ser Arg Trp Ile Glu Ser Lys His Lys Ser Asp Phe Gly Lys
35 40 45
Phe Val Leu Ser Ser Gly Lys Phe Tyr Gly Asp Glu Glu Lys Asp Lys
50 55 60
Gly Leu Gln Thr Ser Gln Asp Ala Arg Phe Tyr Ala Leu Ser Ala Ser
65 70 75 80
Phe Glu Pro Phe Ser Asn Lys Gly Gln Thr Leu Val Val Gln Phe Thr
85 90 95
Val Lys His Glu Gln Asn Ile Asp Cys Gly Gly Gly Tyr Val Lys Leu
100 105 110
Phe Pro Asn Ser Leu Asp Gln Thr Asp Met His Gly Asp Ser Glu Tyr
115 120 125
Asn Ile Met Phe Gly Pro Asp Ile Cys Gly Pro Gly Thr Lys Lys Val
130 135 140
His Val Ile Phe Asn Tyr Lys Gly Lys Asn Val Leu Ile Asn Lys Asp
145 150 155 160
Ile Arg Cys Lys Asp Asp Glu Phe Thr His Leu Tyr Thr Leu Ile Val
165 170 175
Arg Pro Asp Asn Thr Tyr Glu Val Lys Ile Asp Asn Ser Gln Val Glu
180 185 190
Ser Gly Ser Leu Glu Asp Asp Trp Asp Phe Leu Pro Pro Lys Lys Ile
195 200 205
Lys Asp Pro Asp Ala Ser Lys Pro Glu Asp Trp Asp Glu Arg Ala Lys
210 215 220
Ile Asp Asp Pro Thr Asp Ser Lys Pro Glu Asp Trp Asp Lys Pro Glu
225 230 235 240
His Ile Pro Asp Pro Asp Ala Lys Lys Pro Glu Asp Trp Asp Glu Glu
245 250 255
Met Asp Gly Glu Trp Glu Pro Pro Val Ile Gln Asn Pro Glu Tyr Lys
260 265 270
Gly Glu Trp Lys Pro Arg Gln Ile Asp Asn Pro Asp Tyr Lys Gly Thr
275 280 285
Trp Ile His Pro Glu Ile Asp Asn Pro Glu Tyr Ser Pro Asp Pro Ser
290 295 300
Ile Tyr Ala Tyr Asp Asn Phe Gly Val Leu Gly Leu Asp Leu Trp Gln
305 310 315 320
Val Lys Ser Gly Thr Ile Phe Asp Asn Phe Leu Ile Thr Asn Asp Glu
325 330 335
Ala Tyr Ala Glu Glu Phe Gly Asn Glu Thr Trp Gly Val Thr Lys Ala
340 345 350
Ala Glu Lys Gln Met Lys Asp Lys Gln Asp Glu Glu Gln Arg Leu Lys
355 360 365
Glu Glu Glu Glu Asp Lys Lys Arg Lys Glu Glu Glu Glu Ala Glu Asp
370 375 380
Lys Glu Asp Asp Glu Asp Lys Asp Glu Asp Glu Glu Asp Glu Glu Asp
385 390 395 400
Lys Glu Glu Asp Glu Glu Glu Asp Val Pro Gly Gln Ala Lys Asp Glu
405 410 415
Leu
<210> 3
<211> 411
<212> Белок
<213> Homo sapiens
<400> 3
Met Leu Leu Ser Val Pro Leu Leu Leu Gly Leu Leu Gly Leu Ala Val
1 5 10 15
Ala Glu Pro Ala Val Tyr Phe Lys Glu Gln Phe Leu Asp Gly Asp Gly
20 25 30
Trp Thr Ser Arg Trp Ile Glu Ser Lys His Lys Ser Asp Phe Gly Lys
35 40 45
Phe Val Leu Ser Ser Gly Lys Phe Tyr Gly Asp Glu Glu Lys Asp Lys
50 55 60
Gly Leu Gln Thr Ser Gln Asp Ala Arg Phe Tyr Ala Leu Ser Ala Ser
65 70 75 80
Phe Glu Pro Phe Ser Asn Lys Gly Gln Thr Leu Val Val Gln Phe Thr
85 90 95
Val Lys His Glu Gln Asn Ile Asp Cys Gly Gly Gly Tyr Val Lys Leu
100 105 110
Phe Pro Asn Ser Leu Asp Gln Thr Asp Met His Gly Asp Ser Glu Tyr
115 120 125
Asn Ile Met Phe Gly Pro Asp Ile Cys Gly Pro Gly Thr Lys Lys Val
130 135 140
His Val Ile Phe Asn Tyr Lys Gly Lys Asn Val Leu Ile Asn Lys Asp
145 150 155 160
Ile Arg Cys Lys Asp Asp Glu Phe Thr His Leu Tyr Thr Leu Ile Val
165 170 175
Arg Pro Asp Asn Thr Tyr Glu Val Lys Ile Asp Asn Ser Gln Val Glu
180 185 190
Ser Gly Ser Leu Glu Asp Asp Trp Asp Phe Leu Pro Pro Lys Lys Ile
195 200 205
Lys Asp Pro Asp Ala Ser Lys Pro Glu Asp Trp Asp Glu Arg Ala Lys
210 215 220
Ile Asp Asp Pro Thr Asp Ser Lys Pro Glu Asp Trp Asp Lys Pro Glu
225 230 235 240
His Ile Pro Asp Pro Asp Ala Lys Lys Pro Glu Asp Trp Asp Glu Glu
245 250 255
Met Asp Gly Glu Trp Glu Pro Pro Val Ile Gln Asn Pro Glu Tyr Lys
260 265 270
Gly Glu Trp Lys Pro Arg Gln Ile Asp Asn Pro Asp Tyr Lys Gly Thr
275 280 285
Trp Ile His Pro Glu Ile Asp Asn Pro Glu Tyr Ser Pro Asp Pro Ser
290 295 300
Ile Tyr Ala Tyr Asp Asn Phe Gly Val Leu Gly Leu Asp Leu Trp Gln
305 310 315 320
Val Lys Ser Gly Thr Ile Phe Asp Asn Phe Leu Ile Thr Asn Asp Glu
325 330 335
Ala Tyr Ala Glu Glu Phe Gly Asn Glu Thr Trp Gly Val Thr Lys Ala
340 345 350
Ala Glu Lys Gln Met Lys Asp Lys Gln Asp Glu Glu Gln Arg Thr Arg
355 360 365
Arg Met Met Arg Thr Lys Met Arg Met Arg Arg Met Arg Arg Thr Arg
370 375 380
Arg Lys Met Arg Arg Lys Met Ser Pro Ala Arg Pro Arg Thr Ser Cys
385 390 395 400
Arg Glu Ala Cys Leu Gln Gly Trp Thr Glu Ala
405 410
<210> 4
<211> 430
<212> Белок
<213> Homo sapiens
<400> 4
Met Leu Leu Ser Val Pro Leu Leu Leu Gly Leu Leu Gly Leu Ala Val
1 5 10 15
Ala Glu Pro Ala Val Tyr Phe Lys Glu Gln Phe Leu Asp Gly Asp Gly
20 25 30
Trp Thr Ser Arg Trp Ile Glu Ser Lys His Lys Ser Asp Phe Gly Lys
35 40 45
Phe Val Leu Ser Ser Gly Lys Phe Tyr Gly Asp Glu Glu Lys Asp Lys
50 55 60
Gly Leu Gln Thr Ser Gln Asp Ala Arg Phe Tyr Ala Leu Ser Ala Ser
65 70 75 80
Phe Glu Pro Phe Ser Asn Lys Gly Gln Thr Leu Val Val Gln Phe Thr
85 90 95
Val Lys His Glu Gln Asn Ile Asp Cys Gly Gly Gly Tyr Val Lys Leu
100 105 110
Phe Pro Asn Ser Leu Asp Gln Thr Asp Met His Gly Asp Ser Glu Tyr
115 120 125
Asn Ile Met Phe Gly Pro Asp Ile Cys Gly Pro Gly Thr Lys Lys Val
130 135 140
His Val Ile Phe Asn Tyr Lys Gly Lys Asn Val Leu Ile Asn Lys Asp
145 150 155 160
Ile Arg Cys Lys Asp Asp Glu Phe Thr His Leu Tyr Thr Leu Ile Val
165 170 175
Arg Pro Asp Asn Thr Tyr Glu Val Lys Ile Asp Asn Ser Gln Val Glu
180 185 190
Ser Gly Ser Leu Glu Asp Asp Trp Asp Phe Leu Pro Pro Lys Lys Ile
195 200 205
Lys Asp Pro Asp Ala Ser Lys Pro Glu Asp Trp Asp Glu Arg Ala Lys
210 215 220
Ile Asp Asp Pro Thr Asp Ser Lys Pro Glu Asp Trp Asp Lys Pro Glu
225 230 235 240
His Ile Pro Asp Pro Asp Ala Lys Lys Pro Glu Asp Trp Asp Glu Glu
245 250 255
Met Asp Gly Glu Trp Glu Pro Pro Val Ile Gln Asn Pro Glu Tyr Lys
260 265 270
Gly Glu Trp Lys Pro Arg Gln Ile Asp Asn Pro Asp Tyr Lys Gly Thr
275 280 285
Trp Ile His Pro Glu Ile Asp Asn Pro Glu Tyr Ser Pro Asp Pro Ser
290 295 300
Ile Tyr Ala Tyr Asp Asn Phe Gly Val Leu Gly Leu Asp Leu Trp Gln
305 310 315 320
Val Lys Ser Gly Thr Ile Phe Asp Asn Phe Leu Ile Thr Asn Asp Glu
325 330 335
Ala Tyr Ala Glu Glu Phe Gly Asn Glu Thr Trp Gly Val Thr Lys Ala
340 345 350
Ala Glu Lys Gln Met Lys Asp Lys Gln Asp Glu Glu Gln Arg Leu Lys
355 360 365
Glu Glu Glu Glu Asp Lys Lys Arg Lys Glu Glu Glu Glu Ala Glu Asp
370 375 380
Asn Cys Arg Arg Met Met Arg Thr Lys Met Arg Met Arg Arg Met Arg
385 390 395 400
Arg Thr Arg Arg Lys Met Arg Arg Lys Met Ser Pro Ala Arg Pro Arg
405 410 415
Thr Ser Cys Arg Glu Ala Cys Leu Gln Gly Trp Thr Glu Ala
420 425 430
<210> 5
<211> 119
<212> Белок
<213> Rattus norvegicus
<400> 5
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Asn
20 25 30
Phe Ile His Trp Ile Lys Gln Gln Pro Gly Asn Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Phe Pro Gly Asp Gly Asp Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Asn Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Gly Asn Tyr Asn Tyr Glu Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Val Met Val Thr Val Ser Ser
115
<210> 6
<211> 121
<212> Белок
<213> Rattus norvegicus
<400> 6
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Phe Val His Trp Ile Lys Gln Gln Pro Gly Asp Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Asp Thr Glu Tyr Asn His Lys Phe
50 55 60
Asn Gly Lys Ser Thr Leu Thr Ala Asp Arg Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Gly Asn Tyr Tyr Asp Gly Arg Glu Val Met Asp Ala Trp Gly
100 105 110
Gln Gly Ala Ser Val Thr Val Ser Ser
115 120
<210> 7
<211> 121
<212> Белок
<213> Rattus norvegicus
<400> 7
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Phe Val His Trp Ile Lys Gln Gln Pro Gly Asp Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Asp Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Asn Gly Lys Ala Thr Leu Thr Ala Asp Arg Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Gly Asn Tyr Tyr Asp Gly Arg Glu Val Met Asp Ala Trp Gly
100 105 110
Gln Gly Ala Ser Val Thr Val Ser Ser
115 120
<210> 8
<211> 107
<212> Белок
<213> Rattus norvegicus
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Glu Thr Val Ser Ile Glu Cys Leu Ala Ser Glu Asp Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Gln Leu Leu Ile
35 40 45
Phe Ala Ala Asn Arg Leu Gln Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Ser Leu Lys Ile Ser Gly Met Gln Pro
65 70 75 80
Glu Asp Glu Gly Asp Tyr Phe Cys Leu Gln Gly Ser Lys Phe Pro Tyr
85 90 95
Thr Phe Gly Pro Gly Thr Lys Leu Glu Leu Asn
100 105
<210> 9
<211> 112
<212> Белок
<213> Rattus norvegicus
<400> 9
Asp Val Val Leu Thr Gln Thr Pro Pro Thr Leu Ser Ala Thr Ile Gly
1 5 10 15
Gln Ser Val Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Glu Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Ser Val Ser Asn Leu Glu Ser Gly Val Pro
50 55 60
Asn Arg Phe Ser Gly Ser Gly Ser Glu Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Gly Met Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Thr His Gly Pro Tyr Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 10
<211> 112
<212> Белок
<213> Rattus norvegicus
<400> 10
Asp Val Val Leu Thr Gln Thr Pro Pro Thr Leu Ser Ala Thr Ile Gly
1 5 10 15
Gln Ser Val Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Glu Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Cys
35 40 45
Pro Gln Leu Leu Ile Tyr Ser Val Ser Asn Leu Glu Ser Gly Val Pro
50 55 60
Asn Arg Phe Ser Gly Ser Gly Ser Glu Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Gly Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Met Gln Gly
85 90 95
Thr His Gly Pro Tyr Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 11
<211> 357
<212> ДНК
<213> Rattus norvegicus
<400> 11
caggtacagc tgcagcaatc tggggctgaa ctggtgaagc ctgggtcctc agtgaaaatt
60
tcctgcaagg cttctggcta caccttcacc cgtaacttta tacactggat aaaacagcag
120
cctggaaatg gccttgagtg gattgggtgg atttttcctg gagatggtga tacagagtac
180
aatcaaaagt tcaatgggaa ggcaacactc actgcagaca aatcgtccag cacagcctat
240
atgcagctca gcagcctgac atctgaggac tctgcagtct atttctgtgc aagaggaaat
300
tacaactacg agtactttga ttactggggc caaggagtca tggtcacagt ctcctca
357
<210> 12
<211> 363
<212> ДНК
<213> Rattus norvegicus
<400> 12
caggtacagc tgcagcaatc tggggctgaa ctggtgaagc ctgggtcctc agtgaaaatt
60
tcctgcaagg cttctggcta caccttcacc agttactttg tgcactggat aaaacagcag
120
cctggagatg gccttgagtg gattgggtgg atttatcctg gagatggtga tacagagtac
180
aatcacaagt tcaatgggaa gtcaacactc actgcagaca gatcctccag tacagcctat
240
atgcagctca gcagcctgac atctgaggac tctgcagtct atttctgtgc aagagggaat
300
tactatgatg gtcgggaagt tatggatgcc tggggtcaag gagcttcagt cactgtctcc
360
tca
363
<210> 13
<211> 363
<212> ДНК
<213> Rattus norvegicus
<400> 13
caggtacagc tgcagcaatc tggggctgaa ctggtgaagc ctgggtcctc agtgaaaatt
60
tcctgcaagg cttctggcta caccttcacc agttactttg tgcactggat aaaacagcag
120
cctggagatg gccttgagtg gattgggtgg atttatcctg gagatggtga tacagagtac
180
aatcaaaagt tcaatgggaa ggcaacactc actgcagaca gatcctccag tacagcctat
240
atgcagctca gcagcctgac atctgaggac tctgcagtct atttctgtgc aagagggaat
300
tactatgatg gtcgggaagt tatggatgcc tggggtcaag gagcttcagt cactgtctcc
360
tca
363
<210> 14
<211> 321
<212> ДНК
<213> Rattus norvegicus
<400> 14
gacatccaga tgacacagtc tccggcttcc ctgtctgcat ctctgggaga aactgtctcc
60
atcgagtgtc tagcaagtga ggacatttac agttatttag catggtatca acagaagcca
120
gggaaatctc ctcagctcct gatctttgct gcaaataggt tgcaagatgg ggtcccatca
180
cggttcagtg gcagtggatc tggcacacag ttttctctca agatcagcgg catgcaacct
240
gaagatgaag gggattattt ctgtctacag ggttccaagt ttccgtacac ctttggacct
300
gggaccaagc tggaactgaa c
321
<210> 15
<211> 336
<212> ДНК
<213> Rattus norvegicus
<400> 15
gatgttgtgc tgacccagac tccacccact ttatcggcta ccattggaca atcggtctcc
60
atctcttgca ggtcaagtca gagtctctta gatagtgatg gagaaaccta tttaaattgg
120
ttgctacaga ggccaggcca atctccacag cttctaattt attcggtctc caacctggaa
180
tctggggtcc ccaacaggtt cagtggcagt gggtcagaaa cagatttcac actcaaaatc
240
agtggaatgg aggctgaaga tttgggagtt tactactgca tgcaagctac ccatggtccg
300
tacacgtttg gagctgggac caagctggaa ctgaaa
336
<210> 16
<211> 336
<212> ДНК
<213> Rattus norvegicus
<400> 16
gatgttgtgc tgacccagac tccacccact ttatcggcta ccattggaca atcggtctcc
60
atctcttgca ggtcaagtca gagtctctta gatagtgatg gagaaaccta tttaaattgg
120
ttgctacaga ggccaggcca atgtccacag cttctaattt attcggtatc caacctggaa
180
tctggggtcc ccaacaggtt cagtggcagt gggtcagaaa cagatttcac actcaaaatc
240
agtggagtgg aggctgaaga tttgggagtt tactactgca tgcaaggtac ccatggtccg
300
tacacgtttg gagctgggac caagctggaa ctgaaa
336
<210> 17
<211> 10
<212> Белок
<213> Rattus norvegicus
<400> 17
Gly Tyr Thr Phe Thr Arg Asn Phe Ile His
1 5 10
<210> 18
<211> 17
<212> Белок
<213> Rattus norvegicus
<400> 18
Trp Ile Phe Pro Gly Asp Gly Asp Thr Glu Tyr Asn Gln Lys Phe Asn
1 5 10 15
Gly
<210> 19
<211> 10
<212> Белок
<213> Rattus norvegicus
<400> 19
Gly Asn Tyr Asn Tyr Glu Tyr Phe Asp Tyr
1 5 10
<210> 20
<211> 10
<212> Белок
<213> Rattus norvegicus
<400> 20
Gly Tyr Thr Phe Thr Ser Tyr Phe Val His
1 5 10
<210> 21
<211> 17
<212> Белок
<213> Rattus norvegicus
<400> 21
Trp Ile Tyr Pro Gly Asp Gly Asp Thr Glu Tyr Asn His Lys Phe Asn
1 5 10 15
Gly
<210> 22
<211> 12
<212> Белок
<213> Rattus norvegicus
<400> 22
Gly Asn Tyr Tyr Asp Gly Arg Glu Val Met Asp Ala
1 5 10
<210> 23
<211> 10
<212> Белок
<213> Rattus norvegicus
<400> 23
Gly Tyr Thr Phe Thr Ser Tyr Phe Val His
1 5 10
<210> 24
<211> 17
<212> Белок
<213> Rattus norvegicus
<400> 24
Trp Ile Tyr Pro Gly Asp Gly Asp Thr Glu Tyr Asn Gln Lys Phe Asn
1 5 10 15
Gly
<210> 25
<211> 12
<212> Белок
<213> Rattus norvegicus
<400> 25
Gly Asn Tyr Tyr Asp Gly Arg Glu Val Met Asp Ala
1 5 10
<210> 26
<211> 11
<212> Белок
<213> Rattus norvegicus
<400> 26
Leu Ala Ser Glu Asp Ile Tyr Ser Tyr Leu Ala
1 5 10
<210> 27
<211> 7
<212> Белок
<213> Rattus norvegicus
<400> 27
Ala Ala Asn Arg Leu Gln Asp
1 5
<210> 28
<211> 9
<212> Белок
<213> Rattus norvegicus
<400> 28
Leu Gln Gly Ser Lys Phe Pro Tyr Thr
1 5
<210> 29
<211> 16
<212> Белок
<213> Rattus norvegicus
<400> 29
Arg Ser Ser Gln Ser Leu Leu Asp Ser Asp Gly Glu Thr Tyr Leu Asn
1 5 10 15
<210> 30
<211> 7
<212> Белок
<213> Rattus norvegicus
<400> 30
Ser Val Ser Asn Leu Glu Ser
1 5
<210> 31
<211> 9
<212> Белок
<213> Rattus norvegicus
<400> 31
Met Gln Ala Thr His Gly Pro Tyr Thr
1 5
<210> 32
<211> 16
<212> Белок
<213> Rattus norvegicus
<400> 32
Arg Ser Ser Gln Ser Leu Leu Asp Ser Asp Gly Glu Thr Tyr Leu Asn
1 5 10 15
<210> 33
<211> 7
<212> Белок
<213> Rattus norvegicus
<400> 33
Ser Val Ser Asn Leu Glu Ser
1 5
<210> 34
<211> 9
<212> Белок
<213> Rattus norvegicus
<400> 34
Met Gln Gly Thr His Gly Pro Tyr Thr
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МУТАНТНЫЙ БЕЛОК F RSV И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2807742C1 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ ВИРУСА БЕШЕНСТВА И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2764740C1 |
| МОДИФИЦИРОВАННЫЕ АНТИТЕЛА IGG, КОТОРЫЕ СВЯЗЫВАЮТСЯ С ТРАНСФОРМИРУЮЩИМ ФАКТОРОМ РОСТА БЕТА-1 С ВЫСОКОЙ АФФИННОСТЬЮ, АВИДНОСТЬЮ И СПЕЦИФИЧНОСТЬЮ | 2016 |
|
RU2728858C2 |
| НОВЫЕ СЛИТЫЕ БЕЛКИ, СПЕЦИФИЧЕСКИЕ В ОТНОШЕНИИ CD137 И GPC3 | 2020 |
|
RU2814653C2 |
| CD131-СВЯЗЫВАЮЩИЕ БЕЛКИ И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2773927C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР | 2018 |
|
RU2770002C2 |
| ИММУНОКОНЪЮГАТЫ IL2 И МУТАНТНОГО TNF | 2017 |
|
RU2758139C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО, СПЕЦИФИЧНО СВЯЗЫВАЮЩЕЕСЯ С N-КОНЦОМ ЛИЗИЛ-тРНК-СИНТЕТАЗЫ, В КАЧЕСТВЕ ЭФФЕКТИВНОГО ИНГРЕДИЕНТА ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, ОБУСЛОВЛЕННОГО МИГРАЦИЕЙ КЛЕТОК | 2018 |
|
RU2749591C1 |
| СЛИТЫЙ БЕЛОК И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800923C2 |
| АНТИТЕЛО К PD-L1, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2778085C2 |
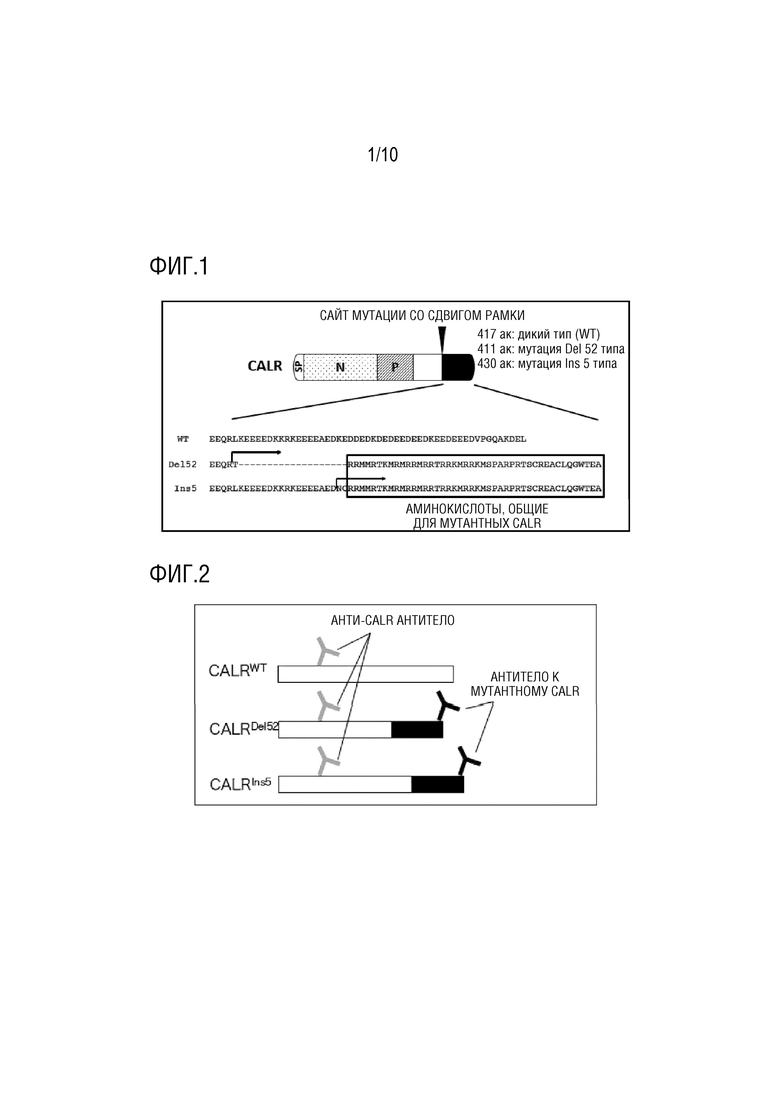
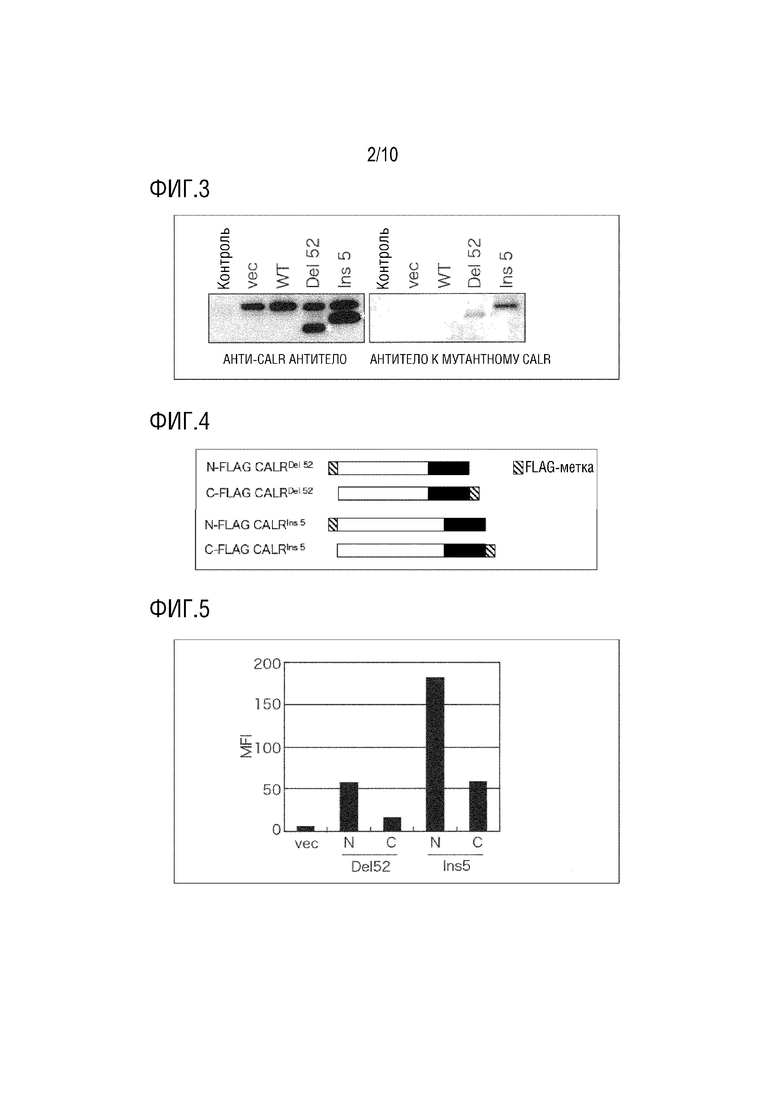
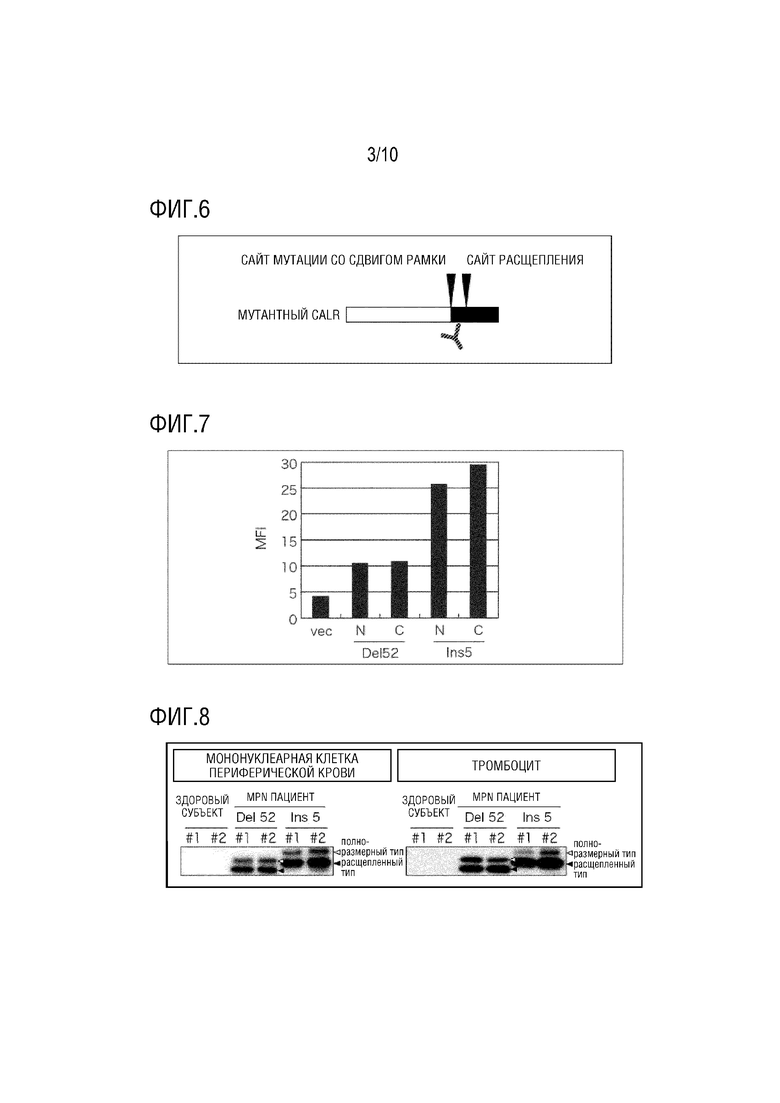
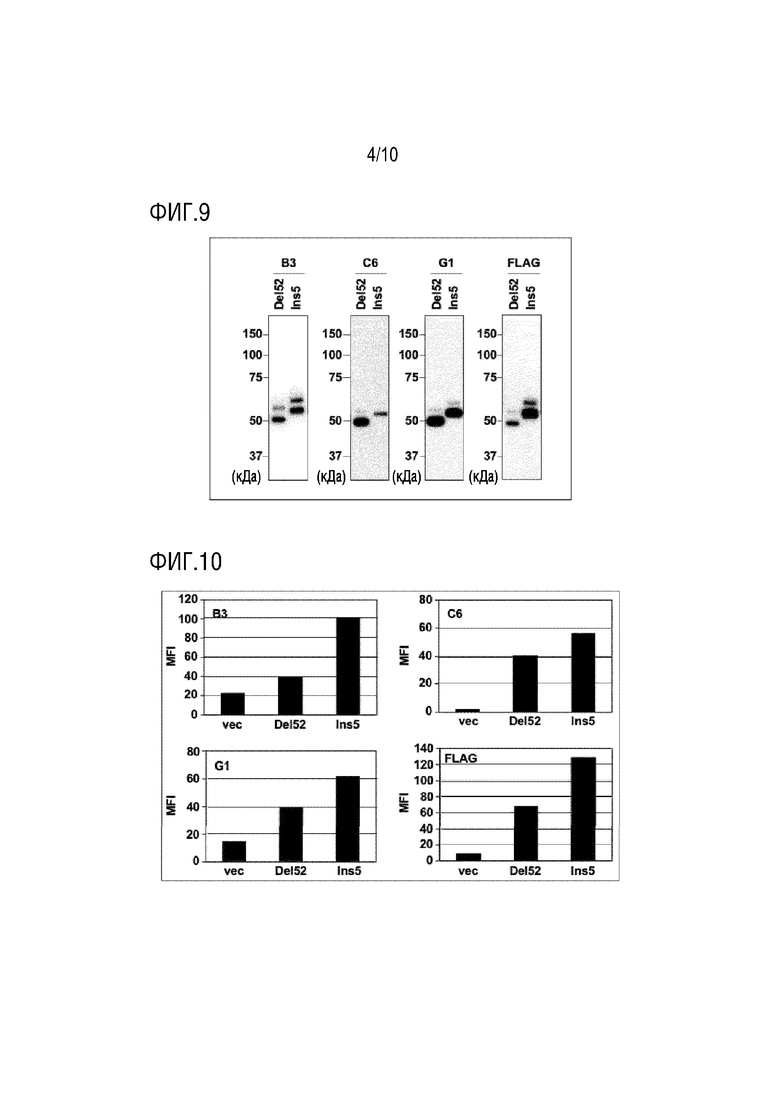
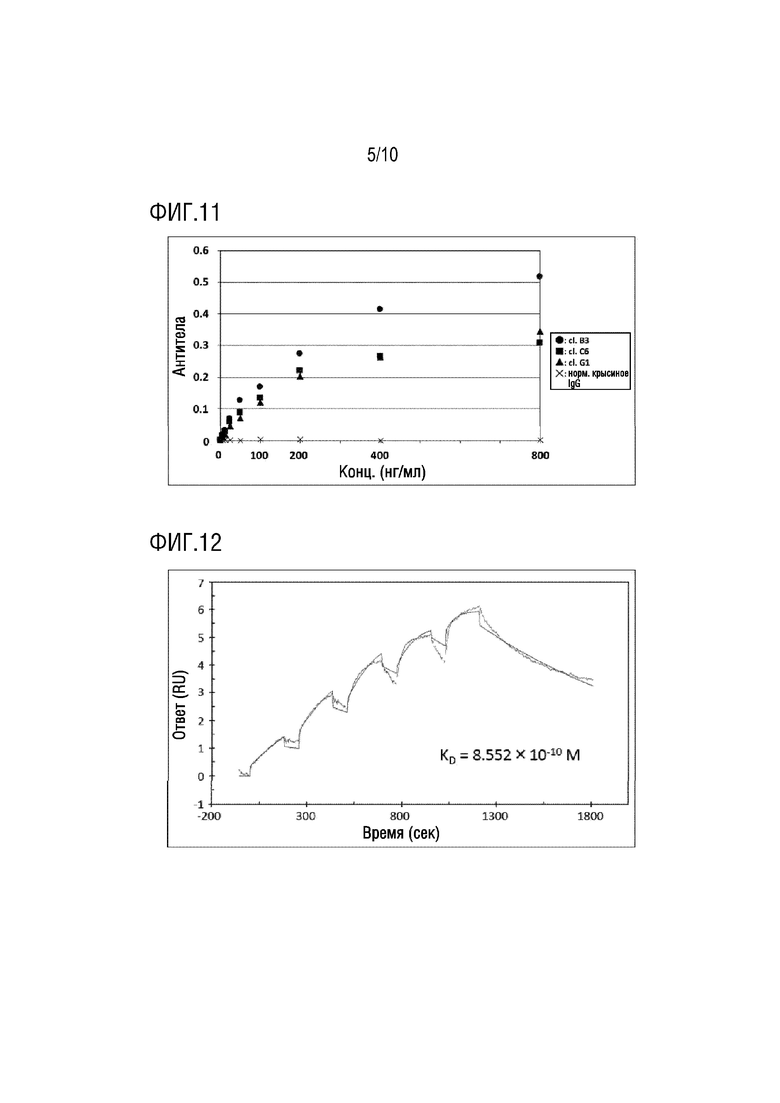
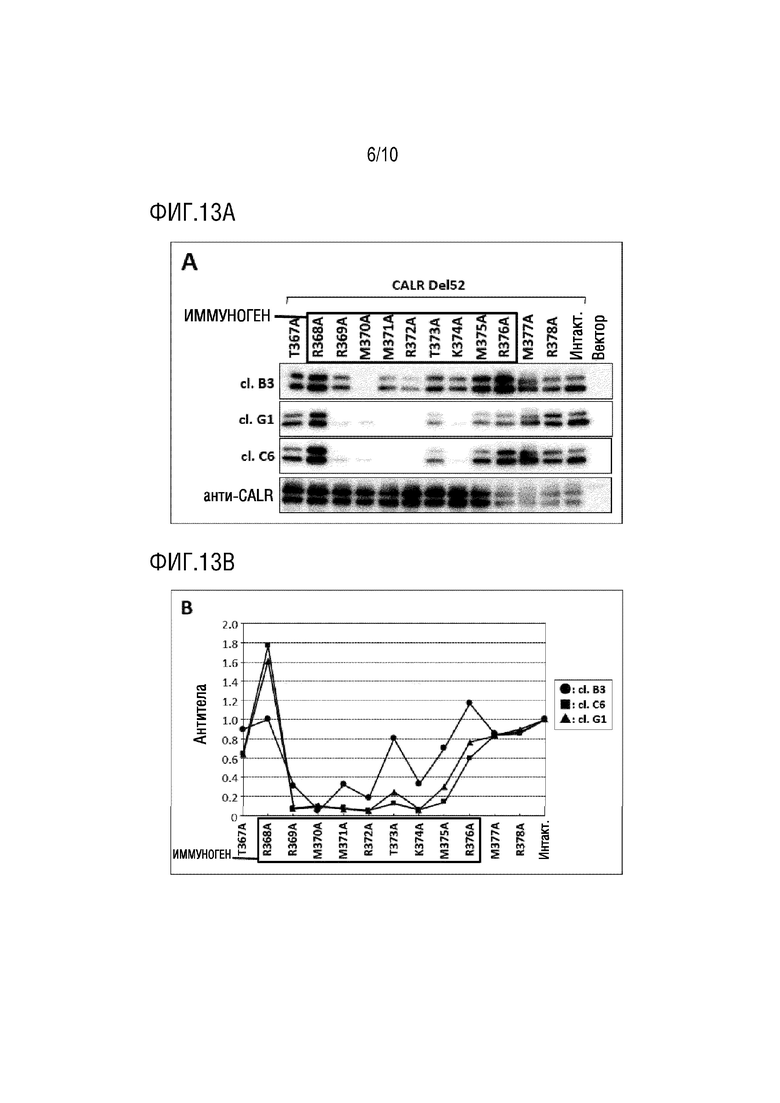



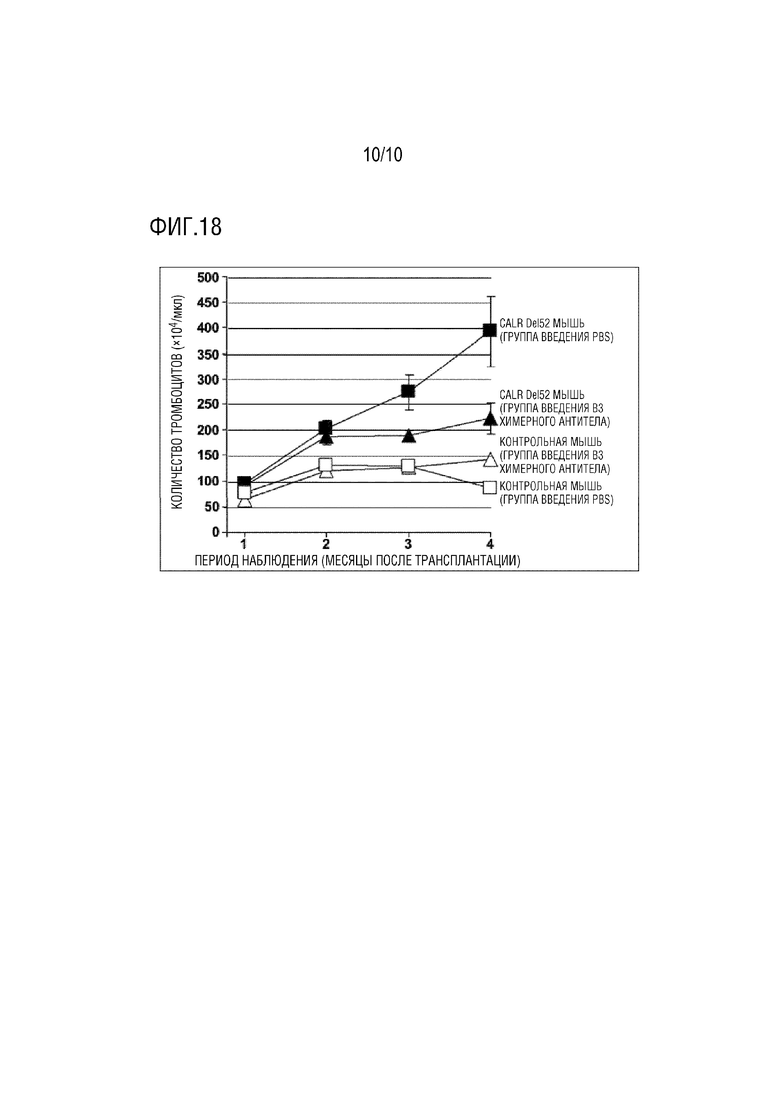
Изобретение относится к области биотехнологии, в частности к антителу или его функциональному фрагменту, которое связывается с расщепленным мутантным белком CALR, а также к композиции, его содержащей. Также раскрыто применение вышеуказанного антитела или его фрагмента в детекции мутантного белка CALR, в скрининге на выявление терапевтического средства для лечения миелопролиферативного новообразования, связанного с мутантным белком CALR, а также в диагностике миелопролиферативного новообразования, связанного с мутантным белком CALR. Изобретение эффективно для профилактики или лечения миелопролиферативного новообразования, связанного с мутантным белком CALR. 9 н. и 1 з.п. ф-лы, 18 ил., 6 пр.
1. Антитело или его функциональный фрагмент, которое связывается с расщепленным мутантным белком CALR, выбранное из следующих (а), (b) и (с):
(a) антитело, в котором CDR1, CDR2 и CDR3 иммуноглобулиновой VH-цепи представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO: 17, 18 и 19 соответственно; и CDR1, CDR2 и CDR3 иммуноглобулиновой VL-цепи представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO: 26, 27 и 28 соответственно;
(b) антитело, в котором CDR1, CDR2 и CDR3 иммуноглобулиновой VH-цепи представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO: 20, 21 и 22 соответственно; и CDR1, CDR2 и CDR3, иммуноглобулиновой VL-цепи представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO: 29, 30 и 31 соответственно; и
(c) антитело, в котором CDR1, CDR2 и CDR3 иммуноглобулиновой VH-цепи представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO: 23, 24 и 25 соответственно; и CDR1, CDR2 и CDR3 иммуноглобулиновой VL-цепи представляют собой полипептиды, состоящие из аминокислотных последовательностей SEQ ID NO: 32, 33 и 34 соответственно.
2. Антитело или его функциональный фрагмент, которое связывается с расщепленным мутантным белком CALR, по п.1, где антитело или его функциональный фрагмент выбран из следующих (А), (В) и (С):
(А) антитело, содержащее
иммуноглобулиновую VH-цепь, состоящую из аминокислотной последовательности SEQ ID NO: 5 или из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO: 5, и
иммуноглобулиновую VL-цепь, состоящую из аминокислотной последовательности SEQ ID NO: 8 или из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO: 8;
(В) антитело, содержащее
иммуноглобулиновую VH-цепь, состоящую из аминокислотной последовательности SEQ ID NO: 6 или из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO: 6, и
иммуноглобулиновую VL-цепь, состоящую из аминокислотной последовательности SEQ ID NO: 9 или из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO: 9; и
(С) антитело, содержащее
иммуноглобулиновую VH-цепь, состоящую из аминокислотной последовательности SEQ ID NO: 7 или из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO: 7, и
иммуноглобулиновую VL-цепь, состоящую из аминокислотной последовательности SEQ ID NO: 10 или из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности SEQ ID NO: 10.
3. Фармацевтическая композиция для профилактики или лечения миелопролиферативного новообразования, связанного с мутантным белком CALR, содержащая антитело или его функциональный фрагмент по п.1 или 2.
4. Фармацевтическая композиция для диагностики миелопролиферативного новообразования, связанного с мутантным белком CALR, содержащая антитело или его функциональный фрагмент по п.1 или 2.
5. Способ детекции мутантного белка CALR, включающий детекцию полипептида в биологическом образце, используя антитело или его функциональный фрагмент по п.1 или 2.
6. Способ скрининга на выявление терапевтического средства для лечения миелопролиферативного новообразования, связанного с мутантным белком CALR, включающий скрининг на выявление лекарственного средства, используя антитело или его функциональный фрагмент по п.1 или 2.
7. Способ диагностики миелопролиферативного новообразования, связанного с мутантным белком CALR, включающий детекцию полипептида в биологическом образце, используя антитело или его функциональный фрагмент по п.1 или 2.
8. Способ профилактики или лечения миелопролиферативного новообразования, связанного с мутантным белком CALR, включающий введение антитела или его функционального фрагмента по любому из п.1 или 2.
9. Применение антитела или его функционального фрагмента по п.1 или 2 для диагностики миелопролиферативного новообразования, связанного с мутантным белком CALR.
10. Применение антитела или его функционального фрагмента по п.1 или 2 для получения средства для диагностики миелопролиферативного новообразования, связанного с мутантным белком CALR.
| WO 2016087514 A1, 09.06.2016 | |||
| МУТАНТНЫЙ КАЛЬРЕТИКУЛИН ДЛЯ ДИАГНОСТИКИ МИЕЛОИДНЫХ НОВООБРАЗОВАНИЙ | 2014 |
|
RU2668808C2 |
| VANNUCCHI A.M | |||
| et al | |||
| Calreticulin mutation-specific immunostaining in myeloproliferative neoplasms: pathogenetic insight and diagnostic value | |||
| LEUKEMIA | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| МЕЛИКЯН А.Л | |||
| и др | |||
| Классические Ph-негативные миелопролиферативные неоплазии | |||
| Приспособление для разматывания лент с семенами при укладке их в почву | 1922 |
|
SU56A1 |
Авторы
Даты
2024-03-25—Публикация
2020-02-28—Подача