Изобретение относится к области получения производных 3,4-дигидро-2H-тиопиранов, которые потенциально могут быть использованы в качестве мономеров, промежуточных продуктов в синтезах биологически активных веществ, ароматизаторов и других практически значимых соединений.
Известен метод получения ангидрида 4,6-дифенил-3,4-дигидро-2H-тиопиран-2,3-дикарбоновой кислоты (4). Метод включает в себя термолиз димератиохалкона (1) в присутствии малеинового ангидрида (3) в атмосфере азота при температуре кипения бензола 80°С (Karakasa, T. Chemistryof α,β-UnsaturatedThioneDimers.2. Reactions of Thiochalcones and 2-Arylidene-1-thiotetralones with Some Olefins and the Parent Ketones of the Thiones / T. Karakasa, S. Motoki // J. Org. Chem., 1979, vol. 44, №23, p. 4151-4155).
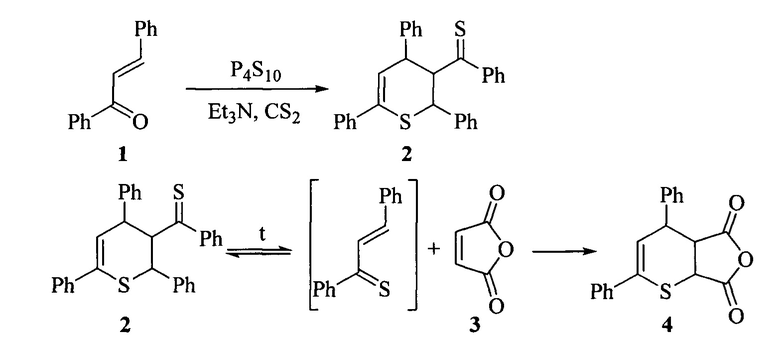
Синтез ангидрида 4,6-дифенил-3,4-дигидро-2H-тиопиран-2,3-дикарбоновой кислоты проводят в две стадии. На первой смесь халкона (1) (0,01 моль), P4S10O (1 г) и триэтиламина (1 мл) перемешивают в осушенном сероуглероде в атмосфере азота при комнатной температуре в течение одного дня. Для выделения димера тиохалкона (2)реакционную смесь отфильтровывают, из фильтрата удаляют растворитель под вакуумом при комнатной температуре. Полученный остаток очищают колоночной хроматографией на Florisil-геле (25 г) с использованием системы лигроин-бензол (в объемном соотношении 1:1) в качестве элюента. Осадок, полученный после удаления растворителя, перекристаллизовывают из смеси бензол-этанол. Выход димера (2) составляет 38% от исходного кетона.
На второй стадии 8 мл димера тиохалкона (2) (без перекристаллизации) и малеиновый ангидрид (3) (0,33 г; 3,4 ммоль) кипятят 5 мин в осушенном бензоле в атмосфере азота. Удаляют растворитель, остаток очищают колоночной хроматографией на вакогелеС-200 с использованием системы бензол-гексан (в объемном соотношении 7:3) в качестве элюента. Растворитель удаляют, остаток перекристаллизовывают из лигроина. Выход целевого продукта (4) составляет 10% (от исходного халкона (1)).
Недостатком данного метода является использование атмосферы инертного газа, токсичных сероуглерода и триэтиламина, низкий выход целевого продукта.
Наиболее близким к предлагаемому является способ получения N-n-толилимида4,6-дифенил-3,4-дигидро-2H-тиопиран-2,3-дикарбоновой кислоты (7). Метод включает в себя термолиз димера тиохалкона (2), полученного путем взаимодействия ненасыщенного карбонильного соединения с реактивом Лавессона (5), в присутствии N-n-толилмалеимида (6) при температуре кипения бензола 80°C (Motoki, S. LewisAcid-promotedHeteroDiels-AlderReactionofα,β-UnsaturatedThioketones / S. Motoki, T. Saito, T. Karakasaetal. // J. Chem. Soc. PerkinTrans. 1, 1992, №21, p. 2943-2948).
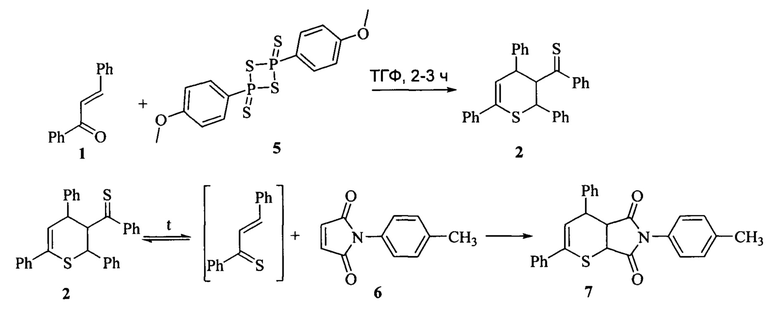
Синтез N-n-толилимида4,6-дифенил-3,4-дигидро-2H-тиопиран-2,3-дикарбоновой кислоты также осуществляют в две стадии. На первой стадии синтеза халкон (1) (28-30 ммоль) и реактив Лавессона (5) (10 г) в осушенном тетрагидрофуране (ТГФ) (50 мл) кипятят при температуре кипения ТГФ 66°С в течение 2-3 часов. После удаления растворителя, остаток очищают методом колоночной хроматографии на Florisil-гелес использованием системы бензол-гексан (в объемном соотношении 1:1) в качестве элюента. Полученный осадок перекристаллизовывают из диэтилового эфира и смеси бензол-гексан (в объемном соотношении 1:1). Выход димера - 24%.
На второй стадии к раствору N-n-толилмалеимида (6) в осушенном хлористом метилене добавляют 0,25 ммоль димератиохалкона (2) и перемешивают 3 ч при комнатной температуре. Для выделения целевого продукта удаляют растворитель под вакуумом, остаток очищают методом колоночной хроматографии на силикагеле с использованием системы бензол-гексан (в объемном соотношении 1:1) в качестве элюента. Полученный осадок перекристаллизовывают из смеси дихлорметан-гексан. Выход N-n-толилимида4,6-дифенил-3,4-дигидро-2H-тиопиран-2,3-дикарбоновой кислоты (7) составляет 90%.
Недостатком этого способа является сложность очистки, необходимость применения токсичных растворителей.
Задача изобретения - разработка одностадийного метода синтеза производных 3,4-дигидро-2H-тиопирана, упрощение процесса за счет исключения очистки колоночной хроматографией при обеспечении хорошего выхода продукта.
Задача решается следующим образом.
Заявляется способ получения производных 3,4-дигидро-2H-тиопирана с различными заместителями во 2, 3 и 4 положении тиопиранового кольца общей формулой 10, 12, 14 и 16.
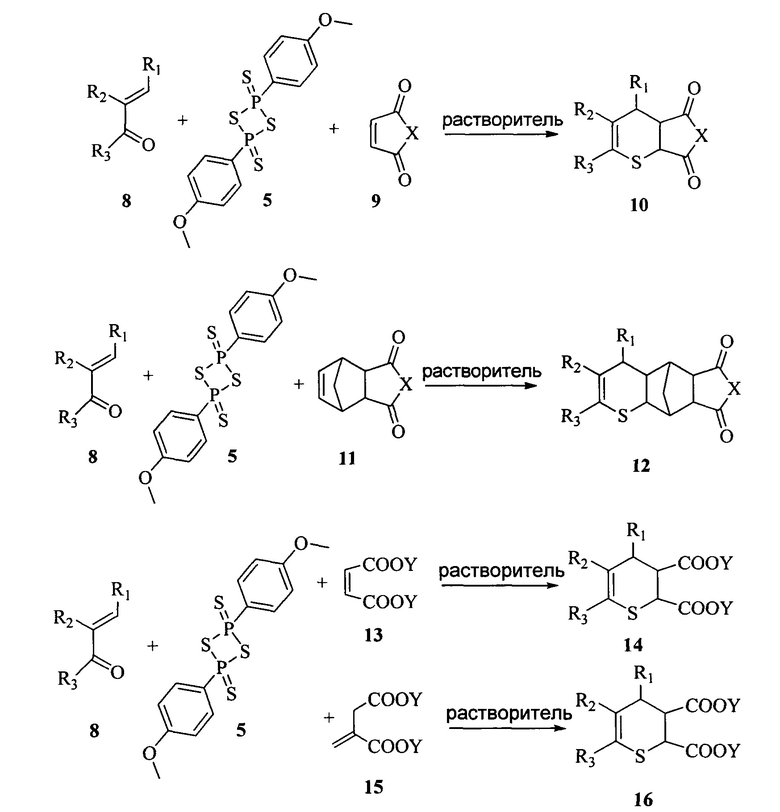
Где R1 и R3: алкил (С1-С2), бензил, арил, 5- или 6-членный гетарил, имеющий 1, 2 или 3 гетероатома в качестве членов кольца, которые выбраны из О, S и N, где фенил и моноциклический гетарил являются незамещенными или могут нести 1, 2 или 3 идентичных или различных заместителя, где фенил и гетероциклическое кольцо могут быть незамещенными или могут быть замещены 1, 2 или 3 идентичными или различными заместителями, алкил-тио-, алкилтиоалкил, С3-С7циклоалкил; R2: водород, алкил (С1-С2), бензил, арил, 5- или 6-членный гетарил, имеющий 1, 2 или 3 гетероатома в качестве членов кольца, которые выбраны из О, S и N, где фенил и моноциклический гетарил являются незамещенными или могут нести 1, 2 или 3 идентичных или различных заместителя, где фенил и гетероциклическое кольцо могут быть незамещенными или могут быть замещены 1, 2 или 3 идентичными или различными заместителями, алкилтио, алкилтиоалкил, С3-С7 циклоалкил; или R2 и R3, взятые вместе представляют собой -(СН2)3-, -(СН2)4-; X представляет собой О или N, где N может быть связан с водородом, метилом, арилом и гетарилом (напрямую или через углеродный мостик С1-С2); Y: алкил С1-С3; осушенный растворитель -бензол, толуол, о-ксилол, м-ксилол, n-ксилол, этилбензол или их смеси.
Получение производных 3,4-дигидро-2H-тиопирана проводят путем гетеро-реакции Дильса-Альдера α,β-ненасыщенных тиокетонов, образующихся при осернении соответствующего карбонильного соединения (8) в осушенном апротонном неполярном растворителе, таком как бензол, толуол, о-ксилол, м-ксилол, n-ксилол, этилбензол или их смеси, при температуре от 60 до 90°С в течение 4-12 часов с использованием в качестве осерняющего агента реактива Лавессона (5) при мольном соотношении α,β-непредельный кетон : реактив Лавессона : диенофил от 1:0,5:0,9 до 1:1,2:1,2. Полнота прохождения реакции контролируется тонкослойной хроматографией. Для выделения целевых продуктов отгоняют растворитель при пониженном давлении, остаток растирают с минимальным количеством диэтилового эфира до кристаллизации. Выпадающий осадок отфильтровывают, перекристаллизовывают из полярного протонного растворителя, такого как этиловый спирт, изопропиловый спирт, уксусная кислота, пропионовая кислота и т.п. или их смеси. Очистку соединений, не образующих осадок после обработки диэтиловым эфиром осуществляют флеш-хроматографией с использованием осушенного хлористого метилена в качестве элюента.
Изобретение иллюстрируется следующими примерами:
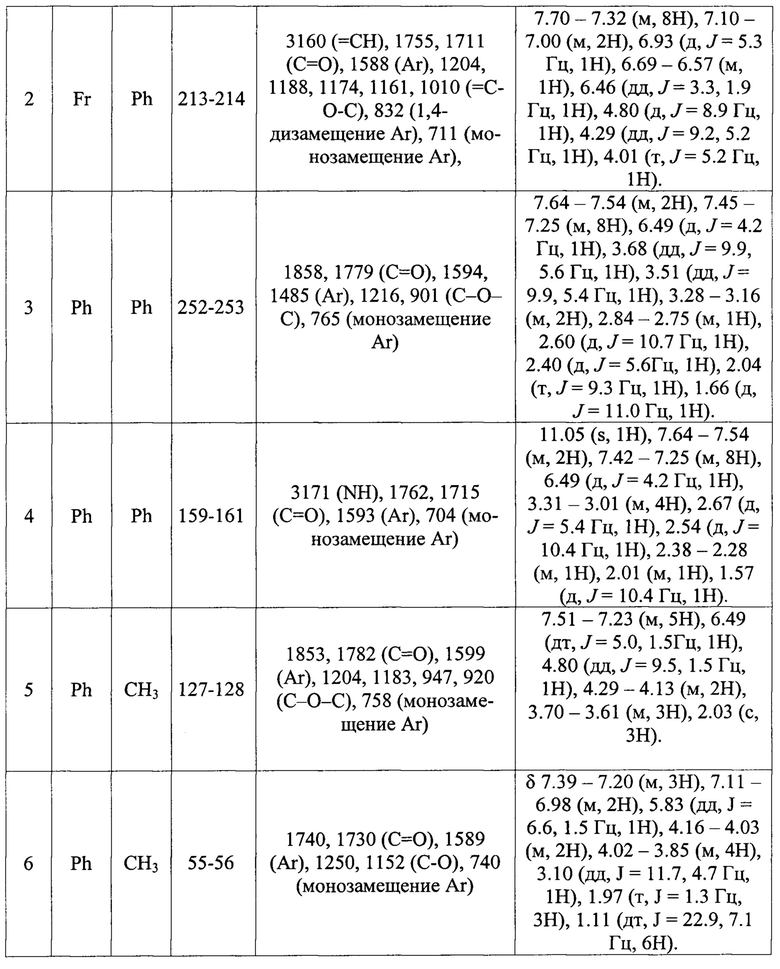
Пример 1. В колбу, снабженную воздушным холодильником загружают 0,5 г (1,97 ммоль) 3-нитрохалкона (R1=м-NO2-Ph, R2=H, R3=Ph), 0,4 г (0,98 ммоль) реактива Лавессона, 0,4 г (1,97 ммоль) N-n-метоксималеимида (X=N-(4-метоксифенил))и 10 мл осушенного толуола, нагревают при перемешивании на водяной бане (60°С в бане) в течение 12 часов. Выпавший после охлаждения осадок отфильтровывают, перекристаллизовывают из уксусной кислоты. Выход N-n-метоксифенилимида 4-(м-нитрофенил)-6-фенил-3,4-дигидро-2H-тиопиран-2,3-дикарбоновой кислоты составляет 55%. Результаты анализов представлены в таблице 2.
Пример 2-3. Получение других N-арилимидов 3,4-дигидро-2H-тиопирановой кислоты общей формулой (10) и ангидридов 4а,5,6,7,8,8а-гексагидро-4H-5,8-метантиохромен-6,7-дикарбоновой кислоты (12, Х=O) проводят аналогично примеру 1. Условия синтеза отличаются временем проведения реакции, температурой и растворителем, используемым для перекристаллизации ангидрида 4а,5,6,7,8,8а-гексагидро-4H-5,8-метантиохромен-6,7-дикарбоновой кислоты (смесь уксусная кислота-уксусный ангидрид в объемном соотношении 10:1). Время реакции, выходы целевых продуктов приведены таблице 1, результаты анализов - в таблице 2.
Пример 4. В колбу, снабженную воздушным холодильником, загружают 10 г (0,068 моль) бензальацетона (R1=Ph, R2=H, R3=CH3), 19,4 г (0,048 моль) реактива Лавессона, 8 г (0,082 моль) малеинового ангидрида (Х=O) и 200 мл осушенного толуола, нагревают при перемешивании на водяной бане (80°С в бане). Полнота прохождения реакции контролируется тонкослойной хроматографией. По окончании реакции растворитель отгоняют при пониженном давлении, смолистый остаток растирают с минимальным количеством диэтилового эфира до кристаллизации. Образующийся осадок отфильтровывают, продукт дополнительно очищают флеш-хроматографией на силикагеле, элюируя осушенным хлористым метиленом. Элюат упаривают при пониженном давлении и смолистый остаток обрабатывают 20 мл диэтилового эфира, что приводит к выпадению 9 г чистого осадка ангидрида6-метил-4-фенил-3,4-дигидро-2H-тиопиран-2,3-дикарбоновой кислоты с выходом 50%. Результаты анализов представлены в таблице 2.
Пример 5. Получение соединений, не образующих осадок, после обработки диэтиловым эфиром, общей формулой (12, Х≠О, 14 и 16) производят аналогично примеру 4. Выходы целевых продуктов приведены таблице 1, результаты анализов - в таблице 2.
Пример 6. В колбу, снабженную воздушным холодильником, загружают 1 г (6,8 ммоль) бензальацетона (Р1=Ph, R2=Н, R3=CH3), 3,3 г (8,16 ммоль) реактива Лавессона, 1,05 г (6,12 ммоль) диэтилового эфира малеиновой кислоты и 20 мл осушенного толуола, нагревают при перемешивании на водяной бане (90°С в бане). Полнота прохождения реакции контролируется тонкослойной хроматографией. По окончании реакции растворитель отгоняют при пониженном давлении, смолистый остаток растворяют в диэтиловом эфире и оставляют при температуре от -5 до -15°С до кристаллизации. Образовавшийся осадок отфильтровывают, выход диэтилового эфира 6-метил-4-фенил-3,4-дигидро-2H-тиопиран-2,3-дикарбоновой кислоты с выходом 40%. Результаты анализов представлены в таблице 2.
Результатом изобретения является новый простой способ получения производных 3,4-дигидро-2H-тиопирана, не требующий очистки продуктов колоночной хроматографией, большого расхода растворителей и обеспечивающий хороший выход продукта.
Спектры ЯМР 1Н растворов анализируемых соединений в ДМСО-d6 регистрировали на приборах «Bruker MSL-300». ИК спектры записывали на приборе ИК-Фурье «Spectrum RX1» на пластинах NaCl в виде суспензии в вазелиновом масле. Температуру плавления соединений определяли на приборе ElectrothermallA 9300 Series.

| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 3-(глиоксилиденметил)-2Н-тиопиранов | 2023 |
|
RU2816356C1 |
| Способ получения 1-метил-N-арил-3-оксо-8-фенил-2-окса-6-тиабицикло[2.2.2]октан-5-карбоксамидов | 2022 |
|
RU2806043C1 |
| СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К PDE9A, И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2788148C2 |
| СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К PDE9A, И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2788147C2 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА | 1994 |
|
RU2124511C1 |
| ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ АМИДИНЫ, ОБЛАДАЮЩИЕ СВОЙСТВАМИ ИНГИБИТОРОВ ТРОМБИНА, СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ПЯТИЧЛЕННОГО ГЕТЕРОЦИКЛИЧЕСКОГО АМИДИНА, В КАЧЕСТВЕ СОСТАВНОЙ ЧАСТИ ИНГИБИТОРОВ СЕРИНПРОТЕАЗЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1997 |
|
RU2175328C2 |
| ПРОИЗВОДНЫЕ ПИРАЗИНА ИЛИ ИХ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ДАННЫЕ СОЕДИНЕНИЯ, И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ | 2001 |
|
RU2297414C2 |
| ПРОИЗВОДНЫЕ 1-[ω-(3,4-ДИГИДРО-2-НАФТАЛИНИЛ)АЛКИЛ]ЦИКЛИЧЕСКОГО АМИНА И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2142453C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛ 3-АЦИЛ-4-ЦИАНО-5-(ДИЦИАНОМЕТИЛЕН)-2-ГИДРОКСИ-2,5-ДИГИДРО-1H-ПИРРОЛ-2-КАРБОКСИЛАТОВ | 2018 |
|
RU2700928C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3,4-ДИАРИЛ(ГЕТАРИЛ)МАЛЕИМИДОВ | 2005 |
|
RU2278855C1 |
Изобретение относится к области получения производных 3,4-дигидро-2H-тиопиранов, которые потенциально могут быть использованы в качестве мономеров, промежуточных продуктов в синтезах биологически активных веществ, ароматизаторов и других практически значимых соединений. Способ получения производных 3,4-дигидро-2H-тиопирана из α,β-ненасыщенных кетонов и диенофилов осуществляют путем гетеро-реакции Дильса-Альдера при повышенной температуре, при атмосферном давлении в осушенном апротонном неполярном растворителе с использованием в качестве осерняющего агента реактива Лавессона с последующим выделением целевых продуктов, где процесс ведут в одну стадию при температуре от 60 до 90°С в течение 4-12 часов при мольном соотношении α,β-непредельный кетон: реактив Лавессона: диенофил от 1:0,5:0,9 до 1:1,2:1,2; с последующим выделением целевых продуктов путем охлаждения полученной смеси, отфильтровывания выпавшего осадка, перекристаллизации из полярного протонного растворителя, либо путем отгонки растворителя при пониженном давлении, растирания остатка с минимальным количеством диэтилового эфира до кристаллизации, отфильтровывания выпавшего осадка, дополнительной очистки флеш-хроматографией с использованием осушенного хлористого метилена в качестве элюента, либо отгонки растворителя при пониженном давлении, растворения осадка в диэтиловом эфире, охлаждения полученной смеси до кристаллизации, отфильтровывания выпавшего осадка. Результатом изобретения является новый простой способ получения производных 3,4-дигидро-2H-тиопирана, не требующий очистки продуктов колоночной хроматографией, большого расхода растворителей и обеспечивающий хороший выход продукта. 2 табл., 6 пр.
Способ получения производных 3,4-дигидро-2H-тиопирана из α,β-ненасыщенных кетонов и диенофилов путем гетеро-реакции Дильса-Альдера при повышенной температуре, при атмосферном давлении в осушенном апротонном неполярном растворителе с использованием в качестве осерняющего агента реактива Лавессона с последующим выделением целевых продуктов, отличающийся тем, что процесс ведут в одну стадию при температуре от 60 до 90°С в течение 4-12 часов при мольном соотношении α,β-непредельный кетон: реактив Лавессона: диенофил от 1:0,5:0,9 до 1:1,2:1,2; с последующим выделением целевых продуктов путем охлаждения полученной смеси, отфильтровывания выпавшего осадка, перекристаллизации из полярного протонного растворителя, либо путем отгонки растворителя при пониженном давлении, растирания остатка с минимальным количеством диэтилового эфира до кристаллизации, отфильтровывания выпавшего осадка, дополнительной очистки флеш-хроматографией с использованием осушенного хлористого метилена в качестве элюента, либо отгонки растворителя при пониженном давлении, растворения осадка в диэтиловом эфире, охлаждения полученной смеси до кристаллизации, отфильтровывания выпавшего осадка.
| Motoki S | |||
| Lewis Acid -promoted Hetero Diels-Alder Reaction of α, β-Unsaturated Thioketones, J | |||
| Chem | |||
| Soc | |||
| Perkin Trans | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Karakasa T | |||
| Chemistry of α, β-Unsaturated Thione Dimers | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Org | |||
| Chem, 1979, v.44, N.23, P.4151-4155 | |||
| Меркулова Е.А | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Всероссийская конференция молодых ученых, посвященная празднованию 100-летия образования Республики Башкортостан, 2017 | |||
| Фотореле для аппарата, служащего для передачи на расстояние изображений | 1920 |
|
SU224A1 |
Авторы
Даты
2018-10-26—Публикация
2018-04-09—Подача