Область техники, к которой относится изобретение
Настоящее изобретение относится к производным гиалуроновой кислоты, которые модифицированы аминокислотами и содержат стерильные группы, введенные в них, к комплексам производных гиалуроновой кислоты и лекарственных средств, и к фармацевтическим композициям, содержащим производные гиалуроновой кислоты и лекарственные средства.
Уровень техники
Недавно были разработаны композиции, содержащие белки и пептиды в качестве активных ингредиентов, в результате достижений в области технологий генетической рекомбинации и химического синтеза, и число таких композиций ежегодно увеличивается. Однако белки и пептиды трудно всасываются в желудочно-кишечном тракте, через слизистую оболочку и т.д. Кроме того, белки и пептиды являются нестабильными в организме и имеют короткий период полураспада в крови. Следовательно, белковые и пептидные препараты требуется вводить частыми инъекциями, что является тяжелой нагрузкой для пациентов и медицинского персонала. Существует потребность в матриксе для системы доставки лекарственного средства (DDS), обладающем способностью к замедленному высвобождению или целенаправленной доставке, для инкапсулирования белка или пептида, без нарушения его фармакологической активности. Кроме того, с точки зрения эффективности введения предпочтительным является матрикс, в котором может быть инкапсулировано максимальное количество белка и/или пептида.
Известно, что фармакологическая активность белков и пептидов в большой степени зависит от их конформации и снижается в результате деградации и агрегации в результате контакта на поверхности раздела с окружающим воздухом или органическим растворителем или воздействия внешних условий, таких как температура, давление и рН. Также известно, что денатурированный или агрегированный белок повышает риски развития побочных реакций при введении в организм, например, будучи антигенным. Для препаратов с замедленным высвобождением, содержащих белок или пептид в качестве активного ингредиента, требуется обеспечивать стабильность белка или пептида в течение периода от формулирования, во время хранения препаратов до высвобождения активного ингредиента в организме после введения.
Для низкомолекулярных лекарственных средств проблемы, касающиеся стабильности лекарственных средств, не являются столь значимыми по сравнению с белками и пептидами, но в данном случае имеется большая потребность в матриксах для DDS, обладающих способностью повышать растворимость слаборастворимых препаратов или обеспечивать замедленное высвобождение или целенаправленную доставку.
Кроме того, матриксы для фармацевтического применения должны быть неантигенными, немутагенными, нетоксичными и биоразлагаемыми по причинам безопасности.
Недавно сообщалось о применении полисахаридов в качестве матриксов для фармацевтических носителей. Один из них, гиалуроновая кислота (ГК), представляет собой биологическое вещество (полисахарид), которое было выделено из стекловидного тела глаза быка K. Meyer в 1934 году, и в течение длительного периода времени известна как основной компонент внеклеточного матрикса. ГК представляет собой гликозаминогликан, состоящий из дисахаридных единиц, содержащих D-глюкуроновую кислоту и N-ацетилглюкозамин, связанные β(1→3)гликозидной связью. Структура ГК не различается между видами в химическом и физическом отношении, и у людей имеется метаболический путь для ГК. Следовательно, это одно из самых безопасных биологических веществ для медицинского применения, также в отношении иммунитета и токсичности.
Помимо ее свойств в качестве безопасного вещества, недавно стали представлять интерес свойства гиалуроновой кислоты в качестве биологически активного вещества в индукции адгезии, пролиферации и подвижности клеток. Кроме того, стало возможным использовать микроорганизмы в отношении продукции, массовой продукции высокомолекулярной гиалуроновой кислоты. По этим причинам недавно настойчиво проводились исследования по DDS с гиалуроновой кислотой. Сообщалось, что конъюгация лекарственного средства с гиалуроновой кислотой успешно использовалась для целенаправленного транспорта в раковую ткань (патентная литература 1), целенаправленного транспорта в печень (патентная литература 2) и снижения антигенности (патентная литература 3). Сообщалось, что рецепторы ГК, включая CD44, RHAMM (рецептор опосредованной гиалуроновой кислотой подвижности), LYVE-1 (рецептор-1 ГК эндотелия лимфатических сосудов), HARE (рецептор для эндоцитоза гиалуроновой кислоты) находятся в живом организме (непатентная литература 7 и непатентная литература 8). В частности, CD44 и RHAMM сверхэкспрессируются во многих раковых клетках. Следовательно, были сделаны попытки использовать ГК в качестве матрикса для носителей с целенаправленной доставкой в раковые опухоли. Примеры таких попыток включают конъюгат паклитаксел-ГК (непатентная литература 9-11 и патентная литература 12), конъюгат камтотецин-ГК (патентная литература 13), конъюгат доксорубицин-HPTM [N-(2-гидроксипропил)метакриламид]-ГК (непатентная литература 12), конъюгат масляная кислота-ГК (непатентная литература 13), наночастицу из ГК-ПЭГ-PLGA, содержащую доксорубицин (непатентная литература 14), siPHK-содержащий ГК гель (непатентная литература 15) и покрытую ГК липосому, содержащую доксорубицин (непатентная литература 16). Кроме того, в непатентной литературе 17 раскрыто производное ГК, конъюгированное с холевой кислотой, посредством этилендиаминного линкера, введенного через амидную связь. Сообщалось, что такие носители, содержащие ГК в качестве матрикса, эффективно захватываются in vitro клетками с высокой экспрессией CD44 (см., например, непатентную литературу 9). Однако известно, что введенная системно ГК in vivo, быстро выводится из крови; немедленно поглощается посредством рецепторов HARE, находящихся, например, на синусоидальных эндотелиальных клетках в печени и метаболизируется (непатентная литература 18-20). Такое короткое время удерживания гиалуроновой кислоты в крови является недостатком при ее применении для пролонгированного удерживания лекарственного средства или в качестве матрикса DDS для целенаправленной доставки. Вероятно, рецепторы распознают шесть последовательных сахарных единиц в гиалуроновой кислоте. Предпринимались попытки удлинить время удерживания в крови посредством модификации карбоксигруппы (патентная литература 4, 5 и 6).
Были разработаны производные гиалуроновой кислоты, которые имеют более длительное время удерживания, за счет высокой степени модификации карбоксигруппы фрагмента глюкуроновой кислоты в гиалуроновой кислоте, и было показано, что они являются пригодными для применения (патентная литература 7). Как правило, увеличение степени модификации карбоксигруппы фрагмента глюкуроновой кислоты пролонгирует время удерживания производного гиалуроновой кислоты в крови. Однако они не показали линейной корреляции, и удерживание резко изменяется в некоторой пороговой точке.
Примеры модификации карбоксигруппы в гиалуроновой кислоте аминокислотой включают модификации этиловым эфиром глицина с использованием 4-(4,6-диметокси-1,3,5-триазин)-4-метилморфолиния (далее по тексту обозначенного как DMT-MM), в качестве конденсирующего агента, который может быть получен, например, взаимодействием 2-хлор-4,6-диметокси-1,3,5-триазина в присутствии N-метилморфолина, по сообщениям, степень модификации которого достигает до 20% (непатентная литература 1). Примеры, в которых соединение на основе триазина используется в качестве конденсирующего агента, включают гиалуроновую кислоту, модифицированную аланином, которая, как сообщалось, обладает повышенной устойчивостью к деградации в результате окисления и потенциально применяется в качестве вязкой добавки (непатентная литература 2). Сообщалось о модификации другими аминокислотами аналогичными способами (непатентная литература 3, патентная литература 9). Примеры включают получение нерастворимых в воде биосовместимых пленок, в которых при использовании гидрохлорида 1-этил-3-(3-диметиламинопропил)карбодиимида (далее по тексту обозначенного как EDC) в качестве конденсирующего агента, гиалуроновую кислоту модифицируют гидрохлоридом метилового эфира лейцина, гидрохлоридом метилового эфира валина, гидрохлоридом метилового эфира изолейцина, гидрохлоридом метилового эфира пролина, гидрохлоридом метилового эфира фенилаланина, гидрохлоридом метилового эфира аргинина и гидрохлоридом метилового эфира гистидина, и гель получают без снятия защиты; однако степень ее модификации не известна (патентная литература 8). Кроме того, в патентной литературе 15, опубликованной после даты приоритета настоящей заявки, раскрывается, что производное гиалуроновой кислоты, полученное модификацией карбоксигруппы гиалуроновой кислоты определенной аминокарбоновой кислотой или ее амидом, обладает способностью к биоразлагаемости и удерживанию в крови, и что оно оказывает положительное влияние на высвобождение лекарственного средства из эндосомы в цитоплазму.
Дополнительные примеры носителей лекарственных средств, полученных из полисахарида, включают производные пуллана, модифицированные холестерильной группой, которые, как сообщалось, образуют мелкие частицы наноразмера в водном растворе и функционируют в качестве молекул хозяина, которые образуют комплексы с гидрофобными молекулами с низкой молекулярной массой, пептидами и белками (непатентная литература 4). Результаты термодинамического анализа производных пуллана после захвата белков показывали, что захваченный белок стабилизирован водородными связями с гидроксигруппами пуллана (непатентная литература 5).
Дополнительные примеры включают карбоксиметилцеллюлозу (СМС; патентная литература 10) и хитозан, модифицированный линолевой кислотой (непатентная литература 6), о которых сообщалось, что они использовались в качестве веществ для получения комплексов с белком. Кроме того, в патентной литературе 11 раскрыта композиция, содержащая производное гиалуроновой кислоты, имеющее поперечно-сшивающую группу и гидрофильное полисахаридное производное, содержащее гидрофобную группу, где производное гиалуроновой кислоты, содержащее поперечно-сшивающую группу, получают поперечным сшиванием гиалуроновой кислоты или ее производного, содержащего группу, способную к поперечному сшиванию в присутствии гидрофильного полисахаридного производного. В патентной литературе 14 описано, что производное гиалуроновой кислоты, в которое введена холестерильная группа в качестве гидрофобной группы, образует мелкие частицы посредством ассоциации и образует комплексы с лекарственными средствами в воде.
Перечень ссылок
Патентная литература
Патентная литература 1: Международная публикация № 92/06714.
Патентная литература 2: Не прошедшая экспертизу опубликованная патентная заявка Японии № 2001-81103.
Патентная литература 3: Не прошедшая экспертизу опубликованная патентная заявка Японии № 2-273176.
Патентная литература 4: Не прошедшая экспертизу опубликованная патентная заявка Японии № 5-85942.
Патентная литература 5: Международная публикация № 01/05434.
Патентная литература 6: Международная публикация № 01/60412.
Патентная литература 7: Международная публикация № 2006/028110.
Патентная литература 8: Международная публикация № 92/20349.
Патентная литература 9: Международная публикация № 2011/148116.
Патентная литература 10: Международная публикация № 2002/022154.
Патентная литература 11: Международная публикация № 2008/136536.
Патентная литература 12: Международная публикация № 2004/035629.
Патентная литература 13: Международная публикация № 2009/074678.
Патентная литература 14: Международная публикация № 2010/053140.
Патентная литература 15: Международная публикация № 2012/118189.
Непатентная литература
Непатентная литература 1: Biomacromolecules, Vol. 8, p. 2190-2195, 2007.
Непатентная литература 2: Carbohydrates Polymers, Vol. 86, p. 747-752, 2011.
Непатентная литература 3: Carbohydrates Polymers, Vol. 87, p. 2211-2216, 2012.
Непатентная литература 4: Macromolecules, Vol. 26, p. 3062-3068, 1993.
Непатентная литература 5: Colloids and Surfaces, Vol. 112, p. 91-95, 1996.
Непатентная литература 6: Carbohydrates Polymers, Vol. 62, p. 293-298, 2005.
Непатентная литература 7: Molecular Pharmaceutics, Vol. 5, p. 474-486, 2008.
Непатентная литература 8: Journal of Drug Targeting, Vol. 16, p. 91-107, 2008.
Непатентная литература 9: Bioconjugate Chem., Vol. 10, p. 755-763, 1999.
Непатентная литература 10: Clinical Cancer Research, Vol. 14, p. 3598-3606, 2008.
Непатентная литература 11: Bioconjugate Chem., Vol. 19, p. 1319-1325, 2008.
Непатентная литература 12: Pharmaceutical Research, Vol. 19, p. 396-402, 2002.
Непатентная литература 13: Clinical Cancer Research, Vol. 10, p. 4822-4830, 2004.
Непатентная литература 14: Nanomedicine: Nanotechnology, Biology and Medicine, Vol. 3, p. 246-257, 2007.
Непатентная литература 15: Journal of Controlled Release, Vol. 119, p. 245-252, 2007.
Непатентная литература 16: Neoplasia, Vol. 6, p. 343-353, 2004.
Непатентная литература 17: Journal of Materials Chemistry, Vol. 19, p. 4102-4107, 2009.
Непатентная литература 18: Cell and Tissue Research, Vol. 243, p. 505-510, 1985.
Непатентная литература 19: Journal of Biological Chemistry, Vol. 275, p. 37733-37741, 2000.
Непатентная литература 20: The Biochemical Journal, Vol. 200, p. 415-424, 1981.
Сущность изобретения
Техническая задача
Удерживание производного гиалуроновой кислоты в крови коррелирует со степенью модификации карбоксигруппы в ее фрагменте глюкуроновой кислоты. Но также было обнаружено, что изменение происходит внезапно при некотором пороговом значении. Следовательно, удерживание производного гиалуроновой кислоты в крови трудно сохранять в требуемых пределах только изменением степени модификации карбоксигруппы. Следовательно, требуется более простой и более надежный способ контроля удерживания в крови. Кроме того, снижение распознавания гиалуроновой кислоты рецепторами гиалуроновой кислоты будет делать гиалуроновую кислоту менее подверженной метаболизму в живом организме и будет снижать ее биоразлагаемость, естественного свойства гиалуроновой кислоты. Следовательно, требуется матрикс, обладающий способностью к биоразлагаемости (этим обеспечивается безопасность) и удерживанию в крови.
Задачей настоящего изобретения является обеспечение производного гиалуроновой кислоты, одновременно обладающего способностью к биоразлагаемости и удерживанию в крови. Другой задачей изобретения является обеспечение комплекса производного гиалуроновой кислоты и лекарственного средства, и фармацевтической композиции, содержащей производное гиалуроновой кислоты, в частности, комплекс производного гиалуроновой кислоты и лекарственного средства.
Решение задачи
В исследовании, направленном на решение указанных задач, авторы настоящего изобретения обнаружили, что производное гиалуроновой кислоты, полученное дополнительным введением стерильной группы в карбоксигруппу фрагмента глюкуроновой кислоты и/или карбоксигруппу фрагмента аминокислоты промежуточного соединения, полученного взаимодействием карбоксигруппы фрагмента глюкуроновой кислоты или ее соли с определенной аминокислотой или амидом аминокислоты с преобразованием карбоксигруппы в амид, обладает способностью к биоразлагаемости и удерживанию в крови, и что комплекс производного гиалуроновой кислоты и лекарственного средства обладает хорошими свойствами в виде фармацевтической композиции, и тем самым осуществили настоящее изобретение. Кроме того, в исследовании авторы настоящего изобретения обнаружили, что производные с определенными амидами аминокислот (такие, в которых Ra, являющийся таким, как определено ниже, представляет собой С1-6алкил, замещенный арилом или гетероарилом, где арил замещен одной или более гидроксигруппами), такими как тирозинамид и триптофанамид, производные которых модифицированы стерильной группой, показывают лучшую диспергируемость в воде, несмотря на гидрофобность стерильной группы, по сравнению с производными без введения стерильной группы, и тем самым осуществили настоящее изобретение. Кроме того, авторы настоящего изобретения сравнили производные с фенилаланинамидом (такие, в которых Ra, являющийся таким, как определено ниже, представляет собой С1-6алкил, замещенный арилом, где арил не является замещенным), производные которого дополнительно модифицированы стерильной группой при степени введения 6% или ниже, с производными без фенилаланинамида, производные которого модифицированы стерильной группой при степени введения 6% или ниже, и обнаружили, что, несмотря на то, что они оба диспергировались в чистой воде, только первое производное диспергировалось в физиологическом растворе и последнее агрегировало с преципитацией, и что первое представляет собой превосходный матрикс для подкожных инъекций для непрерывного введения, и тем самым завершили настоящее изобретение.
Следовательно, настоящее изобретение относится к производным гиалуроновой кислоты, обладающим способностью к биодеградации и удерживанию в крови, к производным гиалуроновой кислоты, которые показывают лучшую диспергируемость в воде введением стерильной группы, и к комплексам, содержащим такие производные гиалуроновой кислоты и соединение, обладающее фармакологической активностью. Кроме того, настоящее изобретение относится к способу получения производного гиалуроновой кислоты и к фармацевтической композиции, содержащей производное гиалуроновой кислоты, и способу получения композиции.
В аспекте настоящего изобретения обеспечиваются производные гиалуроновой кислоты по следующим пунктам (1)-(10).
(1) Производное гиалуроновой кислоты, содержащее повторяющуюся единицу формулы (I):
Химическая формула 1
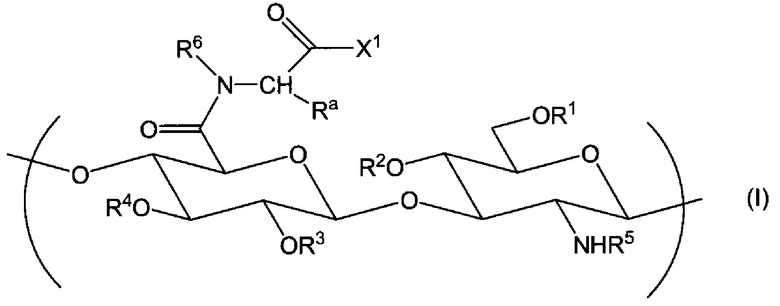 ,
,
где R1, R2, R3 и R4 независимо выбраны из атома водорода, С1-6алкила, формила и С1-6алкилкарбонила;
R5 представляет собой атом водорода, формил или С1-6алкилкарбонил;
Х1 представляет собой гидрокси, С1-6алкокси, -O-Q+, -NR7R8 или NR9-Z1-Z2;
Q+ представляет собой противокатион;
R6, R7, R8 и R9 независимо выбраны из атома водорода и С1-6алкила;
Ra представляет собой атом водорода или С1-6алкил, где алкилы могут быть независимо замещены одной или более группами, выбранными из гидрокси, карбокси, карбамоила, С1-6алкилтио, арила и гетероарила, где арил может быть замещен одной или более гидроксигруппами;
Z1 представляет собой С2-30алкилен или -(СН2СН2О)m-СН2СН2-, где в алкилен может быть введено 1-5 групп, независимо выбранных из -О-, -NRg- и -S-S-, и m является целым числом, выбранным из 1-100;
Z2 выбран из групп, представленных следующими формулами:
-NRb-Z3,
-NRb-COO-Z3,
-NRb-CO-Z3,
-NRb-CO-NRcZ3,
-COO-Z3,
-CO-NRc-Z3,
-O-CO-NRc-Z3,
-O-COO-Z3,
-S-Z3,
-CO-Za-S-Z3,
-O-CO-Zb-S-Z3,
-NRb-CO-Zb-S-Z3 и
-S-S-Z3;
Rb и Rc независимо выбраны из атома водорода, С1-20алкила, амино-С2-20алкила и гидрокси-С2-20алкила, где в алкильные группы может быть введено 1-3 группы, независимо выбранных из -О- и -NRf-;
Rf независимо выбран из атома водорода, С1-12алкила, амино-С2-12алкила и гидрокси-С2-12алкила, и в алкильные группы может быть введено 1-2 группы, независимо выбранных из -О- и -NH-;
Rg независимо выбран из атома водорода, С1-20алкила, амино-С2-20алкила и гидрокси-С2-20алкила, и в алкильные группы может быть введено 1-3 группы, независимо выбранных из -О- и -NH-;
Z3 представляет собой стерильную группу;
Za представляет собой С1-5алкилен; и
Zb представляет собой С2-8алкилен или С2-8алкенилен;
где если производное гиалуроновой кислоты не содержит повторяющихся единиц формулы (I), в которой Х1 представляет собой -NR9-Z1-Z2, тогда производное гиалуроновой кислоты дополнительно содержит повторяющуюся единицу формулы (II):
Химическая формула 2
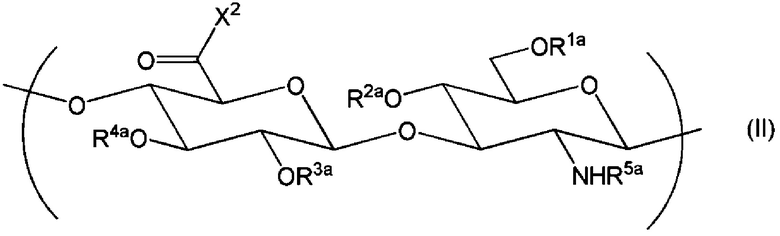 ,
,
где R1a, R2a, R3a и R4a независимо выбраны из атома водорода, С1-6алкила, формила и С1-6алкилкарбонила;
R5a представляет собой атом водорода, формил или С1-6алкилкарбонил;
Х2 представляет собой -NR9-Z1-Z2, где R9, Z1 и Z2 являются такими, как определено выше.
(2) Производное гиалуроновой кислоты по пункту (1) выше, дополнительно содержащее повторяющуюся единицу формулы (IIb):
Химическая формула 3
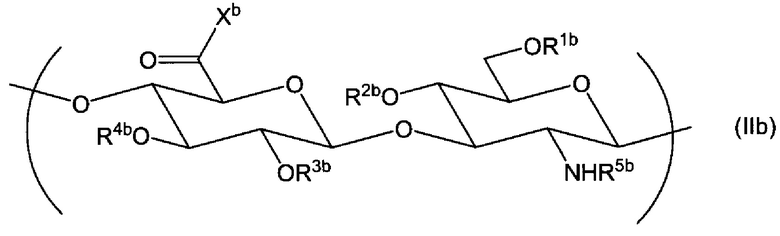 ,
,
где R1b, R2b, R3b и R4b, каждый независимо, выбран из атома водорода, С1-6алкила, формила и С1-6алкилкарбонила;
R5b выбран из атома водорода, формила или С1-6алкилкарбонила;
Xb выбран из гидрокси и -O-Q+, где Q+ представляет собой противокатион.
(3) Производное гиалуроновой кислоты по пункту (1) или (2) выше, где Х1 представляет собой NR9-Z1-Z2 в формуле (I).
(4) Производное гиалуроновой кислоты по любому из пунктов (1)-(3) выше, где процент дисахаридной единицы формулы (I) в имеющихся дисахаридных повторяющихся единицах составляет 70-100%.
(5) Производное гиалуроновой кислоты по любому из пунктов (1)-(4) выше, где процент дисахаридной единицы, содержащей группу NR9-Z1-Z2 в имеющихся дисахаридных повторяющихся единицах, составляет 3-50%.
(6) Производное гиалуроновой кислоты по пункту (1) или (2) выше, не содержащее повторяющуюся единицу формулы (I), где Х1 представляет собой NR9-Z1-Z2.
(7) Производное гиалуроновой кислоты по любому из пунктов (1), (2) и (6) выше, где сумма процентов повторяющейся единицы формулы (I) и повторяющейся единицы формулы (II) в имеющихся дисахаридных повторяющихся единицах составляет 70-100%.
(8) Производное гиалуроновой кислоты по любому из пунктов (1)-(7) выше, где производное гиалуроновой кислоты получено с использованием гиалуроновой кислоты, исключительно состоящей из дисахаридной единицы формулы (IIb) по пункту (2), и имеет среднемассовую молекулярную массу от 3 кДа до 1500 кДа, когда R1b, R2b, R3b и R4b, все представляют собой атомы водорода, R5b представляет собой ацетил, и Xb представляет собой -O-Na+.
(9) Производное гиалуроновой кислоты по любому из пунктов (1)-(8), где Z1 представляет собой С2-10алкилен, Z2 представляет собой -NH-COO-Z3, и Z3 представляет собой холестерильную группу.
(10) Производное гиалуроновой кислоты по любому из пунктов (1)-(9) выше, где производное гиалуроновой кислоты получено взаимодействием производного гиалуроновой кислоты, содержащего повторяющуюся единицу формулы (IIb) и повторяющуюся единицу формулы (Ia):
Химическая формула 4
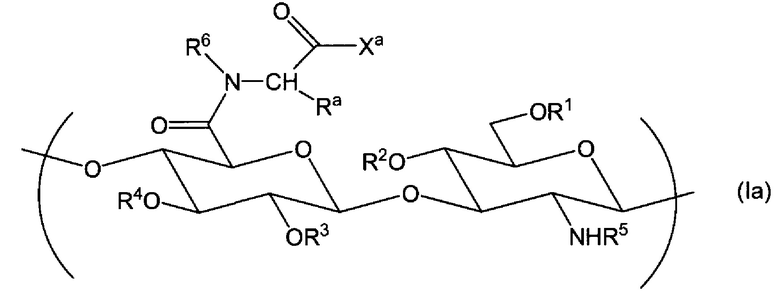 ,
,
где Ха выбран из гидрокси, -О-Q+, С1-6алкокси и -NR7R8, и R1, R2, R3, R4, R5, R6, R7, R8, Q+ и Ra являются такими, как определено в пункте (1) выше, с соединением формулы -HNR9-Z1-Z2, где R9, Z1 и Z2 являются такими, как определено в пункте (1) выше.
В другом аспекте настоящего изобретения обеспечиваются фармацевтические композиции по следующим пунктам (11) и (12).
(11) Фармацевтическая композиция, содержащая производное гиалуроновой кислоты по любому из пунктов (1)-(10) выше и лекарственное средство.
(12) Фармацевтическая композиция по пункту (11), где лекарственное средство удерживается посредством образования комплекса с производным гиалуроновой кислоты.
В еще одном аспекте настоящего изобретения предоставлен комплекс производное гиалуроновой кислоты-лекарственное средство, где лекарственное средство удерживается в производном гиалуроновой кислоты по любому из пунктов (1)-(10) выше. Предпочтительно обеспечивается комплекс производное гиалуроновой кислоты-лекарственное средство, где производное гиалуроновой кислоты образует мелкие частицы ассоциацией в воде и удерживает лекарственное средство.
Кроме того, в еще одном из аспектов настоящего изобретения предоставлен биоразлагаемый носитель лекарственного средства, содержащий производное гиалуроновой кислоты по любому из пунктов (1)-(10).
Кроме того, в еще одном аспекте настоящего изобретения предоставлен способ введения лекарственного средства, включающий введение терапевтически эффективного количества лекарственного средства с производным гиалуроновой кислоты по любому из пунктов (1)-(10).
Арил (необязательно замещенный одной или более гидроксигруппами) в Ra предпочтительно является незамещенным, если Х1 представляет собой гидрокси, -O-Q+ или -NR9-Z1-Z2.
Преимущественные эффекты изобретения
При использовании производного гиалуроновой кислоты по настоящему изобретению можно обеспечить препарат с замедленным высвобождением, содержащий большое количество лекарственного средства, в частности, низкомолекулярного соединения, или белка или пептида, обладающего эффективностью, одновременно сохраняя его биологическую активность. Кроме того, производные гиалуроновой кислоты являются превосходными в отношении безопасности и обладают особенно превосходными свойствами в качестве носителя для фармацевтических препаратов и в качестве матрикса для подкожных инъекций для непрерывного введения, в отношении одновременного удерживания лекарственного средства в крови и биоразлагаемости. Кроме того, фармакокинетика препаратов, полученных с данными производными, может контролироваться изменением степени модификации карбоксигруппы, т.е. процента введения группы -NR9-Z1-Z2 и/или аминокислоты (включая амид аминокислоты) в производные гиалуроновой кислоты по настоящему изобретению.
Краткое описание фигур
На фиг. 1-1 представлен пример 1Н-ЯМР спектра гидрохлорида холестерил-6-аминогексилкарбамата (Chol-C6), полученного в примере 1-1.
На фиг. 1-2 представлен пример 1Н-ЯМР спектра (растворитель: D2O) тетрабутиламмониевой (TBA) соли гиалуроновой кислоты (ГК-TBA), полученной из исходного соединения ГК-Na с молекулярной массой 99 кДа, полученного в примере 1-3.
На фиг. 1-3 представлен пример 1Н-ЯМР спектра ГК-Ala, полученного из исходного соединения ГК-Na с молекулярной массой 99 кДа, полученного в примере 1-4.
На фиг. 1-4 представлен пример 1Н-ЯМР спектра ГК-Ala-Chol/FL, полученного из исходного соединения ГК-Na с молекулярной массой 99 кДа, полученного в примере 1-4 (степень введения холестерильной группы: 7%).
На фиг. 1-5 представлен пример 1Н-ЯМР спектра ГК-ThrNH2-Chol/FL, полученного из исходного соединения ГК-Na с молекулярной массой 99 кДа, полученного в примере 1-5 (степень введения холестерильной группы: 6%).
На фиг. 1-6 представлен пример 1Н-ЯМР спектра ГК-Ser-OEt/FL, полученного в примере 1-6.
На фиг. 1-7 представлен пример 1Н-ЯМР спектра ГК-Ser, полученного в примере 1-6.
На фиг. 1-8 представлен пример 1Н-ЯМР спектра ГК-Ser-Chol/FL, полученного в примере 1-6 (степень введения холестерильной группы: 6%).
На фиг. 1-9 представлен пример 1Н-ЯМР спектра ГК-Gly-OEt, полученного в примере 1-7.
На фиг. 1-10 представлен пример 1Н-ЯМР спектра ГК-Gly, полученного в примере 1-7.
На фиг. 1-11 представлен пример 1Н-ЯМР спектра ГК-Gly-Chol/FL, полученного в примере 1-7 (степень введения холестерильной группы: 6%).
На фиг. 1-12 представлен пример 1Н-ЯМР спектра ГК-Thr, полученного в примере 1-8.
На фиг. 1-13 представлен пример 1Н-ЯМР спектра ГК-Thr-Chol/FL, полученного в примере 1-8 (степень введения холестерильной группы: 6%).
На фиг. 1-14 представлен пример 1Н-ЯМР спектра ГК-Asn, полученного в примере 1-9.
На фиг. 1-15 представлен пример 1Н-ЯМР спектра ГК-Asn-Chol/FL, полученного в примере 1-9 (степень введения холестерильной группы: 7%).
На фиг. 1-16 представлен пример 1Н-ЯМР спектра ГК-Asp, полученного в примере 1-10.
На фиг. 1-17 представлен пример 1Н-ЯМР спектра ГК-Asp-Chol/FL, полученного в примере 1-10 (степень введения холестерильной группы: 6%).
На фиг. 1-18 представлен пример 1Н-ЯМР спектра ГК-Ile, полученного в примере 1-11.
На фиг. 1-19 представлен пример 1Н-ЯМР спектра ГК-Ile-Chol/FL, полученного в примере 1-11 (степень введения холестерильной группы: 6%).
На фиг. 1-20 представлен пример 1Н-ЯМР спектра ГК-Leu, полученного в примере 1-12.
На фиг. 1-21 представлен пример 1Н-ЯМР спектра ГК-Leu-Chol/FL, полученного в примере 1-12 (степень введения холестерильной группы: 6%).
На фиг. 1-22 представлен пример 1Н-ЯМР спектра ГК-Val, полученного в примере 1-13.
На фиг. 1-23 представлен пример 1Н-ЯМР спектра ГК-Val-Chol/FL, полученного в примере 1-13 (степень введения холестерильной группы: 6%).
На фиг. 1-24 представлен пример 1Н-ЯМР спектра ГК-Phe, полученного в примере 1-14.
На фиг. 1-25 представлен пример 1Н-ЯМР спектра ГК-Phe-Chol/FL, полученного в примере 1-14 (степень введения холестерильной группы: 6%).
На фиг. 1-26 представлен пример 1Н-ЯМР спектра (растворитель: смешанный раствор 0,02Н DCl ДМСО-d6/D2O) ГК-SerNH2-Chol/FL, полученного в примере 1-15 (степень введения холестерильной группы: 6%).
На фиг. 1-27 представлен пример 1Н-ЯМР спектра (растворитель:D2O) ГК-SerNH2-Chol/FL, полученного в примере 1-15 (степень введения холестерильной группы: 6%).
На фиг. 1-28 представлен пример 1Н-ЯМР спектра (растворитель: смешанный раствор 0,02Н DCl ДМСО-d6/D2O) ГК-GlyNH2/Chol/FL, полученного в примере 1-16 (степень введения холестерильной группы: 6%).
На фиг. 1-29 представлен пример 1Н-ЯМР спектра (растворитель:D2O) ГК-GlyNH2/Chol/FL, полученного в примере 1-16 (степень введения холестерильной группы: 6%).
На фиг. 1-30 представлен пример 1Н-ЯМР спектра ГК-LeuNH2/Chol/FL, полученного в примере 1-17 (степень введения холестерильной группы: 6%).
На фиг. 1-31 представлен пример 1Н-ЯМР спектра ГК-ValNH2/Chol/FL, полученного в примере 1-18 (степень введения холестерильной группы: 6%).
На фиг. 1-32 представлен пример 1Н-ЯМР спектра ГК-Ala/Chol/FL, полученного в примере 1-19 (степень введения холестерильной группы: 6%).
На фиг. 1-33 представлен пример 1Н-ЯМР спектра ГК-Ser-OEt/Chol/FL, полученного в примере 1-20.
На фиг. 1-34 представлен пример 1Н-ЯМР спектра ГК-Ser/Chol/FL, полученного в примере 1-20 (степень введения холестерильной группы: 6%).
На фиг. 1-35 представлен пример 1Н-ЯМР спектра ГК-Chol/FL, полученного в сравнительном примере 1-1 (степень введения холестерильной группы: 6%).
На фиг. 1-36 представлен пример 1Н-ЯМР спектра ГК-EDOBEA, полученного в сравнительном примере 1-2.
На фиг. 1-37 представлен пример 1Н-ЯМР спектра ГК-EDOBEA-Ac/FL, полученного в сравнительном примере 1-2.
На фиг. 1-38 представлен пример 1Н-ЯМР спектра ГК-Tyr, полученного в сравнительном примере 1-3.
На фиг. 1-39 представлен пример 1Н-ЯМР спектра ГК-Tyr-Chol/FL, полученного в сравнительном примере 1-3 (степень введения холестерильной группы: 6%).
На фиг. 2-1-1 представлен график, показывающий изменения концентрации 99k ГК-Ala-Chol-7%/FL в плазме крови (таблица 9: образец 2-1) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-2 представлен график, показывающий изменения концентрации 99k ГК-Ala-Chol-24%/FL в плазме крови (таблица 9: образец 2-2) и 99k ГК-Chol-24%/FL (таблица 9: сравнительный образец 2-2) (пример 2-2).
На фиг. 2-1-3 представлен график, показывающий изменения концентрации 99k ГК-Ala-Chol-30%/FL в плазме крови (таблица 9: образец 2-3) и 99k ГК-Chol-25%/FL (таблица 9: сравнительный образец 2-3) (пример 2-2).
На фиг. 2-1-4 представлен график, показывающий изменения концентрации 50k ГК-Ala-Chol-6%/FL в плазме крови (таблица 9: образец 2-4) и 50k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-4) (пример 2-2).
На фиг. 2-1-5 представлен график, показывающий изменения концентрации 50k ГК-Ala-Chol-22%/FL в плазме крови (таблица 9: образец 2-5) и 50k ГК-Chol-20%/FL (таблица 9: сравнительный образец 2-5) (пример 2-2).
На фиг. 2-1-6 представлен график, показывающий изменения концентрации 50k ГК-Ala-Chol-26%/FL в плазме крови (таблица 9: образец 2-6) и 50k ГК-Chol-27%/FL (таблица 9: сравнительный образец 2-6) (пример 2-2).
На фиг. 2-1-7 представлен график, показывающий изменения концентрации 10k ГК-Ala-Chol-16%/FL в плазме крови (таблица 9: образец 2-7) и 10k ГК-Chol-15%/FL (таблица 9: сравнительный образец 2-7) (пример 2-2).
На фиг. 2-1-8 представлен график, показывающий изменения концентрации 99k ГК-ThrNH2/Chol-6%/FL в плазме крови (таблица 9: образец 2-8) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-9 представлен график, показывающий изменения концентрации 99k ГК-ThrNH2/Chol-24%/FL в плазме крови (таблица 9: образец 2-9) и 99k ГК-Chol-24%/FL (таблица 9: сравнительный образец 2-2) (пример 2-2).
На фиг. 2-1-10 представлен график, показывающий изменения концентрации 99k ГК-ThrNH2/Chol-31%/FL в плазме крови (таблица 9: образец 2-10) и 99k ГК-Chol-25%/FL (таблица 9: сравнительный образец 2-3) (пример 2-2).
На фиг. 2-1-11 представлен график, показывающий изменения концентрации 99k ГК-Ser-Chol-6%/FL в плазме крови (таблица 9: образец 2-11) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-12 представлен график, показывающий изменения концентрации 99k ГК-Gly-Chol-6%/FL в плазме крови (таблица 9: образец 2-12) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-13 представлен график, показывающий изменения концентрации 99k ГК-Thr-Chol-6%/FL в плазме крови (таблица 9: образец 2-13) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-14 представлен график, показывающий изменения концентрации 99k ГК-Asn-Chol-7%/FL в плазме крови (таблица 9: образец 2-14) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-15 представлен график, показывающий изменения концентрации 99k ГК-Asp-Chol-6%/FL в плазме крови (таблица 9: образец 2-15) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-16 представлен график, показывающий изменения концентрации 99k ГК-Ile-Chol-6%/FL в плазме крови (таблица 9: образец 2-16) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-17 представлен график, показывающий изменения концентрации 99k ГК-Leu-Chol-6%/FL в плазме крови (таблица 9: образец 2-17) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-18 представлен график, показывающий изменения концентрации 99k ГК-Val-Chol-6%/FL в плазме крови (таблица 9: образец 2-18) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-19 представлен график, показывающий изменения концентрации 99k ГК-Phe-Chol-6%/FL в плазме крови (таблица 9: образец 2-19) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-20 представлен график, показывающий изменения концентрации 99k ГК-ValNH2/Chol-6%/FL в плазме крови (таблица 9: образец 2-20) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-21 представлен график, показывающий изменения концентрации 99k ГК-SerNH2/Chol-6%/FL в плазме крови (таблица 9: образец 2-21) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-22 представлен график, показывающий изменения концентрации 99k ГК-LeuNH2/Chol-6%/FL в плазме крови (таблица 9: образец 2-22) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-23 представлен график, показывающий изменения концентрации 99k ГК-GlyNH2/Chol-6%/FL в плазме крови (таблица 9: образец 2-23) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-24 представлен график, показывающий изменения концентрации 99k ГК-Ala/Chol-6%/FL в плазме крови (таблица 9: образец 2-24) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-25 представлен график, показывающий изменения концентрации 99k ГК-Ser/Chol-6%/FL в плазме крови (таблица 9: образец 2-25) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-1-26 представлен график, показывающий изменения концентрации 99k ГК-Tyr-Chol-6%/FL в плазме крови (таблица 9: образец 2-8) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 2-2).
На фиг. 2-2-1 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Ala-Chol-7%/FL (таблица 9: образец 2-1) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-2 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Ala-Chol-24%/FL (таблица 9: образец 2-2) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-3 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Ala-Chol-30%/FL (таблица 9: образец 2-3) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-4 представлены результаты анализа эксклюзионной хроматографией 50k ГК-Ala-Chol-6%/FL (таблица 9: образец 2-4) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-5 представлены результаты анализа эксклюзионной хроматографией 50k ГК-Ala-Chol-22%/FL (таблица 9: образец 2-5) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-6 представлены результаты анализа эксклюзионной хроматографией 50k ГК-Ala-Chol-26%/FL (таблица 9: образец 2-6) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-7 представлены результаты анализа эксклюзионной хроматографией 10k ГК-Ala-Chol-16%/FL (таблица 9: образец 2-7) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-8 представлены результаты анализа эксклюзионной хроматографией 99k ГК-ThrNH2/Chol-6%/FL (таблица 9: образец 2-8) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-9 представлены результаты анализа эксклюзионной хроматографией 99k ГК-ThrNH2/Chol-24%/FL (таблица 9: образец 2-9) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-10 представлены результаты анализа эксклюзионной хроматографией 99k ГК-ThrNH2/Chol-31%/FL (таблица 9: образец 2-10) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-11 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Ser-Chol-6%/FL (таблица 9: образец 2-11) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-12 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Gly-Chol-6%/FL (таблица 9: образец 2-12) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-13 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Thr-Chol-6%/FL (таблица 9: образец 2-13) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-14 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Asn-Chol-7%/FL (таблица 9: образец 2-14) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-15 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Asp-Chol-6%/FL (таблица 9: образец 2-15) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-16 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Ile-Chol-6%/FL (таблица 9: образец 2-16) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-17 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Leu-Chol-6%/FL (таблица 9: образец 2-17) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-18 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Val-Chol-6%/FL (таблица 9: образец 2-18) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-19 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Phe-Chol-6%/FL (таблица 9: образец 2-19) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-20 представлены результаты анализа эксклюзионной хроматографией 99k ГК-ValNH2/Chol-6%/FL (таблица 9: образец 2-20) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-21 представлены результаты анализа эксклюзионной хроматографией 99k ГК-SerNH2/Chol-6%/FL (таблица 9: образец 2-21) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-22 представлены результаты анализа эксклюзионной хроматографией 99k ГК-LeuNH2/Chol-6%/FL (таблица 9: образец 2-22) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-23 представлены результаты анализа эксклюзионной хроматографией 99k ГК-GlyNH2/Chol-6%/FL (таблица 9: образец 2-23) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-24 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Ala/Chol-6%/FL (таблица 9: образец 2-24) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-25 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Ser/Chol-6%/FL (таблица 9: образец 2-25) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-26 представлены результаты анализа эксклюзионной хроматографией 99k ГК-EDOBEA-Ac/FL (сравнительный пример 1-2) и пробы печени мыши, получавшей данный образец, которые указывают на отсутствие метаболизма введенного образца в мышиной печени (пример 2-3).
На фиг. 2-2-27 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Tyr-Chol-6%/FL (таблица 9: сравнительный образец 2-8) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 2-3).
На фиг. 2-3-1 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Ala-Chol-7%/FL (таблица 9: образец 2-1), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-2 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Ala-Chol-24%/FL (таблица 9: образец 2-2), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-3 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Ala-Chol-30%/FL (таблица 9: образец 2-3), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-4 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 50k ГК-Ala-Chol-6%/FL (таблица 9: образец 2-4), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-5 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 50k ГК-Ala-Chol-22%/FL (таблица 9: образец 2-5), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с наиболее высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-6 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 50k ГК-Ala-Chol-26%/FL (таблица 9: образец 2-6), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-7 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 10k ГК-Ala-Chol-16%/FL (таблица 9: образец 2-7), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-8 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-ThrNH2/Chol-6%/FL (таблица 9: образец 2-8), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-9 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-ThrNH2/Chol-24%/FL (таблица 9: образец 2-9), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-10 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-ThrNH2/Chol-31%/FL (таблица 9: образец 2-10), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-11 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Ser-Chol-6%/FL (таблица 9: образец 2-11), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-12 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Gly-Chol-6%/FL (таблица 9: образец 2-12), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-13 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Thr-Chol-6%/FL (таблица 9: образец 2-13), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-14 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Asn-Chol-7%/FL (таблица 9: образец 2-14), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-15 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Asp-Chol-6%/FL (таблица 9: образец 2-15), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-16 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Ile-Chol-6%/FL (таблица 9: образец 2-16), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-17 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Leu-Chol-6%/FL (таблица 9: образец 2-17), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-18 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Vak-Chol-6%/FL (таблица 9: образец 2-18), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-19 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Phe-Chol-6%/FL (таблица 9: образец 2-19), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-20 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-ValNH2/Chol-6%/FL (таблица 9: образец 2-20), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-21 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-SerNH2/Chol-6%/FL (таблица 9: образец 2-21), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-22 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-LeuNH2/Chol-6%/FL (таблица 9: образец 2-22), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-23 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-GlyNH2/Chol-6%/FL (таблица 9: образец 2-23), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-24 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Ala/Chol-6%/FL (таблица 9: образец 2-24), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-25 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Ser/Chol-6%/FL (таблица 9: образец 2-25), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-26 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-EDOBEA-Ac/FL (сравнительный пример 1-2), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 2-3-27 представлены результаты анализа эксклюзионной хроматографией проб мочи мыши, получавшей 99k ГК-Tyr-Chol-6%/FL (таблица 9: сравнительный образец 2-8), где хроматограммы во временных точках в такой же шкале показаны слева и нормализованные с самыми высокими пиками показаны справа (пример 2-4).
На фиг. 3-1 представлен пример ЯМР спектра ГК-Gln, полученного в примере 3-1.
На фиг. 3-2 представлен пример ЯМР спектра ГК-Gln-Chol/FL, полученного в примере 3-1 (степень введения холестерильной группы: 6%).
На фиг. 3-3 представлен пример ЯМР спектра ГК-Met, полученного в примере 3-2.
На фиг. 3-4 представлен пример ЯМР спектра ГК-Met-Chol/FL, полученного в примере 3-2 (степень введения холестерильной группы: 6%).
На фиг. 3-5 представлен пример ЯМР спектра ГК-AlaNH2/Chol/FL, полученного в примере 3-3 (степень введения холестерильной группы: 6%).
На фиг. 3-6 представлен пример ЯМР спектра ГК-AsnNH2/Chol/FL, полученного в примере 3-4 (степень введения холестерильной группы: 6%).
На фиг. 3-7 представлен пример ЯМР спектра ГК-AsnNH2/Chol/FL, полученного в примере 3-4 (степень введения холестерильной группы: 6%).
На фиг. 3-8 представлен пример ЯМР спектра ГК-IleNH2/Chol/FL, полученного в примере 3-5 (степень введения холестерильной группы: 6%).
На фиг. 3-9 представлен пример ЯМР спектра ГК-GlnNH2/Chol/FL, полученного в примере 3-6 (степень введения холестерильной группы: 6%).
На фиг. 3-10 представлен пример ЯМР спектра ГК-MetNH2/Chol/FL, полученного в примере 3-7 (степень введения холестерильной группы: 6%).
На фиг. 3-11 представлен пример ЯМР спектра ГК-Glu, полученного в сравнительном примере 3-1.
На фиг. 3-12 представлен пример ЯМР спектра ГК-Glu-Chol/FL, полученного в сравнительном примере 3-1 (степень введения холестерильной группы: 6%).
На фиг. 3-13 представлен пример ЯМР спектра ГК-Thr, полученного в сравнительном примере 3-2.
На фиг. 3-14 представлен пример ЯМР спектра ГК-Thr-Chol/FL, полученного в сравнительном примере 3-2 (степень введения холестерильной группы: 6%).
На фиг. 4-1-1 представлен график, показывающий изменения концентрации 99k ГК-Gln-Chol-6%/FL в плазме крови (таблица 15: образец 4-1) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 4-2).
На фиг. 4-1-2 представлен график, показывающий изменения концентрации 99k ГК-Met-Chol-6%/FL в плазме крови (таблица 15: образец 4-2) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 4-2).
На фиг. 4-1-3 представлен график, показывающий изменения концентрации 99k ГК-AlaNH2/Chol-6%/FL в плазме крови (таблица 15: образец 4-3) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 4-2).
На фиг. 4-1-4 представлен график, показывающий изменения концентрации 99k ГК-AsnNH2/Chol-6%/FL в плазме крови (таблица 15: образец 4-4) и 99k ГК-Chol-6%/FL (таблица 19: сравнительный образец 2-1) (пример 4-2).
На фиг. 4-1-5 представлен график, показывающий изменения концентрации 99k ГК-IleNH2/Chol-6%/FL в плазме крови (таблица 15: образец 4-5) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 4-2).
На фиг. 4-1-6 представлен график, показывающий изменения концентрации 99k ГК-GlnNH2/Chol-6%/FL в плазме крови (таблица 15: образец 4-6) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 4-2).
На фиг. 4-1-7 представлен график, показывающий изменения концентрации 99k ГК-MetNH2/Chol-6%/FL в плазме крови (таблица 15: образец 4-7) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 4-2).
На фиг. 4-1-8 представлен график, показывающий изменения концентрации 99k ГК-Glu-Chol-6%/FL в плазме крови (таблица 15: сравнительный образец 4-1) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 4-2).
На фиг. 4-1-9 представлен график, показывающий изменения концентрации 99k ГК-Thr-Chol-6%/FL в плазме крови (таблица 15: сравнительный образец 4-2) и 99k ГК-Chol-6%/FL (таблица 9: сравнительный образец 2-1) (пример 4-2).
На фиг. 4-1-10 представлен график, показывающий изменения концентрации 10k ГК-Tyr-Chol-7%/FL в плазме крови (таблица 15: сравнительный образец 4-3) и 99k ГК-Chol-15%/FL (таблица 9: сравнительный образец 2-7) (пример 4-2).
На фиг. 4-2-1 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Gln-Chol-6%/FL (таблица 15: образец 4-1) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 4-3).
На фиг. 4-2-2 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Met-Chol-6%/FL (таблица 15: образец 4-2) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 4-3).
На фиг. 4-2-3 представлены результаты анализа эксклюзионной хроматографией 99k ГК-AlaNH2/Chol-6%/FL (таблица 15: образец 4-3) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 4-3).
На фиг. 4-2-4 представлены результаты анализа эксклюзионной хроматографией 99k ГК-AsnNH2/Chol-6%/FL (таблица 15: образец 4-4) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 4-3).
На фиг. 4-2-5 представлены результаты анализа эксклюзионной хроматографией 99k ГК-IleNH2/Chol-6%/FL (таблица 15: образец 4-5) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 4-3).
На фиг. 4-2-6 представлены результаты анализа эксклюзионной хроматографией 99k ГК-GlnNH2/Chol-6%/FL (таблица 15: образец 4-6) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 4-3).
На фиг. 4-2-7 представлены результаты анализа эксклюзионной хроматографией 99k ГК-MetNH2/Chol-6%/FL (таблица 15: образец 4-7) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 4-3).
На фиг. 4-2-8 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Glu-Chol-6%/FL (таблица 15: сравнительный образец 4-1) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 4-3).
На фиг. 4-2-9 представлены результаты анализа эксклюзионной хроматографией 99k ГК-Trp-Chol-6%/FL (таблица 15: сравнительный образец 4-2) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 4-3).
На фиг. 4-2-10 представлены результаты анализа эксклюзионной хроматографией 10k ГК-Tyr-Chol-7%/FL (таблица 15: сравнительный образец 4-3) и пробы печени мыши, получавшей данный образец, которые указывают на метаболизм введенного образца в мышиной печени (пример 4-3).
На фиг. 5-1 представлен пример ЯМР спектра ГК-TyrNH2/Chol/FL, полученного в примере 5-1 (степень введения холестерильной группы: 6%).
На фиг. 5-2 представлен пример ЯМР спектра ГК-TrpNH2/Chol/FL, полученного в примере 5-2 (степень введения холестерильной группы: 6%).
На фиг. 5-3 представлен пример ЯМР спектра ГК-PheNH2/Chol/FL, полученного в примере 5-3 (степень введения холестерильной группы: 6%).
На фиг. 6-1-1 представлен график, показывающий инкапсулирование паклитаксела, слаборастворимого лекарственного средства, производным гиалуроновой кислоты по настоящему изобретению (образование комплекса производного гиалуроновой кислоты по настоящему изобретению и паклитаксела) в примере 6-1, где на оси ординат указана концентрация паклитаксела (растворимость) в супернатанте, которая повышается в присутствии производного гиалуроновой кислоты по настоящему изобретению. Более высокое значение на оси ординат указывает на большее инкапсулирование.
На фиг. 6-1-2 представлен график, показывающий инкапсулирование паклитаксела, слаборастворимого лекарственного средства, производным гиалуроновой кислоты по настоящему изобретению (образование комплекса производного гиалуроновой кислоты по настоящему изобретению и паклитаксела) в примере 6-1, где на оси ординат указана концентрация паклитаксела (растворимость) в супернатанте, которая повышается в присутствии производного гиалуроновой кислоты по настоящему изобретению. Более высокое значение на оси ординат указывает на большее инкапсулирование.
На фиг. 6-1-3 представлен график, показывающий инкапсулирование паклитаксела, слаборастворимого лекарственного средства, производным гиалуроновой кислоты по настоящему изобретению (образование комплекса производного гиалуроновой кислоты по настоящему изобретению и паклитаксела) в примере 6-1, где на оси ординат указана концентрация паклитаксела (растворимость) в супернатанте, которая повышается в присутствии производного гиалуроновой кислоты по настоящему изобретению. Более высокое значение на оси ординат указывает на большее инкапсулирование.
На фиг. 6-1-4 представлен график, показывающий инкапсулирование паклитаксела, слаборастворимого лекарственного средства, производным гиалуроновой кислоты по настоящему изобретению (образование комплекса производного гиалуроновой кислоты по настоящему изобретению и паклитаксела) в примере 6-1, где на оси ординат указана концентрация паклитаксела (растворимость) в супернатанте, которая повышается в присутствии производного гиалуроновой кислоты по настоящему изобретению. Более высокое значение на оси ординате указывает на большее инкапсулирование.
На фиг. 6-2-1 представлен график, показывающий инкапсулирование циклоспорина, слаборастворимого лекарственного средства, производным гиалуроновой кислоты по настоящему изобретению (образование комплекса производного гиалуроновой кислоты по настоящему изобретению и циклоспорина) в примере 6-2, где на оси ординат указана концентрация циклоспорина (растворимость) в супернатанте, которая повышается в присутствии производного гиалуроновой кислоты по настоящему изобретению. Более высокое значение на оси ординат указывает на большее инкапсулирование.
На фиг. 6-2-2 представлен график, показывающий инкапсулирование циклоспорина, слаборастворимого лекарственного средства, производным гиалуроновой кислоты по настоящему изобретению (образование комплекса производного гиалуроновой кислоты по настоящему изобретению и циклоспорина) в примере 6-2, где на оси ординат указана концентрация циклоспорина (растворимость) в супернатанте, которая повышается в присутствии производного гиалуроновой кислоты по настоящему изобретению. Более высокое значение на оси ординат указывает на большее инкапсулирование.
На фиг. 6-2-3 представлен график, показывающий инкапсулирование циклоспорина, слаборастворимого лекарственного средства, производным гиалуроновой кислоты по настоящему изобретению (образование комплекса производного гиалуроновой кислоты по настоящему изобретению и циклоспорина) в примере 6-2, где на оси ординат указана концентрация циклоспорина (растворимость) в супернатанте, которая повышается в присутствии производного гиалуроновой кислоты по настоящему изобретению. Более высокое значение на оси ординат указывает на большее инкапсулирование.
На фиг. 6-2-4 представлен график, показывающий инкапсулирование циклоспорина, слаборастворимого лекарственного средства, производным гиалуроновой кислоты по настоящему изобретению (образование комплекса производного гиалуроновой кислоты по настоящему изобретению и циклоспорина) в примере 6-2, где на оси ординат указана концентрация циклоспорина (растворимость) в супернатанте, которая повышается в присутствии производного гиалуроновой кислоты по настоящему изобретению. Более высокое значение на оси ординат указывает на большее инкапсулирование.
На фиг. 7-1 представлен график, показывающий высвобождение паклитаксела из ГК-Ala-Chol-41% в примере 7-1, где значения на оси абсцисс и ординат соответственно представляют время (ч) и количество паклитаксела, инкапсулированного в ГК-Ala-Chol-41%, не подвергшегося высвобождению (находящегося в комплексе с ГК-Ala-Chol-41%).
На фиг. 7-2 представлен график, показывающий высвобождение циклоспорина из ГК-Ala-Chol-41% в примере 7-2, где значения на оси абсцисс и ординат соответственно представляют время (ч) и количество циклоспорина, инкапсулированного в ГК-Ala-Chol-41%, не подвергшегося высвобождению (находящегося в комплексе с ГК-Ala-Chol-41%).
На фиг. 8-1 представлен пример ЯМР спектра ГК-Ala-C2-Chol, полученного в примере 8 (степень введения холестерильной группы: 6%).
На фиг. 8-2 представлен пример ЯМР спектра ГК-Ala-C2-Chol, полученного в примере 8 (степень введения холестерильной группы: 7%).
На фиг. 8-3 представлен пример ЯМР спектра ГК-Ala-C12-Chol, полученного в примере 8 (степень введения холестерильной группы: 7%).
На фиг. 8-4 представлен пример ЯМР спектра ГК-Ala-C12-Chol, полученного в примере 8 (степень введения холестерильной группы: 7%).
На фиг. 8-5 представлен пример ЯМР спектра ГК-Ala-EO2-Chol, полученного в примере 8 (степень введения холестерильной группы: 5%).
На фиг. 8-6 представлен пример ЯМР спектра ГК-Ala-EO2-Chol, полученного в примере 8 (степень введения холестерильной группы: 6%).
На фиг. 8-7 представлен пример ЯМР спектра ГК-Ala-CA, полученного в примере 9-2 (степень введения холестерильной группы: 13%).
Описание вариантов осуществления
Производные гиалуроновой кислоты по настоящему изобретению представляют собой производные гиалуроновой кислоты, содержащие одну или более дисахаридных единиц (также повторяющиеся единицы) формулы (I).
В одном из вариантов осуществления настоящего изобретения производное гиалуроновой кислоты по существу состоит из повторяющихся единиц (а) вышеуказанной формулы (I), (b) вышеуказанных формул (I) и (II), (с) вышеуказанных формул (I) и (IIb) или (d) вышеуказанных формул (I) и (II), и (IIb). Производное гиалуроновой кислоты содержит дисахаридные повторяющиеся единицы D-глюкуроновой кислоты и N-ацетилглюкозамина, из которых, например, 80% или более, предпочтительно 90% или более, и более предпочтительно 95% или более представляют собой повторяющиеся единицы формулы (I) и (II), и (IIb). В одном из вариантов осуществления настоящего изобретения производное гиалуроновой кислоты состоит исключительно из повторяющихся единиц (а) вышеуказанной формулы (I), (b) вышеуказанных формул (I) и (II), (с) вышеуказанных формул (I) и (IIb) или (d) вышеуказанных формул (I) и (II), и (IIb).
Процент конкретной дисахаридной единицы по отношению к дисахаридным повторяющимся единицам в производном гиалуроновой кислоты по настоящему изобретению указывает на процент конкретной дисахаридной единицы по отношению ко всем дисахаридным единицам, содержащимся в определенном количестве производного гиалуроновой кислоты, которое составляет полисахарид, содержащий дисахаридные единицы в виде его повторяющихся единиц.
В формуле (I), представляющей дисахаридные единицы, входящие в состав производных гиалуроновой кислоты по настоящему изобретению, R1, R2, R3 и R4, предпочтительно все представляют собой атомы водорода. R5 предпочтительно представляет собой атом водорода или С1-6алкилкарбонил, более предпочтительно атом водорода или ацетил, и еще более предпочтительно ацетил. В формулах (II) и (IIb), представляющих дисахаридные единицы, входящие в состав производных гиалуроновой кислоты по настоящему изобретению, R1a, R2a, R3a и R4a, и R1b, R2b, R3b и R4b, предпочтительно все представляют собой атомы водорода. R5a и R5b предпочтительно представляют собой атом водорода или С1-6алкилкарбонил, более предпочтительно атом водорода или ацетил, и еще более предпочтительно оба представляют собой ацетил.
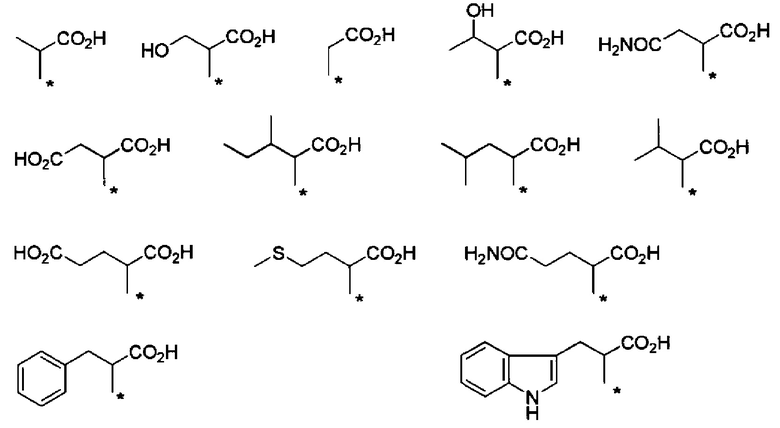
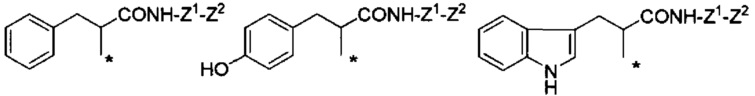
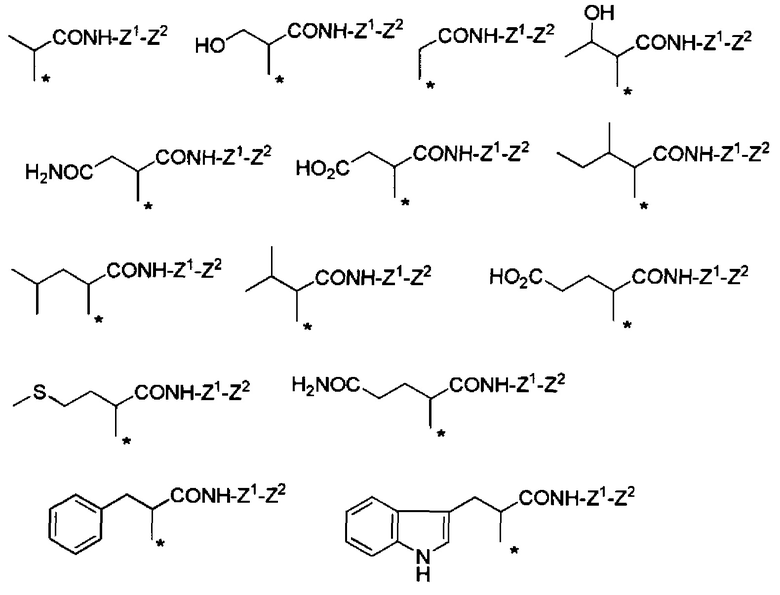
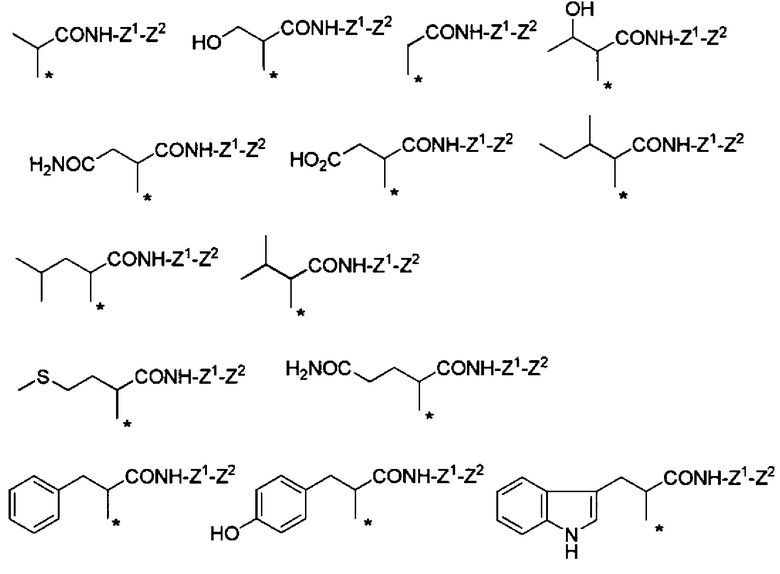
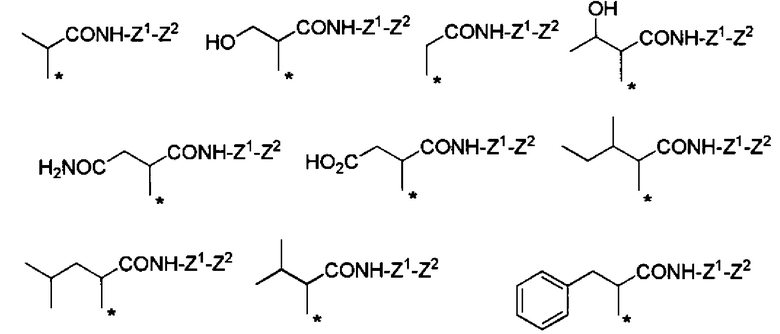
Конкретные примеры Ra в формуле (I) включают атом водорода, метил, гидроксиметил, 1-гидроксиэтил, карбамоилметил, карбоксиметил, 1-метилпропил, 2-метилпропил, изопропил, 2-карбоксиэтил, 2-метилтиоэтил, 2-карбамоилэтил, фенилметил, (4-гидроксифенил)метил и индол-3-илметил.
Если в группе -CHRa- имеется асимметричный центр, то он включает соответствующие оптически активные формы и их смеси. В отношении H2N-CHRa-COOH (аминокислота), то предпочтительно она представляет собой L-форму (природную форму).
В формуле (I) R6, R7, R8 и R9 независимо представляют собой, например, атом водорода или метил, но предпочтительно все являются атомами водорода.
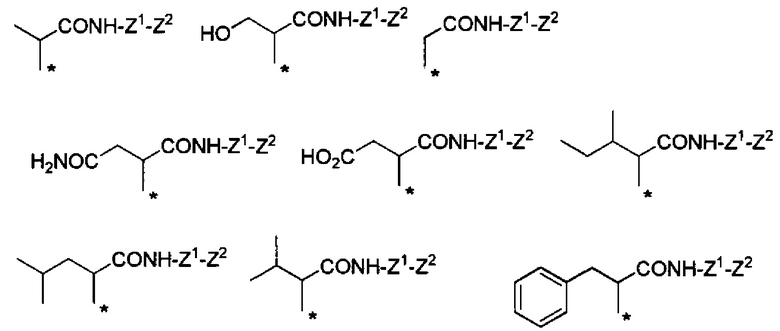
Например, группа -CHRa-COOH включена в качестве варианта осуществления группы -CHRa-CO-Х1 в формуле (I). Конкретные примеры данной группы включают следующие группы.
Химическая формула 5
 ,
,
* показывает положение присоединения к -NR6- (ниже относится к этому же).
Предпочтительные примеры группы -CHRa-COOH включают следующие группы.
Химическая формула 6
 .
.
Предпочтительные примеры группы -CHRa-COOH включают следующие группы.
Химическая формула 7
 .
.
Предпочтительные примеры группы -CHRa-COOH включают следующие группы.
Химическая формула 8
 .
.
Предпочтительные примеры группы -CHRa-COOH включают следующие группы.
Химическая формула 9
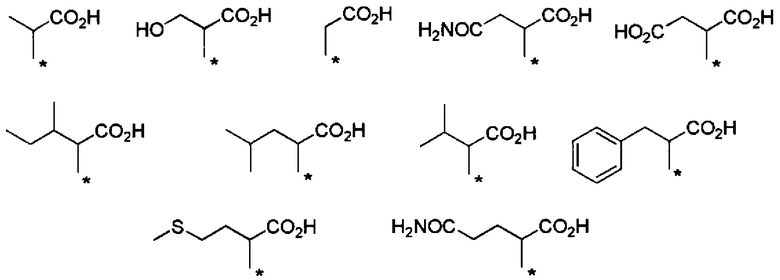 .
.
Предпочтительные примеры группы -CHRa-COOH включают следующие группы.
Химическая формула 10
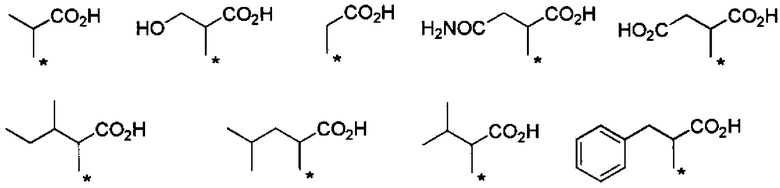 .
.
Любая из групп -CHRa-COOH, представленных выше, все или часть из них, могут быть преобразованы в группу -CHRa-CONH-Z1-Z2. Примеры группы -Z1-Z2 являются такими, как описано ниже.
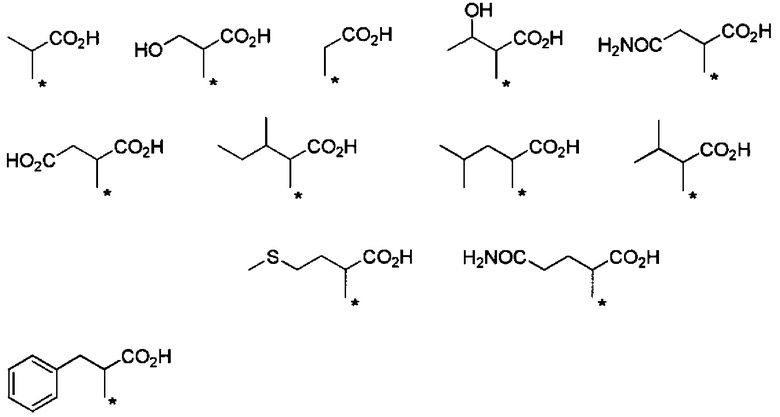
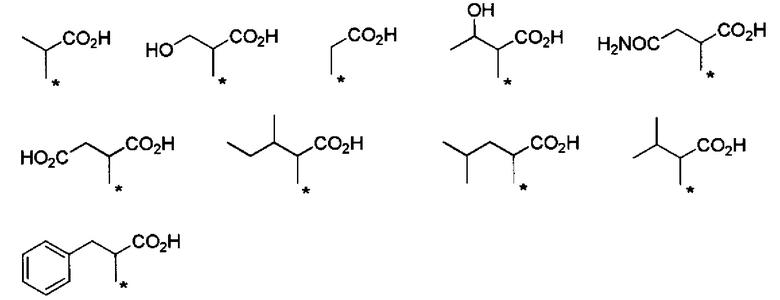
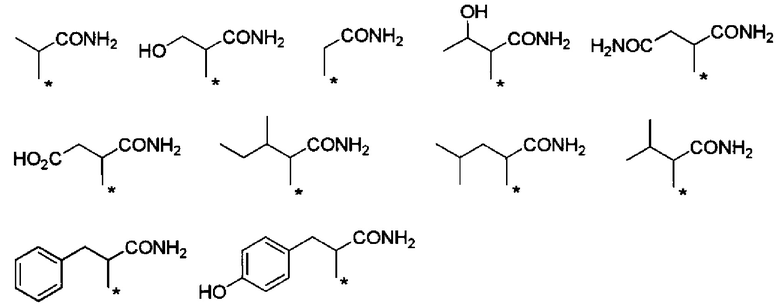
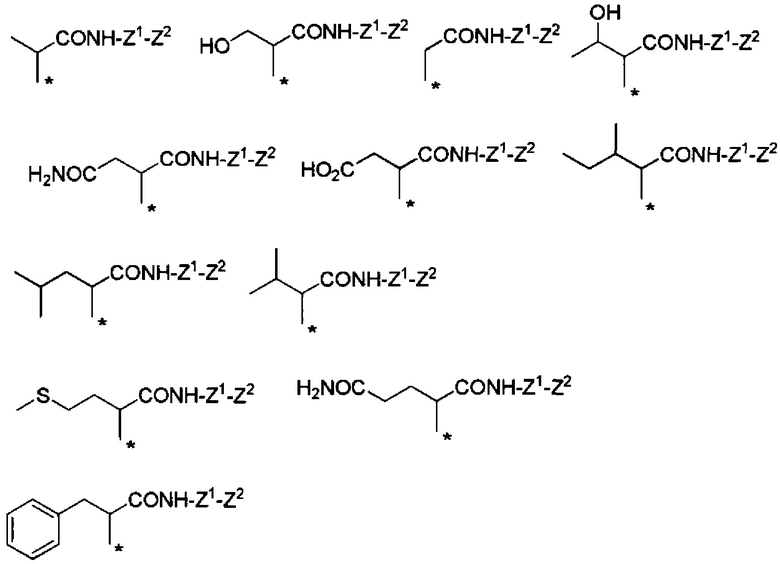
Другие формы группы -CHRa-CO-Х1 в формуле (I) включают группу -CHRa-CONH2. Конкретные примеры данной группы включают следующие группы.
Химическая формула 11
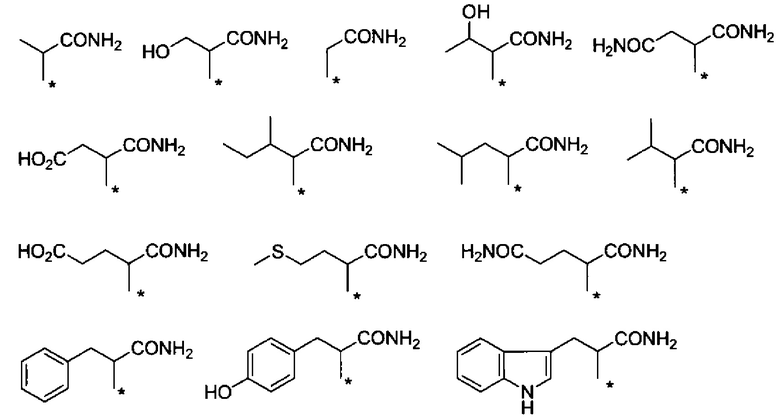 .
.
Предпочтительные примеры группы -CHRa-CONH2 включают следующие группы.
Химическая формула 12
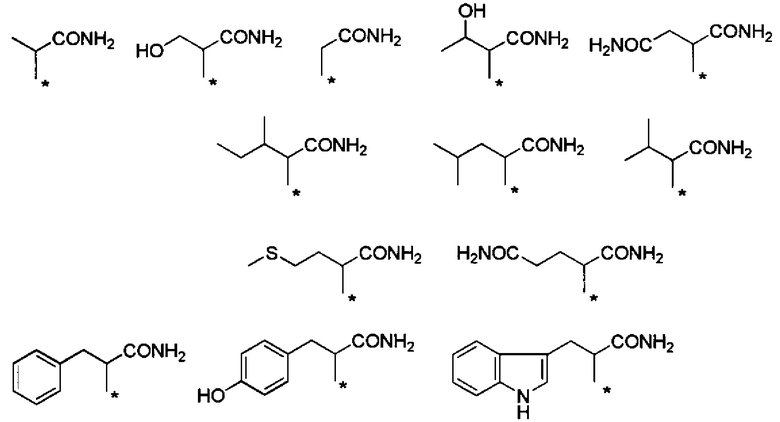 .
.
Предпочтительные примеры группы -CHRa-CONH2 включают следующие группы.
Химическая формула 13
 .
.
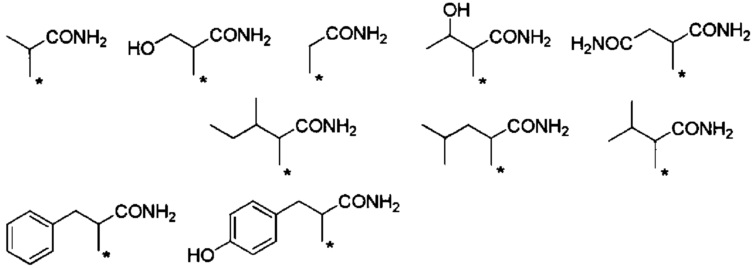
Предпочтительные примеры группы -CHRa-CONH2 включают следующие группы.
Химическая формула 14
 .
.
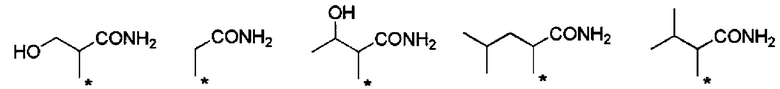
Предпочтительные примеры группы -CHRa-CONH2 включают следующие группы.
Химическая формула 15
 .
.
Также данные группы являются предпочтительными группами в том отношении, что обладают способностью к биоразлагаемости и удерживанию в крови.
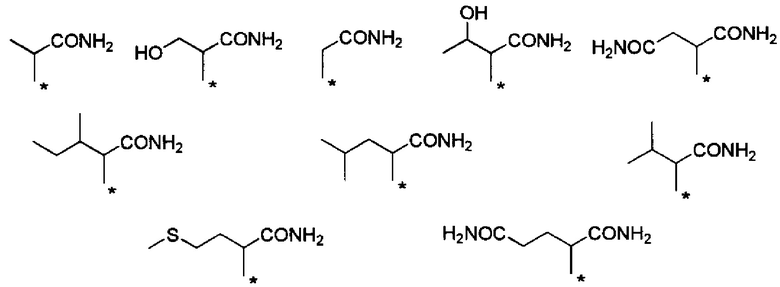
С точки зрения способности к биоразлагаемости и удерживанию в крови, предпочтительные примеры группы -CHRa-CONH2 включают следующие группы.
Химическая формула 16
 .
.
С точки зрения способности к биоразлагаемости и удерживанию в крови, более предпочтительные примеры группы -CHRa-CONH2 включают следующие группы.
Химическая формула 17
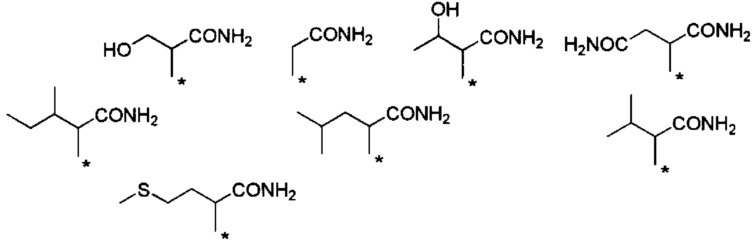 .
.
С точки зрения хорошей диспергируемости в чистой воде, более предпочтительные примеры группы -CHRa-CONH2 включают следующие группы.
Химическая формула 18
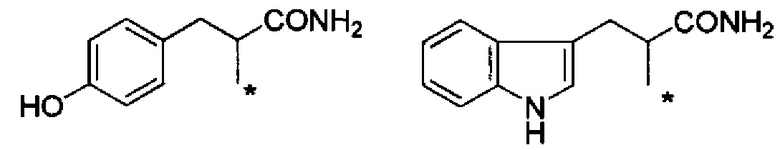 .
.
Данные две группы являются предпочтительными примерами также в отношении матрикса для подкожных инъекций для непрерывного введения.
С точки зрения матрикса для подкожных инъекций для непрерывного введения, предпочтительные примеры группы -CHRa-CONH2 включают следующие группы.
Химическая формула 19
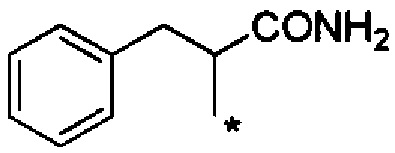 .
.
В качестве R7 атом водорода и метил являются более предпочтительными, и атом водорода является наиболее предпочтительным.
Карбоксигруппа, определенная в формуле (I), (II) и (IIb), может находиться в виде соли, представленной в формуле -COO-Q+. В формуле Q+ особым образом не ограничивается, при условии, что он представляет собой противокатион, образующий соль с карбоксигруппой в воде. Когда он является двухвалентным или более, то Q+ образует соль с множеством карбоксигрупп в зависимости от валентности. Пример противокатиона включает ионы металлов, такие как ион лития, ион натрия, ион рубидия, ион цезия, ион магния и ион кальция; и ионы аммония, представленные формулой N+RjRkRlRm, где Rj, Rk, Rl и Rm, каждый независимо, выбран из атома водорода и С1-6алкила. Предпочтительно примеры включают ион натрия, ион калия и ионы тетраалкиламмония (например, ион тетра-н-бутиламмония). Предпочтительно Rj, Rk, Rl и Rm, все являются одинаковой группой, выбранной из С1-6алкила, и предпочтительно н-бутила.
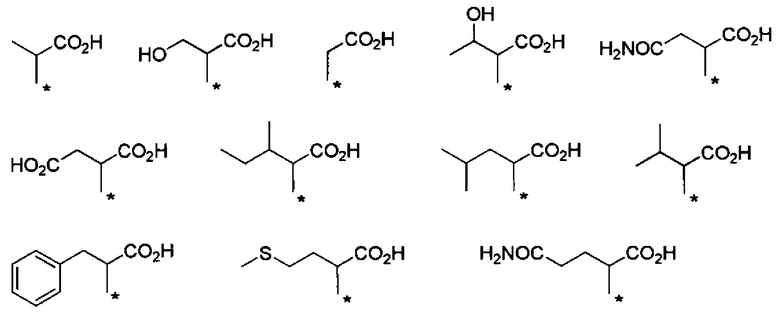
Другие формы группы -CHRa-CO-Х1 в формуле (I) включают группу -CHRa-CONH-Z1-Z2. Конкретные примеры данной группы включают следующие группы.
Химическая формула 20
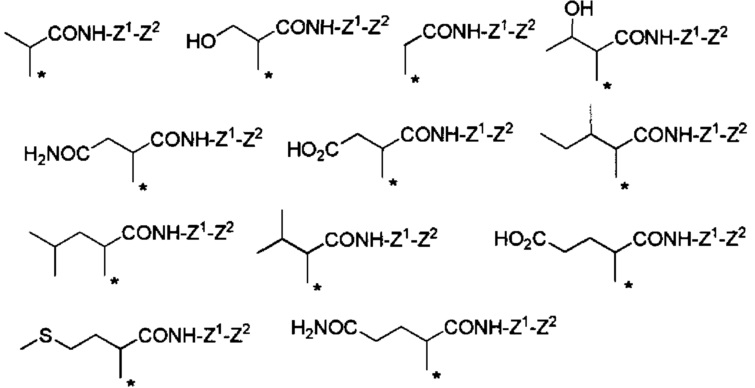
 .
.
Другие конкретные примеры группы включают следующие группы.
Химическая формула 21
 .
.
Предпочтительные примеры группы -CHRa-CONH-Z1-Z2 включают следующие группы.
Химическая формула 22
 .
.
Предпочтительные примеры группы -CHRa-CONH-Z1-Z2 включают следующие группы.
Химическая формула 23
 .
.
Предпочтительные примеры группы -CHRa-CONH-Z1-Z2 включают следующие группы.
Химическая формула 24
 .
.
С точки зрения способности к биоразлагаемости и удерживанию в крови, предпочтительные примеры группы -CHRa-CONH-Z1-Z2 включают следующие группы.
Химическая формула 25
 .
.
Примеры группы -Z1-Z2 включают группу -(С2-10алкилен)-NH-COO-Z3, а также группу -(С2-12алкилен)-NH-COO-Z3. Примеры С2-12алкилена предпочтительно включают -(СН2)2-, -(СН2)6-, -(СН2)8-, -(СН2)10- и -(СН2)12-, и более предпочтительно -(СН2)2- и -(СН2)6-. Примеры группы -Z1-Z2 включают группу -(СН2СН2О)m-СН2-СН2-NH-Z3. В формуле m предпочтительно равно 1-20, более предпочтительно 1-10 и более предпочтительно 1-3. Конкретные примеры предпочтительного m включают 2. Примеры группы -Z1-Z2 предпочтительно включают группу -(гексан-1,6-диил)-NH-СОО-Z3, группу -(этан-1,2-диил)-NH-СОО-Z3 и группу -(СН2СН2О)m-СН2-СН2-NH-Z3; более предпочтительно группу -(гексан-1,6-диил)-NH-СОО-холестерил, группу -(этан-1,2-диил)-NH-СОО-холестерил и -(СН2СН2О)m-СН2-СН2-NH-холаноил; и более предпочтительно группу -(гексан-1,6-диил)-NH-СОО-холестерил. Примеры -Z1, Z2 и группы -Z1-Z2 включают группы, соответствующие Y, X1 и группе -Y-X1, описанные в публикации международной заявки № 2010/053140. Примеры группы -CO-NRc-Z3 и группы -O-CO-NRc-Z3 включают соответствующие группы, где Rc представляет собой атом водорода.
Предпочтительно производные гиалуроновой кислоты по настоящему изобретению представляют собой производные гиалуроновой кислоты, содержащие повторяющиеся единицы формулы (II). В более предпочтительном варианте осуществления Х2 в формуле (II) и Х1 в формуле (I) являются одинаковыми. В одном аспекте настоящего изобретения предоставлено производное гиалуроновой кислоты, содержащее повторяющуюся единицу формулы (I), где Х1 представляет собой -NR9-Z1-Z2, повторяющуюся единицу формулы (II) и повторяющуюся единицу формулы (IIb).
Как используется в данном описании, термин «стерильная группа» относится к группе, имеющей стероидную структуру без особых ограничений. Конкретные примеры стероида включают холестерол, дегидрохолестерол, копростенол, копростерол, холестанол, кампестанол, эргостанол, стигмастанол, копростанол, стигмастерол, ситостерол, ланостерол, эргостерол, симиаренол, желчные кислоты (холановая кислота, литохолевая кислота, гиодезоксихолевая кислота, хенодезоксихолевая кислота, урсодезоксихолевая кислота, дезоксихолевая кислота, апохолевая кислота, холевая кислота, дегидрохолевая кислота, гликохолевая кислота, таурохолевая кислота), тестостерон, эстрадиол, прогестерон, кортизол, кортизон, альдостерон, кортикостерон и дезоксикортикостерон. Примеры стерильной группы включают холестерил, стигмастерил, ланостерил, эргостерил, холаноил и холоил. Предпочтительные примеры включают холестерильные группы (в частности, холест-5-ен-3β-ильную группу, представленную следующей формулой) и холаноильные группы (в частности, 5β-холан-24-оильную группу, представленную следующей формулой):
Химическая формула 26
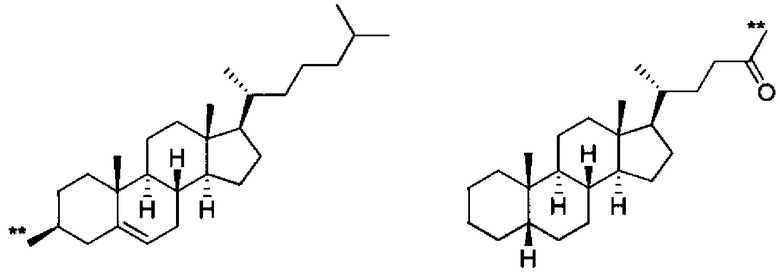 ,
,
где ** показывают положение присоединения к соседней группе.
Как используется в данном описании, термин «С1-20алкил» относится к линейной или разветвленной алкильной группе, содержащей 1-20 атомов углерода. Например, термин включает «С1-4алкил», такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, а также н-пентил, 3-метилбутил, 2-метилбутил, 1-метилбутил, 1-этилпропил, н-гексил, 4-метилпентил, 3-метилпентил, 2-метилпентил, 1-метилпентил, 3-этилбутил и 2-этилбутил. «С1-20алкил» включает «С1-12алкил», содержащий 1-12 атомов углерода, и «С1-6алкил», содержащий 1-6 атомов углерода.
Как используется в данном описании, термин «С1-6алкил» относится к линейной или разветвленной алкильной группе, содержащей 1-6 атомов углерода. Например, термин включает «С1-4алкил», такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил.
Как используется в данном описании, термин «С1-6алкокси» относится к линейному или разветвленному алкилу, содержащему 1-6 атомов углерода. Например, термин включает «С1-4алкокси», такой как метокси, этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, изобутокси и трет-бутокси.
Как используется в данном описании, термин «С1-6алкилкарбонил» относится к алкилкарбонильной группе, в которой алкильный фрагмент представляет собой С1-6алкил, определенный выше. Например, термин включает «С1-4алкилкарбонил», такой как ацетил, пропионил, н-пропилкарбонил, изопропилкарбонил, н-бутилкарбонил, втор-бутилкарбонил, изобутилкарбонил и трет-бутилкарбонил.
Как используется в данном описании, термин «С1-6алкокси» относится к алкоксигруппе, в которой алкильный фрагмент представляет собой С1-6алкил, определенный выше. Например, термин включает метокси (Н3С-О), этокси, н-пропокси, изопропокси, н-бутокси, втор-бутокси, изобутокси и трет-бутокси.
Как используется в данном описании, термин «С1-6алкилтио» относится к алкилтиогруппе, в которой алкильный фрагмент представляет собой С1-6алкил, определенный выше. Например, термин включает метилтио (H3C-S-), этилтио, н-пропилтио, изопропилтио, н-бутилтио, втор-бутилтио, изобутилтио и трет-бутилтио, но предпочтительно метилтио.
Как используется в данном описании, термин «амино-С2-20алкил» относится к линейному или разветвленному алкилу, содержащему 2-20 атомов углерода, который содержит аминогруппу в качестве заместителя. Например, аминогруппа может находиться на атоме углерода в конце алкила. Амино-С2-20алкил включает «амино-С2-12алкил», содержащий 2-12 атомов углерода.
Как используется в данном описании, термин «гидрокси-С2-20алкил» относится к линейному или разветвленному алкилу, содержащему 2-20 атомов углерода, который содержит гидроксигруппу в качестве заместителя. Например, гидроксигруппа может находиться на атоме углерода в конце алкила. Гидрокси-С2-20алкил включает «гидрокси-С2-12алкил», содержащий 2-12 атомов углерода.
Как используется в данном описании, термин «С2-30алкилен» относится к линейной или разветвленной, насыщенной двухвалентной углеводородной группе, содержащей 2-30 атомов углерода. Например, термин включает этилен и пропилен, а также С2-20алкилен, С2-8алкилен, группу -(СН2)n-, где n равно 2-30, предпочтительно 2-20 и более предпочтительно 2-15.
Как используется в данном описании, термин «С1-5алкилен» относится к линейной или разветвленной, насыщенной двухвалентной углеводородной группе, содержащей 1-5 атомов углерода. Например, термин включает этилен (этан-1,2-диил, этан-1,1-диил) и пропилен (пропан-1,1-диил, пропан-1,2-диил, пропан-1,3-диил), бутан-1,4-диил и пентан-1,5-диил.
Как используется в данном описании, термин «С2-10алкилен» относится к линейной или разветвленной, насыщенной двухвалентной углеводородной группе, содержащей 2-10 атомов углерода. Например, термин включает этилен (этан-1,2-диил, этан-1,1-диил), пропилен (пропан-1,1-диил, пропан-1,2-диил, пропан-1,3-диил), бутан-1,4-диил, пентан-1,5-диил, гексан-1,6-диил, гептан-1,7-диил и октан-1,8-диил. «С2-10алкилен» включает «С2-6алкилен», содержащий 2-6 атомов углерода, и «С2-8алкилен», содержащий 2-8 атомов углерода.
Как используется в данном описании, термин «С2-8алкилен» относится к линейной или разветвленной, насыщенной двухвалентной углеводородной группе, содержащей 2-8 атомов углерода. Например, термин включает этилен (этан-1,2-диил, этан-1,1-диил), пропилен (пропан-1,1-диил, пропан-1,2-диил, пропан-1,3-диил), бутан-1,4-диил, пентан-1,5-диил, гексан-1,6-диил, гептан-1,7-диил и октан-1,8-диил.
Как используется в данном описании, термин «С2-8алкенилен» относится к линейной или разветвленной, двухвалентной углеводородной группе, содержащей 2-8 атомов углерода, которая содержит одну или более двойных связей. Например, термин включает -СН=СН-, С(СН3)=СН-, 2-бутен-1,4-диил, гепта-2,4-диен-1,6-диил и окта-2,4,6-триен-1,8-диил. В случае геометрического изомеризма термин включает изомеры и их смеси.
Как используется в данном описании, термин «арил» относится к ароматической карбоциклической группе, например, ароматической карбоциклической группе, содержащей 6-14 атомов углерода. Примеры арила включают фенил и нафтил (1-нафтил и 2-нафтил). Примеры арила, замещенного одной или более гидроксигруппами, включают 4-гидроксифенил.
Как используется в данном описании, термин «гетероарил» относится к ароматической кольцевой группе, содержащей один или более гетероатомов, выбранных из атома азота, атома кислорода и атома серы, среди атомов, составляющих кольцо, которое может быть частично насыщенным. Кольцо может быть моноциклическим кольцом или бициклическим гетероарилом, конденсированным с бензольным кольцом или моноциклическим гетероарильным кольцом. Кольцо может состоять, например, из 4-15, предпочтительно 5-14, более предпочтительно 6-10 атомов. Примеры гетероарила включают, например, фурил, тиенил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиридил, пиримидил, пиридазинил, пиразинил, триазинил, бензофуранил, бензотиенил, бензотиадиазолил, бензотиазолил, бензоксазолил, бензоксадиазолил, бензимидазолил, индолил, изоиндолил, индазолил, хинолил, изохинолил, циннолинил, хиназолинил, хиноксалинил, бензодиоксолил, индолизинил и имидазопиридил; и индол-2-ил является предпочтительным.
Производные гиалуроновой кислоты по настоящему изобретению могут использоваться в качестве носителя лекарственного средства, и носитель лекарственного средства является биоразлагаемым. «Биоразлагаемый» означает, что носитель лекарственного средства, детектированный в печени, превращается в молекулы соединений с более низкой молекулярной массой в течение 15 суток после внутривенного введения крысе и/или человеку. Преобразование «в молекулы соединений с более низкой молекулярной массой» можно детектировать определением размера носителя лекарственного средства в печени эксклюзионной колоночной хроматографией (см. пример 2-3 в данном описании). Носитель лекарственного средства определяется, как биоразлагаемый, если максимальный пик носителя лекарственного средства, извлеченного из печени, сдвигается в сторону более низкомолекулярных продуктов (т.е. время удерживания на хроматограмме колоночной хроматографии становится длиннее) по сравнению с максимальным пиком носителя лекарственного средства до введения. Биоразлагаемые носители лекарственного средства выделяются из организма с мочой, фекалиями или тому подобное. Таким образом, преобразование носителя лекарственного средства в молекулы соединений с более низкой молекулярной массой можно обнаружить при анализе мочи. Однако выделение с мочой производных гиалуроновой кислоты по настоящему изобретению, содержащих гидрофобную группу, может быть снижено за счет их гидрофобности. Следовательно, преобразование в молекулы соединений с более низкой молекулярной массой в печени, которая является основным органом метаболизма гиалуроновой кислоты, является более предпочтительным для непосредственного определения биоразлагаемости носителей лекарственного средства, несмотря на трудоемкость и ограничения в количестве детектирования.
Согласно дополнительному аспекту настоящего изобретения предоставлено производное гиалуроновой кислоты, определенное в данном описании, в котором процент дисахаридной единицы, содержащей группу -NR9-Z1-Z2 (далее определяется как гидрофобная группа) формулы (I) и/или (II) по отношению к дисахаридным повторяющимся единицам, имеющимся в производном (степень введения гидрофобной группы) составляет 3-50%.
Данная степень введения гидрофобной группы рассчитывается по следующей формуле:
Формула 1
«Дисахаридные повторяющиеся единицы, имеющиеся в производном», включают повторяющиеся единицы формулы (I) и (II) и повторяющуюся единицу формулы (IIb). Степень введения может регулироваться реакционными условиями, например, соотношением реагентов и может быть определена, например, ЯМР анализом.
Степень введения гидрофобной группы составляет 3-50%, предпочтительно 5-40%, более предпочтительно 5-35%, более предпочтительно 5-25%, более предпочтительно 5-20% и более предпочтительно 5-10%.
В одном из вариантов осуществления настоящего изобретения предоставлено производное гиалуроновой кислоты, в котором Х1 представляет собой -NR9-Z1-Z2 в формуле (I), как показано в примере 1-4 ниже. Процент дисахаридной единицы формулы (I) по отношению к дисахаридным повторяющимся единицам, присутствующим в производном гиалуроновой кислоты по настоящему изобретению, составляет, например, 70% или более, предпочтительно 75% или более, более предпочтительно 90% или более. Верхняя граница может составлять 100% или ниже для того, чтобы обеспечить способность к биоразлагаемости и удерживанию в крови. Пределы процентов составляют, например, 70-100%, предпочтительно 75-100%, более предпочтительно 90-100%. Производное гиалуроновой кислоты может дополнительно содержать повторяющуюся единицу формулы (II).
В одном из вариантов осуществления настоящего изобретения предоставлено производное гиалуроновой кислоты, которое не содержит повторяющейся единицы формулы (I), где Х1 представляет собой -NR9-Z1-Z2 в формуле (I), как описано в примере 1-5, приведенном ниже. В данном случае, сумма процентов повторяющейся единицы формулы (I) и повторяющейся единицы формулы (II) по отношению к имеющимся дисахаридным повторяющимся единицам составляет 70%-100%, предпочтительно 80-100% и более предпочтительно 90-100%.
Процент повторяющейся единицы формулы (II) в имеющихся дисахаридных повторяющихся единицах предпочтительно составляет 3-50%, более предпочтительно 5-40%, более предпочтительно 5-35%, более предпочтительно 5-25%, более предпочтительно 5-20% и более предпочтительно 5-10%. Процент повторяющейся единицы формулы (I) в имеющихся повторяющихся дисахаридных единицах предпочтительно составляет 20-97%, более предпочтительно 30-95%, более предпочтительно 35-95%, более предпочтительно 45-95%, более предпочтительно 50-95% и более предпочтительно 60-95%.
Если процент повторяющейся единицы формулы (II) составляет 5-10% в имеющихся дисахаридных повторяющихся единицах, то процент повторяющейся единицы формулы (I) предпочтительно составляет 60-95%, более предпочтительно 70-95% и более предпочтительно 75-95%.
Если процент повторяющейся единицы формулы (II) в имеющихся дисахаридных повторяющихся единицах составляет 20-40% и предпочтительно 20-35%, то процент повторяющейся единицы формулы (I) предпочтительно составляет 3080%, более предпочтительно 45-80% и более предпочтительно 60-80%.
Если процент повторяющейся единицы формулы (II) в имеющихся дисахаридных повторяющихся единицах составляет 10%-20%, то процент повторяющейся единицы формулы (I) предпочтительно составляет 50-90%, более предпочтительно 60-90% и более предпочтительно 70-90%.
Гиалуроновая кислота или ее соль могут использоваться в качестве исходного соединения для получения производных гиалуроновой кислоты по настоящему изобретению. Примеры соли гиалуроновой кислоты включают соли щелочных металлов, такие как соли натрия, соли калия и соли лития, и особенно предпочтительными солями являются соли натрия, часто используемые в фармацевтических продуктах. ГК или ее фармацевтически приемлемые соли могут быть получены известными способами, такими как способы, включающие экстракцию из тканей живых организмов, таких как петушиный гребень и подкожная ткань свиней, или ферментацией. Они также являются коммерчески доступными (например, от DENKI KAGAKU KOGYO KABUSHIKI KAISHA, Shiseido Co., Ltd., SEKAGAKU CORPORATION, R&D Systems, Inc. и т.д.).
Среднемассовая молекулярная масса гиалуроновой кислоты (включая ее соль), исключительно состоящей из дисахаридной единицы формулы (IIb), используемой в качестве исходного соединения, предпочтительно составляет от 1 кДа до 200 кДа, более предпочтительно от 3 кДа до 1500 кДа и более предпочтительно от 5 кДа до 1000 кДа; более предпочтительно от 10 кДа до 500 кДа, более предпочтительно от 10 кДа до 200 кДа, более предпочтительно от 45 кДа до 200 кДа и более предпочтительно от 50 кДа до 99 кДа. Для обеспечения меньшего размера частиц, более низкой вязкости или более высокой растворимости среднемассовая молекулярная масса предпочтительно составляет от 1 кДа до 100 кДа, более предпочтительно от 2 кДа до 70 кДа, более предпочтительно от 3 кДа до 50 кДа и более предпочтительно от 5 кДа до 30 кДа. Для обеспечения более высокой вязкости или повышенного удерживания под кожей или в полости сустава среднемассовая молекулярная масса предпочтительно составляет от 45 кДа до 2000 кДа, более предпочтительно от 50 кДа до 2000 кДа, более предпочтительно от 100 кДа до 1000 кДа и более предпочтительно от 200 кДа до 1000 кДа. В отношении матрикса для подкожных инъекций для непрерывного введения среднемассовая молекулярная масса предпочтительно составляет от 5 кДа до 200 кДа. Конкретные примеры среднемассовой молекулярной массы включают 5 кДа, 10 кДа, 50 кДа, 99 кДа, 230 кДа и 1058 кДа. «кДа» является сокращенным обозначением единиц «килодальтон».
Среднемассовая молекулярная масса гиалуроновой кислоты (включая ее соль), исключительно состоящей из дисахаридной единицы формулы (IIb), относится к среднемассовой молекулярной массе гиалуроновой кислоты, где R1b, R2b, R3b и R4b, все представляют собой атомы водорода, R5b представляет собой ацетил, и Xb представляет собой -O-Na+ в формуле (IIb), имея структуру основной цепи производного гиалуроновой кислоты по настоящему изобретению. Следовательно, вариант осуществления, в котором, например, все или часть дисахаридных единиц в гиалуроновой кислоте, фактически используемой в качестве исходного вещества, представляет собой дисахаридную единицу, где Xb представляет собой -O-(ион тетра-н-бутиламмония), и среднемассовая молекулярная масса, рассчитанная, как описано выше, составляет от 45 кДа до 200 кДа, является предпочтительным вариантом осуществления настоящего изобретения.
Молекулярная масса гиалуроновой кислоты (включая ее соль) рассчитывается как среднечисловая молекулярная масса или среднемассовая молекулярная масса, поскольку трудно получить гиалуроновую кислоту в виде отдельных молекул. В настоящем изобретении молекулярная масса рассчитывается в виде среднемассовой молекулярной массы. Среднемассовую молекулярную массу можно определить любым из различных известных методов, таким как определение светорассеяния, осмотического давления или вязкости, как описано, например, Seiichi Nakahama et al., «Essential Polymer Science» (KODANSHA LTD., ISBN4-06-153310-X). Среднемассовая молекулярная масса по измерению вязкости, используемая в данном описании, может быть определена методом, обычно используемым в области, к которой относится настоящее изобретение, например, с использованием вискозиметра Уббелоде. Следовательно, молекулярные массы гиалуроновой кислоты (включая ее соль), используемой в качестве исходного вещества, и производных гиалуроновой кислоты по настоящему изобретению рассчитываются в виде среднемассовой молекулярной массы. В том случае, когда используется коммерчески доступная гиалуроновая кислота (включая ее соль), чья молекулярная масса конкретно указывается, то может использоваться конкретно указанное значение в качестве молекулярной массы гиалуроновой кислоты.
Производное гиалуроновой кислоты по настоящему изобретению особым образом не ограничивается в отношении молекулярной массы, но предпочтительной является гиалуроновая кислота, имеющая высокую вязкость и высокую молекулярную массу, если предполагается функция обеспечения контролируемого высвобождения, основанного на замедленной диффузии при местном введении, и предпочтительной является гиалуроновая кислота, имеющая низкую вязкость и низкую молекулярную массу для ровного введения, если конечной лекарственной формой является раствор.
Производное гиалуроновой кислоты по настоящему изобретению, содержащее дисахаридную единицу формулы (I), можно получить преобразованием карбоксигруппы фрагмента глюкуроновой кислоты в амид, например, преобразованием исходного соединения гиалуроновой кислоты (включая ее соль и тому подобное), предпочтительно гиалуроновой кислоты, исключительно состоящей из дисахаридной единицы формулы (IIb), в тетраалкиламмониевую соль (например, тетрабутиламмониевую соль (TBA)) посредством ионного обмена; взаимодействием соли гиалуроновой кислоты с соединением формулы HNR6-CHRa-COORz, где Rz представляет собой группу, образующую сложный эфир, для защиты карбоксигруппы, и R6 и Ra являются такими, как определено выше, или формулы HNR6-CHRa-COOR7R8, где R7 и R8 являются такими, как определено выше, в присутствии подходящего конденсирующего агента в растворителе; и удаление защитной группы (снятие защиты), если она присутствует (стадия 1). Группа, образующая сложный эфир, особым образом не ограничивается, при условии, что она является группой, обычно используемой для защиты карбоксигруппы. Примеры группы, образующей сложный эфир, включают С1-6алкил, бензил, С1-6алкокси-С1-6алкил и бензилокси-С1-6алкил.
Группы -NR6-CHRa-COORz и -NR6-CHRa-COOR7R8 в формуле (I) могут быть одинаковыми или различными в каждой из множества имеющихся дисахаридных единиц. Например, соединения различных формул HNR6-CHRa-COORz и/или HNR6-CHRa-COOR7R8 могут использоваться для проведения вышеуказанной реакции.
Конденсирующие агенты, которые можно использовать в описанной выше реакции, включают, но, не ограничиваясь ими, например, 4-(4,6-диметокси-1,3,5-триазин)-4-метилморфолиний (DMT-MM), N,N'-карбонилдиимидазол (CDI), N,N’-дициклогексилкарбодиимид (DCC), N-этоксикарбонил-2-этокси-1,2-дигидрохинолин (EEDQ), тетрафторборат 2-бензотриазол-1,1,3,3-тетраметилурония (TBTU), 3,4-дигидро-3-гидрокси-4-оксо-1,2,3-бензотриазин (HODhbt), гексафторфосфат бензотриазол-1-окситриспирролидинофосфония (PyBOP), гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (BOP), 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC) или N-гидроксисукцинимид (NHS).
Без особого ограничения DMT-MM является предпочтительным в том отношении, что реакция является высокоэффективной в смешанном растворителе из воды и органического растворителя. Кроме того, использование DMT-MM в качестве конденсирующего агента позволяет проводить высоко избирательное образование амидной связи между амино и карбоксигруппами с одновременным подавлением образования эфирной связи в системе с присутствием большого количества гидроксигрупп. Использование конденсирующего агента предупреждает, например, взаимодействие между спиртовым растворителем и карбоксигруппой фрагмента гиалуроновой кислоты и образование внутримолекулярных или межмолекулярных связей между гидрокси и карбоксигруппами, совместно расположенных во фрагменте гиалуроновой кислоты, с получением нежелательного поперечного сшивания.
Примеры растворителя, используемого в реакции, описанной выше, включают воду, диметилсульфоксид (ДМСО), диметилформамид (ДМФА), диметилацетамид (DMAc), 1,3-диметил-2-имидазолидинон (DMI), сульфолан (SF), N-диметилпирролидон (NMP), диоксан (например, 1,4-диоксан), метанол, этанол, пропанол, бутанол, ацетонитрил, тетрагидрофуран, дихлорметапн, хлороформ, гексан, диэтиловый эфир, этилацетат и смеси этих растворителей. С точки зрения растворимости исходных соединений, модифицированных продуктов и продуктов, и реакционной способности конденсирующих агентов, то предпочтительно использовать один ДМСО или смешанный растворитель вода/ДМСО. В зависимости от типа аминокарбоновой кислоты, которая является модифицированным продуктом, то для реакции может использоваться метанол или диоксан.
Примеры соединения формулы HNR6-CHRa-COORz включают, например, сложный эфир аланина, сложный эфир серина, сложный эфир глицина, сложный эфир треонина, сложный эфир аспарагина, сложный эфир аспарагиновой кислоты, сложный эфир валина, сложный эфир лейцина, сложный эфир изолейцина, диэфир глутаминовой кислоты, сложный эфир метионина, сложный эфир глутамина, сложный эфир тирозина и сложный эфир триптофана. Указанные выше сложные эфиры представляют собой, например, С1-6алкиловые эфиры, ариловые эфиры, С1-6алкокси-С1-6алкиловые эфиры, арил-С1-6алкиловые эфиры и предпочтительно метиловые эфиры, этиловые эфиры, бензиловые эфиры и т.д.
Примеры соединений формулы HNR6-CHRa-CONR7R8 включают аланинамид, серинамид, глицинамид, треонинамид, аспарагинамид, диамид аспарагиновой кислоты, валинамид, лейцинамид, изолейцинамид, диамид глутаминовой кислоты, метионинамид, глутаминамид, фенилаланинамид, тирозинамид и триптофанамид.
Гидрофобная группа может быть введена преобразованием карбоксигруппы в глюкуроновой кислоте или группы -NR6-CHRa-COOH формулы (I) в амид (стадия 2). Примеры способов включают способ, включающий преобразование исходного соединения гиалуроновой кислоты или ее производного в тетраалкиламмониевую соль (например, тетрабутиламмониевую соль (ТВА)) и взаимодействие соли гиалуроновой кислоты с амином, модифицированным гидрофобной группой формулы HNR9-Z1-Z2, где R9, Z1 и Z2 являются такими, как определено выше, в присутствии подходящего конденсирующего агента в растворителе.
Конденсирующие агенты, которые можно использовать в реакции, описанной выше, включают, но, не ограничиваясь ими, 4-(4,6-диметокси-1,3,5-триазин)-4-метилморфолиний (DMT-MM), N,N’-карбонилдиимидазол (CDI), N,N’-дициклогексилкарбодиимид (DCC), N-этоксикарбонил-2-этокси-1,2-дигидрохинолин (EEDQ), тетрафторборат 2-бензотриазол-1,1,3,3-тетраметилурония (TBTU), 3,4-дигидро-3-гидрокси-4-оксо-1,2,3-бензотриазин (HODhbt), гексафторфосфат бензотриазол-1-окситриспирролидинофосфония (PyBOP), гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (BOP), 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC) или N-гидроксисукцинимид (NHS).
Примеры растворителя, используемого в реакции введения гидрофобной группы, включают воду, ДМСО, метанол, этанол, пропанол, бутанол, ацетонитрил, ДМФА, ТГФ, дихлорметан, хлороформ, гексан, диэтиловый эфир, этилацетат и смеси этих растворителей.
Альтернативно, гидрофобную группу можно ввести преобразованием карбоксигруппы в глюкуроновой кислоте или карбоксигруппы в группе -NR6-CHRa-COOH в формуле (I) в тетраалкиламмониевую соль (например, тетрабутиламмониевую соль (ТВА)), взаимодействием соли гиалуроновой кислоты со спейсером в присутствии подходящего конденсирующего агента в растворителе (на данной стадии при необходимости может быть проведена защита и снятие защиты), преобразованием карбоксигруппы (-СООН) и последующим взаимодействием с подходящим реагентом. Примеры комбинаций групп, преобразованных из карбоксигрупп и реакционного реагента, представлены ниже:
-CONR9-Z1-NRbH+Hal-Z3,
-CONR9-Z1-NRbH+Hal-COOZ3,
-CONR9-Z1-NRbH+HOCO-Z3,
-CONR9-Z1-NRbH+Hal-CO-Z3,
-CONR9-Z1-COOH+HO-Z3,
-CONR9-Z1-OH+Hal-COO-Z3,
-CONR9-Z1-COOH+NRc-Z3,
-CONR9-Z1-OCO-Hal+NRc-Z3,
-CONR9-Z1-OCOOH+HO-Z3,
-CONR9-Z1-OCOOH+Hal-Z3,
-CONR9-Z1-OCO-Hal+HO-Z3,
-CONR9-Z1-SH+Hal-Z3,
-CONR9-Z1-Hal+HS-Z3,
-CONR9-Z1-CO-Ya+HS-Z3,
-CONR9-Z1-CO-Ya+Hal-Z3,
-CONR9-Z1-O-CO-CH=CH2+HS-Z3,
-CONR9-Z1-NRb-CO-C(CH3)=CH2+HS-Z3,
-CONR9-Z1-SH+HS-R,
где R9, Z1, Rb, Rc и Z3 являются такими, как определено выше, и Hal представляет собой атом галогена, выбранный из атома фтора, атома хлора, атома брома и атома йода.
Примеры типа реакции включают реакции дегидрогалогенирования, реакции конденсации, реакции дегидратации, реакции нуклеофильного присоединения, такие как присоединение по Михаэлю, реакция окислительного образования дисульфидов, которые являются хорошо известными реакциями, и могут быть соответствующим образом выбраны и проведены в предпочтительных реакционных условиях специалистами в данной области. Если преобразованный продукт или продукт реакции содержит карбоксигруппу, то его можно преобразовать в имид N-гидроксиянтарной кислоты (далее по тексту обозначаемый как «NHS»), сложный эфир для взаимодействия.
Иллюстративные способы также включают способ, включающий взаимодействие 2-аминоэтил-2-пиридилдисульфида с карбоксигруппой глюкуроновой кислоты или карбоксигруппой в группе -NR6-CHRa-COOH в формуле (I), с получением производного гиалуроновой кислоты, модифицированного спейсером, содержащим меркаптогруппу, модифицированную уходящей группой в конце, и взаимодействие продукта с тиохолестеролом в реакции нуклеофильного замещения с образованием дисульфидной связи.
Примеры способов также включают способ, включающий получение соединения, модифицированного фрагментом спейсера в карбоксигруппе глюкуроновой кислоты или карбоксигруппе в -NR6-CHRa-COOH в формуле (I), и соединения, модифицированного фрагментом спейсера в стериле, и взаимодействие этих соединений. Несмотря на то, что некоторые из конкретных примеров перечислены выше, иллюстративные способы дополнительно включают, если Y содержит -S-S-, способ, включающий получение производного гиалуроновой кислоты, модифицированного спейсером, содержащим меркаптогруппу в конце карбоксигруппы глюкуроновой кислоты или карбоксигруппы в группе -NR6-CHRa-COOH в формуле (I) и стерильную группу, модифицированную спейсером, содержащим меркаптогруппу в конце, и их взаимодействие при реакции окисления с образованием дисульфидной связи. В данном способе одну меркаптогруппу можно подвергнуть взаимодействию с 2-меркаптопиридином с образованием дисульфида, и затем ее можно подвергнуть замещению другой меркаптогруппой.
Порядок проведения стадии 1 и стадии 2 не имеет значения. Например, исходное соединение гиалуроновая кислота (включая ее соль), предпочтительно гиалуроновая кислота, исключительно состоящая из дисахаридной единицы формулы (IIb), может быть преобразована в тетраалкиламмониевую соль (например, тетрабутиламмониевую соль (ТВА)), соль гиалуроновой кислоты можно подвергнуть взаимодействию с амином, модицированным гидрофобной группой -HNR9-Z1-Z2, где R9, Z1 и Z2 являются такими, как определено выше, в присутствии подходящего конденсирующего агента в растворителе, и затем продукт реакции может быть подвергнут взаимодействию с соединением формулы HNR6-CHRa-COORz, где Rz является группой, образующей сложный эфир, для защиты карбокси, и R6 и Ra являются такими, как определено выше, или формулы HNR6-CHRa-CONR7R8, где R7 и R8 являются такими, как определено выше, в присутствии подходящего конденсирующего агента в растворителе.
В одном из вариантов осуществления настоящего изобретения производное гиалуроновой кислоты получают взаимодействием производного гиалуроновой кислоты, содержащего повторяющуюся единицу формулы (IIb) и повторяющуюся единицу формулы (Ia):
Химическая формула 27
 ,
,
[где Ха выбран из гидрокси, -О-Q+, С1-6алкокси и -NR7R8, и R1, R2, R3, R4, R5, R6, R7, R8, Q+ и Ra являются такими, как определено выше], с соединением, представленным следующей формулой: -HNR9-Z1-Z2 [где R9, Z1 и Z2 являются такими, как определено выше].
Реакцию осуществляют конденсацией карбоксигруппы (включая его соль) и аминогруппы с преобразованием карбоксигруппы в амид, и можно применять способ, аналогичный стадии 2.
Настоящее изобретение может содержать повторяющуюся единицу следующей формулы (III). Следовательно, в одном из вариантов осуществления настоящего изобретения предоставлено производное гиалуроновой кислоты, содержащее одну или более дисахаридных единиц (а) формулы (I) и формулы (III), (b) формулы (I), формулы (II) и формулы (III), (с) формулы (I), формулы (IIb) и формулы (III) или (d) формулы (I), формулы (II), формулы (IIb) и формулы (III).
Дисахаридная единица формулы (III):
Химическая формула 28
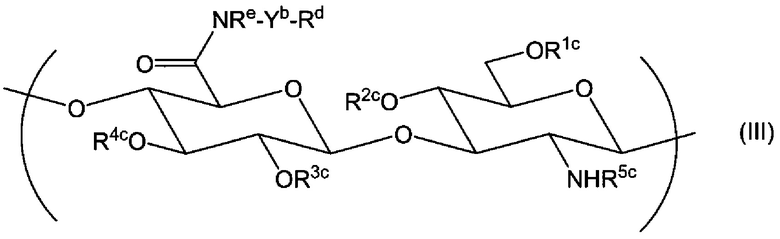 ,
,
[где R1c, R2c, R3c и R4c независимо выбраны из атома водорода, С1-6алкила, формила и С1-6алкилкарбонила;
R5c представляет собой атом водорода, формил или С1-6алкилкарбонил;
Re представляет собой атом водорода или С1-6алкил;
Rd представляет собой атом водорода, С1-6алкил, -CO-C(R10)=CH2 или -CO-G4-Xc;
R10 представляет собой атом водорода или метил;
G4 выбран из фенилена, С3-8циклоалкилена или -G5-(С1-10алкилен)-G6-, где в группу С1-10алкилена может быть введено 1-3 фенилена или С3-8циклоалкилена;
G5 и G6, каждый независимо, выбран из прямой связи, фенилена или С3-8циклоалкилена;
Хс представляет собой меркапто, атом галогена или группу формулы:
Химическая формула 29
 .
.
Yb представляет собой -CH2-(CHR15)l-2-CH2-NH-, -CH2-(CHR16)p-2-CH2-O-, -(CH2)j-S- или -(CH2)a-(Y1-(CH2)b)c-G-;
l, p и j являются целыми числами, каждое из которых независимо выбрано из 2-10, R15 и R16, каждый независимо, представляет собой атом водорода или гидрокси;
а является целым числом, выбранным из 2-10;
b является целым числом, независимо выбранным из 2-10;
с является целым числом, выбранным из 1-200;
Y1 представляет собой атом кислорода или -NRn-;
G представляет собой атом кислорода, атом серы или -NH-;
Rn представляет собой атом водорода, С1-6алкил, -СО-(СН2)d-Ro, -(СН2)e-Rp или -(СН2)f-(Y2-(CH2)g)h-Rq;
q является целым числом, независимо выбранным из 2-10;
d, e, f и h являются целыми числами, независимо выбранными из 2-10;
Ro, Rp и Rq, каждый независимо, представляет собой атом водорода, гидрокси, карбокси или -NHRr;
Y2 представляет собой атом кислорода или -NH-;
Rr представляет собой атом водорода, формил или С1-6алкилкарбонил].
Иллюстративные способы получения производного гиалуроновой кислоты по настоящему изобретению, содержащего дисахаридную единицу формулы (III), включают, например, способ, включающий взаимодействие тетрабутиламмониевой соли гиалуроновой кислоты, описанной выше, с солью гиалуроновой кислоты и соединением формулы HNRe-Yb-Rw, где Rw представляет собой атом водорода, С1-6алкил, -CO-C(R10)=CH2, -CO-G4-Xc, защитную группу для гидроксигруппы, защитную группу для аминогруппы или защитную группу для меркаптогруппы, и Re, Yb, R10, G4 и Xc являются такими, как определено выше, в присутствии подходящего конденсирующего агента в растворителе, и если присутствует защитная группа, удаление защитной группы (снятие защиты). В приведенной выше реакции могут использоваться конденсирующий агент и растворитель, определенные выше.
Конкретные примеры -CO-G4-Xc включают группы, представленные следующими формулами:
Химическая формула 30
 .
.
Конкретные примеры защитной группы, используемой в реакции, описанной выше, описаны, например, T.W.Greene, P.G.M. Wuts, Protective Groups in Organic Synthesis, Third Edition, John Wiley&Sons, Inc., New York, 1999.
Примеры защитной группы для гидроксигруппы включают С1-6алкилкарбонил, арилкарбонил, гетероарилкарбонил, С1-6алкоксикарбонил, С1-6алкокси-С1-6алкил, С1-6алкиламинокарбонил, ди(С1-6алкил)аминокарбонил, арил-С1-6алкил, гетероарил-С1-6алкил, арил-С1-6алкиламинокарбонил, С1-6алкил, С1-6алкилсульфонил, ((амино-С1-6алкил)карбонилокси)С1-6алкил, ненасыщенный гетероциклический карбонилокси-С1-6алкил, арилди(С1-6алкил)силил и три(С1-6алкил)силил. Предпочтительные примеры защитной группы для гидрокси включают ацетил.
Примеры защитной группы для -NH- или аминогруппы включают С1-6алкилкарбонил, арил-С1-6алкилкарбонил, арилкарбонил, гетероарилкарбонил, С1-6алкоксикарбонил, С1-6алкиламинокарбонил, ди(С1-6алкил)аминокарбонил, арил-С1-6алкил, гетероарил-С1-6алкил и (арил-С1-6алкил)аминокарбонил. Предпочтительные примеры защитной группы для аминогруппы включают ацетил, трет-бутоксикарбонил и 9-флуоренилметоксикарбонил. При защите аминогруппа может образовать насыщенную или ненасыщенную гетероциклическую группу, такую как имид фталевой кислоты, имид янтарной кислоты, имид глутаровой кислоты и 1-пирролил.
Примеры защитной группы для меркаптогруппы включают, например, С1-6алкилтио, такой как этилтио и трет-бутилтио, замещенный фенилтио, такой как 2-нитрофенилтио и 2-карбоксифенилтио, и гетероарилтио, такой как 2-пиридилтио. Предпочтительным примером является 2-пиридилтио.
Примеры группы формулы -NRe-Yb-Rd в формуле (III), приведенной выше, включают группы, представленные формулами:
-NH-CH2-(CHR15)1-2-CH2-NH2;
-NH-CH2-CH2-(Y1-CH2-CH2)c-NH2;
-NH-CH2-(CHR16)p-2-CH2-OH;
-NH-CH2-CH2-(Y1-CH2-CH2)c-OH;
-NH-(CH2)j-SH;
-NH-CH2-CH2-(Y1-CH2-CH2)c-SH;
-NH-(CH2)p-O-CO-С(R10)=CH2;
-NH-(CH2)l-NHCO-C(R10)=CH2;
-NH-CH2-(CHR15)1-2-CH2-NH-CO-CH2-SH;
-NH-CH2-CH2-(Y1-CH2-CH2)c-NH-CO-(CH2)u-SH;
-NH-(CH2)p-O-CO-CH2-CH2-SH;
-NH-(CH2)l-NHCO-(CH2)u-SH;
-NH-CH2-CH2-(Y1-CH2-CH2)c-O-CO-CH2-CH2-SH;
-NH-CH2-CH2-(Y1-CH2-CH2)c-NHCO-CH2-CH2-SH;
-NH-CH2-(CHR15)1-2-CH2-NH-CO-CH2-Br;
-NH-CH2-CH2-(Y1-CH2-CH2)c-NH-CO-CH2-I;
-NH-CH2-CH2-(Y1-CH2-CH2)c-NHCO-C(R10)=CH2 или
-NH-CH2-CH2-(Y1-CH2-CH2)c-O-CO-C(R10)=CH2,
[где R10, R15, R16, Y1, c, j, l и p являются такими, как определено в данном описании, и u является целым числом, равным 1-3].
Число CHR15 и CHR16, где R15 и R16 представляют собой гидроксигруппы, входящих в состав молекулы производного гиалуроновой кислоты, составляет для каждого 0-8, предпочтительно 0-3, более предпочтительно 0-1. Посредством изменения числа CHR15 и CHR16, где R15 и R16 представляют собой гидроксигруппы, можно регулировать растворимость в воде производного гиалуроновой кислоты по настоящему изобретению. Если все R15 представляют собой атомы водорода, то предпочтительно l равно 2-6, и конкретные примеры l включают 2 и 6. Если один из R15 представляет собой гидроксигруппу, то конкретные примеры l включают 3. Если Y1 является атомом кислорода, то конкретные примеры с включают 2. Если Y1 является -NH-, то конкретные примеры с включают 1-3. Конкретные примеры l и р включают 3.
Конкретные примеры -(CH2)a-(Y1-(CH2)b)c-G- включают, например, -(CH2)2-(O-CH2-CH2)с-O-, -(CH2)2-(O-CH2-CH2)с-NH-, -(CH2)3-(O-CH2-CH2-CH2)с-O-, -(CH2)3-(O-CH2-CH2-CH2)с-NH-, -(CH2)2-NRn-(CH2)2-O-, -(CH2)2-NRn-(CH2)2-NH-, -(CH2)3-NRn-(CH2)4-O-, -(CH2)6-NRn-(CH2)6-O-, -(CH2)6-NRn-(CH2)6-NH-, -(CH2)3-NRn-(CH2)2-NRn-(CH2)3-O, -(CH2)3-NRn-(CH2)2-NRn-(CH2)3-NH, -(CH2)3-NRn-(CH2)4-NRn-(CH2)3-O, -(CH2)3-NRn-(CH2)4-NRn-(CH2)3-NH- (типа спермина), -(CH2)2-NRn-(CH2)2-NRn-(CH2)2-NRn-(CH2)2-O-, -(CH2)2-NRn-(CH2)2-NRn-(CH2)2-NRn-(CH2)2-NH-, -(CH2)2-NRn-(CH2)2-NRn-(CH2)2-NRn-(CH2)2-NRn-(CH2)2-O- и -(CH2)2-NRn-(CH2)2-NRn-(CH2)2-NRn-(CH2)2-NRn-(CH2)2-NH-. Предпочтительно все Rn представляют собой атомы водорода.
Конкретные примеры Rd, которые связываются с данными -(CH2)a-(Y1-(CH2)b)c-G-, включают, например, атом водорода, -CO-CH=CH2, -CO-C(CH3)=CH2, -CO-CH2-Cl, -CO-CH2-Br, -CO-CH2-I, -CO-CH2-SH и -CO-CH2-CH2-SH.
Конкретные примеры группы формулы -NRe-Yb-Rd включают -NH-(CH2)3-N-(-(CH2)4-NH-(CH2)3-NHCOCH3)-(CH2)2-SH, -NH-(CH2)2-N-(-(CH2)3-NH-(CH2)4-NHCOCH3)-(CH2)3-SH и -NH-(CH2)5-N-(-(CH2)3-NH-(CH2)2-NHCOCH3)-(CH2)2-SH.
Кроме того, конкретные примеры группы формулы -NRe-Yb-Rd включают следующие группы:
-NH-(CH2)p1-O-CO-CH(R17)-CH2-S-CH2-CH(OH)-CH(OH)-CH2-SH;
-NH-(CH2)p1-NH-C(=NH)-(CH2)3-SH;
-NH-(CH2)p1-NH-CO-CH(R17)-CH2-S-CH2-CH(OH)-CH(OH)-CH2-SH;
-NH-(CH2)p1-NH-CO-CH(NH2)-CH2-SH;
-NH-(CH2)p1-NH-CO-CH(NH2)-(CH2)2-SH;
-NH-NH-CO-(CH2)4-CO-NH-NH-C(=NH)-(CH2)3-SH;
-NH-(CH2-CH2-O)q-CH2-CH2-O-CO-CH(R17)-CH2-S-CH2-CH(OH)-CH(OH)-CH2-SH;
-NH-(CH2-CH2-O)q-CH2-CH2-NH-C(=NH)-(CH2)3-SH;
-NH-(CH2-CH2-O)q-CH2-CH2-NH-CO-CH(R17)-CH2-S-CH2-CH(OH)-CH(OH)-CH2-SH;
-NH-(CH2-CH2-O)q-CH2-CH2-NH-CO-CH(NH2)-CH2-SH;
-NH-(CH2-CH2-O)q-CH2-CH2-NH-CO-CH(NH2)-(CH2)2-SH;
-NH-CH(CO2H)-CH2-SH;
-NH-CH(CO2H)-(CH2)2-SH и
-NH-CH(CO2H)-(CH2)2-CONH-CH(CONH-CH2-CO2H)-CH2-SH,
[где R17 представляет собой атом водорода или С1-6алкил, p1 является целым числом из 2-10, и q является целым числом из 1-200].
Процент повторяющейся единицы формулы (III) по отношению к имеющимся дисахаридным повторяющимся единицам составляет, например, 0,1-99,5%, и предпочтительно 1-30%.
Иллюстративные способы получения производного гиалуроновой кислоты по настоящему изобретению, содержащего дисахаридную единицу формулы (III), включают способ (стадия 3а), включающий взаимодействие карбоксигруппы (-СООН) фрагмента глюкуроновой кислоты гиалуроновой кислоты с диамином формулы H2N-CH2-(CHR15)1-2-CH2-NH2 с преобразованием в амид формулы -CONH-CH2-(CHR15)1-2-CH2-NH2 и последующую модификацию концевой аминогруппы с ее преобразованием в амид, представленный группой -CONH-CH2-(CHR15)1-2-CH2-NHRd.
Конкретные примеры диамина, описанного выше, включают, например, H2N-(CH2)2-NH2, H2N-(CH2)3-NH2, H2N-(CH2)4-NH2, H2N-(CH2)5-NH2, H2N-(CH2)6-NH2, H2N-(CH2)7-NH2, H2N-(CH2)8-NH2, H2N-(CH2)9-NH2, H2N-(CH2)10-NH2, H2N-CH2-CHOH-CH2-NH2, H2N-CH2-CHOH-(CH2)2-NH2, H2N-CH2-(CHOH)2-CH2-NH2, H2N-CH2-CHOH-(CH2)3-NH2, H2N-(CH2)2-CHOH-(CH2)2-NH2, H2N-CH2-(CHOH)2-(CH2)2-NH2, H2N-(CH2-CHOH)2-CH2-NH2, H2N-CH2-(CHOH)3-CH2-NH2, H2N-CH2-CHOH-(CH2)4-NH2, H2N-(CH2)2-CHOH-(CH2)3-NH2, H2N-CH2-(CHOH)2-(CH2)3-NH2, H2N-CH2-CHOH-CH2-CHOH-(CH2)2-NH2, H2N-CH2-CHOH-(CH2)2-CHOH-CH2-NH2, H2N-(CH2)2-(CHOH)2-(CH2)2-NH2, H2N-CH2-(CHOH)3-(CH2)2-NH2, H2N-CH2-(CHOH)2-CH2-CHOH-CH2-NH2, H2N-(CH2)2-CHOH-(CH2)4-NH2, H2N-(CH2)3-CHOH-(CH2)4-NH2, H2N-(CH2)2-CHOH-(CH2)6-NH2 и H2N-(CH2)5-CHOH-(CH2)4-NH2.
Иллюстративные способы получения производного гиалуроновой кислоты по настоящему изобретению, содержащего дисахаридную единицу формулы (III), включают способ (стадия 3b), включающий взаимодействие карбоксигруппы (-СООН) фрагмента глюкуроновой кислоты гиалуроновой кислоты с гидроксиамином формулы H2N-CH2-(CHR16)р-2-CH2-ОН с преобразованием в амид формулы -CONH-CH2-(CHR16)р-2-CH2-ОН и последующую модификацию концевой гидроксигруппы с ее преобразованием в группу -CONH-CH2-(CHR16)р-2-CH2-ORd. Объединенные стадии 3а и 3b обозначены как стадия 3.
Конкретные примеры гидроксиамина, описанного выше, включают, например, H2N-(CH2)2-ОН, H2N-(CH2)3-ОН, H2N-(CH2)4-ОН, H2N-(CH2)5-ОН, H2N-(CH2)6-ОН, H2N-(CH2)7-ОН, H2N-(CH2)8-ОН, H2N-(CH2)9-ОН, H2N-(CH2)10-ОН, H2N-CH2-CHOH-CH2-ОН, H2N-CH2-CHOH-(CH2)2-ОН, H2N-CH2-(CHOH)2-CH2-ОН, H2N-CH2-CHOH-(CH2)3-ОН, H2N-(CH2)2-CHOH-(CH2)2-ОН, H2N-CH2-(CHOH)2-(CH2)2-ОН, H2N-(CH2-CHOH)2-CH2-ОН, H2N-CH2-(CHOH)3-CH2-ОН, H2N-CH2-CHOH-(CH2)4-ОН, H2N-(CH2)2-CHOH-(CH2)3-ОН, H2N-CH2-(CHOH)2-(CH2)3-ОН, H2N-CH2-CHOH-CH2-CHOH-(CH2)2-ОН, H2N-CH2-CHOH-(CH2)2-CHOH-CH2-ОН, H2N-(CH2)2-(CHOH)2-(CH2)2-ОН, H2N-CH2-(CHOH)3-(CH2)2-ОН, H2N-CH2-(CHOH)2-CH2-CHOH-CH2-ОН, H2N-(CH2)2-CHOH-(CH2)4-ОН, H2N-(CH2)3-CHOH-(CH2)4-ОН, H2N-(CH2)2-CHOH-(CH2)6-ОН и H2N-(CH2)5-CHOH-(CH2)4-ОН.
Данные соединения являются коммерчески доступными, например, от Sigma-Aldrich Co. LLC. Их можно синтезировать согласно или при обращении к способу, описанному в источниках.
Группы -NRe-Yb-Rd в формуле (III), присутствующие во множестве дисахаридных единиц, могут быть одинаковыми или различными. Например, соединение другой формулы -HNRe-Yb-Rd может использоваться для проведения приведенной выше реакции.
Если Х1 в формуле (I) представляет собой гидрокси, -O-Q+ или С1-6алкокси, то группа -NRe-Yb-Rd может присутствовать не только в указанном положении в дисахаридной единице формулы (III), часть или вся группа может быть замещена Х1 в формуле (I), где Х1 представляет собой -NRe-Yb-Rd.
Порядок проведения стадии 1, стадии 2 и стадии 3 не имеет значения. Предпочтительные порядки включают такой порядок стадия 1, стадия 2 и стадия 3, порядок стадия 2, стадия 1 и стадия 3 и порядок стадия 1, стадия 3 и стадия 2.
Производные гиалуроновой кислоты, содержащие реакционноспособную углерод-углеродную двойную связь в дисахаридной единице формулы (III), можно подвергнуть реакции поперечного сшивания с использованием сшивающего агента (например, дитиотреитола:DTT, бутандитиола, полиэтиленгликольдитиола), содержащего 2 или более меркаптогрупп. Производное гиалуроновой кислоты, содержащее меркаптогруппу в дисахаридной единице формулы (III), можно подвергнуть реакции поперечного сшивания с образованием дисульфидов с использованием сшивающего агента (например, дитиотреитола:DTT, бутандитиола, полиэтиленгликольдитиола), содержащего 2 или более меркаптогрупп, или реакции поперечного сшивания с использованием сшивающего агента (например, дивинилсульфона), содержащего 2 или более реакционноспособных углерод-углеродных двойных связей. Производное гиалуроновой кислоты по настоящему изобретению можно преобразовать в гель поперечным сшиванием.
Другие примеры реакции поперечного сшивания включают поперечное сшивание реакцией конденсации производного гиалуроновой кислоты, модифицированного амино, с использованием сшивающего агента (например, бис[сульфосукцинимидил]суберата (BS3), этиленгликоль-бис[сульфосукцинимидил]сукцината (Sulfo-EGS), гидрохлорида диметиладипимидата (DMA) или тому подобное), содержащего сукцинимидиловые эфиры или другие имидовые эфиры на обоих концах С2-20алкилена; поперечное сшивание производного гиалуроновой кислоты, модифицированного амино, с использованием сшивающего агента (например, глутаральдегида), содержащего формил на обоих концах С2-20алкилена; поперечное сшивание окислительной реакцией в окислительных условиях (например, в присутствии тетратионата натрия (STT)) для производных гиалуроновой кислоты, модифицированных меркапто; поперечное сшивание реакцией присоединения Микаэля производного гиалуроновой кислоты, модифицированного меркапто и сшивающим агентом (например, 1,4-бис-малеимидбутаном (BMB), этилендиметилакрилатом (EDMA)), содержащим ненасыщенные связи, например, малеимидом (MAL) или метакрилоилом на обоих концах С2-20алкилена; поперечное сшивание радикальной полимеризацией производного гиалуроновой кислоты, модифицированного ненасыщенной связью, такой как акрилоил и метакрилоил, и с использованием различных инициаторов полимеризации (например, пероксодисульфат калия (KPS)/N,N,N',N'-тетраметилэтилендиамин (TEMED), Irgacure 2959); поперечное сшивание с использованием конденсирующего агента (например, такого как N,N'-карбонилдиимидазол (CDI), N,N'-дициклогексилкарбодиимид (DCC), N-этоксикарбонил-2-этокси-1,2-дигидрохинолин (EEDQ), 4-(4,6-диметокси-1,3,5-триазин)-4-метилморфолинийхлорид (DMT-MM), тетрафторборат 2-бензотриазол-1,1,3,3-тетраметилурония (TBTU), 3,4-дигидро-3-гидрокси-4-оксо-1,2,3-бензотриазин (HODhbt), гексафторфосфат бензотриазол-1-окси-три(пирролидино)фософония (PyBOP), гексафторфосфат бензотриазол-1-илокситри(диметиламино)фосфония (BOP), 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC) или N-гидроксисукцинимид (NHS)) в присутствии производного диамина (например, EDA, 2,2’-(этилендиокси)бис(этилендиамин)). Поперечное сшивание, описанное выше, может представлять собой внутримолекулярное сшивание в производном гиалуроновой кислоты или межмолекулярное поперечное сшивание между множеством молекул производного гиалуроновой кислоты.
Условия для стадии образования геля производного гиалуроновой кислоты по настоящему изобретению химическим поперечным сшиванием могут быть соответствующим образом выбраны. Условия для поперечного сшивания включают метод поперечного сшивания, концентрацию полимера, концентрацию сшивающего агента, растворитель, рН растворителя, концентрацию соли, температуру и время.
На стадии образования геля производного гиалуроновой кислоты по настоящему изобретению плотность поперечных связей полученного геля может быть повышена, например, повышением концентрации полимера в химическом поперечном сшивании и степени введения поперечно сшиваемых групп среди реакционных условий поперечного сшивания.
Когда сшивающий агент, содержащий поперечно-сшиваемые группы на обоих концах, добавляется к производному гиалуроновой кислоты по настоящему изобретению на стадии образования геля производного гиалуроновой кислоты, предпочтительно сшивающий агент добавляют к производному гиалуроновой кислоты в определенном соотношении сшивающего агента к производному гиалуроновой кислоты, где соотношение (например, молярное соотношение) является таким, что группы могут быстро участвовать в реакции поперечного сшивания без избытка или недостатка. Например, предпочтительно молярное соотношение группа SH:группа МА равно 3:1-1:3, и особенно предпочтительно составляет 2:1-1:2, когда полимер, содержащий метакрилоил (группа МА) поперечно сшивается посредством реакции присоединения Микаэля с использованием DDT.
Растворитель на стадии образования геля производного гиалуроновой кислоты по настоящему изобретению предпочтительно представляет собой растворитель, в котором могут достаточно растворяться полимеры и сшивающие агенты, и без особого ограничения, предпочтительно используется вода, диметилсульфоксид (ДМСО), диметилацетамид (DMAc), диметилформамид (ДМФА), N-метилпирролидон (NMP) и смешанные растворители, выбранные из перечисленных растворителей. Кроме того, можно смешать и использовать органический растворитель, который смешивается с данными растворителями. Органический растворитель, который смешивается, особым образом не ограничивается, и его примеры включают, в частности, метанол, этанол, пропанол, изопропанол, бутанол, ацетон и ацетонитрил.
Структура химической поперечной связи, в результате которой образуется гель производного гиалуроновой кислоты по настоящему изобретению, может включать структуру, которая подвергается разрушению в организме. Например, но без особого ограничения, группы, содержащие сложноэфирную связь и метакрилоил, могут использоваться в качестве группы, которая подвергается реакции поперечного сшивания. Кроме того, соединение, содержащее сложноэфирную связь, такое как Sulfo-EGS или EDMA, или соединение, содержащее пептидный спейсер, расщепляемый под действием ферментов в живом организме, могут использоваться в качестве сшивающего агента. Кроме того, гель, поперечно сшитый дисульфидными связями, образованными окислением меркапто, разрушается в живом организме в результате реакции дисульфидного обмена и реакции восстановления. Поскольку производное гиалуроновой кислоты по настоящему изобретению имеет деградируемую структуру химических поперечных связей, то скорость разрушения геля производного гиалуроновой кислоты можно регулировать в живом организме и, следовательно, можно регулировать скорость высвобождения.
Производное гиалуроновой кислоты по настоящему изобретению образует наночастицы в водном растворе и, следовательно, может преобразовываться в мелкие гелевые частицы наноразмера поперечным сшиванием в разбавленном состоянии, и такие гелевые частицы можно использовать в качестве носителя для контролируемого высвобождения в крови или носителя для целенаправленной доставки. Разбавленное состояние относится к концентрации 10 мг/мл или ниже, предпочтительно 5 мг/мл или ниже и более предпочтительно 1 мг/мл или ниже. Альтернативно, посредством поперечного сшивания в условиях высокой плотности производное гиалуроновой кислоты может преобразовываться в объемный гель, в котором мелкие частицы поперечно сшиты. Он является пригодным в качестве носителя для контролируемого высвобождения при подкожном введении. Состояние высокой плотности относится к концентрации 5 мг/мл или выше, предпочтительно 20 мг/мл или выше и более предпочтительно 40 мг/мл.
Стадия образования геля производного гиалуроновой кислоты по настоящему изобретению может быть проведена в объеме или в прерывистой фазе, такой как эмульсия, или в диспергированных каплях. Например, для проведения стадии в эмульсии вода/масло водную фазу, в которой растворен полимер или сшивающий агент, можно эмульгировать в системе вода-несмешивающийся с водой растворитель и можно проводить реакцию гелеобразования. Примеры несмешивающегося с водой растворителя включают, но без особого ограничения, гексан, хлороформ, дихлорметан, этилацетат, среднецепочечный триглицерид (MCT), жидкий парафин и масло бобов. Можно добавить поверхностно-активное вещество для стабилизации эмульгирования. Кроме того, стадию можно проводить в растворителе, который может быть вытеснен (удаление растворителя) в суперкритическом диоксиде кремния или в ПЭГ. В данном случае, гель с более высокой плотностью поперечных связей может быть получен эмульгированием и/или диспергированием водной фазы или фазы органического растворителя, в которой растворен полимер, поперечно-сшивающий агент или тому подобное, в растворителях, перечисленных выше, поскольку полимер концентрируется в сочетании с удалением растворителя (диффузией растворителя).
На стадии гелеобразования производного гиалуроновой кислоты по настоящему изобретению и после нее можно провести операцию по остановке поперечного сшивания и операцию по деактивации или отмывке оставшейся поперечно-сшивающей функциональной группы. Поперечно-сшивающие функциональные группы, которые не участвовали в реакции, группы, которые связаны только с одним концом сшивающего агента, оставшиеся сшивающие агенты и тому подобное предпочтительно удаляются для обеспечения безопасности, стабильности во время консервации и исключения побочных реакций с инкапсулированным лекарственным средством. Например, но без особого ограничения, если остаются непрореагировавшие сшивающие агенты, то их можно удалить промыванием избыточным количеством воды. Кроме того, если на полимере остается замещенный метакрилоил, то можно добавить, например, избыток меркаптоэтанола для дезактивации метакрилоила, и затем избыток меркаптоэтанола удалить промыванием избытком воды. Кроме того, если остается меркапто, то добавляют избыток 3-малеимидпропионовой кислоты и/или йодоуксусной кислоты для дезактивации меркапто, и затем избыток 3-малеимидпропионовой кислоты и/или йодоуксусной кислоты удаляют промыванием избытком воды.
Стадию дробления можно провести после стадии гелеобразования производного гиалуроновой кислоты по настоящему изобретению. Способ дробления включает дробление с использованием пестика и ступки, и измельчение в мельнице, но измельчение в мельнице является предпочтительным. Примеры дробильно-мельничного оборудования для измельчения включают роторно-дисковой измельчитель, такой как центрифужная дробилка (NISSEI Corporation) и ударная дробилка (Dalton Co., Ltd.), ситовая дробилка, такая как распылитель (Tokyo Atomizer M.F.G. Co., Ltd.), дробилка для дробления образцов (Tokyo Atomizer M.F.G. Co., Ltd.), портативная дробилка (Tokyo Atomizer M.F.G. Co., Ltd.) и дробилка SK (Tokken Inc.), струйная мельница, такая как лабораторная струйная мельница (A-O jet mill, Seishin Enterprise Co., Ltd.) и linrex мельница (Liquid Gas Co., Ltd.), которые могут измельчать при очень низкой температуре, но дробилка SK и linrex мельница являются предпочтительными.
Стадию сушки можно проводить после стадии образования геля производного гиалуроновой кислоты по настоящему изобретению. Примеры методов сушки включают, например, вентиляционную сушку, сушку в термостате, вакуумную сушку и сушку с циркуляцией горячего воздуха. Скорость продувки, время сушки, температура и давление выбирают, как это подходит, при условии, что гель по настоящему изобретению не разлагается или не денатурирует.
Фармацевтическую композицию можно получить инкапсулированием лекарственного средства в геле производного гиалуроновой кислоты по настоящему изобретению. В одном аспекте настоящего изобретения производное гиалуроновой кислоты, содержащее одну или более дисахаридных единиц (а) формулы (I) и формулы (III), (b) формулы (I), формулы (II) и формулы (III), (с) формулы (I), формулы (IIb) и формулы (III) или (d) формулы (I), формулы (II), формулы (IIb) и формулы (III), можно подвергнуть поперечному сшиванию с использованием сшивающего агента, преобразовать в гель и использовать в качестве носителя для инкапсулирования лекарственного средства (низкомолекулярного соединения, белка, пептида или нуклеиновой кислоты). Примеры методов инкапсулирования лекарственного средства включают добавление раствора лекарственного средства к заранее поперечно-сшитому гелю производного гиалуроновой кислоты. В данном способе сначала лекарственное средство абсорбируется диффузией в набухший гель, и абсорбированное лекарственное средство инкапсулируется, сохраняясь в физических поперечно-сшитых областях за счет гидрофобного взаимодействия геля производного гиалуроновой кислоты. Условия, включающие, но, не ограничиваясь ими, растворитель, концентрацию соли, рН, температуру, время и добавление денатурирующего агента могут быть выбраны, соответствующим образом так, чтобы лекарственное средство стабильно инкапсулировалось с высоким выходом. Например, степень набухания и плотность геля производного гиалуроновой кислоты изменяются, а также изменяется состояние ионизации лекарственного средства и тому подобное в зависимости от концентрации соли и рН на время инкапсулирования лекарственного средства, следовательно, подходящие условия должны выбираться в их комбинации соответствующим образом. За счет электростатического отталкивания карбоксигрупп производного гиалуроновой кислоты, проведение инкапсулирования лекарственного средства при низкой концентрации соли приводит к пониженной плотности геля, что способствует инкапсулированию большого количества лекарственного средства или лекарственного средства с большей молекулярной массой. После инкапсулирования лекарственного средства повышение концентрации соли приводит к ослаблению электростатического отталкивания, повышению плотности геля и уменьшению размера отверстий геля ниже, чем размер молекул лекарственного средства, что делает возможным плотно удерживать лекарственное средство и замедлять высвобождение. В это время концентрация соли может быть физиологической концентрацией соли.
Иллюстративные способы инкапсулирования лекарственного средства также включают способ, включающий образование комплекса лекарственного средства и производного гиалуроновой кислоты по настоящему изобретению, и поперечное сшивание превращает производное гиалуроновой кислоты в гель. Условия, включающие, но, не ограничиваясь ими, соотношение растворителей для образования комплекса, концентрацию соли, рН, температуру, время, добавление денатурирующего агента, концентрацию вышеуказанного гидрофильного полисахаридного производного (ПП), концентрацию лекарственного средства, соотношение ПП и лекарственного средства, могут быть выбраны соответствующим образом так, чтобы лекарственное средство стабильно комплексовался с наногелем с высоким выходом. Свободные лекарственные средства, не вошедшие в состав комплекса, могут быть отделены и удалены диализом, эксклюзионной хроматографией (SEC) или тому подобное. Для поперечного сшивания предпочтительно использовать условия поперечного сшивания, в которых инкапсулированный препарат не денатурирует.
Лекарственное средство, инкапсулированное в геле производного гиалуроновой кислоты по настоящему изобретению, высвобождается простой диффузией лекарственного средства в геле, деградацией геля производного гиалуроновой кислоты и замещением лекарственного средства биогенным компонентом. Если лекарственное средство высвобождается диффузией лекарственного средства, то скорость высвобождения может контролироваться плотностью поперечных связей геля и количеством и гидрофобностью области поперечных связей. Примеры деградации геля включают деградацию областей химических поперечных связей и деградацию скелета производного гиалуроновой кислоты. Такая деградация вызывает снижение плотности поперечных связей (повышение степени набухания). Снижение плотности поперечных связей приводит к повышению скорости диффузии лекарственного средства в геле, и расщепление связи также способствует высвобождению. Следовательно, скорость высвобождения лекарственного средства можно изменять регуляцией деградируемости области химических поперечных связей, деградируемости полимерного скелета и деградируемости спейсера.
Замещение биогенным компонентом относится к высвобождению лекарственного средства, например, введением геля в живой организм, подкожно или в кровь, проникновению вещества, такого как белок плазмы, такого как альбумин, или липид, присутствующих в живом организме, в гель и замещению инкапсулированного средства веществом. Гель производного гиалуроновой кислоты по настоящему изобретению может подавлять замещение лекарственного средства биогенным компонентом, связанное с проникновением компонента не только физическим поперечным сшиванием гидрофобных групп, но также химическим поперечным сшиванием, описанным выше. Скорость проникновения биогенного компонента можно контролировать плотностью поперечных связей геля и электрическими зарядами в геле. Когда лекарственное средство предназначено для инкапсулирования добавлением раствора лекарственного средства после образования геля поперечным сшиванием, описанным выше, то условия инкапсулирования могут быть выбраны соответствующим образом, чтобы облегчить абсорбцию лекарственного средства в гель во время инкапсулирования и подавить проникновение биогенных компонентов в живом организме. Например, но без ограничения, если инкапсулируется белок, то электростатическое отталкивание между производным гиалуроновой кислоты и лекарственным средством можно снизить проведением стадии инкапсулирования около изоэлектрической точки белка. Также проведением стадии инкапсулирования при рН около или ниже чем pKa (примерно 4,0) карбоновой кислоты, полученной из глюкуроновой кислоты в гиалуроновой кислоте, отрицательный заряд, который имеет гель, может быть снижен. Это снижает электростатистическое отталкивание между гелем и белками, заряженными отрицательным зарядом, и делает возможным повышение эффективности инкапсулирования. Кроме того, проведение стадии инкапсулирования, например, при концентрации соли ниже, чем имеются в живом организме, делает набухание геля со скоростью набухания выше, чем в живом организме, и облегчает инкапсулирование.
Кроме того, производное гиалуроновой кислоты, модифицированное одновременно гидрофобной группой и поперечно-сшивающей функциональной группой по настоящему изобретению, может преобразовываться в гель химическим поперечным сшиванием при совместном обеспечении гидрофильного полисахаридного производного, содержащего гидрофобную группу. В частности, смешиванием и поперечным сшиванием можно получить производное гиалуроновой кислоты, одновременно модифицированное гидрофобной группой и поперечно-сшивающей функциональной группой, содержащей ненасыщенную связь, по настоящему изобретению и гидрофильное полисахаридное производное, содержащее гидрофобную группу, гель производного гиалуроновой кислоты, в котором гидрофильное полисахаридное производное, содержащее гидрофобную группу, физически инкапсулировано.
Гидрофильное полисахаридное производное, содержащее гидрофобную группу, представляет собой гидрофильный полисахарид, который может быть получен введением гидрофобной группы в гидрофильный полисахарид или его производное, по меньшей мере, одной или более молекул на одну молекулу полисахарида. Гидрофильный полисахарид особым образом не ограничивается, но предпочтительно представляет собой пуллулан, амилопектин, амилозу, декстран, маннан, леван, инулин, хитин, хитозан, гиалуроновую кислоту или декстрин. Данные полисахариды, имеющие различные среднемассовые молекулярные массы, могут быть получены из промышленных источников или согласно способу, описанному в литературе. Особенно предпочтительными гидрофильными полисахаридами являются пуллулан, гиалуроновая кислота и декстрин. Предпочтительно декстрин представляет собой декстрин Cluster (зарегистрированная торговая марка). Декстрин Cluster (зарегистрированная торговая марка) может быть коммерчески доступным от Ezaki Glico Co., Ltd. и использован. Гидрофобная группа особенным образом не ограничивается, но предпочтительно представляет собой группу, такую как С8-50 углеводородная группа, стерильная, группа полимолочной кислоты (PLA), группа сополимера полимолочной-полигликолевой кислоты (PLGA) или группа, содержащая такую группу. Особенно предпочтительной является группа, содержащая холестерильную группу, линейный или разветвленный С8-30алкил или группу, содержащую такую группу. Гидрофобная группа может быть введена через спейсер.
Примеры гидрофильного полисахаридного производного, содержащего гидрофобную группу, включают производное гиалуроновой кислоты по настоящему изобретению. Следовательно, мелкие частицы, состоящие из производного гиалуроновой кислоты по настоящему изобретению, можно инкапсулировать в подходящий гель.
Гидрофильное полисахаридное производное, содержащее гидрофобную группу, можно получить известными способами. Производное гидрофильного полисахарида (далее по тексту также обозначаемые как «пуллулан с холестерильной группой» и «СНР»), в котором N-[6-(холестерилоксикарбониламино)гексил]карбамоил в качестве гидрофобной группы введен в гидроксигруппу пуллулана, используемого в качестве гидрофильного полисахарида, является коммерчески доступным (например, от NOF Corporation). Гидрофильное полисахаридное производное, содержащее гидрофобную группу, образует мелкие частицы (наногель), имеющие структуру геля наноразмеров (1-1000 нм), спонтанной ассоциацией нескольких молекул гидрофобным взаимодействием в водном растворе и, следовательно, способно образовывать комплекс с гидрофобным лекарственным средством или белком, или полисахаридом, обладающим эффективностью.
Молекулярная масса гидрофильного полисахаридного производного, содержащего гидрофобную группу, используемого в настоящем изобретении, особым образом не ограничивается, но предпочтительно составляет от 1 кДа до 1000 кДа, и более предпочтительно от 10 кДа до 300 кДа. Указанное выше гидрофильное полисахаридное производное также может представлять собой фармацевтически приемлемую соль.
Кроме того, например, гидроксигруппа, входящая в состав производного гиалуроновой кислоты по настоящему изобретению и гидрофильного полисахаридного производного, содержащего гидрофобную группу, также доступна в качестве поперечно-сшиваемой группы. Следовательно, гидроксигруппа в производном гиалуроновой кислоты по настоящему изобретению и производное гидрофильного полисахарида, содержащее гидрофобную группу, могут быть поперечно сшиты посредством определенного сшивающего агента, например, дивилсульфона (DVS), карбодиимида или сшивающего агента, содержащего глицидиловый эфир на обоих концах С2-20алкилена.
Когда карбоксигруппы гиалуроновой кислоты замещены заместителями многих типов, то такие заместители могут быть введены одновременно или последовательно.
Согласно дополнительному аспекту настоящего изобретения, предоставлено производное гиалуроновой кислоты, определенное в данном описании, отличается тем, что производное гиалуроновой кислоты образует мелкие частицы ассоциацией в воде. Производное гиалуроновой кислоты обладает способностью к образованию мелких частиц нанопорядка спонтанной ассоциацией в воде за счет, но без ограничения, гидрофобного взаимодействия введенной группы -NR9-Z1-Z2. Для конструирования требуемой системы доставки лекарственного средства, наночастицы, образованные производным гиалуроновой кислоты по настоящему изобретению, являются одним из очень эффективных средств, и их можно использовать в качестве капсулы для доставки белка, пептида или низкомолекулярного соединения, которое является активным ингредиентом, для доставки в место-мишень, одновременно сохраняя их в гидрофобной области, образовавшейся внутри. Лекарственное средство также может быть доставлено в место-мишень конъюгацией лекарственного средства.
Мелкие частицы наноразмера можно вводить системно, и в частности, внутривенно, и их можно использовать в качестве носителей для контролируемого высвобождения лекарственного средства в кровь, посредством чего инкасулированные (входящие в состав комплекса) лекарственные средства высвобождаются в кровь контролируемым образом, или для целенаправленной доставки, посредством которой лекарственные средства доставляются избирательно в органы и клетки-мишени. При использовании в качестве носителей для целенаправленной доставки, можно добавить элементы целенаправленной доставки для направленной доставки в конкретные органы и клетки. Примеры элемента целенаправленной доставки включают специфические пептиды, антитела, фрагменты антител, аптамеры, пептиды RGD для раковых клеток, фолиевую кислоту, анизамид, трансферрин, галактозу для печени и токоферол. Для повышения времени удерживания лекарственного средства в крови производные гиалуроновой кислоты могут быть дополнительно химически поперечно сшиты.
Известно, что молекулы меньше определенного размера выделяются через почки. Например, сообщалось, что полиэтиленгликоль (ПЭГ), который представляет собой линейный полимер, как и гиалуроновая кислота, имеющий молекулярную массу 40 кДа или ниже, выделяется почками (European Journal of Cancer, Vol. 31, p. 766-770, 1995). Следовательно, гиалуроновые кислоты и производные гиалуроновой кислоты, имеющие молекулярную массу одинакового порядка, могут немедленно выводиться из крови. Однако производные ГК, модифицированные гидрофобной группой по настоящему изобретению, могут образовывать комплексы посредством ассоциации и, следовательно, могут использоваться в качестве носителей для контролируемого высвобождения лекарственного средства в крови и для целенаправленной доставки, даже если производные ГК имеют молекулярную массу ниже, чем молекулярная масса ПЭГ, которые выделяются почками.
Мелкие частицы производного гиалуроновой кислоты образуются самоассоциацией в водном растворе и, следовательно, могут быть получены растворением твердого производного гиалуроновой кислоты в воде или водном растворе соли. Альтернативно, мелкие частицы могут быть получены растворением производного гиалуроновой кислоты в другом растворителе (например, ДМСО) и последующей заменой растворителя водой или водным раствором соли. Можно провести обработку ультразвуком для получения мелких частиц одинакового размера.
Повышение степени введения гидрофобной группы в производное гиалуроновой кислоты приводит к снижению растворимости в воде. Для получения мелких частиц, которые могут диспергироваться в водном растворе, предпочтительно используют производное гиалуроновой кислоты, которое получено таким образом, что гидрофобная группа, введенная посредством ковалентной связи, составляет 80% или ниже и предпочтительно 60% или ниже.
Поскольку гиалуроновая кислота содержит карбоксигруппу, которая является диссоциируемой группой, то повышение ионной силы в системе снижает ее растворимость. Следовательно, изменяя степень введения, можно получить производное гиалуроновой кислоты, которое растворяется при низких концентрациях соли или в бессолевых условиях и агрегирует или преципитирует при физиологических концентрациях соли. Его можно использовать в качестве матрикса для композиции для контролируемого высвобождения при подкожном введении. Производные гиалуроновой кислоты, модифицированные гидрофобной группой, в такой степени, что образуются стабильные мелкие частицы при физиологических концентрациях соли, могут использоваться в качестве носителей для системного введения.
Размеры мелких частиц, которые образуются, особым образом не ограничиваются, но предпочтительно составляют 200 мкм или ниже и более предпочтительно 100 мкм или ниже, для обеспечения прохождения через иглы без закупоривания при введении в виде инъекций. Для внутривенного введения размер частиц предпочтительно составляет 500 нм или ниже и более предпочтительно 200 нм или ниже, во избежание закупорки периферических кровеносных сосудов. Кроме того, во избежание захвата ретикулоэндотелиальной системой и увеличения удерживания в крови размер частиц предпочтительно составляет 100 нм или ниже и более предпочтительно 50 нм или ниже.
Производное гиалуроновой кислоты по настоящему изобретению может быть использовано в качестве носителя лекарственных средств в фармацевтической композиции, и может быть обеспечена фармацевтическая композиция, содержащая производное гиалуроновой кислоты по настоящему изобретению и лекарственное средство. Поскольку производное гиалуроновой кислоты по настоящему изобретению может спонтанно образовывать комплекс с лекарственным средством в водном растворе без особых операций, возможно легко получить комплекс носитель-лекарственное средство и удерживать лекарственное средство смешением производного гиалуроновой кислоты и лекарственного средства в водном растворе и инкубацией раствора. Движущей силой образования комплекса в основном является гидрофобное взаимодействие гидрофобной группы производного гиалуроновой кислоты и лекарственного средства, но если лекарственное средство обладает основными свойствами, то свой вклад может внести электростатическое взаимодействие с карбоновой кислотой в производном гиалуроновой кислоты. При концентрации соли, которая имеет место в живом организме, электростатическое взаимодействие слабее, а гидрофобное взаимодействие сильнее, следовательно, образование комплексов в основном можно отнести за счет гидрофобного взаимодействия.
Если Z1 представляет собой алкилен в формулах (I) и (II), представленных выше, то чем длиннее углеводородная цепь алкилена, тем выше гидрофобность группы, и тем более прочные мелкие частицы могут образовываться под действием более сильного гидрофобного взаимодействия. Кроме того, более длинный алкилен образует большее межмолекулярное сцепление и обеспечивает большую вязкость. Размер мелких частиц также можно контролировать изменением длины алкилена.
Если линкер (спейсер) в гидрофобной группе представляет собой сложный эфир или карбонат (например, Х1 или Х2 содержит -COO-Z3 или -O-COO-Z3), то сложный эфир или карбонат деградирует в живом организме, и гидрофобность производного гиалуроновой кислоты снижается. Это приводит к повышению биоразлагаемости и предпочтительно с точки зрения безопасности. Кроме того, известно, что опухолевая ткань имеет низкий рН вокруг ткани. При наличии такого спейсера комплекс производного гиалуроновой кислоты по настоящему изобретению, который удерживает представляющее интерес лекарственное средство, распадается около опухоли с высвобождением лекарственного средства вокруг опухоли.
В частности, если линкер является линкером, имеющим структуру сложного эфира β-тиокарбоксилата, такого как -O-CO-CH2-CH2-S-, то разрушение индуцируется незначительным снижением рН (при рН 6 или так далее). Следовательно, он реагирует на изменение рН сильнее, чем обычный сложный эфир. Если предполагается доставить лекарственное средство в клетки, то такой линкер реагирует на снижение рН в эндосомах, и он способен высвобождать лекарственное средство только после захвата клетками лекарственного средства.
Если линкер (спейсер) содержит дисульфидную связь (например, Х1 или Х2 содержит -S-S-Z3), то линкер разлагается в редуцирующих условиях, и комплекс производного гиалуроновой кислоты по настоящему изобретению разрушается за счет снижения гидрофобности производного гиалуроновой кислоты. Поскольку известно, что цитоплазма представляет собой редуцирующую среду, то посредством инкапсулирования лекарственного средства в производном гиалуроновой кислоты, содержащем такой линкер, и его введения, возможно высвободить лекарственное средство только в цитоплазме, но не в крови.
Условия во время образования комплекса носитель-лекарственное средство, такие как растворитель, концентрация соли, рН, температура, время и добавление денатурирующего агента, можно изменять соответствующим образом, в зависимости от используемого лекарственного средства. Например, в зависимости от концентрации соли и рН во время инкапсулирования лекарственного средства, производное гиалуроновой кислоты изменяется по плотности, а также изменяется состояние ионизации лекарственного средства. Примеры денатурирующих веществ, предназначенных для использования, включают мочевину, гидрохлорид гуанидина и додецилсульфат натрия. Если добавляется денатурирующее вещество, то избыток денатурирующего вещества можно удалить отмывкой избыточным количеством воды после образования комплекса.
Например, но без ограничения, если образуется комплекс производного гиалуроновой кислоты по настоящему изобретению и белка, то количество белка, входящего в состав комплекса, можно повысить проведением образования комплекса около изоэлектрической точки белка, поскольку это может снизить электростатическое отталкивание производного гиалуроновой кислоты и белка. Кроме того, если стадия образования комплекса проводится в условиях при рН, равном или ниже чем pKa (примерно 4,0) карбоксигруппы фрагмента глюкуроновой кислоты, то тогда количество белка, входящего в состав комплекса, может повыситься, поскольку отрицательный заряд, который имеет производное гиалуроновой кислоты, может снизиться, и электростатическое отталкивание подавляется, если белок электрически заряжен отрицательным зарядом в этих условиях. Кроме того, при проведении стадии образования комплекса, например, при концентрации соли ниже, чем в живом организме, количество белка, входящего в состав комплекса, может повыситься, поскольку плотность мелких частиц производного гиалуроновой кислоты, образовавшихся в водном растворе, снижается. Кроме того, посредством повышения концентрации соли в таком состоянии плотность мелких частиц может повыситься, и белок может прочно инкапсулироваться.
На образование комплекса производного гиалуроновой кислоты и белка может оказывать влияние молекулярная масса белка. Как правило, чем ниже молекулярная масса белка, тем выше скорость переноса белка в мелкие частицы производного гиалуроновой кислоты. Кроме того, плотность мелких частиц, зависящая от степени введения гидрофобной группы, может оказывать влияние на образование комплекса с белком и количество белка, входящего в состав комплекса.
Высвобождение лекарственного средства из комплекса производного гиалуроновой кислоты и лекарственного средства в живом организме индуцируется замещением лекарственного средства компонентами в живом организме в дополнении к диффузии лекарственного средства из комплекса. Контролируемое высвобождение лекарственного средства можно регулировать повышением или снижением плотности мелких частиц для регуляции такой диффузии и замещения.
Живой организм содержит биогенные компоненты, такие как белки и липиды плазмы. Когда комплекс производного гиалуроновой кислоты и лекарственного средства вводят в живой организм, например, подкожно или в кровь, то лекарственное средство может высвобождаться замещением лекарственного средства в комплексе такими компонентами в живом организме. Полагают, что альбумин является основным биогенным белком, который вызывает замещение. Посредством снижения степени введения гидрофобной группы в производное гиалуроновой кислоты по настоящему изобретению отрицательные заряды карбоксигруппы фрагмента глюкуроновой кислоты можно повысить, и замещение альбумином (pI=4,6), который имеет отрицательный заряд, может снизиться.
Иллюстративные способы применения производного гиалуроновой кислоты по настоящему изобретению в качестве носителя лекарственного средства включают способ спонтанного образования производным комплекса с лекарственным средством в водном растворе, как описано выше, а также способ получения конъюгата, в котором лекарственное средство сочетается с производным гиалуроновой кислоты по настоящему изобретению.
Следовательно, в еще одном аспекте настоящего изобретения предоставлен конъюгат гиалуроновая кислота-лекарственное средство, в котором один или более лекарственных средств, описанных выше, сочетаются с производным гиалуроновой кислоты, содержащим дисахаридную единицу формулы (I). В одном из вариантов осуществления данного аспекта в качестве производного гиалуроновой кислоты можно использовать производное гиалуроновой кислоты, содержащее одну или более дисахаридных единиц (а) формулы (I) и формулы (III), (b) формулы (I), формулы (II) и формулы (III), (с) формулы (I), формулы (IIb) и формулы (III) или (d) формулы (I), формулы (II), формулы (IIb) и формулы (III). Например, посредством сочетания гидрокси, амино, меркапто, атома галогена (такого как атом брома и йода) или реакционноспособной углерод-углеродной связи (такой как метакрилоил и акрилоил), входящих в состав группы -NRe-Yb-Rd в формуле (III), и лекарственного средства, можно получить конъюгат производное гиалуроновой кислоты-лекарственное средство, описанный выше.
Кроме того, между группой -NRe-Yb-Rd и лекарственным средством может быть вставлен спейсер формулы -G1-G2-G3-J-*** [где *** показывает сайт связывания с лекарственным средством, G1 выбран из прямой связи, -C(=O)-, -NRs- и -S-, G2 выбран из -(CH2)i и (CH2)qa-(O-CH2-CH2)k-, G3 выбран из прямой связи, -C(=O)-NRt-(CH2)r и -NRu-C(=O)-(CH2)ma-, J представляет собой группу, представленную следующей формулой:
Химическая формула 31
 .
.
Rs, Rt и Ru независимо выбраны из атома водорода и С1-6алкила, i является целым числом, выбранным из 1-10, qa является целым числом, выбранным из 2-10, k является целым числом, выбранным из 1-100, r и ma являются целыми числами, независимо выбранными из 1-10.
Конкретные примеры формулы -G1-G2-G3-J-*** включают, например, следующие формулы:
Химическая формула 32
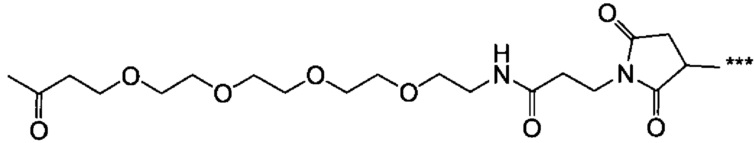
 .
.
Гидроксигруппы в положении 4 глюкуроновой кислоты и в положении 1 ацетилглюкозамина, имеющиеся на концах скелета производного гиалуроновой кислоты по настоящему изобретению, можно преобразовать в другую группу, и примеры такой группы включают С1-6алкокси, формилокси и С1-6алкилкарбонилокси.
Для получения конъюгата производного гиалуроновой кислоты по настоящему изобретению и лекарственного средства можно применить способ, используемый при получении конъюгата известного полимера и лекарственного средства, и например, можно использовать следующие реакции:
взаимодействие карбоксигруппы фрагмента глюкуроновой кислоты производного гиалуроновой кислоты с аминогруппой, гидроксигруппой, атомом йода или брома в лекарственном средстве или аминогруппой, гидроксигруппой, атомом брома или йода, введенных в лекарственное средство;
взаимодействие гидроксигруппы в положении 6 фрагмента N-ацетилглюкозамина производного гиалуроновой кислоты с карбоксигруппой в лекарственном средстве или карбоксигруппой, введенной в лекарственное средство;
взаимодействие аминогруппы, введенной в производное гиалуроновой кислоты, с карбоксигруппой в лекарственном средстве или карбоксигруппой, введенной в лекарственное средство;
взаимодействие аминогруппы, введенной в производное гиалуроновой кислоты, с лекарственным средством с преобразованной группой, в такую как изотиоцианат, изоцианат, ацилазид, сложный эфир NHS и эпоксид, модификацией;
взаимодействие аминогруппы лекарственного средства или аминогруппы, введенной в лекарственное средство, с производным гиалуроновой кислоты с преобразованной группой, в такую как изотиоцианат, изоцианат, ацилазид, сложный эфир NHS и эпоксид, модификацией;
образование шиффова основания и проведения восстановительного аминирования аминогруппы в производном гиалуроновой кислоты и лекарственного средства (такого как альдегид и кетон), содержащего карбонил, и лекарственного средства, в которое введен карбонил;
образование шиффова основания и восстановительное аминирование аминогруппы в лекарственном средстве или аминогруппы, введенной в лекарственное средство, и производного гиалуроновой кислоты, в которое введен карбонил, модификацией;
взаимодействие меркаптогруппы, введенной в производное гиалуроновой кислоты, с лекарственным средством, которое представляет собой соединение, содержащее ненасыщенную связь (такую как малеимид, акрилатный эфир, акриламид, метакрилатный эфир, метакриламид, аллильное производное и винилсульфон), галогенид (такой как хлорацетатный эфир, бромацетатный эфир, йодацетатный эфир, хлорацетамид, бромацетамид и йодацетамид) или тиол, или с лекарственным средством, преобразованным в такое соединение модификацией; и
взаимодействие меркаптогруппы, введенной в лекарственное средство, с производным гиалуроновой кислоты, преобразованным в такое соединение, которое содержит ненасыщенную связь (такую как малеимид, акрилатный эфир, акриламид, метакрилатный эфир, метакриламид, аллильное производное и винилсульфон), галогенид (такой как хлорацетатный эфир, бромацетатный эфир, йодацетатный эфир, хлорацетамид, бромацетамид и йодацетамид) или тиол, модификацией.
Кроме того, линкер (спейсер), содержащий сложный эфир и карбонат, используемый для введения гидрофобной группы в производное ГК и описанный выше, β-тиоэфир, дисульфид или пептид, который отщепляется в определенном сайте, можно использовать в качестве линкера для конъюгации с лекарственным средством. Такие линкеры отщепляются в сайте-мишени с высвобождением лекарственного средства, как описано выше.
Реагенты, используемые для модификации производного гиалуроновой кислоты или лекарственного средства для получения конъюгата, особым образом не ограничиваются, при условии, что они не вызывают нежелательной реакции при получении конъюгата. Данные соединения являются такими, что доступны в качестве реагента или они могут быть синтезированы при обращении к публикации общеизвестного способа.
В частности, синтезом производного гиалуроновой кислоты по настоящему изобретению и взаимодействием производного с лекарственным средством, содержащим амино, или лекарственным средством, в которое введен амино, с использованием конденсирующего агента, такого как DMT-MM, можно получить конъюгат образованием амидной связи. В данной реакции к лекарственному средству может быть добавлен, например, гидрохлорид холестерил-6-аминогексилкарбамата для одновременного введения гидрофобной группы. Кроме того, такое соединение может быть добавлено после или до лекарственного средства. Кроме того, лекарственное средство можно подвергнуть взаимодействию после синтеза и выделения производного гиалуроновой кислоты по настоящему изобретению, или гидрофобную группу можно ввести после синтеза и выделения производного гиалуроновой кислоты, в которое введено лекарственное средство.
Кроме того, лекарственное средство можно конъюгировать с производным гиалуроновой кислоты через сложноэфирную связь синтезом производного гиалуроновой кислоты по настоящему изобретению и взаимодействием лекарственного средства, содержащего гидрокси, или лекарственного средства, в которое введена гидроксигруппа, с использованием конденсирующего агента, такого как DMT-MM, 1,3-дихлоргексилкарбодиимид (DCC). В данной реакции в лекарственное средство может быть добавлен, например, гидрохлорид холестерил-6-аминогексилкарбамата для одновременного введения гидрофобной группы. Кроме того, такое соединение можно добавить после или до лекарственного средства. Однако желательно конъюгировать лекарственное средство после введения гидрофобной группы во избежание гидролиза сложноэфирной связи. Указанный выше способ можно осуществить при обращении к сообщению (Bioconjugate, Vol. 19, 1319-1325, 2008), в котором описано введение паклитаксела в ГК через сложноэфирную связь.
Кроме того, лекарственное средство можно конъюгировать синтезом производного гиалуроновой кислоты по настоящему изобретению взаимодействием лекарственного средства, которое представляет собой бромид или йодид, или лекарственного средства, преобразованного в бромид или йодид модификацией, и преобразованием карбоксигруппы фрагмента глюкуроновой кислоты в сложный эфир. Желательно конъюгировать лекарственное средство после введения гидрофобной группы во избежание гидролиза сложного эфира.
Лекарственное средство может быть конъюгировано с производным гиалуроновой кислоты через сложноэфирную связь синтезом производного гиалуроновой кислоты по настоящему изобретению преобразованием лекарственного средства, содержащего карбоксигруппу, или лекарственного средства, в которое введена карбоксигруппа, в сложный эфир NHS и взаимодействием карбоксигруппы с гидроксигруппой в положении 6 фрагмента N-ацетилглюкозамина. В данной реакции лекарственное средство может быть добавлено после введения гидрофобной группы в ГК, например, с использованием гидрохлорида холестерил-6-аминогексилкарбамата, или лекарственное средство можно добавить до введения. Кроме того, лекарственное средство можно подвергнуть взаимодействию после синтеза и выделения производного гиалуроновой кислоты по настоящему изобретению или гидрофобная группа может быть введена после синтеза и выделения производного гиалуроновой кислоты, в которое введено лекарственное средство. Во избежание гидролиза сложноэфирной связи желательно конъюгировать лекарственное средство после введения гидрофобной группы. Описанный выше способ можно осуществить согласно сообщению (Международная публикация № 2009/074678), в котором описано введение камптотецина в ГК через сложноэфирную связь.
В одном из вариантов осуществления аминогруппа может быть введена реакцией дегидратации карбоксигруппы фрагмента глюкуроновой кислоты и диамина, такого как этилендиамин, после синтеза производного гиалуроновой кислоты по настоящему изобретению. Кроме того, производное гиалуроновой кислоты, в которое был введен йодацетил, можно синтезировать взаимодействием N-сукцинимидилйодацетата (PIERCE) или N-сукцинимидил[4-йодацетил]аминобензоата (PIERCE) с аминогруппой. Лекарственное средство, содержащее меркаптогруппу, можно конъюгировать с таким производным гиалуроновой кислоты. Данный способ является особенно эффективным для высокомолекулярных лекарственных средств, таких как белок, пептид и нуклеиновая кислота, которые имеют много реакционноспособных групп, таких как амино, поэтому конъюгация может быть избирательной для меркаптогруппы. В данной реакции введение лекарственного средства может иметь место до или после введения гидрофобной группы в ГК.
Производное гиалуроновой кислоты по настоящему изобретению, в котором Х1 представляет собой -NH2-COO-R, синтезируется, и часть карбоксигрупп фрагмента глюкуроновой кислоты подвергается взаимодействию с гидрохлоридом 2-аминоэтил-2-пиридилдисульфида. В данное производное гиалуроновой кислоты можно ввести лекарственное средство, содержащее меркаптогруппу, и лекарственное средство, в которое введена меркаптогруппа, реакцией обмена дисульфидов, т.е. реакцией замещения.
В данной реакции длину линкера между лекарственным средством и производным гиалуроновой кислоты можно довести для сохранения биологической активности эффективного конъюгата. Кроме того, может быть введен пептидный линкер, расщепляемый ферментами в специфическом сайте в живом организме. Например, это можно осуществить при обращении к сообщению (Международная заявка № 2005/095464), в котором описано введение метотрексата в ГК через линкер, содержащий пептид, и к сообщению (Международная заявка № 2002/090209), в котором описано введение доксорубицина через линкер, содержащий HPMA (N-(2-гидроксипропил)метакриламид) и пептид, или тому подобное.
Кроме того, имеется много сообщений по ADC (конъюгат антитела и лекарственного средства), в котором низкомолекулярное соединение конъюгировано с антителом (Международная заявка № 2009/026274; Expert Opinion, Vol. 15, p. 1087-1103, 2005; Bioconjugate Chem., Vol. 19, p. 1960-1963, 2008; Bioconjugate Chem., в печати, Bernhard Stump et al., Antibody-Drug Conjugates: Linking Cytotoxic Payloads to Monoclonal Antibodies), и конъюгат производного гиалуроновой кислоты и низкомолекулярного соединения можно получить при обращении к этим сообщениям.
Фармацевтическая композиция, содержащая один или более лекарственных средств и производное гиалуроновой кислоты по настоящему изобретению, и конъюгат, в котором один или более лекарственных средств конъюгированы с производным гиалуроновой кислоты по настоящему изобретению, может находиться в виде наночастиц, микрочастиц, раствора, эмульсии, суспензии, геля, мицеллы, импланта, порошка или пленки. Порошок может быть получен измельчением твердого вещества, полученного лиофилизацией или распылительной сушкой, или получением из вещества, полученного сушкой преципитата.
Фармацевтические композиции и конъюгаты по настоящему изобретению можно вводить пероральным, парентеральным, интраназальным, интравагинальным, внутриглазным, подкожным, внутривенным, внутримышечным, внутрикожным, внутрибрюшинным, внутриартикулярным, интрацеребральным или интраоральным путями.
Фармацевтические композиции и конъюгаты по настоящему изобретению, в частности, для местного контролируемого высвобождения, предпочтительно по размеру составляет 200 мкм или ниже и более предпочтительно 100 мкм или ниже, для прохождения без закупорки иглы.
Фармацевтические композиции и конъюгаты по настоящему изобретению, в частности, для целенаправленной доставки к рецептору гиалуроновой кислоты, включая CD44, предпочтительно по размеру составляют 5 мкм или ниже.
Фармацевтические композиции и конъюгаты по настоящему изобретению, в частности, для длительного удерживания в крови и накопления в опухолевой ткани или воспаленной ткани, по размеру предпочтительно составляют 500 нм или ниже и более предпочтительно 200 нм или ниже. Кроме того, предпочтительно размер составляет 100 нм или ниже во избежание захвата ретикулоэндотеливальной системой и увеличения удерживания в крови.
Фармацевтические композиции и конъюгаты по настоящему изобретению, в частности, для неагрессивного введения таковых, обладающих способностью к адгезии к слизистой оболочке, предпочтительно имеют размер 200 мкм или ниже. В отношении адгезии к слизистой мембране, степень введения гидрофобной группы в производное гиалуроновой кислоты для использования предпочтительно является низкой.
Лекарственные средства, образующие комплекс с производным гиалуроновой кислоты по настоящему изобретению, особым образом не ограничиваются, при условии, что они могут удерживаться. Кроме того, лекарственные средства, предназначенные для связывания с производным гиалуроновой кислоты по настоящему изобретению, особым образом не ограничиваются, при условии, что можно изготовить конъюгат. Примеры лекарственных средств включают белок и/или пептид, полисахарид, нуклеиновую кислоту, низкомолекулярные соединения, и предпочтительные примеры включают белок и/или пептид.
Примеры низкомолекулярных соединений включают, например, противораковые средства (например, такие как алкилирующие агенты, антиметаболиты, алкалоиды, такие как паклитаксел), иммуносупрессивные средства, такие как циклоспорин, противовоспалительные средства (такие как стероидные и нестероидные противовоспалительные средства), противоревматические средства и антибиотики (такие как бета-лактамные антибиотики, аминогликозидные антибиотики, макролидные антибиотики, антибиотики тетрациклинового ряда, новые хинолоновые антибиотики и сульфа-препараты).
Примеры белков и пептидов включают, например, эритропоэтин (ЕРО), гранулоцитарный колониестимулирующий фактор (G-CSF), интерферон-α, β, γ (INF-α, β, γ), тромбопоэтин (ТРО), цилиарный нейротрофический фактор (CNTF), фактор некроза опухолей (TNF), белок, связывающийся с фактором некроза опухолей (TNFbp), интерлейкин-10 (IL-10), FMS-подобная тирозинкиназа (Flt-3), гормон роста (GH), инсулин, инсулин-подобный фактор роста-1 (IGF-1), тромбоцитарный фактор роста (PDGF), антагонист рецептора интерлейкина-1 (IL-1ra), нейротрофический фактор роста головного мозга (BDNF), фактор роста кератиноцитов (KGF), фактор стволовых клеток (SCF), фактор роста и развития мегакариоцитов (MGDF), остеопротегерин (OPG), лептин, паратгормон (РТН), основный фактор роста фибробластов (b-FGF), костный морфогенетический белок (ВМР), атриальный натрийуретический пептид (ANP), мозговой натрийуретический пептид (BNP), натрийуретический пептид С-типа (CNP), глюкагон-подобный пептид-1 (GLP-1), антитело, диатело, минитело и фрагменты антител.
Примеры нуклеиновых кислот включают, например, ДНК, РНК, антисмысловые нуклеиновые кислоты, «ловушку», рибозим, малые интерферирующие РНК и РНК-аптамер.
Производное гиалуроновой кислоты по настоящему изобретению, в котором инкапсулирован лекарственное средство или конъюгат производное гиалуроновой кислоты-лекарственное средство по настоящему изобретению можно вводить в фармацевтическую композицию, содержащую один или более фармацевтически приемлемых разбавителей, смачивающих агентов, эмульгаторов, диспергирующих веществ, адъювантов, консервантов, буферов, связующих веществ и/или стабилизаторов в любой подходящей форме в зависимости от предполагаемого пути введения. Путь введения может представлять парентеральный путь или пероральный путь.
Согласно настоящему изобретению можно обеспечить пролонгированное контролируемое высвобождение лекарственных средств, таких как белки, пептиды, нуклеиновые кислоты и низкомолекулярные соединения, которое невозможно обеспечить обычным препаратом с контролируемым высвобождением, и/или безопасные композиции с контролируемым высвобождением, и фармацевтические композиции, имеющие соответствующую биоразлагаемость.
Примеры
Конкретные предпочтительные варианты осуществления настоящего изобретения будут описаны в примерах ниже.
Единица ГК, описанная ниже, относится к повторяющейся единице N-ацетилглюкозамин-глюкуроновая кислота (1 единица) в гиалуроновой кислоте. Снятие 1Н-ЯМР спектра проводили с использованием ЯМР-спектрометра JNM-ECA500 (JEOL Ltd.). Диализ проводили с использованием мембраны для диализа из регенерированной целлюлозы (Spectra Pore 4: порог отсечения по молекулярной массе: 12 k-14 кДа при использовании натриевой соли гиалуроновой кислоты, имеющей молекулярную массу 50 кДа и 99 кДа в качестве исходного соединения; Spectra Pore 7: порог отсечения по молекулярной массе: 1 кДа или 2 кДа при использовании натриевой соли гиалуроновой кислоты, имеющей молекулярную массу 10 кДа в качестве исходного соединения).
Пример 1. Синтез производного гиалуроновой кислоты
Пример 1-1. Получение гидрохлорида холестерил-6-аминогексилкарбамата
Триэтиламин (TEA, 1,05 мл) добавляли к раствору холестерилхлорформиата (3,37 г, 7,5 мл) в безводном дихлорметане (20 мл) в атмосфере аргона и смесь перемешивали. Добавляли по каплям на льду 6-(трет-бутоксикарбонил)амино-1-аминогексан (1,12 мл, 5 ммоль), смесь перемешивали на льду в течение 30 мин и затем нагревали до комнатной температуры. Смесь перемешивали в течение ночи. Реакционную смесь промывали ультрачистой водой и насыщенным раствором соли, и сушили над безводным сульфатом магния. Затем растворитель выпаривали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат:н-гексан=1:4). Фракции, содержащие целевое соединение, объединяли, и растворитель выпаривали при пониженном давлении. Полученный остаток растворяли в этилацетате (40 мл) и добавляли раствор смеси 4Н хлористоводородная кислота/этилацетат (40 мл). Смесь перемешивали при комнатной температуре в течение ночи, и полученный осадок отделяли центрифугированием. Полученное твердое вещество промывали 4 раза этилацетатом и затем сушили при пониженном давлении, с получением гидрохлорида холестерил-6-аминогексилкарбамата (Chol-C6) (1,2 г). 1Н-ЯМР спектр (EtOH-d6) продукта показан на фиг. 1-1.
Пример 1-2. Получение тетрабутиламмониевой (TBA) соли катионообменной смолы
DOWEX (зарегистрированная торговая марка) 50WX-8-400 (Sigma-Aldrich) суспендировали в ультрачистой воде и смолу промывали 3 раза или больше ультрачистой водой с декантацией. Добавляли 40% масс. водного раствора гидроксида тетрабутиламмония (TBA-OH; Sigma-Aldrich) к смоле из расчета примерно 1,5 эквивалентов на катионообменную способность, и смесь перемешивали в течение 30 мин. Избыток раствора TBA-OH удаляли декантированием, затем промывали несколько раз избытком ультрачистой воды, и, наконец, раствор фильтровали через фильтр 0,45 мкм, с получением TBA соли катионообменной смолы.
Пример 1-3. Получение солей НА
Натриевые соли гиалуроновой кислоты (ГК-Na, Shiseido Co., Ltd.) с молекулярными массами 10 кДа, 55 кДа и 99 кДа, каждую растворяли в ультрачистой воде в концентрации 15 мг/мл. Суспензии ТВА соли катионообменной смолы, полученные в примере 1-2, добавляли в количестве 5 моль-эквивалентов на моль ГК единицы (молекулярная масса единицы 401,3) с учетом ионообменной способности смолы. После перемешивания в течение 15 мин, суспензии фильтровали через фильтр 0,45 мкм. Фильтрат сушили замораживанием, с получением ТВА солей гиалуроновой кислоты (ГК-ТВА) в виде белого твердого вещества.
В качестве репрезентативного примера 1Н-ЯМР спектр продукта, полученного из исходного соединения ГК-Na с молекулярной массой 99 кДа с использованием D2O в качестве растворителя, показан на фиг. 1-2. Основываясь на интегрированном значении сигналов (-COCH3, 2,0 м.д.; 3H) ацетила в глюкозамине в ГК и интегрированном значении сигналов (N(CH2CH2CH2CH3)4, 1,4, 1,7 м.д.; 16H) четырех этиленовых групп в ТВА, рассчитывали количественные соотношения ТВА к единицам ГК. По данным соотношениям рассчитывали среднемассовые молекулярные массы единиц ГК-TBA. Например, среднемассовая молекулярная масса единицы ГК-ТВА, полученной из исходного соединения ГК-Na с молекулярной массой 99 кДа, составляла 752,6.
Пример 1-4. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-аланином (Ala) и холестерил-6-аминогексилкарбаматом (ГК-Ala-Chol/FL)
Готовили растворы (5 мг/мл) ГК-ТВА, синтезированной из исходных соединений ГК-Na (10 кДа, 50 кДа, 99 кДа) в примере 1-3, в безводном ДМСО. Затем добавляли гидрохлорид этилового эфира L-аланина (Aldrich) в количестве 5 моль-эквивалентов на единицу ГК. Затем добавляли 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолинийхлорид (DMT-MM) в количестве 6 моль-эквивалентов на единицу ГК. Смеси перемешивали при комнатной температуре в течение ночи. Реакционные растворы подвергали диализу против водного раствора 0,3М NaCl и ультрачистой воды в указанном порядке. К полученным диализатам добавляли 2Н раствор NaOH до рН 12,5 или выше, и смеси перемешивали в течение 1 ч для гидролиза этилового эфира для снятия защиты с карбоксигруппы. Затем смеси нейтрализовали 2Н HCl, затем подвергали диализу и затем лиофилизировали, с получением ГК-Ala в виде белого твердого вещества. Иллюстративный пример 1Н-ЯМР спектра ГК-Ala (продукта, полученного из исходного соединения ГК с молекулярной массой 99 кДа), снятого в таких же условиях, как описано в примере 1-3, показан на фиг. 1-3. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика метила (-CH3, 1,4 м.д.; 3H) в аланине, рассчитывали степень введения аланина (степень введения Ala) в единицы ГК по формуле, представленной ниже (таблица 1).
Формула 2
Суспензию ТВА соли катионообменной смолы, полученную в примере 1-2, добавляли к водным растворам ГК-Ala в количестве примерно 5 моль-эквивалентов. После перемешивания в течение 15 мин суспензии фильтровали через фильтр 0,45 мкм. Фильтраты лиофилизировали, с получением ТВА солей ГК-Ala (ГК-Ala-ТВА) в виде белого твердого вещества. Основываясь на 1Н-ЯМР спектрах ГК-Ala-ТВА, снятых в таких же условиях, как описано выше в примере 1-3, рассчитывали количественное соотношение ТВА к единице ГК, методом, аналогично описанному в примере 1-3, и, основываясь на интегрированном значении пика ацетила в глюкозамине и интегрированном значении пика метила (-Si(CH3)3, 0,0 м.д.; 9H) в натриевой соли 3-(триметилсилил)пропионата-d4 (TSP-d4), использованной в качестве внутреннего стандарта, рассчитывали массовое содержание единицы ГК.
Готовили растворы (10 мг/мл) ГК-Ala-ТВА в безводном ДМСО. Затем к соответствующим растворам добавляли гидрохлорид Chol-C6, полученный в примере 1-1, в соотношениях к единице ГК-Ala-ТВА, представленных в таблице 1 ниже. Затем к ГК-Ala-ТВА добавляли DMT-MM в соотношении, представленном в таблице 1 ниже. Добавляли гидрохлорид аминометилфлуоресцеина (FL) (Invitrogen) и DMT-MM соответственно в количестве 0,04 моль-эквивалентов и 0,07 моль-эквивалентов на единицу ГК-Ala-ТВА. Смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор подвергали диализу против водного раствора 0,3М ацетата аммония/ДМСО, 0,15М водного раствора NaCl и ультрачистой водой в указанном порядке. Полученные диализаты лиофилизировали, с получением целевых продуктов (ГК-Ala-Chol-FL) в виде желтого твердого вещества.
Иллюстративный пример 1Н-ЯМР спектра (продукта, полученного из исходного соединения ГК-Na с молекулярной массой 99 кДа, и который имел степень введения холестерильной группы 7%) в смешанном растворе 0,02Н DCl ДМСО-d6/D2O (2Н DCl D2O:ДМСО-d6=1:99), использованном в качестве растворителя при анализе, показан на фиг. 1-4. Основываясь на интегрированном значении пика ацетила (-COCH3, 1,6-2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика метила (-CH3, 0,7 м.д.; 3H) в холестерильной группе, рассчитывали степень введения холестерильной группы в единицы ГК по формуле, показанной ниже (таблица 1). Поскольку пики около 1,6-2,0 м.д., включая пики ацетила в глюкозамине, перекрываются с пиками (5Н) холестерильной группы, значения, полученные вычитанием 5/3 интегрированного значения пика (0,7 м.д.) метила в холестерильной группе, из интегрированного значения пиков около 1,6-2,0 м.д. (т.е. интегрированное значение (1,6-2,0 м.д.)-интегрированное значение (0,7 м.д.)×5/3) использовали в качестве интегрированных значений ацетила ГК для расчета степени введения.
Формула 3
В данном примере примеры групп, с которыми аминогруппа в гидрохлориде Chol-C6 может взаимодействовать, включают как карбоксигруппу фрагмента глюкуроновой кислоты в гиалуроновой кислоте, так и карбоксигруппу в Ala. Если гидрофобную группу можно ввести в две реакционноспособные группы, подобные этим, то сокращенное обозначение с дефисом, такое как «-Chol» используется для обозначения мишени.
Пример 1-5. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-треонином (ThrNH2) и холестерил-6-аминогексилкарбаматом (ГК-ThrNH2-Chol/FL)
Готовили растворы (10 мг/мл) ГК-ТВА, синтезированной из исходного соединения ГК-Na (99 кДа) в примере 1-3, в безводном ДМСО. Затем добавляли Chol-С6, полученный в примере 1-1, к соответствующим растворам в соотношениях на единицу ГК, представленных в таблице 2 ниже. Затем добавляли DMT-MM в соотношениях на единицу ГК, представленных в таблице 2 ниже, гидрохлорид 5-аминометилфлуоресцеина (FL) (Invitrogen) и добавляли DMT-MM соответственно в количестве 0,04 моль-эквивалентов и 0,07 моль-эквивалентов на единицу ГК. Смесь перемешивали при комнатной температуре в течение 7 ч. Затем добавляли гидрохлорид L-треонинамида (WATANABE CHEMICAL INDUSTRIES, LTD.) в количестве 3 моль-эквивалентов на единицу ГК. Затем добавляли DMT-MM в количестве 5 моль-эквивалентов на единицу ГК. Смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор подвергали диализу против раствора 0,3М ацетата аммония/ДМСО, 0,15М водного раствора NaCl и ультрачистой водой в указанном порядке. Полученные диализаты лиофилизировали, с получением целевых продуктов (ГК-ThrNH2/Chol/FL) в виде желтого твердого вещества.
Иллюстративный пример 1Н-ЯМР спектра (продукта, полученного из исходного соединения ГК-Na с молекулярной массой 99 кДа, и который имел степень введения холестерильной группы 6%) в смешанном растворе 0,02Н DCl ДМСО-d6/D2O (2Н DCl D2O:ДМСО-d6=1:99), используемом в качестве растворителя при анализе, показан на фиг. 1-5. Основываясь на интегрированном значении пика ацетила (-COCH3, 1,6-2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика метила (-CH3, 0,7 м.д.; 3H) в холестерильной группе, рассчитывали степень введения холестерильной группы в единицы ГК по формуле, показанной ниже (таблица 2). Поскольку пики в области 1,6-2,0 м.д., включая пики ацетила в глюкозамине, перекрываются с пиками (5Н) холестерильной группы, то значения, полученные вычитанием 5/3 интегрированного значения пика (0,7 м.д.) метила в холестерильной группе, из интегрированного значения пиков области 1,6-2,0 м.д. (т.е. интегрированное значение (1,6-2,0 м.д.)-интегрированное значение (0,7 м.д.)×5/3), использовали в качестве интегрированных значений ацетила в ГК для расчета степени введения.
Формула 4
Основываясь на интегрированном значении пика ацетила в глюкозамине и интегрированном значении пика метила (-CH3, 1,2 м.д.; 3H) в треонинамиде, рассчитывали степень введения треонинамида в единицы ГК (таблица 2).
Формула 5
В данном примере аминогруппа в гидрохлориде Chol-C6 взаимодействует только с карбоксигруппой фрагмента глюкуроновой кислоты гиалуроновой кислоты, и гидрофобная группа дополнительно не вводится во введенный ThrNH2. Если гидрофобную группу можно ввести только в карбоксигруппу фрагмента глюкуроновой кислоты гиалуроновой кислоты, подобные этому, сокращенное обозначение с косой черточкой, такое как «/Chol» используется для обозначения мишени.
Пример 1-6. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-серином (Ser) и холестерил-6-аминогексилкарбаматом (ГК-Ser-Chol/FL)
ГК-Ser получали в виде белого твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что использовали гидрохлорид этил-L-серината (Aldrich) вместо гидрохлорида этил-L-аланината. Кроме того, часть диализата (ГК-Ser-OEt) до снятия защиты с карбоксигруппы карбоксигруппу собирали и лиофилизировали в качестве образца для расчета степени введения. 1Н-ЯМР спектр образца, использованного для расчета степени введения, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг.1-6. Основываясь на интегрированном значении пика ацетила (-COCH3, 1,9 м.д.; 3H) в глюкозамине и интегрированном значении пика метила (-CH3, 1,2 м.д.; 3H) в этиловом эфире серина, рассчитывали степень введения серина в единицы ГК аналогично описанному в примере 1-4 (таблица 3). Кроме того, 1Н-ЯМР спектр образца со снятой защитой, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг.1-7. ТВА соль ГК-Ser (ГК-Ser-TBA) получали в виде белого твердого вещества в условиях, аналогично описанным в примере 1-4. Затем ее подвергали взаимодействию с гидрохлоридом Chol-C6 и FL способом, аналогично описанному в примере 1-4, с получением целевого соединения (ГК-Ser-Chol/FL) в виде желтого твердого вещества. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-4, представлен на фиг.1-8. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-4 (таблица 3).
Пример 1-7. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-глицином (Gly) и холестерил-6-аминогексилкарбаматом (ГК-Gly-Chol/FL)
ГК-Gly получали в виде белого твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что использовали гидрохлорид этилглицината (Wako Pure Chemical Industries, Ltd.) вместо гидрохлорида этил-L-аланината. Кроме того, часть диализата (ГК-Gly-OEt) до снятия защиты с карбоксигруппы собирали и лиофилизировали в виде образца, использованного для расчета степени введения. 1Н-ЯМР спектр образца, использованного для расчета степени введения, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг.1-9. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика метила (-CH3, 1,3 м.д.; 3H) в этиловом эфире глицина, рассчитывали степень введения глицина в единицы ГК аналогично описанному в примере 1-4 (таблица 3). Кроме того, 1Н-ЯМР спектр образца со снятой защитой, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг. 1-10. ТВА соль ГК-Gly (ГК-Gly-TBA) получали в виде белого твердого вещества в условиях, аналогично описанным в примере 1-4. Затем ее подвергали взаимодействию с гидрохлоридом Chol-C6 и FL способом, аналогично описанному в примере 1-4, с получением целевого соединения (ГК-Gly-Chol/FL) в виде желтого твердого вещества. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-4, представлен на фиг. 1-11. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-4 (таблица 3).
Пример 1-8. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-треонином (Thr) и холестерил-6-аминогексилкарбаматом (ГК-Thr-Chol/FL)
ГК-Thr получали в виде белого твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что использовали гидрохлорид метил-L-треонината (Bachem) вместо гидрохлорида этил-L-аланината. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг. 1-12. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика метила (-CH3, 1,2 м.д.; 3H) в треонине, рассчитывали степень введения треонина в единицы ГК аналогично описанному в примере 1-4 (таблица 3). ТВА соль ГК-Thr (ГК-Thr-TBA) получали в виде белого твердого вещества в условиях, аналогично описанным в примере 1-4. Затем ее подвергали взаимодействию с гидрохлоридом Chol-C6 и FL способом, аналогично описанному в примере 1-4, с получением целевого соединения (ГК-Thr-Chol/FL) в виде желтого твердого вещества. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-4, представлен на фиг. 1-13. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-4 (таблица 3).
Пример 1-9. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-аспарагином (Asn) и холестерил-6-аминогексилкарбаматом (ГК-Asn-Chol/FL)
ГК-Asn получали в виде белого твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что использовали гидрохлорид метил-L-аспарагината (Bachem) вместо гидрохлорида этил-L-аланината. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг. 1-14. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пиков метилена (-CH2CONH2, 2,7, 2,8 м.д.; 2H) в аспарагине, рассчитывали степень введения аспарагина в единицы ГК аналогично описанному в примере 1-4 (таблица 3). ТВА соль ГК-Asn (ГК-Asn-TBA) получали в виде белого твердого вещества в условиях, аналогично описанным в примере 1-4. Затем ее подвергали взаимодействию с гидрохлоридом Chol-C6 и FL способом, аналогично описанному в примере 1-4, с получением целевого соединения (ГК-Asn-Chol/FL) в виде желтого твердого вещества. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-4, представлен на фиг. 1-15. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-4 (таблица 3).
Пример 1-10. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-аспарагиновой кислотой (Asp) и холестерил-6-аминогексилкарбаматом (ГК-Asp-Chol/FL)
ГК-Asp получали в виде белого твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что использовали гидрохлорид диэтил-L-аспартата (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида этил-L-аланината. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг. 1-16. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пиков метилена (-CH2COOH2, 2,7, 2,8 м.д.; 2H) в аспарагиновой кислоте, рассчитывали степень введения аспарагиновой кислоты в единицы ГК аналогично описанному в примере 1-4 (таблица 3). ТВА соль ГК-Asp (ГК-Asp-TBA) получали в виде белого твердого вещества в условиях, аналогично описанным в примере 1-4. Затем ее подвергали взаимодействию с гидрохлоридом Chol-C6 и FL способом, аналогично описанному в примере 1-4, с получением целевого соединения (ГК-Asp-Chol/FL) в виде желтого твердого вещества. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-4, представлен на фиг.1-17. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-4 (таблица 3).
Пример 1-11. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-изолейцина (Ile) и холестерил-6-аминогексилкарбаматом (ГК-Ile-Chol/FL)
ГК-Ile получали в виде белого твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что использовали гидрохлорид метил-L-изолейцината (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида этил-L-аланината. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг. 1-18. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика двух метилов (-CH(СН3)СН2СН3, 0,9 м.д.; 6H) в изолейцине, рассчитывали степень введения изолейцина в единицы ГК аналогично описанному в примере 1-4 (таблица 3). Поскольку пик водорода в положении 3 изолейцина (-CH(СН3)СН2СН3, 1,9 м.д.; 1H) перекрывается с пиками ацетила в глюкозамине, то значение, полученное вычитанием 1/6 интегрированного значения пика при 0,9 м.д. из интегрированного значения пиков при 1,8-2,2 м.д., использовали в качестве пиков ацетила в глюкозамине для расчета степени введения. ТВА соль ГК-Ile (ГК-Ile-TBA) получали в виде белого твердого вещества в условиях, аналогично описанным в примере 1-4. Затем ее подвергали взаимодействию с гидрохлоридом Chol-C6 и FL способом, аналогично описанному в примере 1-4, с получением целевого соединения (ГК-Ile-Chol/FL) в виде желтого твердого вещества. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-4, представлен на фиг. 1-19. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-4 (таблица 3).
Пример 1-12. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-лейцином (Leu) и холестерил-6-аминогексилкарбаматом (ГК-Leu-Chol/FL)
ГК-Leu получали в виде белого твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что использовали гидрохлорид этил-L-лейцината (Tokyo Chemical Industry Co., Ltd.) вместо гидрохлорида этил-L-аланината. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг. 1-20. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика двух метилов (-CH(СН3)2, 0,9 м.д.; 6H) в лейцине, рассчитывали степень введения лейцина в единицы ГК аналогично описанному в примере 1-4 (таблица 3). ТВА соль ГК-Leu (ГК-Leu-TBA) получали в виде белого твердого вещества в условиях, аналогично описанным в примере 1-4. Затем ее подвергали взаимодействию с гидрохлоридом Chol-C6 и FL способом, аналогично описанному в примере 1-4, с получением целевого соединения (ГК-Leu-Chol/FL) в виде желтого твердого вещества. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-4, представлен на фиг. 1-21. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-4 (таблица 3).
Пример 1-13. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-валином (Val) и холестерил-6-аминогексилкарбаматом (ГК-Val-Chol/FL)
ГК-Val получали в виде белого твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что использовали гидрохлорид этил-L-валината (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида этил-L-аланината. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг. 1-22. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика двух метилов (-CH(СН3)2, 0,9 м.д.; 6H) в валине, рассчитывали степень введения валина в единицы ГК аналогично описанному в примере 1-4 (таблица 3). Поскольку пик водорода в положении 3 валина (-CH(СН3)2, 2,1 м.д.; 1H) перекрывается с пиком ацетила в глюкозамине, то значение, полученное вычитанием 1/6 интегрированного значения пика при 0,9 м.д. из интегрированного значения пиков при 1,8-2,2 м.д., использовали в качестве пиков ацетила в глюкозамине для расчета степени введения. ТВА соль ГК-Val (ГК-Val-TBA) получали в виде белого твердого вещества в условиях, аналогично описанным в примере 1-4. Затем ее подвергали взаимодействию с гидрохлоридом Chol-C6 и FL способом, аналогично описанному в примере 1-4, с получением целевого соединения (ГК-Val-Chol/FL) в виде желтого твердого вещества. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-4, представлен на фиг. 1-23. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-4 (таблица 3).
Пример 1-14. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-фенилаланином (Phe) и холестерил-6-аминогексилкарбаматом (ГК-Phe-Chol/FL)
ГК-Phe получали в виде белого твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что использовали гидрохлорид этил-L-фенилаланината (Aldrich) вместо гидрохлорида этил-L-аланината. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг. 1-24. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пиков фенила (-C6H5, 7,2-7,4 м.д.; 5H) в фенилаланине, рассчитывали степень введения фенилаланина в единицы ГК аналогично описанному в примере 1-4 (таблица 3). ТВА соль ГК-Phe (ГК-Phe-TBA) получали в виде белого твердого вещества в условиях, аналогично описанным в примере 1-4. Затем ее подвергали взаимодействию с гидрохлоридом Chol-C6 и FL способом, аналогично описанному в примере 1-4, с получением целевого соединения (ГК-Phe-Chol/FL) в виде желтого твердого вещества. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-4, представлен на фиг.1-25. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-4 (таблица 3).
Пример 1-15. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-серинамидом (SerNH2) и холестерил-6-аминогексилкарбаматом (ГК-SerNH2/Chol/FL)
ГК-SerNH2-Chol/FL получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-5, за исключением того, что использовали гидрохлорид L-серинамида (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида этил-L-треонинамида. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-5, представлен на фиг. 1-26. Степень введения холестерильной группы в единицы ГК рассчитывали способом, аналогично описанному в примере 1-5 (таблица 4). Кроме того, 1Н-ЯМР спектр продукта, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг. 1-27. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика метилена (-CH2-, 3,9 м.д.; 5H) в серинамиде, рассчитывали степень введения серинамида в единицы ГК аналогично описанному в примере 1-5 (таблица 4). Поскольку пик метилена в серинамиде перекрывается с пиками (4Н) положений 2-5 глюкуроната и пиками (6Н) положений 2-6 глюкозамина, то значение, полученное вычитанием 10/3 интегрированного значения пика при 2,0 м.д. из интегрированного значения пиков при 3,2-4,2 м.д., использовали в качестве пиков метилена в серинамиде для расчета степени введения.
Пример 1-16. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-глицинамидом (GlyNH2) и холестерил-6-аминогексилкарбаматом (ГК-GlyNH2/Chol/FL)
ГК-GlyNH2-Chol/FL получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-5, за исключением того, что использовали гидрохлорид глицинамида (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида этил-L-треонинамида.
1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-5, представлен на фиг. 1-28. Степень введения холестерильной группы в единицы ГК рассчитывали способом, аналогично описанному в примере 1-5 (таблица 4). Кроме того, 1Н-ЯМР спектр продукта, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг. 1-29. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика метилена (-CH2-, 3,9 м.д.; 2H) в глицинамиде, рассчитывали степень введения глицинамида в единицы ГК аналогично описанному в примере 1-5 (таблица 4). Поскольку пик метилена в глицинамиде перекрывается с пиками (4Н) положений 2-5 глюкуроната и пиками (6Н) положений 2-6 глюкозамина, то интегрированное значение пика метилена в глицинамиде рассчитывали способом, аналогично описанному в примере 1-15.
Пример 1-17. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-лейцинамидом (LeuNH2) и холестерил-6-аминогексилкарбаматом (ГК-LeuNH2/Chol/FL)
ГК-LeuNH2-Chol/FL получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-5, за исключением того, что использовали гидрохлорид лейцинамида (Tokyo Chemical Industry Co., Ltd.) вместо гидрохлорида этил-L-треонинамида.
1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-5, представлен на фиг. 1-30. Степень введения холестерильной группы в единицы ГК рассчитывали способом, аналогично описанному в примере 1-5 (таблица 4). Основываясь на интегрированном значении пика ацетила (-COCH3, 1,9 м.д.; 3H) в глюкозамине и интегрированном значении пика двух метилов (-CH(СН3)2, 0,9 м.д.; 6H) в лейцинамиде, рассчитывали степень введения лейцинамида в единицы ГК аналогично описанному в примере 1-5 (таблица 4).
Пример 1-18. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-валинамидом (ValNH2) и холестерил-6-аминогексилкарбаматом (ГК-ValNH2/Chol/FL)
ГК-ValNH2-Chol/FL получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-5, за исключением того, что использовали гидрохлорид L-валинамида (Tokyo Chemical Industry Co., Ltd.) вместо гидрохлорида этил-L-треонинамида.
1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-5, представлен на фиг. 1-31. Степень введения холестерильной группы в единицы ГК рассчитывали способом, аналогично описанному в примере 1-5 (таблица 4). Основываясь на интегрированном значении пика ацетила (-COCH3, 1,9 м.д.; 3H) в глюкозамине и интегрированном значении пика двух метилов (-CH(СН3)2, 1,0 м.д.; 6H) в валинамиде, рассчитывали степень введения валинамида в единицы ГК аналогично описанному в примере 1-5 (таблица 4).
Пример 1-19. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-аланином (Ala) и холестерил-6-аминогексилкарбаматом (ГК-Ala/Chol/FL)
ГК-Ala-Chol/FL получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-5, за исключением того, что использовали гидрохлорид этил-L-аланина (Aldrich) вместо гидрохлорида этил-L-треонинамида, и диализат сразу же удаляли во время диализа против ультрачистой воды со снятием защиты с карбоксигруппы 2Н раствором NaOH. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-5, представлен на фиг.1-32. Степень введения холестерильной группы в единицы ГК рассчитывали способом, аналогично описанному в примере 1-5 (таблица 5). Основываясь на интегрированном значении пика ацетила (-COCH3, 1,9 м.д.; 3H) в глюкозамине и интегрированном значении пика метила (-СН3, 1,3 м.д.; 3H) в аланине, рассчитывали степень введения аланина в единицы ГК аналогично описанному в примере 1-4 (таблица 5). Поскольку пик метила в аланине перекрывается с пиками (0,8-1,6 м.д., 41Н) холестерил-6-аминогексилкарбамата, то значение, полученное вычитанием 41/3 интегрированного значения пика при 0,7 м.д. из интегрированного значения пиков при 0,8-1,6 м.д., использовали в качестве пиков метила в аланине для расчета степени введения.
Пример 1-20. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-серином (Ser) и холестерил-6-аминогексилкарбаматом (ГК-Ser/Chol/FL)
ГК-Ser/Chol/FL получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-5, за исключением того, что использовали гидрохлорид этил-L-серината (Aldrich) вместо гидрохлорида этил-L-треонинамида, и диализат сразу же удаляли во время диализа против ультрачистой воды со снятием защиты с карбоксигруппы 2Н раствором NaOH. Кроме того, часть диализата (ГК-Ser-OEt/Chol/FL) до снятия защиты с карбоксигруппы собирали и лиофилизировали для использования в качестве образца для расчета степени введения. 1Н-ЯМР спектр образца, использованного для расчета степени введения, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг. 1-33. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,3 м.д.; 3H) в глюкозамине и интегрированном значении пика метила (-CH3, 1,6 м.д.; 3H) в этиловом эфире серина, рассчитывали степень введения серина в единицы ГК аналогично описанному в примере 1-6 (таблица 5). Кроме того, 1Н-ЯМР спектр образца со снятой защитой, снятый в таких же условиях, как описано в примере 1-5, представлен на фиг. 1-34. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-5 (таблица 5).
Пример 1-21. Синтез производного гиалуроновой кислоты без флуоресцентной метки
ГК-Ala/Chol, ГК-ThrNH2/Chol, ГК-SerNH2/Chol и ГК-ValNH2/Chol получали в виде белого твердого вещества соответственно способами, описанными в примере 1-4 (Ala), примере 1-5 (ThrNH2), примере 1-15 (SerNH2) и примере 1-18 (ValNH2) за исключением того, что не добавляли 5-аминометилфлуоресцеин. Степень введения холестерильной группы и степень введения аминокислоты и амида аминокислоты рассчитывали способами, описанными в соответствующих примерах 1-5 (таблица 6).
Сравнительный пример 1-1. Синтез меченного флуоресцентной меткой производного ГК, модифицированного холестерил-6-аминогексилкарбаматом (ГК-Chol/FL)
Готовили растворы (10 мг/мл) ГК-ТВА, синтезированной из исходного соединения ГК-Na (10 k, 50 k, 99 кДа) и полученной в примере 1-3, в безводном ДМСО. Затем к соответствующим растворам добавляли Chol-C6, полученный в примере 1-1, в соотношениях к единицам ГК, представленных в таблице 7 ниже, и добавляли гидрохлорид 5-аминометилфлуоресцеина (FL) (Invitrogen) и DMT-MM соответственно в количестве 0,04 моль-эквивалентов и 0,07 моль-эквивалентов на единицу ГК. Реакционный раствор подвергали диализу против раствора 0,3М ацетата аммония/ДМСО, 0,15М водного раствора NaCl и ультрачистой водой в указанном порядке. Полученные диализаты лиофилизировали, с получением целевых продуктов (ГК-Chol/FL) в виде желтого твердого вещества.
Иллюстративный пример 1Н-ЯМР спектра (продукта, полученного из исходного соединения ГК-Na с молекулярной массой 99 кДа, и который имел степень введения холестерильной группы 6%) в смешанном растворе 0,02Н DCl ДМСО-d6/D2O (2Н DCl D2O:ДМСО-d6=1:99), который использовали в качестве растворителя при анализе, показан на фиг.1-35. Степень введения холестерильной группы в единицы ГК рассчитывали способом, описанным в примере 1-4 (таблица 7).
Сравнительный пример 1-2. Синтез меченного флуоресцентной меткой производного ГК, модифицированного EDOBEA (ГК-EDOBEA-Ac /FL)
Готовили растворы (5 мг/мл) ГК-ТВА, синтезированной из исходного соединения ГК-Na (10 k, 50 k, 99 кДа) в примере 1-3, в безводном ДМСО. Затем добавляли EDOBEA и BOP в указанном порядке в эквивалентном соотношении единица НА/BOP (Wako Pure Chemical Industries, Ltd.)/2,2’(этилендиокси)бис(этиламин) (EDOBEA, Sigma-Aldrich)=1/2,5/50 (моль/моль/моль), и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор подвергали диализу против 0,3М водного раствора NaCl и ультрачистой воды в указанном порядке, и затем лиофилизировали, с получением ГК-EDOBEA, имеющего высокую степень введения.
1Н-ЯМР спектр ГК-EDOBEA, имеющего высокую степень введения, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг. 1-36. При снятии спектра NaOD добавляли до концентрации 0,0046Н, с получением раствора щелочи. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика метилена (-CH2NH2, 2,8 м.д.; 2H) в конце EDOBEA, рассчитывали степень введения EDOBEA в единицы ГК аналогично описанному в примере 1-4, и она составила 82%.
Полученный ГК-EDOBEA, имеющий высокую степень введения, растворяли в ультрачистой воде, с получением концентрации 10 мг/мл, и затем 2 раза разводили 100 мМ фосфатным буфером (рН 7,4), с получением раствора 5 мг/мл. К данному раствору добавляли раствор NHS-флуоресцеина в ДМСО в количестве 0,04 экв на единицу ГК, и смесь перемешивали при комнатной температуре в течение 1 ч. Концевую аминогруппу избытка EDOBEA ацетилировали добавлением уксусного ангидрида (Wako Pure Chemical Industries, Ltd.) в количестве 40 моль-эквивалентов на единицу ГК и затем перемешивали в течение 1 ч. Реакционный раствор подвергали диализу в темноте против 0,3М водного раствора NaCl и ультрачистой воды в указанном порядке, и затем лиофилизировали, с получением ГК-EDOBEA-Ac/FL в виде желтого твердого вещества. 1Н-ЯМР спектр продукта, снятый в тех условиях, как описано в примере 1-3, представлен на фиг.1-37.
Сравнительный пример 1-3. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-тирозином (Tyr) и холестерил-6-аминогексилкарбаматом (ГК-Tyr-Chol/FL)
ГК-Tyr получали в виде белого твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что использовали гидрохлорид этил-L-тирозината (Wako Pure Chemical Industries, Ltd.) вместо гидрохлорида этил-L-аланината. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг.1-38. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пиков гидроксифенила (-CH6H4OH, 6,8 м.д., 7,2 м.д.; 4H) в тирозине, рассчитывали степень введения тирозина в единицы ГК аналогично описанному в примере 1-4 (таблица 8). ТВА соль ГК-Tyr (ГК-Tyr-TBA) получали в виде белого твердого вещества в условиях, аналогично описанным в примере 1-4. Затем ее подвергали взаимодействию с гидрохлоридом Chol-C6 и FL способом, аналогично описанному в примере 1-4, с получением целевого соединения (ГК-Tyr-Chol/FL) в виде желтого твердого вещества. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-4, представлен на фиг.1-39. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-4 (таблица 8).
Пример 2. Подтверждение удерживания в крови и биоразлагаемости in vivo
Пример 2-1. Отбор биологической пробы от крысы после введения производного ГК
Соединения, полученные в примерах (1-4)-(1-20) и сравнительных примерах (1-1)-(1-3), вводили крысам однократно внутривенно в дозе 10 мг/кг. Через 5 мин, 2, 7, 24, 28, 72, 168, 240 и 336 ч после введения из яремной вены отбирали кровь с использованием шприцов, обработанных натриевой солью гепарина, и плазму получали центрифугированием. Некоторые пробы крови в сравнительных примерах также отбирали через 96 ч после введения. Данные пробы плазмы криоконсервировали при -20°С или ниже до проведения анализа. Кроме того, собирали мочу с использованием метаболитных камер на 0-24 ч, 24-48 ч, 48-72 ч, 72-96 ч, 168-192 ч, 240-264 и 336-360 ч после введения и криоконсервировали при -20°С или ниже до проведения анализа. Кроме того, извлекали печень через 15 суток после введения продуктов и криоконсервировали при -20°С или ниже до проведения анализа. Соединение, полученное в сравнительном примере 1-2, вводили внутривенно однократно в дозе 20 мг/кг крысам с последующим сбором мочи и извлечением печени.
Пример 2-2. Анализ плазмы крови крысы, получавшей производное ГК
Пробы плазмы крови оттаивали и разводили в 2 раза HP-β-CD (100 мМ)/Трис буфером (500 мМ, рН 9,0), инкубировали при 37°С в течение 1 ч и затем определяли концентрацию меченного флуоресцентной меткой производного ГК с использованием ридера для 96-луночных планшетов (ARVO; нижний предел обнаружения: 0,4 мкг/мл). Динамика изменения концентрации в плазме крови меченных флуоресцентной меткой производных ГК показана на фиг. (2-1-1)-(2-1-26). Кроме того, определяли фармакокинетический параметр (экстраполяция площади под кривой концентрация в плазме крови-время (AUC∞)) с использованием программы WinNonlin версия 6.1 (Pharsight). Значения представлены в таблице 9. Кроме того, соотношения значений AUC∞ по отношению к сравнительным образцам, в которые был введен холестерол на том же уровне, рассчитанные с использованием следующей формулы, представлены в таблице 10.
Формула 6
Было обнаружено, что производные ГК (образцы (2-1)-(2-25)), в которые были введены аминокислота или амид аминокислоты и холестерильная группа в карбоксигруппе, сохраняют концентрацию в плазме крови лучше, чем производные ГК (сравнительные образцы (2-1)-(2-7)), в которые была введена только холестерильная группа в карбоксигруппе.
(Пример 2-3) Анализ печени крысы, получавшей производное ГК
Примерно к 1 г пробы печени добавляли Трис-буфер (10 мМ, рН 9,0), и пробу гомогенизировали с использованием шариков. Добавляли раствор проназы в концентрации 4 мг/мл, и смесь инкубировали при 37°С в течение ночи. После центрифугирования пробу разводили в 2 раза HP-β-CD (100 мМ)/Трис-буфер (500 мМ, рН 9,0), затем инкубировали при 37°С в течение 1 ч и затем фильтровали. Пробу анализировали эксклюзионной хроматографией в следующих условиях. Кроме того, печень от крысы без введения какого-либо образца обрабатывали аналогично, и смеси этой пробы и пробы, отобранной до введения, анализировали аналогично и использовали в качестве стандарта.
Условия анализа эксклюзионной хроматографией
Аналитическая колонка: TSKgel G5000 PWXL (Tosoh Corporation).
Температура колонки: 25°С.
Подвижная фаза: HP-β-CD (10 мМ)/Трис-буфер (500 мМ, рН 9,0).
Скорость потока: 0,5 мл/мин.
Детектирование: длина волны экстинкции 494 нм/длина волны эмиссии 515 нм.
Объем инжектирования: 50 мкл.
Результаты представлены на фиг. (2-2-1)-(2-2-27). Хроматограммы нормализовали по соответствующим самым высоким пикам. В то время как производное ГК из сравнительного примера 1-2 (ГК-EDOBEA-Ac/FL, фиг. 2-2-26) не превращалось в низкомолекулярные молекулы в печени, было обнаружено, что все введенные соединения производных ГК из примеров превращались в низкомолекулярные молекулы. Это указывает на то, что производные ГК по настоящему изобретению обладают биоразлагаемостью. Предполагается, что после деградации они выделяются с мочой или фекалиями из организма.
Пример 2-4. Анализ мочи крысы, получавшей производное ГК
Пробы мочи фильтровали через фильтр 0,22 мкм и разводили в 2 раза HP-β-CD (100 мМ)/Трис-буфер (500 мМ, рН 9,0). После инкубации при 37°С в течение 1 ч, пробы фильтровали и анализировали эксклюзионной хроматографией в условиях, описанных в примере 2-3. Кроме того, пробу мочи от крысы без введения какого-либо образца обрабатывали аналогично, и смеси этой пробы и пробы, отобранной до введения, анализировали аналогично и использовали в качестве стандарта.
Результаты представлены на фиг.(2-3-1)-(2-3-27). На фигурах хроматограммы во временных точках в той же шкале показаны слева и нормализованные по самым высоким пикам показаны справа. Пробы мочи, собранные на 0-24 ч, 24-48 ч, 48-72 ч, 72-96 ч, 168-192 ч, 240-264 и 336-360 ч после введения обозначены, соответственно, как 0-2d, 1-2d, 2-3d, 3-4d, 7-8d, 10-11d и 14-15d, и соответствующие стандарты в виде STD на фигурах. В то время как производное ГК из сравнительного примера 1-2 (ГК-EDOBEA-Ac/FL) не превращалось в молекулы соединений с низкой молекулярной массой, которые присутствовали в моче, было обнаружено, что некоторые введенные соединения производных ГК из примеров превращались в молекулы соединений с низкой молекулярной массой, которые детектировали в моче. Это указывает на то, что биоразлагаемость производных ГК по настоящему изобретению легко оценить анализом мочи.
Пример 3. Синтез производного гиалуроновой кислоты
Пример 3-1. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-глутамином (Gln) и холестерил-6-аминогексилкарбаматом (ГК-Gln-Chol/FL)
ГК-Gln получали в виде белого твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что использовали гидрохлорид метил-L-глутамината (Wako Pure Chemical Industries, Ltd.) вместо гидрохлорида этил-L-аланината. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг.3-1. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пиков метилена (-CH2CH2CONH2, 2,3, 2,4 м.д.; 2H) в глутамине, рассчитывали степень введения глутамина в единицы ГК аналогично описанному в примере 1-4 (таблица 11). Поскольку пик ацетила в глюкозамине перекрывается с пиком другого метилена (-CH2CH2CONH2, 2,1 м.д.; 2H) в глутамине, то значение, полученное вычитанием интегрированного значения пиков при 2,3 м.д. и 2,4 м.д. из интегрированного значения пиков при 1,8-2,2 м.д. использовали в качестве пиков ацетила, для расчета степени введения. ТВА соль ГК-Gln (ГК-Gln-TBA) получали в виде белого твердого вещества в условиях, аналогично описанным в примере 1-4. Затем ее подвергали взаимодействию с гидрохлоридом Chol-C6 и FL способом, аналогично описанному в примере 1-4, с получением целевого соединения (ГК-Gln-Chol/FL) в виде желтого твердого вещества. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-4, представлен на фиг.3-2. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-4 (таблица 11).
Пример 3-2. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-метионином (Met) и холестерил-6-аминогексилкарбаматом (ГК-Met-Chol/FL)
ГК-Met получали в виде белого твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что использовали гидрохлорид этил-L-метионата (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида этил-L-аланината. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг.3-3. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика метилена (-CH2SCH3, 2,6 м.д.; 2H) в метионине, рассчитывали степень введения метионина в единицы ГК аналогично описанному в примере 1-4 (таблица 11). Поскольку пик ацетила в глюкозамине перекрывается с пиком другого метилена и метила (-CH2SCH3, 2,1 м.д.; 5H) в метионине, то значение, полученное вычитанием интегрированного значения пика при 2,6 м.д. из интегрированного значения пиков при 1,8-2,2 м.д., использовали в качестве пиков ацетила в глюкозамине для расчета степени введения.
ТВА соль ГК-Met (ГК-Met-TBA) получали в виде белого твердого вещества в условиях, аналогично описанным в примере 1-4. Затем ее подвергали взаимодействию с гидрохлоридом Chol-C6 и FL способом, аналогично описанному в примере 1-4, с получением целевого соединения (ГК-Met-Chol/FL) в виде желтого твердого вещества. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-4, представлен на фиг.3-4. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-4 (таблица 11).
Пример 3-3. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-аланинамидом (AlaNH2) и холестерил-6-аминогексилкарбаматом (ГК-AlaNH2-Chol/FL)
ГК-AlaNH2-Chol/FL получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-5, за исключением того, что использовали гидрохлорид L-аланинамида (Tokyo Chemical Industry Co., Ltd.) вместо гидрохлорида L-треонинамида. 1Н-ЯМР спектр продукта, снятый в таких же условиях, как описано в примере 1-5, представлен на фиг. 3-5. Степень введения холестерильной группы в единицы ГК рассчитывали способом, аналогично описанному в примере 1-5 (таблица 12). Основываясь на интегрированном значении пика ацетила (-COCH3, 1,8 м.д.; 3H) в глюкозамине и интегрированном значении пика метила (-CH3, 1,3 м.д.; 3H) в аланинамиде, рассчитывали степень введения аланинамида в единицы ГК аналогично описанному в примере 1-5 (таблица 12). Поскольку пик метила в аланинамиде перекрывается с пиками (41Н) холестерила, то значение, полученное вычитанием 41/3 интегрированного значения пика при 0,7 м.д. из интегрированного значения пиков при 0,8-1,6 м.д., использовали в качестве пиков метила в аланинамиде для расчета степени введения.
Пример 3-4. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-аспарагинамидом (AsnNH2) и холестерил-6-аминогексилкарбаматом (ГК-AsnNH2-Chol/FL)
ГК-AsnNH2-Chol/FL получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-5, за исключением того, что использовали гидрохлорид L-аспарагинамида (KOKUSAN CHEMICAL CO., Ltd.) вместо гидрохлорида L-треонинамида. 1Н-ЯМР спектр продукта, снятый в таких же условиях, как описано в примере 1-5, представлен на фиг. 3-6. Степень введения холестерильной группы в единицы ГК рассчитывали способом, аналогично описанному в примере 1-5 (таблица 12). Кроме того, 1Н-ЯМР продукта, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг. 1-7. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пиков метилена (-CH2CONH2, 2,7, 2,8 м.д.; 2H) в аспарагинамиде, рассчитывали степень введения аспарагинамида в единицы ГК аналогично описанному в примере 1-4 (таблица 12).
Пример 3-5. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-изолейцинамидом (IleNH2) и холестерил-6-аминогексилкарбаматом (ГК-IleNH2-Chol/FL)
ГК-IleNH2-Chol/FL получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-5, за исключением того, что использовали гидрохлорид L-изолейцинамида (Tokyo Chemical Industry Co., Ltd.) вместо гидрохлорида L-треонинамида. 1Н-ЯМР спектр продукта, снятый в таких же условиях, как описано в примере 1-5, представлен на фиг. 3-8. Степень введения холестерильной группы в единицы ГК рассчитывали способом, аналогично описанному в примере 1-5 (таблица 12). Основываясь на интегрированном значении пика ацетила (-COCH3, 1,8 м.д.; 3H) в глюкозамине и интегрированном значении пика метилена и двух метилов (-CH(СН3)СН2СН3, 0,9 м.д.; 8H) в изолейцинамиде, рассчитывали степень введения изолейцинамида в единицы ГК аналогично описанному в примере 1-4 (таблица 3). Поскольку пик метила в изолейцинамиде перекрывается с пиками (41Н) холестерила, то значение, полученное вычитанием 41/3 интегрированного значения пика при 0,7 м.д. из интегрированного значения пиков при 0,8-1,6 м.д. использовали в качестве пика метилена в изолейцинамиде, для расчета степени введения. Поскольку пик ацетила в глюкозамине перекрывается с пиком водорода в положении 3 изолейцина (СН(СН3)СН2СН3, 1,9 м.д.; 1H), то значение, полученное вычитанием 1/8 интегрированного значения пиков при 0,8-1,6 м.д. из интегрированного значения пиков при 1,8-2,2 м.д., использовали в качестве пика ацетила в глюкозамине для расчета степени введения.
Пример 3-6. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-глутаминамидом (GlnNH2) и холестерил-6-аминогексилкарбаматом (ГК-GlnNH2-Chol/FL)
ГК-GlnNH2-Chol/FL получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-5, за исключением того, что использовали гидрохлорид L-глутаминамида (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида L-треонинамида. 1Н-ЯМР спектр продукта, снятый в таких же условиях, как описано в примере 1-5, представлен на фиг.3-9. Степень введения холестерильной группы в единицы ГК рассчитывали способом, аналогично описанному в примере 1-5 (таблица 12). Основываясь на интегрированном значении пика ацетила (-COCH3, 1,8 м.д.; 3H) в глюкозамине и интегрированном значении пика метилена (-CH2CH2CONH2, 2,1 м.д.; 2H) в глутаминамиде, рассчитывали степень введения глютаминамида в единицы ГК аналогично описанному в примере 1-4 (таблица 12). Поскольку пик метила в глутаминамиде перекрывается с пиками (2Н) холестерила, то значение, полученное вычитанием 2/3 интегрированного значения пика при 0,7 м.д. из интегрированного значения пика 0,7 м.д., использовали в качестве пика метилена в глутаминамиде для расчета степени введения. Поскольку пик ацетила в глюкозамине перекрывается с пиком метилена (-CH2CH2CONH2, 1,9 м.д.; 2H) в глутаминамиде, то значение, полученное вычитанием 2/2 интегрированного значения пика при 2,1 м.д. из интегрированного значения пиков при 1,8-2,0 м.д., использовали в качестве пика ацетила в глюкозамине для расчета степени введения.
Пример 3-7. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-метионинамидом (MetNH2) и холестерил-6-аминогексилкарбаматом (ГК-MetNH2-Chol/FL)
ГК-MetNH2-Chol/FL получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-5, за исключением того, что использовали гидрохлорид L-метионинамида (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида L-треонинамида. 1Н-ЯМР спектр продукта, снятый в таких же условиях, как описано в примере 1-5, представлен на фиг.3-10. Степень введения холестерильной группы в единицы ГК рассчитывали способом, аналогично описанному в примере 1-5 (таблица 12). Основываясь на интегрированном значении пика ацетила (-COCH3, 1,8 м.д.; 3H) в глюкозамине и интегрированном значении пика метила (-SCH3, 2,1 м.д.; 2H) в метионинамиде, рассчитывали степень введения метионинамида в единицы ГК аналогично описанному в примере 1-4 (таблица 12). Поскольку пик ацетила в глюкозамине перекрывается с пиком метилена (-CH2SCH3, 1,9 м.д.; 2H) в метионинамиде, то значение, полученное вычитанием 2/3 интегрированного значения пика при 2,1 м.д. из интегрированного значения пика при 1,8-2,0 м.д., использовали в качестве пика ацетила в глюкозамине для расчета степени введения.
Сравнительный пример 3-1. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-глутаминовой кислотой (Glu) и холестерил-6-аминогексилкарбаматом (ГК-Glu-Chol/FL)
ГК-Glu получали в виде белого твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что использовали гидрохлорид диэтил-L-глутамата (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида этил-L-аланината. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг.3-11. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика метилена (-СН2СН2СООН, 2,4 м.д.; 2H) в глутаминовой кислоте, рассчитывали степень введения глутаминовой кислоты в единицы ГК аналогично описанному в примере 1-4 (таблица 13). Поскольку пик ацетила в глюкозамине перекрывается с пиком другого метилена (-CH2CH2COOH, 2,1 м.д.; 2H) в глутаминовой кислоте, то значение, полученное вычитанием интегрированного значения пика при 2,4 м.д. из интегрированного значения пиков при 1,8-2,0 м.д., использовали в качестве пика ацетила в глюкозамине для расчета степени введения. ТВА соль ГК-Glu (ГК-Glu-TBA) получали в виде белого твердого вещества в условиях, аналогично описанным в примере 1-4. Затем ее подвергали взаимодействию с гидрохлоридом Chol-C6 и FL способом, аналогично описанному в примере 1-4, с получением целевого соединения (ГК-Glu-Chol/FL) в виде желтого твердого вещества. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-4, представлен на фиг. 3-12. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-4 (таблица 13).
Сравнительный пример 3-2. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-триптофаном (Trp) и холестерил-6-аминогексилкарбаматом (ГК-Trp-Chol/FL)
ГК-Trp получали в виде белого твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что использовали гидрохлорид этил-L-триптофаната (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида этил-L-аланината. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-3, представлен на фиг. 3-13. Основываясь на интегрированном значении пика ацетила (-COCH3, 2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика индольного кольца (-C8H6N, 7,8 м.д.; 1H) в триптофане, рассчитывали степень введения триптофана в единице ГК аналогично описанному в примере 1-4 (таблица 13). ТВА соль ГК-Trp (ГК-Trp-TBA) получали в виде белого твердого вещества в условиях, аналогично описанным в примере 1-4. Затем ее подвергали взаимодействию с гидрохлоридом Chol-C6 и FL способом, аналогично описанному в примере 1-4, с получением целевого соединения (ГК-Trp-Chol/FL) в виде желтого твердого вещества. 1Н-ЯМР спектр, снятый в таких же условиях, как описано в примере 1-4, представлен на фиг. 3-14. Степень введения холестерильной группы рассчитывали способом, описанным в примере 1-4 (таблица 13).
Сравнительный пример 3-3. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-тирозином (Tyr) и холестерил-6-аминогексилкарбаматом (ГК-Tyr-Chol/FL)
ГК-Tyr-Chol/FL 10k получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-3, за исключением того, что использовали ГК-TBA, полученную из исходного соединения с молекулярной массой 10 кДа ГК-Na. Степень введения тирозина и холестерильной группы рассчитывали способом, описанным в примере 1-3 (таблица 13).
Пример 3-8. Синтез производного гиалуроновой кислоты без флуоресцентной метки
Производные гиалуроновой кислоты получали в виде белого твердого вещества способом, описанным в примерах (1-4)-(1-18) и в примерах (3-1)-(3-7) и в сравнительных примерах (3-1)-(3-3), за исключением того, что не добавляли 5-аминометилфлуоресцеин, и в качестве исходного соединения использовали ГК-Na с другой молекулярной массой. Степень введения холестерильной группы и степень введения аминокислоты и амида аминокислоты рассчитывали способами, описанными в соответствующих примерах (таблица 14-1, таблица 14-2). Гиалуроновую кислоту с молекулярной массой 5 кДа использовали в качестве исходного соединения производства R&D Systems, Inc., и другие гиалуроновые кислоты, использованные в качестве исходных соединений, были производства Shiseido Co., Ltd.
Пример 4. Подтверждение удерживания в крови и биоразлагаемость in vivo
Пример 4-1. Отбор биологической пробы от крысы, получавшей производное ГК
Соединения, полученные в примерах (3-1)-(3-7) и сравнительных примерах (3-1)-(3-3), вводили крысам однократно внутривенно в дозе 10 мг/кг. Через 5 мин, 2, 7, 24, 28, 72 и 168 ч после введения из яремной вены отбирали кровь с использованием шприцов, обработанных натриевой солью гепарина, и плазму получали центрифугированием. Некоторые пробы крови в сравнительных примерах также отбирали через 96 ч после введения. Данные пробы плазмы криоконсервировали при -20°С или ниже до проведения анализа. Кроме того, извлекали печень через 7 суток после введения и криоконсервировали при -20°С или ниже до проведения анализа.
Пример 4-2. Анализ плазмы крови крысы, получавшей производное ГК
Пробы плазмы крови оттаивали и разводили в 2 раза HP-β-CD (100 мМ)/Трис-буфер (500 мМ, рН 9,0), инкубировали при 37°С в течение 1 ч и затем определяли концентрацию меченного флуоресцентной меткой производного ГК с использованием ридера для 96-луночных планшетов (ARVO; нижний предел обнаружения: 0,4 мкг/мл). Динамика изменения концентрации в плазме крови меченных флуоресцентной меткой производных ГК показана на фиг. (4-1-1)-(4-1-10). Кроме того, определяли фармакокинетический параметр (экстраполяция площади под кривой концентрация в плазме крови-время (AUC∞)) с использованием программы WinNonlin версия 6.1 (Pharsight). Значения представлены в таблице 15. Кроме того, соотношения значений AUC∞ по отношению к сравнительным образцам, в которые был введен холестерол на том же уровне, рассчитанные с использованием следующей формулы, представлены в таблице 16.
Формула 7
Было обнаружено, что производные ГК (образцы (4-1)-(4-7), в карбоксигруппу которых были введены аминокислота или амид аминокислоты и холестерильная группа, сохраняют концентрацию в плазме крови лучше, чем производное ГК (сравнительный образец 2-1), в карбоксигруппу которого была введена только холестерильная группа. 10k ГК-Tyr-Chol-7%/FL (сравнительный пример 4-3), а также 99k ГК-Tyr-Chol-6%/FL (сравнительный пример 2-8) имели пониженное время удерживания в крови по сравнению с производным ГК, в карбоксигруппу которого была введена только холестерильная группа. С другой стороны, 99k ГК-Ala-Chol-7%/FL (образец 2-1) и 10k ГК-Ala-Chol-16%/FL (образец 2-7), оба сохраняли концентрации в плазме крови в равной степени или даже лучше, чем производное РН, в карбоксигруппу которого была введена только холестерильная группа. На основании этого можно предположить, что различие во времени удерживания в крови производных ГК зависит от различия в аминокислоте, введенной в карбоксигруппу, и не подвергается влиянию (не зависит от) молекулярной массы исходного соединения гиалуроновой кислоты.
Пример 4-3. Анализ печени крысы, получавшей производное ГК
Примерно к 1 г пробы печени добавляли Трис-буфер (10 мМ, рН 9,0), и пробу гомогенизировали с использованием шариков. Добавляли раствор проназы в концентрации 4 мг/мл, и смесь инкубировали при 37°С в течение ночи. После центрифугирования пробу разводили в 2 раза HP-β-CD (100 мМ)/Трис-буфер (500 мМ, рН 9,0), затем инкубировали при 37°С в течение 1 ч, затем фильтровали и анализировали эксклюзионной хроматографией в условиях, описанных ниже. Кроме того, печень от крысы без введения какого-либо образца обрабатывали аналогично, и смеси этой пробы и пробы, отобранной до введения, анализировали аналогично и использовали в качестве стандарта.
Условия анализа эксклюзионной хроматографией
Аналитическая колонка: TSKgel G5000 PWXL (Tosoh Corporation).
Температура колонки: 25°С.
Подвижная фаза: HP-β-CD (10 мМ)/Трис-буфер (500 мМ, рН 9,0).
Скорость потока: 0,5 мл/мин.
Детектирование: длина волны экстинкции 494 нм/длина волны эмиссии 515 нм.
Объем инжектирования: 50 мкл.
Результаты представлены на фиг. (4-2-1)-(4-2-10). Хроматограммы нормализовали по соответствующим самым высоким пикам. В то время как производное ГК из сравнительного примера 1-2 (ГК-EDOBEA-Ac/FL, фиг. 2-2-26) не превращалось в молекулы соединений с низкой молекулярной массой в печени, было обнаружено, что все введенные производные ГК из примеров превращались в молекулы соединений с низкой молекулярной массой. Основываясь на этих данных, полагают, что производные ГК по настоящему изобретению обладают биоразлагаемостью и выделяются с мочой и фекалиями из организма после деградации в организме.
Пример 5. Композиция с контролируемым высвобождением, обладающая способностью к преципитации, реагирующей на концентрацию соли
Пример 5-1. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-тирозинамидом (TyrNH2) и холестерил-6-аминогексилкарбаматом (ГК-TyrNH2-Chol/FL)
ГК-TyrNH2-Chol/FL получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-5, за исключением того, что использовали гидрохлорид L-тирозинамида (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида L-треонинамида. 1Н-ЯМР спектр продукта, снятый для лиофилизированного продукта, в таких же условиях, как описано в примере 1-5, представлен на фиг.5-1. Степень введения холестерильной группы в единицы ГК рассчитывали способом, аналогично описанному в примере 1-5 (таблица 17). Основываясь на интегрированном значении пика ацетила (-COCH3, 1,8 м.д.; 3H) в глюкозамине и интегрированном значении пиков гидроксифенила (-С6Н4ОН, 6,8 м.д., 7,2 м.д.; 4H) в тирозине, рассчитывали степень введения тирозинамида в единицы ГК аналогично описанному в примере 1-4 (таблица 17).
Пример 5-2. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-триптофанамидом (TrpNH2) и холестерил-6-аминогексилкарбаматом (ГК-TrpNH2-Chol/FL)
ГК-TrpNH2-Chol/FL получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-5, за исключением того, что использовали гидрохлорид L-триптофанамида (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида L-треонинамида. 1Н-ЯМР спектр продукта, снятый для лиофилизированного продукта, в таких же условиях, как описано в примере 1-5, представлен на фиг. 5-2. Степень введения холестерильной группы в единицы ГК рассчитывали способом, аналогично описанному в примере 1-5 (таблица 17). Основываясь на интегрированном значении пика ацетила (-COCH3, 1,8 м.д.; 3H) в глюкозамине и интегрированном значении пика индольного кольца (-C8H6N, 7,6 м.д.; 1H) в триптофанамиде, рассчитывали степень введения тирозинамида в единицы ГК аналогично описанному в примере 1-4 (таблица 17).
Пример 5-3. Синтез меченного флуоресцентной меткой производного ГК, модифицированного L-фенилаланинамидом (PheNH2) и холестерил-6-аминогексилкарбаматом (ГК-PheNH2-Chol/FL)
ГК-PheNH2-Chol/FL получали в виде желтого твердого вещества способом, аналогично описанному в примере 1-5, за исключением того, что использовали гидрохлорид L-фенилаланинамида (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида L-треонинамида. 1Н-ЯМР спектр продукта, снятый для лиофилизированного продукта, в таких же условиях, как описано в примере 1-5, представлен на фиг. 5-3. Степень введения холестерильной группы в единицы ГК рассчитывали способом, аналогично описанному в примере 1-5 (таблица 17). Основываясь на интегрированном значении пика ацетила (-COCH3, 1,8 м.д.; 3H) в глюкозамине и интегрированном значении пиков фенила (-С6Н5, 7,2-7,4 м.д.; 5H) в фенилаланине, рассчитывали степень введения фенилаланинамида в единицы ГК аналогично описанному в примере 1-4 (таблица 17).
Сравнительный пример 5-1. Синтез производного ГК (ГК-TyrNH2), модифицированного L-тирозинамидом (TyrNH2)
Готовили раствор ГК-ТВА (99 кДа), синтезированной из исходного соединения ГК-Na в примере 1-3, в безводном ДМСО. Затем добавляли гидрохлорид L-тирозинамида (WATANABE CHEMICAL INDUSTRIES, LTD.) в количестве 5 моль-эквивалентов на единицу ГК. Затем добавляли 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолинийхлорид (DMT-MM) в количестве 3 моль-эквивалентов на единицу ГК. Смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор подвергали диализу против водного раствора 0,15М NaCl и ультрачистой водой в указанном порядке. Во время диализа имела место преципитация, и целевое вещество не удалось получить в виде водного раствора.
Сравнительный пример 5-2. Синтез производного ГК (ГК-TrpNH2), модифицированного L-триптофанамидом (TrpNH2)
Синтез проводили способом, аналогично описанному в сравнительном примере 5-1, за исключением того, что использовали гидрохлорид L-триптофанамида (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида L-тирозинамида. Во время диализа имела место преципитация, и целевое вещество не удалось получить в виде водного раствора.
Сравнительный пример 5-3. Синтез производного ГК (ГК-PheNH2), модифицированного L-фенилаланинамидом (PheNH2)
Синтез проводили способом, аналогично описанному в сравнительном примере 5-1, за исключением того, что использовали гидрохлорид L-фенилаланинамида (WATANABE CHEMICAL INDUSTRIES, LTD.) вместо гидрохлорида L-тирозинамида. PheNH2 получали в виде белого твердого вещества.
Пример 5-4
Результаты по оценке способности к растворению производных ГК, синтезированных в примере 5-1, примере 5-2, сравнительном примере 5-1 и сравнительном примере 5-2, после диализа против воды, представлены в таблице 18.
Было обнаружено, что образец 5-1 и образец 5-2, в которые введена стерильная группа, в большей степени диспергируются в воде, чем сравнительный образец 5-1 и сравнительный образец 5-2, в которые не была введена стерильная группа, несмотря на гидрофобность, которой обладает стерильная группа.
Пример 5-5. Оценка способности к преципитации в зависимости от концентрации соли
Водные растворы (в ультрачистой воде) производных ГК (99k ГК-TyrNH2/Chol-6%/FL, 99k ГК-TrpNH2/Chol-6%/FL, 99k ГК-PheNH2/Chol-6%/FL, 99k ГК-AlaNH2/Chol-6%/FL), полученные в примере 5-1, примере 5-2, примере 5-3 и примере 3-3, добавляли в концентрированном буферном растворе таким образом, что конечный состав буферных растворов составлял 10 мМ РВ и 150 мМ NaCl, и концентрация производных ГК составляла 4,5 мг/мл. Растворы инкубировали при 37°С в течение 20 мин и центрифугировали при 2000 g в течение 1 мин. Определяли интенсивность флуоресценции супернатантов на ридере для 96-луночных планшетов (ARVO). Концентрацию меченных флуоресцентной меткой производных ГК рассчитывали с использованием стандарта для расчета процентов остаточного количества к первоначально использованным количествам (таблица 19). 99k ГК-Chol-6%/FL (сравнительный образец 5-3), полученный в примере 1-1, подвергали аналогичным операциям. Результаты по сравнительным образцам 5-1 и 5-2 являются результатами, описанными в WO2010/053140.
В WO2010/053140 описано, что 50k ГК-Chol-6%/FL (сравнительный образец 5-1) растворяется как при низкой концентрации соли (ультрачистой воде), так и при физиологической концентрации соли (150 мМ NaCl). Также в данном опыте было показано, что 99k ГК-Chol-6%/FL (сравнительный образец 5-3) ведет себя аналогично. Между тем, было подтверждено, что 99k ГК-PheNH2/Chol-6%/FL (образец 5-3) проявляет зависимое от концентрации соли поведение, когда он растворяется в условиях при низкой концентрации соли (ультрачистая вода) и осаждается при физиологической концентрации соли (150 мМ NaCl). На основании данного результата можно предположить возможность применения производного ГК по настоящему изобретению в качестве носителя в композициях, которые преципитируют под кожей после введения, посредством приготовления растворов с низкой концентрацией, приготовленных на изотоническом растворе с сахаром или тому подобное. Кроме того, способность к преципитации (остаточное количество: 1% или ниже) была существенно выше, чем значения, о которых сообщалось ранее по производным ГК (сравнительный пример 5-2: 50k ГК-Chol-7%/FL: 22,6%).
99k ГК-TyrNH2/Chol-6%/FL (образец 5-1) и 99k ГК-TrpNH2/Chol-6%/FL (образец 5-2) также показывали зависимую от концентрации соли преципитацию аналогично 99k ГК-TrpNH2/Chol-6%/FL (образец 5-3), и они являются пригодными для применения в композициях, имеющих способность к преципитации, зависимую от концентрации соли.
Пример 5-6. Оценка способности к преципитации под кожей у крыс
Соединения, полученные из меченных флуоресцентной меткой производных (99k ГК-TyrNH2/Chol-6%/FL, 99k ГК-TrpNH2/Chol-6%/FL, 99k ГК-PheNH2/Chol-6%/FL), полученные в примере 5-1, примере 5-2 и примере 5-3, вводили подкожно крысам однократно в дозе 10 мг/кг (в растворе сахарозы). Место введения осматривали на 7 сутки после введения. Было подтверждено, что меченные флуоресцентной меткой производные ГК преципитировали и оставались на месте.
Пример 5-6. Синтез производного гиалуроновой кислоты без флуоресцентной метки
Производные гиалуроновой кислоты получали в виде белого твердого вещества способами, описанными в примерах (5-1)-(5-3), за исключением того, что не добавляли 5-аминометилфлуоресцеин, и использовали ГК-Na, имеющую другую молекулярную массу, в качестве исходного соединения. Степень введения холестерильной группы и степень введения аминокислоты и амида аминокислоты рассчитывали способами, описанными в соответствующих примерах (таблица 20).
Пример 6. Оценка способности к инкапсулированию лекарственного средства
Пример 6-1. Инкапсулирование паклитаксела (РТХ)
К водным растворам (в ультрачистой воде) производных ГК, полученных в примере 1-4 и примере 1-21, и примере 3-8 и примере 5-7, добавляли паклитаксел (10 мг/мл, раствор в метаноле) таким образом, чтобы конечная концентрация паклитаксела составляла 100 мкг/мл, и концентрация производных ГК составляла 1,0 мг/мл. Смеси выдерживали при 4°С в течение ночи и затем центрифугировали при 4700 g в течение 10 мин. К аликвотной порции 100 мкл супернатантов добавляли 100 мкл 50% ацетонитрила и 50 мкл 100 мМ HP-β-CD, и смеси анализировали жидкостной хроматографией с обратной фазой в следующих условиях:
Условия анализа хроматографией с обратной фазой
Аналитическая колонка: PLRP-S 1,000 Å (Agilent).
Температура колонки: 40°С.
Подвижная фаза A: 0,1% водный раствор ТФУК.
Подвижная фаза В: раствор 0,1% ТФУК/ацетонитрил.
Градиент: В 5%→В 95% (3,4 мин).
Скорость потока: 2 мл/мин.
Детектирование: УФ 254 нм.
Объем инжектирования: 30 мкл.
Концентрацию паклитаксела в супернатантах рассчитывали с использованием стандарта, как показано на фиг. (6-1-1)-(6-1-4). Несмотря на то, что растворимость паклитаксела в отсутствии производных ГК составляет 0,6 мкг/мл, отмечали существенное повышение растворимости паклитаксела в присутствии производных ГК. На основании этого можно предположить, что слаборастворимые низкомолекулярные соединения, такие как паклитаксел, инкапсулируются в производных ГК.
Пример 6-2. Инкапсулирование циклоспорина (циклоспорин А: CyA)
К водным растворам (в ультрачистой воде) производных ГК, полученных в примере 1-4 и примере 1-21, и примере 3-8 и примере 5-7, добавляли циклоспорин (10 мг/мл, раствор в метаноле) таким образом, чтобы конечная концентрация циклоспорина составляла 300 мкг/мл, и концентрация производных ГК составляла 1,0 мг/мл. Смеси выдерживали при 4°С в течение ночи и затем центрифугировали при 4700 g в течение 30 мин. К аликвотной порции 100 мкл супернатантов добавляли 100 мкл 50% ацетонитрила и 50 мкл 100 мМ HP-β-CD, и смеси анализировали хроматографией с обратной фазой, как описано в примере 6-1. Детектирование проводили в УФ-свете при 210 нм. Концентрацию циклоспорина в супернатантах рассчитывали с использованием стандарта, как показано на фиг. (6-2-1)-(6-2-4). Несмотря на то, что растворимость циклоспорина в отсутствии производных ГК составляет 28 мкг/мл, отмечали существенное повышение растворимости циклоспорина в присутствии производных ГК. На основании этого можно предположить, что слаборастворимые пептиды, такие как циклоспорин, инкапсулируются в производных ГК.
Пример 7. Тест оценки высвобождения in vivo
Пример 7-1. Тест оценки высвобождения паклитаксела
К водному раствору (в ультрачистой воде) 10k ГК-Ala-Chol-41%, полученного в примере 1-21, добавляли паклитаксел (10 мг/мл, раствор в метаноле) таким образом, чтобы конечная концентрация паклитаксела составляла 100 мкг/мл, и концентрация производных ГК составляла 1,0 мг/мл. Смесь выдерживали при 4°С в течение ночи. Свободный паклитаксел удаляли при 4°С с использованием диализной мембраны (3000 MWCO). Полученные комплексы производное ГК/паклитаксел помещали на мембрану для диализа (3000 MWCO) и инкубировали при 37°С в PBS. Концентрацию паклитаксела на мембране для диализа определяли в течение времени хроматографией с обратной фазой для подтверждения высвобождения. Количества паклитаксела, оставшиеся на мембране для диализа, показаны на фиг. 7-1. Данный результат указывает на то, что производные ГК могут использовать в качестве носителей для контролируемого высвобождения.
Пример 7-2. Тест оценки высвобождения циклоспорина
Тест проводили способом, описанным в примере 7-1, за исключением того, что использовали циклоспорин А вместо паклитаксела для подтверждения высвобождения циклоспорина. Количества циклоспорина, оставшиеся на диализной мембране, показаны на фиг. 7-2. Данный результат указывает на то, что производные ГК могут быть использованы в качестве носителей для контролируемого высвобождения.
Пример 8. Синтез ГК-AA-Chol, содержащего различные линкеры
Производные ГК-AA-Chol (таблица 21), содержащие различные линкеры, получали в виде твердого вещества способом, аналогично описанному в примере 1-4, за исключением того, что холестерил-2-аминоэтилкарбамат (Chol-C2), холестерил-12-додециламиногексилкарбамат (Chol-С12) или холестерил-8-амино-3,6-диоксаоктилкарбамат (Chol-ЕО2) использовали вместо холестерил-6-аминогексилкарбамата (Chol-C6). Холестерил-2-аминоэтилкарбамат, холестерил-12-додециламиногексилкарбамат или холестерил-8-амино-3,6-диоксаоктилкарбамат синтезировали способами, описанными в WO2010/053140. 1Н-ЯМР спектры продуктов, снятые в условиях, аналогично описанным в примере 1-5, представлены на фиг. (8-1)-(8-6). Степень введения холестерильной группы в единицах ГК рассчитывали способом, аналогично описанному в примере 1-5 (таблица 21).
Пример 9. Синтез ГК-Ala-холановой кислоты
Пример 9-1. Синтез N-(2-аминоэтил)-5β-холаноамида
Метил-5β-холанат (стералоиды, 100 мкг) растворяли в этилендиамине (6 мл), и раствор кипятили с обратным холодильником при 130°С в течение 4 ч. После отгонки при пониженном давлении остаток растворяли в дихлорметане и промывали ультрачистой водой. Растворитель выпаривали при пониженном давлении, с получением аминоэтил-5β-холаноамида.
1Н-ЯМР (CDCl3): δ=0,64 (3Н, с, CH3), 0,91 (3Н, с, CH3), 0,92 (3Н, д, CH3), 2,0-2,3 (2Н, м, COCH3), 2,8 (2Н, м, CH2CH2NHCO), 3,3 (2Н, м, CH2CH2NHCO), 5,9 (1Н, ушир, NHCO).
Пример 9-2. Синтез ГК-Ala-холановой кислоты
Готовили раствор ГК-Ala-TBA (10 мг/мл), синтезированного способом, аналогично описанному в примере 1-4, в безводном ДМСО. Затем к аликвотным порциям раствора добавляли аминоэтил-5β-холанамид, полученный в примере 9-1, в соотношениях к единицам ГК-Ala-TBA, показанным в таблице 22 ниже. Затем к ГК-Ala-TBA добавляли DMT-MM в соотношениях, показанных в таблице 22 ниже. Реакционные растворы подвергали диализу против смешанного раствора метанол/вода 1/1, 0,15М водного раствора NaCl и ультрачистой воды в указанном порядке. Полученные диализаты лиофилизировали, с получением целевого соединения (ГК-Ala-СА) в виде белого твердого вещества.
Иллюстративный пример 1Н-ЯМР спектра (продукта, полученного из исходного соединения ГК-Na с молекулярной массой 99 кДа, и который имел степень введения холановой кислоты 13%) с использованием ДМСО-d6 в качестве растворителя при анализе, показан на фиг.9. Основываясь на интегрированном значении пика ацетила (-COCH3, 1,6-2,0 м.д.; 3H) в глюкозамине и интегрированном значении пика метила (-CH3, 0,6 м.д.; 3H) в холестерильной группе, рассчитывали степень введения холановой кислоты в единицы ГК по формуле, приведенной ниже (таблица 22). Поскольку пики в области 1,6-2,0 м.д., включая пик ацетила в глюкозамине, перекрываются с пиком (7Н) холановой кислоты, то значение, полученное вычитанием 7/3 интегрированного значения пика (0,6 м.д.) метила в группе холановой кислоты из интегрированного значения пиков в области 1,6-2,0 м.д. (т.е. интегрированное значение (1,6-2,0 м.д.)-интегрированное значение (0,7 м.д.)×7/3), использовали в качестве интегрированного значения ацетила в ГК, для расчета степени введения.
Формула 8
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕПАРАТ ВАКЦИНЫ ПРОТИВ РАКА | 2020 |
|
RU2831734C2 |
| ГЕЛЬ, ПОЛУЧЕННЫЙ ИЗ ФОТОСШИТОЙ ГИАЛУРОНОВОЙ КИСЛОТЫ С ВВЕДЕННЫМ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ | 2006 |
|
RU2429018C2 |
| ПРОИЗВОДНОЕ ГИАЛУРОНОВОЙ КИСЛОТЫ И СОДЕРЖАЩЕЕ ЕГО ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2005 |
|
RU2390529C2 |
| ПРОИЗВОДНОЕ ГИАЛУРОНОВОЙ КИСЛОТЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЕГО МОДИФИКАЦИИ | 2010 |
|
RU2550602C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОКИСЛЕННОГО ПРОИЗВОДНОГО ГИАЛУРОНОВОЙ КИСЛОТЫ И СПОСОБ ЕГО МОДИФИКАЦИИ | 2010 |
|
RU2559447C2 |
| ПРОИЗВОДНЫЕ ГИАЛУРОНОВОЙ КИСЛОТЫ С ПОНИЖЕННОЙ БИОДЕГРАДИРУЕМОСТЬЮ | 2007 |
|
RU2350625C2 |
| КОНЪЮГАТЫ: ТЕРАПЕВТИЧЕСКОЕ СОЕДИНЕНИЕ - ЖИРНАЯ КИСЛОТА | 1994 |
|
RU2137755C1 |
| ГИДРОГЕЛИ МЕТАКРИЛОВЫХ ПРОИЗВОДНЫХ ГИАЛУРОНОВОЙ КИСЛОТЫ ДЛЯ ПЕРОРАЛЬНОЙ ФЕРМЕНТНОЙ ТЕРАПИИ ГЛЮТЕНОВОЙ ЭНТЕРОПАТИИ | 2015 |
|
RU2679638C2 |
| МОДИФИЦИРОВАННАЯ ГИАЛУРОНОВАЯ КИСЛОТА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ЕЕ ПРИМЕНЕНИЯ | 2017 |
|
RU2733444C2 |
| КОНЪЮГАТ ГИАЛУРОНОВОЙ КИСЛОТЫ С НОВОКАИНОМ С АМФОТЕРНЫМИ СВОЙСТВАМИ | 2011 |
|
RU2473351C2 |
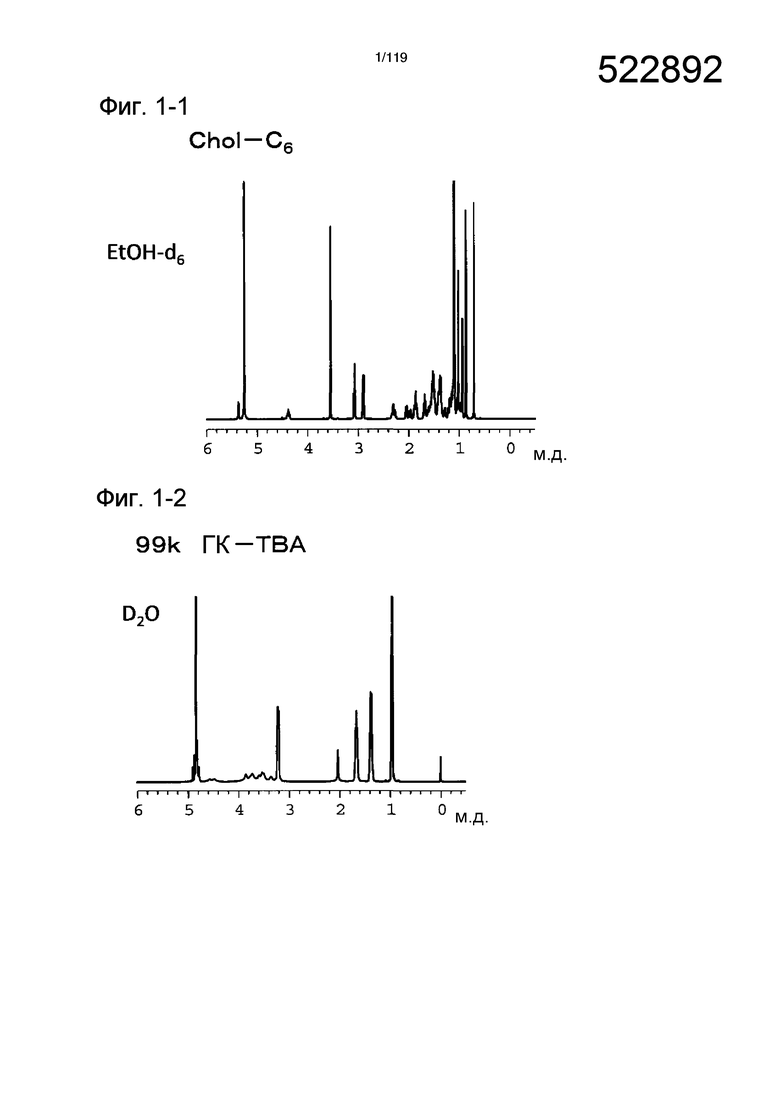
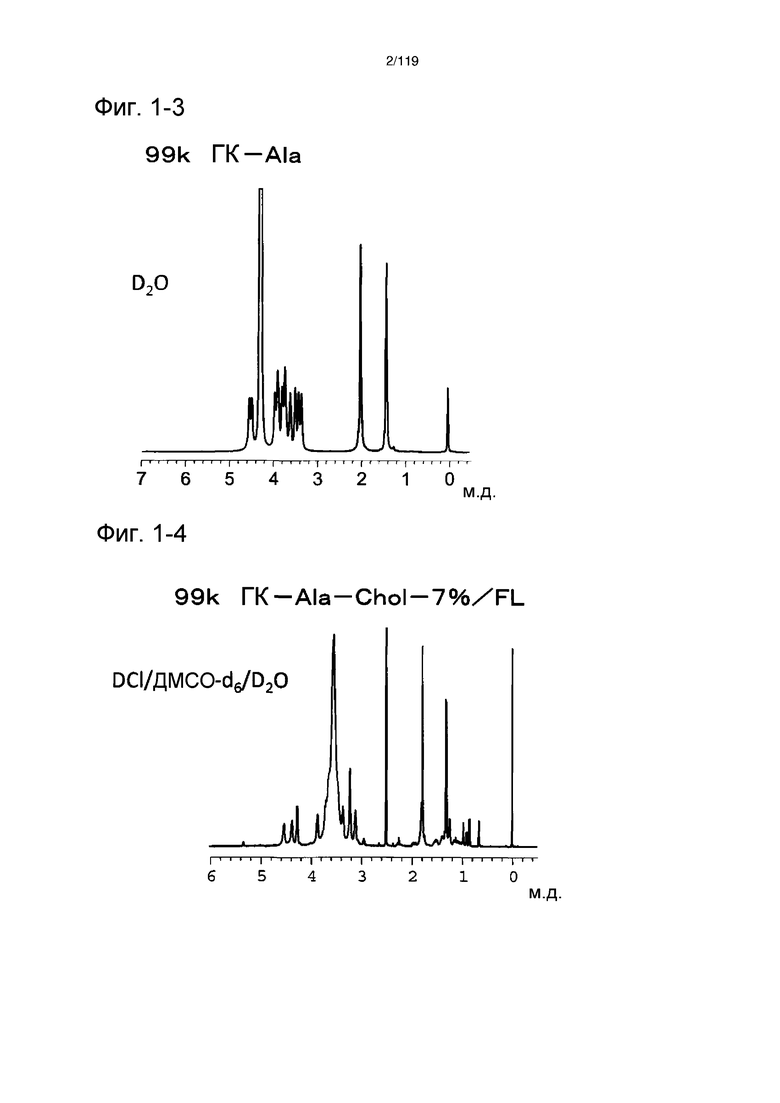
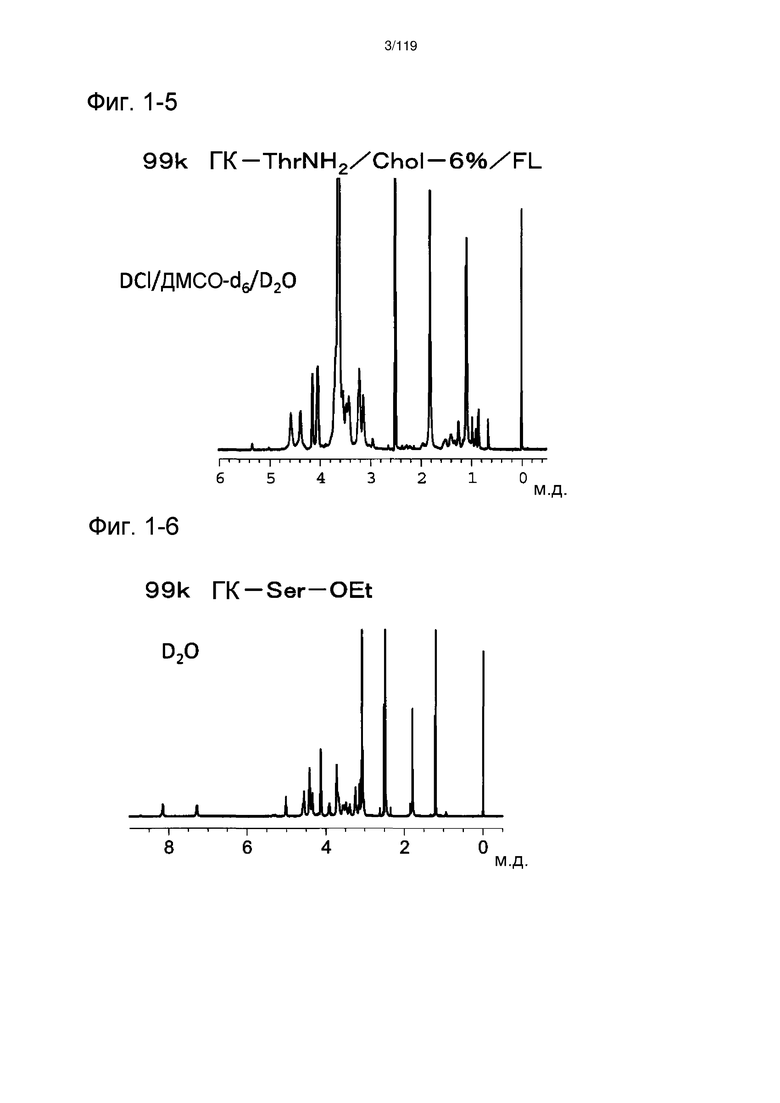
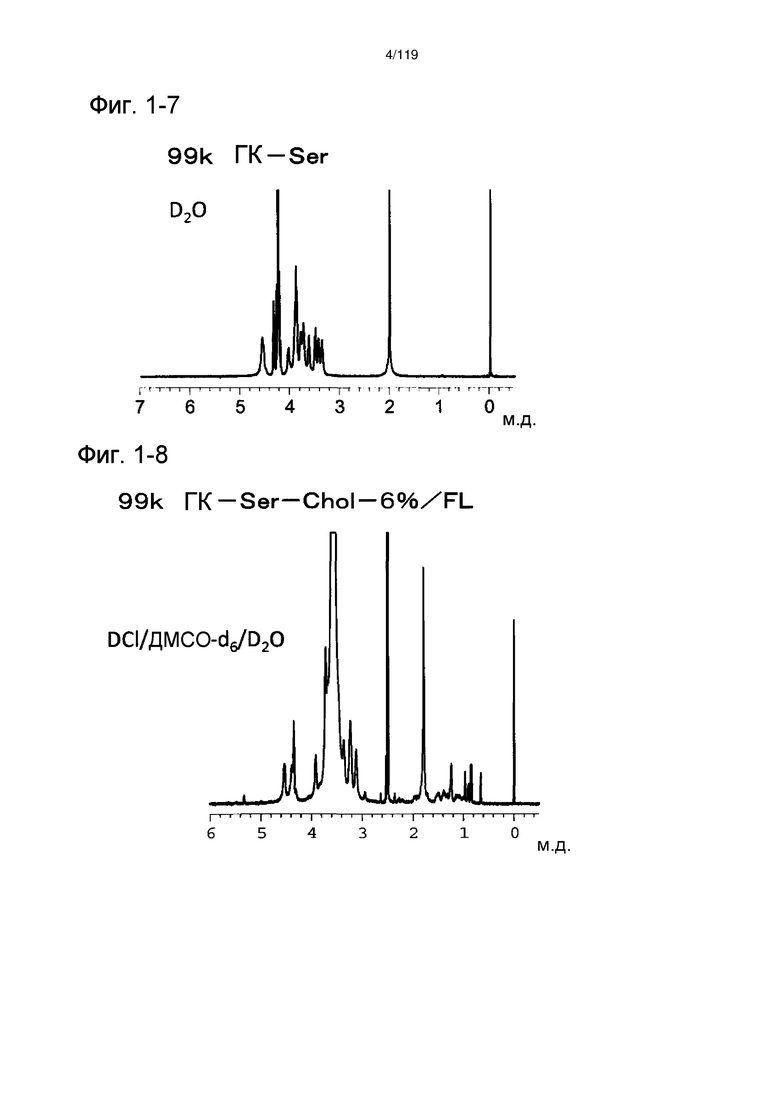
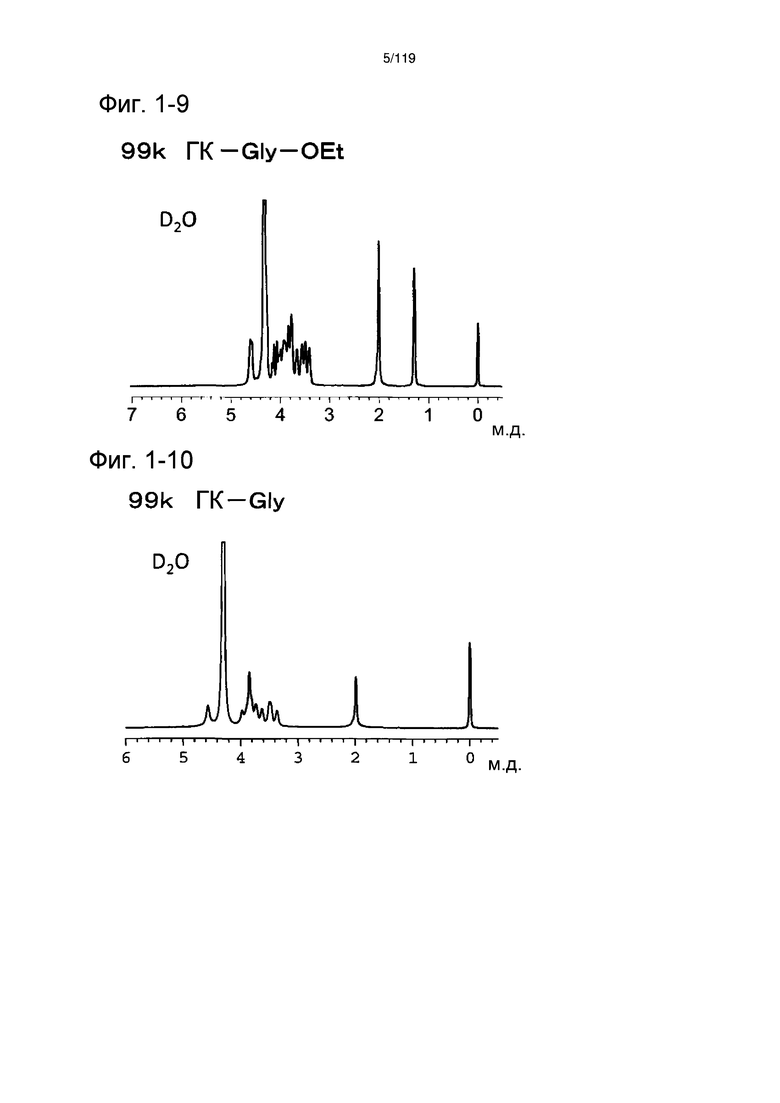
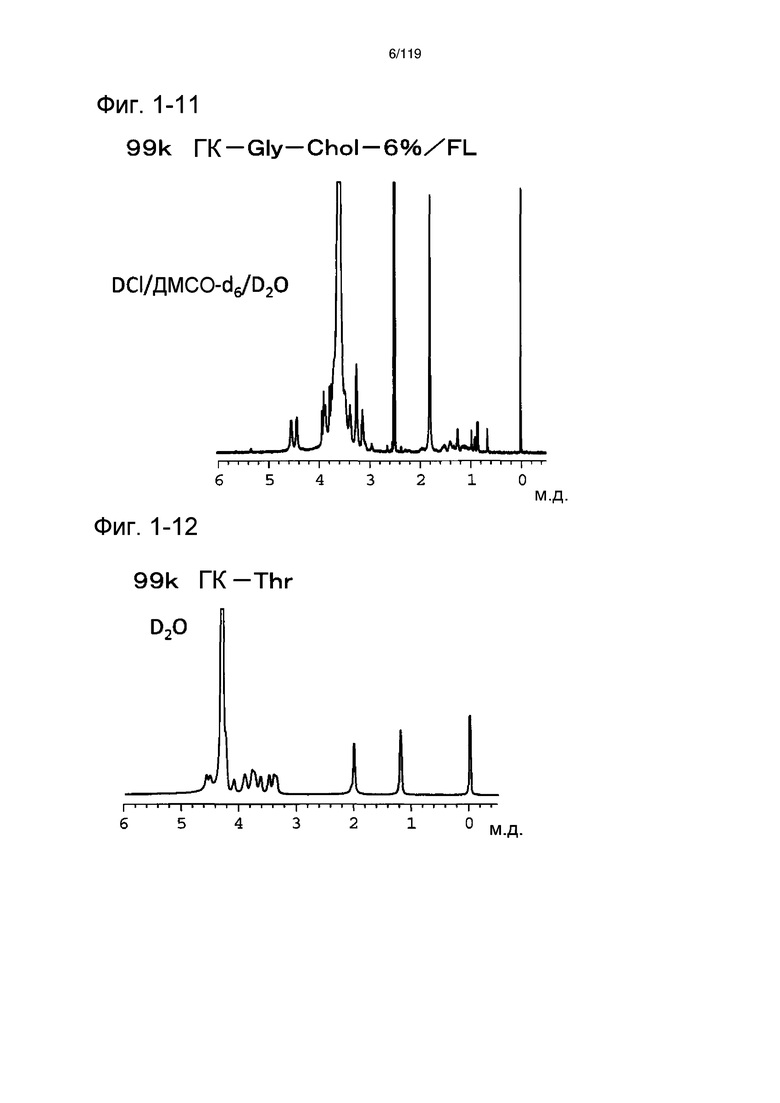
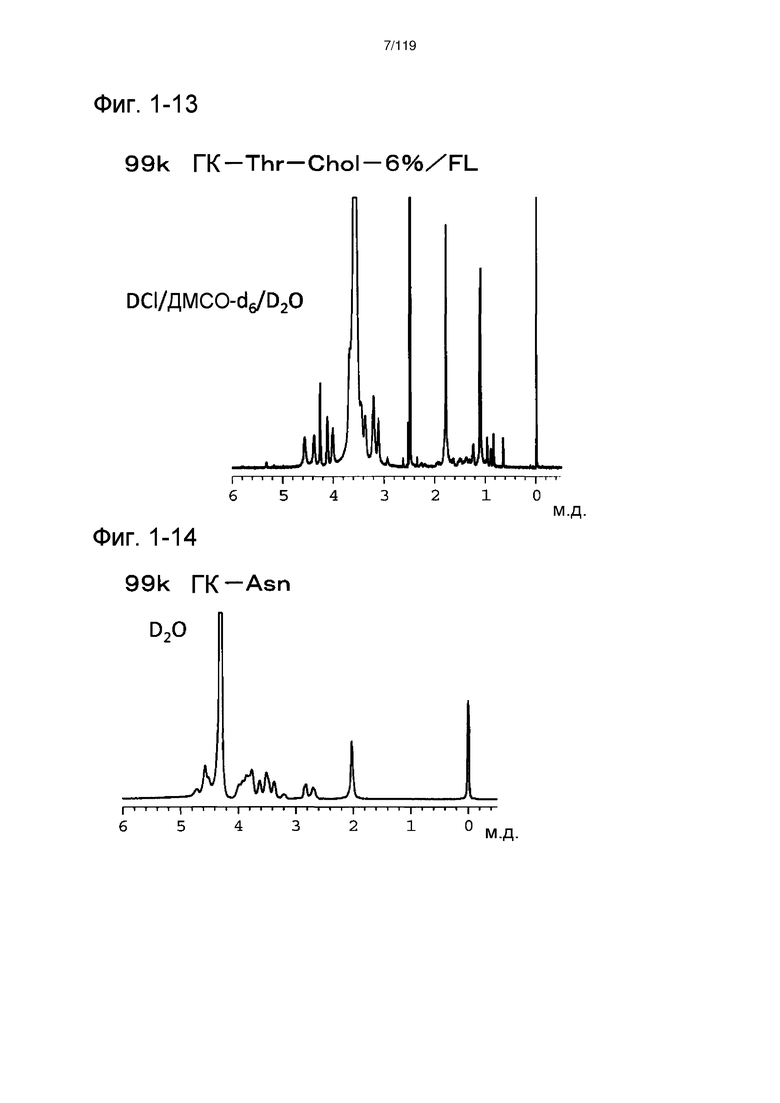
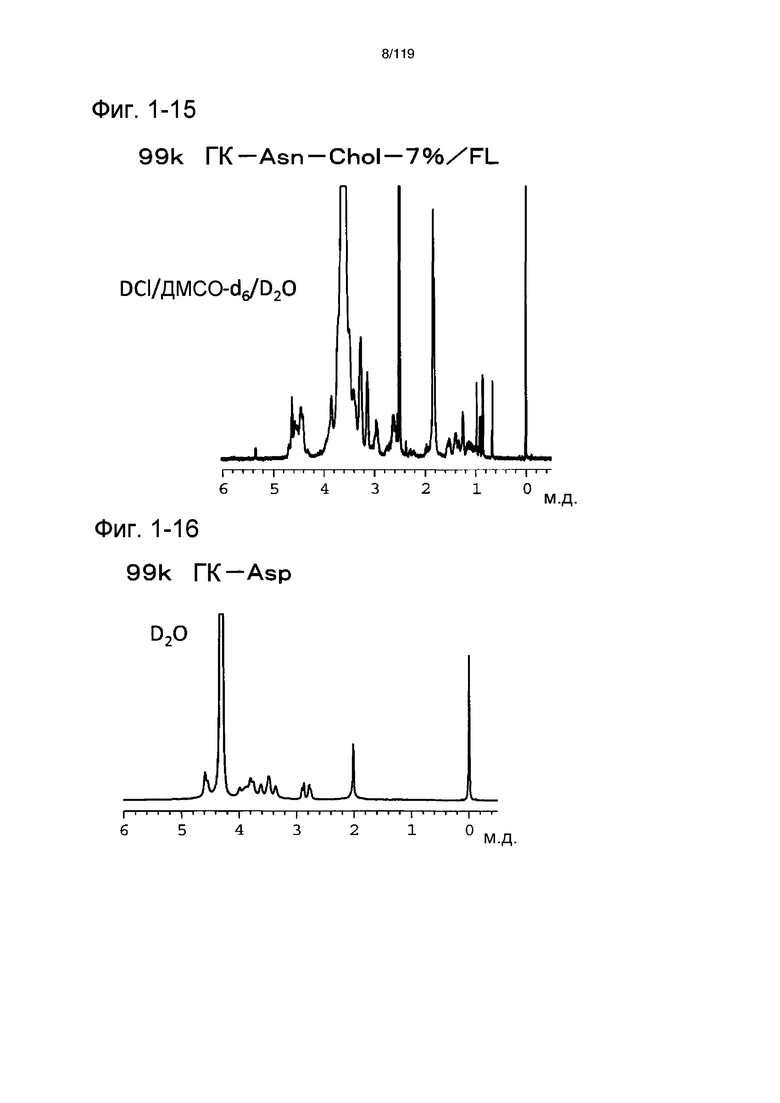
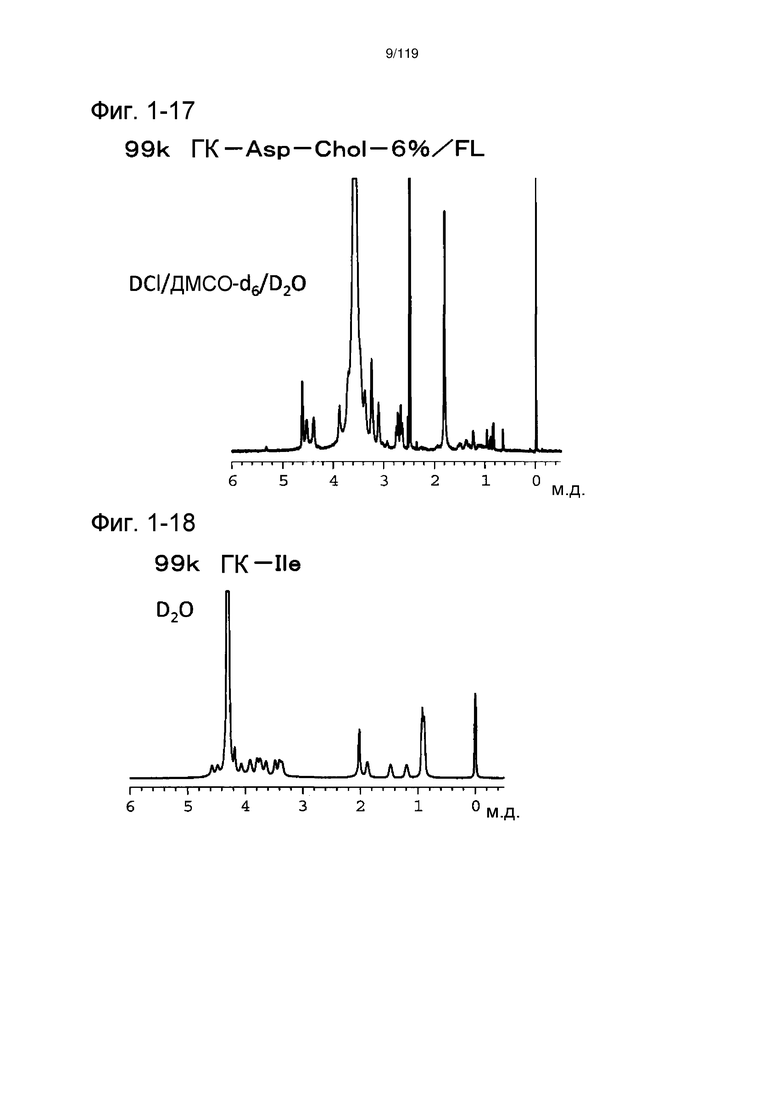
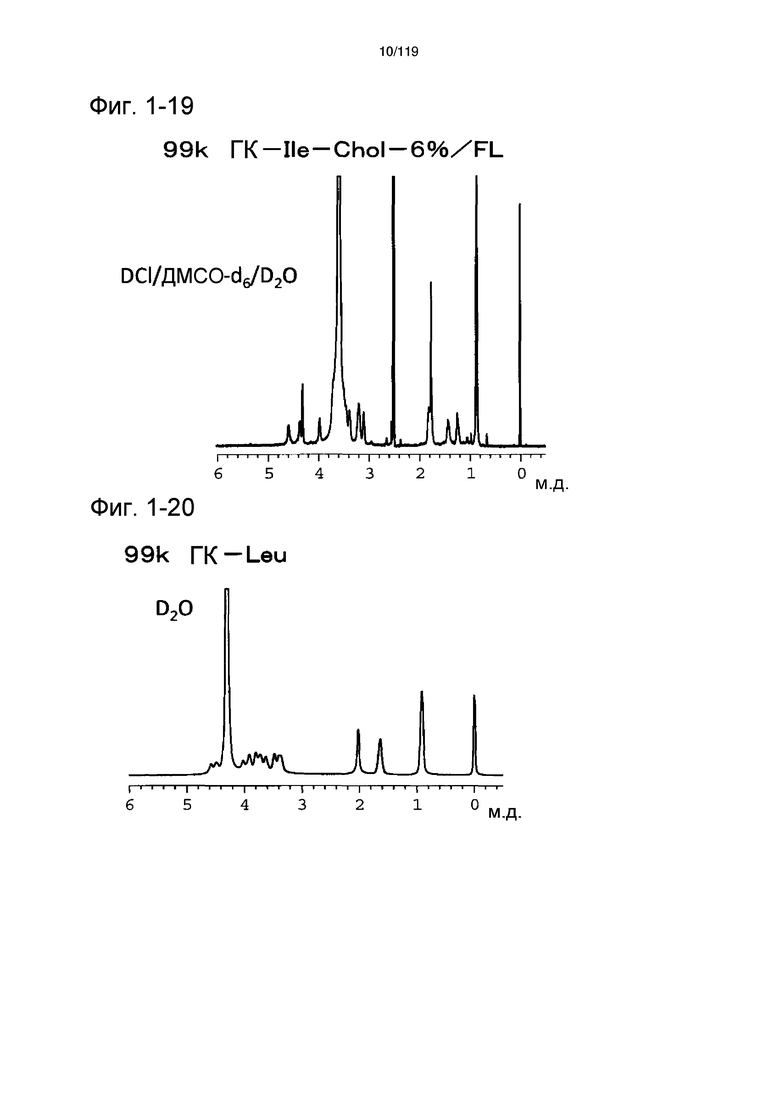
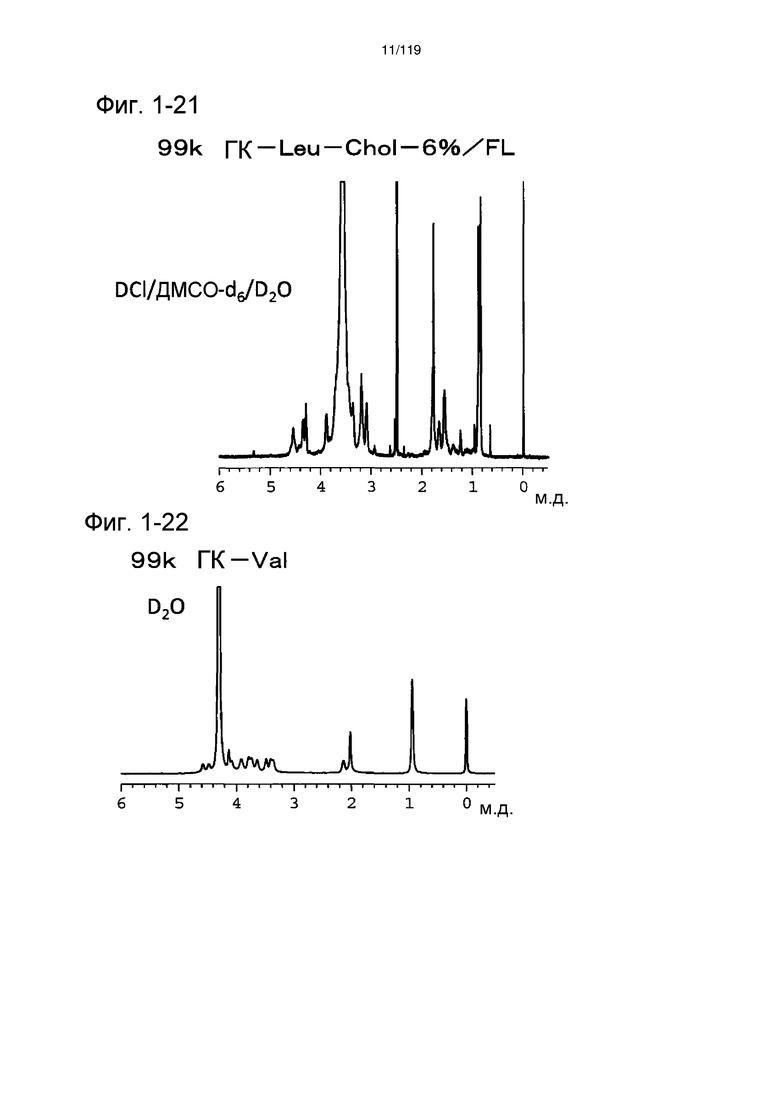
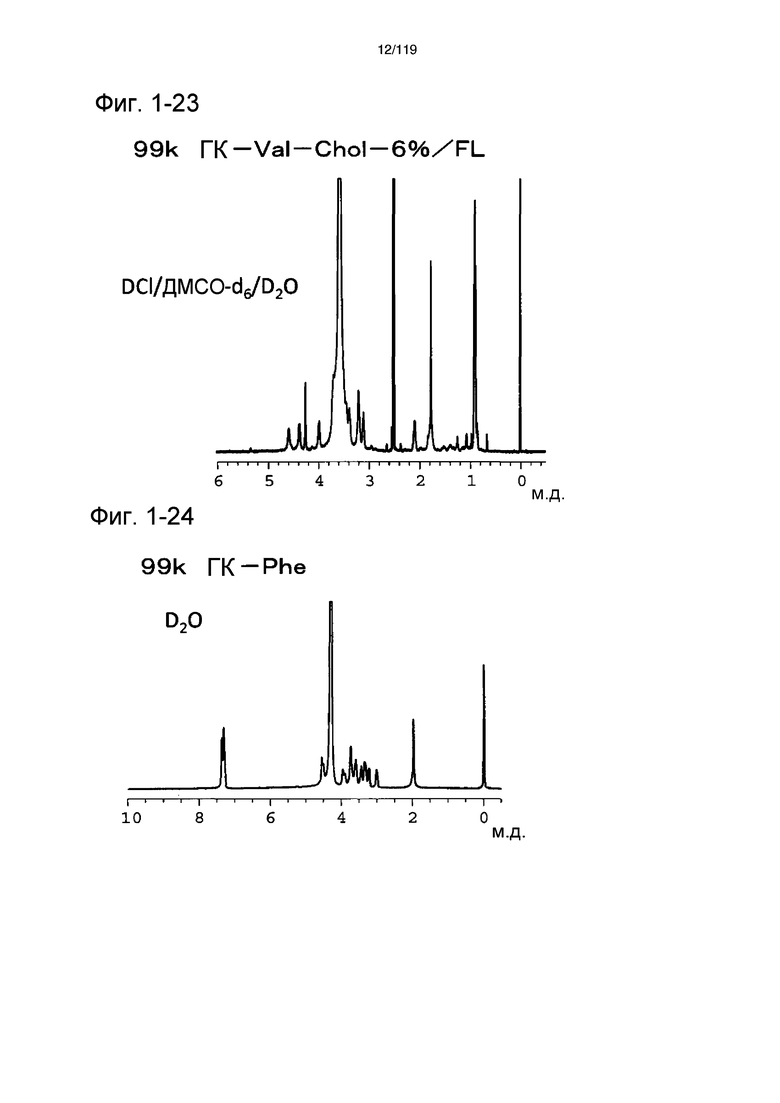
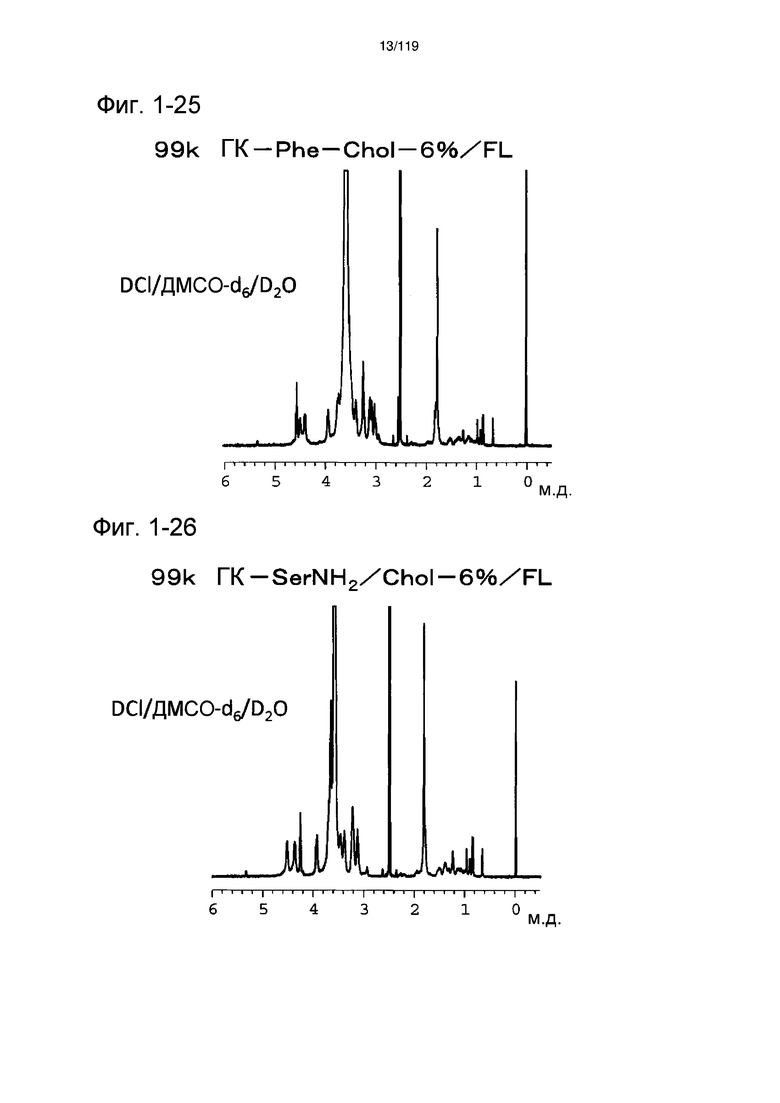
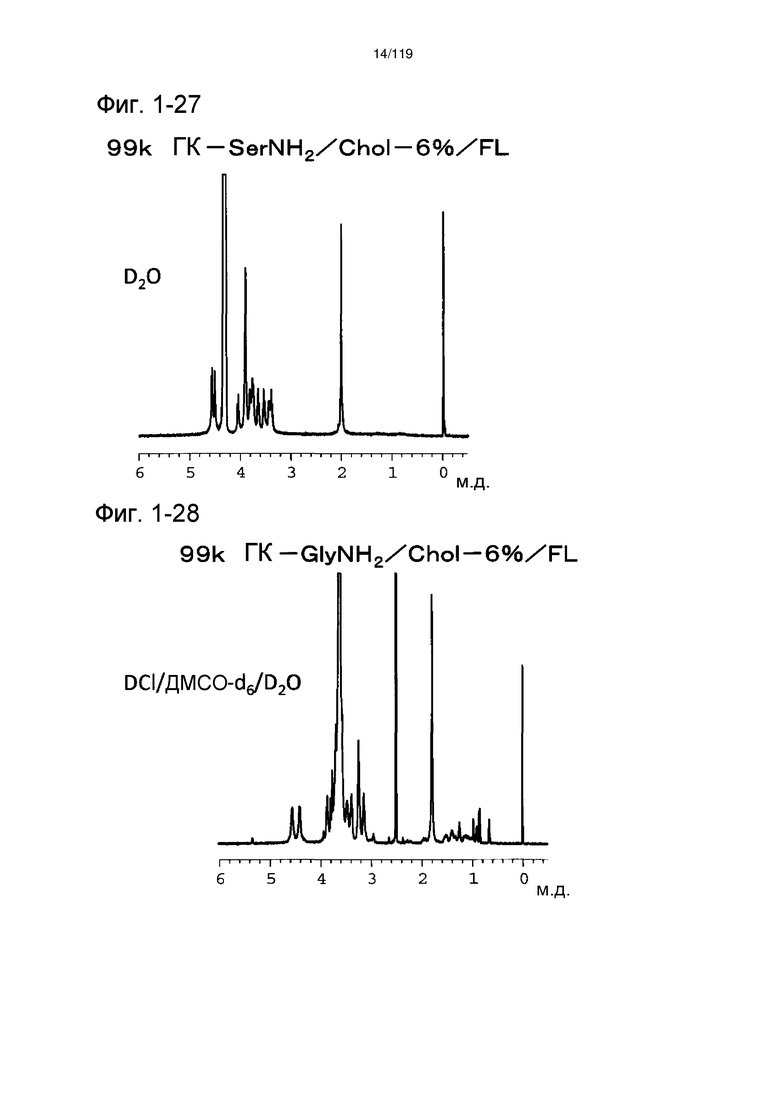
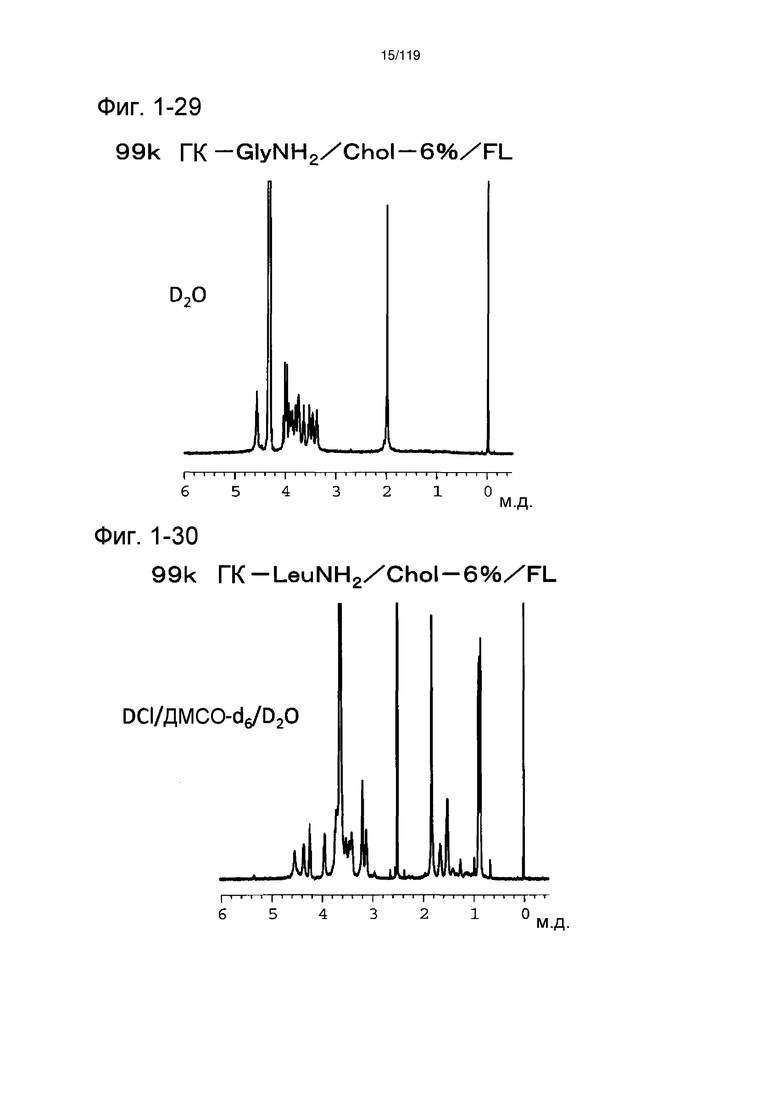
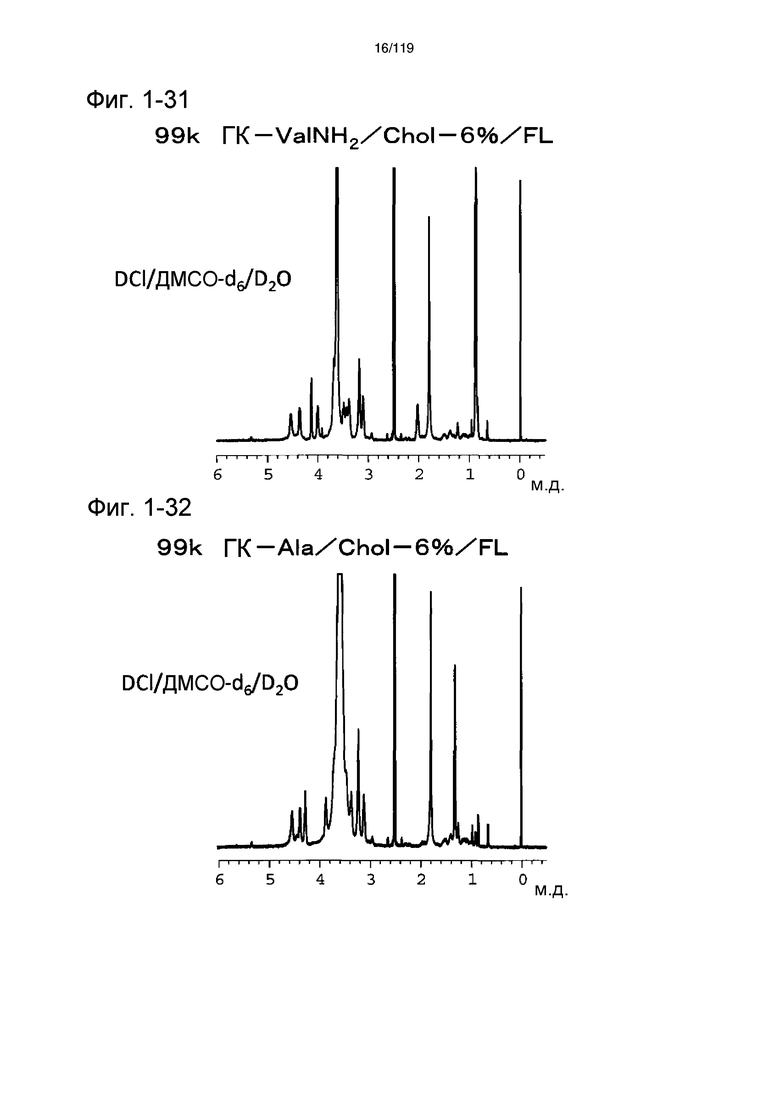
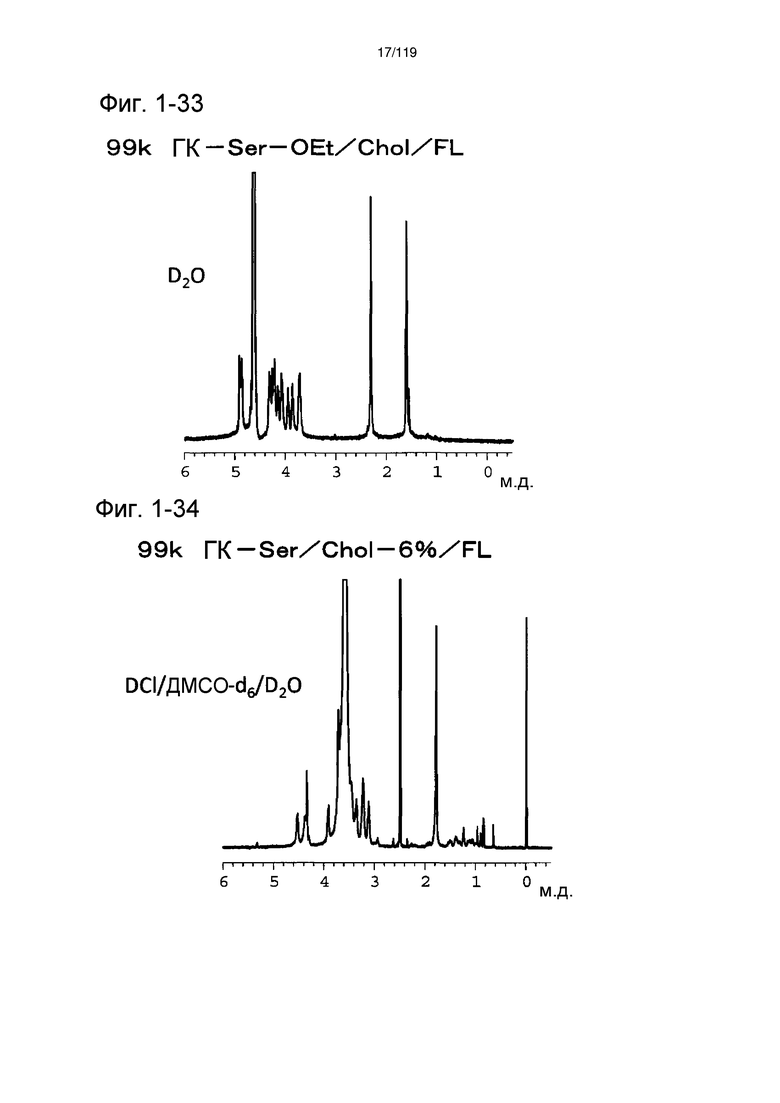
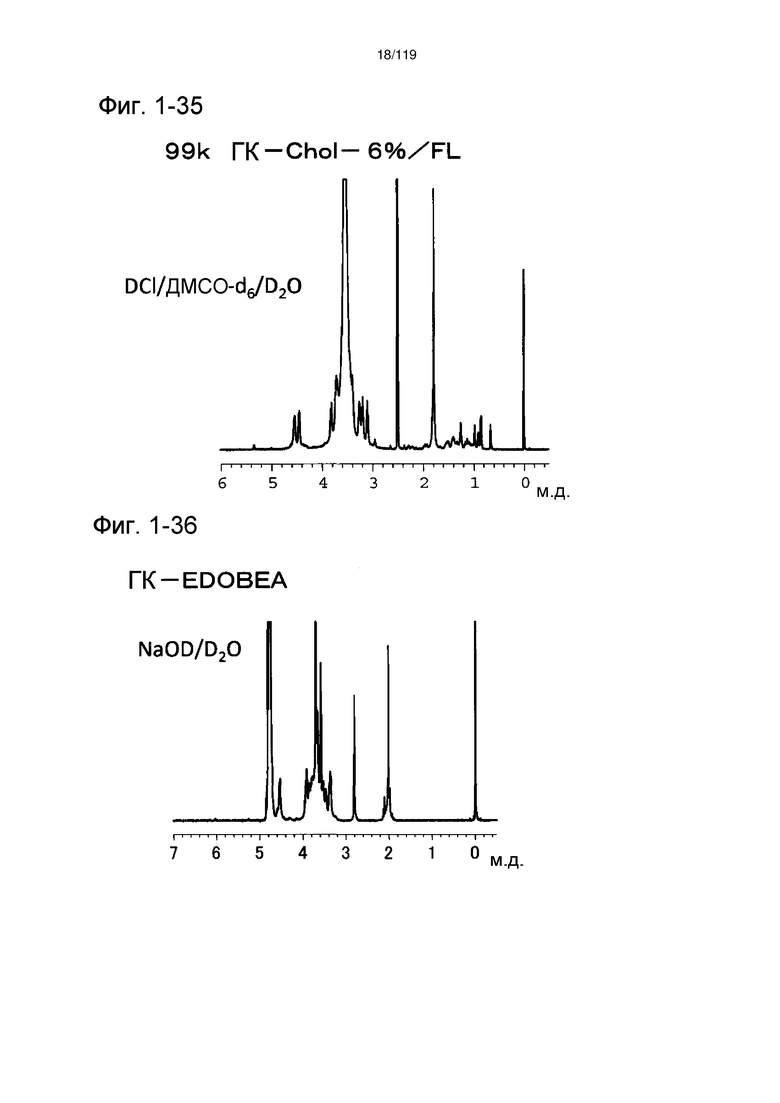
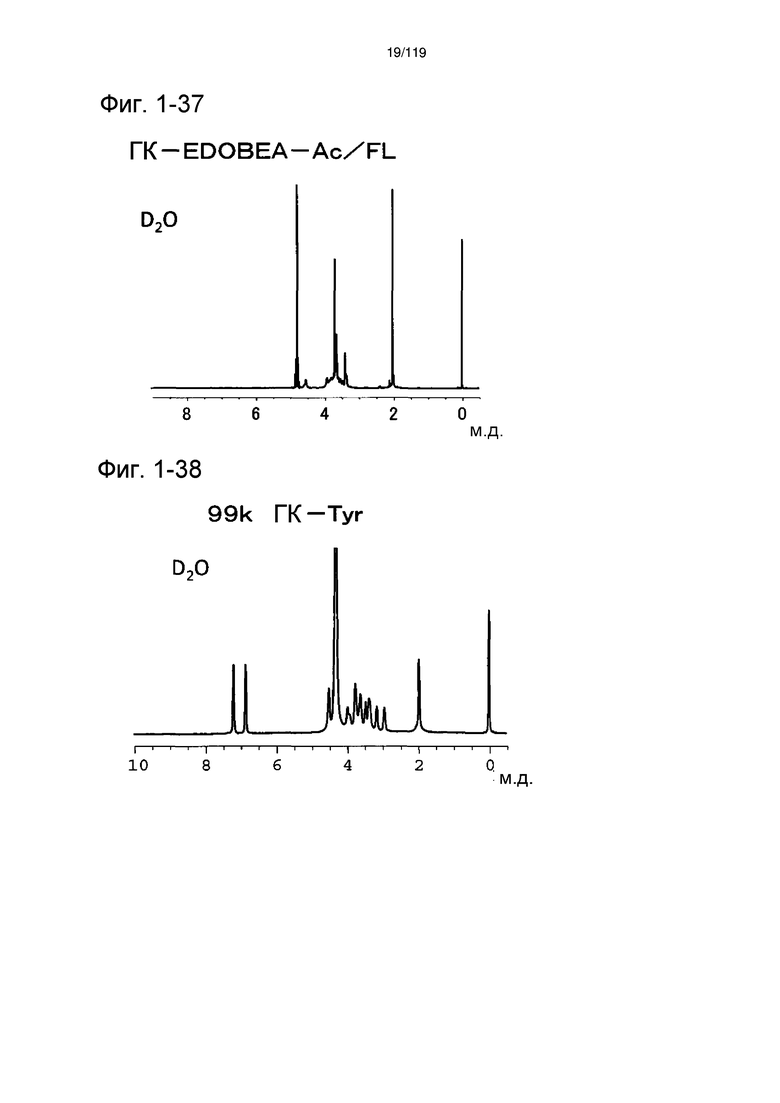
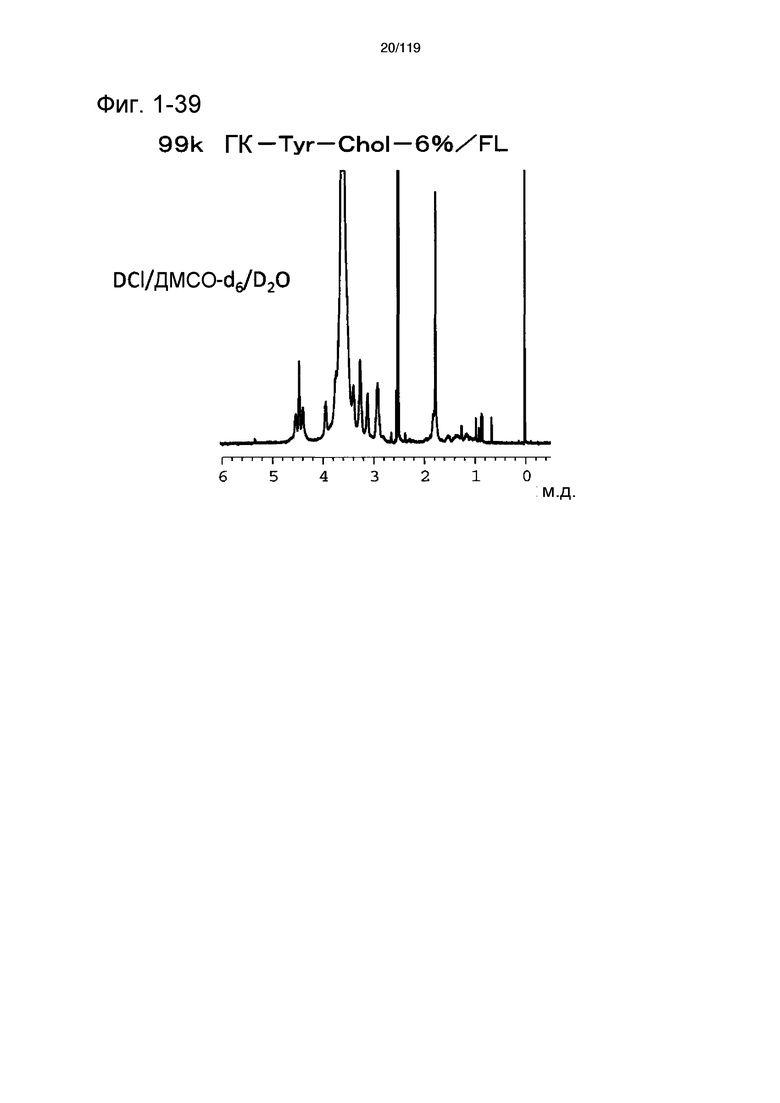
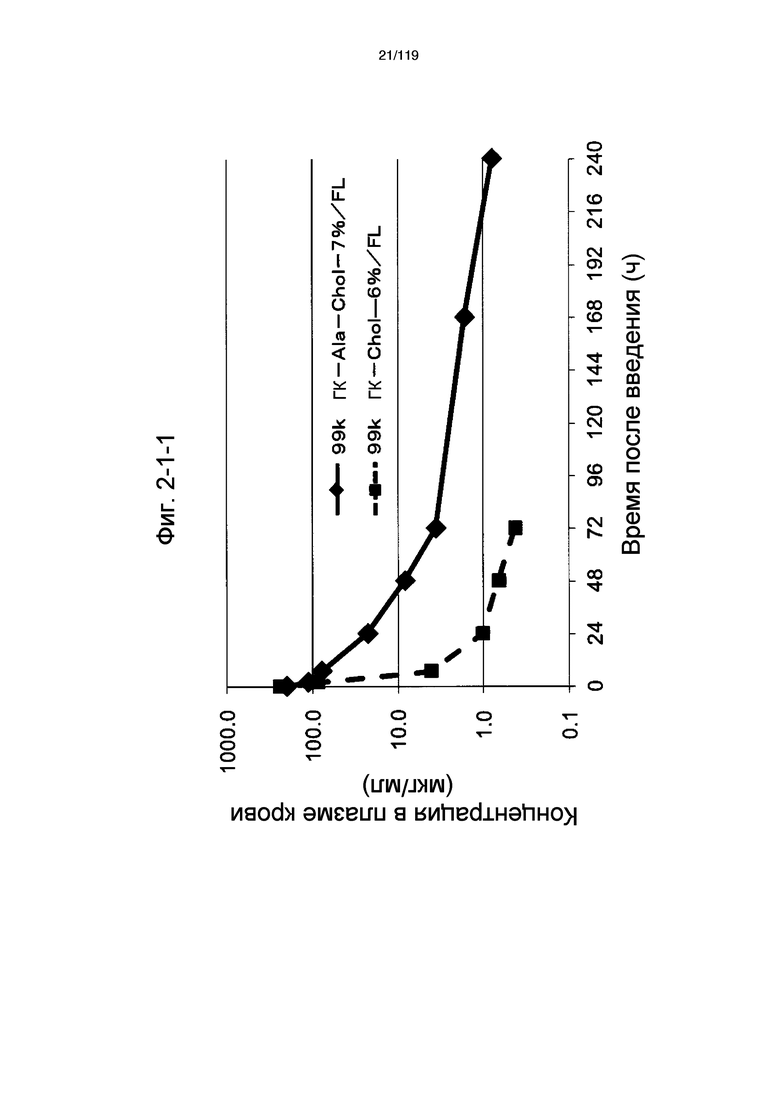
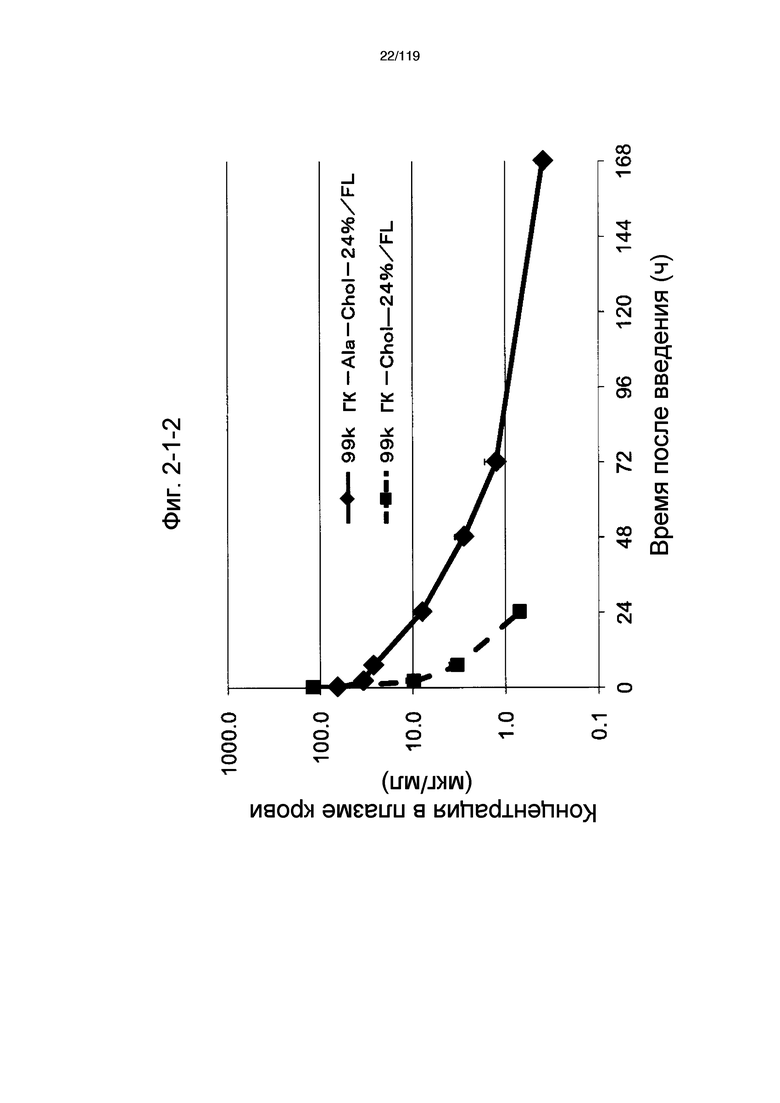
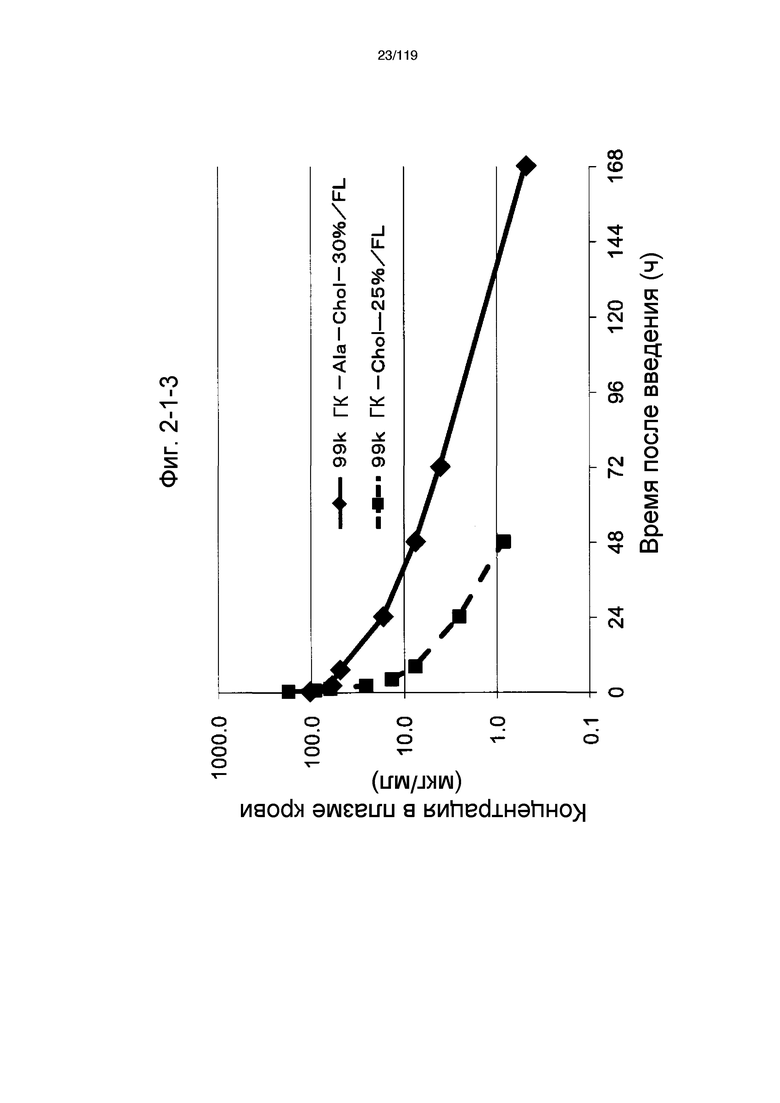
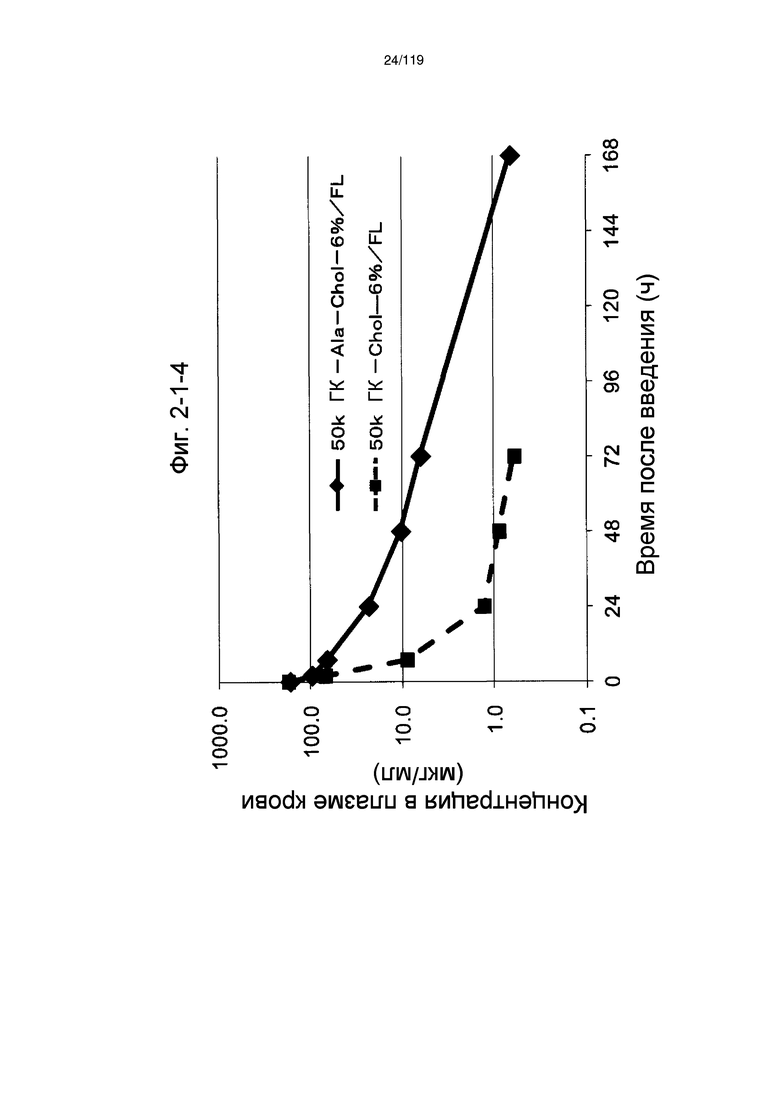
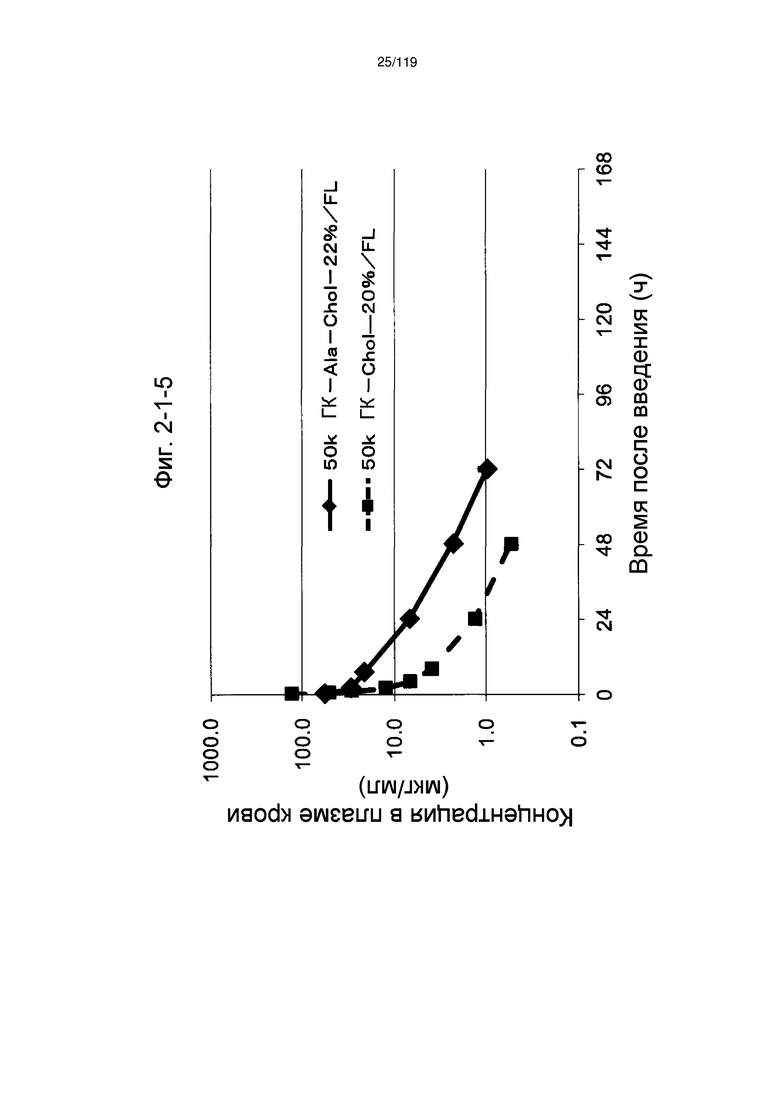
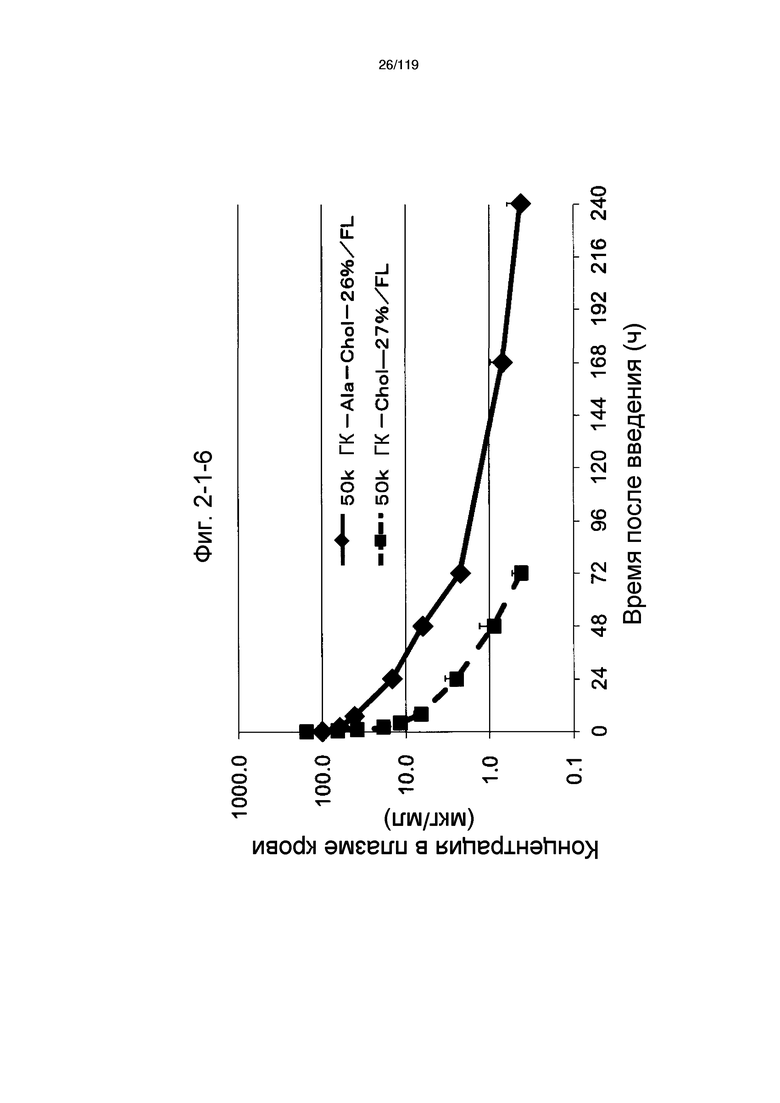
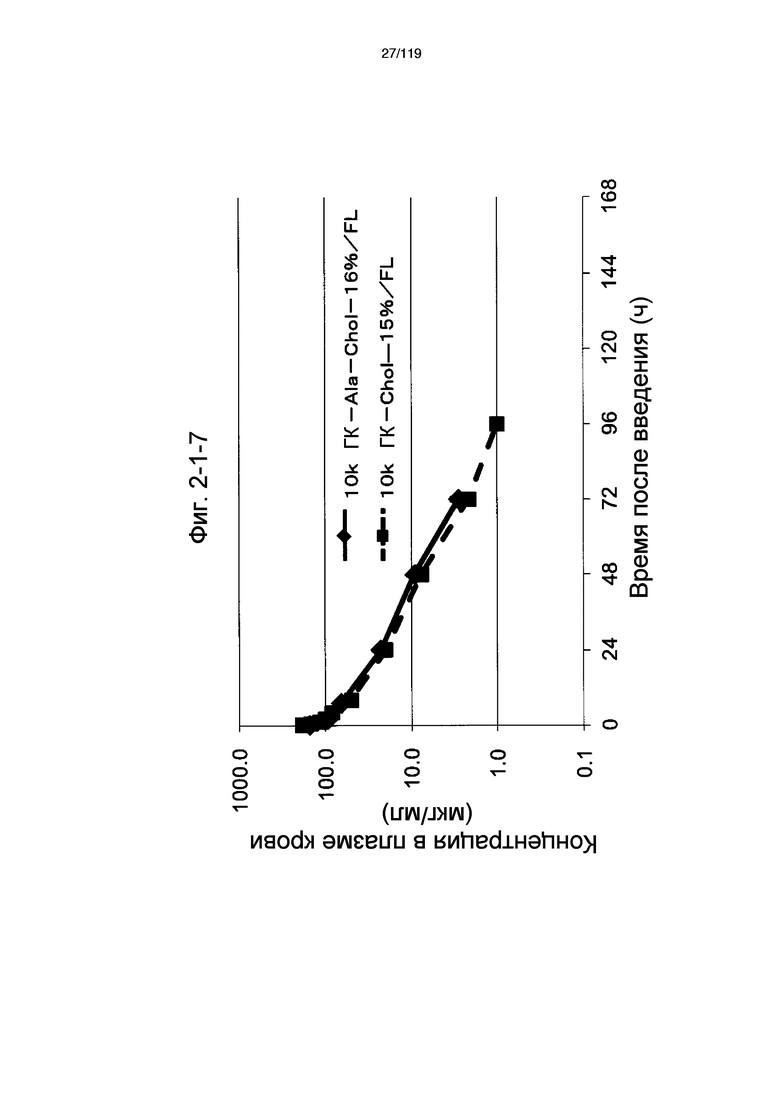
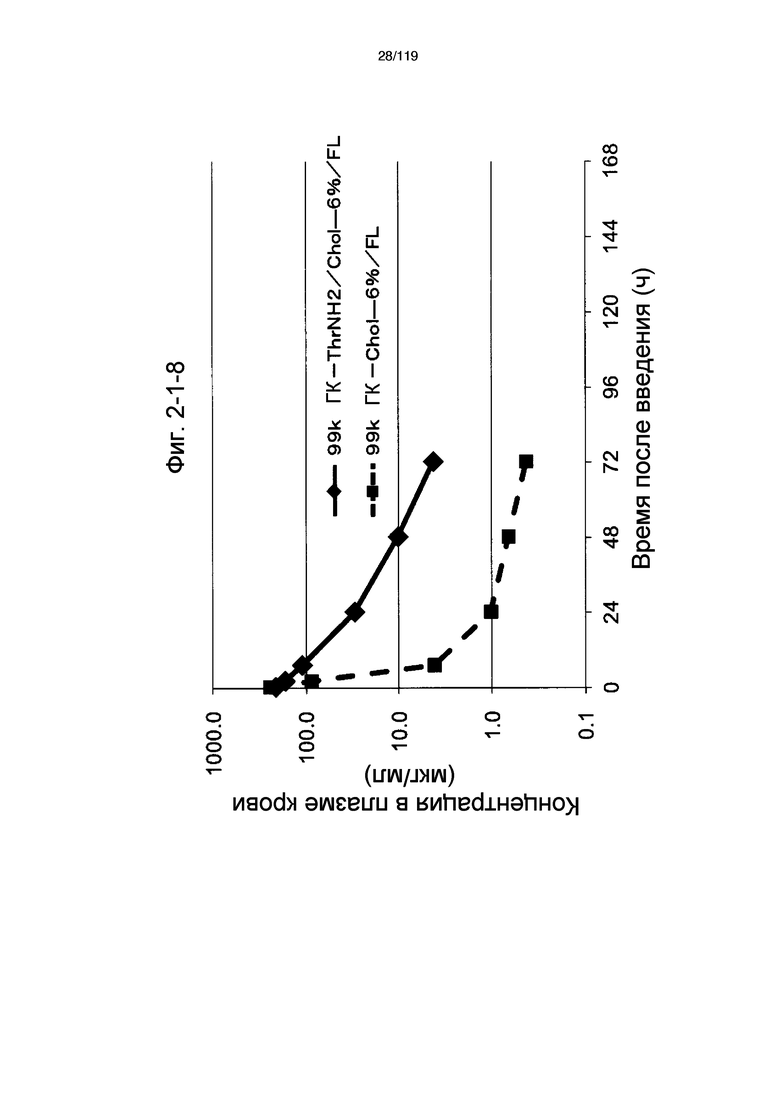
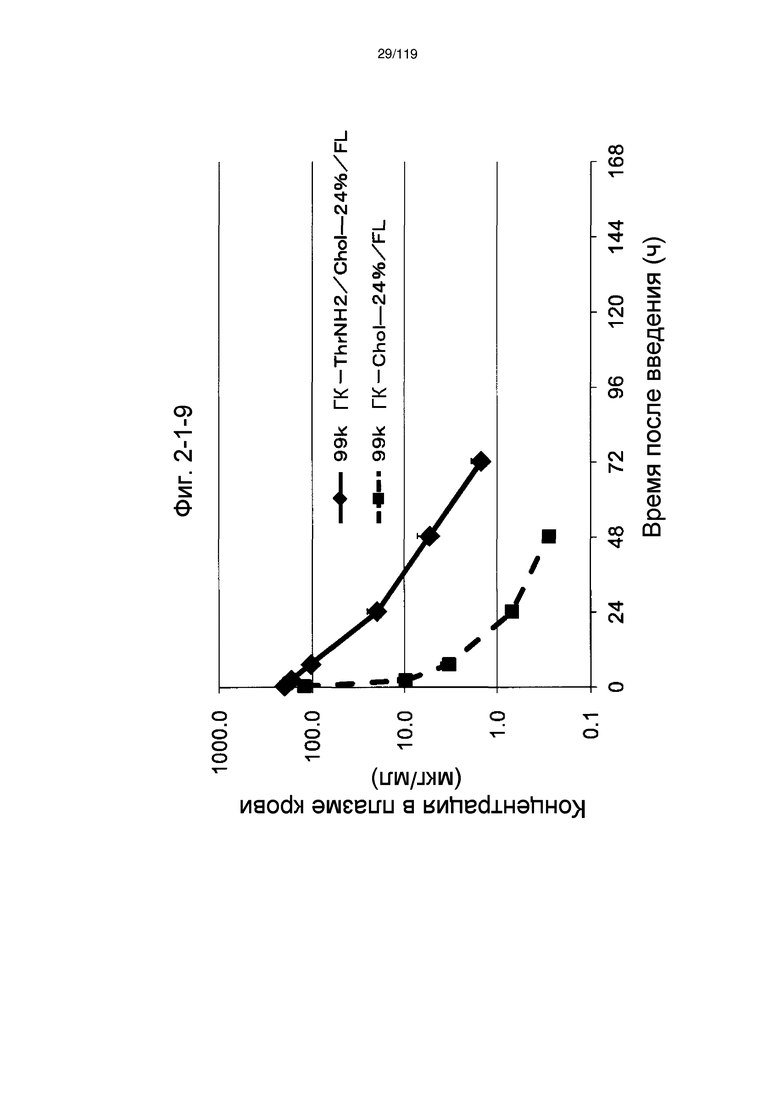
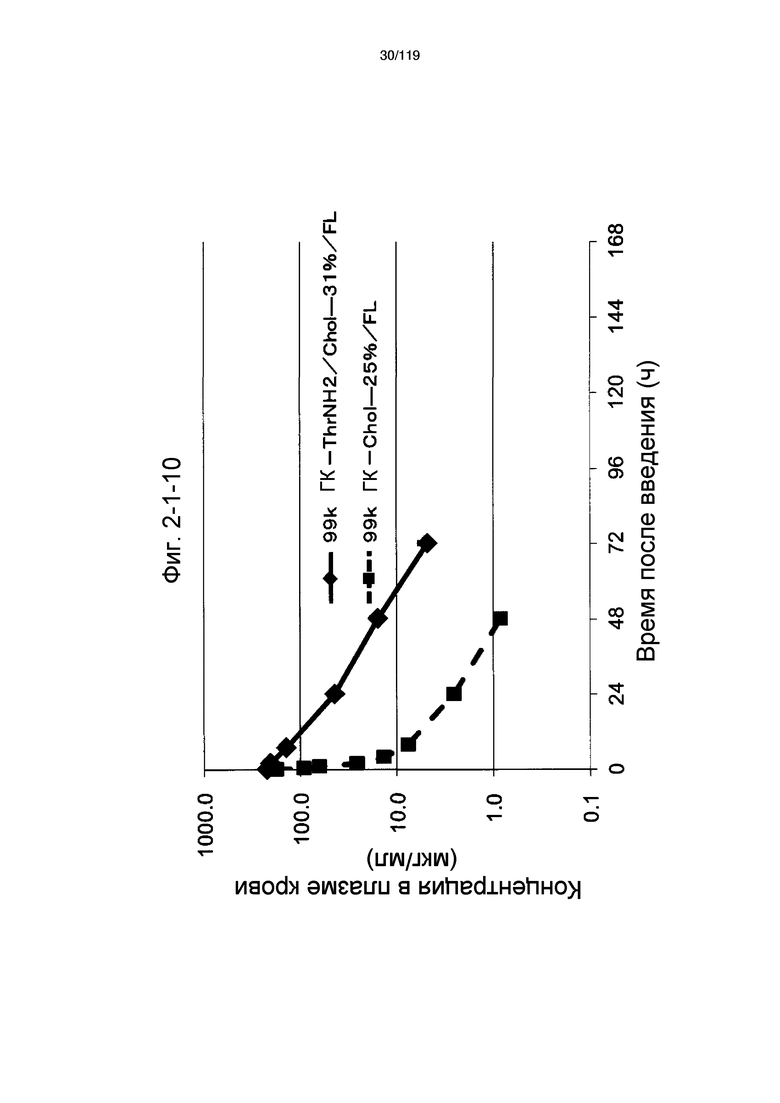
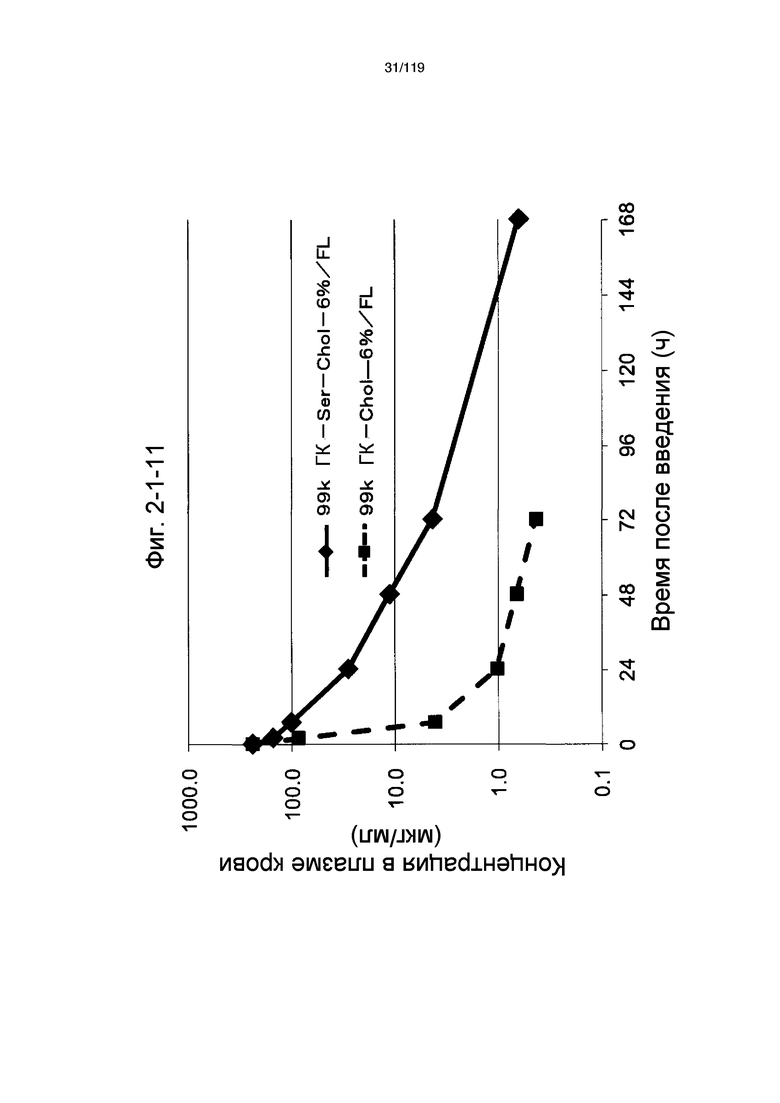
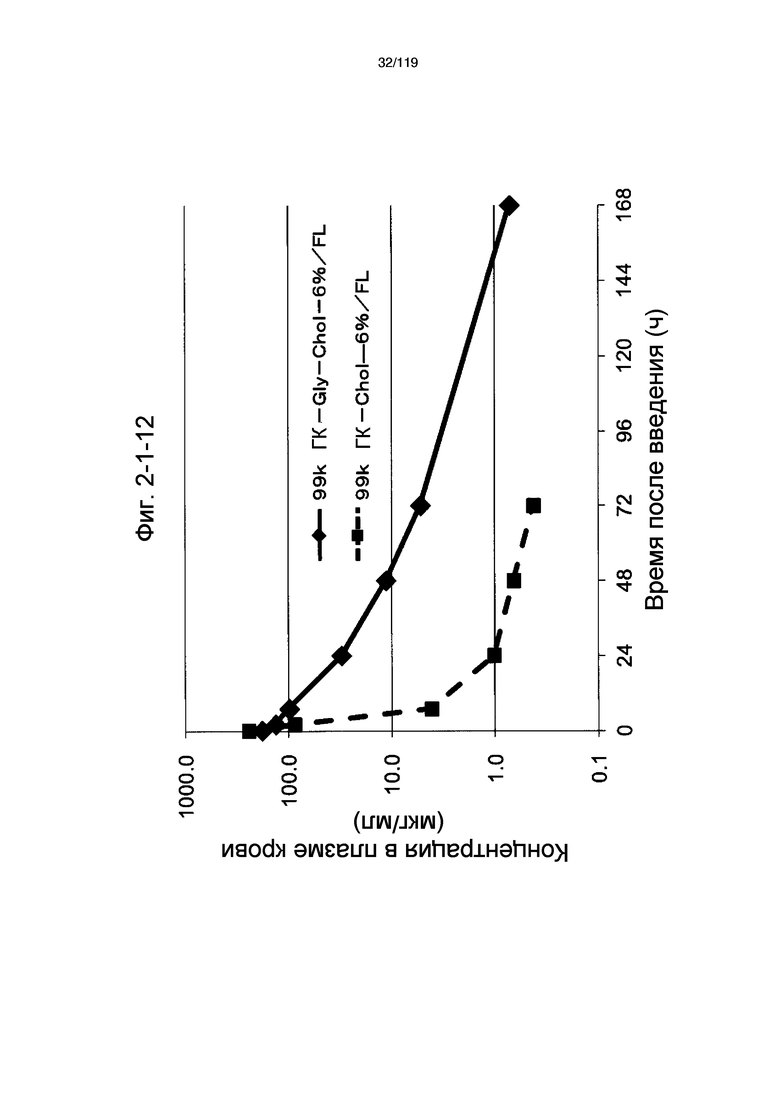
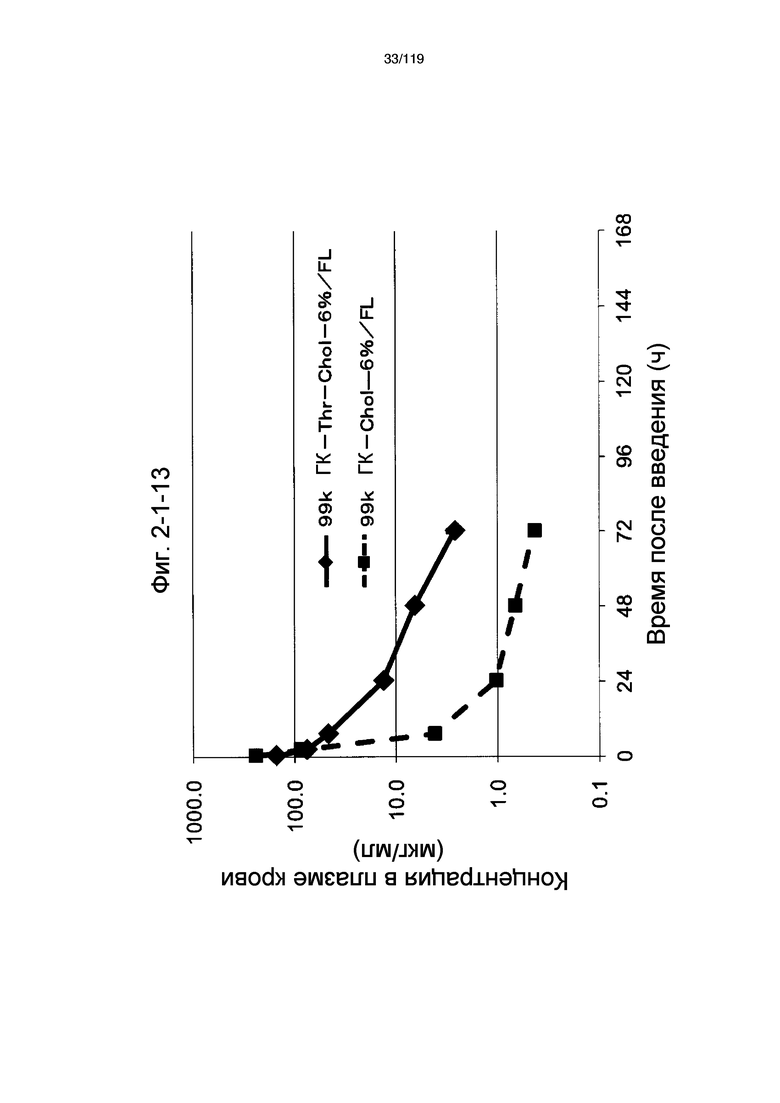
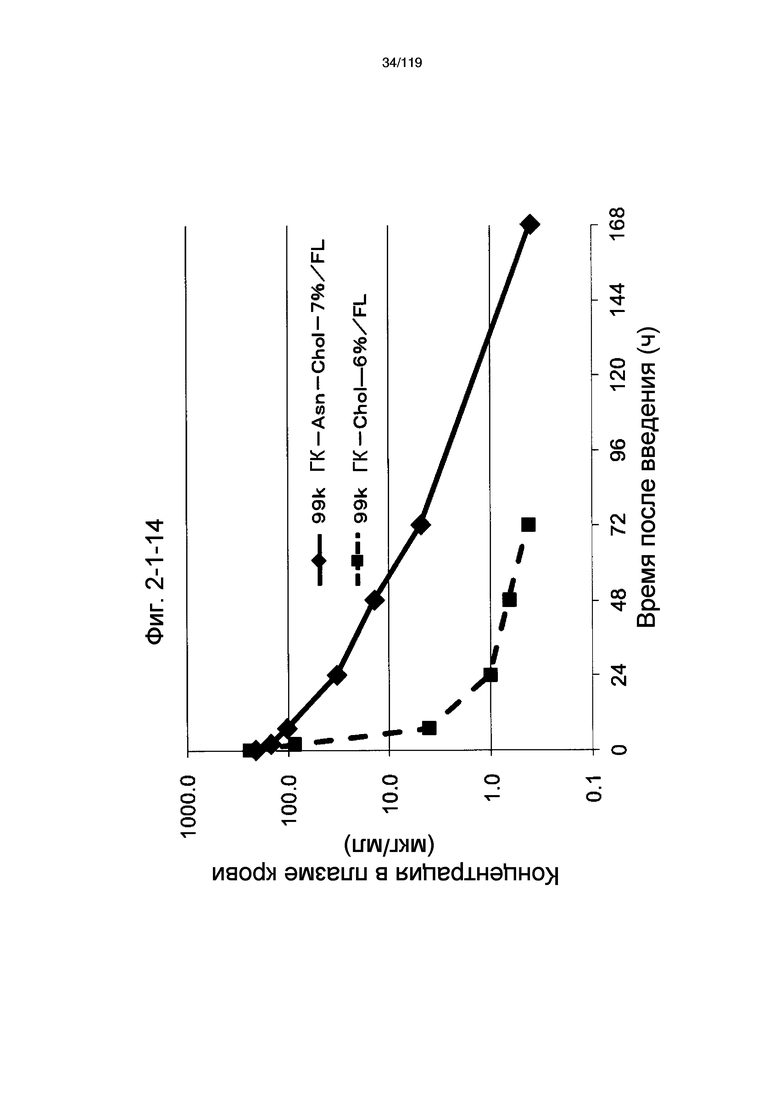

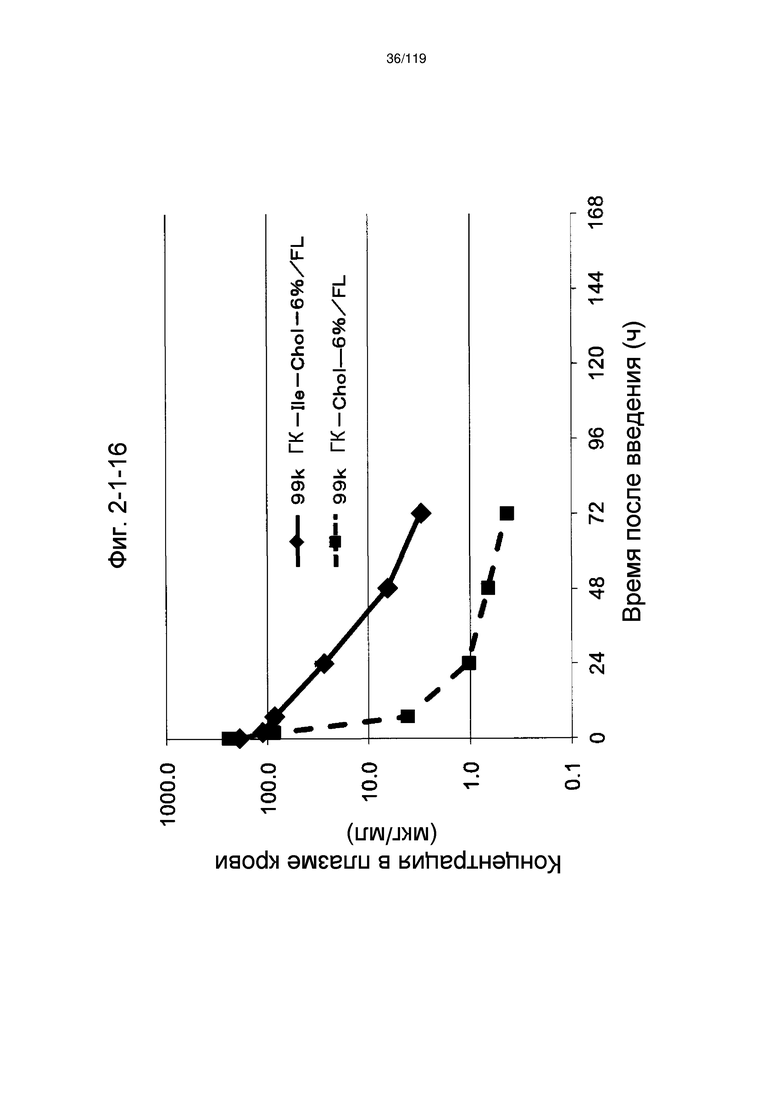
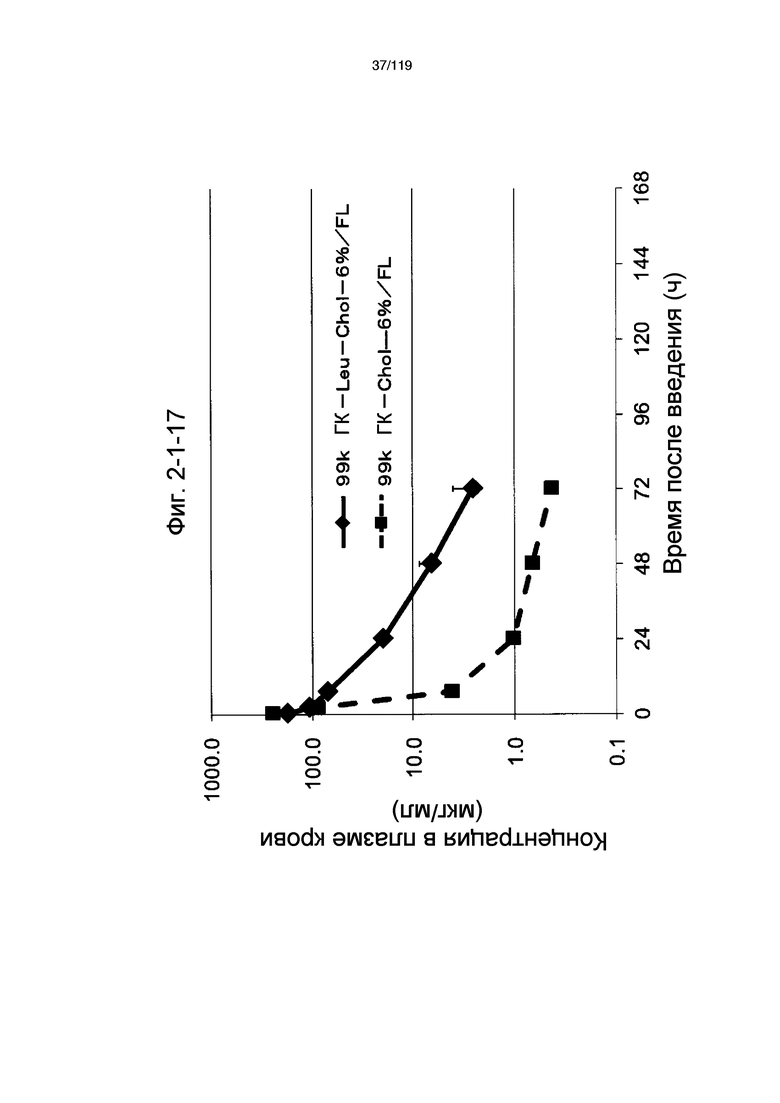
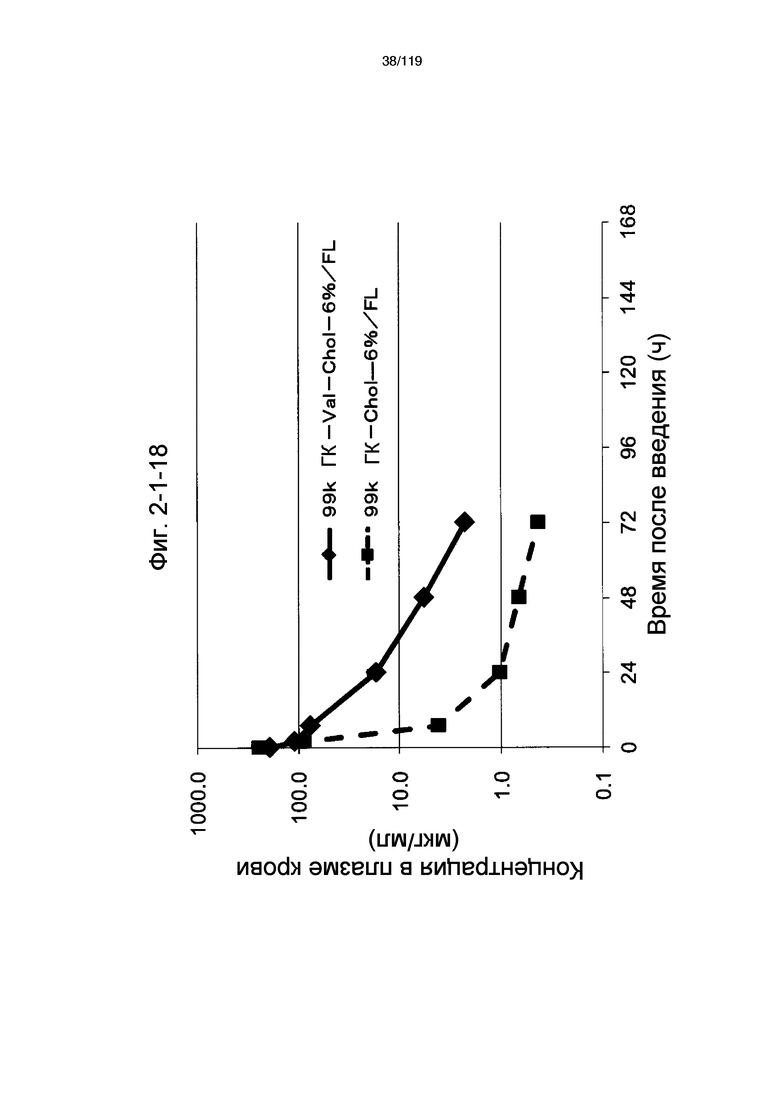
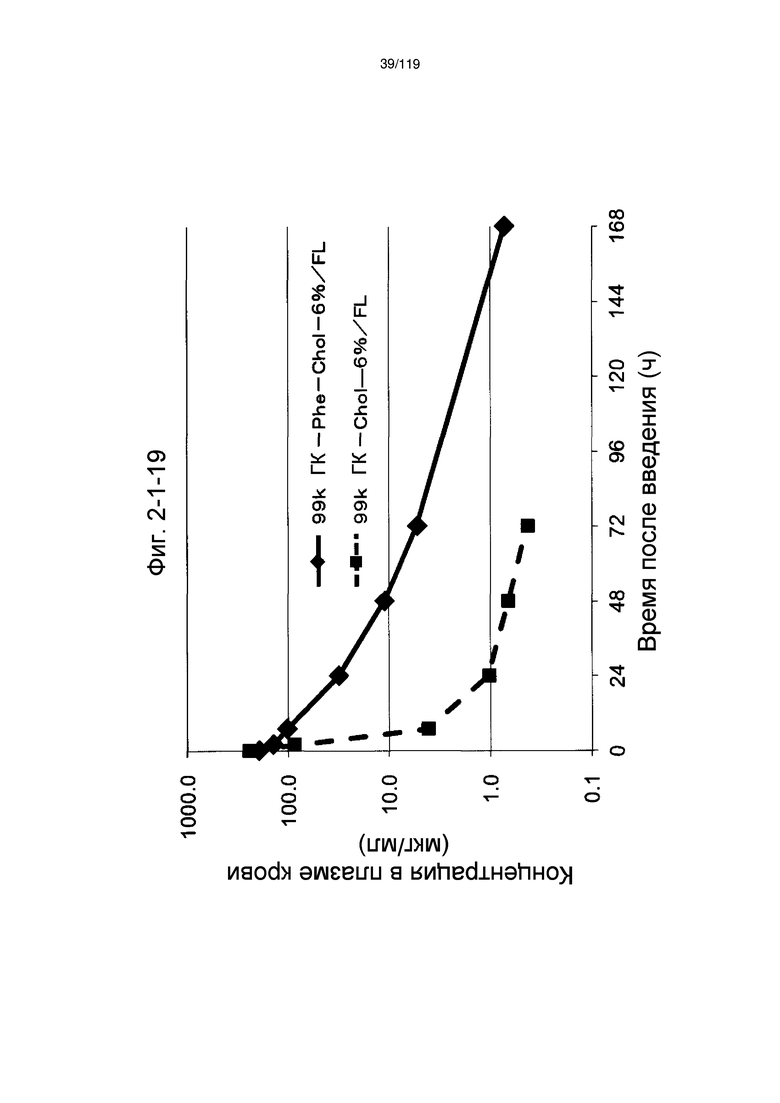
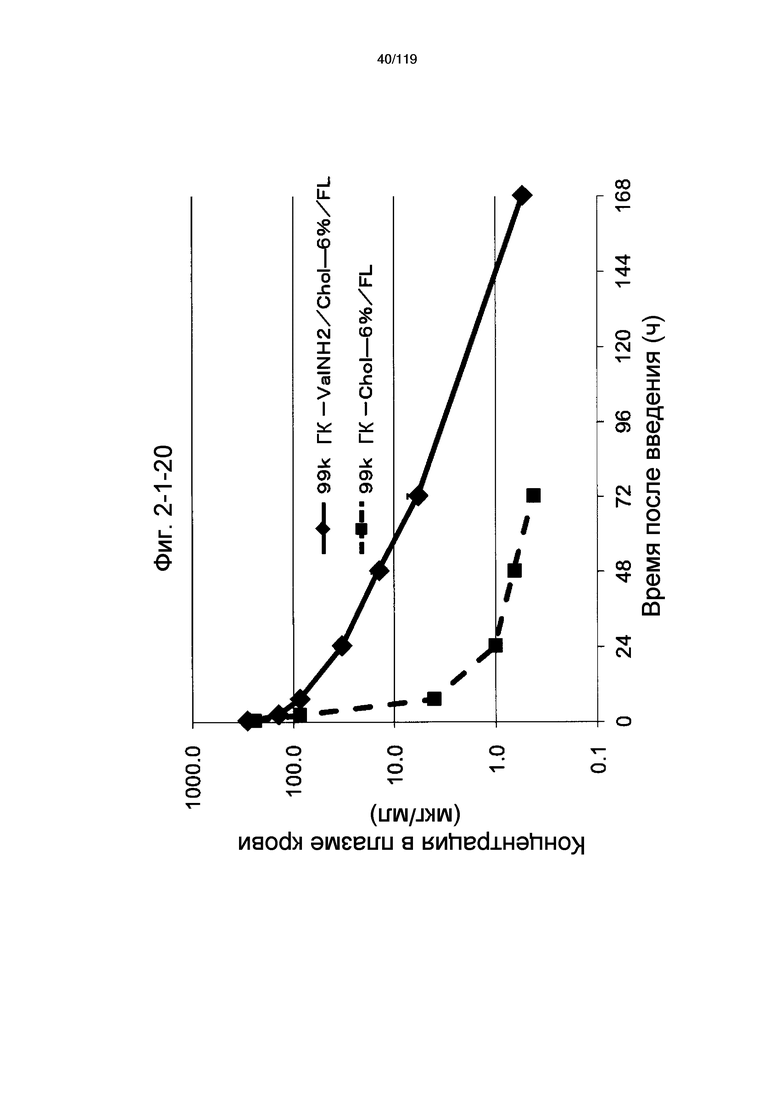
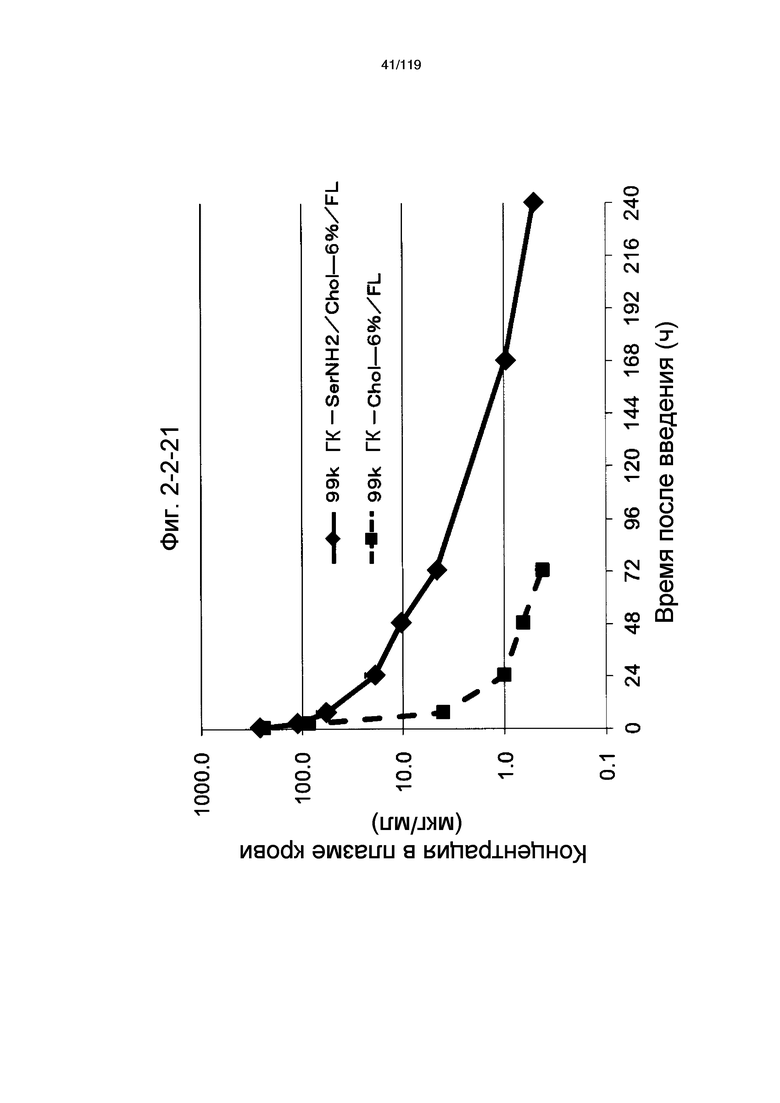
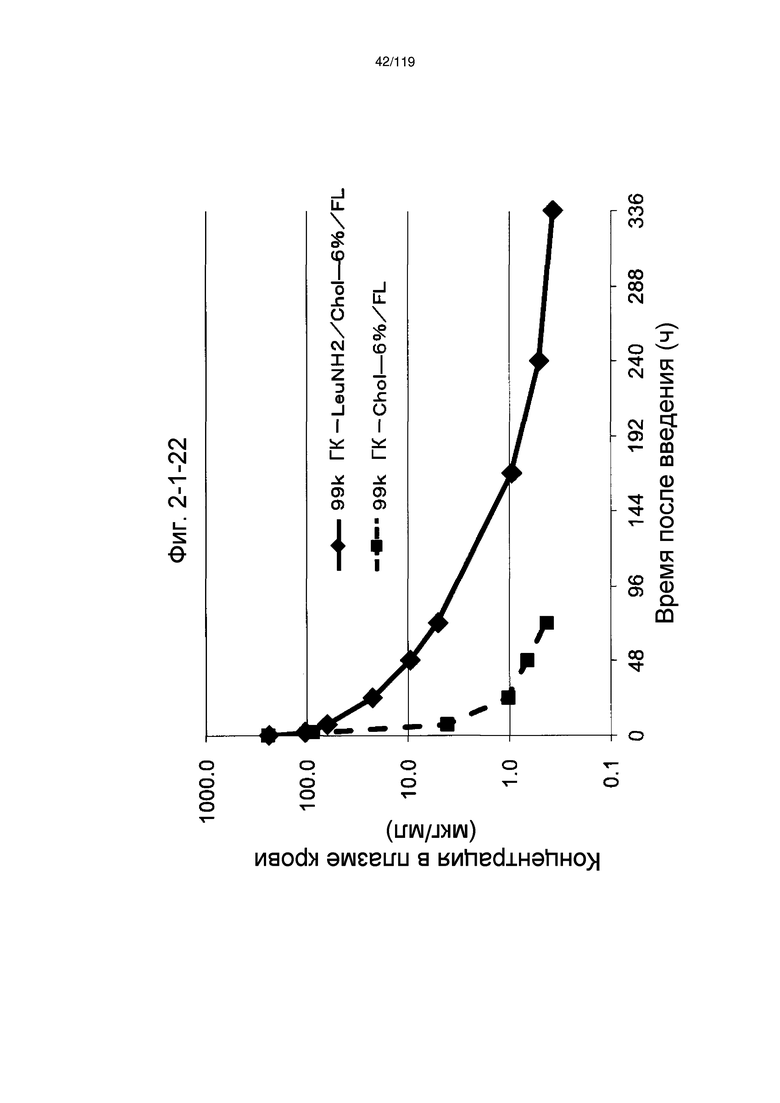
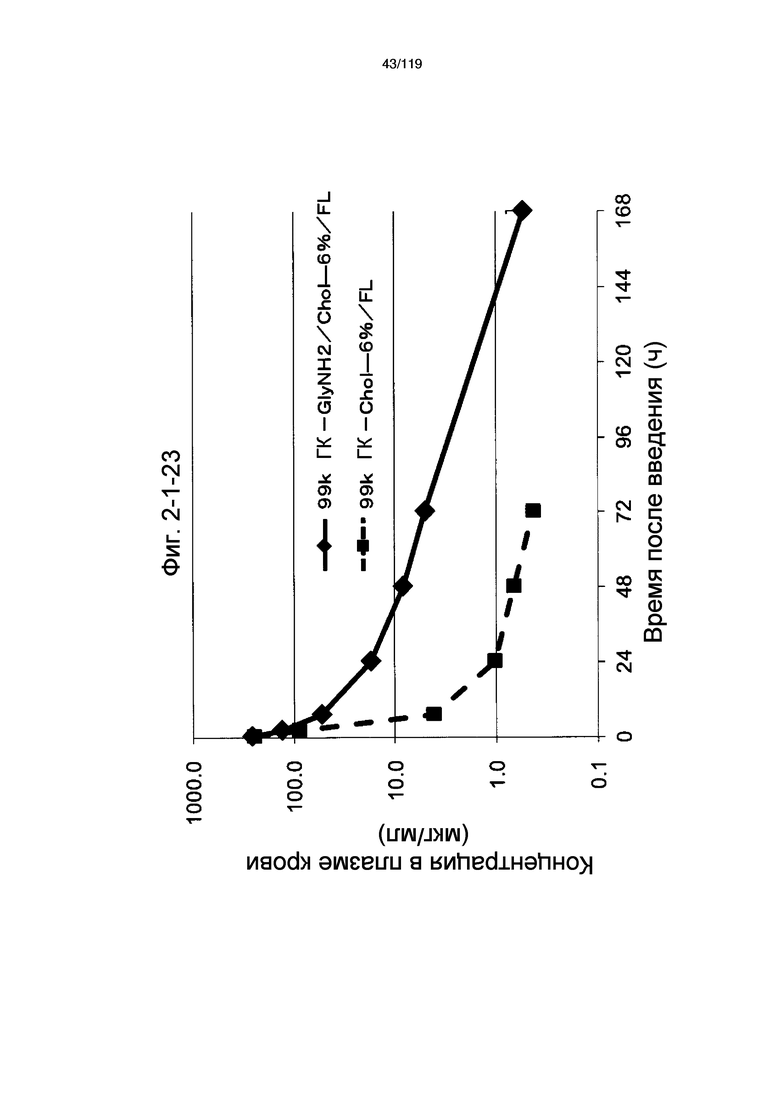
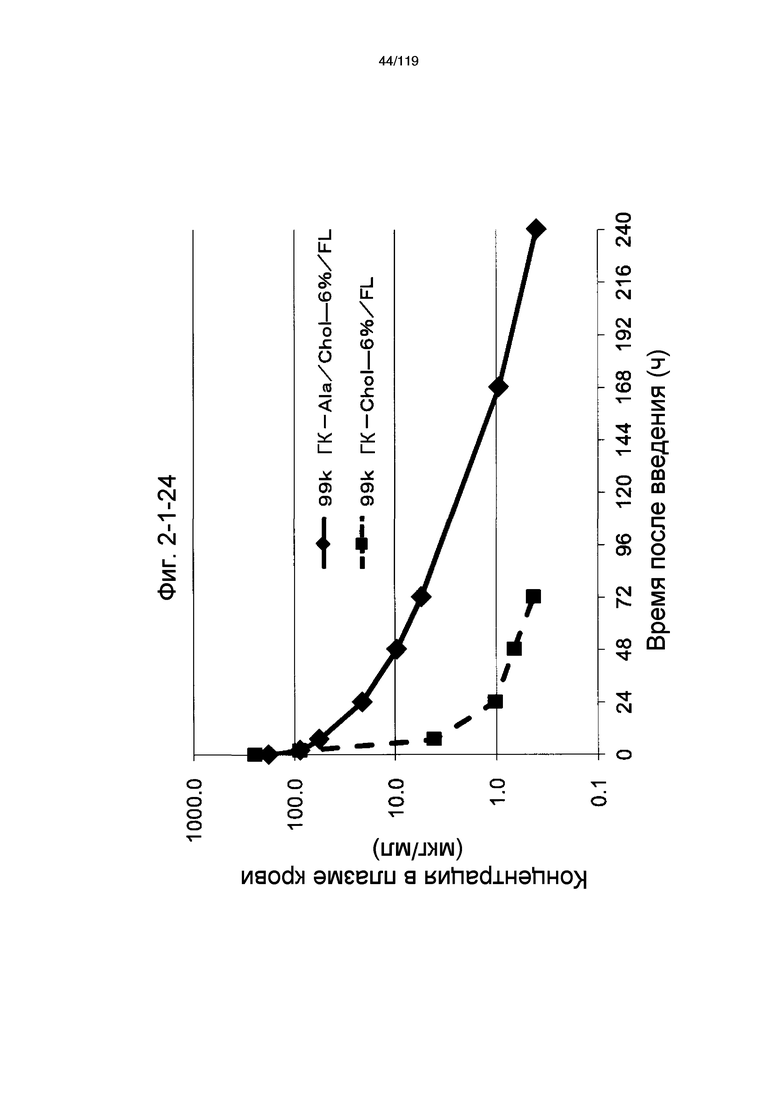

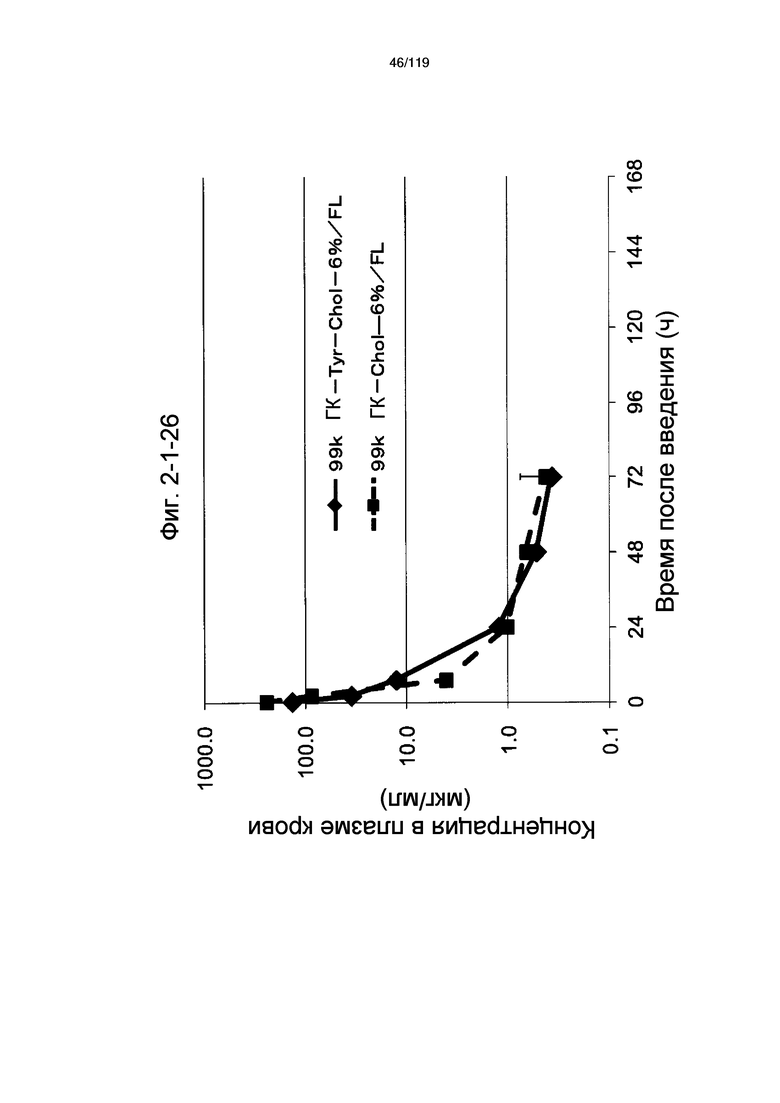
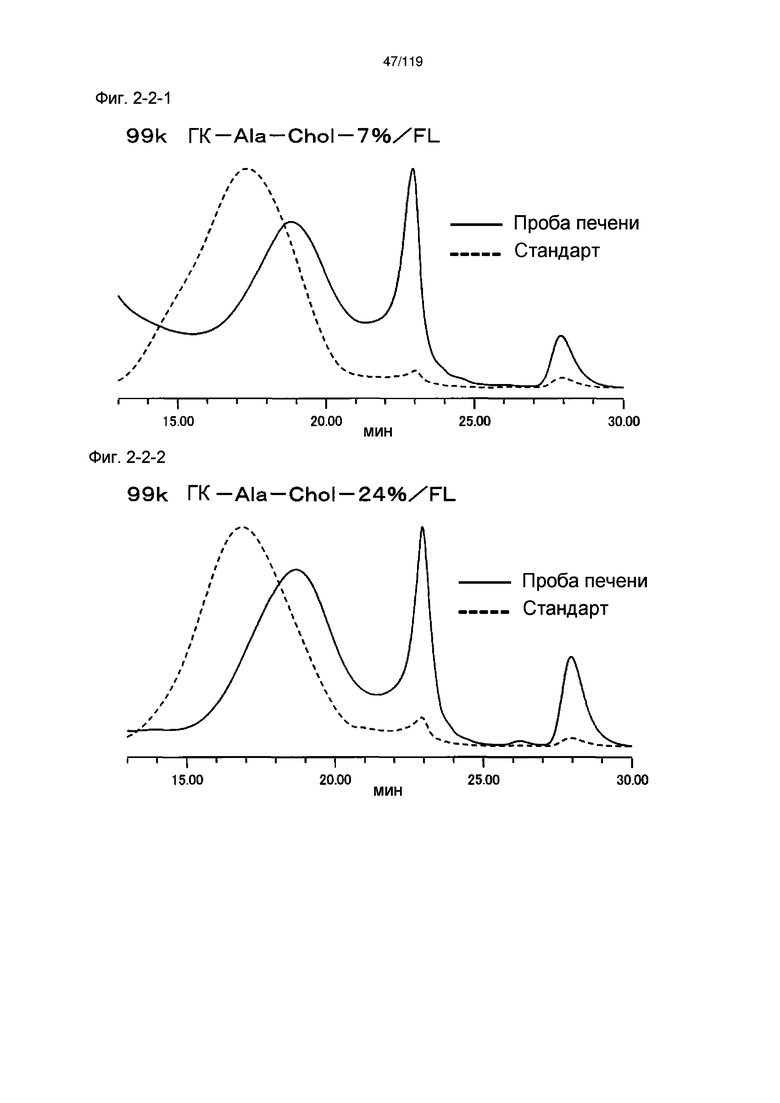
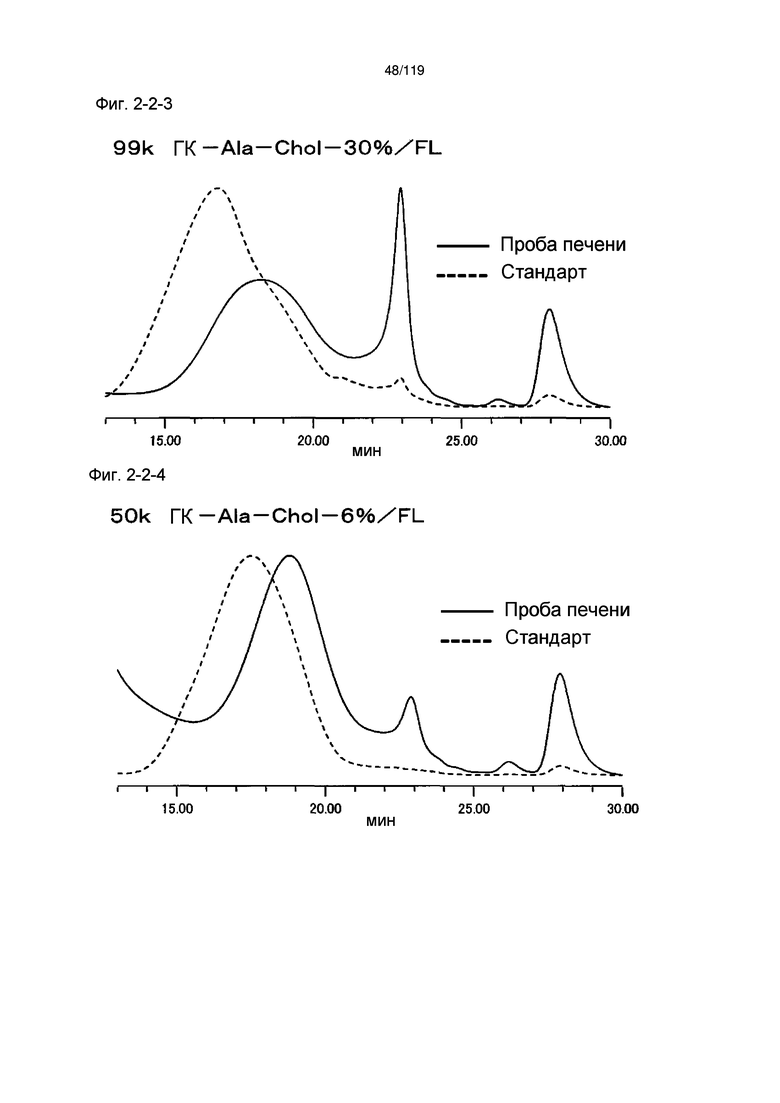
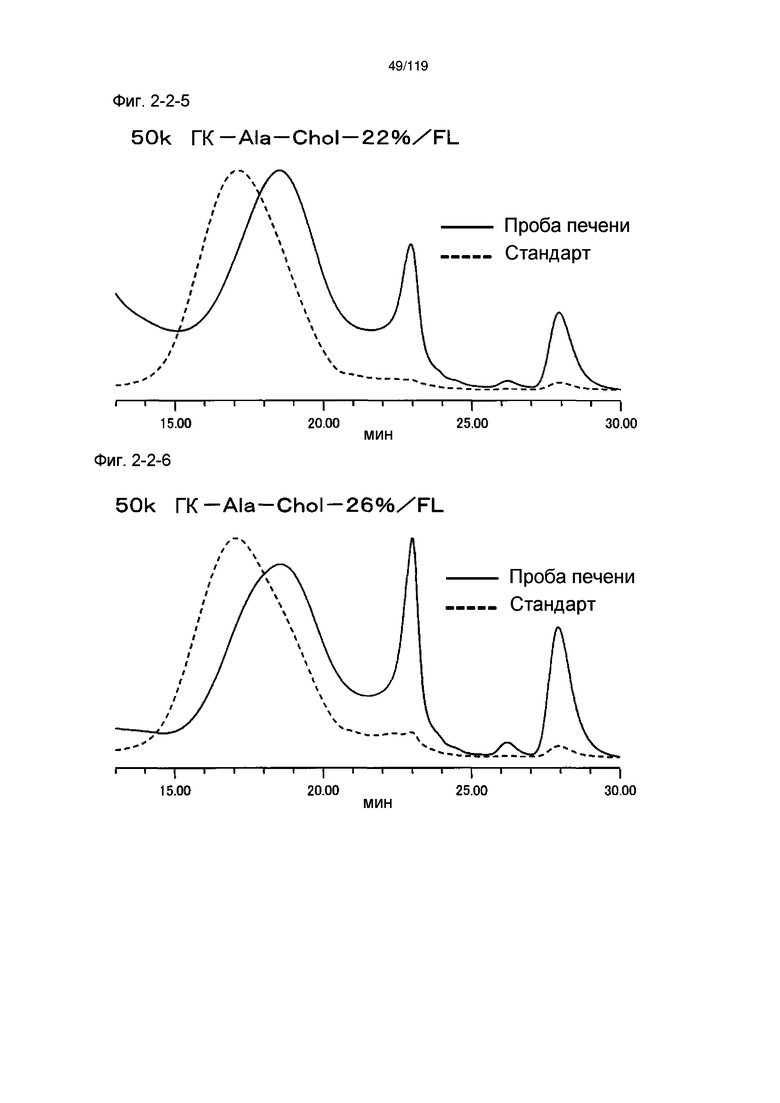
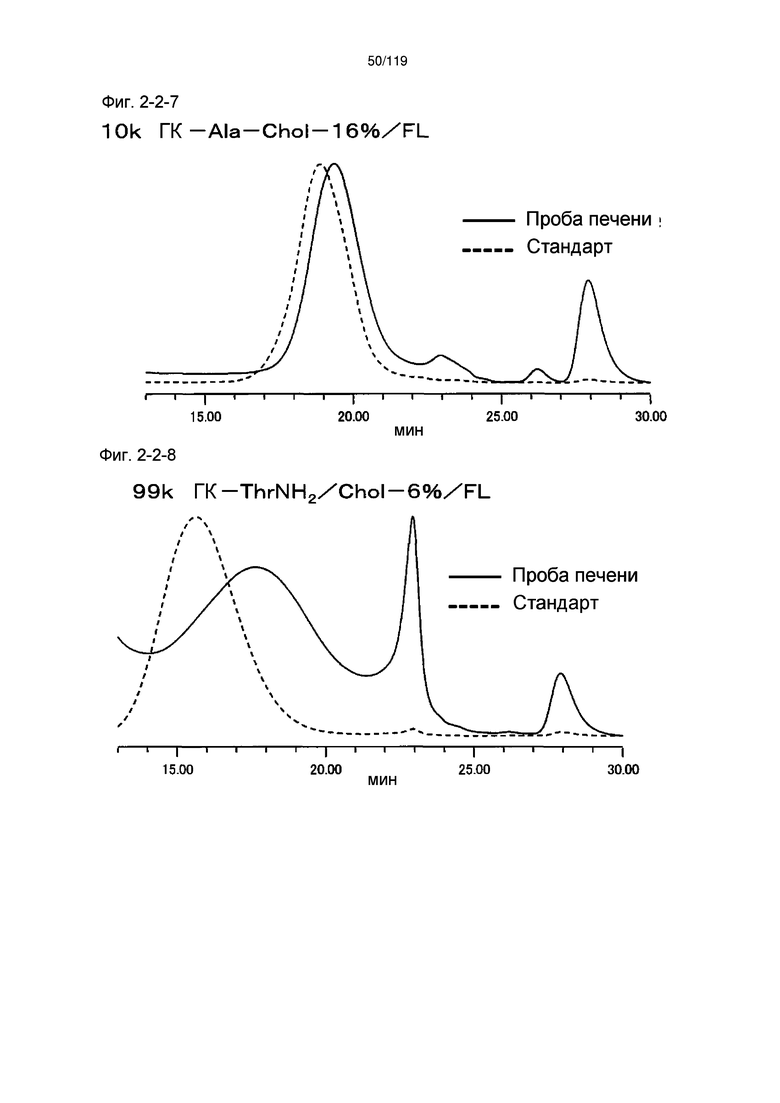
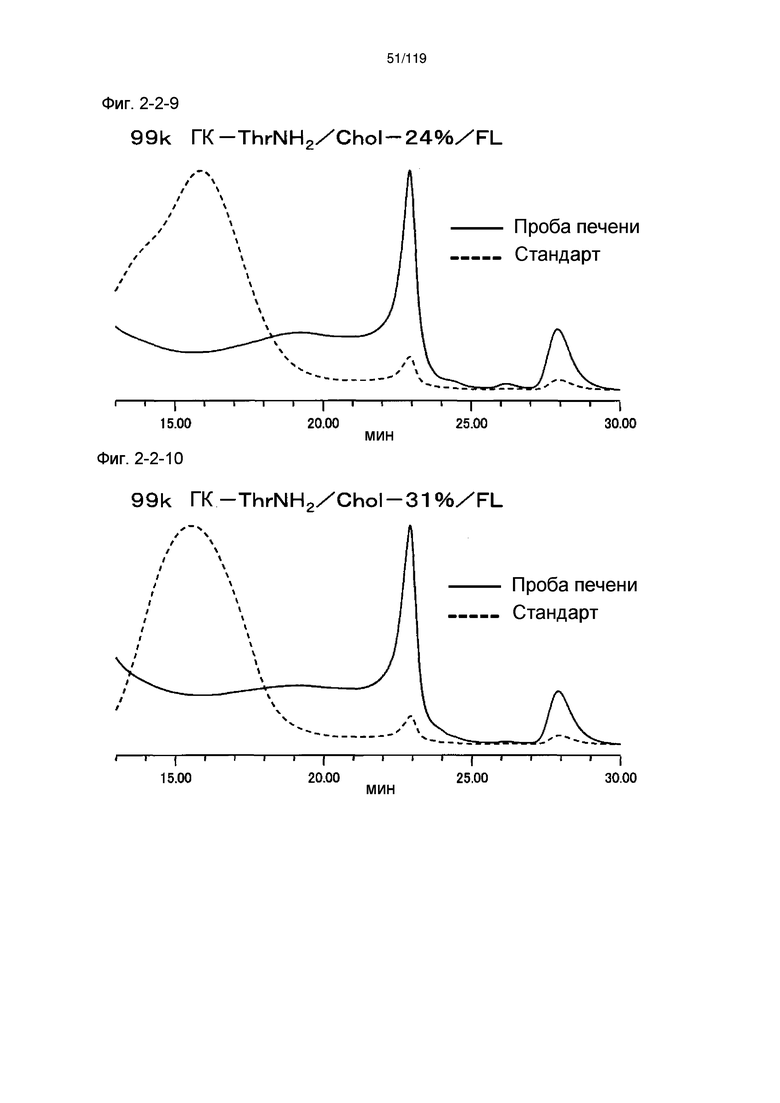
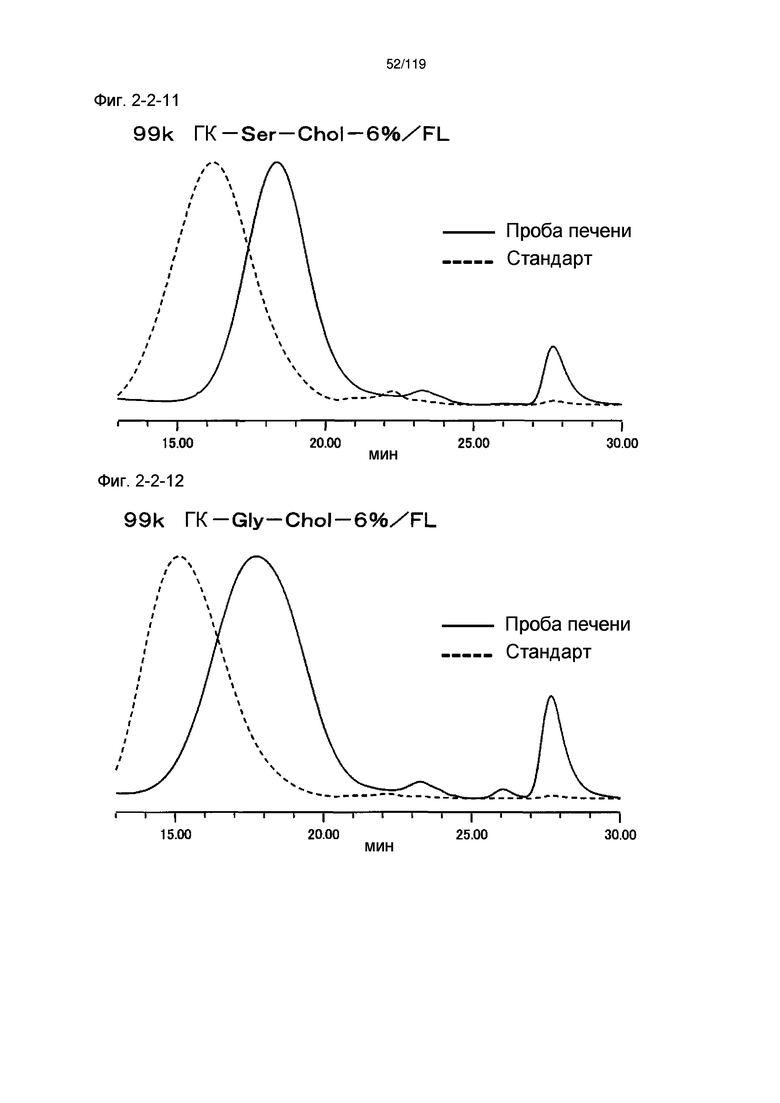
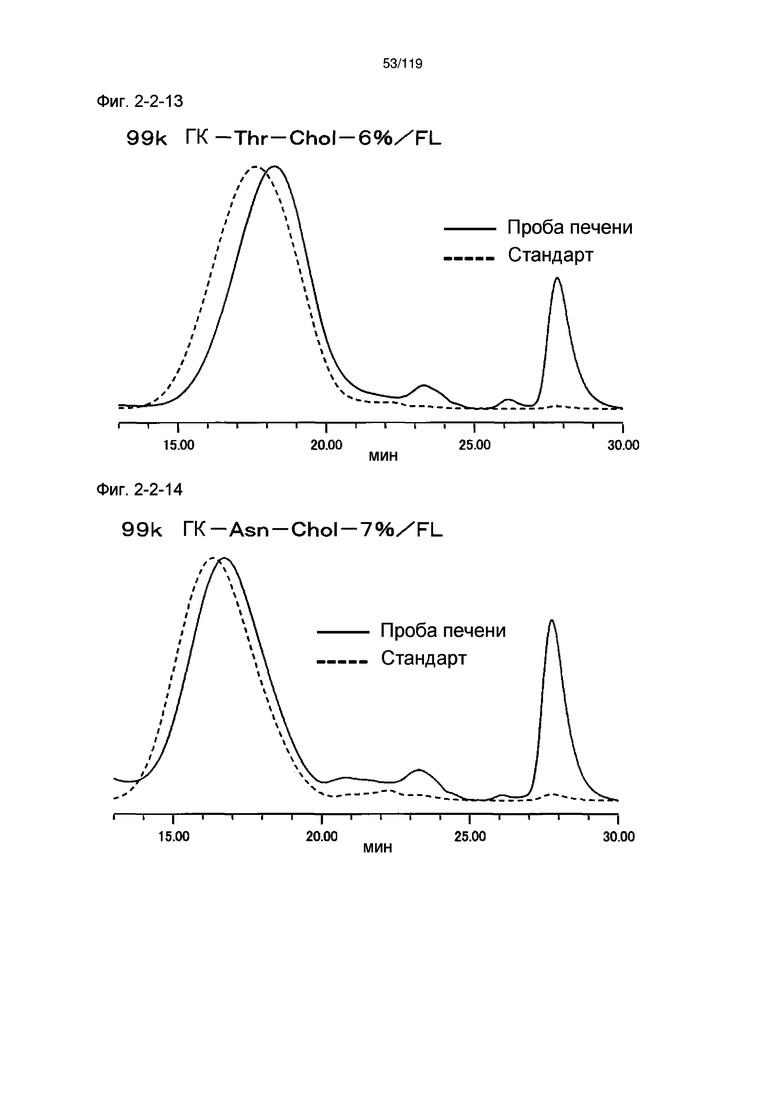
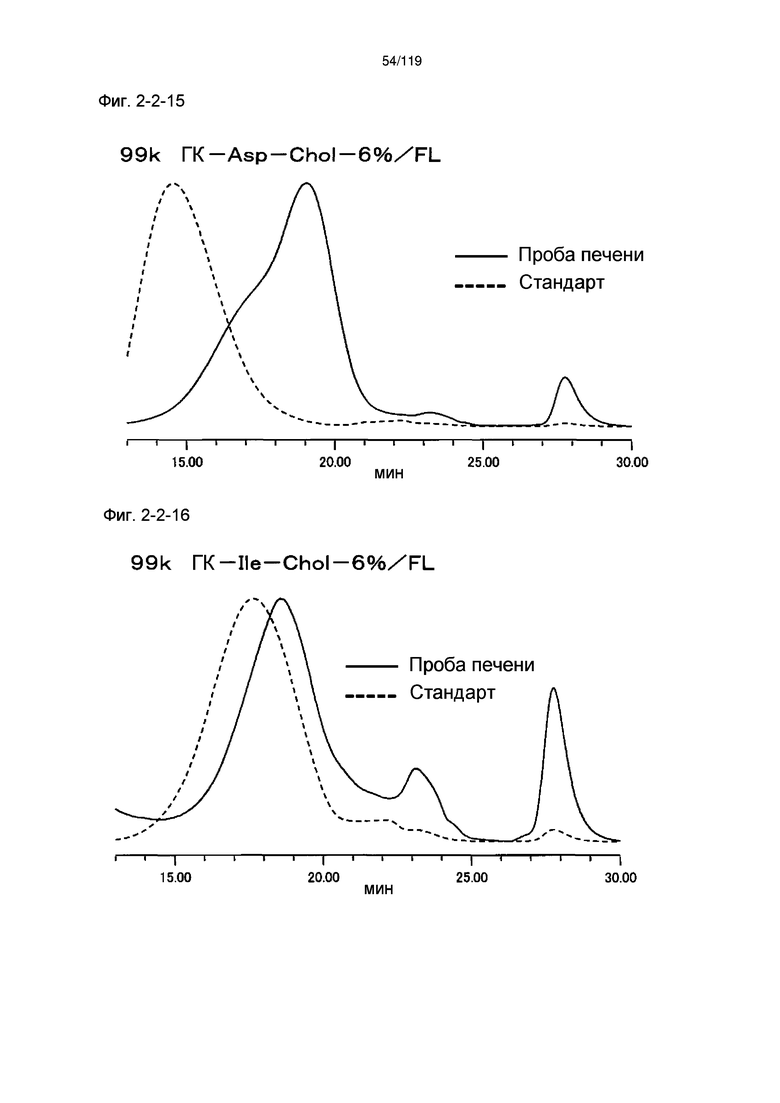
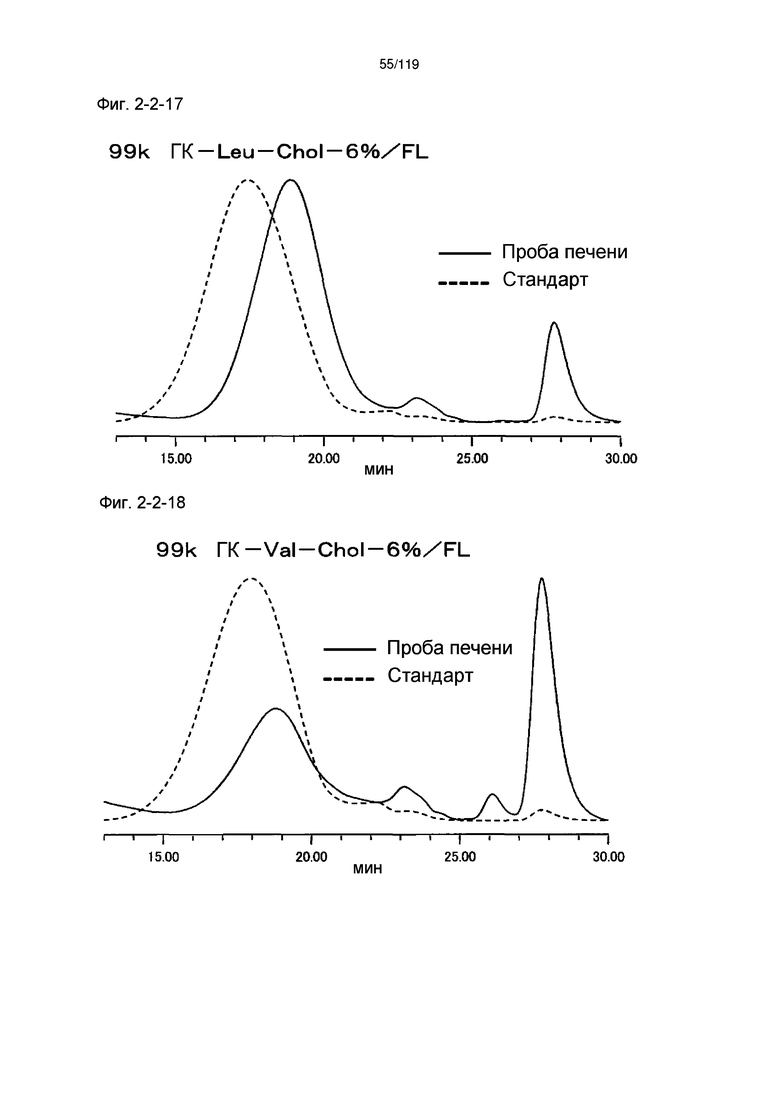
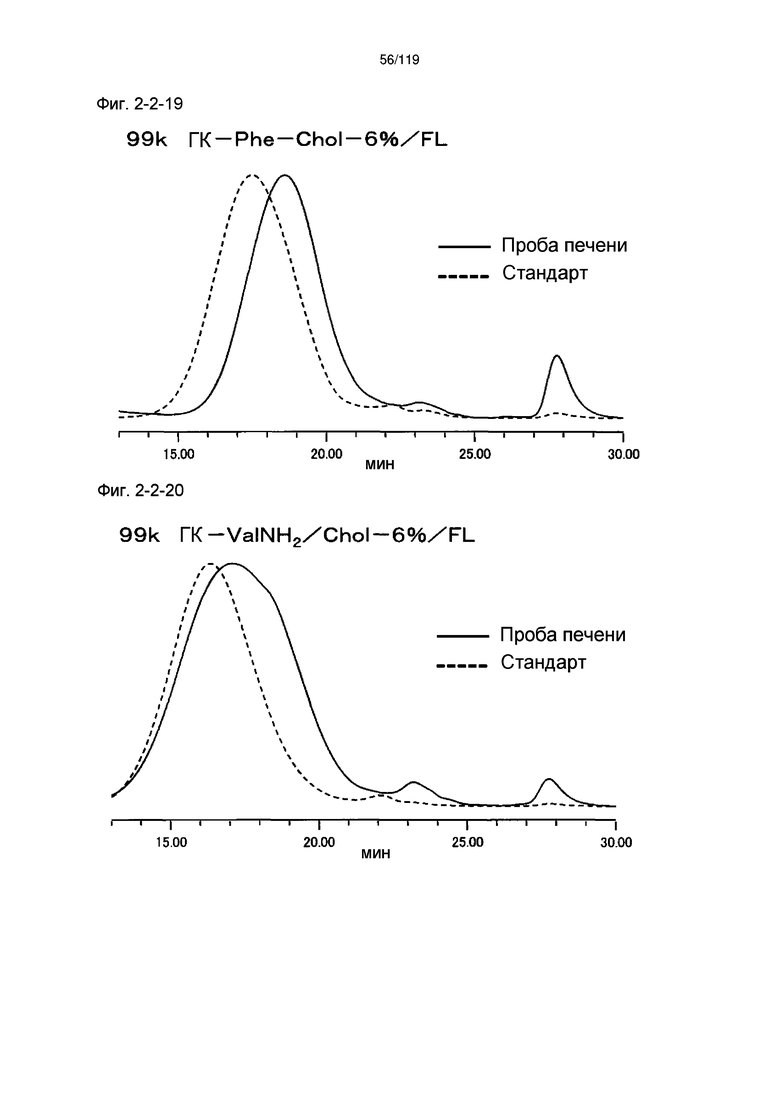
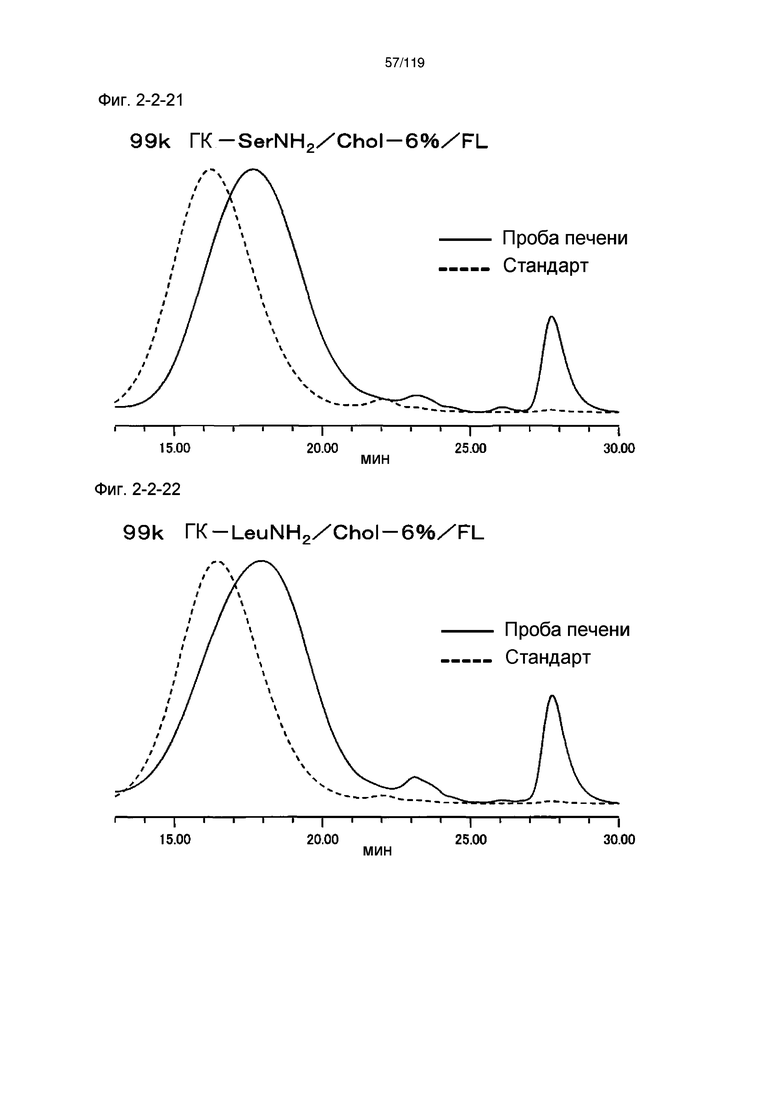
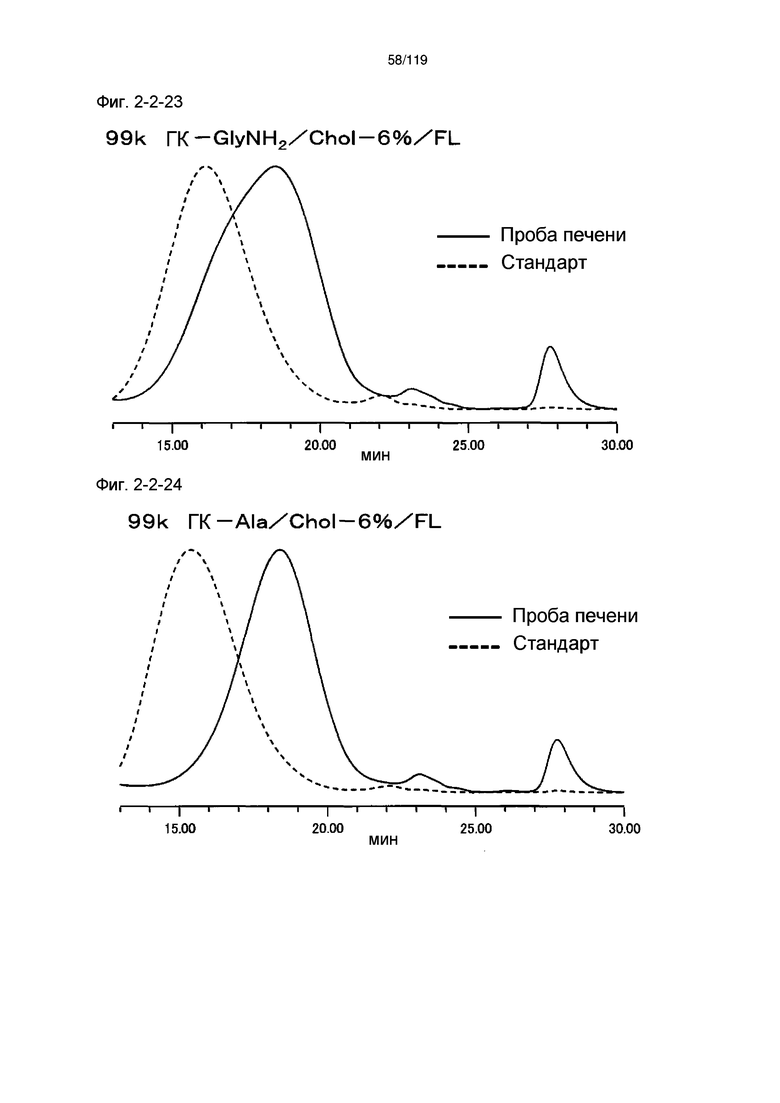
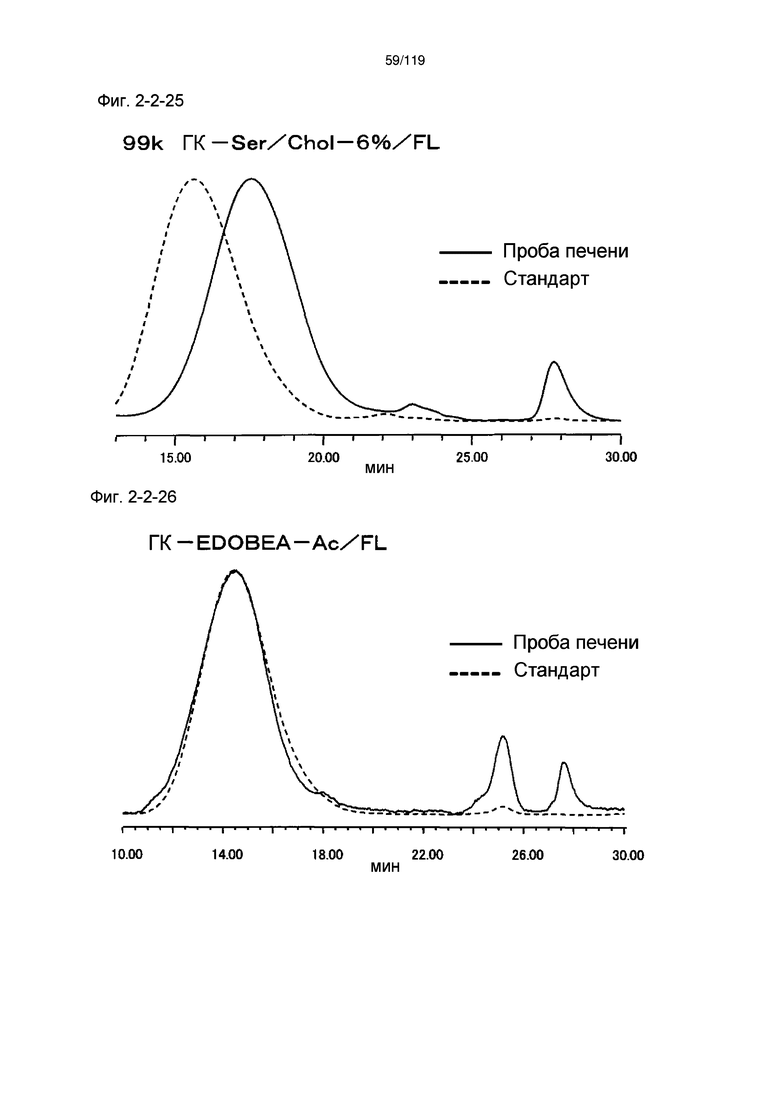
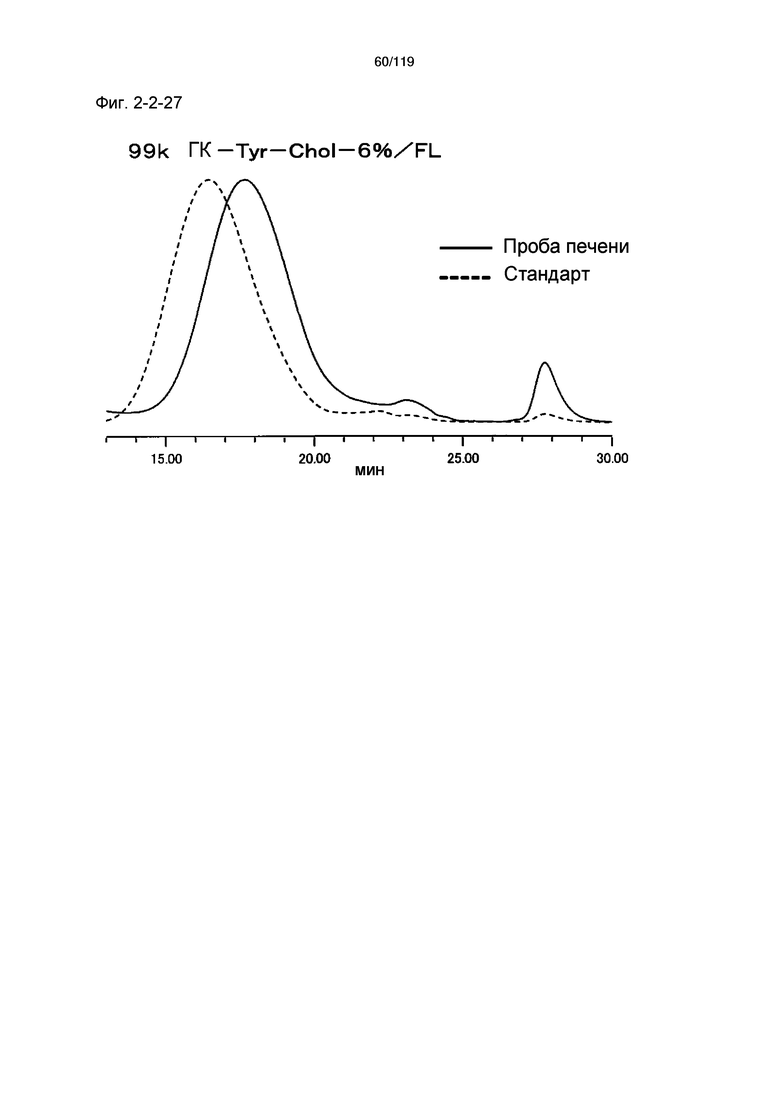
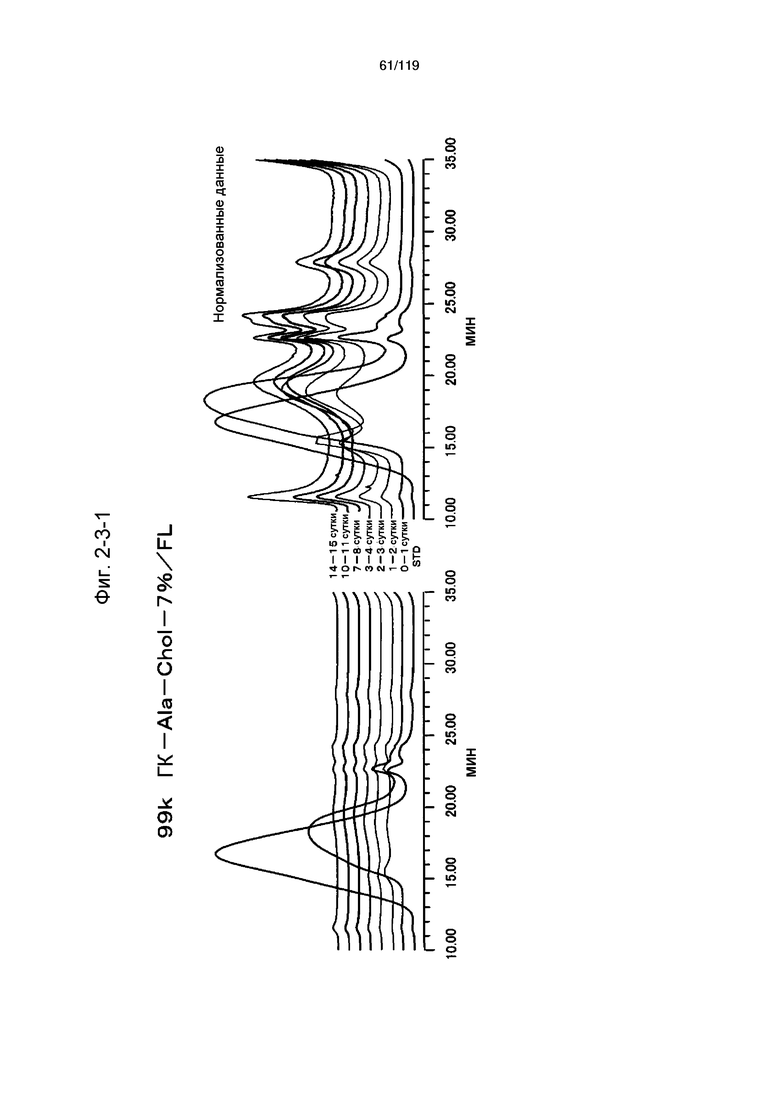
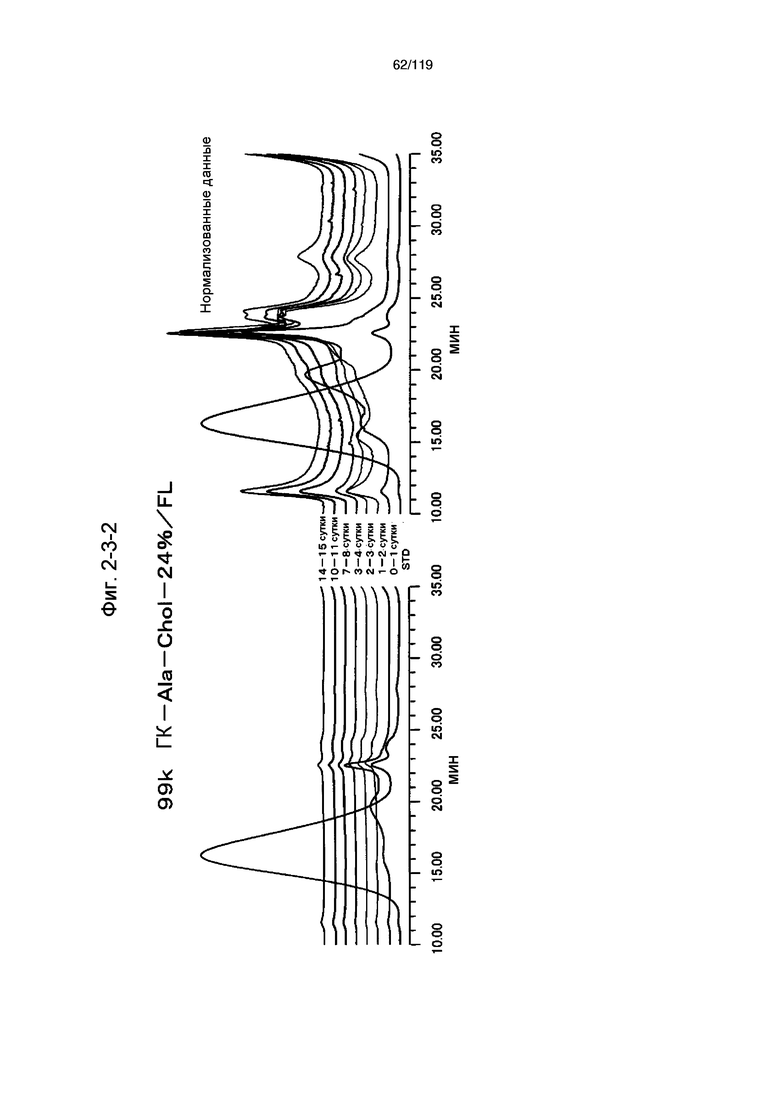
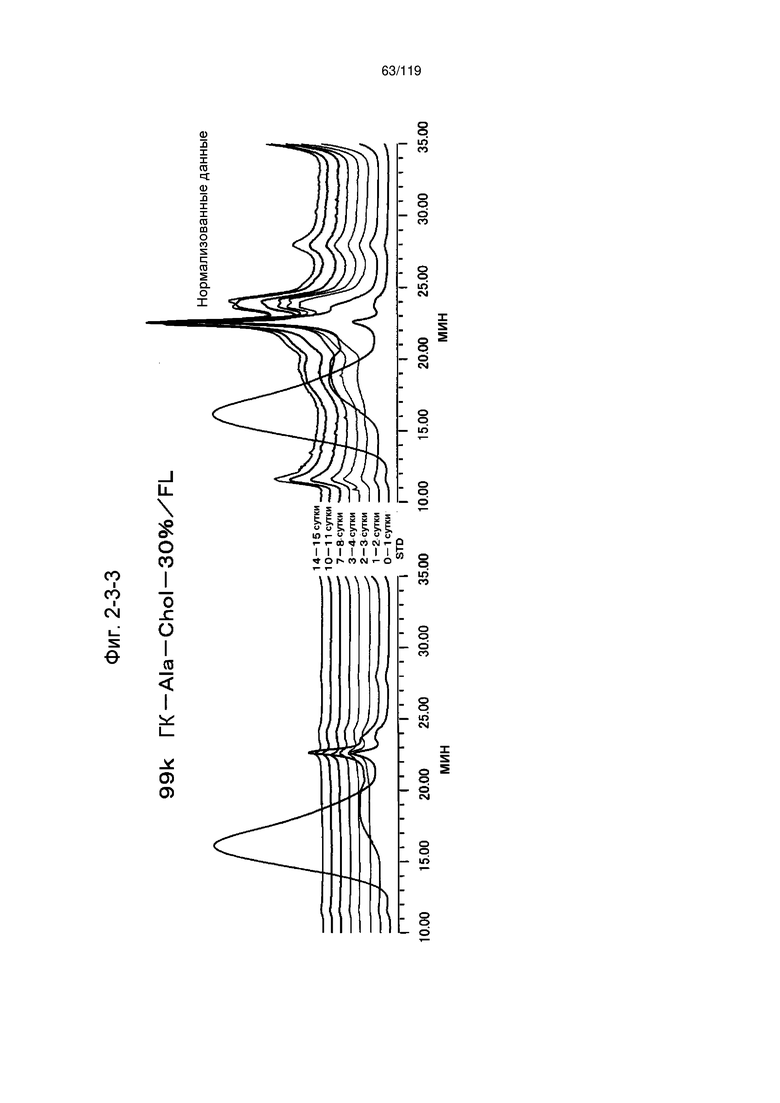
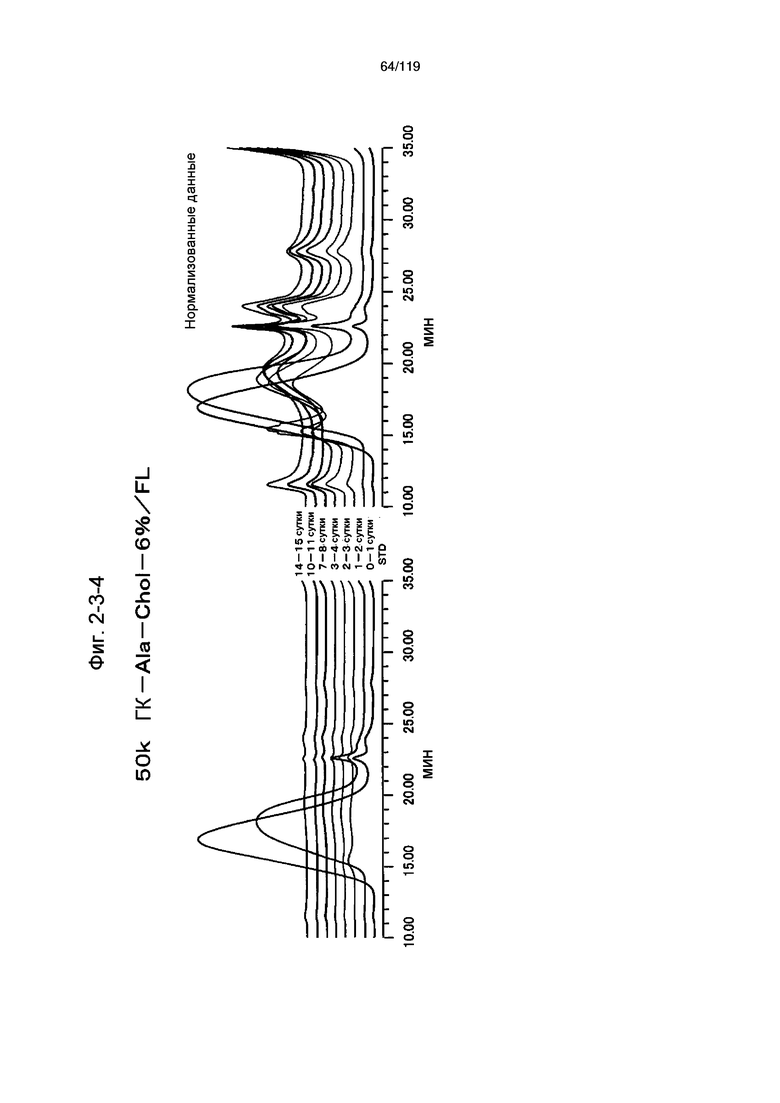
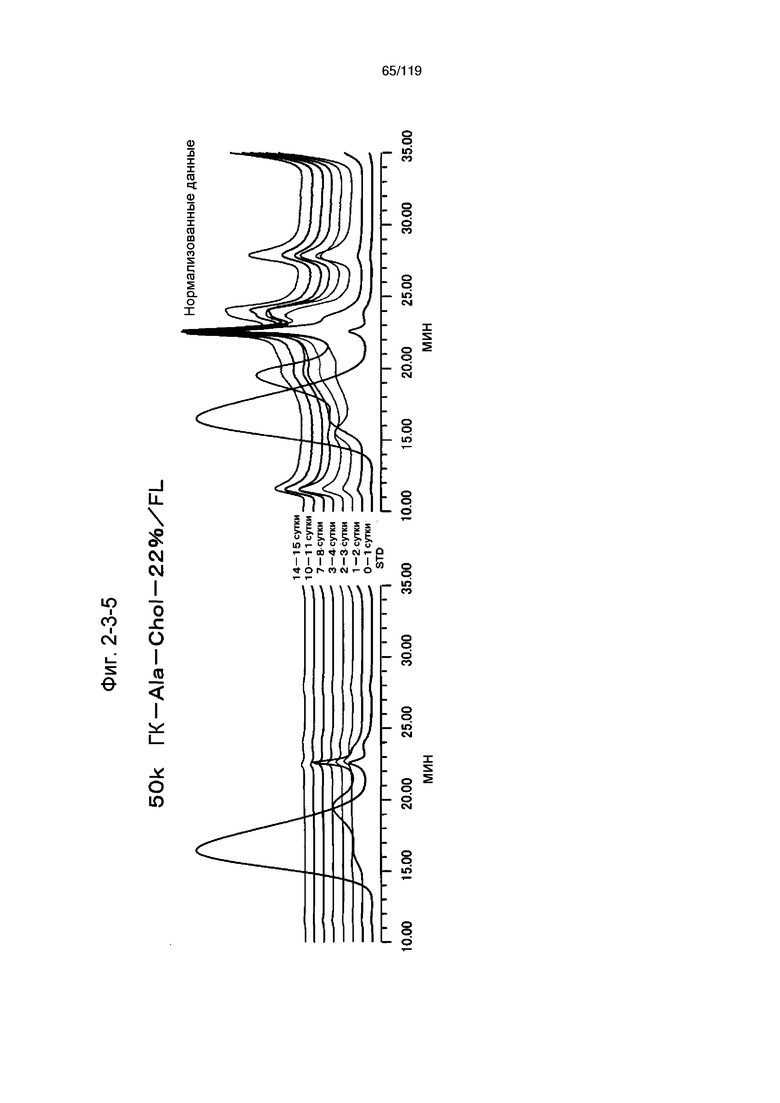
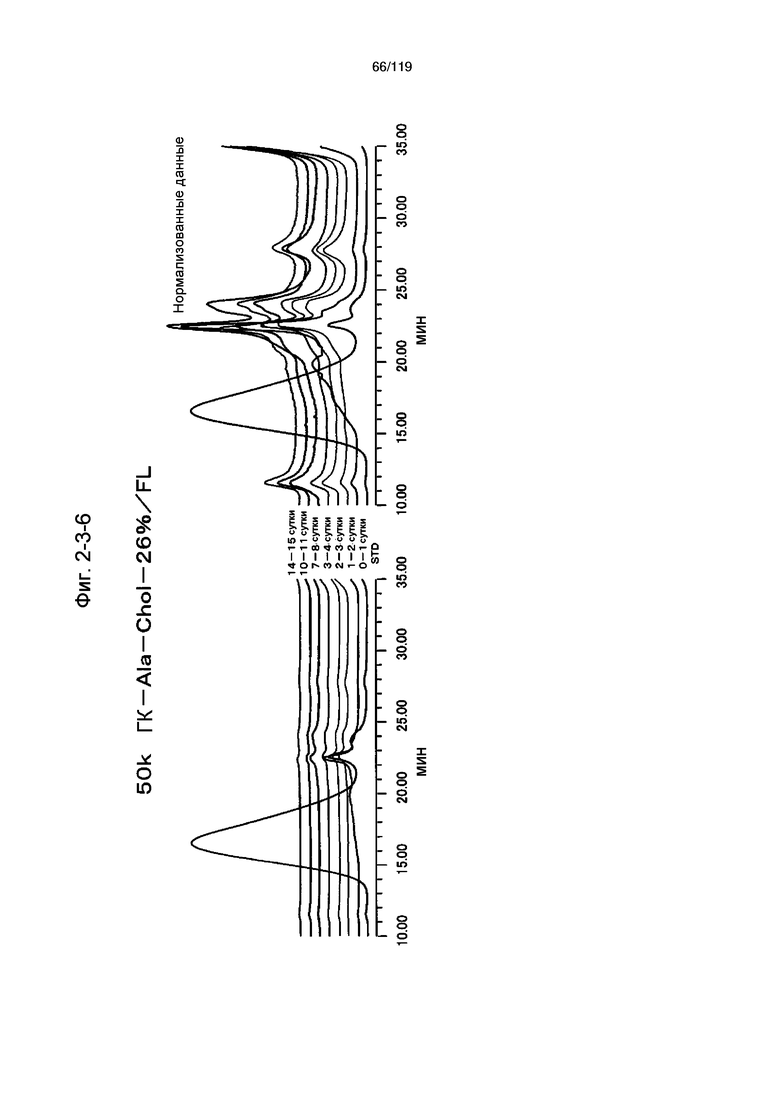
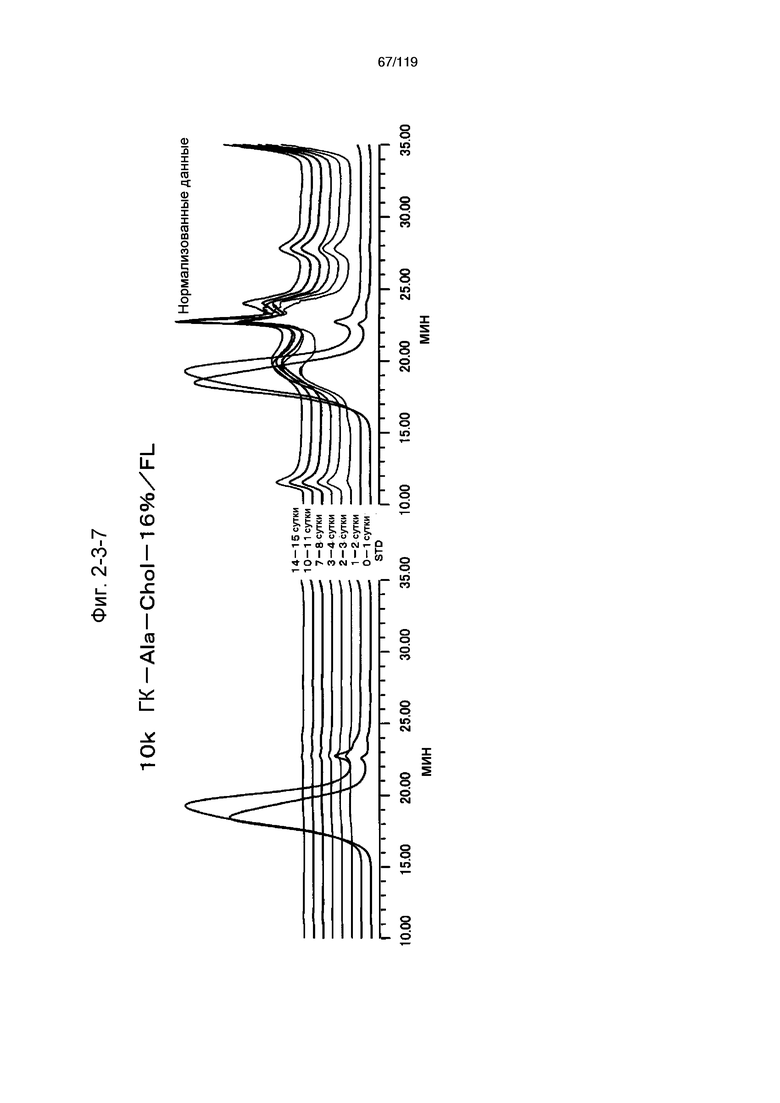
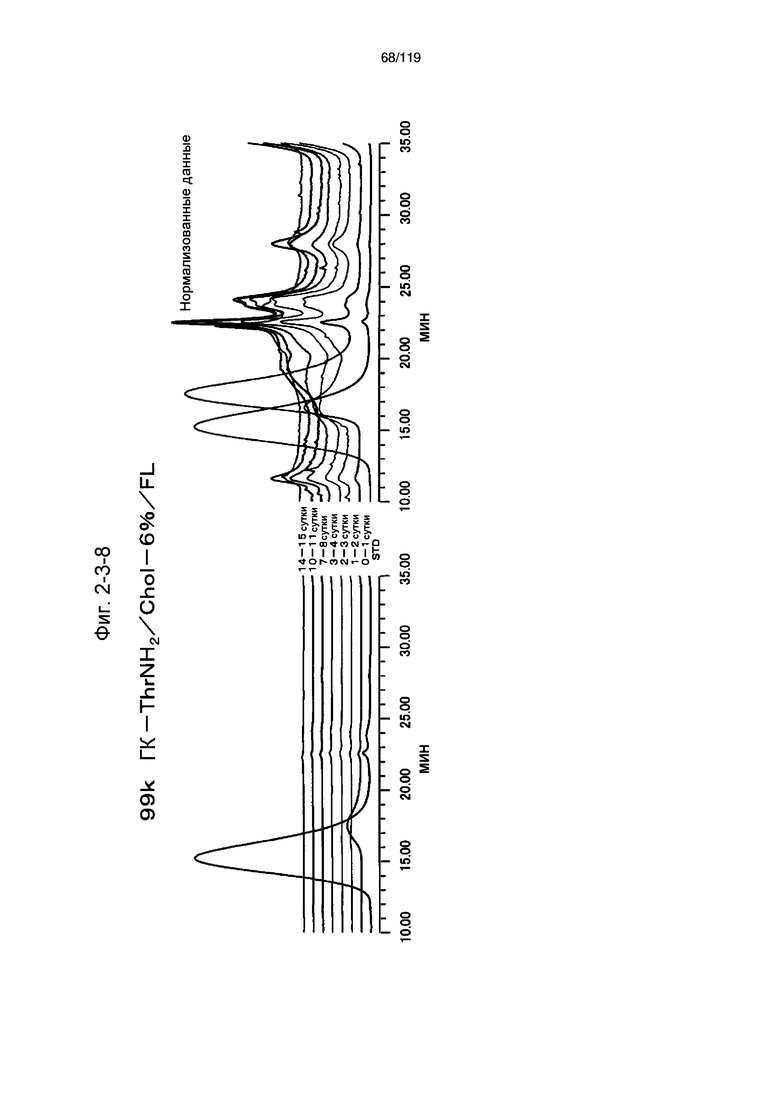
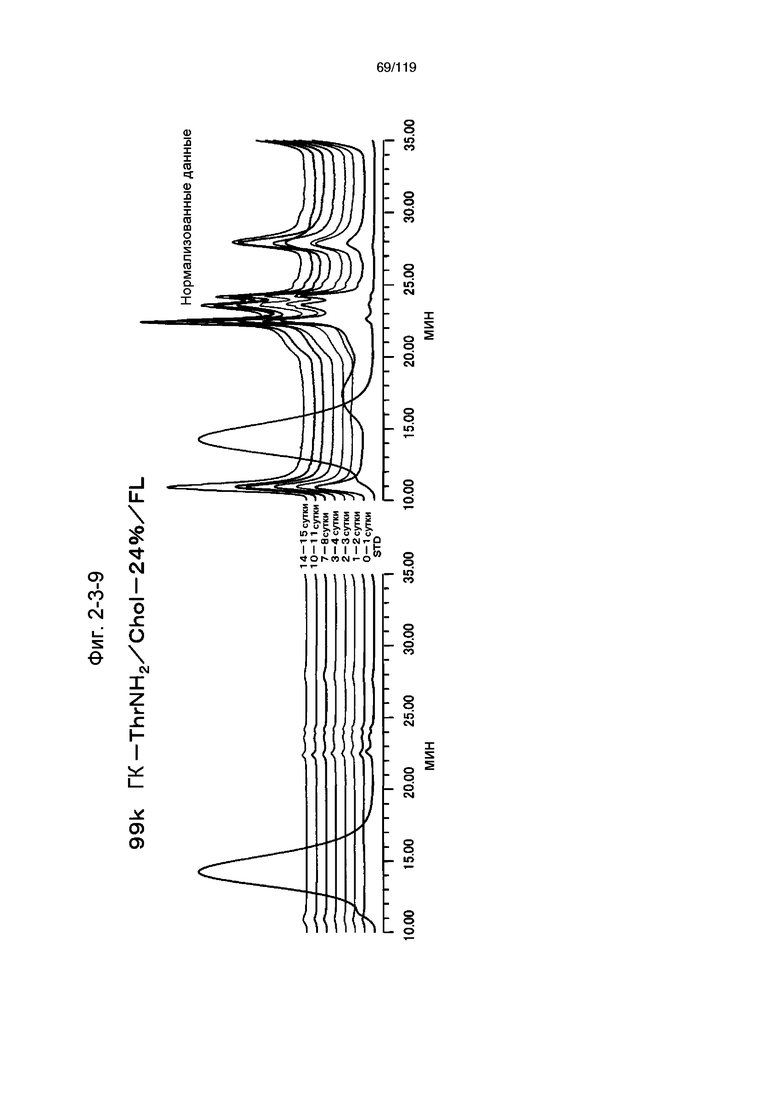
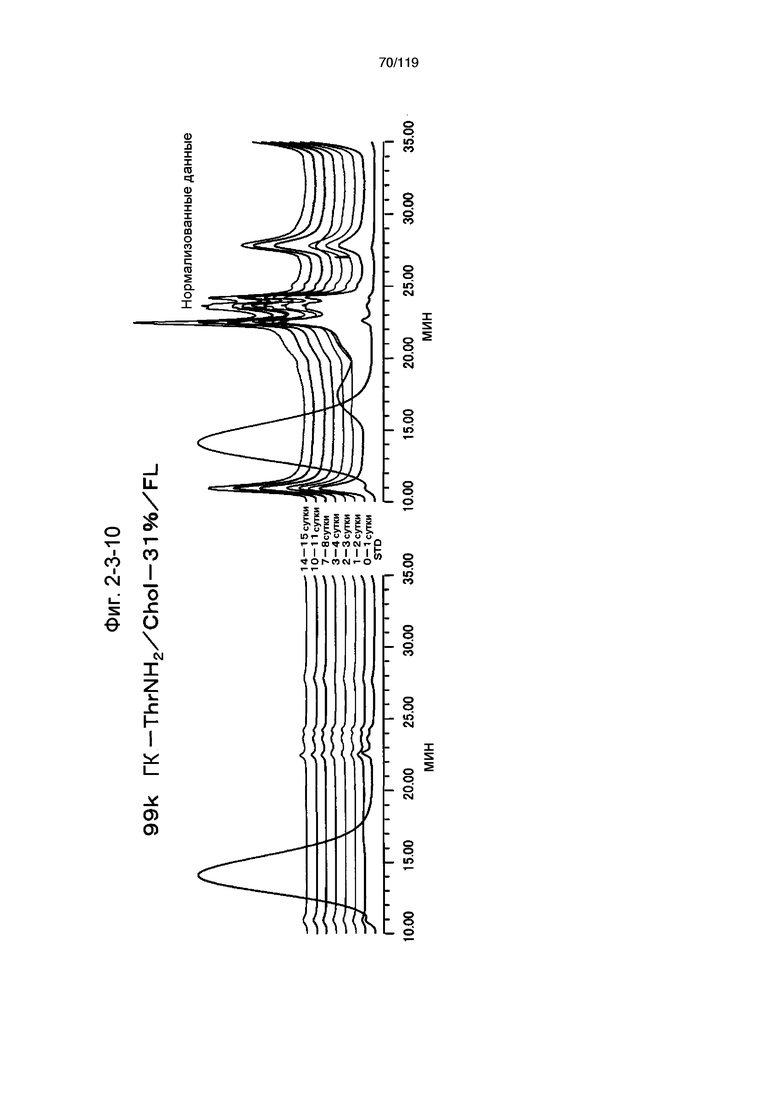
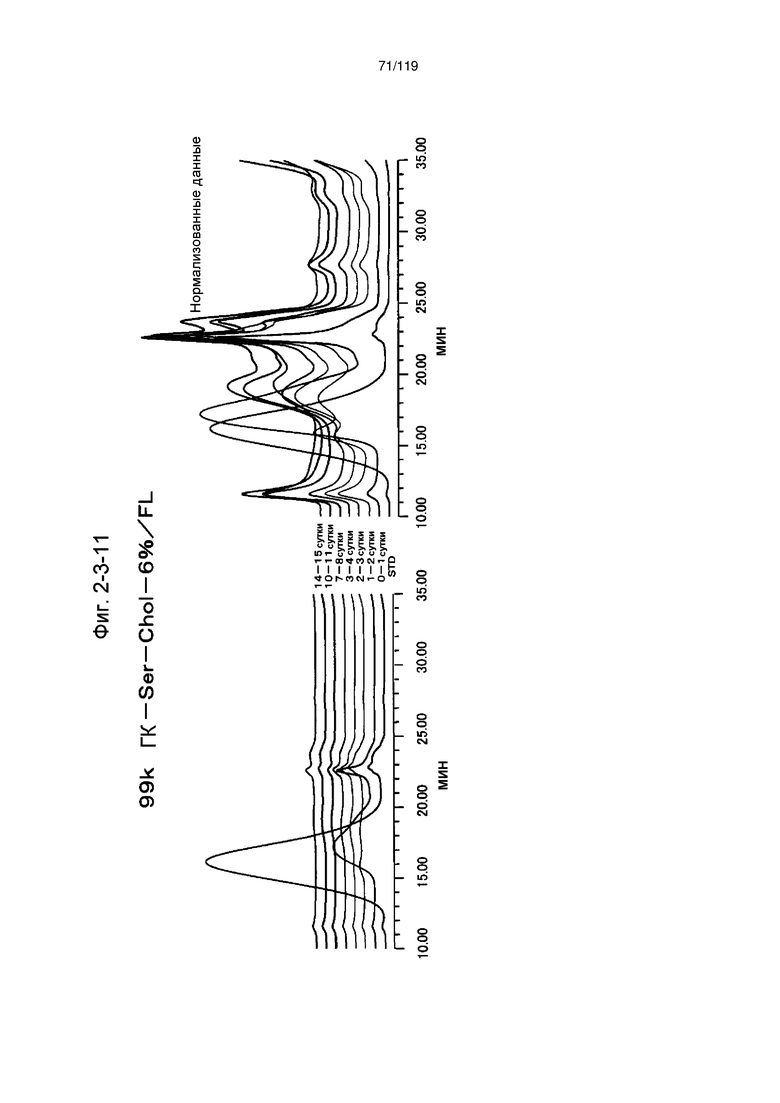
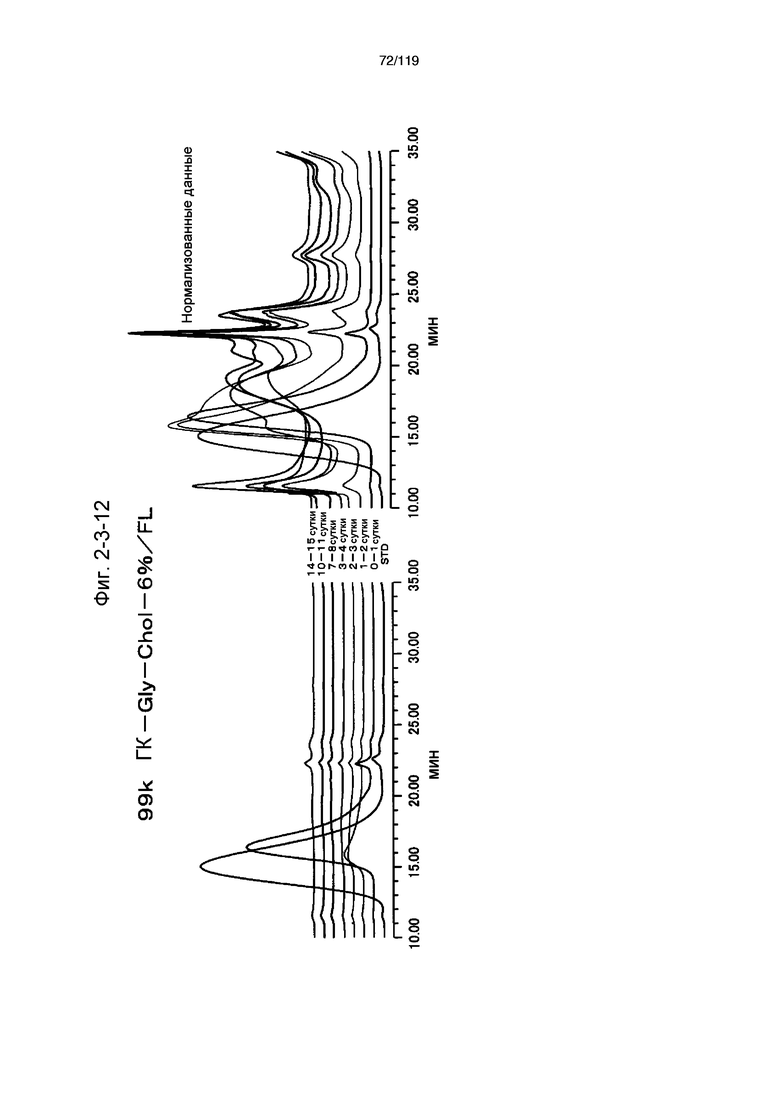
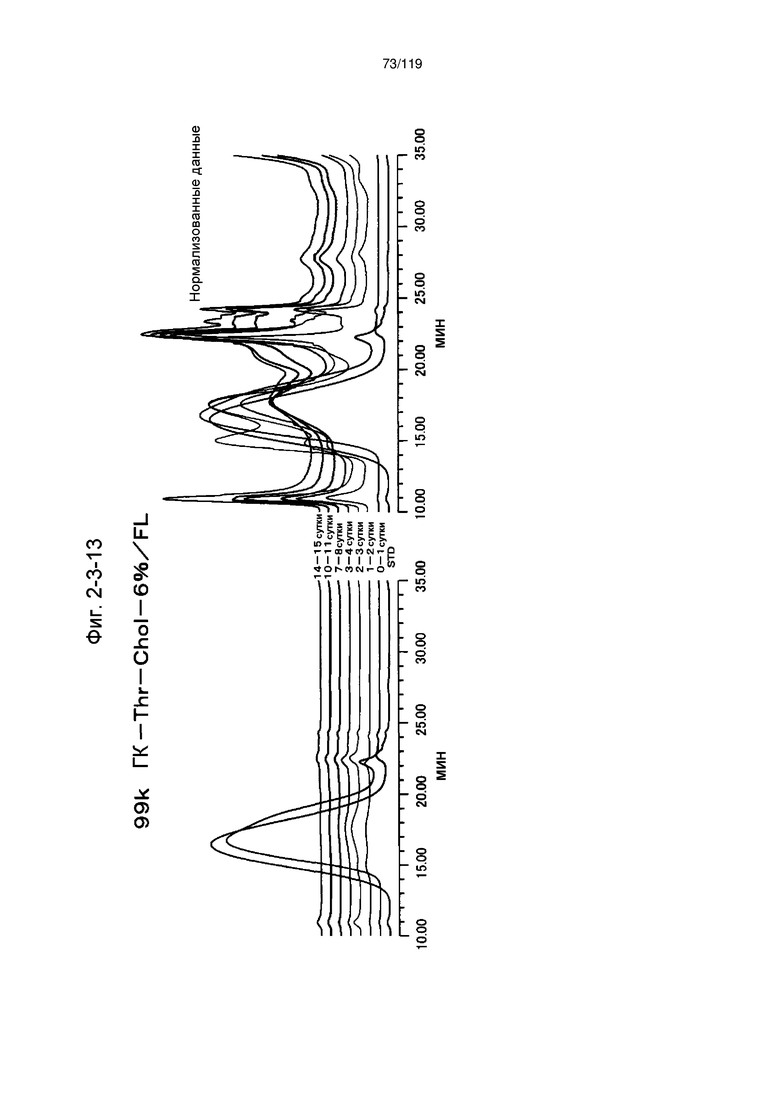
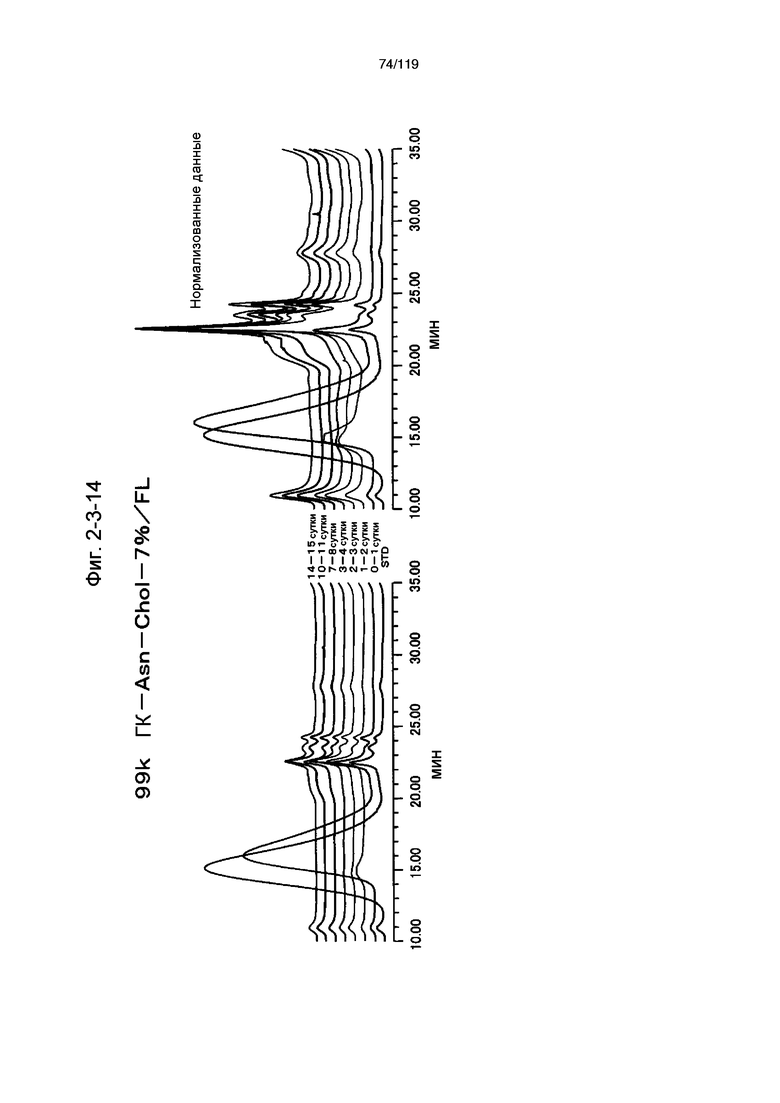
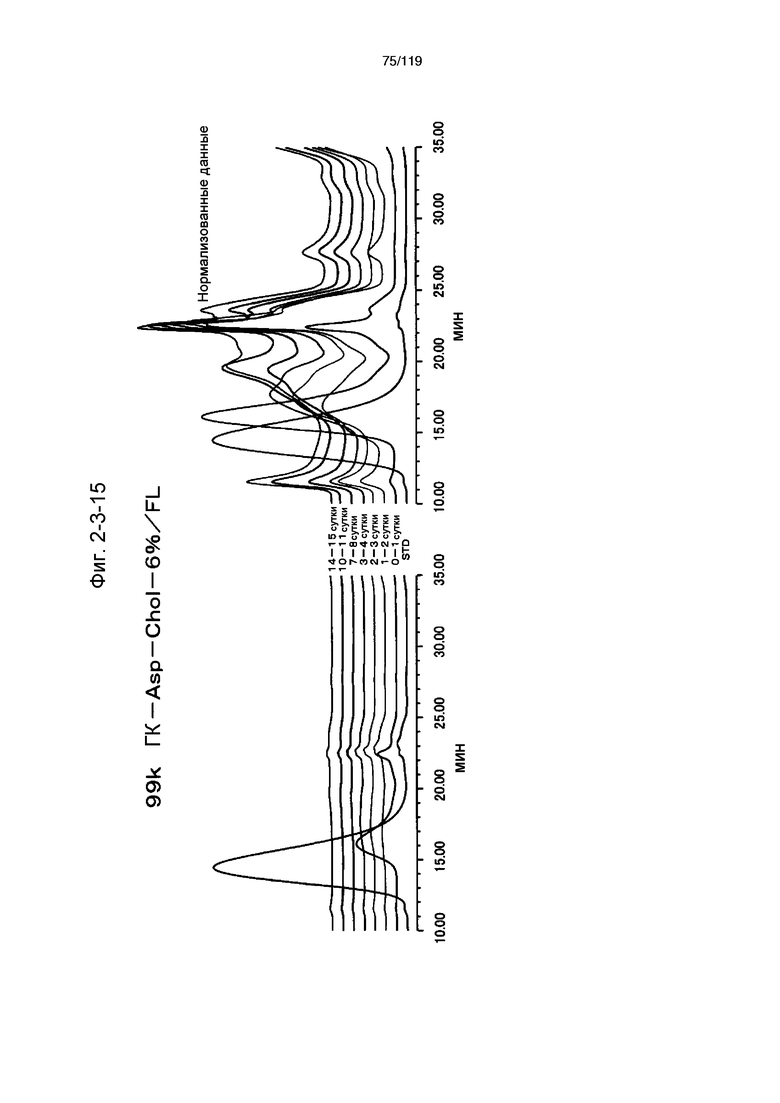
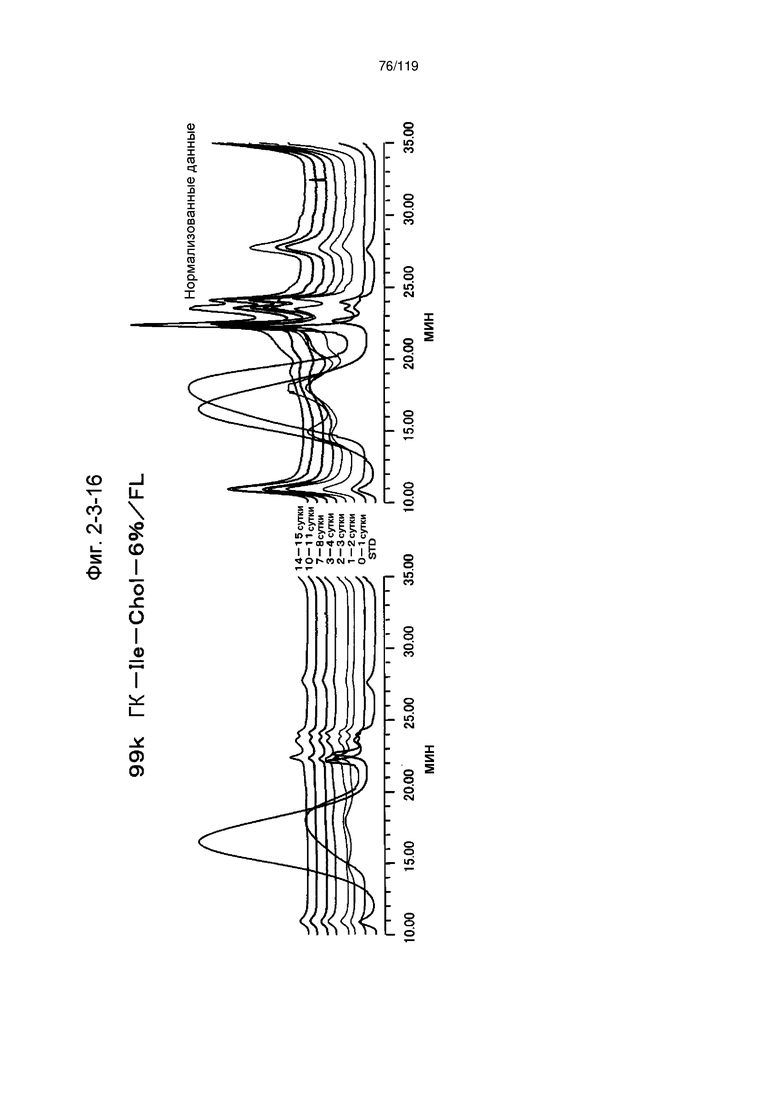
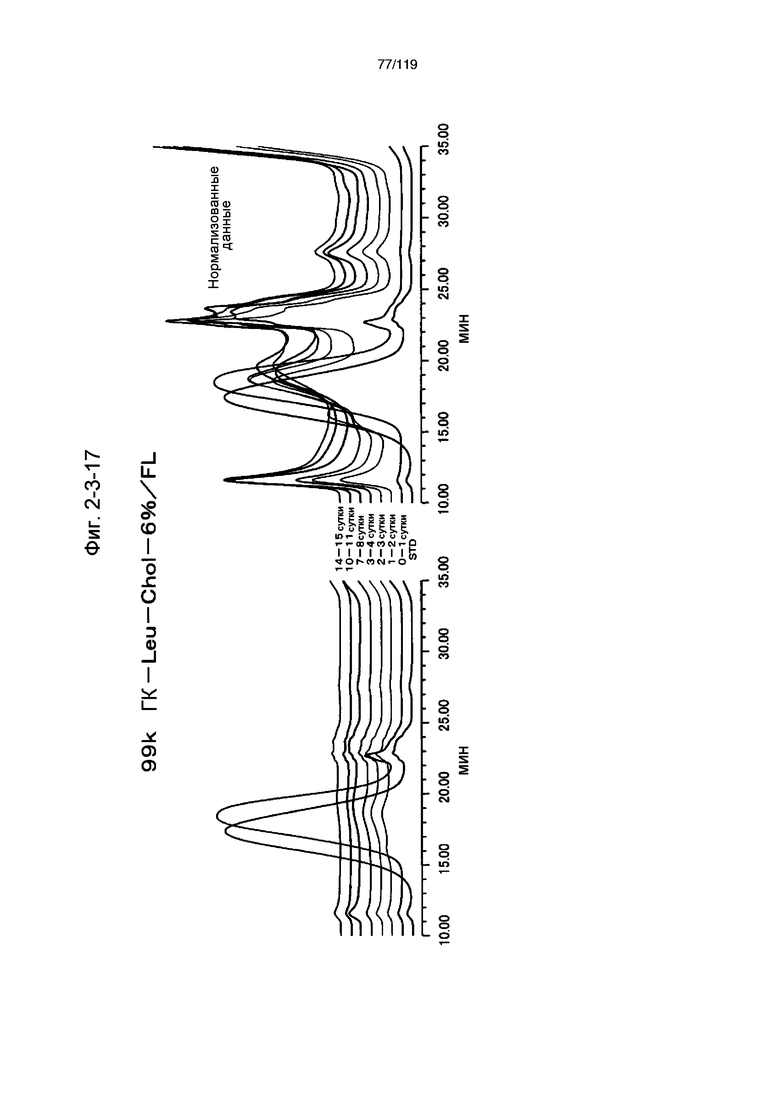
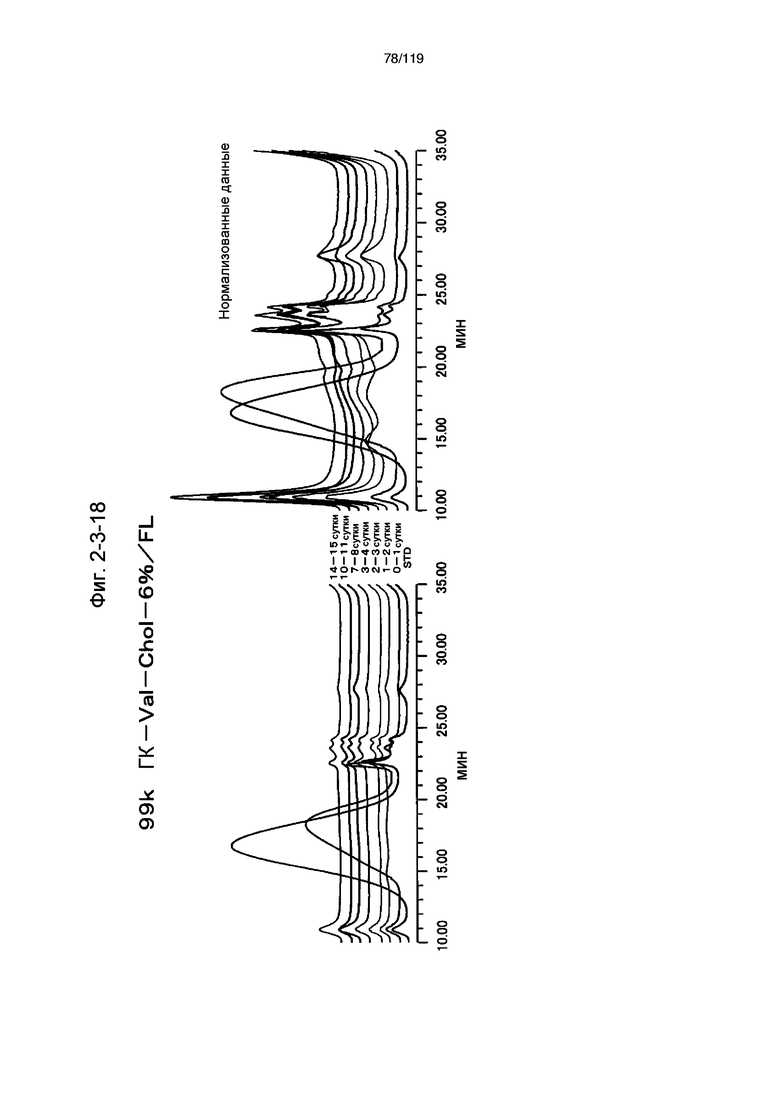
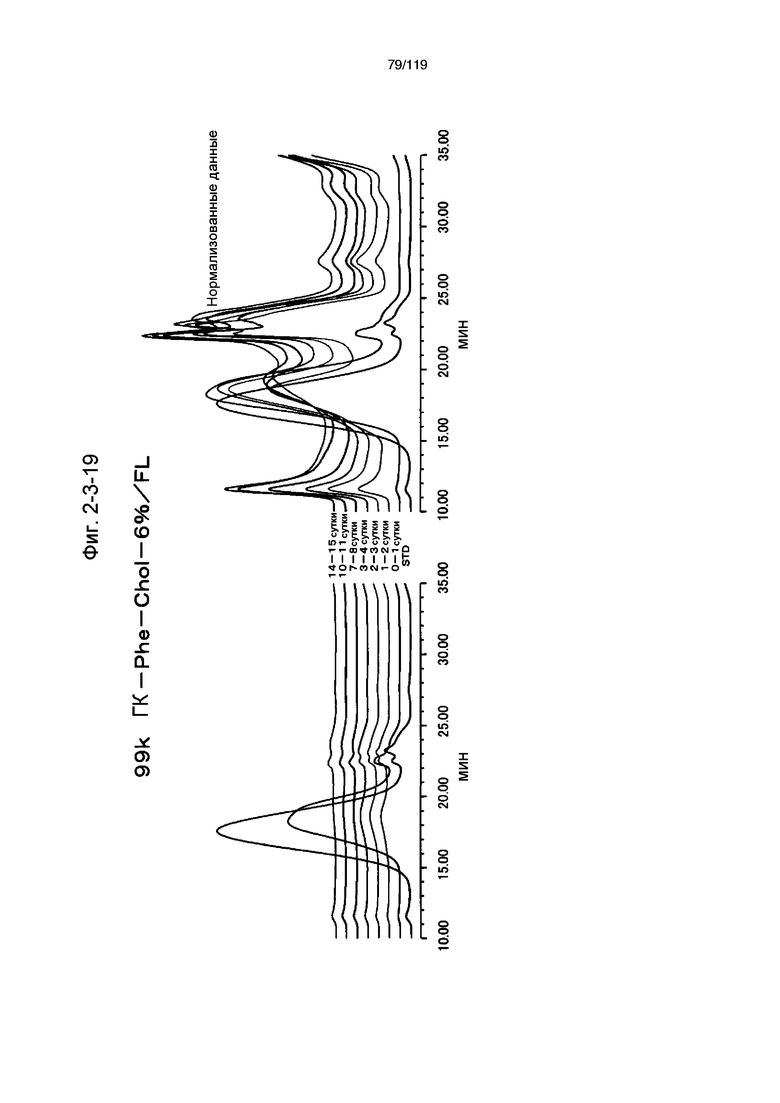
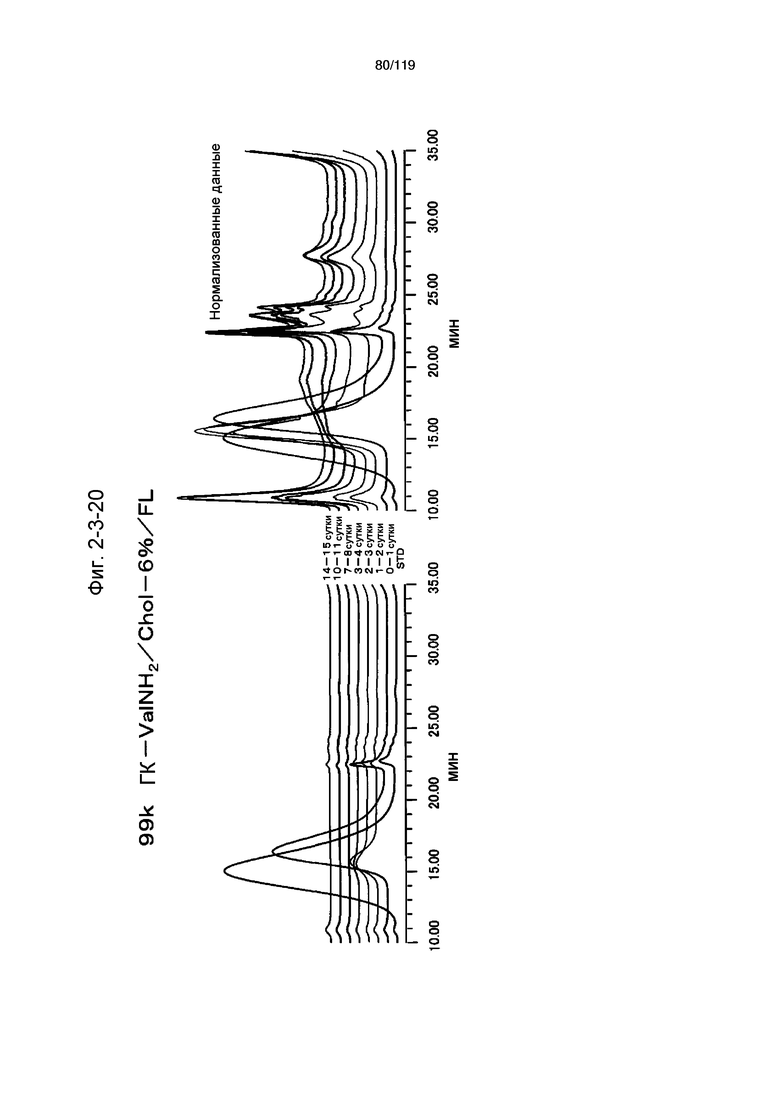
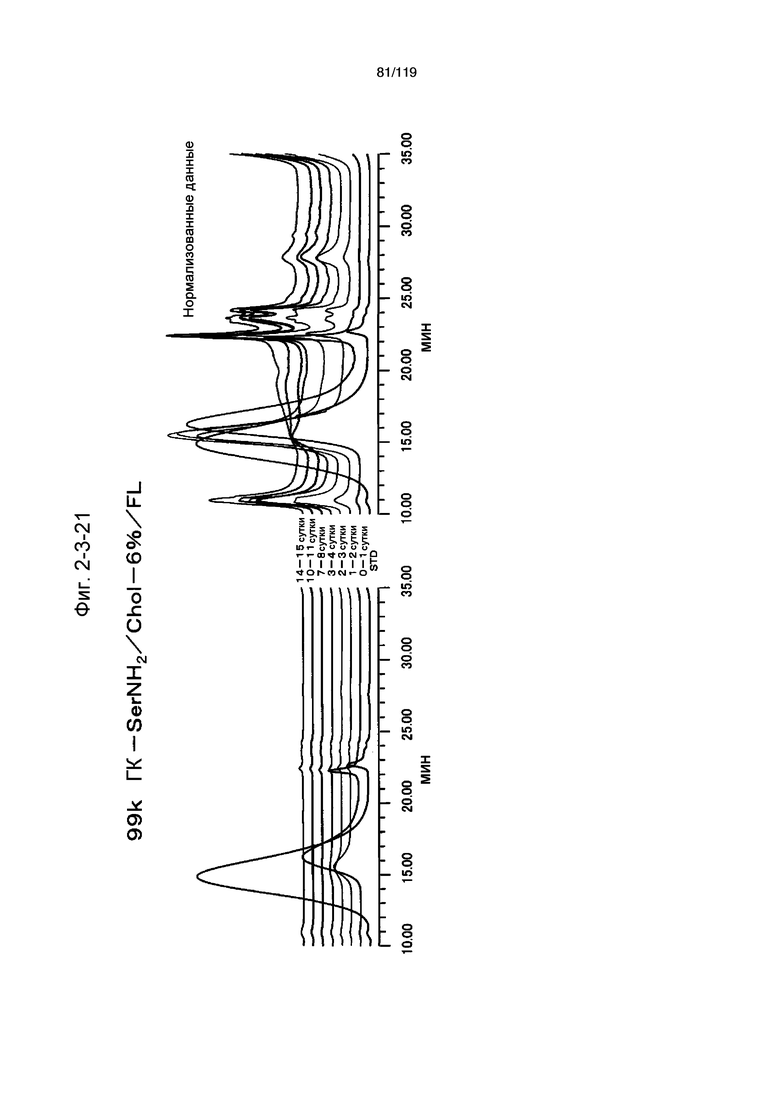
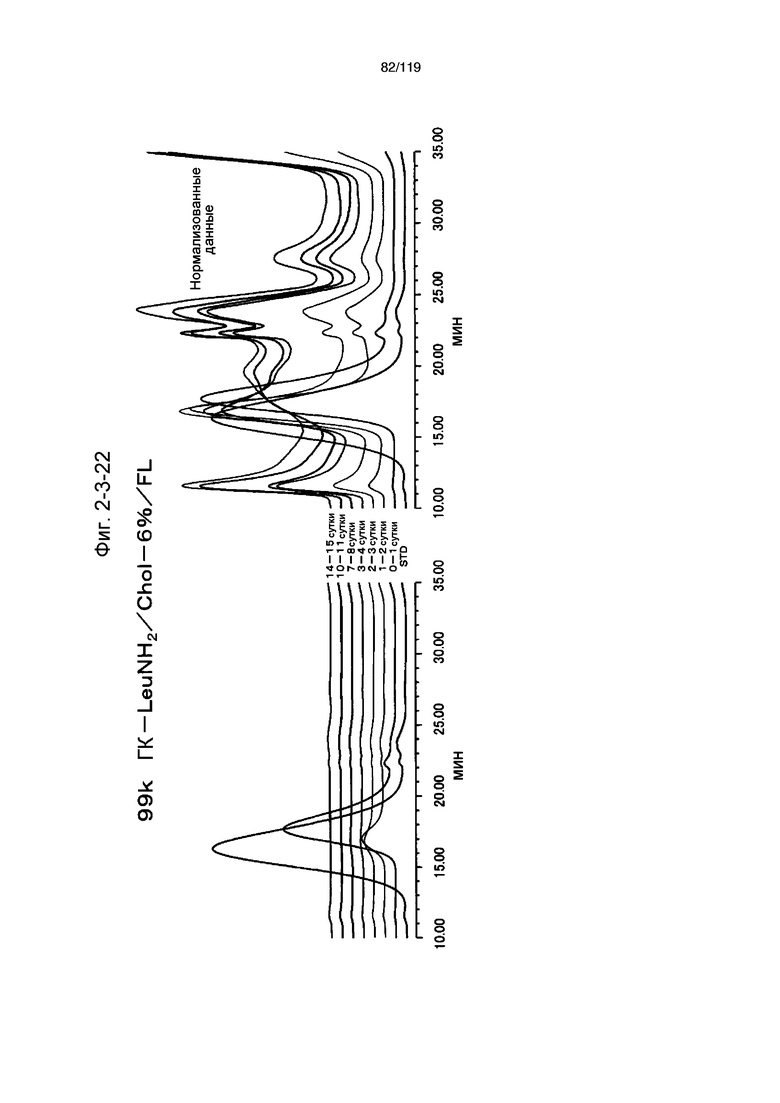
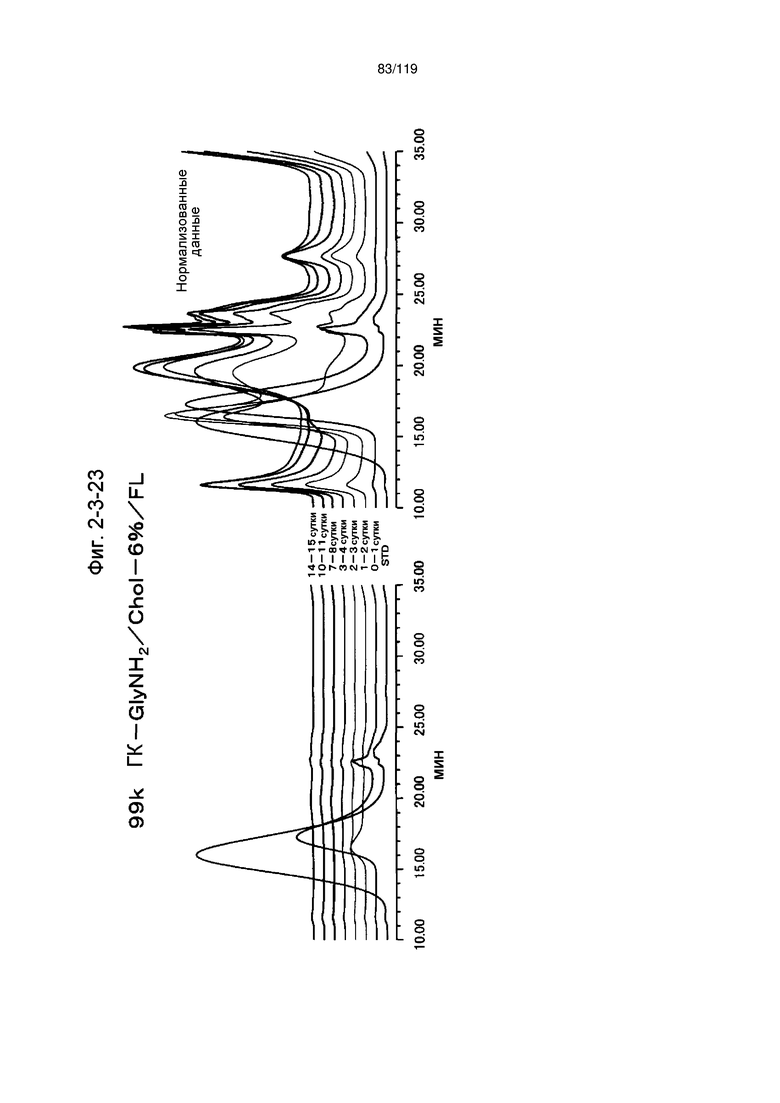
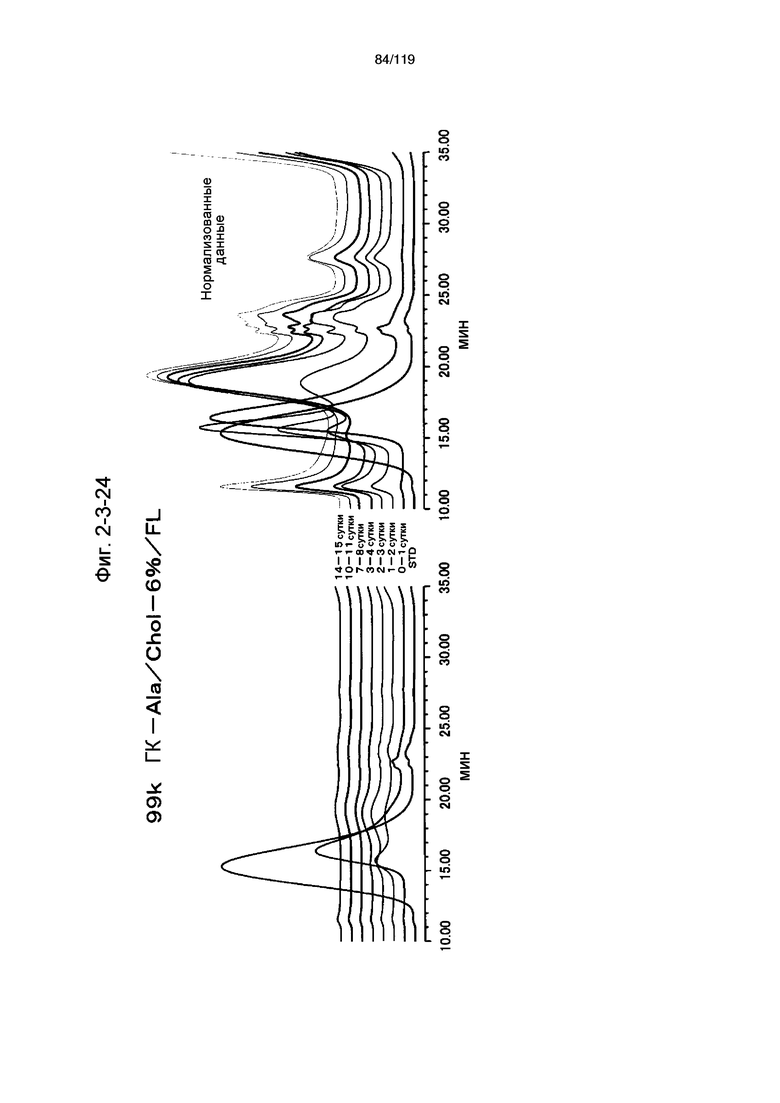
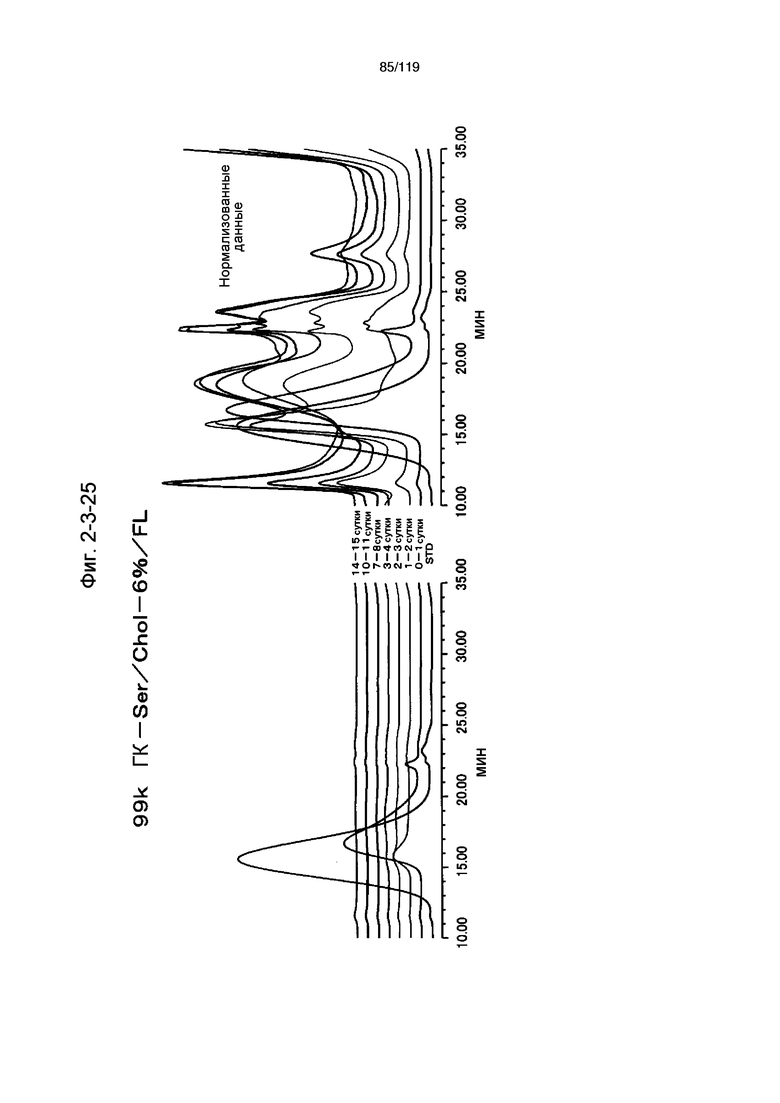
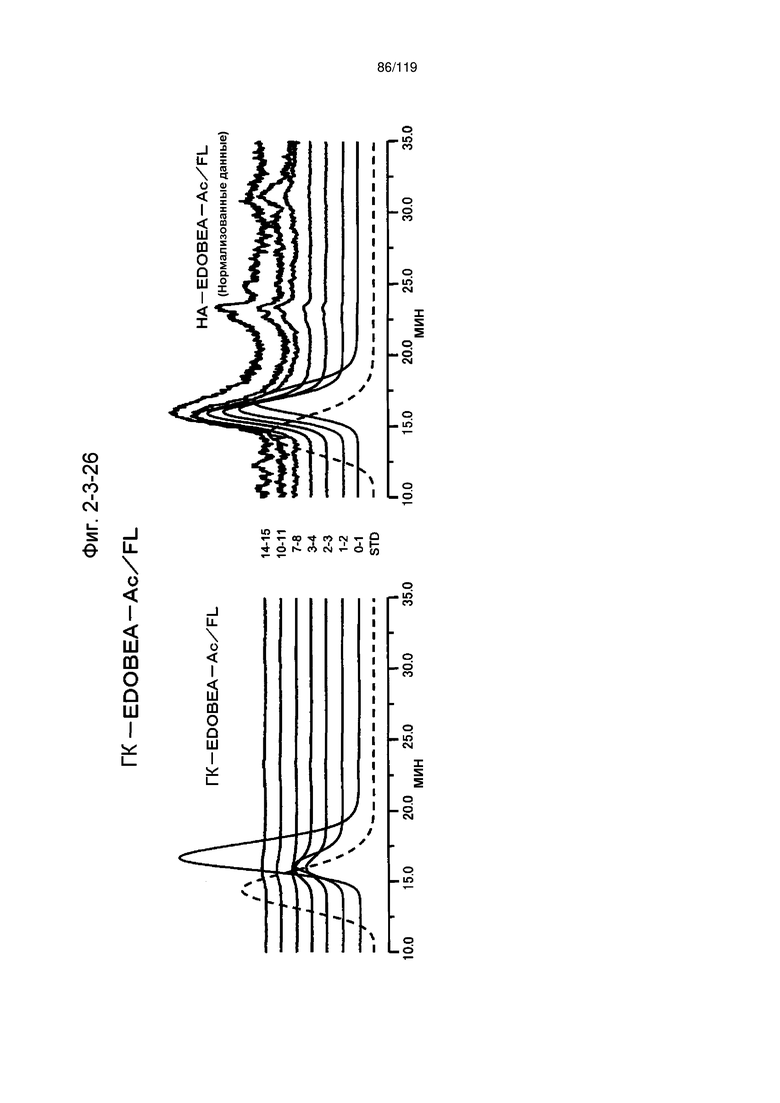
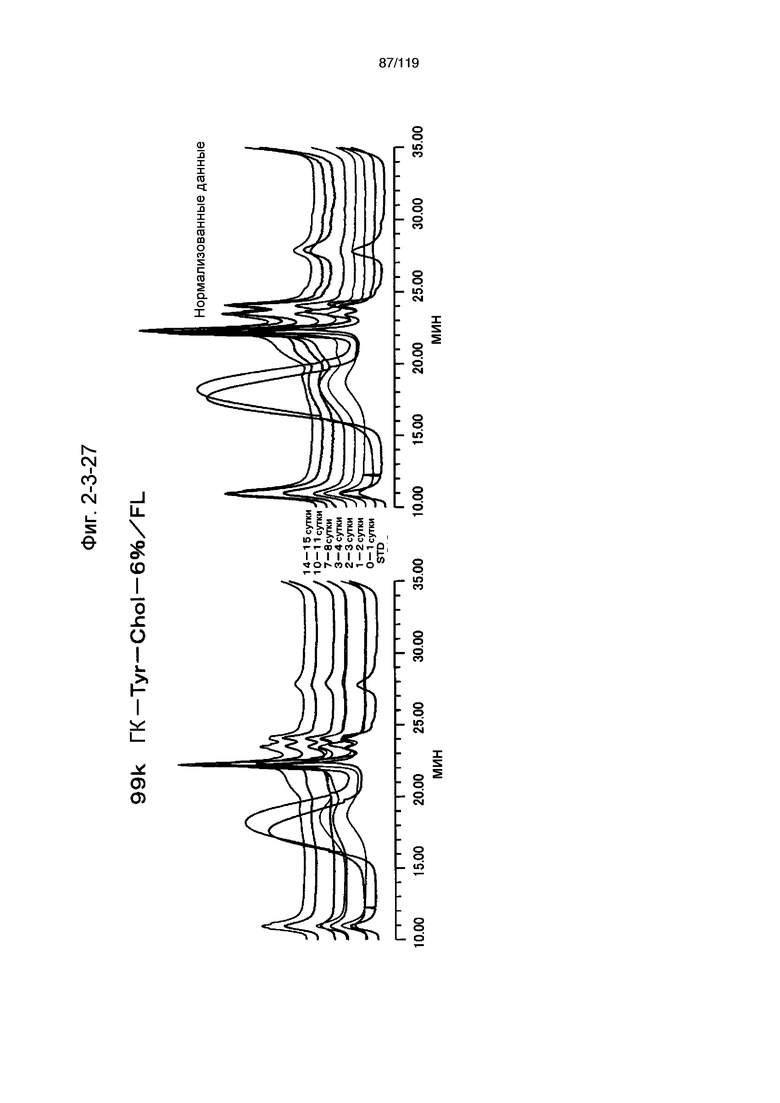
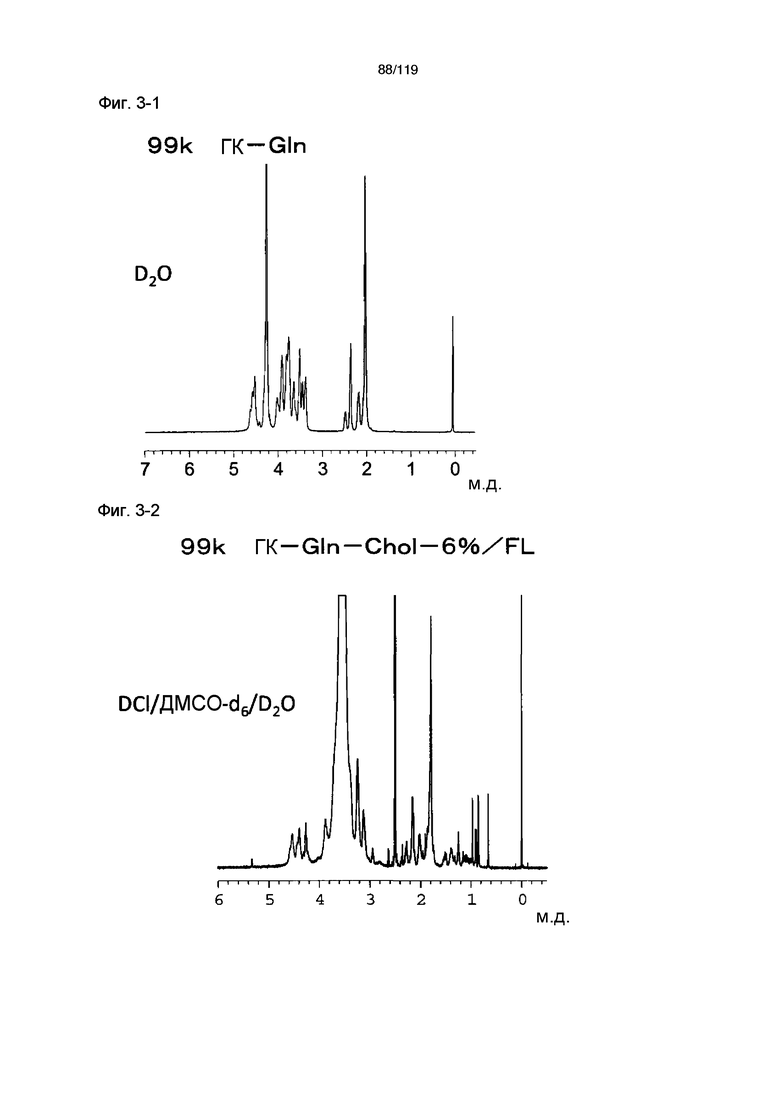
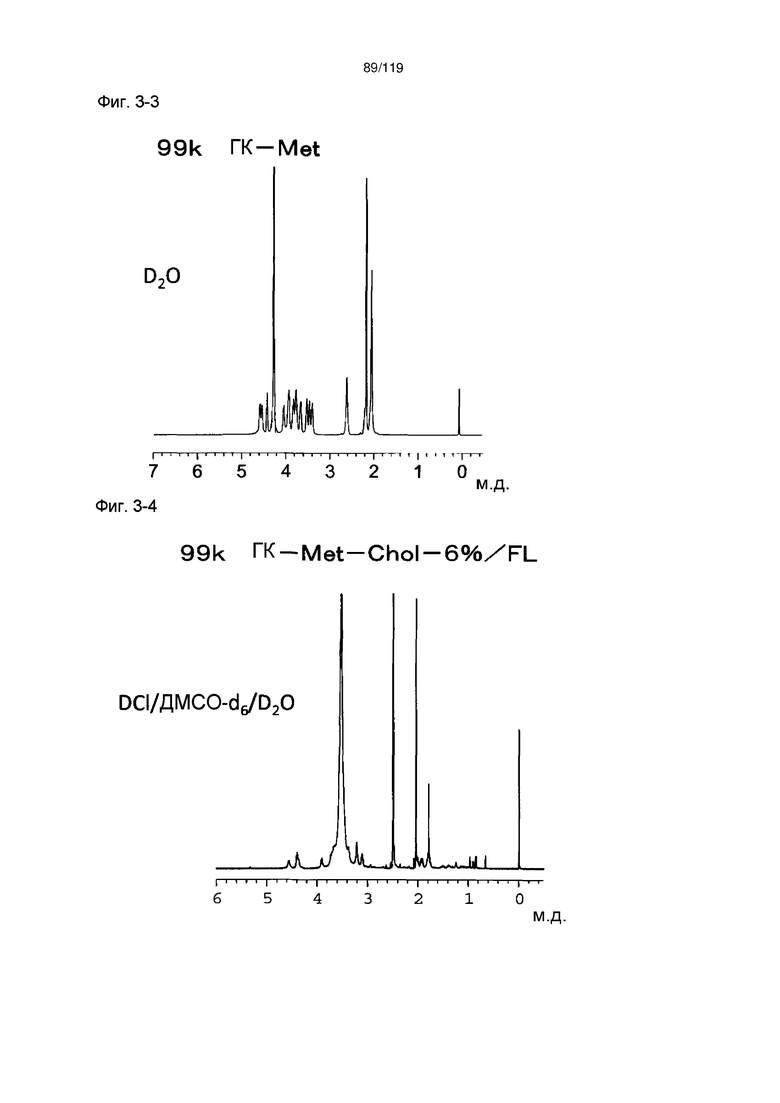
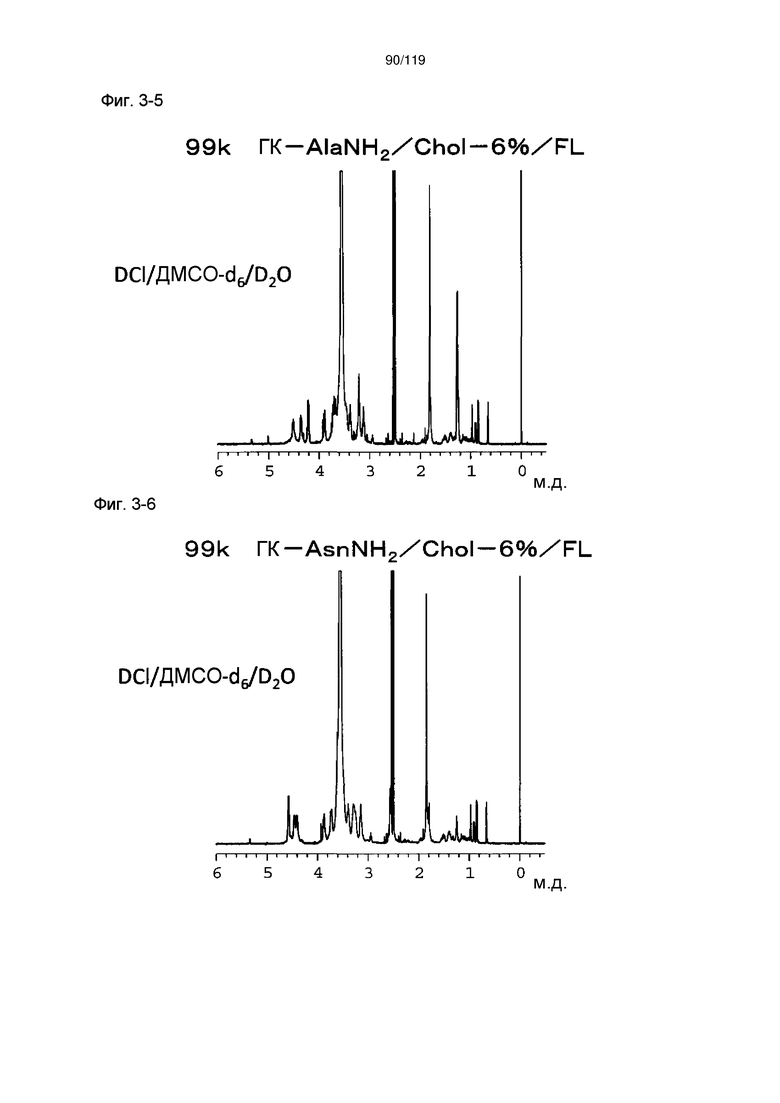
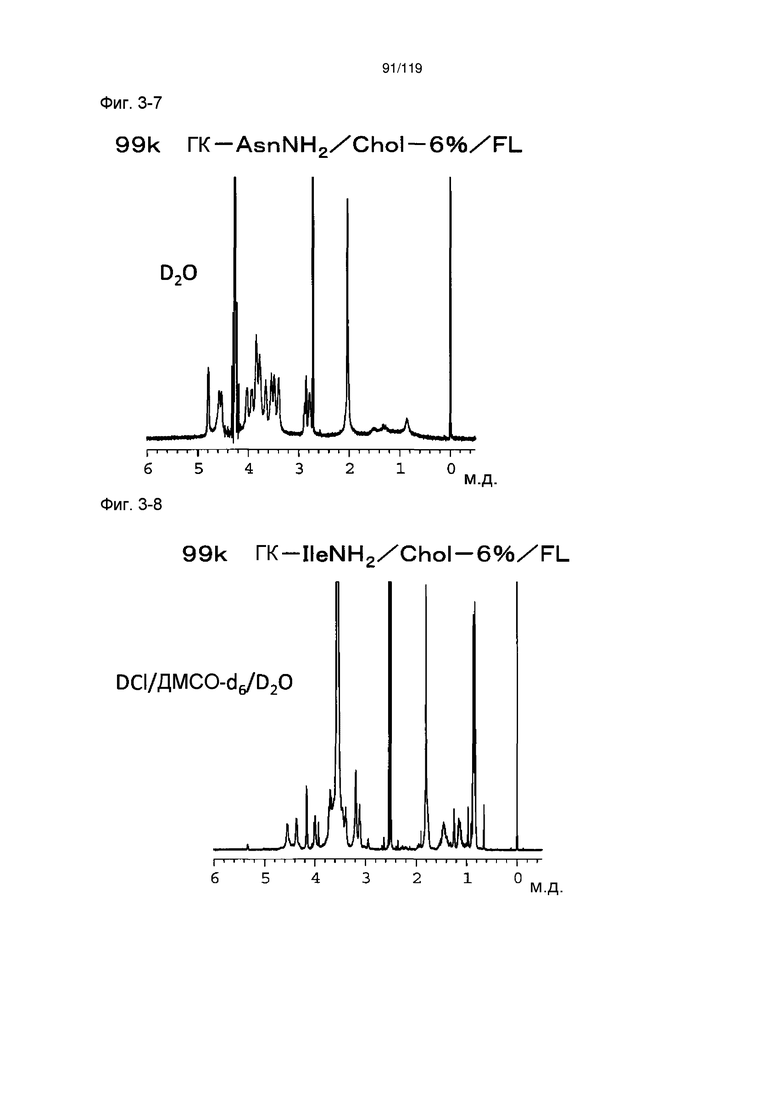
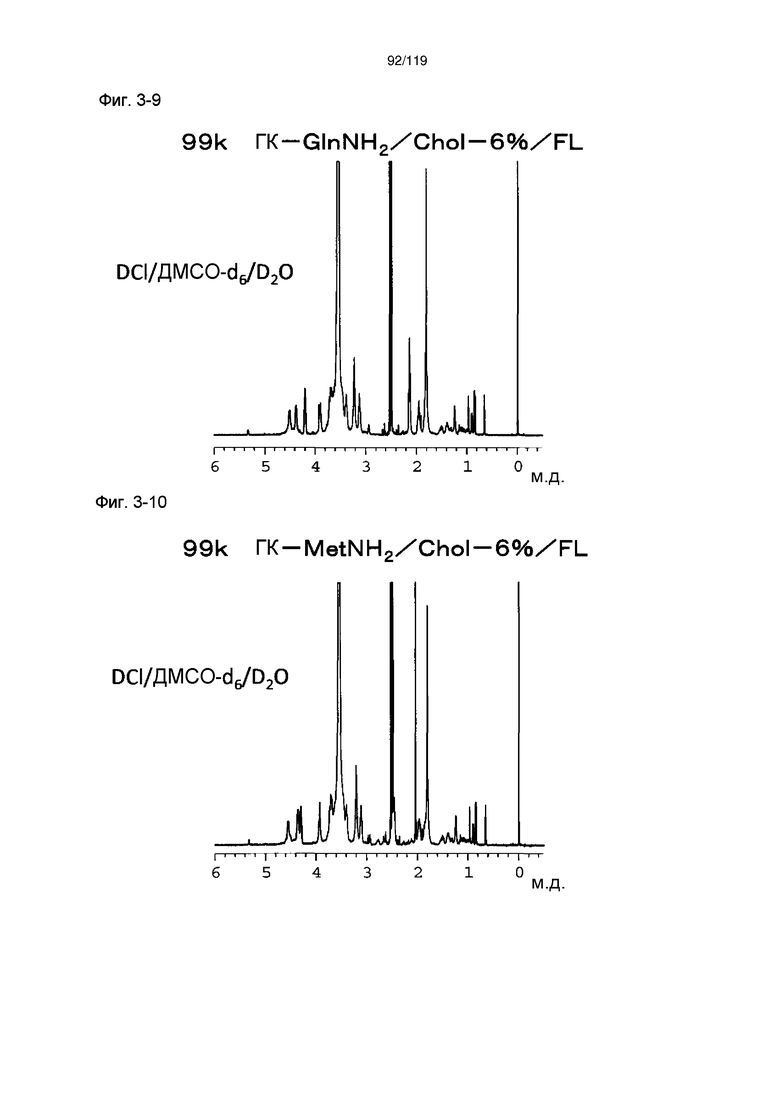
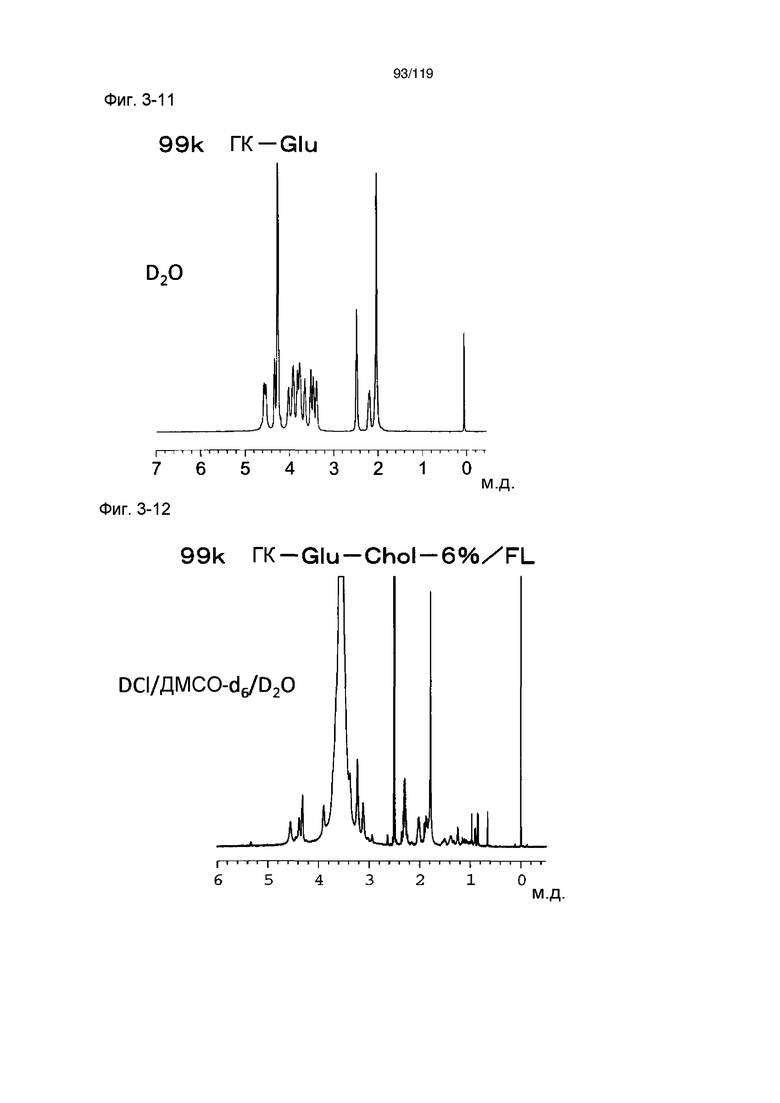
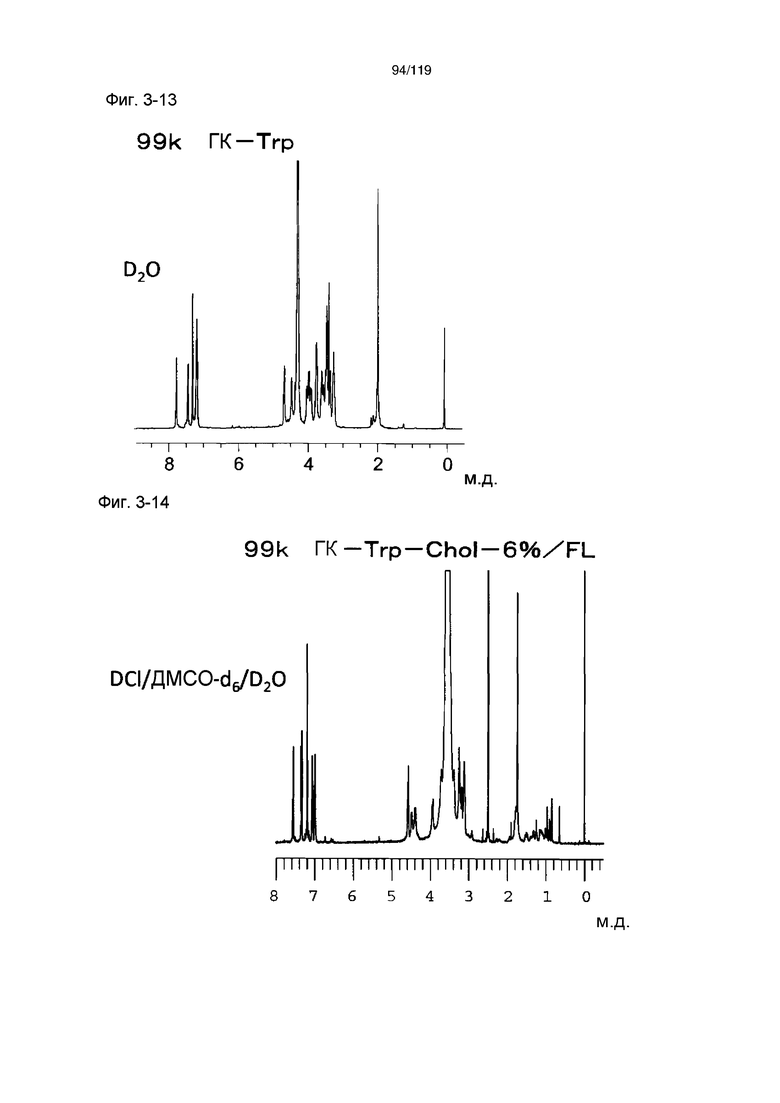
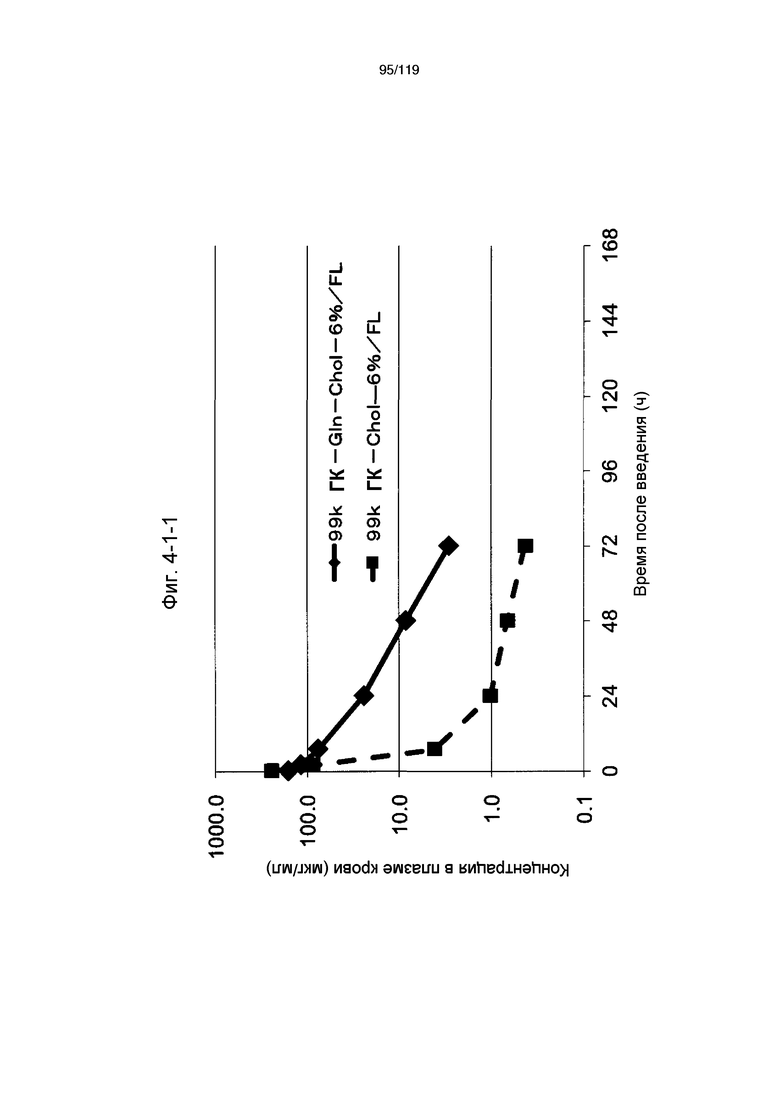
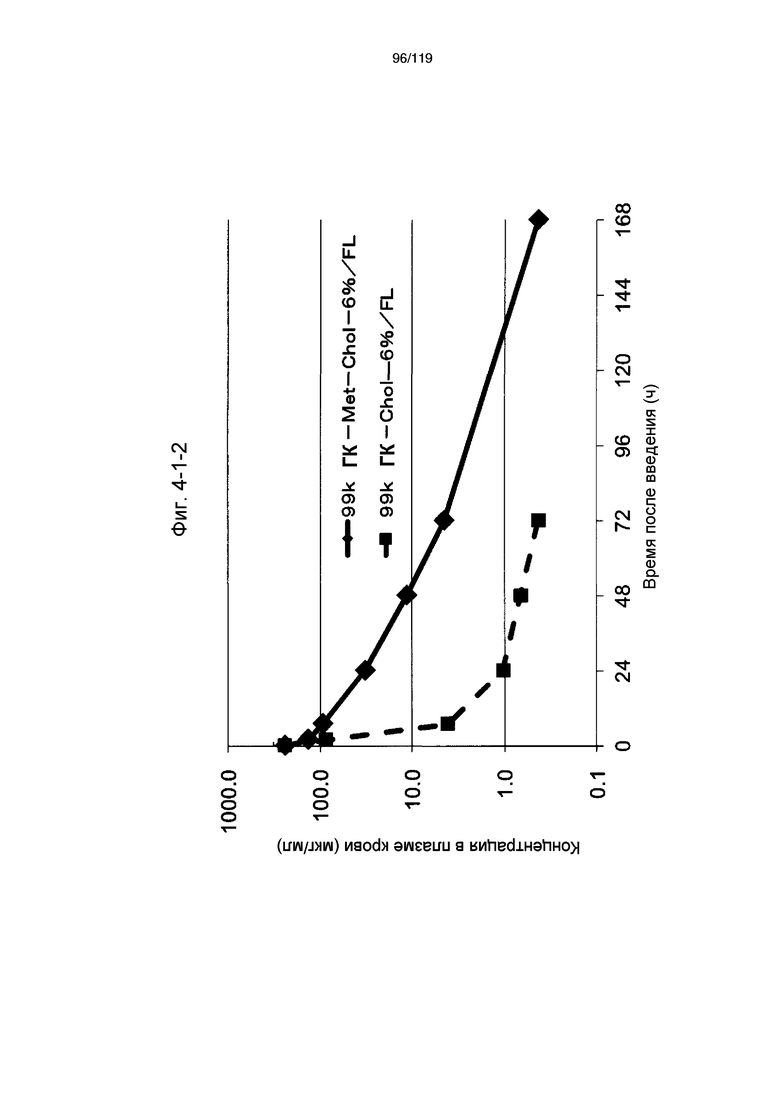
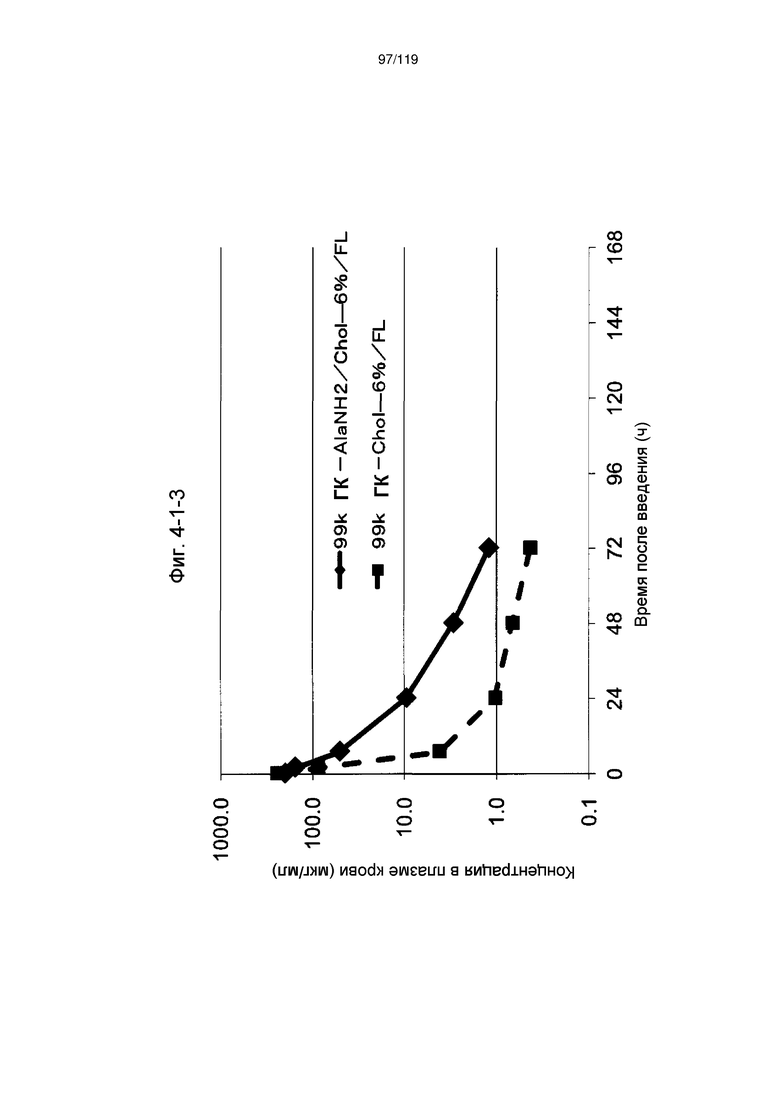
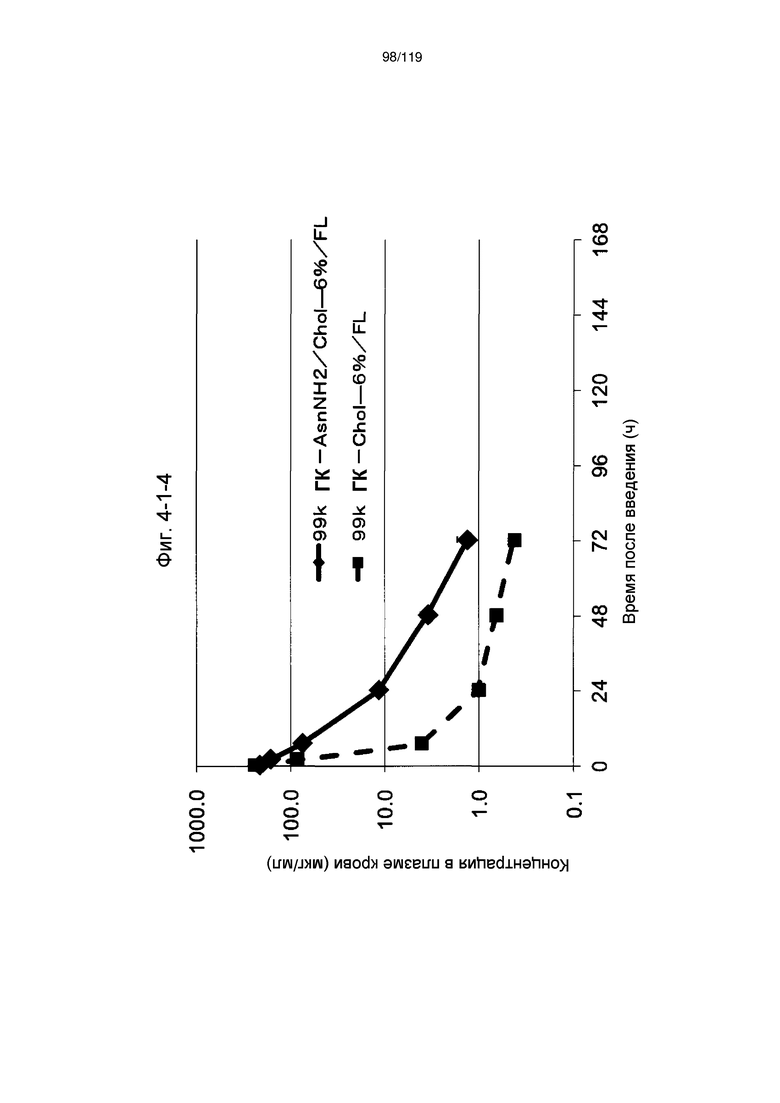

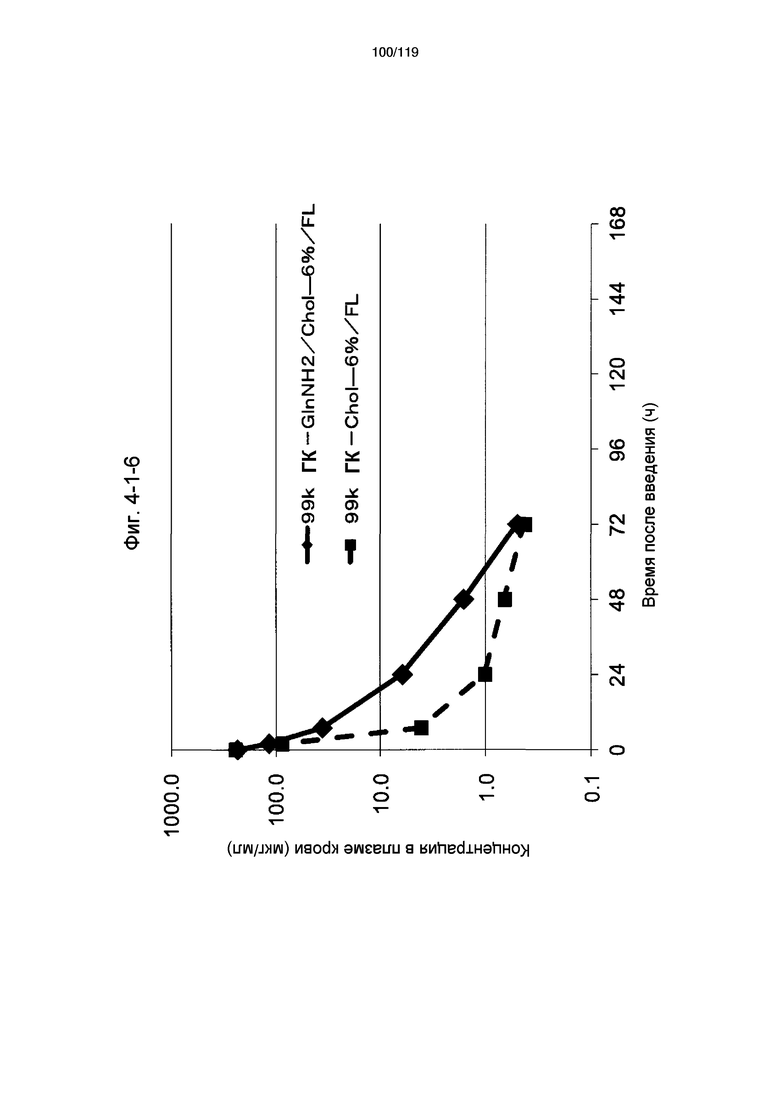
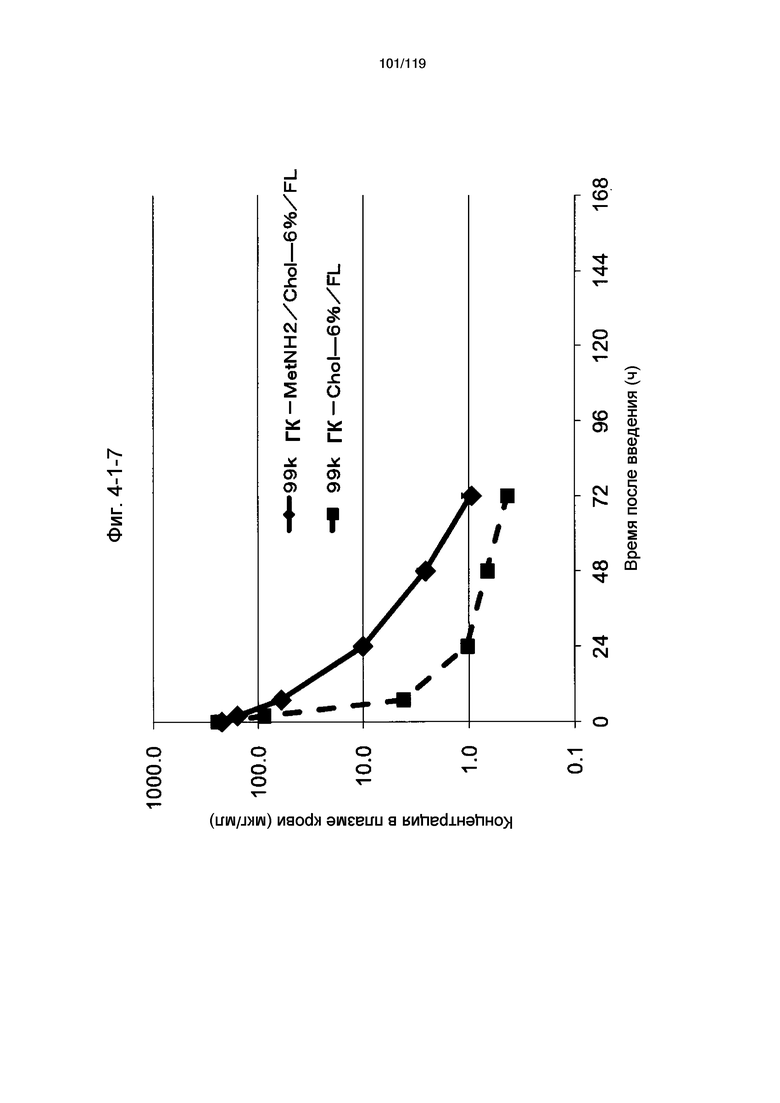
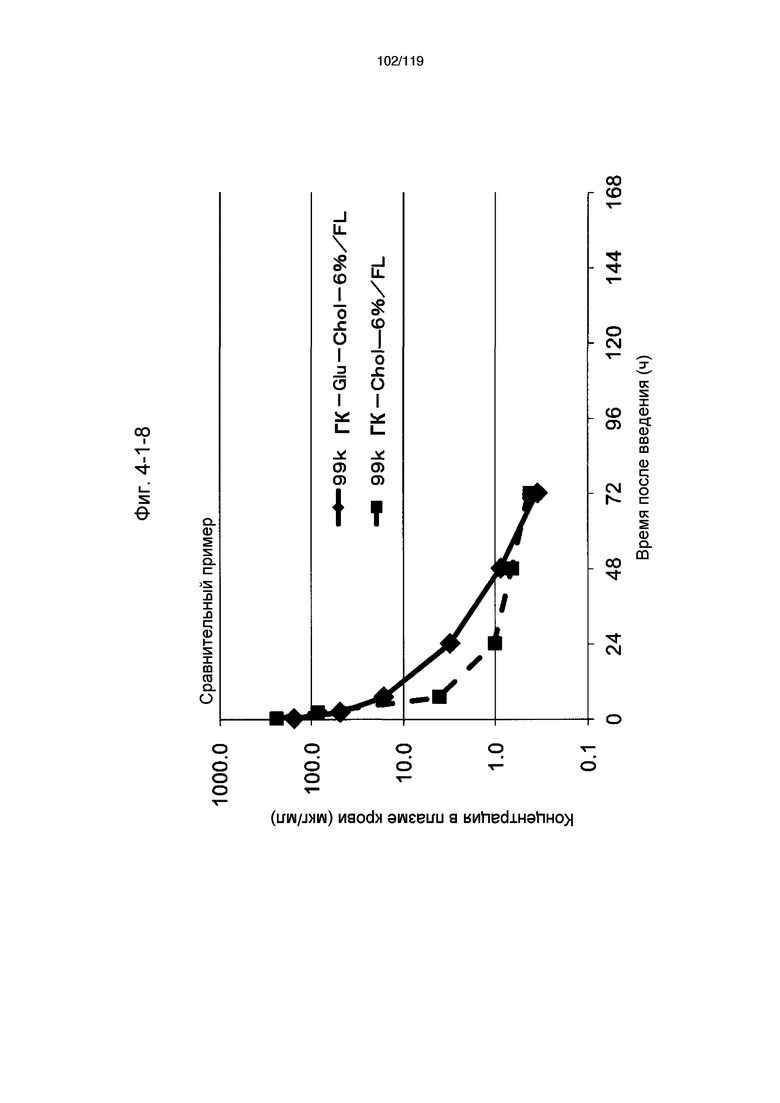
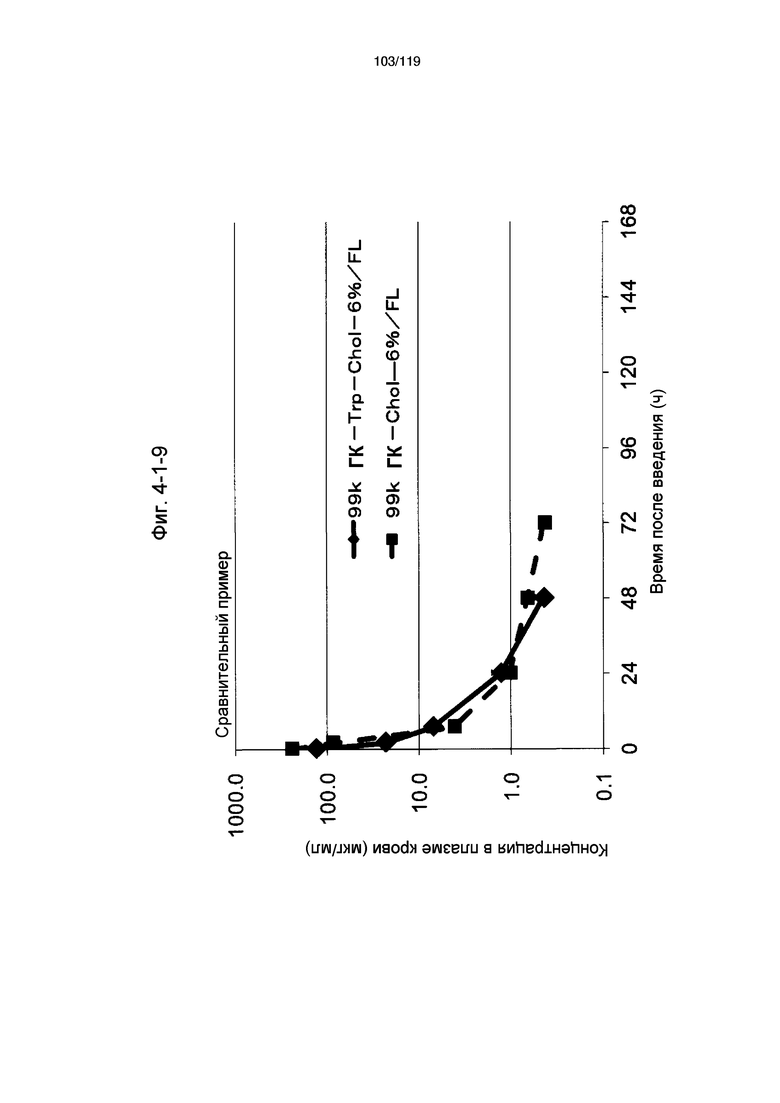
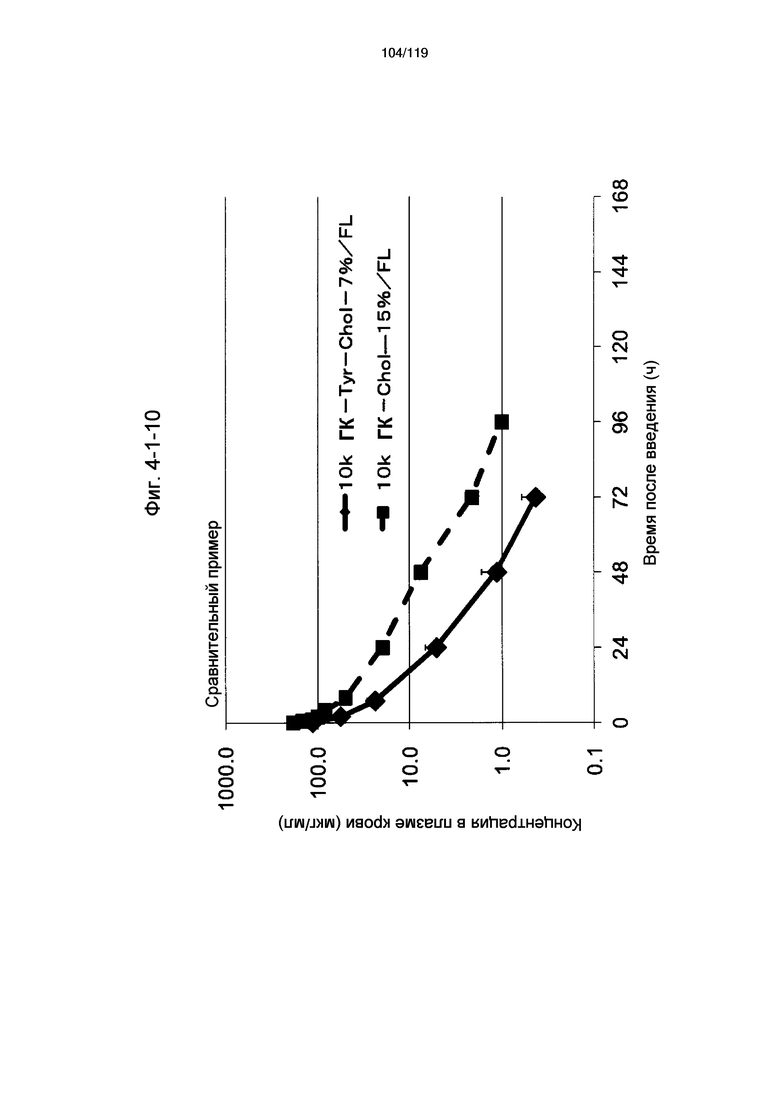
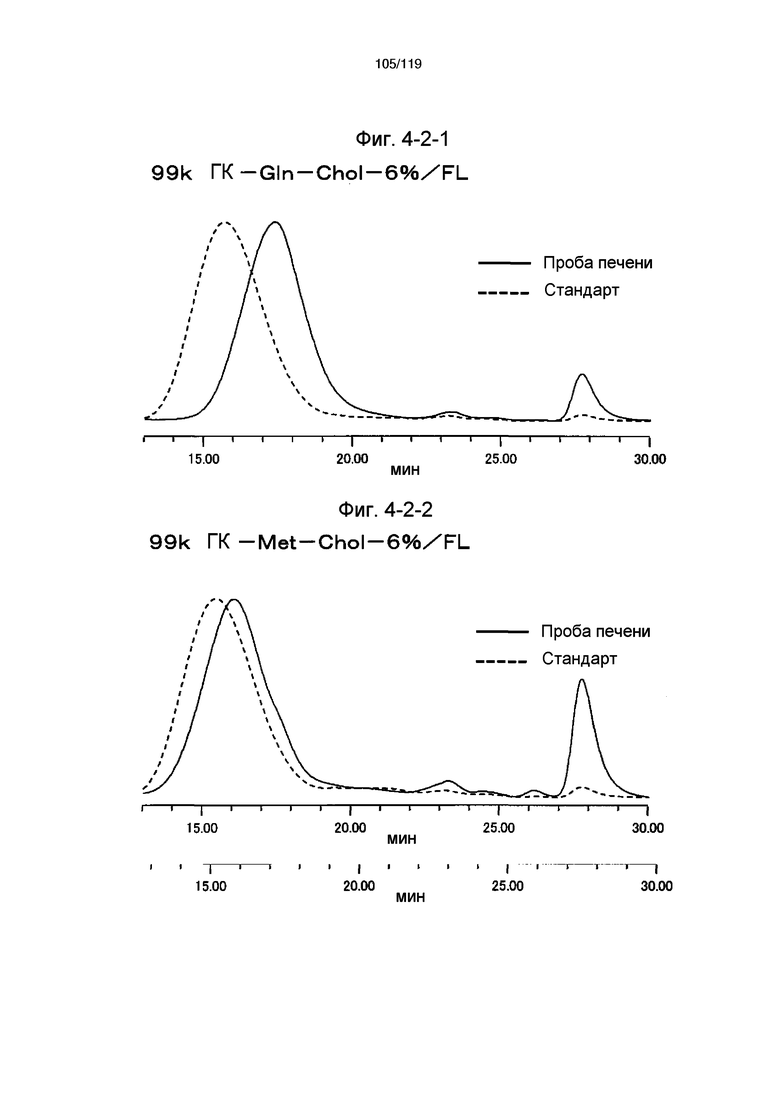
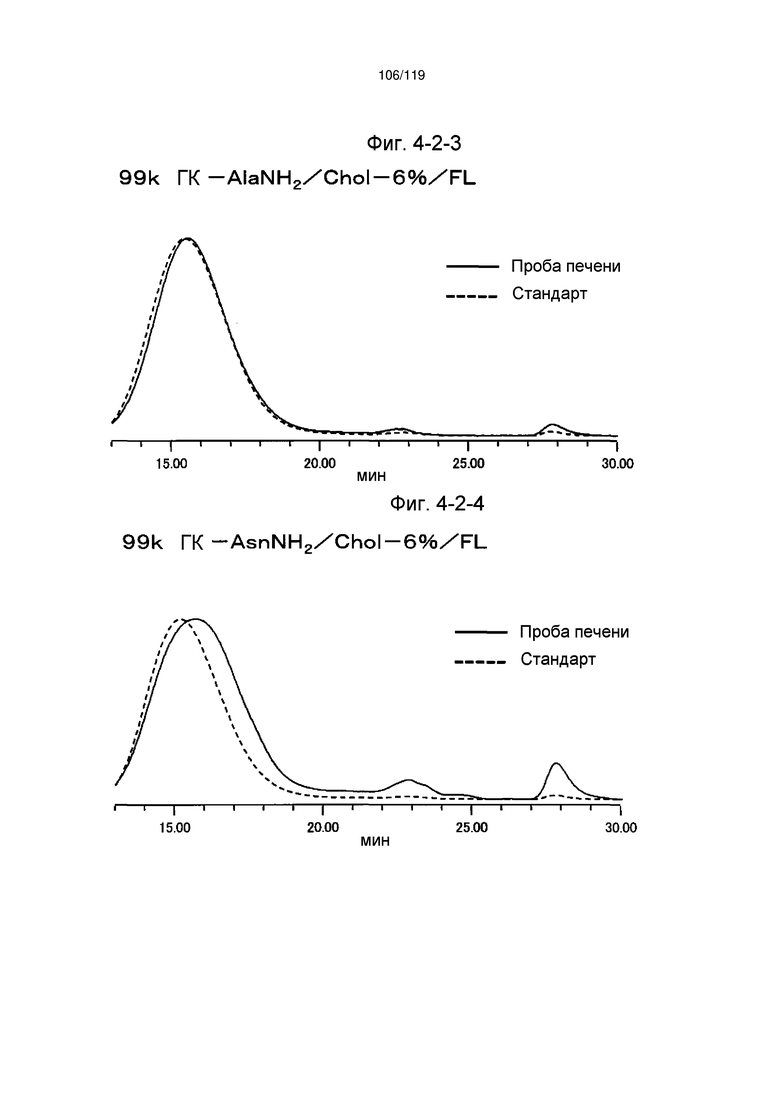
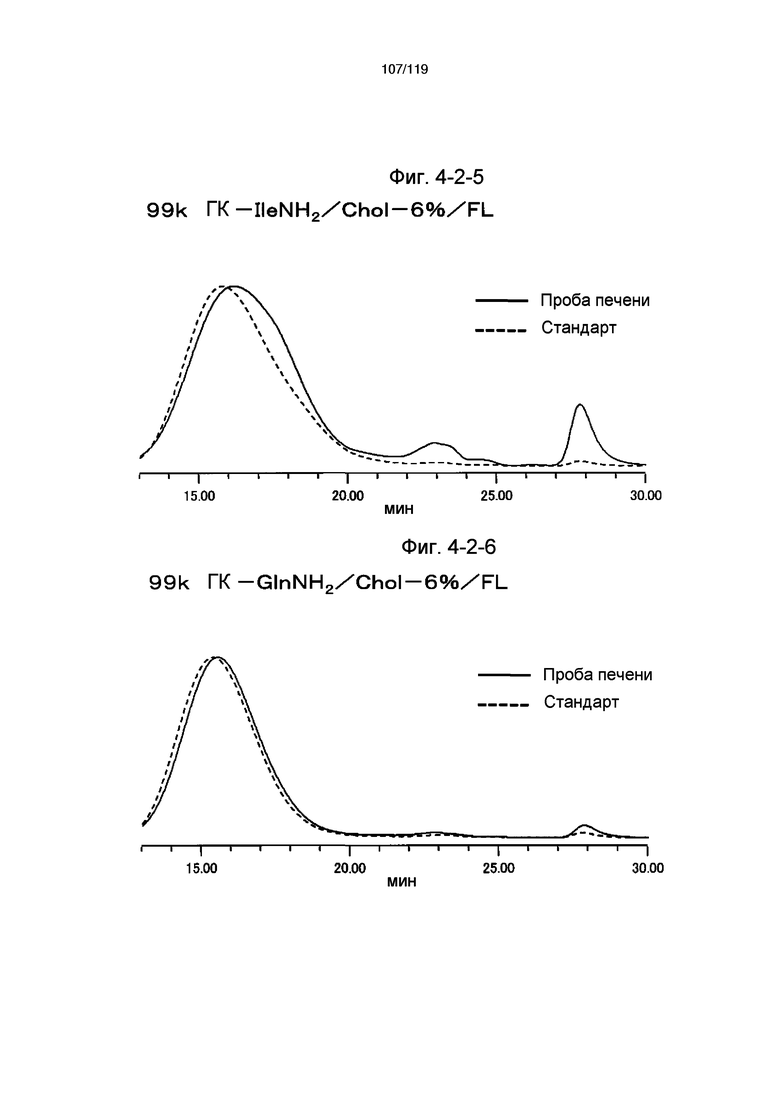
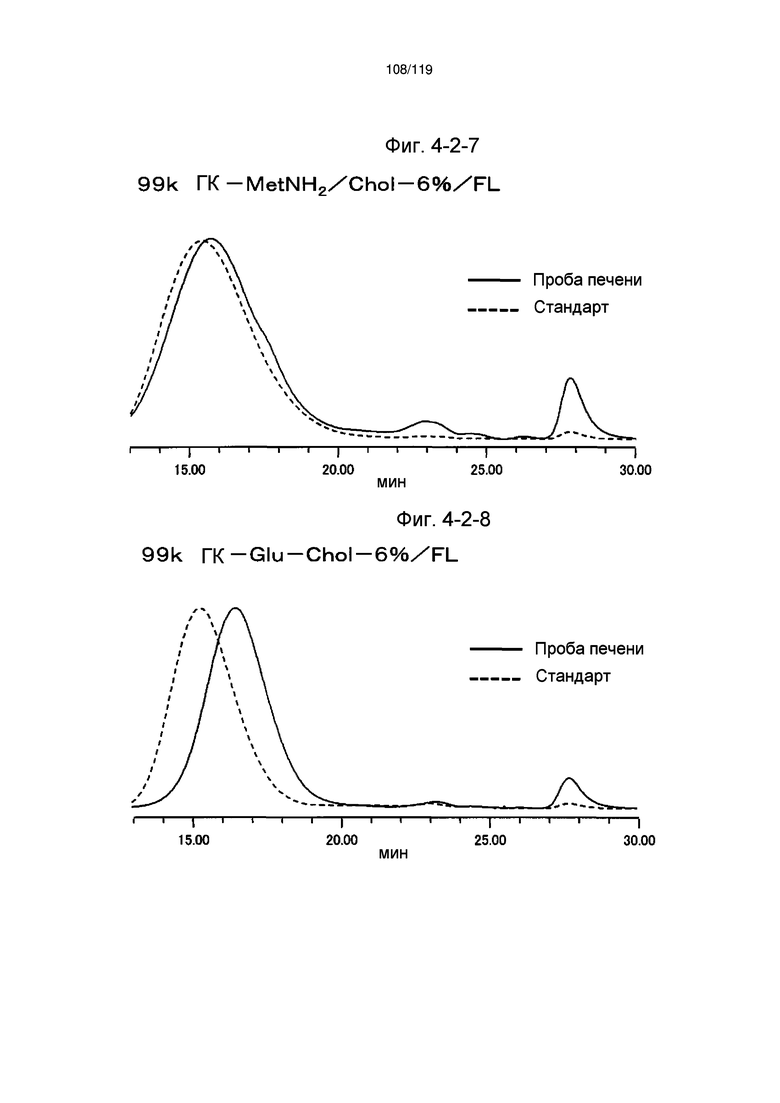
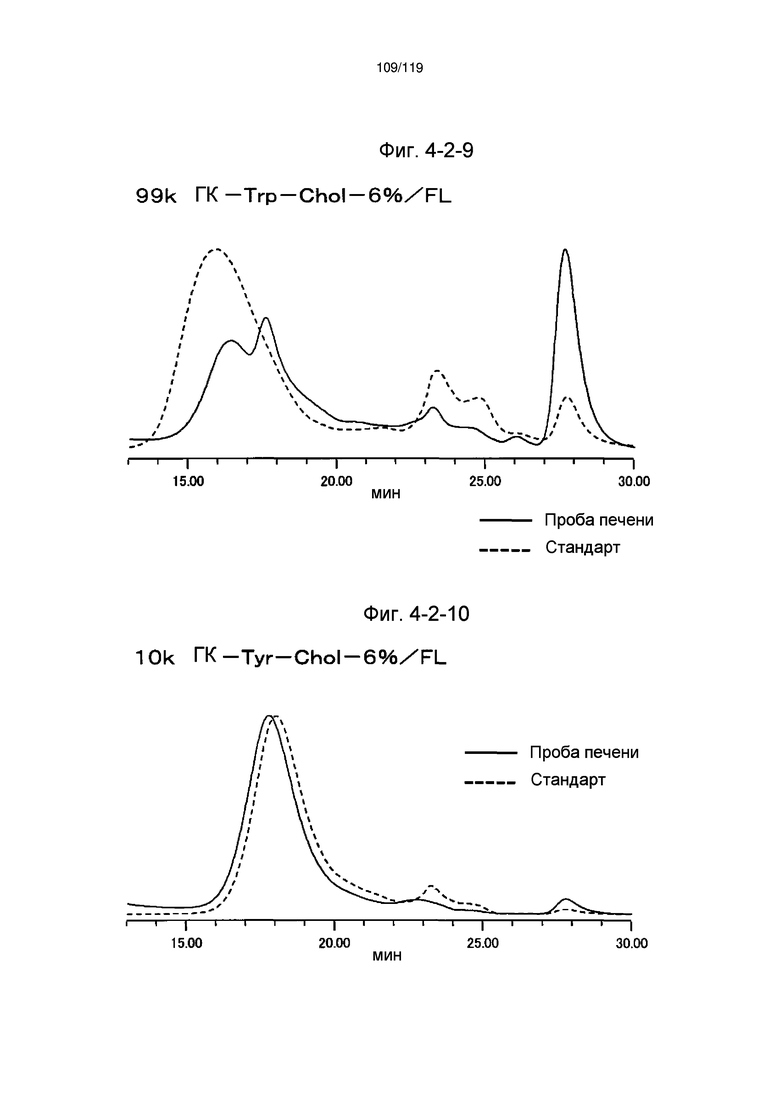
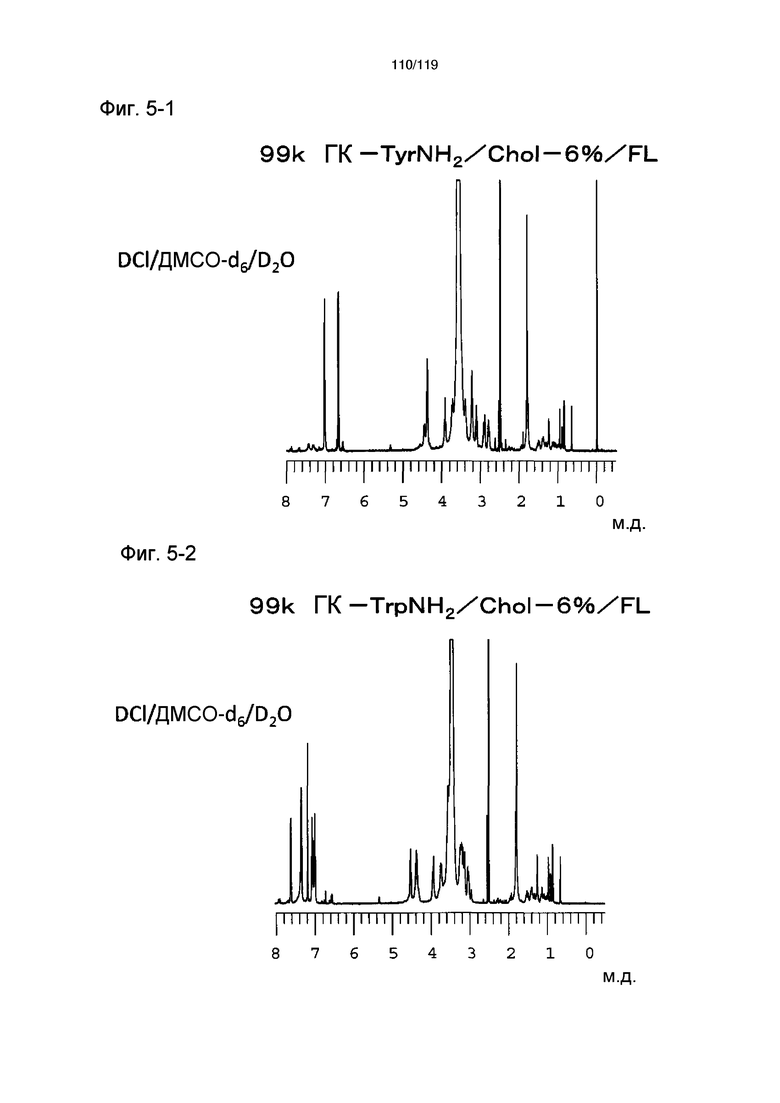
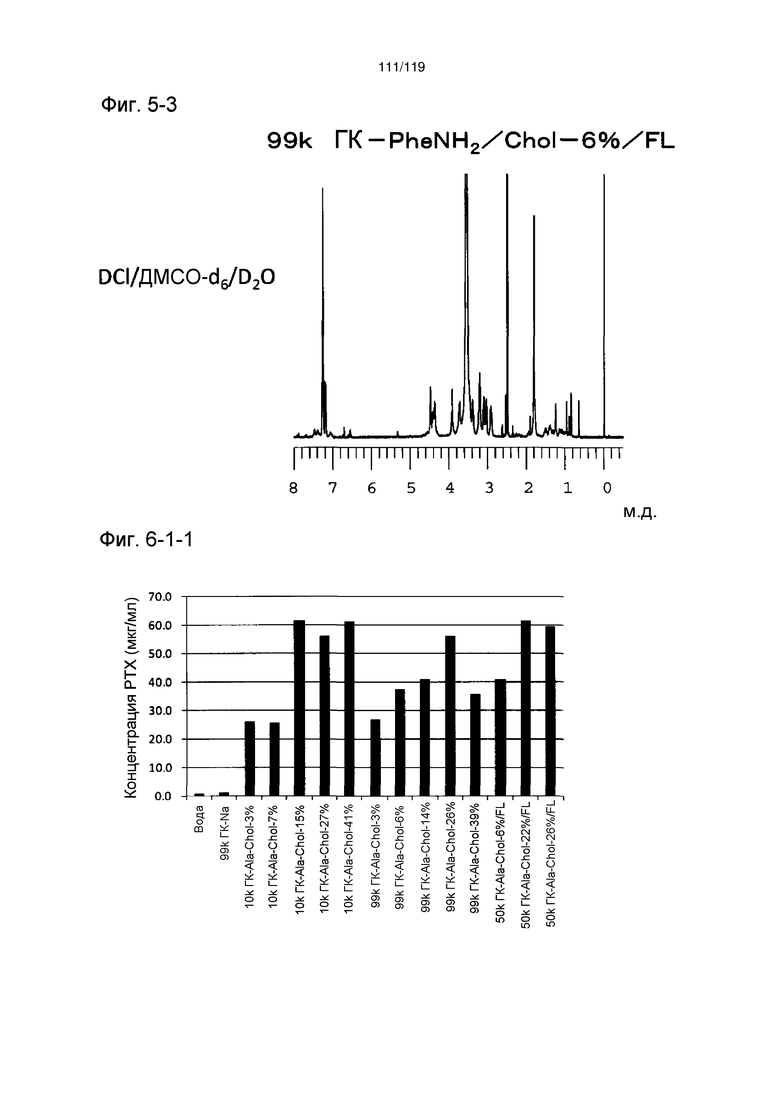
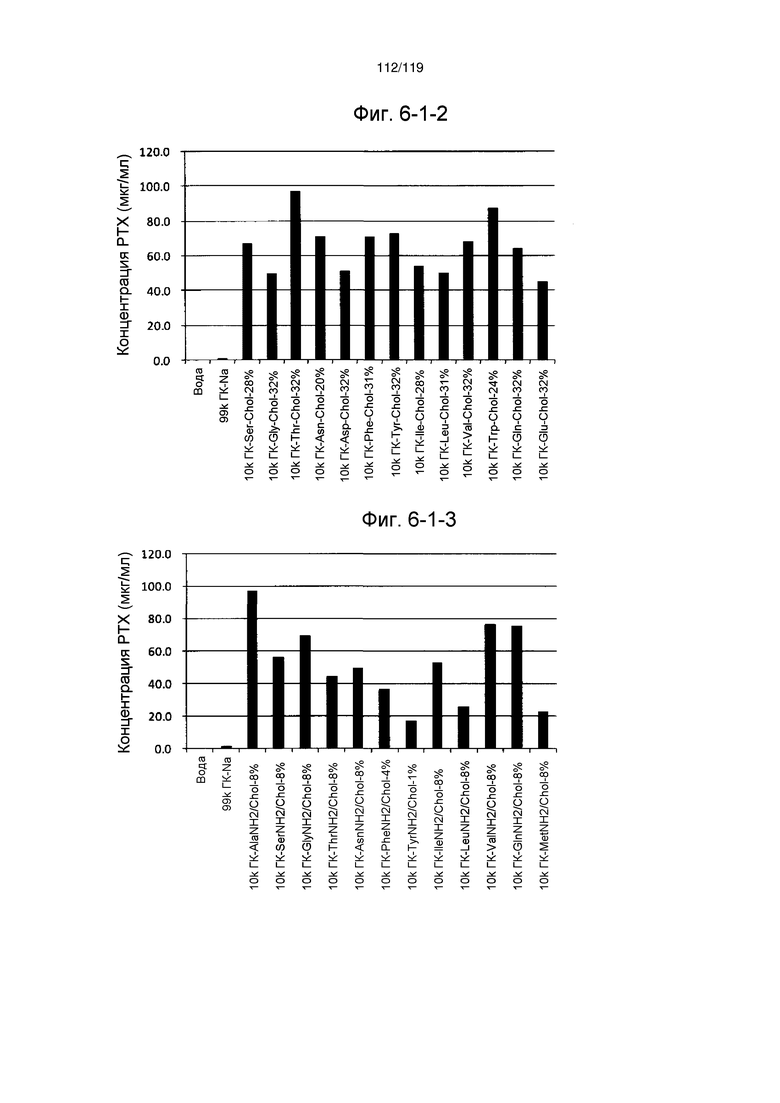
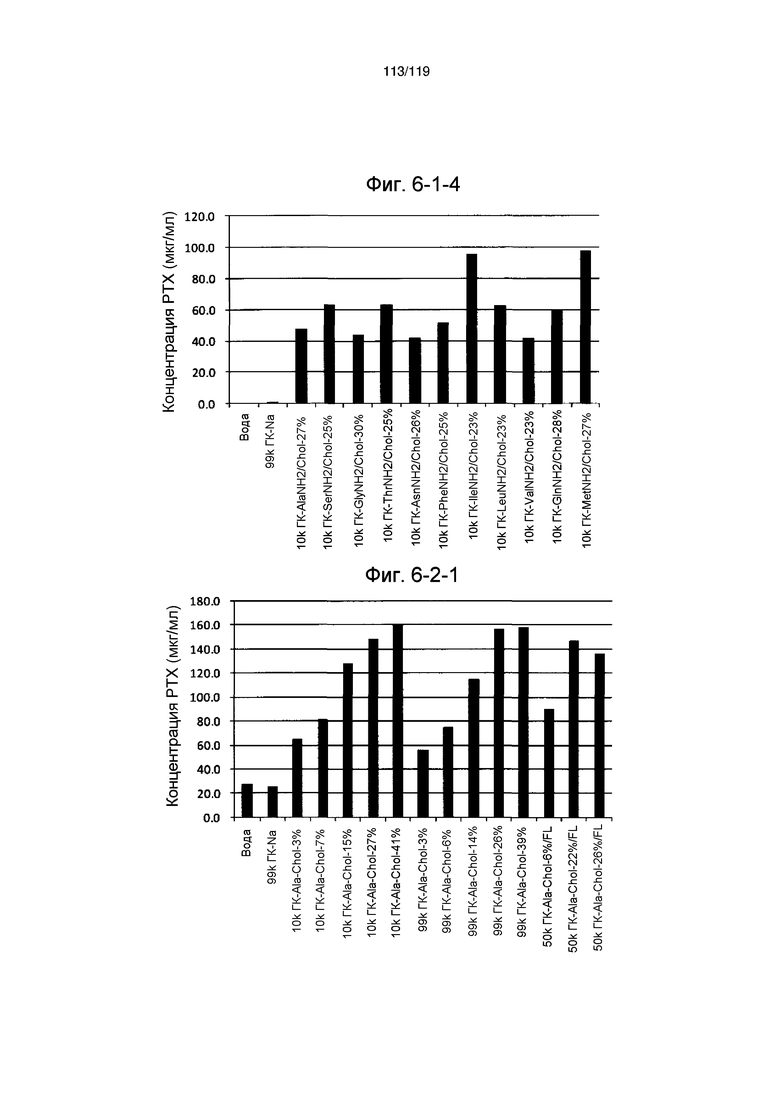
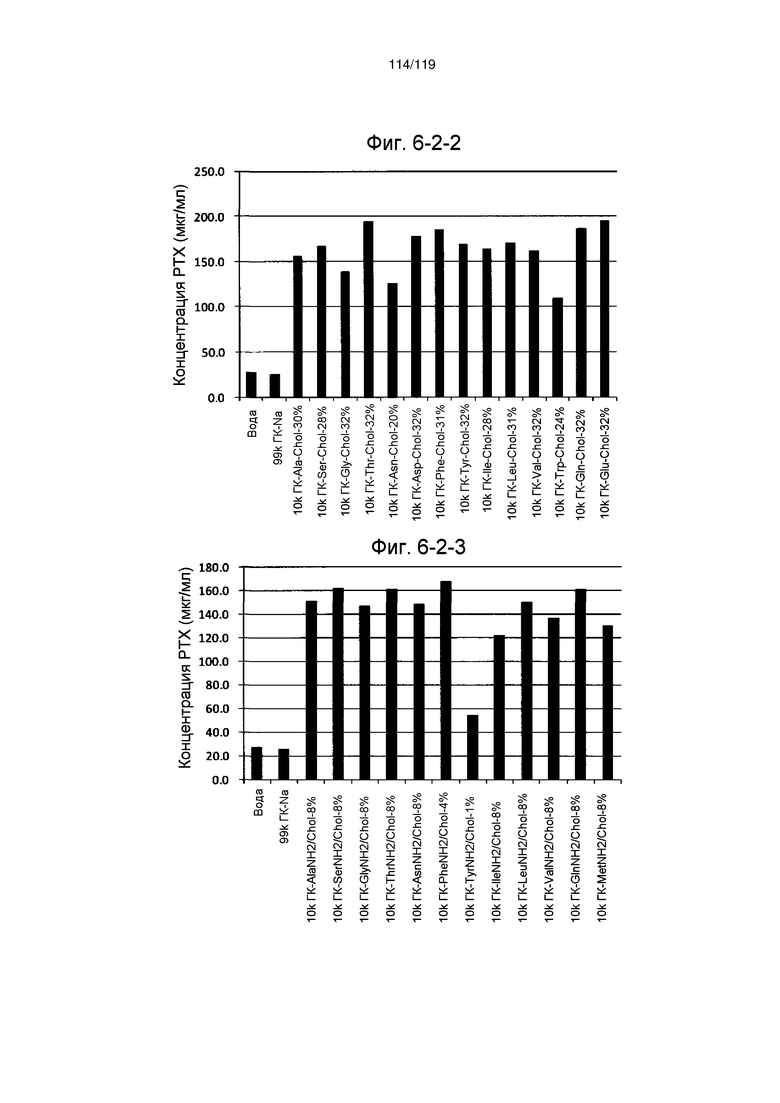
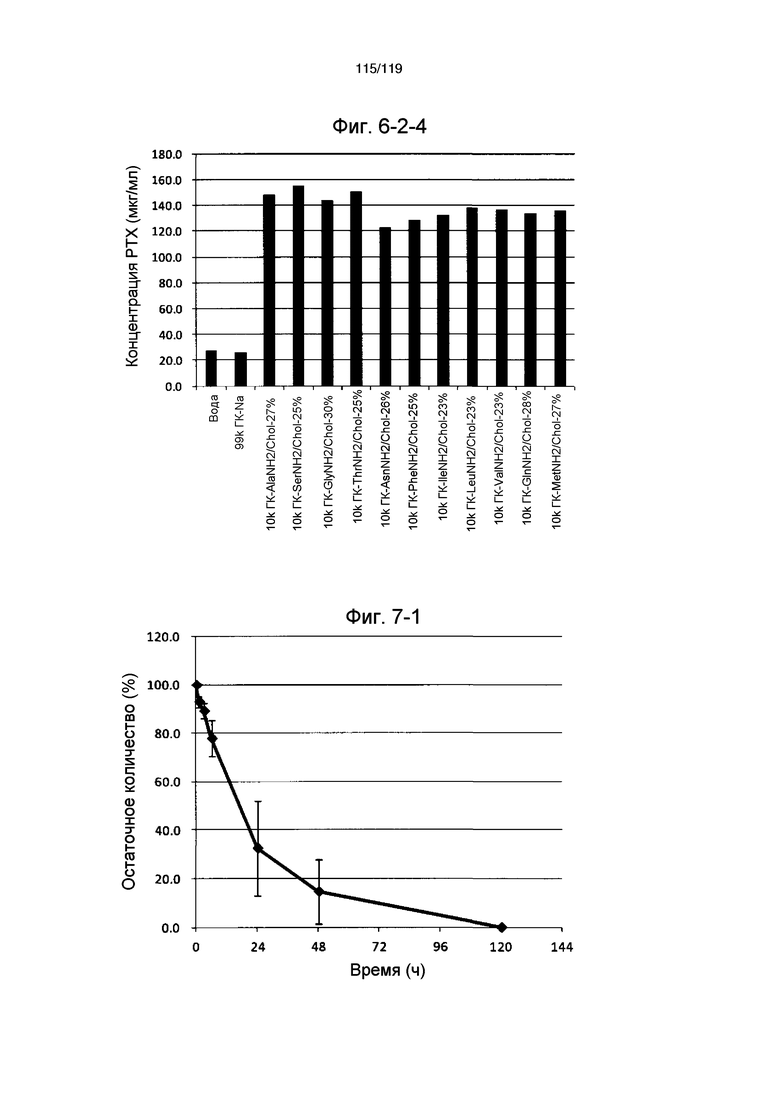
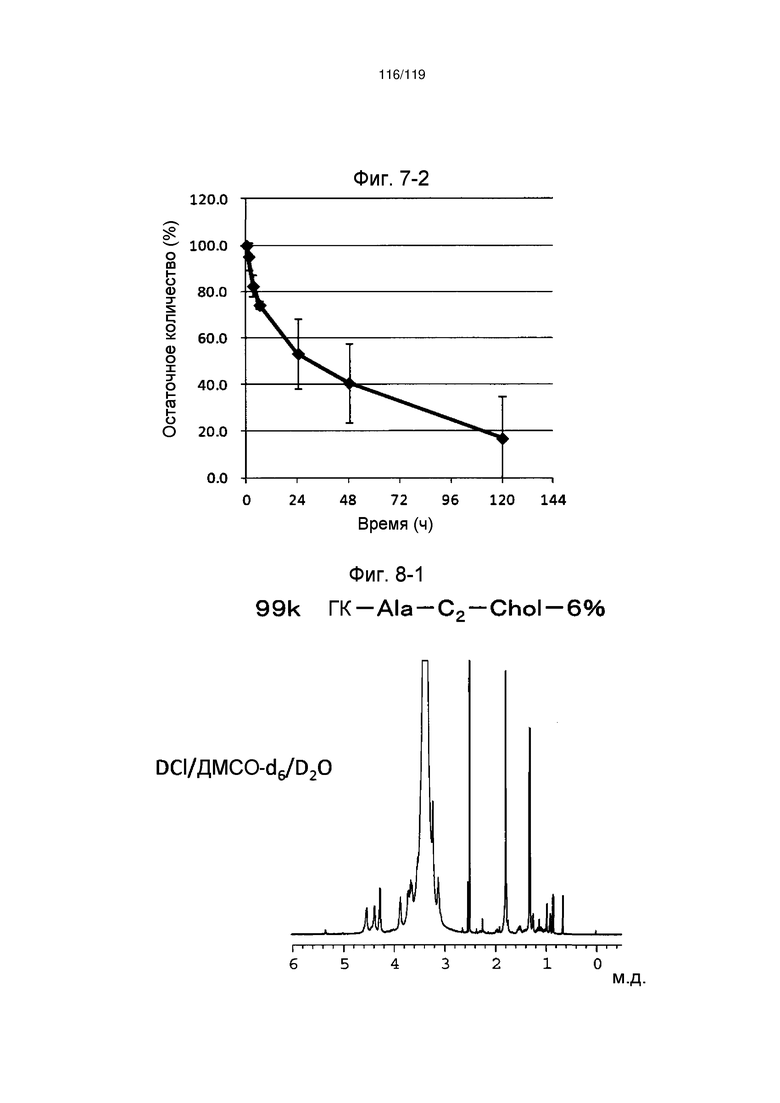
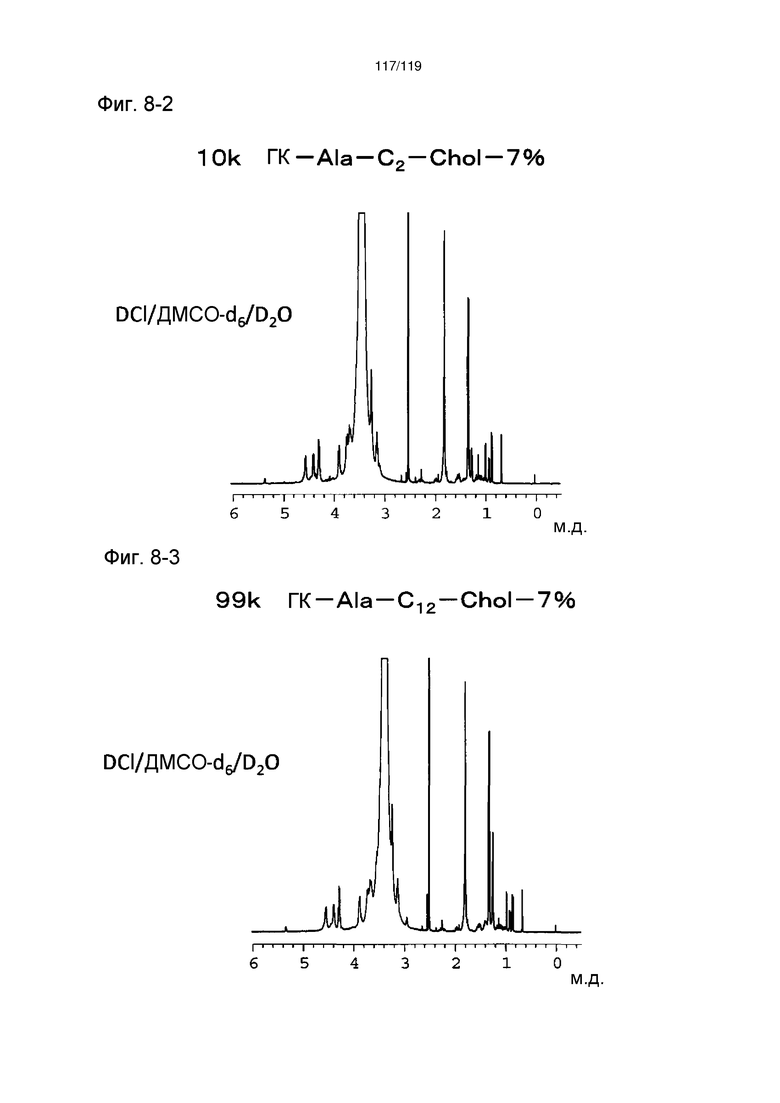
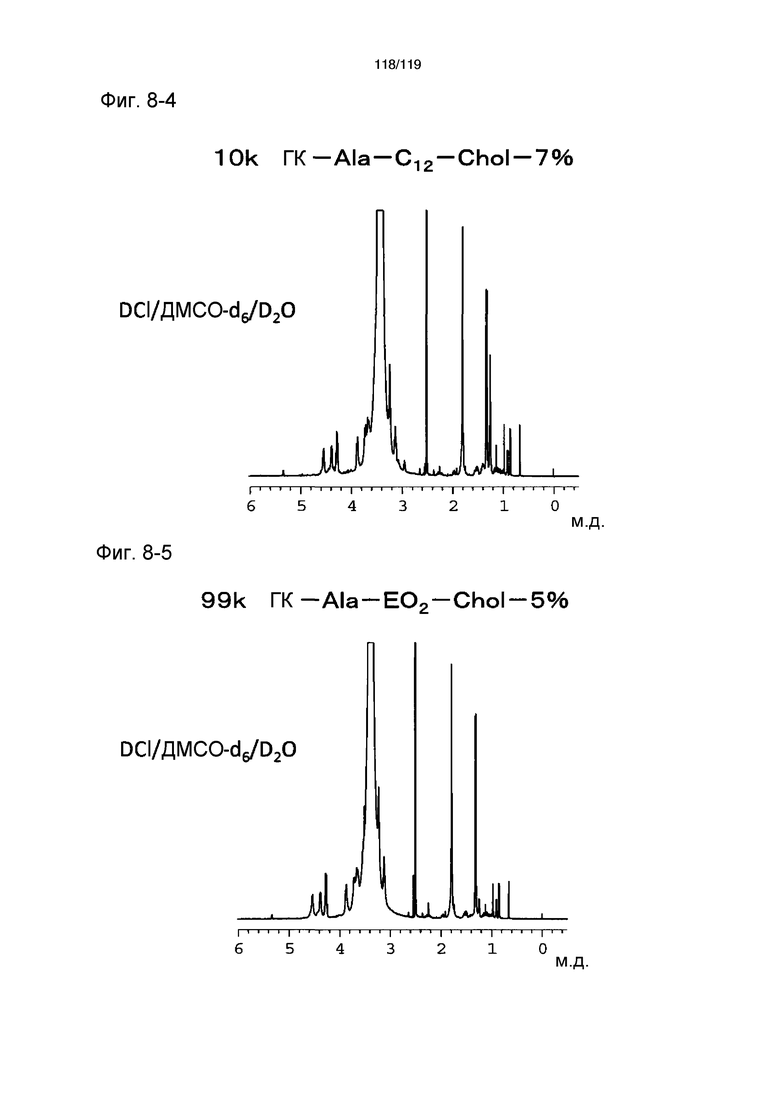
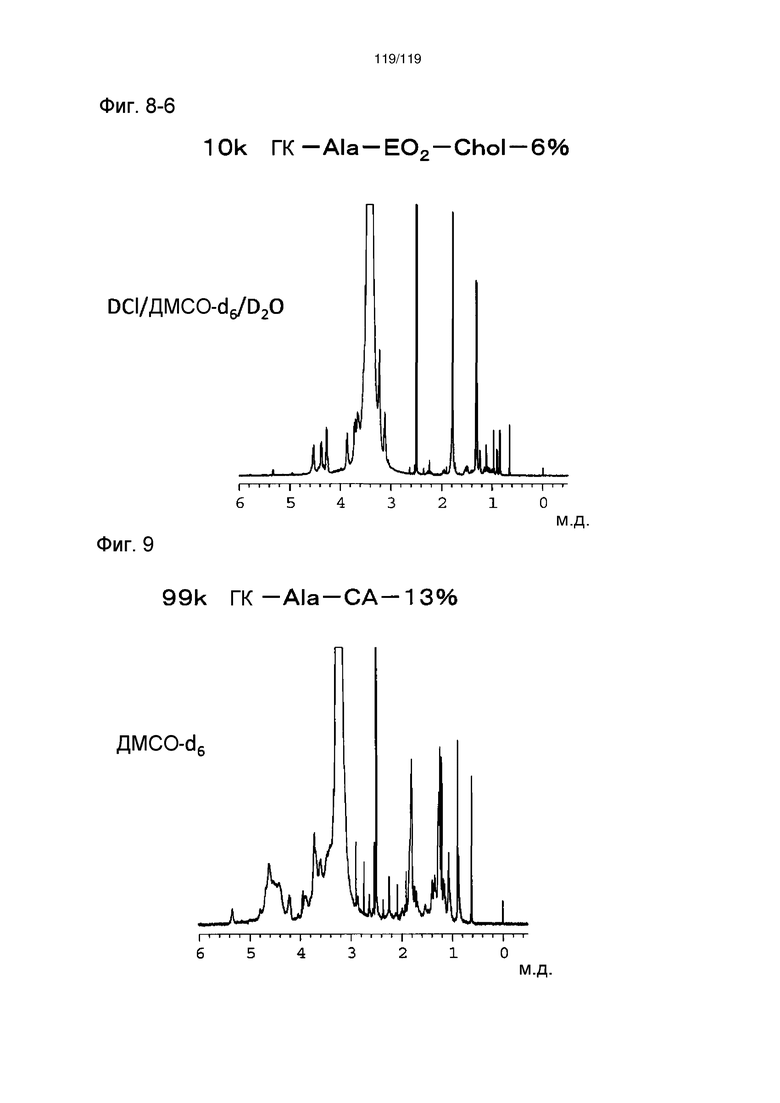
Настоящее изобретение относится к пригодному в медицине производному гиалуроновой кислоты, содержащему единицу формулы (I):
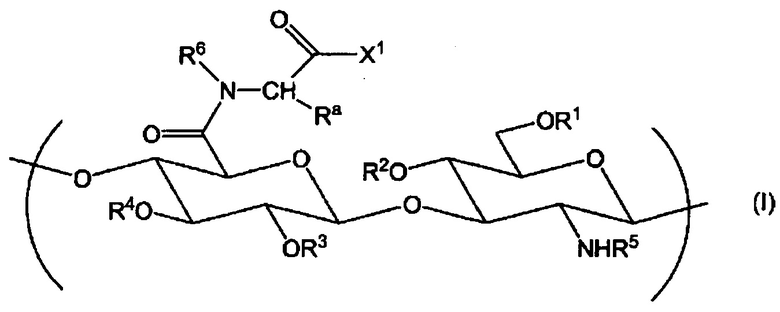
где R1-R4 выбраны из H, С1-6алкила, формила и С1-6алкилкарбонила; R5 выбран из H, формила или С1-6алкилкарбонила; R6 выбран из H и C1-6алкила; -CHRa-CO-X1 выбран из групп:
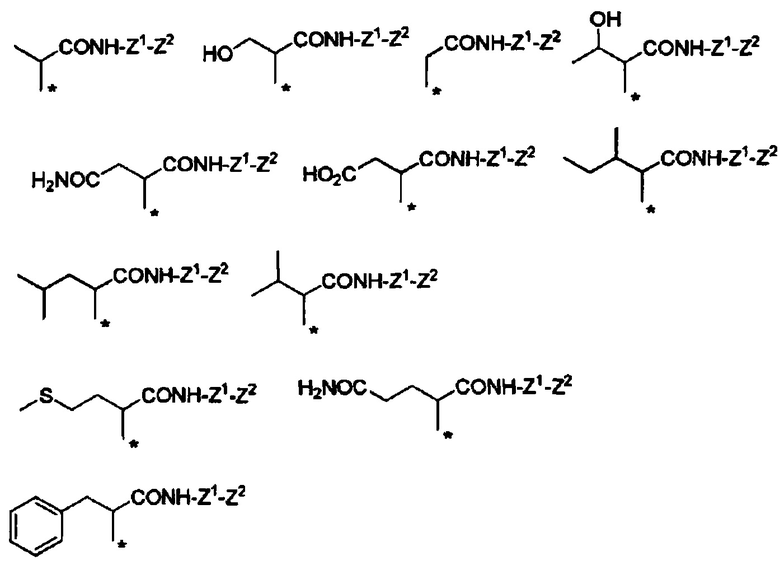 ,
,
где * означает место присоединения к -NR6-; Z1 является С2-30алкиленом или -(СН2СН2О)m-СН2СН2-, необязательно содержащим 1-5 групп -О-, -NRg- или -S-S-; m равен 1-100; Z2 выбран из -NRb-Z3 и -NRb-COO-Z3; Rb выбран из H, С1-20алкила, амино-С2-20алкила и гидрокси-С2-20алкила, необязательно содержащего 1-3 групп -О- и -NRf-; Rf выбран из Н, С1-12алкила, амино-С2-12алкила и гидрокси-С2-12алкила, необязательно содержащих 1-2 групп -О- или -NH-; Rg выбран из Н, С1-20алкила, амино-С2-20алкила или гидрокси-С2-20алкила, необязательно содержащих 1-3 групп -О- или -NH-; Z3 - холаноил или холестерил; и при X1, отличном от -NR9-Z1-Z2, указанное производное дополнительно содержит единицу формулы (II):

где R1a-R4a выбраны из Н, C1-6алкила, формила и C1-6алкилкарбонила; R5a представляет собой Н, формил или C1-6алкилкарбонил; X2 представляет собой -NH-Z1-Z2, где Z1 и Z2 определены выше; и указанное производное получено с использованием гиалуроновой кислоты, исключительно состоящей из единиц формулы (IIb):
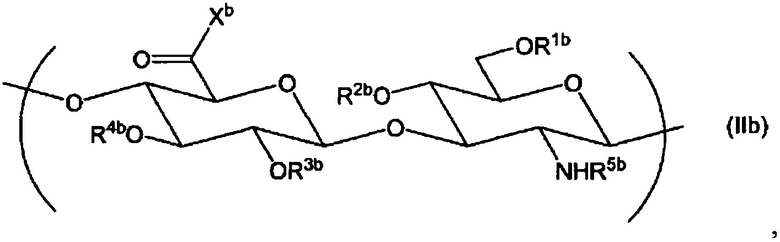
где R5b выбран из Н, формила и С1-6алкилкарбонила; Xb выбран из OH и -O-Q+, где Q+ выбран из Li+, Na+, Rb+, Cs+, Mg2+, Ca2+, N+RjRkRlRm, где Rj, Rk, Rl и Rm выбраны из Н и С1-6алкила, имеющего молекулярную массу от 3 кДа до 1500 кДа, когда R1b-R4b все представляют собой Н, R5b представляет собой ацетил, и Xb представляет собой -O-Na+. Предложено новое соединение, эффективное для инкапсулирования лекарственных средств, и фармацевтическая композиция на его основе. 2 н. и 9 з.п. ф-лы, 9 пр., 22 табл., 119 ил.
1. Производное гиалуроновой кислоты, содержащее единицу формулы (I):
Химическая формула 1
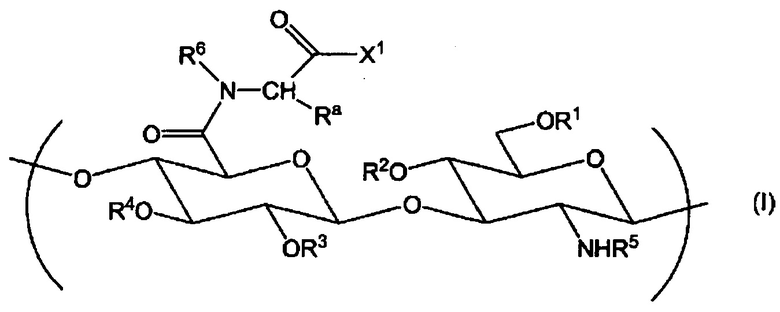
где R1, R2, R3 и R4 независимо выбраны из атома водорода, С1-6алкила, формила и С1-6алкилкарбонила;
R5 представляет собой атом водорода, формил или С1-6алкилкарбонил;
группа -CHRa-CO-X1 выбрана из следующих групп:
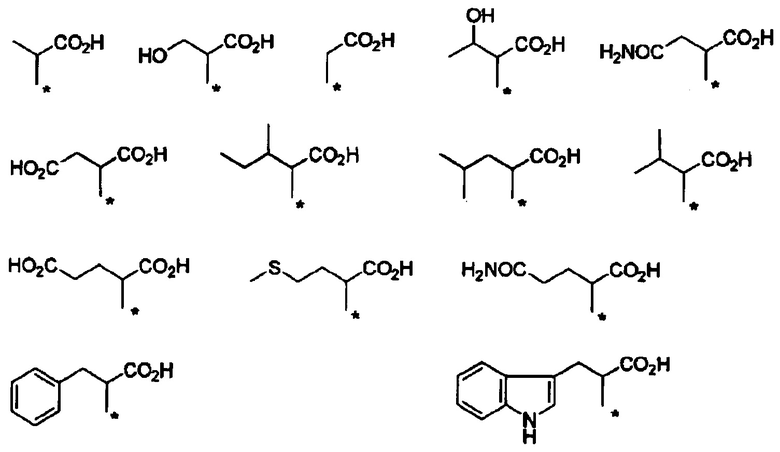
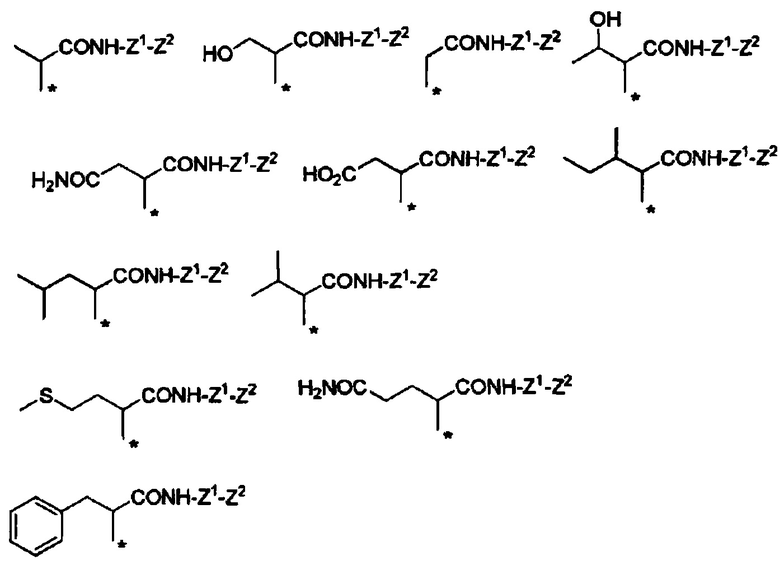
* показывает положение присоединения к -NR6-;
R6 выбран из атома водорода и C1-6алкила;
Z1 представляет собой С2-30алкилен или -(СН2СН2О)m-СН2СН2-, где в алкилен может быть введено 1-5 групп, независимо выбранных из -О-, -NRg- и -S-S-, и m является целым числом, выбранным из 1-100;
Z2 выбран из групп, представленных следующими формулами:
-NRb-Z3, и
-NRb-COO-Z3;
Rb выбран из атома водорода, С1-20алкила, амино-С2-20алкила и гидрокси-С2-20алкила, где в алкильные фрагменты данных групп может быть введено 1-3 группы, независимо выбранных из -О- и -NRf-;
Rf независимо выбран из атома водорода, С1-12алкила, амино-С2-12алкила и гидрокси-С2-12алкила, и в алкильные фрагменты данных групп может быть введено 1-2 группы, независимо выбранных из -О- и -NH-;
Rg независимо выбран из атома водорода, С1-20алкила, амино-С2-20алкила или гидрокси-С2-20алкила, и в алкильные фрагменты данных групп может быть введено 1-3 группы, независимо выбранных из -О- и -NH-;
Z3 представляет собой стерильную группу, выбранную из холаноила и холестерила;
где если производное гиалуроновой кислоты не содержит единицу формулы (I), в которой X1 представляет собой -NR9-Z1-Z2, тогда производное гиалуроновой кислоты дополнительно содержит единицу формулы (II):
Химическая формула 2
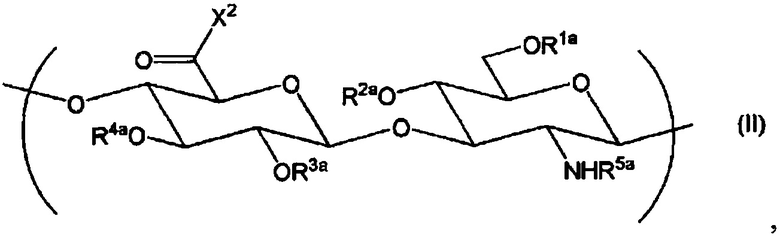
где R1a, R2a, R3a и R4a независимо выбраны из атома водорода, C1-6алкила, формила и C1-6алкилкарбонила;
R5a представляет собой атом водорода, формил или C1-6алкилкарбонил; и
X2 представляет собой -NR9-Z1-Z2, где R9 представляет собой атом водорода, Z1 и Z2 являются такими, как определено выше;
где производное гиалуроновой кислоты получено с использованием гиалуроновой кислоты, исключительно состоящей из дисахаридной единицы формулы (IIb):
Химическая формула 3
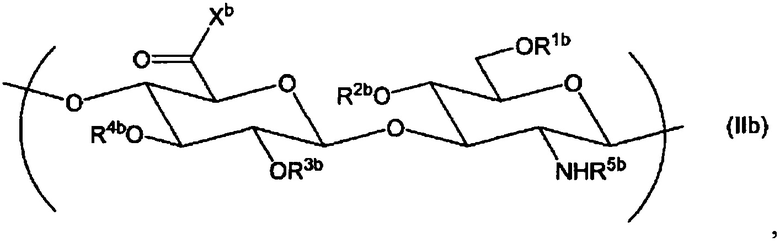
где R1b, R2b, R3b и R4b, каждый независимо, выбран из атома водорода, C1-6алкила, формила и C1-6алкилкарбонила;
R5b выбран из атома водорода, формила и С1-6алкилкарбонила; и
Xb выбран из гидрокси и -O-Q+, где Q+ представляет собой противокатион, выбранный из иона лития, иона натрия, иона рубидия, иона цезия, иона магния, иона кальция, и ионов аммония, представленных формулой N+RjRkRlRm, где Rj, Rk, Rl и Rm, каждый независимо, выбран из атома водорода и С1-6алкила, и имеет среднемассовую молекулярную массу от 3 кДа до 1500 кДа, когда R1b, R2b, R3b и R4b, все представляют собой атомы водорода, R5b представляет собой ацетил, и Xb представляет собой -O-Na+.
2. Производное гиалуроновой кислоты по п. 1, дополнительно содержащее единицу формулы (IIb).
3. Производное гиалуроновой кислоты по п. 1, где X1 представляет собой -NH-Z1-Z2 в формуле (I).
4. Производное гиалуроновой кислоты по любому из пп. 1-3, где процент дисахаридной единицы формулы (I) в имеющихся дисахаридных единицах составляет 70-100%.
5. Производное гиалуроновой кислоты по любому из пп. 1-3, где процент дисахаридной единицы, содержащей группу -NH-Z1-Z2 в имеющихся дисахаридных единицах, составляет 3-50%.
6. Производное гиалуроновой кислоты по п. 1, не содержащее единицу формулы (I), где X1 представляет собой -NH-Z1-Z2.
7. Производное гиалуроновой кислоты по любому из пп. 1, 2 и 6, где сумма процентов единицы формулы (I) и единицы формулы (II) в имеющихся дисахаридных единицах составляет 70-100%.
8. Производное гиалуроновой кислоты по любому из пп. 1, 2, 3 и 6, где Z1 представляет собой С2-10алкилен, Z2 представляет собой -NH-COO-Z3, и Z3 представляет собой холестерильную группу.
9. Производное гиалуроновой кислоты по любому из пп. 1, 2, 3 и 6, где производное гиалуроновой кислоты получено взаимодействием производного гиалуроновой кислоты, содержащего единицу формулы (IIb) и единицу формулы (Ia):
Химическая формула 4
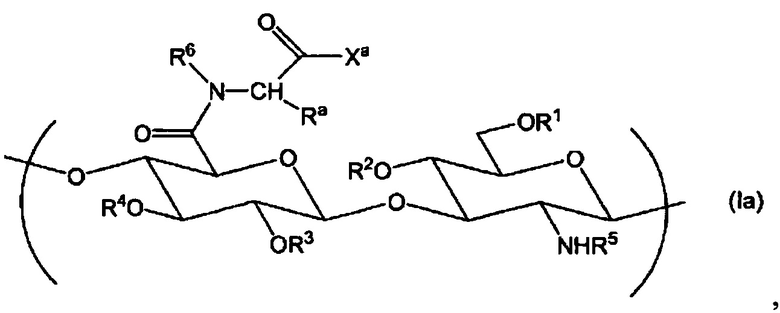
где Ха выбран из гидрокси, -O-Q+, С1-6алкокси, и R1, R2, R3, R4, R5, R6, Q+ и Ra являются такими, как определено в п. 1, с соединением, представленным формулой ниже:
HNR9-Z1-Z2,
где R9, Z1 и Z2 являются такими, как определено в п. 1.
10. Фармацевтическая композиция для инкапсулирования лекарственного средства, содержащая производное гиалуроновой кислоты по любому из пп. 1, 2, 3 и 6, где лекарственное средство выбрано из низкомолекулярного соединения, белка, пептида и нуклеиновой кислоты.
11. Фармацевтическая композиция по п. 10, где лекарственное средство удерживается посредством образования комплекса с производным гиалуроновой кислоты.
| US 20110212901 А1, 01.09.2011; | |||
| JP2012504697 A, 23.02.2012 | |||
| JP 2007535607 A, 06.12.2007 | |||
| JP 2002519481 A, 02.07.2002 | |||
| WO 2010119994 A1, 21.10.2010 | |||
| US 5356883 A1, 18.10.1994 | |||
| ПРОИЗВОДНОЕ ГИАЛУРОНОВОЙ КИСЛОТЫ И СОДЕРЖАЩЕЕ ЕГО ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2005 |
|
RU2390529C2 |
Авторы
Даты
2018-12-04—Публикация
2013-09-05—Подача