Изобретение относится к области органической химии, а именно к способу получения С-нитроимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана.
С-Нитроимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксан является эффективным ингибитором агрегации тромбоцитов (IC50 1.81 мкМ) [А.А. Алексеев, диссертация на соискание ученой степени кандидата фармацевтических наук, Москва 2015 г], превосходящим по доза-зависимому ингибированию агрегации тромбоцитов ряд известных соединений, демонстрирующих выраженный антиагрегационный эффект [Патент RU №2396271, 2009 г.], наиболее активным из которых является Arg-Gly-Gly-Asp-Trp (IC50 6,3 мкМ). Кроме того, С-нитроимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксан является эффективным энергоемким соединением [Quantum chemical study of the mechanism of C-nitroimidazo[4,5-e]benzo[1,2-c;3,4-c’]difuroxan formation, Natalia L. Merkulova, Vjacheslav L. Korolev, Tatyana S. Pivina, Viktor P. Ivshin, In Proc. of the 20-th Seminar “New Trends in Research of Energetic Materials”, NTREM 2017, Pardubice, the Czech Republic, April 26-28, 2017, pg. 814-820; Investigation of the tautomerism of imidazo[4,5-e]benzo[1,2-c;3,4-c’]difuroxan derivatives by computational and experimental methods, Natalia L. Merkulova, Vjacheslav L. Korolev, Vitalii M. Danilenko, Ivan D. Nesterov, Tatyana S. Pivina, In Proc. of the 21-th Seminar “New Trends in Research of Energetic Materials”, NTREM 2018, Pardubice, the Czech Republic, April 17-20, 2018, pg. 861-867].
Таким образом, С-нитроимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксан представляет интерес и в качестве объекта технологий «двойного назначения».
Известен способ получения С-нитроимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана [В.П. Ившин, В.В. Топоров, В.Л. Королев, А.В. Корманов, Состояние исследований и современные достижения в химии органических соединений – NO-доноров, МАТЕРИАЛЫ ПЯТОЙ МЕЖДУНАРОДНОЙ НАУЧНОЙ ШКОЛЫ «НАУКА И ИННОВАЦИИ – 2010», ISS “SI-2010”: Материалы пятого международного научного семинара «Фундаментальные исследования и инновации» и Всероссийского молодежного научного семинара «Наука и инновации 2010», Йошкар-Ола, 18-24 июля 2010 г., с.396-402; В.В. Топоров, В.Л. Королев, В.П. Ившин, В.М. Даниленко. Исследование поведения имидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксанов в реакциях нитрования, алкилирования и кислотного гидролиза. //Тез. докл. XVIII Менделеевского съезда по общей и прикладной химии, Москва, 23-28 сентября, 2007, 462; Quantum chemical study of the mechanism of C-nitroimidazo[4,5-e]benzo[1,2-c;3,4-c’]difuroxan formation, Natalia L. Merkulova, Vjacheslav L. Korolev, Tatyana S. Pivina, Viktor P. Ivshin, In Proc. of the 20-th Seminar “New Trends in Research of Energetic Materials”, NTREM 2017, Pardubice, the Czech Republic, April 26-28, 2017, pg. 814-820] с выходом 24% нитрованием имидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана в системе HNO3/Ac2O. Условия проведения синтеза и выделения продукта не указаны.
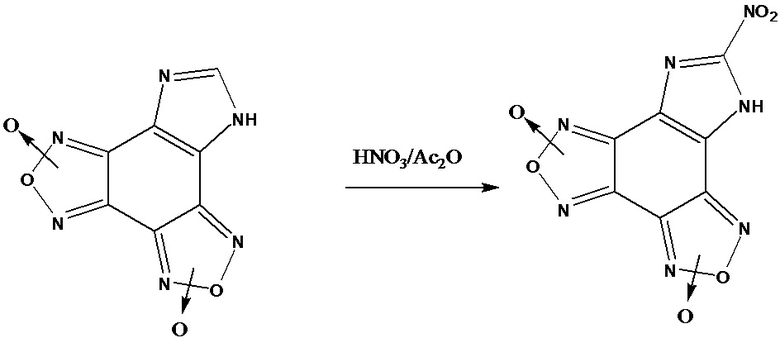
Кроме того, известно нитрование имидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана в системе HNO3/Ac2O при температуре -5оС, ведущее к получению N-нитроимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана [D. Chand, C. He, L. A. Mitchell, D. A. Parrish, J .M. Shreeve, Dalton Trans., 2016, 45, 13827].
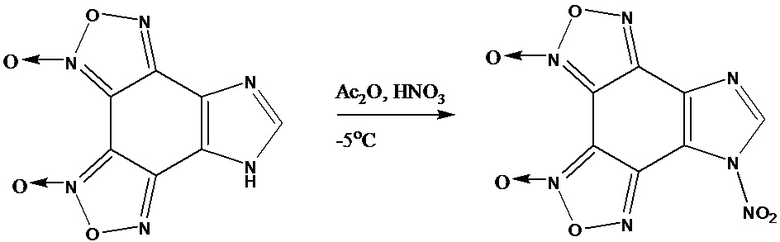
Задачей предлагаемого изобретения является разработка способа получения С-нитроимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана, позволяющего повысить выход целевого продукта.
Технический результат достигается проведением нитрования имидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана в системе HNO3/Ac2O при температуре от -5 до 20оС и выделением продукта известными способами. Выход продукта составляет 62%.
Предлагаемый способ позволяет повысить выход целевого продукта на 38% (в 2,58 раза).
Предлагаемый способ получения С-нитроимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана иллюстрируется следующим примером.
Пример. К раствору 0,70 г (3.0 ммолей) имидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана в 4 мл. HNO3 (d=1.5 г/см3) при -5 оС и перемешивании прикапывали 14 мл Ас2О, повышали температуру до 20 оС, реакционную смесь выливали в лед, выпавший осадок отфильтровывали, промывали Н2О, сушили. Получено 0.52 г. (62%) продукта, т.пл. 196 оС разл (H2O).
В связи с тем, что данные, подтверждающие строение синтезированного соединения в литературе не представлены, мы дополнительно подтвердили структуру полученного продукта методами физико-химического анализа.
Брутто-состав вещества подтвержден данными элементного анализа. Температура плавления определена на микроскопном столике «Boetius».
Строение синтезированного соединения подтверждено методами ИК-, ЯМР 1Н, 13С- и хромато-масс-спектроскопии.
ИК-спектры регистрировали на приборе «Vector 22» в прессовке KBr. Спектры ЯМР 1Н и 13С записаны на приборе «Bruker AM-300», химические сдвиги измеряли относительно сигнала растворителя (ДМСО-d6, δН 2.5 м.д., δС 39.5 м.д.).
Хромато-масс-спектрометрический анализ проводили на приборе Thermo Scientific Ultimate 3000 с диодной матрицей и масс-спектрометрическим детектором высокого разрешения Q Exactive ионизацией электроспреем в положительном режиме: длина волны 220 нм, температура пробоотборника 15ºС, температура термостата колонок 40ºС. MSD – параметры: температура источника 256 ºС, температура газа 300ºС, напряжение на капилляре 3.5 kV; колонка Waters Acquity ВЕН С18, 1.7 µm, 2.1х50 mm. Градиент от 5 до 100% В за 4 мин, (А: 0.1% муравьиной кислоты в воде; В: 0.1% муравьиной кислоты в ацетонитриле), скорость потока -0.3 мл/мин.
Найдено % С 30.00; Н 0.73; N 34.86. C7HN7O6
Вычислено % С 30.11; Н 0.36; N 35.13
Масс-спектр [MS (ES)] m/z: 277,9907 [M-]
ИК (см-1, KBr) 3450, 1652, 1564, 1551, 1537, 1487, 1417, 1384, 1347, 1321, 1241, 1219, 1065, 998, 971, 928, 828, 775, 654, 631, 566.
Спектр ЯМР 1Н (δ, м.д.): нет сигнала. Спектр ЯМР 13С (δ, м.д.) 104.4, 105.9, 107.0 (С=N(O)O); 126.3, 128.0, 128.7, 130.1 (CN=C- и СNH-C); 142.1, 144.5, 146.9, 147.8 (C=NO); 160.0 (C-NO2).
ЯМР 13С -спектры приведены для смеси таутомеров [Н.Л. Меркулова, В.М. Даниленко, В.Л. Королев, Т.С. Пивина, В.П. Ившин. Исследование таутомерии имидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксанов методами хромато-масс-, ЯМР-спектроскопии и квантовой химии. //Тез. докл. Всероссийской научной конференции с международным участием «Современные проблемы органической химии», Новосибирск, 5-9 июня, 2017, 232; В.Л. Королев, В.В. Топоров, Н.Л. Меркулова, В.Д. Даниленко, В.П. Ившин, Т.С. Пивина. Синтез имидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксанов. //Изв.АН. Сер. хим. 2017, 1250-1255; В.Л. Королев, В.В. Топоров, Н.Л. Меркулова, В.Д. Даниленко, В.П. Ившин, Т.С. Пивина. Синтез N-замещенных [имидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксанов. //Изв.АН. Сер. хим. 2017, 2126-2130; Investigation of the tautomerism of imidazo[4,5-e]benzo[1,2-c;3,4-c’]difuroxan derivatives by computational and experimental methods, Natalia L. Merkulova, Vjacheslav L. Korolev, Vitalii M. Danilenko, Ivan D. Nesterov, Tatyana S. Pivina, In Proc. of the 21-th Seminar “New Trends in Research of Energetic Materials”, NTREM 2018, Pardubice, the Czech Republic, April 17-20, 2018, pg. 861-867] С-нитроимидазо [4,5-e]бензо[1,2-c;3,4-c’]дифуроксана.
Фуроксановое кольцо в молекуле производных бензофуроксана обладает способностью таутомеризоваться в свою вторую форму, содержащую N-оксидную группу на другой стороне цикла у атома азота [Хмельницкий Л.И., Новиков С.С, Годовикова Т.И. Химия фуроксанов. Реакции и применение. – М.: Наука. 1983, 311 с.]. Эта изомеризация обратима и в растворах устанавливается равновесие между обоими таутомерами. Для С-нитроимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана теоретически возможно существование четырех таутомерных форм. Их существование в растворе ДМСО-d6 при 36оС подтверждается методом спектроскопии ЯМР 13С проявлением несколько сигналов одних и тех же атомов углерода. 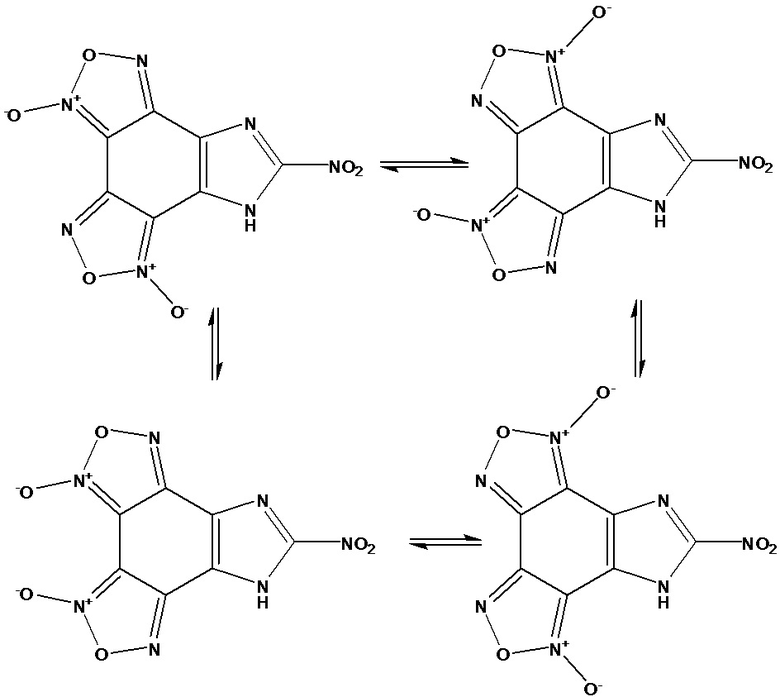
Низкая интенсивность, а также уширение сигналов в спектрах ЯМР 13С С-нитроимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана приводит к уменьшению количества сигналов ароматических атомов углерода.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения C-нитроимидазо[4,5-e]бензо[1,2-c;3,4-c']дифуроксана | 2019 |
|
RU2700931C1 |
| Способ получения С-гидроксиметилимидазо[4,5-e]бензо[1,2-c;3,4-c']дифуроксана | 2019 |
|
RU2692680C1 |
| Способ получения N-цианметилимидазо[4,5-e]бензо[1,2-c;3,4-c']дифуроксана | 2019 |
|
RU2707296C1 |
| Способ получения N-аллилимидазо[4,5-e]бензо[1,2-c;3,4-c']дифуроксана | 2019 |
|
RU2718905C1 |
| Способ получения N-карбэтоксиметил-С-метилимидазо[4,5-e]бензо[1,2-c;3,4-c']дифуроксана | 2020 |
|
RU2725631C1 |
| Способ получения N-карбэтоксиметилимидазо[4,5-e]бензо[1,2-c;3,4-c′]дифуроксана | 2017 |
|
RU2663846C1 |
| Способ получения N-карбэтоксиметилимидазо[4,5-е]бензо[1,2-с;3,4-с']дифуроксана | 2016 |
|
RU2618230C1 |
| N-КАРБОКСИМЕТИЛИМИДАЗО[4,5-е]БЕНЗО[1,2-с;3,4-с']ДИФУРОКСАН | 2014 |
|
RU2544547C1 |
| ГЕТЕРОМЕРНЫЕ ПЕПТИДЫ НА ОСНОВЕ ИМИДАЗО[4,5-е]БЕНЗО[1,2-с;3,4-с']ДИФУРОКСАНА, ИНГИБИРУЮЩИЕ АГРЕГАЦИЮ ТРОМБОЦИТОВ | 2014 |
|
RU2550223C1 |
| N-КАРБ(АРГИНИЛ)ОКСИМЕТИЛИМИДАЗО[4,5-е]БЕНЗО[1,2-с;3,4-с']ДИФУРОКСАН, ИНГИБИРУЮЩИЙ АГРЕГАЦИЮ ТРОМБОЦИТОВ | 2014 |
|
RU2549355C1 |
Изобретение относится к способу получения C-нитроимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана. Технический результат: разработан способ получения C-нитроимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана путем нитрования имидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана в системе HNO3/Ac2O при температуре от -5 до 20°С, который позволяет повысить выход целевого продукта. 1 пр.
Способ получения С-нитроимидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана, отличающийся тем, что нитрование имидазо[4,5-e]бензо[1,2-c;3,4-c’]дифуроксана проводят в системе HNO3/Ac2O при температуре от -5 до 20°С.
| D | |||
| Chand, C | |||
| He, L | |||
| A | |||
| Mitchell, D | |||
| A | |||
| Parrish, J.M | |||
| Shreeve, Electrophilic Iodination: A Gateway to High Iodine Compounds and Energetic Materials, Dalton Trans., 45, 13827-13835, 2016 | |||
| В.П | |||
| Ившин, В.В | |||
| Топоров, В.Л | |||
| Королев, А.В | |||
| Корманов, Состояние исследований и современные достижения в химии органических соединений - NO-доноров, МАТЕРИАЛЫ ПЯТОЙ МЕЖДУНАРОДНОЙ НАУЧНОЙ ШКОЛЫ "НАУКА И ИННОВАЦИИ - 2010", ISS "SI-2010", 396-402 | |||
| Способ получения N-карбэтоксиметилимидазо[4,5-е]бензо[1,2-с;3,4-с']дифуроксана | 2016 |
|
RU2618230C1 |
Авторы
Даты
2018-12-17—Публикация
2018-07-21—Подача