Изобретение относится к сельскому хозяйству и микробиологической промышленности в частности к штаммам, обладающим целлюлозолитической активностью и способствующих ускорению разложения целлюлозосодержащих субстратов, в том числе послеуборочных остатков сельскохозяйственных культур.
Известны различные таксономические группы микроорганизмов, способные к деструкции целлюлозосодержащих субстратов: например, использование культуры микромицета Paecilomyces variotii с целью получения органических удобрений (RU, патент 2094414 C05F 11/08, 1997); использование культуры гриба Rleurotus ostreatus при ферментативной переработке целлюлозосодержащих материалов с использованием на корм для животных (RU, патент 2080078 A23K 1/00, 1997).
Однако они имеют недостатки: процесс компостирования культурой микромицета Paecilomyces variotii ведут в условиях постоянной аэрации, и заканчивают при достижении величины рН более 7; применение культуры Rleurotus ostreatus требует провести первоначально, перед культивированием, обеззараживание сеносоломистого материала.
Активными продуцентами целлюлазы являются штаммы мицелиальных грибов рода Trichoderma. С целью повышения их способности к продукции ферментов и адаптации к более дешевым ферментационным средам были получены различные мутантные и рекомбинантные штаммы. В частности, мутант Trichoderma reesei MCG 80, который при непрерывном культивировании на питательной среде с 8%-ной целлюлозой и биотином обеспечивает высокую активность целлюлаз (Патент США №4472504, кл. C12N 9/42, 1984 г.). Мутант Tr. longibrachiatum TW-1 (BKM F-3634D), полученный с помощью многоступенчатого мутагенеза и селекции из исходной культуры ТУ. reesei var longibrachiatum QM6a (BKM F-2047D) с применением ультрафиолетового облучения (Патент РФ №2195490, 7 C12N 1/14, 9/42, 2001 г. ). Штамм Tr. longibrachiatum TW-1 имеет ферментные системы, позволяющие расти на среде с целлюлозой, крахмалом, хитином, пектином, ксиланом, ламинарином, лихенином.
Однако, для грибов рода Trichoderma характерно то, что они синтезируют фермент целлюлазу с максимальной активность в кислой среде (рН 4,5-5,0), а при повышенных значениях рН (рН 5,5-8,5) активность ферментов существенно снижается.
В качестве прототипа был принят штамм Penicillium verruculosum (Соловьева И.В., Окунев О.Н., Бельков В.В., Кошелев А.В., Бубнова Т.В., Кондратьева Е.Г., Скомаровский А.А., Синицын А.П. Получение и свойства мутантов-суперпродуцентов целлюлаз и ксиланаз // Микробиология, - 2005. - Т. 74. - №2. - С. 172-178) - продуцент целлюлаз, который способен синтезировать ферментный целлюлозолитический комплекс и расщеплять целлюлозосодержащие отходы.
К недостаткам данного штамма можно отнести способность гидролизовать лигнин и целлюлозосодержащий субстрат в условиях жидкофазного культивирования. Однако для микробиологического разложения целлюлозосодержащих отходов растительного происхождения необходимо обеспечить возможность твердофазного культивирования.
Для ускоренной микробиологической переработки целлюлозосодержащих субстратов в условиях твердофазного культивирования с широким спектром рН предлагается штамм Humicola fuscoatra ВНИИСС 016.
Видовое название Humicola fuscoatra.
Штамм Humicola fuscoatra ВНИИСС 016 выделен из чернозема выщелоченного, взятого на опытном поле ФГБНУ «ВНИИСС им. А.Л. Мазлумова» (Рамонский район Воронежской области). Штамм был введен в чистую культуру в результате высева почвенной суспензии в чашки Петри на элективную питательную среду Виноградского. Состав среды, г/л: KH2PO4 - 1,0; MgSO4×7 Н2О - 0,5; NaCl - 0,5; агар-агар - 20. Среда готовится на водопроводной воде как источнике микроэлементов. В качестве источника углерода использовали стерильную фильтровальную бумагу, которую помещали на поверхность разлитой в чашки Петри среды.
Для выделения культурально-морфологических и физиологических признаков штамма, его культивировали в чашках Петри на твердой питательной среде Виноградского при температуре 25-28°С.
Макроморфологические признаки
При выращивании штамма Humicola fuscoatra ВНИИСС 016 на среде Виноградского образуется вегетативный мицелий, стелющийся и ветвящийся. Колонии быстро растущие, при 25-28°С на 6-8 день они становятся белыми, на 10-е сутки - бело-серые, через 14 дней серые и в дальнейшем цвет колонии становится все темнее. Текстура колонии вначале пушистая, потом бархатистая по мере развития. Край колонии ровный, или немного волнистый, на обратной стороне окрашенный в темно-серый цвет, окружающий агар тоже имеет сероватую окраску. Запах отсутствует (фото 1).
Микроморфологические признаки
Штамм имеет гифальное строение, гифы септированные, бесцветные, шириной 4 мкм. Спороносные ветви в виде боковых ответвлений, на верхушках с одиночными конидиями. Конидии (алевроспоры) на маленьких веточках-конидиеносцах шаровидные, с двойными оболочками желтовато-коричневые, в отраженном свете черные, 9-16 мкм в диаметре (фото 2).
Физиологические признаки
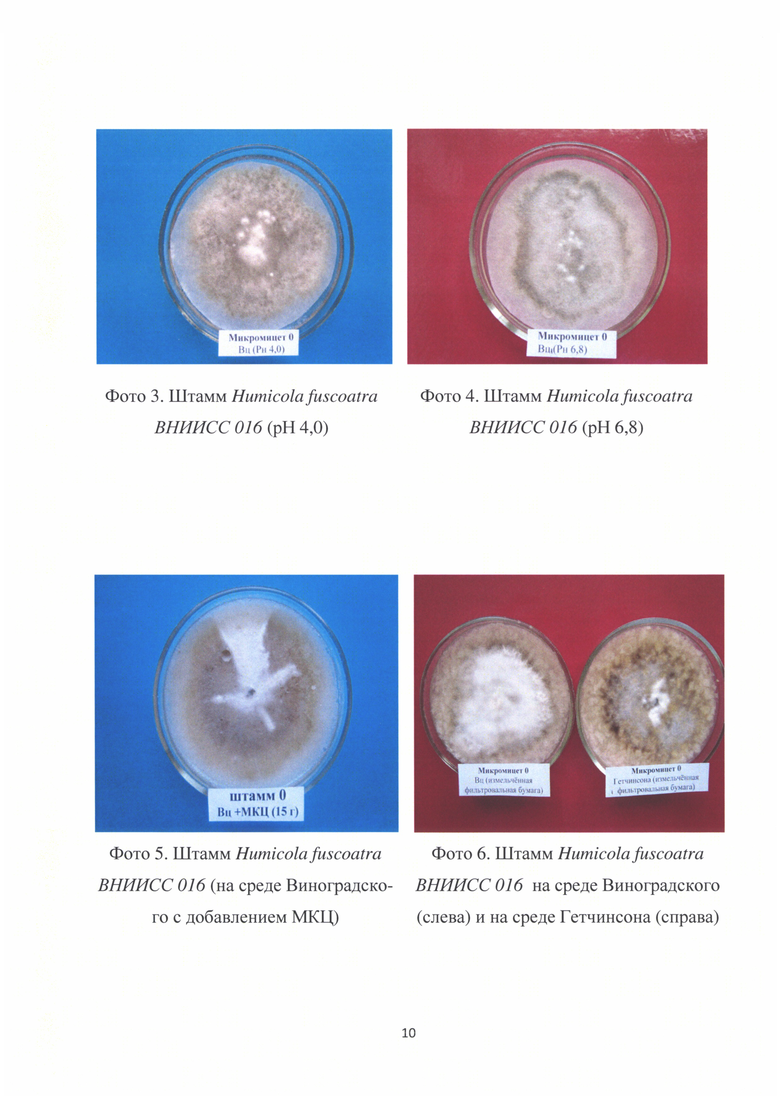
Отношение к значению рН. Штамм развивается в диапазоне значений рН 4,0-7,5, оптимум рН 5,5-6,8 (фото 3 и 4).
Отношение к температуре. Штамм хорошо растет при температуре от 20 до 35°С, оптимум роста 25-28°С.
Отношение к источнику углерода. Лучший рост штамма Humicola fuscoatra ВНИИСС 016 отмечен на среде Виноградского с использованием, в качестве субстрата фильтровальной бумаги, состоящей из целлюлозы. А также при добавлении к среде Виноградского микрокристаллической целлюлозы (МКЦ) в дозе 15 г/л (фото 5).
Отношение к источнику азота. Культура использует ионы NH4+ и NO3-. Легко ассимилируют органические источники азота.
Идентификация штамма Humicola fuscoatra ВНИИСС 016
Культура исследована по многочисленным свойствам, используемым в современной систематике.
Таксономическую принадлежность штамма определяли на основании изучения культурально-морфологических признаков и микроскопического строения с использованием соответствующих определителей (Саттон Д., Фотергилл А., Ринальди М. Определитель грибов / Пер. с анг. - М.: Мир, 2001. - 468 С.; Литвинов М.А. Определитель микроскопических почвенных грибов / М.А. Литвинов. - Л.: Наука, 1967. - 304 с.)
Для депонирования штамма была проведена и генетическая идентификация. Штамм был идентифицирован 8 июня 2016 г. в Национальном Биоресурсном Центре Всероссийская Коллекция Промышленных Микроорганизмов (Россия, Москва, 117545, 1-ый Дорожный проезд, 1, «ФГБУ ГосНИИгенетика»), где по результатам проведенного анализа нуклеотидной последовательности, кодирующей часть генов рРНК установлено, что исследуемый штамм наиболее близок к виду Humicola fuscoatra (99%)
Сведения о депонировании
Указанный штамм депонирован в Национальном Биоресурсном Центре Всероссийская Коллекция Промышленных Микроорганизмов ФГБУ «ГосНИИгенетика», штамму присвоен регистрационный номер F-1330.
Хранение штамма Humicola fuscoatra ВНИИСС 016
Штамм хранят на твердой питательной среде Виноградского. Состав среды, г/л: KH2PO4 - 1,0; MgSO4×7 H2O - 0,5; NaCl - 0,5; агар-агар - 20. Среда готовится на водопроводной воде как источнике микроэлементов. Гриб развивается в диапазоне значений рН 5,5-6,8. Температурный оптимум 25-28°С, необходимости в освещении нет.Лучший рост штамма отмечен на среде с использованием, в качестве субстрата, фильтровальной бумаги, состоящей из целлюлозы. При хранении на данной среде культуру пересевают через 3-4 месяца.
Условия и состав сред для размножения штамма
Штамм размножают на твердой питательной среде Виноградского. Гриб развивается в диапазоне значений рН 5,5-6,8 и температуре 25-28°С, необходимости в освещении нет.Можно использовать и среду Гетчинсона - Клейтона. Состав среды г/л: NaNO3 - 2,5; KH2PO4 - 1,0; MgSO4 - 0,3; NaCl - 0,1; CaCl2 -0,1; FeCl2 - 0,01; агар-агар - 20,0. Но лучший рост отмечен на среде Виноградского (фото 6).
Генетические особенности штамма
Мутации не выявлены. Штамм был найден в естественных условиях, поэтому он не является генетически модифицированным и не содержит генов других организмов; перенесенных генов резистентности; генетических изменений, связанных с использованием генно-технических методик.
Сведения о безопасности использования штамма
Штамм не является зоопатогенным или фитопатогенным.
Активность (продуктивность) штамма
Штамм Humicola fuscoatra ВНИИСС 016 активно разлагает целлюлозу, входящую в состав фильтровальной бумаги, используемой при культивировании чистой культуры на твердой питательной среде Виноградского. При этом происходит нарушение структуры волокон целлюлозы, - это отчетливо видно на снимках, сделанных с помощью сканирующего электронного микроскопа (фото 7, 8).
Пригодность штамма для использования в качестве деструктора целлюлозосодержащих субстратов доказывается следующими примерами: Пример 1.
В лабораторных условиях установили режим разложения соломы озимой пшеницы с помощью штамма совместно с минеральным азотом. Опыты проводили в чашках Петри в моделируемых условиях, в четырехкратной повторности. Режим культивирования был близкий по температурно-влажностным показателям к полевым условиям, которые складываются в конце августа - сентябре в ЦЧР, то есть при температуре 20-25°С, влажности субстрата не выше 60% от полной влагоемкости. Штамм Humicola fuscoatra ВНИИСС 016 использовали в дозе 4300 шт. спор в 1 мл. Степень разложения субстрата определяли весовым методом.
Результаты 30-дневной экспозиции представлены в табл.1.
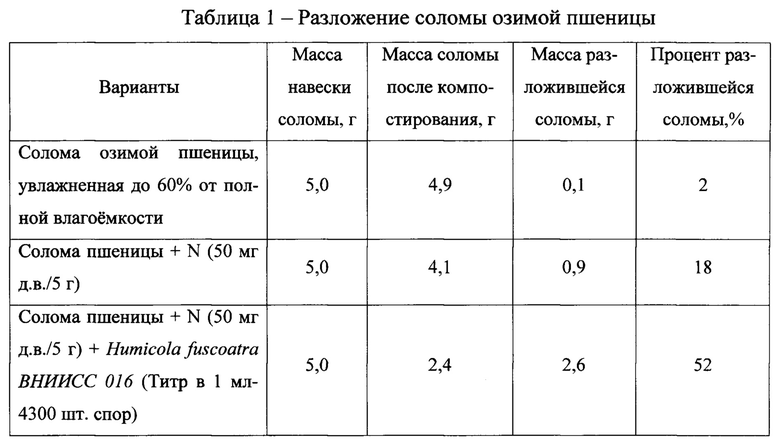
Солома с естественным полевым содержанием зачатков микроорганизмов при увлажнении до 60% от полной влагоемкости субстрата практически не подвергается деструкции (2% разложившегося сухого вещества).
Добавление к субстрату минерального азота (50 мг д.в./5 г соломы) способствовало ускорению разложения соломы, что выразилось в снижении ее массы на 18% от начальной. Максимальная степень разложения соломы озимой пшеницы (52%) установлена при использование Humicola fuscoatra ВНИИСС 016 совместно с азотом (50 мг д.в./5 г, что соответствует 40 кг/га).
Таким образом, штамм Humicola fuscoatra ВНИИСС 016 в комплексе с азотом (50 мг д.в./5 г соломы), ускоряет разложение соломы озимой пшеницы на 50% по сравнению с естественным протеканием процесса деструкции (фото 9).
Пример 2.
В лабораторных условиях проводили опыт по изучению динамики убыли массы соломы ячменя. Эксперимент осуществляли в трехкратной повторности в моделируемых условиях, приближенных к полевым. Остатки соломы ячменя после уборки урожая измельчали и помещали в чашки Петри навеской 4 г. Субстрат увлажняли до 60% от полной влагоемкости субстрата и оставляли в термостате на 2 месяца. Штамм Humicola fuscoatra ВНИИСС 016 использовали в дозе 4300 шт. спор в 1 мл. Результаты приведены в табл.2.
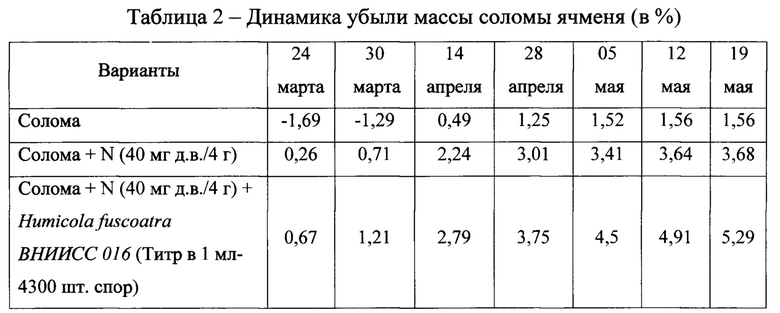
Солома ячменя потеряла в весе 0,82 г, солома с азотным удобрением -1,06 г, а солома с Humicola fuscoatra ВНИИСС 016 - 1,13 г (фото 10).
Пример 3.
Опыт с измельченными послеуборочными остатками подсолнечника и кукурузы заложили в чашках Петри в трехкратной повторности в моделируемых условиях, приближенных к полевым. Масса навески составляла 4 г. Штамм Humicola fuscoatra ВНИИСС 016 использовали в дозе 4300 шт. спор в 1 мл. Время экспозиции - 30 дней.
Результаты исследования приведены в табл.3.
Остатки подсолнечника и кукурузы разложились соответственно на 12,5 и 5%. Степень разложения послеуборочных остатков подсолнечника и кукурузы под воздействием штамма увеличивается по сравнению с естественным протеканием процесса деструкции. Максимальное разложение послеуборочных остатков установлено при добавлении к субстрату штамма Humicola fuscoatra ВНИИСС 016. Процент разложения остатков составил 47,5 и 27,5% (фото 11, 12).

Следует отметить, что растительные остатки подсолнечника лучше разрушаются по сравнению с остатками кукурузы, что обусловлено разницей в строении стеблей культур.
Таким образом, из приведенных примеров видно, что штамм Humicola fuscoatra ВНИИСС 016 ускоряет разложение целлюлозосодержащих субстратов (соломы зерновых культур и послеуборочных остатков подсолнечника и кукурузы) в условиях твердофазного культивирования с широким спектром рН.



Изобретение относится к биотехнологии. Штамм Humicola fuscoatra ВНИИСС 016, обладающий целлюлозолитической активностью, депонирован в Национальном Биоресурсном Центре Всероссийская Коллекция Промышленных Микроорганизмов (ФГБУ «ГосНИИгенетика») под регистрационным номером Humicola fuscoatra ВКПМ F-1330. Штамм Humicola fuscoatra ВКПМ F-1330 может быть использован в сельском хозяйстве и микробиологической промышленности. Изобретение позволяет ускорить микробиологическую переработку целлюлозосодержащих субстратов в условиях твердофазного культивирования. 12 ил., 3 табл., 3 пр.
Штамм Humicola fuscoatra ВНИИСС 016, обладающий целлюлозолитической активностью, осуществляющий деструкцию целлюлозосодержащих субстратов, депонированный в Национальном Биоресурсном Центре Всероссийская Коллекция Промышленных Микроорганизмов «ФГБУ ГосНИИгенетика» под регистрационным номером F-1330.
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА TRICHODERMA LONGIBRACHIATUM - ПРОДУЦЕНТ КОМПЛЕКСА КАРБОГИДРАЗ, СОДЕРЖАЩЕГО ЦЕЛЛЮЛАЗЫ, БЕТА-ГЛЮКАНАЗЫ, КСИЛАНАЗЫ, ПЕКТИНАЗЫ И МАННАНАЗЫ | 2001 |
|
RU2195490C2 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОЙ ОБРАБОТКИ ЦЕЛЛЮЛОЗОСОДЕРЖАЩЕГО СЫРЬЯ | 2013 |
|
RU2542523C1 |
| СПОСОБ МИКРОБИОЛОГИЧЕСКОЙ ОБРАБОТКИ ЦЕЛЛЮЛОЗОСОДЕРЖАЩИХ МАТЕРИАЛОВ | 1999 |
|
RU2169760C1 |
| СПОСОБ БИОКОНВЕРСИИ РАСТИТЕЛЬНЫХ ОТХОДОВ И УСТАНОВКА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1999 |
|
RU2163076C1 |
Авторы
Даты
2018-12-18—Публикация
2018-03-05—Подача