Изобретение относится к области биологических исследований и касается способа заклейки глаза и оценки зрительно-моторного поведения гидробионтов.
Данное открытие относится, в общем виде, к созданию экспериментальных моделей с использованием животных, и, в частности, к способам заклейки глаз экспериментальных водных животных для изучения зрения и зрительно-двигательных реакций in vivo.
Работа поддержана грантом номер №16-04-01759 Федерального государственного бюджетного учреждения «Российский фонд фундаментальных исследований». Права на изобретение принадлежат Федеральному государственному бюджетному учреждению науки Институту теоретической и экспериментальной биофизики Российской академии наук.
Экспериментальные модели с использованием животных в биомедицинских исследованиях необходимы для оценки степени заболеваний, их протекания и поиска возможных способов лечения. Заклейка глаза (в результате травмы, после хирургической операции или вследствие болезни) привлекает внимание широкого круга исследователей, поскольку связана с широко известным в офтальмологической практике заболеванием, носящим название депривационная амблиопия. Восстановление зрения после хирургического вмешательства не происходит, слепота и глубокие дефекты зрения (например, неспособность отличать геометрические фигуры и т.п.) сохраняются, несмотря на месяцы и годы попыток «научить видеть». «Отключение» зрения с одной стороны тела влияет, в первую очередь, на механизмы нейронной пластичности, лежащие в основе зрительно-моторной интеграции (Prusky et al., 2006; Niechwiej-Szwedo et al., 2012; Kaneko, Stryker, 2015). Исследования в данном направлении проводятся преимущественно на высших позвоночных животных с бинокулярным зрением, которым зашивают или заклеивают глазное веко на длительный период. К сожалению, функциональная межполушарная асимметрия мозга позвоночных и сложность его организации препятствуют выявлению связи между функциональной нагрузкой на афферентный вход конкретного нейрона, его морфологическими характеристиками (размером его отдельных частей и состоянием актинового цитоскелета) и особенностями моторного поведения животного (Tailby et al., 2005). Конструктивной модельной тест-системой, которая позволяет обнаружить нарушения сенсомоторной интеграции, служат низшие позвоночные, в частности, костистые рыбы. Асимметрия зрительной функции рыб подробно изучена во взаимосвязи с латерализацией моторного поведения (Sovrano et al., 2001; Dadda et al., 2012), а также в связи с выполнением рыбами зрительно-двигательных реакций, например, оптокинетической реакции (Shtanchayev et al., 2007). Механизмы определения движения, которые рыбы используют при осуществлении оптокинетических реакций, сходны с теми, которые используют приматы (Orger et al., 2000). Более того, в продолговатом мозге костистых рыб находятся два парных ретикулоспинальных Маутнеровских нейрона, которые относятся к числу немногочисленных модельных объектов, на которых возможно тестирование потенциальных агентов, способных влиять на зрительно-моторное поведение рыб in vivo (Moshkov et al., 2013). Наиболее ценно то, что пластичность этих нейронов отображается в моторном поведении с помощью коэффициента моторной асимметрии рыб, который свидетельствует об экспериментально вызванном перераспределении значимости левого и правого Маутнеровских нейронов в реализации двигательных актов (Korn, Faber, 2005). Визуализируя Маутнеровские нейроны рыб с помощью методики трехмерной компьютерной реконструкции по серийным гистологическим срезам мозга (Михайлова и др., 2012), можно определить структурные субстраты, ответственные за сохранение функционального сдвига, то есть нейропластические перестройки (Moshkov et al., 2009).
Использовать традиционный подход к долговременному закрытию глаза, основанный на зашивании или заклеивании века (Wiesel et Hubel, 1963; Prusky et al., 2006), на рыбах не представляется возможным, поскольку не у всех видов рыб есть глазные веки. Кроме того, рыбы живут в водной среде и для заклеивания глаза нужна водостойкая, длительно удерживающаяся на коже животного маска. Поэтому на сегодняшний день метод монокулярной депривации рыб (или закрывания глаза) используют только в краткосрочных экспериментах (Easter, 1972; Fritsches and Marshall, 2002; Qian et al., 2005; Cameron et al., 2013). Так, с помощью заклейки глаза рыб можно моделировать нарушения остроты зрения, контрастной чувствительности и асимметрии оптокинетического ответа, характерные для таких заболеваний как амблиопия и врожденный горизонтальный нистагм (Maurer et al., 2011; Tappeiner et al., 2012; Cameron et al., 2013). Кратковременную обратимую депривацию костистых рыб используют для оценки зависимости скорости оптокинетического ответа от зрительной функции. При этом проводят оптокинетическую стимуляцию иммобилизованных рыб как в назо-темпоральном (против часовой стрелки), так и в темпоро-назальном (по часовой стрелке) направлении (Rick et al., 2000; Qian et al., 2005). Qian с сотр., изучая асимметрию оптокинетических реакций у рыбок-зебр, закрепляли черную пластиковую крышку впереди глаза рыбы в том же растворе метицеллюлозы, в котором находилось иммобилизованное животное (Qian et al., 2005). Аналогичный способ зрительной депривации описан в работе Cameron с сотр., который был использован для измерения остроты зрения каждого глаза рыбок-зебр (Cameron et al., 2013). Вышеперечисленные способы позволяют получить достоверные экспериментальные данные, однако обладают своими недостатками. В первую очередь, способы не исключают попадания световых лучей в глаз и не обеспечивают прекращения притока зрительной информации. Как следствие, сходимость (повторяемость) результатов при использовании данного способа депривации довольно низкая. Так, исследователям приходится прикладывать значительные усилия для перекрывания притока зрительной информации при моделировании катаракты на генетических мутантах рыб rp2/bugeye с асимметричным развитием глаза (Stujenske et al., 2011). Точность этого метода сумели повысить исследователи Kerstin A. Fritsches and N. Justin Marshall, которые, изучая движения глаз, впервые заклеили глаз некоторых видов костистых рыб (отр. пучкожаберных, морская игла Corythoichthyes intestinalis, песчанка Limnichthyes fasciatus, отр. щетинозубые Chaetodon rainfordi). Они использовали в качестве окклюдатора маленький диск непрозрачного черного пластика, который приклеивали на один глаз животного с использованием суперклея (Fritsches and Marshall, 2002). Для рыб с небольшими выступающими глазами, был изготовлен окклюдатор конической формы из алюминиевой фольги. Преимуществом работы было то, что окклюдатор полностью закрывал зрачок, что исключило бинокулярное зрение рыб и позволило успешнее оценивать зрительно-моторные реакции животных. Однако анестезия гвоздичным маслом в концентрации 0.2 Моль/л (базовый раствор 85-95%, Sigma), недостаточная подготовка кожи к приклеиванию окклюдатора и его состав могут привести к отклейке окклюдатора и не гарантируют получения данных на большом объеме животных в условиях ведения длительных экспериментов в водно-воздушной среде, особенно при исследовании оптомоторного ответа животных. Таким образом, ограничением всех перечисленных способов (Fritsches and Marshall, 2002; Qian et al., 2005; Cameron et al., 2013) является то, что они не позволяют животному перемещаться в пространстве и выполнять оптомоторный рефлекс.
Данное ограничение сумел преодолеть только исследователь Easter, который в 1972 г. впервые предложил методику краткосрочного (на время эксперимента) закрытия глаза для изучения зрительно-моторного поведения золотых рыбок Carassius auratus (Easter, 1972). В этих экспериментах к роговице глаза с помощью присоски прикрепляли полиэтиленовую трубку (РЕ 240) шириной 2 мм, длиной 11 мм, плотно закрытую с одного конца, расширяющуюся к другому концу и наполненную черным красителем. Преимуществом этого устройства было то, что окклюдатор не мешал рыбе свободно перемещаться в водном пространстве и выполнять оптокинетический рефлекс. Недостатком устройства являлось неполное закрывание зрачка, поэтому о полноценной монокулярной депривации говорить нельзя.
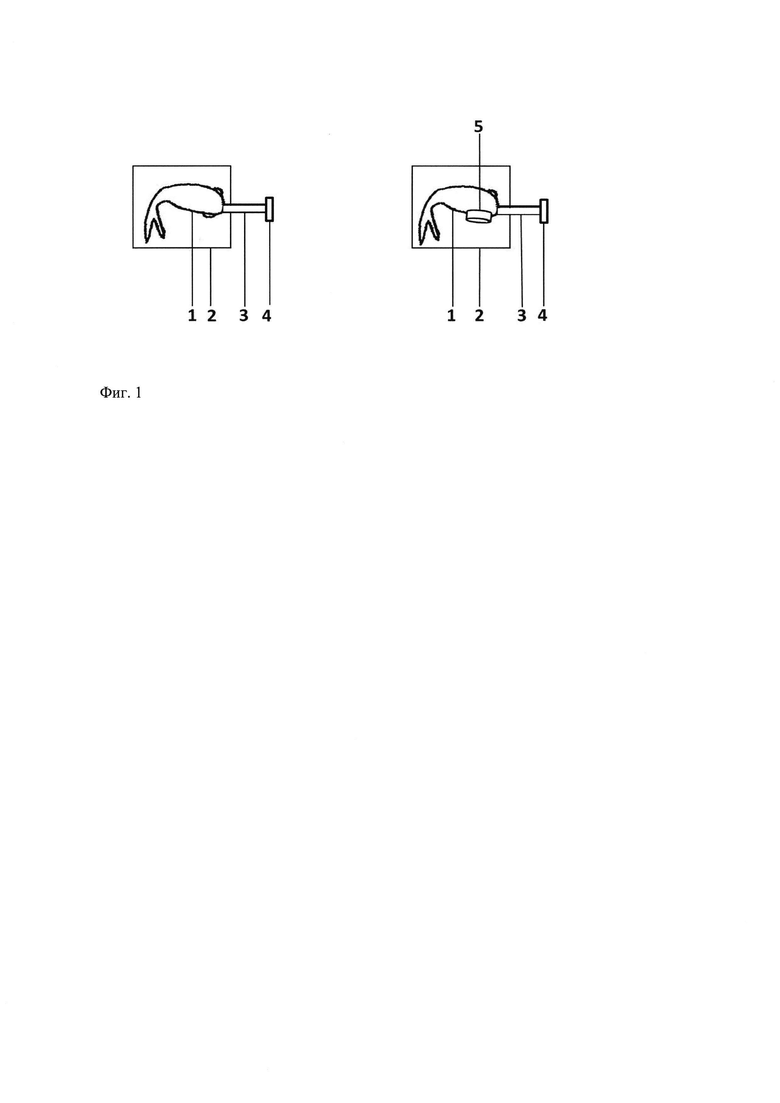
Таким образом, методики, предлагаемые данными авторами, могут использоваться лишь для краткосрочных исследований. Между тем, заклейка глаза на продолжительное время имеет свои преимущества. Во-первых, заклейка глаза на длительное время открывает новые возможности для фундаментальных исследований асимметрии оптомоторного ответа генетических мутантов рыбок-зебр (Neuhauss et al., 1999). Заклейка глаза полностью исключает бинокулярное зрение, обеспечивает подвижность рыб и позволяет интерпретировать данные, полученные на генетических мутантах рыб с помощью других методик и трудно поддающиеся объяснению (Burgess et al., 2010). Во-вторых, учитывая современный уровень развития научных исследований и возможность исследовать in vivo, какие именно нейроны задействованы при выполнении оптокинетической реакции (Ahrens et al., 2012), метод заклейки глаза открывает перспективы для исследования механизмов нарушений глазодвигательных реакций человека и животных, особенно выраженных в таких условиях сенсорной депривации, как микрогравитация и депривационная амблиопия. Кроме того, метод заклейки глаза на длительное время является перспективным при создании экспериментальных моделей в биомедицинских целях. Так, можно использовать оптокинетические реакции рыб как основу для изучения механизмов нейропластичности (Shtanchayev et al., 2007; Grigorieva et al., 2010), аналогично тому, как на сегодняшний день используют зрительные стимуляции грызунов, подвергнутых временной монокулярной депривации на ранних этапах жизни (Kaneko et Stryker, 2014). Необходимо учитывать также, что заклейка глаза может способствовать уменьшению методической ошибки при проведении эксперимента, так как обеспечивает, во-первых, полное прекращение притока зрительной информации в одно из полушарий мозга, а во-вторых, снимает возникновение побочных эффектов от иммобилизационного стресса. Последний возникает при проведении сеансов оптокинетической стимуляции, когда животное иммобилизуют с помощью различных приспособлений, а в случае неудачной иммобилизации эксперимент продлевается в ряде случаев до 30 минут (Rick et al., 2000). Стрессовый характер эксперимента, безусловно, влияет как на поведение рыбок, так и на структуру мозга и его отделов, перестраивающихся при стрессе (Штанчаев, 2008), и эти влияния, далеко не однозначные, требуют специальных исследований. Так, иммобилизация рыбок с помощью механических приспособлений в течение нескольких часов способна привести к разбалансировке морфофункционального гомеостаза Маутнеровских нейронов, в том числе и к изменениям объемов тех или иных участков клеток, в частности латеральных дендритов (Штанчаев, 2008). Все эти вопросы невозможно изучить подробно без использования заклейки глаза на длительное время. Задачей предлагаемого способа является обеспечение монокулярной депривации, то есть «отключения» зрения с одной стороны тела животного на срок, достаточный для проявления компенсаторных нейропластических изменений, и стандартизация условий приклеивания глазной маски к коже животного. Предлагаемый метод заклейки одного глаза прост в использовании, удобен в работе с большим количеством животных и позволяет интерпретировать данные, полученные с помощью других методик. Предлагаемая методика позволяет готовить многослойные маски площадью требуемого размера, в которых основным слоем, контактирующим с глазом, является безопасная жидкая основа для маски на целлюлозно-каучуковой основе. Этот слой с одной стороны соприкасается с внутренним слоем (кожным клеем), с другой стороны с водостойким клеем (внешняя поверхность маски). Протокол выполнения исследований по заклейке глаза включает в себя следующие этапы: анестезия животного и его обездвиживание, процедуры по защите глаза животного от высыхания, подготовка кожи животного к приклеиванию глазной маски, послойное приклеивание маски на глаз, постоперационная реабилитация. Чем дольше рыбка находится в установке с заклеенным глазом, тем более качественным будет эффект операции. Поэтому мы вводили рыбе под холодовой анестезией внутрибрюшинно миорелаксант тубокурарин (1 мкг на 1 г веса тела) (тубокурарина гидрохлорид, Sigma), что способствовало обездвиживанию рыб на полный рабочий день. Fritsches и Marshall в своих исследованиях использовали анестезию гвоздичным маслом в концентрации 0.2 Моль/л (базовый раствор 85-95%, Sigma), что подразумевает быструю анестезию животного и некачественное приклеивание окклюдатора к его коже. Другие исследователи (Easter, 1972; Qian et al., 2005) совсем не использовали анестезии для приклеивания окклюдатора к коже вокруг глаза животного. Предлагаемый нами способ требует длительного нахождения рыбки в установке под анестезией. На рисунке (фиг.1, слева) показано, что рыбку (1) укладывали на подложку (2) требуемой стороной вверх и подключали с помощью пластиковой трубки (3), вставляемой в ротовое отверстие (фиг. 1, слева), к перистальтическому насосу (4) для промывания жабр (скорость протока воды 15-20 мл/мин). Тело рыбки накрывали мокрой тряпочкой (за исключением головы). Далее выполняли процедуры по подготовке кожи животного к приклеиванию маски (5) (фиг. 1, справа). С помощью медицинской груши (спринцовка) с самодельным острым наконечником на зрачок аккуратно наносили небольшое количество сульфацетамида, либо другого противомикробного, обеззараживающего средства для глаз. В течение 1-2 часов кожа вокруг глаза подсушивали фильтровальной бумагой и обдуванием через пластиковую тонкую иглу, соединенную со спринцовкой. Периодически (раз в 10-20 мин) глаз смачивают водой, причем важно, чтобы вода не стекала с глаза на кожу. Устройство для защиты глаза экспериментального животного от высыхания описывалось в заявке на изобретение US 2014352703 (A1), однако имелись в виду не водные животные, а мыши или крысы. Затем, кожу вокруг глаза прижигали перекисью водорода, избегая попадания ее на глаз, при этом кожу зачищали скальпелем и повторно прижигали перекисью водорода. Предварительно подсушив, то же самое проводили, используя спирт. Для предотвращения воспалительной реакции наносили на зрачок небольшое количество гидрокортизона в виде глазной мази на вазелиновой основе, аккуратно размазывая ее по зрачку и вокруг зрачка. Затем послойно наносили клеевую маску специального состава. В первую очередь наносили 8 мкл (эмпирически подобранный объем для 4-6 см рыбок) кожного клея Dermabond на цианакриловой основе (Ethicon Inc.) на полностью высушенную кожу вокруг глаза с помощью дозатора. Клей аккуратно распределяли по всей коже, преимущественно на костяную преджаберную основу под глазом и черепную основу над глазом, избегая попадания клея на ухо, предротовую область и хоану. С помощью заостренной палочки наносили жидкую основу для маски на целлюлозно-каучуковой основе (Ardell Lash Grip Adhesive Dark, American International Industries), прежде всего, поверх кожного клея, то есть вокруг глаза. Потом каплю целлюлозно-каучукового клея наносили на сам глаз, полностью закрывая его. С помощью той же палочки аккуратно разравнивали маску (5) по глазу и коже вокруг него (фиг. 1, справа). После того, как маска окончательно подсохнет, наносили на нее дополнительную водоизоляцию в виде водостойкого клея на полиуретановой основе, который наносится по всей поверхности маски, а также по сухой кромке кожи рыбки вокруг маски. После проведенной операции оставляли рыбку минимум на час в установке. Возвращали оперированную рыбку в индивидуальный мини аквариум, убедившись в том, что она окончательно проснулась. Это проверяли, отсоединяя трубку для подачи воды в жабры - проснувшаяся рыбка активно двигала ртом и шевелилась. После операции рыбку следует содержать в течение недели в слабом растворе метиленового синего (не более 3 мг на 1 л) или любом другом специализированном обеззараживающем растворе для профилактики развития инфекций. Тестировать рыбку можно на вторые-третьи сутки после операции. Однако более оптимальным временем для начала многодневного тестирования следует считать 13-14 дни после операции, если исходить из опытов по необратимой монокулярной депривации (Grigorieva et al., 2010), показавших поведенческий эффект от операции спустя две недели после энуклеации глаза. Заклеенная таким способом глазная маска прочно удерживается в течение 3 недель и более. Временем окончания монокулярной депривации считали день самопроизвольного отклеивания маски. Следует отметить, что оперированный глаз в большинстве случаев выглядит интактным после отклеивания маски. Тестирование моторного поведения рыбок в ходе реабилитационного периода проводили в узком прямолинейном коридоре через десять дней после отклеивания маски и начала бинокулярного зрения.
Пример 1. Влияние заклейки глаза (или монокулярной депривации) и дальнейшей отклейки на параметры моторного поведения золотых рыбок и структуру их Маутнеровских нейронов.
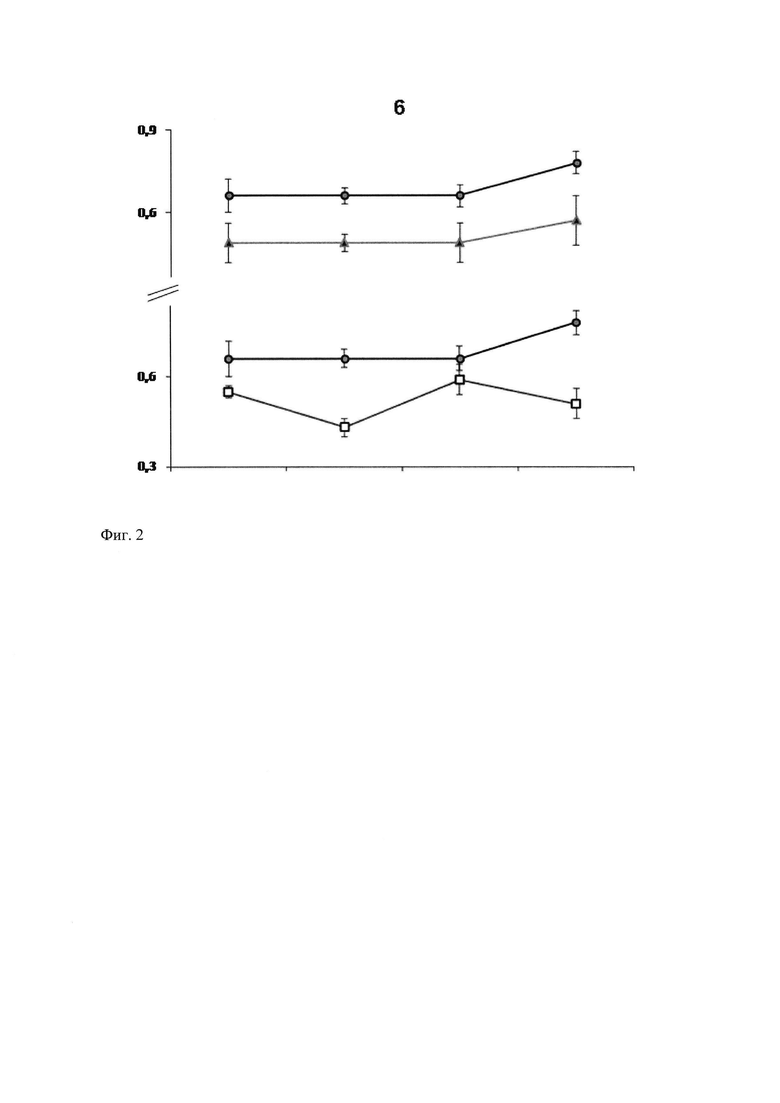
Степень латерализации рыб оценивали с помощью коэффициента моторной асимметрии (КМА), который представляет собой отношение числа полных поворотов в предпочитаемую сторону к сумме поворотов в обе стороны, совершенных рыбкой за 5 минут тестирования в узком прямолинейном коридоре (Михайлова и др., 2005). Сдвиг КМА до значений ниже 0,47-0,50 в ходе эксперимента указывает на инверсию моторной асимметрии, т.е. смену предпочтения стороны поворотов. В данной части работы было показано, что заклейка глаза рыб - амбидекстров, изначально не имевших предпочтения стороны поворотов, приводит к развитию предпочтения поворотов в сторону депривации, причем уже на первые сутки после операции. Сдвиг моторной асимметрии в ослепленную сторону составлял более 30% (n=8, р<0,001). Заклейка правого глаза у рыбок-правшей и заклейка левого глаза у рыбок-левшей приводила к обострению исходной моторной асимметрии и, как следствие, к достоверному увеличению КМА приблизительно на 30%. Спустя 9±2 суток1 (1 Указано среднее ±95% доверительный интервал. В целом, разброс дней тестирования моторной асимметрии рыбок составлял от 2 до 23 суток после операции.) после операции степень латерализации моторного поведения рыбок увеличивается (n=6; р<0,001). Монокулярная депривация правшей и левшей, осуществленная с другой стороны тела, спустя 3-6 суток приводила к инверсии моторного предпочтения (фиг. 2, под цифрой 3; * звездочкой указаны статистически значимые различия, р<0,001).
В процессе наблюдения за поведением рыбок после отклеивания глазной маски было обнаружено, что предпочтение поворачиваться в сторону оперированного глаза, в целом, сохранялось. Очевидно, что сразу после депривации степень латерализации моторного поведения рыбок увеличивается и остается на высоком уровне через 18 дней после отклеивания глазной маски (n=10;*, р<0,05). Величина КМА в восстановительный период свидетельствовала о сохранении латерализованного состояния животных. Снижение среднего КМА после восстановительного периода относительно того же параметра после монокулярной депривации составляло от 9 до 15% у разных особей, оставаясь на 4-32% выше дооперационного значения КМА. Скорость совершения рыбками поворотов после операции статистически значимо снижалась с 4.4±0.6 до 2.4±0.4 пов./мин (p<0.001, n=8). При этом скорость поворотов возвращалась к исходному уровню и даже несколько превышала его через 17-18 дней после отклеивания глазной маски (5.7±1.3 пов./мин; р<0,05).
Обнаруженная нами латерализация моторного поведения у золотых рыбок, подвергнутых монокулярной депривации, является, вероятнее всего, вариантом адаптивной стратегии головного мозга в ответ на одностороннее лишение зрительного опыта. Главными кандидатами на роль нейрональной мишени депривации в ЦНС, которая может быть вовлечена в изменение относительной частоты спонтанных поворотов, могут служить Маутнеровские нейроны и другие ретикулоспинальные клетки ствола мозга. Эти клетки принимают непосредственное участие в контроле моторной активности рыб и амфибий, преобразуя поступающую в головной мозг сенсорную информацию в командные сигналы для двигательных нейронов спинного мозга. В настоящее время известно, что Маутнеровская клетка рыб состоит из клеточного тела (сомы), имеющего максимальный диаметр 80 мкм, а длину 100 и более мкм, аксона, и двух дендритов, латерального и вентрального, отходящих от сомы под углом около 900 друг к другу. Кроме того, с вентральной стороны от тела клетки отходит несколько маленьких (медиальных) дендритов. Латеральный, самый крупный из дендритов, простирается от клеточного тела в латеро-каудальном направлении на расстояние около 360 мкм в область мозга, которую образуют входящие волокна VIII-го нерва. Вентральный дендрит отходит от тела клетки вблизи аксонного холмика в вентральном направлении на расстояние более 500 мкм. Сома и латеральный дендрит каждого Маутнеровского нейрона получают слуховую и вестибулярную, а вентральный дендрит - зрительную афферентацию. Аксон иннервирует через мотонейроны мускулатуру противоположной стороны тела. Слуховая (вестибулярная) или зрительная стимуляция одного из Маутнеровских нейронов, благодаря полному анатомическому перекресту зрительных нервов и аксонов, вызывает поворот тела рыбки. Примечательно, что Маутнеровские нейроны являются связующим звеном между зрительной информацией, поступающей в мозг, и спинальными мотонейронами, активирующими туловищную мускулатуру. В нашем случае развитие моторной асимметрии в ослепленную сторону можно объяснить перераспределением функциональной активности одного Маутнеровского нейрона относительно его напарника вследствие резкого изменения зрительного притока к этим нейронам. Поэтому вклад нейрона, испытавшего депривацию, в осуществление поворотов при свободном плавании рыбки усиливается. Исходя из этого, можно заключить, что стойкое увеличение моторной асимметрии в слепую сторону при энуклеации глаза, а, следовательно, и после заклеивания повязки, является характерным признаком посттравматических изменений сенсорно-двигательного аппарата именно на уровне Маутнеровских клеток.
Чтобы проверить предположение о вкладе Маутнеровских нейронов в развитие моторной асимметрии, был проведен анализ трехмерной структуры нейронов депривированных рыб с помощью трехмерной компьютерной реконструкции по серийным гистологическим срезам толщиной 3 мкм (Михайлова и др., 2012). Количественные данные, характеризующие объем сомы и дендритов нейронов, а также поведения рыбок до и после операции представлены в табл. 1. Буквами К и И в таблице обозначены Маутнеровский нейрон с повышенной частотой активации и менее активный Маутнеровский нейрон, соответственно. Нейрон с отметкой «К» является контралатеральным стороне операции и подвергается временному лишению зрительной афферентации, т.е. является временно депривированным. Видно, что объемы латеральных дендритов обоих нейронов, а также вентрального дендрита недепривированного нейрона сопоставимы в контроле и опыте; объемы соматических частей клеток также близки по своим значениям (различия составляют не более 25%). В то же время, объем стволового участка вентрального дендрита депривированного нейрона уменьшается почти в 2 раза по сравнению с объемом вентрального дендрита контрольных рыб (табл. 1). Еще одним структурным признаком депривации является увеличение объема медиальных дендритов депривированных Маутнеровских клеток (табл. 1).
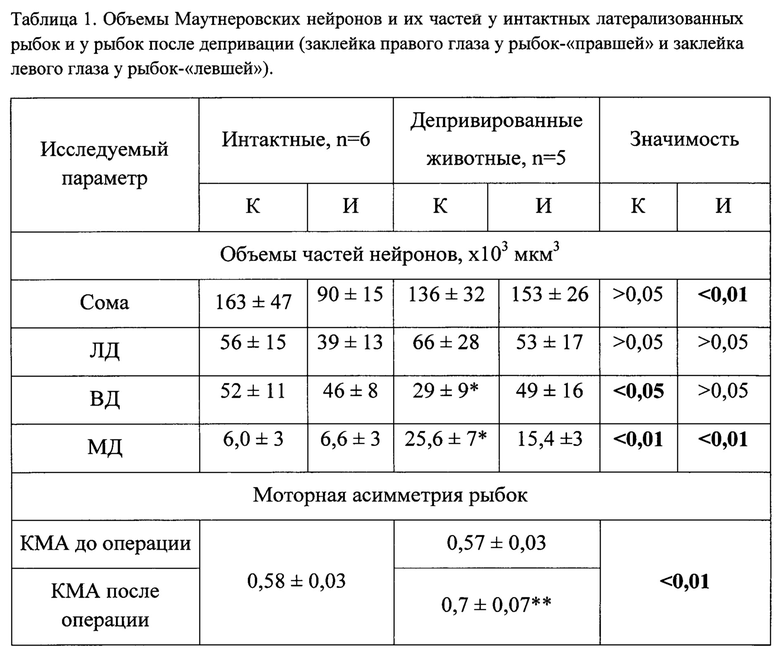
Обозначения: ЛД, ВД и МД - латеральный, вентральный и медиальные дендриты, соответственно, КМА - коэффициент моторной асимметрии. Звездочкой * отмечены статистически значимые различия объемов вентральных и медиальных дендритов именно депривированных нейронов. Звездочкой ** отмечены статистически значимые различия КМА после операции от КМА до операции, р<0,005; КМА рассчитывали по результатам тестирования на 2-11 сутки после операции (в среднем, 6±1 сут).
Через 18 суток со дня отклеивания маски значение коэффициента латерализации моторной функции снижалось до 0,59±0,14. Мозг фиксировали на 18-е сутки после отклеивания глазной маски. Очевидно, что объем вентрального дендрита левого нейрона, временно переставшего принимать зрительную афферентацию вследствие операции, остается меньшим в сравнении с дендритом своего зеркального аналога (табл. 2). Кроме того, количество и объем медиальных дендритов у рыбок, подвергнутых монокулярной депривации (табл. 1), увеличивается, а впоследствии, после восстановительного периода, снова уменьшается до исходного уровня (табл. 1 и 2). Результат можно объяснить тем, что скорость поворотов рыб с заклеенным глазом снижается, а после восстановительного периода данный параметр возвращается к норме. Статистический анализ, проведенный на нескольких рыбках, чей мозг был зафиксирован спустя примерно 2 недели после отклеивания глазной маски, подтвердил указанное наблюдение (табл. 2). Медиальные и вентральные дендриты Маутнеровского нейрона содержат на своей поверхности многочисленные тормозные синапсы, и, судя по данным результатам, депривация вызывает увеличение общего количества синапсов на единицу поверхности дендрита, а, значит, и изменение эффективности тормозной синаптической передачи. В целом, полученные данные указывают на роль тормозных влияний, опосредуемых ингибиторными нейронами, главными нейромедиаторами которых являются ГАМК и глицин.


Обозначения в таблице 2 те же, что и в таблице 1. Звездочкой * указано значимое отличие объема дендрита от контроля, р<0,05. Звездочками ** отмечены статистически значимые отличия КМА после операции от КМА в контроле, р<0,001; КМА рассчитывали по результатам тестирования на 7-17 сутки со дня операции (в среднем, 11±2 сут). Звездочками *** отмечены значения КМА, которые рассчитывали по результатам тестирования на 6-18 сутки после окончания депривации (в среднем, 12±1 сут).
Пример 2. Изучение асимметрии оптомоторного ответа в условиях монокулярной депривации.
Логично было бы предположить, что возможной причиной неполного восстановления поведения рыбок и, следовательно, функции Маутнеровских нейронов является травмирующее воздействие депривации на оперируемый глаз, вследствие чего зрение само по себе не восстанавливается, или восстанавливается частично. Чтобы выяснить этот вопрос, было исследовано влияние оптокинетической стимуляции на плавание рыбок в правую и левую стороны. Такой способ оценки зрительного восприятия рыбки основан на оптомоторной реакции, инстинктивном следовании животных за движущимися ориентирами. Унилатеральную зрительную стимуляцию проводили с помощью оптомоторного барабана, вращающегося со скоростью 30 оборотов в мин, с наклеенными на него контрастными черно-белыми полосками (пространственная частота подачи сигнала 0,04 цикл/град). Для оценки сохранности зрительного восприятия рыбки был использован экспериментальный тест-аквариум, модифицированный внутренней непрозрачной стенкой с учетом преимущественно монокулярного зрения золотых рыбок, так, чтобы объект исследования мог видеть движущиеся полоски оптомоторного барабана только одним глазом, правым или левым (Штанчаев, 2008). Ширина импровизированного кольцевого канала в модифицированном экспериментальном контейнере составляла 3 см, длина (по центру) - 30 см. Регистрировали время, затраченное на совершение рыбкой полного круга вдоль канала тест-аквариума против часовой стрелки (в левую сторону, стимулируется правый глаз) и по часовой стрелке (в правую сторону, активен левый глаз). Каждое тестирование включало совершение 9 полных кругов вслед за оптомоторным барабаном, после чего подсчитывали среднее значение затраченного времени (сек) и, зная длину пройденного трека, считали среднюю скорость плавания рыбки при стимуляции правого и левого глаза. В ходе выполнения данной части исследования мы обнаружили взаимосвязь между степенью моторного предпочтения контрольных рыбок и скоростью их реакции на движущиеся полоски оптомоторного барабана. Из всех исследованных рыбок-«правшей» и «левшей» примерно три четверти (14 из 18) характеризовались тем, что плавали быстрее за движущимися полосками в ту сторону, в которую они предпочитали поворачиваться (табл. 3). Мы вычисляли для каждой рыбки коэффициент асимметрии оптомоторной реакции (КАОР) как отношение скорости в предпочитаемом направлении к сумме скоростей в обоих направлениях. Было показано, что КАОР и КМА амбидекстров близко соответствовали друг другу (табл.3), причем приблизительно у 80% нелатерализованных рыбок (14 из 17) наблюдалась прямая корреляция между средними значениями КМА и КАОР. В общем, из обследованных 35 рыбок 28 (80%) обладали выраженной взаимосвязью двух видов моторного поведения - оптомоторной реакцией и моторной асимметрией; коэффициент корреляции составлял 0.61 (р<0.001).
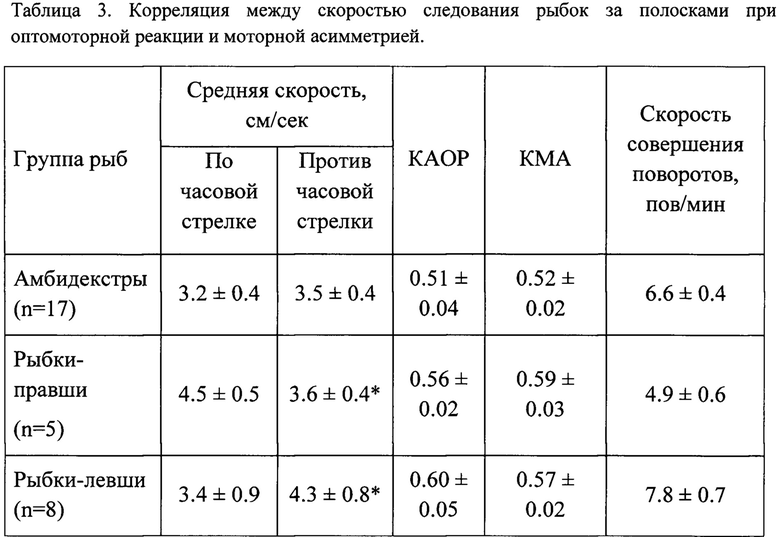
Обозначения: *, значимое отличие скорости плавания в разных направлениях (р<0.01). КАОР - коэффициент асимметрии оптомоторной реакции, КМА - коэффициент моторной асимметрии
Был проведен анализ влияния зрительной депривации на зрительно-моторное поведение рыбок-амбидекстров, а именно, на асимметрию оптомоторных реакций. Обнаружено, что время совершения полного оборота вокруг внутренней стенки тест-аквариума у рыбок, подвергнутых зрительной депривации, не отличается существенно при стимуляции оперированного глаза и при стимуляции интактного глаза. При пересчете измеренного времени на скорость было обнаружено, что скорость следования за оптомоторным барабаном в темпоро-назальную и назо-темпоральную стороны у интактных рыбок, не обладающих моторной асимметрией, практически не отличается. Примерно такое же поведение демонстрируют рыбки-амбидекстры после заклейки правого глаза и дальнейшей реабилитации, хотя скорость плавания по часовой стрелке (стимулируется левый, неоперированный глаз) незначительно выше. И, наконец, как и следовало ожидать, рыбки, потерявшие правый глаз в раннем возрасте в результате естественной травмы и попавшие в лабораторию фактически уже как одноглазые, очень неохотно плыли в темпоро-назальном направлении, соответствующем «слепой» стороне (против часовой стрелки), часто поворачивались, легко теряли интерес к полоскам, не могли за ними уследить. Значения КМА депривированных рыбок после депривации не снижаются, в отличие от значений КАОР для тех же рыбок (р<0,01). Полученные результаты дают основание предполагать, что глаз животного, подвергшийся операции, сохраняет свое морфофункциональное состояние на уровне, близком к интактному. Более того, анализ моторной реакции рыбок после периода реабилитации на визуальную стимуляцию наводит на мысль о том, что, по крайней мере, базовые зрительные функции мозга, связанные с активностью первичного зрительного анализатора - тектума, после операции не нарушены. После депривации способность выполнять оптомоторный рефлекс не меняется, однако при этом, степень моторной латерализации рыб растет и не падает до первоначального уровня даже после восстановительного периода. Следовательно, необходимо восстанавливать именно моторную функцию животного, подвергнутого депривации.
Пример 3. Влияние тренировочных сеансов оптокинетической стимуляции в сочетании с системной аппликацией глицина на моторное поведение рыбок.
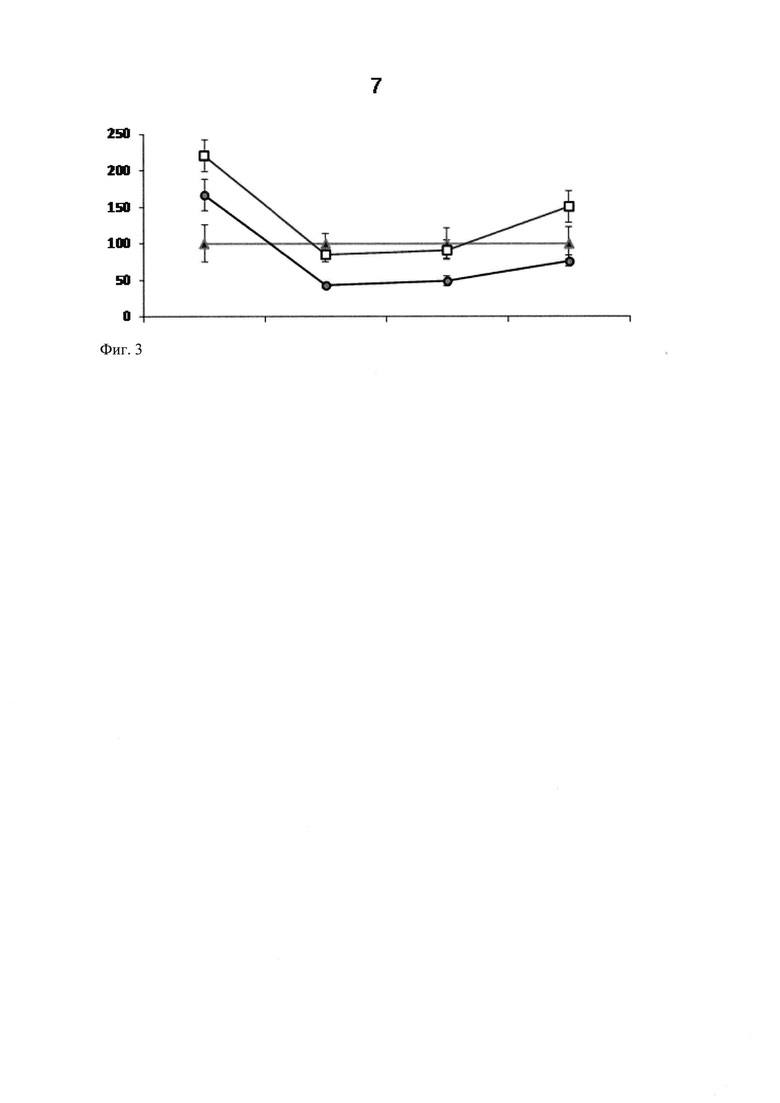
В поиске способов восстановления моторного поведения после отклейки глазной маски мы остановились на традиционном в неврологии подходе к восстановлению после перенесенных повреждений нейронов и мозга в целом, основанном на сочетании терапевтической реабилитации («тренировка ослабленной функции») с фармакологическим лечением (Montey et al., 2013). Было предположено, что кратковременные тренировочные сеансы оптокинетической стимуляции в темпороназальном направлении (Tsaplina et al., 2010; Montey et al., 2013) в сочетании с глицином, нейротрофическим и нейропротекторным фактором (Cervetto et Taccola, 2008), способны привести к возвращению измененного двигательного поведения рыбок в дооперационное состояние. Учитывая преимущественно унилатеральный характер зрительной стимуляции (Shtanchayev et al., 2007), мы предположили, что в восприятии темпоро-назального вращения полосок оптомоторного барабана был задействован, прежде всего, оперированный глаз рыбки. Поэтому всех рыбок с оперированным правым глазом мы подвергали тренировочным сеансам оптокинетической стимуляции в направлении против часовой стрелки. Выбор глицина в качестве фармакологического агента объясняется, к тому же, тем, что он представлен в качестве одного из главных тормозных нейротрансмиттеров золотой рыбки наряду с ГАМК (Curtin et Preuss, 2015). Поскольку глицин слабо проникает через гематоэнцефалический барьер, применяли высокие концентрации препарата в сочетании с его пролонгированным действием. При этом тренировочные сеансы КОС проводили в емкости с раствором глицина (Helicon) в концентрации, соответствующей длительности сеанса. Тренировку рыбок начинали на следующие сутки после отклеивания глазной маски, ежедневно сеанс стимуляции удлинялся на 40 мин, достигая на 15-ый день 600 мин (10 часов). Рыбок тестировали с 1-х по 8-11-е сутки после окончания тренировочных сеансов. На рисунке треугольными маркерами отображены значения параметров КМА рыбок до депривации (фиг. 2), круговыми маркерами - после депривации и квадратными маркерами - после тренировочных сеансов оптокинетической стимуляции. Было обнаружено, что тренировочные сеансы оптокинетической стимуляции в сочетании с глицином снижали средний КМА до уровня предоперационного значения (фиг. 2). В данной серии экспериментов, также как и ранее, было выявлено уменьшение скорости поворотов рыбок после депривации по сравнению с предоперационными значениями скорости поворотов (фиг. 3). На рисунке треугольными маркерами отображены значения параметров скорости совершения рыбками поворотов до депривации, круговыми маркерами - после депривации и квадратными маркерами - после тренировочных сеансов оптокинетической стимуляции (фиг. 3). Характерно, что после прекращения действия монокулярной депривации (отклейки глазной маски) на фоне тренировочных сеансов скорость совершения поворотов рыбками увеличивалась по сравнению со значениями скорости рыбок с заклеенным глазом, достигая уровня, характерного для предоперационных значений. При анализе моторного поведения индивидуальных рыбок в динамике восстановления после перенесенной операции были выявлены некоторые специфические особенности. У одной рыбки, средняя величина КМА которой до операции составляла 0.49±0.14 (что характеризует ее как амбидекстра), после закрытия правого глаза наблюдалось ожидаемое развитие предпочтения правой стороны поворотов (правосторонний КМА составлял 0.70±0.11). После терапии с помощью оптокинетических стимуляций средний КМА составлял 0.55±0.04, что характеризует рыбку как слабо латерализованную правшу. Можно заметить, что моторное поведение данной рыбки не сильно отличалось от поведения рыбок, после депривации не подвергавшихся лечению. Такой же результат наблюдался у другой рыбки, средний КМА которой, рассчитанный по правой стороне, до операции был равен 0.49±0.13, после заклейки правого глаза поднимался до 0.66±0.07, а после отклейки глазной маски и тренировочных сеансов оптокинетической стимуляции составлял 0.59±0.10. В то же время, у других рыбок-амбидекстров после заклеивания правого глаза степень латерализации увеличивалась до 0.66±0.06 и 0.80±0.09, соответственно, а после тренировочных сеансов снижалась до 0.44±0.06 и 0.51±0.10, соответственно. Таким образом, анализ моторного поведения оперированных рыбок показал, что оптокинетическая стимуляция, проводимая в усиленном режиме (Dektyareva et al., 2008), в сочетании с глицином повышенной концентрации снижала среднее значение КМА до предоперационного уровня. Однако, исходя из особенностей моторного поведения рыбок, можно заметить, что тренировочные сеансы выявили две группы рыбок. В одной группе рыбки сильнее реагировали на тренировочные сеансы: КМА таких рыбок снижался значительнее. Этот результат согласуется с полученными ранее данными по оптокинетической стимуляции в темпоро-назальном направлении (Shtanchaev et al., 2007). Скорее всего, у рыбок глаза функционально асимметричны: один них является доминантным и обеспечивает активное слежение за полосками, другой - субдоминантным, которым рыбка при следовании за оптокинетическим барабаном пользуется в гораздо меньшей степени. Таким образом, при исследовании вопроса о снижении зрительной функции недепривированного глаза после монокулярной депривации необходимо принимать во внимание не только моторное предпочтение животных, но и исходную латерализацию зрения.
Взятые в целом, результаты, полученные в настоящей работе, на наш взгляд, могут послужить основой для создания биомедицинской модели монокулярной депривации, которая будет способствовать расшифровке механизмов сенсомоторной интеграции при депривационной амблиопии и поиску способов коррекции указанных нарушений у человека.
Источники информации
1. G.T. Prusky, N.M. Alam, R.M. Douglas, Enhancement of vision by monocular deprivation in adult mice. J. Neurosci. 26, 11554-11561, 2006.
2. E. Niechwiej-Szwedo, H.C. Goltz, M. Chandrakumar, A.M. F. Wong, The Effect of Sensory Uncertainty Due to Amblyopia (Lazy Eye) on the Planning and Execution of Visually-Guided 3D Reaching Movements. PLoS ONE, 2012, Vol. 7, No. 2, P. 1-12.
3. K. Iny, A.J. Heynen, E. Sklar, and M.F. Bear, BidirectionalModifications of Visual Acuity Induced by Monocular Deprivation in Juvenile and Adult Rats. The Journal of Neuroscience, 2006, Vol. 26, No. 28, P. 7368-7374.
4. M. Kaneko, M.P. Stryker, Sensory experience during locomotion promotes recovery of function in adult visual cortex. Elife, 2014, P. 1-16.
5. С. Tailby, L.L. Wright, A.B. Metha, and M.B. Calford, Activity-dependent maintenance and growth of dendrites in adult cortex. PNAS, 2005, Vol. 102, No. 12, P. 4631-4636.
6. V.A. Sovrano, A. Bisazza, and G. Vallortigara, Lateralization of response to social stimuli in fishes: A comparison between different methods and species. Physiology and Behavior, 2001, Vol. 74, P. 237-244.
7. M. Dadda, V.A. Nepomnyashchikh, E.I. Izvekov, and A. Bisazza, Individual-Level Consistency of Different Laterality Measures in the Goldbelly Topminnow. Behavioral Neuroscience, 2012, Vol. 126, No. 6, P. 845-849.
8. R.S. Shtanchayev, G.Z. Mikhailova, N.Y. Dektyareva, N.A. Kokanova, N.R. Tiras, D.A. Moshkov, Effects of optokinetic stimulation on motor asymmetry in the goldfish. Neurophysiology, 2007, Vol. 39, P. 118-129.
9. M.B. Orger, M.C. Smear, S.M. Anstis, H. Baier, Perception of Fourier and non-Fourier motion by larval zebrafish. Nat Neurosci, 2000, Vol. 3, P. 1128-1133.
10. D.A. Moshkov, R.S. Shtanchaev, I.B. Mikheeva, E.N. Bezgina, N.A. Kokanova, G.Z. Mikhailova, N.R. Tiras, L.L. Pavlik, Visual input controls the functional activity of goldfish Mauthner neuron through the reciprocal synaptic mechanism. J. Integr. Neurosci., 2013, Vol. 12, P. 17-34.
11. H. Korn, D.S. Faber, The Mauthner cell half a century later: a neurobiological model for decision-making? Neuron, 2005, Vol. 47, P. 13-28.
12. Г.З. Михайлова, H.A. Коканова, H.P. Тирас, Д.А. Мошков, Трехмерная реконструкция и определение объема нейрона, Москва: Книжный дом "ЛИБРОКОМ", 2012, 80 С.
13. D.A. Moshkov, G.Z. Mikhailova, Е.Е. Grigorieva, R.S. Shtanchaev, Role of different dendrites in the functional activity of the central neuron controlling goldfish behavior. J. Integr. Neurosci.,2009, Vol. 8, P. 441-451.
14. T.N. Wiesel, D.H. Hubel, Effects of visual deprivation on morphology and physiology of cells in the cat's lateral geniculate body. J. Neurophysiol, 1963, Vol. 26, P. 978-993.
15. S.S. Easter, Pursuit eye movements in goldfish (Carassius auratus). Vision Res, 1972, Vol. 12, P. 673-688.
16. K.A. Fritsches, N.J. Marshall, Independent and conjugate eye movements during optokinesis in teleost fish. J. Exp. Biol, 2002, Vol. 205, P. 1241-1252.
17. H. Qian, Y. Zhu, D. J. Ramsey, R.L. Chappell, J.E. Dowling and H. Ripps, Directional Asymmetries in the Optokinetic Response of Larval Zebrafish (Danio rerio). Zebrafish, 2005, Vol. 2, No. 3, P. 189-196.
18. D.J. Cameron, F. Rassamdana, P. Tarn, K. Dang, C. Yanez, S. Ghaemmaghami, M.I. Dehkordi, The Optokinetic Response as a Quantitative Measure of Visual Acuity in Zebrafish. J. Vis. Exp., 2013, Vol. 80, P. 1-6.
19. C.M. Maurer, Y.-Yu Huang, and S.C. F. Neuhauss, Application of zebrafish oculomotor behavior to model human disorders. Rev. Neurosci., Vol. 22, No. 1, P. 5-16, 2011.
20. C. Tappeiner, S. Gerber, V. Enzmann, J. Balmer, A. Jazwinska and M. Tschopp, Visual Acuity and Contrast Sensitivity of Adult Zebrafish. Front. Zool., 2012, Vol. 9, No. 10, P. 1-6.
21. J.M. Rick, I. Horschke and S.C.F. Neuhauss, Optokinetic behavior is reversed in achiasmatic mutant zebrafish larvae. Current Biology, 2000, Vol. 10, No. 10, P. 595-598.
22. J.M. Stujenske, J.E. Dowling, and F. Emran, The bugeye mutant zebrafish exhibits visual deficits that arise with the onset of an enlarged eye phenotype. Invest. Ophthalmol. Vis. Sci, 2011, Vol.52, P. 4200-4207.
23. S.C.F. Neuhauss, O. Biehlmaier, M.W. Seeliger, T. Das, K. Kohler, W.A. Harris, and H. Baier, Genetic disorders of vision revealed by a behavioral screen of 400 essential loci in zebrafish. J. Neurosci, 1999, Vol.19, P.8603-8615.
24. E.E. Grigorieva, R.S. Shtanchayev, G.Z. Mikhailova, N.R. Tiras, D.A. Moshkov, Changes in the motor asymmetry and structure of Mauthner neurons of the goldfish resulting from unilateral visual deprivation. Neurophysiology, 2010, Vol. 42, P. 185-196.
25. R.S. Shtanchayev, G.Z. Mikhailova, N.Y. Dektyareva, N.A. Kokanova, N.R. Tiras, D.A. Moshkov, Effects of optokinetic stimulation on motor asymmetry in the goldfish. Neurophysiology, 2007, Vol. 39, P. 118-129.
26. Р.Ш. Штанчаев, Разработка физиологических моделей для исследования морфофункциональной асимметрии маутнеровских нейронов золотой рыбки. Дисс.на соиск. уч. ст. канд. биол. наук, Пущино, 2008.
27. A. Burgess, Н. Schoch, and М. Granato, Distinct Retinal Pathways Drive Spatial Orientation Behaviors in Zebrafish Navigation. Current Biology, 2010, Vol. 20, P. 381-386.
28. M.B. Ahrens, J.M. Li, M.B. Orger, D.N. Robson, A.F., Schier, F. Engert and R. Portugues, Brain-wide neuronal dynamics during motor adaptation in zebrafish, Nature, 2012, Vol. 485, P. 471-477.
29. B. Brent, Apparatus and methods for preventing ocular dehydration in anesthetized small animals, US2014352703 Patent Application Publication, 2014.
30. K.L. Montey, N.C. Eaton, E.M. Quinlan, Repetitive visual stimulation enhances recovery from severe amblyopia. Learn. Mem., 2013, Vol.20, P. 311-317.
31. N.Y. Tsaplina, G.Z. Mikhailova, R.S. Shtanchaev, D.A. Moshkov, Stabilization of mauthner neuron structure on adaptation of goldfish to contralateral optokinetic stimulation. Neurosci. Behav. Physiol., 2010, Vol. 40, P. 767-771.
32. N.Y. Dektyareva, R.S. Shtanchayev, G.Z. Mikhailova, D.A. Moshkov, Stabilization of motor asymmetry in the goldfish under the influence of optokinetic stimulation. Neurophysiology, 2008, Vol. 40, P. 178-186.
33. P.C. Curtin, Т. Preuss, Glycine and GABAA receptors mediate tonic and phasic inhibitory processes that contribute to prepulse inhibition in the goldfish startle network. Front. Neural Circuits, 2015, Vol. 9, P. 1-10.
34. C. Cervetto, G. Taccola, GABAA and strychnine-sensitive glycine receptors modulate N-methyl-D-aspartate-evoked acetylcholine release from rat spinal motoneurons: a possible role in neuroprotection. Neuroscience, 2008, Vol. 154, P. 1517-1524.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСТРОЙСТВО ДЛЯ ФИКСАЦИИ РЫБЫ ДЛЯ ПРОВЕДЕНИЯ ВЫСОКОТОЧНЫХ ИНВАЗИВНЫХ МАНИПУЛЯЦИЙ | 2022 |
|
RU2798220C1 |
| Способ коррекции угрожающих преждевременных родов | 2017 |
|
RU2647227C1 |
| Способ регенерации клеток головного мозга с восстановлением его функций | 2023 |
|
RU2816789C1 |
| Устройство и способ исследования локомоторной активности рыбы | 2023 |
|
RU2820130C1 |
| Способ прогнозирования развития рассеянного склероза у больных с оптическим невритом подострого течения | 2017 |
|
RU2636519C1 |
| Способ коррекции ишемической нейропатии зрительного нерва производным диметиламиноэтанола 7-16 в эксперименте | 2017 |
|
RU2663643C1 |
| СПОСОБ ДИАГНОСТИКИ АНОМАЛИИ АРНОЛЬДА-КИАРИ 1 У БОЛЬНЫХ С КОХЛЕОВЕСТИБУЛЯРНОЙ ДИСФУНКЦИЕЙ | 2007 |
|
RU2339295C1 |
| Способ повышения уровня сознания пациентов с длительными нарушениями сознания | 2022 |
|
RU2783006C1 |
| УСТРОЙСТВО И СПОСОБ ДЛЯ КОРРЕКЦИИ ПЕРВИЧНЫХ НАРУШЕНИЙ БИНОКУЛЯРНОГО ЗРЕНИЯ | 1992 |
|
RU2090164C1 |
| СПОСОБ СТИМУЛЯЦИИ НЕЙРОГЕНЕЗА В ГИППОКАМПЕ | 2017 |
|
RU2675111C2 |
Изобретение относится к области биологических и экологических исследований и касается условий протокола по заклейке глаза водных животных, не имеющих глазных век. Способ состоит в том, что после анестезии и обездвиживания рыбы на зрачок наносят противомикробное средство для глаз. Затем проводят подготовку кожи вокруг глаза путем подсушивания кожи в течение 1-2 часов фильтровальной бумагой и обдувания через пластиковую тонкую иглу, соединенную со спринцовкой, при этом периодически смачивая глаз водой. Далее проводят обработку кожи вокруг глаза перекисью водорода и спиртом, нанося при этом на зрачок и вокруг него гидрокортизон в виде глазной мази на вазелиновой основе. Затем на полностью высушенную кожу вокруг глаза наносят кожный клей «Dermabond». После этого первый слой маски, состоящий из жидкой основы на целлюлозно-каучуковой основе «Ardell Lash Grip Adhesive Dark», наносят с помощью заостренной палочки вокруг глаза и на сам глаз, полностью закрывая его. После подсыхания второй слой маски, состоящий из водостойкого клея на полиуретановой основе, наносят по всей поверхности первого слоя, а также по сухой кромке кожи рыбы вокруг первого слоя маски. Способ исключает попадание световых лучей в зрительный анализатор и обеспечивает длительное, до 1 месяца удержание глазной маски на коже водного животного, не имеющего глазных век, в водно-воздушной среде при исследовании зрения и зрительно-двигательных реакций. 3 ил., 3 табл., 3 пр.
Способ приклеивания маски на глаз рыбы, отличающийся тем, что после анестезии и обездвиживания рыбы на зрачок наносят противомикробное средство для глаз, затем проводят подготовку кожи вокруг глаза путем подсушивания кожи в течение 1-2 часов фильтровальной бумагой и обдувания через пластиковую тонкую иглу, соединенную со спринцовкой, при этом периодически смачивая глаз водой, с последующей обработкой кожи вокруг глаза перекисью водорода и спиртом, нанося при этом на зрачок и вокруг него гидрокортизон в виде глазной мази на вазелиновой основе, затем на полностью высушенную кожу вокруг глаза наносят кожный клей «Dermabond», после этого первый слой маски, состоящий из жидкой основы на целлюлозно-каучуковой основе «Ardell Lash Grip Adhesive Dark», наносят с помощью заостренной палочки вокруг глаза и на сам глаз, полностью закрывая его, и после подсыхания второй слой маски, состоящий из водостойкого клея на полиуретановой основе, наносят по всей поверхности первого слоя, а также по сухой кромке кожи рыбы вокруг первого слоя маски.
| CAMERON D.J | |||
| et al | |||
| The Optokinetic Response as a Quantitative Measure of Visual Acuity in Zebrafish | |||
| J | |||
| Vis | |||
| Exp., 2013, Vol | |||
| Капельная масленка с постоянным уровнем масла | 0 |
|
SU80A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ БИНОКУЛЯРНОГО, МОНОКУЛЯРНОГО И ОДНОВРЕМЕННОГО ЗРЕНИЯ | 1991 |
|
RU2012215C1 |
| Импульсник с номерным диском для автоматических телефонных установок | 1929 |
|
SU13779A1 |
| US 20140327880 A1, 06.11.2014 | |||
| АЛЕКСЕЕНКО С | |||
| В | |||
| и др | |||
| Нейронные связи глазодоминантных колонок коры головного мозга кошек при монокулярной депривации | |||
| Российский физиологический журнал им | |||
| И | |||
| М | |||
| Сеченова, 2007, Т | |||
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
| АСИНХРОННЫЙ ДВИГАТЕЛЬ С КОРОТКОЗАМКНУТЫМ РОТОРОМ, ПУСКАЕМЫЙ В ХОД БЕЗ РЕОСТАТА | 1923 |
|
SU1024A1 |
| FRITSCHES K.A | |||
| et al | |||
| Independent and conjugate eye movements during optokinesis in teleost fish | |||
| J | |||
| Exp | |||
| Biol, 2002, Vol | |||
| Автоматическая акустическая блокировка | 1921 |
|
SU205A1 |
| Пневматическая секционная шина | 1923 |
|
SU1241A1 |
| WACHAKA PM et al | |||
| Effect of Monocular Deprivation on Rabbit Neural Retinal Cell Densities | |||
| J Ophthalmic Vis Res | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
Авторы
Даты
2019-02-11—Публикация
2016-11-09—Подача