Изобретение относится к общей и медицинской микробиологии и может быть использовано как в научно-исследовательской, так и в практической работе для бактериологической диагностики патогенных грамположительных бактерий (например, рода Listeria, Staphylococcus sp.и др.) с целью выявления клинически значимых, вирулентных штаммов микроорганизмов в инфекционной патологии. Как известно, к роду Listeria относят грамположительные палочковидные бактерии, некоторые патогенные виды которых являются возбудителями заболеваний животных и человека. В последнее время в литературе стали описываться случаи заболевания людей, вызванные и другими видами листерий, считающихся непатогенными (Зайцева Е.А. «Система анализа микробиологических и молекулярно-генетических маркеров для выявления высоковирулентных штаммов Listeria monocytogenes»: дис. докт. мед. наук. Москва, 2010. 299 с).
В настоящее время существуют разнообразные методики и среды для определения дезоксирибинуклеазной (ДНКазной) активности микроорганизмов (и т.д.). ДНКаза бактерий - фермент, деполимеризующий ДНК, выделяющуюся при гибели и некрозе лейкоцитов в месте инфекции. Многие ферменты являются маркерами патогенности штаммов возбудителей и их выявление необходимо для более полной характеристики выделяемых штаммов бактерий.
В отечественной литературе описаны следующие методы изучения ДНКазной активности:
1) Калиниченко Н.Ф., Овчаренко О.И., Бирюкова С.В. «Об определении ДНКазы у микроорганизмов» (ЖМЭИ, 1968, №12, с. 11-14), описывают методику изучения ДНКазы у микроорганизмов на жидкой среде с использованием надосадочной жидкости суточных культур микроорганизмов, с добавлением разных концентрациий MgCl2, ДНК (полученную из вилочковой железы телят) и НС1; метод Джеффриса - к агару добавляют ДНК, несколько капель CaCl2, на котором выращивают культуры микроорганизмов, и которые, в последующем заливали 1 H НС1.
2) Изобретение SU 1693058 А1 (Кишиневский государственный медицинский университет) 23.11.1991 «Способ определения ДНКазной активности микроорганизмов».
Наличие ДНКазной активности у микроорганизмов широко изучается в настоящее время за рубежом. Большинство сред для ее изучения импортного производства. Их используют для определения дезоксирибонуклеазной активности у бактерий и грибов, в первую очередь для идентификации клинических штаммов стафилококков.
Известны среды для определения ДНКазы:
1) в состав которой входит: ДНК, хлорид кальция, хлорид натрия, толуидиновый синий, трис, агар-агар;
2) два варианта среды:
а) первый (М482) имеет в своем составе гидролизат казеина, папаиновый перевар соевой муки, ДНК, хлорид натрия, агар-агар;
б) второй (M1041) - триптозу, ДНК, хлорид натрия, толуидиновый синий, агар-агар; (производитель HiMedia Laboratories Pvt. Limited, Индия, электронный ресурс www.himedialabs.ru/m482-m1041);
3) среда: ДНК, казеиновый пептон, соевый пептон, хлорид натрия, агар (Hispanlab/Laboratorios Conda, Испания, электронный ресурс, www.probiovet. com. ua/goods/item/?it=13&select=1);
4) ДНКазный агар с толуоидным синим, - триптоза, ДНК, хлорид натрия, агар, толуоидин синий (ЗАО «Dasnovamed», Россия, электронный ресурс www.dasnovamed.ru/content/view/30/1/);
Недостатком вышеуказанных питательных сред, является то, что они, как правило, импортного производства и являются дорогостоящими. Кроме того, краситель толуидиновый синий может подавлять рост некоторых штаммов стафилококков. Для точной идентификации рекомендуется проведение дополнительных тестов. При этом эти среды достаточно дорогостоящие. Например, цена среды для определения ДНКазной активности от производителя ЗАО «Dasnovamed» составляет 63 доллара (электронный ресурс www.dasnovamed.ru/content/view/30/1/).
Наиболее близким аналогом заявляемого изобретения по совокупности признаков является среда для определения ДНКазной активности бактерий, состоящая из:
- 1,8% мясопептонного агара (рН 8,6) - 100 мл,
- сухая высокополимерная ДНК - 0,5 - 2,0 мг/мл,
- 2 моль/л раствор едкого натра (NaOH) - 0,8 мл,
- стерильный 10%-ный раствор хлористого кальция (CaCl2) - 0,5 мл,
- дистиллированная вода 3-5 мл,
(Приказ Минздрава СССР от 22.04.1985 №535 "Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений").
Недостатком данной питательной среды является то, что при ее приготовлении используют дорогостоящие компоненты, а именно: мясо-пептонный агар и ДНКа, которую получают из вилочковой железы телят. При этом, время определения ДНКазной активности на этой среде, значительно дольше, чем на заявляемой среде.
В этой связи техническая проблема заключается в расширении арсенала технических средств, таких как разработка простых, недорогих питательных сред отечественного производства с целью импортозамещения, для изучения ДНКазной активности грамположительных бактерий, а также сред с высокой разрешающей способностью в отношении листерий и им подобным.
Задача, решаемая данным изобретением, - удешевление среды с высокой разрешающей способностью.
Техническим результатом при реализации предлагаемого технического решения является: ускорение сроков выявления ДНКазной активности у патогенных грамположительных бактерий до 16 ч за счет наличия в ней постоянного аминокислотного состава и ДНК, входящего непосредственно в белковую основу, простота приготовления.
Технический результат достигается путем приготовления среды для определения ДНКазной активности у патогенных грамположительных бактерий, содержащей белковую основу, микробиологический агар, глюкозу, хлорид натрия, дистиллированную воду, отличающаяся тем, что среда дополнительно содержит хлористый кальций, хлористый магний, а в качестве белковой основы и ДНК используют сухой отвар молок лососевых рыб, при следующем соотношении компонентов, г/л:
при этом после стерилизации среды добавляют 5 мл стерильного 10% раствор хлористого кальция (CaCl2) и 2 мл стерильного раствора 0,1M хлористого магния (MgCl2).
Данная среда проста в применении, не содержит дорогостоящих, нестандартных ингредиентов, таких как мясо и сыворотка крупного рогатого скота.
Известно, что в молоках лососевых рыб (соленых, замороженных, лиофилизированных) любой стадии зрелости, а тем более в не пищевых (т.е. текучих - 5-6-я стадия зрелости), в исходном сырье обнаружено очень большое количество ДНК: 1) в соленых - 5,6 - 8,5%, 2) в мороженых - 4,6 - 6,0% (Ю.И. Касьяненко, Т.Н. Пивненко «Сравнительные физико-химические характеристики низко-молекулярной дезоксирибонуклеиновой кислоты (ДНК) из морских гидробионтов» //«Известия Тихоокеанского научно-исследовательского рыбохозяйственного центра», 1999, т. 125, с. 152-158).
Предлагаемая питательная среда имеет постоянный аминокислотный состав, обуславливающий быстрый и стабильный рост микроорганизмов. Кроме того, отвар из молок лососевых рыб имеет не только высокое содержание дезоксирибонуклеиновой кислоты, но и богатое органическое и минеральное питание: ДНК - 26,7%, белка - 1,5%, углеводов - 4,0%, микроэлементов (мкг/г) - Cu - 0,5, Zn - 2,5, Fe - 3,5, Mn<1,25, As - 0,68.
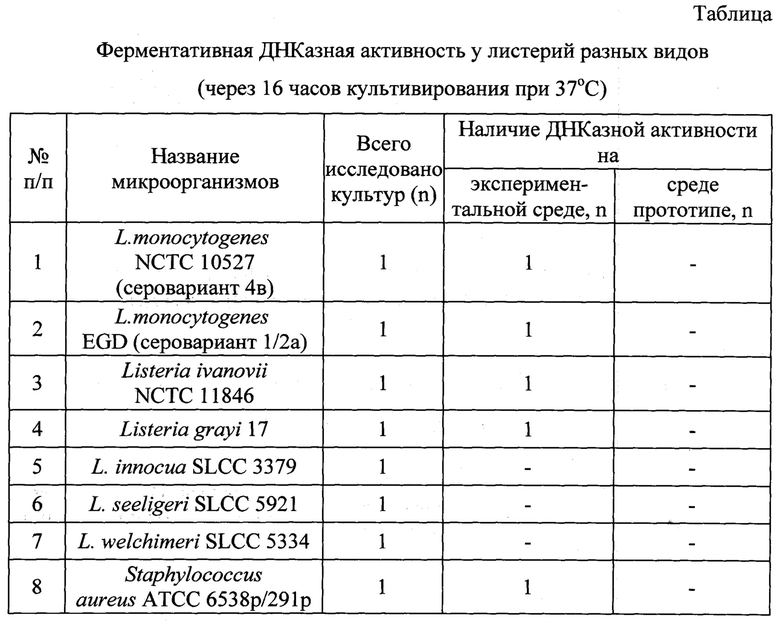
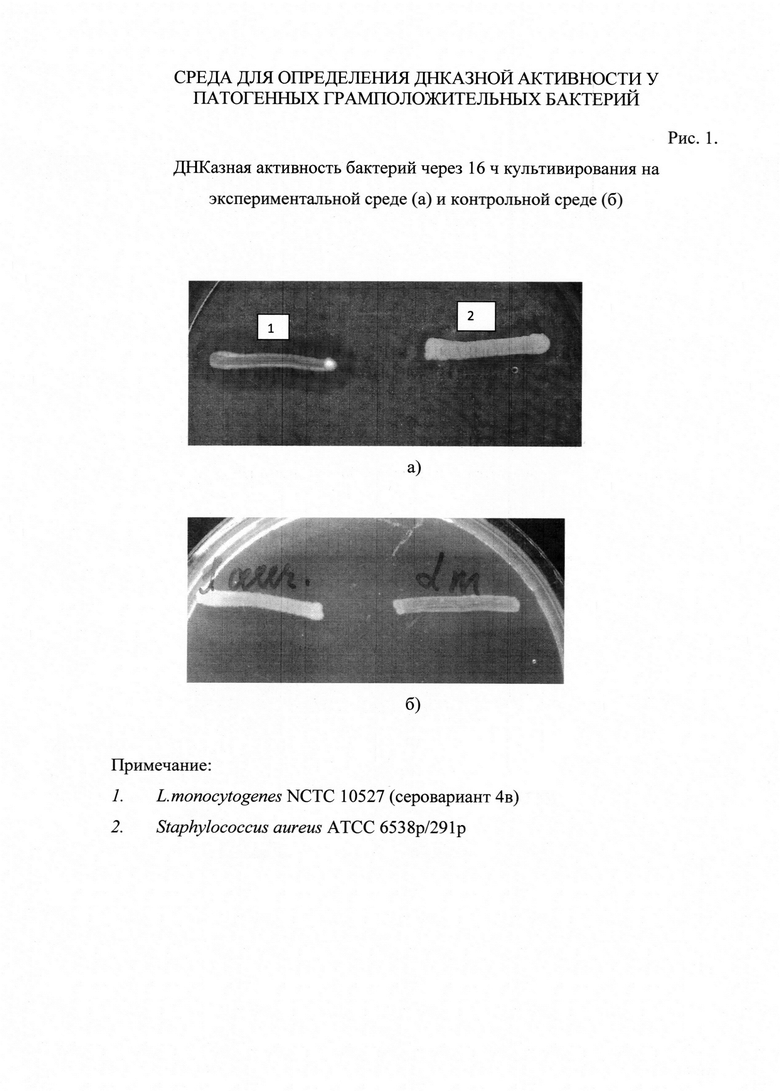
При этом существенными признаками предлагаемого изобретения следует считать качественный и количественный состав питательной среды, т.к. величины содержания компонентов в заявляемой питательной среде являются оптимальными и обусловливают относительную сбалансированность стоимости среды с ее ростовыми характеристиками при выявлении ДНКазной активности бактерий. Например, ДНКазная активность Listeria monocytogenes NCTC 10527 и Staphylococcus aureus АТСС 6538p/291p на данной среде проявляется уже через 16 часов инкубации исследуемых культур при 37°С (рис. 1а).
Питательную среду готовят следующим образом.
Сначала готовят отвар из молок лососевых рыб (горбуши или кеты). К 500,0 г предварительно измельченным молокам рыб добавляют водопроводную воду в соотношении 1:2 и кипятят 1 ч на медленном огне. Полученный отвар фильтруют, стерилизуют давлением 1 атм в течение 30 мин. Сушат. Сухой отвар из молок рыб хранят в бытовом холодильнике (4-8°С) или при комнатной температуре. Сухой отвар молок используют в качестве белковой основы и ДНК для приготовления питательной среды с целью определения ДНКазной активности у бактерий.
К 6,0 г сухого отвара молок лососевых рыб добавляют 1 г глюкозы, 10,0±2,0 г микробиологического агара, 5,0 г хлорида натрия, и доводят питательную среду до 1 л дистиллированной водой. Смесь перемешивают, общеизвестным способом доводят рН среды до 7,2 - 7,4 при помощи 20% NaOH. Полученную питательную среду разливают по емкостям, а затем стерилизуют при 0,5 атм в течение 20 мин. Охлаждают до 50-55°С. Затем в емкость со средой добавляют 5 мл стерильного 10% раствор хлористого кальция (CaCl2) и 2 мл стерильного раствора ОДМ хлористого магния (MgCl2) и разливают по чашкам Петри.
Полученная питательная среда представляет собой полупрозрачный гель молочного цвета, без запаха.
Заявляемая питательная среда соответствует критериям патентоспособности изобретения: «новизна» (в качестве белковой основы и ДНК в питательной среде для определения ДНКазной активности патогенных грамположительных бактерий используют сухой концентрат отвара молок лососевых рыб); «изобретательский уровень» и «промышленная применимость».
Для сравнения свойств заявляемой среды со средой, взятой за прототип (среда для определения ДНКазной активности (Приказ Минздрава СССР от 22.04.1985 №535 "Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений"), исследовали ДНКазную активность следующих тест-штаммов бактерий - Listeria monocytogenes NCTC 10527 (4b серовариант); Listeria monocytogenes CLIP 75936 (1/2a серовариант); Listeria ivanovii NCTC 11846; Listeria innocua SLCC 3379; Listeria seeligeri SLCC 5921; Listeria grayi 17; Listeria welchimeri SLCC 5334 и Staphylococcus aureus ATCC 6538p/291p.
На чашки Петри с заявляемой средой и средой прототипом штрихом засевали исследуемые культуры и культивировали их при температуре 37°С. Учет результатов проводили путем визуального осмотра первоначально через 16 ч, затем через 18, 24 - 48 ч культивирования бактерий в заявляемой питательной среде и в среде прототипе. На заявляемой среде через 16 ч вокруг исследуемых культур наблюдается гидролиз ДНК, проявляющийся в виде появления прозрачного ореола шириной 0,2 - 1,5 см (рис. 1а).
На среде прототипе через 16 ч ореола вокруг культур Listeria monocytogenes NCTC 10527 (4b серовариант); Listeria monocytogenes CLIP 75936 (1/2a серовариант); Listeria ivanovii NCTC 11846, Listeria innocua SLCC 3379; Listeria seeligeri SLCC 5921; Listeria grayi 17; Listeria welchimeri SLCC 5334, а также Staphylococcus aureus ATCC 6538p/291p дезоксирибонуклеазной активности не отмечалось (рис. 1б).
Это подтверждает более высокую разрешающую способность заявляемой среды.
Пример конкретного выполнения.
К 6,0 г сухого отвара молок лососевых рыб добавляют 10,0 г микробиологического агара, 5,0 г хлорида натрия, 1,0 г глюкозы и доводят среду до 1 л дистиллированной воды. Смесь перемешивают, общеизвестным способом доводят рН среды до 7,2 - 7,4 при помощи 20% NaOH. Полученную среду разливают по емкостям, а затем стерилизуют при 0,5 атм в течение 20 мин. Полученную среду охлаждают до 50 - 55°С.Далее в емкость со средой добавляют 5 мл стерильного 10% раствор хлористого кальция (CaCl2)и 2 мл стерильного раствора 0,1M хлористого магния (MgCl2), после чего среду разливают по чашкам Петри.
Полученная среда представляет собой полупрозрачный гель молочного цвета, без запаха.
Готовую питательную среду разливали в чашки Петри, штрихом засевали исследуемые культуры и культивировали их при температуре 37°С.Учет результатов проводили путем визуального осмотра первоначально через 16 ч, затем через 18, 24 - 48 ч культивирования бактерий. На заявляемой среде через 16 ч вокруг исследуемых культур Listeria monocytogenes NCTC 10527 (4b серовариант); L. monocytogenes CLIP 75936 (l/2a серовариант); L. ivanovii NCTC 11846; L. innocua SLCC 3379; L. seeligeri SLCC 5921; L. grayi 17; L. welchimeri SLCC 5334, а также Staphylococcus aureus АТСС 6538p/291p, наблюдается гидролиз ДНК, проявляющийся в виде появления прозрачного ореола шириной 0,2 - 1,5 см (табл., рис. 1а).
На среде прототипе через 16-18 ч ореола вокруг культур L.monocytogenes NCTC 10527 (4b серовариант); L. monocytogenes CLIP 75936 (1/2a серовариант); L. ivanovii NCTC 11846, L. innocua SLCC 3379; L. seeligeri SLCC 5921; L. grayi 17; L. welchimeri SLCC 5334, а также Staphylococcus aureus АТСС 6538p/291p дезоксирибонуклеазной активности не отмечалось (рис. 1б, табл.).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ОПРЕДЕЛЕНИЯ ЛЕЦИТИНАЗНОЙ АКТИВНОСТИ У БАКТЕРИЙ РОДА Listeria | 2011 |
|
RU2444567C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ БАКТЕРИЙ | 2008 |
|
RU2399660C2 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ БАКТЕРИЙ | 2008 |
|
RU2384613C2 |
| КОМПЛЕКСНАЯ ИНДИКАТОРНАЯ СРЕДА ДЛЯ ДИФФЕРЕНЦИАЦИИ БАКТЕРИЙ РОДА LISTERIA | 2005 |
|
RU2303060C1 |
| ШТАММ ENTERОCOCCUS MUNDTII, ПРОДУЦИРУЮЩИЙ СУБСТАНЦИЮ ПЕПТИДНОЙ ПРИРОДЫ С АНТИЛИСТЕРИОЗНОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2532227C1 |
| Композиция антибактериальная для продления срока годности охлажденной рыбы и снижения риска возникновения инфекций, передаваемых пищевым путем, штаммы бактериофагов, используемые для ее получения | 2016 |
|
RU2644667C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ Listeria monocytogenes НА ПИТАТЕЛЬНОЙ СРЕДЕ, ПРИГОТОВЛЕННОЙ НА ОСНОВЕ ЛИСТОВОГО САЛАТА (Lactuca sativa) | 2014 |
|
RU2562859C1 |
| Набор для выявления патогенных микроорганизмов вида Listeria monocytogenes и способ их выявления в пробах биоматериала, в пробах кормов, в объектах внешней среды | 2019 |
|
RU2730658C1 |
| Способ дифференциации Listeria monocytogenes от других видов Listeria spp. методом дот-блоттинга с использованием конъюгированных антител против фактора патогенности InlB | 2023 |
|
RU2812147C1 |
| Питательная среда для получения биомассы листерий | 2021 |
|
RU2767782C1 |
Изобретение относится к медицинской микробиологии и может быть использовано как в научно-исследовательской, так и в практической работе для бактериологической диагностики ряда патогенных микроорганизмов (бактерий рода Listeria, Staphylococcus aureus и др.). Питательная среда для определения ДНКазной активности у патогенных грамположительных бактерий содержит сухой отвар молок лососевых рыб, микробиологический агар, хлорид натрия, глюкозу, 10%-ный стерильный раствор хлористого кальция, 0,1М стерильный раствор хлористого магния и дистиллированную воду при заданном соотношении компонентов. Изобретение позволяет сократить срок выявления ДНКазной активности у патогенных грамположительных бактерий. 2 ил., 1 табл., 1 пр.
Среда для определения ДНКазной активности у патогенных грамположительных бактерий, содержащая белковую основу, микробиологический агар, хлорид натрия, глюкозу, дистиллированную воду, отличающаяся тем, что среда дополнительно содержит хлористый кальций, хлористый магний, а в качестве белковой основы и ДНК используют сухой отвар молок лососевых рыб при следующем соотношении компонентов, г/л:
pH среды 7,2-7,4,
после стерилизации в среду добавляют 5 мл стерильного 10%-ного раствора хлористого кальция (CaCl2) и 2 мл стерильного раствора 0,1М хлористого магния (MgCl2).
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Под ред | |||
| ЛАБИНСКОЙ А.С | |||
| и др | |||
| Частная медицинская микробиология с техникой микробиологических исследований, М., Медицина, 2005, с | |||
| Электрический фонарь - испытательный прибор | 1912 |
|
SU503A1 |
| КАЛИНИЧЕНКО Н.Ф., ОВЧАРЕНКО О.И | |||
| и др | |||
| Об определении ДНК-азы у микроорганизмов, Журнал микробиологии, эпидемиологии и иммунологии, 1968, N 12, с.11-14 | |||
| Отвертка | 1936 |
|
SU52832A1 |
| Молоко и продукты на основе молока | |||
| Обнаружение термонуклеазы, образуемой коагулазоположительными стафилококками, 2010, М., Стандартинформ, с | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ДИФФЕРЕНЦИАЛЬНО-ДИАГНОСТИЧЕСКАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ИДЕНТИФИКАЦИИ БАКТЕРИЙ РОДА YERSINIA | 2012 |
|
RU2511436C2 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ БАКТЕРИЙ | 2008 |
|
RU2399660C2 |
Авторы
Даты
2019-04-11—Публикация
2018-04-24—Подача