Область техники
Предлагаемое изобретение относится к биохимии, органической химии, фармакологии, медицине. Может быть использовано при получении стандартов для хроматографии и иммуноферментного анализа, для производства фармацевтической субстанции, а также в олигонуклеотидном синтезе.
Уровень техники
8-оксо-2'-дезоксигуанозин (8-oxo-dG) - окисленное производное гуанозина, которое уже много лет используется в качестве биомаркера окислительного стресса. Его содержание в составе клеточной ДНК и биологических жидкостей возрастает на фоне воспалительных, аллергических, онкологических, нейродегенеративных и некоторых других заболеваний.
В последнее десятилетие появились исследования, сообщающие о вероятной значимой биологической роли 8-оксо-2'-дезоксигуанозина (8-oxo-dG) и открывающие перспективы его применения в качестве лекарственного препарата.
Имеются источники, в которых описан синтез 8-оксо-2'-дезоксигуанозина (8-oxo-dG).
1) Основным на настоящий момент является синтез из 8-бромо-2'-дезоксигуанозина через промежуточную стадию 8-бензоил-2'-дезоксигуанозина и с дальнейшим гидрированием на палладии (Lin. Т., Cheng J., Ishiguro K., Sartotelli А. 8-Substituted guanosine and 2'deoxyguanosine derivates as potential induses of friend erythroleukemia cells// J. Med. Chem. 1985. V. 28. P. 1194-1198.). Выход целевого продукта составляет 49%. При этом в методике используются газообразный водород и металлический натрий, что сопряжено с высоким производственным риском.
2) Известна также методика получения 8-оксо-2'-дезоксигуанозина (8-oxo-dG) из 2'-дезоксигуанозина по реакции Фентона в водной среде (Cheng K.С., Cahill D.S. 8-Hydroxyguanine, an abundant form of oxidative DNA damage, cause G-T and A-C substitutions // J. Biol. Chem. 1992. V. 267. №1. P. 166-172.). Выход целевого продукта весьма невелик -5,8%, но из-за простоты синтеза метод широко используется для лабораторных исследований.
3) Имеется источник (Roelen H.C.P.F., Saris С.Р., Brugghe H.F., Elst Н., Westra J.G., Marel G.A., Boom J.H. Solid-phase syntheses of DNA fragments containing the modified base 7-hydro-8-oxo-2'-deoxyguanosine //Nucl.Ac.Res. 1991. V. 19. №16. P. 4361-4369.), в котором описан метод ацилирования 8-бромо-2'-дезоксигуанозина для получения триацильных производных 8-оксо-2'-дезоксигуанозина (8-oxo-dG) для олигонуклеотидного синтеза Авторами был получен 2-N,3-O,5'-O-триацетил-8-оксо-2'-дезоксигуанозина для последующего включения в олигонуклеотиды. Выход целевого продукта составляет 12,5%.
4) Имеется источник (Geiger A., Selige N., Nehls P. A new approach for the efficient synthesis of oligodeoxyribonucleotides containing the mutagenic DNA modification 7,8-dihidro-8-oxo-2'-deoxyguanosine at predefined positions // Nucleosides and nucleotides. 1993. V. 12. №5. P. 463-477.), в котором метод ацилирования был усовершенствован и использован для получения 2-N-ацетил-оксо-2'-дезоксигуанозина из 8-бромо-2'-дезоксигуанозина. За счет использования ацетата серебра авторам удалось повысить выход целевого продукта до 22,5%. Для получения 8-оксо-2'-дезоксигуанозина требуется еще одна стадия - снятие ацильной группы с 2-N-ацетил-8-оксо-2'-дезоксигуанозина, которая не проводилась авторами данной методики. Считаем целесообразным взять данный источник за прототип.
К недостаткам прототипа можно отнести сравнительно невысокий выход целевого продукта (22,5%), необходимость использования дорогостоящего и неустойчивого реактива - ацетата серебра, а также необходимость многоступенчатой очистки продукта.
Раскрытие изобретения
Целью предполагаемого изобретения является экономичный способ получения модифицированного мононуклеозида 8-оксо-2'-дезоксигуанозина (8-oxo-dG), обладающего высоким выходом целевого продукта и его чистотой.
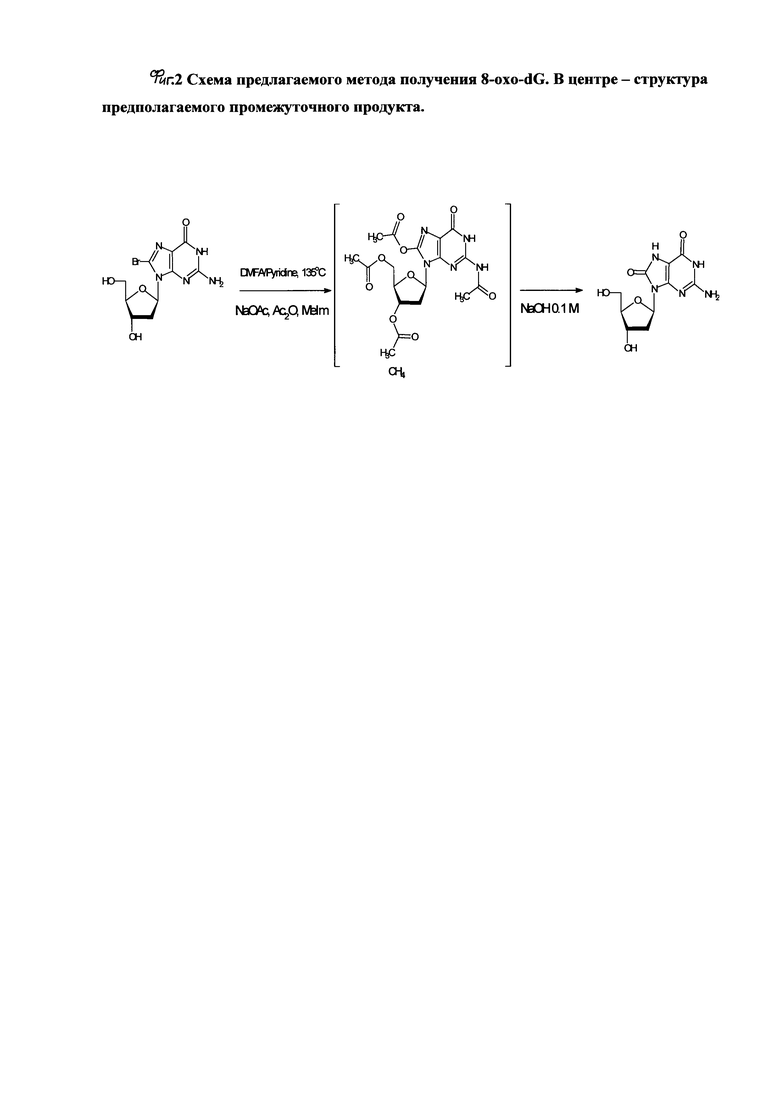
В безводном N,N-диметилформамиде суспендируют сухой 8-бромо-2'-дезоксигуанозин (8-Br-dG) до концентрации 0,1 мМ и безводный ацетат натрия до концентрации 1 мМ. В реакционную смесь добавляют безводный пиридин - конечная концентрация 1,8 мМ, уксусный ангидрид - конечная концентрация 0,6 мМ, N-метилимидазол - конечная концентрация 0,1 мкМ. При перемешивании реакционную смесь нагревают на глицериновой бане до 120-155°С и поддерживают данную температуру в течение 12-28 часов, получение целевого продукта (8-oxo-dG) проводят путем снятия ацильных групп с помощью щелочного гидролиза в 0,1-1,5 М водном растворе NaOH..
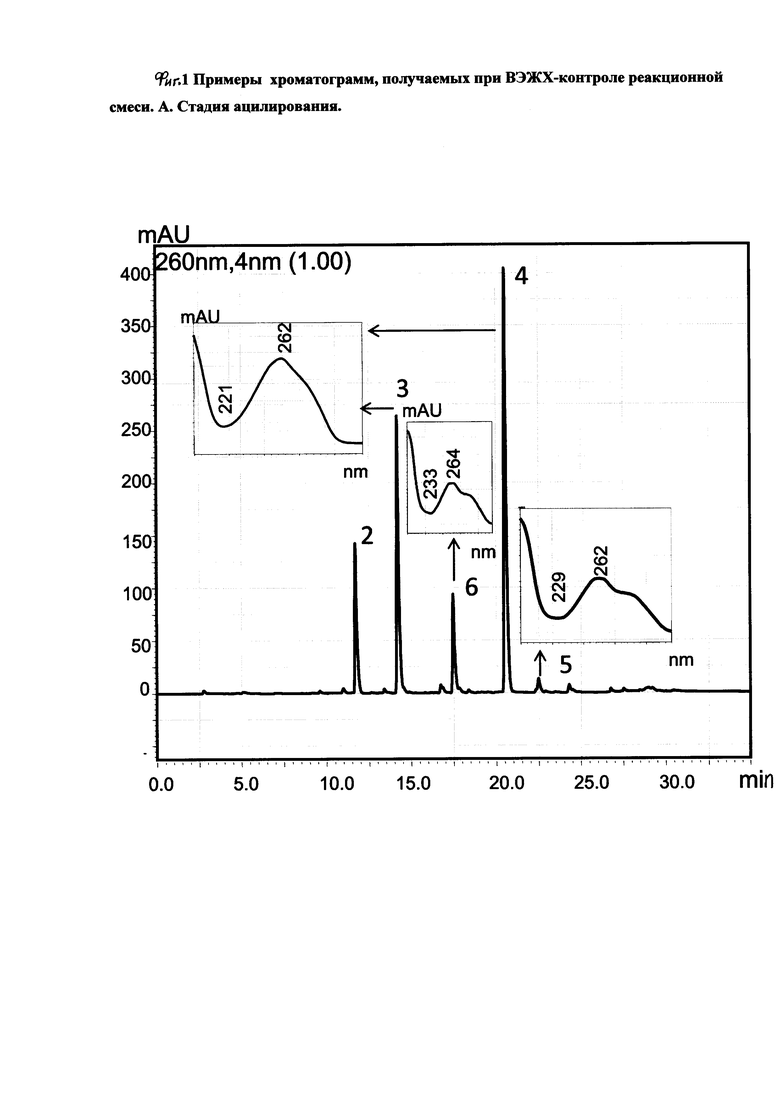
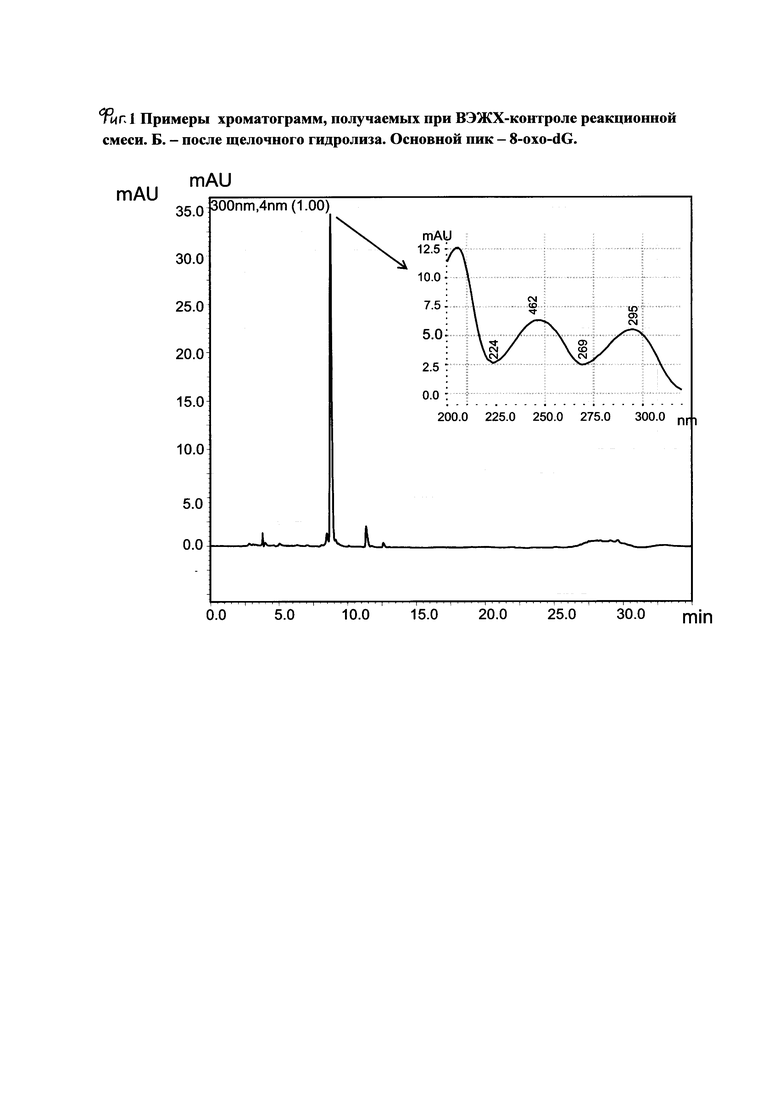
В целях контроля прохождения реакции отбирают пробы для анализа методами ВЭЖХ (фиг. 1, А, Б) и ТСХ. Реакцию ведут до исчезновения триацил-8-бромо-2'-дезоксигуанозина (фиг. 2). В среднем, при температуре 130-135°С время полного расходования реагента составляло 26-28 часов.
После этого нейтрализуют остатки уксусного ангидрида с помощью основного буфера (например, аммоний-бикарбонатного, триэтиламмоний-бикарбонатного), и удаляют растворитель на роторном испарителе.
Осадок заливают 0,1 М NaOH, оставляют на 1-2 часа при перемешивании под контролем хроматографии. Когда ацилированные производные прекращают детектироваться, щелочь нейтрализуют 0,1 М уксусной кислотой до нейтрального рН, растворитель отгоняют на роторе.
Сухой остаток несколько раз (не меньше 3-х) упаривают с водой для удаления остаточного растворителя, растворяют в минимальном объеме дистиллированной воды и наносят на колонку с силанизированным силикагелем. 8-Oxo-dG, очищают от солей и минорных продуктов реакции методом препаративной хроматографии нормального давления. Градиент: 0-8% этанола в воде.
Выход целевого продукта - 74-80% по массе от 8-бромо-2'-дезоксигуанозина.
Физико-химические характеристики продукта: UV (рН=3): λmax1=247 нм, λmax2=294 нм. М=283. NMR (Me2SO-d6): 6 3.41-3.66 (2 Н, 5'-Н), 3.67-3.98 (1 Н, 4'-Н), 3.98-4.21 (1 Н, 3'-Н), 4.71-5.22 (4 Н, 2'-Н; 2'-, 3', and 5'-ОН), 5.58 (1 Н, 1'-Н), 6.46 (2 Н, 2-NH2).
Преимущества предлагаемого способа
1) Повышение выхода целевого продукта (8-оксо-2'-дезоксигуанозина) до 74-80% по массе от 8-бромо-2'-дезоксигуанозина.
2) Получение целевого продукта (8-оксо-2'-дезоксигуанозина), не содержащего ацильную группу в N-положении.
3) Упрощение очистки целевого продукта, заключающееся в отсутствии необходимости использования хроматографии и экстракции на промежуточных стадиях получения 8-оксо-2'-дезоксигуанозина. Так как в предлагаемом способе используют обращенно-фазовую хроматографию нормального давления, которая проводится в водном растворе, последующего избавления от остаточных органических растворителей также не требуется. Химическая чистота продукта по окончанию очистки достигает 94-96%.
4) Повышение экономичности синтеза и очистки. Отказ от использования дорогостоящих солей серебра, которые используются в прототипе, и замена органических растворителей для нормально-фазовой хроматографии на водно-спиртовой раствор позволяют удешевить синтез целевого продукта.
Краткое описание чертежей
На фиг. 1 приведены примеры хроматограмм, получаемых при ВЭЖХ-контроле реакционной смеси. А - стадия ацилирования, цифрой 6 обозначен предшественник 8-oxo-dG. Б - после щелочного гидролиза, основной продукт - 8-oxo-dG.
На фиг. 2 представлена схема предлагаемого метода получения 8-oxo-dG. В центре - структура предполагаемого промежуточного продукта.
Осуществление изобретения
Пример изобретения №1
В безводном N,N-диметилформамиде суспендируют сухой 8-бромо-2'-дезоксигуанозин (8-Br-dG) до концентрации 0,1 мМ и безводный ацетат натрия до концентрации 1 мМ. В реакционную смесь добавляют безводный пиридин - конечная концентрация 1,8 мМ, уксусный ангидрид - конечная концентрация 0,6 мМ, N-метилимидазол - конечная концентрация 0,1 мкМ. При перемешивании реакционную смесь нагревают на глицериновой бане до 130°С и поддерживают данную температуру.
В целях контроля прохождения реакции отбирают пробы для анализа методами ВЭЖХ (фиг. 1, А, Б) и ТСХ. Реакцию ведут до исчезновения триацил-8-бромо-2'-дезоксигуанозина (фиг. 2). В среднем, при температуре 130°С время полного расходования реагента составляло 26 часов.
После этого нейтрализуют остатки уксусного ангидрида с помощью основного буфера (аммоний-бикарбонатного), и удаляют растворитель на роторном испарителе.
Осадок заливают 0,1 М NaOH, оставляют на 1-2 часа при перемешивании под контролем хроматографии. Когда ацилированные производные прекращают детектироваться, щелочь нейтрализуют 0,1 М уксусной кислотой до нейтрального рН, растворитель отгоняют на роторе.
Сухой остаток несколько раз несколько раз (не меньше 3) упаривают с водой для удаления остаточного растворителя, растворяют в минимальном объеме дистиллированной воды и наносят на колонку с силанизированным силикагелем. 8-Охо-dG очищают от солей и минорных продуктов реакции методом препаративной хроматографии нормального давления. Градиент: 0-8% этанола в воде.
Выход целевого продукта-80% по массе от 8-бромо-2'-дезоксигуанозина.
Пример изобретения №2
Все операции выполняют аналогично примеру №1, но реакционную смесь нагревают до 135°С и поддерживают данную температуру в течение 16 часов.
Выход целевого продукта-76% по массе от 8-бромо-2'-дезоксигуанозина.
Пример изобретения №3
Все операции выполняю аналогично примеру №1, но реакционную смесь нагревают до 120°С и поддерживают данную температуру в течение 30 часов.
Выход целевого продукта - 71% по массе от 8-бромо-2'-дезоксигуанозина.
Пример изобретения №4
В качестве растворителей берут смесь безводного N,N-диметилформамида и пиридина, в пропорции 1:1. Остальные реагенты и операции выполняют аналогично примеру №1. Реакционную смесь кипятят с обратным холодильником в течение 24 часов(температура кипения
Выход целевого продукта - 52% по массе от 8-бромо-2'-дезоксигуанозина.
Пример изобретения №5
Все операции выполняю аналогично примеру №1, но реакционную смесь кипятят с обратным холодильником в течение 6 часов.
Выход целевого продукта - 30% по массе от 8-бромо-2'-дезоксигуанозина.
Пример изобретения №6
Все операции выполняю аналогично примеру №1, но реакционную смесь нагревают до 140°С и поддерживают данную температуру в течение 20 часов.
Выход целевого продукта - 45% по массе от 8-бромо-2'-дезоксигуанозина.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ИЗЕПАМИЦИНА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1990 |
|
RU2120444C1 |
| РОДСТВЕННОЕ ВИТАМИНУ A СОЕДИНЕНИЕ И СПОСОБЫ ЕГО ПОЛУЧЕНИЯ | 1998 |
|
RU2188193C2 |
| Способ синтеза триметилзамещенных фуродигидрохинолинов | 2016 |
|
RU2614248C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГАЛОГЕН-О-ГИДРОКСИДИФЕНИЛОВЫХ СОЕДИНЕНИЙ И АЦИЛЬНЫЕ СОЕДИНЕНИЯ | 1998 |
|
RU2191770C2 |
| Способ определения окси- и аминопроизводных в водной среде | 1983 |
|
SU1133548A1 |
| ПРОИЗВОДНЫЕ ПИРАНОБЕНЗОКСАДИАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ. | 1989 |
|
RU2054007C1 |
| ПРОИЗВОДНЫЕ 1-БИФЕНИЛМЕТИЛИМИДАЗОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГИПЕРТЕНЗИИ | 1992 |
|
RU2128173C1 |
| НОВЫЕ АЦИЛИРОВАННЫЕ ПСЕВДОДИПЕПТИДЫ, ИМЕЮЩИЕ ВСПОМОГАТЕЛЬНОЕ ФУНКЦИОНАЛИЗИРОВАННОЕ ОТВЕТВЛЕНИЕ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2000 |
|
RU2275378C2 |
| СПОСОБ ПОЛУЧЕНИЯ УЛИПРИСТАЛА АЦЕТАТА И ЕГО ПРОМЕЖУТОЧНЫХ ПРОДУКТОВ | 2012 |
|
RU2624007C2 |
| 11β-ЗАМЕЩЕННЫЕ 19-НОРСТЕРОИДЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2140423C1 |
Изобретение относится к способу синтеза 8-оксо-2'-дезоксигуанозина (8-oxo-dG), который может быть использован в фармацевтической и химической промышленности. Способ проводят путем ацилирования нуклеозида 8-бромо-2'-дезоксигуанозина (8-Br-dG) смесью уксусного ангидрида и ацетата натрия в полярном апротонном органическом растворителе в присутствии катализатора N-метилимидазола с последующим гидролизом ацильной группы, причем в качестве растворителя используют N-диметилформамид, к нему прибавляют пиридин до конечной концентрации 1,8 мМ для предотвращения апуринизации, реакцию проводят при 120-155°С в течение 12-28 ч, получение целевого продукта (8-oxo-dG) проводят путем снятия ацильных групп с помощью щелочного гидролиза в 0,1-1,5 М водном растворе NaOH. Предложен новый эффективный способ получения ценного продукта. 2 ил., 6 пр.
Способ получения нуклеозида 8-оксо-2'-дезоксигуанозина (8-oxo-dG) путем ацилирования нуклеозида 8-бромо-2'-дезоксигуанозина (8-Br-dG) смесью уксусного ангидрида и ацетата натрия в полярном апротонном органическом растворителе в присутствии катализатора N-метилимидазола с последующим гидролизом ацильной группы, отличающийся тем, что в качестве растворителя используют N-диметилформамид, к нему прибавляют пиридин до конечной концентрации 1,8 мМ для предотвращения апуринизации, реакцию проводят при 120-155°С в течение 12-28 ч, получение целевого продукта (8-oxo-dG) проводят путем снятия ацильных групп с помощью щелочного гидролиза в 0,1-1,5 М водном растворе NaOH.
| Albert Geiger et al, Nucleosides and Nucleotides, 1993, 12(5), 463-477 | |||
| Satyan Nampalli et al, 2000, 10, 1677-1679 | |||
| МУТЕИНЫ ЛИПОКАЛИНА СЛЕЗНОЙ ЖИДКОСТИ, ОБЛАДАЮЩИЕ АФФИННОСТЬЮ К С-МЕТ РЕЦЕПТОРНОЙ ТИРОЗИНКИНАЗЕ ЧЕЛОВЕКА, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2009 |
|
RU2515063C9 |
| US 6797822 B1, 28.09.2004. | |||
Авторы
Даты
2019-06-27—Публикация
2017-07-21—Подача