Ссылка на родственные заявки
По настоящей заявке испрашивается приоритет в соответствии с 35 U.S.C §119(e) предварительной заявки на патент США с номером 61/637631, поданной 24 апреля 2012 г., и 61/779533, поданной 13 марта 2013 г., полное содержание которых включено в настоящий документ.
Область техники, к которой относится настоящее изобретение
Описанная в настоящем документе технология относится к получению плюрипотентных клеток.
Предшествующий уровень техники настоящего изобретения
Современные способы получения плюрипотентных клеток в основном берут за основу ткани ограниченной доступности (например, эмбриональную ткань или пуповинную кровь) или добавление репрограммирующих факторов (Hanna, J. et al. Cell 2008 133, 250-264; Hockemeyer, D. et al. Cell stem cell 2008 3, 346-353; Kim, D. et al. Cell stem cell 2009 4,472-476; Kim, J.B. Nature 2009 461, 649-643; Okabe, M. et al. Blood 2009 114, 1764-1767), которые включают в себя введение экзогенных нуклеиновых кислот. Способы легко производимых стволовых клеток, в частности аутологичных стволовых клеток, без усложнений вносимых путем добавления экзогенных репрограммирующих факторов, будут ускорять исследование в клеточной дифференцировке и развитии терапии на основе стволовых клеток. В то время как предполагается, что повреждение клеток в результате воздействия таких раздражителей, как ожоги, химические повреждения, травмы и излучение, могут изменять нормальные соматические клетки, превращая в злокачественные клетки, не существует прямых доказательств того, что здоровые взрослые соматические клетки могут быть преобразованы в другие состояния без конкретных манипуляций репрограммирующих факторов.
Ранее исследователи сообщали об обнаружении "взрослых стволовых клеток" в тканях взрослого организма (Reynolds, В.А. & Weiss, S. Science 1992 255, 1707-1710; Megeney, L.A. et al., Genes & development 1996 10, 1173-1183; Caplan, A.I. Journal of orthopaedic research 1991 9, 641-650; Lavker, R.M. & Sun, Т.T. The Journal of investigative dermatology 1983 81, 121s-127s). Такие отчеты остаются спорными. Например, исследователям, которые ищут клетки, экспрессирующие маркер стволовых клеток Oct4, не удалось найти экспрессирующие Oct4 клетки во взрослом костном мозге в нормальном гомеостазе (Lengner, С.J., et al. Cell Cycle 2008 7, 725-728; Berg, J.S. & Goodell, M.A. Cell stem cell 2007 1, 359-360), в то время как другие сообщают о возможности выделения экспрессирующих Oct4 клеток из различных взрослых тканей (Jiang, Y. et al. Nature 2010 418, 41-49; D'Ippolito, G. et al. Journal of cell science 2004 117, 2971-2981; Johnson, J. et al. Cell 2005 122, 303-315; Kucia, M. et al. Leukemia 2006 20, 857-869; Kuroda, Y. et al. PNAS 2011 107, 8639-8643; Obokata, H. et al. Tissue engineering. 2011 Part A 17, 607-615; Rahnemai-Azar, A. et al. Cytotherapy 2011 13, 179-192; Huang, Y. et al. Transplantation 2010 89, 677-685; Zuba-Surma, E.K. et al. Journal of cellular and molecular medicine 2011 15, 1319-1328; Paczkowska, E. et al. Annals of transplantation 2011 16, 59-71). Была выдвинута гипотеза, что эти клетки представляют собой либо популяцию взрослых стволовых клеток, либо просто артефакт используемых техник. В любом случае, они остаются редкими и не представляют собой адекватный источник плюрипотентных клеток для исследований и лечебных целей.
Краткое раскрытие настоящего изобретения
В настоящем документе описаны способы получения или создания плюрипотентных клеток de novo от, например, дифференцированных или взрослых клеток. Описанные в настоящем документе способы могут дополнительно относиться к увеличению плюрипотентности клетки (или, например, уменьшению зрелости клетки), например, вызывая переход мультипотентной клетки в плюрипотентную. Описанные в настоящем документе аспекты технологии, которые относятся к производству плюрипотентных клеток, основаны на признании исследователей о том, что стрессы окружающей среды могут вызывать приобретение клеткой более плюрипотентного фенотипа.
Согласно одному аспекту в настоящем документе описан способ получения плюрипотентной клетки, предусматривающий подвергание клетки стрессу. Согласно некоторым вариантам осуществления способ дополнительно предусматривает выбор клеток, проявляющих плюрипотентность. Согласно некоторым вариантам осуществления клетка не присутствует как часть ткани. Согласно некоторым вариантам осуществления стресс предусматривает удаление по меньшей мере приблизительно 40% цитоплазмы из клетки. Согласно некоторым вариантам осуществления стресс предусматривает удаление по меньшей мере приблизительно 40% митохондрий из клетки. Согласно некоторым вариантам осуществления стресса достаточно для разрушения клеточной мембраны по меньшей мере у 10% подвергнутых стрессу клеток. Согласно некоторым вариантам осуществления клетка представляет собой соматическую клетку, стволовую клетку, клетку-предшественника и эмбриональную клетку. Согласно некоторым вариантам осуществления клетка представляет собой выделенную клетку. Согласно некоторым вариантам осуществления клетка присутствует в гетерогенной популяции клеток. Согласно некоторым вариантам осуществления клетка присутствует в гомогенной популяции клеток. Согласно некоторым вариантам осуществления выбор клеток, проявляющих плюрипотентность, предусматривает выбор клеток, экспрессирующих Oct4 или Nanog, или экспрессию Oct4 и Nanog. Согласно некоторым вариантам осуществления выбор клеток, проявляющих плюрипотентность, предусматривает выбор клеток, которые не адгезируют.
Согласно некоторым вариантам осуществления по меньшей мере приблизительно 50% цитоплазмы удаляется из клетки. Согласно некоторым вариантам осуществления по меньшей мере приблизительно 60% цитоплазмы удаляется из клетки. Согласно некоторым вариантам осуществления между 60-80% цитоплазмы удаляется из клетки. Согласно некоторым вариантам осуществления по меньшей мере приблизительно 80% цитоплазмы удаляется из клетки. Согласно некоторым вариантам осуществления по меньшей мере приблизительно 90% цитоплазмы удаляется из клетки.
Согласно некоторым вариантам осуществления стресс предусматривает воздействие на клетки по меньшей мере одним стимулом окружающей среды, выбранного из: травмы, механического раздражителя, химического воздействия, ультразвуковой стимуляции, кислородной недостаточности, радиации и воздействия экстремальных температур. Согласно некоторым вариантам осуществления стресс предусматривает воздействие на клетку рН от приблизительно 4,5 до приблизительно 6.0. Согласно некоторым вариантам осуществления стресс предусматривает воздействие на клетку pH от приблизительно 5,4 до приблизительно 5,8. Согласно некоторым вариантам осуществления на клетку воздействуют в течение 1 дня или менее. Согласно некоторым вариантам осуществления на клетку воздействуют в течение 1 часа или менее. Согласно некоторым вариантам осуществления на клетку воздействуют в течение приблизительно 30 минут.
Согласно некоторым вариантам осуществления воздействие экстремальных температур предусматривает воздействие на клетку температурами ниже 35°С или выше 42°С. Согласно некоторым вариантам осуществления воздействие экстремальными температурами предусматривает воздействие на клетку температурами или ниже точки замерзания или воздействие на клетку температурами по меньшей мере приблизительно 85°С. Согласно некоторым вариантам осуществления механический стимул предусматривает прохождение клеткой через по меньшей мере через одно устройство с меньшим отверстием, чем размер клетки. Согласно некоторым вариантам осуществления механический стимул предусматривает прохождение клеткой через несколько устройств, характеризующихся прогрессивно меньшими отверстиями.
Согласно некоторым вариантам осуществления удаление части цитоплазмы удаляет по меньшей мере приблизительно 50% митохондрий из цитоплазмы. Согласно некоторым вариантам осуществления удаление цитоплазмы или митохондрий удаляет приблизительно 50%-90% митохондрий из цитоплазмы. Согласно некоторым вариантам осуществления удаление цитоплазмы или митохондрий удаляет более 90% митохондрий из цитоплазмы.
Согласно некоторым вариантам осуществления способ может дополнительно предусматривать культивирование плюрипотентной клетки для возможности размножения плюрипотентной клетки. Согласно некоторым вариантам осуществления плюрипотентная клетка экспрессирует один или несколько маркеров плюрипотентных стволовых клеток, выбранных из группы, состоящей из Oct4 и Nanog.
Согласно некоторым вариантам осуществления клетка представляет собой клетку млекопитающего. Согласно некоторым вариантам осуществления клетка представляет собой клетку человека. Согласно некоторым вариантам осуществления клетка представляет собой взрослую клетку или неонатальную клетку. Согласно некоторым вариантам осуществления способ может дополнительно предусматривать поддержание плюрипотентных клеток in vitro. Согласно некоторым вариантам осуществления эпигенетическое состояние клетки изменяется до более близко напоминающего эпигенетическое состояние эмбриональной стволовой клетки. Согласно некоторым вариантам осуществления эпигенетическое состояние предусматривает паттерны метилирования.
Согласно одному аспекту в настоящем документе описан анализ, предусматривающий контактирование плюрипотентных клеток, полученных согласно описанному в настоящем документе способу с кандидатным средством. Согласно некоторым вариантам осуществления этот анализ может быть использован для идентификации средств, которые влияют на одно или несколько из жизнеспособности, дифференциации, пролиферации плюрипотентной клетки.
Согласно одному аспекту в настоящем документе описано использование плюрипотентных клеток, полученных согласно описанному в настоящем документе способу, в способе клеточной терапии для субъекта.
Согласно одному аспекту в настоящем документе описан способ аутологичной клеточной терапии у субъекта, нуждающегося в клеточной терапии, предусматривающий получение плюрипотентной клетки из клетки в соответствии с описанным в настоящем документе способом, при котором клетку получают от субъекта, и введение композиции, содержащей плюрипотентную клетку или ее дифференцированное потомство субъекту. Согласно некоторым вариантам осуществления способ может дополнительно предусматривать дифференциацию плюрипотентных клеток в заранее определенную линию клеток перед введением композиции субъекту.
Согласно одному аспекту в настоящем документе описана композиция, содержащая плюрипотентную клетку, причем плюрипотентную клетку получают из клетки с помощью описанных в настоящем документе способов.
Согласно одному аспекту в настоящем документе описан способ повышения способности к самообновлению плюрипотентных клеток, причем способ, предусматривающий культивирование клетки в присутствии адренокортикотропного гормона (АКТГ) или среды 3i. Согласно некоторым вариантам осуществления клетку культивируют в среде LIF, содержащей АКТГ. Согласно некоторым вариантам осуществления АКТГ присутствует в концентрации, равной от приблизительно 0,1 мкМ до приблизительно 100 мкМ. Согласно некоторым вариантам осуществления клетка представляет собой клетку, полученную посредством описанного в настоящем документе способа. Согласно некоторым вариантам осуществления клетка представляет собой тотипотентную клетку. Согласно некоторым вариантам осуществления клетку культивируют в присутствии АКТГ или среды 3i в течение по меньшей мере 3 дней. Согласно некоторым вариантам осуществления клетку культивируют в присутствии АКТГ или среды 3i в течение по меньшей мере 5 дней. Согласно некоторым вариантам осуществления клетки культивируют в присутствии АКТГ или среды 3i в течение по меньшей мере 7 дней. Согласно некоторым вариантам осуществления после стадии культивирования клетка экспрессирует обнаруживаемый уровень маркера стволовых клеток, выбранного из группы, состоящей из Oct3/4; Nanog; Rex1; Klf4; Sox2; Klf2; Esrr-бета; Tbx3 и Klf5.
Согласно некоторым вариантам осуществления используемые в описанных в настоящем документе способах клетки находятся in vivo. Согласно некоторым вариантам осуществления используемые в описанных в настоящем документе способах клетки находятся in vitro.
Краткое описание графических материалов
На фиг. 1A-1D изображено получение экспрессирующих Oct4 клеток от CD45-положительных соматических клеток. На фиг. 1А изображена экспрессия Oct4-GFP клеток под воздействием стресса. Клетки под воздействием стресса экспрессируют Oct4-GFP, в то время как контрольные без воздействия нет. Увеличение экспрессирующей Oct4 колонии показано в правом верхнем углу в группе под воздействием стресса. Масштабная линейка показывает 100 мкм. На фиг. 1В изображен популяционный анализ клеток под воздействием стресса и контроль без воздействия. Экспрессирующая GFP клеточная популяция наблюдается только в группе под воздействием стресса на 5 день. На фиг. 1С изображен анализ клеточного размера CD45-положительных клеток до и после стрессового воздействия на 7 день. На фиг. 1D изображено хронологическое изменение CD45-положительных клеток после стрессового воздействия.
На фиг. 2А-2В изображена характеристика животных каллусных клеток (АСС). На фиг. 2А изображено хронологическое изменение генной экспрессии плюрипотентных маркерных генов. Уровни информационной РНК нормировали по GAPDH. (n=3, среднее +S.D.) На фиг. 2В изображен анализ метилирования промоторных генов Oct4 и Nanog.
На фиг. 3A-3D изображены клеточные модификации после стрессового воздействия. На фиг. 3А изображена относительная генная экспрессия защищающих от стресса генов во время фазы получения АСС. Образцы собирали на 3-й день и 7-й день и сравнивали с CD45-положительными клетками. (n=3, среднее +S.D.) На фиг. 3В изображены измерения общей клеточной АТФ. (n=3, среднее +S.D.) На фиг. 3С изображено измерение АФК. Столбики ошибок обозначают SD. На фиг. 3D изображена относительная экспрессия генов факторов репликации митохондриальной ДНК. (n=3, среднее +S.D.)
На фиг. 4А-4В изображено получение химерной мыши от АСС. На фиг. 4А изображена схема получения химерной мыши. На панели (i) показано, что АС диссоциировали в отдельные клетки с помощью трипсина или (ii) АС были разрезаны на небольшие кусочки, затем вводимые в бластоцисты. На фиг. 4В изображен анализ вклада в химеры. Ткани от 9 детенышей анализировали с помощью FACS.
На 5А-5С показаны эксперименты с производящими АСС условиями. На фиг. 5А показано, что CD45-положительные клетки подвергали воздействию различных стрессов и анализировали экспрессию Oct4-GFP с помощью FACS. Процент экспрессирующих Oct4-GFP клеток в выживших клетках после стрессового воздействия (n=3, среднее +S.D.). На фиг. 5В изображено определение состояния рН. CD45-положительные клетки подвергали воздействию растворов с различными pH. На 3-й день после стрессового воздействия экспрессию Oct4-GFP анализировали с помощью FACS. На фиг. 5С изображено определение условия культивирования. Клетки под воздействием стресса культивировали в различных средах. Количество экспрессирующих GFP АС подсчитывали на 14-й день (n=3, среднее +S.D.).
На фиг. 6А-6В изображено получение АСС от CD45-положительных клеток, полученных от мышей ICR. На фиг. 6А изображено хронологическое изменение CD45-положительных клеток после стрессового воздействия. Экспрессию Е-кадгерина и SSEA-1 анализировали с помощью FACS. На фиг. 6В показано, что экспрессия генов Oct4 дважды положительных клеток Е-кадгерин/SSEA1 подтверждали с помощью ОТ-ПЦР (n=3, среднее +S.D.).
На фиг. 7А-7В изображено получение АСС из различных тканей, полученных от мышей GOF. На фиг. 7А изображено соотношение экспрессирующих Oct4-GFP клеток после стрессового воздействия. Соматические клетки выделяли из различных тканей и подвергали воздействию различных стрессов. Экспрессию Oct4-GFP анализировали с помощью FACS. На фиг. 7В изображена экспрессия эмбрионального гена АСС, полученных из различных тканей. Генные экспрессии нормировали по GAPDH (n=3, среднее +S.D.).
На фиг. 8 изображена относительная генная экспрессия защищающих от стресса генов на протяжении первых 7 дней. После стрессового воздействия клетки собирали на 1, 3 и 7 день, и генную экспрессию сравнивали с нативными CD45-положительными клетками. На синих графиках указаны генные экспрессии белков теплового шока. На зеленом графике показана экспрессия генов репарации ДНК. На красных графиках показана генная экспрессия окислительно-восстановительных генов. Y-ось указывает относительные кратности экспрессии.
На фиг. 9 изображена дифференциация АСС. На графике изображен анализ вклада химеры. Химерные плоды, полученные с АСС, полученными из различных соматических клеток, анализировали с помощью FACS. На графике показано среднее из 5 химерных плодов от Е13,5 до 15,5.
На фиг. 10 показано, что стрессовое воздействие вызывало репрограммирование соматических клеток с помощью мезенхимально-эпителиального перехода (МЕТ). Экспрессия относящихся к МЕТ генов показана в нативных клетках и в клетках через 3 и 7 дней после начала стрессового воздействия. На оси у показан % экспрессии, нормированный по уровню в образце с уровнем экспрессии для этого гена.
На фиг. 11 показан анализ FACS клеточных популяций до и после стресса. Экспрессия GFP была очевидной, что указывает на образование плюрипотентных клеток в популяциях клеток после стрессового воздействия от каждого испытанного типа ткани.
На фиг. 12А-12Е показано, что воздействие низким pH индуцировало неотвратимое преобразование в коммитированных соматических клетках. На фиг. 12А изображен схематический экспериментальный протокол. На фиг. 12В изображен анализ проточной цитометрии (верхний ряд: oct3/4::GFP+/CD45-; нижний ряд: CD45+ клетки без воздействия). Ось у представляет собой количество клеток Oct3/4:GFP, а ось X представляет собой количество CD45+-клеток. Обе оси представлены в основных единицах 0, 100, 1000 и 10000. На фиг. 12С изображен график жизнеспособных oct3/4::GFP+ и oct3/4::GFP-клеток с течением времени в культуре. На фиг. 12D показан график клеточного размера Oct3/4::GFP+-клеток (левый пик) и CD45+-клеток (правый пик). На фиг. 12Е представлены результаты анализа геномных реаранжировок tcrβ в выделенных oct3/4::GFP+ сферах геномной ПЦР.
На фиг. 13А-13В показано, что индуцированные низким уровнем рН Oct3/4+-клетки характеризовались плюрипотентностью. На фиг. 13А изображен график анализа генной экспрессии с помощью количественной ПЦР в индуцированных низким уровнем pH Oct3/4+ клетках на 7 день, по сравнению с CD45+-клетками (серии представляют собой, слева направо, экспрессию oct3/4, nanog, sox2, ecat1, esg1, dax1 and klf4). Образцы собирали на 3-й день и 7-й день и сравнивали с CD45-положительными клетками (n=3, среднее +S.D.). На фиг. 13В изображены результаты бисульфитного секвенирования из промоторных областей oct3/4 и nanog. CD45+-клетки, с или без дополнительной культуры, отображали в значительной степени метилированные паттерны на обоих промоторах.
На фиг. 14А-14В показано, что клетки STAP могут быть получены из других источников ткани. На фиг. 14А представлен график скорости производства клеток oct3/4::GFP+ на 7 день культуры для ряда тканей (серии представляют собой, слева направо, CD45+-клетки костного мозга, головного мозга, легких, мышц, жировой ткани, фибробласты, печень и хондроциты). На фиг. 14В изображен график анализа генной экспрессии в кластерах клеток oct3/4::GFP+ (серии представляют собой, слева направо, экспрессию Oct3/4, Nanog, Sox2, Klf4 и Rex1).
На фиг. 15А-15В изображена характеристика клеток STAP как плюрипотентных клеток. На фиг. 15А представлен график генной экспрессии клеточных маркеров ES в клетках STAP (серии представляют собой, слева направо, ES, EpiSC, STAP и CD45). На фиг. 15В изображен график % Х-хромосомной инактивации в STAP клетках.
На фиг. 16А изображает график экспрессии Oct4-GFP, анализируемого с помощью FACS в CD45-положительных клетках, подвергающихся воздействию различных стрессов. Процент экспрессирующих Oct4-GFP клеток в выживших клетках после стрессового воздействия (n=3, среднее +S.D.). На фиг. 16В изображен график определения состояния pH. CD45-положительные клетки подвергали воздействию растворов с различным pH. Через 3 дня после стрессового воздействия экспрессию Oct4-GFP анализировали с помощью FACS (n=3, среднее +S.D.). На фиг. 16С представлен график определения состояния культуры. Клетки под воздействием стресса культивировали в различных средах. Количество экспрессирующей GFP под воздействием стресса измененной клеточной массы подсчитывали на 14 день (n=3, среднее +S.D.).
На фиг. 17А-17В изображено получение SAC из CD45-положительных клеток, полученных от мышей ICR. На фиг. 17А изображено хронологическое изменение CD45-положительных клеток после стрессового воздействия. Экспрессию Е-кадгерина и SSEA-1 анализировали с помощью FACS. На фиг. 17В показан график генной экспрессии Oct4 дважды положительных клеток Е-кадгерин/SSEA1, подтвержденной с помощью ОТ-ПЦР (n=3, среднее +S.D.).
На фиг. 18А-18В изображено получение SAC из различных тканей, полученных от мышей GOF. На фиг. 18А изображено соотношение экспрессирующих Oct4-GFP клеток после стрессового воздействия. Соматические клетки выделяли из различных тканей и подвергали воздействию различных стрессов. Экспрессию Oct4-GFP анализировали с помощью FACS. Серии представляют собой, слева направо, костный мозг, головной мозг, легкие, мышцы, жировую ткань, фибробласт и печень. На фиг. 18В изображен график генной экспрессии эмбриональных SAC, полученных из различных тканей. Генные экспрессии нормировали по GAPDH (n=3, среднее +S.D.). Серии представляют собой, слева направо, Oct4, Nanog, Sox2, Klf4 и Ecat1.
На фиг. 19 представлен график относительной генной экспрессии защищающих от стрессов генов в течение первых 7 дней. После стрессового воздействия клетки собирали на 1, 3 и 7 день, и генную экспрессию сравнивали с нативными CD45-положительными клетками. Y-ось показывает относительные кратности экспрессии.
На фиг. 20 показан анализ реаранжировки цепи TCRβ SAC и химерных мышей, полученных от SAC из CD45+-клеток. Химерные мыши 2N #1, #2, #3, #5, #6, #7, #8 и #9 экспрессировали реаранжированные ДНК.
На фиг. 21 показан анализ генотипирования химерных мышей 4N. Генотипирование проводили для доказательства того, что химерные мыши 4N, производимые с SAC, полученными из 129/Sv×B6GFP F1, и 4N бластоцисты, полученные из ICR, экспрессировали специфические гены SAC (129/Sv×B6GFP).
На фиг. 22 показано, что клетки STAP вносят вклад как в эмбриональную, так и в плацентарную ткань in vivo. На графике показано соотношение плодов, в которые вводили клетки только в эмбриональную часть, а также в ткани плаценты и желточного мешка.
На фиг. 23А-23С изображено, что воздействие FGF4 индуцирует некоторый характер трофобластной линии в клетках STAP На фиг. 23А изображена схема воздействия FGF4 для индуцирования подобных TS клеток (F4I) из клеток STAP. На фиг. 23В изображен график анализа кПЦР экспрессии маркера. На фиг. 23С показан график количественного плацентарного вклада с помощью анализа FACS. В отличие от F4I клеток, клетки ES не вносили вклад в плацентарные ткани на детектируемом уровне.
На фиг. 24A-23D изображено, что подобные ES клеткам стволовые клетки могут происходить от клеток STAP. На фиг. 24А изображена схема индукции линий стволовых клеток из клеток STAP. На фиг. 24В изображен график, демонстрирующий высокие темпы роста STAP-S клеток в поддержании культуры более 120 дней. Аналогичные результаты были получены с 16 независимыми линиями. В отличие от этого, исходные клетки STAP быстро уменьшались в числе. На фиг. 24С изображен график анализа кПЦР маркерной генной экспрессии. Клетки ES и STAP-S экспрессировали связанные с плюрипотентностью гены, которые не экспрессировались в CD45+-клетках. На фиг. 24D показано схематическое представление исследования метилирования ДНК с помощью бисульфатного секвенирования.
На фиг. 25А-25В показано, что STAP стволовые клетки представляют собой плюрипотентные и совместимые с наследованием зародышевой линии и тетраплоидной комплементарностью. На фиг. 25А представлен график вклада STAPS клеток в различные ткани у химерных мышей в инъекционном анализе бластоцисты (2N). На фиг. 25В изображен график вклада в плацентарные ткани. В отличие от исходных STAP клеток и клеток TS, STAPS клетки более не сохраняли способность к плацентарным вкладам. Исследовали три независимые линии, и все они показали значительный вклад в эмбриональные части.
Подробное описание настоящего изобретения
Аспекты описанной в настоящем документе технологии относятся к производству или получению плюрипотентных клеток из клеток. Аспекты описанной в настоящем документе технологии основаны на открытии исследователей, что стресс может индуцировать производство плюрипотентных стволовых клеток из клеток без необходимости введения экзогенного гена, транскрипта, белка, ядерного компонента или цитоплазмы в клетку, или без необходимости клеточного слияния. Согласно некоторым вариантам осуществления стресс индуцирует уменьшение количества цитоплазмы и/или митохондрий в клетке; запуск процесса дедифференциации и приводит к плюрипотентным клеткам. Согласно некоторым вариантам осуществления стресс вызывает нарушение целостности клеточной мембраны, например, у по меньшей мере 10% подвергнутых стрессовому воздействию клеток. Эти плюрипотентные клетки характеризуются одним или нескольким из: способности дифференцироваться в каждый из трех зародышевых листков (in vitro и/или in vivo), создавать подобную тератоме клеточную массу in vivo и способности создавать жизнеспособные эмбрионы и/или химерных мышей.
В настоящем документе описаны эксперименты, демонстрирующие, что воздействие на клетки определенными стрессами окружающей среды, включающими в себя без ограничения стрессы, которые снижают количество цитоплазмы и/или митохондрий в клетке, могут уменьшать активность митохондрий, деметилировать области генома, связанные с дедифференциацией, заставлять клетки отображать маркеры известных путей дедифференциации. Соответственно, согласно некоторым вариантам осуществления в настоящем документе предусмотрены способы получения плюрипотентных клеток из клеток, способы, предусматривающие удаление по меньшей мере приблизительно 40% цитоплазмы и/или митохондрий из клетки и выбор плюрипотентности или клеток, обладающих маркерами плюрипотентности, причем клетка не присутствует в ткани. Также в настоящем документе описаны другие стрессовые воздействия, которые могут производить плюрипотентные клетки из клеток.
Для удобства определенные термины, используемые в настоящем документе, описании, примерах и прилагаемой формуле изобретения собраны в настоящем документе. Если не указано иное или неявно из контекста, следующие термины и фразы включают в себя приведенные ниже значения. Если явно не указано иное или не очевидно из контекста, термины и фразы ниже не исключают значение, которое термин или фраза приобрели в настоящей области техники, к которой они относятся. Определения предоставляются для помощи в описании конкретных вариантов осуществления и не предназначены для ограничения заявленного изобретения, поскольку объем настоящего изобретения ограничен только формулой изобретения. Если не указано иное, все используемые в настоящем документе технические и научные термины характеризуются тем же значением, обычно понимаемым специалистом с обычной квалификацией в настоящей области техники, к которой это изобретение принадлежит.
Используемый в настоящем документе термин "содержащий" или "содержит" используется по отношению к композициям, способам и их соответствующему компоненту(ам), которые важны для способа или композиции, но открыты для включения неуказанных элементов, важны ли они или нет.
Используемый в настоящем документе термин "состоящий по существу из" относится к тем элементам, которые необходимы для данного варианта осуществления. Термин позволяет наличие элементов, которые существенно не влияют на основную и новую или функциональную характеристику(и) этого варианта осуществления.
Термин "состоящий из" относится к описанным в настоящем документе композициям, способам и их соответствующим компонентам, которые исключают любой элемент, не описанный в этом описании варианта осуществления.
Используемые в настоящем описании и прилагаемой формуле изобретения формы единственного числа включают в себя ссылки на множественное число, если из контекста явно не следует иное. Так, например, ссылки на "способ" включают в себя один или несколько способов и/или стадий описанного в настоящем документе типа и/или те, которые станут очевидными для специалистов в настоящей области техники после прочтения настоящего раскрытия и так далее. Кроме того, слово "или" предназначено, чтобы включать в себя "и", если из контекста явно не следует иное. Хотя способы и материалы, аналогичные или эквивалентные тем, которые описаны в настоящем документе, могут быть использованы на практике или тестировании настоящего изобретения, подходящие способы и материалы описаны ниже. Аббревиатура "e.g." происходит от латинского exempli gratia и используется в настоящем документе для обозначения неограничивающего примера. Таким образом, сокращение "e.g." представляет собой синоним термина "например".
Определения общих терминов в клеточной биологии и молекулярной биологии можно найти в "The Merck Manual of Diagnosis and Therapy", 19th Edition, published by Merck Research Laboratories, 2006 (ISBN 0-911910-19-0); Robert S. Porter et al. (eds.) и The Encyclopedia of Molecular Biology, published by Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9). Определения общих терминов в области молекулярной биологии также могут быть найдены в Benjamin Lewin, Genes X, published by Jones & Bartlett Publishing, 2009 (ISBN-10: 0763766321); Kendrew et al. (eds.),, Molecular Biology and Biotechnology: a Comprehensive Desk Reference, published by VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8) и Current Protocols in Protein Sciences 2009, Wiley Intersciences, Coligan et al., eds.
Если не указано иное, настоящее изобретение выполнялось с использованием стандартных процедур, как описано, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual (3 ed.), Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., USA (2001); Davis et al., Basic Methods in Molecular Biology, Elsevier Science Publishing, Inc., New York, USA (1995); Current Protocols in Cell Biology (CPCB) (Juan S. Bonifacino et. al. ed., John Wiley and Sons, Inc.) и Culture of Animal Cells: A Manual of Basic Technique by R. Ian Freshney, Publisher: Wiley-Liss; 5th edition (2005), Animal Cell Culture Methods (Methods in Cell Biology, Vol. 57, Jennie P. Mather and David Barnes editors, Academic Press, 1st edition, 1998), которые все полностью включены в настоящий документ посредством ссылки.
Используемые в настоящем документе термины "уменьшение", "сниженный" и "снижение", как правило, означают снижение на статистически значимое количество, по отношению к эталонному. Тем не менее, во избежание сомнений, термины "снижение" или "уменьшение" обычно означают снижение по меньшей мере на 10%, по сравнению с отсутствием данного воздействия, и могут включать в себя, например, уменьшение, по меньшей мере приблизительно на 20%, по меньшей мере, приблизительно на 25% по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 55%, по меньшей мере приблизительно на 60% по меньшей мере приблизительно на 65%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95%, по меньшей мере приблизительно на 98%, по меньшей мере приблизительно на 99%, вплоть до и включая в себя, например, полное отсутствие данного объекта или параметра, по сравнению с отсутствием данного воздействия, или любое уменьшение между 10-99%, по сравнению с отсутствием данного воздействия.
Используемые в настоящем документе термины "увеличенный", "увеличение" или "повышение", как правило, означают увеличение на статически значимое количество; во избежание каких-либо сомнений, термины "увеличенный", "увеличение" или "повышение" означают увеличение по меньшей мере на 10%, по сравнению с эталонным уровнем, например, увеличение по меньшей мере приблизительно на 20% или по меньшей мере приблизительно на 30%, или по меньшей мере приблизительно на 40%, или по меньшей мере приблизительно на 50%, или по меньшей мере приблизительно на 60%, или по меньшей мере приблизительно на 70%, или по меньшей мере приблизительно на 80%, или по меньшей мере приблизительно на 90%, или вплоть до увеличения на 100%, или любое увеличение между 10-100%, по сравнению с эталонным уровнем, или по меньшей мере приблизительно 2-кратное, или по меньшей мере приблизительно 3-кратное, или по меньшей мере приблизительно 4-кратное, или по меньшей мере приблизительно 5-кратное, или по меньшей мере приблизительно 10-кратное увеличение, или какое-либо увеличение между 2-кратным и 10-кратным или более, по сравнению с эталонным уровнем.
Используемые в настоящем документе термины "лечить", "лечение" или "уменьшение" при использовании в отношении заболевания, нарушения или медицинского состояния, относятся к терапевтическим способам лечения состояния, причем объект отменяет, смягчает, улучшает, тормозит, замедляет или останавливает прогрессирование или тяжесть симптома или состояния. Термин "лечение" включает в себя уменьшение или смягчение по меньшей мере одного нежелательного явления или симптома состояния. Лечение, как правило, "эффективно", если один или несколько симптомов или клинических маркеров снижаются. Кроме того, лечение "эффективно", если прогрессирование состояния уменьшается или прекращается. Т.е., "лечение" включает в себя не только улучшение симптомов или маркеров, но также прекращение или по меньшей мере замедление прогрессирования или ухудшения симптомов, которые можно ожидать в отсутствие лечения. Выгодные или желаемые клинические результаты включают в себя без ограничения облегчение одного или нескольких симптомов, уменьшение степени недостаточности стабилизированного (т.е., не ухудшенного) состояния здоровья, задержку или замедление прогрессирования заболевания, а также улучшение или временное облегчение симптомов. Лечение может также включать в себя субъекта, выжившего после статистически ожидаемой смертности.
Используемый в настоящем документе термин "введение" относится к размещению полученной в соответствии с описанными в настоящем документе способами плюрипотентной клетки и/или по меньшей мере частично дифференцированного потомства такой плюрипотентной клетки в субъекте с помощью способа или маршрута, который приводит по меньшей мере к частичной локализации клеток в нужном месте. Фармацевтическую композицию, содержащую плюрипотентную клетку, полученную в соответствии с описанными в настоящем документе способами, и/или по меньшей мере частично дифференцированное потомство такой плюрипотентной клетки можно вводить любым подходящим способом, который приводит к эффективному воздействию на субъект.
Используемый в настоящем документе термин "субъект" означает человека или животного. Обычно животное представляет собой позвоночное, такое как примат, грызун, домашнее животное или промысловое животное. Приматы, например, включают в себя шимпанзе, яванских макак, паукообразных обезьян и макак, например, макак-резус. Грызуны включают в себя мышей, крыс, сурков, хорьков, кроликов и хомяков. Домашние и промысловые животные включают в себя коров, лошадей, свиней, оленей, бизонов, буйволов, кошачьи виды, например, домашних кошек, виды собак, например, собаку, лису, волка, виды птиц, например, курицу, эму, страуса, и рыб, например, форель, сома и лосося. Пациент или субъект включает в себя любое подмножество из вышеперечисленных, например, все из вышеуказанных. Согласно некоторым вариантам осуществления субъект представляет собой млекопитающее, например, примата, например, человека.
Предпочтительно, субъект представляет собой млекопитающего. Млекопитающее может представлять собой человека, нечеловекообразную обезьяну, мышь, крысу, собаку, кошку, лошадь или корову, но не ограничивается этими примерами. Отличные от человека млекопитающие могут быть с успехом использованы в качестве субъектов, которые представляют собой животные модели заболевания, связанного с дефицитом, дисфункцией и/или выходом из строя данной клетки или ткани или дефицитом, дисфункцией или выходом из строя компартмента стволовых клеток. Кроме того, описанные в настоящем документе способы могут быть использованы для лечения сельскохозяйственных животных и/или домашних животных. Субъект может быть мужского или женского пола. Субъектом может быть тот, у кого ранее диагностировали наличие или кого идентифицировали как страдающего от или характеризующегося наличием недостатка, дисфункции и/или сбоя клеточного типа, ткани или компартмента стволовых клеток, или одного или нескольких заболеваний или состояний, связанных с таким состоянием, который не обязательно уже прошел лечение такого состояния. Субъектом может быть тот, у кого ранее диагностировали наличие или кого идентифицировали как страдающего от состояния, включающего в себя недостаток, дисфункцию и/или сбой клеточного типа или ткани, или компартмента стволовых клеток, но который показывает улучшения в известных факторах риска, как результат приема одного или нескольких способов лечения такого состояния. С другой стороны, субъектом также может быть тот, которому не был ранее поставлен диагноз такого состояния. Например, субъектом может быть тот, кто обладает одним или несколькими факторами риска развития такого состояния, или субъект, который не обладает факторами риска для таких условий.
Используемый в настоящем документе термин "выбирать" в отношении клетки или популяции клеток, относится к выбору, разделению, сегрегации и/или выборочному размножению одной или нескольких клеток с желаемой характеристикой. Используемый в настоящем документе термин "выбирать" не обязательно означает, что клетки без желаемой характеристики не могут размножаться в предусмотренных условиях.
Используемый в настоящем документе термин "поддерживать" относится к продолжению жизнеспособности клетки или популяции клеток. Поддерживаемая популяция будет характеризоваться рядом метаболически активных клеток. Количество этих клеток может быть примерно стабильным в течение периода, равного по меньшей мере одному дню, или может расти.
Используемый в настоящем документе термин "определяемый уровень" относится к уровню вещества или активности в образце, который позволяет отличать количество вещества или активности от эталонного уровня, например, уровня вещества или активности в клетке, которая не была подвержена стрессовому воздействию. Согласно некоторым вариантам осуществления определяемый уровень может представлять собой уровень, который по меньшей мере на 10% больше, чем эталонный уровень, например, на 10% больше, на 20% больше, на 50% больше, на 100% больше, на 200% больше или на 300% или больше.
Термин "статистически значимый" или "существенно" относится к статистической значимости и в общем случае означает разницу двух среднеквадратичных отклонений (2SD) выше или ниже эталона, например, концентрации или обилия маркера, например, маркера стволовых клеток или маркера дифференцировки. Термин относится к статистическому доказательству того, что существует разница. Она определяется как вероятность принятия решения об отказе нулевой гипотезы, когда нулевая гипотеза на самом деле верна. Решение часто принимают с использованием р-значения.
Кроме рабочих примеров или если не указано иное, все числа, выражающие количества ингредиентов или условия реакции, используемые в настоящем документе, следует понимать как модифицированные во всех случаях с помощью термина "приблизительно". Термин "приблизительно", используемый в связи с процентами, может означать ±1%.
Другие термины определяются в настоящем документе при описании различных аспектов описанной в настоящем документе технологии.
Аспекты описанной в настоящем документе технологии относятся к способам получения плюрипотентной клетки из клетки, а также применениям и способам использования этих плюрипотентных клеток. В отличие от существующих способов получения плюрипотентных клеток (т.е. индуцированных плюрипотентных стволовых клеток или iPS), которые опираются на повышение экспрессии репрограммирующих факторов, например, путем введения конструктов нуклеиновых кислот, кодирующих один или несколько репрограммирующих факторов (например, Oct4), описанные в настоящем документе способы подвергают клетки стрессу, но не требуют введения чужеродных репрограммирующих факторов.
Согласно некоторым вариантам осуществления стресс уменьшает объем цитоплазмы клетки и/или число митохондрий клетки. Уменьшение объема цитоплазмы клетки или количества клеточных митохондрий индуцирует ответ на стресс, в процессе которого клетка приобретает по меньшей мере плюрипотентные возможности. Согласно одному аспекту в настоящем документе описан способ для получения плюрипотентной клетки, предусматривающий удаление по меньшей мере приблизительно 40% цитоплазмы из клетки, и выбор клеток, проявляющих плюрипотентность, причем клетка не присутствует в ткани. Согласно одному аспекту настоящее изобретение, как описано в настоящем документе, относится к способу получения плюрипотентной клетки, предусматривающему удаление по меньшей мере приблизительно 40% митохондрий из клетки, и выбор клеток, проявляющих плюрипотентность, причем клетка не присутствует в ткани.
Клетки, используемые в описанных в настоящем документе способах, анализах и композициях, могут представлять собой любой тип клетки, например, взрослую клетку, эмбриональную клетку, дифференцированную клетку, стволовую клетку, клетку-предшественника и/или соматическую клетку. Клетка может быть описана с помощью комбинаций описанных выше терминов, например, клетка может представлять собой эмбриональную стволовую клетку или дифференцированную соматическую клетку. Клетка, используемая в описанных в настоящем документе способах, анализах и композициях, может быть получена от субъекта. Согласно некоторым вариантам осуществления клетка представляет собой клетку млекопитающего. Согласно некоторым вариантам осуществления клетка представляет собой клетку человека. Согласно некоторым вариантам осуществления клетка представляет собой взрослую клетку. Согласно некоторым вариантам осуществления клетка представляет собой неонатальную клетку. Согласно некоторым вариантам осуществления клетка представляет собой фетальную клетку. Согласно некоторым вариантам осуществления клетка представляет собой амниотическую клетку. Согласно некоторым вариантам осуществления клетка представляет собой клетку пуповинной крови.
Термин "взрослые" относится к тканям и клеткам, полученным из или в пределах субъекта-животного в любое время после рождения. Термин "эмбриональные" относится к тканям и клеткам, полученным из или в пределах субъекта-животного в любое время до рождения.
Используемый в настоящем документе термин "соматическая клетка" относится к любой клетке, кроме половых клеток, клетке, присутствующей в или полученной из предварительной имплантации эмбриона, или клетки в результате пролиферации такой клетки in vitro. Другими словами, соматическая клетка относится к любым клеткам, образующим тело организма, в отличие от клеток зародышевой линии. У млекопитающих клетки зародышевой линии (также известные как "гаметы") представляют собой сперматозоиды и яйцеклетки, которые сливаются при оплодотворении, чтобы получить клетку под названием зигота, из которой развивается весь эмбрион млекопитающего. Каждый другой тип клеток в организме млекопитающего - отличный от сперматозоида и яйцеклетки, клеток, из которых они получены (гаметоциты) и недифференцированные стволовые клетки - представляет собой соматическую клетку: внутренние органы, кожа, кости, кровь и соединительная ткань, все состоят из соматических клеток. Согласно некоторым вариантам осуществления соматическая клетка представляет собой "неэмбриональную соматическую клетку", под которой подразумевается соматическая клетка, которая не присутствует в или получена из эмбриона и не представляет собой результат пролиферации такой клетки in vitro. Согласно некоторым вариантам осуществления соматическая клетка представляет собой "взрослую соматическую клетку", под которой подразумевают клетку, которая присутствует в или получена из организма, отличного от эмбриона или плода, или в результате пролиферации такой клетки in vitro. Отмечают, что взрослые и неонатальные или эмбриональные клетки могут быть различимы с помощью структурных различий, например, эпигенетической организации, такой как паттерны метилирования. Согласно некоторым вариантам осуществления соматическая клетка представляет собой соматическую клетку млекопитающих. Согласно некоторым вариантам осуществления соматическая клетка представляет собой человеческую соматическую клетку. Согласно некоторым вариантам осуществления соматическая клетка представляет собой взрослую соматическую клетку. Согласно некоторым вариантам осуществления соматическая клетка представляет собой неонатальную соматическую клетку.
Используемый в настоящем документе термин "дифференцированная клетка" относится к клетке, которая представляет собой более специализированную на своем пути или в функции, чем на предыдущем этапе своего развития, и включает в себя как клетки, которые терминально дифференцированы, так и клетки, которые, хотя и не окончательно дифференцированы, но более специализированы, чем на предыдущем этапе их развития. Развитие клетки из некоммитированной клетки (например, стволовой клетки) в клетку с увеличением степени коммитированности до определенного дифференцированного типа клеток, и, наконец, к терминально дифференцированной клетке известно как прогрессивная дифференциация или прогрессивная коммитированность. В контексте клеточного онтогенеза прилагательное "дифференцированный" или "дифференциация" представляет собой относительное понятие. "Дифференцированная клетка" представляет собой клетку, которая продвинулись дальше по пути развития, чем сравниваемая с ней клетка. Таким образом, стволовые клетки могут дифференцироваться в линиеспецифические клетки-предшественники (например, в мезодермальную стволовую клетку), которые в свою очередь могут дифференцироваться в другие типы клеток-предшественников дальше по пути (например, кардиомиоцитный предшественник), а затем в дифференцированную клетку конечной стадии, которая играет характерную роль в определенном типе ткани и может или может не сохранять способность к дальнейшей пролиферации.
Используемый в настоящем документе термин "стволовая клетка" относится к клетке в недифференцированном или частично дифференцированном состоянии, которое характеризуется свойством самообновления и характеризуется потенциалом развития к естественной дифференциации в более дифференцированный тип клеток без специфического предполагаемого значения в отношении потенциала развития (т.е. тотипотентные, плюрипотентные, мультипотентные и т.д.). Под самообновлением подразумевается, что стволовая клетка способна к пролиферации и дает рост большему количеству таких стволовых клеток при сохранении своего потенциала развития. Соответственно, термин "стволовая клетка" относится к любому подмножеству клеток, которые характеризуются потенциалом развития, при определенных обстоятельствах, дифференцироваться в более специализированный или дифференцированный фенотип и которые сохраняют способность, при определенных обстоятельствах, пролиферировать без существенной дифференциации. Термин "соматическая стволовая клетка" используется в настоящем документе для обозначения любой стволовой клетки, полученной из неэмбриональной ткани, включающей в себя фетальную, ювенильную и взрослую ткань. Природные соматические стволовые клетки были выделены из широкого спектра взрослых тканей, включающих в себя кровь, костный мозг, головной мозг, обонятельный эпителий, кожу, поджелудочную железу, скелетные мышцы и сердечную мышцу. Иллюстративные встречающиеся в природе соматические стволовые клетки включают в себя без ограничения мезенхимальные стволовые клетки и гемопоэтические стволовые клетки. Согласно некоторым вариантам осуществления стволовые клетки или клетки-предшественники могут представлять собой эмбриональные стволовые клетки. Используемый в настоящем документе термин "эмбриональные стволовые клетки" относится к стволовым клеткам, полученным из ткани, образованной после оплодотворения, но до конца гестационного периода, включающие в себя преэмбриональную ткань (такую как, например, бластоциста), эмбриональную ткань или фетальную ткань, взятую в любое время в течение периода гестации, обычно, но не обязательно, перед приблизительно 10-12 неделей беременности. Наиболее часто, эмбриональные стволовые клетки представляют собой тотипотентные клетки, полученные из раннего эмбриона или бластоцисты. Эмбриональные стволовые клетки могут быть получены непосредственно из соответствующей ткани, включающей в себя без ограничения человеческую ткань, или из установленных эмбриональных клеточных линий. Согласно одному варианту осуществления эмбриональные стволовые клетки получают, как описано в Thomson et al. (патент США 5843780 и 6200806; Science 282:1145, 1998; Curr. Top. Dev. Biol. 38:133 ff, 1998; Proc. Natl. Acad. Sci. U.S.A. 92:7844, 1995, которые полностью включены в настоящий документ посредством ссылки).
Иллюстративные стволовые клетки включают в себя эмбриональные стволовые клетки, взрослые стволовые клетки, плюрипотентные стволовые клетки, нейронные стволовые клетки, стволовые клетки печени, мышечные стволовые клетки, мышечные стволовые клетки-предшественники, эндотелиальные клетки-предшественники, стволовые клетки костного мозга, хондрогенные стволовые клетки, лимфоидные стволовые клетки, мезенхимальные стволовые клетки, гемопоэтические стволовые клетки, стволовые клетки центральной нервной системы, стволовые клетки периферической нервной системы и тому подобные. Описания стволовых клеток, включающие в себя их способ выделения и культивирования, можно найти, среди других мест, в Embryonic Stem Cells, Methods and Protocols, Turksen, ed., Humana Press, 2002; Weisman et al., Annu. Rev. Cell. Dev. Biol. 17:387 403; Pittinger et al., Science, 284:143 47, 1999; Animal Cell Culture, Masters, ed., Oxford University Press, 2000; Jackson et al., PNAS 96(25):14482 86, 1999; Zuk et al., Tissue Engineering, 7:211 228,2001 ("Zuk et al."); Atala et al., particularly Chapters 33 41 и в патентах США №5559022, 5672346 и 5827735. Описания стромальных клеток, включающие в себя способы их выделения, можно найти, среди других мест, в Prockop, Science, 276:71 74, 1997; Theise et al., Hepatology, 31:235 40, 2000; текущих протоколах в Cell Biology, Bonifacino et al., eds., John Wiley & Sons, 2000 (в том числе обновления по март 2002 г. ) и в патенте США. №4963489.
Используемый в настоящем документе термин "клетки-предшественники" относится к клеткам в недифференцированном или частично дифференцированном состоянии и тем, которые характеризуются потенциалом развития для дифференциации по меньшей мере в еще один зрелый фенотип без специфического подразумеваемого значения в отношении потенциала развития (т.е. тотипотентные, плюрипотентные, мультипотентные и т.д.), и которые не обладают свойством самообновления. Соответственно, термин "клетка-предшественник" означает любое подмножество клеток, которые характеризуются потенциалом развития, при определенных обстоятельствах, дифференцироваться в более специализированный или дифференцированный фенотип. Согласно некоторым вариантам осуществления стволовые клетки или клетки-предшественники представляют собой плюрипотентные стволовые клетки. Согласно некоторым вариантам осуществления стволовые клетки или клетки-предшественники представляют собой тотипотентные стволовые клетки.
Термин "тотипотентная" относится к стволовой клетке, которая может дать рост любой ткани или клеточному типу в организме. "Плюрипотентные стволовые клетки" могут давать рост любому типу клеток в организме, за исключением зародышевой линии клеток. Стволовые клетки, которые могут давать рост меньшему или ограниченному числу различных типов клеток, как правило, называют "мультипотентные". Таким образом, тотипотентные клетки дифференцируются в плюрипотентные клетки, которые могут давать рост большинству, но не всем из тканей, необходимым для фетального развития. Плюрипотентные клетки подвергаются дополнительной дифференцировке в мультипотентные клетки, которые коммутируют для порождения клеток, которые характеризуются определенной функцией. Например, мультипотентные гемопоэтические стволовые клетки дают начало красным кровяным клеткам, белым кровяным клеткам и тромбоцитам в крови.
Используемый в настоящем документе термин "плюрипотентные" относится к клетке со способностью в различных условиях дифференцироваться в типы клеток, характерные для клеток всех трех зародышевых листков (т.е., эндодермы (например, ткани внутренностей), мезодермы (например, крови, мышц и сосудов) и эктодермы (например, кожи и нервной системы)). Плюрипотентные клетки характеризуются, прежде всего, их способностью дифференцироваться во все три зародышевых листка с использованием, например, анализа образование тератомы голой мыши. Плюрипотентность также доказывается экспрессией маркеров эмбриональных стволовых (ЭС) клеток, хотя предпочтительный тест на плюрипотентность представляет собой демонстрацию способности к дифференцировке в клетки каждого из трех зародышевых листков.
Описанные в настоящем документе в примерах клетки "АСС" и "STAP" представляют собой неограничивающие примеры плюрипотентных клеток. "Стволовые клетки STAP" представляют собой неограничивающие примеры плюрипотентных стволовых клеток. Термин плюрипотентная клетка и термин плюрипотентная стволовая клетка может быть использован в настоящем документе взаимозаменяемо, поскольку обе клетки могут быть использованы соответствующим образом для целей настоящего изобретения.
Используемый в настоящем документе термин "плюрипотентность" или "плюрипотентное состояние" относится к клетке со способностью дифференцироваться во все три зародышевых листка: энтодерму (ткани внутренностей), мезодерму (включающую в себя кровь, мышцы и сосуды) и эктодерму (например, кожу и нервы).
Термин "мультипотентная", когда используется по отношению к "мультипотентной клетке", относится к клетке, которая способна дифференцироваться в некоторые, но не все из клеток, полученных из всех трех зародышевых листков. Таким образом, мультипотентная клетка представляет собой частично дифференцированную клетку. Мультипотентные клетки хорошо известны в настоящей области техники, и не ограничивающие примеры мультипотентных клеток могут включать в себя взрослые стволовые клетки, такие как, например, гемопоэтические стволовые клетки, и нейральные стволовые клетки. Мультипотентная означает стволовую клетку, которая может образовывать различные типы клеток в данной линии, но не клетки других линий. Например, мультипотентная стволовая клетка крови может образовывать множество различных типов клеток крови (красные, белые, тромбоциты, и т.д.), но она не может образовать нейроны. Термин "мультипотентность" относится к клетке со степенью универсальности развития, которая меньше тотипотентной и плюрипотентной.
Термин "тотипотентность" относится к клетке со степенью дифференциации, описывающей способность создавать все клетки в теле взрослого человека, а также экстраэмбриональные ткани, включающие в себя плаценту. Оплодотворенная яйцеклетка (зигота) представляет собой тотипотентную, как и ранние расщепляющиеся клетки (бластомеры).
Используемая в описанных в настоящем документе способах клетка может представлять собой клетку, которая не присутствует в ткани. Используемый в настоящем документе термин "ткань" относится к организованному биоматериалу (например, группе, слою или агрегации) из сходно специализированных клеток, объединенных в выполнении по меньшей мере одной конкретной функции. Когда клетки отделяются от организованной суперструктуры или иным образом отделяются от организованной суперструктуры, которая существует in vivo, они больше не присутствуют в ткани. Например, когда образец крови разделяют на две или более неидентичные фракции или селезенку измельчают и механически диссоциируют пипетками Пастера, клетки больше не присутствуют в ткани. Согласно некоторым вариантам осуществления клетки, которые не присутствуют в ткани, представляют собой выделенные клетки. Термин "выделенный" при использовании в настоящем документе в отношении клеток, относится к клетке, которая механически или физически отделена от другой группы клеток, с которыми она, как правило, связана in vivo. Способы выделения одной или нескольких клеток из другой группы клеток хорошо известны в настоящей области техники. Смотрите, например, Culture of Animal Cells: a manual of basic techniques (3rd edition), 1994, R.I. Freshney (ed.), Wiley-Liss, Inc.; Cells:a laboratory manual (vol. 1), 1998, D.L. Spector, R.D. Goldman, L.A. Leinwand (eds.), Cold Spring Harbor Laboratory Press; Animal Cells: culture and media, 1994, D.C. Darling, S.J. Morgan, John Wiley and Sons, Ltd. He обязательно выделенную клетку культивировали in vitro, например, в присутствии других клеток.
Согласно некоторым вариантам осуществления клетка, когда не присутствует в ткани, присутствует в популяции клеток. Согласно некоторым вариантам осуществления популяция клеток представляет собой популяцию клеток. Используемый в настоящем документе термин "популяция клеток" относится к группе по меньшей мере из 2 клеток, например, 2 клеток, 3 клеток, 4 клеток, 10 клеток, 100 клеток, 1000 клеток, 10000 клеток, 100000 клеток или любого значения между ними или большего количества клеток. Возможно, популяция клеток может представлять собой клетки, которые характеризуются общим происхождением, например, они могут происходить от той же исходной клетки, они могут быть клонированы, они могут быть выделены из или происходить от клеток, выделенных из той же ткани, или они могут быть выделены из или происходить от клеток, выделенных из того же образца ткани. Популяция клеток может содержать 1 или несколько типов клеток, например, 1 тип клеток, 2 типа клеток, 3 типа клеток, 4 типа клеток или более типов клеток. Популяция клеток может быть гетерогенной или гомогенной. Популяция клеток может быть по существу гомогенной, если она содержит по меньшей мере 90% клеток одного и того же клеточного типа, например, 90%, 92%, 95%, 98%, 99% или более клеток в популяции одного и того же клеточного типа. Популяция клеток может быть гетерогенной, если менее 90% клеток, присутствующих в популяции, представляют собой клетки одного и того же клеточного типа.
Согласно некоторым вариантам осуществления описанные в настоящем документе способы могут относиться к созданию неплюрипотентной клетки (например, дифференцированной клетки), присваивающей плюрипотентный фенотип. Согласно некоторым вариантам осуществления получение плюрипотентной клетки может включать в себя получение клетки с более плюрипотентным фенотипом, т.е. вынуждением клетки присваивать фенотип, который характеризуется более широким потенциалом дифференциации. В качестве неограничивающего примера очень маленькие подобные эмбриональным клеткам (VSEL) клетки могут быть унипотентными вместо плюрипотентных и/или быть ограничены в своей способности дифференцироваться в некоторые дифференцированные клеточные типы (возможно, из-за эпигенетического состояния VSEL, сильнее напоминающего дифференцированные клетки, чем эмбриональные стволовые клетки). В соответствии с описанными в настоящем документе способами у унипотентной клетки и/или клетки с ограниченной способностью к дифференциации можно вызвать присвоение более плюрипотентного фенотипа. Более плюрипотентный фенотип может представлять собой фенотип, который способен к дифференцировке в большее количество дифференцированных клеточных типов, например, из двух унипотентных клеток, фенотип, который может дифференцироваться в большее количество дифференцированных типов клеток этой линии, представляет собой более плюрипотентный и/или плюрипотентная клетка представляет собой более плюрипотентную, чем унипотентная клетка.
Описанные в настоящем документе способы получения плюрипотентной клетки (или более плюрипотентной клетки) могут предусматривать, например, удаление части цитоплазмы из клетки и/или удаление митохондрий из клетки. Согласно некоторым вариантам осуществления удаление части цитоплазмы или митохондрий из клетки удаляет частичный эпигенетический контроль клетки. Согласно некоторым вариантам осуществления удаляют по меньшей мере приблизительно 40% цитоплазмы, например, удаляют по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90% или более цитоплазмы клетки. Согласно некоторым вариантам осуществления удаляют от 60% до 80% от цитоплазмы клетки. Согласно некоторым вариантам осуществления удаляют по меньшей мере приблизительно 40% митохондрий, например, удаляют по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90% или более митохондрий клетки. Согласно некоторым вариантам осуществления удаляют в пределах от 50% до 90% митохондрий в клетке.
Способ подвергания клетки стрессу и/или удалению части цитоплазмы или митохондрий из клетки может представлять собой любой раздражитель окружающей среды, который приведет к возникновению пор и/или разрывов в мембране клетки ниже порога летальности. Стресс может предусматривать нефизиологический стресс в ткани или клеточной культуре. Не ограничивающие примеры подходящих раздражителей окружающей среды включают в себя травму, механические раздражители, воздействие химических веществ, ультразвуковую стимуляцию, кислородную недостаточность, недостаточность питательных веществ, излучение, воздействие экстремальных температур, диссоциацию, титрование, физический стресс, гиперосмос, гипоосмос, повреждение мембраны, токсин, воздействие экстремальных ионных концентраций, активный кислород, воздействие ультрафиолета, воздействие сильным видимым светом, недостаточность значимых питательных веществ или нефизиологически кислая окружающая среда. Согласно некоторым вариантам осуществления один раздражитель окружающей среды может быть применен к клетке. Согласно некоторым вариантам осуществления множественные раздражители окружающей среды могут быть применены к клетке, например, могут быть применены 2 раздражителя, 3 раздражителя, 4 раздражителя или больше раздражителей. Множественные раздражители окружающей среды могут быть применены одновременно или по отдельности.
Согласно некоторым вариантам осуществления стресс может представлять собой стресс, который будет вызывать разрушение мембраны по меньшей мере у 10% клеток, подвергшихся стрессовому воздействию. Используемый в настоящем документе термин "разрушение мембраны" относится к повреждению, разрыву или разрушению мембраны таким образом, что образуются поры или щели, достаточные, чтобы выпустить обнаруживаемое количество органелл и/или клеточного материала, включающего в себя без ограничения митохондрии и ДНК, во внеклеточную окружающую среду. Способы определения освобождения клеточного материала, например, митохондрий, известны в настоящей области техники и описаны в настоящем документе в другом месте. Высвобожденный клеточный материал может быть свободным или инкапсулированным или окружении мембранами.
Стресс может вызывать разрушение мембран по меньшей мере у 10% клеток, подвергшихся стрессовому воздействию, например, у 10% или более, у 20% или более, у 30% или более, у 40% или более, у 50% или более, у 60% или более, у 70% или более, у 80% или более или у 90% или более. Согласно некоторым вариантам осуществления клетки, подвергшиеся стрессовому воздействию, могут представлять собой клетки одного и того же типа и характеристики, что и клетки, которые сделаны более плюрипотентными, как описано в настоящем документе, например, стресс, подходящий для одного типа клетки, может не подходить для другого типа клеток.
Продолжительность по времени, в течение которой клетки подвергаются воздействию стресса, может изменяться в зависимости от используемого раздражителя. Например, при использовании условий недостаточного питания для стрессового воздействия на клетки в соответствии с описанными в настоящем документе способами клетки можно культивировать в условиях недостаточного питания в течение 1 недели или более, например, 1 недели, 2 недель, 3 недель или дольше. Согласно некоторым вариантам осуществления клетки культивируют в условиях недостаточного питания в течение примерно 3 недель. В другом неограничивающем примере клетки, подвергаемые низкому pH или гипоксии в соответствии с описанными в настоящем документе способами, могут подвергаться воздействию в течение минут или дольше, например, включая в себя в течение нескольких часов, например, в течение по меньшей мере 2 минут, в течение по меньшей мере 5 минут, в течение по меньшей мере 20 минут, в течение по меньшей мере 1 часа, в течение по меньшей мере 2 часов, в течение по меньшей мере 6 часов или дольше.
Механические раздражители, которые индуцируют образование плюрипотентных клеток, могут включать в себя любую форму контакта вещества или поверхности с клеточной мембраной, которая будет механически нарушать целостность мембраны. Механический раздражитель может предусматривать воздействие на клетку для сдвигового напряжения или высокого давления. Иллюстративная форма механического раздражителя представляет собой гомогенизацию. Гомогенизация представляет собой процесс измельчения и/или абразивной обработки поверхности частицы с помощью трения. Не ограничивающий пример процесса гомогенизации в клетке заключается в том, чтобы заставить клетку пройти через устройство, причем устройство характеризуется отверстием меньшим, чем размер клетки. Например, клетку можно заставить, под вакуумным давлением и/или потоком жидкости проходить через пипетку, в которой по меньшей мере часть внутреннего пространства пипетки характеризуется диаметром меньшим, чем диаметр клетки. Согласно некоторым вариантам осуществления клетка проходит по меньшей мере через одно устройство с меньшим отверстием, чем размер клетки. Согласно некоторым вариантам осуществления клетка проходит через несколько устройств, характеризующихся прогрессивно меньшими отверстиями. Согласно некоторым вариантам осуществления клетки могут быть гомогенизированы в течение 5 или более минут, например, 5 минут, 10 минут, 20 минут, 30 минут или 60 минут. Согласно некоторым вариантам осуществления клетки могут быть гомогенизированы с помощью пропускания их через пипетку Пастера с внутренним диаметром, равным 50 мкм. Согласно некоторым вариантам осуществления клетки могут быть гомогенизированы с помощью пропускания их через пипетку Пастера с внутренним диаметром, равным 50 мкм, в течение 20 минут.
Другие способы применения стресса, необходимые, чтобы заставить клетки создавать плюрипотентные клетки, предусматривают, например, воздействие некоторыми химическими веществами или физико-химическими условиями (например, высоким или низким pH, осмотическим шоком, перепадами температуры, недостатком кислорода и т.д.). Воздействия такого рода и другие, которые вызывают образование плюрипотентных клеток, обсуждаются дополнительно ниже. Химическое воздействие может включать в себя, например, любое сочетание pH, осмотического давления и/или порообразующих соединений, которые нарушают или ставят под угрозу целостность клеточных мембран. В качестве неограничивающего примера эти клетки могут быть подвергнуты воздействию нефизиологически кислой окружающей среде или низкого значения pH, стрептолизина О или дистиллированной воды (т.е. осмотическому шоку).
Низкое значение pH может включать в себя значение pH ниже, чем 6,8, например, 6,7, 6,5, 6,3, 6,0, 5,8, 5,4, 5,0, 4,5, 4,0 или меньше. Согласно некоторым вариантам осуществления низкое значение pH составляет от приблизительно 3,0 до приблизительно 6,0. Согласно некоторым вариантам осуществления низкое значение pH составляет от приблизительно 4,5 до приблизительно 6,0. Согласно некоторым вариантам осуществления низкое значение pH составляет от 5,4 до 5,8. Согласно некоторым вариантам осуществления низкое значение pH составляет от 5,4 до 5,6. Согласно некоторым вариантам осуществления низкое значение рН составляет приблизительно 5,6. Согласно некоторым вариантам осуществления низкое значение рН составляет приблизительно 5,7. Согласно некоторым вариантам осуществления низкое значение рН составляет приблизительно 5,5. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты условиям низкого значения рН в течение нескольких дней, например, в течение 6 дней или менее, в течение 4 дней или менее, в течение 3 дней или менее, 2 дней или менее, 1 дня или менее, в течение 12 часов или менее, 6 часов или менее, в течение 3 часов или менее, в течение 2 ч или менее, в течение 1 часа или менее, в течение 30 минут или менее, в течение 20 минут или менее или менее 10 минут. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты рН от 5,4 до 5,6 в течение 3 дней или менее. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты рН от приблизительно 5,6 до 6,8 в течение 3 дней или менее. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты рН от приблизительно 5,6 до 6,8 в течение 1 часа или менее. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты рН от приблизительно 5,6 до 6,8 в течение приблизительно 30 минут. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты рН от приблизительно 5,6 до 6,8 в течение приблизительно 20 минут. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты рН от приблизительно 5,6 до 5,8 в течение 3 дней или менее. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты рН от приблизительно 5,6 до 5,8 в течение 1 часа или менее. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты рН от приблизительно 5,6 до 5,8 в течение приблизительно 30 минут. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты рН от приблизительно 5,6 до 5,8 в течение приблизительно 20 минут.
Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию АТФ для индуцирования образования плюрипотентных клеток. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию АТФ в концентрации от приблизительно 20 мкМ до приблизительно 200 мМ. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию АТФ в концентрации от приблизительно 200 мкМ до приблизительно 20 мМ. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию АТФ в концентрации приблизительно 2,4 мМ. Согласно некоторым вариантам осуществления клетка может подвергаться воздействию АТФ, разведенного в HBSS. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию АТФ в течение 1 минуты или дольше, например, по меньшей мере 1 минуту, по меньшей мере 2 минуты, по меньшей мере 5 минут, по меньшей мере 15 минут, по меньшей мере 30 минут, по меньшей мере 45 минут, по меньшей мере 1 час или дольше. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию АТФ в течение от приблизительно 5 минут до приблизительно 30 минут. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию АТФ в течение 15 минут. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию АТФ в концентрации приблизительно 2,4 мМ в течение 15 минут.
Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию CaCl2 для индуцирования образования плюрипотентных клеток. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию CaCl2 в концентрации от приблизительно 20 мкМ до приблизительно 200 мМ. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию CaCl2 в концентрации от приблизительно 200 мкМ до приблизительно 20 мМ. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию CaCl2 в концентрации, равной приблизительно 2 мМ. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию CaCl2, разбавленному в HBSS. Согласно некоторым вариантам осуществления клетки могут подвергаться воздействию CaCl2 в течение 1 дня или дольше, например, по меньшей мере 1 день, по меньшей мере 2 дня, по меньшей мере 1 неделю, по меньшей мере 2 недели, по меньшей мере 3 недели или дольше. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию CaCl2 в течение от 1 недели до 3 недель. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию CaCl2 в течение приблизительно 2 недель. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию CaCl2 в концентрации приблизительно 2 мМ в течение приблизительно 2 недель. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты воздействию CaCl2 в концентрации приблизительно 2 мМ в течение приблизительно 1 недели.
Примеры порообразующих соединений включают в себя стрептолизин О (SLO), сапонин, дигитонин, филипин, Ае I, цитолизин из актинии, аэролизин, аматоксин, амебапор, гомолог амебапора из Entamoeba dispar, бревинин-le, бревинин-2Е, барбатолизин, цитолизин из Enterococcus faecalis, дельта гемолизин, дифтерийный токсин, El Tor цитолизин из Vibrio cholerae, эквинатоксин, энтеротоксин из Aeromonas hydrophila, эскулентин, гранулизин, гемолизин из Vibrio parahaemolyticus, интермедилизн из Streptococcus intermedins, литический пептид лентивирусов, лейкотоксин из Actinobacillus actinomycetemcomitans, магаинин, мелиттин, ассоциированный с мембранами лимфотоксин, Met-энкефалин, неокиоторфин, фрагмент 1 неокиоторфина, фрагмент 2 неокиоторфина, фрагмент 3 неокиоторфина, фрагмент 4 неокиоторфина, NK лизин, парадаксин, альфацитолизин из Staphylococcus aureus, альфацитолизин из Clostridium septicum, токсин Bacillus Thuringiensis, колицин, комплемент, дефензин, гистолизин, листериолизин, магаинин, мелиттин, пневмолизин, убивающий клетки дрожжей токсин, валиномицин, краун-эфиры Петерсона, перфорин, перфоринголизин О, тетатоксин из Clostridium perfringens, фаллолизин, фаллотоксин и другие молекулы, такие как те, которые описаны в Regen et al. Biochem Biophys Res Commun 1989 159:566-571; который полностью включен в настоящее описание посредством ссылки. Способы очистки или синтеза порообразующих соединений хорошо известны любому специалисту в настоящей области техники. Кроме того, порообразующие соединения представляют собой коммерчески доступные, например, стрептолизин О (№ по каталогу S5265; Sigma-Aldrich; St. Louis, МО). В качестве неограничивающего примера клетки могут подвергаться воздействию SLO в течение 5 минут или дольше, например, по меньшей мере 5 минут, по меньшей мере 10 минут, по меньшей мере 20 минут, по меньшей мере 30 минут, по меньшей мере 45 минут, по меньшей мере 1 час, по меньшей мере 2 часа, по меньшей мере 3 часа или дольше. Согласно некоторым вариантам осуществления клетки подвергаются воздействию SLO в течение от приблизительно 30 минут до 2 часов. Согласно некоторым вариантам осуществления клетки подвергаются воздействию SLO в течение приблизительно 50 минут. В качестве неограничивающего примера клетки могут быть подвергнуты SLO в концентрации от приблизительно 10 нг/мл до 1 мг/мл. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты SLO в концентрации от приблизительно 1 мкг/мл до 100 мкг/мл. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты SLO в концентрации приблизительно 10 мкг/мл. Согласно некоторым вариантам осуществления клетки могут быть подвергнуты SLO в концентрации приблизительно 10 мкг/мл в течение приблизительно 50 минут.
Условия кислородной недостаточности, которые индуцируют образование плюрипотентных клеток, могут предусматривать культивирование клеток в условиях уменьшенного количества кислорода, например, культивирование клеток в атмосфере 10% кислорода или менее. Согласно некоторым вариантам осуществления клетки культивируют в атмосфере 5% кислорода или менее. Продолжительность культивирования в условиях недостаточности кислорода может составлять 1 час или более, например, 1 час, 12 часов, 1 день, 2 дня, 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца или более. Согласно некоторым вариантам осуществления клетки можно культивировать в условиях недостаточности кислорода в течение от 1 недели до 1 месяца. Согласно некоторым вариантам осуществления клетки можно культивировать в условиях недостаточности кислорода в течение приблизительно 3 недель.
Условия недостаточности питательных веществ, которые индуцируют образование плюрипотентных клеток, могут включать в себя отсутствие какого-либо фактора или питательного вещества, полезного для роста клеток. Согласно некоторым вариантам осуществления условия недостаточности питательных веществ предусматривают культивирование клеток в базальной культуральной среде, например, F12 или DMEM без дополнительных добавок, таких как FBS или факторы роста. Продолжительность культивирования в условиях недостаточности питательных веществ может составлять 1 час или более, например, 1 час, 12 часов, 1 день, 2 дня, 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца или более. Согласно некоторым вариантам осуществления клетки можно культивировать в условиях недостаточности питательных веществ от 1 недели до 1 месяца. Согласно некоторым вариантам осуществления клетки можно культивировать в условиях недостаточности питательных веществ в течение приблизительно 2 недель. Согласно некоторым вариантам осуществления клетки можно культивировать в условиях недостаточности питательных веществ в течение приблизительно 3 недель. Согласно некоторым вариантам осуществления условия недостаточности питательных веществ могут включать в себя условия без каких-либо факторов роста или условия с менее чем 50% от стандартной концентрации одного или нескольких факторов роста для данного типа клеток.
Воздействие экстремальных температур, которое вызывает образование плюрипотентных клеток, может предусматривать воздействие либо низкими температурами, либо высокими температурами. Для клетки млекопитающего крайне низкая температура может представлять собой температуру ниже 35°С, например, 34°С, 33°С, 32°С, 31°С или ниже. Согласно некоторым вариантам осуществления крайне низкая температура может представлять собой температуру ниже точки замерзания. Замораживание клеток может приводить к мембранным перфорациям кристаллами льда и дает возможность получить уменьшение цитоплазмы. Для клетки млекопитающего экстремально высокая температура может представлять собой температуру выше 42°С, например, 43°С, 44°С, 45°С, 46°С или выше. Согласно некоторым вариантам осуществления экстремально высокая температура может представлять собой температуру, равную приблизительно 85°С или выше. Продолжительность культивирования в условиях экстремальных температур может составлять 20 минут или дольше, например, 20 минут, 30 минут, 1 час, 12 часов, 1 день, 2 дня, 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца или дольше. Очевидно, что чем выше температура, тем короче воздействие, которое, как правило, будет допустимым для обеспечения образования плюрипотентных клеток.
Другие примеры стрессов, которые могут быть использованы в описанных в настоящем документе способах, включают в себя без ограничения ультразвуковую стимуляцию и лучевую терапию.
Согласно некоторым вариантам осуществления после стрессового воздействия клетки можно культивировать до отбора в соответствии с описанными ниже в настоящем документе способами. Клетки можно культивировать в течение по меньшей мере 1 часа до отбора, например, стрессовый раздражитель удаляют и клетки культивируют в течение по меньшей мере 1 часа, по меньшей мере 2 часов, по меньшей мере 6 часов, по меньшей мере 12 часов, по меньшей мере 1 дня, по меньшей мере 2 дней, по меньшей мере 7 дней или более до отбора, как описано в настоящем документе. В качестве не ограничивающего примера клетки могут подвергаться воздействию SLO в течение приблизительно 50 минут и затем культивироваться в питательной среде без SLO в течение приблизительно 7 дней до отбора. Согласно некоторым вариантам осуществления культуральная среда, используемая для культивирования клеток до отбора, не содержит факторы дифференциации или способствует дифференциации. Согласно некоторым вариантам осуществления культуральная среда представляет собой среду, подходящую для культуры стволовых клеток и/или плюрипотентных клеток. Примеры таких сред описаны ниже в настоящем документе.
Согласно некоторым вариантам осуществления количество цитоплазмы в клетке уменьшается. Уменьшение цитоплазмы в клетке может быть определено путем мониторинга размера клетки. Способы определения размера клеток хорошо известны любому специалисту в настоящей области техники и предусматривают, в качестве неограничивающего примера, цитофлуориметрический анализ. Вкратце, одиночные клетки окрашивают пропидийиодидом, фильтруют и измеряют, например, на анализаторе DAKO GALAXY™ (DAKO) с помощью программного обеспечения FLOMAX™. Цитофлуориметрический анализ может быть выполнен для установления размера клетки. Микрогранулы предопределенных размеров ресуспендируют в изотоническом фосфатном физиологическом растворе (pH 7,2) и используют в качестве стандарта, с которым сравнивают размер клеток, содержащихся в областях с использованием цитофлуориметрического анализа. Как клетки, так и гранулы анализируют с помощью одинаковых параметров настройки (прямое светорассеивание, размер эталонных клеток и гранул и боковое светорассеивание, эталонная клеточная гранулярность). Размер клеток может быть вычислен по кривой, использующей размер гранул на оси х и значения прямого светорассеивания на оси у.
Согласно некоторым вариантам осуществления количество митохондрий в клетке уменьшается. Способы определения количества митохондрий в клетке хорошо известны любому специалисту в настоящей области техники и включают в себя окрашивание специфическим для митохондрий красителем и подсчет количества видимых митохондрий на клетку при просмотре под микроскопом. Специфические для митохондрий красители коммерчески доступны, например, MITOTRACKER™ (№ в каталоге М7512 Invitrogen; Grand Island, NY). Согласно некоторым вариантам осуществления количество митохондрий или интенсивность сигнала от специфических для митохондрий красителей могут быть снижены по меньшей мере на 40% после воздействия описанными выше в настоящем документе способами. Согласно некоторым вариантам осуществления отбирают клетки, в которых количество митохондрий или интенсивность сигнала от специфических для митохондрий красителей снижены по меньшей мере на 40% после воздействия описанными выше в настоящем документе способами.
Количество митохондрий и/или разрушение мембраны также могут быть обнаружены путем измерения окислительно-восстановительной активности во внеклеточной окружающей среде. Когда митохондрии попадают во внеклеточную окружающую среду с помощью описанного в настоящем документе стресса, уровень АФК во внеклеточной среде может расти и может быть использован для оценки эффективности данного стресса.
Согласно некоторым вариантам осуществления любого из описанных в настоящем документе аспектов клетка может быть подвергнута стрессу в присутствии LIF (ингибирующего лейкемию фактора).
Согласно некоторым аспектам после удаления части цитоплазмы и/или митохондрий клетки способ дополнительно предусматривает выбор клеток, проявляющих плюрипотентность. Плюрипотентные клетки могут быть отобраны путем выбора клеток, которые демонстрируют маркеры, фенотипы или функции плюрипотентных клеток. Выбор клеток может предусматривать выделение и размножение клеток, отображающих желаемые характеристики или культивирование популяции клеток с неизвестными характеристиками в таких условиях, когда клетки с требуемой характеристикой(ами) будут выживать и/или размножаться с более высокой скоростью, чем те клетки, которые не характеризуются наличием желаемой характеристики(-). Неограничивающие примеры маркеров и характеристик плюрипотентных клеток описаны в настоящем документе ниже. Согласно некоторым вариантам осуществления отбор клеток на плюрипотентность предусматривает, по меньшей мере частично, отбор клеток, которые экспрессируют Oct4. Согласно некоторым вариантам осуществления отбор клеток на плюрипотентность предусматривает, по меньшей мере частично, отбор клеток, которые экспрессируют Nanog. Согласно некоторым вариантам осуществления отбор клеток на плюрипотентность предусматривает, по меньшей мере частично, отбор клеток, которые экспрессируют Oct4, Nanog, Е-кадгерин и/или SSEA. Согласно некоторым вариантам осуществления плюрипотентные клетки могут быть выбраны путем отбора клеток, экспрессирующих SSEA-1 и Е-кадгерин, с использованием специфических в отношении этих маркеров антител и FACS. Согласно некоторым вариантам осуществления клетки могут быть выбраны на основании размера с использованием FACS или других устройств сортировки клеток, как известно в настоящей области техники и/или описано в настоящем документе. Клетки также могут быть выбраны по их неспособности адгезировать к культуральным чашкам.
Клетки также могут быть выбраны на основании меньшего размера после того, как они подвергаются стрессу. То есть, подвергнутые стрессовому воздействию клетки, которые прогрессируют в плюрипотентности, меньшего размера, чем их неплюрипотентные соматические предшественники. Согласно некоторым вариантам осуществления выбирают клетки с диаметром менее 8 мкм, например, клетки с диаметром 8 мкм или менее, 7 мкм или менее, 6 мкм или менее, 5 мкм или менее или менее. Клетки могут быть выбраны на основании размера после культивирования в течение короткого периода (например, от нескольких минут до нескольких суток) или после того, как клеткам позволяют отдохнуть после стрессового воздействия. Согласно некоторым вариантам осуществления клетки могут быть выбраны на основании размера сразу же после стрессового воздействия. Клетки могут быть выбраны на основании размера любым способом, известным в настоящей области техники, например, с использованием фильтра или FACS.
Согласно некоторым вариантам осуществления описанных в настоящем документе способов плюрипотентная клетка, полученная в соответствии с описанными в настоящем документе способами, может быть культивирована, чтобы обеспечить размножение этой плюрипотентной клетки (т.е. размножение стволовой клетки). Согласно некоторым вариантам осуществления плюрипотентная клетка, полученная в соответствии с описанными в настоящем документе способами, может поддерживаться in vitro. Согласно одному аспекту описанная в настоящем документе технология относится к композиции, содержащей плюрипотентную клетку и/или по меньшей мере частично дифференцированное ее потомство. Согласно некоторым вариантам осуществления плюрипотентная клетка и/или по меньшей мере частично дифференцированное ее потомство можно поддерживать in vitro, например, в качестве клеточной линии. Клеточные линии могут быть использованы для скрининга и/или исследования кандидатных средств, например, терапевтических средств для данного заболевания и/или средств, которые модулируют стволовые клетки, как описано ниже в настоящем описании. Согласно некоторым вариантам осуществления плюрипотентная клетка и/или по меньшей мере частично дифференцированное ее потомство может быть получено из клеток, полученных от субъекта с заболеванием, например, заболеванием, связанным с недостаточностью встречающейся в природе клетки или типа ткани или встречающейся в природе плюрипотентной и/или мультипотентной клетки (как описано ниже), и/или заболеванием, включающим в себя клетки, которые характеризуются наличием генетических мутаций, например, злокачественной опухоли. Описанные в настоящем документе композиции могут быть использованы, например, в моделировании заболеваний, открытии новых лекарственных средств, диагностике и индивидуальном лечении.
Условия, подходящие для размножения и/или поддержания стволовых и/или плюрипотентных клеток, известны в настоящей области техники. Размножение стволовых клеток позволяет расширение числа клеток без существенного индуцирования или разрешения дифференцировки. В качестве неограничивающего примера, условия, подходящие для размножения плюрипотентных клеток, включают в себя посев клеток в концентрации 1×106 клеток/см в F12/DMEM (1:1, об/об) с добавлением 2% В27, 20 нг/мл основного фактора роста фибробластов и 10 нг/мл эпидермального фактора роста. Приблизительно 50% среды может быть заменено каждые 2-3 дня в течение всего срока культуры. Согласно некоторым вариантам осуществления условия, подходящие для размножения стволовых и/или плюрипотентных клеток, предусматривают культивирование клеток в B27-LIF (т.е. в бессывороточной среде, содержащей LIF (1×103 ед/мл, Chemicon; № в каталоге: ESG1107 EMD Millipore, Billerica, MA) и добавку В27 (№ в каталоге: 0080085-SA; Invitrogen; Grand Island, NY), как описано в Hitoshi, S. et al. Genes & development 2004 18, 1806-1811; который полностью включен в настоящий документ посредством ссылки. Другие среды, пригодные для культивирования клеток, описанные в настоящем документе, описаны в настоящем документе в примерах, например, разработанная для ES культуральная среда, 2i, 3i и АСТН, условие культивирования ES, ES-LIF, условие культивирования эмбриональных нервных стволовых клеток и условие культивирования EpiSCs. Согласно некоторым вариантам осуществления условия для размножения или поддержания плюрипотентных клеток могут включать в себя культуру клеток в присутствии LIF (ингибирующий лейкемию фактор).
В процессе размножения плюрипотентная клетка, полученная в соответствии с описанными в настоящем документе способами, будет продолжать экспрессировать один и тот же маркер(ы) плюрипотентных стволовых клеток. Не ограничивающие примеры маркеров плюрипотентных стволовых клеток включают в себя SSEA-1, SSEA-2, SSEA-3, SSEA-4 (все вместе относятся в настоящем документе к SSEA), АР, антиген Е-кадгерина, Oct4, Nanog, Ecat1, Rex1, Zfp296, GDF3, Dppa3, Dppa4, Dppa5, Sox2, Esrrb, DNMT3b, Dnmt3l, Utf1, Tel1, BAT1, Fgf4, Neo, Cripto, Cdx2 и Slc2a3. Способы определения того, экспрессирует ли клетка маркер плюрипотентных стволовых клеток, хорошо известны любому специалисту в настоящей области техники и предусматривают, например, ОТ-ПЦР, использование конструктов репортерных генов (например, экспрессия описанного в настоящем документе конструкта Oct4-GFP в сочетании с FACS или флуоресцентной микроскопией) и FACS или флуоресцентную микроскопию с использованием антител, специфических для представляющих интерес маркеров клеточной поверхности.
Маркеры плюрипотентных клеток также включают в себя удлиненные теломеры, по сравнению с клетками. Длина теломер может быть определена, например, путем выделения геномной ДНК, расщепления гДНК рестрикционными ферментами, такими как Hinf1 и Rsa1, и обнаружение теломер с реагентом анализа длины теломер. Такие реагенты известны в настоящей области техники и коммерчески доступны, например, набор TELOTAGGG™ TELOMERE LENGTH ASSAY (№ по каталогу 12209136001 Roche; Indianapolis, IN).
Согласно некоторым вариантам осуществления клетки, обработанные в соответствии с описанными в настоящем документе способами, могут быть изменены, чтобы больше напоминать эпигенетическое состояние эмбриональной стволовой клетки, чем это было до обработки в соответствии с описанными способами. Эпигенетическое состояние клетки относится к химической маркировке генома, в отличие от изменений в нуклеотидной последовательности генома. Эпигенетические метки могут включать в себя метилирование ДНК (отпечатки), а также метилирование и ацетилирование белков, связанных с ДНК, таких как гистоны. Термин "метилирование ДНК" относится к добавлению метальной (СН3) группы к специфическому основанию в ДНК. У млекопитающих метилирование происходит почти исключительно в положении 5 на цитозине, когда он продолжается гуанином (CpG). Согласно некоторым вариантам осуществления эпигенетическое состояние может содержать эпигенетические паттерны метилирования, например, паттерны метилирования ДНК. Анализы для определения наличия и расположения эпигенетической маркировки известны в настоящей области техники и могут включать в себя бисульфитное секвенирование, например, как описано в примере 2 в настоящем документе. Кратко, ДНК обрабатывают с помощью набора для модификации ДНК CpGenome™ (Chemicon, Temecula, СА), и представляющие интерес области (например, гены Nanog и Oct4) амплифицируют и секвенируют.
Некоторые аспекты описанной в настоящем документе технологии относятся к анализам с использованием плюрипотентной стволовой клетки, полученной с помощью описанных в настоящем документе способов. Например, плюрипотентная стволовая клетка, полученная с помощью описанных в настоящем документе способов, может быть использована для скрининга и/или идентификации средств, которые модулируют жизнеспособность, дифференцировку или размножение плюрипотентных стволовых клеток. Такие анализы могут предусматривать контактирование плюрипотентных клеток, полученных в соответствии с описанными в настоящем документе способами с кандидатными средствами, и определении того, отличается ли жизнеспособность, дифференцировка и/или размножение плюрипотентной клетки, контактировавшей с кандидатным средством, от жизнеспособности, дифференцировки и/или размножение плюрипотентных клеток, не контактировавших с кандидатным средством. Согласно некоторым вариантам осуществления средство может повышать жизнеспособность, дифференцировку и/или размножение плюрипотентной стволовой клетки. Согласно некоторым вариантам осуществления средство может уменьшать жизнеспособность, дифференцировку и/или размножение плюрипотентной стволовой клетки. Согласно некоторым вариантам осуществления плюрипотентная стволовая клетка может контактировать с множеством кандидатных средств, например, для определения синергического или антагонистического действия или для скрининга кандидатных средств в пулах.
Кандидатное средство идентифицируют в качестве средства, которое модулирует жизнеспособность плюрипотентной клетки, полученной в том случае, если количество плюрипотентных клеток, которые жизнеспособны, то есть живы, выше или ниже в присутствии кандидатного средства по отношению к его отсутствию. Способы определения жизнеспособности клетки хорошо известны в настоящей области техники и предусматривают, в качестве неограничивающего примера, определение количества жизнеспособных клеток по меньшей мере в двух временных точках путем обнаружения силы сигнала от маркера живых клеток или количества или пропорции клеток, окрашенных с помощью маркера живых клеток. Маркеры живых клеток коммерчески доступны, например, PRESTO BLUE™ (№ по каталогу А-13261; Life Technologies; Grand Island, NY). Кандидатное средство определяют в качестве средства, которое модулирует размножение плюрипотентной клетки, полученной в том случае, если скорость размножения плюрипотентной клетки изменяется, т.е. количество потомственных клеток, полученных в данный момент времени, выше или ниже в присутствии кандидатного средства. Способы определения скорости размножения клетки известны в настоящей области техники и предусматривают, в качестве неограничивающего примера, определение увеличения числа живых клеток с течением времени.
Кандидатное средство идентифицируют в качестве средства, которое модулирует дифференцировку плюрипотентной клетки, если скорость или характер дифференциации плюрипотентной клетки выше или ниже в присутствии кандидатного средства. Способы определения скорости или характера дифференциации клетки известны в настоящей области техники и включают в себя, в качестве неограничивающего примера, обнаружение маркеров или морфологию конкретной линии и сравнение количества клеток и/или скорости появления клеток с такими маркерами или морфологией в популяции, контактировавшей с кандидатным средством, с популяцией, не контактировавшей с потенциальным средством. Маркеры и морфологические характеристики различных жизненных линий клеток и зрелых типов клеток известны в настоящей области техники. В качестве неограничивающего примера мезодермальные клетки отделяют от плюрипотентных клеток с помощью экспрессии актина, миозина и десмина. Хондроциты можно отличить от типов их клеток-предшественников путем окрашивания сафранином-0 и/или красителями FASTGREEN™ (Fisher; Pittsburg, PA; F99). Остеоциты можно отличить от типов их клеток-предшественников путем окрашивания ализарином красным S (Sigma; St. Louis, МО: Cat No A5533).
Согласно некоторым вариантам осуществления, кандидатное средство может представлять собой потенциального ингибитора опухолевых стволовых клеток, например, описанные в настоящем документе способы могут быть использованы для создания плюрипотентных клеток из зрелых опухолевых клеток, и использования для скрининга средств, которые ингибируют создание и/или жизнеспособность опухолевых клеток. Описанные в настоящем документе способы могут также быть использованы для скрининга средств, которые убивают зрелые опухолевые клетки, но которые не способствуют развитию и/или выживанию опухолевых стволовых клеток.
Согласно некоторым вариантам осуществления плюрипотентные клетки подвергают контакту с одним или несколькими кандидатными средствами и культивируют в условиях, которые способствуют дифференциации в конкретную линию клеток или зрелый тип клеток. Условия, подходящие для дифференциации, известны в настоящей области техники. В качестве неограничивающего примера условия, подходящие для дифференцировки в мезодермальную линию, включают в себя DMEM с добавлением 20% фетальной телячьей сыворотки (FCS), с заменой среды каждые 3 дня. В качестве дополнительного неограничивающего примера условия, подходящие для дифференцировки в нейрональную линию, включают в себя посев клеток на покрытые орнитином камерные слайды в F12/DMEM (1:1, об/об) с добавлением 2% В27, 10% FCS, 10 нг/мл bFGF и 20 нг/м LEGF. Среда может быть заменена каждые 3 дня.
В настоящем описании "кандидатное средство" относится к любому веществу, которое, как правило, не присутствует или не присутствует на вводимом уровне в клетке, ткани или субъекте. Кандидатное средство может быть выбрано из группы, содержащей: химические вещества; небольшие органические или неорганические молекулы; последовательности нуклеиновых кислот; аналоги нуклеиновых кислот; белки; пептиды; аптамеры; пептидомиметик, производное пептида, пептидные аналоги, антитела; интратела; биологические макромолекулы, экстракты, изготовленные из биологических материалов, таких как бактериальные, растительные, грибные или животные клетки или ткани; встречающиеся в природе или синтетические композиции или их функциональные фрагменты. Согласно некоторым вариантам осуществления кандидатное средство представляет собой любое химическое образование или фрагмент, включающий в себя без ограничения синтетические и встречающиеся в природе небелковые образования. Согласно некоторым вариантам осуществления кандидатное средство представляет собой небольшую молекулу, характеризующуюся химическим фрагментом. Например, химические фрагменты включают в себя незамещенный или замещенный алкил, ароматические или гетероциклические фрагменты, включающие в себя макролиды, лептомицины и связанные с ними природные продукты или их аналоги. Кандидатные средства могут, как известно, характеризоваться желаемой активностью и/или свойством или могут быть выбраны из библиотеки разнообразных соединений.
Кандидатные средства могут быть подвергнуты скринингу на их способность модулировать жизнеспособность, размножение и/или дифференцировку плюрипотентной клетки. Согласно одному варианту осуществления кандидатные средства подвергают скринингу с использованием описанных выше и в примерах анализов на жизнеспособность, дифференцировку и/или размножение.
Как правило, соединения могут быть исследованы в любой концентрации, которая может модулировать клеточную функцию, экспрессию гена или активность белка, по отношению к контролю за соответствующий период времени. Согласно некоторым вариантам осуществления соединения исследуют в концентрациях в диапазоне от приблизительно 0,1 нМ до приблизительно 1000 мМ. Согласно одному варианту осуществления соединение исследуют в интервале от приблизительно 0,1 мкМ до приблизительно 20 мкМ, от приблизительно 0,1 мкМ до приблизительно 10 мкМ или от приблизительно 0,1 мкМ до приблизительно 5 мкМ.
В зависимости от конкретного практикуемого варианта осуществления может быть предусмотрено кандидатное или исследуемое средство свободно в растворе или может быть присоединено к носителю или твердому носителю, например, гранулам. Большое количество подходящих твердых носителей может быть использовано для иммобилизации исследуемых средств. Примеры подходящих твердых носителей включают в себя агарозу, целлюлозу, декстран (коммерчески доступный в виде, например, сефадекса, сефарозы), карбоксиметилцеллюлозу, полистирол, полиэтиленгликоль (ПЭГ), фильтровальную бумагу, нитроцеллюлозу, ионообменные смолы, пластиковые пленки, сополимер полиаминометилвинилового эфира и малеиновой кислоты, стеклянные гранулы, сополимер аминокислот, сополимер этилена и малеиновой кислоты, нейлон, шелк и т.д. Кроме того, для описанных в настоящем документе способов исследуемые средства могут быть подвергнуты скринингу индивидуально или в группах или пулах. Групповой скрининг особенно полезен, когда высшие скорости для эффективных исследуемых средств, как ожидается, будут такими низкими, что нельзя ожидать более одного положительного результата для данной группы.
Способы развития основанных на небольших молекулах, полимерах и геномах библиотек описаны, например, в Ding, et al. J Am. Chem. Soc. 124: 1594-1596 (2002) and Lynn, et al., J. Am. Chem. Soc. 123: 8155-8156 (2001). Коммерчески доступные библиотеки соединений могут быть получены, например, из ArQule (Woburn, MA), Invitrogen (Carlsbad, CA), Ryan Scientific (Mt. Pleasant, SC) и Enzo Life Sciences (Farmingdale, NY). Эти библиотеки могут быть подвергнуты скринингу на способность представителей модулировать жизнеспособность, размножение и/или дифференцировку плюрипотентных стволовых клеток. Кандидатные средства могут представлять собой встречающиеся в природе белки и их фрагменты. Такие кандидатные средства могут быть получены из природного источника, например, клеточного или тканевого лизата. Библиотеки полипептидных средств также могут быть получены, например, из библиотеки кДНК, коммерчески доступной или получаемой обычными способами. Кандидатные средства также могут представлять собой пептиды, например, пептиды от приблизительно 5 до приблизительно 30 аминокислот, предпочтительно от приблизительно 5 до приблизительно 20 аминокислот и особенно предпочтительно от приблизительно 7 до приблизительно 15. Пептиды могут представлять собой дайджесты встречающихся в природе белков, случайных пептидов или "смещенных" случайных пептидов. В некоторых способах кандидатные средства представляют собой полипептиды или белки. Пептидные библиотеки, например, комбинаторные библиотеки пептидов или других соединений, могут быть полностью рандомизированы без каких-либо предпочтений последовательностей или констант в любом положении. Кроме того, библиотека может быть смещена, т.е., некоторые позиции в последовательности либо поддерживаются постоянными, либо выбирают из ограниченного числа возможностей. Например, в некоторых случаях, нуклеотиды или аминокислотные остатки рандомизируют в пределах определенного класса, например, гидрофобных аминокислот, гидрофильных остатков, пространственно смещенных (либо малых, либо больших) остатков, по отношению к созданию цистеинов, для перекрестного связывания, пролинов для SH-3 доменов, серинов, треонинов, тирозинов или гистидинов для сайтов фосфорилирования или пуринов.
Кандидатные средства могут также представлять собой нуклеиновые кислоты. Кандидатные средства-нуклеиновые кислоты могут представлять собой природные нуклеиновые кислоты, случайные нуклеиновые кислоты или "смещенные" случайные нуклеиновые кислоты. Например, дайджесты прокариотических или эукариотических геномов могут быть использованы аналогично, как описано выше для белков.
Согласно некоторым вариантам осуществления кандидатное средство, которое подвергают скринингу и идентифицируют на модуляцию жизнеспособности, размножения и/или дифференцировки плюрипотентной клетки в соответствии с описанными в настоящем документе способами, может увеличить жизнеспособность, размножение и/или дифференцировку плюрипотентной клетки по меньшей менее на 5%, предпочтительно по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, в 1 раз, в 1,1 раза, в 1,5 раза, в 2 раза, в 3 раза, в 4 раза, в 5 раз, в 10 раз, в 50 раз, в 100 раз или более, по сравнению с необработанным контролем. Согласно некоторым вариантам осуществления кандидатное средство, которое подвергают скринингу и идентифицируют на модуляцию жизнеспособности, размножения и/или дифференцировки плюрипотентной клетки в соответствии с описанными в настоящем документе способами может уменьшать жизнеспособность, размножение и/или дифференцировку плюрипотентной клетки по меньшей менее на 5%, предпочтительно по меньшей мере на 10%, 20%, 30%, 40%, 50%, 50%, 70%, 80%, 90%, 95%, 97%, 98%, 99% или более, вплоть до полного снижения (т.е. нулевой жизнеспособности, роста, размножения или дифференцировки), по отношению к необработанному контролю.
Согласно некоторым вариантам осуществления кандидатное средство функционирует непосредственно в том виде, в котором его вводят. Альтернативно, кандидатное средство может быть модифицировано или использовано внутриклеточно, чтобы получить форму, которая модулирует желаемую активность, например, введение последовательности нуклеиновой кислоты в клетку и ее транскрипция, приводящая к производству ингибитора или активатора генной экспрессии или активности белка в клетке.
Следует понимать, что описанные в настоящем документе способы и композиции могут быть использованы, например, в разработке противораковых вакцин. Создание по меньшей мере частично дифференцированного потомства плюрипотентных опухолевых клеток, полученных, как описано в настоящем документе (например, с помощью воздействия на зрелую опухолевую клетку в соответствии с описанными в настоящем документе способами), может обеспечить разнообразный и меняющийся профиль антигенов, который может позволить развитие более мощных основанных на АРС (антигенпрезентирующих клетках) противораковых вакцин.
Согласно некоторым вариантам осуществления описанные в настоящем документе способы относятся к повышению эффективности трансформации клетки. Подвергание клеток стрессовому воздействию, например, индуцирующему плюрипотентность, как описано в настоящем документе, может сделать клетки более восприимчивыми к способам генетической модификации, включающей в себя без ограничения вставки трансгена, вирусные векторы и/или эндонуклеазы с цинковыми пальцами. Следует понимать, что описанные в настоящем документе способы могут позволить клеткам модифицироваться до генетически восприимчивого состояния таким образом, что голая ДНК может быть использована для трансформации полученных в результате плюрипотентных клеток.
Некоторые аспекты описанной в настоящем документе технологии относятся к способам клеточной терапии, содержащей введение плюрипотентной клетки, полученной описанными в настоящем документе способами или по меньшей мере частично дифференцированного потомства такой клетки субъекту, нуждающемуся в клеточной терапии. Согласно некоторым вариантам осуществления предусмотрено терапевтически эффективное количество плюрипотентных клеток или по меньшей мере частично дифференцированного потомства плюрипотентных клеток. Согласно некоторым вариантам осуществления плюрипотентные клетки и/или их потомство представляют собой аутологичные. Согласно некоторым вариантам осуществления плюрипотентные клетки и/или их потомство представляют собой аллогенные. Согласно некоторым вариантам осуществления плюрипотентные клетки и/или их потомство представляют собой аутологичные. Согласно некоторым вариантам осуществления плюрипотентные клетки и/или их потомство представляют собой соответствующие по HLA аллогенные. Согласно некоторым вариантам осуществления плюрипотентные клетки и/или их потомство представляют собой сингенные. Согласно некоторым вариантам осуществления плюрипотентные клетки и/или их потомство представляют собой ксеногенные. Согласно некоторым вариантам осуществления клеточная терапия может представлять собой аутологичную терапию, например, клетка от субъекта может быть использована для создания плюрипотентной клетки в соответствии с описанными в настоящем документе способами, и плюрипотентная клетка и/или по меньшей мере частично дифференцированное потомство этой плюрипотентной клетки может быть введено субъекту. Используемый в настоящем документе термин "нуждающийся в клеточной терапии субъект" относится к субъекту, которому поставили диагноз наличия или риска наличия или развития заболевания, связанного с несостоятельностью природных клеток или типа тканей или природной плюрипотентной и/или мультипотентной клетки (например, стволовой клетки).
Согласно некоторым вариантам осуществления описанные в настоящем документе способы могут быть использованы для лечения генетических заболеваний, например Тея-Сакса или гемофилии, например, путем введения аллогенных плюрипотентных клеток и/или их потомства, полученного, как описано в настоящем документе.
Согласно одному аспекту в настоящем документе описан способ получения клетки или ткани, которая совместима с клеточной терапии для введения субъекту, предусматривающий: создание плюрипотентной клетки (или более плюрипотентной клетки) из клетки в соответствии с описанными в настоящем документе способами, причем клетка представляет собой аутологичную клетку или соответствующую по HLA аллогенную клетку. Согласно некоторым вариантам осуществления плюрипотентная клетка (или более плюрипотентная клетка) может быть дифференцирована в заранее определенную линию клеток перед введением в клетку или ткань субъекту.
Полученные в соответствии с описанными в настоящем документе способами плюрипотентные клетки, например, плюрипотентные стволовые клетки могут быть использованы в терапии злокачественной опухоли. Например, высокие дозы химиотерапии плюс трансплантация гемопоэтических стволовых клеток для восстановления кроветворной системы костного мозга могут извлечь выгоду от использования плюрипотентных клеток, полученных, как описано в настоящем документе.
Неограничивающие примеры заболеваний, связанные с выходом из строя встречающейся в природе клетки или типа ткани или встречающейся в природе плюрипотентной и/или мультипотентной клетки, включают в себя апластическую анемию, анемию Фанкони и пароксизмальную ночную гемоглобинурию (PNH). Другие включают в себя, например: острые лейкозы, включающие в себя острый лимфобластный лейкоз (ОЛЛ), острый миелоидный лейкоз (ОМЛ), острый бифенотипический лейкоз и острый недифференцированный лейкоз; хронические лейкозы, включающие в себя хронический миелолейкоз (ХМЛ), хронический лимфолейкоз (ХЛЛ), ювенильный хронический миелолейкоз (JCML) и миеломоноцитарный лейкоз несовершеннолетних (JMML); миелопролиферативные заболевания, включающие в себя острый миелофиброз, миелоидную метаплазию кровеносных сосудов (миелофиброз), полицитемию и существенную тромбоцитемию; лизосомные заболевания накопления, включающие в себя мукополисахаридозы (MPS), синдром Херлера (MPS-IH), синдром Шейе (MPS-IS), синдром Хантера (МПС-П), синдром Санфилиппо (MPS-III), синдром Моркио (MPS-IV), синдром Марото-Лами (МПС-VI), синдром Слая, дефицит бета-глюкуронидазы (МПС-VII), адренолейкодистрофию, муколипидозис II (заболевание I-клеток), заболевание Краббе, заболевание Гоше, заболевание Ниманна-Пика, заболевание Волмана и метахроматическую лейкодистрофию; гистиоцитарные нарушения, включающие в себя семейный эритрофагоцитарный лимфогистиоцитоз, гистиоцитоз-Х и гемофагоцитоз; фагоцитарные нарушения, включающие в себя синдром Чедиака-Хигаси, хроническое гранулематозное заболевание, недостаточность актина нейтрофилов и ретикулярный дисгенез; наследственные нарушения тромбоцитов, включающие в себя амегакариоцитоз/врожденную тромбоцитопению; нарушения плазматических клеток, включающие в себя множественную миелому, лейкемии плазматических клеток и макроглобулинемию Вальденстрема. Другие злокачественные опухоли, которые можно лечить терапией на основе стволовых клеток, включают в себя без ограничения рак молочной железы, саркому Юинга, нейробластому и почечно-клеточную карциному, среди других. Также поддаются лечению стволовыми клетками следующие заболевания: заболевания легких, включающие в себя ХОБЛ и бронхиальную астму; врожденные иммунные нарушения, включающие в себя атаксию-телеангиэктазию, синдром Костмана, дефицит адгезии лейкоцитов, синдром Ди Георга, синдром голых лимфоцитов, синдром Омена, тяжелые комбинированные иммунодефициты (SCID), SCID с дефицитом аденозиндеаминазы, SCID с отсутствием Т- и В-клеток, SCID с отсутствием Т-клеток, SCID нормальных В-клеток, общий вариабельный иммунодефицит и связанные с Х-хромосомой лимфопролиферативные нарушения; другие наследственные нарушения, включающие в себя синдром Леша-Нихана, гипоплазию хрящей-волос, тромбастению Гланцманна и остеопетроз; неврологические заболевания, включающие в себя острый и хронический инсульт, черепно-мозговую травму, церебральный паралич, рассеянный склероз, боковой амиотрофический склероз и эпилепсию; сердечные заболевания, включающие в себя атеросклероз, хроническую сердечную недостаточность и инфаркт миокарда; нарушения обмена веществ, включающие в себя диабет; и глазные нарушения, включающие в себя макулярную дегенерацию и атрофию зрительного нерва. Такие заболевания или нарушения можно лечить путем введения либо самих по себе плюрипотентных клеток, позволяющих дифференциацию in vivo до желаемого типа клеток с или без введения средств для обеспечения желаемой дифференциации и/или путем введения плюрипотентных клеток, дифференцированных до или по меньшей мере частично дифференцированных в сторону желаемого типа клеток in vitro. Способы диагностики таких условий хорошо известны практикующим врачам-специалистам в настоящей области техники. Согласно некоторым вариантам осуществления субъектом может быть тот, кто подвергался воздействию лучевой терапии или других терапий, которые удалили популяцию клеток или стволовых клеток, например, субъект может представлять собой субъекта со злокачественной опухолью костного мозга, которая была удалена лучевой терапией.
Согласно некоторым вариантам осуществления плюрипотентные клетки вводят субъекту. Согласно некоторым вариантам осуществления по меньшей мере частично дифференцированные клетки вводят субъекту. Согласно некоторым вариантам осуществления способ клеточной терапии может дополнительно предусматривать дифференциацию плюрипотентной клетки в заранее определенную линию клеток перед введением клетки. Способы дифференциации стволовых клеток в желаемые клеточные линии известны в настоящей области техники и примеры описаны в настоящем документе.
Согласно некоторым вариантам осуществления композиция, содержащая полученную в соответствии с описанными в настоящем документе способами плюрипотентную клетку или по меньшей мере частично дифференцированную клетку, которая представляет собой потомство плюрипотентной клетки, вводят субъекту.
Согласно некоторым вариантам осуществления композиция, содержащая полученную в соответствии с описанными в настоящем документе способами плюрипотентную клетку или по меньшей мере частично дифференцированную клетку, которая представляет собой потомство плюрипотентной клетки, может дополнительно содержать G-CSF, GM-CSF и/или M-CSF и/или может быть введена субъекту, который содержит или которому будут вводить G-CSF, GM-CSF и/или M-CSF в виде отдельной композиции. Введение G-CSF, GM-CSF и/или M-CSF может, например, индуцировать состояние воспаления, благоприятное для регенерации органов и удаления тканевого мусора, отходов и отложений.
Согласно некоторым вариантам осуществления введение плюрипотентных клеток и/или их по меньшей мере частично дифференцированного потомства может происходить в течение относительно короткого периода времени после производства плюрипотентной клетки в культуре в соответствии с описанными в настоящем документе способами (например, через 1, 2, 5, 10, 24 или 48 часов после получения). Согласно некоторым вариантам осуществления введение по меньшей мере частично дифференцированного потомства может происходить в течение относительно короткого периода времени после дифференциации плюрипотентных клеток в культуре в соответствии с описанными в настоящем документе способами (например, через 1, 2, 5, 10, 24 или 48 часов после получения). Согласно некоторым вариантам осуществления плюрипотентные клетки и/или их по меньшей мере частично дифференцированное потомство может быть криогенно сохранено перед введением.
Согласно некоторым аспектам описанная в настоящем документе технология относится к композиции, содержащей плюрипотентную клетку, полученную в соответствии с описанными в настоящем документе способами, и/или по меньшей мере частично дифференцированное потомство плюрипотентной клетки. Согласно некоторым вариантам осуществления фармацевтическая композиция содержит плюрипотентную клетку, полученную в соответствии с описанными в настоящем документе способами, и/или по меньшей мере частично дифференцированное потомство плюрипотентной клетки и, необязательно, фармацевтически приемлемый носитель. Композиции могут дополнительно содержать по меньшей мере один фармацевтически приемлемое вспомогательное вещество.
Фармацевтическая композиция может включать в себя подходящие вспомогательные вещества или стабилизаторы и может представлять собой, например, растворы, суспензии, гели или эмульсии. Как правило, композиция будет содержать от приблизительно 0,01 до 99 процентов, предпочтительно от приблизительно 5 до 95 процентов клеток вместе с носителем. Клетки в сочетании с фармацевтически или физиологически приемлемыми носителями, вспомогательными веществами или стабилизаторами можно вводить парентерально, подкожно, путем имплантации или инъекции. Для большинства терапевтических целей клетки могут быть введены с помощью инъекции в виде раствора или суспензии в жидком виде. Термин "фармацевтически приемлемый носитель" относится к носителю для введения плюрипотентной клетки, полученной в соответствии с описанными в настоящем документе способами, и/или по меньшей мере частично дифференцированного потомства плюрипотентной клетки. Такие носители включают в себя без ограничения солевой раствор, забуференный солевой раствор, декстрозу, воду, глицерин и их комбинации. Каждый носитель должен быть "приемлемым" в смысле совместимости с другими ингредиентами состава, например, носитель не снижает воздействие средства на субъекта. Другими словами, носитель представляет собой фармацевтически инертный и совместимый с живыми клетками.
Подходящие составы также включают в себя водные и неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостаты, бактерицидные антибиотики и растворенные вещества, которые делают состав изотоническим с жидкостями организма реципиента, для которого этот состав предназначен. Водные и неводные стерильные суспензии могут включать суспендирующие средства и загустители. Составы могут быть представлены в единичной дозе или в многодозовых контейнерах.
Примеры парентеральных лекарственных форм включают в себя без ограничения готовые для инъекций растворы, готовые для инъекций суспензии и эмульсии. Парентеральные дозированные формы могут быть получены, например, с использованием биологически рассасывающихся вспомогательных материалов для поддержания плюрипотентных клеток, полученных в соответствии с описанными в настоящем документе способами, и/или по меньшей мере частично дифференцированного потомства плюрипотентной клетки.
Термин "эпигенетическая модификация" относится к химической маркировке генома. Эпигенетические метки могут включать в себя метилирование ДНК (отпечатки), а также метилирование и ацетилирование белков, связанных с ДНК, такие как гистоны. Специфическая к исходному происхождению генная экспрессия (либо от материнской, либо отцовской хромосомы) часто наблюдается у млекопитающих и происходит из-за эпигенетических модификаций. В исходных зародышевых линиях эпигенетические изменения могут приводить к стабильному сайленсингу или активации генов.
Используемый в настоящем документе термин "вводимое вещество" или "трансплантат" относится к размещению клеток в субъекте по способу или маршруту, который приводит по меньшей мере к частичной локализации клеток в желаемом сайте таким образом, чтобы производился желаемый эффект.
Описанные в настоящем документе плюрипотентные стволовые клетки и/или их по меньшей мере частично дифференцированное потомство могут быть введены любым способом, целесообразным по мнению врача, и могут включать в себя местное введение, например, путем инъекции суспензии клеток или, например, путем имплантации препарата клеток, осажденных или выращенных на или внутри имплантируемого остова или подложки. Имплантируемые остовы могут включать в себя любое количество разлагаемых или рассасывающихся полимеров или, например, шелковый остов, среди прочих. Подходящие маршруты для введения фармацевтической композиции, содержащей описанные в настоящем документе плюрипотентные стволовые клетки и/или их по меньшей мере частично дифференцированное потомство, включают в себя без ограничения местное введение, например, внутрибрюшинное, парентеральное, внутриполостное или подкожное введение. Используемые в настоящем документе фразы "парентеральное введение" и "парентерально" относятся к способам введения, отличных от энтерального и местного введения, обычно путем инъекции, и включают в себя без ограничения, внутрибрюшинную, внутрикожную, подкожную инъекцию и инфузию. Введение может включать в себя использование игл, катетеров и шприцов, пригодных для инъекции или хирургической имплантации. Использование комбинации средств доставки и сайтов доставки рассматривается для достижения желаемого клинического эффекта.
Термин "эпигенетическая модификация" относится к химической маркировке генома. Эпигенетические метки могут включать в себя метилирование ДНК (отпечатки), а также метилирование и ацетилирование белков, связанных с ДНК, таких как гистоны. Специфическая к исходному происхождению генная экспрессия (либо от материнской, либо отцовской хромосомы) часто наблюдается у млекопитающих и происходит из-за эпигенетических модификаций. В исходных зародышевых линиях эпигенетические изменения могут приводить к стабильному сайленсингу или активации генов.
Согласно одному варианту осуществления терапевтически эффективное количество описанных в настоящем документе плюрипотентных стволовых клеток и/или их по меньшей мере частично дифференцированное потомство вводят субъекту. Термин "терапевтически эффективное количество" означает количество описанных в настоящем документе плюрипотентных стволовых клеток и/или их по меньшей мере частично дифференцированного потомства, достаточное для получения измеримого улучшения симптома или маркера состояния, подлежащего лечению. Действительные уровни доз клеток в терапевтической композиции могут варьировать так, чтобы вводить количество клеток, которое эффективно для достижения желаемого терапевтического ответа для конкретного субъекта. Выбранный уровень дозирования будет зависеть от множества факторов, включающих в себя без ограничения активность терапевтической композиции, состава, способа введения, комбинации с другими лекарственными средствами или способов лечения, тяжести подлежащего лечению состояния, физического состояния субъекта, предшествующей истории болезни подлежащего лечению пациента и опыта и решения клинициста или врача, проводящего терапию. Как правило, запланированной дозы и введения должно быть достаточно, чтобы привести к замедлению и предпочтительно ингибированию прогрессирования состояния, а также предпочтительно привести к уменьшению одного или нескольких симптомов или маркеров этого заболевания. Определение и регулировка терапевтически эффективной дозы, а также оценки того, когда и как делать такие изменения, известны специалистам в настоящей области медицины.
Дозировка описанных в настоящем документе плюрипотентных стволовых клеток и/или их по меньшей мере частично дифференцированного потомства, вводимого в соответствии с описанными в настоящем документе способами, может быть определена лечащим врачом и скорректирована, при необходимости, в соответствии с наблюдаемыми эффектами при лечении. Что касается продолжительности и частоты лечения, то для квалифицированных врачей характерно контролировать субъектов для определения того, когда лечение обеспечивает терапевтический эффект, и определения того, следует ли вводить еще одну дозу клеток, увеличивать или уменьшать дозировку, прекращать лечение, корректировать лечение или делать другие варианты изменения схемы лечения. Там, где ожидается, что вводимые клетки трансплантируются и выживут в среднесрочной и долгосрочной перспективе, может быть необходимо повторение дозы. Тем не менее, введение может быть повторено по мере необходимости и в зависимости от переносимости субъектом. Доза не должна быть настолько большой, чтобы вызывать значительные побочные нежелательные явления. Дозировку также можно регулировать с помощью индивидуального врача в случае каких-либо осложнений. Обычно, однако, доза может находиться в диапазоне от 100 до 1×109 описанных в настоящем документе плюрипотентных стволовых клеток и/или их по меньшей мере частично дифференцированного потомства для взрослого человека, например, от 100 до 10000 клеток, от 1000 до 100000 клеток, от 10000 до 1000000 или от 1000000 до 1×109 клеток. Эффективные дозы могут быть экстраполированы из кривых доза-ответ, полученных из, например, биоанализа или систем исследуемых животных моделей.
Терапевтические композиции, содержащие описанные в настоящем документе плюрипотентные стволовые клетки и/или их по меньшей мере частично дифференцированное потомство, полученное, как описано в настоящем документе, необязательно исследуют на одной или нескольких соответствующих животных моделях заболевания in vitro и/или in vivo, таких как SCID мышиная модель, чтобы подтвердить эффективность, оценить рост in vivo трансплантированных клеток, а также оценить дозы, в соответствии со способами, хорошо известными в настоящей области техники. В частности, дозировки могут быть изначально определены с помощью активности, стабильности или других соответствующих измерений воздействия по отношению к без воздействия (например, сравнение обработанных против необработанных животных моделей) в соответствующем анализе. При определении эффективного количества описанных в настоящем документе плюрипотентных стволовых клеток и/или их по меньшей мере частично дифференцированного потомства, врач оценивает, среди прочих критериев, рост и объем трансплантированных клеток и прогрессирование состояния, подлежащего лечению. Дозировка может варьировать в зависимости от используемой лекарственной формы и способа введения.
В отношении описанных в настоящем документе терапевтических способов не предназначено, что введение описанных в настоящем документе плюрипотентных стволовых клеток и/или их по меньшей мере частично дифференцированного потомства будет ограничено конкретным способом введения, дозировкой или частотой дозировки. Рассматриваются все способы введения, включающие в себя внутримышечный, внутривенный, внутрибрюшинный, внутрипузырный, внутрисуставной, внутриочаговый, подкожный или любой другой маршрут, достаточный для обеспечения адекватной дозы для лечения состояния, подлежащего лечению.
Согласно некоторым вариантам осуществления описанные в настоящем документе способы могут быть использованы для создания плюрипотентных клеток in vivo, например, клетка, присутствующая у субъекта, может быть подвергнута стрессу, как описано в настоящем документе, таким образом, что она приобретает плюрипотентный фенотип. Описанные в настоящем документе способы применения стрессов для клеток in vivo полностью очевидны, например, растворы слабой кислоты могут быть введены в ткань через инъекцию и/или прямое применение, температуры может быть изменены с помощью зондов, которые могут нагревать или охлаждать окружающие ткани или через использование неинвазивных способов, например, излучением сфокусированного луча. In vivo модуляция плюрипотентности может быть использована, чтобы, например, увеличить регенерацию тканей или заживление ран. Неограничивающие примеры могут включать в себя инъекцию слабой кислоты в артритный коленный сустав, чтобы заставить клетки коленного сустава (например, синовиальные или хрящевые клетки) приобретать плюрипотентный фенотип и образовывать новые ткани. Дополнительный неограничивающий пример может включать в себя лечение субъекта с инсультом или травмой центральной нервной системы (например, повреждением спинного мозга). После лечения воспаления на прилегающие к поврежденной области клетки можно воздействовать стрессом, как описано в настоящем документе, получая плюрипотентные клетки, которые могут восстанавливать популяцию поврежденной ткани и/или регенерировать или восстанавливать поврежденную ткань.
В дополнительном неограничивающем примере изменения в эпигенетическом статусе (например, с помощью обработки деметилазой) могут приводить к секретирующим неинсулин клеткам (например, глюкагонные альфа-клетки поджелудочной железы) для преобразования в инсулин-секретирующие клетки (например, бета-клетки). Соответственно, воздействие на секретирующие неинсулин клетки (например, глюкагонные альфа-клетки поджелудочной железы) в соответствии с описанными в настоящем документе способами может привести к тому, что клетка становится инсулин-секретирующей клеткой, например, подобной бета-клетке, либо in vivo, либо in vitro.
Кроме того, предполагается, что описанные в настоящем документе плюрипотентные клетки могут сливаться с другими клетками (например, "реципиентными клетками"), например, клетками, не обработанными в соответствии с описанными в настоящем документе способами, неплюрипотентными клетками, зрелыми клетками, опухолевыми клетками и/или поврежденными клетками. Слияние клеток может приводить к повышенному уровню экспрессии фермента клеточного обновления и/или активности в реципиентных клетках, по сравнению с состоянием до слияния. Это может увеличивать здоровье и/или функцию клетки-реципиента, например, за счет увеличения восстановления клеточного повреждения, мутаций и/или модификации эпигенетического статуса клетки-реципиента.
Согласно некоторым вариантам осуществления за счет увеличения плюрипотентности клеток in vivo можно модулировать эпигенетические маркеры (например, статус метилирования ДНК, деметилирования и/или гидроксиметилирования) этих клеток. Модуляция эпигенетических маркеров была вовлечена в, например, злокачественные опухоли, артрит, аутоиммунное заболевание, старение и т.д., и предполагается лечение таких связанных эпигенетически условий в соответствии с описанными в настоящем документе способами.
Согласно некоторым вариантам осуществления множественные ткани могут быть обработаны in vivo в одно и то же время, например, слегка кислое состояние может быть индуцировано во множественных органах, например, последовательно или синхронно (например, в мозге, сердце, печени, легких и/или щитовидной железе) для лечения значительного повреждения или старения.
Кроме того, предполагается, что обработка клеток in vivo, как описано в настоящем документе, может быть объединена с введением плюрипотентных клеток и/или по меньшей мере частично дифференцированного потомства, которые были произведены, как описано в настоящем документе.
В настоящем документе предполагается, что описанные в настоящем документе способы могут быть использованы для воздействия, например, на плод или эмбрион в утробе матери.
Эффективность лечения можно оценить, например, путем измерения маркера, индикатора, симптома или частоты, состояния, подлежащего лечению, как описано в настоящем документе, или любого другого соответствующего измеряемого параметра, например, количества потомства плюрипотентной клетки. Известно, что в пределах способности специалиста в настоящей области техники находится контроль эффективности лечения или профилактики путем измерения какого-либо одного из таких параметров или любой комбинации параметров.
Эффективное воздействие представляет собой очевидное, когда существует статистически достоверное улучшение в одном или нескольких маркерах, индикаторах, или симптомах состояния, на которое воздействуют, или путем неспособности ухудшать или развивать симптомы, где иначе можно было такое ожидать. В качестве примера выгодное изменение по меньшей мере приблизительно 10% в измеряемом параметре состояния и, предпочтительно, по меньшей мере приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50% или более может быть показателем эффективности лечения. Эффективность для плюрипотентных клеток, полученных в соответствии с описанными в настоящем документе способами, и/или по меньшей мере частично дифференцированного потомства плюрипотентных клеток также может быть оценена с использованием экспериментальной модели на животных, известной в настоящей области техники в условиях, описанных в настоящем документе. При использовании экспериментальной модели на животных эффективность лечения доказывается, когда наблюдается статистически значимое изменение в маркере, например, количестве кроветворных клеток, присутствующих у мыши после абляции костного мозга и лечения с плюрипотентными клетками, как описано в настоящем документе.
Согласно одному аспекту в настоящем документе описан способ получения плюрипотентной клетки, способной дифференцироваться в плацентарную клетку, причем способ предусматривает культивирование плюрипотентной клетки, полученной в соответствии с описанными в настоящем документе способами в присутствии FGF4. Согласно некоторым вариантам осуществления плюрипотентная клетка способна дифференцироваться в эмбриональную стволовую клетку. Согласно некоторым вариантам осуществления концентрация FGF4 составляет от приблизительно 1 нМ до приблизительно 1 мкМ. Согласно некоторым вариантам осуществления концентрация приблизительно составляет от 1 нМ до 1 мкМ. Согласно некоторым вариантам осуществления концентрация приблизительно составляет от приблизительно 5 нМ до приблизительно 500 нМ. Согласно некоторым вариантам осуществления концентрация приблизительно составляет от приблизительно 10 нМ до приблизительно 100 нМ.
Согласно некоторым аспектам описанная в настоящем документе технология относится к системе для получения плюрипотентной клетки из клетки, предусматривающей удаление части цитоплазмы и/или митохондрий из клетки.
Система для получения плюрипотентной клетки из клетки в соответствии с описанными в настоящем документе способами может содержать контейнер, в котором клетки подвергают стрессу. Контейнер может быть пригодным для культуры соматических и/или плюрипотентных клеток, как например, когда клетки культивируют в течение нескольких дней или дольше в условиях недостаточности кислорода для того, чтобы уменьшить количество цитоплазмы и/или митохондрий в соответствии с описанными в настоящем документе способами. Альтернативно, контейнер может быть пригодным для подвергания стрессу клеток, но не для культивирования клеток, как например, когда клетки обрабатывают в устройстве с узким отверстием в течение ограниченного периода, например, менее 1 часа. Контейнер может представлять собой, например, сосуд, трубку, микроструйное устройство, пипетку, биореактор или чашку для культуры клеток. Контейнер может поддерживаться в окружающей среде, которая обеспечивает условия, подходящие для культуры соматических и/или плюрипотентных клеток (например, содержание в инкубаторе) или в окружающей среде, которая обеспечивает условия, которые будут вызывать стресс окружающей среды на клетки (например, содержание в инкубаторе с обеспечением окружающей среды с недостаточным содержанием кислорода). Контейнер может быть выполнен с возможностью обеспечения 1 или нескольких описанных выше в настоящем документе стрессов окружающей среды, например, 1 стресса, 2 стрессов, 3 стрессов и более. Контейнеры, пригодные для манипулирования и/или культивирования соматических и/или плюрипотентных клеток, хорошо известны любому специалисту в настоящей области техники и коммерчески доступны (например, № в каталоге CLS430597 Sigma-Aldrich, St. Louis, МО). Согласно некоторым вариантам осуществления, контейнер представляет собой микроструйное устройство. Согласно некоторым вариантам осуществления контейнер представляет собой чашку, колбу или пластину для культуры клеток.
Согласно некоторым вариантам осуществления система может дополнительно содержать средства для отбора плюрипотентных клеток, например, система может содержать систему FACS, которая может выбирать клетки, экспрессирующие маркер плюрипотентности (например, Oct4-GFP) или выбирать по размеру, как описано выше в настоящем документе. Способы и устройства для отбора клеток хорошо известны любому специалисту в настоящей области техники и коммерчески доступны, например, BD FACSARIA SORP™ в сочетании с программным обеспечением BD LSRII™ и BD FACSDIVA™ (№ по каталогу 643629) производства BD Biosciences; Franklin Lakes, NJ.
Согласно некоторым вариантам осуществления клетки, которые не присутствуют в ткани, предусмотрены для системы. Согласно некоторым вариантам осуществления ткани предусмотрены для системы, и система дополнительно содержит средства выделения одного или нескольких типов клеток. В качестве неограничивающего примера система может содержать гомогенизатор ткани. Тканевые гомогенизаторы и способы их использования хорошо известны в настоящей области техники и коммерчески доступны (например, FASTH21™, № по каталогу 21-82041 Omni International; Kennesaw, GA). Кроме того, система может содержать центрифугу для обработки образцов крови или жидкости.
Согласно некоторым вариантам осуществления система может быть автоматизирована. Способы автоматизации выделения клеток, культуры клеток и устройства отбора известны в настоящей области техники и коммерчески доступны. Например, тканевой гомогенизатор FASTH21™ (№ по каталогу 21-82041 Omni International; Kennesaw, GA) и BD FACSARIA SORP™.
Согласно некоторым вариантам осуществления система может быть стерильной, например, она может работать в стерильной среде, или система может работать как закрытая стерильной система.
Согласно одному аспекту в настоящем документе описан способ повышения способности к самообновлению плюрипотентной клетке, причем способ предусматривает культивирование клетки в присутствии адренокортикотропного гормона (АКТГ), среды 2i или 3i. Используемый в настоящем документе термин "способность к самообновлению" относится к продолжительности по времени, в течение которого клетку можно культивировать и пассировать in vitro, например, количеству пассажей клетки, и при этом ее потомство может продолжать производить жизнеспособные клетки. Клетка, которую вынуждают характеризоваться повышенной способностью к самообновлению в соответствии с описанным в настоящем документе способом, может представлять собой, например, тотипотентную клетку и/или клетку, полученную путем стрессового воздействия на нее, как описано в настоящем документе в другом месте.
Согласно некоторым вариантам осуществления культивирование в присутствии АКТГ может предусматривать культивирование клетки в клеточной среде, содержащей от приблизительно 0,1 мкМ до приблизительно 1000 мкМ, например, от приблизительно 0,1 мкМ до приблизительно 100 мкМ, от приблизительно 0,1 мкМ до приблизительно 10 мкМ или приблизительно 10 мкМ. Согласно некоторым вариантам осуществления культивирование клетки в присутствии АКТГ может предусматривать культивирование клетки в среде LIF, содержащей АКТГ. LIF, АКТГ, 2i и 3i коммерчески доступны и хорошо известны в настоящей области техники, например, АКТГ может быть приобретен у Sigma-Aldrich (№ по каталогу А0673; St. Louis, МО) и среды LIF можно приобрести у Millipore (например, № по каталогу ESG1107; Billerica, MA), и 3i можно приобрести у Stem Cells Inc. (например, как среду для культивирования стволовых клеток "iSTEM", № по каталогу SCS-SF-ES-01; Newark, СА).
Согласно некоторым вариантам осуществления стадия культивирования может продолжаться в течение по меньшей мере 3 дней, например, по меньшей мере 3 дня, по меньшей мере 4 дня, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере, 7 или более дней. После стадии культивирования клетки могут поддерживаться в условиях, подходящих для поддержания плюрипотентных клеток, как описано в настоящем документе в другом месте.
Согласно некоторым вариантам осуществления после стадии культивирования клетка может экспрессировать детектируемый и/или повышенный уровень маркера стволовых клеток. Маркеры стволовых клеток и способы их выявления описаны в настоящем документе в другом месте. Согласно некоторым вариантам осуществления маркер стволовых клеток может быть выбран из группы, состоящей из Oct3/4; Nanog; Rex1; Klf4; Sox2; Klf2; Esrr-бета; Tbx3 и Klf5.
Описание вариантов осуществления настоящего изобретения не предназначено, чтобы быть исчерпывающим или для ограничения настоящего раскрытия до точной раскрытой формы. В то время как конкретные варианты осуществления и примеры для настоящего раскрытия описаны в настоящем документе в целях иллюстрации, различные эквивалентные модификации возможны в пределах объема настоящего изобретения, как будет понятно специалистам в настоящей области техники. Например, в то время как стадии способа или функции представлены в заданном порядке, альтернативные варианты осуществления могут выполнять функции в другом порядке, или функции могут быть выполнены, по существу, одновременно. Предусмотренные в настоящем документе учения настоящего раскрытия могут быть применены к другим процедурам или способам в зависимости от обстоятельств. Различные варианты осуществления, описанные в настоящем документе, могут быть объединены, чтобы обеспечить дополнительные варианты осуществления. Аспекты настоящего изобретения могут быть модифицированы, если это необходимо, для использования композиций, функций и концепций, приведенных в ссылках и приложениях выше, чтобы обеспечить еще дальнейшие варианты осуществления настоящего изобретения. Эти и другие изменения могут быть сделаны в раскрытии в свете подробного описания.
Конкретные элементы любых из вышеупомянутых вариантов осуществления могут быть объединены или заменены элементами в других вариантах осуществления. Кроме того, в то время как преимущества, связанные с некоторыми вариантами осуществления изобретения, были описаны в контексте этих вариантов осуществления, другие варианты осуществления могут также демонстрировать такие преимущества, и не все варианты осуществления обязательно обладают такими преимуществами, чтобы подпадать под объем настоящего изобретения.
Все идентифицированные патенты и другие публикации специально включены в настоящий документ посредством ссылки с целью описания и раскрытия, например, описанных в таких публикациях методик, которые могут быть использованы в связи с настоящим изобретением. Эти публикации предоставляются исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в этом отношении не должно быть истолковано как признание того, что изобретатели не имеют права датировать задним числом такое раскрытие на основании предшествующего изобретения или по любой другой причине. Все утверждения относительно даты или представления в отношении содержания этих документов основываются на информации, имеющейся в распоряжении заявителей, и не предполагают какого-либо признания правильности дат или содержания этих документов.
Настоящее изобретение далее иллюстрируется следующими примерами, которые не следует рассматривать как ограничивающие.
1. Способ для получения плюрипотентных клеток, предусматривающий подвергание клетки стрессу.
2. Способ по п. 1, при котором плюрипотентную клетку получают без введения экзогенного гена, транскрипта, белка, ядерного компонента или цитоплазмы или без слияния клеток.
3. Способ по любому из пп. 1-2, дополнительно предусматривающий выбор клетки, проявляющей плюрипотентность.
4. Способ по любому из пп. 1-3, при котором клетка не присутствует как часть ткани.
5. Способ по любому из пп. 1-4, при котором клетка представляет собой соматическую клетку, стволовую клетку, клетку-предшественника или эмбриональную клетку.
6. Способ по любому из пп. 1-5, при котором клетка представляет собой выделенную клетку.
7. Способ по любому из пп. 1-6, при котором клетка присутствует в гетерогенной популяции клеток.
8. Способ по любому из пп. 1-7, при котором клетка присутствует в гомогенной популяции клеток.
9. Способ по любому из пп. 1-8, при котором выбор клетки, проявляющей плюрипотентность, предусматривает выбор клетки, экспрессирующей маркер стволовых клеток.
10. Способ по любому из п. 1-9, при котором маркер стволовых клеток, выбирают из группы, состоящей из: Oct4; Nanog; Е-кадгерина и SSEA4.
11. Способ по любому из пп. 1-10, при котором выбор клетки, проявляющей плюрипотентность, предусматривает выбор клетки, которая не адгезирует.
12. Способ по любому из пп. 1-11, при котором стресс предусматривает нефизиологический стресс в ткани или клеточной культуре.
13. Способ по любому из пп. 1-12, при котором стресс предусматривает воздействие на клетку по меньшей мере одним раздражителем окружающей среды, выбранным из: травмы, механических раздражителей, химического воздействия, ультразвуковой стимуляции, кислородной недостаточности, радиации, воздействия экстремальных температур, диссоциации, растирания, физического стресса, гиперосмоса, гипоосмоса, повреждения мембраны, токсина, экстремальной концентрации ионов, активного кислорода, воздействия ультрафиолетом, сильного видимого света, недостаточности существенного питания или нефизиологической кислой окружающей среды.
14. Способ по любому из пп. 1-13, при котором стресс предусматривает воздействие на клетку рН, составляющим от приблизительно 3,0 до приблизительно 6,8.
15. Способ по любому из пп. 1-14, при котором стресс предусматривает воздействие на клетку рН, составляющим от приблизительно 4,5 до приблизительно 6,0.
16. Способ по п. 15, при котором стресс предусматривает воздействие на клетку рН, составляющим от приблизительно 5,4 до приблизительно 5,8.
17. Способ по любому из пп. 12-16, при котором клетку подвергают воздействию в течение 2-3 дней.
18. Способ по любому из пп. 12-17, при котором клетку подвергают воздействию в течение 1 дня или менее.
19. Способ по любому из пп. 12-18, при котором клетку подвергают воздействию в течение 1 часа или менее.
20. Способ по любому из пп. 12-19, при котором клетку подвергают воздействию в течение 30 минут.
21. Способ по п. 13, при котором воздействие экстремальных температур предусматривает воздействие на клетку температурами ниже 35°С и выше 42°С.
22. Способ по п. 21, при котором воздействие экстремальных температур предусматривает воздействие на клетку температурами, которые или ниже точки замерзания, или воздействие на клетку температурами, равными по меньшей мере приблизительно 85°С.
23. Способ по п. 13, при котором механический раздражитель предусматривает воздействие на клетку напряжением сдвига или/и высоким давлением.
24. Способ по п. 23, при котором механический стимул предусматривает прохождение клеткой по меньшей мере через одно устройство с меньшим отверстием, чем размер клетки.
25. Способ по п. 23, при котором механической стимул предусматривает прохождение клеткой через несколько устройств, характеризующихся прогрессивно меньшими отверстиями.
26. Способ по любому из пп. 1-25, дополнительно предусматривающий культивирование плюрипотентной клетки, чтобы позволить размножение плюрипотентной клетки.
27. Способ по любому из пп. 1-26, при котором плюрипотентная клетка экспрессирует маркер стволовых клеток.
28. Способ по п. 27, при котором маркер стволовых клеток выбирают из группы, состоящей из: Oct4; Nanog; Е-кадгерина и SSEA4.
29. Способ по любому из пп. 1-28, при котором клетка представляет собой клетку млекопитающего.
30. Способ по любому из пп. 1-29, при котором клетка представляет собой клетку человека.
31. Способ по любому из пп. 1-30, при котором клетка представляет собой взрослую клетку, неонатальную клетку, фетальную клетку, амниотическую клетку или клетку пуповинной крови.
32. Способ по любому из пп. 1-31, дополнительно предусматривающий поддержание плюрипотентной клетки in vitro.
33. Способ по любому из пп. 1-32, при котором эпигенетические состояние клетки изменяется, чтобы больше напоминать эпигенетические состояния эмбриональной стволовой клетки.
34. Способ по п. 33, при котором эпигенетическое состояние предусматривает паттерны метилирования.
35. Способ по любому из пп. 1-34, при котором стресс предусматривает удаление по меньшей мере приблизительно 40% цитоплазмы клетки.
36. Способ по п. 35, при котором по меньшей мере приблизительно 50% цитоплазмы удаляется из клетки.
37. Способ по п. 36, при котором по меньшей мере приблизительно 60% цитоплазмы удаляется из клетки.
38. Способ по п. 37, при котором между 60-80% цитоплазмы удаляется из клетки.
39. Способ по п. 37, при котором по меньшей мере приблизительно 80% цитоплазмы удаляется из клетки.
40. Способ по п. 39, при котором по меньшей мере приблизительно 90% цитоплазмы удаляется из клетки.
41. Способ по любому из пп. 1-40, при котором стресс предусматривает удаление по меньшей мере приблизительно 40% митохондрий из клетки.
42. Способ по п. 41, при котором удаление части цитоплазмы удаляет по меньшей мере приблизительно 50% митохондрий из цитоплазмы.
43. Способ по п. 42, при котором удаление цитоплазмы или митохондрий удаляет приблизительно 50%-90% митохондрий из цитоплазмы.
44. Способ по п. 42, при котором удаление цитоплазмы или митохондрий удаляет более 90% митохондрий из цитоплазмы.
45. Способ по любому из пп. 1-44, при котором стресса достаточно, чтобы разрушить клеточную мембрану по меньшей мере 10% клеток, подвергшихся стрессовому воздействию.
46. Анализ, предусматривающий:
контактирование плюрипотентной клетки, полученной с помощью способа по любому из пп. 1-45, с кандидатным средством.
47. Анализ по п. 46 для использования для идентификации средств, которые влияют на одно или несколько из жизнеспособности, дифференциации, пролиферации плюрипотентной клетки.
48. Применение плюрипотентной клетки, полученной с помощью способа по любому из пп. 1-45 в способе клеточной терапии для субъекта.
49. Способ получения клетки или ткани, которая совместима с клеточной терапией для введения субъекту, предусматривающий:
получение плюрипотентной клетки из клетки по любому из пп. 1-45; при котором клетка представляет собой аутологичную клетку или подобранную по HLA аллогенную клетку.
50. Способ по п. 49, дополнительно предусматривающий дифференциацию плюрипотентной клетки в заранее определенную линию клеток перед введением в клетку или ткань субъекту.
51. Композиция, содержащая плюрипотентную клетку, в которой плюрипотентную клетку получают из клетки с помощью способов по любому из пп. 1-45.
52. Способ получения плюрипотентной стволовой клетки, предусматривающий культивирование клетки в присутствии адренокортикотропного гормона (АКТГ), среды 2i или 3i.
53. Способ по п. 52, при котором клетку культивируют в среде LIF, содержащей АКТГ.
54. Способ по п. 52 или 53, при котором АКТГ присутствует в концентрации от приблизительно 0,1 мкМ до приблизительно 100 мкМ.
55. Способ по любому из пп. 52-54, при котором клетка представляет собой клетку, полученную с помощью способа по любому из пп. 1-45.
56. Способ по любому из пп. 52-55, при котором клетка представляет собой тотипотентную клетку.
57. Способ по любому из пп. 52-56, при котором клетку культивируют в присутствии АКТГ, среды 2i или 3i в течение по меньшей мере 3 дней.
58. Способ по любому из пп. 52-57, при котором клетку культивируют в присутствии АКТГ, среды 2i или 3i в течение по меньшей мере 5 дней.
59. Способ по любому из пп. 52-58, при котором клетку культивируют в присутствии АКТГ, среды 2i или 3i в течение по меньшей мере 7 дней.
60. Способ по любому из пп. 52-59, при котором после стадии культивирования клетка экспрессирует обнаруживаемый уровень маркера стволовых клеток, выбранного из группы, состоящей из: Oct3/4; Nanog; Rex1; Klf4; Sox2; Klf2; Esrr-бета; Tbx3 и Klf5.
61. Способ увеличения способности к самообновлению плюрипотентной клетки, при котором способ предусматривает культивирование клетки в присутствии адренокортикотропного гормона (АКТГ), среды 2i или 3i.
62. Способ по п. 61, при котором клетку культивируют в среде LIF, содержащей АКТГ.
63. Способ по любому из пп. 61-62, при котором АКТГ присутствует в концентрации от приблизительно 0,1 мкМ до приблизительно 100 мкМ.
64. Способ по любому из пп. 61-63, при котором клетка представляет собой клетку, полученную с помощью способа по любому из пп. 1-45.
65. Способ по любому из пп. 61-64, при котором клетка представляет собой тотипотентную клетку.
66. Способ по любому из пп. 61-65, при котором клетку культивируют в присутствии АКТГ, среды 2i или 3i в течение по меньшей мере 3 дней.
67. Способ по любому из пп. 61-66, при котором клетку культивируют в присутствии АКТГ, среды 2i или 3i в течение по меньшей мере 5 дней.
68. Способ по любому из пп. 61-67, при котором клетку культивируют в присутствии АКТГ, среды 2i или 3i в течение по меньшей мере 7 дней.
69. Способ по любому из пп. 61-68, при котором после стадии культивирования клетка экспрессирует обнаруживаемый уровень маркера стволовых клеток, выбранного из группы, состоящей из: Oct3/4; Nanog; Rex1; Klf4; Sox2; Klf2; Esrr-бета; Tbx3 и Klf5.
70. Способ аутологичной клеточной терапии у субъекта, нуждающегося в клеточной терапии, предусматривающий
a. получение плюрипотентной клетки из клетки по любому из пп. 1-45, при котором клетку получают от субъекта, и
b. введение композиции, содержащей плюрипотентную клетку или ее дифференцированное потомство субъекту.
71. Способ по п. 70, дополнительно предусматривающий дифференциацию плюрипотентной клетки в заранее определенную линию клеток перед введением композиции субъекту.
72. Способ получения плюрипотентной клетки, способной к дифференциации в плацентарную клетку, причем способ предусматривает культивирование плюрипотентной клетки, полученной с помощью способа по любому из пп. 1-45, в присутствии FGF4.
73. Способ по п 72, при котором концентрация FGF4 составляет от 1 нМ до 1 мкМ.
74. Способ по п. 72 или 73, при котором плюрипотентная клетка способна к дифференциации в эмбриональную стволовую клетку.
ПРИМЕРЫ
Пример 1
Все организмы обладают примитивным инстинктом самосохранения. Когда растения подвергают значительным внешним стрессам, они активируют механизм, чтобы выжить, что вызывает дедифференцировку клеток и обеспечивает регенерацию поврежденной области или всего организма. Хотя такие механизмы, похоже, необходимы для низших организмов, чтобы выживать в экстремальных изменениях окружающей среды, они еще должны быть задокументированы у млекопитающих.
Изобретатели предположили, что физический стресс может приводить к тому, что зрелые клетки млекопитающих возвращаются к состоянию стволовых клеток, подобно тому, что наблюдается у растений и низших организмов. Чтобы проверить эту гипотезу, изучались зрелые клетки, произведенные из семи взрослых соматических тканей. Сначала фокусировались на том, что физические стрессы могут быть наиболее эффективными в изменении зрелых клеток для возвращения к менее зрелому состоянию, изучали CD45-положительные лимфоциты, полученные от мышей Oct4-GFP. Клетки от этих мышей обеспечивают считывание реверсии к фенотипу стволовых клеток при активации специфического к стволовым клеткам промотора Oct4. Зрелые, полностью дифференцированные клетки подвергали воздействию нескольких значительных внешних раздражителей.
Например, CD45-положительные лимфоциты подвергали воздействию раствора с низким pH, чтобы обеспечить сильный химический стресс. В течение 3 дней после воздействия обнаруживали экспрессирующие GFP клетки, и в течение 5 дней наблюдали сферические колонии, состоящие из экспрессирующих GFP клеток. Полученные таким образом клетки называются в данном примере как измененные под воздействием стресса стволовые клетки (SASC или SAC). SAC могут также упоминаться как обновленные стволовые клетки (RSCS) или животные каллусные клетки (АСС). SAC экспрессировали несколько маркеров, обычно связанные с эмбриональными стволовыми клетками. SAC проявляли потенциал дифференциации, эквивалентный клеткам ES, способствовавшие образованию химерных мышей, и были способны создавать целые плоды при введении в 4N бластоцисты. Клетки, полученные таким образом, изначально показывали низкую митохондриальную активность и другие условия, обычно связанные с индукцией основанных на клетках механизмов защиты от повреждений. Затем они проявляли деметилирование промоторов генов Oct4 и Nanog. Репрограммирование измененных под воздействием стресса клеток, казалось, было индуцировано через мезенхимально-эпителиальный переход. Полученные данные согласуются с описаниями клеток, содержащихся в каллусе растений, в ответ на повреждение (внешние раздражители). Каллус растений образован из индуцированного стрессом преобразования клеток в плюрипотентные стволовые клетки растений, способные образовывать клональные тела. Такая сферическая колония, полученная из зрелых полностью дифференцированных соматических клеток млекопитающих в ответ на значительные внешние раздражители, называется в настоящем документе как животный каллус, и измененные под воздействием стресса клетки, содержащиеся в такой колонии или каллусе, как "животные каллусные клетки" (АСС) или SAC.
Таким образом, значительные физические и химические стрессы вызывали репрограммирование нормальных зрелых взрослых клеток в плюрипотентные стволовые клетки, способные к эмбриогенезу. Без ограничения какой-либо теорией, механизм репрограммирования, по-видимому, включает в себя индукцию клеточной выживаемости и восстановительного процесса, обычно наблюдаемую в ответ на повреждение. В настоящем документе показано, что клетки млекопитающих обладают механизмом выживания, очень похожим на таковой у растений, для возвращения к репрограммированному состоянию в ответ на значительные стрессовые внешние раздражители.
Сообщается, что различные типы клеток были репрограммированы до плюрипотентного состояния стволовых клеток через индукцию или вынужденную экспрессию специфических генов 1-5. Считается также, что повреждение клеток в результате воздействия таких раздражителей, как ожоги, химические повреждения, травмы и радиация, не могут изменить нормальные клетки в такой степени, чтобы стать злокачественными клетками.
Введение
Все организмы по-видимому, характеризуются общим инстинктом для выживания после травмы, связанным со стрессовыми раздражителями, приспособлением к окружающей среде и регенерацией их организмов. У растений онтогенез наблюдается не только в зиготах, но и в полностью дифференцированных клетках и незрелой пыльце. У позвоночных тритоны способны к регенерации нескольких анатомических структур и органов, включающих в себя их конечности1. Особо следует отметить, что примечательная регенерационная способность, демонстрируемая растениями и тритонами, индуцируется внешними раздражителями, которые вызывают клеточную дедифференцировку ранее полностью дифференцированных соматических клеток. В то время, как миллиарды лет прошли с самой ранней формы жизни, а также различные организмы эволюционировали уникальными способами, этот инстинкт самосохранения может быть унаследован от общего предка современными организмами. Хотя считается, что конечно дифференцированные клетки млекопитающих, как правило, не в состоянии обратить вспять процесс дифференциации, млекопитающие могут сохранять ранее недооцененную программу избегания гибели в ответ на радикальные изменения в окружающей среде.
Растительный каллус, масса пролиферирующих клеток, сформированная в ответ на внешние раздражители, такие как ранение, которые могут быть простимулированы в культуре с помощью растительных гормонов2. Каллус содержит репрограммированные соматические клетки, относящиеся к каллусным клеткам, каждая из которых способна к клональной регенерации всего организма. Каллусные клетки не присущи растениям, но возникают из соматических клеток в ответ на внешние раздражители. Хотя недавние исследования показали, что соматические клетки млекопитающих могут быть репрограммированы с помощью экзогенных процессов, таких как индукция гена3-7, о репрограммировании соматических клеток млекопитающих в ответ на внешние физические и/или химические раздражители таким же образом, что и у растений, не сообщалось. Интересно, что полагают, что экстремальные внешние стимулы, такие как, воздействие раздражителями, включающими в себя ожоги, химическое повреждение, травму и излучение, может изменять нормальные соматические клетки, превращая в злокачественные клетки. Такие опыты, кажется, указывают на то, что внешние раздражители будут приводить к изменению клеток млекопитающих.
В этом исследовании было высказано предположение, что клетки млекопитающих сохраняют механизм выживания после воздействия значительного внешнего стресса, таким же образом, как и растения. В настоящем докладе представлены доказательства того, что применение значительных физических и химических раздражителей может вызывать репрограммирование зрелых, полностью дифференцированных соматических клеток млекопитающих, полученных из различных тканей, и что такие измененные под воздействием стресса клетки способны образовывать животный каллус, содержащий "животные каллусные клетки", которые могут регенерировать клональное тело. Результаты
Значительные физические и химические раздражители, применяемые к созревшим соматическим клеткам. Поскольку эмбриональный фактор транскрипции Oct4 считается важным в регуляции плюрипотентного статуса клеток, первоначальная стратегия состояла в идентификации того, какие внешние раздражители наиболее эффективно изменяют зрелые клетки, чтобы стать репрограммированными для экспрессии Oct4. CD45-положительные клетки гемопоэтической линии сначала изучали во избежание загрязнения недифференцированными клетками. CD45-положительные клетки, полученные из селезенки, полученные от Oct4-GFP (GOF) мышей8, подвергали различным значительным физическим и химическим раздражителям. Воздействия включали в себя: воздействие осмотическим давлением, воздействие значительным механическим растиранием, воздействие низкими значениями рН, применение повреждения клеточной мембраны с использованием стрептолизина О (SLO), воздействие недостаточным питанием и воздействие гипоксией и высокой концентрацией Са2+. Далее, экспрессирующие GFP клетки идентифицировали, сортировали и собирали с использованием FACS. Экспрессию генов Oct4 подтверждали с помощью ОТ-ПЦР. Воздействие каждого из применяемых раздражителей приводило к репрограммированию зрелых клеток для экспрессии GFP в некоторой степени (фиг. 5А). Воздействия на зрелые клетки химическим стрессом низкого значения рН и физическим стрессом значительного механического растирания оказались наиболее эффективными способами воздействия на изменение зрелых клеток для экспрессии Oct4. Для определения оптимального рН для индукции преобразования в экспрессирующие Oct4 клетки, CD45-положительные клетки подвергали воздействию растворов различной кислотности от рН 4,0 до рН 6,8. Через 3 дня после воздействия кислым раствором, экспрессию GFP клетками анализировали с использованием FACS. Кислотный раствор со значением рН 5,4-5,6 наиболее эффективно изменял клетки для экспрессии GFP (фиг. 5В). Следовательно, для остальной части исследования сфокусировались на выборе воздействием низким рН как на стрессовом воздействии.
Затем определяли оптимальные условия культивирования для поддержания стресса, изменяющего экспрессирующие Oct4 клетки. Изучали несколько описанных выше культуральных сред, включающих в себя: поддерживающую ES культуральную среду, 3i9 и АСТН10, условие культивирования ES, ES-LIF11, условие культивирования эмбриональных нервных стволовых клеток, B27-LIF12 и EpiSCs условие культивирования13. Клетки высевали в каждую из сред, и подсчитывали экспрессировавшие GFP колонии (фиг. 5С). По-видимому, среда B27-LIF была наиболее эффективной при получении экспрессирующих GFP сферических колоний. Поэтому среду B27-LIF использовали для культивирования обработанных клеток.
Подвергнутые стрессовому воздействию CD45-положительные клетки культивировали в среде B27-LIF, и в течение 5 дней наблюдались экспрессирующие GFP сферические колонии, в то время как никаких экспрессирующих GFP колоний не наблюдалось в необработанном контроле (фиг. 1А). Сферические колонии росли до приблизительно 70 мкм в диаметре в течение первых 7 дней, и сферические колонии можно было поддерживать в течение еще 7 дней в таком состоянии культуры. Конфигурация колоний было немного неправильной формы, проявляя форму, более схожую форме каллуса, показанного в ботанике, чем сферы. Клеточная колония, созданная с помощью стрессового воздействия, поэтому была отнесена к животному каллусу (АС). Культивируемые клетки диссоциировали, и анализ популяции затем выполняли с использованием FACS. Анализ показал, что применение определенных важных стимулов приводило к образованию измененных под воздействием стресса клеток, в настоящее время называемых животными каллусными клетками (АСС), которые ранее не существовали в СВ45-положительных клеточных популяциях (фиг. 1В). Фенотипическое изменение С045-положительных клеток в результате стрессового воздействия наблюдалось на одноклеточном уровне. В то время как CD45-положительные клетки не экспрессировали GFP, АСС экспрессировали GFP, связанный с пониженной экспрессией CD45 (данные не представлены). Исследование одиночных клеток показало, что клеточный размер обработанных клеток оказался меньше, чем необработанных клеток. Таким образом, клеточный размер популяции АСС анализировали с помощью FACS. Клеточный размер АСС был достаточно небольшим, с 80% клетками, составляющими менее 8 мкм в диаметре (фиг. 1С).
Для изучения хронологического фенотипического изменения, связанного с уменьшением CD45 и экспрессией Oct4, анализировали CD45-положительные клетки после стрессового воздействия в 1 день, 3 день и 7 день. В 1 день большинство клеток все еще экспрессировали CD45, но не Oct4. На 3-й день экспрессия маркера перешла к выявлению CD45-отрицательных клеток или CD45-отрицательных/Oct4-положительных (dim) клеток. На 7-й день экспрессия CD45 исчезала, и наблюдались экспрессирующие Oct4 клетки (фиг. 1D). Следует отметить, что в течение первых 7 дней культивирования, количество PI-положительных клеток (мертвые клетки) постепенно увеличивалось (данные не представлены), что давало возможность предположить, что стрессовое воздействие и условие культивирования постепенно изменяет характер клеток и выбранных для успешно измененных клеток, которые экспрессировали Oct4.
Характеристика АСС. Чтобы подтвердить репрограммирование соматических клеток в результате воздействия внешних раздражителей, исследовали экспрессию маркерного гена раннего эмбриогенеза АСС. В качестве положительного контроля раннего эмбриогенеза в следующих экспериментах использовали ES клетки. Экспрессию маркера и метилирование ДНК характеризовали следующим образом: иммунофлуоресцентное окрашивание на 7-й день показало, что сферические колонии, содержащие АСС, равномерно экспрессировали маркеры плюрипотентных клеток, антиген Е-кадгерин, Nanog, SSEA-1, РСАМ-1 и АР, и были положительными в отношении Oct4-GFP (данные не представлены). Анализ генной экспрессии показал, что клетки АСС и ES, но не первичные СВ45-положительные клетки, экспрессировали сопоставимые уровни генов Oct4, Nanog, Sox2, Ecat1, Esg1, Dax1, Fgf5, Klf4 и Rex1 (фиг. 2A). Генная экспрессия специфических для ES генов в АСС достигала пика на 7-й день (фиг. 2А). Бисульфитное секвенирование проводили для определения статуса метилирования промоторов генов Oct4 и Nanog в АСС. Нативные лимфоциты и культивированные образцы контрольных лимфоцитов отображали обширное метилирование в обоих промоторах, в то время как АСС показывали широкое деметилирование этих областей по аналогии с таковым в клетках ES (фиг. 2В). Таким образом, показано, что соматические клетки млекопитающих подвергались репрограммированию под воздействием внешнего стресса.
Для подтверждения того, что генная экспрессия Oct4 возникала в результате стрессового воздействия на зрелые клетки не только у мышей GOF, но и у мышей дикого типа, CD45-положительные лимфоциты собирали из селезенки, получаемой от мышей ICR. Лимфоциты затем подвергали стрессовому воздействию и хронологически анализировали до 7 суток с использованием FACS. Популяцию SSEA-1 положительных/Е-кадгерин положительных клеток наблюдали в группе, получавшей стрессовое воздействие, в то время как экспрессия SSEA-1/Е-кадгерина не наблюдалась в контрольной группе без стрессового воздействия (фиг. 6А). Эти двойные положительные клетки проявляли генную экспрессию Oct4, что было подтверждено с помощью ОТ-ПЦР (фиг. 6В). Эти результаты показали, что в результате стрессового воздействия, АСС, Ос14-положительные и экспрессирующие маркер плюрипотентных клеток, получали из CD45-положительных клеток, независимо от линии мыши.
Эти результаты означают, что зрелые полностью дифференцированные взрослые соматические клетки возвращались к "стволовости" в результате стрессового воздействия.
Для оценки стволовости АСС исследовали их потенциал к самообновлению и их потенциал к дифференциации. Для изучения их потенциала к самообновлению, колонии АСС, полученные из ранее зрелых CD45-положительных лимфоцитов, диссоциировали на отдельные клетки и высевали в 96-луночные планшеты с одной клеткой на лунку в попытке получить клонально полученные популяции. Через десять дней после посева сферические колонии наблюдались в 4 лунках из 96. Время деления АСС варьировало от лунки к лунке. Некоторые делились в течение 12-16 ч, а другие делились в течение 30-34 ч. АСС пассировали по меньшей мере 5 раз с наблюдаемой продолжающейся экспрессией Oct4. Следовательно, АСС демонстрировали потенциал к самообновлению и потенциал к дифференциации в клетки всех трех зародышевых листков in vitro.
Полученные из зрелых лимфоцитов GOF АС снова диссоциировали на отдельные клетки, сортировали для содержания только популяции клеток, которые экспрессируют GFP, и затем культивировали в среде для дифференцировки. Через 14-21 день после посева клетки экспрессировали маркер эктодермы, βIII-тубулин и GFAP, маркер мезодермы, а-актин гладких мышц, и маркер энтодермы, α-фетопротеин и цитокератин 7 (данные не представлены). Таким образом, АСС дифференцировали в клетки-представители трех зародышевых листков in vitro.
Изменение под стрессовым воздействием зрелых соматических клеток, полученных из различных взрослых тканей. Чтобы исследовать, могут ли АСС быть получены не только из зрелых лимфоцитов, но также и других типов соматических клеток, мозг, кожу, мышцы, жир, костный мозг, легкие и печень собирали от Oct4-GFP (GOF) мышей8. Клетки выделяли из образцов ткани, диссоциировали на отдельные клетки и воздействовали различными физическими и/или химическими стрессовыми условиями. Эффективность процесса для изменения клеток отличалась в зависимости как от источника клеток, и так стрессового условия(й), которому подвергались клетки (фиг. 7А). Способность стресса изменять зрелые клетки для экспрессии Oct4 отличалась в зависимости от источника клеток, но стресс был способен изменять зрелые клетки для экспрессии Oct4 в некоторой степени, полученные из всех трех зародышевых листков (фиг. 7А). Колонии АСС, полученные из любой зрелой ткани, экспрессировали маркеры плюрипотентности, Е-кадгерин, Nanog, РСАМ-1 и АР (данные не представлены), и специфические для ES гены-маркеры (фиг. 7В). Значительные физические и химические стрессы изменяли зрелые соматические клетки, возвращая их к состоянию стволовых клеток, несмотря на источник тканей и происхождение зародышевых листков.
Клеточная модификация на начальном этапе получения АСС. Эти результаты показывают, что сильные физические и химические раздражители приводят к репрограммированию соматических клеток. Было обнаружено, что лимфоциты после стрессового воздействия образовывали АС в течение 5 дней. Было высказано предположение, что резкое изменение молекулярных событий происходило в результате стрессового воздействия. Поэтому исследования были сосредоточены на начальном этапе репрограммирования, который был в течение первых 7 дней после воздействия раздражителей.
Поскольку АСС выживали после значительного стрессового воздействия, было высказано предположение, что механизмы выживания, которые обычно включаются для восстановления клеточного повреждения, индуцировались в процессе получения АСС. Сначала экспрессию ряда генов-кандидатов, участвующих в клеточном ответе на стресс и репарации ДНК14, сравнивали у нативных CD45-положительных клеток и CD45-положительных клеток послед стрессового воздействия на 1-й день, 3 день и 7 день. Экспрессия гена клеточного ответа наблюдалась уже через 1 день, и эти гены активировались более 7 дней, когда анализировали смеси производимых АСС клеток и других клеток (фиг. 8). Поскольку повышающая регуляция генов клеточного ответа коррелировала с получением АСС, сортировали АСС на 3 и 7 день и анализировали генную экспрессию. За исключением Hif3a, все гены-кандидаты активировались в различной степени при получении АСС (фиг. 3А). Было обнаружено, что четыре гена теплового шока и один ген репарации ДНК активировались в процессе получения АСС. Кроме того, известно, что семь из активированных генов непосредственно участвовали в регуляции клеточного окислительно-восстановительного состояния. Эти результаты свидетельствуют о том, что индуцировался потенциал саморепарации или самозащиты в процессе получения АСС.
Поскольку АСС проявляли активацию связанных с клеточным окислительно-восстановительным потенциалом генов, далее исследовали митохондриальную функцию АСС. Митохондрии представляют собой органеллы, ответственные за производство подавляющего большинства АТФ через окислительно-восстановительную реакцию с использованием кислорода в эукариотических клетках. Экспрессия GFP сферических колоний АСС постепенно уменьшалась от периферически расположенных клеток через 7 дней, когда колонии культивировали без пассажа. АСС, содержащиеся на 10 день, содержали экспрессирующие GFP центральные клетки и не-GFP дифференцированные периферические клетки (данные не представлены). Митохондриальную морфологию оценивали в АСС и в дифференцированных клетках с помощью окрашивания со специфическим митохондриальным красителем, MitoTracker Red. Митохондрии АСС наблюдались как околоядерные кластеры, которые выглядели как точечные и глобулярные, в то время как дифференцированная клетка содержала много митохондрий, которые были нитевидные и широко распространены в цитоплазме. Производство АТФ в АСС было меньше, чем в нативных С045-положительных клетках (фиг. 3В). Кроме того, производство активных форм кислорода (АФК) в АСС было меньше, чем в нативных CD45-положительных клетках (фиг. 3С). Наконец, оценивали ключевые факторы, влияющие на репликацию мтДНК; которые представляют собой митохондриальный фактор транскрипции (Tfam), специфическую для митохондрий ДНК-полимеразу гамма (Polg) и ее вспомогательную единицу (Polg2). Экспрессия генов Tfam, Polg и Polg2 в АСС была ниже, чем таковая в дифференцированных клетках (фиг. 3D). Следовательно, АСС содержали небольшое число митохондрий, и митохондриальная активность АСС была ниже, чем у дифференцированных клеток. Эти результаты подразумевают, что АСС приобретали отличие метаболической системы от дифференцированных клеток, чтобы выжить после тяжелой стрессовой реакции.
Потенциал развития АСС. Наконец, оценивали, обладают ли АСС потенциалом развития, подобным таковому растительных каллусных клеток. В качестве первого исследования для потенциала развития, изучали АСС, имплантированные подкожно иммунодефицитным (SCID) мышам. Через шесть недель после трансплантации АСС производили ткани, представляющие все три зародышевых листка (данные не представлены).
АСС дифференцировались в клетки-представители всех трех зародышевых листков in vivo и in vitro. Таким образом, оценивали потенциал вклада химеры АСС. АСС для применения в исследованиях получения химер получали с использованием CD45-положительных клеток, полученных из F1 GFP (C57BL/6GFP×DBA/2 или 129/SvGFP×C57BL/6GFP) или GOF. Поскольку анализ генной экспрессии выявил, что на 7 день АСС экспрессировали самый высокий уровень маркерных генов плюрипотентности, использовали АСС на 7 день для исследования получения химеры мыши. Первоначально использовали обычные способы для получения химер. АС диссоциировали на отдельные клетки с помощью обработки трипсином. АСС затем инъецировали в бластоцисты (фиг. 4А). Используя этот подход, вклад в химеру диссоциациированных АСС был довольно низким (таблица 1). Поэтому АСС без предварительной обработки трипсином, который часто вызывает повреждение клеток15, инъецировали в бластоцисты. АС нарезали на небольшие кластеры с использованием микроножа под микроскопом. Небольшие кластеры АС инъецировали в бластоцисты (фиг. 4А). Используя этот подход, вклад в химеру АСС резко возрастал (данные не представлены). Химерные мыши, созданные с АСС, росли здоровыми (данные не представлены), и наблюдалась передача зародышевой линии. Степень вклада в химеру каждой ткани анализировали с помощью FACS. Результаты показали, что АСС, полученные из лимфоцитов, вносили вклад во все ткани (фиг. 4В).
Как показано выше, АСС могут быть получены из различных клеток, полученных из всех трех зародышевых листков (фиг. 7А-7В). Для того чтобы исследовать, характеризуются ли АСС, полученные из различных тканей, различными тенденциями к дифференциации, АСС получали из различных тканей, полученных от мышей F1GFP, и инъецировали в бластоцисты ICR. Затем, с использованием FACS, анализировали отношение вклада каждой ткани в полученные химерные мыши. Было обнаружено, что АСС, полученные из любой ткани, вносили вклад в получение химерных мышей (фиг. 9). Кроме того, анализировали отношение вклада в кожу, мозг, мышцы, жир, печень и легкие у химерных мышей, полученных с использованием АСС, полученных из различных тканей. АСС, полученные из любой ткани, вносили вклад в создание тканей-представителей всех трех зародышевых листков, и не наблюдалось никаких тенденций к различиям (фиг. 9).
Получение мышей с помощью тетраплоидной комплементации, которая включает в себя введение плюрипотентных клеток в 4N бластоцисты-хозяева, представляет собой наиболее строгую проверку на потенциал развития, потому что полученные в результате эмбрионы происходят только от введенных донорских клеток16. АСС создавали из лимфоцитов, полученных из DBA×B6GFP F1 или 129/SvGFP×B6GFP F1 мышей. АСС приводили к (средней) поздней гаструляции "полностью АСС эмбрионов" после инъекции в 4N бластоцисты (данные не представлены). Анализ генотипирования показал, что "полностью АСС эмбрионы" характеризовались специфическими генами линии, которая была использована для создания АСС. Таким образом, АСС обладали потенциалом для создания клонального организма так же, как и растительные каллусные клетки.
Обсуждение
Соматические клетки млекопитающих проявляют способность к образованию животного каллуса (АС), очень похожего на растения, в результате воздействия значительных внешних раздражителей. Клетки, содержащиеся в этих каллусах (животные каллусные клетки, АСС), характеризуются возможностью получения химерных мышей и создания новых эмбрионов, полностью состоящих только из клеток, полученных от АСС. Описанные в настоящем документе результаты показывают, что соматические клетки млекопитающих восстанавливают способность дифференцироваться в любой из трех зародышевых листков с помощью внешних раздражителей. Это означает, что соматические клетки характеризуются большей пластичностью, чем считалось ранее. Кроме того, это исследование демонстрирует потенциал репрограммирования соматических клеток без генной индукции или введения чужеродных белков, и предлагает новый взгляд на потенциал взрослых стволовых клеток; представляя собой важную веху в выяснении биологии стволовых клеток.
Материалы и способы
Получение тканей и культивирование клеток. Для выделения зрелых лимфоцитов селезенки, полученные от мышей GOF или мышей ICR, измельчали ножницами и механически диссоциировали пипетками пастера. Диссоциированные селезенки процеживали через ячейки сетчатого фильтра (BD Biosciences, San Jose). Собранные клетки ресуспендировали в среде DMEM и добавляли тот же объем лимфолита (CEDARLANE®, Ontario, Canada), затем центрифугировали при 1000 g в течение 15 мин. Отбирали слой лимфоцитов и связывали с антителами CD45 (ab25603, abcam, Cambridge, MA). CD45-положительные клетки сортировали с помощью FACS Aria (BD Biosciences). Затем CD45-положительные клетки обрабатывали стрессовым воздействием (раствором с рН 5,5 в течение 15 мин) и высевали в среду В27, дополненную LIF 1000U (Sigma) и 10 нг/мл FGF 2 (Sigma).
Воздействие внешними раздражителями - стрессовое воздействие. Чтобы добавить механический стресс для зрелых клеток, пипетки пастера нагревали, а затем растягивали, чтобы создать люмены приблизительно 50 мкм в диаметрах, а затем разбивали. Зрелые соматические клетки затем растирали через эти пипетки в течение 20 мин и культивировали в течение 7 дней. Чтобы обеспечить гипоксический раздражитель для зрелых клеток, клетки культивировали в инкубаторе с концентрацией кислорода 5% в течение 3 недель. Питательный раздражитель для зрелых клеток обеспечивался посредством культивирования клеток в основной культуральной среде в течение 3 недель. Чтобы воздействовать на зрелые клетки физиологическим стрессом, их обрабатывали раствором с низким значением рН (рН 5,5) и культивировали в течение 7 дней. Кроме того, клеткам наносили серьезные повреждения. Чтобы создать поры в зрелых клеточных мембранах, клетки обрабатывали SLO (стрептолизином О).
Обработанные SLO клетки инкубировали в HBSS, содержащей 10 мкг/мл SLO при 37°С в течение 50 мин, а затем культивировали в культуральной среде без SLO в течение 7 дней. Клетки, подвергаемые стрессу в виде недостаточности питания, культивировали в основной среде в течение 2-3 недель. Клетки, подвергаемые стрессу "АТФ", инкубировали в HBSS, содержащей 2,4 мМ АТФ при 37°С в течение 15 мин, а затем культивировали в культуральной среде в течение 7 дней. Клетки, подвергаемые стрессу "Са", культивировали в культуральной среде, содержащей 2 мМ CaCl2 в течение 2 недель.
Бисульфитное секвенирование. Клетки, полученные от мышей GOF, диссоциировали на отдельные клетки. Собирали GFP-положительные клетки, используя FACS Aria. Геномную ДНК экстрагировали из АСС и изучали. Обработку бисульфитом ДНК проводили с использованием набора CpGenome DNA Modification (CHEMICON, Temecula, СА, http://www.chemicon.com) в соответствии с инструкциями изготовителя. Полученную модифицированную ДНК амплифицировали с помощью вложенной полимеразной цепной реакции ПЦР с использованием двух прямых (F) праймеров и одного обратного (R) праймера: Oct4 (F1, GTTGTTTTGTTTTGGTTTTGGATAT (SEQ ID NO: 1; F2, ATGGGTTGAAATATTGGGTTTATTTA (SEQ ID NO: 2); R, CCACCCTCTAACCTTAACCTCTAAC (SEQ ID NO: 3)) и Nanog (F1, GAGGATGTTTTTTAAGTTTTTTTT (SEQ ID NO: 4);. F2, AATGTTTATGGTGGATTTTGTAGGT (SEQ ID NO: 5), R, CCCACACTCATATCAATATAATAAC (SEQ ID NO: 6) ПЦР). ПЦР выполняли с использованием версии TaKaRa Ex Taq Hot Start (RR030A). Секвенирование ДНК проводили с использованием праймера М13 с дополнением GRAS (единица геномного ресурса и анализа).
Иммуногистохимия. Культивируемые клетки фиксировали в 4% параформальдегиде и пермеабилизировали с 0,1% тритоном X-100/PBS до блокирования раствором 1% BSA (Life Technology, Tokyo, Japan). Вторичные антитела представляли собой козьи к мышиным или кроличьим, соединенные с Alexa-488 или -594 (Invitrogen). Ядра клеток визуализировали с DAPI (Sigma). Слайды устанавливали с антифединговым реагентом SlowFade Gold (Invitrogen).
Сортировка активированных флуоресценцией клеток и проточная цитометрия. Клетки подготавливали в соответствии со стандартными протоколами и суспендировали в 0,1% BSA/PBS на льду перед проведением FACS. PI (BD Biosciences) использовали, чтобы исключить мертвые клетки. Клетки сортировали на BD FACSAria SORP и анализировали на BD LSRII с программным обеспечением BD FACSDiva (BD Biosciences).
Получение РНК и анализ ОТ-ПЦР. РНК выделяли с помощью набора RNeasy Micro (QIAGEN). Обратную транскрипцию проводили с помощью набора SupeSACript III First Strand Synthesis (Invitrogen). SYBR Green Mix I (Roche Diagnostics) использовали для амплификации, и образцы считывали на приборе Lightcycler-II (Roche Diagnostics).
Исследования на животных. Для исследований туморогенности клетки, суспендированные в 100 мл PBS, вводили подкожно в бока иммунодефицитных мышей SCID соответствующего возраста. Мышей умерщвляли и вскрывали через 6 недель.
Анализ АТФ и АФК. Межклеточный уровень АТФ измеряли с помощью биолюминесцентного набора для анализа АТФ HS II (Roche) в соответствии с протоколом изготовителя. Интенсивность люминесценции измеряли с использованием 96 микропланшетного люминометра Gelomax (Promega, Madison, WI) и показания люминесценции нормировали с помощью подсчета клеток. Для измерения уровня АФК клетки инкубировали в среде, содержащей 2 мкМ дигидроэтидиума (Molecular Probes) при 37°С в темноте в течение 15 минут. Затем клетки промывали PBS и суспендировали в PBS, содержащем 0,5% BSA. Интенсивность флуоресценции 30000 клеток записывали с помощью BD Biosciences LSRII (BD Bioscience, Spark, MD).
Получение и анализ химерных мышей. Производство диплоидных и тетраплоидных химер. Диплоидные эмбрионы получали от самок линии ICR, скрещенных с самцами ICR, а тетраплоидные эмбрионы получали от самок линии BDF1, скрещенных с самцами BDF1. Тетраплоидные эмбрионы получали с помощью электросливания 2-клеточных эмбрионов. В этом исследовании, поскольку обработка трипсином вызывала низкий химеризм, сферические колонии АСС нарезали небольшими кусочками с помощью микроножа под микроскопом, затем небольшие кластеры АСС вводили на день 4,5 бластоцисты с помощью большой пипетки. На следующий день химерные бластоцисты переносили в псевдобеременных самок дня 2,5.
Ссылки
1. Brockes, J.P. & Kumar, A. Plasticity and reprogramming of differentiated cells in amphibian regeneration. Nature reviews. Molecular cell biology 3, 566-574, doi:10.1038/nrm881 (2002).
2. Sinnott, J.J. & Burklund, C.W. The treatment of carotid insufficiency. The Nebraska state medical journal 45, 357-359 (1960).
3. Hanna, J. et al. Direct reprogramming of terminally differentiated mature В lymphocytes to pluripotency. Cell 133, 250-264, doi:10.1016/j.cell.2008.03.028 (2008).
4. Hockemeyer, D. et al. A drug-inducible system for direct reprogramming of human somatic cells to pluripotency. Cell stem cell 3, 346-353, doi: 10.1016/j.stem.2008.08.014 (2008).
5. Kim, D. et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell stem cell 4, 472-476, doi: 10.1016/j.stem.2009.05.005 (2009).
6. Kim, J.B. et al. Direct reprogramming of human neural stem cells by OCT4. Nature 461, 649-643, doi:10.1038/nature08436 (2009).
7. Okabe, M. et al. Definitive proof for direct reprogramming of hematopoietic cells to pluripotency. Blood 114, 1764-1767, doi:10.1182/blood-2009-02-203695 (2009).
8. Ohbo, K. et al. Identification and characterization of stem cells in prepubertal spermatogenesis in mice small star, filled. Developmental biology 258, 209-225 (2003).
9. Ying, Q.L. et al. The ground state of embryonic stem cell self-renewal. Nature 453, 519-523, doi:10.1038/nature06968 (2008).
10. Ogawa, K., Matsui, H., Ohtsuka, S. & Niwa, H. A novel mechanism for regulating clonal propagation of mouse ES cells. Genes to cells: devoted to molecular & cellular mechanisms 9, 471-477, doi:10.1111/j.1356-9597.2004.00736.x (2004).
11. Gough, N.M. et al. LIF: a molecule with divergent actions on myeloid leukaemic cells and embryonic stem cells. Reproduction, fertility, and development 1, 281-288 (1989).
12. Hitoshi, S. et al. Primitive neural stem cells from the mammalian epiblast differentiate to definitive neural stem cells under the control of Notch signaling. Genes & development 18, 1806-1811, doi:10.1101/gad.1208404 (2004).
13. Tesar, P.J. et al. New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature 448, 196-199, doi:10.1038/nature05972 (2007).
14. Saretzki, G., Armstrong, L., Leake, A., Lako, M. & von Zglinicki, T. Stress defense in murine embryonic stem cells is superior to that of various differentiated murine cells. Stem Cells 22, 962-971, doi:10.1634/stemcells.22-6-962 (2004).
15. Mitalipova, M.M. et al. Preserving the genetic integrity of human embryonic stem cells. Nature biotechnology 23, 19-20, doi:10.1038/nbt0105-19 (2005).
16. Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W. & Roder, J.C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America 90, 8424-8428 (1993).
17. Nagy, A. et al. Embryonic stem cells alone are able to support fetal development in the mouse. Development 110, 815-821 (1990).
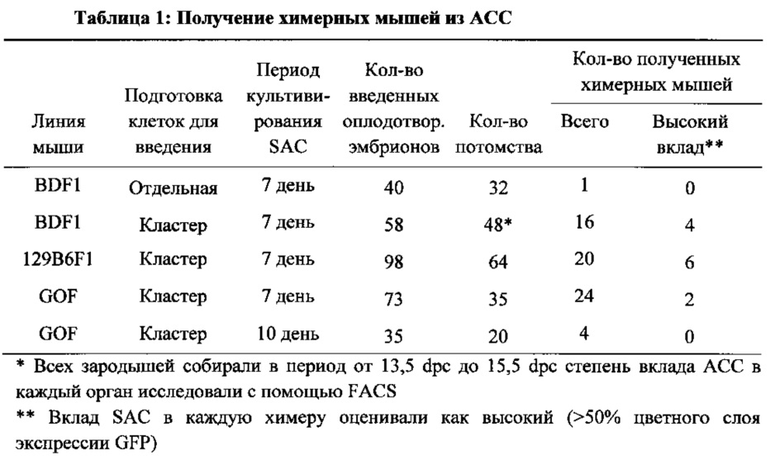
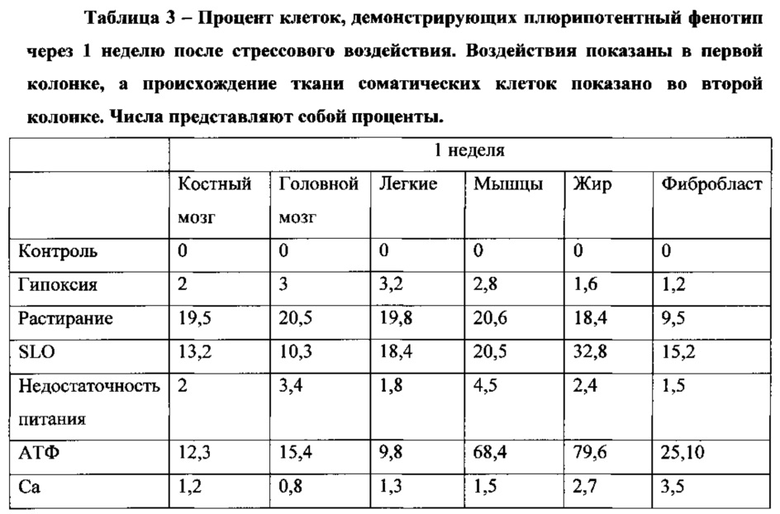
Пример 2: Запускаемые раздражителями преобразования соматических клеток в плюрипотентные
В настоящем документе описано явление ядерной инициализации, "запускаемая раздражителем приобретенная плюрипотентность" (НТС), при котором сильные внешние раздражители достаточно репрограммируют соматические клетки млекопитающих в плюрипотентные клетки без использования переноса ядер или введения факторов транскрипции. В присутствии LIF временный стресс низким значением рН вызывает дедифференциацию CD45+-гемопоэтических клеток в клетки, которые экспрессируют маркеры плюрипотентных клеток, такие как Oct3/4, и характеризуются компетенцией дифференциации трех зародышевых листков. В этих клетках STAP, как и в ES клетках, существенное деметилирование наблюдается в промоторных областях oct3/4 и nanog. Полученные из гемопоэтических клеток клетки STAP несут генные реаранжировки в Т-клеточном рецепторе, указывая на то, что коммитированные соматические клетки дают начало STAP клеткам путем преобразования линии. Инъекция в бластоцисты показывает, что STAP клетки эффективно вносят вклад в химеры, даже в анализе тетраплоидной комплементации, и в потомство с помощью передачи зародышевой линии. Таким образом, эпигенетические состояние определения судьбы может быть радикально инициализировано зависимым от контекста образом с помощью сильных сигналов окружающей среды.
В обзоре канализированности эпигенетической панорамы Waddington судьбы соматических клеток постепенно определяются как клеточная дифференцировка, идущая вниз. Считается, что изменение дифференцированного клеточного статуса требует искусственной, физической или генетической, манипуляции своими ядерными функциями, такими как ядерный перенос1 и введение множественных факторов транскрипции2. Остается без ответа, могут ли соматические клетки проходить инициализацию своей ядерной программы просто в ответ на внешние триггеры без этих прямых ядерных манипуляций. Такие ситуации, как известно, происходят в растениях; кардинальные изменения в культуральных окружающих средах могут преобразовать судьбу зрелых соматических клеток, например, диссоциированных клеток моркови, в незрелые клетки бластемы, из которых в присутствии ауксинов развивается структура всего растения, включающая в себя стебли и корни. Провокационный вопрос заключается в том, могут ли животные соматические клетки характеризоваться сходным потенциалом, который обнаруживается по меньшей мере в особых условиях. За последнее десятилетие наличие плюрипотентных клеток (или близко соответствующих типов клеток) во взрослых тканях было предметом дискуссий, для которых различными группами были представлены противоречивые выводы. Тем не менее, ни одна из них не продемонстрировала, что такие плюрипотентные клетки могут возникать из дифференцированных соматических клеток.
Гемопоэтические клетки, положительные по CD45 (общий антиген лейкоцитов), представляют собой типичные коммитированные по линии соматические клетки, которые часто используются в качестве исходных типов клеток для репрограммирующих исследований, таких как дериватизация клеток iPS. Они никогда не экспрессируют связанные с плюрипотентностью маркеры, такие как Oct3/4, если не репрограммированы. В частности, большинство из CD45+-клеток из тканей селезенки рассматриваются как нестволовые популяции лейкоцитов (созревающие клетки или клетки-предшественники), и преобразование клеток iPS из лимфоцитов, несущих геномные реаранжировки гена В цепи Т-клеточного рецептора (tcrB), рассматривается как подтверждение отличительной черты для репрограммирования из коммутированных соматических клеток. Исследователи поэтому были заинтригованы вопросом, могут ли CD45+-клетки селезенки быть преобразованы, чтобы получить плюрипотентность от резких изменений внешних условий, таких как те, которые вызваны простыми химическими возмущениями.
Результаты
Воздействие низким рН индуцировало обращение судьбы коммитированных соматических клеток. CD45+-клетки, полученные из взрослых селезенок, полученных от oct3/4::gfp В6 мышей15, подвергали различным видам сильных переходных раздражителей, включающих в себя физические и химические, и исследовали на активацию промотора oct3/4 после культивирования в суспензии с использованием содержащей LIF среды В27 в течение нескольких дней. Среди этих различных возмущений, возмущение с низким значением рН было в центре внимания. Как будет показано ниже, этот тип возмущений оказался наиболее эффективным в индукции oct3/4.
Без воздействия раздражителей ни одна из клеток, отсортированных с CD45, не экспрессировала oct3/4::GFP, независимо от срока культуры в содержащей LIF среде, что было разрешено для выживания отсортированных клеток. В отличие от этого, 30-минутное воздействие на CD45+-клетки селезенки средами с низким значением рН (рН 4,5-6,0; фиг. 12А) приводило к появлению значительного числа oct3/4::GFP+-клеток на 7-й день (d7) культуры (фиг. 12В; наиболее эффективный диапазон рН составлял 5,4-5,8; фиг. 16В). Эти клетки поддерживали экспрессию oct3/4::GFP без пассирования по меньшей мере в течение еще 7 дней (всего 14 дней). На d7 этой не адгезирующей культуры индуцированные низким значением рН oct3/4::GFP+-клетки образовывали сферические (или немного неправильные) кластеры (данные не представлены; состоящие из нескольких до нескольких десятков клеток), которые больше не экспрессировали CD45 (фиг. 12С). Интересно, что клеточный размер индуцированных низким значением рН oct3/4::GFP+-клеток был значительно меньше, чем у CD45+-клеток без воздействия (смотрите иммуноокрашивание oct3/4::GFP и CD45 в одной клетке, фиг. 12С); 80% первых клеток были меньше, чем 8 мкм в диаметре, в то время как контрольные CD45+-клетки находились в диапазоне от 8 до 10 мкм (фиг. 12D (левый пик показывает Oct3/4::GFP+-клетки, а правый пик показывает CD45+-клетки), что оценивали с помощью анализа прямого светорассеивания в FACS). Эти наблюдения позволяют предположить драматические изменения между популяциями oct3/4::GFP+ и CD45+, выходящие за рамки различий в экспрессии двух маркеров.
Анализ зависимости от времени (фиг. 12С) показал динамическое изменение клеточных популяций на протяжении d1-d3. Большинство выживших клеток в d1 (число выживших клеток соответствовало ~85% популяции d0) были еще CD45+ и oct3/4::GFP-. В d2 и d3 значительная группа (21% и 34%, соответственно) от всех выживших клеток становилась oct3/4::GFP+ и ослабляла CD45 (фиг. 12С; ~50-60% от высеянных клеток теряли к этому времени). На d7 значительное число oct3/4::GFP+/CD45--клеток (54% от всех выживших клеток) составляли отличную популяцию от oct3/4::GFP-/CD45- (фиг. 12В, вверху, общее число клеток на d7 было аналогично тому, которое было в d3). Очевидного образования популяций oct3/4::GFP+/CD45- не было замечено в культуре необработанных CD45+-клеток (фиг. 12В, внизу). Таким образом, количество популяций oct3/4::GFP+/CD45- в группе после воздействия низким значением рН было довольно существенным и соответствовало приблизительно половине от всех выживших клеток в d7. На самом деле, когда сигналы oct3/4::GFP впервые появлялись на d2, число GFP+-клеток соответствовало ~8% первоначально высеянных CD45+-клеток. Таким образом, представляется маловероятным, что очень незначительная популяция (например, загрязнение CD45"-клетками) быстро росла для образования такой существенной популяции oct3/4::GFP+ в течение первых двух дней после воздействия низким значением pH.
В анализе прямого изображения (данные не представлены) CD45+ клетки с воздействием низким рН, но не клетки без воздействия, как правило, образовывали небольшие кластеры, у которых постепенно возникали сигналы GFP в течение первых нескольких дней. Затем эти небольшие кластеры oct3/4::GFP+ часто сливались и образовывали сферы большего размера к d5, указывающие на то, что кластеры представляют собой мультиклональные. Интересно, что эти кластеры GFP+ (но не GFP--клетки) были весьма подвижны и часто выпячивали клеточные процессы (данные не представлены).
Для исследования того, вносили ли вклад коммутированные по линии CD45+-клетки селезенки, в частности, популяции Т-клеток, в oct3/4::GFP+-клетки, геномные реаранжировки tcrβ рассматривали в выделенных oct3/4::GFP+ сферах с помощью геномной ПЦР, и было обнаружено, что каждая сфера содержала клетки с реаранжировками гена tcrβ (данные не представлены). Чтобы исключить возможность обнаружения реаранжировки в загрязнении oct3/4::GFP-/CD45+-клетками, oct3/4::GFP+/CD45--клетки отсортировывали с помощью FACS на d7 и подвергали анализу реаранжировки гена tcrβ. В этом случае, также, реаранжировки гена tcrβ отчетливо наблюдались (фиг. 12Е). Эти результаты показывают, что коммитированные популяции соматических клеток в клетках селезенки (по меньшей мере, Т-клетки) вносили вклад в oct3/4::GFP+-клетки путем преобразования их судьбы из CD45+ в oct3/4::GFP++.
Индуцированные низким рН Oct3/4+-клетки характеризуются плюрипотентностъю. Далее исследовали, представляет ли собой экспрессия oct3/4::GFP+ в индуцированных раздражителем клетках плюрипотентное состояние этих клеток или просто представляет собой специфическое изменение в паттерне генной экспрессии (в данном случае, oct3/4 и cd45), не приобретая плюрипотентность. Иммуноокрашивание показало, что на d7 oct3/4::GFP+ сферы экспрессировали связанные с плюрипотентностью маркеры, такие как Oct3/4, SSEA-1, Nanog, Е-кадгерин и АР (данные не представлены). Анализ генной экспрессии с помощью количественной ПЦР показал, что индуцированные низким значением oct3/4::GFP+-клетки на d7, в отличие от CD45+-клеток, экспрессировали уровни генов oct3/4, nanog, sox2, ecat1, esg1, dax1 и klf4, сопоставимые таковым в ES клетках (фиг. 13А (серии представляют собой, слева направо, экспрессию oct3/4, nanog, sox2, ecatl1, esg1, dax1 и klf4); эти маркеры были уже положительными на d3), указывая на то, что индуцированные низким значением рН oct3/4::GFP+-клетки экспрессируют истинный набор маркерных генов, характерных для плюрипотентности, которые никогда не экспрессируются в CD45+-клетках.
Далее исследовали, сопровождалось ли это драматическое изменение в паттерне генной экспрессии изменением в эпигенетической модификации связанных с плюрипотентностью генов. С этой целью, проводили бисульфитное секвенирование, чтобы исследовать статус метилирования промоторных областей oct3/4 и nanog. CD45+-клетки, с или без дополнительного культивирования, отображали паттерны метилирования в значительной степени на обоих промоторах. В отличие от этого, индуцированные низким значением рН oct3/4::GFP+-клетки показали обширное деметилирование в этих областях, подобно ES клеткам (фиг. 13В), демонстрируя, что клетки подвергались существенному репрограммированию эпигенетического статуса в этих ключевых генах плюрипотентности.
Далее исследовали, характеризовались ли индуцированные низким рН клетки способностью к созданию производных трех зародышевых листков, что представляет собой общий критерий для плюрипотентной природы. Как анализы дифференциации in vitro (данные не представлены), так и исследование образования тератомы (данные не представлены) показали, что эти клетки могут давать начало эктодермальным (например, β-тубулин Ш+), мезодермальным (например, актин+ гладких мышц) и эндодермальным (например, альфа-фетопротеин+) клеткам.
В совокупности эти результаты показывают, что дифференцированное состояние коммитированной линии соматических клеток может быть превращено в состояние плюрипотентности клеток с помощью сильных раздражителей, получаемых извне. Далее, изменение судьбы из соматических клеток в плюрипотентные клетки с помощью сильных внешних раздражителей, таких как низкое значение рН, упоминается как "запускаемая раздражителем приобретенная плюрипотентность" (STAP), а полученные клетки - как STAP клетки.
STAP клетки из других тканевых источников. Еще один важный вопрос о STAP клетках заключается в том, ограничивается ли феномен запуска преобразования низким рН CD45+-лейкоцитами. Для решения этого вопроса, аналогичные эксперименты по преобразованию проводили с соматическими клетками, полученными из тканей головного мозга, кожи, мышц, жира, костного мозга, легких и печени oct3/4::gfp мышей.
Клетки из тканевых образцов диссоциировали на отдельные клетки, подвергали временному воздействию низкого значения рН и культивировали в содержащей LIF среде. Хотя эффективность преобразования варьировала среди тканей по их происхождению, oct3/4::GFP+-клетки воспроизводимо наблюдались в d7 культуре (фиг. 14А (серии представляют собой, слева направо, CD45+-клетки, костный мозг, головной мозг, легкие, мышцы, жир, фибробласты, печень и хондроциты). Следует отметить, что STAP клетки эффективно получали из мезенхимальных клеток жировой ткани (данные не представлены), где CD45+-клетки были редки, а также из первичной культуры клеток хондроцитов, указывая на то, что популяции не-CD45+-клеток могут приводить к STAP клеткам. Эти кластеры oct3/4::GFP+-клеток также экспрессировали связанные с плюрипотентностью маркеры (фиг. 14В (серии представляют собой, слева направо, экспрессию Oct3/4, Nanog, Sox2, Klf4 и Rex1), и фиг. 18В, данные не представлены) и специфические для ES клеток маркерные гены (фиг. 14В и фиг. 18В).
Характеристики STAP клеток как плюрипотентных клеток. Таким образом, STAP клетки экспрессируют специфические для ES клеток гены и показывают аналогичные паттерны метилирования в генах oct3/4 и nanog. Кроме того, STAP клетки могут быть установлены в культуральных средах для мышиных ES клеток, таких как содержащие LIF среды, но не в мышиной среде EpiSC (данные не представлены).
Тем не менее, хотя STAP клетки проявляли значительное сходство с мышиными ES клетками, несколько различных особенностей также были найдены. Например, STAP клетки показали ограниченную способность к самообновлению. В отличие от мышиных ES клеток (данные не представлены), когда сферы STAP клеток ферментативно диссоциировали на отдельные клетки для клонального культивирования в каждой лунке 96-луночного планшета, никаких колоний (АР+ или Oct3/4::GFP+) не образовывалось после дополнительных 10 дней культивирования в содержащей LIF среде (основанной на G-MEM или В27) либо при адгезивных, либо неадгезивных условиях (данные не представлены). В то время как образование сферических колоний видели редко (как правило, в 2-4 лунках из 96 лунок), эти колонии были все АР- и oct3/4::GFP-. Даже тогда, когда сферы STAP клеток частично диссоциировали и культивировали в условиях высокой клеточной плотности (данные не представлены; по-видимому, более благоприятной для самообновления), число клеток начинало снижаться после двух пассажей, и oct3/4::GFP+-клетки не могли поддерживаться более пяти пассажей. Эти характеристики роста и поддержания предполагают, что STAP клетки представляют собой популяцию плюрипотентных клеток, чьи характерные черты частично отличаются от мышиных ES и iPS клеток.
Мышиные EpiSC представляют собой другую категорию плюрипотентных стволовых клеток, которые рассматриваются как немного более продвинутые в стадиях дифференциации. STAP клетки, казалось, ведут себя отлично от EpiSC клеток в нескольких аспектах. В адгезионной культуре, подобно мышиным ES клеткам, oct3/4::GFP+-клетки образовывали полусферические колонии путем нагромождения, в отличие от монослойных плоских колоний, обнаруженных для EpiSC мыши. STAP клетки не могли поддерживаться в среде EpiSC, также, предполагая, что они отличаются от EpiSC (данные не представлены). Кроме того, воздействие ингибитором ROCK, который улучшает одноклеточные пассажи EpiSC (ref; Ohgushi), не способствовало образованию колоний от диссоциированных STAP клеток (данные не представлены).
Иммуноокрашивание показало, что STAP клетки были отрицательными по маркерам EpiSC Claudin 7 и ZO-1 и положительными по Klf2/4 (данные не представлены). Группировка между ES клеткой, STAP клеткой и EpiSC может быть не такой простой, поскольку экспрессия маркера ES клеток Esrrβ была низкой как в STAP клетках, так и в EpiSC, в то время как экспрессия elf5 специфически низкая в STAP клетках (фиг. 15А (серии представляют собой, слева направо, ES, EpiSC, STAP и CD45)). В кластерном анализе транскриптома генома STAP клетки были ближе всего к ES клеткам и характеризовались существенным сходством с бластоцистами в экспрессии РНК, в то время как они наиболее удалены от исходных CD45+-клеток (данные не представлены). Положение Х-хромосомной инактивации в STAP клетках было интригующим; ~40% женских STAP клеток (d7) показали инактивированную хромосому, в то время как Х-хромосомная инактивация была отменена у остальных (~60%) (фиг. 15В).
Эти данные повысили вероятность того, что состояние дифференциации STAP клеток может представлять собой новое метастабильное плюрипотентное состояние, тесно связанное, но отличное от ES клеток.
Образование химер и передача зародышевой линии у мышей. И, наконец, способность к образованию химер STAP клеток оценивали с помощью анализа инъекции в бластоцисты. В отличие от ES клеток, когда STAP клетки (В6-фон) диссоциировали на отдельные клетки и инъецировали в бластоцисты ICR, никаких химерных мышей, несущих темную окраску шерсти, не рождалось (таблица 4). Поскольку отдельные STAP клетки вряд ли могут поддерживаться in vitro, был сделан вывод, что клеточная диссоциация каким-то образом изменяла их способность. Таким образом, кластеры STAP клеток вручную разрезали на маленькие кусочки с использованием микроножа под микроскопом и вводили целиком в бластоцисты (данные не представлены). С этим маневром, химерные мыши рождались в заметной степени и все нормально развивались (данные не представлены). Далее исследовали вклад в ткань вводимых STAP клеток, которые были получены от CD45+-клеток мышей, конститутивно экспрессирующих GFP (F1 C57BL/6GFP скрещивали с DBA/2 или 129/Sv). От умеренного до высокого вклад экспрессирующих GFP клеток наблюдался в химерных эмбрионах, которым вводили кластеры STAP клеток (данные не представлены).
Степень вклада GFP+-клеток в каждую ткань анализировали в этих химерных эмбрионах с помощью FACS. Полученные из CD45+-клеток STAP клетки вносили вклад во все исследованные ткани (данные не представлены). Кроме того, потомство, полученное от STAP клеток, рождалось в виде химерных мышей (таблица 5). Этот потенциал STAP клеток важен и демонстрирует подлинную природу этих плюрипотентных клеток, так как передача зародышевой линии рассматривается как строгий критерий для плюрипотентности, а также генетической и эпигенетической нормальности22. Анализ тетраплоидной (4N) комплементации затем выполняли путем введения клеток в 4N бластоцисты, что считается наиболее строгим исследованием на потенциал развития введенных клеток, поскольку получаемые в результате эмбрионы происходят только из этих донорских клеток23 (данные не представлены). При введении в 4N бластоцисты, полученные из CD45+-клеток STAP клетки (от DBA×B6GFP или 129/Sv×B6GFP F1 мышей), создавали "все GFP+ эмбрионы" на Е10,5 (данные не представлены), демонстрируя, что только STAP клеток было достаточно, чтобы создать полную эмбриональную структуру.
Взятые вместе, эти данные явно показывают, что STAP клетки обладают способностью развития дифференцировки во все линии соматических клеток и зародышевой линии в контексте эмбриональных условий.
Обсуждение
Описанные в настоящем документе данные показали удивительно гибкую пластичность, которой латентно обладают соматические клетки. Эта динамическая пластичность, даже преобразующая в плюрипотентные клетки, возникает, когда на клетки временно воздействуют сильными раздражителями, с которыми они обычно не сталкиваются в своих условиях жизни.
Преобразование из CD45+-клеток в STAP клетки, по существу, не подвергалось влиянию по меньшей мере воздействия ингибиторов HDAC (например, трикостатин А) или 5-аза-цитидина.
В настоящем документе показано, что воздействие низким значением рН существенно сокращало количество клеток в культуре. Тем не менее, на самом деле, снижение выживших клеток в течение первых 24 часов был незначительным, предполагая, что это воздействие вряд ли оказывало острое летальное воздействие на большинство клеток. Вместо этого, отсроченная потеря клеток постепенно происходила на протяжении d2-d5. В соответствии с этим, данные показали, что число генов, участвующих в клеточном ответе на стресс и репарации ДНК21, было сильно индуцировано у подвергшихся низкому значению рН oct3/4::GFP+-клеток на d3, но не у контрольных клеток, культивируемых в той же среде, предполагая, что клетки отвечали на раздражитель, как угрожающий жизни, или сублетальный, стресс. Интересно, что уровни их генной экспрессии становились еще выше на d7; таким образом, это интригует в будущем исследовать не только роли индуцированных стрессом генов для клеточного выживания, но возможно, также их возможное участие в процессе репрограммирования.
Другой открытый вопрос состоит в том, может ли клеточное репрограммирование быть инициировано специфическим путем воздействия низким значением pH или некоторыми другими типами сублетального стресса, такими как физическое повреждение, перфорация плазматической мембраны, осмотический шок, недостаточность ростовых факторов, гипоксия и воздействие средой с высоким содержанием Са2+. Следует отметить, что по меньшей мере некоторые из них, в частности, физическое повреждение сильным растиранием и перфорация мембраны с помощью стрептолизина О, индуцировали образование oct3/4::GFP+-клеток из CD45+-клеток (фиг. 18А). Эти данные указывают на возможность, что некоторые наиболее часто встречающиеся регуляторные модули, лежащие по направлению этих отдаленно связанных сублетальных стрессов, действуют в качестве ключа для освобождения соматических клеток от плотно закрытого эпигенетического состояния дифференциации, приводя к глобальному изменению в эпигенетической регуляции. Учитывая, что некоторые oct3/4::GFP+-клетки появлялись к d2, такой механизм репрограммирования может начинать функционировать в течение первых двух дней.
Ссылки
1 Wakayama, Т., Perry, А.С, Zuccotti, М., Johnson, K.R. & Yanagimachi, R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature 394, 369-374, doi:10.1038/28615 (1998).
2 Takahashi, K. & Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 126, 663-676, doi: 10.1016/j.cell.2006.07.024 (2006).
3 Jiang, Y. et al. Pluripotency of mesenchymal stem cells derived from adult marrow. Nature 418, 41-49, doi:10.1038/nature00870 (2002).
4 D'Ippolito, G. et al. Marrow-isolated adult multilineage inducible (MIAMI) cells, a unique population of postnatal young and old human cells with extensive expansion and differentiation potential. Journal of cell science 117, 2971-2981, doi:10.1242/jcs.01103 (2004).
5 Johnson, J. et al. Oocyte generation in adult mammalian ovaries by putative germ cells in bone marrow and peripheral blood. Cell 122, 303-315, doi: 10.1016/j.cell.2005.06.031 (2005).
6 Kucia, M. et al. A population of very small embryonic-like (VSEL) CXCR4(+)SSEA-1(+)Oct-4+ stem cells identified in adult bone marrow. Leukemia : official journal of the Leukemia Society of America, Leukemia Research Fund, U.K 20, 857-869, doi: 10.1038/sj.leu.2404171 (2006).
7 Kuroda, Y. et al. Unique multipotent cells in adult human mesenchymal cell populations. Proceedings of the National Academy of Sciences of the United States of America 107, 8639-8643, doi: 10.1073/pnas.0911647107 (2010).
8 Obokata, H. et al. The potential of stem cells in adult tissues representative of the three germ layers. Tissue engineering. Part A 17, 607-615, doi:10.1089/ten.TEA.2010.0385 (2011).
9 Rahnemai-Azar, A. et al. Human marrow-isolated adult multilineage-inducible (MIAMI) cells protect against peripheral vascular ischemia in a mouse model. Cytotherapy 13, 179-192, doi:10.3109/14653249.2010.515579 (2011).
10 Huang, Y. et al. Bone marrow transplantation temporarily improves pancreatic function in streptozotocin-induced diabetes: potential involvement of very small embryonic-like cells. Transplantation 89, 677-685, doi:10.1097/TP.0b013e3181c9dc7d (2010).
11 Zuba-Surma, E.K. et al. Transplantation of expanded bone marrow-derived very small embryonic-like stem cells (VSEL-SCs) improves left ventricular function and remodelling after myocardial infarction. Journal of cellular and molecular medicine 15, 1319-1328, doi:10.1111/j.1582-4934.2010.01126.x (2011).
12 Paczkowska, E. et al. Aldehyde dehydrogenase (ALDH) - a promising new candidate for use in preclinical and clinical selection of pluripotent very small embryonic-like stem cells (VSEL SCs) of high long-term repopulating hematopoietic potential. Annals of transplantation: quarterly of the Polish Transplantation Society 16, 59-71 (2011).
13 Lengner, C.J., Welstead, G.G. & Jaenisch, R. The pluripotency regulator Oct4: a role in somatic stem cells? Cell Cycle 7, 725-728 (2008).
14 Berg, J.S. & Goodell, M.A. An argument against a role for Oct4 in somatic stem cells. Cell stem cell 1, 359-360, doi:10.1016/j.stem.2007.09.007 (2007).
15 Ohbo, K. et al. Identification and characterization of stem cells in prepubertal spermatogenesis in mice small star, filled. Developmental biology 258, 209-225 (2003).
16 Ying, Q.L. et al. The ground state of embryonic stem cell self-renewal. Nature 453, 519-523, doi:10.1038/nature06968 (2008).
17 Ogawa, K., Matsui, H., Ohtsuka, S. & Niwa, H. A novel mechanism for regulating clonal propagation of mouse ES cells. Genes to cells: devoted to molecular & cellular mechanisms 9, 471-477, doi:10.1111/j.1356-9597.2004.00736.x (2004).
18 Gough, N.M. et al. LIF: a molecule with divergent actions on myeloid leukaemic cells and embryonic stem cells. Reproduction, fertility, and development 1, 281-288 (1989).
19 Hitoshi, S. et al. Primitive neural stem cells from the mammalian epiblast differentiate to definitive neural stem cells under the control of Notch signaling. Genes & development 18, 1806-1811, doi: 10.1101/gad.1208404 (2004).
20 Tesar, P.J. et al. New cell lines from mouse epiblast share defining features with human embryonic stem cells. Nature 448, 196-199, doi:10.1038/nature05972 (2007).
21 Saretzki, G., Armstrong, L., Leake, A., Lako, M. & von Zglinicki, T. Stress defense in murine embryonic stem cells is superior to that of various differentiated murine cells. Stem Cells 22,962-971, doi:10.1634/stemcells.22-6-962 (2004).
22 Surani, M.A. & Barton, S. C. Development of gynogenetic eggs in the mouse: implications for parthenogenetic embryos. Science 222, 1034-1036 (1983).
23 Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W. & Roder, J.C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proceedings of the National Academy of Sciences of the United States of America 90, 8424-8428 (1993).
24 A.P. Dyban, V.S.B. Cytogenetics of Mammalian Embryonic Development. Oxford Univ. Press, New York (1987).
25 Gropp, A., Winking, H., Herbst, E.W. & Claussen, C.P. Murine trisomy: developmental profiles of the embryo, and isolation of trisomic cellular systems. The Journal of experimental zoology 228, 253-269, doi:10.1002/jez.1402280210 (1983).
Материалы и способы
Получение тканей и культивирование клеток. Для выделения зрелых лимфоцитов селезенки, полученные от 1-недельных мышей GOF или мышей ICR, измельчали ножницами и механически диссоциировали пипетками пастера. Диссоциированные селезенки процеживали через ячейки сетчатого фильтра (BD Biosciences, San Jose). Собранные клетки ресуспендировали в среде DMEM и добавляли тот же объем лимфолита (CEDARLANE®, Ontario, Canada), затем центрифугировали при 1000 g в течение 15 мин. Отбирали слой лимфоцитов и связывали с антителами CD45 (ab25603, abeam, Cambridge, MA). CD45-положительные клетки сортировали с помощью FACS Aria (BD Biosciences). Затем CD45-положительные клетки обрабатывали стрессовым воздействием (раствором с рН 5,5 в течение 15 мин) и высевали в среду В27, дополненную LIF 1000U (Sigma) и 10 нг/мл FGF 2 (Sigma).
Воздействие внешними раздражителями - стрессовое воздействие. Чтобы добавить механический стресс для зрелых клеток, пипетки пастера нагревали, а затем растягивали, чтобы создать люмены приблизительно 50 микрон в диаметрах, а затем разбивали. Зрелые соматические клетки затем растирали через эти пипетки в течение 20 мин и культивировали в течение 7 дней. Чтобы обеспечить гипоксический раздражитель для зрелых клеток, клетки культивировали в инкубаторе с концентрацией кислорода 5% в течение 3 недель. Питательный раздражитель для зрелых клеток обеспечивался посредством культивирования клеток в основной культуральной среде в течение 3 недель. Культивирование с высокой концентрацией Ca обеспечивалось для зрелых клеток посредством культивирования клеток в среде, содержащей 2 мМ CaCl2 в течение 7 дней. Чтобы воздействовать на зрелые клетки физиологическим стрессом, их обрабатывали раствором с низким значением pH (pH 5,5) и культивировали в течение 7 дней. Кроме того, клеткам наносили более серьезные повреждения. Чтобы создать поры в зрелых клеточных мембранах, клетки обрабатывали SLO (стрептолизином О) (S5265, Sigma) в течение 2 ч, а затем культивировали в течение 7 дней.
Бисульфитное секвенирование. Клетки, полученные от мышей GOF, диссоциировали на отдельные клетки. Собирали GFP-положительные клетки, используя FACS Aria™. Геномную ДНК экстрагировали из SAC и изучали. Обработку бисульфитом ДНК проводили с использованием набора CpGenome™ DNA Modification (Chemicon, Temecula, СА, http://www.chemicon.com) в соответствии с инструкциями изготовителя.
Полученную модифицированную ДНК амплифицировали с помощью вложенной полимеразной цепной реакции ПЦР с использованием двух прямых (F) праймеров и одного обратного (R) праймера: Oct4 (F1, GTTGTTTTGTTTTGGTTTTGGATAT; F2, ATGGGTTGAAATATTGGGTTTATTTA; R, CCACCCTCTAACCTTAACCTCTAAC). И Nanog (F1, GAGGATGTTTTTTAAGTTTTTTTT; F2, AATGTTTATGGTGGATTTTGTAGGT; R, CCCACACTCATATCAATATAATAAC). ПЦР выполняли с использованием версии TaKaRa Ex Taq Hot Start (RR030A). Секвенирование ДНК проводили с использованием праймера М13 с дополнением GRAS (единица геномного ресурса и анализа).
Иммуногистохимия. Культивируемые клетки фиксировали в 4% параформальдегиде и пермеабилизировали с 0,1% тритоном X-100/PBS до блокирования раствором 1% BSA (Life Technology, Tokyo, Japan). Вторичные антитела представляли собой козьи к мышиным или кроличьим, соединенные с Alexa-488 или - 594 (Invitrogen). Ядра клеток визуализировали с DAPI (Sigma). Слайды устанавливали с антифединговым реагентом SlowFade Gold (Invitrogen).
Сортировка активированных флуоресценцией клеток и проточная цитометрия. Клетки подготавливали в соответствии со стандартными протоколами и суспендировали в 0,1% BSA/PBS на льду перед проведением FACS. PI™ (BD Biosciences) использовали, чтобы исключить мертвые клетки. В отрицательных контролях первичное антитело заменяли отрицательными контролями IgG того же изотипа, чтобы убедиться в специфичности. Клетки сортировали на BD FACSAria SORP™ и анализировали на BD LSRII™ с программным обеспечением BD FACSDiva™ (BD Biosciences).
Получение РНК и анализ ОТ-ПЦР. РНК выделяли с помощью набора RNeasy™ Micro (QIAGEN). Обратную транскрипцию проводили с помощью набора SupeSACript III First Strand Synthesis (Invitrogen). SYBR Green™ Mix I (Roche Diagnostics) использовали для амплификации, и образцы считывали на приборе Lightcycler-II™ (Roche Diagnostics).
Исследования на животных. Для исследований туморогенности клетки, суспендированные в 100 мл PBS, вводили подкожно в бока иммунодефицитных мышей SCID соответствующего возраста. Мышей умерщвляли и вскрывали через 6 недель.
Анализ АТФ и АФК. Межклеточный уровень АТФ измеряли с помощью биолюминесцентного набора для анализа АТФ HS II™ (Roche) в соответствии с протоколом изготовителя. Интенсивность люминесценции измеряли с использованием 96-луночного микропланшетного люминометра Gelomax™ (Promega, Madison, WI) и показания люминесценции нормировали с помощью подсчета клеток. Для измерения уровней АФК клетки инкубировали в среде, содержащей 2 мкМ дигидроэтидиума (Molecular Probes) при 37°С в темноте в течение 15 минут. Затем клетки промывали PBS и суспендировали в PBS, содержащем 0,5% BSA. Интенсивность флуоресценции 30000 клеток записывали с помощью BD Biosciences LSRII (BD Bioscience, Spark, MD).
Получение и анализ химерных мышей.
Производство диплоидных и тетраплоидных химер. Диплоидные эмбрионы получали от самок линии ICR, скрещенных с самцами ICR, а тетраплоидные эмбрионы получали от самок линии BDF1, скрещенных с самцами BDF1. Тетраплоидные эмбрионы получали с помощью электросливания 2-клеточных эмбрионов. В этом исследовании, поскольку обработка трипсином вызывала низкий химеризм, сферические колонии SAC нарезали небольшими кусочками с помощью микроножа под микроскопом, затем небольшие кластеры SAC вводили на день 4,5 бластоцисты с помощью большой пипетки. На следующий день химерные бластоцисты переносили в псевдобеременных самок дня 2,5.
Анализ дифференциации in vitro.
Анализа дифференциации мезодермалъной линии. Измененные под воздействием стресса массы клеток собирали через 7 дней и диссоциировали на отдельные клетки, а затем собирали только Oct4-GFP-положительные клетки с помощью клеточного сортера. Собранные клетки помещали в DMEM, дополненную 20% FCS. Среду заменяли каждые 3 дня. Через 7-14 дней мышечные клетки окрашивали антителом к а-актину гладких мышц (N1584, DAKO). В качестве отрицательных контролей первичное антитело заменяли отрицательными контролями IgG того же изотипа, чтобы обеспечить специфичность.
Анализ дифференциации нейроналъной линии. Измененные под воздействием стресса массы клеток собирали через 7 дней и диссоциировали на отдельные клетки, а затем собирали только Oct4-GFP-положительные клетки с помощью клеточного сортера. Собранные клетки высевали на покрытые орнитином слайды камеры (Nalge Nunc International) в F12/DMEM (1:1, об/об), с дополнением 2% В27 (Invitrogen), 10% FCS, 10 нг/мл bFGF (R&D Systems) и 20 нг/м EGF (R&D Systems). Среду заменяли каждые 3 дня. Через 10-14 дней клетки фиксировали в 4% параформальдегиде в течение 30 минут при 4°С, промывали PBS, содержащим 0,2% Тритон Х-100 в течение 15 минут при комнатной температуре, инкубировали с PBS, содержащим 2% FCS в течение 20 минут, чтобы блокировать неспецифические реакции, и инкубировали с мышиным моноклональным антителом к βIII тубулину (G7121, Promega) и мышиным моноклональным антителом к GFAP (АВ5804, CHEMICON). В качестве отрицательных контролей первичное антитело заменяли отрицательными контролями IgG того же изотипа, чтобы обеспечить специфичность.
Анализ печеночной дифференциации. Измененные под воздействием стресса клеточные массы собирали через 7 дней и диссоциировали на отдельные клетки, а затем собирали только Oct4-GFP-положительные клетки с помощью клеточного сортера. Собранные клетки высевали на предметное стекло 2 луночной камеры (Nalge Nunc International) в среде для культуры гепатоцитов, состоящей из 500 мл базальной среды для гепатоцитов (Lonza, Wuppertal, Germany), 0,5 мл аскорбиновой кислоты, 10 мл BSA-FAF (без жирных кислот), 0,5 мл гидрокортизона, 0,5 мл трансферрина, 0,5 мл инсулина, 0,5 мл EGF и 0,5 мл гентамицин-амфотерицина (GA-1000, все от Lonza) с добавлением 10% FCS, 1% пенициллина/стрептомицина (Sigma). Дифференцированные клетки обнаруживали иммуногистохимически с использованием следующих антител; мышиного моноклонального антитела к α-фетопротеину (МАВ1368, R&D System) и мышиного моноклонального антитела к цитокератину 7 (ab668, abeam). В качестве отрицательных контролей первичное антитело заменяли отрицательными контролями IgG того же изотипа, чтобы обеспечить специфичность.
Анализ дифференциации in vitro. Измененные под воздействием стресса клеточные массы собирали через 7 дней и диссоциировали на отдельные клетки, а затем собирали только Oct4-GFP-положительные клетки с помощью клеточного сортера. Собранные клетки ресуспендировали в 50 мкл DMEM с 10% FBS. Этот раствор высевали на лист 3×3×1 мм, состоящий из нетканой сетки из волокон полигликолевой кислоты, 200 микрон в диаметре, и имплантировали подкожно в дорсальные бока NOD/SCID мыши возрастом 4 недели. Через четыре недели имплантаты собирали и анализировали с использованием иммуногистохимических способов. Имплантаты фиксировали 10% формальдегидом, заливали в парафин и приводили к толщине 4 мкм. Срезы окрашивали гематоксилином и эозином. Энтодермальные ткани идентифицировали мышиным моноклональным антителом к энтодермальному маркеру α-фетопротеину (МАВ1368, R&D System). Эктодермальные ткани идентифицировали мышиным моноклональным антителом к βIII тубулину (G7121, Promega). Мезодермальные ткани идентифицировали антителом к α-актину гладкой мускулатуры (N1584, DAKO). В качестве отрицательных контролей первичное антитело заменяли отрицательными контролями IgG того же изотипа, чтобы обеспечить специфичность.
Анализ реаранжировки TCRB цепи. гДНК экстрагировали из SAC и кончиков хвостов от химерных мышей, полученных с SAC, полученными из CD45-положительных клеток. ПЦР проводили с 50 нг гДНК с использованием следующих праймеров.
(5'-GCACCTGTGGGGAAGAAACT-3' и
5'-TGAGAGCTGTCTCCTACTATCGATT-3'). Амплифицированную ДНК подвергали электрофорезу в 1,5% агарозном геле.
Генотипирование химерных мышей. гДНК экстрагировали из кончиков хвостов от 4N химерных мышей. Генотипирование проводили с использованием следующих праймеров. (GFP: F-AGAACTGGGACCACTCCAGTG и R-TTCACCCTCTCCACTGACAGATCT. IL-2: F-CTAGGCCACAGAATTGAAAGATCT и R-GTAGGTGGAAATTCTAGCATCATCC)
Затем определяли оптимальные условия культивирования для поддержания измененных под воздействием стресса экспрессирующих Oct4 клеток. Исследовали несколько описанных выше культуральных сред, включающих в себя: созданную для ES культуральную среду, 3i 16 и АКТГ 17, условие культивирования ES, ES-LIF 18, условие культивирования экспрессирующих Oct4 примитивных нейрональных стволовых клеток, B27-LIF 19, и условие культивирования EpiSCs 20. Клетки высевали в каждую среду, и подсчитывали экспрессирующие GFP колонии (фиг. S1C). Среда В27-LIF проявила себя как наиболее эффективная при получении экспрессирующих GFP сферических колоний. Поэтому мы использовали среду B27-LIF для культивирования обработанных клеток.
В целях изучения того, характеризуются ли SAC, полученные из клеток от различных тканей, различной тенденцией к дифференциации, SAC получали из различных тканей, полученных от мышей GFP F1, вводили их в бластоцисты ICR. Затем, используя FACS, анализировали отношение вклада каждой ткани в полученных химерных мышей. Было обнаружено, что полученные из любой ткани SAC, способствовали образованию химерных мышей (данные не представлены). Кроме того, отношение вклада в кожу, головной мозг, мышцы, жир, печень и легкие анализировали у химерных мышей, полученных с использованием SAC, полученных из различных тканей. SAC, полученные из любой ткани, вносили вклад в создание тканей-представителей всех трех зародышевых листков, а также не наблюдалось никакой тенденции к различиям (данные не представлены).
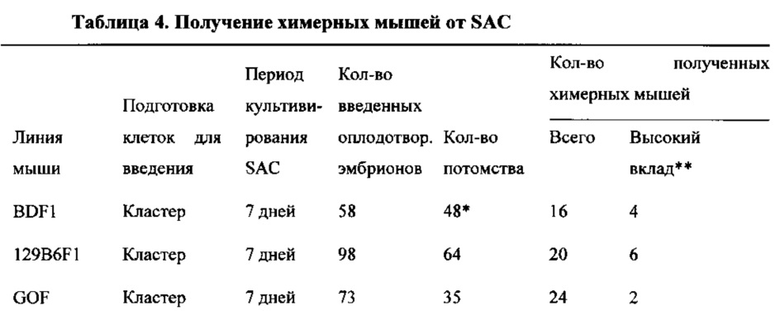

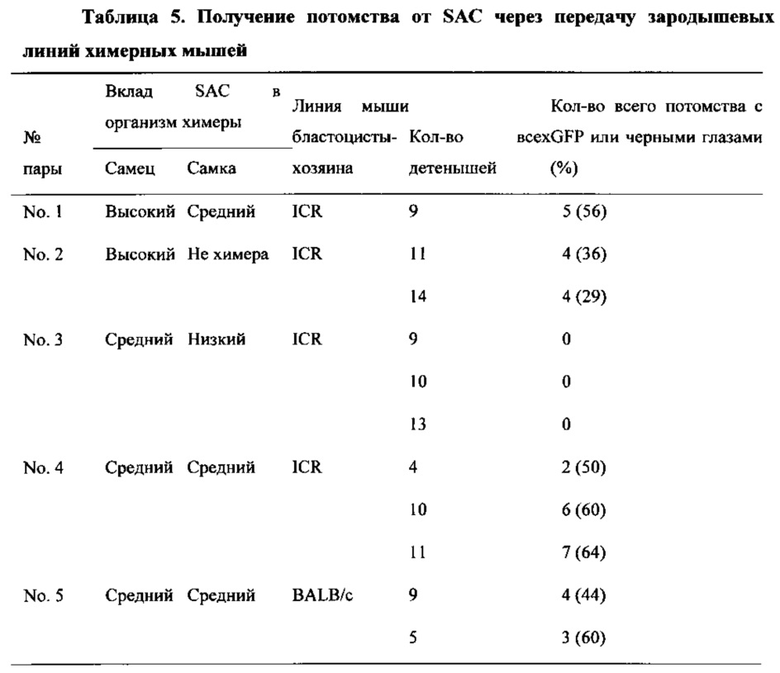
Пример 3
Без ограничения какой-либо теорией, описанные в настоящем документе способы, как предполагается, будут активировать процесс, относящийся к апоптозу, или контролируемую гибель клеток. Мягкое повреждение клеток может индуцировать активацию генов репарации. Тяжелое повреждение клеток может активировать ранее неопределенный механизм выживания. Предполагается, что когда клетки подвергаются значительному стрессу, такому как описанные в настоящем документе стрессы, клеточные компоненты (например, митохондрии, везикулы, ядра, рибосомы, эндоплазматический ретикулум, экзосомы, эндосомы, клеточные мембраны, митохондрии, лизосомы, АТФ, белки, ферменты, углеводы, липиды и т.д.) высвобождаются из поврежденных клеток в "cellieu". Описанные в настоящем документе данные показывают, что это "cellieu" может быть способно к восстановлению и/или содействию выживанию клеток. Дополнительно предусмотрено, не желая быть связанными какой-либо теорией, что митохондрии (и другие органеллы) могут направлять восстановление клеток. Из-за небольшого размера, простоты, способности направлять дифференцировку клеток и подобной прокариотам природы митохондрии могут выживать после стрессов, которые оказываются смертельными для родительской клетки. Митохондрии могут быть высвобождаться из клетки свободными, инкапсулированными в мембрану и/или связанными с другими клеточными компонентами.
Кроме того, без ограничения какой-либо теорией, ядра могут оставаться интактными, инкапсулированными в мембрану, которые могут содержать несколько митохондрий. Эти поврежденные клетки с очень небольшим количеством цитоплазмы и очень небольшим количеством органелл, которые потеряли эпигенетический контроль ядра, могут взаимодействовать и, возможно, сливаться с органеллами, которые были высвобождены. Это обеспечивает клетки субклеточными компонентами, необходимыми для роста и репликации, но клетки теряют эпигенетический контроль, и, следовательно, индуцируется более примитивное (например, более плюрипотентное) состояние.
Пример 4: потенциал развития для эмбриональных и плацентарных линий в репрограммированных клетках с приобретенной плюрипотентностью
В общем, судьба постнатальных соматических клеток фиксирована и не меняется, если они не подвергаются ядерному переносу1,2 или генетической манипуляции с ключевым фактором транскрипции. Как показано в настоящем документе, авторы настоящего изобретения обнаружили неожиданное явление соматического репрограммирования клеток в плюрипотентные клетки с помощью сублетальных раздражителей, названное запускаемая раздражителями приобретенная плюрипотентность (STAP)4. Также в настоящем документе описана демонстрация того, что репрограммированные STAP клетки проявляют уникальную способность к дифференциации, которая отличается от ES клеток. STAP клетки могут вносить вклад не только в эмбриональные ткани, но и в плацентарную систему, как показано в анализе инъекции в бластоцисты. Их эффективность в плацентарном вкладе дополнительно укрепилась с помощью культивирования с FGF4. И, наоборот, при культивировании в течение дополнительных пассажей в поддерживаемой ES культуральной среде, STAP клетки, которые первоначально показывали ограниченную способность к самообновлению, производили уверенно пролиферирующие клеточные линии, которые проявляют подобные ES клеткам, но не подобные трофобласту характеристики. Эти измененные STAP клетки (STAP стволовые клетки) давали рождение мышам в анализе тетраплоидной комплементации5, но больше не вносили вклад в плацентарные ткани. Таким образом, STAP клетки, в отличие от iPS клеток, могут представлять собой новое метастабильное состояние плюрипотентности6, которое отличается от ES клеток. Технология STAP стволовых клеток может предложить универсальный, мощный ресурс для нового поколения регенеративной медицины.
В настоящем документе описан интригующий феномен превращения клеточной судьбы: соматические клетки восстанавливают плюрипотентность после того, как они подвергаются воздействию сублетальных раздражителей, таких как воздействие низким рН4. Когда CD45+-клетки селезенки (включающие в себя коммитированные Т-клетки) подвергают воздействию рН 5,7 в течение 30 мин и затем культивируют в присутствии LIF, значительная часть выживших клеток начинает экспрессировать маркер плюрипотентных клеток Oct3/4 в день 2 (d2). К d7 кластеры плюрипотентных клеток образуют истинный профиль маркеров плюрипотентности и приобретают способность для дифференциации трех зародышевых листков (например, как показано образованием тератомы). Эти STAP клетки могут также эффективно вносить вклад в химерных мышей и подвергаться передаче зародышевой линии в анализе инъекции в бластоцисту. В то время как эти характеристики сходны с ES клетками, STAP клетки, похоже, отличаются от ES клеток, по меньшей мере их ограниченной способностью к самообновлению (как правило, 3-5 пассажей максимум) и их уязвимостью к диссоциационному культивированию4.
В настоящем примере авторы настоящего изобретения дополнительно исследовали уникальную природу STAP клеток, уделяя особое внимание их потенциалу к дифференциации на две основные категории клеток в бластоцисте7-9: клетки типа внутренней клеточной массы (или подобные ES клеткам) и клетки трофобластной/плацентарной линии после анализа инъекции в бластоцисты выявили неожиданный вывод. В общем, потомство введенных ES клеток находится в эмбриональной части химеры, но редко в плацентарной части7 (данные не представлены). Удивительно, введенные НТС клетки вносили вклад не только в эмбрион, но также в плаценту и внезародышевые мембраны (фиг. 22). Этот вклад в двойную линию наблюдался примерно у 60% химерных эмбрионов.
Этот вывод побудил к исследованию способности к трофобластической дифференциации STAP клеток. Известно, что трофобластические клеточные линии (стволовые клетки трофобласта; TS клетки)8,9 могут быть получены в длительной адгезионной культуре бластоцист в присутствии FGF4. Когда кластеры STAP клеток культивировали при тех же условиях (фиг. 23А, один кластер на лунку в 96-луночном планшете), кластеры сфероидных STAP клеток постепенно исчезали, и клетки с плоским внешним видом, отличные от STAP клеток, росли и образовывали колонии к d7-d10 (данные не представлены). В отличие от STAP клеток, которые характеризуются высоким уровнем экспрессии oct3/4::GFP, эти плоские клетки (адгезирующие к дну пластины) проявляли умеренные сигналы GFP в 7-й день культуры с FGF4 (данные не представлены). Иммуноокрашивание показало, что индуцированные FGF4 (F4I) клетки сильно экспрессировали трофобластические маркеры10-12 интегрин альфа 7 и эомезодермин (данные не представлены) в дополнение к умеренным уровням oct3/4::GFP. Экспрессия Nanog обнаруживалась, но была довольно низкой (данные не представлены). В соответствии с этим, анализ кПЦР показал, что F4I клетки экспрессировали значительные уровни маркерных генов трофобластной линии (например, cdx2), в то время как их экспрессия octS/4 и nanog была ниже, чем таковая в исходных STAP клетках (фиг. 23В). Эти F4I клетки могут быть эффективно расширены путем пассирования с трипсиновым расщеплением каждый третий день, и они оставались стабильными в течение более 30 пассажей в присутствии FGF4 (при его отсутствии они прекращали пролиферацию). Хотя это установление и расширение может быть сделано как на MEF клетках, так и на покрытом желатином дне, их культивирование на фидере MEF, как правило, показывает более четкое эпителиальное проявление (данные не представлены).
В анализе инъекции в бластоцисту часто наблюдался вклад в плаценту F4I клеток (50-60%) (данные не представлены). В химерной плаценте F4I клетки, как правило, вносили вклад в ~10% от общего количества плацентарных клеток (фиг. 23С, полосы 1-3; обратите внимание, что контрольные ES клетки не давали никакого существенного плацентарного вклада, полосы 4-6). Эти данные свидетельствуют о том, что STAP клетки характеризуются способностью к получению TS-подобных клеток с помощью воздействия FGF4, по меньшей мере в свете экспрессии маркера трофобласта и плацентарного вклада. Так как этот тип происхождения TS-подобных клеток не имеет ничего общего с ES клетками (если генетически не модифицированы)11, такая способность может представлять собой еще одну особенность STAP клеток, которая отличается от ES клеток.
С другой стороны, полученные из STAP клеток F4I клетки могут также обладать различными характеристиками, отличными от полученных из бластоцист TS клеток. Во-первых, в отличие от обычных TS клеток13, F4I клетки экспрессировали умеренный уровень oct3/4 (данные не представлены). Кроме того, в отличие от TS клеток, введенные в бластоцисты F4I клетки также вносили свой вклад в эмбриональные части (во всех случаях, связанных с химерной плацентой), хотя степень вклада была в целом низкой (данные не представлены).
В совокупности, эти наблюдения показывают, что популяция STAP клеток качественно отличается от ES клеток, по отношению к их способности к плацентарной дифференциации.
Имея это в виду, исследовали дифференциацию в эмбриональную линию, другой тип клеток, присутствующий в бластоцисте. В отличие от ES клеток, STAP клетки характеризовались ограниченной способностью к самообновлению и не могли расширяться из отдельных клеток. STAP клетки не могли поддерживаться в течение более чем 5 пассажей (даже с частичной диссоциационной культурой кластеров) в обычных содержащих LIF средах (включающих в себя среду B27+LIF, используемую в создании STAP клеток). Тем не менее, содержащая АКТГ среда с LIF15 (АКТГ среда, далее) оказывала относительно хорошее поддерживающее влияние на скорость роста колоний STAP клеток (данные не представлены). При культивировании в этой среде на фидере MEF или желатине в среде АКТГ (фиг. 24А) некоторая часть кластеров STAP клеток (обычно находимая в 20-50% лунках в однокластерной культуре с использованием 96-луночных планшетов) продолжала расти (данные не представлены). Эти растущие колонии были аналогичны мышиным ES клеткам и экспрессировали высокий уровень oct3/4::GFP. В отличие от исходных STAP клеток, клетки в этих расширенных колониях после культивирования в этой среде в течение семи дней становились устойчивыми к диссоциации и могли быть пассированы в виде отдельных клеток (данные не представлены). В отличие от STAP клеток, эти измененные клетки могли быть расширены в геометрической прогрессии, по меньшей мере до 120 дней культивирования (фиг. 24В), подобно ES клеткам. Это усиленная способность к экспансии не сопровождалась хромосомной аномалией, как показано с помощью многоцветного FISH анализа16 (данные не представлены). После семидневной экспансии клетки росли и могли поддерживаться в любой из исследуемых сред для ES клеток, в то время как это первоначальная 7-дневная экспансия наиболее эффективно осуществлялась с АКТГ средой (например, колонии образовывались медленно и менее часто в 3i среде17; данные не представлены).
Далее, пролиферативные клетки, полученные из клеток STAP, называют STAP стволовыми клетками. В отличие от STAP клеток, STAP стволовые клетки не производят TS-подобные клетки в культуре с FGF4 (данные не представлены). Через иммунноокрашивание было обнаружено, что Х-хромосомная инактивация18, которая была обнаружена в значительной части женских STAP клеток (ref), больше не наблюдалась в STAP стволовых клетках (данные не представлены). STAP стволовые клетки экспрессировали различные РНК (фиг. 24С) и белковые (данные не представлены) маркеры для ES клеток. Уровни метилирования ДНК в локусах oct3/4 и nanog, которые становятся деметилированными при преобразовании из CD45+ в STAP клетки, оставались на низком уровне (фиг. 24D). В дифференциационной культуре19-21 STAP стволовые клетки производили эктодермальные, мезодермальные и эндодермальные производные (данные не представлены). Эти результаты демонстрируют, что STAP стволовые клетки проявляют особенности, неотличимые от таковых ES клеток.
В соответствии с этим, STAP стволовые клетки, даже после нескольких пассажей, могли образовывать тератомы (данные не приведены) и, путем введения в бластоцисты, эффективно вносить вклад в химерных мышей (данные не приведены). Примечательно, что эффективность STAP стволовых клеток в их эмбриональном вкладе была явно продемонстрирована тем фактом, что в анализе тетраплоидной комплементации5 эти клетки могли дать рождение мышам, способным расти до взрослых и даже производить потомство (данные не представлены). Учитывая, что восемь независимых линий STAP стволовых клеток воспроизводимо показали эту способность (отметим, что такая полная комплементация часто бывает трудна даже с обычно используемыми клеточными линиями ES), мы приходим к выводу, что STAP клетки, которые происходят от взрослых соматических клеток, могут быть привлекательным источником для происхождения линий плюрипотентных стволовых клеток, эквивалентных (или, может быть, лучше) самим бластоцистам в этом аспекте.
Важно отметить, что в отличие от STAP и F4I клеток, STAP стволовые клетки, похоже, потеряли свою способность вносить вклад в плацентарные ткани (данные не представлены), в то время как они давали начало различным тканям в химерами (фиг. 25А-25В). Таким образом, разница между STAP клетками и STAP стволовыми клетками ограничивается не только активностями самообновления, но также включает в себя потерю способности дифференцироваться в плацентарные линии.
Эти результаты указывают на уникальное плюрипотентное состояние STAP клеток. В то время как неспособность клонировать STAP клетки от отдельных клеток (описанных выше) затрудняет анализ коммитированности на уровне одной клетки, стоит отметить, что процедура STAP может конвертировать соматические клетки в популяцию плюрипотентных клеток с возможностью как для эмбриональных, так и плацентарных линий. Глубокое понимание состояния дифференциации STAP клеток представляет собой важную тему для будущего исследования. В частности, будет интересно исследовать, представляют ли собой STAP клетки более незрелое состояние, чем ES клеток, как это было предположено по их способности для плацентарных линий, которая напоминает эмбриональные клетки на стадии морулы. Недавнее исследование показало, что обычная культура ES клеток также содержит очень незначительную популяцию Oct3/4--клеток с характерной особенностью, напоминающей функцию эмбрионов очень ранней стадии22. STAP клетки могут характеризоваться таким же метастабильным состоянием, позволяющим двойную способность, но, в отличие от ES клеток, это обнаруживается в большинстве клеточной популяции.
В настоящем документе показано, что STAP клетки характеризуются способностью к трансформации в подобные ES плюрипотентные стволовые клеточные линии. Стоит отметить, что STAP клетки (от самок мышей) представляют собой что-то типа мозаики в инактивации Х-хромосомы; инактивация исчезает в ~40% STAP клеток4, в то время как остальные ее поддерживают. В ES-клетках, напротив, обе X-хромосомы воспроизводимо активированы. Интересно, что после образования STAP "стволовые" клетки не показывают инактивации Х-хромосомы, подобно ES клеткам, предполагая, что эпигенетический контроль в исходных STAP клетках похож, но не идентичен ES клеткам мыши, и в этом смысле.
Представленные результаты показывают неожиданную "спонтанную способность к преобразованию" коммитированных соматических клеток репрограммировать свою судьбу в наивные клетки при воздействии сублетальными раздражителями. Это вызывает многочисленные интригующие и глубокие биологические вопросы, включая те, которые описаны выше. На верхушке их - это недавно обнаруженное STAP явление может революционизировать методологии в медицине с применением стволовых клеток. Предполагается, что получение различных типов тканей может быть разрешено управляемой дифференциацией из STAP клеток или STAP стволовых клеток, которые представляют собой производные от соматических клеток без генного переноса (которое может повысить риск злокачественной трансформации). Кроме того, в отличие от преобразования iPS клеток, преобразование STAP происходит со значительно более высокой частотой и проходит с помощью некоторых эндогенных программ, которые запускаются сильными раздражителями, такими как воздействие низким значением рН. Поскольку STAP стволовые клетки, подобно ES клеткам, легко способны к экспансии и клонированию, они были бы более подходящими, чем STAP клетки, для крупномасштабного производства медицински полезных тканей под строгим контролем качества. В предварительном исследовании авторов настоящего изобретения, авторам настоящего изобретения удалось показать эффективную дифференциацию STAP стволовых клеток в ретинальные предшественники23, кортикальные предшественники24 и ритмически сокращающиеся кардиомиоциты25 (данные не представлены).
Способы
Культивирование клеток. STAP клетки получали из CD45+-клеток с помощью временного воздействия раствором с низким рН с последующим культивированием в среде В27+LIF (Obokata et al, 2013; представили совместно). Для создания F4I клеточной линии, кластеры STAP клеток переносили в содержащую FGF4 среду TS на фидерных клетках MEF в 96-луночных планшетах. Клетки подвергали первому пассажу на протяжении d7-d10 с использованием обычного трипсинового способа. Для создания STAP стволовых (STAPS) клеточных линий, сферы STAP переносили в содержащую АКТГ среду на фидер MEF или покрытую желатином чашку. Через четыре-семь дней клетки подвергали первому пассажу с использованием обычного трипсинового способа, и суспендированные клетки высевали в поддерживающую ES среду, содержащую 5% FCS и 1% KSR.
Получение и анализ химерных мышей. Для введения STAP стволовых клеток, F4I клеток и ES клеток использовали обычный способ инъекции в бластоцисты. Для инъекции STAP клеток, кластеры STAP клеток вводили целиком, так как воздействие трипсином вызывало низкий химеризм. Сферические колонии STAP разрезали на маленькие кусочки с помощью микроножа под микроскопом, затем небольшие кластеры STAP колонии вводили на 4,5 день бластоцисты с помощью большой пипетки. На следующий день химерные бластоцисты переносили в псевдобеременных самок в день 2,5. Тетраплоидные эмбрионы производили электрослиянием 2-клеточных эмбрионов.
Анализ дифференциации in vitro и in vivo: Образование тератомы исследовали с помощью инъецирования 1×105 клеток STAPS подкожно в дорсальную боковую часть 4-недельных NOD/SCID мышей. Нейральную дифференциацию in vitro индуцировали с помощью способов SDIA и SFEBq24,26. Эндомезодермальную дифференцицию25 in vitro индуцировали с помощью культивирования агрегата STAPS клеток с факторами роста (активин) или 10% FCS.
Анализ кариотипа. Субконфлюентные STAPS клетки останавливали в метафазе с помощью колцемида и подвергали многоцветному FISH анализу (M-FISH). Специфичные к мышиной хромосоме окрашенные зонды помечали с использованием семи различных флуорохромов и гибридизовали, как описано ранее (Jentsch et al., 2003).
Культивирование клеток. STAP клетки получали из CD45+-клеток с последующим культивированием в среде В27+LIF в течение 7 дней (Obokata et al, 2013; совместно представили). Для создания F4I клеточной линии, кластеры STAP клеток переносили в содержащую FGF4 среду TS на фидерных клетках MEF в 96-луночных планшетах. Клетки подвергали первому пассажу на протяжении d7-d10 с использованием обычного трипсинового способа. Последующие пассажи выполняли каждый третий день.
Для создания STAP стволовых (STAPS) клеточных линий, сферы STAP переносили в содержащую АКТГ среду на фидерные клетки MEF. Через четыре-семь дней клетки подвергали первому пассажу с использованием обычного трипсинового способа, и суспендированные клетки высевали в поддерживающую ES среду, содержащую 5% FCS и 1% KSR. Последующие пассажи выполняли каждый второй день.
Получение и анализ химерных мышей. Для получения диплоидных и тетраплоидных химер диплоидные эмбрионы получали от самок линии ICR, скрещенных с самцами ICR, а тетраплоидные эмбрионы получали от самок линии BDF1, скрещенных с самцами BDF1. Тетраплоидные эмбрионы производили электрослиянием 2-клеточных эмбрионов. Для введения STAP стволовых клеток, F4I клеток и ES клеток использовали обычный способ инъекции в бластоцисты. Для инъекции STAP клеток, кластеры STAP клеток вводили целиком, так как воздействие трипсином вызывало низкий химеризм. Сферические колонии STAP разрезали на маленькие кусочки с использованием микроножа под микроскопом, затем небольшие кластеры STAP колонии вводили на 4,5 день бластоцисты с помощью большой пипетки. На следующий день химерные бластоцисты переносили в псевдобеременных самок на 2,5 день.
Анализ дифференциации in vitro и in vivo: 1×105 клеток STAP-S вводили подкожно в дорсальные боковые части 4-недельных NOD/SCID мышей. Через шесть недель имплантаты собирали и гистологически анализировали. Имплантаты фиксировали с 10% формальдегидом, заливали в парафин и обычно приводили к толщине 4 мкм. Срезы окрашивали гематоксилином и эозином.
Нейральную дифференциацию in vitro индуцировали с помощью способов SDIA и SFEBq. Эндомезодермальную дифференцицию in vitro индуцировали с помощью культивирования агрегата STAPS клеток с факторами роста (активин) или 10% FCS.
Иммуноокрашивание. Клетки фиксировали в 4% PFA в течение 15 мин, пермеабилизировали с 0,5% тритоном Х-100 и затем инкубировали с первичными антителами: к H3K27me3 (Millipore, 1:300), к Oct3/4 (Santa Cruz Biotechnology, 1:300), к Nanog (eBioscience; 1:300), к KLF2/4 (R&D System; 1:300) и к Esrrβ (R&D System; 1:300). После инкубации в течение ночи связанные антитела визуализировали со вторичным антителом, конъюгированным с Alexa546 (Molecular Probes). Ядра окрашивали DAPI (Molecular Probes).
Получение РНК и анализ ОТ-ПЦР. РНК выделяли с RNeasy™ Mini kit (QIAGEN). Обратную транскрипцию проводили с помощью набора SupeSACript III First Strand Synthesis (Invitrogen). Power SYBR™ Green Mix (Roche Diagnostics) использовали для ПЦР-амплификации, и образцы разгоняли на приборе LightCycler-II™ (Roche Diagnostics).
Анализ кариотипа. Анализ кариотипа выполняли с помощью многоцветного анализа FISH (M-FISH). Субконфлюентные STAPS клетки останавливали в метафазе с помощью колцемида (конечная концентрация 0,270 мкг/мл) в культуральной среде в течение 2,5 ч при 37°С в 5% СО2. Клетки промывали PBS, обрабатывали трипсином/этилендиаминтетрауксусной кислотой (ЭДТА), ресуспендировали в среде клеток и центрифугировали в течение 5 мин при 1200 оборотах в минуту. К клеточному осадку в 3 мл PBS, добавляли 7 мл нагретого гипотонического раствора 0,0375 М КС1. Клетки инкубировали в течение 20 мин при 37°С. Клетки центрифугировали в течение 5 мин при 1200 оборотах в минуту и осадок ресуспендировали в 3-5 мл 0,0375 М раствора КС1. Клетки фиксировали смесью метанол/уксусная кислота (3:1; об/об) аккуратным пипетированием. Фиксацию проводили четыре раза до распространения клеток на покровных стеклах. Для процедуры FISH, специфичные к мышиной хромосоме окрашенные зонды помечали с использованием семи различных флуорохромов и гибридизовали, как описано ранее (Jentsch et al., 2003). Для каждой клеточной линии, 9-15 метафазных распространений обнаруживали с помощью эпифлуоресцентного микроскопа Leica DM RXA RF8 (Leica Mikrosysteme GmbH, Bensheim, Germany), оснащенного камерой Sensys CCD (Photometries, Tucson, AZ). Камера и микроскоп контролировались программным обеспечением Q-FISH Leica (Leica Microsystems hanging solutions, Cambridge, United Kingdom). Метафазные распространения обрабатывали на основе программного обеспечения Leica МСК и представляли в виде многоцветных кариограм.
Бисульфитное секвенирование.
Геномную ДНК экстрагировали из клеток STAPS. Бисульфитное воздействие на ДНК проводили с использованием набора CpGenome DNA Modification (CHEMICON, Temecula, CA, http://www.chemicon.com) в соответствии с инструкциями изготовителя.
Полученную в результате модифицированную ДНК амплифицировали с помощью вложенной полимеразной цепной реакции с использованием двух прямых (F) праймеров и одного обратного (R) праймера: oct3/4 (F1, GTTGTTTTGTTTTGGTTTTGGATAT (SEQ ID NO: 73); F2, ATGGGTTGAAATATTGGGTTTATTTA (SEQ ID NO: 74); R, CCACCCTCTAACCTTAACCTCTAAC (SEQ ID NO: 75)). И nanog (F1, GAGGATGTTTTTTAAGTTTTTTTT (SEQ ID NO: 76); F2, AATGTTTATGGTGGATTTTGTAGGT (SEQ ID NO: 77); R, CCCACACTCATATCAATATAATAAC (SEQ ID NO: 78)). ПЦР проводили с использованием версии TaKaRa Ex Taq Hot Start (RR030A). Секвенирование ДНК проводили с использованием праймера М13 в Genome Resource and Analysis Unit, RIKEN CDB.
References
1. Gurdon, JB. The developmental capacity of nuclei taken from intestinal epithelium cells of feeding tadpoles. J Embryol Exp Morphol. 10, 622-640 (1962)
2. Wakayama, Т., Perry, А.С, Zuccotti, M., Johnson, K.R. & Yanagimachi, R. Full-term development of mice from enucleated oocytes injected with cumulus cell nuclei. Nature 394, 369-374 (1998).
3. Takahashi, K. & Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell 126, 663-676 (2006).
4. Obokata et al, Stimulus-Triggered Fate Conversion of Somatic Cells into Pluripotency. Co-submitted to this manuscript.
5. Nagy, A., Rossant, J., Nagy, R., Abramow-Newerly, W. & Roder, J.C. Derivation of completely cell culture-derived mice from early-passage embryonic stem cells. Proc Nation Acad Sci USA 90, 8424-8428 (1993).
6. Ohgushi, M. and Sasai, Y. Lonely death dance of human pluripotent stem cells: ROCKing between metastable cell states. Trends in Cell Biology 21, 274-282 (2011).
7. Niwa, H. How is pluripotency determined and maintained? Development 134, 635-646 (2007)
8. Quinn J, Kunath T, Rossant J. Mouse trophoblast stem cells. Methods Mol Med. 121, 125-148 (2006).
9. Rossant J. Stem cells and lineage development in the mammalian blastocyst. Reprod FertilDev. 19, 111-8 (2007)
10. Tanaka TS, Kunath T, Kimber WL, Jaradat SA, Stagg CA, Usuda M, Yokota T, Niwa H, Rossant J, Ko MS. Gene expression profiling of embryo-derived stem cells reveals candidate genes associated with pluripotency and lineage specificity. Genome Res. 12, 1921-1928 (2002)
11. Klaffky E, Williams R, Yao CC, Ziober B, Kramer R, Sutherland A. Trophoblast-specific expression and function of the integrin alpha 7 subunit in the peri-implantation mouse embryo. Dev Biol. 239, 161-175 (2001).
12. Russ AP, Wattler S, Colledge WH, Aparicio SA, Carlton MB, Pearce JJ, Barton SC, Surani MA, Ryan K, Nehls MC, Wilson V, Evans MJ. Eomesodermin is required for mouse trophoblast development and mesoderm formation. Nature 404, 95-99 (2000).
13. Niwa H, Toyooka Y, Shimosato D, Strumpf D, Takahashi K, Yagi R, Rossant J. Interaction between Oct3/4 and Cdx2 determines trophectoderm differentiation. Cell 123, 917-929 (2005)
14. Toyooka Y, Shimosato D, Murakami K, Takahashi K, Niwa H. Identification and characterization of subpopulations in undifferentiated ES cell culture. Development 135, 909-918 (2008).
15. Ogawa, K., Matsui, H., Ohtsuka, S. & Niwa, H. A novel mechanism for regulating clonal propagation of mouse ES cells. Genes to cells 9, 471-477 (2004).
16. Jentsch I, Geigl J, Klein CA, Speicher MR. Seven-fluorochrome mouse M-FISH for high-resolution analysis of interchromosomal rearrangements. Cytogenet Genome Res. 103, 84-88 (2003),
17. Ying, Q.L. et al. The ground state of embryonic stem cell self-renewal. Nature 453, 519-523 (2008).
18. Murakami K, Araki K, Ohtsuka S, Wakayama T, Niwa H. Choice of random rather than imprinted X inactivation in female embryonic stem cell-derived extra-embryonic cells. Development 138, 197-202 (2011).
19. Watanabe, K., Kamiya, D., Nishiyama, A., Katayama, Т., Nozaki, S., Kawasaki, H., Mizuseki, K., Watanabe, Y., and Sasai, Y. (2005) Directed differentiation of telencephalic precursors from embryonic stem cells. Nature Neurosci. 8, 288-296
20. Kawasaki, H., Mizuseki, K., Nishikawa, S., Kaneko, S., Kuwana, Y., Nakanishi, S., Nishikawa, S.-I. and Sasai, Y. (2000) Induction of midbrain dopaminergic neurons from ES cells by Stromal Cell-Derived Inducing Activity. Neuron 28, 31-40.
21. Gouon-Evans V, Boussemart L, Gadue P, Nierhoff D, Koehler CI, Kubo A, Shafritz DA, Keller G. (2006) BMP-4 is required for hepatic specification of mouse embryonic stem cell-derived definitive endoderm. Nat Biotechnol. 24, 1402-1411.
22. Macfarlan TS, Gifford WD, Driscoll S, Lettieri K, Rowe HM, Bonanomi D, Firth A, Singer O, Trono D, Pfaff SL. Embryonic stem cell potency fluctuates with endogenous retrovirus activity. Nature 487, 57-63 (2012).
23. Eiraku, M., Takata, N., Ishibashi, H., Kawada, M., Sakakura, E., Okuda, S., Sekiguchi, K., Adachi, T. and Sasai, Y. (2011) Self-organizing optic-cup morphogenesis in three-dimensional culture. Nature 472, 51-56.
24. Eiraku, M, Watanabe, K., Matsuo-Takasaki, M., Kawada, M., Yonemura, S., Matsumura, M., Wataya, Т., Nishiyama, A., Muguruma, K. and Sasai, Y. (2008) Self-Organized Formation of Polarized Cortical Tissues from ES cells and its Active Manipulation by Extrinsic Signals. Cell Stem Cell 3, 519-532
25. Boheler KR, Czyz J, Tweedie D, Yang HT, Anisimov SV, Wobus AM. Differentiation of pluripotent embryonic stem cells into cardiomyocytes. Circ Res. 91, 189-201 (2002).
26. Kawasaki, H., Mizuseki, K., Nishikawa, S., Kaneko, S., Kuwana, Y., Nakanishi, S., Nishikawa, S.-I. and Sasai, Y. Induction of midbrain dopaminergic neurons from ES cells by Stromal Cell-Derived Inducing Activity. Neuron 28, 31-40 (2000)

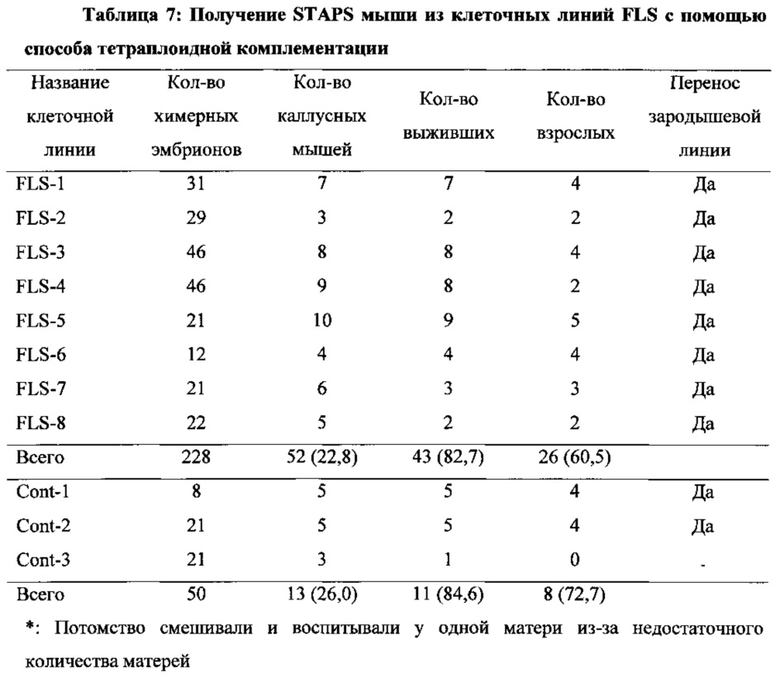
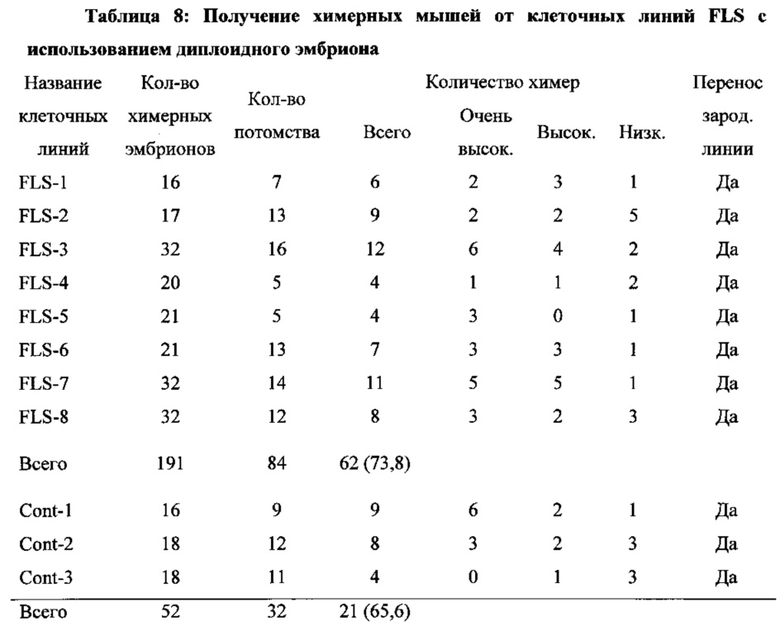
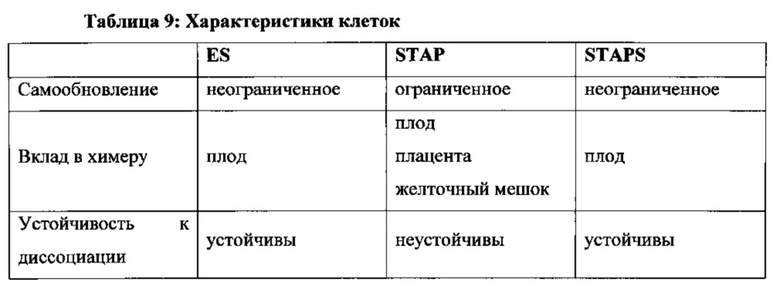
Перечень последовательностей
<110> VACANTI, CHARLES A.
VACANTI, MARTIN P.
KOJIMA, KOJI
OBOKATA, HARUKO
WAKAYAMA, TERUHIKO
SASAI, YOSHIKI
YAMATO, MASAYUKI
<120> ПОЛУЧЕНИЕ ПЛЮРИПОТЕНТНЫХ КЛЕТОК DE NOVO
<130> 043214-071763-US
<140>
<141>
<150> PCT/US13/37996
<151> 2013-04-24
<150> 61/779,533
<151> 2013-03-13
<150> 61/637,631
<151> 2012-04-24
<160> 90
<170> PatentIn version 3.5
<210> 1
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 1
gttgttttgt tttggttttg gatat 25
<210> 2
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 2
atgggttgaa atattgggtt tattta 26
<210> 3
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 3
ccaccctcta accttaacct ctaac 25
<210> 4
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 4
gaggatgttt tttaagtttt tttt 24
<210> 5
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 5
aatgtttatg gtggattttg taggt 25
<210> 6
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 6
cccacactca tatcaatata ataac 25
<210> 7
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 7
gtcatccttg atctgcccct 20
<210> 8
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 8
ggtacttacg atgcccagca 20
<210> 9
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 9
ccctgaatat ccctctgct 19
<210> 10
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 10
agatggctac atctctcggt 20
<210> 11
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 11
cactctggac ttggagatgc 20
<210> 12
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 12
cttgtcgttg gtgatggtga 20
<210> 13
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 13
gttgaagcag ttaatatggc 20
<210> 14
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 14
agatgagacc aacctggacc 20
<210> 15
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 15
aggtggagat catcgccaac 20
<210> 16
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 16
cgttgaattt gccgtgagtg 20
<210> 17
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 17
attgccaagt cgttctacga 20
<210> 18
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 18
aggtcgctta cagattgctg 20
<210> 19
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 19
gtctctttag aaaagtgtga 20
<210> 20
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 20
tacagctttc ttcctggcca 20
<210> 21
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 21
atgtcagcct tgtggaaatt 20
<210> 22
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 22
gtctgacaga ccaataccat 20
<210> 23
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 23
aacggctgcg tggtgaagcg 20
<210> 24
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 24
ggacctccct tagagaggga 20
<210> 25
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 25
acagtgcctt caggttagtc 20
<210> 26
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 26
gcatacaaag aagctgtgag 20
<210> 27
<211> 22
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 27
tctttccacc aggcccccgg ct 22
<210> 28
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 28
tgtggggccc tgaaaggcga gctgagat 28
<210> 29
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 29
gaagtctggt tccttggcag gatg 24
<210> 30
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 30
caggtgtttg agggtagctc 20
<210> 31
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 31
actgcccctc atcagactgc tact 24
<210> 32
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 32
gttccaacct gtgcctcgcg tctt 24
<210> 33
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 33
cgtggtgagc atcttcggag tgg 23
<210> 34
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 34
acgagtggca gtttcttctt ggga 24
<210> 35
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 35
atggacgcaa ctgtgaacat gatgttcgca 30
<210> 36
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 36
tgctgcggtc caggccatca agag 24
<210> 37
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 37
tagagctaga ctccgggcga tga 23
<210> 38
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 38
gcgaactcac acaggcgaga aacc 24
<210> 39
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 39
gctgtgtctc aggggattgt 20
<210> 40
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 40
gagacgacct gctacacctg 20
<210> 41
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 41
tccctacctg actgcttacg 20
<210> 42
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 42
tatgtctgct cgtacccctt 20
<210> 43
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 43
tcagacctcg gttcatcttc 20
<210> 44
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 44
cttggacctt cgaaggacga 20
<210> 45
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 45
tcaaagcgca gaccacctcg 20
<210> 46
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 46
gcatgtcgtc cgcagtaact 20
<210> 47
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 47
tcgacttcgt cttgttcggt 20
<210> 48
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 48
tctacctgtt ccgcgtctag 20
<210> 49
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 49
tggtgaaggt cggtgtgaac 20
<210> 50
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 50
gtaggacaga aacggatgga 20
<210> 51
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 51
gtgtcgatcg ttcttcact 19
<210> 52
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 52
attgcagctg caaatccctg 20
<210> 53
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 53
tacgattcac ggaccgtgcc 20
<210> 54
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 54
aacgataact gatccctggg 20
<210> 55
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 55
cagttctacc tgtaggacag 20
<210> 56
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 56
cctccttcca ggtctccgga 20
<210> 57
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 57
agcatgccag ccagagtcac t 21
<210> 58
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 58
actccaatct gagcaagacc 20
<210> 59
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 59
gttatatgct gaacgaggtc 20
<210> 60
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 60
tgcgggcgga catggggaga tcc 23
<210> 61
<211> 28
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 61
atgggccgcc atacgacgac gctcaact 28
<210> 62
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 62
actcgataca ctggcctagc 20
<210> 63
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 63
cggttcatca tggtacagtc 20
<210> 64
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 64
cactgccttg tactcgggta gctg 24
<210> 65
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 65
agcgaggcat ggagagagcg gagcag 26
<210> 66
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 66
ccttcttggt ccgcccgttc tta 23
<210> 67
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 67
tatgactcac ttccaggggg cact 24
<210> 68
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 68
ctttgaggtc ctggtccatc acgtgaccat 30
<210> 69
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 69
gggcactgtt cagttcagcg gatc 24
<210> 70
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 70
ttgccttaaa caagaccacg aaa 23
<210> 71
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 71
tcgcttcctc ttcctccgac aca 23
<210> 72
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 72
cactctcggc ctgtcttttc 20
<210> 73
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 73
gttgttttgt tttggttttg gatat 25
<210> 74
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 74
atgggttgaa atattgggtt tattta 26
<210> 75
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 75
ccaccctcta accttaacct ctaac 25
<210> 76
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 76
gaggatgttt tttaagtttt tttt 24
<210> 77
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 77
aatgtttatg gtggattttg taggt 25
<210> 78
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 78
cccacactca tatcaatata ataac 25
<210> 79
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 79
gttgttttgt tttggttttg gatat 25
<210> 80
<211> 26
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 80
atgggttgaa atattgggtt tattta 26
<210> 81
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 81
ccaccctcta accttaacct ctaac 25
<210> 82
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 82
gaggatgttt tttaagtttt tttt 24
<210> 83
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 83
aatgtttatg gtggattttg taggt 25
<210> 84
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 84
cccacactca tatcaatata ataac 25
<210> 85
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 85
gcacctgtgg ggaagaaact 20
<210> 86
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 86
tgagagctgt ctcctactat cgatt 25
<210> 87
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 87
agaactggga ccactccagt g 21
<210> 88
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 88
ttcaccctct ccactgacag atct 24
<210> 89
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 89
ctaggccaca gaattgaaag atct 24
<210> 90
<211> 25
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 90
gtaggtggaa attctagcat catcc 25
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ, ОТНОСЯЩИЕСЯ К ПЛЮРИПОТЕНТНЫМ КЛЕТКАМ | 2015 |
|
RU2711942C2 |
| ДОСТАВКА, КОНСТРУИРОВАНИЕ И ОПТИМИЗАЦИЯ СИСТЕМ, СПОСОБОВ И КОМПОЗИЦИЙ ДЛЯ МАНИПУЛЯЦИИ С ПОСЛЕДОВАТЕЛЬНОСТЯМИ И ПРИМЕНЕНИЯ В ТЕРАПИИ | 2013 |
|
RU2721275C2 |
| КОМПОНЕНТЫ СИСТЕМЫ CRISPR-CAS, СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ МАНИПУЛЯЦИИ С ПОСЛЕДОВАТЕЛЬНОСТЯМИ | 2013 |
|
RU2796549C2 |
| ДНК-СОДЕРЖАЩИЕ ПОЛИНУКЛЕОТИДЫ И РУКОВОДЯЩИЕ ПОСЛЕДОВАТЕЛЬНОСТИ ДЛЯ СИСТЕМ CRISPR ТИПА V И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2832314C1 |
| ГЕНОМНАЯ ИНЖЕНЕРИЯ | 2014 |
|
RU2764757C2 |
| ГЕНОМНАЯ ИНЖЕНЕРИЯ | 2021 |
|
RU2812848C2 |
| СИСТЕМЫ CRISPR-CAS И СПОСОБЫ ИЗМЕНЕНИЯ ЭКСПРЕССИИ ПРОДУКТОВ ГЕНОВ | 2013 |
|
RU2796273C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2841244C2 |
| КОНСТРУИРОВАНИЕ СИСТЕМ, СПОСОБЫ И ОПТИМИЗИРОВАННЫЕ НАПРАВЛЯЮЩИЕ КОМПОЗИЦИИ ДЛЯ МАНИПУЛЯЦИИ С ПОСЛЕДОВАТЕЛЬНОСТЯМИ | 2013 |
|
RU2796017C2 |
| ГУМАНИЗИРОВАННЫЕ M-CSF МЫШИ | 2012 |
|
RU2730643C2 |








































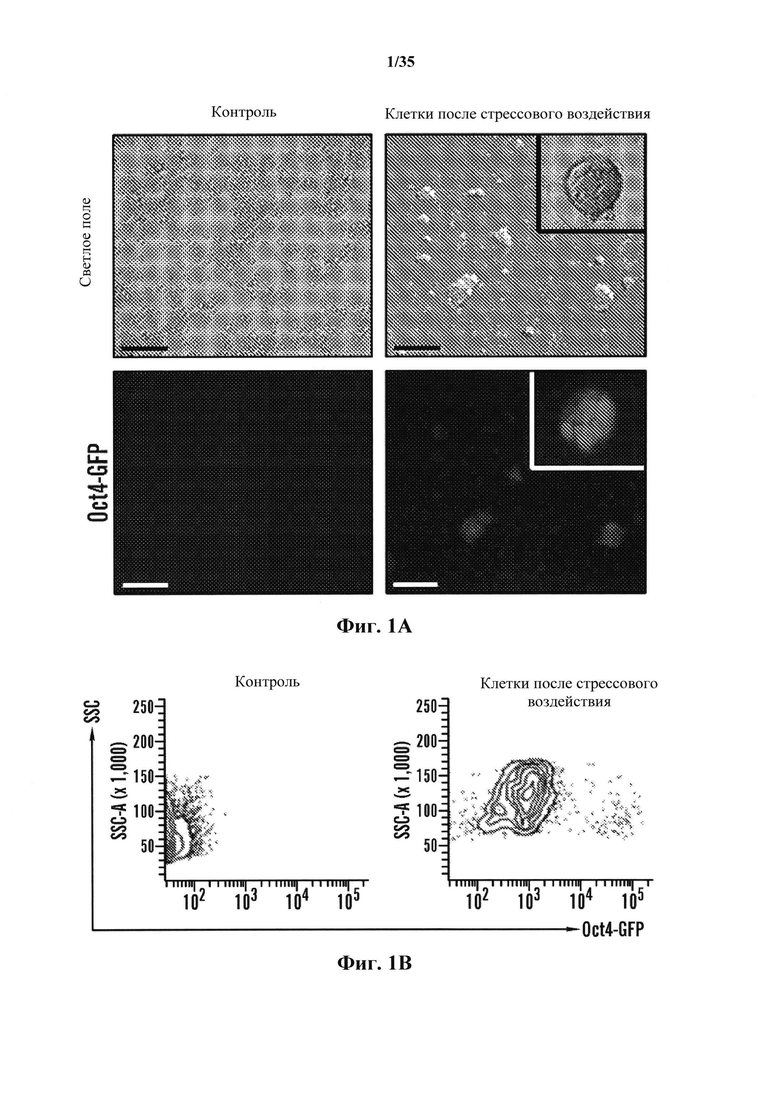
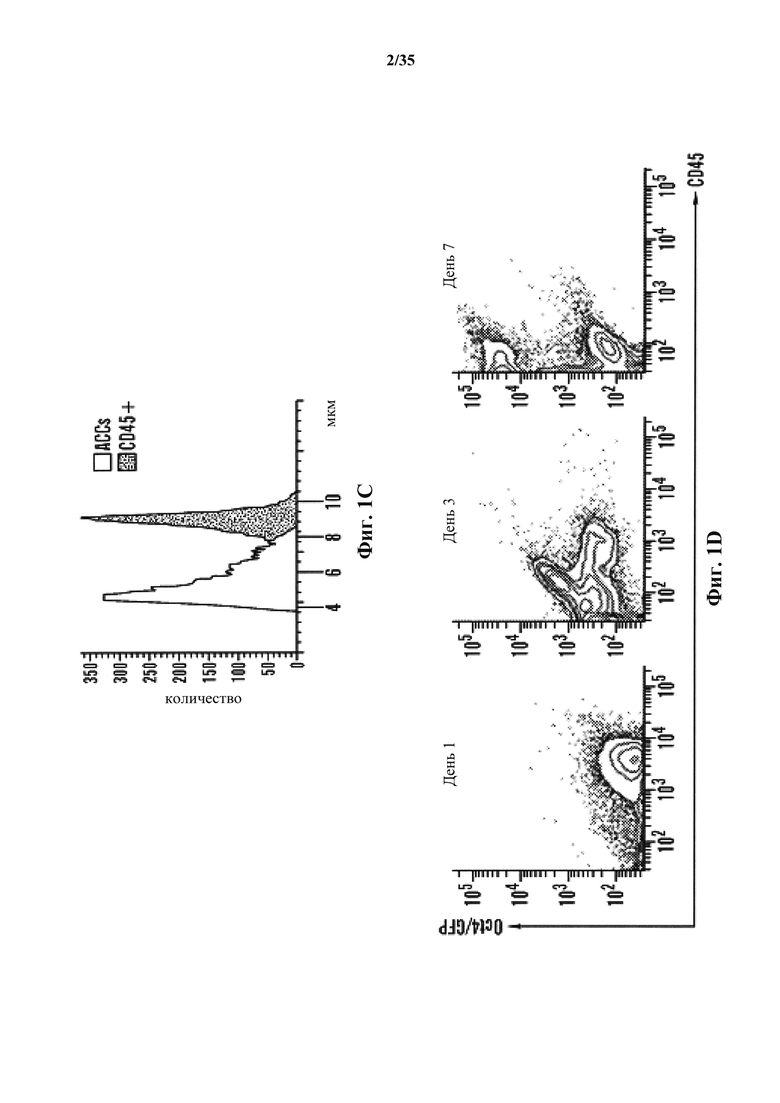
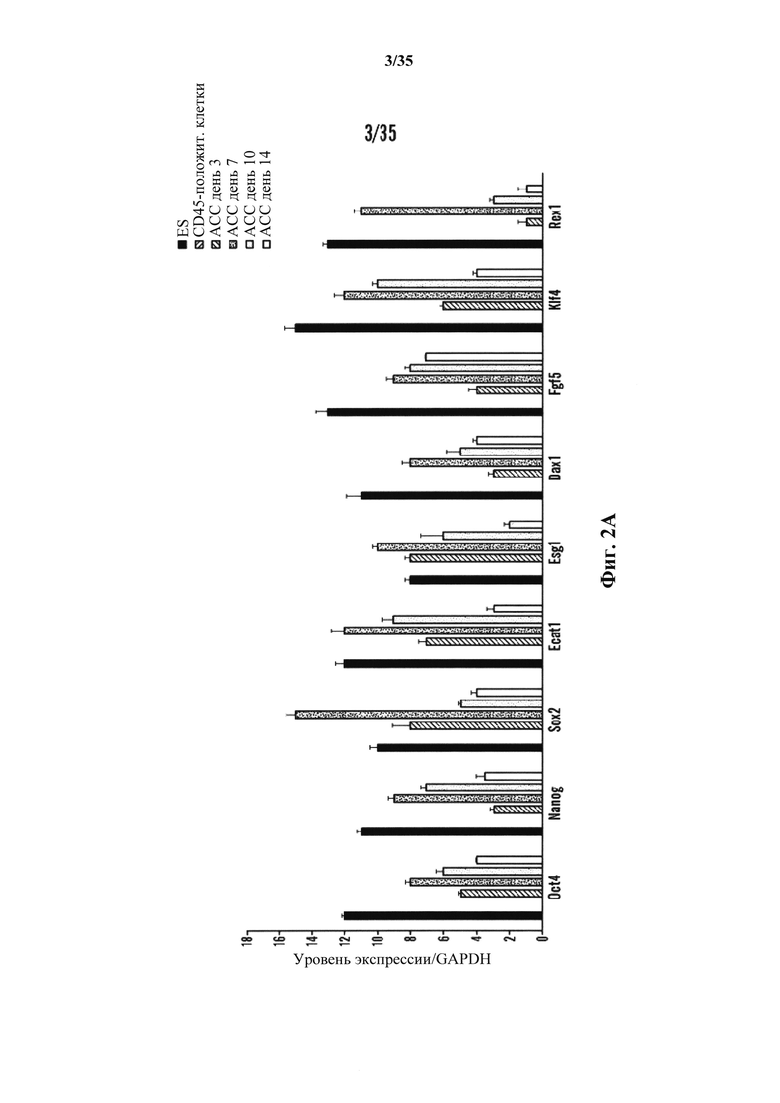
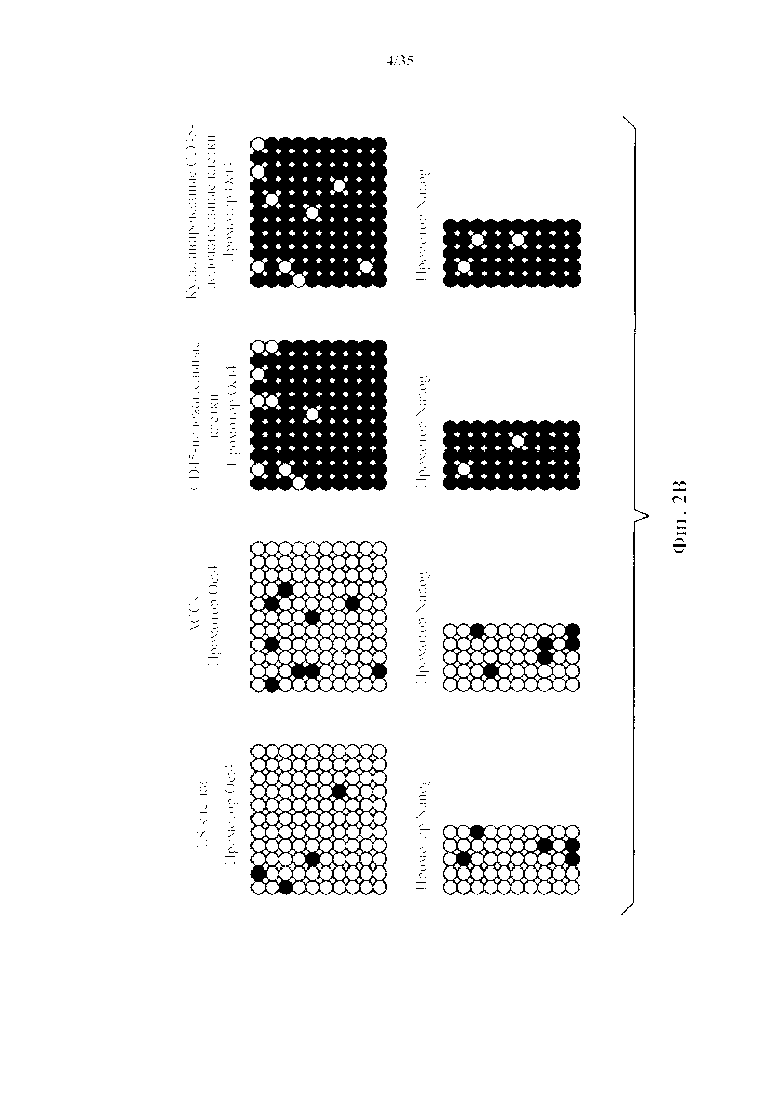

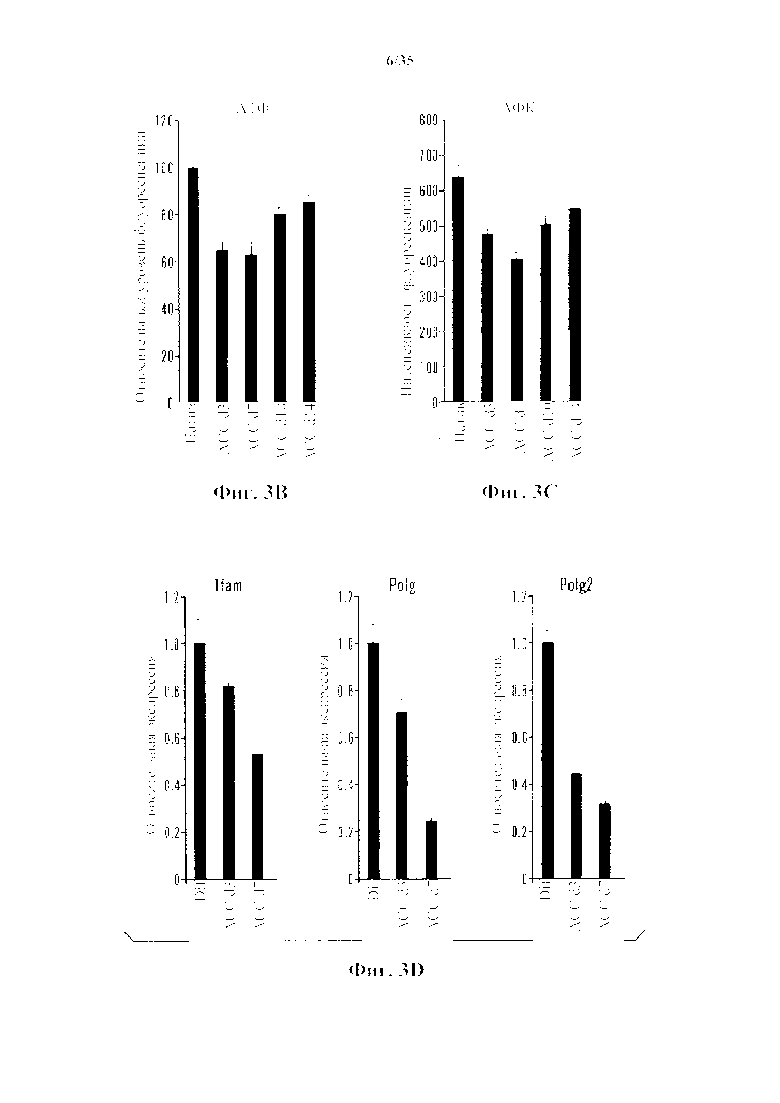
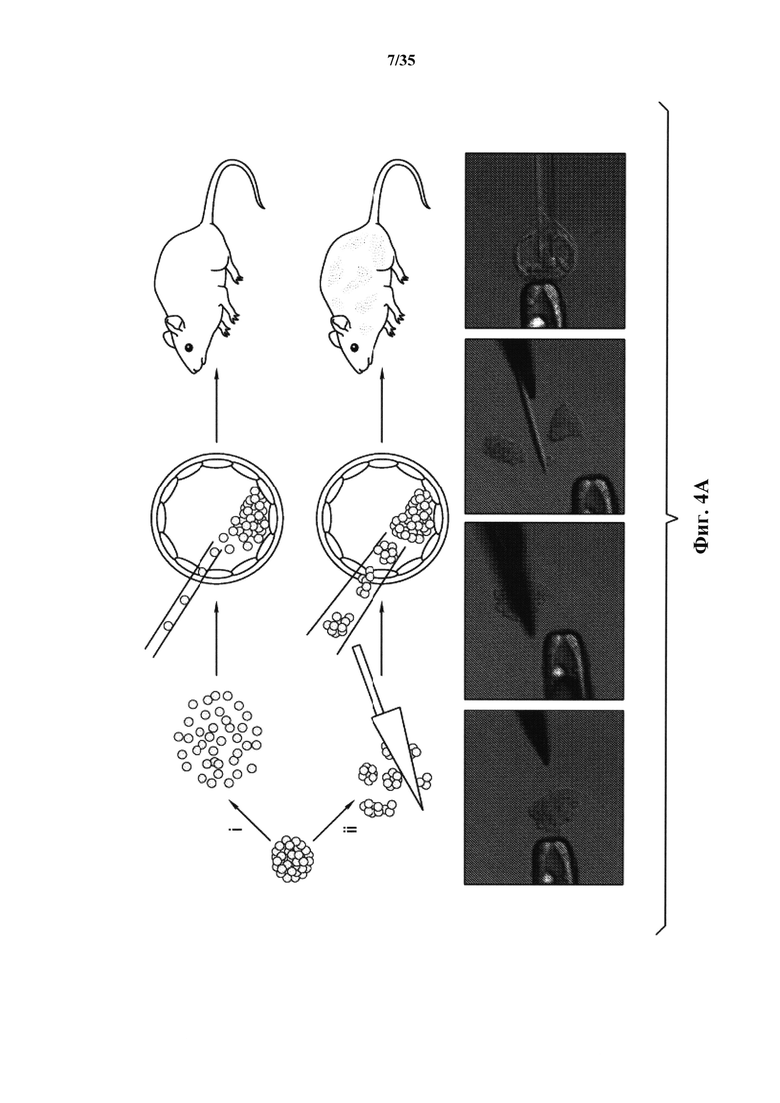
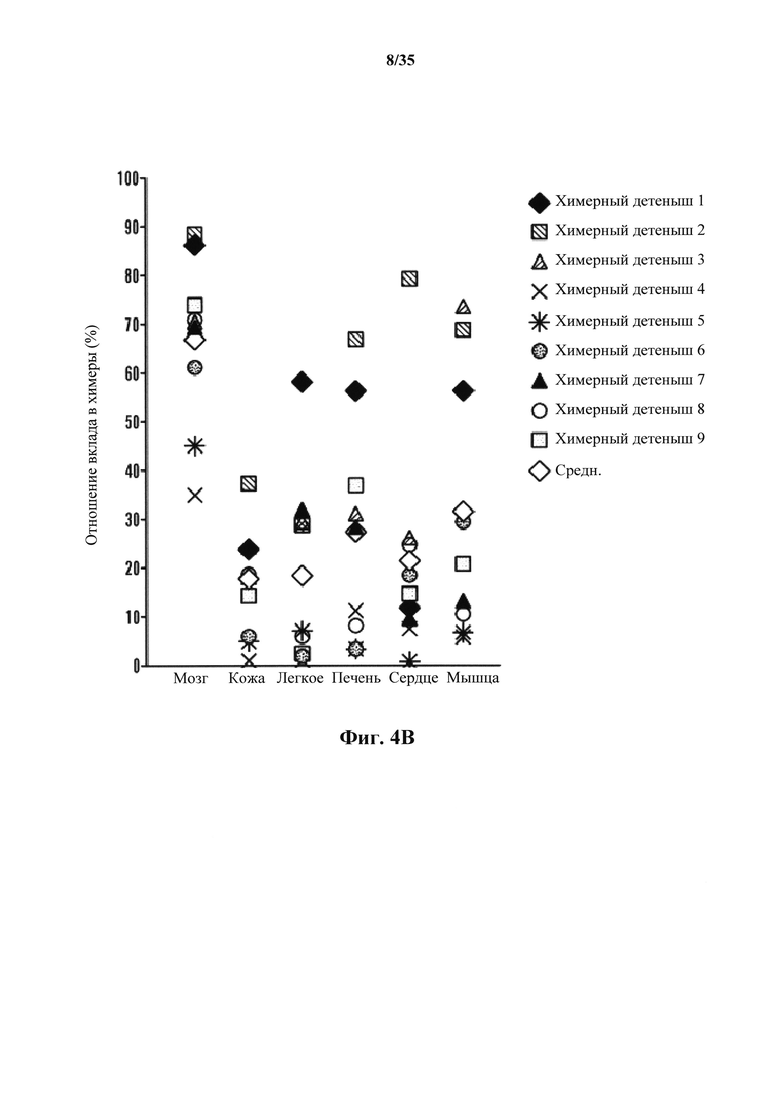
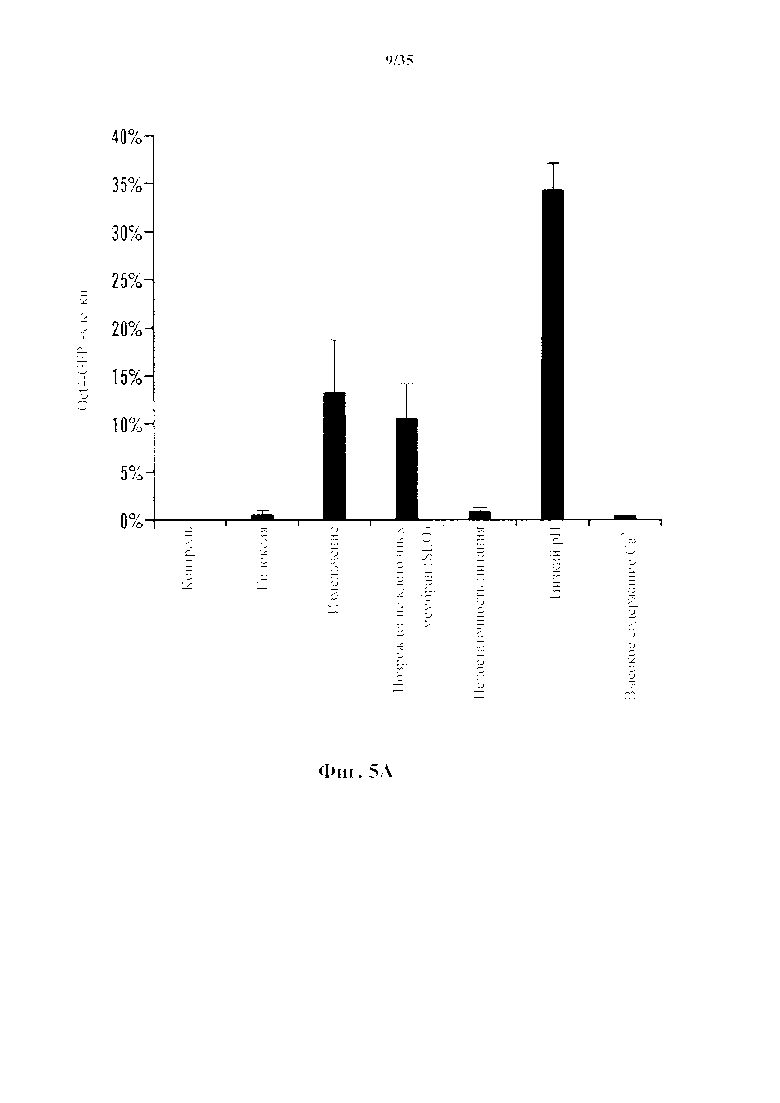
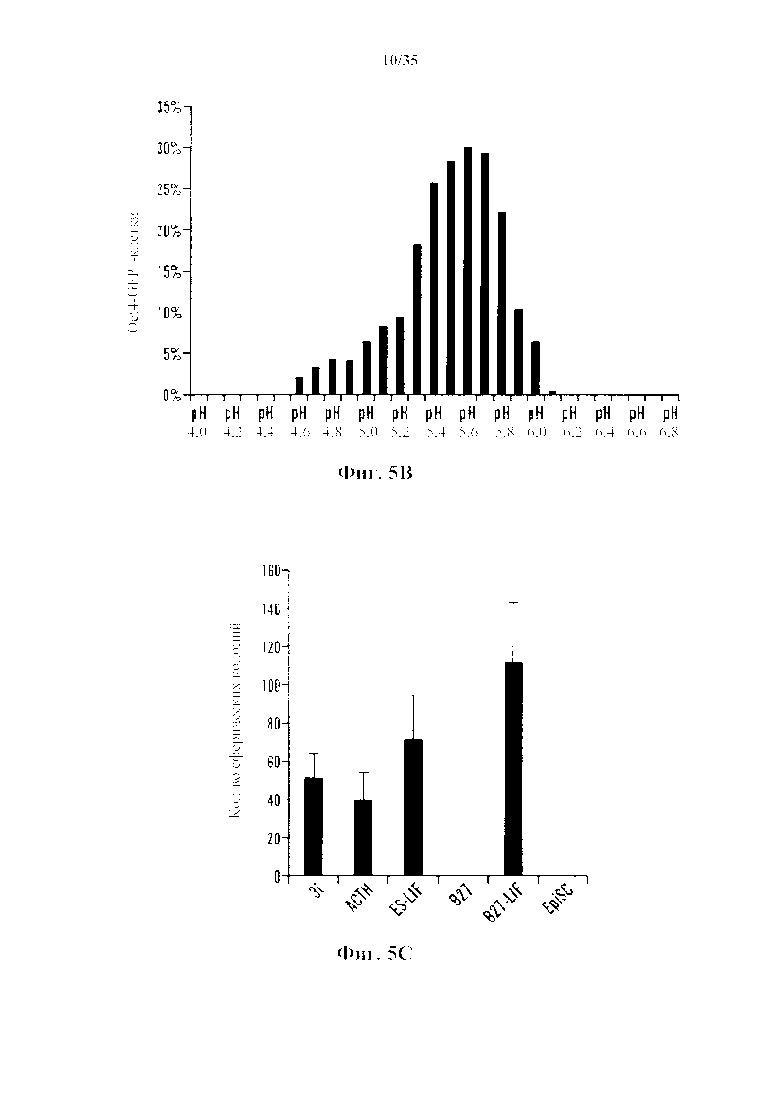
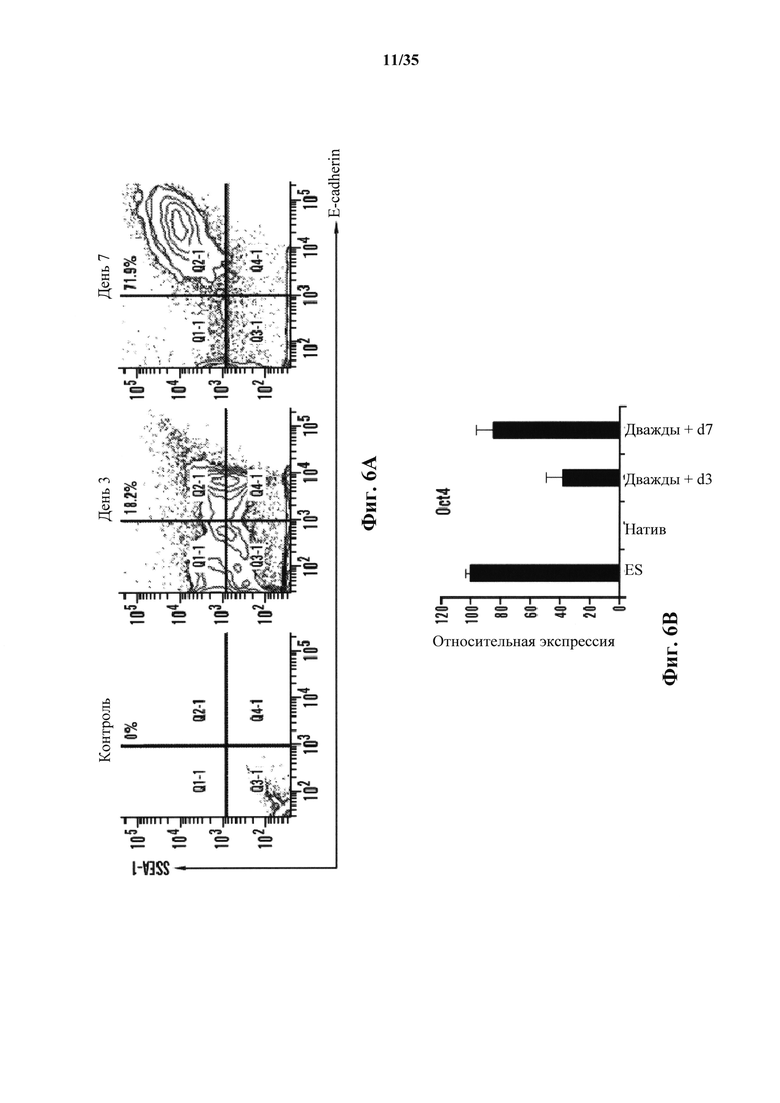
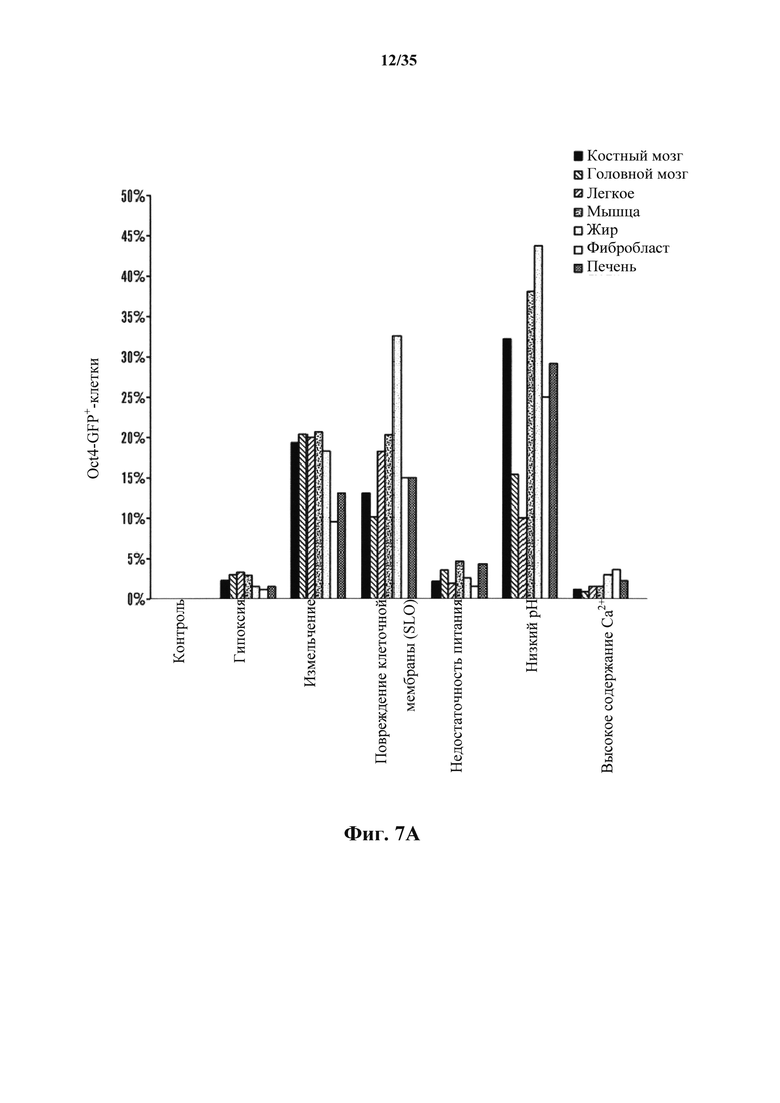
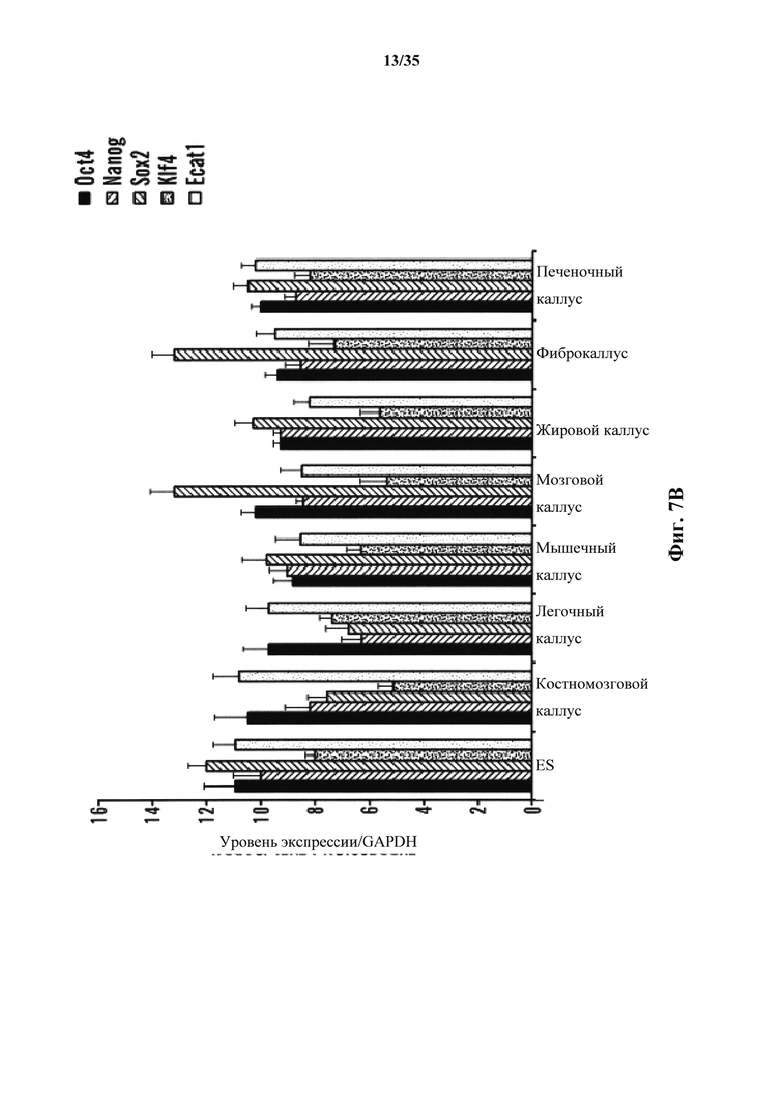
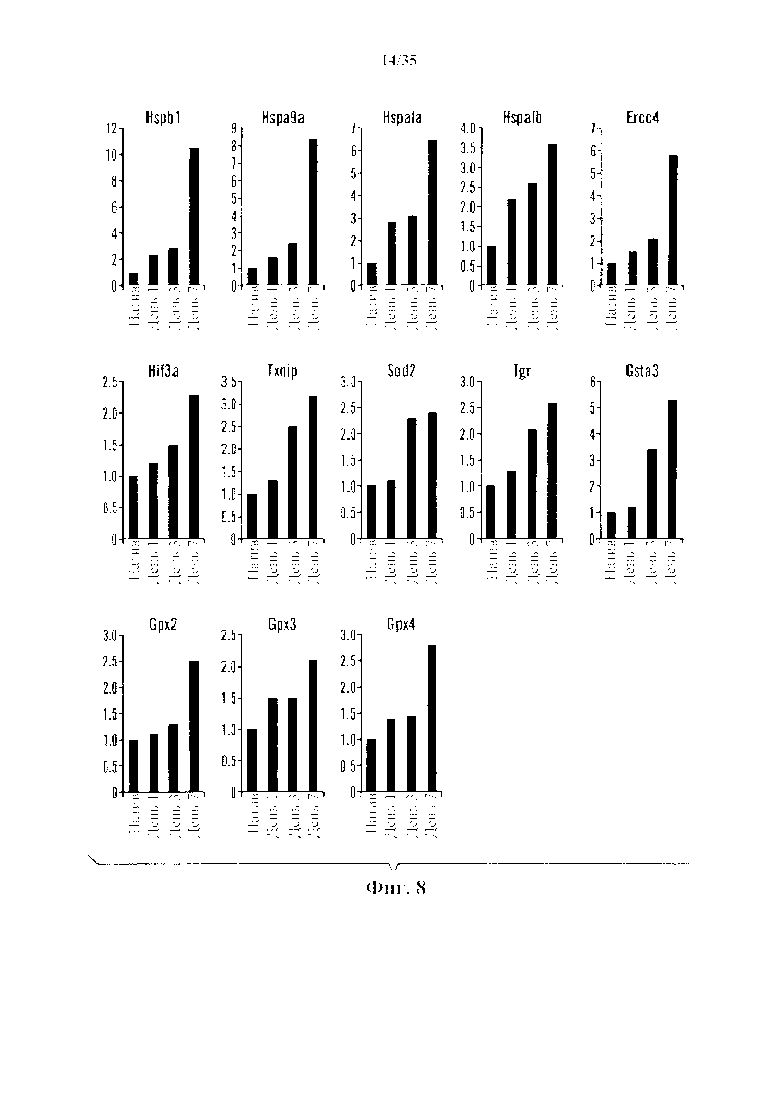
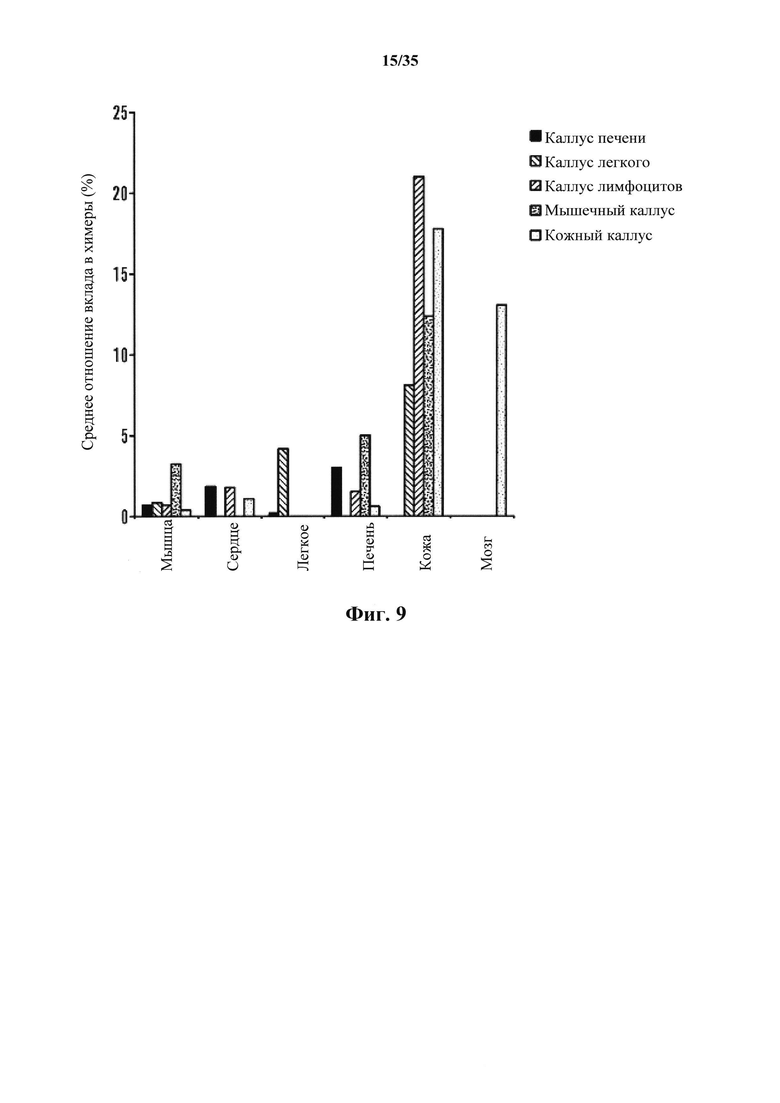
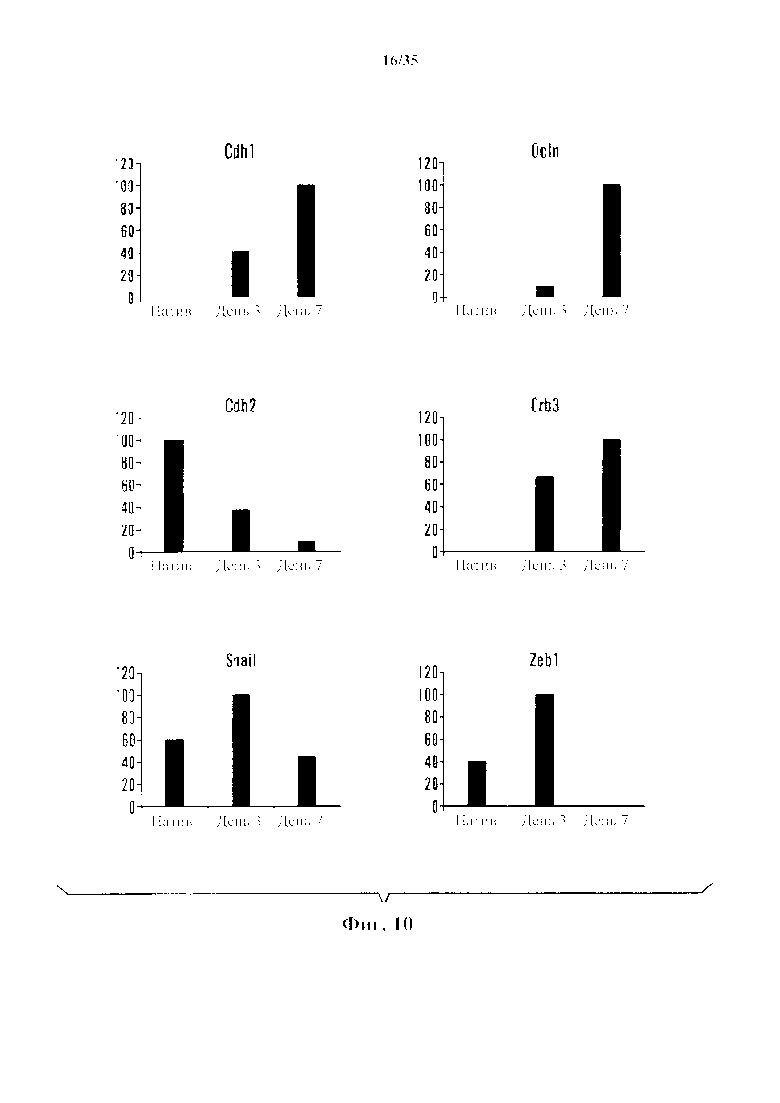
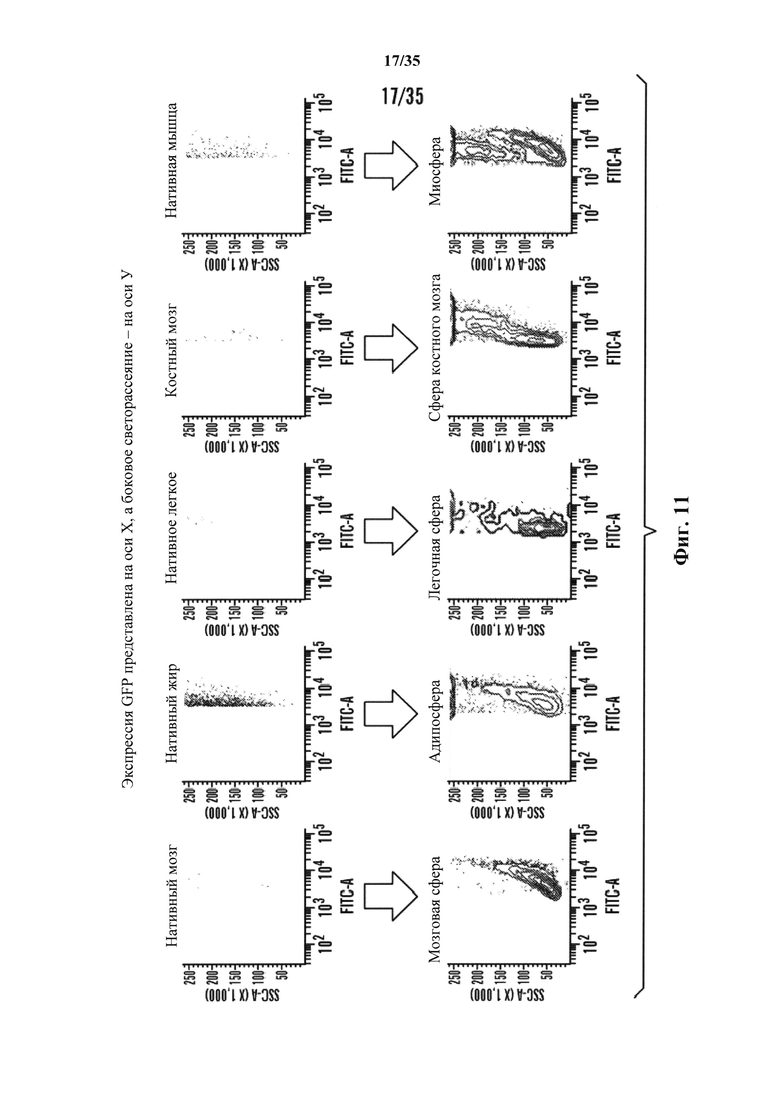
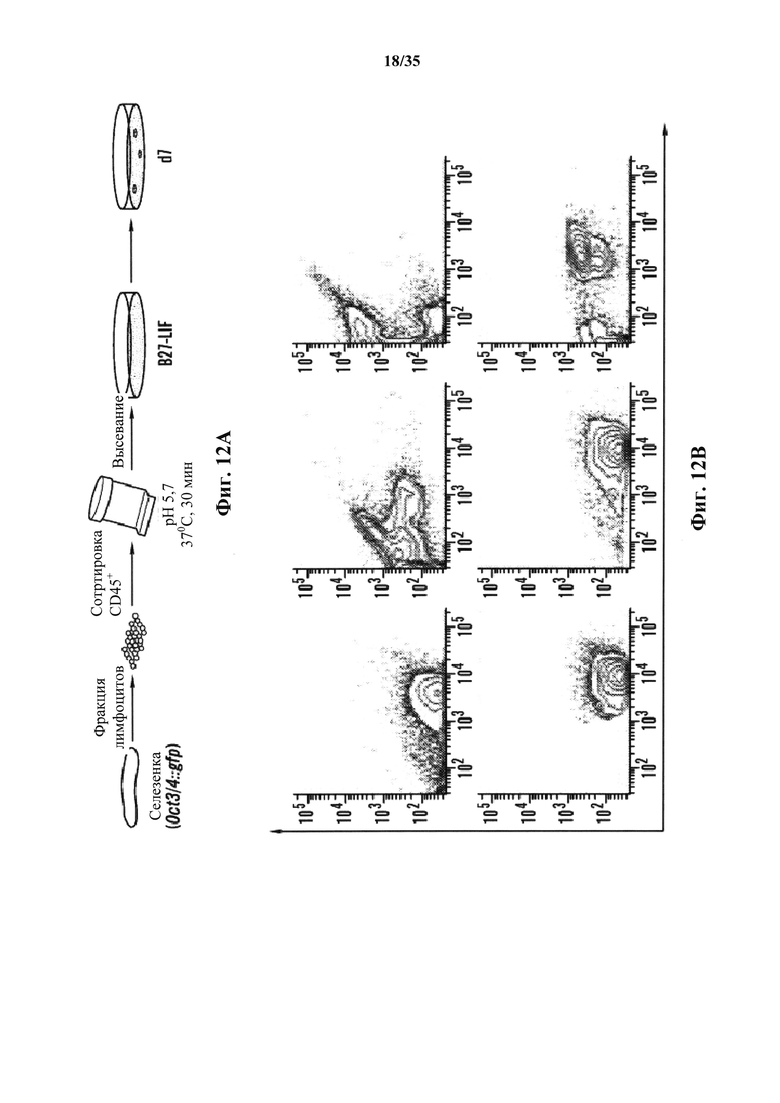
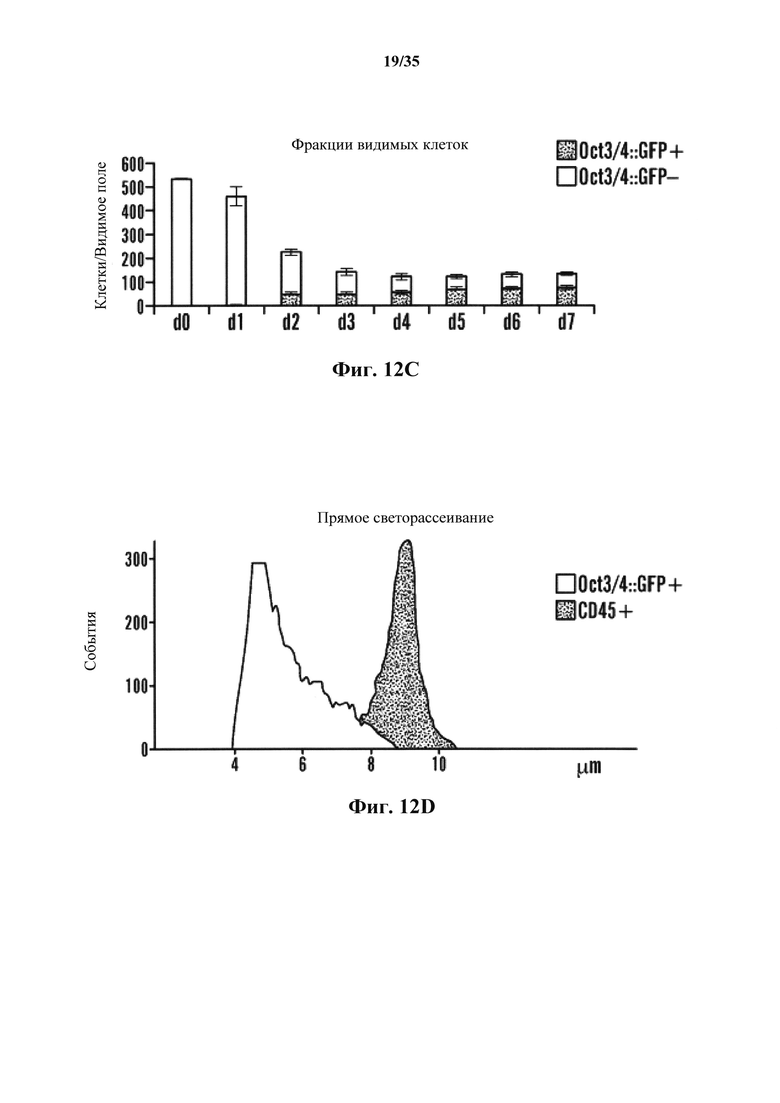
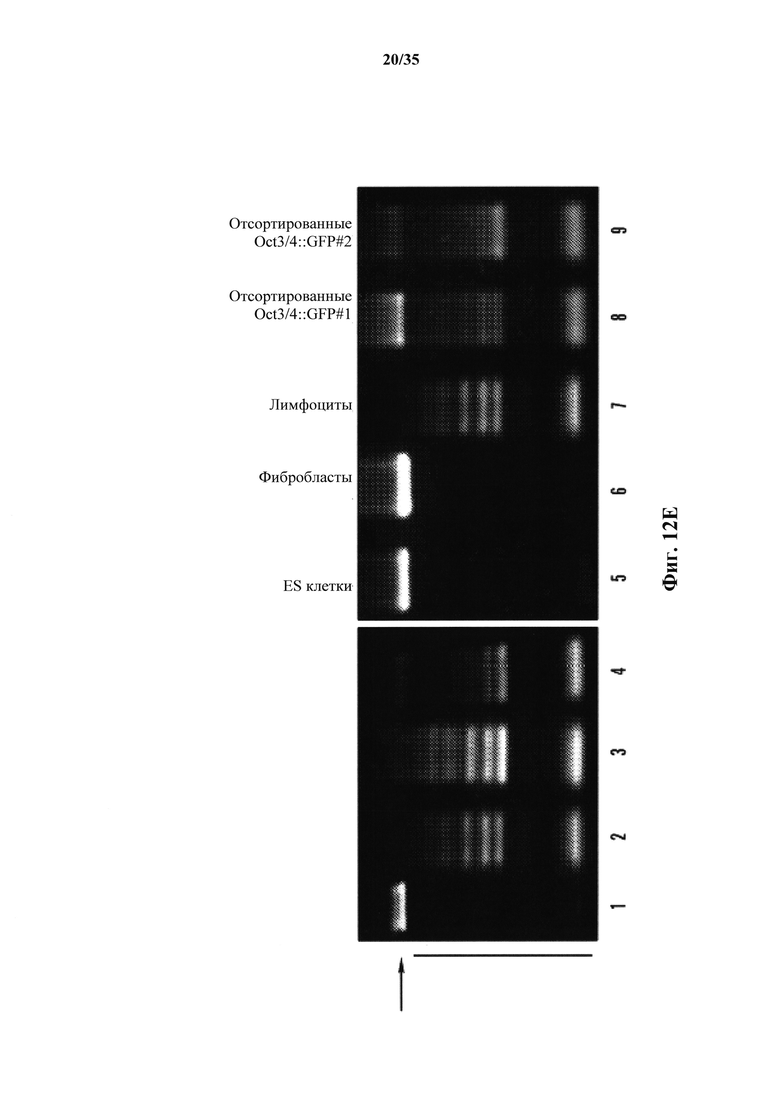
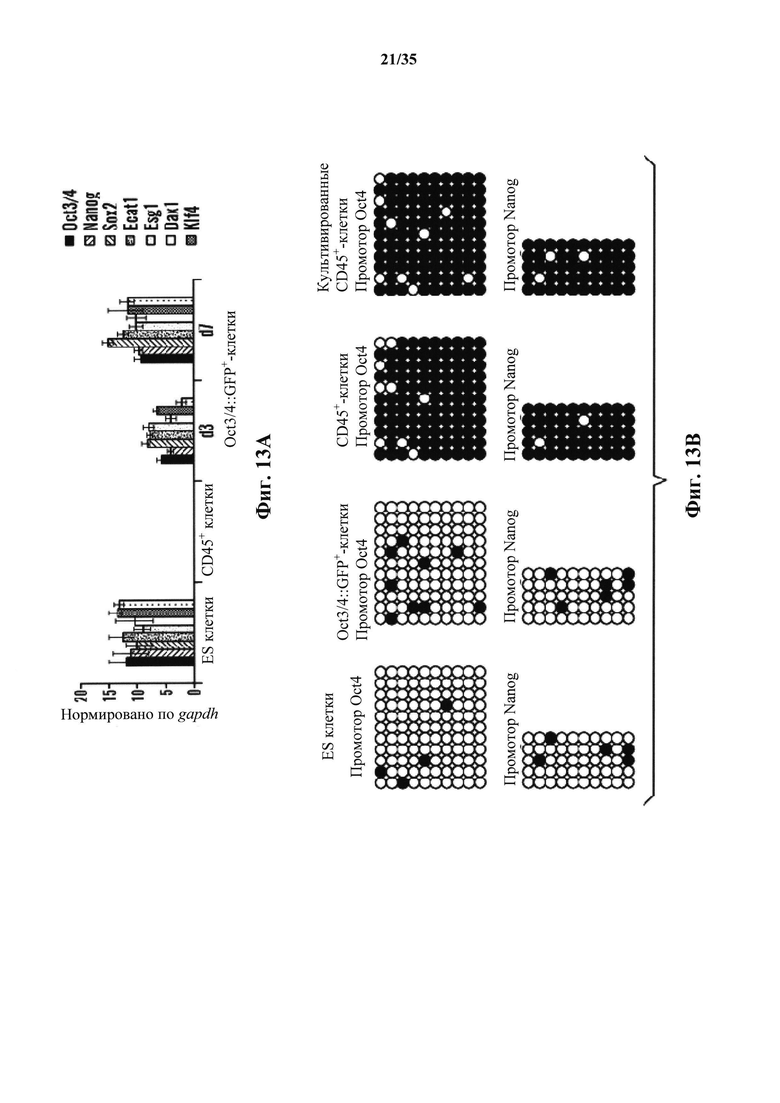
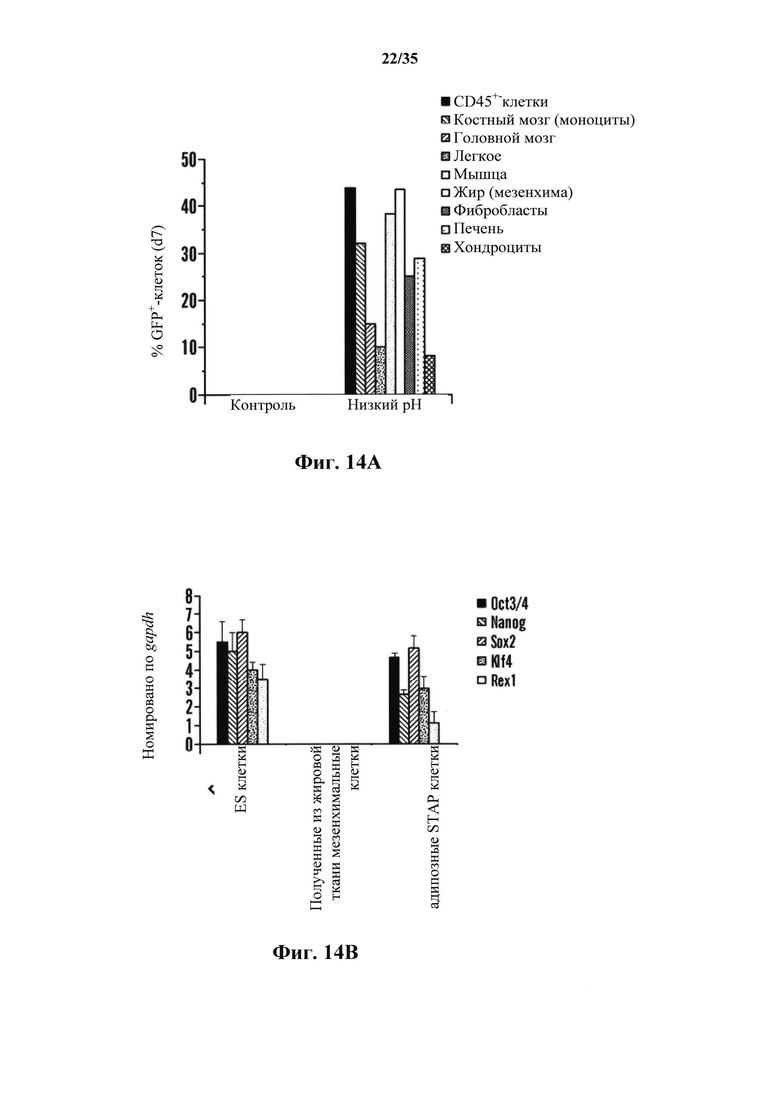
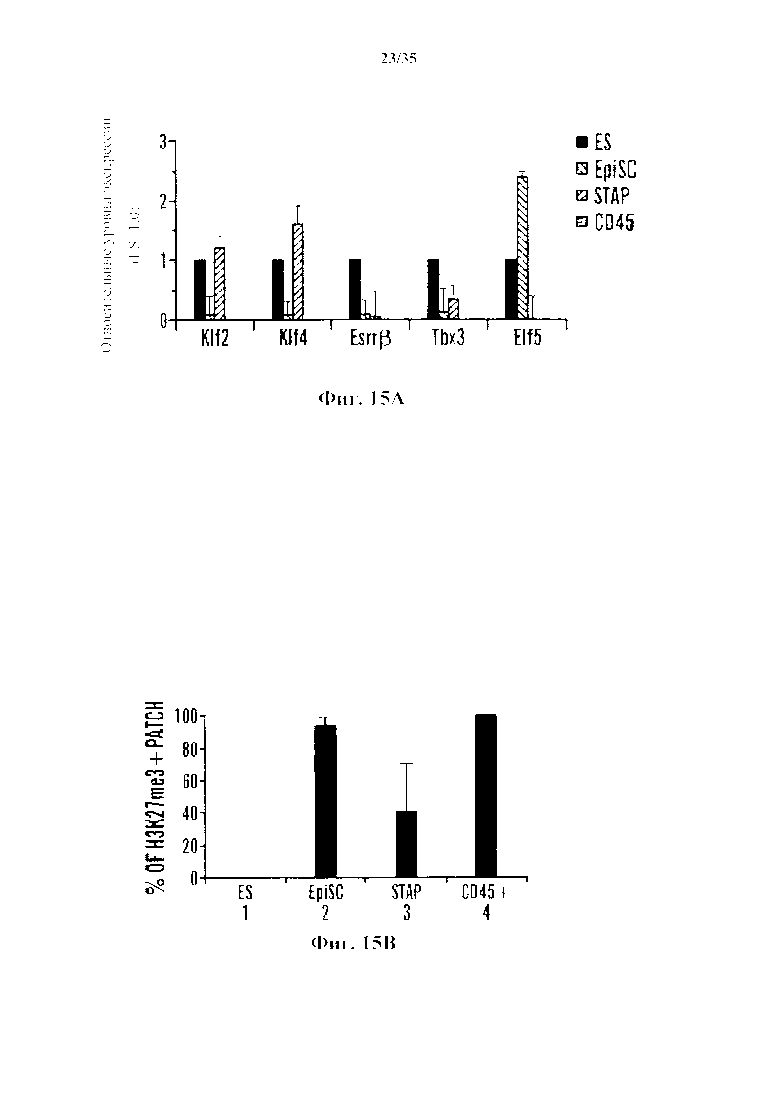
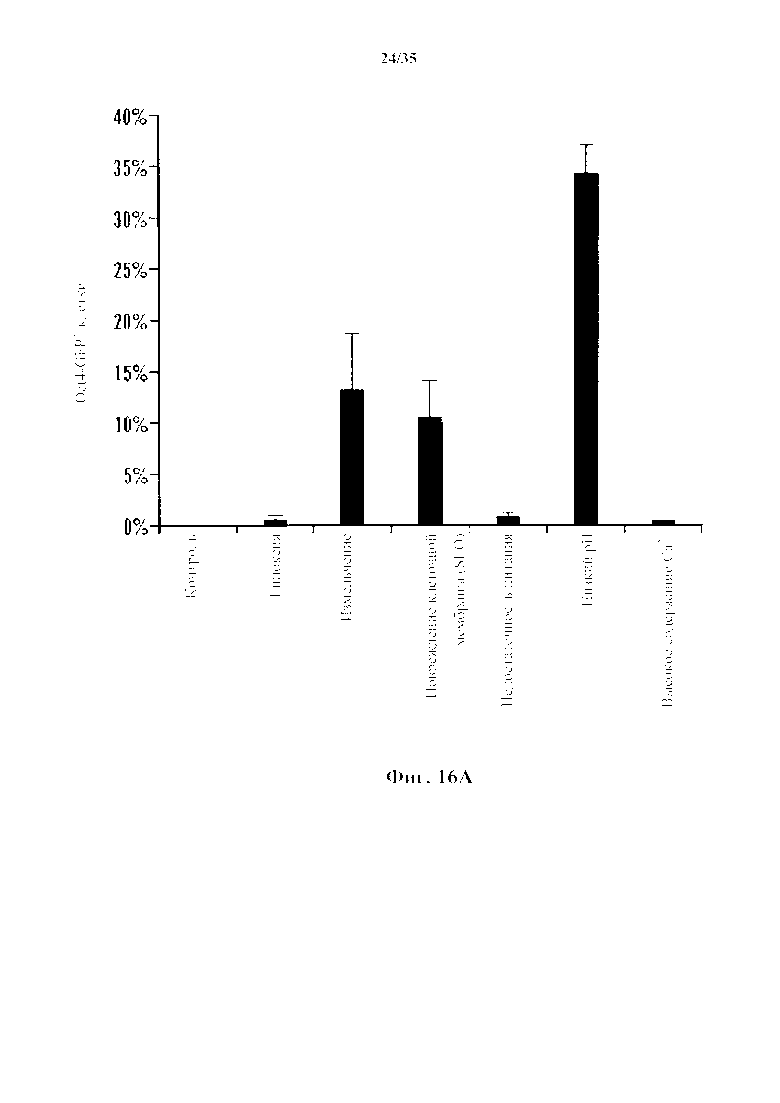
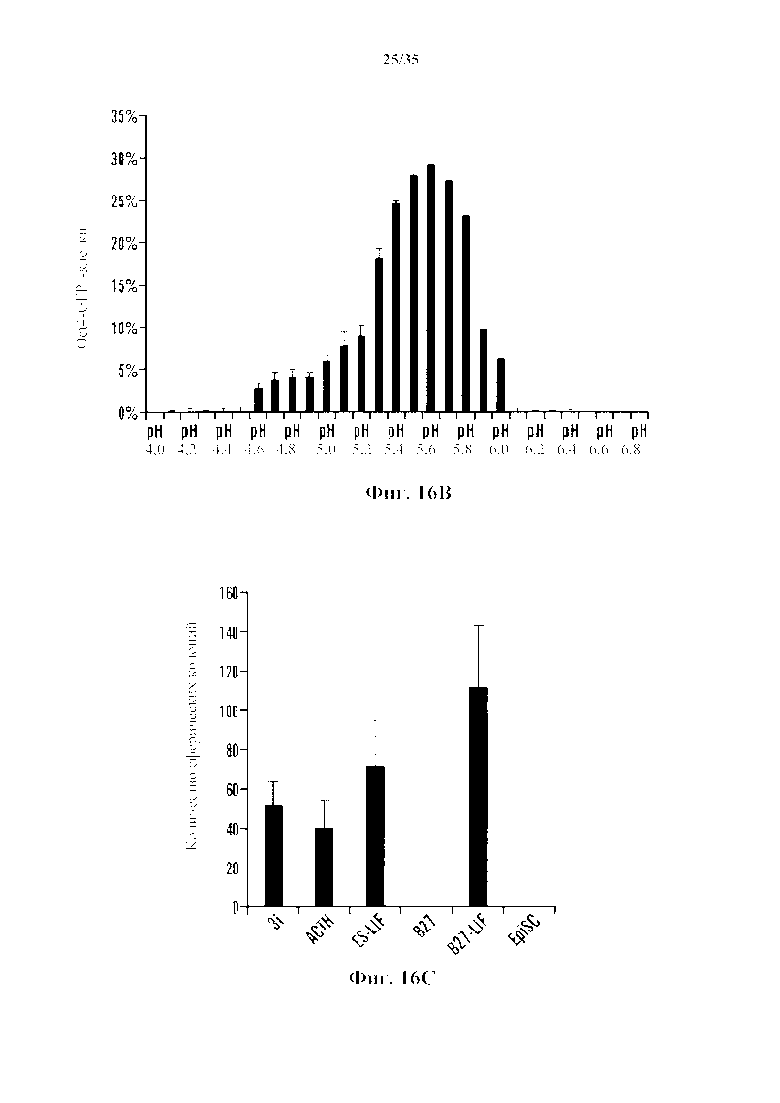
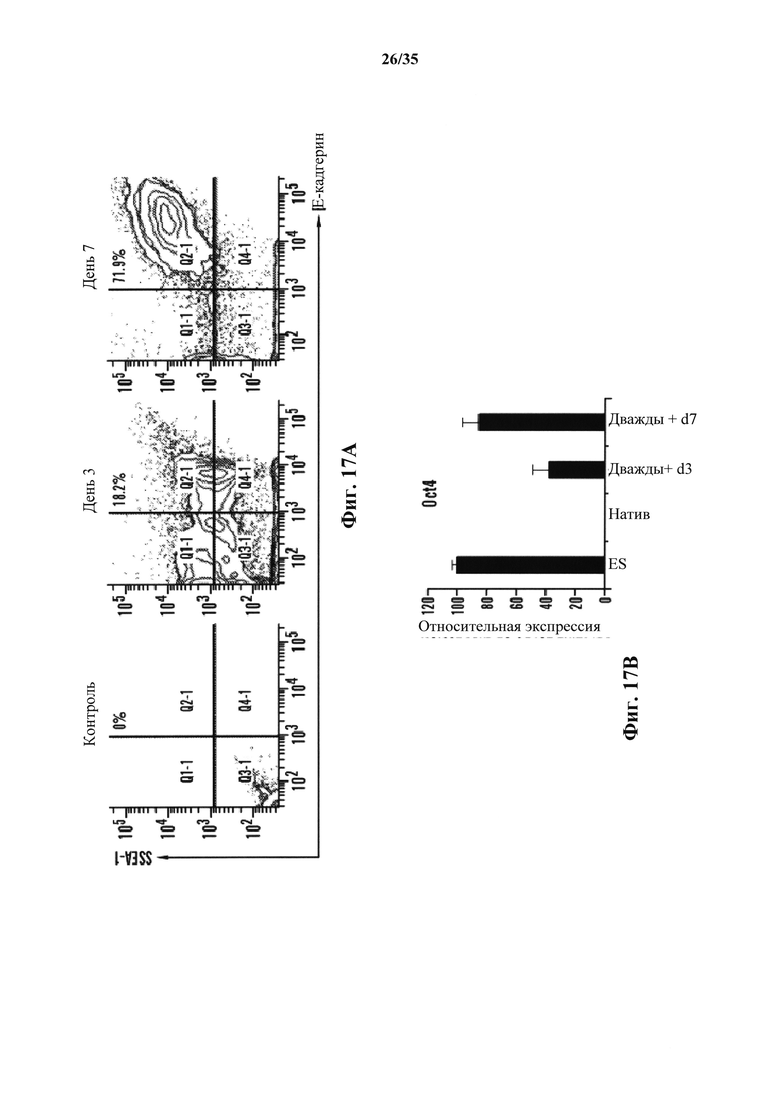
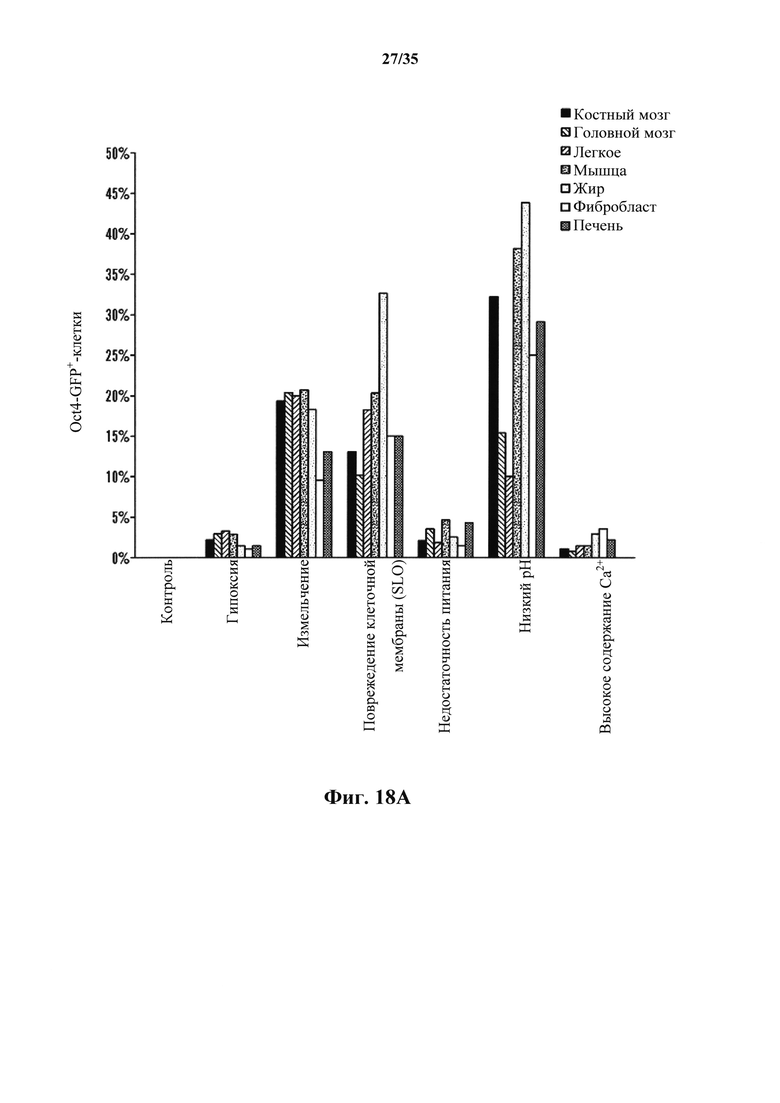
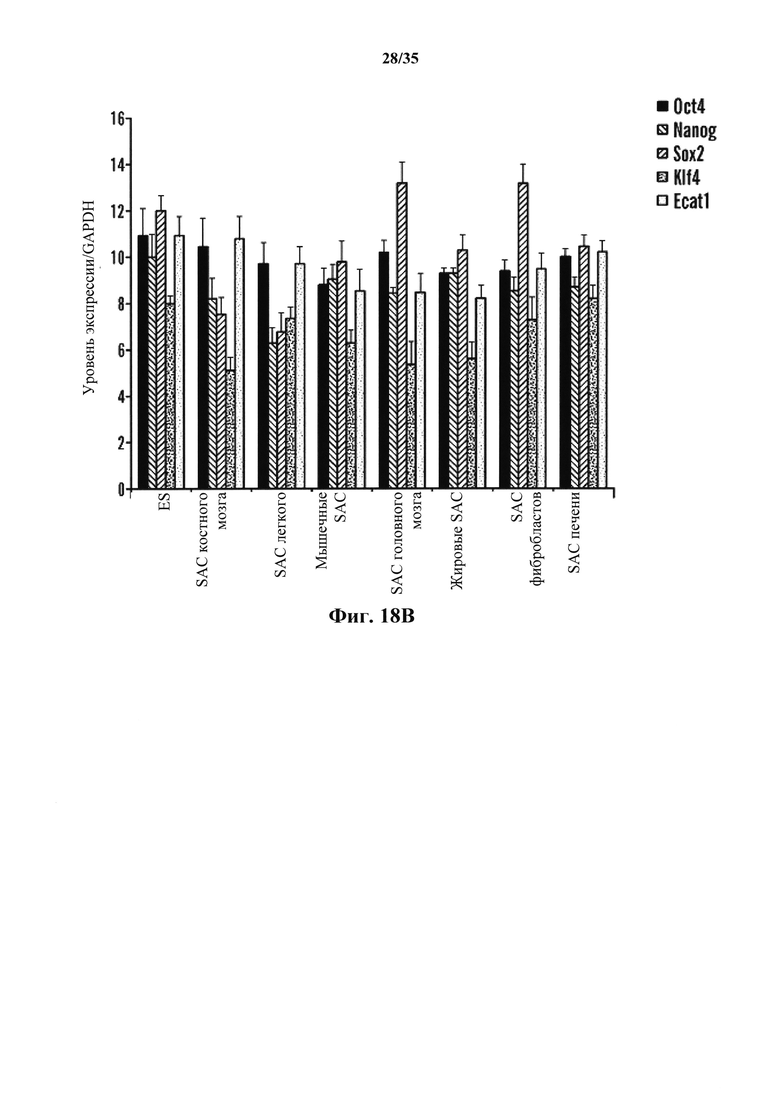
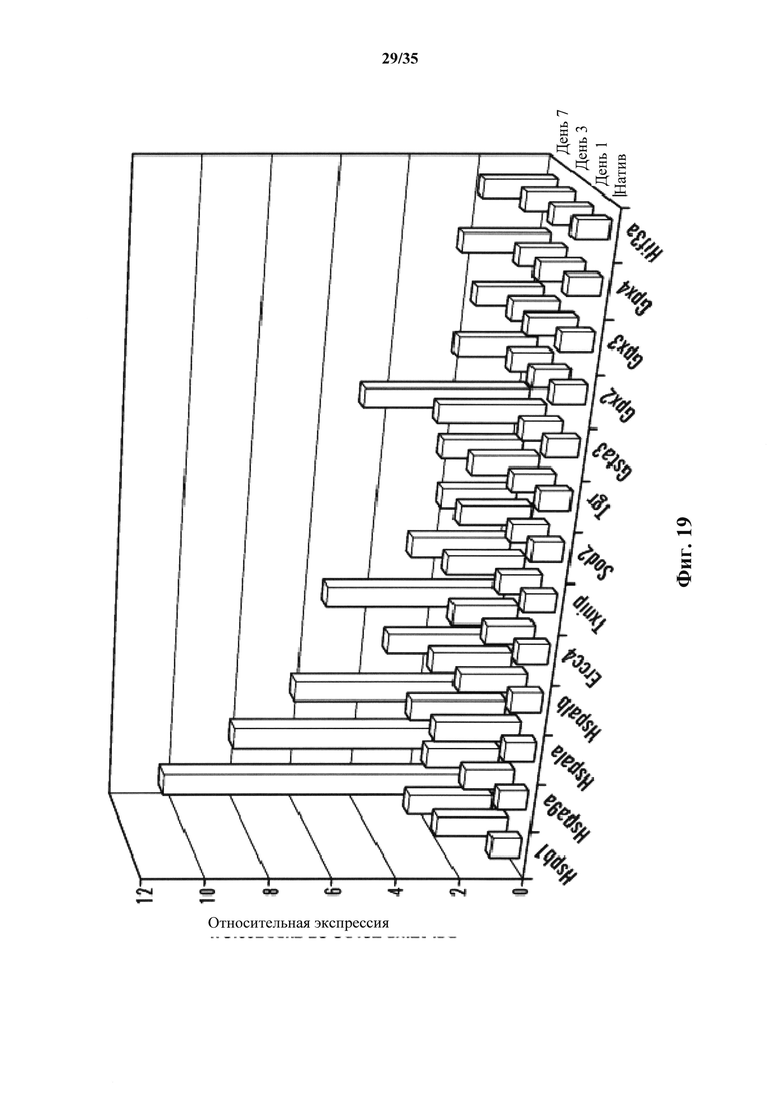
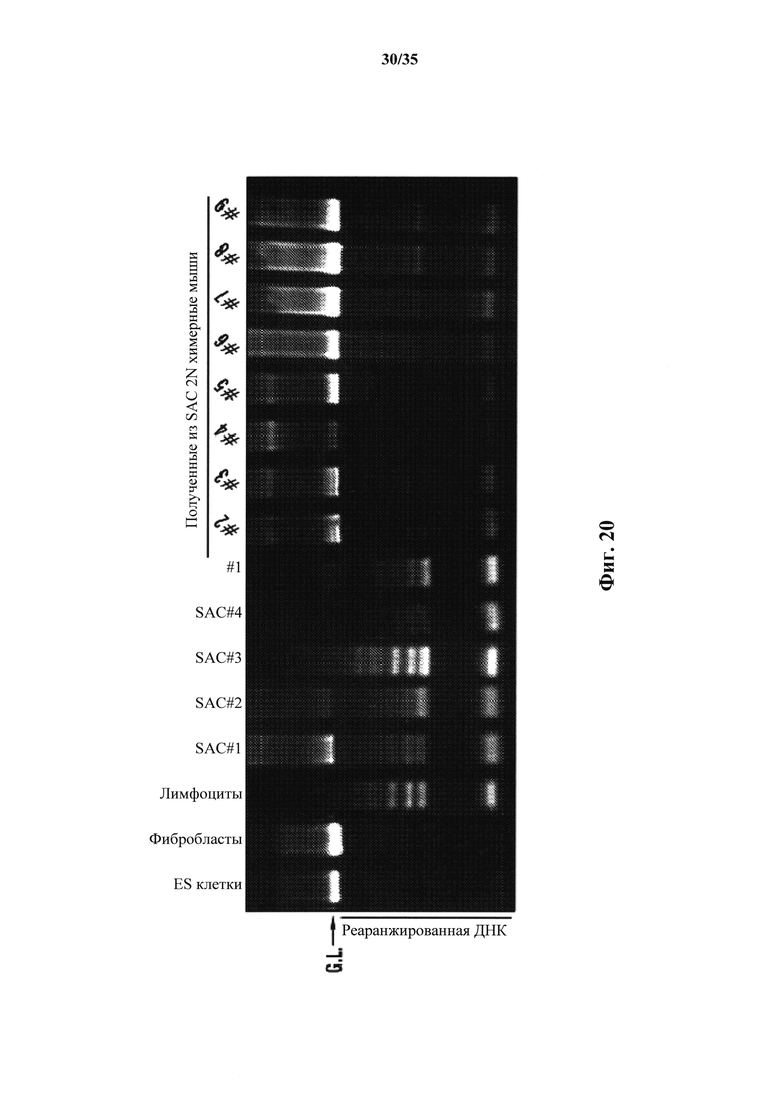
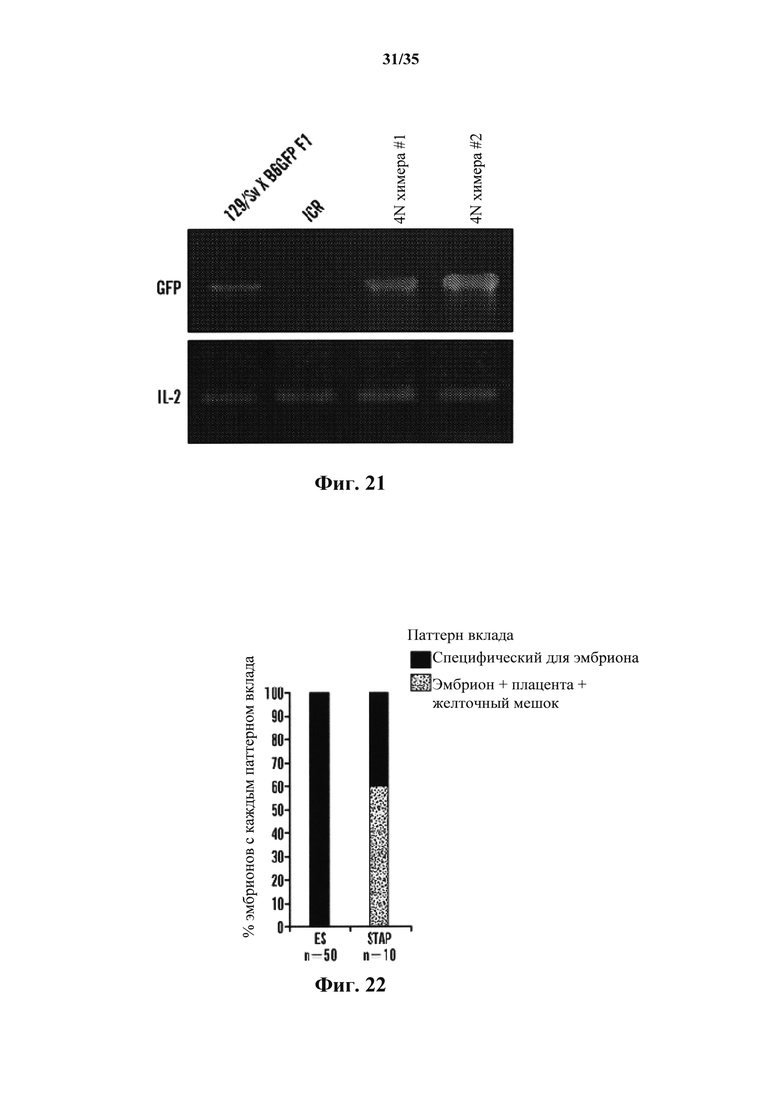
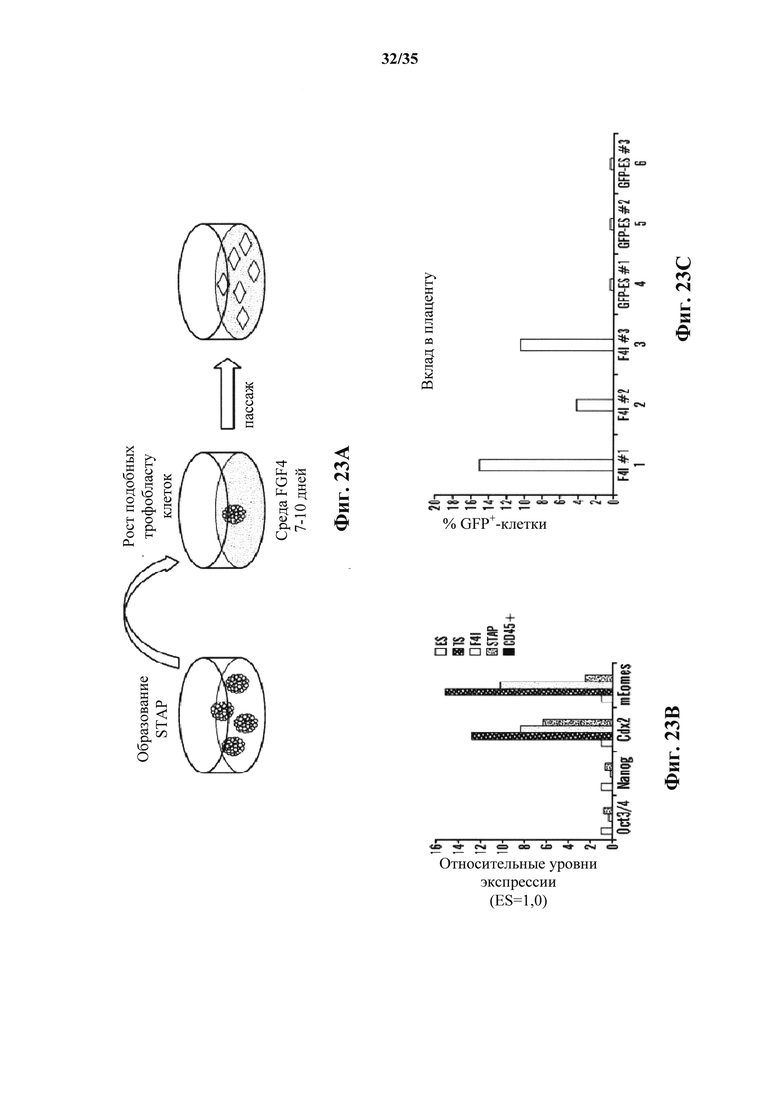
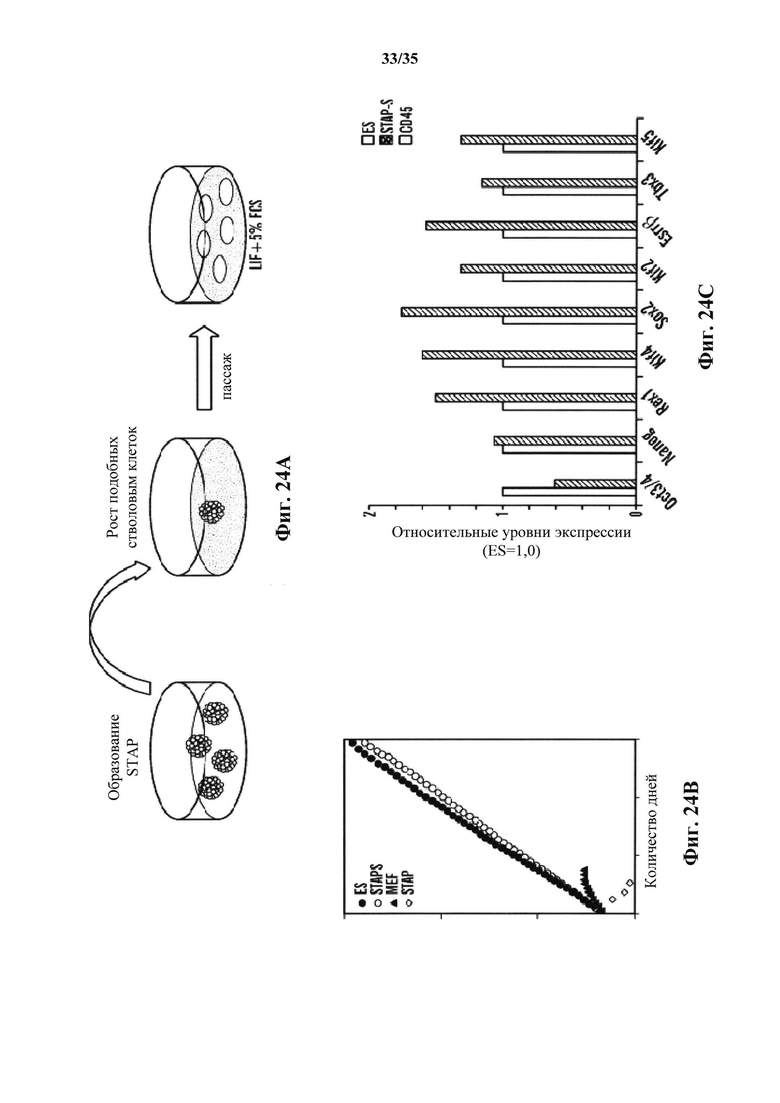
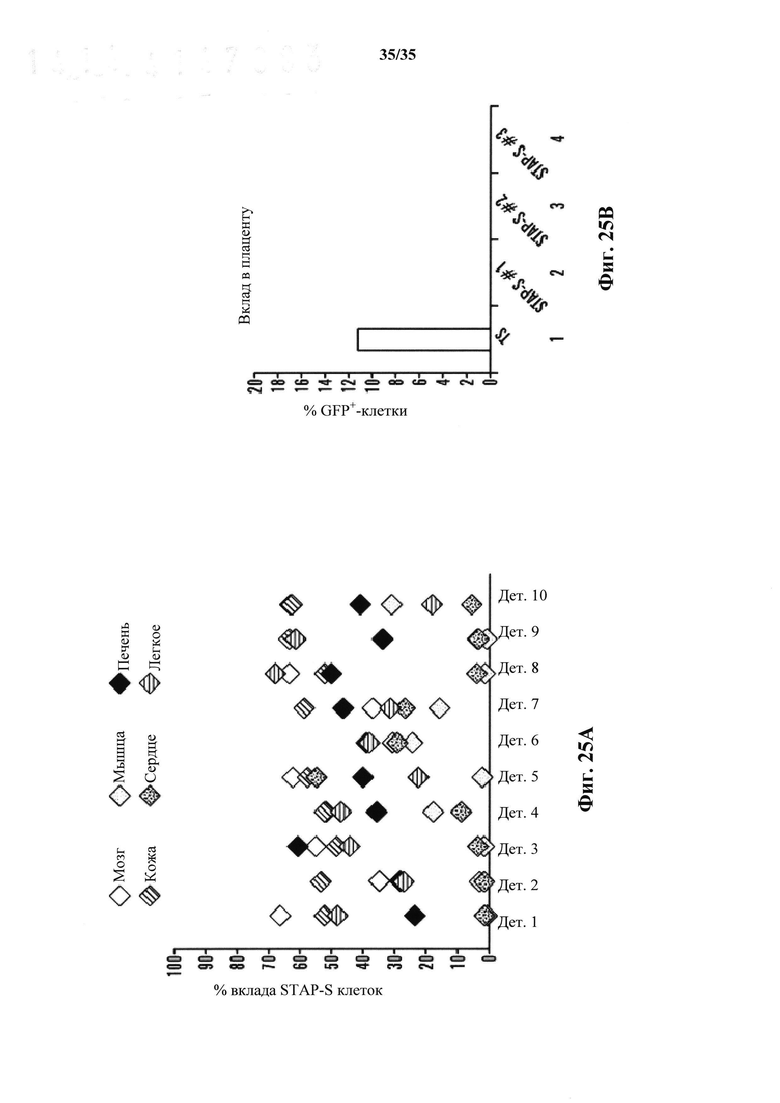
Изобретение относится к области биотехнологии, а именно к получению клетки, экспрессирующей ген Oct3/4. Способ включает подвергание соматической клетки или клетки-предшественника, которые не являются эмбриональными клетками человека, стрессу низким рН от 5,4 до 5,8, которое доводится при помощи АТФ, в комбинации с механическим раздражителем, включающим подвергание клетки сдвиговому напряжению, высокому давлению или их комбинациям. Изобретение позволяет расширить арсенал технических средств. 14 з.п. ф-лы, 25 ил., 9 табл., 4 пр.
1. Способ получения клетки, экспрессирующей ген Oct3/4, включающий подвергание соматической клетки или клетки-предшественника стрессу низким рН от 5,4 до 5,8 в комбинации с механическим раздражителем, включающим подвергание клетки сдвиговому напряжению, высокому давлению или их комбинациям, причем рН доводится при помощи АТФ и соматическая клетка и клетка-предшественник не являются эмбриональной клеткой человека.
2. Способ по п. 1, в котором клеточную массу получают без введения экзогенного гена, транскрипта, белка, ядерного компонента или цитоплазмы или без слияния клеток.
3. Способ по п. 1 или 2, в котором клетка не присутствует как часть ткани.
4. Способ по любому из пп. 1, 2, в котором клетка представляет собой выделенную клетку.
5. Способ по любому из пп. 1, 2, в котором клетка присутствует в гетерогенной популяции клеток.
6. Способ по любому из пп. 1, 2, в котором клетка присутствует в гомогенной популяции клеток.
7. Способ по любому из п.п. 1, 2, в котором клетку подвергают воздействию в течение 2-3 дней.
8. Способ по любому из п.п. 1, 2, в котором клетку подвергают воздействию в течение 1 дня или менее.
9. Способ по любому из п.п. 1, 2, в котором клетку подвергают воздействию в течение 1 часа или менее.
10. Способ по любому из п.п. 1, 2, в котором клетку подвергают воздействию в течение приблизительно 30 минут.
11. Способ по любому из пп. 1, 2, в котором клетка представляет собой клетку млекопитающего.
12. Способ по любому из пп. 1, 2, в котором клетка представляет собой клетку человека.
13. Способ по любому из пп. 1, 2, в котором клетка представляет собой взрослую клетку, амниотическую клетку или клетку пуповинной крови.
14. Способ по любому из пп. 1, 2, дополнительно включающий поддержание клеточной массы in vitro.
15. Способ по п. 1, в котором механический раздражитель включает прохождение клетки через по меньшей мере одно устройство с меньшим отверстием, чем размер клетки.
| US 20110070647 А1, 24.04.2011 | |||
| US 20110070647 А1, 24.04.2011 | |||
| US 20110070647 А1, 24.04.2011 | |||
| US 20070190646 A1, 16.08.2007 | |||
| СПОСОБ ПОЛУЧЕНИЯ НЕДИФФЕРЕНЦИРОВАННОЙ КЛЕТКИ | 1996 |
|
RU2215539C2 |
| WO 2008038148 A2, 03.04.2008. | |||
Авторы
Даты
2019-07-30—Публикация
2013-04-24—Подача