ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет по предварительной заявке на патент США с № 62/348,009, поданной 9 июня 2016 г.
ОБЛАСТЬ ТЕХНИКИ
Этот документ относится к антителам анти-TNFRSF25 и к их применению в исследовательских, терапевтических и диагностических целях.
УРОВЕНЬ ТЕХНИКИ
Член суперсемейства рецепторов фактора некроза опухоли 25 (TNFRSF25) является членом суперсемейства TNF-рецепторов, который экспрессируется предпочтительно активированными и «обученными» антигеном Т-лимфоцитами. TNFRSF25 активируют с помощью его лиганда TL1A (также называемого TNFSF15), который быстро активируется в антигенпредставляющих клетках и в некоторых эндотелиальных клетках после активации рецептора Toll-Like или Fc. TNFRSF25 может стимулировать активность ядерного фактора «каппа-би», а также может стимулировать активацию каспазы для регуляции апоптоза клеток (Bodmer et al, Immunity 6(1):79-88, 1997 и Kitson et al, Nature 384(6607):372-375, 1996). Структурная организация длинного белка TNFRSF25 человека длиной 393 аминокислот является наиболее гомологичной рецептору 1 TNF (TNFR1). Внеклеточный домен TNFRSF25 включает четыре богатых цистеином домена, а цитоплазматическая область содержит домен смерти, известный как сигнальный апоптоз. Альтернативный сплайсинг дает множество различных изоформ TNFRSF25, большинство из которых являются потенциально секретируемыми молекулами. Альтернативный сплайсинг гена TNFRSF25 в B и T-клетках приводит к изменению программы при активации Т-клеток, которая преимущественно продуцирует полноразмерные мембрано-связанные изоформы и, как полагают, участвует в контроле пролиферации лимфоцитов, индуцируемой активацией Т-клеток.
Активация TNFRSF25 связана с предыдущим вхождением в контакт Т-клеточного рецептора. После связывания TNARSF25 с TL1A передача сигналов TNFRSF25 повышает чувствительность Т-клеток к эндогенному IL-2 и усиливает пролиферацию Т-клеток. Поскольку активация TNFRSF25 зависит от Т-клеточного рецептора, активность TNFRSF25 in vivo специфична по отношению к Т-клеткам, которые сталкиваются с распознанным антигеном. В состоянии покоя и когда отсутствует основной аутоиммунитет, большинство Т-клеток, которые регулярно сталкиваются с распознанным антигеном, являются регуляторными Т-клетками FoxP3+. Стимуляция TNFRSF25 в отсутствие каких-либо других экзогенных сигналов стимулирует высокоспецифическую пролиферацию регуляторных Т-клеток FoxP3+ от базового уровня 8-10 % всех Т-клеток CD4+ до 35-40 % всех Т-клеток CD4+ в течение пяти дней (Schreiber et al., J Clin Invest 120(10):3629-3640, 2010). Терапевтические агонисты TNFRSF25 могут быть применены для стимуляции экспансии Treg, которая может уменьшить воспаление в экспериментальных моделях астмы, аллогенной трансплантации паренхиматозных органов и окулярного кератита (Schreiber et al., supra; Reddy et al, J Virol 86(19): 10606-10620, 2012; и Wolf et al., Transplantation 94(6):569-574, 2012). Аналогичным образом, поскольку активация TNFRSF25 является зависимой от антигена, костимуляция TNFRSF25 вместе с аутоантигеном или с вакцинным антигеном может привести к обострению иммунопатологии или усиленному иммунитету против вакцин, соответственно (Schreiber et al., J Immunol 189(7):3311-3318, 2010).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Этот документ основан, по крайней мере частично, на развитии антител, направленных на конкретные эпитопы в пределах TNFSF25. В некоторых вариантах осуществления антитела могут перекрестно реагировать между видами. Например, в некоторых вариантах осуществления настоящий документ предлагает антитела, которые могут связываться с полипептидами TNFRSF25 грызунов и человека со значениями Kd, которые находятся в 100-кратном пределе (например, в 10-кратном) друг от друга. В некоторых случаях описанные в данном документе антитела способны вызывать событие передачи сигналов, которое согласуется с сигнальной активностью TL1A (например, TL1A грызуна или человека), связывающимся с TNFRSF25. В некоторых вариантах осуществления антитела способны связываться с эпитопом в области аминокислот C48-L71 TNFRSF25 человека. Например, антитела могут специфически связываться с эпитопом в области аминокислот P64-T69.
Этот документ также основан, по крайней мере частично, на развитии антител с созревшей аффинностью, направленных на TNFRSF25. Антитела с созревшей аффинностью могут иметь повышенную аффинность к TNFRSFS25 по сравнению с исходным антителом анти-TNFRSF25, или антитела с созревшей аффинностью могут иметь повышенную активность по сравнению с исходным антителом анти-TNFRSF25, или антитела с созревшей аффинностью могут иметь как увеличенную аффинность к TNFRSF25, так и повышенную активность по сравнению с исходным антителом анти-TNFRSF25.
Таким образом, в первом аспекте, в этом документе представлено антитело анти-TNFRSF25 или его антигенсвязывающий фрагмент. Антитело или фрагмент антитела может содержать (i) вариабельную область тяжелой цепи, содержащую последовательности CDR1, CDR2 и CDR3 тяжелой цепи, причем последовательность CDR1 тяжелой цепи представляет собой GFTFSNHDLN (SEQ ID NO: 12), последовательность CDR2 тяжелой цепи представляет собой YISSASGLISYADAVRG (SEQ ID NO: 14); и последовательность CDR3 тяжелой цепи представляет собой DPAYTGLYALDF (SEQ ID NO:26); и (ii) вариабельную область легкой цепи, содержащую последовательности CDR1, CDR2 и CDR3 легкой цепи, причем последовательность CDR1 легкой цепи представляет собой TLSSELSWYTIV (SEQ ID NO:25), последовательность CDR2 легкой цепи представляет собой LKSDGSHSKGD (SEQ ID NG:21) и последовательность CDR3 легкой цепи представляет собой CGAGYTLAGQYGWV (SEQ ID NO,23).
Антитело или фрагмент антитела может содержать (i) вариабельную область тяжелой цепи, содержащую последовательности CDR1, CDR2 и CDR3 тяжелой цепи, причем последовательность CDR1 тяжелой цепи представляет собой GFTFSNHDLN (SEQ ID NO: 12), последовательность CDR2 тяжелой цепи представляет собой YISSASGLISYADAVRG (SEQ ID NO: 14); и последовательность CDR3 тяжелой цепи представляет собой DPPYSGLYALDF (SEQ ID NO: 16); и (ii) вариабельную область легкой цепи, содержащую последовательности CDR1, CDR2 и CDR3 легкой цепи, причем последовательность CDR1 легкой цепи представляет собой TLSSELSWYTIV (SEQ ID NO:25), последовательность CDR2 легкой цепи представляет собой LKSDGSHSKGD (SEQ ID NG:21) и последовательность CDR3 легкой цепи представляет собой CGAGYTLAGQYGWV (SEQ ID NO:23).
Антитело или фрагмент антитела может содержать (i) вариабельную область тяжелой цепи, содержащую последовательности CDR1, CDR2 и CDR3 тяжелой цепи, причем последовательность CDR1 тяжелой цепи представляет собой GFTFSNHDLN (SEQ ID NO: 12), последовательность CDR2 тяжелой цепи представляет собой YISSAS LISYADAVRG (SEQ ID NO: 14); и последовательность CDR3 тяжелой цепи представляет собой DPAYTGLYALDF (SEQ ID NO:26) и (ii) вариабельную область легкой цепи, содержащую последовательности CDR1, CDR2 и CDR3 легкой цепи, причем последовательность CDR1 легкой цепи представляет собой TLSSELSGFTIV (SEQ ID NO:27), последовательность CDR2 легкой цепи представляет собой LKSDGSHSKGD (SEQ ID NO:21) и последовательность CDR3 легкой цепи представляет собой CGAGYTLANQYGWV (SEQ ID NO:28).
Антитело или антигенсвязывающий фрагмент может дополнительно включать каркасные последовательности (FW) вариабельной области, сопоставляемые между CDR в соответствии с формулой (FW1)-(CDR1)-(FW2)-(CDR2)-(FW3)-(CDR3)-(FW4), причем FW последовательности вариабельной области в вариабельной области тяжелой цепи представляют собой FW последовательности вариабельной области тяжелой цепи, и причем FW последовательности вариабельной области в вариабельной области легкой цепи представляют собой FW последовательности вариабельной области легкой цепи. FW последовательности вариабельной области могут быть человеческими. Антитело или антигенсвязывающий фрагмент может дополнительно содержать тяжелую цепь человека и константные области легкой цепи. Константные области могут быть выбраны из группы, состоящей из IgG1, IgG2, IgG3 и IgG4 человека. Константными областями являются IgG1 или IgG4. Апоптоз опухолевых клеток у субъекта может быть увеличен после введения антитела или антигенсвязывающего фрагмента субъекту в дозе от около 0,1 мг/кг до около 50 мг/кг.
В другом аспекте, в этом документе представлена фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и антитело или антигенсвязывающий фрагмент, как описано в данном документе.
В другом аспекте, в этом документе представлено изделие, содержащее вышеуказанную фармацевтическую композицию, и по меньшей мере одно дополнительное средство для лечения рака. По меньшей мере одно дополнительное средство может быть средством, которое направляет CTLA-4, PD-1, PD-L1, LAG-3, Tim-3, TNFRSF4, TNFRSF9, TNFRSF18, CD27, CD39, CD47, CD73, или CD278 или может быть антагонистом рецептора A2A или антагонистом TGF-бета. По меньшей мере одно дополнительное средство может представлять собой одно или более из костимулирующей молекулы семейства B7, костимулирующей молекулы суперсемейства рецептора TNF, вакцинной композиции или химиотерапевтического средства. По меньшей мере одно дополнительное средство может включать трансфицированные химерным антигенным рецептором Т-клетки или размножаемые инфильтрирующие опухоли лимфоциты для применения в адоптивной Т-клеточной терапии in vitro или на субъекте. По меньшей мере одно дополнительное средство может быть применено во время in vitro процесса получения аутологичного Т-клеточного терапевтического средства.
В еще одном аспекте в этом документе представлен способ лечения опухоли у субъекта, причем способ включает введение субъекту такого количества композиции, описанной в данном документе, которое является эффективным, чтобы индуцировать апоптоз TNFRSF25-экспрессирующих опухолевых клеток в опухоли.
В этом документе также представлен способ стимуляции пролиферации Т-клеток CD8+ у субъекта, причем способ включает введение субъекту терапевтически эффективного количества композиции, как описано в данном документе. Пролиферация Т-клеток CD8+ может быть увеличена по меньшей мере на 20 % по сравнению с исходным уровнем пролиферации перед введением, что определяют с помощью проточной цитометрии антигенспецифических Т-клеток CD8+.
Кроме того, в этом документе представлен способ выявления иммунного ответа у субъекта, причем способ включает введение субъекту терапевтически эффективного количества композиции, как описано в данном документе.
В этом документе также представлен способ стимуляции пролиферации регуляторных Т-клеток CD4+FoxP3+ у субъекта, причем способ включает введение субъекту терапевтически эффективного количества композиции, как описано в данном документе.
В другом аспекте, в этом документе представлено выделенное моноклональное антитело или его Fab-фрагмент, который специфически связывается с TNFRSF25 человека, причем его антитело или его Fab-фрагмент после связывания с TNFRSF25 вызывает событие передачи сигналов, которое согласуется с событием передачи сигналов, вызванным связыванием TL1A с TNFRSF25 и при этом антитело связывается с эпитопом в области аминокислот C48-L71 TNFRSF25 человека. Антитело или фрагмент могут связываться с эпитопом, содержащим по меньшей мере один из следующих остатков TNFRSF25: C48, R49, G50, C51, P52, A53, G54, H55, Y56, L57, K58, A59, P60, C61, T62, E63, P64, C65, G66, N67, S68, T69, C70 или L71 SEQ ID NO:1. Связывание антитела или фрагмента с TNFRSF25 может блокировать связывание TL1A с TNFRSF25. Антитело может быть гуманизированным антителом или антителом человека. Антитело может быть антителом IgG любого подтипа. Антитело или фрагмент могут быть способны связываться с TNFRSF25 мыши, TNFRSF25 нечеловекообразного примата и TNFRSF25 человека со значениями Kd, которые находятся в 100-кратном пределе относительно других.
В другом аспекте, в этом документе представлено выделенное моноклональное антитело или его Fab-фрагмент, который специфически связывается с TNFRSF25 человека, причем антитело или его Fab-фрагмент после связывания с TNFRSF25 вызывает событие передачи сигналов, которое является характерным для события передачи сигналов, вызванного связыванием TL1A с TNFRSF25, и при этом антитело связывается с эпитопом в области аминокислот P64-T69 TNFRSF25 человека. Антитело или фрагмент могут связываться с эпитопом, содержащим по меньшей мере один из следующих остатков TNFRSF25: P64, C65, G66, N67, S68 или T69 SEQ ID NO: 1. Связывание антитела или фрагмента с TNFRSF25 может блокировать связывание TL1A с TNFRSF25. Антитело может быть гуманизированным антителом или антителом человека. Антитело может быть антителом IgG любого подтипа. Антитело или фрагмент могут быть способны связываться с TNFRSF25 мыши, TNFRSF25 нечеловекообразного примата и TNFRSF25 человека со значениями Kd, которые находятся в 100-кратном пределе относительно других.
В другом аспекте, в этом документе представлено изолированное моноклональное антитело или его Fab-фрагмент, который специфически связывается с TNFRSF25 человека, причем антитело связывается с эпитопом, имеющим последовательность по меньшей мере на 80 % идентичную последовательности, приведенной в C48-L71 SEQ ID NO: 1. В некоторых вариантах осуществления антитело может связываться с эпитопом, имеющим последовательность по меньшей мере на 90 % идентичную последовательности, приведенной в C48-L71 SEQ ID NO: 1, или с эпитопом, имеющим последовательность по меньшей мере на 95 %, по меньшей мере на 98 % или по меньшей мере на 99 % идентичную последовательности, приведенной в C48-L71 SEQ ID NO: 1.
В другом аспекте, в этом документе представлено изолированное моноклональное антитело или его Fab-фрагмент, который специфически связывается с TNFRSF25 человека, причем антитело связывается с эпитопом, имеющим последовательность по меньшей мере на 85 %, по меньшей мере на 90 % или по меньшей мере на 95 % идентичную последовательности, приведенной в P64-T69 SEQ ID NO: 1.
В этом документе также представлено специфически изолированное моноклональное антитело или его Fab-фрагмент, который специфически связывается с TNFRSF25 человека, причем антитело связывается с эпитопом, имеющим последовательность, приведенную в C48-L71 SEQ ID NO: 1, но с четырьмя или менее аминокислотными заменами. В некоторых вариантах осуществления антитело может связываться с эпитопом, имеющим последовательность, приведенную в C48-L71 SEQ ID NO: 1, но с тремя или менее аминокислотными заменами, с двумя или менее аминокислотными заменами или с одной аминокислотной заменой.
В другом аспекте, в этом документе представлено выделенное моноклональное антитело или его Fab-фрагмент, который специфически связывается с TNFRSF25 человека, причем антитело связывается с эпитопом, имеющим последовательность, приведенную в P64-T69 SEQ ID NO: 1, но с одной аминокислотной заменой.
В еще одном аспекте, в этом документе представлен способ ингибирования роста опухоли у млекопитающего. Способ может включать введение млекопитающему композиции, содержащей фармацевтически приемлемый носитель и моноклональное антитело или его Fab-фрагмент, который специфически связывается с TNFRSF25 человека, причем антитело или его Fab-фрагмент способны имитировать событие передачи сигналов, стимулируемое связыванием TL1A с TNFRSF25 и при этом антитело связывается с эпитопом в области аминокислот C48-L71 TNFRSF25 человека. Антитело или фрагмент могут связываться с эпитопом, содержащим по меньшей мере один из следующих остатков TNFRSF25: C48, R49, G50, C51, P52, A53, G54, H55, Y56, L57, K58, A59, P60, C61, T62, E63, P64, C65, G66, N67, S68, T69, C70 или L71 SEQ ID NO: 1. Антитело или фрагмент могут связываться с эпитопом, содержащим по меньшей мере один из следующих остатков TNFRSF25: P64, C65, G66, N67, S68 или T69 SEQ ID NO: 1. Связывание антитела или фрагмента с TNFRSF25 может блокировать связывание TL1A с TNFRSF25. Антитело может быть гуманизированным антителом или антителом человека. Антитело может быть антителом IgG любого подтипа. Антитело или фрагмент могут быть способны связываться с TNFRSF25 мыши, TNFRSF25 нечеловекообразного примата и TNFRSF25 человека со значениями Kd, которые находятся в 100-кратном пределе относительно других.
В другом аспекте, в этом документе представлена фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и изолированное моноклональное антитело или Fab-фрагмент, как описано в данном документе. Кроме того, в этом документе представлено применение фармацевтической композиции для лечения рака, инфекционного заболевания или тканевого трансплантата у пациента.
Если не указано иначе, все технические и научные термины, применяемые в данном документе, имеют такое же значение, которое обычно понимает специалист с обычной квалификацией в данной области техники, к которой относится данное изобретение. Хотя способы и материалы, аналогичные или эквивалентные описанным в данном документе, могут быть применены для осуществления изобретения, подходящие способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в данном документе, включены посредством ссылки во всей своей полноте. В случае противоречий данная спецификация, в том числе определения, будет иметь преимущество. Кроме того, материалы, способы и примеры являются иллюстративными и не носят ограничительного характера.
Детали одного или нескольких вариантов осуществления изобретения приведены в сопроводительных графических материалах и в приведенном ниже описании. Другие признаки, цели и преимущества изобретения будут очевидны из описания и графических материалов и из формулы изобретения.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
ФИГ. 1A представляет собой совмещение аминокислотной последовательности TNFRSF25 человека (SEQ ID NO: 2) с TNFR1 человека (SEQ ID NO: 3) и Fas человека (SEQ ID NO: 4), с которым TNFRSF25 разделяет некоторую гомологию. Нумерация последовательности начинается с N-конца ожидаемого зрелого белка. Показаны местоположения богатых цистеинами областей I-IV, трансмембранного домена (TM) и домена смерти (DD). Остатки, идентичные по меньшей мере в двух последовательностях, выделены полужирным шрифтом и подчеркнуты.
ФИГ. 1B показывает две типичные аминокислотные последовательности TNFRSF25 от человека (SEQ ID NO: 1 и 7) и типичные аминокислотные последовательности TNFRSF25 от мыши (SEQ ID NO:8), Rhesus Macaque (SEQ ID NO:9) и Cynomolgus Macaque (SEQ ID NO: 10).
ФИГ. 2 представляет собой схему, изображающую этапы способа оценки экспрессии различных рекомбинантных полипептидов TNFRSF25.
ФИГ. 3 представляет собой график, изображающий уровни экспрессии для шести рекомбинантных полипептидов TNFRSF25.
ФИГ. 4 представляет собой схему, изображающую этапы способа оценки связывания химерного антитела анти-TNFRSF25 с рекомбинантными полипептидами TNFRSF25.
ФИГ. 5 представляет собой график, изображающий связывание возрастающих количеств рекомбинантного полипептида TNFRSF25 с химерным антителом анти-TNFRSF25.
ФИГ. 6 представляет собой график, изображающий кратность изменения при связывании различных мутантов аланина TNFRSF25 с антителом анти-TNFRSF25.
ФИГ. 7 представляет собой диаграмму структуры TNFRSF25, указывающую положения остатков, идентифицированных как участвующие или возможно участвующие в связывании антитела.
ФИГ. 8 представляет собой пространственную диаграмму структуры TNFRSF25, рассматриваемую с двух сторон и указывающую положение аминокислот, идентифицированных как участвующие в связывании антител. Остатки «горячей точки» были идентифицированы как находящиеся в области между аминокислотами 48 и 71.
ФИГ. 9 представляет собой график, иллюстрирующий ингибирование связывания антител анти-TNFRSF25 с TNFRSF25 в присутствии или в отсутствие слитого белка TL1A-Ig или ингибирование связывания TL1A-Ig с TNFRSF25 в присутствии или в отсутствие антитела анти-TNFRSF25. Левые столбцы: связывание антитела анти-TNFRSF25 («исходного антитела хомяка») с рекомбинантным TNFRSF25 человека полностью ингибировалось в присутствии TL1A-Ig. Центральные столбцы: связывание слитого TL1A-Ig с рекомбинантным TNFRSF25 человека полностью ингибировалось в присутствии исходного антитела анти-TNFRSF25. Правые столбцы: связывание гуманизированного антитела анти-TNFRSF25 с рекомбинантным TNFRSF25 человека полностью ингибировалось в присутствии TL1A-Ig.
ФИГ. 10 представляет собой график, изображающий связывание исходного гуманизированного антитела анти-TNFRSF25 и клонов с созревшей аффинностью со слитым белком TNFRSF25-Fc.
ФИГ. 11A и 11B представляют собой графики, показывающие каспазную активность исходного антитела анти-TNFRSF25, TL1A и указанных клонов с созревшей аффинностью. Клоны с созревшей аффинностью были в формате IgG1.
ФИГ. 12 представляет собой график, показывающий каспазную активность исходного антитела анти-TNFRSF25, TL1 А и указанных клонов с созревшей аффинностью. Клоны с созревшей аффинностью были в формате IgG1 или IgG4, как указано.
ФИГ. 13A представляет собой график, показывающий уровни флуоресценции в конкурентных анализах, в которых меченый по позиции 647 TLlA от ALEXAFLUOR® и различные конкуренты антител (исходный 4C12 и клоны M3, M4 и M5 с созревшей аффинностью) инкубировали с клетками p815, экспрессирующими TNFRSF25 (DR.3). ФИГ. 13В представляет собой график, показывающий уровни флуоресценции в конкурентных анализах, в которых меченый по позиции 647 4C12 от ALEXAFLUOR® и различные конкуренты антител (исходный 4C12, hIgG1, клоны M3, М4 и M5 с созревшей аффинностью) инкубировали с клетками p815, экспрессирующими TNFRSF25 (DR3).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Этот документ основан, по крайней мере частично, на развитии антител, направленных на конкретные эпитопы в пределах TNFSF25. Например, в этом документе предлагаются антитела, которые могут связываться с эпитопами в области аминокислот C48-L71 TNFRSF25 человека. В некоторых вариантах осуществления антитела могут связываться с полипептидами TNFRSF25 человека и грызунов со значениями Kd, которые находятся в 100-кратном пределе (например, в 10-кратном) друг от друга, и могут быть способны имитировать сигнальную активность связывания TL1A человека и грызунов с TNFRSF25. В некоторых вариантах осуществления антитела могут связываться с эпитопом в области аминокислот P64-T69, которая является консервативной областью полипептида у плацентарных млекопитающих. Также в данном документе предлагаются способы применения одного или более антител, представленных в данном документе, или композиций, содержащих одно или более антител, для стимуляции пролиферации Т-клеток (например, Т-клеток человека, Т-клеток мыши или Т-клеток макаки), а также способы применения одного или более антител или композиций для лечения больного раком человека (например, путем введения количества антитела анти-TNFRSF25, которое является эффективным для стимулирования пролиферации Т-клеток CD8+).
Этот документ также предлагает гуманизированные специфические моноклональные антитела TNFRSF25 с созревшей аффинностью и антигенсвязывающие фрагменты антител с созревшей аффинностью. Также в данном документе предлагаются способы применения антител с созревшей аффинностью для, помимо прочего, стимулирования пролиферации Т-клеток (например, Т-клеток человека, в том числе встречающихся в природе опухолереактивных Т-клеток CD8+ или регуляторных Т-клеток CD4+FoxP3+, а также Т-клеток мыши или Т-клеток макаки) и способы применения антител с созревшей аффинностью в лечении рака и других болезненных состояний, при которых экспансия Т-клеток может иметь благоприятный эффект (например, инфекционное заболевание, болезнь «трансплантат против хозяина» и аутоиммунные заболевания). Способы могут включать, например, введение количества антитела с созревшей аффинностью, которое является эффективным для стимулирования пролиферации Т-клеток CD8+ или соответствующей популяции регуляторных Т-клеток.
Частичная аминокислотная последовательность в случае TNFRSF25 человека показана на ФИГ. 1, совмещенная с аминокислотными последовательностями в случае TNFR1 человека и FA. Репрезентативная полноразмерная аминокислотная последовательность TNFRSF25 человека представляет собой: MEQRPRGCAAVAAALLLVLLGARAQGGTRSPRCDCAGDFHKKIGLFCCRGCPAGHYLKAPCTEPCGNSTCLVCPQDTFLAWENHHNSECARCQACDEQASQVALENCSAVADTRCGCKPGWFVECQVSQCVSSSPFYCQPCLDCGALHRHTRLLCSRRDTDCGTCLPGFYEHGDGCVSCPTSTLGSCPERCAAVCGWRQMFWVQVLLAGLVVPLLLGATLTYTYRHCWPHKPLVTADEAGMEALTPPPATHLSPLDSAHTLLAPPDSSEKICTVQLVGNSWTPGYPETQEALCPQVTWSWDQLPSRALGPAAAPTLSPESPAGSPAMMLQPGPQLYDVMDAVPARRWKEFVRTLGLREAEIEAVEVEIGRFRDQQYEMLKRWRQQQPAGLGAVYAALERMGLDGC VEDLRSRLQRGP (SEQ ID NO: 1)
Используемый в данном документе термин «антитело» относится к любому иммуноглобулину или антителу (например, антителам человека, хомяка, кошачьих, мыши, хрящевой рыбы или верблюда) и к любому его производному или конъюгату, который специфически связывается с антигеном. Специалистам в данной области техники известно широкое разнообразие антител. Неограничивающие примеры антител включают моноклональные антитела, поликлональные антитела, гуманизированные антитела, мультиспецифические антитела (например, биспецифические антитела), одноцепочечные антитела (например, однодоменные антитела, антитела верблюда и антитела хрящевой рыбы), химерные антитела, антитела кошачьих и фелинизированные антитела. Моноклональные антитела являются гомогенными популяциями антител к определенному эпитопу антигена. Поликлональные антитела представляют собой гетерогенные популяции молекул антитела, которые содержатся в сыворотке иммунизированных животных. Термин «антитело» также включает производные и конъюгаты антител (например, антитело, конъюгированное со стабилизирующим белком, детектируемым фрагментом или терапевтическим средством).
Под «выделенным» или «очищенным» по отношению к полипептиду (например, антителу или его фрагменту) подразумевается, что полипептид в некоторой степени отделяется от клеточных компонентов, с которыми он обычно существует в природе (например, другие полипептиды, липиды, углеводы и нуклеиновые кислоты). В некоторых вариантах осуществления «выделенный» полипептид представляет собой тот, который экспрессируется и продуцируется в среде, отличной от среды, в которой полипептид экспрессируется и продуцируется естественным образом. Например, растительный полипептид выделяют при экспрессировании и продуцировании бактериями или грибами. Аналогичным образом, растительный полипептид выделяют, когда его кодирующая последовательность генов функционально связана с химерным регуляторным элементом и экспрессируется в ткани, где полипептид не экспрессируется естественным образом.
Выделенный полипептид может давать одну основную полосу на невосстанавливающем полиакриламидном геле. Выделенный полипептид может быть по меньшей мере на около 75 % чистым (например, на по меньшей мере 80 %, 85 %, 90 %, 95 %, 97 %, 98 %, 99 % или 100 % чистым). Выделенные полипептиды могут быть получены путем, например, экстракции из природного источника путем химического синтеза или путем рекомбинантного получения в клетке-хозяине или трансгенном растении и могут быть очищены с применением, например, аффинной хроматографии, иммунопреципитации, эксклюзионной хроматографии и ионообменной хроматографии. Степень очистки может быть измерена с применением любого подходящего способа, в том числе, без ограничения этим, колоночной хроматографии, электрофореза в полиакриламидном геле или высокоэффективной жидкостной хроматографии.
«Антигенсвязывающий фрагмент» представляет собой любую часть полноразмерного антитела, содержащую по меньшей мере один вариабельный домен (например, вариабельный домен тяжелой или легкой цепи иммуноглобулина млекопитающего (например, кошачьих, человека, хомяка или мыши), вариабельный антигенсвязывающий домен верблюда (VHH) или домен нового антигенного рецептора иммуноглобулина хрящевой рыбы (Ig-NAR)), который способен специфически связываться с антигеном. Неограничивающие примеры фрагментов антитела включают Fab, Fab’, F(ab’)2 и Fv-фрагменты, диатела, линейные антитела и мультиспецифические антитела, образованные из фрагментов антитела. Дополнительные фрагменты антитела, содержащие по меньшей мере один домен VHH верблюда или по меньшей мере один домен Ig-NAR хрящевой рыбы включают мини-тела, микро-антитела, субнано-антитела и нано-антитела, а также любую из иных форм антител описанных, например, в публикации патента США № 2010/0092470.
«Fv-фрагмент» является минимальным фрагментом антитела, который содержит полный сайт распознавания и связывания антигена. Эта область состоит из димера одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи в плотной нековалентной ассоциации. Именно в указанной конфигурации три определяющие комплементарность области (CDR) каждого вариабельного домена взаимодействуют для того, чтобы определить антиген-связывающий сайт на поверхности димера VH-VL. Термин «определяющая комплементарность область» или «CDR» относится к области внутри иммуноглобулина (тяжелой или легкой цепи иммуноглобулина), которая образует часть антигенсвязывающего сайта в антителе или его антигенсвязывающем фрагменте. Как известно в данной области техники, иммуноглобулины тяжелой цепи и легкой цепи содержат три CDR, называемые CDR1, CDR2 и CDR3. В любом антителе или антигенсвязывающем фрагменте три CDR из иммуноглобулина тяжелой цепи и три CDR из иммуноглобулина легкой цепи вместе образуют антигенсвязывающий сайт в антителе или его антигенсвязывающем фрагменте. База данных Kabat представляет собой единую систему, применяемую в данной области техники, для обозначения последовательностей CDR, присутствующих в иммуноглобулине легкой цепи или иммуноглобулине тяжелой цепи.
В совокупности шесть CDR придают антигенсвязывающую специфичность антителу. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичные по отношению к антигену) обладает способностью распознавать и связывать антиген, хотя обычно при более низкой аффинности, чем весь сайт связывания. «Fab-фрагмент» также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. «Fab-фрагмент» отличается от «Fab’-фрагмента» добавлением нескольких остатков на карбоксильном конце домена CH1 тяжелой цепи, в том числе одного или более цистеинов из шарнирной области антитела. «F(ab’)2-фрагмент» первоначально получают в виде пары «Fab» фрагментов», которые имеют шарнирные цистеины между ними. Специалистам в данной области техники известны такие способы получения фрагментов антител, как расщепление папаином или пепсином. Например, F(ab’)2-фрагменты могут быть получены путем расщепления пепсином молекулы антитела, а Fab-фрагменты могут быть получены путем восстановления дисульфидных мостиков F(ab’)2-фрагментов. В некоторых случаях могут быть построены библиотеки экспрессии Fab. Смотри, например, Huse et al, Science, 246:1275, 1989. После получения антитела или их фрагменты могут быть исследованы на распознавание полипептида TNFRSF25 с применением стандартных способов иммуноанализа, таких как методики ELISA, радиоиммунологические анализы и вестерн-блоттинг. Смотри, Short Protocols in Molecular Biology. Chapter 11, Green Publishing Associates and John Wiley & Sons, Ed. Ausubel et al., 1992.
Антитело может являться IgA-, IgD-, IgE, IgG- или IgM-типа, в том числе IgG- или IgM-типов, таких как, без ограничения этим, IgG1-, IgG2-, IgG3~, IgG4~, IgMl- и IgM2- типы. Например, в некоторых случаях антитело относится к IgG1-, IgG2- или IgG4-типу.
В некоторых вариантах осуществления антитела, как предлагается в данном документе, могут быть полностью человеческими или гуманизированными антителами. Под «антителом человека» подразумевается антитело, которое кодируется нуклеиновой кислотой (например, реорганизованным локусом тяжелой или легкой цепи иммуноглобулина человека), присутствующей в геноме человека. В некоторых вариантах осуществления антитело человека может быть получено в культуре клеток человека (например, клеток гибридомы кошачьих). В некоторых вариантах осуществления антитело человека может быть получено в клетке, не относящегося к человеку вида (например, клеточной линии мыши или хомяка). В некоторых вариантах осуществления человеческое антитело может быть получено в бактериальной или дрожжевой клетке.
Антитела человека могут избежать определенных проблем, связанных со ксеногенными антителами, такими как антитела, которые обладают вариабельными и/или постоянными областями мыши или крысы. Например, поскольку эффекторная часть является человеческой, она может лучше взаимодействовать с другими частями иммунной системы человека, например, для более эффективного уничтожения клеток-мишеней с помощью комплемент-зависимой цитотоксичности или антителозависимой клеточной цитотоксичности. Кроме того, иммунная система человека не должна распознавать антитело как чужеродное. Кроме того, период полураспада в кровотоке человека будет аналогичен встречающимся в природе антителам человека, позволяющим давать меньшие и менее частые дозы. Способы получения человеческих антител известны в данной области техники.
Используемый в данном документе термин «гуманизированное антитело» относится к антителу человека, которое содержит минимальную последовательность, полученную из иммуноглобулина не относящегося к человеку вида (например, мыши, хомяка, крысы, кролика или козы). Гуманизированные антитела обычно являются химерными или мутантными моноклональными антителами мыши, крысы, хомяка, кролика или других видов, несущих человеческие домены константной и/или вариабельной области или специфические изменения. В неограничивающих примерах, гуманизированные антитела представляют собой человеческие антитела (реципиентное антитело), в которых остатки гипервариабельной области (HVR) реципиентного антитела заменяют остатками HVR из антител, не относящихся к человеку видов (донорных), таких как антитело мыши, крысы, кролика или козы, имеющее желаемую специфичность, аффинность и способность. В некоторых вариантах осуществления каркасные Fv-остатки иммуноглобулина человека могут быть заменены соответствующими не относящимися к человеку остатками. В некоторых вариантах осуществления гуманизированные антитела могут содержать остатки, которые не обнаружены в организме реципиента или в донорском антителе. Такие модификации могут быть сделаны, например, для уточнения характеристик антитела.
В некоторых вариантах осуществления гуманизированное антитело может содержать по существу все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или, по существу, все гипервариабельные петли (CDR) соответствуют таковым из не относящегося к человеку иммуноглобулина, тогда как все или практически все каркасные области представляют собой таковые последовательности иммуноглобулина человека. Гуманизированное антитело также может содержать по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, иммуноглобулина человека.
В некоторых вариантах осуществления гуманизированное антитело или антигенсвязывающий фрагмент, как предлагается в данном документе, могут иметь уменьшенную или минимальную эффекторную функцию (например, по сравнению с соответствующим, не гуманизированным антителом), так что он не стимулирует действие эффекторных клеток в той же степени, что и соответствующее не гуманизированное антитело.
Методики получения гуманизированных антител хорошо известны специалистам в данной области техники. В некоторых вариантах осуществления может использоваться контролируемая перегруппировка доменов антител, соединенных через дисульфидные связи белка с образованием новых искусственных белковых молекул или «химерных» антител (Konieczny et al., Haematologia (Budap.) 14:95, 1981). Технология рекомбинантной ДНК может быть применена для конструирования слияний генов между последовательностями ДНК, кодирующими переменные домены легких и тяжелых цепей антитела мыши и константные домены легких и тяжелых цепей антитела человека (Morrison et al., Proc Natl Acad Sci USA 81:6851, 1984). Например, последовательности ДНК, кодирующие антигенсвязывающие части или CDR моноклональных антител мыши, могут быть привиты молекулярными способами в последовательности ДНК, кодирующие каркасы тяжелых и легких цепей антитела человека (Jones et al,, Nature 321:522, 1986; and Riechmann et al., Nature 332:323, 1988). Экспрессированные рекомбинантные продукты называют «реконфигурированными» или гуманизированными антителами и содержат каркас легкой или тяжелой цепи антитела человека и части распознавания антигена, CDR, моноклонального антитела мыши.
Другие способы конструирования тяжелых и легких цепей и для получения гуманизированных антител описаны, например, в патентах №№ США 5530101; 5565332; 5585089; 5,639,641, 5693761; 5693762; и 5733743, а дополнительные способы гуманизации антител описаны, например, в патентах США №№ 4816567; 4935496; 5502167; 5558864; 5693493, 5698417; 5705154; 5750078; и 5770403.
Термин «одноцепочечное антитело» относится к одноцепочечному полипептиду, который содержит по меньшей мере один вариабельный связывающий домен (например, вариабельный домен иммуноглобулина тяжелой или легкой цепи млекопитающих, VHH верблюда или домен Ig-NAR хрящевой рыбы (например, акулы)), который способен специфически связываться с антигеном. Неограничивающие примеры одноцепочечных антител включают однодоменные антитела.
Используемый данном документе термин «однодоменное антитело» относится к полипептиду, который содержит один VHH верблюда или по меньшей мере один Ig-NAR хрящевой рыбы, который способен специфически связываться с антигеном. Неограничивающие примеры однодоменных антител описаны, например, в публикации патента США № 2010/0092470.
Антитело или его антигенсвязывающий фрагмент «специфически связывается» с конкретным антигеном, например, TNFRFS25, когда он связывается с этим антигеном в образце и не распознает и не связывается или распознает и связывается с другими молекулами в образце в меньшей степени. В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент могут избирательно связываться с эпитопом с аффинностью (Kd), равной или менее, например, около 1 × 10-6 M (например, равной или менее около 1 × 10-9 M, равной или менее около 1 × 10-10 M, равной или менее около 1 × 10-11 M или равной или менее около 1 × 10-12 M) в фосфатно-солевом буферном растворе. Способность антитела или антигенсвязывающего фрагмента к специфическому связыванию с белковым эпитопом может быть определена с применением любого из способов, известных в данной области техники, или способов, описанных в данном документе (например, с помощью Biacore/поверхностного плазмонного резонанса). Это может включать, например, связывание с TNFRSF25 на живых клетках в качестве способа стимуляции активации каспазы в живых трансформированных клетках, связывание с иммобилизованным целевым субстратом, в том числе, слитыми белками TNFRSF25 человека, как обнаружено с применением способа ELISA, связывание с TNFRSF25 на живых клетках, что обнаруживают с помощью проточной цитометрии или связыванием с иммобилизованным субстратом с помощью поверхностного плазмонного резонанса (в том числе, ProteOn).
Антитела, обладающие специфической связывающей аффинностью к TNFRSF25, могут быть получены с применением стандартных способов. Например, полипептид TNFRSF25 (например, имеющий последовательность, представленную в SEQ ID NO: 1, SEQ ID NO: 2 или фрагмент SEQ ID NO: 1 или SEQ ID NO: 2, дина которого составляет по меньшей мере от шести до десяти аминокислот) может быть получен рекомбинантно, очищен от биологического образца (например, гетерологичной системы экспрессии) или химически синтезирован и применен для иммунизации животного-хозяина, в том числе, кроликов, цыплят, мышей, морских свинок или крыс. Различные адъюванты, которые могут быть применены для увеличения иммунологического ответа, зависят от видов хозяев и включают адъювант Фрейнда (полный и неполный), минеральные гели, такие как гидроксид алюминия, поверхностно-активные вещества, такие как лизолецитин, плюрониловые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин лимфы улитки и динитрофенол. Моноклональные антитела могут быть получены с применением полипептида TNFRSF25 и стандартной гибридомной технологии. В частности, моноклональные антитела могут быть получены любой методикой, которая предлагает получение молекул антитела при помощи перевиваемых клеточных линий в такой культуре, как описано в Kohler et al. (Nature 256:495, 1975), гибридомной методики В-клеток человека в Kosbor et al. (Immunology Today, 4:72, 1983) или Cote et al. (Proc. Natl. Acad. Sci. USA, 80:2026, 1983) и EBV-гибридомной методики, описанной Cole et al. (Monoclonal Antibodies and Cancer Therapy. Alan R. Liss, Inc., pp. 77-96, 1983). Такие антитела могут быть любого класса иммуноглобулинов, в том числе IgG, IgM, IgE, IgA, IgD, и любого их подкласса. Гибридома, которая производит моноклональные антитела, может быть культивирована in vitro и in vivo.
В некоторых вариантах осуществления моноклональное антитело анти-TNFRSF25, как предлагается в данном документе, имеет вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, приведенную в SEQ ID NO: 5, но с от одной до 24 модификаций (например, замены, добавления или делеции), такие как те, в которых аминокислотная последовательность на от 80 до 99,5 % идентична SEQ ID NO: 5. В некоторых вариантах осуществления моноклональное антитело анти-TNFRSF25, как предлагается в данном документе, имеет вариабельную область легкой цепи, содержащую аминокислотную последовательность, представленную в SEQ ID NO: 6, но с от одной до 23 модификаций (например, замены, добавления или делеции), так что аминокислотная последовательность на от 80 % до 99,9% идентична SEQ ID NO: 6. Последовательности SEQ ID NO: 5 и SEQ ID NO:6 являются следующими:
EVQLVESGGGLSQPGNSLQLSCEASGFTFSNHDLNWVRQAPGKGLEWVAYISSASGLISYADAVRGRFTISRDNAKNSLFLQMNNLKSEDTAMYYCARDPPYSGLYALDFWGQGTQVTVSS (SEQ ID NO: 5)
QPVLTQSPSASASLSGSVKLTCTLSSELSSYTIVWYQQRPDKAPKYVMYLKSDGSHSKGDGIPDRFSGSSSGAHRYLSISNVQSEDDATYFCGAGYTLAGQYGWVFGSGTKVTVL (SEQ ID NO: 6)
Таким образом, в этом документе предлагаются полипептиды вариабельной области тяжелой цепи, содержащие аминокислотную последовательность, представленную в SEQ ID NO: 5 или ее антигенсвязывающий фрагмент, нос от одной до 24 модификаций последовательности, так же как полипептиды, имеющие по меньшей мере около 80 % (например, около 85 %, около 90 %, около 91 %, около 92 %, около 93 %, около 94 %, около 95 %, около 96 %, около 97 %, около 98 % или около 99 %) идентичности аминокислотной последовательности по отношению к SEQ ID NO: 5 или ее антигенсвязывающему фрагменту. В некоторых вариантах осуществления полипептид вариабельной области тяжелой цепи может содержать 24 или менее (например, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, десять, девять, восемь, семь, шесть, пять, четыре, три, две или одну) аминокислотных замен по отношению к SEQ ID NO: 5 или ее антигенсвязывающему фрагменту.
Этот документ также предлагает полипептиды вариабельной области легкой цепи, содержащие аминокислотную последовательность, представленную в SEQ ID NO:6, или ее антигенсвязывающий фрагмент, но с от одной до 23 модификаций последовательности, а также полипептиды, имеющие по меньшей мере около 80 % (например, около 85 %, около 90 %, около 91 %, около 92 %, около 93 %, около 94 %, около 95 %, около 96 %, около 97 %, около 98 % или около 99 %) идентичности аминокислотной последовательности с SEQ ID NO:6 или ее антигенсвязывающему фрагменту. В некоторых вариантах осуществления полипептид вариабельной области легкой цепи может содержать 23 или менее (например, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, десять, девять, восемь, семь, шесть, пять, четыре, три, две или одну) аминокислотных замен по отношению к SEQ ID NO: 6 или ее антигенсвязывающему фрагменту.
Этот документ также предлагает антитела и антигенсвязывающие фрагменты, которые содержат и полипептид вариабельной области тяжелой цепи, и полипептид вариабельной области легкой цепи, как описано в данном документе. В некоторых вариантах осуществления, например, антитело или антигенсвязывающий фрагмент может содержать как последовательность вариабельной области тяжелой цепи, содержащую аминокислотную последовательность, представленную в SEQ ID NO: 5 с от одной до 24 аминокислотных замен (например, от одной до пяти, от пяти до десяти, от десяти до 15, от 15 до 20 или от 20 до 24 аминокислотных замен в общем), так и последовательность вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 6 с от одной до 23 аминокислотных замен (например, от одной до пяти, от пяти до десяти, от десяти до 15, от 15 до 20 или от 20 до 23 аминокислотных замен в общем). Аминокислотная замена относится к замене одного аминокислотного остатка в пептидной последовательности другим.
В некоторых вариантах осуществления антитело анти-TNFRSF25 или его антигенсвязывающий фрагмент, как предлагается в данном документе, может связываться с эпитопом TNFRSF25, который имеет аминокислотную последовательность с по меньшей мере 80 % идентичности (например, по меньшей мере 85 %, по меньшей мере 90 % или по меньшей мере 95 % идентичности) по отношению к последовательности, приведенной в C48-L71 SEQ ID NO: 1. Например, в некоторых случаях антитело или его антигенсвязывающий фрагмент могут связываться с эпитопом TNFRSF25, который имеет последовательность, приведенную в C48-L71 SEQ ID NO: 1, но с четырьмя или менее (например, тремя или менее или двумя или менее) аминокислотными заменами или с одной аминокислотной заменой.
В некоторых вариантах осуществления антитело анти-TNFRSF25 или его антигенсвязывающий фрагмент, как предлагается в данном документе, может связываться с эпитопом TNFRSF25, который имеет аминокислотную последовательность с по меньшей мере 85 % идентичности по отношению к последовательности, приведенной в P64-T69 SEQ ID NO: 1. Например, в некоторых случаях антитело или его антигенсвязывающий фрагмент могут связываться с эпитопом TNFRSF25, который имеет последовательность, приведенную в P64-T69 SEQ ID NO:1, но с одной аминокислотной заменой.
Как описано в данном документе, гуманизированное моноклональное антитело против TNFRSF25, полученное таким образом, как описано в другом месте (смотри, WO 2016/081455), применяют в исследованиях созревания аффинности, что приводит к идентификации нескольких модификаций CDR вариабельной области тяжелой и легкой цепей, которые, по-видимому, были связаны с повышенной аффинностью и/или активностью. Интересно, однако, и как обсуждается в Примере 3 в данном документе, клоны, демонстрирующие наибольшую аффинность связывания с TNFRSF25, не всегда являются клонами, которые имеют наибольшую активность по сравнению с исходным антителом. Например, клон, обозначенный в данном документе как «М5», показывает улучшенную агонистическую активность, определенную с помощью анализа высвобождения каспазы-3, но, как ни удивительно, его связывание со слитым белком TNFRSF25-Fc было значительно слабее, чем в случае большинства других клонов, идентифицированных с помощью скрининга комбинаторной библиотеки. Исключением из этого вывода был клон, идентифицированный как «M4», который проявляет как улучшенное связывание с TNFRSF25-Fc, так и улучшенную агонистическую активность по сравнению с исходным антителом.
Таким образом, в некоторых случаях антитела, предлагаемые в данном документе, могут иметь повышенную аффинность связывания в случае TNFRSF25, повышенную агонистическую активность (например, как определено с помощью анализа каспазы-3), или как повышенную аффинность, так и активность по сравнению с исходным гуманизированным антителом 4C12. Под «увеличенным» сродством или активностью подразумевают увеличение по меньшей мере 5 % (например, по меньшей мере 10 %, 20 %, 30 %, 40 %, 50 %, 60 %, 70 %, 80 %, 90 % 100 % или более 100 %) по сравнению с аффинной или агонистической активностью гуманизированного 4C12.
Последовательности вариабельных областей тяжелой и легкой цепей 4C12 приведены в данном документе в SEQ ID NO: 5 и 6, соответственно. Агонистическую активность антитела можно оценить с применением, например, анализа каспазы-3, как описано в данном документе, или анализа сигнальной активности рецептора TNFRSF25, как описано в другом источнике (смотри, например, Bu et al., Bone 33(5):760-770, 2003).
В некоторых вариантах осуществления, следовательно, этот документ предлагает полипептиды вариабельной области тяжелой цепи, содержащие последовательность CDR1, представленную в SEQ ID NO: 12, последовательность CDR2, представленную в SEQ ID NO: 14, и последовательность CDR3, как представлено в любой из SEQ ID NO: 16, 26 и 32. Полипептид также может включать каркасные (FW) последовательности тяжелой цепи вариабельной области, соединенные с CDR, в соответствии с формулой (FW1)-(CDR1)-(FW2)-(CDR2)-(FW3)-(CDR3)-(FW4), например. В некоторых вариантах осуществления FW последовательности могут представлять собой последовательности человека. В некоторых вариантах осуществления полипептид вариабельной области тяжелой цепи может включать последовательность FW1, представленную в SEQ ID NO: 11, последовательность FW2, представленную в SEQ ID NO: 13, последовательность FW3, представленную в SEQ ID NO: 15, и последовательность FW4, представленную в SEQ ID NO: 17.
В этом документе также предложены полипептиды вариабельной области легкой цепи, содержащие последовательность CDR1, как представлено в любой из SEQ ID NO: 25, 27 и 29, последовательность CDR2, представленную в SEQ ID NO: 21, и последовательность CDR3, как представлено в любой из SEQ ID NO:23, 28 и 30. Полипептид также может включать FW легкой цепи вариабельной области, сопоставимый между CDR, в соответствии с формулой (FW1)-(CDR1)-(FW2)-(CDR2)-(FW3)-(CDR3)-(FW4). В некоторых случаях FW последовательности могут представлять собой последовательности человека. В некоторых вариантах осуществления полипептид вариабельной области легкой цепи может включать последовательность FW1, представленную в SEQ ID NO: 18, последовательность FW2, представленную в SEQ ID NO.20, последовательность FW3, представленную в SEQ ID NO: 22 и последовательность FW4, представленную в SEQ ID NO: 24.
Этот документ также предлагает антитела и антигенсвязывающие фрагменты, которые содержат и полипептид вариабельной области тяжелой цепи, и полипептид вариабельной области легкой цепи, как описано в данном документе. В некоторых вариантах осуществления, например, антитело или антигенсвязывающий фрагмент может содержать как последовательность вариабельной области тяжелой цепи, имеющую последовательности CDR тяжелой цепи, как описано в данном документе, так и последовательность вариабельной области легкой цепи, имеющую последовательности CDR легкой цепи, как описано в данном документе. В некоторых случаях антитело не является антителом 4C12, таким образом, что оно не содержит вариабельную область тяжелой цепи CDRS, как представлено в SEQ ID NO: 12, 14 и 16, и не содержит CDR вариабельной области легкой цепи, как представлено в SEQ ID NO: 19, 21 и 23.
В некоторых вариантах осуществления аминокислотные замены могут быть получены путем выбора консервативных замен, которые существенно не отличаются по своему влиянию на поддержание (а) структуры пептидного остова в области замещения, (b) заряда или гидрофобности молекулы на целевом сайте или (c) общей части боковой цепи. Например, встречающиеся в природе остатки возможно разделить на группы, основанные на свойствах боковой цепи: (1) гидрофобные аминокислоты (норлейцин, метионин, аланин, валин, лейцин и изолейцин); (2) нейтральные гидрофильные аминокислоты (цистеин, серин и треонин); (3) кислые аминокислоты (аспарагиновая кислота и глутаминовая кислота); (4) основные аминокислоты (аспарагин, глутамин, гистидин, лизин и аргинин); (5) аминокислоты, которые влияют на ориентацию цепей (глицин и пролин); и (6) ароматические аминокислоты (триптофан, тирозин и фенилаланин). Замены, сделанные в этих группах, можно считать консервативными заменами. Неограничивающие примеры консервативных замен включают, без ограничения этим, замещение валина на аланин, лизина на аргинин, глутамина на аспарагин, глутаминовой кислоты на аспарагиновую кислоту, серина на цистеин, аспарагина на глутамин, аспарагиновой кислоты на глутаминовую кислоту, пролина на глицин, аргинина на гистидин, лейцина на изолейцин, изолейцина на лейцин, аргинина на лизин, лейцина на метионин, лейцина на фенилаланин, глицина на пролин, треонина на серин, серина на треонин, тирозина на триптофан, фенилаланина на тирозин и/или лейцина на валин. В некоторых вариантах осуществления аминокислотная замена может быть неконсервативной, так что член одного из классов аминокислот, описанных выше, обменивают на член другого класса.
Процент идентичности последовательности между конкретной нуклеиновой кислотой или аминокислотной последовательностью и последовательностью, на которую ссылается конкретный идентификационный номер последовательности, определяют следующим образом. Сначала последовательность нуклеиновой кислоты или аминокислоты сравнивают с последовательностью, представленную под определенным идентификационным номером последовательности, с применением программы BLAST 2 Sequences (B12seq) из автономной версии BLASTZ, содержащей BLASTN версии 2.0.14 и BLASTP версии 2.0.14. Эта отдельная версия BLASTZ может быть получена онлайн по адресу fr.com/blast или по адресу ncbi.nlm.nih.gov. Инструкции, объясняющие, как применять программу B12seq, можно найти в файле readme, сопровождающем BLASTZ. B12seq выполняет сравнение между двумя последовательностями, применяя либо алгоритм BLASTN, либо алгоритм BLASTP. BLASTN применяют для сравнения последовательностей нуклеиновых кислот, тогда как BLASTP применяют для сравнения аминокислотных последовательностей. Чтобы сравнить две последовательности нуклеиновой кислоты, параметры задаются следующим образом: -i устанавливают для файла, содержащего первую последовательность нуклеиновой кислоты, которую следует сравнивать (например, C:\seq1.txt); -j устанавливают для файла, содержащего вторую последовательность нуклеиновой кислоты, которую следует сравнивать (например, C:\seq2.txt); -p устанавливают для blastn; -o устанавливают для любого требуемого имени файла (например, C:\output.txt); -q устанавливают равным -1; -r устанавливают равным 2; а все остальные параметры оставляют в соответствии с их установками по умолчанию. Например, для генерирования выходного файла, содержащего сравнение между двумя последовательностями, можно применять следующую команду: C:\B12seq -i c:\seq1.txt -j c:\seq2.txt -p blastn -o c:\output.txt -q -1 -r 2. Для сравнения двух аминокислотных последовательностей параметры B12seq устанавливают следующим образом: -i устанавливают для файла, содержащего первую аминокислотную последовательность, которую следует сравнивать (например, C:\seq1.txt); -j устанавливают для файла, содержащего вторую аминокислотную последовательность, которую следует сравнивать (например, C:\seq2.txt); -p устанавливают для biastp; -o устанавливают для любого требуемого имени файла (например, C:\output.txt); а все остальные параметры оставляют в соответствии с их установками по умолчанию. Например, для генерирования выходного файла, содержащего сравнение между двумя аминокислотными последовательностями, можно применять следующую команду: C:\B12seq -i c:\seq1.txt -j c:\seq2.txt -p biastp -o c:\output.txt. Если две сравниваемые последовательности разделяют гомологию, то указанный выходной файл будет представлять эти области гомологии, как совмещенные последовательности. Если две сравниваемые последовательности не разделяют гомологию, то в указанном выходном файле совмещенных последовательностей не будет.
После совмещения количество совпадений определяется путем подсчета количества позиций, в которых идентичный нуклеотидный или аминокислотный остаток представлен в обеих последовательностях. Процент идентичности последовательности определяется путем деления числа совпадений либо на длину последовательности, представленной в идентифицированной последовательности (например, SEQ ID NO: 1), либо на длину сочлененной области (например, 100 последовательных нуклеотидов или аминокислотных остатков из последовательности, представленной в идентифицированной последовательности), с последующим умножением полученного значения на 100. Например, аминокислотная последовательность, которая имеет 110 совпадений при совмещении с последовательностью, представленной в SEQ ID NO: 1, имеет 90,9 %, идентичности с последовательностью, представленной в SEQ ID NO: 1 (например, 110 ÷ 121 × 100 = 90,9). Отмечают, что процентное значение идентичности последовательности округляют до ближайшей десятой. Например, 75,11, 75,12, 75,13 и 75,14 округляют в меньшую сторону до 75,1, тогда как 75,15, 75,16, 75,17, 75,18 и 75,19 округляют в большую сторону до 75,2. Также отмечают, что значение длины всегда будет целым числом.
Кроме того, в этом документе также предлагаются фармацевтические композиции, которые содержат фрагмент антитела или антигенсвязывающий фрагмент, как описано в данном документе, в комбинации с фармацевтически приемлемым носителем. «Фармацевтически приемлемый носитель» (также называемый «эксципиентом» или «носителем») представляет собой фармацевтически приемлемый растворитель, суспендирующее средство, стабилизирующее средство или любой другой фармакологически инертный носитель для доставки одного или нескольких терапевтических соединений субъекту (например, млекопитающему, такому как человек, нечеловекообразному примату, собаке, кошке, овце, свинье, лошади, корове, мыши, крысе или кролю), который нетоксичен по отношению к клетке или субъекту, подвергаемым воздействию при применяемых дозировках и концентрациях. Фармацевтически приемлемые носители могут быть жидкими или твердыми и могут быть выбраны с учетом предполагаемого способа введения, чтобы обеспечить требуемый объем, консистенцию и другие соответствующие транспортные и химические свойства в сочетании с одним или несколькими терапевтическими соединениями и любыми другими компонентами данной фармацевтической композиции. Типичные фармацевтически приемлемые носители, которые не вредно реагируют с аминокислотами, включают, например, воду, солевой раствор, связывающие средства (например, поливинилпирролидон или гидроксипропилметилцеллюлозу), наполнители (например, лактозу и другие сахара, желатин или сульфат кальция), смазывающие вещества (например, крахмал, полиэтиленгликоль или ацетат натрия), разрыхлители (например, крахмал или натрийгликолят крахмала) и смачивающие средства (например, лаурилсульфат натрия). Фармацевтически приемлемые носители также включают водные растворы для поддержания рН буфера или липосомы (небольшие везикулы, состоящие из различных типов липидов, фосфолипидов и/или поверхностно-активных веществ, которые полезны для доставки лекарственного средства млекопитающему). Дополнительные примеры фармацевтически приемлемых носителей включают такие буферы, как фосфатный, цитратный и другие органические кислоты, антиоксиданты, такие как аскорбиновая кислота, низкомолекулярные (менее чем около 10 остатков) полипептиды, белки, такие как сывороточный альбумин, желатин или иммуноглобулины, гидрофильные полимеры, такие как поливинилпирролидон, аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин, моносахариды, дисахариды и другие углеводы, в том числе глюкоза, манноза или декстрины, хелатирующие средства, такие как ЭДТА, сахарные спирты, такие как маннит или сорбит, солеобразующие противоионы, такие как натрий и/или неионные поверхностно-активные вещества, такие как TWEEN™, полиэтиленгликоль (ПЭГ) и PLURONICS™.
Фармацевтические композиции могут быть составлены путем смешивания одного или более активных средств с одним или более физиологически приемлемыми носителями, разбавителями и/или адъювантами и необязательно другими средствами, которые обычно входят в состав композиции для обеспечения улучшенного переноса, доставки, переносимости и тому подобного. Фармацевтическая композиция может быть составлена, например, в лиофилизированных составах, водных растворах, дисперсиях или твердых препаратах, таких как таблетки, драже или капсулы. Множество подходящих составов можно найти в формуляре, известном всем химикам-фармацевтам: Remington’s Pharmaceutical Sciences (18th ed, Mack Publishing Company, Easton, PA (1990)), в частности, Глава 87 авторства Block, Lawrence, вышеуказанного источника. Эти составы включают, например, порошки, пасты, мази, желе, воски, масла, липиды, содержащие липид (катионный или анионный) везикулы (такие как LIPOFECTIN™), ДНК-конъюгаты, безводные абсорбирующие пасты, эмульсии масло-в-воде и вода-в-масле, эмульсии карбовакс (полиэтиленгликоли с разной молекулярной массой), полутвердые гели и полутвердые смеси, содержащие карбовакс. Любая из вышеуказанных смесей может быть подходящей в лечении и терапии, как описано в данном документе, при условии, что активное средство в рецептуре не инактивируется составом, а препарат является физиологически совместимым и переносимым с применением способа введения. Смотри, также, Baldrick, Regul Toxicol Pharmacol 32:210-218, 2000; Wang, Ini J Pharm 203:1-60, 2000; Charm an J Pharm Sci 89:967-978, 2000; и Powell et al. PDA J Pharm Sci Technol 52:238-311, 1998) и ссылки на них для получения дополнительной информации, касающейся составов, эксципиентов и носителей, хорошо известных химикам-фармацевтам.
Фармацевтические композиции включают, без ограничения этим, растворы, эмульсии, водные суспензии и композиции, содержащие липосомы. Эти композиции могут быть получены из множества компонентов, которые включают, например, преформированные жидкости, самоэмульгирующиеся твердые вещества и самоэмульгирующиеся полуизомеры. Эмульсии часто представляют собой двухфазные системы, состоящие из двух несмешивающихся жидких фаз, тщательно перемешиваемых и диспергированных друг с другом; в общем, эмульсии представляют собой разновидности либо воду в масле (в/м), либо масло-в-воде (м/в). Эмульсионные составы широко применяют для пероральной доставки терапевтических средств из-за их легкости состава и эффективности солюбилизации, абсорбции и биодоступности.
Композиции и составы могут содержать стерильные водные растворы, которые также могут содержать буферы, разбавители и другие подходящие добавки (например, усилители проникновения, соединения-носители и другие фармацевтически приемлемые носители). Композиции дополнительно могут содержать другие вспомогательные компоненты, обычно применяемые в фармацевтических композициях. Таким образом, композиции также могут включать совместимые, фармацевтически активные материалы, такие как, например, противозудные средства, вяжущие средства, местные анестетики или противовоспалительные средства или дополнительные материалы, полезные при физической разработке различных дозированных форм предлагаемых в данном документе композиций, таких как красители, ароматизирующие средства, консерванты, антиоксиданты, замутнители, загустители, и стабилизаторы. Кроме того, композицию можно смешивать со вспомогательными средствами, например, смазывающими веществами, консервантами, стабилизаторами, смачивающими средствами, эмульгаторами, солями для воздействия на осмотическое давление, буферами, красителями, ароматизаторами и ароматическими веществами. Однако при добавлении такие материалы не должны чрезмерно мешать биологической активности полипептидных компонентов в композициях, представленных в данном документе. При необходимости, композиции можно стерилизовать.
В некоторых вариантах осуществления композиция, содержащая антитело или антигенсвязывающий фрагмент, как предлагается в данном документе, может быть в форме раствора или порошка с разбавителем или без него для изготовления инъекционной суспензии. Композиция может содержать дополнительные ингредиенты, в том числе, без ограничения этим, фармацевтически приемлемые носители, такие как физиологический раствор, вода, молочная кислота, маннит или их комбинации, например.
Любой подходящий способ может быть применен для введения антитела или антигенсвязывающего фрагмента, как описано в данном документе, млекопитающему. Введение может быть, например, парентеральным (например, путем подкожной, интратекальной, внутрижелудочковой, внутримышечной или внутрибрюшинной инъекции или с помощью внутривенного вливания). Введение может быть быстрым (например, путем инъекции) или может происходить в течение определенного периода времени (например, путем медленной инфузии или введения медленно высвобождающихся препаратов). В некоторых вариантах осуществления введение может быть местным (например, трансдермальным, сублингвальным, офтальмологическим или интраназальным), легочным (например, путем ингаляции или инсуффляции порошков или аэрозолей) или пероральным. Кроме того, композицию, содержащую антитело или антигенсвязывающий фрагмент, как описано в данном документе, можно вводить до, после или вместо хирургической резекции опухоли.
Композицию, содержащую антитело анти-TNFRSF25 или антигенсвязывающий фрагмент, можно вводить млекопитающему в любом подходящем количестве с любой подходящей частотой и для любой подходящей продолжительности, эффективной для достижения желаемого результата. Например, антитело анти-TNFRSF25 или антигенсвязывающий фрагмент возможно вводить субъекту в количестве, эффективном для стимулирования пролиферации Т-клеток in vitro или in vivo (например, Т-клетки человека, мыши, хомяка или макаки, в том числе Т-клетки CD8+ и/или регуляторные Т-клетки CD4+FoxP3+), чтобы стимулировать апоптоз опухолевых клеток, которые экспрессируют TNFRSF25, уменьшить размер опухоли или увеличить выживаемость больного раком без прогрессирования. В некоторых вариантах осуществления антитело анти-TNFRSF25 или антигенсвязывающий фрагмент можно вводить в дозировке от около 0,1 мг/кг до около 10 мг/кг (например, от около 0,1 мг/кг до около 1 мг/кг, от около 1 мг/кг до около 5 мг/кг или от около 5 мг/кг до около 10 мг/кг) и может вводиться один раз каждые от одной до трех недель (например, каждую неделю, каждые 10 дней, каждые две недели или каждые три недели).
Введение субъекту антитела или антигенсвязывающего фрагмента, как предлагается в настоящем документе, может приводить к увеличению числа Т-клеток (например, встречающихся в природе опухолереактивных Т-клеток CD8+ или регуляторных Т-клеток CD4+FoxP3+), которые могут оказывать противораковое действие против раковых клеток, присутствующих в млекопитающем. Таким образом, в этом документе также предлагаются способы стимуляции пролиферации Т-клеток у субъекта путем введения субъекту антитела, антигенсвязывающего фрагмента или композиции, как описано в данном документе. В некоторых случаях композицию, содержащую антитело анти-TNFRSF25 или антигенсвязывающий фрагмент, как описано в данном документе, могут вводиться субъекту в количестве, эффективном для увеличения пролиферации Т-клеток (например, по меньшей мере около 10 процентов, около 20 процентов, около 25 процентов, около 50 процентов, около 60 процентов, около 70 процентов, около 75 процентов, около 80 процентов, около 90 процентов, около 100 процентов или более 100 процентов) по сравнению с «базовым» уровнем пролиферации Т-клеток у субъекта до введения композиции или по сравнению с уровнем пролиферации Т-клеток у контрольного субъекта или популяции субъектов, которым композиция не вводилась. Т-клетки могут представлять собой, например, Т-клетки CD8+ или регуляторные Т-клетки CD4+FoxP3+. Любой подходящий способ может быть применен для определения того, увеличивается ли уровень пролиферации Т-клеток у субъекта. Такие способы могут включать, без ограничения этим, проточную цитометрию антигенспецифических Т-клеток (например, проточную цитометрию пропорции антигенспецифических Т-клеток CD8+ в виде доли от общего количества Т-клеточного пула CD8+), анализ маркеров пролиферации клеток (например, экспрессии Ki67) в Т-клетках CD8+, увеличение количества Т-клеток CD8+ или увеличение пропорций отдельных последовательностей TCR конкретного клона Т-клеток CD8+.
В этом документе также предлагаются способы промотирования апоптоза опухолевых клеток, экспрессирующих TNFRSF25, у субъекта путем обработки субъекта антителом, антигенсвязывающим фрагментом или композицией, как описано в данном документе. В некоторых случаях композицию, содержащую антитело или антигенсвязывающий фрагмент, как предлагается в данном документе, можно вводить субъекту (например, больному раком) в количестве, эффективном для увеличения апоптоза опухолевых клеток, экспрессирующих TNFRSF25 (например, по меньшей мере около 10 процентов, около 20 процентов, около 25 процентов, около 50 процентов, около 60 процентов, около 70 процентов, около 75 процентов, около 80 процентов, около 90 процентов, около 100 процентов или более 100 процентов), по сравнению с «базовым» уровнем апоптоза опухолевых клеток у субъекта до введения композиции или по сравнению с уровнем апоптоза опухолевых клеток у контрольного субъекта или популяции субъектов, которым композиция не вводилась. Любой подходящий способ может быть применен для определения того, увеличивается ли уровень апоптоза опухолевых клеток у субъекта. Это может включать, например, радиологические методики, такие как КТ или МРТ, с контрастом или без него, что указывает на наличие некротической или апоптотической опухоли, биопсию образца опухоли, указывающую на увеличение смерти опухолевых клеток, индукцию каспазы в опухолевых клетках, устранение выявляемых опухолевых поражений путем радиологического или хирургического или физического обследования.
Способы лечения субъекта (например, человека) с раком, в том числе солидных опухолей и лейкозов/лимфом) также предлагаются в данном документе. В некоторых случаях композицию, содержащую антитело-связывающий фрагмент антитела или антиген, как описано в данном документе, можно вводить субъекту, имеющему рак, в количестве, эффективном для снижения скорости прогрессирования рака (например, на по меньшей мере около 10 процентов, около 20 процентов, около 25 процентов, около 50 процентов, около 60 процентов, около 70 процентов, около 75 процентов, около 80 процентов, около 90 процентов или более 90 процентов) по сравнению со скоростью прогрессирования рака у субъекта до введения композиции или по сравнению со скоростью прогрессирования рака у контрольного субъекта или популяции субъектов, которым композиция не вводилась. В некоторых вариантах осуществления скорость прогрессирования может быть уменьшена, так что никакой дополнительной прогрессии рака не обнаруживают. Любой подходящий способ может быть применен для определения того, будет ли снижена частота прогрессирования рака. В случае рака кожи (например, меланомы), например, скорость прогрессирования может быть оценена путем визуализации ткани в разные моменты времени и определения количества присутствующих раковых клеток. Количество раковых клеток, определенных в ткани в разное время, можно сравнить, чтобы определить скорость прогрессирования. После лечения, как описано в данном документе, скорость прогрессирования может быть определена снова в течение другого временного интервала. В некоторых случаях, стадию рака после лечения можно определить и сравнить со стадией до лечения, чтобы определить, была ли снижена скорость прогрессирования.
Композицию, содержащую антитело или антигенсвязывающий фрагмент, как описано в данном документе, также могут вводить субъекту, имеющему рак, в условиях, когда повышенная выживаемость увеличивается (например, на по меньшей мере около 10 процентов, около 20 процентов, около 25 процентов, около 50 процентов, около 60 процентов, около 70 процентов, около 75 процентов, около 80 процентов, около 90 процентов, около 100 процентов или более 100 процентов) по сравнению с медианной выживаемостью без прогрессирования у соответствующих субъектов, имеющих рак и не подвергавшихся лечению, или медианной выживаемостью без прогрессирования у соответствующих субъектов, имеющих рак и подвергавшихся лечению другими видами терапии (например, только химиотерапевтическими средствами). Безрецидивная выживаемость может измеряться в течение любого периода времени (например, один месяц, два месяца, три месяца, четыре месяца, пять месяцев, шесть месяцев или более).
Эффективное количество композиции, содержащей предлагаемую в данном документе молекулу, может представлять собой любое количество, которое имеет желаемый эффект (например, стимулирует пролиферацию Т-клеток CD8+, стимулирует апоптоз опухолевых клеток, экспрессирующих TNFRSF25, стимулирует или вызывает иммунный ответ у субъекта, уменьшает размер опухоли, уменьшает скорость прогрессирования рака, увеличивает безрецидивную выживаемость больного раком или увеличивает среднее время до прогрессирования без существенной токсичности). Оптимальные дозы могут варьироваться в зависимости от относительной эффективности отдельных полипептидов (например, антител и антигенсвязывающих фрагментов) и их можно в целом оценивать на основе EC50, которые оказались эффективными в моделях животных in vitro и in vivo. Обычно, дозировка составляет от 0,01 до 100 г на кг массы тела. Например, эффективное количество антитела или антигенсвязывающего фрагмента может составлять от около 0,1 мг/кг до около 50 мг/кг (например, около 0,4 мг/кг, около 2 мг/кг, около 5 мг/кг, около 10 мг/кг, около 20 мг/кг, около 30 мг/кг, около 40 мг/кг или около 50 мг/кг) или любой диапазон между ними, например, от около 0,1 мг/кг до около 10 мг/кг, от около 0,4 мг/кг до около 20 мг/кг, от около 2 мг/кг до около 30 мг/кг или от около 5 мг/кг до около 40 мг/кг. Если конкретный субъект не реагирует на конкретное количество, то количество антитела или антигенсвязывающего фрагмента может быть увеличено, например, в два раза. После получения этой более высокой концентрации субъект может контролироваться как на реагирование на лечение, так и симптомы токсичности, и соответствующим образом вносят корректировки. Эффективное количество может оставаться постоянным или может быть скорректировано путем скользящей шкалы или переменной дозы в зависимости от ответа субъекта на лечение. Различные факторы могут влиять на фактическое эффективное количество, применяемое в случае конкретного применения. Например, частота введения, длительность лечения, применение нескольких лечебных средств, способ введения и тяжесть рака могут потребовать увеличения или уменьшения фактической эффективной дозы.
Частота введения может представлять собой любую частоту, которая, например, стимулирует пролиферацию Т-клеток CD8+, стимулирует апоптоз опухолевых клеток, экспрессирующих TNFRSF25, уменьшает размер опухоли, уменьшает скорость прогрессирования рака, увеличивает безрецидивную выживаемость больного раком или увеличивает среднее время до прогрессирования без существенной токсичности. Например, частота введения может составлять один или более раз в день, раз в две недели, еженедельно, ежемесячно или даже меньше. Частота введения может оставаться постоянной или может быть переменной во время лечения. Курс лечения может включать периоды отдыха. Например, композицию, содержащую антитело или антигенсвязывающий фрагмент, как предлагается в данном документе, можно вводить в течение двухнедельного периода с последующим двухнедельным периодом отдыха, а такой режим можно повторять множество раз. Как и в случае эффективного количества, различные факторы могут влиять на фактическую частоту введения, применяемую в случае конкретного применения. Например, эффективное количество, продолжительность лечения, применение нескольких лечебных средств, способ введения и тяжесть рака могут потребовать увеличения или уменьшения частоты введения.
Эффективная продолжительность введения композиции, предлагаемой в данной документе, может представлять собой любую продолжительность, которая стимулирует пролиферацию Т-клеток CD8+, стимулирует апоптоз опухолевых клеток, экспрессирующих TNFRSF25, уменьшает размер опухоли, уменьшает скорость прогрессирования рака, увеличивает безрецидивную выживаемость больного раком или увеличивает среднее время до прогрессирования без существенной токсичности. Таким образом, эффективная продолжительность может варьироваться от нескольких дней до нескольких недель, месяцев или лет. В общем, эффективная продолжительность лечения рака может варьироваться от нескольких недель до нескольких месяцев. В некоторых случаях, эффективная продолжительность может быть до тех пор, пока жив индивидуум. Множественные факторы могут влиять на фактическую эффективную продолжительность, применяемую в случае конкретного лечения. Например, эффективная продолжительность может варьироваться в зависимости от частоты введения, эффективного количества, применения нескольких лечебных средств, способа введения и степени тяжести рака.
После введения композиции, как предлагается в данном документе, больного раком, пациент может наблюдаться с целью контроля, чтобы определить, был ли вылечен рак. Например, субъект может быть оценен после лечения, чтобы определить, была ли уменьшена скорость прогрессирования рака (например, остановлена). Любой способ, в том числе те, которые являются стандартными в данной области, может применяться для оценки скорости прогрессирования и показателей выживаемости.
Способ применения фрагмента антитела или антигена, как предлагается в данном документе, может быть объединен с известными способами лечения рака, например, в виде комбинированных или дополнительных этапов лечения или в качестве дополнительных компонентов терапевтического состава. Например, усиление иммунной функции хозяина может быть полезным для борьбы с опухолями. Способы могут включать, без ограничения этим, стимулирование APC, например, путем инъекции в опухоль ДНК, кодирующей чужеродные MHC-антигены (в том числе опухолевые антигены, полученные в результате мутации антигены или другие антигены), или трансфекцию биопсированных опухолевых клеток генами, которые увеличивают вероятность распознавания иммунантигена (например, иммуностимулирующих цитокинов, GM-CSF или со-стимулирующих молекул B7.1, B7.2) опухоли. Другие способы могут включать, например, солюбилизацию специфических опухолевых антигенов вдепо или препараты с замедленным высвобождением, трансфекцию аллогенных опухолевых клеток адъювантными белками или белками-носителями антигена, трансфекцию аллогенных опухолевых клеток иммуностимулирующими белками, такими как альфа-галактозилцерамид, включение специфических опухолевых антигенов в схему вакцинации на основе вируса, инкорпорацию специфических опухолевых антигенов в схему вакцинации на основе Listeria, адаптивную клеточную иммунотерапию (в том числе Т-клетки с химерными антигенными рецепторами) или лечение активированными опухолеспецифическими T-клетками (в том числе размножаемые ex vivo инфильтрирующие опухоли лимфоциты). Адаптивная клеточная иммунотерапия может включать выделение инфильтрующих опухоли Т-лимфоцитов хозяина и расширение популяции in vitro (например, путем стимулирования с помощью IL-2). Затем T-клетки могут повторно вводиться хозяину. Другие способы лечения, которые могут применяться в комбинации с антителом или его антиген-связывающим фрагментом, как предлагается в данном документе, включают, например, лучевую терапию, химиотерапию, гормональную терапию и применение ингибиторов ангиогенеза. Дополнительные партнеры по комбинации, которые могут быть полезны, включают ингибиторы контрольных точек (например, анти-PD 1/L1, анти-CTLA-4, анти-LAG3, анти-B7-H3, анти-B7-H4, анти-TIM3, анти-TIGIT, анти-CD47, анти-TMIGD2, анти-BTLA, анти-CEACAM или анти-GARP), другие костимулирующие антитела (например, анти-OX40, анти-ICOS, анти-CD 137, анти-GITR или анти-CD40), (например, вакцины на основе вирусов, пептидные вакцины, цельноклеточные вакцины или вакцины на основе РНК) и средства направленного действия [например, HERCEPTIN® (трастузумаб), TARCEVA® (эрлотиниб), AVASTIN® (бевацизумаб) или IMBRUVICA® (ибрутиниб)].
Таким образом, в некоторых вариантах осуществления антитело анти-TNFRSF25 или антигенсвязывающий фрагмент могут быть применены в комбинации с одним или более дополнительными моноклональными антителами, которые ингибируют связывание PD-L1 с PD-1, ингибируют связывание CTLA-4 с CD80 или CD86, или активируют передачу сигналов посредством путей TNFRSF4, TNFRSF9 или TNFRSF18, например. Это также может включать введение с другим антителом, слитым белком или малой молекулой, которая связывает специфическую мишень с опухолевой клеткой (например, комбинации с моноклональными антителами, которые связывают, такие цели, как CD20, Her2, EGFRvIII, DR4, DR5, VEGF, CD39 и CD73). Антитело анти-TNFRSF25 или антигенсвязывающий фрагмент также можно применять в сочетании с методом противораковой вакцины для усиления активации специфичных к опухолевым антигенам Т-клеток у больного раком. Кроме того, антитело анти-TNFRSF25 или антиген связывающий фрагмент может быть применен после введения аутологичных или аллогенных Т или NK-клеток, сконструированных для экспрессии химерного рецептора Т-клеток, который распознает специфический опухолевый антиген. Кроме того, антитело анти-TNFRSF25 или антигенсвязывающий фрагмент можно применять в сочетании со стратегиями специфической химиотерапии или лучевой терапии в качестве способа размножения опухолеспецифических Т-клеток и повышения активности любого метода в качестве монотерапии у больного раком.
Когда одна или несколько обычных терапий сочетаются с лечением с применением антитела анти-TNFRSF25 или антигенсвязывающего фрагмента, как предлагается в данном документе для лечения рака, например, обычную терапию(-и) можно вводить до, после или одновременно с введением антитела анти-TNFRSF25 или антигенсвязывающего фрагмента. Например, блокирующее антитело PD-1 может быть введено пациенту перед введением антитела агониста TNFRSF25. Такой режим может быть циклическим в течение нескольких недель, месяцев или лет, например. В качестве альтернативы, блокирующее антитело PD-1 может быть введено одновременно с введением антитела агониста TNFRSF25 или после этого. Такой режим также может быть циклическим в течение нескольких недель, месяцев или лет. В некоторых вариантах осуществления комбинированные терапии, которые повторно вводят в течение определенного периода времени, могут включать две или более из вышеуказанных стратегий введения.
В некоторых вариантах осуществления антитело анти-TNFRSF25 или антигенсвязывающий фрагмент, как предлагается в данном документе, могут быть применены во время in vitro анализа или производственного процесса в качестве способа стимуляции пролиферации инфильтрирующих опухоли лимфоцитов, выделенных у больного раком, или для стимулирования пролиферации экспрессирующих химерный рецептор антигена Т-клеток, которые размножаются in vitro, и предназначены для последующей инфузии для лечения больного раком.
Также в данном документе предлагаются изделия, содержащие антитело или антигенсвязывающий фрагмент, как предлагается в данном документе, или фармацевтическую композицию, содержащую антитело или антигенсвязывающий фрагмент. Антитело или фармацевтическая композиция могут находиться внутри контейнера (например, бутылки, флакона или шприца). Изделие также может содержать этикетку с указаниями для восстановления и/или применения антитела, антигенсвязывающего фрагмента или композиции. В некоторых вариантах осуществления изделие может включать один или более дополнительных элементов (например, один или более буферов, разбавителей, фильтров, игл, шприцев и/или вкладышей пакетов с дополнительными инструкциями по применению). Также изделие может включать по меньшей мере одно дополнительное средство для лечения рака. Например, изделие, как предлагается в данном документе, может содержать средство, которое нацелено на CTLA-4, PD-1, PD-L1, LAG-3, Tim-3, TNFRSF4, TNFRSF9, TNFRSF18, CD27, CD39, CD47, CD73 или CD278. В некоторых вариантах осуществления изделие может содержать антагонист рецептора A2A или антагонист TGF-бета. В некоторых вариантах осуществления изделие может включать костимулирующую молекулу семейства B7 (например, CD28 или CD278) или костимулирующую молекулу суперсемейства рецептора TNF (например, TNFRSF4, TNFRSF9 или TNFRSF18), химиотерапевтическое средство или композицию анти-опухолевой вакцины.
Изобретение будет дополнительно описано в следующих примерах, которые не ограничивают объем изобретения, описанный в формуле изобретения.
ПРИМЕРЫ
Пример 1 - Картирование эпитопов
Подготавливали несколько экспрессионных конструкций TNFRSF25. Они включали либо весь внеклеточный домен (ECD), проходящий от Gin в положении 25 (Q25) до Phe в положении 201 (F201), либо разрешимый вариант сплайсинга, проходящий от Q25 до Thr в положении 181 (T181). Конструкции также включали различные метки, в том числе 6His, hFc-6His и mFc-His. Шесть конструкций (ТАБЛИЦА 1) трансфицировали в клетки 293F и измеряли их уровни экспрессии, как показано на ФИГ. 2.
M = разрешимый вариант сплайсинга (QGGT……SCPT)
Среди исследуемых конструкций W381-hProl.ECD-M.mFcH демонстрировал наивысшую экспрессию (ФИГ. 3). Таким образом, эту версию TNFRSF25 выбирали в качестве остова для картирования эпитопов на основе сканирования аланина.
Генерировали семьдесят три мутанта аланина и измеряли их экспрессию, как описано выше. Мутанты разделяли на пять групп на основе их уровней экспрессии (ТАБЛИЦЫ 2А и 2В) и применяли для анализа активности связывания.
Для идентификации эпитопа TNFRSF25, распознанного антителом, связывание антитела с мутеинами TNFRSF25 после этого оценивали с применением этапов, изображенных на ФИГ. 4. В частности, осуществляли исследования для оценки связывания химерного антитела W330-cAbl.hIgG1(35783) (исходное антитело анти-TNFRSF25 хомяка, которое было химерным с IgFc человека) с аланиновыми мутантами WBP330-hProl.ECD.hFcHis, которые экспрессировали при более чем 1500 нг/мл. Аффинность связывания с каждым мутеином сравнивали с аффинностью связывания с не мутировавшими WBP330-hProl.ECD.hFcHis (ФИГ. 5). Мутеины, которые проявляют изменение сигнала более, чем на 25 % (кратность изменения <0,75; ТАБЛИЦА 3 и ФИГ. 6) применяли для структурного моделирования (ФИГ. 7 и 8).
Кроме того, проводили исследования для определения того, может ли антитело ингибировать связывание TL1A с TNFRSF25 и наоборот. Как показано на ФИГ. 9, связывание антитела анти-TNFRSF25 («исходного антитела хомяка») с рекомбинантным TNFRSF25 человека блокировали с помощью TL1A-Ig (левая пара столбцов). И наоборот, связывание слитого TL1A-Ig с рекомбинантным TNFRSF25 человека блокировали с помощью исходного антитела анти-TNFRSF25 (центральная пара столбцов). Кроме того, связывание гуманизированного антитела анти-TNFRSF25 (полученного из «исходного антитела хомяка») с рекомбинантным TNFRSF25 человека блокировали с помощью TL1A-Ig (правая пара столбцов).
ОК = Отрицательный контроль (только клетки 293F ).
Пример 2 - Способы созревания аффинности и исследования
Оптимизация аффинности антитела W3153-P8R32-H6: Каждая аминокислота трех CDR исходного клона индивидуально подвергалась процессу мутации по всем 20 аминокислотам с применением способа гибридизационного мутагенеза (Kunkel, Proc Natl Acad Sci USA 82(2):488-492, 1985). ДНК-праймеры, содержащие кодон NNS, кодирующий 20 аминокислот, применяли для введения мутаций в каждое целевое положение CDR. Отдельные вырожденные праймеры применяли в реакциях гибридизационного мутагенеза. Вкратце, каждый вырожденный праймер фосфорилировали, а затем применяли в соотношении 10:1 с уридинилированной ssDNA. Смесь нагревали до 85°С в течение 5 минут, а затем охлаждали до 55°С в течение 1 часа. После этого добавляли Т4-лигазу и ДНК-полимеразу Т4 и смесь инкубировали в течение 1,5 часов при 37°С. Продукты синтеза в случае CDR VH и VL объединяли, соответственно. Как правило, 200 нг объединенной библиотеки ДНК электропорировали в BL21 для образования бляшек на бактериальном газоне BL21 или для получения scFv-фрагментов.
Последовательности исходных тяжелых и легких цепей и их областей CDR и FW представляли собой следующие:
Вариабельная область тяжелой цепи:
EVQLVESGGGLSQPGNSLQLSCEASGFTFSNHDLNWVRQAPGKGLEWVAYISSASGLISYADAVRGRFTISRDNAKNSLFLQMNNLKSEDTAMYYCARDPPYSGLYALDFWGQGTQVTVSS (SEQ ID NO: 5)
FW1: EVQLVESGGGLSQPGNSLQLSCEAS (SEQ ID NO: 11)
CDR1: GFTFSNHDLN (SEQ ID NO: 12)
FW2: WVRQAPGKGLEWVA (SEQ ID NO: 13)
CDR2: YISSASGLISYADAVRG (SEQ ID NO: 14)
FW3: RFIISRDNAKNSLFLQMNNLKSEDTAMYYCAR (SEQ ID NO: 15)
CDR3: DPPYSGLYALDF (SEQ ID NO: 16)
FW4: WGQGTQVTVSS (SEQ ID NO: 17)
Вариабельная область легкой цепи: QPVLTQSPSASASLSGSVKLTCTLSSELSSYT IVWYQQRPDKAPKYVMYLKSDGSHSKGDGIPDRFSGSSSGAHRYLSISNVQSEDDATYF CGAGYTLAGQYGWVFGSGTKVTVL (SEQ ID NO: 6)
FW1: QPVLTQSPSASASLSGSVKLTC (SEQ ID NO: 18)
CDR1: TLSSELSSYTIV (SEQ ID NO: 19)
FW2: WYQQRPDKAPKYVMY (SEQ ID NO: 20)
CDR2: LKSDGSHSKGD (SEQ ID NO: 21)
FW3: GIPDRFSGSSSGAHRYLSISNVQSEDDATYF (SEQ ID NO: 22)
CDR3: CGAGYTLAGQYGWV (SEQ ID NO: 23)
FW4: FGSGTKVTVL (SEQ ID NO: 24)
Первичный скрининг библиотеки scFv: Первичный скрининг состоял из одноточечного анализа ELISA (SPE), который проводили с применением периплазматического экстракта (PE) бактерий, выращенных в 96-луночных (глубоких) планшетах. Вкратце, этот ELISA с захватом включал покрытие отдельных лунок из 96-луночного планшета от Maxisorp Immunoplate с помощью антитела анти-c-myc в покрывающем буфере (200 мM Na2CO3/NaHCO3) при pH 9,2 в течение ночи при 4 °C. На следующий день планшет блокировали казеином в течение 1 часа при комнатной температуре. Затем в планшет добавляли PE scFv и инкубировали при комнатной температуре в течение 1 часа. После промывания биотинилированный антигенный белок добавляли в лунку и инкубировали смесь в течение 1 часа при комнатной температуре. После этого следовала инкубация с конъюгатом стрептавидина-пероксидазы хрена (HRP) в течение 1 часа при комнатной температуре. Активность HRP определяли с помощью субстрата тетраметилбензидина (TMB) и гасили реакцию с помощью 2M HCl. Планшеты считывали при 450 нм. Клоны, демонстрирующие сигнал оптической плотности (OD) при 450 нм, который был больше, чем сигнал OD исходного клона, улавливали и повторно анализировали с помощью ELISA (как описано выше) в двух экземплярах для подтверждения положительных результатов. Секвенировали клоны, которые неоднократно демонстрировали сигнал, превышающий сигнал исходного антитела. Концентрацию белка scFv каждого клона, который имел изменение CDR, затем определяли с помощью количественного ELISA scFv, где scFv с известной концентрацией применяли в качестве эталона. Концентрацию белка scFv определяли путем сравнения сигналов ELISA с сигналами, генерируемыми контрольным scFv. Анализ связывания повторяли еще раз для всех положительных вариантов при нормализованных концентрациях scFv, чтобы определить относительную аффинность связывания мутантного scFv и исходного антитела. Выбранные совпадения scFv, демонстрирующие улучшенное связывание, повторно составляли в IgG1 и исследовали в анализе каспазы-3, как описано ниже.
Комбинаторный скрининг библиотеки scFv: Точечные мутации в VH и VL цепях, которые определяли как выгодные для связывания с антигеном, объединяли, чтобы определить, достигнута ли дополнительная синергия связывания. Комбинаторные мутанты экспрессировали в виде scFv и подвергали скринингу с применением ELISA с захватом. Клоны, демонстрирующие сигнал OD при 450 нм, который был больше, чем сигнал OD исходного клона, секвенировали и дополнительно оценивали путем связывания ELISA, как описано выше. Одиннадцать топовых клонов выбирали для повторного форматирования IgG4 и дополнительного исследования, как описано выше.
Повторное форматирование, переходная экспрессия и очистка мутантов 4C12 с улучшенной аффинностью: V-гены клонов топ-rScFv, идентифицированные из первичного и комбинаторного скрининга, амплифицировали с помощью ПЦР и клонировали в патентованный экспрессирующий вектор WuXi Biology и экспрессировали из клеток 293F. Супернатанты культуры, содержащие антитела, собирали и очищали с применением хроматографии с белком А.
Анализ высвобождения каспазы: Клетки P815, экспрессирующие TNFRSF25, инкубировали с различными концентрациями антител (от 1 мкг/мл до 1 нг/мл) в течение 5 часов при 37 °С в 96-луночном планшете. Активность каспазы определяли с применением набора реактивов для определения гомогенной каспазы (Roche: 005372001). Флуоресценцию считывали с помощью планшет-ридера Molecular Devices SPECTRAMAX® M5e.
Конкурентные анализы: Исходные клетки p815 и клетки p815, экспрессирующие TNFRSF25 человека (также называемые p815-hDR3), культивировали в суспензии в IMDM + 10 % FBS. Клетки подсчитывали во время сбора, гранулировали и ресуспендировали в концентрации 300000 клеток/100 мкл в бессывороточной среде. 100 мкл аликвоты клеточной суспензии помещали в пробирки Эппендорфа.
ALEXAFLUOR® 647 (AF647)-конъюгированный 4C12 и hTL1A-Ig (очистка AKTA, этап 1) получали с применением набора для мечения Molecular Probes ALEXA FLUOR® (R# 170512) согласно инструкциям производителя. Степень маркировки для 4C12-AF647 составляла 5,98 молей красителя на антитело, а в случае hTL1A-Ig-AF647 степень маркировки составляла 4,55 молей красителя на белок (оба считали находящимися в допустимом диапазоне).
hTL1A-Ig-AF647 или 4C12-AF647 добавляли в пробирки Эппендорфа в концентрации 0,5 мкг/мл. Немеченый 4C12 с созревшей аффинностью 4C12 (подтип hIgG1) или изотипический контрольный hIgG1 добавляли сразу после этого в концентрациях от 2 мкг/мл до 0,0078 мкг/мл. Смеси инкубировали при 37°С во влажном инкубаторе с 5 % CO2 в течение 1 часа. Клетки подвергали гранулированию в микроцентрифуге и промывали один раз с помощью буфера FACS. Пеллеты ресуспендировали в 300 мкл буфера FACS и анализировали с помощью проточного цитометра Sony SH800. Живые отдельные клетки закрывали и определяли MFI для AF647 в случае каждого образца.
Пример 3 - Результаты созревания аффинности и исследования
Первичный скрининг давал 11 мутантов в 7 позициях CDR, которые демонстрировали сигнал ELISA с захватом по меньшей мере в 2 раза выше, чем у дикого типа (ТАБЛИЦА 4). Множественные мутации в положении 42 в CDR1 легкой цепи последовательно демонстрировали улучшенное связывание с белком TNFRSF25-Fc. Замена Ser на Trp в этом положении приводила к более чем 10-кратному увеличению сигнала ELISA. Две другие мутации, Ala в Thr в положении 27 в CDR3 тяжелой цепи и Tyr в Phe в положении 43 в CDR1 легкой цепи, также показали значительное улучшение связывания. Эти мутанты преобразовывали в IgG1 и тестировали на активность с применением анализа каспазы-3 (ТАБЛИЦА 5). Только мутанты в положении 42 показали улучшенную активность в анализе высвобождения каспазы-3. Один конкретный клон IgG W3072-z4C12-RI-42G2-uIgG1L, который содержит мутацию Ser в Trp в CDR1 легкой цепи, показал наибольший рост агонистической активности каспазы-3.
Совпадения первичного скрининга
OD450
OD450
OD450
OD450
¶ W381-1H11-scFv
† Неспецифический контроль
‡ исходный клон W3072-z4C12.
Результаты высвобождения каспазы
Все индивидуальные мутации, улучшающие аффинность, идентифицированные в первичном скрининге, применяли для проектирования и построения библиотеки комбинаторных мутантов. Эту библиотеку проверяли, чтобы идентифицировать комбинации мутаций, которые оказывают синергетическое воздействие на улучшение связывания. Одиночный мутантный клон 42G2 применяли в качестве эталона. Выявляли несколько комбинационных клонов-мутантов со значительным улучшением связывания с белком TNFRSF25-Fc (ФИГ. 10). Однако только один комбинационный мутант 9G2 включал мутацию Ser в Trp в легкой цепи CDR1. Этот клон, а также три дополнительных клона, которые показали сильнейшее связывание с белком TNFRSF25-Fc (9A5, 1F10 и 5A6) выбирали для конверсии IgG и дополнительного исследования (ТАБЛИЦА 6).
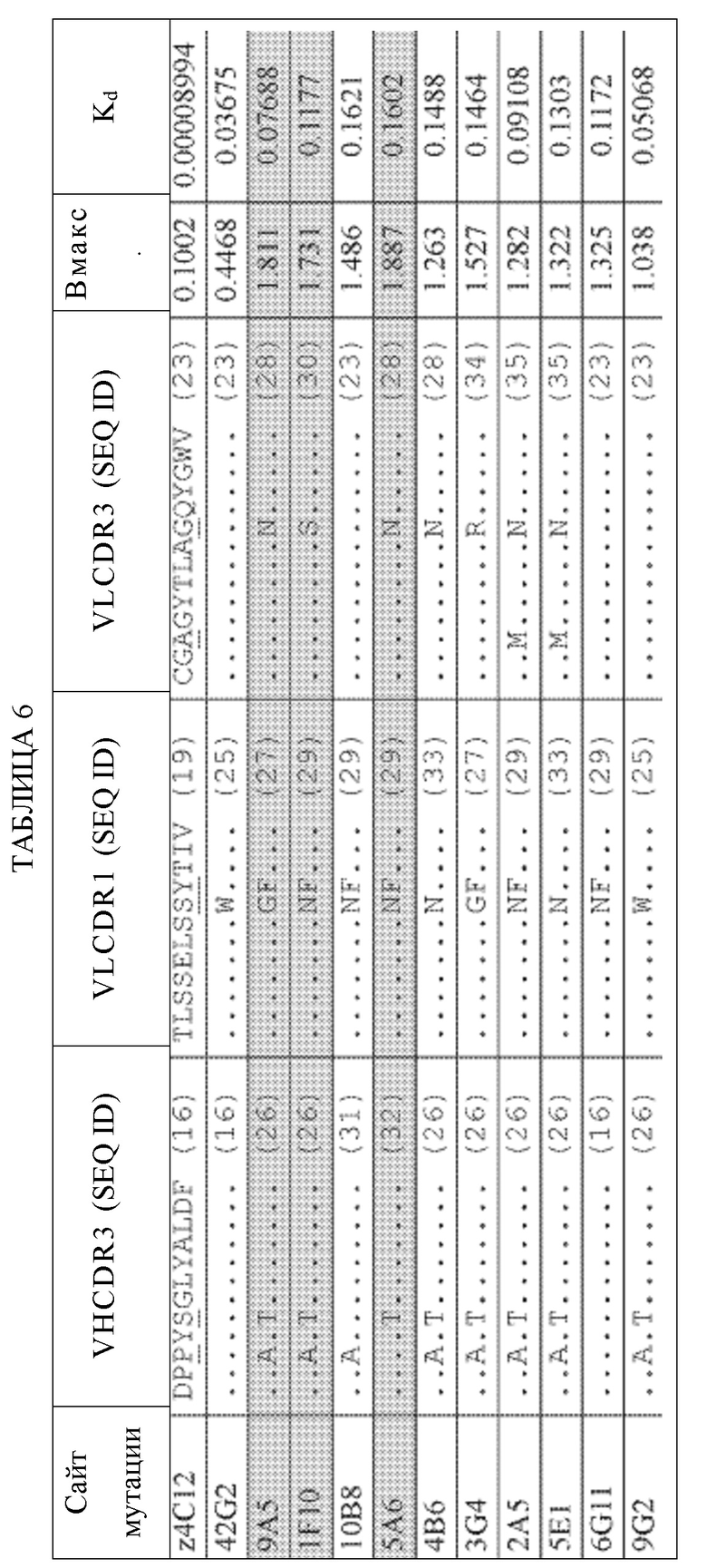
После преобразования IgG клоны с улучшенным связыванием с белком TNFRSF25-Fc обозначали следующим образом;
1F10 → W3072-z4C12-m1 (также упоминается в данном документе как M1)
5A6 → W3072-z4C12-m2 (также упоминается в данном документе как M2)
9A5 → W3072-z4C12-m3 (также упоминается в данном документе как M3)
9G2 → W3072-z.4C12-m4 (также упоминается в данном документе как M4)
42G2 → W3072-z4C12-m5 (также упоминается в данном документе как M5)
Анализ высвобождения каспазы-3, выявил, что только M5 и M4 (оба содержат замену Ser→Trp в легкой цепи CDR1) демонстрировали улучшенную агонистическую активность по сравнению с исходным гуманизированным клоном (W330-hAb35816, полученным с помощью CDR-прививки) и природным лигандом TL1A, тогда как три других мутанта показывали низкую агонистическую активность (ФИГ. 11A и 11B, ТАБЛИЦА 6), но более высокую аффинность к TNFRSF25, чем исходное антитело (ФИГ. 10). Интересно, что клон M4 с более высокой аффинностью имел более высокую амплитуду ответа, чем клон M5 (ФИГ. 11B). Клон с наивысшей аффинностью, М3, обладал агонистической активностью, которая была хуже, чем у исходного гуманизированного антитела и химерного клона (ФИГ. 11А). Также было удивительно, что гуманизированное исходное антитело имело значительно более высокую амплитуду ответа по сравнению с химерным исходным антителом (ФИГ. 11A).
M5 и M4 переформатированы в форматы IgG4 и IgG1 и IgG4, которые исследовали в анализе высвобождения каспазы-3. Эти исследования показали, что антитела, отформатированные IgG1, последовательно демонстрировали улучшенную агонистическую активность по сравнению с исходным гуманизированным 4C12 IgG1 (W330-hAb35816; ТАБЛИЦА 7).
Конкурентные исследования проводили для определения того, могут ли антитела с созревшей аффинностью конкурировать с 4C12 или TL1A для связывания с TNFRSF25. В первом эксперименте все образцы получали 0,5 мкг/мл hTL1A-Ig-AF647, который конкурировал с немеченым 4C12-M3, 4C12-M4, 4C12-M5 и 4C12. Как показано на ФИГ.
13А, антитела М4 и М5 демонстрировали более сильную конкуренцию против TL1A, чем исходное антитело 4C12. Таким образом, хотя M4 и M5 показали более слабое связывание с TNFRSF25-Fc, чем M3 (9A5, ФИГ. 10), но более сильное связывание, чем исходное антитело (WT; ФИГ. 10), они оказались более сильными конкурентами связывания TL1A с экспрессируемым клеточной поверхностью TNFRSF25. Образцы, не получавшие hTL1A-Ig-AF647, имели MFI около 1000, а образцы, получающие изотип hIgG1, имели MFI около 3320.
Проводили дополнительные конкурентные анализы, в которых все образцы получали 0,5 мкг/мл 4C12-AF647, который являлся конкурентом по отношению к немеченым 4C12-M3, 4C12-M4 и 4C12-M5 при длительных концентрациях немеченых антител до 8 мкг/мл, чтобы завершить кривую связывания. Как показано на ФИГ. 13B, немеченый исходный 4C12 конкурирует с меченым 4C12, тогда как изотип hIgG1 не имел конкурентного эффекта. Образцы, не получающие 4C12-AF647, имели MFI около 1400. Антитела 4C12, M4 и M5 с созревшей аффинностью демонстрировали аналогичную конкуренцию по отношению к меченым 4C12, в то время как M3 был самым слабым конкурентным ингибитором.
Таким образом, когда гуманизированное антитело 4C12 было с созревшей аффинностью, первичный скрининг (путем насыщенного мутагенеза антител CDR) идентифицировал множественные мутанты с улучшенным связыванием с белком TNFRSF25-Fc. В частности, клон M5, содержащий мутацию Ser→Trp в легкой цепи CDR1, показывал улучшенную агонистическую активность, что определяли с помощью анализа высвобождения каспазы-3. В скрининге комбинаторной библиотеки получали множественные мутанты со значительно более сильным связыванием, чем M5, с белком TNFRSF25-Fc, но, как ни удивительно, большинство из них проявляли худшую агонистическую активность по сравнению с исходными антителами. Исключением этого был M4, который содержал ту же мутацию Ser→Trp в CDR1 легкой цепи, как M5. Только M5 и M4 показали как улучшенную агонистическую активность в анализе высвобождения каспазы-3, так и улучшенное связывание со слитым белком TNFRSF25-Fc. Кроме того, эти клоны также демонстрировали более сильное конкурентное связывание против TL1A с экспрессируемым клеткой TNFRSF25, по сравнению с исходным 4C12 (ФИГ. 13A), сохраняя сопоставимую конкуренцию против связывания 4C12 с TNFRSF25 (ФИГ. 13B).
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Следует понимать, что, хотя изобретение описано в связи с его подробным описанием, приведенное выше описание предназначено для иллюстрации и не ограничивает объем изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации находятся в рамках следующих пунктов формулы изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ПЕЛИКАН ТЕРАПЬЮТИКС, ИНК.
<120> АНТИТЕЛА АНТИ-TNFRSF25
<130> 37405-0012WO1
<150> US 62/348009
<151> 09.06.2016
<160> 35
<170> PatentIn версия 3.5
<210> 1
<211> 417
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Met Glu Gln Arg Pro Arg Gly Cys Ala Ala Val Ala Ala Ala Leu Leu
1 5 10 15
Leu Val Leu Leu Gly Ala Arg Ala Gln Gly Gly Thr Arg Ser Pro Arg
20 25 30
Cys Asp Cys Ala Gly Asp Phe His Lys Lys Ile Gly Leu Phe Cys Cys
35 40 45
Arg Gly Cys Pro Ala Gly His Tyr Leu Lys Ala Pro Cys Thr Glu Pro
50 55 60
Cys Gly Asn Ser Thr Cys Leu Val Cys Pro Gln Asp Thr Phe Leu Ala
65 70 75 80
Trp Glu Asn His His Asn Ser Glu Cys Ala Arg Cys Gln Ala Cys Asp
85 90 95
Glu Gln Ala Ser Gln Val Ala Leu Glu Asn Cys Ser Ala Val Ala Asp
100 105 110
Thr Arg Cys Gly Cys Lys Pro Gly Trp Phe Val Glu Cys Gln Val Ser
115 120 125
Gln Cys Val Ser Ser Ser Pro Phe Tyr Cys Gln Pro Cys Leu Asp Cys
130 135 140
Gly Ala Leu His Arg His Thr Arg Leu Leu Cys Ser Arg Arg Asp Thr
145 150 155 160
Asp Cys Gly Thr Cys Leu Pro Gly Phe Tyr Glu His Gly Asp Gly Cys
165 170 175
Val Ser Cys Pro Thr Ser Thr Leu Gly Ser Cys Pro Glu Arg Cys Ala
180 185 190
Ala Val Cys Gly Trp Arg Gln Met Phe Trp Val Gln Val Leu Leu Ala
195 200 205
Gly Leu Val Val Pro Leu Leu Leu Gly Ala Thr Leu Thr Tyr Thr Tyr
210 215 220
Arg His Cys Trp Pro His Lys Pro Leu Val Thr Ala Asp Glu Ala Gly
225 230 235 240
Met Glu Ala Leu Thr Pro Pro Pro Ala Thr His Leu Ser Pro Leu Asp
245 250 255
Ser Ala His Thr Leu Leu Ala Pro Pro Asp Ser Ser Glu Lys Ile Cys
260 265 270
Thr Val Gln Leu Val Gly Asn Ser Trp Thr Pro Gly Tyr Pro Glu Thr
275 280 285
Gln Glu Ala Leu Cys Pro Gln Val Thr Trp Ser Trp Asp Gln Leu Pro
290 295 300
Ser Arg Ala Leu Gly Pro Ala Ala Ala Pro Thr Leu Ser Pro Glu Ser
305 310 315 320
Pro Ala Gly Ser Pro Ala Met Met Leu Gln Pro Gly Pro Gln Leu Tyr
325 330 335
Asp Val Met Asp Ala Val Pro Ala Arg Arg Trp Lys Glu Phe Val Arg
340 345 350
Thr Leu Gly Leu Arg Glu Ala Glu Ile Glu Ala Val Glu Val Glu Ile
355 360 365
Gly Arg Phe Arg Asp Gln Gln Tyr Glu Met Leu Lys Arg Trp Arg Gln
370 375 380
Gln Gln Pro Ala Gly Leu Gly Ala Val Tyr Ala Ala Leu Glu Arg Met
385 390 395 400
Gly Leu Asp Gly Cys Val Glu Asp Leu Arg Ser Arg Leu Gln Arg Gly
405 410 415
Pro
<210> 2
<211> 393
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Gln Gly Gly Thr Arg Ser Pro Arg Cys Asp Cys Ala Gly Asp Phe His
1 5 10 15
Lys Lys Ile Gly Leu Phe Cys Cys Arg Gly Cys Pro Ala Gly His Tyr
20 25 30
Leu Lys Ala Pro Cys Thr Glu Pro Cys Gly Asn Ser Thr Cys Leu Val
35 40 45
Cys Pro Gln Asp Thr Phe Leu Ala Trp Glu Asn His His Asn Ser Glu
50 55 60
Cys Ala Arg Cys Gln Ala Cys Asp Glu Gln Ala Ser Gln Val Ala Leu
65 70 75 80
Glu Asn Cys Ser Ala Val Ala Asp Thr Arg Cys Gly Cys Lys Pro Gly
85 90 95
Trp Phe Val Glu Cys Gln Val Ser Gln Cys Val Ser Ser Ser Pro Phe
100 105 110
Tyr Cys Gln Pro Cys Leu Asp Cys Gly Ala Leu His Arg His Thr Arg
115 120 125
Leu Leu Cys Ser Arg Arg Asp Thr Asp Cys Gly Thr Cys Leu Leu Gly
130 135 140
Phe Tyr Glu His Gly Asp Gly Cys Val Ser Cys Pro Thr Ser Thr Leu
145 150 155 160
Gly Ser Cys Pro Glu Arg Cys Ala Ala Val Cys Gly Trp Arg Gln Met
165 170 175
Phe Trp Val Gln Val Leu Leu Ala Gly Leu Val Val Pro Leu Leu Leu
180 185 190
Gly Ala Thr Leu Thr Tyr Thr Tyr Arg His Cys Trp Pro His Lys Pro
195 200 205
Leu Val Thr Ala Asp Glu Ala Gly Met Glu Ala Leu Thr Pro Pro Pro
210 215 220
Ala Thr His Leu Ser Pro Leu Asp Ser Ala His Thr Leu Leu Ala Pro
225 230 235 240
Pro Asp Ser Ser Glu Lys Ile Cys Thr Val Gln Leu Val Gly Asn Ser
245 250 255
Trp Thr Pro Gly Tyr Pro Glu Thr Gln Glu Ala Leu Cys Pro Gln Val
260 265 270
Thr Trp Ser Trp Asp Gln Leu Pro Ser Arg Ala Leu Gly Pro Ala Ala
275 280 285
Ala Pro Thr Leu Ser Pro Glu Ser Pro Ala Gly Ser Pro Ala Met Met
290 295 300
Leu Gln Pro Gly Pro Gln Leu Tyr Asp Val Met Asp Ala Val Pro Ala
305 310 315 320
Arg Arg Trp Lys Glu Phe Val Arg Thr Leu Gly Leu Arg Glu Ala Glu
325 330 335
Ile Glu Ala Val Glu Val Glu Ile Gly Arg Phe Arg Asp Gln Gln Tyr
340 345 350
Glu Met Leu Lys Arg Trp Arg Gln Gln Gln Pro Ala Gly Leu Gly Ala
355 360 365
Val Tyr Ala Ala Leu Glu Arg Met Gly Leu Asp Gly Cys Val Glu Asp
370 375 380
Leu Arg Ser Arg Leu Gln Arg Gly Pro
385 390
<210> 3
<211> 433
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Tyr Pro Ser Gly Val Ile Gly Leu Val Pro His Leu Gly Asp Arg Glu
1 5 10 15
Lys Arg Asp Ser Val Cys Pro Gln Gly Lys Tyr Ile His Pro Gln Asn
20 25 30
Asn Ser Ile Cys Cys Thr Lys Cys His Lys Gly Thr Tyr Leu Tyr Asn
35 40 45
Asp Cys Pro Gly Pro Gly Gln Asp Thr Asp Cys Arg Glu Cys Glu Ser
50 55 60
Gly Ser Phe Thr Ala Ser Glu Asn His Leu Arg His Cys Leu Ser Cys
65 70 75 80
Ser Lys Cys Arg Lys Glu Met Gly Gln Val Glu Ile Ser Ser Cys Thr
85 90 95
Val Asp Arg Asp Thr Val Cys Gly Cys Arg Lys Asn Gln Tyr Arg His
100 105 110
Tyr Trp Ser Glu Asn Leu Phe Gln Cys Phe Asn Cys Ser Leu Cys Leu
115 120 125
Asn Gly Thr Val His Leu Ser Cys Gln Glu Lys Gln Asn Thr Val Cys
130 135 140
Thr Cys His Ala Gly Phe Phe Leu Arg Glu Asn Glu Cys Val Ser Cys
145 150 155 160
Ser Asn Cys Lys Lys Ser Leu Glu Cys Thr Lys Leu Cys Leu Pro Gln
165 170 175
Ile Glu Asn Val Lys Gly Thr Glu Asp Ser Gly Thr Thr Val Leu Leu
180 185 190
Pro Leu Val Ile Phe Phe Gly Leu Cys Leu Leu Ser Leu Leu Phe Ile
195 200 205
Gly Leu Met Tyr Arg Tyr Gln Arg Trp Lys Ser Lys Leu Tyr Ser Ile
210 215 220
Val Cys Gly Lys Ser Thr Pro Glu Lys Glu Gly Glu Leu Glu Gly Thr
225 230 235 240
Thr Thr Lys Pro Leu Ala Pro Asn Pro Ser Phe Ser Pro Thr Pro Gly
245 250 255
Phe Thr Pro Thr Leu Gly Phe Ser Pro Val Pro Ser Ser Thr Phe Thr
260 265 270
Ser Ser Ser Thr Tyr Thr Pro Gly Asp Cys Pro Asn Phe Ala Ala Pro
275 280 285
Arg Arg Glu Val Ala Pro Pro Tyr Gln Gly Ala Asp Pro Ile Leu Ala
290 295 300
Thr Ala Leu Ala Ser Asp Pro Ile Pro Asn Pro Leu Gln Lys Trp Glu
305 310 315 320
Asp Ser Ala His Lys Pro Gln Ser Leu Asp Thr Asp Asp Pro Ala Thr
325 330 335
Leu Tyr Ala Val Val Glu Asn Val Pro Pro Leu Arg Trp Lys Glu Phe
340 345 350
Val Arg Arg Leu Gly Leu Ser Asp His Glu Ile Asp Arg Leu Glu Leu
355 360 365
Gln Asn Gly Arg Cys Leu Arg Glu Ala Gln Tyr Ser Met Leu Ala Thr
370 375 380
Trp Arg Arg Arg Thr Pro Arg Arg Glu Ala Thr Leu Glu Leu Leu Gly
385 390 395 400
Arg Val Leu Arg Asp Met Asp Leu Leu Gly Cys Leu Glu Asp Ile Glu
405 410 415
Glu Ala Leu Cys Gly Pro Ala Ala Leu Pro Pro Ala Pro Ser Leu Leu
420 425 430
Arg
<210> 4
<211> 319
<212> БЕЛОК
<213> Homo sapiens
<400> 4
Arg Leu Ser Ser Lys Ser Val Asn Ala Gln Val Thr Asp Ile Asn Ser
1 5 10 15
Lys Gly Leu Glu Leu Arg Lys Thr Val Thr Thr Val Glu Thr Gln Asn
20 25 30
Leu Glu Gly Leu His His Asp Gly Gln Phe Cys His Lys Pro Cys Pro
35 40 45
Pro Gly Glu Arg Lys Ala Arg Asp Cys Thr Val Asn Gly Asp Glu Pro
50 55 60
Asp Cys Val Pro Cys Gln Glu Gly Lys Glu Tyr Thr Asp Lys Ala His
65 70 75 80
Phe Ser Ser Lys Cys Arg Arg Cys Arg Leu Cys Asp Glu Gly His Gly
85 90 95
Leu Glu Val Glu Ile Asn Cys Thr Arg Thr Gln Asn Thr Lys Cys Arg
100 105 110
Cys Lys Pro Asn Phe Phe Cys Asn Ser Thr Val Cys Glu His Cys Asp
115 120 125
Pro Cys Thr Lys Cys Glu His Gly Ile Ile Lys Glu Cys Thr Leu Thr
130 135 140
Ser Asn Thr Lys Cys Lys Glu Glu Gly Ser Arg Ser Asn Leu Gly Trp
145 150 155 160
Leu Cys Leu Leu Leu Leu Pro Ile Pro Leu Ile Val Trp Val Lys Arg
165 170 175
Lys Glu Val Gln Lys Thr Cys Arg Lys His Arg Lys Glu Asn Gln Gly
180 185 190
Ser His Glu Ser Pro Thr Leu Asn Pro Glu Thr Val Ala Ile Asn Leu
195 200 205
Ser Asp Val Asp Leu Ser Lys Tyr Ile Thr Thr Ile Ala Gly Val Met
210 215 220
Thr Leu Ser Gln Val Lys Gly Phe Val Arg Lys Asn Gly Val Asn Glu
225 230 235 240
Ala Lys Ile Asp Glu Ile Lys Asn Asp Asn Val Gln Asp Thr Ala Glu
245 250 255
Gln Lys Val Gln Leu Leu Arg Asn Trp His Gln Leu His Gly Lys Lys
260 265 270
Glu Ala Tyr Asp Thr Leu Ile Lys Asp Leu Lys Lys Ala Asn Leu Cys
275 280 285
Thr Leu Ala Glu Lys Ile Gln Thr Ile Ile Leu Lys Asp Ile Thr Ser
290 295 300
Asp Ser Glu Asn Ser Asn Phe Arg Asn Glu Ile Gln Ser Leu Val
305 310 315
<210> 5
<211> 121
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 5
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Ser Gln Pro Gly Asn
1 5 10 15
Ser Leu Gln Leu Ser Cys Glu Ala Ser Gly Phe Thr Phe Ser Asn His
20 25 30
Asp Leu Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Ala Ser Gly Leu Ile Ser Tyr Ala Asp Ala Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Phe
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Asp Pro Pro Tyr Ser Gly Leu Tyr Ala Leu Asp Phe Trp Gly
100 105 110
Gln Gly Thr Gln Val Thr Val Ser Ser
115 120
<210> 6
<211> 115
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 6
Gln Pro Val Leu Thr Gln Ser Pro Ser Ala Ser Ala Ser Leu Ser Gly
1 5 10 15
Ser Val Lys Leu Thr Cys Thr Leu Ser Ser Glu Leu Ser Ser Tyr Thr
20 25 30
Ile Val Trp Tyr Gln Gln Arg Pro Asp Lys Ala Pro Lys Tyr Val Met
35 40 45
Tyr Leu Lys Ser Asp Gly Ser His Ser Lys Gly Asp Gly Ile Pro Asp
50 55 60
Arg Phe Ser Gly Ser Ser Ser Gly Ala His Arg Tyr Leu Ser Ile Ser
65 70 75 80
Asn Val Gln Ser Glu Asp Asp Ala Thr Tyr Phe Cys Gly Ala Gly Tyr
85 90 95
Thr Leu Ala Gly Gln Tyr Gly Trp Val Phe Gly Ser Gly Thr Lys Val
100 105 110
Thr Val Leu
115
<210> 7
<211> 426
<212> БЕЛОК
<213> Homo sapiens
<400> 7
Met Glu Gln Arg Pro Arg Gly Cys Ala Ala Val Ala Ala Ala Leu Leu
1 5 10 15
Leu Val Leu Leu Gly Ala Arg Ala Gln Gly Gly Thr Arg Ser Pro Arg
20 25 30
Cys Asp Cys Ala Gly Asp Phe His Lys Lys Ile Gly Leu Phe Cys Cys
35 40 45
Arg Gly Cys Pro Ala Gly His Tyr Leu Lys Ala Pro Cys Thr Glu Pro
50 55 60
Cys Gly Asn Ser Thr Cys Leu Val Cys Pro Gln Asp Thr Phe Leu Ala
65 70 75 80
Trp Glu Asn His His Asn Ser Glu Cys Ala Arg Cys Gln Ala Cys Asp
85 90 95
Glu Gln Ala Ser Gln Val Ala Leu Glu Asn Cys Ser Ala Val Ala Asp
100 105 110
Thr Arg Cys Gly Cys Lys Pro Gly Trp Phe Val Glu Cys Gln Val Ser
115 120 125
Gln Cys Val Ser Ser Ser Pro Phe Tyr Cys Gln Pro Cys Leu Asp Cys
130 135 140
Gly Ala Leu His Arg His Thr Arg Leu Leu Cys Ser Arg Arg Asp Thr
145 150 155 160
Asp Cys Gly Thr Cys Leu Pro Gly Phe Tyr Glu His Gly Asp Gly Cys
165 170 175
Val Ser Cys Pro Thr Pro Pro Pro Ser Leu Ala Gly Ala Pro Trp Gly
180 185 190
Ala Val Gln Ser Ala Val Pro Leu Ser Val Ala Gly Gly Arg Val Gly
195 200 205
Val Phe Trp Val Gln Val Leu Leu Ala Gly Leu Val Val Pro Leu Leu
210 215 220
Leu Gly Ala Thr Leu Thr Tyr Thr Tyr Arg His Cys Trp Pro His Lys
225 230 235 240
Pro Leu Val Thr Ala Asp Glu Ala Gly Met Glu Ala Leu Thr Pro Pro
245 250 255
Pro Ala Thr His Leu Ser Pro Leu Asp Ser Ala His Thr Leu Leu Ala
260 265 270
Pro Pro Asp Ser Ser Glu Lys Ile Cys Thr Val Gln Leu Val Gly Asn
275 280 285
Ser Trp Thr Pro Gly Tyr Pro Glu Thr Gln Glu Ala Leu Cys Pro Gln
290 295 300
Val Thr Trp Ser Trp Asp Gln Leu Pro Ser Arg Ala Leu Gly Pro Ala
305 310 315 320
Ala Ala Pro Thr Leu Ser Pro Glu Ser Pro Ala Gly Ser Pro Ala Met
325 330 335
Met Leu Gln Pro Gly Pro Gln Leu Tyr Asp Val Met Asp Ala Val Pro
340 345 350
Ala Arg Arg Trp Lys Glu Phe Val Arg Thr Leu Gly Leu Arg Glu Ala
355 360 365
Glu Ile Glu Ala Val Glu Val Glu Ile Gly Arg Phe Arg Asp Gln Gln
370 375 380
Tyr Glu Met Leu Lys Arg Trp Arg Gln Gln Gln Pro Ala Gly Leu Gly
385 390 395 400
Ala Val Tyr Ala Ala Leu Glu Arg Met Gly Leu Asp Gly Cys Val Glu
405 410 415
Asp Leu Arg Ser Arg Leu Gln Arg Gly Pro
420 425
<210> 8
<211> 387
<212> БЕЛОК
<213> Mus musculus
<400> 8
Met Glu Glu Leu Pro Arg Arg Glu Arg Ser Pro Pro Gly Ala Ala Thr
1 5 10 15
Pro Gly Ser Thr Ala Arg Val Leu Gln Pro Leu Phe Leu Pro Leu Leu
20 25 30
Leu Leu Leu Leu Leu Leu Leu Gly Gly Gln Gly Gln Gly Gly Met Ser
35 40 45
Gly Arg Cys Asp Cys Ala Ser Glu Ser Gln Lys Arg Tyr Gly Pro Phe
50 55 60
Cys Cys Arg Gly Cys Pro Lys Gly His Tyr Met Lys Ala Pro Cys Ala
65 70 75 80
Glu Pro Cys Gly Asn Ser Thr Cys Leu Pro Cys Pro Ser Asp Thr Phe
85 90 95
Leu Thr Arg Asp Asn His Phe Lys Thr Asp Cys Thr Arg Cys Gln Val
100 105 110
Cys Asp Glu Glu Ala Leu Gln Val Thr Leu Glu Asn Cys Ser Ala Lys
115 120 125
Ser Asp Thr His Cys Gly Cys Gln Ser Gly Trp Cys Val Asp Cys Ser
130 135 140
Thr Glu Pro Cys Gly Lys Ser Ser Pro Phe Ser Cys Val Pro Cys Gly
145 150 155 160
Ala Thr Thr Pro Val His Glu Ala Pro Thr Pro Leu Phe Trp Val Gln
165 170 175
Val Leu Leu Gly Val Ala Phe Leu Phe Gly Ala Ile Leu Ile Cys Ala
180 185 190
Tyr Cys Arg Trp Gln Pro Cys Lys Ala Val Val Thr Ala Asp Thr Ala
195 200 205
Gly Thr Glu Thr Leu Ala Ser Pro Gln Thr Ala His Leu Ser Ala Ser
210 215 220
Asp Ser Ala His Thr Leu Leu Ala Pro Pro Ser Ser Thr Gly Lys Ile
225 230 235 240
Cys Thr Thr Val Gln Leu Val Gly Asn Asn Trp Thr Pro Gly Leu Ser
245 250 255
Gln Thr Gln Glu Val Val Cys Gly Gln Ala Ser Gln Pro Trp Asp Gln
260 265 270
Leu Pro Asn Arg Thr Leu Gly Thr Pro Leu Ala Ser Pro Leu Ser Pro
275 280 285
Ala Pro Pro Ala Gly Ser Pro Ala Ala Val Leu Gln Pro Gly Pro Gln
290 295 300
Leu Tyr Asp Val Met Asp Ala Val Pro Ala Arg Arg Trp Lys Glu Phe
305 310 315 320
Val Arg Thr Leu Gly Leu Arg Glu Ala Glu Ile Glu Ala Val Glu Val
325 330 335
Glu Ile Cys Arg Phe Arg Asp Gln Gln Tyr Glu Met Leu Lys Arg Trp
340 345 350
Arg Gln Gln Gln Pro Ala Gly Leu Gly Ala Ile Tyr Ala Ala Leu Glu
355 360 365
Arg Met Gly Leu Glu Gly Cys Ala Glu Asp Leu Arg Ser Arg Leu Gln
370 375 380
Arg Gly Pro
385
<210> 9
<211> 420
<212> БЕЛОК
<213> Macaca mulatta
<400> 9
Met Glu Gln Arg Ser Arg Gly Ser Ala Ala Val Ala Ala Val Ser Thr
1 5 10 15
Ala Leu Leu Leu Val Leu Leu Gly Ala Arg Ala Gln Gly Gly Thr Gln
20 25 30
Ser Pro Arg Cys Asp Cys Ala Gly Asp Phe His Lys Lys Asn Gly Val
35 40 45
Phe Cys Cys Arg Gly Cys Pro Ala Gly His Tyr Leu Lys Ala Pro Cys
50 55 60
Thr Glu Pro Cys Gly Asn Ser Thr Cys Leu Leu Cys Pro Gln Asp Thr
65 70 75 80
Phe Leu Ala Trp Glu Asn His His Asn Ser Glu Cys Ala Arg Cys Gln
85 90 95
Ala Cys Asp Glu Gln Ala Ser Gln Val Ala Leu Glu Asn Cys Ser Ala
100 105 110
Val Ala Asp Thr Arg Cys Gly Cys Lys Pro Gly Trp Phe Val Glu Cys
115 120 125
Gln Val Ser Gln Cys Val Ser Ser Ser Pro Phe Tyr Cys Gln Pro Cys
130 135 140
Leu Asp Cys Arg Ala Leu His Arg His Thr Arg Leu Leu Cys Ser Arg
145 150 155 160
Arg Asp Thr Asp Cys Gly Thr Cys Leu Pro Gly Phe Tyr Glu His Asp
165 170 175
Asp Gly Cys Val Ser Cys Pro Thr Ser Thr Leu Gly Ser Cys Pro Glu
180 185 190
Arg Cys Ala Ala Val Cys Gly Trp Arg Gln Met Phe Trp Val Gln Val
195 200 205
Leu Leu Ala Gly Leu Val Val Pro Leu Leu Leu Gly Ala Thr Leu Thr
210 215 220
Tyr Thr Tyr Arg His Cys Trp Pro His Lys Pro Met Val Thr Ala Asp
225 230 235 240
Glu Ala Gly Met Glu Ala Leu Thr Pro Pro Pro Ala Thr His Leu Ser
245 250 255
Pro Ser Asp Lys Ala His Thr Leu Leu Val Pro Pro Asp Ser Ser Glu
260 265 270
Lys Ile Cys Thr Val Gln Leu Val Asp Asn Ser Trp Thr Pro Gly Tyr
275 280 285
Pro His Thr Gln Glu Ala Leu Cys Pro Gln Met Thr Trp Ser Trp Asp
290 295 300
Gln Leu Pro Asn Arg Ala Leu Gly Pro Val Pro Ala Ser Thr Leu Leu
305 310 315 320
Pro Glu Ser Pro Val Gly Ser Pro Thr Met Met Leu Gln Pro Gly Pro
325 330 335
Gln Leu Tyr Asp Val Met Asp Ala Val Pro Ala Arg Arg Trp Lys Glu
340 345 350
Phe Val Arg Thr Leu Gly Leu Arg Glu Ala Glu Ile Glu Ala Val Glu
355 360 365
Val Glu Ile Gly Arg Phe Arg Asp Gln Gln Tyr Glu Met Leu Lys Arg
370 375 380
Trp Arg Gln Gln Gln Pro Ala Gly Leu Gly Ala Val Tyr Ala Ala Leu
385 390 395 400
Glu Arg Met Gly Leu Asp Gly Cys Ala Glu Asp Leu Arg Ser Arg Leu
405 410 415
Gln Arg Gly Pro
420
<210> 10
<211> 417
<212> БЕЛОК
<213> Macaca fascicularis
<400> 10
Met Glu Gln Arg Ser Arg Gly Ser Ala Ala Val Ala Ala Ala Leu Leu
1 5 10 15
Leu Val Leu Leu Gly Ala Arg Ala Gln Gly Gly Thr Gln Ser Pro Arg
20 25 30
Cys Asp Cys Ala Gly Asp Phe His Lys Lys Asn Gly Val Phe Cys Cys
35 40 45
Arg Gly Cys Pro Ala Gly His Tyr Leu Lys Ala Pro Cys Thr Glu Pro
50 55 60
Cys Gly Asn Ser Thr Cys Leu Leu Cys Pro Gln Asp Thr Phe Leu Ala
65 70 75 80
Trp Glu Asn His His Asn Ser Glu Cys Ala Arg Cys Gln Ala Cys Asp
85 90 95
Glu Gln Ala Ser Gln Val Ala Leu Glu Asn Cys Ser Ala Val Ala Asp
100 105 110
Thr Arg Cys Gly Cys Lys Pro Gly Trp Phe Val Glu Cys Gln Val Ser
115 120 125
Gln Cys Gly Ser Ser Ser Pro Phe Tyr Cys Gln Pro Cys Leu Asp Cys
130 135 140
Arg Ala Leu His Arg His Thr Arg Leu Leu Cys Ser Arg Arg Asp Thr
145 150 155 160
Asp Cys Gly Thr Cys Leu Pro Gly Phe Tyr Glu His Asp Asp Gly Cys
165 170 175
Val Ser Cys Pro Thr Ser Thr Leu Gly Ser Cys Pro Glu Arg Cys Ala
180 185 190
Ala Val Cys Gly Trp Arg Gln Met Phe Trp Val Gln Val Leu Leu Ala
195 200 205
Gly Leu Val Val Pro Leu Leu Leu Gly Ala Thr Leu Thr Tyr Thr Tyr
210 215 220
Arg His Cys Trp Pro His Lys Pro Met Val Thr Ala Asp Glu Ala Gly
225 230 235 240
Met Glu Ala Leu Thr Pro Pro Pro Ala Thr His Leu Ser Pro Ser Asp
245 250 255
Asn Ala His Thr Leu Leu Val Pro Pro Asp Ser Ser Glu Lys Ile Cys
260 265 270
Thr Val Gln Leu Val Asp Asn Ser Trp Thr Pro Gly Tyr Pro His Thr
275 280 285
Gln Glu Ala Leu Cys Pro Gln Met Thr Trp Ser Trp Asp Gln Leu Pro
290 295 300
Asn Arg Ala Leu Gly Pro Val Pro Ala Ser Thr Leu Leu Pro Glu Ser
305 310 315 320
Pro Val Gly Ser Pro Thr Met Met Leu Gln Pro Gly Pro Gln Leu Tyr
325 330 335
Asp Val Met Asp Ala Val Pro Ala Arg Arg Trp Lys Glu Phe Val Arg
340 345 350
Thr Leu Gly Leu Arg Glu Ala Glu Ile Glu Ala Val Glu Val Glu Ile
355 360 365
Gly Arg Phe Arg Asp Gln Gln Tyr Glu Met Leu Lys Arg Trp Arg Gln
370 375 380
Gln Gln Pro Ala Gly Leu Gly Ala Val Tyr Ala Ala Leu Glu Arg Met
385 390 395 400
Gly Leu Asp Gly Cys Ala Glu Asp Leu Arg Ser Arg Leu Gln Arg Gly
405 410 415
Pro
<210> 11
<211> 25
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 11
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Ser Gln Pro Gly Asn
1 5 10 15
Ser Leu Gln Leu Ser Cys Glu Ala Ser
20 25
<210> 12
<211> 10
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 12
Gly Phe Thr Phe Ser Asn His Asp Leu Asn
1 5 10
<210> 13
<211> 14
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 13
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala
1 5 10
<210> 14
<211> 17
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 14
Tyr Ile Ser Ser Ala Ser Gly Leu Ile Ser Tyr Ala Asp Ala Val Arg
1 5 10 15
Gly
<210> 15
<211> 32
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 15
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Phe Leu Gln
1 5 10 15
Met Asn Asn Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys Ala Arg
20 25 30
<210> 16
<211> 12
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 16
Asp Pro Pro Tyr Ser Gly Leu Tyr Ala Leu Asp Phe
1 5 10
<210> 17
<211> 11
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 17
Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
1 5 10
<210> 18
<211> 22
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 18
Gln Pro Val Leu Thr Gln Ser Pro Ser Ala Ser Ala Ser Leu Ser Gly
1 5 10 15
Ser Val Lys Leu Thr Cys
20
<210> 19
<211> 12
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 19
Thr Leu Ser Ser Glu Leu Ser Ser Tyr Thr Ile Val
1 5 10
<210> 20
<211> 15
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 20
Trp Tyr Gln Gln Arg Pro Asp Lys Ala Pro Lys Tyr Val Met Tyr
1 5 10 15
<210> 21
<211> 11
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 21
Leu Lys Ser Asp Gly Ser His Ser Lys Gly Asp
1 5 10
<210> 22
<211> 31
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 22
Gly Ile Pro Asp Arg Phe Ser Gly Ser Ser Ser Gly Ala His Arg Tyr
1 5 10 15
Leu Ser Ile Ser Asn Val Gln Ser Glu Asp Asp Ala Thr Tyr Phe
20 25 30
<210> 23
<211> 14
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 23
Cys Gly Ala Gly Tyr Thr Leu Ala Gly Gln Tyr Gly Trp Val
1 5 10
<210> 24
<211> 10
<212> БЕЛОК
<213> Cricetulus migratorius
<400> 24
Phe Gly Ser Gly Thr Lys Val Thr Val Leu
1 5 10
<210> 25
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 25
Thr Leu Ser Ser Glu Leu Ser Trp Tyr Thr Ile Val
1 5 10
<210> 26
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 26
Asp Pro Ala Tyr Thr Gly Leu Tyr Ala Leu Asp Phe
1 5 10
<210> 27
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 27
Thr Leu Ser Ser Glu Leu Ser Gly Phe Thr Ile Val
1 5 10
<210> 28
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 28
Cys Gly Ala Gly Tyr Thr Leu Ala Asn Gln Tyr Gly Trp Val
1 5 10
<210> 29
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 29
Thr Leu Ser Ser Glu Leu Ser Asn Phe Thr Ile Val
1 5 10
<210> 30
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 30
Cys Gly Ala Gly Tyr Thr Leu Ala Ser Gln Tyr Gly Trp Val
1 5 10
<210> 31
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 31
Asp Pro Ala Tyr Ser Gly Leu Tyr Ala Leu Asp Phe
1 5 10
<210> 32
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 32
Asp Pro Pro Tyr Thr Gly Leu Tyr Ala Leu Asp Phe
1 5 10
<210> 33
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 33
Thr Leu Ser Ser Glu Leu Ser Asn Tyr Thr Ile Val
1 5 10
<210> 34
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 34
Cys Gly Ala Gly Tyr Thr Leu Ala Arg Gln Tyr Gly Trp Val
1 5 10
<210> 35
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 35
Cys Gly Met Gly Tyr Thr Leu Ala Asn Gln Tyr Gly Trp Val
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| CD47-АНТИГЕНСВЯЗЫВАЮЩАЯ ЕДИНИЦА И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2780859C2 |
| ИММУНОЦИТОКИНЫ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2818371C1 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
| ТЕРАПЕВТИЧЕСКИЕ АНТИТЕЛА ПРОТИВ ЛИГАНДА CD40 | 2018 |
|
RU2770209C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2808030C2 |
| АНТИ-PCSK9 АНТИТЕЛО, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2739208C2 |
| ПРОКОАГУЛЯНТНЫЕ АНТИТЕЛА | 2018 |
|
RU2810094C2 |
| АНТИТЕЛО К B7-H4, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2792748C2 |
| АНТИ-CD137 АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2829536C2 |
| АМАТОКСИНОВЫЕ КОНЪЮГАТЫ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2826004C2 |


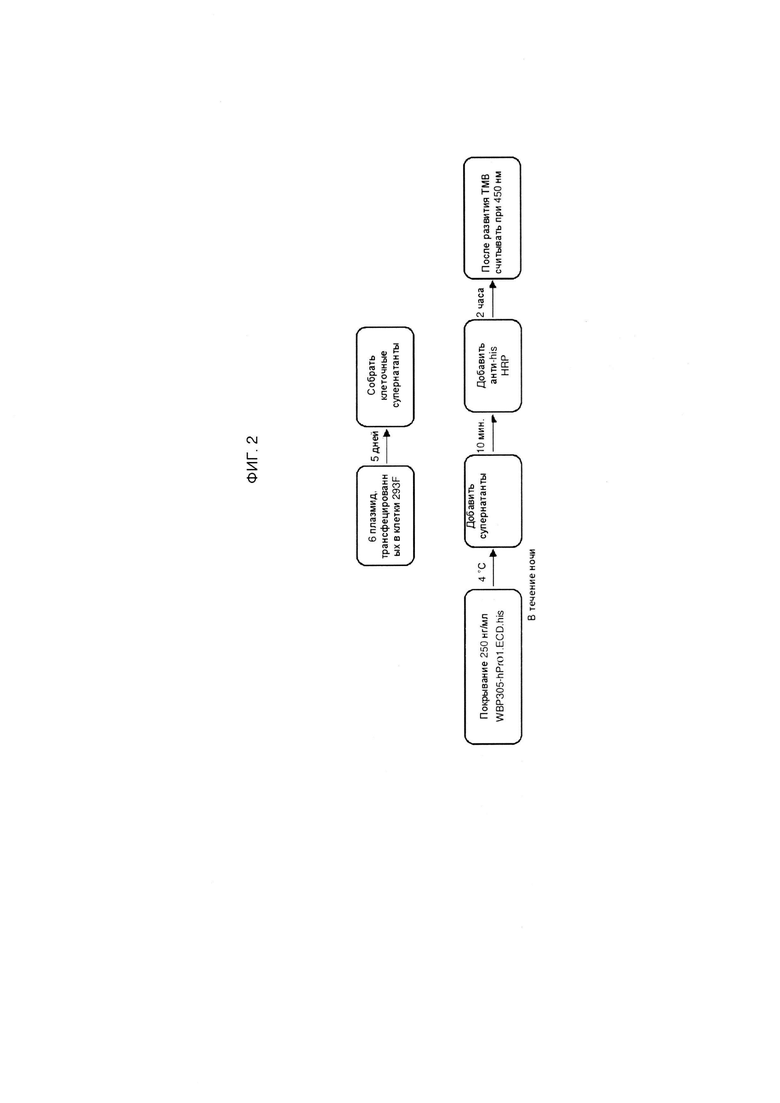
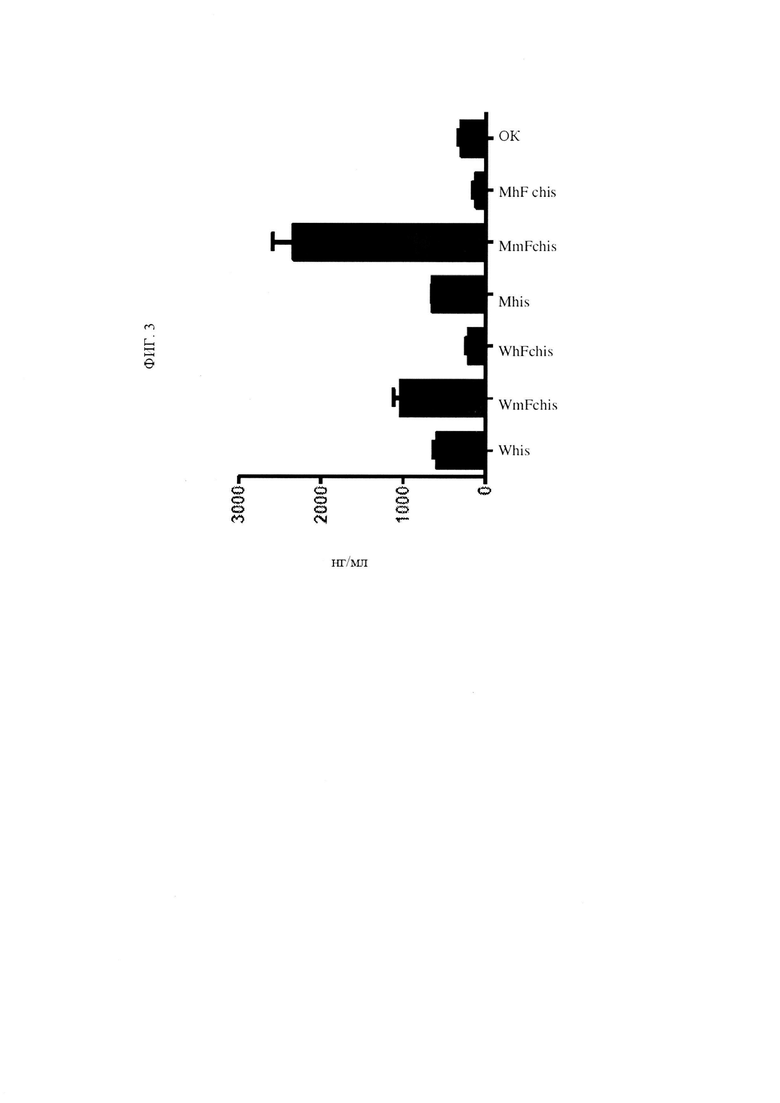
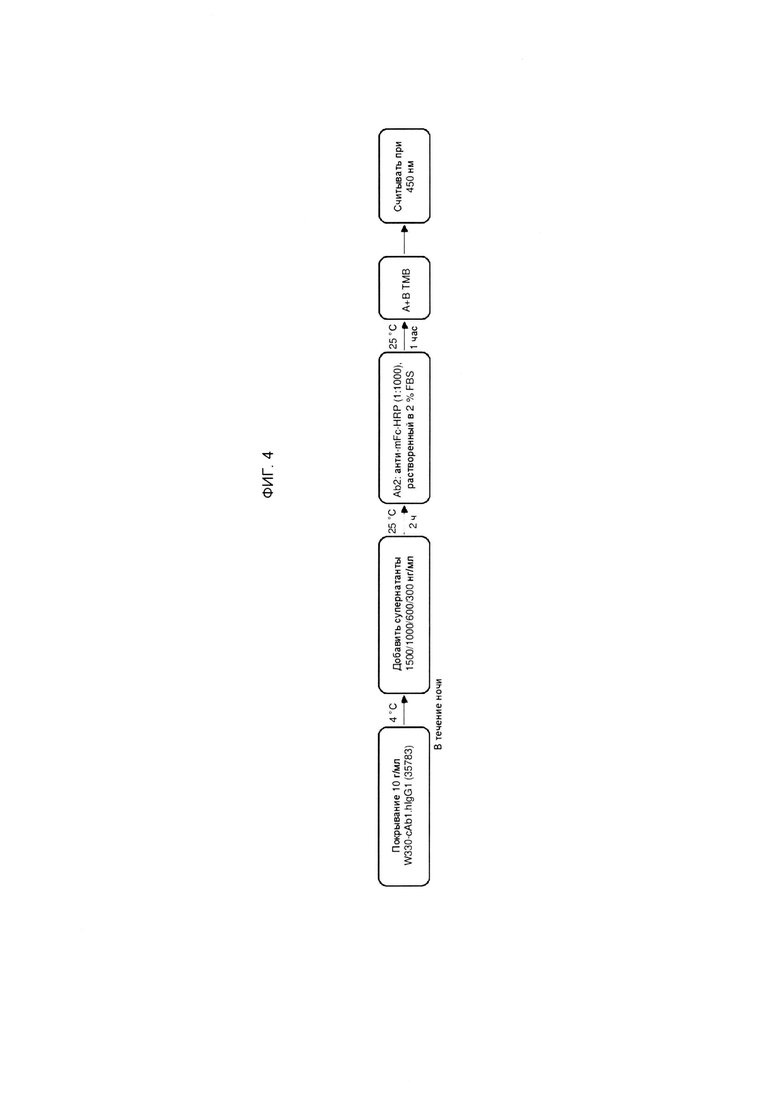
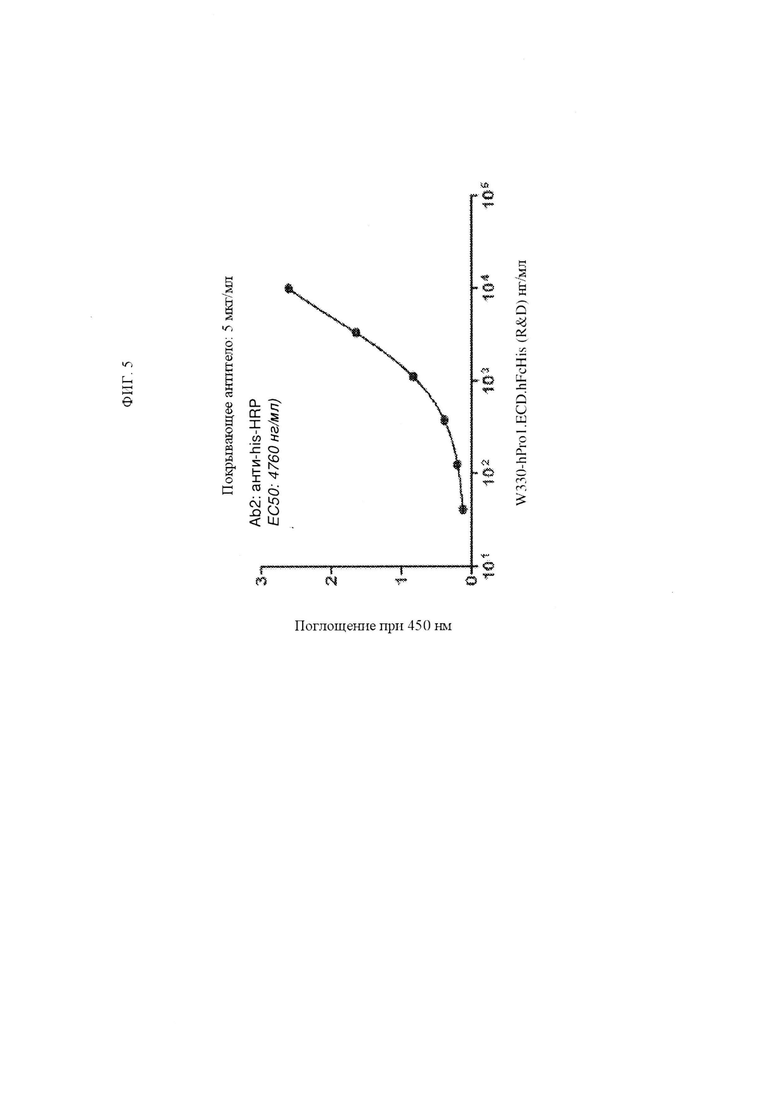
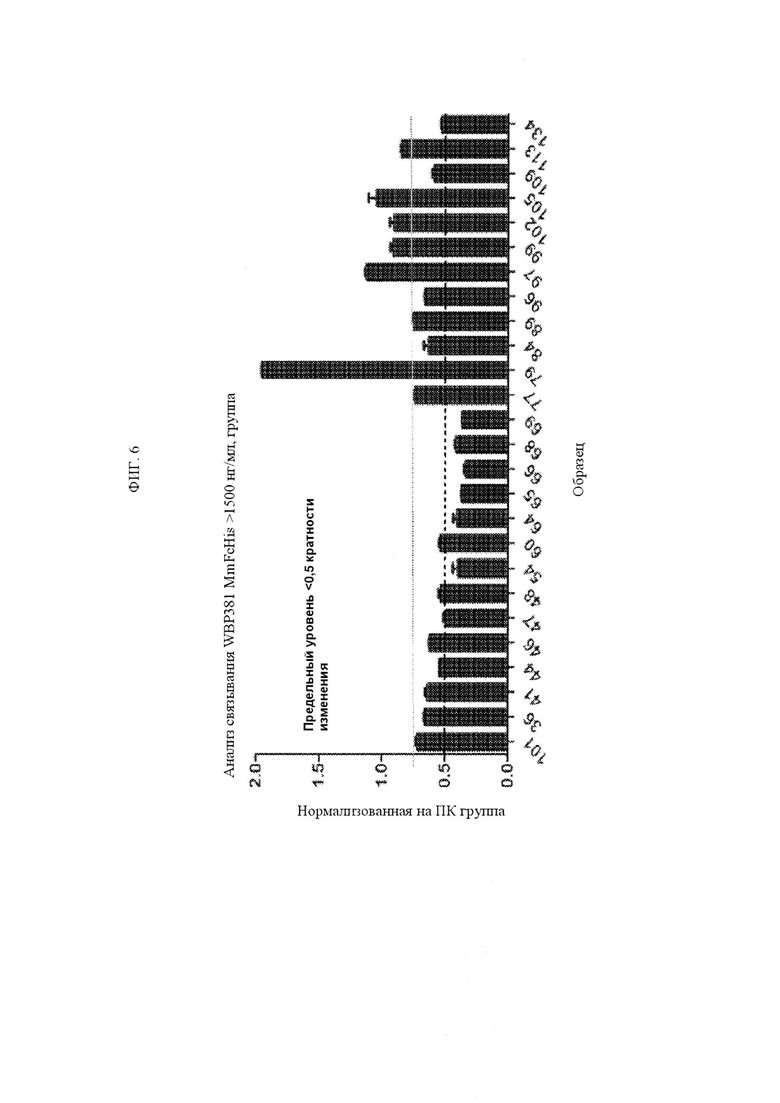
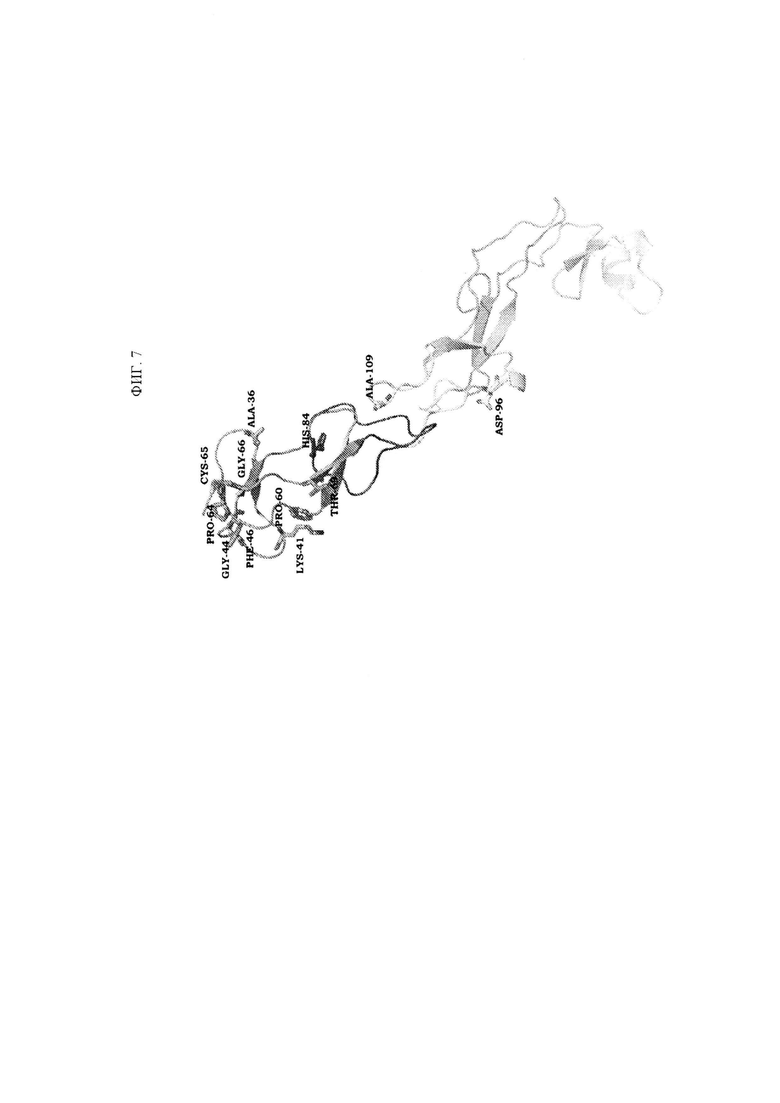
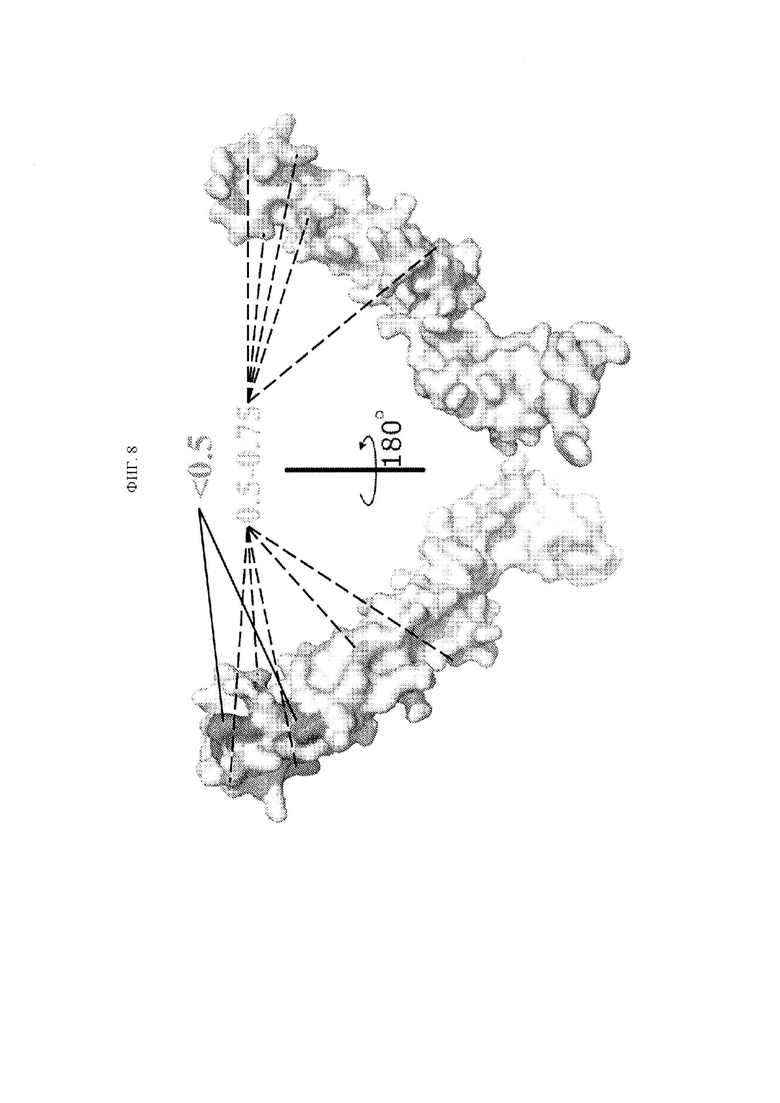
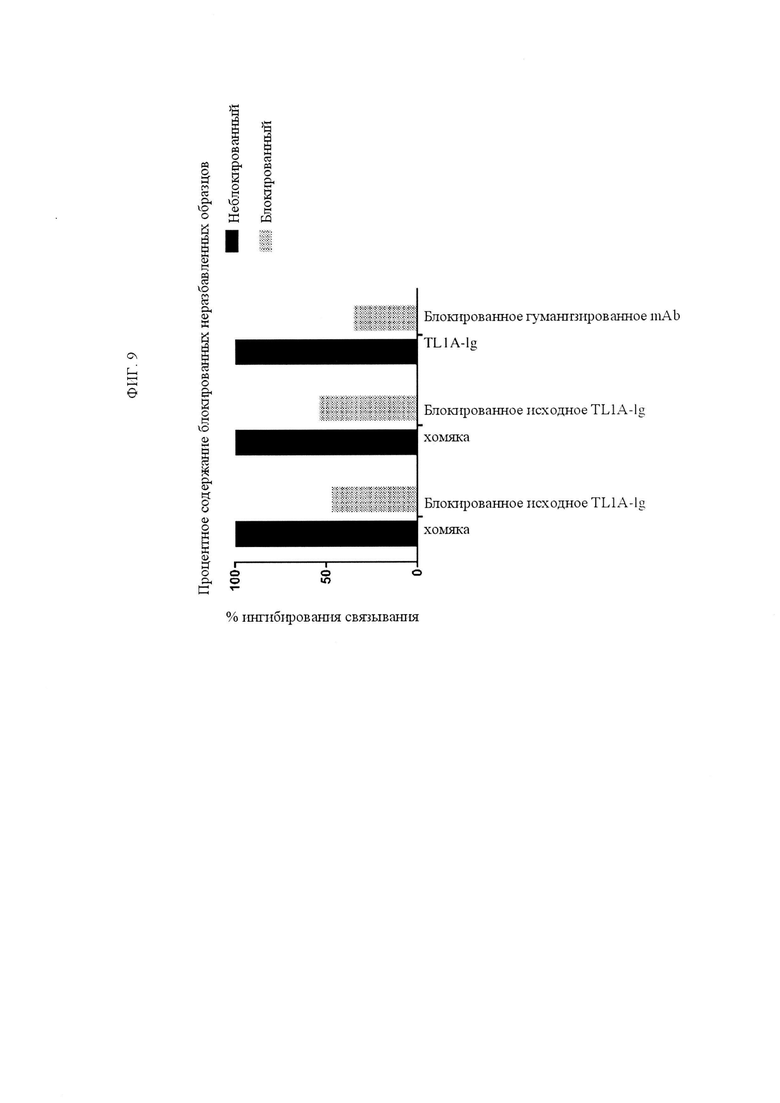
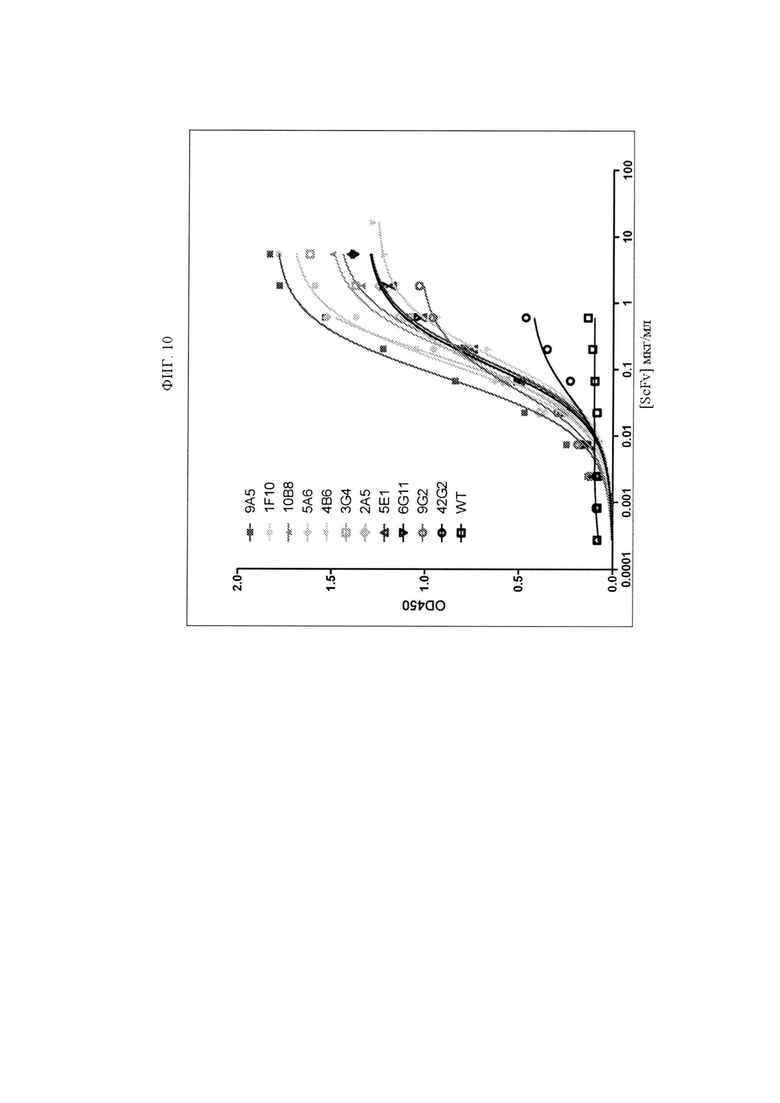
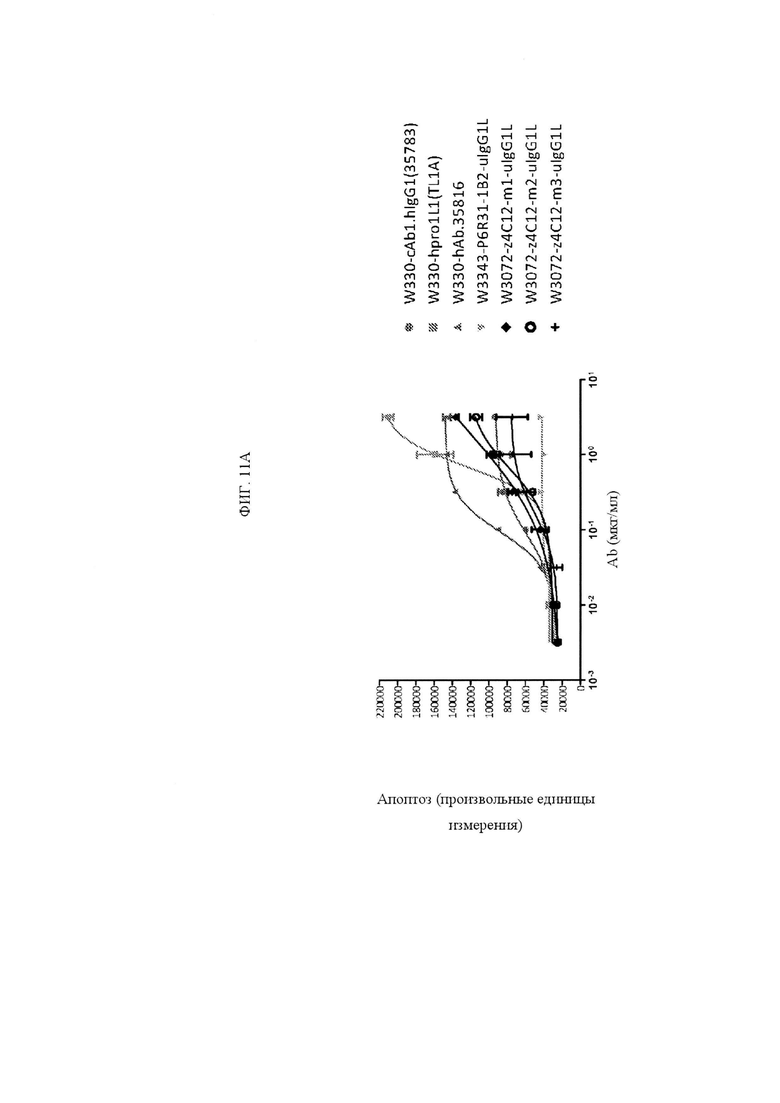
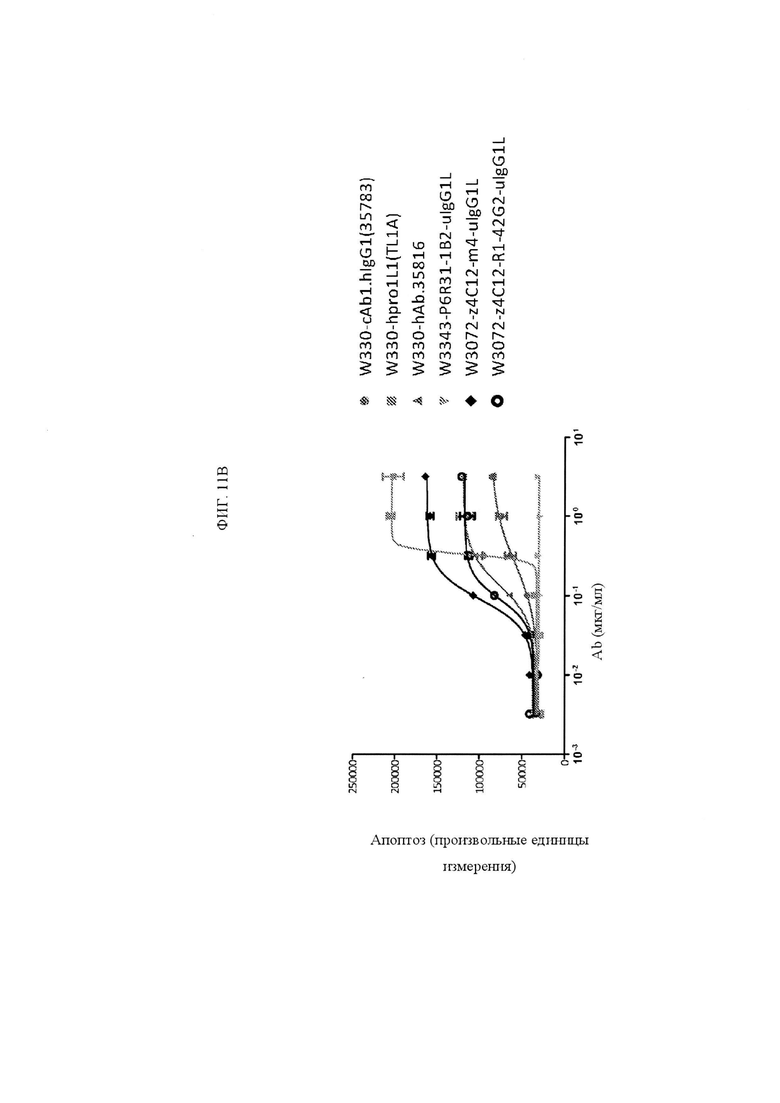
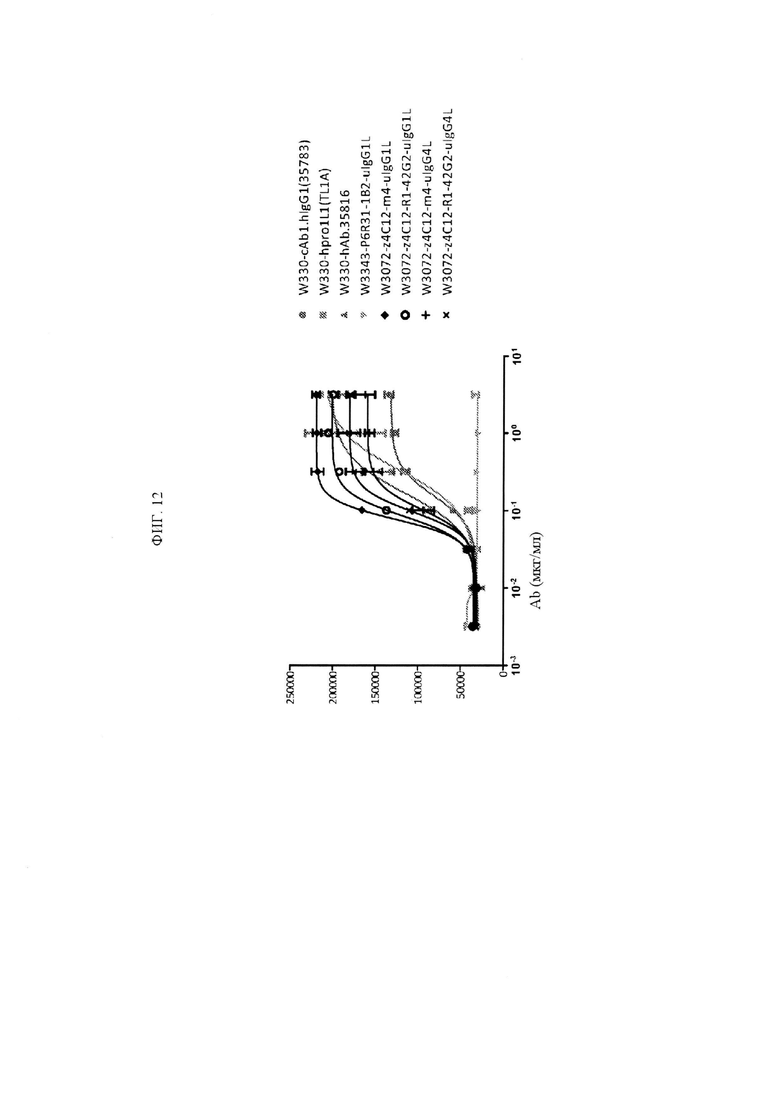
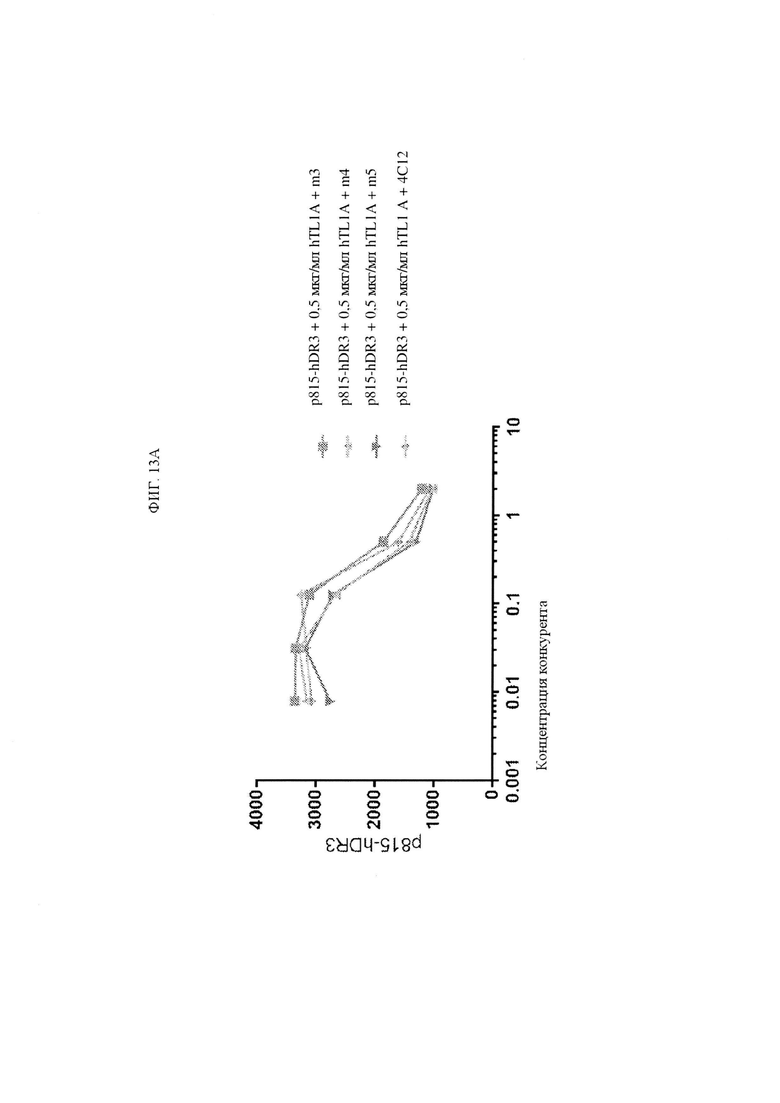
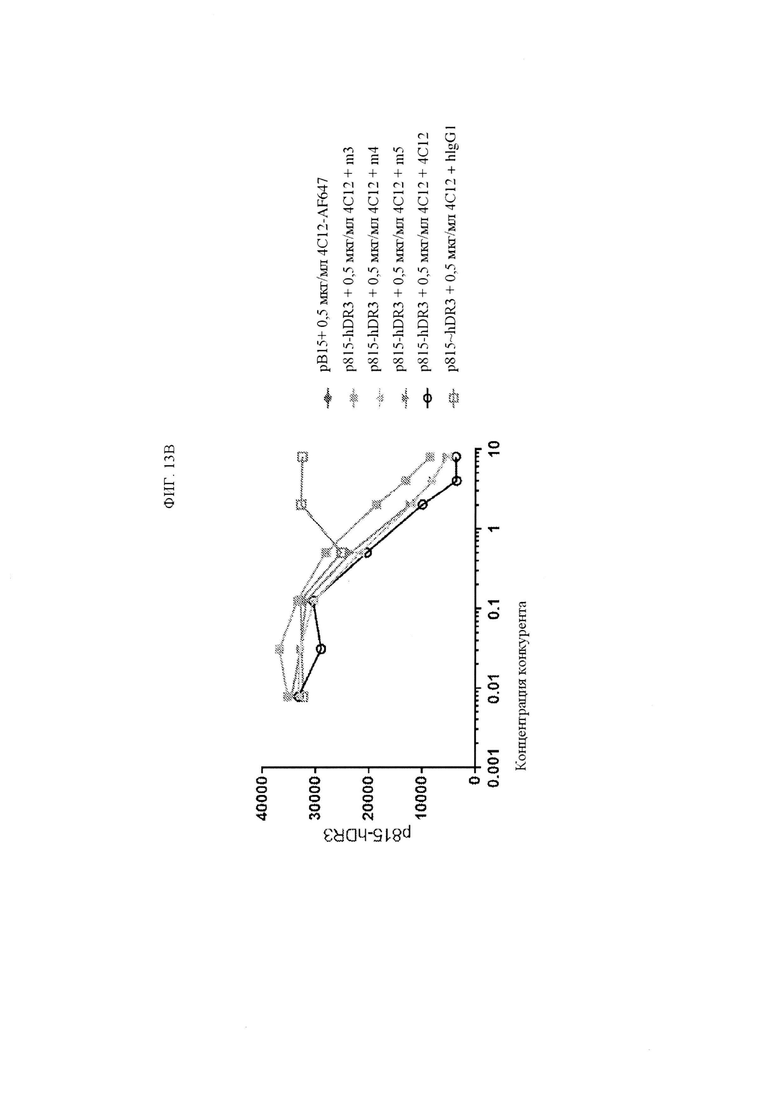
Изобретение относится к области биотехнологии, в частности к антителу против члена суперсемейства рецепторов фактора некроза опухоли 25 (TNFRSF25) или его антигенсвязывающему фрагменту, а также к композиции и изделию, его содержащему. Также раскрыто применение вышеуказанного антитела или его фрагмента для стимуляции пролиферации Т-клеток CD8+ у больного раком, для получения иммунного ответа у больного раком, а также для стимуляции пролиферации регуляторных Т-клеток CD4+FoxP3+ у больного раком. Изобретение позволяет эффективно осуществлять лечение рака, включающего TNFRSF25-экспрессирующие опухолевые клетки. 7 н. и 11 з.п. ф-лы, 7 табл., 3 пр., 13 ил.
1. Антитело против члена суперсемейства рецепторов фактора некроза опухоли 25 (TNFRSF25) или его антигенсвязывающий фрагмент для связывания с TNFRSF25 человека, где антитело или фрагмент антитела содержит:
(i) вариабельную область тяжелой цепи, содержащую последовательности CDR1, CDR2 и CDR3 тяжелой цепи, причем последовательность CDR1 тяжелой цепи представляет собой GFTFSNHDLN (SEQ ID NO: 12), последовательность CDR2 тяжелой цепи представляет собой YISSASGLISYADAVRG (SEQ ID NO: 14); и последовательность CDR3 тяжелой цепи представляет собой DPAYTGLYALDF (SEQ ID NO: 26) или DPPYSGLYALDF (SEQ ID NO: 16); и
(ii) вариабельную область легкой цепи, содержащую последовательности CDR1, CDR2 и CDR3 легкой цепи, причем последовательность CDR1 легкой цепи представляет собой TLSSELSWYTIV (SEQ ID NO:25), последовательность CDR2 легкой цепи представляет собой LKSDGSHSKGD (SEQ ID NO: 21) и последовательность CDR3 легкой цепи представляет собой CGAGYTLAGQYGWV (SEQ ID NO: 23).
2. Антитело или антигенсвязывающий фрагмент по п. 1, содержащий каркасные (FW) последовательности вариабельной области, соединенные с CDR согласно формуле (FW1)-(CDR1)-(FW2)-(CDR2)-(FW3)-(CDR3)-(FW4), где FW последовательности вариабельной области в вариабельной области тяжелой цепи представляют собой FW последовательности вариабельной области тяжелой цепи и где FW последовательности вариабельной области в вариабельной области легкой цепи представляют собой FW последовательности вариабельной области легкой цепи.
3. Антитело или антигенсвязывающий фрагмент по п. 2, где FW последовательности вариабельных областей являются человеческими.
4. Антитело или антигенсвязывающий фрагмент по любому из пп. 1-3, содержащий константные области тяжелой цепи и легкой цепи человека.
5. Антитело или антигенсвязывающий фрагмент по п. 4, где константные области выбраны из группы, состоящей из IgG1, IgG2, IgG3 и IgG4 человека.
6. Антитело или антигенсвязывающий фрагмент по п. 5, где константные области представляют собой IgG1.
7. Антитело или антигенсвязывающий фрагмент по п. 4, где константные области представляют собой IgG4.
8. Фармацевтическая композиция для лечения рака, включающего TNFRSF25-экспрессирующие опухолевые клетки, у субъекта, содержащая фармацевтически приемлемый носитель и эффективное количество антитела или антигенсвязывающего фрагмента по любому из пп. 1-7.
9. Изделие для применения фармацевтической композиции по п. 8, причем изделие содержит фармацевтическую композицию по п. 8 и по меньшей мере одно дополнительное средство для лечения рака.
10. Изделие по п. 9, где по меньшей мере одно дополнительное средство представляет собой средство, которое направлено на CTLA-4, PD-1, PD-L1, LAG-3, Tim-3, TNFRSF4, TNFRSF9, TNFRSF18, CD27, CD39, CD47, CD73 или CD278, или представляет собой антагонист рецептора A2A или антагонист TGF-бета.
11. Изделие по п. 9, где по меньшей мере одно дополнительное средство представляет собой костимулирующую молекулу семейства B7, костимулирующую молекулу суперсемейства рецептора TNF, вакцинную композицию или химиотерапевтическое средство.
12. Изделие по п. 9, где по меньшей мере одно дополнительное средство содержит трансфицированные химерным антигенным рецептором Т-клетки или размножаемые инфильтрирующие опухоли лимфоциты для применения в адоптивной Т-клеточной терапии in vitro или у субъекта.
13. Изделие по п. 9, где по меньшей мере одно дополнительное средство применяют во время in vitro процесса получения аутологичного Т-клеточного терапевтического средства.
14. Способ лечения рака, включающего TNFRSF25-экспрессирующие опухолевые клетки, у субъекта, включающий введение субъекту количества композиции по п. 8, которое является эффективным для того, чтобы индуцировать апоптоз опухолевых клеток, экспрессирующих TNFRSF25, в опухоли субъекта.
15. Способ стимуляции пролиферации Т-клеток CD8+ у больного раком, включающий введение больному раком терапевтически эффективного количества композиции по п. 8, которое эффективно для стимуляции пролиферации Т-клеток CD8+ у больного раком.
16. Способ по п. 15, где пролиферация Т-клеток CD8+ увеличена по меньшей мере на 20 % по сравнению с исходным уровнем пролиферации перед введением, что определяют с помощью проточной цитометрии антигенспецифических Т-клеток CD8+.
17. Способ получения иммунного ответа у больного раком, включающий введение больному раком терапевтически эффективного количества композиции по п. 8.
18. Способ стимуляции пролиферации регуляторных Т-клеток CD4+FoxP3+ у больного раком, включающий введение больному раком терапевтически эффективного количества композиции по п. 8.
| WO2016081455 A1, 26.05.2016 | |||
| BYUNG-SU KIM et al., Treatment with agonistic DR3 antibody results in expansion of donor Tregs and reduced graft-versus-host disease, BLOOD, 2015, Vol.126, N.4, pp.546-557 | |||
| WO2011017303 A1, 10.02.2011 | |||
| ГУМАНИЗИРОВАННОЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СПЕЦИФИЧНОЕ К СИНДЕКАНУ-1 | 2013 |
|
RU2551235C2 |
Авторы
Даты
2021-04-12—Публикация
2017-06-09—Подача