Изобретение относится к области медицины, в частности онкологии, и может быть использовано для снижения клоногенной активности опухолевых стволовых клеток (ОСК).
Известно, что опухолевые клетки гетерогенны по различным морфофункциональным показателям, включая чувствительность к радио- и химиотерапии. По современным представлениям среди всех опухолевых клеток существует небольшая фракция ОСК, которые в различных литературных источниках называют стволоподобными клетками (stem-like cells), опухоль-инициирующими клетками (tumor initiating cells) или опухоль-распространяющими клетками (tumor propagating cells). Эти клетки характеризуются более высокой радио- и химио-резистентностью по сравнению с остальной массой опухолевых клеток. Полагают, что ОСК, сохранившие жизнеспособность и пролиферативный потенциал в ходе лучевой и химиотерапии, могут являться причиной развития рецидивов и метастазов после окончания лечения (Marotta L., Polyak К. Cancer stem cells: a model in the making // Current Opinion in Genetics & Development. - 2009. - V. 19. - P. 44-50). Поэтому разработка средств и способов терапии, направленной на снижение клоногенной активности ОСК, при самостоятельном применении таких средств/способов или в комбинации с известными противоопухолевыми воздействиями является одной из наиболее важных проблем онкологии (Rajendran V., Jain M.V. In Vitro Tumorigenic Assay: Colony Forming Assay for Cancer Stem Cells // Methods Mol Biol. - 2018. - V. 1692. - P. 89-95).
Существует несколько способов идентификации ОСК, один из которых основан на способности ОСК активно откачивать во внеклеточную среду флуоресцентный краситель Хёхст 33342 (в отличие от остальных опухолевых клеток), вследствие чего ОСК формируют так называемую боковую популяцию (side population - SP) слабо окрашенных клеток при проточноцитометрическом анализе внутриклеточной флуоресценции этого красителя. Метод выявления клеток SP используется и для идентификации стволовых клеток рака молочной железы - наиболее частого онкологического заболевания у женщин (Patrawala L., Calhoun Т., Schneider-Broussard R., Zhou J., Claypool K., Tang D.G. Side population is enriched in tumorigenic, stem-like cancer cells, whereas ABCG2 + and ABCG2-cancer cells are similarly tumorigenic // Cancer Res. - 2005. - V. 65. - N14. - P. 6207-6219).
Тест на клоногенную активность опухолевых клеток достаточно часто применяется при разработке новых противоопухолевых средств и/или радиосенсибилизаторов опухолевых клеток, однако в таких исследованиях оценивают изменение клоногенной активности общей массы опухолевых клеток, а не популяции ОСК.
Так, например, известен способ, снижающий клоногенную активность клеток злокачественных опухолей головы и шеи в условиях in vitro, на основе использования полиэфирного ионофорного антибиотика салиномицин (Zhang Y., Zuo Y., Guan Z., Lu W., Xu Z., Zhang H., Yang Y., Yang M., Zhu H., Chen X. Salinomycin radiosensitizes human nasopharyngeal carcinoma cell line CNE-2 to radiation // Tumour Biol. - 2016. - V. 37. - N1. - P. 305-311; Scherzed A., Hackenberg S., Froelich K., Rak K., Ginzkey C., Hagen R., Schendzielorz P., Kleinsasser N. Effects of salinomycin and CGP37157 on head and neck squamous cell carcinoma cell lines in vitro // Mol Med Rep. - 2015. - V. 12. - N3. - P. 4455-4461). Возможные механизмы действия салиномицина на опухолевые клетки связаны с индукцией апоптоза, задержкой клеточного цикла на стадиях G2/M, увеличением количества повреждений ДНК, повышением экспрессии Вах и др.
Недостатком этого способа снижения клоногенной активности опухолевых клеток является отсутствие сведений о его влиянии на клоногенную активность ОСК - наиболее резистентную часть опухолевых клеток, а также его токсичность в отношении клеток нервной системы и других нормальных клеток (Boehmerle W., Endres М. Salinomycin induces calpain and cytochromec-mediated neuronal cell death // Cell Death and Disease. - 2011. - V. 2. - P. 2-10; Jaganmohan R., Jain M.V., Hallbeck A.L., Roberq K., Lotfi K., Los M.J. Glucose starvation-mediated inhibition of salinomycin induced autophagy amplifies cancer cell specific cell death // Oncotarget. - V. 6. - N12. - P. 10134-10145).
Известно вещество куркумин (дифферулоилметан), которое представляет собой полифенол, полученный из азиатской специи куркумы. Показана способность куркумина подавлять клоногенную активность клеток рака молочной железы и печени ( М., Jelkmann W., Depping R. Curcumin decreases survival of Нер3В liver and MCF-7 breast cancer cells: the role of HIF // Strahlenther Onkol. - 2011. - V. 187. - N7. - P. 393-400; Jia Т., Zhang L., Duan Y., Zhang M., Wang G., Zhang J. Zhao Z. The differential susceptibilities of MCF-7 and MDA-MB-231 cells to the cytotoxic effects of curcumin are associated with the PI3K/Akt-SKP2-Cip/Kips pathway // Cancer Cell Int. - 2014. - V. 14. - N1:126). Куркумин воздействует на ряд сигнальных путей, играющих важную роль в регуляции клеточной пролиферации, например, таких как SKP2-Cip/Kips и PI3K/Akt.
М., Jelkmann W., Depping R. Curcumin decreases survival of Нер3В liver and MCF-7 breast cancer cells: the role of HIF // Strahlenther Onkol. - 2011. - V. 187. - N7. - P. 393-400; Jia Т., Zhang L., Duan Y., Zhang M., Wang G., Zhang J. Zhao Z. The differential susceptibilities of MCF-7 and MDA-MB-231 cells to the cytotoxic effects of curcumin are associated with the PI3K/Akt-SKP2-Cip/Kips pathway // Cancer Cell Int. - 2014. - V. 14. - N1:126). Куркумин воздействует на ряд сигнальных путей, играющих важную роль в регуляции клеточной пролиферации, например, таких как SKP2-Cip/Kips и PI3K/Akt.
Однако нет данных о влиянии куркумина на клоногенную активность ОСК. Недостатком этого соединения является его низкая биодоступность, плохая абсорбция и недостаточная стабильность in vivo (Bansal S., Goel M., Aqil F., Vadhanam M., Gupta R. Advanced drug-delivery systems of curcumin for cancer chemoprevention // Cancer Prev. Res. (Phila). - 2011. - №4. - P. 1158-1171; Anand P., Kunnumakkara A., Newman R., Aggarwal B. Bioavailability of Curcumin: Problems and Promises // Molecular Pharmaceutics. - 2007. - V. 4. - N6. - P. 807-818).
Показана также способность целого ряда синтетических и природных соединений, экстрактов растений снижать клоногенную активность клеток рака молочной железы in vitro, но данные об их влиянии на клоногенную активность ОСК отсутствуют (Wang W., Wang Z., Bian X.-W. Disulfiram formulation, US 20180311178; Liu P., Kumar I.S., Brown S., Kannappan V., Tawari P.E., Tang J.Z., Jiang W., Armesilla A.L., Darling J.L., Wang W. Disulfiram targets cancer stem-like cells and reverses resistance and cross-resistance in acquired paclitaxel-resistant triple-negative breast cancer cells // Br J Cancer. -. 2013. - V. 109. - N7. - P. 1876-1885; Murias M., Luczak M.W., Niepsuj A., Krajka-Kuzniak V., Zielinska-Przyjemska M., Jagodzinski P.P.,  W., Szekeres Т., Jodynis-Liebert J. Cytotoxic activity of 3,3',4,4',5,5'-hexahydroxystilbene against breast cancer cells is mediated by induction of p53 and downregulation of mitochondrial superoxide dismutase // Toxicol In Vitro. - 2008. - V. 22. - N5. - P. 1361-1370; Lemos L.G., Nestal de Moraes G., Delbue D., Vasconcelos Fda C, Bernardo P.S., Lam E.W., Buarque C.D., Costa P.R., Maia R.C. 11a-N-Tosyl-5-deoxi-pterocarpan, LQB-223, a novel compound with potent antineoplastic activity toward breast cancer cells with different phenotypes // J Cancer Res Clin Oncol. - 2016. - V. 142. - N10. - P. 2119-2130; Chaudhary S., Chandrashekar K.S, Pai K.S., Setty M.M., Devkar R.A., Reddy N.D., Shoja M.H. Evaluation of antioxidant and anticancer activity of extract and fractions of Nardostachys jatamansi DC in breast carcinoma // BMC Complement Altern Med. - 2015. - V. 15:50; Fatima N., Ahmad M.K., Ansari J.A., Ali Z., Khan A.R., Mahdi A.A. Anticancer, antioxidant potential and profiling of polyphenolic compounds of Wrightia tinctoria Roxb. (R.Br.) bark // J Adv Pharm Technol Res. - 2016. - V. 7. - N4. - P. 159-165; Malki A., El-Saadani M., Sultan A.S. Garlic constituent diallyl trisulfide induced apoptosis in MCF7 human breast cancer cells // Cancer Biol Ther. - 2009. - V. 8. - N22. - P. 2175-2185; Syed Najmuddin S.U., Romli M.F., Hamid M., Alitheen N.B., Nik Abd Rahman N.M. Anti-cancer effect of Annona Muricata Linn Leaves Crude Extract (AMCE) on breast cancer cell line // BMC Complement Altern Med. - 2016. - V. 16. - N1:311;
W., Szekeres Т., Jodynis-Liebert J. Cytotoxic activity of 3,3',4,4',5,5'-hexahydroxystilbene against breast cancer cells is mediated by induction of p53 and downregulation of mitochondrial superoxide dismutase // Toxicol In Vitro. - 2008. - V. 22. - N5. - P. 1361-1370; Lemos L.G., Nestal de Moraes G., Delbue D., Vasconcelos Fda C, Bernardo P.S., Lam E.W., Buarque C.D., Costa P.R., Maia R.C. 11a-N-Tosyl-5-deoxi-pterocarpan, LQB-223, a novel compound with potent antineoplastic activity toward breast cancer cells with different phenotypes // J Cancer Res Clin Oncol. - 2016. - V. 142. - N10. - P. 2119-2130; Chaudhary S., Chandrashekar K.S, Pai K.S., Setty M.M., Devkar R.A., Reddy N.D., Shoja M.H. Evaluation of antioxidant and anticancer activity of extract and fractions of Nardostachys jatamansi DC in breast carcinoma // BMC Complement Altern Med. - 2015. - V. 15:50; Fatima N., Ahmad M.K., Ansari J.A., Ali Z., Khan A.R., Mahdi A.A. Anticancer, antioxidant potential and profiling of polyphenolic compounds of Wrightia tinctoria Roxb. (R.Br.) bark // J Adv Pharm Technol Res. - 2016. - V. 7. - N4. - P. 159-165; Malki A., El-Saadani M., Sultan A.S. Garlic constituent diallyl trisulfide induced apoptosis in MCF7 human breast cancer cells // Cancer Biol Ther. - 2009. - V. 8. - N22. - P. 2175-2185; Syed Najmuddin S.U., Romli M.F., Hamid M., Alitheen N.B., Nik Abd Rahman N.M. Anti-cancer effect of Annona Muricata Linn Leaves Crude Extract (AMCE) on breast cancer cell line // BMC Complement Altern Med. - 2016. - V. 16. - N1:311;  F.C., Rosa J.L., Schneider Т., Cubillos-Rojas M.,
F.C., Rosa J.L., Schneider Т., Cubillos-Rojas M.,  S., Azzolin V.F., Assmann C.E., Machado A.K., Ribeiro E.E., da Cruz I.B.M.
S., Azzolin V.F., Assmann C.E., Machado A.K., Ribeiro E.E., da Cruz I.B.M.  a Highly Caffeinated Food, Presents in vitro Antitumor Activity in Colorectal and Breast Cancer Cell Lines by Inhibiting AKT/mTOR/S6K and MAPKs Pathways // Nutr Cancer. - 2017. - V. 69. - N5. - P. 800-810).
a Highly Caffeinated Food, Presents in vitro Antitumor Activity in Colorectal and Breast Cancer Cell Lines by Inhibiting AKT/mTOR/S6K and MAPKs Pathways // Nutr Cancer. - 2017. - V. 69. - N5. - P. 800-810).
Известна способность ряда соединений снижать клоногенную активность клеток рака молочной железы in vitro при их комбинированном использовании с ионизирующим излучением, но отсутствуют данные о влиянии таких соединений в комбинации с облучением на клоногенную активность ОСК. В частности, с помощью клоногенного теста показано синергическое действие икаритина и ионизирующего излучения на опухолевые клетки молочной железы (Hong J., Zhang Z., Lv W., Zhang M., Chen C., Yang S., Li S., Zhang L., Han D., Zhang W. Icaritin synergistically enhances the radiosensitivity of 4T1 breast cancer cells // PLoS One. - 2013. - V. 8. - N8: e71347), но влияние икаритина на ОСК не изучалось. Соединение 2-бензоил-3-фенил-6,7-дихлороквиноксалин 1,4-диоксид оказывало радиосенсибилизирующее действие на общую массу клеток карциномы молочной железы по критерию клоногенной активности (Haykal J., Fernainy P., Itani W., Haddadin M., Geara F., Smith C, Gali-Muhtasib H. Radiosensitization of EMT6 mammary carcinoma cells by 2-benzoyl-3-phenyl-6,7-dichloroquinoxaline 1,4-dioxide // Radiother Oncol. - 2008. - V. 86. - N3. - P. 412-418), но влияние этого соединения на ОСК не изучалось. Применение целебрекса (Liu W., Chen Y., Wang W., Keng P., Finkelstein J., Hu D., Liang L., Guo M., Fenton В., Okunieff P., Ding I. Combination of radiation and celebrex (celecoxib) reduce mammary and lung tumor growth // Am J Clin Oncol. - 2003. - V. 26. - N4. - P. 103-109), аналога витамина D3 ЕВ1089 (Sundaram S., Gewirtz D.A. The vitamin D3 analog EB 1089 enhances the response of human breast tumor cells to radiation // Radiat Res. - 1999. - V. 152. N5. - P. 479-486), селеноорганического соединения эбселен (Thabet N.M., Moustafa E.M. Synergistic effect of Ebselen and gamma radiation on breast cancer cells // Int J Radiat Biol. - 2017. - V. 93. - N8. - P. 784-792), наночастиц золота, связанных с тиоглюкозой (Wang С., Jiang Y., Li X., Hu L. Thioglucose-bound gold nanoparticles increase the radiosensitivity of a triple-negative breast cancer cell line (MDA-MB-231) // Breast Cancer. - 2015. - V. 22. - N4. P. 413-420), или салиномицина (Zhang Y., Zuo Y., Guan Z., Lu W., Xu Z., Zhang H., Yang Y., Yang M., Zhu H., Chen X. Salinomycin radiosensitizes human nasopharyngeal carcinoma cell line CNE-2 to radiation // Tumour Biol. - 2016. - V. 37. - N1. - P. 305-311) приводило к усилению радиационного эффекта по критерию уменьшения клоногенной активности опухолевых клеток молочной железы различных линий, но влияние на ОСК этих соединений в комбинации с ионизирующим излучением не изучалось.
Известен способ идентификации и характеристики ОСК молочной железы, в котором показано уменьшение клоногенной активности этих клеток под влиянием антагонистов NOTCH4 (Clarke M.F., Wicha M.S., Al-Hajj M. Prospective identification and characterization of breast cancer stem cells, US 20090004205).
Однако во всех известных способах снижения клоногенной активности опухолевых клеток, в том числе ОСК, не используются димерные бисбензимидазолы, получаемые методами химического синтеза.
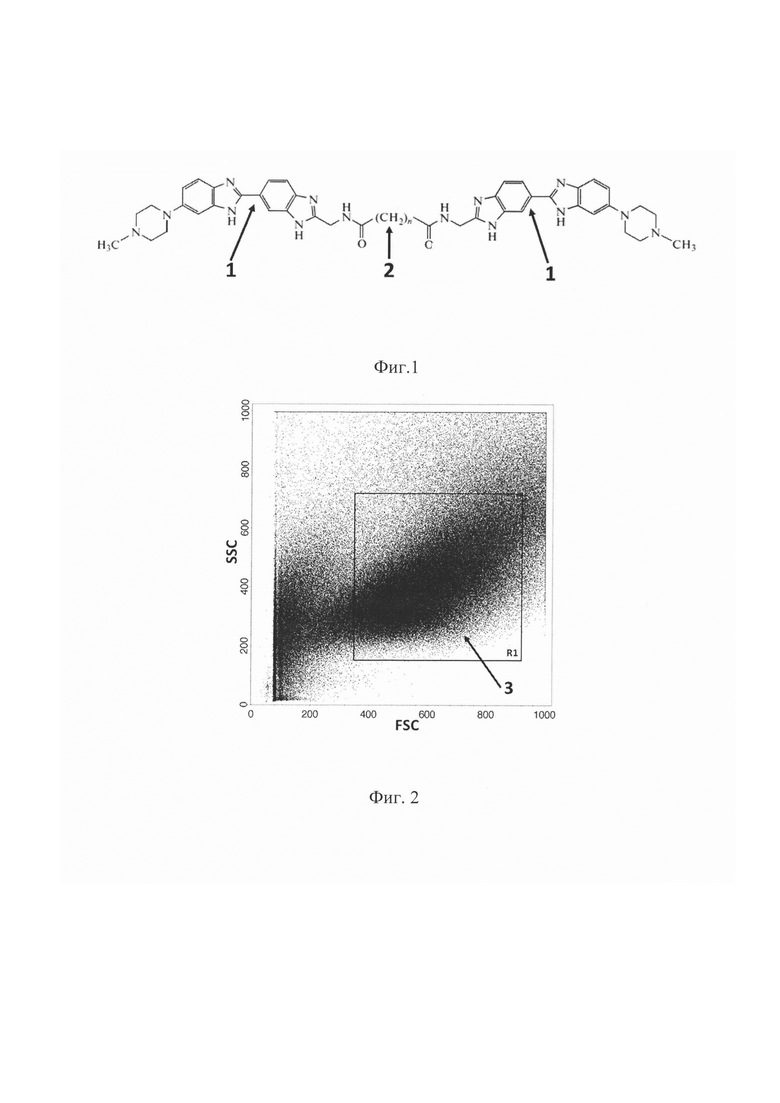
Прототипом предлагаемого технического решения является способ снижения общей клоногенной активности опухолевых клеток рака молочной железы человека in vitro, основанный на применении водонерастворимых димерных бисбензимидазолов (dimeric bisbenzimidazoles - DB) (Чурюкина К.А., Замулаева И.А., Иванов А.А., Коваль B.C., Жузе А.Л. Радиомодифицирующее и противоопухолевое действие синтетических димерных бисбензимидазолов на клетки рака молочной железы линии MCF-7 in vitro // Радиационная биология. Радиоэкология. - 2017. - Т. 57. - №2. - С. 136-144). С помощью клоногенного теста доказана способность этих соединений не только снижать клоногенную активность общей массы опухолевых клеток линии MCF-7 при одиночном применении, но и оказывать аддитивное действие на этот показатель в комбинации с облучением. Водонерастворимые димерные бисбензимидазолы являются флуоресцентными химическими соединениями из группы бисбензимидазолов, в них два бисбензимидазольных блока соединены между собой метиленовым линкером - DB(n), где n - число метиленовых звеньев (фиг. 1) (Иванов, А.А., Салянов В.И., Стрельцов С.А., Черепанова Н.А., Громова Е.С., Жузе А.Л. Лиганды, специфичные к определенным последовательностям пар оснований ДНК. XIV. Синтез флуоресцентных биологически активных димерных бисбензимидазолов - DB (3, 4, 5, 7, 11) // Биоорганическая химия. - 2011. - Т. 37. - №4. - С. 530-541; Иванов А.А., Салянов В.И., Жузе А.Л. Лиганды, специфичные к определенным последовательностям пар оснований ДНК. XV. Синтез и спектральные характеристики новой серии димерных бисбензимидазолов - DB (1, 2, 6, 8, 9, 10, 12). // Биоорганическая химия. - 2016. - Т. 42. - №2. - С. 205-213).
Однако в известном способе отсутствуют данные о действии DB(n) на клоногенную активность ОСК при одиночном использовании этих соединений или в комбинации с облучением.
Технический результат заявляемого изобретения заключается в снижении клоногенной активности ОСК и синергическом усилении эффектов радиационного воздействия на ОСК по критерию клоногенной активности in vitro.
Технический результат достигается тем, что также как и в известном способе в течение 72 часов воздействуют на опухолевые клетки in vitro с помощью ДНК-связывающих лигандов - водонерастворимых димерных бисбензимидазолов.
Особенность заявляемого способа заключается в том, что опухолевые клетки сортируют на две популяции: стволовые и не стволовые клетки и через сутки к отсортированным клеткам добавляют водонерастворимый димерный бисбензимидазол с 5 метиленовыми звеньями в составе линкера (DB (5) или водонерастворимоый димерный бисбензимидазол с 7 метиленовыми звеньями (DB (7), через трое суток клетки отмывают от соединений и 8 суток культивируют в стандартных условиях при температуре +37°С в СО2-инкубаторе с 5% содержанием СО2, после чего проводят фиксацию и подсчет количества колоний, содержащих не менее 50 клеток. Определяют синергическое снижение клоногенной активности стволовых клеток рака молочной железы при комбинированном действии водонерастворимых димерных бисбензимидазолов и ионизирующего излучения, для этого опухолевые клетки сортируют на две популяции: стволовые и не стволовые клетки и через сутки к отсортированным клеткам добавляют водонерастворимый димерный бисбензимидазол с 5 метиленовыми звеньями в составе линкера (DB (5) или водонерастворимый димерный бисбензимидазол с 7 метиленовыми звеньями (DB (7), далее через сутки клетки облучают в дозе 4 Гр, через двое суток после облучения клетки отмывают от соединений и 8 суток культивируют в стандартных условиях при температуре +37°С в СО2-инкубаторе с 5% содержанием СО2, проводят фиксацию и подсчет количества колоний, содержащих не менее 50 клеток, после чего для оценки радиомодифицирующих свойств DB(n) рассчитывают коэффициенты синергизма по формуле:
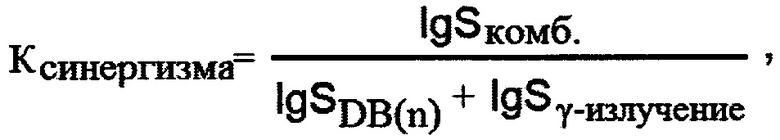
где S - количество колоний, выраженное в долях от контрольного уровня, в изучаемой популяции при комбинированном действии DB(n) и γ-излучения (комб.), при действии только DB(n) и при действии только γ-излучения.
Изобретение иллюстрируется подробным описанием, примерами и иллюстрациями, на которых изображено:
Фиг. 1. - Химическая структура синтетических водонерастворимых димерных бисбензимидазолов DB(n): 1 - бисбензимидазольный блок, 2 - метиленовый линкер, в котором п может варьировать от 1 до 11.
Фиг. 2. - Пример выделения клеток линии MCF-7 на основе показателей прямого (FSC) и бокового (SSC) светорассеяния с помощью проточной цитометрии. 3 - регион клеток R1 для последующей идентификации клеток SP (ОСК).
Фиг. 3. - Графики распределения клеток по интенсивности флуоресценции Хёхста33342 в рабочем диапазоне красителя (F15 - 675±20 нм, F14 - 424±20 нм). Выделены регионы: 4 - SP и 5 - не SP; а) Образец без верапамила, б) Контрольный образец с верапамилом.
Фиг. 4. - Клоногенная активность ОСК (SP) и остальных клеток (не SP) при одиночном и комбинированном действии DB(5) или DB(7) и ионизирующего излучения в дозе 4 Гр. Показано количество колоний, выросших после указанных воздействий, в долях от количества колоний в интактном контроле, принятого за единицу.
*р<0,05 при сравнении с облучением,
^р<0,05 при сравнении с интактным контролем.
Фиг. 5. - Типичные фотографии клеток SP (ОСК), полученные с помощью лазерной сканирующей микроскопии (увеличение объектива 63х): 6 - флуоресцентный режим; 7 - режим наложения светлого поля и флуоресценции.
Способ осуществляют следующим образом:
I. Пробоподготовка для выделения клеток SP (ОСК):
Клетки рака молочной железы линии MCF-7 рассевают в культуральные флаконы (площадь дна 25 см2) с добавлением полной питательной среды (культуральная среда DMEM, содержащая 10% сыворотки крови крупного рогатого скота (СККРС), пенициллин (50000 ед/л), стрептомицин (50 мг/л) и глютамин (292 мг/л).
По достижении 70% конфлюентности клетки снимают со дна флакона с помощью смеси растворов версена и трипсина (1:1) в бессывороточную питательную среду.
Производят подсчет количества клеток, выросших во флаконе с помощью камеры Горяева.
Затем клетки разводят до концентрации 1 млн клеток в 1 мл среды.
К части проб добавляют верапамил («ЭбевеФарма», Австрия) (блокатор АТФ-связывающих кассетных транспортеров, препятствующий обратному транспорту из клеток ряда веществ, в том числе Хёхста 33342) в концентрации 12,5 мг/мл.
Клетки инкубируют с верапамилом 15 минут при 37°С.
Во все образцы (с верапамилом или без него) добавляют флуоресцентный краситель Хехст 33342 («Calbiochem», Германия) в конечной концентрации 5 мкг/мл и инкубируют в течение 90 минут при +37°С.
После окончания инкубации клетки центрифугируют в течение 5 минут при 200xg, далее к осадку добавляют холодный раствор Хэнкса, содержащий 2% СККРС, 10 ммоль/л Хепеса («ПанЭко», Россия) и 2 мкг/мл йодистого пропидия (ИП, «Sigma», США).
II. Выявление и сортировка SP и остальных клеток:
Подготовленный образец анализируют и сортируют на проточном цитофлуориметре, оснащенном лазерами с длинами волн 364 и 488 нм.
Флуоресценцию Хехста33342 измеряют в красной (675±20 нм) и синей (424±20 нм) областях спектра при λвозбуждения=364 нм. Флуоресценцию ИП регистрируют при длине волны 585±20 нм при λвозбуждения=488 нм.
На графике распределения клеток по SSC и FSC выделяют регион клеток R1 для дальнейшего анализа флуоресценции ИП и Хёхста33342 (фиг. 2).
Для исключения из анализа мертвых и погибающих клеток отбирают группу ИП-отрицательных клеток на графике распределения клеток по интенсивности FSC и флуоресценции ИП.
Далее среди живых (ИП-отрицательных) клеток идентифицируют ОСК по их способности формировать SP с низкой интенсивностью флуоресценции этого красителя в образцах без верапамила (фиг. 3А). При этом регион SP выбирается таким образом, чтобы в него попадало минимальное количество клеток в образцах с верапамилом (фиг. 3Б).
Клетки SP и не SP стерильно сортируют в 6-луночные культуральные планшеты по 400 клеток в лунку с добавлением 2 мл полной питательной среды.
III. Обработка клеток с помощью DB(n), облучение и оценка клоногенной активности клеток:
Через сутки после сортировки к клеткам добавляют DB (5) или DB (7) в конечной концентрации 20 мкМ.
Через сутки после добавления DB(n) производят острое облучение части клеточных культур на гамма-установке в дозе 4 Гр.
После облучения клетки культивируют в стандартных условиях в СО2 инкубаторе в течение 2-х суток. Необлученные клетки продолжают культивировать в тех же условиях. В конце этого периода оценивают накопление DB(n) в необлученных клетках с помощью лазерной сканирующей микроскопии при λвозбуждения=405 НМ λфлуоресценции=410-550 нм.
Затем клетки отмывают от DB(n) со сменой среды в лунках.
Клетки культивируют в стандартных условиях в течение 8 суток.
Выросшие колонии фиксируют в 96% этаноле в течение 10 минут, после чего окрашивают трипановым синим в течение 10 минут при комнатной температуре.
Производят подсчет колоний численностью не менее 50 клеток под световым микроскопом.
Для статистического анализа количество колоний, выросших в интактном контроле в каждой из популяций, принимают за единицу. Количество колоний, выросших после комбинированного действия DB(n) и γ-излучения (комб.), после действия только DB(n) и после действия только γ-излучения, выражают в долях от контрольного количества колоний, принятого за единицу.
Для оценки радиомодифицирующих свойств DB(n) рассчитывают коэффициенты синергизма по формуле:
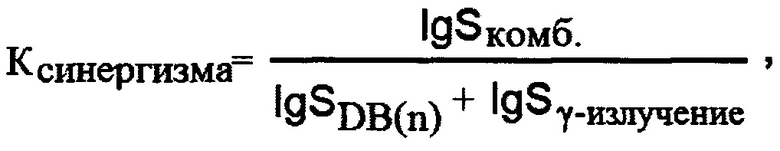
где S - количество колоний, выраженное в долях от контрольного уровня, в изучаемой популяции при комбинированном действии DB(n) и γ-излучения (комб.), при действии только DB(n) и при действии только γ-излучения.
Пример 1. Изменение клоногенной активности ОСК после инкубации с DB (5) или DB (7).
Показано, что способность ОСК, выделенных с помощью метода SP, к формированию колоний значительно снижается при воздействии на них как DB(5), так и DB(7) (фиг. 4). Так, вещество DB(5) снижает количество колоний, выросших из клеток SP в 1,7 раз по сравнению с контролем (р<0,05), а вещество DB (7) - в 1,4 раза (р<0,05). В то же время количество колоний, выросших из остальных (не стволовых) клеток, снижается при воздействии на них этих соединений в меньшей степени. Так, DB(5) снижает количество колоний в 1,2 раза, DB (7) - в 1,3 раза по сравнению с контролем.
Данный пример подтверждает ингибирующее действие DB(5) и DB(7) на ОСК по критерию подавления клоногенной активности клеток SP.
Пример 2. Изменение клоногенной активности ОСК после комбинированного действия DB(5) или DB(7) и ионизирующего излучения.
Радиочувствительность ОСК (SP) и остальных клеток после комбинированного действия γ-излучения и DB(n) оценивали по критерию клоногенной активности (количество выросших колоний), принятой в контроле за 100% отдельно в каждой из исследуемых популяций. Полученные результаты представлены на фиг. 4. Показано, что одиночное действие γ-излучения в дозе 4 Гр снижает клоногенную активность SP (ОСК) только на 18% по сравнению с контролем, но при этом почти в 2 раза сильнее уменьшает клоногенную активность остальных клеток (на 33% относительно контроля), что подтверждает данные литературы о более высокой радиорезистентности ОСК по сравнению с остальными клетками. Впервые в данном исследовании установлено, что DB(n) в комбинации с γ-излучением снижают клоногенную активность клеток SP по сравнению с одиночным действием облучения (р<0,05). Для оценки эффектов комбинированного действия DB(n) и ионизирующего излучения рассчитывали коэффициент синергизма, показывающий, во сколько раз увеличился биологический эффект при комбинированном действии по сравнению с тем, который ожидался при независимом (аддитивном) сложении эффектов от каждого агента, используемого в комбинации (Петин В.Г., Жураковская Г.П., Комарова Л.Н. Радиобиологические основы синергических взаимодействий в биосфере // М.: ГЕОС, 2012. - 219 с.). Установлено, что эффекты комбинированного действия DB(n) и ионизирующего излучения на клетки SP носят синергический характер: в случае DB(5) коэффициент синергизма составляет 1,3, в случае DB(7) - 1,2. В отношении остальных клеток (не SP) комбинированное применение DB(n) и облучения приводит к аддитивному или субаддитивному эффекту снижения клоногенной активности: для DB (5) коэффициент синергизма равен 1,0, для DB(7) - 0,7.
Данный пример демонстрирует радиомодифицирующее действие DB(n), которое заключается в синергическом снижении клоногенной активности ОСК (SP) при комбинированном применении DB(n) и ионизирующего излучения. Эффекты комбинированного воздействия на остальные (не стволовые) клетки выражены в меньшей степени, т.к. носят аддитивный или субаддитивный характер.
Пример 3. Накопление DB(5) и DB(7) в ОСК (SP) и остальных клетках.
Благодаря тому, что комплекс DB(n) - ДНК обладает достаточно высокой флуоресценцией, существует возможность оценки внутриклеточного накопления данных соединений с помощью методов флуоресцентной или лазерной сканирующей микроскопии. Для оценки связывания DB(n) со стволовыми и не стволовыми опухолевыми клетками выполняли стерильную сортировку популяции SP (ОСК) и остальных клеток в культуральные слайд-флаконы, через сутки добавляли DB(5) или DB(7) в концентрации 20 мкМ и через 72 часа после инкубации с этими соединениями проводили анализ их накопления в клетках MCF-7 на лазерном сканирующем микроскопе TCS SPE DMI 4000 В (Leica, США).
Полученные результаты свидетельствуют, что DB(n) проникают внутрь клеток SP (ОСК) и остаются в них в течение всего времени инкубации, локализуясь и в ядрах (где регистрируются в виде относительно слабой неравномерной флуоресценции), и в цитоплазме (в виде ярко флуоресцирующих гранул разного размера и формы) (фиг. 5).
Пример показывает, что DB(n) не откачиваются из ОСК, как многие известные химиопрепараты и Хёхст33342.
Положительный эффект.
Примеры №1 и 2 показывают, что новый способ, заключающийся в 72 часовом воздействии на клетки ДНК-связывающих лигандов - водонерастворимых димерных бисбензимидазолов in vitro, позволяет снижать клоногенную активность ОСК как при одиночном применении этих соединений, так и в комбинации с ионизирующим излучением. Причем эффекты комбинированного действия на ОСК водонерастворимых димерных бисбензимидазолов с числом метиленовых звеньев 5 или 7 (DB (5), DB (7) и облучения носят синергический характер. Пример №3 подтверждает эффективность действия DB(n), где n=5 или 7, на ОСК благодаря тому, что данные соединения не откачиваются из ОСК, а задерживаются внутри этих клеток.
Вместе, результаты из примеров №1-3 показывают способность DB (n) оказывать ингибирующее действие на радио- и химиорезистентную часть опухолевых клеток - на популяцию ОСК, а именно: доказывают способность этих соединений снижать клоногенную активность ОСК при одиночном применении и в комбинации с радиационным воздействием.
В соответствии с концепцией ОСК, все ключевые характеристики злокачественных новообразований, делающие их смертельно опасными заболеваниями, определяются именно ОСК. Снижение клоногенной активности ОСК, которые являются более химио- и радиорезистентными, чем остальная масса опухолевых клеток, позволит повысить химио- и радиочувствительность опухоли в целом, что в свою очередь будет способствовать повышению эффективности лечения.
Исследование выполнено за счет гранта Российского научного фонда (проект №18-75-10025).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СНИЖЕНИЯ КОЛИЧЕСТВА СТВОЛОВЫХ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2018 |
|
RU2702910C2 |
| СПОСОБ ИНГИБИРОВАНИЯ РАДИАЦИОННО-ИНДУЦИРОВАННОГО УВЕЛИЧЕНИЯ КОЛИЧЕСТВА СТВОЛОВЫХ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2022 |
|
RU2800366C2 |
| СПОСОБ СНИЖЕНИЯ КОЛИЧЕСТВА СТВОЛОВЫХ КЛЕТОК АДЕНОКАРЦИНОМЫ МОЛОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2022 |
|
RU2798550C2 |
| Способ подавления индуцирующего действия высокомолекулярной гиалуроновой кислоты на стволовые клетки рака молочной железы | 2021 |
|
RU2774031C1 |
| Способ определения снижения радиационно-индуцированной миграции клеток рака молочной железы человека линии MCF-7 | 2022 |
|
RU2789099C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАДИОЧУВСТВИТЕЛЬНОСТИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2020 |
|
RU2735982C2 |
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ДЕЙСТВИЯ ПРОТОННОЙ ТЕРАПИИ НА СТВОЛОВЫЕ КЛЕТКИ МЕЛАНОМЫ | 2022 |
|
RU2798733C2 |
| СПОСОБ УСИЛЕНИЯ ЦИТОТОКСИЧЕСКИХ ЭФФЕКТОВ ПАНОБИНОСТАТА НА ОПУХОЛЕВЫЕ КЛЕТКИ | 2023 |
|
RU2806371C2 |
| Средство, обладающее противоклоногенной активностью в отношении опухолевых клеток человека | 2016 |
|
RU2648820C2 |
| ПРОТИВОРАКОВАЯ ТЕРАПИЯ, НАПРАВЛЕННАЯ ПРОТИВ РАКОВЫХ СТВОЛОВЫХ КЛЕТОК И ФОРМ РАКА, УСТОЙЧИВЫХ К ЛЕЧЕНИЮ ЛЕКАРСТВЕННЫМИ ПРЕПАРАТАМИ | 2010 |
|
RU2568834C2 |

Изобретение относится к области медицины, в частности онкологии, и может быть использовано для снижения клоногенной активности опухолевых стволовых клеток рака молочной железы. Способ заключается в 72-часовом воздействии на опухолевые клетки in vitro ДНК-связывающих лигандов - водонерастворимых димерных бисбензимидазолов. Опухолевые клетки сортируют на две популяции: стволовые и нестволовые клетки и через сутки к отсортированным клеткам добавляют водонерастворимый димерный бисбензимидазол с 5 метиленовыми звеньями в составе линкера (DB (5)) или водонерастворимый димерный бисбензимидазол с 7 метиленовыми звеньями (DB (7)). Через трое суток клетки отмывают от соединений и 8 суток культивируют в стандартных условиях при температуре +37°С в СО2-инкубаторе с 5% содержанием СО2, после чего проводят фиксацию и подсчет количества колоний, содержащих не менее 50 клеток. Использование данного изобретения позволяет снизить клоногенную активность опухолевых стволовых клеток рака молочной железы, что позволяет повысить химио- и радиочувствительность опухоли, и, в свою очередь, будет способствовать повышению эффективности лечения. 1 з.п. ф-лы, 5 ил., 2 пр.
1. Способ снижения клоногенной активности стволовых клеток рака молочной железы, заключающийся в 72-часовом воздействии на опухолевые клетки in vitro ДНК-связывающих лигандов - водонерастворимых димерных бисбензимидазолов, отличающийся тем, что опухолевые клетки сортируют на две популяции: стволовые и нестволовые клетки и через сутки к отсортированным клеткам добавляют водонерастворимый димерный бисбензимидазол с 5 метиленовыми звеньями в составе линкера (DB (5) или водонерастворимый димерный бисбензимидазол с 7 метиленовыми звеньями (DB (7), через трое суток клетки отмывают от соединений и 8 суток культивируют в стандартных условиях при температуре +37°С в СО2-инкубаторе с 5% содержанием СО2, после чего проводят фиксацию и подсчет количества колоний, содержащих не менее 50 клеток.
2. Способ по п. 1, отличающийся тем, что определяют синергическое снижение клоногенной активности стволовых клеток рака молочной железы при комбинированном действии водонерастворимых димерных бисбензимидазолов и ионизирующего излучения, для этого опухолевые клетки сортируют на две популяции: стволовые и нестволовые клетки и через сутки к отсортированным клеткам добавляют водонерастворимый димерный бисбензимидазол с 5 метиленовыми звеньями в составе линкера (DB (5) или водонерастворимый димерный бисбензимидазол с 7 метиленовыми звеньями (DB (7), далее через сутки клетки облучают в дозе 4 Гр, через двое суток после облучения клетки отмывают от соединений и 8 суток культивируют в стандартных условиях при температуре +37°С в СО2-инкубаторе с 5% содержанием СО2, проводят фиксацию и подсчет количества колоний, содержащих не менее 50 клеток, после чего для оценки радиомодифицирующих свойств DB(n) рассчитывают коэффициенты синергизма по формуле:
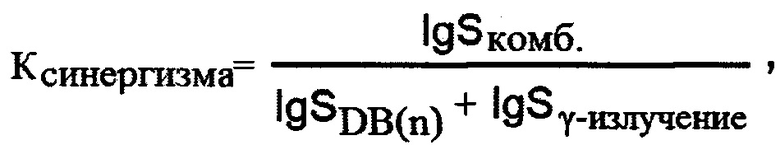
где S - количество колоний, выраженное в долях от контрольного уровня, в изучаемой популяции при комбинированном действии DB(n) и γ-излучения (комб.), при действии только DB(n) и при действии только γ-излучения.
| Чурюкина К.А | |||
| и др | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Радиоэкология, 2017, Т | |||
| Способ получения на волокне оливково-зеленой окраски путем образования никелевого лака азокрасителя | 1920 |
|
SU57A1 |
| Регулятор для ветряного двигателя в ветроэлектрических установках | 1921 |
|
SU136A1 |
| Дарий М.В | |||
| и др | |||
| Димерные бисбензимидазолы: цитотоксичность и влияние на метилирование ДНК в нормальных и раковых клетках человека // Молекулярная биология, 2013, N2, Т.47, стр.259-266 | |||
| Устройство для питания цепи накала катодных ламп переменным током | 1930 |
|
SU23466A1 |
| WO 2015178426 A1, 26.11.2015 | |||
| Haykal J | |||
| et al | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Пюпитр для работы на пишущих машинах | 1922 |
|
SU86A1 |
| Способ применения поваренной соли в нагревательной закалочной ванне при высоких температурах | 1923 |
|
SU412A1 |
Авторы
Даты
2019-09-19—Публикация
2019-02-27—Подача