Изобретение относится к фармакологии, а именно к биологически активным веществам, препятствующим развитию диабетических патий, и обладающим кардио-, эндотелио-, нефро-, микроангио-, макроангио- и энцефалопротекторными свойствами при сахарном диабете, которые могут быть использованы как действующие начала в фармацевтических композициях для профилактики и лечения осложнений данного заболевания.
Известны аналоги фенацилтиазола бромида (ФТБ), являющиеся потенциальной основой для создания лекарственных средств, восстанавливающих эластичность коллагенового каркаса сердечнососудистой системы, а также устраняющих и профилактирующих наступление полисистемных осложнений сахарного диабета, что было впервые показано более 20 лет назад [1,2]. Отмечено, что применение аналогов ФТБ влечет микроструктурную и функциональную нормализацию состояния сосудистой стенки и миокарда на фоне исходной гипертрофии и сниженной эластичности [3,4,5]. Галоид-замещенный ацетофенон, именуемый также фенацил, являясь основой ФТБ, служит привилегированной структурной основой для веществ, замедляющих развитие отдаленных осложнений сахарного диабета.
Положительное по характеру влияние на сердечно-сосудистую систему диабетических крыс отмечается для ряда веществ, находящихся на доклиническом этапе исследования. К этим веществам относятся 3-бензилоксикарбонил-метил-4-метил-тиазол-3-иум бромид (соединение С36), 3-бензилоксикарбонилметил-4,5-диметил-тиазол-3-бромид, 3-бензилокси карбонилметил-5-(2-гидроксиэтил)-4-метил-тиазол-3-бромид, 3-бензилокси карбонилметил-4-метил-тиазол-3-бромид, 3-бензилоксикарбонилметил-4,5,6,7-тетрагидро-бензотиазол-3-бромид, 3-карбоксиметил-4-метил-тиазол-3-бромид. Все вышеперечисленные соединения, относятся к веществам замещенного 5-членного азацикла, имеют тиазольное или бензилтиазольное ядро молекулы, а также ряд заместителей, ассоциируемых с повышением активности этих веществ, к числу которых относятся фенацильный, бензильный или бензилоксикарбонильный радикалы. Некоторые вещества имеют тиазольную основу и бензилоксикарбонильный заместитель [6].
Наибольший интерес представляет аналог ФТБ, стабильный в физиологических буферных системах - 4,5-диметил-3-(2-оксо-2-фенилэтил)тиазол-3-иум хлорид (соединение ALT-711, алагебриум). Было показано, что антидиабетический потенциал данного вещества отвечает требованию по эффективности как к средству профилактики и лечения отдаленных осложнений диабета - проблеме, не решаемой посредством классического ряда препаратов, нацеленных на гликемический контроль [2]. Данное вещество нормализует гемодинамику при диабете, улучшая эндотелиальную функцию и эластичность стенки сосудов, что становится причиной нормализации артериального давления, замедления течения кардиомио- и ангиопатий [7]. Анализ гистологической и биофизической картины изменений, происходящих при воздействии алагебриума на стромальные компоненты органов, поврежденных диабетом, показывает, что происходит перераспределение соотношения типов коллагена и снижение содержания типа 1, что влечет за собой повышение эластичности всех стромальных элементов, включая сердечно-сосудистую систему [8]. Данный эффект производных фенацила на органную строму может быть рассмотрен в качестве целевого, обуславливающего достижение потенциального клинического эффекта. Дополнительно для алагебриума была установлена позитивная динамика состояния сердечно-сосудистой системы в условиях патологий, ассоциируемых со старением организма [9].
Однако, подавление проявлений отдаленных осложнений сахарного диабета остается недостаточно эффективным.
Техническим результатом изобретения является увеличение эффективности кардио- и эндотелиопртекторной активности, при сохранении микроангио-, макроангио-, нефро- и энцефалопротекторных свойств.
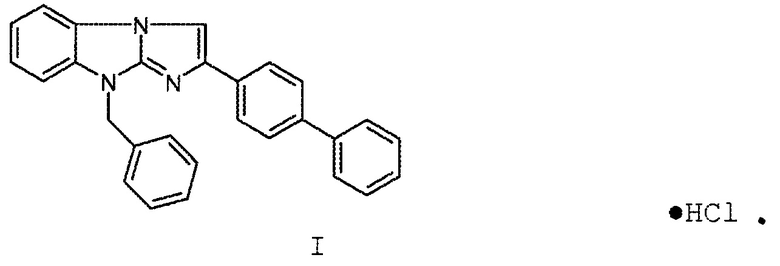
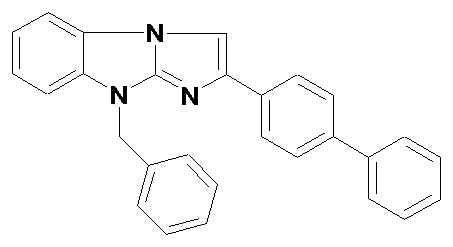
Технический результат достигается гидрохлоридом 9-бензил-2-бифенилимидазо[1,2-a]бензимидазола общей формулы I:
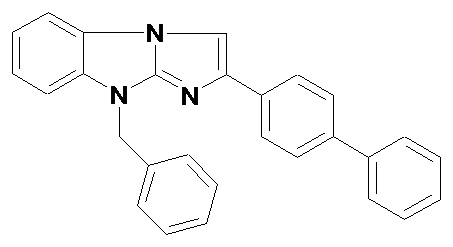 ●HCl
●HCl
I
Соединение может применяться как действующее начало в биологически активных композициях, обладающих кардио- и эндотелиопртекторной активностью, а также микроангио-, макроангио-, нефро- и энцефалопротекторными свойствами, в том числе в фармацевтических композициях для профилактики и лечения осложнений при сахарном диабете.
Соединение I известно как проявляющее свойства разрушителей поперечных сшивок гликированных белков [10].
Способ его получения заключается во взаимодействии 2-амино-1-бензилбензимидазола и 4-фенилфенацилбромида, с последующей циклизацией образующейся четвертичной соли бромида 1-бензил-3-фенилфенацил-2-аминобензимидазолия путем нагревания в водно-спиртовой растворе карбоната натрия. Полученное основание переводят в соль обработкой кислотой. Пример получения описан в патенте РФ № 2627769.
Ниже приведены примеры исследования кардио-, эндотелио-, нефро-, микроангио-, макроангио- и энцефалопротекторных свойств соединения I.
Материалы и методы
Объект исследования - гидрохлорид 9-бензил-2-бифенилимидазо[1,2-a]бензимидазола (лабораторный шифр ДФ-5).
Исследование выполнено на 30 крысах-самцах с массой тела 200-220 г и 30 белых нелинейных мышах-самцах массой 18-22 г (острая токсичность). Животные содержались в условиях вивария на стандартной диете (гранулированный комбикорм, гранулы 5 мм, ГОСТ 51899-02), при соблюдении правил лабораторной практики при проведении доклинических исследований в РФ (ГОСТ З 51000.3-96 и 1000.4-96), а также правил и Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997). За 12 ч до эксперимента животные не получали пищу без ограничения доступа к воде.
Сахарный диабет 1 типа вызывали путем однократного внутрибрюшинного введения стрептозотоцина (СТ3, Sigma, США) в дозе 65 мг/кг. Животным контрольной группы вводили цитратный буфер (растворитель) в одинаковом объеме. СД 1 типа моделировали на протяжении 8 недель. На протяжении этого периода животных взвешивали и регистрировали уровень глюкозы в крови. В эксперимент включались животные в уровнем глюкозы в крови не менее 15 ммоль/л. Средний уровень глюкозы у групп крыс с экспериментальным сахарным диабетом был в 5-6 раз выше, чем у интактной группы животных.
Исследование кардиопротекторных свойств соединения у крыс с экспериментальным сахарным диабетом было проведено путем изучения влияния нагрузки адреналином на функциональные резервы сердца в количестве 0,1 мл (разведение 10-7 г/мл) на 100 г веса животного. Производилась оценка изменений гемодинамики и функциональных резервов миокарда у крыс на фоне нагрузки с использованием компьютерного гемодинамического анализатора на базе программы Acknowledge, Version 3 (BIOPAC System Inc.) [11].
При морфологической оценке тканей сердца материал для исследования получали из левого желудочка сердца. Вырезали фрагменты левого желудочка, включающие все слои, и фиксировали в течение 24 часов в 10% растворе нейтрального забуференного формалина (pH 7,4), обезвоживали и заливали в парафин по общепринятой гистологической методике. На роторном микротоме изготавливали срезы толщиной 3-5 мкм, которые окрашивали гематоксилином и эозином, по Массону, Sirius Red.
Гистологические препараты фотографировали цифровой камерой Axiocam 105 color (Карл Цейс, Германия, 5 мегапикселей) на базе микроскопа Axiocam plus (Карл Цейс, Германия) с использованием объектива х10; х40 и окуляра х10. При морфологическом исследовании оценивали наличие изменений в сердце в виде изменений соединительной ткани и наличия воспалительной инфильтрации. С помощью морфометрического метода исследования (с использованием программы «ZEN Pro 2012», (Карл Цейс, Германия) определяли среднюю площадь периваскулярной соединительной ткани в сердце (мкм2).
Оценка эндотелиопротекторного действия наиболее активных веществ при сердечной недостаточности была проведена при введении ацетилхолина и нитропруссида натрия, с последующим анализом коэффициента эндотелиальной дисфункции [11].
Исследование нефропротекторных свойств изучаемого вещества проводилось путем оценки следующих показателей: измерение количества белка в моче, суточная экскреция белка, суточный диурез.
Материал для исследования почки крыс, производили исследование образцов ткани, взятых на уровне ворот почки. Вырезали продольные и поперечные фрагменты, включающие корковое и мозговое вещество. Образцы ткани фиксировали в течение 24 часа в 10% растворе нейтрального забуференного формалина (pH 7,4), обезвоживали и заливали в парафин по общепринятой гистологической методике. На роторном микротоме изготавливали срезы толщиной 3-5 мкм, которые окрашивали гематоксилином и эозином, по Массону, Sirius Red.
Гистологические препараты фотографировали цифровой камерой Axiocam 105 color (Карл Цейс, Германия, 5 мегапикселей) на базе микроскопа Axiocam plus (Карл Цейс, Германия) с использованием объектива х10; х40 и окуляра х10. При морфологическом исследовании оценивали наличие изменений в почках в виде изменений соединительной ткани и наличия воспалительной инфильтрации. С помощью морфометрического метода исследования (с использованием программы «ZEN Pro 2012», (Карл Цейс, Германия) определяли площадь клубочка, площадь соединительной ткани в клубочке (мкм2).
Изучение церебропротекторных свойств исследуемого соединения проводили по модели оценки пространственной памяти у грызунов с использованием теста Барнса. Эксперимент проводили на протяжении 28 дней. В первый день исследования выполняли этап приучения животных к поиску истинной норки. На следующий день после обучения животных помещали в установку, на поиск норки отводили максимально 5 минут (300 с.). Если животное не справлялось за указанный период, то его считали «не приученным», после чего животное выводили из эксперимента.
Для проведения гистологического исследования головной мозг фиксировали в течение 24 часов в 10%-м растворе нейтрального забуференного формалина (pH 7,4), обезвоживали и заливали в парафин по общепринятой гистологической методике. На роторном микротоме изготавливали срезы толщиной 3-5 мкм, которые окрашивали гематоксилином и эозином и тионином по методу Ниссля.
Гистологические препараты фотографировали цифровой камерой Axiocam 105 color (Карл Цейс, Германия, 5 мегапикселей) на базе микроскопа Axiocam plus (Карл Цейс, Германия) с использованием объектива х 10; х40 и окуляра х10. При морфологическом исследовании оценивали наличие изменений в пирамидном слое различных полей вентрального и дорсального гиппокампа, гранулярном слое зубчатой извилины, а также различных функциональных отделов коры головного мозга. Для статистической обработки использовался дисперсионный анализ Краскела-Уоллиса с последующим попарным сравнением групп по критерию Манна-Уитни.
Фиксацию тканей головного мозга для электронно-микроскопического исследования размером до 1 мм3 производили в течение 12 часов в 4 % растворе параформа на 0,1М какодилатном буфере с последующей постфиксацией в течение 2 часов в 1 % растворе тетраокисида осмия на 0,1М какодилатном буфере (рН = 7,4) при температуре +4°С. После промывки в нескольких порциях раствора какодилатного буфера материал подвергали дегидратации в спиртах возрастающей концентрации и заливали в смесь эпона и аралдита. Ультратонкие срезы толщиной 50-90 нм получали на ультрамикротоме LKB-8800 и монтировали на медные сетки. После контрастирования в 2,5%-м растворе уранилацетата на 50° этаноле в течение 40 минут и 0,3%-м растворе цитрата свинца в течение 20 минут срезы изучались в электронном микроскопе Tesla BS-500 при ускоряющем напряжении 60 кВ. Фотодокументирование производили с использованием фототехнической пленки «ФТ-41П». Электронные микрофотограммы изготавливали на фотографической черно-белой бумаге «Унибром 160 БП».
Для измерения внутриглазного давления использовали офтальмологический ветеринарный тонометр Tonovet (Финляндия). Определение среднего давления высчитывали по результату 6 повторностей как среднее арифметическое.
Изучаемое соединение и препарат сравнения алагебриум вводили после 8 недель моделирования сахарного диабета на протяжении 4 недель в дозе 12,5 мг/кг перорально.
Острую токсичность исследуемых соединений изучали на белых беспородных мышах-самцах массой 18-22 г при пероральном введении. Расчет величины ЛД50 производили по методу Прозоровского.
Статистическую обработку результатов проводили с использованием табличного редактора Microsoft Excel 2007 для Windows и пакета программ GraphPad Prism 5.0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Кардиопатия у животных с экспериментальным сахарным диабетом на фоне перорального введения соединения ДФ-5
В серии исследований адренореактивности сердечно-сосудистой системы при экспериментальном сахарном диабете показаны изменения чувствительности миокарда к активации адренорецепторов, что отражено в изменениях параметров левожелудочкового давления (Табл. 1), частоты сердечных сокращений (Табл. 2), среднего артериального давления (Табл. 3), систолического (Табл. 4), диастолического давления (Табл. 5) и гипертрофии миокарда крыс (Табл. 6) в ответ на адреналиновую нагрузку.
При оценке функциональных резервов сердца у крыс с экспериментальной кардиопатией установлено, что на фоне терапии изучаемым соединением ДФ-5 наблюдалось восстановление сократимости миокарда, что было выражено в статистически значимом увеличении левожелудочкового давления (ЛЖД) в ответ на дозированную стимуляцию адренорецепторов с последующим его снижением к исходным значениям. При этом максимальное увеличение ЛЖД наблюдалось в точке 10 секунд от начала стимуляции, а абсолютные значения для каждой отдельной временной точки в выборке животных, имевших смоделированный СД и получавших соединение ДФ-5, статистически значимо не отличались от таковых у интактных контрольных животных, что говорит о нормализации величины данного показателя в условиях смоделированного СД. У группы животных, получающих препарат сравнения алагебриум также отмечается статистически значимое относительно группы сахарного диабета увеличение ЛЖД с максимумом на 10 секунде наблюдения, однако менее выраженное в среднем в 1,7 раза, чем у группы животных, получающих вещество ДФ-5. При этом у крыс без сахарного диабета не отмечается подобных изменений (Табл. 1).
Таблица 1
Изменение левожелудочкового давления на фоне дозированной стимуляции адренорецепторов сердца крыс с экспериментальным сахарным диабетом при пероральном введении соединения ДФ-5 и препарата сравнения алагебриум в дозе 12,5 мг/кг, Δ % (n=5, M±m)
* - различия достоверны по отношению к интактному контролю, p≤0,05;
# - различия достоверны по отношению к сахарному диабету, p≤0,05;
• - различия достоверны по отношению к группе животных, получавших препарат сравнения алагебриум, p≤0,05.
При оценке изменений частоты сердечных сокращений (ЧСС) у группы крыс с экспериментальным сахарным диабетом, получающих соединение ДФ-5, было отмечено, что показатель у данной группы животных статистически значимо не отличается от значений, установленных для интактного контроля. На основании этого можно предполагать восстановление адренореактивности сердца до нормальных значений по данному параметру, что, вероятно, стало следствием проявления активности соединения ДФ-5. Алагебриум, в свою очередь, понижал адренореактивность сердца во всех временных точках, кроме 5-й секунды наблюдения, в которой ЧСС была существенно выше соответствующего показателя интактного контроля. Для группы животных с экспериментальным сахарным диабетом характерно статистически значимое увеличение ЧСС относительно остальных групп животных с максимальной точкой на 10 секунде наблюдения и с низковыраженным снижением данного показателя к исходным значениям (Табл. 2).
Таблица 2
Изменение частоты сердечных сокращений на фоне дозированной стимуляции адренорецепторов сердца крыс с экспериментальным сахарным диабетом при пероральном введении соединения ДФ-5 и препарата сравнения алагебриум в дозе 12,5 мг/кг, Δ % (n=5, M±m)
* - различия достоверны по отношению к интактному контролю (ИК), p≤0,05;
# - различия достоверны по отношению к сахарному диабету (СД), p≤0,05;
• - различия достоверны по отношению к группе, получавшей препарат сравнения алагебриум, p≤0,05.
На основании исследования среднего артериального давления можно сделать вывод о том, что для группы животных с экспериментальным сахарным диабетом, получающих вещество ДФ-5 характерна нормализация сократимости миокарда, которая выражалась в увеличении АД с максимумом на 10 секунде наблюдения с последующим снижением к исходным значениям после дозированной стимуляции рецепторов адреналином. При этом в максимальной точке наблюдается повышение артериального давление на 10 % больше, чем у группы, получающей препарат сравнения алагебриум. Стоит отметить, что у животных с экспериментальным сахарным диабетом наблюдается максимальное значение АД на 20 % ниже, чем у группы крыс, получающих соединение ДФ-5. Данные отличия являются статистически значимыми (Табл. 3).
Таблица 3
Изменение среднего артериального давления на фоне дозированной стимуляции адренорецепторов сердца крыс с экспериментальным сахарным диабетом при пероральном введении соединения ДФ-5 и препарата сравнения алагебриум в дозе 12,5 мг/кг, Δ % (n=5, M±m)
* - различия достоверны по отношению к интактному контролю, p≤0,05;
# - различия достоверны по отношению к сахарному диабету, p≤0,05;
• - различия достоверны по отношению к группе, получавшей препарат сравнения алагебриум, p≤0,05.
При изучении изменений систолического артериального давления отмечалась следующая картина экспериментального исследования. У групп животных получающих соединения ДФ-5 и алагебруим максимальное увеличение АДсист. наблюдалось на 15 и 10 секунде соответственно. При этом препарат сравнения уступал изучаемому веществу в 1,3 раза. Данные изменения к 60 секунде исследования возвращались к исходным показателям и не носили статистически значимых отличий в группах относительно друг друга, а также группы интактного контроля. Данные изменения также характеризируют восстановление адренореактивности сердечно-сосудистой системы в ответ на дозированную стимуляцию адренергческих рецепторов сердца и сосудов. Необходимо отметить, что для группы животных с экспериментальным сахарным диабетом отмечалось максимальное увеличение систолического артериального давления на 10 секунде исследования, при этом данное изменение АДсист. статистически значимо уступало остальным группам животных более чем на 20 % (Табл. 4).
Таблица 4
Изменение систолического артериального давления на фоне дозированной стимуляции адренорецепторов сердца крыс с экспериментальным сахарным диабетом при пероральном введении соединения ДФ-5 и препарата сравнения алагебриум в дозе 12,5 мг/кг, Δ % (n=5, M±m)
* - различия достоверны по отношению к интактному контролю, p≤0,05;
# - различия достоверны по отношению к сахарному диабету, p≤0,05;
• - различия достоверны по отношению к группе, получавшей препарат сравнения алагебриум, p≤0,05.
На основании исследования изменений диастолического артериального давления можно сделать вывод о том, что после введения адреналина в группах животных, получающих соединения ДФ-5 и алагебриум отмечалось максимальное увеличение АДдиаст. на 10 секунде наблюдения с последующим снижением к исходным значениям. При этом в группе контрольных крыс с экспериментальным сахарным диабетом отмечалось также увеличение систолического артериального давления на 10 секунде исследования, однако на 10 % меньше, чем в группе животных, получающих соединение ДФ-5. После чего наблюдалось резкое снижение АДдиаст. до отрицательных значение без последующего восстановления (Табл. 5).
Таблица 5
Изменение диастолического артериального давления на фоне дозированной стимуляции адренорецепторов сердца крыс с экспериментальным сахарным диабетом при пероральном введении соединения ДФ-5 и препарата сравнения алагебриум в дозе 12,5 мг/кг, Δ % (n=5, M±m)
* - различия достоверны по отношению к интактному контролю, p≤0,05;
# - различия достоверны по отношению к сахарному диабету, p≤0,05;
• - различия достоверны по отношению к группе, получавшей препарат сравнения алагебриум, p≤0,05.
Кроме того, была произведена оценка гипертрофии миокарда у крыс с экспериментальным сахарным диабетом. Так, было установлено, что при введении изучаемого соединения ДФ-5 наблюдалось статистически значимое снижение гипертрофии относительно группы животных с экспериментальным сахарным диабетом до уровня интактного контроля. При сравнении групп животных, получающих препарат сравнения и вещество ДФ-5 было выявлено, что на фоне экспериментального вещества у животных с сахарным диабетом отмечалось уменьшение гипертрофированных тканей миокарда в 1.1 раз меньше, чем при введении референсного вещества. Данные отличия являются статистически значимыми (Табл. 6).
Таблица 6
Индекс гипертрофии миокрада у животных с экспериментальным сахарным диабетом при пероральномвведении соединения ДФ-5 и препарата сравнения алагебриум в дозе 12,5 мг/кг в течение 1 месяца (n=5, M±m).
* - различия достоверны по отношению к интактному контролю, p≤0,05;
# - различия достоверны по отношению к сахарному диабету, p≤0,05;
• - различия достоверны по отношению к группе, получавшей препарат сравнения алагебриум, p≤0,05.
При поляризационной микроскопии гистологических препаратов, окрашенных Sirius Red у контрольных животных было умеренное количество коллагеновых волокон в миокарде. При этом, у животных с сахарным диабетом, наряду с неизмененными мышечными волокнами встречались истонченные клетки, сохраняющие нормальную поперечную исчерченность и умеренно воспринимающие кислые красители. Отмечалась гетерогенность кардиомиоцитов по отношению к красителям. Ядра этих клеток светлые, но приобретали более вытянутую форму, содержали два-три ядрышка. Отмечалась деформация отдельных мышечных волокон. В субэндокардиальном и субэпикардиальном слоях левого желудочка обнаруживались эозинофильные мышечные сегменты, содержащие пикнотичные ядра.
В миокарде ярко выраженное капиллярное и венозное полнокровие, отмечается незначительный периваскулярный и интерстициальный отек. Наблюдалась дистрофия интрамуральных артерий миокарда. Просвет сосуда часто деформирован, эндотелий уплощен. Внутренняя эластическая мембрана слегка извилиста. Гладкомышечные клетки находились в расслабленном состоянии, некоторые из них дистрофически изменены. Вены субэпикардиального слоя полнокровны. Встречались мелкие очаги диапедезных кровоизлияний. В периваскулярном пространстве и межпучковых прослойках соединительной ткани наблюдалось увеличенное количество соединительнотканных клеток, среди которых преобладают фибробласты и макрофаги. Пучки коллагенновых волокон в адвентиции сосудов и в интерстициальных прослойках миокарда выглядели несколько утолщенными.
При поляризационной микроскопии гистологических препаратов, окрашенных Sirius Red у животных с сахарным диабетом было выявлено значительное количество коллагеновых волокон в миокарде, состоящих из коллагена 1 типа.
В группе животных, получавших алагебриум, большинство мышечных клеток умеренно окрашивались кислыми красителями, сохраняя правильную поперечную ичерченность, содержали светлые, овальные, умеренно базофильные ядра. Наряду с ними встречались эозинофильные мышечные сегменты, которые локализовались преимущественно в субэндокардиальных и субэпикардиальных слоях левого желудочка.
В миокарде желудочков были отмечены нарушения гемоциркуляции. Вены субэпикардиального слоя расширены, их просвет заполнен эритроцитами. Отмечалось расширение капилляров, умеренный периваскулярный отек. Встречались мелкие очаги диапедезных кровоизлияний. Ядра эндотелиальных клеток уплощены, внутренняя эластическая мембрана почти ровная. Наблюдается умеренный периваскулярный склероз. В межпучковых прослойках интерстициальной соединительной ткани обнаруживались пучки коллагеновых волокон с единичными фибробластами и макрофагами.
В перикарде было отмечено большое количество коллагеновых волокон с очаговыми кровоизлияниями, участками гемосидероза.
При поляризационной микроскопии гистологических препаратов, окрашенных Sirius Red у животных, получавших алагебриум, было выявлено наличие значительного количества коллагеновых волокон в миокарде, состоящих из коллагена 1 типа.
При проведении морфометрического исследования срезов сердца животных, получавших препарат сравнения алагебриум, выявлено, что средняя площадь периваскулярной соединительной ткани на срезах составила 4559,49±732,37 мкм2, т.е. уменьшилась в 2 раза (p<0,01) по сравнению с животными со смоделированным сахарным диабетом, и не получавшими лечения.
При поляризационной микроскопии гистологических препаратов, окрашенных Sirius Red у животных, получавших ДФ-5 было выявлено умеренное количество коллагена 1 типа в миокарде. В группе животных, получавших ДФ-5, большинство мышечных клеток умеренно окрашивались кислыми красителями, сохраняя поперечную исчерченность, содержали светлые, овальные ядра. Так же встречались эозинофильные мышечные сегменты, которые располагались субэндокардиально и субэпикардиально. В эозинофильных мышечных сегментах встречались пикнотичные ядра.
В миокарде левого желудочка отмечались нарушения гемодинамики: кровеносные сосуды полнокровны и иногда заполнены плазмой. В некоторых случаях наблюдалось очаговое пропитывание плазмой межклеточного пространства. Артерии и артериолы в состоянии пареза. Эндотелиальные клетки уплощены, эластические мембраны утолщены, часто неравномерно извиты. Отмечался умеренный периваскулярный склероз.
При проведении морфометрического исследования срезов сердца животных с ДФ-5, выявлено, что средняя площадь периваскулярной соединительной ткани на срезах составила 5928,15±1159,15 мкм2, т.е. уменьшалась на 39,7% (p<0,01) по сравнению с группой животных с диабетом, не получавшей лечения.
Таким образом, при пероральном введении изучаемого вещества животным с экспериментальным сахарным диабетом 1 типа отмечено восстановление сократимости миокарда, выраженное в увеличении ЛЖД. Показатель был более выражен (в 1,7 раза) в группе животных, получавших соединение ДФ-5, чем в группе животных, получавщих алагебриум, с последующим снижением к исходным значениям (Табл. 1). Также вывод о большей активности ДФ-5 по сравнению с алагебриумом сделан исходя из статистически значимого более значительного (на 10%) повышения артериального давления, в сравнении с группой, получающей препарат сравнения алагебриум (Табл. 3).
При оценке показателя частоты сердечных сокращений отмечено соответствие установленных значений у животных со смоделированным сахарным диабетом, получавших соединение ДФ-5 и животных интактной группы. Отсутствие статистически значимых различий между показателями двух групп позволяет судить о нормализации адренореактивности сердца крыс, получавших на фоне диабета соединение ДФ-5. Животные, получавшие алагебриум, имели отличные от всех прочих групп показатели адренореактивности сердца, что было выражено в отсутствии значимой реакции повышения ЧСС в ответ на адреналин во всех временных точках, кроме 5 секунд (Табл. 2).
По влиянию на нарастание систолического артериального давления в ответ на адреностимуляцию изучаемое вещество превосходит препарат сравнения в 1,3 раза (Табл. 4), а по влиянию на нарастание диастолического артериального давления - показывает равную эффективность (Табл. 5).
Было отмечено статистически значимое снижение индекса гипертрофии миокарда, относительно группы сравнения животных с сахарным даибетом и крыс, получающих алагебриум на 10% меньше (Табл. 6).
При морфометрическом исследовании срезов сердца установлено, что у животных, получающих соединение ДФ-5 и препарат сравнения алагебриум в одинаковой степени снижалось количество периваскулярной соединительной ткани, а также сокращалось количество коллагеновых волокон в миокраде относительно группы сахарного диабета.
Таким образом, по совокупности признаков, позволяющих оценить выраженность кардиопротективного действия фармакологического агента, можно заключить о большей эффективности соединения ДФ-5 в сравнении с алагебриумом.
Исследование макроангиопатии у животных с экспериментальным сахарным диабетом на фоне введения вещества ДФ-5
При исследовании сосудов сердца интактных животных установлено, что в стенке интрамуральных артерий различимы три оболочки. Внутренняя включает эндотелий, тонкий подэндотелиальный слой и внутреннюю эластическую мембрану. Околоядерные области эндотелиоцитов выбухают в просвет сосуда, эластическая мембрана умеренно извита. Средняя оболочка артерий состоит из нескольких рядов спирально расположенных гладкомышечных клеток. В расслабленном состоянии они имеют веретенообразную форму, при сокращении приобретают более округлые эллипсоидные очертания. В широкой части гладкомышечных клеток располагается овальное светлое ядро, форма которого также изменяется при сокращении клетки. Наружная оболочка артерий образована рыхлой волокнистой соединительной тканью, основную массу которых составляют коллагеновые волокна. Внутренняя оболочка интрамуральных вен также состоит из эндотелия, к наружи от которого располагается более тонкая и ровная, по сравнению с артериями, эластическая мембрана. Гладкомышечные клетки не обнаружены в стенке интармуральных вен. Наружная оболочка представлена узкой полоской рыхловолокнистой соединительной ткани.
В межпучковых прослойках интерстициальной соединительной ткани выявляли тонкие пучки коллагеновых волокон, изредка встречались фибробласты.
При проведении морфометрического исследования срезов сердца контрольных животных и крыс с экспериментальным сахарным диабетом выявлено, что средняя площадь периваскулярной соединительной ткани на срезах сердца у диабетических животных в 3,92 раза больше. На фоне соединения ДФ-5 показатель средней площади периваскулярной соединительной ткани животных соответствовал таковому у животных, получавших алагебриум (Табл. 7).
Таблица 7
Морфологическая оценка тканей миокрада крыс с экспериментальным сахарным диабетом при пероральном введении соединения ДФ-5 и препарата сравнения алагебриум в дозе 12,5 мг/кг (n=5, M±m). Окраска по Массону
* - Различия достоверны по сравнению с интактным контролем, p<0,05.
Таким образом, исследуемое соединение подавляет проявления макроангиопатии с эффективностью соответствующей препарату сравнения.
Эндотелиопротекторные свойства соединения ДФ-5 у животных с экспериментальным сахарным диабетом
При исследовании эндотелиальной дисфункции у животных с экспериментальным сахарным диабетом было установлено, что под влиянием соединения ДФ-5 наблюдалось статистически значимое снижение коэффициента эндотелиальной дисфункции относительно группы сахарного диабета более чем в 2 раза. Более того, не отмечено статистически значимых отличий при сравнении интактной группы животных и групп крыс, получающих соединение ДФ-5 и препарат алагебриум (Табл. 8). Однако, если в группе животных, получавших алагебриум, восстановление функции происходило на 87,6%, то в группе, получавшей соединение ДФ-5 процесс восстановления протекал в полном объеме, с восстановлением до нормы, установленной для интактных животных.
Таблица 8
Коэффициент эндотелиальной дисфункции у животных с экспериментальным сахарным диабетом при пероральном введении соединения ДФ-5 и препарата сравнения алагебриум в дозе 12,5 мг/кг в течение 1 месяца , (n=5, M±m).
* - различия достоверны по отношению к интактному контролю, p≤0,05;
# - различия достоверны по отношению к сахарному диабету, p≤0,05;
• - различия достоверны по отношению к группе животных, получавших препарат сравнения алагебриум, p≤0,05.
Таким образом, соединение ДФ-5 по показателю эндотелиопротекторной активности превосходит препарат сравнения алагебриум.
Нефропротекторные свойства соединения ДФ-5 у животных с экспериментальным сахарным диабетом
При моделировании сахарного диабета было установлено, что масса тела животных с патологией через три месяца эксперимента была в 1,5 раза меньше, чем у интактных животных. При исследовании нефропатии у животных с экспериментальным сахарным диабетом было установлено, что через 8 недель моделирования СД 1 типа у животных наблюдалось увеличение уровня белка в моче более чем в три раза относительно группы интакного контроля. При этом уровень суточного диуреза у диабетических животных увеличился в 2,6 раза относительно интактных животных (Табл. 9).
Таблица 9
Изучение массы тела, общего объема диуреза, экскреции белка почками у крыс с экспериментальным сахарным диабетом при пероральном введении соединения ДФ-5 и препарата сравнения алагебриум в дозе 12,5 мг/кг (n=5, M±m)
* - различия достоверны по отношению к интактному контролю, p≤0,05;
# - различия достоверны по отношению к сахарному диабету, p≤0,05;
• - различия достоверны по отношению к группе животных, получавших препарат сравнения алагебриум, p≤0,05.
На фоне терапии изучаемым веществом было выявлено статистически значимое снижение данного показателя относительно группы животных сахарного диабета более чем в два раза. При сравнении групп животных, получающих препарат сравнения и экспериментальное вещество было обнаружено, что уровень белка в моче на 11 % меньше у животных с соединением ДФ-5 (отсутствует статистическая значимость). Кроме того, на основе оценки суточной экскреции белка в моче можно сделать вывод также о статически значимом снижении уровня белка в данной биологической жидкости при введении экспериментального вещества и препарата сравнения в 2,46 и в 2,14 раз соответственно (Табл. 9). На основании сравнения суточной экскреции белка у животных, получающих соединения ДФ-5 или алагебриум, можно сделать о вывод об отсутствии статистически значимых отличий между этими двумя группами. При изучении количества мочи за сутки не было установлено каких-либо изменений у групп животных, получающих изучаемое вещество и референсный препарат.
При морфологических исследованиях тканей почек было установлено, что, у животных с сахарным диабетом, относительно интактной группы крыс, происходило уменьшение размеров почечных телец за счет дистрофических изменений. Выявлялись почечные тельца с уменьшенным просветом полости капсулы клубочка, вплоть до отсутствия таковой. Отмечалось образование синехий висцерального и париетального листков капсул клубочков. Отмечалось очаговое утолщение базальной мембраны капилляров клубочков, расширение мезангия. В фенестрированных капиллярах клубочков отмечено нарушений кровообращения в виде полнокровия, явлений стаза и диапедеза эритроцитов.
Проксимальные канальцы характеризовались выстилкой, представленной однослойным кубическим каемчатым эпителием. Форма просвета канальцев была округлой. Тонкие канальцы были выстланы одним слоем плоских эпителиоцитов. Дистальные канальцы и собирательные трубочки характеризовались минимальными неспецифическими структурными изменениями. При поляризационной микроскопии гистологических препаратов, окрашенных Sirius Red у животных с сахарным диабетом было выявлено умеренное количество коллагена 1 типа в почках.
В группе животных, получавших алагебриум, почечные тельца округлой формы. Хорошо определялась почечная капсула. Наружная и внутренняя стенки капсул почечных телец были выстланы однослойным плоским эпителием. Отмечалось образование единичных синехий висцерального и париетального листков капсул клубочков. Определялось очаговое утолщение базальной мембраны капилляров клубочков, расширение мезангия с гиперклеточностью. В капиллярах клубочков отмечено нарушений кровообращения в виде полнокровия.
При поляризационной микроскопии гистологических препаратов, окрашенных Sirius Red у животных, получавших алагебриум, было выявлено умеренное количество коллагена 1 типа в сосудистых клубочках почек.
В группе животных, получавших ДФ-5 почечные тельца округлой формы. Хорошо определялась почечная капсула. Наружная и внутренняя стенки капсул почечных телец были выстланы однослойным плоским эпителием. Определялось очаговое утолщение базальной мембраны капилляров клубочков, расширение мезангия. В капиллярах клубочков отмечено нарушений кровообращения в виде полнокровия.
Проксимальные канальцы характеризовались выстилкой, представленной однослойным кубическим каемчатым эпителием. Форма просвета канальцев была округлой. Тонкие канальцы были выстланы одним слоем плоских эпителиоцитов. Собирательные трубочки были образованы одним слоем эпителиоцитов призматической формы.
При поляризационной микроскопии гистологических препаратов, окрашенных Sirius Red у животных, получавших ДФ-5 было выявлено умеренное количество коллагена 1 типа в сосудистых клубочках почек.
При исследовании нефропротекторных свойств соединения ДФ-5 было установлено, что статистически значимо снижался уровень белка в моче по отношению к группе сахарного диабета, как при разовом заборе проб, так и при суточной экскреции. Более того, при оценке морфологических изменений было показано улучшение состояния почечной капсулы, расширение мезангия, а также установлено снижение коллагена 1 типа, относительно животных с сахарным диабетом, не получавших веществ. По уровню приведенной активности соединение ДФ-5 соответствовало препарату сравнения алагебриуму.
Таким образом, нефропротективное действие соединения ДФ-5 соответствует таковому у препарата сравнения алагебриума.
Микроангиопатия у крыс с эксепериментальным сахарным диабетом на фоне перорального введения соединения ДФ-5
У животных с сахарным диабетом относительно группы интактных животных внутрипочечные кровеносные сосуды неравномерно полнокровны и иногда заполнены плазмой. Эндотелиальные клетки равномерно, эластические мембраны не утолщены. Вены полнокровны.
При проведении морфометрического исследования срезов почек животных с сахарным диабетом, окрашенных по Массону, выявлено, что площадь клубочка не достоверно уменьшилась на 15,54 % по сравнению с контролем; отмечалось увеличение площади соединительной ткани клубочков в 4,8 раз, по сравнению с интактной группой; относительна площадь соединительной ткани клубочков при этом увеличилась на 20 % по сравнению с контролем.
У группы животных, получавших алагебриум, внутрипочечные кровеносные сосуды неравномерно полнокровны. Эндотелиальные клетки равномерны, эластические мембраны не утолщены. Вены полнокровны.
При проведении морфометрического исследования срезов почек животных, получавших алагебриум, окрашенных по Массону, выявлено, что площадь клубочка не достоверно уменьшилась на 6,1 % по сравнению с контролем и составила 13968,94±856,26 мкм2; площадь соединительной ткани клубочков составила 1640,38±543,19 мкм2, что в 2 раза меньше, чем у животных с сахарным диабетом; относительная площадь соединительной ткани клубочков составила - 11,7 %, что на 15% ниже по сравнению диабетическими крысами.
У группы животных, получавших ДФ-5, внутрипочечные кровеносные сосуды неравномерно полнокровны. Эндотелиальные клетки равномерно, эластические мембраны не утолщены. Вены полнокровны.
При исследовании микроангиопатии почек под влиянием соединения ДФ-5 было установлено очаговое утолщение базальной мембраны капилляров клубочков, расширение мезангия. В капиллярах клубочков сохранялись нарушения кровообращения в виде полнокровия.
При окраске по Массону, отмечалось снижение площади соединительной ткани клубочков в 1,4 раза по сравнению с группой животных с сахарным диабетом, не получавшей лечения; в сравнении с той же группой отмечалось снижение относительной площади соединительной ткани клубочков на 10,5%.
При поляризационной микроскопии гистологических препаратов, окрашенных Sirius Red у животных, получавших ДФ-5 сохранялось умеренное количество коллагена 1 типа в стенках артериол и капилляров сосудистых клубочков почек.
Таким образом, было установлено, что для животных, получающих экспериментальное соединение ДФ-5, характерно снижение средней площади почечного клубочка в сравнении с животными с сахарным диабетом 1 типа. Все отличия являются статистически значимыми с сравнении с группой крыс с экспериментальной патологией. По выраженности позитивных изменений, установленных в группах животных, получавших соединение ДФ-5, можно сделать вывод, что соединение ДФ-5 не уступает по активности алагебриуму.
Энцефалопротекторные свойства соединения ДФ-5 у животных с экспериментальным сахарным диабетом
При оценке когнитивных функций животных с экспериментальным сахарным диабетом было установлено, что перед началом введения исследуемых веществ успешно прошли этап обучения нахождения норки 80 % крыс с экспериментальным сахарным диабетом и 100 % интактных животных. Через 28 дней после введения изучаемого веществ и препарата сравнения отмечалась следующая картина исследования. Для группы интактного контроля наблюдалось устойчивое время нахождения норки менее чем за 60 сек. Для контрольной группы животных с сахарным диабетом, не получавшей лечения, данный показатель составил более 110 сек. Для группы животных с экспериментальным сахарным диабетом, получающих алагебриум, отмечалось статистически значимое уменьшение времени нахождения норки, чем у группы животных с сахарным диабетом, но без лечения. Группа животных, получающих исследуемое вещество находила истинную норку в 4 раза быстрее группы, получающей референтный препарат и в 7,5 раз быстрее группы сахарного диабета. Данные отличия являются статистически значимыми (Табл. 10).
Таблица 10
Изучение влияния соединения ДФ-5 и препарата сравнения алагебриум при пероральном введении в дозе 12.5 мг/кг на когнитивные свойства животных с экспериментальным сахарным диабетом (Метод Барнса). Латентное время нахождения норки (n=5, M±m)
(n=7)
(n=5)
(n=4)
(n=4)
* - различия достоверны по отношению к интактному контролю, p≤0,05;
# - различия достоверны по отношению к сахарному диабету, p≤0,05;
• - различия достоверны по отношению группе животных, получавших препарат сравнения алагебриум, p≤0,05.
Таким образом, при оценке когнитивных способностей животных с экспериментальным сахарным диабетом было установлено, что на фоне терапии соединением ДФ-5 отмечалось статистически значимое сокращение время поиска истинной норки лабиринта Барнса крысами, относительно группы сахарного диабета. Кроме того, через 28 дней исследования наблюдалось статистически значимое сокращение времени поиска убежища животными, получающими соединение ДФ-5, относительно группы крыс, которым вводили алагебриум.
При оценке нейроморфологических изменений тканей голоного мозга в светооптическом исследовании коры (теменная доля) интактных животных и крыс с эксперимнетальным сахарным диабетом наиболее выраженные изменения наблюдали в наружном и внутреннем зернистом слое, слое пирамидальных нейронов и ганглионарном слое. У диабетических крыс обнаруживалось большое количество, так называемых, «темных нейронов» с уменьшением размеров клеточных тел и усилением базофилии цитоплазмы. На основании ультрамикроскопического анализа было установлено, что большинство таких клеток характеризуются резким повышением электронной плотности ядра и цитоплазмы, снижением площади цитоплазмы перикариона. У животных с патологией вотличии от интакнтх животных в ядре отмечено появление мелкогранулярного электроноплотного материала. Обращает на себя внимание, значительно увеличенное в объеме ядрышко. Контуры ядер приобретали неправильную форму, при этом отмечено появление участков низкой электронной плотности, отделяющих ядро от осмиофильной цитоплазмы. В цитоплазме заметны светлые митохондрии, часть из которых лишена крист, а также умеренно расширенные цистерны эндоплазматической сети. Полисомы формировали более крупные гроздевидные скопления.
Сосуды микроциркуляторного русла у животных с эксперимнетальным сахарным диабетом в сравнении с интактными крысами характеризовались значительными ультраструктурными изменениями. Был отмечен периваскулярный отек с дистрофическими изменениями прилегающих ножек астроцитов и других элементов нейропиля. Базальная мембрана капилляров характеризуется однородным электронно-плотным строением с плохо контурирующимися слоями, неравномерной толщиной и участками разволокнения. В перицитарных клетках и в эндотелиоцитах преобладают дистрофические изменения по типу гидропической дистрофии с просветлением цитоплазмы и вакуолизацией митохондрий и распадом органелл.
При морфологической оценке нейродегенеративных изменений было установлено, что у контрольных животных с сахарным диабетом в 58 раз увеличилось удельное количество слабоизмененных нейронов в СА1 области гиппокампа, а количество грубоизмененных нейронов там же увеличилось в 3 раза. Кроме того были установлены изменения совместно в областях СА3 и СА4 - количество слабоизмененных нейронов увеличилось в 70 раз, грубоизмененных - в 17 раз. При оценке изменений коры головного мозга крыс с сахарным диабетом относительно интактных животных было отмечено: удельное количество гиперхромных нейронов в моторном отделе коры головного мозга увеличилось более, чем в 50 раз, в соматосенсорной коре - в 40 раз, в слуховой коре - в 35 раз, в зрительной коре - в 50 раз, в енторинальной коре - в 80 раз (Табл. 11).
Таблица 11
Удельное количество гиперхромных нейронов в различных отделах коры головного мозга M±m %
мозга
Примечание. * - показатели статистически значимо отличаются от группы СД при р < 0,05; Критерий Манна -Уитни.
В тоже время на основании электронно-микроскопического исследования коры головного мозга животных с экспериментальным сахарным диабетом, получающих соединение ДФ-5, было выявлено наличие умеренных ультраструктурных изменений пирамидных нейронов и астроцитов церебральной коры. Ядра некоторых нейронов имели неправильную полигональную форму с преимущественно периферическим распределением гетерохроматина. В большинстве случаев, признаки значимых ультраструктурных изменений органелл отсутствовали, однако, встречались отдельные набухшие митохондрии с деструкцией крист, а также имело место очаговое расширение цистерн эндоплазматического ретикулума. Также, обращает на себя внимание наличие единичных осмиофильных цитоплазматических включений. Кроме того, было установлено, что клетки астроглии отличались повышенной электронной прозрачностью ядра и цитоплазмы в сравнении с другими типами глии. Кариоплазма круглых или овальных ядер содержала, обычно, мелкие глыбки конденсированного хроматина, прилежащие непосредственно к ядерной оболочке. Эндоплазматический ретикулум представлен небольшим числом мелких цистерн, присутствуют также многочисленные митохондрии и небольшое количество свободных рибосом. Вокруг большинства сосудов микроциркуляторного русла выявлялись умеренные признаки отека с ултраструктурными изменениями элементов нейропиля с формированием миелиноподобных структур. Эндотелиоциты характеризовались умеренными признаками дистрофических изменений в виде вакуолизации единичных митохондрий с частичным распадом крист. Схожий характер изменений наблюдался и в перицитарных клетках. Сосудистая базальная мембрана, на большем своем протяжении, имела трехслойную структуру без существенных утолщений и деформаций. Изредка визуализировались ограниченные участки истончения и разволокнения базальной мембраны.
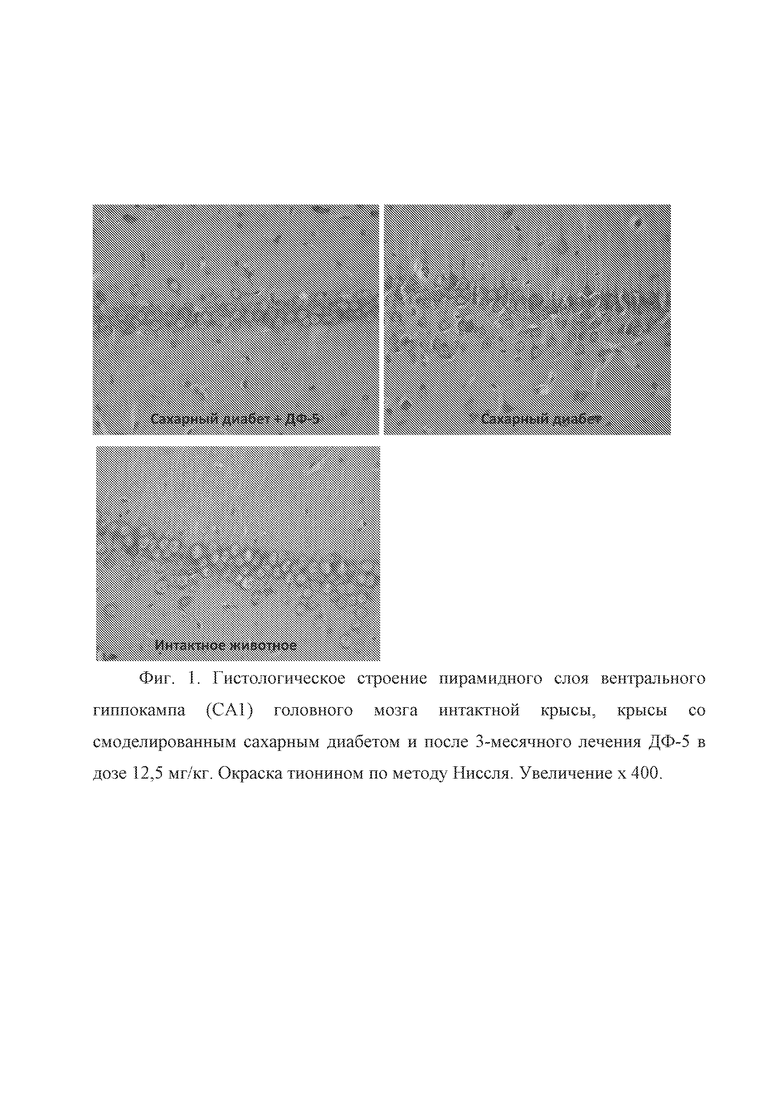
После введения соединения ДФ-5 в целом гистологическое строение пирамидного слоя СА1 соответствовало контрольным (интактным) животным. Встречались участки СА1 поля с наличием единичных сморщенных гмперхромных пирамидных нейронов, с гомогенизацией цитоплазмы и пикнозом ядра, однако подобные клетки обнаруживались как у животных с сахарным диабетом в отсутствие лечения, так и у интактных животных (Фиг. 1). На фиг. 1 представлено гистологическое строение пирамидного слоя вентрального гиппокампа (СА1) головного мозга интактной крысы, крысы со смоделированным сахарным диабетом и после 3-месячного лечения ДФ-5 в дозе 12,5 мг/кг. Окраска тионином по методу Ниссля. Увеличение x 400.
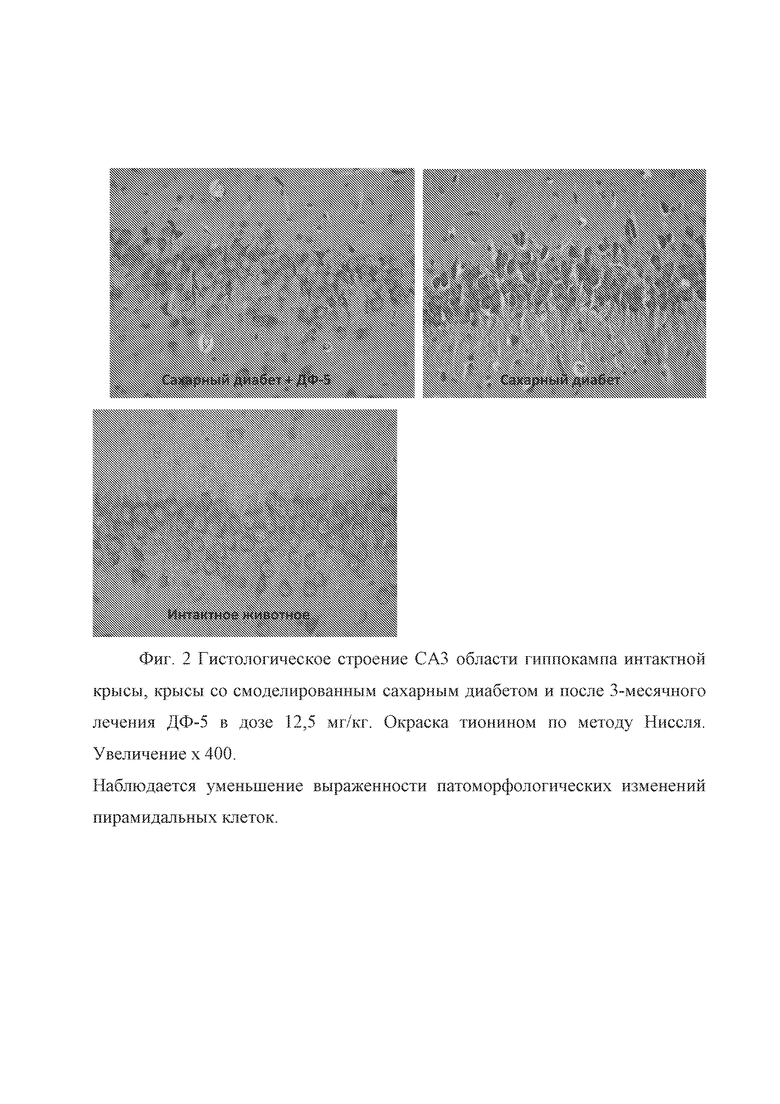
В СА3 поле большинство нейронов пирамидного слоя характеризовалось нормальном гистологическим строением, т.е. принципиально не отличались от интактных животных. На отдельных участках пирамидного слоя наблюдались изменения части нервных клеток в виде сморщивания клеточных тел, перикарионы и ядра приобретали вытянутую извитую форму с усилением гиперхромии цитоплазмы (Фиг. 2). На фиг. 2 представлено гистологическое строение СА3 области гиппокампа интактной крысы, крысы со смоделированным сахарным диабетом и после 3-месячного лечения ДФ-5 в дозе 12,5 мг/кг. Окраска тионином по методу Ниссля. Увеличение x 400. Наблюдается уменьшение выраженности патоморфологических изменений пирамидальных клеток.
При морфологическом исследовании сосудов микроциркуляторного русла различных полей дорсального и вентрального гиппокампа каких либо значительных изменений, по сравнению с иинтактными животными, выявлено не было.
На основании электронно -микроскопического исследования коры головного мозга группы животных с экспериментальным сахарным диабетом, получающих препарат сравнения алагебриум, был подтвержден неоднородный состав популяции нейронов, наблюдаемый на светооптическом уровне. В некоторых из таких клеток наблюдалась тенденция к увеличению количества рибосом и элементов гранулярного ЭПС. Как правило, в цитоплазме содержалось от 1 до 3 мелких осмиофильных включений. Другая часть нейронов характеризовалась выраженными ультраструктурными изменениями проявляющимеся в значительном повышении электронной плотности ядра и цитоплазмы, снижении площади цитоплазмы перикариона. Контуры ядер, как правило, приобретали неправильную форму, с диффузным распределением гетерохроматина. Цитоплазма характеризовалась компактным расположением органелл. Большинство цитоплазматических ультраструктур отличает усиление осмиофилии, однако встречались единичные светлые митохондрии с частичной деструкцией крист, а также участки значительного расширения цистерн эндоплазматического ретикулума и аппарата Гольджи. Часть измененных клеток была окружена микроглиоцитами. Характер ультраструктурных изменений сосудов микроциркуляторного русла существенно отличался от животных с экспериментальным сахарным диабетом в отсутствии лечения. Признаки перваскулярного отека носили менее выраженный характер. Эндотелиальные и перицитарные клетки характеризовались существенным усилением осмиофилии цитоплазмы. При этом, большинство органелл также отличало усиление электронной плотности, что затрудняло их визуализацию. Обращали на себя внимание единичные набухшие митохондрии со светлым матриксом и частичным разрушением крист. Базальная мембрана большинства сосудов МЦР характеризовалась относительно однородным строением, с хорошо просматриваемой трехслойной структурой. Однако, в единичных случаях, выявлялись участки выраженной деструкции и разволокнения мембраны, при этом в прилегающих элементах нейропиля отмечалось усиление признаков отека и деструктивных изменений.
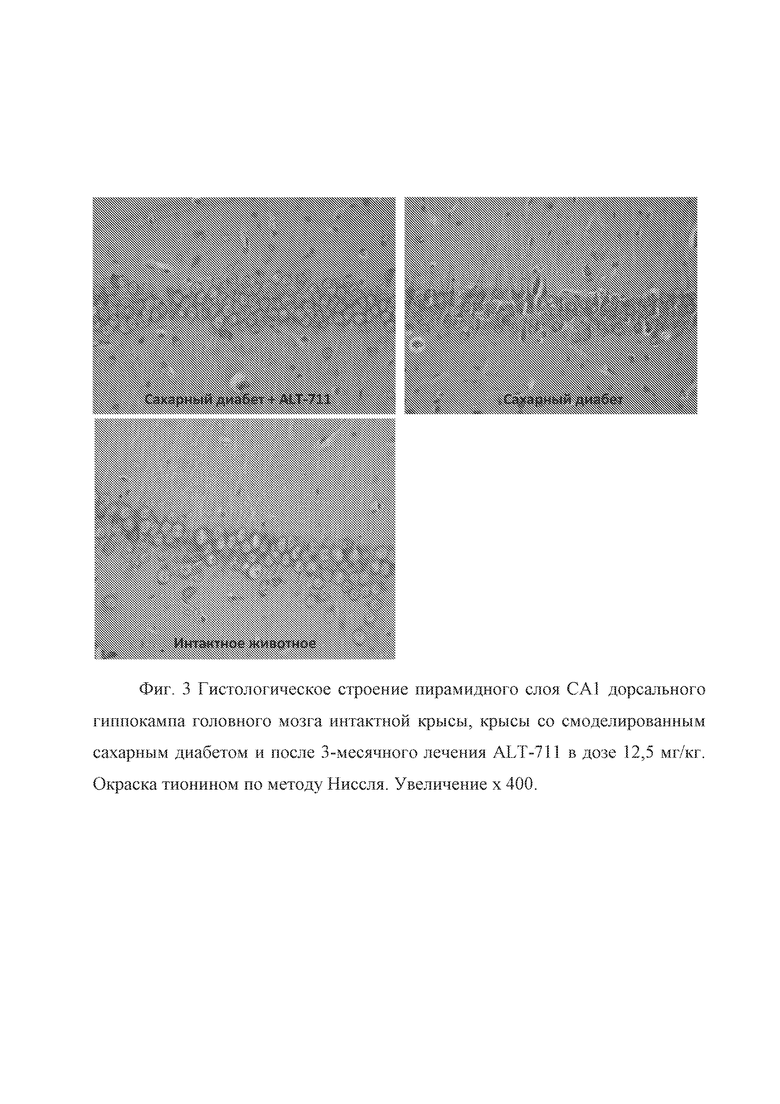
После введения алагебриума в СА3 поле изменения были выражены незначительно по сравнению с группой контрольных (интактных) животных, однако иногда в пирамидном слое встречались мелкие очаги с наличием сморщенных гипрехромных нейронов, с деформированными пикнотическими ядрами. В СА1 поле дорсального и вентрального гиппокампа обнаруживались единичные гиперхромные клетки (Фиг. 3). На фиг. 3 представлено гистологическое строение пирамидного слоя СА1 дорсального гиппокампа головного мозга интактной крысы, крысы со смоделированным сахарным диабетом и после 3-месячного лечения алагебриумом в дозе 12,5 мг/кг. Окраска тионином по методу Ниссля. Увеличение x 400.
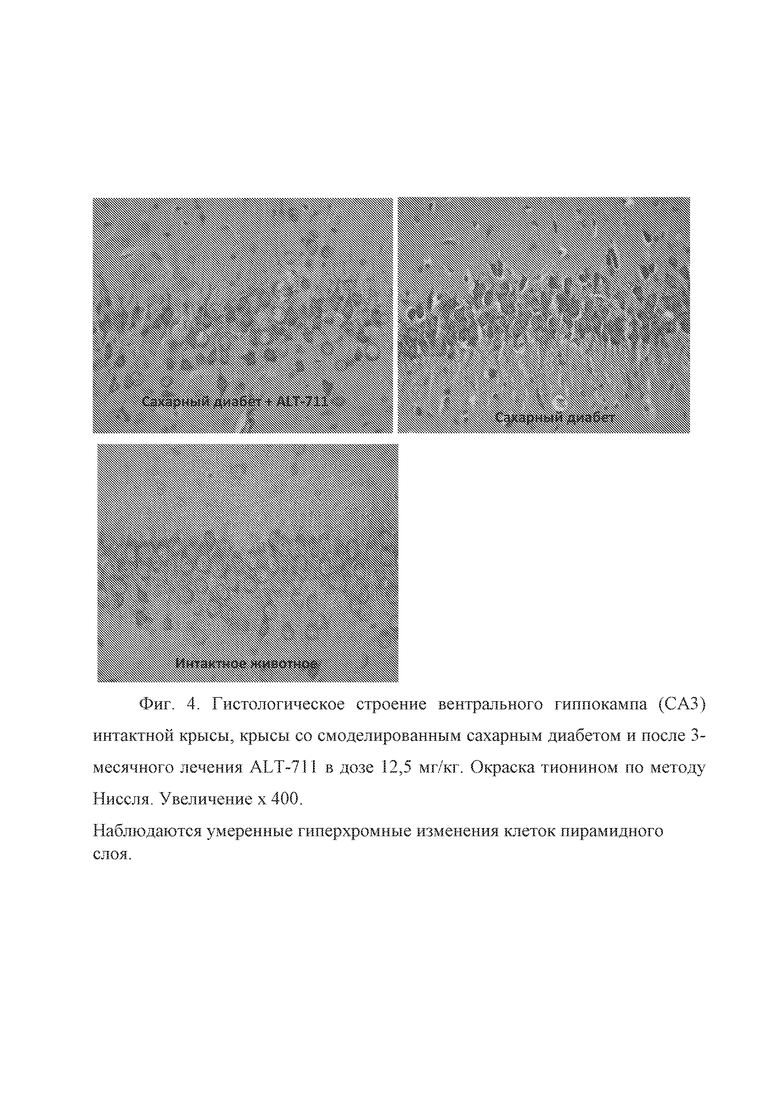
Только в одном случае наблюдались значительные патоморфологические изменения в вентральных отделах СА3 поля гиппокампа. Данные изменения носили очаговый характер, и выражалась в появлении темных гиперхромных нейронов пирамидного слоя. На фоне гомогенной цитоплазмы, которая выглядела более темной, чем в норме, выявлялись пикноморфные гомогенные ядра, приобретающие треугольную или полигональную форму (Фиг. 4). На фиг. 4 представлено гистологическое строение вентрального гиппокампа (СА3) интактной крысы, крысы со смоделированным сахарным диабетом и после 3-месячного лечения алагебриумом в дозе 12,5 мг/кг. Окраска тионином по методу Ниссля. Увеличение x 400. Наблюдаются умеренные гиперхромные изменения клеток пирамидного слоя.
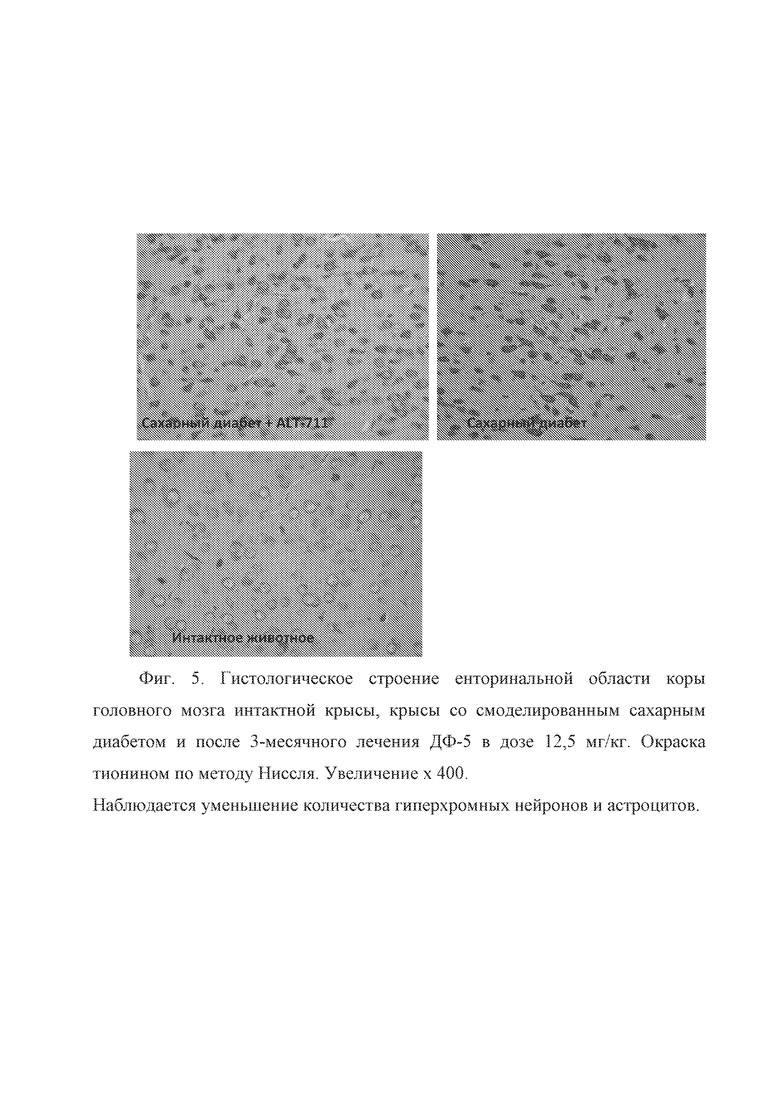
Во всех отделах коры полушарий головного мозга наблюдались стереотипные патоморфологические изменения, выражающиеся в появлении мелких очагов гиперхромных клеток (нейроны и клетки глии) преимущественно в гранулярном и пирамидном слое церебральной коры. Однако, по сравнению с группой животных с экспериментальным сахарным диабетом, практически во всех функциональных отделах коры наблюдалось существенное уменьшение количества гиперхромных клеток (Фиг. 5, 6). На фиг. 5 представлено гистологическое строение енторинальной области коры головного мозга интактной крысы, крысы со смоделированным сахарным диабетом и после 3-месячного лечения ДФ-5 в дозе 12,5 мг/кг. Окраска тионином по методу Ниссля. Увеличение x 400. Наблюдается уменьшение количества гиперхромных нейронов и астроцитов. На фиг. 6 представлено гистологическое строение ганглионарного слоя соматосенсорной области коры головного мозга интактной крысы, крысы со смоделированным сахарным диабетом и после 3-месячного лечения ДФ-5 в дозе 12,5 мг/кг. Окраска тионином по методу Ниссля. Увеличение x 400.
Таким образом, на основании электронно-микроскопического изучения париетальных отделов коры головного мозга экспериментальных животных были выявлены дистрофические изменения нервных клеток. В группе животных с СД на фоне введения соединения ДФ-5 и алагебриума патологические изменения нервных клеток носили менее распространенный, очаговый. Эффективность применения соединения ДФ-5 соответствовала таковой у алагебриума.
В группе животных с СД, получающих соединение ДФ-5, ультраструктура нейронов, клеток глии и сосудов МЦР существенно не отличалась от интактных животных без сахарного диабета, то есть отмечалось уменьшение тяжести ультраструктурных изменений по сравнению с группами СД и СД+алагебриум. При этом, на основе анализа материала, полученного от животных с СД на фоне лечения алагебриумом, можно установить наличие выраженных ультраструктурных изменений части нейронов в виде пикноза ядер, выраженной осмиофилии кариоплазмы и цитоплазмы, с расширением цистерн эндоплазматического ретикулума и аппарата Гольджи. Схожий характер ультраструктурных изменений наблюдался и в сосудах МЦР, что проявлялось в усилении электронной плотности цитоплазмы эндотелиоцитов и перицитов, а также наличии участков разрушения и разволокнения базальной мембраны.
При исследовании морфологии нейронов было отмечено, что в подавляющем большинстве случаев изменения сводились к гиперхромии цитоплазмы и отростков, изменению формы перикариона и успению базофилии ядер. Данные изменения носили распространенный характер охватывая протяженные участки СА1 и СА3 полей гиппокампа (Табл. 12).
Таблица 12
Морфологическая характеристика нейродегенеративных изменений нейронов в различных регионах гиппокампа, удельное количество клеток (M±m %).
гиппокампа
Примечание. * - показатели статистически значимо отличаются от группы СД при р < 0,05; Критерий Манна -Уитни.
Степень поражения нейронов [Чубинидзе А.И., 1972]:нейроны нормальные, неизмененные (НН); слабоизмененные нейроны (СН) с сохранением ядра, но со структурными или тинкториальными нарушениями компонентов цитоплазмы (набухание, гиперхроматоз, хроматолиз, центральная тинкториалъная ацидофилия); грубо измененные нейроны (ГН) - выраженное сморщивание, «тяжелое изменение», гомогенизирующее изменение нейронов, клетки-тени.
Помимо структур гиппокампа выраженные изменения наблюдались в церебральной коре экспериментальных животных. Данные изменения носили неспецифический характер и проявлялись преимущественно сморщиванием и гиперхромией нейронов и клеток глии.
На основе морфометрического анализа было продемонстрировано увеличение относительной удельной плотности гиперхромных клеток практически во всех функциональных отделах коры головного мозга. При этом максимальное их количество отмечалось в моторной и энторинальной областях (Табл. 11, Фиг. 7). На фиг. 7 представлено гистологическое строение моторной коры головного мозга интактной крысы, крысы со смоделированным сахарным диабетом и после 3-месячного лечения ДФ-5 в дозе 12,5 мг/кг. Окраска тионином по методу Ниссля. Увеличение x 400. Наблюдается уменьшение количества гиперхромных нейронов и астроцитов.
На основании изучения морфологических изменений различных структур головного мозга при экспериментальном сахарном диабете на фоне введения изучаемого вещества было показано достоверное снижение выраженности нейродегенеративных изменений. Это выражалось в нормализации гистологического строения структур головного мозга, уменьшении количества измененных нейронов.
При исследовании отделов церебральной коры головного мозга было отмечено, что изучаемое соединение ДФ-5 и препарат сравнения алагебриум характеризовались одинаковой активностью, заключающейся в достоверном снижении удельной плотности гиперхромных клеток во всех функциональных отделах по сравнению с группой животных с экспериментальным сахарным диабетом.
Таким образом, соединение ДФ-5 по своей энцефалопротективной активности соответствовало эталонному препарату сравнения алагебриуму.
Внутриглазное давление у крыс с экспериментальным сахарным диабетом на фоне введения вещества ДФ-5
При исследовании внутриглазного давления (ВГД) у крыс было установлено, что у животных с экспериментальным сахарным диабетом данный показатель в 1,5 раза выше, чем у интактных животных, что соответствует литературным данным [12]. Однако на фоне введения изучаемого соединения ДФ-5 было отмечено статистически значимое снижение ВГД относительно группы сахарного диабета. Стоит отметить, что при введении экспериментального соединения и препарата сравнения отмечалось снижение ВГД в равной степени и не имело статистических отличий от группы интактных животных (Табл. 13).
Таблица 13
Глазное давление у крыс с экспериментальным сахарным диабетом на фоне перорального введения соединений ДФ-5 и препарата сравнения алагебриум в дозе 12,5 мг/кг
мм рт. ст.
Примечание. * - показатели статистически значимо отличаются от группы СД при р < 0,05; t-Критерий Стьюдента.
Таким образом, установлено, что у животных с экспериментальным сахарным диабетом на фоне введения экспериментального соединения ДФ-5 и препарата сравнения в равной степени снижается внтутриглазное давление. При этом при измерении ВГД не наблюдалось статистически значимых отличий от интактной группы животных.
Острая токсичность соединения ДФ-5
При исследовании острой токсичности соединения ДФ-5 было установлено, что изучаемое вещество при пероральном пути введения характеризуется низкой токсичностью. Соединение ДФ-5 при пероральном введении в дозах, высшей среди которых была 2 г/кг, не вызывало гибели животных. Стоит отметить, что ЛД50 препарата сравнения алагебриума составляет 300 мг/кг (Clearsynth Labs Pvt. Ltd., India, Material safety data sheet)
Из этого можно заключить, что соединение ДФ-5 более чем в 6 раз менее токсично, чем алагебриум.
Заключение
Основываясь на результатах проведенных исследований по влиянию 9-бензил-2-бифенилимидазо[1,2-a]бензимидазола на диабетические кардиопатию, микроангиопатию, макроангиопатию, эндотелиопатию, нефропатию, энфефалопатию, нейропатию на гистологическом уровне, с дополнительной верификацией результатов оценки энцефалопротекторной активности in vivo, установлено, что 9-бензил-2-бифенилимидазо[1,2-a]бензимидазол способен подавлять развитие указанных диабетических патий в условиях смоделированного сахарного диабета. Это является свидетельством антидиабетической активности у вещества 9-бензил-2-бифенилимидазо[1,2-a]бензимидазол, а именно препятствования развитию диабетических патий и проявления веществом кардио-, эндотелио-, нефро-, микроангио-, макроангио-, и энцефалопротекторного действия при сахарном диабете. Это основывается на показателях оценки гистологической, функциональной и биохимической картины подверженных формированию патологии органов и тканей.
Так, по показателю кардиопротективного эффекта соединение ДФ-5 более эффективно, чем препарат сравнения алагебриум, препятствует в условиях эксперимента гипертрофии миокарда. При этом, при оценке функциональности миокарда по показателю ЧСС в условиях целостного организма, для ДФ-5 не было отмечено снижения реактивности сердечной мышцы, как это было отмечено в группе животных, получавших на фоне диабета алагебриум, напротив, данный показатель в группе животных, получавших ДФ-5, был близок к значениям, полученным для интактного контроля. Более эффективно, чем препарат сравнения алагебриум, ДФ-5 оказывает эндотелиопротективное действие, что является важным критерием предпочтительности в пользу ДФ-5, поскольку эндотелиальная дисфункция является основой многих отдаленных осложнений диабета, ассоциированных с функционированием сосудистой системы (инсульт, эректильная дисфункция и др). Соединение ДФ-5 при оценке влияния на когднитивные функции не только было эффективнее, чем препарат сравнения алагебриум по способности устранять когнитивную дисфункцию, но и улучшило оцениваемые показатели до значений, незначительно превосходящих интактный контроль (к 28 дню эксперимента). При гистологической оценке было показано, что нейропротективный эффект соединения ДФ-5 соответствует стандартному эффекту алагебриума. По влиянию на показатель встречаемости гиперхромных нейронов в материалах срезов разных отделов мозга соединение ДФ-5 также незначительно превосходило препарат сравнения, что свидетельствует в пользу несколько большей силы нейропротективного действия ДФ-5.
При оценке таких функциональных параметров работы сердечно-сосудистой системы, как сократительная левожелудочковая реактивность в ответ на адренергическую стимуляцию, соединение ДФ-5 превосходило алагебриум. По параметрам показателей АД, а также при морфологической оценке состояния сердечной мышцы соединение ДФ-5 соответствовало алагебриуму. Таким образом, совокупный кардиопротективный эффект ДФ-5 оказался несколько более выражен, чем таковой алагебриума. Кроме этого, у ДФ-5 был отмечен офтальмопротективный эффект (нормализация внутриглазного давления), сопоставимый с алагебриумом.
По показателю токсичности (LD50) соединение ДФ-5 оказалось более чем в 6 раз безопасным при пероральном введении, чем алагебриум, что является критерием большей терапевтической широты.
Таким образом, при прочих равных условиях (доза, экспериментальные животные) соединение ДФ-5 оказывается более эффективным, чем алагебриум в подавлении проявлений отдаленных осложнений сахарного диабета по кардио- и эндотелиопротекторной активности при сохранении микроангио-, макроангио-, нефро- и энцефалопротекторных свойств, при этом являясь значительно менее токсичным.
Соединение может применяться как действующее начало в биологически активных композициях, обладающих кардио- и эндотелиопртекторной активностью, а также микроангио-, макроангио-, нефро- и энцефалопротекторными свойствами. Соединение может быть использовано при изготовлении лекарственных средств как действующее начало в фармацевтических композициях для профилактики и лечения осложнений при сахарном диабете.
Список литературы
1) Toprak C, Sirmagul B, Yigitaslan S. Functional Effects of Alagebrium (ALT-711) -Isolated Rat Carotid Artery. Eurasian J Med. 2017; 49(3): 188 -192.
2) Williams ME, Tuttle KR. The next generation of diabetic nephropathy therapies: an update. Adv Chronic Kidney Dis. 2005;12(2):212-22.
3) Carrick-Ranson G, Fujimoto N, Shafer KM, et al. The effect of 1 year of Alagebrium and moderate-intensity exercise training on left ventricular function during exercise in seniors: a randomized controlled trial. J Appl Physiol (1985). 2016 Aug 1;121(2):528-36.
4) Wang H, Liu J, Wu L. Methylglyoxal-induced mitochondrial dysfunction in vascular smooth muscle cells. Biochem Pharmacol. 2009; 77(11):1709-16.
5) Gurbuz N, Sagdic G, Sanli A, et al. Therapeutic effect of combination of alagebrium (ALT-711) and sildenafil on erectile function in diabetic rats. International. Journal of Impotence Research. 2012; 24:114 -121.
6) Ли Сун и др. Новые соли замещенного 5-членного азацикла и их применение в лечении заболеваний, связанных со старением белков: заявка на изобретение РФ № 2008134899/04, МПК А61К 31/421, 2007
7) Zhang B, He K, Chen W, et al. Alagebrium (ALT-711) improves the anti-hypertensive efficacy of nifedipine in diabetic-hypertensive rats. Hypertens Res. 2014;37(10):901-7.
8) Siegman MJ, Eto M, Butler TM. Remodeling of the rat distal colon in diabetes: function and ultrastructure. Am J Physiol Cell Physiol. 2016; 310(2): C151 -C160.
9) Steppan J, Tran H, Benjo AM, et al. Alagebrium in combination with exercise ameliorates age-associated ventricular and vascular stiffness. Exp Gerontol. 2012;47(8):565-72.
10) Тюренков И.Н., Воронков А.В. Методический подход к оценке эндотелиальной дисфункции в эксперименте. Экспериментальная и клиническа фармакология. Том 71, № 1. 2008. С - 49-51.
11) Жуковская О.Н. и др. 9-бензил-2-бифенилимидазо[1,2-a]бензимидазол и его фармацевтически приемлемые соли, проявляющие свойства разрушителей поперечных сшивок гликированных белков: Патент РФ № 2627769, МПК СO7D 487/04, А6lК 31/4188, 2017.
12) Masato M., Nahoko O. et al. Intraocular pressure in Japanese diabetic patients. Clin Ophthalmol. 2012; 6: 1005 -1009.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ НАТРИЕВОЙ СОЛИ ДИЭТИЛОВОГО ЭФИРА 4-ОКСО-1,4-ДИГИДРОПИРАЗОЛО[5,1-С]-1,2,4-ТРИАЗИН-3,8-ДИКАРБОНОВОЙ КИСЛОТЫ, МОНОГИДРАТА В КАЧЕСТВЕ СРЕДСТВА ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ПОЗДНИХ ОСЛОЖНЕНИЙ САХАРНОГО ДИАБЕТА | 2019 |
|
RU2765117C2 |
| Способ создания трансляционной модели диабетического фенотипа хронической сердечной недостаточности | 2023 |
|
RU2817822C1 |
| Способ оценки эффективности применения лекарственного препарата "Лаеннек" на фармакологической модели неалкогольной жировой болезни печени с перегрузкой железом у экспериментальных животных | 2024 |
|
RU2837019C1 |
| Способ коррекции стрептозотоцин-индуцированного сахарного диабета у крыс с использованием лекарственного средства на основе амида гетероциклических кислот | 2018 |
|
RU2687979C1 |
| СОЛЬ 2-ЭТИЛ-6-МЕТИЛ-3-ГИДРОКСИПИРИДИНА С НИКОТИНОВОЙ КИСЛОТОЙ, ОБЛАДАЮЩАЯ ГИПОГЛИКЕМИЧЕСКОЙ, ГИПОЛИПИДЕМИЧЕСКОЙ И НЕЙРОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2454406C2 |
| Способ моделирования остеопороза на фоне стрептозотоцин-индуцированного сахарного диабета у крыс | 2019 |
|
RU2712153C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ АНТИГЛИКИРУЮЩЕГО ДЕЙСТВИЯ В ТВЕРДОЙ ЛЕКАРСТВЕННОЙ ФОРМЕ В ВИДЕ КАПСУЛ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2019 |
|
RU2738804C1 |
| Способ стимуляции акто-, кардио- и нейропротекции в условиях вынужденной физической нагрузки в эксперименте путем применения аллогенного биоматериала | 2024 |
|
RU2826978C1 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО ПОСТСТРЕПТОКОККОВОГО ГЛОМЕРУЛОНЕФРИТА В ЭКСПЕРИМЕНТЕ | 2009 |
|
RU2393547C1 |
| Способ синтеза (3aR,4S,8S,12R,12aS,12bR)-10-метил-2-фенилоктагидро-1H-4,12a-этено-8,12-метанопирроло[3',4':3,4]пиридо[1,2-a][1,5]диазоцин-1,3,5(4H)-триона с ноотропными, гипогликемическими, антигипоксическими и антиагрегационными свойствами | 2024 |
|
RU2836645C1 |


Изобретение относится к фармакологии и эндокринологии. Предложено применение гидрохлорида 9-бензил-2-бифенилимидазо[1,2-а]бензимидазола формулы I в качестве средства, обладающего кардио-, эндотелио-, нефро-, микроангио-, макроангио- и энцефалопротекторными свойствами. Средство может быть использовано как действующее начало в фармацевтических композициях для профилактики и лечения кардио-, эндотелио-, нефро-, микроангио-, макроангио- и энцефалопротекторных нарушений. Техническим результатом изобретения является увеличение эффективности кардио- и эндотелиопртекторной активности при сохранении микроангио-, макроангио-, нефро- и энцефалопротекторых свойств при сахарном диабете. 1 з.п. ф-лы, 7 ил., 13 табл.
1. Применение гидрохлорида 9-бензил-2-бифенилимидазо[1,2-a]бензимидазола формулы I
 HCI
HCI
I
в качестве средства, обладающего кардио-, макроангио-, микроангио-, нефро-, эндотелио- и энцефалопротекторной активностью.
2. Применение гидрохлорида по п.1 в биологически активных композициях.
| 9-Бензил-2-бифенилимидазо[1,2-а]бензимидазол и его фармацевтически приемлемые соли, проявляющие свойства разрушителей поперечных сшивок гликированных белков | 2016 |
|
RU2627769C1 |
| СПАСОВ А.А | |||
| и др | |||
| Терапевтический потенциал разрывателей поперечных сшивок гликированных белков | |||
| Вестник ВолгГМУ | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| SADAU S | |||
| et al | |||
| In vitro glycation of an endotheliallized and innervated tissue-engineered skin to screen anti-AGE molecules | |||
| Biomaterials | |||
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ КОМПОЗИЦИЯ ДЛЯ УЛУЧШЕНИЯ ПОЛОВОЙ ФУНКЦИИ МУЖЧИН (ВАРИАНТЫ) | 2012 |
|
RU2519221C1 |
| JP 2012017270 A,26.01.2012. | |||
Авторы
Даты
2019-09-23—Публикация
2018-10-05—Подача