Изобретение относится к области медицины, онкологии и может быть использовано для радионуклидной диагностике операбельного рака молочной железы с гиперэкспрессией Her2/neu.
В последние годы все большую популярность получают таргетные радионуклидные методы диагностики злокачественных заболеваний, обладающие высокой специфичностью к различным молекулярным мишеням и позволяющие визуализировать опухолевые очаги различных размеров (как основной опухолевый узел, так и метастатические очаги) [Чернов В.И., Братина О.Д., Синилкин И.Г. и соавт. Радиоиммунотерапия: современное состояние проблемы // Вопросы онкологии. 2016. Т. 62. №1. С. 24-26]. Для обеспечения направленной доставки радионуклидов необходимо использование молекул, имеющих ряд обязательных характеристик, таких как, связывание исключительно с «таргетным» антигеном для специфической локализации, отсутствие иммуногенности, стабильность и возможность быстрой химической модификации для проведения процессов мечения [Nicholes N., Date A., Beaujean P. et.al. Modular protein switches derived from antibody mimetic proteins // Protein Engineering, Design and Selection. 2016. Vol. 29. P. 77-85]. Также для медицинской визуализации существенным является скорость связывания с мишенью и быстрое удаление несвязавшихся молекул из организма пациента для достижения высокого качества визуализации опухоли и сокращения временного промежутка между инъекцией и началом исследования [Boersma Y.L., Pluckthun A. DARPins and other repeat protein scaffolds: advances in engineering and applications // Curr. Opin. Biotechnol. 2011. Vol. 22. P. 849-57]. В настоящее время для этих целей используются новые молекулярные структуры, получившие название «альтернативных каркасных белков» и отвечающие всем требованиям для оптимальной доставки радионуклида к опухолевым клеткам [Lindbo S., Garousi J., Mitran В. et.al. Radionuclide Tumor Targeting Using ADAPT Scaffold Proteins: Aspects of Label Positioning and Residualizing Properties of the Label // J. Nucl. Med. 2018. Vol. 59. №1. P. 93-99]. Одним из представителей адресных молекул неиммуноглобулиновой природы является DARPin (Design Ankyrin Repeat Protein), к преимуществам которого относятся небольшой размер (14-20 кДа) [ A. Designed ankyrin repeat proteins (DARPins): binding proteins for research, diagnostics, and therapy // Annu Rev Pharmacol Toxicol. 2015. Vol. 55. P. 489-511], стабильная структура, высокая специфичность и аффинность к антигену, а также значительно более низкая стоимость производства, обусловленная их экспрессией в бактериальных средах [Kramer L, Renko М,
A. Designed ankyrin repeat proteins (DARPins): binding proteins for research, diagnostics, and therapy // Annu Rev Pharmacol Toxicol. 2015. Vol. 55. P. 489-511], стабильная структура, высокая специфичность и аффинность к антигену, а также значительно более низкая стоимость производства, обусловленная их экспрессией в бактериальных средах [Kramer L, Renko М,  J, Turk D, Seeger MA, Vasiljeva О et.al Non-invasive in vivo imaging of tumour-associated cathepsin В by a highly selective inhibitory DARPin. Theranostics. 2017; 8: 2806-2821].
J, Turk D, Seeger MA, Vasiljeva О et.al Non-invasive in vivo imaging of tumour-associated cathepsin В by a highly selective inhibitory DARPin. Theranostics. 2017; 8: 2806-2821].
Наиболее часто используемым радионуклидом для проведения диагностических исследований как на территории Российской Федерации, так и в мире, остается короткоживущий (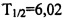 ч) технеций-99м (99mTc). Как правило, технециевые радиофармпрепараты (РФП) изготавливаются в виде стандартных наборов реагентов (лиофилизатов) к генератору технеция-99м, которые представляют собой приготовленные методом сублимационной сушки при низких температурах смеси [Лыков А.В. Сублимационная сушка // В кн.: Теория сушки. - М., Энергия. -1968. - С. 334-362]. При их смешивании с выделенного из генератора элюатом технеция-99м (раствор натрия пертехнетата, 99mTc), получается готовый РФП с заданными свойствами. Срок годности лиофилизатов обычно составляет 1 год.
ч) технеций-99м (99mTc). Как правило, технециевые радиофармпрепараты (РФП) изготавливаются в виде стандартных наборов реагентов (лиофилизатов) к генератору технеция-99м, которые представляют собой приготовленные методом сублимационной сушки при низких температурах смеси [Лыков А.В. Сублимационная сушка // В кн.: Теория сушки. - М., Энергия. -1968. - С. 334-362]. При их смешивании с выделенного из генератора элюатом технеция-99м (раствор натрия пертехнетата, 99mTc), получается готовый РФП с заданными свойствами. Срок годности лиофилизатов обычно составляет 1 год.
Одной из наиболее изучаемых молекулярных мишеней по-прежнему остается рецептор эпидермального роста Her2/neu, гиперэкспрессия которого определяется на поверхности опухолевых клеток (преимущественно рака молочной железы, реже рака яичников, желудка, простаты и пр.) и характеризуется неблагоприятным прогнозом относительно безрецидивной и общей выживаемости [Slamon D.J., Clark G.M., Wong S.G. et.al. Human breast cancer: correlation of relapse a survival with amplification of the Her-2/neu oncogenes // Science. 1987. Vol. 235. P. 177-182]. Применяемые в настоящее время методы диагностики для определения статуса Her2/neu обычно требуют инвазивного вмешательства, в большинстве случаев имеют субъективный характер, обусловленный квалификацией персонала, освоением им сложной методологии, а также характеризуются невозможностью выполнения исследования in vivo с оценкой распространенности опухолевого процесса (состояние опухолевого узла, регионарных лимфатических узлов и отдаленных органов и тканей).
Наиболее близким к предлагаемому является способ диагностики рака молочной железы с гиперэкспрессией Her2/neu с использованием меченных индием-111 альтернативных каркасных белков аффибоди (111In-ABY-025). Применяемый в известном способе радиофармацевтический препарат является специфическим и фиксируется на поверхности мембран опухолевых клеток, экспрессирующих Her2/neu, что позволяет их визуализировать как основной опухолевый узел, так и метастатические очаги [Sorensen J., Sandberg D., Sandstrom M., et.al. First-in-Human Molecular Imaging of HER2 Expression in Breast Cancer Metastases Using the 111In-ABY-025 Affibody Molecule // Tee Journal of Nuclear Medicine. 2014. Vol. 55 (5). P. 730-735]. Основным недостатком данного метода являются неоптимальные радиологические характеристики препарата, связанные с длительным периодом полураспада (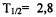 сут) и следовательно высокой дозой облучения на обследуемого, высокой стоимостью циклотронного производства, а также наличием в его спектре облучения высокоэнергетических гамма-квантов, препятствующих получению качественных сцинтиграфических изображений. Существенным недостатком также является недоступность получения аффибоди на территории Российской Федерации.
сут) и следовательно высокой дозой облучения на обследуемого, высокой стоимостью циклотронного производства, а также наличием в его спектре облучения высокоэнергетических гамма-квантов, препятствующих получению качественных сцинтиграфических изображений. Существенным недостатком также является недоступность получения аффибоди на территории Российской Федерации.
Новый технический результат - повышение специфичности и информативности и доступности диагностики операбельного рака молочной железы с гиперэкспрессией Her2/neu.
Для достижения нового технического результата в способе диагностики операбельного рака молочной железы с гиперэкспрессией Her2/neu пациентам, включающем внутривенное введение радиофармацевтического препарата(РФП) с последующим проведением однофотонной эмиссионной компьютерной томографии, вводят инъекционную форму радиофармпрепарата на основе меченных технецием-99m рекомбинантных адресных молекул DARPin9_29, который изготавливают непосредственно перед введением, для чего в асептических условиях 1 мл элюата 99mTcO4- 7 ГБк с помощью шприца добавляют в набор для приготовления трикарбонильного технеция и инкубируют при температуре 100°С в течение 30 минут, после инкубации 1000 мкл трикарбонила технеция добавляют к 334 мкл DARPin9_29 при концентрации раствора основного вещества 3,6 мг/л и инкубируют при температуре 40°С в течение 60 минут, далее выполняют очистку полученного соединения от белковых примесей и несвязавшихся с технецием молекул DARPin9_29 с помощью очистительных колонок, полученный после очищения препарат в дозе 500 МБк разбавляют в 10 мл физиологического раствора и через стерилизующий фильтр медленно вводят пациенту, через 4 часа после введения препарата пациенту выполняют однофотонную эмиссионную компьютерную томографию на двух детекторной гамма-камере, оценивают полученные результаты и при визуализации участков гиперфиксации РФП в ткани молочных желез диагностируют злокачественную опухоль.
Способ осуществляют следующим образом, радиофармацевтический препарат готовят непосредственно перед введением: в набор «CRS Isolink» (Center for Radiopharmaceutical Science, Paul Scherrer Institute, Villigen, Швейцария) для приготовления трикарбонила технеция [99mTc(СО)3(H2O)3]+добавляют 1 мл (7 ГБк) элюата 99mTcO4- и инкубируют в течение 30 минут при температуре 100°С. После инкубации 1 мл трикарбонила технеция добавляют к 334 мкл (1200 мкг) DARPin9_29 при концентрации раствора основного вещества 3,6 мг/л и инкубируют при температуре 40°С в течение 60 минут (согласно лабораторному регламенту получения РФП ЛР-02069303-0217 от 03.02.2017 г). В дальнейшем выполняют очистку полученного соединения от белковых примесей и несвязавшихся с технецием молекул DARPin9_29 с использованием очистительных колонок NAP-5 (GE Healthcare, Швеция). Радиохимические выход и чистоту определяют с помощью тонкослойной радиохроматографии (ТСРХ). Анализ хроматограмм проводят с использованием хроматографа Hitachi Chromaster HPLC systems с радиоактивным детектором. Полученный после очищения препарат в дозе 500 МБк разбавляют в 10 мл физиологического раствора и через стерилизующий фильтр медленно вводят пациенту. Через 4 часа после введения препарата пациенту выполняют однофотонную эмиссионную компьютерную томографию на двух детекторной гамма-камере и оценивают полученные результаты и при визуализации участков гиперфиксации РФП в ткани молочных желез диагностируют злокачественную опухоль.
Способ основан на анализе результатов экспериментальных клинических исследований. Для подтверждения эффективности выявления злокачественных опухолей молочных желез с гиперэкспрессией Her2/neu было проведено изучение особенностей накопления радиофармацевтического препарата на основе меченных технецием-99m рекомбинантных адресных молекул DARPin9_29. С этой целью была сформирована группа из 8 пациенток с верифицированным диагнозом рака молочной железы T4N0-3M0-1: исследуемую подгруппу составляли 4 пациентки с гиперэкспрессией Her2/neu, контрольную - 4 пациентки без экспрессии данного параметра. Всем пациенткам внутривенно вводили радиофармацевтический препарат на основе меченных технецием-99m рекомбинантных адресных молекул DARPin9_29 в дозе 500 МБк. Радиофармацевтический препарат готовили непосредственно перед введением согласно разработанному авторами лабораторному регламенту: для приготовления набор «CRS Isolink» (Center for Radiopharmaceutical Science, Paul Scherrer Institute, Villigen, Швейцария) для приготовления трикарбонила технеция [99mTc(СО)3(H2O)3]+добавляли 1 мл (7 ГБк) элюата 99mTcO4- и инкубировали в течение 30 минут при температуре 100°С. После инкубации 1 мл трикарбонила технеция добавляли к 334 мкл (1200 мкг) DARPin9_29 при концентрация раствора основного вещества 3,6 мг/л, и инкубировали при температуре 40°С в течение 60 минут (согласно лабораторному регламенту получения РФП ЛР-02069303-0217 от 03.02.2017 г). В дальнейшем выполняли очистку полученного соединения от белковых примесей и несвязавшихся с технецием молекул DARPin9_29 с использованием очистительных колонок NAP-5 (GE Healthcare, Швеция). Радиохимические выход и чистоту определяли с помощью тонкослойной радиохроматографии (ТСРХ). Анализ хроматограмм проводили с использованием хроматографа Hitachi Chromaster HPLC systems с радиоактивным детектором. Полученный после очищения препарат в дозе 500 МБк разбавляли в 10 мл физраствора и через стерилизующий фильтр медленно вводили пациенту.
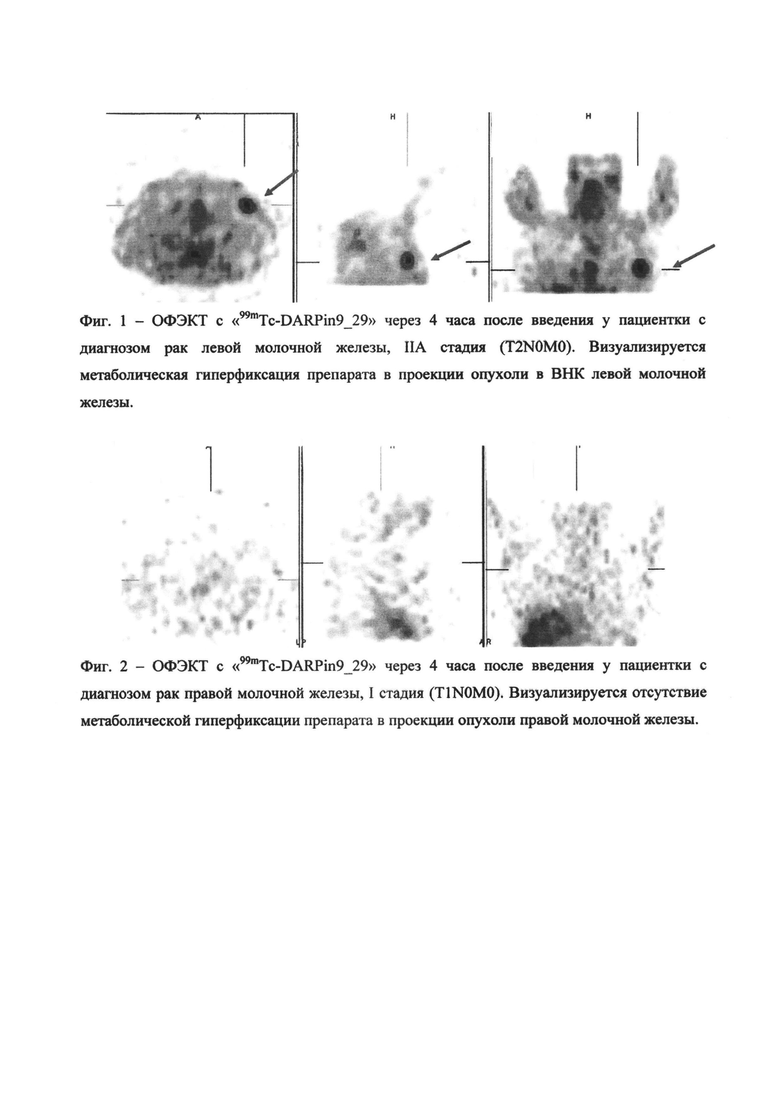
Через 4 часа после введения препарата пациенту выполняли однофотонную эмиссионную компьютерную томографию на двух детекторной гамма-камере Е.САМ фирмы SIEMENS в стандартном режиме. Производили запись 64 проекций в матрицу 64×64 пикселя с применением низкоэнергетических коллиматоров с энергией 140 КэВ. Окно дифференциального дискриминатора было настроено на 20%, аппаратное увеличение не использовали. Полученные при исследовании изображения (сцинтиграммы) подвергали постпроцессинговой обработке с использованием фирменного пакета программ E.Soft (SIEMENS, Германия). Патологическими считались участки повышенной аккумуляции препарата в ткани молочной железы (Фиг. 1). Кроме того, при постпроцессинговой обработке производили расчет индекса «опухоль/фон», отражающий соотношение накопления препарата в опухолевой ткани и в здоровой ткани молочной железы. Результаты исследования продемонстрировали 100% чувствительность способа в диагностике операбельного рака молочной железы с гиперэкспрессией Her2/neu, то есть с применением указанного радиофармпрепарата удалось выявить опухоль у всех 10 пациенток, включенных в исследование. Произведенные расчеты показали, что средние значения индекса «опухоль/фон» составили 5,76±0,12.
Клинический пример 1.
Пациентка В., 58 лет: Ds.: Рак левой молочной железы IIA стадия (T2N0M0)
Гистологическое и иммуногистохимическое исследование: Инвазивная карцинома неспецифического типа 2 степени злокачественности. РЭ+, РП+, Her2/neu +
В плане обследования дополнительно выполнена однофотонная эмиссионная компьютерная томография с РФП на основе меченных технецием-99m рекомбинантных адресных молекул DARPin9_29 согласно предлагаемому способу.
На фиг. 1 - ОФЭКТ с РФП на основе меченных технецием-99m рекомбинантных адресных молекул DARPin9_29 через 4 часа после введения у пациентки с диагнозом рак левой молочной железы, IIA стадия (T2N0M0). Визуализируется метаболическая гиперфиксация препарата в проекции опухоли в ВНК левой молочной железы.
Клинический пример 2.
Пациентка У., 60 лет: Ds.: Рак правой молочной железы I стадия (T1N0M0) Гистологическое исследование: Инвазивная дольковая карцинома. РЭ+, РП+, Her2/neu - В плане обследования дополнительно выполнена однофотонная эмиссионная компьютерная томография с РФП на основе меченных технецием-99m рекомбинантных адресных молекул DARPin9_29 согласно предлагаемому способу. На Фиг. 2 - ОФЭКТ с РФП на основе меченных технецием-99m рекомбинантных адресных молекул DARPin9_29, через 4 часа после введения у пациентки с диагнозом рак правой молочной железы, I стадия (T1N0M0). Визуализируется отсутствие метаболической гиперфиксации препарата в проекции опухоли правой молочной железы.
Таким образом, предлагаемый способ диагностики операбельного рака молочной железы с гиперэкспрессией Her2/neu с применением радиофармацевтического препарата на основе меченных технецием-99m рекомбинантных адресных молекул DARPin9_29, позволяет отчетливо визуализировать злокачественные опухоли молочных желез на метаболическом уровне, а степень аккумуляции представленного радиофармпрепарата в опухоли дает возможность получать сцинтиграфические изображения надлежащего качества. Таким образом, применение нового способа с использованием радиофармацевтического препарата на основе меченных технецием-99m рекомбинантных адресных молекул DARPin9_29 позволит повысить эффективность, специфичность и доступность радионуклидной диагностики операбельного рака молочных желез с гиперэкспрессией Her2/neu.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ радионуклидной диагностики вторичной отечно-инфильтративной формы рака молочной железы с гиперэкспрессией Her2/neu с использованием рекомбинантных адресных молекул DARPin9_29 | 2019 |
|
RU2700109C1 |
| Способ оценки динамики неоадъювантной системной терапии рака молочной железы с гиперэкспрессией Her2/neu | 2020 |
|
RU2737996C1 |
| Способ диагностики рака желудка с гиперэкспрессией Her2/neu | 2020 |
|
RU2739107C1 |
| Способ радионуклидной диагностики рака молочной железы с гиперэкспрессией Her2/neu | 2019 |
|
RU2720801C1 |
| СПОСОБ ОЦЕНКИ НЕОАДЪЮВАНТНОЙ ХИМИОТЕРАПИИ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ С ГИПЕРЭКСПРЕССИЕЙ HER2/NEU | 2022 |
|
RU2785387C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ СТАТУСА РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА HER2/NEU В ОСНОВНОМ ОПУХОЛЕВОМ УЗЛЕ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2021 |
|
RU2762317C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ СТАТУСА РЕЦЕПТОРА ЭПИДЕРМАЛЬНОГО ФАКТОРА РОСТА HER2/NEU В ОСНОВНОМ ОПУХОЛЕВОМ УЗЛЕ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2022 |
|
RU2779751C1 |
| СПОСОБ ДИАГНОСТИКИ ОТДАЛЕННЫХ МЕТАСТАЗОВ У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ С ГИПЕРЭКСПРЕССИЕЙ HER2/NEU | 2022 |
|
RU2800864C1 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ С ГИПЕРЭКСПРЕССИЕЙ HER2/NEU | 2022 |
|
RU2800818C1 |
| Способ прогнозирования статуса рецептора эпидермального фактора роста HER2/neu в метастатических аксиллярных лимфатических узлах у больных раком молочной железы | 2023 |
|
RU2803857C1 |
Изобретение относится к медицине, а именно к онкологии и лучевой радионуклидной диагностике, и может быть использовано для диагностики операбельного рака молочной железы с гиперэкспрессией Her2/neu. Вводят инъекционную форму радиофармпрепарата на основе меченных технецием-99m рекомбинантных адресных молекул DARPin9_29, который изготавливают непосредственно перед введением. Для чего в асептических условиях 1 мл элюата 99mTcO4- 7 ГБк с помощью шприца добавляют в набор для приготовления трикарбонильного технеция и инкубируют при температуре 100°С в течение 30 минут. После инкубации 1000 мкл трикарбонила технеция добавляют к 334 мкл DARPin9_29 при концентрации раствора основного вещества 3,6 мг/л и инкубируют при температуре 40°С в течение 60 минут. Далее выполняют очистку полученного соединения от белковых примесей и несвязавшихся с технецием молекул DARPin9_29 с помощью очистительных колонок. Полученный после очищения препарат в дозе 500 МБк разбавляют в 10 мл физиологического раствора и через стерилизующий фильтр медленно вводят пациенту. Через 4 часа после введения препарата пациенту выполняют однофотонную эмиссионную компьютерную томографию на двухдетекторной гамма-камере. Оценивают полученные результаты и при визуализации участков гиперфиксации РФП в ткани молочных желез диагностируют злокачественную опухоль. Технический результат обеспечивает повышение специфичности, информативности и доступности диагностики операбельного рака молочной железы с гиперэкспрессией Her2/neu. 2 ил., 2 пр.
Способ диагностики операбельного рака молочной железы с гиперэкспрессией Her2/neu, включающий внутривенное введение радиофармацевтического препарата (РФП) с последующим проведением однофотонной эмиссионной компьютерной томографии, отличающийся тем, что вводят инъекционную форму радиофармпрепарата на основе меченных технецием-99m рекомбинантных адресных молекул DARPin9_29, который изготавливают непосредственно перед введением, для чего в асептических условиях 1 мл элюата 99mTcO4- 7 ГБк с помощью шприца добавляют в набор для приготовления трикарбонильного технеция и инкубируют при температуре 100°С в течение 30 минут, после инкубации 1000 мкл трикарбонила технеция добавляют к 334 мкл DARPin9_29 при концентрации раствора основного вещества 3,6 мг/л и инкубируют при температуре 40°С в течение 60 минут, далее выполняют очистку полученного соединения от белковых примесей и несвязавшихся с технецием молекул DARPin9_29 с помощью очистительных колонок, полученный после очищения препарат в дозе 500 МБк разбавляют в 10 мл физиологического раствора и через стерилизующий фильтр медленно вводят пациенту, через 4 часа после введения препарата пациенту выполняют однофотонную эмиссионную компьютерную томографию на двухдетекторной гамма-камере, оценивают полученные результаты и при визуализации участков гиперфиксации РФП в ткани молочных желез диагностируют злокачественную опухоль.
Авторы
Даты
2019-10-07—Публикация
2019-01-18—Подача