Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к соединению, обладающему ингибирующей активностью в отношении ацетил-CoA-карбоксилазы 2 (здесь и далее в тексте называемой ACC2).
[Предпосылки создания изобретения]
[0002]
Ацетил-СоА-карбоксилаза (здесь и далее в тексте называемая ACC) представляет собой фермент, который образует малонил-СоА путем карбоксилирования ацетил-СоА. Она участвует в метаболизме жирных кислот. АСС имеет две изоформы, называемые ацетил-СоА-карбоксилаза 1 (здесь и далее в тексте называемая ACC1) и ACC2.
ACC2 преимущественно экспрессируется в сердце и скелетных мышцах, а продуцируемый ACC2 малонил-СоА ингибирует окисление жирных кислот путем ингибирования карнитинпальмитоилтрансферазы I (CPT-I).
У дефицитных по ACC2 мышей снижено количество малонил-СоА в сердце и скелетных мышцах. В результате, жирные кислоты у мышей непрерывно окисляются, и мыши теряют в весе, несмотря на увеличение потребления пищи. Кроме того, сообщалось, что у дефицитных по ACC2 мышей развивается толерантность к диабету и ожирению, индуцируемая введением пиши с высоким содержанием жира/углеводов.
В виду вышеуказанной информации, ACC2 связана с нарушениями, такими как диабет, ожирение и т. п. Предполагается, что ингибитор, как ожидается, представляет собой лекарство против диабета и против ожирения.
С другой стороны, поскольку дефицитные по ACC1 мыши представляют собой эмбрионы во внутриутробном периоде развития, предполагается, что лекарство будет ингибировать ACC2 селективно без ингибирования ACC1.
Ингибиторы ACC2 раскрыты в патентных документах 1-7. Например, следующие два соединения, характеризующиеся оксиметиленовой структурой, раскрыты в патентном документе 1.
[Формула 1]

Десять соединений, представленные ниже, характеризующиеся оксиметиленовой структурой, раскрыты в патентном документе 3.
[Формула 2]

Хотя каждое из указанных соединений содержит замещенную или незамещенную алкилоксигруппу в пара-положении концевого кольца, в орто-положении заместителя нет.
Соединение, представленное ниже, раскрыто в патентном документе 3 в качестве соединения, характеризующегося олефиновой структурой.
[Формула 3]

[0003]
Производные простого тиазолфенилового эфира, специфически ингибирующие ACC2, раскрыты в непатентных документах 1-5. Производные бифенила или 3-фенилпиридина, демонстрирующие ингибирующую активность в отношении рецепторов ACC1 и ACC2, раскрыты в непатентном документе 6. Соединение, представленное ниже, демонстрирующее ингибирующую активность в отношении ACC2 рецептора и обладающее предпочтительными фармакокинетическими параметрами, раскрыто в непатентном документе 7.
[Формула 4]

Предпочтительные соединения, обладающие двойной ингибирующей активностью в отношении ACC1 и ACC2 в виртуальном скрининге, раскрыты в непатентном документе 8.
[0004]
Однако настоящее изобретение не раскрывается и не предполагается вышеуказанным известным уровнем техники.
[0005]
Кроме того, в патентном документе 8 представленные ниже соединения раскрыты в качестве соединения, обладающего ингибирующей активностью в отношении рецептора ACC2.
[Формула 5]
[Формула 6]

Хотя соединения, содержащие 9-членное конденсированное кольцо, раскрыты в патентных документах 9-12, настоящее изобретение не раскрывается и не предполагается известным уровнем техники.
Документы известного уровня техники
Патентные документы
[0006]
[Патентный документ 1] WO2008/079610
[Патентный документ 2] WO2010/050445
[Патентный документ 3] WO2010/003624
[Патентный документ 4] WO2007/095601
[Патентный документ 5] WO2007/095602
[Патентный документ 6] WO2007/095603
[Патентный документ 7] US2006/178400
[Патентный документ 8] WO2013/035827
[Патентный документ 9] WO2013/142369
[Патентный документ 10] WO2010/000615
[Патентный документ 11] WO2010/000612
[Патентный документ 12] WO2010/000611
Непатентные документы
[0007]
[Непатентный документ 1] Bioorganic & Medicinal Chemistry Letters, (2006), Vol,16, 6078-6081
[Непатентный документ 2] Journal of Medicinal Chemistry, (2006), Vol,49, 3770-3773
[Непатентный документ 3] Bioorganic & Medicinal Chemistry Letters, (2007), Vol,17, 1803-1807
[Непатентный документ 4] Bioorganic & Medicinal Chemistry Letters, (2007), Vol,17, 1961-1965
[Непатентный документ 5] Journal of Medicinal Chemistry, (2007), Vol,50, 1078-1082
[Непатентный документ 6] Bioorganic & Medicinal Chemistry Letters, (2009), Vol,19, 5872-5876
[Непатентный документ 7] Journal of Medicinal Chemistry, (2010), Vol,53, 8679-8687
[Непатентный документ 8] Molecular Diversity, (2013), Vol,17, 139-149
Раскрытие настоящего изобретения
Задачи, подлежащие решению настоящим изобретением
[0008]
Целью настоящего изобретения является предоставление новых соединений, обладающих селективной ингибирующей активностью в отношении ACC2. Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей соединение согласно настоящему изобретению.
Средства решения задачи
[0009]
Настоящее изобретение включает в себя следующее.
(1) Соединение формулы (I):
[Формула 7]

или его фармацевтически приемлемая соль,
где
R1 представляет собой замещенный или незамещенный конденсированный ароматический гетероциклил, представленный формулой:
[Формула 8]

где
кольцо B представляет собой 5-членное кольцо, кольцо C представляет собой 6-членное кольцо;
кольцо A представляет собой замещенный или незамещенный неароматический карбоцикл, замещенный или незамещенный неароматический гетероцикл, замещенный или незамещенный ароматический карбоцикл, или замещенный или незамещенный ароматический гетероцикл;
-L1- представляет собой -O-(CR6R7)m-, -N(R8)-(CR6R7)m- или -(CR6R7)m-, где связь с левой стороны присоединена к R1, связь с правой стороны присоединена к кольцу A;
-L2- представляет собой -O-(CR6R7)n-, -O-CR6=CR7-, -CR6=CR7- или -(CR6R7)n-, где связь с левой стороны присоединена к кольцу A, связь с правой стороны присоединена к группе, представленной формулой:
[Формула 9]
 ;
;
где
каждый R6 независимо представляет собой водород, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, или замещенный или незамещенный алкинил;
каждый R7 независимо представляет собой водород, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, или замещенный или незамещенный алкинил;
R6 и R7 на одном атоме углерода могут формировать кольцо вместе с этим атомом углерода;
R8 представляет собой замещенный или незамещенный алкил;
каждый m представляет собой целое число, равное 0, 1, 2 или 3;
каждый n представляет собой целое число, равное 1, 2 или 3;
R2 представляет собой замещенный или незамещенный алкил;
R3 представляет собой водород или замещенный или незамещенный алкил;
R4 представляет собой замещенный или незамещенный алкилкарбонил, замещенный или незамещенный алкенилкарбонил, замещенный или незамещенный алкинилкарбонил, замещенный или незамещенный неароматический карбоциклилкарбонил, замещенный или незамещенный ароматический карбоциклилкарбонил, замещенный или незамещенный неароматический гетероциклилкарбонил, замещенный или незамещенный ароматический гетероциклилкарбонил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкенилоксикарбонил, замещенный или незамещенный алкинилоксикарбонил, замещенный или незамещенный неароматический карбоциклилоксикарбонил, замещенный или незамещенный ароматический карбоциклилоксикарбонил, замещенный или незамещенный неароматический гетероциклилоксикарбонил, замещенный или незамещенный ароматический гетероциклилоксикарбонил, замещенный или незамещенный карбамоил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный алкенилсульфонил, замещенный или незамещенный алкинилсульфонил, замещенный или незамещенный неароматический карбоциклилсульфонил, замещенный или незамещенный ароматический карбоциклилсульфонил, замещенный или незамещенный неароматический гетероциклилсульфонил, замещенный или незамещенный ароматический гетероциклилсульфонил, или замещенный или незамещенный сульфамоил;
при условии исключения следующих соединений (i) и (ii):
(i) соединения, где R1 представляет собой бензимидазолил или имидазопиридил, замещенный замещенным или незамещенным ароматическим гетероциклилалкилом или замещенным или незамещенным неароматическим гетероциклилалкилом; кольцо A представляет собой пиперидин; -L1- представляет собой -NH-; -L2- представляет собой -CH2-; и R4 представляет собой трет-бутилоксикарбонил, и
(ii) следующие соединения, представленные формулой:
[Формула 10]

 .
.
(2) Соединение или его фармацевтически приемлемая соль в соответствии с представленным выше пунктом (1), где R1 представляет собой группу, представленную формулой:
[Формула 11]
где
X1 представляет собой N или C(Rx1);
X2 представляет собой N или C(Rx2);
X3 представляет собой N или C(Rx3);
X4 представляет собой N или C(Rx4);
X5 представляет собой N(Rx5), O или S;
X6 представляет собой N или C(Rx6);
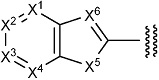
каждый Rx1, Rx2, Rx3, Rx4, Rx5 и Rx6 независимо представляет собой водород, галоген, гидрокси, карбокси, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкенилокси, замещенный или незамещенный алкинилокси, замещенный или незамещенный алкилсульфанил, замещенный или незамещенный алкенилсульфанил, замещенный или незамещенный алкинилсульфанил, замещенный или незамещенный амино, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил, замещенный или незамещенный алкилкарбонил, замещенный или незамещенный алкенилкарбонил, замещенный или незамещенный алкинилкарбонил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкенилоксикарбонил, замещенный или незамещенный алкинилоксикарбонил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный алкенилсульфонил, замещенный или незамещенный алкинилсульфонил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный неароматический карбоциклилсульфонил, замещенный или незамещенный ароматический карбоциклилсульфонил, замещенный или незамещенный неароматический гетероциклилсульфонил, замещенный или незамещенный ароматический гетероциклилсульфонил, замещенный или незамещенный неароматический карбоциклилокси, замещенный или незамещенный ароматический карбоциклилокси, замещенный или незамещенный неароматический гетероциклилокси, или замещенный или незамещенный ароматический гетероциклилокси.
(3) Соединение или его фармацевтически приемлемая соль в соответствии с представленным выше пунктом (2), где X5 представляет собой N(Rx5), и X6 представляет собой N.
(4) Соединение или его фармацевтически приемлемая соль в соответствии с представленным выше пунктом (2), где X5 представляет собой S, и X6 представляет собой N.
(5) Соединение или его фармацевтически приемлемая соль в соответствии с представленным выше пунктом (2), где R1 представляет собой группу, представленную формулой:
[Формула 12]

где символы имеют те же значения, что и представленные в пункте (2).
(6) Соединение или его фармацевтически приемлемая соль в соответствии с представленным выше пунктом (2), где R1 представляет собой группу, представленную формулой:
[Формула 13]

где символы имеют те же значения, что и представленные в пункте (2).
(7) Соединение или его фармацевтически приемлемая соль в соответствии с представленным выше пунктом (5) или (6), где Rx1 представляет собой водород, галоген или циано; Rx2 представляет собой водород, галоген или циано; Rx3 представляет собой замещенный или незамещенный алкилокси, замещенный или незамещенный неароматический карбоциклилокси, замещенный или незамещенный ароматический карбоциклилокси, замещенный или незамещенный неароматический гетероциклилокси, или замещенный или незамещенный ароматический гетероциклилокси; Rx4 представляет собой водород, галоген или циано, и Rx5 представляет собой замещенный или незамещенный алкил.
(8) Соединение или его фармацевтически приемлемая соль в соответствии с любым из представленных выше пунктов (1) - (7), где -L1- представляет собой -O-(CR6R7)m-.
(9) Соединение или его фармацевтически приемлемая соль в соответствии с любым из представленных выше пунктов (1) - (7), где -L1- представляет собой -N(R8)-(CR6R7)m-.
(10) Соединение или его фармацевтически приемлемая соль в соответствии с представленным выше пунктом (8) или (9), где m равен 0.
(11) Соединение или его фармацевтически приемлемая соль в соответствии с любым из представленных выше пунктов (1) - (10), где -L2- представляет собой -O-(CR6R7)n- или -(CR6R7)n-.
(12) Соединение или его фармацевтически приемлемая соль в соответствии с представленным выше пунктом (11), где -L2- представляет собой -O-(CR6R7)n-.
(13) Соединение или его фармацевтически приемлемая соль в соответствии с любым из представленных выше пунктов (1) - (12), где кольцо A представляет собой замещенный или незамещенный неароматический карбоцикл, или замещенный или незамещенный неароматический гетероцикл.
(14) Соединение или его фармацевтически приемлемая соль в соответствии с любым из представленных выше пунктов (1) - (13), где группа, представленная формулой -L1-кольцо A-L2-, представляет собой группу, выбранную из следующих формул:
[Формула 14]

где
R9 представляет собой галоген, циано, гидрокси, карбокси, оксо, замещенный или незамещенный алкил, замещенный или незамещенный алкилокси, или замещенный или незамещенный амино;
p представляет собой целое число, равное 0-4.
(10') Соединение или его фармацевтически приемлемая соль в соответствии с любым из представленных выше пунктов (1) - (9), где -L1- представляет собой -O-(CR6R7)m-.
(11') Соединение или его фармацевтически приемлемая соль в соответствии с любым из представленных выше пунктов (1) - (9), где -L1- представляет собой -N(R8)-(CR6R7)m-.
(12') Соединение или его фармацевтически приемлемая соль в соответствии с представленным выше пунктом (10') или (11'), где m равен 0.
(13') Соединение или его фармацевтически приемлемая соль в соответствии с любым из представленных выше пунктов (1) - (9) и (10') - (12'), где -L2- представляет собой группу формулы: -O-(CR6R7)n-, где n равен 1, или группу формулы: -(CR6R7)n-.
(14') Соединение или его фармацевтически приемлемая соль в соответствии с представленными выше пунктами (1) - (9) и (10') - (12'), где -L2- представляет собой -(CR6R7)n-, и n равен 2.
(15) Соединение или его фармацевтически приемлемая соль в соответствии с любым из представленных выше пунктов (1) - (14) и (10') - (14'), где R4 представляет собой замещенный или незамещенный алкилкарбонил, замещенный или незамещенный алкенилкарбонил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный карбамоил, замещенный или незамещенный алкилсульфонил, или замещенный или незамещенный сульфамоил.
(16) Соединение или его фармацевтически приемлемая соль в соответствии с представленным выше пунктом (15), где R4 представляет собой замещенный или незамещенный алкилкарбонил.
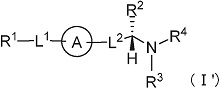
(17) Соединение или его фармацевтически приемлемая соль в соответствии с любым из представленных выше пунктов (1) - (16) и (10') - (14'), где формула (I) представляет собой формулу:
[Формула 15]
 .
.
(18) Соединение или его фармацевтически приемлемая соль в соответствии с любым из представленных выше пунктов (1) - (17) и (10') - (14'), где формула (I) представляет собой формулу:
[Формула 16]
 .
.
(18') Соединение формулы (I):
[Формула 17]

или его фармацевтически приемлемая соль,
где
R1 представляет собой группу, представленную формулой:
[Формула 18]
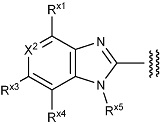
где X2 представляет собой N или C(H),
Rx1 представляет собой галоген,
Rx3 представляет собой неароматический карбоциклилокси,
Rx4 представляет собой водород,
Rx5 представляет собой алкил,
кольцо A представляет собой группу, представленную формулой:
[Формула 19]

-L1- представляет собой -O-,
-L2- представляет собой -O-(CH2)- или -(CH2)2-, где левая связь присоединена к кольцу A, правая связь присоединена к группе, представленной формулой:
[Формула 20]
 ,
,
R2 представляет собой алкил или галогеналкил,
R3 представляет собой водород,
R4 представляет собой алкилкарбонил или карбамоил,
при условии исключения следующего соединения,
[Формула 21]
 .
.
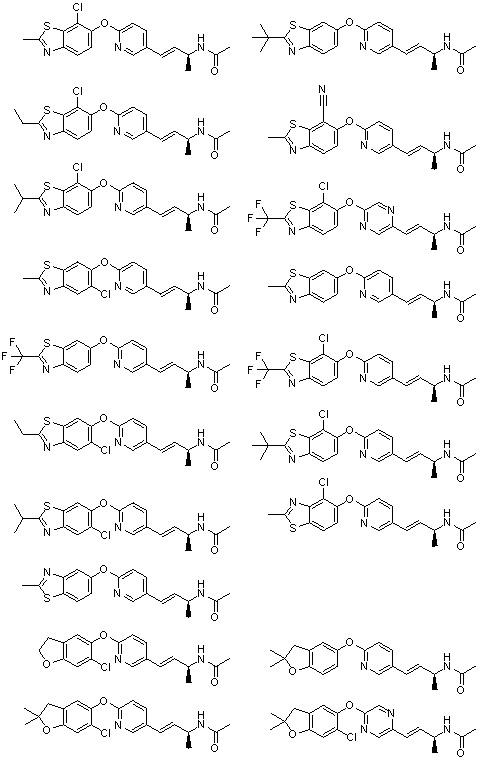
(19) Соединение или его фармацевтически приемлемая соль в соответствии с представленным выше пунктом (1), где соединение выбирают из группы, состоящей из Примеров I-200, I-201, I-205, I-219, I-221, I-222, I-231, I-234, I-237, I-243 и I-249.
(20) Фармацевтическая композиция, которая содержит соединение или его фармацевтически приемлемую соль в соответствии с любым из представленных выше пунктов (1) - (19), (10') - (14') и (18').
(21) Фармацевтическая композиция в соответствии с представленным выше пунктом (20) для лечения или профилактики заболевания, ассоциированного с ACC2.
(22) Способ лечения или профилактики заболевания, ассоциированного с ACC2, характеризующийся введением соединения или его фармацевтически приемлемой соли в соответствии с любым из представленных выше пунктов (1) - (19), (10') - (14') и (18').
(23) Применение соединения или его фармацевтически приемлемой соли в соответствии с любым из представленных выше пунктов (1) - (19), (10') - (14') и (18') для лечения или профилактики заболевания, ассоциированного с ACC2.
(24) Соединение или его фармацевтически приемлемая соль в соответствии с любым из представленных выше пунктов (1) - (19), (10') - (14') и (18') для лечения или профилактики заболевания, ассоциированного с ACC2.
(25) Фармацевтическая композиция в соответствии с представленным выше пунктом (20), характеризующаяся ингибитороной активность в отношении ACC2.
Эффект настоящего изобретения
[0010]
Соединение согласно настоящему изобретению характеризуется ингибирующей активностью в отношении ACC2. Фармацевтическая композиция, содержащая соединение согласно настоящему изобретению, применима в качестве лекарственного средства для профилактики или лечения заболевания, ассоциированного с ACC2, например, метаболического синдрома, ожирения, диабета, резистентности к инсулину, аномальной толерантности к глюкозе, диабетической периферической нейропатии, диабетической нефропатии, диабетического заболевания сетчатки, диабетической макроангиопатии, гиперлипидемии, гипертензии, сердечно-сосудистого заболевания, артериального склероза, атеросклеротического сердечно-сосудистого заболевания, остановки сердца, инфаркта миокарда, инфекционного заболевания, новообразования и т. п. (Journal of Cellular Biochemistry, (2006), vol. 99, 1476-1488, EXPERT OPINION ON THERAPEUTIC TARGETS, (2005), Vol,9, 267-281, WO2005/108370, JP2009-196966, JP2010-081894, JP2009-502785).
Вариант осуществления изобретения
[0011]
Термины, использованные в настоящем описании, разъяснены ниже. В настоящем описании, если каждый термин используется по отдельности или используется с другими терминами, то термин характеризуется одним и тем же значением.
[0012]
«Галоген» включает в себя атом фтора, атом хлора, атом брома и атом йода. Особенно предпочтительным является атом фтора или атом хлора.
[0013]
«Алкил» включает в себя неразветвленную или разветвленную C1-C15-, предпочтительно C1-C10-, более предпочтительно C1-C6-, еще более предпочтительно C1-C4-алкильную группу. Примеры включают в себя метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, изогексил, н-гептил, изогептил, н-октил, изооктил, н-нонил, н-децил, и т. п.
Предпочтительный вариант осуществления «алкила» включает в себя метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, и т. п. Более предпочтительно, представляет собой метил, этил, н-пропил, изопропил, трет-бутил, и т. п.
Предпочтительный вариант осуществления «алкила» в составе R2 включает в себя метил, и т. п.
Предпочтительный вариант осуществления «алкила» в составе Rx1, Rx2, Rx3, Rx4, Rx5 и Rx6 включает в себя метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, и т. п. Более предпочтительно, представляет собой метил, этил, н-пропил, изопропил, и т. п.
Предпочтительный вариант осуществления «алкила» в составе Rx2 включает в себя метил, этил, н-пропил, изопропил, и т. п.
Предпочтительный вариант осуществления «алкила» в составе Rx3 включает в себя метил, этил, н-пропил, изопропил, и т. п.
Предпочтительный вариант осуществления «алкила» в составе Rx5 включает в себя метил, этил, н-пропил, изопропил, и т. п.
[0014]
«Алкилокси» означает определенный выше «алкил», присоединенный к атому кислорода. Примерами являются метилокси, этилокси, н-пропилокси, изопропилокси, н-бутилокси, трет-бутилокси, изобутилокси, втор-бутилокси, пентилокси, изопентилокси, гексилокси, и т. п. Предпочтительный вариант осуществления «алкилокси» включает в себя метилокси, этилокси, н-пропилокси, изопропилокси, трет-бутилокси, и т. п.
Предпочтительный вариант осуществления «алкилокси» в составе Rx1, Rx2, Rx3 и Rx4 включает в себя метилокси, этилокси, н-пропилокси, изопропилокси, н-бутилокси, изобутилокси, втор-бутилокси, трет-бутилокси, и т. п. Более предпочтительно, представляет собой метилокси, этилокси, н-пропилокси, изопропилокси, и т. п.
Предпочтительный вариант осуществления «алкилокси» в составе Rx1 включает в себя метилокси, этилокси, н-пропилокси, изопропилокси, и т. п.
Предпочтительный вариант осуществления «алкилокси» в составе Rx2 включает в себя метилокси, этилокси, н-пропилокси, изопропилокси, изобутилокси, и т. п.
Предпочтительный вариант осуществления «алкилокси» в составе Rx3 включает в себя метилокси, этилокси, н-пропилокси, изопропилокси, и т. п.
Предпочтительный вариант осуществления «алкилокси» в составе Rx4 включает в себя метилокси, этилокси, н-пропилокси, изопропилокси, и т. п.
[0015]
«Алкилоксикарбонил» означает карбонильную группу, к которой присоединен определенный выше «алкилокси». Примерами являются метилоксикарбонил, этилоксикарбонил, пропилоксикарбонил, изопропилоксикарбонил, трет-бутилоксикарбонил, изобутилоксикарбонил, втор-бутилоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил, гексилоксикарбонил, и т. п. Более предпочтительный вариант осуществления «алкилоксикарбонила» включает в себя метилоксикарбонил, этилоксикарбонил, пропилоксикарбонил, и т. п.
Особенно предпочтительный вариант осуществления «алкилоксикарбонила» в составе R4 включает в себя метилоксикарбонил, и т. п.
[0016]
«Алкенил» включает в себя неразветвленный или разветвленный C2-C15-, предпочтительно C2-C10-, более предпочтительно C2-C6-, еще более предпочтительно C2-C4-алкенил, содержащий в любом положении одну или несколько двойных связей. Примеры включают в себя винил, аллил, пропенил, изопропенил, бутенил, изобутенил, пренил, бутадиенил, пентенил, изопентенил, пентадиенил, гексенил, изогексенил, гексадиенил, гептенил, октенил, ноненил, деценил, ундеценил, додеценил, торидеценил, тетрадеценил, пентадеценил, и т. п.
Предпочтительный вариант осуществления «алкенила» включает в себя винил, аллил, пропенил, изопропенил, бутенил.
Предпочтительный вариант осуществления «алкенила» в составе Rx1, Rx2, Rx3, Rx4, Rx5 и Rx6 включает в себя винил, и т. п.
Предпочтительный вариант осуществления «алкенила» в составе Rx2 включает в себя винил.
Предпочтительный вариант осуществления «алкенила» в составе Rx3 включает в себя винил.
[0017]
«Алкинил» включает в себя неразветвленный или разветвленный C2-C10-, предпочтительно C2-C8-, более предпочтительно C2-C6-, еще более предпочтительно C2-C4-алкинил, содержащий в любом положении одну или несколько тройных связей. Примеры включают в себя этинил, пропинил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил, децинил, и т. п. Алкинил может содержать двойную(ые) связь(и) по любому(ым) произвольному(ым) положению(ям).
Предпочтительный вариант осуществления «алкинила» включает в себя этинил, пропинил, бутинил, пентинил, и т. п.
[0018]
«Алкенилокси» означает определенный выше «алкенил», присоединенный к атому кислорода. Примеры включают в себя винилокси, аллилокси, 1-пропенилокси, 2-бутенилокси, 2-пентенилокси, 2-гексенилокси, 2-гептенилокси, 2-октенилокси, и т. п.
[0019]
«Алкинилокси» означает определенный выше «алкинил» присоединенный к атому кислорода. Примеры включают в себя этинилокси, 1-пропинилокси, 2-пропинилокси, 2-бутинилокси, 2-пентинилокси, 2-гексинилокси, 2-гептенилокси, 2-октинилокси, и т. п.
[0020]
«Алкилсульфанил» означает сульфанильную группу, атом водорода которой заменен определенным выше «алкилом». Примерами являются метилсульфанил, этилсульфанил, н-пропилсульфанил, изопропилсульфанил, н-бутилсульфанил, трет-бутилсульфанил, изобутилсульфанил, втор-бутилсульфанил, пентилсульфанил, изопентилсульфанил, гексилсульфанил, и т. п. Предпочтительный вариант осуществления «алкилсульфанила» включает в себя метилсульфанил, этилсульфанил, н-пропилсульфанил, изопропилсульфанил, трет-бутилсульфанил.
Вариант осуществления «алкилсульфанила» в составе Rx1, Rx2, Rx3 и Rx4 включает в себя метилсульфанил, этилсульфанил, н-пропилсульфанил, изопропилсульфанил, и т. п. Предпочтительный вариант осуществления включает в себя метилсульфанил, и т. п.
Предпочтительный вариант осуществления «алкилсульфанила» в составе Rx2 включает в себя метилсульфанил, этилсульфанил, и т. п.
Предпочтительный вариант осуществления «алкилсульфанила» в составе Rx3 включает в себя метилсульфанил, этилсульфанил, изобутилсульфанил, и т. п.
[0021]
«Алкенилсульфанил» означает сульфанильную группу, атом водорода которой заменен определенным выше «алкенилом». Примеры включают в себя винилсульфанил, аллилсульфанил, 1-пропенилсульфанил, 2-бутенилсульфанил, 2-пентенилсульфанил, 2-гексенилсульфанил, 2-гептенилсульфанил, 2-октенилсульфанил, и т. п.
[0022]
«Алкинилсульфанил» означает сульфанильную группу, атом водорода которой заменен определенным выше «алкинилом». Примеры включают в себя этинилсульфанил, 1-пропинилсульфанил, 2-пропинилсульфанил, 2-бутинилсульфанил, 2-пентинилсульфанил, 2-гексинилсульфанил, 2-гептинилсульфанил, 2-октинилсульфанил, и т. п.
[0023]
«Алкилкарбонил» означает карбонильную группу, к которой присоединен определенный выше «алкил». Примеры включают в себя метилкарбонил, этилкарбонил, пропилкарбонил, изопропилкарбонил, трет-бутилкарбонил, изобутилкарбонил, втор-бутилкарбонил, пентилкарбонил, изопентилкарбонил, гексилкарбонил, и т. п. Предпочтительный вариант осуществления «алкилкарбонила» включает в себя метилкарбонил, этилкарбонил, н-пропилкарбонил, и т. п.
Особенно предпочтительный вариант осуществления «алкилкарбонила» в составе R4 включает в себя метилкарбонил, и т. п.
[0024]
«Алкенилкарбонил» означает карбонильную группу, к которой присоединен определенный выше «алкенил». Примеры включают в себя винилкарбонил, пропенилкарбонил, и т. п.
[0025]
«Алкинилкарбонил» означает карбонильную группу, к которой присоединен определенный выше «алкинил». Примеры включают в себя этинилкарбонил, пропинилкарбонил, и т. п.
[0026]
«Циклоалкил» означает циклическую насыщенную углеводородную C3-C8-группу и циклическую насыщенную углеводородную группу, концденсированную с одним или с двумя 3-8-членным(и) кольцом(ами). Примеры циклического насыщенного C3-C8-карбоциклила включают в себя циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, и т. п. Особенно предпочтительные примеры включают в себя C3-C6-циклоалкил или C5-C6-циклоалкил. Кроме того, предпочтительным является C3-циклоалкил.
Конденсированное с циклической насыщенной углеводородной C3-C8-группой 3-8-членное кольцо включает в себя циклоалкановое кольцо (например, циклогексановое кольцо, циклопентановое кольцо, и т. п.), циклоалкеновое кольцо (например, циклогексеновое кольцо, циклопентеновое кольцо, и т. п.), неароматический гетероцикл (например, пиперидиновое кольцо, пиперазиновое кольцо, морфолиновое кольцо, и т. п.). В определенном выше кольце, связь(и) может(могут) быть присоединена(ы) к циклической насыщенной углеводородной C3-C8-группе.
Например, следующие группы также представлены в качестве примера циклоалкила и включены в термин «циклоалкил». Указанные группе могут быть замещены по любому(ым) произвольному(ым) положению(ям). Если циклоалкил является замещенным, то заместитель(и) на циклоалкиле может(могут) быть расположен(ы) либо на циклической насыщенной углеводородной C3-C8-группе, либо на 3-8-членном кольце, конденсированном с циклической насыщенной углеводородной C3-C8-группой.
[Формула 22]

[Формула 23]

[Формула 24]

Кроме того, «циклоалкил» включает в себя следующие группы с мостиковой связью или группы с формированием спиро-кольца.
[Формула 25]

[0027]
«Циклоалкил, замещенный карбокси» означает определенный выше «циклоалкил», замещенным одним или несколькими карбокси.
[0028]
«Циклоалкенил» означает циклическую ненасыщенную алифатическую углеводородную C3-C8-группу и циклическую ненасыщенную алифатическую углеводородную группу, концденсированную с одним или с двумя 3-8-членным(и) циклом(ами). «Циклическая ненасыщенная алифатическая углеводородная C3-C8-группа» предпочтительно означает, что циклическая ненасыщенная алифатическая углеводородная C3-C8-группа содержит от 1 до 3 двойных связей между атомом углерода и атом углерода в кольце. Конкретно, предпочтительным является циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклогексадиенил, и т. п., особенно предпочтительным является C5- или C6-циклоалкенил.
Кольцо, конденсированное с циклической ненасыщенной алифатической углеводородной C3-C8-группой, включает в себя карбоцикл (ароматический карбоцикл (например, бензольное кольцо, нафталиновое кольцо, и т. п.), циклоалкановое кольцо (например, циклогексановое кольцо, циклопентановое кольцо, и т. п.), циклоалкеновое кольцо (например, циклогексеновое кольцо, циклопентеновое кольцо, и т. п.), и т. п.), гетероцикл (ароматический гетероцикл (пиридиновое кольцо, пиримидиновое кольцо, пиррольное кольцо, имидазольное кольцо, и т. п.), неароматический гетероцикл (например, пиперидиновое кольцо, пиперазиновое кольцо, морфолиновое кольцо, и т. п.)).
В определенном выше кольце, связь(и) может(могут) быть присоединена(ы) к циклической ненасыщенной алифатической углеводородной C3-C8-группе.
Например, следующие группы также представлены в качестве примера циклоалкенила и включены в термин «циклоалкенил». Указанные группе могут быть замещены по любому(ым) произвольному(ым) положению(ям). Если циклоалкенил является замещенным, то заместитель(и) на циклоалкениле может(могут) быть расположен(ы) либо на циклической ненасыщенной алифатической углеводородной C3-C8-группе, либо на 3-8-членном кольце, конденсированном с циклической ненасыщенной алифатической углеводородной C3-C8-группой.
[Формула 26]

[Формула 27]

[Формула 28]

[Формула 29]

Кроме того, «циклоалкенил» также включает в себя следующую группу с формированием спиро-кольца:
[Формула 30]
[0029]
«Неароматический карбоциклил» включает в себя определенные выше «циклоалкил» и «циклоалкенил».
Примеры «неароматического карбоциклила» в составе Rx1, Rx2, Rx3, Rx4, Rx5 и Rx6 включают в себя циклопропил, циклобутил, циклопентил, циклогексил, и т. п. Предпочтительные примеры включают в себя циклопропил, циклобутил, и т. п.
Примеры «неароматического карбоциклила» в составе Rx1 включают в себя циклоалкил. Предпочтительные примеры включают в себя циклопропил, циклобутил, и т. п.
Примеры «неароматического карбоциклила» в составе Rx2 включают в себя циклоалкил. Предпочтительные примеры включают в себя циклопропил, циклобутил, и т. п.
Примеры «неароматического карбоциклила» в составе Rx3 включают в себя циклоалкил. Предпочтительные примеры включают в себя циклопропил, циклобутил, и т. п.
Примеры «неароматического карбоциклила» в составе Rx4 включают в себя циклоалкил. Предпочтительные примеры включают в себя циклопропил, циклобутил, и т. п.
[0030]
«Циклоалкан» означает циклический насыщенный C3-C8-углеводород и циклический насыщенный углеводород, конденсированный с одним или двумя 3-8-членными кольцами. Примеры циклической насыщенной C3-C8-углеводородной группы включают в себя циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклооктан. Особенно предпочтительным является C3-C6-циклоалкан.
Например, кольцо, конденсированное с циклической насыщенной C3-C8-углеводородной группой, включает в себя циклоалкановое кольцо (например, циклогексановое кольцо, циклопентановое кольцо, и т. п.), циклоалкеновое кольцо (например, циклогексеновое кольцо, циклопентеновое кольцо, и т. п.), неароматический гетероцикл (например, пиперидиновое кольцо, пиперазиновое кольцо, морфолиновое кольцо, и т. п.).
[0031]
«Циклоалкен» означает циклический ненасыщенный алифатический C3-C8-углеводород и циклический ненасыщенный алифатический углеводород, конденсированный с одним или двумя 3-8-членными кольцами. «Циклический ненасыщенный алифатический C3-C8-углеводород» предпочтительно означает, что циклический ненасыщенный алифатический C3-C8-углеводород содержит от 1 до 3 двойных связей между атомом углерода и атомом углерода в кольце. В частности, предпочтительным является циклопропен, циклобутен, циклопентен, циклогексен, циклогептен, циклогексадиен, и т. п. Особенно предпочтительным является C5- или C6-циклоалкен.
Кольцо, конденсированное с циклическим ненасыщенным алифатическим C3-C8-углеводородом включает в себя карбоцикл (ароматический карбоцикл (например, бензольное кольцо, нафталиновое кольцо, и т. п.), циклоалкановое кольцо (например, циклогексановое кольцо, циклопентановое кольцо, и т. п.), циклоалкеновое кольцо (например, циклогексеновое кольцо, циклопентеновое кольцо, и т. п.) и т. п.), гетероцикл (ароматический гетероцикл (пиридиновое кольцо, пиримидиновое кольцо, пиррольное кольцо, имидазольное кольцо, и т. п.), неароматический гетероцикл (например, пиперидиновое кольцо, пиперазиновое кольцо, морфолиновое кольцо, и т. п.)).
[0032]
«Неароматический карбоцикл» включает в себя определенные выше «циклоалкан» и «циклоалкен». В частности, предпочтительным является циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклооктан, циклопропен, циклобутен, циклопентен, циклогексен, циклогептен, циклогексадиен, и т. п.
Примеры «неароматического карбоцикла» в составе кольца A включают в себя циклоалкан, и т. п. Предпочтительным является циклобутан, циклогексан, и т. п.
[0033]
«Ароматический карбоциклил» означает моноциклический или полициклический ароматический карбоциклил и моноциклический или полициклический ароматический карбоциклил, конденсированный с одним или двумя 3-8-членными кольцами. Примеры «моноциклического или полициклического ароматического карбоциклила» включают в себя фенил, нафтил, антрил, фенантрил. Особенно предпочтительным является фенил.
Кольцо, конденсированное с моноциклическим или полициклическим ароматическим карбоциклилом, включает в себя неароматический карбоцикл (например, циклоалкановое кольцо (например, циклогексановое кольцо, циклопентановое кольцо, и т. п.), циклоалкеновое кольцо (например, циклогексеновое кольцо, циклопентеновое кольцо, и т. п.) и т. п.), неароматический гетероцикл (например, пиперидиновое кольцо, пиперазиновое кольцо, морфолиновое кольцо, и т. п.).
В определенном выше кольце, связи могут быть присоединены к моноциклическому или полициклическому ароматическому карбоциклу.
Например, следующие группы также представлены в качестве примера ароматического карбоциклила и включены в «ароматический карбоциклил». Указанные группы могут быть замещены по любому(ым) произвольному(ым) положению(ям). Если ароматический карбоциклил является замещенным, то заместитель(и) на ароматической карбоциклильной группе могут быть расположены либо на моноциклическом или полициклическом ароматическом карбоциклиле, либо на 3-8-членном кольце, конденсированном с моноциклической или полициклической ароматической карбоциклильной группой.
[Формула 31]
[Формула 32]

[0034]
Пример «6-членного ароматического карбоцикла» включает в себя бензольное кольцо.
Пример «ароматического карбоциклила» в составе Rx1 включает в себя фенил.
[0035]
«Конденсированный ароматический карбоциклил» означает полициклический ароматический карбоциклил, моноциклический или полициклический ароматический карбоциклил, конденсированный с одним или двумя 3-8-членными кольцами. Примеры моноциклического или полициклического ароматического карбоциклила включают в себя фенил, нафтил, антрил, фенантрил. Особенно предпочтительным примером является фенил.
[0036]
«Замещенный ароматический карбоциклил» включает в себя ароматический карбоциклил, замещенный оксо. «Замещенный конденсированный ароматический карбоциклил» включают в себя конденсированный ароматический карбоциклил замещенный оксо. «Ароматический карбоциклил, замещенный оксо» и «конденсированный ароматический карбоциклил, замещенный оксо» означают, что два атома водорода на 3-8-членном кольце, конденсированном с моноциклическим или полициклическим ароматическим карбоциклилом, составляющим ароматический карбоциклил, замещены группой =O.
В качестве примеров «ароматического карбоциклила, замещенного оксо» и «конденсированного ароматического карбоциклила, замещенный оксо» представлены следующие формулы:
[Формула 33]
 .
.
[0037]
«Ароматический гетероциклил» означает моноциклический или полициклический ароматический гетероциклил, содержащий в кольце один или несколько гетероатомов, произвольно выбранных из O, S и N, или моноциклическом или полициклическом ароматическом гетероциклиле, конденсированном с одним или двумя 3-8-членными кольцами, и включает в себя «моноциклический ароматический гетероциклил» и «конденсированный ароматический гетероциклил».
Особенно предпочтительными примерами «моноциклического ароматического гетероциклила» являются 5- или 6-членные ароматические гетероциклилы. Примеры «5-членного ароматического гетероциклила» включают в себя пирролил, имидазолил, пиразолил, тетразолил, изооксазолил, оксазолил, оксадиазолил, изотиазолил, тиазолил, тиадиазолил, фурил, тиенил, и т. п. Примеры «6-членного ароматического гетероциклила» включают в себя пиридил, пиридазинил, пиримидинил, пиразинил, триазолил, триазинил, и т. п.
Примеры кольца, конденсированного с моноциклическим ароматическим гетероциклилом, включают в себя циклоалкановое кольцо (например, циклогексановое кольцо, циклопентановое кольцо, и т. п.), циклоалкеновое кольцо (например, циклогексеновое кольцо, циклопентеновое кольцо, и т. п.), неароматический гетероцикл (например, пиперидиновое кольцо, пиперазиновое кольцо, морфолиновое кольцо, и т. п.), и т. п. В определенном выше кольце, связи могут быть присоединены к моноциклическому или конденсированному ароматическому гетероциклилу, содержащему в кольце один или несколько гетероатомов, произвольно выбранных из O, S и N.
Например, следующие группы также представлены в качестве примера ароматического гетероциклила и включены в «ароматический гетероциклил». Указанные группы могут быть замещены по любому(ым) произвольному(ым) положению(ям). Если ароматический гетероциклил является замещенным, то заместитель(и) на ароматическом гетероциклиле может(гут) быть расположен(ы) либо на моноциклическом или конденсированном ароматическом гетероциклиле, либо на 3-8-членном кольце, конденсированном с моноциклическим или конденсированным ароматическим гетероциклилом.
[Формула 34]
[Формула 35]

[0038]
Замещенный ароматический гетероциклил включает в себя ароматический гетероциклил, замещенный оксо. «Ароматический гетероциклил, замещенный оксо» означает, что два атома водорода, присоединенные к атому углерода на 3-8-членном кольце, конденсированном с моноциклическим или полициклическим ароматическим гетероциклом, составляющим ароматический гетероциклил, замещены группой =O.
В качестве примеров «ароматического гетероциклила, замещенного оксо» и «конденсированного ароматического гетероциклила, замещенный оксо» представлены следующие формулы:
[Формула 36]
 .
.
Особенно предпочтительными примерами «конденсированного ароматического гетероциклила» является ароматический гетероциклил, конденсированный с 5- или 6-членным кольцом. Примеры включают в себя бициклический ароматический гетероциклил: например, индолил, изоиндолил, индазолил, индолизинил, хинолинил, изохинолинил, циннолинил, фталазинил, хиназолинил, нафтилидинил, хиноксалинил, пуринил, птеридинил, бензимидазолил, бензизооксазолил, бензоксазолил, бензоксадиазолил, бензизотиазолил, бензотиазолил, бензотиадиазолил, бензофурил, изобензофурил, бензотиенил, бензотриазолил, имидазопиридил, триазолопиридил, имидазотиазолил, пиразинопиридазинил, оксазолопиридил, тиазолопиридил, и т. п.
Примеры «конденсированного ароматического гетероциклила» в составе R1 включают в себя индолил, изоиндолил, индазолил, индолизинил, бензимидазолил, бензизооксазолил, бензоксазолил, бензоксадиазолил, бензоизотиазолил, бензотиазолил, бензотиадиазолил, бензофурил, изобензофурил, бензотиенил, бензотриазолил, имидазопиридил, триазолопиридил, имидазотиазолил, пиразинопиридазинил, оксазолопиридил, тиазолопиридил, и т. п. Предпочтительным является индолил, бензимидазолил, бензизооксазолил, бензоксазолил, бензоксадиазолил, бензоизотиазолил, бензотиазолил, бензотиадиазолил, бензофурил, изобензофурил, бензотиенил, бензотриазолил, имидазопиридил, триазолопиридил, имидазотиазолил, пиридинопиридазинил, оксазолопиридил, тиазолопиридил, и т. п. Особенно предпочтительные примеры включают в себя бензимидазолил, бензоксазолил, бензтиазолил, имидазопиридил, имидазотиазолил, и т. п. Более предпочтительные примеры включают в себя бензимидазолил, имидазопиридил, и т. п.
Особенно предпочтительные варианты осуществления «конденсированного ароматического гетероциклила» в составе R1 включают в себя тетрабензоксазепинил, тетрагидроизохинолил, бензотиазолил, дигидробензотиазолил, дигидробензоизоксазолил, и т. п.
[0039]
«Неароматический гетероциклил» означает моноциклический неароматический гетероциклил, содержащий в кольце один или несколько гетероатомов, произвольно выбранных из O, S и N, и моноциклический неароматический гетероциклил, конденсированный с одним или двумя 3-8-членными кольцами (полициклические неароматические гетероциклильные группы).
Предпочтительными примерами «моноциклического неароматического гетероциклила» являются моноциклическая 3-8-членная неароматическая гетероциклильная группа, содержащая в кольце от 1 до 4 гетероатомов, произвольно выбранных из O, S и N. Конкретно, в качестве примера приводятся диоксанил, тииранил, оксиранил, оксатиоланил, азетидинил, тианил, пирролидинил, пирролинил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперидил, пиперидино, пиперазинил, пиперазино, морфолинил, морфолино, оксадиазинил, дигидропиридил, тиоморфолинил, тиоморфолино, тетрагидрофурил, тетрагидропиранил, тетрагидротиазолил, тетрагидроизотиазолил, оксазолидил, тиазолидил, оксетанил, тиазолидинил, тетрагидропиридил, дигидротиазолил, дигидрооксазинил, гексагидроазепинил, тетрагидродиазепинил, тетрагидропиридазинил, гексагидропиримидинил, диоксоланил, диоксазинил, азиридинил, диоксолинил, оксепанил, тиоланил, тиазинил, тиазинил, и т. п.
В качестве примера кольца, конденсированного с моноциклическим неароматическим гетероциклилом, содержащим в кольце один или несколько гетероатомов, произвольно выбранных из O, S и N, представлены, например, карбоцикл (ароматическое углеводородное кольцо (например, бензольное кольцо, нафталиновое кольцо, и т. п.), циклоалкановое кольцо (например, циклогексановое кольцо, циклопентановое кольцо, и т. п.), циклоалкеновое кольцо (например, циклогексеновое кольцо, циклопентеновое кольцо, и т. п.) и т. п.), гетероцикл (ароматический гетероцикл (пиридиновое кольцо, пиримидиновое кольцо, пиррольное кольцо, имидазольное кольцо, и т. п.), неароматический гетероцикл (например, пиперидиновое кольцо, пиперазиновое кольцо, морфолиновое кольцо, и т. п.).
В качестве примера полициклического неароматического гетероциклила, представлены, например, индолинил, изоиндолинил, хроманил, изохроманил, и т. п.
Если «неароматический гетероциклил» представляет собой полициклический неароматический гетероциклил, то связи могут быть присоединены к неароматическому гетероциклилу, содержащему в кольце один или несколько гетероатомов, произвольно выбранных из O, S и N. Например, следующие группы также включают в себя неароматический гетероциклил. Указанные группы могут быть замещены по любому(ым) произвольному(ым) положению(ям). Если неароматический гетероциклил является замещенным, то заместитель(и) на неароматическом гетероциклиле может(гут) быть расположен(ы) либо на моноциклическом неароматическом гетероциклиле, содержащем в кольце один или несколько гетероатомов, произвольно выбранных из O, S и N, либо на 3-8-членном кольце, конденсированном с моноциклической неароматической гетероциклильной группой.
[Формула 37]

[Формула 38]

[Формула 39]

[Формула 40]

«Неароматический гетероциклил» включает в себя кольцо, содержащее мостиковую связь, или кольцо, формирующее спирокольцо.
[Формула 41]

Примеры «неароматического гетероциклила» в составе Rx3 включают в себя азетидинил, и т. п.
[0040]
«Неароматический гетероцикл» означает моноциклический неароматический гетероцикл, содержащий в кольце один или несколько гетероатомов, произвольно выбранных из O, S и N, или моноциклический неароматический гетероцикл, конденсированный с одним или двумя 3-8-членными кольцами (полициклический неароматический гетероцикл).
Предпочтительными примерами «моноциклического неароматического гетероцикла» является моноциклический 3-8-членный неароматический гетероцикл, содержащий в кольце от 1 до 4 гетероатомов, произвольно выбранных из O, S и N, например, диоксан, тииран, оксиран, оксатиолан, азетидин, тиан, пирролидин, пирролин, имидазолидин, имидазолин, пиразолидин, пиразолин, пиперидин, пиперазин, морфолин, оксадиазин, дигидропиридин, тиоморфолин, тетрагидрофуран, тетрагидропиран, тетрагидротиазол, тетрагидроизотиазол, оксазолидин, тиазолидин, оксетан, тиазолидин, тетрагидропиридин, дигидротиазол, дигидрооксазин, гексагидроазепин, тетрагидродиазепин, тетрагидропиридазин, гексагидропиримидин, диоксолан, диоксазин, азиридин, диоксолин, оксепан, тиолан, тиазин, и т. п.
Примеры «неароматического гетероцикла» в составе кольца A включают в себя тетрагидрофуран, диоксолан. Предпочтительными примерами являются тетрагидрофуран, 1,3-диоксолан, и т. п.
[0041]
Применительно к определенным выше терминам «циклоалкил», «циклоалкенил», «неароматический карбоциклил», «ароматический карбоциклил», «ароматический гетероциклил» и «неароматический гетероциклил», «неароматический карбоцикл», «неароматический гетероцикл», «ароматический карбоцикл», «ароматический гетероцикл», «карбоцикл» и «гетероцикл», которые определены как «конденсированное кольцо», означают следующее. Если кольцо является замещенным, то кольцо может содержать заместитель на конденсированном кольце. «Неароматический карбоцикл» и «неароматический гетероцикл» могут быть замещены оксо.
«Неароматический карбоцикл» означает циклическое насыщенное C3-C8-углеводородное кольцо и циклическое ненасыщенное алифатическое C3-C8-углеводородное кольцо. Например, в качестве примера представлены циклогексановое кольцо, циклопентановое кольцо, циклогексеновое кольцо, циклопентеновое кольцо, и т. п.
«Неароматический гетероцикл» означает 3-8-членный неароматический гетероцикл, содержащий в кольце от 1 до 4 гетероатомов, произвольно выбранных из O, S и N. Например, в качестве примера представлены пиперидиновое кольцо, пиперазиновое кольцо, морфолиновое кольцо, и т. п.
«Ароматический карбоцикл» означает моноциклический или полициклический ароматический карбоцикл. Например, в качестве примера представлены бензольное кольцо, нафталиновое кольцо, и т. п.
«Ароматический гетероцикл» означает моноциклический или полициклический ароматический гетероцикл, содержащий в кольце один или несколько гетероатомов, произвольно выбранных из O, S и N. Например, в качестве примера представлены пиридиновое кольцо, пиримидиновое кольцо, пиррольное кольцо, имидазольное кольцо, и т. п.
«Карбоцикл» включает в себя определенные выше «неароматический карбоцикл» и «ароматический карбоцикл».
«Гетероцикл» включает в себя определенные выше «неароматический гетероцикл» и «ароматический гетероцикл».
[0042]
«Неароматический карбоциклилокси» означает определенный выше «неароматический карбоциклил», присоединенный к атому кислорода. Например, в качестве примера представлены циклопропилокси, циклогексилокси, циклогексенилокси, циклопропенилокси, циклобутенилокси, циклопентенилокси, циклогексенилокси, циклогептенилокси, циклогексадиенилокси, и т. п.
Примеры «неароматического карбоциклилокси» в составе Rx3 включают в себя циклоалкилокси. Предпочтительными являются циклопропилокси, циклобутилокси, и т. п.
[0043]
«Ароматический карбоциклилокси» означает определенный выше «ароматический карбоциклил», присоединенный к атому кислорода. Например, в качестве примера представлены фенилокси, нафтилокси и т. п.
[0044]
«Ароматический гетероциклилокси» означает определенный выше «ароматический гетероциклил», присоединенный к атому кислорода. Например, в качестве примера представлены пиридилокси, оксазолилокси и т. п.
Примеры «ароматического гетероциклилокси» в составе Rx3 включают в себя пиримидилокси.
[0045]
«Неароматический гетероциклилокси» означает определенный выше «неароматический гетероциклил», присоединенный к атому кислорода. Например, в качестве примера представлены пиперидинокси, тетрагидрофурилокси, и т. п.
Примеры «неароматического гетероциклилокси» в составе Rx3 включают в себя оксетанилокси, и т. п.
[0046]
«Неароматический карбоциклилкарбонил» означает определенный выше «циклоалкил» или «циклоалкенил», присоединенный к карбонильной группе. Например, в качестве примера представлены циклопропилкарбонил, циклогексилкарбонил, циклогексенилкарбонил, циклогексенилкарбонил, и т. п.
[0047]
«Ароматический карбоциклилкарбонил» означает определенный выше «ароматический карбоциклил», присоединенный к карбонильной группе. Например, в качестве примера представлены фенилкарбонил, нафтилкарбонил, и т. п.
[0048]
«Ароматический гетероциклилкарбонил» означает определенный выше «ароматический гетероциклил», присоединенный к карбонильной группе. Например, в качестве примера представлены пиридилкарбонил, пиразолилкарбонил, оксазолилкарбонил, изоксазолилкарбонил, фурилкарбонил, и т. п.
Примеры «ароматического гетероциклилкарбонил» в составе R4 включают в себя пиразолилкарбонил, и т. п.
[0049]
«Неароматический гетероциклилкарбонил» означает определенный выше «неароматический гетероциклил», присоединенный к карбонильной группе. Например, в качестве примера представлены оксетанилкарбонил, пиперидинилкарбонил, тетрагидрофурилкарбонил, и т. п.
[0050]
«Алкилсульфонил» означает описанный выше «алкил», присоединенный к сульфонильной группе. Например, в качестве примера представлены метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, трет-бутилсульфонил, изобутилсульфонил, втор-бутилсульфонил, и т. п.
Предпочтительный вариант осуществления «алкилсульфонила» включает в себя метилсульфонил, этилсульфонил.
Примеры «алкилсульфонила» в составе RX3 включают в себя изобутилсульфонил, и т. п.
Примеры «алкилсульфонила» в составе R4 включают в себя метилсульфонил, и т. п.
[0051]
«Алкенилсульфонил» означает определенный выше «алкенил», присоединенный к сульфонильной группе. Например, в качестве примера представлены этиленилсульфонил, пропенилсульфонил, и т. п.
[0052]
«Алкинилсульфонил» означает определенный выше «алкинил», присоединенный к сульфонильной группе. Например, в качестве примера представлены этинилсульфонил, пропинилсульфонил, и т. п.
[0053]
«Неароматический карбоциклилсульфонил» означает определенный выше «неароматический карбоциклил», присоединенный к сульфонильной группе. Например, в качестве примера представлены циклопропилсульфонил, циклопентанилсульфонил, циклогексилсульфонил, циклопропенилсульфонил, циклопентенилсульфонил, циклогексенилсульфонил, и т. п.
[0054]
«Ароматический карбоциклилсульфонил» означает определенный выше «ароматический карбоциклил», присоединенный к сульфонильной группе. Например, в качестве примера представлены фенилсульфонил, нафтилсульфонил, и т. п.
[0055]
«Ароматический гетероциклилсульфонил» означает определенный выше «ароматический гетероциклил», присоединенный к сульфонильной группе. Например, в качестве примера представлены пиридилсульфонил, оксазолилсульфонил, и т. п.
[0056]
«Неароматический гетероциклилсульфонил» означает определенный выше «неароматический гетероциклил», присоединенный к сульфонильной группе. Например, в качестве примера представлены пиперидинилсульфонил, тетрагидрофурилсульфонил, и т. п.
[0057]
«Алкенилоксикарбонил» означает определенный выше «алкенилокси», присоединенный к карбонильной группе. Например, в качестве примера представлены этиленилоксикарбонил, пропенилоксикарбонил, и т. п.
[0058]
«Алкинилоксикарбонил» означает определенный выше «алкинилокси», присоединенный к карбонильной группе. Например, в качестве примера представлены этинилоксикарбонил, пропинилоксикарбонил, и т. п.
[0059]
«Ароматический карбоциклилоксикарбонил» означает определенный выше «ароматический карбоциклилокси», присоединенный к карбонильной группе. Например, в качестве примера представлены фенилоксикарбонил, нафтилоксикарбонил, и т. п.
[0060]
«Неароматический карбоциклилоксикарбонил» означает определенный выше «неароматический карбоциклилокси», присоединенный к карбонильной группе. Например, в качестве примера представлены циклопропилоксикарбонил, циклогексилоксикарбонил, циклогексенилоксикарбонил, циклопропенилоксикарбонил, и т. п.
[0061]
«Ароматический гетероциклилоксикарбонил» означает определенный выше «ароматический гетероциклилокси», присоединенный к карбонильной группе. Например, в качестве примера представлены пиридилоксикарбонил, оксазолилоксикарбонил, и т. п.
[0062]
«Неароматический гетероциклилоксикарбонил» означает определенный выше «неароматический гетероциклилокси», присоединенный к карбонильной группе. Например, в качестве примера представлены пиперидиноксикарбонил, тетрагидрофурилоксикарбонил, и т. п.
[0063]
«Неароматический карбоциклилсульфанил» означает сульфанильную группу, атом водорода которой заменен определенным выше «неароматическим карбоциклилом». Например, в качестве примера представлены циклопропилсульфанил, циклогексилсульфанил, циклогексенилсульфанил, циклопропенилсульфанил, циклобутенилсульфанил, циклопентенилсульфанил, циклогептенилсульфанил, циклогексадиенилсульфанил, и т. п.
[0064]
«Ароматический карбоциклилсульфанил» означает сульфанильную группу, атом водорода которой заменен определенным выше «ароматическим карбоциклилом». Например, в качестве примера представлены фенилсульфанил, нафтилсульфанил, и т. п.
[0065]
«Ароматический гетероциклилсульфанил» означает сульфанильную группу, атом водорода которой заменен определенным выше «ароматическим гетероциклилом». Например, в качестве примера представлены пиридилсульфанил, оксазолилсульфанил, и т. п.
[0066]
«Неароматический гетероциклилсульфанил» означает сульфанильную группу, атом водорода которой заменен определенным выше «неароматическим гетероциклилом». Например, в качестве примера представлены пиперидинилсульфанил, тетрагидрофурилсульфанил, и т. п.
[0067]
«Алкилсульфинил» означает описанный выше «алкил», присоединенный к сульфинильной группе. Например, в качестве примера представлены метилсульфинил, этилсульфинил, н-пропилсульфинил, изопропилсульфинил, и т. п.
[0068]
«Алкенилсульфинил» означает определенный выше «алкенил», присоединенный к сульфинильной группе. Например, в качестве примера представлены этиленилсульфинил, пропенилсульфинил, и т. п.
[0069]
«Алкинилсульфинил» означает определенный выше «алкинил», присоединенный к сульфинильной группе. Например, в качестве примера представлены этинилсульфинил, пропинилсульфинил, и т. п.
[0070]
«Неароматический карбоциклилсульфинил» означает определенный выше «неароматический карбоциклил», присоединенный к сульфинильной группе. Например, в качестве примера представлены циклопропилсульфинил, циклогексилсульфинил, циклогексенилсульфинил, циклопропенилсульфинил, циклобутенилсульфинил, циклопентенилсульфинил, циклогептенилсульфинил, циклогексадиенилсульфинил, и т. п.
[0071]
«Ароматический карбоциклилсульфинил» означает определенный выше «ароматический карбоциклил», присоединенный к сульфинильной группе. Например, в качестве примера представлены фенилсульфинил, нафтилсульфинил, и т. п.
[0072]
«Ароматический гетероциклилсульфинил» означает определенный выше «ароматический гетероциклил», присоединенный к сульфинильной группе. Например, в качестве примера представлены пиридилсульфинил, оксазолилсульфинил, и т. п.
[0073]
«Неароматический гетероциклилсульфинил» означает определенный выше «неароматический гетероциклил», присоединенный к сульфинильной группе. Например, в качестве примера представлены пиперидинилсульфинил, тетрагидрофурилсульфинил, и т. п.
[0074]
«Аминосульфинил» означает аминогруппу, присоединенную к сульфинильной группе.
[0075]
«Алкилсульфонилокси» означает определенный выше «алкилсульфонил», присоединенный к атому кислорода. Например, в качестве примера представлены метилсульфонилокси, этилсульфонилокси, пропилсульфонилокси, изопропилсульфонилокси, трет-бутилсульфонилокси, изобутилсульфонилокси, втор-бутилсульфонилокси и т. п.
Предпочтительный вариант осуществления «алкилсульфонилокси» включает в себя метилсульфонилокси, этилсульфонилокси, и т. п.
[0076]
«Алкенилсульфонилокси» означает определенный выше «алкенилсульфонил», присоединенный к атому кислорода. Например, в качестве примера представлены этиленилсульфонилокси, пропенилсульфонилокси и т. п.
[0077]
«Алкинилсульфонилокси» означает определенный выше «алкинилсульфонил», присоединенный к атому кислорода. Например, в качестве примера представлены этинилсульфонилокси, пропинилсульфонилокси и т. п.
[0078]
«Неароматический карбоциклилсульфонилокси» означает определенный выше «неароматический карбоциклилсульфонил», присоединенный к атому кислорода. Например, в качестве примера представлены циклопропилсульфонилокси, циклогексилсульфонилокси, циклогексенилсульфонилокси, циклопропенилсульфонилокси и т. п.
[0079]
«Ароматический карбоциклилсульфонилокси» означает определенный выше «ароматический карбоциклилсульфонил», присоединенный к атому кислорода. Например, в качестве примера представлены фенилсульфонилокси, нафтилсульфонилокси и т. п.
[0080]
«Ароматический гетероциклилсульфонилокси» означает определенный выше «ароматический гетероциклилсульфонил», присоединенный к атому кислорода. Например, в качестве примера представлены пиридилсульфонилокси, оксазолилсульфонилокси и т. п.
[0081]
«Неароматический гетероциклилсульфонилокси» означает определенный выше «неароматический гетероциклилсульфонил», присоединенный к атому кислорода. Например, в качестве примера представлены пиперидинилсульфонилокси, тетрагидрофурилсульфонилокси и т. п.
[0082]
«Алкилкарбонилокси» означает определенный выше «алкилкарбонил», присоединенный к атому кислорода. Примеры «алкилкарбонилокси» включают в себя метилкарбонилокси, этилкарбонилокси, пропилкарбонилокси, изопропилкарбонилокси, трет-бутилкарбонилокси, изобутилкарбонилокси, втор-бутилкарбонилокси, и т. п.
Предпочтительный вариант осуществления «алкилкарбонилокси» включает в себя метилкарбонилокси, этилкарбонилокси, и т. п.
[0083]
«Алкенилкарбонилокси» означает определенный выше «алкенилкарбонил», присоединенный к атому кислорода. Например, в качестве примера представлены этиленилкарбонилокси, пропенилкарбонилокси и т. п.
[0084]
«Алкинилкарбонилокси» означает определенный выше «алкинилкарбонил», присоединенный к атому кислорода. Например, в качестве примера представлены этинилкарбонилокси, пропинилкарбонилокси и т. п.
[0085]
«Неароматический карбоциклилкарбонилокси» означает определенный выше «неароматический карбоциклилкарбонил», присоединенный к атому кислорода. Примеры «циклоалкилкарбонилокси» включают в себя циклопропилкарбонилокси, циклогексилкарбонилокси, циклогексенилкарбонилокси, и т. п.
[0086]
«Ароматический карбоциклилкарбонилокси» означает определенный выше «ароматический карбоциклилкарбонил», присоединенный к атому кислорода. Примеры «ароматического карбоциклилкарбонилокси» включают в себя фенилкарбонилокси, нафтилкарбонилокси, и т. п.
[0087]
«Ароматический гетероциклилкарбонилокси» означает определенный выше «ароматический гетероциклилкарбонил», присоединенный к атому кислорода. Примеры «ароматического гетероциклилкарбонилокси» включают в себя пиридилкарбонилокси, оксазолилкарбонилокси и т. п.
[0088]
«Неароматический гетероциклилкарбонилокси» означает определенный выше «неароматический гетероциклилкарбонил», присоединенный к атому кислорода. Примеры «неароматического гетероциклилкарбонилокси» включают в себя пиперидинилкарбонилокси, тетрагидрофурилкарбонилокси и т. п.
[0089]
«Алкилоксикарбонил» означает определенный выше «алкилокси», присоединенный к карбонильной группе. Примеры «алкилоксикарбонила» включают в себя метилоксикарбонил, этилоксикарбонил, пропилоксикарбонил, изопропилоксикарбонил, трет-бутилоксикарбонил, изобутилоксикарбонил, втор-бутилоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил, гексилоксикарбонил, и т. п. Предпочтительный вариант осуществления «алкилоксикарбонил» включает в себя метилоксикарбонил, этилоксикарбонил, пропилоксикарбонил, и т. п.
[0090]
«Алкенилоксикарбонил» означает определенный выше «алкенилокси», присоединенный к карбонильной группе. Примеры «алкенилоксикарбонил» включают в себя этиленилоксикарбонил, пропенилоксикарбонил, и т. п.
[0091]
«Алкинилоксикарбонил» означает определенный выше «алкинилокси», присоединенный к карбонильной группе. Примеры «алкинилоксикарбонила» включают в себя этинилоксикарбонил, пропинилоксикарбонил, и т. п.
[0092]
«Неароматический карбоциклилоксикарбонил» означает определенный выше «неароматический карбоциклилокси», присоединенный к карбонильной группе. Например, в качестве примера представлены циклопропилоксикарбонил, циклопентилоксикарбонил, циклогексилоксикарбонил, циклопропенилоксикарбонил, циклопентенилоксикарбонил, циклогексенилоксикарбонил, и т. п.
[0093]
«Ароматический карбоциклилоксикарбонил» означает определенный выше «ароматический карбоциклилокси», присоединенный к карбонильной группе. Например, в качестве примера представлены фенилоксикарбонил, нафтилоксикарбонил, и т. п.
[0094]
«Ароматический гетероциклилоксикарбонил» означает определенный выше «ароматический гетероциклилокси», присоединенный к карбонильной группе. Например, в качестве примера представлены пиридилоксикарбонил, оксазолилоксикарбонил, и т. п.
[0095]
«Неароматический гетероциклилоксикарбонил» означает определенный выше «неароматический гетероциклилокси», присоединенный к карбонильной группе. Например, в качестве примера представлены пиперидиноксикарбонил, тетрагидрофурилоксикарбонил, и т. п.
[0096]
«Алкилкарбонилсульфанил» означает определенный выше «алкилкарбонил», присоединенный к атому серы. Например, в качестве примера представлены метилкарбонилсульфанил, этилкарбонилсульфанил, н-пропилкарбонилсульфанил, изопропилкарбонилсульфанил, н-бутилкарбонилсульфанил, трет-бутилкарбонилсульфанил, изобутилкарбонилсульфанил, втор-бутилкарбонилсульфанил, пентилкарбонилсульфанил, изопентилкарбонилсульфанил, гексилкарбонилсульфанил, и т. п. Предпочтительный вариант осуществления «алкилкарбонилсульфанила» включает в себя метилкарбонилсульфанил, этилкарбонилсульфанил, пропилкарбонилсульфанил, изопропилкарбонилсульфанил, трет-бутилкарбонилсульфанил, изобутилкарбонилсульфанил, втор-бутилкарбонилсульфанил, и т. п.
[0097]
«Галогеналкил» означает определенный выше «алкил», один или несколько произвольных атомов водорода которого заменены определенным выше «галогеном». Например, в качестве примера представлены монофторметил, монофторэтил, монофторпропил, 2,2,3,3,3-пентафторпропил, монохлорметил, трифторметил, трихлорметил, 2,2,2-трифторэтил, 2,2,2-трихлорэтил, 1,2-дибромэтил, 1,1,1-трифторпропан-2-ил, и т. п.
[0098]
«Галогеналкилкарбонил» означает определенный выше «галогеналкил», присоединенный к карбонильной группе. Например, в качестве примера представлены монофторметилкарбонил, дифторметилкарбонил, монофторэтилкарбонил, монофторпропилкарбонил, 2,2,3,3,3-пентафторпропилкарбонил, монохлорметилкарбонил, трифторметилкарбонил, трихлорметилкарбонил, 2,2,2-трифторэтилкарбонил, 2,2,2-трихлорэтилкарбонил, 1,2-дибромэтилкарбонил, 1,1,1-трифторпропан-2-илкарбонил, и т. п.
[0099]
«Галогеналкенил» означает определенный выше «алкенил», один или несколько произвольных атомов водорода которого заменены определенным выше «галогеном».
[0100]
«Гидроксиалкил» означает определенный выше «алкил», один или несколько произвольных атомов водорода которого заменены «гидроксилом».
[0101]
«Триалкилсилил» означает атом кремния, присоединенный к определенным выше трем «алкильным» группам. Три алкильные группы могут быть одинаковыми или различными. Например, в качестве примера представлены триметилсилил, триэтилсилил, трет-бутилдиметилсилил, триизопропилсилил, и т. п.
[0102]
«Триалкилсилилокси» означает определенный выше «триалкилсилил», присоединенный к атому кислорода. Например, в качестве примера представлены триметилсилилокси, триэтилсилилокси, трет-бутилдиметилсилилокси, триизопропилсилилокси и т. п.
[0103]
«Цианоалкил» означает определенный выше «алкил», один или несколько произвольных атомов которого замещены циано. Например, в качестве примера представлен цианометил, и т. п.
[0104]
«Цианоалкилокси» означает определенный выше «цианоалкил», присоединенный к атому кислорода. Например, в качестве примера представлен цианометилокси и т. п.
[0105]
«Галогеналкилокси» означает определенный выше «галогеналкил», присоединенный к атому кислорода. Например, в качестве примера представлены монофторметилокси, монофторэтилокси, трифторметилокси, трихлорметилокси, трифторэтилокси, трихлорэтилокси и т. п.
Предпочтительный вариант осуществления «галогеналкилокси» включает в себя трифторметилокси, трихлорметилокси, и т. п.
[0106]
«Карбамоилалкилкарбонил» означает определенный выше «алкилкарбонил», замещенный карбамоилом. Например, в качестве примера представлены карбамоилметилкарбонил, карбамоилэтилкарбонил, и т. п.
[0107]
«Моноалкиламино» означает аминогруппу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкилом». Примеры «моноалкиламино» включают в себя метиламино, этиламино, и т. п.
[0108]
«Диалкиламино» означает аминогруппу, в которой два атома водорода, присоединенные к атому азота, заменены определенным выше «алкилом». Две алкильные группы могут быть одинаковыми или разными. Например, в качестве примера представлены диметиламино, диэтиламино, N,N-диизопропиламино, N-метил-N-этиламино, N-изопропил-N-этиламино и т. п.
Предпочтительный вариант осуществления «диалкиламино» включает в себя диметиламино, диэтиламино, и т. п.
[0109]
«Моноалкилкарбониламино» означает аминогруппу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкилкарбонилом». Например, в качестве примера представлены метилкарбониламино, этилкарбониламино, пропилкарбониламино, изопропилкарбониламино, трет-бутилкарбониламино, изобутилкарбониламино, втор-бутилкарбониламино и т. п.
Предпочтительный вариант осуществления «моноалкилкарбониламино» включает в себя метилкарбониламино, этилкарбониламино, и т. п.
[0110]
«Диалкилкарбониламино» означает аминогруппу, в которой два атома водорода, присоединенные к атому азота, заменены определенным выше «алкилкарбонилом». Две алкилкарбонильные группы могут быть одинаковыми или разными. Например, в качестве примера представлены диметилкарбониламино, диэтилкарбониламино, N,N-диизопропилкарбониламино и т. п.
Предпочтительный вариант осуществления «диалкилкарбониламино» включает в себя диметилкарбониламино, диэтилкарбониламино, и т. п.
[0111]
«Моноалкилоксикарбониламино» означает аминогруппу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкилоксикарбонилом». Предпочтительный вариант осуществления «моноалкилоксикарбониламино» включает в себя метилоксикарбониламино, этилоксикарбониламино, и т. п.
[0112]
«Диалкилоксикарбониламино» означает аминогруппу, в которой два атома водорода, присоединенные к атому азота, заменены определенным выше «алкилоксикарбонилом». Две алкилоксикарбонильные группы могут быть одинаковыми или разными.
[0113]
«Моноалкилсульфониламино» означает аминогруппу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкилсульфонилом». Например, в качестве примера представлены метилсульфониламино, этилсульфониламино, пропилсульфониламино, изопропилсульфониламино, трет-бутилсульфониламино, изобутилсульфониламино, втор-бутилсульфониламино и т. п.
Предпочтительный вариант осуществления «моноалкилсульфониламино» включает в себя метилсульфониламино, этилсульфониламино, и т. п.
[0114]
«Диалкилсульфониламино» означает аминогруппу, в которой два атома водорода, присоединенные к атому азота, заменены определенным выше «алкилсульфонилом». Две алкилсульфонильные группы могут быть одинаковыми или разными. Например, в качестве примера представлены диметилсульфониламино, диэтилсульфониламино, N,N-диизопропилсульфониламино и т. п.
Предпочтительный вариант осуществления «диалкилсульфониламино» включает в себя диметилсульфониламино, диэтилсульфониламино, и т. п.
[0115]
«Алкилимино» означает иминогруппу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкилом». Например, в качестве примера представлены метилимино, этилимино, н-пропилимино, изопропилимино и т. п.
[0116]
«Алкенилимино» означает иминогруппу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкенилом». Например, в качестве примера представлены этиленилимино, пропенилимино и т. п.
[0117]
«Алкинилимино» означает иминогруппу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкинилом». Например, в качестве примера представлены этинилимино, пропинилимино и т. п.
[0118]
«Алкилкарбонилимино» означает иминогруппу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкилкарбонилом». Например, в качестве примера представлены метилкарбонилимино, этилкарбонилимино, н-пропилкарбонилимино, изопропилкарбонилимино и т. п.
[0119]
«Алкенилкарбонилимино» означает иминогруппу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкенилкарбонилом». Например, в качестве примера представлены этиленилкарбонилимино, пропенилкарбонилимино и т. п.
[0120]
«Алкинилкарбонилимино» означает иминогруппу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкинилкарбонилом». Например, в качестве примера представлены этинилкарбонилимино, пропинилкарбонилимино и т. п.
[0121]
«Алкилоксиимино» означает иминогруппу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкилокси». Например, в качестве примера представлены метилоксиимино, этилоксиимино, н-пропилоксиимино, изопропилоксиимино, и т. п.
[0122]
«Алкенилоксиимино» означает иминогруппу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкенилокси». Например, в качестве примера представлены этиленилоксиимино, пропенилоксиимино, и т. п.
[0123]
«Алкинилоксиимино» означает иминогруппу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкинилокси». Например, в качестве примера представлены этинилоксиимино, пропинилоксиимино, и т. п.
[0124]
«Моноалкилкарбамоил» означает карбамоильную группу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкилом». Например, метилкарбамоил, этилкарбамоил, и т. п. в качестве примера представлены.
[0125]
«Моноалкилкарбамоилалкилокси» означает определенный выше «алкилокси», замещенный одним или несколькими определенными выше «моноалкилкарбамоилами». Например, в качестве примера представлены метилкарбамоилметилокси и т. п.
[0126]
«Моно(гидроксиалкил)карбамоил» означает определенный выше «моноалкилкарбамоил», произвольные атомы водорода которого заменены гидроксильной группой. Например, в качестве примера представлены гидроксиметилкарбамоил, гидроксиэтилкарбамоил, и т. п.
[0127]
«Диалкилкарбамоил» означает карбамоильную группу, в которой два атома водорода, присоединенные к атому азота, заменены определенным выше «алкилом». Две алкильные группы могут быть одинаковыми или разными. Например, в качестве примера представлены диметилкарбамоил, диэтилкарбамоил, и т. п.
[0128]
«Алкилоксикарбонилалкил» означает определенный выше «алкил», замещенный одним или несколькими определенными выше «алкилоксикарбонилами».
[0129]
«Моноалкилоксикарбонилалкилкарбамоил» означает карбамоильную группу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкилоксикарбонилалкилом». Например, в качестве примера представлены метилоксикарбонилметилкарбамоил, этилоксикарбонилметилкарбамоил, и т. п.
[0130]
«Диалкилоксикарбонилалкилкарбамоил» означает карбамоильную группу, в которой два атома водорода, присоединенные к атому азота, заменены определенным выше «алкилоксикарбонилалкилом».
[0131]
«Карбоксиалкил» означает определенный выше «алкил», замещенный одним или несколькими определенными выше «карбокси».
[0132]
«Карбоксиалкилкарбамоил» означает карбамоильную группу, в которой один или несколько атомов водорода, присоединенных к атому азота, заменены определенным выше «карбоксиалкилом». Например, в качестве примера представлен карбоксиметилкарбамоил, и т. п.
[0133]
«Диалкиламиноалкил» означает определенный выше «алкил», замещенный одним или несколькими определенными выше «диалкиламино». Например, в качестве примера представлены диметиламинометил, диметиламиноэтил, и т. п.
[0134]
«Моно(диалкиламиноалкил)карбамоил» означает карбамоильную группу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «диалкиламиноалкилом». Например, в качестве примера представлены диметиламинометилкарбамоил, диметиламиноэтилкарбамоил, и т. п.
[0135]
«Ди(диалкиламиноалкил)карбамоил» означает карбамоильную группу, в которой два атома водорода, присоединенные к атому азота, заменены определенным выше «диалкиламиноалкилом». Например, в качестве примера представлены ди(метилоксикарбонилметил)карбамоил, ди(этилоксикарбонилметил)карбамоил, и т. п.
[0136]
«Неароматический карбоциклилкарбамоил» означает карбамоильную группу, в которой один или несколько атомов водорода, присоединенных к атому азота, заменены определенным выше «неароматическим карбоциклилом». Например, в качестве примера представлен циклопропилкарбамоил, и т. п.
[0137]
«Неароматический гетероциклилкарбамоил» означает карбамоильную группу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «неароматическим гетероциклилом». Примеры включают в себя группу, представленную следующей формулой:
[Формула 42]
 .
.
[0138]
«Моноалкилоксикарбамоил» означает карбамоильную группу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкилокси». Например, в качестве примера представлен метилоксикарбамоил, и т. п.
[0139]
«Диалкилоксикарбамоил» означает карбамоильную группу, в которой два атома водорода, присоединенных к атому азота, заменены определенным выше «алкилокси». Например, в качестве примера представлен ди(метилокси)карбамоил, и т. п.
[0140]
«Моноалкилсульфамоил» означает сульфамоильную группу, в которой один атом водорода, присоединенный к атому азота, заменен определенным выше «алкил». Например, в качестве примера представлены метилсульфамоил, этилсульфамоил, и т. п.
[0141]
«Диалкилсульфамоил» означает сульфамоильную группу, в которой два атома водорода, присоединенные к атому азота, заменены определенным выше «алкил». Две алкильные группы могут быть одинаковыми или разными. Например, в качестве примера представлены диметилсульфамоил, диэтилсульфамоил, и т. п.
[0142]
«Ароматический карбоциклилалкил» означает определенный выше «алкил», замещенный одним или несколькими определенными выше «ароматическими карбоциклилами». Например, в качестве примера представлены бензил, фенэтил, фенилпропил, бенгидрил, тритил, нафтилметил, группа, представленная следующей формулой:
[Формула 43]
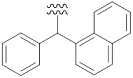 , и т. п.
, и т. п.
Предпочтительный вариант осуществления «ароматического карбоциклилалкила» включает в себя бензил, фенэтил, бензгидрил, и т. п.
[0143]
«Циклоалкилалкил» означает определенный выше «алкил», замещенный одним или несколькими определенными выше «циклоалкилами». «Циклоалкилалкил» включает в себя «циклоалкилалкил», алкильная часть которого дополнительно замещена определенным выше «ароматическим карбоциклилом». Например, в качестве примера представлены циклопентилметил, циклогексилметил, группа, представленная следующей формулой:
[Формула 44]
 , и т. п.
, и т. п.
[0144]
«Циклоалкенилалкил» означает определенный выше «алкил», замещенный одним или несколькими определенными выше «циклоалкенилами». «Циклоалкенилалкил» включает в себя «циклоалкенилалкил», алкильная часть которого дополнительно замещена определенным выше «ароматическим карбоциклилом». Например, в качестве примера представлены циклопропенилметил, циклобутенилметил, циклопентенилметил, циклогексенилметил, и т. п.
[0145]
«Ароматический гетероциклилалкил» означает определенный выше «алкил», замещенный одним или несколькими определенными выше «ароматическими карбоциклилами». «Ароматический гетероциклилалкил» включает в себя «ароматический гетероциклилалкил», алкильная часть которого дополнительно замещена определенным выше «ароматическим карбоциклилом» и/или «неароматическим карбоциклилом». Например, в качестве примера представлены пиридилметил, фуранилметил, имидазолилметил, индолилметил, бензотиофенилметил, оксазолилметил, изоксазолилметил, тиазолилметил, изотиазолилметил, пиразолилметил, изопиразолилметил, пирролидинилметил, бензоксазолилметил, группа, представленная следующей формулой:
[Формула 45]
 , и т. п.
, и т. п.
[0146]
«Неароматический гетероциклилалкил» означает определенный выше «алкил», замещенный одним или несколькими определенными выше «неароматическими гетероциклилами». «Неароматический гетероциклилалкил» включает в себя «неароматический гетероциклилалкил», алкильная часть которого дополнительно замещена определенным выше «ароматическим карбоциклилом», «неароматическим карбоциклилом» и/или «ароматическим гетероциклилом». Например, в качестве примера представлены тетрагидропиранилметил, морфолинилэтил, пиперидинилметил, пиперазинилметил, группа, представленная следующей формулой:
[Формула 46]
 , и т. п.
, и т. п.
[0147]
«Неароматический гетероциклилалкилкарбамоил» означает карбамоильную группу, в которой один или два атома водорода, присоединенные к атому азота, заменены одним или двумя определенными выше «неароматическими гетероциклилалкилами». Например, в качестве примера представлена группа, представленная следующей формулой:
[Формула 47]
 .
.
[0148]
«Ароматический карбоциклилалкилокси» означает определенный выше «алкилокси», замещенный одним или несколькими определенными выше «ароматическими карбоциклами». Например, в качестве примера представлены бензилокси, фенэтилокси, фенилпропинилокси, бензгидрилокси, тритилокси, нафтилметилокси, группа, представленная следующей формулой:
[Формула 48]
 , и т. п.
, и т. п.
[0149]
«Неароматический карбоциклилалкилокси» означает определенный выше «алкилокси», замещенный одним или несколькими определенными выше «неароматическими карбоциклилами». «Неароматический карбоциклилалкилокси» включает в себя «неароматический карбоциклилалкилокси», алкильная часть которого дополнительно замещены определенным выше «ароматическим карбоциклилом». Например, в качестве примера представлены циклопропилметилокси, циклобутилметилокси, циклопентилметилокси, циклогексилметилокси, циклопропилметилокси, циклобутилметилокси, циклопентилметилокси, циклогексилметилокси, группа, представленная следующей формулой:
[Формула 49]
 , и т. п.
, и т. п.
[0150]
«Ароматический гетероциклилалкилокси» означает определенный выше «алкилокси», замещенный одним или несколькими определенными выше «ароматическими гетероциклилами». «Ароматический гетероциклилалкилокси» включает в себя «ароматический гетероциклилалкилокси», алкильная часть которого дополнительно замещена определенным выше «ароматическим карбоциклилом» и/или «неароматическим карбоциклилом». Например, в качестве примера представлены пиридилметилокси, фуранилметилокси, имидазолилметилокси, индолилметилокси, бензотиофенилметилокси, оксазолилметилокси, изоксазолилметилокси, тиазолилметилокси, изотиазолилметилокси, пиразолилметилокси, изопиразолилметилокси, пирролидинилметилокси, бензоксазолилметилокси, группа, представленная следующей формулой:
[Формула 50]
 , и т. п.
, и т. п.
[0151]
«Неароматический гетероциклилалкилокси» означает определенный выше «алкилокси», замещенный одним или несколькими определенными выше «неароматическими гетероциклилами». «Неароматический гетероциклилалкилокси» включает в себя «неароматический гетероциклилалкилокси», алкильная часть которого дополнительно замещена определенным выше «ароматическим карбоциклилом», «неароматическим карбоциклилом» и/или «ароматическим гетероциклилом». Например, в качестве примера представлены тетрагидропиранилметилокси, морфолинилэтилокси, пиперидинилметилокси, пиперазинилметилокси, группа, представленная следующей формулой:
[Формула 51]
 , и т. п.
, и т. п.
[0152]
«Ароматический карбоциклилалкилоксикарбонил» означает определенный выше «алкилоксикарбонил», замещенный одним или несколькими определенными выше «ароматическими карбоциклилами». Например, в качестве примера представлены бензилоксикарбонил, фенэтилоксикарбонил, фенилпропинилоксикарбонил, бензгидрилоксикарбонил, тритилоксикарбонил, нафтилметилоксикарбонил, группа, представленная следующей формулой:
[Формула 52]
 , и т. п.
, и т. п.
[0153]
«Неароматический карбоциклилалкилоксикарбонил» означает определенный выше «алкилоксикарбонил», замещенный одним или несколькими определенными выше «неароматическими карбоциклилами». «Неароматический карбоциклилалкилоксикарбонил» включает в себя «неароматический карбоциклилалкилоксикарбонил», алкильная часть которого дополнительно замещена определенным выше «ароматическим карбоциклилом». Например, в качестве примера представлены циклопропилметилоксикарбонил, циклобутилметилоксикарбонил, циклопентилметилоксикарбонил, циклогексилметилоксикарбонил, циклопропенилметилоксикарбонил, циклобутенилметилоксикарбонил, циклопентенилметилоксикарбонил, циклогексенилметилоксикарбонил, группа, представленная следующей формулой:
[Формула 53]
 , и т. п.
, и т. п.
[0154]
«Ароматический гетероциклилалкилоксикарбонил» означает определенный выше «алкилоксикарбонил», замещенный одним или несколькими определенными выше «ароматическими гетероциклилами». «Ароматический гетероциклилалкилоксикарбонил» включает в себя «ароматический гетероциклилалкилоксикарбонил», алкильная часть которого дополнительно замещена определенным выше «ароматическим карбоциклилом» и/или «неароматическим карбоциклилом». Например, в качестве примера представлены пиридилметилоксикарбонил, фуранилметилоксикарбонил, имидазолилметилоксикарбонил, индолилметилоксикарбонил, бензотиофенилметилоксикарбонил, оксазолилметилоксикарбонил, изоксазолилметилоксикарбонил, тиазолилметилоксикарбонил, изотиазолилметилоксикарбонил, пиразолилметилоксикарбонил, изопиразолилметилоксикарбонил, пирролидинилметилоксикарбонил, бензоксазолилметилоксикарбонил, группа, представленная следующей формулой:
[Формула 54]
 , и т. п.
, и т. п.
[0155]
«Неароматический гетероциклилалкилоксикарбонил» означает определенный выше «алкилоксикарбонил», замещенный одним или несколькими определенными выше «неароматическими гетероциклилами». «Неароматический гетероциклилалкилоксикарбонил» включает в себя «неароматический гетероциклилалкилоксикарбонил», алкильная часть которого дополнительно замещена определенным выше «ароматическим карбоциклилом», «неароматическим карбоциклилом» и/или «ароматическим гетероциклом». Например, в качестве примера представлены тетрагидропиранилметилокси, морфолинилэтилокси, пиперидинилметилокси, пиперазинилметилокси, группа, представленная следующей формулой:
[Формула 55]
 , и т. п.
, и т. п.
[0156]
«Ароматический карбоциклилалкиламино» означает аминогруппу, в которой один или два атома водорода, присоединенные к атому азота, заменены определенным выше «ароматическим карбоциклилалкилом». Например, в качестве примера представлены бензиламино, фенэтиламино, фенилпропиниламино, бензгидриламино, тритиламино, нафтилметиламино, дибензиламино, и т. п.
[0157]
«Неароматический карбоциклилалкиламино» означает аминогруппу, в которой один или два атома водорода, присоединенные к атому азота, заменены определенным выше «неароматическим карбоциклилалкилом». Например, в качестве примера представлены циклопропилметиламино, циклобутилметиламино, циклопентилметиламино, циклогексилметиламино, циклопропенилметиламино, циклобутенилметиламино, циклопентенилметиламино, циклогексенилметиламино, и т. п.
[0158]
«Ароматический гетероциклилалкиламино» означает аминогруппу, в которой один или два атома водорода, присоединенные к атому азота, заменены определенным выше «ароматическим гетероциклилалкилом». Например, в качестве примера представлены пиридилметиламино, фуранилметиламино, имидазолилметиламино, индолилметиламино, бензотиофенилметиламино, оксазолилметиламино, изоксазолилметиламино, тиазолилметиламино, изотиазолилметиламино, пиразолилметиламино, изопиразолилметиламино, пирролидинилметиламино, бензоксазолилметиламино, и т. п.
[0159]
«Неароматический гетероциклилалкиламино» означает аминогруппу, в которой один или два атома водорода, присоединенные к атому азота, заменены определенным выше «неароматическим гетероциклилалкилом». Например, в качестве примера представлены тетрагидропиранилметиламино, морфолинилэтиламино, пиперидинилметиламино, пиперазинилметиламино, и т. п.
[0160]
«Алкилоксиалкил» означает определенный выше «алкил», замещенный одним ил двумя определенными выше «алкилокси». Например, в качестве примера представлены метилоксиметил, метилоксиэтил, этилоксиметил, и т. п.
[0161]
«Ароматический карбоциклилалкилоксиалкил» означает определенный выше «алкилоксиалкил», замещенный одним или несколькими определенными выше «ароматическими карбоциклилами». Например, в качестве примера представлены бензилоксиметил, фенэтилоксиметил, фенилпропинилоксиметил, бензгидрилоксиметил, тритилоксиметил, нафтилметилоксиметил, группа, представленная следующей формулой:
[Формула 56]
 , и т. п.
, и т. п.
[0162]
«Неароматический карбоциклилалкилоксиалкил» означает определенный выше «алкилоксиалкил», замещенный одним или несколькими определенными выше «неароматическими карбоциклилами». «Неароматический карбоциклилалкилоксиалкил» включает в себя «неароматический карбоциклилалкилоксиалкил», в котором алкильная часть, присоединенная к неароматическому гетероциклу, дополнительно замещена определенным выше «ароматическим карбоциклилом». Например, в качестве примера представлены циклопропилметилоксиметил, циклобутилметилоксиметил, циклопентилметилоксиметил, циклогексилметилоксиметил, циклопропенилметилоксиметил, циклобутенилметилоксиметил, циклопентенилметилоксиметил, циклогексенилметилоксиметил, группы, представленные следующими формулами:
[Формула 57]
 , и т. п.
, и т. п.
[0163]
«Ароматический гетероциклилалкилоксиалкил» означает определенный выше «алкилоксиалкил», замещенный одним или несколькими определенными выше «ароматическими гетероциклилами». «Ароматический гетероциклилалкилоксиалкил» включает в себя «ароматический гетероциклилалкилоксиалкил», в котором алкильная часть, присоединенная к ароматическому гетероциклу, дополнительно замещена определенным выше «ароматическим карбоциклилом» и/или «неароматическим карбоциклилом». Например, в качестве примера представлены пиридилметилоксиметил, фуранилметилоксиметил, имидазолилметилоксиметил, индолилметилоксиметил, бензотиофенилметилоксиметил, оксазолилметилоксиметил, изоксазолилметилоксиметил, тиазолилметилоксиметил, изотиазолилметилоксиметил, пиразолилметилоксиметил, изопиразолилметилоксиметил, пирролидинилметилоксиметил, бензоксазолилметилоксиметил, группы, представленные следующей формулой:
[Формула 58]
 , и т. п.
, и т. п.
[0164]
«Неароматический гетероциклилалкилоксиалкил» означает определенный выше «алкилоксиалкил», замещенный одним или несколькими определенными выше «неароматическими гетероциклилами». «Неароматический гетероциклилалкилоксиалкил» включает в себя «неароматический гетероциклилалкилоксиалкил», в котором алкильная часть, присоединенная к неароматическому гетероциклу, дополнительно замещена определенным выше «ароматическим карбоциклилом», «неароматическим карбоциклилом» и/или «ароматическим гетероциклилом». Например, в качестве примера представлены тетрагидропиранилметилоксиметил, морфолинилэтилоксиметил, пиперидинилметилоксиметил, пиперазинилметилоксиметил, группы, представленные следующей формулой:
[Формула 59]
 , и т. п.
, и т. п.
[0165]
«Алкилоксиалкилокси» означает определенный выше «алкилоксиалкил», присоединенный к атому кислорода.
[0166]
Заместители атома азота в определенном выше «замещенном или незамещенном амино», «замещенном или незамещенном карбамоиле», «замещенном или незамещенном сульфамоиле», «замещенном или незамещенном амидино» и «замещенном или незамещенном аминосульфиниле» включают в себя следующие заместители. Атом водорода на атоме азота может быть заменен одним или несколькими заместителями, выбранными из следующих заместителей.
Заместители:
алкил, алкенил, алкинил, галогеналкил, галогеналкенил, галоген, гидрокси, карбокси, формил, формилокси, карбамоил, сульфамоил, сульфанил, сульфино, сульфо, тиоформил, тиокарбокси, дитиокарбокси, тиокарбамоил, циано, нитро, нитрозо, азидо, гидрадино, уреидо, амидино, гуанидино, триалкилсилил, алкилокси, алкилоксиалкилокси, алкенилокси, алкинилокси, галогеналкилокси, триалкилсилилокси, цианоалкилокси, алкилкарбонил, галогеналкилкарбонил, карбамоилалкилкарбонил, алкенилкарбонил, алкинилкарбонил, моноалкиламино, диалкиламино, алкилсульфонил, алкенилсульфонил, алкинилсульфонил, моноалкилкарбониламино, диалкилкарбониламино, моноалкилсульфониламино, диалкилсульфониламино, алкилимино, алкенилимино, алкинилимино, алкилкарбонилимино, алкенилкарбонилимино, алкинилкарбонилимино, алкилоксиимино, алкенилоксиимино, алкинилоксиимино, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилоксикарбонил, моноалкилоксикарбониламино, диалкилоксикарбониламино, алкенилоксикарбонил, алкинилоксикарбонил, алкилсульфанил, алкилкарбонилсульфанил, алкенилсульфанил, алкинилсульфанил, алкилсульфинил, алкенилсульфинил, алкинилсульфинил, моноалкилкарбамоил, моно(гидроксиалкил)карбамоил, диалкилкарбамоил, гидроксикарбамоил, цианокарбамоил, карбоксиалкилкарбамоил, моно(диалкиламиноалкил)карбамоил, ди(диалкиламиноалкил)карбамоил, неароматический карбоциклилалкилкарбамоил, неароматический карбоциклилкарбамоил, неароматический гетероциклилалкилкарбамоил, неароматический гетероциклилкарбамоил, моноалкилоксикарбамоил, диалкилоксикарбамоил, моноалкилоксикарбонилалкилкарбамоил, диалкилоксикарбонилалкилкарбамоил, моноалкилсульфамоил, диалкилсульфамоил, ароматический карбоциклил, неароматический карбоциклил, ароматический гетероциклил, неароматический гетероциклил, ароматический карбоциклилокси, неароматический карбоциклилокси, неароматический гетероциклилокси, неароматический гетероциклилокси, ароматический карбоциклилкарбонил, неароматический карбоциклилкарбонил, ароматический гетероциклилкарбонил, неароматический гетероциклилкарбонил, неароматический карбоциклилкарбонилокси, ароматический карбоциклилкарбонилокси, ароматический гетероциклилкарбонилокси, неароматический гетероциклилкарбонилокси, ароматический карбоциклилоксикарбонил, неароматический карбоциклилоксикарбонил, ароматический гетероциклилоксикарбонил, неароматический гетероциклилоксикарбонил, ароматический карбоциклилалкил, неароматический карбоциклилалкил, ароматический гетероциклилалкил, неароматический гетероциклилалкил, ароматический карбоциклилалкилокси, неароматический карбоциклилалкилокси, ароматический гетероциклилалкилокси, неароматический гетероциклилалкилокси, ароматический карбоциклилалкилоксикарбонил, неароматический карбоциклилалкилоксикарбонил, ароматический гетероциклилалкилоксикарбонил, неароматический гетероциклилалкилоксикарбонил, ароматический карбоциклилалкиламино, неароматический карбоциклилалкиламино, ароматический гетероциклилалкиламино, неароматический гетероциклилалкиламино, ароматический карбоциклилсульфанил, неароматический карбоциклилсульфанил, ароматический гетероциклилсульфанил, неароматический гетероциклилсульфанил, ароматический карбоциклилсульфонил, неароматический карбоциклилсульфонил, ароматический гетероциклилсульфонил, неароматический гетероциклилсульфонил, алкилсульфонилокси, алкенилсульфонилокси, алкинилсульфонилокси, неароматический карбоциклилсульфонилокси, ароматический карбоциклилсульфонилокси, ароматический гетероциклилсульфонилокси, неароматический гетероциклилсульфонилокси, алкилоксикарбонилалкил, карбоксиалкил, гидроксиалкил, диалкиламиноалкил, гидроксиалкил, алкилоксиалкил, ароматический карбоциклилалкилоксиалкил, неароматический карбоциклилалкилоксиалкил, ароматический гетероциклилалкилоксиалкил и неароматический гетероциклилалкилоксиалкил.
[0167]
Заместители определенного выше «замещенного или незамещенного алкила», «замещенного или незамещенного алкенила», «замещенного или незамещенного алкинила», «замещенного или незамещенного алкилокси», «замещенного или незамещенного алкенилокси», «замещенного или незамещенного алкинилокси», «замещенного или незамещенного алкилсульфанила», «замещенного или незамещенного алкенилсульфанила», «замещенного или незамещенного алкинилсульфанила», «замещенного или незамещенного алкилкарбонила», «замещенного или незамещенного алкенилкарбонила», «замещенного или незамещенного алкинилкарбонила», «замещенного или незамещенного алкилсульфонила», «замещенного или незамещенного алкенилсульфонила», «замещенного или незамещенного алкинилсульфонила», «замещенного или незамещенного алкилоксикарбонила», «замещенного или незамещенного алкенилоксикарбонила», «замещенного или незамещенного алкинилоксикарбонила», «замещенного или незамещенного алкилсульфинила», «замещенного или незамещенного алкенилсульфинила», «замещенного или незамещенного алкинилсульфинила», «замещенного или незамещенного алкилсульфонилокси», «замещенного или незамещенного алкенилсульфонилокси», «замещенного или незамещенного алкинилсульфонилокси», «замещенного или незамещенного алкилкарбонилокси», «замещенного или незамещенного алкенилкарбонилокси» и «замещенного или незамещенного алкинилкарбонилокси» включают в себя следующие заместители. Атом водорода в одном или нескольких произвольных положениях на атоме углерода может быть заменен одним или несколькими заместителями, выбранными из следующих заместителей.
Заместители:
галоген, гидрокси, карбокси, амино, имино, гидрокси амино, гидрокси имино, формил, формилокси, карбамоил, сульфамоил, сульфанил, сульфино, сульфо, тиоформил, тиокарбокси, дитиокарбокси, тиокарбамоил, циано, нитро, нитрозо, азидо, гидрадино, уреидо, амидино, гуанидино, триалкилсилил, алкилокси, алкилоксиалкилокси, алкенилокси, алкинилокси, галогеналкилокси, триалкилсилилокси, цианоалкилокси, алкилкарбонил, галогеналкилкарбонил, карбамоилалкилкарбонил, алкенилкарбонил, алкинилкарбонил, моноалкиламино, диалкиламино, алкилсульфонил, алкенилсульфонил, алкинилсульфонил, моноалкилкарбониламино, диалкилкарбониламино, моноалкилсульфониламино, диалкилсульфониламино, алкилимино, алкенилимино, алкинилимино, алкилкарбонилимино, алкенилкарбонилимино, алкинилкарбонилимино, алкилоксиимино, алкенилоксиимино, алкинилоксиимино, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилоксикарбонил, моноалкилоксикарбониламино, диалкилоксикарбониламино, алкенилоксикарбонил, алкинилоксикарбонил, алкилсульфанил, алкилкарбонилсульфанил, алкенилсульфанил, алкинилсульфанил, алкилсульфинил, алкенилсульфинил, алкинилсульфинил, моноалкилкарбамоил, моно(гидроксиалкил)карбамоил, диалкилкарбамоил, гидроксикарбамоил, цианокарбамоил, карбоксиалкилкарбамоил, моно(диалкиламиноалкил)карбамоил, ди(диалкиламиноалкил)карбамоил, неароматический карбоциклилкарбамоил, неароматический гетероциклилалкилкарбамоил, неароматический гетероциклилкарбамоил, моноалкилоксикарбамоил, диалкилоксикарбамоил, моноалкилоксикарбонилалкилкарбамоил, диалкилоксикарбонилалкилкарбамоил, моноалкилсульфамоил, диалкилсульфамоил, ароматический карбоциклил, неароматический карбоциклил, ароматический гетероциклил, неароматический гетероциклил, ароматический карбоциклилокси, неароматический карбоциклилокси, ароматический гетероциклилокси, неароматический гетероциклилокси, ароматический карбоциклилкарбонил, неароматический карбоциклилкарбонил, ароматический гетероциклилкарбонил, неароматический гетероциклилкарбонил, неароматический карбоциклилкарбонилокси, ароматический карбоциклилкарбонилокси, ароматический гетероциклилкарбонилокси, неароматический гетероциклилкарбонилокси, ароматический карбоциклилоксикарбонил, неароматический карбоциклилоксикарбонил, ароматический гетероциклилоксикарбонил, неароматический гетероциклилоксикарбонил, ароматический карбоциклилалкилокси, неароматический карбоциклилалкилокси, ароматический гетероциклилалкилокси, неароматический гетероциклилалкилокси, ароматический карбоциклилалкилоксикарбонил, неароматический карбоциклилалкилоксикарбонил, ароматический гетероциклилалкилоксикарбонил, неароматический гетероциклилалкилоксикарбонил, ароматический карбоциклилалкиламино, неароматический карбоциклилалкиламино, ароматический гетероциклилалкиламино, неароматический гетероциклилалкиламино, ароматический карбоциклилсульфанил, неароматический карбоциклилсульфанил, ароматический гетероциклилсульфанил, неароматический гетероциклилсульфанил, неароматический карбоциклилсульфонил, ароматический карбоциклилсульфонил, ароматический гетероциклилсульфонил, неароматический гетероциклилсульфонил, алкилсульфонилокси, алкенилсульфонилокси, алкинилсульфонилокси, неароматический карбоциклилсульфонилокси, ароматический карбоциклилсульфонилокси, ароматический гетероциклилсульфонилокси и неароматический гетероциклилсульфонилокси.
[0168]
Заместители на кольце определенного выше «замещенного или незамещенного конденсированного ароматического гетероциклила», «замещенного или незамещенного неароматического карбоцикла», «замещенного или незамещенного ароматического карбоцикла», «замещенного или незамещенного неароматического гетероцикл», «замещенного или незамещенного ароматического гетероцикла», «замещенного или незамещенного неароматического карбоциклила», «замещенного или незамещенного ароматического карбоциклила», «замещенного или незамещенного неароматического гетероциклила», «замещенного или незамещенного ароматического гетероциклила», «замещенного или незамещенного неароматического карбоциклилкарбонила», «замещенного или незамещенного ароматического карбоциклилкарбонила», «замещенного или незамещенного ароматического гетероциклилкарбонила», «замещенного или незамещенного неароматического гетероциклилкарбонила», «замещенного или незамещенного неароматического карбоциклилсульфонила», «замещенного или незамещенного ароматического карбоциклилсульфонила», «замещенного или незамещенного ароматического гетероциклилсульфонила», «замещенного или незамещенного неароматического гетероциклилсульфонила», «замещенного или незамещенного неароматического карбоциклила», «замещенного или незамещенного ароматического карбоциклила», «замещенного или незамещенного ароматического гетероциклила», «замещенного или незамещенного конденсированного ароматического карбоциклила», «замещенного или незамещенного конденсированного ароматического гетероциклила», «замещенного или незамещенного неароматического гетероциклила», «замещенного или незамещенного ароматического карбоциклилоксикарбонила», «замещенного или незамещенного неароматического карбоциклилоксикарбонила», «замещенного или незамещенного ароматического гетероциклилоксикарбонила», «замещенного или незамещенного неароматического гетероциклилоксикарбонила», «замещенного или незамещенного неароматического карбоциклилокси», «замещенного или незамещенного ароматического карбоциклилокси», «замещенного или незамещенного ароматического гетероциклилокси», «замещенного или незамещенного неароматического гетероциклилокси», «замещенного или незамещенного неароматического карбоциклилсульфанила», «замещенного или незамещенного ароматического карбоциклилсульфанила», «замещенного или незамещенного ароматического гетероциклилсульфанила», «замещенного или незамещенного неароматического гетероциклилсульфанила», «замещенного или незамещенного неароматического карбоциклилсульфинила», «замещенного или незамещенного ароматического карбоциклилсульфинила», «замещенного или незамещенного ароматического гетероциклилсульфинила», «замещенного или незамещенного неароматического гетероциклилсульфинила», «замещенного или незамещенного неароматического карбоциклилсульфонилокси», «замещенного или незамещенного ароматического карбоциклилсульфонилокси», «замещенного или незамещенного ароматического гетероциклилсульфонилокси», «замещенного или незамещенного неароматического гетероциклилсульфонилокси», «замещенного или незамещенного неароматического карбоциклилкарбонилокси», «замещенного или незамещенного ароматического карбоциклилкарбонилокси», «замещенного или незамещенного ароматического гетероциклилкарбонилокси» и «замещенного или незамещенного неароматического гетероциклилкарбонилокси» включают в себя следующие заместители. Атом водорода в одном или нескольких произвольных положениях кольца может быть заменен одной или несколькими группами, выбранными из следующих заместителей.
Заместитель:
алкил, алкенил, алкинил, галогеналкил, галогеналкенил, галоген, гидрокси, карбокси, формил, формилокси, карбамоил, сульфамоил, сульфанил, сульфино, сульфо, тиоформил, тиокарбокси, дитиокарбокси, тиокарбамоил, циано, нитро, нитрозо, азидо, гидрадино, уреидо, амидино, гуанидино, триалкилсилил, алкилокси, алкилоксиалкилокси, алкенилокси, алкинилокси, галогеналкилокси, триалкилсилилокси, цианоалкилокси, алкилкарбонил, галогеналкилкарбонил, карбамоилалкилкарбонил, алкенилкарбонил, алкинилкарбонил, моноалкиламино, диалкиламино, алкилсульфонил, алкенилсульфонил, алкинилсульфонил, моноалкилкарбониламино, диалкилкарбониламино, моноалкилсульфониламино, диалкилсульфониламино, алкилимино, алкенилимино, алкинилимино, алкилкарбонилимино, алкенилкарбонилимино, алкинилкарбонилимино, алкилоксиимино, алкенилоксиимино, алкинилоксиимино, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилоксикарбонил, моноалкилоксикарбониламино, диалкилоксикарбониламино, алкенилоксикарбонил, алкинилоксикарбонил, алкилсульфанил, алкилкарбонилсульфанил, алкенилсульфанил, алкинилсульфанил, алкилсульфинил, алкенилсульфинил, алкинилсульфинил, моноалкилкарбамоил, моно(гидроксиалкил)карбамоил, диалкилкарбамоил, гидроксикарбамоил, цианокарбамоил, карбоксиалкилкарбамоил, моно(диалкиламиноалкил)карбамоил, ди(диалкиламиноалкил)карбамоил, неароматический карбоциклилалкилкарбамоил, неароматический карбоциклилкарбамоил, неароматический гетероциклилалкилкарбамоил, неароматический гетероциклилкарбамоил, моноалкилоксикарбамоил, диалкилоксикарбамоил, моноалкилоксикарбонилалкилкарбамоил, диалкилоксикарбонилалкилкарбамоил, моноалкилсульфамоил, диалкилсульфамоил, ароматический карбоциклил, неароматический карбоциклил, ароматический гетероциклил, неароматический гетероциклил, ароматический карбоциклилокси, неароматический карбоциклилокси, неароматический гетероциклилокси, неароматический гетероциклилокси, ароматический карбоциклилкарбонил, неароматический карбоциклилкарбонил, ароматический гетероциклилкарбонил, неароматический гетероциклилкарбонил, неароматический карбоциклилкарбонилокси, ароматический карбоциклилкарбонилокси, ароматический гетероциклилкарбонилокси, неароматический гетероциклилкарбонилокси, ароматический карбоциклилоксикарбонил, неароматический карбоциклилоксикарбонил, ароматический гетероциклилоксикарбонил, неароматический гетероциклилоксикарбонил, ароматический карбоциклилалкил, неароматический карбоциклилалкил, ароматический гетероциклилалкил, неароматический гетероциклилалкил, ароматический карбоциклилалкилокси, неароматический карбоциклилалкилокси, ароматический гетероциклилалкилокси, неароматический гетероциклилалкилокси, ароматический карбоциклилалкилоксикарбонил, неароматический карбоциклилалкилоксикарбонил, ароматический гетероциклилалкилоксикарбонил, неароматический гетероциклилалкилоксикарбонил, ароматический карбоциклилалкиламино, неароматический карбоциклилалкиламино, ароматический гетероциклилалкиламино, неароматический гетероциклилалкиламино, ароматический карбоциклилсульфанил, неароматический карбоциклилсульфанил, ароматический гетероциклилсульфанил, неароматический гетероциклилсульфанил, ароматический карбоциклилсульфонил, неароматический карбоциклилсульфонил, ароматический гетероциклилсульфонил, неароматический гетероциклилсульфонил, алкилсульфонилокси, алкенилсульфонилокси, алкинилсульфонилокси, неароматический карбоциклилсульфонилокси, ароматический карбоциклилсульфонилокси, ароматический гетероциклилсульфонилокси, неароматический гетероциклилсульфонилокси, алкилоксикарбонилалкил, карбоксиалкил, гидроксиалкил, диалкиламиноалкил, гидроксиалкил, алкилоксиалкил, ароматический карбоциклилалкилоксиалкил, неароматический карбоциклилалкилоксиалкил, ароматический гетероциклилалкилоксиалкил и неароматический гетероциклилалкилоксиалкил.
В качестве предпочтительного примера представлены галоген, циано, замещенный или незамещенный алкил (группа-заместитель: галоген, гидрокси), замещенный или незамещенный алкенил (группа-заместитель: галоген, гидрокси), замещенный или незамещенный алкинил (группа-заместитель: галоген, гидрокси), замещенный или незамещенный неароматический карбоциклил (группа-заместитель: галоген), замещенный или незамещенный ароматический карбоциклил (группа-заместитель: галоген), замещенный или незамещенный неароматический гетероциклил (группа-заместитель: галоген), замещенный или незамещенный ароматический гетероциклил (группа-заместитель: галоген), замещенный или незамещенный алкилокси (группа-заместитель: галоген, неароматический карбоциклил, ароматический карбоциклил), замещенный или незамещенный алкенилокси (группа-заместитель: галоген, неароматический карбоциклил, ароматический карбоциклил), замещенный или незамещенный алкинилокси (группа-заместитель: галоген, неароматический карбоциклил, ароматический карбоциклил), замещенный или незамещенный неароматический карбоциклилокси (группа-заместитель: галоген, циано, алкил, алкилкарбонил, алкилоксикарбонил), замещенный или незамещенный ароматический карбоциклил (группа-заместитель: галоген, циано, алкил, алкилкарбонил, алкилоксикарбонил), замещенный или незамещенный неароматический гетероциклилокси (группа-заместитель: галоген, циано, алкил, алкилкарбонил, алкилоксикарбонил), замещенный или незамещенный ароматический гетероциклилокси (группа-заместитель: галоген, циано, алкил, алкилкарбонил, алкилоксикарбонил), алкилсульфанил, алкенилсульфанил, алкинилсульфанил, алкилсульфонил, алкенилсульфонил, алкинилсульфонил, неароматический карбоциклилалкиламино, ароматический карбоциклилалкиламино, неароматический гетероциклилалкиламино, ароматический гетероциклилалкиламино, карбамоил.
В качестве более предпочтительного примера представлены галоген, циано, замещенный или незамещенный алкил (группа-заместитель: галоген, гидрокси), алкенил, неароматический карбоциклил, ароматический карбоциклил, замещенный или незамещенный неароматический гетероциклил (группа-заместитель: галоген), ароматический гетероциклил, замещенный или незамещенный алкилокси (группа-заместитель: галоген, неароматический карбоциклил, ароматический карбоциклил), замещенный или незамещенный неароматический карбоциклилокси (группа-заместитель: галоген, циано, алкил), замещенный или незамещенный ароматический карбоциклил (группа-заместитель: галоген), замещенный или незамещенный неароматический гетероциклилокси (группа-заместитель: алкилкарбонил, алкилоксикарбонил), ароматический гетероциклилокси, алкилсульфанил, алкилсульфонил, неароматический карбоциклилалкиламино, карбамоил.
[0169]
Определенный выше «замещенный или незамещенный неароматический карбоциклил», «замещенный или незамещенный неароматический гетероциклил», «замещенный или незамещенный конденсированный ароматический карбоциклил» и «замещенный или незамещенный конденсированный ароматический гетероциклил» могут быть замещены «оксо». В этом случае, два атома водорода на атоме углерода заменены группой =O следующим образом:
[Формула 60]
 .
.
[0170]
Неароматическая карбоциклическая часть и неароматическая гетероциклическая часть в определенном выше «замещенном или незамещенном неароматическом гетероциклиле», «замещенном или незамещенном ароматическом карбоциклилокси», «замещенном или незамещенном неароматическом гетероциклилокси», «замещенном или незамещенном неароматическом карбоциклилсульфаниле», «замещенном или незамещенном неароматическом гетероциклилсульфаниле», «замещенном или незамещенном неароматическом карбоциклилсульфиниле», «замещенном или незамещенном неароматическом гетероциклилсульфиниле», «замещенном или незамещенном неароматическом карбоциклилсульфониле», «замещенном или незамещенном неароматическом гетероциклилсульфониле», «замещенном или незамещенном неароматическом карбоциклилсульфонилокси», «замещенном или незамещенном неароматическом гетероциклилсульфонилокси», «замещенном или незамещенном неароматическом карбоциклилкарбониле», «замещенном или незамещенном неароматическом гетероциклилкарбониле», «замещенном или незамещенном неароматическом карбоциклилкарбонилокси», «замещенном или незамещенном неароматическом гетероциклилкарбонилокси», «замещенном или незамещенном неароматическом карбоциклилоксикарбониле» и «замещенном или незамещенном неароматическом гетероциклилоксикарбониле» может быть замещена «оксо», как описано выше.
[0171]
Заместители «замещенного алкила», «замещенного алкенила» и «замещенного алкинила» включают в себя гидрокси, галоген, дигалоген, тригалоген, неароматический карбоциклил, замещенный неароматическим карбоциклилом (заместитель: галоген, циано, алкил), ароматический карбоциклил, замещенный ароматическим карбоциклилом (заместитель: галоген, циано, алкил), неароматический гетероциклил, замещенный неароматическим гетероциклилом (заместитель: галоген, циано, алкил), ароматический гетероциклил, замещенный ароматическим гетероциклилом (заместитель: галоген, циано, алкил), и т. п.
Заместители «замещенного алкила» в составе Rx2 включают в себя галоген, дигалоген, тригалоген, неароматический карбоциклил, замещенный неароматическим карбоциклилом (заместитель: галоген, циано, алкил), и т. п.
[0172]
Заместители «замещенного неароматического карбоциклила», «замещенного неароматического гетероциклила», «замещенного ароматического карбоциклила» и «замещенного ароматического гетероциклила» включают в себя галоген, дигалоген, и т. п.
Заместители «замещенного неароматического гетероциклила» в составе Rx3 включают в себя галоген, дигалоген, и т. п.
[0173]
Заместители «замещенного алкилокси», «замещенного алкенилокси» и «замещенного алкинилокси» включают в себя галоген, дигалоген, тригалоген, циано, неароматический карбоциклил, галоген-замещенный неароматический карбоциклил, дигалоген-замещенный неароматический карбоциклил, ароматический карбоциклил, и т. п.
Заместители «замещенного алкилокси» в составе Rx3 включают в себя галоген, дигалоген, тригалоген, циано, неароматический карбоциклил, галоген-замещенный неароматический карбоциклил, дигалоген-замещенный неароматический карбоциклил, ароматический карбоциклил, и т. п.
[0174]
Заместители «замещенного неароматического карбоциклилокси», «замещенного неароматического гетероциклилокси», «замещенного ароматического карбоциклилокси» и «замещенного ароматического гетероциклилокси» включают в себя галоген, алкил, гидрокси, гидрокси-замещенный неароматический карбоциклил, алкилкарбонил, алкилоксикарбонил, и т. п.
Заместители «замещенного неароматического гетероциклилокси» в составе Rx3 включают в себя алкилкарбонил, алкилоксикарбонил, и т. п.
Заместители «замещенного ароматического карбоциклилокси» в составе Rx3 включают в себя галоген, алкил, гидрокси, гидрокси-замещенный неароматический карбоциклил, и т. п.
Заместители «замещенного амино» включают в себя неароматический карбоциклилалкил, и т. п.
Заместители «замещенного амино» в составе Rx3 включают в себя неароматический карбоциклилалкил, и т. п.
[0175]
Заместители «замещенного алкилкарбонила», «замещенного алкенилкарбонила» и «замещенного алкинилкарбонила» включают в себя галоген, дигалоген, циано, гидрокси, и т. п.
Заместители «замещенного алкилкарбонил» в составе R4 включают в себя галоген, дигалоген, циано, гидрокси, и т. п.
[0176]
Заместители «замещенного карбамоила» и «замещенного сульфамоила» включают в себя алкил, диалкил, и т. п.
Заместители «замещенного карбамоила» в составе R4 включают в себя алкил, диалкил, и т. п.
[0177]
Предпочтительные варианты осуществления R1, R2, R3, R4, -L1-, -L2- и кольца A в соединениях формулы (I) описаны ниже.
[Формула 61]

Предпочтительными являются следующие возможные комбинаторные соединения.
[0178]
R1 включает в себя замещенный или незамещенный конденсированный ароматический гетероциклил, представленный следующей формулой:
[Формула 62]

где кольцо B представляет собой 5-членное кольцо, кольцо C представляет собой 6-членное кольцо.
Предпочтительный вариант осуществления R1 представляет собой группу, представленную формулой:
[Формула 63]

где
X1 представляет собой N или C(Rx1),
X2 представляет собой N или C(Rx2),
X3 представляет собой N или C(Rx3),
X4 представляет собой N или C(Rx4),
X5 представляет собой N(Rx5), O или S,
X6 представляет собой N или C(Rx6),
каждый Rx1, Rx2, Rx3, Rx4, Rx5 и Rx6 независимо представляет собой водород, галоген, гидрокси, карбокси, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкенилокси, замещенный или незамещенный алкинилокси, замещенный или незамещенный неароматический карбоциклилокси, замещенный или незамещенный ароматический карбоциклилокси, замещенный или незамещенный неароматический гетероциклилокси, замещенный или незамещенный ароматический гетероциклилокси, замещенный или незамещенный алкилсульфанил, замещенный или незамещенный алкенилсульфанил, замещенный или незамещенный алкинилсульфанил, замещенный или незамещенный неароматический карбоциклилсульфанил, замещенный или незамещенный ароматический карбоциклилсульфанил, замещенный или незамещенный неароматический гетероциклилсульфанил, замещенный или незамещенный ароматический гетероциклилсульфанил, замещенный или незамещенный амино, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил, замещенный или незамещенный алкилкарбонил, замещенный или незамещенный алкенилкарбонил, замещенный или незамещенный алкинилкарбонил, замещенный или незамещенный неароматический карбоциклилкарбонил, замещенный или незамещенный ароматический карбоциклилкарбонил, замещенный или незамещенный неароматический гетероциклилкарбонил, замещенный или незамещенный ароматический гетероциклилкарбонил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкенилоксикарбонил, замещенный или незамещенный алкинилоксикарбонил, замещенный или незамещенный неароматический карбоциклилоксикарбонил, замещенный или незамещенный ароматический карбоциклилоксикарбонил, замещенный или незамещенный неароматический гетероциклилоксикарбонил, замещенный или незамещенный ароматический гетероциклилоксикарбонил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный алкенилсульфонил, замещенный или незамещенный алкинилсульфонил, замещенный или незамещенный неароматический карбоциклилсульфонил, замещенный или незамещенный ароматический карбоциклилсульфонил, замещенный или незамещенный неароматический гетероциклилсульфонил, замещенный или незамещенный ароматический гетероциклилсульфонил, или замещенный или незамещенный сульфамоил.
Другой предпочтительный вариант осуществления R1 представляет собой группу, представленную формулой:
[Формула 64]

где
X1 представляет собой C(Rx1),
X2 представляет собой N или C(Rx2),
X3 представляет собой C(Rx3),
X4 представляет собой C(Rx4),
X5 представляет собой N(Rx5), O или S,
X6 представляет собой N или C(Rx6),
каждый Rx1, Rx2, Rx3, Rx4, Rx5 и Rx6 независимо представляет собой водород, галоген, гидрокси, карбокси, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкенилокси, замещенный или незамещенный алкинилокси, замещенный или незамещенный неароматический карбоциклилокси, замещенный или незамещенный ароматический карбоциклилокси, замещенный или незамещенный неароматический гетероциклилокси, замещенный или незамещенный ароматический гетероциклилокси, замещенный или незамещенный алкилсульфанил, замещенный или незамещенный алкенилсульфанил, замещенный или незамещенный алкинилсульфанил, замещенный или незамещенный неароматический карбоциклилсульфанил, замещенный или незамещенный ароматический карбоциклилсульфанил, замещенный или незамещенный неароматический гетероциклилсульфанил, замещенный или незамещенный ароматический гетероциклилсульфанил, замещенный или незамещенный амино, замещенный или незамещенный карбамоил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный алкенилсульфонил, замещенный или незамещенный алкинилсульфонил, замещенный или незамещенный неароматический карбоциклилсульфонил, замещенный или незамещенный ароматический карбоциклилсульфонил, замещенный или незамещенный неароматический гетероциклилсульфонил, замещенный или незамещенный ароматический гетероциклилсульфонил, или замещенный или незамещенный сульфамоил.
Кроме того, другой предпочтительный вариант осуществления R1 представляет собой группу, представленную формулой:
[Формула 65]

где
X1 представляет собой C(Rx1),
X2 представляет собой N или C(Rx2),
X3 представляет собой C(Rx3),
X4 представляет собой C(Rx4),
X5 представляет собой N(Rx5), O или S,
X6 представляет собой N,
каждый Rx1, Rx2, Rx3, Rx4 и Rx5 независимо представляет собой водород, галоген, гидрокси, карбокси, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкенилокси, замещенный или незамещенный алкинилокси, замещенный или незамещенный неароматический карбоциклилокси, замещенный или незамещенный ароматический карбоциклилокси, замещенный или незамещенный неароматический гетероциклилокси, или замещенный или незамещенный ароматический гетероциклилокси.
Кроме того, другой предпочтительный вариант осуществления R1 представляет собой группу, представленную формулой:
[Формула 66]

где
X1 представляет собой C(Rx1),
X2 представляет собой N или C(Rx2),
X3 представляет собой C(Rx3),
X4 представляет собой C(Rx4),
X5 представляет собой N(Rx5),
X6 представляет собой N,
Rx1 представляет собой водород, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический карбоциклил, или замещенный или незамещенный алкилокси,
Rx2 представляет собой водород, галоген, замещенный или незамещенный алкил, замещенный или незамещенный алкилокси, замещенный или незамещенный неароматический карбоциклилокси, или замещенный или незамещенный неароматический гетероциклилокси,
Rx3 представляет собой водород, галоген, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный неароматический карбоциклилокси, замещенный или незамещенный ароматический карбоциклилокси, замещенный или незамещенный ароматический гетероциклилокси, замещенный или незамещенный алкилсульфанил, замещенный или незамещенный алкилсульфонил, или замещенный или незамещенный амино,
Rx4 представляет собой водород, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический карбоциклил, или замещенный или незамещенный карбамоил,
Rx5 представляет собой водород, замещенный или незамещенный алкил, или замещенный или незамещенный неароматический карбоциклил.
[0179]
Кольцо A представляет собой замещенный или незамещенный неароматический карбоцикл, замещенный или незамещенный неароматический гетероцикл, замещенный или незамещенный ароматический карбоцикл, или замещенный или незамещенный ароматический гетероцикл.
Предпочтительный вариант осуществления кольца A представляет собой замещенный или незамещенный неароматический карбоцикл, или замещенный или незамещенный неароматический гетероцикл.
Более предпочтительный вариант осуществления кольца A представляет собой замещенный или незамещенный циклобутан, замещенный или незамещенный циклогексан, замещенный или незамещенный тетрагидропиран, или замещенный или незамещенный диоксан.
Другой предпочтительный вариант осуществления кольца A представляет собой замещенный или незамещенный циклобутан, замещенный или незамещенный циклогексан, замещенный или незамещенный тетрагидропиран, или замещенный или незамещенный диоксан.
Предпочтительный вариант осуществления группы, представленной «-L1-кольцо A-L2-», представляет собой любую из групп, представленных следующей формулой:
[Формула 67]

где R9 представляет собой галоген, циано, гидрокси, карбокси, оксо, замещенный или незамещенный алкил, замещенный или незамещенный алкилокси, или замещенный или незамещенный амино, p представляет собой целое число от 0 до 4.
[0180]
-L1- представляет собой -O-(CR6R7)m- или -N(R8)-(CR6R7)m-, где левая связь присоединена к R1, правая связь присоединена к кольцу A.
Предпочтительный вариант осуществления -L1- представляет собой -O-(CR6R7)m-, где левая связь присоединена к R1, правая связь присоединена к кольцу A.
Предпочтительный вариант осуществления -L1- представляет собой -N(R8)-(CR6R7)m-, где левая связь присоединена к R1, правая связь присоединена к кольцу A.
Другой предпочтительный вариант осуществления -L1- представляет собой -O- или -O-(CR6R7)-, где левая связь присоединена к R1, правая связь присоединена к кольцу A.
Другой предпочтительный вариант осуществления -L1- представляет собой -NH- или -NH-(CR6R7)-, где левая связь присоединена к R1, правая связь присоединена к кольцу A.
Более предпочтительный вариант осуществления -L1- представляет собой -O-.
Другой более предпочтительный вариант осуществления -L1- представляет собой -NH-.
[0181]
-L2- представляет собой -O-(CR6R7)n-, -O-CR6=CR7- или -(CR6R7)n-, где левая связь присоединена к кольцу A, правая связь присоединена к группе, представленной следующей формулой:
[Формула 68]
 .
.
Предпочтительный вариант осуществления -L2- представляет собой -O-(CR6R7)n- или -(CR6R7)n-, где левая связь присоединена к кольцу A, правая связь присоединена к группе, представленной следующей формулой:
[Формула 69]
 .
.
Другой предпочтительный вариант осуществления -L2- представляет собой -O-(CR6R7)n-, где левая связь присоединена к кольцу A, правая связь присоединена к группе, представленной следующей формулой:
[Формула 70]
 .
.
Другой предпочтительный вариант осуществления -L2- представляет собой -(CR6R7)n-, где левая связь присоединена к кольцу A, правая связь присоединена к группе, представленной следующей формулой:
[Формула 71]
 .
.
Более предпочтительный вариант осуществления -L2- представляет собой -O-(CR6R7)-, где левая связь присоединена к кольцу A, правая связь присоединена к группе, представленной следующей формулой:
[Формула 72]
 .
.
Другой более предпочтительный вариант осуществления -L2- представляет собой -(CR6R7)2-, где левая связь присоединена к кольцу A, правая связь присоединена к группе, представленной следующей формулой:
[Формула 73]
 .
.
[0182]
Каждый m независимо представляет собой целое число, равное 0, 1, 2 или 3.
Согласно предпочтительному варианту осуществления, каждый m независимо равен 0 или 1.
Согласно другому предпочтительному варианту осуществления, m равен 0.
[0183]
Каждый n независимо представляет собой целое число, равное 1, 2 или 3.
Согласно предпочтительному варианту осуществления, каждый n независимо равен 1 или 2.
Согласно другому предпочтительному варианту осуществления, n равен 1.
Согласно другому предпочтительному варианту осуществления, n равен 2.
[0184]
Каждый R6 независимо представляет собой водород, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, или замещенный или незамещенный алкинил.
Согласно предпочтительному варианту осуществления, каждый R6 независимо представляет собой водород, галоген, или замещенный или незамещенный алкил.
Согласно другому предпочтительному варианту осуществления, каждый R6 независимо представляет собой водород.
[0185]
p представляет собой целое число от 0 до 4.
Согласно предпочтительному варианту осуществления, p представляет собой целое число от 0 до 2.
Согласно другому предпочтительному варианту осуществления, p равен 0.
[0186]
Каждый R7 независимо представляет собой водород, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, или замещенный или незамещенный алкинил.
Согласно предпочтительному варианту осуществления, каждый R7 независимо представляет собой водород, галоген, или замещенный или незамещенный алкил.
Согласно другому предпочтительному варианту осуществления, каждый R7 представляет собой водород.
[0187]
R8 представляет собой замещенный или незамещенный алкил.
Предпочтительный вариант осуществления R8 представляет собой водород или метил.
Другой предпочтительный вариант осуществления R8 представляет собой водород.
[0188]
R2 представляет собой замещенный или незамещенный алкил.
Предпочтительный вариант осуществления R2 представляет собой замещенный или незамещенный метил.
Другой предпочтительный вариант осуществления R2 представляет собой метил, гидроксиметил, или галогенметил.
[0189]
R3 представляет собой замещенный или незамещенный алкил.
Предпочтительный вариант осуществления R3 представляет собой водород.
[0190]
R4 представляет собой замещенный или незамещенный алкилкарбонил, замещенный или незамещенный алкенилкарбонил, замещенный или незамещенный алкинилкарбонил, замещенный или незамещенный неароматический карбоциклилкарбонил, замещенный или незамещенный ароматический карбоциклилкарбонил, замещенный или незамещенный неароматический гетероциклилкарбонил, замещенный или незамещенный ароматический гетероциклилкарбонил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкенилоксикарбонил, замещенный или незамещенный алкинилоксикарбонил, замещенный или незамещенный неароматический карбоциклилоксикарбонил, замещенный или незамещенный ароматический карбоциклилоксикарбонил, замещенный или незамещенный неароматический гетероциклилоксикарбонил, замещенный или незамещенный ароматический гетероциклилоксикарбонил, замещенный или незамещенный карбамоил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный алкенилсульфонил, замещенный или незамещенный алкинилсульфонил, замещенный или незамещенный неароматический карбоциклилсульфонил, замещенный или незамещенный ароматический карбоциклилсульфонил, замещенный или незамещенный неароматический гетероциклилсульфонил, замещенный или незамещенный ароматический гетероциклилсульфонил, или замещенный или незамещенный сульфамоил.
Предпочтительный вариант осуществления R4 представляет собой замещенный или незамещенный алкилкарбонил, замещенный или незамещенный алкенилкарбонил, замещенный или незамещенный ароматический гетероциклилкарбонил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный карбамоил, замещенный или незамещенный алкилсульфонил, или замещенный или незамещенный сульфамоил.
Другой предпочтительный вариант осуществления R4 представляет собой замещенный или незамещенный алкилкарбонил, замещенный или незамещенный ароматический гетероциклилкарбонил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный карбамоил, замещенный или незамещенный алкилсульфонил, или замещенный или незамещенный сульфамоил.
Другой более предпочтительный вариант осуществления R4 представляет собой метилкарбонил, гидроксиметилкарбонил, моногалогенметилкарбонил, дигалогенметилкарбонил, тригалогенметилкарбонил, цианометилкарбонил, цианометилкарбонил, карбамоилоксиметилкарбонил, пиразолилкарбонил, карбамоил, метилкарбамоил, метилоксикарбонилкарбамоил, метилоксикарбонил или метилсульфонил.
[0191]
Другие предпочтительные варианты осуществления R1, R2, R3, R4, -L1-, -L2- и кольца A в соединении, представленном формулой (I):
[Формула 74]

Являются следующими.
Соединение формулы (I) или его фармацевтически приемлемая соль,
где
R1 представляет собой группу, представленную формулой:
[Формула 75]

где X2 представляет собой N или C(H),
Rx1 представляет собой водород, галоген или циано,
Rx3 представляет собой галогеналкилокси, неароматический карбоциклилокси или неароматический гетероциклилокси,
Rx4 представляет собой водород или галоген,
Rx5 представляет собой алкил,
кольцо A представляет собой группу, представленную формулой:
[Формула 76]
 ,
,
-L1- представляет собой -O-,
-L2- представляет собой -O-(CH2)- или -(CH2)2-, где левая связь присоединена к кольцу A, и правая связь присоединена к группе, представленной формулой:
[Формула 77]
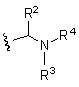 ,
,
R2 представляет собой алкил или галогеналкил,
R3 представляет собой водород,
R4 представляет собой алкилкарбонил или карбамоил,
При условии исключения следующей формулы
[Формула 78]
 .
.
Особенно предпочтительным является соединение, представленное следующей формулой:
[Формула 79]

[Формула 80]

или его фармацевтически приемлемая соль.
[0192]
Термин «заболевание, ассоциированное с ACC2» включает в себя метаболический синдром, ожирение, диабет, резистентность к инсулину, аномальную толерантность к глюкозе, диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическое заболевание сетчатки, диабетическую макроангиопатию, гиперлипидемию, гипертензию, сердечно-сосудистое заболевание, артериальный склероз, атеросклеротическое сердечно-сосудистое заболевание, остановку сердца, инфаркт миокарда, инфекционное заболевание, новообразование и т. п.
[0193]
Соединения формулы (I), (I') и (I'') не ограничены конкретным изомером и включают в себя все возможные изомеры (например, кето-енольный изомер, имин-енаминовый изомер, диастереоизомер, энантиомер, ротамер и т. п.), рацематы и их смеси, за исключением части, представленной химической структурой.
[0194]
Один или несколько атомов водорода, углерода и/или других атомов соединений формулы (I), (I') и (I'') могут быть заменены изотопами атомов водорода, углерода и/или других атомов. Примеры изотопов включают в себя изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как 2H, 3H, 11C, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F, 123I и 36Cl, соответственно. Соединения формулы (I), (I') и (I'') включают в себя соединения, которые замещены изотопами. Замещенные изотопами соединения применимы в качестве лекарственного средства и включают в себя меченые радиоактивным изотопом формы соединений формулы (I), (I') и (I''). Способ мечения соединения радиоактивной меткой с получением «меченой радиоактивным изотопом формы» охватывается настоящим изобретением и применим в качестве исследовательского и/или диагностического инструмента при исследовании фармакокинетики метаболизма и в методах анализа связывания.
[0195]
Меченые радиоактивным изотопом соединения формулы (I), (I') и (I'') могут быть получены посредством способов, известных в данной области техники. Например, тритий-содержащие соединения формулы (I), (I') и (I'') могут быть приготовлены путем введения трития в конкретное соединение формулы (I), (I') и (I''), например, посредством каталитического дегалогенирования с тритием. Такой способ может включать в себя взаимодействие подходящего галоген-замещенного предшественника соединения формулы (I), (I') и (I'') с газообразным тритием в присутствии подходящего катализатора, такого как Pd/C, в присутствии или в отсутствие основания. Другие подходящие способы получения тритий-содержащих соединений могут быть найдены в Filer, Isotopes in the Physical and Biomedical Sciences, Vol,1, Labeled Compounds (Part A), Chapter 6 (1987). 14C-меченые соединения можно получать с использованием веществ, содержащих углерод 14C.
[0196]
Примеры «фармацевтически приемлемых солей» включают в себя соль, такую как соль соединения формулы (I), (I') и (I'') с щелочными металлами (например, литием, натрием, калием и т. п.), щелочно-земельными металлами (например, кальцием, барием и т. п.), магнием, переходными металлами (например, цинком, железом и т. п.), аммонием, органическими основаниями (например, триметиламином, триэтиламином, дициклогексиламином, этаноламином, диэтаноламином, триэтаноламином, меглумином, диэтаноламином, этилендиамином, пиридином, пиколином, хинолоном и т. п.) и аминокислотами, и соли с неорганическими кислотами (например, соляной, серной кислотой, азотной кислотой, карбоновыми кислотами, бромистоводородной кислотой, фосфорной кислотой, йодистоводородной кислотой и т. п.), или органическими кислотами (например, муравьиной кислотой, уксусной кислотой, пропионовой кислотой, трифторуксусной кислотой, лимонной кислотой, молочной кислотой, винной кислотой, щавелевой кислотой, малеиновой кислотой, фумаровой кислотой, миндальной кислотой, глутаровой кислотой, яблочной кислотой, бензойной кислотой, фталевой кислотой, аскорбиновой кислотой, бензолсульфоновой кислотой, пара-толуолсульфоновой кислотой, метансульфоновой кислотой, этансульфоновой кислотой и т. п.). Особенно предпочтительными примерами являются соли с соляной кислотой, серной кислотой, фосфорной кислотой, винной кислотой или метансульфоновой кислотой. Указанные соли можно приготовить посредством общепринятого способа.
[0197]
Соединения формулы (I), (I') и (I''), согласно настоящему изобретению или их фармацевтически приемлемые соли могут быть получены в форме их сольвата (например, гидрата и т. п.) и/или их кристаллического полиморфа, причем настоящее изобретение включает в себя такие сольваты и полиморфы. Любое количество молекул растворителя может быть координировано с формированием такого сольвата соединений формулы (I), (I') и (I''). Если соединения формулы (I), (I') и (I'') или их фармацевтически приемлемую соль оставить в атмосфере, то она может абсорбировать влагу с присоединением абсорбированной воды или с формированием гидрата. Кроме того, соединения формулы (I), (I') и (I'') или их фармацевтически приемлемая соль может быть перекристаллизована с получением кристаллического полиморфа.
[0198]
Соединения формулы (I), (I') и (I'') согласно настоящему изобретению или их фармацевтически приемлемые соли могут формировать пролекарство, причем настоящее изобретение включает в себя различные пролекарства. Пролекарства представляют собой производные соединений согласно настоящему изобретению, обладающие группой, расщепляемой химическим или метаболическим способом, и являются соединениями, которые получаются посредством сольволиза или в физиологических условиях и представляют собой соединения, обладающие активностью in vivo. Пролекарства включают в себя соединения, преобразующиеся до соединений формулы (I), (I') и (I'') согласно настоящему изобретению путем реакции окисления, восстановления или гидролиза в физиологических условиях in vivo, и соединения, гидролизующиеся до соединений формулы (I), (I') и (I'') согласно настоящему изобретению желудочной кислотой и т. п. Способы выбора подходящих пролекарственных производных и их приготовления можно найти в файловой системе, например, в Design of Prodrugs, Elsevier, Amsterdam 1985. Пролекарство может обладать собственной активностью.
[0199]
Если соединения формулы (I), (I') и (I'') согласно настоящему изобретению или их фармацевтически приемлемая соль содержит, например, гидроксигруппу, то оно взаимодействовало с подходящим ацилгалоидом, подходящим ацилангидридом, подходящим сульфонилхлоридом, подходящим сульфонилангидридом и смешанным ангидридом или с конденсирующим средством с получением пролекарства, такого как ацилокси-производные или сульфонилокси-производные.
[0200]
Примеры пролекарств представляют собой CH3COO-, C2H5COO-, трет-BuCOO-, C15H31COO-, PhCOO-, (мета-NaOOCPh)COO-, NaOOCCH2CH2COO-, CH3CH(NH2)COO-, CH2N(CH3)2COO-, CH3SO3-, CH3CH2SO3-, CF3SO3-, CH2FSO3-, CF3CH2SO3-, пара-CH3-O-PhSO3-, PhSO3-, пара-CH3PhSO3- и т. п.
[0201]
Общие методики получения соединений согласно настоящему изобретению раскрыты ниже. Любые исходные вещества и используемые в реакциях реагенты являются коммерчески доступными или могут быть получены с использованием соединений, которые являются коммерчески доступными, посредством методик или процедур, легко доступных специалисту в данной области техники.
[0202]
Например, соединение согласно настоящему изобретению, представленное формулой (I), (I') и (I''), может быть получено посредством следующего пути синтеза.
[0203]
Способ получения соединения b2
[Формула 81]
где X1 представляет собой N или C(Rx1),
X2 представляет собой N или C(Rx2),
X3 представляет собой N или C(Rx3),
X4 представляет собой N или C(Rx4),
каждый Rx1, Rx2, Rx3, Rx4 и Rx5 независимо представляет собой водород, галоген, гидрокси, карбокси, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкенилокси, замещенный или незамещенный алкинилокси, замещенный или незамещенный неароматический карбоциклилокси, замещенный или незамещенный ароматический карбоциклилокси, замещенный или незамещенный неароматический гетероциклилокси, замещенный или незамещенный ароматический гетероциклилокси, замещенный или незамещенный алкилсульфанил, замещенный или незамещенный алкенилсульфанил, замещенный или незамещенный алкинилсульфанил, замещенный или незамещенный неароматический карбоциклилсульфанил, замещенный или незамещенный ароматический карбоциклилсульфанил, замещенный или незамещенный неароматический гетероциклилсульфанил, замещенный или незамещенный ароматический гетероциклилсульфанил, замещенный или незамещенный амино, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил, замещенный или незамещенный алкилкарбонил, замещенный или незамещенный алкенилкарбонил, замещенный или незамещенный алкинилкарбонил, замещенный или незамещенный неароматический карбоциклилкарбонил, замещенный или незамещенный ароматический карбоциклилкарбонил, замещенный или незамещенный неароматический гетероциклилкарбонил, замещенный или незамещенный ароматический гетероциклилкарбонил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкенилоксикарбонил, замещенный или незамещенный алкинилоксикарбонил, замещенный или незамещенный неароматический карбоциклилоксикарбонил, замещенный или незамещенный ароматический карбоциклилоксикарбонил, замещенный или незамещенный неароматический гетероциклилоксикарбонил, замещенный или незамещенный ароматический гетероциклилоксикарбонил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный алкенилсульфонил, замещенный или незамещенный алкинилсульфонил, замещенный или незамещенный неароматический карбоциклилсульфонил, замещенный или незамещенный ароматический карбоциклилсульфонил, замещенный или незамещенный неароматический гетероциклилсульфонил, замещенный или незамещенный ароматический гетероциклилсульфонил, или замещенный или незамещенный сульфамоил, и Rb1 представляет собой замещенный или незамещенный алкил.
Соединение b2 может быть получено путем осуществления взаимодействия с 1,1'-тиокарбонилдиимидазолом после осуществления взаимодействия раствора соединения b1 с восстановителем в присутствии кислоты.
Примеры реакционного растворителя включают в себя этанол, воду, метанол, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Примеры восстановителя включают в себя железо, цинк, и т. п. Их количество может составлять от 2 до 10 моль-эквивалентов, предпочтительно от 3 до 5 моль-эквивалентов, для 1 моля соединения b1.
Примеры кислоты включают в себя хлорид аммония, уксусную кислоту, соляную кислоту, и т. п. Их количество может составлять от 2 до 10 моль-эквивалентов, предпочтительно от 3 до 5 моль-эквивалентов, для 1 моля соединения b1.
Температура реакции для реакции с восстановителем может составлять от комнатной температуры до 100°C, предпочтительно от комнатной температуры до 80°C.
Продолжительность реакции для реакции с восстановителем может составлять от 1 до 12 часов, предпочтительно от 3 до 6 часов.
Количество 1,1'-тиокарбонилдиимидазола может составлять от 1 до 3 моль-эквивалентов, предпочтительно от 1 до 2 моль-эквивалентов, для 1 моль-эквивалента соединения b1.
Температура реакции для реакции с 1,1'-тиокарбонилдиимидазолом может составлять от 0°C до 50°C, предпочтительно от 0°C до комнатной температуры.
Продолжительность реакции для реакции с 1,1'-тиокарбонилдиимидазолом может составлять от 0,5 до 6 часов, предпочтительно от 0,5 до 2 часов.
[0204]
Способ получения соединения b4
[Формула 82]

где
X6 представляет собой N или C(Rx6), Rx6 представляет собой водород, галоген, гидрокси, карбокси, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический гетероциклил, замещенный или незамещенный ароматический гетероциклил, замещенный или незамещенный алкилокси, замещенный или незамещенный алкенилокси, замещенный или незамещенный алкинилокси, замещенный или незамещенный неароматический карбоциклилокси, замещенный или незамещенный ароматический карбоциклилокси, замещенный или незамещенный неароматический гетероциклилокси, замещенный или незамещенный ароматический гетероциклилокси, замещенный или незамещенный алкилсульфанил, замещенный или незамещенный алкенилсульфанил, замещенный или незамещенный алкинилсульфанил, замещенный или незамещенный неароматический карбоциклилсульфанил, замещенный или незамещенный ароматический карбоциклилсульфанил, замещенный или незамещенный неароматический гетероциклилсульфанил, замещенный или незамещенный ароматический гетероциклилсульфанил, замещенный или незамещенный амино, замещенный или незамещенный карбамоил, замещенный или незамещенный сульфамоил, замещенный или незамещенный алкилкарбонил, замещенный или незамещенный алкенилкарбонил, замещенный или незамещенный алкинилкарбонил, замещенный или незамещенный неароматический карбоциклилкарбонил, замещенный или незамещенный ароматический карбоциклилкарбонил, замещенный или незамещенный неароматический гетероциклилкарбонил, замещенный или незамещенный ароматический гетероциклилкарбонил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкенилоксикарбонил, замещенный или незамещенный алкинилоксикарбонил, замещенный или незамещенный неароматический карбоциклилоксикарбонил, замещенный или незамещенный ароматический карбоциклилоксикарбонил, замещенный или незамещенный неароматический гетероциклилоксикарбонил, замещенный или незамещенный ароматический гетероциклилоксикарбонил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный алкенилсульфонил, замещенный или незамещенный алкинилсульфонил, замещенный или незамещенный неароматический карбоциклилсульфонил, замещенный или незамещенный ароматический карбоциклилсульфонил, замещенный или незамещенный неароматический гетероциклилсульфонил, замещенный или незамещенный ароматический гетероциклилсульфонил, или замещенный или незамещенный сульфамоил. Значения других символов определены выше.
Соединение b4 может быть получено путем осуществления взаимодействия раствора соединения b3 с окислителем.
Примеры реакционного растворителя включают в себя дихлорметан, хлороформ, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Примеры окислителя включают в себя мета-хлорметоксибензойную кислоту, раствор пероксида водорода, и т. п. Количество окислителя может составлять от 1 до 5 моль-эквивалентов, предпочтительно от 1,5 до 2,5 моль-эквивалентов, для 1 моль-эквивалента соединения b3.
Температура реакции может составлять от 0°C до комнатной температуры, предпочтительно комнатную температуру.
Продолжительность реакции может составлять от 0,5 до 12 часов, предпочтительно от 1 до 6 часов.
[0205]
Способ получения соединения b6
[Формула 83]
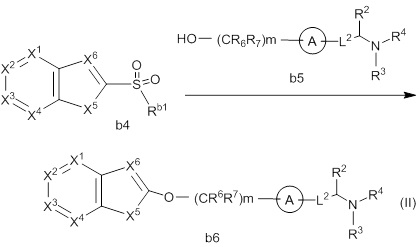
где кольцо A представляет собой замещенный или незамещенный неароматический карбоцикл, замещенный или незамещенный неароматический гетероцикл, замещенный или незамещенный ароматический карбоцикл, или замещенный или незамещенный ароматический гетероцикл, -L2- представляет собой -O-(CR6R7)n-, -O-CR6=CR7- или -(CR6R7)n-, каждый R6 и R7 независимо представляет собой водород, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, или замещенный или незамещенный алкинил, или R6 и R7 на одном атоме углерода могут формировать кольцо вместе с этим атомом углерода, R8 представляет собой замещенный или незамещенный алкил, каждый m независимо представляет собой целое число, равное 0, 1, 2 или 3, каждый n независимо представляет собой целое число, равное 1, 2 или 3,
R2 представляет собой замещенный или незамещенный алкил,
R3 представляет собой замещенный или незамещенный алкил,
R4 представляет собой замещенный или незамещенный алкилкарбонил, замещенный или незамещенный алкенилкарбонил, замещенный или незамещенный алкинилкарбонил, замещенный или незамещенный неароматический карбоциклилкарбонил, замещенный или незамещенный ароматический карбоциклилкарбонил, замещенный или незамещенный неароматический гетероциклилкарбонил, замещенный или незамещенный ароматический гетероциклилкарбонил, замещенный или незамещенный алкилоксикарбонил, замещенный или незамещенный алкенилоксикарбонил, замещенный или незамещенный алкинилоксикарбонил, замещенный или незамещенный неароматический карбоциклилоксикарбонил, замещенный или незамещенный ароматический карбоциклилоксикарбонил, замещенный или незамещенный неароматический гетероциклилоксикарбонил, замещенный или незамещенный ароматический гетероциклилоксикарбонил, замещенный или незамещенный карбамоил, замещенный или незамещенный алкилсульфонил, замещенный или незамещенный алкенилсульфонил, замещенный или незамещенный алкинилсульфонил, замещенный или незамещенный неароматический карбоциклилсульфонил, замещенный или незамещенный ароматический карбоциклилсульфонил, замещенный или незамещенный неароматический гетероциклилсульфонил, замещенный или незамещенный ароматический гетероциклилсульфонил, или замещенный или незамещенный сульфамоил, каждый R6 и R7 независимо представляет собой водород, галоген, циано, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, или замещенный или незамещенный алкинил, или R6 и R7 на одном атоме углерода могут формировать кольцо вместе с этим атомом углерода,
R8 представляет собой замещенный или незамещенный алкил,
каждый m независимо представляет собой целое число, равное 0, 1, 2 или 3, и
значения других символов определены выше.
Соединение b6 может быть получено путем осуществления взаимодействия раствора соединения b4 с соединением b5 в присутствии основания.
Примеры реакционного растворителя включают в себя THF, DMF, диоксан, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Примеры основания включают в себя трет-бутоксид калия, гидрид калия, карбонат калия, и т. п. Количество основания может составлять от 2 до 5 моль-эквивалентов, предпочтительно от 2 до 3 моль-эквивалентов, для 1 моль-эквивалента соединения b4.
Количество соединения b5 может составлять от 1 до 3 моль-эквивалентов, предпочтительно от 1 до 1,5 моль-эквивалентов, для 1 моль-эквивалента соединения b4.
Температура реакции может составлять от 0°C до комнатной температуры, предпочтительно комнатную температуру.
Продолжительность реакции может составлять от 0,5 до 6 часов, предпочтительно от 1 до 3 часов.
[0206]
Способ получения соединения b8
[Формула 84]

где Pr1 представляет собой защитную группу для спиртов (например, TBDPS, и т. п.), Rb2 представляет собой замещенный или незамещенный алкил, и значения других символов определены выше.
Соединение b8 может быть получено путем осуществления взаимодействия раствора соединения b7 с восстановителем.
Примеры реакционного растворителя включают в себя THF, метанол, этанол, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Примеры восстановителя включают в себя боргидрид натрия, алюмогидрид лития, и т. п. Количество восстановителя может составлять от 1 до 5 моль-эквивалентов, предпочтительно от 2 до 4 моль-эквивалентов, для 1 моль-эквивалента соединения b7.
Температура реакции может составлять от -78°C до комнатной температуры, предпочтительно от 0°C до комнатной температуры.
Продолжительность реакции может составлять от 0,5 до 24 часов, предпочтительно от 3 до 15 часов.
[0207]
Способ получения соединения b9
[Формула 85]

где Rb3 представляет собой замещенный или незамещенный алкил, и значения других символов определены выше.
Синтез соединения b9
Соединение b9 может быть получено путем осуществления взаимодействия фосфор-содержащего соединения в присутствии основания после осуществления взаимодействия раствора соединения b8 с окислителем.
Примеры реакционного растворителя включают в себя дихлорметан, хлороформ, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Примеры окислителя включают в себя реагент Десс-Мартина, 2,2,6,6-тетраметилпиперидин-1-оксил, и т. п. Количество окислителя может составлять от 1 до 3 моль-эквивалентов, предпочтительно от 1 до 1,5 моль-эквивалентов, для 1 моль-эквивалента соединения b8.
Температура реакции может составлять от -78°C до комнатной температуры, предпочтительно от 0°C до комнатной температуры.
Продолжительность реакции может составлять от 0,5 до 24 часов, предпочтительно от 1 до 6 часов.
Примеры основания включают в себя гидрид калия, трет-бутоксид калия, диизопропиламин лития, и т. п. Количество основания может составлять от 1 до 3 моль-эквивалентов, предпочтительно от 1 до 1,5 моль-эквивалентов, для 1 моль-эквивалента соединения b8.
Примеры фосфор-содержащего соединения включают в себя диалкилфосфоноалкилацетат, и т. п. Количество фосфор-содержащего соединения может составлять от 1 до 3 моль-эквивалентов, предпочтительно от 1 до 1,5 моль-эквивалентов, для 1 моль-эквивалента соединения b8.
Примеры реакционного растворителя включают в себя THF, диэтиловый эфир, дихлорметан, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Температура реакции может составлять от -78°C до температуры возгонки растворителя, предпочтительно от 0°C до комнатной температуры.
Продолжительность реакции может составлять от 0,5 до 12 часов, предпочтительно от 0,5 до 2 часов.
[0208]
Синтез соединения b10
[Формула 86]

где значения каждого символа определены выше.
Соединение b10 может быть получено путем осуществления взаимодействия раствора соединения b9 с восстановителем.
Примеры реакционного растворителя включают в себя THF, метанол, этанол, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Примеры восстановителя включают в себя боргидрид натрия, алюмогидрид лития, и т. п. Количество восстановителя может составлять от 1 до 5 моль-эквивалентов, предпочтительно от 2 до 4 моль-эквивалентов, для 1 моль-эквивалента соединения b9.
Температура реакции может составлять от -78°C до комнатной температуры, предпочтительно от 0°C до комнатной температуры.
Продолжительность реакции может составлять от 0,5 до 24 часов, предпочтительно от 3 до 15 часов.
[0209]
Синтез соединения b11
[Формула 87]
где Rb4 представляет собой замещенный или незамещенный алкил, и значения других символов определены выше.
Соединение b11 может быть получено путем осуществления взаимодействия с сульфинамидным соединением в присутствии кислоты Льюиса после осуществления взаимодействия соединения b10 с окислителем.
Примеры реакционного растворителя включают в себя дихлорметан, хлороформ, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Примеры окислителя включают в себя реагент Десс-Мартина, 2,2,6,6-тетраметилпиперидин-1-оксил, и т. п. Количество окислителя может составлять от 1 до 3 моль-эквивалентов, предпочтительно от 1 до 1,5 моль-эквивалентов, для 1 моль-эквивалента соединения b10.
Температура реакции может составлять от -78°C до комнатной температуры, предпочтительно от 0°C до комнатной температуры.
Продолжительность реакции может составлять от 0,5 до 24 часов, предпочтительно от 1 до 6 часов.
Примеры кислоты Льюиса включают в себя тетраэтоксид титана, хлорид алюминия, и т. п. Количество кислоты Льюиса может составлять от 1 до 5 моль-эквивалентов, предпочтительно от 1 до 1,5 моль-эквивалентов, для 1 моль-эквивалента соединения b10.
(R)-трет-бутилсульфинамид может быть использован в количестве от 1 до 2 моль-эквивалентов, предпочтительно от 1 до 1,5 моль-эквивалентов, для 1 моль-эквивалента соединения b10.
Примеры реакционного растворителя включают в себя толуол, THF, дихлорметан, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Температура реакции может составлять от комнатной температуры до 100°C, предпочтительно от комнатной температуры до 80°C.
Продолжительность реакции может составлять от 0,5 до 24 часов, предпочтительно от 0,5 до 3 часов.
[0210]
Синтез соединения b12
[Формула 88]

где значения каждого символа определены выше.
Соединение b12 может быть получено путем осуществления взаимодействия соединения b11 с металлорганическим соединением.
Примеры реакционного растворителя включают в себя толуол, THF, дихлорметан, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Примеры металлорганического реагента включают в себя алкилмагния галогенид, алкиллитий, алкилнатрий, и т. п. Количество металлорганического реагента может составлять от 1 до 6 моль-эквивалентов, предпочтительно от 1 до 4 моль-эквивалентов, для 1 моль-эквивалента соединения b11.
Температура реакции может составлять от 0°C до 100°C, предпочтительно от 0°C до комнатной температуры.
Продолжительность реакции может составлять от 1 до 24 часов, предпочтительно от 1 до 6 часов.
[0211]
Синтез соединения b13
[Формула 89]

где Rb5 представляет собой замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный неароматический карбоциклил, замещенный или незамещенный ароматический карбоциклил, замещенный или незамещенный неароматический гетероциклил, или замещенный или незамещенный ароматический гетероциклил, и значения других символов определены выше.
Соединение b13 может быть получено путем осуществления взаимодействия с ацилирующим агентом после осуществления взаимодействия соединения b12 с кислотой.
Примеры реакционного растворителя включают в себя 1,4-диоксан, THF, метанол, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Примеры кислоты включают в себя соляную кислоту, TFA, и т. п. Количество кислоты может составлять от 1 до 10 моль-эквивалентов, предпочтительно от 3 до 5 моль-эквивалентов, для 1 моль-эквивалента соединения b12.
Температура реакции может составлять от 0°C до 50°C, предпочтительно от 0°C до комнатной температуры.
Продолжительность реакции может составлять от 0,5 до 24 часов, предпочтительно от 1 до 15 часов.
Примеры ацилирующего агента включают в себя ангидрид кислоты, ацилгалогенид, и т. п. Количество ацилирующего агента может составлять от 1 до 5 моль-эквивалентов, предпочтительно от 1 до 2 моль-эквивалентов, для 1 моль-эквивалента соединения b12.
Температура реакции может составлять от 0°C до комнатной температуры, предпочтительно комнатную температуру.
Продолжительность реакции может составлять от 0,5 до 6 часов, предпочтительно 0,5 до 2 часов.
[0212]
Синтез соединения b14
[Формула 90]
где значения каждого символа определены выше.
Соединение b14 может быть получено путем осуществления взаимодействия соединения b13 с агентом снятия защиты.
Примеры реакционного растворителя включают в себя THF, дихлорметан, 1,4-диоксан, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Примеры агента снятия защиты включают в себя фторид тетрабутиламмония, фтороводород, и т. п. Количество агента снятия защиты может составлять от 1 до 5 моль-эквивалентов, предпочтительно от 1 до 2 моль-эквивалентов, для 1 моль-эквивалента соединения b13.
Температура реакции может составлять от комнатной температуры до 100°C, предпочтительно от комнатной температуры до 50°C.
Продолжительность реакции может составлять от 1 до 24 часов, предпочтительно от 3 до 5 часов.
[0213]
Способ получения соединения b16
[Формула 91]

где Pr2 представляет собой гидроксил-защитную группу (например, бензил, бензоил, и т. п.), и Rb6 представляет собой галоген, циано, алкилокси, и т. п.
Стадия 1
Соединение b16 может быть получено путем осуществления взаимодействия соединения b15 с нуклеофилом.
Примеры реакционного растворителя включают в себя отсутствие растворителя, THF, DMF, 1,4-диоксан, NMP, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Примеры нуклеофила включают в себя фторид тетрабутиламмония, цианид натрия, метоксид натрия, и т. п. Количество нуклеофила может составлять от 1 до 5 моль-эквивалентов, предпочтительно от 1 до 2 моль-эквивалентов, для 1 моль-эквивалента соединения b15.
Температура реакции может составлять от 0°C до 150°C, предпочтительно от комнатной температуры до 100°C.
Продолжительность реакции может составлять от 1 до 24 часов, предпочтительно от 1 до 3 часов.
[0214]
[Формула 92]

где значения каждого символа определены выше.
Стадия 2
Раствор соединения b16 каталитически восстанавливают в присутствии металл-содержащего катализатора с получением соединения b17.
Примеры реакционного растворителя включают в себя этилацетат, метанол, THF, 1,4-диоксан, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Примеры металл-содержащего катализатора включают в себя палладированный уголь, гидрат палладия, хлорид палладия, и т. п. Количество металл-содержащего катализатора может составлять от 0,001 до 1 моль-эквивалента, предпочтительно от 0,05 до 0,2 моль-эквивалента, для 1 моль-эквивалента соединения b16.
Температура реакции может составлять от комнатной температуры до температуры возгонки растворителя, предпочтительно от комнатной температуры до 50°C.
Продолжительность реакции может составлять от 0,5 до 48 часов, предпочтительно от 0,5 до 5 часов.
Способ получения соединения b19
[Формула 93]

где каждый Pr3 и Pr4 независимо представляет собой амино-защитную группу (например, бензил, бензоил, и т. п.), и значения других символов определены выше.
Соединение b19 может быть получено путем осуществления взаимодействия раствора соединения b18 с амином в присутствии металл-содержащего катализатора, лиганда и основания.
Примеры реакционного растворителя могут представлять собой толуол, DMF, 1,4-диоксан, NMP, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Примеры основания могут представлять собой трет-бутоксид натрия, трет-бутоксид калия, гидрид калия, фосфат калия, и т. п. Количество основания может составлять от 1 до 5 моль-эквивалентов, предпочтительно от 1 до 2 моль-эквивалентов, для 1 моль-эквивалента соединения b18.
Примеры металл-содержащего катализатора могут представлять собой трис(дибензилиденацетон)палладий(0), ацетат палладия, и т. п., и количество металл-содержащего катализатора может составлять от 0,001 до 1 моль-эквивалента, предпочтительно от 0,05 до 0,5 моль-эквивалента, для 1 моль-эквивалента соединения b18.
Примеры лиганда могут представлять собой 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, дифенилфосфиноферроцен, 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил, и т. п. Количество лиганда может составлять от 0,001 до 1 моль-эквивалента, предпочтительно от 0,1 до 0,5 моль-эквивалента, для 1 моль-эквивалента соединения b18.
Температура реакции может составлять от 0°C до температуры возгонки растворителя, предпочтительно от комнатной температуры до 130°C.
Продолжительность реакции может составлять от 0,5 до 24 часов, предпочтительно от 0,5 до 3 часов.
Способ получения соединения b21
[Формула 94]

где значения каждого символа определены выше.
Раствор соединения b20 каталитически восстанавливают в присутствии металл-содержащего катализатора с получением соединения b21.
Примеры реакционного растворителя включают в себя метанол, этанол, THF, диоксан, воду, и т. п., и в качестве единого растворителя также может быть использована их смесь.
Примеры металл-содержащего катализатора включают в себя палладированный уголь, гидрат палладия, оксид палладия, и т. п. Количество металл-содержащего катализатора может составлять от 0,001 до 1 моль-эквивалента, предпочтительно от 0,05 до 0,5 моль-эквивалента, для 1 моль-эквивалента соединения b20.
Температура реакции может составлять от 0°C до температуры возгонки растворителя, предпочтительно от комнатной температуры до 80°C.
Продолжительность реакции может составлять от 0,5 до 24 часов, предпочтительно от 0,5 до 2 часов.
[0215]
Соединение согласно настоящему изобретению характеризуется ингибирующей активностью в отношении ACC2. Кроме того, соединение согласно настоящему изобретению может представлять собой лекарственное средство со сниженными побочными эффектами вследствие высокой селективности в отношении ACC2 по сравнению с ACC1. Кроме того, соединение согласно настоящему изобретению может представлять собой лекарственное средство со сниженными побочными эффектами вследствие низких сердечно-сосудистых или MBI рисков. Фармацевтическая композиция, содержащая соединение согласно настоящему изобретению, применима для профилактики или лечения заболевания, ассоциированного с ACC2. Примеры заболеваний, ассоциированных с ACC2, означают заболевание, индуцированное продуцированным ACC2 малонил-СоА, и представляют собой метаболический синдром, ожирение, диабет, резистентность к инсулину, аномальную толерантность к глюкозе, диабетическую периферическую нейропатию, диабетическую нефропатию, диабетическое заболевание сетчатки, диабетическую макроангиопатию, гиперлипидемию, гипертензию, сердечно-сосудистое заболевание, артериосклероз, атеросклероз, остановку сердца, инфаркт миокарда, инфекционное заболевание, новообразование и т. п. Фармацевтическая композиция, содержащая соединение согласно настоящему изобретению, применима в качестве лекарственного средства для профилактики или лечения указанных заболеваний.
Соединение согласно настоящему изобретению обладает не только ингибирующей активностью в отношении ACC2, но также применимо в качестве лекарственного средства и характеризуется, частично или полностью, хорошими характеристиками, выбранными из следующих:
а) слабое ингибирование фермента CYP (например, CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4 и т. п.)
b) хорошая лекарственная кинетика, такая как высокая биодоступность, подходящий клиренс и т. п.
с) высокая метаболическая стабильность.
d) отсутствие необратимого ингибирования фермента CYP (например, CYP3A4) в пределах концентраций в качестве условий измерения, описанных в настоящем описании.
е) отсутствие мутагенности.
f) низкий сердечно-сосудистый риск.
g) высокая растворимость в воде.
[0216]
Фармацевтическую композицию согласно настоящему изобретению можно вводить перорально или парентерально в качестве средства от ожирения или средства от анорексии. В случае перорального введения, она может находиться в любой обычной форме, такой как таблетки, гранулы, порошки, капсулы и т. п. Если соединение вводят парентерально, то предпочтительна любая обычная форма, такая как инъекционная форма. Пероральное введение особенно предпочтительно, поскольку соединения согласно настоящему изобретению демонстрируют высокую пероральную всасываемость.
[0217]
Фармацевтическая композиция может быть изготовлена путем смешивания эффективного количества соединения согласно настоящему изобретению с различными фармацевтическими добавками, подходящими для формы введения, такими как наполнители, связующие вещества, увлажнители, разрыхлители, смазки и т. п.
[0218]
Хотя дозировку фармацевтической композиции согласно настоящему изобретению в качестве средства от ожирения или средства от анорексии, следует определять с учетом возраста пациента и массы тела, типа и степени заболеваний, пути введения и т. п., обычная пероральная дозировка для взрослого составляет от 0,05 до 100 мг/кг в сутки, предпочтительно, от 0,1 до 10 мг/кг в сутки. Для парентерального введения, хотя дозировка высоко варьирует от пути введения, обычная дозировка составляет от 0,005 до 10 мг/кг в сутки, предпочтительно от 0,01 до 1 мг/кг в сутки. Дозировку можно вводить однократно или несколько раз в сутки.
Примеры
[0219]
Настоящее изобретение дополнительно поясняется последующими примерами, справочными примерами, подготовительными примерами и тестовыми примерами, которые не предназначены для ограничения объема настоящего изобретения.
[0220]
Сокращения, использованные в настоящем описании, соответствуют следующим значениям.
Ac: ацетил
Bu: бутил
dba: дибензилиденацетон
DMF: N,N-диметилформамид
Et: этил
HATU: O-(7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат
Me: метил
NMP: N-метил-2-пирролидон
Pd2(dba)3: трис(дибензилиденацетон)биспалладий
Ph: фенил
Tf: трифторметансульфонил
THF: тетрагидрофуран
Boc2O: ди-трет-бутилдикарбонат
TBDPS: трет-бутилдифенилсилил
[0221]
Спектры 1H-ЯМР примеров измеряли на спектрометрах при 300 МГц или 400 МГц в d6-DMSO или CDCl3.
[0222]
«RT» в примерах или таблицах представляет собой «время удерживания» согласно LC/MS (жидкостная хроматография/масс-спектрометрия). Данные LC/MS соединений получали в следующих условиях.
Способ 1: колонка: Gemini-NX (5 мкм, внутр. диам. 4,6×50 мм (Phenomenex)
Скорость потока: 3,0 мл/мин
Длина волны УФ-детектирования: 254 нм
Подвижная фаза: [A] представляет собой 0,1% раствор муравьиной кислоты в воде, [B] представляет собой 0,1% раствор муравьиной кислоты в ацетонитриле
Градиент: использовали линейный градиент 5%-100% растворителя [B] в течение 3,5 минут, и выдерживали 100% растворитель [B] в течение 0,5 минут.
Способ 2: колонка: Shim-pack XR-ODS (2,2 мкм, внутр. диам. 50×3,0 мм (Shimadzu)
Скорость потока: 1,6 мл/мин
Длина волны УФ-детектирования: 254 нм
Подвижная фаза: [A] представляет собой 0,1% раствор муравьиной кислоты в воде, [B] представляет собой 0,1% раствор муравьиной кислоты в ацетонитриле
Градиент: использовали линейный градиент 10%-100% растворителя [B] в течение 3 минут, и выдерживали 100% растворитель [B] в течение 0,5 минут.
Способ 3: колонка: ACQUITY UPLC(R) BEH C18 (1,7 мкм, внутр. диам. 2,1×50 мм (Waters)
Скорость потока: 0,55 мл/мин
Длина волны УФ-детектирования: 254 нм
Подвижная фаза: [A] представляет собой 0,1% раствор муравьиной кислоты в воде, [B] представляет собой 0,1% раствор муравьиной кислоты в ацетонитриле
Градиент: использовали линейный градиент 5%-100% растворителя [B] в течение 3 минут, и выдерживали 100% растворитель [B] в течение 0,5 минут.
Способ 4: колонка: ACQUITY UPLC(R) BEH C18 (1,7 мкм внутр. диам. 2,1×50 мм (Waters)
Скорость потока: 0,8 мл/мин
Длина волны УФ-детектирования: 254 нм
Подвижная фаза: [A] представляет собой 0,1% раствор муравьиной кислоты в воде, [B] представляет собой 0,1% раствор муравьиной кислоты в ацетонитриле
Градиент: использовали линейный градиент 5%-100% растворителя [B] в течение 3,5 минут, и выдерживали 100% растворитель [B] в течение 0,5 минут.
Способ 5: колонка: Shim-pack XR-ODS (2,2 мкм, внутр. диам. 50×3,0 мм (Shimadzu)
Скорость потока: 1,6 мл/мин
Длина волны УФ-детектирования: 254 нм
Подвижная фаза: [A] представляет собой 0,1% раствор муравьиной кислоты в воде, [B] представляет собой 0,1% раствор муравьиной кислоты в ацетонитриле
Градиент: использовали линейный градиент 10%-100% растворителя [B] в течение 8 минут, и выдерживали 100% растворитель [B] в течение 0,5 минут.
Способ 6: колонка: ACQUITY UPLC(R) BEH C18 (1,7 мкм внутр. диам. 2,1×50 мм (Waters)
Скорость потока: 0,55 мл/мин
Длина волны УФ-детектирования: 254 нм
Подвижная фаза: [A] представляет собой 0,1% раствор муравьиной кислоты в воде, [B] представляет собой 0,1% раствор муравьиной кислоты в ацетонитриле
Градиент: использовали линейный градиент 5%-100% растворителя [B] в течение 8 минут, и выдерживали 100% растворитель [B] в течение 0,5 минут.
Пример 2. Получение соединения a18
Стадия 1. Получение соединения a9
[Формула 95]

К раствору соединения a8 (2 г, 11,29 ммоль) в THF (20 мл) при охлаждении на льду последовательно добавляли триметиламин (3,44 мл, 24,85 ммоль) и метиламин (33% раствор в этаноле, 1,547 мл, 12,42 ммоль). Реакционную смесь перемешивали при 0°C в течение 10 часов. К реакционной смеси добавляли солевой раствор (100 мл), и дважды экстрагировали реакционную смесь этилацетатом (100 мл). Органический слой сушили над сульфатом натрия. Растворитель концентрировали в условиях пониженного давления с получением соединения a9 (2,2 г, чистота 90%, 93%) в виде смеси с соединением a10. 1H-ЯМР (CDCl3) δ: 2,97 (д, J=5,0 Гц, 3H), 6,18-6,28 (м, 2H), 7,64 (с, 1H).
Стадия 2. Получение соединения a11
[Формула 96]
К раствору соединения a9 (5,92 г, чистота 90%, 28,35 ммоль) в ацетонитриле (40 мл) при 90°C добавляли N-хлорсукцинимид (4,62 г, 34,6 ммоль), и перемешивали смесь в течение 1 часа. Реакционную смесь концентрировали в условиях пониженного давления, и фильтровали нерастворимое вещество. Остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат=5/1) с получением соединения a11 (2,25 г, 32%) в виде желтого твердого вещества. 1H-ЯМР (CDCl3) δ: 2,94 (д, J=5,5 Гц, 3H), 5,23 (с, 1H), 6,43 (дд, J=9,9, 8,5 Гц, 1H).
Стадия 3. Получение соединения a13
[Формула 97]

К раствору соединения a11 (2,25 г, 10,11 ммоль) в THF (20 мл) добавляли 2,2-дифторэтанол (0,704 мл, 11,12 ммоль), карбонат калия (3,07 г, 22,24 ммоль) и 18-краун-6 (8,02 г, 30,3 ммоль), а затем нагревали смесь с обратным холодильником в течение 1 часа. К реакционной смеси добавляли дистиллированную воду (30 мл), и дважды реакционную смесь экстрагировали этилацетатом (30 мл). Органический слой промывали дистиллированной водой (30 мл) дважды, и однократно солевым раствором (30 мл). Органический слой сушили над сульфатом натрия, и концентрировали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат=5:1) с получением соединения a13 в виде смеси с соединением a14 (1,33 г, a13:a14=2:1, 31%).
Стадия 4. Получение соединения a15
[Формула 98]

К раствору смеси соединения a13 и соединения a14 (1,33 г, 4,67 ммоль, a13:a14=2:1) в THF (20 мл) добавляли 5% Pt/C (50%wet, 300 мг, 0,038 ммоль), и перемешивали смесь в течение 14 часов в атмосфере водорода. После фильтрования через целит, растворитель концентрировали в условиях пониженного давления. К раствору остатка в THF (20 мл) добавляли имидазол (0,636 г, 9,35 ммоль) и 1,1'-тиокарбонилдиимидазол (0,999 г, 5,61 ммоль), и нагревали смесь с обратным холодильником в течение 2 часов. К реакционной смеси добавляли дистиллированную воду, и экстрагировали реакционную смесь этилацетатом. Органический слой дважды промывали солевым раствором и сушили над сульфатом натрия. Растворитель концентрировали в условиях пониженного давления. Остаток суспендировали этилацетатом, и фильтровали с получением соединения a15 в виде смеси с соединением a16 (1,05 г, a15:a16=2:1, 50%).
Стадия 5. Получение соединения a17
[Формула 99]
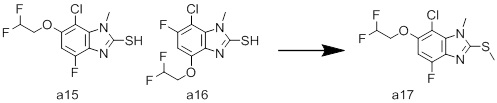
К раствору смеси соединения a15 и соединения a16 (988 мг, 3,33 ммоль, a15:a16=2:1) в THF (10 мл) добавляли карбонат калия (1013 мг, 7,33 ммоль) и метилйодид (0,229 мл, 3,66 ммоль), и перемешивали смесь при комнатной температуре в течение 3 часов. После фильтрования через целит, растворитель концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат=3:1) с получением соединения a17 (581 мг, 56%) в виде белого твердого вещества. 1H-ЯМР (CDCl3) δ: 2,80 (с, 3H), 4,00 (с, 3H), 4,23 (тд, J=13,0, 4,1 Гц, 2H), 6,14 (тт, J=55,0, 4,1 Гц, 1H), 6,68 (д, J=10,7 Гц, 1H).
Стадия 6. Получение соединения a18
[Формула 100]

К раствору соединения a17 (580 мг, 1,867 ммоль) в дихлорметане (10 мл) добавляли мета-хлорпероксибензойную кислоту (1012 мг, 4,11 ммоль), и перемешивали смесь при комнатной температуре в течение 5 часов. К реакционной смеси добавляли дистиллированную воду (50 мл), и дважды экстрагировали реакционную смесь этилацетатом (50 мл). Органический слой пятикратно промывали 1 М водным раствором гидроксида натрия (50 мл) и однократно солевым раствором (50 мл). Органический слой сушили над сульфатом натрия, а затем концентрировали растворитель в условиях пониженного давления. Остаток суспендировали этилацетатом и фильтровали с получением соединения a18 (640 мг, 100%) в виде белого твердого вещества. 1H-ЯМР (CDCl3) δ: 3,59 (с, 3H), 4,29 (тд, J=12,8, 4,1 Гц, 2H), 4,45 (с, 3H), 6,16 (тт, J=54,8, 4,1 Гц, 1H), 6,85 (д, J=10,5 Гц, 1H).
[0223]
Пример 3. Получение соединения a26
Стадия 1. Получение соединения a20
[Формула 101]

К раствору соединения a19 (21,63 г, 111 ммоль) в THF (150 мл) при охлаждении на льду последовательно добавляли карбонат калия (33,7 г, 244 ммоль) и метиламин (33% раствор в этаноле, 14,49 мл, 116 ммоль), и перемешивали смесь при 0°C в течение 20 минут. После фильтрования через целит, растворитель концентрировали в условиях пониженного давления. Остаток разбавляли этилацетатом (200 мл). Органический слой трижды промывали солевым раствором (200 мл), и сушили над сульфатом натрия. Растворитель концентрировали в условиях пониженного давления. К раствору полученного твердого остатка в THF (150 мл) добавляли карбонат калия (30,6 г, 222 ммоль), 2,2-дифторэтанол (7,02 мл, 111 ммоль) и 18-краун-6 (35,2 г, 133 ммоль), а затем нагревали смесь с обратным холодильником в течение 1 часа. После фильтрования через целит, растворитель концентрировали в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле (гексан:этилацетат=5:1) с получением соединения a20 (21,1 г, 71%) в виде желтого твердого вещества. 1H-ЯМР (CDCl3) δ: 3,18 (дд, J=6,9, 5,4 Гц, 3H), 4,26 (тд, J=12,7, 4,0 Гц, 2H), 5,93-6,28 (м, 2H), 6,83 (с, 1H).
Стадия 2. Получение соединения a21
[Формула 102]

К суспензии соединения a21 (2,03 г, 7,57 ммоль) в этаноле (10 мл) добавляли THF (10 мл), цинк (2,475 г, 37,8 ммоль) и хлорид аммония (2,025 г, 37,8 ммоль), и перемешивали смесь при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали через целит, и концентрировали растворитель в условиях пониженного давления. К раствору полученного остатка в THF (20 мл) добавляли имидазол (1,546 г, 22,71 ммоль) и 1,1'-тиокарбонилдиимидазол (1,619 г, 9,08 ммоль), и перемешивали смесь в течение 1 часа при нагревании с обратным холодильником. К реакционному раствору добавляли карбонат калия (2,092 г, 15,14 ммоль) и метилйодид (0,568 мл, 9,08 ммоль), и дополнительно перемешивали смесь при комнатной температуре в течение 3 часов. Реакционную смесь фильтровали через целит, и концентрировали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (гексан:этилацетат=2:1) с получением соединения a21 (1,83 г, 82%) в виде белого твердого вещества. 1H-ЯМР (CDCl3) δ: 2,80 (с, 3H), 3,84 (с, 3H), 4,25 (тд, J=13,1, 4,1 Гц, 2H), 6,10 (тт, J=55,0, 4,1 Гц, 1H), 6,66 (дд, J=10,5, 6,0 Гц, 1H).
Стадия 3. Получение соединения a22
[Формула 103]

К раствору соединения a21 (1,8 г, 6,12 ммоль) в дихлорметане (30 мл) добавляли мета-хлорпероксибензойную кислоту (3,32 г, 13,46 ммоль), и перемешивали смесь при комнатной температуре в течение 3 часов. К реакционной смеси добавляли дистиллированную воду (200 мл), и дважды экстрагировали реакционную смесь этилацетатом (200 мл). Органический слой пятикратно промывали 0,1 М водным раствором гидроксида натрия (200 мл) и однократно солевым раствором (200 мл). Органический слой сушили над сульфатом натрия, и концентрировали растворитель в условиях пониженного давления. Остаток суспендировали этилацетатом и фильтровали с получением соединения a22 (2 г, 100%) в виде белого твердого вещества. 1H-ЯМР (CDCl3) δ: 3,58 (с, 3H), 4,29 (с, 3H), 4,32 (дт, J=4,0, 12,9 Гц, 2H), 6,12 (тт, J=54,8, 4,0 Гц, 1H), 6,84 (дд, J=10,3, 5,9 Гц, 1H).
[0224]
Пример 5. Получение соединения a43
[Формула 104]

Стадия 1. Получение соединения a37
Раствор соединения a35 (1,35 г, 6,55 ммоль) в DMF (13,5 мл) охлаждали на бане со льдом, добавляли к нему гидрид калия (0,315 г, 7,87 ммоль), и перемешивали смесь при той же температуре в течение 30 минут. К смеси добавляли соединение a36 (2,65 г, 7,21 ммоль), и перемешивали реакционную смесь при комнатной температуре в течение 1 часа. Дополнительно добавляли к смеси соединение a36 (0,482 г, 1,31 ммоль), и перемешивали реакционную смесь при 60°C в течение 1 часа. После охлаждения до комнатной температуры, к смеси добавляли 2 М соляную кислоту (13,1 мл, 26,2 ммоль), и перемешивали реакционную смесь при комнатной температуре в течение 1 часа. Реакционную смесь нейтрализовали добавлением карбоната натрия, а затем экстрагировали этилацетатом. Органический слой промывали водой, и концентрировали растворитель в условиях пониженного давления. Полученный остаток очищали методом хроматографии на силикагеле (гексан/этилацетат) с получением соединения a37 (1,06 г, выход 33%). [M+H]=494,20, условия согласно способу 3: время удерживания 3,35 мин
Стадия 2. Получение соединения a38
Соединение a37 (400 мг, 0,810 ммоль) растворяли во фториде тетрабутиламмония (1 М раствор в THF, 1 мл, 1,00 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали в условиях пониженного давления, и очищали полученный остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a38 (272 мг, выход 89%). [M+H]=380,15, условия согласно способу 3: время удерживания 2,29 мин.
Стадия 3. Получение смеси соединений a39 и a40
Раствор имидазола в дихлорметане (293 мг, 4,30 ммоль) охлаждали на бане со льдом, добавляли к нему тионилхлорид (0,094 мл, 1,29 ммоль), и перемешивали смесь при комнатной температуре в течение 1 часа. Реакционную смесь охлаждали до -15°C, и по каплям добавляли к ней раствор соединения a38 (272 мг, 0,717 ммоль) в дихлорметане (8 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли 10% водный раствор лимонной кислоты, и экстрагировали реакционную смесь. Органический слой промывали водой, и концентрировали растворитель в условиях пониженного давления. Полученный остаток растворяли в дихлорметане (4 мл), и при охлаждении на льду добавляли к нему мета-перйодат натрия (399 мг, 1,86 моль) и гидрат оксида рутения (2,4 мг, 0,016 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь разбавляли этилацетатом, и отфильтровывали нерастворимое вещество. Фильтрат экстрагировали, водный слой промывали водой, а затем концентрировали растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением смеси соединения a39 (148 мг, выход 47%) и соединения a40 (84 мг, выход 26%). При этом соотношение обоих соединений рассчитывали на основании соотношения площадей (1,00:0,55) полностью независимых двух сигналов с δ 4,26 м.д. (2H, с, соединение a39) и δ 5,00-5,10 м.д. (1H, м, соединение a40) в спектре 1H-ЯМР.
Стадия 4. Получение смеси соединений a41 и a42
Смесь соединения a39 (141 мг, 0,320 ммоль) и соединения a40 (80 мг, 0,176 ммоль) растворяли во фториде тетрабутиламмония (1 М раствор в THF, 0,991 мл, 0,991 ммоль), и перемешивали смесь при комнатной температуре в течение 21 часов. К реакционной смеси добавляли 10% водный раствор лимонной кислоты (2 мл), и перемешивали реакционную смесь при комнатной температуре в течение 1 часа. Реакционную смесь экстрагировали этилацетатом, и концентрировали водный слой в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением смеси соединения a41 (110 мг, выход 90%) и соединения a42 (63 мг, выход 90%). При этом соотношение обоих соединений рассчитывали на основании соотношения площадей (1,00:0,55) полностью независимых двух сигналов с δ 4,78-4,92 м.д. (1H, м, соединение a41) и δ 5,00-5,10 м.д. (1H, м, соединение a42) в спектре 1H-ЯМР.
Стадия 5. Получение соединения a43
Смесь соединения a41 (108 мг, 0,283 ммоль) и соединения a42 (62 мг, 0,156 ммоль) растворяли в этилацетате (5 мл). К реакционной смеси в атмосфере азота добавляли 10% палладированный уголь (увлажненный до 50% водой, 56 мг, 0,013 ммоль), и перемешивали реакционную смесь в атмосфере водорода (1 атм) при комнатной температуре в течение 24 часов. Реакционную смесь фильтровали, и концентрировали фильтрат в условиях пониженного давления. Полученную неочищенную смесь соединения a43 и непрореагировавшего соединения a42 растворяли в THF (2 мл) и метаноле (2 мл). К реакционной смеси добавляли 2 М водный раствор гидроксида натрия (0,283 мл, 0,566 ммоль), и перемешивали реакционную смесь при комнатной температуре в течение 4,5 часов. Реакционную смесь концентрировали и экстрагировали этилацетатом. После концентрирования в условиях пониженного давления, полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a43 (121 мг, выход 95%). 1H-ЯМР (CDCl3) δ: 1,29-1,38 (4H, м), 1,45 (9H, с), 1,91-2,03 (4H, м), 3,27-3,33 (1H, м), 3,48 (1H, ддд, J=9,4, 6,0, 1,8 Гц), 3,59 (1H, ддд, J=9,4, 4,0, 1,3 Гц), 3,67-3,73 (1H, м), 3,88-3,97 (1H, м), 4,40 (1H, ддд, J=47,4, 9,0, 6,0 Гц), 4,39-4,60 (1H, м), 4,82-4,88 (1H, м).
[0225]
Пример 6. Получение соединения a44-2
[Формула 105]

Стадия 1. Получение соединения a44-1
Раствор соединения a39 (44 мг, 0,10 ммоль) в THF (0,4 мл) растворяли во фториде тетрабутиламмония (1 М раствор в THF, 0,12 мл, 0,120 ммоль), и перемешивали реакционную смесь при комнатной температуре в течение 1 часа. К реакционному раствору добавляли насыщенный раствор хлорида аммония (2 мл), и перемешивали реакционную смесь при комнатной температуре в течение 1 часа. Реакционную смесь экстрагировали этилацетатом, и концентрировали водный слой в условиях пониженного давления. Полученный остаток растворяли в 4 М хлороводороде в этилацетате (0,25 мл), и перемешивали смесь при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали в условиях пониженного давления, и растворяли полученный неочищенный остаток в THF (0,4 мл). К реакционному раствору при комнатной температуре добавляли уксусный ангидрид (0,014 мл, 0,149 ммоль) и триэтиламин (0,028 мл, 0,199 ммоль). Реакционную смесь перемешивали в течение 30 минут. К реакционной смеси добавляли насыщенный раствор хлорида аммония, и экстрагировали реакционную смесь. Органический слой промывали водой, и концентрировали водный слой в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a44-1 (25 мг, выход 78%).
Стадия 2. Получение соединения a44-2
Соединение a44-1 (49 мг, 0,152 ммоль) растворяли в метаноле (0,5 мл). В атмосфере азота к нему добавляли 10% палладированный уголь (увлажненный до 50% водой, 16 мг), и перемешивали смесь в атмосфере водорода (1 атм) при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали, и концентрировали фильтрат в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a44-2 (36 мг, выход 100%). 1H-ЯМР (CDCl3) δ: 1,28-1,36 (4H, м), 1,95-2,03 (4H, м), 2,01 (3H, с), 3,31 (1H, м), 3,49 (1H, м), 3,59 (1H, м), 3,69 (1H, м), 4,28 (1H, м), 4,32-4,60 (2H, м), 5,83 (1H, ушир. с).
[0226]
Пример 9. Получение соединения a61
[Формула 106]

Стадия 1. Получение соединения a58
Соединение a57 (131 мг, 0,54 ммоль; WO201005562) растворяли в дихлорметане (2,5 мл), и при -78°C добавляли к нему 1 М диизобутилалюмогидрид (2,16 мл, 2,16 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли этилацетат (0,4 мл), и насыщенную сегнетову соль в этилацетате (5 мл), и перемешивали смесь в течение 1 часа при комнатной температуре. Реакционную смесь концентрировали в условиях пониженного давления и экстрагировали дихлорметаном. Органический слой промывали водой и солевым раствором, а затем сушили над безводным сульфатом натрия. Растворитель отгоняли в условиях пониженного давления, и очищали полученный остаток методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением соединения a58 (63 мг, выход 58%). 1H-ЯМР (CDCl3) δ: 1,28 (т, J=7,2 Гц, 3H), 1,29 (д, J=7,2 Гц, 3H), 2,01 (с, 3H), 4,17 (кв, J=7,2 Гц, 2H), 4,74 (м, 1H), 5,42 (ушир. с, 1H), 5,89 (д, J=15,6 Гц, 1H), 6,87 (дд, J=4,8, 15,6 Гц, 1H).
Стадия 2. Получение соединения a59
Соединение a58 (440 мг, 2,04 ммоль) растворяли в дихлорметане (4 мл), и при 0°C добавляли трифторуксусную кислоту (1,57 мл, 20,4 ммоль). Смесь перемешивали в течение 30 минут. Реакционную смесь концентрировали в условиях пониженного давления, и добавляли триэтиламин (847 мкл, 6,11 ммоль) и уксусный ангидрид (385 мкл, 4,07 ммоль) к раствору полученного остатка в дихлорметане (3,0 мл). Смесь перемешивали в течение 1 часа. К реакционной смеси добавляли воду, и экстрагировали смесь дихлорметаном. Органический слой промывали 2 М соляной кислотой и насыщенным солевым раствором, и сушили над безводным сульфатом натрия. Растворитель отгоняли в условиях пониженного давления, и растворяли полученный остаток в смеси THF/H2O (2 мл; 1/1). К смеси добавляли 2 М гидроксид натрия. Реакционный раствор перемешивали при комнатной температуре в течение 30 минут. К реакционной смеси добавляли воду, и экстрагировали смесь дихлорметаном. Органический слой промывали водой и солевым раствором, и сушили над безводным сульфатом натрия. Органический слой концентрировали в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением соединения a59 (220 мг, выход 75%). 1H-ЯМР (CDCl3) δ: 1,25 (д, J=6,8 Гц, 3H), 1,40 (с, 1H), 1,99 (с, 3H), 4,55 (ушир. с, 2H), 4,60 (м, 1H), 5,32 (с, 1H), 5,68 (м, 1H), 5,76 (м, 1H).
Стадия 3. Получение соединения a60
Соединение a59 (40 мг, 0,279 ммоль) растворяли в дихлорметане (2 мл), добавляли к нему диоксид марганца (484 мг, 5,56 ммоль), и перемешивали смесь в течение 1 часа. Реакционную смесь фильтровали, и концентрировали фильтрат в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения-альдегида (28 мг, выход 71%).
К раствору альдегида в толуоле (1 мл) добавляли 2-(бензилокси)пропан-1,3-диол (54 мг, 0,298 ммоль) и пиридиния пара-толуолсульфонат (2,5 мг, 9,9 мкмоль), и перемешивали смесь при 90°C в течение 6 часов. Реакционный раствор концентрировали, и очищали остаток методом препаративной HPLC (ацетонитрил/вода с 0,1% муравьиной кислоты) с получением соединения a60 (3,8 мг, выход 6%) и его цис-изомера (4,0 мг, выход 6%). 1H-ЯМР (CDCl3) δ: 1,23 (д, J=8,4 Гц, 3H), 1,95 (с, 3H), 3,49 (дд, J=10,8, 10,8 Гц, 2H), 3,67 (м, 1H), 3,49 (дд, J=4,8, 10,8 Гц, 2H), 4,56 (с, 2H), 4,62 (м, 1H), 4,86 (д, J=4,4 Гц, 1H), 5,32 (д, J=8,4 Гц, 1H), 5,59 (ддд, J =1,6, 4,4, 15,6 Гц, 1H) 5,93 (дд, J=5,2, 15,6 Гц, 1H), 7,27-7,37 (м, 5H). Цис-изомер: 1H-ЯМР (CDCl3) δ: 1,24 (д, J=6,8 Гц, 3H), 1,96 (с, 3H), 3,25 (с, 1H), 3,87 (д, J=12,0 Гц, 2H), 4,23 (д, J=12,0 Гц, 2H), 4,64 (м, 1H), 4,67 (с, 2H), 5,02 (д, J=4,8 Гц, 1H), 5,36 (д, J=7,2 Гц, 1H), 5,69 (ддд, J =1,6, 4,4, 16,0 Гц, 1H) 5,98 (дд, J=4,8, 16,0 Гц, 1H), 7,27-7,39 (м, 5H).
Стадия 4. Получение соединения a61
Соединение a60 (4,0 мг, 0,012 ммоль) растворяли в метаноле (1 мл), и добавляли к нему гидроксид палладия (1 мг, 0,16 ммоль). Реакционную смесь перемешивали в атмосфере водорода в течение 5 часов. Реакционный раствор фильтровали, и концентрировали фильтрат в условиях пониженного давления с получением соединения a61 (2,6 мг, выход 100%) в виде неочищенного продукта. 1H-ЯМР (CDCl3) δ: 1,13 (д, J=6,8 Гц, 3H), 1,45-1,68 (м, 4H), 1,95 (с, 3H), 3,67 (дд, J=10,8, 10,8 Гц, 2H), 3,67 (м, 1H), 3,88 (м, 1H), 3,97 (м, 1H), 4,16 (дд, J=4,8, 10,8 Гц, 2H), 4,44 (дд, J=4,8, 4,8 Гц, 1H), 5,31 (ушир. с, 1H).
[0227]
Пример 10. Получение соединения a66
[Формула 107]

Стадия 1. Получение соединения a64
Соединение a63 (3,0 г, 127 ммоль) растворяли в смеси DMF (30 мл) и THF (30 мл), и при охлаждении на льду добавляли к нему гидрид калия (0,51 г, 12,7 ммоль). Реакционную смесь перемешивали в течение 30 минут при охлаждении на льду. К реакционному раствору при охлаждении на льду добавляли раствор (S)-3-бензил-4-метил-1,2,3-оксатиазолидин-2,2-диоксида (2,31 г, 10,15 ммоль) в THF (5 мл). Смесь перемешивали при 40°C в течение 2 часов. К смеси при охлаждении на льду добавляли 2 М водный раствор соляной кислоты (17 мл), а затем перемешивали в течение 1 часа при комнатной температуре. К смеси добавляли 2 М раствор гидроксида натрия (30 мл), и экстрагировали смесь этилацетатом. Реакционный растворитель упаривали в условиях пониженного давления, и очищали полученный остаток методом колоночной хроматографии на аминосиликагеле (хлороформ/метанол) с получением соединения a64 (3,7 г, выход 87%). 1H-ЯМР (CDCl3) δ: 1,01 (д, J=6,0 Гц, 3H), 1,05 (м, 9H), 1,15-1,22 (м, 2H), 1,33-1,41 (м, 2H), 1,74 (м, 2H), 1,88 (м, 2H), 2,85 (м, 1H), 3,25 (м, 2H), 3,35 (дд, J=4,0, 9,2 Гц, 1H), 3,68 (м, 1H), 3,70 (д, J=13,2 Гц, 1H), 3,83 (д, J=13,2 Гц, 1H), 7,20-7,44 (м, 11H), 7,66 (д, J=6,8 Гц, 4H).
Стадия 2. Получение соединения a65
Соединение a64 (50,5 г, 101 ммоль) растворяли в этаноле (505 мл), добавляли к нему Pd-C (11,3 г, 5,0 ммоль) и формиат аммония (12,7 г, 201 ммоль), и перемешивали смесь при 65°C в течение 3 часов. К смеси дополнительно добавляли формиат аммония (6,35 г, 101 ммоль), и перемешивали смесь при 65°C в течение 2,5 часов. Реакционную смесь фильтровали, и концентрировали фильтрат в условиях пониженного давления. К остатку добавляли насыщенный водный раствор карбоната натрия, и экстрагировали смесь этилацетатом. Органический слой промывали водой и солевым раствором, и сушили над безводным сульфатом магния. Растворитель отгоняли в условиях пониженного давления, полученный остаток растворяли в дихлорметане (253 мл), и добавляли к нему триэтиламин (13,95 мл, 101 ммоль) и уксусный ангидрид (10,5 мл, 111 ммоль). Смесь перемешивали при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли воду, и экстрагировали смесь этилацетатом. Органический слой промывали солевым раствором и сушили над безводным сульфатом магния. Растворитель отгоняли в условиях пониженного давления, и очищали полученный остаток методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением соединения a65 (37,75 г, выход 83%). 1H-ЯМР (CDCl3) δ: 1,05 (м, 9H), 1,12 (д, J=6,8 Гц, 3H), 1,16-1,26 (м, 2H), 1,33-1,43 (м, 2H), 1,75 (м, 2H), 1,89 (м, 2H), 1,93 (с, 3H), 3,28 (м, 1H), 3,32 (м, 1H), 3,38 (дд, J=4,0, 9,2 Гц, 1H), 3,71 (м, 1H), 4,08 (м, 1H), 5,63 (м, 1H), 7,34-7,44 (м, 6H), 7,66 (д, J=6,8 Гц, 4H).
Стадия 3. Получение соединения a66
Соединение a65 (30,2 г, 66,6 ммоль) растворяли в THF (100 мл), добавляли к нему 1 М фторид тетрабутиламмония (100 мл, 100 ммоль), и перемешивали смесь при 70°C в течение 7 часов. Реакционный раствор отгоняли в условиях пониженного давления, и очищали полученный остаток методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением соединения a66 (11,65 г, выход 81%). 1H-ЯМР (CDCl3) δ: 1,17 (д, J=6,8 Гц, 3H), 1,23-1,35 (м, 4H), 1,8-1,90 (м, 2H), 1,97 (с, 3H), 3,27 (м, 1H), 3,38 (дд, J=4,0, 9,6 Гц, 1H), 3,44 (дд, J=4,0, 9,6 Гц, 1H), 3,72 (м, 1H), 4,13 (м, 1H), 5,66 (ушир. с, 1H).
[0228]
Пример 12. Получение соединения a79
[Формула 108]

Стадия 1. Получение соединения a71
Соединение a70 (1,0 г, 4,15 ммоль) растворяли в диоксане (16 мл), и добавляли к нему трет-бутилметилкарбамат (653 мг, 4,98 ммоль), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (297 мг, 0,622 ммоль), фосфат калия (2,20 г, 10,73 ммоль) и трис(дибензилиденацетон)палладий (190 мг, 0,207 ммоль). Смесь перемешивали при 100°C в течение 5 часов. К смеси добавляли трет-бутилметилкарбамат (218 мг, 1,66 ммоль), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (99 мг, 0,207 ммоль), фосфат калия (0,73 г, 3,57 ммоль) и трис(дибензилиденацетон)палладий(0) (63,3 мг, 0,069 ммоль), и перемешивали смесь в течение 3 часов. Затем, к смеси добавляли трет-бутилметилкарбамат (435 мг, 3,32 ммоль), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (99 мг, 0,207 ммоль) и трис(дибензилиденацетон)палладий(0) (63,3 мг, 0,069 ммоль), и перемешивали смесь в течение 5,5 часов. К реакционной смеси добавляли воду, и экстрагировали смесь этилацетатом. Органический слой промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния, и концентрировали водный слой в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (гексаны/этилацетат) с получением соединения a71 (0,75 г, выход 74%). [M+H]=244,95, условия согласно способу 3: время удерживания 2,08 мин.
Стадия 2. Получение соединения a72
Циклопропанол (105 мг, 1,80 ммоль) растворяли в THF (5,0 мл), и добавляли к смеси соединение a71 (400 мг, 1,64 ммоль). К реакционной смеси при охлаждении на льду добавляли трет-бутоксид калия (239 мг, 2,12 ммоль), и перемешивали смесь в течение 3,5 часов при охлаждении на льду. К реакционной смеси добавляли воду, и экстрагировали смесь этилацетатом. Органический слой промывали насыщенным солевым раствором, и сушили над безводным сульфатом магния. Растворитель упаривали в условиях пониженного давления с получением соединения a72 (440 мг) в виде неочищенного продукта. [M+H]=283,30, условия согласно способу 3: время удерживания 2,18 мин.
Стадия 3. Получение соединения a73
Соединение a72 (440 мг, 1,55 ммоль) растворяли в дихлорметане (5,0 мл), и добавляли к смеси 4 М хлороводород в диоксане (10 мл, 40 ммоль). Затем, смесь перемешивали при комнатной температуре в течение 20 часов. Реакционный раствор упаривали в условиях пониженного давления, и добавляли к смеси 1 М водный раствор карбоната натрия. Смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель упаривали в условиях пониженного давления с получением соединения a73 (278 мг) в виде неочищенного продукта. [M+H]=183,00, условия согласно способу 3: время удерживания 0,98 мин.
Стадия 4. Получение соединения a74
Соединение a73 (278 мг, 1,52 ммоль) растворяли в ацетонитриле (5,0 мл), и добавляли к смеси N-бромсукцинимид (312 мг, 1,72 ммоль). Смесь перемешивали в течение 2 часов при комнатной температуре. После упаривания растворителя в условиях вакуума, очищали остаток методом колоночной хроматографии на силикагеле (гексаны/этилацетат) с получением соединения a74 (173 мг, выход 40%). 1H-ЯМР (CDCl3) δ: 0,77-0,82 (м, 4H), 3,17-3,20 (м, 3H), 4,25-4,27 (м, 1H), 4,44 (с, 1H). [M+H]=262,85, условия согласно способу 3: время удерживания 2,09 мин.
Стадия 5. Получение соединения a75
Соединение a74 (173 мг, 0,663 ммоль) растворяли в DMF (3,0 мл), к смеси при охлаждении на льду добавляли гидрид калия (34. 5 мг, 0,861 ммоль), и перемешивали смесь в течение 5 минут. К реакционному раствору добавляли бензилбромид (0,087 мл, 0,729 ммоль), и перемешивали смесь в течение 1,5 часов при охлаждении на льду. К смеси добавляли гидрид натрия (3,5 мг, 0,086 ммоль) и бензилбромид (0,009 мл, 0,0757 ммоль), и перемешивали смесь в течение 50 минут. К реакционной смеси добавляли воду, и экстрагировали смесь этилацетатом. Органический слой промывали насыщенным солевым раствором, и сушили водный слой над безводным сульфатом магния. После упаривания растворителя в условиях пониженного давления, очищали остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a75 (174 мг, выход 75%). [M+H]=350,90, условия согласно способу 3: время удерживания 2,86 мин.
Стадия 6. Получение соединения a76
Соединение a75 (170 мг, 0,484 ммоль) растворяли в толуоле (4,0 мл), и добавляли к смеси трет-бутоксид натрия (93,0 мг, 0,968 ммоль), трис(дибензилиденацетон)палладий(0) (44,3 мг, 0,048 ммоль), 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (60,3 мг, 0,097 ммоль) и бензиламин (0,212 мл, 1,938 ммоль). Смесь перемешивали при 100°C в течение 2 часов. Соль удаляли путем фильтрования, и упаривали реакционный раствор в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a76 (140 мг, выход 76%). [M+H]=378,05, условия согласно способу 3: время удерживания 2,83 мин.
Стадия 7. Получение соединения a77
Соединение a76 (140 мг, 0,371 ммоль) растворяли в метаноле (3,0 мл), и добавляли к смеси палладированный уголь (96. 0 мг, 0,115 ммоль) и формиат аммония (234 мг, 0,371 ммоль). Смесь перемешивали при 60°C в течение 45 минут. Реакционную смесь охлаждали до комнатной температуры, и добавляли к смеси дихлорметан (5,0 мл). Нерастворимые вещества удаляли путем фильтрования через целит. Растворитель упаривали в условиях пониженного давления с получением соединения a77 (69,0 мг) в виде неочищенного продукта.
Стадия 8. Получение соединения a78
Соединение a77 (69,0 мг, 0,349 ммоль) растворяли в THF (3,0 мл), и добавляли к смеси триэтиламин (0,206 мл, 1,484 ммоль) и 1,1'-тиокарбонилдиимидазол (74,2 мг, 0,408 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. К смеси добавляли триэтиламин (0,100 мл, 0,722 ммоль) и 1,1'-тиокарбонилдиимидазол (20,0 мг, 0,112 ммоль), и перемешивали смесь при комнатной температуре в течение 1 часа. К смеси добавляли метилйодид (0,500 мл, 8,00 ммоль), и перемешивали смесь в течение 2 часов при комнатной температуре. Растворитель отгоняли в условиях пониженного давления, и очищали остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a78 (36,0 мг, выход 38%). [M+H]=253,95, условия согласно способу 3: время удерживания 1,87 мин.
Стадия 9. Получение соединения a79
Соединение a78 (36,0 мг, 0,142 ммоль) растворяли в дихлорметане (2,0 мл), при охлаждении на льду добавляли к нему 69 масс.% мета-хлорпероксибензойную кислоту (74,6 мг, 0,298 ммоль), и перемешивали смесь при комнатной температуре в течение 18 часов. К смеси добавляли 69 масс.% мета-хлорпероксибензойную кислоту (25,0 мг, 0,703 ммоль), и перемешивали смесь в течение 3,5 часов. К смеси добавляли 69 масс.% мета-хлорпероксибензойную кислоту (10,0 мг, 0,281 ммоль), и перемешивали смесь в течение 1,5 часов. Реакционный раствор очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a79 (35,0 мг, выход 86%). [M+H]=285,90, условия согласно способу 3: время удерживания 1,77 мин.
[0229]
Пример 13. Получение соединения a85
[Формула 109]

Стадия 1. Получение соединения a83
Соединение a82 (5,00 г, 9,96 ммоль) растворяли в этаноле (20 мл), добавляли к нему палладированный уголь (0,5 г) и формиат аммония (6,28 г, 100 ммоль), и перемешивали смесь при 80°C в течение 3 часов. Нерастворимые вещества удаляли путем фильтрования на целите, и упаривали полученный фильтрат в условиях пониженного давления. Полученный неочищенный продукт соединения a83 использовали непосредственно на следующей стадии. [M+H]=412,05, условия согласно способу 3: время удерживания 2,19 мин.
Стадия 2. Получение соединения a84
1,1'-Карбонилдиимидазол (3,23 г, 19,96 ммоль) растворяли в диметилформамиде (25 мл), и при охлаждении на льду добавляли по каплям раствор соединения a83 в диметилформамиде (25 мл). Смесь перемешивали при комнатной температуре в течение 1,5 часов. К смеси при охлаждении на льду добавляли 28% водный раствор аммиака (10 мл, 129 ммоль), и перемешивали смесь при комнатной температуре в течение 17 часов. К реакционному раствору добавляли 0,5 М водный раствор соляной кислоты, и экстрагировали смесь этилацетатом. Органический слой сушили над безводным сульфатом магния, и упаривали растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат, хлороформ/метанол) с получением соединения a84 (4,35 г, выход 96%). [M+H]=455,10, условия согласно способу 3: время удерживания 2,82 мин. 1H-ЯМР (CDCl3) δ: 1,05 (с, 9H), 1,12 (д, J=6,8 Гц, 3H), 1,18-1,26 (м, 2H), 1,33-1,44 (м, 2H), 1,70-1,79 (м, 2H), 1,87-1,95 (м, 2H), 3,26-3,31 (м, 2H), 3,42 (дд, J=9,0, 3,5 Гц, 1H), 3,66-3,80 (м, 2H), 4,51-4,62 (м, 2H), 7,35-7,44 (м, 6H), 7,63-7,68 (м, 4H).
Стадия 3. Получение соединения a85
К соединению a84 (4,35 г, 9,57 ммоль) добавляли 1,0 М раствор фторида тетрабутиламмония в тетрагидрофуране (11 мл, 11,0 ммоль), и нагревали смесь с обратным холодильником в течение 4,5 часов. Реакционный раствор упаривали в условиях пониженного давления, и очищали полученный остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат, хлороформ/метанол) с получением соединения a85 (510 мг, выход 24%). 1H-ЯМР (MeOD) δ: 1,13 (д, J=6,8 Гц, 3H), 1,26-1,37 (м, 4H), 1,89-1,96 (м, 2H), 1,98-2,05 (м, 2H), 3,25-3,33 (м, 1H), 3,35-3,39 (м, 2H), 3,40-3,44 (м, 2H), 3,55-3,63 (м, 1H), 3,76-3,84 (м, 1H). [M+H]=217,00, условия согласно способу 3: время удерживания 0,72 мин.
[0230]
Пример 14. Получение соединения a92
[Формула 110]

Стадия 1. Получение соединения a87
Соединение a86 (1,34 мл, 11,4 ммоль) растворяли в тетрагидрофуране (20 мл), при охлаждении на льду добавляли к нему триэтиламин (1,90 мл, 13,7 ммоль), 2,0 М раствор монометиламина в тетрагидрофуране (6,0 мл, 24,0 ммоль), и перемешивали смесь при комнатной температуре в течение 20 часов. К реакционной смеси добавляли воду и насыщенный водный раствор хлорида аммония, и экстрагировали смесь этилацетатом. Органический раствор сушили над безводным сульфатом магния, а затем отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a87 (1,71 г, выход 80%). 1H-ЯМР (CDCl3) δ: 2,97 (д, J=5,0 Гц, 3H), 6,18-6,28 (м, 2H), 7,63 (ушир. с, 1H). [M+H]=188,95, условия согласно способу 3: время удерживания 1,87 мин.
Стадия 2. Получение соединения a88
Циклобутанол (340 мг, 5,85 ммоль) растворяли в тетрагидрофуране (10 мл), и добавляли к нему соединение a87 (1. 00 г, 5,32 ммоль), карбонат калия (1,62 г, 11,7 ммоль) и 18-краун-6 (4,22 г, 16,0 ммоль). Смесь перемешивали при 60°C в течение 3 часов. К реакционному раствору добавляли воду и 1,0 М водный раствор соляной кислоты, и экстрагировали смесь этилацетатом. Органический слой сушили над безводным сульфатом магния, а затем отгоняли растворитель. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a88 (254 мг, выход 21%). 1H-ЯМР (CDCl3) δ: 2,96 (д, J=5,0 Гц, 3H), 3,77-3,81 (м, 1H), 6,11-6,13(м, 1H), 6,20 (дд, J=13,6, 2,5 Гц, 1H), 7,84 (ушир. с, 1H). [M+H]=226,95, условия согласно способу 3: время удерживания 2,10 мин.
Стадия 3. Получение соединения a89
Соединение a88 (253 мг, 1,12 ммоль) растворяли в смеси этанола (4 мл) и тетрагидрофурана (4 мл), и при охлаждении на льду добавляли к ней цинк (732 мг, 11,2 ммоль) и хлорид аммония (732 мг, 11,2 ммоль). Смесь перемешивали при комнатной температуре в течение 5,5 часов. Нерастворимые вещества удаляли путем фильтрования на целите, и упаривали полученный фильтрат в условиях пониженного давления с получением соединения a89 в виде неочищенного продукта. [M+H]=197,05, условия согласно способу 3: время удерживания 1,37 мин.
Стадия 4. Получение соединения a90
Неочищенное соединение a89 растворяли в тетрагидрофуране (5 мл), и добавляли к нему 1,1'-тиокарбонилдиимидазол (438 мг, 2,46 ммоль) и имидазол (304 мг, 4,47 ммоль). Смесь перемешивали при комнатной температуре в течение 16 часов. К смеси добавляли 1,1'-тиокарбонилдиимидазол (319 мг, 1,79 ммоль), и перемешивали смесь при комнатной температуре в течение 2,5 часов. К реакционной смеси добавляли карбонат калия (618 мг, 4,47 ммоль) и метилйодид (0,182 мл, 2,91 ммоль), и перемешивали смесь при комнатной температуре в течение 15 часов. Нерастворимые вещества удаляли путем фильтрования, а затем упаривали полученный фильтрат в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a90 (269 мг, выход 95%). [M+H]=253,25, условия согласно способу 3: время удерживания 1,91 мин
Стадия 5. Получение соединения a91
Соединение a90 (269 мг, 1,07 ммоль) растворяли в дихлорметане (5 мл), и при охлаждении на льду добавляли к нему 3-хлорпероксибензойную кислоту (560 мг, 2,24 ммоль). Смесь перемешивали при комнатной температуре в течение 2,5 часов. Реакционный раствор отгоняли в условиях пониженного давления, и очищали полученный остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a91 (260 мг, выход 86%). [M+H]=284,90, условия согласно способу 3: время удерживания 1,83 мин.
Стадия 6. Получение соединения a92
Соединение a85 (44,9 мг, 0,208 ммоль) растворяли в диметилформамиде (1 мл), и при охлаждении на льду добавляли к нему трет-бутоксид калия (66,9 мг, 0,623 ммоль). Смесь сразу перемешивали в течение 10 минут. К смеси добавляли раствор соединения a91 (59,0 мг, 0,280 ммоль) в диметилформамиде (1,5 мл), и перемешивали смесь в течение 4 часов. К реакционной смеси добавляли воду, и экстрагировали смесь этилацетатом. Органический слой сушили над безводным сульфатом магния, а затем отгоняли растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат, хлороформ/метанол) с получением соединения a92 (58 мг, выход 67%). 1H-ЯМР (CDCl3) δ: 0,77-0,80 (м, 4H), 1,19 (д, J=6,8 Гц, 3H), 1,49-1,71 (м, 4H), 1,97-2,05 (м, 2H), 2,16-2,25 (м, 2H), 3,35-3,45 (м, 2H), 3,49-3,53 (м, 4H), 3,71-3,77 (м, 1H), 3,87 (ушир. с, 1H), 4,50 (ушир. с, 2H), 4,59 (ушир. д, J=6,0 Гц, 1H,), 5,16-5,24 (м, 1H), 6,62 (д, J=2,0 Гц, 1H), 6,67 (дд, J=12,0, 2,0 Гц, 1H). [M+H]=421,05, условия согласно способу 3: время удерживания 1,95 мин.
[0231]
Пример 15. Получение соединения a94
[Формула 111]

Стадия 1. Получение соединения a93
Смесь соединения a43 (11 мг, 0,062 ммоль) и соединения a22 (30 мг, 0,093 ммоль) растворяли в THF (0,7 мл). К реакционной смеси добавляли при охлаждении на льду трет-бутоксид калия (17 мг, 0,156 ммоль), и перемешивали смесь в течение 1 часа. К реакционной смеси добавляли воду, и экстрагировали смесь этилацетатом. После упаривания в условиях пониженного давления, полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a93 (20 мг, выход 59%).
Стадия 2. Получение соединения a94
Соединение a93 (20 мг, 0,037 ммоль) растворяли в хлористом метилене (0,7 мл). К реакционной смеси при охлаждении на льду добавляли трифторуксусную кислоту (0,28 мл, 3,7 ммоль), и перемешивали смесь в течение 30 минут. К смеси добавляли 2 М водный раствор гидроксида натрия, и экстрагировали смесь этилацетатом. После упаривания в условиях пониженного давления, полученное амино-соединение растворяли в хлористом метилене (0,7 мл). К нему при комнатной температуре добавляли пиридин (20 мкл, 0,25 ммоль) и 4-нитрофенилкарбонилхлорид (15 мг, 0,075 ммоль), и перемешивали смесь в течение 2 часов. К реакционной смеси добавляли воду, и экстрагировали смесь этилацетатом. После упаривания в условиях пониженного давления, полученный карбамат растворяли в ацетонитриле (0,7 мл). К реакционному раствору при комнатной температуре добавляли DIEA (44 мкл, 0,25 ммоль) и хлорид аммония (13 мг, 0,25 ммоль), и перемешивали смесь в течение 1 часа. К реакционной смеси добавляли воду, и экстрагировали смесь этилацетатом. После упаривания в условиях пониженного давления, полученный остаток очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением соединения a94 (13,6 мг, выход 57%). 1H-ЯМР (CDCl3) δ: 1,58 (м, 2H), 1,67 (м, 2H), 2,02 (м, 2H), 2,17 (м, 2H), 3,45 (м, 1H), 3,55 (м, 1H), 3,62 (м, 1H), 3,70 (с, 3H), 4,11 (м, 1H), 4,23 (дт, J=4,0, 13,2 Гц, 2H), 4,39 (м, 1H), 4,43 (ушир. с, 2H), 4,50 (м, 1H), 4,62 (дд, J=4,0, 8,8 Гц, 1H), 4,88 (д, J=8,4 Гц, 1H), 5,19 (м, 1H), 6,60 (тт, J=4,0, 54,8 Гц, 1H) 6,62 (дд, J=6,0, 10,4 Гц, 1H).
[0232]
Пример 16. Получение соединения a110
[Формула 112]

Стадия 1. Получение соединения a97
К раствору соединения a96 (3,00 г, 14,6 ммоль) в дихлорметане (30 мл) при -78°C по каплям добавляли 1,04 М раствор диизобутилалюмогидрида в гексане (15 мл, 15,6 ммоль), и перемешивали смесь при той же температуре в течение 2 часов. К реакционной смеси добавляли воду (15 мл), смесь разбавляли этилацетатом, а затем перемешивали смесь при комнатной температуре в течение 45 минут. Полученное белое твердое вещество фильтровали через целит, и отгоняли растворитель в условиях пониженного давления. К остатку добавляли этилацетат, и проводили дегидратацию раствора путем азеотропной перегонки. Полученное бесцветное масло использовали на следующей стадии без очистки.
Стадия 2. Получение соединения a98
К раствору полученного на стадии 1 соединения a97 в дихлорметане (30 мл) при комнатной температуре добавляли пиридин (3,5 мл, 43,7 ммоль), безводную уксусную кислоту (3,4 мл, 36,4 ммоль) и DMAP (1,78 г, 14,6 ммоль), и перемешивали смесь в течение 1 часа. Реакционный раствор концентрировали в условиях пониженного давления, и очищали полученный остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a98 (3,31 г, выход 91%) в виде бесцветного масла.
Стадия 3. Получение соединения a99
К раствору соединения a98 (3,31 г, 13,2 ммоль) и аллилтриметилсилана (6,04 г, 52,8 ммоль) в дихлорметане (88 мл) при -78°C по каплям добавляли комплекс трифторида бора и диэтилового эфира (2,00 мл, 15,9 ммоль), и перемешивали смесь в течение 30 минут при комнатной температуре. К реакционной смеси добавляли воду, и нейтрализовали смесь добавлением гидрокарбоната натрия. Смесь экстрагировали этилацетатом. Органический слой промывали водой, и концентрировали растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a99 (2,63 г, 86% выход) в виде бесцветного масла. 1H-ЯМР (CDCl3) δ: 1,27-1,50 (2H, м), 1,75 (1H, ддд, J=13,0, 5,6, 3,3 Гц), 2,13-2,31 (3H, м), 3,18 (1H, т, J=10,4 Гц), 3,27-3,33 (1H, м), 3,42-3,49 (1H, м), 4,09 (1H, д.кв, J=10,8, 2,3 Гц), 4,56 (2H, кв, J=11,8 Гц), 5,04-5,10 (2H, м), 5,76-5,86 (1H, м), 7,26-7,36 (5H, м).
Стадия 4. Получение соединения a100
К раствору соединения a99 (486 мг, 2,09 ммоль) в смеси ацетона (17 мл), воды (3,8 мл) и уксусной кислоты (0,8 мл) при комнатной температуре добавляли раствор перманганата калия (537 мг, 3,40 ммоль) в смеси ацетона (9,4 мл) и воды (3,1 мл), и перемешивали смесь в течение ночи. К реакционному раствору добавляли этанол (1 мл), и удаляли нерастворимые вещества путем фильтрования на целите. Отфильтрованное твердое вещество промывали этилацетатом, и концентрировали фильтрат в условиях пониженного давления. К концентрированному остатку добавляли толуол, и проводили дегидратацию раствора путем азеотропной перегонки. Концентрированный остаток разбавляли этилацетатом, и фильтровали нерастворимые вещества. Фильтрат концентрировали в условиях пониженного давления с получением смеси соединения a100 и соединения a99 в соотношении 73/27. Полученное соединение использовали в следующей реакции без дополнительной очистки. [M+H]=265,05, условия согласно способу 3: время удерживания 1,65 мин.
Стадия 5. Получение соединения a101
К раствору полученной на стадии 4 смеси соединения a100 и соединения a99 в этилацетате (5,5 мл) при комнатной температуре добавляли триэтиламин (0,406 мл, 2,93 ммоль), безводную уксусную кислоту (0,237 мл, 2,51 ммоль) и DMAP (77,0 мг, 0,628 ммоль), и перемешивали смесь при комнатной температуре в течение 40 минут. Реакционную смесь разбавляли этилацетатом, и промывали водный слой водой. Органический слой упаривали в условиях пониженного давления, и очищали полученный остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a101 (298 мг, выход 47%) в виде бесцветного масла. 1H-ЯМР (CDCl3) δ: 1,33-1,50 (2H, м), 1,79 (1H, дт, J=10,0, 2,7 Гц), 2,03-2,23 (4H, м), 2,44 (1H, дд, J=15,3, 4,6 Гц), 2,61 (1H, дд, J=15,3, 7,8 Гц), 3,18 (1H, т, J=10,5 Гц), 3,41-3,46 (1H, м), 3,69-3,73 (1H, м), 4,04 (1H, д.кв, J=10,9, 2,3 Гц), 4,49-4,75 (4H, м), 7,25-7,37 (5H, м).
Стадия 6. Получение соединения a102
К раствору соединения a101 (296 мг, 0,966 ммоль) в дихлорметане (6 мл) при 0°C добавляли трифторид N,N-диэтиламиносеры (0,38 мл, 2,90 ммоль), и перемешивали смесь при комнатной температуре в течение 19 часов. К смеси добавляли трифторид N,N-диэтиламиносеры (0,255 мл, 1,93 ммоль), и дополнительно перемешивали смесь в течение 24 часов. К реакционной смеси добавляли лед, и нейтрализовали смесь добавлением гидрокарбоната натрия. Смесь экстрагировали этилацетатом. Органический слой концентрировали в условиях пониженного давления, и очищали полученный остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a102 (145 мг, выход 46%) в виде бесцветного масла.
Кроме того, соединение a101 извлекали (87,3 мг, извлекаемая доля: 30%) и растворяли в дихлорметане (1,6 мл), и добавляли к нему трифторид N,N-диэтиламиносеры (0,188 мл, 1,43 ммоль). Смесь перемешивали в течение 65 часов. Реакционную смесь подвергали той же процедуре, что и описанная выше обработка, с получением соединения a102 (50,0 мг, выход 53%) в виде бесцветного масла. 1H-ЯМР (CDCl3) δ: 1,38-1,54 (2H, м), 1,77 (1H, дд, J=12,8, 2,4 Гц), 1,93-2,24 (6H, м), 3,17 (1H, т, J=10,5 Гц), 3,39-3,57 (2H, м), 4,05 (1H, д.кв, J=10,9, 2,3 Гц), 4,22-4,38 (2H, м), 4,55 (2H, дд, J=22,3, 11,9 Гц), 7,23-7,39 (7H, м).
Стадия 7. Получение соединения a103
К раствору соединения a102 (142 мг, 0,432 ммоль) в THF (4 мл) при -78°C по каплям добавляли 1,00 М раствор диизобутилалюмогидрида в гексане (0,95 мл, 0,95 ммоль), и перемешивали смесь при комнатной температуре в течение 20 минут. К реакционной смеси добавляли воду (1 мл). Органический слой разбавляли этилацетатом, и перемешивали смесь при комнатной температуре в течение 45 минут. Выпавшее в осадок белое твердое вещество удаляли путем фильтрования на целите, и упаривали фильтрат в условиях пониженного давления. К концентрированному остатку добавляли этилацетат, и проводили дегидратацию раствора путем азеотропной перегонки. Полученное бесцветное масло использовали на следующей стадии без дополнительной очистки.
Кроме того, К раствору соединения a102 (50,0 мг, 0,152 ммоль) в THF (2 мл) при -78°C по каплям добавляли 1,00 М раствор диизобутилалюмогидрида в гексане (0,54 мл, 0,54 ммоль), и перемешивали смесь при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду (0,54 мл). Органический слой разбавляли этилацетатом, и перемешивали смесь при комнатной температуре в течение 45 минут. Выпавшее в осадок белое твердое вещество удаляли путем фильтрования на целите, а затем упаривали фильтрат в условиях пониженного давления. К концентрированному остатку добавляли этилацетат, и проводили дегидратацию раствора путем азеотропной перегонки. Полученное бесцветное масло использовали на следующей стадии без дополнительной очистки.
Стадия 8. Получение соединения a104
К раствору полученного на стадии 7 соединения a103 в дихлорметане (2,0 мл) при комнатной температуре добавляли реагент Десс-Мартина (220 мг, 0,519 ммоль), и перемешивали смесь в течение 22 часов.
Кроме того, к раствору другого полученного на стадии 9 соединения a102 в дихлорметане (2,0 мл) при комнатной температуре добавляли реагент Десс-Мартина (77,0 мг, 0,182 ммоль), и перемешивали смесь в течение 17 часов. Объединенные два реакционных раствора концентрировали, и разбавляли смесь этилацетатом. Раствор фильтровали через целит для удаления нерастворимых веществ. Фильтрат концентрировали, и разбавляли смесь этилацетатом (4 мл) и гексаном (4 мл). Реакционный раствор фильтровали через целит для удаления нерастворимых веществ. Фильтрат упаривали в условиях пониженного давления, и использовали полученное желтое масло на следующей стадии без дополнительной очистки.
Стадия 9. Получение соединения a105
К раствору полученного на стадии 8 соединения a104 в дихлорметане (6 мл) добавляли безводный сульфат меди (420 мг, 2,63 ммоль) и (S)-2-метилпропан-2-сульфинимид (106 мг, 0,877 ммоль), и нагревали смесь с обратным холодильником в течение 23 часов. Реакционную смесь охлаждали до комнатной температуры, и удаляли нерастворимые вещества путем фильтрования на целите. Фильтрат концентрировали, и очищали полученный остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a105 (161 мг, выход 71%) в виде бесцветного масла. [M+H]=388,05, условия согласно способу 3: время удерживания 2,49 мин.
Стадия 10. Получение соединения a106
К раствору соединения a105 (159 мг, 0,411 ммоль) в дихлорметане (3 мл) при -78°C по каплям добавляли 3 М раствор метилмагнийбромида в диэтиловом эфире (0,27 мл, 0,27 ммоль), и перемешивали смесь в течение 1 часа. Температура реакционной смеси повышалась до -15°C, после чего к ней по каплям дополнительно добавляли 3 М раствор метилмагнийбромида в диэтиловом эфире (0,27 мл, 0,27 ммоль). Смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь разбавляли водой, и добавляли 2 М водный раствор соляной кислоты для корректировки реакционной смеси до pH=5. Смесь экстрагировали этилацетатом. Органический слой промывали водой, а затем концентрировали растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a106 (44,8 мг, выход 27%) в виде желтого масла. 1H-ЯМР (CDCl3) δ: 1,20 (9H, с), 1,34 (3H, д, J=6,8 Гц), 1,37-1,55 (2H, м), 1,71-1,77 (1H, м), 1,88-2,03 (1H, м), 2,14-2,31 (2H, м), 3,21 (1H, т, J=10,5 Гц), 3,43-3,48 (1H, м), 3,59 (1H, дд, J=14,1, 5,2 Гц), 3,70 (1H, дд, J=15,3, 7,2 Гц), 4,02-4,20 (2H, м), 4,55 (2H, дд, J=25,0, 11,9 Гц), 7,27-7,39 (5H, м).
Стадия 11. Получение соединения a107
К раствору соединения a106 (43,2 мг, 0,107 ммоль) в метаноле (1 мл) при комнатной температуре добавляли 4 М раствор хлороводорода в диоксане (0,027 мл, 0,107 ммоль), и перемешивали смесь в течение 20 минут. Реакционный раствор концентрировали, и использовали выпавшее в осадок белое твердое вещество на следующей стадии без дополнительной очистки. [M+H]=300,05, условия согласно способу 3: время удерживания 1,35 мин.
Стадия 12. Получение соединения a108
К раствору полученного на стадии 11 соединения a107 в THF (1 мл) при комнатной температуре добавляли 2 М водный раствор гидроксида натрия и безводную уксусную кислоту (0,015 мл, 0,161 ммоль), и перемешивали смесь в течение 30 минут. Реакционный раствор разбавляли водой и экстрагировали этилацетатом. Органический слой промывали водой, и концентрировали растворитель в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением соединения a108 (32,3 мг, выход 88%) в виде бесцветного масла. [M+H]=342,10, условия согласно способу 3: время удерживания 1,94 мин.
Стадия 13. Получение соединения a109
К раствору соединения a108 (32,3 мг, 0,095 ммоль) в метаноле (4 мл) при комнатной температуре добавляли 20% гидроксид палладия (увлажненный до 50% водой, 24,8 мг, 0,018 ммоль), и перемешивали смесь в атмосфере водорода (1 атм) в течение 6 часов. Атмосферу водорода в реакторе заменяли атмосферой азота, и фильтровали реакционную смесь через целит. Фильтрат концентрировали в условиях пониженного давления, и очищали полученный остаток методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением соединения a109 (22,2 мг, выход 93%) в виде белого твердого вещества. [M+H]=130,05, условия согласно способу 3: время удерживания 1,00 мин.
Стадия 14. Получение соединения a110
К раствору соединения a22 (22,2 мг, 0,088 ммоль) и соединения a109 (28,8 мг, 0,088 ммоль) в THF (2 мл) при 0°C добавляли трет-бутоксид калия (20,8 мг, 0,186 ммоль), и перемешивали смесь при комнатной температуре в течение 1 часа. К реакционному раствору добавляли лед, и экстрагировали смесь этилацетатом. Органический слой промывали водой и концентрировали в условиях пониженного давления. Полученный остаток очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением соединения a110 (30,4 мг, выход 69%) в виде белого твердого вещества. 1H-ЯМР (CDCl3) δ: 1,23 (3H, д, J=6,8 Гц), 1,63-1,72 (2H, м), 1,87-2,10 (5H, м), 2,17-2,31 (1H, м), 2,47-2,51 (1H, м), 3,40 (1H, т, J=10,4 Гц), 3,70 (4H, д, J=8,5 Гц), 4,23 (2H, дт, J=3,9, 13,0 Гц), 4,29-4,35 (1H, м), 4,40-4,55 (1H, м), 5,11-5,21 (1H, м), 5,82 (1H, д, J=9,7 Гц), 6,09 (1H, тт, J=55,0, 4,1 Гц), 6,62 (1H, дд, J=10,6, 6,1 Гц).
[0233]
Соединения I-194 - I-252 синтезировали в соответствии с той же методикой, что и описанная в представленных выше примерах. Их химические формулы и физические константы представлены ниже.
[0234]
[Таблица 1]

[0235]
[Таблица 2]

[0236]
[Таблица 3]
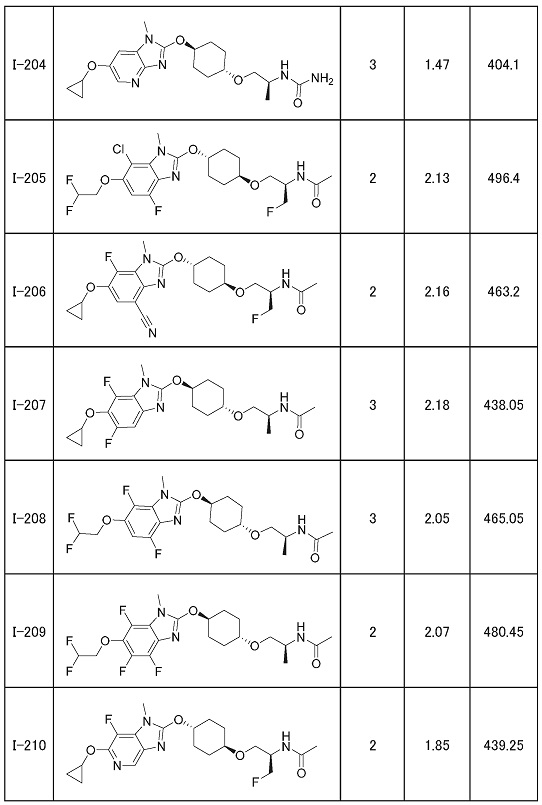
[0237]
[Таблица 4]

[0238]
[Таблица 5]

[0239]
[Таблица 6]

[0240]
[Таблица 7]

[0241]
[Таблица 8]

[0242]
[Таблица 9]

[0243]
Биологические тестовые примеры согласно настоящему изобретению описаны ниже.
[0244]
Подготовительный пример 1: Получение рекомбинантной ACC2 человека
После клонирования кДНК, кодирующей ACC2 человека (N-концевые аминокислотные остатки от 27 до 2458), из библиотеки кДНК почки человека (Clontech), проводили инсерцию гена ACC2 человека, содержащего последовательность His-tag на 5'-конце, в pFastBac1 (Invitrogen). Рекомбинантный бакуловирус создавали с использованием системы экспрессии бакуловируса Bac-to-Bac (Invitrogen) в соответствии с протоколом производителя. Для экспрессии ACC2 человека клетки Sf-9 инфицировали рекомбинантным бакуловирусом. После разрушения инфицированных клеток, фильтрованный лизат подвергали Ni-аффинной хроматографии и анион-обменной хроматографии. Фракции, содержащие белок ACC2 человека, объединяли в виде раствора рекомбинантного ACC2 человека.
[0245]
Подготовительный пример 2: Получение рекомбинантной ACC1 человека
После клонирования кДНК ACC1 человека (N-концевые аминокислотные остатки от 1 до 2346) из библиотеки кДНК печени человека (BioChain), проводили инсерцию гена ACC1 человека, содержащего последовательности myc-tag и His-tag на 3'-конце, в рIEXBAC3 (Novagen). Рекомбинантный бакуловирус создавали с использованием системы FlashBACGOLD (Oxford Expression Technologies) в соответствии с протоколом производителя. Для экспрессии ACC1 человека клетки Sf-9 инфицировали рекомбинантным бакуловирусом. После разрушения инфицированных клеток, фильтрованный лизат подвергали Ni-аффинной хроматографии и анион-обменной хроматографии. Фракции, содержащие белок ACC1 человека, объединяли в виде раствора рекомбинантного ACC1 человека.
[0246]
Тестовый пример 1: Измерение ингибирующей активности в отношении ACC1 и ACC2 человека
Рекомбинантную ACC1 человека и рекомбинантную ACC2 человека, которые получали посредством способа, упомянутого выше, прединкубировали с аналитическим буферным раствором (50 мМ HEPES-KOH (pH 7,4), 10 мМ хлорида магния, 6-10 мМ цитрата калия, 4 мМ восстановленной формы глутатиона, 1,5 мг/мл альбумина бычьей сыворотки) в течение 1 часа. Затем, в 384-луночный микропланшет добавляли 0,2 мкл раствора каждого из соединений согласно настоящему изобретению (в DMSO), в микропланшет добавляли 5 мкл прединкубированного раствора фермента и 5 мкл раствора субстрата (50 мМ HEPES-KOH (pH 7,4), 1 мМ АТФ, 0,8 мМ ацетил-CoA и 25-50 мМ бикарбоната калия). После центрифугирования и встряхивания, реакционные смеси инкубировали в увлажненном боксе при комнатной температуре в течение 1-3 часов. После инкубирования, ферментативные реакции останавливали добавлением EDTA. Затем, после сокристаллизации образцов с содержащими CHCA (α-циано-4-гидроксикоричная кислота) матрицами на пластине для MALDI, с использованием матричной времяпролетной масс-спектрометрии с лазерной деионизацией (MALDI-TOF MS), образцы измеряли в режиме регистрации отрицательно заряженных ионов. Определяли депротонированные ионы ацетил-CoA (AcCoA) субстрата и малонил-CoA (MalCoA) продукта реакции, а затем по величине каждого сигнала рассчитывали скорость преобразования ацетил-CoA в малонил-CoA по формуле: интенсивность [MalCoA-H]-/(интенсивность [MalCoA-H]-+интенсивность [AcCoA-H]-). По скорости ингибирования ферментативной реакции для каждой концентрации соединений вычисляли концентрацию полумаксимального ингибирования (IC50). Кроме того, для каждого типа фермента корректировали концентрации цитрата калия в аналитическом буферном растворе, концентрации гидрокарбоната калия в растворе субстрата и время инкубирования.
[0247]
Измеряли концентрацию полумаксимального ингибирования (IC50) соединения I-199, I-204, I-230, I-233, I-242, I-245, I-248 и I-252 в отношении ACC1 человека, и результаты для указанных соединений составили более 100 мкМ.
[0248]
Ингибирующая активность каждого соединения согласно настоящему изобретению в отношении ACC2 человека представлена в следующей таблице.
[0249]
[Таблица 10]

[0250]
Тестовый пример 2: Тест на ингибирование CYP
Используя коммерчески доступные микросомы печени человека и О-деэтилирование 7-этоксирезоруфина (CYP1A2), метилгидроксилирование толбутамида (CYP2C9), 4'-гидроксилилрование мефенитоина (CYP2C19), О-деметилирование декстрометорфана (CYP2D6) и гидроксилирование терфенедина (CYP3A4) в качестве типичных маркерных реакций метаболизма субстрата пятью основными ферментативными формами CYP человека (CYP1A2, 2C9, 2C19, 2D6, 3A4), оценивали степень ингибирования продукции каждого продукта метаболизма тестируемого соединения.
[0251]
Условия реакции были следующими: субстрат, 0,5 мкМ S-мефенитоина (CYP2C19), 5 мкМ декстрометорфана (CYP2D6), 1 мкМ терфенедина (CYP3A4); время реакции 15 минут; температура реакции 37°C; фермент, смешанные микросомы печени человека, 0,2 мг белка/мл; концентрация тестируемого лекарства 1, 5, 10, 20 мкМ (четыре точки).
[0252]
Каждый из пяти видов субстратов, микросомы печени человека или тестируемое лекарство в 50 мМ Hepes-буфера в качестве реакционного раствора добавляли в 96-луночный планшет в описанной выше композиции, для инициации маркерных реакций метаболизма в качестве кофактора добавляли NADPH, и после инкубирования при температуре 37°C в течение 15 минут, добавляли смесь метанол/ацетонитрил=1/1 (по объему) для остановки реакции. После центрифугирования при 3000 об/мин в течение 15 минут при помощи флуоресцентного многоканального счетчика в надосадочной жидкости подсчитывали количество резоруфина (метаболит CYP1A2), а количество гидроксида трибутамида (метаболит CYP2CP), 4'-гидроксида мефенитоина (метаболит CYP2C19), декстрометорфана (метаболит CYP2D6) и терфенадинового спирта (метаболит CYP3A4) подсчитывали методом LC/MS/MS.
[0253]
Добавление только DMSO, являющегося растворителем, растворяющим лекарство для реакционной системы, рассматривали в качестве контроля (100%), остаточную активность (%) вычисляли для каждой концентрации тестируемого лекарства, добавленного в виде раствора, и вычисляли IC50 согласно обратному допущению в логистической модели с использованием концентрации и степени ингибирования.
[0254]
Тестовый пример 3: Тест ВА
Экспериментальное вещество и способ оценки перорального всасывания
(1) Используемые животные: использовали крыс SD или мышей;
(2) Условия содержания: пища и стерилизованная питьевая вода в свободном доступе;
(3) Определение параметров дозирования и деления на группы: Определенную заранее дозу вводили перорально или внутривенно; Группы формировали как представлено ниже (доза варьировала в зависимости от каждого соединения):
пероральное введение 1-30 мг/кг (n=2-3)
внутривенное введение 0,5-10 мг/кг (n=2-3)
(4) Приготовление вводимых жидкостей: При пероральном введении вводили раствор или суспензию. При внутривенном введении, введение осуществляют после солюбилизации.
(5) Способ введения: При пероральном введении, обязательное введение в желудок проводили с использованием пероральной пробы. При внутривенном введении, введение через хвостовую вену осуществляли с использованием шприца с инъекционной иглой.
(6) Параметр оценки: Кровь собирали хронологически, а затем измеряли концентрацию соединения согласно настоящему изобретению в плазме крови методом LC/MS/MS.
(7) Статистический анализ: Принимая во внимание изменение концентрации в плазме, площадь под кривой в координатах концентрация в плазме-время (AUC) вычисляли с использованием нелинейного метода наименьших квадратов в программе WinNonlin®. Биодоступность (ВА) вычисляли по AUC для пероральной группы введения и для внутривенной группы введения, соответственно.
[0255]
Тестовый пример 4: Тест на стабильность метаболизма
Используя коммерчески доступные смешанные микросомы печени человека, осуществляли взаимодействие тестируемого соединения в течение постоянного времени, и рассчитывали остаточную скорость путем сравнения прореагировавшего образца и не прореагировавшего образца, оценивая тем самым степень метаболизма в печени.
[0256]
Реакцию (реакцию окисления) осуществляли при температуре 37°C в течение 0 минут или 30 минут в присутствии 1 мМ NADPH в 0,2 мл буфера (50 мМ Трис-HCl pH 7,4, 150 мМ хлорида калия, 10 мМ хлорида магния), содержащего 0,5 мг белка/мл микросом печени человека. После реакции, 50 мкл реакционного раствора добавляли к 100 мкл смеси метанол/ацетонитрил=1/1 (по объему), перемешивали и центрифугировали при 3000 об/мин в течение 15 минут. Тестируемое соединение в надосадочной жидкости оценивали методом LC/MS/MS, и рассчитывали количество тестируемого соединения после реакции, принимая за 100%количество соединения на 0 минуте реакции. Реакцию гидролиза осуществляли в отсутствие NADPH, а реакцию глюкуронидации проводили в присутствии 5 мМ UDP-глюкуроновой кислоты вместо NADPH, с проведением последующих аналогичных процедур.
[0257]
Тестовый пример 5: Флуоресцентный MBI тест на CYP3A4
Флуоресцентный MBI тест на CYP3A4 представляет собой тест на усиление соединением ингибирования CYP3A4 в реакции метаболизма, и проводили тест с использованием реакции, в которой 7-бензилокситрифторметилкумарин (7-BFC) дебензилировали ферментом CYP3A4 с получением метаболита, 7-гидрокситрифтор-метилкумарина (7-HFC), испускающего флуоресцентное излучение.
[0258]
Условия реакции были следующими: субстрат, 5,6 мкМ 7-BFC; время до реакции 0 или 30 минут; время реакции 15 минут; температура реакции 25°C (комнатная температура); содержание CYP3A4 (экспрессируемого в Escherichia coli) до реакции 62,5 пмоль/мл, в ходе реакции 6,25 пмоль/мл (10-кратное разбавление); концентрация тестируемого лекарства 0,625, 1,25, 2,5, 5, 10, 20 мкМ (шесть точек).
[0259]
Фермент в K-Pi буфере (рН 7,4) и раствор тестируемого лекарства в качестве дореакционной смеси добавляли в 96-луночный планшет в дореакционную композицию, часть переносили в другой 96-луночный планшет так, чтобы получить разбавление 1/10 субстратом в K-Pi буфере, в качестве кофактора добавляли NADPH для запуска показательной реакции («без прединкубации»), и после определенного времени реакции добавляли смесь ацетонитрил/0,5 М Трис (трисгидроксиаминометан)=4/1 (по объему) для остановки реакции. Кроме того, в остающийся прединкубируемый раствор добавляли NADPH для начала прединкубации («с прединкубацией»), после определенного времени прединкубации часть перемещали на другой планшет так, чтобы получить разбавление 1/10 субстратом в K-Pi буфере, для запуска показательной реакции. Через определенное время реакции добавляли смесь ацетонитрил/0,5 М Трис (трисгидроксиаминометан)=4/1 (по объему) для остановки реакции. При помощи флуоресцентного планшетного ридера, в планшете, в котором проводили каждую показательную реакцию, измеряли значение флуоресценции 7-HFC (возбуждение=420 нм, испускание=535 нм), который представляет собой метаболитом реакции.
[0260]
Добавление только DMSO, являющегося растворителем, растворяющим лекарство для реакционной системы, рассматривали в качестве контроля (100%), для каждой концентрации тестируемого лекарства, добавленного в виде раствора, вычисляли остаточную активность (%), и вычисляли IC50 согласно обратному допущению в логистической модели с использованием концентрации и степени ингибирования. Если разница между значениями IC50 составляла 5 мкМ или более, то ее определяли как (+), а если разница составляла 3 мкМ или менее, то ее определяли как (-)
[0261]
Тестовый пример 6: Тест на флуктуацию Эймса
Соединения согласно настоящему изобретению оценивали на мутагенные свойства.
В 10 мл жидкой питательной среды (2,5% Oxoid питательная среда №2) вносили 20 мкл замороженных бацилл тифа крыс (штамм TA98, штамм TA100 Salmonella typhimurium), и культивировали при встряхивании при температуре 37°C в течение 10 часов. Для удаления культурального раствора, центрифугировали (2000 об/мин, 10 минут) 9 мл бактериального раствора штамма ТА98, бактерии суспендировали в 9 мл буфера Micro F (K2HPO4: 3,5 г/л, KH2PO4: 1 г/л, (NH4)2SO4: 1 г/л, тринатрия цитрат дегидрат: 0,25 г/л, MgSO4•7H2O: 0,1 г/л), суспензию добавляли в 110 мл среды для обработки (буфер Micro F, содержащий биотин: 8 мкг/мл, гистидин: 0,2 мкг/мл, глюкоза: 8 мг/мл), и добавляли штамм ТА100 в 120 мл среды для обработки к 3,16 мл бактериального раствора с получением бактериального раствора для тестирования. Двенадцать микролитров каждого из раствора тестируемого вещества в DMSO (8-стадийное разбавление в 2-3-раза, начиная от максимальной дозы 50 мг/мл); DMSO в качестве отрицательного контроля; 50 мкг/мл раствор 4-нитрохинолин-1-оксида в DMSO для штамма ТА98, 0,25 мкг/мл раствор 2-(2-фурил)-3-(5-нитро-2-фурил)акриламида в DMSO для штамма ТА100 в условиях отсутствия активации метаболизма; 40 мкг/мл раствор 2-аминоантрацена в DMSO для штамма ТА98, 20 мкг/мл раствор 2-аминоантрацена в DMSO для штамма ТА100 в условиях активирования метаболизма в качестве положительного контроля; и 588 мкл тестируемого бактериального раствора (смешанный раствор из 498 мкл тестируемого бактериального раствора и 90 мкл смеси S9 в условиях активирования метаболизма) перемешивали и культивировали при встряхивании при температуре 37°C в течение 90 минут. Смешивали 460 мкл бактериального раствора, подвергавшегося обработке тестируемым веществом, с 2300 мкл индикаторной среды (Micro F буфер, содержащий биотин: 8 мкг/мл, гистидин: 0,2 мкг/мл, глюкоза: 8 мг/мл, Бром-крезол Пурпурный 37,5 мкг/мл), распределяли смесь в микропланшете по 50 мкл (48 лунок на дозу), и подвергали стационарному культивированию при температуре 37°C в течение 3 суток. Поскольку в лунке с бактерией, которая получила способность к пролиферации посредством мутации гена фермента, синтезирующего аминокислоты (гистидин), цвет меняется с пурпурного на желтый в связи с изменением рН, подсчитывали лунки с пролиферацией бактерий, которые стали желтыми в 48 лунках на дозу, и оценивали в сравнении с группой отрицательного контроля. Обозначение (-) означает, что мутагенность отрицательная, а обозначение (+) означает положительную мутагенность.
[0262]
Тестовый пример 7: hERG тест
Для оценки риска увеличения интервала QT на электрокардиограмме, исследовали воздействие соединения согласно настоящему изобретению на ток K+ с замедленным выпрямлением (IKr), который играет важную роль в процессе реполяризации желудочков, с использованием клеток HEK293, экспрессирующих ген альфа-субъединицы калиевого канала (hERG).
После того, как на клетке поддерживали мембранный потенциал -80 мВ методом пэтч-кламп на целой клетке с использованием автоматизированной пэтч-кламп системы (PatchXpress 7000A, Axon Instruments Inc.), ток IKr индуцировали деполяризационной пульсовой стимуляцией при +40 мВ в течение 2 секунд, а затем регистрировали реполяризационную пульсовую стимуляцию при -50 мВ в течение 2 секунд. После стабилизации вызванного тока, к клеткам при комнатной температуре на 10 минут добавляли внеклеточный раствор (NaCl: 135 мМ, KCl: 5,4 мМ, NaH2PO4: 0,3 мМ, CaCl2•2H2O: 1,8 мМ, MgCl2•6H2O: 1 мМ, глюкоза: 10 мМ, HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота): 10 мМ, pH=7,4), в котором было растворено тестируемое соединение в заданной концентрации. Исходя из зарегистрированного тока IKr, измеряли абсолютное значение конечного пикового тока по значению тока в условиях мембранном потенциале покоя с использованием аналитического программного обеспечения (DataXpress ver,1, Molecular Devices Corporation). Затем, вычисляли ингибирование (в %) относительно конечного пикового тока до применения тестируемого вещества, и сравнивали с группой, получавшей основу (0,1% раствор диметилсульфоксида) для оценки воздействия тестируемого вещества на ток IKr.
[0263]
Тестовый пример 8: Тест на растворимость
Растворимость соединений согласно настоящему изобретению определяли в условиях добавления 1% DMSO. В DMSO приготавливали 10 мМ раствор соединения. К 594 мкл искусственного кишечного сока (к 250 мл 0,2 М реагента дигидрофосфата калия и 118 мл 0,2 М раствора NaOH добавляли воду, доводя объем раствора до 1000 мл) добавляли 6 мкл соединения согласно настоящему изобретению. После хранения при температуре 25°C в течение 16 часов, смесь фильтровали путем аспирации. Фильтрат двукратно разбавляли смесью метанол/вода=1/1 (по объему) и измеряли концентрацию соединения в фильтрате методом HPLC или LC/MS/MS по абсолютной калибровочной кривой.
[0264]
Тестовый пример 9: Тест на растворимость порошка
Подходящие количества тестируемых веществ помещали в подходящие контейнеры. В соответствующие контейнеры добавляли 200 мкл жидкости JP-1 (2,0 г хлорида натрия, 7,0 мл соляной кислоты и вода до объема 1000 мл), 200 мкл жидкости JP-2 (500 мл фосфатного буфера (рН 6,8) и 500 мл воды) и 200 мкл 20 мМ ТСА (таурохолат натрия) в жидкости JP-2 (1,08 г ТСА и жидкость JP-2 до 100 мл). В том случае, когда после добавления тестируемой жидкости тестируемое соединение растворялось, соответствующим образом добавляли нерасфасованный порошок. Контейнеры закрывали и перемешивали в течение 1 часа при температуре 37°C. Смеси фильтровали и добавляли 100 мкл метанола в каждый фильтрат (100 мкл), так что фильтрат двукратно разбавлялся. При необходимости, степень разбавления изменяли. Разбавленные растворы наблюдали на предмет пузырьков и преципитатов, а затем контейнеры закрывали и встряхивали. Количественную оценку осуществляли методом HPLC с использованием способа абсолютной калибровки.
[0265]
Пример состава
Следующие примеры составов приведены исключительно в качестве примера и не предназначены для ограничения объема настоящего изобретения.
Пример состава 1: Таблетки
Соединение согласно настоящему изобретению 15 мг
Лактоза 15 мг
Стеарат кальция 3 мг
Компоненты, отличные от стеарата кальция, гомогенно перемешивали и высушивали путем измельчающего гранулирования, и формировали гранулы подходящего размера. Затем, таблетки формовали путем сжатия с добавлением стеарата кальция.
[0266]
Пример состава 2: Капсулы
Соединение согласно настоящему изобретению 10 мг
Стеарат магния 10 мг
Лактоза 80 мг
Компоненты однородно перемешивали до получения порошкообразного лекарственного средства в виде порошка или мелкодисперсных гранул. Капсулы приготавливали путем заполнения смесью контейнера-капсулы.
[0267]
Пример состава 3: Гранулы
Соединение согласно настоящему изобретению 30 г
Лактоза 265 г
Стеарат магния 5 г
После однородного перемешивания вышеуказанных ингредиентов, смесь подвергали сжатию, измельчали, гранулировали и просеивали для получения гранул подходящего размера.
Промышленная применимость
[0268]
Соединения согласно настоящему изобретению характеризуются ингибирующей активностью в отношении ACC2 и применимы для лечения или профилактики заболевания, ассоциированного с ACC2.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ ДИГИДРОПИРАЗОЛОПИРАЗИНОНА, ОБЛАДАЮЩЕЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ MGAT-2 | 2020 |
|
RU2803743C2 |
| 6-ЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2683245C1 |
| АМИДНОЕ ПРОИЗВОДНОЕ, ИМЕЮЩЕЕ ПРОТИВОВИРУСНУЮ АКТИВНОСТЬ | 2021 |
|
RU2836730C1 |
| АЗОТСОДЕРЖАЩИЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ ИНГИБИРОВАНИЯ РЕПЛИКАЦИИ ВИЧ | 2016 |
|
RU2720145C2 |
| БИЦИКЛИЧЕСКИЕ АЗОТСОДЕРЖАЩИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ВКЛЮЧАЮЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2017 |
|
RU2753524C2 |
| ЗАМЕЩЕННЫЕ ПОЛИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРИДОНА И ИХ ПРОЛЕКАРСТВА | 2016 |
|
RU2712275C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ СУЛЬФОНАМИДА, ОБЛАДАЮЩИЕ СЕЛЕКТИВНОЙ NOX-ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ | 2019 |
|
RU2809030C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЗАМЕЩЕННЫЕ ПОЛИЦИКЛИЧЕСКИЕ ПИРИДОНОВЫЕ ПРОИЗВОДНЫЕ И ИХ ПРОЛЕКАРСТВО | 2017 |
|
RU2727962C1 |
| ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ ГРИППА, ХАРАКТЕРИЗУЮЩИЙСЯ ТЕМ, ЧТО В НЕМ ОБЪЕДИНЕНЫ ИНГИБИТОР КЭП-ЗАВИСИМОЙ ЭНДОНУКЛЕАЗЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО ПРОТИВ ГРИППА | 2016 |
|
RU2745071C2 |
| ПРОИЗВОДНОЕ НУКЛЕИНОВОЙ КИСЛОТЫ, ОБЛАДАЮЩЕЕ ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2016 |
|
RU2730871C1 |
Изобретение относится к области органической химии, а именно к конкретным производным бензимидазола, структуры которых указаны ниже. Также изобретение относится к фармацевтической композиции на основе указанного производного бензимидазола и его применению. Технический результат: получены новые производные бензимидазола, полезные для лечения или профилактики заболевания, ассоциированного с АСС2. 3 н. и 2 з.п. ф-лы, 10 табл., 30 пр.
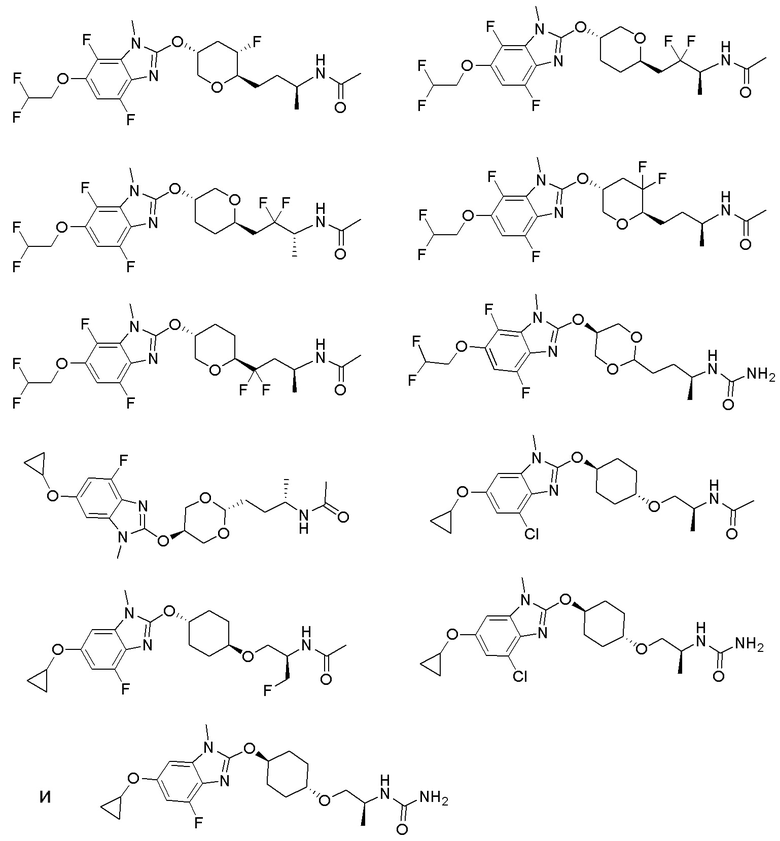
1. Соединение, выбранное из группы, состоящей из:

1. Соединение по п.1, выбранное из группы, состоящей из:

3. Фармацевтическая композиция для лечения или профилактики заболевания, ассоциированного с ACC2, содержащая соединение по любому из пп.1 или 2.
4. Применение соединения по любому из пп.1 или 2 для лечения или профилактики заболевания, ассоциированного с ACC2.
5. Соединение по любому из пп.1 или 2 для лечения или профилактики заболевания, ассоциированного с ACC2.
Авторы
Даты
2019-10-09—Публикация
2016-03-30—Подача