Изобретение относится к области ветеринарии а именно, к способу определения антагонистической активности штаммов микроорганизмов против Pseudomonas aeruginosa, также способ может быть использован в микробиологии и других областях.
Интегральным критерием антагонистической активности синегнойной палочки является снижение концентрации оксифеназинов (соединений которые образует синегнойная палочка в процесс реакций чувства кворума), для накопления которых нужно наличие синегнойной палочки и продукции этим микроорганизмом токсичного метаболита - пиоцианина, относящегося к оксифеназинам.
Известен способ определения антагонистической активности в тестах по сокультивированию (патент РФ №2376381 C1 от 20.12.2009 МПК C12Q 1/00 (2006.01), включающий получение из исследуемой культуры микроорганизмов экстрактов, представляющих собой экзометаболиты, клеточный экстракт и клеточные стенки. Полученные экстракты обеззараживают хлороформом из расчета 0,1 мл хлороформа на 3 мл экстракта. Затем смешивают каждый из подготовленных препаратов со штаммом-антагонистом в соотношении 1:2 соответственно. Параллельно готовят две контрольные пробы, при этом контроль 1 готовят из жидкой питательной среды и физиологического раствора, а контроль 2 - из жидкой питательной среды и штамма-антагониста. После чего опытные и контрольные пробы инкубируют. После этого разбавляют жидкой питательной средой, инкубируют и отделяют супернатанты (надосадочную жидкость) центрифугированием. Полученные супернатанты обеззараживают путем обработки их хлороформом из расчета 0,1 мл хлороформа на 3 мл супернатанта. Обеззараженные супернатанты смешивают с взвесью индикаторного штамма в соотношении 1:2 соответственно. Инкубируют и разбавляют жидкой питательной средой. После чего высевают индикаторный штамм на плотную питательную среду и культивируют. Затем подсчитывают КОЕ (колониеобразующие единицы) в опытных и контрольных пробах. Рассчитывают антагонистическую активность штамма-антагониста и по изменению антагонистической активности в опытных пробах по сравнению с контролем судят о способности исследуемой культуры микроорганизмов регулировать антагонистическую активность бактерий. Изобретение позволяет определять способность микроорганизмов регулировать антагонистическую активность бактерий.
Недостатком данного способа является то, что способ предусматривает оценку взаимодействия только клеточных компонентов исследуемого микроорганизма (экзометаболитов, клеточного экстракта и клеточных стенок), а не живых микроорганизмов на рост штамма-антагониста.
Известен способ способ определения продукции оксифеназинов. Пиоцианин (оксифеназин) последовательно экстрагируют и 0,2М HCl (соляной кислотой) после чего его содержание определяли спектрофотометрически при длине волны 520 нм хлороформом (Essar et al., 1990 D.W. Essar, L. Eberly, A. Hadero, I.P. Crawford Identification and characterization of genes for a second anthranilate synthase in Pseudomonas aeruginosa: interchangeability of the two anthranilate synthases and evolutionary implications Journal of Bacteriology, 172 (1990), pp. 884-900).
Недостатком данного способа является то, что способ не используется для оценки антагонистической активности бактерий в отношении Pseudomonas aeruginosa.
Наиболее близким по технической сущности и выбранным в качестве прототипа является определения антагонистической активности штаммов бактерий (патент РФ №2328734 С1 от 10.07.2008 МПК G01N 33/48 (2006.01), G01N 33/15 (2006.01), C12Q 1/02 (2006.01), при котором выделяются чистые культуры бактерий, после чего осуществляют пересев культур, различающихся по морфологическим критериям и ферментативной активности, на мясопептонный агар, изучают их рост в присутствии тест-штамма Proteus vulgaris. Культуры, которые не были подавлены ползучим ростом подвижного штамма P. vulgaris, считаются антагонистичными в отношении данного вида микроорганизма. Использование способа позволяет проводить массовый поиск широкого видового спектра пробиотических штаммов бактерий, обладающих антагонистической активностью в отношении P. vulgaris, путем тестирования больших количеств культур микроорганизмов, высеваемых из различных источников. Также, использование способа позволяет оценивать антагонистическое действие бактерий в отношении одного из механизмов патогенности P. vulgaris.
Недостатком данного способа является только визуальная оценка антагонистической активности исследуемых штаммов, путем подавления подвижного роста P.vulgaris на твердой питательной среде. В данном способе отсутствует сопоставление роста исследуемых культур без P. vulgaris. Данный тест не используется для оценки антагонистической активности культур в отношении P. aeruginosa, которая является наибольшей проблемой обусловливающей сложность терапии хронических инфекций у людей и животных особенно с признаками иммунодефицита.
Задачей заявленного изобретения является поиск штаммов бактерий, которые будут подавлять выработку оксифеназинов P. aeruginosa, являющихся критерием биологической активности бактерий этого вида, при формировании биопленки.
Поставленная задача решается тем, что в способе определения антагонистически активных штаммов бактерий в отношении P. aeruginosa, включающем культивирование тестируемых штаммов бактерий вместе с P. aeruginosa, согласно изобретению, выявление антагонистической активности тестируемых штаммов осуществляют путем оценки продукции оксифеназинов P. aeruginosa в присутствии штаммов-антагонистов в сравнении с чистой культурой P. aeruginosa на основе спектрофотметрической оценки их содержания в экстрактах.
Способ осуществляется следующим образом сокультивирование культуры P. aeruginosa с тестируемым штаммом микроорганизма в жидкой питательной среде, одновременно проводится культивирование чистой культуры P. aeruginosa при температуре 37°С в течение 22-24 ч., согласно изобретению, после инкубации оксифеназины экстрагируют последовательно вначале 1 мл хлороформа, а затем 1 мл 0,2М HCl, Оценка подавления синтеза оксифеназинов производится путем выявления снижения оптической плотности экстракта оксифеназинов P. aeruginosa (при сокультивировании) при длине волны 520 нм в сравнении с контрольной пробой (чистой культурой P. aeruginosa). Антагонистическая активность тестируемого штамма выявляется по факту подавления продукции оксифеназинов P. aeruginosa.
Для иллюстрации способа приведены примеры.
Пример 1. Способ определения оксифеназинов
Для выявления штаммов бактерий подавляющих продукцию оксифеназинов использовали культуру P. aeruginosa стабильно продуцирующий оксифеназины. Штамм засевали в объеме 100 мл триптиказо-соевого бульона и выращивали при температуре 37°С в течение 22 ч до стационарной фазы, которая сопровождалась накоплением концентрации клеток 2×109 КОЕ/мл и оксифеназинов. Затем клетки из культуральной среды осаждали центрифугированием при 5000 об/мин в течение 10 минут. Осадок отмывали один раз физиологическим раствором, и снова повторяли осаждение клеток методом центрифугирования при тех же условиях. Отмытые клетки ресуспендировали в 10 мл триптиказо-соевого бульона, таким образом сконцентрировали клетки в 10 раз и повысили титр P. aeruginosa до конечной концентрации клеток 3,2×1010 КОЕ/мл, а затем вносили по одному миллилитру в конические пробирки содержащие по 5 мл суточной культуры тестируемой бактерии Lactobacillus spp., в качестве отрицательного контроля при сокультивировании штаммов использовали P. aeruginosa. Полученные образцы сокультивирования штаммов инкубировали при температуре 37°С в течение 23 ч. Затем оксифеназины экстрагировали последовательно вначале 1 мл хлороформа, а затем 1 мл 0,2М HCl, экстрагированные образцы объединяли. После чего содержание оксифеназинов определяли спектрофометрически на спектрофотометре СФ-ломо 26. Продукция оксифеназинов P. aeruginosa в тестах по сокультивированию с Lactobacillus spp. составляла OD520 нм 0,01±0,001, в отличие от контроля P. aeruginosa OD520 нм 0,27±0,13.
Таким образом, происходит полное подавление синтеза оксифеназинов лактобактериями при сокультивировании с P. aeruginosa.
Пример 2. Поиск штаммов подавляющих активность образования оксифеназинов P. aeruginosa
Для выявления штаммов бактерий подавляющих продукцию оксифеназинов использовали культуру P. aeruginosa стабильно продуцирующий оксифеназины. Штамм засевали в объеме 1000 мл триптиказо-соевого бульона и выращивали при температуре 37°С в течение 22 ч до стационарной фазы, которая сопровождалась накоплением концентрации клеток 4,5×109 КОЕ/мл и оксифеназинов. Затем клетки из культуральной среды осаждали центрифугированием при 5000 об./мин в течение 10 минут. Осадок отмывали один раз физиологическим раствором, и снова повторяли осаждение клеток методом центрифугирования при тех же условиях. Отмытые клетки ресуспендировали в 100 мл триптиказо-соевого бульона, таким образом сконцентрировали клетки в 10 раз и повысили титр Р. aeruginosa до конечной концентрации клеток 5,3×1010 КОЕ/мл, а затем вносили по одному миллилитру в конические пробирки содержащие по 5 мл суточных культур тестируемых бактерий Weisella solipiscis, Acinetobacter calcoaceticus, Staphylococcus cohnii, Pseudomonas oryzihabitans, Enterobacter oryza, Serratia spp., в качестве отрицательного контроля при сокультивировании штаммов использовали P. aeruginosa. Полученные образцы сокультивирования штаммов инкубировали при температуре 37°С в течение 24 ч. Затем из каждого образца при сокультивировании экстрагировали оксифеназины последовательно, вначале 1 мл хлороформа, а затем 1 мл 0,2М НСд, экстрагированные образцы объединяли. После чего содержание оксифеназинов определяли спектрофометрически при длине волны 520 нм используя спектрофотометр СФ-ломо 26.
Данные по активности продукции оксифеназинов P. aeruginosa в тестах по сокультивированию с различными бактериями представлены в таблице 1.
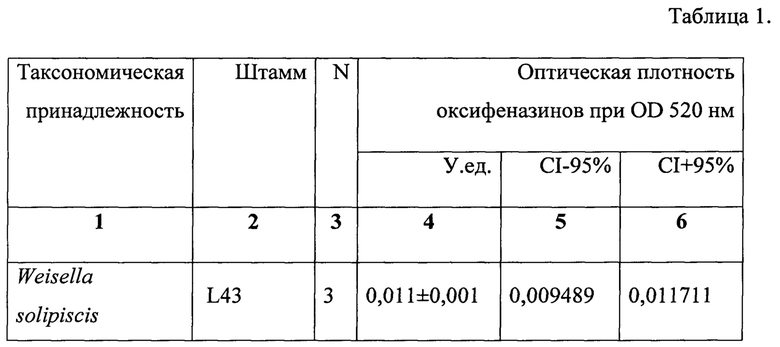
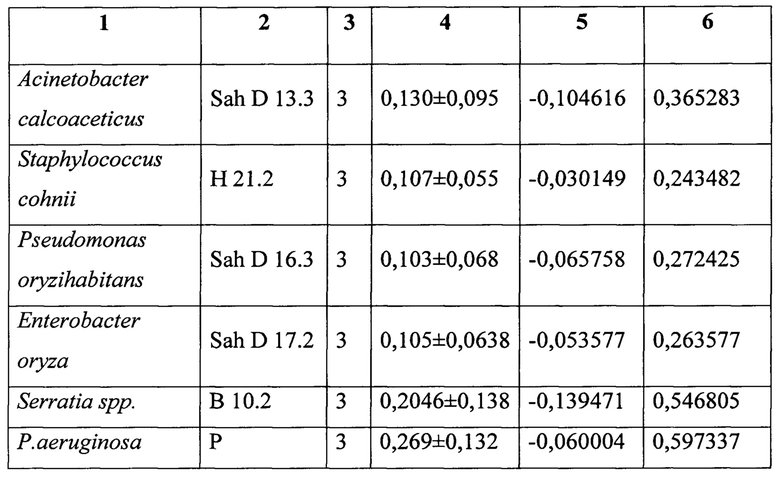
Для оценки ингибирования продукции оксифеназинов P. aeruginosa рассчитывали удельную долю оптической плотности экстракта оксифеназинов, образовавшихся в присутствии тестируемого штамма, от оптической плотности экстракта чистой культуры P. aeruginosa. Например, штамм Weisella solipiscis L43 подавлял продукцию оксифеназинов Р. aeruginosa на 95,91% что позволяет его рассматривать в качестве перспективного пробиотического штамма.
Пример 3. Снижение синтеза бутаноил-гомосеринлактона
Для разрушения бутаноил-гомосеринлактона (сигнальной молекулы запускающий ряд реакций чувства кворума) проводили сокультивирование P. aeruginosa и Enterobacter cloacae SahD11-2 подавляющего синтез оксифеназинов. Шамм Е. cloacae SahD11-2 в предварительных экспериментах подавлял образование оксифеназинов P. aeruginosa (OD520 нм 0,12±0,05). Предварительно выращивали по 10 мл культуры P. aeruginosa в течение 5 суток при комнатной температуре, затем культуры центрифугировали при 5000 об/мин в течение 10 мин, осадок ресуспендировали в 1 мл стерильного физиологического раствора. В пробирки с культурой Enterobacter cloacae SahD11-2 вносили по 1 мл отмытой и ресуспендированой в физиологическом растворе биомассу P. aeruginosa. После сокультивирования при 37°С в течение суток, культуры центрифугировали 5000 об/мин в течение 10 мин. Супернатант стерилизовали добавлением 200 мкл хлороформа. Бутаноил-гомосеринлактон из образцов экстрагировали 1% раствором уксусной кислоты в ацетонитриле трехкратно. Объединенные экстракты высушивали в вакууме, растворяли в 150 мкл ледяной уксусной кислоте. Хромато-масспектрометрические исследования выполняли с помощью жидкостного хроматографа Agilent 1200 (с диодно-матричным детектором) и гибридного квадруполь-времяпролетного масс-спектрометра micrOTOF-Q (фирма Bruker). Для хроматографирования использовали колонку в Zorbax Bonus-RP (2.1*100 mm, 3.5 μm) и Zorbax Eclipse XDB-C8 (2.1*150 mm, 3.5 μm) с линейным градиентом от 10 до 100% ACN с 3-й до 33-й минуты. Скорость потока: 0,2 мл/мин 0.2 ml/min, 5 μL пробы. УФ-детектирование вели на 250/320 нм.
Рабочие параметры масс-детектирования. Метод ионизации: электростатическое распыление при атмосферном давлении (API-ES). Детектирование положительных ионов в диапазоне m/z=80-1300. Поток газа-осушителя (азот): 8 л/мин, его температура: 230°С, давление на распылителе: 3 bar.
Для исследований использовали штаммы P. aeruginosa стабильно секретирующие в стационарной фазе бутаноил-гомосеринлактон (что было установлено на основании LC-ESI-Q-TOF-MS). Проведенная хроматография и масспектрометрический анализ показал снижение продукции бутанол-гомосернлактона.
Таким образом, штамм Enterobacter cloacae SahD11-2 характеризовался как способностью к подавлению синтеза оксифеназинов P. aeruginosa, так и способностью к подавлению сигнала соответствующего бутаноил-гомосеринлактону при HPLC/MS анализе. Это свидетельствует о том, что предлагаемый способ позволяет оценивать не только подавление роста P. aeruginosa, но и подавление продукции такого фактора патогенности как бутаноил-гомосеринлактон, который является сигнальной молекулой, и отвечает за интенсивность реакций кворум-сенсинга (чувства кворума) в биопленках.
Предложенный способ следует считать удобным тестом для интегральной оценки антагонистической активности микроорганизмов в отношении P. aeruginosa так как в тестах по сокультивированию может быть затруднительным разделение бактерий разных видов при подсчете числа КОЕ.
Пример 4. Применение предлагаемого способа для поиска антагонистически активных штаммов.
Для поиска антагонистически активных штаммов было взято 26 штаммов бактерий преимущественно рода Bacillus. Культуры бацилл выращивали при комнатной температуре на среде LB 3 суток. Затем к 5 мл среды добавляли 1 мл культуры (тщательно ресуспендированной) и 100 мкл суточной культуры P. aeruginosa штамм 669 ИХБФМ и культивировали при 37С 24 ч. Также выращивали чистую культуру P. aeruginosa в аналогичных условиях. Оценивали продукцию оксифеназинов визуально и по предлагаемому способу. Тесты проводили в трех повторностях. Результаты опыта представлены в таблице 2.

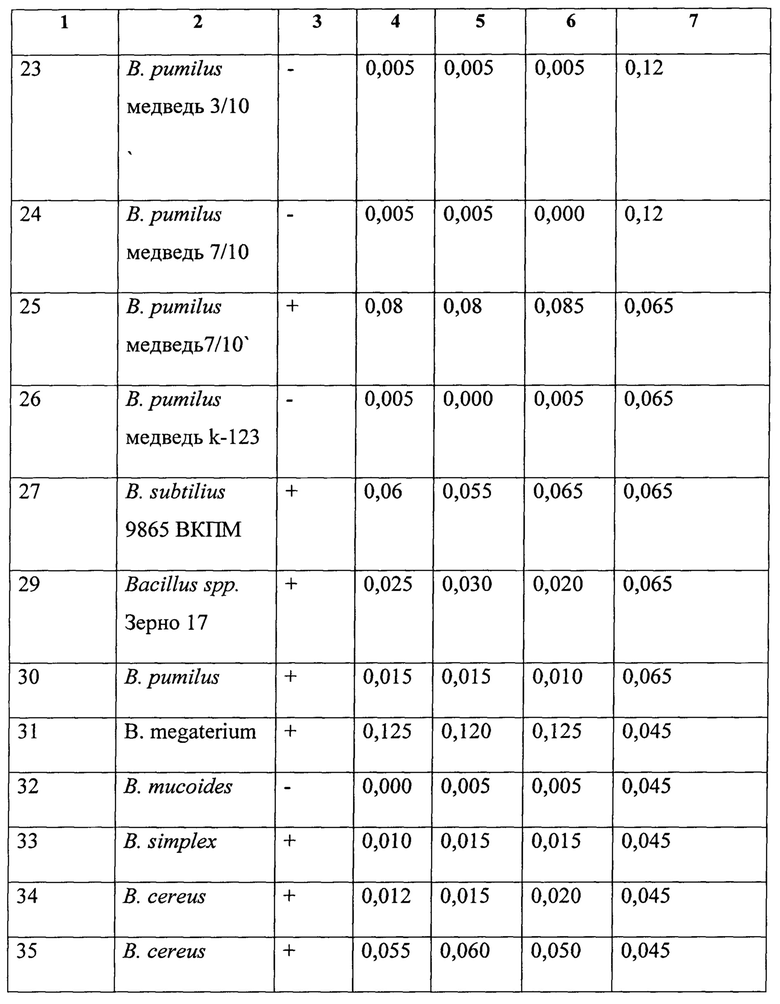
Как следует из таблицы 2, 10 штаммов микроорганизмов подавляли образование оксифеназинов P. aeruginosa что позволяет их отнести к антагонистически активным в отношении данного вида патогенных микроорганизмов.
Изобретение относится к области биотехнологии, а именно к способу определения антагонистической активности штаммов бактерий в отношении Pseudomonas aeruginosa, включающему культивирование Pseudomonas aeruginosa и тестируемых штаммов на питательных средах, отличающемуся тем, что выявление антагонистической активности тестируемых штаммов осуществляют путем оценки продукции оксифеназинов P. aeruginosa в присутствии тестируемых штаммов в сравнении с чистой культурой P. aeruginosa на основе спектрофотометрической оценки их содержания в экстрактах, и при установлении факта подавления продукции оксифеназинов выявляют антагонистическую активность тестируемого штамма. Использование способа позволяет оценивать антагонистическую активность штаммов бактерий, подавляющих рост P. aeruginosa и препятствующих накоплению факторов патогенности, ассоциируемых с образованием биопленок. 4 пр., 2 табл.
Способ определения антагонистической активности штаммов бактерий в отношении Pseudomonas aeruginosa, включающий культивирование Pseudomonas aeruginosa и тестируемых штаммов на питательных средах, отличающийся тем, что выявление антагонистической активности тестируемых штаммов осуществляют путем оценки продукции оксифеназинов P. aeruginosa в присутствии тестируемых штаммов в сравнении с чистой культурой P. aeruginosa на основе спектрофотометрической оценки их содержания в экстрактах, и при установлении факта подавления продукции оксифеназинов выявляют антагонистическую активность тестируемого штамма.
| ГРИЦЕНКО В.А | |||
| и др | |||
| Антагонистические взаимоотношения Pseudomonas aeruginosa с грамотрицательными бактериями // Бюллетень Оренбургского научного центра УрО РАН (электронный журнал) | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Способ оценки антагонистической активности лактобактерий толстокишечного биотопа пациента относительно разнообразных бактерий двухэтапным культивированием микроорганизма-антагониста и тестируемой культуры в условиях комбинированной системы | 2018 |
|
RU2670585C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТИ ПРОБИОТИКОВ | 2000 |
|
RU2187801C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СПОСОБНОСТИ МИКРООРГАНИЗМОВ РЕГУЛИРОВАТЬ АНТАГОНИСТИЧЕСКУЮ АКТИВНОСТЬ БАКТЕРИЙ | 2008 |
|
RU2376381C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТАГОНИСТИЧЕСКИ АКТИВНЫХ ШТАММОВ БАКТЕРИЙ | 2006 |
|
RU2328734C1 |
Авторы
Даты
2019-10-24—Публикация
2018-10-22—Подача