[0001] Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США № 61/877042, поданной 12 сентября 2013 г., содержание которой полностью включено в данную заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к векторам экспрессии фактора VIII (FVIII) на основе аденоассоциированного вируса (ААВ), включая ААВ-векторы экспрессии FVIII с высокой экспрессионной активностью и ААВ-векторы экспрессии FVIII, которые экспрессируют полноразмерный или укороченный функциональный FVIII. Настоящее изобретение также относится к способам получения описанных в данной заявке ААВ-векторов экспрессии FVIII и соответствующим применениям указанных векторов в терапии.
УРОВЕНЬ ТЕХНИКИ
[0003] Аденоассоциированный вирус (ААВ) представляет собой малый, не способный к самостоятельной репликации, не имеющий оболочки вирус животных, который инфицирует людей и некоторых других видов приматов. Некоторые свойства ААВ делают данный вирус привлекательным средством доставки терапевтических белков посредством генотерапии, включая, например, свойство, состоящее в том, что ААВ, насколько известно, не вызывает заболеваний человека и индуцирует слабый иммунный ответ, и что ААВ-векторы могут инфицировать как делящиеся, так и покоящиеся клетки, не встраиваясь в геном клетки-хозяина. Генотерапевтические векторы на основе ААВ успешно применялись в некоторых клинических испытаниях, например, для доставки фактора IX (FIX) человека в печень для лечения гемофилии B (Nathwani и др., New Engl. J. Med. 365:2357-2365, 2011).
[0004] Тем не менее, у генотерапевтических ААВ-векторов все же есть некоторые недостатки. В частности, клонирующая емкость ААВ-векторов ограничена как следствие ограничения емкости вируса для упаковки ДНК. Геном ААВ дикого типа, представленный одноцепочечной ДНК, составляет приблизительно 4,7 тысяч нуклеотидов (т.п.н.). На практике, геномы ААВ размером до приблизительно 5,0 т.п.н. оказываются полностью упакованными (т.е. полноразмерными) в вирусные частицы ААВ. Учитывая необходимость того, чтобы нуклеиновая кислота в геноме ААВ-вектора содержала два инвертированных концевых повтора (ITR) ААВ размером приблизительно 145 оснований, емкость ААВ-вектора для упаковки ДНК такова, что можно заключить в капсид максимум приблизительно 4,4 т.п.н. кодирующей белок последовательности.
[0005] Вследствие этого ограничения по размеру, большие терапевтические гены, т.е., гены, длина которых больше, чем приблизительно 4,4 т.п.н., как правило, не подходят для применения в ААВ-векторах. Один такой терапевтический ген представляет собой ген фактора VIII (FVIII), который кодирует мРНК размером приблизительно 7,0 т.п.н., которая кодирует полипептид, состоящий из 2332 аминокислот, содержащий, от N-конца к C-концу, сигнальный пептид размером 19 аминокислот и три больших домена (т.е. домен тяжелой цепи или домен A, центральный домен или домен B и домен легкой цепи или домен C). Одна стратегия, которую применяли, чтобы преодолеть ограничение по размеру ААВ-вектора для FVIII, состояла в применении двух ААВ-векторов, один из которых кодировал домен тяжелой цепи или домен A, а другой кодировал домен легкой цепи или домен C (см., например, Coutu и др., патенты США с номерами 6221349, 6200560 и 7351577). Другая стратегия, которую применяли, чтобы обойти данное ограничение по размеру, состояла в получении ААВ-векторов, кодирующих FVIII, в котором центральная часть, или домен B, указанного белка была удалена и заменена на линкер из 14 аминокислот, известный как последовательность SQ (Ward и др., Blood, 117:798-807, 2011, и McIntosh и др., Blood, 121:3335-3344, 2013).
[0006] Хотя в литературе сообщали об ААВ-векторах, содержащих геномы ААВ размером > 5,0 т.п.н., во многих из данных случаев 5'- или 3'-концы кодируемых генов оказывались укороченными (см. Hirsch и др., Molec. Ther. 18-6-8, 2010, и Ghosh и др., Biotech. Genet. Engin. Rev. 24:165-178, 2007). Тем не менее, показали, что в инфицированных ААВ клетках происходит гомологичная рекомбинация между перекрывающимися фрагментами нуклеиновых кислот, укороченных по 5'-концу и укороченных по 3'-концу, таким образом получают “целую” нуклеиновую кислоту, кодирующую большой белок, тем самым реконструируя функциональный полноразмерный ген.
[0007] Существует потребность в новых ААВ-векторах, кодирующих функциональный белок фактора VIII, полезных для генотерапевтических подходов для лечения гемофилии A. По этой причине, настоящее изобретение относится к ААВ-векторам, которые кодируют функционально активный FVIII, таким образом, что либо в капсид вирионов ААВ заключена целая нуклеиновая кислота, кодирующая терапевтический белок, т.е., полностью упакованные ААВ-векторы экспрессии FVIII, тем самым избегая описанных выше проблем слишком большого размера геномов, либо они по меньшей мере продуцируют функционально активный белок фактора VIII, который может быть укороченным или не укороченным. Более того, чтобы избежать направленного против капсида иммунного ответа, у ААВ-векторов должна быть наиболее высокая возможная активность трансдукции/экспрессии целевого белка на частицу капсида. Настоящее изобретение также относится к получению целых ААВ-векторов экспрессии FVIII с высокой экспрессионной активностью. Наконец, настоящее изобретение относится к способам получения описанных в данной заявке ААВ-векторов экспрессии фактора VIII и соответствующим способам их применения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] Согласно настоящему изобретению предложены ААВ-векторы, кодирующие функционально активный FVIII (называемые в данной заявке “ААВ-векторами экспрессии FVIII”). Геномы, кодирующие функционально активный FVIII, предпочтительно не более 7,0 т.п.н. в длину, более предпочтительно не более 6,5 т.п.н. в длину, еще более предпочтительно не более 6,0 т.п.н. в длину, еще более предпочтительно не более 5,5 т.п.н. в длину, еще более предпочтительно не более 5,0 т.п.н. в длину, с усиленной промоторной функцией.
[0009] В данной заявке “функционально активный FVIII” представляет собой белок FVIII, который обладает функциональными свойствами белка FVIII дикого типа in vitro, когда экспрессируется в культивированных клетках, или in vivo, когда экспрессируется в клетках или тканях организма. Указанные свойства включают, например, то, что он позволяет крови свернуться и уменьшает время, которое требуется крови, чтобы свернуться, у субъекта, страдающего от гемофилии A. FVIII дикого типа участвует в свертывании крови посредством коагуляционного каскада, действуя как кофактор для активированного FIX (FIXa), который в присутствии ионов кальция и фосфолипидов образует комплекс, который превращает фактор X (FX) в активированный FX (FXa). Соответственно, функционально активный FVIII может образовывать комплекс с FIXa, который может превращать FX в FXa.
[0010] В данной заявке “ААВ-вектор” относится к нуклеиновым кислотам, либо однонитевым, либо двунитевым, содержащим последовательность 5'-инвертированного концевого повтора (ITR) ААВ и 3'-ITR ААВ, фланкирующие кодирующую белок последовательность, функционально связанную с элементами, регулирующими транскрипцию, т.е. с одним или более промоторами и/или энхансерами, и последовательность полиаденилирования, и, возможно, один или более интронов, вставленных между экзонами кодирующей белок последовательности. Однонитевой ААВ-вектор относится к нуклеиновым кислотам, которые присутствуют в геноме вирусной частицы ААВ, и может представлять собой либо смысловую нить, либо антисмысловую нить последовательностей нуклеиновых кислот, описанных в данной заявке. Размер таких однонитевых нуклеиновых кислот представлен в основаниях. Двунитевой ААВ-вектор относится к нуклеиновым кислотам, которые присутствуют в ДНК плазмид, например, pUC19, или геноме двунитевого вируса, например, бакуловируса, применяемого для экспрессии или переноса нуклеиновых кислот ААВ-вектора. Размер таких двунитевых нуклеиновых кислот представлен в парах оснований (п.о.).
[0011] Термин “инвертированный концевой повтор (ITR)” в данной заявке относится к известным в данной области техники участкам, находящимся на 5'- и 3'-концах генома ААВ, которые функционируют в цис-положении как точки начала репликации ДНК и как сигналы упаковки вирусного генома. ITR ААВ, вместе с областью, кодирующей rep ААВ, обеспечивают эффективное исключение и вырезание, и встраивание последовательности нуклеотидов, вставленной между двумя фланкирующими ITR, в геном клетки-хозяина. Последовательности некоторых ассоциированных с ААВ ITR описаны в Yan и др., J. Virol. 79(1):364-379 (2005), которая полностью включена в данную заявку посредством ссылки.
[0012] “Элемент, регулирующий транскрипцию”, относится к последовательности нуклеотидов гена, вовлеченной в регуляцию транскрипции гена, включая промотор, плюс элементы ответа, последовательности активатора и энхансера для связывания транскрипционных факторов, чтобы способствовать связыванию РНК-полимеразы и вызывать экспрессию, и последовательности оператора или сайленсера, с которыми связываются репрессорные белки, чтобы блокировать присоединение РНК-полимеразы и предотвращать экспрессию. Термин “специфический для печени элемент, регулирующий транскрипцию”, относится к регуляторному элементу, который модулирует экспрессию гена специфично в ткани печени. Примеры специфических для печени регуляторных элементов включают, но не ограничены перечисленными: промотор тиретина мыши (mTTR), промотор эндогенного фактора VIII человека (F8), промотор альфа-1-антитрипсина человека (hAAT) и его активные фрагменты, минимальный промотор альбумина человека и промотор альбумина мыши. Также предложены энхансеры, полученные из сайтов связывания специфических для печени транскрипционных факторов, таких как EBP, DBP, HNF1, HNF3, HNF4, HNF6 и Enh1.
[0013] В одном варианте реализации ААВ-вектор согласно настоящему изобретению содержит нуклеиновую кислоту, кодирующую функционально активный FVIII, в котором домен B заменен на состоящую из 14 аминокислот последовательность SQ, т.е., кодирующую SQ FVIII. Последовательность SQ описана в Ward и др., Blood, 117:798-807, 2011, и McIntosh и др., Blood, 121:3335-3344, 2013. Последовательность кодирующей области FVIII представляет собой кодон-оптимизированную последовательность (см. Nathwani и др., заявка на патент США № 2013/0024960A1, опубликованная 24 января 2013 г., содержание которой полностью включено в данную заявку посредством ссылки, и McIntosh и др., Blood, 121:3335-3344, 2013). Данную последовательность в настоящей заявке называют “UCL SQ FVIII”.
[0014] В первом аспекте ААВ-вектор согласно настоящему изобретению включает Proto 1, который схематически изображен на фигуре 2A, и включает последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 1.
[0015] Во втором аспекте ААВ-вектор согласно настоящему изобретению включает Proto 1S, который схематически изображен на фигуре 2B, и включает последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 2.
[0016] В третьем аспекте ААВ-вектор согласно настоящему изобретению включает Proto 2S, который схематически изображен на фигуре 2C, и включает последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 3.
[0017] В четвертом аспекте ААВ-вектор согласно настоящему изобретению включает Proto 3S, который схематически изображен на фигуре 2D, и включает последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 4.
[0018] В другом варианте реализации ААВ-вектор согласно настоящему изобретению содержит нуклеиновую кислоту, кодирующую FVIII, в котором нет всего домена B, включая последовательность SQ и домен a3, расположенный непосредственно с N-стороны от домена легкой цепи или домена C. Последовательность кодирующей области FVIII представляет собой кодон-оптимизированную последовательность (см. Nathwani и др., заявка на патент США № 2013/0024960A1, опубликованная 24 января 2013 г., содержание которой полностью включено в данную заявку посредством ссылки, и McIntosh и др., Blood, 121:3335-3344, 2013).
[0019] В первом аспекте ААВ-вектор согласно настоящему изобретению включает Proto 4, который схематически изображен на фигуре 3A, и включает последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 5.
[0020] Во втором аспекте ААВ-вектор согласно настоящему изобретению включает Proto 5, который схематически изображен на фигуре 3B, и включает последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 6.
[0021] В третьем аспекте ААВ-вектор согласно настоящему изобретению включает Proto 6, который схематически изображен на фигуре 3C, и включает последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 7.
[0022] В четвертом аспекте ААВ-вектор согласно настоящему изобретению включает Proto 7, который схематически изображен на фигуре 3D, и включает последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 8.
[0023] В другом варианте реализации ААВ-вектор согласно настоящему изобретению включает нуклеиновую кислоту, содержащую 5'-инвертированный концевой повтор (ITR) ААВ2, специфическую для печени область регуляции транскрипции, кодон-оптимизированную кодирующую область функционально активного FVIII, возможно один или более интронов, последовательность полиаденилирования и 3'-ITR ААВ2. В предпочтительном варианте реализации специфическая для печени область регуляции транскрипции включает укороченную последовательность энхансера ApoE, проксимальный промотор альфа-1-антитрипсина человека (hAAT) длиной 186 оснований, включая 42 основания 5'-нетранслируемой области (НТО), и один или более энхансеров, выбранных из группы, состоящей из (i) энхансера ApoE/C1 человека длиной 34 основания, (ii) дистальной области X промотора AAT человека длиной 32 основания и (iii) 80 дополнительных оснований дистального элемента проксимального промотора AAT человека; и кодон-оптимизированные области, кодирующие функционально активный FVIII, кодируют вариант SQ FVIII. В другом предпочтительном варианте реализации специфическая для печени область регуляции транскрипции включает последовательность энхансера a1-микроглобулина и проксимальный промотор альфа-1-антитрипсина (AAT) человека длиной 186 оснований.
[0024] В первом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 100ATG, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 9.
[0025] Во втором аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 100ATG bGH poly A, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 10.
[0026] В третьем аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 100ATG short bGH polyA, включающую последовательность, представленную в SEQ ID NO: 11.
[0027] В четвертом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 103ATG, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 12.
[0028] В пятом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 103ATG short bGH poly A, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 13.
[0029] В шестом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 105ATG bGH poly A, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 14.
[0030] В седьмом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию DC172ATG FVIII, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 15.
[0031] В восьмом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию DC172ATG FVIII hAAT, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 16.
[0032] В девятом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию DC172 2xHCR ATG FVIII, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 17.
[0033] В десятом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию DC172 2xHCR ATG FVIII hAAT, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 18.
[0034] В одиннадцатом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 2x SerpinA hAAT ATG FVIII, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 19.
[0035] В двенадцатом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 2x SerpinA hAAT ATG FVIII 2x μ-globulin enhancer, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 20.
[0036] В тринадцатом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 100ATG short polyA 2x μ-globulin enhancer, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 21.
[0037] В четырнадцатом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию Factor VIII-BMN001, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 22.
[0038] В пятнадцатом аспекте ААВ-вектор согласно настоящему изобретению включает последовательность конструкции Factor VIII-BMN002, представленную в SEQ ID NO: 23.
[0039] В шестнадцатом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 99, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 24.
[0040] В семнадцатом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 100, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 25.
[0041] В восемнадцатом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 100 в обратной ориентации, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 26.
[0042] В девятнадцатом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 100AT, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 27.
[0043] В двадцатом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 100AT 2x MG, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 28.
[0044] В двадцать первом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 100AT 2x MG bGH polyA, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 29.
[0045] В двадцать втором аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 100AT 2x MG (reverse) bGH polyA, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 30.
[0046] В двадцать третьем аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 100 bGH polyA, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 31.
[0047] В двадцать четвертом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 100-400, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 32.
[0048] В двадцать пятом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 101, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 33.
[0049] В двадцать шестом аспекте ААВ-вектор согласно настоящему изобретению включает последовательность конструкции 102, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 34.
[0050] В двадцать седьмом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 103, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 35.
[0051] В двадцать девятом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 103 в обратной ориентации, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 36.
[0052] В тридцатом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 103AT, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 37.
[0053] В тридцать первом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 103AT 2xMG, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 38.
[0054] В тридцать втором аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 103AT 2xMG bGH polyA, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 39.
[0055] В тридцать третьем аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 103 bGH polyA, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 40.
[0056] В тридцать четвертом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 104, включающую нуклеиновую кислоту, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 41.
[0057] В тридцать пятом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 105, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 42.
[0058] В тридцать шестом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 106, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 43.
[0059] В тридцать седьмом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 106AT, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 44.
[0060] В тридцать восьмом аспекте ААВ-вектор согласно настоящему изобретению включает конструкцию 2x SerpinA hAAT, включающую последовательность нуклеиновой кислоты, представленную в SEQ ID NO: 45.
[0061] В еще одном варианте реализации настоящее изобретение относится к векторным конструкциям, кодирующим функциональный полипептид фактора VIII, при этом указанные конструкции содержат один или более из отдельных элементов описанных выше конструкций и комбинации перечисленных элементов, в одной или более различных ориентациях. Настоящее изобретение также направлено на описанные выше конструкции в противоположной ориентации.
[0062] ААВ-векторы согласно настоящему изобретению по одной нити меньше, чем приблизительно 7,0 т.п.н. в длину, или меньше, чем 6,5 т.п.н. в длину, или меньше, чем 6,4 т.п.н. в длину, или меньше, чем 6,3 т.п.н. в длину, или меньше, чем 6,2 т.п.н. в длину, или меньше, чем 6,0 т.п.н. в длину, или меньше, чем 5,8 т.п.н. в длину, или меньше, чем 5,6 т.п.н. в длину, или меньше, чем 5,5 т.п.н. в длину, или меньше, чем 5,4 т.п.н. в длину, или меньше, чем 5,4 т.п.н. в длину, или меньше, чем 5,2 т.п.н. в длину или меньше, чем 5,0 т.п.н. в длину. Длины ААВ-векторов согласно настоящему изобретению по одной нити находятся в диапазонах от приблизительно 5,0 т.п.н. до приблизительно 6,5 т.п.н., или в диапазонах от приблизительно 4,8 т.п.н. до приблизительно 5,2 т.п.н., или от 4,8 т.п.н. до 5,3 т.п.н., или в диапазонах от приблизительно 4,9 т.п.н. до приблизительно 5,5 т.п.н., или от приблизительно 4,8 т.п.н. до приблизительно 6,0 т.п.н., или от приблизительно 5,0 т.п.н. до 6,2 т.п.н. или от приблизительно 5,1 т.п.н. до приблизительно 6,3 т.п.н., или от приблизительно 5,2 т.п.н. до приблизительно 6,4 т.п.н., или от приблизительно 5,5 т.п.н. до приблизительно 6,5 т.п.н.
[0063] В другом варианте реализации согласно настоящему изобретению предложены способы получения рекомбинантной частицы аденоассоциированного вируса (ААВ), содержащей любой из ААВ-векторов согласно настоящему изобретению. Указанные способы включают этапы культивирования клетки, которая была трансфицирована любым из ААВ-векторов согласно настоящему изобретению, и получения рекомбинантного ААВ из супернатанта указанной трансфицированной клетки.
[0064] Клетки согласно настоящему изобретению представляют собой любой тип клетки, восприимчивый к бакуловирусной инфекции, включая клетки насекомого, такие как High five, Sf9, Se301, SeIZD2109, SeUCR1, Sf9, Sf900+, Sf21, BTI-TN-5B1-4, MG-1, Tn368, HzAm1, BM-N, Ha2302, Hz2E5 и Ao38. Предпочтительные используемые клетки млекопитающих могут представлять собой клетки HEK293, HeLa, CHO, NS0, SP2/0, PER.C6, Vero, RD, BHK, HT 1080, A549, Cos-7, ARPE-19 и MRC-5, и включают такие клетки млекопитающих, как клетки HEK293, HeLa, CHO, NS0, SP2/0, PER.C6, Vero, RD, BHK, HT 1080, A549, Cos-7, ARPE-19 и MRC-5.
[0065] Согласно настоящему изобретению также предложена вирусная частица, содержащая любой из ААВ-векторов согласно настоящему изобретению, или любая вирусная частица, полученная с помощью описанных выше способов согласно настоящему изобретению.
[0066] "Вирион ААВ", или "вирусная частица ААВ", или "векторная частица ААВ" относится к вирусной частице, состоящей из по меньшей мере одного капсидного белка ААВ и заключенного в капсид полинуклеотида ААВ-вектора. Если указанная частица содержит гетерологичный полинуклеотид (т.е. полинуклеотид, отличный от генома ААВ дикого типа, такой как трансген для доставки в клетку млекопитающего), ее обычно называют "ААВ-векторной частицей" или просто "ААВ-вектором". Таким образом, получение ААВ-векторной частицы обязательно включает получение ААВ-вектора, так как такой вектор содержится внутри ААВ-векторной частицы.
[0067] Согласно настоящему изобретению также предложены клетки, содержащие любой из ААВ-векторов согласно настоящему изобретению, и вирусные частицы, продуцированные данными клетками согласно настоящему изобретению.
[0068] В другом варианте реализации согласно настоящему изобретению предложены способы лечения пациента, страдающего гемофилией A, включающие введение пациенту эффективного количества любого из ААВ-векторов согласно настоящему изобретению, или вирусной частицы согласно настоящему изобретению, или вирусных частиц, полученных с помощью способа согласно настоящему изобретению.
[0069] В дополнительном варианте реализации согласно настоящему изобретению предложено применение любого из ААВ-векторов согласно настоящему изобретению для получения лекарственного средства для лечения гемофилии A. В одном аспекте указанное лекарственное средство содержит некоторое количество ААВ-вектора, который экспрессирует FVIII человека в количестве, эффективном для лечения гемофилии A.
[0070] В другом варианте реализации согласно настоящему изобретению предложена композиция, содержащая любой из ААВ-векторов согласно настоящему изобретению, для лечения гемофилии A. В одном аспекте указанная композиция содержит некоторое количество ААВ-вектора, который экспрессирует FVIII человека в количестве, эффективном для лечения гемофилии A.
[0071] В другом варианте реализации ААВ-векторы согласно настоящему изобретению применяют для получения ААВ-вирусных частиц, которые полезны для лечения пациента, страдающего гемофилией A.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0072] На фигуре 1 представлено схематическое изображение вектора UCL SQ. Слева направо вектор UCL SQ содержит 5'-ITR ААВ2, последовательность вируса ААВ2 дикого типа, энхансер ApoE/C1 человека длиной 34 основания, дистальную область X промотора AAT человека длиной 32 основания, промотор AAT человека длиной 186 оснований, включая 42 основания последовательности 5'-НТО, кодон-оптимизированную последовательность SQ FVIII человека (см. Nathwani и др., заявка на патент США № 2013/0024960A1, опубликованная 24 января 2013 г., содержание которой полностью включено в данную заявку посредством ссылки, и McIntosh и др., Blood, 121:3335-3344, 2013), синтетическую последовательность полиаденилирования длиной 49 оснований, последовательность вируса ААВ2 дикого типа и 3'-ITR ААВ2. Длина вектора UCL SQ составляет 5081 основание.
[0073] На фигуре 2 представлены схематические изображения и последовательности векторов Proto 1, Proto 1S, Proto 2S и Proto 3S. (A) Схематическое изображение вектора Proto 1. Начиная с вектора UCL SQ (см. фигуру 1), чужеродные последовательности вируса ААВ2 дикого типа были удалены, и последовательности, соответствующие сайтам рестрикции между 5'-НТО AAT человека и кодирующей областью FVIII человека, и между терминирующим кодоном FVIII человека и синтетической последовательностью полиаденилирования, были удалены. (B) Схематическое изображение вектора Proto 1S. Начиная с вектора Proto 1, 10 оснований на 3'-конце 5'-ITR ААВ2 и 10 оснований на 5'-конце 3'-ITR были удалены. (C) Схематическое изображение вектора Proto 2S. Начиная с вектора Proto 1S, энхансер ApoE/C1 человека и дистальная область X промотора AAT человека были перемещены в синтетический интрон длиной 100 оснований, который был вставлен между экзонами 1 и 2 последовательности FVIII человека. Стрелками обозначено, что ориентации энхансера ApoE/C1 человека и дистальной области X промотора AAT человека были противоположными по сравнению с их ориентациями в Proto 1S. (D) Схематическое изображение вектора Proto 3S. Начиная с Proto 2S, дистальная область X промотора AAT человека заменена на вторую копию энхансера ApoE/C1 человека в обратной ориентации.
[0074] На фигуре 3 представлено схематическое изображение векторов Proto 4, Proto 5, Proto 6 и Proto 7. (A) Схематическое изображение вектора Proto 4. Начиная с вектора Proto 1, последовательность SQ и домен a3 были удалены. (B) Схематическое изображение вектора Proto 5. Начиная с вектора Proto 4, интрон FVIII длиной 129 оснований был вставлен между экзонами 1 и 2 последовательности фактора VIII человека. (C) Схематическое изображение вектора Proto 6. Начиная с вектора Proto 5, вторая копия энхансера ApoE/C1 человека была вставлена в прямой ориентации в интрон FVIII. (D) Схематическое изображение вектора Proto 7. Начиная с вектора Proto 5, вторая копия энхансера ApoE/C1 человека была вставлена в обратной ориентации в интрон FVIII.
[0075] На фигуре 4A - фигуре 4KK представлены схематические изображения ААВ-векторов экспрессии FVIII с улучшенными последовательностями промотора/энхансера. (A) Схематическое изображение конструкции 100ATG. (B) Схематическое изображение конструкции 100ATG bGH polyA. (C) Схематическое изображение конструкции 100ATG short bGH poly A. (D) Схематическое изображение конструкции 103ATG. (E) Схематическое изображение конструкции 103ATG short bGH poly A. (F) Схематическое изображение конструкции 105ATG bGH polyA. (G) Схематическое изображение конструкции DC172ATG FVIII. (H) Схематическое изображение конструкции DC172ATG FVIII hAAT. (I) Схематическое изображение конструкции DC172 2xHCR ATG FVIII. (J) Схематическое изображение конструкции DC172 2xHCR ATG FVIII hAAT. (K) Схематическое изображение конструкции 2x SerpinA hAAT ATG FVIII. (L) Схематическое изображение конструкции 2x SerpinA hAAT ATG FVIII 2x μ-globulin enhancer. (M) Схематическое изображение конструкции 100ATG short. (N) Схематическое изображение конструкции Factor VIII-BMN001. (O) Схематическое изображение конструкции FVIII-BMN002. (P) Схематическое изображение конструкции 99. (Q) Схематическое изображение конструкции 100. (R) Схематическое изображение конструкции 100 в обратной ориентации. (S) Схематическое изображение конструкции 100AT. (T) Схематическое изображение конструкции 100AT 2x MG. (U) Схематическое изображение конструкции 100AT 2x MG bGH polyA. (V) Схематическое изображение конструкции 100AT 2x MG (reverse) bGH poly A. (W) Конструкция 100 bGH poly A. (X) Схематическое изображение конструкции 100-400. (Y) Схематическое изображение конструкции 101. (Z) Схематическое изображение конструкции 102. (AA) Схематическое изображение конструкции 103. (BB) Схематическое изображение конструкции 103 в обратной ориентации. (CC) Схематическое изображение конструкции 103AT. (DD) Схематическое изображение конструкции 103AT 2x MG. (EE) Схематическое изображение конструкции 103AT 2x MG bGH poly A. (FF) Схематическое изображение 103 sbGH poly A. (GG) Схематическое изображение конструкции 104. (HH) Схематическое изображение конструкции 105. (II) Схематическое изображение конструкции 106. (JJ) Схематическое изображение конструкции 106AT. (KK) Схематическое изображение конструкции 2x SerpinA hAAT.
[0076] На фигуре 5 представлены результаты оценки конструкций Proto в мышах Rag2, и продемонстрировано, что Proto 1 осуществляет трансдукцию FVIII аналогично дикому типу.
[0077] На фигурах 6 и 7 продемонстрировано, что Proto 1, Proto 1S, Proto 2S и Proto 3S экспрессируют белок VP1, VP2 и VP3 (фигура 5) и ДНК VP1, VP2 и VP3 (фигура 6).
[0078] На фигурах 8-10 продемонстрировано, что конструкции с улучшенным промотором осуществляют повышенную экспрессию FVIII.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0079] ААВ-векторы с превышенным размером оказываются произвольным образом укорочены по 5'-концам, и в них отсутствует 5'-ITR ААВ. Так как ААВ представляет собой однонитевой ДНК вирус, и в него упакована либо смысловая, либо антисмысловая нить, в смысловой нити в ААВ-векторах с превышенным размером отсутствует 5'-ITR ААВ и, возможно, части 5'-конца целевого кодирующего белок гена, и в антисмысловой нити в ААВ-векторах с превышенным размером отсутствует 3'-ITR и, возможно, части 3'-конца целевого кодирующего белок гена. Функциональный трансген получают в клетках, инфицированных ААВ-вектором с превышенным размером, путем гибридизации смыслового и антисмыслового укороченных геномов внутри целевой клетки.
[0080] Согласно настоящему изобретению предложены ААВ-векторы, кодирующие функционально активный FVIII, т.е. полностью упакованные ААВ-векторы экспрессии FVIII или ААВ-векторы экспрессии FVIII с высокой экспрессионной активностью. ААВ-векторы экспрессии FVIII согласно настоящему изобретению проявляют улучшенную экспрессию на частицу, а также улучшенный выход продукции ААВ-вируса, и их проще очистить. Введение одного или более интронов в кодирующую область белка FVIII повышает экспрессию. Реконфигурация количества и расположения энхансеров также повышает экспрессию.
Вектор UCL SQ
[0081] Вектор UCL SQ, который подробно описан в Nathwani и др., заявке на патент США № 2013/0024960A1, опубликованной 24 января 2013 г., содержание которой полностью включено в данную заявку посредством ссылки, и в McIntosh и др., Blood, 121:3335-3344, 2013, представляет собой ААВ-вектор с превышенным размером, т.е. больший, чем 5,0 т.п.н. На фигуре 1 показано, что вектор UCL SQ содержит слева направо 5'-ITR ААВ серотипа 2 (ААВ2), последовательность вируса ААВ2 дикого типа, энхансер аполипопротеина E (ApoE)/C1 человека длиной 34 основания, дистальную область X промотора альфа-1-антитрипсина (AAT) человека длиной 32 основания, промотор AAT человека длиной 186 оснований, включая 42 основания последовательности 5'-нетранслируемой области (НТО), кодон-оптимизированную последовательность FVIII человека, в которой домен B заменен на состоящую из 14 аминокислот последовательность SQ, синтетическую последовательность полиаденилирования длиной 49 оснований, последовательность вируса ААВ2 дикого типа и 3'-ITR ААВ2. Длина вектора UCL SQ составляет 5081 основание.
[0082] В Nathwani и др., заявке на патент США № 2013/0024960A1, опубликованной 24 января 2013 г., и в McIntosh и др., Blood, 121:3335-3344, 2013 г., показано, что вектор UCL SQ экспрессирует функционально активный FVIII in vitro и in vivo.
Векторы Proto 1, Proto 1S, Proto 2S и Proto 3S
[0083] Для того, чтобы избежать проблемы ААВ-векторов с превышенным размером и/или повысить экспрессию ААВ-векторов, согласно настоящему изобретению предложены полностью упакованные, меньшего размера, т.е. меньшие, чем 5,0 т.п.н., ААВ-векторы, кодирующие вариант SQ FVIII. Последовательность нуклеотидов Proto 1 длиной 4970 п.о. представлена в последовательности SEQ ID NO: 1.
[0084] Для того, чтобы получить ААВ-вектор Proto 1, последовательности, которые сочли необязательными для получения функционально активного FVIII, были удалены из вектора UCL SQ. В примере 1 показано, что были удалены 110 оснований чужеродной ДНК, включая 53 основания последовательности вируса ААВ2 с 3' от 5'-ITR ААВ2, 46 оснований последовательности вируса ААВ2 с 5' от 3'-ITR ААВ2 и 11 оснований, расположенных рядом с кодон-оптимизированной кодирующей областью SQ FVIII. Длина полученного вектора Proto 1 составила 4970 оснований. При разработке было неизвестно, будет ли вектор Proto 1 способен экспрессировать функциональный полипептид FVIII, либо in vitro, либо in vivo.
[0085] Для того, чтобы получить ААВ-вектор Proto 1S, 10 оснований на 3'-конце от 5'-ITR ААВ2 и 10 оснований на 5'-конце от 3'-ITR ААВ32 были удалены из вектора Proto 1. Длина полученного вектора Proto 1S составила 4950 оснований. Последовательность нуклеотидов Proto 1S представлена в последовательности SEQ ID NO: 2.
[0086] Для того, чтобы получить ААВ-вектор Proto 2S, синтетический интрон длиной 100 оснований был вставлен между экзонами 1 и 2 кодон-оптимизированной последовательности SQ FVIII в векторе Proto 1S. Энхансер ApoE/C1 длиной 34 основания и дистальную область X промотора AAT человека длиной 32 основания удалили против хода транскрипции от промотора AAT человека и встроили в синтетический интрон в обратной ориентации (по сравнению с ориентацией, когда данные элементы были расположены против хода транскрипции от промотора AAT человека). Длина полученного вектора Proto 2S составила 4983 основания. Последовательность нуклеотидов Proto 2S представлена в последовательности SEQ ID NO: 3.
[0087] Для того, чтобы получить ААВ-вектор Proto 3S, дистальную область X промотора AAT человека удаляли из вектора Proto 2S и заменяли на вторую копию энхансера ApoE/C1 длиной 34 основания в обратной ориентации. Длина полученного вектора Proto 3S составила 4984 основания. Последовательность нуклеотидов Proto 3S представлена в последовательности SEQ ID NO: 4.
Векторы Proto 4, Proto 5, Proto 6 и Proto 7
[0088] Для того, чтобы уменьшить размер ААВ-векторов и/или повысить экспрессию ААВ-векторов, согласно настоящему изобретению также предложены полностью упакованные, меньшего размера, т.е. меньшие, чем 5,0 т.п.н., ААВ-векторы, кодирующие FVIII, в котором удален домен B и домен a3.
[0089] Для того, чтобы получить ААВ-вектор Proto 4, последовательность SQ длиной 14 аминокислот и домен a3, расположенный рядом с доменом C, удаляли из вектора Proto 1. Общий размер удаленной последовательности FVIII составлял 55 аминокислот или 165 оснований. Длина полученного вектора Proto 4 составила 4805 оснований. Последовательность нуклеотидов Proto 4 представлена в последовательности SEQ ID NO: 5.
[0090] Для того, чтобы получить ААВ-вектор Proto 5, укороченный интрон FVIII длиной 129 оснований был вставлен между экзонами 1 и 2 кодон-оптимизированной последовательности FVIII в векторе Proto 4. Длина полученного вектора Proto 5 составила 4934 основания. Последовательность нуклеотидов Proto 5 представлена в последовательности SEQ ID NO: 6.
[0091] Для того, чтобы получить ААВ-вектор Proto 6, 34 основания интрона FVIII были заменены в векторе Proto 5 на вторую копию энхансера ApoE/C1 человека длиной 34 основания в прямой ориентации. Длина полученного вектора Proto 6 составила 4934 основания. Последовательность нуклеотидов Proto 6 представлена в последовательности SEQ ID NO: 7.
[0092] Для того, чтобы получить ААВ-вектор Proto 7, 34 основания интрона FVIII были заменены в векторе Proto 5 на вторую копию энхансера ApoE/C1 человека длиной 34 основания в обратной ориентации. Длина полученного вектора Proto 7 составила 4934 основания. Последовательность нуклеотидов Proto 7 представлена в последовательности SEQ ID NO: 8.
[0093]
Дополнительные ААВ-векторы экспрессии FVIII с улучшенными последовательностями промотора/энхансера
[0094] ААВ-векторы с превышенным размером с сильными промоторами получали, чтобы увеличить экспрессию FVIII, в котором удален домен B и домен a3, и данные конструкции получали с модифицированными последовательностями энхансера и/или промотора. В некоторых вариантах реализации ААВ-векторы экспрессии FVIII экспрессируют укороченный функциональный FVIII. Данные конструкции содержали одну или более последовательностей промоторов и энхансеров, таких как HCR ApoE или его фрагменты, энхансер μ-глобулина или его фрагменты, промотор альфа-1-антитрипсина человека (hAAT) или его фрагменты, энхансер серпина A или его фрагменты, энхансер промотора LP1 или его фрагменты или энхансер макроглобулина или его фрагмент. Данные конструкции содержат последовательность полиаденилирования, такую как последовательность поли(А) bGH или синтетическая последовательность поли(А) бета-глобина кролика. В некотором варианте реализации указанные конструкции содержат интрон или фрагменты интрона, такой как интрон hAAT или интрон бета-глобина человека.
[0095] Длина конструкции 100ATG составляет 5511 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 9, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 160-502 представляют собой HCR ApoE, основания 509-726 представляют собой промотор hAAT, основания 727-910 представляют собой модифицированный 2ой интрон бета-глобина человека, основания 923-5296 представляют собой кодон-оптимизированный SQ FVIII, основания 5305-5352 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5367-5511 представляют собой 3'-ITR ААВ2.
[0096] Длина конструкции 100ATG bGH poly A составляет 5688 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 10, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 160-502 представляют собой HCR ApoE, основания 509-726 представляют собой промотор hAAT, основания 727-910 представляют собой модифицированный 2ой интрон бета-глобина человека, основания 923-5296 представляют собой кодон-оптимизированный SQ FVIII, основания 5305-5529 представляют собой поли(А) bGH и основания 5544-5688 представляют собой 3'-ITR ААВ2.
[0097] Длина конструкции 100ATG short bGH poly A составляет 5613 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 11, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 160-502 представляют собой HCR ApoE, основания 509-726 представляют собой промотор hAAT, основания 727-910 представляют собой модифицированный 2ой интрон бета-глобина человека, основания 923-5296 представляют собой кодон-оптимизированный SQ FVIII, основания 5305-5454 представляют собой короткий поли(А) bGH и основания 5469-5613 представляют собой 3'-ITR ААВ2.
[0098] Длина конструкции 103ATG составляет 5362 основания. Данная конструкция представлена в последовательности SEQ ID NO: 12, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-344 представляют собой четыре копии (4x) 44 п.о.-повтора ApoE, основания 360-577 представляют собой промотор hAAT, основания 578-761 представляют собой модифицированный 2ой интрон бета-глобина человека, основания 774-5147 представляют собой кодон-оптимизированный SQ FVIII, основания 5156-5203 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5218-5362 представляют собой 3'-ITR ААВ2.
[0099] Длина конструкции 103ATG short bGH poly A составляет 5464 основания. Данная конструкция представлена в последовательности SEQ ID NO: 13, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-344 представляют собой четыре копии (4x) 44 п.о.-повтора ApoE, основания 360-577 представляют собой промотор hAAT, основания 578-761 представляют собой модифицированный 2ой интрон бета-глобина человека, основания 774-5147 представляют собой кодон-оптимизированный SQ FVIII, основания 5156-5305 представляют собой короткий поли(А) bGH и основания 5320-5464 представляют собой 3'-ITR ААВ2.
[00100] Длина конструкции 105ATG bGH polyA составляет 6354 основания. Данная конструкция представлена в последовательности SEQ ID NO: 14, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 173-512 представляют собой две копии (2x) энхансера микроглобулина длиной 170 п.о., основания 519-736 представляют собой промотор hAAT, основания 737-920 представляют собой модифицированный 2ой интрон бета-глобина человека, основания 933-5306 представляют собой кодон-оптимизированный SQ FVIII, основания 5315-5539 представляют собой поли(А) bGH, основания 5546-6195 представляют собой две копии (2x) HCR ApoE длиной 325 п.о. и основания 6210-6354 представляют собой 3'-ITR ААВ2.
[00101] Длина конструкции DC172ATG FVIII составляет 6308 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 15, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 160-449 представляют собой две копии (2x) энхансера макроглобулина длиной 145 п.о., основания 450-1347 представляют собой промотор hAAT длиной 898 п.о., основания 1348-1531 представляют собой модифицированный 2ой интрон бета-глобина человека, основания 1544-5917 представляют собой кодон-оптимизированный SQ FVIII, основания 5926-6149 представляют собой поли(А) bGH и основания 6164-6308 представляют собой 3'-ITR ААВ2.
[00102] Длина конструкции DC172ATG FVIII hAAT составляет 5635 оснований. Данная конструкция представлена в виде последовательности SEQ ID NO: 16, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 160-449 представляют собой две копии (2x) энхансера макроглобулина длиной 145 п.о., основания 457-674 представляют собой промотор hAAT, основания 675-858 представляют собой модифицированный 2ой интрон бета-глобина человека, основания 871-5244 представляют собой кодон-оптимизированный SQ FVIII, основания 5253-5476 представляют собой поли(А) bGH и основания 5490-5635 представляют собой 3'-ITR ААВ2.
[00103] Длина конструкции DC172 2xHCR ATG FVIII составляет 6962 основания. Данная конструкция представлена в последовательности SEQ ID NO: 17, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 160-807 представляют собой две копии (2x) HCR ApoE длиной 321 п.о., основания 814-1103 представляют собой две копии (2x) энхансера макроглобулина длиной 145 п.о., основания 1104-2001 представляют собой промотор hAAT длиной 898 п.о., основания 2002-2185 представляют собой модифицированный 2ой интрон бета-глобина человека, основания 2198-6571 представляют собой кодон-оптимизированный SQ FVIII, основания 6580-6803 представляют собой поли(А) bGH и основания 6818-6962 представляют собой 3'-ITR ААВ2.
[00104] Длина конструкции DC172 2xHCR ATG FVIII hAAT составляет 6289 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 18, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 160-807 представляют собой две копии (2x) HCR ApoE длиной 321 п.о., основания 814-1103 представляют собой две копии (2x) энхансера макроглобулина длиной 145 п.о., основания 1111-1328 представляют собой промотор hAAT, основания 1329-1512 представляют собой модифицированный 2ой интрон бета-глобина человека, основания 1525-5898 представляют собой кодон-оптимизированный SQ FVIII, основания 5907-6130 представляют собой поли(А) bGH и основания 6245-6289 представляют собой 3'-ITR ААВ2.
[00105] Длина конструкции 2x SerpinA hAAT ATG FVIII составляет 5430 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 19, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 168-309 представляют собой две копии (2x) энхансера серпина A длиной 71 п.о., основания 326-543 представляют собой промотор hAAT, основания 544-727 представляют собой модифицированный 2ой интрон бета-глобина человека, основания 740-5113 представляют собой кодон-оптимизированный SQ FVIII, основания 5122-5271 представляют собой короткий поли(А) bGH и основания 5286-5430 представляют собой 3'ААВ2 ITR.
[00106] Длина конструкции 2x SerpinA hAAT ATG FVIII 2x μ-globulin enhancer составляет 5779 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 20, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 168-309 представляют собой две копии (2x) энхансера серпина A длиной 71 п.о., основания 326-543 представляют собой промотор hAAT, основания 544-727 представляют собой модифицированный 2ой интрон бета-глобина человека, основания 740-5113 представляют собой кодон-оптимизированный SQ FVIII, основания 5122-5271 представляют собой короткий поли(А) bGH, основания 5279-5618 представляют собой две копии (2x) энхансера μ-глобулина длиной 170 п.о. и основания 5635-5779 представляют собой 3'-ITR ААВ2.
[00107] Длина конструкции 100ATG short bGH poly A 2x μ-globulin enhancer составляет 5962 основания. Данная конструкция представлена в последовательности SEQ ID NO: 21, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 160-502 представляют собой HCR ApoE, основания 509-726 представляют собой промотор hAAT, основания 727-910 представляют собой модифицированный 2ой интрон бета-глобина человека, основания 923-5296 представляют собой кодон-оптимизированный SQ FVIII, основания 5305-5454 представляют собой короткий поли(А) bGH, основания 5462-5801 представляют собой две копии (2x) энхансера микроглобулина длиной 170 п.о. и основания 5818-5962 представляют собой 3'-ITR ААВ2.
[00108] Длина конструкции Factor VIII-BMN001 составляет 5919 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 22, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 160-480 представляют собой HCR ApoE, основания 487-884 представляют собой промотор hAAT длиной 398 п.о., основания 885-1145 представляют собой укороченный интрон hAAT, основания 1155-5528 представляют собой кодон-оптимизированный SQ FVIII, основания 5537-5760 представляют собой поли(А) bGH и основания 5775-5919 представляют собой 3'-ITR ААВ2.
[00109] Длина конструкции FVIII-BMN002 составляет 5306 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 23, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 175-705 представляют собой промотор/энхансер LP1, основания 718-5091 представляют собой кодон-оптимизированный SQ FVIII, основания 5100-5147 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5162-5306 представляют собой 3'-ITR ААВ2.
[00110] Длина конструкции 99 составляет 5461 основание. Данная конструкция представлена в последовательности SEQ ID NO: 24, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-627 представляют собой HCR/MAR ApoE, основания 634-866 представляют собой промотор hAAT, основания 873-5246 представляют собой кодон-оптимизированный SQ FVIII, основания 5255-5302 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5317-5461 представляют собой 3'-ITR ААВ2.
[00111] Длина конструкции 100 составляет 5327 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 25, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-493 представляют собой HCR ApoE, основания 509-726 представляют собой промотор hAAT, основания 739-5112 представляют собой кодон-оптимизированный SQ FVIII, основания 5121-5168 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5183-5327 представляют собой 3'-ITR ААВ2.
[00112] Длина конструкции 100 в обратной ориентации составляет 5309 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 26, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 160-484 представляют собой HCR ApoE в обратной ориентации, основания 491-708 представляют собой промотор hAAT, основания 721-5094 представляют собой кодон-оптимизированный SQ FVIII, основания 5103-5150 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5165-5309 представляют собой 3'-ITR ААВ2.
[00113] Длина конструкции 100AT составляет 5532 основания. Данная конструкция представлена в последовательности SEQ ID NO: 27, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-493 представляют собой HCR ApoE, основания 509-726 представляют собой промотор hAAT, основания 727-931 представляют собой интрон hAAT, основания 944-5317 представляют собой кодон-оптимизированный SQ FVIII, основания 5326-5373 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5388-5532 представляют собой 3'-ITR ААВ2.
[00114] Длина конструкции 100AT 2x MG составляет 5877 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 28, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-493 представляют собой HCR ApoE, основания 508-847 представляют собой две копии (2x) энхансера μ-глобулина длиной 170 п.о., основания 854-1071 представляют собой промотор hAAT, основания 1072-1276 представляют собой интрон hAAT, основания 1289-5662 представляют собой кодон-оптимизированный SQ FVIII, основания 5671-5718 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5733-5877 представляют собой 3'-ITR ААВ2.
[00115] Длина конструкции 100AT 2x MG bGH poly A составляет 6054 основания. Данная конструкция представлена в последовательности SEQ ID NO: 29, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-493 представляют собой HCR ApoE, основания 508-847 представляют собой две копии (2x) энхансера μ-глобулина длиной 170 п.о., основания 854-1071 представляют собой промотор hAAT, основания 1072-1276 представляют собой интрон hAAT, основания 1289-5662 представляют собой кодон-оптимизированный SQ FVIII, основания 5671-5895 представляют собой поли(А) bGH и основания 5910-6054 представляют собой 3'-ITR ААВ2.
[00116] Длина конструкции 100AT 2x MG (reverse) bGH poly A составляет 6054 основания. Данная конструкция представлена в последовательности SEQ ID NO: 30, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-493 представляют собой HCR ApoE, основания 508-847 представляют собой две копии (2x) энхансера μ-глобулина длиной 170 п.о. в обратной ориентации, основания 854-1071 представляют собой промотор hAAT, основания 1072-1276 представляют собой интрон hAAT, основания 1289-5662 представляют собой кодон-оптимизированный SQ FVIII, основания 5671-5895 представляют собой поли(А) bGH и основания 5910-6054 представляют собой 3'-ITR ААВ2.
[00117] Длина конструкции 100 bGH poly A составляет 5504 основания. Данная конструкция представлена в последовательности SEQ ID NO: 31, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-493 представляют собой HCR ApoE, основания 509-726 представляют собой промотор hAAT, основания 739-5112 представляют собой кодон-оптимизированный SQ FVIII, пары оснований 5121-5345 представляют собой поли(А) bGH и основания 5360-5504 представляют собой 3'-ITR ААВ2.
[00118] Длина конструкции 100-400 составляет 5507 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 32, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-493 представляют собой HCR ApoE, основания 512-906 представляют собой промотор hAAT длиной 398 п.о., основания 919-5292 представляют собой кодон-оптимизированный SQ FVIII, основания 5301-5348 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5363-5507 представляют собой 3'-ITR ААВ2.
[00119] Длина конструкции 101 составляет 5311 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 33, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 170-477 представляют собой две копии (2x) HCR ApoE длиной 154 п.о., основания 493-710 представляют собой промотор hAAT, основания 723-5096 представляют собой кодон-оптимизированный SQ FVIII, основания 5105-5152 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5167-5311 представляют собой 3'-ITR ААВ2.
[00120] Длина конструкции 102 составляет 5156 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 34, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-322 представляют собой HCR ApoE длиной 154 п.о., основания 338-555 представляют собой промотор hAAT, основания 568-4941 представляют собой кодон-оптимизированный SQ FVIII, основания 4950-4997 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5012-5156 представляют собой 3'-ITR ААВ2.
[00121] Длина конструкции 103 составляет 5178 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 35, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-344 представляют собой четыре копии (4x) HCR ApoE длиной 44 п.о., основания 360-577 представляют собой промотор hAAT, основания 590-4963 представляют собой кодон-оптимизированный SQ FVIII, основания 4972-5019 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5034-5178 представляют собой 3'-ITR ААВ2.
[00122] Длина конструкции 103 в обратной ориентации составляет 5160 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 36, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 160-335 представляют собой четыре копии (4x) HCR ApoE длиной 44 п.о. в обратной ориентации, основания 342-559 представляют собой промотор hAAT, основания 572-4945 представляют собой кодон-оптимизированный SQ FVIII, основания 4954-5001 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5016-5160 представляют собой 3'-ITR ААВ2.
[00123] Длина конструкции 103AT составляет 5383 основания. Данная конструкция представлена в последовательности SEQ ID NO: 37, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-344 представляют собой четыре копии (4x) HCR ApoE длиной 44 п.о., основания 360-577 представляют собой промотор hAAT, основания 578-782 представляют собой интрон hAAT, основания 795-4374 представляют собой кодон-оптимизированный SQ FVIII, основания 5177-5224 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5239-5383 представляют собой 3'-ITR ААВ2.
[00124] Длина конструкции 103AT 2x MG составляет 5728 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 38, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-344 представляют собой четыре копии (4x) HCR ApoE длиной 44 п.о., основания 359-698 представляют собой две копии (2x) энхансера μ-глобулина длиной 170 п.о., основания 705-922 представляют собой промотор hAAT, основания 923-1127 представляют собой интрон hAAT, основания 1140-5513 представляют собой кодон-оптимизированный SQ FVIII, основания 5522-5569 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5584-5728 представляют собой 3'-ITR ААВ2.
[00125] Длина конструкции 103AT 2x MG bGH poly A составляет 5905 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 39, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-344 представляют собой четыре копии (4x) HCR ApoE длиной 44 п.о., основания 359-698 представляют собой две копии (2x) энхансера μ-глобулина длиной 170 п.о., основания 705-922 представляют собой промотор hAAT, основания 923-1127 представляют собой интрон hAAT, основания 1140-5513 представляют собой кодон-оптимизированный SQ FVIII, основания 5522-5746 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5761-5905 представляют собой 5'-ITR ААВ2.
[00126] Длина конструкции 103 bGH poly A составляет 5355 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 40, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-344 представляют собой четыре копии (4x) HCR ApoE длиной 44 п.о., основания 360-577 представляют собой промотор hAAT, основания 590-4963 представляют собой кодон-оптимизированный SQ FVIII, основания 4972-5196 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5211-5355 представляют собой 3'-ITR ААВ2.
[00127] Длина конструкции 104 составляет 5618 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 41, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 169-784 представляют собой четыре копии (4x) HCR ApoE длиной 154 п.о., основания 800-1017 представляют собой промотор hAAT, основания 1030-5403 представляют собой кодон-оптимизированный SQ FVIII, основания 5412-5459 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5474-5618 представляют собой 3'-ITR ААВ2.
[00128] Длина конструкции 105 составляет 5993 основания. Данная конструкция представлена в последовательности SEQ ID NO: 42, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 173-512 представляют собой две копии (2x) энхансера μ-глобулина длиной 170 п.о., основания 519-736 представляют собой промотор hAAT, основания 749-5122 представляют собой кодон-оптимизированный SQ FVIII, основания 5131-5178 представляют собой синтетическую последовательность поли(А) бета-глобина кролика, основания 5185-5834 представляют собой две копии (2x) HCR ApoE и основания 5849-5993 представляют собой 3'-ITR ААВ2.
[00129] Длина конструкции 106 составляет 5337 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 43, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 173-512 представляют собой две копии (2x) энхансера μ-глобулина длиной 170 п.о., основания 519-736 представляют собой промотор hAAT, основания 749-5122 представляют собой кодон-оптимизированный SQ FVIII, основания 5131-5178 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5193-5337 представляют собой 3'-ITR ААВ2.
[00130] Длина конструкции 106AT составляет 5542 основания. Данная конструкция представлена в последовательности SEQ ID NO: 44, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 173-512 представляют собой две копии (2x) энхансера μ-глобулина длиной 170 п.о., основания 519-736 представляют собой промотор hAAT, основания 737-941 представляют собой интрон hAAT, основания 954-5327 представляют собой кодон-оптимизированный SQ FVIII, основания 5336-5383 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 5398-5542 представляют собой 3'-ITR ААВ2.
[00131] Длина конструкции 2x SerpinA hAAT составляет 5126 оснований. Данная конструкция представлена в последовательности SEQ ID NO: 45, в которой основания 1-145 представляют собой 5'-ITR ААВ2, основания 160-301 представляют собой HCR ApoE, основания 308-525 представляют собой промотор hAAT, основания 538-4911 представляют собой кодон-оптимизированный SQ FVIII, основания 4920-4967 представляют собой синтетическую последовательность поли(А) бета-глобина кролика и основания 4982-5126 представляют собой 3'-ITR ААВ2.
ААВ-векторы
[00132] В данной заявке термин "ААВ" представляет собой стандартную аббревиатуру для аденоассоциированного вируса. Аденоассоциированный вирус представляет собой парвовирус с однонитевой ДНК, который растет лишь в клетках, в которых определенные функции обеспечиваются совместно инфицируемым вирусом-помощником. На сегодняшний день известно тринадцать серотипов ААВ, которые были охарактеризованы, как показано ниже в таблице 1. Основную информацию и обзоры ААВ можно найти, например, в Carter, 1989, Handbook of Parvoviruses, том 1, стр. 169-228, и Berns, 1990, Virology, стр. 1743-1764, Raven Press (Нью-Йорк). Тем не менее, нет сомнения, что те же самые принципы будут применимы к дополнительным серотипам ААВ, поскольку хорошо известно, что различные серотипы довольно близкородственны, как структурно, так и функционально, даже на генетическом уровне (см., например, Blacklowe, 1988, стр. 165-174 в Parvoviruses and Human Disease, J. R. Pattison, ред.; и Rose, Comprehensive Virology 3:1-61 (1974)). Например, все серотипы ААВ очевидно проявляют очень близкие репликационные свойства, опосредованные гомологичными генами rep; и все несут три родственных капсидных белка, таких как экспрессируемые в ААВ 6. О степени родства дополнительно свидетельствует гетеродуплексный анализ, который показал обширную перекрестную гибридизацию между серотипами по всей длине генома; и присутствие аналогичных подверженных самоотжигу фрагментов на концах, которые соответствуют "последовательностям инвертированных концевых повторов" (ITR). Близкие паттерны инфективности также позволяют предположить, что репликационные функции у каждого серотипа находятся под аналогичным регуляторным контролем.
[00133] "ААВ-вектор" в данной заявке относится к вектору, содержащему один или более интересующих полинуклеотидов (или трансгенов), которые фланкированы последовательностями концевых повторов (ITR) ААВ. Такие ААВ-векторы могут реплицироваться и упаковываться в инфекционные вирусные частицы, когда они находятся в клетке-хозяине, которая была трансфицирована вектором, кодирующим и экспрессирующим продукты генов rep и cap.
[00134] "ААВ-вирион", или "ААВ-вирусная частица", или "ААВ-векторная частица" относится к вирусной частице, состоящей из по меньшей мере одного капсидного белка ААВ и заключенного в капсид полинуклеотидного ААВ-вектора. Если указанная частица содержит гетерологичный полинуклеотид (т.е. полинуклеотид, отличный от генома ААВ дикого типа, такой как трансген, который нужно доставить в клетку млекопитающего), то ее обычно называют "ААВ-векторной частицей" или просто "ААВ-вектором". Таким образом, получение ААВ-векторной частицы обязательно включает получение ААВ-вектора, так как такой вектор содержится внутри ААВ-векторной частицы.
[00135] Гены "rep" и "cap" ААВ представляют собой гены, кодирующие белки репликации и заключения в капсид, соответственно. Гены rep и cap ААВ были обнаружены во всех серотипах ААВ, исследованных на сегодняшний день, и описаны в данной заявке и в цитируемых источниках. В ААВ дикого типа гены rep и cap, как правило, обнаруживают расположенными рядом друг с другом в вирусном геноме (т.е. они "соединены" друг с другом как примыкающие или перекрывающиеся транскрипционные единицы), и они, как правило, консервативны среди серотипов ААВ. Гены rep и cap ААВ также по-отдельности и совместно называют "генами упаковки ААВ". Ген cap ААВ в соответствии с настоящим изобретением кодирует белок Cap, который способен упаковывать ААВ-векторы в присутствии rep и функции аденовируса-помощника и способен связывать целевые клеточные рецепторы. В некоторых вариантах реализации ген cap ААВ кодирует капсидный белок с последовательностью аминокислот, полученной из конкретного серотипа ААВ, например, серотипов, представленных в таблице 1.
Серотипы ААВ
[00136] Последовательности ААВ, используемые для получения ААВ, могут быть получены из генома любого серотипа ААВ. Как правило, геномные последовательности серотипов ААВ обладают значительной гомологией на уровнях аминокислот и нуклеиновых кислот, обеспечивают аналогичный набор генетических функций, продуцируют вирионы, которые по существу физически и функционально эквивалентны, и реплицируются и собираются с помощью практически идентичных механизмов. Геномные последовательности серотипов ААВ и обсуждение геномного сходства см., например, по номеру доступа в Genbank U89790; номеру доступа в Genbank J01901; номеру доступа в Genbank AF043303; номеру доступа в Genbank AF085716; в Chlorini и др., J. Vir. 71: 6823-33(1997); Srivastava и др., J. Vir. 45:555-64 (1983); Chlorini и др., J. Vir. 73:1309-1319 (1999); Rutledge и др., J. Vir. 72:309-319 (1998); и Wu и др., J. Vir. 74: 8635-47 (2000).
[00137] Геномная организация всех известных серотипов ААВ очень сходна. Геном ААВ представляет собой линейную однонитевую молекулу ДНК, длина которой составляет менее чем приблизительно 5000 нуклеотидов (нт). Инвертированные концевые повторы (ITR) фланкируют уникальные последовательности нуклеотидов, кодирующие неструктурные белки репликации (Rep) и структурные (VP) белки. Белки VP образуют капсид. Концевые 145 нт самокомплементарны и организованы таким образом, что может образоваться энергетически стабильный внутримолекулярный дуплекс, формирующий T-образную шпильку. Такие шпилечные структуры функционируют как точки начала репликации вирусной ДНК и служат праймерами для клеточного комплекса ДНК-полимеразы. Гены Rep кодируют белки Rep: Rep78, Rep68, Rep52 и Rep40. Rep78 и Rep68 транскрибируются с промотора p5, и Rep 52 и Rep40 транскрибируются с промотора p19. Гены cap кодируют белки VP: VP1, VP2 и VP3. Гены cap транскрибируются с промотора p40.
[00138] В некоторых вариантах реализации последовательность нуклеиновой кислоты, кодирующая капсидный белок ААВ, функционально связана с последовательностями, контролирующими экспрессию в определенном типе клеток, таком как клетки Sf9 или HEK. Известные специалисту в данной области методики экспрессии чужеродных генов в клетках-хозяевах насекомого или клетках-хозяевах млекопитающего можно применять для осуществления настоящего изобретения. Методика молекулярной инженерии и экспрессии полипептидов в клетках насекомого описана, например, в Summers и Smith. 1986. A Manual of Methods for Baculovirus Vectors and Insect Culture Procedures, Texas Agricultural Experimental Station, номер бюллетеня 7555, Колледж-Стейшен, Техас; Luckow. 1991. In Prokop и др., Cloning and Expression of Heterologous Genes in Insect Cells with Baculovirus Vectors' Recombinant DNA Technology and Applications, 97-152; King, L. A. и R. D. Possee, 1992, The baculovirus expression system, Chapman and Hall, Великобритания; O'Reilly, D. R., L. K. Miller, V. A. Luckow, 1992, Baculovirus Expression Vectors: A Laboratory Manual, Нью-Йорк; W.H. Freeman и Richardson, C. D., 1995, Baculovirus Expression Protocols, Methods in Molecular Biology, том 39; в патенте США номер 4745051; US2003148506 и WO 03/074714. Особенно подходящий промотор для транскрипции последовательности нуклеотидов, кодирующей капсидный белок ААВ, например, представляет собой полиэдроновый промотор. Тем не менее, также предложены другие промоторы, которые активны в клетках насекомого, известные в данной области, например, промоторы p10, p35 или IE-1, и дополнительные промоторы, описанные в приведенных выше источниках.
[00139] Применение клеток насекомого для экспрессии гетерологичных белков хорошо обосновано, так же, как и способы введения в такие клетки нуклеиновых кислот, таких как векторы, например, совместимые с клеткой насекомого векторы, и способы поддержания таких клеток в культуре. См., например, METHODS IN MOLECULAR BIOLOGY, ред. Richard, Humana Press, Нью-Джерси (1995); O'Reilly и др., BACULOVIRUS EXPRESSION VECTORS, A LABORATORY MANUAL, Oxford Univ. Press (1994); Samulski и др., J. Vir. 63:3822-8 (1989); Kajigaya и др., Proc. Nat'l. Acad. Sci. USA 88: 4646-50 (1991); Ruffing и др., J. Vir. 66:6922-30 (1992); Kirnbauer и др., Vir. 219:37-44 (1996); Zhao и др., Vir. 272:382-93 (2000); и Samulski и др., патент США номер 6204059. В некоторых вариантах реализации конструкция нуклеиновой кислоты, кодирующая ААВ в клетках насекомого, представляет собой совместимый с клеткой насекомого вектор. "Совместимый с клеткой насекомого вектор" или "вектор" в данной заявке относится к молекуле нуклеиновой кислоты, способной продуктивно трансформировать или трансфицировать насекомое или клетку насекомого. Примеры биологических векторов включают плазмиды, линейные молекулы нуклеиновых кислот и рекомбинантные вирусы. Можно применять любой вектор, при условии, что он совместим с клеткой насекомого. Указанный вектор может встраиваться в геном клеток насекомого, но присутствие вектора в клетке насекомого не обязательно должно быть постоянным, и временные эписомные векторы также входят в объем настоящего изобретения. Векторы можно ввести с помощью любого известного средства, например, путем химической обработки клеток, электропорации или инфекции. В некоторых вариантах реализации вектор представляет собой бакуловирус, вирусный вектор или плазмиду. В более предпочтительном варианте реализации вектор представляет собой бакуловирус, т.е. конструкция представляет собой бакуловирусный вектор. Бакуловирусные векторы и способы их применения описаны в цитируемых выше источниках по молекулярной инженерии клеток насекомого.
[00140] Бакуловирусы представляют собой имеющие оболочку ДНК-содержащие вирусы членистоногих, два представителя которых являются хорошо известными векторами экспрессии для получения рекомбинантных белков в культурах клеток. Бакуловирусы содержат кольцевые двунитевые геномы (80-200 т.п.н.), которые можно сконструировать таким образом, чтобы позволить доставку большого геномного содержимого в определенные клетки. Вирусы, применяемые в качестве вектора, как правило, представляют собой вирус множественного ядерного полиэдроза совки калифорнийской люцерновой (AcMNPV) или вирус множественного ядерного полиэдроза гусеницы тутового шелкопряда (BmNPV) (Kato и др., 2010).
[00141] Бакуловирусы широко применяют для инфицирования клеток насекомых для экспрессии рекомбинантных белков. В частности, экспрессию гетерологичных генов в насекомых можно осуществить, как описано, например, в патенте США номер 4745051; в Friesen и др. (1986); EP 127839; EP 155476; Vlak и др. (1988); Miller и др. (1988); Carbonell и др. (1988); Maeda и др. (1985); Lebacq-Verheyden и др. (1988); Smith и др. (1985); Miyajima и др. (1987); и Martin и др. (1988). Множество штаммов и вариантов бакуловирусов и соответствующих пермиссивных клеток-хозяев насекомых, которые можно применять для получения белка, описаны в Luckow и др. (1988), Miller и др. (1986); Maeda и др. (1985) и McKenna (1989).
Способы получения рекомбинантных ААВ
[00142] В настоящем описании предложены материалы и способы получения рекомбинантных ААВ в клетках насекомых или млекопитающих. В некоторых вариантах реализации вирусная конструкция дополнительно содержит промотор и сайт рестрикции по ходу транскрипции от промотора, чтобы обеспечить возможность вставки полинуклеотида, кодирующего один или более интересующих белков, при этом указанный промотор и сайт рестрикции расположены по ходу транскрипции от 5'-ITR ААВ и против хода транскрипции от 3'-ITR ААВ. В некоторых вариантах реализации вирусная конструкция дополнительно содержит посттранскрипционый регуляторный элемент по ходу транскрипции от сайта рестрикции и против хода транскрипции от 3'-ITR ААВ. В некоторых вариантах реализации вирусная конструкция дополнительно содержит полинуклеотид, вставленный в сайт рестрикции и функционально связанный с промотором, при этом полинуклеотид содержит кодирующую область интересующего белка. Для квалифицированного специалиста будет очевидно, что любой из ААВ-векторов, описанных в настоящей заявке, можно применять в указанном способе в качестве вирусной конструкции для получения рекомбинантного ААВ.
[00143] В некоторых вариантах реализации вспомогательные функции предусмотрены в виде одной или более плазмид-помощников или вирусов-помощников, содержащих аденовирусные или бакуловирусные вспомогательные гены. Лишь некоторые из примеров аденовирусных или бакуловирусных вспомогательных генов включают, но не ограничены перечисленными: E1A, E1B, E2A, E4 и VA, - которые могут осуществлять вспомогательные функции по упаковке ААВ.
[00144] Вирусы-помощники ААВ известны в данной области и включают, например, вирусы из семейства Adenoviridae и семейства Herpesviridae. Примеры вирусов-помощников ААВ включают, но не ограничены перечисленными: вирус-помощник SAdV-13 и SAdV-13-подобный вирус-помощник, описанный в публикации патента США № 20110201088 (описание которого включено в данную заявку посредством ссылки), вспомогательные векторы pHELP (Applied Viromics). Для квалифицированного специалиста должно быть очевидно, что в данной заявке можно применять любой вирус-помощник или плазмиду-помощник ААВ, которые могут обеспечить достаточные вспомогательные функции для ААВ.
[00145] В некоторых вариантах реализации в плазмиде присутствуют гены cap ААВ. Плазмида может дополнительно содержать ген rep ААВ. В данной заявке для получения рекомбинантного ААВ можно применять гены cap и/или ген rep из любого серотипа ААВ (включая, но не ограничиваясь перечисленными серотипами: ААВ1, ААВ2, ААВ4, ААВ5, ААВ6, ААВ7, ААВ8, ААВ9, ААВ10, ААВ11, ААВ12, ААВ13, - и любыми их вариантами). В некоторых вариантах реализации гены cap ААВ кодируют капсид из серотипа 1, серотипа 2, серотипа 4, серотипа 5, серотипа 6, серотипа 7, серотипа 8, серотипа 9, серотипа 10, серотипа 11, серотипа 12, серотипа 13 или их варианта.
[00146] В некоторых вариантах реализации клетку насекомого или млекопитающего можно трансфицировать плазмидой-помощником или вирусом-помощником, вирусной конструкцией и плазмидой, кодирующей гены cap ААВ; и рекомбинантный ААВ-вирус можно собрать в различные моменты времени после совместной трансфекции. Например, рекомбинантный ААВ-вирус можно собрать через приблизительно 12 часов, приблизительно 24 часа, приблизительно 36 часов, приблизительно 48 часов, приблизительно 72 часа, приблизительно 96 часов, приблизительно 120 часов, или в некоторый момент времени между любыми из указанных двух моментов времени после совместной трансфекции.
[00147] Рекомбинантный ААВ также можно получить, применяя любые стандартные способы, известные в данной области, подходящие для получения инфекционного рекомбинантного ААВ. В некоторых случаях рекомбинантный ААВ можно получить путем применения клетки насекомого или млекопитающего, которая стабильно экспрессирует некоторые из обязательных компонентов для получения частицы ААВ. Например, можно встроить в геном клетки плазмиду (или несколько плазмид), содержащую гены rep и cap ААВ и селектируемый маркер, такой как ген устойчивости к неомицину. Клетку насекомого или млекопитающего затем можно подвергнуть совместной инфекции вирусом-помощником (например, аденовирусом или бакуловирусом, обеспечивающим вспомогательные функции) и вирусным вектором, содержащим 5'- и 3'-ITR ААВ (и последовательность нуклеотидов, кодирующую гетерологичный белок, при необходимости). Преимущества данного способа состоят в том, что клетки можно подвергнуть селекции, и что они подходят для крупномасштабного получения рекомбинантного ААВ. В качестве другого лишь одного из примеров для введения генов rep и cap в упаковывающие клетки можно применять предпочтительно аденовирус или бакуловирус, а не плазмиды. В качестве еще другого лишь одного из примеров, как вирусный вектор, содержащий 5'- и 3'-LTR ААВ, так и гены rep-cap можно стабильно встроить в ДНК клеток-продуцентов, и вспомогательные функции могут обеспечиваться аденовирусом дикого типа для получения рекомбинантного ААВ.
Типы клеток, применяемые для получения ААВ
[00148] Вирусные частицы, содержащие ААВ-векторы согласно настоящему изобретению, можно воспроизводить, применяя любой тип клеток беспозвоночных, который позволяет получить ААВ или биологические продукты и который можно поддерживать в культуре. Например, используемая линия клеток насекомого может принадлежать к Spodoptera frugiperda, например, SF9, SF21, SF900+, линиям клеток дрозофилы, линиям клеток москитов, например, линиям клеток, полученным из Aedes albopictus, линиям клеток культивируемого тутового шелкопряда, например, линиям клеток гусеницы тутового шелкопряда, линиям клеток Trichoplusiani, таким как клетки High five, или линиям клеток чешуекрылых, таким как линии клеток Ascalapha odorata. Предпочтительные клетки насекомого представляют собой клетки из видов насекомого, которые восприимчивы к бакуловирусной инфекции, включая High five, Sf9, Se301, SeIZD2109, SeUCR1, Sf9, Sf900+, Sf21, BTI-TN-5B1-4, MG-1, Tn368, HzAm1, BM-N, Ha2302, Hz2E5 и Ao38.
[00149] Бакуловирусы представляют собой имеющие оболочку ДНК-содержащие вирусы членистоногих, два представителя которых являются хорошо известными векторами экспрессии для получения рекомбинантных белков в культурах клеток. Бакуловирусы содержат кольцевые двунитевые геномы (80-200 т.п.н.), которые можно сконструировать таким образом, чтобы позволить доставку большого геномного содержимого в определенные клетки. Вирусы, применяемые в качестве вектора, как правило, представляют собой вирус множественного ядерного полиэдроза совки калифорнийской люцерновой (AcMNPV) или вирус множественного ядерного полиэдроза гусеницы тутового шелкопряда (BmNPV) (Kato и др., 2010).
[00150] Бакуловирусы широко применяют для инфицирования клеток насекомых для экспрессии рекомбинантных белков. В частности, экспрессию гетерологичных генов в насекомых можно осуществить, как описано, например, в патенте США номер 4745051; в Friesen и др. (1986); EP 127839; EP 155476; Vlak и др. (1988); Miller и др. (1988); Carbonell и др. (1988); Maeda и др. (1985); Lebacq-Verheyden и др. (1988); Smith и др. (1985); Miyajima и др. (1987); и Martin и др. (1988). Множество штаммов и вариантов бакуловирусов и соответствующих пермиссивных клеток-хозяев насекомых, которые можно применять для получения белка, описаны в Luckow и др. (1988), Miller и др. (1986); Maeda и др. (1985) и McKenna (1989).
[00151] В другом аспекте настоящего изобретения способы согласно настоящему изобретению также осуществляют с применением любого типа клеток млекопитающих, который позволяет репликацию ААВ или получение биологических продуктов и который можно поддерживать в культуре. Предпочтительные применяемые клетки млекопитающих могут представлять собой клетки HEK293, HeLa, CHO, NS0, SP2/0, PER.C6, Vero, RD, BHK, HT 1080, A549, Cos-7, ARPE-19 и MRC-5.
Тестирование ААВ-векторов экспрессии FVIII
[00152] Анализы для тестирования полностью упакованных ААВ-векторов экспрессии FVIII согласно настоящему изобретению включают, например, (1) временную трансфекцию плазмидами из двунитевой ДНК, содержащей нуклеиновые кислоты ААВ-вектора, клеток HepG2, линии клеток, полученной из печени человека, чтобы проверить экспрессию и сплайсинг специфической для печени мРНК и продукцию и секрецию белка FVIII in vitro; (2) получение ААВ-вирионов, содержащих ААВ-векторы экспрессии FVIII, в клетках 293 и инфицированных бакуловирусом клетках насекомого; (3) оценку нуклеиновых кислот ААВ-вектора путем анализа в щелочном геле и анализов репликации; и (4) оценку экспрессии FVIII, активности FVIII и удельной активности FVIII в мышах Rag2. Данные анализы описаны более подробно в примерах.
[00153] Полностью упакованные ААВ-векторы экспрессии FVIII согласно настоящему изобретению проявляют по меньшей мере такой же уровень экспрессии и/или активности, как и вектор UCL SQ, и предпочтительно в 1,5 раза, в 2 раза, в 3 раза, 4 в раза или 5 в раз или более высокий уровень экспрессии и/или активности по сравнению с вектором UCL SQ.
[00154] Полностью упакованные ААВ-векторы экспрессии FVIII согласно настоящему изобретению позволяют получить вектор с высоким выходом с небольшой долей примесей фрагментарного генома или без примесей, и предпочтительно с в 1,5 раза, в 2 раза, в 3 раза, 4 в раза или 5 в раз большим выходом вектора по сравнению с вектором UCL SQ.
[00155] Другие аспекты и преимущества настоящего изобретения будут понятны после рассмотрения следующих пояснительных примеров.
ПРИМЕРЫ
Пример 1 Получение векторов Proto 1, Proto 1S, Proto 2S и Proto 3S
[00156] Вектор UCL SQ, который подробно описан в Nathwani и др., в заявке на патент США № 2013/0024960A1, опубликованной 24 января 2013 г., содержание которой полностью включено в данную заявку посредством ссылки, и McIntosh и др., Blood, 121:3335-3344, 2013, представляет собой ААВ-вектор с превышенным размером, т.е. больше, чем 5,0 т.п.н. На фигуре 1 показано, что вектор UCL SQ содержит слева направо 5'-ITR ААВ серотипа 2 (ААВ2), последовательность вируса ААВ2 дикого типа, энхансер аполипопротеина E (ApoE)/C1 человека длиной 34 основания, дистальную область X промотора альфа-1-антитрипсина (AAT) человека длиной 32 основания, промотор AAT человека длиной 186 оснований, включая 42 основания последовательности 5'-нетранслируемой области (НТО), кодон-оптимизированную последовательность FVIII человека, в которой домен B заменен на состоящую из 14 аминокислот последовательность SQ, синтетическую последовательность полиаденилирования длиной 49 оснований, последовательность вируса ААВ2 дикого типа и 3'-ITR ААВ2. Длина вектора UCL SQ составляет 5081 основание.
[00157] Для того, чтобы получить вектор, который меньше, чем вектор UCL SQ, последовательности ДНК, которые авторы настоящего изобретения считают необязательными для экспрессии и/или активности FVIII или для продукции ААВ-вириона, были удалены из последовательности вектора UCL SQ. Чужеродную последовательность ДНК удаляли, включая 53 основания последовательности вируса ААВ2 с 3'-стороны от 5'-ITR ААВ2, 46 оснований последовательности вируса ААВ2 с 5'-стороны от 3'-ITR ААВ2 и 11 оснований, расположенных рядом с кодон-оптимизированной кодирующей областью SQ FVIII. Полученный вектор Proto 1, длина которого составила 4970 оснований, показан в схематическом виде на фигуре 2A, и его последовательность представлена в SEQ ID NO: 1. Proto 1 позволял получить инфекционный вирус и кодировал функциональный полипептид фактора VIII.
[00158] Последовательности, расположенные рядом с петлей шпильки в ITR ААВ2, также могут быть необязательными в рекомбинантных ААВ-векторах (см. Srivastava и др., патент США номер 6521225; Wang и др., J. Virol. 70:1668-1677, 1996; и Wang и др., J. Virol. 71:3077-3082, 1997). Для того, чтобы дополнительно уменьшить размер вектора Proto 1, 10 оснований последовательности ААВ2 удаляли непосредственно с 3'-стороны от петли шпильки в 5'-ITR ААВ2 и 10 оснований последовательности ААВ2 удаляли непосредственно с 5'-стороны от петли шпильки в 3'-ITR ААВ2. Полученный вектор Proto 1S, длина которого составляла 4950 оснований, показан в схематическом виде на фигуре 2B, и его последовательность представлена в SEQ ID NO: 2.
[00159] В одной попытке повысить экспрессию варианта SQ FVIII с вектора Proto 1S синтетический интрон длиной 100 оснований был вставлен в кодон-оптимизированную последовательность FVIII между экзонами 1 и 2. Известно, что вставка интрона может привести к повышенному уровню экспрессии мРНК в противном случае не содержащих интронов генов, таких как, например, гены интерферона.
[00160] Считают, что энхансеры работают независимо от расстояния и ориентации. Энхансер ApoE/C1 длиной 34 основания работает независимо от расстояния и ориентации в отношении экспрессии FVIII, что следует, например, из его предполагаемой энхансерной активности, описанной в Gray и др., в патенте США номер 8030065 (экспрессия FIX), и в Nathwani и др., заявке на патент США № 2013/0024960 (экспрессия FVIII), обе из которых полностью включены в данную заявку посредством ссылки. Дистальная область X промотора AAT человека длиной 32 основания, описанная в Di Simone и др., EMBO J. 6:2759-2766, 1987, расположена внутри регуляторного домена, который повышает экспрессию с гетерологичного промотора.
[00161] В другой попытке дополнительно повысить экспрессию варианта SQ FVIII с вектора Proto 1S синтетическая последовательность интрона содержала энхансер ApoE/C1 человека длиной 34 основания и дистальную область X промотора AAT человека длиной 32 основания, которую переместили с ее расположения против хода транскрипции от промотора AAT человека. Данные два регуляторных элемента вставили в обратной ориентации по сравнению с их ориентацией в Proto 1S. Полученный вектор Proto 2S, длина которого составила 4983 основания, показан в схематическом виде на фигуре 2C, и его последовательность представлена в SEQ ID NO: 3.
[00162] Так как ранее не было показано, что дистальная область X промотора AAT человека функционирует по ходу транскрипции от сайта инициации транскрипции в интроне, данный регуляторный элемент в векторе Proto 2S заменили на вторую копию энхансера ApoE/C1 человека длиной 34 основания в той же ориентации, что и у первой копии энхансера в интроне. Полученный вектор Proto 3S, длина которого составила 4985 оснований, показан в схематическом виде на фигуре 2D, и его последовательность представлена в SEQ ID NO: 4.
[00163] Нуклеиновые кислоты векторов Proto 1, Proto 1S, Proto 2S и Proto 3S клонировали в плазмиду для экспрессии в бактериях pUC19, тем самым получая двунитевые формы ААВ-векторов экспрессии FVIII.
Пример 2 Получение векторов Proto 4, Proto 5, Proto 6 и Proto 7
[00164] Для того, чтобы дополнительно уменьшить размер вектора Proto 1 и/или повысить экспрессию FVIII по сравнению с вектором Proto 1, удаляли домен a3, который расположен рядом с доменом легкой цепи или доменом C. Домен a3 участвует в связывании с фактором фон Виллебранда, но он может быть необязательным для функциональной активности FVIII in vivo.
[00165] Из вектора Proto 1 удаляли последовательность SQ длиной 14 аминокислот и домен a3 длиной 41 аминокислота (соответствующий аминокислотам 1649-1689 FVIII дикого типа). Полученный вектор Proto 4, длина которого составила 4805 оснований, показан в схематическом виде на фигуре 3A, и его последовательность представлена в SEQ ID NO: 5.
[00166] В попытке повысить экспрессию FVIII, в котором удален домен B и домен a3, укороченный интрон FVIII длиной 129 оснований вставляли между экзонами 1 и 2 в кодон-оптимизированную последовательность FVIII в векторе Proto 4. Полученный вектор Proto 5, длина которого составила 4934 основания, показан в схематическом виде на фигуре 3B, и его последовательность представлена в SEQ ID NO: 6.
[00167] В попытке дополнительно повысить экспрессию FVIII, в котором удален домен B и домен a3, в вектор Proto 5 вставляли вторую копию энхансера ApoE/C1 человека длиной 34 основания либо в прямой, либо в обратной ориентации. Полученный вектор Proto 6, длина которого составила 4934 основания и который содержал энхансер ApoE/C1 в интроне в прямой ориентации, показан в схематическом виде на фигуре 3C, и его последовательность представлена в SEQ ID NO: 7.
[00168] Полученный вектор Proto 7, длина которого составила 4934 основания и который содержал энхансер ApoE/C1 в интроне в обратной ориентации, показан в схематическом виде на фигуре 3D, и его последовательность представлена в SEQ ID NO: 8.
[00169] Нуклеиновые кислоты векторов Proto 4, Proto 5, Proto 6 и Proto 7 клонировали в плазмиду pUC19 для экспрессии в бактериях, что позволяло получить двунитевые формы ААВ-векторов экспрессии FVIII.
Пример 3 Анализы для проверки экспрессии и активности ААВ-векторов экспрессии FVIII
[00170] Анализы для проверки ААВ-векторов экспрессии FVIII согласно настоящему изобретению включают, например, (1) временную трансфекцию плазмидами, состоящими из двунитевой ДНК и содержащими нуклеиновые кислоты ААВ-вектора, клеток HepG2, линии клеток, полученной из печени человека, чтобы проверить экспрессию и сплайсинг специфической для печени мРНК и продукцию и секрецию белка FVIII in vitro; (2) получение ААВ-вирионов, содержащих ААВ-векторы экспрессии FVIII, в клетках 293 и инфицированных бакуловирусом клетках насекомого; (3) оценку нуклеиновых кислот ААВ-вектора путем анализа в щелочном геле и анализов репликации; и (4) оценку экспрессии FVIII, активности FVIII и специфичной активности FVIII в мышах Rag2.
Анализы временной трансфекции.
[00171] Осуществляли предварительный анализ in vitro для сравнения экспрессии и активности FVIII, полученного с помощью ААВ-векторов экспрессии FVIII согласно настоящему изобретению, с таковыми для вектора UCL SQ. Двунитевыми формами ААВ-векторов экспрессии FVIII согласно настоящему изобретению временно трансфицировали линию клеток печени человека HepG2. После трансфекции, например, спустя 24 или 48 часов, измеряли количество антигена и активность FVIII в культуральных супернатантах.
[00172] Применяя данный анализ выявили, что активность FVIII в клетках HepG2, временно трансфицированных векторами Proto 1, Proto 1S и Proto 2S, была сходна с активностью FVIII, полученного с применением вектора UCL SQ, демонстрируя, что векторы Proto 1, Proto 1S и Proto 2S были способны экспрессировать функциональный белок фактора VIII.
Получение ААВ-вирионов в клетках 293 и инфицированных бакуловирусом клетках насекомого.
[00173] Для того, чтобы продемонстрировать, что ААВ-векторы экспрессии FVIII согласно настоящему изобретению действительно позволяют упаковать нуклеиновые кислоты, кодирующие FVIII, двунитевые формы ААВ-векторов экспрессии FVIII, полученные, как описано в примерах 1 и 2, вводили в клетки, способные продуцировать ААВ-вирионы. В первой системе продукции ААВ-вируса клетки 293 трансфицировали плазмидами, содержащими нуклеиновые кислоты ААВ-вектора экспрессии FVIII в двунитевой форме, совместно с плазмидой, которая экспрессирует белки Cap и Rep ААВ, и с плазмидой, которая экспрессирует вспомогательные белки аденовируса, необходимые для продукции ААВ-вирионов. Во второй системе продукции ААВ-вируса, получали конструкции бакуловируса, экспрессирующие нуклеиновые кислоты ААВ-вектора экспрессии FVIII и белки Cap и Rep ААВ, а затем ими совместно инфицировали клетки насекомого Sf9. ААВ-вирионы, полученные во временно трансфицированных клетках 293 или инфицированных бакуловирусом клетках Sf9, очищали и анализировали с помощью стандартных способов, известных в данной области.
Оценка путем анализа в щелочном геле и репликационного анализа
[00174] Анализ методом электрофореза в щелочном геле применяли, чтобы определить размер упакованной нуклеиновой кислоты. Анализ центров репликации применяли, чтобы определить, какие ААВ-векторы экспрессии FVIII упакованы в интактной форме с помощью двух способов упаковки.
[00175] Анализ удлинения праймеров применяли, чтобы определить количество нуклеиновых кислот ААВ-векторов экспрессии FVIII, которые содержат целые концы, т.е., заканчиваются 5'-концом петли шпильки в 5'-ITR (смысловая нить) или 3'-ITR (антисмысловая нить) ААВ2.
[00176] В качестве альтернативы применяли анализ ПЦР, чтобы определить, содержат ли нуклеиновые кислоты ААВ-векторов экспрессии FVIII целые концы, т.е. заканчиваются ли 5'-концом петли шпильки в 5'-ITR (смысловая нить) или 3'-ITR (антисмысловая нить) ААВ2.
Оценка в мышах Rag2
[00177] ААВ-вирионы, полученные во временно трансфицированных клетках 293 или инфицированных бакуловирусом клетках Sf9, упаковывающих векторы, исследовали на способность экспрессировать FVIII и на активность FVIII в мышах Rag2 после внутривенного введения 2e11, 2e12 и 2e13 вирусных геномов (vg)/кг. Мышей Rag2 использовали в данном анализе, так как экспрессия и/или активность FVIII не осложнялась наличием иммунного ответа хозяина на ААВ-вирус или на белок FVIII человека.
[00178] Антиген FVIII определяли, применяя анализ на основе твердофазного иммуноферментного анализа (ELISA). Активность FVIII определяли, применяя анализ активации FXa и/или анализ коагуляции. Удельную активность FVIII определяли, применяя анализы антигена и активности FVIII.
[00179] Ожидается, что множество модификаций и вариаций осуществления настоящего изобретения придут в голову специалисту в данной области после рассмотрения описанных предпочтительных вариантов его реализации. Следовательно, единственными ограничениями, которые могут накладываться на объем настоящего изобретения, являются ограничения, которые представлены в прилагаемой формуле изобретения.
Пример 4 Получение конструкций с улучшенными последовательностями промотора/энхансера
[00180] Для того, чтобы получить дополнительные ААВ-векторы с сильными промоторами, которые повышают экспрессию функционального FVIII, получали конструкции с модифицированными последовательностями энхансера и/или промотора. В некоторых вариантах реализации указанные конструкции содержали укороченные варианты энхансеров ApoE или μ-глобулина. Данные конструкции получали, применяя стандартные методики клонирования ДНК, и их последовательности представлены в SEQ ID NO: 9-45.
Пример 5 Получение ААВ-вирусных частиц
Получение рекомбинантной бакмиды
[00181] Компетентные клетки DH10 Bac размораживали на льду. Добавляли рекомбинантную челночную плазмиду (например, pFB-GFP), аккуратно перемешивали с компетентными клетками и инкубировали на льду в течение 30 минут. Компетентные клетки затем подвергали термическому воздействию при температуре, приблизительно равной 42°C, в течение 30 секунд, а затем охлаждали на льду в течение 2 минут. Компетентные клетки подвергали шоковому термическому воздействию в течение 30 секунд при 42°C и охлаждали на льду в течение 2 мин. К клеткам добавляли SOC и оставляли инкубироваться при 37°C при взбалтывании в течение 4 часов, чтобы позволить произойти рекомбинации. В течение периода инкубации распределяли X-gal по двум LB-чашкам (дополнительно содержащим различные антибиотики (например, канамицин, гентамицин и тетрациклин)) для трансформации, а затем IPTG.
[00182] Получали некоторое количество инкубационной смеси, разбавляли, а затем распределяли по двум LB-чашкам и инкубировали при 37°C в течение приблизительно 30-48 часов. Из каждой чашки выбирали по несколько белых колоний и культивировали их в течение ночи в среде LB, содержащей такую же комбинацию антибиотиков, которая содержалась в LB-чашках. Затем получали бакмидную ДНК и ее исходный раствор в глицерине и хранили при -80°C.
Очистка рекомбинантной бакмидной ДНК
[00183] Некоторое количество исходного раствора бакмидной ДНК в глицерине отбирали и инокулировали им среду LB, содержащую такую же комбинацию антибиотиков, которая содержалась в LB-чашках, описанных в примере 1. Культурам позволяли расти в течение ночи при 37°C при встряхивании. Затем некоторое количество культуры осаждали на микроцентрифуге при максимальной скорости в течение приблизительно 30 секунд.
[00184] Осадки ресуспендировали в буфере для ресуспендирования, используя пипетку, а затем добавляли лизирующий буфер и пробирку переворачивали несколько раз, чтобы перемешать буфер, после чего инкубировали при комнатной температуре в течение приблизительно 5 минут. Типичный буфер для ресуспендирования содержит 50 мМ Трис-HCl, pH 8,0, 10 мМ ЭДТА и 100 мкг/мл РНКазы A. Типичный лизирующий буфер содержит 200 мМ NaOH и 1% ДСН. Некоторое количество преципитирующего буфера (например, буфера, содержащего 3,0 М ацетат калия, pH 5,5) медленно добавляли и переворачивали пробирку несколько раз, чтобы перемешать буфер, а затем инкубировали на льду в течение приблизительно 10 минут. Пробирку центрифугировали в течение приблизительно 10 минут при максимальной скорости и супернатант переливали в пробирку, содержащую изопропанол. Пробирку переворачивали несколько раз, чтобы перемешать раствор.
[00185] Затем раствор центрифугировали при максимальной скорости в течение приблизительно 15 минут при комнатной температуре и супернатант удаляли незамедлительно после центрифугирования с помощью пипетки.
[00186] Некоторое количество 70% этанола добавляли, чтобы промыть осадок, и снова осаждали при максимальной скорости в течение 1 минуты. Этанол затем удаляли и раствор опять осаждали, чтобы удалить следовые количества этанола. Некоторое количество буфера TE/EB добавляли в каждую пробирку и осадок аккуратно растворяли с помощью пипетки. Полученный раствор хранили при -20°C, если не использовали незамедлительно.
Получение исходного раствора рекомбинантного бакуловируса P0
[00187] Клетки Sf9 высевали в количестве приблизительно 1×106 клеток/лунку в 6-луночный планшет (или 6×106 клеток в чашку диаметром 10 см, или 1,7×107 клеток в чашку диаметром 15 см) и позволяли клеткам прикрепиться в течение по меньшей мере 1 часа перед трансфекцией.
[00188] Растворы для трансфекции A и B получали, как описано далее. Раствор A: некоторое количество бакмиды разбавляли в некотором количестве бессывороточной среды без антибиотиков в пробирке объемом 15 мл. Раствор B: некоторое количество реагента для трансфекции CellFectin разбавляли в некотором количестве бессывороточной среды без антибиотиков в пробирке объемом 15 мл. Раствор B добавляли в Раствор A, аккуратно перемешивали с помощью пипетки приблизительно три раза и инкубировали при комнатной температуре в течение 30-45 минут. Затем среду из чашки аспирировали и добавляли некоторое количество бессывороточной среды без антибиотиков, чтобы промыть клетки. Некоторое количество SF900II без антибиотиков добавляли в каждую пробирку, содержащую смеси липид-ДНК.
[00189] Аспирировали среду с клеток, добавляли к клеткам раствор для трансфекции и инкубировали клетки в течение приблизительно 5 часов при 28°C. Раствор для трансфекции удаляли, добавляли некоторое количество бессывороточной среды+антибиотики и инкубировали в течение приблизительно 4 дней при 28°C. Среды, которые содержали рекомбинантный бакуловирус, собирали и осаждали в течение приблизительно 5 минут при 1000 об/мин, чтобы удалить обломки клеток. Бакуловирус хранили при 4°C в темноте.
Амплификация бакуловируса (P1)
[00190] Клетки Sf9 растили до концентрации приблизительно 4×106 клеток/мл и разбавляли свежей средой до концентрации приблизительно 2×106 клеток/мл в плоскодонных колбах для шейкера. Некоторое количество клеток Sf9 инфицировали некоторым количеством исходного раствора бакуловируса P0. Множественность заражения (MOI) составляла приблизительно 0,1.
[00191] Клетки Sf9 инкубировали в течение приблизительно 3 дней и собирали бакуловирус. Клетки центрифугировали при 2000 об/мин в течение 5 минут, чтобы осадить клетки, и супернатант собирали и хранили при 4°C в темноте. Титр бакуловируса определяли, следуя протоколу из набора Rapid Titre от Clontech.
Получение ААВ с применением рекомбинантных бакуловирусов P1
[00192] Клетки Sf9 растили до концентрации приблизительно 1×107 клеток/мл и разбавляли до концентрации приблизительно 5×106 клеток/мл. Некоторое количество разбавленных клеток Sf9 инфицировали Bac-вектором (5 MOI) и Bac-помощником (15 MOI) в течение 3 дней. Жизнеспособность клеток оценивали на третий день (наблюдали приблизительно 50-70% мертвых клеток).
[00193] Осадки клеток собирали путем центрифугирования при 3000 об/мин в течение 10 минут. Среды удаляли и клетки лизировали (или осадки клеток хранили при -20°C, если не использовали незамедлительно).
Протокол лизирования и зонального центрифугирования
[00194] Некоторое количество буфера, лизирующего клетки Sf9, с добавлением бензоназы добавляли к каждому осадку клеток и встряхивали на вортексе, чтобы полностью ресуспендировать клетки. Ресуспендировнные клетки Sf9 инкубировали на льду в течение приблизительно 10 мин, чтобы охладить лизат. Полученный лизат разрушали ультразвуком в течение приблизительно 20 секунд, чтобы полностью лизировать клетки, а затем инкубировали при 37°C в течение приблизительно 30 минут.
[00195] Добавляли некоторое количество 5 М NaCl и встряхивали смесь на вортексе, а затем инкубировали в течение дополнительных 30 минут при 37°C. Добавляли некоторое количество NaCl, чтобы довести концентрацию соли до приблизительно 500 мМ, встряхивали на вортексе и центрифугировали при 8000 об/мин в течение 20 минут при 15°C с получением осветленного лизата.
[00196] Осветленный лизат подвергали этапам ультрацентрифугирования. Градиент CsCl получали путем добавления сначала осветленного лизата, затем некоторого количества растворов CsCl при плотности 1,32 г/см3 и 1,55 г/см3 через шприц с длинной иглой. Помечали границу раздела между растворами CsCl. Добавляли ФБР до верха центрифужных пробирок и пробирки тщательно уравновешивали и запечатывали.
[00197] Пробирки центрифугировали при 55000 об/мин в течение приблизительно 20 часов при 15°C. Прокалывали отверстие в крышке каждой пробирки и отмечали зону ААВ, расположенную немного выше отметки границы раздела двух растворов CsCl.
[00198] Второе центрифугирование в CsCl осуществляли путем переноса раствора ААВ в центрифужную пробирку для ротора 70.1 Ti, и добавляли некоторое количество раствора CsCl почти до верха пробирки. Пробирки уравновешивали и запечатывали. Пробирки центрифугировали при 65000 об/мин в течение приблизительно 20 часов и собирали зону ААВ (нижняя зона, более верхняя зона соответствовала пустым капсидам).
Пример 5 Оценка конструкций в мышах Rag2
[00199] Получали геномы ААВ, которые содержали кодон-оптимизированную последовательность гена, кодирующего SQ FVIII, применяя бакуловирус и клетки 293, с помощью конструкций UCL SQ, Proto 1, Proto S1, Proto S2 и Proto S3. Пределы упаковки ссоавляли 4800 п.о. для бакуловируса и 4950 п.о. для клеток 293.
[00200] На фигуре 5 показано, что Proto 1 с укороченным или неукороченным геномом осуществляет трансдукцию FVIII аналогично конструкции UCL SQ. ААВ5.2, полученный из бакуловируса и лизатов клеток 293T, измеряли с помощью ЭФ в 4-12% бис-трис геле. На фигуре 6 показано, что в каждом образце экспрессировались белки VP1, VP2 и VP3. Геномную ДНК из образцов ААВ разделяли на 0,8% щелочных агарозных гелях, как показано на фигуре 7.
[00201] Трансдукция Proto 1 была аналогично таковой для конструкции UCL SQ, если данные ААВ были получены с помощью системы бакуловируса. Включение интрона, который содержался в Proto 2S и 3S, не приводило к улучшенной трансдукции по сравнению с Proto 1. Вектор UCL SQ, содержащий фланкирующие последовательности ААВ, полученный в клетках 293, оказался более эффективным, чем UCL SQ, в котором не содержалось последовательности ААВ, полученный в бакуловирусе. В результате, пытаясь повысить эффективность, к Proto 1 добавляли дополнительные энхансеры, например, как в конструкциях 101, 102, 102 и 104.
Пример 6 Экспрессия и активность ААВ-векторов экспрессии FVIII с улучшенными последовательностями промоторов/энхансера
[00202] Исследовали экспрессию и активность ААВ-векторов, включая конструкции 99-106, применяя протокол гидродинамической инъекции. Гидродинамическая доставка представляет собой быстрый способ скрининга печеночных промоторов in vivo. Плазмидную ДНК ААВ получали, применяя способ, описанный в примере 5, а затем разбавляли в растворе для гидродинамической доставки TransIT-QR. Плазмидную ДНК вводили путем инъекции в хвостовую вену мышей C57Bl/6 (весом 18-25 г) в возрасте 5-6 недель в объеме, определенном по формуле: масса мыши (г)/10=0,1 мл доставляемого раствора. Время инъекции составляло менее 5 секунд. Плазму собирали из каждой мыши через 48 часов после инъекции и измеряли количество экспрессируемого антигена FVIII, применяя анализ ELISA.
[00203] В хвостовую вену мышей вводили путем инъекции возрастающие дозы плазмиды Proto 1 (2,5, 5, 12,5 и 50 мкг). Измеряли количество FVIII в плазме получившей инъекцию мыши, применяя анализ ELISA, и рекомбинантный FVIII (эквиваленты SQ Xyntha) использовали в качестве стандарта для сравнения.
[00204] Исследовали экспрессию с улучшенных промоторных/энхансерных элементов конструкции p100-400, конструкции 100(p100), конструкции FVIII-BMN001 (pFVIII-BMN001), Proto1, конструкции 100AT (p100-AT), конструкции 100 bGH poly A (p100-bGHPA), конструкции 101 (p101) и конструкции 104 (p104). На фигуре 8 показано, что из всех конструкций получали функциональный FVIII с различными уровнями эффективности.
[00205] На фигурах 9 и 10 приведены результаты инъекции 1 мкг различных конструкций плазмид. На фигуре 8 показано, что инъекция конструкции FVIII-BMN001, конструкции FVIII-BMN002, конструкции 102 (p102), конструкции 103 (p103) и конструкции 104 (p104) приводила к экспрессии по меньшей мере 20 нг FVIII у 5 из 10 мышей. На фигуре 9 показано, что инъекция конструкции FVIII-BMN001, конструкции 103 (p103), конструкции 103-AT (p103-AT; промотор hAAT длиной 398 п.о.), конструкции 100 (p100), конструкции 100AT (p100-AT; промотор hAAT длиной 398 п.о.) приводила к экспрессии по меньшей мере 100 нг/мл FVIII у 5 из 10 мышей.


























































































































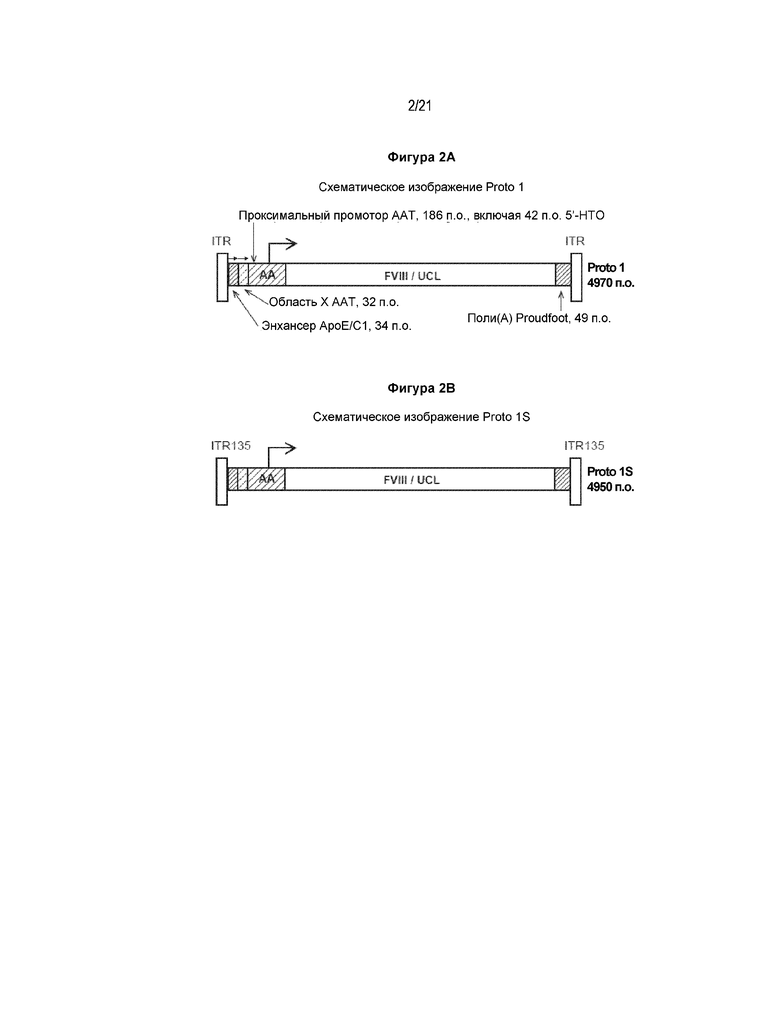
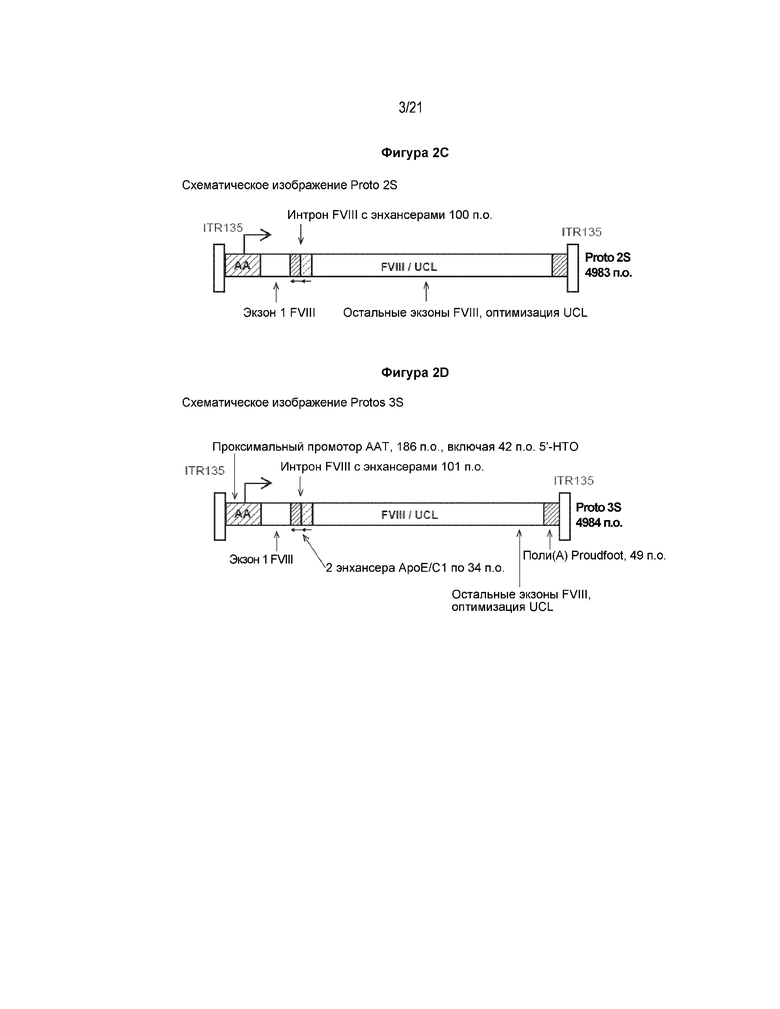
















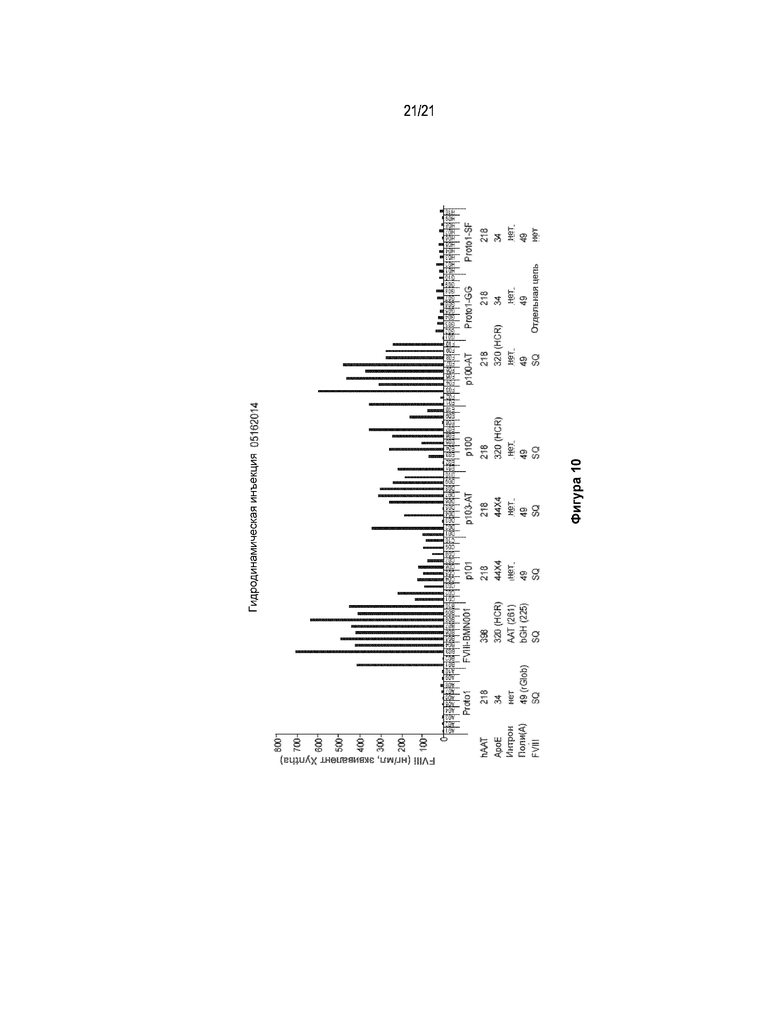
Изобретение относится к биотехнологии. Описан вектор экспрессии фактора VIII (FVIII) на основе аденоассоциированного вируса (ААВ), содержащий нуклеиновую кислоту, содержащую 5’-инвертированный концевой повтор (ITR) ААВ2, специфическую для печени область регуляции транскрипции, кодон-оптимизированную область, кодирующую функционально активный FVIII, возможно один или более интронов, последовательность полиаденилирования и 3’-ITR ААВ2, причем область, кодирующая функционально активный FVIII, включает нуклеотиды 923-5296 последовательности SEQ ID NO: 9 и причем вектор имеет длину менее 5000 нуклеотидов. Также описан способ получения частицы рекомбинантного аденоассоциированного вируса (ААВ), включающий: A) культивирование клетки, которая была трансфицирована ААВ-вектором экспрессии FVIII, описанным выше; и B) получение частицы рекомбинантного ААВ из супернатанта культивированной клетки, причем культивированная клетка дополнительно содержит один или более векторов, экспрессирующих хелперные функции, необходимые для упаковки частиц ААВ. Кроме того, описана частица рекомбинантного аденоассоциированного вируса (AAВ) для лечения гемофилии A, полученная указанным способом, причем частица ААВ содержит геном, содержащий нуклеиновую кислоту, содержащую 5’-инвертированный концевой повтор (ITR) ААВ2, специфическую для печени область регуляции транскрипции, кодон-оптимизированную область, кодирующую функционально активный FVIII, возможно один или более интронов, последовательность полиаденилирования и 3’-ITR ААВ2, причем область, кодирующая функционально активный FVIII, включает нуклеотиды 923-5296 последовательности SEQ ID NO: 9 и причем вектор имеет длину менее 5000 нуклеотидов. Кроме того, представлен способ лечения пациента, страдающего гемофилией. Изобретение расширяет арсенал средств лечения гемофилии А. 8 н. и 8 з.п. ф-лы, 10 ил., 1 табл., 6 пр.
1. Вектор экспрессии фактора VIII (FVIII) на основе аденоассоциированного вируса (ААВ), содержащий нуклеиновую кислоту, содержащую 5’-инвертированный концевой повтор (ITR) ААВ2, специфическую для печени область регуляции транскрипции, кодон-оптимизированную область, кодирующую функционально активный FVIII, возможно один или более интронов, последовательность полиаденилирования и 3’-ITR ААВ2, причем область, кодирующая функционально активный FVIII, включает нуклеотиды 923-5296 последовательности SEQ ID NO: 9 и причем вектор имеет длину менее 5000 нуклеотидов.
2. ААВ-вектор экспрессии FVIII по п. 1, в котором указанная специфическая для печени область регуляции включает нуклеотиды 146-397 последовательности SEQ ID NO: 1.
3. ААВ-вектор экспрессии FVIII по любому из пп. 1 или 2, в котором указанная специфическая для печени область регуляции состоит из нуклеотидов 146-397 последовательности SEQ ID NO: 1.
4. ААВ-вектор экспрессии FVIII по любому из пп. 1-3, включающий нуклеотиды 1-397 последовательности SEQ ID NO: 1.
5. ААВ-вектор экспрессии FVIII по любому из пп. 1-4, в котором указанная область, кодирующая функционально активный FVIII, состоит из нуклеотидов 923-5296 последовательности SEQ ID NO: 9.
6. ААВ-вектор экспрессии FVIII по п. 1, в котором нуклеиновая кислота состоит из последовательности нуклеотидов, выбранной из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7 или SEQ ID NO: 8.
7. Способ получения частицы рекомбинантного аденоассоциированного вируса (ААВ), включающий:
A) культивирование клетки, которая была трансфицирована ААВ-вектором экспрессии FVIII по любому из пп. 1-6; и
B) получение частицы рекомбинантного ААВ из супернатанта культивированной клетки, причем культивированная клетка дополнительно содержит один или более векторов, экспрессирующих хелперные функции, необходимые для упаковки частиц ААВ.
8. Способ по п. 7, в котором указанная клетка представляет собой клетку насекомого.
9. Способ по п. 8, в котором указанная клетка насекомого представляет собой клетку Sf9.
10. Частица рекомбинантного аденоассоциированного вируса (AAВ) для лечения гемофилии A, полученная способом по любому из пп. 7-9, причем частица ААВ содержит геном, содержащий нуклеиновую кислоту, содержащую 5’-инвертированный концевой повтор (ITR) ААВ2, специфическую для печени область регуляции транскрипции, кодон-оптимизированную область, кодирующую функционально активный FVIII, возможно один или более интронов, последовательность полиаденилирования и 3’-ITR ААВ2, причем область, кодирующая функционально активный FVIII, включает нуклеотиды 923-5296 последовательности SEQ ID NO: 9 и причем вектор имеет длину менее 5000 нуклеотидов.
11. Частица рекомбинантного AAВ по п. 10, содержащая капсид AAВ5.
12. Вирусная частица, содержащая вирусный вектор по любому из пп. 1-6, для применения в лечении гемофилии А.
13. Клетка для продуцирования частиц рекомбинантного аденоассоциированного вируса (ААВ), содержащая вирусный вектор по любому из пп. 1-6, дополнительно содержащая один или более векторов, экспрессирующих хелперные функции, необходимые для упаковки частиц ААВ.
14. Применение ААВ-вектора экспрессии FVIII по любому из пп. 1-6 для получения лекарственного средства для лечения гемофилии A.
15. Применение частицы рекомбинантного ААВ по п. 10 или 11 или вирусной частицы по п. 12 для получения лекарственного средства для лечения гемофилии A
16. Способ лечения пациента, страдающего гемофилией A, включающий введение пациенту эффективного количества частицы рекомбинантного ААВ по п. 10 или 11 или вирусной частицы по п. 12.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| ДЕФЕКТНЫЙ РЕКОМБИНАНТНЫЙ АДЕНОВИРУСНЫЙ ВЕКТОР (ВАРИАНТЫ) | 1994 |
|
RU2219241C2 |
| WO 2007003582 A2, 11.01.2007 | |||
| RU 2001125671 A, 27.08.2003. | |||
Авторы
Даты
2019-12-26—Публикация
2014-09-10—Подача