Предлагаемое изобретение относится к медицинской микробиологии, а именно к получению селективной питательной среды, которая может быть использована в лабораторной практике для диагностики пищевых токсикоинфекций бактериальной природы
В настоящее время существует проблема и необходимость создания питательной среды соответствующей современным требованиями для выделения патогенных парагемолитических вибрионов (ПГВ) с возможностью определения их галофильности.
Известна питательная среда для выделения и культивирования возбудителя холеры и других энтеропатогенных вибрионов (TCBS-агар (1),следующего состава, г/л: пептон мясной - 15,0; дрожжевой экстракт - 5,0; агар - 10,0; сахарозу - 20,0; желчь очищенную - 7,0; натрий сернистокислый - 10,0; натрий углекислый - 2,0; натрий лимоннокислый - 5,5; натрий хлористый - 10,0; железо лимонно кислое - 1,0; бромтимоловый синий - 0,04; тимоловый синий - 0,04; дистиллированную воду - 1 л. Ph 8,6.
Недостатком известной среды является ее высокая себестоимость, низкая селективность при повышенной нагрузке посевного материала и невозможность использования этой среды для идентификации парагемолитических вибрионов в тесте на галофильность в связи с значительным содержанием в ней солей натрия.
Наиболее близкой к предлагаемой питательной среде является дифференциально-диагностический агар (среда ДДА) с пенициллином для выделения парагемолитических вибрионов (2), следующего состава:
Рыбо- или мясопептонный щелочной 2% агар(РПА, МПА) - 1000,0 мл
Однако данная среда является препаратом лабораторного приготовления, включает мало стандартные составные части, обладающие лабильными ростовыми (РПА, МПА) и селективными свойствами (жидкость «Прогресс», раствор калия теллурита). Высокое содержание натрия хлорид - более 7% и пенициллина -5000ЕД ограничивает прорастание в данной среде ряда видов патогенных вибрионов - V.cholerae, V. mimicus, V. hollisae, V. damsela, V. vulnificus, V. harveyi (3).
Кроме того среда ДДА не может быть использована для идентификации галофильных свойств парагемолитических вибрионов. Среду-прототип характеризует невысокая селективность при повышенной нагрузке контаминации сапрофитами исследуемого материала. Ее использование в схеме выделения и идентификации ПГВ вибрионов предусматривает постановку и учет теста на галофильность только на 4-5-е сутки анализа исследуемых проб. В связи с необходимостью стандартизации исследования материала на наличие ПГВ и повышения селективности среды и сокращения сроков получения результатов анализа несомненным является потребность в новой диагностической среде промышленного изготовления.
Технической задачей предполагаемого изобретения является создание новой селективной питательной среды (ПГВС) для выделения и идентификации парагемолитических вибрионов в тесте на галофильность, позволяющей значительно сократить сроки диагностики пищевых токсикоинфекций.
Поставленная задача достигается тем, что в питательную основу дополнительно введены калия карбонат, калия сульфат, желчь КРС, экстракт дрожжевой сухой, а селективная добавка представляет собой смесь алкилсульфатов при следующем соотношении компонентов по первому варианту, г/л:
Основа питательной среды -
Пептон ферментативный сухой - 8,0-12,0
Экстракт дрожжевой сухой - 2,0-4,0
Агар микробиологический - 10,0-14,0
Сахароза - 15,0-25,0
Желчь КРС - 4,0-6,0
Калия карбонат - 1,5-2,5
Калия сульфит - 0,4-0,6
Бромтимоловый синий водорастворимый - 0,08-0,12
Селективная добавка - смесь алкилсульфатов - 1,0-3,0
Идентифицирующая добавка - натрия хлорид - 20,0-40,0
При рН 8,5
Кроме того в питательную основу дополнительно введены калия карбонат, калия сульфат, желчь КРС, экстракт дрожжевой сухой, а селективная добавка представляет собой смесь алкилсульфатов при следующем соотношении компонентов по второму варианту, г/л:
Основа питательной среды -
Пептон ферментативный сухой - 8,0-12,0
Экстракт дрожжевой сухой - 2,0-4,0
Агар микробиологический - 10,0-14,0
Сахароза - 15,0-25,0
Желчь КРС - 4,0-6,0
Калия карбонат - 1,5-2,5
Калия сульфит - 0,4-0,6
Бромтимоловый синий водорастворимый - 0,08-0,12
Селективная добавка - смесь алкилсульфатов - 1,0-3,0
При рН 8,5
При этом способ получения питательной среды, включающий расплавление основы и ее охлаждение, заключается в том, что одновременно готовят два варианта среды в различных емкостях оъемом 2 л, в которые помещают питательную основу, заливают 1,0 л дистиллированной воды и доводят до температуры 100°С, при тщательном перемешивании, кипятят 3-5 минут до полного расплавления, после этого охлаждают до температуры 45-50°С и добавляют 2,0 г/л селективной добавки, при этом в первый вариант среды вносят идентифицирующую добавку в количестве 30,0 г/л по рецептуре среды п. 1, которая предназначена для выделения парагемолитических вибрионов и является положительным контролем, а во второй вариант идентифицирующую добавку в виде натрия хлорида не вносят по рецептуре среды п. 2. последнюю используют для идентификации парагемолитмческих вибрионов как тест на галофильность, затем полученные среды разливают в чаши петри по 25 мл и хранят в герметичных пакетах ри 5-8°С до 20 дней.
Способ приготовления питательной среды осуществляют по следующей технологии:
Компануют препарат из трех частей - сухой основы среды и двух добавок - селективной и идентифицирующей. Сухая основа состаит из: пептона ферметативного 8,0-12,0 г/л; экстракта дрожжевого 2,0-4,0 г/л; агара микробиологического 10,0-14,0 г/л; бромтимоловый синий водорастворимый 0,08-0,12 г/л; сахарозу 15,0-25,0 г/л, сухую желчь КРС 4,0-6,0 г/л и не натриевые соли - калия карбонат 1,5-2,5 г/л и калия сульфит.
0,4-0,6 г/л. Два набора данных реагентв помещают в емкости, а именно колбы объемом 2,0 л, которые затем заливают каждый 1,0 л дистиллированной водой и доводят до температуры 100°С при тщательном перемешивании, кипятят 3-5 минут до полного расплавления.
Затем смесь охлаждают до температуры 45-50°С. После этого полученную смесь разливают в емкости, чашки Петри диаметром 90 мм по 25 мл. В оба варианта расплава ПГВС вносят селективную добавку в виде смеси алкилсульфатов 1,0-3,0 г/л. В первый вариант среды добавляют идентифицирующую добавку, а именно натрия хлорид 20,0-40,0 г/л получая среду 1 варианта, второй вариант среды остается бессолевым так как в него натрия хлорид не вносят. Чашки хранят в герметичных пакетах при 5-8°С до 20 дней.
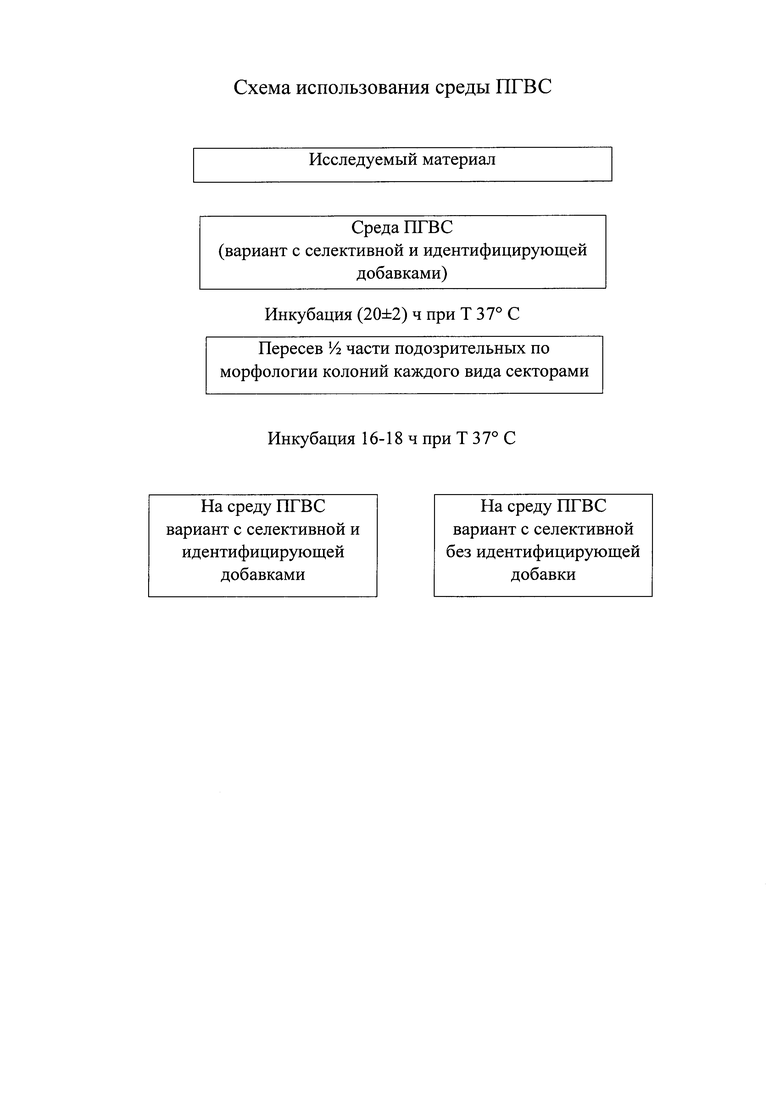
Далее исследуемый материал высевают в чашки с питательной средой по 1 варианту, проводят инкубирование в течение 20 часов при температуре 37°С (см. рисунок, где представлена схема использования среды ПГВС).
После этого подозрительные колонии желтого цвета или бесцветно-голубоватые делят на две части и пересевают на питательную среду по 1 варианту, а вторую часть на чаши с питательной средой (2 вариант) без натрия хлора. Через 16-18 часов учитывают наличие роста на чашах.
Из наблюдений следуют следующие результаты:
а) Наличие роста
культуры из колоний на ПГВС по 1 варианту (вариант с селективной и идентифицирующей добавками);
Наличие роста культуры из колоний на ПГВС по 2 варианту (вариант с селективной без идентифицирующей добавки);
Вывод: штамм предположительно относится к негалофильным вибрионам (V. cholerae, V. mimicus)
б) Наличие роста культуры из колоний на ПГВС по 1 варианту (вариант с селективной и идентифицирующей добавкой);
Отсутствие роста культуры из колоний на ПГВС по 2 варианту (вариант с селективной добавкой без идентифицирующей).
Вывод: штамм предположительно относится к галофильным вибрионам.
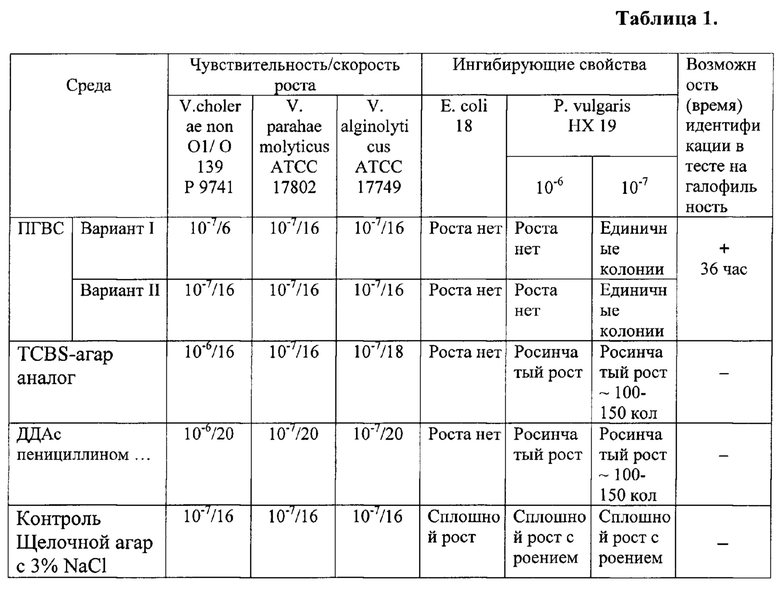
Контроль среды проводят в соответствии с Методическими указаниями (4). Для контроля бактериологических показателей искомой среды, среды-аналога (TCBS-агар) и прототипа (ДДА), использованы стандартные тест-штаммы вибрионов V.cholerae 01 9741, V. parahaemolyticus АТСС 17802, V. alginolyticusATCC 17749 взяты из коллекции музея живых культур Ростовского НИПЧИ. Ингибирующие свойства оценивали по отношению к тест-штаммам Е. Coli и P. vulgaris - характерным представителям сапрофитирующей микрофлоры.
В таблице №1 представлены результаты сравнительных испытаний чувствительности среды, скорости роста микроорганизмов, ингибирующих свойств среды, а также возможности среды по идентификации вибрионов в тесте на галофильность и ориентировочное время получения результатов первичной идентификации.
Из таблицы 1 видно, что на среде ПГВС рост штаммов вибрионов наблюдается, в зависимости от величины посевной дозы, при посеве 10-100 м.к. - через 16-18 ч, при посеве 103-105 м.к. - через 14-16 ч. Морфологически ферментирующие сахарозу вибрионы (V.cholerae, V. alginolyticus) образуют на новой среде полупрозрачные желтые колонии, сахарозонегативные штаммы (V. parahaemolyticus) формируют полупрозрачные голубоватые или бесцветные колонии. На среде TCBS-агар колонии вибрионов сходного цвета.
Количественный анализ ростовых и ингибирующих свойств среды ПГВС и сред сравнения показал, что предлагаемая среда превосходит аналоговую и среду-прототип по чувствительности и скорости роста, и находится на одном уровне с культуральной средой.
По уровню ингибирующей активности ПГВС также превосходит среду ПГВС и ДДА в отношении высоких концентраций P. vulgaris. При этом ни среда TCBS, ни ДДА не могут быть использованы при определении галофильных свойств вибрионов. В случае регламентированного действующим МУК (3) последовательного тестирования парагемолитических вибрионов, включая их выделение на селективной среде (TCBS, ДДА), получение чистой культуры на щелочном агаре с 3% натрия хлорида, подращивание культуры на пептонной воде с 1,5% натрия хлорида и проведение теста на галофильность в ряду пробирок с пептонной водой и разными концентрациями хлорида натрия минимальное время получения результата теста составляет 52-54 часа. Результат теста на галофильность с использованием предлагаемой среды ПГВС составляет 34-36 часов, что значительно ускоряет получение окончательного диагноза.
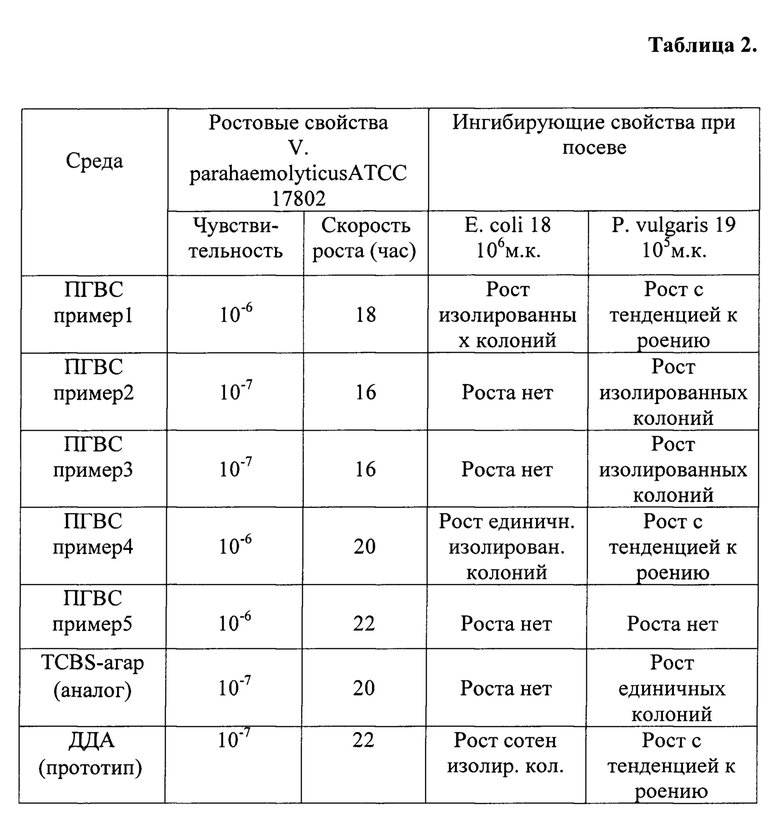
С использованием тест-штамма V. parahaemolyticusATCC 17802 и штаммов микробов-контаминантов представлены результаты испытаний рецепта среды ПГВС с различным содержанием ингредиентов - примеры 1, 2, 3, 4, 5 (таблица 2). Информация дополнена материалами проверки биологических свойств искомого препарата в оптимальном рецепте на контрольных штаммах различных видов патогенных вибрионов (таблица №3) и развернутого варианта ингибирующей активности среды в отношении типичных возбудителей кишечных инфекций (таблица 4).
Пример 1.
Для приготовления среды используют вышеуказанные препараты в следующих концентрациях, г/л:
1. Пептон ферментативный для бактериологических целей сухой - 8,0
2. Экстракт дрожжевой сухой - 2,0
3. Агар микробиологический - 10,0
4. Сахароза - 15,0
5. Желчь КРС - 4,0
6. Калия карбонат - 1,5
7. Калия сульфит - 0,4
8. Бромтимоловый синий водорастворимый - 0,08
9. Смесь алкилсульфатов 1,0
10. Натрия хлорид 20,0
рН среды 8,4
Два набора данных реагентов помещают раздельно в колбы объемом 2 л, заливают каждый 1,0 л дистиллированной воды и доводят до кипения при тщательном перемешивании, кипятят 3-5 мин до полного расплавления. Расплавы охлаждают до 45-50°. В оба варианта расплава ПГВС вносят селективную добавку в объеме 1,0 г/л. В первый вариант среды добавляют идентифицирующую добавку 20,0 г/л, второй вариант среды остается бессолевым. Готовые среды разливают в чашки Петри по 25 мл.
Оговоренные действующими Методическими указаниями (2, 4) основные характеристики - показатель чувствительности, скорости роста и ингибирующие свойства определяют на варианте среды ПГВС с селективной и идентифицирующей добавками. На варианте среды с селективной и без идентифицирующей добавки определялют галофильность тест-штамма.
Как видно из таблицы №2, испытания данного варианта среды ПГВС (пример 1) установлено, что среда обладает удовлетворительной чувствительностью и скоростью роста микроорганизмов. Она подавляет рост микробов-контаминантов в концентрации 106 для Е. coli 18 и 105 для Р. vulgaris. Минимальное время идентификации в тесте на галофильность составляет 38 часа.
Пример 2.
Для приготовления среды используют вышеуказанные препараты в следующих концентрациях, г/л:
1. Пептон ферментативный для бактериологических целей сухой -10,0
2. Экстракт дрожжевой сухой - 3,0
3. Агар микробиологический - 12,0
4. Сахароза - 20,0
5. Желчь КРС - 5,0
6. Калия карбонат - 2,0
7. Калия сульфит - 0,5
8. Бромтимоловый синий водорастворимый - 0,1
9. Смесь алкилсульфатов 2,0
10. Натрия хлорид 30,0
рН среды 8,5
В ходе приготовления и испытания среды использованы методические приемы, идентичные в примере 1.
Из таблицы №2 видно, испытания данного варианта среды ПГВС (пример 2) установлено, что среда обладает оптимальной чувствительностью и скоростью роста микроорганизмов. Она более активно подавляет рост микробов-контаминантов вплоть до полного угнетения роста кишечной палочки в концентрации 106 и остаточного роста единичных колоний в концентрации 105 для P. vulgaris. Минимальное время идентификации в тесте на галофильность составляет 34 часа.
Пример 3.
Для приготовления среды используют вышеуказанные препараты в следующих концентрациях, г/л:
1. Пептон ферментативный для бактериологических целей сухой - 12,0
2. Экстракт дрожжевой сухой - 4,0
3. Агар микробиологический - 14,0
4. Сахароза - 25,0
5. Желчь КРС - 6,0
6. Калия карбонат - 2,5
7. Калия сульфит - 0,6
8. Бромтимоловый синий водорастворимый - 0,12
9. Смесь алкил сульфатов 3,0
10. Натрия хлорид 40,0
рН среды 8,6
Как видно из таблицы №2, где отражены биологические свойства питательной среды ПГВС в вариантах состава, испытания данного варианта (пример 3) установлено, что среда обладает достаточной чувствительностью и скоростью роста микроорганизмов в соответствии с нормативными требованиями. Ее ингибирующая активность обеспечивает подавление роста микробов-контаминантов вплоть до угнетения роста кишечной палочки в концентрации 106 до уровня единичных колоний и остаточного роста десятков колоний без тенденции к роению в концентрации 105 для протея. Минимальное время идентификации в тесте на галофильность составляет 38 часов.
Для приготовления среды используют вышеуказанные препараты в концентрациях (г/л) ниже- и выше нормативных величин примеры 4, 5.
Пример 4.
1. Пептон ферментативный для бактериологических целей сухой - 6,0
2. Экстракт дрожжевой сухой - 1,0
3. Агар микробиологический - 9,0
4. Сахароза - 10,0
5. Желчь КРС-3,0
6. Калия карбонат - 1,0
7. Калия сульфит - 0,3
8. Бромтимоловый синий водорастворимый - 0,06
9. Смесь алкилсульфатов 0,5
10. Натрия хлорид 10,0
рН среды 8,2
Пример 5.
1. Пептон ферментативный для бактериологических целей сухой - 14,0
2. Экстракт дрожжевой сухой - 6,0
3. Агар микробиологический - 16,0
4. Сахароза - 30,0
5. Желчь КРС - 8,0
6. Калия карбонат - 3,0
7. Калия сульфит - 0,8
8. Бромтимоловый синий водорастворимый - 0,15
9. Смесь алкилсульфатов 4,0
10. Натрия хлорид 50,0
рН среды 8,7
В ходе приготовления и испытания среды использованы методические приемы, идентичные в примере 1.
Как видно из таблицы №2, испытания данных вариантов среды ПГВС (примеры 4, 5) установлено, что эти среды не обеспечивают требуемый уровень чувствительности и скорости роста микроорганизмов. Вариант (пример 4) мало активен в отношении подавления роста микробов-контаминантов. Вариант (пример 5) полностью подавляет рост контаминантов, однако он не приемлем из-за низких ростовых свойств. Минимальное время идентификации в тесте на галофильность составляет более 49 часов.
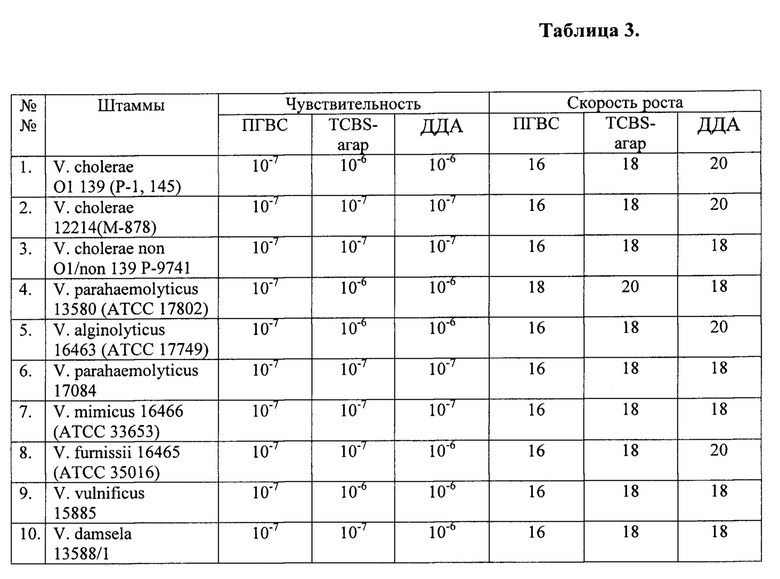
Пример 6. Подтверждает универсальность среды для выделения парагемолитических вибрионов различных видов.
Оптимальный (пример 3) вариант среды ПГВС был испытан в отношении различных видов патогенных вибрионов. Подготовку и контроль сред проводят в соответствии с методическими подходами, использованными в предыдущих примерах. Культуры вибрионов готовят по методике, идентичной таковой при подготовке тест-штаммов. Ростовые характеристики проведенного испытания приведены в таблице 3.
Результаты данного испытания показывают, что среда ПГВС (вариант с селективной и идентифицирующей добавками) обеспечивают ростовые свойства всех испытанных штаммов вибрионов. Количественный выход холерных вибрионов колебался от 42,5 до 93,5 колоний. На среде ПГВС (вариант с селективной без идентифицирующей добавки) галофильные вибрионы не ростут.
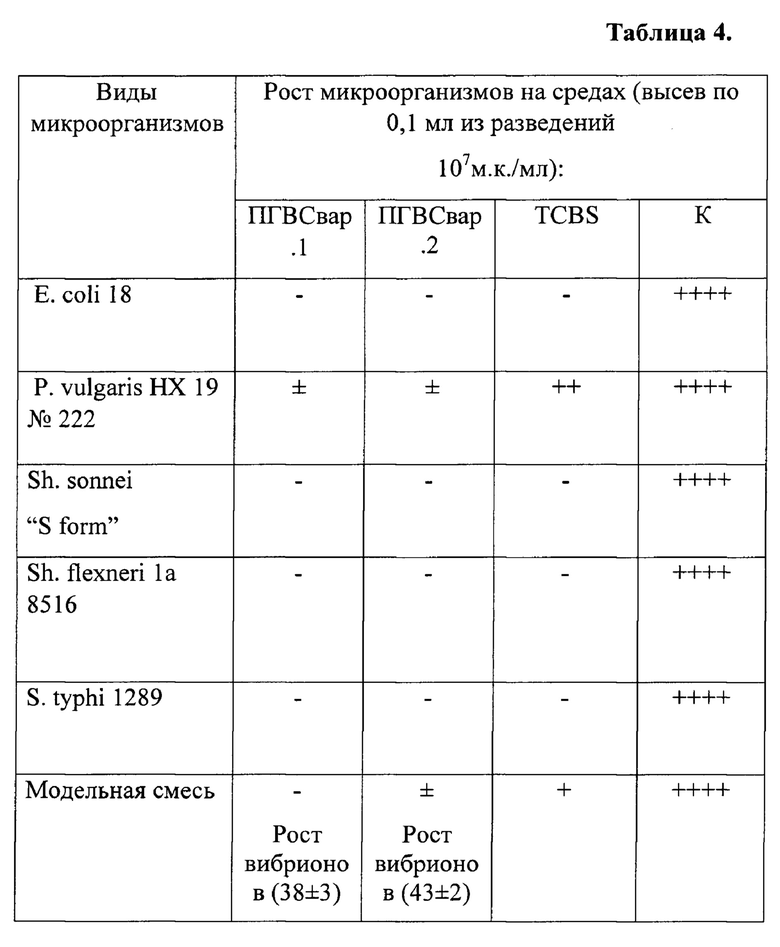
Пример 7. Подтверждающий возможность использования среды при исследовании материала обсемененного различными видами посторонней (патогенной) микрофлоры.
Оптимальный (пример 3) вариант среды ПГВС был испытан в отношении широкого круга микробов-ассоциантов, в том числе, возбудителей острых кишечных инфекций.
Подготовку и контроль сред проводят в соответствии с методическими подходами, использованными в предыдущих примерах. Культуры ассоциантов готовят по методике, идентичной таковой при подготовке тест-штаммов. Была также приготовлена модельная смесь feces здорового человека и V. parahaemolyticus 13580 (АТСС 17802) с содержанием вибрионов 103 м.к./мл. Ингибирующая активность среды ПГВС представлена в таблице 4, где показано:
«-» - отсутствие роста контаминантов;
«±» - наличие единичных колоний контаминантов, не мешающих выделению;
«+-++» - значительный рост контаминантов, создающий сложности при выделении вибрионов;
«++++» - сливной рост на поверхности агаровой пластинки.
Установлено, что визуально через 18-20 ч инкубации при температуре (37±1)°С на всех засеянных чашках наблюдают рост вибриона в виде типичных колоний диаметром не менее 1,0 мм. Полностью подавляется рост Е. coli и микробов-ассоциантов. Рост P. vulgaris на средах ПГВС+ и ПГВС- в виде единичных изолированных колоний беловато-матового цвета не мешал выделению возбудителя. На среде сравнения TCBS количество колоний вульгарного протея колебалось от 20 до 50 колоний и создавало сложности при выделении возбудителя.
Высокая эффективность среды ПГВС продемонстрирована при посеве модельной смеси feces с V. parahaemolyticus 13580 (АТСС 17802). На чашках со средой ПГВС+ рост посторонней микрофлоры отмечался в виде от единичных до 1,0 мм бесцветных или слабо окрашенных желтоватых колоний. На среде ПГВС- количество посторонней микрофлоры было несколько больше. Среда TCBS обладала более низкой ингибирующей способностью в отношении кишечной флоры в модельной смеси. Контрольная среда ингибирующей активностью в отношении микробов тест-штаммов и модельной смеси не обладала.
Таким образом, предлагаемая среда обеспечивает более высокую в сравнении с прототипом ингибирующую активность посторонней микрофлоры при требуемом уровне прорастаемости парагемолитических вибрионов (обязательное наличие роста на чашках при посеве 10 м.к. и не менее 30% при посеве 100 м.к.).
Исходя из вышеизложенного полученные результаты характеризуют новую среду как препарат, соответствующий современным требованиям к средам для выделения парагемолитических вибрионов. Высокую эффективность среды ПГВС подтверждают данные идентичности ростовых и повышения ингибирующих характеристик в сравнении с препаратом-аналогом - референтной средой TCBS, включенной в список препаратов, используемых для выделения патогенных вибрионов.
Следовательно приведенные данные позволяют сделать вывод о соответствии биологических свойств среды требованиям, предъявляемым диагностическим средам для вибрионов. По большинству показателей среда ПГВС соответствует контрольной среде TCBS. Новую питательную среду может эффективно использовать при обследовании объектов внешней среды, о чем свидетельствует включение данного препарата в состав сред, рекомендованных для применения действующим МУК 4.2.1793-03 (3, 5). Проведенные ранее межлабораторные комиссионные испытания в институте подтвердили высокое качество среды ПГВС, что дало основание администрации учреждения рекомендовать ее к регистрации в качестве изделия медицинского назначения.
Особым преимуществом данной среды можно считать ее эффективность при определении галофильных свойств выделяемых в ходе обследования парагемолитических вибрионов, что позволяет значительно сокращать сроки диагностики пищевых токсикоинфекций. Экономическая целесообразность данного препарата основана на ее низкой себестоимости (250-300 руб/л) и комплектации реагентами исключительно отечественного производства.
Источнки информации.
1. Питательные среды для выделения, культивирования и идентификации возбудителей особо опасных инфекций бактериальной природы (И.А. Дятлов, В.В. Кутырев, М.В. Храмов. М., 2012. С. 175).
2. Методические указания по контролю в рыбных продуктах парагемолитических вибрионов - возбудителей пищевых токсикоинфекций N 5780-91 от 3.04.1991.
3. МУК 4.2.1793-03 «Лабораторная диагностика заболеваний, вызываемых парагемолитическими и другими патогенными для человека вибрионами».
4. Контроль диагностических питательных сред по биологическим показателям для возбудителя чумы, холеры, сибирской язвы, туляремии, бруцеллеза, легионеллеза МУ 3.3.2.2124-06, М., - 2007.
5. Методы контроля бактериологических питательных сред: МУК 4.2.2316-08, М., 2008.
6. Межгосударственный стандарт ГОСТ ISO/TS 21872-1-2013. Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод обнаружения потенциально энтеропатогенных Vibrio spp. Часть 1. Обнаружение бактерий VibrioparahaemolyticusVibriocholerae. М., Стандартинформ, 2014.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЭЛЕКТИВНО-ДИФФЕРЕНЦИАЛЬНАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ ХОЛЕРНЫХ ВИБРИОНОВ (ВАРИАНТЫ) | 2012 |
|
RU2484141C1 |
| Питательная среда для дифференциации парагемолитических вибрионов | 2021 |
|
RU2778997C1 |
| Дифференциально-селективная питательная среда для выделения шигелл и сальмонелл сухая (Гектоеновый энтеро-агар) | 2023 |
|
RU2812423C1 |
| Селективная питательная среда с маннитом, желчью и полимиксином для выявления бактерий родов Proteus, Morganella, Providencia сухая | 2022 |
|
RU2792438C1 |
| ДИФФЕРЕНЦИАЛЬНО-ДИАГНОСТИЧЕСКАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ ВОЗБУДИТЕЛЕЙ КИШЕЧНОГО ИЕРСИНИОЗА И ПСЕВДОТУБЕРКУЛЕЗА | 1995 |
|
RU2101342C1 |
| Питательная среда для выделения парагемолитических вибрионов | 1988 |
|
SU1513034A1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ДРОЖЖЕЙ | 2006 |
|
RU2430156C2 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ СЕЛЕКТИВНОГО НАКОПЛЕНИЯ ЭНТЕРОБАКТЕРИЙ, СУХАЯ (БУЛЬОН МОССЕЛЯ), ВАРИАНТЫ | 2013 |
|
RU2553224C2 |
| Питательная среда для накопления парагемолитических вибрионов при постановке теста Канагава | 2023 |
|
RU2824882C1 |
| Способ дифференциации бактерий Vibrio cholerae от бактерий представителей рода Aeromonas | 2019 |
|
RU2734940C1 |
Группа изобретений относится к медицинской микробиологии. Предложены питательная среда для выделения и идентификации парагемолитических вибрионов (варианты) и способ получения предложенной среды (варианты). Среда содержит питательную основу из пептона ферментативного, агара микробиологического, сахарозы, бромтимолового синего с добавлением калия карбоната, калия сульфита, желчи КРС, экстракта дрожжевого сухого и смеси алкилсульфатов. В качестве идентифицирующей добавки используют натрий хлорид. Способы предусматривают расплавление кипячением при 100°С при перемешивании питательной основы и добавленных реагентов с последующим охлаждением до 45-50°С. Изобретения обеспечивают идентификацию галофильных патогенных парагемолитических вибрионов. 4 н.п. ф-лы, 1 ил., 4 табл., 7 пр.
1. Питательная среда для выделения и идентификации парагемолитических вибрионов, включающая питательную основу из пептона ферментативного, агара микробиологического, сахарозы, бромтимолового синего, натрия хлорида и селективную добавку, отличающаяся тем, что в питательную основу дополнительно введены калия карбонат, калия сульфит, желчь КРС, экстракт дрожжевой сухой, а селективная добавка представляет собой смесь алкилсульфатов при следующем соотношении компонентов, г/л:
Основа питательной среды -
Пептон ферментативный сухой - 8,0-12,0
Экстракт дрожжевой сухой - 2,0-4,0
Агар микробиологический - 10,0-14,0
Сахароза - 15,0-25,0
Желчь КРС - 4,0-6,0
Калия карбонат - 1,5-2,5
Калия сульфит - 0,4-0,6
Бромтимоловый синий водорастворимый - 0,08-0,12
Селективная добавка - смесь алкилсульфатов - 1,0-3,0
Идентифицирующая добавка - натрия хлорид - 20,0-40,0
При рН 8,5
2. Питательная среда для выделения и идентификации парагемолитических вибрионов, включающая питательную основу из пептона ферментативного, агара микробиологического, сахарозы, бромтимолового синего и селективной добавки, отличающаяся тем, что в питательную основу дополнительно введены калия карбонат, калия сульфит, желчь КРС, экстракт дрожжевой сухой, а селективная добавка представляет собой смесь алкилсульфатов при следующем соотношении компонентов, г/л:
Основа питательной среды -
Пептон ферментативный сухой - 8,0-12,0
Экстракт дрожжевой сухой - 2,0-4,0
Агар микробиологический - 10,0-14,0
Сахароза - 15,0-25,0
Желчь КРС - 4,0-6,0
Калия карбонат - 1,5-2,5
Калия сульфит - 0,4-0,6
Бромтимоловый синий водорастворимый - 0,08-0,12
Селективная добавка - смесь алкилсульфатов - 1,0-3,0
При рН 8,5
3. Способ получения питательной среды по п. 1, включающий расплавление основы и ее охлаждение, отличающийся тем, что первый вариант среды готовят в емкости объемом 2 л, в которую помещают питательную основу, заливают 1,0 л дистиллированной воды и доводят до температуры 100°С при тщательном перемешивании, кипятят 3-5 минут до полного расплавления, после этого охлаждают до температуры 45-50°С и добавляют 2,0 г/л селективной добавки, затем вносят идентифицирующую добавку в количестве 30,0 г/л, которая предназначена для выделения парагемолитических вибрионов и является положительным контролем.
4. Способ получения питательной среды по п. 2, включающий расплавление основы и ее охлаждение, отличающийся тем, что второй вариант среды готовят в емкости объемом 2 л, в которую помещают питательную основу, заливают 1,0 л дистиллированной воды и доводят до температуры 100°С при тщательном перемешивании, кипятят 3-5 минут до полного расплавления, после этого охлаждают до температуры 45-50°С и добавляют 2,0 г/л селективной добавки, исключая натрия хлорид, используя питательную среду, как отрицательный контроль в тесте на галофильность.
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| Питательная среда для выделения парагемолитических вибрионов | 1988 |
|
SU1513034A1 |
| РЫКОВСКАЯ О.А | |||
| и др | |||
| "Разработка комплексного метода оценки вирулентности парагемолитических вибрионов".// Клиническая лабораторная диагностика, 2013, N 2, с.38-41. | |||
Авторы
Даты
2020-01-23—Публикация
2019-02-14—Подача