Область техники
Настоящее изобретение относится к антителам, которые связываются с белком запрограммированной гибели клетки 1 (PD-1).
Уровень техники
Истощение Т-клеток это состояние, при котором происходит нарушение функций Т-клеток, возникающее при многих хронических инфекциях и раке. Указанное состояние характеризуется отсутствием надлежащей эффекторной функции Т-клеток, устойчивой экспрессией ингибиторных рецепторов и транскрипционным состоянием, которое отличается от такового для функциональных эффекторных Т-клеток или Т-клеток памяти. Истощение не позволяет оптимально контролировать инфекцию и опухоли. (Е John Wherry., Nature Immunology 12, 492-499 (2011)).
Истощение Т-клеток характеризуется постепенной и прогрессирующей потерей функций Т-клеток. Истощение хорошо описано при хронической инфекции вирусом лимфоцитарного хориоменингита и обычно развивается в условиях персистенции антигена, которые возникают после многих хронических инфекций, включая инфекции вирусом гепатита В, вирусом гепатита С и вирусом иммунодефицита человека, а также во время образования метастаз опухолей. Истощение является неоднородным патологическим состоянием, поскольку может проявляться определенный набор фенотипических и функциональных дефектов, и Т-клетки, которые подверглись истощению, отличаются от прототипических эффекторных Т-клеток, Т-клеток памяти, а также энергических Т-клеток. Истощенные Т-клетки чаще всего появляются во время злокачественных хронических инфекций, при этом интенсивность и продолжительность антигенной стимуляции являются критическими факторами, определяющими этот процесс. (Yi et al., Immunology Apr 2010; 129(4):474-481).
Циркулирующие опухолеспецифичные CD8+ Т-клетки человека могут быть цитотоксическими и вырабатывают цитокины в условиях in vivo, это свидетельствует о том, что аутологичные и опухолеспецифичные CD8+ Т-клетки человека могут достигать функциональной компетентности после интенсивной иммунотерапии, такой как прививка с использованием пептида, неполного адъюванта Фрейнда (IFА) и CpG, или после адоптивного переноса клеток. В отличие от клеток периферической крови Т-клетки из метастазов являются функционально неполноценными, при этом они характеризуются аномально низкой выработкой цитокинов и активацией ингибиторных рецепторов PD-1, CTLA-4 и TIM-3. Функциональная неполноценность является обратимой, поскольку Т-клетки, выделенные из ткани меланомы, могут восстановить выработку ИФН-γ после кратковременного культивирования в условиях in vitro. Тем не менее, еще предстоит определить, затрагивает ли функциональное нарушение последующие молекулярные пути, вероятно, как это происходит при истощении или анергии Т-клеток, согласно результатам определения на животных моделях. (Baitsch et al., J Clin Invest. 2011;121(6):2350-2360).
Белок запрограммированной гибели клеток 1 (PD-1), который также называется CD279, представляет собой мембранный белок типа I, кодируемый в организме человека геном PDCD1. Он имеет два лиганда, PD-L1 и PD-L2.
Путь передачи сигналов с участием PD-1 является одним из ключевых иммунных ингибирующих посредников истощения Т-клеток. Блокирование этого пути может привести к активации, размножению Т-клеток и усилению эффекторных функций Т-клеток. Следовательно, PD-1 отрицательно регулирует ответы Т-клеток. PD-1 был идентифицирован как маркер истощенных Т-клеток при хронических патологических состояниях, и было показано, что блокирование взаимодействий PD-1:PD-1L частично восстанавливает функцию Т-клеток. (Sakuishi et al., JEM Vol. 207, September 27, 2010, pp 2187-2194).
Ниволюмаб (BMS-936558) представляет собой антитело к PD-1, которое было одобрено для лечения меланомы в Японии в июле 2014 года. Другие антитела к PD-1 описаны в WO 2010/077634, WO 2006/121168, WO 2008/156712 и WO 2012/135408.
Домен Т-клеточного иммуноглобулина-муцина 3 (TIM-3) представляет собой иммунный регулятор, активность которого, как установлено, повышена в истощенных CD8+ Т-клетках (Sakuishi et al., JEM Vol. 207, September 27, 2010, pp 2187-2194). Первоначально было установлено, что TIM-3 селективно экспрессируется на клетках Th1 и Tc1, секретирующих ИФН-γ. Взаимодействие TIM-3 с его лигандом, галектином-9, индуцирует гибель TIM-3+ Т-клеток. Антитела к TIM-3 описаны в Ngiow et al (Cancer Res. 2011 May 15;71(10):3540-51) и в US 8552156.
Оба белка, TIM-3 и PD-1, могут функционировать как отрицательные регуляторы ответов Т-клеток, и одновременное воздействие на оба пути передачи сигналов с участием TIM-3 и PD-1 является более эффективным для контроля роста опухоли, чем воздействие на один из путей по отдельности. (Sakuishi et al., JEM Vol. 207, September 27, 2010, pp 2187-2194; и Ngiow et al Cancer Res. 2011 May 15;71(10):3540-51).
Краткое описание изобретения
В настоящем изобретении предложены антитела или антигенсвязывающие фрагменты, которые связываются с PD-1. В настоящем изобретении также предложены полипептиды тяжелой цепи и легкой цепи. Антитела, антигенсвязывающие фрагменты и полипептиды могут быть обеспечены в выделенной и/или очищенной форме и могут быть изготовлены в виде композиций, пригодных для использования в исследованиях, терапии и диагностике.
Согласно некоторым вариантам реализации настоящего изобретения антитело или его антигенсвязывающий фрагмент, или полипептид может быть эффективным для восстановления функции Т-клеток в Т-клетках, например, CD8+ Т-клетках, которые характеризуются истощением Т-клеток или анергией Т-клеток.
Согласно одному аспекту в настоящем изобретении предложено антитело или его антигенсвязывающий фрагмент, при этом аминокислотная последовательность указанного антитела может содержать аминокислотные последовательности i)-iii) или аминокислотные последовательности iv)-vi), или предпочтительно аминокислотные последовательности i)-vi):

или его вариант, в котором одна или две, или три аминокислоты в одной или более из указанных последовательностей (i)-(vi) заменены другой аминокислотой, где X1=А или S, Х2=S или А, Х3=V, Y, F, D, S или А, Х4=L, Y, V или А, Х5=Y, R или Н, Х6=S или Т, Х7=V, I или М и Z1=L или Y, Z2=А или S, Z3=Р или Y, Z4=Y или L, Z5=K, М или L, Z6=Н или V.
Применительно ко всем аспектам настоящего изобретения в предложенных вариантах реализации настоящего изобретения, в которых HC-CDR1: SYGMH (SEQ ID NO: 89), указанная последовательность может входить с состав большей последовательности GFTFSSYGMH (SEQ ID NO: 39).
Согласно некоторым вариантам реализации настоящего изобретения LC-CDR3 представляет собой одну из следующих последовательностей: ASWDDVLYGSV (SEQ ID NO: 27), ASWDDYYYGTI (SEQ ID NO: 28), ASWDDYLRGTV (SEQ ID NO: 29), SAWDDYLHGTV (SEQ ID NO: 30), ASWDDYVRGTM (SEQ ID NO: 31), SSWDDFLRGTV (SEQ ID NO: 32), SSWDDDARGTI (SEQ ID NO: 33), AAWDDVYYGTI (SEQ ID NO: 34), ASWDDSLYGTV (SEQ ID NO: 35), AAWDDAYYGTI (SEQ ID NO: 36), ASWDDVYRGTV (SEQ ID NO: 37) или SSWDDSLYGTI (SEQ ID NO: 38). Согласно некоторым вариантам реализации настоящего изобретения HC-CDR3 представляет собой одну из следующих последовательностей: DLGAGPYYYGKDH (SEQ ID NO: 41), DLGAGPYYYGKDV (SEQ ID NO: 42), DYGAGPYYYGMDV (SEQ ID NO: 43), DLGAGPYYYGLDV (SEQ ID NO: 44), DLGAGPYYYGMDV (SEQ ID NO: 45), DLGAGPYYYGMDV (SEQ ID NO: 46), DLGAGPYYYGMDV (SEQ ID NO: 47), DLGAGPYYYGMDV (SEQ ID NO: 48), DLGAGPYYYGMDV (SEQ ID NO: 49), DYGAGPYYYGMDV (SEQ ID NO: 50), DLGSGYYLYGMDV (SEQ ID NO: 51) или DLGAGPYYYGMDV (SEQ ID NO: 52).
Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область легкой цепи, содержащую следующие гипервариабельные участки (CDR):

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:

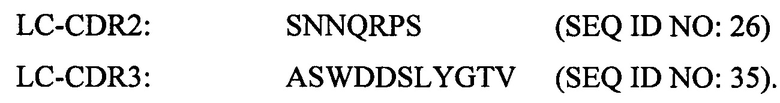
Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:
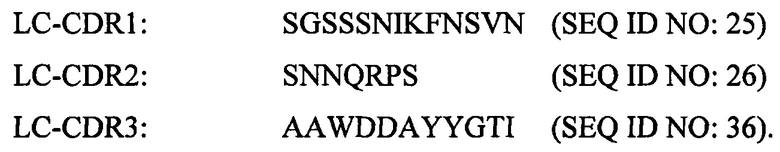
Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:

Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может содержать по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:

Антитело может содержать по меньшей мере одну вариабельную область легкой цепи, содержащую CDR, представленные на фигурах 1 или 3. Антитело может содержать по меньшей мере одну вариабельную область тяжелой цепи, содержащую CDR, представленные на фигурах 2 и 3.
Антитело может содержать по меньшей мере одну вариабельную область легкой цепи (Vl), содержащую аминокислотную последовательность, выбранную из одной из последовательностей SEQ ID NO: 1, 25, 26, 27 или 2, 25, 26, 28, или 3, 25, 26, 29, или 4, 25, 26, 30, или 5, 25, 26, 31, или 6, 25, 26, 32, или 7, 25, 26, 33, или 8, 25, 26, 34, или 9, 25, 26, 35, или 10, 25, 26 36, или 11, 25, 26, 37, или 12, 25, 26, 38, или одну из аминокислотных последовательностей, представленных на фигуре 1, или аминокислотную последовательность, которая по меньшей мере на 70%, более предпочтительно по меньшей мере на 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, представленной в SEQ ID NO: 1, 25, 26, 27 или 2, 25, 26, 28, или 3, 25, 26, 29, или 4, 25, 26, 30, или 5, 25, 26, 31, или 6, 25, 26, 32, или 7, 25, 26, 33, или 8, 25, 26, 34, или 9, 25, 26, 35, или 10, 25, 26 36, или 11, 25, 26, 37, или 12, 25, 26, 38, или аминокислотной последовательности цепи Vl, представленной на фигуре 1.
Антитело может содержать по меньшей мере одну вариабельную область тяжелой цепи (Vh), содержащую аминокислотную последовательность, выбранную из одной из последовательностей SEQ ID NO: 13, 39 или 89, 40, 41, или 14, 39, или 89, 40, 42, или 15, 39, или 89, 40, 43, или 16, 39, или 89, 40, 44, или 17, 39, или 89, 40, 45, или 18, 39, или 89, 40, 46, или 19, 39, или 89, 40, 47, или 20, 39, или 89, 40, 48, или 21, 39, или 89, 40, 49, или 22, 39, или 89, 40, 50, или 23, 39, или 89, 40, 51, или 24, 39, или 89, 40, 52, или одну из аминокислотных последовательностей, представленных на фигуре 2, или аминокислотную последовательность, которая по меньшей мере на 70%, более предпочтительно по меньшей мере на 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична последовательности, представленной в SEQ ID NO: 13, 39, 40, 41 или 14, 39, или 89, 40, 42, или 15, 39, или 89, 40, 43, или 16, 39, или 89, 40, 44, или 17, 39, или 89, 40, 45, или 18, 39, или 89, 40, 46, или 19, 39, или 89, 40, 47, или 20, 39, или 89, 40, 48, или 21, 39, или 89, 40, 49, или 22, 39, или 89, 40, 50, или 23, 39, или 89, 40, 51, или 24, 39, или 89, 40, 52, или аминокислотной последовательности цепи Vh, представленной на фигуре 2.
Антитело может содержать по меньшей мере одну вариабельную область легкой цепи, содержащую аминокислотную последовательность, выбранную из одной из последовательностей, представленных в SEQ ID NO: 1, 25, 26, 27 или 2, 25, 26, 28, или 3, 25, 26, 29, или 4, 25, 26, 30, или 5, 25, 26, 31, или 6, 25, 26, 32, или 7, 25, 26, 33, или 8, 25, 26, 34, или 9, 25, 26, 35, или 10, 25, 26 36, или 11, 25, 26, 37, или 12, 25, 26, 38, или одну из аминокислотных последовательностей, представленных на фигуре 1 (или аминокислотную последовательность, которая по меньшей мере на 70%, более предпочтительно по меньшей мере на 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентична одной из последовательностей, представленных в SEQ ID NO: 1, 25, 26, 27 или 2, 25, 26, 28, или 3, 25, 26, 29, или 4, 25, 26, 30, или 5, 25, 26, 31, или 6, 25, 26, 32, или 7, 25, 26, 33, или 8, 25, 26, 34, или 9, 25, 26, 35, или 10, 25, 26 36, или 11, 25, 26, 37, или 12, 25, 26, 38, или одной из аминокислотных последовательностей цепи Vl, представленных на фигуре 1), и по меньшей мере одну вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, выбранную из одной из последовательностей, представленных в SEQ ID NO: 13, 39 или 89, 40, 41, или 14, 39, или 89, 40, 42, или 15, 39, или 89, 40, 43, или 16, 39, или 89, 40, 44, или 17, 39, или 89, 40, 45, или 18, 39, или 89, 40, 46, или 19, 39, или 89, 40, 47, или 20, 39, или 89, 40, 48, или 21, 39, или 89, 40, 49, или 22, 39, или 89, 40, 50, или 23, 39, или 89, 40, 51, или 24, 39, или 89, 40, 52, или одну из аминокислотных последовательностей, представленных на фигуре 2 (или аминокислотную последовательность, которая по меньшей мере на 70%, более предпочтительно по меньшей мере на 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична одной из последовательностей, представленных в SEQ ID NO: 13, 39 или 89, 40, 41, или 14, 39, или 89, 40, 42, или 15, 39, или 89, 40, 43, или 16, 39, или 89, 40, 44, или 17, 39, или 89, 40, 45, или 18, 39, или 89, 40, 46, или 19, 39, или 89, 40, 47, или 20, 39, или 89, 40, 48, или 21, 39, или 89, 40, 49, или 22, 39, или 89, 40, 50, или 23, 39, или 89, 40, 51, или 24, 39, или 89, 40, 52, или одной из аминокислотных последовательностей цепи Vh, представленных на фигуре 2).
Антитела необязательно могут связываться с PD-1. Антитело может необязательно содержать компоненты аминокислотной последовательности, описанной выше. Антитело может представлять собой IgG. Согласно одному варианту реализации настоящего изобретения предложен комплекс в условиях in vitro, необязательно выделенный, содержащий антитело или антигенсвязывающий фрагмент, описанный в настоящем документе, связанный с PD-1.
Согласно одному аспекту настоящего изобретения предложен выделенный полипептид вариабельной области тяжелой цепи, причем указанный полипептид вариабельной области тяжелой цепи содержит следующие CDR:
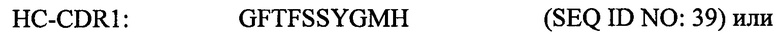

где Z1=L или Y, Z2=А или S, Z3=P или Y, Z4=Y или L, Z5=K, M или L, Z6=H или V.
Согласно некоторым вариантам реализации настоящего изобретения HC-CDR3 представляет собой одну из последовательностей DLGAGPYYYGKDH (SEQ ID NO: 41), DLGAGPYYYGKDV (SEQ ID NO: 42), DYGAGPYYYGMDV (SEQ ID NO: 43), DLGAGPYYYGLDV (SEQ ID NO: 44), DLGAGPYYYGMDV (SEQ ID NO: 45), DLGAGPYYYGMDV (SEQ ID NO: 46), DLGAGPYYYGMDV (SEQ ID NO: 47), DLGAGPYYYGMDV (SEQ ID NO: 48), DLGAGPYYYGMDV (SEQ ID NO: 49), DYGAGPYYYGMDV (SEQ ID NO: 50), DLGSGYYLYGMDV (SEQ ID NO: 51) или DLGAGPYYYGMDV (SEQ ID NO: 52).
Согласно одному аспекту настоящего изобретения предложено антитело или антигенсвязывающий фрагмент, причем указанное антитело или антигенсвязывающий фрагмент содержит последовательность вариабельной области тяжелой цепи и легкой цепи, в котором:
тяжелая цепь содержит HC-CDR1, HC-CDR2, HC-CDR3, последовательности которых по меньшей мере на 85% идентичны
HC-CDR1: GFTFSSYGMH (SEQ ID NO: 39) или SYGMH (SEQ ID NO: 89),
HC-CDR2 VISYDGSNKYYADSVKG (SEQ ID NO: 40),
HC-CDR3: представляет собой одну из последовательностей DZ1GZ2GZ3YZ4YGZ5DZ6 (SEQ ID NO: 54), DLGAGPYYYGKDH (SEQ ID NO: 41), DLGAGPYYYGKDV (SEQ ID NO: 42), DYGAGPYYYGMDV (SEQ ID NO: 43), DLGAGPYYYGLDV (SEQ ID NO: 44), DLGAGPYYYGMDV (SEQ ID NO: 45), DLGAGPYYYGMDV (SEQ ID NO: 46), DLGAGPYYYGMDV (SEQ ID NO: 47), DLGAGPYYYGMDV (SEQ ID NO: 48), DLGAGPYYYGMDV (SEQ ID NO: 49), DYGAGPYYYGMDV (SEQ ID NO: 50), DLGSGYYLYGMDV (SEQ ID NO: 51) или DLGAGPYYYGMDV (SEQ ID NO: 52), соответственно, где Z1=L или Y, Z2=А или S, Z3=P или Y, Z4=Y или L, Z5=K, M или L, Z6=H или V, и
легкая цепь содержит LC-CDR1, LC-CDR2, LC-CDR3, последовательности которых по меньшей мере на 85% идентичны
LC-CDR1: SGSSSNIKFNSVN (SEQ ID NO: 25),
LC-CDR2: SNNQRPS (SEQ ID NO: 26),
LC-CDR3: представляет собой одну из последовательностей X1X2WDDX3X4X5GX6X7 (SEQ ID NO: 53), ASWDDVLYGSV (SEQ ID NO: 27), ASWDDYYYGTI (SEQ ID NO: 28), ASWDDYLRGTV (SEQ ID NO: 29), SAWDDYLHGTV (SEQ ID NO: 30), ASWDDYVRGTM (SEQ ID NO: 31), SSWDDFLRGTV (SEQ ID NO: 32), SSWDDDARGTI (SEQ ID NO: 33), AAWDDVYYGTI (SEQ ID NO: 34), ASWDDSLYGTV (SEQ ID NO: 35), AAWDDAYYGTI (SEQ ID NO: 36), ASWDDVYRGTV (SEQ ID NO: 37) или SSWDDSLYGTI (SEQ ID NO: 38), соответственно, где X1=А или S, X2=S или A, X3=V, Y, F, D, S или A, X4=L, Y, V или A, X5=Y, R или H, X6=S или T, X7=V, I или M.
Согласно некоторым вариантам реализации настоящего изобретения степень идентичности последовательностей может составлять 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%.
Согласно другому аспекту настоящего изобретения предложено антитело или его антигенсвязывающий фрагмент, необязательно выделенный, содержащий последовательность вариабельной области тяжелой цепи и легкой цепи, в котором:
последовательность тяжелой цепи по меньшей мере на 85% идентична одной из последовательностей тяжелой цепи, представленных в SEQ ID NO: 13-24 (фигура 2), и
последовательность легкой цепи по меньшей мере на 85% идентична одной из последовательностей легкой цепи, представленных в SEQ ID NO: 1-12 (фигура 1).
Согласно некоторым вариантам реализации настоящего изобретения степень идентичности последовательностей может составлять 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%.
Согласно некоторым вариантам реализации настоящего изобретения антитело, антигенсвязывающий фрагмент или полипептид дополнительно содержит последовательности каркаса вариабельной области тяжелой цепи между CDR согласно схеме HCFR1:HC-CDR1:HCFR2:HC-CDR2:HCFR3:HC-CDR3:HCFR4. Последовательности каркаса могут быть получены из консенсусных последовательностей каркаса человека.
Согласно одному аспекту настоящего изобретения предложен выделенный полипептид вариабельной области легкой цепи, необязательно в комбинации с полипептидом вариабельной области тяжелой цепи, описанной в настоящем документе, при этом полипептид вариабельной области легкой цепи содержит следующие CDR:

где X1=А или S, Х2=S или А, Х3=V, Y, F, D, S или А, Х4=L, Y, V или А, Х5=Y, R или Н, Х6=S или Т, Х7=V, I или М.
Согласно некоторым вариантам реализации настоящего изобретения LC-CDR3 представляет собой одну из последовательностей ASWDDVLYGSV (SEQ ID NO: 27), ASWDDYYYGTI (SEQ ID NO: 28), ASWDDYLRGTV (SEQ ID NO: 29), SAWDDYLHGTV (SEQ ID NO: 30), ASWDDYVRGTM (SEQ ID NO: 31), SSWDDFLRGTV (SEQ ID NO: 32), SSWDDDARGTI (SEQ ID NO: 33), AAWDDVYYGTI (SEQ ID NO: 34), ASWDDSLYGTV (SEQ ID NO: 35), AAWDDAYYGTI (SEQ ID NO: 36), ASWDDVYRGTV (SEQ ID NO: 37) или SSWDDSLYGTI (SEQ ID NO: 38).
Согласно некоторым вариантам реализации настоящего изобретения антитело, антигенсвязывающий фрагмент или полипептид дополнительно содержит каркасные последовательности вариабельной области легкой цепи между CDR в соответствии со схемой LCFR1:LC-CDR1:LCFR2:LC-CDR2:LCFR3:LC-CDR3:LCFR4. Каркасные последовательности могут быть получены из консенсусных каркасных последовательностей человека.
Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может дополнительно содержать константную область человека. Например, константную область, выбранную из одной из областей IgG1, IgG2, IgG3 и IgG4.
Согласно некоторым вариантам реализации настоящего изобретения антитело или антигенсвязывающий фрагмент может дополнительно содержать константную область мыши. Например, константную область, выбранную из одной из областей IgG1, IgG2A, IgG2B и IgG3.
Согласно другому аспекту настоящего изобретения предложено антитело или антигенсвязывающий фрагмент, необязательно выделенный, который способен связываться с PD-1 и который представляет собой биспецифичное антитело или биспецифичный антигенсвязывающий фрагмент. Согласно некоторым вариантам реализации настоящего изобретения биспецифичное антитело или биспецифичный антигенсвязывающий фрагмент содержит антигенсвязывающий фрагмент или полипептид, способный связываться с PD-1, как описано в настоящем документе, и дополнительно содержит домен связывания антигена, который способен связываться с другим белком-мишенью, например, белком-мишенью, отличным от PD-1. Согласно некоторым вариантам реализации настоящего изобретения белок-мишень представляет собой поверхностный рецептор клеток. Согласно некоторым вариантам реализации настоящего изобретения белок-мишень представляет собой поверхностный рецептор клеток, экспрессируемый на поверхности иммунных клеток, например, Т-клеток. Согласно некоторым вариантам реализации настоящего изобретения белок-мишень может быть членом семейства CD28. Согласно некоторым вариантам реализации настоящего изобретения член семейства CD28 выбран из TIM-3, LAG3, ICOS, CTLA4, BTLA или CD28.
Согласно другому аспекту настоящего изобретения предложена композиция, например, фармацевтическая композиция или лекарственное средство. Композиция может содержать антитело, антигенсвязывающий фрагмент или полипептид, описанный в настоящем документе, и по меньшей мере один фармацевтически приемлемый носитель, вспомогательное вещество, адъювант или разбавитель.
Согласно другому аспекту настоящего изобретения предложена выделенная нуклеиновая кислота, кодирующая антитело, антигенсвязывающий фрагмент или полипептид, описанный в настоящем документе. Нуклеиновая кислота может содержать последовательность, представленную в одной из SEQ ID NO: 55, 56, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87 или 88 (фигура 4), или кодирующую последовательность, которая является вырожденной как результат генетического кода, или может содержать нуклеотидную последовательность, которая по меньшей мере на 70% идентична указанной последовательности, возможно, идентична на 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%.
Согласно одному аспекту настоящего изобретения предложен вектор, содержащий нуклеиновую кислоту, описанную в настоящем документе. Согласно другому аспекту настоящего изобретения предложена клетка-хозяин, содержащая вектор. Например, клетка-хозяин может представлять собой эукариотическую клетку или клетку млекопитающего, например, клетку яичника китайского хомяка (СНО) или клетку человека, или может представлять собой прокариотическую клетку, например, E. coli.
Согласно одному аспекту настоящего изобретения предложен способ получения антитела или антигенсвязывающего фрагмента или полипептида, описанного в настоящем документе, причем указанный способ включает культивирование клетки-хозяина, описанной в настоящем документе, в условиях, подходящих для экспрессии вектора, кодирующего антитело или антигенсвязывающий фрагмент или полипептид, и выделение антитела или антигенсвязывающего фрагмента или полипептида.
Согласно другому аспекту настоящего изобретения предложено антитело, антигенсвязывающий фрагмент или полипептид для применения в терапии или в способе лечения. Согласно другому аспекту настоящего изобретения предложено антитело, антигенсвязывающий фрагмент или полипептид, описанный в настоящем документе, для применения в лечении нарушения функционирования Т-клеток. Согласно другому аспекту настоящего изобретения предложено применение антитела, антигенсвязывающего фрагмента или полипептида, описанного в настоящем документе, в производстве лекарственного средства или фармацевтической композиции для применения в лечении нарушения функционирования Т-клеток.
Согласно другому аспекту настоящего изобретения предложен способ усиления функции Т-клеток, включающий введение антитела, антигенсвязывающего фрагмента или полипептида, описанного в настоящем документе, в Т-клетку с нарушенными функциями. Способ можно осуществлять в условиях in vitro и в условиях in vivo.
Согласно другому аспекту настоящего изобретения предложен способ лечения нарушения функционирования Т-клеток, включающий введение антитела, антигенсвязывающего фрагмента или полипептида, описанного в настоящем документе, пациенту, страдающему нарушением функционирования Т-клеток.
Согласно другому аспекту настоящего изобретения предложен способ модулирования иммунного ответа у субъекта, включающий введение субъекту антитела, антигенсвязывающего фрагмента или полипептида, описанного в настоящем документе, так, что у субъекта модулируется иммунный ответ.
Согласно другому аспекту настоящего изобретения предложен способ ингибирования размножения опухолевых клеток у субъекта, причем способ включает введение субъекту терапевтически эффективного количества антитела, антигенсвязывающего фрагмента или полипептида, описанного в настоящем документе.
Согласно другому аспекту настоящего изобретения предложен способ, который включает приведение образца, содержащего или предположительно содержащего PD-1, в контакт с антителом или антигенсвязывающим фрагментом, описанным в настоящем документе, и детектирование образования комплекса антитела или его антигенсвязывающего фрагмента с PD-1.
Согласно другому аспекту настоящего изобретения предложен способ диагностики заболевания или состояния у субъекта, причем способ включает приведение образца, полученного от субъекта, в контакт с антителом или антигенсвязывающим фрагментом, описанным в настоящем документе, в условиях in vitro и детектирование образования комплекса антитела или антигенсвязывающего фрагмента с PD-1.
Согласно другому аспекту настоящего изобретения предложен способ отбора или стратификации субъекта для лечения с использованием агентов, нацеленных к PD-1, причем способ включает приведение образца, полученного от субъекта, в контакт с антителом или антигенсвязывающим фрагментом, в соответствии с настоящим изобретением, в условиях in vitro и детектирование образования комплекса антитела или антигенсвязывающего фрагмента с PD-1.
Согласно другому аспекту настоящего изобретения предложено применение антитела или антигенсвязывающего фрагмента, описанного в настоящем документе, для детектирования PD-1 в условиях in vitro. Согласно другому аспекту настоящего изобретения предложено применение антитела или антигенсвязывающего фрагмента, описанного в настоящем документе, в качестве диагностического агента в условиях in vitro.
Согласно другому аспекту настоящего изобретения предложен способ размножения популяции Т-клеток, причем указанный способ включает приведение Т-клеток в контакт с антителом, его антигенсвязывающим фрагментом или полипептидом в соответствии с настоящим изобретением в условиях in vitro или ex vivo.
Согласно другому аспекту настоящего изобретения предложен способ лечения субъекта, имеющего нарушение функционирования Т-клеток, причем указанный способ включает культивирование Т-клеток, полученных из образца крови субъекта, в присутствии антитела, антигенсвязывающего фрагмента или полипептида согласно настоящему изобретению, чтобы размножить популяцию Т-клеток, сбор размноженных Т-клеток, а также введение размноженных Т-клеток субъекту, нуждающемуся в лечении.
В способах согласно настоящему изобретению антитело, антигенсвязывающий фрагмент или полипептид могут быть представлены в виде композиции, описанной в настоящем документе.
Согласно некоторым вариантам реализации настоящего изобретения антитело может представлять собой клон антитела A3, А10, В6, С4, D4, E1, F2, G1, G2, G10, Н4 или Н9, описанный в настоящем документе.
Описание
Антитела
Антитела согласно настоящему изобретению предпочтительно связываются с PD-1 (антиген), предпочтительно с PD-1 человека или макаки-резуса, необязательно с величиной Kd, которая находится в диапазоне от 0,1 до 2 нМ.
Согласно любому аспекту настоящего изобретения антитело предпочтительно специфично связывается с PD-1 (например, человека или макаки-резуса) по сравнению с другими членами семейства CD28 (предпочтительно из того же организма), например, одним или более или любым из TIM-3 (HAVCR2), LAG3 (CD223), ICOS (CD278), CTLA4 (CD 152), BTLA (CD272) или CD28.
Антитела согласно настоящему изобретению могут быть предложены в выделенной форме.
Антитела в соответствии с настоящим изобретением могут обладать по меньшей мере одним из следующих свойств:
a) связываться с PD-1 человека с величиной Kd 1 мкМ или менее, предпочтительно с величиной KD≤10 нМ, ≤1 нМ, ≤800 пМ, ≤700 пМ, ≤600 пМ, ≤500 пМ, ≤400 пМ, ≤300 пМ, ≤200 пМ или ≤100 пМ;
b) по существу не связываться с TIM-3, LAG3, ICOS, CTLA4, BTLA или CD28 человека;
c) увеличивать пролиферацию Т-клеток в количественном исследовании реакции смешанной культуры лимфоцитов (СКЛ) (например, см. Bromelow et al J. Immunol Methods, 2001 Jan 1;247(1-2):1-8);
d) увеличивать выработку ИФН-γ в количественном исследовании СКЛ; или
e) увеличивать секрецию интерлейкина-2 (ИЛ-2) в количественном исследовании СКЛ.
Согласно некоторым вариантам реализации настоящего изобретения антитела могут быть способны увеличивать выработку ИФН-γ в количественном исследовании СКЛ в зависимости от дозы. Согласно некоторым вариантам реализации настоящего изобретения антитела могут быть способны увеличивать выработку ИФН-γ в количественном исследовании СКЛ лимфоцитами, экспрессирующими один или более маркеров истощения, например, PD-1.
Под термином «антитело» понимают его фрагмент или его производное или синтетическое антитело или фрагмент синтетического антитела.
С учетом современных методик в отношении технологии моноклональных антител, антитела могут быть получены для большинства антигенов. Антигенсвязывающий участок может быть частью антитела (например, фрагмент Fab) или фрагментом синтетического антитела (например, одноцепочечный фрагмент Fv [scFv]). Подходящие моноклональные антитела к выбранным антигенам могут быть получены с помощью известных методик, например, тех, которые описаны в "Monoclonal Antibodies: A manual of techniques", H Zola (CRC Press, 1988) и в "Monoclonal Hybridoma Antibodies: Techniques and Applications", JGR Hurrell (CRC Press, 1982). Химерные антитела обсуждаются Neuberger et al (1988, 8th International Biotechnology Symposium Part 2, 792-799).
Моноклональные антитела (MAT) могут быть использованы в способах согласно настоящему изобретению и представляют собой гомогенную популяцию антител, специфично нацеленных к одному эпитопу на антигене.
Поликлональные антитела можно применять в способах согласно настоящему изобретению. Предпочтительными являются моноспецифичные поликлональные антитела. Подходящие поликлональные антитела могут быть получены с использованием способов, хорошо известных в данной области техники.
Антигенсвязывающие фрагменты антител, такие как фрагменты Fab и Fab2, также могут быть использованы/обеспечены в виде модифицированных антител и фрагментов антител. Вариабельная область тяжелой цепи (Vh) и вариабельная область легкой цепи (Vl) антитела участвуют в распознавании антигена, этот факт был впервые обнаружен в первоначальных экспериментах с использованием протеазного расщепления. Дальнейшее подтверждение было найдено с применением «гуманизации» антител грызунов. Вариабельные области грызунов могут быть гибридизованы с константными областями человека так, что полученное антитело сохраняет антигенную специфичность исходного антитела грызуна (Morrison et al (1984) Proc. Natl. Acad. Sd. USA 81, 6851-6855).
Антигенная специфичность обеспечивается вариабельными областями и не зависит от константных областей, как известно из экспериментов с использованием бактериальной экспрессии фрагментов антител, все из которых содержат одну или более вариабельных областей. Перечисленные молекулы включают Fab-подобные молекулы (Better et al (1988) Science 240, 1041); молекулы Fv (Skerra et al (1988) Science 240, 1038); одноцепочечные молекулы Fv (scFv), в которых партнерские домены Vh и Vl связаны посредством гибкого олигопептида (Bird et al (1988) Science 242, 423; Huston et al (1988) Proc. Natl. Acad. Sd. USA 85, 5879) и однодоменные антитела (dAbs), содержащие выделенные вариабельные области (Ward et al (1989) Nature 341, 544). Общий обзор методик синтеза фрагментов антител, которые сохраняют свои специфичные сайты связывания, можно найти в Winter & Milstein (1991) Nature 349, 293-299.
Под термином «молекулы scFv» подразумевают молекулы, в которых партнерские домены Vh и Vl ковалентно связаны, например, с помощью гибкого олигопептида.
Фрагменты антител Fab, Fv, scFv и dAb могут быть экспрессированы клетками E. coli и могут быть секретированы из них, обеспечивая тем самым легкий способ получения больших количеств указанных фрагментов.
Целые антитела и фрагменты F(ab')2 являются «двухвалентными». Под термином «двухвалентный» подразумевают, что указанные антитела и фрагменты F(ab')2 содержат два антигенсвязывающих сайта. Напортив, фрагменты Fab, Fv, scFv и dAb являются одновалентными и содержат только один антигенсвязывающий сайт. Синтетические антитела, которые связываются с PD-1, также могут быть изготовлены с использованием технологии фагового дисплея, как хорошо известно в данной области техники.
В настоящем изобретении также предложено антитело или антигенсвязывающий фрагмент, который способен связываться с PD-1, и который представляет собой биспецифичное антитело или биспецифичный антигенсвязывающий фрагмент. Согласно некоторым вариантам реализации настоящего изобретения биспецифичное антитело или биспецифичный антигенсвязывающий фрагмент может быть выделенным.
Согласно некоторым вариантам реализации настоящего изобретения биспецифичные антитела и биспецифичные антигенсвязывающие фрагменты содержат антигенсвязывающий фрагмент или полипептид в соответствии с настоящим изобретением. Согласно некоторым вариантам реализации настоящего изобретения биспецифичные антитела и биспецифичные антигенсвязывающие фрагменты содержат антигенсвязывающий домен, способный связываться с PD-1, причем указанный антигенсвязывающий домен, который способен связываться с PD-1, содержит или состоит из антигенсвязывающего фрагмента или полипептида в соответствии с настоящим изобретением.
Согласно некоторым вариантам реализации настоящего изобретения биспецифичные антитела и биспецифичные антигенсвязывающие фрагменты содержат антигенсвязывающий домен, способный связываться с PD-1, и антигенсвязывающий домен, способный связываться с другим белком-мишенью.
Антигенсвязывающий домен, способный связываться с другим белком-мишенью, может быть способен связываться с другим белком, отличным от PD-1. Согласно некоторым вариантам реализации настоящего изобретения белок-мишень представляет собой поверхностный рецептор клеток. Согласно некоторым вариантам реализации настоящего изобретения белок-мишень представляет собой поверхностный рецептор клеток, экспрессируемый на поверхности иммунных клеток, например, Т-клеток. Согласно некоторым вариантам реализации настоящего изобретения белок-мишень может быть членом семейства CD28. Согласно некоторым вариантам реализации настоящего изобретения белок-мишень может быть членом семейства CD28, таким как TIM-3 (HAVCR2), LAG3 (CD223), ICOS (CD278), CTLA4 (CD 152), BTLA (CD272) или CD28. Согласно конкретным вариантам реализации настоящего изобретения белок-мишень может представлять собой CTLA4 или LAG3.
Согласно некоторым вариантам реализации настоящего изобретения антигенсвязывающий домен TIM-3 может содержать CDR, вариабельные области легкой и тяжелой цепей или другой фрагмент, связывающий TIM-3, например, клон антитела TIM-3, F38-2E2 (BioLegend), клон 2Е2 (Merck Millipore), клон 6В6Е2, клон 024 (Sino Biological), клон 344801 (R&D Systems), клон Е-18, клон Н-191 (Santa Cruz Biotechnology), или клон 13А224 (United States Biological). Согласно некоторым вариантам реализации настоящего изобретения антигенсвязывающий домен LAG3 может содержать CDR, вариабельные области легкой и тяжелой цепей или другой фрагмент, связывающий LAG3, например, клон антитела к LAG-3, 17В4 (Enzo Life Sciences), клон 333210 (R&D Systems), или клон 14L676 (United States Biological). Согласно некоторым вариантам реализации настоящего изобретения антигенсвязывающий домен для ICOS может содержать CDR, вариабельные области легкой и тяжелой цепей или другой фрагмент, связывающий ICOS, например, клон антитела к ICOS, ISA-3 (eBioscience), клон SP98 (Novus Biologicals), клон 1G1, клон 3G4 (Abnova Corporation), клон 669222 (R&D Systems), клон TQ09 (Creative Diagnostics) или клон C398.4A (BioLegend). Согласно некоторым вариантам реализации настоящего изобретения антигенсвязывающий домен CTLA4 может содержать CDR, вариабельные области легкой и тяжелой цепей или другой фрагмент, связывающий CTLA4, например, клон антитела к CTLA-4, 42F1, клон 1F4 (Abnova Corporation), клон 9Н10 (EMD Millipore), клон BNU3 (GeneTex), клон 1Е2, клон AS32 (LifeSpan Biosciences), клон А3.4Н2.Н12 (Acris Antibodies), клон 060 (Sino Biological), клон BU5G3 (Creative Diagnostics), клон MIH8 (MBL International), клон A3.6B10.G1 или клон L3D10 (BioLegend). Согласно некоторым вариантам реализации настоящего изобретения антигенсвязывающий домен для BTLA может содержать CDR, вариабельные области легкой и тяжелой цепей или другой фрагмент, связывающий BTLA, например, клон антитела к BTLA, 1В7, клон 2G8, клон 4С5 (Abnova Corporation), клон 4В8 (antibodies-online), клон MIH26 (Thermo Scientific Pierce Antibodies), клон UMAB61 (OriGene Technologies), клон 330104 (R&D Systems), клон 1B4 (LifeSpan Biosciences), клон 440205, клон 5E7 (Creative Diagnostics). Согласно некоторым вариантам реализации настоящего изобретения антигенсвязывающий домен для CD28 может содержать CDR, вариабельные области легкой и тяжелой цепей или другой фрагмент, связывающий CD28, например, клон антитела к CD28, CD28.6 (eBioscience), клон CD28.2, клон JJ319 (Novus Biologicals), клон 204.12, клон В-23, клон 10F3 (Thermo Scientific Pierce Antibodies), клон 37407 (R&D Systems), клон 204-12 (Abnova Corporation), клон 15E8 (EMD Millipore), клон 204-12, клон YTH913.12 (AbD Serotec), клон B-T3 (Acris Antibodies), клон 9H6E2 (Sino Biological), клон C28/77 (MyBioSource.com), клон KOLT-2 (ALPCO), клон 152-2E10 (Santa Cruz Biotechnology) или клон XPH-56 (Creative Diagnostics).
Антигенсвязывающий домен биспецифичного антитела или биспецифичного антигенсвязывающего фрагмента в соответствии с настоящим изобретением может представлять собой любой домен полипептида, который способен связываться с антигеном. Согласно некоторым вариантам реализации настоящего изобретения антигенсвязывающий домен содержит по меньшей мере три CDR легкой цепи (т.е. LC-CDR1, LC-CDR2 и LC-CDR3) и три CDR тяжелой цепи (т.е. HC-CDR1, HC-CDR2 и НС-CDR3), которые совместно определяют антигенсвязывающий участок антитела или антигенсвязывающего фрагмента. Согласно некоторым вариантам реализации настоящего изобретения антигенсвязывающий домен может содержать вариабельный домен легкой цепи и вариабельный домен тяжелой цепи антитела или антигенсвязывающего фрагмента. Согласно некоторым вариантам реализации настоящего изобретения антигенсвязывающий домен может содержать полипептид легкой цепи и полипептид тяжелой цепи антитела или антигенсвязывающего фрагмента.
Биспецифичные антитела и биспецифичные антигенсвязывающие фрагменты согласно настоящему изобретению могут быть представлены в любом подходящем формате, например, в форматах, описанных в работе Kontermann MAbs 2012, 4(2): 182-197, которая полностью включена в настоящую заявку посредством ссылки. Например, биспецифичное антитело или биспецифичный антигенсвязывающий фрагмент может представлять собой конъюгат биспецифичного антитела (например, IgG2, F(ab')2 или CovX-Body), биспецифичный IgG или IgG-подобную молекулу (например, IgG, scFv4-Ig, IgG-scFv, scFv-IgG, DVD-Ig, IgG-sVD, sVD-IgG, 2 в 1-IgG, mAb2 или Tandemab обычной LC), асимметричный биспецифичный IgG или IgG-подобную молекулу (например, kih IgG, kih IgG обычной LC, CrossMab, kih IgG-scFab, mAb-Fv, заряженную пару или SEED-body), небольшую молекулу биспецифичного антитела (например, диатело dsDb, DART, scDb, tandAbs, тандем ScFv (taFv), тандем dAb/VHH, триатело, тривалентные антитела, Fab-scFv или F(ab')2-scFv2), биспецифичную область Fc и гибридный белок Сн3 (например, taFv-Fc, Di-диатело, scDb-Сн3, scFv-Fc-scFv, HCAb-VHH, scFv-kih-Fc или scFv-kih-Сн3) или биспецифичный гибридный белок (например, scFv2-альбумин, scDb-альбумин, taFv-токсин, DNL-Fab3, DNL-Fab4-IgG, DNL-Fab4-IgG-цитокин2). См., в частности, фигуру 2 в работе Kontermann MAbs 2012, 4(2): 182-19.
Специалист в данной области техники может разработать и получить биспецифичные антитела и биспецифичные антигенсвязывающие фрагменты в соответствии с настоящим изобретением.
Способы получения биспецифичных антител включают химическую сшивку антител или фрагментов антител, например, с помощью восстанавливаемых дисульфидных или невосстанавливаемых тиоэфирных связей, например, как описано в работе Segal and Bast, 2001. Production of Bispecific Antibodies. Current Protocols in Immunology. 14:IV:2.13:2.13.1-2.13.16, которая полностью включена в настоящую заявку посредством ссылки. Например, N-сукцинимидил-3-(-2-пиридилдитио)пропионат (SPDP) может быть использован для химической сшивки, например, фрагментов Fab с помощью SH-групп шарнирной области, чтобы создать дисульфид-сшитые биспецифичные гетеродимеры F(ab)2.
Другие способы получения биспецифичных антител включают гибридизацию вырабатывающего антитела гибрида, например, с полиэтиленгликолем, чтобы получить клетку квадромы, способную секретировать биспецифичное антитело, например, как описано в работе D.М. Segal and Bast, В.J. 2001. Production of Bispecific Antibodies. Current Protocols in Immunology. 14:IV:2.13:2.13.1-2.13.16.
Биспецифичные антитела и биспецифичные антигенсвязывающие фрагменты в соответствии с настоящим изобретением также могут быть получены рекомбинантным способом, путем экспрессии, например, с конструкции нуклеиновой кислоты, кодирующей полипептиды для антигенсвязывающих молекул, например, как описано в работах Antibody Engineering: Methods and Protocols, Second Edition (Humana Press, 2012), в главе 40: Production of Bispecific Antibodies: Diabodies and Tandem scFv (Hornig and  ) или French, How to make bispecific antibodies, Methods Mol. Med. 2000; 40:333-339, полное содержание которых включено в настоящую заявку посредством ссылки.
) или French, How to make bispecific antibodies, Methods Mol. Med. 2000; 40:333-339, полное содержание которых включено в настоящую заявку посредством ссылки.
Например, конструкция ДНК, кодирующая вариабельные области легкой и тяжелой цепей для двух антигенсвязывающих доменов (т.е. вариабельные области легкой цепи и тяжелой цепи для антигенсвязывающего домена, способного связываться с PD-1, а также вариабельные области легкой цепи и тяжелой цепи для антигенсвязывающего домена, способного связываться с другим белком-мишенью), включая последовательности, кодирующие подходящий линкер, или домен димеризации между антигенсвязывающими доменами, может быть получена с помощью методик молекулярного клонирования. Рекомбинантные биспецифичные антитела затем могут быть получены путем экспрессии (например, в условиях in vitro) конструкции в подходящей клетке-хозяине (например, клетке-хозяине млекопитающих), и экспрессированное рекомбинантное биспецифичное антитело затем необязательно может быть очищено.
Антитела могут быть получены с помощью способа созревания аффинности, в котором получают модифицированное антитело с улучшенной аффинностью указанного антитела в отношении антигена, по сравнению с немодифицированным исходным антителом. Антитела с созревшей аффинностью могут быть получены способами, известными в данной области техники, например, см. Marks et al., Rio/Technology 10:779-783 (1992); Barbas et al. Proc Nat. Acad. Sci. USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al, J. Immunol. 154(7):3310-159 (1995); и Hawkins et al, J. Mol. Biol. 226:889-896 (1992).
Антитела в соответствии с настоящим изобретением предпочтительно специфично связываются с PD-1. Антитело, которое специфично связывается с молекулой-мишенью, предпочтительно связывается с мишенью с более высокой аффинностью, и/или в течение более длительного периода времени, чем оно связывается с другими мишенями. Согласно одному варианту реализации настоящего изобретения степень связывания антитела с неродственной мишенью составляет менее чем приблизительно 10% от величины степени связывания антитела с мишенью, согласно результатам измерения, например, с помощью твердофазного иммуноферментного анализа (ИФА) или с помощью радиоиммуноанализа (РИА). В другом варианте специфичность связывания может быть отражена с использованием аффинности связывания, при этом антитело к PD-1 согласно настоящему изобретению связывается с PD-1 с KD, величина которой по меньшей мере на 0,1 порядка (т.е. 0,1×10n, где n представляет собой целое число, представляющее порядок величины) превышает величину KD антитела в отношении другой молекулы-мишени, например, другого члена семейства CD28. Величина KD необязательно может представлять собой одну величину из по меньшей мере 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,5 или 2,0.
Антитела согласно настоящему изобретению предпочтительно имеют константу диссоциации (Kd)≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ или ≤100 пМ. Аффинность связывания антитела в отношении его мишени часто описывают, используя его константу диссоциации (Kd). Величина аффинности связывания может быть измерена с помощью способов, известных в данной области техники, например, с помощью поверхностного плазмонного резонанса или с помощью количественного исследования связывания радиоактивномеченого антигена (RIA), который проводят с использованием фрагмента Fab молекулы антитела и антигена.
Антитела согласно настоящему изобретению могут представлять собой антитела «антагонисты», которые ингибируют или уменьшают биологическую активность антигена, с которым они связываются. Блокирование PD-1 помогает восстанавливать функцию Т-клеток путем ингибирования иммунного ингибирующего сигнального пути, опосредованного PD-1.
Согласно некоторым аспектам настоящего изобретения антитело представляет собой клон A3 или вариант A3. A3 содержит следующие последовательности CDR:
Легкая цепь:
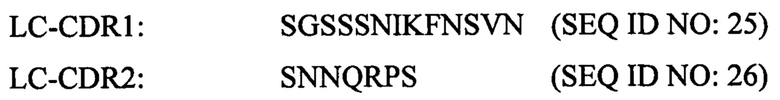
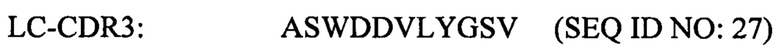
Тяжелая цепь:

Последовательности CDR определены в соответствии с системой Кабат (Kabat).
Согласно некоторым аспектам настоящего изобретения антитело представляет собой клон А10 или вариант А10. А10 содержит следующие последовательности CDR:
Легкая цепь:

Тяжелая цепь:

Последовательности CDR определены в соответствии с системой Кабат (Kabat).
Согласно некоторым аспектам настоящего изобретения антитело представляет собой клон В6 или вариант В6. В6 содержит следующие последовательности CDR:
Легкая цепь:

Тяжелая цепь:

Последовательности CDR определены в соответствии с системой Кабат (Kabat).
Согласно некоторым аспектам настоящего изобретения антитело представляет собой клон С4 или вариант С4. С4 содержит следующие последовательности CDR:
Легкая цепь:

Тяжелая цепь:

Последовательности CDR определены в соответствии с системой Кабат (Kabat).
Согласно некоторым аспектам настоящего изобретения антитело представляет собой клон D4 или вариант D4. D4 содержит следующие последовательности CDR:
Легкая цепь:

Тяжелая цепь:

Последовательности CDR определены в соответствии с системой Кабат (Kabat).
Согласно некоторым аспектам настоящего изобретения антитело представляет собой клон антитела Е1 или вариант E1. Е1 содержит следующие последовательности CDR:
Легкая цепь:

Тяжелая цепь:

Последовательности CDR определены в соответствии с системой Кабат (Kabat).
Согласно некоторым аспектам настоящего изобретения антитело представляет собой клон F2 или вариант F2. F2 содержит следующие последовательности CDR:
Легкая цепь:

Тяжелая цепь:

Последовательности CDR определены в соответствии с системой Кабат (Kabat).
Согласно некоторым аспектам настоящего изобретения антитело представляет собой клон G1 или вариант G1. G1 содержит следующие последовательности CDR:
Легкая цепь:

Тяжелая цепь:

Последовательности CDR определены в соответствии с системой Кабат (Kabat).
Согласно некоторым аспектам настоящего изобретения антитело представляет собой клон G2 или вариант G2. G2 содержит следующие последовательности CDR:
Легкая цепь:

Тяжелая цепь:


Последовательности CDR определены в соответствии с системой Кабат (Kabat).
Согласно некоторым аспектам настоящего изобретения антитело представляет собой клон G10 или вариант G10. G10 содержит следующие последовательности CDR:
Легкая цепь:

Тяжелая цепь:

Последовательности CDR определены в соответствии с системой Кабат (Kabat).
Согласно некоторым аспектам настоящего изобретения антитело представляет собой клон Н4 или вариант Н4. Н4 содержит следующие последовательности CDR:
Легкая цепь:

Тяжелая цепь:

Последовательности CDR определены в соответствии с системой Кабат (Kabat).
Согласно некоторым аспектам настоящего изобретения антитело представляет собой клон Н9 или вариант Н9. Н9 содержит следующие последовательности CDR:
Легкая цепь:

Тяжелая цепь:


Последовательности CDR определены в соответствии с системой Кабат (Kabat).
Антитела согласно настоящему изобретению могут содержать CDR одного из клонов A3, А10, В6, С4, D4, E1, F2, G1, G2, G10, Н4 или Н9 или одной из последовательностей, представленных в SEQ ID NO: 1 и 13, 2 и 14, 3 и 15, 4 и 16, 5 и 17, 6 и 18, 7 и 19, 8 и 20, 9 и 21, 10 и 22, 11 и 23, или 12 и 24. В антителе согласно настоящему изобретению одна или две, или три, или четыре из шести последовательностей CDR могут варьироваться. Вариант может содержать одну или две замены аминокислот в одной или двух из шести последовательностей CDR.
Аминокислотные последовательности цепей Vh и Vl клонов антитела к PD-1 представлены на фигурах 1 и 2. Кодирующие нуклеотидные последовательности представлены на фигуре 4.
CDR легкой цепи и тяжелой цепи также могут быть особенно пригодными в комбинации с целым рядом различных каркасных областей. Соответственно, легкие и/или тяжелые цепи, содержащие LC-CDR1-3 или HC-CDR1-3, могут содержать альтернативный каркасный участок. Подходящие каркасные участки хорошо известны в данной области техники и описаны, например, в работе М. Lefranc & G. Lefranc (2001) "The Immunoglobulin FactsBook", Academic Press, которая включена в настоящую заявку посредством ссылки.
В данном описании антитела могут содержать цепи Vh и/или Vl, содержащие аминокислотную последовательность, которая имеет высокий процент идентичности последовательностей с одной или более из аминокислотных последовательностей Vh и/или Vl, представленных в SEQ ID NO: 1 и 13, 2 и 14, 3 и 15, 4 и 16, 5 и 17, 6 и 18, 7 и 19, 8 и 20, 9 и 21, 10 и 22, 11 и 23, или 12 и 24, соответственно, или с одной из аминокислотных последовательностей, представленных на фигурах 1 и 2.
Например, антитела в соответствии с настоящим изобретением включают антитела, которые связываются с PD-1 и содержат цепь Vh или Vl, которая содержит аминокислотную последовательность, которая по меньшей мере на 70%, более предпочтительно по меньшей мере на 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности цепи Vh или Vl, представленной в SEQ ID NO: 1-24, или одной из аминокислотных последовательностей, представленных на фигурах 1 и 2.
Антитела согласно настоящему изобретению могут быть помечены детектируемой меткой или по меньшей мере пригодны для детектирования. Например, антитело может быть помечено радиоактивным атомом или окрашенной молекулой или флуоресцентной молекулой, или молекулой, которую можно легко детектировать любым другим способом. Подходящие детектируемые молекулы включают флуоресцентные белки, люциферазу, субстраты ферментов и радиоактивные метки. Связывающий фрагмент может быть непосредственно помечен детектируемой меткой или может быть помечен косвенным образом. Например, связывающий фрагмент может представлять собой немеченое антитело, которое можно детектировать с помощью другого антитела, которое в свою очередь является меченым. В другом варианте второе антитело может быть связано с биотином, и связывание меченого стрептавидина с биотином используют для непрямого детектирования первого антитела.
Способы детектирования
Антитела или антигенсвязывающие фрагменты, описанные в настоящем документе, могут быть использованы в способах, которые включают связывание антитела или его антигенсвязывающего фрагмента с PD-1. Указанные способы могут включать детектирование связанного комплекса антитела или антигенсвязывающего фрагмента с PD-1. Следовательно, в одном варианте реализации предложен способ, включающий приведение образца, содержащего или предположительно содержащего PD-1, в контакт с антителом или антигенсвязывающим фрагментом, описанным в настоящем документе, и детектирование образования комплекса антитела или антигенсвязывающего фрагмента с PD-1.
Подходящие варианты способов хорошо известны в данной области техники, включая иммунологические количественные исследования, такие как исследования в формате «сэндвич», например, ИФА. Способ может включать мечение антитела или антигенсвязывающего фрагмента, или PD-1, или их обоих, детектируемой меткой, например, флуоресцентной, люминесцентной или радиоактивной меткой.
Подходящие способы могут служить основой способа диагностики заболевания или состояния, требующего детектирования и количественного определения PD-1. Подходящие способы можно осуществлять в условиях in vitro на образце пациента или после обработки образца пациента. После получения образца присутствие пациента не требуется для проведения диагностики в условиях in vitro, и в этой связи способ может представлять собой способ, который не требует для своего проведения наличия тела человека или животного.
Указанные способы могут включать определение количества PD-1, присутствующего в образце пациента. Способ может дополнительно включать сравнение определенного количества со стандартной или эталонной величиной как часть способа постановки диагноза. Другие диагностические тесты могут быть использованы в комбинации с теми, которые описаны в настоящем документе, чтобы повысить точность диагноза или прогноза или подтвердить полученный результат с помощью тестов, описанных в настоящем документе.
Уровень PD1, присутствующий в образце пациента, может свидетельствовать о том, что пациент может отвечать на лечение с использованием антитела к PD1. Присутствие высокого уровня PD1 в образце может быть использовано для отбора пациента для лечения с использованием антитела к PD1. Следовательно, антитела согласно настоящему изобретению можно применять для отбора пациента для лечения с использованием антитела к PD-1.
Детектирование PD-1 в образце можно применять для диагностики нарушения функционирования Т-клеток или предракового состояния у пациента, диагностики предрасположенности к предраковому состоянию или прогнозирования (предсказания) предракового состояния. Диагноз или прогноз может относиться к существующему (ранее диагностированному) предраковому состоянию, которое может быть доброкачественным или злокачественным, может быть связано с подозрением на предраковое состояние, или может быть связано со скринингом предракового состояния у пациента (которое ранее могло быть не диагностировано).
Согласно одному варианту реализации настоящего изобретения уровень экспрессии PD-1 на CD8+ Т-клетках можно детектировать, чтобы указать степень истощения Т-клеток и степень тяжести течения заболевания.
Образец может быть взят из любой ткани или жидкости тела. Образец может содержать или может быть получен из: некоторого количества крови; некоторого количества сыворотки крови, полученной из крови индивидуума, которая может содержать жидкую составляющую крови, полученную после удаления фибринового сгустка и клеток крови; образца ткани или биопсии; или клеток, выделенных у указанного индивидуума.
Способы согласно настоящему изобретению предпочтительно осуществляют в условиях in vitro. Термин «в условиях in vitro» включает эксперименты с использованием клеток в культуре, в то время как термин «в условиях in vivo» включает эксперименты с использованием интактных многоклеточных организмов.
Варианты терапевтического применения
В настоящем изобретении могут быть предложены антитела, антигенсвязывающие фрагменты и полипептиды согласно настоящему изобретению и композиции, содержащие указанные агенты для применения в способах лечения. Способ лечения может быть обеспечен субъектам, имеющим заболевание или состояние, нуждающееся в лечении. Заболевание или состояние может представлять собой нарушение функционирования Т-клеток, включая нарушение функционирования Т-клетки, связанное с раком, или рак, или нарушение функционирования Т-клетки, связанное с инфекцией, или инфекцию.
Нарушение функционирования Т-клеток может представлять собой заболевание или состояние, при котором нормальная функция Т-клеток нарушается, что вызывает подавление иммунного ответа субъекта на патогенные антигены, например, те, которые вырабатываются при инфекции экзогенными агентами, такими как микроорганизмы, бактерии и вирусы, или вырабатываются у хозяина при некоторых патологических состояниях, таких как некоторые формы рака (например, в виде ассоциированных с опухолью антигенов).
Нарушение функционирования Т-клеток может включать истощение Т-клеток или анергию Т-клеток. Истощение Т-клеток включает состояние, при котором CD8+ Т-клетка не способна к пролиферации или осуществлению эффекторных функций Т-клеток, таких как цитотоксичность и секреция цитокина (например, ИФН-γ), в ответ на стимуляцию антигеном. Истощенные Т-клетки также могут быть охарактеризованы устойчивой экспрессией PD-1, причем блокирование взаимодействий PD-1:PD-L1 может обратить истощение Т-клеток и восстановить антиген-специфичные Т-клеточные ответы.
Нарушение функционирования Т-клеток может проявляться как инфекция или неспособность выработать эффективный иммунный ответ против инфекции. Инфекция может быть хронической, устойчивой, скрытой или медленнотекущей, и может возникнуть в результате бактериальной, вирусной, грибковой или паразитарной инфекции. Следовательно, способ лечения может быть обеспечен пациентам, имеющим бактериальные, вирусные или грибковые инфекции. Примеры бактериальных инфекций включают инфекции Helicobacter pylori. Примеры вирусных инфекций включают инфекции ВИЧ, гепатитом В или гепатитом С.
Нарушение функционирования Т-клеток может быть связано с раком, таким как ускользание опухоли от иммунного ответа. Многие опухоли человека экспрессируют ассоциированные с опухолью антигены, распознаваемые Т-клетками, и способные индуцировать иммунный ответ. Тем не менее, иммунное уклонение является распространенным и, как полагают, опосредовано рядом растворимых факторов, включая PD-L1. Следовательно, блокирование взаимодействия PD-1 и PD-L1 может ингибировать этот отрицательный иммунный регуляторный сигнал к опухолевым клеткам и повысить иммунитет, опосредованный опухолеспецифичными CD8+ Т-клетками.
Различные виды рака, при которых отсутствуют признаки нарушения функционирования Т-клеток, такие как истощение Т-клеток, также можно лечить с использованием антитела, антигенсвязывающего фрагмента или полипептида в соответствии с настоящим изобретением, которые позволяют подавить у субъекта передачу сигналов с участием PD-1 и вызвать эффективный иммунный ответ с ограниченным нарушением, уклонением или индукцией ускользания опухоли от иммунного ответа. В указанных способах лечения антитело, антигенсвязывающий фрагмент или полипептид может обеспечить лечение рака, которое включает предотвращение феномена ускользания опухоли от иммунного ответа.
Лечение может быть направлено на предотвращение нарушения функционирования Т-клеток, например, предотвращение инфекции или развития или прогрессирования рака. Антитела, антигенсвязывающие фрагменты и полипептиды могут быть использованы сами по себе для изготовления фармацевтических композиций или лекарственных средств, и субъекты могут получать профилактическое лечение против развития патологического состояния. Профилактическое лечение может быть использовано до появления симптомов патологического состояния и/или может быть обеспечено субъектам, которые, как полагают, подвергаются риску инфекции или развития рака.
Лечение может включать совместную терапию с использованием вакцины, например, Т-клеточной вакцины, которая может включать одновременную, раздельную или последовательную терапию или комбинированное введение вакцины и антитела, антигенсвязывающего фрагмента или полипептида в одной композиции. Применительно к указанному способу лечения антитело, антигенсвязывающий фрагмент или полипептид может быть обеспечен в качестве адъюванта для вакцины. Ограниченный пролиферативный потенциал истощенных Т-клеток являлся основной причиной неэффективности Т-клеточной иммунотерапии, и комбинирование агентов, способных блокировать или обращать истощение Т-клеток, является перспективной стратегией для улучшения эффективности Т-клеточной иммунотерапии (Barber et al., Nature Vol 439, No. 9 p 682-687 Feb 2006).
Антитело, антигенсвязывающий фрагмент или полипептид предпочтительно вводят в «терапевтически эффективном количестве», которое является достаточным,. чтобы обеспечить пользу индивидууму. Фактическое вводимое количество, частота и продолжительность курса введения будут зависеть от природы и степени тяжести заболевания, которое лечат. Назначение способа лечения, например, решение по дозировке и т.д. находится в пределах ответственности врачей общей практики и других врачей, и, как правило, принимается с учетом заболевания, подлежащего лечению, состояния отдельного пациента, места доставки, способа введения и других факторов, известных врачам общей практики. Примеры методик и протоколов, упомянутых выше, можно найти в Remington's Pharmaceutical Sciences, 20th Edition, 2000, pub. Lippincott, Williams & Wilkins.
Изготовление фармацевтически подходящих композиций и лекарственных средств
Антитела, антигенсвязывающие фрагменты и полипептиды согласно настоящему изобретению могут быть изготовлены в виде фармацевтических композиций, предназначенных для клинического применения, и могут содержать фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество или адъювант.
В соответствии с настоящим изобретением также предложены способы получения фармацевтически подходящих композиций, такие способы получения могут включать один или более этапов, выбранных из: выделения антитела, антигенсвязывающего фрагмента или полипептида, описанного в настоящем документе; и/или смешивания выделенного антитела, антигенсвязывающего фрагмента или полипептида, описанного в настоящем документе, с фармацевтически приемлемым носителем, адъювантом, вспомогательным веществом или разбавителем.
Например, согласно другому аспекту настоящего изобретения предложен способ изготовления или получения лекарственного средства или фармацевтической композиции для применения в лечении нарушения функционирования Т-клеток, причем указанный способ включает изготовление фармацевтической композиции или лекарственного средства путем смешивания антитела, антигенсвязывающего фрагмента или полипептида, описанного в настоящем документе, с фармацевтически приемлемым носителем, адъювантом, вспомогательным веществом или разбавителем.
Инфекция
Инфекция может представлять собой любую инфекцию или инфекционное заболевание, например, бактериальную, вирусную, грибковую или паразитарную инфекцию. Согласно некоторым вариантам реализации настоящего изобретения особенно желательным может быть лечение хронических/устойчивых инфекций, например, инфекций, связанных с нарушением функционирования Т-клеток или истощением Т-клеток.
Хорошо известно, что истощение Т-клеток представляет собой нарушение функционирования Т-клеток, которое возникает при многих хронических инфекциях (включая вирусные, бактериальные и паразитарные инфекции), а также при раке (Wherry Nature Immunology Vol. 12, No. 6, p 492-499, June 2011).
Инфекция или инфекционное заболевание может представлять собой заболевание, при котором активируется PD-1 (например, как установлено в работе Radziewicz Н, et al., J Virol. 2007;81(6):2545-2553 и Golden-Mason L et al., J Virol. 2007;81(17):9249-9258).
Примеры бактериальных инфекций, которые можно лечить, включают инфекции Bacillus spp., Bordetella pertussis, Clostridium spp., Corynebacterium spp., Vibrio chloerae, Staphylococcus spp., Streptococcus spp. Escherichia, Klebsiella, Proteus, Yersinia, Erwina, Salmonella, Listeria sp, Helicobacter pylori, микобактериями (например, Mycobacterium tuberculosis) и Pseudomonas aeruginosa. Например, бактериальная инфекция может представлять собой сепсис или туберкулез.
Yao et al (PD-1 on dendritic cells impedes innate immunity against bacterial infection. Blood 113(23):5811-5818 Jun 4 2009) установили, что PD-1 участвует в отрицательной регуляции функции дендритных клеток (ДК) при ответе врожденной иммунной системы на инфекцию Listeria monocytogenes. Brahmamdam et al (Delayed administration of anti-PD-1 antibody reverses immune dysfunction and improves survival during sepsis. Journal of Leukocyte Biology vo. 88, no. 2 233-240, August 2010) сообщили, что антитело к PD-1, которое вводили через 24 ч после сепсиса, предотвращало сепсис-индуцированное истощение лимфоцитов и ДК, повышало Bcl-xL, блокировало апоптоз и улучшало выживаемость. Как сообщалось, взаимодействия TIM-3:галектин-9 опосредуют истощение Т-клеток и опосредуют врожденный и адаптивный иммунный ответ на инфекцию Mycobacterium tuberculosis (Jayaraman et al., The Journal of Immunology 2012, 188, 70.6).
Примеры вирусных инфекций, которые можно лечить, включают инфекцию вирусом гриппа, вирусом кори, вирусом гепатита В (HBV), вирусом гепатита С (ВГС), вирусом иммунодефицита человека (ВИЧ), вирусом лимфоцитарного хориоменингита (LCMV), вирусом простого герпеса и вирусом папилломы человека.
Хронические вирусные инфекции, такие как те, которые вызваны ВГС, ВГВ и ВИЧ, обычно включают механизмы ускользания от иммунного ответа. Было установлено, что экспрессия PD-1 и TIM-3 коррелирует с нарушенными ответами Т-клеток на вирус гепатита С (ВГС) (McMahan et al., The Journal of Clinical Investigation Vol. 120, No. 12 p 4546-4557, December 2010). McMahan et al (выше) установили, что при инфекции ВГС уровень экспрессии обоих белков, TIM-3 и PD-1, на ВГС-специфичных ЦТЛ предшествовал развитию вирусной персистенции, это факт обеспечивает прогностическую информацию. Barber et al. (Nature Vol 439, No. 9 p 682-687 Feb 2006) установили, что PD-1 активируется при хронической вирусной инфекции. В данной работе установлено, что у мышей, инфицированных LCMV, блокирование ингибиторного пути PD-1/PD-L1 оказывает положительное влияние на CD8 Т-клетки, восстанавливая их способность к пролиферации, секреции цитокинов, лизису инфицированных клеток и снижению вирусной нагрузки. Экспрессия PD-1 также повышалась при ВИЧ-инфекции (Said et al., Nature Medicine Vol. 16, No. 4 p 452-460 April 2010). Блокирование взаимодействия между PD-1 и PD-L1 способствовало элиминации вируса и улучшало функцию Т-клеток в животных моделях хронической вирусной инфекции (Said et al., выше).
Примеры грибковых инфекций, которые можно лечить, включают инфекции Alternaria sp, Aspergillus sp, Candida sp и Histoplasma sp. Грибковая инфекция может представлять собой грибковый сепсис или гистоплазмоз.
Chang et al (Blockade of the negative co-stimulatory molecules PD-1 and CTLA-4 improves survival in primary and secondary fungal sepsis. Critical Care 2013, 17:R85) сообщили, что антитело к PD1 было весьма эффективным в повышении выживаемости при первичном и вторичном грибковом сепсисе.  et al (The PD-1/PD-L costimulatory pathway critically affects host resistance to the pathogenic fungus Histoplasma capsulatum PNAS vol. 105, no. 7, p 2658-2663, 19 Feb 2008) сообщили, что антитела к PD-1 значительно увеличили выживаемость мышей, инфицированных Histoplasma capsulatum. Следовательно, важность истощения Т-клеток при развитии грибковой инфекции хорошо установлена.
et al (The PD-1/PD-L costimulatory pathway critically affects host resistance to the pathogenic fungus Histoplasma capsulatum PNAS vol. 105, no. 7, p 2658-2663, 19 Feb 2008) сообщили, что антитела к PD-1 значительно увеличили выживаемость мышей, инфицированных Histoplasma capsulatum. Следовательно, важность истощения Т-клеток при развитии грибковой инфекции хорошо установлена.
Примеры паразитарных инфекций, которые можно лечить, включают инфекцию видами Plasmodium (например, Plasmodium falciparum, Plasmodium yoeli, Plasmodium ovale, Plasmodium vivax или Plasmodium chabaudi chabaudi). Паразитарные инфекции могут представлять собой заболевание, такое как малярия, лейшманиоз и токсоплазмоз.
Было установлено, что инфицирование людей Plasmodium falciparum приводит к более высокой экспрессии PD-1 и истощению Т-клеток у мышей (Butler et al., Nature Immunology Vol. 13, No. 12, p 188-195 February 2012). Блокирование PD-L1 и LAG-3 с использованием моноклональных антител к PD-L1 и LAG-3 в условиях in vivo способствует восстановлению функции CD4+ Т-клеток, увеличению количества фолликулярных хелперных Т-клеток, В-клеток зародышевых центров и плазмобластов, усилению выработки защитных антител и быстрому устранению патогена на стадии распространения малярии в кровеносном русле у мышей. Также было установлено, что указанные антитела блокируют развитие хронической инфекции (Butler et al., выше).
Рак
Рак может представлять собой любую нежелательную пролиферацию клеток (или любое заболевание, проявляющееся нежелательной пролиферацией клеток), новообразование или опухоль, или повышенный риск или предрасположенность к нежелательной пролиферации клеток, новообразованию или опухоли. Рак может быть доброкачественным или злокачественным и может быть первичным или вторичным (метастатическим). Новообразование или опухоль может представлять собой любое аномальное размножение или пролиферацию клеток и может располагаться в любой ткани. Примеры тканей включают надпочечники, мозговое вещество надпочечников, анус, аппендикс, мочевой пузырь, кровь, кость, костный мозг, мозг, молочную железу, слепую кишку, центральную нервную систему (включая и за исключением головного мозга), мозжечок, шейку матки, толстую кишку, двенадцатиперстную кишку, эндометрий, эпителиальные клетки (например, эпителий почек), желчный пузырь, пищевод, глиальные клетки, сердце, подвздошную кишку, тощую кишку, почки, слезную железу, гортань, печень, легкие, лимфу, лимфатический узел, лимфобласты, максиллу, средостение, брыжейку, миометрий, носоглотку, сальник, ротовую полость, яичник, поджелудочную железу, околоушную железу, периферическую нервную систему, брюшину, плевру, предстательную железу, слюнную железу, сигмовидную кишку, кожу, тонкую кишку, мягкие ткани, селезенку, желудок, семенники, тимус, щитовидную железу, язык, миндалины, трахею, матку, вульву, лейкоциты.
Опухоли, подлежащие лечению, могут представлять собой опухоли нервной системы или опухоли других систем. Опухоли нервной системы могут представлять собой опухоли центральной или периферической нервной системы, например, глиому, менингиому, медуллобластому, нейрофиброму, эпендимому, Шванному, нейрофибросаркому, астроцитому и олигодендроглиому. Разновидности рака/опухоли системы, отличной от нервной системы, могут возникать в любой другой ткани, отличной от нейрональной ткани, примеры включают меланому, мезотелиому, лимфому, миелому, лейкемию, неходжкинскую лимфому (НХЛ), лимфому Ходжкина, хронический миелолейкоз (ХМЛ), острый миелоидный лейкоз (ОМЛ), миелодиспластический синдром (МДС), кожную Т-клеточную лимфому (CTCL), хронический лимфоцитарный лейкоз (ХЛЛ), гепатому, плоскоклеточную карциному, карциному предстательной железы, рак молочной железы, рак легких, рак толстой кишки, рак яичников, рак поджелудочной железы, рак тимуса, НМРЛ, гемобластоз и саркому.
Согласно некоторым вариантам реализации настоящего изобретения рак представляет собой один или более из рака легкого, рака почек и рака мочевого пузыря.
Терапия на основе адоптивного переноса Т-клеток
Терапия на основе адоптивного переноса Т-клеток обычно относится к процессу, при котором у субъекта удаляют лейкоциты, как правило, путем отбора образца крови, из которого лейкоциты выделяют, размножают в условиях in vitro или ex vivo и возвращают этому же самому субъекту или другому субъекту. Лечение, как правило, направлено на увеличение количества/концентрации активной формы требуемой популяции Т-клеток у субъекта. Указанное лечение может принести пользу пациентам, страдающим истощением Т-клеток.
Антитела, способные блокировать механизм истощения Т-клеток или обращать его, обеспечивают средство повышения активности Т-клеток и усиления пролиферации Т-клеток.
Соответственно, согласно другому аспекту настоящего изобретения предложен способ размножения популяции Т-клеток, в котором Т-клетки приводят в контакт с антителом, антигенсвязывающим фрагментом или полипептидом в соответствии с настоящим изобретением в условиях in vitro или ex vivo.
Способ может дополнительно содержать одну или более из следующих стадий: отбор образца крови у субъекта; выделение Т-клеток из образца крови; культивирование Т-клеток в условиях in vitro или ex vivo (на этом этапе Т-клетки могут вступать в контакт с антителом, антигенсвязывающим фрагментом или полипептидом), сбор размноженной популяции Т-клеток; смешивание Т-клеток с адъювантом, разбавителем или носителем; введение размноженных Т-клеток субъекту.
Соответственно, согласно некоторым аспектам настоящего изобретения предложен способ лечения субъекта с нарушением функционирования Т-клеток, причем указанный способ включает получение образца крови от субъекта, нуждающегося в лечении, культивирование Т-клеток, полученных из образца крови в присутствии антитела, антигенсвязывающего фрагмента или полипептида в соответствии с настоящим изобретением так, чтобы размножить популяцию Т-клеток, сбор размноженных Т-клеток, а также введение размноженных Т-клеток субъекту, нуждающемуся в лечении.
Т-клетки могут быть получены от субъекта, нуждающегося в лечении, и могут быть выделены и/или очищены. Они могут представлять собой популяции CD4+ и/или CD8+ Т-клеток. Т-клетки могут представлять собой популяцию Т-клеток, испытывающих истощение, и необязательно могут иметь повышенную экспрессию PD-1.
Во время культивирования Т-клетки могут быть приведены в контакт с антителом, антигенсвязывающим фрагментом или полипептидом в условиях и в течение периода времени, достаточного для того чтобы обеспечить размножение Т-клеток до желаемого количества клеток. После соответствующего периода времени Т-клетки могут быть собраны, необязательно концентрированы, и могут быть смешаны с подходящим носителем, адъювантом или разбавителем и возвращены в организм субъекта. Субъект может проходить один или более этапов указанной терапии.
Способы размножения Т-клеток хорошо известны в данной области техники, например, такие как те, которые описаны в работах Kalamasz et al., J Immunother 2004 Sep-Oct; 27(5):405-18; Montes et al., Clin Exp Immunol 2005 Nov;142(2):292-302;  and Greenburg Nature Protocols 9 p 950-966 27 March 2014; Trickett and Kwan Journal of Immunological Methods Vol. 275, Issues 1-2, 1 April 2003, p 251-255; Butler et al PLoSONE 7(1) 12 Jan 2012.
and Greenburg Nature Protocols 9 p 950-966 27 March 2014; Trickett and Kwan Journal of Immunological Methods Vol. 275, Issues 1-2, 1 April 2003, p 251-255; Butler et al PLoSONE 7(1) 12 Jan 2012.
Одновременное или последовательное введение
Композиции можно вводить по отдельности или в комбинации с другими способами лечения, одновременно или последовательно, в зависимости от состояния, подлежащего лечению.
В настоящем документе антитело, антигенсвязывающий фрагмент или полипептид согласно настоящему изобретению и противоинфекционный агент или химиотерапевтический агент (терапевтический агент) могут быть введены одновременно или последовательно.
Согласно некоторым вариантам реализации настоящего изобретения лечение с использованием антитела, антигенсвязывающего фрагмента или полипептида согласно настоящему изобретению может сопровождаться химиотерапией.
Одновременное введение относится к совместному введению антитела, антигенсвязывающего фрагмента или полипептида и терапевтического агента, например, в виде фармацевтической композиции, содержащей оба агента (комбинированный препарат), или непосредственно друг за другом и необязательно с помощью одного и того же способа введения, например, через одну и ту же артерию, вену или другой кровеносный сосуд.
Последовательное введение относится к введению одного из антитела, антигенсвязывающего фрагмента или полипептида или терапевтического агента, за которым следует введение другого агента через заданный интервал времени. Введение двух агентов одним и тем же путем не требуется, хотя в некоторых вариантах реализации агенты вводят одним и тем же путем. Временной интервал может быть любым временным интервалом.
Противоинфекционные агенты
При лечении инфекции антитело, антигенсвязывающий фрагмент или полипептид согласно настоящему изобретению можно вводить в комбинации с противоинфекционным агентом, как описано выше. Противоинфекционный агент может представлять собой агент, который, как известно, направлен против микроорганизма или вируса, вызывающего инфекцию.
Подходящие противоинфекционные агенты включают антибиотики (такие как пенициллины, цефалоспорины, рифамицины, липиармицины, хинолоны, сульфонамиды, макролиды, линкозамиды, тетрациклины, циклические липопептиды, глицилциклины, оксазолидиноны и липиармицины), противовирусные агенты (такие как ингибиторы обратной транскриптазы, ингибиторы интегразы, ингибиторы транскрипционного фактора, антисмысловые и миРНК-агенты и ингибиторы протеазы), противогрибковые агенты (такие как полиены, имидиазолы, триазолы, тиазолы, аллиламины и эхинокандины) и противопаразитарные агенты (такие как антинематодные агенты, антицестодные агенты, антитрематодные агенты, антиамебные агенты и антипротозойные агенты).
Химиотерапия
Химиотерапия относится к лечению рака с использованием лекарственного препарата или ионизирующего излучения (например, лучевая терапия с использованием рентгеновских лучей или γ-лучей). Согласно предпочтительным вариантам реализации настоящего изобретения химиотерапия относится к лечению с использованием лекарственного препарата. Лекарственный препарат может представлять собой химическое соединение, например, низкомолекулярный лекарственный препарат, антибиотик, интеркалятор ДНК, ингибитор белка (например, ингибитор киназы) или биологический агент, например, антитело, фрагмент антитела, аптамер нуклеиновой кислоты или пептида, нуклеиновую кислоту (например, ДНК, РНК), пептид, полипептид или белок. Лекарственный препарат может быть изготовлен в виде фармацевтической композиции или лекарственного средства. Состав может содержать один или более лекарственных препаратов (например, один или более активных агентов) совместно с одним или более фармацевтически приемлемыми разбавителями, вспомогательными веществами или носителями.
Лечение может включать введение более чем одного лекарственного препарата. Лекарственный препарат можно вводить по отдельности или в комбинации с другими способами лечения, одновременно или последовательно, в зависимости от состояния, подлежащего лечению. Например, химиотерапия может представлять собой совместную терапию, включающую введение двух лекарственных препаратов, один или более из которых могут быть предназначены для лечения рака.
Химиотерапия может быть введена с помощью одного или более путей введения, например, парентерального, внутривенного, перорального, подкожного, внутрикожного или внутриопухолевого пути введения.
Химиотерапия может быть введена в соответствии со схемой лечения. Схема лечения может представлять собой заранее определенное расписание, план, схему или график введения химиотерапии, который может быть составлен с помощью врача или практикующего врача и может быть адаптирован для пациента, нуждающегося в лечении.
Схема лечения может содержать указания, касающиеся одного или более из: типа химиотерапии для введения пациенту; дозы каждого лекарственного препарата или облучения; временного интервала между введениями; продолжительности каждого цикла лечения; количества и характера любых перерывов в лечении, если таковые имеются и т.д. Для совместной терапии может быть предусмотрена единая схема лечения, в которой указано то, как каждый лекарственный препарат должен быть введен.
Химиотерапевтические препараты и биопрепараты могут быть выбраны из:
- алкилирующих агентов, таких как цисплатин, карбоплатин, мехлорэтамин, циклофосфамид, хлорамбуцил, ифосфамид;
- пуриновых или пиримидиновых антиметаболитов, таких как азатиопурин или меркаптопурин;
- алкалоидов и терпеноидов, таких как алкалоиды барвинка (например, винкристин, винбластин, винорелбин, виндезин), подофиллотоксин, этопозид, тенипозид, таксаны, такие как паклитаксел (таксол™), доцетаксел;
- ингибиторов топоизомеразы, таких как ингибиторы топоизомеразы типа I камптотецины иринотекан и топотекан, или ингибиторы топоизомеразы типа II амсакрин, этопозид, этопозида фосфат, тенипозид;
- противоопухолевых антибиотиков (например, антрациклиновых антибиотиков), таких как дактиномицин, доксорубицин (адриамицин™), эпирубицин, блеомицин, рапамицин;
- агентов на основе антител, таких как антитело к TIM-3, антитело к CTLA-4, антитело к LAG-3, антитело к 4-1ВВ, антитело к GITR, антитело к CD27, антитело к BLTA, антитело к ОХ40, антитело к VEGF, антитело к TNF-α, антитело к ИЛ-2, антитело к GpIIb/IIIa, антитело к CD-52, антитело к CD20, антитело к RSV, антитело к HER2/Neu (erbB2), антитело к рецептору TNF, антитело к ЭФРР, моноклональные антитела или фрагменты антител, например: цетуксимаб, панитумумаб, инфликсимаб, базиликсимаб, бевацизумаб (авастин®), абциксимаб, даклизумаб, гемтузумаб, алемтузумаб, ритуксимаб (мабтера®), паливизумаб, трастузумаб, этанерцепт, адалимумаб, нимотузумаб;
- ингибиторов EGFR, таких как эрлотиниб, цетуксимаб и гефитиниб;
- антиангиогенных агентов, таких как бевацизумаб (авастин®);
- противораковых вакцин, таких как Sipuleucel-T (провенж®);
Согласно одному варианту реализации настоящего изобретения химиотерапевтический агент представляет собой антитело к TIM-3, антитело к CTLA-4, антитело к LAG-3, антитело к 4-1 ВВ, антитело к GITR, антитело к CD27, антитело к BLTA, антитело к ОХ40, антитело к VEGF, антитело к TNF-α, антитело к ИЛ-2, антитело к GPIIb/IIIa, антитело к CD-52, антитело к CD20, антитело к RSV, антитело к HER2/Neu (erbB2), антитело к рецептору TNF, антитело к EGFR или другое антитело. Согласно некоторым вариантам реализации настоящего изобретения химиотерапевтический агент представляет собой ингибитор иммунной контрольной точки или костимулирующей молекулы.
Другие химиотерапевтические лекарственные средства могут быть выбраны из: 13-цис-ретиноевой кислоты, 2-хлордезоксиаденозина, 5-азацитидина, 5-фторурацила, 6-меркаптопурина, 6-тиогуанина, абраксана, аккутана®, актиномицина-D адриамицина®, адруцила®, афинитора®, агрилина®, Ала-Корта®, алдеслейкина, алемтузумаба, алимта, алитретиноина, алкабан-AQ®, алкерана®, полностью транс-ретиноевой кислоты, альфа-интерферона, алтретамина, аметоптерина, амифостина, аминоглютетимида, анагрелида, анандрона®, анастрозола, арабинозилцистеина, аранеспа®, аредиа®, аримидекса®, аромасина®, арранона®, триоксида мышьяка, аспарагиназы, ATRA авастина®, азацитидина, BCG, BCNU, бендамустина, бевацизумаба, бексаротена, бексара®, бикалутамида, BiCNU, бленоксана®, блеомицина, бортезомиба, бусульфана, бусульфекса®, кальция лейковорина, кампата®, камптосара®, камптотецина-11, капецитабина, карака™, карбоплатина, кармустина, касодекса®, СС-5013, CCI-779, CCNU, CDDP, CeeNU, церубидина®, цетуксимаба, хлорамбуцила, цисплатина, цитроворум фактора, кладрибина, кортизона, космегена®, СРТ-11, циклофосфамида, цитадрена®, цитарабина (цитозар-U®), цитоксана®, дакогена, дактиномицина, дарбепоэтина альфа, дазатиниба, дауномицина, даунорубицина, даунорубицина гидрохлорида, липосомального даунорубицина, дауноксома®, декадрона, децитабина, Дельта-кортефа®, дельтасона®, денилейкина, дефтитокса, депоцита™, дексаметазона, дексаметазона ацетата, дексаметазона фосфата натрия, дексазона, дексразоксана, DHAD, DIC, диодекса, доцетаксела, доксила®, доксорубицина, липосомального доксорубицина, дроксиа™, DTIC, DTIC-дом®, дюралона®, элигарда™, элленса™, флоксатина™, элспара®, эмцита®, эпирубицина, эпоэтина альфа, эрбитукса, эрлотиниба, L-аспарагиназы Erwinia, эстрамустина, этиола, этопофоса®, этопозида, этопозида фосфата, эулексина®, эверолимуса, эвиста®, экземестана, фаслодекса®, фемара®, филграстита, флоксуридина, флудара®, флударабина, фтороплекса®, фторурацила, флуоксиместерона, флутамида, фолиновой кислоты, FUDR®, фулвестранта, гефитиниба, гемцитабина, гемтузумаба озогамицина, гливека™, глиадела® Wafer, гозерелина, Г-КСФ, ГМ-КСФ, герцептина®, гексадрола, гексалена®, гексаметилмеламина, НММ, гикамтина®, гидреа®, гидрокорта ацетата®, гидрокортизона, гидрокортизона фосфата натрия, гидрокортизона сукцината натрия, гидрокортона фосфата, гидроксимочевины, ибритумомаба, ибритумомаба тиуксетана, идамицина®, идарубицина, ифекса®, ИФН-альфа, ифосфамида, ИЛ-11, ИЛ-2, иматиниба мезилата, имидазола карбоксамида, интерферона-альфа, интерферона-альфа-2b (ПЭГ-конъюгат), интерлейкина-2, интерлейкина-11, интрона А® (интерферона-альфа-2b), иресса®, иринотекана, изотретиноина, иксабепилона, иксемпра™, кидроласа, ланакорта®, лапатиниба, L-аспарагиназы, LCR, леналидомида, летрозола, лейковорина, лейкерана, лейкина™, леупролида, лейрокристина, лейстатина™, липосомального Ara-C, жидкого преда®, ломустина, L-PAM, L-сарколизина, люпрона®, люпрона-депо®, матулана®, максидекса, мехлорэтамина, мехлорэтамина гидрохлорида, медралона®, медрола®, мегаса, мегестрола, мегестролацетата, мелфалана, меркаптопурина, месна, меснекса, метотрексата, метотрексата натрия, метилпреднизолона, метикортена®, митомицина, митомицина-С, митоксантрона, М-преднизола®, МТС, МТХ, мустаргена®, мустина, мутамицина®, милерана®, милоцела™, милотарга®, навелбина®, неларабина, неосара®, нейласта™, неймега®, нейпогена®, нексавара®, ниландрона®, нилутамида, нипента®, хлорметина, новалдекса®, новантрона®, октреотида, октреотида ацетата, онкоспара®, онковина, онтака, онксала, опревелкина, орапреда, оразона, оксалиплатина, паклитаксела, связанного с белком паклитаксла, памидроната, панитумумаба, панретина®, параплатина®, педиапреда®, ПЭГ-интерферона, пегаспаргаза, пегфилграстима, ПЭГ-интрона™, ПЭГ-L-аспарагиназы, пеметрекседа, пентостатина, мелфалана, платинола®, платинол-AQ®, преднизолона, преднизона, прелона®, прокарбазина, прокрита®, пролейкина®, пролифепроспана 20 с кармустин-имплантом, пуринетола®, ралоксифена, ревлимида®, ревматрекса®, ритуксана®, ритуксимаба, роферона-А® (интерферона альфа-2а), рубекса®, рубидомицина гидрохлорида, сандостатина®, сандостатина LAR®, саргаромостима, Солу-кортеф®, Солу-медрол®, сорафениба, сприцела™, STI-571, стрептозоцина, SU11248, санитиниба, сутента®, тамоксифена, тарцева®, таргретина®, таксола®, таксотера®, темодара®, темозоломида, темсиролимуса, тенипозида, TESPA, талидомида, таломида®, TheraCys®, тиогуанина, тиогуанина таблоида®, тиофосфоамида, тиоплекса®, тиотепа, TICE®, топосара®, топотекана, торемифена, торисела®, тозитумомаба, трастузумаба, треанда®, третиноина, трексола™, тризенокса®, TSPA, TYKERB®, VCR, вектибиска™, велбана®, велкада®, вепезида®, веханоида®, виадура™, видаза®, винбластина, винбластина сульфата, винкасара Pfs®, винкристина, винорелбина, винорелбина тартрата, VLB, VM-26, вориностата, VP-16, вумона®, кселода®, заносара®, зевалина™, зинекарда®, золадекса®, золедроновой кислоты, золинза, зомета®.
Пути введения
Антитела, антигенсвязывающие фрагменты, полипептиды и другие терапевтические агенты, лекарственные средства и фармацевтические композиции в соответствии с аспектами настоящего изобретения могут быть изготовлены для введения несколькими путями, включая, но не ограничиваясь ими, парентеральный, внутривенный, внутриартериальный, внутримышечный, подкожный, внутрикожный, внутриматочный и оральный пути введения. Антитела, антигенсвязывающие фрагменты, полипептиды и другие терапевтические агенты могут быть изготовлены в жидкой или твердой форме. Жидкие составы могут быть изготовлены для введения путем инъекции в выбранную область тела человека или животного.
Схема дозирования
В настоящем изобретении может быть предложено несколько доз антитела, антигенсвязывающего фрагмента или полипептида. Одна или более или каждая из доз может сопровождаться одновременным или последовательным введением другого терапевтического агента.
Несколько доз могут быть разделены заданным временным интервалом, который может быть выбран из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или 31 дня или 1, 2, 3, 4, 5 или 6 месяцев. Например, дозы могут быть введены один раз каждые 7, 14, 21 или 28 дней (плюс или минус 3, 2 или 1 день).
Наборы
Согласно некоторым аспектам настоящего изобретения предложен набор компонентов. Согласно некоторым вариантам реализации набор может включать по меньшей мере один контейнер, содержащий заранее определенное количество антитела, антигенсвязывающего фрагмента или полипептида. Набор может обеспечивать антитело, антигенсвязывающий фрагмент или полипептид в форме лекарственного средства или фармацевтической композиции и может быть обеспечен вместе с инструкциями для введения пациенту для лечения определенного заболевания или состояния. Антитело, антигенсвязывающий фрагмент или полипептид может быть изготовлен так, чтобы быть подходящим для инъекции или инфузии в опухоль или кровь.
Согласно некоторым вариантам реализации набор может дополнительно содержать по меньшей мере один контейнер, содержащий заранее определенное количество другого терапевтического агента (например, противоинфекционного агента или химиотерапевтического агента). Согласно указанным вариантам реализации набор может также содержать второе лекарственное средство или фармацевтическую композицию так, что два лекарственных средства или фармацевтические композиции могут быть введены одновременно или по отдельности, чтобы обеспечить комбинированное лечение конкретного заболевания или состояния. Терапевтический агент также может быть изготовлен в форме, пригодной для инъекции или инфузии в опухоль или кровь.
Субъекты
Субъект, подлежащий лечению, может представлять собой любое животное или человека. Субъект предпочтительно представляет собой млекопитающее, более предпочтительно человека. Субъект может быть млекопитающим, отличным от человека, но более предпочтительно человеком. Субъект может быть мужского или женского пола. Субъект может быть пациентом. Субъекту мог быть поставлен диагноз заболевания или состояния, требующего лечения, или у субъекта подозревали присутствие такого заболевания или состояния.
Экспрессия белка
Методики молекулярной биологии, подходящие для получения полипептидов в соответствии с настоящим изобретением в клетках, хорошо известны в данной области техники, например, такие как те, которые описаны в Sambrook et al., Molecular Cloning: A Laboratory Manual, New York: Cold Spring Harbor Press, 1989.
Полипептид может быть экспрессирован из нуклеотидной последовательности. Нуклеотидная последовательность может содержаться в векторе, присутствующем в клетке, или может быть включена в геном клетки.
В настоящей заявке «вектор» представляет собой олигонуклеотидную молекулу (ДНК или РНК), используемую в качестве носителя для переноса экзогенного генетического материала в клетку. Вектор может быть вектором экспрессии для экспрессии генетического материала в клетке. Подходящие векторы могут включать промоторную последовательность, функционально связанную с нуклеотидной последовательностью, кодирующей генную последовательность, подлежащую экспрессии. Вектор также может содержать кодон терминации и энхансеры экспрессии. Любые подходящие векторы, промоторы, энхансеры и кодоны терминации, известные в данной области техники, могут быть использованы для экспрессии полипептидов из вектора согласно настоящему изобретению. Подходящие векторы включают плазмиды, бинарные векторы, вирусные векторы и искусственные хромосомы (например, искусственные хромосомы дрожжей).
В настоящем описании термин «функционально связанный» может включать ситуацию, когда выбранная нуклеотидная последовательность и регуляторная нуклеотидная последовательность (например, промотор и/или энхансер) ковалентно связаны так, чтобы экспрессия нуклеотидной последовательности находилась под влиянием или контролем регуляторной последовательности (образуя тем самым кассету экспрессии). Следовательно, регуляторная последовательность функционально связана с выбранной нуклеотидной последовательностью, если регуляторная последовательность способна осуществлять транскрипцию нуклеотидной последовательности. При необходимости полученный транскрипт может быть транслирован в желаемый белок или полипептид.
Любая клетка, подходящая для экспрессии полипептидов, может быть использована для получения пептидов в соответствии с настоящим изобретением. Клетка может представлять собой прокариотическую или эукариотическую клетку. Подходящие прокариотические клетки включают E. coli. Примеры эукариотических клеток включают дрожжевую клетку, растительную клетку, клетку насекомого или клетку млекопитающего. В некоторых случаях клетка не является прокариотической клеткой, поскольку некоторые прокариотические клетки не способны обеспечить некоторые посттрансляционные модификации в отличие от эукариотических клеток. Помимо этого, в эукариотических клетках могут быть получены очень высокие уровни экспрессии, и белки могут быть легко выделены из эукариотических клеток с использованием подходящих меток. Специфичные плазмиды могут быть использованы для усиления секреции белка в среду.
Способы получения представляющего интерес полипептида могут включать культивирование или ферментацию клетки, модифицированной для экспрессии полипептида. Культивирование или ферментацию можно проводить в биореакторе, снабженном соответствующим источником питательных веществ, воздуха/кислорода и/или факторов роста. Секретируемые белки могут быть собраны путем отделения культуральной среды/ферментационного бульона от клеток, экстрагирования белкового содержимого и отделения отдельных белков для выделения секретируемого полипептида. Методики культивирования, ферментации и разделения хорошо известны специалистам в данной области техники.
Биореакторы включают один или более сосудов, в которых могут быть культивированы клетки. Культивирование в биореакторе может происходить непрерывно, с непрерывным поступлением реагентов и непрерывным отбором культивируемых клеток из реактора. В другом варианте культивирование можно осуществлять в отъемно-доливном режиме. Биореактор проверяет и контролирует условия окружающей среды, такие как рН, содержание кислорода, скорость поступления и оттока в биореакторе и перемешивание внутри сосуда так, чтобы обеспечить оптимальные условия культивируемым клеткам.
После культивирования клеток, которые экспрессируют представляющий интерес полипептид, указанный полипептид предпочтительно выделяют. Может быть использован любой подходящий способ отделения полипептидов/белков от клеточной культуры, известный в данной области техники. Для того чтобы выделить представляющий интерес полипептид/белок из культуры сначала может потребоваться отделение культивируемых клеток от среды, содержащей представляющий интерес полипептид/белок. Если представляющий интерес полипептид/белок секретируется из клеток, клетки могут быть отделены от культуральной среды, которая содержит секретируемый полипептид/белок, путем центрифугирования. Если представляющий интерес полипептид/белок накапливается внутри клетки, то необходимо разрушить клетки до центрифугирования, например, используя ультразвуковую обработку, быстрое замораживание-оттаивание или осмотический лизис. Центрифугирование позволит получить осадок, содержащий культивируемые клетки, или фрагменты культивируемых клеток, и культуральную среду, содержащую супернатант, и представляющий интерес полипептид/белок.
Желательным может быть последующее выделение представляющего интерес полипептида/белка из супернатанта или культуральной среды, которая может содержать другие белковые и небелковые компоненты. Общий подход к отделению полипептидных/белковых компонентов от супернатанта или культуральной среды представляет собой осаждение. Полипептиды/белки, имеющие различную растворимость, осаждаются при различных концентрациях осаждающего агента, такого как сульфат аммония. Например, при низких концентрациях осаждающего агента выделяют водорастворимые белки. Следовательно, добавляя увеличивающиеся концентрации осаждающего агента можно различать белки с различной растворимостью. В дальнейшем для удаления сульфата аммония из отделенных белков можно использовать диализ.
Другие способы различения разных полипептидов/белков известны в данной области техники, например, ионообменная хроматография и эксклюзионная хроматография. Подходящие способы могут быть использованы в качестве альтернативы осаждению или могут быть впоследствии осуществлены для осаждения.
После выделения представляющего интерес полипептида/белка из культуры может потребоваться концентрирование белка. Несколько способов концентрирования представляющего интерес белка известны в данной области техники, например, ультрафильтрация или лиофилизация.
Определение идентичности последовательностей
Выравнивание с целью определения процента идентичности аминокислотных или нуклеотидных последовательностей может быть достигнуто различными способами, известными специалисту в данной области техники, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение ClustalW 1.82. T-coffee или Megalign (DNASTAR). При использовании указанного программного обеспечения предпочтительно применяют параметры по умолчанию, например, для штрафа за внесение пропуска и штрафа за продление пропуска. По умолчанию параметры ClustalW 1.82: штраф за внесение пропуска в последовательность белка = 10,0, штраф за продление пропуска в последовательности белка = 0,2, белковая матрица = Gonnet, белок/ДНК ENDGAP = -1, белок/ДНК GAPDIST = 4.
Настоящее изобретение включает комбинацию описанных аспектов и предпочтительных признаков, за исключением случаев, когда такая комбинация явно недопустима или явно исключена.
Используемые в настоящем документе заголовки разделов предназначены исключительно для организационных целей и не должны истолковываться как ограничивающие объект изобретения.
Аспекты и варианты реализации настоящего изобретения далее будут проиллюстрированы, например, со ссылкой на прилагаемые чертежи. Другие аспекты и варианты реализации будут очевидны для специалистов в данной области техники. Все документы, упомянутые в тексте настоящего описания, включены в настоящую заявку посредством ссылки.
В тексте настоящего описания, включая нижеследующую формулу изобретения, если из контекста не следует иное, слово «содержать» и варианты, такие как «содержит» и «содержащий», будут подразумевать включение указанного целого числа или этапа или группы целых чисел или этапов, но не исключение любого другого целого числа или этапа или группы целых чисел или этапов.
Следует отметить, что в настоящем описании и прилагаемой формуле изобретения формы единственного числа «a», «an» и «the» включают множественное число, если из контекста явно не следует иное. Диапазоны могут быть представлены в настоящем документе как от «приблизительно» одного конкретного значения и/или до «приблизительно» другого конкретного значения. В том случае, если представлен такой диапазон, другой вариант реализации включает диапазон от одного конкретного значения и/или до другого конкретного значения. Аналогичным образом, если значения представлены в виде приближений, то использование антецедента «приблизительно» будет указывать на то, что конкретное значение образует другой вариант реализации.
Краткое описание чертежей
Варианты реализации и эксперименты, иллюстрирующие принципы настоящего изобретения, далее будут описаны со ссылкой на прилагаемые чертежи, на которых:
Фигура 1. Последовательности вариабельной области легкой цепи для клонов антитела к PD-1, A3, А10, В6, С4, D4, E1, F2, G1, G2, G10, Н4, Н9 (IgG4 человека). CDR подчеркнуты и показаны отдельно.
Фигура 2. Последовательности вариабельной области тяжелой цепи для клонов антитела к PD-1, A3, А10, В6, С4, D4, E1, F2, G1, G2, G10, Н4, Н9 (IgG4 человека). CDR подчеркнуты и показаны отдельно.
Фигура 3. Таблица, в которой представлены последовательности CDR легкой цепи и тяжелой цепи для клонов антитела к PD-1, A3, А10, В6, С4, D4, E1, F2, G1, G2, G10, Н4, Н9.
Фигура 4. Нуклеотидные последовательности и кодируемые аминокислотные последовательности вариабельных областей тяжелой и легкой цепей клонов антитела к PD-1, A3, А10, оптимизированного А10, В6, оптимизированного В6, С4, оптимизированного С4, D4, E1, F2, G1, G2, G10, Н4, оптимизированного Н4, Н9 (IgG4 человека).
Фигура 5. Таблица, в которой представлены величины аффинности связывания (Kd, нМ) клонов A3, А10, В6, С4, D4, E1, F2, G1, G2, G10, Н4 и Н9, и контрольных антител к PD-1 человека, ниволюмаба и ламбролизумаба.
Фигура 6. Диаграмма, на которой представлены результаты оценки связывания антител к PD-1 человека, A3, А10, ниволюмаба и ламбролизумаба, с активированными Т-клетками.
Фигура 7. Диаграмма, на которой представлены результаты оценки связывания антител к PD-1 человека, А10, В6, С4, D4, E1, F2, G1, G2, G10, Н4 и Н9, ниволюмаба и ламбролизумаба, с активированными Т-клетками.
Фигура 8. Диаграмма, показывающая способность клонов В6, С4, D4, E1, F2, G1, G2, G10, Н4 и Н9 вступать в реакцию с PD-1 человека, PD-1 макаки-резуса и CTLA-4 человека.
Фигура 9. Диаграмма, на которой представлены результаты оценки пролиферации аллогенных CD4+ Т-клеток для истощенных Т-клеток в ответ на антитела A3, А10, ниволюмаб, ламбролизумаб.
Фигура 10. Диаграмма, на которой представлены результаты оценки пролиферации аллогенных CD4+ Т-клеток для истощенных Т-клеток в ответ на антитела А10, В6, С4, D4, E1, F2, G1, G2, G10, Н4, Н9, ниволюмаб, ламбролизумаб.
Фигура 11. Диаграмма, на которой представлены уровни секреции ИФН-γ истощенными Т-клетками в ответ на антитела A3, А10, ниволюмаб, ламбролизумаб.
Фигура 12. Диаграмма, на которой представлены уровни секреции ИФН-γ истощенными Т-клетками в ответ на антитела А10, В6, С4, D4, E1, F2, G1, G2, G10, Н4, Н9, ниволюмаб, ламбролизумаб.
Фигура 13. Диаграмма, показывающая специфичность связывания антител A3, А10, В6, С4, D4, E1, F2, G1, G2, G10, Н4, Н9 в отношении PD-1 человека и макаки-резуса по сравнению с другим членом семейства CD28 человека (h) или мыши (m), при сопоставлении с ниволюмабом и ламбролизумабом, согласно результатам определения методом ИФА.
Фигура 14. Диаграмма, на которой представлены результаты оценки пролиферации аллогенных CD4+ Т-клеток для истощенных Т-клеток в ответ на кодон-оптимизированное антитело А10, кодон-оптимизированное антитело В6, кодон-оптимизированное антитело С4, кодон-оптимизированное антитело Н4, ниволюмаб, ламбролизумаб.
Фигура 15. Диаграмма, на которой представлены уровни секреции ИФН-γ истощенными Т-клетками в ответ на кодон-оптимизированное антитело А10, кодон-оптимизированное антитело В6, кодон-оптимизированное антитело С4, кодон-оптимизированное антитело Н4, ниволюмаб, ламбролизумаб.
Фигура 16. Диаграмма, на которой представлены уровни экспрессии маркеров истощения PD-1, PD-L1, TIM-3 и LAG-3 лимфоцитами, проникающими в опухоль легких. Приблизительно 2/3 CD4+ и CD8+ лимфоцитов в опухоли экспрессируют PD-1.
Фигура 17. Диаграмма, на которой представлены уровни секреции ИФН-γ лимфоцитами, проникающими в опухоль легких (А), после 7 дней культивирования в присутствии или в отсутствие антитела к PD-1 (первичная культура диссоциированной опухолевой ткани), (В) после проведения реакции смешанной культуры лимфоцитов в присутствии или в отсутствие антитела к PD-1.
Фигура 18. Диаграмма, на которой представлены уровни секреции ИФН-γ после культивирования мононуклеарных клеток периферической крови (МКПК) с дендритными клетками, инфицированными вирусом гриппа, в присутствии или в отсутствие антител к PD-1.
Фигура 19. Диаграмма, на которой представлены уровни экспрессии маркеров истощения PD-1, PD-L1, TIM-3, LAG-3 и CTLA4 лимфоцитами, проникающими в опухоль легких. Приблизительно 2/3 CD4+ и CD8+ лимфоцитов в опухоли экспрессируют PD-1.
Фигура 20. Диаграммы, на которых представлены уровни секреции ИФН-γ лимфоцитами, проникающими в опухоль, после реакции смешанной культуры лимфоцитов в присутствии или в отсутствие антител к PD-1 для трех пациентов. (А) Пациент №1, (В) Пациент №2, (С) Пациент №3. Представлены средние значения ± стандартное отклонение среднего для экспериментов с двумя и тремя повторами.
Фигура 21. Диаграммы, на которых представлены уровни экспрессии маркеров истощения PD-1, PD-L1, TIM-3, LAG-3 и CTLA4 (А) лимфоцитами, проникающими в опухоль почек, и (В) лимфоцитами из крови пациентов с карциномой почек. Приблизительно 2/3 CD4+ и CD8+ лимфоцитов в опухоли экспрессируют PD-1, тогда как большинство лимфоцитов МКПК не экспрессируют PD-1.
Фигура 22. Диаграммы, на которых представлены уровни секреции ИФН-γ лимфоцитами, проникающими в опухоль, после реакции смешанной культуры лимфоцитов в присутствии или в отсутствие антител к PD-1 для трех пациентов. (А) Пациент №1, (В) Пациент №2, (С) Пациент №3. Представлены средние значения ± стандартное отклонение среднего для экспериментов с двумя и тремя повторами.
Фигура 23. Диаграммы, на которых представлены уровни экспрессии маркеров истощения PD-1, PD-L1, TIM-3, LAG-3 и CTLA4 (А) лимфоцитами, проникающими в опухоль мочевого пузыря, и (В) циркулирующими в кровотоке лимфоцитами пациентов с карциномой мочевого пузыря. Большинство лимфоцитов, проникающих в опухоль, экспрессируют PD-1, тогда как только меньшая часть лимфоцитов МКПК экспрессируют PD-1.
Фигура 24. Диаграмма, на которой представлены уровни секреции ИФН-γ лимфоцитами, проникающими в опухоль, после реакции смешанной культуры лимфоцитов в присутствии или в отсутствие антител к PD-1 для одного пациента. Представлены средние значения ± стандартное отклонение среднего для экспериментов с двумя и тремя повторами.
Примеры
В нижеследующих примерах авторы настоящего изобретения описали способ выявления нуклеотидных и аминокислотных последовательностей выделенных антител или их антигенсвязывающих частей, которые специфично связываются с PD-1 человека и макак-резусов, блокируют путь передачи сигналов с участием PD-1 и восстанавливают активность истощенных Т-клеток.
Выделение антител к PD-1 человека
Антитела к PD-1 выделяли из библиотеки фагового дисплея антител человека с помощью отбора в условиях in vitro в ходе 4-х этапного биопэннинга.
Стрептавидин-конъюгированные магнитные гранулы покрывали биотинилированным PD-1 человека и использовали для выделения фагов, специфичных в отношении PD-1, с использованием магнитной сортировки. В процессе отбора были добавлены некоторые этапы для удаления потенциальных антител к биотину.
Специфичные фрагменты Fab антител первоначально выявляли с помощью ИФА с использованием PD-1 человека в качестве антигена. Первый этап скрининга для оценки клональности выполняли с помощью ДНК-типирования; последовательность подтверждали с помощью секвенирования.
Созревание аффинности
Отобранные антитела подвергали созреванию аффинности путем модификации CDR. Отбор антител, специфичных в отношении PD-1, проводили с помощью фагового дисплея. Было создано более 80 клонов с созревшей аффинностью с ~100-кратно улучшенной аффинностью. Для отбора клонов проводили исследования термостабильности. Антитела нагревали и контролировали стабильность на основе их способности связываться с PD-1 человека методом ИФА. Клоны, поддерживающие стабильность при 71°С, сохраняли для дальнейшего анализа, и их аффинность в отношении PD-1 человека измеряли с использованием биоанализатора ProteOn (Biorad). В общих чертах, PD-1 человека, связанный с Fc, иммобилизовали на сенсорной микросхеме и применяли поток антител; измеряли скорость ассоциации и диссоциации и рассчитывали сродство (Kd). Двенадцать из клонов с созревшей аффинностью обозначили A3, А10, В6, С4, D4, E1, F2, G1, G2, G10, Н4 и Н9.
Аффинность выделенных антител к PD-1
Аффинность A3, А10, В6, С4, D4, E1, F2, G1, G2, G10, Н4 и Н9 в отношении PD-1 человека измеряли с помощью поверхностного плазмонного резонанса и сравнивали с аффинностью ниволюмаба и ламбролизумаба, двух антител к PD-1, которые проходят последние этапы клинической разработки (фигура 5).
В общих чертах, PD-1 человека или мыши, связанный с Fc человека, иммобилизовали на сенсорной микросхеме, совместимой с биоанализатором Proteon XPR36 (Biorad). Затем неочищенные экстракты Fab (или контрольные антитела) выливали на чип, регистрировали и анализировали ассоциацию/диссоциацию каждого кандидата Fab и затем оценивали аффинность (Kd).
Величины аффинности A3, А10, В6, С4, D4, E1, F2, G1, G2, G10, Н4 и Н9 находятся в диапазоне от 0,1 до 0,7 нМ, тогда как величины Kd ниволюмаба и ламбролизумаба находятся в пределах 1,9 и 0,5 нМ, соответственно (фигура 5).
Характеристика антител к PD-1 человека;
Связывание с клетками, экспрессирующими PD-1
50000 Т-клеток, выделенных от здорового донора, инкубировали в присутствии 5000 дендритных клеток моноцитарного происхождения (ДК) от другого донора в течение 7 дней при 37°С. Антитела, экспрессированные в виде IgG4, инкубировали с указанными активированными Т-клетками в течение 30 минут в фосфатно-солевом буферном растворе (ФСБ). После промывки ФСБ флуоресцентномеченое вторичное антитело добавляли в течение 30 минут и затем промывали ФСБ. Клетки ресуспендировали в буфере для проточной цитометрии, и связывание антитела с клеткам контролировали с помощью проточной цитометрии (фигуры 6 и 7).
Перекрестная реактивность с PD-1 макаки-резуса
Клоны фрагментов Fab с созревшей аффинностью исследовали с помощью ИФА для распознавания PD-1 макаки-резуса. В общих чертах, планшеты для ИФА покрывали PD-1 человека или макаки-резуса в концентрации 350 нг/лунку в карбонатном буфере и затем блокировали раствором казеина. После интенсивных промывок ФСБ+твин-20 супернатанты, содержащие антитела, переносили в планшеты для ИФА в присутствии 7% молока в ФСБ. Через 90 минут инкубации при комнатной температуре с перемешиванием и интенсивными промывками добавляли антитело козы к Fab человека, конъюгированное с пероксидазой хрена (ПХ). Через час планшеты промывали и добавляли субстрат ТМВ. Реакцию останавливали с помощью 1 М HCl, и оптическую плотность измеряли при длине волны 450 нм с контролем при 670 нм (фигура 8).
Функциональная активность в условиях in vitro
Антитело к PD-1 испытывали в функциональном количественном исследовании путем измерения 2 параметров активности Т-клеток: пролиферации и секреции ИФН-γ. В общих чертах, Т-клетки выделяли у здорового донора и культивировали в течение 7 дней в присутствии дендритных клеток моноцитарного происхождения от другого донора (50000 Т-клеток/5000 ДК). Данная непрерывная стимуляция вызывает истощение Т-клеток. Антитела затем добавляли к культурам для дополнительного культивирования в течение 5 дней. Через 4 дня супернатант собирали для измерения ИФН-γ с помощью ИФА, и Т-клетки культивировали в течение 4 дней с добавлением 1 мкКю меченого тритием тимидина в течение последних 18 часов. Затем клетки собирали, и пролиферацию измеряли с помощью бета-счетчика.
Клоны A3, А10, В6, С4, D4, E1, F2, G1, G2, G10, Н4 и Н9 способны восстанавливать пролиферацию ранее истощенных Т-клеток и восстанавливать их способность секретировать ИФН-γ (фигура 9-12).
Специфичность в отношении PD-1
Антитела к PD-1 исследовали методом ИФА в отношении их способности связываться с другими членами семейства CD28.
В общих чертах, планшеты для ИФА покрывали с использованием 350 нг/лунку одного из следующих антигенов в комбинации с Fc человека в карбонатном буфере: PD-1 человека, PD-L1 человека, TIM-3 человека, LAG-3 человека, ICOS человека, CTLA4 человека, BTLA человека, CD28 человека, TIM-3 мыши или PD-1 макаки-резуса. Затем планшет блокировали раствором казеина. После интенсивных промывок ФСБ+твин-20 антитела вносили в лунки для ИФА в присутствии 7% молока в ФСБ. Через 90 минут инкубации при комнатной температуре с перемешиванием и интенсивными промывками добавляли антитело козы к Fab человека, конъюгированное с ПХ. Через час планшеты промывали и добавляли субстрат ТМВ. Реакцию останавливали с помощью 1 М HCl, и оптическую плотность измеряли при длине волны 450 нм с контролем при 670 нм.
Принимая во внимание, что ниволюмаб перекрестно связывается с PD-L1, TIM-3, LAG-3, BTLA и CD28 (ламбролизумаб также проявляет незначительную перекрестную реактивность), 1D11 и 1G4 являются специфичными только в отношении PD-1; и проявляют очень слабую перекрестную реактивность в отношении других членов семейства, отличных от PD-1 (фигура 13).
Выход продукции
Клетки линии НЕК-293.6Е кратковременно трансфецировали для получения антитела к PD-1 в формате IgG4; проводили сравнение выхода продукции в указанной системе.

Все новые клоны антител имели лучший выход продукции, по сравнению с ламбролизумабом.
Оптимизация кодонов
Для повышения эффективности экспрессии гена А10, В6, С4 и Н4 подвергли оптимизации кодонов.
Оптимизированные по составу кодонов клоны сохраняют свою способность нейтрализовывать PD-1 и восстанавливать активность Т-клеток (пролиферацию Т-клеток и секрецию ИФН-γ - фигуры 14 и 15).
Применение антител к PD-1 для лечения опухолей: активация лимфоцитов, проникающих в опухоли, в условиях ex vivo
Образцы опухолей легких получали из Национального онкологического центра Сингапура после одобрения соответствующим Экспертным советом организации (ЭСО). Образцы диссоциировали с использованием набора для диссоциации опухоли человека и устройства для диссоциации ткани.
Чтобы подтвердить экспрессию маркеров истощения на поверхности лимфоцитов, проникающих в опухоли, выделенную смесь клеток промывали один раз и пропускали через фильтр с диаметром пор 70 мкм для получения суспензии отдельных клеток. Клетки окрашивали антителами к CD4, CD8, PD-1, PD-L1, TIM-3 и LAG-3; маркер живых/погибших клеток также использовали для исключения мертвых клеток из анализа. Клетки исследовали с помощью проточной цитометрии. Результаты представлены на фигуре 16.
Смесь после диссоциации опухоли культивировали с антителами к PD-1 с оптимизированными кодонами, А10, В6, С4 и Н4, в течение 7 дней до измерения ИФН-γ в супернатанте с помощью ИФА. Ниволюмаб и ламбролизумаб использовали в качестве положительного контроля, изотипическое антитело использовали в качестве отрицательного контроля.
На фигуре 17А представлена секреция ИФН-γ лимфоцитами, проникающими в опухоли, после 7 дней культивирования в присутствии или в отсутствие антител к PD-1. Антитела к PD-1 способны повторно активировать секрецию ИФН-γ лимфоцитами в зависимости от дозы.
Другую фракцию диссоциированной смеси совместно культивировали с аллогенными дендритными клетками (ДК) для инициирования реакции смешанной культуры лимфоцитов (СКЛ). Клетки сначала культивировали с ДК в течение 7 дней без антител, а затем повторно стимулировали с использованием ДК в течение 7 дней в присутствии антител к PD-1 или контрольных антител. После проведения 2 этапов уровень ИФН-γ в супернатантах количественно исследовали с помощью ИФА.
На фигуре 17 В представлены результаты оценки секреции ИФН-γ после СКЛ в присутствии или в отсутствие антител к PD-1. Антитела к PD-1 смогли восстановить способность лимфоцитов, расположенных в опухолевом очаге, секретировать ИФН-γ в зависимости от дозы.
Применение антител к PD-1 для лечения инфекций: аутологичная активация Т-клеток в присутствии вируса гриппа
Кровь собирали от доноров, инфицированных вирусом гриппа. ДК моноцитарного происхождения инфицировали вирусом гриппа A/PR/8/34 (H1N1). Инфицированные ДК затем смешивали с МКПК от того же донора для первого этапа культивирования в течение 5 дней. Затем клетки повторно стимулировали с использованием ДК, инфицированных вирусом гриппа, и культивировали для второго этапа в течение 5 дней в присутствии антител к PD-1. После 2 этапов большинство клеток в культуре представляют собой Т-клетки, специфичные в отношении вируса гриппа. После 2-х этапов культивирования уровень ИФН-γ в супернатантах количественно исследовали с помощью ИФА.
На фигуре 18 представлены результаты оценки секреции ИФН-γ после культивирования МКПК с ДК, инфицированными вирусом гриппа, в присутствии или в отсутствие антител к PD-1. Антитела к PD-1 смогли восстановить способность лимфоцитов секретировать ИФН-γ при вирусной стимуляции в зависимости от дозы.
Рак легких: применение антител к PD-1 для повторной активации лимфоцитов, проникающих в опухоль легких (данные ex vivo)
Образцы опухолей легких получали из Национального онкологического центра Сингапура после одобрения соответствующим Экспертным советом организации (ЭСО). Образцы диссоциировали с использованием набора для диссоциации опухоли человека и устройства для диссоциации ткани.
Чтобы подтвердить экспрессию маркеров истощения на поверхности лимфоцитов, проникающих в опухоли, выделенную смесь клеток промывали один раз и пропускали через фильтр с диаметром пор 70 мкм для получения суспензии отдельных клеток. Клетки окрашивали антителами к CD4, CD8, PD-1, PD-L1, TIM-3, LAG-3 и CTLA-4; маркер живых/погибших клеток также использовали для исключения мертвых клеток из анализа. Клетки исследовали с помощью проточной цитометрии.
На фигуре 19 представлены результаты оценки экспрессии PD-1, PD-L1, TIM-3, LAG-3 и CTLA-4 лимфоцитами, проникающими в опухоль, у 3 разных пациентов (представлено среднее значение ± стандартное отклонение среднего из 3 независимых экспериментов с использованием клеток от 3 разных доноров, все эксперименты выполняли с тремя повторами). Приблизительно 2/3 CD4+ и CD8+ лимфоцитов в опухоли экспрессировали PD-1.
Смесь после диссоциации опухоли культивировали с аллогенными дендритными клетками (ДК), чтобы инициировать реакцию смешанной культуры лимфоцитов (СКЛ). Клетки сначала культивировали в течение 7 дней без антител и затем в течение 7 дней в присутствии антител к PD-1 или контрольных антител. После 2 этапов культивирования уровень ИФН-γ в супернатантах количественно исследовали с помощью ИФА.
На фигурах 20А-20С представлены результаты оценки секреции ИФН-γ после СКЛ в присутствии или в отсутствие антител к PD-1. Показаны средние значения ± стандартное отклонение среднего для трех повторов в трех независимых экспериментах (клетки от 3 разных пациентов). Антитела к PD-1 смогли восстановить способность лимфоцитов, расположенных в опухолевом очаге, секретировать ИФН-γ в зависимости от дозы.
Карцинома почек: применение антител к PD-1 для повторной активации лимфоцитов, проникающих в опухоль почек (данные ex vivo)
Образцы опухолей почек получали из Национального онкологического центра Сингапура после одобрения соответствующим Экспертным советом организации (ЭСО). Образцы диссоциировали с использованием набора для диссоциации опухоли человека и устройства для диссоциации ткани.
Чтобы подтвердить экспрессию маркеров истощения на поверхности лимфоцитов, проникающих в опухоли, выделенную смесь клеток промывали один раз и пропускали через фильтр с диаметром пор 70 мкм для получения суспензии отдельных клеток. Клетки окрашивали антителами к CD4, CD8, PD-1, PD-L1, ТГМ-3, LAG-3 и CTLA-4; маркер живых/погибших клеток также использовали для исключения мертвых клеток из анализа. Клетки исследовали с помощью проточной цитометрии. Для сравнения экспрессию одних и тех же маркеров оценивали на МКПК у одних и тех же пациентов.
На фигурах 21А и 21В представлены результаты оценки экспрессии PD-1, PD-L1, TIM-3, LAG-3 и CTLA-4 лимфоцитами, проникающими в опухоль (фиг. 21А), и на циркулирующих в кровотоке лимфоцитах (фиг. 21В) у 3 разных пациентов (представлено среднее значение ± стандартное отклонение среднего для 3 независимых экспериментов с использованием клеток от 3 разных доноров, все эксперименты проводили с тремя повторами). Приблизительно 2/3 CD4+ и CD8+ лимфоцитов в опухоли экспрессировали PD-1, в то время как большинство лимфоцитов МКПК не экспрессировали PD-1.
Смесь после диссоциации опухоли культивировали совместно с аллогенными дендритными клетками (ДК), чтобы инициировать реакцию смешанной культуры лимфоцитов (СКЛ). Клетки сначала культивировали в течение 7 дней без антител и затем в течение 7 дней в присутствии антител к PD-1 или контрольных антител. После 2 этапов культивирования уровень ИФН-γ в супернатантах количественно исследовали с помощью ИФА.
На фигурах 22А-22С представлены результаты оценки секреции ИФН-γ после СКЛ в присутствии или в отсутствие антител к PD-1. Показаны средние значения ± стандартное отклонение среднего для двух или трех повторов в трех независимых экспериментах (клетки от 3 разных пациентов). Антитела к PD-1 смогли восстановить способность лимфоцитов, расположенных в опухолевом очаге, секретировать ИФН-γ в зависимости от дозы.
Рак мочевого пузыря: применение антитела к PD-1 для повторной активации лимфоцитов, проникающих в опухоль мочевого пузыря (данные ex vivo)
Образцы опухоли мочевого пузыря получали из Национального онкологического центра Сингапура после одобрения соответствующим Экспертным советом организации (ЭСО). Образцы диссоциировали с использованием набора для диссоциации опухоли человека и устройства для диссоциации ткани.
Чтобы подтвердить экспрессию маркеров истощения на поверхности лимфоцитов, проникающих в опухоли, выделенную смесь клеток промывали один раз и пропускали через фильтр с диаметром пор 70 мкм для получения суспензии отдельных клеток. Клетки окрашивали антителами к CD4, CD8, PD-1, PD-L1, TIM-3, LAG-3 и CTLA-4; маркер живых/погибших клеток также использовали для исключения мертвых клеток из анализа. Клетки исследовали с помощью проточной цитометрии.
На фигуре 23А и 23В представлены результаты оценки экспрессии PD-1, PD-L1, TIM-3, LAG-3 и CTLA-4 лимфоцитами, проникающими в опухоль (фиг. 23А), и циркулирующими в кровотоке лимфоцитами (фиг. 23В) от 2 разных пациентов (представлено среднее значение ± стандартное отклонение среднего для 2 независимых экспериментов с использованием клеток от 2 разных доноров, все эксперименты проводили с тремя повторами). Большинство лимфоцитов, проникающих в опухоль, экспрессируют PD-1, в то время как лишь небольшая часть циркулирующих в кровотоке лимфоцитов экспрессируют PD-1.
Смесь после диссоциации опухоли культивировали совместно с аллогенными дендритными клетками (ДК), чтобы инициировать реакцию смешанной культуры лимфоцитов (СКЛ). Клетки культивировали в течение первых 7 дней без антител и затем в течение 7 дней в присутствии антитела к PD-1 или контрольных антител. После 2 этапов культивирования уровень ИФН-γ в супернатантах количественно исследовали с помощью ИФА.
На фигуре 24 представлены результаты оценки секреции ИФН-γ после СКЛ в присутствии или в отсутствие антител к PD-1. Показано среднее значение ± стандартное отклонение среднего для трех повторов в 1 эксперименте. Антитело к PD-1 было способно восстанавливать способность лимфоцитов, расположенных в опухолевом очаге, секретировать ИФН-γ в зависимости от дозы.
--->
Перечень последовательностей
<110> Agency for Science, Technology and Research
<120> Антитела к PD-1
<130> RIC/FP7150477
<150> GB 1419084.7
<151> 2014-10-27
<160> 89
<170> PatentIn version 3.3
<210> 1
<211> 110
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области легкой цепи для клона антитела к PD-1 A3
<400> 1
Leu Pro Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Lys Phe Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Phe Cys Ala Ser Trp Asp Asp Val Leu
85 90 95
Tyr Gly Ser Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 2
<211> 110
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области легкой цепи для клона антитела к PD-1 A10
<400> 2
Leu Pro Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Lys Phe Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Phe Cys Ala Ser Trp Asp Asp Tyr Tyr
85 90 95
Tyr Gly Thr Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 3
<211> 110
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области легкой цепи для клона антитела к PD-1 B6
<400> 3
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Lys Phe Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ser Trp Asp Asp Tyr Leu
85 90 95
Arg Gly Thr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 4
<211> 110
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области легкой цепи для клона антитела к PD-1 C4
<400> 4
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Lys Phe Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ala Trp Asp Asp Tyr Leu
85 90 95
His Gly Thr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 5
<211> 110
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области легкой цепи для клона антитела к PD-1 D4
<400> 5
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Lys Phe Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ser Trp Asp Asp Tyr Val
85 90 95
Arg Gly Thr Met Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 6
<211> 110
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области легкой цепи для клона антитела к PD-1 E1
<400> 6
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Lys Phe Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Trp Asp Asp Phe Leu
85 90 95
Arg Gly Thr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 7
<211> 110
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области легкой цепи для клона антитела к PD-1 F2
<400> 7
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Lys Phe Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Trp Asp Asp Asp Ala
85 90 95
Arg Gly Thr Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 8
<211> 110
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области легкой цепи для клона антитела к PD-1 G1
<400> 8
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Lys Phe Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Val Tyr
85 90 95
Tyr Gly Thr Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 9
<211> 110
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области легкой цепи для клона антитела к PD-1 G2
<400> 9
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Lys Phe Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ser Trp Asp Asp Ser Leu
85 90 95
Tyr Gly Thr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 10
<211> 110
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области легкой цепи для клона антитела к PD-1 G10
<400> 10
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Lys Phe Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ala Tyr
85 90 95
Tyr Gly Thr Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 11
<211> 110
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области легкой цепи для клона антитела к PD-1 H4
<400> 11
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Lys Phe Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ser Trp Asp Asp Val Tyr
85 90 95
Arg Gly Thr Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 12
<211> 110
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области легкой цепи для клона антитела к PD-1 H9
<400> 12
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Lys Phe Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Trp Asp Asp Ser Leu
85 90 95
Tyr Gly Thr Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 13
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 A3
<400> 13
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Lys Asp His Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 14
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 A10
<400> 14
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Lys Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 15
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 B6
<400> 15
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asp Tyr Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 16
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 C4
<400> 16
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Leu Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 17
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 D4
<400> 17
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 18
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 E1
<400> 18
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 19
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 F2
<400> 19
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 20
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 G1
<400> 20
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 21
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 G2
<400> 21
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 22
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 G10
<400> 22
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asp Tyr Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 23
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 H4
<400> 23
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asp Leu Gly Ser Gly Tyr Tyr Leu Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 24
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 H9
<400> 24
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 25
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR1
<400> 25
Ser Gly Ser Ser Ser Asn Ile Lys Phe Asn Ser Val Asn
1 5 10
<210> 26
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR2
<400> 26
Ser Asn Asn Gln Arg Pro Ser
1 5
<210> 27
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR3
<400> 27
Ala Ser Trp Asp Asp Val Leu Tyr Gly Ser Val
1 5 10
<210> 28
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR3
<400> 28
Ala Ser Trp Asp Asp Tyr Tyr Tyr Gly Thr Ile
1 5 10
<210> 29
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR3
<400> 29
Ala Ser Trp Asp Asp Tyr Leu Arg Gly Thr Val
1 5 10
<210> 30
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR3
<400> 30
Ser Ala Trp Asp Asp Tyr Leu His Gly Thr Val
1 5 10
<210> 31
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR3
<400> 31
Ala Ser Trp Asp Asp Tyr Val Arg Gly Thr Met
1 5 10
<210> 32
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR3
<400> 32
Ser Ser Trp Asp Asp Phe Leu Arg Gly Thr Val
1 5 10
<210> 33
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR3
<400> 33
Ser Ser Trp Asp Asp Asp Ala Arg Gly Thr Ile
1 5 10
<210> 34
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR3
<400> 34
Ala Ala Trp Asp Asp Val Tyr Tyr Gly Thr Ile
1 5 10
<210> 35
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR3
<400> 35
Ala Ser Trp Asp Asp Ser Leu Tyr Gly Thr Val
1 5 10
<210> 36
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR3
<400> 36
Ala Ala Trp Asp Asp Ala Tyr Tyr Gly Thr Ile
1 5 10
<210> 37
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR3
<400> 37
Ala Ser Trp Asp Asp Val Tyr Arg Gly Thr Val
1 5 10
<210> 38
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR3
<400> 38
Ser Ser Trp Asp Asp Ser Leu Tyr Gly Thr Ile
1 5 10
<210> 39
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR1
<400> 39
Gly Phe Thr Phe Ser Ser Tyr Gly Met His
1 5 10
<210> 40
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR2
<400> 40
Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 41
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR3
<400> 41
Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Lys Asp His
1 5 10
<210> 42
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR3
<400> 42
Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Lys Asp Val
1 5 10
<210> 43
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR3
<400> 43
Asp Tyr Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val
1 5 10
<210> 44
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR3
<400> 44
Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Leu Asp Val
1 5 10
<210> 45
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR3
<400> 45
Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val
1 5 10
<210> 46
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR3
<400> 46
Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val
1 5 10
<210> 47
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR3
<400> 47
Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val
1 5 10
<210> 48
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR3
<400> 48
Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val
1 5 10
<210> 49
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR3
<400> 49
Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val
1 5 10
<210> 50
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR3
<400> 50
Asp Tyr Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val
1 5 10
<210> 51
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR3
<400> 51
Asp Leu Gly Ser Gly Tyr Tyr Leu Tyr Gly Met Asp Val
1 5 10
<210> 52
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR3
<400> 52
Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Met Asp Val
1 5 10
<210> 53
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: LC-CDR3
<220>
<221> Вариант
<222> (1)..(1)
<223> Xaa= Ala или Ser
<220>
<221> Вариант
<222> (2)..(2)
<223> Xaa= Ser или Ala
<220>
<221> Вариант
<222> (6)..(6)
<223> Xaa= Val, Tyr, Phe, Asp, Ser или Ala
<220>
<221> Вариант
<222> (7)..(7)
<223> Xaa= Leu, Tyr, Val или Ala
<220>
<221> Вариант
<222> (8)..(8)
<223> Xaa= Tyr, Arg или His
<220>
<221> Вариант
<222> (10)..(10)
<223> Xaa= Ser или Thr
<220>
<221> Вариант
<222> (11)..(11)
<223> Xaa= Val, Ile или Met
<400> 53
Xaa Xaa Trp Asp Asp Xaa Xaa Xaa Gly Xaa Xaa
1 5 10
<210> 54
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR3
<220>
<221> Вариант
<222> (2)..(2)
<223> Xaa= Leu или Tyr
<220>
<221> Вариант
<222> (4)..(4)
<223> Xaa= Ala или Ser
<220>
<221> Вариант
<222> (6)..(6)
<223> Xaa= Pro или Tyr
<220>
<221> Вариант
<222> (8)..(8)
<223> Xaa= Tyr или Leu
<220>
<221> Вариант
<222> (11)..(11)
<223> Xaa= Lys, Met или Leu
<220>
<221> Вариант
<222> (13)..(13)
<223> Xaa= His или Val
<400> 54
Asp Xaa Gly Xaa Gly Xaa Tyr Xaa Tyr Gly Xaa Asp Xaa
1 5 10
<210> 55
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для клона антитела к PD-1 A3
<400> 55
ctgcctgtgc tgactcagcc cccctcagcg tccgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcaaa tttaacagtg ttaactggta tcagcaactc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcgaccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcact tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta tttctgtgct tcttgggatg atgttcttta tggatctgtg 300
ttcggcggag ggaccaagct gaccgtcctg 330
<210> 56
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для клона антитела к PD-1 A10
<400> 56
ctgcctgtgc tgactcagcc cccctcagcg tccgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcaaa tttaacagtg ttaactggta tcagcaactc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcgaccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcact tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta tttctgtgct tcttgggatg attattatta tggaactatt 300
ttcggcggag ggaccaagct gaccgtcctg 330
<210> 57
<211> 110
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: кодируемая аминокислотная последовательность вариабельной области легкой цепи для кодон-оптимизированного клона антитела к PD-1 A10
<400> 57
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Lys Phe Asn
20 25 30
Ser Val Asn Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ser Trp Asp Asp Tyr Tyr
85 90 95
Tyr Gly Thr Ile Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 58
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для кодон-оптимизированного клона антитела к A10
<400> 58
cagagcgtcc tgacacagcc tcctagtgca agcggaaccc ctgggcagag agtgaccatt 60
tcttgtagcg gcagcagcag taacatcaag ttcaactccg tgaattggta tcagcagctg 120
cccggaactg ctcctaaact gctgatctac tctaacaatc agcgaccaag tggcgtcccc 180
gaccggttca gcggctccaa gtctgggacc agtgcctcac tggctatcag cgggctccag 240
tccgaggacg aagcagatta ctattgcgcc agctgggacg attactatta cggcaccatt 300
ttcggcgggg gaacaaaact gaccgtcctg 330
<210> 59
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для клона антитела к PD-1 B6
<400> 59
cagtctgtgc tgactcagcc cccctcagcg tccgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcaaa tttaacagtg ttaactggta tcagcaactc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcgaccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcact tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta ttactgtgct tcttgggatg attatcttcg tggaactgtt 300
ttcggcggag ggaccaagct gaccgtcctg 330
<210> 60
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для кодон-оптимизированного клона антитела к PD-1 B6
<400> 60
cagagcgtgc tgacccagcc ccccagcgcc agtggaacac ccggacagag agtgaccatc 60
agttgctcag gcagctcctc taacattaag ttcaactctg tgaattggta tcagcagctg 120
cccggaactg ctcctaaact gctgatctat tctaacaatc agcgaccaag tggcgtcccc 180
gaccggttca gcggctccaa gtctgggacc agtgcctcac tggctattag cgggctccag 240
tccgaggacg aagcagatta ctattgtgcc agctgggacg attacctgag gggcaccgtg 300
ttcggaggag gaacaaaact gaccgtcctg 330
<210> 61
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для клона антитела к PD-1 C4
<400> 61
cagtctgtgc tgactcagcc cccctcagcg tccgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcaaa tttaacagtg ttaactggta tcagcaactc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcgaccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcact tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta ttactgttct gcttgggatg attatcttca tggaactgtg 300
ttcggcggag ggaccaagct gaccgtcctg 330
<210> 62
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для кодон-оптимизированного клона антитела к PD-1 C4
<400> 62
cagagcgtcc tgacacagcc cccttccgca agtggaaccc ctgggcagcg agtgactatt 60
tcatgcagtg gatcttcatc taacatcaag ttcaactccg tgaattggta tcagcagctg 120
cccggaactg ctcctaaact gctgatctat tctaacaatc agcgaccaag tggcgtcccc 180
gaccggttca gcggctccaa gtctgggacc agtgcctcac tggctattag cgggctccag 240
tccgaggacg aagcagatta ctattgcagc gcctgggacg attacctgca cggcaccgtg 300
ttcggaggag gaacaaaact gaccgtcctg 330
<210> 63
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для клона антитела к PD-1 D4
<400> 63
cagtctgtgc tgactcagcc cccctcagcg tccgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcaaa tttaacagtg ttaactggta tcagcaactc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcgaccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcact tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta ttactgtgct tcttgggatg attatgttcg tggaactatg 300
ttcggcggag ggaccaagct gaccgtcctg 330
<210> 64
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для клона антитела к PD-1 E1
<400> 64
cagtctgtgc tgactcagcc cccctcagcg tccgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcaaa tttaacagtg ttaactggta tcagcaactc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcgaccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcact tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta ttactgttct tcttgggatg attttcttcg tggaactgtt 300
ttcggcggag ggaccaagct gaccgtcctg 330
<210> 65
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для клона антитела к PD-1 F2
<400> 65
cagtctgtgc tgactcagcc cccctcagcg tccgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcaaa tttaacagtg ttaactggta tcagcaactc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcgaccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcact tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta ttactgttct tcttgggatg atgatgctcg tggaactatt 300
ttcggcggag ggaccaagct gaccgtcctg 330
<210> 66
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для клона антитела к PD-1 G1
<400> 66
cagtctgtgc tgactcagcc cccctcagcg tccgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcaaa tttaacagtg ttaactggta tcagcaactc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcgaccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcact tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta ttactgtgct gcttgggatg atgtttatta tggaactatt 300
ttcggcggag ggaccaagct gaccgtcctg 330
<210> 67
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для клона антитела к PD-1 G2
<400> 67
cagtctgtgc tgactcagcc cccctcagcg tccgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcaaa tttaacagtg ttaactggta tcagcaactc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcgaccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcact tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta ttactgtgct tcttgggatg attctcttta tggaactgtt 300
ttcggcggag ggaccaagct gaccgtcctg 330
<210> 68
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для клона антитела к PD-1 G10
<400> 68
cagtctgtgc tgactcagcc cccctcagcg tccgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcaaa tttaacagtg ttaactggta tcagcaactc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcgaccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcact tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta ttactgtgct gcttgggatg atgcttatta tggaactatt 300
ttcggcggag ggaccaagct gaccgtcctg 330
<210> 69
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для клона антитела к PD-1 H4
<400> 69
cagtctgtgc tgactcagcc cccctcagcg tccgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcaaa tttaacagtg ttaactggta tcagcaactc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcgaccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcact tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta ttactgtgct tcttgggatg atgtttatcg tggaactgtt 300
ttcggcggag ggaccaagct gaccgtcctg 330
<210> 70
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для кодон-оптимизированного клона антитела к PD-1 H4
<400> 70
cagagcgtcc tgacacagcc cccaagcgca agcggaaccc ccggccagcg agtgaccatt 60
agttgtagtg gaagtagtag taacatcaag ttcaactccg tgaattggta tcagcagctg 120
cccggaactg ctcctaaact gctgatctat tctaacaatc agcgaccaag tggcgtcccc 180
gaccggttca gcggctccaa gtctgggacc agtgcctcac tggctattag cgggctccag 240
tccgaggacg aagcagatta ctattgcgcc agctgggacg atgtgtacag gggcaccgtc 300
ttcggcgggg gaacaaaact gaccgtcctg 330
<210> 71
<211> 330
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области легкой цепи для клона антитела к PD-1 H9
<400> 71
cagtctgtgc tgactcagcc cccctcagcg tccgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcaaa tttaacagtg ttaactggta tcagcaactc 120
ccaggaacgg cccccaaact cctcatctat agtaataatc agcgaccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcact tcagcctccc tggccatcag tgggctccag 240
tctgaggatg aggctgatta ttactgttct tcttgggatg attctcttta tggaactatt 300
ttcggcggag ggaccaagct gaccgtcctg 330
<210> 72
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 A3
<400> 72
caggtccagc tggtgcagtc cgggggaggc gtggtccagc ctgggcggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatcatatg atggaagtaa taaatactac 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagtgatctt 300
ggtgctggtc cttattatta tggtaaggat cattggggcc aagggaccac ggtcaccgtc 360
tcaagc 366
<210> 73
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 A10
<400> 73
caggtccagc tggtgcagtc tgggggaggc gtggtccagc ctgggcggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatcatatg atggaagtaa taaatactac 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagtgatctt 300
ggtgctggtc cttattatta tggtaaggat gtttggggcc aagggaccac ggtcaccgtc 360
tcaagc 366
<210> 74
<211> 122
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: кодируемая аминокислотная последовательность вариабельной области тяжелой цепи для кодон-оптимизированного клона антитела к PD-1 A10
<400> 74
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Asp Leu Gly Ala Gly Pro Tyr Tyr Tyr Gly Lys Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 75
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для кодон-оптимизированного клона антитела к PD-1 A10
<400> 75
caggtgcagc tggtcgaatc cggggggggg gtggtgcagc ctggacggtc actgagactg 60
agttgtgccg cctctgggtt tactttcagc tcctatggca tgcactgggt gaggcaggct 120
cccggcaagg ggctggagtg ggtggcagtc atctcttacg acggcagtaa caagtactat 180
gccgatagcg tcaaagggcg gttcactatt tcaagagaca acagcaaaaa taccctgtac 240
ctccagatga acagcctgcg ggccgaagac acagctgtgt actattgcgc atctgatctg 300
ggagccggcc cttactatta cggcaaggat gtctgggggc agggaaccac agtcaccgtc 360
tcaagc 366
<210> 76
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 B6
<400> 76
caggtccagc tggtagagtc cgggggaggc gtggtccagc ctgggcggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatcatatg atggaagtaa taaatactac 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagtgattat 300
ggtgctggtc cttattatta tggtatggat gtttggggcc aagggaccac ggtcaccgtc 360
tcaagc 366
<210> 77
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для кодон-оптимизированного клона антитела к PD-1 B6
<400> 77
caggtgcagc tggtggaaag cggggggggc gtggtgcagc ctggaaggtc actgagactg 60
tcttgtgccg catctgggtt tacatttagc tcctatggca tgcactgggt gaggcaggct 120
cccggcaagg ggctggagtg ggtggcagtc atctcttacg acggcagtaa caagtactat 180
gccgatagcg tcaaagggcg gttcactatt tcaagagaca acagcaaaaa taccctgtac 240
ctccagatga acagcctgcg ggccgaagac acagctgtgt actattgcgc atctgattac 300
ggagccggcc cttactatta cggcatggat gtctgggggc agggaaccac agtcaccgtc 360
tcaagc 366
<210> 78
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 C4
<400> 78
caggtccagc tggtagagtc cgggggaggc gtggtccagc ctgggcggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatcatatg atggaagtaa taaatactac 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagtgatctt 300
ggtgctggtc cttattatta tggtttggat gtttggggcc aagggaccac ggtcaccgtc 360
tcaagc 366
<210> 79
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для кодон-оптимизированного клона антитела к PD-1 C4
<400> 79
caggtgcagc tggtggaatc tggggggggg gtcgtgcagc ccggacggtc actgagactg 60
tcatgtgccg cttcagggtt tacttttagc tcctatggca tgcactgggt gaggcaggct 120
cccggcaagg ggctggagtg ggtggcagtc atctcttacg acggcagtaa caagtactat 180
gccgatagcg tcaaagggcg gttcactatt tcaagagaca acagcaaaaa taccctgtac 240
ctccagatga acagcctgcg ggccgaagac acagctgtgt actattgcgc atctgatctg 300
ggagccggcc cttactatta cggcctggat gtctgggggc agggaaccac agtcaccgtc 360
tcaagc 366
<210> 80
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 D4
<400> 80
caggtccagc tggtagagtc cgggggaggc gtggtccagc ctgggcggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatcatatg atggaagtaa taaatactac 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagtgatctt 300
ggtgctggtc cttattatta tggtatggat gtttggggcc aagggaccac ggtcaccgtc 360
tcaagc 366
<210> 81
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 E1
<400> 81
caggtccagc tggtagagtc cgggggaggc gtggtccagc ctgggcggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatcatatg atggaagtaa taaatactac 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagtgatctt 300
ggtgctggtc cttattatta tggtatggat gtttggggcc aagggaccac ggtcaccgtc 360
tcaagc 366
<210> 82
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 F2
<400> 82
caggtccagc tggtagagtc cgggggaggc gtggtccagc ctgggcggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatcatatg atggaagtaa taaatactac 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagtgatctt 300
ggtgctggtc cttattatta tggtatggat gtttggggcc aagggaccac ggtcaccgtc 360
tcaagc 366
<210> 83
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 G1
<400> 83
caggtccagc tggtagagtc cgggggaggc gtggtccagc ctgggcggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatcatatg atggaagtaa taaatactac 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagtgatctt 300
ggtgctggtc cttattatta tggtatggat gtttggggcc aagggaccac ggtcaccgtc 360
tcaagc 366
<210> 84
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 G2
<400> 84
caggtccagc tggtagagtc cgggggaggc gtggtccagc ctgggcggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatcatatg atggaagtaa taaatactac 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagtgatctt 300
ggtgctggtc cttattatta tggtatggat gtttggggcc aagggaccac ggtcaccgtc 360
tcaagc 366
<210> 85
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 G10
<400> 85
caggtccagc tggtagagtc cgggggaggc gtggtccagc ctgggcggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatcatatg atggaagtaa taaatactac 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagtgattat 300
ggtgctggtc cttattatta tggtatggat gtttggggcc aagggaccac ggtcaccgtc 360
tcaagc 366
<210> 86
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 H4
<400> 86
caggtccagc tggtagagtc cgggggaggc gtggtccagc ctgggcggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatcatatg atggaagtaa taaatactac 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagtgatctt 300
ggttctggtt attatcttta tggtatggac gtctggggcc aagggaccac ggtcaccgtc 360
tcaagc 366
<210> 87
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для кодон-оптимизированного клона антитела к PD-1 H4
<400> 87
caggtgcagc tggtggagag cggggggggg gtggtgcagc ctggacggtc actgagactg 60
agttgcgccg catctggatt cacatttagc tcctacggca tgcactgggt gaggcaggca 120
cccggcaagg ggctggagtg ggtggccgtc atctcttatg acggcagtaa caagtactat 180
gctgatagcg tcaaagggcg gttcactatt tcaagagaca acagcaaaaa taccctgtac 240
ctccagatga atagcctgcg ggccgaagac acagctgtgt actattgcgc ctccgatctg 300
ggatctggct actatctgta tggcatggat gtctgggggc agggaaccac agtcaccgtc 360
tcaagc 366
<210> 88
<211> 366
<212> DNA
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: нуклеотидная последовательность вариабельной области тяжелой цепи для клона антитела к PD-1 H9
<400> 88
caggtccagc tggtagagtc cgggggaggc gtggtccagc ctgggcggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatggca tgcactgggt ccgccaggct 120
ccaggcaagg ggctggagtg ggtggcagtt atatcatatg atggaagtaa taaatactac 180
gcagactccg tgaagggccg attcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggctgtgt attactgtgc gagtgatctt 300
ggtgctggtc cttattatta tggtatggat gtttggggcc aagggaccac ggtcaccgtc 360
tcaagc 366
<210> 89
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность: HC-CDR1
<400> 89
Ser Tyr Gly Met His
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Антитела против лиганда-1 запрограммированной смерти (PD-L1) и их применение | 2017 |
|
RU2721582C1 |
| БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СОДЕРЖАЩИЕ АНТИ-FAP КЛОН 212 | 2019 |
|
RU2799429C2 |
| Связывающие молекулы, специфичные в отношении CD73, и пути их применения | 2015 |
|
RU2730665C2 |
| АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2788095C2 |
| Иммунотерапия с применением антител, связывающих лиганд 1 белка программируемой смерти клеток (PD-L1) | 2017 |
|
RU2766582C2 |
| АНТИТЕЛА ПРОТИВ ЛИГАНДА 1 ПРОГРАММИРУЕМОЙ ГИБЕЛИ И ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2786235C1 |
| АНТИТЕЛО К PD-L1, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2778085C2 |
| АНТИТЕЛА ПРОТИВ VISTA И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2750723C1 |
| АНТИТЕЛО ПРОТИВ TNFR2 И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2793165C1 |
| АНТИТЕЛО К PD-1, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2807484C2 |












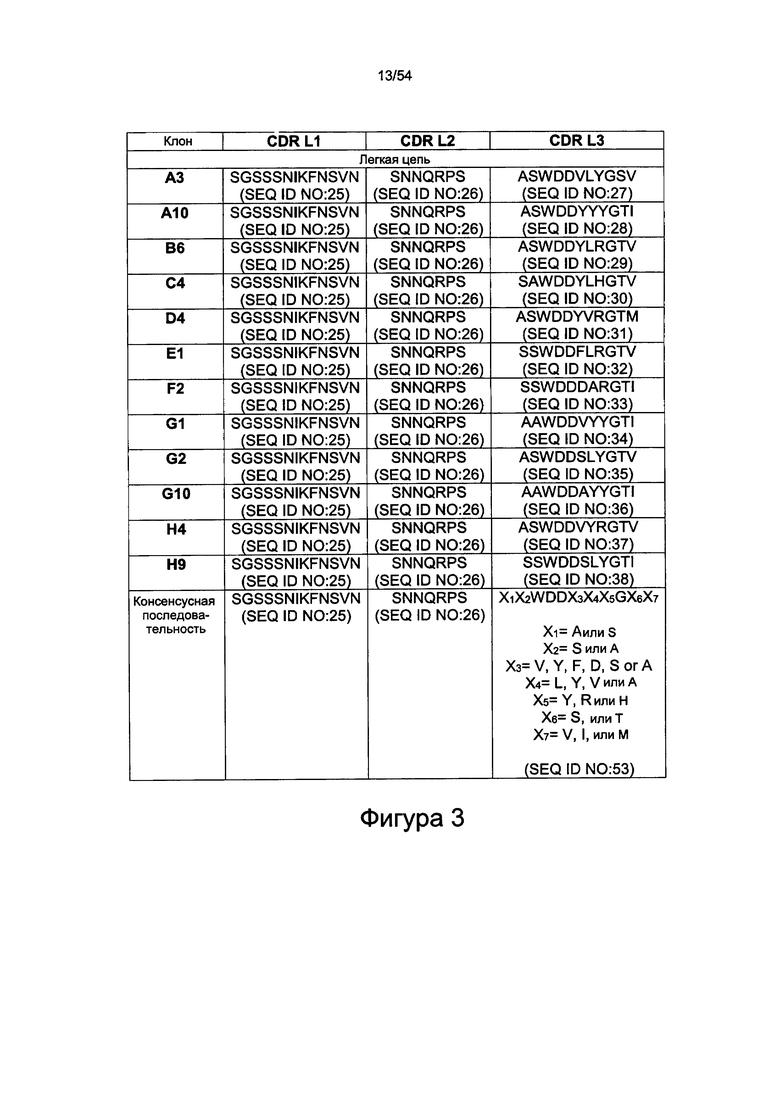
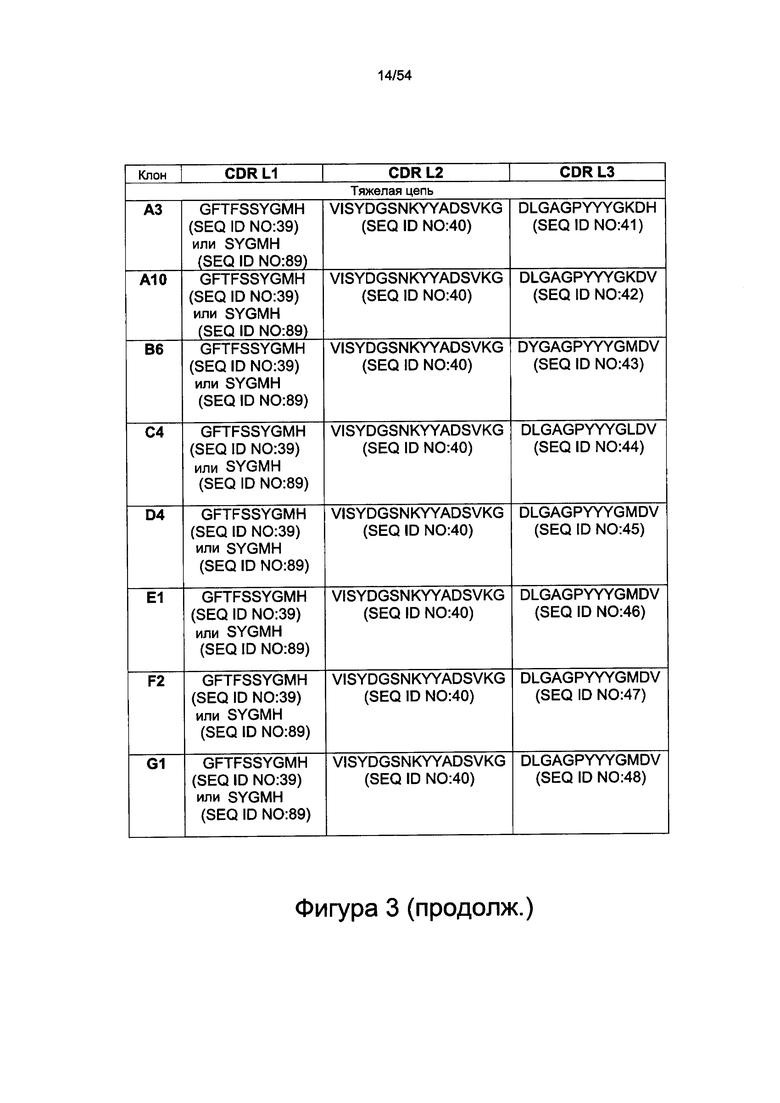
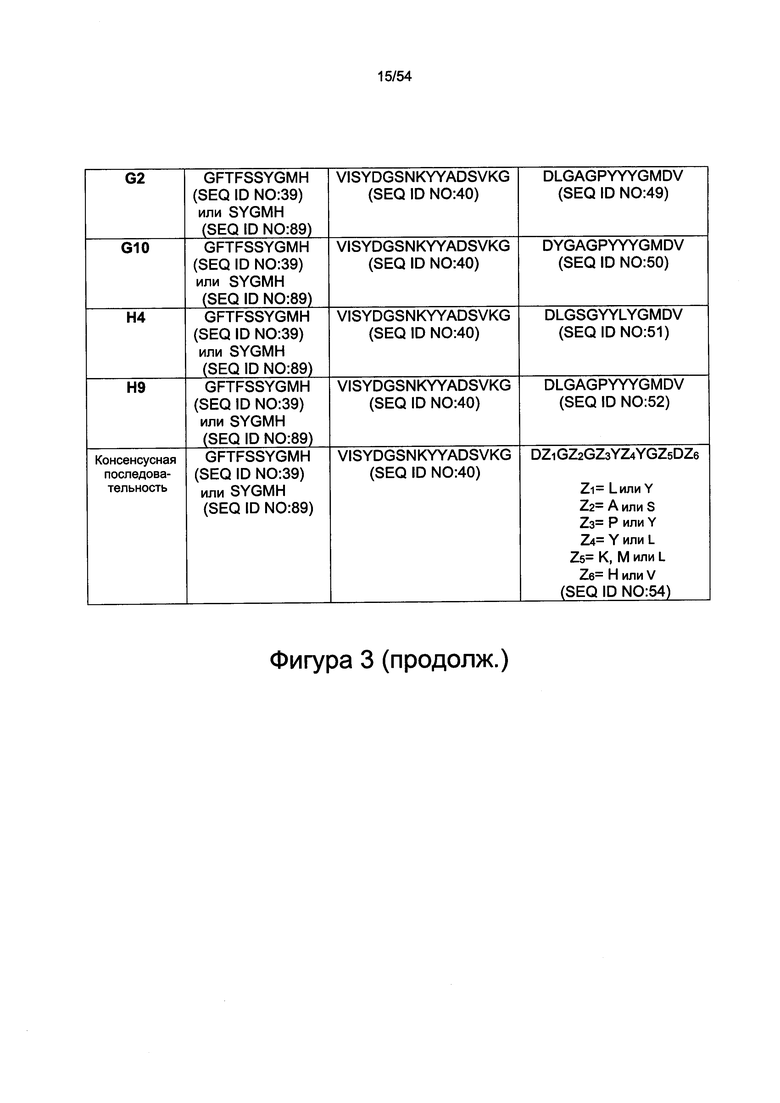















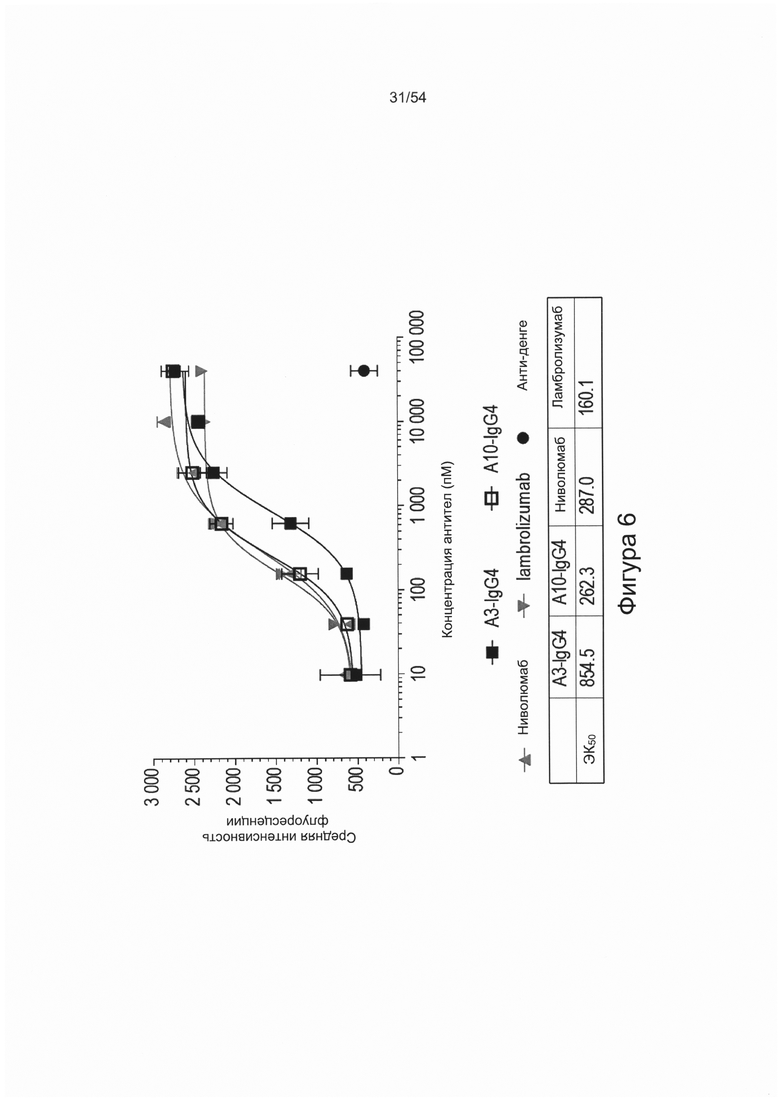
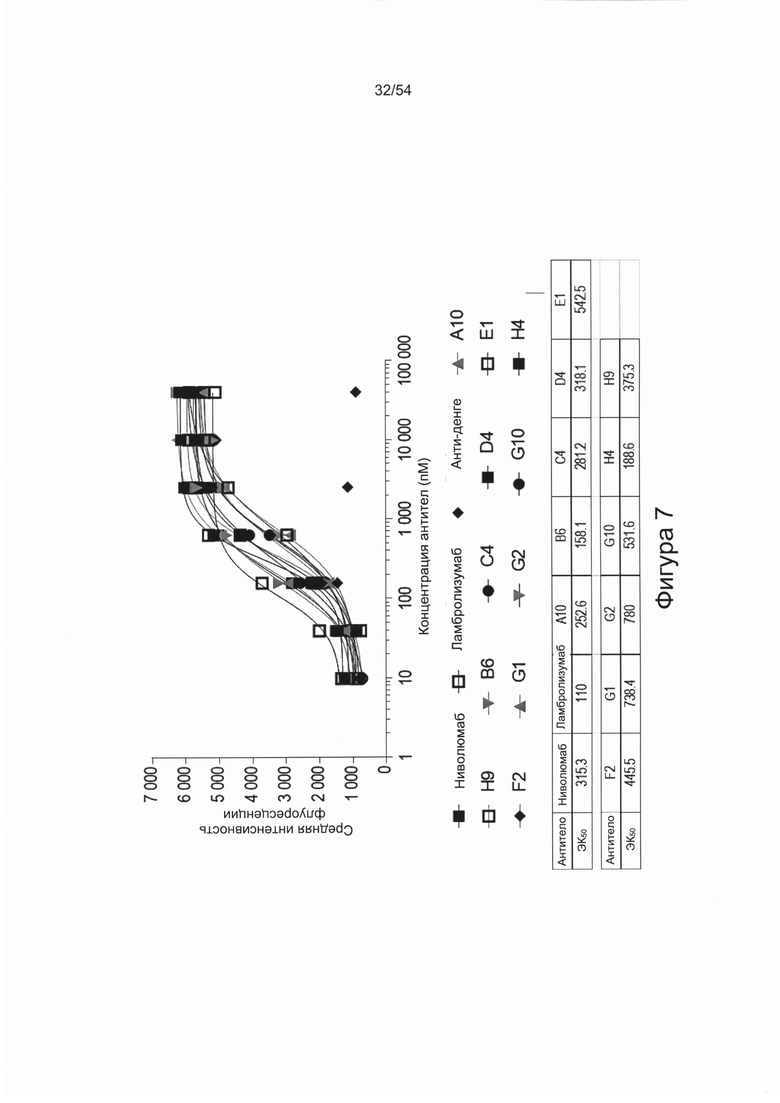
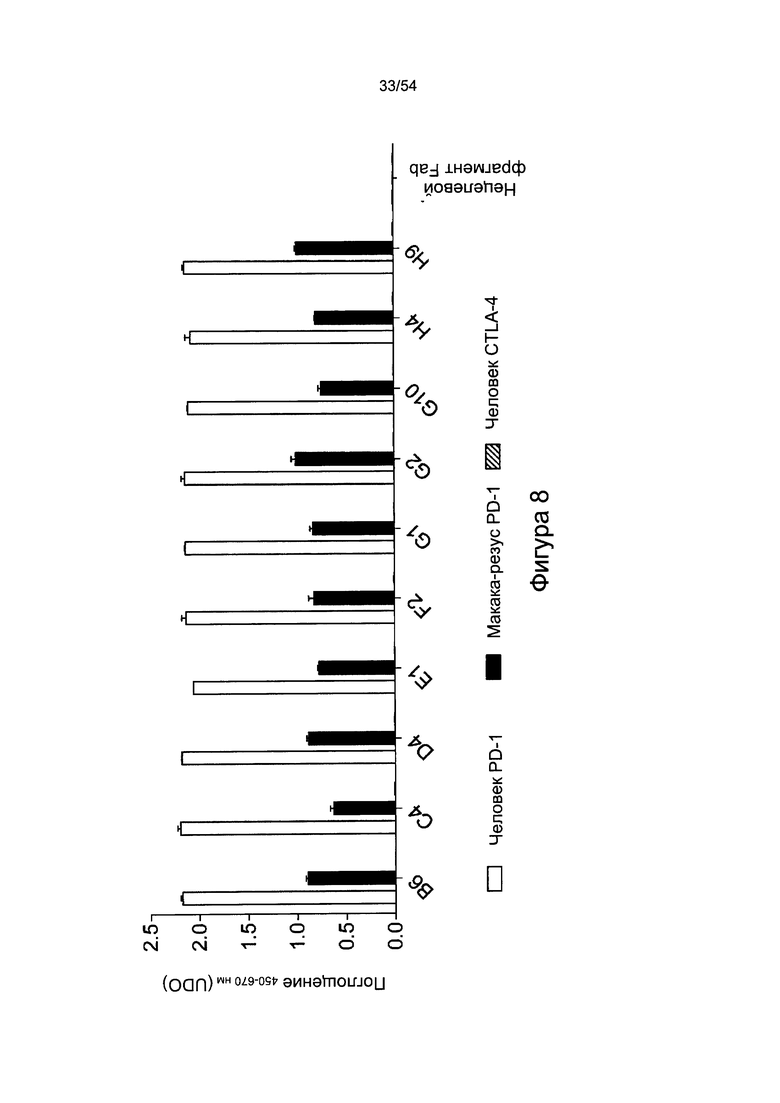

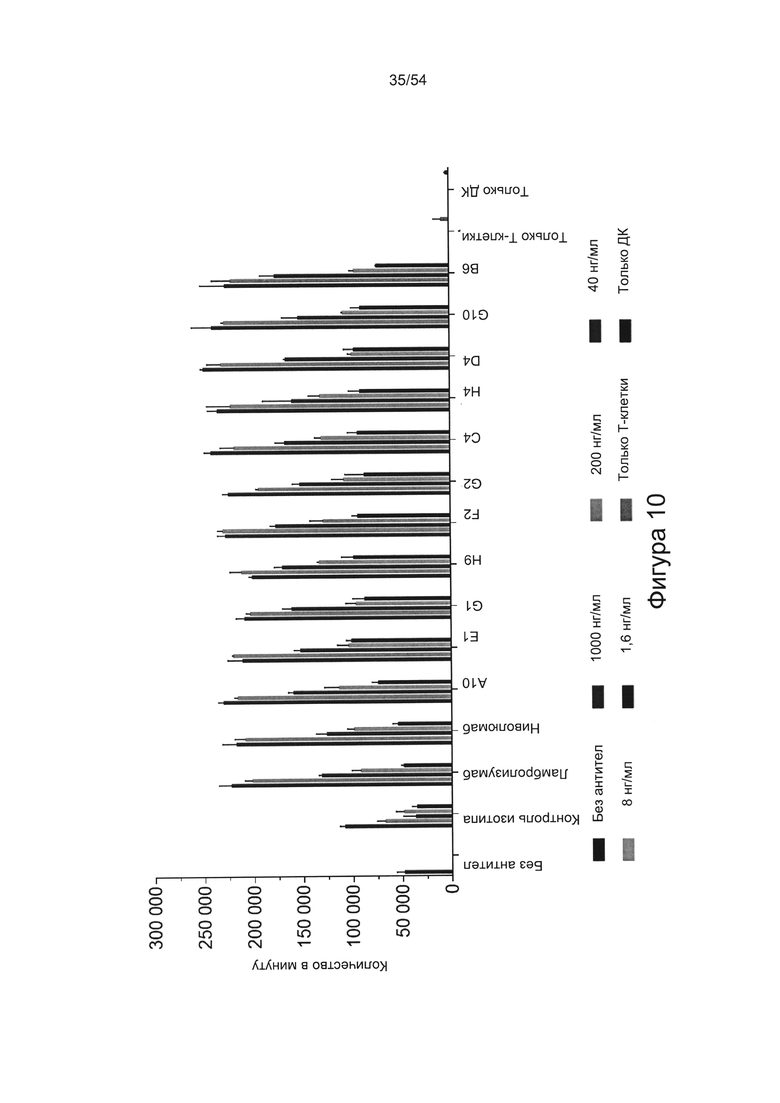
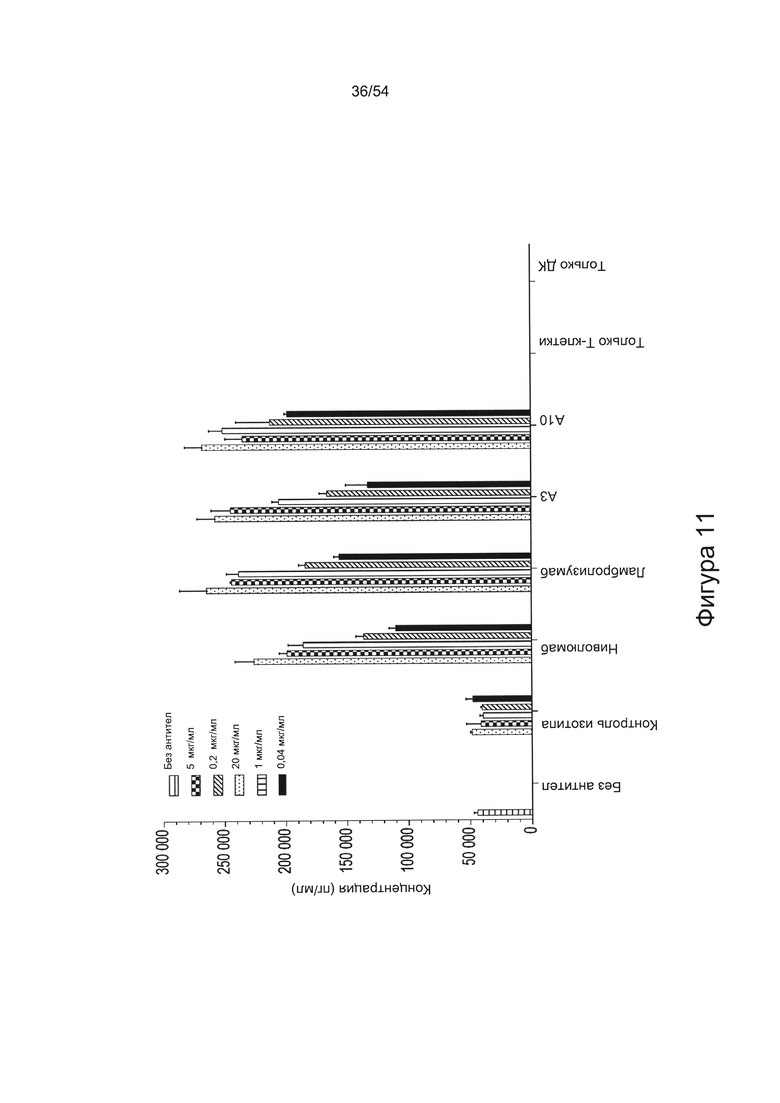
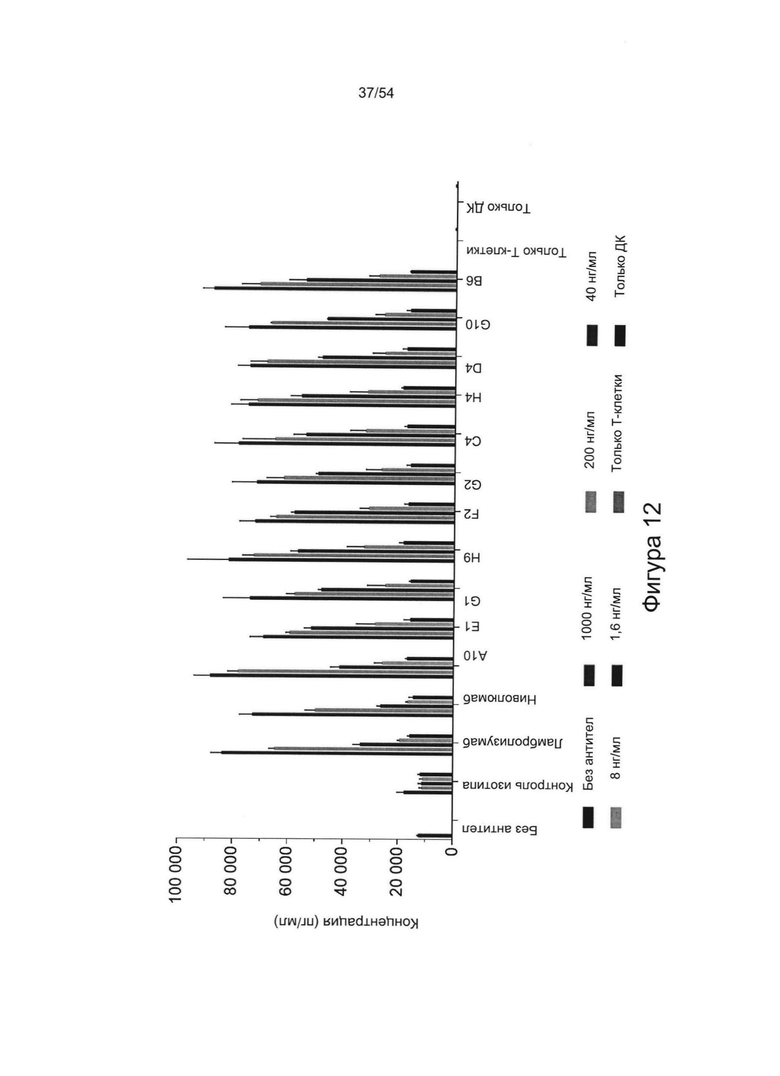
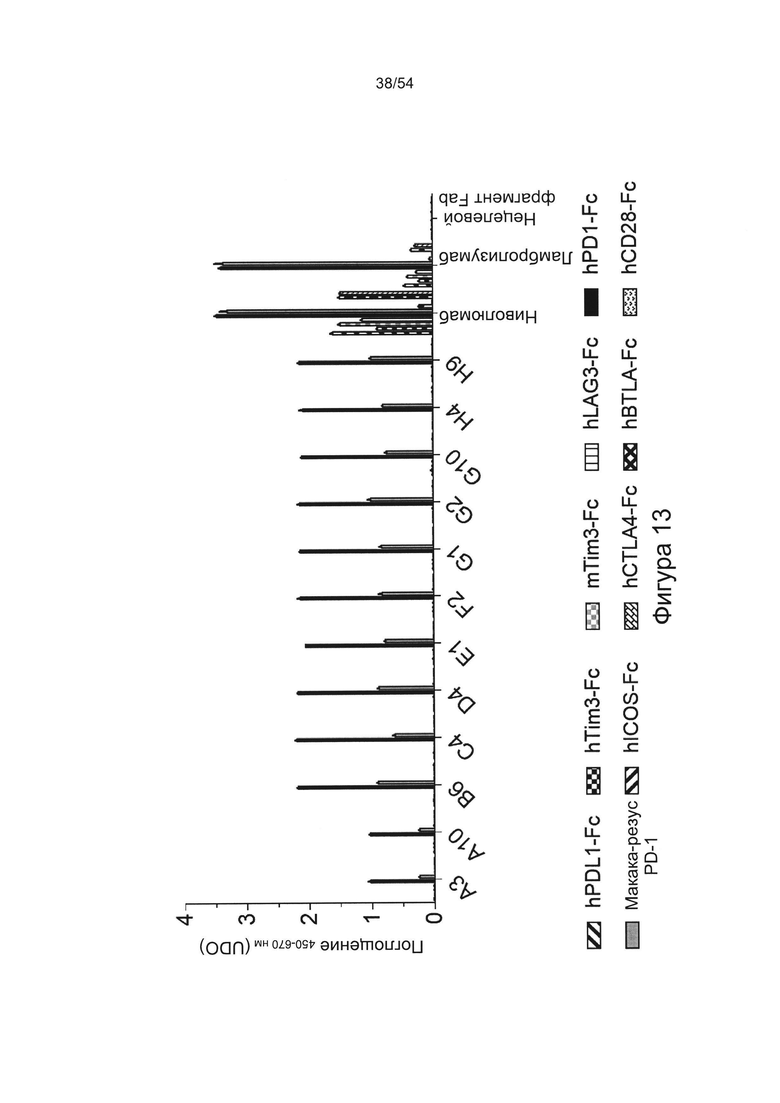
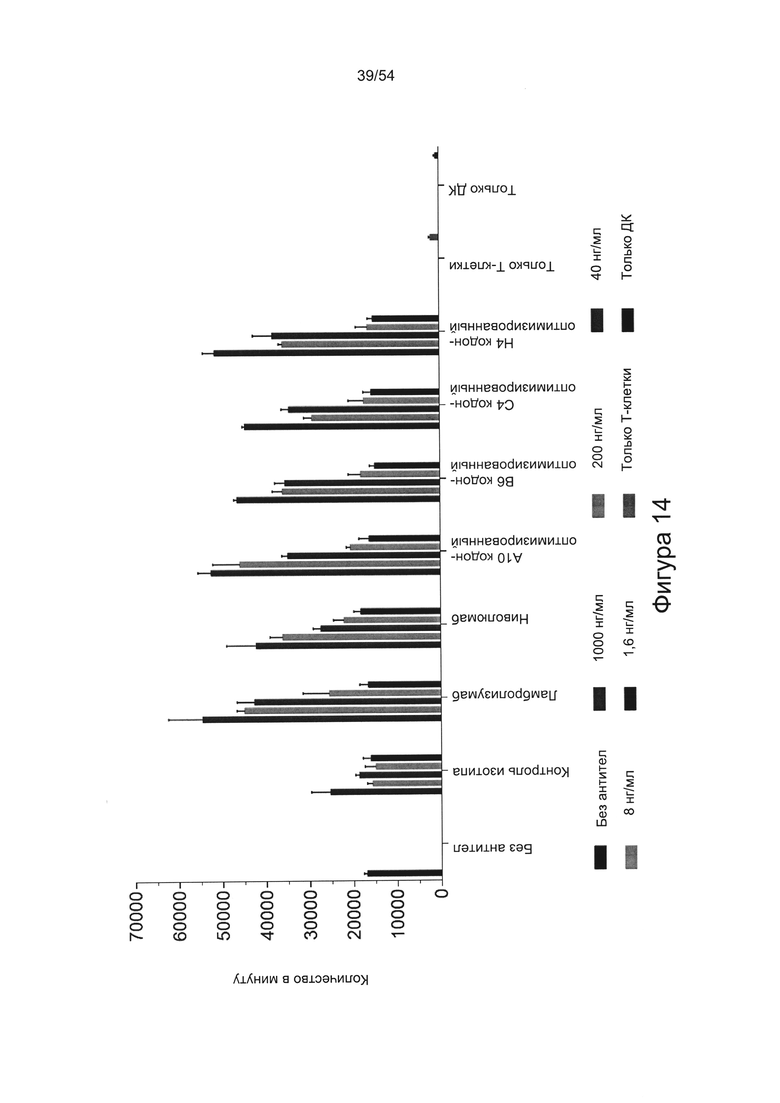

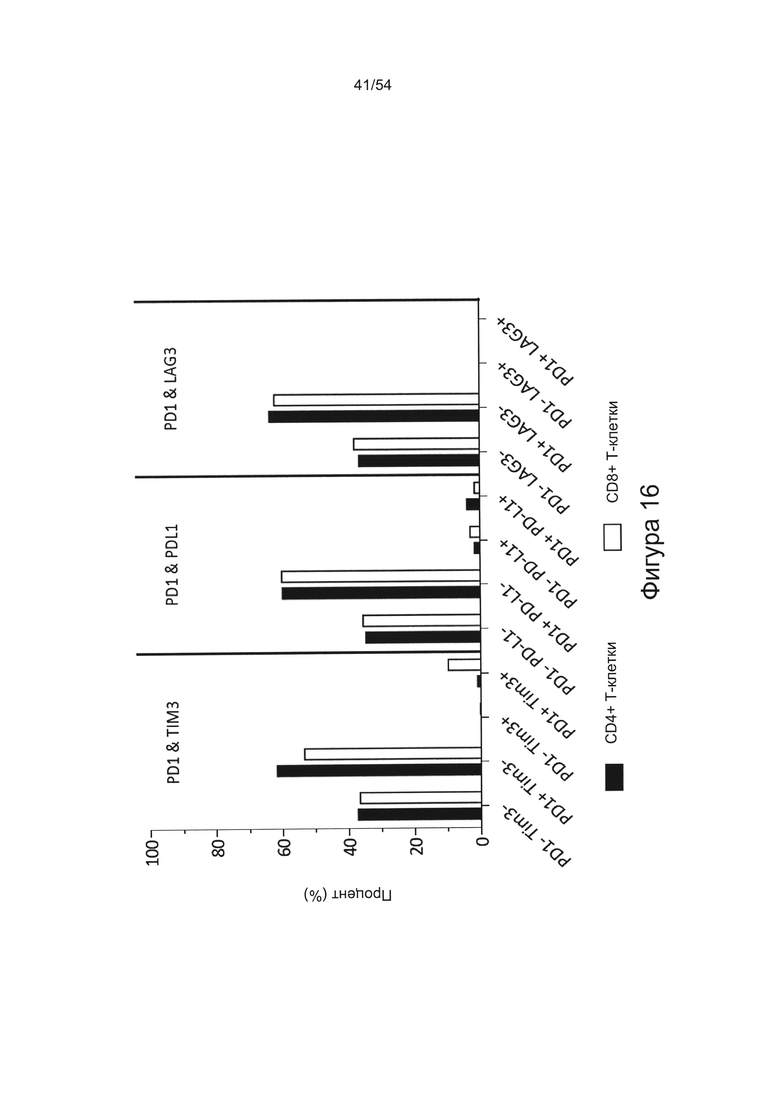
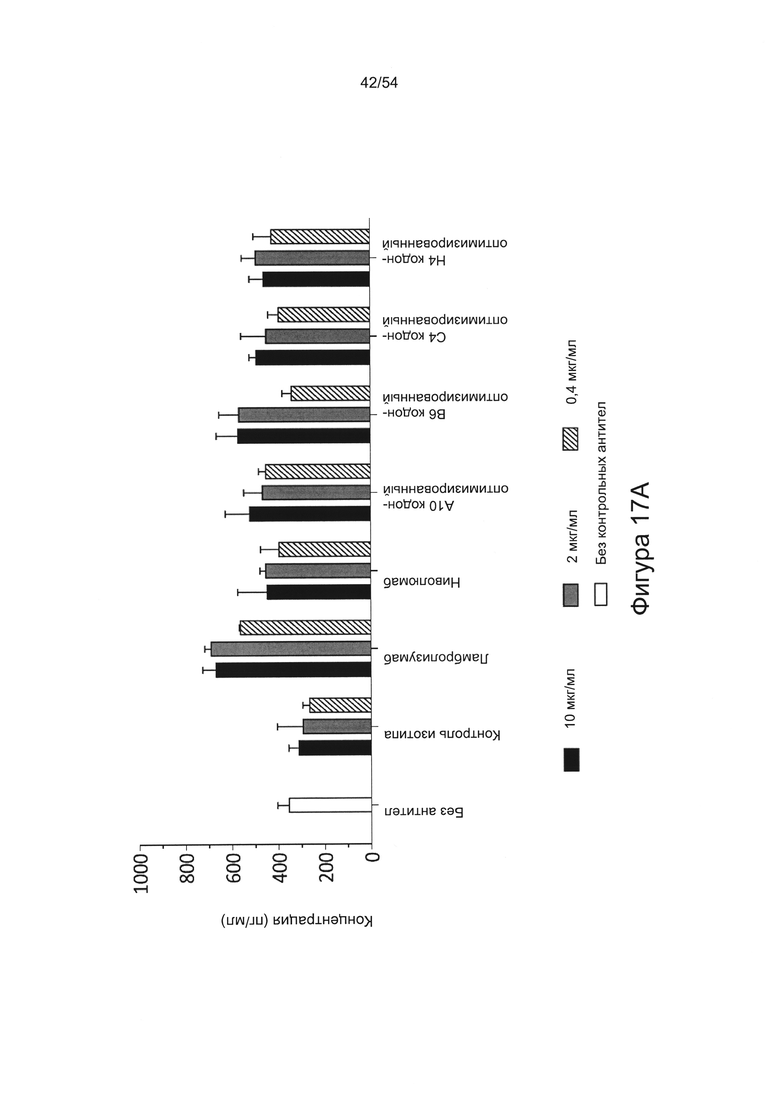
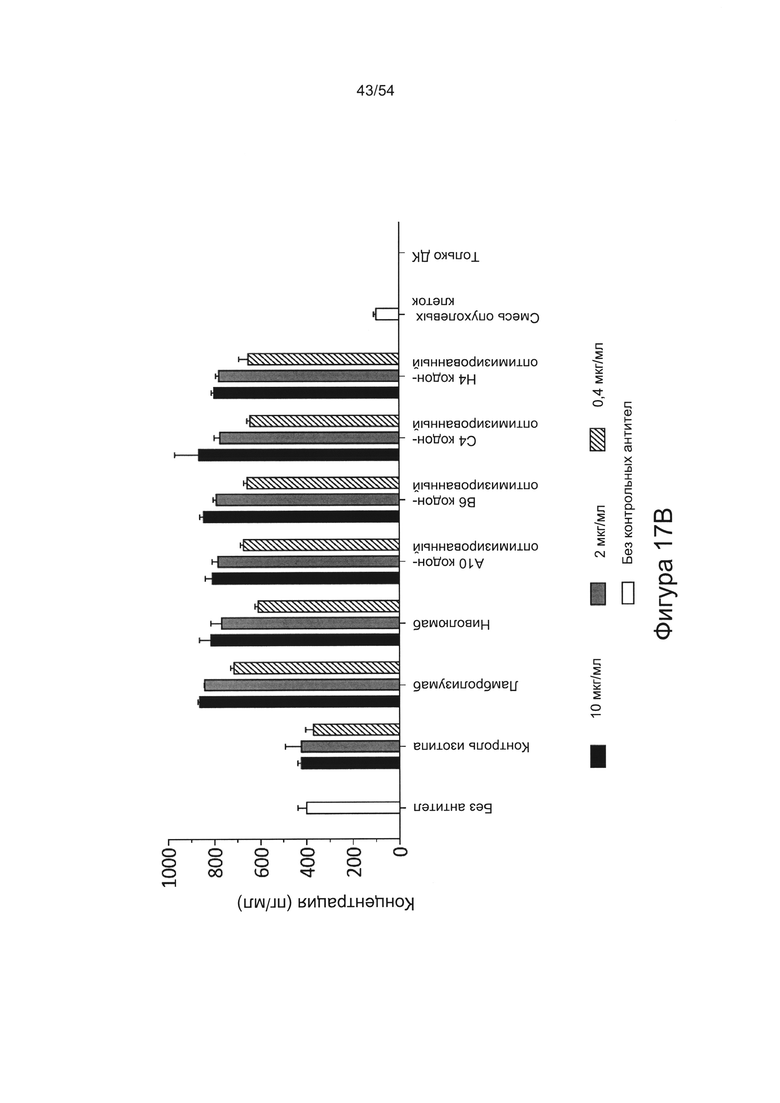
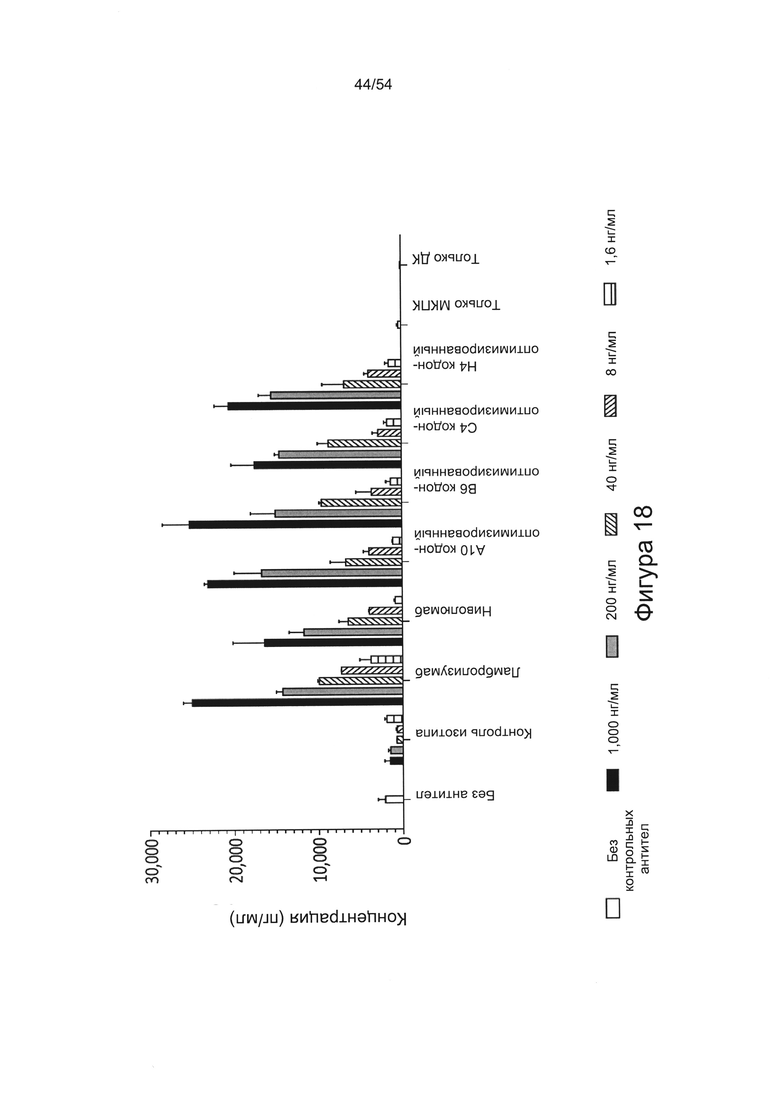
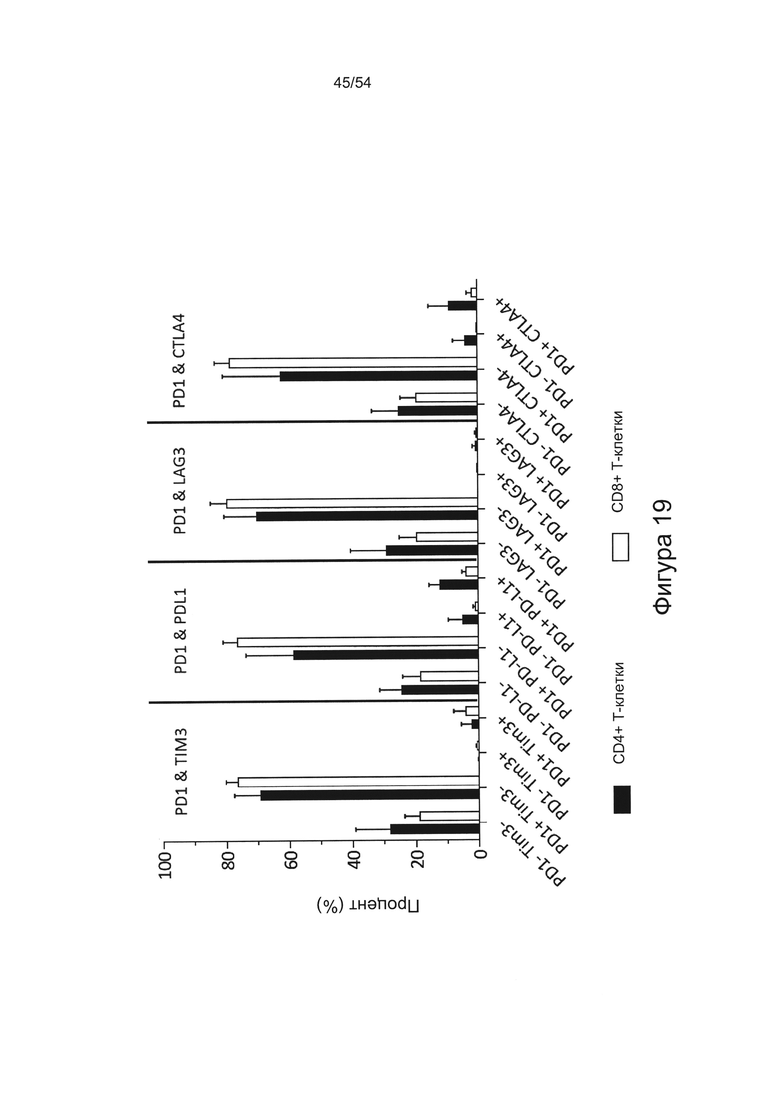
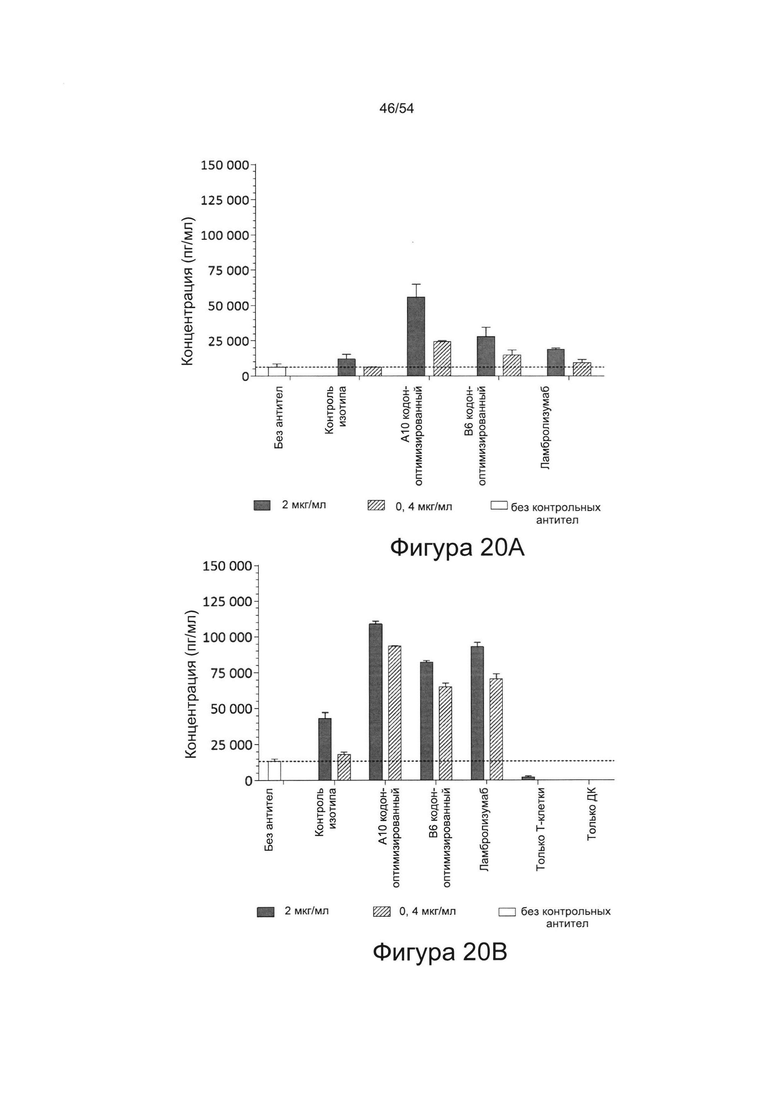
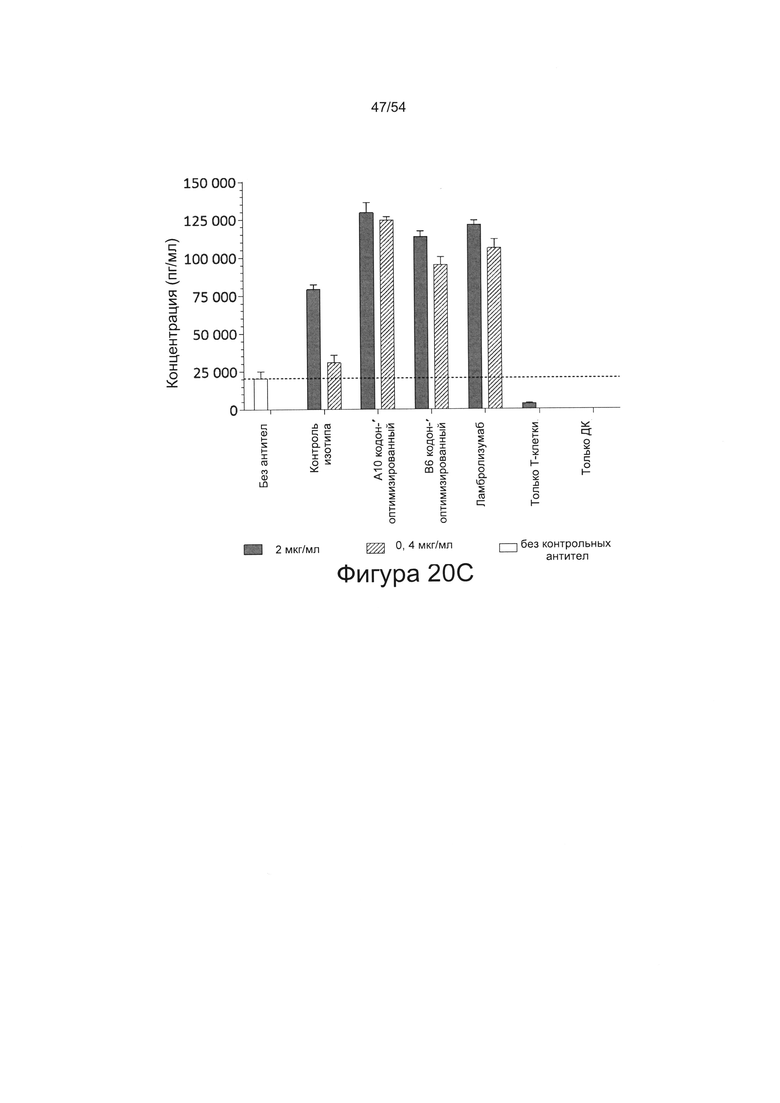
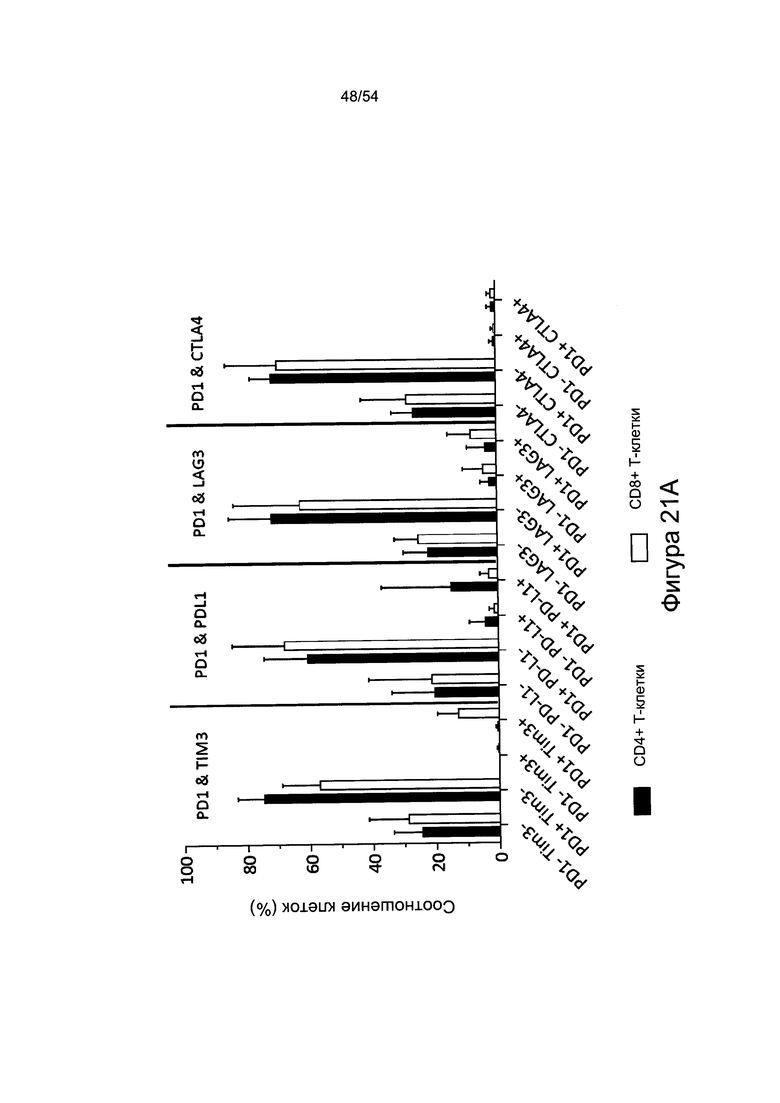
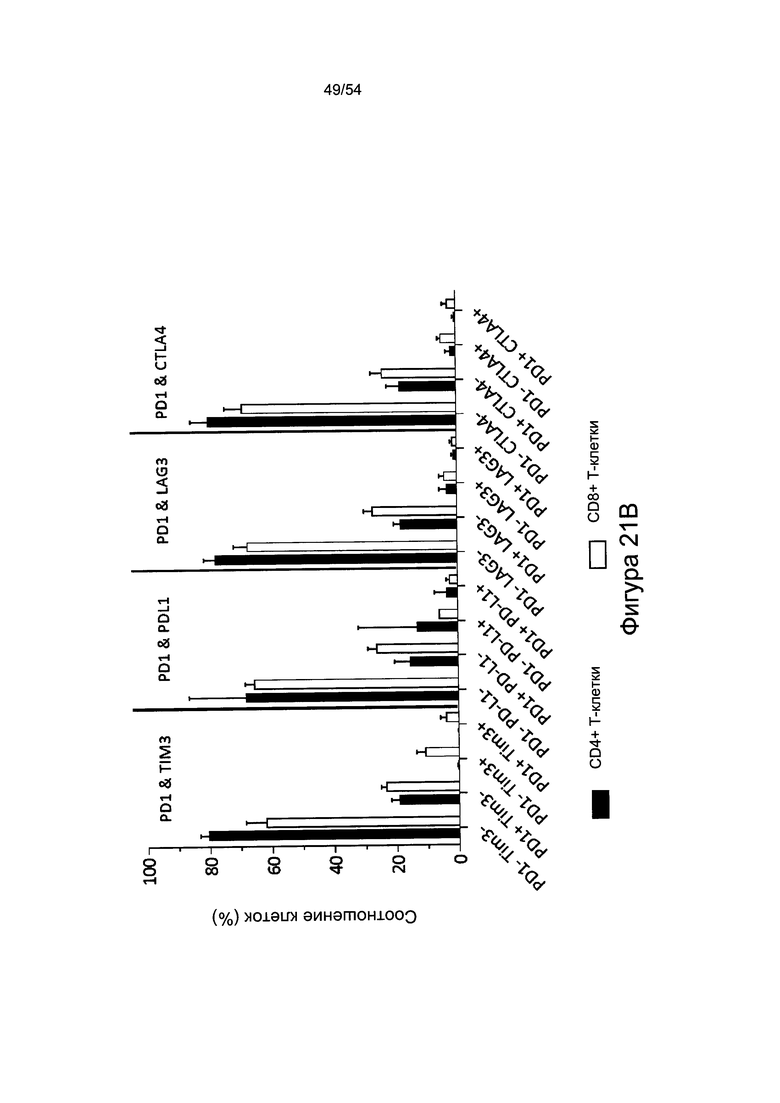
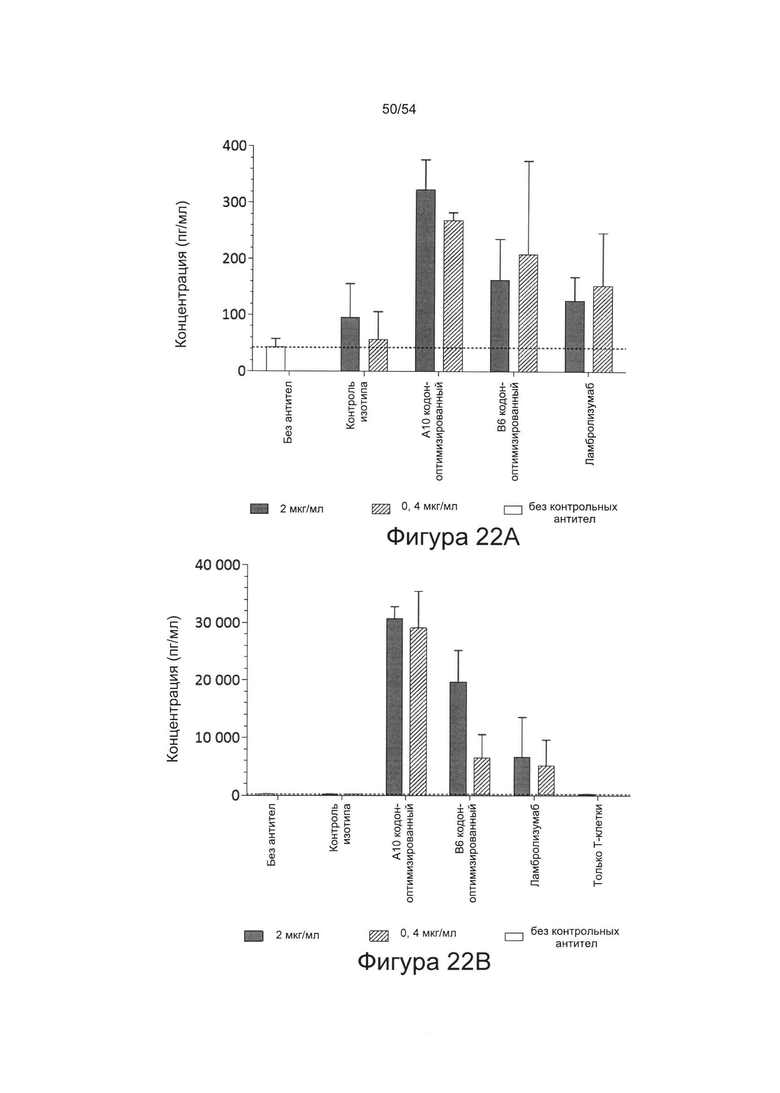
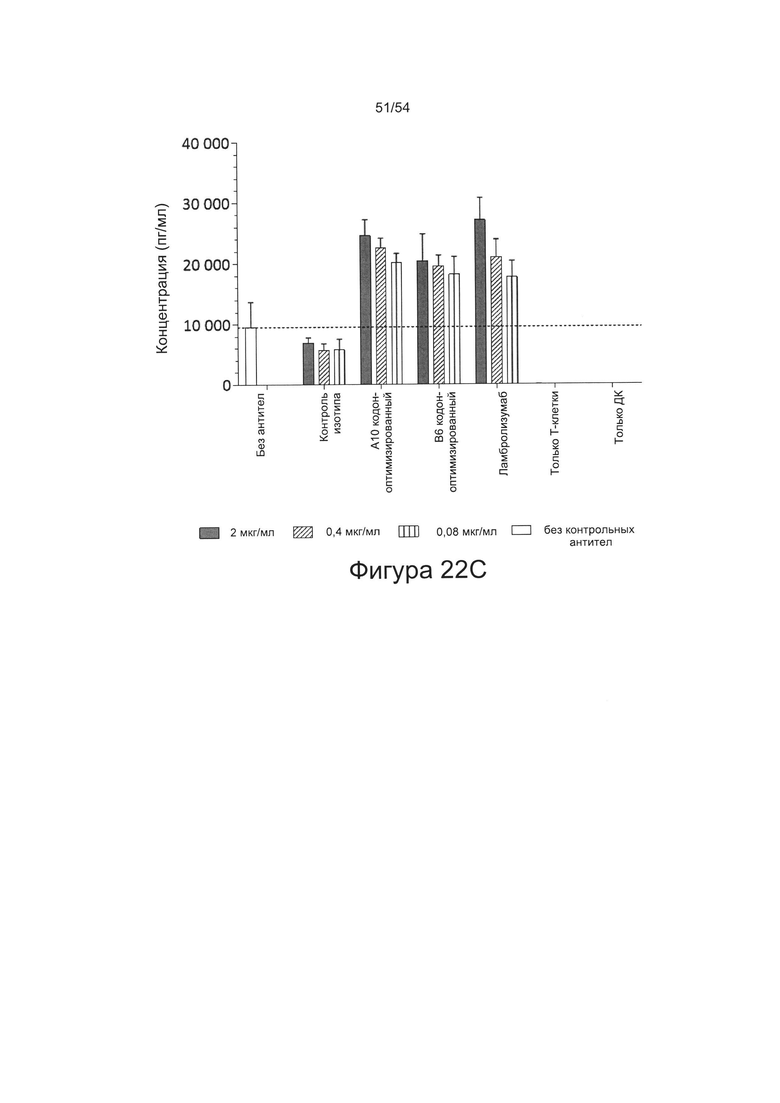
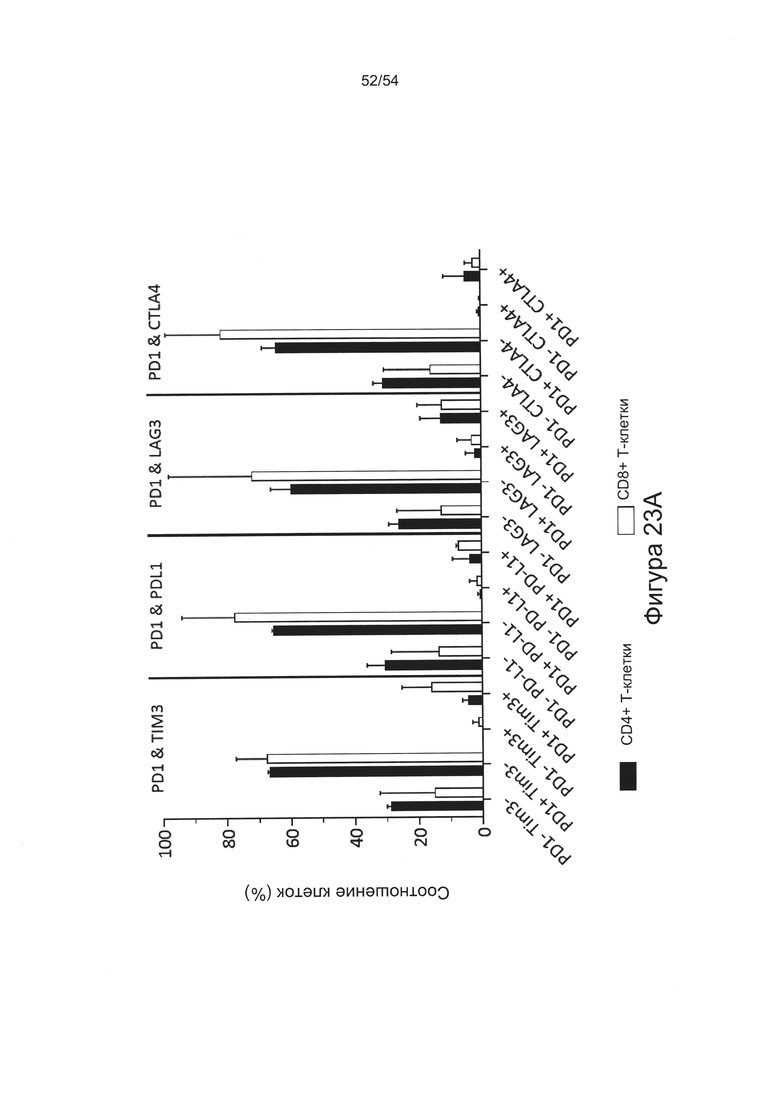
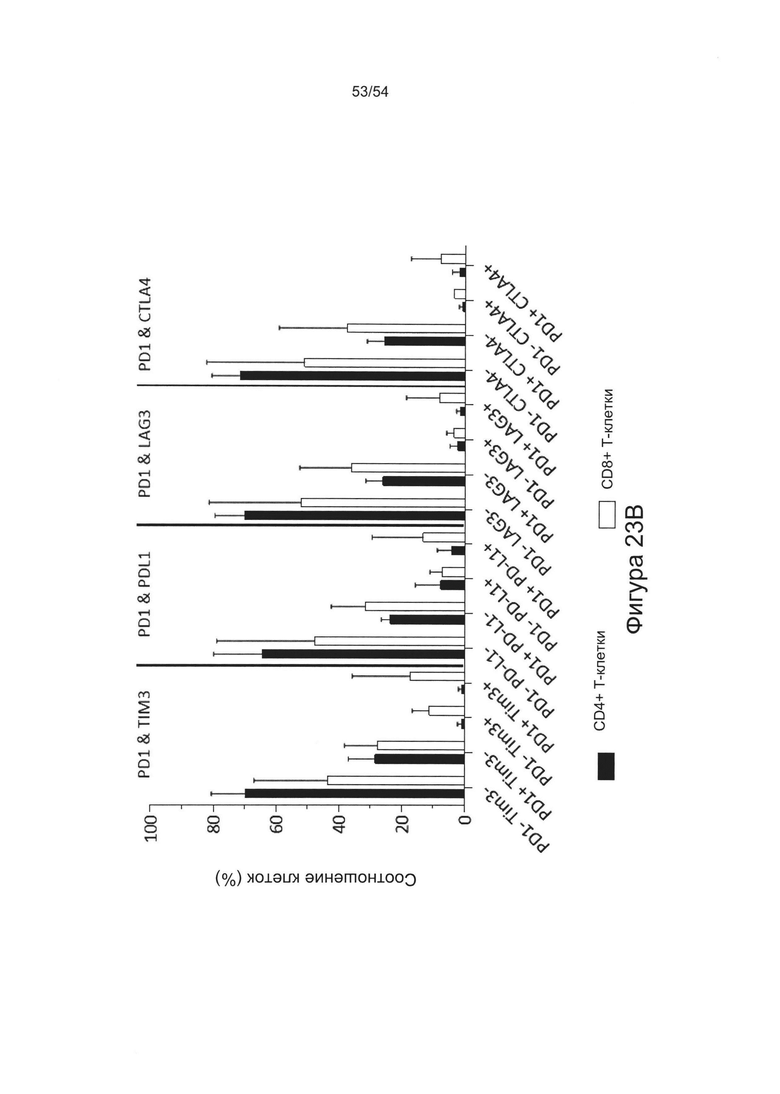
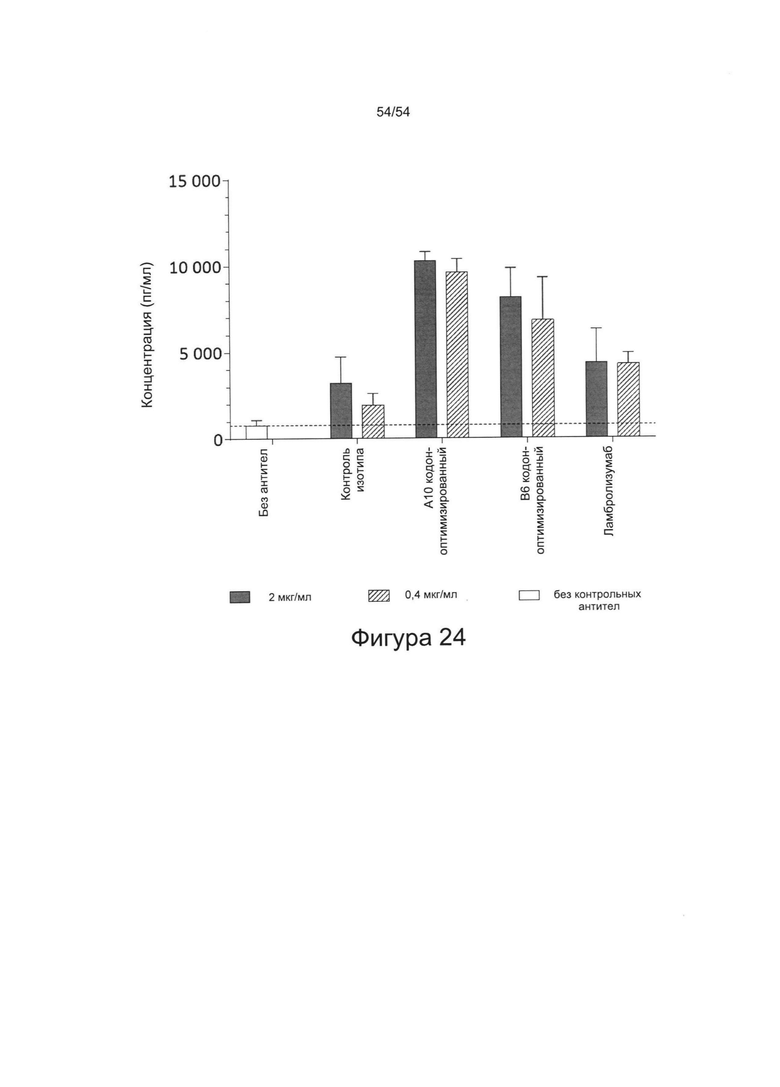
Изобретение относится к области биохимии, в частности к антителу, которое специфично связывается с PD-1. Также раскрыты композиция, содержащая указанное антитело, нуклеиновая кислота, кодирующая указанное антитело, вектор и клетка-хозяин, содержащие указанную нуклеиновую кислоту. Раскрыты способы лечения рака и инфекционного заболевания, диагностики, отбора, обнаружения, усиления с помощью указанного антитела, способ получения указанного антитела, способ размножения популяции Т-клеток и применение указанного антитела для приготовления лекарственного средства для обнаружения PD-1. Изобретение позволяет эффективно лечить заболевания, ассоциированные с PD-1. 18 н. и 3 з.п. ф-лы, 24 ил., 1 пр., 1 табл.
1. Антитело или антигенсвязывающий фрагмент, который способен специфично связываться с PD-1,
(i) содержащий по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:
LC-CDR1: SGSSSNIKFNSVN (SEQ ID NO: 25)
LC-CDR2: SNNQRPS (SEQ ID NO: 26)
LC-CDR3: ASWDDYLRGTV (SEQ ID NO: 29); и
по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:
HC-CDR1: SYGMH (SEQ ID NO: 89)
HC-CDR2: VISYDGSNKYYADSVKG (SEQ ID NO: 40)
HC-CDR3: DYGAGPYYYGMDV (SEQ ID NO: 43) ; или
(ii) содержащий по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:
LC-CDR1: SGSSSNIKFNSVN (SEQ ID NO: 25)
LC-CDR2: SNNQRPS (SEQ ID NO: 26)
LC-CDR3: ASWDDYLRGTV (SEQ ID NO: 29); и
по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:
HC-CDR1: GFTFSSYGMH (SEQ ID NO: 39)
HC-CDR2: VISYDGSNKYYADSVKG (SEQ ID NO: 40)
HC-CDR3: DYGAGPYYYGMDV (SEQ ID NO: 43); или
(iii) содержащий по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:
LC-CDR1: SGSSSNIKFNSVN (SEQ ID NO: 25)
LC-CDR2: SNNQRPS (SEQ ID NO: 26)
LC-CDR3: ASWDDYYYGTI (SEQ ID NO: 28); и
по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:
HC-CDR1: SYGMH (SEQ ID NO: 89)
HC-CDR2: VISYDGSNKYYADSVKG (SEQ ID NO: 40)
HC-CDR3: DLGAGPYYYGKDV (SEQ ID NO: 42), или
(iv) содержащий по меньшей мере одну вариабельную область легкой цепи, содержащую следующие CDR:
LC-CDR1: SGSSSNIKFNSVN (SEQ ID NO: 25)
LC-CDR2: SNNQRPS (SEQ ID NO: 26)
LC-CDR3: ASWDDYYYGTI (SEQ ID NO: 28); и
по меньшей мере одну вариабельную область тяжелой цепи, содержащую следующие CDR:
HC-CDR1: GFTFSSYGMH (SEQ ID NO: 39)
HC-CDR2: VISYDGSNKYYADSVKG (SEQ ID NO: 40)
HC-CDR3: DLGAGPYYYGKDV (SEQ ID NO: 42).
2. Антитело или антигенсвязывающий фрагмент по п.1, содержащий последовательность вариабельной области тяжелой цепи и последовательность вариабельной области легкой цепи, где
последовательность тяжелой цепи выбрана из SEQ ID NO: 15 или 14 и
последовательность легкой цепи выбрана из SEQ ID NO: 3 или 2.
3. Антитело или антигенсвязывающий фрагмент по п.1 или 2, отличающийся тем, что указанное антитело или антигенсвязывающий фрагмент специфично связывается с PD-1 человека или макаки-резуса по сравнению с другими членами семейства CD28.
4. Антитело или антигенсвязывающий фрагмент по любому из пп. 1-3, отличающийся тем, что указанное антитело или антигенсвязывающий фрагмент является эффективным для восстановления функции T-клеток в T-клетках, проявляющих истощение T-клеток или анергию T-клеток.
5. Антитело или антигенсвязывающий фрагмент, который способен специфично связываться с PD-1, который представляет собой биспецифичное антитело или биспецифичный антигенсвязывающий фрагмент, содержащий (i) антигенсвязывающий фрагмент по любому из пп. 1-4 и (ii), антигенсвязывающий домен, способный специфично связываться с одним из TIM-3, LAG-3, ICOS, CTLA4, BTLA или CD28.
6. Фармацевтическая композиция, содержащая эффективное количество антитела или антигенсвязывающего фрагмента по любому из пп. 1-5 и по меньшей мере один фармацевтически приемлемый носитель.
7. Выделенная нуклеиновая кислота, кодирующая указанное антитело или антигенсвязывающий фрагмент по любому из пп. 1-5.
8. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 7.
9. Клетка-хозяин, способная экспрессировать антитело по п.1, содержащая вектор экспрессии по п. 8.
10. Способ получения антитела или антигенсвязывающего фрагмента по любому из пп. 1-5, включающий культивирование клетки-хозяина по п. 9 в условиях, подходящих для экспрессии указанного вектора, кодирующего антитело или антигенсвязывающий фрагмент, и выделение указанного антитела или антигенсвязывающего фрагмента.
11. Применение антитела или антигенсвязывающего фрагмента по любому из пп. 1-5 в приготовлении лекарственного средства для применения в лечении рака.
12. Применение антитела или антигенсвязывающего фрагмента по любому из пп. 1-5 в приготовлении лекарственного средства для применения в лечении инфекционного заболевания.
13. Способ in vitro или in vivo усиления эффекторной функции T-клетки, включающий введение антитела или антигенсвязывающего фрагмента по любому из пп. 1-5 в T-клетку, проявляющую истощение T-клеток.
14. Способ лечения рака, включающий введение антитела или антигенсвязывающего фрагмента по любому из пп. 1-5 пациенту, страдающему от рака.
15. Способ лечения инфекционного заболевания, включающий введение антитела или антигенсвязывающего фрагмента по любому из пп. 1-5 пациенту, страдающему от инфекционного заболевания.
16. Способ обнаружения PD-1, включающий приведение образца, содержащего или предположительно содержащего PD-1, в контакт с антителом или антигенсвязывающим фрагментом по любому из пп 1-5 и обнаружение образования комплекса антитела или антигенсвязывающего фрагмента и PD-1.
17. Способ диагностики заболевания или состояния у субъекта, причем указанный способ включает приведение образца, полученного от субъекта, в контакт с антителом или антигенсвязывающим фрагментом по любому из пп. 1-5 в условиях in vitro и обнаружение образования комплекса указанного антитела или антигенсвязывающего фрагмента и PD-1.
18. Способ отбора или стратификации субъекта для лечения с использованием агентов, нацеленных к PD-1, причем указанный способ включает приведение образца, полученного от субъекта, в контакт с антителом или антигенсвязывающим фрагментом по любому из пп. 1-5 в условиях in vitro, и обнаружение образования комплекса указанного антитела или антигенсвязывающего фрагмента и PD-1.
19. Применение антитела или антигенсвязывающего фрагмента по любому пп. 1-5 для обнаружения PD-1 в условиях in vitro.
20. Способ размножения популяции T-клеток, отличающийся тем, что T-клетки в условиях in vitro или ex vivo приводят в контакт с антителом или антигенсвязывающим фрагментом по любому из пп. 1-5.
21. Способ лечения субъекта, страдающего от рака или инфекционного заболевания, причем указанный способ включает культивирование T-клеток, полученных из образца крови субъекта, в присутствии антитела или антигенсвязывающего фрагмента по любому из пп. 1-5 так, чтобы обеспечить размножение популяции T-клеток, сбор размноженных T-клеток и введение указанных размноженных T-клеток субъекту, нуждающемуся в лечении.
| Рабочий орган хлопкоуборочного аппарата | 1988 |
|
SU1576014A1 |
| RU 2007145419 A, 20.06.2009 | |||
| AU 2013204861 A1, 09.05.2013. | |||
Авторы
Даты
2020-03-02—Публикация
2015-10-27—Подача