Настоящей заявке испрашивается приоритет по китайской патентной заявке №201910713742.1, поданной 2 августа 2019 года, полное содержание которой включено в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[01] Изобретение относится к антителу против TNFR2 или его антигенсвязывающему фрагменту, фармацевтической композиции, содержащей антитело против TNFR2 или его антигенсвязывающий фрагмент, и к их применению.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[02] Иммунитет представляет собой защитный ответ организма, на который влияет множество генов, белков и клеток. Иммунные нарушения могут вызывать множество заболеваний, включая опухоли, иммунодефицит (например, СПИД), аллергию и ревматоидный артрит. За последние несколько лет иммунотерапия опухоли в качестве новейшего способа лечения стала точкой притяжения в области исследований терапии опухоли. Антитела-антагонисты, которые нацелены на белки иммунных точек контроля, такие как моноклональные антитела против PD-1 и против CTLA-4, используются для лечения различных типов злокачественных опухолей и достигают революционных результатов, значительно продлевая период выживания пациентов со злокачественными опухолями. Однако все еще существует множество пациентов со злокачественной опухолью, которые не отвечают на лечение антителами-антагонистами против белков иммунных точек контроля или у которых развивается резистентность или лекарственная устойчивость после кратковременного лечения. Таким образом, является необходимой разработка новых лекарственных средств для лечения злокачественной опухоли, которые могут использоваться отдельно или в комбинации с другими способами лечения и антителами-антагонистами, нацеленными на белки иммунных точек контроля, для дальнейшего повышения эффективности и безопасности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[03] Авторы изобретения обнаружили, что TNFR2 человека сверхэкспрессируется на поверхности Treg человека и различных опухолевых клеток человека, что указывает на то, что TNFR2 человека может способствовать образованию опухоли у пациентов и опосредовать иммуносупрессию и иммунное ускользание в микроокружении опухоли.
[04] Противоопухолевой стратегией, имеющей очень высокий потенциал, может быть регуляция функции Treg-клеток через TNFR2 для ингибирования возникновения опухолей. Авторы изобретения получил антитело-антагонист TNFR2, которое может 1) специфически связываться с TNFR2, блокировать связывание TNFR2 с лигандом TNFα, таким образом, ингибируя пролиферацию Treg-клеток и ингибиторную функцию, опосредуемую Treg-клетками, и способствуя экспансии T-клеток и противоопухолевой функции, опосредуемой T-клетками и другими иммунными клетками. Кроме того, 2) вследствие высокой экспрессии TNFR2 в опухолевых клеточных линиях человека, антитело также может прямо опосредовать эффект уничтожения на опухолевые клетки с высокой экспрессией TNFR2.
[05] Авторы изобретения также обнаружили, что потенциальная функция TNFR2 далее была подтверждена в соответствующих экспериментах на мышах. Результаты показывают, что антитело-антагонист TNFR2 по сравнению с моноклональным антителом против PD-1 или против PD-L1 может значительно ингибировать рост резистентных к антителу против PD-1 опухолей, снижать размер опухолей, эффективно повышать соотношение CD8+T/Treg и частично обращать вспять иммунодеплецию CD8+T-клеток в модели рака ободочной и прямой кишки CT26. Таким образом, TNFR2 может стать новой мишенью для иммунотерапии опухоли. Ожидается, что антитело-антагонист TNFR2 поможет изменить микроокружение опухоли и может использоваться отдельно и/или в комбинации с существующими антителами-антагонистами иммунных точек контроля, таким образом, имея широкую перспективу применения. По этой причине авторы изобретения получили различные антитела против TNFR2 и осуществили посредством этого настоящее изобретение.
[06] В первом аспекте настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, которые специфически связываются с TNFR2 и которые способны регулировать функцию иммунных клеток, включая Treg-клетки и/или MDSC, и могут использоваться в качестве лекарственного средства для лечения заболеваний, обусловленных иммунными нарушениями, например, опухолями.
[07] В одном варианте осуществления регуляция включает ингибирование пролиферации и/или активации Treg-клеток и/или супрессорных клеток миелоидного происхождения (MDSC). В другом варианте осуществления регуляцию осуществляют путем блокирования связывания TNFα с TNFR2.
[08] В конкретном варианте осуществления антитело или его антигенсвязывающий фрагмент содержит:
[09] (1) комбинации CDR тяжелой цепи: CDR1-VH, CDR2-VH и CDR3-VH,
[10] CDR1-VH, CDR2-VH и CDR3-VH представляют собой любую комбинацию последовательностей, выбранную из группы, состоящей из следующих последовательностей или комбинаций последовательностей, имеющих 1, 2, 3 или более инсерций, делеций и/или замен аминокислот по сравнению с комбинацией последовательностей:
[11] и/или
[12] (2) комбинации CDR легкой цепи: CDR1-VL, CDR2-VL и CDR3-VL,
[13] CDR1-VH, CDR2-VH и CDR3-VH представляют собой любую комбинацию последовательностей, выбранную из группы, состоящей из следующих последовательностей или комбинаций последовательностей, имеющих 1, 2, 3 или более инсерций, делеций и/или замен аминокислот по сравнению с комбинацией последовательностей:
[14] В частности, антитело или его антигенсвязывающий фрагмент по настоящему изобретению содержит, например, комбинацию CDR тяжелой цепи и CDR легкой цепи, выбранную из группы, состоящей из VH1+VL1, VH2+VL2, VH3+VL3, VH4+VL4, VH5+VL5, VH6+VL6, VH7+VL7, VH8+VL8, VH9+VL9, VH10+VL10, VH11+VL11, VH12+VL12, VH13+ VL13, VH14+VL14, VH15+VL15, VH16+VL16, VH17+VL17, VH18+VL18, VH19+VL19, VH20+VL20, VH21+VL21 и VH22+VL22, и комбинации CDR, имеющие 1, 2, 3 или более инсерций, делеций и/или замен аминокислота по сравнению с комбинацией CDR тяжелой цепи и CDR легкой цепи.
[15] В другом конкретном варианте осуществления настоящее изобретение относится к такому антителу или его антигенсвязывающему фрагменту, где
[16] 1) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность, показанную в SEQ ID NO: 1 и SEQ ID NO: 2, соответственно, или последовательность, обладающую 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более высоким соответствием показанной последовательности;
[17] 2) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность, показанную в SEQ ID NO: 3 и SEQ ID NO: 4, соответственно, или последовательность, обладающую 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более высоким соответствием показанной последовательности;
[18] 3) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность, показанную в SEQ ID NO: 5 и SEQ ID NO: 6, соответственно, или последовательность, обладающую 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более высоким соответствием показанной последовательности;
[19] 4) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность, показанную в SEQ ID NO: 7 и SEQ ID NO: 8, соответственно, или последовательность, обладающую 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более высоким соответствием показанной последовательности;
[20] 5) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность, показанную в SEQ ID NO: 9 и SEQ ID NO: 10, соответственно, или последовательность, обладающую 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более высоким соответствием показанной последовательности;
[21] 6) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность, показанную в SEQ ID NO: 11 и SEQ ID NO: 12, соответственно, или последовательность, обладающую 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более высоким соответствием показанной последовательности;
[22] 7) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность, показанную в SEQ ID NO: 13 и SEQ ID NO: 14, соответственно, или последовательность, обладающую 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более высоким соответствием показанной последовательности;
[23] 8) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность, показанную в SEQ ID NO: 15 и SEQ ID NO: 16, соответственно, или последовательность, обладающую 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более высоким соответствием показанной последовательности;
[24] 9) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность, показанную в SEQ ID NO: 17 и SEQ ID NO: 18, соответственно, или последовательность, обладающую 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более высоким соответствием показанной последовательности;
[25] 10) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность, показанную в SEQ ID NO: 19 и SEQ ID NO: 20, соответственно, или последовательность, обладающую 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более высоким соответствием показанной последовательности; или
[26] 11) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность, показанную в SEQ ID NO: 21 и SEQ ID NO: 22, соответственно, или обладают 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или более высоким соответствием показанной последовательности.
[27] В предпочтительном варианте осуществления антитело или его антигенсвязывающий фрагмент по настоящему изобретению имеет константу диссоциации (KD) не более 5 нМ для связывания с TNFR2 человека и не более 5 нМ для связывания с TNFR2 яванского макака.
[28] В предпочтительном варианте осуществления антитело или его антигенсвязывающий фрагмент по настоящему изобретению представляет собой химерное, или химеризованное, или полностью человеческое антитело или антигенсвязывающий фрагмент.
[29] В предпочтительном варианте осуществления антитело или его антигенсвязывающий фрагмент по настоящему изобретению содержит константную область, выбранную из группы, состоящей из IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgE и IgD человека, и антитело или антигенсвязывающий фрагмент:
[30] 1) специфически связывается с клетками, которые экспрессируют TNFR2 на клеточной поверхности;
[31] 2) специфически связывается с Treg-клетками;
[32] 3) ингибирует связывание TNFα с белком TNFR2;
[33] 4) ингибирует связывание TNFα с TNFR2, экспрессируемым на клеточной поверхности;
[34] 5) ингибирует опосредуемую TNFα пролиферацию Treg и/или функцию Treg;
[35] 6) опосредует функцию ADCC против TNFR2-экспрессирующих клеток; или/и
[36] 7) ингибирует рост опухоли.
[37] В другом предпочтительном варианте осуществления антигенсвязывающий фрагмент по настоящему изобретению выбран из группы, состоящей из F(ab)2, Fab', Fab, Fv, scFv, биспецифических антител, наноантител и минимальных распознающих компонентов антител.
[38] В другом варианте осуществления антитело или его антигенсвязывающий фрагмент по настоящему изобретению может конкурировать с антителом, выбранным из группы, состоящей из антител номер 001, 088, 125, 133, 219, 224, 226, 309, 352, 365 и 395, за связывание с TNFR2.
[39] Во втором аспекте настоящее изобретение относится к полинуклеотиду, кодирующему антитело или его антигенсвязывающий фрагмент или любую их комбинацию, как описано в первом аспекте выше.
[40] В третьем аспекте настоящее изобретение относится к экспрессирующему вектору, содержащему полинуклеотид, как описано во втором аспекте выше.
[41] В четвертом аспекте настоящее изобретение относится к клетке, содержащей экспрессирующий вектор, как описано для третьего аспекта выше. Клетка представляет собой, например, прокариотическую или эукариотическую клетку, включая клетки яичника китайского хомячка, дрожжевые клетки, клетки насекомых, Escherichia coli и Bacillus subtilis.
[42] В пятом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей антитело или его антигенсвязывающий фрагмент, как описано для первого аспекта выше, полинуклеотид, как описано для второго аспекта, экспрессирующий вектор, как описано для третьего аспекта, или клетку, как описано для четвертого аспекта, и фармацевтически приемлемый носитель.
[43] В одном варианте осуществления фармацевтическая композиция по настоящему изобретению, кроме того, содержит дополнительные противоопухолевые средства. Дополнительные противоопухолевые средства выбраны, например, из группы, состоящей из химиотерапевтических средств, таргетных терапевтических средств и иммунотерапевтических средств, например, терапевтических средств против PD-1/PD-L1 (включая антитела против PD-1 и антитела против PD-L1) и терапевтических средств против CTLA-4 (включая антитела против CTLA-4).
[44] В шестом аспекте настоящее изобретение относится к набору, содержащему антитело или его антигенсвязывающий фрагмент, как описано для первого аспекта выше, полинуклеотид, как описано для второго аспекта, экспрессирующий вектор, как описано для четвертого аспекта, или клетку, как описано для четвертого аспекта, и инструкции по применению.
[45] В седьмом аспекте настоящее изобретение относится к способу лечения и/или предупреждения обусловленных иммунным нарушением заболеваний, причем способ включает введение индивидууму, нуждающемуся в этом, антитела или его антигенсвязывающего фрагмента, как описано для первого аспекта, полинуклеотида, как описано для второго аспекта, экспрессирующего вектора, как описано для третьего аспекта, клетки, как описано для четвертого аспекта, или фармацевтической композиции, как описано для пятого аспекта. Обусловленные иммунным нарушением заболевания представляют собой, например, обусловленные иммунным нарушением заболевания, характеризующиеся нарушениями sTNFR2, включая заболевания, связанные с функцией Treg-клеток и/или MDSC, в частности, опухоль.
[46] В одном варианте осуществления способ по настоящему изобретению, кроме того, включает проведение у индивидуума дополнительной противоопухолевой терапии, включая химиотерапию, лучевую терапию, таргетную терапию и иммунотерапию, например, терапию против PD-1/PD-L1, такую как антитело против PD-1/PD-L1, терапию против CTLA-4, такую как антитело против CTLA-4.
[47] В одном варианте осуществления обусловленное заболевание представляет собой опухоль, предпочтительно выбранную из:
[48] 1) рака яичника, развернутой эпидермальной T-клеточной лимфомы, метастазирующего рака ободочной и прямой кишки стадии III/IV, тройного негативного рака молочной железы и/или рака поджелудочной железы; или,
[49] 2) метастазирующей меланомы или другой возможной развернутой солидной опухоли, резистентной к терапии CTLA-4 и PD-1.
[50] В восьмом аспекте настоящее изобретение относится к лекарственному продукту соответствующему способу, описанному для седьмого аспекта выше, который используется в профилактическом и/или терапевтическом способе, описанном для седьмого аспекта. Кроме того, настоящее изобретение относится к применению для получения лекарственного средства или набора в соответствии со способом, описанным для седьмого аспекта, где продукт согласно аспектам с первого по пятый выше используют для производства, и лекарственное средство или набор используют для способа предупреждения и/или лечения, описанного для седьмого аспекта выше.
[51] В девятом аспекте настоящее изобретение относится к способу детекции sTNFR2, который включает приведение в контакт образца, предположительно содержащего sTNFR2, с антителом или его антигенсвязывающим фрагментом согласно первому аспекту. Способ детекции может использоваться для диагностики заболеваний, обусловленных иммунными нарушениями, характеризующимися нарушениями sTNFR2, например, диагностики того, страдает ли индивидуум, от которого получен образец, от обусловленных иммунным нарушением заболеваний (таких как заболевания, обусловленные функцией Treg-клеток и/или MDSC), или имеет ли он риск их возникновения. Таким образом, настоящее изобретение также относится к применению реагента для детекции sTNFR2 для получения набора для диагностики того, страдает ли индивидуум, от которого получен образец, от обусловленного иммунным нарушением заболевания (такого как обусловленное иммунным нарушением заболевание, связанное с нарушением экспрессии TNFR2), или имеет ли он риск его возникновения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[52] Вышеупомянутые аспекты и другие аспекты изобретения будут подробно объяснены в приведенном ниже подробном описании изобретения и на прилагаемых чертежах. Чертежи предоставлены для иллюстрации некоторых предпочтительных вариантов осуществления изобретения, однако следует понимать, что изобретение не ограничивается конкретными описанными вариантами осуществления.
[53] На фиг. 1 представлена степень экспрессии TNFR2 в 13 опухолевых клеточных линиях человека. Позитивную долю определяют в соответствии с выявленной величиной для соответствующего изотипического контрольного антитела после окрашивания посредством проточно-цитометрической флуоресцентной сортировки (FACS), и процент, показанный на фигуре, представляет собой процент экспрессии TNFR2.
[54] На фиг. 2 представлена степень экспрессии TNFR2 на Treg, CD8+ T-клетках и CD4+CD25-Tcon-клетках в мононуклеарных клетках периферической крови (PBMC) человека. На фиг. 2A представлен график рассеяния для окрашивания посредством проточной цитометрии и стратегия гейтирования Treg-клеток, CD8+ T-клеток и Tcon-клеток, и уровень экспрессии TNFR2 на этих клетках; на фиг. 2B представлена доля и средняя величина интенсивности флуоресценции (MFI) для экспрессии TNFR2 в активированных Treg (CD4+CD25hiFoxP3hi Treg), инактивированных Treg (CD4+CD25hiFoxP3+ Treg), Tcon (CD4+CD25-T cells) и CD8+ T-клетках.
[55] На фиг. 3 представлено связывание тестируемых антител с клетками CHO, которые сверхэкспрессируют TNFR2 человека (CHO-TNFR2). На фиг. 3A представлено подтверждение экспрессии TNFR2 человека на поверхности клеток CHO-TNFR2; на фиг. 3B представлено связывание 11 тестируемых антител по изобретению с TNFR2, сверхэкспрессированным на клетках CHO, среди них, отрицательными контролями в этом эксперименте являются антитело против Fc IgG1 человека с PE отдельно и изотипическое контрольное антитело против Hel (лизоцим яичного белка представляет собой внутриклеточный антиген, и он не существует в организме человека, что делает его хорошим неродственным контрольным антителом, приобретаемым от Biotron), в то время как неокрашенный контроль представляет собой пустой клеточный контроль без какого-либо окрашивания антителом.
[56] На фиг. 4 представлена связывающая способность тестируемых антител на Treg-клетках. На фиг. 4A показано, что чистота Foxp3+ Treg-клеток, использованных в эксперименте, составляет 91,4%, и доля экспрессии TNFR2 составляет 99,5% (незакрашенная диаграмма пика означает изотипическое контрольное антитело против Hel, закрашенная диаграмма пика означает антитело против TNFR2-PE); на фиг. 4B представлена связывающая способность каждого из 11 антител по изобретению на Treg-клетках (закрашенные пики), антитело против Fc IgG1 человека с PE отдельно и неокрашенный контроль (пустой клеточный контроль без добавления какого-либо антитела) представляют собой отрицательные контроли и концентрация антитела составляет 200 нг/мл.
[57] На фиг. 5 показано, что тестируемые антитела по изобретению блокируют взаимодействие между TNFα человека и TNFR2 человека, экспрессируемыми на клетках CHO-TNFR2. 002# Ab представляет собой антитело-инструмент, которое является положительным контрольным антителом в этом эксперименте; изотипическое контрольное антитело против Hel является отрицательным контрольным антителом; клеточный контроль представляет собой CHO-K1 (использованный для конструирования материнской клетки для CHO-TNFR2, которая не экспрессирует TNFR2 человека).
[58] На фиг. 6 представлен ингибиторный эффект тестируемых антител по изобретению на ингибиторную активность Treg в отношении пролиферации Tcon-клеток. По оси ординат представлены различные антитела, по оси абсцисс представлено следующее (доля пролиферации отвечающих клеток для каждого антитела - доля пролиферации отвечающих клеток для контрольного антитела)/доля пролиферации отвечающих клеток для контрольного антитела × 100%, причем контрольное антитело представляет собой антитело против Hel, экспериментальная концентрация каждого антитела составляет 12,5 мкг/мл, и используемые отвечающие клетки представляют собой CD4+CD25-Tcon-клетки.
[59] На фиг. 7 представлен эффект тестируемых антител по изобретению на экспрессию sTNFR2 в супернатанте клеток в анализе ингибирования функции Treg. По оси ординат представлены различные антитела, по оси абсцисс представлено следующее (уровень экспрессии sTNFR2 в супернатанте клеток для каждого тестируемого антитела - уровень экспрессии sTNFR2 в супернатанте клеток для контрольного антитела)/уровень экспрессии sTNFR2 в супернатанте клеток для контрольного антитела × 100%, контрольное антитело представляет собой антитело против Hel и экспериментальная концентрация каждого антитела составляет 12,5 мкг/мл.
[60] На фиг. 8 представлено ингибирование индуцируемой TNF пролиферации Treg-клеток посредством тестируемых антител по изобретению. На фиг. 8A представлена пролиферация Treg-клеток после культивирования в течение 3 суток без цитокина или с IL-2 отдельно, или с IL-2 и TNFα. На фиг. 8B представлен ингибиторный эффект различных антител на индуцируемую TNFα пролиферацию Treg. По оси ординат представлены различные антитела, по оси абсцисс представлено следующее (ингибиторная способность каждого антитела в отношении индуцируемой TNFα пролиферации Treg - ингибиторная способность контрольного антитела в отношении индуцируемой TNFα пролиферации Treg)/ингибиторная способность контрольного антитела в отношении индуцируемой TNFα пролиферации Treg × 100%, контрольное антитело представляет собой антитело против Hel и экспериментальная концентрация каждого антитела составляет 12,5 мкг/мл.
[61] На фиг. 9 представлен результат ELISA для эффекта блокирования тестируемыми антителами по изобретению секреции sTNFR2 в индуцированных посредством IL-2 и TNFα CD4+ T-клетках. Способ статистического анализа является следующим: Graphpad prism 6, односторонний = ANOVA, ** P < 0,01, *** P < 0,001.
[62] На фиг. 10 представлен эффект тестируемых антител по настоящему изобретению в отношении уничтожения посредством антителозависимой клеточной цитотоксичности (ADCC) Treg. На фиг. 10A представлена экспрессия TNFR2 на клетке-мишени, т.е. Treg; на фиг. 10B представлено подтверждение чистоты эффекторных NK-клеток, выделенных и обогащенных из клеток периферической крови PBMC человека; На фиг. 10C представлена эффективность тестируемых антител в отношении функции ADCC, где образец # 52 представляет собой положительное в отношении ADCC контрольное антитело, подвергнутое скринингу против мишени TNFR2, и изотипический контроль против Hel представляет собой изотипический отрицательный контроль.
[63] На фиг. 11 представлен эффект тестируемых антител по изобретению в отношении уничтожения посредством ADCC клеток CHO-TNFR2, сверхэкспрессирующих TNFR2 человека. Среди них, # 219, # 224 и # 001 представляют собой тестируемые антитела и изотипический контроль против Hel представляет собой отрицательное контрольное антитело.
[64] На фиг. 12 представлен результат эффективности in vivo для резистентных к антителу против PD-1 опухолевых клеток CT26, включая изменение кривых роста опухолей (мм3, 12A), % ингибирование роста опухоли (TGI%) (12B) и изменение массы тела мыши (12C) в каждой группе дозирования.
[65] На фиг. 13 представлен анализ каждой подгруппы иммунных клеток в инфильтрирующих опухоль лимфоцитах (TIL) в опухолевых тканях мышей для эксперимента по определению эффективности против CT26 in vivo. На 13A и 13B представлены стратегии гейтирования для панели 1 и панели 2 при иммунофенотипировании FACS. На фиг. 13C представлено исследование процентов CD4+ T-клеток, CD8+ T-клеток и Treg-клеток при иммунофенотипировании посредством FACS; на фиг. 13D представлено исследование соотношения тотальных CD8+ T-клеток и Treg-клеток при иммунофенотипировании посредством FACS; на фиг. 13E представлено исследование соотношения CD8+ T-клеток памяти и Treg-клеток при иммунофенотипировании посредством FACS; на фиг. 13F представлено исследование уровня PD-1, LAG-3 и TNFR2, экспрессируемых на CD8+ T-клетках при иммунофенотипировании посредством FACS.
[66] На фиг. 14 представлен результат эксперимента по определению эффективности в отношении CT26 in vivo для 4 экспериментальных групп, который проведен с носителем, антителом против TNFR2 отдельно, антителом против PD-1 отдельно или комбинацией двух вышеупомянутых антител. На 14A представлено изменение кривых роста опухоли (мм3), на 14B представлено изменение скорости ингибирования роста опухоли (TGI%) и на 14C представлена кривая выживаемости мышей.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[67] Как используют в настоящем описании, если нет иных указаний, термины имеют значения, хорошо понятные специалистам в данной области. Для термина, прямо определенного в настоящем описании, значение термина будет приведено в определении.
[68] Как используют в настоящем описании, термин "антитело" (Ab) относится к молекуле иммуноглобулина, которая специфически связывается с или является иммунологически реактивной в отношении конкретного антигена и включает поликлональные, моноклональные, сконструированные способами генной инженерии и иным образом модифицированные формы антител (включая, но не ограничиваясь ими химерные антитела, гуманизированные антитела, полностью человеческие антитела, гетероконъюгатные антитела (например, би-, три- и тетраспецифические антитела, диатела, триатела и тетратела), конъюгаты антител) и антигенсвязывающие фрагменты антител (включая, например, Fab'-, F(ab')2-, Fab-, Fv-, rIgG- и scFv-фрагменты). Более того, если нет иных указаний, под термином "моноклональное антитело" (mAb) подразумевают как интактные молекулы, так и фрагменты антител (например, Fab- и F(ab’)2-фрагменты), которые способны специфически связываться с белком-мишенью. Fab- и F(ab’)2-фрагменты лишены Fc-фрагментов интактного антитела, выводятся быстрее из кровотока животного и, таким образом, лишены Fc-опосредуемой эффекторной функции (см. Wahl et al., J. Nucl. Med. 24: 316, 1983; включенную в настоящее описание в качестве ссылки).
[69] Как используют в настоящем описании, термин "антигенсвязывающий фрагмент" относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном-мишенью. Антигенсвязывающая функция антитела может выполняться фрагментами полноразмерного антитела. Фрагменты антител могут представлять собой Fab-фрагмент, F(ab')2-фрагмент, scFv-фрагмент, SMIP, диатело, триатело, аффитело, нанотело, аптамер или доменное антитело. Примеры связывающих фрагментов, охватываемых термином "антигенсвязывающий фрагмент" антитела, включают, но не ограничиваются ими: (i) Fab-фрагмент, одновалентный фрагмент, состоящий из доменов VL, VH, CL и CH; (ii) F(ab)2-фрагмент, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fab-фрагмент, состоящий из доменов VH и CH; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела; (V) dAb, включающий домены VH и VL; (vi) dAb-фрагмент состоящий из домена VH (Ward et al., Nature 341: 544-546, 1989); (vii) dAb, состоящий из домена VH или VL; (viii) выделенную определяющую комплементарность область (CDR); и (ix) комбинацию двух или более выделенных CDR, которые необязательно могут быть связаны синтетическими линкерами. Более того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, они могут быть связаны с использованием рекомбинантного способа посредством линкера, который позволяет получение их в качестве одной белковой цепи, в которой домены VL и VH образуют пару, формируя одновалентные молекулы (известный как одноцепочечный Fv (scFv); см. например, Bird et al., Science 242: 423-426, 1988, и Huston et al., Proc. Natl. Acad. Sci. USA 85: 5879-5883, 1988). Эти фрагменты антител могут быть получены с использованием общепринятых способов, известных специалистам в данной области, и фрагменты могут быть подвергнуты скринингу в отношении пригодности аналогично тому, как и интактные антитела. Антигенсвязывающие фрагменты могут быть получены способами рекомбинантных ДНК, посредством ферментативного или химического расщепления интактных иммуноглобулинов, или, в некоторых вариантах осуществления, посредством химических методик пептидного синтеза, известных в данной области.
[70] Как используют в настоящем описании, термин "TNFR2" относится к рецептору 2 фактора некроза опухоли, а также относится к представителю 1B суперсемейства рецептора фактора некроза опухоли (TNFRSF1B) или CD120b, который представляет собой мембранный рецептор, который связывается с фактором некроза опухоли-α (TNFα). Предпочтительно TNFR2 представляет собой TNFR2 человека.
[71] Как используют в настоящем описании, термины "антитело против рецептора 2 фактора некроза опухоли", "антитело против рецептора 2 фактора некроза опухоли", "антитело против TNFR2", "антитело против TNFR2", "часть антитела против TNFR2" и/или "фрагмент антитела против TNFR2" и т.п. относятся к любой содержащей белок или пептид молекуле, которая включает по меньшей мере часть молекулы иммуноглобулина (например, но не ограничиваясь ими, по меньшей мере одну определяющую комплементарность область (CDR) тяжелой или легкой цепи или ее лиганд-связывающую часть, вариабельную область тяжелой цепи или легкой цепи, константную область тяжелой цепи или легкой цепи, каркасную область или любую ее часть), которая способна специфически связываться с TNFR2. Антитела против TNFR2 также включают антитело-подобные белковые каркасы (например, 10-й домен фибронектинового типа III (10Fn3)), которые содержат структурные петли BC, DE и FG, сходные по структуре доступности для растворителя с CDR антитела. Третичная структура домена 10Fn3 напоминает третичную структуру вариабельной области тяжелой цепи IgG, и специалист в данной области может трансплантировать, например, CDR моноклонального антитела против TNFR2 на фибронектиновый каркас путем замены остатков петель BC, DE и FG 10Fn3 остатками областей CDR-H1, CDR-H2 или CDR-H3 моноклонального антитела против TNFR2.
[72] Как используют в настоящем описании, термин "биспецифическое антитело" относится к моноклональным, часто человеческим или гуманизированным антителам, которые обладают способностью связывания по меньшей мере с двумя различными антигенами. В рамках изобретения одна из специфичностей связывания может быть направлена на антигенный эпитоп TNFR2, а другая может быть направлена на другой антигенный эпитоп TNFR2 или любого другого антигена, например, на белок клеточной поверхности, рецептор, субъединицу рецептора, тканеспецифический антиген, белок вирусного происхождения, кодируемый вирусом белок оболочки, белок бактериального происхождения или бактериальный поверхностный белок, и т.д.
[73] Как используют в настоящем описании, термин "химерное" антитело относится к антителу, имеющему вариабельные последовательности, происходящие из иммуноглобулина одного из организма, являющегося источником, такого как крыса или мышь, и константные области, происходящие из иммуноглобулина другого организма (например, человека). Способы получения химерных антител известны в данной области. См., например, Morrison, 1985, Science 229 (4719): 1202-7; Oi et al., 1986, Bio Techniques 4: 224-221; Gillies et al., 1985 J Immunol Methods 125: 191-202; включенную в настоящее описание в качестве ссылки.
[74] Как используют в настоящем описании, термин "определяющая комплементарность область" (CDR) относится к гипервариабельной области, встречающейся в вариабельных доменах как легкой цепи, так и тяжелой цепи. Более высококонсервативные части вариабельных доменов называют каркасными областями (FR). Как понятно в данной области, положения аминокислот, которые ограничивают вариабельную область антитела, могут варьироваться в зависимости от контекста и различных определений, известных в данной области. Некоторые положения в вариабельном домене могут быть рассмотрены в качестве гибридных гипервариабельных положений, поскольку эти положения могут считаться находящимися в вариабельной области согласно одному набору критериев (таких как IMGT или KABAT), в то время как могут считаться находящимися вне вариабельной области согласно другому набору критериев (таких как KABAT или IMGT). Одно или несколько из этих положений также могут быть найдены в расширенных вариабельных областях. Изобретение относится к антителам, содержащим модификации в этих гибридных вариабельных положениях. Каждый из вариабельных доменов тяжелых и легких цепей содержит четыре каркасных области, которые в основном принимают конфигурацию β-листа, соединенных тремя CDR (CDR1, CDR2 и CDR3), и которые образуют петли, которые соединяют и в некоторых случаях формируют часть структуры β-листа. CDR в каждой цепи удерживаются вместе вблизи FR-области в порядке FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4 и вместе с CDR из других цепей антител участвуют в образовании антигенсвязывающих участков антитела (см. Kabat et al., Sequences of Proteins of Immunological Interest, National Institute of Health, Bethesda, Md. 1987; включенную в настоящее описание в качестве ссылки). Как используют в настоящем описании, например, CDR1-VH, CDR2-VH и CDR3-VH относятся к первой CDR, второй CDR и третьей CDR вариабельной области тяжелой цепи (VH), соответственно, которые составляют комбинацию CDR (комбинация VHCDR) тяжелой цепи (или ее вариабельной области); CDR1-VL, CDR2-VL и CDR3-VL относятся к первой CDR, второй CDR и третьей CDR вариабельной области легкой цепи (VL), соответственно, которые составляют комбинацию CDR (комбинация VLCDR) легкой цепи (или ее вариабельной области).
[75] Как используют в настоящем описании, термин "конъюгат антитела" относится к конъюгату, образованному путем химического связывания молекулы антитела с другой молекулой, либо прямо, либо через линкер, например, конъюгату антитело-лекарственное средство (ADC), где молекула лекарственного средства представляет собой вышеупомянутую другую молекулу.
[76] Как используют в настоящем описании, термин "моноклональное антитело" относится к антителу, происходящему из одного клона (включая любой эукариотический, прокариотический или фаговый клон), и оно не ограничивается способом, посредством которого оно получено.
[77] Как используют в настоящем описании, термин "VH" относится к вариабельной области тяжелой цепи иммуноглобулина (включая тяжелую цепь Fv, scFv или Fab). Термин "VL" относится к вариабельной области легкой цепи иммуноглобулина (включая легкую цепь Fv, scFv, dsFv или Fab).
[78] Как используют в настоящем описании, термин "регуляторные T-клетки" или "Treg", также упоминаемые как супрессорные T-клетки, представляют собой группу лимфоцитов, которые регулируют иммунный ответ организма для поддержания толерантности к аутоантигенам, контроля иммунной гиперреакции, избегания иммунного повреждения нормальных клеток и предупреждения рецидива аутоиммунных заболеваний. Treg экспрессируют следующие биомаркеры: CD4, FOXP3 и CD25, которые, как полагают, происходят из той же зародышевой линии, что и незрелые клетки CD47. Treg играют чрезвычайно важную роль в возникновении опухолей. Во многих исследованиях было показано, что количество Treg-клеток в микроокружении опухоли значительно возрастало, включая меланому, рак яичника, рак молочной железы, рак толстого кишечника, рак легкого, рак поджелудочной железы и т.д. Между тем, количество Treg-клеток также было тесно связано с выживаемостью пациентов с опухолью. Кроме того, опухолевые клетки могут индуцировать пролиферацию инфильтрирующих опухоль Treg-клеток. После пролиферации Treg-клетки секретируют большое количество факторов иммуносупрессии, таких как TGF-β, ингибируют функции иммунных клеток, таких как CD8+T-клетки, и блокируют эффект уничтожения иммунными клетками опухолей. Это является важным механизмом резистентности к лекарственным средствам при неуспехе иммунотерапии в отношении различных солидных опухолей и гематологических опухолей. В последних исследованиях было показано, что иммунная толерантность пациентов с иммунотерапией, направленной на PD-1/PD-L1, и другой иммунотерапией тесно связана с Treg.
[79] Как используют в настоящем описании, термин "супрессорная клетка миелоидного происхождения" или "MDSC" относится к гетерогенной клеточной популяции иммунной системы, состоящей из незрелых нейтрофилов, моноцитов и дендритных клеток, которая имеет эффект ингибирования иммунного ответа и опухолевого иммунного ответа. MDSC модулирует активность различных эффекторных клеток и антигенпредставляющих клеток (таких как T-клетки, NK-клетки, дендритные клетки, макрофаги и т.д.). Супрессорные клетки миелоидного происхождения характеризуются их профилем экспрессии генов, которые экспрессируют все или подгруппу белков или низкомолекулярных соединений, выбранных из группы, состоящей из B7-1 (CD80), B7-H1 (PD-L1), CCR2, CD1d, CD1dl, CD2, CD31 (PECAM-I), CD43, CD44, компонента комплемента C5aR1, F4/80 (EMR1), FcγRIII (CD16), FcγRII (CD32), FcγRIIA (CD32b), FcγRIIB/C (CD32b/c), FcγRIIC (CD32c), FcγRIIIA (CD16A), FcγRIIIB (CD16b), галактина-3, GP130, Gr-1 (Ly-6G), ICAM-1 (CD54), IL-1RI, IL-4Ra, IL-6Ra, интегрина a4 (CD49d), интегрина aL (CD11a), интегрина aM (CD11b), M-CSFR, MGL1 (CD301a), MGL1/2 (CD301a/b), MGL2(CD301b), оксид азота, PSGL-1(CD162), L-селектина (CD62L), siglec-3(CD33), рецептора трансферрина (TfR), VEGFR1 (Flt-I) и VEGFR2 (KDR или Flk-1). В частности, MDSC не экспрессирует белки, выбранные из группы, состоящей из B7-2 (CD86), B7-H4, CD11c, CD14, CD21, CD23 (FcεRII), CD34, CD35, CD40 (TNFRSF5), CD117 (c-kit), HLA-DR и Sca-I (Ly6).
[80] Как используют в настоящем описании, термин "процентное (%) соответствие последовательностей" относится к проценту аминокислотных остатков (или остатков нуклеиновой кислоты) последовательности-кандидата, которые являются идентичными аминокислотным остаткам (или остаткам нуклеиновой кислоты) эталонной последовательности после выравнивания последовательностей и внесения пропусков, при необходимости, для достижения максимальной процентной идентичности последовательностей (например, для оптимального выравнивания могут быть внесены пропуски в одну или несколько последовательностей-кандидатов и эталонных последовательностей и негомологичные последовательности могут игнорироваться для целей сравнения). Выравнивание для определения процентной идентичности последовательностей можно проводить различными способами, известными специалистам в данной области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить соответствующие параметры для проведения выравнивания, включая любые алгоритмы, требуемые для достижения максимального выравнивания на протяжении всей длины сравниваемых последовательностей. Например, эталонная последовательность, выравниваемая для сравнения с последовательностью-кандидатом, может демонстрировать, что последовательность-кандидат демонстрирует от 50% до 100% идентичность последовательности на протяжении всей длины последовательности-кандидата или выбранной части последовательно расположенных аминокислотных остатков (или остатков нуклеиновой кислоты) последовательности-кандидата. Длина последовательности-кандидата, выровненной для целей сравнения, может составлять, например, по меньшей мере 30% (например, 30%, 40, 50%, 60%, 70%, 80%, 90%, или 100%) от длины эталонной последовательности. Когда положение в последовательности-кандидате занято тем же аминокислотным остатком, что и соответствующее положение в эталонной последовательности, тогда молекулы являются идентичными в этом положении.
[81] Как используют в настоящем описании, термин "специфически связывается" относится к реакции связывания, которая определяет присутствие антигена в гетерологичной совокупности белков и других биологических молекул, который индивидуально распознается, например, антителом или его антигенсвязывающим фрагментом. Антитело или его антигенсвязывающий фрагмент, которые специфически связываются с антигеном, связываются с антигеном с KD менее 100 нМ. Например, антитело или его антигенсвязывающий фрагмент, которые специфически связываются с антигеном, связываются с антигеном с KD вплоть до 100 нМ (например, от 1 пМ до 100 нМ). Антитело или его антигенсвязывающий фрагмент, которые не демонстрируют специфического связывания с конкретным антигеном или его эпитопом, демонстрируют KD более 100 нМ (например, более 500 нм, 1 мкМ, 100 мкМ, 500 мкМ или 1 мМ) для этого конкретного антигена или его эпитопа. Для выбора антител, которые обладают специфической иммунореактивностью в отношении конкретного белка или углевода, можно использовать различные форматы иммуноанализа. Например, способы твердофазного иммуноанализа ELISA обычно используются для выбора антител, которые обладают специфической иммунореактивностью в отношении белка или углевода. См., Harlow & Lane, Antibodies, A Laboratory Manual, Cold Spring Harbor Press, New York (1988) и Harlow & Lane, Using Antibodies, A Laboratory Manual, Cold Spring Harbor Press, New York (1999), для описания форматов иммуноанализа и условий, которые могут использоваться для определения специфической иммунореактивности.
[82] Как используют в настоящем описании, термин "вектор" включает вектор на основе нуклеиновой кислоты, например, ДНК-вектор, такой как плазмида, РНК-вектор, вирус или другой подходящий репликон (например, вирусный вектор). Для доставки полинуклеотидов, кодирующих экзогенные белки, в прокариотическую или эукариотическую клетку, были разработаны различные векторы. Экспрессирующие векторы по изобретению содержат полинуклеотидную последовательность, а также, например, дополнительные элементы последовательности, используемые для экспрессии белков и/или встраивания этих полинуклеотидных последовательностей в геном клетки млекопитающего. Определенные векторы, которые могут использоваться для экспрессии антител и фрагментов антител по изобретению, включают плазмиды, которые содержат регуляторные последовательности, такие как промоторные и энхансерные области, которые определяют транскрипцию генов. Другие пригодные векторы для экспрессии антител и фрагментов антител содержат полинуклеотидные последовательности, которые повышают скорость трансляции этих генов или повышает стабильность или ядерный экспорт мРНК, который является результатом транскрипции гена. Эти элементы последовательности включают, например, 5’- и 3’-нетранслируемые области, внутренний участок связывания рибосомы (IRES) и участок сигнала полиаденилирования для направления эффективной транскрипции гена, находящегося на экспрессирующем векторе. Экспрессирующие векторы по изобретению также могут содержать полинуклеотид, кодирующий маркер для селекции клеток, которые содержат такой вектор. Примеры подходящего маркера включают гены, которые кодируют резистентность к антибиотикам, такие как ампициллин, хлорамфеникол, канамицин или ноурсеотрицин.
[83] Как используют в настоящем описании, термины "индивидуум" и "пациент" относятся к организму, который подвергают лечению от конкретного заболевания или состояния, как описано в настоящем описании (такого как злокачественная опухоль или инфекционное заболевание). Примеры индивидуумов и пациентов включают млекопитающих, таких как люди, приматы, свиньи, козы, кролики, хомячки, кошки, собаки, морские свинки, представители семейства бычьих (такие как крупный рогатый скот, бизон, буйвол, лось и як, среди прочих), коровы, овцы, лошади и бизон, среди прочих, которым проводят лечение заболеваний или состояний, например, клеточно-пролиферативных нарушений, таких как злокачественная опухоль или инфекционные заболевания.
[84] Как используют в настоящем описании, термины "лечить" или "лечение" относятся к хирургическому или фармацевтическому лечению, при котором у индивидуума намереваются предотвратить или замедлить (уменьшить) нежелательное физиологическое изменение или нарушение, такое как прогрессирование клеточно-пролиферативного нарушения, такого как злокачественная опухоль, или инфекционного заболевания. Благоприятные или желаемые клинические результаты включают, но не ограничиваются ими, облегчение симптомов, уменьшение степени заболевания, стабилизацию (т.е. не ухудшение) состояния заболевания, отсрочивание или замедление прогрессирования заболевания, смягчение или облегчение болезненного состояния и ремиссию (как частичную, так и полную), как поддающиеся детекции, так и не поддающиеся детекции. Индивидуумы, нуждающиеся в лечении, включают индивидуумов, уже имеющих состояние или нарушение, а также индивидуумов, склонных к наличию состояния или нарушения, или индивидуумов, у которых состояние или нарушение намереваются предотвратить. Когда упоминаются термины замедление, смягчение, уменьшение, облегчение, и ремиссия, они также включают значения устранения, исчезновения и отсутствия возникновения.
[85] Варианты осуществления изобретения подробно описаны ниже в комбинации с примерами, однако специалистам в данной области будет понятно, что приведенные ниже примеры представлены только для иллюстрации изобретения и они не должны считаться ограничивающими объем изобретения. Если в примерах не приводятся конкретные условия, следует соблюдать общепринятые условия или условия, рекомендованные производителем. Если для реагента или устройства не указан производитель, они являются общепринятым продуктом, который может быть приобретен из коммерческого источника.
ПРИМЕР 1. Получение моноклонального антитела против TNFR2
[86] Рекомбинантный белок TNFR2 человека (приобретенный от SinoBiologicals, каталожный номер 10417-H08H и Novoprotein, каталожный номер C830) смешивали с полным адъювантом Фрейнда (CFA, приобретенный от SIGMA, каталожный номер F5881) для первой иммунизации самок мышей SJL (приобретенных от Beijing Viton Lihua Experimental Animal Technology Co., Ltd.) или мышей Balb/c (приобретенных от Shanghai Slake Experimental Animal Co., Ltd.) в возрасте 6-8 недель, и в качестве адъюванта для последних трех иммунизаций использовали неполный адъювант Фрейнда (IFA, приобретенный от SIGMA, каталожный номер F5506) и CpGODN1826 (синтезированный Shanghai Biotechnology). В частности, первую и вторую иммунизации проводили в подушечку задней лапы и спину, а третью и четвертую иммунизации проводили подкожным путем в хвост и спину для получения антисыворотки и антигенспецифических иммунных клеток с высоким титром, высокой аффинностью и высокой специфичностью. На 7-е сутки после последней иммунизации (четвертая иммунизация) мышей умерщвляли и селезенку извлекали в асептических условиях. Лимфоциты селезенки мышей выделяли в асептических условиях, разделяли на аликвоты и замораживали в жидком азоте, и размораживали для применения. TNFR2-специфические единичные B-клетки в селезенке и лимфатических узлах иммунизированных мышей отсортировывали в 96-луночные планшеты посредством клеточного сортера BD ARIA III и мРНК единичных клеток подвергали обратной транскрипции в кДНК. Затем проводили гнездовую ПЦР с использованием кДНК в качестве матрицы для амплификации тяжелой цепи и легкой цепи антитела, соответственно. Вариабельную область тяжелой цепи и вариабельную область легкой цепи амплифицировали и клонировали в экспрессирующий вектор тяжелой цепи и экспрессирующий вектор легкой цепи, соответственно, способом гомологичной рекомбинации. Константные области экспрессирующего вектора тяжелой цепи и экспрессирующего вектора легкой цепи происходят из IgG1 человека. Полная последовательность экспрессии тяжелой цепи является следующей: сигнальный пептид-VH-CH1-шарнирная область-CH2-CH3, и полная последовательность экспрессии легкой цепи является следующей: сигнальный пептид-Vκ-Cκ. Клонирование и экспрессию вышеупомянутых антител единичных B-клеток во всех случаях проводили в 96-луночном планшете для достижения быстрой идентификации и исследования высокопроизводительным образом. После серии физико-химических и функциональных скринингов 523 пары клонированных тяжелых и легких цепей антител было получено 11 положительных молекул антител-кандидатов. CDR молекул антител-кандидатов анализировали посредством IMGT и KABAT, соответственно, и соответствующая информация о последовательности представлена в таблицах 1-3 ниже, где в таблице 1 представлены последовательности VH и VL молекул антител-кандидатов, в таблице 2 представлены результаты анализа согласно IMGT для CDR молекул антител-кандидатов, и в таблице 3 представлены результаты анализа согласно KABAT для CDR молекул антител-кандидатов.
Таблица 1. Последовательности VH и VL молекул антител-кандидатов
Таблица 2. Результаты анализа согласно IMGT для антител-кандидатов
Таблица 3. Результаты анализа согласно KABAT антител-кандидатов
ПРИМЕР 2. Оценка посредством FACS экспрессии TNFR2 в опухолевых клеточных линиях
[87] Хорошо растущие клетки собирали и 2×106 клеток получали после подсчета из каждой опухолевой клетки и использовали в группе изотипического контроля и группы окрашивания TNFR2 (1×106 клеток/тест) соответственно. Клетки промывали два раза PBS и центрифугировали при 300g × 5 мин для удаления супернатанта, добавляли 1× рабочий раствор Live/Dead (Zombie violet L/D, Biolegend, каталожный номер 423114), 100 мкл/тест, и клетки окрашивали при комнатной температуре в течение 20 минут. Через 20 минут клетки промывали два раза буфером FACS (DPBS+2% FBS) и центрифугировали при 300g × 5 мин для удаления супернатанта, добавляли 1× рабочий раствор антитела для окрашивания в количестве 100 мкл/тест описанным ниже образом, и клетки инкубировали при 4°С в течение 30 минут, избегая света.
[88] Для опухолевых клеток человека: 1) в группе изотипического контроля: добавляли 1 мкл изотипического контроля IgG2b κ крысы с PE (BD Pharmingen, каталожный номер 553989)/100 мкл буфера для FACS/тест; 2) группа окрашивания TNFR2: к опухолевым клеткам человека добавляли 8 мкл антитела крысы против CD120b человека с PE (BD Pharmingen, каталожный номер 552418)/100 мкл буфера для FACS /тест. После инкубации клетки промывали два раза буфером для FACS, центрифугировали при 300g × 5 мин для удаления супернатанта и ресуспендировали с 300 мкл буфера FACS, и клеточную суспензию анализировали с использованием проточного цитометра (Invitrogen, Attune NxT). Затем данные экспортировали и анализировали посредством программного обеспечения Flowjo (TreeStar), как показано на фиг. 1, где различные опухолевые клетки экспрессировали различные уровни TNFR2, и результаты обобщенно представлены в таблице 4.
Таблица 4. Результаты экспрессии TNFR2 для 13 опухолевых клеточных линий человека
(%)
ПРИМЕР 3. Оценка посредством FACS уровней экспрессии TNFR2 на различных T-клетках человека
[89] Коммерческие замороженные PBMC человека (Hemacare) или активированные посредством Dynabead анти-CD3/CD28 (Gibco, каталожный номер 11129D) и подвергнутые экспансии Treg-клетки размораживали и культивировали в течение ночи. На следующие сутки PBMC человека центрифугировали при 300×g в течение 10 минут для удаления супернатанта. После подсчета было получено 2×106 клеток PBMC, и их использовали в группе изотипического контроля и группе окрашивания на TNFR2 (1×106 клеток/тест), соответственно. Клетки промывали два раза PBS и центрифугировали в течение 5 мин при 300g для удаления супернатанта, добавляли 1× рабочий раствор Live/Dead (Zombie violet L/D, Biolegend, каталожный номер №423114), 100 мкл/тест, и клетки окрашивали при комнатной температуре в течение 20 минут. Через 20 минут клетки промывали два раза буфером для FACS (DPBS+2% FBS) и центрифугировали в течение 5 мин при 300g для удаления супернатанта, добавляли 1× рабочий раствор антитела для окрашивания в количестве 100 мкл/тест следующим образом, и клетки инкубировали при 4°C в течение 30 минут, избегая света.
Для клеток PBMC: 1) группа контроля Fluorescence Minus One (FMO): добавляли 1 мкл антитела, показанного в таблице ниже/100 мкл буфера для FACS/тест;
2) группа окрашивания на TNFR2: добавляли 1 мкл антитела, приведенного в таблице ниже/100 мкл буфера для FACS /тест;
Для Treg-клеток: 1) группа контроля FMO: добавляли 1 мкл антитела, представленного в таблице ниже/100 мкл буфера для FACS/тест;
2) Группа окрашивания TNFR2: добавляли 1 мкл антитела, показанного в таблице ниже/100 мкл буфера для FACS/тест;
После инкубации клетки промывали два раза буфером для FACS, центрифугировали при 300g в течение 5 мин для удаления супернатанта и ресуспендировали с 300 мкл буфера для FACS, и клеточную суспензию анализировали с использованием проточного цитометра (Invitrogen, Attune NxT). Затем данные экспортировали и анализировали с использованием программного обеспечения Flowjo, как показано на фиг. 2, где уровень экспрессии TNFR2 на CD4+CD25-Tcon-клетках и CD8+ T-клетках был значительно более низким, чем как на инактивированных, так и на активированных Treg-клетках с наиболее высоким уровнем экспрессии в последних.
ПРИМЕР 4. Анализ с использованием BIAcore специфического связывания антитела против TNFR2 с белками TNFR2 человека и яванского макака
[90] Biacore использовали для детекции специфического связывания 11 клонов антител против TNFR2 из примера 1 с белками TNFR2 человека и яванского макака. В этом эксперименте использовали чип с белком A и время, требуемое для улавливания чипом разбавленного антитела, определяли путем прогона вручную, так что Rmax антигена с насыщенным связыванием составлял 50 RU. TNFR2 человека (Sino 10417-H08H) и TNFR2 яванского макака (Sino 90102-C08H) разбавляли до 32, 16, 8, 4, 2 нМ. Аффинность антитела и антигена определяли посредством мультицикловой кинетики. В каждом цикле антитела против TNFR2 инжектировали перед инжектированием градиентных концентраций белка TNFR2, позволяя произойти ассоциации и диссоциации антитело-антиген. После каждого цикла чип с белком A регенерировали с использованием глицина, pH 1,5 (для удаления белка на чипе). Программное обеспечения для анализа BIAcore T200 использовали для вычисления KD аффинности связывания антитела с антигеном.
Таблица 5. Результаты Biacore для специфического связывания антитела против TNFR2 с белками TNFR2 человека или яванского макака
[91] Как показано в таблице 5, 11 антител против TNFR2 из примера 1 специфически связываются с белками TNFR2 человека и яванского макака с высокой аффинностью.
ПРИМЕР 5. Анализ посредством ELISA специфического связывания антитела против TNFR2 с белками TNFR2 человека и яванского макака
[92] Микропланшет предварительно покрывали 100 мкл/лунка TNFR2 человека или TNFR2 яванского макака в концентрации 0,5 мкг/мл (тот же антигенный белок, что и в примере 4). Очищенные антитела против TNFR2 из примера 1 разбавляли до 28 нг/мл (что соответствует EC80 кривой связывания антитела #1), добавляли в концентрации 100 мкл/лунка и инкубировали при встряхивании при комнатной температуре в течение 1,5 ч. После промывания планшета в планшет добавляли рабочий раствор антитела мыши против Fc IgG человека с HRP (разведение 1:10000) в количестве 100 мкл/лунка и инкубировали при качании при комнатной температуре в течение 1,0 ч. Планшет вновь промывали, добавляли TMB, являющийся субстратом HRP, для развития окраски, а затем реакцию завершали добавлением раствора для терминации. Для считывания величины поглощения использовали устройство для считывания микропланшетов. Данные в таблице 6 показывают, что 11 антител могут специфически связываться с белками TNFR2 человека и яванского макака, но не с TNFR2 мыши или контрольным белком CREG-His человека.
Таблица 6. Результаты ELISA для специфического связывания антитела против TNFR2 с белками TNFR2 человека и яванского макака
Примечание: 1. 002# представляет собой антитело-инструмент (SBT-002 из WO2017/083525 A1)
2. Для каждого антитела проводили измерение только однократной концентрации, которую выражали посредством величины OD, где концентрация антител #088 и #309 составляла 12 нг/мл, и концентрация других антител составляла 28 нг/мл.
ПРИМЕР 6. Оценка посредством FACS связывания антитела с TNFR2 человека на поверхности клеток CHO-TNFR2
[93] Клетки CHO, которые стабильно сверхэкспрессировали TNFR2 человека, конструировали путем трансфекции клеток плазмидой TNFR2 (приобретенной от Sino Biological, каталожный номер №HG10417-UT). Все эксперименты по связыванию проводили с использованием клеточной плотности, не превышающей 80%. Культуральную среду удаляли и клетки промывали PBS и расщепляли 1 мл трипсина в течение 2 минут. Культуральную среду HamFBS, содержавшую 10% FBS, использовали для завершения расщепления и получения клеточной суспензии. Подходящее количество клеточной суспензии отбирали поле подсчета и центрифугировали при 350×g. Супернатант сливали и клетки ресуспендировали до плотности 1×107 клеток/мл путем добавления буфера для блокирования (10% FBS+PBS) и инкубировали при 4°C в течение 30 минут. После инкубации супернатант сливали после центрифугирования при 350×g и клетки ресуспендировали до плотности 2×106 клеток/мл с использованием буфера для окрашивания (2% FBS+PBS), а затем помещали в 96-луночный планшет в количестве 50 мкл на лунку для последующего применения. Антитела разбавляли до 80 нг/мл посредством PBS, а затем разбавленные антитела добавляли в лунки с 50 мкл клеточной суспензии. Планшет помещали на устройство для качания микропланшетов и качали при 500 об/мин в течение 1 минуты для полного перемешивания клеток и антител с последующей инкубацией при 4° в течение 1 часа. После инкубации клетки промывали два раза буфером для окрашивания в количестве 100 мкл на лунку, и центрифугировали при 350×g в течение 5 минут, а затем супернатант сливали. Антитело козы против Fc IgG человека с PE (ebioscience, каталожный номер №12-4998-82) разбавляли в 250 раз буфером для окрашивания, добавляли в лунки с промытыми клетками в объеме 100 мкл на лунку, равномерно перемешивали и окрашивали при 4°С в течение 30 минут. После окрашивания клетки также промывали два раза буфером для окрашивания и ресуспендировали посредством 200 мкл буфера для окрашивания. Для детекции интенсивности сигнала использовали проточную цитометрию. Более сильный сигнал означает более сильную способность антител связываться с TNFR2 на экспрессирующих клетках. Как показано на фиг. 3A, антитело крысы против IgG2b с PE (Biolegend, каталожный номер №400636) и антитело крысы hTNFR2 с PE (BD Biosciences, каталожный номер №552418) использовали для количественного определения экспрессии TNFR2, и было обнаружено, что интенсивность экспрессии TNFR2 на поверхности клеток CHO-TNFR2 была практически в 134 раза большей, чем у окрашенных изотипическим контролем клеток. Исходя из этого уровня экспрессии TNFR2 была выявлена способность 11 антител против TNFR2 из примера 1 связываться с TNFR2 на клеточной поверхности, и все результаты были положительными, как показано на фиг. 3B.
ПРИМЕР 7. Оценка посредством FACS связывания антитела с TNFR2 человека на поверхности Treg-клеток
[94] Treg-клетки человека выделяли из PBMC человека с использованием набора для сортировки (Stemcell, каталожный номер №18063), подвергали экспансии in vitro посредством Dynabeads Human Treg Expander (Gibco, каталожный номер №11129D) в течение 17 суток, распределяли на аликвоты и криоконсервировали для последующего применения. Treg-клетки, выделенные и подвергнутые экспансии in vitro, размораживали в течение ночи, центрифугировали при 300×g в течение 5 минут на следующие сутки, ресуспендировали в DPBS и подсчитывали. Количество клеток, требуемое для эксперимента, добавляли в центрифужные пробирки, центрифугировали при 300×g в течение 5 мин и супернатант удаляли. Клеточную плотность доводили до 1×107 клеток/мл блокирующим раствором с последующей инкубацией при 4°С в течение 30 мин. После центрифугирования при 300×g в течение 5 мин супернатант сливали, а затем клеточную плотность доводили до 2×106/мл буфером для окрашивания. Затем клетки помещали в 96-луночный планшет в количестве 50 мкл на лунку. В каждую лунку вносили 11 антитела #001, #088, #125, #133, #219, #224, #226, #309, #352, #365 и #395 из примера 1 и изотипическое контрольное антитело против Hel (разбавленное до 200 нг/мл посредством PBS, соответственно, с общим количеством 100 мкл) в количестве 50 мкл на лунку. Планшет с клеточной суспензией и антителами помещали на устройство для качания микропланшетов и качали при скорости 500 об/мин в течение 1 мин для полного перемешивания клеток и антител с последующей инкубацией при 4°C в течение 60 мин. После инкубации в каждую лунку добавляли 100 мкл буфера для окрашивания, клетки центрифугировали при 350×g в течение 5 мин, ресуспендировали добавлением в каждую лунку 200 мкл буфера для окрашивания и вновь центрифугировали при 350×g в течение 5 мин. Раствор буфера для окрашивания добавляли к антителу козы против Fc IgG человека с PE в соотношении 250:1 (буфер для окрашивания: краситель) с получением раствора для окрашивания, который равномерно перемешивали и добавляли в объеме 100 мкл на лунку. Планшет помещали на устройство для качания микропланшетов при скорости 500 об/мин в течение 1 мин для полного перемешивания клеток с раствором для окрашивания с последующей инкубацией при 4°C в течение 30 мин. Клетки промывали два раза и ресусендировали в 200 мкл PBS для анализа FACS. CD25+FoxP3+ клетки, представленные на фиг. 4A, представляют собой Treg-клетки человека, 99,5% гейтированных Treg-клеток экспрессируют TNFR2, что указывает на то, что Treg-клетки человека обладают высокой экспрессией TNFR2. На фиг. 4B показано, что изотипическое контрольное антитело против Hel не связывается с Treg, в то время как все 11 антител из примера 1 могут эффективно связываться с Treg-клетками.
ПРИМЕР 8. Оценка посредством ELISA блокирования взаимодействия TNFα/TNFR2 посредством антитела против TNFR2
[95] Микропланшет предварительно покрывали посредством 100 мкл/лунка TNFR2 человека в концентрации 1 мкг/мл (Novoprotein, каталожный номер №C830). Каждое антитело против TNFR2 из примера 1 разбавляли до 40 нМ и 4 нМ. Разбавленные антитела смешивали с TNFa человека в концентрации 15 нг/мл (Acro Biosystem, каталожный номер №TNA-H82E3) в равных объемах, соответственно, добавляли в микропланшет в количестве 100 мкл/лунка, и инкубировали при качании при комнатной температуре в течение 2,0 ч. После промывания планшета добавляли рабочий раствор стрептавидин-HRP (разведение 1:10000) в количестве 100 мкл/лунка и инкубировали при качании при комнатной температуре в течение 40 мин. Планшет вновь промывали, добавляли TMB, являющийся субстратом HRP, для развития окраски, для завершения реакции добавляли раствор для терминации, и устройство для считывания микропланшетов использовали для считывания величины поглощения. Чем более низкой является величина OD, тем более выраженной является способность антител ингибировать связывание TNFa с TNFR2. Наконец, величины OD всех антител нормализовывали к величине OD для антитела-инструмента 002#, и более высокая процентная величина означает более высокую способность к ингибированию. Данные в таблице 7 показывают, что 11 антител из примера 1 обладают активностью ингибирования связывания TNFa с TNFR2 как при 20 нМ, так и при 2 нМ (таблица 7a-7b).
Таблица 7a. Результаты 1 ELISA, часть тестируемых антител блокируют связывание TNFα с TNFR2
Таблица 7b. Результаты 2 ELISA, часть тестируемых антител блокирует связывание TNFα с TNFR2
Примечание: 1. 002# представляет собой антитело-инструмент; 2. % относительно OD 002#=OD для 002# согласно ELISA (20 нМ или 2 нМ) / OD для антитела согласно ELISA (20 нМ или 2 нМ) × 100.
ПРИМЕР 9. Антитела против TNFR2 блокируют связывание TNFα с TNFR2, сверхэкспрессированным на клетках CHO
[96] Клетки CHO, которые стабильно сверхэкспрессировали TNFR2 человека, использовали для экспериментов. Клетки размораживали и пассировали до тех пор, пока их состояние не становилось хорошим, и уровень экспрессии TNFR2 человека на клетках оценивали посредством FACS. По сравнению с изотипическим контролем анализ можно было проводить, когда кратность изменения средней интенсивности флуоресценции (MFI) составляло более 100 раз.
[97] Клетки CHO-TNFR2 расщепляли, промывали два раза DPBS и окрашивали посредством Live/Dead (L/D) при комнатной температуре в течение 20 мин, а затем высевали в количестве 1×105 клеток/50 мкл/лунка. Антитела против TNFR2 из примера 1 разбавляли буфером для окрашивания до 40 нМ в качестве первоначальной концентрации и разбавляли 3-кратным градиентом всего для 7 точек концентрации. Разбавленные антитела добавляли в количестве 50 мкл/лунка в лунки, в которые были предварительно посеяны клетки, и осторожно продували и перемешивали до конечных концентраций антител 20, 6,67, 2,22, 0,74, 0,247, 0,08, 0,027 и 0 нМ, соответственно, с последующей инкубацией при 4°C в течение 30 мин. Затем добавляли TNFα человека-биотин в концентрации 100 нг/мл в количестве 100 мкл/лунка, осторожно продували и перемешивали, и инкубировали в течение 30 мин при 4°C. После промывания два раза буфером для окрашивания добавляли PE-стрептавидин в количестве 100 мкл/лунка и инкубировали при 4°C в течение 30 мин. После дополнительного промывания буфером для окрашивания два раза 150 мкл ресуспендированных клеток анализировали с использованием проточной цитометрии. Принимая логарифмическую величину концентраций антител в качестве абсциссы и соответствующую величину MFI в качестве ординаты, строили кривую ингибирования для антитела, и величину IC50 вычисляли посредством четырехпараметрической аппроксимации. Чем более низкой является величина IC50, тем более высокой является способность антитела ингибировать связывание TNFα человека с TNFR2 человека. Поскольку форма кривых блокирования некоторых антител различалась, эффект блокирования всех антител нормализовывали к 002# с использованием площади под кривой (AUC). Чем более высокой является процентная величина, тем лучшим является эффект антитела в отношении ингибирования. Кривые ингибирования для 11 антител представлены на фиг. 5, и активность ингибирования представлена в таблице 8.
[98] Как можно видеть из фиг. 5 и таблицы 8, все 11 антител из примера 1 могут значительно ингибировать связывание TNFα в TNFR2, экспрессируемым на клетках CHO-TNFR2.
Таблица 8. Антитела против TNFR2 блокируют связывание TNFα с клеткой TNFR2-CHO
IC50 (г/мл)
IC50 (г/мл)
%
[99] Примечание: AUC%=AUC для 002 # ÷ AUC для антитела × 100.
ПРИМЕР 10. Ингибирование функции Treg антителом против TNFR2
[100] Препятствование антителом ингибиторным эффектам Treg-клеток оценивали путем детекции ингибиторных эффектов Treg-клеток на иммунореактивные T-клетки в условиях, включающих антитело против TNFR2. Treg (CD4+CD25+FoxP3+ T cells) и иммунореактивные клетки Tcon (CD4+CD25-T клетки) размораживали и восстанавливали в течение ночи, на следующие сутки центрифугировали при 400×g в течение 5 минут. Затем клетки ресуспендировали в среде RPMI1640 (Gibco, каталожный номер №72400047) и подсчитывали для последующего применения. Клетки Tcon окрашивали с использованием набора для пролиферации клеток CellTrace CFSE (Biolegend, каталожный номер №423801), из которого получали 1 мл раствора для окрашивания с использованием 1 мкл раствора для хранения для каждых 4×106 клеток. Клетки Tcon окрашивали в течение 5 мин, процесс окрашивания гасили добавлением того же объема сыворотки. затем окрашенным клеткам позволяли стоять в течение 5 мин и центрифугировали при 400×g в течение 5 мин. Клетки ресуспендировали и промывали средой и вновь центрифугировали для удаления супернатанта с последующем посевом клеток в 96-луночные планшеты с плотностью 1×105 клеток на лунку. Каждые 1×105 клеток ресуспендировали в 50 мкл среды и переносили в 50-мл центрифужную пробирку. Между тем, получали Treg-клетки. Treg-клетки и Tcon-клетки сокультивировали в соотношениях 1:1, 1:2, 1:4 и 1:8. Каждая лунка каждого 96-луночного планшета соответствовала отличающейся плотности Treg-клеток, и клетки в каждой лунке ресуспендировали в 50 мкл среды. В соответствии с общим количеством Tcon-клеток, получали соответствующие шарики CD3/CD28 Dynabeads (Gibco, каталожный номер №11129D) в соотношении 1/8, и добавляли в среду, содержавшую Treg и Tcon, в объеме 50 мкл на лунку. В каждую лунку добавляли тестируемые антитела до конечной концентрации каждого тестируемого антитела 12,5 г/мл. Для каждых условий получали дублированные лунки. Затем вышеупомянутые планшеты помещали в инкубатор при 37°C в течение 4 суток для анализа FACS. Результаты показывают, что антитело #001 и антитело #224 может значительно подавлять ингибиторный эффект Treg на Tcon-клетки и способствовать пролиферации Tcon при различных соотношениях Treg/Tcon (фиг. 6).
[101] Формула для вычисления эффекта тестируемых антител из примера 1 на функцию ингибирования Treg-клеток по сравнению с изотипическим контрольным антителом против Hel является следующим: (пролиферативная способность иммунореактивных T-клеток в присутствии протестированных антител - пролиферативная иммунореактивных T-клеток в присутствии антитела против Hel антитело)/пролиферативная способность иммунореактивных T-клеток в присутствии антитела против Hel×100%.
ПРИМЕР 11. Эффект антитела против TNFR2 на продуцирование sTNFR2 в супернатанте клеток в анализе ингибирования функции Treg
[102] Ингибиторный эффект антитела против TNFR2 на функцию Treg оценивали путем измерения уровня sTNFR2 в супернатанте клеток. Treg и иммунореактивные T-клетки обрабатывали антителами из примера 1 в течение 4 суток, 100 мкл супернатанта на лунку собирали в качестве образца для тестирования. Затем собранный супернатант разбавляли в 5 раз для оценки sTNFR2. Для деталей способа для sTNFR2 можно обратиться к инструкции набора для TNFRII/TNFRSF1B человека (каталожный номер №DRT200) от R&D Company. Результаты показывают, что #001, #088, #125, #219, #224, #226 и #309 могут значительно снижать уровень sTNFR2 в супернатанте клеток при различных соотношениях Treg:Tcon (фиг. 7).
ПРИМЕР 12. Ингибирование антителом против TNFR2 индуцируемой TNFα пролиферации Treg-клеток
[103] Эффект ингибирования антителом против TNFR2 индуцируемой TNFα пролиферации Treg-клеток определяли путем определения индуцируемой TNFα пролиферации Treg-клеток в присутствии антитела против TNFR2 (Zaragoza B et al., Nat Med. 2016 Jan; 22 (1): 16-7). Treg-клетки, криоконсервированные после экспансии in vitro, размораживали и восстанавливали в течение ночи, центрифугировали при 400×g в течение 5 минут на следующие сутки, ресуспендировали в культуральной среде и подсчитывали для последующего применения. Treg окрашивали CFSE и получали 1 мл раствора для окрашивания с использованием 1 мкл раствора для хранения для каждых 4×106 клеток. Treg-клетки окрашивали в течение 5 мин, процесс окрашивания гасили добавлением того же объема сыворотки. Окрашенным клеткам позволяли стоять в покое в течение 5 мин и центрифугировали при 400×g в течение 5 мин. Клетки ресуспендировали, промывали один раз средой и вновь центрифугировали для удаления супернатанта. Затем клетки высевали в 96-луночные планшеты с плотностью 1×105 клеток на лунку. 1×105 клеток ресуспендировали в 50 мкл среды и переносили в 96-луночные планшеты. Тестируемые антитела из примера 1 высевали в каждую лунку до конечной концентрации антитела 12,5 г/мл. Затем планшеты помещали в инкубатор на 30 минут. Затем добавляли 50 мкл среды, содержавшей IL-2 (конечная концентрация 300 МЕ) и другие 50 мкл среды, содержавшие TNFα в конечной концентрации 50 нг/мл. Конечный объем доводили до 200 мкл на лунку посредством культуральной среды. Для каждых условий использовали три экземпляра лунок. В вышеупомянутых лунках проводили перемешивание, а затем их помещали в инкубатор с 37°С на 3 суток перед анализом FACS. Ингибиторный эффект антитела на индуцируемую TNFα пролиферацию Treg оценивали по процентной пролиферации Treg. Как показано на фиг. 8, следующие антитела эффективно ингибировали индуцируемую TNFα пролиферацию Treg по сравнению с контрольным антителом против Hel: #001 (ингибирование пролиферации 17,1%), #088 (ингибирование пролиферации 6,9%), #125 (ингибирование пролиферации 5,2%), #133 (ингибирование пролиферации 9,7%), #219 (ингибирование пролиферации 13,6%), #226 (ингибирование пролиферации 10,3%) и #365 (ингибирование пролиферации 11,0%). По сравнению с контрольным антителом, формула для вычисления доли ингибирования тестируемым антителом пролиферации Treg-клеток, индуцируемой TNFα, является следующей: (доля индуцируемой TNFα пролиферации Treg в присутствии тестируемого антитела - доля индуцируемой TNFα пролиферации Treg в присутствии изотипического антитела против Hel)/доля индуцируемой TNF пролиферации Treg в присутствии изотипического антитела против Hel×100%. На фиг. 8A представлено значительное повышение пролиферации Treg после добавления IL-2 (20% против 4%) и дальнейшее повышение доли пролиферации после добавления TNFα (40% против 20%). На фиг. 8B представлен ингибиторный эффект 11 антител на способность индуцировать пролиферацию Treg после добавления IL-2 и TNFα, и 8 антител-кандидатов за исключением #224, #352 и #395 могли ингибировать индуцируемую IL-2 и TNFα пролиферацию Treg.
ПРИМЕР 13. Детекция посредством ELISA эффекта антитела против TNFR2 на продуцирование sTNFR2 в супернатанте культуры CD4+ T-клеток
[104] Коммерческие криоконсервированные PBMC человека размораживали и оставляли в покое на ночь. После выдерживания в течение ночи PBMC человека центрифугировали при 300×g в течение 10 мин для удаления супернатанта и промывали два раза буфером для выделения Easybuffer из набора, а затем подсчитывали для последующего применения. Выделение CD4+ T-клеток человека проводили в соответствии с инструкциями набора для выделения CD4+ T-клеток человека (Stemcell, EasySepTM Human CD4+ T cell Isolation Kit, каталожный номер №17952). Выделенные CD4+ T-клетки вновь подсчитывали и ресуспендировали до подходящей концентрации с последующим просеиванием в 96-луночный круглодонный планшет с плотностью 4×105 клеток/лунка и объемом 50 мкл/лунка. Получали рабочий раствор антитела (50 мкг/мл, 4×) и добавляли к планшету в количестве 50 мкл/лунка с последующей инкубацией при 37°C с 5% CO2 в течение 30 мин. Затем получали рабочий раствор IL-2 (800 МЕ/мл, 4×) и рабочий раствор TNFα (200 нг/мл, 4×) и добавляли в планшет в объеме 50 мкл/лунка, соответственно. Экспериментальные группы представляют собой: группу без стимуляции, группу со стимуляцией IL-2, группу со стимуляцией TNF, группу с совместной стимуляцией IL-2+TNF и группу с совместной стимуляцией антитело+IL-2+TNF (т.е. группа, подлежащая тестированию). Планшет с этими экспериментальными группами помещали в инкубатор и культивировали в течение 3 суток в условиях 37°C и 5% CO2. Через 3 суток культуральный супернатант собирали для детекции sTNFR2.
[105] Получали стандарт sTNFR2 человека, отбирали клеточный супернатант из вышеуказанного эксперимента, и проводили анализ в соответствии с инструкциями набора ELISA для sTNFR2 (R&D System, Solution TNF Receptor II Human ELISA Kit, каталожный номер №DRT200). Стадии эксперимента были следующими: 1) добавление клеточного супернатанта и стандарта 100 мкл/лунка в высокоаффинный планшет и инкубация в течение 2,5 ч при слабом качании при комнатной температуре (18-25°C); 2) удаление супернатанта и промывания планшета 4 раза в количестве 300 мкл/лунка буфером для промывания; 3) добавление 100 мкл/лунка меченного 1× биотином растворимого антитела против TNFR2 человека после высыхания планшета и инкубация в течение 1 ч при небольшом качании при комнатной температуре (18-25°C); 4) слив супернатанта и промывание планшета 4 раза при 300 мкл/лунка буфером для промывания; 5) добавление 100 мкл/лукна 1× раствора HRP-стрептавидин после высыхания планшета и инкубация в течение 45 мин при слабом качании при комнатной температуре (18-25°C); 6) слив супернатанта и промывание планшета 4 раза в количестве 300 мкл/лунка буфером для промывания; 7) добавление 100 мкл/лунка раствора субстрата TMB после высыхания планшета и инкубация в течение 30 мин при слабом качании при комнатной температуре (18-25°C) с защитой от света, и 8) добавление 50 мкл/лунка раствора для терминации реакции и сразу определение величины OD450 в устройстве для считывания микропланшетов.
[106] Как показано на фиг. 9, все 11 антител из примера 1 ингибируют секрецию sTNFR2 в клеточном супернатанте по сравнению с группой отрицательного контрольного антитела против Hel. Продуцирование sTNFR2 в культуральном супернатанте возрастает, в то время как CD4+ T-клетки активируются при костимуляции IL-2 и TNFα. Все 11 антител могут блокировать эффект IL-2 и TNFα в отношении активации CD4+ T-клеток в различной степени, среди которых антитела под номерами #88, #219, #001 (P < 0,001), #125, #224 (P < 0,01) обладают особенно выраженными ингибиторными эффектами со статистически значимыми отличиями. Чем более низкой является величина OD450, тем более низким является уровень экспрессии sTNFR2, т.е. тем более высокой является активность антагониста у антитела.
ПРИМЕР 14. Оценка посредством FACS опосредуемой антителом против TNFR2 активности ADCC против Treg-клеток
[107] PBMC и криоконсервированные Treg-клетки оживляли за одни сутки в полной среде (RPMI1640-Glutamax+10% FBS+1×P/S+1×ITS+50 мкл MPM-меркаптоэтанола), где в культуры PBMC добавляли 100 МЕ/мл IL-2. В день эксперимента NK-клетки выделяли из PBMC в соответствии с инструкциями набора для выделения (Stemcell, каталожный номер №17955) и ресуспендировали в полной среде (без IL-2) при плотности 0,45×106/мл. Treg-клетки метили фиолетовым реагентом Cell Trace и после мечения клеточную плотность доводили до 0,3×106/мл. 11 антител-кандидатов получали в 4-кратном градиентном разведении полной средой. Клетки-мишени высевали в планшет в объеме 50 мкл/лунка в соответствии с картой планшета с последующим добавлением разбавленных антител в соответствующие лунки и инкубировали в течение 30 минут при 37°C. После инкубации в требуемые лунки добавляли 100 мкл суспензии эффекторных клеток, в то время как не требуемые лунки заполняли 100 мкл культуральной среды и инкубировали в течение 4 ч при 37°C. В каждую лунку добавляли 1 мкл красителя PI перед детекцией в устройстве FACS. Чем более сильным является сигнал PI в клетках-мишенях, тем более выраженным является эффект ADCC. Результаты теста ADCC (фиг. 10 и таблица 9) показывают, что отрицательное контрольное изотипическое антитело против Hel не имеет эффекта уничтожения ADCC, в то время как положительный контроль #52 демонстрирует выраженную функцию ADCC. Все 11 протестированных антител демонстрируют ограниченную активность ADCC. На фиг. 10A показано, что Treg человека сверхэкспрессируют TNFR2 с 80-кратным сдвигом MFI по сравнению с окрашиванием изотипическим контрольным антителом против Hel. На фиг. 10B показано, что доля NK-клеток в PBMC перед выделением с использованием набора составляет 14,5%, и чистота NK-клеток после выделения достигает 88,3%. На фиг. 10C представлен эффект ADCC у 11 антител, причем антитело #52 представляет собой положительное контрольное антитело, изотипическое антитело против Hel представляет собой отрицательное контрольное антитело и мишень отдельно представляет собой клеточный отрицательный контроль без NK-клеток, но только с Treg-клетками, являющимися мишенями.
Таблица 9. Сравнение AUC кривой для ADCC (площадь под ROC-кривой) для тестируемых антител в отношении Treg
Примечание: относительную активность ADCC вычисляют в качестве величины AUC кривой ADCC для протестированного антитела, деленной на величину AUC положительного контрольного антитела #52.
ПРИМЕР 15. Анализ с репортерным геном для оценки опосредуемой антителом против TNFR2 активности ADCC против клеток CHO-TNFR2
[108] Клетки-мишени (CHO-TNFR2) высевали в белый 96-луночный планшет с прозрачным дном (Corning, каталожный номер №3610) с буфером для детекции (RPMI1640 (Gibco, каталожный номер №22400105) + 0,5% FBS (Gibco, каталожный номер №10099141) +1×P/S (Gibco, каталожный номер №15140-122)) в количестве 10000 клеток на лунку заранее за один день, позволяя клеткам прикрепиться к дну планшета. На следующие сутки лекарственное средство постепенно разбавляли до 2-кратной конечной концентрации буфером для детекции для последующего применения. Буфер для детекции в планшете сливали, в каждую лунку добавляли 25 мкл нового буфера для детекции, а затем добавляли разбавленное лекарственное средство в соответствующие лунки в объеме 25 мкл на лунку и инкубировали с клетками-мишенями в течение 1 часа при 37°С. После инкубации в соответствующие лунки добавляли 25 мкл 2× лекарственного средства, а затем добавляли 25 мкл клеточной суспензии для ADCC (BPS, каталожный номер №60541) в количестве 75000 клеток на лунку. Затем 100 мкл смешанных клеточных суспензий на лунку инкубировали в инкубаторе в течение 6 часов. После инкубации планшет помещали в условия комнатной температуры на 10 минут, и в него добавляли реагент Bright-Glo (Promega, каталожный номер №2620), предварительно нагретый до комнатной температуры, в количестве 100 мкл на лунку, и помещали на устройство для качания при 500 об/мин в течение 10 минут. Величину люминесценции регистрировали с использованием устройства для считывания микропланшетов. Чем более сильным является сигнал люминесценции, тем более выраженным является эффект ADCC. Результаты эксперимента с ADCC показывают, что отрицательное контрольное изотипическое антитело против Hel не обладает эффектом уничтожения ADCC, поскольку оно не обладает связыванием с мишенью, однако все из обнаруженных антител против TNFR2 #001, #219 и #224 обладают эффектами ADCC (фиг. 11).
ПРИМЕР 16. Связывание эпитопов антителами против TNFR2, являющимися кандидатами
[109] Biacore использовали для детекции конкуренции среди антител против TNFR2, являющихся кандидатами, для группирования антител, и предварительно определили, скольким эпитопным бинам они принадлежат (Abdiche YN et al., Plos One. Mar 20, 2014). Для иммобилизации белка TNFR2 человека использовали реакцию присоединения по аминогруппе. Сначала инжектировали выбранные антитела, а затем инжектировали вторичные антитела до тех пор, пока не использовали поочередно все антитела. Путем сравнения того, существовало ли различие в сигналах связывания между первыми инжектированными антителами и вторыми инжектированными антителами, и наоборот, с TNFR2 человека, можно было определить взаимосвязь эпитопов связывания между этими антителами в отношении белка TNFR2 человека. В частности, в каждом цикле все антитела определяли посредством инъекции в концентрации 300 нМ в течение 180 с и антитела, подлежавшие тестированию, элюировали 650 мМ раствором HCl.
[110] Результаты из таблицы 10 показывают, что антитело 224 связывается с эпитопом, отличным от других 10 протестированных антител.
Таблица 10. Результаты Biacore для биннинга эпитопов антител против TNFR2 в отношении белка TNFR2 человека
Примечание: Y: с конкуренцией за эпитоп; N: без конкуренцией за эпитоп
ПРИМЕР 17. Оценка эффективности in vivo суррогатного антитела против TNFR2 мыши
[111] Поскольку 11 антител против TNFR2 человека из примера 1 специфически связывались с TNFR2 человека и яванского макака, но не с TNFR2 мыши, антитело против TNFR2 мыши использовали в качестве суррогатного антитела для проведения экспериментов по связанной с TNFR2-мишенью эффективности в относительно резистентной к терапии PD-1/PD-L1 модели рака толстого кишечника на мышах CT26 WT, которые происходили из мышей Balb/c. Суррогатное антитело против mTNFR2 приобретали от BioXcell (каталожный номер №BE0247). Мышам подкожно инокулировали 1×105 клеток рака толстого кишечника CT26 в правый бок (выбрано в качестве 0 суток эксперимента). Когда объем опухоли достигал ~110 мм3, мышей с надлежащим объемом опухоли отбирали и случайным образом распределяли на 4 экспериментальных группы с использованием способа случайных номеров EXCEL (G1 в качестве контрольной группы, G2 в качестве группы суррогатного антитела против mTNFR2, G3 в качестве группы антитела против mPD-L1 (BioXcell, каталожный номер №BE0101), G4 в качестве группы антитела против mPD-1 (BioXcell, каталожный номер №BE0146)), с 8 мышами в каждой группе. Антитела вводили внутрибрюшинно два раза в неделю, начиная в день распределения на группы (13 сутки) с дозами для антитела против mTNFR2 5 мг/кг (mpk), для антитела против mPD-L1 10 мг/кг (mpk) и для антитела против mPD-1 10 мг/кг (mpk). Объем опухоли и массу тела измеряли три раза в неделю в фиксированное время.
[112] На 21-е сутки после инокуляции опухоли по сравнению с контрольной группой рост опухоли в группе введения антитела против mTNFR2 и в группе введения антитела против mPD-L1 в значительной степени ингибировался (P < 0,05), где группа антитела против mTNFR2 продемонстрировала более высокую величину ингибирования роста опухоли (TGI), чем группа антитела против mPD-L1. Результаты показывают, что антитело против mTNFR2 обладает лучшей эффективностью в модели опухоли CT26, чем введение либо антитела против PD-1, либо антитела против PD-L1 (фиг. 12A-B).
[113] В ходе периода введения экспериментальные животные в каждой группы имели хорошее состояние активности и питания, и их масса тела возрастала до определенной степени. Результаты показывают, что введение антитела против mTNFR2 хорошо переносилось (фиг. 12C).
[114] Через 24 часа после последнего дозирования большинство мышей в контрольной группе G1 и группе G2 антитела против mTNFR2 отбирали для анализа FACS в отношении TIL. Все клеточные популяции гейтировали в соответствии с FMO-контролями (фиг. 13A-B). Результат показывает, что процент CD8+ T в группе введения суррогатного антитела против mTNFR2 является значительно более высоким, чем в контрольной группе (P < 0,01) (фиг. 13C). Между тем, отношение тотальных CD8+ T-клеток и CD8+ T-клеток памяти к Treg-клеткам (CD8+ T/Treg) в группе введения mTNFR2 также было значительно более высоким, чем в контрольной группе (p < 0,001) (фиг. 13D-E). Средняя интенсивность флуоресценции для PD-1, экспрессируемого на CD8+ T-клетках в группе введения антитела против mTNFR2, очевидно является более низкой, чем в группе изотипического контроля (p < 0,001) (фиг. 13F). Вышеупомянутые данные указывают на то, что противоопухолевый эффект антитела против mTNFR2 может быть объяснен увеличением соотношения CD8+ T/Treg и частично обращенным вспять состоянием истощения CD8+ T-клеток.
[115] Формула для вычисления объема опухоли (TV) представляет собой: V=1/2×a×b2, где a и b представляют собой длину и ширину, соответственно. Относительный объем опухоли (RTV) вычисляли, исходя из измеренных результатов, и формула вычисления представляет собой: RTV=Vt/V0, где V0 представляет собой объем опухоли, измеренный в момент распределения на группы (т.е. 0 сутки), и Vt представляет собой объем опухоли, измеренный в каждый из моментов времени. TGI%=[1-RTV (экспериментальная группа)/RTV (контрольная группа)]×100%.
ПРИМЕР 18. Оценка эффективности in vivo суррогатного антитела против TNFR2 мыши в комбинации с суррогатным антителом против PD-1 мыши
[116] Мышам подкожно инокулировали 1×105 клеток рака толстого кишечника CT26 в правый бок (выбрано в качестве 0 суток эксперимента). Когда объем опухоли достигал ~100 мм3, мышей с надлежащим объемом опухоли отбирали и случайным образом распределяли на 6 экспериментальных групп с использованием способа случайных номеров EXCEL (G1 в качестве контрольной группы, G2 в качестве группы антитела против mTNFR2, G3 в качестве группы антитела против mPD-1, G4 в качестве группы антитела против-mTNFR2+антитело против mPD-1), с 9 мышами в каждой группе. Антитела вводили внутрибрюшинно два раза в неделю, начиная в день распределения на группы (14 сутки) с дозами для антитела против mTNFR2 5 мг/кг (mpk) и для антитела против mPD-1 10 мг/кг (mpk). Объем опухоли и массу тела измеряли три раза в неделю в фиксированное время.
[117] На 28-е сутки после инокуляции опухоли, по сравнению с контрольной группой, рост опухоли в группе G2 антитела против mTNFR2 и в группе G3 антитела против mPD-L1 значительно ингибировался (P < 0,05), где группа антитела против mTNFR2 продемонстрировала более высокую величину ингибирования роста опухоли (TGI), чем группа антитела против mPD-L1. Результаты показывают, что антитело против mTNFR2 обладает лучшей эффективностью в этой модели на животных. Группа комбинированного введения G4 имеет наибольшую эффективность среди всех групп введения (p < 0,01, p < 0,001), что указывает на то, что может быть достигнута синергия эффективности при комбинировании введения антитела против mTNFR2 и антитела против mPD-1 (фиг. 14A-B).
[118] Через 28 суток после последней дозы все мыши в четырех группах были в фазе наблюдения и объемы опухолей для каждой мыши регистрировали по меньшей мере один раз в неделю. Объем опухоли для мышей в группе G2 антитела против mTNFR2 и группе G3 антитела против mPD-L1 постепенно рос, и мыши в двух группах в конечном итоге погибли на 55 сутки, в то время как некоторые мыши в группе комбинированного введения G4 все еще были живы на 68 сутки, и выживаемость в этой группе превышала 50% (55,6%). 3 мыши в группе комбинированного введения G4 продемонстрировали полную регрессию опухоли до конца эксперимента, что является значительно лучшим, по сравнению с группами введения единичного лекарственного средства и контрольной группой (p < 0,001, p < 0,0001), что указывает на лучшую эффективность комбинированного введения по сравнению с любым из введений единичных лекарственных средств (фиг. 14C).
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> JIANGSU SIMCERE PHARMACEUTICAL CO., LTD.
СИМСЕРЕ БАЙО-ФАРМАСЬЮТИКАЛ ТЕКНОЛОДЖИ., ЛТД.
<120> АНТИТЕЛО ПРОТИВ TNFR2 И ЕГО ПРИМЕНЕНИЕ
<130> OP201036
<160> 154
<170> PatentIn version 3.3
<210> 1
<211> 121
<212> БЕЛОК
<213> Искусственный
<220>
<223> VH положительного клона-кандидата ID 1
<400> 1
Glu Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Asn Leu Ser Cys Ala Ala Ser Gly Phe Ala Phe Ser Thr Tyr
20 25 30
Asp Leu Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Tyr Ile Asn Asn Gly Gly Ile Ser Thr Tyr Tyr Ser Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Val Arg Gly Pro Phe Tyr Gly Ser Ala Asn Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 2
<211> 107
<212> БЕЛОК
<213> Искусственный
<220>
<223> VL положительного клона-кандидата ID 1
<400> 2
Glu Ile Val Met Thr Gln Ser Pro Ala Ser Leu Ser Leu Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Thr Ser Glu Ser Ile Tyr Ser Asn
20 25 30
Leu Pro Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Asp Ala Thr Lys Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Glu Ser Gly Thr Gln Tyr Ser Leu Lys Ile Asn Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Gly Thr Tyr Tyr Cys Gln His Phe Trp Val Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 3
<211> 121
<212> БЕЛОК
<213> Искусственный
<220>
<223> VH положительного клона-кандидата ID 88
<400> 3
Glu Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Asn Leu Ser Cys Ala Ala Ser Gly Phe Ala Phe Ser Thr Tyr
20 25 30
Asp Leu Ser Trp Val Arg Gln Thr Pro Gly Lys Arg Leu Glu Trp Val
35 40 45
Ala Tyr Ile Asn Asn Gly Gly Ile Ser Thr Tyr Tyr Ser Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Thr Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Val Arg Gly Pro Phe Tyr Gly Ser Ala Asn Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 4
<211> 107
<212> БЕЛОК
<213> Искусственный
<220>
<223> VL положительного клона-кандидата ID 88
<400> 4
Asp Ile Leu Met Thr Gln Ser Pro Ala Ser Leu Ser Leu Phe Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Asp Ala Thr Lys Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Glu Ser Gly Thr Gln Tyr Ser Leu Lys Ile Asn Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Gly Thr Tyr Tyr Cys Gln His Phe Trp Val Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 5
<211> 121
<212> БЕЛОК
<213> Искусственный
<220>
<223> VH положительного клона-кандидата ID 125
<400> 5
Glu Val Gln Leu Gln Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Asn Leu Ser Cys Ala Ala Ser Gly Phe Ala Phe Ser Ile Tyr
20 25 30
Asp Leu Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Tyr Ile Asn Asn Gly Gly Ile Ser Thr Tyr Tyr Ser Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Val Arg Gly Pro Phe Tyr Gly Ser Ala Asn Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 6
<211> 107
<212> БЕЛОК
<213> Искусственный
<220>
<223> VL положительного клона-кандидата ID 125
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Leu Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Asp Ala Thr Lys Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Glu Ser Gly Thr Gln Tyr Ser Leu Lys Ile Asn Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Gly Thr Tyr Tyr Cys Gln His Phe Trp Val Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 7
<211> 119
<212> БЕЛОК
<213> Искусственный
<220>
<223> VH положительного клона-кандидата ID 133
<400> 7
Glu Val Gln Leu Gln Glu Ser Gly Ala Glu Leu Val Arg Ser Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Ile Lys Asp Tyr
20 25 30
Tyr Ile Gln Trp Val Lys Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Asp Pro Glu Ser Gly Asn Thr Lys Tyr Ala Pro Lys Phe
50 55 60
Gln Asp Lys Ala Thr Met Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Gly Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Asn Ala Tyr Tyr Asp Tyr Asp Gly Ser Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 8
<211> 113
<212> БЕЛОК
<213> Искусственный
<220>
<223> VL положительного клона-кандидата ID 133
<400> 8
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Thr Asp Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Thr Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 9
<211> 123
<212> БЕЛОК
<213> Искусственный
<220>
<223> VH положительного клона-кандидата ID 219
<400> 9
Glu Val Gln Leu Gln Glu Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile His Pro Ser Asp Thr Glu Thr Arg Leu Asn Gln Asn Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ser Tyr
65 70 75 80
Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Glu Gly Leu Gly Ala Ala Arg Ser Val Ser Met Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 10
<211> 107
<212> БЕЛОК
<213> Искусственный
<220>
<223> VL положительного клона-кандидата ID 219
<400> 10
Asp Ile Leu Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Val Leu Ile
35 40 45
Tyr Tyr Thr Ala Ile Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 11
<211> 120
<212> БЕЛОК
<213> Искусственный
<220>
<223> VH положительного клона-кандидата ID 224
<400> 11
Glu Val Gln Leu Gln Glu Ser Gly Pro Glu Ile Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Asn Lys Asp Ile
20 25 30
Tyr Met His Trp Val Lys Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Thr Gly Asn Thr Lys His Asp Pro Lys Phe
50 55 60
Gln Asp Lys Ala Thr Leu Ser Ser Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Phe Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala His Ser Pro Tyr Gly Asp Phe Gly Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 12
<211> 108
<212> БЕЛОК
<213> Искусственный
<220>
<223> VL положительного клона-кандидата ID 224
<400> 12
Asp Ile Gln Met Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Thr Cys Thr Ala Ser Ser Ser Val Ser Ser Asn
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Pro Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu
65 70 75 80
Ala Glu Asp Ala Ala Thr Tyr Tyr Cys His Gln Tyr His Arg Ser Pro
85 90 95
Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 13
<211> 123
<212> БЕЛОК
<213> Искусственный
<220>
<223> VH положительного клона-кандидата ID 226
<400> 13
Glu Val Gln Leu Gln Glu Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Glu Gly Leu Gly Ala Ala Arg Ser Val Ser Met Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 14
<211> 107
<212> БЕЛОК
<213> Искусственный
<220>
<223> VL положительного клона-кандидата ID 226
<400> 14
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Val Leu Ile
35 40 45
Tyr Tyr Thr Ala Leu Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 15
<211> 120
<212> БЕЛОК
<213> Искусственный
<220>
<223> VH положительного клона-кандидата ID 309
<400> 15
Glu Val Gln Leu Gln Glu Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Ile His Trp Val Lys Leu Arg Pro Gly Gln Gly Phe Glu Trp Ile
35 40 45
Gly Glu Ile Asn Pro Asn Asn Gly Gly Thr Asp Tyr Asn Glu Lys Phe
50 55 60
Lys Arg Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Thr Ile Asp Ser Met Ile Thr Thr Thr Trp Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 16
<211> 107
<212> БЕЛОК
<213> Искусственный
<220>
<223> VL положительного клона-кандидата ID 309
<400> 16
Glu Ile Val Met Thr Gln Ser Gln Lys Leu Met Ser Thr Val Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Asn
20 25 30
Val Ala Trp Phe Gln Gln Lys Pro Gly Gln Ser Pro Lys Ala Leu Ile
35 40 45
Asn Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys Gln Gln Tyr Asn Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 17
<211> 119
<212> БЕЛОК
<213> Искусственный
<220>
<223> VH положительного клона-кандидата ID 352
<400> 17
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Val Val Ile Trp Ser Asp Gly Gly Thr Thr Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg His Asp Asp Asp Gly Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 18
<211> 106
<212> БЕЛОК
<213> Искусственный
<220>
<223> VL положительного клона-кандидата ID 352
<400> 18
Asp Ile Val Leu Thr Gln Ser Pro Ser Leu Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Gly Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Arg Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Leu Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Val Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asp Pro Phe Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 19
<211> 119
<212> БЕЛОК
<213> Искусственный
<220>
<223> VH положительного клона-кандидата ID 365
<400> 19
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Leu Ile Trp Ser Asp Gly Ser Pro Asp Tyr Ser Ala Ala Phe Ile
50 55 60
Ser Arg Leu Ser Ile Asn Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Ala Asp Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg Asn Asp Asp Gly Gly Asp Tyr Val Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 20
<211> 106
<212> БЕЛОК
<213> Искусственный
<220>
<223> VL положительного клона-кандидата ID 365
<400> 20
Glu Ile Val Leu Thr Gln Ser Pro Ala Leu Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Arg Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Leu Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Thr Ser Asn Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 21
<211> 119
<212> БЕЛОК
<213> Искусственный
<220>
<223> VH положительного клона-кандидата ID 395
<400> 21
Glu Val Gln Leu Gln Glu Ser Gly Pro Val Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Ser Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ser Asp Gly Gly Thr Asp Tyr Ser Ala Ala Phe Ile
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Ala Asp Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg Asn Asp Asp Gly Gly Asp Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 22
<211> 106
<212> БЕЛОК
<213> Искусственный
<220>
<223> VL положительного клона-кандидата ID 395
<400> 22
Glu Ile Val Leu Thr Gln Ser Pro Ala Leu Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Arg Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Leu Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 23
<211> 5
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 1, проанализированная
согласно KABAT
<400> 23
Thr Tyr Asp Leu Ser
1 5
<210> 24
<211> 17
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 1, проанализированная
согласно KABAT
<400> 24
Tyr Ile Asn Asn Gly Gly Ile Ser Thr Tyr Tyr Ser Asp Thr Val Lys
1 5 10 15
Gly
<210> 25
<211> 12
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 1, проанализированная
согласно KABAT
<400> 25
Gly Pro Phe Tyr Gly Ser Ala Asn Tyr Phe Asp Tyr
1 5 10
<210> 26
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 1, проанализированная
согласно IMGT
<400> 26
Gly Phe Ala Phe Ser Thr Tyr Asp
1 5
<210> 27
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 1, проанализированная
согласно IMGT
<400> 27
Ile Asn Asn Gly Gly Ile Ser Thr
1 5
<210> 28
<211> 14
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 1, проанализированная
согласно IMGT
<400> 28
Val Arg Gly Pro Phe Tyr Gly Ser Ala Asn Tyr Phe Asp Tyr
1 5 10
<210> 29
<211> 11
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 1, проанализированная
согласно KABAT
<400> 29
Arg Thr Ser Glu Ser Ile Tyr Ser Asn Leu Pro
1 5 10
<210> 30
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 1, проанализированная
согласно KABAT
<400> 30
Asp Ala Thr Lys Leu Ala Glu
1 5
<210> 31
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 1, проанализированная
согласно KABAT
<400> 31
Gln His Phe Trp Val Thr Pro Trp Thr
1 5
<210> 32
<211> 6
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 1, проанализированная
согласно IMGT
<400> 32
Glu Ser Ile Tyr Ser Asn
1 5
<210> 33
<211> 3
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 1, проанализированная
согласно IMGT
<400> 33
Asp Ala Thr
1
<210> 34
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 1, проанализированная
согласно IMGT
<400> 34
Gln His Phe Trp Val Thr Pro Trp Thr
1 5
<210> 35
<211> 5
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 88, проанализированная
согласно KABAT
<400> 35
Thr Tyr Asp Leu Ser
1 5
<210> 36
<211> 17
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 88, проанализированная
согласно KABAT
<400> 36
Tyr Ile Asn Asn Gly Gly Ile Ser Thr Tyr Tyr Ser Asp Thr Val Lys
1 5 10 15
Gly
<210> 37
<211> 12
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 88, проанализированная
согласно KABAT
<400> 37
Gly Pro Phe Tyr Gly Ser Ala Asn Tyr Phe Asp Tyr
1 5 10
<210> 38
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 88, проанализированная
согласно IMGT
<400> 38
Gly Phe Ala Phe Ser Thr Tyr Asp
1 5
<210> 39
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 88, проанализированная
согласно IMGT
<400> 39
Ile Asn Asn Gly Gly Ile Ser Thr
1 5
<210> 40
<211> 14
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 88, проанализированная
согласно IMGT
<400> 40
Val Arg Gly Pro Phe Tyr Gly Ser Ala Asn Tyr Phe Asp Tyr
1 5 10
<210> 41
<211> 11
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 88, проанализированная
согласно KABAT
<400> 41
Arg Ala Ser Glu Asn Ile Tyr Ser Asn Leu Ala
1 5 10
<210> 42
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 88, проанализированная
согласно KABAT
<400> 42
Asp Ala Thr Lys Leu Ala Glu
1 5
<210> 43
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 88, проанализированная
согласно KABAT
<400> 43
Gln His Phe Trp Val Thr Pro Trp Thr
1 5
<210> 44
<211> 6
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 88, проанализированная
согласно IMGT
<400> 44
Glu Asn Ile Tyr Ser Asn
1 5
<210> 45
<211> 3
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 88, проанализированная
согласно IMGT
<400> 45
Asp Ala Thr
1
<210> 46
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 88, проанализированная
согласно IMGT
<400> 46
Gln His Phe Trp Val Thr Pro Trp Thr
1 5
<210> 47
<211> 5
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 125, проанализированная
согласно KABAT
<400> 47
Ile Tyr Asp Leu Ser
1 5
<210> 48
<211> 17
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 125, проанализированная
согласно KABAT
<400> 48
Tyr Ile Asn Asn Gly Gly Ile Ser Thr Tyr Tyr Ser Asp Thr Val Lys
1 5 10 15
Gly
<210> 49
<211> 12
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 125, проанализированная
согласно KABAT
<400> 49
Gly Pro Phe Tyr Gly Ser Ala Asn Tyr Phe Asp Tyr
1 5 10
<210> 50
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 125, проанализированная
согласно IMGT
<400> 50
Gly Phe Ala Phe Ser Ile Tyr Asp
1 5
<210> 51
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 125, проанализированная
согласно IMGT
<400> 51
Ile Asn Asn Gly Gly Ile Ser Thr
1 5
<210> 52
<211> 14
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 125, проанализированная
согласно IMGT
<400> 52
Val Arg Gly Pro Phe Tyr Gly Ser Ala Asn Tyr Phe Asp Tyr
1 5 10
<210> 53
<211> 11
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 125, проанализированная
согласно KABAT
<400> 53
Arg Ala Ser Glu Asn Ile Tyr Ser Asn Leu Ala
1 5 10
<210> 54
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 125, проанализированная
согласно KABAT
<400> 54
Asp Ala Thr Lys Leu Ala Glu
1 5
<210> 55
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 125, проанализированная
согласно KABAT
<400> 55
Gln His Phe Trp Val Thr Pro Trp Thr
1 5
<210> 56
<211> 6
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 125, проанализированная
согласно IMGT
<400> 56
Glu Asn Ile Tyr Ser Asn
1 5
<210> 57
<211> 3
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 125, проанализированная
согласно IMGT
<400> 57
Asp Ala Thr
1
<210> 58
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 125, проанализированная
согласно IMGT
<400> 58
Gln His Phe Trp Val Thr Pro Trp Thr
1 5
<210> 59
<211> 5
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 133, проанализированная
согласно KABAT
<400> 59
Asp Tyr Tyr Ile Gln
1 5
<210> 60
<211> 17
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 133, проанализированная
согласно KABAT
<400> 60
Trp Ile Asp Pro Glu Ser Gly Asn Thr Lys Tyr Ala Pro Lys Phe Gln
1 5 10 15
Asp
<210> 61
<211> 10
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 133, проанализированная
согласно KABAT
<400> 61
Tyr Tyr Asp Tyr Asp Gly Ser Met Asp Tyr
1 5 10
<210> 62
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 133, проанализированная
согласно IMGT
<400> 62
Gly Phe Asn Ile Lys Asp Tyr Tyr
1 5
<210> 63
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 133, проанализированная
согласно IMGT
<400> 63
Ile Asp Pro Glu Ser Gly Asn Thr
1 5
<210> 64
<211> 12
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 133, проанализированная
согласно IMGT
<400> 64
Asn Ala Tyr Tyr Asp Tyr Asp Gly Ser Met Asp Tyr
1 5 10
<210> 65
<211> 16
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 133, проанализированная
согласно KABAT
<400> 65
Arg Ser Ser Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr Leu His
1 5 10 15
<210> 66
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 133, проанализированная
согласно KABAT
<400> 66
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 67
<211> 10
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 133, проанализированная
согласно KABAT
<400> 67
Ser Gln Ser Thr His Val Pro Thr Trp Thr
1 5 10
<210> 68
<211> 11
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 133, проанализированная
согласно IMGT
<400> 68
Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr
1 5 10
<210> 69
<211> 3
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 133, проанализированная
согласно IMGT
<400> 69
Lys Val Ser
1
<210> 70
<211> 10
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 133, проанализированная
согласно IMGT
<400> 70
Ser Gln Ser Thr His Val Pro Thr Trp Thr
1 5 10
<210> 71
<211> 5
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 219, проанализированная
согласно KABAT
<400> 71
Asn Tyr Trp Met Asn
1 5
<210> 72
<211> 17
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 219, проанализированная
согласно KABAT
<400> 72
Met Ile His Pro Ser Asp Thr Glu Thr Arg Leu Asn Gln Asn Phe Lys
1 5 10 15
Asp
<210> 73
<211> 14
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 219, проанализированная
согласно KABAT
<400> 73
Gly Glu Gly Leu Gly Ala Ala Arg Ser Val Ser Met Asp Tyr
1 5 10
<210> 74
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 219, проанализированная
согласно IMGT
<400> 74
Gly Tyr Ser Phe Thr Asn Tyr Trp
1 5
<210> 75
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 219, проанализированная
согласно IMGT
<400> 75
Ile His Pro Ser Asp Thr Glu Thr
1 5
<210> 76
<211> 16
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 219, проанализированная
согласно IMGT
<400> 76
Ala Arg Gly Glu Gly Leu Gly Ala Ala Arg Ser Val Ser Met Asp Tyr
1 5 10 15
<210> 77
<211> 11
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 219, проанализированная
согласно KABAT
<400> 77
Arg Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 78
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 219, проанализированная
согласно KABAT
<400> 78
Tyr Thr Ala Ile Leu His Ser
1 5
<210> 79
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 219, проанализированная
согласно KABAT
<400> 79
Gln Gln Gly Asn Thr Leu Pro Trp Thr
1 5
<210> 80
<211> 6
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 219, проанализированная
согласно IMGT
<400> 80
Gln Asp Ile Ser Asn Tyr
1 5
<210> 81
<211> 3
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 219, проанализированная
согласно IMGT
<400> 81
Tyr Thr Ala
1
<210> 82
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 219, проанализированная
согласно IMGT
<400> 82
Gln Gln Gly Asn Thr Leu Pro Trp Thr
1 5
<210> 83
<211> 5
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 224, проанализированная
согласно KABAT
<400> 83
Asp Ile Tyr Met His
1 5
<210> 84
<211> 17
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 224, проанализированная
согласно KABAT
<400> 84
Arg Ile Asp Pro Ala Thr Gly Asn Thr Lys His Asp Pro Lys Phe Gln
1 5 10 15
Asp
<210> 85
<211> 11
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 224, проанализированная
согласно KABAT
<400> 85
Ser Pro Tyr Gly Asp Phe Gly Ala Met Asp Tyr
1 5 10
<210> 86
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 224, проанализированная
согласно IMGT
<400> 86
Gly Phe Asn Asn Lys Asp Ile Tyr
1 5
<210> 87
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 224, проанализированная
согласно IMGT
<400> 87
Ile Asp Pro Ala Thr Gly Asn Thr
1 5
<210> 88
<211> 13
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 224, проанализированная
согласно IMGT
<400> 88
Ala His Ser Pro Tyr Gly Asp Phe Gly Ala Met Asp Tyr
1 5 10
<210> 89
<211> 12
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 224, проанализированная
согласно KABAT
<400> 89
Thr Ala Ser Ser Ser Val Ser Ser Asn Tyr Leu His
1 5 10
<210> 90
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 224, проанализированная
согласно KABAT
<400> 90
Ser Thr Ser Asn Leu Pro Ser
1 5
<210> 91
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 224, проанализированная
согласно KABAT
<400> 91
His Gln Tyr His Arg Ser Pro Trp Thr
1 5
<210> 92
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 224, проанализированная
согласно IMGT
<400> 92
Ser Ser Val Ser Ser Asn Tyr
1 5
<210> 93
<211> 3
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 224, проанализированная
согласно IMGT
<400> 93
Ser Thr Ser
1
<210> 94
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 224, проанализированная
согласно IMGT
<400> 94
His Gln Tyr His Arg Ser Pro Trp Thr
1 5
<210> 95
<211> 5
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 226, проанализированная
согласно KABAT
<400> 95
Asn Tyr Trp Met Asn
1 5
<210> 96
<211> 17
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 226, проанализированная
согласно KABAT
<400> 96
Met Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 97
<211> 14
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 226, проанализированная
согласно KABAT
<400> 97
Gly Glu Gly Leu Gly Ala Ala Arg Ser Val Ser Met Asp Tyr
1 5 10
<210> 98
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 226, проанализированная
согласно IMGT
<400> 98
Gly Tyr Ser Phe Thr Asn Tyr Trp
1 5
<210> 99
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 226, проанализированная
согласно IMGT
<400> 99
Ile His Pro Ser Asp Ser Glu Thr
1 5
<210> 100
<211> 16
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 226, проанализированная
согласно IMGT
<400> 100
Ala Arg Gly Glu Gly Leu Gly Ala Ala Arg Ser Val Ser Met Asp Tyr
1 5 10 15
<210> 101
<211> 11
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 226, проанализированная
согласно KABAT
<400> 101
Arg Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 102
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 226, проанализированная
согласно KABAT
<400> 102
Tyr Thr Ala Leu Leu His Ser
1 5
<210> 103
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 226, проанализированная
согласно KABAT
<400> 103
Gln Gln Gly Asn Thr Leu Pro Trp Thr
1 5
<210> 104
<211> 6
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 226, проанализированная
согласно IMGT
<400> 104
Gln Asp Ile Ser Asn Tyr
1 5
<210> 105
<211> 3
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 226, проанализированная
согласно IMGT
<400> 105
Tyr Thr Ala
1
<210> 106
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 226, проанализированная
согласно IMGT
<400> 106
Gln Gln Gly Asn Thr Leu Pro Trp Thr
1 5
<210> 107
<211> 5
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 309, проанализированная
согласно KABAT
<400> 107
Ser Tyr Trp Ile His
1 5
<210> 108
<211> 17
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 309, проанализированная
согласно KABAT
<400> 108
Glu Ile Asn Pro Asn Asn Gly Gly Thr Asp Tyr Asn Glu Lys Phe Lys
1 5 10 15
Arg
<210> 109
<211> 11
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 309, проанализированная
согласно KABAT
<400> 109
Asp Ser Met Ile Thr Thr Thr Trp Phe Ala Tyr
1 5 10
<210> 110
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 309, проанализированная
согласно IMGT
<400> 110
Gly Tyr Thr Phe Thr Ser Tyr Trp
1 5
<210> 111
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 309, проанализированная
согласно IMGT
<400> 111
Ile Asn Pro Asn Asn Gly Gly Thr
1 5
<210> 112
<211> 13
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 309, проанализированная
согласно IMGT
<400> 112
Thr Ile Asp Ser Met Ile Thr Thr Thr Trp Phe Ala Tyr
1 5 10
<210> 113
<211> 11
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 309, проанализированная
согласно KABAT
<400> 113
Lys Ala Ser Gln Asn Val Gly Thr Asn Val Ala
1 5 10
<210> 114
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 309, проанализированная
согласно KABAT
<400> 114
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 115
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 309, проанализированная
согласно KABAT
<400> 115
Gln Gln Tyr Asn Ser Tyr Pro Phe Thr
1 5
<210> 116
<211> 6
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 309, проанализированная
согласно IMGT
<400> 116
Gln Asn Val Gly Thr Asn
1 5
<210> 117
<211> 3
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 309, проанализированная
согласно IMGT
<400> 117
Ser Ala Ser
1
<210> 118
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 309, проанализированная
согласно IMGT
<400> 118
Gln Gln Tyr Asn Ser Tyr Pro Phe Thr
1 5
<210> 119
<211> 5
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 352, проанализированная
согласно KABAT
<400> 119
Ser Tyr Gly Val His
1 5
<210> 120
<211> 16
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 352, проанализированная
согласно KABAT
<400> 120
Val Ile Trp Ser Asp Gly Gly Thr Thr Tyr Asn Ser Ala Leu Lys Ser
1 5 10 15
<210> 121
<211> 11
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 352, проанализированная
согласно KABAT
<400> 121
His Asp Asp Asp Gly Tyr Tyr Ala Met Asp Tyr
1 5 10
<210> 122
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 352, проанализированная
согласно IMGT
<400> 122
Gly Phe Ser Leu Thr Ser Tyr Gly
1 5
<210> 123
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 352, проанализированная
согласно IMGT
<400> 123
Ile Trp Ser Asp Gly Gly Thr
1 5
<210> 124
<211> 13
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 352, проанализированная
согласно IMGT
<400> 124
Ala Arg His Asp Asp Asp Gly Tyr Tyr Ala Met Asp Tyr
1 5 10
<210> 125
<211> 10
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 352, проанализированная
согласно KABAT
<400> 125
Ser Ala Ser Ser Ser Val Gly Tyr Met Tyr
1 5 10
<210> 126
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 352, проанализированная
согласно KABAT
<400> 126
Leu Thr Ser Asn Leu Ala Ser
1 5
<210> 127
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 352, проанализированная
согласно KABAT
<400> 127
Gln Gln Trp Ser Ser Asp Pro Phe Thr
1 5
<210> 128
<211> 5
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 352, проанализированная
согласно IMGT
<400> 128
Ser Ser Val Gly Tyr
1 5
<210> 129
<211> 3
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 352, проанализированная
согласно IMGT
<400> 129
Leu Thr Ser
1
<210> 130
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 352, проанализированная
согласно IMGT
<400> 130
Gln Gln Trp Ser Ser Asp Pro Phe Thr
1 5
<210> 131
<211> 5
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 365, проанализированная
согласно KABAT
<400> 131
Ser Tyr Gly Val His
1 5
<210> 132
<211> 16
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 365, проанализированная
согласно KABAT
<400> 132
Leu Ile Trp Ser Asp Gly Ser Pro Asp Tyr Ser Ala Ala Phe Ile Ser
1 5 10 15
<210> 133
<211> 11
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 365, проанализированная
согласно KABAT
<400> 133
Asn Asp Asp Gly Gly Asp Tyr Val Met Asp Tyr
1 5 10
<210> 134
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 365, проанализированная
согласно IMGT
<400> 134
Gly Phe Ser Leu Thr Ser Tyr Gly
1 5
<210> 135
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 365, проанализированная
согласно IMGT
<400> 135
Ile Trp Ser Asp Gly Ser Pro
1 5
<210> 136
<211> 13
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 365, проанализированная
согласно IMGT
<400> 136
Ala Arg Asn Asp Asp Gly Gly Asp Tyr Val Met Asp Tyr
1 5 10
<210> 137
<211> 10
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 365, проанализированная
согласно KABAT
<400> 137
Ser Ala Ser Ser Ser Val Ser Tyr Met Tyr
1 5 10
<210> 138
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 365, проанализированная
согласно KABAT
<400> 138
Leu Thr Ser Asn Leu Ala Ser
1 5
<210> 139
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 365, проанализированная
согласно KABAT
<400> 139
Gln Gln Trp Thr Ser Asn Pro Leu Thr
1 5
<210> 140
<211> 5
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 365, проанализированная
согласно IMGT
<400> 140
Ser Ser Val Ser Tyr
1 5
<210> 141
<211> 3
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 365, проанализированная
согласно IMGT
<400> 141
Leu Thr Ser
1
<210> 142
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 365, проанализированная
согласно IMGT
<400> 142
Gln Gln Trp Thr Ser Asn Pro Leu Thr
1 5
<210> 143
<211> 5
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 395, проанализированная
согласно KABAT
<400> 143
Ser Tyr Ser Val His
1 5
<210> 144
<211> 16
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 395, проанализированная
согласно KABAT
<400> 144
Val Ile Trp Ser Asp Gly Gly Thr Asp Tyr Ser Ala Ala Phe Ile Ser
1 5 10 15
<210> 145
<211> 11
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 395, проанализированная
согласно KABAT
<400> 145
Asn Asp Asp Gly Gly Asp Tyr Ala Met Asp Tyr
1 5 10
<210> 146
<211> 8
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VH положительного клона-кандидата ID 395, проанализированная
согласно IMGT
<400> 146
Gly Phe Ser Leu Thr Ser Tyr Ser
1 5
<210> 147
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VH положительного клона-кандидата ID 395, проанализированная
согласно IMGT
<400> 147
Ile Trp Ser Asp Gly Gly Thr
1 5
<210> 148
<211> 13
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VH положительного клона-кандидата ID 395, проанализированная
согласно IMGT
<400> 148
Ala Arg Asn Asp Asp Gly Gly Asp Tyr Ala Met Asp Tyr
1 5 10
<210> 149
<211> 10
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 395, проанализированная
согласно KABAT
<400> 149
Ser Ala Ser Ser Ser Val Ser Tyr Met Tyr
1 5 10
<210> 150
<211> 7
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 395, проанализированная
согласно KABAT
<400> 150
Leu Thr Ser Asn Leu Ala Ser
1 5
<210> 151
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 395, проанализированная
согласно KABAT
<400> 151
Gln Gln Trp Ser Ser Asn Pro Leu Thr
1 5
<210> 152
<211> 5
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR1-VL положительного клона-кандидата ID 395, проанализированная
согласно IMGT
<400> 152
Ser Ser Val Ser Tyr
1 5
<210> 153
<211> 3
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR2-VL положительного клона-кандидата ID 395, проанализированная
согласно IMGT
<400> 153
Leu Thr Ser
1
<210> 154
<211> 9
<212> БЕЛОК
<213> Искусственный
<220>
<223> CDR3-VL положительного клона-кандидата ID 395, проанализированная
согласно IMGT
<400> 154
Gln Gln Trp Ser Ser Asn Pro Leu Thr
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО ПРОТИВ КЛАУДИНА 18A2 И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2811431C2 |
| НОВОЕ АНТИТЕЛО ПРОТИВ ПРЕСЕПСИНА | 2015 |
|
RU2710439C2 |
| АНТИТЕЛО, СВЯЗЫВАЮЩЕЕ ЧЕЛОВЕЧЕСКИЙ IL-4R, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2779649C1 |
| АНТИТЕЛО ПРОТИВ КЛАУДИНА 18.2 И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2822550C2 |
| АНТИТЕЛО К B7-H4, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2792748C2 |
| АНТИТЕЛО К PD-1, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2807484C2 |
| БИСПЕЦИФИЧЕСКИЙ БЕЛОК | 2019 |
|
RU2784486C1 |
| АНТИТЕЛО ПРОТИВ IL-5, ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2772716C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ АНТИТЕЛА К PD-L1 И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2766590C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АНТИТЕЛО К LAG-3, И ЕЕ ПРИМЕНЕНИЕ | 2018 |
|
RU2771384C2 |
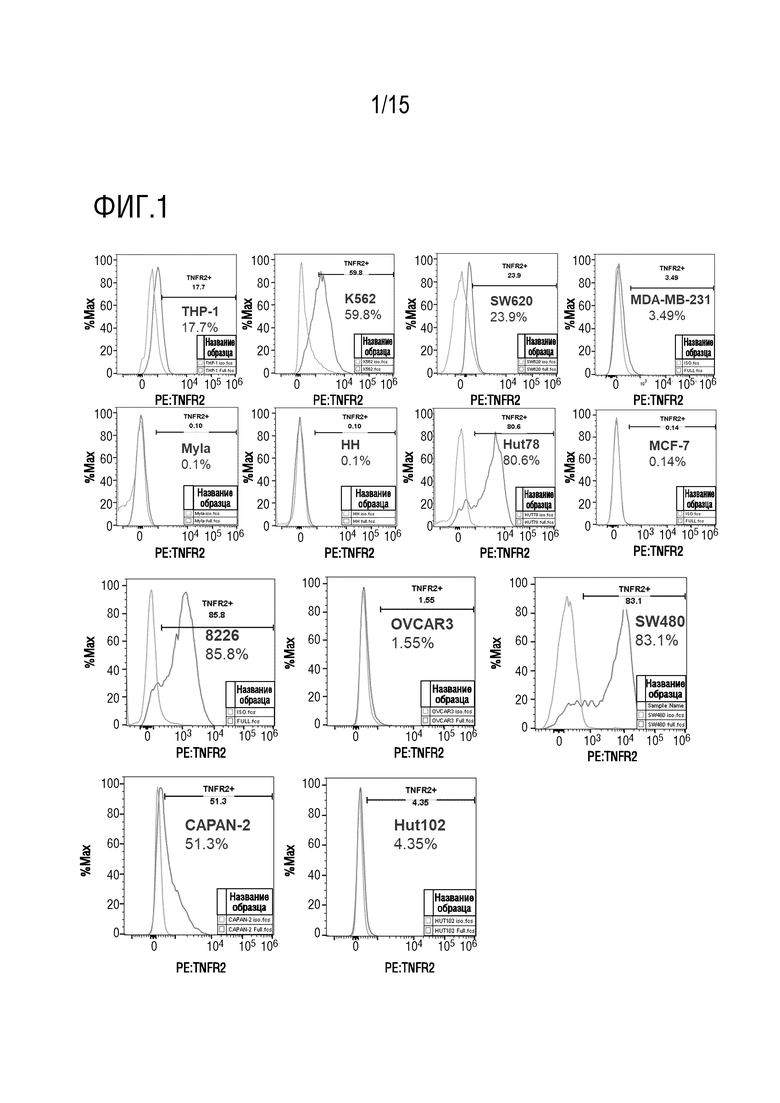
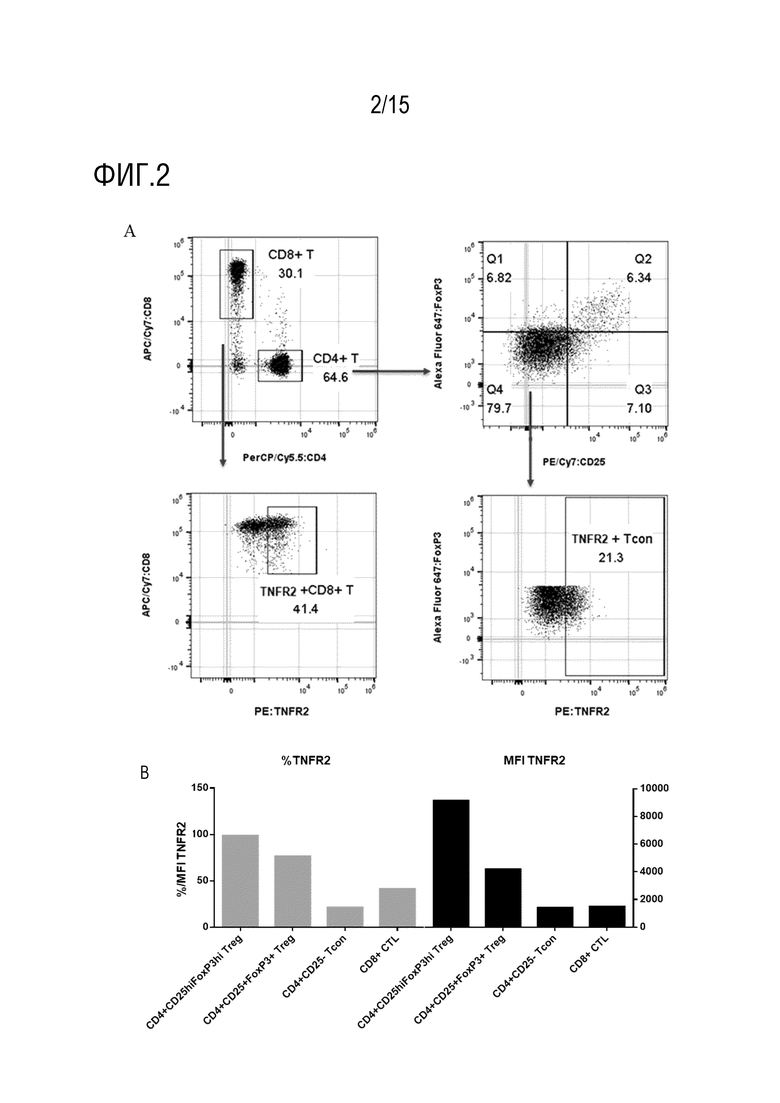

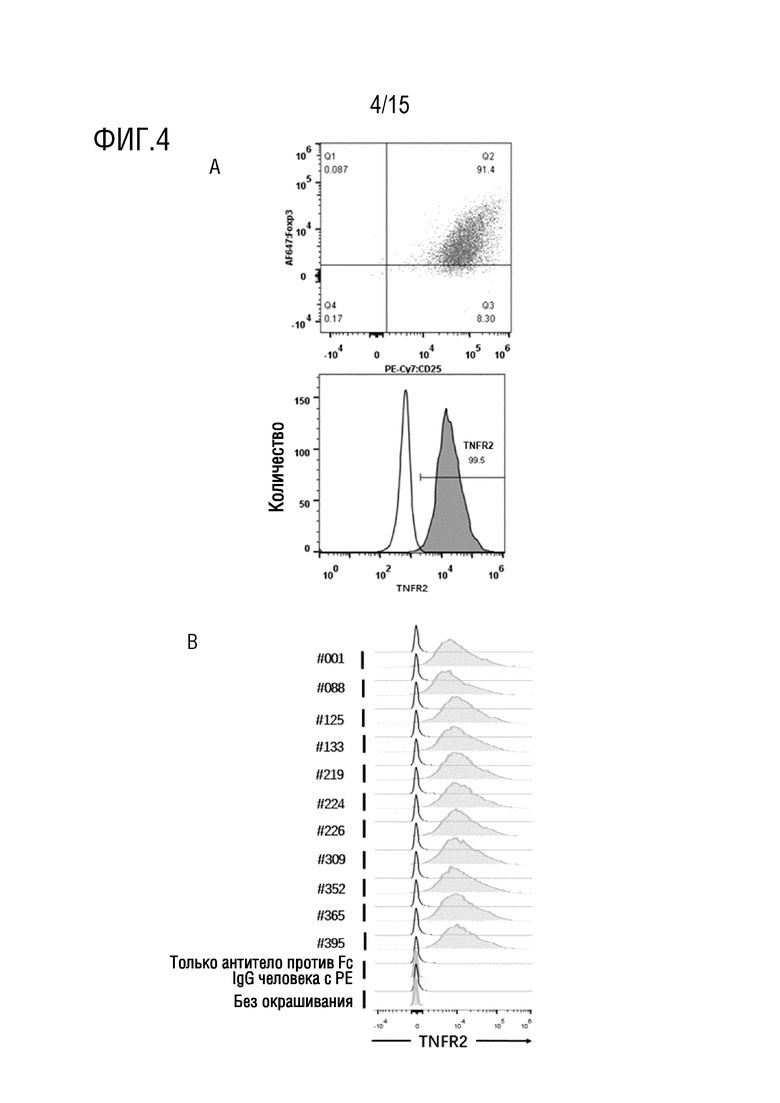
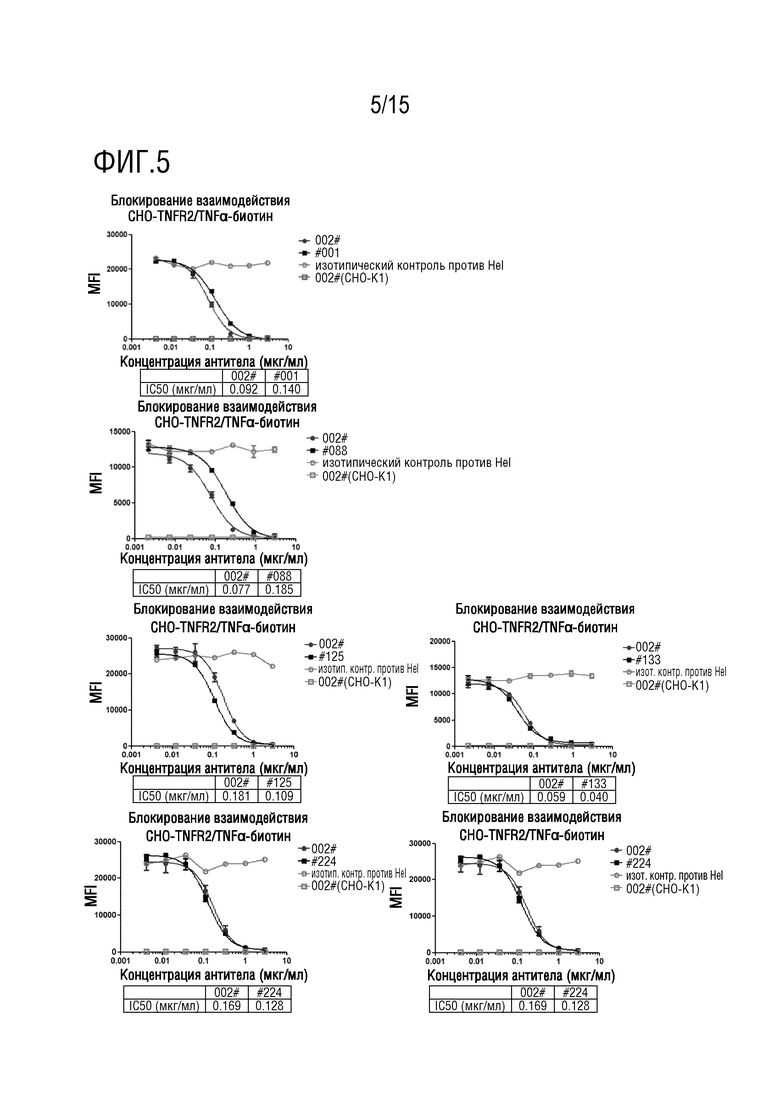
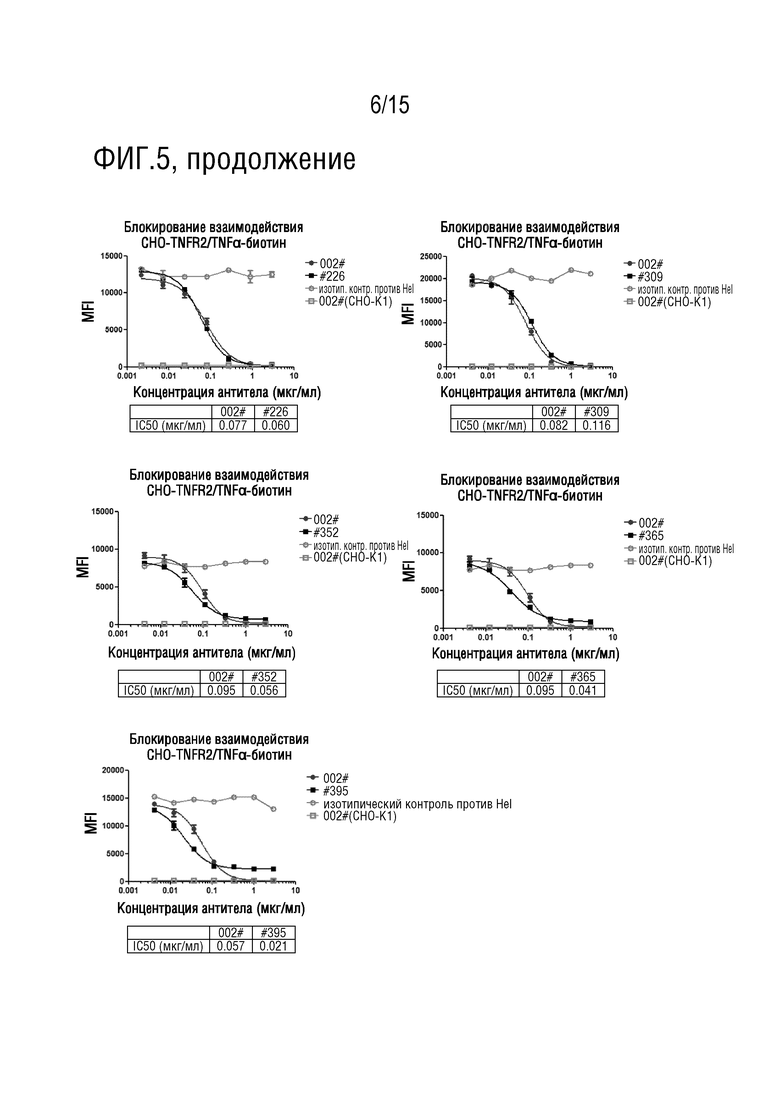
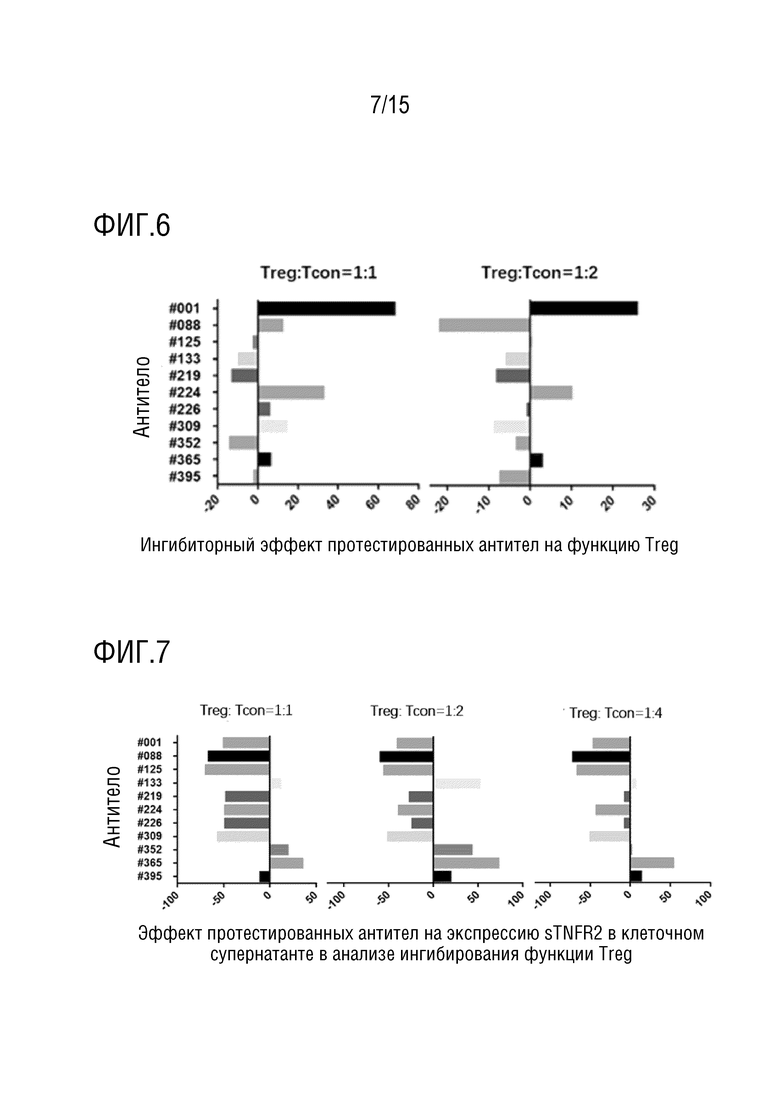
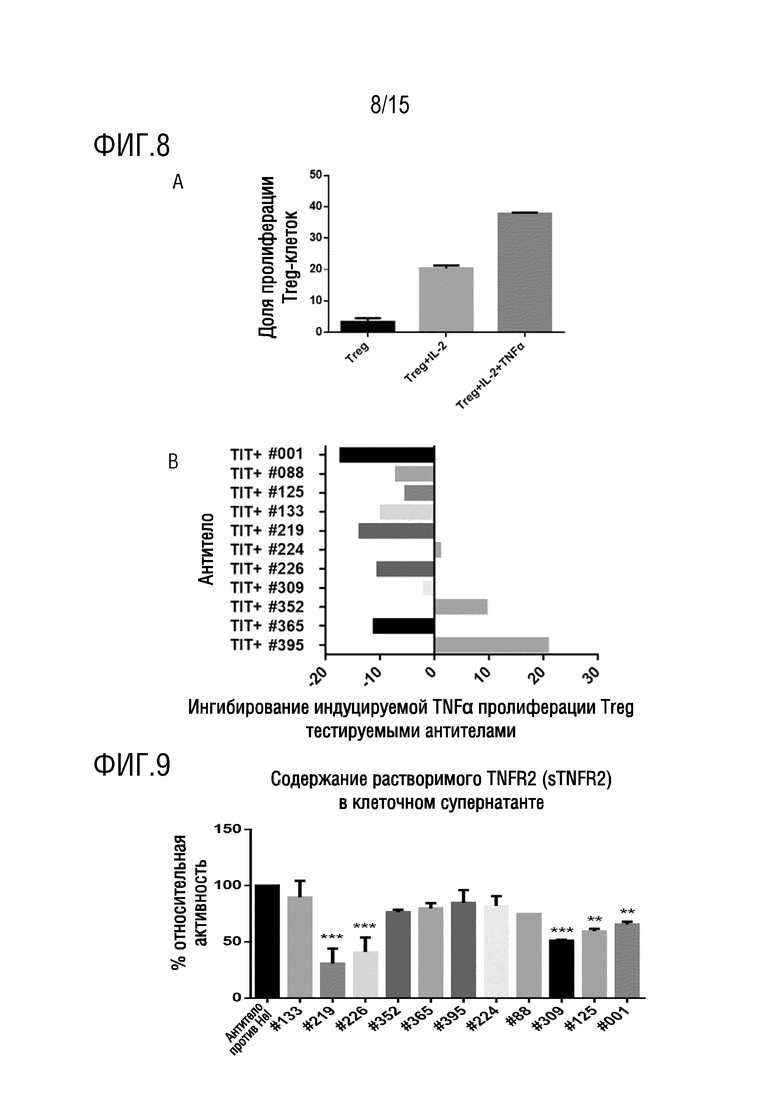
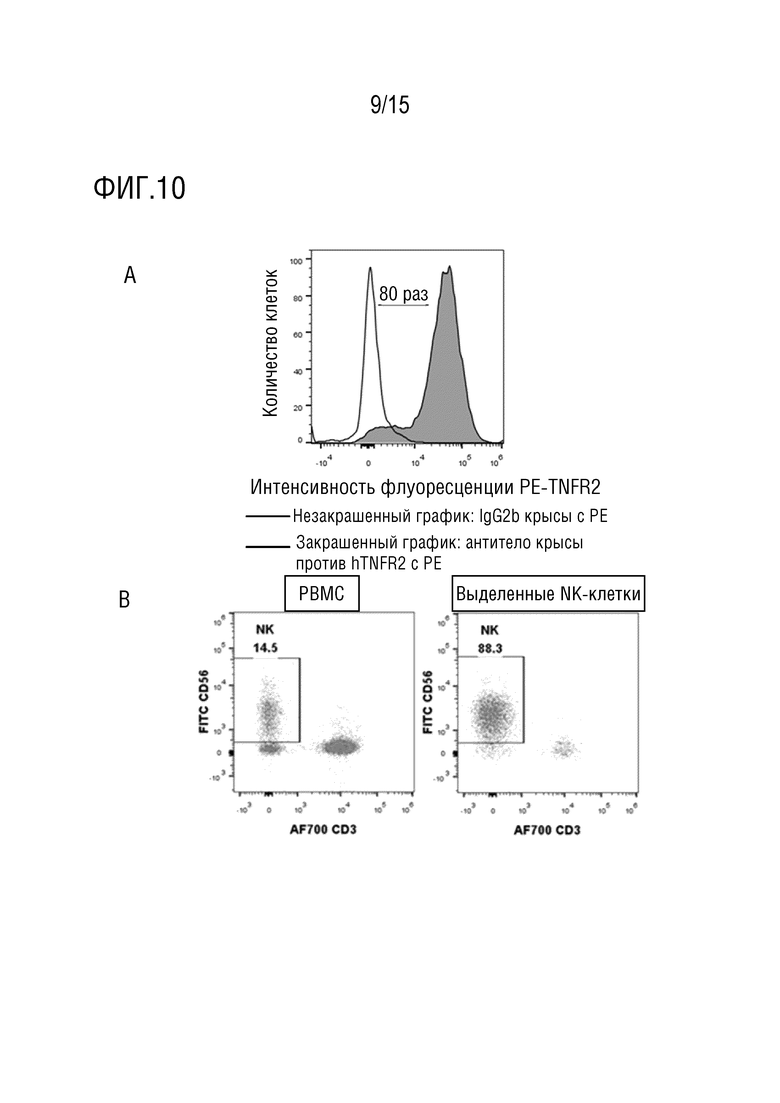
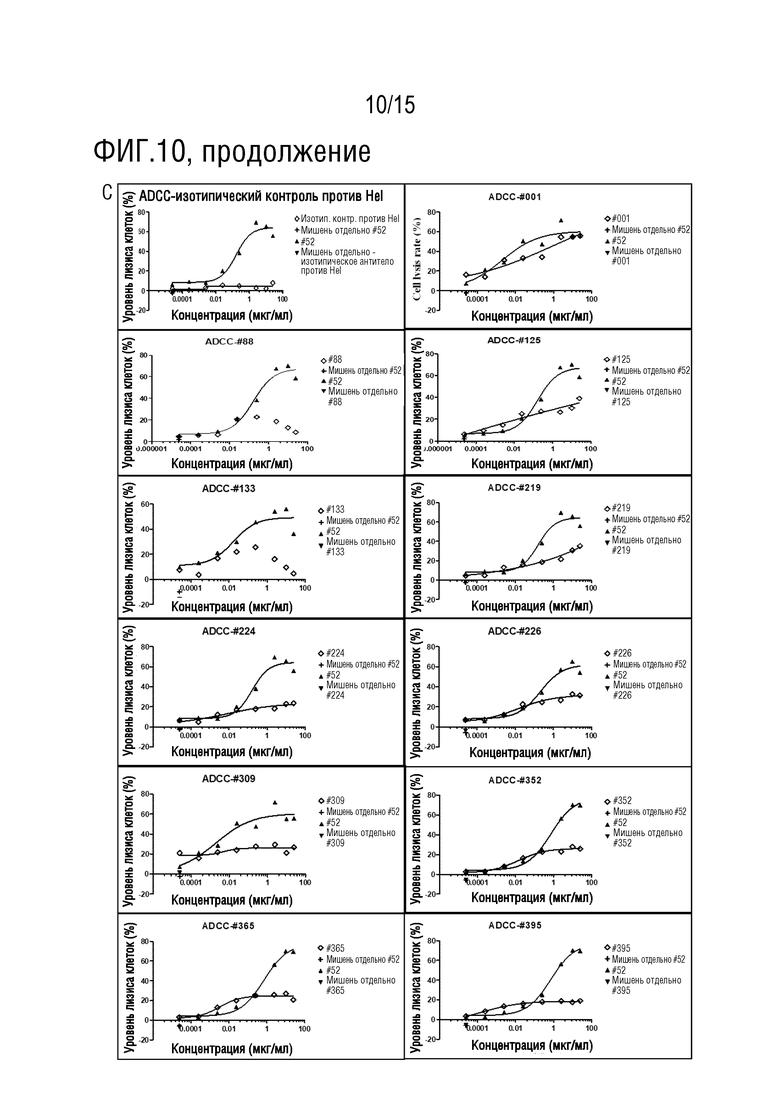

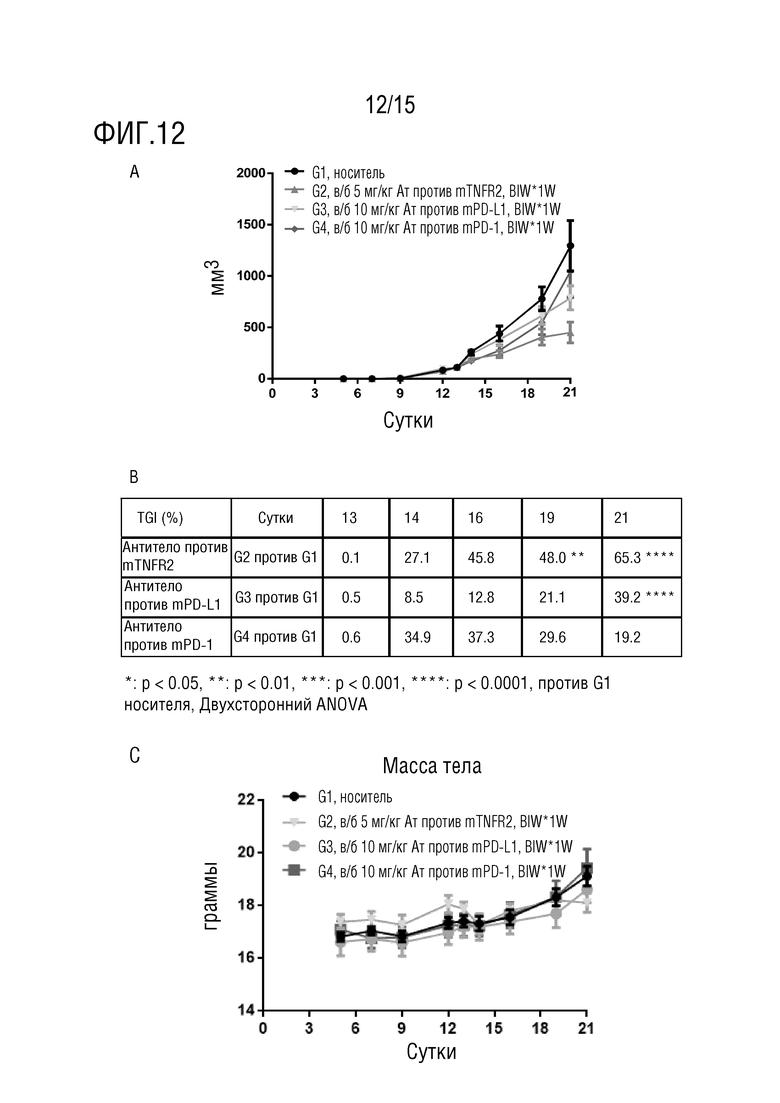
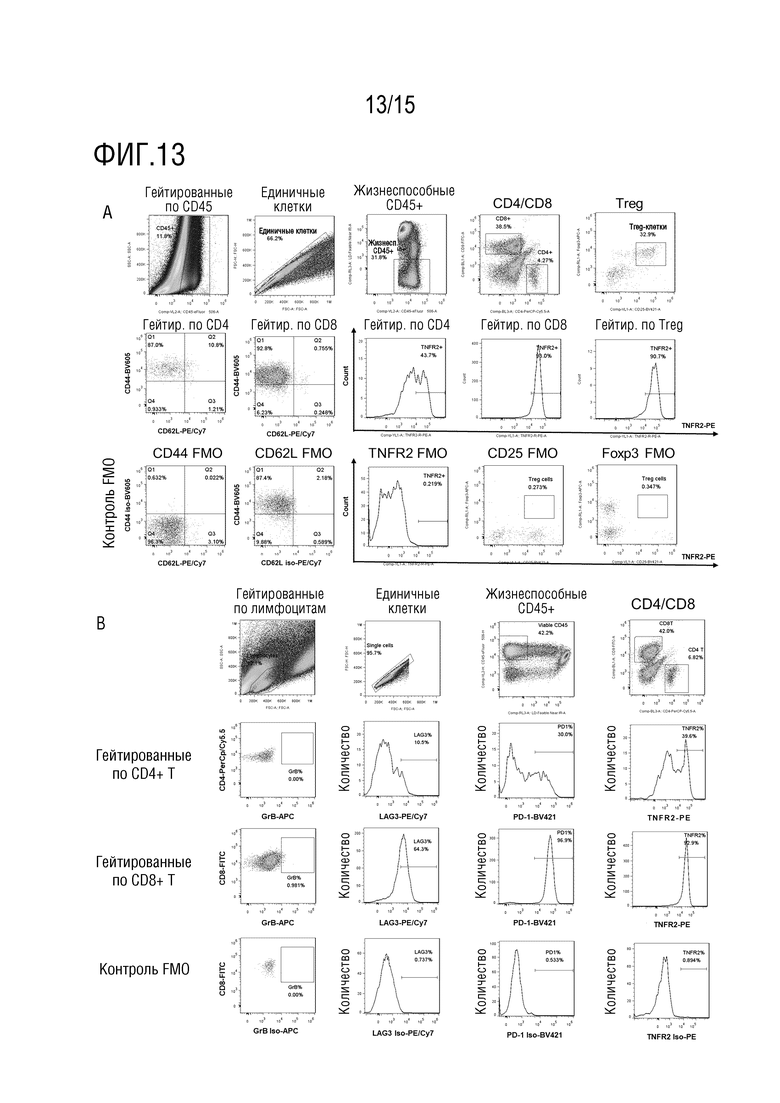
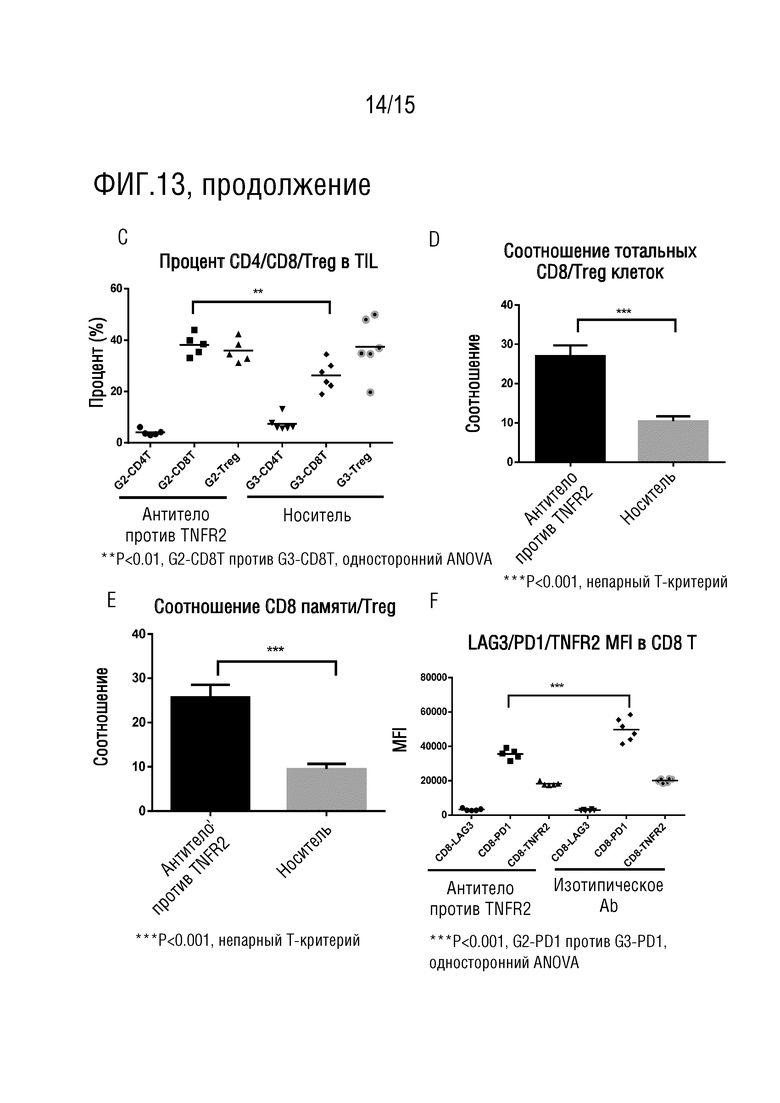
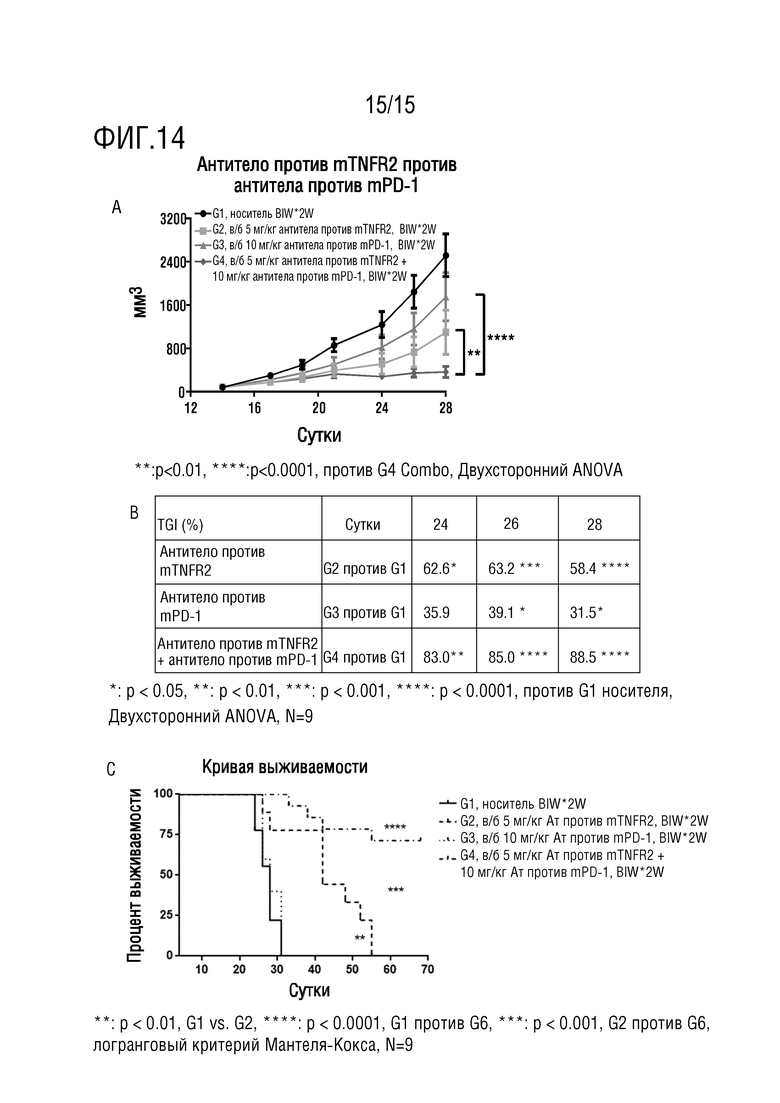
Изобретение относится к области биотехнологии, в частности к антителу или его антигенсвязывающему фрагменту, которые специфически связываются с фактором некроза опухоли 2 (TNFR2); к фармацевтической композиции и набору для лечения рака, содержащим упомянутое антитело; к способу лечения заболевания, связанного с иммунным нарушением; к применению упомянутого антитела, или его антигенсвязывающего фрагмента, или фармацевтической композиции для получения лекарственного средства для лечения заболевания, связанного с иммунным нарушением; к способу детекции растворимого TNFR2 (sTNFR2)с помощью упомянутого антитела. Изобретение позволяет регулировать функцию иммунных клеток и может быть использовано в качестве лекарственного средства для лечения заболеваний, связанных с иммунными нарушениями, такими как опухоль. 6 н. и 10 з.п. ф-лы, 14 ил., 10 табл., 18 пр.
1. Антитело или его антигенсвязывающий фрагмент, которые специфически связываются с фактором некроза опухоли 2 (TNFR2) и которые способны регулировать функцию иммунных клеток, а также использоваться в качестве лекарственного средства для лечения заболеваний, связанных с иммунными нарушениями, таких как опухоли;
где антитело или его антигенсвязывающий фрагмент содержат:
(1) комбинации CDR тяжелой цепи CDR1-VH, CDR2-VH и CDR3-VH,
где CDR1-VH, CDR2-VH и CDR3-VH представляют собой любую комбинацию последовательностей, выбранную из группы, состоящей из следующих последовательностей:
и
(2) комбинации CDR легкой цепи CDR1-VL, CDR2-VL и CDR3-VL,
где CDR1-VH, CDR2-VH и CDR3-VH представляют собой любую комбинацию последовательностей, выбранную из группы, состоящей из следующих последовательностей:
и где антитело или его антигенсвязывающий фрагмент содержат комбинацию CDR тяжелой цепи и CDR легкой цепи, выбранную из группы, состоящей из VH1+VL1, VH2+VL2, VH3+VL3, VH4+VL4, VH5+VL5, VH6+VL6, VH7+VL7, VH8+VL8, VH9+VL9, VH10+VL10, VH11+VL11, VH12+VL12, VH13+VL13, VH14+VL14, VH15+VL15, VH16+VL16, VH17+VL17, VH18+VL18, VH19+VL19, VH20+VL20, VH21+VL21 и VH22+VL22.
2. Антитело или его антигенсвязывающий фрагмент по п.1, где регуляция включает ингибирование пролиферации и/или активации регуляторных T-клеток (Treg-клеток) и/или супрессорных клеток миелоидного происхождения (MDSC).
3. Антитело или его антигенсвязывающий фрагмент по п.1 или 2, где регуляции достигают путем блокирования связывания TNF с TNFR2.
4. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-3, где
1) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность SEQ ID NO:1 и SEQ ID NO:2, соответственно;
2) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность SEQ ID NO:3 и SEQ ID NO:4, соответственно;
3) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность SEQ ID NO:5 и SEQ ID NO:6, соответственно;
4) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность SEQ ID NO:7 и SEQ ID NO:8, соответственно;
5) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность SEQ ID NO:9 и SEQ ID NO:10, соответственно;
6) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность SEQ ID NO:11 и SEQ ID NO:12, соответственно;
7) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность SEQ ID NO:13 и SEQ ID NO:14, соответственно;
8) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность SEQ ID NO:15 и SEQ ID NO:16, соответственно;
9) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность SEQ ID NO:17 и SEQ ID NO:18, соответственно;
10) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность SEQ ID NO:19 и SEQ ID NO:20, соответственно; или
11) вариабельная область тяжелой цепи и вариабельная область легкой цепи имеют последовательность SEQ ID NO:21 и SEQ ID NO:22, соответственно.
5. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-4, где их константа диссоциации (KD) для связывания с TNFR2 человека не превышает 5 нМ и их константа диссоциации (KD) для связывания с TNFR2 яванского макака не превышает 5 нМ.
6. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-5, где антитело представляет собой химерное антитело, гуманизированное антитело или полностью человеческое антитело.
7. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-6, содержащие константную область, выбранную из группы, состоящей из IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgE и IgD человека, где антитело или антигенсвязывающий фрагмент:
1) специфически связывается с клетками, которые экспрессируют TNFR2 на клеточной поверхности;
2) специфически связывается с Treg-клетками;
3) ингибирует связывание TNFα с белком TNFR2;
4) ингибирует связывание TNFα с TNFR2, экспрессируемым на клеточной поверхности;
5) ингибирует опосредуемую TNFα пролиферацию Treg и/или функцию Treg;
6) опосредует функцию ADCC против экспрессирующей TNFR2 клетки; или/и
7) ингибирует рост опухоли.
8. Антитело или его антигенсвязывающий фрагмент по любому из пп.1-7, где антигенсвязывающий фрагмент выбран из группы, состоящей из F(ab)2, Fab', Fab, Fv, scFv, наноантител и минимальных распознающих элементов антител.
9. Фармацевтическая композиция для лечения рака, содержащая антитело или его антигенсвязывающий фрагмент по любому из пп.1-8 и фармацевтически приемлемый носитель.
10. Фармацевтическая композиция по п.9, также содержащая дополнительные противоопухолевые средства.
11. Набор для лечения рака, содержащий антитело или его антигенсвязывающий фрагмент по любому из пп.1-8 и инструкции по применению.
12. Способ лечения заболевания, связанного с иммунным нарушением, включающий введение индивидууму антитела или его антигенсвязывающего фрагмента по любому из пп.1-8 или фармацевтической композиции по п.9, где заболевание, связанное с иммунным нарушением, представляет собой заболевание, такое как заболевание, связанное с функцией Treg-клеток и/или MDSC, в частности опухоль.
13. Способ по п.12, также включающий введение индивидууму дополнительного средства противоопухолевой терапии, такого как химиотерапевтическое средство, таргетное терапевтическое средство и иммунотерапевтическое средство, включающее терапию против PD-1/PD-L1, такую как антитело против PD-1/PD-L1, терапию против CTLA-4, такую как антитело против CTLA-4.
14. Применение антитела, или его антигенсвязывающего фрагмента по любому из пп.1-8, или фармацевтической композиции по п.9 для получения лекарственного средства для лечения заболевания, связанного с иммунным нарушением, где заболевание, связанное с иммунным нарушением, представляет собой, например, заболевание, связанное c функцией Treg-клеток и/или MDSC, в частности опухоль.
15. Способ по п.12 или 13, применение по п.14, где опухоль выбрана из группы, состоящей из:
1) рака яичника, развернутой эпидермальной T-клеточной лимфомы, метастазирующего рака ободочной и прямой кишки III/IV, тройного отрицательного рака молочной железы и/или рака поджелудочной железы; или
2) развернутых солидных опухолей, метастазирующей меланомы, резистентной к терапии CTLA-4 и PD-1.
16. Способ детекции растворимого TNFR2 (sTNFR2), включающий приведение в контакт образца, предположительно содержащего sTNFR2, с антителом или его антигенсвязывающим фрагментом по любому из пп.1-8.
| WO2017197331 A2, 16.11.2017 | |||
| YANG S | |||
| et al., Role of TNF-TNF receptor 2 signal in regulatory T cells and its therapeutic implications | |||
| Front Immunol | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| Vol | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Art | |||
| Способ замораживания пищевых веществ | 1916 |
|
SU784A1 |
| NIE Y | |||
| et al., Blockade of TNFR2 signaling enhances the immunotherapeutic effect of CpG ODN in a mouse model of colon cancer | |||
| Sci Signal | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| Vol | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| No | |||
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДЫХ ПРОДУКТОВ УПЛОТНЕНИЯ ФОРМАЛЬДЕГИДА С ФЕНОЛАМИ И ДРУГИМИ ВЕЩЕСТВАМИ | 1925 |
|
SU511A1 |
| Art | |||
Авторы
Даты
2023-03-29—Публикация
2020-07-31—Подача