Область техники, к которой относится изобретение
Настоящее изобретение относится к области лечения клеток пигментного эпителия сетчатки (ПЭС).
Более конкретно, настоящее изобретение направлено на применение композиции для защиты клеток пигментного эпителия сетчатки (ПЭС), в частности для лечения возрастной макулярной дегенерации (ВМД), а также болезни Штаргардта и пигментного ретинита у млекопитающих.
Задачей настоящего изобретения является улучшение зрения у индивидуумов, страдающих этими заболеваниями, или, по меньшей мере, стабилизация прогрессирования заболевания.
Уровень техники
Возрастная макулярная дегенерация (ВМД) является причиной необратимой слепоты у пожилых людей, в частности в Европе и Северной Америке. ВМД поражает центральную часть сетчатки, называемую макулой, что приводит к серьезному нарушению зрения и к необратимой потере центрального зрения.
Макула отвечает за центральное зрение и остроту зрения, высокое разрешение которого связано с высокой концентрацией колбочковых фоторецепторов. На ранней стадии ВМД отмечаются отложения, называемые друзами, которые лишь незначительно влияют на зрение. Последующие стадии включают две формы ВМД: географическую атрофию (сухую форму) или экссудативную атрофию (влажную или неоваскулярную форму), при этом первая форма встречается намного чаще, чем вторая. Последние фазы этих двух форм приводят к разрушению макулярной нейросенсорной сетчатки, но прогрессирование сухой формы ВМД обычно происходит медленно, в то время как влажная форма ВМД может привести к полной слепоте за несколько недель.
Старение является постепенным накоплением со временем изменений, которые связаны с повышением восприимчивости к данному заболеванию (или являются ответственными за него). В сетчатке при старении может развиваться определенный ряд дегенеративных заболеваний, включая глаукому, пигментный ретинит и ВМД. Группа пигментных ретинитов вместе с гетерогенным набором генетических дегенераций сетчатки поражает фоторецепторы и ПЭС и приводит к потере ночного зрения, а затем центрального зрения. Хотя специфические механизмы, ответственные за развитие различных типов заболеваний, связанных со старением сетчатки, различны, полагают, что окислительный стресс и воспаление, к которому он приводит, являются важными элементами, вносящими вклад в патогенез этих заболеваний.
Теории об этиологии ВМД включают гидродинамические модификации в мембране Бруха, вызванные постепенным накоплением экстрацеллюлярного материала, содержащего липиды, и старение ПЭС, активность которого необходима для выживания фоторецепторов. Клетки ПЭС выполняют несколько разных функций в глазу: они устанавливают гематоофтальмический барьер за счет своих плотных контактов, и таким образом, ответственны за иммуно-привилегированный статус внутренней части глазного яблока; они поддерживают жизнедеятельность фоторецепторов, обеспечивая их питательными веществами и участвуя в визуальном цикле. Современное представление состоит в том, что снижение функции клеток ПЭС ответственно за развитие ВМД. Старение вызывает дисфункцию клеток ПЭС и недостаточность их метаболизма, а также их фагоцитарной активности. Неполное расщепление внешних сегментов фоторецепторов может приводить к образованию друз путем снижения диффузии через мембрану Бруха, что в первую очередь приводит к деформации сетчатки и воспринимаемых изображений.
С возрастом в ПЭС хранится все большее количество липофусцинов. Они состоят из липидов и белков, которые происходят из фаголизосом, лизосом и фоторецепторов. Липофусцины также содержат N-ретинил-N-ретинилиден-этаноламин (А2Е), который образован путем конденсации двух молекул ретинальдегида с этаноламином.
Старение сопровождается повышенным накоплением А2Е в сетчатке (Bhosale et al., 2009). Под действием синего света и в присутствии кислорода А2Е генерирует активные формы кислорода, которые вызывают повреждение белков, липидов и ДНК, и таким образом, значительный окислительный стресс в стареющих клетках ПЭС (Sparrow& Cai, 2001). Это повреждение нарушает лизосомальную активность клеток ПЭС и вызывает накопление отходов, что в конечном итоге приводит, от места к месту, к гибели клеток ПЭС, а затем фоторецепторов, с которыми они связаны.
Не существует коммерческих медикаментов для лечения сухой ВМД, в то время как продаются препараты антител к ФРЭС (фактору роста эндотелия сосудов) для интравитреального введения, обеспечивающие возможность частичного блокирования образования новых сосудов и таким образом, позволяющие проводить альтернативное лечение влажной ВМД. Производятся пищевые добавки с типичными антиоксидантными соединениями, в частности минералами и витаминами с антиоксидантными свойствами, например цинком, витаминами А, С, Е, с реальной, но ограниченной терапевтической эффективностью. Нутрицевтическая формула 1 AREDS («Age-Related Eye Disease Study» AREDS 2001) считается стандартом медицинской помощи в Соединенных Штатах для лечения сухой ВМД, снизившим риск развития запущенной ВМД на 25% и потери зрения на 19% в течение пяти лет.
Многочисленные продукты предлагают общую основу для композиции: цинк и витамины С и Е, к которым добавляют различные ингредиенты: лютеин, ресвератол, омега-3 жирные кислоты; однако, не имеется убедительных данных об эффективности в отношении этих дополнительных ингредиентов, или в отношении категорий пациентов, которые могут положительно отвечать на эти разные вещества (Elliot & Williams, 2012). В частности, в уровне техники известна международная заявка WO 2005/110375, которая относится к пищевой добавке, предназначенной для ограничения или профилактики потери зрительной активности глаза в результате заболевания.
Каротиноиды (вещества, обеспечиваемые исключительно рационом) изучены более детально, поскольку некоторые из них (лютеин, зеаксантин = ксантофиллы) естественным образом присутствуют в макуле (Subczynski et al., 2010), и известно, что эти соединения обладают сильной антиокислительной активностью. Таким образом, логично было тестировать эти соединения (по отдельности или в комбинации) в формуле AREDS, но полученные результаты оказались ограниченными; эффективность добавки была доказана только для подгруппы пациентов с дефицитом этих соединений (Pinazo-Durán et al., 2014). Эти вещества являются эффективными in vitro для защиты клеток ПЭС (Human D407) от токсических эффектов перекиси водорода (Pintea et al., 2011).
Японская патентная заявка JP 2010285364 обеспечивает смесь, состоящую из кроцетина и другого каротиноида, который может быть ксантофиллом или другим диапокаротиноидом, например биксином или норбиксином. Эта смесь, благодаря своим антиокислительным свойствам, предлагается для облегчения или профилактики заболеваний, в которых вовлечен окислительный феномен.
Другие ксантофиллы также являются предметом исследований для пероральных добавок, по отдельности или в комбинации с лютеином и/или зеаксантином (например, астаксантином (Parisi et al., 2008)). Недавно диапокаротиноиды (каротиноиды, усеченные на двух концах, по химической номенклатуре IUPAC), в частности кроцетин (8,8’-диапокаротин-8,8’-диоат) и его гликозиды (кроцины), были протестированы в условиях in vitro и in vivo. Кроцины демонстрируют фотозащитный эффект in vitro на первичных культурах фоторецепторов быков или приматов (Laabich et al., 2006), а кроцетин защищает клетки нервных ганглиев от окислительного стресса (Yamauchi et al., 2011). Доказана активность шафрана (специи, богатой кроцинами/кроцетином) при пероральном применении in vivo в отношении качества сетчатки (Maccarone et al., 2008; Falsini et al., 2010; Boisti et al., 2014). Однако, поскольку шафран содержит другие вещества, которые могут действовать на сетчатку, такие как другие каротиноиды, а также сафраналь, образуемый в то же самое время, что и кроцетин (Verma&Middha, 2010; Fernández-Sánchez et al., 2012), трудно сделать вывод об эффекте одного кроцетина.
Были проведены эксперименты с другим апокаротиноидом, биксином (метилгидро-6,6’-диапокаротин-6,6’-диоатом) или его некоторыми производными, in vitro на клетках нервного ганглия и in vivo путем интравитреального введения, для противодействия влиянию стресса на эндоплазматический ретикулум (Tsuruma et al., 2012). Эксперименты, проведенные таким образом, позволяют провести наиболее общую оценку антиокислительной и, следовательно, защитной активности соединений в отношении различных типов клеток сетчатки, подвергаемых воздействию окислительного агента (например, перекиси водорода), и таким образом, не относятся напрямую к ВМД.
Экстракт семян аннато (Bixa orellana), разработанный ранее (Bixilia®), продемонстрировал фотозащитный эффект для кожи человека, подвергнутой действию УФ излучения (FR 2947173, Veillet et al., 2009), и для клеток ПЭС, подвергнутых воздействию фото-окислительного стресса (Fontaine et al., 2011). Экстракт Bixilia® является натуральным экстрактом аннато, обогащенным биксином. Bixilia® содержит другие фотозащитные соединения фенольной природы, присутствие которых может объяснить высокую фотозащитную активность неочищенного экстракта, по сравнению с биксином по отдельности. В патенте FR 11 54172 (Fontaine et al., 2011) анализировали защитный эффект в отношении клеток ПЭС для некоторых соединений из экстракта Bixilia®. Результаты экспериментов с применением биксина или норбиксина в концентрациях 0,1 мкмоль (мкМ), 1 мкМ и 10 мкМ не показали какой-либо фотозащитной активности, и даже продемонстрировали, что чем выше была концентрация биксина или норбиксина, тем меньше выживали клетки ПЭС, и таким образом, тем слабее был фотозащитный эффект. Среди прочего отмечалось, что такие вещества, как цианидин и эллаговая кислота в концентрациях 10 мкМ и 20 мкМ оказывают благоприятное фотозащитное влияние на клетки ПЭС.
Было проведено более детальное исследование с идентификацией активных веществ, присутствующих в экстракте Bixilia®, и установлением механизма их действия, а затем была продемонстрирована их эффективность in vivo на мышах и крысах. Это исследование дало начало настоящему изобретению. Таким образом, изобретение предусматривает поиск лечения для защиты клеток ПЭС, которое является альтернативной уже существующим способам.
Краткое изложение сути изобретения
Авторы настоящего изобретения установили, что норбиксин, в частности его 9’-цис форма, позволяет сильно уменьшить клеточную гибель, вызванную облучением синим светом клеток ПЭС, предварительно обработанных N-ретинил-N-ретинилиден-этаноламином (А2Е).
В соответствии с первым аспектом, настоящее изобретение направлено на композицию, включающую более 90% мас. норбиксина, полученного путем очистки из экстракта семян Bixa orellana, для применения с целью защиты от облучения клеток пигментного эпителия сетчатки (ПЭС) у млекопитающих.
В контексте настоящего изобретения «экстракт семян Bixa orellana» означает экстракт, приготовленный из внешней части семян, то есть из воскового вещества, покрывающего семена Bixa orellana. Известно, что это восковое вещество богато биксином и другими второстепенными каротиноидами, а также применяется в качестве пищевого красителя.
Норбиксин, биодоступный у млекопитающих после перорального применения, адсорбируется гораздо лучше биксина, и был обнаружен в глазу, в частности в сетчатке.
В частных вариантах осуществления изобретения композиция включает более 90% мас. норбиксина.
В частных вариантах осуществления изобретения композиция включает более 95% мас. норбиксина.
В частных вариантах осуществления изобретения композиция включает более 90% мас. норбиксина в его 9’-цис форме формулы (I):
(I)
В частных вариантах композиция включает по меньшей мере один элемент, выбранный из цинка, витамина С и витамина Е.
В частных вариантах осуществления композиция может применяться в форме пищевой добавки или медикамента.
Термин «пищевая добавка» предназначен для обозначения продукта, содержащего указанную композицию, выполняющего задачу обогащения рациона путем обеспечения питательных веществ, благоприятных для здоровья, в соответствии с определением, данным Европейской Директивой 2002/46/EC. Например, пищевая добавка может быть желатиновой капсулой или таблеткой для приема внутрь, или порошком или маленьким флаконом для смешивания с пищей, и оказывает благоприятное влияние на клетки ПЭС.
Термин «медикамент» предназначен для обозначения продукта, содержащего точную дозу указанного соединения или указанного экстракта в соответствии с определением, данным Европейской Директивой 2002/46/EC, а именно, любого вещества или композиции, обладающей лечебными или профилактическими свойствами в отношении заболеваний человека или животных. Например, медикамент, содержащий соединение в терапевтических дозах, можно применять перорально в форме желатиновой капсулы или таблетки, или вводить интравитреально или любым другим путем, который обеспечивает возможность достижения благоприятных эффектов в сетчатке.
В частных вариантах осуществления композиция включает основу, пригодную для перорального применения, инъекционного введения в глаз, инъекционного системного введения или инъекционного введения в кровь.
В некоторых вариантах осуществления композицию применяют у млекопитающего в количестве от 0,48 мг/кг массы тела до 48 мг/кг массы тела в сутки, предпочтительно от 0,6 мг/кг массы тела до 20 мг/кг массы тела в сутки.
В соответствии с другими частными вариантами осуществления изобретения, композиция предназначена для профилактики повреждения сетчатки, которое может быть вызвано воздействием синего излучения. Термин «синее излучение» предназначен для обозначения излучения, соответствующего синей области спектра видимого света, имеющего длину волны от 435 нм до 490 нм.
В частных вариантах осуществления изобретения композиция предназначена для лечения возрастной молекулярной дегенерации (ВМД) у млекопитающих.
В других частных вариантах осуществления композиция предназначена для лечения болезни Штаргардта и/или пигментного ретинита у млекопитающих. Болезнь Штаргардта или синдром Штаргардта является наследственным патологическим состоянием, которое объединяет двустороннее снижение остроты зрения и атрофию макулы, при котором проявляются в раннем возрасте симптомы сухой формы ВМД.
Краткое описание фигур
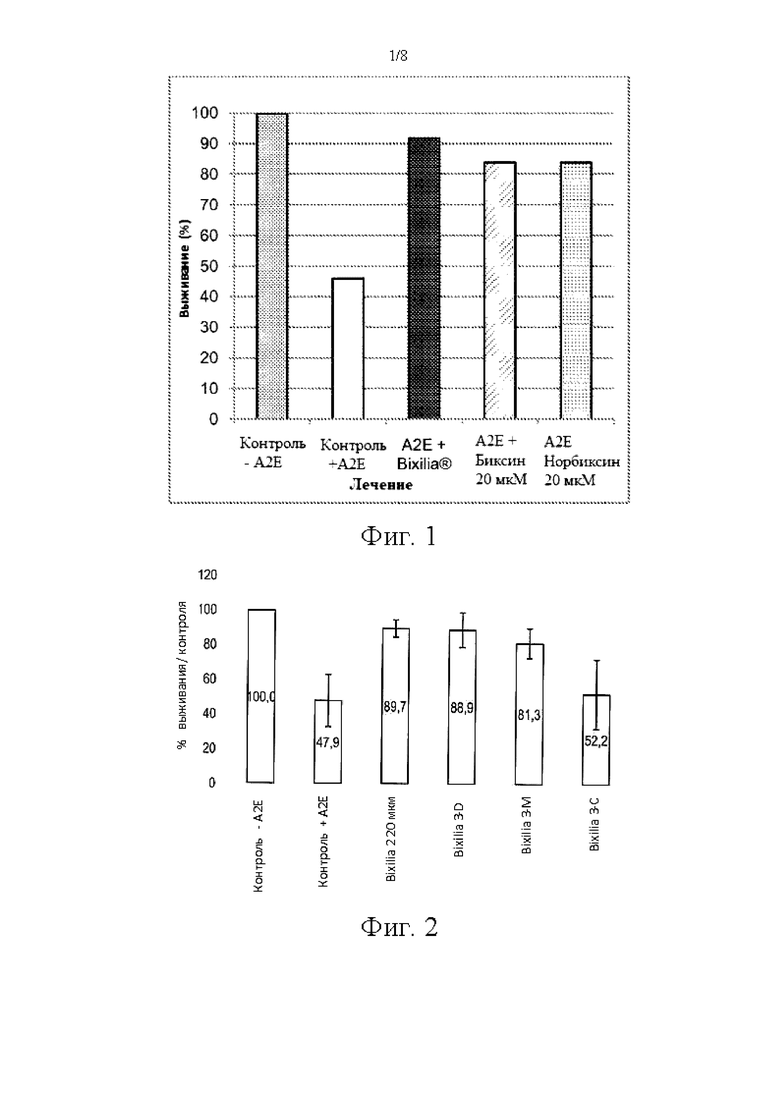
Фиг. 1 иллюстрирует процент клеток ПЭС, выживающих в присутствии N ретинил-N-ретинилиден-этаноламина (A2E) и экстракта Bixilia® или биксина (20 мкМ) или норбиксина (20 мкМ) после воздействия излучения.
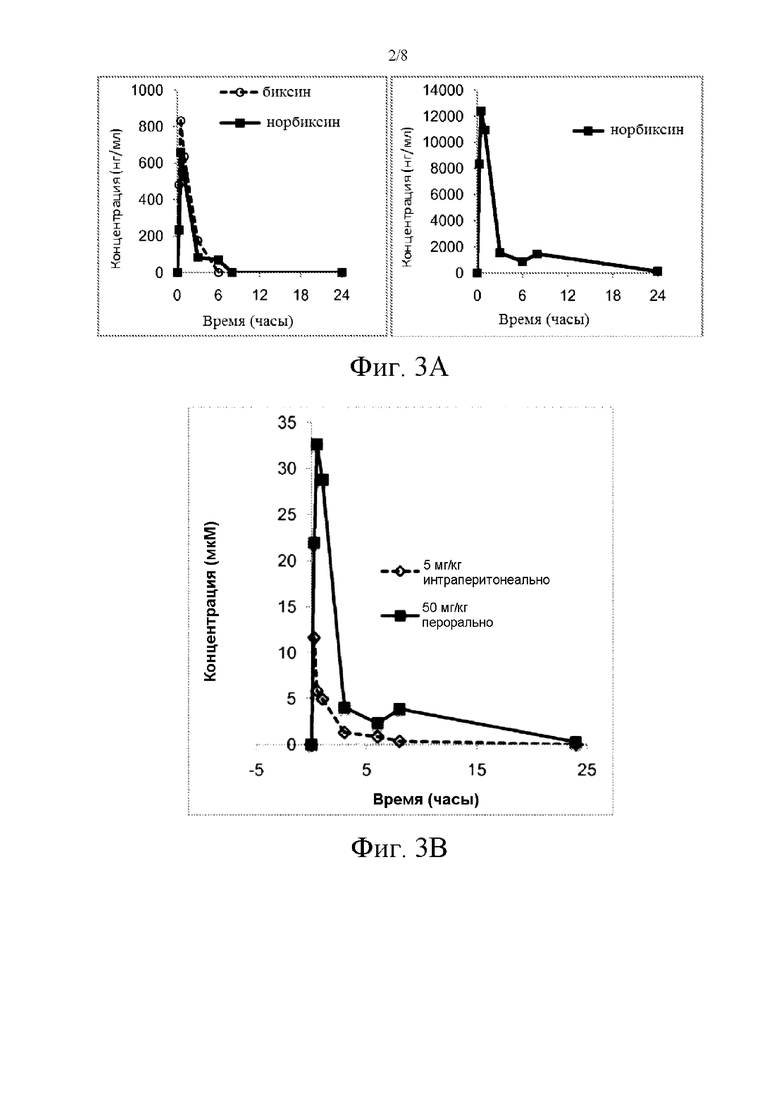
Фиг. 2 иллюстрирует фотозащитную активность последовательных экстрактов из семян аннато (С = циклогексан; D = дихлорметан; М = метанол) на клетках ПЭС, культивируемых в присутствии А2Е и подвергнутых облучению.
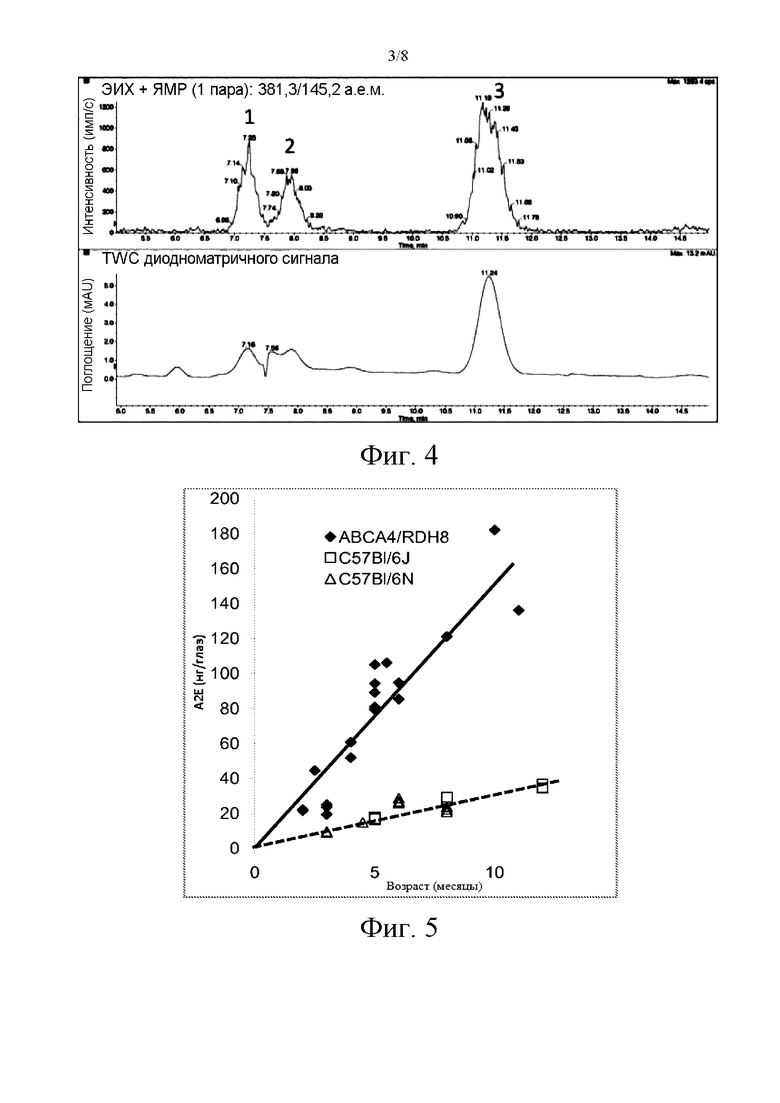
Фиг. 3А иллюстрирует концентрацию в плазме после приема биксина (слева) или норбиксина (справа) у мышей C57Bl/6.
Фиг. 3В иллюстрирует фармакокинетический анализ норбиксина у мышей C57Bl/6.
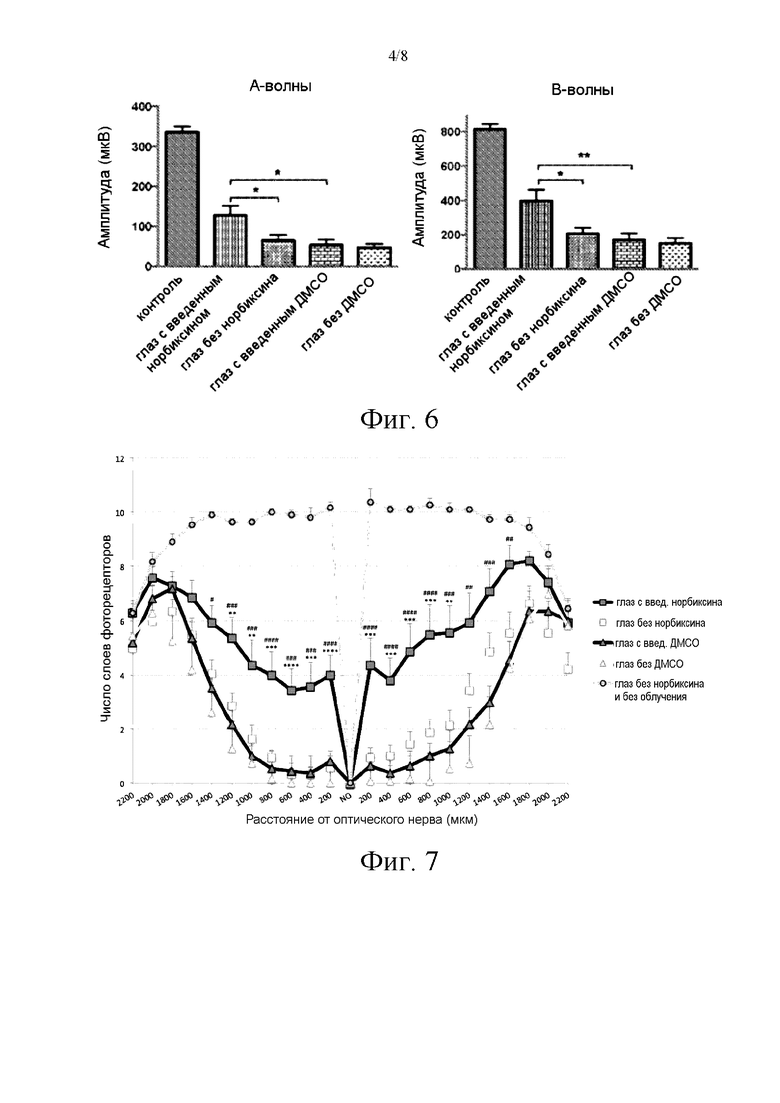
Фигура 4 иллюстрирует ВЭЖХ-МС/МС анализ норбиксина в глазах мышей, нокаутных по двум генам (ABCA4-/-, RDH8-/-), после интраперитонеального введения (10 мг/кг). (3: введение норбиксина, 1 и 2: введение моноглюкуронидов данного соединения).
Фиг. 5 иллюстрирует кинетику накопления А2Е в глазах мышей, нокаутных по двум генам (ABCA4-/-, RDH8-/-), в зависимости от возраста, по сравнению с нормальными мышами.
Фиг. 6 иллюстрирует электроретинограммы (А-волны слева и В-волны справа) у мышей, нокаутных по двум генам (ABCA4-/-, RDH8-/-), после одностороннего интравитреального введения норбиксина (для достижения итоговой концентрации в стекловидном теле 130 мкМ), помещенных в темноту на 24 часа, а затем подвергнутых воздействию синего света (4000 люкс, 1 час). Электроретинограммы получали спустя 7 суток после облучения.
Фиг. 7 иллюстрирует число слоев ядер фоторецепторов в зависимости от расстояния от оптического нерва в глазах мышей, получавших лечение, как на фиг. 6.
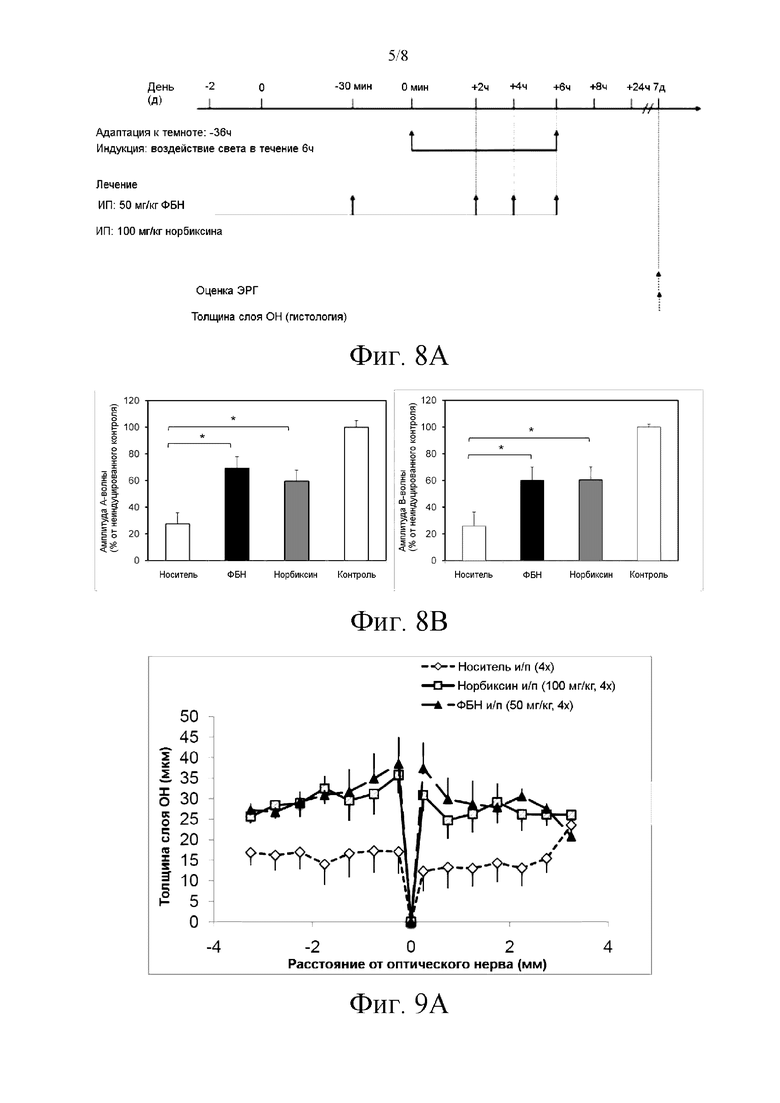
Фиг. 8А иллюстрирует протокол эксперимента по созданию «крысиной модели синего света».
Фиг. 8В иллюстрирует результаты электроретинограмм крыс, которым вводили норбиксин (100 мг/кг, 4 инъекции раствора 50 мМ в 0,9% NaCl на крысу, по 4 крысы в серии), с применением ФБН (фенил-N-трет-бутилнитрона, 50 мг/кг, раствор 20 мг/мл в 0,9% NaCl) в качестве положительного контроля. Электроретинограммы получали спустя 7 суток после лечения.
Фиг. 9А иллюстрирует число слоев ядер фоторецепторов в зависимости от расстояния от оптического нерва крыс после интраперитонеального введения альфа-фенил-N-трет-бутилнитрона (ФБН) или норбиксина и облучения синим светом. Гистологические анализы проводили спустя 7 суток после лечения.
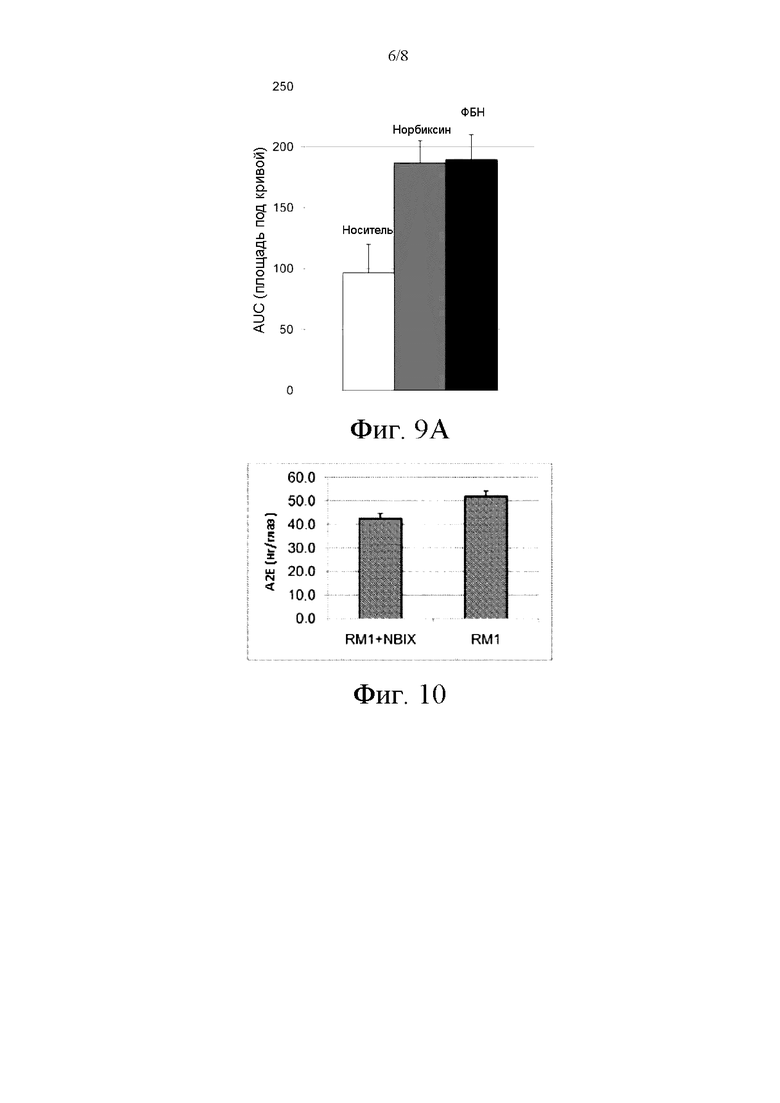
Фиг. 9В иллюстрирует площадь под фармакокинетической кривой с фиг. 9А.
Фиг. 10 иллюстрирует количество А2Е, накопленного в глазах мышей, нокаутных по двум генам (ABCA4-/-, RDH8-/-), получавших или не получавших корм с добавлением норбиксина в течение 3 месяцев.
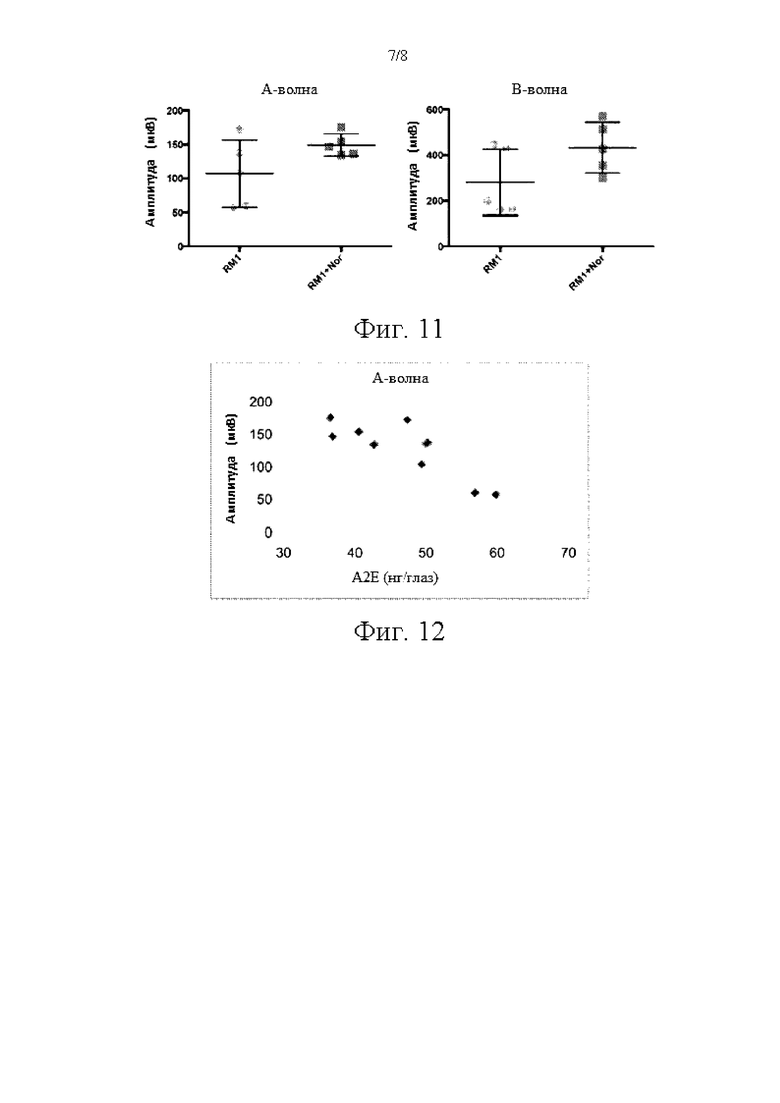
Фиг. 11 иллюстрирует электроретинограммы мышей, нокаутных по двум генам (ABCA4-/-, RDH8-/-), получавших или не получавших корм, содержащий 0,3 мг/г чистого норбиксина, в течение 3 месяцев.
Фиг. 12 иллюстрирует взаимоотношение между амплитудой электроретинограммы (А-волны) и количеством А2Е, накопленного в глазах мышей, нокаутных по двум генам (ABCA4-/-, RDH8-/-).
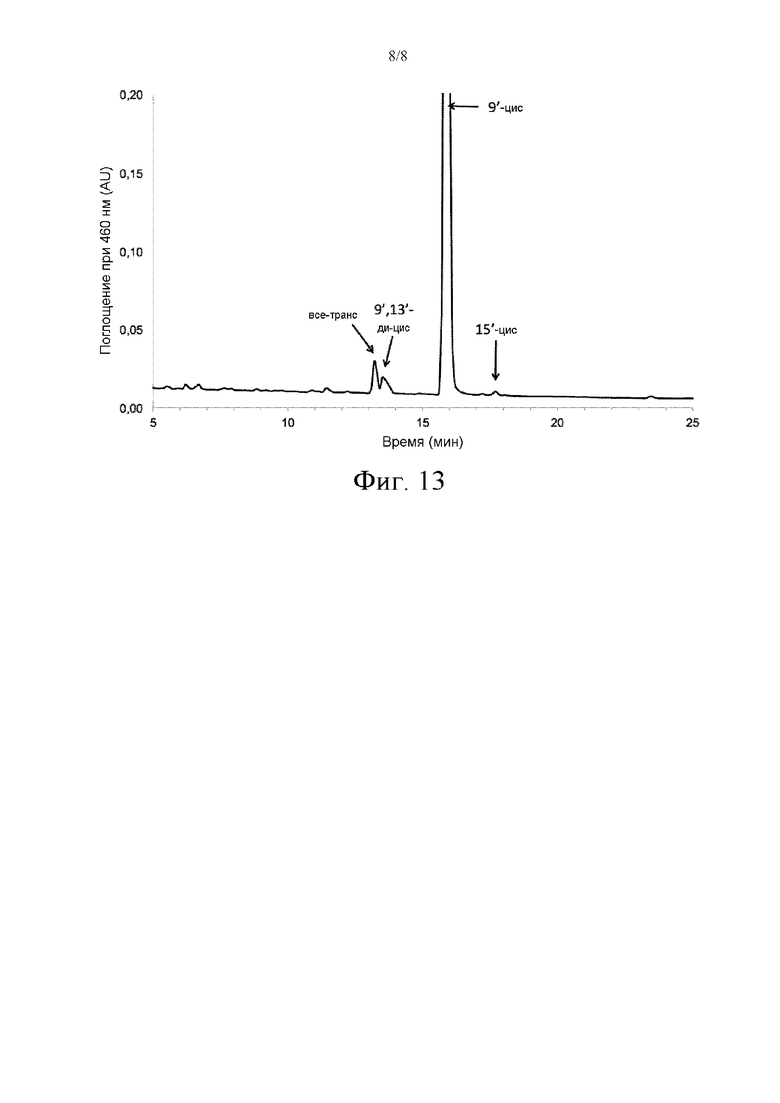
Фиг. 13 иллюстрирует результаты анализа посредством обращенно-фазовой ВЭЖХ норбиксина, очищенного из экстракта Bixa orellana (изомеры были идентифицированы в соответствии с Scotter et al., 1998 and Polar-Cabrera et al., 2010).
Подробное описание примеров осуществления изобретения
В отличие от большинства ранее опубликованных исследований, модели, используемые в настоящем изобретении (как in vitro, так и in vivo), выдвигают на передний план роль N-ретинил-N-ретинилиден-этаноламина (А2Е) и его фототоксичность, и в этом отношении близки к патологическому состоянию человека. Анализы, используемые in vitro, подобны с точки зрения их принципа тем, которые применялись с другими натуральными веществами на линии клеток ПЭС человека (ARPE-19 клетках – Young et al., 2005).
Протоколы и результаты
1 - Приготовление биксина и норбиксина
Биксин с чистотой 95% мас. готовили из коммерческого продукта (Аннато В), полученного путем экстракции семян аннато органическими растворителями и с концентрацией биксина более 85% мас. Очистку проводили путем последовательной рекристаллизации.
Норбиксин с чистотой 95% мас. получали после щелочного гидролиза очищенного биксина (5% КОН, 60°С, 3 часа). Полученный раствор подкисляли концентрированной соляной кислотой, и выделяли норбиксин путем центрифугирования. Осадок промывали водой дважды для удаления солей, и итоговый осадок лиофилизировали.
Чистоту соединений оценивали посредством УФ-Виз спектрофотометрии и обращенно-фазовой хроматографии: соединения по существу содержат 9’-цис изомеры (концентрация больше 90% мас., фиг. 13).
2 - Анализы in vitro
Использовали анализ in vitro, предназначенный для изучения фотозащитного эффекта различных натуральных веществ в клетках ПЭС, культивируемых в присутствии А2Е. Фотозащитный эффект соединений оценивали на клеточной модели фототоксичности, индуцированной под действием А2Е, с последующим облучением синим светом. Термин «синее излучение» предназначен для оценки излучения, соответствующего синей области видимого спектра света, то есть имеющего длину волны от 435 до 490 нм.
В этой модели были использованы первичные культуры ПЭС взрослых свиней. Выживание клеток количественно оценивали посредством анализа жизнеспособности клеток. За 48 часов соединения, подлежащие анализу (в 5 мМ растворе ДМСО), добавляли до достижения итоговых концентраций 1-20 мкМ, затем за 19 часов добавляли А2Е (итоговая концентрация 30 мкМ), и клетки облучали (время 0 часов). Спустя 24 часа определяли выживание клеток. Получение изображений и их обработку осуществляли посредством флуоресцентного микроскопа, контролируемого программным обеспечением Metamorph со специальной программой количественной оценки. Эксперименты проводили на 96-луночных микропланшетах в четырех повторах, и эксперимент воспроизводили минимум четыре раза. Результаты выражены в форме отношения, представляющего число живых клеток в лунках, обработанных тестируемыми соединениями, деленное на число живых клеток в контрольных лунках (обработанных средой разведения без А2Е).
Этот анализ ранее позволил продемонстрировать очень хорошую фотозащитную активность этанольного экстракта семян аннато (Bixilia® - см. Fontaine et al., 2011). В предыдущей работе, в то время как была продемонстрирована активность экстракта аннато, природа фотозащитного вещества (веществ) не была установлена, и было показано, что главный компонент этого экстракта (биксин) является неэффективным при концентрациях 0,1 мкМ, 1 мкМ и 10 мкМ. Была проведена дополнительная работа для идентификации активного соединения (соединений).
а) Биксин является ответственным за значительную часть фотозащитной активности Bixilia®
Фиг. 1 показывает, что биксин и норбиксин (20 мкМ) эффективно защищают клетки ПЭС от фототоксичности, индуцированной в присутствии А2Е, по сравнению с контролем с А2Е. Неочищенный экстракт семян аннато, разбавленный до получения 20 мкМ биксина, обладает высокой фотозащитной активностью. Применение биксина с высокой чистотой в концентрации 20 мкМ позволило продемонстрировать, что этот компонент действительно обладает существенной фотозащитной активностью (фиг. 1), и что это объясняет значительную часть активности экстракта Bixilia®, разбавленного до получения такого же количества биксина. Сопоставимая активность была также найдена для норбиксина, который представляет собой основной циркулирующий метаболит биксина (Lévy et al., 1997). Эти результаты согласуются с фотозащитной активностью этих соединений, ранее продемонстрированной для защиты кожи человека от излучения (Veillet et al., 2009).
b) Bixilia® содержит другие фотозащитные соединения.
Bixilia® содержит другие фотозащитные соединения фенольной природы, присутствие которых может объяснять более высокую активность неочищенного экстракта, по сравнению с биксином по отдельности (при одной и той же концентрации биксина). Последовательную экстракцию оболочки семян аннато проводили последовательно циклогексаном, дихлорметаном и метанолом (по 1 литру каждого на 100 грамм семян).
После экстракции циклогексаном получали фракцию с концентрацией биксина 0,65 мкМ; после экстракции дихлорметаном получали фракцию с концентрацией биксина 1485 мкМ, а после экстракции метанолом получали фракцию с концентрацией биксина 45 мкМ.
Затем воспроизводили предыдущий тест in vitro.
В соответствии с фиг. 2, дихлорметановая фракция, содержащая 97% биксина, является очень активной, но также отмечалось, что метанольный экстракт, богатый фенольными соединениями, обладает значительной активностью (С = циклогексан; D = дихлорметан; М = метанол).
3 - Биодоступность биксина и норбиксина
Исследования биодоступности биксина и норбиксина проводили на C57Bl/6 мышах. Соединения применяли перорально (50 мг/кг). Образцы крови отбирали спустя 0,25; 0,5; 1; 3; 6; 8 и 24 часа, и анализировали посредством ВЭЖХ-ДМД (УФ 460 нм) - МС/МС. Таблица 1 и фиг. 3А демонстрируют, что, будучи проглоченным, биксин быстро превращается в норбиксин, и что два соединения циркулируют в сопоставимых концентрациях; они не обнаруживались спустя 8 часов. Далее, также отмечалось, что проглоченный норбиксин является гораздо более биодоступным, чем биксин.

Сравнение анализируемых веществ в плазме (фиг. 3В) после интраперитонеального введения (5 мг/кг) и после перорального применения (50 мг/кг) показало, что биодоступность норбиксина составляет 55%.
Присутствие норбиксина в глазах исследовали у мышей, нокаутных по двум генам (ABCA4-/-, RDH8-/-), спустя 3 часа после интраперитонеального введения норбиксина (10 мг/кг). Глазные яблоки 6 животных разрезали, и экстрагировали образцы ацетонитрилом, собирали и анализировали посредством ВЭЖХ-МС/МС (фиг. 4), что позволило специфически выявить присутствие норбиксина в ПЭС и сетчатке (таблица 2).

В соответствии с фиг. 4, отмечается, что в плазме, а также в глазах норбиксин присутствует в конъюгированной форме: исходное соединение фактически дает два моноглюкуронида, которые элюируются перед исходным соединением и проявляют схожую фрагментацию, несомненно, из-за разрушения глюкуронидов в источнике масс-спектрометра. Глюкуронизация также описана в случае кроцетина (Asai et al., 2005).
Можно также наблюдать цис-транс-изомеризацию норбиксина, степень которой варьируется в соответствии с продолжительностью экспериментов. Она является обычным феноменом в (поли)ненасыщенных соединениях, соответствующим цис-транс изомеризации одной или нескольких двойных связей, и наблюдалась у людей в случае норбиксина Lévy et al. (1997). Соединение, используемое в настоящей заявке, очищали из коммерческих соединений (Аннато В); оно в основном содержит 9-цис форму и очень небольшие количества всех транс форм и других цис или ди-цис форм (фиг. 13).
4 - Фотозащитная активность при интравитреальном введении у мышей
Модель с генетически модифицированными мышами, разработанную Maeda et al. (2008), использовали для оценки фотозащитной активности норбиксина. На этой мышиной модели инактивированы два гена, участвующие в цикле зрительного пигмента (ABCA4 и RDH8), что приводит к раннему накоплению А2Е в глазах (фиг. 5). Эта животная модель в результате подобна патологическому состоянию человека, конечно с некоторыми ограничениями, что связано с различиями в организации глаза грызунов и приматов.
Таким образом, использовали мышей в возрасте 7 недель для выполнения одностороннего интравитреального введения норбиксина (для достижения итоговой концентрации в стекловидном теле 130 мкМ). Спустя 24 часа в темноте, мышей подвергали воздействию синего света (4000 люкс, 1 час). Электроретинограммы, полученные спустя 7 дней, показали защитный эффект норбиксина, присутствие которого позволило сохранить значительную электрическую активность, как показано на фиг. 6.
Гистологический анализ толщины слоя внешних ядер продемонстрировал защитный эффект норбиксина на фоторецепторах (фиг. 7). Необходимо отметить, что норбиксин практически исчезал спустя 24 часа после интравитреального введения, и таким образом, присутствовал лишь на очень низких уровнях в глазах ко времени облучения.
5 - Фотозащитная активность при системном (интаперитонеальном) введении у крыс
Крысиная модель «синего света» заключается в облучении животных интенсивным синим светом в течение 6 часов для индукции повреждения глаз, которое оценивают спустя 7 суток путем получения электроретинограмм с последующим гистологическим анализом. Антиоксидантное соединение, ФБН (фенил-N-трет-бутилнитрон), используют в качестве положительного контроля (Ranchon et al., 2001; Tomita et al., 2005). Соединения, для которых определяют фотозащитную активность, вводят (интаперитонеально) до и во время фазы облучения. Указанную фазу осуществляют с синими неоновыми лампами Philips (4,2 мВ/см2). Протокол эксперимента представлен на фиг. 8А.
Три серии экспериментов проводили с норбиксином (100 мг/кг, по четыре инъекции раствора 50 мМ в 0,9% NaCl на крысу, по 4 крысы на серию) с применением ФБН (фенил-N-трет-бутилнитрона, 50 мг/кг, раствор 20 мг/мл в 0,9% NaCl) в качестве положительного контроля. Анализ электроретинограмм (А-волны и В-волны) представлен на фиг. 8В.
Этот тест позволил продемонстрировать значительную эффективность норбиксина, близкую к ФБН. Соответствующие гистологические данные (фиг. 9А и 9В) подтверждают фотозащитное влияние норбиксина на выживание фоторецепторов.
6 - Фотозащитная активность при хроническом пероральном применении у мышей
Готовили корм, содержащий 0,3 мг/г чистого норбиксина, и давали мышам, нокаутным по двум генам (ABCA4-/-, RDH8-/-), в течение периода 3 месяцев.
Животные, получавшие корм с добавлением норбиксина, продемонстрировали снижение накопления А2Е в глазах (фиг. 10): различие между двумя группами является высоко достоверным (p = 0,0109).
Корм с добавлением норбиксина также оказывал положительное влияние на амплитуду электроретинограммы (ЭРГ) (фиг. 11).
Эти анализы также показали, что имеется обратная взаимосвязь между количеством А2Е, накопленного в глазах, и амплитудой ЭРГ (фиг. 12), что подтверждает роль накопления А2Е в развитии патологического состояния (Wu et al., 2014); и продемонстрировали преимущество веществ, применение которых снижает накопление А2Е в глазах.
Однако значительного накопления норбиксина в глазах во время этого хронического лечения не отмечалось, что позволило сделать вывод, что, в отличие от ксантофиллов, это вещество, судя по всему, разрушается. Отсутствие накопления этого активного вещества можно считать преимуществом, поскольку накопление некоторых каротиноидов (например, кантаксантина) способно привести к образованию отложений внутри клеток ПЭС (Goralczyk et al., 1997). Это также является указанием скорее на эффект модификации активности клеток ПЭС, а не на роль фильтра или антиоксиданта, как предполагается для лютеина и зеаксантина. Этот результат согласуется с тем, что отмечалось при интравитреальных инъекциях (а именно, с исчезновением норбиксина ко времени облучения).
Суточное потребление, которое позволяет существенно снизить дегенерацию сетчатки у мышей после перорального применения, составляет 48 мг/кг массы тела. Преобразование для людей дает активное суточное потребление 4,8 мг/кг массы тела. Далее, известно, что допустимая суточная доза или ДСД норбиксина составляет самое большее 0,6 мг/кг массы тела в сутки (JECFA/67/FC). Эта величина установлена на основе потребления максимальной дозы, не приводящей к развитию наблюдаемых нежелательных эффектов или NOAEL у крыс, 69 мг/кг массы тела в сутки, что эквивалентно суточному потреблению без развития наблюдаемых нежелательных эффектов у человека 11 мг/кг, с учетом того, что не наблюдалось токсичности до 20 мг/кг/сутки (Hagiwara et al., 2003). Предлагаемый режим приема составляет от 0,48 мг/кг/сутки до 48 мг/кг/сутки, в идеале от 0,6 мг/кг/сутки до 20 мг/кг/сутки.
Ссылки на литературу
AREDS Report No. 8. 2001. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta carotene, and zinc for age-related macular degeneration and vision loss. Arch Ophthalmol, 119: 1417-1436.
Asai A, Nakano T, Takahashi M, Nagao A. 2005. Orally administered crocetin and crocins are absorbed into blood plasma as crocetin and its glucuronide conjugates in mice. J Agric Food Chem, 53: 7302-7306.
Bhosale P, Serban B, Bernstein PS. 2009. Retinal carotenoids can attenuate formation of A2E in the retinal pigment epithelium. Arch BiochemBiophys, 483: 175 181.
Bisti S, Maccarone R, Falsini B. 2014. Saffron and retina: neuroprotection and pharmaco-kinetics. Visual Neurosci, 1-7. doi:10.1017/S0952523814000108.
Chábera P, Fuciman M, Hribek P, Polivka T. 2009. Effect of carotenoid structure on excited-state dynamics of carbonyl carotenoids. PhysChemChemPhys, 11: 8795 8803.
Elliott JG, Williams NS. 2012. Nutrients in the battle against age-related eye diseases. American Optometric Association. doi:10.1016/j.optm.2011.11.006
Falsini B, Piccardi M, Minnella A, Savastano C, Capoluongo E, Fadda A, Balestratti E, Maccarone R, Bisti S. 2010. Influence of saffron supplementation on retinal flicker sensitivity in early age-related macular degeneration. InvestOphthalmol Vis Sci, 51: 6118-6124.
Fernández-Sánchez L, Lax P, Esquiva G, Martin-Nieto J, Pinilla I, Cuenca N. 2012. Safranal, a saffron constituent, attenuates retinal degeneration in P23H rats. PLoS ONE, 7(8): e43074.
Fontaine V, Lafont R, Sahel JA, Veillet S. 2011. Utilisation de composés et composition pour le traitement de la dégénérescence maculaire liée à l’âge (DMLA) [Use of compounds and composition for the treatment of age-related macular degeneration (ARMD)]. Application FR 25506 (filed on May 14, 2011).
Goralczyk R, Buser S, Bausch J, Bee W, Zühlke U, Barker FM. 1997. Occurrence of birefringent retinal inclusions in cynomolgus monkeys after high doses of canthaxanthin. Invest Ophthalmol Vis Sci, 38: 741-752.
Hagiwara A, Imai N, Ichihara T, Sano M, Tamano S, Aoki H, Yasuhara K, Koda T, Nakamura M, Shirai T. 2003. A thirteen-week oral toxicity study of annatto extract (norbixin), a natural food color extracted from the seed of annatto (Bixaorellana L.), in Sprague-Dawley rats. Food ChemToxicol, 41: 1157-1164.
Laabich A, Vissvesvaran GP, Lieu KL, Murata K, McGinn TE, Manmoto CC, Sinclair JR, Karliga I, Leung DW, Fawzi A, Kubota R. 2006. Protective effect of crocin against blue light- and white light-mediated photoreceptor cell death in bovine and primate retinal primary cell culture. Invest Ophthalmol Vis Sci, 47: 3156-3163.
Lévy LW, Regalado E, Navarette S, Watkins RH. 1997. Bixin and norbixin in human plasma: Determination and study of the absorption of a single dose of annatto food color. Analyst, 122: 977-980.
Liu X, Osawa T. 2007. Cisastaxanthin and especially 9-cisastaxanthin exhibits a higher antioxidant activity in vitro compared to the all-trans isomer. BiochemBiophys Res Comm, 357: 187-193.
Maccarone R, Di Marco S, Bisli S. 2008. Saffron supplementation maintains morphology and function after exposure to damaging light in mammalian retina. Invest Ophthalmol Vis Sci , 49: 1254-1261.
Maeda T, Maeda A, Golczak M, Palczewski K. 2008. Retinopathy in mice induced by disrupted all-trans-retinal clearance. J BiolChem, 283: 26684-26693.
Maeda T, Maeda A, Matosky M, Okano K, Roos S, Tang J, Palczewski K. 2009. Evaluation of potential therapies for a mouse model of human age-related macular degeneration caused by delayed all-trans-retinal clearance. Invest Ophthalmol Vis Sci, 50: 4917-1925.
Melendez-Martinez AJ, Stinco CM, Liu C, Wang XD. 2013. A simple HPLC method for the comprehensive analysis of cis/trans (Z/E) geometrical isomers of carotenoids for nutritional studies. Food Chem, 138: 1341-1350.
Montenegro MA, De O Rios A, Mercadante AZ, Nazareno MA, Borsarelli CD. 2004. Model studies on the photosensitized isomerization of bixin. J Agric Food Chem, 52: 367-373.
Parisi V, Tedeschi M, Gallinaro G, Varano M, Saviano S, Piermarocchi S. 2008. Carotenoids and antioxidants in age-related maculopathy Italian study: multifocal electroretinogram modifications after 1 year. Ophthalmology, 115(2): 324-333.
Phan-Thi H, Waché Y. Isomerization and increase in the antioxidant properties of lycopene from Momordicacochinchinensis (gac) by moderate heat treatment with UV-Vis spectra as a marker. Food Chem, 156: 58-63.
Pinazo-Durán MD, Gómez-Ulla F, Arias L, Araiz J, Casaroli-Marano R, Gallego-Pinazo R, García-Medina JJ, López-Gálvez MA, Manzanaq L, Salas A, Zapara M, Diaz-Llopis M, García-Layana A. 2014. Do nutritional supplements have a role in age macular degeneration prevention? J Ophthalmology, article ID 901686.
Pintea A, Rugina DO, Pop R, Bunea A, Socaciu C. 2011. Xanthophylls protect against induced oxidation in cultured human retinal pigment epithelial cells. J Food Compos Anal, 24(6): 830-836.
Rios ADO, Borsarelli CD, Mercadante AZ. 2005. Thermal degradation kinetics of bixin in an aqueous model system. J Agric Food Chem, 53: 2307-2311.
Sparrow JR, Cai B. 2001. Blue light-induced apoptosis of A2E-containing RPE: involvement of caspase-3 and protection by Bcl-2. Invest Ophthalmol Vis Sci, 42: 1356-1362.
Subczynski WK, Wisniewska A, Widomska J. 2010. Location of macular pigments in the most vulnerable regions of photoreceptor outer-segment membranes. Arch BiochemBiophys, 504: 61-66.
Tsuruma K, Shimazaki H, Nakashima K, Yamauchi M, Sugitani S, Shimazawa M, Iinuma M, Hara H. 2012. Annatto prevents retinal degeneration induced by endoplasmic reticulum stress in vitro and in vivo. MolNutr Food Res, 56: 713-724.
Veillet S, Lafont R, Dioh W. 2009. Cosmetic composition for protection from the sun containing urucum extract. Priority Application FR2009-54354 A (June 25, 2009), Application No. FR 2009-54354, WO 2010-FR51323.
Verma RS, Middha D. 2010. Analysis of saffron (Crocus sativus L.) stigma components by LC-MS-MS. Chromatographia, 71: 117-123.
Widomska J, Subczynski WK. 2014. Why has nature chosen lutein and zeaxanthin to protect the retina? J ClinExpOphthalmol, 5(1): 326, doi:10:4172/2155-9570.1000326.
Wu L, Ueda K, Nagasaki T, Sparrow JT. 2014. Light damage in Abca4 and Rpe65rd12 mice. Invest Ophthalmol Vis Sci, 55: 1910-1918.
Yamauchi M, Tsuruma K, Imai S, Nakanishi T, Umigai N, Shimazawa M, Hara H. 2011. Crocetin prevents retinal degeneration induced by oxidative stress and endoplasmic reticulum stress via inhibition of caspase activity. Mol Cell Pharmacol, 650: 110-119.
Young JP, Zhou J, Nakanishi K, Sparrow JN. 2005. Anthocyanins protect against A2E photooxidation and membrane permeabilization in retinal pigment epithelial cells. PhotochemPhotobiol, 81: 529-536.
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИМИЧЕСКИЕ СОЕДИНЕНИЯ, ВОЗДЕЙСТВУЮЩИЕ НА ГЛАЗА, И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ГЛАЗНЫХ ЗАБОЛЕВАНИЙ | 2020 |
|
RU2830634C1 |
| Способ моделирования атрофии ретинального пигментного эпителия | 2019 |
|
RU2727000C1 |
| ДЕМЕТИЛИРОВАНИЕ ДЛЯ ЛЕЧЕНИЯ ГЛАЗНОГО ЗАБОЛЕВАНИЯ | 2019 |
|
RU2804300C2 |
| Способ дифференциальной диагностики друз при возрастной макулярной дистрофии | 2020 |
|
RU2750907C1 |
| ОФТАЛЬМОЛОГИЧЕСКИЕ ПРЕПАРАТЫ НА ОСНОВЕ BDNF (НЕЙРОТРОФИЧЕСКОГО ФАКТОРА ГОЛОВНОГО МОЗГА) И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2564920C2 |
| Способ трансплантации стволовых клеток при повреждении пигментного эпителия сетчатки в эксперименте | 2018 |
|
RU2707264C1 |
| Вектор, способ лечения хороидермии, способ селективной экспрессии полинуклеотида | 2014 |
|
RU2723101C2 |
| Применение соединения формулы I, фармацевтическая композиция, лекарственное средство | 2016 |
|
RU2730854C2 |
| ГЕННАЯ ТЕРАПИЯ | 2016 |
|
RU2740038C2 |
| СПОСОБ ЛЕЧЕНИЯ "СУХОЙ" ФОРМЫ ВОЗРАСТНОЙ МАКУЛЯРНОЙ ДЕГЕНЕРАЦИИ | 2008 |
|
RU2375016C1 |
Заявленная группа изобретений относится к области медицины и фармацевтики и представляет собой применение композиции, содержащей более 90 мас.% норбиксина, полученного путем очистки из экстракта семян Bixa orellana, для фотозащиты клеток пигментного эпителия сетчатки (ПЭС) у млекопитающих путем введения этому млекопитающему указанной композиции в количестве от 0,48 мг/кг массы тела до 48 мг/кг массы тела в сутки, и композицию, содержащую более 95 мас.% норбиксина, полученного путем очистки из экстракта семян Bixa orellana, для использования с целью фотозащиты клеток пигментного эпителия сетчатки (ПЭС) у млекопитающих. Заявленная группа изобретений высокоэффективна для фотозащиты клеток пигментного эпителия сетчатки (ПЭС) у млекопитающих. 2 н. и 14 з.п. ф-лы, 13 ил., 2 табл.
1. Применение композиции, содержащей более 90 мас.% норбиксина, полученного путем очистки из экстракта семян Bixa orellana, для фотозащиты клеток пигментного эпителия сетчатки (ПЭС) у млекопитающих путем введения этому млекопитающему указанной композиции в количестве от 0,48 мг/кг массы тела до 48 мг/кг массы тела в сутки.
2. Композиция, содержащая более 95 мас.% норбиксина, полученного путем очистки из экстракта семян Bixa orellana, для использования с целью фотозащиты клеток пигментного эпителия сетчатки (ПЭС) у млекопитающих.
3. Применение или композиция по любому из пп. 1 и 2, где композиция включает более 90 мас.% норбиксина в его 9’-цис-форме формулы (I):
 (I).
(I).
4. Применение или композиция по любому из пп. 1-3, где композиция включает цинк.
5. Применение или композиция по любому из пп. 1-4, где композиция включает витамин С.
6. Применение или композиция по любому из пп. 1-5, где композиция включает витамин Е.
7. Применение или композиция по любому из пп. 1-6, где композиция имеет форму пищевой добавки или медикамента.
8. Применение или композиция по любому из пп. 1-7, где композиция включает основу, пригодную для перорального применения.
9. Применение или композиция по любому из пп. 1-8, где композиция включает основу, пригодную для инъекционного введения в глаз.
10. Применение или композиция по любому из пп. 1-9, где композиция включает основу, пригодную для инъекционного введения в кровь.
11. Применение или композиция по любому из пп. 1-10, которую вводят млекопитающему в количестве от 0,48 мг/кг массы тела до 48 мг/кг массы тела в сутки.
12. Применение или композиция по любому из пп. 1-11, где композицию вводят млекопитающему в количестве от 0,6 мг/кг массы тела до 20 мг/кг массы тела в сутки.
13. Применение или композиция по любому из пп. 1-12 для профилактики повреждения сетчатки, вызванного воздействием синего излучения, соответствующего синей области видимой части светового спектра, имеющего длину волны от 435 нм до 490 нм.
14. Применение или композиция по любому из пп. 1-13 для лечения возрастной макулярной дегенерации (ВМД) у млекопитающих.
15. Применение или композиция по любому из пп. 1-13 для лечения болезни Штаргардта у млекопитающих.
16. Применение или композиция по любому из пп. 1-13 для лечения пигментного ретинита у млекопитающих.
| FR 2947173 A1, 31.12.2010 | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| US 20140322371 A1, 30.10.2014. | |||
Авторы
Даты
2020-03-04—Публикация
2016-04-28—Подача