Область техники
Настоящее изобретение относится к способам и фармацевтическим композициям для экспрессии нужных полинуклеотидов в пигментном эпителии сетчатки субъекта.
Уровень техники
Наследственные дистрофии сетчатки (IRD или НДС) представляют собой большую группу заболеваний, которые являются генетически и клинически гетерогенными. Для них характерна прогрессирующая потеря зрения, хотя возраст наступления полной слепоты варьирует. Несмотря на то, что это достаточно редкая патология, в пересчете на популяцию, НДС встречаются, приблизительно, у 1 человека из 2000 по всему миру (Berger et al, 2010).
Наиболее распространенной формой НДС является группа пигментных ретинопатий, которые характеризуются дегенерацией фоторецепторных клеток сетчатки и наличием пигментных отложений в области глазного дна. Показательным примером является хороидеремия (СМН). СМН представляет собой Х-сцепленную пигментную ретинопатию, которая составляет приблизительно 2% от всех НДС. (Bocquet et al, 2013). Она характеризуется ночной слепотой, появляющейся в детстве с последующей прогрессирующей потерей полей зрения, что приводит к полной слепоте приблизительно к 40-50 годам. СНМ имеет характерный фенотип, включающий наличие пигментных отложений и атрофию хориокапилляров сосудистой оболочки глаза (хороидеи), располагающейся непосредственно за сетчаткой. Установлен причинный ген, СНМ, который кодирует REP1, Rab эскортный белок 1 (Seabra et al, 1992), убиквитарный шаперон-белок, обеспечивающий нормальное пренилирование Rab ГТФаз и последующую доставку их к мембранным мишеням. Сетчатка в целом является хорошей мишенью для генной терапии поскольку а) на нее легко воздействовать неинвазивными методами б) она имеет небольшой размер и является закрытой, что позволяет использовать низкие дозы векторов, и в) наличие гемато-ретинального барьера, состоящего из плотных соединений пигментного эпителия сетчатки (ПЭС) и нефенестрированных капилляров ретинальной сети, препятствует проникновению препарата в общий кровоток и делает сетчатку иммуно-привилегированной зоной (Colella et al, 2009). Указанные преимущества способствовали первым клиническим исследованиям генной терапии заболеваний сетчатки в 2008 году (Bainbridge et al, 2008; Maguire et al, 2008), за которыми быстро последовали новые исследования (Bennett et al, 2012; Hauswirth et al, 2008; Jacobson et al, 2012; Maguire et al, 2009). Целевой IRD был врожденный амавроз Лебера (LCA), возникающий в результате мутаций в ПЭС-специфическом гене, RPE65 (Marlhens et al, 1997), который кодирует ключевой фермент зрительного цикла. RPE65 успешно доставляли к ПЭС при помощи вектора рекомбинантного адено-ассоциированного вируса серотипа 2 (AAV2/2). Положительные результаты позволили доказать концепцию о том, что перенос генов может помочь улучшить зрение у пациентов с нарушениями, а также способствовали поиску и идентификации новых наиболее эффективных векторов, в особенности для экспрессии нужных полинуклеотидов в ПЭС.
Краткое описание изобретения Настоящее изобретение относится к способам и фармацевтическим композициям для экспрессии нужных полинуклеотидов в пигментном эпителии сетчатки субъекта. Детально настоящее изобретение раскрывается в формуле изобретения.
Детальное описание изобретения
Авторы изобретения перепрограммировали REP1-дефицитные фибробласты пациента с СНМ-/у в индуцированные плюрипотентные стволовые клетки (iPSc или ИПСК), которые затем дифференцировались в пигментный эпителий сетчатки (RPE или ПЭС). Было показано, что полученный на основании ИПСК пигментный эпителий представляет собой поляризованный монослой с классической морфологией, экспрессирующий характерные маркеры, обеспечивающий функционирование транспорта жидкостей и фагоцитоз, а также мимикрирующий биохимический фенотип пациентов. Затем авторы изобретения исследовали панель AAV векторов разных серотипов и впервые показали, что AAV2/5 является наиболее эффективным вектором (>60% трансдукции) для ПЭС клеток человека, а также, что перенос СНМ гена может нормализовать биохимический фенотип. Высокой эффективности in vitro трансдукции, вероятно, способствует способность клеток к фагоцитозу. Таким образом, авторы изобретения показали преимущество AAV 2/5 у человека с мутацией СНМ в ПЭС.
Соответственно, в одном аспекте настоящее изобретение относится к способу селективной экспрессии нужных полинуклеотидов в пигментном эпителии сетчатки в глазах субъекта, нуждающегося в этом, при этом указанный способ включает этап трансфекции пигментного эпителия сетчатки rAAV2/5 вектором, содержащим нужный полинуклеотид.
Используемый в настоящем описании термин "субъект" или "субъект, нуждающийся в лечении" относится к человеку. Обычно субъект уже болеет или, имеет вероятность заболеть дистрофией сетчатки, поражающей клетки пигментного эпителия. Таким образом, заявленные в настоящем изобретении технологии могут использоваться для лечения широкого спектра заболеваний сетчатки, к которым обычно относятся наследственные и ненаследственные дегенеративные заболевания сетчатки, дистрофии сетчатки, пигментный ретинит, макулярные дегенерации, врожденный амавроз Лебера (LCA), палочко-колбочковые дистрофии, неоваскулярные заболевания глаз, хориоидальные дегенерации, хориоидальный склероз, диабетические ретинопатии, пролиферативные витреоретинопатии, хороидеремия, глаукома и метаболические заболевания, такие, как Sly синдром (MPS VII - мукополисахаридоз VII типа, обусловленный дефектом в гене бета-глукоронидазы) и гиратная атрофия (обусловленная дефектом в гене орнитин-дельта-аминотрансферазы, ОАТ), отслойка сетчатки в результате травмы или вследствие ретинопатий (как наследственных, так и после хирургических вмешательств, травм, воздействия токсических соединений, или индуцированных светом).
Согласно другому аспекту настоящее изобретение предлагает способ лечения заболевания сетчатки у субъекта, нуждающегося в подобном лечении, путем доставки в глаз субъекта rAAV2/5 вектора, содержащего нужный полинуклеотид, который затем экспрессируется в клетках ПЭС, и оказывает благоприятный эффект на заболевание сетчатки.
Используемый в настоящем описании термин "нужный полинуклеотид" относится к любой нуклеотидной последовательности, кодирующей любой полипептид, структурный белок, фермент и т.д., экспрессия которой необходима в клетке-мишени по любой причине. Он также может обозначать и некодирующую последовательность, например, антисмысловую последовательность или последовательность интерферирующей РНК, направленную на уменьшение экспрессии гена. Специалист в данной области на основании своих знаний и при помощи специфической научной литературы легко определит, какие полинуклеотиды являются наиболее подходящими для лечения специфического заболевания сетчатки.
Генная терапия заболеваний глаз при помощи rAAV2/5 векторов в соответствии с настоящим изобретением, может осуществляться как путем введения в клетки ПЭС функциональной копии нужного полинуклеотида (например, гена), которого не достает в указанных клетках (генная заместительная терапия), так и путем доставки в клетки ПЭС полинуклеотида, который будет оказывать благоприятный эффект и способствовать лечению заболевания сетчатки (симптоматическая терапия).
В частности, полинуклеотидный продукт представляет собой полипептид, который будет улучшать функцию пигментного эпителия сетчатки. Примерами таких нужных полинуклеотидов, которые могут применяться для генной заместительной терапии, являются гены, которые специфически или преимущественно экспрессируются клетками ПЭС, такие, как RGR (пигментный ретинит, RP, хромосома 10), RDH5 (белоточечное глазное дно, хромосома 12), RPE65 (врожденный амавроз Лебера, LCA, хромосома 1), RLBP1 (RP, хромосома 15), MERTK (RP, хромосома 2), LRAT (RP, хромосома 4), REP1 (хороидеремия, хромосома 21), RBP4 (RPE дегенерация, хромосома 10) или гены, которые также экспрессируются в клетках другого типа, такие, как MY07A (синдром Ушера типа 1, хромосома 11), ELOVL4 (макулярная дегенерация, хромосома 6), EFEMP1 (болезнь Malattia Leventinese, хромосома 15), BEST1 (болезнь Беста, хромосома 11), TIMP3 (дистрофия глазного дна Сорсби, хромосома 22), AIPL1 (LCA, хромосома 7), и CRB1 (RP, хромосома 1).
Согласно некоторым вариантам осуществления изобретения, полинуклеотид представляет собой полинуклеотид, кодирующий REP1, эскортный Rab белок 1 (СНМ ген).
Согласно одному из вариантов осуществления изобретения, нужный полинуклеотид может кодировать нейротрофический фактор. Используемый в настоящем описании термин "нейротрофический фактор" - это общий термин для обозначения белков, обладающих физиологическим действием, которое заключается в обеспечении выживания и поддержании нервных клеток, стимуляции дифференцировки нейронов. Примерами нейротрофических факторов являются, без ограничений указанными, bFGF, aFGF, BDNF, CNTF, IL-1beta, NT-3, IGF-II, GDNF, NGF и RdCVF.
В определенных обстоятельствах, нужный полинуклеотидный продукт является сайт-специфичной эндонуклеазой, которая обеспечивает сайт-специфическое выключение функции гена, например, такая нуклеаза нокаутирует аллель, ассоциированный с заболеванием сетчатки. Например, если доминантный аллель кодирует дефектную копию гена, который, как ген дикого типа, кодирует структурный белок сетчатки и/или обеспечивает нормальную функцию сетчатки, сайт-специфическая эндонуклеаза (такая, как TALE нуклеаза, мегануклеазы или нуклеазы белкового домена "цинковые пальцы") может доставляться непосредственно к дефектному аллелю и нокаутировать его. Помимо нокаутирования дефективного аллеля, сайт-специфическая нуклеаза может также использоваться для стимуляции гомологичной рекомбинации с донорской ДНК, которая кодирует функциональную копию белка, кодируемого дефектным аллелем. Таким образом, например, способ в соответствии с настоящим изобретением, может использоваться как для доставки сайт-специфической эндонуклеазы, которая нокаутирует дефектный аллель, так и для доставки функциональной копии дефектного аллеля, что приводит к восстановлению дефектного аллеля и обеспечивает продукцию функционального белка в сетчатке. Согласно некоторым вариантам осуществления изобретения, вектор содержит полинуклеотид, который кодирует сайт-специфическую эндонуклеазу, и полинуклеотид, который кодирует функциональную копию дефектного аллеля, при этом функциональная копия кодирует функциональный белок сетчатки. Сайт-специфическая эндонуклеаза, которая подходит для использования в соответствии с настоящими изобретением, может представлять собой, например, эндонуклеазу белкового домена "цинковые пальцы" (ZFN); и эффекторные нуклеазы, действующие подобно транскрипционным активаторам (TALEN), при этом такие сайт-специфические эндонуклеазы не существуют в природе и подвергаются модификациям для таргетного действия на специфический ген. Такие сайт-специфические нуклеазы могут быть сконструированы для вырезания определенных участков генома, а негомологичное соединение концов затем позволяет "починить" разрыв посредством вставки или удаления нескольких нуклеотидов. Такие сайт-специфические эндонуклеазы (также известные, как "INDEL") затем удаляют белок из рамки считывания и эффективно нокаутируют ген (например, публикация US No. 2011/0301073).
Согласно некоторым вариантам осуществления изобретения, полинуклеотидный продукт представляет собой интерферирующую РНК (RNAi). Используемый в настоящем описании термин "AAV" имеет общепринятое в данной области знаний значение и представляет собой аббревиатуру для аденоассоциированного вируса и также может использоваться для обозначения вируса как такового или его производных. Термин объединяет все серотипы и варианты, как существующие в природе, так и сконструированные при помощи генной инженерии. Согласно изобретению, термин "AAV" обозначает AAV 1 типа (AAV-1), AAV 2 типа (AAV-2), AAV 3 типа (AAV-3), AAV 4 типа (AAV-4), AAV 5 типа (AAV-5), AAV 6 типа (AAV-6), AAV 7 типа (AAV-7), и AAV 8 типа (AAV-8) и AAV 9 типа (AAV9). Геномные последовательности различных серотипов AAV, а также последовательности нативных концевых повторов (TRs), Rep белков, и капсидных субъединиц хорошо известны специалистам в данной области. Указанные последовательности можно легко найти в соответствующей литературе, а также в публичных базах данных, таких, как GenBank (например, номера доступа GenBank NC_001401 (AAV-2), AF043303 (AAV2), и NC_006152 (AAV-5).
Используемый в настоящем описании термин "rAAV вектор" относится к AAV вектору, содержащему нужный полинуклеотид (например, гетерологичный полинуклеотид) для генетической трансформации клеток ПЭС. rAAV векторы содержат 5' и 3' инвертированные концевые повторы аденоассоциированного вируса (ITRs) и нужный полинуклеотид, оперативно связанный с указанными последовательностями, которые регулируют его экспрессию в клетке-мишени.
Термин "AAV гибридный вектор", используемый в настоящем описании, относится к вектору, содержащему нативный AAV капсид, включая rAAV векторный геном и AAV Rep протеины, при этом Cap, Rep и ITRs векторного генома получены, по крайней мере, из двух разных серотипов AAV. Гибридный вектор в соответствии с настоящим изобретением, представляет собой rAAV2/5 вектор, содержащий AAV-5 капсид и rAAV геном с AAV-2 ITRs. Например, представляется возможным получить кэп ген из кэп гена AAV-2 путем замещения его последовательностью кэп гена AAV-5, таким образом, что экспрессируемые белки будут способны сформировать капсид AAV-5.
Согласно настоящему изобретению rAAV2/5 векторы получают при помощи способов, хорошо известных из области техники. Такие способы обычно включают (а) интродукцию rAAV вектора в клетку-хозяина, (б) интродукцию AAV хэлперного конструкта в клетку-хозяина, при этом такой хэлперный конструкт обладает вирусными функциями, которых лишен rAAV вектор и (в) индродукцию хэлперного вируса в клетку-хозяина. Все функции, необходимые для репликации и упаковки rAAV вириона, должны присутствовать для достижения репликации и упаковки rAAV вектора в rAAV вирионы. Интродукция в клетку-хозяина может осуществляться при помощи стандартных вирусологических технологий одновременно с использованием стандартных технологий, таких, как CsCl градиенты. Остаточная активность хэлперного вируса может быть подавлена при помощи известных методик, например, тепловой инактивации. Затем очищенный rAAV вирион готов для использования.
Вектор также может включать регуляторные последовательности, обеспечивающие экспрессию и секрецию кодируемого белка, такие, как, промотор, энхансер, сигналы полиаденилирования, участки внутренней посадки рибосомы (IRES), последовательности, кодирующие домены белковой трансдукции (PTD) и т.п. В связи с этим, вектор содержит промоторный участок, оперативно связанный с нужным полинуклеотидом, для запуска или усиления экспрессии белка в инфицированной клетке. Такой промотор может быть убиквитарным, ткане-специфичным, сильным, слабым, регулируемым, химерным, индуцибельным и т.д., для обеспечения эффективной и адекватной продукции белка в инфицированных клетках. Промотор может быть гомологичным кодируемому белку, или гетерологичным, включая клеточные, вирусные, грибковые, растительные или синтетические промоторы. Предпочтительные промоторы, подходящие для использования в соответствии с настоящим изобретением, должны функционировать в клетках ПЭС. Примерами таких регулируемых промоторов являются, без ограничений указанными, промоторы, содержащие Tet on/off элементы, рапамицин-индуцируемые промоторы и промоторы металлотионеинов. Примерами убиквитарных промоторов являются вирусные промоторы, в особенности CMV промотор, CAG промотор (куриный промотор бета актина с CMV энхансером), RSV промотор, SV40 промотор и т.д., а также клеточные промоторы, такие, как PGK (фосфоглицераткиназа) промотор. Промоторы также могут быть нейроспецифическими, такими, как Синапсин или промотор NSE (нейрон-специфической енолазы) или NRSE (нейрон ограниченные элементы "молчания") последовательности, помещаемые выше убиквитарного PGK промотора, или промоторами, специфичными для клеточных типов ПЭС, такими, как RPE65, BEST1, промотор родопсина или аррестина колбочек. Вектор также может содержать таргетные последовательности для микроРНК, что позволяет подавлять трансгенную экспрессию в нежелательных клетках. Согласно одному из вариантов осуществления изобретения, вектор содержит лидерную последовательность, обеспечивающую секрецию кодируемого белка. Слияние нужного полинуклеотида с последовательностью, кодирующей сигнальный пептид секреции (обычно располагается на N-конце секретируемых полипептидов) позволит обеспечить продукцию лечебного белка в форме, которая может секретироваться трансфицированными клетками. Примерами таких сигнальных пептидов являются альбумин, β-глюкуронидаза, алкалиновая протеза или сигнальные пептиды секреции фибронектина. Согласно наиболее предпочтительному варианту осуществления изобретения, промотор является специфичным или функциональным в клетках сетчатки, в особенности, фоторецепторных или ганглионарных клетках сетчатки или в ПЭС, то есть, обеспечивает (преимущественно) экспрессию трансгена в указанных клетках. Например, подходящими регуляторными элементами, специфичными для фоторецепторных клеток, являются, промотор родопсина; промотор родопсинкиназы (Young et al. 2003. Ophthalmol. Vis. Sci. 44:4076); промотор гена бета фосфтодиэстеразы (Nicoud et al. 2007. J. Gene Med. 9: 1015); промотор гена пигментного ретинита (Nicoud et al. 2007); энхансер гена межфоторецепторного ретинол-связывающего белка (IRBP)_(Nicoud et al. 2007); промотор гена IRBP (Yokoyama et al. 1992. Exp Eye Res. 55:225). Дозы вектора могут регулироваться в зависимости от заболевания, особенностей субъекта (например, в зависимости от его веса, метаболизма и пр.), режима лечения и т.п. Предпочтительная эффективная доза в контексте настоящего изобретения должна обеспечивать трансдукцию клеток ПЭС. Обычно, мышам в одной дозе вводят от 108 до 1010 вирусных геномов (вг). Обычно, дозы AAV вектора, которые могут применяться у людей, составляют от 1010 до 1012 вг.
Введение вектора, в соответствии с настоящим изобретением, может осуществляться посредством прямой инъекции в сетчатку, в субретинальное пространство или путем интравитреальной инъекции. Согласно данному способу, введение векторных частиц, предпочтительно, осуществляется путем субретинальной инъекции.
Согласно некоторым аспектам, настоящее изобретение относится к rAAV2/5 вектору, содержащему полинуклеотид, кодирующий REP1. Согласно некоторым вариантам осуществления изобретения, полинуклеотид находится под контролем CAG промотора. Такой вектор наиболее подходит для лечения хороидеремии у субъекта, нуждающегося в подобном лечении.
Примерная аминокислотная последовательность для REP1 представлена SEQ ID NO: 6, а примерная нуклеотидная последовательность для REP1 представлена SEQ ID NO: 7.
SEQ ID NO: 6: NCBI Стандартная последовательность: NP_001138886.1

SEQ ID NO: 7: NCBI Стандартная последовательность: NM_000390.2
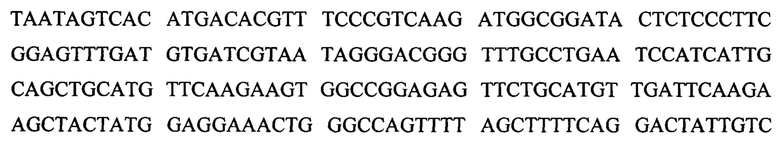



Вектор, в соответствии с настоящим изобретением, может быть включен в состав фармацевтической композиции. Такие композиции могут включать, помимо вектора, фармацевтически приемлемое вспомогательное вещество, носитель, буфер, стабилизатор, или другие вещества, хорошо известные специалистам в данной области. Такие вещества должны быть нетоксичными и не должны влиять на эффективность активного ингредиента (то есть, вектора в соответствии с настоящим изобретением). Подходящая природа носителя или другого вещества может быть легко установлена специалистом в данной области, исходя из способа введения, то есть прямой ретинальной, субретинальной или интравитреальной инъекции. Фармацевтическая композиция обычно представлена в жидкой форме. Жидкая фармацевтическая композиция обычно содержит жидкий носитель, такой, как вода, петролеум, животное или растительное масло, минеральное масло или синтетическое масло. Физиологический солевой раствор, хлорид магния, декстроза или другие растворы сахаридов или гликолей, таких, как этиленгликоль, пропиленгликоль или полиэтиленгликоль могут входить с состав указанных композиций. Для инъекционного введения, активный ингредиент должен быть в форме водного раствора, не содержащего пирогенных веществ и имеющего подходящий рН, изотонические свойства и обладающий стабильностью. Тот, кто обладает необходимыми знаниями в данной области, способен приготовить подходящие растворы, используя, например, изотонические носители, такие как хлорид натрия, раствор Рингера, раствор Рингера с лактатом. Консерванты, стабилизаторы, буферы, антиоксиданты и/или другие дополнительные вещества могут быть включены в состав композиций, если это требуется. Если требуется замедленное высвобождение, вектор может быть включен в состав фармацевтической композиции, специально созданной для замедленного высвобождения активного ингредиента, например, в форме микрокапсул из биосовместимых полимеров или в форме липосомных систем, согласно способам, хорошо известным из области техники.
Настоящее изобретение дополнительно иллюстрируется представленными ниже фигурами и примерами. Однако, указанные примеры и фигуры не должны рассматриваться как ограничивающие сущность настоящего изобретения.
Перечень фигур.
Фиг. 1. Эффективность трансдукции AAV векторами клеток ПЭС, полученных из ИПСК.
a) Сравнение эффективности трансдукции панели AAV векторов (2/2, 2/4, 2/5, 2/8, 2/9), экспрессирующих EGFP, под контролем CMV промотора. Эффективность трансдукции также сравнивали с эффективностью для AAV2/5 вектора, экспрессирующего EGFP под контролем CAG промотора. Трансдукцию осуществляли в дозе 25000 вг на клетку, а количество EGFP-позитивных клеток анализировали при помощи FACS.
b) Сравнение эффективности трансдукции достигалось путем использования большого количества вирусных частиц (100 ООО вг/клетка) AAV векторов серотипов 2/2, 2/5, 2/8, 2/9, экспрессирующих EGFP под контролем CMV промотора. Количество EGFP-позитивных клеток анализировали при помощи FACS с) Динамика экспрессии EGFP для той же панели AAV векторов г) Для клеток ПЭС дикого типа и СНМ1 ПЭС эффективность трансдукции AA2/5-CAG-EGFP векторами была одинаковой.
Фиг. 2. Экспрессия REP1 СНМ1 фибробластами после введения вектора AAV2/5-CAG-CHM.
a) IF (иммуноферментный) анализ экспрессии REP1 в фибробластах дикого типа
b) Отсутствие экспрессии REP1 в СНМ1 фибробластах
c) Экспрессия REP1 из AAV2/5-CAG-CHM через 48 ч. после трансдукции СНМ1 фибробластов в дозе 100000 вг/клетка.
d) Вестерн-блоттинг фибробластов через 48 ч. после трансдукции вектором AAV2/5-CAG-CHM в дозе 100000 вг/клетка показал, что REP1 экспрессируется приблизительно на 17% от уровня экспрессии клетками дикого типа (WT).
e) Вестерн-блоттинг фибробластов через 4 недели после трансдукции вектором AAV2/5-CAG-CHM в дозе 100000 вг/клетка показал, что REP1 экспрессируется приблизительно на 53% от уровня экспрессии клетками дикого типа (WT). Необходимо отметить отсутствие экспрессии REP1 в нетрансдуцированных СНМ1 клетках (NT) как в исследовании d), так и в исследовании е).
Фиг. 3. Восстановление нормального клеточного фенотипа СНМ ПЭС после трансдукции вектором AAV2/5-CAG-CHM.
A) In vitro пренилирование с последующим вестерн-блоттингом включенного биотинилированного донора пренила в клетках дикого типа, не трансдуцированных СНМ1 RPE и СНМ1 ПЭС, трансдуцированных вектором AAV2/5-CAG-CHM.
B) Дифференциальное центрифугирование и вестерн-блоттинг цитозольных и мембранных фракций в клетках дикого типа, нетрансдуцированных СНМ1 ПЭС клетках и СНМ1 ПЭС клетках, трансдуцированных вектором AAV2/5-CAG-CHM или AAV2/5-CAG-EGFP.
C) Количественный анализ и нормализация по уровню нагрузки бета-актина, показали снижение цитозольного пула Rab до уровней дикого типа после трансдукции СНМ1 ПЭС вектором AAV2/5 -CAG-CHM.
D) Количественный анализ показал восстановление внутриклеточного профиля распределения Rab27A до уровня дикого типа после трансдукции СНМ1 ПЭС вектором AAV2/5-CAG-CHM. В противоположность этому, уровни оставлялись неизменными после трансдукции AAV2/5-CAG-EGFP.
Фиг. 4. In vivo генный трансфер в клетки сетчатки мышей
a) Две недели после введения 4.68×109 вг AAV5-CAG-CHM вектора или -EGFP вектора, экспрессия трансгена может быть определена при помощи количественной ПНР
b) Вестерн-блоттинг подтвердил специфическую экспрессию REP1 и EGFP после введения AAV5-CAG-CHM или -EGFP вектора, соответственно.
c) Фундоскопия (осмотр глазного дна) показала здоровую сетчатку за пределами места инъекции после введения вектора AAV5-CAG-CHM и распространенную экспрессию трансгена, наиболее выраженную в месте инъекции после введения вектора AAV5-CAG-EGFP.
d) Экспрессию EGFP определяли во всей сетчатке на стороне зрительного нерва, место выхода которого соответствовало точке введения (масштабная метка); при увеличении была подтверждена экспрессия EGFP в ПЭС клетках и фоторецепторных клетках.
Пример
Материалы и Методы
Выделение и амплификация фибробластов кожи
Биопсии кожи проводили в стерильных условиях, образцы получали из внутренней стороны верхней части руки 16-летнего мальчика (обозначенного как СНМ1) с подтвержденным молекулярно диагнозом хороидеремии (делеция 8 экзона СНМ гена, выявлена при помощи ПЦР в реальном времени; Klinkum der Universitat, Германия) при обследовании в Центре контроля за генетическими сенсорными заболеваниями (CHRU Montpellier). Препараты кожи промывали PBS, нарезали на маленькие кусочки и культивировали в 35 мм чашках Петри (2 кусочка на чашку) в основной среде AmnioMAX С100 с L-глутамином (Invitrogen, Life Technologies, Франция), содержащей 10% декомплементированную FCS (Lonza, Бельгия), 1% пенициллин-стрептомицин-амфотерицин В (Lonza) и 2% AmnioMax-С100 добавкой (Invitrogen, Life Technologies) при 37°С под 5% CO2. После того как степень смыкания монослоя фибробластов достигала 80% препараты переносили на свежие чашки. Всего клетки переносили 4 раза, а клетки, из каждого порядка от Р1 до Р5 из каждой отдельной культуры замораживали в FCS, содержащей 10% DMSO (Sigma Aldrich, Франция).
Характеристизация мутации
Геномную ДНК выделяли из первичных фибробластов при помощи набора для исследования ДНК в крови и тканях (DNeasy Blood & Tissue Kit, Qiagen, Франция) согласно инструкции производителя. Для установления границ делеции 8 экзона в гене СНМ (мутации, имевшейся у пациента), проводили ПЦР амплификацию контрольного образца и ДНК пациента в стандартных условиях, с использованием 3 пар праймеров на 1,6 кб геномной ДНК в направлении 5' к 8 экзону, и 8 пар праймеров на 38 кб ДНК в направлении 3' к 8 экзону. После того, как редуцированный интервал был установлен, для амплификации 666 пар оснований фрагмента геномной ДНК, очищенного при помощи специального набора ExoSAP-IT PCR Clean-up Kit (GE Healthcare, Франция) использовали интронный 7F праймер (5'-ТТС-ATCTCC-TTT-TTG-TGG-GG-3') (SEQ ID NO: 1), располагавшийся на 78 паре оснований вверх по рамке считывания 8 экзона, и интронный 8R праймер (5'-CTG-GAA-ACA-TCC-TGT-GTT-CAT-C-3') (SEQ ID NO: 2), располагающийся на 362 паре оснований вниз по рамке считывания 8 экзона; после чего полученный фрагмент секвенировали при помощи набора BigDye Terminator Cycle Sequencing Ready Reaction kit V3.1 на анализаторе Applied Biosystems 3130xL Genetic Analyser (Applied Biosystems, США).
Определение мутации
Три пары праймеров использовали для ПЦР амплификации 7, 8 и 9 экзонов для определения наличия делеции СНМ в геномной ДНК клеток различного типа. Пары праймеров для 7 экзона амплифицировали 493-п.о. фрагмент, праймер для 8 экзона амплифицировал 177-п.о. фрагмент, а праймер для 9 экзона - 975 п.о. фрагмент.РНК выделяли из клеток различных типов при помощи мининаборов QiaShredder и RNeasy (Qiagen), согласно инструкции производителя. Выделенную РНК обрабатывали ДНК-азой, свободной от РНКазы (Qiagen) и обратно транскрибировали при помощи специального набора Superscript III Reverse Transcriptase kit (Life Technologies). Наличие или отсутствие делеции СНМ подтверждали при помощи ПЦР амплификации экзонов 7-11, которые соответствовали фрагменту 559 п.о. контрольной кДНК и фрагменту 333 п.о. ДНК пациента.
Вестерн блоттинг
Клетки соскабливали в ледяной PBS, содержащий коктейль полных ингибиторов протеаз (Roche, Франция), и центрифугировали при 200 г в течение 5 минут при 4°С. Затем дебрис повторно суспендировали в 2х буфера для образца Лэмли (Biorad, Франция), содержащем Бензоназу (Sigma Aldrich). Концентрацию белка в лизатах измеряли при помощи набора для анализа белков Pierce ВСА Protein Assay kit (ThermoFisher Scientific, Франция) и наносили на гель AnyKD MiniProtean TGX Stain Free gel (Biorad). Разделенные белки подвергали электрофорезу при помощи системы Trans-Blot® Turbo™ Mini PVDF Transfer Pack and System (Biorad). После блокировки в течение 1 часа в 0,5% Tween-PBS в 5% обезжиренном молоке (блокирующий раствор, Skim Milk) планшет инкубировали с 1/1000 разведением в блокирующем растворе моноклонального мышиного анти-REP1 антитела (клон 2F1; Millipore, Франция) в течение 1 ч. при комнатной температуре. После трехкратного отмывания раствором 0.5% Tween-PBS, фильтрат инкубировали с 1/1000 разведением антитела овцы к цельным мышиным иммуноглобулинам, конъюгированным с пероксидазой хрена (HRP) (Life Technologies). Этап определения осуществляли при помощи первичного проявляющего реагента для вестерн-блоттинга Amersham ECL(GE Healthcare).
Получение лентивирусных векторов
Плазмиды, на основе лентивирусов, содержащие доксициклин-индуцибельные факторы транскрипции c-MYC (FUW-tetO-hMYC; плазмида ID 20723), SOX2 (FUW-tetO-SOX2; 20724), KLF4 (FUW-tetO-KLF4; 20725), OCT4 (FUW-tetO-OCT4; 20726), обратный трансактиватор доксициклина M2rtTA (FUW-M2rtTA; 20342) и GFP (FUGW; 14883), полученные в лаборатории Addgene (США). Лентивирусные векторы получали на специальной лентивирусной платформе (Montpellier, France). Инфекционный титр FUGW рассчитывали при 1010 TU/мл. Инфекционные титры оставшихся вирусов определяли путем расчета соотношения концентрации Р24 для них и для FUGW: FUW-tetO-hMYC - 2×109 TU/мл; FUW-tetO-SOX2 - 7×109 TU/мл; FUW-tetO-KLF4 - 8×109 TU/мл; FUW-tetO-OCT4 - 3×109 TU/мл и FUW-M2rtTA - 9.8×109 TU/мл.
Питающие клетки
Фибробласты крайней плоти человека получали в Американской коллекции типовых культур АТСС (hFF-1; LTC стандарты, Франция). Клетки культивировали в DMEM среде, содержащей Глутамакс (Gibco, Life technologies), обогащенной 10% FCS (фетальной телячьей сывороткой) и облучали дозой 35 Грей при помощи аппарата Cegelec BloodXrad (Etablissement Francais du Sang, Франция). Питающие клетки выращивали на планшете с плотностью 2.5×105 клеток/35 мм.
Перепрограммирование и культура ИПСК
Перед началом перепрограммирования, рассчитывали подходящую множественность заражения (MOI) для опытов по трансдукции, используя GFP-кодирующий FUGW вектор. Фибробласты СНМ пациента в День 0 помещали на 6-луночные планшеты с плотностью 105 клеток на лунку, в среду DMEM, содержащую Глутамакс, обогащенную 10% FCS и 1% пенициллин-стрептомицин-амфотерицином В. В 1 день клетки трансдуцировали 5 вирусами (контрольный FUGW вектор не использовали в опытах по перепрограммированию) при MOI 10 на вектор (общий показатель MOI - 50) в присутствии 8 мкг/мл полибрена. На 2 день клетки промывали PBS и добавляли свежую среду. На 5 день среду снова обновляли и обогащали 2 мкг/мл доксициклина. На 6 день трансдуцированные клетки диссоциировали 0,25% трипсином (Gibco), а клетки из 1 лунки разделяли на 4 лунки, содержащие слой питающих клеток (разведение 1А). Клетки культивировали в ES среде (КО DMEM, Gibco), обогащенной 20% заменителем сыворотки КО (Gibco), 200 мМ L-глутамина (Gibco), 1% не относящимися к незаменимым аминокислотами (Gibco), 0.1% В-меркаптоэтанолом (Gibco), 1% пенициллин-стрептомицином (Gibco) и 10 нг/мл DFGF (Peprotech, Франция), содержащей 2 мкг/мл доксициклина (Sigma Aldrich), среду меняли ежедневно. Полученные ИПСК механически пересевали при помощи скальпеля под стереомикроскопом Lynx (Vision Engineering, Франция) на 35 мм планшеты, содержащие питающие клетки в ES среде.
Образование тератомы и анализ
ИПСК предварительно обрабатывали 10 мкМ КОСКингибитора (Rho-ассоциированная формирующая суперспираль серин/треонин протеинкиназа) (Y-27632; Sigma Aldrich), в течение 1 ч при 37°С и затем ферментативно диссоциировали 1x TrypLE Select (Gibco) в течение 10 минут при 37°С. Диссоциированые клетки пересаживали на планшет с плотностью 5000 клеток/см2 на 10-см планшет, содержащий слой питающих клеток, и культивировали в среде ES, содержащей 30% мембранную матрицу BD Matrigel Basement Membrane Matrix (BD Biosciences, Франция) в концентрации 2 × 106 клеток на 200 мкл. Разведение животных и все эксперименты осуществляли в соответствии с Европейским и Национальными руководствами по защите и использованию лабораторных животных (Council Directive 2010/63/EU) и после одобрения региональными и институционными этическими комитетами (номер разрешения CEAA-LR-12157). Мышей линии NOD. Cg-Prkdcscid Il2rgtmlWjl/SzJ (Charles River, Франция) вводили в наркоз кетамином в дозе 35 мг/кг (Merial, Франция) и ксилазином в дозе 14 мг/кг (Bayer Healthcare, Франция), выбривали участки шерсти с правого и левого бока и вводили туда подкожно 100 мкл клеточной смеси при помощи 1 мл шприца с иглой 27 калибра. В качестве контроля мышам вводили 30% среду Matrigel/ES, не содержащую клеток или содержащую клетки предварительно охарактеризованной линии ИПСК дикого типа (М4С7; Ramirez et al, 2013). Мышей содержали в индивидуальных проветриваемых клетках и подвергали эвтаназии после того, как размер опухоли достигал максимального размера в 1 см2 (~ 2 мес после инъекции). Опухоли иссекали, промывали PBS и фиксировали в 3,7% формальдегиде и заливали в парафин. Срезы толщиной 4 мм окрашивали гематоксилин-эозином и анализировали на предмет присутствия трех зародышевых слоев
Поколение ПЭС (RPE)
Для дифференцировки ИПСК в ПЭС авторы использовали описанный ранее протокол спонтанной дифференцировки клеток (Liao et al, 2010) с минимальными изменениями. Колонии ИПСК выращивали до смыкания монослоя на питающих клетках, после чего из ES среды удаляли DFGF. Далее среду меняли ежедневно во время процесса дифференцировки. После удаления DFGF примерно через месяц появились пигментированные очаги, которые иссекали вручную. Очаги из одного планшета объединяли, диссоциировали 0, 15% трипсином, высевали на 24- или 6-луночные планшеты, покрытые Matrigel (разведеном 1:30) и культивировали в лишенной FGF ES среде. После достижения цельного монослоя, клетки анализировали на наличие пигментной полигональной морфологии и содержали в культуре длительное время. Клетки пересевали посредством диссоциации трипсином и амплифицировали по необходимости. Все анализы проводили на ПЭС клетках третьего пассажа (РЗ). Наполненные жидкостью купола наблюдали в микроскопе SteREO Discovery V2.0 (Carl Zeiss, Франция).
Электронная микроскопия
ПЭС пересевали на прозрачные вкладыши для клеточных культур BD Falcon высокой плотности и размером пор 0,4 мкМ (BD Biosciences). После проведения характеризующего морфологического анализа, фильтры отделяли от камер, фиксировали в 3,3% глутаральдегиде, повторно фиксировали в 2% тетраоксиде осмия и заливали в эпоксидную смолу. Полутонкие (700 нм) срезы окрашивали толуидиновым голубым и изучали в световом микроскопе. Срезы в семьдесят нм окрашивали уранил ацетатом и лимоннокислым свинцом и изучали при помощи трансмиссионного электронного микроскопа Hitachi Н7100 (Centre Regional d'Imagerie Cellulaire (CRIC), Франция).
Иммунофлуоресцентная микроскопия
Для иммунофлуоресцентных исследований, ИПСК и ПЭС высевали на пластиковые 96-луночные планшеты, а фибробласты - на стеклянные покровные стекла. Клетки всех типов фиксировали 3,7% формальдегидом и блокировали в 5% сыворотке осла/1% BSA. Клетки пермеабилизировали 0,2% Тритоном х-100 или 0,05% сапонином. Первичные антитела инкубировали на срезах в течение ночи при 4°С, а вторичные антитела инкубировали 45 минут при комнатной температуре с 0,2 мкг/мл бисбензимидового Хекста (Sigma-Aldrich) и 1 нг/мл фаллоидин- TRITC (Sigma-Aldrich) перед закреплением в флуоресцентной среде Dako (Dako France, Франция), по необходимости. Для ИПСК, первичные антитела представляли собой антитела крысы к IgM человека SSEA3 (Developmental Studies Hybridoma Bank, University of Iowa, США) в разведении 1:5, и антитела козы к человеку NANOG (R&D Systems Europe, Франция) в разведении 1:10. Для ПЭС, первичные антитела представляли собой кроличьи антитела к челоеку ZO1 (Invitrogen, Life technologies) в разведении 1:100, кроличьи антитела к человеку MERTK (AbCam, Великобритания) в разведении 1:250, мышиные антитела к человеку RPE65 (AbCam) в разведении 1/150 и мышиные антитела к человеку CRALBP (направленные против рекомбинантного белка; Agrobio, Франция) в разведении 1:1000. Для фибробластов, первичные антитела представляли собой мышиные антитела к человеку REP1 (Millipore) в разведении 1/500. Для всех типов клеток, вторичные антитела представляли собой антитела осла к мышиным IgM-Alexa594 или - Alexa488 в разведении 1:800, или в разведении 1:1000 антитела осла к мышиному, кроличьему или козлиному IgG-Alexa Fluor 594 или - Alexa 488 (Invitrogen). Для изучения фагоцитоза, клетки инкубировали с желто-зелеными (505/515 нм) карбоксилат-модифицированными микросферами диаметром 1 мкм (FluoSpheres; Life technologies) в количестве 160 сфер на клетку. Клетки изучали под высокоскоростным/спектральным конфокальным микроскопом Zeiss 5 live duo, а получение изображений осуществляли при помощи соответствующего программного обеспечения (Carl Zeiss S.A.S.; Montpellier RIO Imaging platform).
Обратная транскрипция и количественные ПЦР исследования
Количественную ПЦР в реальном времени (кПЦР) использовали для анализа экспрессии экзогенных трансгенов в трансдуцированных фибробластах, а также сайленсинга экзогенных трансгенов и активации эндогенных плюрипотентных генов в ИПСК. После выделения РНК и синтеза кДНК, осуществляли кПЦР с использованием ген-специфических праймеров (Supplementary Material, Table) на аппарате LightCycler® 480 SYBR Green I Master и LightCycler® 480II thermal cycler (Roche). Экспрессию генов нормализовали по экспрессии GAPDH. Результаты анализировали при помощи программного обеспечения LightCycler® 480 и Microsoft Excel. Экспрессию ПЭС-специфических маркеров анализировали при помощи классической полимеразной цепной реакции с обратной транскрипцией (RT-PCR) с ген-специфичными праймерами, а продукты амплификации анализировали на 2% агарозном геле.
Анализ пренилирования in vitro
ПЭС, культивированные в лунках 24-луночного планшета, отмывали ледяным PBS, соскабливали в PBS, содержащий антипротеазы, осаждали центрифугированием и повторно суспендировали в ледяном, дегазированном пренилирующем/лизирующем буфере, свежеизготовленном, как описано ранее (Wu et al, 2007). Клетки инкубировали в течение 15 минут на льду и затем обрабатывали ультразвуком 3 раза в течение 45 минут при 40 герц. Затем клетки центрифугировали в течение 5 минут при 1500 г и 4°С, супернатант собирали и дополнительно центрифугировали в течение 30 минут при 450000 g при 4°С на ультрацентрифуге Optima MAX-TL (Beckman, Франция). Анализ пренилирования in vitro осуществляли на свежеприготовленном лизате с использованием 5 мкМ биотин-меченного геранил пирофосфата (B-GPP) (Euromedex, Франция) в качестве донора пренильной группы, 0,5 мкМ рекомбинантных ПЭС 1 (Euromedex), 0.5 мкМ Rab геранилгеранилтрансферазы (RGGT; Euromedex) и 20 мкМ GDP в пренилирующем/лизирующем буфере при 37°С в течение 1 ч (Nguyen et al, 2010; Wu et al, 2007). Реакцию пренилирования гасили 6x SDS, раствор кипятили при 90°С в течение 5 минут и анализировали при помощи вестерн-блоттинга. Мембрану инкубировали с HRP-конъюгированным стрептавидином в разведении 1:5000 (Jackson ImmunoResearch, Великобритания) или мышиным антителом к В-актину в разведении 1:50000 (Sigma Aldrich). Обнаружение осуществляли при помощи системы ChemiDoc MP (Biorad), а протяженность биотин-геранил включений рассчитывали при помощи сканирующей денситометрии с использованием подходящего программного обеспечения (Image Lab, Biorad) и выражали как функцию бета-актинового сигнала. Для относительных сравнений, количество биотиновых включений в СНМ RPE принимали за 100%.
Дифференциальное центрифугирование
Осажденные ПЭС клетки из 24-луночного планшета тщательно гомогенизировали в трех объемах лизирующего буфера для субклеточного фракционирования (SFLB), содержащего 50 мМ Tris-HCl (рН 7.5), 150 MMNaCl, 2 мМ MgC12,0.5 мМ ЭДТА, 0.5 мМ ЭДТА, 5 мМ ДТТ (дитиотреитол), 0.1 мМ ГДФ и ингибиторы белов, как описано (Seabra et al, 1995). Гомогенат центрифугировали при 800 х g при 4°С, осадок удаляли, а супернатант центрифугировали при 450000 х g в течение 1 часа при 4°С до получения цитозольной и мембранной фракции. После ультрацентрифугирования, осадок повторно суспендировали в 1 объеме SFLB, доведенном до 1% Nonidet Р-40 (Sigma Aldrich). Содержание белка в цитозольном супернатанте и 1% Nonidet P-40-солюбилизированной мембранной фракции анализировали при помощи вестерн-блоттинга. Мембраны инкубировали с мышиными анти- Rab27A (AbCam) антителами в разведении 1:250 или мышиными анти-β-актин антителами в разведении 1:50000. Уровни Rab27A в цитозоле и мембранах подсчитывали по отношению к контрольному белку - бета-актину, и выражали как процент от общего содержания Rab27A в каждой лунке.
Получение AAV вектора
Для получения всех AAV векторов, использовавшихся в данной работе, использовали платформу для получения вирусных векторов (Nantes, Франция). Вирусные векторы получали путем транзиторной трансфекции 293 клеток, а вирусные частицы преципитировали из супернатанта при помощи полиэтиленгликоля, или, в случае AAV2/4 и -2/5 векторов, из клеточного осадка при помощи сульфата аммония. Векторы очищали двойным CsCl-центрифугированием, диализировали и титровали при помощи дот-блот анализа. Для экспериментов по определению эффективности трансдукции, титры AAV векторов, экспрессирующих EGFP под контролем CMV промотора, были как указано далее: AAV2/2-CMV-EGFP - 3.5×1012 векторных геномов (вг/мл; AAV2/4-CMV-EGFP (получены от F. Rolling, Inserm UMR 1089, Франция) - 3×1011 вг/мл; AAV2/5-CMV-EGFP - 3.3×1012 вг/мл; AAV2/8-CMV-EGFP - 9×1012 вг/мл, и AAV2/9-CMV-EGFP - 2.55×1012 вг/мл Для обоснования решающих экспериментов использовали AAV плазмиды, несущие СНМ ген (предоставлены J. Bennett, Пенсильванский университет, США) или EGFP ген (предоставлены The Nantes Viral Vector Production Platform) под контролем CAG промотора (промотор бета-актина цыплят с CMV энхансером), для получения следующих векторов: AAV2/5-CAG-CHM - 4.4×1012 вг/мл и AAV2/5-CAG-EGFP - 2.34×1012 вг/мл.
In vitro AAV трансдукции
Для экспериментов по определению эффективности трансдукции, ПЭС, полученные из ИПСК, высевали на 96-луночные планшеты, а для слияния монослоя было установлено количество клеток, составлявшее 2×105 клеток на лунку. Клетки трансдуцировали 25000 вг (обусловлено серотипом с наименьшим титром) в минимальном объеме (50 мкл) лишенной DFGF ES среды в течение 6 часов для обеспечения взаимодействия вируса с клеткой. Затем лунки обогощали дополнительной средой, которую меняли каждые 3-4 дня. В заданные временные точки клетки диссоциировали 0,25% трипсином, фиксировали в 3,7% формальдегиде, а количество EGFP-экспрессирующих клеток анализировали при помощи проточного цитометра BD FACSCalibur (BD Biosciences) через 48 ч, 1-, 2-, 4- и 6- недель после трансдукции. Эксперименты осуществляли в двух повторениях. Для экспериментов по изучению экспрессии трансгенов, фибробласты в количестве 2×104 высевали на 24-луночный планшеты с покровным стеклом. Через 24 часа после высевания клетки трансдуцировали AAV2/5-CAG-CHM вектором в дозе 100000 вг в течение 48 ч. Параллельно, планшеты без покровных стекол трансдуцировали AAV2/5-CHM-EGFP вектором в эквивалентной MOI для последующей проточной цитометрии. Для решающих экспериментов, ПЭС, полученные из ИПСК, высевали на 24-луночные планшеты, а для слияния монослоя было установлено количество клеток, составлявшее 1,2×106 клеток на лунку. Клетки трансдуцировали с MOI 1000000 и осуществляли анализ пренилирования через 4 нед после трансдукции. Эксперименты проводили трижды.
Субретинальная инъекция
8-недельных мышей мужского пола линии C57BL/6J (Harlan France SARL, Франция) вводили в наркоз при помощи кетамина в дозе 70 мг/кг и ксилазина в дозе 28 мг/кг, зрачки расширяли каплей 0,5% тропикамида (Mydriaticum, Франция) в каждый глаз. Роговицу покрывали каплей препарата Lacryvisc (Alcon, Франция) и покровным стеклом. Под хирургическим микроскопом сначала рассекали роговично-склеральное соединение. Затем осуществляли субретинальные инъекции при помощи 5 мкл шприца Hamilton и косой иглы 34 калибра. В каждый глаз вводили по 2 мкл PBS или по 2 мкл 4.68×109 вг AAV2/5CAG-CHM вектора, либо AAV2/5-CAG-EGFP вектора. Регулярно проводили осмотр глазного дна (на 2, 4, 6 и 8 недели после инъекции). В каждую временную точку мышей вводили в наркоз, расширяли зрачок, а фотографии глазного дна получали при помощи специального микроскопа для получения изображений сетчатки Micron III (Phoenix Research Laboratories, США). Перед эвтаназией животным проводили электроретинографию, как описано ранее (Chekroud et al, 2011). Статистические сравнения осуществляли при помощи дисперсионного анализа Kruskall Wallis ANOVA, а апостериорные сравнения проводили при помощи сравнений Siegel-Castellan 2x2 (Siegel & Castellan, 1988).
Анализ трансгенной экспрессии
Мышей умерщвляли через 2 недели после инъекции, глазные яблоки энакулировали, удаляли передние сегменты. Для вестерн-блоттинга нейроретинальную ткань иссекали и помещали в лизирующий буфер (50 мМ Tris рН 6.8, 10% глицерол и 2% SDS), соответственно. Затем при помощи пинцета в лизирующий буфер соскабливали ПЭС и хороидею и объединяли с нейроретинальной тканью. Процент (7.5%) от общего белка в образце переносили и подвергали гибридизации с анти-REPl или анти-EGFP сывороткой кролика в разведении 1/2000 (Invitrogen), как описано выше. Для количественного ПЦР анализа, нейроретинальную ткань и образцы ПЭС/хороидеи быстро замораживали до выделения РНК и синтеза кДНК. Количественную ПЦР осуществляли при помощи генноспецифичных праймеров, нормализованных по экспрессии L27.
Гистологический анализ
Для изучения экспрессии EGFP, глазные яблоки энуклеировали и фиксировали в 3,7% формальдегиде в течение 6 ч при 4°С, инкубировали последовательно в ваннах с 10%, 20%, 30% и 40% сахарозой, после чего заливали в ОСТ матрицу и изготовляли срезы толщиной 14 мкм (Réseau d'Histologie Expérimentale de Montpellier (RHEM)). Для изучения гистологии, глазные яблоки энуклеировали и фиксировали в 3,7% формальдегиде в течение 24 ч при 4°С, дегидратировали в нескольких ваннах с этанолом, заливали в парафин и изготавливали срезы толщиной 4 мкм (RHEM). Для подсчета фоторецепторов, срезы окрашивали гематоксилином и эозином. Микроскопические изображения получали при помощи прибора Slide Scanner (Hamamatsu Photonics K.K., Япония; Montpellier RIO Imaging platform). Как минимум в четырех сагиттальных срезах сетчатки проводили подсчет (место инъекции маскировали), определяли среднее число ядер фоторецепторных клеток.
Результаты
Характеризация мутации, имевшейся у пациента
Характеризация геномной ДНК фибробластов пациента с СНМ1 выявила дупликацию 7 пары оснований (TAGTTCT) (SEQ ID NO: 3) в последовательности 7-го интрона, расположенной на 40 п. о вверх по рамке считывания от начала экзона 8. Между дуплицированной последовательностью была выявлена 4 п.о. вставка (GATT) (SEQ ID NO: 4). После этой первой дупликационной последовательности следовала вторая дупликация 15 п.о. в последовательности 8 экзона (GTCATGCATTCAATT) (SEQ ID NO: 5), расположенная на 68 п.о. от начала. Последовательность ДНК 97 п.о., расположенная между двумя дупликациями, включающая конец 7-го экзона и начало 8 экзона, была делетирована. Потеря акцепторного сайта сплайсинга 7-го интрона и последующая деления 8 экзона приводят к прогнозируемому сдвигу рамки считывания на 314 аминокислотной позиции и преждевременному стоп кодону в позиции 332 (REP1 дикого типа - это 653 а/к), что приводит к усечению второго домена ингибитора диссоциации ГДФ REP1. Вестерн-блоттинг с антителом к N-концевому эпитопу, присутствующему как в REP1 дикого типа, так и в усеченном REP1 (73.49 кД), а также в REP2 (74.08 кД), выявил две полоски для контрольных клеток и одну полоску для СНМ клеток (соответствует REP2), что свидетельствует о нестабильности усеченного бежа. Вестерн блоттинг со вторым REP1-специфичным антителом не выявил белка в СНМ1 клетках, в отличие от контрольных клеток.
Таким образом, мутация СНМ1, которая имеется у пациента, приводила к подавлению продукции REP1 белка. Кроме того, специальные тесты для определения изменений на уровне ДНК, РНК и белков, позволят установить наличие данной мутации в клетках любого типа последующих генераций.
Создание и проверка достоверности специфичных ИПСК пациента
Авторы использовали доксициклин-индуцибельные векторы, несущие коктейль факторов транскрипции Yamanaka (c-MYC, KLF4, OCT4, SOX2) для перепрограммирования СНМ1 фибробластов. Экспрессию каждого трансгена подтверждали при помощи количественной ПЦР через 24 часа после индукции доксициклином. Через неделю после индукции доксициклином фибробласты начали менять свою морфологию с формированием частично перепрограммированных колоний (пре-ИПСК колонии), которые в течение времени то появлялись, то исчезали. В противоположность этому, через 5 недель после индукции доксициклина, было определено наличие морфологически характерных колоний, которые выжили после механической пересевания в ES среду без доксициклина. ПЦР амплификация СНМ1 ДНК ИПСК показала, что оригинальная делеция СНМ присутствовала и приводила к полной делеции 8 экзона из мРНК, что подтверждалось различиями в 266 п.о. между фрагментами кДНК дикого типа и РНК СНМ1 РНК ИПСК. Кроме того, СНМ1 ИПСК не имели каких-либо больших хромосомных аномалий, которые могли произойти во время перепрограммирования, что было подтверждено кариотипическим анализом.
Плюрипотентность СНМ1 ИПСК была подтверждена при помощи различных методик и с использованием клона М4С7 дикого типа (Ramirez et al, 2013) в качестве позитивного контроля. Во-первых, измерение уровня мРНК, а также кПЦР продемонстрировали сайленсинг экзогенных c-MYC, KLF4, ОСТ4 и SOX2, а также активацию экспрессии эндогенных ОСТ4, SOX2, LIN28 и NANOG в СНМ1 ИПСК. Во-вторых, окрашивание на щелочную фосфатазу было положительным, а иммунофлуоресценция (ИФ) подтвердила экспрессию NANOG и выявила экспрессию SSEA3. Наконец, СНМ1 ИПСК индуцировали образование тератом при подкожном введении иммуно-дефицитным мышам, а экспрессия маркеров трех зародышевых линий подтверждалась гистологическим анализом: присутствовали эктодерма, мезодерма и эндодерма.
В заключение, авторам изобретения удалось создать подлинные ИПСК пациента с СНМ мутацией.
Создание и проверка достоверности специфичных ПЭС пациента
Авторы использовали протокол спонтанной дифференцировки для получения клеток пигментного эпителия сетчатки (ПЭС) из ИПСК дикого типа М4С7 и СНМ1 ИПСК. Приблизительно через 30 дней после культивирования ИПСК до образования монослоя и удаления bFGF из среды, на планшетах появились пигментированные очаги. Очаги механически пересевали, и после слияния они образовывали слой полигональных пигментных клеток, имеющих характеристики ПЭС. Клетки пересевали на полупрозрачные пористые фильтры для последующего разделения и гистологического анализа. Исследование полутонких срезов подтвердило наличие регулярного монослоя. При помощи трансмиссионной электронной микроскопии было установлено, что монослой представлял собой поляризованный эпителий с микроворсинками на апикальной стороне, ядром на базальной, меланосомами в цитозоле и десмосомами, свидетельствующими о наличии плотных межклеточных соединений. Эпителий секретировал базальную мембрану, определяемую между ПЭС клетками и покрытием из матригеля. ПЦР в реальном времени подтвердила, что эпителий, полученный из ИПСК, экспрессировал классические гены, участвующие в зрительном цикле (такие, как RLBP1, RPE65, LRAT, RDH5), развитии сетчатки (РАХ6), фагоцитозе (MERTK), пигментации (TYR), транспорте ионов (BEST1), и клеточной адгезии (ZO-1). Кроме того, ИФ исследования показали, что MERTK локализовался в апикальных микроворсинках (Фиг. 4F), CRALBP и RPE65 в цитоплазме, a ZO-1 в апикальных соединениях, то есть в соответствии с их функциями. Кроме того, наличие десмосом согласовалось с позитивным ZO-1-мечением. В дополнение к указанной классической ПЭС морфологии, две in vivo функции эпителия также сохранялись и в ПЭС, полученном из ИПСК. Во-первых, в течение времени, на планшетах появились наполненные жидкостью купола. Они, по всей видимости, образовывались в результате апикально-базального транспорта жидкости, отделяя ПЭС от планшета. Во-вторых, ПЭС обладали способностью к фагоцитозу флуоресцирующих микросфер (FluoSpheres), которые можно обнаружить при помощи эпифлуоресцентной микроскопии. FACS-анализ показал, что количество поглощенных сфер увеличивалось в течение времени. Наконец, оригинальная мутация СНМ присутствовала на уровне ДНК и РНК, a REP1 отсутствовал в СНМ1 ПЭС.
Все полученные результаты подтверждают, что эпителий, полученный из ИПСК дикого типа и из СНМ1 ИПСК представлял собой истинный и функционирующий пигментный эпителий сетчатки.
Определение биохимического дефекта
Для того, чтобы определить, насколько ПЭС, полученные из ИПСК с СНМ1 мутацией, приводят к тем же биохимическим последствиям, которые наблюдаются у пациента, авторы изобретения провели два различных исследования для определения статуса пренилирования внутриклеточных Rabs, что отражает активность REP1. Для начала авторы исследовали размер непренилированного пула Rab в клетках при помощи анализа пренилирования in vitro. С этой целью к лизату клеток дикого типа и СНМ1 клеток добавляли рекомбинантный RGGT, REP1 и биотинилированный донор пренильных групп. Таким образом, если непренилированный пул Rab был доступен для пренилирования, интегрированный биотин можно определить при помощи вестерн-блоттинга с использованием HRP-конъюгированного стрептавидина. Обнаруженные связи, соответствующие биотинилированным Rabs, нормализовывали по бета-актиновому контролю, а пренилированный пул Rab, определяемый в СНМ1 ПЭС, принимали за 100% для проведения относительных сравнений. В среднем, приблизительно 4-х кратное снижение уровней биотинилированных Rab белков определялось в ПЭС дикого типа, что согласовывалось с тем фактом, что в присутствии REP1 и REP2, большая часть Rabs находится в пренилированном состоянии и связаны с мембраной. Затем авторы специально изучали внутриклеточное распределение Rab27A, Rab белка, который активно экспрессируется в сетчатке (Seabra et al, 1995). При помощи дифференциального центрифугирования разделяли цитозольную и мембранную фракции лизатов клеток дикого типа и СНМ1 клеток и анализировали соответствующее содержание Rab27A при помощи вестерн-блоттинга с соответствующим антителом. Как и для анализа пренилирования, количество Rab27A в каждой фракции нормализовывали по контрольному бета-актину. Затем общее количество (цитозольного + мембранного) Rab27A в каждом клеточном лизате принималось за 100%, а количество в каждой конкретной фракции выражали как процент от общего содержания Rab27A. В клетках дикого типа количество цитозольного Rab27A в среднем было приблизительно в 4,7 раз ниже, чем количество мембранного белка. В противоположность этому, в ПЭС с СНМ1 мутацией, количество цитозольного Rab27A в среднем приблизительно в два раза превышало количество белка в клетках дикого типа, но было приблизительно в 1,8 раз ниже, чем количество мембранной фракции белка.
Таким образом, СНМ1 ПЭС клетки имитировали биохимические нарушения, наблюдаемые у СНМ пациентов, то есть отсутствие пренилирования Rab белков в результате отсутствия REP1.
Трансдукция ПЭС
Для того чтобы определить, возможно ли осуществить трансдукцию ПЭС, полученных из ИПСК, при помощи AAV векторов и установить наиболее эффективный серотип, авторы изобретения тестировали панель векторов, экспрессирующих EGFP под контролем CMV промотора: AAV2/2, -2/4, -2/5, -2/8 и -2/9. Во-первых, все серотипы обладали способностью к трансдукции ПЭС, полученных из ИПСК, что было подтверждено экспрессией EGFP, а эффективность трансдукции зависела от дозы. Во-вторых, при эквивалентном количестве вирусных геномов, эффективность каждого серотипа составляла 2/5>2/2>2/4>2/8/>2/9 (Фиг. 1а). Причем в среднем, экспрессия при использовании вектора AAV2/5 была в 1,5 раза выше, чем при использовании вектора AAV2/2 (1.45±0.26, n=5), при этом она была приблизительно в 6 раз выше, чем экспрессия для обоих векторов AAV2/8 и 2/9.
Чтобы объяснить дозозависимый эффект указанных четырех серотипов, авторы увеличили количество вирусных геномов на одну клетку до 100000. Несмотря на то, что эффективность трансдукции AAV2/5 увеличивалась с 55 до 80%, что оценивалось по количеству EGFP-позитивных клеток, эффективность трансдукции AAV2/2 и AAV2/8 или 2/9 оставалась приблизительно в 1,5 и 6 раз ниже, соответственно (Фиг. 1b). Кроме того, авторы использовали наиболее эффективный серотип (AAV2/5) для сравнения эффективности двух разных промоторов: CMV промотора и CAG промотора (промотор бета-актина цыплят с CMV энхансером). В среднем, CAG обеспечивал увеличение уровня экспрессии в два раза, по сравнению с CMV (2.04±0.21, n=5; Фиг. 1а). В третьих, исследование в динамике позволило предположить, что экспрессия достигала пика через 4 недели после трансдукции (Фиг. 1 с). Наконец, было показано, что генотип ПЭС, полученных из ИПСК (то есть клетки дикого типа vs СНМ) никак не влиял на эффективность трансдукции (Фиг. 1d).
При обобщении полученных результатов можно сделать вывод о том, что AAV2/5 векторы являются наиболее эффективными для трансдукции ПЭС клеток человека, полученных из ИПСК, чем векторы на основе других серотипов, в частности, AAV2/2 и AAV2/8.
AAV2/5-CAG-CHM-направленная REP1 экспрессия
Таким образом, авторы создали AAV2/5 вектор, экспрессирующий СНМ, под контролем промотора С AG. ИФ анализ СНМ1 фибробластов, трансдуцированных AAV2/5-CAG-CHM, подтвердил, что кодируемый REP1 экспрессировался и был корректно расположен главным образом в везикулах цитоплазмы, что подтверждалось специальным окрашиванием (Фиг. 2а-с). Вестерн-блоттинг трансдуцированных фибробластов (Фиг. 2d) с последующим полуколичественным определением экспрессии REP1, нормализованной по уровням бета-актина, показал, что экспрессия REP1 была эквивалентна приблизительно 17% уровня экспрессии клетками дикого типа. Параллельно, а также в соответствии с данными вестерна блотинга, авторы осуществляли трансдукцию фибробластов AAV2/5-CAG-EGFP и определяли 14% EGFP-позитивных клеток при помощи проточной цитометрии. Соответственно, исследование первичной трансдукции ПЭС AAV2/5-CAG-CHM вектором с последующим вестерн-блоттингом (Фиг. 2е) и полуколичественным анализом, показало, что экспрессия REP1 в 40% EGFP-позитивных клетках (определено при помощи проточной цитометрии AAV2/5-CAG-EGFP-трансдуцированных ПЭС клеток) была эквивалентна 53% экспрессии в клетках дикого типа,
При обобщении полученных результатов можно сделать вывод о том, что экспрессия REP1 в СНМ1 клетках, трансдуцированных AAV2/5-CAG-CHM вектором, была, по крайней мере, эквивалента экспрессии в клетках дикого типа.
Трансфер гена СНМ
Затем СНМ1 ПЭС трансдуцировали AAV2/5-CAG-CHM вектором и, основываясь на результатах предьщущих наблюдений в динамике, активность REP1 анализировали через 4 недели после трансдукции. Результаты показательного эксперимента представлены на Фиг. 3а. Как описано ранее, как и в экспериментах по изучению пренилирования, определяемый пул биотинилированных Rabs принимали за 100%. После трансдукции СНМ1 ПЭС AAV2/5-CAG-CHM вектором, наблюдалось снижение количества биотинилированных Rab белков в 4,5 раза, что соответствовало уровням в ПЭС клетках дикого типа (Фиг. 3с). Аналогично, анализ внутриклеточного распределения Rab27A после трансдукции AAV2/5-CAG СНМ вектором (Фиг. 3b) показал, что цитозольная фракция Rab27A уменьшалась в 2,4 раза, а мембранно-связанная фракция увеличивалась в 1,3 раза, по сравнению с нетрансдуцированными ПЭС, что соответствовало уровням в клетках ПЭС дикого типа (Фиг. 3d). Кроме того, трансдукция СНМ1 ПЭС контрольным AAV2/5-CAG-EGFP вектором существенным образом не изменяла пропорции Rab27A в каждой фракции.
В заключение, авторы провели решающий эксперимент, доказавший, что ААУ2/5-опосредуемый трансфер СНМ гена приводит к восстановлению клеточного фенотипа ПЭС у пациентов с мутацией СНМ.
Трансфер генов in vivo
Для того, чтобы дополнить результаты исследований in vitro, авторы вводили в глаза мышей PBS, AAV2/5-CAG-EGFP или AAV2/5-CAG-CHM векторы и исследовали экспрессию. Уже на 3 день после инъекции, экспрессия EGFP была едва заметна в области дна у мышей, которым вводили AAV-CAG-EGFP. Количественная ПЦР экстрактов сетчатки через 2 недели после инъекции показала наличие специфической экспрессии человеческого СНМ в экстрактах сетчатки у мышей, которым вводили AAV2/5CAG-CHM вектор, и экспрессии EGFP в тканях глаза мышей, которым вводили CAV2/5-CAG-EGFP (Фиг. 4а). Вестерн-блоттинг в тот же период времени подтвердил наличие специфической экспрессии на белковом уровне (Фиг. 4b). Авторы проследили эволюцию экспрессии EGFP при помощи фундоскопии через 1 неделю, 2 неделю (Фиг. 4с) и 1 месяц после инъекции и наблюдали распространенную трансдукцию, которая казалась стабильной. Флуоресцентная микроскопия подтвердила трансдукцию большей половины сетчатки вплоть до места выхода зрительного нерва, а экспрессия EGFP наблюдалась как в ПЭС, так и в фоторецепторных клетках (Фиг. 4d).
В заключение, AAV2/5-опосредованный трансфер гена in vivo в сетчатку мышей приводит к экспрессии гена как клетками ПЭС, так и фоторецепторами.
Обсуждение
Стволовые клетки привели к революции в культивировании клеток человека, поскольку они представляют собой бессмертную линию плюрипотентных клеток, которые теоретически могут превращаться в любой тип клеток в организме (Yu & Thomson, 2008). В частности, индуцируемые плюрипотентные стволовые клетки (ИПСК) представляют собой исключительный потенциал, поскольку могут быть получены из соматических клеток взрослого человека (Takahashi et al, 2007; Yu et al, 2007), что позволяет обойти этические органичения, связанные с использованием эмбриональных стволовых клеток (ЭСК) человека. Кроме того, поскольку стволовые клетки теоретически могут дифференцироваться в клетки любого типа, это открывает доступ к первичным клеточным линиям, которые невозможно выделить при помощи стандартных методик (Grimm, 2004).
Кроме того, если исходный материал получают от пациента с определенным генетическим заболеванием, желаемый тип получаемых клеток будет представлять собой специфическую клеточную модель заболевания (Park et al, 2008).
Авторы изобретения использовали ИПСК технологию для получения пигментного эпителия сетчатки, несущего ген специфической болезни и представляющего собой модель, позволяющую экспериментально доказать подход в лечении при помощи генной терапии. Это первый пример такой стратегии. В целом, клеточные модели на основе ИПСК, используются для получения углубленных представлений о патофизиологии заболевания (Singh et al, 2013), для изучения эффективности фармакологической терапии (Egawa et al, 2012), или для получения клеточных предшественников в расчете на трансплантацию клеток (Tucker et al, 2011). Авторы изобретения в своих экспериментах показали дополнительный потенциал клеточных моделей на основе ИПСК и возможность их применения для оценки эффективности стратегии генной терапии в клетках-мишенях, на которые будет направлено соответствующее лечение.
AAV векторы в настоящее время являются общепризнанным и эффективным средством для генной терапии заболеваний сетчатки. Среди идентифицированных серотипов AAV, все серотипы, а именно AAV2/2, -2/4, -2/5, -2/8 и -2/9, как было показано, обладают способностью трансдуцировать клетки сетчатки различных типов с различной эффективностью в зависимости от биологического вида реципиента (Vandenberghe & Auricchio, 2012). Все пять указанных серотипов трансдуцировали ПЭС, при этом все, за исключением AAV2/4, обладали способностью к трансдукции фоторецепторных клеток (Weber et al, 2003). Кроме того, при изучении трансдукции фоторецепторов, было показано на моделях глаз мышей и свиней, что AAV2/5, -2/8 и -2/9 серотипы обладают большей эффективностью, чем серотип AAV2/2 (Allocca et al, 2007; Mussolino et al, 2011). К настоящему времени только два серотипа, AAV2/2 (Bainbridge et al, 2008; Hauswirth et al, 2008; Maguire et al, 2008) и -2/4 (данные не опубликованы), были изучены на человеке, а накапливающиеся данные по изучению токсикологии свидетельствуют, что указанные векторы являются абсолютно безопасными для глаз человека, однако, наиболее эффективные типы векторов еще необходимо установить.
Авторы исследовали эффективность трансдукции упомянутых выше серотипов AAV векторов на ПЭС, полученных из ИПСК человека. Полученные данные совпадают с данными литературы, AAV2/5 приводит к двухкратному увеличению уровня экспрессии при использовании того же промотора, по сравнению с AAV2/2. Однако авторы показали, что AAV2/8 серотип обладал неожиданно меньшей эффективностью, чем AAV2/2. Изначально было сделано предположение о том, что это было обусловлено тем, что первая партия используемых AAV2/8 векторов была получена при помощи другой платформы для получения векторов. Тогда авторы получили вторую партию векторов при помощи платформы, которая использовалась изначально для получения других серотипов, однако результаты оказались идентичными. Более того, авторы изучили дозозависимый эффект, но AAV2/5 серотип вновь продемонстрировал меньшую эффективность, чем серотип AAV2/8 в ПЭС клетках человека. Кроме того, результаты была аналогичными и для серотипа AAV2/9. Возможно, указанные различия обусловлены разницей поверхностных клеточных рецепторов, поскольку AAV2/5 связывается с альфа-2-3 N-связанными сиаловыми кислотами, a AAV2/2, 2/8 и 2/9 не используют данный рецептор (Agbandje-McKenna & Kleinschmidt, 2011). Как было показано, ПЭС клетки человека, полученные из ИПСК, имеют классические характеристики функциональных ПЭС клеток in vivo, поэтому превосходство AAV2/5 серотипа над серотипами AAV2/8 и AAV2/9 в любых дозах, наблюдаемое in vitro, будет очевидно и in vivo. Таким образом, вероятно что в клетках ПЭС человека, небольшие дозы AAV2/5 вирусного вектора будут обеспечивать лучшую трансдукцию, чем другие серотипы, что имеет большое значение с точки зрения безопасности.
Авторы показали, что трансдукция ПЭС при помощи AAV2/5 вектора является дозозависимой, поэтому использование промотора CAG, вместо промотора CMV, позволяет дополнительно увеличить эффективность трансдукции. Авторам удалось достичь трансдукции с эффективностью до 85%, что было неожиданным, принимая во внимание известные сложности, возникающие при использовании AAV векторов для трансдукции in vitro. Трансдукция, вероятно, усиливалась благодаря способности ПЭС к фагоцитозу, что является одним из основных свойств этих клеток в глазу человека (Sparrow et al, 2010). In vivo, фоторецепторные клетки постоянно обновляют диски в своих внутренних сегментах и "сбрасывают" свои старые сегменты в сторону ПЭС ежедневно. ПЭС отвечает за фагоцитоз отработанных дисков, которые при накоплении будут оказывать токсическое действие. Следовательно, способность к фагоцитозу ПЭС клеток, полученных из ИПСК, позволяет смоделировать ситуацию, с которой сталкивается AAV вектор при введении в субретинальное пространство и дополнительно подчеркивает исключительный потенциал данной модели. In vivo, фоторецепторы ежедневно обновляют диски в своих внутренних сегментах на апикальной стороне и отравляют отработанные диски к базальным сегментам. ПЭС отвечает за фагоцитоз отработанных дисков, которые при накоплении будут оказывать токсическое действие. Это свойство также позволяет объяснить высокую эффективность трансдукции ПЭС AAV векторами по сравнению с фоторецепторными клетками у всех биологических видов (Vandenberghe et al, 2011). Наконец, при достижении монослоя ПЭС в культуре, деление клеток прекращается, что делает возможным продолжение экспрессии трансгена в течение длительного периода времени, поскольку не происходит потери AAV вектора со временем.
Для того чтобы определить, возможно ли использовать клеточную модель ПЭС человека для изучения эффективности переноса генов при помощи AAV2/5 вектора, авторы получили ПЭС клетки на базе ИПСК для пациента с хороидеремией. Хороидеремия - это дистрофия сетчатки, при которой деградация ПЭС, по всей видимости, играет ключевую роль в патофизиологии. (Krock et al, 2007; Tolmachova et al, 2010). Кроме того, данная болезнь является прекрасной мишенью для изучения ИПСК-подхода, поскольку не существует специфической модели животных, которая была бы информативной для генных исследований (Tolmachova et al, 2013; Tolmachova et al, 2012). Авторы показали, что полученные специфические для хороидеремии ПЭС клетки экспрессируют характерные белки, являются функциональным и мимикрирует биохимический дефект, наблюдаемый у пациентов: отсутствие кодируемого белка, REP1, приводит к нарушению пренилирования Rab белков, в особенности, Rab27A, и в свою очередь, к уменьшению количества мембранносвязанных Rabs и увеличению цитозольного пула указанных белков. Это позволяет количественно оценить восстановление функции. При помощи двух независимых исследований, авторы показали, что перенос гена СНМ позволяет уменьшить цитозольный пул Rabs белков в целом, и Rab27A, в частности. Таким образом, удалось доказательно подтвердить концепцию о том, что трансфер гена СНМ при помощи AAV2/5 вектора в клетки ПЭС человека может восстанавливать нормальный клеточный фенотип.
Работа, описанная выше, демонстрирует возможность использования специфической для определенного заболевания человека клеточной модели в исследованиях по доказательству эффективности концепции при отсутствии подходящей модели животных. Это также подтверждает тот факт, что носитель сам по себе (пусть даже и другой его серотип) уже прошел клинические испытания на сетчатке как органе-мишени, таким образом, исследование in vitro, главным образом, было направлено на оценку функциональности трансгена. Если область AAV-опосредованной генной терапии сетчатки будет дальше прогрессивно развиваться, тогда аналогичная стратегия может применяться при различных дистрофиях сетчатки, при которых поражается ПЭС, что ускорит переход к клиническому применению данного подхода.
Предложенный авторами изобретения подход, позволяющий доказать эффективность соответствующей клеточной модели человека для конкретного заболевания сетчатки, является первым примером такого рода и привел к революции в "доклиническом" мышлении. Также уже были опубликованы две другие статьи, подтверждающие сложность применения традиционных мышиных моделей для осуществления исследований по восстановлению клеточного фенотипа при хороидеремии; а также касающиеся проведения исследований по доказательству эффективности подходов к лечению на специфических клеточных моделях (фибробласты СНМ и ИПСК, Tolmachova et al, 2013; Vasireddy et al, 2013).
Таким образом, авторы вышли на следующий этап и предложили доказательство эффективности концепции по трансдукции ПЭС клеток, основного типа клеток, который поражается при дистрофиях сетчатки, и при этом смогли избежать экстраполяции на другие типы клеток, не участвующие в патогенезе заболевания. Кроме того, в указанных выше документах оценивалась эффективность ААУ2/2-опосредованного переноса СНМ гена, что, как было показано авторами изобретения, является менее эффективным, чем AAV2/5-опосредованный перенос генов, для ПЭС человека.
В заключение необходимо отметить, что полученные данные впервые демонстрируют, что AAV2/5 вектор, который использовался для переноса СНМ гена под контролем CAG промотора, является наилучшим вектором для генной терапии ПЭС сетчатки у пациентов с хороидеремией, по сравнению с векторами AAV2/2, AAV2/4, AAV2/8 и AAV2/9.
Ссылки.
Agbandje-McKenna М, Kleinschmidt J (2011) AAV capsid structure and cell interactions. Methods Mol Biol 807: 47-92
Allocca M, Mussolino C, Garcia-Hoyos M, Sanges D, Iodice C, Petrillo M, Vandenberghe LH, Wilson JM, Marigo V, Surace EM, Auricchio A (2007) Novel adeno-associated virus serotypes efficiently transduce murine photoreceptors. J Virol 81: 11372-11380
Bainbridge JW, Smith AJ, Barker SS, Robbie S, Henderson R, Balaggan K, Viswanathan A, Holder GE, Stockman A, Tyler N, Petersen- Jones S, Bhattacharya SS, Thrasher AJ, Fitzke FW, Carter BJ, Rubin GS, Moore AT, Ali RR (2008) Effect of gene therapy on visual function in Leber's congenital amaurosis. N EnglJ Med 358: 2231-2239
Bennett J, Ashtari M, Wellman J, Marshall KA, Cyckowski LL, Chung DC, McCague S, Pierce EA, Chen Y, Bennicelli JL, Zhu X, Ying GS, Sun J, Wright JF, Auricchio A, Simonelli F, Shindler KS, Mingozzi F, High KA, Maguire AM (2012) AAV2 gene therapy readministration in three adults with congenital blindness. Science translational medicine 4: 120
Berger W, Kloeckener-Gruissem B, Neidhardt J (2010) The molecular basis of human retinal and vitreoretinal diseases. Prog Retin Eye Res 29: 335-375
Bocquet B, Lacroux A, Surget MO, Baudoin C, Marquette V, Manes G, Hebrard M, Senechal A, Delettre C, Roux AF, Claustres M, Dhaenens CM, Rozet JM, Perrault I, Bonnefont JP, Kaplan J, Dollfus H, Amati-Bonneau P, Bonneau D, Reynier P, Audo I, Zeitz C, Sahel JA, Paquis-Flucklinger V, Calvas P, Arveiler B, Kohl S, Wissinger B, Blanchet C, Meunier I, Hamel CP (2013) Relative frequencies of inherited retinal dystrophies and optic neuropathies in Southern France: assessment of 21 - year data management. Ophthalmic epidemiology 20: 13-25
Chekroud K, Arndt C, Basset D, Hamel CP, Brabet P, Pequignot MO (2011) Simple and efficient: validation of a cotton wick electrode for animal electroretinography. Ophthalmic research 45: 174-179
Colella P, Cotugno G, Auricchio A (2009) Ocular gene therapy: current progress and future prospects. Trends Mol Med 15: 23-31
Egawa N, Kitaoka S, Tsukita K, Naitoh M, Takahashi K, Yamamoto T, Adachi F, Kondo T, Okita K, Asaka I, Aoi T, Watanabe A, Yamada Y, Morizane A, Takahashi J, Ayaki T, Ito H, Yoshikawa K, Yamawaki S, Suzuki S, Watanabe D, Hioki H, Kaneko T, Makioka K, Okamoto K, Takuma H, Tamaoka A, Hasegawa K, Nonaka T, Hasegawa M, Kawata A, Yoshida M, Nakahata T, Takahashi R, Marchetto MC, Gage FH, Yamanaka S, Inoue H (2012) Drug screening for ALS using patient-specific induced pluripotent stem cells. Science trans lational medicine 4: 145 Grimm S (2004) The art and design of genetic screens: mammalian culture cells. Nat Rev Genet 5: 179-189
Hauswirth WW, Aleman TS, Kaushal S, Cideciyan AV, Schwartz SB, Wang L, Conlon TJ, Boye SL, Flotte TR, Byrne В J, Jacobson SG (2008) Treatment of leber congenital amaurosis due to RPE65 mutations by ocular subretinal injection of adeno-associated virus gene vector: short-term results of a phase I trial. Hum Gene Ther 19: 979-990
Jacobson SG, Cideciyan AV, Ratnakaram R, Heon E, Schwartz SB, Roman AJ, Peden MC, Aleman TS, Boye SL, Sumaroka A, Conlon TJ, Calcedo R, Pang JJ, Erger KE, Olivares MB, Mullins CL, Swider M, Kaushal S, Feuer WJ, Iannaccone A, Fishman GA, Stone EM, Byrne В J, Hauswirth WW (2012) Gene therapy for leber congenital amaurosis caused by RPE65 mutations: safety and efficacy in 15 children and adults followed up to 3 years. Arch Ophthalmol 130: 9-24
Krock BL, Bilotta J, Perkins BD (2007) Noncell-autonomous photoreceptor degeneration in a zebrafish model of choroideremia. Proc Natl Acad Sci U S A 104: 4600-4605
Liao JL, Yu J, Huang K, Hu J, Diemer T, Ma Z, Dvash T, Yang XJ, Travis GH, Williams DS, Bok D, Fan G (2010) Molecular signature of primary retinal pigment epithelium and stem-cell-derived RPE cells. Human molecular genetics 19: 4229-4238
Maguire AM, High KA, Auricchio A, Wright JF, Pierce EA, Testa F, Mingozzi F, Bennicelli JL, Ying GS, Rossi S, Fulton A, Marshall KA, Banfi S, Chung DC, Morgan JI, Hauck B, Zelenaia O, Zhu X, Raffini L, Coppieters F, De Baere E, Shindler KS, Volpe NJ, Surace EM, Acerra C, Lyubarsky A, Redmond TM, Stone E, Sun J, McDonnell JW, Leroy BP, Simonelli F, Bennett J (2009) Age-dependent effects of RPE65 gene therapy for Leber's congenital amaurosis: a phase 1 dose-escalation trial. Lancet 374: 1597-1605
Maguire AM, Simonelli F, Pierce EA, Pugh EN, Jr., Mingozzi F, Bennicelli J, Banfi S, Marshall KA, Testa F, Surace EM, Rossi S, Lyubarsky A, Arruda VR, Konkle B, Stone E, Sun J, Jacobs J, Dell'Osso L, Hertle R, Ma JX, Redmond TM, Zhu X, Hauck B, Zelenaia O, Shindler KS, Maguire MG, Wright JF, Volpe NJ, McDonnell JW, Auricchio A, High KA, Bennett J (2008) Safety and efficacy of gene transfer for Leber's congenital amaurosis. N Engl J Med 358: 2240-2248
Marlhens F, Bareil C, Griffoin J-M, Zrenner E, Amalric P, Eliaou C, Liu S-Y, Harris E, Redmond TM, Arnaurd B, Claustres M, Hamel CP (1997) Mutations in RPE65 cause Leber's congenital amaurosis. Nat Genet 17: 139-141
Mussolino C, della Corte M, Rossi S, Viola F, Di Vicino U, Marrocco E, Neglia S, Doria M, Testa F, Giovannoni R, Crasta M, Giunti M, Villani E, Lavitrano M, Bacci ML, Ratiglia R, Simonelli F, Auricchio A, Surace EM (2011) AAV-mediated photoreceptor transduction of the pig cone-enriched retina. Gene Ther 18: 637-645
Nguyen UTT, Wu Y, Goodall A, Alexandrov К (2010) Analysis of Protein Prenylation In Vitro and In vivo Using Functionalized Phosphoisoprenoids. Current Protocols in Protein Science 62: 14.13.11-14.13.15
Park IH, Zhao R, West JA, Yabuuchi A, Huo H, Ince ТА, Lerou PH, Lensch MW, Daley GQ (2008) Reprogramming of human somatic cells to pluripotency with defined factors. Nature 451: 141-146
Ramirez JM, Bai Q, Pequignot M, Becker F, Kassambara A, Bouin A, Kalatzis V, Dijon-Grinand M, De Vos J (2013) Side scatter intensity is highly heterogeneous in undifferentiated pluripotent stem cells and predicts clonogenic self-renewal. Stem Cells Dev22: 1851-1860
Seabra MC, Brown MS, Slaughter CA, Sudhof TC, Goldstein JL (1992) Purification of component A of Rab geranylgeranyl transferase: possible identity with the choroideremia gene product. Cell 70: 1049- 1057
Seabra MC, Ho YK, Anant JS (1995) Deficient geranylgeranylation of Ram/Rab27 in choroideremia. J Biol Chem 270: 24420-24427
Siegel S, Castellan NJ (1988) Non parametric statistics for the behavioral sciences, New York: McGraw-Hill.
Singh R, Shen W, Kuai D, Martin JM, Guo X, Smith MA, Perez ET, Phillips MJ, Simonett JM, Wallace KA, Verhoeven AD, Capowski EE, Zhang X, Yin Y, Halbach PJ, Fishman GA, Wright LS, Pattnaik BR, Gamm DM (2013) iPS cell modeling of Best disease: insights into the pathophysiology of an inherited macular degeneration. Hum Mol Genet 22: 593-607
Sparrow JR, Hicks D, Hamel CP (2010) The retinal pigment epithelium in health and disease. Curr Mol Med 10: 802-823
Takahashi K, Tanabe K, Ohnuki M, Narita M, Ichisaka T, Tomoda K, Yamanaka S (2007) Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell 131:861-872
Tolmachova T, Tolmachov OE, Barnard AR, de Silva SR, Lipinski DM, Walker NJ, Maclaren RE, Seabra MC (2013) Functional expression of Rab escort protein 1 following AAV2-mediated gene delivery in the retina of choroideremia mice and human cells ex vivo. J MolMed (Berl) 91: 825-837
Tolmachova T, Tolmachov OE, Wavre-Shapton ST, Tracey-White D, Futter CE, Seabra MC (2012) CHM/REP1 cDNA delivery by lentiviral vectors provides functional expression of the transgene in the retinal pigment epithelium of choroideremia mice. J Gene Med 14: 158-168
Tolmachova T, Wavre-Shapton ST, Barnard AR, MacLaren RE, Futter CE, Seabra MC (2010) Retinal pigment epithelium defects accelerate photoreceptor degeneration in cell type-specific knockout mouse models of choroideremia. Invest Ophthalmol Vis Sci 51: 4913-4920
Tucker BA, Park IH, Qi SD, Klassen HJ, Jiang C, Yao J, Redenti S, Daley GQ, Young MJ (2011) Transplantation of adult mouse iPS cell-derived photoreceptor precursors restores retinal structure and function in degenerative mice. PLoS One 6: 8992.
Vandenberghe LH, Auricchio A (2012) Novel adeno-associated viral vectors for retinal gene therapy. Gene Ther 19: 162-168
Vandenberghe LH, Bell P, Maguire AM, Cearley CN, Xiao R, Calcedo R, Wang L, Castle MJ, Maguire AC, Grant R, Wolfe JH, Wilson JM, Bennett J (2011) Dosage thresholds for AAV2 and AAV8 photoreceptor gene therapy in monkey. Science translational medicine 3: 88
Vasireddy V, Mills JA, Gaddameedi R, Basner-Tschakarjan E, Kohnke M, Black AD, Alexandrov K, Zhou S, Maguire AM, Chung DC, Mac H, Sullivan L, Gadue P, Bennicelli JL, French DL, Bennett J (2013) AAV-Mediated Gene Therapy for Choroideremia: Preclinical Studies in Personalized Models. PLoS One 8: e61396
Weber M, Rabinowitz J, Provost N, Conrath H, Folliot S, Briot D, Cherel Y, Chenuaud P, Samulski J, Moullier P, Rolling F (2003) Recombinant adeno-associated virus serotype 4 mediates unique and exclusive long-term transduction of retinal pigmented epithelium in rat, dog, and nonhuman primate after subretinal delivery. Mol Ther 7: 774-781 Wu YW, Alexandrov K, Brunsveld L (2007) Synthesis of a fluorescent analogue of geranylgeranyl pyrophosphate and its use in a high-throughput fluorometric assay for Rab geranylgeranyltransferase. Nature protocols 2: 2704-2711
Yu J, Thomson JA (2008) Pluripotent stem cell lines. Genes Dev 22: 1987-1997 Yu J, Vodyanik MA, Smuga-Otto K, Antosiewicz-Bourget J, Frane JL, Tian S, Nie J,
Jonsdottir GA, Ruotti V, Stewart R, Slukvin, II, Thomson JA (2007) Induced pluripotent stem cell lines derived from human somatic cells. Science 318: 1917-1920.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕННАЯ ТЕРАПИЯ ОФТАЛЬМОЛОГИЧЕСКИХ НАРУШЕНИЙ | 2016 |
|
RU2762747C2 |
| ВИРИОНЫ АДЕНОАССОЦИИРОВАННОГО ВИРУСА С ВАРИАНТНЫМ КАПСИДОМ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2017 |
|
RU2742724C1 |
| КОДОН-ОПТИМИЗИРОВАННЫЙ ФАКТОР КОМПЛЕМЕНТА I | 2019 |
|
RU2824048C2 |
| ВИРИОНЫ АДЕНОАССОЦИИРОВАННОГО ВИРУСА С ВАРИАНТНЫМ КАПСИДОМ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2012 |
|
RU2611202C2 |
| ФАКТОР КОМПЛЕМЕНТА I И КОФАКТОР ФАКТОРА КОМПЛЕМЕНТА I, КОДИРУЮЩИЕ ИХ ВЕКТОРЫ И ПРИМЕНЕНИЕ В ТЕРАПЕВТИЧЕСКИХ ЦЕЛЯХ | 2019 |
|
RU2809247C2 |
| АДЕНОАССОЦИИРОВАННЫЕ ВИРУСНЫЕ ВЕКТОРЫ ДЛЯ ЛЕЧЕНИЯ МИОЦИЛИНОВОЙ (MYOC) ГЛАУКОМЫ | 2015 |
|
RU2746991C2 |
| ГЕННОЕ РЕДАКТИРОВАНИЕ ГЛУБОКИХ ИНТРОННЫХ МУТАЦИЙ | 2016 |
|
RU2759335C2 |
| ВЕКТОРЫ AAV | 2018 |
|
RU2793112C2 |
| ЛЕЧЕНИЕ ПИГМЕНТНОГО РЕТИНИТА | 2016 |
|
RU2737049C2 |
| АДЕНОАССОЦИИРОВАННЫЕ ВИРУСНЫЕ ВЕКТОРЫ ДЛЯ ЛЕЧЕНИЯ МУКОПОЛИСАХАРИДОЗОВ ТИПА IV A | 2019 |
|
RU2794960C2 |












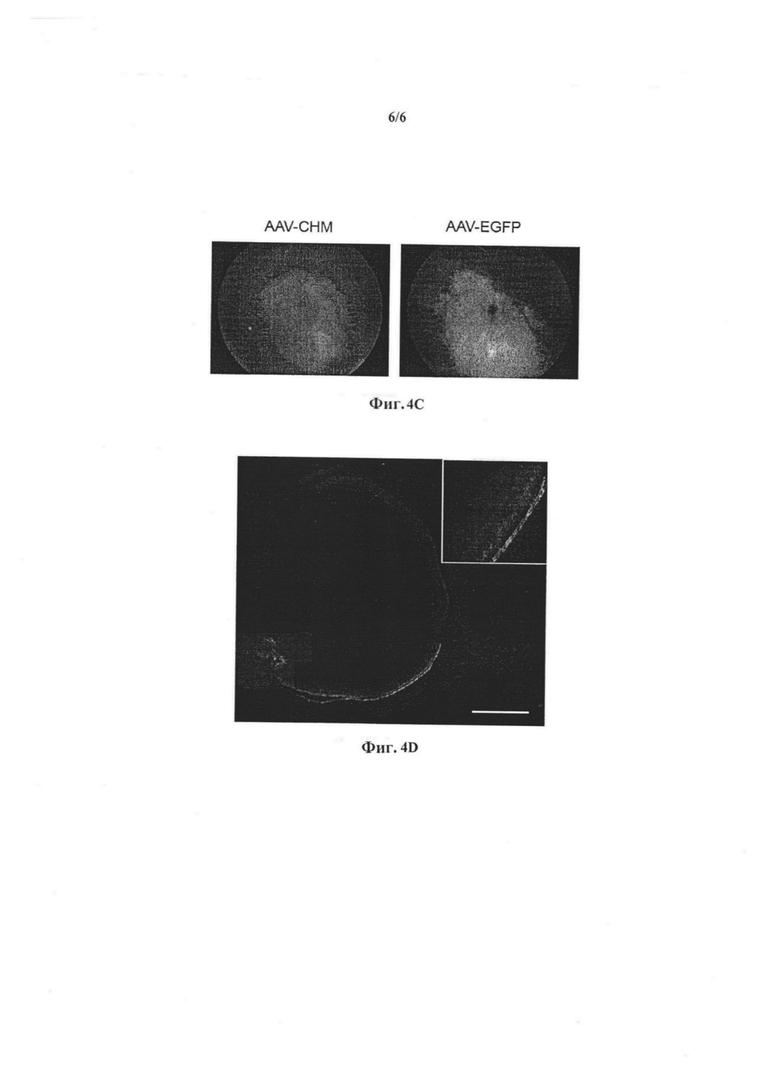
Изобретение относится к биотехнологии и медицине, в частности к способу селективной экспрессии целевого полинуклеотида в клетках пигментного эпителия сетчатки глаза человеческого субъекта, нуждающегося в этом, согласно которому вводят субъекту путем субретинальной инъекции rAAV2/5 вектор, содержащий полинуклеотид под контролем CAG промотора, посредством чего осуществляют трансдукцию клеток пигментного эпителия сетчатки. Изобретение позволяет улучшить зрение у пациентов с нарушениями. 2 н. и 11 з.п. ф-лы, 5 ил.
1. Способ селективной экспрессии целевого полинуклеотида в клетках пигментного эпителия сетчатки (RPE) глаза человеческого субъекта, нуждающегося в этом, отличающийся тем, что вводят субъекту путем субретинальной инъекции rAAV2/5 вектор, содержащий полинуклеотид под контролем CAG промотора, посредством чего осуществляют трансдукцию клеток пигментного эпителия сетчатки.
2. Способ по п. 1, при котором субъект (пациент) имеет болезнь или вероятность заболеть дистрофией сетчатки, поражающей клетки пигментного эпителия, выбранную из группы, включающей наследственные и ненаследственные дегенеративные заболевания сетчатки, дистрофии сетчатки, пигментный ретинит, макулярные дегенерации, врожденный амавроз Лебера (LCA), палочко-колбочковые дистрофии, неоваскулярные заболевания глаз, хориоидальные дегенерации, хориоидальный склероз, диабетические ретинопатии, пролиферативные витреоретинопатии, хороидеремия, глаукома и метаболические заболевания, такие, как Sly синдром (MPS VII - мукополисахаридоз VII типа) и гиратная атрофия, отслойку сетчатки или травму.
3. Способ по п. 1, при котором полинуклеотид используют для заместительной генотерапии и выбирают из группы, включающей RGR, RDH5, RPE65, RLBP1, MERTK, LRAT, REP1, RBP4, ELOVL4, EFEMPI, BEST1, TIMP3, AIPL1, и CRB1.
4. Способ по п. 3, при котором полинуклеотид кодирует RLBP1.
5. Способ по п. 3, при котором полинуклеотид кодирует REP1.
6. Способ по п. 1, при котором полинуклеотид кодирует нейротрофный фактор, предпочтительно выбираемый из группы, включающей bFGF, aFGF, BDNF, CNTF, IL-1beta, NT-3, IGF-II, GDNF, NGF и RdCVF.
7. Способ по п. 1, при котором полинуклеотид кодирует сайт-специфическую эндонуклеазу, обеспечивающую выключение функции гена и выбираемую из группы, включающей нуклеазу цинковых пальцев (ZFNs) и активатороподобные эффекторные нуклеазы транскрипции (TALENS).
8. Способ по п. 1, при котором полинуклеотид представлет собой интерферирующую РЫК (RNAi).
9. rAAV2/5 вектор, содержащий целевой полунуклеотид, для использования в качестве вектора экспрессии для лечения человека, имеющего болезнь или вероятность заболеть дистрофией сетчатки, поражающей клетки пигментного эпителия, при котором полинуклеотид используют для заместительной генотерапии и выбирают из группы, включающей RGR, RDH5, RPE65, RLBP1, MERTK, LRAT, REP1, RBP4, ELOVL4, EFEMPI, BEST1, TIMP3, AIPL1, и CRB1, предпочтительно, под контролем CAG промотора.
10. rAAV2/5 вектор по п. 9, где дистрофия сетчатки, поражающая клетки пигментного эпителия выбирается из группы, включающей наследственные и ненаследственные дегенеративные заболевания сетчатки, дистрофии сетчатки, пигментный ретинит, макулярные дегенерации, врожденный амавроз Лебера (LCA), палочко-колбочковые дистрофии, неоваскулярные заболевания глаз, хориоидальные дегенерации, хориоидальный склероз, диабетические ретинопатии, пролиферативные витреоретинопатии, хороидеремия, глаукома и метаболические заболевания, такие как Sly синдром (MPS VII - мукополисахаридоз VII типа) и гиратная атрофия, отслойку сетчатки или травму.
11. rAAV2/5 вектор по п. 9, где целевой полунуклеотид представляет собой:
- RGR, и субъект имеет болезнь или вероятность заболеть пигментным ретинитом;
- RDH5, и субъект имеет болезнь или вероятность заболеть белоточечным глазным дном;
- RPE65, и субъект имеет болезнь или вероятность врожденного амавроза Лебера;
- RLBP1, и субъект имеет болезнь или вероятность заболеть пигментным ретинитом;
- MERTK, и субъект имеет болезнь или вероятность заболеть пигментным ретинитом;
- LRAT, и субъект имеет болезнь или вероятность заболеть пигментным ретинитом;
REP1, и субъект имеет болезнь или вероятность заболеть хороидеремией;
- RBP4, и субъект имеет болезнь или вероятность заболеть дегенерацией клеток пигментного эпителия сетчатки;
- ELOVL4, и субъект имеет болезнь или вероятность заболеть макулярной дегенерацией;
- EFEMPI, и субъект имеет болезнь или вероятность заболеть макулярной дегенерацией болезнью Malattia Leventinese (сотовая дистрофия сетчатки);
- BEST1, и субъект имеет болезнь или вероятность заболеть болезнью Беста;
- TIMP3, и субъект имеет болезнь или вероятность заболеть дистрофией глазного дна Сорсби;
- AIPL1, и субъект имеет болезнь или вероятность врожденного амавроза Лебера;
и CRB1, и субъект имеет болезнь или вероятность заболеть пигментным ретинитом;
предпочтительно под контролем CAG промотора.
12. rAAV2/5 вектор по любому из пп. 9-11, который содержит полунуклеотид, кодирующий RLBP1, и дистрофия сетчатки представляет собой пигментный ретинит.
13. rAAV2/5 вектор по любому из пп. 9-11, который содержит полунуклеотид, кодирующий REP1, и дистрофия сетчатки представляет собой хороидеремию.
| LEBHERZ C | |||
| et al | |||
| Novel AAV serotypes for improved ocular gene transfer, J | |||
| Gene Med., 2008, v.10, is.4, p.375-382 | |||
| ALLOCCA M | |||
| et al | |||
| Serotype-dependent packaging of large genes in adeno-associated viral vectors results in effective gene delivery in mice, J | |||
| of Clin | |||
| Invest., 2008, v.118, p.1955-1964 | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| TOLMACHOVA T | |||
Авторы
Даты
2020-06-08—Публикация
2014-12-05—Подача