ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к антагонисту рецептора 4 простагландина E2 (EP4) для применения в лечении рака печени, ассоциированного с неалкогольным стеатогепатитом (NASH). Способ лечения NASH-ассоциированного рака печени включает введение любого из 4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]-бензойной кислоты (далее "Соединение A"), 4-((1S)-1-{[5-хлор-2-(4-фторфенокси)бензоил]амино}этил)бензойной кислоты (далее "Соединение B") или 3-[2-(4-{2-этил-4,6-диметил-1H-имидазо[4,5-с]пиридин-1-ил}фенил)этил]-1-[(4-метилбензол)сульфонил]мочевины (далее "Соединение C") или их фармацевтически приемлемой соли в качестве антагониста EP4 (далее "соединения по изобретению"), или фармацевтической композиции, содержащей соединения по изобретению, человеку или животному. Способ лечения включает введение соединений по изобретению отдельно или в комбинации с одним или несколькими другими активными агентами и/или видами терапии человеку или животному, имеющему NASH-ассоциированный рак печени. Способ лечения также включает терапию, которая регулирует специфические функции иммунных клеток и/или их распределения в опухолевой ткани NASH-ассоциированного рака печени с помощью антагонистов EP4, включающих в себя соединения по изобретению. Кроме того, настоящее изобретение относится к фармацевтической композиции или набору, содержащему соединения по изобретению или их фармацевтически приемлемые соли. В дальнейшем "соединения по изобретению" включают любое соединение из соединения A, соединения B и соединения C, каждое отдельно или в комбинации, или фармацевтически приемлемую соль любого из этих соединений.
УРОВЕНЬ ТЕХНИКИ
[0002] Неалкогольная жировая болезнь печени (NAFLD) является наиболее распространенной причиной хронического заболевания печени в Соединенных Штатах с предполагаемой распространенностью от 30 до 40% взрослого населения. Хотя только от 5 до 20% пациентов с NAFLD как правило считаются соответствующими гистопатологическим критериям для неалкогольного стеатогепатита (NASH), это все же приводит к общенациональной распространенности от 2 до 5% населения, у которых повышенный риск развития цирроза. Сам цирроз является достаточным фактором риска развития рака печени, включая гепатоцеллюлярную карциному (HCC). Ожирение также, по-видимому, вносит свой вклад в риск развития HCC с мета-анализом когортных исследований, показывающим 90% повышенный риск HCC у страдающих ожирением. Это может частично объяснить растущие темпы HCC в развитых странах и 80% увеличение годовой заболеваемости HCC в США за последние два десятилетия (НПЛ 1: Torres с соавт., Semin Liver Dis., 2012, 32 (1)): 30-38).
[0003] Еще более тревожным является тот факт, что HCC, как было показано, наблюдается у пациентов с нецирротическим NASH. В совокупности эти данные предоставляют убедительные доказательства того, что HCC может встречаться больше у пациентов с нецирротическим NASH, чем у пациентов с цирротическим NASH, хотя для получения показателей заболеваемости требуются более крупные проспективные исследования. Связь между NASH и раком печени была точно установлена. Большие тематические исследования продемонстрировали специфический фенотип более старых пациентов преимущественно мужского пола с сопутствующим метаболическим синдромом, который может развивать HCC не на фоне цирроза. Некоторые из предполагаемых сложных патофизиологических механизмов, которые приводят к этому, были описаны, но полное понимание взаимодействия и совпадения между NASH-стимуляцией и онкогенными процессами все еще находится в стадии разработки (НПЛ 1).
[0004] Основные причины гепатита и HCC можно разделить на следующие две категории: (1) инфицирование вирусами гепатита B (HBV) и C (HCV) и (2) метаболические причины, такие как потребление алкоголя и NAFLD. Как правило, гепатит, опосредованный хронической вирусной инфекцией, является наиболее распространенной причиной гепатита, за которой следуют алкогольные заболевания печени и NAFLD. Лекарственная терапия гепатита, опосредованного вирусными инфекциями, уже установлена, и обычно назначают противовирусную терапию с использованием интерферона альфа и нуклеотидных аналогов. С другой стороны, лекарственная терапия NAFLD, NASH и заболеваний, связанных с раком печени, не была установлена, поскольку сама болезнь была только недавно признана.
[0005] Ожирение стало всемирной проблемой со здоровьем и, как известно, увеличивает риск развития диабета, сердечно-сосудистых заболеваний и нескольких видов рака. Показано, что среди опухолей, ассоциированных с ожирением, рак печени имеет прочную связь с ожирением, основываясь на эпидемиологических исследованиях (НПЛ 2: Bhaskaran с соавт., Lancet, 2014, 384: 755-765; НПЛ 3: Calle и Kaaks, Nature Reviews Cancer, 2004, 4: 579-591; и НПЛ 4: Calle с соавт., New England J. Med., 2003, 348(17): 1625-1638). Наиболее распространенным фактором риска для HCC является длительная инфекция HBV или HCV (НПЛ 5: El-Serag, New England J. Med., 2011, 365: 1118-1127; и НПЛ 6: Marengo с соавт., Annual Review of Medicine, 2016, 67: 103-117). Тем не менее, недавно выяснилось, что ассоциированные с ожирением NAFLD и NASH являются факторами риска развития рака печени (НПЛ 6, НПЛ 7: Michelotti с соавт., Nat. Rev. Gastroenterol. Hepatol., 2013, 10: 656-665; и НПЛ 8: Streba с соавт., World J. Gastroenterology, 2015, 21(14): 4103-4110). В настоящее время нет доступных терапевтических средств для NAFLD, NASH и NASH-ассоциированного рака печени. Поэтому существует острая необходимость в развитии терапевтического лечения NASH-ассоциированного рака печени.
[0006] Простагландины являются медиаторами боли, лихорадки и других симптомов, связанных с воспалением. Простагландин E2 (PGE2) является основным эйкозаноидом, экспрессируемым в условиях воспаления. PGE2 также вовлечен в различные физиологические и/или патологические состояния, такие как гипералгезия, маточное сокращение, пищеварительная перистальтика, пробуждение, подавление секреции желудочного сока, кровяное давление, функция тромбоцитов, метаболизм костной ткани, ангиогенез и рост раковых клеток, инвазия и метастазирование, или т.п. В непатентных ссылках раскрыты характер простаноидных рецепторов, связь с терапией и наиболее широко используемые селективные агонисты и антагонисты (см., например, НПЛ 9: Konya с соавт., Pharmacology & Therapeutics, 2013, 138: 485-502; и НПЛ 10: Yokoyama с соавт., Pharmacol. Rev., 2013, 65: 1010-1052).
[0007] Сообщается, что PGE2 высоко экспрессируется в раковых тканях различных типов рака, и также было показано, что PGE2 коррелирует с началом, ростом и развитием раковых и болезненных состояний пациентов. Общепризнано, что PGE2 имеет отношение к активации клеточной пролиферации и гибели клеток (апоптоз) и играет важную роль в процессах пролиферации раковых клеток, прогрессирования заболевания и метастазирования рака (см., например, НПЛ 9 и НПЛ 10).
[0008] Существует четыре подтипа рецептора PGE2, EP1, EP2, EP3 и EP4, которые обладают различными фармакологическими свойствами. Подтип рецептора EP4 относится к подсемейству рецептора, сопряженного с G-белком, известному как рецептор с семью трансмембранными доменами. Соответственно, EP4 играет значительную роль в биологических процессах путем стимулирования функций, опосредуемых сигналом цАМФ. С точки зрения фармакологических исследований было проведено несколько исследований соединений с активностью антагониста рецептора EP4 и известны селективные антагонисты рецептора EP4 (НПЛ 9).
[0009] Что касается роли рецептора EP4 при раке, несколько непатентных литературных источников (например, НПЛ 10 и НПЛ 11: Ma с соавт., Oncoimmunology, 2013, 2(1): e22647) и патентный литературный источник (ПТЛ 1: Патент США № 8,921,391 B2) демонстрируют ингибирование роста и/или метастазирования рака толстой кишки, молочной железы, желудка, легких, предстательной железы и других типов рака в животных моделях опухолей с использованием антагонистов рецептора EP4. Некоторые патентные литературные источники (например, ПТЛ 2: WO2015/179615 A1 и ПТЛ 3: US2015/0004175 A1) демонстрируют терапевтическую эффективность антагониста рецептора EP4 или ингибирование передачи сигнала EP4 в результате ингибирования роста опухоли. Кроме того, ингибирование сигнала EP4 в комбинации с другими противораковыми терапевтическими средствами или лучевой терапией демонстрируют дополнительные преимущества по сравнению с каждой монотерапией (см. ПТЛ 2).
[0010] Роль рецептора EP4 при раке печени недавно была опубликована в непатентных литературных источниках. Передача сигнала рецептора PGE2/EP4 через активацию PKA/CREB повышала экспрессию c-Myc и приводила к стимулированию клеточного роста в клетках HCC in vitro (НПЛ 12: Xia с соавт., Oncology Reports, 2014, 32: 1521-1530). PGE2 также способствовал индуцированному звездчатыми клетками печени накоплению супрессорных клеток миелоидного происхождения (MDSC) в экспериментах in vitro и in vivo, которые, как полагают, стимулировали рост рака печени (НПЛ 13: Xu с соавт., Oncotarget, 2016, 7(8): 8866-8878). В этом литературном источнике указано, что передача сигнала PGE2/EP4 может играть определенную роль в росте рака печени. Однако эти ссылки не демонстрируют подавления рака печени при ингибировании сигнала PGE2/EP4 у животных. Подавление только передачи сигнала PGE2/EP4 (или в комбинации с PD-1-антителом) восстанавливает функциональную активность CD8+ Т-клеток (CTL) (НПЛ 14: Chen с соавт., Nature Medicine, 2015, 21(4):327-334; и ПТЛ 3). Эти ссылки демонстрируют, что ингибирование сигнала EP4 опосредует активацию активности CTL хозяина, но нет прямых доказательств того, что ингибирование сигнала EP4 или антагонистическая активность EP4 имеет способность влияния на рост и/или метастазирование HCC.
[0011] Патент США № 8,921,391 B2 (ПТЛ 1) демонстрирует противоопухолевую эффективность соединения A, B и/или C при раке желудка, легких, предстательной железы и других типах рака в животных моделях опухолей. В этом патенте не предоставлены никакие экспериментальные примеры в отношении рака печени, и рак печени не встречается ни в каком из пунктов формулы изобретения. Кроме того, в этом патенте не раскрыто лечение рака печени, "ассоциированного с неалкогольным стеатогепатитом (NASH)", и не раскрыто никакой информации, относящейся к NASH или NAFLD.
[0012] В 2015 году было опубликовано существенное значение ингибирования сигнала PGE2/EP4 в терапии рака печени, особенно при хронических заболеваниях, связанных с вирусной инфекцией, таких как заболевания печени, опосредованные HBV и HCV. Ингибирование сигнала PGE2/EP4 вызывает значительную индукцию или активацию экспрессии PD-1 в вирус-специфических CD8+ Т-клетках (CTL) в животной модели (НПЛ 14). Увеличение экспрессии PD-1 на CTL в высокой степени указывает на подавление ключевой иммунологической функции, опосредованной Т-клетками, против вирусной инфекции. В случае хронически HBV- или HCV-инфицированного рака печени увеличение экспрессии PD-1 на CTL должно в свою очередь стимулировать экспрессию вируса, а также развитие и рост опухоли. Влияние увеличения экспрессии PD-1 на CTL при росте и развитии опухоли было ясно продемонстрировано поразительной эффективностью их ингибитора (например, анти-PD-1-антитела или ингибитора иммунных контрольных точек) в недавно проведенной клинической терапии рака. Соответственно, это исследование создало общую причину для озабоченности по поводу риска увеличения роста опухоли путем ингибирования сигнала PGE2/EP4 при лечении рака печени (НПЛ 14). Таким образом, ожидается, что ингибирование сигнала PGE2/EP4 активирует экспрессию PD-1, которая подавляет иммунологический ответ против вирусной инфекции, а затем способствует развитию вируса и развитию рака печени.
[0013] Принимая во внимание эту негативную причину для озабоченности по поводу ингибирования сигнала EP4 при терапии рака печени, авторы настоящего изобретения неожиданно обнаружили значительные противоопухолевые эффекты и подавление экспрессии PD-1 на CD8+ Т-клетках (CTL) при NASH-ассоциированном раке печени. Это противоречит результатам экспрессии PD-1 в модели вирус-ассоциированного рака печени для антагониста EP4 в монотерапии и в комбинации с другим лекарственным препаратом на животной модели. NASH-ассоциированный рак печени имеет причины, отличные от рака печени, ассоциированного с вирусной инфекцией. На сегодняшний день нет доказательств для поддержки механизма EP4, включая антагонистическую активность EP4, в терапии для лечения NASH-ассоциированного рака печени. Более того, в данной области техники не было обнаружено никаких доказательств, касающихся эффективности комбинированной терапии рецептора EP4 с любыми другими видами терапии в лечении NASH-ассоциированного рака печени. Соответственно, применение антагониста EP4 в отношении NASH-ассоциированного рака печени является неожиданным в данной области техники.
Список цитирования
[Патентная литература]
[0014] {ПТЛ 1} Патент США № 8,921,391 B2
{ПТЛ 2} WO 2015/179615
{ПТЛ 3} US 2015/0004175 A1
[Непатентная литература]
[0015] {НПЛ 1} Torres с соавт., Semin Liver Dis., 2012, 32(1): 30-38
{НПЛ 2} Bhaskaran с соавт., Lancet, 2014, 384: 755-765
{НПЛ 3} Calle и Kaaks, Nature Reviews Cancer, 2004, 4: 579-591
{НПЛ 4} Calle с соавт., New England J. Med., 2003, 348(17): 1625-1638
{НПЛ 5} El-Serag, New England J. Med., 2011, 365: 1118-1127
{НПЛ 6} Marengo с соавт., Annual Review of Medicine, 2016, 67:103-117
{НПЛ 7} Michelotti с соавт., Nat. Rev. Gastroenterol. Hepatol., 2013, 10: 656-665
{НПЛ 8} Streba с соавт., World J. Gastroenterology, 2015, 21(14): 4103-4110
{НПЛ 9} Konya с соавт., Pharmacology & Therapeutics, 2013, 138: 485-502
{НПЛ 10} Yokoyama с соавт., Pharmacol. Rev., 2013, 65: 1010-1052
{НПЛ 11} Ma с соавт., Oncoimmunology, 2013, 2(1): e22647
{НПЛ 12} Xia с соавт., Oncology Reports, 2014, 32:1521-1530
{НПЛ 13} Xu с соавт., Oncotarget, 2016, 7(8): 8866-8878
{НПЛ 14} Chen с соавт., Nature Medicine, 2015, 21(4): 327-334
{НПЛ 15} Ohtani с соавт., Cancer Research, 2014, 74: 1885-1889
{НПЛ 16} Fuertes с соавт., J. Exp. Med., 2011, 208: 2005-2016
{НПЛ 17} Salmon с соавт., Immunity, 2016, 44: 924-938
{НПЛ 18} Zelenay с соавт., Cell, 2015, 162: 1257-1270
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Техническая задача
[0016] Как обсуждалось выше, ожирение стало всемирной проблемой со здоровьем и, как известно, увеличивает риск возникновения нескольких видов рака. Ассоциированный с ожирением рак печени имеет казуальные факторы риска, которые отличаются от факторов HCC, опосредованной длительной инфекцией HBV или HCV. Было показано, что рак печени имеет прочную связь с ожирением, основываясь на эпидемиологических исследованиях. Кроме того, недавно выяснилось, что ассоциированные с ожирением NAFLD и NASH являются факторами риска развития рака печени. В результате срочно необходимы точные молекулярные механизмы, опосредующие развитие ассоциированного с ожирением и/или NASH рака печени, а также терапевтические средства для этих заболеваний. Ожидается, что лечение хронического HBV- и HCV-инфицированного рака печени с помощью ингибирования сигнала PGE2/EP4 приведет к увеличению выявления рака печени путем увеличения экспрессии PD-1 на CTL. В результате существовала причина для озабоченности по поводу лечения рака печени, не только хронически инфицированного вирусом рака печени, но и ассоциированного с алкоголем, NAFLD и NASH рака печени с помощью ингибирования сигнала EP4.
Решение задачи
[0017] Цель настоящего изобретения состоит в том, чтобы предоставить способ лечения NASH-ассоциированного рака печени с использованием антагониста рецептора EP4 либо отдельно, либо в комбинации с имеющимися терапевтическими средствами. Для достижения этой цели авторы настоящего изобретения обнаружили, что каждое из следующих трех соединений и их фармацевтически приемлемые соли резко снижают рост и развитие индуцированного ожирением NASH-ассоциированного рака печени в валидированной мышиной модели:
4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]-бензойная кислота (соединение A),
4-((1S)-1-{[5-хлор-2-(4-фторфенокси)бензоил]амино}этил)бензойная кислота (соединение B) и
3-[2-(4-{2-этил-4,6-диметил-1H-имидазо[4,5-c]пиридин-1-ил}фенил)этил]-1-[(4-метилбензол)сульфонил]мочевина (соединение C).
[0018] Соответственно, настоящее изобретение основано на обнаружении того, что соединения по изобретению обладают EP4-селективной антагонистической активностью и ингибировали рост и развитие индуцированного ожирением NASH-ассоциированного рака печени в мышиной модели. Это первое открытие в мире, что антагонист EP4 обладает терапевтической эффективностью против индуцированного ожирением NASH-ассоциированного рака печени. Кроме того, изобретатели обнаружили, что лечение NASH-ассоциированного рака печени с помощью антагониста EP4 в комбинации с PD-1-антителом демонстрирует синергический эффект более высокой эффективности по сравнению с лечением монотерапией каждым лекарственным препаратом.
[0019] В частности, настоящее изобретение выглядит следующим образом:
[1] Способ лечения NASH-ассоциированного рака печени, который включает введение фармацевтически эффективного количества антагониста EP4 человеку или животному, нуждающемуся в этом.
[0020] [2] Способ по [1], дополнительно включающий введение фармацевтически эффективного количества антагониста EP4 в комбинации со вторым активным агентом, противоопухолевой терапией или и тем, и другим.
[0021] [3] Способ по [2], в котором второй активный агент представляет собой ингибитор иммунных контрольных точек или ингибитор PD-1.
[0022] [4] Способ по любому из [1]-[3], в котором антагонист EP4 представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из:
4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]бензойной кислоты (соединение А),
4-((1S)-1-{[5-хлор-2-(4-фторфенокси)бензоил]амино}этил)бензойной кислоты (соединение B) и
3-[2-(4-{2-этил-4,6-диметил-1H-имидазо[4,5-c]пиридин-1-ил}фенил)этил]-1-[(4-метилбензол)сульфонил]мочевины (соединение С),
или их фармацевтически приемлемой соли.
[0023] [5] Способ терапии, который выбирают из одного или нескольких из группы, состоящей из:
увеличения количества ДК, ДК CD103+, которые могут активировать противоопухолевую иммунную функцию у человека или у животного, нуждающегося в этом,
уменьшения количества клеток Foxp3+ Tрег, которые подавляют иммунную функцию против опухолей у человека или у животного, нуждающегося в этом,
увеличения количественного отношения CD8+/Tрег у человека или у животного, нуждающегося в этом,
увеличения количества активированных CD8+ Т-клеток (клеток CD69+) у человека или у животного, нуждающегося в этом, и
уменьшения экспрессии PD-1 в CD8+ Т-клетках у человека или у животного, нуждающегося в этом, и
где способ включает введение фармацевтически эффективного количества антагониста EP4 для лечения NASH-ассоциированного рака печени человеку или животному, нуждающемуся в этом.
[0024] [6] Способ по [5], дополнительно включающий введение фармацевтически эффективного количества антагониста EP4 в комбинации со вторым активным агентом, противоопухолевой терапией или и тем, и другим.
[0025] [7] Способ по [5] или [6], в котором второй активный агент представляет собой ингибитор иммунных контрольных точек или ингибитор PD-1.
[0026] [8] Способ по любому из [5]-[7], в котором антагонист EP4 представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из:
4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]бензойной кислоты (соединение А),
4-((1S)-1-{[5-хлор-2-(4-фторфенокси)бензоил]амино}этил)бензойной кислоты (соединение B) и
3-[2-(4-{2-этил-4,6-диметил-1H-имидазо[4,5-c]пиридин-1-ил}фенил)этил]-1-[(4-метилбензол)сульфонил]мочевины (соединение С),
или их фармацевтически приемлемой соли.
[0027] [9] Фармацевтическая композиция для лечения NASH-ассоциированного рака печени, которая содержит антагонист EP4 и фармацевтически приемлемую добавку, разбавитель или носитель.
[0028] [10] Фармацевтическая композиция по [9], дополнительно содержащая второй активный агент и/или противоопухолевые антибиотики.
[0029] [11] Фармацевтическая композиция по [9] или [10], в которой антагонист EP4 представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из:
4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]бензойной кислоты (соединение А),
4-((1S)-1-{[5-хлор-2-(4-фторфенокси)бензоил]амино}этил)бензойной кислоты (соединение B) и
3-[2-(4-{2-этил-4,6-диметил-1H-имидазо[4,5-c]пиридин-1-ил}фенил)этил]-1-[(4-метилбензол)сульфонил]мочевины (соединение С),
или их фармацевтически приемлемой соли.
[0030] [12] Применение антагониста EP4 или его фармацевтически приемлемой соли для лечения NASH-ассоциированного рака печени человека или животного.
[0031] [13] Применение по [12], где антагонист EP4 применяют в комбинации со вторым активным агентом, противоопухолевой терапией или и тем, и другим.
[0032] [14] Применение по [12] или [13], где антагонист EP4 представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из:
4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]бензойной кислоты (соединение А),
4-((1S)-1-{[5-хлор-2-(4-фторфенокси)бензоил]амино}этил)бензойной кислоты (соединение B) и
3-[2-(4-{2-этил-4,6-диметил-1H-имидазо[4,5-c]пиридин-1-ил}фенил)этил]-1-[(4-метилбензол)сульфонил]мочевины (соединение С),
или их фармацевтически приемлемой соли.
[0033] [15] Применение антагониста EP4 или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения NASH-ассоциированного рака печени человека или животного.
[0034] [16] Применение по [15], где антагонист EP4 применяют в комбинации со вторым активным агентом, противоопухолевой терапией или и тем, и другим.
[0035] [17] Применение по [15] или [16], где антагонист EP4 представляет собой по меньшей мере одно соединение, выбранное из группы, состоящей из:
4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]бензойной кислоты (соединение А),
4-((1S)-1-{[5-хлор-2-(4-фторфенокси)бензоил]амино}этил)бензойной кислоты (соединение B) и
3-[2-(4-{2-этил-4,6-диметил-1H-имидазо[4,5-c]пиридин-1-ил}фенил)этил]-1-[(4-метилбензол)сульфонил]мочевины (соединение С),
или их фармацевтически приемлемой соли.
Полезные эффекты изобретения
[0036] Следовательно, соединения по изобретению полезны для пациентов, которым требуется лечение NASH-ассоциированного рака печени.
Краткое описание чертежей
[0037] Антагонист EP4 соединение A ингибирует развитие опухоли печени в модели индуцированного ожирением NASH-ассоциированного рака печени мыши (НПЛ 15: Ohtani с соавт., Cancer Research, 2014, 74:1885-1889).
[0038] Фигура 1
На фиг.1 показана временная шкала мышиной модели, подготовленная посредством обработки с помощью 7,12-диметилбенз(a)антрацена ("DMBA") и посредством кормления рационом с высоким содержанием жиров (HFD). Соединение А вводили мышам каждый день с 19-недельного возраста до 30-недельного возраста, а затем подвергали эвтаназии ("Эвт").
[0039] Фигура 2
Фиг.2 представляет собой макроскопические фотографии печени, отделенной от мышей, обработанных носителем (левая сторона), и мышей, обработанных соединением A (правая сторона). В этой мышиной модели экспрессия EP4, но не других рецепторов PGE2, была значительно повышена в опухолевых тканях. Соединением A или носителем (n=5, каждым) обрабатывали мышей каждый день с 19-недельного возраста до 30-недельного возраста. Стрелки указывают на гепатоцеллюлярные карциномы (HCC).
[0040] Фигура 3
На фиг.3 показаны средние количества опухолей печени и относительное распределение по размерам (отнесенные к категориям >6мм, 2-6 мм и≤2 мм). "НЗ" означает незначительный. Обработка соединением A значительно ингибировала количество опухолей в печени по сравнению с мышами, обработанными носителем. Опухолевая колония размером более 6 мм полностью исчезла после обработки соединением A.
[0041] Фигура 4
На фиг.4 изображен средний вес тела обработанной носителем группы и группы, обработанной соединением A, в возрасте 30 недель. Данные представлены как средние±SD. Ежедневная обработка соединением A не влияла на вес тела мышей. Таким образом, соединение А продемонстрировало значительное ингибирование развития рака печени без потери веса у мышей.
[0042] Фигура 5
На фиг.5А показан проточный цитометрический анализ иммунных клеток среди мышей, обработанных носителем, или мышей, обработанных соединением A. Проценты общего количества клеток CD11chi MHC класса II (MHC II)hi, CD11b+ CD11chi MHC IIhi или CD103+ CD11chi MHC IIhi анализировали с помощью проточной цитометрии. Данные представлены как средние±SEM.
На фиг.5В показаны точечные графики экспрессии CD11b и CD103 в клеточных компартментах CD11chi MHC класса IIhi печени от мышей, обработанных носителем (левая сторона), и мышей, обработанных соединением A (правая сторона). Числа на графиках указывают процентное содержание клеток в указанных "воротах".
Частоты дендритных клеток (ДК) CD11chi MHC класса IIhi и ДК CD11b+ не изменялись обработкой соединением A. Количество ДК CD103+, необходимых ДК для противораковых иммунных ответов, было увеличено в группе, обработанной соединением A.
[0043] Фигура 6
На фиг.6А показаны процентные содержания клеток CD3+ CD4+ Foxp3+, CD3+ CD4+ Foxp3-, CD3+ CD8+, проанализированные проточной цитометрией. Было рассчитано отношение CD8+ T-клеток к CD4+ Foxp3+ Tрег. Данные представлены как средние±SEM. НЗ=незначительный, *p < 0,05, **p < 0,01.
На фиг.6В показаны точечные графики экспрессии Foxp3 в CD4+ Т-клеточных компартментах печени от мышей, обработанных носителем (левая сторона), и мышей, обработанных соединением A (правая сторона). Числа на графиках указывают процентное содержание клеток в указанных "воротах".
Частота CD4+ Foxp3+ регуляторных Т-клеток (Tрег), но не CD4+ Foxp3- T-клеток, значительно снижалась при лечении соединением A. Кроме того, отношение CD8+ T-клеток к Tрег было увеличено у мышей, обработанных соединением A, хотя частота CD8+ T-клеток не изменялась.
[0044] Фигура 7
На фиг.7А процентные содержания клеток CD69+ CD8+ анализировали с помощью проточной цитометрии (*p <0,05, **p <0,01).
На фиг.7В показаны гистограммы экспрессии CD69 на CD8+ Т-клетках печени от мышей, обработанных носителем (левая сторона), и мышей, обработанных соединением A (правая сторона). Числа на гистограммах указывают процентное содержание клеток CD69+.
Количество CD8+ Т-клеток, экспрессирующих активационный маркер CD69, было значительно увеличено в печени от мышей, обработанных соединением A. Этот результат указывает, что лечение соединением A активирует функции CD8+ Т-клеток в опухолевой ткани.
[0045] Фигура 8
На фиг.8А процентные содержания клеток PD-1+ CD8+ анализировали с помощью проточной цитометрии (*p <0,05, **p <0,01).
На фиг.8В показаны гистограммы экспрессии PD-1 на CD8+ Т-клетках печени от мышей, обработанных носителей (левая сторона), и мышей, обработанных соединением A (правая сторона). Числа на гистограммах указывают процентное содержание клеток PD-1+.
Введение соединения А значительно уменьшало количество CD8+ Т-клеток, экспрессирующих запрограммированную гибель клеток-1 (PD-1), ключевого ингибирующего рецептора на Т-клетках в микроокружении опухоли.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0046] Соединения по изобретению, которые полезны для лечения NASH-ассоциированного рака печени представляют собой:
4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]бензойную кислоту (соединение А),
4-((1S)-1-{[5-хлор-2-(4-фторфенокси)бензоил]амино}этил)бензойную кислоту (соединение B) и
3-[2-(4-{2-этил-4,6-диметил-1H-имидазо[4,5-c]пиридин-1-ил}фенил)этил]-1-[(4-метилбензол)сульфонил]мочевину (соединение С),
или их фармацевтически приемлемую соль.
Соединения по изобретению также включают сольваты, комплексы, полиморфы, пролекарства, изомеры и их изотопно-меченые соединения.
[0047] Соединения по изобретению раскрыты в WO 2005/021508.
[0048] Фармацевтически приемлемые соли включают их соли присоединения кислоты и основные соли. Подходящие соли присоединения кислоты образуются из кислот, которые образуют нетоксичные соли. Примеры включают ацетатные, аспартатные, бензоатные, безилатные, бикарбонатные/карбонатные, бисульфатные/сульфатные, боратные, камсилатные, цитратные, эдизилатные, эзилатные, формиатные, фумаратные, глюцептатные, глюконатные, глюкуронатные, гексафторфосфатные, гибензатные, гидрохлоридные/хлоридные, гидробромидные/бромидные, гидроиодидные/иодидные, изетионатные, лактатные, малатные, малеатные, малонатные, мезилатные, метилсульфатные, нафтилатные, 2-напсилатные, никотинатные, нитратные, оротатные, оксалатные, пальмитатные, памоатные, фосфатные/гидрофосфатные/дигидрофосфатные, сахаратные, стеаратные, сукцинатные, тартратные, тозилатные и трифторацетатные соли.
[0049] Подходящие основные соли образуются из оснований, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка.
[0050] Для обзора подходящих солей см. справочник "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" от Stahl и Wermuth (Wiley-VCH, Weinheim, Германия, 2002).
[0051] Фармацевтически приемлемую соль соединений по изобретению можно легко получить путем смешивания растворов соединения по настоящему изобретению и желаемой кислоты или основания, если это необходимо. Соль может осаждаться из раствора и собираться посредством фильтрования или может быть извлечена путем выпаривания растворителя. Степень ионизации в соли может варьироваться от полностью ионизованной до почти неионизованной.
[0052] Соединения по изобретению могут существовать как в несольватированных, так и в сольватированных формах. Термин "сольват" используется в настоящем документе для описания молекулярного комплекса, содержащего соединение по изобретению, и одну или несколько молекул фармацевтически приемлемого растворителя, например, этанола.
[0053] В объем настоящего изобретения входят комплексы, такие как клатраты, комплексы включения лекарственное средство-хозяин, в которых, в отличие от вышеупомянутых сольватов, лекарственное средство и хозяин присутствуют в стехиометрических или нестехиометрических количествах. Также включены комплексы соединений, содержащие два или более органических и/или неорганических компонентов, которые могут находиться в стехиометрических или нестехиометрических количествах. Полученные в результате комплексы могут быть ионизированы, частично ионизированы или неионизированы. Для обзора таких комплексов см. J. Pharm. Sci., 64(8):1269-1288 от Haleblian (Август 1975).
[0054] В дальнейшем все ссылки на соединения по изобретению включают ссылки на их соли, сольваты и комплексы и на сольваты и комплексы их солей.
[0055] Соединения по изобретению включают соединения по изобретению, как определено выше в настоящем документе, полиморфы, пролекарства и их изомеры (включая оптические, геометрические и таутомерные изомеры), как указано ниже в настоящем документе, и изотопно-меченые соединения по изобретению.
[0056] Как указано выше, изобретение включает все полиморфы соединений по изобретению, как определено в настоящем документе.
[0057] Также в объем изобретения входят так называемые "пролекарства" соединений по изобретению. Таким образом, некоторые производные соединений по изобретению, которые могут иметь небольшую фармакологическую активность или совсем не иметь фармакологическую активность, при введении в организм или применении к организму могут быть превращены в соединения, имеющие формулу любого из соединений по изобретению, имеющих желаемую активность, например, путем гидролитического расщепления. Такие производные называются "пролекарствами". Дополнительную информацию о применении пролекарств можно найти в ʺPro-drugs as Novel Delivery Systemsʺ, Vol. 14, ACS Symposium Series (T. Higuchi и W. Stella) и ʺBioreversible Carriers in Drug Designʺ, Pergamon Press, 1987 (под ред. E. B. Roche, Американская фармацевтическая ассоциация).
[0058] Пролекарства в соответствии с изобретением могут быть получены, например, путем замены соответствующих функциональных групп, присутствующих в соединениях по изобретению, определенными группами, известными специалистам в данной области, такими как "профрагменты", как описано, например, в ʺDesign of Prodrugsʺ от H Bundgaard (Elsevier, 1985).
[0059] Некоторые примеры пролекарств в соответствии с изобретением включают:
(i) где соединение по изобретению содержит функциональную группу карбоновой кислоты (-COOH), ее сложный эфир, например, замещение водорода (C1-C8)алкилом;
(ii) где соединение по изобретению содержит спиртовую функциональную группу (-OH), ее эфир, например, замещение водорода (C1-C6)алканоилоксиметилом; и
(iii) где соединение по изобретению содержит первичную или вторичную аминофункциональную группу (-NH2 или -NHR, где R не представляет собой H), ее амид, например, замещение одного или обоих атомов водорода (C1-C10)алканоилом.
[0060] Дополнительные примеры групп заместителей, отличных от вышеприведенных примеров, известны специалистам в данной области и могут быть найдены в вышеупомянутых ссылках, но не ограничиваются ими.
[0061] Наконец, соединения по изобретению сами по себе могут действовать как пролекарства других соединений по изобретению.
[0062] Соединения по изобретению, содержащие один или несколько асимметричных атомов углерода, могут существовать в виде двух или более стереоизомеров. Если соединение по изобретению содержит алкенильную или алкениленовую группу, возможны геометрические цис/транс (или Z/E) изомеры. Если соединение содержит, например, кето- или оксимную группу или ароматический остаток, может иметь место таутомерная изомерия ("таутомерия"). Из этого следует, что одно соединение может проявлять более одного типа изомерии.
[0063] В объем настоящего изобретения включены все стереоизомеры, геометрические изомеры и таутомерные формы соединений по изобретению, включая соединения, обладающие более чем двумя типами одинаковой изомерии, и смеси одного или нескольких из них. Также включены кислотные или основные соли, в которых противоион является оптически активным, например, D-лактат или L-лизин, или рацемическим, например, DL-тартрат или DL-аргинин.
[0064] Цис/транс-изомеры могут быть разделены обычными способами, хорошо известными специалистам в данной области техники, например, хроматографией и фракционной кристаллизацией.
[0065] Обычные способы получения/выделения индивидуальных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного) с использованием, например, хиральной жидкостной хроматографии высокого давления (ЖХВД).
[0066] Альтернативно, рацемат (или рацемический предшественник) может быть подвергнут взаимодействию с подходящим оптически активным соединением, например, спиртом, или, в случае, когда соединение по изобретению содержит кислотный или основный фрагмент, кислотой или основанием, такими как винная кислота или 1-фенилэтиламин. Полученная в результате диастереомерная смесь может быть разделена хроматографией и/или фракционной кристаллизацией, и один или оба диастереоизомера превращены в соответствующий чистый энантиомер(ы) с помощью средств, хорошо известных специалисту в данной области техники.
[0067] Хиральные соединения по изобретению (и их хиральные предшественники) могут быть получены в энантиомерно обогащенной форме с использованием хроматографии, обычно ВЭЖХ, на асимметричной смоле с подвижной фазой, состоящей из углеводорода, обычно гептана или гексана, содержащего от 0 до 50% (масс./масс.) изопропанола, обычно от 2 до 20% (масс./масс.), и от 0 до 5% (масс./масс.) алкиламина, обычно 0,1% (масс./масс.) диэтиламина. Концентрация элюата дает обогащенную смесь.
[0068] Стереоизомерные конгломераты могут быть разделены обычными методами, известными специалистам в данной области техники (см., например, Stereochemistry of Organic Compounds от E L Eliel (Wiley, New York, 1994)).
[0069] Изобретение включает все фармацевтически приемлемые изотопно-меченые соединения по изобретению, в которых один или несколько атомов замещены атомами, имеющими такое же атомное число, но атомную массу или массовое число, отличные от атомной массы или массового числа, обычно встречающихся в природе.
[0070] Примеры изотопов, подходящих для включения в соединения по изобретению, включают изотопы водорода, такие как 2H и 3H, углерода, такие как 11C, 13C и 14C, хлора, такие как 36Cl, фтора, такие как 18F, иода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фосфора, такие как 32P и серы, такие как 35S.
[0071] Некоторые изотопно-меченые соединения по изобретению, например, содержащие радиоактивный изотоп, полезны в связанных с терапией рака исследованиях распределения лекарственного препарата и/или субстрата в тканях, которые включают диагностику, облегчение симптомов, улучшение QOL и профилактику. Для этой цели особенно полезны радиоактивные изотопы трития, то есть 3H, и углерода-14, то есть 14С, с учетом их легкости включения и готовых средств обнаружения.
[0072] Замещение более тяжелыми изотопами, такими как дейтерий, то есть 2H, может давать определенные терапевтические преимущества, являющиеся результатом большей метаболической стабильности, например, увеличение периода полувыведения in vivo или снижение необходимой дозировки и, следовательно, может быть предпочтительным в некоторых случаях.
[0073] Замещение позитронно-активными изотопами, такими как 11C, 18F, 15O и 13N, может быть полезно в исследованиях с применением позитронно-эмиссионной топографии (PET) для изучения степени занятости рецептора субстратом.
[0074] Изотопно-меченые соединения по изобретению обычно могут быть получены обычными способами, известными специалистам в данной области техники, или способами, аналогичными тем, что описаны в прилагаемых примерах и получениях, с использованием соответствующих изотопно-меченых реагентов вместо ранее используемого немеченого реагента.
[0075] Фармацевтически приемлемые сольваты в соответствии с изобретением включают те, в которых растворитель кристаллизации может быть изотопно замещен, например, D2O, d6-ацетон, d6-ДМСО.
[0076] Соединения по изобретению, предназначенные для фармацевтического применения, могут быть введены в виде кристаллических или аморфных продуктов. Они могут быть получены, например, в виде твердой прессованной массы, порошков или пленок способами, такими как осаждение, кристаллизация, лиофилизация или распылительная сушка, или испарительная сушка. Для этой цели можно использовать микроволновую или радиочастотную сушку.
[0077] Каждое из соединений по изобретению (то есть соединение A, B или C) может быть введено отдельно либо в комбинации, либо в комбинации с одним или несколькими другими лекарственными средствами (или в виде любой их комбинации). Как правило, их вводят в виде состава в комбинации с одной или несколькими фармацевтически приемлемыми добавками. Термин "добавка" используется в настоящем документе для описания любого ингредиента, отличного от соединений по изобретению. Выбор добавки будет во многом зависеть от различных факторов, таких как, конкретный способ введения, влияние добавки на растворимость и стабильность и характер дозированной формы. Соединения по изобретению могут быть введены по отдельности или в комбинации с фармацевтически приемлемым носителем или разбавителем посредством любого из приведенных выше способов, указанных ранее, и такое введение может быть осуществлено в виде разовой или многократных доз. Более конкретно, соединения по изобретению могут быть введены в виде самых разных дозированных форм, то есть их можно объединять с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, пастилок для рассасывания, троше, леденцов, порошков, спреев кремов, бальзамов, суппозиториев, желе, гелей, паст, лосьонов, мазей, водных суспензий, растворов для инъекций, эликсиров, сиропов и тому подобного. Такие носители включают твердые разбавители или наполнители, стерильную водную среду и различные нетоксичные органические растворители и т.д. Кроме того, пероральные фармацевтические композиции могут быть подслащены и/или ароматизированы. В общем, соединения по изобретению присутствуют в таких дозированных формах в концентрациях от 5 до 95% по массе. Для перорального введения таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, дикалий фосфат и глицин могут быть использованы вместе с различными разрыхлителями, такими как крахмал и предпочтительно кукурузный, картофельный или тапиоковый крахмал, альгиновая кислота и некоторые комплексные силикаты, вместе с грануляционными связующими, такими как поливинилпирролидон, сахароза, желатин и аравийская камедь. Кроме того, смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк, часто очень полезны для целей таблетирования. Твердые композиции аналогичного типа могут также быть использованы в качестве наполнителей в желатиновых капсулах; предпочтительные вещества в этой связи также включают лактозу или молочный сахар, а также полиэтиленгликоли с высокой молекулярной массой. Когда желательны водные суспензии и/или эликсиры для перорального введения, активный ингредиент может быть объединен с различными подслащивающими или ароматизирующими агентами, пигментом или красителями и, при желании, еще и эмульгирующими и/или суспендирующими агентами, вместе с такими разбавителями как вода, этанол, пропиленгликоль, глицерин и различные подобные их комбинации.
[0078] Таким образом, изобретение предоставляет соединения по изобретению, их сольват, их пролекарство, их комбинацию и комбинацию с одним или несколькими другими фармакологически активными агентами. Кроме того, изобретение предоставляет фармацевтическую композицию, содержащую соединения по изобретению и фармацевтически приемлемую добавку, разбавитель или носитель, в частности для лечения NASH-ассоциированного рака печени. Кроме того, изобретение предоставляет набор, содержащий первую фармацевтическую композицию, содержащую соединения по изобретению или их фармацевтически приемлемую соль; вторую фармацевтическую композицию; и контейнер. Кроме того, вторая фармацевтическая композиция может содержать соединение по изобретению.
[0079] Одним из изобретений является набор для лечения NASH-ассоциированного рака печени, который содержит соединения по изобретению или их фармацевтически приемлемые соли. Серийная упаковка, содержащая фармацевтическую композицию, содержащую соединения по изобретению или их фармацевтически приемлемые соли, и письменные материалы, связанные с ними, где в письменном материале указано, что соединения могут или должны применяться для лечения NASH-ассоциированного рака печени, также является одним из изобретений.
[0080] Другие признаки и преимущества изобретения могут быть очевидны из нижеследующего подробного описания и формулы изобретения. Хотя были описаны конкретные варианты осуществления изобретения, различные другие известные или обычные изменения и модификации в этой области подпадают под изобретение и находятся в пределах формулы изобретения. Изобретение также включает в себя эквиваленты, изменения, применения или варианты, которые находятся в пределах сущности изобретения.
[0081] Соединения по изобретению вводят в количестве, эффективном для регресса рака, уменьшения размера раковой опухоли, уменьшения метастазирования рака, регулировки функций иммунных клеток и/или повышения эффективности терапии рака. Такое терапевтическое эффективное количество варьируется в зависимости от конкретного соединения по изобретению, конкретного состояния, подлежащего лечению, состояния пациента, пути введения, состава, решения на месте и других факторов. В свете раскрытия, в зависимости от того, что известно специалистам в данной области техники, это решается с помощью обычных методов оптимизации. Соединения по изобретению могут быть введены посредством либо перорального, парентерального, либо местного путей млекопитающим. В общем, эти соединения наиболее предпочтительно вводят людям в дозах от 1 мг до 1000 мг, предпочтительно от 10 мг до 600 мг, которые могут быть введены в виде разовой дозы или в виде дробных доз в течение дня, хотя изменения обязательно будут происходить в зависимости от веса и состояния подлежащего лечению субъекта, болезненного состояния, подлежащего лечению, и выбранного пути введения.
[0082] Фармацевтическая композиция может содержать соединения по изобретению или их фармацевтическую соль в комбинации с фармацевтически приемлемой транспортной средой или носителем.
[0083] В контексте настоящего описания термин "фармацевтически приемлемая транспортная среда" включает растворители, дисперсионную среду, покрытия, антибактериальные и противогрибковые агенты, изотонические и замедляющие абсорбцию агенты и тому подобное, совместимые с фармацевтическим введением. Вышеуказанная среда также включает другие активные или неактивные ингредиенты и является специфической в отношении раковой ткани в зависимости от композиции.
[0084] Терапевтическая эффективность соединений по изобретению может быть определена в свете этого раскрытия стандартными терапевтическими процедурами в культурах клеток или экспериментальных животных, например, для определения ED50 (доза, терапевтически эффективная у 50% популяции).
[0085] Данные, полученные из анализов клеточной культуры и исследований на животных, могут быть использованы при составлении диапазона дозировки для применения у людей. Дозировка может варьироваться в зависимости от состава и способа введения. Для любого антагониста рецептора EP4, используемого в способе по изобретению (то есть соединения A, B или C), терапевтически эффективную дозу можно оценить первоначально из анализов клеточной культуры. Доза может быть составлена на животных моделях для достижения диапазона концентраций циркулирующей плазмы, который включает IC50, как определено на культуре клеток. Такая информация может быть использована для более точного определения полезных доз у людей или животных. Уровни в плазме можно измерять, например, с помощью высокоэффективной жидкостной хроматографии.
[0086] Специалистам в данной области техники хорошо известно, что определенные факторы могут влиять на дозировку и время, необходимое для эффективного лечения млекопитающего, включая, но не ограничиваясь ими, тяжесть заболевания или расстройства, предшествующие методы лечения, общее состояние здоровья и/или возраст млекопитающего и другие присутствующие заболевания. Кроме того, лечение млекопитающего терапевтически эффективным количеством соединений по изобретению может включать, но не ограничивается ими, однократное лечение, лечение через день или серию лечений. Соединения по изобретению могут быть введены посредством либо перорального, парентерального, либо местного путей млекопитающим. В общем, эти соединения наиболее желательно вводить людям, например, один раз в день или двумя-четырьмя дробными порциями в день.
[0087] Точное количество соединений, вводимых пациенту-человеку, будет прежде всего ответственностью дежурного врача. Однако используемая доза будет зависеть от ряда факторов, включая возраст и пол пациента, точное состояние, подлежащее лечению, и его тяжесть, а также способ введения. В случае перорального введения, например, суточная доза в отношении соединений по изобретению обычно составляет приблизительно от 0,02 до 200 мг и предпочтительно приблизительно от 0,1 до 100 мг на 1 кг массы тела млекопитающего (включая человека), которую можно вводить один раз в день или за две-четыре дробные порции в день. Более конкретно, например, введение человеку составляет приблизительно от 0,02 до 20 мг на кг массы тела в день, более конкретно, приблизительно от 0,2 до 12 мг на кг массы тела в день. Введение собаке, например, составляет от 0,5 до 25 мг на кг массы тела в день, более конкретно, приблизительно от 1 до 10 мг на кг массы тела в день. Введение мышам, например, составляет приблизительно от 1 до 100 мг на кг массы тела в день, более конкретно, приблизительно от 3 до 30 мг на кг массы тела в день.
[0088] Соединения по изобретению удобно вводить в форме фармацевтической композиции для лечения NASH-ассоциированного рака печени. Такая композиция может быть удобно представлена для применения обычным способом в смеси с одним или несколькими фармацевтически приемлемыми носителями или эксципиентами.
[0089] Несмотря на то, что соединения по изобретению можно вводить в виде неразбавленного химического вещества, предпочтительно представлять его в виде фармацевтической композиции в форме фармацевтического состава. Составы содержат соединения вместе с одним или несколькими приемлемыми носителями или разбавителями и необязательно с другими терапевтическими ингредиентами. Носитель(и) должен быть "приемлемым" в том смысле, что совместим с другими ингредиентами состава и не вреден для его реципиента.
[0090] Фармацевтическую композицию составляют для достижения желаемого пути введения. Путь введения, например, представляет собой парентеральное (например, внутривенное, внутрикожное, подкожное), пероральное (например, прием внутрь или ингаляция), чрескожное (местное), мукозальное и ректальное, и местное (в том числе чрескожное, пероральное и сублингвальное) введение. Фармацевтическую композицию, составленную в виде раствора или суспензии, можно получить способом, описанным, например, в Remington's Pharmaceutical Sciences, 18-е изд., под ред. Gennaro, изд. Mack Publishing Co., Easton, PA, (1990).
[0091] Наиболее подходящий способ введения может быть различным в зависимости, например, от состояния и расстройства пациента, получающего лечение. Составы могут быть удобно представлены в виде единичной дозированной формы и могут быть получены любым из способов, хорошо известных в области фармации. Все способы включают стадию объединения соединения (то есть "активного ингредиента") с носителем, который представляет собой один или несколько вспомогательных ингредиентов. Обычно составы получают путем равномерного и непосредственного объединения активного ингредиента с жидким носителем или тонко измельченным твердым носителем или тем и другим, а затем, при необходимости, формованием продукта в желаемый состав.
[0092] Составы по настоящему изобретению, подходящие для перорального введения, могут быть представлены в виде отдельных единиц, таких как капсулы, облатки или таблетки (например, жевательные таблетки, в частности для педиатрического введения), каждая из которых содержит заданное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной жидкости или неводной жидкости; или в виде жидкой эмульсии типа "масло-в-воде" или жидкой эмульсии "вода-в-масле". Активный ингредиент также может быть представлен в виде болюса, электуария или пасты.
[0093] Таблетка может быть изготовлена путем прессования или формования, необязательно с одним или несколькими вспомогательными ингредиентами. Спрессованные таблетки могут быть получены путем прессования в подходящей машине активного ингредиента в свободно текучей форме, такой как порошок или гранулят, необязательно смешанного со связующим, скользящим веществом, инертным разбавителем, смазывающим, поверхностно-активным или диспергирующим веществом. Формованные таблетки могут быть изготовлены путем формования в подходящей машине смеси порошкообразного активного ингредиента, смоченного инертным жидким разбавителем. Таблетки могут быть необязательно покрыты или с риской и могут быть составлены таким образом, чтобы обеспечить медленное или контролируемое высвобождение активного ингредиента в ней.
[0094] Составы для парентерального введения включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостаты и растворенные вещества, которые делают состав изотоничным с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты и загустители. Составы могут быть представлены в однодозовых или многодозовых контейнерах, например, в герметичных ампулах и флаконах, и могут храниться в высушенном заморозкой (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением. Экстемпоральные инъекционные растворы и суспензии могут быть получены из стерильных порошков, гранул и таблеток описанного ранее типа.
[0095] Составы для ректального введения могут быть представлены в виде суппозитория с обычными носителями, такими как масло какао, твердый жир или полиэтиленгликоль.
[0096] Составы для местного применения во рту, например, буккально или сублингвально, включают пастилки для рассасывания, содержащие активный ингредиент в ароматизированной основе, такой как сахароза и аравийская или трагакантовая камедь, и пастилки, содержащие активный ингредиент в основе, такой как желатин и глицерин или сахароза и аравийская камедь.
[0097] Соединения по изобретению могут также быть приготовлены в виде депо-препаратов. Такие препараты длительного действия могут быть введены путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Так, например, соединения по изобретению могут быть объединены с подходящими полимерными или гидрофобными веществами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами или составлены в виде малорастворимых производных, например, в виде малорастворимой соли.
[0098] В дополнение к ингредиентам, в частности упомянутым выше, составы могут содержать другие агенты, общепринятые в данной области техники, имеющие отношение к типу рассматриваемого состава, например, те, что подходят для перорального введения, могут содержать вкусо-ароматические добавки.
[0099] Вторые активные агенты, которые являются малыми молекулами, также могут быть использованы для облегчения побочных эффектов, связанных с введением соединений по изобретению. Однако, как и некоторые крупные молекулы, многие, как полагают, способны оказывать синергетический эффект при введении (например, до, после или одновременно) с соединениями по изобретению. Примеры вторых активных агентов с малой молекулой включают, но не ограничиваются ими, противораковые агенты, антибиотики, иммунодепрессанты и стероиды.
[0100] Изобретение также включает в себя объединение отдельных фармацевтических композиций в форме набора. Набор содержит две отдельные фармацевтические композиции; соединение по изобретению; и второй терапевтический агент согласно настоящему описанию. Набор содержит контейнер для содержания отдельных композиций, таких как разделенная бутылка или разделенный пакет из фольги, однако отдельные композиции также могут содержаться в одном, неразделенном контейнере. Как правило, набор содержит указания по введению отдельных компонентов. Форма набора особенно выгодна, когда отдельные компоненты предпочтительно вводят в разных дозированных формах (например, перорально и парентерально), вводят с различными интервалами между введением лекарственного средства или когда титрование отдельных компонентов комбинации является желательным с точки зрения лечащего врача.
[0101] Примером такого набора является так называемая блистерная упаковка. Блистерные упаковки хорошо известны в упаковочной промышленности и широко используются для упаковки фармацевтических единичных дозированных форм (таблетки, капсулы и тому подобное). Блистерные упаковки обычно содержат лист относительно жесткого материала, покрытого пленкой предпочтительно прозрачного полимерного материала. Во время процесса упаковки в полимерной пленке образуются выемки. Выемки имеют размер и форму таблеток или капсул, подлежащих упаковке. Затем таблетки или капсулы помещают в выемки, а лист относительно жесткого материала плотно прикладывают к полимерной пленке на лицевую поверхность пленки, которая противоположна направлению, в котором образованы выемки. В результате таблетки или капсулы герметизируют в углублениях между пластиковой пленкой и листом. Предпочтительно прочность листа такова, что таблетки или капсулы могут быть удалены из блистерной упаковки путем ручного приложения давления на выемки, посредством чего создается отверстие в листе в месте выемки. Затем таблетку или капсулу можно удалить через указанное отверстие.
[0102] В некоторых вариантах осуществления предоставляемые в настоящем документе способы включают введение соединений по изобретению в комбинации с одним или несколькими вторыми активными агентами и/или в комбинации с лучевой терапией и/или хирургическим вмешательством. Примеры второго активного агента включают, например, дополнительные антагонисты EP4, ингибиторы иммунных контрольных точек, ингибиторы PD-1, ингибиторы PD-L1, ингибиторы CTLA4, лечение адоптивными иммунными клетками, противораковые вакцины и другие иммуно-онкологические лекарственные препараты, специфические, например, по отношению к рецептору колониестимулирующего фактора 1 (CSF1R), индоламин 2,3-диоксигеназе (IDO) или карциноэмбриональному антигену (СЕА). Более того, молекулярно-специфические противораковые лекарственные средства и химиотерапия рака также включены в качестве второго активного агента. Более конкретно, вторые активные агенты включают, например, PD-1-антитела, такие как ниволумаб, ламбролизумаб/пембролизумаб, REGE2810, PD-L1-антитела, такие как авелумаб, атезолизумаб, дурвалумаб, пембролизумаб, CTLA-4-антитела, такие как ипилимумаб и тремелимумаб, молекулярно-сепцифические лекарственные средства, такие как антитело против HER2, антитело против VEGF, антитело против EGFR, ингибиторы тирозинкиназы против рецептора EGFR, рецептора PDGFR, киназ рецептора VEGFR, c-kit и Bcr-Abl и противоопухолевые химиотерапевтические средства, такие как алкилирующие агенты, антиметаболиты, противоопухолевые антибиотики, противоинфекционные препараты, ингибиторы микротрубочек, гормональные терапевтические средства, лекарственные средства на основе платины, ингибиторы топоизомеразы, гуморальные терапевтические средства, такие как ингибиторы ароматазы, антиэстрогенные лекарственные препараты, антиандрогенные лекарственные препараты, прогестерон, эстрадиол, LG-RH-агонисты, а также иммунотерапию, такую как адоптивная Т-клеточная терапия, адоптивная терапия дендритными клетками, адоптивная NK-клеточная терапия и терапия противораковыми вакцинами. Введение соединений по изобретению и вторых активных агентов пациенту может происходить одновременно или последовательно одним и тем же или разными путями введения. Пригодность конкретного способа введения, используемого для конкретного активного агента, будет зависеть от самого активного агента (например, можно ли его вводить перорально без разложения до поступления в кровоток) и заболевания, подлежащего лечению. Рекомендуемые пути введения для вторых активных агентов известны специалистам в данной области техники. Лучевая терапия включает в себя все виды терапии, указанные для рака печени, например, протонную лучевую терапию. Хирургическое вмешательство включает в себя все виды терапии, указанные для терапии рака печени.
[0103] Определения терминов
"Антагонист EP4" относится к соединению, которое ингибирует или блокирует передачу сигналов на клеточном уровне, инициированную взаимодействием PGE2 с рецептором EP4. Примеры антагонистов EP4 включают, но не ограничиваются ими, ER-819762, MK-2894, MF 498, ΟΝΟ-ΑΕ3-208, эватанепаг, ΟΝΟ-ΑΕ2-227, BGC201531, ΟΝΟ-ΑΕ3-240, GW 627368 и AH23848, которые перечислены в базе данных МСФ как антагонисты рецептора EP4. Соединения A, B и C и их фармацевтически приемлемые соли (соединения по изобретению) также являются примерами антагонистов EP4.
[0104] "Ингибитор иммунных контрольных точек" относится к типу лекарственного средства, которое блокирует определенные белки, произведенные некоторыми типами иммунных клеток, такими как Т-клетки и некоторые раковые клетки. Эти белки помогают держать иммунные ответы под контролем и могут удерживать Т-клетки от убийства раковых клеток. Когда эти белки блокируются, тормоза на иммунной системе высвобождаются, и Т-клетки способны убивать раковые клетки лучше. Примеры ингибиторов иммунных контрольных точек включают, но не ограничиваются ими, ингибиторы PD-1, ингибиторы CTLA-4, ингибиторы LAG-3, ингибиторы TIM-3, ингибиторы BTLA, ингибиторы PD-L1, ингибиторы PD-L2, ингибиторы B7-1, ингибиторы B7-2, ингибиторы галектина-9 и ингибиторы HVEM. Ингибиторами иммунных контрольных точек могут быть малые молекулы, пептиды, белки, такие как антитела, нуклеиновые кислоты или тому подобное.
[0105] "Ингибитор PD-1" относится к антителу или другой молекуле, которая ингибирует функцию запрограммированной гибели белка 1 (PD1). Иллюстративные ингибиторы/антитела включают, но не ограничиваются ими, антитела, описанные в патентах США №№ 7,488,802, 7,521,051, 8,008,449, 8,354,509, 8,617,546 и 8,709,417. Конкретные варианты осуществления антитела включают MDX-1106/ниволумаб, BMS-936558 (Bristol-Myers Squibb), ламбролизумаб (Merck), MK-3475/пембролизумаб (зарегистрированный товарный знак KEYTRUDA, Merck), AMP-224 (GSK) и CT-011 (Cure Tech).
[0106] "Ингибитор PD-L1" относится к антителу или другой молекуле, которая ингибирует функцию запрограммированной гибели лиганда 1 (PDL1). Иллюстративные антитела включают, но не ограничиваются ими, антитела, описанные в патентах США №№ 8,217,149, 8,383,796, 8,552,154 и 8,617,546. В конкретном варианте осуществления антитело представляет собой MPDL3280A/RG7446 (Roche), BMS-936559 (BMS), MEDI4736 (AstraZeneca) или MSB0010718C (MerckSerono).
[0107] "Ингибитор CTLA4" относится к антителу или другой молекуле, которая ингибирует функцию цитотоксического t-лимфоцитарного антигена 4 (CTLA4). Иллюстративные ингибиторы/антитела включают, но не ограничиваются ими, антитела, которые являются антагонистами CTLA4 или антителами CTLA4, описанными в патентах США №№ 8,685,394 и 8,709,417. Некоторые варианты осуществления антитела включают MDX-010 (ипилимумаб, Bristol-Myers Squibb) и CP-675,206 (тремелимумаб, AstraZeneca). В конкретном варианте осуществления антитело представляет собой ипилимумаб или тремелимумаб.
[0108] "Лечение", "лечить" и "лечащий" относятся к облегчению, ингибированию и/или обращению прогрессирования рака у субъекта, нуждающегося в этом. Термин "лечение" включает любые признаки успеха в лечении или облегчении рака, включая любые объективные или субъективные параметры, такие как ослабление боли или выраженности симптома; ремиссия; ослабление симптомов или способствование тому, что повреждение, патология или состояние становится более терпимым для субъекта; задержка или замедление скорости прогрессирования и т.д. Измерение лечения или ослабления может быть основано, например, на результатах врачебного осмотра, патологического теста и/или диагностического теста, известного в данной области техники. Лечение может также относиться к уменьшению частоты возникновения или наступления рака, или его повторения (например, удлинение времени ремиссии) по сравнению с тем, которое происходило бы в отсутствии предпринятой меры. Термин "лечение" в контексте настоящего описания включает в себя не только уменьшение опухолевой ткани, но также облегчение симптомов, улучшение качества жизни (QOL) и профилактику (лучевая терапия, послеоперационная профилактика рецидивов, адъювантная химиотерапия и тому подобное).
[0109] "Фармацевтически эффективное количество" относится к количеству, которое эффективно для лечения рака, как отмечено клиническим тестированием и оценкой, наблюдением пациента и/или тому подобным. "Эффективное количество" может дополнительно обозначать количество, которое вызывает заметное изменение в биологической или химической активности. Обнаруживаемые изменения могут быть обнаружены и/или дополнительно количественно определены специалистом в данной области техники для соответствующего механизма или процесса. Кроме того, "эффективное количество" может обозначать количество, которое поддерживает желаемое физиологическое состояние, то есть уменьшает или предотвращает значительное ухудшение и/или способствует улучшению состояния. "Эффективное количество" может дополнительно относиться к терапевтически эффективному количеству.
[0110] В контексте настоящего описания термин "фармацевтически приемлемая соль" согласуется с приведенными выше примерами и относится к соли относительно нетоксичной, неорганической или органической кислоты и соединения по изобретению. Эти соли могут быть получены in situ во время конечного выделения и очистки соединений или путем взаимодействия очищенного соединения в свободной форме отдельно с подходящей органической или неорганической кислотой и выделения полученной таким образом соли. Репрезентативные соли с кислотами включают, но не ограничиваются ими, ацетатные, адипатные, аспартатные, бензоатные, безилатные, бикарбонатные/карбонатные, бисульфатные/сульфатные, боратные, камсилатные, цитратные, цикламатные, эдизилатные, эзилатные, формиатные, фумаратные, глюцептатные, глюконатные, глюкуронатные, гексафторфосфатные, гибензатные, гидрохлоридные/хлоридные, гидробромидные/бромидные, гидроиодидные/иодидные, изетионатные, лактатные, малатные, малеатные, малонатные, мезилатные, метилсульфатные, нафтилатные, 2-напсилатные, никотинатные, нитратные, оротатные, оксалатные, пальмитатные, памоатные, фосфатные/гидрофосфатные/дигидрофосфатные, пироглутаматные, сахаратные, стеаратные, сукцинатные, таннатные, тартратные, тозилатные, трифторацетатные и ксинафоатные соли. В одном варианте осуществления фармацевтически приемлемая соль представляет собой гидрохлоридную/хлоридную соль.
[0111] "Второй активный агент" представляет собой низкомолекулярный лекарственный препарат или биологический препарат, который обладает фармакологически эффективной активностью и включает в себя, но не ограничивается ими, ингибиторы сигнала PGE2, такие как дополнительные антагонисты EP4, ингибитор микросомальной простагландин-E-синтазы (mPGES)-1, ингибиторы COX-2, НПВП и ингибиторы иммунных контрольных точек, лекарственные препараты, нацеленные иммунные клетки, молекулярно-специфические противораковые лекарственные средства, алкилирующие агенты, антиметаболиты, противоопухолевые антибиотики, противоинфекционные препараты, ингибиторы микротрубочек, гормональные терапевтические средства, лекарственные средства на основе платины, ингибиторы топоизомеразы, молекулярно-специфические лекарственные препараты, молекулярно-специфические противораковые терапевтические средства, иммунотерапевтические средства и так далее.
[0112] "Противоопухолевая терапия" включает, но не ограничивается ими, терапию противоопухолевой вакциной и адоптивную терапию иммунными клетками, такую как адоптивная Т-клеточная терапия, адоптивная терапия дендритными клетками или адоптивная NK-клеточная терапия, а также включает, но не ограничивается ими, противораковую лучевую терапию и терапию с помощью хирургической операции.
[0113] "Биологический препарат" включает, но не ограничивается ими, фармакологически активный белок, такой как интерферон гамма и интерлейкин 2, и фармакологически активный пептид, нуклеиновую кислоту и полисахарид.
[0114] "Молекулярно-специфические лекарственные препараты" включают, но не ограничиваются ими, антитело против HER2, антитело против VEGF, антитело против EGFR, ингибитор тирозинкиназы против рецептора EGFR, рецептора PDGFR, киназ рецептора VEGFR, c-kit и Bcr-Abl.
[0115] "Иммунотерапия" включает, но не ограничивается ими, иммунорегулирующие лекарственные препараты, адоптивные виды терапии иммунными клетками, виды терапии противоопухолевыми вакцинами и так далее.
[0116] "NASH" относится к безалкогольному стеатогепатиту, синдрому, который развивается у пациентов, которые не являются алкоголиками; он вызывает повреждение печени, которое гистологически неотличимо от алкогольного гепатита. Он чаще всего развивается у пациентов по меньшей мере с одним из следующих факторов риска: ожирение, дислипидемия и непереносимость глюкозы. Патогенез плохо понимается, но, по-видимому, связан с резистентностью к инсулину (например, как при ожирении или метаболическом синдроме).
[0117] "NASH-ассоциированный рак печени" относится к раку, включая гепатоцеллюлярную карциному (HCC) и другое раковое заболевание(ия), которые встречаются в органах, связанных с печенью, таких как кровеносный сосуд печени или желчный проток, которые индуцированы и/или ассоциированы с NASH. NASH-ассоциированный рак печени отличается от гепатоцеллюлярной карциномы, которая индуцируется вирусами гепатита В или С в терминах патогенеза заболевания.
[0118] "Метастатический рак" относится к раку, в котором раковые клетки из органа или части тела распространились (через "метастаз") на другой, несоседний орган или часть тела. Рак в несоседнем органе или части тела ("вторичная опухоль" или "метастатическая опухоль") включает раковые клетки, происходящие из органа или части тела, из которой распространяется рак или раковые клетки. Участки, в которых может встречаться вторичная опухоль, включают, но не ограничиваются ими, лимфатические узлы, легкие, мозг и/или кости.
[0119] Термин "сигнал EP4" или "передача сигнала EP4" в контексте настоящего описания означает повышение цАМФ и последующую передачу сигналов в связи с агонистической стимуляцией рецептора EP4.
ПРИМЕРЫ
[0120] Пример 1:
Соединение A ингибирует рост рака печени в индуцированной рационом с высоким содержанием жиров NASH-ассоциированной модели рака печени мыши.
[0121] Эксперименты с животными
Мышей C57/BL6 приобретали у CLEA Japan Inc. Мышей Tlr2-/- (C57/BL6) приобретали у Oriental Yeast Co. Ltd.
[0122] Гистология и иммунофлюоресцентный анализ
Окраску гематоксилином и эозином и иммунофлюоресцентный анализ проводили, как описано ранее (Yoshimoto с соавт., Nature, 2013, 499:97-101).
[0123] Выделение иммунных клеток
Иммунные клетки получали из печени мышей и подвергали измерению производства цитокинов и проточному цитометрическому анализу.
[0124] Статистический анализ
Данные анализировали с помощью непарного t-критерия Стьюдента с коррекцией Уэлша (двухсторонняя) или Ман-Уитни (двухсторонняя). Значения P менее 0,05 считались значительными. "НЗ" указывает на незначительные.
[0125] Результаты исследования
Эту модель мыши подготавливали путем обработки с помощью DMBA, 7,12-диметилбенза(а)антрацена, и путем кормления рационом с высоким содержанием жиров (HFD) (НПЛ 15). В этой модели мыши экспрессия EP4, но не других рецепторов PGE2, была значительно повышена в опухолевых тканях, что предполагает, что EP4 может преимущественно опосредовать передачу сигнала PGE2 в индуцированной ожирением NASH-ассоциированной опухолевой ткани печени. В этом эксперименте мышам ежедневно вводили соединение A 30 мг/кг ежедневно с 19-недельного возраста до 30-недельного возраста (Фигура 1). В качестве контроля отдельную группу мышей обрабатывали только носителем и без активного ингредиента. Развитие гепатоцеллюлярной карциномы (HCC) у мышей, обработанных соединением A, сильно уменьшалось по сравнению с мышами, обработанными носителями (Фигура 2 и Фигура 3). Примечательно, однако, что обработка соединением A не влияло на вес тела (Фигура 4).
[0126] Оценивали влияние блокирования EP4 на распространенность и статус активации иммунных клеток. Хотя частоты дендритных клеток (ДК) CD11chi MHC класса IIhi и ДК CD11b+ не изменялись, популяция ДК CD103+, которые являются существенными для противораковых иммунных реакций (НПЛ 16: Fuertes с соавт., J. Exp. Med., 2011, 208:2005-2016; НПЛ 17: Salmon с соавт., Immunity, 2016, 44:924-938; и НПЛ 18: Zelenay с соавт., Cell, 2015, 162:1257-1270), была увеличена в группе, обработанной соединением A (Фигура 5). Частота CD4+Foxp3+ регуляторных Т-клеток (Tрег), но не CD4+Foxp3- T-клеток, значительно снижалась лечением соединением A (Фигура 6). Кроме того, отношение CD8+ T-клеток к Tрег было увеличено у мышей, обработанных соединением A, хотя частота CD8+ T-клеток не изменялась (Фигура 6). Более того, количество CD8+ Т-клеток, экспрессирующих активационный маркер CD69, было значительно увеличено в печени от мышей, обработанных соединением A (Фигура 7). Напротив, введение соединения A значительно уменьшало количество CD8+ Т-клеток, экспрессирующих запрограммированную гибель клеток-1 (PD-1), ключевого ингибирующего рецептора на Т-клетках в микроокружении опухоли (Фигура 8). Эти результаты свидетельствуют о том, что блокирование пути EP4 может повторно активировать противоопухолевый иммунитет в микроокружении NASH-ассоциированной опухоли печени.
[0127] Вывод
Антагонист EP4 соединение A значительно ингибирует рост и развитие модели индуцированного ожирением NASH-ассоциированного рака печени. Лечение соединением A для мышиной модели увеличивало частоты подтипа ДК, который необходим для противоракового иммунного ответа (CD103+), и уменьшало экспрессию PD-1 на цитотоксических CD8+ Т-клетках в опухолевой ткани. Лечение соединением A также уменьшало популяцию иммунно-подавляющих клеток Tрег (Foxp3+) в опухолевых тканях.
[0128] Пример 2:
Ожидается, что соединение A в комбинации с PD-1-антителом продемонстрирует более высокую противоопухолевую эффективность, чем взятое отдельно соединение A в HFD-индуцированной NASH-ассоциированной модели рака печени мыши.
[0129] Способы исследования
Такую же модель мыши, что и в примере 1, использовали для проверки эффективности соединения A в комбинации с PD-1-антителом в HFD-индуцированной NASH-ассоциированной модели рака печени мыши. Соответственно, пример 1 повторяют, за исключением того, что PD-1-антитело также вводят с соединением A в группе, которую лечат соединением A.
[0130] Результаты
Ожидается, что терапия соединением А в комбинации с PD-1-антителом продемонстрирует более высокую противоопухолевую эффективность, чем у мышей из примера 1, обработанных соединением А, в HFD-индуцированной NASH-ассоциированной модели рака печени мыши.
[0131] Пример 3:
Ожидается, что лечение соединением B будет ингибировать рост рака печени в HFD-индуцированной NASH-ассоциированной модели рака печени мыши.
[0132] Способы исследования
Такую же модель мыши, что и в примере 1, использовали для проверки эффективности соединения B. Таким образом, повторяют пример 1, за исключением того, что вместо соединения A используют соединение B.
[0133] Результаты исследования
Ожидается, что терапия соединением B будет препятствовать росту рака печени в HFD-индуцированной NASH-ассоциированной модели рака печени мыши. Ожидается, что соединение B будет контролировать функцию иммунных клеток в опухолевой ткани таким же образом, что и соединение A в примере 1.
[0134] Вывод
Ожидается, что антагонист EP4 соединение B будет ингибировать рост и развитие в модели NASH-ассоциированного рака печени мыши, что согласуется с результатами соединения A в примере 1. Ожидается, что соединение B для мышиной модели увеличит частоты подтипа ДК, который необходим для противоракового иммунного ответа (CD103+) и уменьшит экспрессию PD-1 на цитотоксических CD8+ Т-клетках в опухолевой ткани. Ожидается также, что лечение соединением B уменьшит популяцию иммунно-подавляющих клеток Tрег (Foxp3+) в опухолевых тканях.
[0135] Пример 4:
Ожидается, что соединение B в комбинации с PD-1-антителом продемонстрирует более высокую противоопухолевую эффективность, чем взятое отдельно соединение B в HFD-индуцированной NASH-ассоциированной модели рака печени мыши.
[0136] Способы исследования
Такую же модель мыши, что и в примере 3, использовали для проверки эффективности соединения B в комбинации с PD-1-антителом в HFD-индуцированной NASH-ассоциированной модели рака печени мыши. Соответственно, пример 3 повторяют, за исключением того, что PD-1-антитело также вводят с соединением B в группе, которую лечат соединением B.
[0137] Результаты
Ожидается, что терапия соединением B в комбинации с PD-1-антителом продемонстрирует более высокую противоопухолевую эффективность, чем у мышей из примера 3, обработанных соединением B, в HFD-индуцированной NASH-ассоциированной модели рака печени мыши.
[0138] Пример 5:
Ожидается, что лечение соединением С будет ингибировать рост рака печени в HFD-индуцированной NASH-ассоциированной модели рака печени мыши.
[0139] Способы исследования
Такую же модель мыши, что и в примере 1 использовали для проверки эффективности соединения C. Соответственно, пример 1 повторяют, за исключением того, что вместо соединения A используют соединение C.
[0140] Результаты исследования
Ожидается, что терапия соединением С будет препятствовать росту рака печени в HFD-индуцированной NASH-ассоциированной модели рака печени мыши. Ожидается, что соединение С будет контролировать функцию иммунных клеток в опухолевой ткани таким же образом, как и соединение А в примере 1.
[0141] Вывод
Ожидается, что антагонист EP4 соединение C будет ингибировать рост и развитие в модели NASH-ассоциированного рака печени мыши, что согласуется с результатами соединения A в примере 1 и ожидаемыми результатами соединения B в примере 3. Ожидается, что соединение C для мышиной модели увеличит частоты подтипа ДК, который необходим для противоракового иммунного ответа (CD103+) и уменьшит экспрессию PD-1 на цитотоксических CD8+ Т-клетках в опухолевой ткани. Ожидается также, что лечение соединением С уменьшит популяцию иммунно-подавляющих клеток Tрег (Foxp3+) в опухолевых тканях.
[0142] Пример 6:
Ожидается, что соединение C в комбинации с PD-1-антителом продемонстрирует более высокую противоопухолевую эффективность, чем взятое отдельно соединение C в HFD-индуцированной NASH-ассоциированной модели рака печени мыши.
[0143] Способы исследования
Такую же модель мыши, что и в примере 5, использовали для проверки эффективности соединения C в комбинации с PD-1-антителом в HFD-индуцированной NASH-ассоциированной модели рака печени мыши. Соответственно, пример 5 повторяют, за исключением того, что антитело PD-1 также вводят с соединением C в группе, которую лечат соединением C.
[0144] Результаты
Ожидается, что терапия соединением C в комбинации с PD-1-антителом продемонстрирует более высокую противоопухолевую эффективность, чем у мышей из примера 5, обработанных соединением C, в HFD-индуцированной NASH-ассоциированной модели рака печени мыши.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ АНТАГОНИСТОВ РЕЦЕПТОРА EP4 ДЛЯ ЛЕЧЕНИЯ NASH-АССОЦИИРОВАННОГО РАКА ПЕЧЕНИ | 2017 |
|
RU2762193C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2015 |
|
RU2708374C2 |
| НОВЫЙ ПОДХОД К ЛЕЧЕНИЮ РАКА С ПРИМЕНЕНИЕМ ИММУНОМОДУЛЯЦИИ | 2016 |
|
RU2817047C2 |
| НОВЫЙ ПОДХОД К ЛЕЧЕНИЮ РАКА С ПРИМЕНЕНИЕМ ИММУНОМОДУЛЯЦИИ | 2016 |
|
RU2711380C2 |
| ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2021 |
|
RU2816314C1 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА К CD25 И Fc ГАММА-РЕЦЕПТОРУ ДЛЯ ЭЛИМИНАЦИИ ОПУХОЛЕСПЕЦИФИЧЕСКИХ КЛЕТОК | 2017 |
|
RU2759970C2 |
| ПРОИЗВОДНЫЕ ТИОКАРБАМАТА В КАЧЕСТВЕ ИНГИБИТОРОВ A2A, ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И КОМБИНАЦИИ С ПРОТИВОРАКОВЫМИ СРЕДСТВАМИ | 2019 |
|
RU2824502C2 |
| Комбинированная терапия с использованием антагониста хемокинового рецептора 2 (CCR2) и ингибитора PD-1/PD-L1 | 2018 |
|
RU2796863C2 |
| ИНГИБИТОР КОНТРОЛЬНЫХ ТОЧЕК И ЦЕЛЫЕ КЛЕТКИ МИКОБАКТЕРИЙ ДЛЯ ПРИМЕНЕНИЯ В ТЕРАПИИ РАКА | 2016 |
|
RU2733033C2 |
| ПРОТИВОРАКОВАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ОПУХОЛЕСПЕЦИФИЧЕСКИЙ ОНКОЛИТИЧЕСКИЙ АДЕНОВИРУС И ИНГИБИТОР КОНТРОЛЬНОЙ ТОЧКИ ИММУННОГО ОТВЕТА | 2018 |
|
RU2740713C1 |
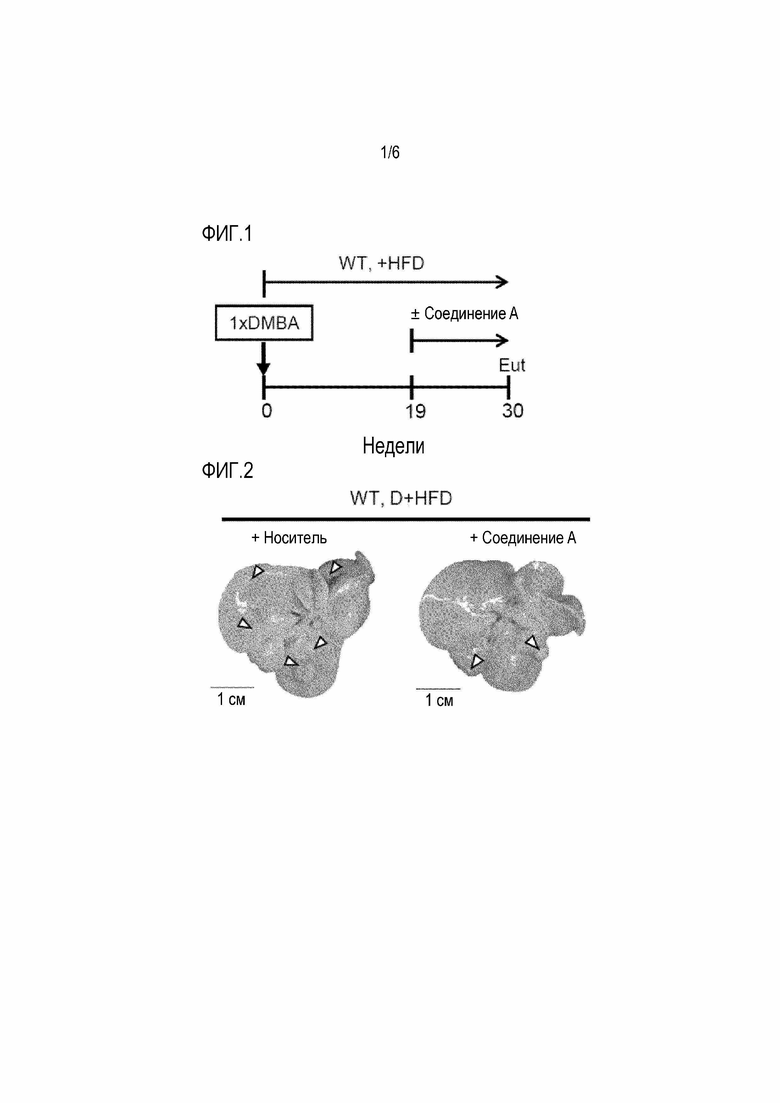
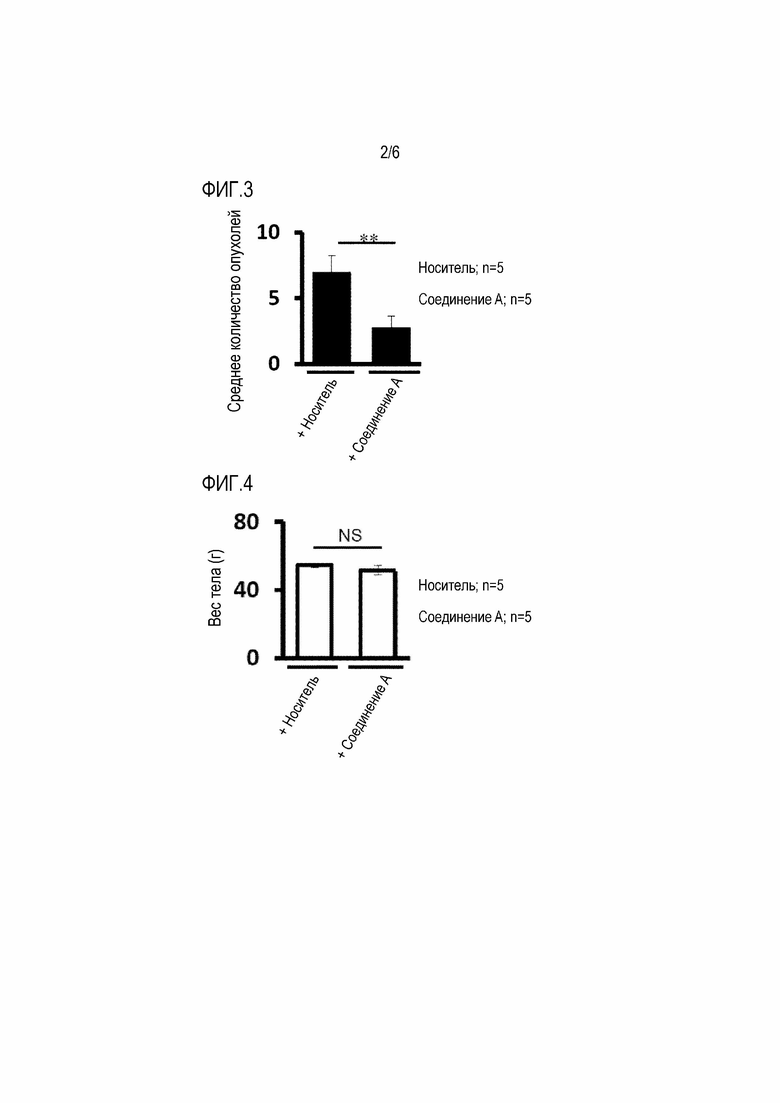
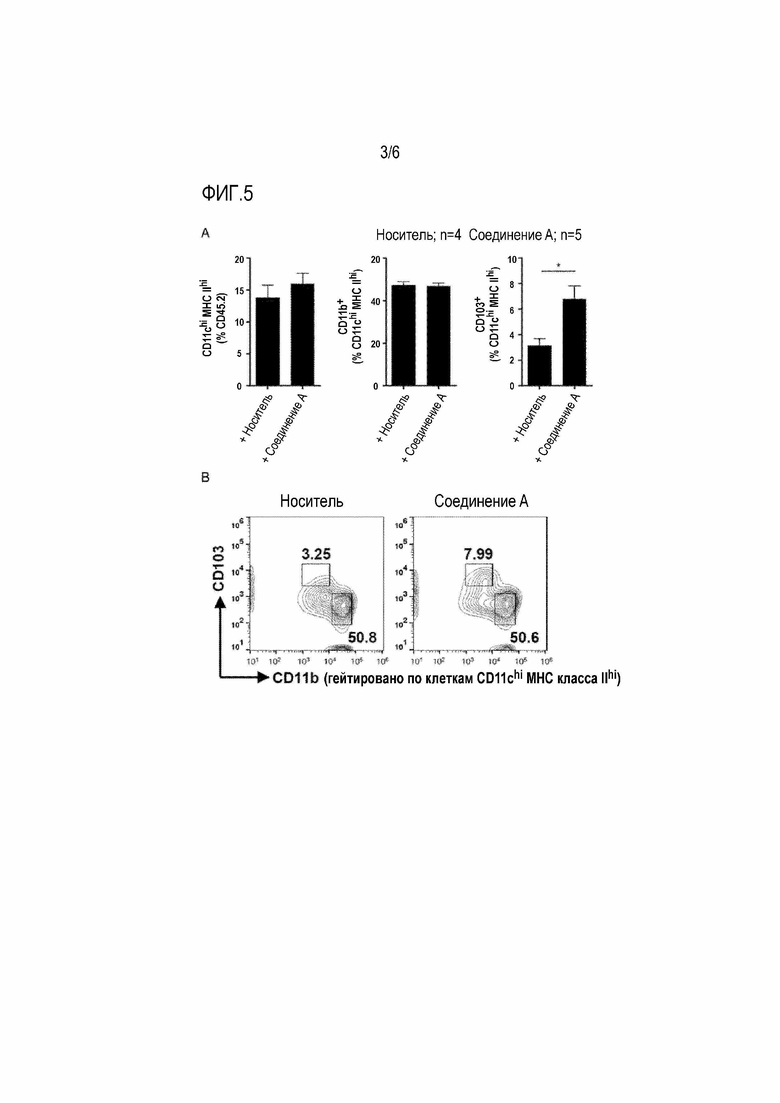

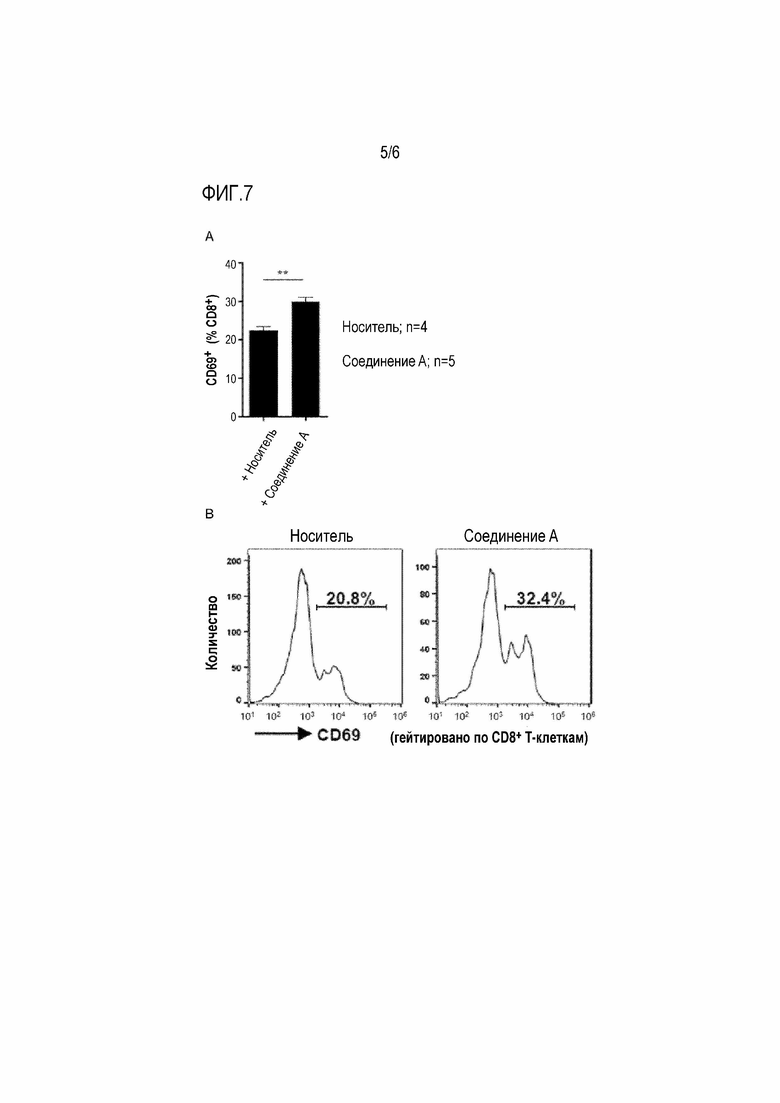
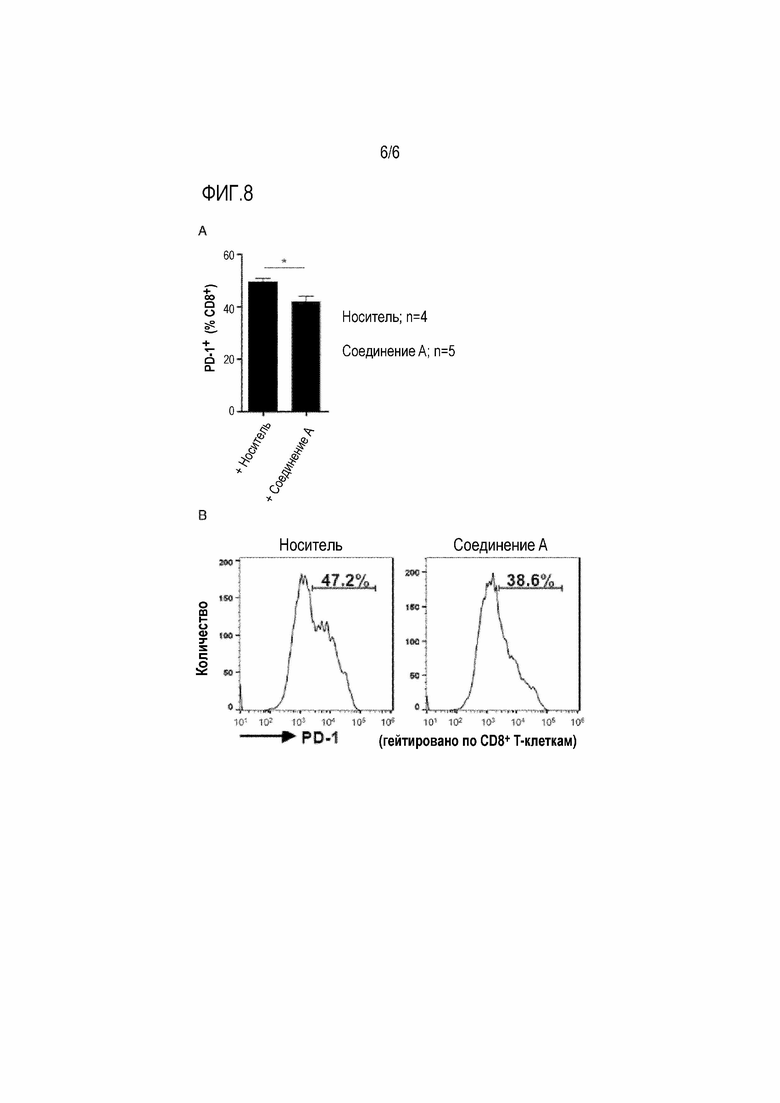
Группа изобретений относится к онкологии и фармации. Предложены: способ лечения ассоциированного с неалкогольным стеатогепатитом (NASH-ассоциированного) рака печени, включающий введение фармацевтически эффективного количества 4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]бензойной кислоты или ее соли (варианты), применение данного соединения или его соли для лечения NASH-ассоциированного рака печени и применение его для производства лекарственного средства того же назначения. Технический результат: соединение (или его соли) подавляет развитие вызванного ожирением NASH-ассоциированного рака печени, при этом повторно активирует противоопухолевый иммунитет в микроокружении данного рака, в частности снижает популяцию иммуноподавляющих клеток Трег (Foxp3+) в ткани опухоли. 4 н. и 8 з.п. ф-лы, 8 ил., 6 пр.
1. Способ лечения NASH-ассоциированного рака печени, который включает введение фармацевтически эффективного количества 4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]бензойной кислоты (соединение А) или ее фармацевтически приемлемой соли человеку или животному, нуждающемуся в этом.
2. Способ по п. 1, дополнительно включающий введение фармацевтически эффективного количества соединения А или его фармацевтически приемлемой соли в комбинации со вторым активным агентом, противоопухолевой терапией или и тем, и другим.
3. Способ по п. 2, в котором второй активный агент представляет собой ингибитор иммунных контрольных точек или ингибитор PD-1.
4. Способ лечения NASH-ассоциированного рака печени, который выбирают из одного или нескольких из группы, состоящей из:
увеличения количества дендритных клеток, которые могут активировать противоопухолевую иммунную функцию у человека или у животного, нуждающегося в этом,
уменьшения количества клеток Foxp3+ Tрег, которые подавляют иммунную функцию против опухолей у человека или у животного, нуждающегося в этом,
увеличения количественного отношения CD8+/Tрег у человека или у животного, нуждающегося в этом,
увеличения количества активированных CD8+ Т-клеток (клеток CD69+) у человека или у животного, нуждающегося в этом, и
уменьшения экспрессии PD-1 в CD8+ Т-клетках у человека или у животного, нуждающегося в этом, и
где способ включает введение фармацевтически эффективного количества 4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]бензойной кислоты (соединение А) или ее фармацевтически приемлемой соли человеку или животному, нуждающемуся в этом.
5. Способ по п. 4, дополнительно включающий введение фармацевтически эффективного количества соединения А или его фармацевтически приемлемой соли в комбинации со вторым активным агентом, противоопухолевой терапией или и тем, и другим.
6. Способ по п. 5, в котором второй активный агент представляет собой ингибитор иммунных контрольных точек или ингибитор PD-1.
7. Применение 4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]бензойной кислоты (соединение А) или ее фармацевтически приемлемой соли для лечения NASH-ассоциированного рака печени человека или животного.
8. Применение по п. 7, где соединение А применяют в комбинации со вторым активным агентом, противоопухолевой терапией или и тем, и другим.
9. Применение по п. 8, где второй активный агент представляет собой ингибитор иммунных контрольных точек или ингибитор PD-1.
10. Применение 4-[(1S)-1-({[5-хлор-2-(3-фторфенокси)пиридин-3-ил]карбонил}амино)этил]бензойной кислоты (соединение А) или ее фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения NASH-ассоциированного рака печени человека или животного.
11. Применение по п. 10, где соединение А применяют в комбинации со вторым активным агентом.
12. Применение по п. 11, где второй активный агент представляет собой ингибитор иммунных контрольных точек или ингибитор PD-1.
| ПРИМЕНЕНИЕ АНТАГОНИСТОВ РЕЦЕПТОРА EP4 В ЛЕЧЕНИИ IL-23-ОПОСРЕДУЕМЫХ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2571816C2 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| WEINMANN A | |||
| et al | |||
| Treatment and survival of non-alcoholic steatohepatitis associated hepatocellular carcinoma | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| ПРИМЕНЕНИЕ АНТАГОНИСТОВ РЕЦЕПТОРА EP4 В ЛЕЧЕНИИ IL-23-ОПОСРЕДУЕМЫХ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2571816C2 |
| PANDEY V | |||
| еt al | |||
| Comparative analysis and modeling of the severity of | |||
Авторы
Даты
2020-03-23—Публикация
2017-11-02—Подача