СПОСОБ ПОЛУЧЕНИЯ НИБОМИЦИНА
Область техники
Изобретение относится к микробной биотехнологии и фармацевтике, а именно к способу получения нибомицина - редкого природного антибиотика азолохинолиновой группы, обладающего активностью против грамположительных бактерий, и что особенно важно, против патогенов, обладающих множественной антибиотикорезистентностью (таких как метициллин- и ванкомицин-устойчивые штаммы Staphylococcus aureus (MRSA и VRSA), - и таким образом, представляющего значительные перспективы для клинического применения.
Уровень техники
Сведения о появлении антибиотико-устойчивых форм патогенов стали появляться вскоре после введения в клиническую практику пенициллина, еще в начале 1940-х. С тех пор преодоление данной проблемы основывалось на интенсификации поиска новых антибиотиков, обладающих иными механизмами действия или более высокой активностью. Однако приобретение бактериями устойчивости к вводимым в широкую практику препаратам тоже стремительно возрастало. В конце концов, это привело к распространению патогенов, обладающих множественной устойчивостью к основным группам лекарственных средств. Одним из наиболее значимых примеров являются метициллин-устойчивые штаммы Staphylococcus aureus (MRSA), впервые выделенные еще в 1961 году. В настоящее время штаммы MRSA обладают резистентностью практически ко всем используемым антибиотикам, включая ванкомицин (VRSA), которое долгое время считался препаратом резерва.
Поиск новых химиотерапевтических средств или стратегий имеют решающее значение для разрыва порочного круга между антибиотиками и антибиотикорезистентностью. Особый интерес в литературе приобретают так называемые "реверсные антибиотики", которые могут решить проблему борьбы с резистентными штаммами. Впервые эта способность была открыта у нибомицина - антибиотика, известного с 1955 года, однако, так и не введенного в клиническую практику. Было показано, что нибомицин и его производные способны подавлять рост хинолон-устойчивых стафиллококков (Hiramatsu et al., 2012). Установлено, что хинолон-устойчивые штаммы S.aureus имеют мутацию в гене, кодирующем синтез ДНК-гиразы. Молекулы нибомицина способны вызывать обратные изменения в данном гене, возвращая S. aureus восприимчивость к хинолоновым антибиотикам. За это нибомицин был назван "реверсным" или "обратным антибиотиком" (Hiramatsu et al., 2015). Таким образом, перспективным методом контроля над хинолон-устойчивыми бактериями, таким как MRSA и VRSA, является применение нибомицина и его производных совместно с хинолонами (Hiramatsu K. et al., 2015).
Известен способ получения нибомицина путем химического синтеза (Forbis, Rinehart, 1973) из о-анизидина: процесс протекает в 12 стадий и общий выход нибомицина составляет 0,16%. Очевидным недостатком получения нибомицина путем химического синтеза, несмотря на высокий выход целевого продукта, является потребность в специалистах высокой квалификации в области синтеза органических веществ, наличия соответствующего оборудования и необходимых реагентов.
Также известны способы получения нибомицина путем биосинтеза с помощью штамма-продуцента Streptomyces hyalinum АТСС® 29817™ (Naganawa Н, Wakashiro Т, Yagi A, Kondo S, Takita Т. Deoxynybomycin from a Streptomyces. J Antibiot (Tokyo) 1970; 23:365-8.). Способ получения антибиотика нибомицина заключается в культивировании продуцента Streptomyces hyalinum АТСС® 29817™ в глубинных аэробных условиях при температуре 30±1°С в жидкой питательной следующего состава (г/л): крахмал растворимый - 10±1, глюкоза - 10±1, мясной экстракт - 7,5±0,5, пептон основной - 7,5±0,5, NaCl - 3±0,1, MgSO4 - 1±0,05, вода - остальное. Максимум продукции в культуральной жидкости наблюдается на 4-5 сутки в условиях непрерывной аэрации. Антибиотик из профильтрованной культуральной жидкости экстрагируется бутилацетатом при pH=2. Экстракт концентрируют и наносят на колонку с силикагелем. После промывки колонки бензолом антибиотик элюируют смесью бензол-метанол (10:1). Очистку нибомицина производят хроматографически на колонке с силикагелем, используя хлороформ и хлороформ-метанол (10:1) как подвижную фазу. Минимальная ингибирующая концентрация (МИК) нибомицина, получаемого таким образом, составляла для Escherichia coli K-12 - более 20 мг/л, Bacillus cereus АТСС 10702 - 10 мг/л, Staphylococcus aureus FDA 209 Р - 10 мг/л. Данный способ получения антибиотика нибомицина обладает множеством недостатков: низкой антибиотической активностью продуцента, особенно в отношении стафилококка, поликомпонентным составом ферментационной среды и, соответственно, ее относительно высокой стоимостью, а также многостадийностью, трудоемкостью стадии выделения и химической очистки, большим количеством органических растворителей: бутилацетат, бензол, метанол, хлороформ. Необходимость сложной многостадийной очистки препарата обусловлена использованием на первой технологической стадии бутилацетата в качестве экстрагента.
Данный способ получения нибомицина был выбран нами за прототип.
Также известен способ культивирования Streptomyces hyalinum ATCC® 29817™ в жидкой среде (pH 7), содержащей (г/л): глицерин – 5, сахароза – 20, дрожжевой экстракт - 10, соевый гидролизат - 10, кукурузный экстракт - 5, хлорид кобальта десятиводный - 0,0001, вода - остальное. Конические колбы объемом 500 мл с 100 мл вышеописанной среды инкубируют на платформенном шейкере при непрерывном перемешивании (180 rpm) при 27°С в течение 120 часов (Патент US 2012/025898.0 A1). Полученную культуральную жидкость центрифугируют, фильтрат смешивают с бутанолом. Бутаноловый экстракт упаривают, добавляют гексан, центрифугируют, отделяют гексан-нерастворимую фракцию. Из полученной фракции производят экстракцию смесью хлороформ-метанол-вода (соотношение объемов 5:6:4) при тщательном перемешивании, отделяют самый нижний слой с последующим концентрированием его и сушкой под низким давлением. Полученный экстракт в дальнейшем подвергают дальнейшему многоэтапному разделению путем экстракции в системе жидкость-жидкость с применением смеси хлороформ-метанол-вода (соотношение объемов 5:6:4). В заключение производится финальная очистка полученных фракций с применением ВЭЖХ. Общий выход нибомицина при таком способе получения составляет 0,008%. Приведенный способ культивирования продуцента и получения антибиотика нибомицина, очень трудоемкий, длительный, затратный. Сложный состав ферментационной среды, многократные циклы экстракции органическими растворителями, многие из которых токсичны, финальные стадии хроматографической очистки - все это делает биосинтез нибомицина по данной методике - сложной и дорогостоящей процедурой. Данный способ получения нибомицина был выбран нами за прототип.
Раскрытие изобретения
Технической проблемой решаемой заявляемым изобретением является разработка простого способа получения нибомицина с высоким выходом продукта.
Техническая проблема решается способом получения антибиотика нибомицина путем культивирования продуцента Streptomyces iakyrus ВКПМ Ас-2084 в питательной среде, содержащей глюкозу, аспарагин, гидрофосфат калия при температуре 28±1°С с последующим выделением целевого продукта, при этом для культивирования используют питательную среду с рН 6,8-7,0 следующего состава (г/л):
глюкоза 10,0±2;
аспарагин 0,5±0,1;
гидроортофосфат калия 0,5±0,1;
вода - остальное,
а культивирование продуцента осуществляют без перемешивания или при перемешивании со скоростью не более 50 об/мин. в течение 10-14 суток. Выделение нибомицина осуществляют путем последовательной фильтрации через бумажные, а затем мембранные фильтры, после чего фракционируют на устойчивом и пригодном к многократному использованию селективном к антибиотику нибомицина сорбенте, полученную фракцию инкубируют до выпадения осадка, который отделяют центрифугированием, промывают дистиллированной водой для избавления от надосадочной жидкости с последующей сушкой в вакуумном концентраторе до постоянного веса. Предпочтительно в качестве селективного сорбента использовать сильносшитый полистирольный гидрофилизированный сорбент с диаметром 50-1000 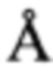 , десорбцией 20±3 об.% водным раствором ацетонитрила при нейтральном рН (5,5-8,5), в качестве мембранного фильтра - фильтр с диаметром пор не более 0,65 мкм, а в качестве бумажного фильтра - фильтр «белая лента». При этом инкубацию фракции проводят при +4±1°С в течении 12-24 часов.
, десорбцией 20±3 об.% водным раствором ацетонитрила при нейтральном рН (5,5-8,5), в качестве мембранного фильтра - фильтр с диаметром пор не более 0,65 мкм, а в качестве бумажного фильтра - фильтр «белая лента». При этом инкубацию фракции проводят при +4±1°С в течении 12-24 часов.
За счет оптимизации условий культивирования штамма Streptomyces iakyrus ВКПМ Ас-2084 - продуцента редкого и перспективного антибиотика нибомицина, и разработки новой методики выделения из культуральной жидкости антибиотика получают нибомицин высокой степени чистоты 99%, а именно:
1. подбор питательных сред и оптимальных условий культивирования, позволяет получить культуральную жидкость с содержанием нибомицина 15-25 мг/л (величины того же порядка, что и при способе биосинтеза выбранного нами за прототип), при минимальном количестве иных сопутствующих метаболитов (в частности, пигментов) (не более 1%);
2. разработка новой простой и экономически выгодной технологии выделения и очистки нибомицина с целью получения продукта высокой степени чистоты - 99%;
3. способ мониторинга и контроля за накоплением нибомицина в ферментационной среде при помощи спектрофотометрического исследования спектров поглощения культуральной жидкости в УФ-области.
Краткое описание чертежей
Изобретение поясняется следующими чертежами.
На фиг. 1 представлены спектры поглощения культуральной жидкости Streptomyces iakyrus ВКПМ Ас-2084 при росте в глюкозо-аспарагиновой среде: 0-ые (исходная  ) и 9-ые сутки культивирования (
) и 9-ые сутки культивирования ( ).
).
На фиг. 2 показан спектр поглощения нибомицина в УФ-диапазоне: ось ординат - поглощение, ось абсцисс - длина волны (нм).
На фиг. 3 показана временная динамика накопления нибомицина по спектрам поглощения ферментационной среды ( - исходная,
- исходная,  - 4 сутки,
- 4 сутки,  - 9 сутки,
- 9 сутки,  - 14 сутки,
- 14 сутки,  - 44 сутки).
- 44 сутки).
На фиг. 4 представлены результаты ВЭЖХ-анализа нибомицина, получаемого предлагаемым нами методом осаждения, в сочетании со спектром поглощения антибиотика в УФ-области.
Осуществление изобретения
В предлагаемом способе получения нибомицина культивируют продуцент Streptomyces iakyrus ВКПМ Ас-2084, выделенный из природных условий и хранящийся в Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИгенетика (ВКПМ, Москва, 1-й Дорожный пр., д. 1).
Штамм Streptomyces iakyrus Реб ВКПМ Ас-2084 был выделен при поверхностном посеве на среду, содержащую крахмал и нитрат (минеральный агар Гаузе 1), из гомогенизата рабочих особей муравьев Camponotus vagus. Образцы гнездового материала и живые особи муравьев-древоточцев Camponotus vagus были отобраны в Брянской области (государственный природный биосферный заповедник "Брянский лес", 52.440009 N, 34.126288 Е) в июле 2014 года.
Идентификация штамма Streptomyces iakyrus Ре6 ВКПМ Ас-2084 основывалась на анализе данных секвенирования нуклеотидной последовательности гена 16s рРНК и сопоставления этих данных с последовательностями, депонированными в базу GenBank (https://www.ncbi.nlm.nih.gov/genbank). Данный подход в настоящее время считается безусловно надежным для идентификации мицелиальных актинобактерий на уровне рода.
Штамм Streptomyces iakyrus ВКПМ Ре6 Ас-2084 характеризуется следующими культурально-морфологическими и физиолого-биохимическими признаками:
Культурально-морфологические признаки
Штамм ВКПМ Ас-2084 при росте на спектре твердых питательных сред, рекомендуемых для фенотипического описания стрептомицетов (Гаузе Г.Ф., Преображенская Т.П., Свешникова М.А., Терехова Л.П., Максимова Т.С. Определитель актиномицетов: роды Streptomyces, Streptoverticillium, Chainia. М.: Наука. 1983. 248 с.) образует:
хорошо развитый воздушный мицелий светло-серого, серого, желтовато-серого или белого цвета;
спороносцы спиральные (S), споры с гладкой оболочкой;
зрелые спороносцы содержат 10-50 спор в цепочке;
субстратный мицелий буроватый, бурый, коричневый, темно-коричневый;
растворимый пигмент бурый, коричневый, темно-коричневый;
меланоидные пигменты образует.
Физиолого-биохимические признаки
Штамм растет в аэробных условиях в диапазоне температур от +18 до +40°С, с оптимумом роста при 28±2°С.
Растет в диапазоне рН 6,0-9,0, оптимальная величина рН всех используемых сред составляет 7,2-7,7.
В качестве источника углерода утилизирует глюкозу, фруктозу, рамнозу, инозит, сахарозу, глицерин. Не использует арабинозу, лактозу, ксилозу, маннит, сорбит, целлюлозу. Крахмал гидролизует.
В качестве источника азота использует нитратные, аммонийные соединения, гидролизаты белков, аминокислоты. Обладает протеолитической активностью. Желатину разжижает, молоко пептонизирует.
Образует антибиотик нибомицин, активный в отношении грамположительных бактерий. Штамм ВКПМ Ас-2084 не патогенен.
Таким образом, на основании филогенетического родства и фенотипических признаков выделенный штамм Ре6 был отнесен к виду Streptomyces iakyrus и депонирован в коллекцию ВКПМ под номером Ас-2084.
Хранение и поддержание жизнеспособности штамма
Штамм можно хранить при +4°С и поддерживать путем пересева раз в 2-3 недели на плотные питательные среды, например, следующего состава: овсяная мука - 20 г, агар - 20 г, раствор микроэлементов - 1 мл, агар - 20 г, вода дистиллированная - 1 л (Гаузе и др., 1983).
Длительное хранение штамма при температуре от -20 до -70°С может быть обеспечено культивированием в жидкой питательной среде, содержащей глюкозу, гидролизат белков, дрожжевой экстракт, минеральные соли в течение 3-7 дней, разлив культуральной жидкости в специальные емкости для хранения при низких температурах с добавлением веществ-криопротекторов, соблюдая условия стерильности.
Пример. Штамм Streptomyces iakyrus ВКПМ Ре6 Ас-2084 культивируют в жидкой питательной среде следующего состава: глюкоза - 10 г, пептон - 10 г, гидролизат казеина - 2 г, дрожжевой экстракт - 2 г, NaCl - 6 г, вода - 1 л, при 28°С. Затем в 3-5 суточную культуральную жидкость в качестве криопротектора асептически вводят стерильный раствор 50% глицерола в объемном соотношении 1:1. Полученную смесь раскапывают по криопробиркам и помещают на хранение при температуре ниже -20°С.
В процессе роста на питательной среде, содержащей в качестве источника азота пептон, триптон или иные ферментативные белковые гидролизаты, многие стрептомицеты, в том числе Streptomyces iakyrus ВКПМ Ас-2084, образуют темноокрашенные пигменты - меланины, которые требуют дополнительных стадий очистки и использования органических растворителей. Кроме того, в средах, содержащих ферментативные гидролизаты, исходно содержится много пептидов, которые также затрудняют очистку и, кроме того, делают невозможным мониторинг накопления нибомицина в среде по спектрам поглощения в УФ-области.
Поэтому, предложено использование питательной среды, в которой источником азота служит аминокислота аспарагин, источником углерода - глюкоза. Данные ингредиенты позволяют получить бесцветную и прозрачную питательную среду, с минимальным поглощением в УФ-области (фиг. 1). В процессе роста в данной среде штамма Streptomyces iakyrus ВКПМ Ас-2084 с течением времени происходит накопление нибомицина, который можно идентифицировать в образцах культуральной жидкости по характерным пикам поглощения в УФ-области (фиг. 2). Это позволяет вести экспресс-мониторинг за накоплением целевого продукта в ферментационных сосудах (фиг. 3).
Процесс биосинтеза осуществляют в глубинных условиях при 28±2°С в течение не менее 240 ч в жидкой питательной среде с pH 6,5-6,7 следующего состава г/л: глюкоза 10,0±2; аспарагин 0,5±0,1; гидроортофосфат калия 0,5±0,1; вода - остальное.
Существенными преимуществами данной питательной среды являются:
во-первых, ее относительно низкая удельная стоимость, что делает ее более экономически выгодной по сравнению со средами, в состав которых входят ферментативные гидролизаты белков, растворимый крахмал и другие компоненты;
а, во-вторых, использование в качестве источника азота - аминокислоты аспарагина. При росте на данной среде штамм Streptomyces iakyrus ВКПМ Ас-2084 не образует темноокрашенных пигментов, осложняющих последующее выделения антибиотика, ферментационная среда в процессе роста не окрашивается и не мутнеет, что делает возможным наблюдать за накоплением нибомицина по спектрам поглощения культуральной жидкости в УФ-области.
Культивирование продуцента в вышеуказанной среде производят либо в статичных условиях (без перемешивания), либо при слабом встряхивании (не более 50 об/мин), которое не препятствует формированию биопленок продуцента на стенках ферментационных сосудов. Продуктивность штамма-продуцента, культивируемого в форме биопленок, в 2-4 раза выше, чем при образовании этим штаммом отдельных сферических микроколоний (табл. 1).

Антибиотик из культуральной жидкости выделяют путем хроматографического разделения. Вначале культуральную жидкость освобождают от клеток продуцента путем фильтрации через бумажные фильтры в условиях свободной гравитации. Затем пропускают ее через мембранные фильтры с диаметром пор не превышающим 0,65 мкм с использованием вакуумного насоса.
Очищенную от клеток культуральную жидкость наносят на колонку с молекулярным сорбентом на основе сополимера дивинилбензола/ гидрофильного мономера. Десорбцию проводят 20%-ным (по объему) раствором ацетонитрила в воде (допускается использование растворов с концентрацией 17-23%) в нейтральных условиях. При инкубации собранных элюатов при температуре +4±1°С в течении 12-24 часов происходит самопроизвольное выпадение из раствора кристаллов нибомицина. Осадок собирают центрифугированием, достаточным для уплотнения осадка и его отделения, отбрасывая супернатант. Затем осадок промывают дистиллированной водой, снова центрифугируют, отбрасывают супернатант - так не менее трех раз. Окончательно высушивают осадок в центрифужном вакуумном концентраторе до достижения постоянного веса при комнатной температуре.
Осадок возможно растворить только в концентрированных растворах соляной или трифторуксусной кислоты, и только затем - растворить в ДМСО. Полученный раствор можно использовать для УФ-спектроскопического и масс-спектрометрического подтверждения, что выделенное вещество является нибомицином (фиг. 4). Данные высокоэффективной жидкостной хроматографии свидетельствуют, что нибомицин, получаемый таким образом, обладает высокой степенью чистоты - 99%.
Антагонистические признаки.
Оценка антагонистического действия нибомицина, вырабатываемого штаммом Streptomyces iakyrus ВКПМ Ас-2084 проводилась с помощью репортерной системы JW 5503 ΔtolC -pDualrep2 (Остерман и др., 2016).
Пример 1.
Культивирование продуцента. Штамм Streptomyces iakyrus ВКПМ Ас-2084 наращивали в культуральных флаконах (Eppendorf Cell Culture Flasks, T-175) с вентилируемыми крышками, заполненных 50 мл среды следующего состава (г/л): глюкоза - 10,0; аспарагин - 0,5; гидроортофосфат калия - 0,5; вода - остальное, после автоклавирования рН составляло 6,8. Флаконы инкубировали статично, при 28°С в течение 10 суток. За указанный период на стенках ферментационных сосудов сформировалась зрелая физиологически активная биомасса в форме биопленки, в то время как культуральная жидкость на основании визуальной оценки цветности и мутности (по ГОСТ Р 57164-2016) оставалась бесцветной и прозрачной.
Культуральную жидкость освобождали от клеток путем последовательной фильтрации сначала через бумажные фильтры (обеззоленные фильтры "белая лента", соответствующие ГОСТ 12026-76), а затем через мембранные фильтры с диаметром пор 0,45 мкм в условиях разрежения, создаваемого вакуумным насосом.
Подготовка хроматографической колонки. Сорбент LPS-500-H (сополимер дивинилбензола/ гидрофильного мономера) в количестве 1 мл помещали в колонку для твердофазной экстракции, промывали 10 мл 15% водного раствора ацетонитрила, затем трижды промывали дистиллированной водой порциями по 10 мл.
Выделение целевого вещества. Через подготовленную и уравновешенную колонку в режиме гравитационного потока пропускали по 200 мл культуральной жидкости Streptomyces iakyrus ВКПМ Ас-2084, после чего проводили элюцию 20% водным раствором ацетонитрила (допускается использовать растворы 17-23% по объему), а затем промывали колонку 50% раствором ацетонитрила.
Фракцию, элюированную 20% ацетонитрилом, в течение 12-24 часов выдерживали при температуре +4°С, в результате чего выпадает белый осадок, который легко отделяется центрифугированием при 13000 об/мин (Eppendorf 5810R). Супернатант отбрасывали, осадок промывали дистиллированной водой, вновь центрифугировали и, таким образом, повторяли процедуру 3-5 раз. Промытый осадок сушили в вакуумном центрифужном испарителе (Thermofisher SpeedVac) при комнатной температуре, доводя до постоянного веса.
Полученное вещество не растворимо в воде, но растворимо в концентрированном растворе соляной или трифторуксусной кислоты, в дальнейшем полученный раствор можно растворять в ДМСО и использовать для исследований.
Результаты УФ-спектроскопии и масс-спектрометрического анализа показывают, что данное вещество является нибомицином. Данные высокоэффективной жидкостной хроматографии подтверждают, что нибомицин, получаемый таким образом, обладает высокой степенью чистоты - 99% (фиг. 4).
Штамм Streptomyces iakyrus ВКПМ Ас-2084 наращивали на средах, включающих глюкозу, аспарагин, гидроортофосфат калия и воду в количествах заявленного диапазона, рН которой после автоклавирования составляло 6,8-7,0, при этом выделенный из культуральной жидкости антибиотик нибомицин обладал степенью чистоты 99%.
Определение минимальной ингибирующей концентрации (МИК) нибомицина.
Определение минимальной действующей концентрации нибомицина было проведено в отношении двух штаммов E. coli: BW25513 (т.н. "дикий тип") и JW5503 ΔtolC (генетический конструкт). Штамм Е. coli ΔtolC является нокаутом по гену белка TolC, который ответственен за экспорт различных метаболитов из клетки, в том числе антибиотиков. Использование штамма ΔtolC позволяет снизить минимальную ингибирующую концентрацию и определять механизм действия антибиотиков, которые не действуют на обычный штамм Е. coli дикого типа (YS Polikanov, IA Osterman, Т. Szal, VN Tashlitsky, MV Serebryakova, P. Kusochek, D. Bulkley, IA Malanicheva, ТА Efimenko, OV Efremenkova, AL Konevega, KJ Shaw, AA Bogdanov, MV Rodnina, OA Dontsova, AS Mankin, ТА Steitz, and PV Sergiev. Amicoumacin A inhibits translation by stabilizing mRNA interaction with the ribosome. Molecular Cell, 2014. 10.1016/j.molcel.2014.09.020).
Установление минимальной действующей концентрации проводят методом предельных разведений в жидкой среде LB (г/л: триптон - 10, дрожжевой экстракт - 5, NaCl - 10) (Wiegand, I., Hilpert, K. and Hancock, R.E. (2008) Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nat. Protoc, 3, 163-175.). Суспензии клеток тест-организмов с начальной концентрацией 5×105 кл/мл раскапывают по 200 мкл в лунки 96-местного микропланшета. Затем в те же лунки вносили нибомицин в виде серийных разведений в ДМСО. Микропланшеты в закрытом виде инкубировали при 37°С на платформенном шейкере в течение 16-20 часов. Оптическую плотность суспензии тест-организмов при 590 нм (OD590) в каждой лунке измеряли с помощью микропланшетного сканера, и самая низкая концентрация нибомицина, при которой наблюдается отсутствие роста тест-культур, принимается за минимальную ингибирующую концентрацию (МИК).
Для генетически модифицированного штамма E. coli ΔtolC - МИК нибомицина составила 0,4 мг/л, а для кишечной палочки "дикого типа" BW25513 потребовалось более чем 10 мг/л. Это согласуется с данными о том, что грамотрицательные бактерии слабо восприимчивы к действию нибомицина благодаря действию эффлюкс-систем (Richter М., Drown B.S., Riley А.Р., Garcia A., Tomohiro Shirai Т., Svec RL, Hergenrother P.J. Predictive compound accumulation rules yield a broad-spectrum antibiotic. doi:10.1038/nature22308).
Таким образом, заявляемым способом получают нибомицин с чистотой не менее 99% и обладающий активностью в отношении грамположительных бактерий, в том числе хинолон-устойчивых штаммов Staphylococcus aureus (MRSA и VRSA).
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм Streptomyces iakyrus Pe6 ВКПМ Ас-2084 - продуцент антибиотика нибомицина | 2018 |
|
RU2696029C1 |
| Штамм Amycolatopsis rifamycinica - продуцент антибиотика тетраценомицина Х | 2019 |
|
RU2724537C1 |
| Штамм Streptomyces virginiae - продуцент вирджиниамицина и способ получения вирджиниамицина | 2016 |
|
RU2637857C1 |
| Штамм Amycolatopsis orientalis - продуцент антибиотика диметилванкомицина и способ получения антибиотика | 2016 |
|
RU2633511C1 |
| Штамм Streptomyces olivaceiscleroticus - продуцент противоопухолевого антибиотика оливомицина | 2021 |
|
RU2761482C1 |
| ШТАММ Amycolatopsis orientalis - ПРОДУЦЕНТ АНТИБИОТИКА ЭРЕМОМИЦИНА И СПОСОБ ПОЛУЧЕНИЯ ЭРЕМОМИЦИНА | 2016 |
|
RU2621866C1 |
| Штамм Streptomyces tendae - продуцент противобактериального антибиотика ИНА 5812 | 2019 |
|
RU2710733C1 |
| Штамм Amycolatopsis umgeniensis - продуцент антибиотика эремомицина | 2018 |
|
RU2689699C1 |
| Штамм Streptomyces rochei MP21 - продуцент антибиотика кирромицина | 2022 |
|
RU2798207C1 |
| ШТАММ Amycolatopsis orientalis ВКПМ-Ас-807-ПРОДУЦЕНТ ЭРЕМОМИЦИНА | 2007 |
|
RU2352631C2 |


Изобретение относится к биотехнологии, в частности к производству антибиотика нибомицина. Осуществляют культивирование штамма-продуцента Streptomyces iakyrus ВКПМ Ас-2084. Штамм выращивают на питательной среде, содержащей глюкозу, аспарагин и гидроортофосфат калия и воду при заданном содержании компонентов. Осуществляют последовательную фильтрацию культуральной жидкости через бумажные, а затем мембранные фильтры. Отфильтрованную культуральную жидкость фракционируют на селективном сорбенте с последующей десорбцией 20±3%-ным водным раствором ацетонитрила при нейтральном рН и инкубированием элюата до выпадения кристаллов нибомицина. Изобретение позволяет повысить выход нибомицина. 3 з.п. ф-лы, 4 ил., 1 табл.,1 пр.
1. Способ получения антибиотика нибомицина путем культивирования продуцента Streptomyces iakyrus ВКПМ Ас-2084 в питательной среде, содержащей глюкозу, аспарагин, гидрофосфат калия, при температуре 28±1°С с последующим выделением целевого продукта, отличающийся тем, что для культивирования используют питательную среду с рН 6,8-7,0 следующего состава (г/л):
культивирование продуцента осуществляют без перемешивания в течение 10-14 суток, а выделение нибомицина осуществляют путем последовательной фильтрации через бумажные, а затем мембранные фильтры, после чего фракционируют на селективном сорбенте, полученную фракцию инкубируют до выпадения осадка, который отделяют центрифугированием, промывают дистиллированной водой для избавления от надосадочной жидкости с последующей сушкой в вакуумном концентраторе до постоянного веса.
2. Способ по п. 2, отличающийся тем, что в качестве селективного сорбента используют сильносшитый полистирольный гидрофилизированный сорбент с диаметром пор 50-1000 Å, десорбцией 20±3 об.% водным раствором ацетонитрила при нейтральном рН.
3. Способ по п. 2, отличающийся тем, что в качестве мембранного фильтра используют фильтр с диаметром пор не более 0,65 мкм.
4. Способ по п. 2, отличающийся тем, что инкубацию фракции проводят при +4±1°С в течение 12-24 часов.
| HIROSHI NAGANAWA, TAKASHI WAKASHIRO et.al., Deoxynybomycin from a Streptomyces, J | |||
| Antibiot (Tokio), 1970 Jul; 23(7), p | |||
| Станок для нарезания зубьев на гребнях | 1921 |
|
SU365A1 |
| JOSEPH A | |||
| POPE., et | |||
| al., Applications of thin layer chromatography, high performance liquid chromatography and mass spectrometry in the fermentation and isolation of the antibiotic nybomycin, Journal of Industrial | |||
Авторы
Даты
2020-04-15—Публикация
2018-12-07—Подача