[0001] В настоящей заявке испрашивается приоритет по китайской заявке на патент № 201610876752.3, озаглавленной "ПРИМЕНЕНИЕ IDHP В ПОЛУЧЕНИИ ЛЕКАРСТВЕННОГО СРЕДСТВА ИЛИ МЕДИЦИНСКОГО ПРОДУКТА ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ КОРОНАРНОГО АТЕРОСКЛЕРОЗА", поданной в SIPO 8 октября 2016 г., и полное содержание которой включено в настоящую заявку посредством ссылки.
Область техники, к которой относится изобретение
[0002] Настоящее раскрытие относится к новому применению β-(3,4-дигидроксифенил)-α-гидроксиизопропилпропионата (IDHP), в частности, к применению IDPH для изготовления лекарственного средства или лечебного питания для профилактики и лечения заболеваний, связанных с атеросклерозом коронарных артерий.
Предпосылки создания изобретения
[0003] β-(3,4-Дигидроксифенил)-α-гидроксиизопропилпропионат (IDHP) представляет собой активное соединение, отобранное из большого количества метаболитов и серий их модификаций в процессе исследования пилюль Danshen, таблеток Guanxin Danshen, напитка Danshen и других рецептурах соединения Даньшэнь и пары трав Jun-Shi с использованием ВЭЖХ-МС, ГХ-МС, ГХ-FTIR(инфракрасная спектроскопия на основе преобразования Фурье), МС, ЯМР и других технических методов метаболомики. IDHP также можно синтезировать.
Сущность изобретения
[0004] Авторы изобретения исследовали роль IDHP в ингибировании агрегации тромбоцитов, стимуляции ангиогенеза и т.д., что обеспечило ценную теоретическую основу для разработки новых лекарственных средств и продуктов лечебного питания для профилактики и лечения заболеваний, связанных с коронарным атеросклерозом.
[0005] Атеросклероз коронарных артерий представляет собой тип заболевания, вызываемого накоплением бляшек внутри коронарной артерии, что вызывает стеноз или закупорку просвета сосудов, что приводит к ишемии, гипоксии или некрозу. Распространенным заболеванием, связанным с атеросклерозом коронарных сосудов, является ишемическая болезнь сердца, инсульт и инфаркт миокарда (ИМ). Основной патогенез ишемической болезни сердца тесно связан с нестабильной коронарной атеросклеротической бляшкой и образованием тромбоза. Агрегация тромбоцитов является важным фактором, приводящим к тромбозу, поэтому антитромбоцитарная терапия играет важную роль в профилактике и лечении ишемической болезни сердца. Инсульт относится к заболеванию высокого риска, при котором у пациента с цереброваскулярным заболеванием различные факторы будут вызывать стеноз, окклюзию или разрыв церебральной артерии, что приводит к острой дисфункции мозгового кровообращения и клинически проявляется как преходящая или постоянная дисфункция головного мозга. Антитромбоцитарная терапия играет важную роль в первичной и вторичной профилактике инсульта и в настоящее время признана одним из трех основных методов лечения (хирургическое вмешательство, антикоагуляция и меры, направленные против агрегации тромбоцитов). Кроме того, возникновение и лечение заболеваний, связанных с атеросклерозом коронарных артерий тесно связаны с ангиогенезом. Патологическая неоваскуляризация часто происходит в атеросклеротических бляшках, что может способствовать развитию атеросклеротических поражений и даже вызвать кровоизлияние в бляшку и разрыв бляшки и связанные с этим осложнения. Плотность неоваскуляризации вокруг места образования инфаркта при ишемическом инсульте напрямую связана с выживаемостью пациентов с ишемическим инсультом, и стимулирование ангиогенеза после ишемического инсульта способствует сохранению области "ишемической полутени". Ангиогенез также является ключевым процессом в коронарной реперфузии и репарации ишемически поврежденного миокарда. Кроме того, проангиогенез играет значительную роль после выздоровления от инфаркта миокарда. Исследования авторов изобретения показывают, что IDHP может значительно ингибировать ADP или коллаген-индуцированную агрегацию тромбоцитов человека, и в то же время IDHP может значительно стимулировать ангиогенез в первичных эндотелиальных клетках пупочной вены человека (HUVEC). Этот результат указывает на то, что IDHP можно использовать для получения лекарственных средств для профилактики и лечения заболеваний, связанных с атеросклерозом коронарных артерий.
[0006] Авторы изобретения обнаружили, что IDHP может значительно ингибировать ADP или коллаген-индуцированную агрегацию тромбоцитов человека, что становится основой для использования IDHP в разработке лекарственных средств против агрегации тромбоцитов.
[0007] Авторы изобретения обнаружили, что IDHP может значительно стимулировать ангиогенез в первичных эндотелиальных клетках пупочной вены человека (HUVEC), и IDHP также может значительно способствовать росту межсегментарных сосудов и хвостовых продольных кровеносных сосудов данио-рерио, это указывает на то, что IDHP можно использовать для получения лекарственных средств для стимуляции ангиогенеза.
[0008] IDHP может значительно ингибировать агрегацию тромбоцитов и стимулировать ангиогенез у человека, улучшать циркуляцию крови, и, таким образом, его можно использовать для лечения сосудистой деменции.
[0009] При помощи испытаний на острую и хроническую токсичность и экспериментов с гемолизом на мышах авторы изобретения обнаружили, что безопасность IDHP относительно высока. В сочетании с вышеуказанными данными активности, IDHP можно использовать для разработки продуктов лечебного питания для профилактики и лечения атеросклероза коронарных артерий, агрегации тромбоцитов, стимуляции ангиогенеза и профилактики и лечения сосудистой деменции.
[0010] Авторы изобретения обнаружили, что IDHP является веществом человеческого происхождения. При приеме IDHP можно поддерживать гомеостаз организма, чтобы достичь цели профилактики и лечения заболеваний, связанных с коронарным атеросклерозом и сосудистой деменцией.
Краткое описание чертежей
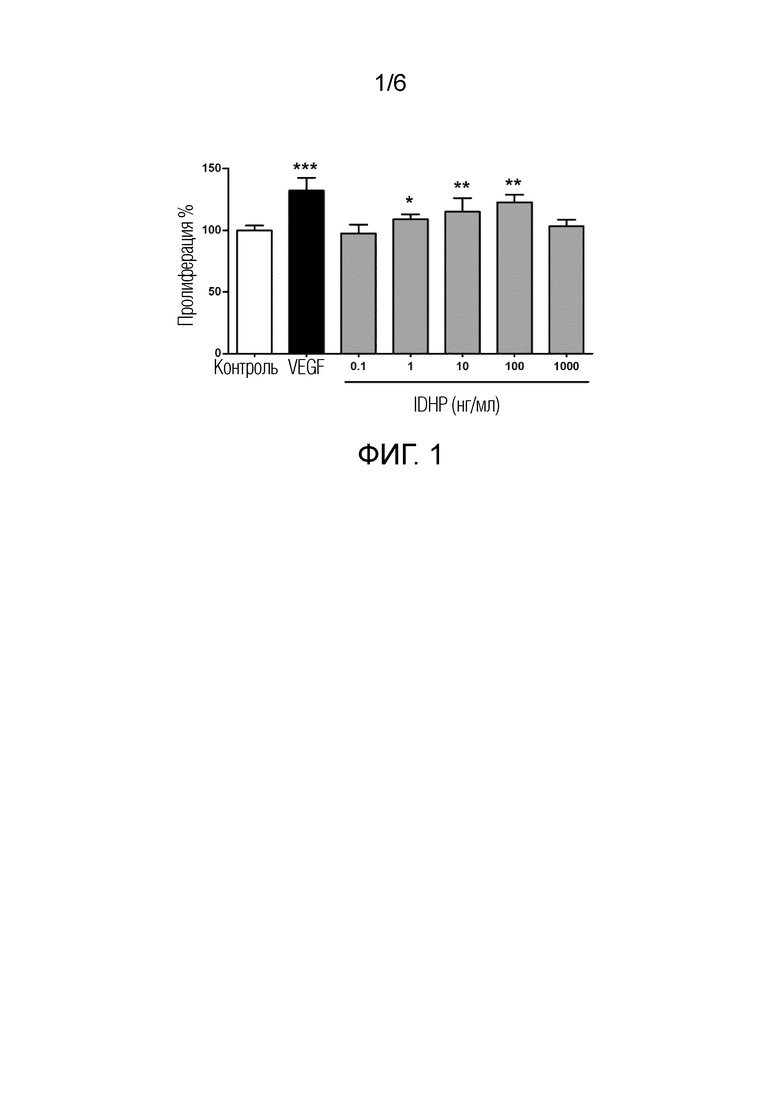
[0011] Фиг. 1 показывает эффект различных концентраций IDHP на пролиферацию эндотелиальных клеток пупочной вены человека;
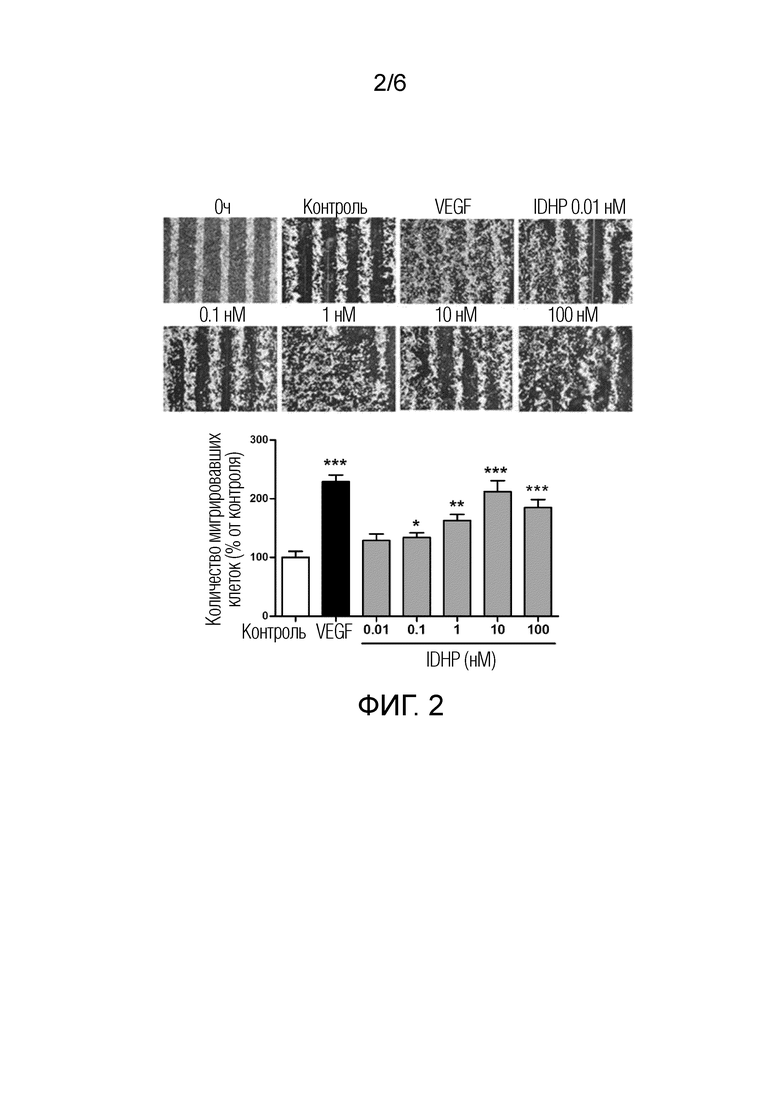
[0012] Фиг. 2 показывает эффект различных концентраций IDHP на миграцию эндотелиальных клеток пупочной вены человека;
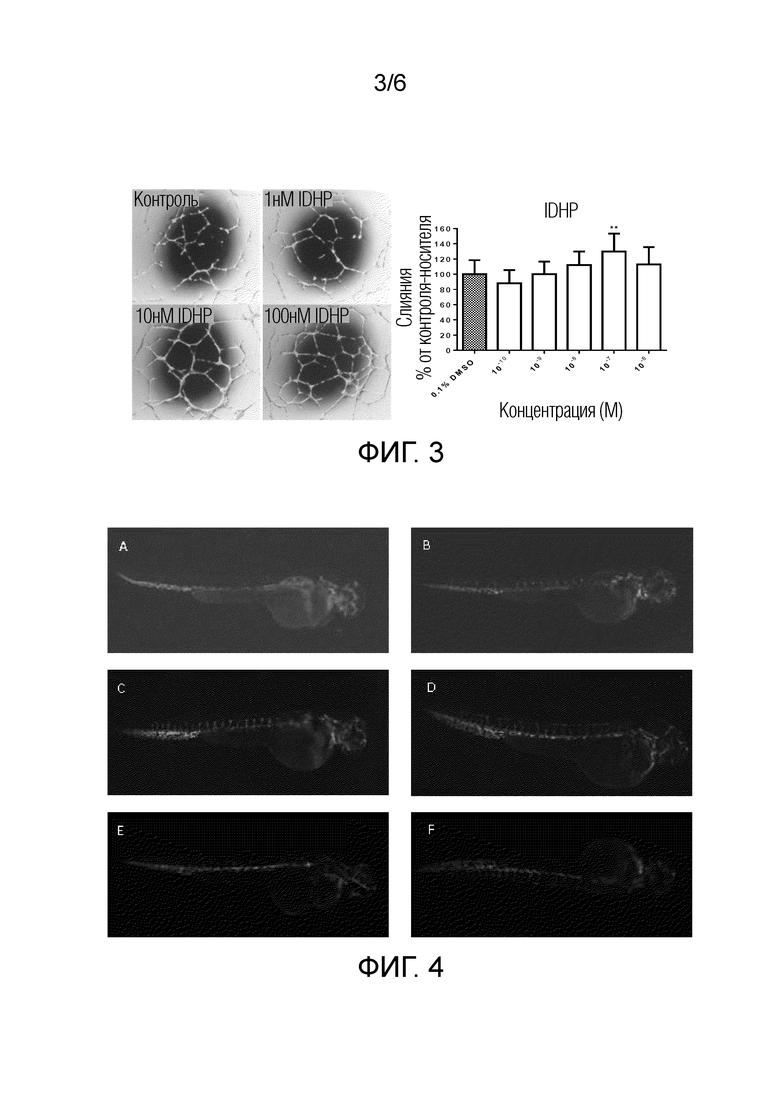
[0013] Фиг. 3 показывает эффект различных концентраций IDHP на образование трубочек эндотелиальных клеток пупочной вены человека;
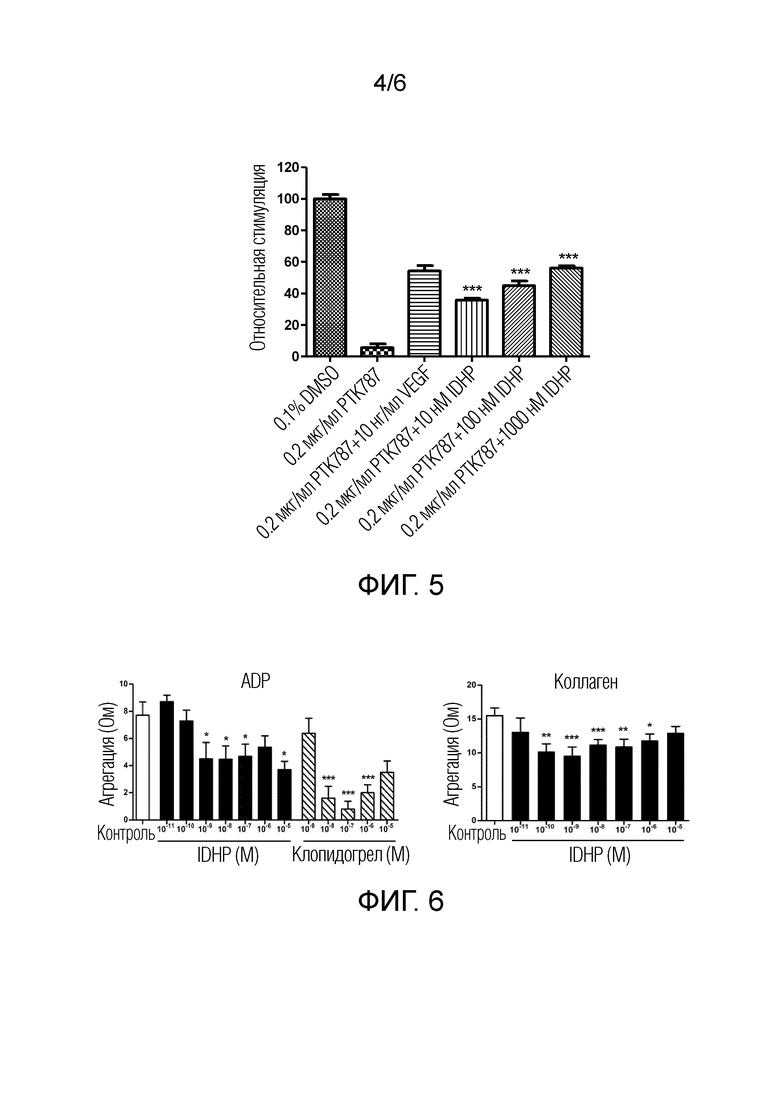
[0014] Фиг. 4 показывает эффект IDHP на рост межсегментарных сосудов данио-рерио, где: A, PTK 787; B, 0,01 мкМ IDHP; C, 0,1 мкМ IDHP; D, 1,0 мкМ IDHP; E, 10,0 мкМ IDHP; F, 10 нм VEGF;
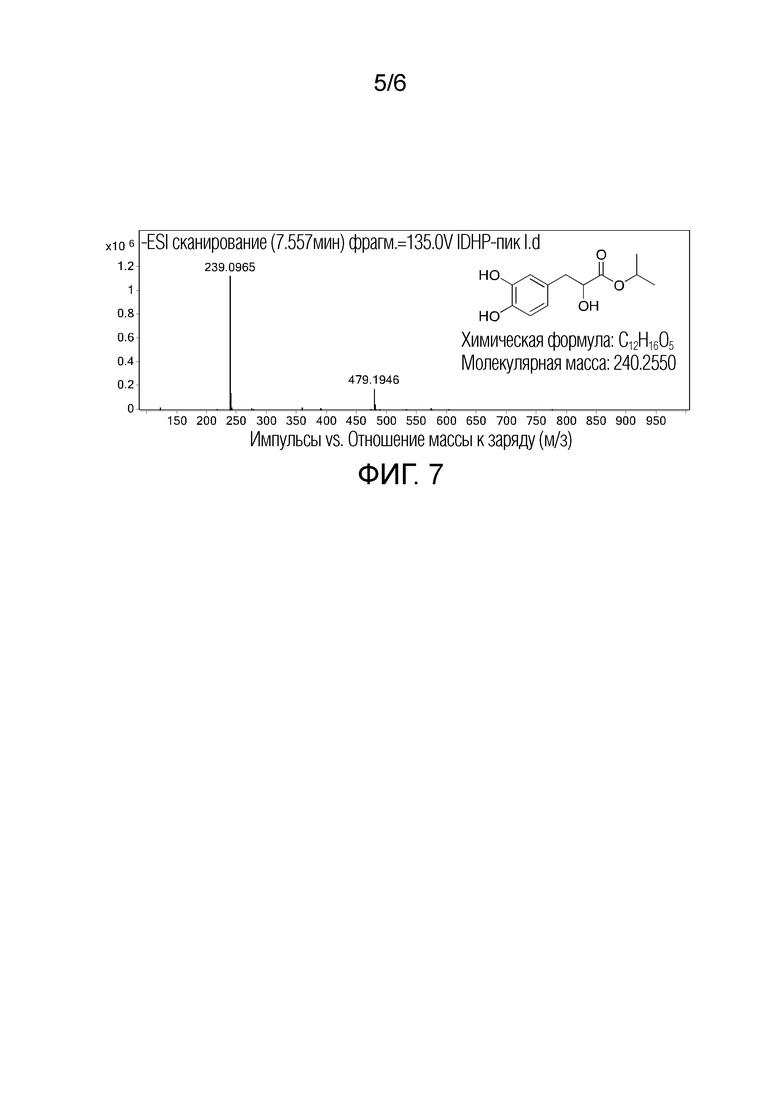
[0015] Фиг. 5 показывает результат роста межсегментарных сосудов, стимулируемого IDHP, у данио-рерио;
[0016] Фиг. 6 показывает эффект IDHP на ADP и коллаген- индуцируемую нормальную агрегацию тромбоцитов у человека (n=16);
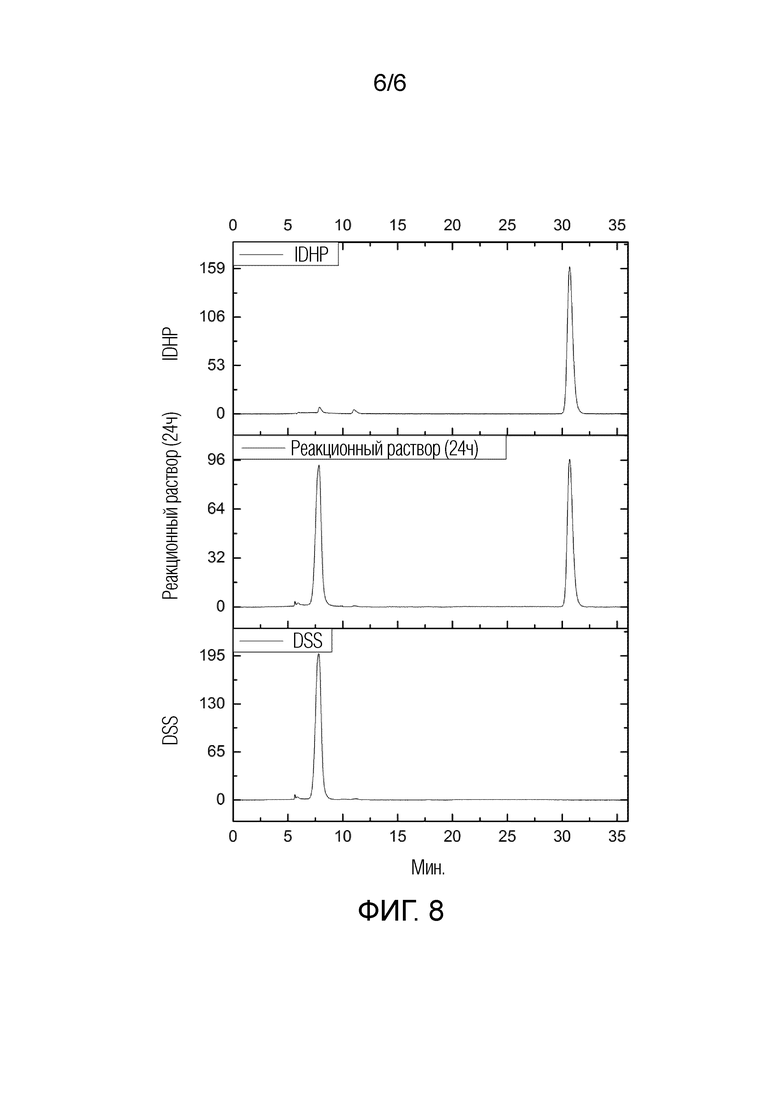
[0017] Фиг. 7 показывает идентификацию IDHP при помощи масс-спектра;
[0018] Фиг. 8 показывает идентификацию IDHP жидкостной хроматографией.
Подробное описание изобретения
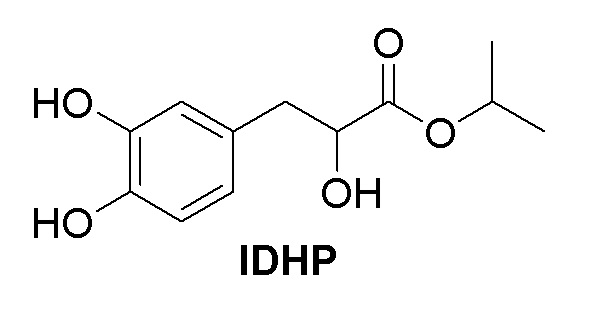
[0019] Структура соединения IDHP по настоящему изобретению показана в следующей формуле, и способ его получения может быть отнесен к CN 200410026205,3, но не ограничивается этим описанием в литературе.
[0020] Продукты лечебного питания, указанные в настоящем раскрытии, могут представлять собой мягкую капсулу, капельную пилюлю, эмульсию, таблетку, спрей и т.д.
Пример 1: IDHP промотирует ангиогенез культивируемых эндотелиальных клеток пупочной вены человека (HUVEC) in vitro
1.1 Детекция пролиферации эндотелиальных клеток пупочной вены человека, стимулируемой IDHP - метод CCK-8
[0021] Эндотелиальные клетки пупочной вены человека высевали в 96-луночный планшет с плотностью примерно 2500 клеток/лунка. Затем клетки культивировали в течение 24 часов, среду меняли на свежую среду, содержащую лекарственное средство, 100 мкл/лунка, и клетки продолжали культивировать в течение 48 часов. За 2 часа до окончания обработки лекарственным средством в культуральную среду в темноте добавляли реагент CCK-8, 10 мкл на лунку. Культивирование продолжали в течение 2 часов, а затем определяли поглощение при 450 нм при помощи микропланшет-ридера для расчета процента пролиферации клеток. Результат показан на Фиг. 1. По сравнению с нулевой контрольной группой, IDHP значительно стимулировал пролиферацию эндотелиальных клеток сосудов при концентрации от 10-9 до 10-7 M (P < 0,01).
1.2 Детекция миграции эндотелиальных клеток пупочной вены человека (HUVEC), стимулируемой IDHP - метод нанесения царапин
[0022] Эндотелиальные клетки высевали на покровное стекло, предварительно покрытое желатином, в 24-луночном планшете с плотностью примерно 105 клеток/лунка. Затем клетки, прикрепившиеся к покровному стеклу и достигшие конфлюенции, помещали в бессывороточную среду на 4 часа. Использовали изготовленный на месте инструмент, чтобы сделать царапину на покровном стекле с клетками. Покровное стекло дважды промывали PBS и добавляли среду, содержащую лекарственное средство, 600 мкл/лунка. Контрольную группу немедленно фиксировали ледяным метанолом в точке времени ноль; остальные клетки культивировали в течение 16 часов и затем фиксировали ледяным метанолом. Изображения получали под микроскопом и подвергали статистическому анализу. Результат (Фиг. 2) показывает, что IDHP может стимулировать миграцию эндотелиальных клеток пупочной вены человека (HUVEC) дозозависимым образом в диапазоне концентраций от 10-10 до 10-7 M.
1.3 Детекция образования трубочек эндотелиальных клеток пупочной вены человека (HUVEC), стимулируемого IDHP - метод с использованием матригеля
[0023] Наконечники для пипеток и 96-луночный планшет предварительно охлаждали при -20°C. Матригель помещали на лед и расплавляли и затем добавляли в предварительно охлажденный 96-луночный планшет (60 мкл/лунка). Избегали образования пузырьков воздуха. Планшет помещали на лед на 5 минут для выравнивания матригеля и затем помещали в инкубатор для клеточных культур на 30 минут для затвердевания. Эндотелиальные клетки добавляли в лунки (5×104 клеток/лунка), содержащие гель матригель, и добавляли свежую среду, содержащую различные концентрации лекарственного средства, инкубировали при 37°C в течение 8 часов. Планшет наблюдали под микроскопом, 5 областей наблюдения выбирали в положениях 0, 3, 6, 9 часов и центре каждой лунки, наблюдали количество трубочек и целостность трубчатой структуры и получали изображения. Результат показывает, что, по сравнению с контрольной группой Ctrl, IDHP значительно стимулировал образование трубочек первичных эндотелиальных клеток пупочной вены человека (HUVEC), указывая на то, что IDHP обладает активностью стимуляции ангиогенеза in vitro.
Пример 2 IDHP промотирует ангиогенез у трансгенных данио-рерио
[0024] Трансгенных Tg (VEGFR2:GFP) данио-рерио культивировали в стандартных условиях освещения 14 часов света/10 часов темноты при 28°C. Здоровых и зрелых рыбок данио-рерио помещали в контейнер для разведения в соотношении самок и самцов 1/1 или 1/2 для спаривания. Оплодотворенные яйцеклетки получали в 9-10 часов следующего дня. Оплодотворенные яйцеклетки стерилизовали и промывали, затем переносили в среду для культивирования эмбрионов данио-рерио и культивировали при 28°C.
[0025] Раствор лекарственного средства добавляли в 24-луночный культуральный планшет и через 24 часа после оплодотворения эмбрионы осторожно переносили в лунки, 8-10 на лунку, и культуральную среду добавляли до общего объема 2 мл, чтобы убедиться, что конечная концентрация DMSO в среде не превышала 1%. После 24-часовой обработки лекарственным средством эмбрионы наблюдали под флуоресцентным микроскопом, подсчитывали общее количество межсегментарных сосудов (ISV) в туловище и хвосте, и рассчитывали относительную скорость генерации ISV в каждой группе введения. Дисперсионный анализ между группами выполняли с использованием программного обеспечения SPSS.
[0026] Результат показывает, что IDHP при концентрациях 0,01, 0,1 и 1,0 мкМ, соответственно, значительно стимулировал рост межсегментарных сосудов и хвостовых продольных кровеносных сосудов у рыбок данио-рерио (Фиг. 4) при значительном увеличении общего количества и длины кровеносных сосудов (Таблица 1). В соответствии с формулой: относительная скорость генерации (%)=(общая длина кровеносных сосудов в группе лечения лекарственным средством - общая длина кровеносных сосудов в контрольной группе PTK787) ÷ общее кровяное давление нормальной контрольной группы ×100, вычисляли относительную скорость генерации, и результат показал дозозависимый эффект от лечения лекарственным средством (Фиг. 5).
Промотирующий эффект IDHP на рост ISV данио-рерио
Пример 3 IDHP ингибирует нормальную агрегацию тромбоцитов человека, индуцированную ADP и коллагеном
[0027] Образцы цельной крови здоровых добровольцев собирали в пробирки с антикоагулянтом и центрифугировали при 800 g в течение 5 минут при комнатной температуре. Светло-желтый супернатант представлял собой обогащенную тромбоцитами плазму (PRP); оставшийся раствор далее центрифугировали при 4000 g в течение 10 минут при комнатной температуре, и полученный супернатант представлял собой обедненную тромбоцитами плазму (PPP).
[0028] PRP доводили до 3×105 тромбоцитов/мкл при помощи PPP, 300 мкл полученной PRP добавляли к 30 мкл PBS или различных концентраций IDHP и инкубировали при 37°C в течение 3 минут в аппарате для коагуляции крови. Для инициирования реакции агрегации тромбоцитов добавляли коллаген или ADP при конечной концентрации 3 мкмоль/л. Ингибирующее действие IDHP и клопидогрела на агрегацию тромбоцитов определяли турбидиметрией. Результат на Фиг. 6 показывает, что клопидогрел значительно ингибировал ADP-индуцированную агрегацию тромбоцитов в измеренном диапазоне концентраций (p < 0,001); по сравнению с группами которым вводили только ADP или только коллагеном (Ctrl), IDHP соответственно и значительно ингибируют ADP- или коллаген-индуцированную агрегацию тромбоцитов, и ингибирующий эффект на коллаген-индуцированную агрегацию тромбоцитов был более значительным(P < 0,001).
Пример 4 Токсикологическое исследование IDHP
4.1 Испытание на острую токсичность у мышей с быстрым введением
[0029] Использовали шестьдесят мышей, половина самцов и половина самок, и их случайным образом разделяли на 6 групп. IDHP формулировали в шести концентрациях с использованием физиологического раствора: 3,145%, 2,68%, 2,4%, 2%, 1,875% и 1,6%. Интервал между концентрациями составлял 1:0,9. После того как животные голодали в течение 12 часов, каждую группу подвергали внутривенному введению, объем составлял 20 мл/кг, и введение завершали в течение 5 секунд для каждого животного. Дозы для шести групп составляли 629 мг/кг, 530 мг/кг, 480 мг/кг, 400 мг/кг, 375 мг/кг, и 320 мг/кг, соответственно. После внутривенного введения у животного отмечали затруднение дыхания, учащенное сердцебиение, подергивания и конвульсии, за которыми следовали замедление движений и лежание на земле. Признаки отравления усиливались с увеличением дозы; мертвые животные в основном умерали в течение 1 минуты после введения, а выжившие животные возвращались к норме через 10 минут. Мертвых мышей подвергали вскрытию, наблюдали невооруженным глазом, не было никаких нарушений в жизненно важных органах, таких как сердце, печень, селезенка, легкие, почки, мозг, желудок или кишечник, LD50 измеряли по методу Блисса, и значение составляло 424 ± 58 мг/кг, 95% доверительный интервал составлял от 370 до 486 мг/кг, как показано в Таблице 2.
LD50 для IDHP, измеренная по методу Блисса
мг/кг
(×10-6)
Базовая смертность: 0%
Индекс значимости: G=0,1760; X50=-0,3722; Sx=0,0158; G относительно мал, значение опускали
Проверка неоднородности: Chi2=6,90; Chi2,05=9,64; Sb=2,7993; Отсутствие неоднородности
Формула уравнения регрессии: Y(пробит)=9,8687+13,0795×log(D); r=0,8716
LD50=424,4 ± 39,7 (мг/кг)
Коррекция неоднородности Феллера: Sx=0,0229; Sb=3,6778
LD50=424,4 ± 57,9 (мг/кг)
95% доверительный интервал составлял от 370,4 до 486,2 мг/кг.
4.2 Тест на острую токсичность у мышей при медленном введении
[0030] После помещения в лабораторию на 1 день, отбирали испытуемых мышей с определенной массой тела и случайным образом разделяли на группы в соответствии с массой тела и полом, по 10 для каждой группы, половина самцов и половина самок. В соответствии с результатом предварительного измерения, абсолютная летальная доза составила 2,4 г/кг. Введение осуществляли в хвостовую вену, дозу для мышей рассчитывали в соответствии с массой тела. Дозы составляли 2,4 г/кг, 2,2 г/кг, 2,0 г/кг и 1,8 г/кг соответственно, и рассчитывали скорость доставки лекарственного средства. Введение завершали в течение 10 минут. Реакции мышей наблюдали после введения, и смерть мышей регистрировали в течение 14 дней.
[0031] Основными токсическими реакциями после внутривенного введения были центральное торможение, дыхательная недостаточность и т.д. Бóльшая часть смертей происходила во время введения. Никаких аномальных изменений в анатомии обнаружено не было. После 14 дней наблюдения вычисляли уровень смертности мышей. LD50 измеряли по методу Блисса, и значение составляло 2,048 г/кг ± 0,085 г/кг, 95% доверительный интервал составлял от 1,965 до 2,135 г/кг, результат показан в Таблице 3:
LD50 для IDHP, измеренное по методу Блисса у мышей при введении через хвостовую вену
4.3 Анализ гемолиза
[0032] Артериальную кровь домашнего кролика собирали, удаляли фибрин, эритроциты промывали физиологическим раствором и затем смешивали с 2%-ным физиологическим раствором эритроцитов. Тест проводили в соответствии с Таблицей 4, четыре параллельных лабораторных пробирки в каждой группе.
[0033] После вышеуказанной процедуры пробирки помещали в водяную баню при 37±0,5°С, одну пробирку из каждой группы отбирали через 0,5, 1, 2 и 3 часа соответственно, центрифугировали при 3000 об/мин в течение 15 минут. Наблюдали гемолиз эритроцитов, в это же время морфологию эритроцитов наблюдали под световым микроскопом.
[0034] Результат теста показывает, что эритроциты были интактными, выраженного гемолиза не было, что свидетельствует о том, что IDHP не обладает эффектом гемолиза.
Пример 5: Эндогенное исследование IDHP
[0035] Катализируемый липазой синтез IDHP из изопропанола и Даншенсу.
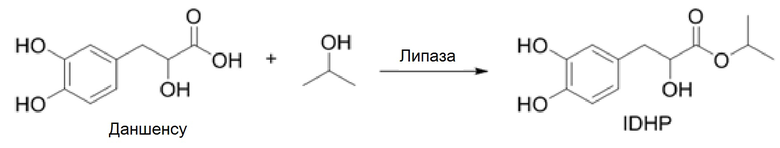
[0036] Что касается конкретного осуществления, ссылаются, но не ограничиваясь этим, на следующее решение:
[0037] Даншенсу (5,0 мг, 0,025 ммоль), изопропанол (0,3 мг, 0,005 ммоль), воду (1,5 мл) и липазу (5 мг) закрывали, помещали в шейкер (220 об/мин) и инкубировали при 37°C в течение 24 часов. Отбирали 100 мкл реакционного раствора, добавляли 100 мкл этилацетата и встряхивали в течение 20 секунд. Органическую фазу подвергали жидкостной хроматографии и масс-спектрометрии. Масс-спектрометрические данные ([M-1]=239,0965) показаны на Фиг. 7; данные жидкостной хроматографии показаны на Фиг. 8.
[0038] Условия жидкостной хроматографии были следующими: метанол:0,2% водный раствор муравьиной кислоты=3:7; скорость потока: 0,6 мл/мин; хроматографическая колонка: C18 (zorbax), 250 мм, 5 мкм, 4,6 мм (внутренний диаметр); температура колонки: 25°С.
[0039] Вместе с предыдущими исследованиями авторов изобретения, в которых было обнаружено, что Даншенсу является веществом, происходящим из организма человека, также липаза широко присутствует в тканях животных, растений и микроорганизмов (таких как плесень, бактерии), содержащих жиры, а организм человека содержит изопропанол, предполагая, что IDHP является эндогенным веществом человеческого организма.
Пример 6: Эмульсия IDHP
[0040] Формула эмульсии представляла собой следующую: IDHP 10,0 г, витамин E 3,0 г, рафинированная соя 200,0 г, олеиновая кислота 15,0 г, очищенный белок лецитин 25,0 г, вода для инъекций около 900 мл, глицерин 2,0 г.
Пример 7: Капельная пилюля IDHP
[0041] IDHP: 10,4 г, крахмал: 6,3 г, натрий карбоксиметилкрахмал: 1,8 г, полиэтиленгликоль (молекулярная масса 6000): 26,5 г. В процессе получения прописанное количество IDHP и полиэтиленгликоля 6000 нагревали до 80°C для расплавления, а затем добавляли крахмал и натрий карбоксиметилкрахмал, хорошо перемешивали, добавляли по каплям в жидкий парафиновый охладитель (от 1 до 5°С) для получения 1000 пилюль, 45 мг на пилюлю. Следы масла на поверхности удаляли с получением конечного продукта.
[0042] Настоящее изобретение было подробно описано выше, включая его предпочтительные варианты осуществления. Однако следует понимать, что, принимая во внимание то, что раскрыто в настоящем изобретении, специалист в данной области техники может внести изменения и/или улучшения в настоящее изобретение в пределах сущности и объема изобретения, которые также входят в объем настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| 4-ФТОР-N-ИНДАН-2-ИЛБЕНЗАМИД И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКОГО АГЕНТА | 2002 |
|
RU2308946C2 |
| ПРИМЕНЕНИЕ ФЛАВОЛИГНАНОВ ДЛЯ ПОДАВЛЕНИЯ ИЗБЫТОЧНОЙ И ПАТОЛОГИЧЕСКОЙ ПРОЛИФЕРАЦИИ ЭНДОТЕЛИЯ СОСУДОВ | 2005 |
|
RU2291706C1 |
| ЛЕЧЕНИЕ ГЛАЗНЫХ БОЛЕЗНЕЙ | 2007 |
|
RU2472523C2 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2008 |
|
RU2485971C2 |
| СПОСОБ ОЦЕНКИ АНГИОГЕННОГО ПОТЕНЦИАЛА ПРОГЕНИТОРНЫХ КЛЕТОК У БОЛЬНЫХ СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ | 2011 |
|
RU2548801C2 |
| ПРИМЕНЕНИЕ о-АТФ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВКЛЮЧАЮЩИХ АНГИОГЕНЕЗ | 2005 |
|
RU2359679C2 |
| РЕГУЛЯТОР АКТИВАЦИИ НЕЙТРОФИЛОВ | 2018 |
|
RU2742417C1 |
| АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТ ЧЕЛОВЕЧЕСКИЙ БЕЛОК БЕТА-ТИРОЗИН ФОСФАТАЗУ (НРТРВЕТА), И ИХ ИСПОЛЬЗОВАНИЕ | 2007 |
|
RU2494108C2 |
| ПОВРЕЖДЕНИЯ МИТОХОНДРИАЛЬНОЙ ДНК КАК ПРОГНОСТИЧЕСКИЙ ПРИЗНАК АТЕРОСКЛЕРОТИЧЕСКОЙ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 2000 |
|
RU2243558C2 |
| АГЕНТ, СПОСОБСТВУЮЩИЙ АНГИОГЕНЕЗУ, И МЕТОДЫ ЕГО ИСПОЛЬЗОВАНИЯ | 2018 |
|
RU2771982C2 |
Группа изобретений относится к медицине и фармации. Предложено применение изопропил β-(3,4-дигидроксифенил)-α-гидроксипропионата (IDHP) для ингибирования агрегации тромбоцитов и применение IDHP для стимулирования ангиогенеза. Технический результат состоит в реализации заявленных назначений. Изобретения могут стать основой для применения IDHP в разработке лекарственных средств против агрегации тромбоцитов и для стимуляции ангиогенеза. 2 н.п. ф-лы, 8 ил., 4 табл., 7 пр.
1. Применение β-(3,4-дигидроксифенил)-α-гидроксиизопропилпропионата (IDHP) для ингибирования агрегации тромбоцитов.
2. Применение IDHP для стимулирования ангиогенеза.
| Способ возведения вторичной обделки в тоннеле и устройство для его осуществления | 1987 |
|
SU1583710A1 |
| TIAN J | |||
| et al | |||
| Переставная шейка для вала | 1921 |
|
SU309A1 |
| Neurosci | |||
| Lett | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| СОВРЕМЕННАЯ МЕДИЦИНСКАЯ ЭНЦИКЛОПЕДИЯ С-Пб | |||
| Норипринт | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| KASHIWAZAKI D | |||
| et al | |||
| Involvement | |||
Авторы
Даты
2020-04-17—Публикация
2017-09-29—Подача