Область техники
[0001] Настоящее изобретение относится к электроду для электролиза и способу его получения, и к электролизеру, содержащему такой электрод для электролиза.
Предпосылки изобретения
[0002] Электролиз хлорида натрия способом с ионообменной мембраной представляет собой способ электролиза рассола с использованием электрода для электролиза с тем, чтобы получить каустическую соду, хлор и водород. Для процесса электролиза хлорида натрия способом с ионообменной мембраной требуется технология, посредством которой можно поддерживать низкое напряжение электролиза на протяжении длительного периода времени, чтобы сократить расход электроэнергии. Когда подробно анализируют разбивку напряжения электролиза, становится ясно, что в дополнение к теоретически необходимому напряжению электролиза имеют место напряжение, обусловленное сопротивлением ионообменной мембраны и конструктивным сопротивлением электролизера, перенапряжение на аноде и катоде, которые представляют собой электроды для электролиза, напряжение, обусловленное расстоянием между анодом и катодом, и т.п.. Кроме того, когда электролиз продолжается на протяжении длительного периода времени, может происходить возрастание напряжения и т.п., вызванное разнообразными причинами, такими как примеси в рассоле.
[0003] В отношении различных описанных выше составляющих напряжения электролиза были проведены исследования с целью снижения перенапряжения на аноде для выделения хлора. Например, патентный документ 1 раскрывает технологию нерастворимого анода, полученного нанесением на титановую подложку покрытия из оксида металла платиновой группы, такого как рутений. Этот анод называется DSA (зарегистрированный товарный знак, от англ. Dimension Stable Anode – стабильный по размерам анод). В дополнение, непатентный документ 1 описывает историю разработки методов электролиза соды с использованием DSA.
[0004] В отношении вышеописанного DSA к настоящему времени также были сделаны разнообразные усовершенствования и проведены исследования по улучшению технических характеристик. Например, патентный документ 2 сообщает об аноде для выделения хлора, полученном сплавлением платины и палладия, причем внимание сосредоточивается на низком перенапряжении хлора и высоком перенапряжении кислорода на палладии в платиновой группе. Патентный документ 3 и патентный документ 4 предлагают электрод, полученный подверганием поверхности платино-палладиевого сплава окислительной обработке с образованием оксида палладия на поверхности. В дополнение, патентный документ 5 предлагает электрод, покрытый наружным слоем катализатора, содержащим оксид олова в качестве основного компонента и содержащим оксиды рутения, иридия, палладия и ниобия. С этим электродом предпринята попытка подавить реакцию выделения кислорода на аноде, протекающую одновременно с выделением хлора, чтобы получить хлор высокой чистоты с низкой концентрацией кислорода.
Список цитированной литературы
[0005] Патентная литература
Патентный документ 1: Японская патентная публикация № 46-021884
Патентный документ 2: Японская патентная публикация № 45-11014
Патентный документ 3: Японская патентная публикация № 45-11015
Патентный документ 4: Японская патентная публикация № 48-3954
Патентный документ 5: Национальная публикация Международной патентной заявки № 2012-508326
Непатентная литература
[0006] Непатентный документ 1: Hiroaki Aikawa, «National Museum of Nature and Science, Survey Reports on the Systemization of Technologies No. 8», published by Independent Administrative Institution National Museum of Nature and Science, 30 марта 2007 года, стр. 32
Сущность изобретения
Техническая проблема
[0007] Однако, проблема с такими традиционными анодами, как описанный в патентном документе 1 DSA, состоит в том, что перенапряжение сразу после начала электролиза становится высоким, и требуется определенный период времени перед стабилизацией на низком перенапряжении вследствие активации катализатора, и поэтому во время электролиза происходит потеря потребляемой электроэнергии.
В дополнение, электроды для выделения хлора, описанные в патентных документах 2-4, могут иметь высокое перенапряжение и низкую стойкость. Кроме того, при получении электродов, описанных в патентных документах 3 и 4, необходимо применение сплава в качестве самой подложки, и, в дополнение, требуется сложная в исполнении стадия, такая как формирование оксида на подложке термическим разложением, с последующими сплавлением при восстановлении и затем формированием оксида палладия электролитическим окислением; таким образом, требуется весьма существенное усовершенствование как в практическом отношении, так и в плане способа получения.
Описанный в патентном документе 5 электрод является в определенной мере эффективным в улучшении продолжительности электролиза (срока службы электрода) с палладием (примечание: палладий считается имеющим плохую химическую стойкость), но нельзя сказать, что он достаточно снижает перенапряжение выделения хлора.
Как описано выше, способы, описанные в патентных документах 1-5 и в непатентном документе 1, не могут обеспечить электрод для электролиза, который имеет достаточно низкое перенапряжение на начальном этапе электролиза и позволяет проводить электролиз при низком напряжении и с низким расходом электроэнергии на протяжении длительного периода времени.
[0008] Настоящее изобретение было создано для того, чтобы решить вышеописанные проблемы. Поэтому задача настоящего изобретения состоит в том, чтобы предложить электрод для электролиза, который может снижать перенапряжение на начальном этапе электролиза и позволяет проводить электролиз при низком напряжении и с низким расходом электроэнергии на протяжении длительного периода времени, а также способ его получения и электролизер, содержащий такой электрод для электролиза.
Решение проблемы
[0009] Авторы настоящего изобретения провели обстоятельное исследование, чтобы решить вышеуказанные проблемы. В результате авторы настоящего изобретения нашли, что регулированием в конкретном диапазоне численного значения, которое является показателем емкости двойного электрического слоя электрода для электролиза, имеющего слой катализатора, содержащий заданные элементы-металлы в заданном соотношении, может быть снижено перенапряжение на начальном этапе электролиза, и электролиз может быть осуществлен при низком напряжении и с низким расходом электроэнергии в течение длительного периода времени, тем самым выполнив настоящее изобретение. Более конкретно, настоящее изобретение заключается в следующем.
[1] Электрод для электролиза, включающий:
проводящую подложку; и
слой катализатора, сформированный на поверхности проводящей подложки, причем
слой катализатора содержит элемент рутений, элемент иридий, элемент титан и по меньшей мере один первый элемент-переходный металл, выбранный из группы, состоящей из Sc, V, Cr, Fe, Co, Ni, Cu и Zn,
относительное содержание первого элемента-переходного металла, содержащегося в слое катализатора, в расчете на 1 моль элемента титана составляет 0,25 мол.% или более и менее 3,4 мол.%, и
значение D, являющееся показателем емкости двойного электрического слоя электрода для электролиза, составляет 120 Кл/м2 или более и 420 Кл/м2 или менее.
[2] Электрод для электролиза по пункту [1], в котором первый элемент-переходный металл образует твердый раствор с твердым раствором оксида рутения, оксида иридия и оксида титана.
[3] Электрод для электролиза по пункту [1] или [2], в котором первый элемент-переходный металл включает по меньшей мере один элемент-металл, выбранный из группы, состоящей из ванадия, кобальта, меди и цинка.
[4] Электрод для электролиза по любому из пунктов [1]-[3], в котором первый элемент-переходный металл включает элемент ванадий.
[5] Электрод для электролиза по любому из пунктов [1]-[4], в котором относительное содержание первого элемента-переходного металла в расчете на все элементы-металлы, содержащиеся в слое катализатора, составляет 10 мол.% или более и 30 мол.% или менее.
[6] Электрод для электролиза по любому из пунктов [1]-[5], в котором относительное содержание первого элемента-переходного металла, содержащегося в слое катализатора, в расчете на 1 моль элемента рутения составляет 0,3 моля или более и менее 2 молей.
[7] Электрод для электролиза по любому из пунктов [1]-[6], в котором значение D составляет 120 Кл/м2 или более и 380 Кл/м2 или менее.
[8] Способ получения электрода для электролиза по любому из пунктов [1]-[7], включающий стадии:
приготовление жидкости для нанесения покрытия, содержащей соединение рутения, соединение иридия, соединение титана и соединение, содержащее первый элемент-переходный металл;
нанесение на по меньшей мере одну поверхность проводящей подложки жидкости для нанесения покрытия с образованием пленки покрытия; и
прокаливание пленки покрытия в кислородсодержащей атмосфере с образованием слоя катализатора.
[9] Электролизер, содержащий электрод для электролиза по любому из пунктов [1]-[7].
Преимущественные эффекты изобретения
[0010] Настоящее изобретение представляет электрод для электролиза, который может снижать перенапряжение на начальном этапе электролиза и позволяет проводить электролиз при низком напряжении и с низким расходом электроэнергии на протяжении длительного периода времени.
Краткое описание чертежей
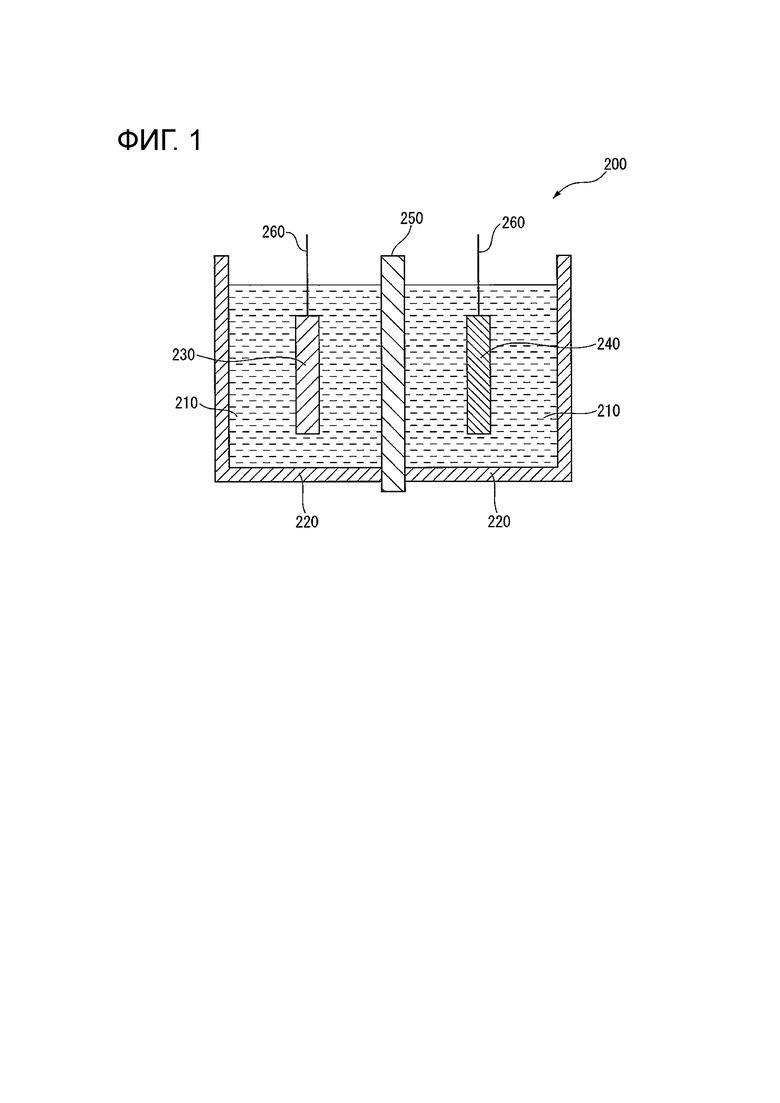
[0011] Фигура 1 иллюстрирует схематический вид в разрезе электролизера согласно одному примеру в данном варианте осуществления.
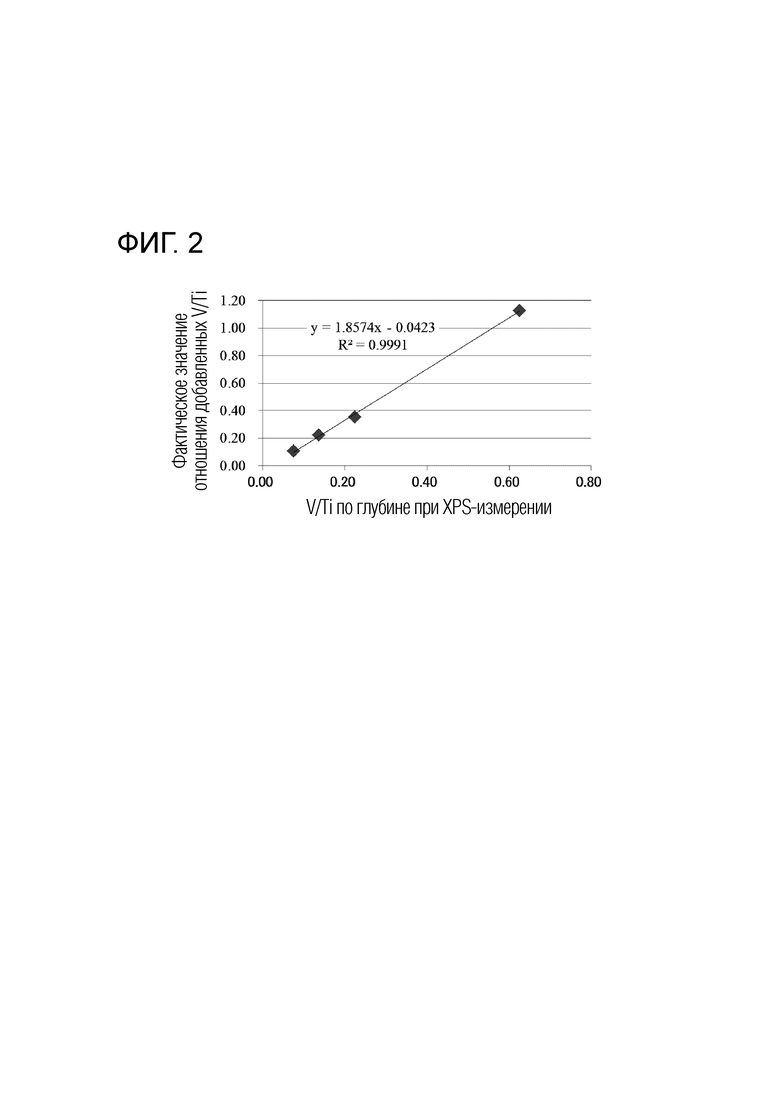
Фигура 2 иллюстрирует график, показывающий результаты построения и линейной аппроксимации измеренных значений V/Ti, полученных XPS-анализом профиля по глубине, и фактических значений V/Ti, добавленных в жидкости для нанесения покрытия, для четырех образцов с различными соотношениями элементов (молярными соотношениями) между V и Ti.
Описание вариантов осуществления изобретения
[0012] Ниже будет подробно описан вариант осуществления настоящего изобретения (далее называемый просто «данным вариантом осуществления»). Приведенный ниже данный вариант осуществления представляет собой иллюстрацию для описания настоящего изобретения и не предполагается ограничивающим настоящее изобретение нижеследующим изложением. В настоящее изобретение могут быть внесены подходящие модификации без выхода за пределы его смысла.
[0013] Электрод для электролиза согласно данному варианту осуществления представляет собой электрод для электролиза, включающий проводящую подложку и слой катализатора, сформированный на поверхности проводящей подложки, причем слой катализатора содержит элемент рутений, элемент иридий, элемент титан и по меньшей мере один первый элемент-переходный металл, выбранный из группы, состоящей из скандия, ванадия, хрома, железа, кобальта, никеля, меди и цинка (эти элементы-переходные металлы далее также совместно называются «первыми элементами-переходными металлами»). Кроме того, электрод для электролиза согласно данному варианту осуществления выполнен так, что относительное содержание первого элемента-переходного металла, содержащегося в слое катализатора, в расчете на 1 моль элемента титана составляет 0,25 мол.% или более и менее 3,4 мол.%, и значение D, являющееся показателем емкости двойного электрического слоя электрода для электролиза, составляет 120 Кл/м2 или более и 420 Кл/м2 или менее.
В данном варианте осуществления, с использованием первого элемента-переходного металла в дополнение к элементу рутению, элементу иридию и элементу титану в слое катализатора, обеспечивается электрод для электролиза, в котором положение пика, приписываемого Ru 3d5/2, происходящего от RuO2, измеренного методом рентгеновской фотоэлектронной спектроскопии (XPS), сдвигается от 280,5 эВ для RuO2 в сторону более высокой энергии связи. Для коррекции заряда в XPS, коррекция выполняется так, что энергия связи Ti 2p3/2 составляет 458,4 эВ. Сдвиг положения пика Ru 3d5/2 в сторону более высокой энергии связи указывает на состояние, в котором Ru является более окисленным в плане заряда, и это считается обусловленным добавлением первого элемента-переходного металла. Например, когда в качестве первого элемента-переходного металла добавляется ванадий, происходит следующая поляризация.
RuO2 + VO2 → RuO2δ+ + VO2δ-
RuO2δ+ представляет собой активный центр адсорбции для адсорбирования хлора и способствует адсорбцию хлора, а значит, перенапряжение выделения хлора может быть снижено.
Хотя нет намерения ограничиваться вышеописанным механизмом действия, электрод для электролиза согласно данному варианту осуществления имеет вышеописанную конфигурацию, и поэтому при проведении электролиза с использованием такого электрода для электролиза может быть снижено перенапряжение на начальном этапе электролиза, и электролиз может выполняться при низком напряжении и с низким расходом электроэнергии на протяжении длительного периода времени. Электрод для электролиза согласно данному варианту осуществления предпочтительно может быть использован в качестве электрода для выделения хлора, в особенности для электролиза хлорида натрия способом с ионообменной мембраной.
(Проводящая подложка)
[0014] Электрод для электролиза согласно данному варианту осуществления может быть использован в рассоле с высокой концентрацией, близкой к насыщению, в атмосфере образования газообразного хлора. Поэтому в качестве материала проводящей подложки в данном варианте осуществления предпочтительны коррозионностойкие вентильные металлы. Примеры вентильных металлов включают, но не ограничиваются ими, титан, тантал, ниобий и цирконий. По соображениям экономии и сродства к слою катализатора предпочтителен титан.
Форма проводящей подложки конкретно не ограничена, и может быть выбрана подходящая форма сообразно назначению. Например, предпочтительно применяются такие формы, как просечно-вытяжная форма, форма пористой пластины и форма проволочной сетки. Толщина проводящей подложки предпочтительно составляет от 0,1 до 2 мм.
Поверхность проводящей подложки, находящаяся в контакте со слоем катализатора, предпочтительно подвергается обработке для увеличения площади поверхности, чтобы улучшить адгезионную способность слоя катализатора. Примеры способа обработки для увеличения площади поверхности включают, но не ограничены ими, струйную обработку с использованием нарезанной проволоки, стальной дроби, глиноземной дроби или т.п.; и кислотную обработку с использованием серной кислоты или соляной кислоты. Из этих способов обработки предпочтителен способ формирования неровностей на поверхности проводящей подложки струйной обработкой, а затем дополнительным выполнением кислотной обработки.
(Слой катализатора)
[0015] Слой катализатора, формируемый на поверхности проводящей подложки, подвергнутой вышеописанной обработке, содержит элемент рутений, элемент иридий, элемент титан и первый элемент-переходный металл.
Каждый из элемента рутения, элемента иридия и элемента титана предпочтительно находится в виде оксида.
Примеры оксида рутения включают, но не ограничиваются им, RuO2.
Примеры оксида иридия включают, но не ограничиваются им, IrO2.
Примеры оксида титана включают, но не ограничиваются им, TiO2.
[0016] В слое катализатора по данному варианту осуществления оксид рутения, оксид иридия и оксид титана предпочтительно образуют твердый раствор. Когда оксид рутения, оксид иридия и оксид титана образуют твердый раствор, дополнительно улучшается долговечность оксида рутения.
Под твердым раствором обычно подразумевается материал, в котором вещества двух или более типов растворены друг в друге и который в целом составляет однородную твердую фазу. Примеры веществ, образующих твердый раствор, включают простые вещества-металлы и оксиды металлов. В частности, в случае твердого раствора предпочтительных для данного варианта осуществления оксидов металлов, атомы металлов двух или более типов нерегулярно размещаются в эквивалентных узлах кристаллической решетки в элементарной ячейке кристаллической структуры оксида. Более конкретно, предпочтителен твердый раствор замещения, в котором оксид рутения, оксид иридия и оксид титана смешиваются друг с другом, и в структуре оксида рутения атомы рутения замещены атомами иридия или атомами титана, или обоими из них. Растворенное состояние конкретно не ограничено, и может иметь место область частичного растворения.
Размер элементарной ячейки в кристаллической структуре слегка изменяется вследствие растворения. Степень этого изменения может быть подтверждена, например, тем фактом, что при измерении методом порошковой рентгеновской дифракции обусловленная кристаллической структурой дифрактограмма не изменяется, а изменяется положение пика, обусловленное размером элементарной ячейки.
[0017] В слое катализатора по данному варианту осуществления, в отношении относительного содержания элемента рутения, элемента иридия и элемента титана предпочтительно, чтобы относительное содержание элемента иридия составляло от 0,06 до 3 молей, а относительное содержание элемента титана составляло от 0,2 до 8 молей, в расчете на 1 моль элемента рутения; более предпочтительно, чтобы относительное содержание элемента иридия составляло от 0,2 до 3 молей, а относительное содержание элемента титана составляло от 0,2 до 8 молей, в расчете на 1 моль элемента рутения; еще более предпочтительно, чтобы относительное содержание элемента иридия составляло от 0,3 до 2 молей, а относительное содержание элемента титана составляло от 0,2 до 6 молей, в расчете на 1 моль элемента рутения; и особенно предпочтительно, чтобы относительное содержание элемента иридия составляло от 0,5 до 1,5 молей, а относительное содержание элемента титана составляло от 0,2 до 3 молей, в расчете на 1 моль элемента рутения. При установлении относительного содержания этих трех типов элементов в вышеописанных диапазонах еще более проявляется тенденция к улучшению долговременной стойкости электрода для электролиза. Каждый из иридия, рутения и титана может содержаться в слое катализатора в виде иного материала, нежели оксид, например, в виде простого вещества-металла.
[0018] Слой катализатора в данном варианте осуществления содержит первый элемент-переходный металл вместе с вышеописанными элементом рутением, элементом иридием и элементом титаном. Форма существования первого элемента-переходного металла конкретно не ограничена, и первый элемент-переходный металл должен содержаться в слое катализатора, будь то, например, в виде оксида или в виде простого вещества-металла или сплава. В данном варианте осуществления, из соображений долговечности слоя катализатора, первый элемент-переходный металл предпочтительно образует твердый раствор с твердым раствором оксида рутения, оксида иридия и оксида титана. Образование такого твердого раствора может быть подтверждено, например, методом рентгеновской дифрактометрии (XRD). Вышеуказанный твердый раствор может быть образован регулированием температуры прокаливания при формировании слоя катализатора, количества добавляемого первого элемента-переходного металла и т.п. в надлежащих диапазонах.
[0019] В данном варианте осуществления, из соображений достижения как напряжения, так и долговечности слоя катализатора, первый элемент-переходный металл предпочтительно включает элемент-металл, выбранный из группы, состоящей из ванадия, кобальта, меди и цинка, а более предпочтительно первый элемент-переходный металл включает элемент ванадий.
[0020] Относительное содержание первого элемента-переходного металла в расчете на все элементы-металлы, содержащиеся в слое катализатора по данному варианту осуществления, предпочтительно составляет 10 мол.% или более и 30 мол.% или менее, более предпочтительно более 10 мол.% и 22,5 мол.% или менее, а еще более предпочтительно 12 мол.% или более и 20 мол.% или менее. Когда первый элемент-переходный металл включает ванадий, относительное содержание ванадия в расчете на все элементы-металлы, содержащиеся в слое катализатора, особенно предпочтительно удовлетворяет вышеуказанному диапазону.
Вышеуказанное относительное содержание главным образом выводится из фактического соотношения элементов, добавленных в жидкость для нанесения покрытия, приготовленную в описываемом позже предпочтительном способе получения электрода для электролиза, и может быть подтверждено анализом профиля по глубине методом кросс-секционного STEM-EDX (растровый просвечивающий электронный микроскоп-рентгеноспектральный электронно-зондовый микроанализ) или рентгеновской фотоэлектронной спектроскопии (XPS), описываемыми позже.
Когда относительное содержание первого элемента-переходного металла составляет 10 мол.% или более, оказывается возможным снижение перенапряжения выделения хлора или напряжения электролиза с начального этапа электролиза. Когда относительное содержание первого элемента-переходного металла составляет 30 мол.% или менее, может в достаточной мере обеспечиваться долговечность оксида рутения.
[0021] Относительное содержание первого элемента-переходного металла, содержащегося в слое катализатора по данному варианту осуществления, в расчете на 1 моль элемента рутения предпочтительно составляет 0,3 моля или более и менее 2 молей, более предпочтительно 0,5 моля или более и менее 2 молей, а еще более предпочтительно 0,5 моля или более и менее 1,8 моля. Когда первый элемент-переходный металл включает ванадий, относительное содержание ванадия в расчете на 1 моль элемента рутения, содержащегося в слое катализатора, особенно предпочтительно удовлетворяет вышеуказанному диапазону.
Вышеуказанное относительное содержание главным образом выводится из фактического соотношения элементов, добавленных в жидкость для нанесения покрытия, приготовленную в описываемом позже предпочтительном способе получения электрода для электролиза, и может быть подтверждено описываемым позже анализом профиля по глубине методом кросс-секционного STEM-EDX или рентгеновской фотоэлектронной спектроскопии (XPS).
Когда относительное содержание первого элемента-переходного металла составляет 0,3 моля или более по числу молей в расчете на 1 моль элемента рутения, оказывается возможным снижение перенапряжения выделения хлора или напряжения электролиза с начального этапа электролиза, и становится возможным достаточное увеличение значения D, являющегося показателем емкости двойного электрического слоя, описываемого позже. Когда относительное содержание первого элемента-переходного металла составляет менее 2 молей, может в достаточной мере обеспечиваться долговечность оксида рутения.
[0022] Относительное содержание первого элемента-переходного металла, содержащегося в слое катализатора по данному варианту осуществления, в расчете на 1 моль элемента титана составляет 0,25 моля или более и менее 3,4 моля, предпочтительно 0,25 моля или более и менее 2,6 моля. Когда первый элемент-переходный металл включает ванадий, относительное содержание ванадия в расчете на 1 моль элемента титана, содержащегося в слое катализатора, особенно предпочтительно удовлетворяет вышеуказанному диапазону.
Вышеуказанное относительное содержание главным образом выводится из фактического соотношения элементов, добавленных в жидкость для нанесения покрытия, приготовленную в описываемом позже предпочтительном способе получения электрода для электролиза, и может быть подтверждено описываемым позже анализом профиля по глубине методом кросс-секционного STEM-EDX или рентгеновской фотоэлектронной спектроскопии (XPS).
Когда относительное содержание первого элемента-переходного металла составляет 0,25 моля или более по числу молей в расчете на 1 моль элемента титана, оказывается возможным снижение перенапряжения выделения хлора или напряжения электролиза с начального этапа электролиза, и становится возможным достаточное увеличение значения D, являющегося описываемым позже показателем емкости двойного электрического слоя. Когда относительное содержание первого элемента-переходного металла составляет менее 3,4 моля, может в достаточной мере обеспечиваться долговечность оксида рутения.
[0023] Соотношение элементов (молярное соотношение) между V и Ti в слое катализатора в электроде для электролиза может быть подтверждено, например, анализом профиля по глубине методом кросс-секционного STEM-EDX или рентгеновской фотоэлектронной спектроскопии (XPS). Например, метод измерения соотношения элементов (молярного соотношения) между V и Ti в слое катализатора, содержащем элемент рутений, элемент иридий, элемент титан и элемент ванадий в качестве первого элемента-переходного металла, с использованием количественного XPS-анализа профиля по глубине будет показан ниже. Здесь в качестве проводящей подложки применяется Ti-ая подложка.
Условия XPS-измерения могут быть следующими:
прибор: PHI 5000 VersaProbe II производства фирмы ULVAC-PHI, INC.,
источник возбуждения: монохроматический AlKα (15 кВ×0,3 мА),
размер анализируемой области: диаметром примерно 200 мкм,
угол разлета фотоэлектронов: 45°,
энергетический барьер: 46,95 эВ (узкое сканирование).
Условия распыления Ar+ могут быть следующими:
ускоряющее напряжение: 2 кВ,
растровый диапазон: квадрат 2 мм,
с системой вращения образца (Zalar rotation).
[0024] Для метода расчета концентрации энергетические уровни фотоэлектронных пиков, используемые для количественного определения Ru, Ir, Ti и V, представляют собой Ru 3d, Ir 4f, Ti 2p и V 2p3/2. Ru 3p3/2 и Ti 3s перекрываются с Ti 2p и Ir 4f соответственно, и поэтому количественное определение может быть выполнено по следующей процедуре.
(1) Относительные интенсивности по площади пиков (далее – интенсивности по площади пиков) Ru 3d, Ir 4f (в том числе Ti 3s), Ti 2p (в том числе Ru 3p3/2) и V 2p3/2 при каждом времени распыления (на каждой глубине) получаются с использованием аналитического пакета программ «MaltiPak», прилагаемого к прибору.
(2) Интенсивность по площади пика Ru 3p3/2 рассчитывается на основе интенсивности по площади пика Ru 3d. Расчет выполняется с использованием величины «Corrected RSF» (относительная чувствительность прибора, скорректированная на значение энергетического барьера) в пакете «MaltiPak». Она вычитается из интенсивности по площади пика Ti 2p, включающего Ru 3p3/2, для расчета интенсивности по площади пика только Ti 2p.
(3) Интенсивность по площади пика Ti 3s рассчитывается на основе скорректированной интенсивности по площади пика Ti 2p с использованием величины «Corrected RSF». Она вычитается из интенсивности по площади пика Ir 4f, включающего Ti 3s, для расчета интенсивности по площади пика только Ir 4f.
[0025] Измеренное значение соотношения элементов (молярного соотношения) между V и Ti в слое катализатора, полученное количественным XPS-анализом профиля по глубине, представляет собой отношение значения, полученного суммированием интенсивностей по площади пиков V 2p3/2 на глубинах в диапазоне глубин слоя катализатора, в которых детектируется V, и делением суммы на величину «Corrected RSF» для V 2p3/2, к значению, полученному суммированием интенсивностей по площади пиков Ti 2p на глубинах и делением суммы на величину «Corrected RSF» для Ti 2p, на основе нижеследующей расчетной формулы. Диапазон глубин слоя катализатора, в котором суммируются интенсивности по площади пиков элементов, например, диапазон глубин от самой наружной поверхности до места, где начинает детектироваться сигнал Ti, происходящий от Ti-ой подложки, когда слой катализатора представляет собой одиночный слой. При этом, когда слой катализатора является многослойным, диапазон глубин представляет собой диапазон глубин каждого слоя катализатора для иных слоев, нежели слой катализатора, сформированный непосредственно на поверхности Ti-ой подложки, и диапазон глубин до места, где начинает детектироваться сигнал Ti, происходящий от Ti-ой подложки, для слоя катализатора, сформированного непосредственно на поверхности Ti-ой подложки.
[0026] V/Ti=[значение, полученное суммированием интенсивностей по площади пиков V 2p3/2 на глубинах и делением суммы на величину Corrected RSF для V 2p3/2]/[значение, полученное суммированием интенсивностей по площади пиков Ti 2p после коррекции на глубинах и делением суммы на величину Corrected RSF для Ti 2p]
[0027] Фигура 2 показывает результаты следующих четырех образцов a-d, имеющих различные соотношения элементов (молярные соотношения) между V и Ti, в которых измеренные значения V/Ti, полученные XPS-анализом профиля по глубине по вышеописанному методу измерения, и фактические значения V/Ti для количеств V и Ti, добавленных в жидкости для нанесения покрытия, нанесены на график.
(Образец а) электрод для электролиза с фактическим отношением добавленных V/Ti в 0,11
Электрод для электролиза, полученный таким же способом, как и в описываемом позже Примере 1, за исключением того, что проводящая подложка покрыта с использованием жидкости а для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и ванадия составляет 23,75:23,75:47,5:5.
(Образец b) электрод для электролиза с фактическим отношением добавленных V/Ti в 0,22
Электрод для электролиза, полученный таким же способом, как и в описываемом позже Примере 1, за исключением того, что проводящая подложка покрыта с использованием жидкости b для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и ванадия составляет 22,5:22,5:45:10.
(Образец с) электрод для электролиза с фактическим отношением добавленных V/Ti в 0,35
Электрод для электролиза, полученный таким же способом, как и в описываемом позже Примере 1.
(Образец d) электрод для электролиза с фактическим отношением добавленных V/Ti в 1,13
Электрод для электролиза, полученный таким же способом, как и в описываемом позже Примере 3.
[0028] Так как фигура 2 показала положительную корреляцию между измеренными и фактическими значениями V/Ti, соотношение элементов (молярное соотношение) между V и Ti в слое катализатора, содержащем элемент рутений, элемент иридий, элемент титан и элемент ванадий, может быть получено с использованием калибровочной кривой. Когда содержащиеся в слое катализатора компоненты изменяются, соотношение элементов (молярное соотношение) между V и Ti в слое катализатора может быть получено путем обращения к калибровочной кривой измеренных и фактических значений V/Ti таким же методом.
В электроде для электролиза согласно данному варианту осуществления слой катализатора может быть составлен лишь из одного слоя или может иметь многослойную структуру из двух или более слоев. Когда слой катализатора имеет многослойную структуру, относительное содержание первого элемента-переходного металла, содержащегося в по меньшей мере одном слое в ней, в расчете на 1 моль элемента титана должно составлять 0,25 моля или более и менее 3,4 моля, а другие слои не должны удовлетворять этому относительному содержанию.
[0029] Электрод для электролиза согласно данному варианту осуществления характеризуется тем, что значение D, являющееся показателем емкости двойного электрического слоя, составляет 120 Кл/м2 или более и 420 Кл/м2 или менее. Значение D более предпочтительно составляет 120 Кл/м2 или более и 380 Кл/м2 или менее, еще более предпочтительно 150 Кл/м2 или более и 360 Кл/м2 или менее. Когда значение D составляет 120 Кл/м2 или более, может подавляться перенапряжение выделения хлора и может быть снижено напряжение электролиза. Когда значение D составляет 420 Кл/м2 или менее, может поддерживаться долговечность оксида рутения.
[0030] Здесь значение D, являющееся показателем емкости двойного электрического слоя, представляет собой значение, рассчитываемое с использованием понятия емкости двойного электрического слоя, и считается, что чем больше площадь поверхности электрода (то есть удельная площадь поверхности слоя катализатора на электроде), тем выше это значение. Например, при регулировании содержания первого элемента-переходного металла в вышеописанном предпочтительном диапазоне значение D может быть в вышеописанном диапазоне. В частности, при повышении содержания первого элемента-переходного металла значение D также проявляет тенденцию к возрастанию. При повышении температуры прокаливания в ходе формирования слоя катализатора (температуры последующего обжига) значение D проявляет тенденцию к снижению. Более конкретно, значение D может быть рассчитано с использованием значений плотности тока электролиза (А/м2), измеренной в отношении некоторых скоростей развертки (В/с) методом, описываемым в приведенных позже Примерах, то есть методом циклической вольтамперометрии. Более подробно, для каждой скорости развертки получают характерную разность плотностей тока (разность между плотностью тока во время прямого хода развертки и плотностью тока во время обратного хода развертки), и данные наносят на график, где по вертикальной оси отложено произведение разности плотностей тока и 0,3 В, диапазона развертки, а по горизонтальной оси отложена скорость развертки, и наклон при линейной аппроксимации этих графиков представляет собой значение D. Здесь произведение разности плотностей тока и 0,3 В, диапазона развертки, полностью пропорционален скорости развертки, и поэтому значение D может быть выражено следующей формулой (а). При установлении значения D как показателя емкости двойного электрического слоя в вышеописанном диапазоне перенапряжение на начальном этапе электролиза может быть снижено без ущерба долговечности полученного электрода для электролиза.
D (Кл/м2) = [разность плотностей тока электролиза (А/м2) × 0,3 (В)] ÷ [скорость развертки (В/с)] (а)
[0031] Когда слой катализатора в данном варианте осуществления содержит элемент рутений, элемент иридий, элемент титан и первый элемент-переходный металл, и, кроме того, относительное содержание первого элемента-переходного металла и элемента титана находится в конкретном диапазоне, улучшается его функция как катализатора электролиза в связи с возрастанием значения D, являющегося показателем емкости двойного электрического слоя, и может быть снижено перенапряжение на начальном этапе электролиза.
[0032] Слой катализатора в данном варианте осуществления может содержать в качестве составляющих элементов только элемент рутений, элемент иридий, элемент титан и вышеописанный первый элемент-переходный металл, или же может содержать другой элемент-металл в дополнение к ним. Конкретные примеры другого элемента-металла включают, но не ограничиваются ими, элементы, выбранные из тантала, ниобия, олова, платины и т.п.. Примеры формы существования этих других элементов-металлов включают присутствие в виде элементов-металлов, содержащихся в оксидах.
Когда слой катализатора в данном варианте осуществления содержит другой элемент-металл, его относительное содержание предпочтительно составляет 20 мол.% или менее, более предпочтительно 10 мол.% или менее, как молярное отношение другого элемента-металла ко всем элементам-металлам, содержащимся в слое катализатора.
Толщина слоя катализатора в данном варианте осуществления предпочтительно составляет от 0,1 до 5 мкм, более предпочтительно от 0,5 до 3 мкм. При установлении толщины слоя катализатора на вышеуказанное нижнее предельное значение или более становится возможным в достаточной мере поддерживать первоначальные характеристики электролиза. При установлении толщины слоя катализатора на вышеуказанное верхнее предельное значение или менее может быть получен электрод для электролиза с превосходной экономичностью.
[0033] Слой катализатора может содержать только один слой, или же число слоев катализатора может составлять два или более.
Когда число слоев катализатора составляет два или более, по меньшей мере один из них должен представлять собой слой катализатора по данному варианту осуществления. Когда число слоев катализатора составляет два или более, по меньшей мере самый наружный слой предпочтительно представляет собой слой катализатора по данному варианту осуществления. Также предпочтителен вариант с двумя или более слоями катализатора по данному варианту осуществления с одинаковым составом или с различными составами.
Даже когда число слоев катализатора составляет два или более, толщина слоя катализатора по данному варианту осуществления предпочтительно составляет от 0,1 до 5 мкм, более предпочтительно от 0,5 до 3 мкм, как описано выше.
(Способ получения электрода для электролиза)
[0034] Далее будет подробно описан один пример способа получения электрода для электролиза согласно данному варианту осуществления.
Электрод для электролиза согласно данному варианту осуществления может быть получен, например, формированием слоя катализатора, содержащего элемент рутений, элемент иридий, элемент титан и первый элемент-переходный металл, на проводящей подложке, подвергнутой вышеописанной обработке для увеличения площади поверхности. Формирование слоя катализатора предпочтительно выполняют методом термического разложения.
В способе получения согласно методу термического разложения слой катализатора может быть сформирован нанесением на проводящую подложку жидкости для нанесения покрытия, включающей смесь соединений (прекурсоров), содержащих вышеуказанные элементы, с последующим прокаливанием в кислородсодержащей атмосфере для термического разложения компонентов в жидкости для нанесения покрытия. Согласно этому способу, электрод для электролиза может быть получен с высокой производительностью за меньшее число стадий, чем в традиционных способах получения.
[0035] Здесь под термическим разложением подразумевается прокаливание являющихся прекурсорами солей металлов или т.п. в кислородсодержащей атмосфере для их разложения до оксидов металлов, или металлов, и газообразных веществ. Получающимися продуктами разложения можно управлять посредством разновидностей металлов, содержащихся в прекурсорах, примешанных в жидкость для нанесения покрытия в качестве исходных материалов, типов солей металлов, атмосферы, в которой выполняется термическое разложение, и т.п.. Обычно в окислительной атмосфере многие металлы склонны легко образовывать оксиды. В промышленном процессе получения электрода для электролиза термическое разложение обычно выполняется на воздухе. В данном варианте осуществления также диапазон концентраций кислорода при прокаливании конкретно не ограничен, и достаточным является выполнение прокаливания на воздухе. Однако в обжиговую печь может продуваться воздух, или же может подаваться кислород, при необходимости.
[0036] В качестве предпочтительного варианта способа получения электрода для электролиза согласно данному варианту осуществления, способ предпочтительно включает стадии приготовления жидкости для нанесения покрытия, содержащей соединение рутения, соединение иридия, соединение титана и соединение, содержащее первый элемент-переходный металл; нанесения жидкости для нанесения покрытия на по меньшей мере одну поверхность проводящей подложки с образованием пленки покрытия; и прокаливания пленки покрытия в кислородсодержащей атмосфере с образованием слоя катализатора. Соединение рутения, соединение иридия, соединение титана и соединение, содержащее первый элемент-переходный металл, соответствуют прекурсорам, содержащим элементы-металлы, содержащиеся в слое катализатора по данному варианту осуществления. Вышеописанным способом может быть получен электрод для электролиза, имеющий однородный слой катализатора.
[0037] В качестве соединений, содержащихся в жидкости для нанесения покрытия, соединение рутения, соединение иридия и соединение титана могут представлять собой оксиды, но не обязательно должны быть оксидами. Например, они могут быть солями металлов или т.п.. Примеры этих солей металлов включают, но не ограничиваются ими, любые, выбранные из группы, состоящей из хлоридных солей, нитратов, динитродиаминных комплексов, нитрозилнитратов, сульфатов, ацетатов и алкоксидов металлов.
Примеры соли металла – соединения рутения включают, но не ограничиваются ими, хлорид рутения и нитрат рутения.
Примеры соли металла – соединения иридия включают, но не ограничиваются ими, хлорид иридия и нитрат иридия.
Примеры соли металла – соединения титана включают, но не ограничиваются им, тетрахлорид титана.
[0038] В качестве соединений, содержащихся в жидкости для нанесения покрытия, соединение, содержащее первый элемент-переходный металл, может представлять собой оксид, но не обязательно должно быть оксидом. Например, этим соединением предпочтительно является одно или более, выбранные из группы, состоящей из оксокислоты ванадия и ее соли; хлорида ванадия; и нитрата ванадия.
[0039] Примеры противокатиона в вышеуказанной оксокислоте могут включать, но не ограничиваются ими, Na+, K+ и Са2+.
[0040] В качестве конкретных примеров таких соединений, конкретные примеры оксокислоты или ее соли могут включать метаванадат натрия, ортованадат натрия и ортованадат калия; конкретные примеры хлорида могут включать хлорид ванадия; и конкретные примеры нитрата могут включать нитрат ванадия.
[0041] Вышеуказанные соединения надлежащим образом выбираются и используются сообразно желательному соотношению элементов-металлов в слое катализатора.
Жидкость для нанесения покрытия может дополнительно содержать другое соединение, иное, нежели соединения, входящие в число вышеописанных соединений. Примеры другого соединения включают, но не ограничиваются ими, соединения металлов, содержащие такие элементы-металлы, как тантал, ниобий, олово, платина и родий; и органические соединения, содержащие элементы-металлы, такие как тантал, ниобий, олово, платина и родий.
Жидкость для нанесения покрытия предпочтительно представляет собой жидкостную композицию, полученную растворением или диспергированием вышеуказанной группы соединений в надлежащем растворителе. Растворитель применяемой здесь жидкости для нанесения покрытия может быть выбран сообразно типам вышеуказанных соединений. Например, могут быть использованы вода и спирты, такие как бутанол. Общая концентрация соединений в жидкости для нанесения покрытия конкретно не ограничена, но предпочтительно составляет от 10 до 150 г/л из соображений надлежащего регулирования толщины слоя катализатора.
[0042] Способ нанесения на поверхность проводящей подложки жидкости для нанесения покрытия не ограничен нижеследующими, и, например, могут быть применены способ погружения, в котором проводящую подложку погружают в жидкость для нанесения покрытия, способ, в котором жидкость для нанесения покрытия наносят на поверхность проводящей подложки кистью, способ накатки, в котором проводящую подложку пропускают над губчатым валиком, пропитанным жидкостью для нанесения покрытия, и способ электростатического нанесения, в котором проводят распыление в виде тумана, причем проводящая подложка и жидкость для нанесения покрытия заряжаются противоположными зарядами. Среди этих способов нанесения предпочтительны способ накатки и способ электростатического нанесения с точки зрения достижения превосходной производительности в промышленном масштабе. Пленка покрытия из жидкости для нанесения покрытия может быть сформирована на по меньшей мере одной поверхности проводящей подложки этими способами нанесения.
После того, как проводящая подложка покрыта жидкостью для нанесения покрытия, при необходимости предпочтительно выполняют стадию сушки пленки покрытия. Посредством этой стадии сушки пленка покрытия может быть более прочно закреплена на поверхности проводящей подложки. Условия высушивания могут быть надлежащим образом выбраны сообразно составу и природе растворителя жидкости для нанесения покрытия, и т.п.. Стадия сушки предпочтительно выполняется при температуре от 10 до 90°С в течение времени от 1 до 20 минут.
[0043] После того, как пленка покрытия из жидкости для нанесения покрытия сформирована на поверхности проводящей подложки, покрытие прокаливают в кислородсодержащей атмосфере. Температура прокаливания может быть надлежащим образом выбрана сообразно составу и природе растворителя жидкости для нанесения покрытия. Температура прокаливания предпочтительно составляет от 300 до 650°С. Когда температура прокаливания составляет менее 300°С, разложение прекурсоров, таких как соединение рутения, является недостаточным, и слой катализатора, содержащий оксид рутения и т.п., может быть не получен. Когда температура прокаливания составляет более 650°С, проводящая подложка может претерпевать окисление, и поэтому может снижаться адгезионная способность поверхности раздела между слоем катализатора и подложкой. Эту тенденцию следует рассматривать как особенно важную, когда в качестве проводящей подложки применяется выполненная из титана подложка.
Продолжительность прокаливания предпочтительно является длительной. С одной стороны, с точки зрения производительности получения электрода предпочтительно регулирование выполняют так, чтобы продолжительность прокаливания не была чрезмерно длительной. С учетом этих соображений, продолжительность одного прокаливания предпочтительно составляет от 5 до 60 минут.
[0044] При необходимости возможно многократное повторение стадий нанесения, сушки и прокаливания описанного выше слоя катализатора, с образованием слоя катализатора с желательной толщиной. Также при необходимости возможно формирование слоя катализатора, а затем дополнительно выполнение длительного прокаливания, чтобы еще больше улучшить стабильность химически, физически и термически исключительно стабильного слоя катализатора. В качестве условий длительного прокаливания предпочтительна температура от 400 до 650°С в течение примерно от 30 минут до 4 часов.
[0045] Электрод для электролиза согласно данному варианту осуществления имеет низкое перенапряжение даже на начальном этапе электролиза и позволяет проводить электролиз при низком напряжении и с низким расходом электроэнергии на протяжении длительного периода времени. Поэтому электрод для электролиза согласно данному варианту осуществления может быть использован для электролиза разнообразных типов. В частности, электрод для электролиза согласно данному варианту осуществления предпочтительно применяется в качестве анода для выделения хлора, а более предпочтительно – в качестве анода для электролиза хлорида натрия способом с ионообменной мембраной.
(Электролизер)
[0046] Электролизер согласно данному варианту осуществления содержит электрод для электролиза согласно данному варианту осуществления. В этом электролизере снижено начальное напряжение при электролизе. Фигура 1 показывает схематический вид в разрезе согласно одному примеру электролизера в данном варианте осуществления.
[0047] Электролизер 200 содержит электролитические растворы 210, контейнер 220 для содержания электролитических растворов 210, анод 230 и катод 240, погруженные в электролитические растворы 210, ионообменную мембрану 250 и провода 260 для соединения анода 230 и катода 240 с источником питания. В электролизере 200 пространство на анодной стороне, отделенное ионообменной мембраной 250, называется анодной камерой, а пространство на катодной стороне называется катодной камерой. Электролизер согласно данному варианту осуществления может быть использован для разнообразных типов электролиза. В качестве его типичного примера ниже будет описан случай, где электролизер согласно данному варианту осуществления используется для электролиза водного раствора хлорида щелочного металла. В качестве электролитического раствора 210, подаваемого в электролизер согласно данному варианту осуществления, например, водный раствор хлорида щелочного металла, такой как 2,5-5,5-нормальный (N) водный раствор хлорида натрия (рассол) или водный раствор хлорида калия, может быть использован в анодной камере, а в катодной камере могут быть использованы разбавленный водный раствор гидроксида щелочного металла (например, водный раствор гидроксида натрия или водный раствор гидроксида калия) или вода.
[0048] В качестве анода 230 используется электрод для электролиза согласно данному варианту осуществления. В качестве ионообменной мембраны 250, например, может применяться фторполимерная пленка, имеющая ионообменную группу. Конкретные примеры ее могут включать «Aciplex» (R) F6801 (производства фирмы «Asahi Kasei Corporation»). В качестве катода 240 применяется катод для выделения водорода, представляющий собой электрод, полученный путем покрывания проводящей подложки катализатором, или т.п.. В качестве этого катода может быть применен известный катод. Конкретные примеры включают катод, полученный путем покрывания никелевой подложки никелем, оксидом никеля, сплавом никеля и олова, сочетанием активированного угля и оксида, оксидом рутения, платиной или т.п.; и катод, полученный формированием покрытия из оксида рутения на подложке из проволочной сетки, выполненной из никеля.
[0049] Конфигурация электролизера согласно данному варианту осуществления конкретно не ограничена и может быть униполярной или биполярной. Составляющие электролизер материалы конкретно не ограничены, но, например, в качестве материала анодной камеры предпочтительны титан и подобные, устойчивые к хлоридам щелочных металлов и хлору; а в качестве материала катодной камеры предпочтительны никель и подобные, устойчивые к гидроксидам щелочных металлов и водороду.
Электрод для электролиза согласно данному варианту осуществления (анод 230) может быть размещен с надлежащим интервалом от ионообменной мембраны 250, и может быть использован без какой-либо проблемы, даже если размещается в контакте с ионообменной мембраной 250. Катод 240 может быть размещен с надлежащим интервалом от ионообменной мембраны 250, и даже электролизер контактного типа без интервала с ионообменной мембраной 250 (мембранный электролизер с нулевым зазором) может быть использован без какой-либо проблемы.
Условия электролиза в электролизере согласно данному варианту осуществления конкретно не ограничены, и электролизер согласно данному варианту осуществления может эксплуатироваться при известных условиях. Например, электролиз предпочтительно проводят при температуре электролиза, регулируемой на 50-120°С, и при плотности тока, регулируемой на 0,5-10 кА/м2.
[0050] Электрод для электролиза согласно данному варианту осуществления может снижать напряжение электролиза при электролизе хлорида натрия по сравнению с традиционными методами. Поэтому, с помощью электролизера согласно данному варианту осуществления, содержащего такой электрод для электролиза, может быть снижен расход электроэнергии, необходимой для электролиза хлорида натрия.
Кроме того, электрод для электролиза согласно данному варианту осуществления имеет химически, физически и термически исключительно стабильный слой катализатора, и поэтому обладает превосходной долговременной стойкостью. Таким образом, с помощью электролизера согласно данному варианту осуществления, содержащего такой электрод для электролиза, каталитическая активность электрода сохраняется высокой на протяжении длительного времени, и может стабильно получаться высокочистый хлор.
Примеры
[0051] Данный вариант осуществления будет описан ниже более подробно на основе Примеров. Данный вариант осуществления не ограничен только этими Примерами. Сначала ниже будут показаны методы оценки в Примерах и Сравнительных примерах.
(Электролиз хлорида натрия при испытании способа с ионообменной мембраной)
[0052] В качестве электролитической ячейки была предусмотрена электролитическая ячейка, включающая анодную ячейку с анодной камерой и катодную ячейку с катодной камерой.
Каждый из электродов для электролиза, приготовленных в Примерах и Сравнительных примерах, разрезали до заданного размера (95×110 мм = 0,01045 м2) с получением испытуемого электрода, и испытуемый электрод установили на ребро в анодной камере анодной ячейки с помощью сварки и использовали в качестве анода.
В качестве катода использовали катод, полученный покрыванием подложки из никелевой проволочной сетки катализатором из оксида рутения. Сначала выполненную из металлического никеля просечно-вытяжную подложку, в качестве токоотвода, обрезали до такого же размера, как анод, и приварили на ребро в катодной камере катодной ячейки, затем разместили демпфирующую прокладку, полученную вязанием выполненных из никеля проволок, и на ней разместили катод.
В качестве уплотнения использовали каучуковый уплотнитель, выполненный из EPDM (этилен-пропилен-диенового каучука), и между анодной ячейкой и катодной ячейкой проложили ионообменную мембрану. В качестве такой ионообменной мембраны применяли предназначенную для электролиза хлорида натрия катионообменную мембрану «Aciplex» (R) F6801 (производства фирмы «Asahi Kasei Corporation»).
[0053] Чтобы измерять перенапряжение хлора, платиновую проволоку с покрытием из PFA (сополимера тетрафторэтилена и перфторалкилвинилового простого эфира), с которой покрытие было удалено на участке примерно 1 мм от конца, чтобы обнажить платину, закрепили на поверхности анода, противоположной ионообменной мембране, привязыванием ниткой, выполненной из политетрафторэтилена, и использовали в качестве электрода сравнения. Во время испытания электролиза электрод сравнения предполагался дающим потенциал выделения хлора вследствие атмосферы, насыщенной образовавшимся газообразным хлором. Поэтому результат, полученный вычитанием потенциала электрода сравнения из потенциала анода, оценивали как перенапряжение хлора на аноде.
С другой стороны, в качестве напряжения электролиза измеряли разность потенциалов между катодом и анодом.
Для измерения первоначальных характеристик электролиза на аноде по перенапряжению и напряжению электролиза соответственно измеряли значения каждые 7 дней после начала электролиза. Что касается условий электролиза, то электролиз выполняли при плотности тока 6 кА/м2, концентрации рассола 205 г/л в анодной ячейке, концентрации NaOH 32 мас.% в катодной ячейке и температуре 90°С. В качестве электролитического выпрямителя применяли «PAD36-100LA» (производства фирмы «KIKUSUI ELECTRONICS CORPORATION»).
(Ускоренное испытание)
[0054] Использовали такую же электролитическую ячейку, как и в вышеописанном испытании электролиза хлорида натрия способом с ионообменной мембраной, за исключением того, что использовали установленный в анодной ячейке испытуемый электрод, разрезанный до размера 58×48 мм = 0,002748 м2.
Что касается условий электролиза, то электролиз выполняли при плотности тока 6 кА/м2, концентрации рассола 205 г/л в анодной ячейке, концентрации NaOH 32 мас.% в катодной ячейке и температуре 90°С. Для подтверждения долговечности испытуемого электрода выполнили серию операций, прекращение электролиза, промывание водой электролитической ячейки (10 минут) и запуск электролиза, с частотой один раз каждые 7 дней, и измеряли перенапряжение хлора (перенапряжение на аноде) каждые 7 дней после начала электролиза. Кроме того, остаточные доли Ru и Ir в слое катализатора в испытуемом электроде после электролиза (100 × содержание до электролиза/содержание после электролиза, %) рассчитывали с использованием численных значений, полученных измерением методом рентгенофлуоресцентного анализа (XRF) металлических компонентов до и после электролиза. В качестве прибора для XRF-измерений применяли Niton XL3t-800 или XL3t-800s (торговое название, производства фирмы Thermo Scientific).
(Значение D как показатель емкости двойного электрического слоя)
[0055] Испытуемый электрод обрезали до размера 30×30 мм = 0,0009 м2 и прикрепили к электролитической ячейке винтом, выполненным из титана. Для противоэлектрода использовали платиновую сетку и проводили электролиз в водном растворе NaCl при 85-90°С и концентрации рассола 205 г/л, при плотностях тока электролиза 1 кА/м2, 2 кА/м2 и 3 кА/м2 в течение 5 минут каждой и при 4 кА/м2 в течение 30 минут так, что испытуемый анод выделял хлор.
После вышеописанного электролиза, используя Ag/AgCl в качестве электрода сравнения, в диапазоне приложенного потенциала от 0 В до 0,3 В, при скоростях развертки 10 мВ/с, 30 мВ/с, 50 мВ/с, 80 мВ/с, 100 мВ/с и 150 мВ/с, проводили измерения методом циклической вольтамперометрии, и измеряли плотность тока электролиза при 0,15 В, что было центром диапазона приложенного потенциала во время прямого хода развертки от 0 В до 0,3 В, и плотность тока электролиза при 0,15 В, что было центром диапазона приложенного потенциала во время обратного хода развертки от 0,3 В до 0 В, и получали разность между этими двумя плотностями тока электролиза при каждой описанной выше скорости развертки. Произведение разности плотности тока электролиза, полученной при каждой скорости развертки, и 0,3 В, диапазона развертки, обычно было прямо пропорционально скорости развертки, и его наклон рассчитывали как значение D (Кл/м2), являющееся показателем емкости двойного электрического слоя.
[Пример 1]
[0056] В качестве проводящей подложки использовали выполненную из титана просечно-вытяжную подложку, в которой больший размер (LW) отверстия составлял 6 мм, меньший размер (SW) отверстия составлял 3 мм, а толщина пластины составляла 1,0 мм. Эту просечно-вытяжную подложку прокаливали на воздухе при 540°С в течение 4 часов для образования оксидной пленки на ее поверхности, а затем подвергли кислотной обработке в 25%-ной по массе серной кислоте при 85°С в течение 4 часов для предварительной обработки, чтобы создать мельчайшие неровности на поверхности проводящей подложки.
Затем, в то время как водный раствор нитрата рутения (производства фирмы «Furuya Metal Co., Ltd.», концентрация рутения 100 г/л) охлаждали до 5°C или менее сухим льдом и перемешивали, малыми порциями добавляли тетрахлорид титана (производства фирмы «Wako Pure Chemical Industries, Ltd.»), и затем дополнительно добавляли малыми порциями водный раствор хлорида иридия (производства фирмы «TANAKA KIKINZOKU KOGYO K.K.», концентрация иридия 100 г/л) и хлорид ванадия(III) (производства фирмы «KISHIDA CHEMICAL Co., Ltd.») так, чтобы соотношение элементов (молярное соотношение) рутения, иридия, титана и ванадия составляло 21,25:21,25:42,5:15. Так получили жидкость А1 для нанесения покрытия, представлявшую собой водный раствор с общей концентрацией металлов 100 г/л.
[0057] Эту жидкость А1 для нанесения покрытия нагнетали в принимающий жидкость бак машины для нанесения покрытий, приводили во вращение выполненный из EPDM губчатый валик, всасывающий жидкость А1 для нанесения покрытия для пропитки, а выполненный из поливинилхлорида (PVC) валик разместили так, чтобы он был в контакте с верхней частью губчатого валика. Затем проводящую подложку, подвергнутую предварительной обработке, пропускали между выполненным из EPDM губчатым валиком и выполненным из PVC валиком для нанесения покрытия. Немедленно после нанесения покрытия, проводящую подложку после вышеуказанного нанесения покрытия пропускали между двумя выполненными из EPDM губчатыми валиками, обернутыми тканью, для впитывания избыточной жидкости для нанесения покрытия. Затем выполняли высушивание при 50°С в течение 10 минут, а затем выполняли прокаливание на воздухе при 400°С в течение 10 минут.
Цикл, включающий вышеуказанные нанесение покрытия валиком, высушивание и прокаливание, дополнительно повторили три раза с повышенной температурой прокаливания 450°С, и, наконец, дополнительно провели прокаливание при 520°С в течение 1 часа с образованием черновато-коричневого слоя катализатора на проводящей подложке, изготовив электрод для электролиза.
[Сравнительный пример 1]
[0058] В то время как водный раствор хлорида рутения (производства фирмы «TANAKA KIKINZOKU KOGYO K.K.», концентрация рутения 100 г/л) охлаждали до 5°C или менее сухим льдом и перемешивали, малыми порциями добавляли тетрахлорид титана (производства фирмы «Wako Pure Chemical Industries, Ltd.»), а затем дополнительно добавляли малыми порциями водный раствор хлорида иридия (производства фирмы «TANAKA KIKINZOKU KOGYO K.K.», концентрация иридия 100 г/л) так, чтобы соотношение элементов (молярное соотношение) рутения, иридия и титана составляло 25:25:50. Тем самым получили жидкость В1 для нанесения покрытия, представлявшую собой водный раствор с общей концентрацией металлов 100 г/л. Электрод для электролиза изготовили таким же способом, как и в Примере 1, за исключением того, что применяли эту жидкость В1 для нанесения покрытия, и цикл, включающий нанесение покрытия валиком, высушивание и прокаливание, выполняли с первой температурой прокаливания, установленной на 440°С, а затем повторяли три раза с повышенной температурой прокаливания 475°С, и, наконец, дополнительно провели прокаливание при 520°С в течение 1 часа.
[Пример 2]
[0059] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что проводящую подложку покрывали с использованием жидкости А2 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и ванадия было 25,45:25,45:30:19,1.
[Пример 3]
[0060] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что проводящую подложку покрывали с использованием жидкости А3 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и ванадия было 28,75:28,75:20:22,5.
[Пример 4]
[0061] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что проводящую подложку покрывали с использованием жидкости А4 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и ванадия было 32,05:32,05:10:25,9.
[Пример 5]
[0062] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что проводящую подложку покрывали с использованием жидкости А5 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и ванадия было 17,5:17,5:35:30.
[0063] Таблица 1 показывает конфигурацию (состав металлов в жидкости для нанесения покрытия, используемой для формирования слоя катализатора) каждого из электродов для электролиза, изготовленных в Примерах 1-5 и Сравнительном примере 1 соответственно, вместе с измеренным значением D, являющимся показателем емкости двойного электрического слоя. Единица «мол.%» в таблице означает содержание в мольных процентах (фактическое значение соотношения добавленных элементов) в расчете на все элементы-металлы, содержащиеся в образованном слое катализатора. Значение отношения первого элемента-переходного металла/Ru и значение отношения первого элемента-переходного металла/Ti представляли собой значения, рассчитанные из фактического значения соотношения добавленных элементов.
[0064] [Таблица 1]
[Испытание способа электролиза хлорида натрия с ионообменной мембраной]
[0065] Испытание способа электролиза хлорида натрия с ионообменной мембраной проводили с использованием электродов для электролиза, изготовленных в Примерах 1-5 и Сравнительном примере 1 соответственно. Результаты показаны в Таблице 2.
[0066] [Таблица 2]
6 кА/м2
6 кА/м2
[0067] Напряжение электролиза при плотности тока 6 кА/м2 составляло 2,94 В для Примера 1 и 2, 2,92 В – для Примера 3 и 4, и 2,91 В – для Примера 5. Все они были очень низкими значениями по сравнению с 2,99 В для Сравнительного примера 1. Перенапряжение на аноде составляло 0,032 В для Примера 1, 0,034 В – для Примера 2, 0,032 В – для Примера 3 и Примера 4, и 0,031 В – для Примера 5. Все они были низкими значениями по сравнению с 0,057 В для Сравнительного примера 1.
[Пример 6]
[0068] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что проводящую подложку покрывали с использованием жидкости А6 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и ванадия было 37:33,35:11,15:18,5, и цикл, включающий нанесение покрытия валиком, высушивание и прокаливание, проводили с первой температурой прокаливания, установленной на 310°С, а затем повторили три раза с повышенной температурой прокаливания 520°С, и далее провели прокаливание при 520°С в течение 1 часа.
[Пример 7]
[0069] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что проводящую подложку покрывали с использованием жидкости А7 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и ванадия было 31,25:28,1:9,4:31,25, и цикл, включающий нанесение покрытия валиком, высушивание и прокаливание, проводили с первой температурой прокаливания, установленной на 380°С, а затем повторили три раза с повышенной температурой прокаливания 450°С, и далее провели прокаливание при 450°С в течение 1 часа.
[Пример 8]
[0070] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что использовали водный раствор хлорида рутения (производства фирмы «TANAKA KIKINZOKU KOGYO K.K.», концентрация рутения 100 г/л) вместо водного раствора нитрата рутения, проводящую подложку покрывали с использованием жидкости А8 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и ванадия было 19,6:20,2:47,09:13,11, и цикл, включающий нанесение покрытия валиком, высушивание и прокаливание, проводили восемь раз с температурами прокаливания, установленными на 393°С, а затем дополнительно провели прокаливание при 485°С в течение 1 часа.
[Пример 9]
[0071] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что использовали водный раствор хлорида рутения (производства фирмы «TANAKA KIKINZOKU KOGYO K.K.», концентрация рутения 100 г/л) вместо водного раствора нитрата рутения, вместо хлорида ванадия(III) использовали гексагидрат хлорида кобальта(II) (производства фирмы «Wako Pure Chemical Industries, Ltd.»), проводящую подложку покрывали с использованием жидкости А9 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и кобальта было 50:3:30:17, и цикл, включающий нанесение покрытия валиком, высушивание и прокаливание, проводили с первой температурой прокаливания, установленной на 440°С, а затем повторили три раза с повышенной температурой прокаливания 475°С, и, наконец, дополнительно провели прокаливание при 520°С в течение 1 часа.
[Пример 10]
[0072] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что вместо хлорида ванадия(III) использовали тригидрат нитрата меди(II) (производства фирмы «Wako Pure Chemical Industries, Ltd.»), и проводящую подложку покрывали с использованием жидкости А10 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и меди было 32,05:32,05:10:25,9.
[Пример 11]
[0073] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что вместо хлорида ванадия(III) использовали гексагидрат нитрата цинка(II) (производства фирмы «Wako Pure Chemical Industries, Ltd.»), и проводящую подложку покрывали с использованием жидкости А11 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и цинка было 32,05:32,05:10:25,9.
[Сравнительный пример 2]
[0074] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что проводящую подложку покрывали с использованием жидкости В2 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и ванадия было 20:18:60:2, для составления жидкости для нанесения покрытия использовали водный раствор хлорида рутения (производства фирмы «TANAKA KIKINZOKU KOGYO K.K.», концентрация рутения 100 г/л), и цикл, включающий нанесение покрытия валиком, высушивание и прокаливание, проводили с первой температурой прокаливания, установленной на 450°С, и затем повторили три раза с такими же температурами прокаливания, и дополнительно провели прокаливание при 450°С в течение 1 часа.
[Сравнительный пример 3]
[0075] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что проводящую подложку покрывали с использованием жидкости В3 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и ванадия было 22,7:20,5:34,1:22,7, и цикл, включающий нанесение покрытия валиком, высушивание и прокаливание, проводили с первой температурой прокаливания, установленной на 380°С, и затем повторили три раза с такими же температурами прокаливания, и, наконец, дополнительно провели прокаливание при 590°С в течение 1 часа.
[Сравнительный пример 4]
[0076] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что проводящую подложку покрывали с использованием жидкости В4 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и ванадия было 28,6:25,7:42,8:2,9, и цикл, включающий нанесение покрытия валиком, высушивание и прокаливание, проводили с первой температурой прокаливания, установленной на 450°С, и затем повторили три раза с повышенной температурой прокаливания 520°С, и дополнительно провели прокаливание при 520°С в течение 1 часа.
[Сравнительный пример 5]
[0077] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что проводящую подложку покрывали с использованием жидкости В5 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и ванадия было 18,5:16,7:55,55:9,25, для составления жидкости для нанесения покрытия использовали водный раствор хлорида рутения (производства фирмы «TANAKA KIKINZOKU KOGYO K.K.», концентрация рутения 100 г/л), и цикл, включающий нанесение покрытия валиком, высушивание и прокаливание, проводили с первой температурой прокаливания, установленной на 310°С, и затем повторили три раза с повышенной температурой прокаливания 380°С, и, наконец, дополнительно провели прокаливание при 590°С в течение 1 часа.
[Сравнительный пример 6]
[0078] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что вместо хлорида ванадия(III) в Примере 1 использовали нитрат марганца (производства фирмы «Wako Pure Chemical Industries, Ltd.»), и проводящую подложку покрывали с использованием жидкости В6 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и марганца было 21,25:21,25:42,5:15.
[Сравнительный пример 7]
[0079] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что вместо хлорида ванадия(III) в Примере 1 использовали нитрат цинка (производства фирмы «Wako Pure Chemical Industries, Ltd.»), и проводящую подложку покрывали с использованием жидкости В7 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и цинка было 21,25:21,25:42,5:15.
[Сравнительный пример 8]
[0080] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что вместо хлорида ванадия(III) в Примере 1 использовали нитрат палладия (производства фирмы «Wako Pure Chemical Industries, Ltd.»), проводящую подложку покрывали с использованием жидкости В8 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, иридия, титана и палладия было 16,9:15,4:50,8:16,9, и цикл, включающий нанесение покрытия валиком, высушивание и прокаливание, проводили с первой температурой прокаливания, установленной на 450°С, и затем повторили три раза с повышенной температурой прокаливания 520°С, и, наконец, дополнительно провели прокаливание при 590°С в течение 1 часа.
[Сравнительный пример 9]
[0081] Электрод для электролиза изготовили таким же способом, как в Примере 1, за исключением того, что проводящую подложку покрывали с использованием жидкости В9 для нанесения покрытия, составленной так, что соотношение элементов (молярное соотношение) рутения, титана и ванадия было 40:40:20, для составления жидкости для нанесения покрытия использовали водный раствор хлорида рутения (производства фирмы «TANAKA KIKINZOKU KOGYO K.K.», концентрация рутения 100 г/л), и цикл, включающий нанесение покрытия валиком, высушивание и прокаливание, проводили с первой температурой прокаливания, установленной на 440°С, и затем повторили три раза с повышенной температурой прокаливания 475°С, и, наконец, дополнительно провели прокаливание при 520°С в течение 1 часа.
[0082] Таблица 3 показывает конфигурацию (состав металлов в жидкости для нанесения покрытия, используемой для формирования слоя катализатора) каждого из электродов для электролиза, изготовленных в Примерах 6-11 и Сравнительных примерах 2-9 соответственно, вместе с измеренным значением D, являющимся показателем емкости двойного электрического слоя. Единица «мол.%» в таблице означает содержание в мольных процентах (соотношение при подаче) в расчете на все элементы-металлы, содержащиеся в образованном слое катализатора. Значение отношения первого элемента-переходного металла/Ru и значение отношения первого элемента-переходного металла/Ti представляли собой значения, рассчитанные из соотношения при подаче.
[0083] [Таблица 3]
(*) Со для Примера 9, Cu для Примера 10, Zn для Примера 11, Zn для Сравнительного примера 7, Pd для Сравнительного примера 8.
[Ускоренное испытание]
[0084] Ускоренное испытание проводили с использованием электродов для электролиза, изготовленных в Примерах 1-11 и Сравнительных примерах 1-9 соответственно. Результаты показаны в Таблице 4. Для Сравнительного примера 9 долговечность рутения была низка, и поэтому показаны результаты оценки в момент времени, когда испытание было прекращено после 14 дней.
[0085] [Таблица 4]
6 кА/м2
(*) Сравнительный пример 9: значение в момент времени, когда испытание было прекращено после 14 дней в испытании.
[0086] При проведении ускоренного испытания в течение 21 дня было найдено следующее. В отношении электродов для электролиза Примеров 1-11 перенапряжение на аноде через 1 день после начала испытания составляло от 0,030 до 0,045 В, а перенапряжение на аноде через 21 день составляло от 0,030 до 0,039 В. В отличие от этого, в случае электродов для электролиза Сравнительных примеров 1-8 перенапряжение на аноде через 1 день после начала испытания составляло от 0,042 до 0,110 В, а перенапряжение на аноде через 21 день составляло от 0,043 до 0,093 В. Тем самым было подтверждено, что Примеры обеспечивали возможность электролиза при низком напряжении и с низким расходом электроэнергии на начальном этапе электролиза и на протяжении длительного периода времени, в сопоставлении со Сравнительными примерами. В дополнение, для Примеров 1-11 остаточные доли обоих из Ru и Ir были высокими даже через 21 день после начала испытания, в сопоставлении со Сравнительным примером 9, для которого перенапряжение на аноде было на том же уровне, и было подтверждено, что хотя перенапряжение на аноде сохранялось низким, долговечность при длительном электролизе также был достаточным.
[0087] Эта заявка испрашивает приоритет на основе заявки на патент Японии № 2016-227066, поданной 22 ноября 2016 года, содержание которой включено сюда по ссылке.
Промышленная применимость
[0088] Электрод для электролиза согласно настоящему изобретению обеспечивает низкое перенапряжение выделения хлора и позволяет проводить электролиз при низком напряжении и с низким расходом электроэнергии, и поэтому может предпочтительно использоваться в области электролиза хлорида натрия. В частности, электрод для электролиза согласно настоящему изобретению пригоден в качестве анода для электролиза хлорида натрия способом с ионообменной мембраной, и может производить газообразный хлор высокой чистоты с низкой концентрацией газообразного кислорода, при низком напряжении и с низким расходом электроэнергии на протяжении длительного периода времени.
[0089] Список ссылочных позиций
200 электролизер для электролиза
210 электролитический раствор
220 контейнер
230 анод (электрод для электролиза)
240 катод
250 ионообменная мембрана
260 провода
Изобретение относится к электроду для электролиза, содержащему: проводящую подложку; и слой катализатора, сформированный на поверхности проводящей подложки, причем слой катализатора содержит элемент рутений, элемент иридий, элемент титан и по меньшей мере один первый элемент-переходный металл, выбранный из группы, состоящей из V, Cr, Fe, Co, Cu и Zn, относительное содержание первого элемента-переходного металла, содержащегося в слое катализатора, в расчете на 1 моль элемента титана составляет 0,25 мол.% или более и менее 3,4 мол.%, и значение D, являющееся показателем емкости двойного электрического слоя электрода для электролиза, составляет 120 Кл/м2 или более и 420 Кл/м2 или менее. Также изобретение относится к способу получения электрода и электролизеру. Предлагаемый электрод для электролиза может снижать перенапряжение на начальном этапе электролиза и позволяет проводить электролиз при низком напряжении и с низким расходом электроэнергии на протяжении длительного периода времени. 3 н. и 6 з.п. ф-лы, 2 ил., 4 табл., 11 пр.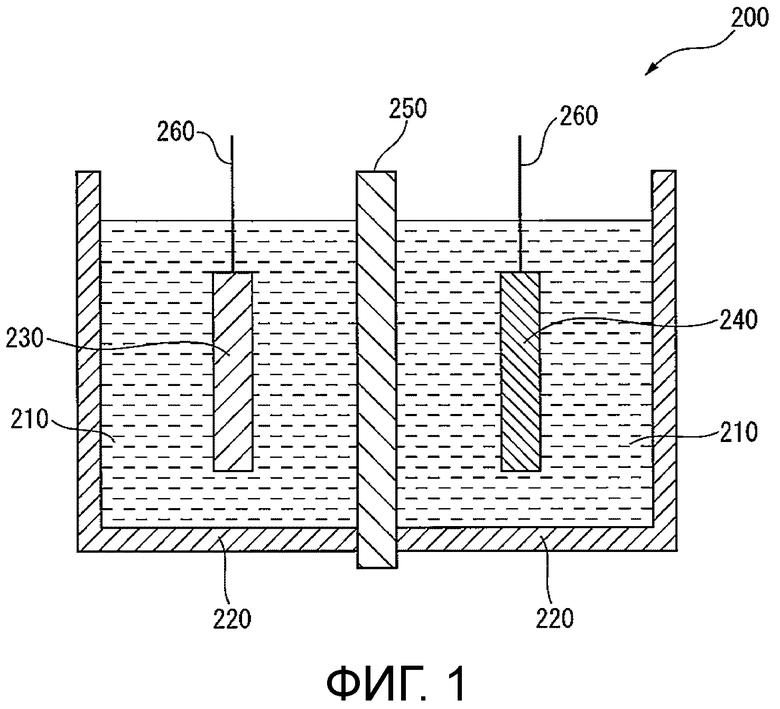
1. Электрод для электролиза, содержащий:
проводящую подложку; и
слой катализатора, сформированный на поверхности проводящей подложки, причем
слой катализатора содержит элемент рутений, элемент иридий, элемент титан и по меньшей мере один первый элемент-переходный металл, выбранный из группы, состоящей из V, Cr, Fe, Co, Cu и Zn,
относительное содержание первого элемента-переходного металла, содержащегося в слое катализатора, в расчете на 1 моль элемента титана составляет 0,25 мол.% или более и менее 3,4 мол.%, и
значение D, являющееся показателем емкости двойного электрического слоя электрода для электролиза, составляет 120 Кл/м2 или более и 420 Кл/м2 или менее.
2. Электрод для электролиза по п. 1, в котором первый элемент-переходный металл образует твердый раствор с твердым раствором оксида рутения, оксида иридия и оксида титана.
3. Электрод для электролиза по п. 1 или 2, в котором первый элемент-переходный металл включает по меньшей мере один элемент-металл, выбранный из группы, состоящей из ванадия, кобальта, меди и цинка.
4. Электрод для электролиза по любому из пп. 1-3, в котором первый элемент-переходный металл включает элемент ванадий.
5. Электрод для электролиза по любому из пп. 1-4, в котором относительное содержание первого элемента-переходного металла в расчете на все элементы-металлы, содержащиеся в слое катализатора, составляет 10 мол.% или более и 30 мол.% или менее.
6. Электрод для электролиза по любому из пп. 1-5, в котором относительное содержание первого элемента-переходного металла, содержащегося в слое катализатора, в расчете на 1 моль элемента рутения составляет 0,3 моля или более и менее 2 молей.
7. Электрод для электролиза по любому из пп. 1-6, в котором значение D составляет 120 Кл/м2 или более и 380 Кл/м2 или менее.
8. Способ получения электрода для электролиза по любому из пп. 1-7, включающий:
приготовление жидкости для нанесения покрытия, содержащей соединение рутения, соединение иридия, соединение титана и соединение, содержащее первый элемент-переходный металл;
нанесение на по меньшей мере одну поверхность проводящей подложки жидкости для нанесения покрытия с образованием пленки покрытия; и
прокаливание пленки покрытия в кислородсодержащей атмосфере с образованием слоя катализатора,
причем температура прокаливания составляет от 300°С до 650°С,
причем относительное содержание первого элемента-переходного металла, содержащегося в слое катализатора, в расчете на 1 моль элемента титана составляет 0,25 мол.% или более и менее 3,4 мол.%.
9. Электролизер, содержащий электрод для электролиза по любому из пп. 1-7.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| JP 5686455 B2, 18.03.2015 | |||
| RU 2002102499 A, 27.08.2003 | |||
| АНОД ДЛЯ ЭЛЕКТРОЛИЗА | 2007 |
|
RU2419686C2 |
| Предохранительное устройство впереди повозки | 1928 |
|
SU9714A1 |
| ИРИДИЕВО-ТИТАНОВЫЙ ЭЛЕКТРОД И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 1996 |
|
RU2140466C1 |
Авторы
Даты
2020-04-28—Публикация
2017-11-17—Подача