Перекрестная ссылка на родственные заявки
[0001] По настоящей заявке испрашивается приоритет предварительной заявки США № 61/730906, поданной 28 ноября 2012 г., предварительной заявки США № 61/761641, поданной 6 февраля 2013 г., предварительной заявки США № 61/818874, поданной 2 мая 2013 г., и предварительной заявки США № 61/869200, поданной 23 августа 2013 г., полное описание каждой включено в настоящее описание в качестве ссылки в полном объеме для любых целей.
Перечень последовательностей
[0002] Настоящая заявка содержит перечень последовательностей, который был подан посредством EFS-Web и включен в настоящее описание в качестве ссылки в полном объеме.
Уровень техники
[0003] Биспецифические антитела способны связываться с двумя различными эпитопами. Эти эпитопы могут располагаться на одном и том же антигене, или эпитопы могут располагаться на разных антигенах. Эта особенность биспецифических антител делает их привлекательным инструментом для различных вариантов терапевтического применения, когда терапевтический эффект лечения заболевания заключается в нацеливании или привлечении более одной молекулы. Один из подходов формирования биспецифического антитела предполагает сопутствующую экспрессию двух уникальных тяжелых цепей антитела и двух уникальных легких цепей антитела. Правильное образование биспецифических антител в формате, подобном антителам дикого типа, остается проблемой, так как тяжелые цепи антител в эволюции связывают легкие цепи антител сравнительно беспорядочным образом. В результате такого беспорядочного образования пар одновременная экспрессия двух тяжелых цепей антитела и двух легких цепей антитела в природе приводит к перестановке элементов пар тяжелая–легкая цепи. Это ошибочное образование пар остается главной трудностью при создании биспецифических терапевтических средств, при которых однородное образование пар является необходимым условием для удовлетворительной производительности и биологической эффективности.
[0004] Было описано несколько подходов к получению биспецифических антител, при которых определенные легкие цепи или фрагменты антител образуют пары с определенными тяжелыми цепями или фрагментами антител. Обзор различных подходов к решению этой задачи можно найти в публикации Klein et al., (2012) mAbs 4:6, 1-11. В международной патентной заявке PCT/EP2011/056388 (WO2011/131746) описан in vitro способ получения гетеродимерного белка, в котором в области СН3 двух моноспецифических исходных белков вносят асимметричные мутации для того, чтобы запустить направленный обмен «Fab-фрагмента» или «половины молекулы» между двумя моноспецифическими IgG4- или IgG4-подобными антителами при инкубировании в восстанавливающих условиях.
[0005] В статье Schaefer et al. (Roche Diagnostics GmbH) описан способ сборки двух тяжелых и двух легких цепей, полученных из двух существующих антител, в двухвалентные биспецифические антитела IgG человека, не используя искусственные линкеры (PNAS (2011) 108(27): 11187-11192). Способ предусматривает обмен доменов тяжелой цепи и легкой цепи в пределах антигенсвязывающего фрагмента (Fab) одной половины биспецифического антитела.
[0006] В статье Strop et al. (Rinat-Pfizer Inc.) описан способ независимого получения стабильных биспецифических антител путем экспрессии и очистки двух представляющих интерес антител, а затем смешения их в определенных окислительно-восстановительных условиях (J. Mol. Biol. (2012) 420:204-19).
[0007] В статье Zhu et al. (Genentech) были разработаны мутации в интерфейсе VL/VH конструкции диатела, состоящей из вариантов фрагментов доменные антител, полностью лишенных константных доменов, и создано гетеродимерное диатело (Protein Science (1997) 6:781-788). Подобным образом, в статье Igawa et al. (Chugai) также были разработаны мутации в интерфейсе VL/VH одноцепочечного диатела для стимуляции селективной экспрессии и ингибирования конформационной изомеризации диатела (Protein Engineering, Design & Selection (2010) 23:667-677).
[0008] В публикации патента США № 2009/0182127 (Novo Nordisk, Inc.) описано получение биспецифических антител посредством модификации аминокислотных остатков в интерфейсе Fc и в интерфейсе пар CH1:CL легкая-тяжелая цепь, что снижает способность легкой цепи одной пары взаимодействовать с тяжелой цепью другой пары.
Сущность изобретения
[0009] В настоящем документе описана выделенная антигенсвязывающая полипептидная конструкция, содержащая по меньшей мере первый гетеродимер и второй гетеродимер, при этом первый гетеродимер содержит полипептидную последовательность тяжелой цепи первого иммуноглобулина (H1) и полипептидную последовательность легкой цепи первого иммуноглобулина (L1); а второй гетеродимер содержит полипептидную последовательность тяжелой цепи второго иммуноглобулина (H2) и полипептидную последовательность легкой цепи второго иммуноглобулина (L2), при этом по меньшей мере одна из последовательностей H1 или L1 первого гетеродимера отличается от соответствующей последовательности H2 или L2 второго гетеродимера, и при этом каждая из H1 и H2 содержит по меньшей мере вариабельный домен тяжелой цепи (VH домен) и константный домен тяжелой цепи (CH1 домен); каждая из L1 и L2 содержит по меньшей мере вариабельный домен легкой цепи (VL домен) и константный домен легкой цепи (CL домен); и по меньшей мере одна из H1, H2, L1 и L2 содержит по меньшей мере одну аминокислотную модификацию по меньшей мере одного константного домена и/или по меньшей мере одного вариабельного домена, при этом H1 предпочтительно образует пары с L1 по сравнению с L2, а H2 предпочтительно образует пары с L2 по сравнению с L1.
[0010] В некоторых аспектах конструкция дополнительно содержит гетеродимерный Fc, где Fc содержит по меньшей мере две последовательности CH3, при этом Fc связан с первым гетеродимером и вторым гетеродимером посредством одного или нескольких линкеров или без них, причем димеризованные последовательности CH3 имеют температуру плавления (Tпл) около 68°C или выше, как измерено посредством дифференциальной сканирующей калориметрии (DSC), и при этом конструкция является биспецифической.
[0011] В некоторых аспектах по меньшей мере одна аминокислотная модификация выбрана по меньшей мере из одной аминокислотной модификации, показанной в таблицах или примерах.
[0012] В некоторых аспектах H1 предпочтительно образует пары с L1 по сравнению с L2, а H2 предпочтительно образует пары с L2 по сравнению с L1 при совместной экспрессии H1, H2, L1 и L2 в клетке или в клетке млекопитающего, или при совместной экспрессии H1, H2, L1 и L2 в бесклеточной системе экспрессии, или если H1, H2, L1 и L2 совместно производятся, или если H1, H2, L1 и L2 совместно производятся при помощи окислительно-восстановительной системы продукции.
[0013] В некоторых аспектах по меньшей мере одна из H1, H2, L1 и L2 содержит по меньшей мере одну аминокислотную модификацию домена VH и/или VL и по меньшей мере одну аминокислотную модификацию домена CH1 и/или CL, так что H1 предпочтительно образует пары с L1 по сравнению с L2, и/или H2 предпочтительно образует пары с L2 по сравнению с L1.
[0014] В некоторых аспектах, если H1 содержит по меньшей мере одну аминокислотную модификацию в домене CH1, то по меньшей мере одна из L1 и L2 содержит по меньшей мере одну аминокислотную модификацию в домене CL; и/или если H1 содержит по меньшей мере одну аминокислотную модификацию в домене VH, то по меньшей мере одна из L1 и L2 содержит по меньшей мере одну аминокислотную модификацию в домене VL.
[0015] В некоторых аспектах H1, L1, H2 и/или L2 содержит по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных мутаций. В некоторых аспектах по меньшей мере одна из H1, H2, L1 и L2 содержит по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотных модификаций по меньшей мере одного константного домена и/или по меньшей мере одного вариабельного домена.
[0016] В некоторых аспектах, если обе L1 и L2 совместно экспрессируются по меньшей мере с одной H1 и H2, относительное образование пар по меньшей мере одной из гетеродимерных пар H1-L1 и H2-L2 с соответствующей гетеродимерной парой H1-L2 или H2-L1 составляет больше чем 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 и 99%, и при этом относительное образование пар модифицированной гетеродимерной пары H1-L1 или H2-L2 является большим по сравнению с соответствующим относительным образованием пар, наблюдаемым в соответствующей гетеродимерной паре H1-L1 или H2-L2 без по меньшей мере одной аминокислотной модификации.
[0017] В некоторых аспектах термостабильность, определенная посредством измерения температуры плавления (Tпл), измеренной при помощи DSC, по меньшей мере одного из первого и второго гетеродимеров, находится в пределах около 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10°C от Tпл соответствующего гетеродимера без по меньшей мере одной аминокислотной модификации. В некоторых аспектах термостабильность, определенная посредством измерения температуры плавления (Tпл), измеренной при помощи DSC, каждого гетеродимера, содержащего по меньшей мере одну аминокислотную модификацию, находится в пределах около 0, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10°C от Tпл соответствующего гетеродимера без по меньшей мере одной аминокислотной модификации.
[0018] В некоторых аспектах аффинность каждого гетеродимера к антигену, с которым он связывается, находится в пределах около 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 25, 30, 35, 40, 45 или 50-кратной аффинности соответствующего немодифицированного гетеродимера к тому же антигену, как измерено посредством поверхностного плазмонного резонанса (SPR) или FACS.
[0019] В некоторых аспектах по меньшей мере одна из H1 и L1 содержит по меньшей мере один домен, содержащий по меньшей мере одну аминокислотную модификацию, что приводит к большей стерической комплементарности аминокислот при спаривании H1 с L1 по сравнению с L2. В некоторых аспектах по меньшей мере одна из H2 и L2 содержит по меньшей мере один домен, содержащий по меньшей мере одну аминокислотную модификацию, что приводит к большей стерической комплементарности аминокислот при спаривании H2 с L2 по сравнению с L1. В некоторых аспектах по меньшей мере одна из H1 и L1 содержит по меньшей мере один домен, содержащий по меньшей мере одну аминокислотную модификацию что приводит к большей электростатической комплементарности между заряженными аминокислотами при спаривании H1 с L1 по сравнению с L2. В некоторых аспектах по меньшей мере одна из H2 и L2 содержит по меньшей мере один домен, содержащий по меньшей мере одну аминокислотную модификацию, что приводит к большей электростатической комплементарности между заряженными аминокислотами при спаривании H2 с L2 по сравнению с L1.
[0020] В некоторых аспектах по меньшей мере одна из аминокислотных модификаций представляет собой набор мутаций, показанных по меньшей мере в одной из таблиц или в примерах. В некоторых аспектах по меньшей мере одна модификация не представляет собой H1-Q39E, L1-Q38K, H2-Q39K и L2-Q38E. В некоторых аспектах по меньшей мере одна модификация не представляет собой H1-Q39E, L1-Q38E, H2-Q39K и L2-Q38K.
[0021] В некоторых аспектах конструкция дополнительно содержит Fc, который содержит по меньшей мере две последовательности CH3, при этом Fc связан с первым гетеродимером и со вторым гетеродимером посредством одного или нескольких линкеров или без них.
[0022] В некоторых аспектах Fc представляет собой Fc человека, Fc IgG1 человека, Fc IgA человека, Fc IgG человека, Fc IgD человека, Fc IgE человека, Fc IgM человека, Fc IgG2 человека, Fc IgG3 человека или Fc IgG4 человека. В некоторых аспектах Fc представляет собой гетеродимерный Fc. В некоторых аспектах Fc содержит одну или больше модификаций по меньшей мере в одной из последовательностей CH3. В некоторых аспектах димеризованные последовательности CH3 имеют температуру плавления (Tпл), измеренную посредством DSC, составляющую около 68; 69; 70; 71; 72; 73; 74; 75; 76; 77; 77,5; 78; 79; 80; 81; 82; 83; 84 или 85°C или выше. В некоторых аспектах Fc представляет собой гетеродимер, который при производстве получен с чистотой более чем около 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%; или Fc представляет собой гетеродимер, полученный с чистотой более чем около 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% при экспрессии или при экспрессии в единственной клетке. В некоторых аспектах Fc содержит одну или больше модификаций по меньшей мере в одной из последовательностей CH3, которые способствуют получению гетеродимерного Fc со стабильностью, сравнимой со стабильностью гомодимерного Fc дикого типа. В некоторых аспектах Fc дополнительно содержит по меньшей мере одну последовательность CH2. В некоторых аспектах последовательность(и) CH2 Fc содержит(ат) одну или несколько модификаций. В некоторых аспектах Fc содержит одну или несколько модификаций, чтобы способствовать селективному связыванию Fc-гамма рецепторов.
[0023] В некоторых аспектах Fc связан с гетеродимерами посредством одного или нескольких линкеров, или при этом Fc связан с H1 и H2 посредством одного или нескольких линкеров. В некоторых аспектах один или несколько линкеров представляют собой один или несколько полипептидных линкеров. В некоторых аспектах один или несколько линкеров содержат один или несколько шарнирных участков антитела. В некоторых аспектах один или несколько линкеров содержат один или несколько шарнирных участков IgG1. В некоторых аспектах один или несколько линкеров содержат одну или несколько модификаций. В некоторых аспектах одна или более модификаций в одном или нескольких линкерах способствуют селективному связыванию Fc-гамма рецепторов.
[0024] В некоторых аспектах по меньшей мере одна аминокислотная модификация представляет собой по меньшей мере одну аминокислотную мутацию, или по меньшей мере одна аминокислотная модификация представляет собой по меньшей мере одну аминокислотную замену.
[0025] В некоторых аспектах последовательности каждой из H1, H2, L1 и L2 получены из человеческих последовательностей.
[0026] В некоторых аспектах конструкция является мультиспецифической или биспецифической. В некоторых аспектах конструкция является поливалентной или двухвалентной.
[0027] В настоящем документе также описан выделенный полинуклеотид или набор выделенных полинуклеотидов, содержащих по меньшей мере одну последовательность, которая кодирует конструкцию, описанную в настоящем документе. В некоторых аспектах полинуклеотид или набор полинуклеотидов представляют собой кДНК.
[0028] В настоящем документе также описан вектор или набор векторов, содержащих один или несколько полинуклеотидов или набор полинуклеотидов, описанных в настоящем документе. В некоторых аспектах вектор или набор векторов выбран из группы, состоящей из плазмиды, мультицистронного вектора, вирусного вектора, неэписомного вектора млекопитающих, вектора экспрессии и рекомбинантного вектора экспрессии.
[0029] В настоящем документе также описана выделенная клетка, которая содержит полинуклеотид или набор полинуклеотидов, описанных в настоящем документе, или вектор или набор векторов, описанных в настоящем документе. В некоторых аспектах клетка представляет собой гибридому, клетку яичника китайского хомячка (CHO) или клетку HEK293.
[0030] В настоящем документе также описана фармацевтическая композиция, содержащая конструкцию, описанную в настоящем документе, и фармацевтически приемлемый носитель. В некоторых аспектах композиция дополнительно содержит одно или несколько веществ, выбранных из группы, состоящей из буфера, антиоксиданта, низкомолекулярной молекулы, лекарственного средства, белка, аминокислоты, углевода, липида, хелатирующего агента, стабилизатора и вспомогательного вещества.
[0031] В настоящем документе также описано применение конструкции, описанной в настоящем документе, или фармацевтической композиции, описанной в настоящем документе, для лечения заболевания или расстройства, или злокачественной опухоли, или сосудистого заболевания у индивида или для получения лекарственного средства.
[0032] В настоящем документе также описан способ лечения индивида, страдающего заболеванием или расстройством, или больного раком или сосудистым заболеванием, включающий введение индивиду конструкции, описанной в настоящем документе, или композиции, описанной в настоящем документе.
[0033] В настоящем документе также описан способ ингибирования, уменьшения или блокирования сигнала внутри клетки или по направлению к клетке, включающий приведение в контакт клетки с конструкцией, описанной в настоящем документе, или композицией, описанной в настоящем документе.
[0034] В настоящем документе также описан способ получения конструкции, описанной в настоящем документе, из культуры клеток-хозяев, при этом способ включает стадии: (a) получения культуры клеток-хозяев, содержащей по меньшей мере одну клетку-хозяина, содержащую одну или несколько последовательностей нуклеиновых кислот, кодирующих указанную конструкцию; и (b) восстановления конструкции из культуры клеток-хозяев.
[0035] В настоящем документе также описан способ получения конструкции, описанной в настоящем документе, который включает стадии: (a) получения H1, L1, H2 и L2; (b) предоставления возможности H1 образовывать пары предпочтительно с L1 по сравнению с L2, а H2 образовывать пары предпочтительно с L2 по сравнению с L1; и (c) получения конструкции.
[0036] В настоящем документе также описан способ получения конструкции, описанной в настоящем документе, который включает: получение полинуклеотида или набора полинуклеотидов, кодирующих по меньшей мере одну конструкцию; определение оптимального соотношения каждого из полинуклеотида или набора полинуклеотидов для введения по меньшей мере в одну клетку-хозяина, при этом оптимальные соотношения определяют путем оценки количества гетеродимерных пар Н1-L1 и H2-L2, образованных при экспрессии H1, L1, H2 и L2 по сравнению с ошибочно спаренными гетеродимерными парами Н1-L2 и H2-L1, образующимися при экспрессии H1, L1, H2 и L2; выбор предпочтительного оптимального соотношения, при котором трансфекция по меньшей мере одной клетки-хозяина предпочтительным оптимальным соотношением полинуклеотида или набора полинуклеотидов приводит к экспрессии конструкции; трансфекцию по меньшей мере одной клетки-хозяина оптимальным соотношением полинуклеотида или набора полинуклеотидов; и культивирование по меньшей мере одной клетки-хозяина для экспрессии конструкции.
[0037] В некоторых аспектах выбор оптимального соотношения оценивают путем трансфекции в системе временной трансфекции. В некоторых аспектах трансфекция по меньшей мере одной клетки-хозяина предпочтительным оптимальным соотношением полинуклеотида или набором полинуклеотидов приводит к оптимальной экспрессии конструкции. В некоторых аспектах конструкция содержит Fc, который содержит по меньшей мере две последовательности CH3, при этом Fc связан с первым гетеродимером и вторым гетеродимером при помощи одного или нескольких линкеров или без них. В некоторых аспектах Fc представляет собой гетеродимер, необязательно содержащий одну или несколько аминокислотных модификаций.
[0038] В настоящем документе также описан машиночитаемый носитель для хранения данных, содержащий набор данных, представляющих комплементарные мутации в первом гетеродимере, содержащем полипептидную последовательность тяжелой цепи первого иммуноглобулина (H1) и полипептидную последовательность легкой цепи первого иммуноглобулина (L1); и втором гетеродимере, содержащем полипептидную последовательность тяжелой цепи второго иммуноглобулина (H2) и полипептидную последовательность легкой цепи второго иммуноглобулина (L2), при этом каждая из H1 и H2 содержит по меньшей мере вариабельный домен тяжелой цепи (VH домен) и константный домен тяжелой цепи (CH1 домен); при этом каждая из L1 и L2 содержит по меньшей мере вариабельный домен легкой цепи (VL домен) и константный домен легкой цепи (CL домен), и где набор данных комплементарных мутаций содержит данные, представляющие те мутации, что перечислены в таблицах или примерах, или подмножество этих мутаций; и рабочую компьютерную программу для определения вероятности того, будет ли H1 образовывать пары предпочтительно с L1 по сравнению с L2 и/или будет ли H2 образовывать пары предпочтительно с L2 по сравнению с L1.
[0039] В настоящем документе также описан способ на основе программного обеспечения для определения предпочтительного образования пар, включающий: получение набора данных, содержащего данные, представляющие комплементарные мутации в первом гетеродимере, содержащем полипептидную последовательность тяжелой цепи первого иммуноглобулина (H1) и полипептидную последовательность легкой цепи первого иммуноглобулина (L1); и втором гетеродимере, содержащем полипептидную последовательность тяжелой цепи второго иммуноглобулина (H2) и полипептидную последовательность легкой цепи второго иммуноглобулина (L2), при этом каждая из H1 и H2 содержит по меньшей мере вариабельный домен тяжелой цепи (VH домен) и константный домен тяжелой цепи (CH1 домен); при этом каждая из L1 и L2 содержит по меньшей мере вариабельный домен легкой цепи (VL домен) и константный домен легкой цепи (CL домен), и при этом набор данных комплементарных мутаций содержит данные, представляющие те мутации, что перечислены в таблицах или разделе «Примеры», или подмножество этих мутаций; и определение, при помощи процессора компьютера, вероятности того, будет ли H1 образовывать пары предпочтительно с L1 по сравнению с L2 и/или будет ли H2 образовывать пары предпочтительно с L2 по сравнению с L1. В некоторых аспектах способ дополнительно включает производство конструкции, описанной в настоящем документе.
[0040] В настоящем документе также описан способ получения биспецифической антигенсвязывающей полипептидной конструкции, при этом указанная биспецифическая конструкция содержит первый гетеродимер, содержащий полипептидную последовательность тяжелой цепи первого иммуноглобулина (H1) и полипептидную последовательность легкой цепи первого иммуноглобулина (L1) из первого моноспецифического антигенсвязывающего полипептида; и второй гетеродимер, содержащий полипептидную последовательность тяжелой цепи второго иммуноглобулина (H2) и полипептидную последовательность легкой цепи второго иммуноглобулина (L2) из второго моноспецифического антигенсвязывающего полипептида, при этом каждая из H1 и H2 содержит по меньшей мере вариабельный домен тяжелой цепи (VH домен) и константный домен тяжелой цепи (CH1 домен); при этом каждая из L1 и L2 содержит по меньшей мере вариабельный домен легкой цепи (VL домен) и константный домен легкой цепи (CL домен), при этом способ включает: получение набора данных, содержащих данные, представляющие набор аминокислотных модификаций в H1, H2, L1 и L2 таким образом, что при введении подмножества модификаций в H1, H2, L1 и/или L2, в тестовой системе H1 предпочтительно образует пары с L1 по сравнению с L2, и H2 предпочтительно образует пары с L2 по сравнению с L1; введение подмножества из одной или нескольких модификаций из набора данных в первый гетеродимер и/или второй гетеродимер; и совместную экспрессию первого гетеродимера и второго гетеродимера по меньшей мере в одной клетке-хозяине для получения продукта экспрессии, содержащего биспецифическую конструкцию.
[0041] В некоторых аспектах способ дополнительно включает определение количества биспецифической конструкции в продукте экспрессии по сравнению с другими полипептидными продуктами. В некоторых аспектах биспецифическую конструкцию получают с чистотой более чем 70% по сравнению с другими полипептидными продуктами. В некоторых аспектах набор данных представляет собой набор данных, описанный в настоящем документе. В некоторых аспектах способ дополнительно включает стадию добавления дополнительных аминокислотных модификаций по меньшей мере к одной из H1, H2, L1 или L2, чтобы повысить чистоту биспецифической конструкции по сравнению с другими полипептидными продуктами. В некоторых аспектах конструкция содержит Fc, который содержит по меньшей мере две последовательности CH3, при этом Fc связан с первым гетеродимером и вторым гетеродимером посредством одного или нескольких линкеров или без них. В некоторых аспектах Fc представляет собой гетеродимер, необязательно содержащий одну или несколько аминокислотных модификаций. В некоторых аспектах антигенсвязывающий полипептид представляет собой антитело, Fab или scFv.
Краткое описание графических материалов
[0042] На фигуре 1 представлена таблица, где показано предпочтительное образование пар гетеродимеров антигенсвязывающих конструкций, описанных в настоящем документе, в наборах дизайна LCCA, где аминокислотные модификации были сделаны в доменах VH или VL.
[0043] На фигуре 2 представлена таблица, где показано предпочтительное образование пар гетеродимеров в наборах дизайна LCCA, где аминокислотные модификации были сделаны в доменах CH1 или CL.
[0044] На фигуре 3 представлена таблица, где показана термостабильность и аффинность к антигену выбранных предпочтительно спаренных или ошибочно спаренных гетеродимеров антигенсвязывающих конструкций, описанных в настоящем документе.
[0045] На фигуре 4 представлены кривые термального разворачивания для выбранных гетеродимеров.
[0046] На фигуре 5 представлены профили эксклюзионной хроматографии для выбранных гетеродимеров.
[0047] На фигуре 6 изображены аминокислотные последовательности тяжелой цепи и легкой цепи D3H44, которые выровнены относительно канонических последовательностей зародышевой линии человека для сегментов вариабельной, константной и J-областей. (обозначения на фигурах: «*» идентичность последовательности, «#» интерфейсные горячие точки (драйверы специфичности), «+» мутированные остатки, протестированные в дизайнах). На фигуре 6A изображены подгруппы VH зародышевой линии человека (для каждого семейства изображена одна типичная последовательность). Идентичность последовательности основана на выравнивании D3H44 относительно VH3 и IGHJ3*02. На фигуре 6B изображены подгруппы VL каппа зародышевой линии человека (для каждого семейства изображена одна типичная последовательность). Идентичность последовательности основывается на выравнивании D3H44 относительно VKI и IGKJ1*01. На фигуре 6C изображены подгруппы VL лямбда зародышевой линии человека (для каждого семейства изображена одна типичная последовательность). Идентичность последовательности основывается на выравнивании D3H44 относительно VL1 и IGLJ1*01. На фигуре 6D изображены последовательности аллеля CH1 человека. На фигуре 6E изображены последовательности аллелей каппа и лямбда человека.
[0048] На фигуре 7 изображена блок-схема с изложением стратегии разработки биспецифического антитела.
[0049] На фигуре 8 проиллюстрирован схематический обзор высокого уровня требований конструирования для получения биспецифического Mab (моноклонального антитела) и необходимые требования к анализу количественного определения пар тяжелой цепи и легкой цепи. Цель дизайна конструирования биспецифического Mab высокой чистоты (то есть с незначительным ошибочным образованием пар или без ошибочного образования пар объединений H-L) может быть достигнута путем рационального конструирования (через введение специфических аминокислотных мутаций) предпочтительного образования пар двух уникальных тяжелых цепей с их уникальными родственными легкими цепями. Этот процесс показан схематично; здесь H1 был сконструирован для предпочтительного образования пар с L1, а не с L2. Подобным образом, H2 был сконструирован для предпочтительного образования пар с L2, а не с L1. Для экспериментального скрининга дизайна биспецифических Mab необходим анализ, способный одновременно определять количественно H1-L1:H1-L2 и H2-L2:H2-L1. Эти требования к анализу могут быть упрощены, если предположить, что каждый биспецифический Fab-фрагмент может быть сконструирован независимо. В этом случае, в анализе будет необходимо только количественное определение H1-L1:H1-L2 или H2-L2:H2-L1, но не того и другого одновременно.
[0050] На фигуре 9 представлено схематическое изображение того, как метят тяжелые цепи и легкие цепи и как определяют предпочтительное образование пар. На этой схеме круг представляет собой клетку, в которую трансфицируют 3 конструкции. Продукты экспрессии секретируется из клетки, и супернатант (СПНТ) проходит через устройство обнаружения, в данном случае через чип SPR. Исходя из уровня обнаружения двух различных меток, слитых с двумя легкими цепями, конкурирующими за образование пар с тяжелой цепью, может быть определена количественная оценка предпочтительного образования пар тяжелой цепи с двумя легкими цепями.
[0051] На фигуре 10 изображены продукты, связанные с тяжелой цепью, ожидаемые, когда каждая из двух полноразмерных тяжелых цепей независимо совместно экспрессируется с двумя различными легкими цепями. Предпочтительное образование пар оценивается с помощью MCA.
[0052] На фигуре 11 изображен иллюстративный набор цепей H1, L1, H2, L2, который был разработан таким образом, что Н1 предпочтительно образует пары с L1 по сравнению с L2 и H2 предпочтительно образует пары с L2 по сравнению с L1. Представлено упрощенное изображение 3-мерной кристаллической структуры вариабельной области интерфейса тяжелой и легкой цепи. Мутации, введенные в интерфейс, достигают электростатической и стерической комплементарности в двух наборах интерфейса вариабельной области, соответственно, для предпочтительного формирования облигатной пары. С другой стороны, существует неблагоприятное стерическое и электростатическое несоответствие в неправильной паре, которое может приводить к сниженной предрасположенности к образованию пар для ошибочно спаренной пары, а также к снижению стабильности.
[0053] На фигуре 12 изображены спектры ЖХ/МС, полученные при совместной экспрессии H1, L1 и L2 (левая панель) и при совместной экспрессии Н2, L1 и L2 (правая панель), на основе иллюстративного набора цепей H1, L1, H2, L2, показанных на фигуре 11.
[0054] На фигуре 13 изображена оценка биофизических свойств пар H1-L1 и H2-L2 на основе дизайна, показанного на фигуре 11. На фигуре 13А показан невосстанавливающий анализ ДСН-ПААГ пар H1-L1 и H2-L2 до и после очистки с использованием белка А, а выход продукта показан в нижней части гелей; на фигуре 13B показаны DSC термограммы спаренных продуктов H1-L1 и H2-L2; а на фигуре 13С показан профиль СПЖХ-ЭХ (H2-L2) для пары H2-L2.
[0055] На фигуре 14 показаны продукты, связанные с тяжелой цепью, ожидаемые, когда две различные легкие цепи совместно экспрессируются в клетке с двумя различными тяжелыми цепями. Предпочтительное образование пар оценивается с помощью SMCA (конкурентного анализа моноклональных антител).
[0056] На фигуре 15 изображены спектры ЖХ/МС биспецифических антигенсвязывающих конструкций (H1-L1_H2-L2) на основе дизайна, показанного на фигуре 11.
[0057] На фигуре 16A на левой панели показана оценка чистоты биспецифической антигенсвязывающей конструкции, полученной из набора дизайна, показанного на фигуре 11. На фигуре показан окрашенный Кумасси в невосстанавливающих ДСН-ПААГ вариант SMCA вместе с контрольным вариантом, состоящим из Mab, связывающего Her2 с гетеродимерным Fc. Чистота варианта SMCA после белковой очистки (белок А) является высокой и качественно эквивалентной контролю. По оценкам, после обработки белком А, выход варианта SMCA составляет 20 мг/л, что сравнимо с контрольным выходом 40 мг/мл. На правой панели (фигура 16В) изображен профиль ЭХ вышеупомянутой биспецифической конструкции. Основной пик (>90% общей площади пика) наблюдается при молекулярной массе ~150 кДа и состоит из мономеров Mab. Наблюдаемый незначительный пик имеется при ~75 кДа и состоит из половинных антител. Никаких существенных пиков при более высокой молекулярной массе (потенциально указывающих на агрегаты видов) не наблюдается.
[0058] На фигуре 17А изображены данные SPR, показывающие моноспецифическое связывание для антигена TF или Her2 биспецифической конструкции на основе набора дизайна, изображенного на фигуре 11 (примечание: в этом дизайне SMCA используют те же дизайны MCA H1-L1 и H2-L2, что и показанные на фигуре 11).
[0059] На фигуре 17В изображены данные SPR, показывающие одновременное биспецифическое связывание антигенов TF и Her2 биспецифической антигенсвязывающей конструкцией.
[0060] На фигуре 18 изображена блок-схема для идентификации критических остатков интерфейса и для компьютерного моделирования дизайнов с предпочтительным образованием пар тяжелой и легкой цепей.
[0061] На фигуре 19 представлено схематическое изображение способа получения биспецифического антитела с использованием библиотеки облигатных пар мутаций, представленных в этом изобретении.
Подробное описание сущности изобретения
[0062] Настоящее изобретение относится к антигенсвязывающим полипептидным конструкциям (также называемые гетеродимерными парами), которые могут содержать первый гетеродимер и второй гетеродимер, при этом каждый гетеродимер содержит тяжелую цепь иммуноглобулина или ее фрагмент и легкую цепь иммуноглобулина. По меньшей мере один из гетеродимеров может содержать одну или несколько аминокислотных модификаций в константном домене тяжелой цепи 1 иммуноглобулина (CH1) и одну или несколько аминокислотных модификаций в константном домене легкой цепи иммуноглобулина (CL); одну или несколько аминокислотных модификаций в вариабельном домене тяжелой цепи иммуноглобулина (VH) и одну или несколько аминокислотных модификаций в вариабельном домене легкой цепи иммуноглобулина (VL); или комбинацию описанных выше аминокислотных модификаций в обоих константном и вариабельном доменах тяжелых и легких цепей. Модифицированные аминокислоты, как правило, являются частью интерфейса между легкой цепью и тяжелой цепью и модифицированы, чтобы создать предпочтительное образование пар между каждой тяжелой цепью и желаемой легкой цепью таким образом, что тяжелая цепь первого гетеродимера предпочтительно образует пары с одной из легких цепей, а не с другой. Подобным образом, тяжелая цепь второго гетеродимера может образовывать пары предпочтительно со второй легкой цепью, а не с первой.
[0063] Как указано выше, специфические комбинации аминокислотных модификаций, как описано в настоящем документе, способствуют предпочтительному образованию пар тяжелых цепей с конкретными легкими цепями, тем самым обеспечивая экспрессию биспецифического моноклонального антитела (Mab) с незначительным или ограниченным ошибочным образованием пар, и сводят к минимуму необходимость очистки желаемых гетеродимеров от нежелательных или ошибочно спаренных продуктов. Гетеродимеры могут проявлять термостабильность, сравнимую с термостабильностью гетеродимеров, которые не содержат аминокислотных модификаций, а также могут проявлять аффинность связывания с антигеном, сравнимую с гетеродимерами, которые не содержат аминокислотных модификаций.
[0064] Дизайны первого и второго гетеродимеров могут быть использованы для создания биспецифических антител, оказывающих мишеневое воздействие на две разных терапевтических мишени или оказывающих мишеневое воздействие на два разных эпитопа (перекрывающихся или неперекрывающихся) одного и того же антигена.
[0065] Настоящее изобретение также относится к способу получения гетеродимерных пар по изобретению.
Определения
[0066] Если не определено иное, то все использованные в настоящем документе технические и научные термины имеют такое же значение, которое понятно специалистами в области, к которой относится настоящее изобретение. В том случае, если для используемых в настоящем документе терминов существует несколько определений, предпочтение отдается определениям, приводимым в этом разделе. Если сделана ссылка на URL или иной подобный идентификатор или адрес, то понятно, что такие идентификаторы могут меняться, и что конкретная информация в Интернете может появляться и исчезать, однако при поиске в нем может быть найдена эквивалентная информация. Ссылка лишь свидетельствует об открытом доступе и широком распространении такой информации.
[0067] Следует понимать, что как вышеприведенное общее описание, так и нижеследующее подробное описание являются всего лишь иллюстративными и пояснительными и не ограничивают любой объект, заявленный в формуле изобретения. В этой заявке использование единственного числа предусматривает множественное число, если специально не указано иное.
[0068] Необходимо понимать, что в настоящем описании любой диапазон концентраций, процентный диапазон, диапазон соотношений или диапазон целых чисел включает значение любого целого числа в пределах приведенного диапазона и, в соответствующих случаях, их дроби (например, одна десятая и одна сотая целого числа), если не указано иное. Как используется в настоящем документе, «примерно» означает ±10% от указанного диапазона, значения, последовательности или структуры, если не указано иное. Следует понимать, что термины, используемые в настоящем описании, в единственном числе означают «один или несколько» из перечисленных компонентов, если иное не указано или не очевидно из контекста. Использование альтернативы (например, «или») следует понимать как означающий либо одну, обе или любую комбинацию альтернатив. В данном описании термины «включает» и «содержит» используются как синонимы. Кроме того, следует понимать, что отдельные одноцепочечные полипептиды или конструкции иммуноглобулинов, полученные из различных комбинаций структур и заместителей, описанных в настоящем документе, раскрыты в настоящей заявке в той же степени, как если бы каждый отдельный одноцепочечный полипептид или гетеродимер были раскрыты отдельно. Таким образом, выбор конкретных компонентов для образования отдельных одноцепочечных полипептидов или гетеродимеров находится в пределах объема настоящего раскрытия
[0069] Использованные в настоящем описании заглавия разделов даны с целью упорядочивания информации, а не с целью ограничения описываемых объектов. Все цитируемые в настоящем описании документы или выдержки из документов, включая, но не ограничиваясь ими, патенты, заявки на патенты, статьи, книги, инструкции и научные работы, непосредственно включены в настоящее описание посредством ссылки во всей своей полноте для любых целей.
[0070] Следует понимать, что способы и композиции, описанные в настоящем документе, не ограничиваются конкретной методикой, протоколами, клеточными линиями, конструкциями и реагентами, описанными в настоящем документе, поскольку они могут изменяться. Также следует понимать, что терминология, использованная в настоящем документе, служит целям описания только конкретных вариантов осуществления настоящего изобретения и не предназначена для ограничения объема способов и композиций, описанных в настоящем документе, которые будут ограничиваться только прилагаемой формулой изобретения.
[0071] Все публикации и патенты, указанные в настоящем описании, включены в него в качестве ссылки в полном объеме с целью описания и раскрытия, например, конструкций и методик, которые описаны в публикациях, которые могут быть использованы в связи со способами, композициями и соединениями, описанными в настоящем документе. Публикации, обсуждаемые в настоящем описании, предоставлены исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в настоящей заявке не должно быть истолковано как признание того, что изобретение не дает права датировать такие раскрытия задним числом на основании предшествующего изобретения или по любой другой причине.
[0072] В данной заявке названия аминокислот и названия атомов (например, N, О, С и тому подобное) используются, как определено Банком данных белков (Protein DataBank, PDB) (www.pdb.org), который основывается на номенклатуре IUPAC (IUPAC Nomenclature and Symbolism for Amino Acids and Peptides (названия остатков, названия атомов и тому подобное), Eur. J. Biochem., 138, 9-37 (1984) вместе с их поправками в Eur. J. Biochem., 152, 1 (1985). Термин «аминокислотный остаток» прежде всего предназначен для указания аминокислотного остатка, относящегося к группе, состоящей из 20 встречающихся в природе аминокислот, то есть остатков аланина (Ala или А), цистеина (Cys или С), аспарагиновой кислоты (Asp или D), глутаминовой кислоты (Glu или Е), фенилаланина (Phe или F), глицина (Gly или G), гистидина (His или Н), изолейцина (Ile или I), лизина (Lys или К), лейцина (Leu или L), метионина (Met или М), аспарагина (Asn или N), пролина (Pro или Р), глутамина (Gln или Q), аргинина (Arg или R), серина (Ser или S), треонина (Thr или Т), валина (Val или V), триптофана (Trp или W) и тирозина (Tyr или Y).
[0073] Термины «полипептид», «пептид» и «белок» используются в настоящем документе взаимозаменяемо для обозначения полимера из аминокислотных остатков. То есть, описание, которое относится к полипептиду, в равной степени относится к описанию пептида и описанию белка, и наоборот. Термины относятся к полимерам, состоящим из встречающихся в природе аминокислот, а также к полимерам, состоящим из аминокислот, в которых один или несколько аминокислотных остатков являются аминокислотой, закодированной не встречающимся в природе образом. Как используется в настоящем документе, эти термины относятся к аминокислотным цепям любой длины, включая полноразмерные белки, при этом аминокислотные остатки соединены ковалентными пептидными связями.
[0074] Термин «нуклеотидная последовательность» или «последовательность нуклеиновой кислоты» обозначает последовательный отрезок двух или нескольких нуклеотидных молекул. По происхождению, нуклеотидная последовательность может быть геномной, кДНК, РНК, полусинтетической или синтетической, или представлять собой любую их комбинацию.
[0075] «Клетка», «клетка-хозяин», «клеточная линия» и «культура клеток» используются в настоящем документе взаимозаменяемо, и все подобные термины, как должно быть понятно, включают в себя потомство, получаемое путем роста или культивирования клетки. Термины «трансформация» и «трансфекция» используются взаимозаменяемо для обозначения процесса введения в клетку последовательности нуклеиновой кислоты.
[0076] Термин «аминокислота» означает природные и неприродные аминокислоты, а также аналоги аминокислот и миметики аминокислот, которые действуют подобно природным аминокислотам. Кодируемыми в природе аминокислотами являются 20 обычных аминокислот (аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутамин, глутаминовая кислота, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин) и пирролизин и селеноцистеин. Термин «аналоги аминокислот» означает соединения, которые имеют такую же основную химическую структуру, что и природная аминокислота, то есть атом углерода, связанный с водородом, карбоксигруппу, аминогруппу и R-группу, например, гомосерин, норлейцин, метионинсульфоксид, метионин метил сульфоний. Такие аналоги имеют модифицированные R-группы (например, норлейцин) или модифицированные пептидные остовы, но сохраняют ту же основную химическую структуру, что и природная аминокислота. Ссылка на аминокислоты включает, например, природные протеиногенные L-аминокислоты; D-аминокислоты, химически модифицированные аминокислоты, такие как аминокислотные варианты и производные; природные, не протеиногенные аминокислоты, такие как аланин или орнитин и тому подобное; и химически синтезированные соединения, имеющие свойства, известные в данной области как характеристики аминокислот. Примеры не встречающихся в природе аминокислот включают, но ими не ограничиваются, α-метильные аминокислоты (например, метилаланин), D-аминокислоты, гистидиноподобные аминокислоты (например, 2-аминогистидин, гидроксигистидин, гомогистидин), аминокислоты, имеющие дополнительный метилен в боковой цепи («гомо» аминокислоты), и аминокислоты, в которых функциональная группа карбоновой кислоты в боковой цепи заменена на группу сульфоновой кислоты (например, цистеиновой кислоты). Введение не встречающихся в природе аминокислот, включая синтетические ненативные аминокислоты, замещенные аминокислоты или одну или несколько D-аминокислот в белки по настоящему изобретению, может быть предпочтительным в ряде различных способов. Пептиды, содержащие D-аминокислоты и т.п., демонстрируют повышенную стабильность in vitro или in vivo по сравнению с аналогами, содержащими L-аминокислоты. Таким образом, конструкция пептидов и т.п., с включением D-аминокислоты, может быть особенно полезной, когда желательна или необходима большая внутриклеточная стабильность. Более конкретно, D-пептиды и т.п. являются устойчивыми к действию эндогенных пептидаз и протеаз, тем самым обеспечивая улучшенную биодоступность молекулы и более длительную продолжительность жизни in vivo, когда такие свойства желательны. Кроме того, D-пептиды и т.п. не могут быть эффективно процессированы для ограниченной главным комплексом гистосовместимости класса II презентации Т-хелперных клеток и, следовательно, с меньшей вероятностью вызывают гуморальный иммунный ответ в целом организме.
[0077] Аминокислоты могут быть обозначены в настоящем документе либо общеизвестными трехбуквенными символами, либо однобуквенными символами, рекомендованными Комиссией по биохимической номенклатуре IUPAC-IUB. Аналогично, нуклеотиды могут быть обозначены их общепринятыми однобуквенными кодами.
[0078] Термин «консервативно модифицированные варианты» относится как к последовательностям аминокислот, так и к последовательностям нуклеиновых кислот. В отношении определенных последовательностей нуклеиновых кислот, «консервативно модифицированные варианты» относятся к тем нуклеиновым кислотам, которые кодируют идентичные или по существу идентичные последовательности аминокислот, или к тем, в которых нуклеиновая кислота не кодирует последовательность аминокислот по существу идентичных последовательностей. Вследствие вырожденности генетического кода большое число функционально идентичных нуклеиновых кислот кодирует любой заданный белок. Например, все кодоны GCA, GCC, GCG и GCU кодируют аминокислоту аланин. Таким образом, в каждом положении, где кодоном определен аланин, кодон может быть изменен на любой из описанных соответствующих кодонов без изменения кодируемого полипептида. Данные варианты нуклеиновой кислоты представляют собой «молчащие варианты», которые представляют собой один из видов консервативно модифицированных вариантов. В данном описании каждая последовательность нуклеиновой кислоты, которая кодирует полипептид, описывает также каждый возможный «молчащий» вариант нуклеиновой кислоты. Обычный специалист в данной области будет понимать, что каждый кодон в нуклеиновой кислоте (за исключением AUG, который обычно является единственным кодоном для метионина, и TGG, который обычно является единственным кодоном для триптофана) может быть модифицирован с получением функционально идентичной молекулы. Соответственно, каждый молчащий вариант нуклеиновой кислоты, который кодирует полипептид, подразумевается в каждой из описанных последовательностей.
[0079] Что касается аминокислотных последовательностей, обычный специалист в данной области понимает, что индивидуальные замены, делеции или добавления в нуклеиновую кислоту, пептид, полипептид или белковую последовательность, которые изменяют, добавляют или удаляют отдельные аминокислоты или небольшой процент аминокислот в кодируемой последовательности, представляют собой «консервативно модифицированный вариант», если изменение приводит к делеции аминокислоты, добавлению аминокислоты или замещению аминокислоты на химически подобную аминокислоту. Таблицы консервативных замен, приводящих к получению функционально похожих аминокислот, хорошо известны специалистам в данной области. Такие консервативно модифицированные варианты представляют собой, помимо прочего, и не исключают полиморфные варианты, межвидовые гомологи и аллели по настоящему изобретению.
[0080] Таблицы консервативных замен, представляющие функционально сходные аминокислоты, хорошо известны специалистам в данной области. Следующие восемь групп содержат аминокислоты, которые являются консервативными заменами друг друга:
[0081] 1) аланин (А), глицин (G);
[0082] 2) аспарагиновая кислота (D), глутаминовая кислота (Е);
[0083] 3) аспарагин (N), глутамин (Q);
[0084] 4) аргинин (R), лизин (K);
[0085] 5) изолейцин (I), лейцин (L), метионин (М), валин (V);
[0086] 6) фенилаланин (F), тирозин (Y), триптофан (W);
[0087] 7) серин (S), треонин (Т); и
[0088] 8) цистеин (С), метионин (М)
[0089] (см., например, Creighton, Proteins: Structures and Molecular Properties (W H Freeman & Co.; 2nd edition (December 1993).
[0090] Термины «идентичный» или процент «идентичности» в контексте двух или более последовательностей нуклеиновых кислот или полипептидов относятся к двум или нескольким последовательностям или субпоследовательностям, которые являются одинаковыми. Последовательности являются «по существу идентичными», если они имеют процент аминокислотных остатков или нуклеотидов, которые являются одинаковыми (т.e., около 50% идентичности, около 55% идентичности, 60% идентичности, около 65%, около 70%, около 75%, около 80%, около 85%, около 90%, около 95% или около 99% идентичности относительно заданного участка), при сравнении и выравнивании для максимального соответствия относительно окна сравнения либо сконструированного участка, как измеряют при использовании одного из следующих алгоритмов сравнения последовательностей (или других алгоритмов, доступных обычным специалистам в данной области) или посредством выравнивания вручную и визуального изучения. Это определение также относится и к комплементу тестовой последовательности. Идентичность может существовать относительно участка, который составляет по меньшей мере около 50 аминокислот или нуклеотидов в длину или относительно участка, который составляет 75-100 аминокислот или нуклеотидов в длину или там, где не указано иное, по всей последовательности полинуклеотида или полипептида. Полинуклеотид, кодирующий полипептид по настоящему изобретению, в том числе гомологи других видов, не только человека, может быть получен способом, который включает стадии скрининга библиотеки в строгих условиях гибридизации с меченым зондом, имеющим полинуклеотидную последовательность по изобретению или с ее фрагментом, и выделения полноразмерной кДНК и геномных клонов, содержащих указанную последовательность полинуклеотида. Такие способы гибридизации хорошо известны специалистам в данной области.
[0091] Говорят, что производное или вариант полипептида разделяет «гомологию» или является «гомологичным» пептиду, если аминокислотные последовательности производного или варианта по меньшей мере на 50% идентичны последовательности из 100 аминокислот исходного пептида. В некоторых вариантах осуществления настоящего изобретения производное или вариант по меньшей мере на 75% такой же, как любой пептид или фрагмент пептида с таким же числом аминокислотных остатков, что и указанное производное. В некоторых вариантах осуществления настоящего изобретения производное или вариант по меньшей мере на 85% такой же, как любой пептид или фрагмент пептида с таким же числом аминокислотных остатков, что и указанное производное. В некоторых вариантах осуществления настоящего изобретения аминокислотная последовательность производного по меньшей мере на 90% такая же, как пептид или фрагмент пептида с таким же числом аминокислотных остатков, что и указанное производное. В некоторых вариантах осуществления настоящего изобретения аминокислотная последовательность производного по меньшей мере на 95% такая же, как пептид или фрагмент пептида с таким же числом аминокислотных остатков, что и указанное производное. В некоторых вариантах осуществления настоящего изобретения производное или вариант по меньшей мере на 99% такое же, как любой пептид или фрагмент пептида с таким же числом аминокислотных остатков, что и указанное производное.
[0092] Как используется в настоящем документе “выделенный” полипептид или конструкция представляет собой конструкцию или полипептид, которые был идентифицированы и выделены и/или отделены от компонента природной клеточной среды. Загрязняющие компоненты природной среды представляют собой вещества, которые обычно могут мешать диагностическим или терапевтическим вариантам применения гетеродимера и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества.
[0093] В некоторых вариантах осуществления, как используется в настоящем документе, “выделенные” антигенсвязывающие конструкции, описанные в настоящем документе, содержат гетеродимерные пары или “выделенные” гетеродимерные пары, содержащие гетеродимер или гетеродимерную пару, которые были идентифицированы и выделены и/или отделены от компонента природной клеточной среды. Загрязняющие компоненты природной среды представляют собой вещества, которые обычно могут мешать диагностическим или терапевтическим вариантам применения гетеродимера или антигенсвязывающей конструкции и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества.
[0094] Гетеродимеры и антигенсвязывающие конструкции и гетеродимерные пары, как правило, очищают до существенной гомогенности. Фразы «по существу гомогенный», «по существу гомогенная форма» и «существенная гомогенность» используются в настоящем описании, чтобы указать, что продукт по существу лишен побочных продуктов, образующихся из нежелательных полипептидных комбинаций (например, гомодимеров). В пересчете на чистоту, существенная гомогенность означает, что количество побочных продуктов не превышает 10%, а предпочтительно составляет менее 5%, более предпочтительно менее 1%, наиболее предпочтительно менее 0,5%, причем проценты указаны по массе.
[0095] Фраза «селективно (или специфично) гибридизуется с» относится к связыванию, образованию дуплекса или гибридизации молекулы только с определенной нуклеотидной последовательностью в строгих условиях гибридизации, когда последовательность присутствует в комплексной смеси (включая, но не ограничиваясь этим, клеточную или библиотечную ДНК или РНК).
[0096] Каждый из терминов, понятных специалистам в области техники антител, имеет значение, принятое в данной области, если в настоящем описании специально не указано иное. Антитела, как известно, имеют вариабельные области, шарнирный участок и константные домены. Структура и функции иммуноглобулинов рассматриваются, например, в публикации Harlow et al, Eds., Antibodies: A Laboratory Manual, Chapter 14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, 1988).
[0097] Как используется в настоящем описании, термины «антитело» и «иммуноглобулин» или «антигенсвязывающий полипептид» используются взаимозаменяемо. «Антигенсвязывающий полипептид» обозначает полипептид, по существу кодируемый геном иммуноглобулина или генами иммуноглобулина или одним или более их фрагментами, которые специфически связывают аналит (антиген). Известные гены иммуноглобулинов включают гены каппа, лямбда, альфа, гамма, дельта, эпсилон и мю константных областей, а также множество генов вариабельной области иммуноглобулина. Легкие цепи подразделяются на каппа и лямбда. Тяжелые цепи классифицируются как гамма-, мю-, альфа-, дельта- или эпсилон-цепи, которые в свою очередь определяют изотипы иммуноглобулина, а именно IgG, IgM, IgA, IgD и IgE, соответственно. Кроме того, антитело может принадлежать одному из нескольких подтипов, например, IgG могут принадлежать к подклассам IgG1, IgG2, IgG3 или IgG4.
[0098] Типичная структурная единица иммуноглобулина (антитела) состоит из двух пар полипептидных цепей, при этом каждая пара имеет одну «легкую» (около 25 кДа) и одну «тяжелую» цепь (около 50-70 кДа). Термин «легкая цепь» включает полноразмерную легкую цепь и ее фрагменты, имеющие достаточную последовательность вариабельной области для обеспечения специфичности связывания. Полноразмерная легкая цепь включает домен вариабельной области, VL, и домен константной области, CL. Домен вариабельной области легкой цепи находится на аминоконце полипептида. Легкие цепи включают каппа-цепи и лямбда-цепи. Термин «тяжелая цепь» включает полноразмерную тяжелую цепь и ее фрагменты, имеющие достаточную последовательность вариабельной области для обеспечения специфичности связывания. Полноразмерная тяжелая цепь включает домен вариабельной области VH и три домена константной области: CH1, CH2 и CH3. Домен VH находится на аминоконце полипептида, а домены CH находятся на карбоксиконце, при этом СН3 находится ближе всех к карбоксиконцу полипептида. Тяжелые цепи могут быть любого изотипа, включая IgG (включая подклассы IgG1, IgG2, IgG3 и IgG4), IgA (включая подклассы IgA1 и IgA2), IgM и IgE. Термин «вариабельная область» или «вариабельный домен» относится к части легкой и/или тяжелой цепи антитела, которая, как правило, отвечает за распознавание антигена и обычно включает приблизительно 120–130 аминоконцевых аминокислот в тяжелой цепи (VH) и около 100–110 аминоконцевых аминокислот в легкой цепи (VL). «Область, определяющая комплементарность» или «CDR» представляет собой аминокислотную последовательность, которая способствует антигенсвязывающей специфичности и аффинности. «Каркасные» области (FR) могут помочь в поддержании правильной конформации CDR, содействовать связыванию антигенсвязывающей области и антигена. Структурно каркасные области могут быть расположены в антителах между CDR. Вариабельные области обычно имеют такую же общую структуру, что и относительно консервативные каркасные области (FR), соединенные тремя гипервариабельными областями, CDR. Участки CDR из двух цепей каждой пары обычно выравнены каркасными областями, что позволяет связываться со специфичным эпитопом. Вариабельные области как легкой, так и тяжелой цепи обычно содержат от N-конца к С-концу домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Аминокислоты в каждом домене обычно распределены в соответствии с определением, приведенным в публикации Kabat Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987 и 1991)), если не указано иное. В некоторых вариантах осуществления настоящего изобретения конструкции иммуноглобулинов содержат по меньшей мере один домен иммуноглобулина из IgG, IgM, IgA, IgD или IgE, связанный с терапевтическим полипептидом. В некоторых вариантах осуществления настоящего изобретения домен иммуноглобулина, который содержится в иммуноглобулиновой конструкции, представленной в настоящем документе, является формой конструкции на основе иммуноглобулина, такой как диатело или нанотело. В некоторых вариантах осуществления настоящего изобретения конструкции иммуноглобулинов, описанные в настоящем документе, содержат по меньшей мере один домен иммуноглобулина из тяжелой цепи антитела, такого как верблюжье антитело. В некоторых вариантах осуществления настоящего изобретения конструкции иммуноглобулинов, предложенные в настоящем описании, содержат по меньшей мере один домен иммуноглобулина из антитела млекопитающего, такого как бычье антитело, антитело человека, верблюжье антитело, мышиное антитело или любое химерное антитело.
[0099] «Биспецифический», «двойной специфический» или «бифункциональный» антигенсвязывающий белок или антитело представляет собой гибридный антигенсвязывающий белок, имеющий два различных антигенсвязывающих участка. Биспецифические антигенсвязывающие белки и антитела представляют собой виды мультиспецифических антигенсвязывающих белков-антител. Два участка связывания биспецифического антигенсвзывающего белка или антитела будут связываться с двумя различными эпитопами, которые могут находиться на той же или на разных молекулярных мишенях. «Мультиспецифический антигенсвязывающий белок» или «мультиспецифическое антитело» представляет собой то, которое нацелено на более чем один антиген или эпитоп. «Двухвалентный антигенсвязывающий белок» или «двухвалентное антитело» содержит два антигенсвязывающих участка. В некоторых случаях два связывающих участка имеют аналогичные антигенные специфичности. Двухвалентные антигенсвязывающие белки и двухвалентные антитела могут быть биспецифическими, см. ниже. Двухвалентное антитело, отличное от «мультиспецифического» или «многофункционального» антитела, в некоторых вариантах осуществления настоящего изобретения, как правило, понимается как имеющее каждый из сайтов связывания одинаковый.
[00100] Термин «предпочтительное образование пар» используется в настоящем документе для описания модели образования пар первого полипептида со вторым полипептидом, например, тяжелой цепи иммуноглобулина с легкой цепью иммуноглобулина в антигенсвязывающих конструкциях и гетеродимерных парах, описанных в настоящем документе. Таким образом, «предпочтительное образование пар» относится к предпочтительному образованию пар первого полипептида со вторым полипептидом, когда один или несколько дополнительных, отличающихся полипептидов присутствуют во время образования пар первого и второго полипептидов. Обычно предпочтительное образование пар происходит в результате модификации (например, аминокислотной модификации) одного или обоих первого и второго полипептидов. Как правило, предпочтительное образование пар приводит к спаренному первому и второму полипептиду, что является наиболее распространенным димером, присутствующим после образования пар. В данной области известно, что тяжелая цепь иммуноглобулина (Н1) при совместной экспрессии с двумя различными легкими цепями иммуноглобулина (L1 и L2) будет статистически одинаково образовывать пары с обеими легкими цепями, что приведет в результате к приблизительно 50:50 смеси H1, спаренной с L1, и H1, спаренной с L2. В этом контексте «предпочтительное образование пар» происходит между, например, H1 и L1, если количество гетеродимеров H1-L1 тяжелая цепь-легкая цепь было больше, чем количество гетеродимера H1-L2, когда H1 совместно экспрессируется с обеими L1 и L2. Таким образом, в этом случае H1 предпочтительно образует пары с L1 по сравнению с L2.
[00101] Тяжелые цепи антитела спариваются с легкими цепями антитела и встречаются или контактируют друг с другом на «интерфейсе». «Интерфейс» включает один или несколько «контактов» аминокислотных остатков в первом полипептиде, которые взаимодействуют с одним или более «контактами» аминокислотных остатков второго полипептида. В одном контексте термин «интерфейс» может быть использован, чтобы описать интерфейс димеризованного домена Fc СН3, где Fc предпочтительно получают из антитела IgG, например, IgG1 и наиболее предпочтительно антитела IgG1 человека.
[00102] Тяжелые цепи антитела, которые должны быть связаны с легкими цепями антитела, обычно встречаются или контактируют друг с другом на «интерфейсе». Легкая цепь иммуноглобулина функционально связывается с тяжелой цепью иммуноглобулина через «интерфейс». «Интерфейс» содержит те из одного или нескольких «контактов» аминокислотных остатков в тяжелой цепи иммуноглобулина, которые взаимодействуют с одним или более «контактами» аминокислотных остатков интерфейса легкой цепи иммуноглобулина. Как используется в настоящем описании, интерфейс может содержать домены VH и CH1 тяжелой цепи иммуноглобулина и домены VL и CL легкой цепи иммуноглобулина. «Интерфейс» может быть получен из антитела IgG и наиболее предпочтительно из антитела IgG1 человека.
[00103] Термин «аминокислотные модификации», используемый в настоящем описании, включает, но не ограничивается аминокислотными мутациями, инсерциями, делециями, заменами, химическими модификациями, физическими модификациями и перестановками.
Антигенсвязывающие конструкции и гетеродимерные пары
[00104] Антигенсвязывающие конструкции, описанные в настоящем документе, могут содержать первый гетеродимер и второй гетеродимер; каждый гетеродимер получен посредством образования пар тяжелой цепи иммуноглобулина с легкой цепью иммуноглобулина. Структура и организация константных и вариабельных доменов тяжелых и легких цепей иммуноглобулинов хорошо известны в данной области. Тяжелые цепи иммуноглобулинов обычно содержат один вариабельный домен (VH) и три константных домена, CH1, CH2 и CH3. Легкие цепи иммуноглобулинов обычно содержат один вариабельный домен (VL) и один константный домен (CL). Могут быть сделаны различные модификации этих типичных форматов.
[00105] Антигенсвязывающие конструкции и гетеродимерные пары, описанные в настоящем документе, могут содержать первый гетеродимер и второй гетеродимер, при этом каждый гетеродимер, содержит тяжелую цепь иммуноглобулина/антитела или ее фрагмент, имеющий по меньшей мере домен VH и CH1, и легкую цепь иммуноглобулина/антитела, имеющую домен VL и домен CL. В одном из вариантов осуществления настоящего изобретения оба гетеродимера гетеродимерной пары и антигенсвязывающей конструкции содержат полноразмерную тяжелую цепь иммуноглобулина. В другом варианте осуществления настоящего изобретения оба гетеродимера гетеродимерной пары или антигенсвязывающей конструкции содержат фрагмент тяжелой цепи иммуноглобулина, который содержит по меньшей мере домен VH и CH1. В одном из вариантов осуществления настоящего изобретения оба гетеродимера гетеродимерной пары содержат аминоконцевой фрагмент тяжелой цепи иммуноглобулина, который содержит по меньшей мере домен VH и CH1. В другом варианте осуществления настоящего изобретения оба гетеродимера гетеродимерной пары содержат карбоксиконцевой фрагмент тяжелой цепи иммуноглобулина, который содержит по меньшей мере домен VH и CH1.
[00106] Каждый гетеродимер гетеродимерной пары может специфически связываться с антигеном или эпитопом. В одном из вариантов осуществления настоящего изобретения тяжелую цепь иммуноглобулина и легкую цепь иммуноглобулина каждого гетеродимера получают или конструируют из известного терапевтического антитела. Терапевтическое антитело представляет собой антитело, которое эффективно для лечения заболевания или расстройства у млекопитающего, страдающего заболеванием или расстройством, или предрасположенным к ним. Подходящие терапевтические антитела, из которых может быть получен каждый гетеродимер, включают, но ими не ограничиваются, абаговомаб, адалимумаб, алемтузумаб, аурограб, бапинейзумаб, базиликсимаб, белимумаб, бевацизумаб, бриакинумаб, канакинумаб, катумаксомаб, цертолизумаб пегол, цетуксимаб, даклизумаб, деносумаб, эфализумаб, галиксимаб, гемтузумаб озогамицин, голимумаб, ибритумомаб тиуксетан, инфликсимаб, ипилимумаб, лумиликсимаб, меполизумаб, мотавизумаб, муромонаб, микограб, натализумаб, нимотузумаб, окрелизумаб, офатумумаб, омализумаб, паливизумаб, панитумумаб, пертузумаб, ранибизумаб, реслизумаб, ритуксимаб, теплизумаб, тоцилизумаб/атлизумаб, тозитумомаб, трастузумаб, ProxiniumTM, RencarexTM, устекинумаб и залутумумаб.
[00107] В одном из вариантов осуществления тяжелая цепь иммуноглобулина и легкая цепь иммуноглобулина каждого гетеродимера получены или сконструированы из антитела, которое специфически связывается с молекулой, включая, но ими не ограничиваясь, следующие белки, а также субъединицы, домены, мотивы и эпитопы, принадлежащие следующим перечисленным белкам: ренин; гормон роста, включая человеческий гормон роста и бычий гормон роста; рилизинг-фактор гормона роста; паратиреоидный гормон; тиреотропный гормон; липопротеины; альфа-1-антитрипсин; А-цепь инсулина; В-цепь инсулина; проинсулин, фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания, такие как фактор VII, фактор VIIIC, фактор IX, тканевый фактор (TF) и фактор Виллебранда; препятствующие свертыванию крови факторы, такие как белок С; предсердный натрийуретический фактор; легочный сурфактант; активатор плазминогена, такой как урокиназа или человеческий мочевой или тканевой активатор пламиногена (t-PA); бомбезин; тромбин; гемопоэтический ростовой фактор; фактор-альфа и -бета некроза опухоли; энкефалиназа; RANTES (регулятор активации нормальной Т-клеточной экспрессии и секреции); человеческий воспалительный белок макрофагов (MIP-1-альфа); сывороточный альбумин, такой как человеческий сывороточный альбумин; ингибирующая субстанция Мюллера; А-цепь релаксина; В-цепь релаксина; прорелаксин; мышиный гонадотропин-ассоциированный пептид; микробный белок, такой как бета-лактамаза; ДНКаза; IgE; антиген, связанный с цитотоксическими Т-лимфоцитами (CTLA), такой как CTLA-4; ингибин; активин; сосудистый эндотелиальный фактор роста (VEGF); рецепторы для гормонов или факторов роста, такие, например, как EGFR, VEGFR; интерфероны, такие как альфа-интерферон (альфа-IFN), бета-интерферон (бета-IFN) и гамма-интерферон (гамма-IFN); белок А или D; ревматоидный факторы; нейротрофический фактор, такой как нейротрофический фактор головного мозга (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6), или фактор роста нерва; тромбоцитарный фактор роста (PDGF); фактор роста фибробластов, такой как AFGF и PFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, включая TGF-1, TGF-2, TGF-3, TGF-4 или TGF-5; инсулиноподобный ростовой фактор-I и -II (IGF-I и IGF-II); дез(1-3)-IGF-I (IGF-I головного мозга), белки, связывающиеся с инсулиноподобным ростовым фактором; CD-белки, такие как CD2, CD3, CD4, CD8, CD11a, CD14, CD18, CD19, CD20, CD22, CD23, CD25, CD33, CD34, CD40, CD40L, CD52, CD63, CD64, CD80 и CD147; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; морфогенетический костный белок (BMP); интерферон, такой как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), такие как M-CSF, GM-CSF и G-CSF; интерлейкины (IL), например, IL-1–IL-13; TNF-альфа, супероксиддисмутаза; Т-клеточные рецепторы; поверхностные мембранные белки; усиливающий расщепление фактор; вирусный антиген, такой, например, как часть оболочки вируса СПИДа, например gp120; транспортные белки; хоминг-рецепторы; аддрессины; регуляторные белки; молекулы клеточной адгезии, такие как LFA-1, Mac 1, p150.95, VLA-4, ICAM-1, ICAM-3 и VCAM, a4/p7 интегрин и (включая Xv/р3-интегрин или любые их субъединицы, субъединицы интегрина-альфа, такие как CD49a, CD49b, CD49c, CD49d, CD49e, CD49f, альфа7, альфа8, альфа9, альфаD, CD11a, CD11b, CD51, CD11c, CD41, альфаIIb, альфаIELb; бета-субъединицы интегрина, такие как CD29, CD 18, CD61, CD104, бета5, бета6, бета7 и бета8; комбинации субъединиц интегрина, включая, но не ограничиваясь только ими, альфаVбета3, альфаVбета5 и альфа4бета7; фактор, участвующий в пути апоптоза; IgE; антигены группы крови; flk2/flt3-рецептор; рецептор ожирения (OB); mp1-рецептор; CTLA-4; белок С; Eph-рецептор, такой как EphA2, EphA4, EphB2 и тому подобное; человеческий лейкоцитарный антиген (HLA), такой как HLA-DR; белки комплемента, такие как рецептор комплемента CR1, C1Rq и другие факторы комплемента, такие как С3 и С5; гликопротеиновый рецептор, такой как GpIb.альфа., GPIIb/IIIa и CD200; и фрагменты любого из перечисленных выше полипептидов.
[00108] В одном из вариантов осуществления тяжелые и легкие цепи иммуноглобулина каждого гетеродимера получены или сконструированы из антител, которые специфически связываются с антигенами злокачественной опухоли, включая, но не ограничиваясь перечисленным, рецептор ALK (рецептор плейотропина), плейотропин, карциномный пан-антиген KS 1/4, антиген карциномы яичника (СА125), простатический кислый фосфат, простатоспецифический антиген (PSA), связанный с меланомой антиген р97, меланомный антиген gp75, высокомолекулярный меланомный антиген (HMW-MAA), простатоспецифический мембранный антиген, карциноэмбриональный антиген (СЕА), полиморфный эпителиальный муциновый антиген, человеческий антиген капелек молочного жира, связанные с колоректальной опухолью антигены, такие как: CEA, TAG-72, CO17-1A, GICA 19-9, CTA-1 и LEA, антиген-38.13 лимфомы Беркитта, CD19, антиген CD20 человеческой В-лимфомы, CD33, специфические для меланомы антигены, такие как ганглиозид GD2, ганглиозид GD3, ганглиозид GM2, ганглиозид GM3, опухолеспецифический трансплантационный находящийся на клеточной поверхности антиген (TSTA), антигены индуцируемой вирусом опухоли, включая Т-антиген опухоли, ДНК опухолевый вирусы и оболочечные антигены опухолей, индуцируемых РНК-вирусом, онкофетальный антиген альфа-фетопротеин, такой как СЕА ободочной кишки, онкофетальный трофобластический гликопротеин 514 и онкофетальный антиген опухоли мочевого пузыря, дифференцировочный антиген, такой как антиген L6 и L20 карциномы легкого человека, антигены фибросаркомы, антиген Gp37 человеческого Т-клеточного лейкоза, неогликопротеин, сфинголипиды, антиген рака молочной железы, такой как EGFR (рецептор эпидермального фактора роста), NY-BR-16; NY-BR-16 и HER2 антиген (p185HER2), полиморфный эпителиальный муцин (РЕМ), антиген-АРО-1 злокачественных лимфоцитов человека, дифференцировочный антиген, такой как I-антиген, обнаруженный в фетальных эритроцитах, антиген I первичной эндодермы, обнаруженный в эритроцитах взрослых, зародышах до имплантации, I(Ма), обнаруженный при желудочных аденокарциномах, M18, M39, обнаруженный в эпителии молочной железы, SSEA-1, обнаруженный в миелоидных клетках, VEP8; VEP9; Myl; Va4-D5; D156-22, обнаруженные при колоректальном раке, TRA-1-85 (группа крови Н), SCP-1, обнаруженный при раке яичек и яичников, С14, обнаруженный при аденокарциноме ободочной кишки, F3, обнаруженный при легочной аденокарциноме, АН6, обнаруженный при раке желудка, Y-гаптен, Ley, обнаруженный в клетках эмбриональной карциномы, TL5 (группа крови А), EGF-рецептор, обнаруженный в клетках А431, серии Е1 (группа крови В), обнаруженный при раке поджелудочной железы, FC10.2, обнаруженный в клетках эмбриональных карцином, антиген желудочной аденокарциномы, СО-514 (группа крови Lea), обнаруженный при аденокарциноме, NS-10, обнаруженный при аденокарциномах, СО-43 (группа крови Leb), G49, обнаруженный в EGF-рецепторе клеток А431, МН2 (группа крови ALeb/Ley), обнаруженный при аденокарциноме ободочной кишки, 19.9, обнаруженный при раке ободочной кишки, муцины рака желудка, Т5А7, обнаруженный в миелоидных клетках, R24, обнаруженный при меланоме, 4.2, GD3, D1.1, OFA-1, GM2, OFA-2, GD2 и M1:22:25:8, обнаруженные в клетках эмбриональной карциномы, и SSEA-3 и SSEA-4, обнаруженные в зародышах на стадии 4-8-клеток, антиген кожной Т-клеточной лимфомы; антиген MART-1; антиген Sialy Tn (STn); антиген рака ободочной кишки NY-CO-45; антиген рака легкого NY-LU-12, вариант А; антиген аденокарциномы ART1; паранеопластический связанный с раком головного мозга-яичек антиген (онконейральный антиген МА2; паранеопластический нейронный антиген); нейроонкологический вентральный антиген 2 (NOVA2); антигены гена 520 печеночно-клеточной карциномы; связанный с опухолью антиген СО-029; связанные с опухолью антигены MAGE-C1 (антиген рака/яичек СТ7), MAGE-B1 (антиген MAGE-XP), MAGE-B2 (DAM6), MAGE-2, MAGE-4-a, MAGE-4-b и MAGE-X2; антиген рака яичек (NY-EOS-1) и фрагменты любых вышеперечисленных полипептидов.
[00109] Антитела человека могут быть сгруппированы в изотипы, включающие IgG, IgA, IgE, IgM и IgD. В одном из вариантов осуществления настоящего изобретения Fc получают из изотипа IgG. В другом варианте осуществления настоящего изобретения Fc получают из изотипа IgA. В другом варианте осуществления настоящего изобретения Fc получают из изотипа IgE. В другом варианте осуществления настоящего изобретения Fc получают из изотипа IgM. В другом варианте осуществления настоящего изобретения Fc получают из изотипа IgD.
[00110] Антитела IgG человека также могут быть разделены на подклассы IgG1, IgG2, IgG3 и IgG4. Таким образом, в некоторых вариантах осуществления настоящего изобретения предполагается, что Fc может быть получен из подкласса антител IgG1, IgG2, IgG3 или IgG4.
[00111] Каждый гетеродимер гетеродимерой пары может специфически связываться с эпитопом или антигеном. В одном из вариантов осуществления настоящего изобретения каждый гетеродимер гетеродимерой пары связывается с тем же эпитопом. В другом варианте осуществления настоящего изобретения первый гетеродимер гетеродимерой пары специфически связывается с эпитопом на одном антигене, а второй гетеродимер гетеродимерой пары специфически связывается с другим эпитопом на том же антигене. В другом варианте осуществления настоящего изобретения первый гетеродимер гетеродимерой пары специфически связывается с эпитопом на первом антигене, а второй гетеродимер гетеродимерой пары специфически связывается с эпитопом на втором антигене, который отличается от первого антигена. Например, в одном из вариантов осуществления настоящего изобретения первый гетеродимер специфически связывается с тканевым фактором, тогда как второй гетеродимер специфически связывается с антигеном Her2(ErbB2). В другом варианте осуществления настоящего изобретения первый гетеродимер специфически связывается с молекулой или раковым антигеном, описанными выше. В другом варианте осуществления настоящего изобретения второй гетеродимер специфически связывается с молекулой или раковым антигеном, описанными выше. В еще одном варианте осуществления настоящего изобретения первый гетеродимер специфически связывается с антигеном CD3, тогда как второй гетеродимер специфически связывается с антигеном CD19.
[00112] Как указано выше, в некоторых вариантах осуществления настоящего изобретения тяжелая цепь иммуноглобулина и легкая цепь иммуноглобулина каждого гетеродимера может быть получена или сконструирована из известного терапевтического антитела или из антитела, которое связывает различные молекулы-мишени или антигены злокачественной опухоли. Аминокислотные и нуклеотидные последовательности большинства таких молекул легко доступны (см., например, GenBank: AJ308087.1 (вариабельная область и домен CL легкой цепи гуманизированного антитела к тканевому фактору человека D3H44); GenBank: AJ308086.1 (вариабельная область и домен CH1 тяжелой цепи гуманизированного антитела к тканевому фактору человека D3H44); GenBank: HC359025.1 (генный модуль легкой цепи Fab пертузумаба); GenBank: HC359024.1 (генный модуль тяжелой цепи Fab пертузумаба); GenBank: GM685465.1 (антитело трастузумаб (=герцептин)–дикого типа; легкая цепь); GenBank: GM685463.1 (антитело трастузумаб (=герцептин)–дикого типа; тяжелая цепь); GenBank: GM685466.1 (антитело трастузумаб (=герцептин)–GC-оптимизированная легкая цепь); и GenBank: GM685464.1 (антитело трастузумаб (=герцептин)–GC-оптимизированная тяжелая цепь. Последовательности каждого из номеров GenBank, описанные в настоящем документе, доступны на веб-сайте NCBI на 28 ноября 2012 года, и каждая из них включена посредством ссылки во всей своей полноте для всех целей.
[00113] В некоторых аспектах выделенная антигенсвязывающая конструкция содержит аминокислотную последовательность, которая является по меньшей мере на 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентичной аминокислотной последовательности или ее фрагменту, приведенным в Таблицах, или номерам доступа, раскрытым в настоящем описании. В некоторых аспектах выделенная антигенсвязывающая конструкция содержит аминокислотную последовательность, которая кодируется полинуклеотидом, который по меньшей мере на 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100% идентичен нуклеотидной последовательности или ее фрагменту, приведенным в таблицах или номерам доступа, раскрытым в настоящем описании.
Аминокислотные модификации тяжелых и легких цепей иммуноглобулина
[00114] По меньшей мере один из гетеродимеров гетеродимерной пары может содержать одну или несколько аминокислотных модификаций в тяжелых цепях иммуноглобулина и/или легких цепях иммуноглобулина, так что тяжелая цепь первого гетеродимера предпочтительно образует пары с одной из легких цепей, а не с другой. Подобным образом, тяжелая цепь второго гетеродимера может образовывать пары предпочтительно со второй легкой цепью, а не с первой. Это предпочтительное образование пар одной тяжелой цепи с одной из двух легких цепей может быть основано на наборах дизайнов, содержащих одну тяжелую цепь иммуноглобулина и две легкие цепи иммуноглобулина, при этом тяжелая цепь иммуноглобулина предпочтительно образует пары с одной из двух легких цепей иммуноглобулина по сравнению с другой, при совместной экспрессии тяжелой цепи иммуноглобулина с двумя легкими цепями иммуноглобулина. Таким образом, набор дизайнов LCCA может содержать одну тяжелую цепь иммуноглобулина, первую легкую цепь иммуноглобулина и вторую легкую цепь иммуноглобулина.
[00115] В одном из вариантов осуществления настоящего изобретения одна или более аминокислотных модификаций содержит одну или несколько аминокислотных замен.
[00116] В одном из вариантов осуществления настоящего изобретения предпочтительное образование пар, продемонстрированное в наборе дизайнов LCCA, установлено путем модификации одной или более аминокислот, которые являются частью интерфейса между легкой цепью и тяжелой цепью. В одном из вариантов осуществления настоящего изобретения предпочтительное образование пар, продемонстрированное в наборе дизайнов LCCA, установлено путем модификации одной или нескольких аминокислот по меньшей мере в одном из перечисленного: домен CH1 тяжелой цепи иммуноглобулина, домен CL первой легкой цепи иммуноглобулина и домен CL второй легкой цепи иммуноглобулина.
[00117] В одном из вариантов осуществления настоящего изобретения одна или несколько аминокислотных модификаций ограничены консервативными остатками каркасной области вариабельных (VH, VL) и константных (CH1, CL) доменов, как показано нумерацией остатков по Kabat. Например, Almagro [Frontiers In Bioscience (2008) 13: 1619-1633] дает определение каркасных остатков на основе схем нумерации Kabat, Chotia и IMGT.
[00118] В одном из вариантов осуществления настоящего изобретения по меньшей мере один из гетеродимеров содержит одну или несколько мутаций, введенных в тяжелые цепи иммуноглобулина и легкие цепи иммуноглобулина, которые являются комплементарными друг другу. Комплементарность в интерфейсе тяжелой и легкой цепи может быть достигнута на основе пространственных и гидрофобных контактов, электростатических/зарядных взаимодействий или комбинации различных взаимодействий. Комплементарность между белковыми поверхностями широко описана в литературе в терминах соответствия «ключа-в-замке», «выступа-во-впадине», «выступа и полости», «донора и акцептора» и тому подобное, все из которых подразумевают природу структурного и химического соответствия между двумя взаимодействующими поверхностями. В одном из вариантов осуществления настоящего изобретения по меньшей мере один из гетеродимеров содержит одну или несколько мутаций, при этом мутации, введенные в тяжелые цепи иммуноглобулина и легкие цепи иммуноглобулина, вводят новую водородную связь в легкую и тяжелую цепь на интерфейсе. В одном из вариантов осуществления настоящего изобретения по меньшей мере один из гетеродимеров содержит одну или несколько мутаций, при этом мутации, введенные в тяжелые цепи иммуноглобулина и легкие цепи иммуноглобулина, вводят новый солевой мостик в легкую и тяжелую цепь на интерфейсе.
[00119] Неограничивающие примеры подходящих наборов дизайна LCCA, показанные в Таблице 1, демонстрируют аминокислотные модификации в домене CH1 одной тяжелой цепи (H1) иммуноглобулина и доменах CL двух легких цепей иммуноглобулина (L1 и L2) гетеродимеров, при этом H1 предпочтительно образует пары с L1 при совместной экспрессии H1, L1 и L2. Аминокислотные модификации, показанные в этих наборах дизайна LCCA, основаны на аминокислотной последовательности тяжелых и легких цепей иммуноглобулина антитела к тканевому фактору D3H44.
[00120]
[00121] Дополнительные неограничивающие примеры подходящих наборов дизайна LCCA, показанные в Таблице 2, демонстрируют аминокислотные модификации в домене CH1 одной тяжелой цепи (H2) иммуноглобулина, и доменах CL двух легких цепей иммуноглобулина (L1 и L2) гетеродимеров, где H2 предпочтительно образует пары с L2 при совместной экспрессии H2, L1 и L2:
[00122]
[00123] Дополнительные неограничивающие примеры подходящих наборов дизайна LCCA описаны в Примерах, Таблицах и Фигурах.
[00124] В одном из вариантов осуществления настоящего изобретения наборы дизайна LCCA содержат тяжелую цепь иммуноглобулина по меньшей мере с одной аминокислотной модификацией в домене CH1, первую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене CL и вторую легкую цепь иммуноглобулина без каких-либо аминокислотных модификаций в домене CL. В другом варианте осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина по меньшей мере с одной аминокислотной модификацией в домене CH1, первую легкую цепь иммуноглобулина по меньшей мере с одной аминокислотной модификацией в домене CL и вторую легкую цепь иммуноглобулина по меньшей мере с одной аминокислотной модификацией в домене CL. В другом варианте осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина по меньшей мере с одной аминокислотной модификацией в домене CH1, первую легкую цепь иммуноглобулина по меньшей мере с двумя аминокислотными модификациями в домене CL и вторую легкую цепь иммуноглобулина по меньшей мере с двумя аминокислотными модификациями в домене CL. В другом варианте осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене CH1, первую легкую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене CL и вторую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене CL.
[00125] В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина без аминокислотных модификаций в домене CH1, первую легкую цепь иммуноглобулина без аминокислотных модификаций в домене CL и вторую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене CL. В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина без аминокислотных модификаций в домене CH1, первую легкую цепь иммуноглобулина без аминокислотных модификаций в домене CL и вторую легкую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене CL.
[00126] В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене CH1, первую легкую цепь иммуноглобулина без аминокислотных модификаций в домене CL, и вторую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене CL. В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене CH1, первую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене CL и вторую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене CL. В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене CH1, первую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене CL и вторую легкую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене CL. В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене CH1, первую легкую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене CL и вторую легкую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене CL. В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене CH1, первую легкую цепь иммуноглобулина с по меньшей мере тремя аминокислотными модификациями в домене CL и вторую легкую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене CL.
[00127] В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере тремя аминокислотными модификациями в домене CH1, первую легкую цепь иммуноглобулина без аминокислотных модификаций в домене CL и вторую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене CL. В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере тремя аминокислотными модификациями в домене CH1, первую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене CL и вторую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене CL. В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере тремя аминокислотными модификациями в домене CH1, первую легкую цепь иммуноглобулина с по меньшей мере тремя аминокислотными модификациями в домене CL и вторую легкую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене CL. В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере тремя аминокислотными модификациями в домене CH1, первую легкую цепь иммуноглобулина с по меньшей мере четырьмя аминокислотными модификациями в домене CL и вторую легкую цепь иммуноглобулина с по меньшей мере тремя аминокислотными модификациями в домене CL.
[00128] В одном из вариантов осуществления настоящего изобретения предпочтительное образование пар, продемонстрированное в наборе дизайнов LCCA, установлено путем модификации одной или более аминокислот по меньшей мере в одном из перечисленного: домен VH тяжелой цепи иммуноглобулина, домен VL первой легкой цепи иммуноглобулина и домен VL второй легкой цепи иммуноглобулина. Неограничивающие примеры подходящих наборов дизайна LCCA, показанные в таблице 3, демонстрируют аминокислотные модификации в домене VH одной тяжелой цепи иммуноглобулина (H1) и доменах VL двух легких цепей иммуноглобулина (L1 и L2) гетеродимеров, где H1 предпочтительно образует пары с L1 при совместной экспрессии H1, L1 и L2:
[00129]
[00130] Дополнительные неограничивающие примеры подходящих наборов дизайна LCCA, представленные в Таблице 4, демонстрируют аминокислотные модификации в домене VH одной тяжелой цепи иммуноглобулина (H2) и доменах VL двух легких цепей иммуноглобулина (L1 и L2) гетеродимеров, где H2 предпочтительно образует пары с L2 при совместной экспрессии H2, L1 и L2:
[00131]
[00132] В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина без аминокислотных модификаций в домене VH, первую легкую цепь иммуноглобулина без аминокислотных модификаций в домене VL и вторую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене VL. В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина без аминокислотных модификаций в домене VH, первую легкую цепь иммуноглобулина без аминокислотных модификаций в домене VL и вторую легкую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене VL.
[00133] В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене VH, первую легкую цепь иммуноглобулина без аминокислотных модификаций в домене VL и вторую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене VL. В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене VH, первую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене VL и вторую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене VL. В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене VH, первую легкую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене VL и вторую легкую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене VL.
[00134] В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене VH, первую легкую цепь иммуноглобулина без аминокислотных модификаций в домене VL и вторую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене VL. В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене VH, первую легкую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене VL и вторую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене VL. В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA содержит тяжелую цепь иммуноглобулина с по меньшей мере двумя аминокислотными модификациями в домене VH, первую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене VL и вторую легкую цепь иммуноглобулина с по меньшей мере одной аминокислотной модификацией в домене VL.
[00135] В одном из вариантов осуществления настоящего изобретения наборы дизайна LCCA, продемонстрированные в Таблицах 1–4, объединяют с предоставлением комбинации, содержащей две различные тяжелые цепи иммуноглобулина (H1 и H2) и две различные легкие цепи иммуноглобулина (L1 и L2), где H1 предпочтительно образует пары с L1, а H2 предпочтительно образует пары с L2 при совместной экспрессии H1, H2, L1 и L2. В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA из Таблицы 1, содержащий модификации в домене CH1 тяжелой цепи и/или домене CL легкой цепи, объединяют с набором дизайнов LCCA из Таблицы 2, который также содержит модификации в домене CH1 тяжелой цепи и/или домене CL легкой цепи.
[00136] Неограничивающие примеры наборов дизайна, полученных из комбинаций наборов дизайна LCCA, показаны в Таблице 5:
[00137]
[00138] В одном из вариантов осуществления настоящего изобретения набор дизайнов LCCA из Таблицы 3, содержащий модификации домена VH тяжелой цепи и/или домена VL легких цепей объединяют с набором дизайнов LCCA из Таблицы 4, который также содержит модификации домена VH тяжелой цепи и/или домена VL легких цепей. Неограничивающие примеры наборов дизайна, полученных из таких комбинаций наборов дизайна LCCA, показаны в Таблице 6:
[00139]
Возможность переноса специфических аминокислотныхмодификаций идентифицированных в настоящем документе, на другие антитела:
[00140] Хотя специфические аминокислотные модификации в тяжелых и легких цепях иммуноглобулина, указанные выше, были описаны по отношению к тяжелым и легким цепям иммуноглобулина антитела D3H44 к внеклеточному домену тканевого фактора, предполагается, и в настоящем документе продемонстрировано (см. Примеры, Фигуры и Таблицы), что эти аминокислотные модификации могут быть перенесены на другие тяжелые и легкие цепи иммуноглобулина, что приводит к схожим моделям предпочтительного образования пар одной тяжелой цепи иммуноглобулина с одной из двух легких цепей иммуноглобулина в силу нижеописанного.
[00141] Остатки интерфейса VH:VL и CH1:CL в интерфейсе между тяжелыми и легкими цепями иммуноглобулина относительно хорошо сохранены. (Padlan et al., 1986, Mol. Immunol. 23(9): 951-960). Это сохранение последовательностей, результат эволюционных ограничений, увеличивает вероятность того, что во время комбинаторного образования пар легких и тяжелых цепей будут образовываться функционально активные домены связывания антител. Как результат такого сохранения последовательностей следует то, что модификации последовательностей в конкретных примерах, указанных выше для D3H44, которые управляют предпочтительным образованием пар, могут переноситься на другие тяжелые и легкие цепи пары гетеродимеров с приблизительно эквивалентными результатами, получаемыми в отношении предпочтительного образования пар, так как этот участок демонстрирует высокую степень сохранения последовательностей в антителах. Кроме того, когда происходят различия в последовательностях, они обычно находятся дистально по отношению к интерфейсу CH1:CL. Это особенно относится к доменам CH1 и CL. Существует, однако, некоторая вариабельность последовательностей на антигенсвязывающем сайте в отношении остатков петли (и длины) CDR (области, определяющей комплементарность), в частности, для CDR-H3. Таким образом, в одном из вариантов осуществления настоящего изобретения гетеродимерные пары в соответствии с изобретением содержат гетеродимеры, где по меньшей мере один гетеродимер содержит одну или несколько аминокислотных модификаций в доменах VH и/или VL, которые лежат дистальнее петли CDR, когда аминокислотная последовательность антигенсвязывающего сайта значительно отличается от таковой в антителе D3H44. В другом варианте осуществления настоящего изобретения гетеродимерные пары по настоящему изобретению включают гетеродимеры, в которых по меньшей мере один гетеродимер содержит одну или несколько аминокислотных модификаций в доменах VH и/или VL, которые лежат проксимальнее или дистальнее петель CDR, когда аминокислотная последовательность антигенсвязывающего сайта является по существу такой же, как таковая в антителе D3H44.
[00142] В одном из вариантов осуществления настоящего изобретения аминокислотные модификации, описанные в настоящем документе, могут быть перенесены на тяжелые и легкие цепи иммуноглобулинов в антителах на основе человеческих или гуманизированных цепей IgG1/κ. Неограничивающие примеры таких цепей IgG1/κ включают офатумумаб (для человеческих) или трастузумаб, пертузумаб или бевацизумаб (для гуманизированных).
[00143] В другом варианте осуществления настоящего изобретения аминокислотные модификации, описанные в настоящем документе, могут быть перенесены на тяжелые и легкие цепи иммуноглобулинов в антителах, в которых используются наиболее часто используемые подгруппы VH и VL. Неограничивающие примеры таких антител влючают перузумаб.
[00144] В одном из вариантов осуществления настоящего изобретения аминокислотные модификации, описанные в настоящем документе, могут быть перенесены на тяжелые и легкие цепи иммуноглобулинов в антителах, имеющих каркасную область, близкую к зародышевой линии. Примеры таких антител включают обинутузумаб.
[00145] В одном из вариантов осуществления настоящего изобретения аминокислотные модификации, описанные в настоящем документе, могут быть перенесены на тяжелые и легкие цепи иммуноглобулинов в антителах, имеющих междоменный угол VH:VL, близкий к среднему, наблюдаемому для пар тяжелых и легких цепей. Пример такого типа антитела включает, среди прочего, пертузумаб. В другом варианте осуществления настоящего изобретения аминокислотные модификации, описанные в настоящем документе, могут быть перенесены на тяжелые и легкие цепи иммуноглобулинов в антителах, имеющих канонические домены CL и CH1. Подходящие примеры таких антител включают, среди прочего, трастузумаб.
[00146] В некоторых вариантах осуществления настоящего изобретения некоторые подмножества аминокислотных модификаций, описанных в настоящем документе, используются в вариантах доменов в антигенсвязывающих конструкциях, приведенных выше.
[00147] В Примерах, Фигурах и Таблицах продемонстрированы такие аминокислотные модификации (то есть в одном или нескольких фрагментах Fab, содержащих вариабельную область и константную область), которые могут быть перенесены на другие тяжелые и легкие цепи иммуноглобулинов, что в результате приводит к подобным моделям предпочтительного образования пар одной тяжелой цепи иммуноглобулина с одной или двумя легкими цепями иммуноглобулина.
Предпочтительное образование пар
[00148] Как описано выше, по меньшей мере один гетеродимер антигенсвязывающей конструкции/гетеродимерных пар по настоящему изобретению может содержать одну или несколько аминокислотных модификаций в иммуноглобулиновых тяжелых и/или иммуноглобулиновых легких цепях, так что тяжелая цепь одного гетеродимера, например H1, предпочтительно образует пары с одной из легких цепей, например L1, а не с другой легкой цепью L2, а тяжелая цепь другого гетеродимера H2 предпочтительно образует пары с легкой цепью L2, а не с легкой цепью L1. Другими словами, считается, что желательное предпочтительное образование пар происходит между H1 и L1 и между H2 и L2. Предпочтительное образование пар между, например, H1 и L1 считается состоявшимся, если выход гетеродимера H1-L1 является большим, чем выход ошибочно спаренного гетеродимера H1-L2, когда H1 объединяется с L1 и L2, в сравнении с соответствующим образованием пар соответствующей пары H1/L1 и пары H2/L2 без одной или более аминокислотных модификаций. Подобным образом, предпочтительное образование пар между H2 и L2 считается состоявшимся, если выход гетеродимера H2-L2 является большим, чем выход ошибочно спаренного гетеродимера H2-L1, когда H2 объединяется с L1 и L2, в сравнении с соответствующим образованием пар соответствующей пары H1-L1 и пары H2-L2 без одной или более аминокислотных модификаций. В этом контексте в настоящем документе гетеродимер, который содержит H1 и L1 (H1-L1) или H2 и L2 (H2-L2), называется предпочтительно спаренным, правильно спаренным, облигатно спаренным или желательным гетеродимером, тогда как гетеродимер, содержащий H1 и L2 (H1-L2) или H2 и L1 (H2-L1), называется в настоящем документе ошибочно спаренным гетеродимером. Набор мутаций, соответствующий двум тяжелым цепям и двум легким цепям, предназначенный для достижения селективного образования пар Н1-L1 и H2-L2, упоминается как набор дизайнов.
[00149] Таким образом, в одном из вариантов осуществления настоящего изобретения, когда одна иммуноглобулиновая тяжелая цепь гетеродимера совместно экспрессируется с двумя легкими цепями иммуноглобулина, относительный выход желательного гетеродимера составляет больше чем 55%. В другом варианте осуществления настоящего изобретения, когда одна иммуноглобулиновая тяжелая цепь гетеродимера совместно экспрессируется с двумя легкими цепями иммуноглобулина, относительный выход желательного гетеродимера составляет больше чем 60%. В другом варианте осуществления настоящего изобретения, когда одна иммуноглобулиновая тяжелая цепь гетеродимера совместно экспрессируется с двумя легкими цепями иммуноглобулина, относительный выход желательного гетеродимера составляет больше чем 70%. В другом варианте осуществления настоящего изобретения, когда одна иммуноглобулиновая тяжелая цепь гетеродимера совместно экспрессируется с двумя легкими цепями иммуноглобулина, относительный выход желательного гетеродимера составляет больше чем 80%. В другом варианте осуществления настоящего изобретения, когда одна иммуноглобулиновая тяжелая цепь гетеродимера совместно экспрессируется с двумя легкими цепями иммуноглобулина, относительный выход желательного гетеродимера составляет больше чем 90%. В другом варианте осуществления настоящего изобретения, когда одна иммуноглобулиновая тяжелая цепь гетеродимера совместно экспрессируется с двумя легкими цепями иммуноглобулина, относительный выход желательного гетеродимера составляет больше чем 95%.
[00150] В приведенном выше примере предпочтительное образование пар между H1-L1 считается состоявшимся, если количество желаемого гетеродимера H1-L1 является большим, чем количество ошибочно спаренного гетеродимера H1-L2 при совместной экспрессии H1 с L1 и L2. Подобным образом, предпочтительное образование пар между H2-L2 считается состоявшимся, если количество желаемого гетеродимера H2-L2 является большим, чем количество ошибочно спаренного гетеродимера H2-L2 при совместной экспрессии H2 с L1 и L2. Таким образом, в одном из вариантов осуществления настоящего изобретения, когда одна иммуноглобулиновая тяжелая цепь гетеродимера совместно экспрессируется с двумя легкими цепями иммуноглобулина, соотношение желательного гетеродимера к ошибочно спаренному гетеродимеру составляет больше чем 1,25:1. В одном из вариантов осуществления настоящего изобретения, когда одна иммуноглобулиновая тяжелая цепь гетеродимера совместно экспрессируется с двумя легкими цепями иммуноглобулина, соотношение желательного гетеродимера к ошибочно спаренному гетеродимеру составляет больше чем 1,5:1. В другом варианте осуществления настоящего изобретения, когда одна иммуноглобулиновая тяжелая цепь гетеродимера совместно экспрессируется с двумя легкими цепями иммуноглобулина, соотношение желательного гетеродимера к ошибочно спаренному гетеродимеру составляет больше чем 2:1. В другом варианте осуществления настоящего изобретения, когда одна иммуноглобулиновая тяжелая цепь гетеродимера совместно экспрессируется с двумя легкими цепями иммуноглобулина, соотношение желательного гетеродимера к ошибочно спаренному гетеродимеру составляет больше чем 3:1. В другом варианте осуществления настоящего изобретения, когда одна иммуноглобулиновая тяжелая цепь гетеродимера совместно экспрессируется с двумя легкими цепями иммуноглобулина, соотношение желательного гетеродимера к ошибочно спаренному гетеродимеру составляет больше чем 5:1. В другом варианте осуществления настоящего изобретения, когда одна иммуноглобулиновая тяжелая цепь гетеродимера совместно экспрессируется с двумя легкими цепями иммуноглобулина, соотношение желательного гетеродимера к ошибочно спаренному гетеродимеру составляет больше чем 10:1. В другом варианте осуществления настоящего изобретения, когда одна иммуноглобулиновая тяжелая цепь гетеродимера совместно экспрессируется с двумя легкими цепями иммуноглобулина, соотношение желательного гетеродимера к ошибочно спаренному гетеродимеру составляет больше чем 25:1. В другом варианте осуществления настоящего изобретения, когда одна иммуноглобулиновая тяжелая цепь гетеродимера совместно экспрессируется с двумя легкими цепями иммуноглобулина, соотношение желательного гетеродимера к ошибочно спаренному гетеродимеру составляет больше чем 50:1.
Термостабильность гетеродимеров
[00151] В одном из вариантов осуществления настоящего изобретения каждый гетеродимер гетеродимерной пары по настоящему изобретению имеет термостабильность, сравнимую с термостабильностью гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов, но без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В одном из вариантов осуществления настоящего изобретения термостабильность определяют путем измерения температуры плавления или Tпл. Таким образом, в одном из вариантов осуществления настоящего изобретения термостабильность гетеродимера по настоящему изобретению находится в пределах около 10°C от термостабильности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. Таким образом, в одном из вариантов осуществления настоящего изобретения термостабильность гетеродимера по настоящему изобретению находится в пределах около 5°C от термостабильности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В другом варианте осуществления настоящего изобретения термостабильность гетеродимера по настоящему изобретению находится в пределах около 3°C от термостабильности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В другом варианте осуществления настоящего изобретения термостабильность гетеродимера по настоящему изобретению находится в пределах около 2°C от термостабильности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В другом варианте осуществления настоящего изобретения термостабильность гетеродимера по настоящему изобретению находится в пределах около 1,5°C от термостабильности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В другом варианте осуществления настоящего изобретения термостабильность гетеродимера по настоящему изобретению находится в пределах около 1°C от термостабильности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В другом варианте осуществления настоящего изобретения термостабильность гетеродимера по настоящему изобретению находится в пределах около 0,5°C от термостабильности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В другом варианте осуществления настоящего изобретения термостабильность гетеродимера по настоящему изобретению находится в пределах около 0,25°C от термостабильности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе.
Аффинность гетеродимеров к антигену
[00152] В одном из вариантов осуществления настоящего изобретения каждый гетеродимер гетеродимерной пары имеет аффинность к соответствующему ему антигену, которая одинакова или сравнима с аффинностью гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов, но без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В одном из вариантов осуществления настоящего изобретения гетеродимер гетеродимерной пары имеет аффинность к соответствующему ему антигену, которая находится в пределах около 50-кратной или величины порядка термостабильности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В одном из вариантов осуществления настоящего изобретения гетеродимер гетеродимерной пары имеет аффинность к соответствующему ему антигену, которая находится в пределах около 25-кратной или величины порядка термостабильности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В одном из вариантов осуществления настоящего изобретения гетеродимер гетеродимерной пары имеет аффинность к соответствующему ему антигену, которая находится в пределах около 10-кратной или величины порядка термостабильности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В другом варианте осуществления настоящего изобретения гетеродимер гетеродимерной пары имеет аффинность к соответствующему ему антигену, которая находится в пределах около 5-кратной аффинности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В другом варианте осуществления настоящего изобретения гетеродимер гетеродимерной пары имеет аффинность к соответствующему ему антигену, которая находится в пределах около 2,5-кратной аффинности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В другом варианте осуществления настоящего изобретения гетеродимер гетеродимерной пары имеет аффинность к соответствующему ему антигену, которая находится в пределах около 2-кратной аффинности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В другом варианте осуществления настоящего изобретения гетеродимер гетеродимерной пары имеет аффинность к соответствующему ему антигену, которая находится в пределах около 1,5-кратной аффинности гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе. В другом варианте осуществления настоящего изобретения гетеродимер гетеродимерной пары имеет аффинность к соответствующему ему антигену, которая находится в пределах около такой же, что и у гетеродимера, содержащего такие же тяжелые и легкие цепи иммуноглобулинов без аминокислотных модификаций в доменах CH1, CL, VH или VL, описанных в настоящем документе.
Дополнительные необязательные модификации
[00153] В одном из вариантов осуществления настоящего изобретения тяжелые и легкие цепи иммуноглобулинов гетеродимерных пар по настоящему изобретению могут быть дополнительно модифицированы (то есть путем ковалентного присоединения различных типов молекул) так, что ковалентное присоединение не мешает предпочтительному образованию пар между тяжелой цепью и легкими цепями или не влияет на способность гетеродимера связываться с антигеном или не влияет на его стабильность. Такая модификация включает, например, но не в качестве ограничения, гликозилирование, ацетилирование, пэгилирование, фосфорилирование, амидирование, дериватизацию с помощью известных защитных/блокирующих групп, протеолитическое расщепление, связывание с клеточным лигандом или другим белком, и тому подобное. Любая из многочисленных химических модификаций может быть осуществлена известными методами, в том числе, но не ограничиваясь этим, специфическим химическим расщеплением, ацетилированием, формилированием, метаболическим синтезом туникамицина и тому подобное
[00154] В другом варианте осуществления настоящего изобретения тяжелые и легкие цепи иммуноглобулинов гетеродимерных пар по настоящему изобретению могут быть конъюгированы (прямо или косвенно) с терапевтическим агентом или лекарственным фрагментом, который модифицирует заданную биологическую реакцию. Терапевтические агенты или фрагменты лекарственного средства не должны быть истолкованы как ограниченные классическими химическими терапевтическими агентами. Например, фрагмент лекарственного средства может представлять собой белок или полипептид, обладающий желаемой биологической активностью. Такие белки могут включать, например, токсин, такой как арбин, рицин A, онконазу (или другую цитотоксическую РНКазу), экзотоксин Pseudomonas, холерный токсин или токсин дифтерии; белок, такой как фактор некроза опухоли, альфа-интерферон, бета-интерферон, фактор роста нервов, тромбоцитарный фактор роста, тканевой активатор плазминогена, апоптозный агент, например, TNF-альфа, TNF-бета, AIM I (см. международную публикацию № WO 97/33899), AIM II (см. международную публикацию № WO 97/34911), лиганд Fas (Takahashi et al., 1994, J. Immunol., 6:1567), и VEGI (см. международную публикацию № WO 99/23105), тромботический агент или антиангиогенный агент, например, ангиостатин или эндостатин; или модификатор биологического ответа, такой как, например, лимфокин (например, интерлейкин-1 («IL-1»), интерлейкин-2 («IL-2»), интерлейкин-6 («IL-6»), гранулоцитарно-макрофагальный колониестимулирующий фактор («GM-CSF») и гранулоцитарный колониестимулирующий фактор («G-CSF»)) или фактор роста (например, гормон роста («GH»)).
[00155] Кроме того, в альтернативном варианте осуществления изобретения антитело может быть конъюгировано с терапевтическими фрагментами, такими как радиоактивные материалы или макроциклические хелатообразующие средства, применяемые для конъюгации ионов радиоактивных металлов (смотри выше примеры радиоактивных материалов). В некоторых вариантах осуществления настоящего изобретения макроциклический хелатор представляет собой 1,4,7,10-тетраазациклододекан-N,N',N'',N''-тетрауксусную кислоту (DOTA), которая может быть присоединена к антителу с помощью линкерной молекулы. Такие молекулы линкера хорошо известны в данной области и описаны в публикациях Denardo et al., 1998, Clin Cancer Res. 4:2483; Peterson et al., 1999, Bioconjug. Chem. 10:553; и Zimmerman et al., 1999, Nucl. Med. Biol. 26:943.
[00156] В некоторых вариантах осуществления настоящего изобретения тяжелые и легкие цепи иммуноглобулина гетеродимера экспрессируются в виде слитых белков, содержащих метку для облегчения очистки и/или тестирования и тому подобное. Как указано в настоящем описании, термин «метка» означает любой добавленный ряд аминокислот, которые вводят в белке на С-конце, N-конце или внутри, который способствует идентификации или очистке белка. Подходящие метки включают в себя, среди прочего, метки, которые, как известно специалистам в данной области, являются полезным для очистки и/или тестирования, такие как альбумин-связывающий домен (ABD), His-метка, FLAG-метка, глутатион-s-трансфераза, гемагглютинин (HA) и мальтоза-связывающий белок. Также могут быть сконструированы такие меченые белки, которые содержат сайт расщепления, такой как сайт расщепления тромбином, энтерокиназой или фактором X, для простоты удаления метки до, во время или после очистки.
[00157] В некоторых вариантах осуществления настоящего изобретения один или несколько остатков цистеина в нижней части домена Fab легкой (позиция 214, нумерация по Kabat) и тяжелой цепи (позиция 233, нумерация по Kabat), которые образуют межцепочечную дисульфидную связь, могут быть изменены на серин или аланин или не-цистеин или отличающуюся аминокислоту.
[00158] Предполагается, что дополнительные аминокислотные модификации могут быть сделаны в тяжелых цепях иммуноглобулина для того, чтобы повысить уровень предпочтительного образования пар и/или термостабильности гетеродимерных пар. Например, дополнительные аминокислотные модификации могут быть сделаны в домене Fc тяжелой цепи иммуноглобулина для того, чтобы управлять предпочтительным образованием пар между гетеродимерными парами в сравнении с гомодимерными парами. Такие аминокислотные модификации известны в данной области и включают, например, те, что описаны в публикации патента США № 2012/0149876. Кроме того, также могут быть использованы альтернативные стратегии для управления предпочтительным образованием пар между гетеродимерными парами по сравнению с гомодимерными парами, такие как, например, технологии «выступы-во-впадине», заряженные остатки с ионными взаимодействиями, и сконструированный домен цепочечного обмена (SEED). Последние стратегии были описаны в данной области и рассматриваются в публикации Klein et al, выше. Дальнейшее обсуждение Fc доменов следует ниже.
Домены Fc
[00159] Конструкции, описанные в настоящем документе, могут дополнительно содержать Fc. В некоторых аспектах Fc содержит по меньшей мере одну или две последовательности домена CH3. В некоторых аспектах Fc связан, посредством одного или нескольких линкеров или без них, с первым гетеродимером и/или вторым гетеродимером. В некоторых аспектах Fc является Fc человека. В некоторых аспектах Fc является Fc IgG или IgG1 человека. В некоторых аспектах Fc является гетеродимерным Fc. В некоторых аспектах Fc содержит по меньшей мере одну или две последовательности домена CH2.
[00160] В некоторых аспектах Fc содержит одну или несколько модификаций по меньшей мере в одной из последовательностей домена CH3. В некоторых аспектах Fc содержит одну или несколько модификаций по меньшей мере в одной из последовательностей домена CH2. В некоторых аспектах Fc представляет собой единственный полипептид. В некоторых аспектах Fc представляет собой множество пептидов, например, два полипептида.
[00161] В некоторых аспектах Fc содержит одну или несколько модификаций по меньшей мере в одной из последовательностей CH3. В некоторых аспектах Fc содержит одну или несколько модификаций по меньшей мере в одной из последовательностей CH2. В некоторых аспектах Fc представляет собой единственный полипептид. В некоторых аспектах Fc представляет собой множество пептидов, например, два полипептида.
[00162] В некоторых аспектах Fc представляет собой Fc, описанный в патентной заявке PCT/CA2011/001238, поданной 4 ноября 2011 года, или в патентной заявке PCT/CA2012/050780, поданной 2 ноября 2012 года, полное раскрытие каждой из которых включено в данное описание посредством ссылки во всей своей полноте для всех целей.
[00163] В некоторых аспектах конструкция, описанная в настоящем документе, содержит гетеродемерный Fc, содержащий модифицированный домен CH3, который был модифицирован асимметрично. Гетеродимерный Fc может содержать два константных домена тяжелой цепи полипептидов: первую тяжелую цепь полипептида и вторую тяжелую цепь полипептида, которые могут использоваться взаимозаменяемо при условии, что Fc содержит одну первую тяжелую цепь полипептида и одну вторую тяжелую цепь полипептида. Обычно первая тяжелая цепь полипептида содержит первую последовательность CH3, а вторая тяжелая цепь полипептида содержит вторую последовательность CH3.
[00164] Две последовательности CH3, которые содержат одну или несколько аминокислотных модификаций, введенных асимметричным образом, при димеризации двух последовательностей СН3 обычно приводят к гетеродимерному Fc, а не гомодимерному. Как используется в настоящем документе, термин “асимметричные аминокислотные модификации” относятся к любой модификации, при которой аминокислота в определенной позиции первой последовательности СН3 отличается от аминокислоты в той же позиции второй последовательности СН3, при этом и первая и вторая последовательности СН3 предпочтительно образуют пары с образованием гетеродимера, а не гомодимера. Эта гетеродимеризация может быть результатом модификации только одной из двух аминокислот в одной и той же соответствующей позиции аминокислоты каждой последовательности; или модификации обеих аминокислот в каждой последовательности в той же соответствующей позиции каждой из первой и второй последовательностей СН3. Первая и вторая последовательность СН3 гетеродимерного Fc может содержать одну или несколько чем одну асимметричную аминокислотную модификацию.
[00165] Таблица X предоставляет аминокислотную последовательность Fc последовательности человеческого IgG1, соответствующую аминокислотам 231-447 полноразмерной тяжелой цепи человеческого IgG1. CH3 последовательность содержит аминокислоты 341–447 полноразмерной тяжелой цепи человеческого IgG1.
[00166] Обычно Fc может содержать две смежные последовательности тяжелой цепи (А и В), которые обладают возможностью димеризации. В некоторых аспектах одна или обе последовательности Fc содержат одну или несколько мутаций или модификаций в следующих позициях: L351, F405, Y407, T366, K392, T394, T350, S400 и/или N390, при использовании нумерации EU. В некоторых аспектах Fc содержит мутантную последовательность, показанную в таблице X. В некоторых аспектах Fc содержит мутации варианта 1 A-B. В некоторых аспектах Fc содержит мутации варианта 2 A-B. В некоторых аспектах Fc содержит мутации варианта 3 A-B. В некоторых аспектах Fc содержит мутации варианта 4 A-B. В некоторых аспектах Fc содержит мутации варианта 5 A-B.
[00167] Первая и вторая последовательности CH3 могут содержать аминокислотные мутации, описанные в настоящем документе, со ссылкой на аминокислоты 231–447 полноразмерной тяжелой цепи IgG1 человека. В одном из вариантов осуществления настоящего изобретения гетеродимерный Fc содержит модифицированный домен CH3, при этом первая последовательность CH3 имеет аминокислотные модификации в позициях F405 и Y407, а вторая последовательность CH3 имеет аминокислотные модификации в позиции T394. В одном из вариантов осуществления настоящего изобретения гетеродимерный Fc содержит модифицированный домен CH3, при этом первая последовательность CH3 имеет одну или несколько аминокислотных модификаций, выбранных из L351Y, F405A и Y407V, а вторая последовательность CH3 имеет одну или несколько аминокислотных модификаций, выбранных из T366L, T366I, K392L, K392M, и T394W.
[00168] В одном из вариантов осуществления настоящего изобретения гетеродимерный Fc содержит модифицированный домен CH3, при этом первая последовательность CH3 имеет аминокислотные модификации в позициях L351, F405 и Y407, а вторая последовательность CH3 имеет аминокислотные модификации в позициях T366, K392 и T394, и одна из первой или второй последовательностей СН3 дополнительно содержит аминокислотные модификации в позиции Q347, а другая последовательность CH3 дополнительно содержит аминокислотную модификацию в позиции K360. В другом варианте осуществления настоящего изобретения гетеродимерный Fc содержит модифицированный домен CH3, при этом первая последовательность CH3 имеет аминокислотные модификации в позициях L351, F405 и Y407, а вторая последовательность CH3 имеет аминокислотные модификации в позиции T366, K392 и T394, одна из первой или второй последовательностей СН3 дополнительно содержит аминокислотные модификации в позиции Q347, а другая последовательность CH3 дополнительно содержит аминокислотную модификацию в позиции K360, и одна или обе указанных последовательностей CH3 дополнительно содержат аминокислотную модификацию T350V.
[00169] В одном из вариантов осуществления настоящего изобретения гетеродимерный Fc содержит модифицированный домен CH3, при этом первая последовательность CH3 имеет аминокислотные модификации в позициях L351, F405 и Y407, а вторая последовательность CH3 имеет аминокислотные модификации в позициях T366, K392 и T394 и одна из указанных первой и второй последовательностей CH3 дополнительно содержит аминокислотную модификацию D399R или D399K, а другая последовательность CH3 содержит одну или несколько из T411E, T411D, K409E, K409D, K392E и K392D. В другом варианте осуществления настоящего изобретения гетеродимерный Fc содержит модифицированный домен CH3, при этом первая последовательность CH3 имеет аминокислотные модификации в позициях L351, F405 и Y407, а вторая последовательность CH3 имеет аминокислотные модификации в позициях T366, K392 и T394, одна из указанных первой и второй последовательностей CH3 дополнительно содержит аминокислотную модификацию D399R или D399K, а другая последовательность CH3 содержит одну или несколько из T411E, T411D, K409E, K409D, K392E и K392D, и одна или обе из указанных последовательностей CH3 дополнительно содержат аминокислотную модификацию T350V.
[00170] В одном из вариантов осуществления настоящего изобретения гетеродимерный Fc содержит модифицированный домен CH3, при этом первая последовательность CH3 имеет аминокислотные модификации в позициях L351, F405 и Y407, а вторая последовательность CH3 имеет аминокислотные модификации в позициях T366, K392 и T394, при этом одна или обе из указанных последовательностей CH3 дополнительно содержат аминокислотную модификацию T350V.
[00171] В одном из вариантов осуществления настоящего изобретения гетеродимерный Fc содержит модифицированный домен CH3, который содержит следующие аминокислотные модификации, где “A” представляет аминокислотные модификации первой последовательности CH3, а “B” представляет аминокислотные модификации второй последовательности CH3: A:L351Y_F405A_Y407V, B:T366L_K392M_T394W, A:L351Y_F405A_Y407V, B:T366L_K392L_T394W, A:T350V_L351Y_F405A_Y407V, B:T350V_T366L_K392L_T394W, A:T350V_L351Y_F405A_Y407V, B:T350V_T366L_K392M_T394W, A:T350V_L351Y_S400E_F405A_Y407V и/или B:T350V_T366L_N390R_K392M_T394W.
[00172] Одна или более асимметричных аминокислотных модификаций может стимулировать образование гетеродимерного Fc, в котором гетеродимерный домен CH3 имеет стабильность, сопоставимую со стабильностью гомодимерного домена CH3 дикого типа. В одном из вариантов осуществления настоящего изобретения одна или более асимметричных аминокислотных модификаций стимулирует образование гетеродимерного домена Fc, при этом гетеродимерный домен Fc имеет стабильность, сопоставимую со стабильностью гомодимерного домена Fc дикого типа. В одном из вариантов осуществления настоящего изобретения одна или более асимметричных аминокислотных модификаций стимулирует образование гетеродимерного домена Fc, при этом гетеродимерный домен Fc имеет стабильность, наблюдаемую через показатели температуры плавления (Tпл) в исследовании дифференциальной сканирующей калориметрии, и где температура плавления находится в пределах 4°C от той, что наблюдается у соответствующего симметричного гомодимерного домена Fc дикого типа. В некоторых аспектах Fc содержит одну или несколько модификаций по меньшей мере в одной из последовательностей CH3, которые способствуют получению гетеродимерного Fc со стабильностью, сравнимой со стабильностью гомодимерного Fc дикого типа.
[00173] В одном из вариантов осуществления настоящего изобретения стабильность домена CH3 может быть оценена посредством измерения температуры плавления домена CH3, например, при помощи дифференциальной сканирующей калориметрии (DSC). Таким образом, в дополнительном варианте осуществления настоящего изобретения домен CH3 имеет температуру плавления около 68°C или выше. В другом варианте осуществления настоящего изобретения домен CH3 имеет температуру плавления около 70°C или выше. В другом варианте осуществления настоящего изобретения домен CH3 имеет температуру плавления около 72°C или выше. В другом варианте осуществления настоящего изобретения домен CH3 имеет температуру плавления около 73°C или выше. В другом варианте осуществления настоящего изобретения домен CH3 имеет температуру плавления около 75°C или выше. В другом варианте осуществления настоящего изобретения домен CH3 имеет температуру плавления около 78°C или выше. В некоторых аспектах димеризованные последовательности CH3 имеют температуру плавления (Tпл) около 68; 69; 70; 71; 72; 73; 74; 75; 76; 77; 77,5; 78; 79; 80; 81; 82; 83; 84 или 85°C или выше.
[00174] В некоторых вариантах осуществления настоящего изобретения гетеродимерный Fc, который содержит модифицированные последовательности CH3, может быть образован с чистотой, составляющей по меньшей мере около 75% по сравнению с гомодимерным Fc в экспрессируемом продукте. В другом варианте осуществления настоящего изобретения гетеродимерный Fc получают с чистотой более чем около 80%. В другом варианте осуществления настоящего изобретения гетеродимерный Fc получают с чистотой более чем около 85%. В другом варианте осуществления настоящего изобретения гетеродимерный Fc получают с чистотой более чем около 90%. В другом варианте осуществления настоящего изобретения гетеродимерный Fc получают с чистотой более чем около 95%. В другом варианте осуществления настоящего изобретения гетеродимерный Fc получают с чистотой более чем около 97%. В некоторых аспектах Fc представляет собой гетеродимер, полученный с чистотой более чем около 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% при экспрессии. В некоторых аспектах Fc представляет собой гетеродимер, полученный с чистотой более чем около 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% при экспрессии через единственную клетку.
[00175] Дополнительные способы модификации мономерных полипептидов Fc для стимуляции образования гетеродимерного Fc описаны в международной патентной публикации № WO 96/027011 (выступы-во-впадинах), в публикации Gunasekaran et al. (Gunasekaran K. et al. (2010) J Biol Chem. 285, 19637-46, электростатический дизайн для достижения селективной гетеродимеризации), в публикации Davis et al. (Davis, JH. et al. (2010) Prot Eng Des Sel; 23(4): 195-202, технология сконструированного домена цепочечного обмена (SEED)) и в публикации Labrijn et al [Efficient generation of stable bispecific IgG1 by controlled Fab-arm exchange. Labrijn AF, Meesters JI, de Goeij BE, van den Bremer ET, Neijssen J, van Kampen MD, Strumane K, Verploegen S, Kundu A, Gramer MJ, van Berkel PH, van de Winkel JG, Schuurman J, Parren PW. Proc Natl Acad Sci U S A. 2013 Mar 26; 110(13): 5145-50.
[00176] В некоторых вариантах осуществления настоящего изобретения выделенная конструкция, описанная в настоящем документе, содержит антигенсвязывающую конструкцию, которая связывает антиген; и конструкцию димерного полипептида Fc, которая имеет превосходные биофизические свойства, такие как стабильность и простота изготовления, по сравнению с антигенсвязывающей конструкцией, которая не содержит тот же полипептид Fc. В данной области известен ряд мутаций в последовательности тяжелой цепи Fc для селективного изменения аффинности антитела Fc к различным рецепторам Fc-гамма. В некоторых аспектах Fc содержит одну или несколько модификаций, чтобы способствовать селективному связыванию Fc-гамма рецепторов.
[00177] Домен CH2 представляет собой аминокислоту 231-340 последовательности, приведенной в Таблице X. Примеры мутаций перечислены ниже:
[00178] S298A/E333A/K334A, S298A/E333A/K334A/K326A (Lu Y, Vernes JM, Chiang N, et al. J Immunol Methods. 2011 Feb 28;365(1-2):132-41);
[00179] F243L/R292P/Y300L/V305I/P396L, F243L/R292P/Y300L/L235V/P396L (Stavenhagen JB, Gorlatov S, Tuaillon N, et al. Cancer Res. 2007 Sep 15; 67(18): 8882-90; Nordstrom JL, Gorlatov S, Zhang W, et al. Breast Cancer Res. 2011 Nov 30; 13(6): R123);
[00180] F243L (Stewart R, Thom G, Levens M, et al. Protein Eng Des Sel. 2011 Sep; 24(9): 671-8.), S298A/E333A/K334A (Shields RL, Namenuk AK, Hong K, et al. J Biol Chem. 2001 Mar 2; 276(9): 6591-604);
[00181] S239D/I332E/A330L, S239D/I332E (Lazar GA, Dang W, Karki S, et al. Proc Natl Acad Sci U S A. 2006 Mar 14; 103(11): 4005-10);
[00182] S239D/S267E, S267E/L328F (Chu SY, Vostiar I, Karki S, et al. Mol Immunol. 2008 Sep; 45(15): 3926-33);
[00183] S239D/D265S/S298A/I332E, S239E/S298A/K326A/A327H, G237F/S298A/A330L/I332E, S239D/I332E/S298A, S239D/K326E/A330L/I332E/S298A, G236A/S239D/D270L/I332E, S239E/S267E/H268D, L234F/S267E/N325L, G237F/V266L/S267D и другие мутации, перечисленные в публикациях WO2011/120134 и WO2011/120135, включенные в настоящий документ посредством ссылки. В публикации Therapeutic Antibody Engineering (by William R. Strohl and Lila M. Strohl, Woodhead Publishing series in Biomedicine No 11, ISBN 1 907568 37 9, Oct 2012) мутации перечислены на стр. 283.
[00184] В некоторых вариантах осуществления настоящего изобретения домен CH2 содержит одну или несколько асимметричных аминокислотных модификаций. В некоторых вариантах осуществления настоящего изобретения домен CH2 содержит одну или несколько асимметричных аминокислотных модификаций, чтобы способствовать селективному связыванию FcγR. В некоторых вариантах осуществления настоящего изобретения домен CH2 предоставляет возможность разделения и очистки выделенной конструкции, описанной в настоящем документе.
[00185] Связывание FcRn и ФК параметры
[00186] Как известно в данной области, связывание с FcRn возвращает подвергшееся эндоцитозу антитело из эндосомы обратно в кровоток (Raghavan et al., 1996, Annu Rev Cell Dev Biol 12: 181-220; Ghetie et al., 2000, Annu Rev Immunol 18: 739-766). Данный процесс, сопряженный с нарушением фильтрации почек вследствие большого объема полноразмерной молекулы, приводит к подходящему времени полужизни антител в сыворотке в диапазоне от одной до трех недель. Связывание Fc с FcRn также играет ключевую роль в переносе антитела. Таким образом, в одном из вариантов осуществления конструкции по изобретению способны связывать FcRn.
[00187] Дополнительные модификации для улучшения эффекторной функции
[00188] В некоторых вариантах осуществления настоящего изобретения конструкция, описанная в настоящем документе, может быть модифицирована для улучшения ее эффекторной функции. Такие модификации известны в данной области и включают в себя афукозилирование или конструирование аффинности части Fc антител в отношении активирующего рецептора, главным образом FCGR3a для антителозависимой клеточноопосредованной цитотоксичности (АЗКЦ), и в отношении C1q для комплементзависимой цитотоксичности КЗЦ. В приведенной ниже Таблице Y суммированы различные дизайны для конструирования эффекторной функции, описанные в литературе.
[00189] Таким образом, в одном из вариантов осуществления настоящего изобретения конструкция, описанная в настоящем документе, может содержать димерный Fc, который содержит одну или несколько аминокислотных модификаций, как указано в приведенной выше таблице, которые придают улучшенную эффекторную функцию. В другом варианте осуществления настоящего изобретения для улучшения эффекторной функции конструкция может быть афукозилирована.
[00190] Линкеры
[00191] Конструкции, описанные в настоящем документе, могут содержать один или несколько гетеродимеров, описанных в настоящем документе, функционально связанных с Fc, описанным в настоящем документе. В некоторых аспектах Fc связан с одним или несколькими гетеродимерами при помощи одного или нескольких линкеров или без них. В некоторых аспектах Fc непосредственно связан с одним или несколькими гетеродимерами. В некоторых аспектах Fc связан с одним или несколькими гетеродимерами посредством одного или нескольких линкеров. В некоторых аспектах Fc связан с тяжелой цепью каждого гетеродимера посредством линкера.
[00192] В некоторых аспектах один или несколько линкеров представляют собой один или несколько полипептидных линкеров. В некоторых аспектах один или несколько линкеров содержат один или несколько шарнирных участков антитела. В некоторых аспектах один или несколько линкеров содержат один или несколько шарнирных участков IgG1.
Способы получения гетеродимерных пар
[00193] Как описано выше, гетеродимерные пары по настоящему изобретению могут содержать первый гетеродимер и второй гетеродимер, при этом каждый гетеродимер содержит тяжелую цепь иммуноглобулина или ее фрагмент, имеющие по меньшей мере домен VH и CH1, и легкую цепь иммуноглобулина, имеющую домен VL и домен CL. Тяжелые цепи иммуноглобулина и легкие цепи иммуноглобулина гетеродимеров можно легко получить с использованием способа рекомбинантной ДНК, известного в данной области. Стандартные способы, такие как, например, те, что описаны в публикациях Sambrook and Russell, Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 3rd ed., 2001); Sambrook et al., Molecular Cloning: A Laboratory Manual (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 2nd ed., 1989); Short Protocols in Molecular Biology (Ausubel et al., John Wiley and Sons, New York, 4th ed., 1999); и Glick and Pasternak, Molecular Biotechnology: Principles and Applications of Recombinant DNA (ASM Press, Washington, D.C., 2nd ed., 1998), могут быть использованы для методов рекомбинантных нуклеиновых кислот, синтеза нуклеиновых кислот, культуры клеток, трансгенного включения и экспрессии рекомбинантных белков. Кроме того, гетеродимеры и гетеродимерные пары по настоящему изобретению могут быть синтезированы химически.
[00194] Последовательности нуклеиновых кислот и аминокислот тяжелых и легких цепей иммуноглобулина антител, из которых получают гетеродимеры, либо известны в данной области либо могут быть легко определены с использованием способов секвенирования нуклеиновых кислот и/или белков. Способы генетического слияния метки, описанной в настоящем документе, с тяжелыми и/или легкими цепями иммуноглобулина известны в данной области, и некоторые из них описаны ниже и в примерах.
[00195] Например, способы экспрессии и совместной экспрессии тяжелых и легких цепей иммуноглобулинов в клетке-хозяине, хорошо известны в данной области. Кроме того, способы мечения тяжелых цепей и/или легких цепей с использованием технологии рекомбинантных ДНК, также хорошо известны в данной области. Векторы экспрессии и клетки-хозяева, подходящие для экспрессии тяжелых и легких цепей, также хорошо известны в данной области, как описано ниже.
[00196] Способы производства биспецифического антитела, которые не основаны на использовании только одной клональной или переходной клеточной линии, экспрессирующей все четыре цепи, известны в данной области (Gramer, et al. (2013) mAbs 5, 962; Strop et al. (2012) J Mol Biol 420, 204.). Эти способы основаны на обмене фрагментов в окислительно-восстановительных условиях после получения в двух парах легкой и тяжелой цепи, участвующих в образовании биспецифического антитела (окислительно-восстановительное производство). При таком подходе пары H1:L1 и H2:L2 могут быть экспрессированы в двух различных клеточных линиях, чтобы независимо получить два Fab-фрагмента. Впоследствии оба Fab-фрагмента смешивают в выбранных окислительно-восстановительных условиях для достижения повторного связывания двух уникальных тяжелых цепей H1 и H2 с образованием биспецифического антитела, которое содержит цепи L1:H1:H2:L2. Можно предвидеть использование набора библиотеки/данных дизайнов, описанных в настоящем документе, в производстве биспецифических антител с использованием окислительно-восстановительного способа производства или модифицированных версий этого способа.
[00197] В некоторых вариантах осуществления настоящего изобретения для совместной экспрессии полипептидов (например, тяжелой и легкой цепи полипептидов) используются бесклеточные системы экспрессии белка без использования живых клеток. Вместо этого все компоненты, необходимые для транскрипции ДНК в РНК и трансляции РНК в белок (например, рибосомы, тРНК, ферменты, кофакторы, аминокислоты), предоставляются в растворе для использования in vitro. В некоторых вариантах осуществления настоящего изобретения для экспрессии in vitro требуется (1) генетический шаблон (мРНК или ДНК), кодирующий тяжелую и легкую цепи полипептидов, и (2) реакционный раствор, содержащий необходимую молекулярную производственную структуру для транскрипции и трансляции. В некоторых вариантах осуществления настоящего изобретения клеточные экстракты, по существу, поставляют компоненты реакционного раствора, например: РНК-полимеразы для транскрипции мРНК, рибосомы для трансляции полипептида, тРНК, аминокислоты, кофакторы ферментов, источник энергии и клеточные компоненты, необходимые для правильного фолдинга белка. Бесклеточные системы экспрессии белка могут быть получены с использованием лизатов, полученных из бактериальных клеток, дрожжевых клеток, клеток насекомых, клеток растений, клеток млекопитающих, клеток человека или их комбинаций. Такие клеточные лизаты могут обеспечить правильную композицию и пропорции ферментов и строительных блоков, необходимых для трансляции. В некоторых вариантах осуществления настоящего изобретения клеточные мембраны удаляют, чтобы оставить только цитозольные компоненты и органеллы клетки.
[00198] В данной области известно несколько бесклеточных систем экспрессии белка, которые рассмотрены в публикации Carlson et al. (2012) Biotechnol. Adv. 30: 1185-1194. Например, доступны бесклеточные системы экспрессии белка на основе прокариотических или эукариотических клеток. Примеры прокариотических бесклеточных систем экспрессии включают системы из E. coli. Доступны эукариотические бесклеточные системы экспрессии белка на основе экстрактов из ретикулоцитов кролика, зародышей пшеницы и клеток насекомых, например. Такие прокариотические и эукариотические бесклеточные системы экспрессии белка коммерчески доступны от таких компаний, как Roche, Invitrogen, Qiagen и Novagen. Специалист в данной области легко сможет выбрать подходящие бесклеточные системы экспрессии белка, которые будут производить полипептиды (например, тяжелую цепь и легкую цепь полипептидов), способные образовывать пары друг с другом. Кроме того, чтобы повысить эффективность фолдинга IgG, бесклеточная система экспрессии белка также может быть дополнена шаперонами (например, BiP) и изомеразами (например, дисульфидной изомеразой).
[00199] В некоторых вариантах осуществления настоящего изобретения бесклеточные системы экспрессии используются для совместной экспрессии тяжелой и легкой цепей полипептидов из шаблонов ДНК (транскрипция и трансляция) или шаблонов мРНК (только трансляция).
Векторы и клетки-хозяева
[00200] Рекомбинантная экспрессия тяжелых и легких цепей требует конструирования вектора экспрессии, содержащего полинуклеотид, который кодирует тяжелую или легкую цепь (например, антитело или гибридный белок). После получения полинуклеотида, кодирующего тяжелую или легкую цепи, вектор для продуцирования тяжелой и легкой цепей может быть получен путем технологии рекомбинантной ДНК с использованием способов, хорошо известных в данной области. Таким образом, способы получения белка путем экспрессии полинуклеотида, содержащего нуклеотидную последовательность, кодирующую тяжелую и легкую цепи, описаны в настоящем документе. Способы, которые хорошо известны специалистам в данной области, могут быть использованы для конструирования векторов экспрессии, содержащих последовательности, кодирующие тяжелую или легкую цепь, и подходящие сигналы контроля транскрипции и трансляции. Данные способы включают, например, технологии рекомбинантных ДНК in vitro, способы синтеза и генетическую рекомбинанацию in vivo. Настоящее изобретение предлагает реплицирующиеся векторы, содержащие нуклеотидную последовательность, кодирующую тяжелые или легкие цепи, функционально связанные с промотором.
[00201] Вектор экспрессии традиционными способами переносят в клетку-хозяина, и затем трансфицированные клетки культивируют традиционными способами для получения модифицированных тяжелых и легких цепей для использования в способе по настоящему изобретению. В конкретных вариантах осуществления настоящего изобретения тяжелые и легкие цепи для использования в способе совместно экспрессируются в клетке-хозяине для экспрессии полной молекулы иммуноглобулина, как подробно описано ниже.
[00202] Для экспрессии модифицированных легких и тяжелых цепей могут быть использованы различные векторные системы для экспрессии в клетке-хозяине. Такие системы для экспрессии в клетке-хозяине представляют собой проводники, посредством которых представляющие интерес кодирующие последовательности могут быть произведены и впоследствии очищены, но также представляют собой клетки, которые могут, при трансформации или трансфекции с помощью последовательностей, кодирующих подходящий нуклеотид, экспрессировать модифицированные тяжелые и легкие цепи in situ. Эти системы включают в себя, но ими не ограничиваются, системы микроорганизмов, таких как бактерии (например, Е. coli и В. subtilis), трансформированные с помощью рекомбинантной ДНК бактериофага, экспрессирующих векторов на основе плазмидной ДНК или космидной ДНК, содержащих последовательности, кодирующие модифицированные тяжелые и легкие цепи; дрожжи (например, Saccharomyces Pichia), трансформированные с помощью рекомбинантных дрожжевых векторов экспрессии, содержащих последовательности, кодирующие модифицированные тяжелые и легкие цепи; клеточные системы насекомых, инфицированные с помощью рекомбинантных вирусных экспрессирующих векторов (например, бакуловирусов), содержащих последовательности, кодирующие модифицированные тяжелые и легкие цепи; системы растительных клеток, инфицированных с помощью рекомбинантных вирусных векторов экспрессии (например, вируса мозаики цветной капусты, CaMV; вируса табачной мозаики, TMV) или трансформированных с помощью рекомбинантных плазмидных векторов экспрессии (например, Ti-плазмиды), содержащих последовательности, кодирующие модифицированные тяжелые и легкие цепи; или системы клеток млекопитающих (например, клеток COS, CHO, BHK, HEK-293, NSO, и 3T3), содержащих рекомбинантные конструкции экспрессии, содержащие промоторы, полученные из генома клеток млекопитающих (например, металлотионеиновый промотор) или вирусов млекопитающих (например, поздний аденовирусный промотор; промотор 7.5К вируса коровьей оспы). В некоторых вариантах осуществления настоящего изобретения бактериальные клетки, такие как Escherichia coli или эукариотические клетки, используют для экспрессии модифицированных тяжелых и легких цепей, которые являются рекомбинантной молекулой антитела или гибридного белка. Например, клетки млекопитающих, такие как клетки яичников китайского хомячка (CHO), в сочетании с вектором, таким как основной промежуточный ранний генный промоторный элемент из цитомегаловируса человека, являются эффективной экспрессионной системой антител ((Foecking et al., 1986, Gene 45: 101; и Cockett et al., 1990, Bio/Technology 8: 2). В конкретном варианте осуществления настоящего изобретения экспрессия нуклеотидной последовательности, кодирующей тяжелые и легкие цепи иммуноглобулина каждого гетеродимера, регулируется конститутивным промотором, индуцируемым промотором или тканеспецифичным промотором.
[00203] В клетках-хозяевах млекопитающих может быть использован ряд экспрессионных систем на основе вирусов. В случаях, когда в качестве вектора экспрессии используют аденовирус, представляющая интерес последовательность, кодирующая модифицированную легкую и тяжелую цепь, может быть лигирована с аденовирусным комплексом, контролирующим транскрипцию/трансляцию, например поздним промотором и тройственной лидерной последовательностью. Данный химерный ген может быть затем встроен в аденовирусный геном путем in vitro или in vivo рекомбинации. Вставка в несущественную область вирусного генома (например, область Е1 или Е3) даст в результате рекомбинантный вирус, который жизнеспособен и способен экспрессировать модифицированные тяжелые и легкие цепи в инфицированных хозяевах (например, см. Logan & Shenk, 1984, Proc. Natl. Acad. Sci. USA 81: 355-359). Для эффективной трансляции встроенных последовательностей, кодирующих антитело, могут также требоваться специфические сигналы инициации. Данные сигналы включают в себя инициирующий кодон ATG и прилегающие последовательности. Кроме того, инициирующий кодон должен быть в фазе с рамкой считывания желаемой кодирующей последовательности для обеспечения трансляции полного инсерта. Данные экзогенные сигналы контроля трансляции и инициирующие кодоны могут быть из различных источников, как природных, так и синтетических. Эффективность экспрессии может быть повышена путем включения подходящих энхансерных элементов транскрипции, терминаторов транскрипции и тому подобное (см. Bittner et al., 1987, Methods in Enzymol. 153: 516-544).
[00204] Экспрессия тяжелых и легких цепей иммуноглобулинов гетеродимеров может контролироваться любым промоторным или энхансерным элементом, известным в данной области. Промоторы, которые могут быть использованы для контроля экспрессии гена, кодирующего модифицированные тяжелые и легкие цепи (например, антитела или слитого белка), включают, среди прочего, область раннего промотора SV40 (Bernoist and Chambon, 1981, Nature 290:304-310), промотор, содержащийся в 3' длинном концевом повторе вируса саркомы Рауса (Yamamoto, et al., 1980, Cell 22:787-797), промотор тимидинкиназы герпеса (Wagner et al., 1981, Proc. Natl. Acad. Sci. U.S.A. 78.1441-1445), регуляторные последовательности гена металлотионеина (Brinster et al., 1982, Nature 296:39-42), тетрациклиновый (Tet) промотор (Gossen et al., 1995, Proc. Nat. Acad. Sci. USA 89:5547-5551); прокариотические векторы экспрессии, такие как промотор β-лактамазы (Villa-Kamaroff et al, 1978, Proc. Natl. Acad. Sci. U.S.A. 75:3727-3731) или промотор (tac) (DeBoer et al., 1983, Proc. Natl. Acad. Sci. U.S.A. 80:21-25; см. также «Useful proteins from recombinant bacteria» в Scientific American, 1980, 242:74-94); растительные векторы экспрессии, содержащие промоторную область нопалин синтетазы (Herrera-Estrella et al., Nature 303:209-213) промотор 35S РНК вируса мозаики цветной капусты (Gardner et al., 1981, Nucl. Acids Res. 9:2871) и промотор фермента фотосинтеза рибулозо-бисфосфат-карбоксилазы (Herrera-Estrella et al., 1984, Nature 310:115-120); промоторные элементы на основе дрожжей или других грибов, такие как промотор Gal 4, промотор ADC (алкогольдегидрогеназы) промотор PGK (фосфоглицеринкиназы), промотор щелочной фосфатазы и следующие области, контролирующие транскрипцию у животных, которые проявляют тканеспецифичность и были использованы в трансгенных животных: регуляторная область гена эластазы I, которая активна в панкреатических ацинарных клетках (Swift et al., 1984, Cell 38:639-646; Ornitz et al., 1986, Cold Spring Harbor Symp. Quant. Biol. 50:399-409; MacDonald, 1987, Hepatology 7:425-515); регуляторная область гена инсулина, активная в панкреатических бета-клетках (Hanahan, 1985, Nature 315:115-122), регуляторная область гена иммуноглобулина, активная в лимфоидных клетках (Grosschedl et al., 1984, Cell 38:647-658; Adames et al., 1985, Nature 318:533-538; Alexander et al., 1987, Mol. Cell. Biol. 7:1436-1444), регуляторная область мышиного вируса опухоли молочной железы, активного в клетках яичек, молочной железы, лимфоцитах и тучных клетках (Leder et al., 1986, Cell 45:485-495), регуляторная область гена альбумина, активная в печени (Pinkert et al., 1987, Genes and Devel. 1:268-276), регуляторная область гена альфа-фетопротеина, активная в печени (Krumlauf et al., 1985, Mol. Cell. Biol. 5:1639-1648; Hammer et al., 1987, Science 235:53-58; регуляторная область гена альфа 1-антитрипсина, активная в печени (Kelsey et al., 1987, Genes and Devel. 1:161-171), регуляторная область гена бета-глобина, активная в миелоидных клетках ((Mogram et al., 1985, Nature 315:338-340; Kollias et al., 1986, Cell 46:89-94; регуляторная область гена основного миелинового белка, активная в олигодендроцитах мозга (Readhead et al., 1987, Cell 48:703-712); регуляторная область гена легкой цепи-2 миозина, активная в скелетной мышце (Sani, 1985, Nature 314:283-286); нейрон-специфичная энолаза (NSE), активная в нервных клетках (Morelli et al., 1999, Gen. Virol. 80:571-83); регуляторная область гена мозгового нейротрофического фактора (BDNF), который активен в нервных клетках (Tabuchi et al., 1998, Biochem. Biophysic. Res. Com. 253:818-823); промотор глиального фибриллярного кислого белка (GFAP), который активен в астроцитах (Gomes et al., 1999, Braz J Med Biol Res 32(5):619-631 ; Morelli et al., 1999, Gen. Virol. 80:571-83), и регуляторная область гена гонадотропин-высвобождающего гормона, активная в гипоталамусе (Mason et al., 1986, Science 234:1372-1378).
[00205] Кроме того, может быть выбрана линия клетки-хозяина, которая модулирует экспрессию встроенных последовательностей или модифицирует и процессирует продукт гена определенным желаемым способом. Экспрессия из определенных промоторов может быть усилена в присутствии определенных индукторов; таким образом можно контролировать экспрессию генно-инженерного слитого белка. Кроме того, различные клетки-хозяева имеют характерные и специфические механизмы для трансляционного и посттрансляционного процессинга (например, гликозилирование, фосфорилирование белков). Подходящие клеточные линии или системы клетки-хозяина могут быть выбраны для обеспечения желательной модификации и процессинга экспрессированного чужеродного белка. Например, экспрессия в бактериальной системе будет производить негликозилированный продукт, а экспрессия в дрожжах будет производить гликозилированный продукт. Могут быть использованы эукариотические клетки-хозяева, которые обладают клеточным механизмом для правильного процессинга первичного транскрипта (например, гликозилирования и фосфорилирования) продукта гена. Такие клетки-хозяева млекопитающих включают в себя, но ими не ограничиваются, CHO, VERY, BHK, Hela, COS, MDCK, HEK-293, 3T3, WI38, NSO и, в частности, нейронные клеточные линии, такие как, например, клетки нейробластомы человека SK-N-AS, SK-N-FI, SK-N-DZ (Sugimoto et al., 1984, J. Natl. Cancer Inst. 73: 51-57), нейробластомы человека SK-N-SH (Biochim. Biophys. Acta, 1982, 704: 450-460), медуллобластомы мозжечка человека Daoy (He et al., 1992, Cancer Res. 52: 1144-1148), клетки глиобластомы DBTRG-05MG (Kruse et al., 1992, In Vitro Cell. Dev. Biol. 28A: 609-614), нейробластомы человека IMR-32 (Cancer Res., 1970, 30: 2110-2118), астроцитомы человека 1321 N1 (Proc. Natl. Acad. Sci. USA, 1977, 74: 4816), астроцитомы человека MOG-G-CCM (Br. J. Cancer, 1984, 49: 269), глиобластомы-астроцитомы человека U87MG (Acta Pathol. Microbiol. Scand., 1968, 74: 465-486), глиобластомы человека A172 (Olopade et al., 1992, Cancer Res. 52: 2523-2529), клетки глиомы крысы C6 (Benda et al., 1968, Science 161: 370-371), нейробластомы мыши Neuro-2a (Proc. Natl. Acad. Sci. USA, 1970, 65: 129-136), нейробластомы мыши NB41A3 (Proc. Natl. Acad. Sci. USA, 1962, 48: 1184-1190), сосудистого сплетения овец SCP (Bolin et al., 1994, J. Virol. Methods 48: 211-221), G355-5, PG-4 нормальных астроцитов котов (Haapala et al., 1985, J. Virol. 53: 827-833), Mpf мозга хорька (Trowbridge et al., 1982, In Vitro 18: 952-960) и нормальные клеточные линии, такие как, например, CTX TNA2 нормальной коры головного мозга крысы (Radany et al., 1992, Proc. Natl. Acad. Sci. USA 89: 6467-6471), например, CRL7030 и Hs578Bst. Кроме того, различные системы экспрессии вектор/хозяин могут в разной степени влиять на реакции процессинга.
[00206] Для длительного крупномасштабного производства рекомбинантных белков часто предпочтительна стабильная экспрессия. Например, могут быть сконструированы клеточные линии, которые стабильно экспрессируют модифицированные тяжелые и легкие цепи по настоящему изобретению (например, антитела или гибридного белка). Вместо использования экспрессирующих векторов, которые содержат вирусные точки начала репликации, клетки-хозяева могут быть трансформированы с использованием ДНК, контролируемой подходящими элементами контроля экспрессии (например, промотором, энхансером, последовательностями, терминаторами транскрипции, сайтами полиаденилирования и др.), и с использованием селектируемого маркера. После введения чужеродной ДНК сконструированным клеткам может быть позволено расти в течение 1-2 дней в обогащенной среде, а затем их переводят на селективную среду. Селектируемый маркер в рекомбинантной плазмиде придает устойчивость к селекции и позволяет клеткам стабильно интегрировать плазмиду внутрь их хромосом и расти с образованием очагов, которые, в свою очередь, могут быть клонированы и размножены в клеточных линиях.
[00207] Может быть использован ряд селекционных систем, в том числе, но не ограничиваясь этим, гены тимидинкиназы вируса простого герпеса (Wigler et al., 1977, Cell 11:223), гипоксантин-гуанин-фосфорибозилтрансферазы Szybalska & Szybalski, 1962, Proc. Natl. Acad. Sci. USA 48:2026) и аденин-фосфорибозилтрансферазы (Lowy et al., 1980, Cell 22:817), которые могут быть применены в tk-, hgprt- или aprt-клетках, соответственно. Также антиметаболитная устойчивость может быть использована в качестве основы для отбора следующих генов: dhfr, который придает устойчивость к метотрексату (Wigler et al., 1980, Natl. Acad. Sci. USA 77:3567; O'Hare et al., 1981, Proc. Natl. Acad. Sci. USA 78:1527); gpt, который придает устойчивость к микофенольной кислоте (Mulligan & Berg, 1981, Proc. Natl. Acad. Sci. USA 78:2072); neo, который придает устойчивость к аминогликозиду G-418 (Colberre-Garapin et al., 1981, J. Mol. Biol. 150:1); и hygro, который придает устойчивость к гигромицину (Santerre et al., 1984, Gene 30:147).
Совместная экспрессия тяжелых цепей и легких цепей
[00208] Тяжелые цепи и легкие цепи иммуноглобулинов гетеродимерных пар по настоящему изобретению могут совместно экспрессироватьтся в клетках млекопитающих, как отмечено выше. В одном из вариантов осуществления настоящего изобретения одна тяжелая цепь совместно экспрессируется с двумя различными легкими цепями в наборе дизайнов LCCA, как описано выше, при этом тяжелая цепь предпочтительно образует пары с одной из двух легких цепей. В другом варианте осуществления настоящего изобретения две тяжелые цепи совместно экспрессируются с двумя различными легкими цепями, при этом каждая тяжелая цепь предпочтительно образует пары с одной из легких цепей.
Исследования гетеродимерных пар
[00209] Как описано выше, по меньшей мере один гетеродимер гетеродимерных пар по настоящему изобретению может содержать одну или несколько аминокислотных модификаций в их иммуноглобулиновых тяжелых и/или иммуноглобулиновых легких цепях, так что когда при совместной экспрессии двух тяжелых цепей и двух легких цепей гетеродимерной пары в клетке млекопитающего, тяжелая цепь первого гетеродимера предпочтительно образует пары с одной из легких цепей, а не с другой. Подобным образом тяжелая цепь второго гетеродимера предпочтительно образует пары со второй легкой цепью, а не с первой. Степень предпочтительного образования пар может быть оценена, например, с помощью методов, описанных ниже. Аффинность каждого гетеродимера гетеродимерой пары к его соответствующему антигену может быть проверена так, как описано ниже. Термостабильность каждого гетеродимера гетеродимерой пары также может быть проверена так, как описано ниже.
Способы измерения предпочтительного образования пар
[00210] LCCA
[00211] В одном из вариантов осуществления настоящего изобретения предпочтительное образование пар между тяжелыми и легкими цепями иммуноглобулинов определяют посредством выполнения конкурентного анализа образования пар с легкой цепью (LCCA). В совместной заявке на патент PCT/US2013/063306, поданной 3 октября, 2013 года, описаны различные варианты осуществления LCCA, и они включены в настоящий документ посредством ссылки во всей своей полноте для всех целей. Способ обеспечивает количественный анализ образования пар тяжелых цепей с конкретными легкими цепями в смеси совместно экспрессируемых белков, и его можно использовать для определения того, связывается ли селективно одна конкретная тяжелая цепь иммуноглобулина с одной или двумя легкими цепями иммуноглобулина при совместной экспрессии тяжелой цепи и легких цепей. Способ можно кратко описать следующим образом: по меньшей мере одна тяжелая цепь и две различные легкие цепи совместно экспрессируются в клетке в таких соотношениях, что тяжелая цепь является реагентом ограничения образования пар; необязательное отделение секретируемых белков из клетки; отделение полипептидов легкой цепи иммуноглобулина, связанных с тяжелой цепью, от остальной части секретируемых белков для получения выделенной из спаренной фракции тяжелой цепи; определение количества каждой отдельной легкой цепи в выделенной фракции тяжелой цепи; и анализ относительного количества каждой отдельной легкой цепи в выделенной фракции тяжелой цепи, чтобы определить способность по меньшей мере одной тяжелой цепи селективно образовывать пары с одной из легких цепей.
[00212] Способ обеспечивает разумную производительность и является надежным (то есть нечувствительным к небольшим изменениям при его использовании, таким как, например, пользователь или скорость потока) и точным. Этот способ обеспечивает чувствительный анализ, при помощи которого можно измерить эффекты малых вариаций в последовательностях белков. Для взаимодействия беспорядочный белок–белок; домен–домен; цепь–цепь на больших площадях поверхности, как правило, требуется несколько мутаций (перестановок) в целях внедрения селективности. Нет необходимости в выделении и очистке белковых продуктов, что позволяет более эффективный скрининг. Дополнительные детали, касающиеся варианта осуществления этого способа, описаны в Примерах.
[00213] Альтернативные способы определения предпочтительного образования пар
[00214] Альтернативные способы определения предпочтительного образования пар включают применение ЖХ-МС (жидкостная хроматографи-масс-спектрометрия) для количественной оценки относительной гетеродимерной популяции, включая каждую легкую цепь, с использованием различий их молекулярной массы для определения каждого отдельного вида. Для количественной оценки относительной гетеродимерной популяции, содержащей каждую легкую цепь, также может быть использован анализ активности антигена, при этом для оценки каждой соответствующей гетеродимерной популяции будет использоваться измеренная степень связывания (по отношению к контрольной).
[00215] Дополнительные способы, такие как SMCA, описаны в Примерах, Фигурах и Таблицах.
Термостабильность
[00216] Термостабильность гетеродимеров может быть определена в соответствии со способами, известными в данной области. Температура плавления каждого гетеродимера свидетельствует о него термостабильности. Температура плавления гетеродимера может быть измерена с помощью таких способов, как дифференциальная сканирующая калориметрия (Chen et al (2003) Pharm Res 20:1952-60; Ghirlando et al (1999) Immunol Lett 68:47-52). В качестве альтернативы, термостабильность гетеродимера может быть измерена с помощью кругового дихроизма (Murray et al. (2002) J. Chromatogr Sci 40:343-9).
Аффинность к антигену
[00217] Аффинность связывания гетеродимеров с соответствующими антигенами и скорость диссоциации взаимодействия может быть определена путем анализов конкурентного связывания в соответствии со способами, хорошо известными в данной области. Одним из примеров анализа конкурентного связывания является радиоиммуноанализ, включающий инкубацию меченого антигена (например, 3Н или 125I с представляющей интерес молекулой (например, гетеродимером по настоящему изобретению) в присутствии возрастающих количеств немеченого антигена, и детектирование молекулы, которая связывается с меченым лигандом. Аффинность гетеродимера по настоящему изобретению к антигену и показатели скорости диссоциации связывания могут быть определены на основе данных насыщения посредством анализа Скэтчарда.
[00218] Кинетические параметры гетеродимера по настоящему изобретению также могут быть определены с использованием анализов на основе поверхностного плазмонного резонанса (SPR), известных в данной области (например, кинетический анализ BIAcore). Для обзора способов на основе SPR см. публикации Mullet et al., 2000, Methods 22: 77-91; Dong et al., 2002, Review in Mol. Biotech., 82: 303-23; Fivash et al., 1998, Current Opinion in Biotechnology 9: 97-101; Rich et al., 2000, Current Opinion in Biotechnology 11: 54-61. Кроме того, в способах по настоящему изобретению для измерения белок-белковых взаимодействий предусмотрен любой из инструментов SPR и способов, основанных на SPR, описанный в патентах США под номерами 6373577; 6289286; 5322798; 5341215; 6268125. Для измерения аффинности также можно использовать анализ FACS, как это известно в данной области.
Фармацевтические композиции
[00219] Настоящее изобретение также относится к фармацевтическим композициям, содержащим гетеродимеры или гетеродимерные пары, описанные в настоящем документе. Такие композиции содержат терапевтически эффективное количество гетеродимера или гетеродимерной пары и фармацевтически приемлемый носитель. В конкретном варианте осуществления настоящего изобретения термин «фармацевтически приемлемый» означает одобренный регулирующим ведомством федерального правительства или правительства штата или указанный в фармакопейном списке США или другой общепризнанной фармакопее для применения на животных и более конкретно на человеке. Термин «носитель» относится к разбавителю, адъюванту, вспомогательному веществу или наполнителю, с которым вводят терапевтическое средство. Такими фармацевтическими носителями могут быть стерильные жидкости, такие как вода и масла, включая масла из нефти, масла животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобные. При внутривенном введении фармацевтической композиции предпочтительным носителем является вода. В качестве жидких носителей, в частности, для растворов и для инъекций, также могут быть использованы солевые растворы и водные растворы декстрозы и глицерина. Подходящие фармацевтические вспомогательные вещества включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, воду, этанол и т.п. Композиция при желании также может содержать небольшие количества увлажнителей или эмульгаторов, или агентов для забуферивания pH. Указанные композиции могут иметь форму растворов, суспензий, эмульсий, таблеток, пилюль, капсул, порошков, препаратов замедленного высвобождения и т.п. Композиция может быть приготовлена в виде суппозитория с традиционными связующими веществами и носителями, такими как триглицериды. Пероральные препараты могут включать стандартные носители фармацевтической категории чистоты, такие как маннит, лактоза, крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат магния и т.п. Примеры подходящих фармацевтических носителей описаны в «Remington's Pharmaceutical Sciences» by E. W. Martin. Такие композиции будут содержать терапевтически эффективное количество соединения, предпочтительно в очищенной форме, вместе с подходящим количеством носителя так, чтобы обеспечить форму для надлежащего введения пациенту. Препарат должен соответствовать способу введения.
[00220] В некоторых вариантах осуществления настоящего изобретения композиция, содержащая гетеродимер или гетеродимерную пару, формулируется в соответствии с обычными процедурами как фармацевтическая композиция, адаптированная для внутривенного введения человеку. Как правило, композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. При необходимости композиция также может содержать солюбилизирующее средство и местный анестетик, такой как лигнокаин, чтобы уменьшить боль в месте инъекции. Как правило, ингредиенты поставляются по отдельности или в смеси в виде единичной дозированной формы, например, в виде сухого лиофилизированного порошка или безводного концентрата в герметически закрытом контейнере, таком как ампула или пакет-саше, с указанием количества активного средства. Если композицию вводят путем инфузии, ее можно дозировать с помощью флакона для инфузий, содержащего стерильную воду или стерильный физиологический раствор фармацевтической категории чистоты. Если композицию вводят путем инъекции, может предоставляться ампула со стерильной водой для инъекции или со стерильным физиологическим раствором для смешивания ингредиентов перед введением.
[00221] В некоторых вариантах осуществления настоящего изобретения композиции, описанные в настоящем документе, сформулированы в виде нейтральной или солевой формы. Фармацевтически приемлемые соли включают соли, образованные с анионами, такими как полученные из хлористоводородной, фосфорной, уксусной, щавелевой, винной кислот и тому подобное, и соли, образованные катионами, такими как те, которые получены из натрия, калия, аммония, кальция, гидроксида железа, изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.п.
[00223] Количество композиции, описанной в настоящем документе, которое будет эффективным в лечении, ингибировании и предотвращении заболевания или расстройства, связанного с патологической экспрессией и/или активностью терапевтического белка, может быть определено с помощью стандартных клинических способов. Кроме того, могут быть необязательно использованы анализы in vitro, чтобы помочь определить оптимальные диапазоны доз. Точная доза для применения в композиции будет также зависеть от пути введения и серьезности заболевания или расстройства, и решение относительно нее должно быть принято в соответствии с мнением лечащего врача и обстоятельств для каждого пациента. Эффективные дозы являются экстраполированными из кривых доза-ответ, полученных из тест-систем в модели животных или in vitro.
Применение гетеродимерных пар
[00223] Как описано выше, гетеродимерные пары по настоящему изобретению могут содержать первый гетеродимер и второй гетеродимер, при этом иммуноглобулиновая тяжелая цепь и иммуноглобулиновая легкая цепь каждого гетеродимера получена или сконструирована из известного терапевтического антитела или из известного антитела, которое связывается с молекулой. Таким образом, предполагается, что гетеродимеры, полученные или сконструированные из этих антител, могут быть использованы для лечения или профилактики того же заболевания, расстройства или инфекции, для которого могло быть использовано известное терапевтическое антитело или известное антитело.
[00224] Таким образом, в одном из вариантов осуществления настоящего изобретения гетеродимерные пары по настоящему изобретению, которые содержат гетеродимер с тяжелыми и легкими цепями, полученными из терапевтического антитела, которое может быть использовано для лечения и/или профилактики злокачественной опухоли и связанных с ней заболеваний, также могут быть использованы для лечения и/или профилактики злокачественной опухоли и связанных с ней заболеваний.
[00225] В другом варианте осуществления настоящего изобретения гетеродимерные пары по настоящему изобретению, которые содержат гетеродимер с тяжелыми и легкими цепями, полученными из терапевтического антитела, которое может быть использовано для профилактики, лечения или контроля симптомов воспалительного расстройства у индивида, также могут быть использованы для профилактики, лечения или контроля симптомов воспалительного расстройства у индивида.
[00226] В другом варианте осуществления настоящего изобретения гетеродимерные пары по настоящему изобретению, которые содержат гетеродимер с тяжелыми и легкими цепями, полученными из терапевтического антитела, которое может быть использовано для лечения или профилактики аутоиммунного заболевания или воспалительного заболевания у индивида, также могут быть использованы для лечения или профилактики аутоиммунного заболевания или воспалительного заболевания у индивида.
[00227] В другом варианте осуществления настоящего изобретения гетеродимерные пары по настоящему изобретению, которые содержат гетеродимер с тяжелыми и легкими цепями, полученными из терапевтического антитела, которое может быть использовано для лечения или профилактики инфекционного заболевания у индивида, также могут быть использованы для лечения или профилактики инфекционного заболевания у индивида.
[00228] В другом варианте осуществления настоящего изобретения гетеродимерные пары по настоящему изобретению, которые содержат гетеродимер с тяжелыми и легкими цепями, полученными из терапевтического антитела, которое может быть использовано для лечения сосудистого заболевания у индивида, также могут быть использованы для лечения сосудистого заболевания у индивида.
[00229] В другом варианте осуществления настоящего изобретения гетеродимерные пары по настоящему изобретению также могут быть преимущественно использованы в комбинации с другими терапевтическими агентами, известными в данной области для лечения или профилактики злокачественной опухоли, аутоиммунного заболевания, воспалительных заболеваний или инфекционных заболеваний. В конкретном варианте осуществления настоящего изобретения гетеродимерные пары по настоящему изобретению могут быть использованы в комбинации с моноклональными или химерными антителами, лимфокинами или гематопоэтическими факторами роста (такими как, например, IL-2, IL-3 и IL-7), которые, например, служат для увеличения количества или активности эффекторных клеток, которые взаимодействуют с молекулами, и повышают иммунный ответ. Гетеродимерные пары по настоящему изобретению также могут быть преимущественно использованы в комбинации с одним или более лекарственными средствами для лечения заболевания, расстройства или инфекции, такими как, например противораковые средства, противовоспалительные средства или противовирусные средства.
Наборы
[00230] В настоящем изобретении дополнительно предлагаются наборы, включающие одну или несколько гетеродимерных пар. Отдельные компоненты набора, должны быть упакованы в отдельные контейнеры, и с такими контейнерами могут быть связаны уведомления в форме, предписанной правительственным органом, регулирующим производство, применение или продажу фармацевтических препаратов или биологических продуктов, при этом уведомление отражает одобрение правительственным органом изготовления, использования или продажи. Набор может необязательно содержать инструкции или указания с изложением способа использования или схемы введения гетеродимерных пар.
[00231] Когда один или несколько компонентов набора предоставлены в виде растворов, например в виде водного раствора или стерильного водного раствора, средство контейнера может само по себе быть ингалятором, шприцем, пипеткой, глазной капельницей или другим подобным устройством, из которого раствор может быть введен индивиду или введен и смешан с другими компонентами набора.
[00232] Компоненты набора могут также быть представлены в высушенной или лиофилизированной форме, и набор может дополнительно содержать подходящий растворитель для растворения из лиофилизированных компонентов. Независимо от количества и типа контейнеров, наборы по изобретению также могут содержать инструмент для содействия введению композиции пациенту. Такой инструмент может представлять собой ингалятор, устройство для назального распыления, шприц, пипетку, щипцы, мерную ложку, глазную капельницу или аналогичные средства доставки, утвержденные для медицинского использования.
Реализация с использованием компьютера
[00233] В одном из вариантов осуществления настоящего изобретения компьютер содержит по меньшей мере один процессор, соединенный с набором микросхем. Также с набором микросхем связаны память, устройства хранения данных, клавиатура, графический адаптер, указательное устройство и сетевой адаптер. Дисплей соединен с графическим адаптером. В одном из вариантов осуществления настоящего изобретения функциональность набора микросхем обеспечивается хабом контроллера памяти и хабом контроллера ввода/вывода (I/O). В другом варианте осуществления настоящего изобретения память непосредственно связана с процессором, а не с набором микросхем.
[00234] Устройство хранения представляет собой любое устройство, способное хранить данные, такое как жесткий диск, компакт-диск с памятью только для чтения (CD-ROM), DVD или устройство полупроводниковой памяти. Память хранит инструкции и данные, используемые процессором. Указательное устройство может представлять собой мышь, трекбол или другой тип указательного устройства, и используется в комбинации с клавиатурой для ввода данных в компьютерную систему. Графический адаптер отображает изображения и другую информацию на дисплее. Сетевой адаптер соединяет компьютерную систему с локальной или глобальной сетью.
[00235] Как известно в данной области, компьютер может иметь отличающиеся и/или другие компоненты, чем те, которые описаны ранее. Кроме того, компьютер может не иметь определенных компонентов. Более того, устройство хранения может быть локальным и/или удаленным от компьютера (например, воплощенным в сети хранения данных (СХД)).
[00236] Как известно в данной области, компьютер выполнен с возможностью выполнения компьютерных программных модулей для обеспечения функциональных возможностей, описанных в настоящем документе. Как используется в настоящем документе, термин “модуль“ относится к логике компьютерной программы, используемой для того, чтобы обеспечить заданные функциональные возможности. Таким образом, модуль может быть реализован в аппаратных средствах, встроенном программном обеспечении и/или программном обеспечении. В одном из вариантов осуществления настоящего изобретения программные модули хранятся на устройстве хранения, загружаются в память и выполняются процессором.
[00237] Следует понимать, что примеры и варианты осуществления настоящего изобретения, описанные в настоящем документе, предназначены только для иллюстративных целей, и что в их свете специалистам в данной области будут предложены различные модификации или изменения, которые должны быть включены в объем сущности и сферы действия этой заявки и объем прилагаемой формулы изобретения.
ПРИМЕРЫ
[00238] Ниже приведены примеры конкретных вариантов осуществления настоящего изобретения. Примеры предлагаются только для иллюстративных целей и не предназначены для ограничения объема настоящего изобретения каким-либо образом. Были предприняты усилия, чтобы обеспечить точность в отношении используемых цифр (например, количеств, температуры и тому подобное), но, конечно же, учитываются и некоторые экспериментальные ошибки и отклонения.
[00239] В применении настоящего изобретения на практике будут использоваться, если не указано иное, обычные способы химии белков, биохимии, способы рекомбинантных ДНК и фармакологии, в рамках, известных специалистам в данной области. Такие способы подробно описаны в литературе. См., например, публикации T.E. Creighton, Proteins: Structures and Molecular Properties (W.H. Freeman and Company, 1993); A.L. Lehninger, Biochemistry (Worth Publishers, Inc., текущее издание); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Methods In Enzymology (S. Colowick and N. Kaplan eds., Academic Press, Inc.); Remington's Pharmaceutical Sciences, 18th Edition (Easton, Pennsylvania: Mack Publishing Company, 1990); Carey and Sundberg Advanced Organic Chemistry 3rd Ed. (Plenum Press) Vols A and B(1992).
Пример 1: Получение конструкций, кодирующих тяжелые цепи IgG D3H44 и легкие цепи IgG D3H44.
[00240] Тяжелые и легкие цепи антитела D3H44 дикого типа к тканевому фактору для использования в наборах совместной экспрессии, описанных в настоящем документе, были получены следующим образом. Последовательности Fab легкой (AJ308087.1) и тяжелой (AJ308086.1) цепей D3H44 получали от GenBank (Таблицы A, A1 и A2), гены были синтезированы и кодон-оптимизированы для экспрессии у млекопитающих. Векторные вставки из легкой цепи, состоящие из 5’-EcoRI место разреза – HLA-A сигнальный пептид – метка HA или FLAG – клон легкой цепи Ig – ‘TGA стоп’ – BamH1 место разреза-3’, лигировали в вектор pTT5 (Durocher Y et al., Nucl. Acids Res. 2002; 30, No.2 e9). Полученный вектор + вставку секвенировали, чтобы подтвердить правильность рамки считывания и последовательность кодирующей ДНК. Подобным образом, векторные вставки из тяжелой цепи, состоящие из 5’-EcoR1 место разреза – HLA-A сигнальный пептид – клон тяжелой цепи (заканчивается на T238; см. Таблицу A1) – ABD2-His6 метка – TGA стоп – BamH1 место разреза-3’, лигировали в вектор pTT5 (ABD; альбумин-связывающий домен). Полученный вектор + вставку также секвенировали, чтобы подтвердить правильность рамки считывания и последовательность кодирующей ДНК. Различные конструкции D3H44 получали либо при помощи генного синтеза, либо при помощи сайт-направленного мутагенеза (Braman J, Papworth C & Greener A., Methods Mol. Biol. (1996) 57:31-44).
[00241] Тяжелую и легкую цепи метили на C- и N-концах, соответственно, для того чтобы облегчить оценку предпочтительного образования пар посредством скрининга конкурентного анализа SPR. Метка ABD2-His6 тяжелой цепи предоставляла возможность специфичного захвата комплексов HC-LC анти-his меткой поверхности SPR чипа, в то время как метки FLAG и HA легкой цепи предоставляли возможность количественного определения относительных популяций LC1 и LC2.
Пример 2: Оценка предпочтительного образования пар гетеродимеров в наборах совместной экспрессии, содержащих модификации вариабельного домена в легких и/или тяжелых цепях IgG D3H44.
[00242] Была определена способность гетеродимеров к предпочтительному образованию пар в наборах совместной экспрессии, содержащих тяжелые и легкие цепи D3H44 с модифицированными доменами VL и/или VH, результаты показаны на Фигуре 1. Результаты, представленные на Фигуре 1, являются предварительными, и ниже приводится более полный набор данных результатов. Аминокислотные модификации, показанные на Фигурах 1–3, идентифицированы со ссылкой на аминокислотные последовательности тяжелой цепи D3H44 и легкой цепи D3H44. См. таблицы A, A1 и A2.
[00243] Одну конструкцию тяжелой цепи D3H44 совместно экспрессировали с двумя уникальными конструкциями легкой цепи D3H44, и из скринингового конкурентного анализа SPR определяли специфичность относительного образования пар легкой цепи (то есть H1-L1:H1-L2) (колонка, озаглавленная “Результаты скрининга конкурентного анализа” на Фигуре 1). Избранные гетеродимерные хиты были проверены с помощью верификации посредством конкурентного анализа образования пар с легкой цепью, в котором во время трансфекции соотношения ДНК L1:L2 варьировали как 40:60, 50:50 и 60:40 (колонка, озаглавленная “Результаты верификации конкурентного анализа” на Фигуре 1). Тяжелую цепь сохраняли в ограниченных количествах (то есть HC<L1+L2) как для скрининговых конкурентных анализов, так и для анализов верификации. Схема, представляющая дизайн анализа, показана на Фигуре 8.
[00244] Способы осуществляли следующим образом: в конкурентном анализе образования пар с легкой цепью (LCCA) количественно оценивают относительное образование пар одной тяжелой цепи по меньшей мере с двумя уникальными легкими цепями. Анализ и предыдущие стадии можно резюмировать следующим образом: 1. одновременная экспрессия тяжелых и легких цепей, при этом тяжелая цепь присутствует в ограниченных количествах (например, HC:LC1:LC2=1:1:1), 2. выделение комплексов HC-LC достигается посредством связывания тяжелых цепей с чипом SPR с ослаблением his-метки, и 3. количественное определение относительных популяций HC-LC (то есть H1-L1:H1-L2). В формате SPR для количественной оценки использовали антитела, специфичные к популяциям с уникальными мечеными легкими цепями. Примечание: Этот анализ можно проводить с использованием или без использования дисульфидной связи H-L. Принципиальной схема, представляющая данный способ, показана на Фигуре 9.
[00245] Способ трансфекции
[00246] Наборы совместной экспрессии, содержащие конструкции из одной тяжелой цепи и двух легких цепей, полученные так, как описано в Примере 1, трансфицировали в клетки CHO-3E7 следующим образом. Клетки CHO-3E7 культивировали с плотностью 1,7-2×106 клеток/мл при температуре 37°C в среде FreeStyleTM F17 (Invitrogen, номер по каталогу A-1383501) с добавлением 4 мМ глутамина и 0,1% плюроника F-68 (Invitrogen, номер по каталогу 24040-032). Общий объем 2 мл трансфицировали общим количеством 2 мкг ДНК с использованием PEI-pro (полиэтиленимин, Polyplus, номер по каталогу 115-010) в соотношении ДНК:PEI 1:2,5. Через двадцать четыре часа после добавления смеси ДНК-PEI, эти клетки переносили в условия 32°C. На 7-ой день супернатанты тестировали в отношении экспрессии посредством анализа ДСН-ПААГ в невосстанавливающих условиях с последующим окрашиванием Кумасси голубым, чтобы визуализировать полосы. Соотношения HC:LC являются такими, как указано в Таблице 7.
[00247]
HC:L1:L2
[00248] Способ конкурентного анализа SPR
[00249] Степень предпочтительного образования пар легкой цепи D3H44 с тяжелой цепью D3H44 в наборах совместной экспрессии оценивали с помощью основанного на SPR считывании данных уникальных эпитопных меток, расположенных на N-конце каждой легкой цепи.
[00250] Расходные материалы для анализа поверхностного плазмонного резонанса (SPR). Сенсорный чип GLM, набор реактивов аминного связывания Biorad ProteOn (1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид (ЭДК), N-гидроксисульфосукцинимид (sNHS) и этаноламин) и 10 мМ буферов ацетата натрия приобретали в компании Bio-Rad Laboratories (Сanada) Ltd. (Mississauga, ON). Рекомбинантный белок Her-2 был приобретен в компании eBioscience (San Diego, CA). Буфер 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновую кислоту (ГЭПЭС), этилендиаминтетрауксусную кислоту (ЭДТК) и NaCl приобретали в компании Sigma-Aldrich (Oakville, ON). Раствор 10% Твин 20 был приобретен в компании Teknova (Hollister, CA).
[00251] Биосенсорные анализы SPR. Все анализы поверхностного плазмонного резонанса выполняли с использованием аппарата BioRad ProteOn XPR36 (Bio-Rad Laboratories (Canada) Ltd. (Mississauga, ON) с подвижным буфером ФСБТ (ФСБ Teknova Inc с 0,05% Твин 20) при температуре 25°C. Поверхность захвата анти-пента-His была создана с использованием сенсорного чипа GLM, активированного разведением 1:5 стандартных растворов BioRad sNHS/ЭДК, впрыскиваемых в течение 140 сек при скорости 100 мкл/ мин в направлении аналита (по горизонтали). Сразу же после активации 25 мкг/мл раствора анти-пента-His антитела (Qiagen Inc.) в 10 мМ NaOAc, рН 4,5, впрыскивали в аналит в (вертикальном) направлении, при скорости потока 25 мкл/мин, пока не были иммобилизованы приблизительно 3000 резонансных единиц (РЕ). Остальные активные группы гасили в течение 140°C впрыскиванием 1М этаноламина со скоростью 100 мкл/мин в направлении аналита, что также обеспечивает промежуточные участки с имитацией активации для пустых ссылок.
[00252] Скрининг связывания гетеродимеров с моноклональными антителами к FLAG (Sigma Inc.) и HA(Roche Inc.) происходил в две стадии: непрямой захват гетеродимеров на анти-пента-His поверхность в направлении лиганда с последующим впрыскиванием анти-FLAG и анти-HA в направлении аналита. Вначале использовали одно впрыскивание буфера в течение 30 сек со скоростью 100 мкл/мин в направлении лиганда для стабилизации исходного уровня. Для каждого захвата гетеродимера, неочищенные гетеродимеры в клеточной культуральной среде разводили в ФСБТ до 4%. От одного до пяти гетеродимеров или контролей (например, контролей, содержащих либо 100% HA-легкая цепь или 100% FLAG-легкая цепь) одновременно впрыскивали в каналы отдельных лигандов в течение 240 сек при потоке 25 мкл/мин. Это приводило к захвату на анти-пента-His поверхности от около 300 до 400 РЕ насыщающего гетеродимера. Первый канал лиганда оставляли пустым, чтобы использовать при необходимости в качестве пустого контроля. За этой стадией захвата гетеродимера немедленно следовали два впрыскивания буфера в направлении аналита, чтобы стабилизировать исходный уровень, а затем впрыскивали в двух повторностях каждый из 5 нМ анти-FLAG и 5 нМ анти-HA со скоростью потока 50 мкл/мин в течение 120 сек с фазой диссоциации 180 сек, в результате чего для каждого захваченного гетеродимера получали набор сенсограмм связывания со ссылкой на буфер. Там где это возможно, антиген, с которым связывается гетеродимер, также можно впрыскивать в последний оставшийся канал аналита в качестве контроля активности. Гетеродимеры были восстановлены посредством 18-сек импульса 0,85% фосфорной кислоты в течение 18 сек при скорости потока 100 мкл/мин для подготовки анти-пента-His поверхности для следующего цикла впрыскивания. Сенсограммы выравнивали и дважды сравнивали с эталоном с использованием пустого впрыскивания буфера и промежуточных участков, и полученные сенсограммы анализировали с использованием программного обеспечения ProteOn Manager software v3.0.
[00253] Общий процент L1 и L2 должен, теоретически, прибавляться до 100%. На практике, для некоторых вариантов наблюдалось, что общее количество L1 и L2 составило значительно меньше, чем 100%. Это расхождение общего процента легкой цепи, как полагают, возникает отчасти из-за изменчивого неспецифического связывания во время начального захвата гетеродимера на чипе SPR.
Пример 3: Оценка предпочтительного образования пар гетеродимеров в наборах совместной экспрессии, содержащих модификации константного домена (CL или CH1) в легких и/или тяжелых цепях D3H44 IgG.
[00254] Способность гетеродимеров образовывать пары предпочтительно в наборах совместной экспрессии, содержащих тяжелые и легкие цепи D3H44, с модифицированными доменами CL и/или CH1 определяли так, как описано для гетеродимеров с модификациями вариабельного домена в Примере 2, результаты показаны на Фигуре 2. Одну конструкцию тяжелой цепи D3H44 совместно экспрессировали с двумя уникальными конструкциями легкой цепи D3H44, и специфичность относительного образования пар легкой цепи (например, H1-L1:H1-L2) определяли при помощи скринингового конкурентного анализа SPR (колонка, озаглавленная «Результаты скрининга конкурентного анализа» на Фигуре 2). Избранные гетеродимерные хиты были проверены с помощью модифицированного конкурентного анализа верификации, в котором во время трансфекции соотношения ДНК L1:L2 варьировали как 40:60, 50:50 и 60:40 (колонка, озаглавленная “Результаты верификации конкурентного анализа” на Фигуре 2). Как описано в Примере 2, тяжелую цепь сохраняли в ограниченных количествах (то есть HC<L1+L2) как для скрининговых конкурентных анализов, так и для анализов верификации. Оценку предпочтительного образования пар проводили так, как описано в Примере 2.
Пример 4: Масштабирование для биофизической характеристики
[00255] Избранные гетеродимеры, как спаренные, так и ошибочно спаренные, масштабировали (как правило, до 50 мл) и очищали так, как описано далее, чтобы протестировать на термостабильность и связывание с антигенами. Гетеродимеры HD100-HD115 экспрессировали и очищали, как показано на Фигуре 3. Тяжелую и легкую цепи каждого гетеродимера экспрессировали в 50 мл культуры клеток СНО-3E7 в условиях культивирования, описанных выше. Клетки центрифугировали, и гетеродимеры очищали путем загрузки супернатанта на колонку Fractogel, загруженную никелем, как описано ниже.
[00256] Очистка на колонке Fractogel, загруженной никелем (His)
[00257] Загрузка колонки никелем: последовательно промывали 5 объемами колонки (ОК) 0,5 М NaCl (без коррекции уровня рН), а затем 4 ОК 200 мМ NiCl2 (никель) и 2 ОК 0,5 М NaCl, рН 5,0. Пример загрузки и элюирования: уравновешивали колонку 10 ОК ФСБ. Загружали образец и промывали 10 ОК промывочного буфера № 1 (50 мМ фосфата натрия, рН 7,0, 300 мМ NaCl) с последующим промыванием 10 ОК промывочного буфера № 2 (50 мМ фосфата натрия, рН 7,0, 300 мМ NaCl, 25 мМ имидазола) для удаления примесей, связанных с колонкой. Гетеродимеры элюировали фракциями промывочным буфером № 1+300 мМ имидазола. Содержание белка в каждой фракции тестировали согласно способу анализа белка по Бредфорду. Фракции, содержащие белок, объединяли. Очищенные гетеродимеры затем анализировали в отношении связывания антигена и термостабильности, как описано в Примере 5.
Пример 5: Измерения термостабильности гетеродимеров и аффинности к антигенам.
[00258] Термостабильность и аффинность к антигену избранных гетеродимерных пар измеряли для того, чтобы сравнить эти характеристики с такими же в немодифицированной паре тяжелая цепь-легкая цепь дикого типа. Правильно спаренные и ошибочно спаренные гетеродимеры из наборов совместной экспрессии индивидуально масштабировали, очищали (то есть очистка с помощью аффинности к His-метке) и оценивали в отношении термостабильности и связывания с антигеном, как описано ниже. Полученные результаты приведены на Фигуре 3.
[00259] Измерение термостабильности
[00260] Термостабильность избранных гетеродимерных пар измеряли с использованием дифференциальной сканирующей калориметрии (DSC) следующим образом.
[00261] Каждый гетеродимер очищали так, как описано в Примере 3, и разводили до 0,2 мг/мл в ФСБ, и всего 400 мкл использовали для анализа DSC на аппарате VP-Capillary DSC (GE Healthcare). В начале каждого прогона DSC проводили 5 буферных пустых впрыскиваний для стабилизации исходного уровня, и впрыскивания буфера выполняли для ссылки перед каждым впрыскиванием гетеродимера. Каждый образец сканировали при температуре от 20 до 100°C при скорости 60°C/ч с низкой обратной связью, 8 сек фильтрацией, 5 мин preTstat и давлением азота 70 фунтов на квадратный дюйм. Полученные термограммы сравнивали с эталонными и анализировали с помощью программного обеспечения Origin 7.
[00262] Кривые термального разворачивания для протестированных гетеродимеров показаны на Фигуре 4. Результаты показывают, что правильно спаренный гетеродимер (с точки зрения дизайна), как правило, является значительно более стабильным, чем предполагаемый ошибочно спаренный гетеродимер (например, HD107 по сравнению с HD108). Кроме того, многие из правильно спаренных гетеродимеров демонстрируют термостабильность, близкую к Fab дикого типа (например, HD114).
[00263] Измерение аффинности к антигену
[00264] Аффинность гетеродимерных пар к антигену (внеклеточные домены тканевого фактора) измеряли с помощью анализов поверхностного плазмонного резонанса (SPR). Все анализы поверхностного плазмонного резонанса проводили с использованием оборудования BioRad ProteOn XPR36 (Bio-Rad Laboratories (Canada) Ltd. (Mississauga, ON) с подвижным буфером ФСБТ (ФСБ Teknova Inc с 0,05% твин 20) при температуре 25°C. Очищенную поверхность тканевого фактора (TF) получали с использованием сенсорного чипа GLM, активированного разведением 1:10 стандартных растворов BioRad sNHS/ЭДК, которые впрыскивали в течение 140 сек при скорости потока 100 мкл/мин в направлении лиганда (вертикально). Сразу же после активации 25 мкг/мл раствора TF в 10 мМ NaOAc рН 4,5 впрыскивали в направлении лиганда при скорости потока 25 мкл/мин до иммобилизации около 1000 резонансных единиц (РЕ) (или достаточной для максимального ответа 100 РЕ при протекании 60 нМ FAB). Остальные активные группы гасили 140 сек впрыскиванием 1М этаноламина при скорости 100 мкл/мин в направлении аналита. Для каждой серии впрыскиваний два пустых впрыскивания буфера в горизонтальном направлении предшествовали впрыскиванию очищенного гетеродимера. Серии 3-кратного разбавления каждого гетеродимера (60 нМ, 20 нМ, 6,7 нМ, 2,2 нМ) с пустым буферным контролем одновременно впрыскивали при скорости 50 мкл/мин в течение 120 сек с 20-минутной диссоциацией, в результате чего получали набор сенсограмм связывания для каждого из гетеродимеров с эталонным показателем для буфера. Комплексы гетеродимер:TF на поверхности SPR были восстановлены посредством 18-сек импульса 0,85% фосфорной кислоты в течение 18 сек при скорости потока 100 мкл/мин для подготовки TF поверхности для следующего цикла впрыскивания. Сенсограммы выравнивали и дважды сравнивали с эталоном с использованием пустого впрыскивания буфера и промежуточных участков, и полученные сенсограммы анализировали с использованием модели связывания 1:1 в программном обеспечении ProteOn Manager software v3.0
[00265] Результаты показывают, что правильно спаренный гетеродимер (с точки зрения дизайна) демонстрирует спектр аффинностей к антигену, при этом некоторые дизайны показывают аффинность связывания антигена, подобную таковой у дикого типа (например, HD107 и HD114).
Пример 6: Профили эксклюзионной хроматографии (ЭХ) меченых гетеродимеров дикого типа D3H44 и репрезентативных образцов отдельных предпочтительно спаренных гетеродимеров
[00266] Гетеродимер D3H44 дикого типа (одна тяжелая цепь и одна легкая цепь) с С-концевой меткой ABD2-His6 на тяжелой цепи и N-концевой меткой FLAG на легкой цепи экспрессировали и очищали в соответствии со способами, известными в данной области, и аналогично тем, которые описаны в Примерах 1 и 4. Предпочтительно или правильно спаренные гетеродимеры из наборов совместной экспрессии (гетеродимеры HD100, HD105 и HD107, показанные на Фигуре 3) были масштабированы по отдельности и очищены с помощью аффинной к His-метке очистки, как описано в Примере 4 и ЭХ.
[00267] ЭХ проводили следующим образом. Образцы гетеродимера разделяли с использованием колонки Superdex 200 HR 10/30 Pharmacia (GE Healthcare), установленной на системе Pharmacia (GE Healthcare) ÄKTA Purifier. Образцы гетеродимеров (0,3-0,5 мл) в ФСБ вручную загружали в 0,5 мл петли, заполненные ФСБ. Затем образцы автоматически впрыскивали в колонку и разделяли при скорости потока 0,5 мл/мин с объемом элюирования 1 ОК. Элюирование белка наблюдали при ОП280 и собирали в 1 мл фракции.
[00268] Как показано на Фигуре 5, правильно спаренные гетеродимеры демонстрировали профили ЭХ, близкие к профилям, наблюдаемым у гетеродимера дикого типа без аминокислотных модификаций (средний пик [*]:гетеродимер). Эквивалентные результаты получают, когда легкая цепь из гетеродимера дикого типа имеет N-концевую HA-метку.
Пример 7: Дополнительные данные, относящиеся к стабильности гетеродимеров
[00269] Дизайны, продемонстрированные в Таблице 8, были выделены как комбинации драйверов дизайнов с улучшенной селективностью HC-LC.
[00270]
[00271] Нумерация остатков соответствует номенклатуре Kabat (Kabat E.A. et al., (1983) Sequence of Proteins of Immunological Interest National Institutes of Health, Bethesda).
[00272] Большинство дизайнов сохранило термостабильность (Tпл) и аффинность связывания TF, подобные термостабильности и аффинности связывания дикого типа, как показано в Таблице 9.
[00273]
[00274] Дизайн 12 содержит образование пар Н2-L2 дикого типа (см. Таблицу 8). В результате Fab Н2-L2 сохраняет аффинность связывания дикого типа. Tпл анти-TF D3H44 Fab дикого типа =~76°C (данные не показаны).
Пример 8: Дополнительные гетеродимеры и их тестирование
[00275] Были получены и протестированы дополнительные гетеродимерные пары, описанные в Таблице 10. Эти гетеродимеры были разработаны для увеличения покрытия активных участков Fab.
[00276]
[00277]*Нумерация остатков в Таблице 10 следует соглашению, которое используется для остатков в кристаллической структуре D3H44 Fab (PDB ID= 1JPT [Faelber K et al., J. Mol. Biol. (2001) 313:83-97]; www.rcsb.org/pdb/explore/explore.do?structureId=1JPT).
[00278] Стабильность, способность связываться с мишенью и способность избирательного образования пар для этих гетеродимеров были определены, как описано в Примере 5, результаты показаны в Таблице 11.
[00279]
[00280] KD анти-TF D3H44 Fab дикого типа=0,052 нМ; Tпл анти-TF Fab дикого типа =~76°C
Пример 9: Дополнительные гетеродимеры
[00281] Следующие гетеродимерные пары также были получены и протестированы в отношении их способности селективно образовывать пары.
дизайна
цепь
[00282]
[00283] Нумерация в Таблице 12 следует соглашению, которое используется для остатков в кристаллической структуре D3H44 Fab (PDB ID= 1JPT [Faelber K et al., J. Mol. Biol. (2001) 313:83-97]; www.rcsb.org/pdb/explore/explore.do?structureId=1JPT).
[00284]
[00285] Нумерация остатков в Таблице 13 следует соглашению, которое используется для остатков в кристаллической структуре D3H44 Fab (PDB ID= 1JPT [Faelber K et al., J. Mol. Biol. (2001) 313:83-97]; www.rcsb.org/pdb/explore/explore.do?structureId=1JPT).
Пример 10: Оценка предпочтительного образования пар гетеродимеров в наборах совместной экспрессии, содержащих модификации константного домена и/или вариабельного домена тяжелой и легкой цепей D3H44 в Fab формате
[00286] Были разработаны наборы совместной экспрессии в дополнение к тем, что продемонстрированы на Фигурах 1 и 2. Конструкции, кодирующие тяжелые и легкие цепи IgG в Fab формате, содержащие аминокислотные модификации в соответствии с наборами дизайна совместной экспрессии, получали так, как описано в Примере 1. Способность пар Fab тяжелой и легкой цепей D3H44 образовывать пары предпочтительно оценивали, как описано в Примерах 2 и 3. Стабильность и аффинность связывания дизайнов определяли так, как описано в Примере 5. Результаты, приведенные в Таблицах 14 и 15, являются накопительными и включают в себя результаты для дизайнов, показанных на Фигурах 1 и 2 в дополнение к новым дизайнам. Аминокислотные модификации, представленные в этих таблицах, определены со ссылкой на аминокислотной последовательности тяжелой цепи D3H44 и легкой цепи D3H44. См. Таблицы A, A1 и A2.
[00287] Следует отметить, что «дизайн» или «набор дизайнов» в данной заявке относится к набору мутаций цепей Н1, L1, H2 и L2. «Дизайн LCCA» относится к набору мутаций в H1, L1 и L2.
[00288] Каждому уникальному набору мутаций H1, L1 и L2 (формат LCCA) был назначен уникальный номер или так называемый «уникальный идентификатор». Когда данные представлены в формате H1 L1 H2 L2 (формат пар Fab или SMCA), такой набор дизайнов, следовательно, обозначенный как «уникальный набор идентификаторов», состоит из уникальных идентификаторов для двух составляющих LCCA (например, 1-2). Дизайны, имеющие черты D3H44 набора данных LCCA, были назначены в первую очередь. Дизайны, которые не присутствуют в этом наборе, но которые присутствуют в различных гомогенных или смешанных данных системы и/или в различных форматах (MCA), в дополнение обозначены как «*». В этом осуществлении присвоения уникальных идентификаторов с помощью автоматической обработки многочисленных таблиц, возникла некоторая избыточность. Случаи, когда различные аминокислоты ДТ в системах, отличных от D3H44, занимают ту же позицию, представляют собой: 309*=319*=47, 316*=101, 317*=183, 318*=182, 310*=48, 311*=102, 323*=180, 324*=179. Случаи, когда дополнительные мутации были введены для ЖХ/МС, представляют собой: 442*=326* и 443*=23.
[00289] Следует отметить, что большинство экспериментов LCCA проводились на конструкциях, не имеющих межцепочечной дисульфидной связи (связей) Fab, расположенной(ых) в константном домене (H/C233S-L/C214S).
[00290] В Таблице 14 представлены дизайны, которые демонстрируют специфичность правильного образования пар 55%:45% (H1-L1:H1-L2 и H2-L2:H2-L1) или больше. Для целей выделения конкретного успешного дизайна в отношении предпочтительного образования пар, два комплементарных набора LCCA ((H1, L1, L2 и H2, L2, L1) представлены в формате пар Fab.
[00291] Наличие меток (L:HA и FLAG и H:ABD2) не влияет на ожидаемое нейтральное образование пар ~50%:50% для D3H44 ДТ (это дополнительно подтверждается результатами образования пар реальных дизайнов, поэтому информация по меткам не включена в эту таблицу).
[00292] В таблице измеренное количество соответствующих видов Fab (H1-L1, H1-L2 и H2-L2, H2-L1) было включено в формате соотношения (H1-L1:H1-L2 и H2-L2:H2-L1). В большинстве случаев проводилось несколько экспериментальных повторов LCCA (скрининг и верификация). Также предоставляется итоговый столбец в формате нормализованного соотношения (то есть сумма до 100% Н1-L1 и L2 H1) для медианы H1-L1:H1-L2 и H2-L2:H2-L1.
[00293] Данные были сгруппированы в соответствии с данными термостабильности (Tпл) и аффинности к антигену (в сегментах таблицы обозначение TF используется для аффинности к тканевому фактору) в категории:
[00294] Tпл1 (x=>71°C); Tпл2 (71°C>x=>66°C); Tпл3 (66°C>x). Категория Tпл3 также включает случаи НВ (эксперимент не выполняли).
[00295] Для ссылки, Tпл Fab D3H44 ДТ (без дисульфидной связи) составляет ~76°C.
[00296] TF1 (х=<5X KD от медианного значения ДТ ); TF2 (5<x=<20X KD от медианного значения ДТ); и прочие категории, которые включает случаи х>20X KD от медианного значения ДТ, где случаи БС (без связывания: для KD больше, чем 500 нм, что составляет ~10000X KD медианного ДТ) были помечены отдельно. Эта последняя категория также включает случаи НВ (эксперимент не выполняли).
[00297] Для ссылки, медианное значение KD Fab D3H44 ДТ составляет 0,06 нМ (с диапазоном 0,1).
[00298] Примечание: в столбцах Таблицы, относящихся к антигенной аффинности и термостабильности, диапазон (считывание мин-макс) указывается, если количество выполненных экспериментов было больше, чем 1 (n>1).
[00299] В каждом сегменте дизайны упорядочены по убыванию специфичности образования пар H1-L1:H1-L2 с последующими H2-L2:H2-L1.
[00300] Пример категорий считывания сегментов в таблице:
[00301] Только Tпл1 (и H1-L1 и H2-L2 Tпл принадлежат к категории Tпл1)
[00302] Tпл1/Tпл2 (Tпл H1-L1 или H2-L2 принадлежит к категории Tпл1, а другая к Tпл2)
[00303] Та же логика применима и к категориям “TF”.
[00304] Дополнительный набор результатов LCCA (Таблица 15), также представленный в формате пар Fab, полученный в дополнительном цикле дизайна, включен в отдельную таблицу. Этот набор данных расположен в порядке убывания специфичности образования пар и содержит несколько ограниченных данных относительно термостабильности.
[00305] Результаты в Таблице 14 и 15 демонстрируют, что подход авторов изобретения к дизайну in silico в разнообразных наборах дизайнов и их вариациях привел к достижению предпочтительного образования пар Н1-L1 в сравнении с Н1-L2 и Н2-L2 в сравнении с Н2-L1. Эти дизайны обычно делятся на две основные категории: электростатическая (на основе драйверов специфичности, которые используют водородные связи или взаимодействия заряд-заряд) и стерическая комплементарности. Специфичность такого образования пар находится в диапазоне от умеренной до ~100% правильного образования пар для обоих дизайнов LCCA. Как видно из таблицы, некоторые из этих дизайнов не влияют на термостабильность (Tпл) или антигенсвязывающую аффинность, тогда как некоторые демонстрируют различные степени влияния на эти два качества. Кроме того, успешные дизайны присутствовали как в константном, так и в вариабельном домене, а также в формате дизайна комбинации доменов.
Пример 11: Оценка предпочтительного образования пар гетеродимеров в наборах совместной экспрессии, содержащих модификации константного домена и/или вариабельного домена тяжелой и легкой цепей смешанного Ab или чистого Ab в Fab формате
[00306] Некоторые дизайны, описанные в предыдущих примерах, были протестированы в системе, в которой гетеродимерные пары были получены из различных Ab (перенос к D3H44) или двух различных антител, чтобы оценить, насколько дизайн набора совместной экспрессии приводит к предпочтительному образованию пар в этих типах систем. Был протестирован ряд различных систем. В одном примере одна гетеродимерная пара в формате Fab была получена из тяжелых и легких цепей D3H44, а вторая гетеродимерная пара в формате Fab была получена из тяжелых и легких цепей пертузумаба. В другом примере одна гетеродимерная пара в формате Fab была получена из тяжелых и легких цепей D3H44, а вторая гетеродимерная пара в формате Fab была получена из тяжелых и легких цепей трастузумаба.
[00307] Конструкции в формате Fab, кодирующие тяжелые и легкие цепи IgG D3H44, пертузумаба и трастузумаба, содержащие аминокислотные модификации в соответствии с набором дизайна совместной экспрессии, получали так, как описано в Примере 1. Основная ДНК последовательность тяжелой цепи пертузумаба, основная ДНК последовательность легкой цепи пертузумаба, основная ДНК последовательность тяжелой цепи трастузумаба и основная ДНК последовательность легкой цепи трастузумаба приведены в Таблицах А, А1 и А2. Аминокислотные модификации были введены в эти последовательности с помощью сайт-направленного мутагенеза или были синтезированы ДНК-последовательности, включающие аминокислотные модификации из основных последовательностей, как описано в Примере 1.
[00308] Способность гетеродимерных дизайнов преимущественно образовывать пары оценивали так, как описано в Примерах 2 и 3, за исключением того, что, когда были протестированы смешанные системы, использованные не облигатные цепи принадлежали разным Fab.
[00309] Результаты показаны в Таблице 16. Аминокислотные модификации, показанные в Таблице 16, идентифицированы со ссылкой на аминокислотную последовательность тяжелой цепи D3H44 и легкой цепи D3H44; тяжелой цепи пертузумаба и легкой цепи пертузумаба; тяжелой цепи трастузумаба и легкой цепи трастузумаба. См. Таблицы A, A1 и A2.
[00310] Репрезентативное и разнообразное подмножество дизайнов, которые демонстрируют успешное предпочтительное образование пар в системе D3H44, были протестированы в различных системах (трастузумаб (TRAS) и пертузумаб (PERT)), а также в смешанных системах (D3H44/TRAS, D3H44/PERT и TRAS/PERT) (как и с конструкцией D3H44 LCCA без дисульфида Fab).
[00311] Данные представлены для двух LCCA (Таблица 16) и форматов образования пар Fab (Таблица 17). Данные LCCA отражают минимальную «единицу конкуренции» (то есть H1-L1:H1-L2) и оптимальный формат для интерпретации того, может ли дизайн LCCA быть успешно перенесен на Fab. Анализ в формате пары Fab, включая вторую пару Fab (то есть H2-L2:H2-L1), дополнительно иллюстрируется степенью трансляции на целый дизайн (то есть Н1-L1 и Н2-L2) и его эффективностью в этих различных Fab системах. Помимо соотношения Н1-L1:H1-L2, авторы изобретения представляют относительную склонность к правильному образованию пар по отношению к неправильному образованию пар как скаляр, где скаляр = ln(H1-L1:H1-L2).
[00312] В некоторых смешанных системах наблюдалась присущая предпочтительность перекрестного образования пар в системе (например, H_D3H44 предпочтительно образует пары с L_PERT, а не с L_D3H44) (Таблица 17). В таком же примере, предпочтительное образование пар H_D3H44 с L_PERT было также поддержано измерениями термостабильности (Tпл), которые показали, что виды H_D3H44-L_PERT были более стабильными, чем H_D3H44-L_D3H44. Таким образом, наряду с регистрацией фактических измеренных количеств видов, нормированные данные поведения в соответствующей системе ДТ LCCA (СРВН.) представлены в виде ΔСкаляр (ВАР-СРВН._ДТ), где ΔСкаляр = ln (H1-L1:H1-L2/H2-L2:H2-L1). Этот показатель является индикатором реальной эффективности дизайна LCCA. Данные, содержащиеся в таблицах, включают в себя дизайны, которые дали эквивалент специфичности образования пар 55%:45% и более (то есть ΔСкаляр (ВАР-СРВН._ДТ)>0,2).
[00313] В отличие от системы D3H44, на соотношения определенных видов иногда влияла метка легкой цепи только в системах ДТ PERT и ДТ TRAS (в меньшей степени) (Таблица 18). Это, как кажется, происходило из-за случайных событий расщепления метки HA (доступны доказательства ЖХ/МС, имевшиеся на момент тестирования систем в формате Mab), а не из-за влияния меток на образование пар. Следовательно, метки были приняты во внимание при представлении результатов в соответствующих таблицах.
[00314] Краткое изложение результатов, как в формате LCCA, так и Fab образования пар, между различными системами представлены в Таблицах 19 и 20. Результаты показывают возможность переноса дизайна между различными протестированными системами Fab. Эти результаты не обязательно отражают, что некоторые из дизайнов являются лучшими по сравнению с другими; они не отражают более полную оценку переноса. Успешные дизайны LCCA (например, средний ΔСкаляр (ВАР-СРВН._ДТ)>0,2) в двух системах и более представлены в Таблице 19 и составляют около 30% протестированных дизайнов LCCA в этих различных системах. Это свидетельствует о возможности переноса, зависящей от конкретной системы и дизайна. Таким образом, наличие коллекции уникальных дизайнов позволяет создание биспецифических пар для ряда систем и подчеркивает полезность библиотеки набора дизайнов, которые могут быть оценены в контексте какого-либо антитела (или пары антител), представляющих интерес. Это пример показывает, что наборы мутаций/дизайнов могут быть использованы для достижения предпочтительного образования пар гетеродимеров в наборах совместной экспрессии, содержащих модификации константного домена и/или вариабельного домена в тяжелой и легкой цепи смешанного Ab или чистого Ab в формате Fab.
Пример 12: Оценка предпочтительного образования пар гетеродимеров в наборах совместной экспрессии, содержащих модификации константного домена и/или вариабельного домена тяжелой и легкой цепей D3H44 в формате полноразмерной тяжелой цепи (Mab)
[00315] Наборы дизайнов совместной экспрессии гетеродимеров оценивали, чтобы определить, возможно ли их предпочтительное образование пар также в таком формате (формат Mab), при котором тяжелая цепь является полноразмерной тяжелой цепью, а не Fab фрагментом.
[00316] Получение конструкций:
[00317] Конструкции, кодирующие тяжелые и легкие цепи IgG D3H44, содержащие аминокислотные модификации в соответствии с набором дизайна совместной экспрессии, получали следующим образом. Конструкции Fab легкой цепи D3H44 были получены так, как описано в Примере 1. Последовательности тяжелой цепи D3H44 были получены так, как описано в Примере 1, за исключением полноразмерной тяжелой цепи D3H44, которая была создана путем добавления ДНК-последовательности IgG1*01, кодирующей шарнир-CH2-CH3-домены, на C-конце Fab тяжелой цепи D3H44. Следует отметить, что канонический C-концевой остаток лизина тяжелой цепи удаляли в целях предотвращения сигнала гетерогенности в ЖХ-МС в связи с отсечением C-концевого лизина ((Lawrence W. Dick Jr. et al., Biotechnol. Bioeng. (2008) 100:1132-43).
[00318] Формат анализа Mab
[00319] Способность тяжелых и легких цепей D3H44 к предпочтительному образованию пар оценивали следующим образом: одну конструкцию полноразмерной тяжелой цепи D3H44 экспрессировали совместно с двумя уникальными конструкциями легкой цепи D3H44, с получением трех возможных видов антител: H1-L1:H1-L1, H1-L2:H1-L2 и H1-L1:H1-L2 (см. Фигуру 10). Относительную специфичность образования пар легкой цепи с точки зрения количества преимущественных видов Н1-L1:H1-L1 по сравнению с другими типами определяли с помощью ЖХ-МС после очистки с использованием белка А (pA). Там, где это было возможно, цепи оставляли без меток, предоставляя три возможных вида Mab, полученных в результате совместной трансфекции трех цепей, отличавшихся друг от друга по меньшей мере на 50 Да. Когда разница масс исключала эту возможность, по меньшей мере одна из легких цепей была сконструирована с N-концевым слиянием метки HA или FLAG, чтобы обеспечить достаточную дифференциацию массы между видами. Как описано в Примере 2, тяжелая цепь присутствовала в ограниченных количествах (то есть HC<L1+L2).
[00320] Способ трансфекции для Mab формата анализа
[00321] Наборы совместной экспрессии, содержащие конструкции из одной тяжелой цепи и двух легких цепей, полученные так, как описано в Примере 12, трансфицировали в клетки CHO-3E7 следующим образом. Клетки CHO-3E7 культивировали с плотностью 1,7-2×106 клеток /мл при температуре 37°C в среде FreeStyleTM F17 (Invitrogen, номер по каталогу A-1383501) с добавлением 4 мМ глутамина и 0,1% плюроника F-68 (Invitrogen, номер по каталогу 24040-032). Общий объем 50 мл трансфицировали общим количеством 50 мкг ДНК с использованием PEI-pro (полиэтиленимин, Polyplus, номер по каталогу 115-010) в соотношении ДНК:PEI 1:2,5. Через двадцать четыре часа после добавления смеси ДНК-PEI, эти клетки переносили в условия 32°C. На 7-ой день супернатанты тестировали в отношении экспрессии посредством анализа ДСН-ПААГ в невосстанавливающих условиях с последующим окрашиванием голубым Кумасси, чтобы визуализировать полосы. Использованные соотношения HC: L1:L2 составляли 1:1:1.
[00322] Способ масс-спектрометрии для анализа в Mab формате
[00323] Степень предпочтительного образования пар легкой цепи D3H44 с тяжелой цепью D3H44 в наборах совместной экспрессии оценивали с помощью масс-спектрометрии после очищения с использованием белка А и дегликозилирования. Очищенные образцы дегликозилировали с помощью PNGазы F следующим образом: 0,2 Ед PNGазыF/мкг антитела в 50 мМ Трис-HCl рН 8,0 в течение ночи инкубировали при 37°C, конечная концентрация белка составляла 0,45 мг/мл. Белковые образцы анализировали с помощью ЖХ-МС с использованием системы для ВЭЖХ Agilent 1100, соединенной с гибридным масс-спектрометром LTQ-Orbitrap XL (ThermoFisher Scientific) через интерфейс электрораспыления с высокой скоростью потока. Образцы (2,5 мкг) впрыскивали на колонку Poros R2 2,1×10 мм (Applied Biosystems) и элюировали с использованием следующих условий градиента: 0–3 мин: 20% растворитель B; 3–6 мин: 20-90% растворитель B. Растворитель A представлял собой 0,1% водный раствор муравьиной кислоты, а растворитель B представлял собой 65% АЦН, 25% ТГФ, 9,9% ddH2O, 0,1% муравьиной кислоты. Скорость потока составляла 1 мл/мин. Поток был разделен после колонки, чтобы направить 100 мкл/мин на электрораспылительный интерфейс. Колонку и растворитель нагревали до 80°C для улучшения формы белкового пика. Прибор LTQ-Orbitrap XL калибровали с использованием калибровочного раствора ThermoFisher Scientific’s LTQ Positive Ion ESI (кофеин, MRFA и Ultramark 1621) и настраивали с использованием 10 мг/мл раствора CsI. Конус напряжения (источник установки фрагментации) составил 40 В, разрешение FT составляло 7500, и диапазон сканирования составлял m/z 400-4000.
[00324] Белковые спектры подвергали деконволюции с использованием модуля MaxEnt управления прибором и анализа данных алгоритма MassLynx (Waters). Коротко, данные ЖХ-МС неочищенного белка впервые были открыты в модуле просмотра спектра QualBrower аппарата Xcalibur (Thermo Scientific) и преобразованы для совместимости с MassLynx с помощью программы преобразования файлов DataBridge, предоставленной компанией Waters. Преобразованные белковые спектры были просмотрены в модуле Spectrum MassLynx и подвергнуты деконволюции с использованием MaxEnt. Содержание различных видов антител в каждом образце определяли непосредственно из полученных профилей молекулярной массы.
[00325] Результаты показаны в Таблице 21. Аминокислотные модификации, показанные в Таблице 21, идентифицированы со ссылкой на аминокислотную последовательность тяжелой цепи D3H44 и легкой цепи D3H44. См. Таблицы A, A1 и A2.
[00326] Подмножество дизайнов, которые демонстрируют успешное предпочтительное образование пар в системе D3H44, которое также является репрезентативными для различных наборов дизайнов, были выбраны для оценки формата переносимости, то есть от LCCA с Fab структурами на конкурентный анализ Mab (MCA) на основе структур Mab.
[00327] Как показано в Таблице 21, D3H44 ДТ, используемый в конкурентном анализе Mab, демонстрировал отклонение от ожидаемого теоретического распределения видов 50% H1-L1_H1-L2 и 25% каждой из H1-L1_H1-L1 и H1-L2_H1-L2, при этом легкие цепи отличались наличием или отсутствием метки (HA или FLAG). Это отклонение, вероятно, является результатом зависимых от меток уровней экспрессии, а не зависимого от меток образования пар (например, на основе экспериментов, выполненных для разных соотношений ДТ H1:L1:L2, а также на основе косвенного наблюдения поведения дизайнов). Медианные значения для всех измеренных видов в экспериментальных повторах и/или вариантах, отличающихся идентификационной меткой, были также включены.
[00328] Пример ЖХ/МС спектров двух успешных вариантов анализа Mab (Фигура 11), которые содержат данный дизайн, представлен на Фигуре 12. В случае этих вариантов большинство измеренных видов соответствовало желаемым видам H1-L1_H1-L1. Профили экспрессии СПЖХ-ЭХ (показаны только для видов H2-L2_H2-L2 (на фигуре обозначены как Н2-L2)) и DSC-термограммы, представленные на Фигуре 13, являются типичными для характеристики вариантов, выполненных для определенных хитов. В данном конкретном случае это продемонстрировано хорошо экспрессированными, гомогенными видами с относительно незначительным влиянием на стабильность Fab.
[00329] Результаты в Таблице 21 демонстрируют, что возможность переноса на формат Mab была достигнута с заметным успехом среди дизайнов LCCA. 11 из 12 протестированных дизайнов LCCA продемонстрировали равное или большее количество правильно спаренных видов, чем теоретически рассчитанные 25%. Эти данные показывают, что формат LCCA, который использовали в качестве первоначального скрининга библиотеки дизайнов, подходит для оценки и/или прогнозирования успеха дизайна в формате Mab.
Пример 13: Оценка предпочтительного образования пар гетеродимеров в наборах совместной экспрессии, содержащих модификации константного домена и/или вариабельного домена в формате биспецифического антитела
[00330] Наборы дизайнов совместной экспрессии гетеродимеров оценивали, чтобы определить, возможно ли их предпочтительное образование пар в формате биспецифических Mab антител. В этом примере область Fc полноразмерной тяжелой цепи каждого гетеродимера была асимметрично модифицирована с целью стимулирования гетеродимеризации уникальных тяжелых цепей по сравнению с гомодимеризацией.
[00331] Получение конструкций:
[00332] Наборы дизайнов совместной экспрессии гетеродимеров тестировали в контексте следующих биспецифических антител: a) D3H44/пертузумаб, b) D3H44/трастузумаб, c) D3H44/рамуцирумаб и d) трастузумаб/рамуцирумаб. Тяжелые и легкие цепи D3H44, пертузумаба и трастузумаба, содержащие аминокислотные модификации в константном и/или вариабельном доменах, получали так, как описано в Примере 12, за исключением того, что мутации, комплементарные гетеродимеризации Fc, были введены в каждую из двух тяжелых цепей набора дизайнов совместной экспрессии. Тяжелые и легкие цепи рамуцирумаба получали на основе основной ДНК последовательности для тяжелой цепи и легкой цепи рамуцирумаба. См. Таблицу А. Последовательности СН3 тяжелых цепей включали следующие аминокислотные модификации:
[00333] a) D3H44/пертузумаб: цепь A: T371V_T389L_K420L_T422W, цепь B: T371V_L372Y_F436A_Y438V
[00334] b) D3H44/трастузумаб: цепь A: T371V_T389L_K420L_T422W, цепь B: T371V_L372Y_F436A_Y438V
[00335] c) D3H44/рамуцирумаб: цепь A: T371V_T389L_K420L_T422W, цепь B: T371V_L372Y_F436A_Y438V
[00336] d) трастузумаб/рамуцирумаб: цепь A: T371V_T389L_K420L_T422W, цепь B: T371V_L372Y_F436A_Y438V
[00337] Формат анализа (SMCA)
[00338] Способность наборов дизайнов совместной экспрессии гетеродимеров преимущественно образовывать пары, чтобы сформировать биспецифическое антитело, оценивали так, как описано ниже. Анализ основан на совместной экспрессии четырех цепей (две из Ab1 и две из Àb2) и детекции наличия правильно сформированного биспецифического антитела с помощью масс-спектрометрии (ЖХ-МС). Анализ проводили следующим образом. Фигура 14 представляет собой схему, изображающую четыре исходных полипептидных цепи и потенциальные продукты, полученные от совместной экспрессии этих исходных полипептидных цепей при отсутствии предпочтительного образования пар между тяжелыми и легкими цепями этих гетеродимерных пар. Две конструкции полноразмерной тяжелой цепи совместно экспрессировались с двумя уникальными конструкциями легкой цепи, что давало десять возможных видов антител: H1-L1:H1-L1, H1-L2:H1-L2, H1-L1:H1-L2, H2-L1:H2-L1, H2-L2:H2-L2, H2-L1:H2-L2, H1-L1:H2-L1, H1-L2:H2-L2, H1-L2:H2-L1 и H1-L1:H2-L2. Последний вид представляет собой правильно спаренный гетеродимер (см. Фигуру ниже). Относительную специфичность образования пар с точки зрения количества преимущественных видов H1-L1:H2-L2 по сравнению с другими определяли с помощью ЖХ-МС после очистки с использованием pA. Там, где это было возможно, цепи оставляли без меток, предоставляя все виды Mab и половинных Ab, отличавшихся друг от друга по меньшей мере на 50 Да. Когда разница масс исключала эту возможность, по меньшей мере одна из легких цепей была сконструирована с N-концевым слиянием метки HA, чтобы обеспечить достаточную дифференциацию массы между видами. Авторы ссылаются на этот анализ с вовлечением стадий экспрессии и скрининга биспецифического антитела, как на анализ SMCA.
[00339] Способ трансфекции
[00340] Наборы совместной экспрессии, содержащие конструкции из двух тяжелых цепей и двух легких цепей, полученные так, как описано в Примере 1, трансфицировали в клетки CHO-3E7 следующим образом. Клетки CHO-3E7 культивировали с плотностью 1,7-2×106 клеток /мл при температуре 37°C в среде FreeStyle™ F17 (Invitrogen, номер по каталогу A-1383501) с добавлением 4 мМ глутамина и 0,1% плюроника F-68 (Invitrogen, номер по каталогу 24040-032). Общий объем 20 мл трансфицировали общим количеством 20 мкг ДНК с использованием PEI-pro (полиэтиленимин, Polyplus, номер по каталогу 115-010) в соотношении ДНК:PEI 1:2,5. Через двадцать четыре часа после добавления смеси ДНК-PEI, эти клетки переносили в условия 32°C. На 7-ой день супернатанты тестировали в отношении экспрессии посредством анализа ДСН-ПААГ в невосстанавливающих условиях с последующим окрашиванием голубым Кумасси, чтобы визуализировать полосы. Использованные соотношения H1:H2: L1:L2 вначале были нейтральными (15:15:35:35), чтобы оценить эффективность экспрессии. Набор соотношений ДНК H1:H2:L1:L2 был затем протестирован в экспрессиях СНО для оценки того, какое условие (условия) продуцирует смесь, отражающую теоретическое распределение различных видов, когда все цепи являются цепями дикого типа. Эти соотношения компенсируют естественные различия в уровнях экспрессии и/или внутренней склонности к образованию пар между тяжелыми и легкими цепями двух различных антител.
[00341] Биосенсорные анализы SPR
[00342] ЭДК: 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид; sNHS: N-гидроксисульфосукцинимид; SPR: поверхностный плазмонный резонанс; ЭДТК: этилендиаминтетрауксусная кислота; ГЭПЭС: 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота; TF: тканевой фактор.
[00343] Расходные материалы для анализа SPR. Сенсорный чип GLC, набор реактивов аминного связывания Biorad ProteOn (ЭДК, sNHS и этаноламин) и 10 мM буферов ацетата натрия приобретали в компании Bio-Rad Laboratories (Canada) Ltd. (Mississauga, ON). Рекомбинантный белок Her-2 был приобретен в компании eBioscience (San Diego, CA). ФСБ подвижный буфер с 0,05% Твин 20 (ФСБТ) приобретали в компании Teknoca Inc. (Hollister, CA). Козье поликлональное антитело против человеческого Fc приобретали в компании Jackson Immuno Research Laboratories Inc. (West Grove, PA).
[00344] Все анализы поверхностного плазмонного резонанса выполняли с использованием аппарата BioRad ProteOn XPR36 (Bio-Rad Laboratories (Canada) Ltd. (Mississauga, ON) с подвижным буфером ФСБТ при температуре 25°C. Поверхность захвата античеловеческого Fc была создан с использованием сенсорного чипа GLC, активированного разведением 1:5 стандартных растворов BioRad sNHS/ЭДК, впрыскиваемых в течение 140 сек при скорости 100 мкл/мин в направлении аналита (по горизонтали). Сразу же после активации 10 мкг/мл раствора антитела к Fc антитела человека в 10 мМ NaOAc рН 4,5 впрыскивали в аналит в направлении лиганда (вертикальном), при скорости потока 25 мкл/мин пока не были иммобилизованы приблизительно 3000 резонансных единиц (РЕ). Остальные активные группы гасили 140 сек впрыскиванием 1М этаноламина со скоростью 100 мкл/мин в направлении аналита, что также обеспечивает промежуточные участки с имитацией активации для пустых ссылок. Скрининг связывания вариантов антител с антигенами-мишенями Her2 или TF происходил в две стадии: непрямой захват вариантов антитела на поверхность захвата античеловеческого Fc антитела в направлении лиганда с последующим впрыскиванием 5 концентраций очищенного антигена и одного пустого буфера для двойного сравнивания с эталоном в направлении аналита. Вначале использовали одно впрыскивание буфера в течение 30 сек со скоростью 100 мкл/мин в направлении лиганда для стабилизации исходного уровня. Для каждого захвата варианта антитела, неочищенные варианты в клеточной культуральной среде разводили в ФСБТ до 4%. От одного до пяти вариантов или контролей одновременно впрыскивали в каналы отдельных лигандов в течение 240 сек при потоке 25 мкл/мин. Это привело к захвату от около 400 до 600 РЕ на поверхность античеловеческого Fc. Первый канал лиганда оставляли пустым, чтобы использовать при необходимости в качестве пустого контроля. За этой стадией захвата немедленно следовали два впрыскивания буфера в направлении аналита, чтобы стабилизировать исходный уровень, а затем одновременно впрыскивали 60 нМ, 20 нМ, 6,7 нМ, 2,2 нМ и 0,74 нМ антигена (TF или Her2) вместе с пустым буфером скоростью потока 50 мкл/мин в течение 120 сек с фазой диссоциации 300 сек. Поверхности захваченных антител были восстановлены посредством 18-сек импульса 0,85% фосфорной кислоты в течение 18 сек при скорости потока 100 мкл/мин для подготовки следующего цикла впрыскивания. Сенсограммы выравнивали и дважды сравнивали с эталоном с использованием пустого впрыскивания буфера, и полученные сенсограммы анализировали с использованием программного обеспечения ProteOn Manager software v3.1. Сенсограммы с двойной ссылкой были подогнаны к модели связывания 1:1. Значения Rmax для каждого антигена были нормированы к уровням захвата антитела для каждого варианта и их сравнивали с 100% контролями.
[00345] Стабильность биспецифических антител тестировали так, как описано в Примере 5. Анализ ЖХМС биспецифических антител проводили с использованием способа, описанного в Примере 12.
[00346] Ряд выбранных D3H44 дизайнов LCCA были протестированы в формате SMCA. Более того, некоторые дизайны непосредственно оценивали только в формате SMCA. Большинство дизайнов тестировали в системе D3H44/пертузумаб. Подмножество дизайнов, которые были выбраны в этой системе (с вовлечением различных дизайнов), дополнительно протестировали в трех дополнительных системах биспецифических Mab: системах D3H44/трастузумаб, D3H44/рамуцирумаб (RAMU) и трастузумаб/рамуцирумаб.
[00347] Присущее кросс-системное предпочтение легкой/тяжелой цепи, наблюдаемое в LCCA экспериментах для D3H44/пертузумаба и D3H44/трастузумаба (Пример 11), было воспроизводимым также в формате полного антитела. Кроме того, подобное поведение, хотя и с разными тенденциями кросс-системного образования пар, также наблюдалось для двух других систем (Таблица 22).
[00348] Желаемые биспецифические виды, H1-L1_H2-L2, в целом нельзя отличить экспериментально на основе ЖХ/МС от ошибочно спаренного типа: H1-L2_H2-L1. Таким образом, когда в таблицах представлено биспецифическое содержание, нельзя полностью исключить, что оно не содержит этот тип ошибочно спаренных видов. Тем не менее, наблюдаемое очень низкое содержание таких видов, как H1-L2_H1-L2 и H2-L1_H2-L1, а также половинных антител H1-L2 и H2-L1, свидетельствует, что происходит только незначительное загрязнение биспецифических видов, если оно вообще присутствует. Все другие виды, которые присутствуют в конкретном образце, измеренном с помощью ЖХ/МС, включены в таблицу. В большинстве случаев пики МС сопровождались побочными пиками; однако они были аннотированы только для биспецифических видов. При нормализации интенсивности МС пиков, эти аддуктивные виды не были приняты во внимание. Цифры, представленные для побочного пика(ов) в таблицах, были получены посредством сравнения интенсивности с интенсивностью основного биспецифического пика. Некоторые предварительные анализы свидетельствуют о том, что побочный пик коррелирует с наличием меток легкой цепи, связанных с формированием аддуктов или гетерогенности в расщеплении лидерных пептидов, и, вполне вероятно, являются представительными для видов основного пика.
[00349] Наконец, все спаренные виды были суммированы, в дополнение к ошибочно спаренным видам, чтобы получить соотношения, представленные в колонке «спаренные:ошибочно спаренные». Это соотношение было в дальнейшем использовано для расчета ΔСкаляр (ВАР-СРВН._ДТ), следуя математическому подходу, описанному в Примере 11, чтобы продемонстрировать силу конкретного дизайна. В системе дизайны были упорядочены в порядке убывания метрического значения Скаляра.
[00350] Из-за естественных предпочтений кросс-системы к образованию пар легких и тяжелых цепей, описанных в Примере 12, соотношения ДНК H1:L1:H2:L2 требуют изменения (например, чрезмерная экспрессии H1 (D3H44) в сравнении с H2 (PERT)) с получением наивысшего содержания желаемых биспецифических видов (H1-L1_H2-L2). Оптимальные соотношения могут также в некоторой степени меняться с получением в результате конкретного дизайна. Соотношения ДНК в основном влияют на реальное соотношение биспецифических видов:видов спаренных половинных антител (как правило, одного типа: H1-L1 или Н2-L2). Пример включен в Таблицу 23, где титрование ДНК с этим соотношением изменяется, но общее соотношение спаренных:ошибочно спаренных видов было относительно постоянным.
[00351] В случае системы D3H44/пертузумаб для большинства дизайнов проводили ограниченный набор титрований ДНК. Данные для соотношений, которые привели к наивысшему содержанию спаренных:ошибочно спаренных видов, приведены в Таблицах 22 и 24. В остальных трех системах трансфекции проводили только в одном соотношении, приведенном в таблицах. Если при приведенном соотношении эксперимент повторяли, то в таблицу включали среднее значение. Информация относительно идентификационной метки не была включена, поскольку для ДТ влияние метки не наблюдалось (Таблица 26). Представленная для сравнения эталонная ДТ была выбрана в качестве такой, чтобы представлять наиболее распространенное соотношение ДНК среди представленных данных дизайнов.
[00352] Анализ ЖХ/МС проводили на образцах, которые хранились при pH 4, а также при рН 7. Эксперименты с образцами, хранившимися при pH 7, были протестированы в случае систем D3H44/трастузумаба, D3H44/рамуцирумаба (RAMU) и трастузумаба/рамуцирумаба. Поэтому данные представлены в двух таблицах (Таблица 22 (pH 4) и 24 (pH 7)). Между двумя экспериментами наблюдалась удовлетворительная корреляция для соотношений спаренных:ошибочно спаренных видов, указывая на то, что уровни рН, вероятно, не играют существенную роль в эксперименте ЖХ/МС, то есть в характеристике типа присутствующих видов.
[00353] На Фигуре 15 представлены результаты анализа ЖХ/МС биспецифической конструкции нацеливания TF и Her2 на основе дизайнов, представленных на Фигуре 11 и Фигуре 12, в формате MCA. Наблюдалось около 92% предпочтительных биспецифических антител с правильным образованием пар облигатных тяжелых и легких цепей. На Фигуре 16 представлен профиль экспрессии белкового продукта в надосадочной жидкости и последующей очистки с использованием белка А в ДСН-ПААГ, а также ЭХ профиль соединения, очищенного с использованием белка А. На Фигуре 17 представлены характеристики целевого биспецифического связывания биспецифической молекулы сначала с двумя мишенями (TF и Her2 независимо), а затем в сэндвич-режиме (система перекрестных связей).
[00354] В некоторых случаях мутации в H/S115 и H/S156, показанные в ограниченном наборе вариантов, не были частью фактического дизайна, а скорее были добавлены по практическим соображениям, чтобы получить необходимую разницу масс для целей эксперимента ЖХ/МС. Эти аминокислоты расположены на поверхности константного домена, достаточно далеко от фактического набора дизайнов мутаций и, как ожидается, не будут оказывать влияние на поведение антител.
[00355] Термостабильность и аффинность к антигену оценивали для ряда дизайнов в системе D3H4/пертузумаб, результаты представлены в Таблице 25. Значения Tпл (указаны курсивом) были аннотированы вручную. Гомодимерные Mab контроли (ДТ) продемонстрировали следующий диапазон стабильности теплового плавления (Tпл) для продукта, экспрессированного в повторах трансфекции (при рН 7): PERT (72,03-77,72) и для D3H44 (77,97-78,88). Более широкий диапазон, который наблюдался для пертузумаба, возникал, скорее всего, из-за его собственных свойств. Измерения аффинности выполняли только после pA очистки. Наблюдаемый диапазон KD для гомодимерных Mab является таким: TF: 0,04–0,076 нМ, HER2: 1,84–6,3 нМ. В большинстве случаев можно было бы ожидать два перехода плавления благодаря вышеуказанным разным диапазонам для двух Fab. В тех случаях, когда представлено только одно значение для Tпл, оно потенциально возникает по одной из двух причин: изменение стабильности пертузумаба и/или дестабилизация дизайна Fab D3H44, которые могут совпадать с Fab пертузумаба. Результаты показывают, что выбор вариантов SMCA находится в диапазоне от тех, которые минимально влияют на термостабильность и на связывание с антигеном до тех, которые влияют в той или иной степени.
[00356] Некоторые дизайны были протестированы с обеими возможными расположениями Fc-мутаций. Они могут быть идентифицированы по наличию того же уникального идентификатора и обозначаются *D3H44 (или в Таблице 25 с предшествующим номером уникального набора идентификаторов). Как видно из Таблицы 22, расположение Fc-мутаций, кажется, не влияют на результат спаренных:ошибочно спаренных видов с ограниченными исключениями.
[00357] Результаты SMCA показывают, что значительное число дизайнов, представляющих разнообразные наборы, может преодолеть тенденцию естественного образования пар между видами в формате Mab. Среди них около четверти протестированных дизайнов попадают в категорию высокого соотношения спаренных:ошибочно спаренных (>=80:20) (цифры приведены для более тщательно протестированных систем, D3H44/пертузумаб). Сравнение эффективности дизайна в различных системах показывает разную степень возможности переноса. Кроме того, примерно 60% дизайнов, перечисленных в Таблице 27, транспортируемых из D3H44 LCCA в формат SMCA, приводит к высокой степени предпочтительного образования пар (>75%:25%) по меньшей мере в одной из четырех протестированных систем SMCA.
[00358] Для дизайнов, протестированных в других системах, отличных от D3H44/пертузумаб, размещение дизайна также инвертировали по отношению к связывающим доменам, например, дизайны H1-L1 на связывающем домене D3H44, дизайны H2-L2 на TRAS, а также дизайны H1-L1 на TRAS и дизайны H2-L2 на D3H44. Полученные результаты показывают, что на эффективность дизайнов в большинстве случаев может повлиять такое перевернутое размещение.
[00359] Результаты, описанные выше, показывают, что на возможность переноса дизайна может влиять комбинация антигенсвязывающих доменов в сочетании с управляющим потенциалом компонентов дизайна (например, управление H1L1L2 может быть лучше, чем H2L2L1). Результаты показывают, что большое количество основного ядра дизайнов работает в диапазоне пар Mab с образованием биспецифических Ab с более чем 75% селективного образования пар.
Пример 14: Молекулярное моделирование и компьютерное конструирование интерфейса Fab
[00360] Авторы изобретения использовали подход на основе структурного и компьютерного молекулярного моделирования для получения библиотеки дизайнов мутаций тяжелых и легких цепей, которые могут быть подвергнуты скринингу в контексте других антител или их фрагментов для идентификации мутаций, которые обладают требуемой специфичностью в антителах, представляющих интерес. Стратегия конструирования дизайна для предпочтительного образования пар HC-LC включает, в первую очередь, идентификацию репрезентативного Ab (то есть D3H44), с которым будут работать. Ключевые критерии для этого Ab показаны в Таблице 28.
[00361]
Имеет наиболее используемые подгруппы VH и VL
Каркас близок к зародышевой линии
Междоменный угол упаковки VH:VL близок к наблюдаемому в среднем для Fab
Нет серьезных структурных изменений, наблюдаемых при связывании антигена
[00362] Как указано в Таблице 28, основным критерием, представленным этим антителом, было то, что оно представляло собой человеческое/гуманизированное Ab с используемыми обычно подгруппами VH и VL и минимальными мутациями каркасной области. Кроме того, соображения по структуре были такими: междоменный угол VH:VL должен быть близок к среднему, наблюдаемому для Ab. После выбора Fab проводили анализ интерфейса Fab in silico с целью идентификации и понимания важных остатков. Использовали двусторонний подход. Во-первых, общий анализ сохранения последовательностей в вариабельных и константных интерфейсах Fab был проведен с помощью выравниваний последовательности и структуры общедоступных Ab. Выравнивание последовательностей константного и вариабельного домена из различных подгрупп антител представлено на Фигуре 6. Параллельно была проанализирована кристаллическая структура интерфейса D3H44 с помощью ряда инструментов молекулярного моделирования, перечисленных на Фигуре 18 (например, ResidueContactsTM). Эти анализы привели к идентификации списка активных участков для конструирования предпочтительного образования пар HC-LC. Позиции активных участков, определенные в этом анализе, приведены в Таблице 29.
[00363] Таблица 29: Активные аминокислотные позиции на интерфейсе тяжелой (H) и легкой (L) цепи в типичном Fab, полученном из человеческих VH и VL цепей каппа. Эти позиции и аминокислоты также в основном сохраняются в лямбда цепях VL. Это в основном каркасные остатки за исключением нескольких, расположенных в петлях CDR3. Аминокислоты последовательностей родительского D3H44 с нумерацией по Kabat представлены в Таблицах A1-A2.
[00364] Далее потенциальные мутации и дизайны позиций активных участков, а также соседних с активными участками позиций, представляющих интерес в 3D структуре кристалла, были смоделированы и определены с помощью in silico мутагенеза и упаковки/моделирования с использованием ZymepackTM, и оценены в баллах на основе ряда факторов, включая стерическую и электростатическую комплементарность. Фигура 11 представляет ограниченное число позиций активных участков на интерфейсе тяжелой и легкой цепи в вариабельных доменах, и показывает, как в эти позиции интерфейса могут быть введены мутации для облегчения селективного образования пар облигатных цепей и уменьшения неблагоприятного образования неправильного образования пар цепей. Стерическая комплементарность была смоделирована, а также рассчитана на основе энергетических факторов, таких как упаковка согласно Ван-дер-Ваальсу, кавитационные эффекты и тесный контакт гидрофобных групп. Подобным образом энергии электростатического взаимодействия были смоделированы и оценены на основе кулоновских взаимодействий между зарядами, водородных связей и эффектов десольватации. Обе предпочтительные модели пар тяжелых и легких цепей, такие как H1:L1 (или H2:L2), и неправильных пар, таких как H1:L2 (и H2:L1), полученные путем введения мутации, представляющей интерес, были смоделированы для вычисления относительных стерических и электростатических оценок. Это позволило авторам решить, приводит ли конкретный набор мутаций к благоприятным энергиям, то есть большей стерической или электростатической комплементарности для предпочтительного (облигатного) образования пар тяжелой-легкой цепи относительно неправильного (не облигатного) образования пар. Рассчитанные стерические и электростатические энергии являются компонентами свободной энергии, связанной с образованием пар легкой и тяжелой цепи. Поэтому большая стерическая и электростатическая комплементарность свидетельствует о большем изменении свободной энергии, связанной с образованием пар облигатных пар по отношению к образованию пар не облигатных пар. Большая стерическая или электростатическая комплементарность приводит к предпочтительному (селективному) образованию пар облигатных тяжелых и легких цепей в сравнении с не облигатным образованием пар, и при совместной экспрессии может быть обнаружена как процент от двух продуктов (облигатно спаренные относительно не облигатно спаренных тяжелой и легкой цепи). Большая стерическая или электростатическая комплементарность в облигатной паре также может, как правило, наблюдаться в виде лучшей/большей термостабильности по отношению к необлигатной паре. Кандидаты дизайнов были включены в окончательный список и упорядочены. Первоначально дизайны были протестированы in vitro с использованием системы LCCA. Умеренно выполненные дизайны, демонстрирующие неоптимальные биофизические характеристики, такие как плохая специфичность образования пар HC-LC, низкая термостабильность или сниженная аффинность связывания с антигеном, были дополнительно улучшены с помощью дополнительных раундов in silico разработки и скрининга in vitro. Лучшие дизайны тестировали в формате биспецифических Mab; in vitro скрининг осуществляли преимущественно в формате SMCA.
Пример 15: Создание биспецифического антитела из данных Mab1 и Mab2 с использованием библиотеки наборов дизайна мутаций биспецифических антител.
[00365] В одном из вариантов осуществления настоящего изобретения в настоящем описании представлен набор дизайна мутаций биспецифических антител, направленных на селективное образование биспецифических антител из данных двух канонических антител Mab1 м Mab2, содержащих антигенсвязывающие фрагменты Fab1 и Fab2, соответственно. Набор дизайнов состоит из родственных мутаций, соответствующих Fab1, Fab2 и Fc, соответственно. Мутации вводят в интерфейс легкой и тяжелой цепей Fab1, чтобы достичь селективного образования пар между двумя облигатными цепями в присутствии конкурирующих легких и тяжелых цепей Fab2. Селективное образование пар достигается путем введения благоприятных комплементарных мутаций в две облигатные легкие и тяжелые цепи на основе стерической, гидрофобной или электростатической комплементарности между определенными каркасными остатками с активными участками на интерфейсе, при этом указанные мутированные остатки участвуют в неблагоприятном интерфейсном взаимодействии не облигатного образования пар цепей. В каждом наборе дизайнов мутации селективного образования пар могут быть также введены в интерфейс легкой и тяжелой цепи Fab2 для достижения селективного образования пар между этими двумя облигатными цепями в присутствии конкурирующих легкой и тяжелой цепи Fab1. Эти мутации направлены на снижение ошибочного образования пар легкой цепи Fab1 с тяжелой цепью Fab2 и наоборот. Мутации вводят в интерфейс Fc для того, чтобы достичь селективного образования пар тяжелых цепей с образованием асимметричных молекул антител, содержащих две различные тяжелые цепи.
[00366] Конструирование в некоторых положениях остатков интерфейса легких и тяжелых цепей антитела часто может привести к вредным эффектам, таким как потеря этим антителом аффинности связывания с антигеном, стабильности, растворимости, склонности к агрегации и тому подобное Может быть затронут ряд связанных свойств, таких как константа скорости ассоциации и константа скорости диссоциации, температура плавления (Tпл), стабильности в стрессовых условиях, таких как влияние кислоты, основания, окисление, замораживания/оттаивания, встряхивания, давления и тому подобное. На эти свойства часто влияют области, определяющие комплементарность (CDR) антитела, представляющего интерес. Учитывая, что CDR антител, как правило, не одинаковы, влияние набора дизайнов мутаций может не быть одинаковым для всех антител. В другом варианте осуществления настоящего изобретения определен ряд различных наборов дизайна биспецифических мутаций, составляющих библиотеку наборов дизайна мутаций биспецифических антител, включающих мутации в различных положениях активных участков на интерфейсе. Библиотека таких наборов дизайна мутаций биспецифических антител показана в Таблице 30. В настоящем описании представлен способ, позволяющий создавать биспецифическое антитело с заметной чистотой по отношению к другим загрязняющих веществам, содержащим неправильно спаренные антителоподобные структуры для любых двух доступных антител Mab1 и Mab2. Легкие и тяжелые цепи Mab1 и Mab2 совместно экспрессируются после введения родственных мутаций из каждого набора дизайна мутаций, и экспрессированный продукт антитела подвергают аналитическому скринингу, чтобы оценить чистоту предпочтительного биспецифического антитела по отношению к другим видам, подобным Mab, которые экспрессируются в белковом продукте. В некоторых вариантах осуществления настоящего изобретения процедура аналитического скрининга может быть основана на способе ЖХ-МС. В некоторых вариантах осуществления настоящего изобретения процедура аналитического скрининга может быть основана на разделении на основе заряда, например, на способе капиллярного изоэлектрофокусирования (кИЭФ). Пример способа скрининга на основе процедуры SMCA представлен в Примере 13. В некоторых вариантах осуществления настоящего изобретения заметная чистота биспецифического антитела определяется как представляющая собой более 70% от всех полученных видов, подобных Mab, в экспрессированном белковом продукте. В некоторых вариантах осуществления настоящего изобретения заметная чистота биспецифического антитела определяется как представляющая собой более 90% от всех полученных видов, подобных Mab, в экспрессированном белковом продукте. Способ получения и отбора набора дизайнов биспецифического Mab из данных Mab1 и Mab2 схематически показан на Фигуре 19.
[00367] Все публикации, патенты и патентные заявки, упомянутые в этом описании, включены в описание в виде ссылки в той же степени, как если бы каждая отдельная публикация, патент или патентная заявка были конкретно и индивидуально указаны как включенные в настоящее описание посредством ссылки.
[00368] В то время как изобретение было конкретно показано и описано со ссылкой на предпочтительный вариант осуществления и различные альтернативные варианты осуществления, специалистам в данной области должно быть понятно, что в нем могут быть сделаны различные изменения в форме и деталях без отступления от сущности и объема изобретения.
[00369] Все ссылки, выданные патенты и патентные заявки, цитируемые в основной части данного описания, включены в него посредством ссылки во всей их полноте для всех целей.
ПОСЛЕДОВАТЕЛЬНОСТИ
Таблицы A1-A2: Аминокислотные последовательности тяжелой цепи и легкой цепи D3H44, трастузумаба, пертузумаба и рамуцирумаба
KABAT
(Ссылка: Molecular Immunology. Volume 45,Issue 14, August 2008, Pages 3832–3839).
KABAT
S188G
S188G
S188G
S188L
Q179R
Q179R
S188G
Q179D_S188L
S188L
S188F
S188L
S188F
S188F
S188F
S188L
S188L
S188F
S188L
V190A
Q179R
F98W
F98W
S188G
D146G_Q179E_
S188G_V190S
Q179E_V190A
L135A
L135A
T85K
Q179R
F98A
V190A
T85K
A139G_V190A
F98A
F98W
F98W
Q179D_S188F
D146G_S188G_
V190S
F98W
Q179D_S188L
Q179E_V190A
Q179D_S188L
F98W
F98W
F98W
F98W
F98W
F98W
F98W
81:1_83:1_90:1_93:1_99:1
Q179D_S188L
Q179D_S188L
Q179D_S188L
S188L
S188L
S188G
S188G
S188G
79:36_80:24_82:12_
83:25_90:8
S188G
67:29_78:17_82:18_83:18_
83:21_83:23_85:21_
86:14_86:20
76:26_76:28_86:16_
87:21_99:4
75:20_76:24_78:24_81:15_85:8
Q179D_S188L
S188L
S188F
112:1_115:1_94:1_97:1_99:1
S188L
112:1_115:1_94:1_97:1_99:1
S188F
81:1_83:1_90:1_93:1_99:1
87:1_88:5_94:4_95:3_99:1
87:1_88:5_94:4_95:3_99:1
87:1_88:5_94:4_95:3_99:1
88:12_92:10_92:13_93:13_
94:15
86:1_86:21_88:13_93:11_
94:17
Q179R
Q179R
W103F
79:12_82:12_83:6_89:6_97:1
W103F
W103F
86:8_91:14_91:17_97:6_98:5
W103F
79:12_82:12_83:6_89:6_97:1
67:16_68:10_69:11_
69:11_69:12_74:15
L135A
Q179D_S188F
Q179D_S188F
112:1_115:1_94:1_97:1_99:1
87:1_88:5_94:4_95:3_99:1
W103F
W103F
W103F
W103F
W103F
W103F
W103F
F98A
F98A
F98A
W103H
W103H
V190G
W103V
W103H
W103H
W103H
W103F
W103H
W103H
W103V
W103F
W103V
68:1
W103V
W103H
T85K
W103V
T85K
F98A
77:26_78:26_83:22_
86:16_95:8
77:18_79:31_81:28_
86:21_91:16
V190A
A139W
L135A
A139G_V190A
F98A
W103H
Q179D_S188F
Q179D_S188F
W103L
W103F
W103H
W103L
V190S
F98A
W103H
W103H
W103H
W103H
F98A
W103H
W103H
L135A
W103H
F98L
W103F
F98L
V190G
F98A
W103H
F98L
81:14_88:9
W103F
F98L
W103T
F98A
77:26_78:26_83:22_
86:16_95:8
W103L
W103H
F98L
W103H
F98L
W103F
F98L
W103F
F98L
F98A
65:37_70:38_59:40_
62:40_54:45
W103T
только верификации/
скрининга и верификации (с/в/с_в)
94:6
97:33
67:3_81:1_83:1_90:1_93:1_99:1
85:12_85:18_86:9_
88:7_89:10_99:2
97:17
83:18
97:17
85:18_85:6_86:14_
90:10_91:16
(0,1017)
76:35_77:31_81:35_
91:26_91:27_97:15
74:34_77:32_79:30_
81:34_82:34
112:1_112:1_117:2_
120:1_123:1_92:2
88:12_88:12_92:10_
92:13_93:13_94:15
83:12_86:1_86:21_
88:13_93:11_94:17
88:12_88:12_92:10_
92:13_93:13_94:15
85:12_85:18_86:9_
88:7_89:10_99:2
84:21_85:23_86:13_
86:18_88:5_91:16
96:15_96:6_99:12
108:1_110:1_111:1_
115:1_117:1_120:1
81:3_92:3_96:1_96:
3_99:2_99:3
72:1_72:11_75:12_
76:9_80:8_82:7
75:25_77:26_78:26_
83:22_86:16_95:8
75:25_77:26_78:26_
83:22_86:16_95:8
67:6
S188L
S188L
S188L
S188L
S188L
S188L
только верификации/скрининга и верификации (с/в/с_в)
H1-L2
скрининга и верификации (с/в/с_в)
H2-L1
58:15
101:9
51:16
84:11
46:19
80:4
79:18
76:22_
77:8
97:10_
31:35
83:14
81:8
87:25
42:22
77:43
77:43
81:17
86:27
76:22_
77:8
97:10_
31:35
метка
Ab
метка
K145T
V133D
S186K
Q124E_
L135A_
T180E
F98W
D146G
V133D
K145T_
D146G_
Q179E_
V190A
Q124E_
L135A_
T180E
F98A
Q160E_
T178D
T178R
P175S_
S188G
L135A
Q179D_
S188L
T178R
Q160E_
T178D
V190Y
V190A
L135A
F98W
F98T
Q179D_
S188F
Q160K_
T178R
V133W_
Q160E_
T180E
K145T
D146G_
Q179R
V133W_
Q160E_
T180E
Q160K_
T178R
S186K
Q124E_
L135A_
T180E
F98W
K145T_
D146G_
Q179E_
V190A
D146G
V133D
F98A
P175S_
S188G
L135A
K145L_
Q179E_
S188G_
V190S
S131K_
V133G_
S176F_
T178A
K145L_
Q179E_
V190A
Q179R
Q160E_
T178D
S186K_
S188A
V133S_
S176A_
T180E
F98W
V190A
K145T
S186K
Q124E_
L135A_
T180E
F98W
Q179R
Q160E_
T178D
P175S_
S188G
L135A
Q179R
K145T
P175S_
S188G
S186K
Q124E_
L135A_
T180E
Q179D_
S188L
T178R
D146G
V133D
V190A
K145T_
D146G_
Q179E_
V190A
F98W
F98T
F98A
L135A
V190Y
K145T
P175S_
S188G
L135A
D146G_
Q179R
V133W_
Q160E_
T180E
S186K
Q124E_
L135A_
T180E
S186K_
S188A
V133S_
S176A_
T180E
L135A
F98W
Q179D_
S188L
T178R
K145T_
D146G_
Q179E_
V190A
D146G
V133D
F98A
K145L_
Q179E_
S188G_
V190S
S131K_
V133G_
S176F_
T178A
Q179R
Q160E_
T178D
G101I
F98W
F98A
V190Y
V190A
F98T
D146G
Q179R
Q160E_
T178D
D146G_
Q179R
V133W_
Q160E_
T180E
Q89W_
F98A
F98W
D146G_
Q179R
V133W_
Q160E_
T180E
D146G
V133D
L135A
F98A
F98W
F98T
Q89W_F98A
ДТ H1-L1:H1-L2 Скаляр (Медиана)
ДТ) H1-L1:H1-L2 Скаляр
54:36_58:43_58:43
D3H44
72:44_66:50
56:58_48:60
78:34_78:47_57:35_
56:36_65:53_65:53_
53:50
105:6_126:9_102:7_
113:15
65:44_67:46
97:1_94:1_90:1
109:2_113:3_102:3
97:2_110:3_97:3
108:2_100:2_115:2
D3H44
31:87_20:67
21:71_21:76
D3H44 или HA_L_PERT вероятно из-за проблем с HA-меткой, т.к. предпочтение H_D3H44 к FLAG_L_
PERT в сравн. с HA_L_
D3H44 не противоречиво
43:60_47:70
29:73_27:73_2:101_
1:98
121:5_110:10_85:24
78:32_78:36_66:51
ТАБЛИЦА 17
H1-L2
ДТ к ВАР1
H1-L2
H1-L2 Скаляр
94:1
69:23
98:1
73:13
96:1
75:15
95:1
77:2
49:61_
34:68_
21:71_
21:76
85:4
ДТ к ВАР2 H2-L2:
H2-L1 Скаляр (Медиа-на)
84:21_72:44_
66:50
метка
F98A
H1-L2
H1-L2
H1-L2 Скаляр (Медиана)
ДТ к ВАР1
ДТ к ВАР1 H1-L1:
H1-L2 Скаляр (Медиана)
H1-L2 Скаляр
29:70_
27:67_
29:73_
27:73_
2:101_
1:98
99:3_
101:4_
121:5_
110:10_
85:24
8_58:52_
43:60_
47:70
H2-L1
H2-L1 Скаляр (Медиана)
ДТ к ВАР2
H2-L1
ДТ к ВАР2 H2-L2:
H2-L1 Скаляр (Меди-ана)
H2-L1 Скаляр
108:2_100:2_115:2
H1-L1:H1-L2
70:29_78:34_
78:47_57:35_
56:36_65:53_
65:53_53:50
66:43_54:36_
58:43_58:43
35:86_31:87_
20:67
34:68_21:71_
21:76
52_43:60_47:70
27:67_29:73_
27:73_2:101_
1:98
18_86:17_89:18_61:19
123:2_105:6_
126:9_102:7_
113:15
68:25_65:44_
67:46
55:56_56:58_
48:60
D146G_Q179E_
V190A
L135A_T180E
L135A_T180E
S188L
T178D
Q179R
Q160E_T180E
T178R
Q179E_S188G_
V190S
V133G_S176F_
T178A
S176A_T180E
F98A
S188G
T178D
S188A
S176A_T180E
V133G_S176F_
T178A
PERT-PERT/D3H44; D3H44-D3H44/TRAS; D3H44-D3H44/PERT
PERT-PERT/D3H44
PERT-PERT/PERT; PERT-PERT/D3H44
PERT-PERT/D3H44
PERT-PERT/PERT; PERT-PERT/D3H44
PERT-PERT/D3H44; D3H44-D3H44/PERT
D3H44-D3H44/PERT
PERT-PERT/PERT; PERT-PERT/D3H44; D3H44-D3H44/PERT
PERT-PERT/PERT; PERT-PERT/D3H44
PERT-PERT/PERT; PERT-PERT/D3H44; D3H44-D3H44/TRAS
PERT-PERT/D3H44; D3H44-D3H44/PERT
PERT-PERT/D3H44
PERT-PERT/PERT; PERT-PERT/D3H44
PERT-PERT/D3H44
PERT-PERT/D3H44
D146G_Q179E_
V190A
S186K
T180E
S188G
V190Y
L135A
8,6
V190Y
S188G
Q179R
Q160E_
T178D
T178R
Q179D_
S188L
T178R
Q160E_
T178D
H1-L1_H1-L2
H1-L1_H1-L1
H1-L2
34,4
90,3
42,4
91,0
Ab
Ab
Q179E
Q160E_T180E
V190A
K145Y_
Q179E
Q179K
K145T
V190A
K145Y_
Q179E
Q179K
K145T
T180E
K145T_
Q179E
S176K
Q179K
K145T
чество экспериментов
ошибочно спаренных_Скаляр
Скаляр
H2-L2
H2-L2
H2-L1
H2-L2
Ab
V133G_
S176D
L124E
Q179R
V133W_
Q160E_
T180E
Q179D_
S188F
V133D
K145T
Q179E
S131K
Q160E_
T180E
K145T_
Q179E
L1:L2
ошибочно спаренные виды (все)
ошибочно спаренные виды (среднее)
S176K
T178R
T180E
ошибочно спаренных_Скаляр
ошибочно спаренных_
Скаляр
H2-L1)
H2-L1) побочный пик
H1-L1
H1-L2
H1-L2
H2-L1
H2-L2
H2-L2
H2-L1
H2-L2
Ab
L135W
S131K
V133D
K145T
F98W
Q39R_
W103F
L135W
A139W
F98W
Q39E_
W103F
P44W
Q39E
D146G_Q179E_
V190A
S186K
L135A_T180E
ошибочно спаренных_Скаляр
ошибочно спаренных_Скаляр
H1-L1
H1-L2
H1-L2
H2-L1
H2-L2
H2-L2
H2-L1
H2-L2
Q160E_
T180E
K145T_
Q179E
Q160E_
T178D
Q179E
W103F
Q160E_
T178D
Q179D_
S188L
W103F
W103F
K145T_
Q179E
W103F
W103F
W103F
ошибочно спаренные виды (все)
S131K
T178R
ошибочно спаренных_Скаляр
ошибочно спаренных_Скаляр
H2-L1)
H1-L1
H1-L2
H1-L2
H2-L1
H2-L1
H2-L2
Ab
W103F
W103F
Q179E_S188G_
V190S
V133G_S176F_
T178A
S186K_
S188A
W103F
T178R
Q179K
P175S_
S188G
T178D
K145T
ошибочно спаренные виды (все)
ошибочно спаренные виды (среднее)
ошибочно спаренных_Скаляр
ошибочно спаренных_Скаляр
H2-L2 (и H1-L2_H2-L1) побочный пик
H1-L1
H1-L2
H1-L2
H2-L1
H2-L2
H2-L2
H2-L1
H2-L2
Ab
Ab
S176D
W103F
T178R
Q160E_T180E
T180E
T180E
ошибочно спаренных_Скаляр
ошибочно спаренных_Скаляр
H2-L2 (и H1-L2_
H2-L1)
H1-L1
H1-L2
H1-L2
H2-L1
H2-L2
H2-L2
H2-L1
H2-L2
Ab
Ab
S186K
L135A_T180E
L124W
K145T_
S188L
L124A
S186E_
S188L
ошибочно спаренных_Скаляр
ошибочно спаренных_Скаляр
H2-L2 (и H1-L2_
H2-L1)
H2-L2 (и H1-L2_
H2-L1) побочный пик
H1-L1
H1-L2
H1-L2
H2-L1
H2-L2
H2-L2
H2-L1
H2-L2
Ab
Ab
Q179E
S131K
A139W
L135W
A139W
L1:L2
ошибочно спаренных_Скаляр
ошибочно спаренных_Скаляр
H2-L2 (и H1-L2_
H2-L1)
H2-L2 (и H1-L2_
H2-L1) побочный пик
H1-L1
H1-L2
H1-L2
H2-L1
H2-L2
H2-L2
H2-L1
H2-L2
K145T
K145T
59
ошибочно спаренных_Скаляр
ошибочно спаренных_Скаляр
H2-L2 (и H1-L2_
H2-L1)
H2-L1) побочный пик
H1-L1
H1-L2
H1-L2
H2-L1
H2-L2
H2-L2
H2-L1
H2-L2
Ab
_Ab
мутация
K145T
Q39R
Q39E
Q179E
Q39E
Q179K
Q179K
K145T
Q179K
Q39R
Q179E
Q179K
K145T
ошибочно спаренных_Скаляр
H2-L2 (и H1-L2_
H2-L1)
H2-L2 (и H1-L2_
H2-L1) побочный пик
H1-L1
H1-L2
H1-L2
H2-L1
H2-L2
H2-L2
H2-L1
H2-L2
Ab
Ab
Q39E
Q39E
K145T
Q179K
Q179E
K145T
Q179K
Q179E
Q39E
Q39R
Q179K
K145T
39E
Q179K
K145T
ошибочно спаренных_Скаляр
ошибочно спаренных_Скаляр
H2-L1)
H1-L1
H1-L2
H1-L2
H2-L1
H2-L2
H2-L2
H2-L1
H2-L2
каторов
Ab
_Ab
W103F
W103F
W103F
W103F
W103F
W103F
W103F
W103F
W103F
ошибочно спаренных_Скаляр
H2-L1)
H2-L1) побочный пик
H1-L1
H1-L2
H1-L2
H2-L1
H2-L2
H2-L2
H2-L1
H2-L2
_Ab
_Ab
тация
L1:L2
L-124E
V133A_
S176K
S176D
35:35
ческий )
S186R
Q160E_T180E
K145T_Q179E
S131K
46:24
56:14
Q160K_
T178R
46:24
Q39E
F98A
Q39R_
W103V
P44W
35:35
46:24
W103F
35:35
V133G_S176D
L124E
V133A_
S176K
46:24
Q39R
F98W
Q39E
F98A
35:35
Q160K_
T178R
35:35
W103F
46:24
S131K_
L135A
46:24
S131K_
L135A
46:24
46:24
Q39R_
W103V
P44W
Q39E
F98A
56:14
Q39R
F98W
Q39E
F98A
40:30
Q39E
F98A
46:24
53:17
Q160K_
T178R
53:17
Q39E
Q39R
F98W
53:17
Q39R
F98W
Q39E
F98A
53:17
Q39E
F98A
53:17
Q39E
F98A
53:17
53:17
Q160E_
T180E
53:17
Q160E_
T180E
53:17
Q160E_
T180E
53:17
Q39E
F98A
53:17
53:17
Q160E_
T180E
53:17
Q160E_
T180E
53:17
Q39E
F98A
Q39R
F98W
53:17
53:17
Q160K_
T178R
53:17
Q160E_
T180E
53:17
Q39R
F98W
Q39E
F98A
53:17
Q39E
F98A
53:17
Q160E_
T180E
35:35
Q160E_
T180E
35:35
Q160E_
T180E
35:35
Q39R
F98W
Q39E
F98A
35:35
Q39E
F98A
35:35
Q39E
F98A
Q39R
F98W
35:35
35:35
35:35
Q39E
F98A
35:35
Q160K_
T178R
35:35
ошибочно спаренных_Скаляр
H2-L2 (и
H1-L2_
H2-L1)
H2-L2 (и H1-L2_
H2-L1) побочный пик
H1-L1
H1-L2
H1-L2
H2-L1
H2-L2
H2-L2
H2-L1
H2-L2
ошибочно спаренных_Скаляр
H2-L2 (и
H1-L2_
H2-L1)
H2-L2 (и H1-L2_
H2-L1) побочный пик
H1-L1
H1-L2
H1-L2
H2-L1
H2-L2
H2-L2
H2-L1
H2-L2
Ab
L1:L2
53:17
53:17
53:17
Ab
H2-L2 (и
H1-L2_H2-L1)
H2-L2 (и
H1-L2_H2-L1) побочный пик
H1-L1
H1-L2
Ab
H1-L2
H2-L1
H2-L2
H2-L2
H2-L1
H2-L2
V190A
Q160E_T180E
Ключ для Таблиц 14-27 и 30-31
Таблица 14. Данные LCCA для системы D3H44 в формате образования пар Fab
Таблица 15. Дополнительные данные LCCA для системы D3H44 в формате образования пар Fab
Таблица 16. Данные LCCA для отобранных чистых и смешанных систем
Таблица 17. Данные LCCA для отобранных чистых и смешанных систем, в формате образования пар Fab
Таблица 18. Данные ДТ LCCA_для отобранных чистых и смешанных систем
Таблица 19. Сводные данные Таблицы 17
Таблица 20. Сводные данные Таблицы 18
Таблица 21.Данные анализа Mab для системы D3H44
Таблица 22. Данные SMCA для выбранных систем, pH 4
Таблица 23. Пример титрования ДНК для SMCA экспериментов
Таблица 24. Данные SMCA для отобранных систем, pH 7
Таблица 25. Данные термостабильности и связывания антигенов для отобранных SMCA дизайнов
Таблица 26. Данные SMCA для отобранных ДТ (метки легкой цепи vis-a-vis )
Таблица 27. Успешные дизайны в обеих LCCA (D3H44) и по меньшей мере одной протестированной SMCA системе
Таблица 30. Библиотека дизайнов
Таблица 31. Дизайны ядра
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ZYMEWORKS INC.
<120> СКОНСТРУИРОВАННЫЕ ПАРЫ ТЯЖЕЛАЯ–ЛЕГКАЯ ЦЕПИ ИММУНОГЛОБУЛИНА И ИХ ПРИМЕНЕНИЕ
<130> V87006WO
<140> PCT/CA2013/050914
<141> 2013-11-28
<150> 61/869,200
<151> 2013-08-23
<150> 61/818,874
<151> 2013-05-02
<150> 61/761,641
<151> 2013-02-06
<150> 61/730,906
<151> 2012-11-28
<160> 85
<170> PatentIn версия 3.5
<210> 1
<211> 217
<212> Белок
<213> Homo sapiens
<400> 1
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
1 5 10 15
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
20 25 30
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
35 40 45
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
50 55 60
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
65 70 75 80
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
85 90 95
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
100 105 110
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
115 120 125
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
130 135 140
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
145 150 155 160
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
165 170 175
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
180 185 190
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
195 200 205
Lys Ser Leu Ser Leu Ser Pro Gly Lys
210 215
<210> 2
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетическая метка
6xHis
<400> 2
His His His His His His
1 5
<210> 3
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетическая метка
пента His
<400> 3
His His His His His
1 5
<210> 4
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Arg Asp Ile Lys Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Tyr Ala Thr Ser Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Gly Glu Ser Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 5
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 5
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 6
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 7
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 7
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Ile Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Asp Asn Trp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Asp Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Tyr Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Ala Lys Ala Phe Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Asp Ile Lys Gly Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 8
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 8
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Glu Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Leu Ile Asp Pro Glu Gln Gly Asn Thr Ile Tyr Asp Pro Lys Phe
50 55 60
Gln Asp Arg Ala Thr Ile Ser Ala Asp Asn Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Thr Ala Ala Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 9
<211> 448
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 9
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe
115 120 125
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
130 135 140
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
145 150 155 160
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
165 170 175
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
180 185 190
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
195 200 205
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
210 215 220
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
225 230 235 240
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
245 250 255
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
260 265 270
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
275 280 285
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
290 295 300
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
305 310 315 320
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
325 330 335
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
340 345 350
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
355 360 365
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
370 375 380
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
385 390 395 400
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
405 410 415
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
420 425 430
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 10
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 10
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly
<210> 11
<211> 445
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 11
Glu Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Thr Asp Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440 445
<210> 12
<211> 1431
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<400> 12
gccaccatgg ccgtgatggc tcctagaacc ctggtgctgc tgctgtctgg agctctggct 60
ctgactcaga cctgggctgg agaggtgcag ctggtggaaa gcggaggagg actggtgcag 120
ccaggaggat ctctgcgact gagttgcgcc gcttcaggat tcaacatcaa ggacacctac 180
attcactggg tgcgacaggc tccaggaaaa ggactggagt gggtggctcg aatctatccc 240
actaatggat acacccggta tgccgactcc gtgaagggga ggtttactat tagcgccgat 300
acatccaaaa acactgctta cctgcagatg aacagcctgc gagccgaaga taccgctgtg 360
tactattgca gtcgatgggg aggagacgga ttctacgcta tggattattg gggacagggg 420
accctggtga cagtgagctc cgcctctacc aagggcccca gtgtgtttcc cctggctcct 480
tctagtaaat ccacctctgg agggacagcc gctctgggat gtctggtgaa ggactatttc 540
cccgagcctg tgaccgtgag ttggaactca ggcgccctga caagcggagt gcacactttt 600
cctgctgtgc tgcagtcaag cgggctgtac tccctgtcct ctgtggtgac agtgccaagt 660
tcaagcctgg gcacacagac ttatatctgc aacgtgaatc ataagccctc aaatacaaaa 720
gtggacaaga aagtggagcc caagagctgt gataagaccc acacctgccc tccctgtcca 780
gctccagaac tgctgggagg acctagcgtg ttcctgtttc cccctaagcc aaaagacact 840
ctgatgattt ccaggactcc cgaggtgacc tgcgtggtgg tggacgtgtc tcacgaggac 900
cccgaagtga agttcaactg gtacgtggat ggcgtggaag tgcataatgc taagacaaaa 960
ccaagagagg aacagtacaa ctccacttat cgcgtcgtga gcgtgctgac cgtgctgcac 1020
caggactggc tgaacgggaa ggagtataag tgcaaagtca gtaataaggc cctgcctgct 1080
ccaatcgaaa aaaccatctc taaggccaaa ggccagccaa gggagcccca ggtgtacaca 1140
ctgccaccca gcagagacga actgaccaag aaccaggtgt ccctgacatg tctggtgaaa 1200
ggcttctatc ctagtgatat tgctgtggag tgggaatcaa atggacagcc agagaacaat 1260
tacaagacca cacctccagt gctggacagc gatggcagct tcttcctgta ttccaagctg 1320
acagtggata aatctcgatg gcagcagggg aacgtgttta gttgttcagt gatgcatgaa 1380
gccctgcaca atcattacac tcagaagagc ctgtccctgt ctcccggctg a 1431
<210> 13
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<400> 13
gccactatgg ctgtgatggc ccctaggacc ctggtgctgc tgctgtccgg agctctggct 60
ctgactcaga cctgggctgg agacatccag atgacccagt ctccatcctc cctgtctgca 120
tctgtaggag acagagtcac catcacttgc cgggcaagtc aggacgttaa caccgctgta 180
gcttggtatc agcagaaacc agggaaagcc cctaagctcc tgatctattc tgcatccttt 240
ttgtacagtg gggtcccatc aaggttcagt ggcagtcgat ctgggacaga tttcactctc 300
accatcagca gtctgcaacc tgaagatttt gcaacttact actgtcaaca gcattacact 360
accccaccca ctttcggcca agggaccaaa gtggagatca aacgaactgt ggctgcacca 420
tctgtcttca tcttcccgcc atctgatgag cagttgaaat ctggaactgc ctctgttgtg 480
tgcctgctga ataacttcta tcccagagag gccaaagtac agtggaaggt ggataacgcc 540
ctccaatcgg gtaactccca agagagtgtc acagagcagg acagcaagga cagcacctac 600
agcctcagca gcaccctgac gctgagcaaa gcagactacg agaaacacaa agtctacgcc 660
tgcgaagtca cccatcaggg cctgagctcg cccgtcacaa agagcttcaa caggggagag 720
tgttga 726
<210> 14
<211> 1419
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<400> 14
gccaccatgg ccgtgatggc tcctagaaca ctggtcctgc tgctgtcagg ggcactggca 60
ctgactcaga cttgggctgg ggaggtccag ctggtccagt ccggaggagg actggtgaag 120
cctggaggga gtctgcgact gtcatgcgcc gctagcgggt tcacctttag ctcctacagc 180
atgaactggg tgcgacaggc accaggcaaa ggactggaat gggtgtctag tatctcaagc 240
tcctctagtt acatctacta tgcagacagc gtgaagggcc ggttcaccat cagcagagat 300
aacgccaaaa attccctgta tctgcagatg aacagcctgc gagccgagga caccgctgtc 360
tactattgcg cacgggtgac agacgccttc gatatttggg gacagggcac catggtcaca 420
gtgtcaagcg cctccaccaa gggaccaagc gtgttcccac tggctccatc ctctaaaagc 480
acttccggag gaaccgcagc cctgggatgt ctggtgaagg attacttccc agagcccgtc 540
acagtgtcat ggaacagcgg ggctctgacc tctggagtcc acacatttcc agcagtgctg 600
cagagttcag gactgtacag cctgagctcc gtggtcacag tgccctctag ttcactgggc 660
actcagacct atatctgcaa cgtgaatcac aagccaagca atactaaagt cgacaagaaa 720
gtggaaccca agtcctgtga taaaacacat acttgcccac cttgtcctgc accagagctg 780
ctgggaggac catccgtgtt cctgtttcca cccaagccta aagacactct gatgatttct 840
aggacacccg aagtcacttg cgtggtcgtg gacgtgagcc acgaggaccc cgaagtcaag 900
tttaactggt acgtggatgg cgtcgaggtg cataatgcta agacaaaacc tagggaggaa 960
cagtacaaca gtacatatag agtcgtgtca gtcctgactg tgctgcatca ggactggctg 1020
aacggaaagg aatataagtg caaagtgagc aataaggctc tgcccgcacc tatcgagaaa 1080
actatttcca aggctaaagg ccagcctaga gaaccacagg tgtacaccct gcctccatct 1140
agggacgagc tgactaagaa ccaggtcagt ctgacctgtc tggtgaaagg cttctatcct 1200
agcgatatcg cagtggagtg ggaatccaat gggcagccag agaacaatta caagaccaca 1260
ccccctgtgc tggactccga tgggtctttc tttctgtata gtaagctgac cgtcgataaa 1320
tcacggtggc agcagggaaa cgtgttcagc tgtagtgtca tgcacgaagc actgcacaat 1380
cattacaccc agaagagcct gtcactgtca cccggatga 1419
<210> 15
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<400> 15
gccaccatgg ctgtgatggc acctagaaca ctggtcctgc tgctgtccgg ggcactggca 60
ctgactcaga cttgggctgg cgatattcag atgacccaga gtccaagctc cgtgtccgcc 120
tctatcggcg accgagtcac cattacatgc agagctagcc agggcatcga taactggctg 180
gggtggtacc agcagaagcc tggaaaagcc ccaaagctgc tgatctacga cgcttccaat 240
ctggatacag gcgtgccctc taggttcagt ggctcaggga gcggaactta ctttactctg 300
accatctcta gtctgcaggc tgaggacttc gcagtgtatt tttgccagca ggcaaaagcc 360
ttccccccta cctttggcgg gggaacaaaa gtcgacatca aggggaccgt ggccgctccc 420
tcagtcttca tttttccacc cagcgatgag cagctgaagt ctggaacagc cagtgtggtc 480
tgtctgctga acaatttcta ccctcgggaa gcaaaagtgc agtggaaggt cgacaacgcc 540
ctgcagtccg gcaacagcca ggagagtgtg actgaacagg actcaaaaga tagcacctat 600
tccctgtcaa gcacactgac tctgtccaag gctgattacg aaaagcacaa agtgtatgca 660
tgtgaggtca cccatcaggg gctgtcaagt ccagtcacaa aaagtttcaa ccgaggagag 720
tgctga 726
<210> 16
<211> 1422
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<400> 16
gccacaatgg ccgtgatggc tcctagaaca ctggtcctgc tgctgtccgg ggctctggct 60
ctgactcaga cttgggctgg ggaggtgcag ctggtcgaat ctggaggagg actggtgcag 120
ccaggagggt cactgagact gagctgcgcc gcttccggct tcaacatcaa ggagtactat 180
atgcactggg tgaggcaggc acctggcaaa ggactggagt gggtgggact gatcgaccca 240
gaacagggga acaccatcta cgaccctaag tttcaggata gggcaaccat ttctgccgac 300
aacagtaaaa atacagctta tctgcagatg aacagcctga gggctgaaga tactgcagtg 360
tactattgcg cacgcgacac cgcagcctac ttcgattatt ggggacaggg caccctggtc 420
acagtgagct ccgcatcaac taagggaccc agcgtgtttc cactggcccc ctctagtaaa 480
tccacttctg gaggcaccgc tgcactgggc tgtctggtga aggattactt cccagagccc 540
gtcacagtga gctggaactc cggggccctg accagcggag tccatacatt tcctgctgtg 600
ctgcagtcaa gcgggctgta ctccctgtcc tctgtggtca ccgtgccaag ttcaagcctg 660
ggaactcaga cctatatctg caacgtgaat cacaagcctt caaatacaaa agtcgacaag 720
aaagtggaac caaagagctg tgataaaaca catacttgcc caccttgtcc tgcaccagag 780
ctgctgggag gaccaagcgt gttcctgttt ccacccaagc ccaaagacac cctgatgatt 840
tcccgcacac cagaagtcac ttgcgtggtc gtggacgtgt ctcacgagga ccccgaagtc 900
aagttcaact ggtacgtgga tggcgtcgag gtgcataatg ccaagacaaa accccgggag 960
gaacagtaca actccacata tagagtcgtg tctgtcctga ctgtgctgca ccaggactgg 1020
ctgaacggga aggagtataa gtgcaaagtg agtaataagg ccctgcccgc tcctatcgag 1080
aaaacaatta gcaaggccaa aggccagcct cgagaaccac aggtgtacac tctgcctcca 1140
tctcgggacg agctgactaa gaaccaggtc agtctgacct gtctggtgaa aggattctat 1200
cccagcgata tcgctgtgga gtgggaatcc aatggccagc ctgagaacaa ttacaagacc 1260
acaccccctg tgctggactc tgatggcagt ttctttctgt atagtaagct gaccgtcgat 1320
aaatcacgat ggcagcaggg gaacgtgttc agctgttcag tgatgcacga agccctgcac 1380
aaccattaca cccagaagag cctgagcctg tctcccggct ga 1422
<210> 17
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<400> 17
gccacaatgg ctgtgatggc accccgaacc ctggtcctgc tgctgagtgg agcactggca 60
ctgacccaga catgggcagg cgacatccag atgacacagt cccctagctc cctgagtgcc 120
tcagtggggg acagagtcac tatcacctgc cgggcttcca gagatattaa gtcttacctg 180
aactggtatc agcagaagcc aggcaaagca cccaaggtgc tgatctacta tgccaccagt 240
ctggctgaag gagtgccttc acggttcagc ggctccgggt ctggaactga ctacacactg 300
actatttcta gtctgcagcc tgaggatttc gctacctact attgcctgca gcacggcgaa 360
tccccatgga cttttggcca ggggaccaaa gtggagatca agaggacagt ggccgctcca 420
tccgtcttca tttttccccc ttctgacgaa cagctgaaat caggaactgc cagcgtggtc 480
tgtctgctga acaatttcta cccccgcgag gcaaaagtgc agtggaaggt cgataacgcc 540
ctgcagagtg gcaattcaca ggagagcgtg acagaacagg actccaaaga ttctacttat 600
agtctgtcaa gcaccctgac actgtctaag gctgattacg agaagcacaa agtgtatgca 660
tgcgaagtca cccatcaggg gctgtcctct cccgtgacaa agagctttaa tcggggagag 720
tgttga 726
<210> 18
<211> 1428
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<400> 18
gccacaatgg ctgtgatggc tccaagaacc ctggtcctgc tgctgtccgg ggctctggct 60
ctgactcaga cctgggccgg ggaagtgcag ctggtcgaat ctggaggagg actggtgcag 120
ccaggagggt ccctgcgcct gtcttgcgcc gctagtggct tcacttttac cgactacacc 180
atggattggg tgcgacaggc acctggaaag ggcctggagt gggtcgccga tgtgaaccca 240
aatagcggag gctccatcta caaccagcgg ttcaagggcc ggttcaccct gtcagtggac 300
cggagcaaaa acaccctgta tctgcagatg aatagcctgc gagccgaaga tactgctgtg 360
tactattgcg cccggaatct ggggccctcc ttctactttg actattgggg gcagggaact 420
ctggtcaccg tgagctccgc ctccaccaag ggaccttctg tgttcccact ggctccctct 480
agtaaatcca catctggggg aactgcagcc ctgggctgtc tggtgaagga ctacttccca 540
gagcccgtca cagtgtcttg gaacagtggc gctctgactt ctggggtcca cacctttcct 600
gcagtgctgc agtcaagcgg gctgtacagc ctgtcctctg tggtcaccgt gccaagttca 660
agcctgggaa cacagactta tatctgcaac gtgaatcaca agccatccaa tacaaaagtc 720
gacaagaaag tggaacccaa gtcttgtgat aaaacccata catgcccccc ttgtcctgca 780
ccagagctgc tgggaggacc aagcgtgttc ctgtttccac ccaagcctaa agatacactg 840
atgattagta ggaccccaga agtcacatgc gtggtcgtgg acgtgagcca cgaggacccc 900
gaagtcaagt ttaactggta cgtggacggc gtcgaggtgc ataatgccaa gactaaaccc 960
agggaggaac agtacaacag tacctatcgc gtcgtgtcag tcctgacagt gctgcatcag 1020
gattggctga acgggaaaga gtataagtgc aaagtgagca ataaggctct gcccgcacct 1080
atcgagaaaa caatttccaa ggcaaaagga cagcctagag aaccacaggt gtacactctg 1140
cctccatcaa gggatgagct gacaaagaac caggtcagcc tgacttgtct ggtgaaagga 1200
ttctatccct ctgacattgc tgtggagtgg gaaagtaatg gccagcctga gaacaattac 1260
aagaccacac cccctgtgct ggactcagat ggcagcttct ttctgtatag caagctgacc 1320
gtcgacaaat cccggtggca gcaggggaat gtgtttagtt gttcagtcat gcacgaggca 1380
ctgcacaacc attacaccca gaagtcactg tcactgtcac cagggtga 1428
<210> 19
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полинуклеотид
<400> 19
gccacaatgg ctgtgatggc acctagaaca ctggtcctgc tgctgagcgg ggcactggca 60
ctgacacaga cttgggccgg ggatattcag atgacccagt ccccaagctc cctgagtgcc 120
tcagtgggcg accgagtcac catcacatgc aaggcttccc aggatgtgtc tattggagtc 180
gcatggtacc agcagaagcc aggcaaagca cccaagctgc tgatctatag cgcctcctac 240
cggtataccg gcgtgccctc tagattctct ggcagtgggt caggaacaga ctttactctg 300
accatctcta gtctgcagcc tgaggatttc gctacctact attgccagca gtactatatc 360
tacccatata cctttggcca ggggacaaaa gtggagatca agaggactgt ggccgctccc 420
tccgtcttca tttttccccc ttctgacgaa cagctgaaaa gtggcacagc cagcgtggtc 480
tgtctgctga acaatttcta ccctcgcgaa gccaaagtgc agtggaaggt cgataacgct 540
ctgcagagcg gcaacagcca ggagtctgtg actgaacagg acagtaaaga ttcaacctat 600
agcctgtcaa gcacactgac tctgagcaag gcagactacg agaagcacaa agtgtatgcc 660
tgcgaagtca cacatcaggg gctgtcctct cctgtgacta agagctttaa cagaggagag 720
tgttga 726
<210> 20
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 20
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Glu Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Leu Ile Asp Pro Glu Gln Gly Asn Thr Ile Tyr Asp Pro Lys Phe
50 55 60
Gln Asp Arg Ala Thr Ile Ser Ala Asp Asn Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 21
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 21
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 22
<211> 100
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 22
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Val Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala Leu Ile Tyr Trp Asn Asp Asp Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Arg
100
<210> 23
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 23
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Lys Gln Asp Gly Ser Glu Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 24
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 24
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gly
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Asn Trp Trp Ser Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Gly Glu Ile Tyr His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Ile Ser Val Asp Lys Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 25
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 25
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg
<210> 26
<211> 101
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 26
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg
100
<210> 27
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 27
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Asn Thr Gly Asn Pro Thr Tyr Ala Gln Gly Phe
50 55 60
Thr Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Cys Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg
<210> 28
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 28
Asp Thr Ala Ala Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
1 5 10 15
Val Ser Ser
<210> 29
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 29
Ala Glu Tyr Phe Gln His Trp Gly Gln Gly Thr Leu Val Thr Val Ser
1 5 10 15
Ser
<210> 30
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 30
Tyr Trp Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu Val Thr Val Ser
1 5 10 15
Ser
<210> 31
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 31
Asp Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
1 5 10 15
<210> 32
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 32
Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10 15
<210> 33
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 33
Asn Trp Phe Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10 15
<210> 34
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 34
Tyr Tyr Tyr Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val
1 5 10 15
Thr Val Ser Ser
20
<210> 35
<211> 95
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 35
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Arg Asp Ile Lys Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Tyr Ala Thr Ser Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Gly Glu Ser Pro
85 90 95
<210> 36
<211> 95
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 36
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro
85 90 95
<210> 37
<211> 101
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 37
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Asp Gly Asn Thr Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Ser Pro Gln Leu Leu Ile Tyr Thr Leu Ser Tyr Arg Ala Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
65 70 75 80
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln
85 90 95
Arg Ile Glu Phe Pro
100
<210> 38
<211> 96
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 38
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
<210> 39
<211> 101
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 39
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Thr Pro
100
<210> 40
<211> 95
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 40
Glu Thr Thr Leu Thr Gln Ser Pro Ala Phe Met Ser Ala Thr Pro Gly
1 5 10 15
Asp Lys Val Asn Ile Ser Cys Lys Ala Ser Gln Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Ala Ala Ile Phe Ile Ile
35 40 45
Gln Glu Ala Thr Thr Leu Val Pro Gly Ile Pro Pro Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Ile Glu Ser
65 70 75 80
Glu Asp Ala Ala Tyr Tyr Phe Cys Leu Gln His Asp Asn Phe Pro
85 90 95
<210> 41
<211> 95
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 41
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Ser
20 25 30
Leu His Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Gln Ser Phe Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys His Gln Ser Ser Ser Leu Pro
85 90 95
<210> 42
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 42
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 43
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 43
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 44
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 44
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
1 5 10
<210> 45
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 45
Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
1 5 10
<210> 46
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 46
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 47
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 47
Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
1 5 10
<210> 48
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 48
Gln Ser Val Leu Thr Gln Pro Pro Ser Val Ser Glu Ala Pro Arg Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Leu Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Leu Leu Pro Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly
<210> 49
<211> 99
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 49
Gln Ser Ala Leu Thr Gln Pro Pro Ser Ala Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Val Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Glu Val Ser Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Val Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Ala Gly Ser
85 90 95
Asn Asn Phe
<210> 50
<211> 95
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 50
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Asp Lys Leu Gly Asp Lys Tyr Ala
20 25 30
Cys Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Val Leu Val Ile Tyr
35 40 45
Gln Asp Ser Lys Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ala Trp Asp Ser Ser Thr Ala
85 90 95
<210> 51
<211> 103
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 51
Leu Pro Val Leu Thr Gln Pro Pro Ser Ala Ser Ala Leu Leu Gly Ala
1 5 10 15
Ser Ile Lys Leu Thr Cys Thr Leu Ser Ser Glu His Ser Thr Tyr Thr
20 25 30
Ile Glu Trp Tyr Gln Gln Arg Pro Gly Arg Ser Pro Gln Tyr Ile Met
35 40 45
Lys Val Lys Ser Asp Gly Ser His Ser Lys Gly Asp Gly Ile Pro Asp
50 55 60
Arg Phe Met Gly Ser Ser Ser Gly Ala Asp Arg Tyr Leu Thr Phe Ser
65 70 75 80
Asn Leu Gln Ser Asp Asp Glu Ala Glu Tyr His Cys Gly Glu Ser His
85 90 95
Thr Ile Asp Gly Gln Val Gly
100
<210> 52
<211> 104
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 52
Gln Pro Val Leu Thr Gln Pro Pro Ser Ser Ser Ala Ser Pro Gly Glu
1 5 10 15
Ser Ala Arg Leu Thr Cys Thr Leu Pro Ser Asp Ile Asn Val Gly Ser
20 25 30
Tyr Asn Ile Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Pro Pro Arg Tyr
35 40 45
Leu Leu Tyr Tyr Tyr Ser Asp Ser Asp Lys Gly Gln Gly Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Lys Asp Ala Ser Ala Asn Thr Gly Ile
65 70 75 80
Leu Leu Ile Ser Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys
85 90 95
Met Ile Trp Pro Ser Asn Ala Ser
100
<210> 53
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 53
Asn Phe Met Leu Thr Gln Pro His Ser Val Ser Glu Ser Pro Gly Lys
1 5 10 15
Thr Val Thr Ile Ser Cys Thr Arg Ser Ser Gly Ser Ile Ala Ser Asn
20 25 30
Tyr Val Gln Trp Tyr Gln Gln Arg Pro Gly Ser Ser Pro Thr Thr Val
35 40 45
Ile Tyr Glu Asp Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Ile Asp Ser Ser Ser Asn Ser Ala Ser Leu Thr Ile Ser Gly
65 70 75 80
Leu Lys Thr Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ser
85 90 95
Ser Asn
<210> 54
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 54
Gln Thr Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Ala Ser Ser Thr Gly Ala Val Thr Ser Gly
20 25 30
Tyr Tyr Pro Asn Trp Phe Gln Gln Lys Pro Gly Gln Ala Pro Arg Ala
35 40 45
Leu Ile Tyr Ser Thr Ser Asn Lys His Ser Trp Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Val
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Leu Leu Tyr Tyr Gly Gly
85 90 95
Ala Gln
<210> 55
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 55
Gln Thr Val Val Thr Gln Glu Pro Ser Phe Ser Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Gly Leu Ser Ser Gly Ser Val Ser Thr Ser
20 25 30
Tyr Tyr Pro Ser Trp Tyr Gln Gln Thr Pro Gly Gln Ala Pro Arg Thr
35 40 45
Leu Ile Tyr Ser Thr Asn Thr Arg Ser Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Ile Leu Gly Asn Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Ala Asp Asp Glu Ser Asp Tyr Tyr Cys Val Leu Tyr Met Gly Ser
85 90 95
Gly Ile
<210> 56
<211> 104
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 56
Gln Pro Val Leu Thr Gln Pro Pro Ser Ala Ser Ala Ser Leu Gly Ala
1 5 10 15
Ser Val Thr Leu Thr Cys Thr Leu Ser Ser Gly Tyr Ser Asn Tyr Lys
20 25 30
Val Asp Trp Tyr Gln Gln Arg Pro Gly Lys Gly Pro Arg Phe Val Met
35 40 45
Arg Val Gly Thr Gly Gly Ile Val Gly Ser Lys Gly Asp Gly Ile Pro
50 55 60
Asp Arg Phe Ser Val Leu Gly Ser Gly Leu Asn Arg Tyr Leu Thr Ile
65 70 75 80
Lys Asn Ile Gln Glu Glu Asp Glu Ser Asp Tyr His Cys Gly Ala Asp
85 90 95
His Gly Ser Gly Ser Asn Phe Val
100
<210> 57
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 57
Gln Ala Gly Leu Thr Gln Pro Pro Ser Val Ser Lys Gly Leu Arg Gln
1 5 10 15
Thr Ala Thr Leu Thr Cys Thr Gly Asn Ser Asn Asn Val Gly Asn Gln
20 25 30
Gly Ala Ala Trp Leu Gln Gln His Gln Gly His Pro Pro Lys Leu Leu
35 40 45
Ser Tyr Arg Asn Asn Asn Arg Pro Ser Gly Ile Ser Glu Arg Leu Ser
50 55 60
Ala Ser Arg Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Leu Gln
65 70 75 80
Pro Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ala Trp Asp Ser Ser Leu
85 90 95
Ser Ala
<210> 58
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 58
Tyr Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
1 5 10
<210> 59
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 59
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
1 5 10
<210> 60
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 60
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
1 5 10
<210> 61
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 61
Phe Val Phe Gly Gly Gly Thr Gln Leu Ile Ile Leu
1 5 10
<210> 62
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 62
Trp Val Phe Gly Glu Gly Thr Glu Leu Thr Val Leu
1 5 10
<210> 63
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 63
Asn Val Phe Gly Ser Gly Thr Lys Val Thr Val Leu
1 5 10
<210> 64
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 64
Ala Val Phe Gly Gly Gly Thr Gln Leu Thr Val Leu
1 5 10
<210> 65
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 65
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
100 105
<210> 66
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 66
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val
<210> 67
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 67
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val
<210> 68
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 68
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val
<210> 69
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 69
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Tyr Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val
<210> 70
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 70
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val
<210> 71
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 71
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val
<210> 72
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 72
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Thr Ile Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val
<210> 73
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 73
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val
<210> 74
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 74
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Thr Ser Asn Phe Leu Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val
<210> 75
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 75
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 76
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 76
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 77
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 77
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Leu Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 78
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 78
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Asn Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 79
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 79
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Glu Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Gly Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 80
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 80
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Arg Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Glu Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 81
<211> 104
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 81
Pro Lys Ala Asn Pro Thr Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
1 5 10 15
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
20 25 30
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val Lys
35 40 45
Ala Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys Tyr
50 55 60
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
65 70 75 80
Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
85 90 95
Thr Val Ala Pro Thr Glu Cys Ser
100
<210> 82
<211> 105
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 82
Gln Pro Lys Ala Asn Pro Thr Val Thr Leu Phe Pro Pro Ser Ser Glu
1 5 10 15
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
20 25 30
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val
35 40 45
Lys Ala Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys
50 55 60
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
65 70 75 80
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
85 90 95
Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 83
<211> 105
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 83
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
1 5 10 15
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
20 25 30
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
35 40 45
Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys
50 55 60
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
65 70 75 80
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
85 90 95
Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 84
<211> 104
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 84
Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu
1 5 10 15
Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr
20 25 30
Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val Lys
35 40 45
Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys Tyr
50 55 60
Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His
65 70 75 80
Lys Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys
85 90 95
Thr Val Ala Pro Thr Glu Cys Ser
100
<210> 85
<211> 105
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 85
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
1 5 10 15
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
20 25 30
Tyr Pro Gly Ala Val Lys Val Ala Trp Lys Ala Asp Gly Ser Pro Val
35 40 45
Asn Thr Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys
50 55 60
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
65 70 75 80
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
85 90 95
Lys Thr Val Ala Ala Thr Glu Cys Ser
100 105
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СКОНСТРУИРОВАННЫЕ ПАРЫ ТЯЖЕЛАЯ-ЛЕГКАЯ ЦЕПИ ИММУНОГЛОБУЛИНА И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2826203C1 |
| АНТИГЕНСВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДНЫЕ КОНСТРУКЦИИ, СОДЕРЖАЩИЕ ЛЕГКИЕ ЦЕПИ КАППА И ЛЯМБДА, И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2824193C2 |
| МОДИФИЦИРОВАННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДНЫЕ КОНСТРУКЦИИ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2832921C1 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА К CCL2 | 2020 |
|
RU2819613C1 |
| ТРИСПЕЦИФИЧЕСКИЕ МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ BCMA, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2829901C2 |
| АНТИТЕЛА К LY6G6D И СПОСОБЫ ПРИМЕНЕНИЯ | 2020 |
|
RU2818569C1 |
| АНТИТЕЛА ПРОТИВ ТАУ-БЕЛКА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2732122C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ BCMA, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2812322C2 |
| АНТИТЕЛО ПРОТИВ LILRB1 И ЕГО ПРИМЕНЕНИЯ | 2021 |
|
RU2813373C1 |
| HER-2-НАПРАВЛЕННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СОДЕРЖАЩИЕ 4-1BBL | 2019 |
|
RU2815451C2 |
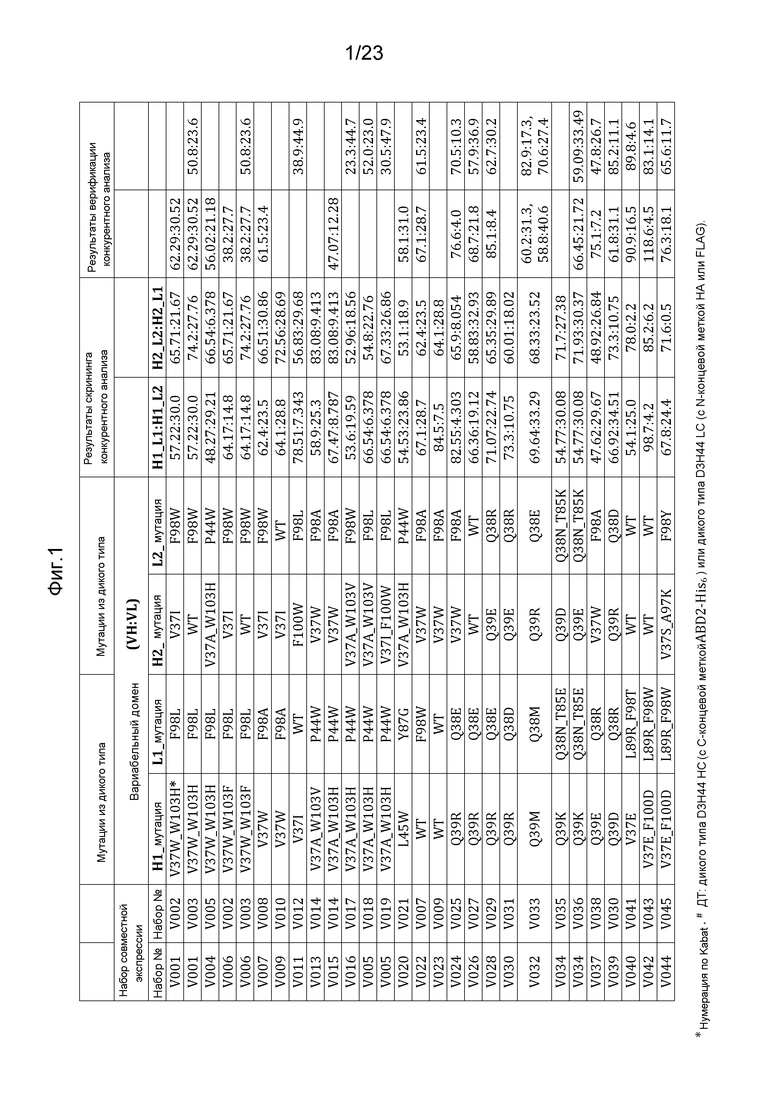
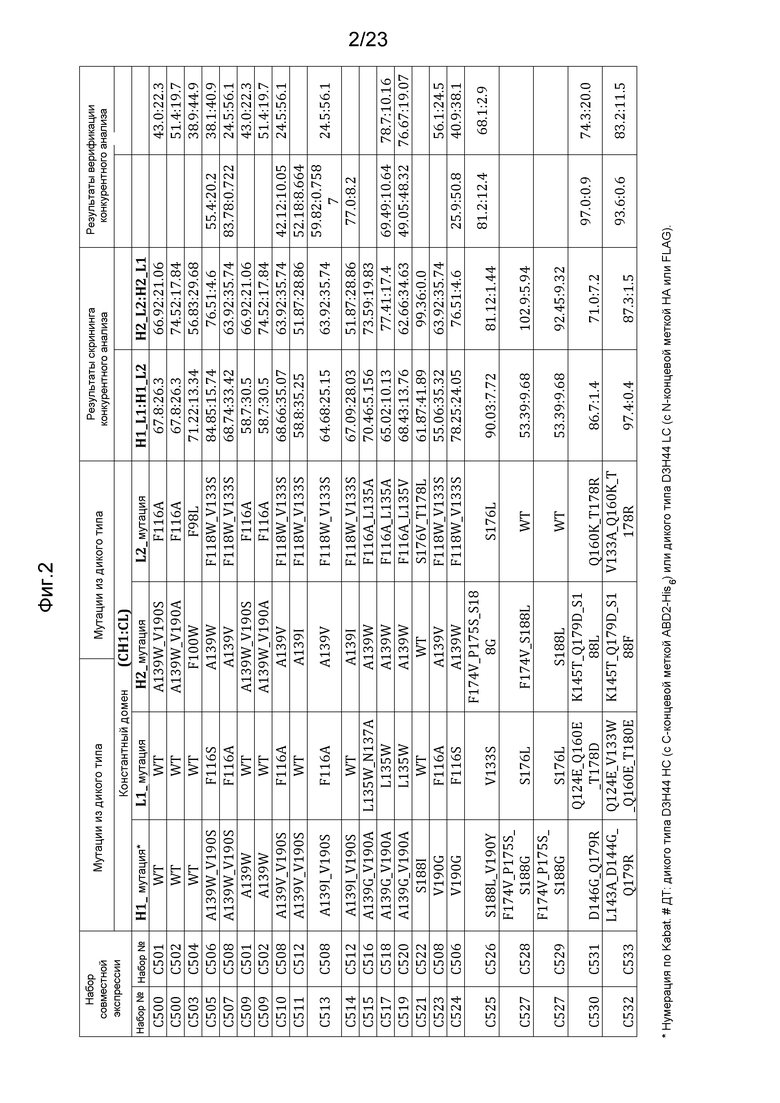
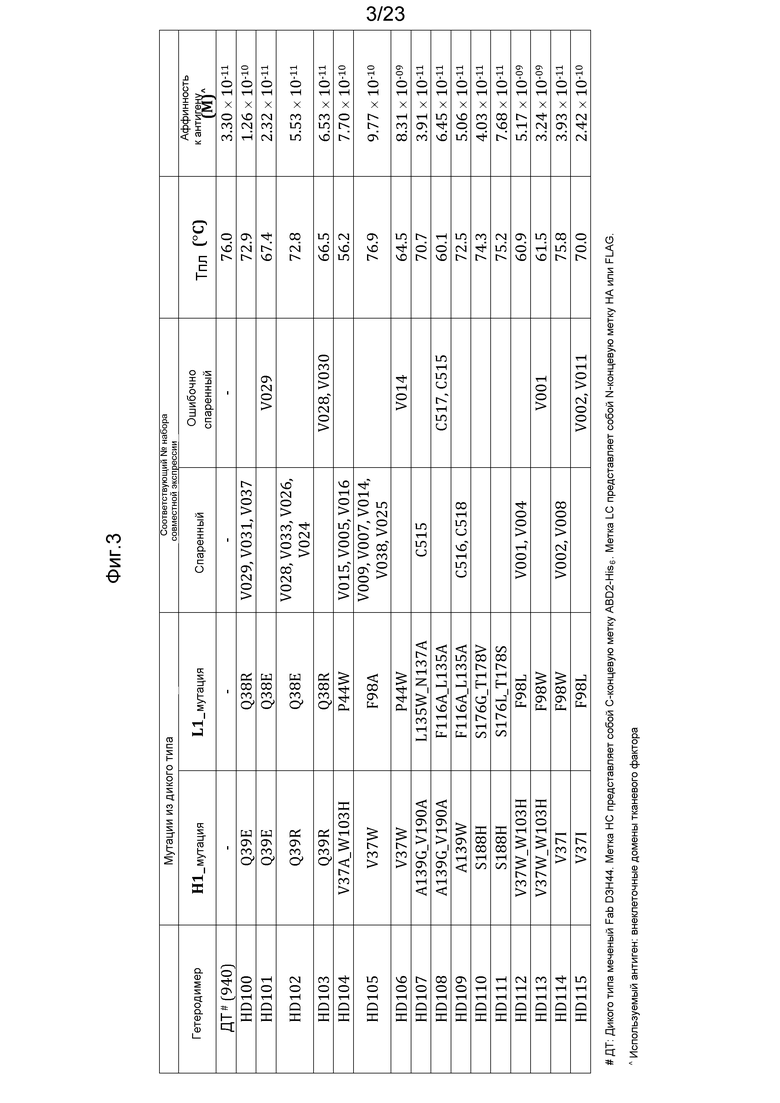
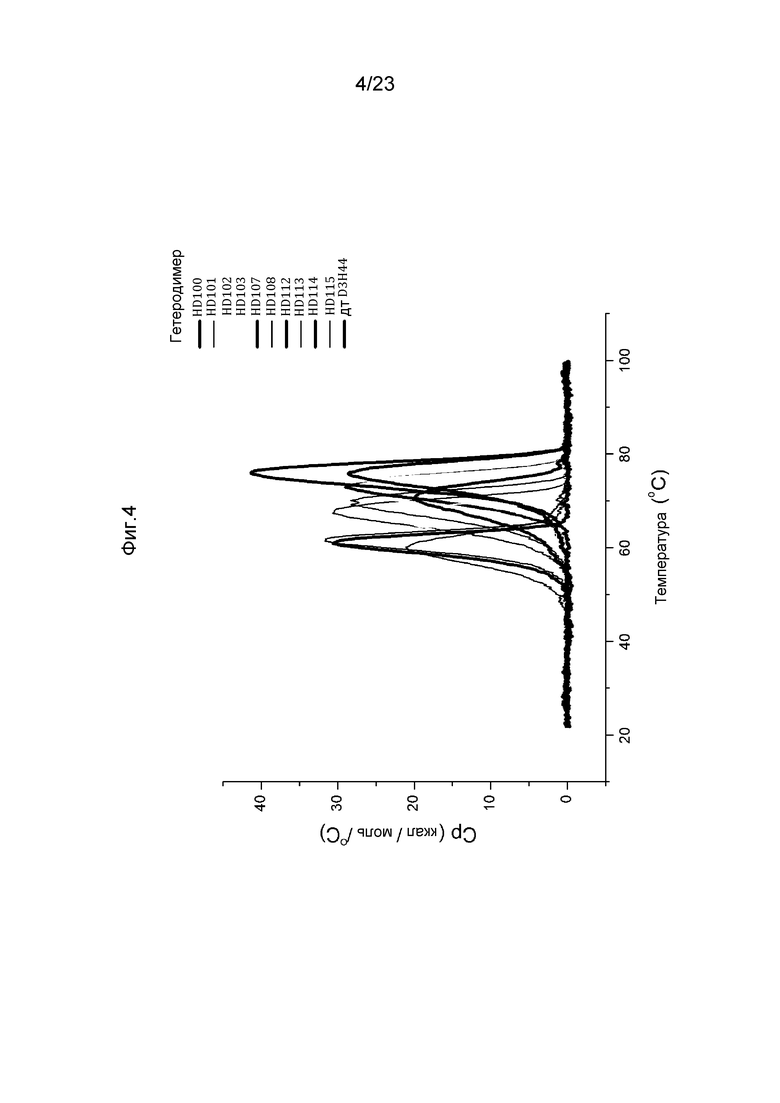


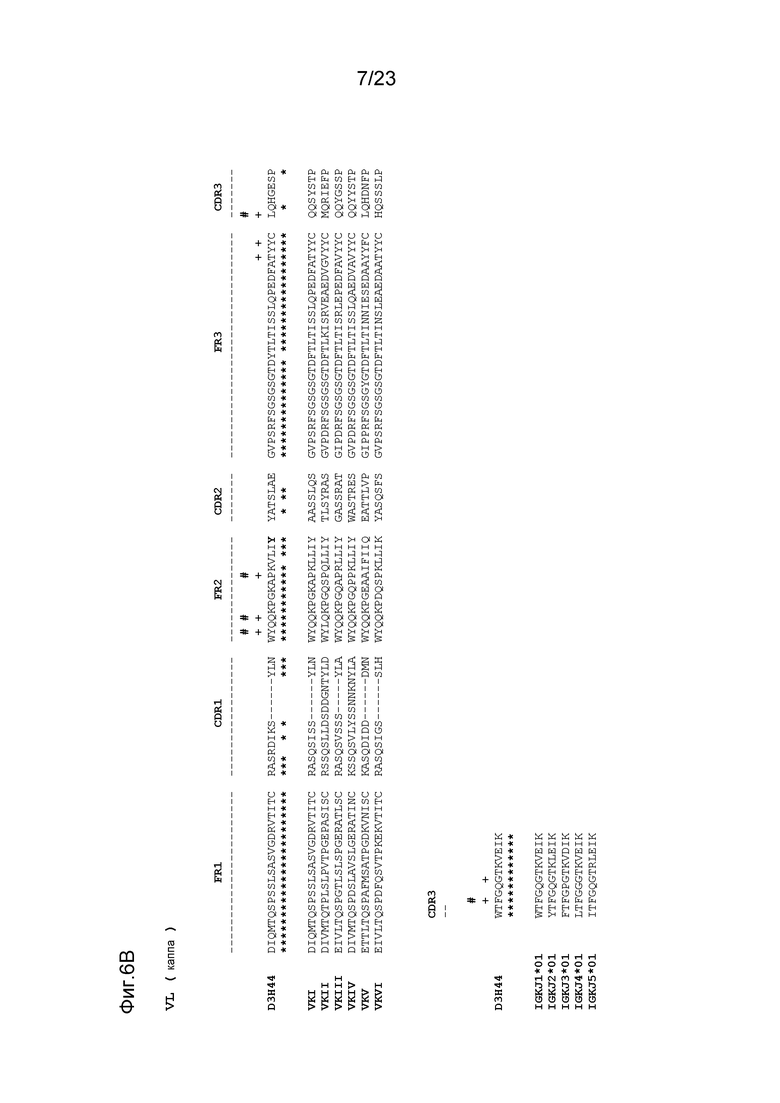

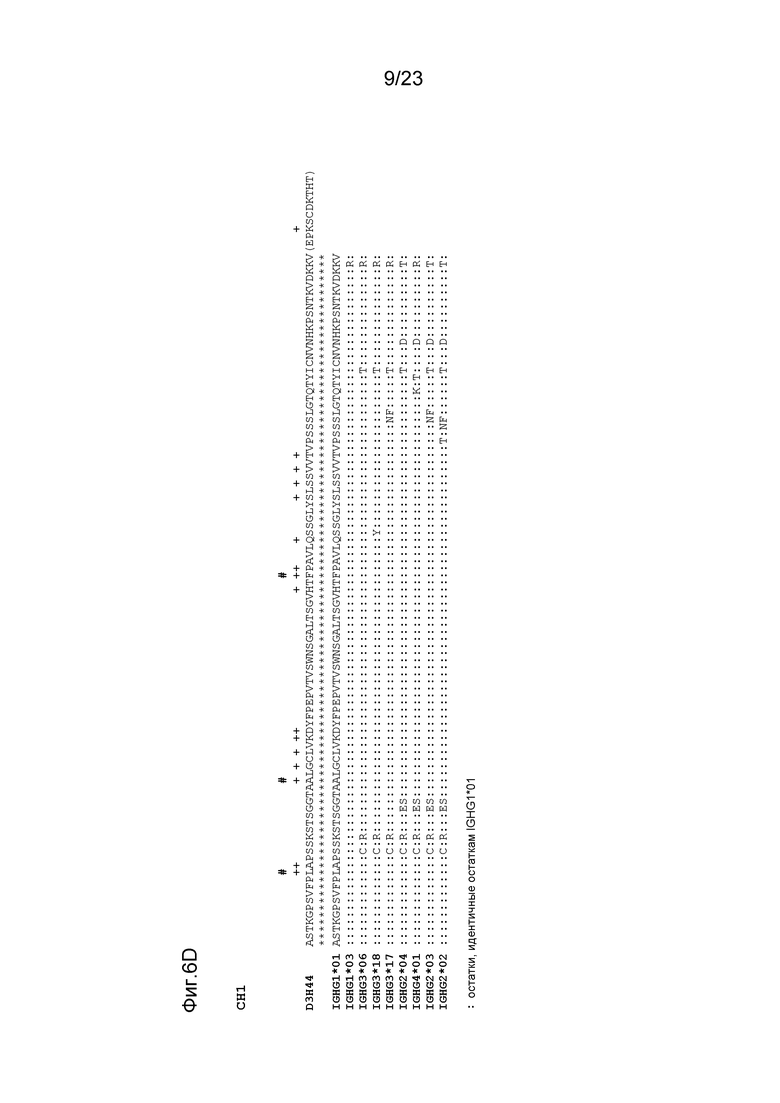

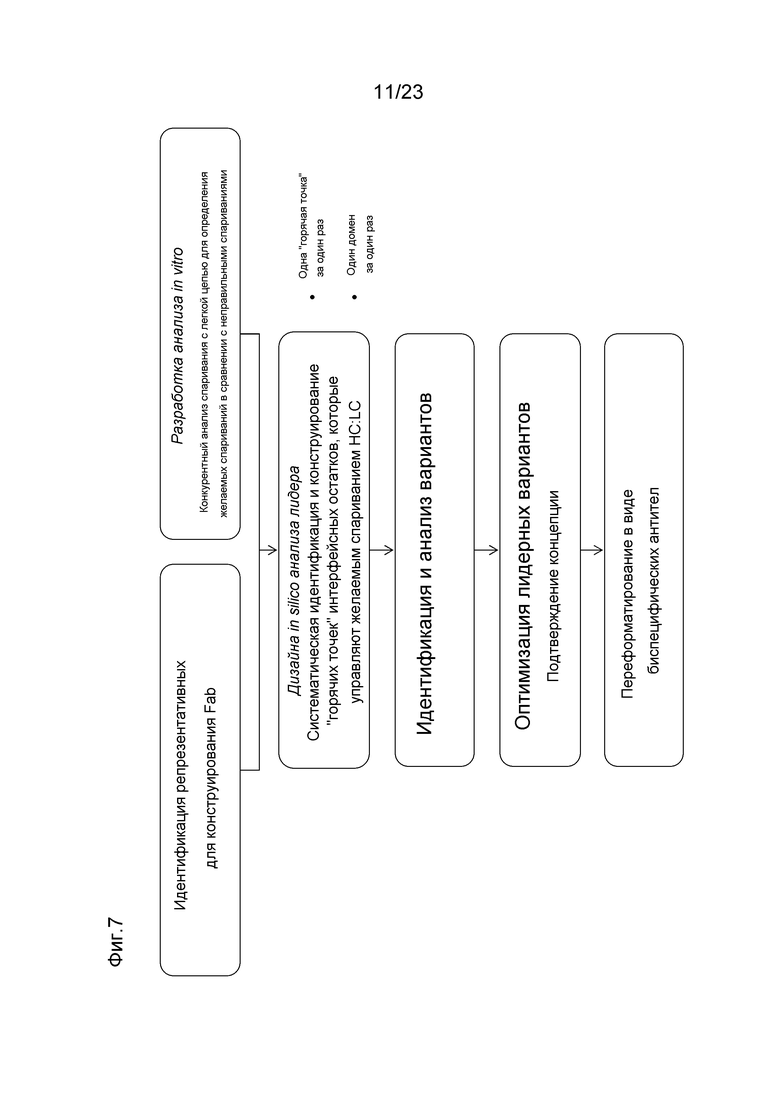
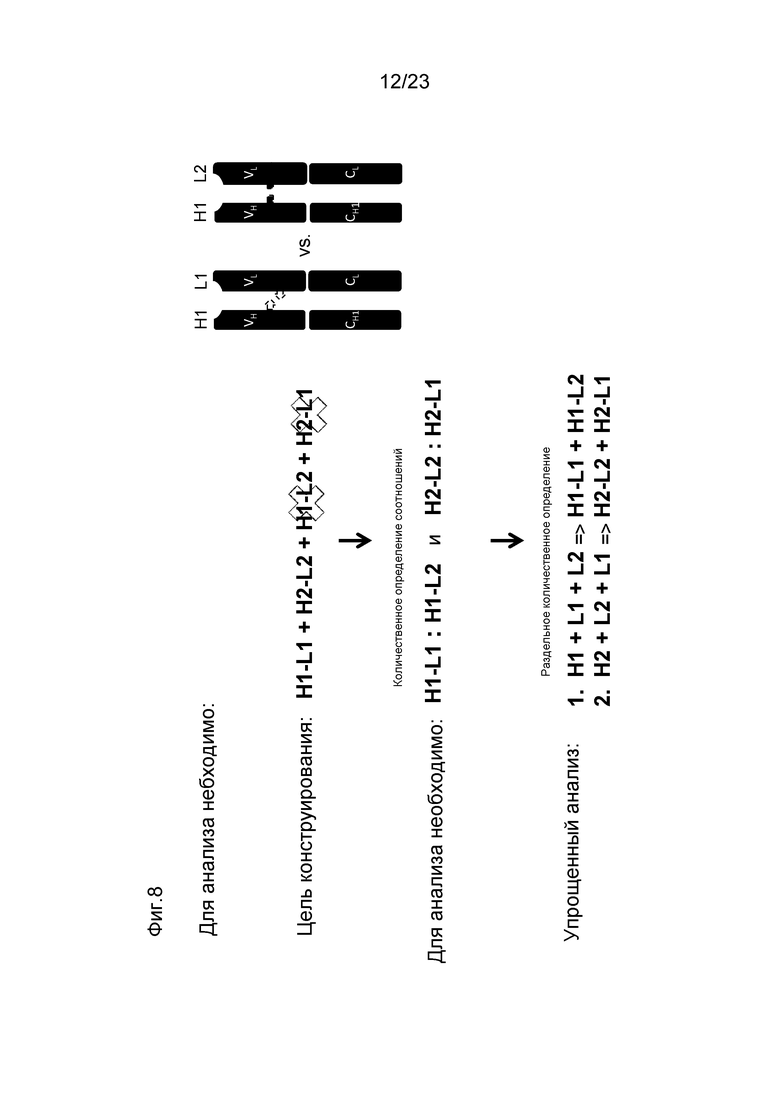
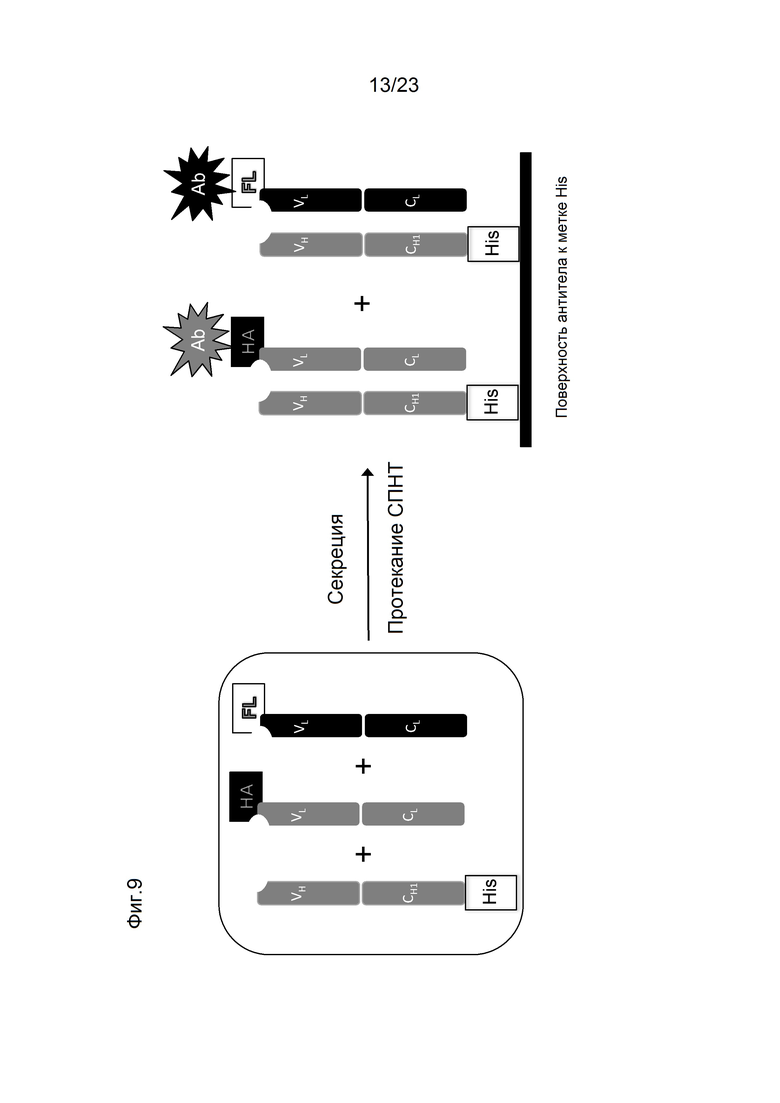
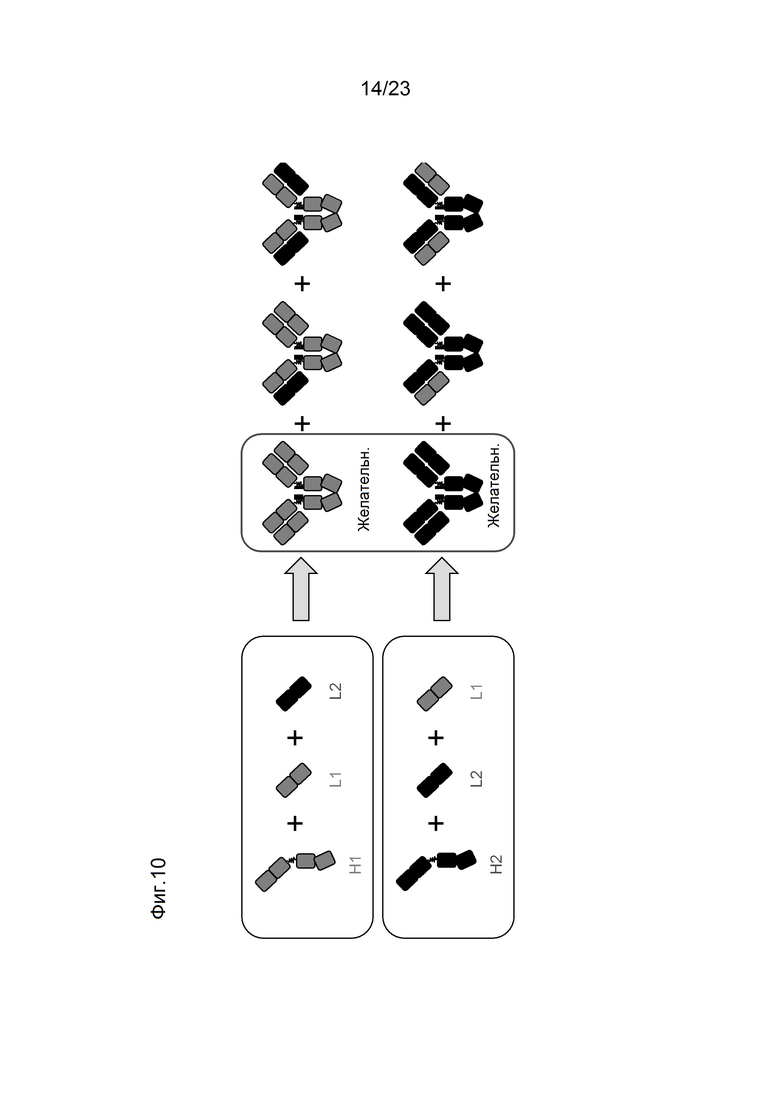
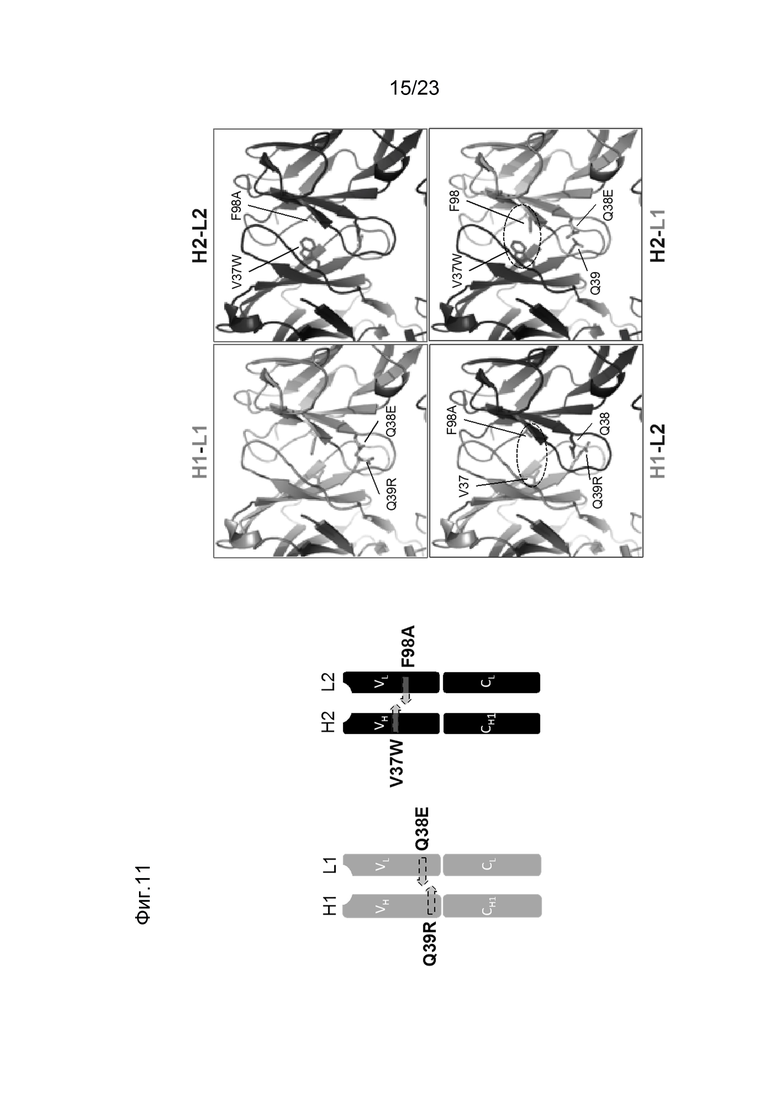
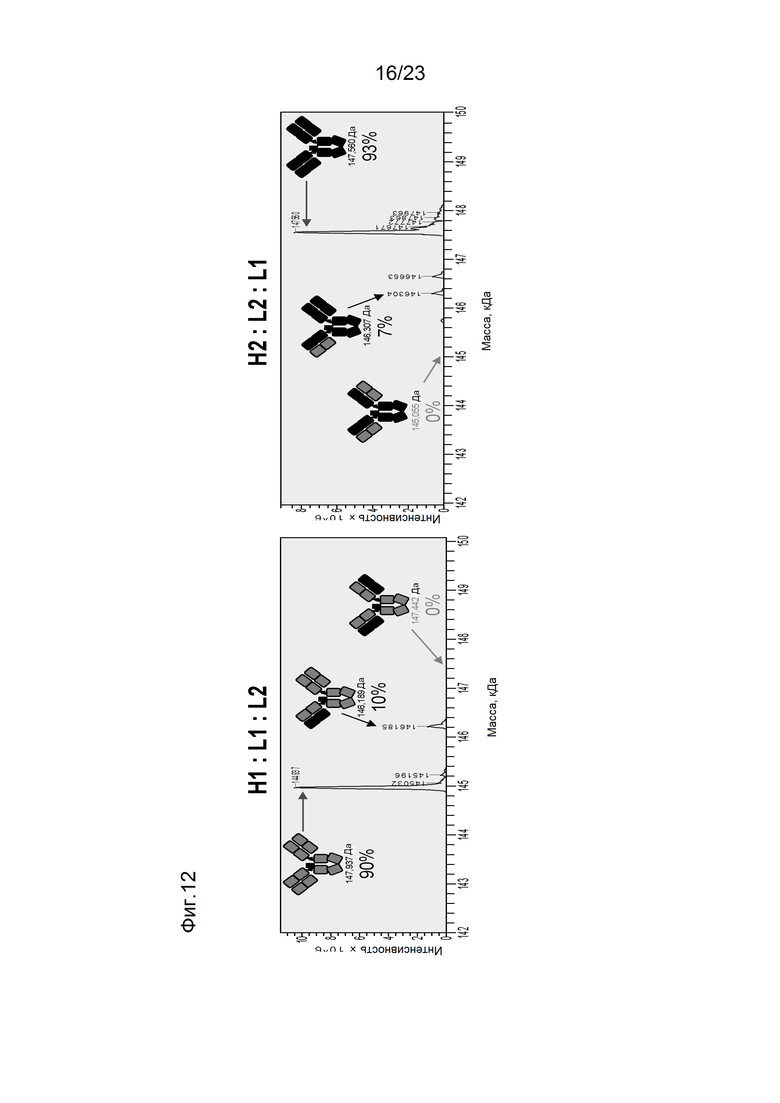
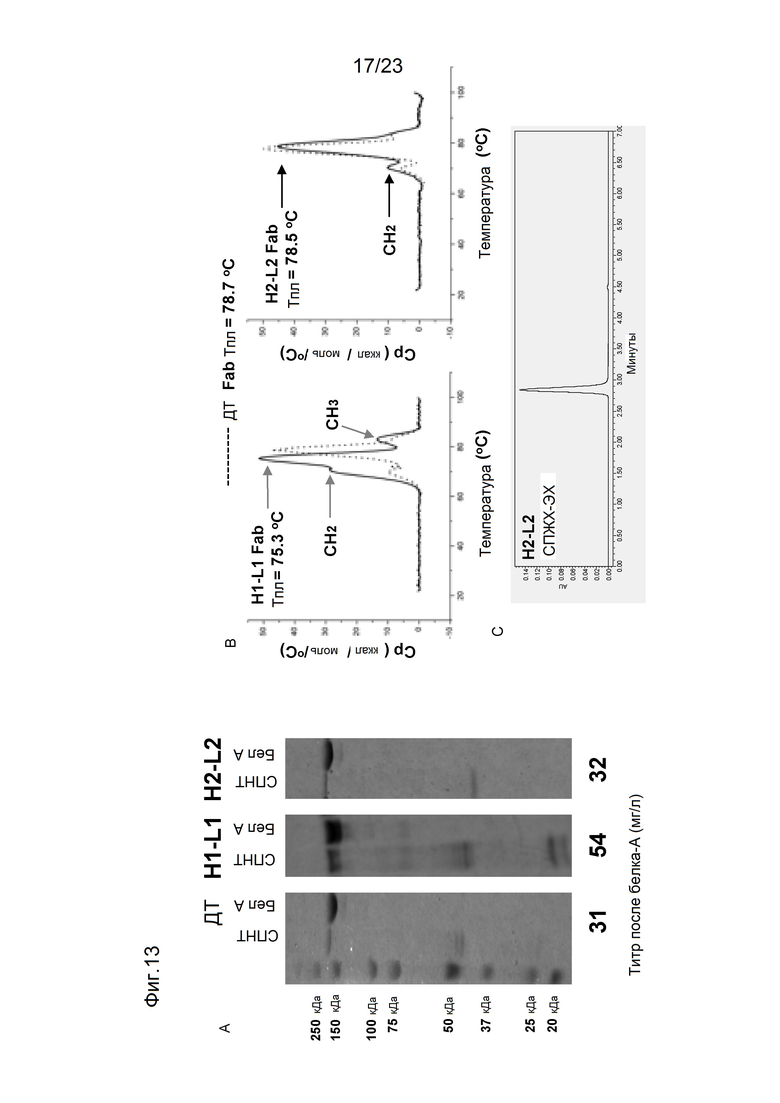
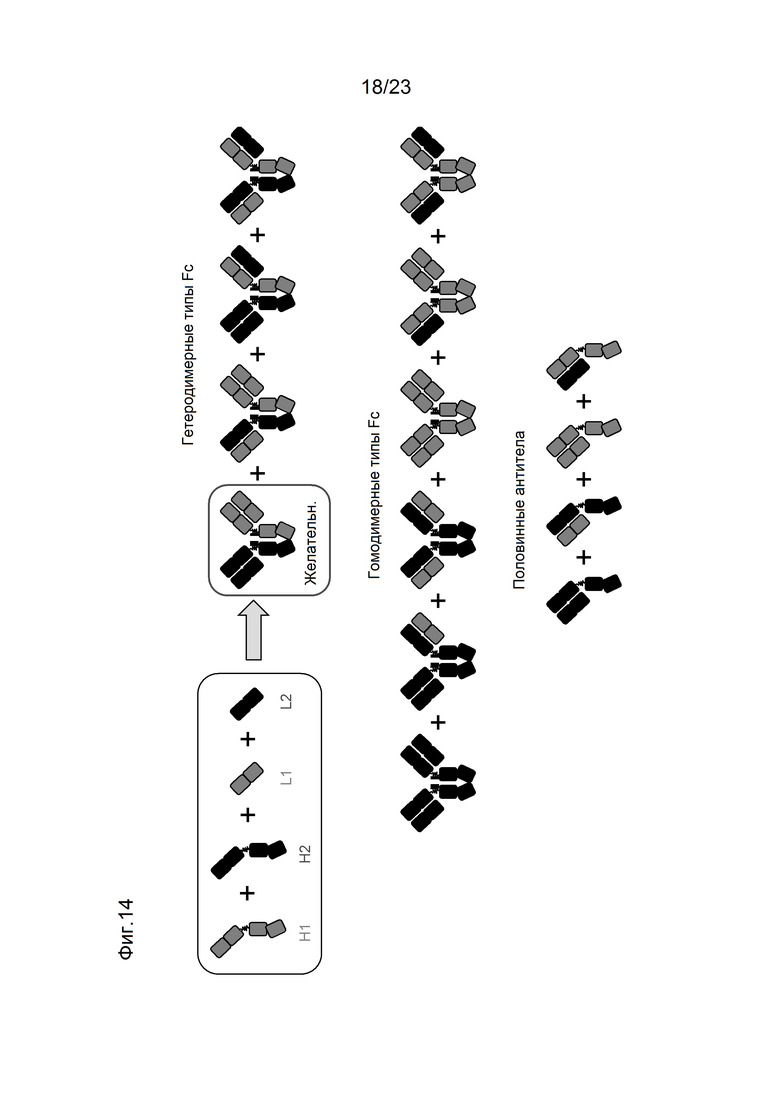
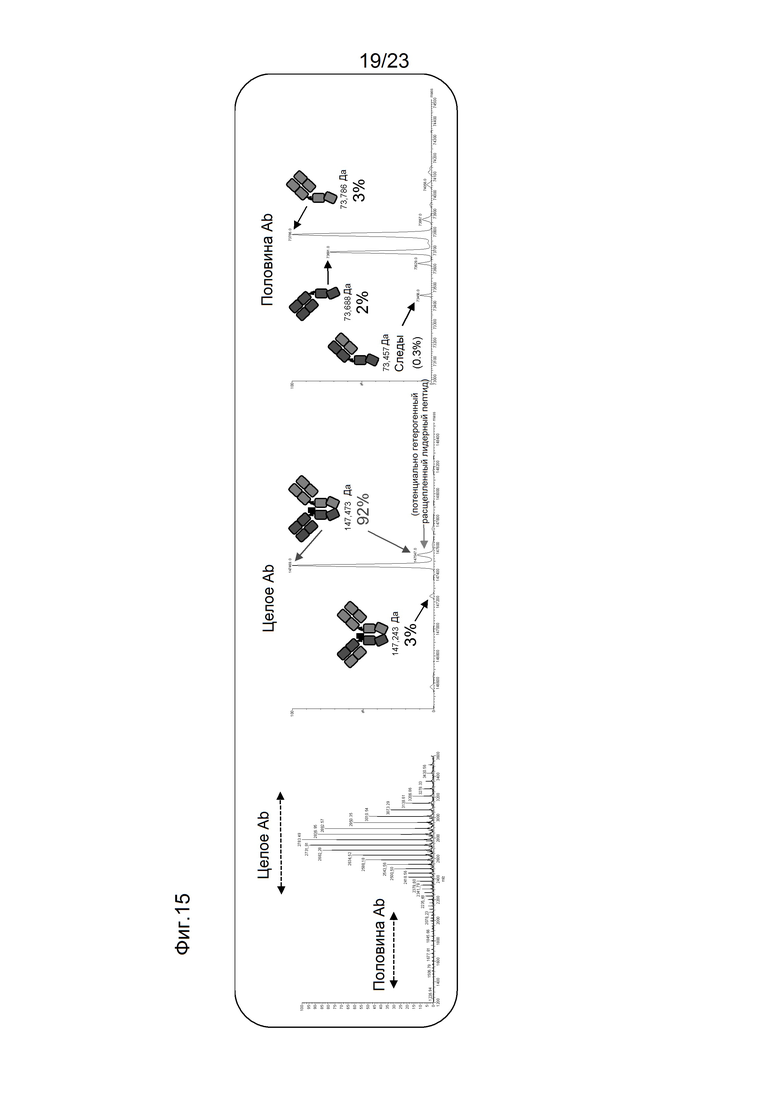
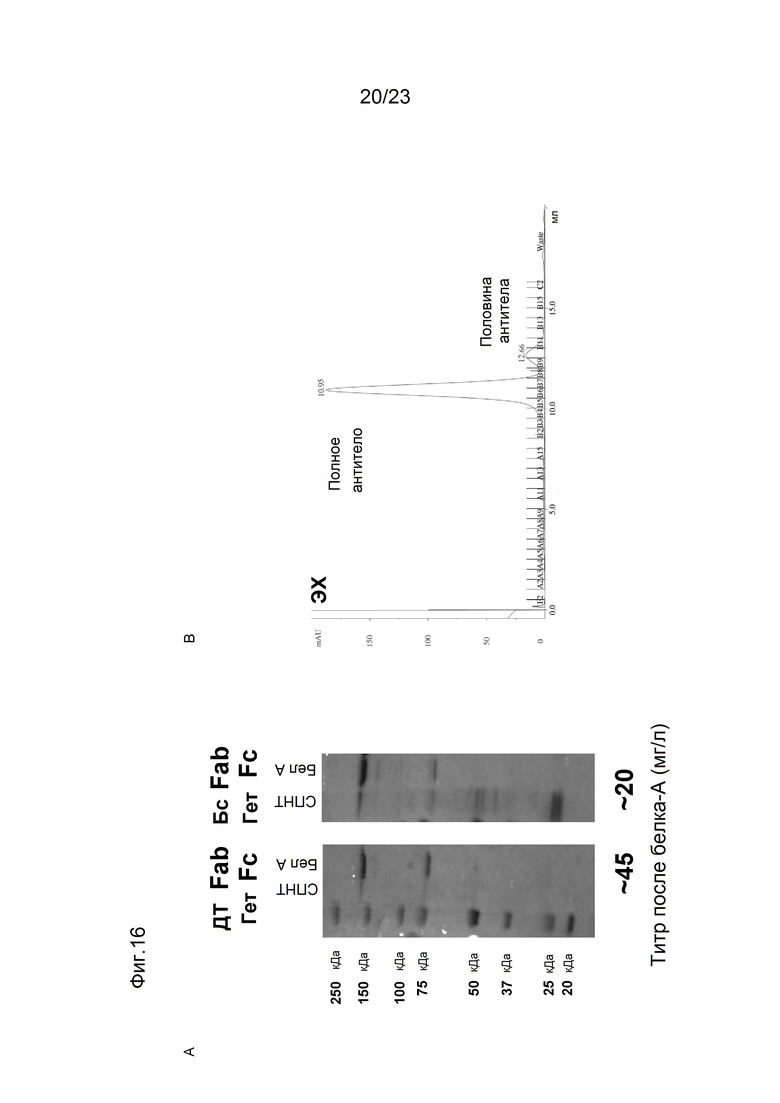
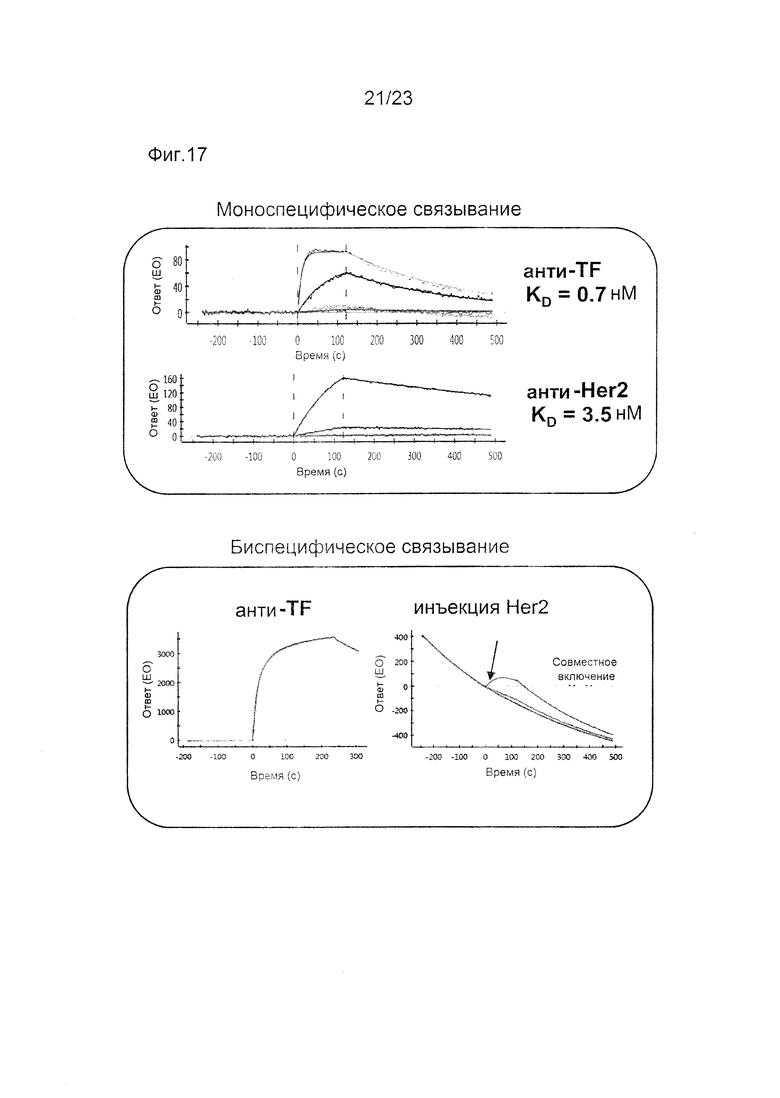
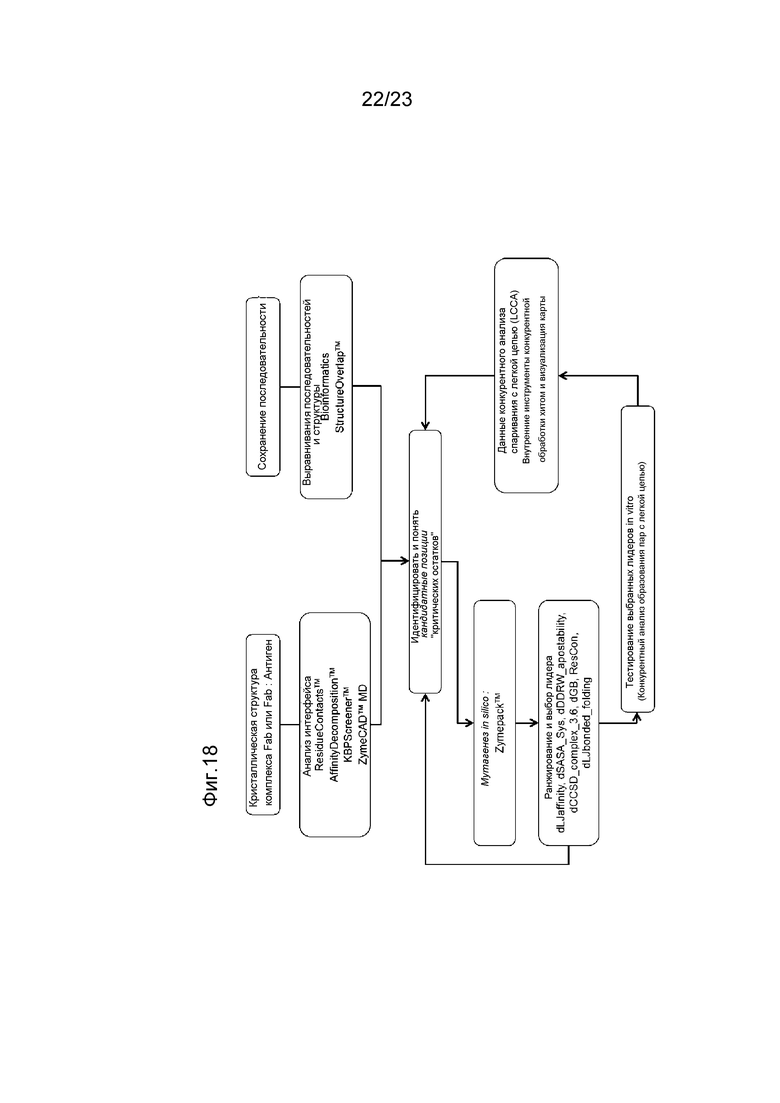
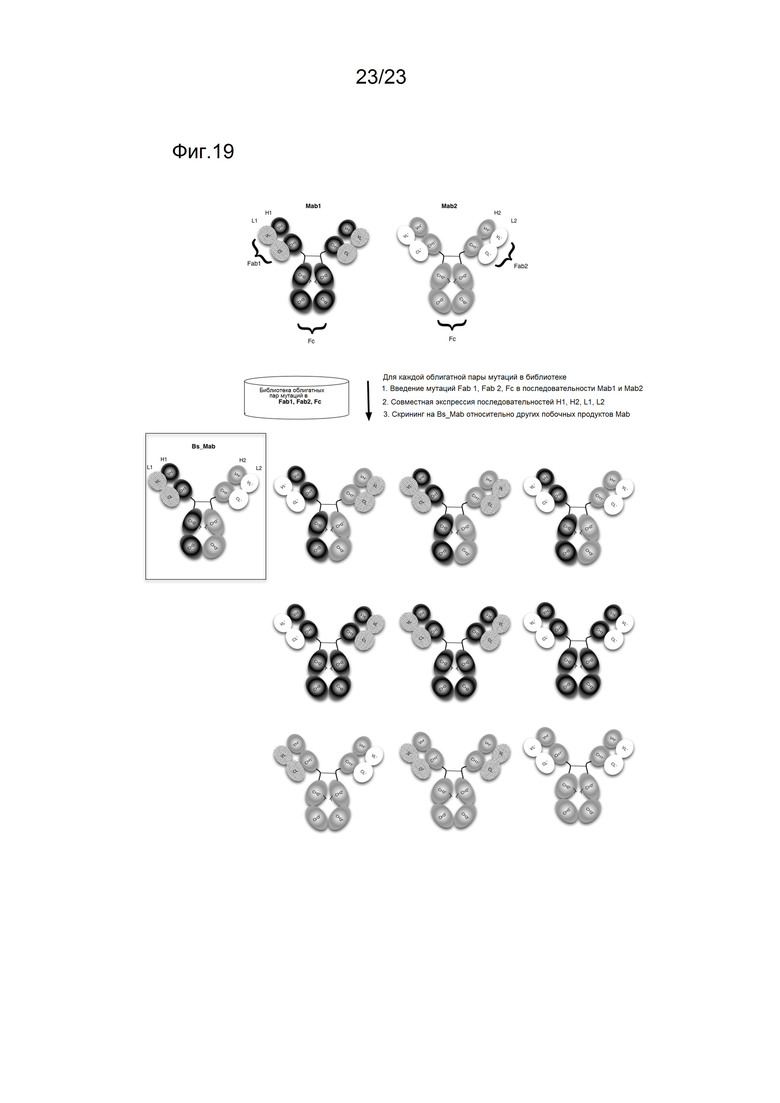
Настоящая группа изобретений относится к биотехнологии. Предложены: набор полинуклеотидов, набор векторов, выделенная клетка и способы получения с их использованием антигенсвязывающей полипептидной конструкции. Данная группа изобретений позволяет получать гетеродимерные антигенсвязывающие конструкции на основе иммуноглобулина IgG, в том числе биспецифические антитела, с пониженным выходом ошибочно спаренного гетеродимера. 5 н. и 29 з.п. ф-лы, 19 ил., 35 табл., 15 пр.
1. Набор полинуклеотидов для получения антигенсвязывающей полипептидной конструкции, причем набор полинуклеотидов кодирует антигенсвязывающую полипептидную конструкцию, содержащую по меньшей мере первый гетеродимер, который связывает первый эпитоп, и второй гетеродимер, который связывает второй эпитоп,
первый гетеродимер, содержащий полипептидную последовательность тяжелой цепи первого человеческого или гуманизированного иммуноглобулина G (IgG) (H1) и полипептидную последовательность легкой цепи первого человеческого или гуманизированного иммуноглобулина (L1); и второй гетеродимер, содержащий полипептидную последовательность тяжелой цепи второго человеческого или гуманизированного иммуноглобулина G (IgG) (Н2) и полипептидную последовательность легкой цепи второго человеческого или гуманизированного иммуноглобулина (L2), при этом по меньшей мере одна из последовательностей H1 или L1 первого гетеродимера отличается от соответствующей последовательности Н2 или L2 второго гетеродимера,
где каждая из H1 и Н2 содержит по меньшей мере вариабельный домен тяжелой цепи (VH домен) и константный домен тяжелой цепи (CH1 домен), и каждая из L1 и L2 содержит по меньшей мере вариабельный домен легкой цепи (VL домен) и константный домен легкой цепи (CL домен);
где H1, L1, Н2 и L2 содержат следующие аминокислотные замены, которые способствуют преимущественному спариванию H1 с L1 по сравнению с L2, и Н2 с L2 по сравнению с L1, в положениях, идентифицированных в соответствии с системой нумерации Kabat:
a) H1 содержит аминокислотную замену в остатках 143 и 145,
L1 содержит аминокислотную замену в остатке 124 или в остатках 160 и 178,
Н2 содержит аминокислотную замену в остатках 146 и 179, и
L2 содержит аминокислотную замену в остатках 124, 160 и 180 или в остатках 124, 160 и 178,
где аминокислотная замена в остатке 143 представляет собой 143Е; в остатке 145 представляет собой 145Т; в остатке 124 представляет собой 124R или 124Е; в остатке 160 представляет собой 160K или 160Е; в остатке 178 представляет собой 178R или 178D; в остатке 146 представляет собой 146G; в остатке 180 представляет собой 180Е, а в остатке 179 представляет собой 179K,
или их консервативные замены;
b) H1 содержит аминокислотную замену в остатках 143 и 145,
L1 содержит аминокислотную замену в остатке 124 или в остатках 160 и 178,
Н2 содержит аминокислотную замену в остатке 186, и
L2 содержит аминокислотную замену в остатке 124 или в остатке 178,
где аминокислотная замена в остатке 143 представляет собой 143Е; в остатке 145 представляет собой 145Т; в остатке 124 представляет собой 124Е, 124K или 124R; в остатке 160 представляет собой 160K или 160Е; в остатке 178 представляет собой 178R, 178D или 178Е, а аминокислотная замена в остатке 186 представляет собой 186R,
или их консервативные замены;
c) H1 содержит аминокислотную замену в остатках 143 и 145,
L1 содержит аминокислотную замену в остатке 124,
Н2 содержит аминокислотную замену в остатке 143, и
L2 содержит аминокислотную замену в остатке 124, 133 или 178,
где аминокислотная замена в остатке 143 представляет собой 143Е, 143R или 143K; в остатке 145 представляет собой 145Т; в остатке 124 представляет собой 124Е, 124R или 124K; в остатке 133 представляет собой 133D или 133Е, а аминокислотная замена в остатке 178 представляет собой 178Е,
или их консервативную замену; или
d) H1 содержит аминокислотную замену в остатках 143 и 145,
L1 содержит аминокислотную замену в остатке 124,
Н2 не содержит аминокислотных замен, которые способствуют преимущественному спариванию, и
L2 не содержит аминокислотных замен, которые способствуют преимущественному спариванию, или L2 содержит аминокислотную замену в остатке 124,
где аминокислотная замена в остатке 143 представляет собой 143Е; в остатке 145 представляет собой 145Т; в остатке 124 представляет собой 124R или 124Е,
или их консервативную замену.
2. Набор полинуклеотидов по п. 1, где H1 предпочтительно образует пары с L1 по сравнению с L2, и Н2 предпочтительно образует пары с L2 по сравнению с L1, когда H1, Н2, L1 и L2 совместно экспрессируются в клетке или в клетке млекопитающего, или когда H1, Н2, L1 и L2 совместно экспрессируются в бесклеточной системе экспрессии, или когда H1, Н2, L1 и L2 совместно производятся, или когда H1, Н2, L1 и L2 совместно производятся при помощи окислительно-восстановительной системы производства.
3. Набор полинуклеотидов по п. 1, где когда обе L1 и L2 совместно экспрессируются с по меньшей мере одной из H1 и Н2, относительное образование гетеродимерных пар H1-L1 и H2-L2 по сравнению с образованием соответствующих гетеродимерных пар H1-L2 или H2-L1 является большим по сравнению с соответствующим относительным образованием пар, наблюдаемым в соответствующей гетеродимерной паре H1-L1 или H2-L2 без аминокислотных замен, которые способствуют преимущественному спариванию.
4. Набор полинуклеотидов по п. 1, характеризующийся тем, что
термостабильность, определенная посредством измерения температуры плавления (Тпл), как измерено посредством дифференциальной сканирующей калориметрии (DSC), по меньшей мере одного из первого и второго гетеродимеров, находится в пределах около 10°С Тпл соответствующего гетеродимера без указанной по меньшей мере одной аминокислотной модификации; или
термостабильность, определенная посредством измерения температуры плавления (Тпл), как измерено посредством DSC, каждого гетеродимера, содержащего по меньшей мере одну аминокислотную модификацию, находится в пределах около 10°С Тпл соответствующего гетеродимера без указанной по меньшей мере одной аминокислотной модификации.
5. Набор полинуклеотидов по п. 1, характеризующийся тем, что аффинность каждого гетеродимера к антигену, с которым он связывается, находится в пределах около 50-кратной аффинности соответствующего немодифицированного гетеродимера к тому же антигену, как измерено посредством поверхностного плазмонного резонанса (SPR) или FACS.
6. Набор полинуклеотидов по п. 1 а), где:
a) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотные замены 146G и 179K, a L2 содержит аминокислотные замены 124Е, 160Е и 180Е;
b) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотные замены 124R, 160K и 178R, Н2 содержит аминокислотные замены 146G и 179K, a L2 содержит аминокислотные замены 124Е, 160Е и 180Е;
c) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотные замены 124R, 160K и 178R, Н2 содержит аминокислотные замены 146G и 179K, a L2 содержит аминокислотные замены 124Е, 160Е и 180Е;
d) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотные замены 160K и 178R, Н2 содержит аминокислотные замены 146G и 179R, a L2 содержит аминокислотные замены 124Е, 160Е и 180Е;
e) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотные замены 160K и 178R, Н2 содержит аминокислотные замены 146G и 179R, a L2 содержит аминокислотные замены 124Е, 160Е и 178D;
f) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотные замены 124R, 160K и 178R, Н2 содержит аминокислотные замены 146G и 179R, a L2 содержит аминокислотные замены 124Е, 160Е и 178D;
g) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотные замены 160K и 178R, Н2 содержит аминокислотные замены 146G и 179K, a L2 содержит аминокислотные замены 124Е, 160Е и 180Е;
h) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотные замены 160K и 178R, Н2 содержит аминокислотные замены 146G и 179K, a L2 содержит аминокислотные замены 124Е, 160Е и 178D, или
i) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотные замены 124R, 160K и 178R, Н2 содержит аминокислотные замены 146G и 179K, a L2 содержит аминокислотные замены 124Е, 160Е и 178D,
или их консервативные замены.
7. Набор полинуклеотидов по п. 1 b), где H1 дополнительно содержит аминокислотную замену в остатках 179 или 188, Н2 дополнительно содержит аминокислотную замену в остатке 146, a L2 дополнительно содержит аминокислотную замену в остатках 160 или 180, где аминокислотная замена в остатке 179 представляет собой 179Е; в остатке 188 представляет собой 188L; в остатке 146 представляет собой 146G, а аминокислотная замена в остатке 180 представляет собой 180Е,
или их консервативные замены.
8. Набор полинуклеотидов по п. 7, где H1 содержит аминокислотную замену в остатках 143 и 145, в остатках 143, 145 и 179 или в остатках 143, 145 и 188; L1 содержит аминокислотную замену в остатке 124, в остатках 124, 160 и 178, в остатках 124 и 178 или в остатках 160 и 178, Н2 содержит аминокислотную замену в остатке 186 или в остатках 146 и 186, a L2 содержит аминокислотную замену в остатке 124, в остатках 124, 160 и 178, в остатках 124, 160 и 180, в остатках 124 и 178, в остатках 124, 178 и 180, в остатках 160 и 178, в остатке 178 или в остатках 178 и 180.
9. Набор полинуклеотидов по п. 8, где:
a) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 186R, a L2 содержит аминокислотную замену 124Е;
b) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 186R, a L2 содержит аминокислотные замены 124Е, 160Е и 180Е;
c) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотные замены 124K и 178R, Н2 содержит аминокислотную замену 186R, a L2 содержит аминокислотную замену 124Е;
d) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотные замены 124K и 178R, Н2 содержит аминокислотную замену 186R, a L2 содержит аминокислотные замены 124Е, 160Е и 180Е;
e) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотные замены 124R, 160K и 178R, Н2 содержит аминокислотную замену 186R, a L2 содержит аминокислотные замены 124Е, 160Е и 180Е;
f) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 186R, a L2 содержит аминокислотные замены 178Е и 180Е;
g) H1 содержит аминокислотные замены 143Е, 145Т и 179Е, L1 содержит аминокислотные замены 124K и 178R, Н2 содержит аминокислотную замену 186R, a L2 содержит аминокислотные замены 124Е, 178Е и 180Е;
h) H1 содержит аминокислотные замены 143Е, 145Т и 179Е, L1 содержит аминокислотные замены 124K и 178R, Н2 содержит аминокислотную замену 186R, a L2 содержит аминокислотные замены 124Е, 160Е и 180Е;
i) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотные замены 124R, 160K и 178R, Н2 содержит аминокислотные замены 146G и 186R, a L2 содержит аминокислотные замены 124Е, 160Е и 178D;
j) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотные замены 160K и 178R, Н2 содержит аминокислотные замены 146G и 186R, a L2 содержит аминокислотные замены 124Е, 160Е и 178D;
k) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотные замены 160K и 178R, Н2 содержит аминокислотные замены 146G и 186R, a L2 содержит аминокислотные замены 124Е, 160Е и 180Е;
l) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 186R, a L2 содержит аминокислотные замены 124Е, 160Е и 178D;
m) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 186R, a L2 содержит аминокислотные замены 178Е;
n) H1 включает аминокислотные замены 143Е, 145Т и 188L, L1 включает аминокислотную замену 124R, Н2 содержит аминокислотную замену 186R, a L2 включает аминокислотные замены 178Е;
о) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 186R, a L2 содержит аминокислотные замены 160Е и 178Е;
р) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 186R, a L2 содержит аминокислотные замены 124Е и 178Е;
q) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 186R, a L2 содержит аминокислотную замену 124Е, или
r) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124K, Н2 содержит аминокислотную замену 186R, a L2 содержит аминокислотную замену 124Е,
или их консервативные замены.
10. Набор полинуклеотидов по п. 1 с), где H1 дополнительно содержит аминокислотную замену в остатке 188, или Н2 дополнительно содержит аминокислотную замену в остатке 146, где аминокислотная замена в остатке 188 представляет собой 188L, а аминокислотная замена в остатке 146 представляет собой 146G,
или их консервативную замену.
11. Набор полинуклеотидов по п. 10, где H1 содержит аминокислотную замену в остатках 143 и 145 или в остатках 143, 145 и 188; L1 содержит аминокислотную замену в остатке 124; Н2 содержит аминокислотную замену в остатке 143 или в остатках 143 и 146, a L2 содержит аминокислотную замену в остатке 124, в остатке 133, в остатке 178, в остатках 124 и 133 или в остатках 124 и 178.
12. Набор полинуклеотидов по п. 11, где:
a) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 143R, a L2 содержит аминокислотную замену 124Е;
b) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотные замены 143K и 146G, a L2 содержит аминокислотные замены 124Е и 133D;
c) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 143R, a L2 содержит аминокислотную замену 133Е;
d) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 143R, a L2 содержит аминокислотные замены 124Е и 133Е;
e) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 143R, a L2 содержит аминокислотную замену 124Е;
f) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124K, Н2 содержит аминокислотную замену 143R, a L2 содержит аминокислотную замену 124Е;
g) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 143K, a L2 содержит аминокислотную замену 133Е;
h) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 143K, a L2 содержит аминокислотные замены 178Е;
i) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 143K, a L2 содержит аминокислотные замены 124Е и 133Е;
j) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 143K, a L2 содержит аминокислотные замены 124Е и 178Е;
k) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 143K, a L2 содержит аминокислотную замену 124Е;
l) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену 124K, Н2 содержит аминокислотную замену 143K, a L2 содержит аминокислотную замену 124Е, или
m) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотную замену 124R, Н2 содержит аминокислотную замену 143K, a L2 содержит аминокислотную замену 124Е,
или их консервативные замены.
13. Набор полинуклеотидов по п. 1 d), где H1 дополнительно содержит аминокислотную замену в остатке 188, где аминокислотная замена в остатке 188 представляет собой 188L,
или их консервативные замены.
14. Набор полинуклеотидов по п. 13, где H1 содержит аминокислотную замену в остатках 143 и 145 или в остатках 143, 145 и 188.
15. Набор полинуклеотидов по п. 14, где:
a) H1 содержит аминокислотные замены 143Е, 145Т и 188L, L1 содержит аминокислотную замену в остатке 124R, Н2 не содержит аминокислотных замен, которые способствуют преимущественному спариванию, a L2 содержит аминокислотную замену в остатке 124Е;
b) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотную замену 124R, а Н2 и L2 оба не содержат аминокислотных замен, которые способствуют преимущественному спариванию, или
c) H1 содержит аминокислотные замены 143Е и 145Т, L1 содержит аминокислотную замену в остатке 124R, Н2 не содержит аминокислотных замен, которые способствуют преимущественному спариванию, a L2 содержит аминокислотную замену в остатке 124Е,
или их консервативные замены.
16. Набор полинуклеотидов по любому из пп. 1-15, где L1 и L2 представляют собой легкие цепи каппа.
17. Набор полинуклеотидов по п. 16, где конструкция дополнительно содержит Fc, который содержит по меньшей мере две последовательности CH3, при этом Fc связан с первым гетеродимером и вторым гетеродимером при помощи одного или нескольких линкеров или без них.
18. Набор полинуклеотидов по п. 17, где Fc представляет собой Fc человека, Fc IgG1 человека, Fc IgA человека, Fc IgG человека, Fc IgD человека, Fc IgE человека, Fc IgM человека, Fc IgG2 человека, Fc IgG3 человека или Fc IgG4 человека.
19. Набор полинуклеотидов по п. 17, где Fc представляет собой гетеродимерный Fc, содержащий одну или более модификаций в по меньшей мере одной из последовательностей CH3, которые способствуют образованию гетеродимерного Fc со стабильностью, сравнимой с гомодимерным Fc дикого типа.
20. Набор полинуклеотидов по п. 19, где гетеродимерный Fc представляет собой
i) гетеродимерный Fc IgG1, имеющий замены L351Y_F405A_Y407V в одной последовательности СН3 и замены T366L_K392M_T394W в другой последовательности СН3;
ii) гетеродимерный Fc IgG1, имеющий замены L351Y_F405A_Y407V в одной последовательности СН3 и замены T366L_K392L_T394W в другой последовательности СН3;
iii) гетеродимерный Fc IgG1, имеющий замены T350V_L351Y_F405A_Y407V в одной последовательности СН3 и замены T350V_T366L_K392L_T394W в другой последовательности СН3;
iv) гетеродимерный Fc IgG1, имеющий замены T350V_L351Y_F405A_Y407V в одной последовательности СН3 и замены T350V_T366L_K392M_T394W в другой последовательности СН3; или
v) гетеродимерный Fc IgG1, имеющий замены T350V_L351Y_S400E_F405A_Y407V в одной последовательности СН3 и замены T350V_T366L_N390R_K392M_T394W в другой последовательности СН3, и
причем нумерация аминокислотных остатков в указанной последовательности СН3 соответствует EU системе нумерации.
21. Набор полинуклеотидов по любому из пп. 17-20, где Fc содержит одну или несколько модификаций для способствования селективному связыванию Fc-гамма рецепторов.
22. Набор полинуклеотидов по п. 17, где один или несколько линкеров представляют собой один или несколько полипептидных линкеров.
23. Набор полинуклеотидов по п. 22, где один или несколько линкеров содержат один или несколько шарнирных участков антитела или одну или несколько шарнирных областей IgG1.
24. Набор полинуклеотидов по п. 17, где конструкция конъюгирована с терапевтическим агентом или лекарственным фрагментом.
25. Набор векторов экспрессии для получения антигенсвязывающей полипептидной конструкции, причем набор векторов экспрессии содержит набор полинуклеотидов по любому из пп. 1-24.
26. Набор векторов экспрессии по п. 25, которые выбраны из группы, состоящей из плазмиды, мультицистронного вектора, вирусного вектора, неэписомного вектора млекопитающих, вектора экспрессии и рекомбинантного вектора экспрессии.
27. Выделенная клетка для получения антигенсвязывающей полипептидной конструкции, причем выделенная клетка содержит набор полинуклеотидов по любому из пп. 1-24 или набор векторов по п. 25 или 26.
28. Выделенная клетка по п. 27, отличающаяся тем, что клетка представляет собой гибридому, клетку яичника китайского хомячка (СНО) или клетку HEK293.
29. Способ получения антигенсвязывающей полипептидной конструкции из культуры клеток-хозяев, при этом способ включает следующие стадии:
(а) получение культуры клеток-хозяев, содержащей по меньшей мере одну клетку-хозяина, содержащую набор полинуклеотидов по любому из пп. 1-24; и
(b) извлечение конструкции из культуры клеток-хозяев.
30. Способ получения антигенсвязывающей полипептидной конструкции, который включает:
a. получение набора полинуклеотидов по любому из пп. 1-24;
b. определение оптимальных соотношений каждого из полинуклеотидов указанного набора полинуклеотидов для введения по меньшей мере в одну клетку-хозяина, где оптимальные соотношения определяют путем оценки количества гетеродимерных пар H1-L1 и H2-L2, образованных при экспрессии H1, LI, Н2 и L2, по сравнению с ошибочно спаренными гетеродимерными парами H1-L2 и H2-L1, образующимися при экспрессии H1, L1, Н2 и L2;
c. выбор предпочтительного оптимального соотношения, причем трансфекция по меньшей мере одной клетки-хозяина указанным предпочтительным оптимальным соотношением полинуклеотидов набора полинуклеотидов приводит к экспрессии конструкции;
d. трансфекцию по меньшей мере одной клетки-хозяина оптимальным соотношением полинуклеотидов указанного набора полинуклеотидов; и
e. культивирование по меньшей мере одной клетки-хозяина, чтобы экспрессировать конструкцию.
31. Способ по п. 30, где выбор оптимального соотношения оценивают путем трансфекции в системе временной трансфекции.
32. Способ по любому из пп. 30 и 31, где трансфекция по меньшей мере одной клетки-хозяина предпочтительным оптимальным соотношением полинуклеотидов указанного набора полинуклеотидов приводит к оптимальной экспрессии конструкции.
33. Способ по любому из пп. 30 и 31, где конструкция содержит Fc, который содержит по меньшей мере две последовательности CH3, при этом Fc связан с первым гетеродимером и вторым гетеродимером при помощи одного или нескольких линкеров или без них.
34. Способ по п. 33, где Fc представляет собой гетеродимер, необязательно содержащий одну или несколько аминокислотных модификаций.
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| EP 1870459 A1, 26.12.2007 | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| KALOFF C.R., HAAS I.G., "Coordination of immunoglobulin chain folding and immunoglobulin chain assembly is essential for the formation of functional IgG." Immunity, 1995, 2(6): 629-637 | |||
| ДЕЕВ С.М., ЛЕБЕДЕНКО Е | |||
| Н., "Современные | |||
Авторы
Даты
2020-04-30—Публикация
2013-11-28—Подача