Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов IFNB1, IFNA14, IFNA2, IL12A, IL12B для повышения уровня экспрессии этих целевых генов, способ его получения и применения, штамм Escherichia coli SCS110-AF/VTvaf17-IFNB1 или Escherichia coli SCS110-AF/VTvaf17-IFNA14 или Escherichia coli SCS110-AF/VTvaf17-IFNA2 или Escherichia coli SCS110-AF/VTvaf17-IL12A или Escherichia coli SCS110-AF/VTvaf17-IL12B, несущий генотерапевтический ДНК-вектор, способ его получения, способ производства в промышленных масштабах генотерапевтического ДНК-вектора.
Область техники
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания препаратов генной терапии.
Уровень техники
Генная терапия - это современный медицинский подход, направленный на лечение наследственных и приобретенных заболеваний путем введения нового генетического материала в клетки пациента с целью компенсации или подавления функции мутантного гена и/или исправления генетического дефекта. Конечным продуктом экспрессии гена может являться молекула РНК или белка. Однако осуществление большей части физиологических процессов в организме связано с функциональной активностью белковых молекул, тогда как молекулы РНК являются либо промежуточным продуктом в синтезе белков, либо осуществляют регуляторные функции. Таким образом целью генной терапии является, в большинстве случаев, введение в организм генов, обеспечивающих транскрипцию и последующую трансляцию белковых молекул, кодируемых этими генами. В рамках описания настоящего изобретения под экспрессией гена подразумевается продукция белковой молекулы, аминокислотная последовательность которой кодируется этим геном.
Гены IFNB1, IFNA14, IL12A, IL12B, IFNA2, входящие в группу генов, играют ключевую роль в ряде процессов в организме человека и животных. Показана связь низких/недостаточных концентраций этих белков с различными неблагоприятными состояниями человека, которая, в ряде случаев, подтверждена нарушениями в нормальной экспрессии генов, кодирующих эти белки. Таким образом, генотерапевтическое повышение экспрессии гена, выбранного из группы генов IFNB1, IFNA14, IL12A, IL12B, IFNA2, обладает потенциалом для коррекции различных состояний человека и животных.
Интерфероны I типа важны для защиты от вирусных инфекций и являются одними из основных компонентов врожденного иммунитета. Кроме того, интерфероны I типа участвуют в клеточной дифференциации и противоопухолевой защите. После секреции в ответ на патоген интерфероны I типа связывают гомологичный рецепторный комплекс и индуцируют транскрипцию ряда генов, таких как кодирующие провоспалительные цитокины и хемокины. Мыши с отсутствием или сниженной экспрессией этого гена, демонстрируют несколько фенотипов, включая дефекты созревания В-клеток и повышенную восприимчивость к вирусной инфекции.
Помимо антивирусной активности интерфероны I типа (IFN-α / β) также опосредуют множество иммунорегуляторных эффектов. Функции иммуномодуляции предполагают, что IFN I типа могут обеспечивать связь между врожденными и адаптивными иммунными ответами. Известно, что IFN-α / β участвуют в индукции экспрессии MHC класса I и активации цитотоксических эффектов NK клеток и регулируют экспрессию других цитокинов.
В целом механизм действия интерферонов I типа может выглядеть следующим образом: в случае контролируемой вирусной инфекции или других «слабых» и опосредованных индукторов действие интерферонов I типа ограничено локальными эффектами. При условии активации IL-12 наряду с IFN-α / β, происходит стимулирование продукции IFN-γ CD4 Т клетками и, при экспозиции антигенов в составе MHC I, также CD8 T-клетками. В контексте распространения вирусной инфекции и высоких уровней индукции IFN-α / β также происходит активация цитотоксичности NK-клеток и преимущественная поляризация в сторону CD8-Т-клеточных реакций.
Ген IFNB1 кодирует цитокин интерферон 1 бета. Белок, кодируемый этим геном, относится к классу интерферонов I типа. В ряде экспериментальных работ противовирусные свойства IFNB1 предлагается использовать для контроля репликации ретровирусов, таких как ВИЧ. В экспериментах in vivo было показано, что трансфекция мононуклеарных клеток пациентов с ВИЧ ретровирусным вектором, экспрессирующим ген IFNB1, приводила к подавлению репликации ВИЧ по сравнению с контрольными клетками, трансплантация таких клеток экспериментальным мышам приводила к подавлению репликации ВИЧ до неопределяемого стандартными тестами уровня у 40% животных (Vieillard V et al., 1999). Аналогичные положительные результаты были получены в экспериментах на приматах (Gay W et al., 2004).
В отношении противораковой активности IFNB1 было продемонстрировано, что трансфекция клеток глиомы человека плазмидным вектором, экспрессирующим ген IFNB1, эффективно подавляло репликацию клеток in vitro (Mizuno M et al., 1990). Более того, трансфекция клеток меланомы вирусным вектором, экспрессирующим ген IFNB1, приводила к значительному увеличению эффективности блеомицина и, как результат, к гибели до 98% опухолевых клеток (Fondello C et al., 2018). Генетически модифицированные клетки, экспрессирующие ген IFNB1, также обладали противоопухолевой активностью в экспериментах in vivo на лабораторных животных, в том числе на мышиной модели метастазирующей хориокарциномы (Kim GS et al., 2018).
Рассеянный склероз (РС) среди аутоиммунных заболеваний является наиболее изученной патологией с точки зрения роли IFNB1. IFNB1 используется как действующее вещество во многих эффективных препаратах, используемых для терапии РС (Rebif, Betaseron, Avonex и др.). Генотерапевтический подход с использованием плазмидного вектора, экспрессирующего рекомбинантный модифицированный ген IFNB1, также рассматривается как перспективный подход к терапии РС (Hamana A et al., 2018).
Также показано, что экспрессия IFNB1 в нейронах играет роль в патогенезе болезни Паркинсона. Более того, введение лентивирусного вектора, экспрессирующего этот ген, мышам с экспериментальной моделью болезни Паркинсона, предотвращало развитие заболевания (Ejlerskov P et al., 2015).
В настоящий момент проводится начальная фаза клинических испытаний внутрисуставного введения аденоассоциированного вирусного вектора, экспрессирующего ген IFNB1, пациентам с ревматоидным артритом (NCT02727764).
Гены IFNA14, IFNA2 кодируют цитокины IFN-α подтипов 14 и 2 также относящиеся к интерферонам I типа. Все подтипы IFN-α связываются с одним и тем же рецептором интерферона I типа (IFNAR). Однако аффинность связывания разных подтипов варьирует, что приводит к индукции различных сигнальных путей и различным биологическим эффектам. Различия в эффективности разных подтипов были описаны при инфекции HSV, MCMV и вируса гриппа у мышей. В случае заражения ВИЧ-1 было показано, что IFN-α2 может играть роль самого патогенетически значимого подтипа, однако в этой работе оценивалось только шесть подтипов IFN-α с использованием адаптированного к лабораторным исследованиям штамма ВИЧ-1 (Sperber SJ et al., 1992). В работе Harper et al. было показано, что существует обратная зависимость между экспрессией подтипов IFN-α и эффективностью в снижении репликации ВИЧ-1 in vitro. Было обнаружено, что наиболее распространенные (под влиянием ВИЧ-инфекции) подтипы, IFN-α2 и -α1 / 13 были менее эффективны по сравнению с IFN-α6, -α14 и -α8 (Harper et al., 2015). В последующей работе с использованием плазмидных векторов, экспрессирующих различные подтипы IFN-I, было показано, что, хотя все подтипы IFN-I подавляют репликацию ВИЧ-1, эффект был более длительным у мышей, получавших плазмиды, экспрессирующие гены IFNB1, IFNA14 (Abraham S et al., 2016).
Таким образом существуют противоречивые данные о сравнительной эффективности различных интерферонов I типа для модуляции иммунологических процессов. Однако очевидно, что каждый из подтипов может быть использован в качестве основы для терапии аутоиммунных, вирусных и других состояний, связанных с дисбалансом иммунной системы.
Гены IL12A, IL12B кодируют субъединицы цитокина IL-12 – p35 и p40 соответственно. IL-12 является провоспалительным цитокином, продуцируемым дендритными клетками, макрофагами и В-клетками в ответ на инфекционные агенты. Индукция IL-12 стимулирует продукцию IFN-g Т-клетками и приводит к потенциированию презентации антигена, что облегчает дифференцировку TH1 клеток. IL-12 также может индуцировать продуцию IFN-g NK-клетками. Характер течения и исход многих инфекций зависит от способности возбудителя индуцировать синтез IL-12. Так, например, инфекция Candida albicans индуцирует синтез IL-12, и он способствует эффективной клеточной защите от возбудителя. Вирус иммунодефицита человека (HIV) ингибирует синтез IL-I2, c чем связаны многие дефекты клеточной защиты при СПИДе. Лейшмании, способные ингибировать синтез IL-12, вызывают хроническую инфекцию. Селективная ингибиция синтеза IL-12, даже при сохранении продукции других провоспалительных цитокинов (IL-1, TNF-a), позволяет возбудителям длительно персистировать в организме хозяина (Okwor I, Uzonna JE., 2016). Генотерапевтический подход с использованием плазмидных векторов, экспрессирующих IL-12, оказывал протективный эффект при инфекции лейшманиями и трипаносомами (Sakai T et al., 2000). Способность IL-12 поляризовать иммунный ответ в сторону Th1 позволила использовать его в качестве иммуномодулирующего агента при вакцинации, при этом в ряде работ был использован генотерапевтический подход (Tapia E et al., 2003).
Мутации в генах IL12A, IL12B ассоциированы с такими аутоиммунными заболеваниями как рассеянный склероз, системная красная волчанка, первичный билиарный цирроз, болезнь Бехчета, целиакия, синдром Шегрена и другие. Способность IL-12 стимулировать дендритные клетки и бустировать противоопухолевый иммунитет была исследована в многочисленных работах, в частности, с использованием генотерапевтического подхода, был показан противоопухолевый эффект (Razi Soofiyani S et al., 2016). В работе Denies и савт. плазмидный вектор, экспрессирующий ген IL-12, был успешно использован в комбинации с противоопухолевой вакцинацией, выступая при этом в роли генотерапевтического адьюванта, оказывающего иммуномдулирующее действие (Denies S et al., 2014).
Более того, поскольку субъединица р40, является общей для нескольких цитокинов из семейства IL-12, то модуляция экспрессии гена IL12B, в том числе с использованием генотерапевтического подхода, открывает потенциальные возможности воздействия на состояния, связанные с недостаточной экспрессией таких цитокинов как IL-23, IL-27 (Waldner MJ, Neurath MF, 2009).
Таким образом предшествующий уровень техники свидетельствует о том, гены IFNB1, IFNA14, IFNA2, IL12A, IL12B обладают потенциалом для коррекции ряда отклонений, включающих в себя, но не ограничивающихся, инфекционными, аутоиммунными заболеваниями, раком, наследственными и приобретенными патологическими состояниями, а также необходимостью модуляции иммунного ответа. Этим обусловлено объединение генов IFNB1, IFNA14, IFNA2, IL12A, IL12B в рамках данного патента в группу генов. Генетические конструкции, обеспечивающие экспрессию белков, кодируемых генами из группы IFNB1, IFNA14, IFNA2, IL12A, IL12B могут быть использованы для разработки лекарственных препаратов для предотвращения и терапии различных заболеваний и патологических состояний.
Более того, приведенные данные свидетельствуют о том, что недостаточная экспрессия белков, кодируемых генами IFNB1, IFNA14, IFNA2, IL12A, IL12B входящими в группу генов, связана не только с патологическими состояниями, но и с предрасположенность к их развитию. Также приведенные данные свидетельствуют о том, что недостаточная экспрессия данных белков может не проявляться в явном виде в форме патологии, которая может быть однозначно описана в рамках существующих стандартов клинической практики (например, с применением кода МКБ), однако при этом вызывать состояния, которые неблагоприятны для человека и животных и связанны с ухудшением качества жизни.
Анализ подходов для повышения экспрессии целевых генов подразумевает возможность использования различных генотерапевтических векторов.
Генотерапевтические векторы разделяют на вирусные, клеточные и ДНК-векторы (Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal Products EMA/CAT/80183/2014). В последнее время в генной терапии всё большее внимание уделяется разработке невирусных систем доставки генетического материала, среди которых лидируют плазмидные векторы. Плазмидные векторы лишены недостатков, присущих клеточным и вирусным векторам. В клетке-мишени они существуют в эписомальной форме, не интегрируют в геном, производство их достаточно дешево, отсутствие иммунного ответа и побочных реакций на введение плазмидного вектора делают их удобным инструментом генной терапии и генетической профилактики (ДНК-вакцины) (Li L, Petrovsky N. // Expert Rev Vaccines. 2016;15(3):313-29).
Тем не менее, ограничениями для использования плазмидных векторов для генной терапии являются: 1) наличие генов устойчивости к антибиотикам для наработки в бактериальных штаммах, 2) наличие различных регуляторных элементов, представленных последовательностями вирусных геномов 3) размер терапевтического плазмидного вектора, определяющий эффективность проникновения вектора в клетку-мишень.
Известно, что Европейское агентство по лекарственным средствам считает необходимым избегать введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011 EMA/CAT/GTWP/44236/2009 Committee for advanced therapies). Данная рекомендация связана, в первую очередь, с потенциальной опасностью проникновения ДНК-вектора или горизонтального переноса генов антибиотикорезистентности в клетки бактерий, представленных в организме в составе нормальной или оппортунистической микрофлоры. Помимо этого, наличие генов антибиотикорезистентности значительно увеличивает размер ДНК-вектора, что приводит к снижению эффективности его проникновения в эукариотические клетки.
Необходимо отметить, что гены антибиотикорезистентности также вносят принципиальный вклад в способ получения ДНК-векторов. В случае наличия генов антибиотикорезистентности штаммы для наработки ДНК-векторов обычно культивируются в среде, содержащей селективный антибиотик, что создает риск наличия следовых количеств антибиотика в недостаточно очищенных препаратах ДНК-векторов. Таким образом, получение ДНК-векторов для генной терапии, в которых отсутствуют гены антибиотикорезистентности, связано с получением штаммов, обладающих такой отличительной особенностью как способность к стабильной амплификации целевых ДНК-векторов в среде без содержания антибиотиков.
Кроме того, Европейское Медицинское Агентство рекомендует избегать наличия в составе терапевтических плазмидных векторов регуляторных элементов для повышения экспрессии целевых генов (промоторов, энхансеров, посттрансляционных регуляторных элементов), являющихся нуклеотидными последовательностями геномов различных вирусов (Draft Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products,http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2015/05/WC500187020.pdf). Данные последовательности, хотя и могут увеличивать уровень экспрессии целевого трансгена, однако создают риск рекомбинации с генетическим материалом вирусов дикого типа и интеграции в геном эукариотической клетки. Более того, целесообразность гиперэкспрессии того или иного гена в целях терапии остается нерешенным вопросом.
Также, существенным моментом является размер терапевтического вектора. Известно, что современные плазмидные векторы зачастую перегружены нефункциональными участками, серьезно увеличивающими размер вектора (Mairhofer J, Grabherr R. // Mol Biotechnol. 2008.39(2):97-104). Например, ген устойчивости к ампициллину в векторах серии pBR322, как правило, состоит из не менее чем 1000 п.н., что составляет более 20% от размера самого вектора. При этом наблюдается обратная зависимость между размером вектора и его способностью проникать в эукариотические клетки – ДНК-векторы с небольшим размером эффективней проникаю в клетки человека и животных. Так, например, в серии экспериментов по трансфекции клеток HELA ДНК-векторами с размером от 383 до 4548 п.н. было показано, что разница в эффективности проникновения может достигать двух порядков (отличаться в 100 раз) (Hornstein BD et al. // PLoS ONE. 2016;11(12): e0167537.).
Таким образом при выборе ДНК-вектора в целях безопасности и наибольшей эффективности следует отдавать предпочтение тем конструкциям, в которых не содержатся гены устойчивости к антибиотикам, последовательности вирусного происхождения и размер которых позволяет эффективно проникать в эукариотические клетки. Штамм для получения такого ДНК-вектора в количествах, достаточных для целей генной терапии, должен обеспечивать возможность стабильной амплификации ДНК-вектора с использованием питательных сред, не содержащих антибиотики.
Примером использования рекомбинантных ДНК-векторов для генной терапии является способ получения рекомбинантного вектора для генетической иммунизации по патенту US 9550998 В2. Вектор представляет собой суперскрученный плазмидный ДНК-вектор и предназначен для экспрессии клонированных генов в клетках животных и человека. Вектор состоит из ориджина репликации, регуляторных элементов, включающих промотор и энхансер цитомегаловируса человека, регуляторные элементы из Т-лимфотропного вируса человека.
Накопление вектора проводят в специальном штамме E. coli без использования антибиотиков за счет антисенс-комплементации гена sacB, введенного в штамм посредством бактериофага. Недостатком данного изобретения является наличие в составе ДНК-вектора регуляторных элементов, представляющих собой последовательности вирусных геномов.
Прототипами настоящего изобретения в части использования генотерапевтических подходов для повышения уровня экспрессии генов из группы IFNB1, IFNA14, IFNA2, IL12A, IL12B являются следующие заявки.
В патенте US4808523A описан плазмидный вектор, несущий ген, кодирующий IFNB1. Данный вектор позволяет повышать экспрессию IFNB1 в клетках млекопитающих. Недостатком данного изобретения является способ использования, ограниченный продукцией белка IFNB1 в условиях in vitro и отличный от генотерапевтического использования данного вектора. Также недостатком данного изобретения является наличие в составе вектора последовательностей вирусного происхождения.
В заявке US20040203118A1 описаны полинуклеотиды, кодирующие различные варианты IFNA14, а также терапевтическое средство, представляющее собой вектор, экспрессирующий различные варианты IFNA14. Недостатком данного изобретения является неопределенность целей использования данного изобретения и неопределенные требования к безопасности используемых векторов.
В заявке CN101304758A описана нуклеотидная последовательность, кодирующая IFNA2, а также вектор, экспрессирующий данную последовательность для терапии различных заболеваний, связанных с нарушением экспрессии этого гена. Недостатком данного изобретения является неопределенность требований к безопасности используемого вектора.
В патенте US5723127A описан способ использования белка IL12 для терапевтической иммуномодуляции, в частности в качестве адъюванта. Недостатком данного изобретения является использование белка IL12 вместо генотерапевтического вектора, экспрессирующего ген, кодирующий белок IL12.
Раскрытие изобретения
Задачей изобретения является конструирование генотерапевтических ДНК-векторов для повышения уровня экспрессии группы генов IFNB1, IFNA14, IFNA2, IL12A, IL12B в организме человека и животных, сочетающих в себе следующие свойства:
I) Эффективность генотерапевтического ДНК-вектора для повышения уровня экспрессии целевых генов в эукариотических клетках.
II) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов.
III) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора генов антибиотикорезистентности.
IV) Технологичность получения и возможность наработки генотерапевтического ДНК-вектора в промышленных масштабах.
Пункты II и III предусмотрены в данном техническом решении в соответствии с рекомендациями государственных регуляторов к лекарственным средствам для генной терапии, в частности, Европейского Агентства по лекарственным средствам касательно отказа от введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011, EMA/CAT/GTWP/44236/2009 Committee for advanced therapies) и касательно отказа от введения в разрабатываемые плазмидные векторы для генной терапии элементов вирусных геномов (Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products / 23 March 2015, EMA/CAT/80183/2014, Committee for Advanced Therapies).
Задачей изобретения также является конструирование штаммов, несущих эти генотерапевтические ДНК-вектора, для наработки и производства в промышленных масштабах генотерапевтических ДНК-векторов.
Поставленная задача решается за счет того, что создан генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов IFNB1, IFNA14, IFNA2, IL12A, IL12B для повышения уровня экспрессии этого целевого гена в организме человека и животных, при этом генотерапевтический ДНК-вектор VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B имеет нуклеотидную последовательность SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 соответственно. При этом каждый из созданных генотерапевтических ДНК-векторов: VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B за счет ограниченного размера векторной части VTvaf17, не превышающей 3200 п.н., обладает способностью эффективно проникать в клетки и экспрессировать клонированный в него целевой ген, выбранный из группы генов IFNB1, IFNA14, IFNA2, IL12A, IL12B соответственно. В составе генотерапевтического ДНК-вектора отсутствуют нуклеотидные последовательности вирусного происхождения и отсутствуют гены антибиотикорезистентности, обеспечивая возможность его безопасного применения для генетической терапии человека и животных.
Создан также способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ген IFNB1, ген IFNA14, ген IFNA2, ген IL12A, ген IL12B, который заключается в том, что каждый из генотерапевтических ДНК-векторов: VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B получают следующим образом: кодирующую часть целевого гена из группы IFNB1, или IFNA14, или IFNA2, или IL12A, или IL12B клонируют в ДНК-вектор VTvaf17 и получают генотерапевтический ДНК-вектор VTvaf17-IFNB1, SEQ ID №1, или VTvaf17-IFNA14, SEQ ID №2 или VTvaf17-IFNA2, SEQ ID №3, или VTvaf17-IL12A, SEQ ID №4, или VTvaf17-IL12B, SEQ ID №5 соответственно.
Способ применения созданного генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ген IFNB1, ген IFNA14, ген IFNA2, ген IL12A, ген IL12B для повышения уровня экспрессии этих целевых генов, заключается во введении выбранного генотерапевтического ДНК-вектора или нескольких выбранных генотерапевтических ДНК-векторов в клетки, органы и ткани человека или животного, и/или во введении в органы и ткани человека или животного аутологичных клеток человека или животного, трансфицированных выбранным генотерапевтическим ДНК-вектором или несколькими выбранными генотерапевтическими ДНК-векторами, или в сочетании обозначенных способов.
Способ получения штамма Escherichia coli SCS110-AF/VTvaf17-IFNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA14, или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA2, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12A или штамма Escherichia coli SCS110-AF/VTvaf17-IL12B заключается в электропорации компетентных клеток штамма Escherichia coli SCS110-AF созданным генотерапевтическим ДНК-вектором и последующей селекцией стабильных клонов штамма с использованием селективной среды.
Заявлен штамм Escherichia coli SCS110-AF/VTvaf17-IFNB1, или штамм Escherichia coli SCS110-AF/VTvaf17-IFNA14, или штамм Escherichia coli SCS110-AF/VTvaf17-IFNA2, или штамм Escherichia coli SCS110-AF/VTvaf17-IL12A или штамм Escherichia coli SCS110-AF/VTvaf17-IL12B, несущий генотерапевтический ДНК-вектор для его наработки с возможностью культивирования штамма без использования антибиотиков.
Способ производства в промышленных масштабах генотерапевтического ДНК-вектора заключается в масштабировании бактериальной культуры штамма до количеств, необходимых для наращивания бактериальной биомассы в промышленном ферментере, после чего биомассу используют для выделения фракции, содержащей целевой ДНК-продукт - генотерапевтический ДНК-вектор VTvaf17-IFNB1 или VTvaf17-IFNA14 или VTvaf17-IFNA2 или VTvaf17-IL12A многостадийно фильтруют и очищают хроматографическими методами.
Краткое описание чертежей
На фиг.1
приведена схема генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов IFNB1, IFNA14, IFNA2, IL12A, IL12B, который представляет собой кольцевую двуцепочечную молекулу ДНК, способную к автономной репликации в клетках бактерии Escherichia coli.
На фиг.1 приведены схемы, соответствующие:
A - генотерапевтический ДНК-вектор VTvaf17-IFNB1,
B - генотерапевтический ДНК-вектор VTvaf17-IFNA14,
C - генотерапевтический ДНК-вектор VTvaf17-IFNA2,
D - генотерапевтический ДНК-вектор VTvaf17-IL12A,
E - генотерапевтический ДНК-вектор VTvaf17-IL12B.
На схемах отмечены следующие структурные элементы вектора:
EF1a - промоторная область гена человеческого фактора элонгации EF1A с собственным энхансером, содержащимся в первом интроне гена. Служит для обеспечения высокого уровня транскрипции рекомбинантного гена в большинстве тканей человека;
Рамка считывания целевого гена, соответствующая кодирующей части гена IFNB1 (фиг. 1A), или IFNA14 (фиг. 1B), или IFNA2 (фиг. 1C), или IL12A (фиг. 1D) или IL12B (фиг. 1E) соответственно;
hGH-TA – терминатор транскрипции и сайт полиаденилирования гена фактора роста человека;
ori – ориджин репликации, служащий для автономной репликации с однонуклеотидной заменой для повышения копийности плазмиды в клетках большинства штаммов Escherichia coli;
RNA-out – регуляторный элемент РНК-out транспозона Tn 10, обеспечивающий возможность положительной селекции без использования антибиотиков при использовании штамма Eshcerichia coli SCS 110.
Отмечены уникальные сайты рестрикции.
На фиг.2
показаны графики накопления ампликонов кДНК целевого гена, а именно, гена IFNB1, в культуре клеток нормального бронхиального эпителия человека BEAS-2B (ATCC® CRL-9609™) до их трансфекции и через 48 часов после трансфекции этих клеток генотерапевтическим ДНК-вектором VTvaf17-IFNB1 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.2 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 – кДНК гена IFNB1 в культуре клеток BEAS-2B до трансфекции ДНК-вектором VTvaf17-IFNB1;
2 – кДНК гена IFNB1 в культуре клеток BEAS-2B после трансфекции ДНК-вектором VTvaf17-IFNB1;
3 – кДНК гена B2M в культуре клеток BEAS-2B до трансфекции ДНК-вектором VTvaf17-IFNB1;
4 – кДНК гена B2M в культуре клеток BEAS-2B после трансфекции ДНК-вектором VTvaf17-IFNB1.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.3
показаны графики накопления ампликонов кДНК целевого гена, а именно гена IFNA14, в культуре мононуклеарных клеток периферической крови (PBMC) человека до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-IFNA14 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.3 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена IFNA14 в культуре PBMC до трансфекции ДНК-вектором VTvaf17-IFNA14;
2 – кДНК гена IFNA14 в культуре PBMC после трансфекции ДНК-вектором VTvaf17-IFNA14;
3 - кДНК гена B2M в культуре PBMC до трансфекции ДНК-вектором VTvaf17-IFNA14;
4 - кДНК гена B2M в культуре PBMC после трансфекции ДНК-вектором VTvaf17-IFNA14.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.4
показаны графики накопления ампликонов кДНК целевого гена, а именно гена IFNA2 в клетках культуры фибробластов десен человека линии HGF-1 (ATCC® CRL-2014™) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-IFNA2 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.4 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена IFNA2 в клетках фибробластов десен человека линии HGF-1 до трансфекции ДНК-вектором VTvaf17-IFNA2;
2 – кДНК гена IFNA2 в клетках фибробластов десен человека линии HGF-1 после трансфекции ДНК-вектором VTvaf17-IFNA2;
3 - кДНК гена B2M в клетках фибробластов десен человека линии HGF-1 до трансфекции ДНК-вектором VTvaf17-IFNA2:
4 - кДНК гена B2M в клетках фибробластов десен человека линии HGF-1 после трансфекции ДНК-вектором VTvaf17-IFNA2.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.5
показаны графики накопления ампликонов кДНК целевого гена, а именно гена IL12A, в культуре клеток нормального бронхиального эпителия человека BEAS-2B (ATCC® CRL-9609™) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-IL12A с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.5 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена IL12A в культуре клеток BEAS-2B до трансфекции ДНК-вектором VTvaf17-IL12A;
2 – кДНК гена IL12A в культуре клеток BEAS-2B после трансфекции ДНК-вектором VTvaf17-IL12A;
3 - кДНК гена B2M в культуре клеток BEAS-2B до трансфекции ДНК-вектором VTvaf17-IL12A;
4 - кДНК гена B2M в культуре клеток BEAS-2B после трансфекции ДНК-вектором VTvaf17-IL12A.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.6
показаны графики накопления ампликонов кДНК целевого гена, а именно гена IL12B, в культуре клеток BEAS-2B (ATCC® CRL-9609™) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-IL12B с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.6 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена IL12B в культуре клеток BEAS-2B до трансфекции ДНК-вектором VTvaf17-IL12B;
2 – кДНК гена IL12B в культуре клеток BEAS-2B после трансфекции ДНК-вектором VTvaf17-IL12B;
3 - кДНК гена B2M в культуре клеток BEAS-2B до трансфекции ДНК-вектором VTvaf17-IL12B;
4 - кДНК гена B2M в культуре клеток BEAS-2B после трансфекции ДНК-вектором VTvaf17-IL12B.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.7
показана диаграмма концентрации белка IFNB1 в клеточном лизате культуры клеток нормального бронхиального эпителия человека BEAS-2B (ATCC® CRL-9609™) после трансфекции этих клеток ДНК-вектором VTvaf17- IFNB1 с целью оценки функциональной активности, то есть экспрессии на уровне белка, по изменению количества белка IFNB1 в лизате клеток.
На фиг.7 отмечены следующие элементы:
культура А – культура BEAS-2B, трансфицированная водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура BEAS-2B, трансфицированных ДНК-вектором VTvaf17;
культура C - культура BEAS-2B, трансфицированных ДНК-вектором VTvaf17-IFNB1.
На фиг. 8
показана диаграмма концентрации белка IFNA14 в лизате клеток культуры мононуклеарных клеток периферической крови (PBMC) человека, после трансфекции этих клеток ДНК-вектором VTvaf17-IFNA14 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген IFNA14.
На фиг.8 отмечены следующие элементы:
культура А - культура PBMC, трансфицированная водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура PBMC, трансфицированная ДНК-вектором VTvaf17;
культура C - культура PBMC, трансфицированных ДНК-вектором VTvaf17-IFNA14.
На фиг.9
показана диаграмма концентрации белка IFNA2 в лизате культуры клеток фибробластов десен человека линии HGF-1 (ATCC® CRL-2014™) после трансфекции этих клеток ДНК-вектором VTvaf17-IFNA2 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген IFNA2.
На фиг.9 отмечены следующие элементы:
культура А - культура клеток фибробластов десен человека линии HGF-1, трансфицированных водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура клеток фибробластов десен человека линии HGF-1, трансфицированных ДНК-вектором VTvaf17;
культура C - культура клеток фибробластов десен человека линии HGF-1, трансфицированных ДНК-вектором VTvaf17-IFNA2.
На фиг. 10
показана диаграмма концентрации белка IL12A в лизате культуры клеток человеческих хондроцитов Human Chondrocytes (HC) (Cell Applications, Inc Кат. 402K-05a) после трансфекции этих клеток ДНК-вектором VTvaf17-IL12A с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген IL12A.
На фиг.10 отмечены следующие элементы:
культура А - культура клеток человеческих хондроцитов Human Chondrocytes (HC), трансфицированных водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура клеток человеческих хондроцитов Human Chondrocytes (HC), трансфицированных ДНК-вектором VTvaf17;
культура C - культура клеток человеческих хондроцитов Human Chondrocytes (HC), трансфицированных ДНК-вектором VTvaf17-IL12A.
На фиг. 11
показана диаграмма концентрации белка IL12B в лизате культуры клеток нормального бронхиального эпителия человека BEAS-2B (ATCC® CRL-9609™) после трансфекции этих клеток ДНК-вектором VTvaf17-IL12B с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген IL12B.
На фиг.10 отмечены следующие элементы:
культура А - культура клеток BEAS-2B, трансфицированных водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура клеток BEAS-2B, трансфицированных ДНК-вектором VTvaf17;
культура C - культура клеток BEAS-2B, трансфицированных ДНК-вектором VTvaf17-IL12B.
На фиг. 12
показана диаграмма концентрации белка IL12A в биоптатах кожи трех пациентов после введения в кожу этих пациентов генотерапевтического ДНК-вектора VTvaf17-IL12A с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген IL12A.
На фиг.12 отмечены следующие элементы:
П1I – биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17-IL12A;
П1II – биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III – биоптат кожи пациента П1 из интактного участка;
П2I – биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17-IL12A;
П2II – биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III – биоптат кожи пациента П2 из интактного участка;
П3I – биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17-IL12A;
П3II – биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III – биоптат кожи пациента П3 из интактного участка.
На фиг. 13
показана диаграмма концентрации белка IFNA2 в биоптатах икроножной мышцы трех пациентов после введения в икроножную мышцу этих пациентов генотерапевтического ДНК-вектора VTvaf17- IFNA2, с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген IFNA2.
На фиг.13 отмечены следующие элементы:
П1I – биоптат икроножной мышцы пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17- IFNA2;
П1II – биоптат икроножной мышцы пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III – биоптат интактного участка икроножной мышцы пациента П1;
П2I – биоптат икроножной мышцы пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17- IFNA2;
П2II – биоптат икроножной мышцы пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III – биоптат интактного участка икроножной мышцы пациента П2;
П3I – биоптат икроножной мышцы пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17- IFNA2;
П3II – биоптат икроножной мышцы пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III – биоптат интактного участка икроножной мышцы пациента П3.
На фиг.14
показана диаграмма концентрации белка IFNA14 в биоптатах кожи трех пациентов после введения в кожу этих пациентов генотерапевтического ДНК-вектора VTvaf17-IFNA14 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген IFNA14.
На фиг.14 отмечены следующие элементы:
П1I – биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17-IFNA14;
П1II – биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III – биоптат кожи пациента П1 из интактного участка;
П2I – биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17-IFNA14;
П2II – биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III – биоптат кожи пациента П2 из интактного участка;
П3I – биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17-IFNA14;
П3II – биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III – биоптат кожи пациента П3 из интактного участка.
На фиг. 15
показана диаграмма концентрации белка IFNA14 в биоптатах кожи человека после введения в кожу культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-IFNA14 с целью демонстрации способа применения путем введения аутологичных клеток, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-IFNA14.
На фиг.15 отмечены следующие элементы:
П1С – биоптат кожи пациента П1 в зоне введения культуры аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-IFNA14;
П1B – биоптат кожи пациента П1 в зоне введения аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17;
П1А – биоптат кожи пациента П1 из интактного участка.
На фиг. 16
показана диаграмма концентраций белков: белка IFNB1 человека, белка IFNA14 человека, белка IFNA2 человека, белка IL12A человека, белка IL12B человека в мышечной ткани трех крыс линии Wistar после инъекционного введения смеси генотерапевтических векторов: генотерапевтического ДНК-вектора VTvaf17-IFNB1, генотерапевтического ДНК-вектора VTvaf17-IFNA14, генотерапевтического ДНК-вектора VTvaf17-IFNA2, генотерапевтического ДНК-вектора VTvaf17-IL12A, генотерапевтического ДНК-вектора VTvaf17-IL12B с целью демонстрации способа применения смеси генотерапевтических ДНК-векторов.
На фиг.16 отмечены следующие элементы:
К1I – фрагмент мышечной ткани крысы К1 в зоне введения смеси генотерапевтических ДНК векторов: VTvaf17- IFNB1, VTvaf17- IFNA14, VTvaf17- IFNA2, VTvaf17- IL12A и VTvaf17- IL12B;
К1II – фрагмент мышечной ткани крысы К1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
К1III – фрагмент мышечной ткани контрольного интактного участка крысы К1;
К2I – фрагмент мышечной ткани крысы К2 в зоне введения смеси генотерапевтических ДНК векторов: VTvaf17- IFNB1, VTvaf17- IFNA14, VTvaf17- IFNA2, VTvaf17- IL12A и VTvaf17- IL12B;
К2II – фрагмент мышечной ткани крысы К2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
К2III – фрагмент мышечной ткани контрольного интактного участка крысы К2;
К3I – фрагмент мышечной ткани крысы К3 в зоне введения смеси генотерапевтических ДНК векторов: VTvaf17- IFNB1, VTvaf17- IFNA14, VTvaf17- IFNA2, VTvaf17- IL12A и VTvaf17- IL12B;
К3II – фрагмент мышечной ткани крысы К3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
К3III – фрагмент мышечной ткани контрольного интактного участка крысы К3.
На фиг. 17
показаны графики накопления ампликонов кДНК целевого гена IFNA2 в мононуклеарных клетках периферической крови (PBMC) быка до и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-IFNA2 с целью демонстрации способа применения путем введения генотерапевтического ДНК-вектора животным.
На фиг.17 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена IFNA2 в клетках PBMC быка до трансфекции генотерапевтическим ДНК-вектором VTvaf17- IFNA2;
2 – кДНК гена IFNA2 в клетках PBMC быка после трансфекции генотерапевтическим ДНК-вектором VTvaf17- IFNA2;
3 - кДНК гена ACT в клетках PBMC быка до трансфекции генотерапевтическим ДНК-вектором VTvaf17- IFNA2;
4 - кДНК гена ACT в клетках PBMC быка после трансфекции генотерапевтическим ДНК-вектором VTvaf17- IFNA2;
В качестве референтного гена использовали ген актина быка/ коровы (АСТ), приведенного в базе данных GenBank под номером AH001130.2.
Реализация изобретения
На основе ДНК-вектора VTvaf17 размером 3165 п.н. созданы генотерапевтические ДНК-векторы, несущие целевые гены человека, предназначенные для повышения уровня экспрессии этих целевых генов в тканях человека и животных. При этом способ получения каждого генотерапевтического ДНК-вектора, несущего целевые гены заключается в том, что в полилинкер генотерапевтического ДНК-вектора VTvaf17 клонируют белок-кодирующую последовательность целевого гена, выбранного из группы генов: ген IFNB1 (кодирует белок IFNB1), ген IFNA14 (кодирует белок IFNA14), ген IFNA2 (кодирует белок IFNA2), ген IL12A (кодирует белок IL12A), ген IL12B (кодирует белок IL12B) человека. Известно, что способность ДНК-векторов проникать в эукариотические клетки обусловлена, главным образом, размером вектора. При этом ДНК-вектора с наименьшим размером обладают более высокой проникающей способностью. Таким образом, предпочтительным является отсутствие в составе вектора элементов, которые не несут функциональной нагрузки, но при этом увеличивают размер ДНК-вектора. Данные особенности ДНК-векторов были учтены при получении генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов IFNB1, IFNA14, IFNA2, IL12A, IL12B путем отсутствия в составе вектора крупных нефункциональных последовательностей и генов антибиотикорезистентности, что позволило, помимо технологических преимуществ и преимуществ в плане безопасности применения, значительно уменьшить размер полученного генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов IFNB1, IFNA14, IFNA2, IL12A, IL12B. Таким образом, способность проникать в эукариотические клетки полученного генотерапевтического ДНК-вектора обусловлена его небольшими размерами.
Каждый из генотерапевтических ДНК-векторов: ДНК-вектор VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B получали следующим образом: кодирующую часть целевого гена IFNB1, или IFNA14, или IFNA2, или IL12A, или IL12B клонировали в генотерапевтический ДНК-вектор VTvaf17 и получали генотерапевтический ДНК-вектор VTvaf17-IFNB1, SEQ ID №1, или VTvaf17-IFNA14, SEQ ID №2 или VTvaf17-IFNA2, SEQ ID №3, или VTvaf17-IL12A, SEQ ID №4, или VTvaf17-IL12B, SEQ ID №5 соответственно. Кодирующую часть гена IFNB1 размером 565 п.н., или гена IFNA14 размером 571 п.н., или гена IFNA2 размером 568 п.н., или гена IL12A размером 766 п.н., или гена IL12B размером 988 п.н. получали путем выделения суммарной РНК из биологического образца ткани здорового человека. Для получения первой цепи кДНК генов IFNB1, IFNA14, IFNA2, IL12A, IL12B человека использовали реакцию обратной транскрипции. Амплификацию проводили с использованием созданных для этого методом химического синтеза олигонуклеотидов. Расщепление продукта амплификации специфическими эндонуклеазами рестрикции проводили с учетом оптимальной процедуры дальнейшего клонирования, причем клонирование в генотерапевтический ДНК-вектор VTvaf17 проводили по сайтам рестрикции BamHI, EcoRI, HindIII, KpnI, SalI, расположенными в полилинкере вектора VTvaf17. Выбор сайтов рестрикции проводили таким образом, чтобы клонированный фрагмент попадал в рамку считывания экспрессионной кассеты вектора VTvaf17, при этом белок-кодирующая последовательность не содержала сайты рестрикции для выбранных эндонуклеаз. При этом специалистам в данной области техники понятно, что методическая реализация получения генотерапевтического ДНК-вектора VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B может варьировать в рамках выбора известных методов молекулярного клонирования генов, при этом эти способы подпадают под объем настоящего изобретения. Так, например, могут быть использованы различные последовательности олигонуклеотидов для амплификации гена IFNB1, или IFNA14, или IFNA2, или IL12A, или IL12B различные эндонуклеазы рестрикции или такие лабораторные техники как безлигазное клонирование генов.
Генотерапевтический ДНК-вектор VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B обладает нуклеотидной последовательностью SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 соответственно. При этом специалистам в данной области техники известно свойство вырожденности генетического кода, из которого следует, что под объем настоящего изобретения также подпадают варианты нуклеотидных последовательностей, отличающихся инсерцией, делецией или заменой нуклеотидов, которые не приводят к изменению полипептидной последовательности, кодируемой целевым геном, и/или не приводят к потере функциональной активности регуляторных элементов вектора VTvaf17. При этом специалистам в данной области техники известно явление генетического полиморфизма, из которого следует, что под объем настоящего изобретения также подпадают варианты нуклеотидных последовательностей генов из группы генов IFNB1, IFNA14, IFNA2, IL12A, IL12B которые при этом кодируют различные варианты аминокислотных последовательностей белков IFNB1, IFNA14, IFNA2, IL12A, IL12B не отличающихся от приведенных по своей функциональной активности при физиологических условиях.
Способность проникать в эукариотические клетки и функциональную активность, то есть способность экспрессировать целевой ген, полученного генотерапевтического ДНК-вектора VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B подтверждают путем введения в эукариотические клетки полученного вектора и последующим анализом экспрессии специфической мРНК и/или белкового продукта целевого гена. Наличие специфической мРНК в клетках, в которые был введен генотерапевтический ДНК-вектор VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B свидетельствует как о способности полученного вектора проникать в эукариотические клетки, так и о его способности экспрессировать мРНК целевого гена. При этом, как известно специалистам в данной области техники, наличие мРНК гена является обязательным условием, но не доказательством трансляции белка, кодируемого целевым геном. Поэтому для подтверждения свойства генотерапевтического ДНК-вектора VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B экспрессировать целевой ген на уровне белка в эукариотических клетках, в которые был введен генотерапевтический ДНК-вектор, проводят анализ концентрации белков, кодируемых целевыми генами, с использованием иммунологических методов. Наличие белка IFNB1, или IFNA14, или IFNA2, или IL12A, или IL12B подтверждает эффективность экспрессии целевых генов в эукариотических клетках и возможность повышения уровня концентрации белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов IFNB1, IFNA14, IFNA2, IL12A, IL12B. Таким образом для подтверждения эффективности экспрессии созданного генотерапевтического ДНК-вектора VTvaf17-IFNB1, несущего целевой ген, а именно, ген IFNB1, генотерапевтического ДНК-вектора VTvaf17-IFNA14, несущего целевой ген, а именно, ген IFNA14, генотерапевтического ДНК-вектора VTvaf17-IFNA2, несущего целевой ген, а именно, ген IFNA2, генотерапевтического ДНК-вектора VTvaf17-IL12A, несущего целевой ген, а именно, ген IL12A, генотерапевтического ДНК-вектора VTvaf17-IL12B, несущего целевой ген, а именно, ген IL12B, использовали следующие методы:
А) ПЦР в реальном времени - изменение накопления ампликонов кДНК целевых генов в лизате клеток человека и животного, после трансфекции различных клеточных линий человека и животного генотерапевтическим ДНК-векторами;
B) Иммуноферментный анализ - изменение количественного уровня целевых белков в лизате клеток человека, после трансфекции различных клеточных линий человека генотерапевтическими ДНК-векторами;
C) Иммуноферментный анализ - изменение количественного уровня целевых белков в супернатанте биоптатов тканей человека и животного, после введения в эти ткани генотерапевтических ДНК-векторов;
D) Иммуноферментный анализ - изменение количественного уровня целевых белков в супернатанте биоптатов тканей человека, после введения в эти ткани аутологичных клеток этого человека, трансфицированных генотерапевтическими ДНК-векторами.
Для подтверждения реализуемости способа применения созданного генотерапевтического ДНК-вектора VTvaf17-IFNB1, несущего целевой ген, а именно, ген IFNB1, генотерапевтического ДНК-вектора VTvaf17-IFNA14, несущего целевой ген, а именно, ген IFNA14, генотерапевтического ДНК-вектора VTvaf17-IFNA2, несущего целевой ген, а именно, ген IFNA2, генотерапевтического ДНК-вектора VTvaf17-IL12A, несущего целевой ген, а именно, ген IL12A, генотерапевтического ДНК-вектора VTvaf17-IL12B, несущего целевой ген, а именно, ген IL12B, выполняли:
А) трансфекцию генотерапевтическими ДНК-векторами различных клеточных линий человека и животного;
B) введение генотерапевтических ДНК-векторов в различные ткани человека и животного;
С) введение в ткани животного смеси генотерапевтических ДНК-векторов;
D) введение в ткани человека аутологичных клеток, трансфицированных генотерапевтическими ДНК-векторами.
Указанные способы применения характеризуются отсутствием потенциальных рисков для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов, и за счет отсутствия в составе генотерапевтического ДНК-вектора генов устойчивости к антибиотикам, что подтверждается отсутствием участков, гомологичных вирусным геномам и генам антибиотикорезистентности в нуклеотидных последовательностях генотерапевтического ДНК-вектора VTvaf17-IFNB1, или генотерапевтического ДНК-вектора VTvaf17-IFNA14, или генотерапевтического ДНК-вектора VTvaf17-IFNA2, или генотерапевтического ДНК-вектора VTvaf17-IL12A или генотерапевтического ДНК-вектора VTvaf17-IL12B (SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 соответственно).
Как известно специалистам в данной области техники, гены антибиотикорезистентности в составе генотерапевтических ДНК-векторов используются с целью получения этих векторов в препаративных количествах путем наращивания бактериальной биомассы в питательной среде, содержащей селективный антибиотик. В рамках настоящего изобретения в целях возможности безопасного применения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген IFNB1 или IFNA14 или IFNA2 или IL12A или IL12B, использование селективных питательных сред, содержащих антибиотик, не представляется возможным. В качестве технологического решения для получения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов IFNB1, IFNA14, IFNA2, IL12A, IL12B для возможности масштабирования до промышленных масштабов получения генотерапевтических векторов предлагается способ получения штаммов для наработки указанных генотерапевтических векторов на основе бактерии Escherichia coli SCS110-AF. Способ получения штамма Escherichia coli SCS110-AF/VTvaf17-IFNB1 или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA14, или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA2, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12A или штамма Escherichia coli SCS110-AF/VTvaf17-IL12B заключается в получении компетентных клеток штамма Escherichia coli SCS110-AF с введением в эти клетки генотерапевтического ДНК-вектора VTvaf17-IFNB1, или ДНК-вектора VTvaf17-IFNA14, или ДНК-вектора VTvaf17-IFNA2, или ДНК-вектора VTvaf17-IL12A, или ДНК-вектора VTvaf17-IL12B соответственно с помощью методов трансформации (электропорации), общеизвестных специалистам в данной области техники. Полученный штамм Escherichia coli SCS110-AF/VTvaf17-IFNB1, или штамм Escherichia coli SCS110-AF/VTvaf17-IFNA14, или штамм Escherichia coli SCS110-AF/VTvaf17-IFNA2, или штамм Escherichia coli SCS110-AF/VTvaf17-IL12A, или штамм Escherichia coli SCS110-AF/VTvaf17-IL12B используется для наработки генотерапевтического ДНК-вектора VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B соответственно с возможностью использования сред без содержания антибиотиков.
Для подтверждения получения штамма Escherichia coli SCS110-AF/VTvaf17-IFNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA14, или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA2, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12A, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12B проводили трансформацию, селекцию и последующее наращивание с выделением плазмидной ДНК.
Для подтверждения технологичности получения и возможности масштабирования до промышленного производства генотерапевтического ДНК-вектора VTvaf17-IFNB1, несущего целевой ген, а именно, ген IFNB1, генотерапевтического ДНК-вектора VTvaf17-IFNA14, несущего целевой ген, а именно, ген IFNA14, генотерапевтического ДНК-вектора VTvaf17-IFNA2, несущего целевой ген, а именно, ген IFNA2, генотерапевтического ДНК-вектора VTvaf17-IL12A, несущего целевой ген, а именно, ген IL12A, генотерапевтического ДНК-вектора VTvaf17-IL12B, несущего целевой ген, а именно, ген IL12B, выполняли ферментацию в промышленном масштабе штамма Escherichia coli SCS110-AF/VTvaf17-IFNB1 или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA14 или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA2, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12A, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12B, каждый из которых содержит генотерапевтический ДНК-вектор VTvaf17, несущий целевой ген, а именно IFNB1, или IFNA14, или IFNA2, или IL12A, или IL12B.
Способ масштабирования получения бактериальной массы до промышленных масштабов для выделения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов IFNB1, IFNA14, IFNA2, IL12A, IL12B заключается в том, что затравочную культуру штамма Escherichia coli SCS110-AF/VTvaf17-IFNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA14, или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA2, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12A, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12B инкубируют в объеме питательной среды без содержания антибиотика обеспечивающим подходящую динамику накопления биомассы, по достижению достаточного количества биомассы в логарифмической фазе роста, бактериальную культуру переносят в промышленный ферментер, после чего растят до достижения стационарной фазы роста, затем выделяют фракцию, содержащую целевой ДНК-продукт - генотерапевтический ДНК-вектор VTvaf17-IFNB1, или генотерапевтический ДНК-вектор VTvaf17-IFNA14, или генотерапевтический ДНК-вектор VTvaf17-IFNA2, или генотерапевтический ДНК-вектор VTvaf17-IL12A или генотерапевтический ДНК-вектор VTvaf17-IL12B многостадийно фильтруют и очищают хроматографическими методами. При этом специалистам в данной области техники понятно, что условия культивирования штаммов, состав питательных сред (за исключением содержания антибиотиков), используемое оборудование, методы очистки ДНК могут варьировать в рамках стандартных операционных процедур в зависимости от отдельно взятой производственной линии, но известные подходы к масштабированию, промышленному получению и очистке ДНК-векторов с использованием штамма Escherichia coli SCS110-AF/VTvaf17-IFNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA14, или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA2, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12A, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12B или подпадают под объем настоящего изобретения.
Описанное раскрытие изобретения подтверждается примерами реализации настоящего изобретения.
Изобретение поясняется следующими примерами.
Пример 1.
Получение генотерапевтического ДНК-вектора VTvaf17-IFNB1, несущего целевой ген, а именно, гена IFNB1.
Генотерапевтический ДНК-вектор VTvaf17-IFNB1 конструировали клонированием кодирующей части гена IFNB1 размером 565 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции BamHI и EcoRI. Кодирующую часть гена IFNB1 размером 565 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
IFNB1_F AGGATCCACCATGACCAACAAGTGTCTCCTC
IFNB1_R ATAGAATTCAGTTTCGGAGGTAACCTGTAAG
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США).
Генотерапевтический ДНК-вектор VTvaf17 конструировали объединением шести фрагментов ДНК, полученных из разных источников:
(а) ориджин репликации получали путем ПЦР-амплификации участка коммерческой плазмиды pBR322 с внесением точечной мутации;
(б) промоторный регион EF1а получали путем ПЦР-амплификации участка геномной ДНК человека;
(в) терминатор транскрипции hGH-TA получали путем ПЦР-амплификации участка геномной ДНК человека;
(г) регуляторный участок транспозона Tn10 РНК-out получали путем синтеза из олигонуклеотидов;
(д) ген устойчивости к канамицину получали путем ПЦР-амплификации участка коммерческой плазмиды pET-28 человека;
(е) полилинкер получали отжигом двух синтетических олигонуклеотидов.
ПЦР-амплификацию проводили с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США) в соответствии с инструкцией производителя. Фрагменты имеют перекрывающиеся области для возможности их объединения с последующей ПЦР-амплификацией. Объединяли фрагменты (а) и (б) с использованием олигонуклеотидов Ori-F и EF1-R, а также фрагменты (в), (г) и (д) с использованием олигонуклеотидов hGH-F и Kan-R. Далее полученные участки объединяли путем рестрикции с последующим лигированием по сайтам BamHI и NcoI. В результате получали плазмиду, пока еще не содержащую полилинкер. Для его введения проводили расщепление плазмиды по сайтам BamHI и EcoRI, и лигирование с фрагментом (е). Таким образом, получали вектор размером 3165 п.н., несущий ген устойчивости к канамицину, который фланкирован сайтами рестрикции SpeI. Далее этот участок выщепляли по сайтам рестрикции SpeI, после чего оставшийся фрагмент лигировали сам на себя. Таким образом получали генотерапевтический ДНК-вектор VTvaf17 размером 3165 п.н., который является рекомбинантным, с возможностью селекции без антибиотиков.
Расщепление продукта амплификации кодирующей части гена IFNB1 и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI и EcoRI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-IFNB1 размером 3706 п.н. с нуклеотидной последовательностью SEQ ID №1 и общей структурой изображенной на фиг.1A.
Пример 2.
Получение генотерапевтического ДНК-вектора VTvaf17-IFNA14, несущего целевой ген, а именно, гена IFNA14.
Генотерапевтический ДНК-вектор VTvaf17-IFNA14 конструировали клонированием кодирующей части гена IFNA14 размером 571 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции BamHI и EcoRI. Кодирующую часть гена IFNA14 размером 571 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
IFNA14_F AGGATCCACCATGGCATTGCCCTTTGCTTTAATG
IFNA14_R TATGAATTCAATCCTTCCTCCTTAATCTTTTTTGC
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI и EcoRI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-IFNA14 размером 3712 п.н. с нуклеотидной последовательностью SEQ ID №2 и общей структурой изображенной на фиг.1B.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 3
Получение ДНК-вектора VTvaf17-IFNA2, несущего целевой ген, а именно, гена IFNA2 человека.
Генотерапевтический ДНК-вектор VTvaf17-IFNA2 конструировали клонированием кодирующей части гена IFNA2 размером 568 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции BamHI и EcoRI. Кодирующую часть гена IFNA2 размером 568 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
IFNA2_F AGGATCCACCATGGCCTTGACCTTTGCTTTAC
IFNA2_R TATGAATTCATTCCTTACTTCTTAAACTTTCTTG
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI и EcoRI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-IFNA2 размером 3709 п.н. с нуклеотидной последовательностью SEQ ID №3 и общей структурой изображенной на фиг.1C.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 4.
Получение генотерапевтического ДНК-вектора VTvaf17-IL12A, несущего целевой ген, а именно, гена IL12A.
Генотерапевтический ДНК-вектор VTvaf17-IL12A конструировали клонированием кодирующей части гена IL12A размером 766 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции SalI, KpnI. Кодирующую часть гена IL12A размером 766 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген) и ПЦР-амплификации с использованием олигонуклеотидов:
IL12A_F ATCGTCGACCACCATGTGGCCCCCTGGGTCA
IL12A_R TTCGGTACCTTAGGAAGCATTCAGATAGCTCATC
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции SalI, KpnI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-IL12A размером 3925 п.н. с нуклеотидной последовательностью SEQ ID №4 и общей структурой изображенной на фиг.1D.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 5.
Получение генотерапевтического ДНК-вектора VTvaf17-IL12B, несущего целевой ген, а именно, гена IL12B.
Генотерапевтический ДНК-вектор VTvaf17-IL12B конструировали клонированием кодирующей части гена IL12B размером 988 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции BamHI, HindIII. Кодирующую часть гена IL12B размером 988 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген) и ПЦР-амплификации с использованием олигонуклеотидов:
IL12B_F AGGATCCACCATGTGTCACCAGCAGTTGGTC,
IL12B_R TGTAAGCTTAACTGCAGGGCACAGATGC
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI, HindIII (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-IL12B размером 4141 п.н. с нуклеотидной последовательностью SEQ ID №5 и общей структурой, изображенной на фиг.1E.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 6.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-IFNB1, несущего целевой ген, а именно, ген IFNB1, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена IFNB1, в культуре нормального бронхиального эпителия человека BEAS-2B (ATCC® CRL-9609™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-IFNB1, несущим ген IFNB1 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Для оценки изменения накопления мРНК целевого гена IFNB1, использовалась культура клеток человека BEAS-2B. Клеточную культуру BEAS-2B выращивали в стандартных условиях (37 ˚С, 5% СО2) с использованием набора для приготовления питательной среды BEGM (Lonza/Clonetics Corporation, No. CC-3170). В процессе культивирования каждые 48 ч происходила смена ростовой среды.
Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-IFNB1, экспрессирующим ген IFNB1 человека, проводили с использованием Lipofectamine 3000 (ThermoFisher Scientific, США) согласно рекомендациям производителя. В пробирке №1 к 25 мкл среды Opti-MEM (Gibco, США) добавляли 1 мкл раствора ДНК-вектора VTvaf17-IFNB1 (концентрация 500 нг/мкл) и 1 мкл реагента Р3000. Аккуратно перемешивали легким встряхиванием. В пробирке №2 к 25 мкл среды Opti-MEM (Gibco, США) добавляли 1 мкл раствора Lipofectamin 3000. Аккуратно перемешивали легким встряхиванием. Добавляли содержимое пробирки №1 к содержимому пробирки №2, инкубировали 5 мин при комнатной температуре. Полученный раствор по каплям добавляли к клеткам в объеме 40 мкл.
В качестве контроля использовали клетки BEAS-2B, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена (кДНК гена IFNB1 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано. Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано выше.
Суммарную РНК из клеток BEAS-2B выделяли с использованием Trizol Reagent (Invitrogen, США) согласно рекомендациям производителя. В лунку с клетками добавляли 1 мл Trizol Reagent и гомогенизировали с последующим прогреванием в течении 5 мин при 65°С. Далее образец центрифугировали при 14000g в течении 10 мин и снова прогревали в течении 10 мин при 65 0С. Далее добавляли 200 мкл хлороформа, плавно перемешивали и центрифугировали при 14000g в течении 10 мин. Затем отбирали водную фазу, добавляли к ней 1/10 объема 3М ацетата натрия, рН 5.2 и равный объем изопропилового спирта. Инкубировали образец при -20 0С в течении 10 мин с последующим центрифугированием при 14000g в течении 10 мин. Осадок промывали 1 мл 70% этилового спирта, высушивали на воздухе и растворяли в 10 мкл воды, свободной от РНКаз. Определение уровня экспрессии мРНК гена IFNB1 после трансфекции проводили путем оценки динамики накопления ампликонов кДНК методом ПЦР в режиме реального времени. Для получения и амплификации кДНК, специфичной для гена IFNB1 человека, использовали олигонуклеотиды IFNB1_SF и IFNB1_SR:
IFNB1_SF TGGCAATTGAATGGGAGGCT
IFNB1_FR GTCTCATTCCAGCCAGTGCT
Длина продукта амплификации - 182 п.н.
Реакцию обратной транскрипции и ПЦР-амплификацию проводили с помощью набора реагентов SYBR GreenQuantitect RT–PCR Kit (Qiagen, США) для ПЦР в режиме реального времени. Реакцию проводили в объеме 20 мкл, содержащих: 25 мкл QuantiTect SYBR Green RT-PCR MasterMix, 2,5 мM хлорида магния, по 0,5 мкМ каждого праймера, 5 мкл РНК. Реакцию осуществляли на амплификаторе CFX96 (Bio-Rad, США) при следующих условиях: 1 цикл обратной транскрипции при 42°С - 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°C - 30 сек и элонгацию 72°С - 30 сек. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов IFNB1 и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество динамику накопления ампликонов кДНК генов IFNB1 и B2M оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 2.
Из фигуры 2 следует, что в результате трансфекции культуры клеток эпителия бронхов человека BEAS-2B генотерапевтическим ДНК-вектором VTvaf17-IFNB1, уровень специфической мРНК гена IFNB1 человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген IFNB1 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-IFNB1 для повышения уровня экспрессии гена IFNB1 в эукариотических клетках.
Пример 7.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-IFNA14, несущего целевой ген, а именно, ген IFNA14, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена IFNA14, в культуре мононуклеарных клеток периферической крови человека через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-IFNA14, несущим ген IFNA14 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Первичную культуру клеток культуре мононуклеарных клеток периферической крови человека выделяли из 10 мл венозной крови здорового добровольца путем центрифугирования в растворе фиколла 1,09 (Панэко, Р051) и культивировали в среде RPMI Media 1640 (GIBCO®, 11875-085) с добавлением 10 % лошадиной сыворотки Horse Serum (ATCC® 30-2040™) в стандартных условиях (37˚С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-IFNA14, экспрессирующим ген IFNA14 человека, проводили как описано в примере 5. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве контроля использовали культуру клеток остеосаркомы человека MG-63, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена IFNA14 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано. Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 5, за исключением олигонуклеотидов с отличающимися от примера 5 последовательностями. Для амплификации кДНК, специфичной для гена IFNA14 человека, использовали олигонуклеотиды IFNA14_SF и IFNA14_SR:
IFNA14_SF GGCAACCAGTTCCAGAAAGC
IFNA14_SR CACACAGGCTTCCAGGTCAT
Длина продукта амплификации – 168 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов IFNA14 и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов – кДНК генов IFNA14 и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 3.
Из фигуры 3 следует, что в результате трансфекции культуры мононуклеарных клеток периферической крови человека генотерапевтическим ДНК-вектором VTvaf17-IFNA14, уровень специфической мРНК гена IFNA14 человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген IFNA14 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-IFNA14 для повышения уровня экспрессии гена IFNA14 в эукариотических клетках.
Пример 8.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-IFNA2, несущего целевой ген, а именно, ген IFNA2, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена IFNA2 в культуре клеток фибробластов десен человека линии HGF-1 (ATCC® CRL-2014™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-IFNA2, несущим ген IFNA2 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Культуру клеток фибробластов десен человека линии HGF-1 (ATCC® CRL-2014™) выращивали в среде Dulbecco's Modified Eagle's Medium (DMEM) (ATCC® 30-2002™) с добавлением 10 % сыворотки крупного рогатого скота (ATCC® 30-2020™) в стандартных условиях (37˚С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-IFNA2, экспрессирующим ген IFNA2 человека, проводили как описано в примере 5. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве контроля использовали культуру клеток фибробластов десен человека линии HGF-1, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена IFNA2 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано. Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 5, за исключением олигонуклеотидов с отличающимися от примера 5 последовательностями. Для амплификации кДНК, специфичной для гена IFNA2 человека, использовали олигонуклеотиды IFNA2_SF и IFNA2_SR:
IFNA2_SF AGCTGAATGACCTGGAAGCC
IFNA2_SR CTGCTCTGACAACCTCCCAG
Длина продукта амплификации – 165 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов IFNA2 и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов – кДНК генов IFNA2 и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 4.
Из фигуры 4 следует, что в результате трансфекции культуры клеток фибробластов десен человека линии HGF-1 генотерапевтическим ДНК-вектором VTvaf17-IFNA2 уровень специфической мРНК гена IFNA2 человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген IFNA2 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-IFNA2 для повышения уровня экспрессии гена IFNA2 в эукариотических клетках.
Пример 9.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-IL12A, несущего целевой ген, а именно, ген IL12A, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена IL12A, в культуре клеток нормального бронхиального эпителия человека BEAS-2B (ATCC® CRL-9609™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-IL12A, несущим ген IL12A человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Культуру клеток человека линии BEAS-2B выращивали с использованием набора для приготовления питательной среды BEGM (Lonza/Clonetics Corporation, No. CC-3170) в стандартных условиях (37˚С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-IL12A, экспрессирующим ген IL12A человека, проводили как описано в примере 5. В качестве контроля использовали культуру клеток хондроцитов человека линии BEAS-2B, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена IL12A до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано. Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 5, за исключением олигонуклеотидов с отличающимися от примера 5 последовательностями. Для амплификации кДНК, специфичной для гена IL12A человека, использовали олигонуклеотиды IL12A_SF и IL12A_SR:
IL12A_SF GCTCCAGAAGGCCAGACAAA
IL12A_SR GCCAGGCAACTCCCATTAGT
Длина продукта амплификации – 183 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов IL12A и B2M. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов – кДНК генов IL12A и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 5.
Из фигуры 5 следует, что в результате трансфекции культуры клеток человека линии BEAS-2B генотерапевтическим ДНК-вектором VTvaf17-IL12A, уровень специфической мРНК гена IL12A человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген IL12A на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтическим ДНК-вектором VTvaf17-IL12A для повышения уровня экспрессии гена IL12A в эукариотических клетках.
Пример 10.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-IL12B, несущего целевой ген, а именно, ген IL12B, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена IL12B, в культуре клеток нормального бронхиального эпителия человека BEAS-2B (ATCC® CRL-9609™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-IL12B, несущим ген IL12B человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Культуру клеток человека линии BEAS-2B выращивали с использованием набора для приготовления питательной среды BEGM (Lonza/Clonetics Corporation, No. CC-3170) в стандартных условиях (37˚С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-IL12B, экспрессирующим ген IL12B человека, проводили как описано в примере 5. В качестве контроля использовали культуру клеток хондроцитов человека линии BEAS-2B, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена IL12B до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано. Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 5, за исключением олигонуклеотидов с отличающимися от примера 5 последовательностями. Для амплификации кДНК, специфичной для гена IL12B человека, использовали олигонуклеотиды IL12B_SF и IL12B_SR:
IL12B_SF CATCAAACCTGACCCACCCA
IL12B_SR GCTGAGGTCTTGTCCGTGAA
Длина продукта амплификации – 192 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов IL12B и B2M. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов – кДНК генов IL12B и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 5.
Из фигуры 5 следует, что в результате трансфекции культуры клеток человека линии BEAS-2B генотерапевтическим ДНК-вектором VTvaf17-IL12B, уровень специфической мРНК гена IL12B человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген IL12B на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтическим ДНК-вектором VTvaf17-IL12B для повышения уровня экспрессии гена IL12B в эукариотических клетках.
Пример 11.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-IFNB1, несущего ген IFNB1, для повышения экспрессии белка IFNB1 в клетках млекопитающих.
Оценивали изменение количества белка IFNB1 в лизате культуры клеток нормального бронхиального эпителия человека BEAS-2B (ATCC® CRL-9609™) после трансфекции этих клеток ДНК-вектором VTvaf17-IFNB1, несущим ген IFNB1 человека.
Клеточную культуру клеток нормального бронхиального эпителия BEAS-2B человека выращивали как это описано в примере 6.
Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена IFNB1 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-IFNB1, несущий ген IFNB1 человека (С). Приготовление комплекса ДНК/дендример проводили по методике производителя (QIAGEN, SuperFect Transfection Reagent Handbook, 2002) с некоторыми изменениями. Для трансфекции клеток в одной лунке 24-луночного планшета к 1 мкг ДНК-вектора, растворенного в буфере ТЕ, добавляли культуральную среду до конечного объема 60 мкл, затем добавляли 5 мкл SuperFect Transfection Reagent и осторожно перемешивали пятикратным пипетированием. Комплекс инкубировали при комнатной температуре в течении 10-15 мин. Далее отбирали из лунок культуральную среду, лунки промывали 1 мл буфера PBS. К образовавшемуся комплексу добавляли 350 мкл среды, содержащей 10 мкг/мл гентамицина, осторожно перемешивали и добавляли к клеткам. Клетки инкубировали с комплексом 2-3 часа при 37°С в атмосфере, содержащей 5% СО2.
Затем осторожно удаляли среду, промывали клеточный монослой 1 мл буфера PBS. Затем добавляли среду, содержащую 10 мкг/мл гентамицина, и инкубировали 24-48 часов при 37°С в атмосфере 5% СО2.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение белка IFNB1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human IFN-в (Interferon Beta) ELISA Kit (ElabBioscience E-EL-H0085) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка IFNB1, входящим в состав набора. Чувствительность метода составляла не менее 18,75 пг/мл, диапазон измерения - от 31,25 пг/мл до 2000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг. 7.
Из фигуры 7 следует, что трансфекция клеток BEAS-2B генотерапевтическим ДНК-вектором VTvaf17-IFNB1 приводит к увеличению количества белка IFNB1 по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген IFNB1 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-IFNB1 для повышения уровня экспрессии IFNB1 в эукариотических клетках.
Пример 12.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-IFNA14, несущего ген IFNA14, для повышения экспрессии белка IFNA14 в клетках млекопитающих.
Оценивали изменение количества белка в мононуклеарных клетках периферической крови человека после трансфекции этих клеток ДНК-вектором VTvaf17-IFNA14, несущим ген IFNA14 человека. Клетки выделяли и выращивали как описано в примере 7.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена IFNA14 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-IFNA14, несущий ген IFNA14 человека (С). Приготовление комплекса ДНК-дендример и трансфекцию клеток MG-63 проводили как описано в примере 11.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение белка IFNA14 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human IFNA14 / Interferon Alpha 14 ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences LS-F13512-1) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка IFNA14, входящим в состав набора. Чувствительность метода составляла не менее 15,6 пг/мл, диапазон измерения - от 15,6 пг/мл до 1000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг. 8.
Из фигуры 8 следует, что трансфекция культуры мононуклеарных клетках периферической крови человека генотерапевтическим ДНК-вектором VTvaf17-IFNA14 приводит к увеличению количества белка IFNA14 по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген IFNA14 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-IFNA14 для повышения уровня экспрессии IFNA14 в эукариотических клетках.
Пример 13.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-IFNA2, несущего ген IFNA2, для повышения экспрессии белка IFNA2 в клетках млекопитающих.
Оценивали изменение количества белка IFNA2 в лизате культуре клеток фибробластов десен человека линии HGF-1 (ATCC® CRL-2014™) после трансфекции этих клеток ДНК-вектором VTvaf17-IFNA2, несущим ген IFNA2 человека. Клетки культивировали как описано в примере 8.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена IFNA2 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-IFNA2, несущий ген IFNA2 человека (С). Приготовление комплекса ДНК-дендример и трансфекцию клеток фибробластов десен человека линии HGF-1 проводили как описано в примере 11.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение белка IFNA2 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human Interferon Alpha 2 ELISA Kit (Abcam, ab233622) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка IFNA2, входящим в состав набора. Чувствительность метода составляла не менее 56.04 пг/мл, диапазон измерения - от 187.5 пг/мл до 12000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг. 9.
Из фигуры 9 следует, что трансфекция культуры клеток фибробластов десен человека линии HGF-1 генотерапевтическим ДНК-вектором VTvaf17-IFNA2 приводит к увеличению количества белка IFNA2 по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген IFNA2 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-IFNA2 для повышения уровня экспрессии IFNA2 в эукариотических клетках.
Пример 14.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-IL12A, несущего ген IL12A, для повышения экспрессии белка IL12A в клетках млекопитающих.
Оценивали изменение количества белка IL12A в лизате культуры клеток нормального бронхиального эпителия человека BEAS-2B (ATCC® CRL-9609™) после трансфекции этих клеток ДНК-вектором VTvaf17-IL12A, несущим ген IL12A человека. Клетки культивировали как описано в примере 9.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена IL12A (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-IL12A, несущий ген IL12A человека (С). Приготовление комплекса ДНК-дендримеры и трансфекцию клеток BEAS-2B проводили как описано в примере 11.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка IL12A проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human IL12A / p35 ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences LS-F24142-1) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка IL12A, входящим в состав набора. Чувствительность метода составляла не менее 4.688 пг/мл, диапазон измерения - от 7.813 пг/мл до 500 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа, представлены на фиг. 10.
Из фигуры 10 следует, что трансфекция культуры клеток BEAS-2B генотерапевтическим ДНК-вектором VTvaf17-IL12A приводит к увеличению количества белка IL12A по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген IL12A на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-IL12A для повышения уровня экспрессии IL12A в эукариотических клетках.
Пример 15.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-IL12B, несущего ген IL12B, для повышения экспрессии белка IL12B в клетках млекопитающих.
Оценивали изменение количества белка IL12B в лизате культуры клеток нормального бронхиального эпителия человека BEAS-2B (ATCC® CRL-9609™) после трансфекции этих клеток ДНК-вектором VTvaf17-IL12B, несущим ген IL12B человека. Клетки культивировали как описано в примере 9.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена IL12B (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-IL12B, несущий ген IL12B человека (С). Приготовление комплекса ДНК-дендримеры и трансфекцию клеток BEAS-2B проводили как описано в примере 11.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка IL12B проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human IL12B / IL12 p40 ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences LS-F24549-1) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка IL12B, входящим в состав набора. Чувствительность метода составляла не менее 2 пг/мл, диапазон измерения - от 31,2 пг/мл до 2000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа, представлены на фиг. 11.
Из фигуры 11 следует, что трансфекция культуры клеток нормального эпителия бронхов человека BEAS-2B генотерапевтическим ДНК-вектором VTvaf17-IL12B приводит к увеличению количества белка IL12B по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген IL12B на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-IL12B для повышения уровня экспрессии IL12B в эукариотических клетках.
Пример 16.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-IL12A, несущего ген IL12A, для повышения экспрессии белка IL12A в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-IL12A, несущего целевой ген, а именно, ген IL12A и реализуемости способа его применения оценивали изменения количества белка IL12A в коже человека при введении в кожу человека генотерапевтического ДНК-вектора VTvaf17-IL12A, несущего ген человека IL12A.
С целью анализа изменения количества белка IL12A трем пациентам вводили в кожу предплечья генотерапевтический ДНК-вектор VTvaf17-IL12A, несущий ген IL12A и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена IL12A.
Пациент 1, мужчина 66 лет, (П1); пациент 2, женщина 65 лет, П2); пациент 3, мужчина, 52 года, (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Генотерапевтический ДНК-вектор VTvaf17-IL12A, который содержит кДНК гена IL12A и генотерапевтический ДНК-вектор VTvaf17, используемый в качестве плацебо, который не содержит кДНК гена IL12A, каждый из которых растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генетической конструкции готовили комплексы ДНК- cGMP grade in-vivo-jetPEI в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-IL12A, несущий ген IL12A вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину 3 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-IL12A, несущего ген IL12A - 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагались на участке предплечья на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков кожи пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-IL12A, несущего ген IL12A (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактных участков кожи (III), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка методом твердофазного иммуноферментного анализа (ELISA). Количественное определение белка IL12A проводили методом твердофазного иммуноферментного анализа как это описано в примере 14.
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка IL12A, входящим в состав набора. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США). Графики, полученные в результате анализа, представлены на фиг. 12.
Из фигуры 12 следует, что в коже всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17- IL12A, несущего целевой ген IL12A человека, произошло увеличение количества белка IL12A в сравнении с количеством белка IL12A в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего ген IL12A человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-IL12A и подтверждает реализуемость способа его применения, в частности при внутрикожном введении генотерапевтического ДНК-вектора в ткани человека.
Пример 17.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-IFNA2, несущего ген IFNA2, для повышения экспрессии белка IFNA2 в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-IFNA2, несущего целевой ген IFNA2 и реализуемости способа его применения оценивали изменение количества белка IFNA2 в мышечной ткани человека при введении генотерапевтического ДНК-вектора VTvaf17-IFNA2, несущего целевой ген, а именно, ген IFNA2 человека.
С целью анализа изменения количества белка IFNA2 трем пациентам вводили в ткань икроножной мышцы генотерапевтический ДНК-вектор VTvaf17- IFNA2, несущий ген IFNA2 с транспортной молекулой, и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена IFNA2 с транспортной молекулой.
Пациент 1, женщина 48 лет, (П1); пациент 2, мужчина 32 года (П2); пациент 3, мужчина 54 года, (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция), пробоподготовку проводили в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-IFNA2, несущий ген IFNA2 вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину около 10 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-IFNA2, несущего ген IFNA2 - 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагали медиально на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков мышечной ткани пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-IFNA2, несущего ген IFNA2 (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактного участка икроножной мышцы (III), используя устройство для взятия биопсии MAGNUM (BARD, США). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 20 куб. мм, масса - около 22 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка IFNA2 проводили методом твердофазного иммуноферментного анализа как это описано в примере 13.
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка IFNA2, входящим в состав набора. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа представлены на фиг. 13.
Из фигуры 13 следует, что в икроножной мышце всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17-IFNA2, несущего целевой ген, а именно, ген IFNA2 человека, произошло увеличение количества белка IFNA2 в сравнении с количеством белка IFNA2 в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего ген IFNA2 человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-IFNA2 и подтверждает реализуемость способа его применения, в частности при внутримышечном введении генотерапевтического ДНК-вектора в ткани человека.
Пример 18.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-IFNA14, несущего ген IFNA14, для повышения экспрессии белка IFNA14 в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-IFNA14, несущего целевой ген, а именно, ген IFNA14 и реализуемости способа его применения оценивали изменения количества белка IFNA14 в коже человека при введении в кожу человека генотерапевтического ДНК-вектора VTvaf17-IFNA14, несущего ген человека IFNA14.
С целью анализа изменения количества белка IFNA14 трем пациентам вводили в кожу предплечья генотерапевтический ДНК-вектор VTvaf17-IFNA14, несущий ген IFNA14 и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена IFNA14.
Пациент 1, женщина 55 лет (П1); пациент 2, мужчина 47 лет (П2); пациент 3, мужчина, 60 лет (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Генотерапевтический ДНК-вектор VTvaf17-IFNA14, который содержит кДНК гена IFNA14 и генотерапевтический ДНК-вектор VTvaf17, используемый в качестве плацебо, который не содержит кДНК гена IFNA14, каждый из которых растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генетической конструкции готовили комплексы ДНК- cGMP grade in-vivo-jetPEI в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-IFNA14, несущий ген IFNA14 вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину 3 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-IFNA14, несущего ген IFNA14 - 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагались на участке предплечья на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков кожи пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-IFNA14, несущего ген IFNA14 (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактных участков кожи (III), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка методом твердофазного иммуноферментного анализа как это описано в примере 12.
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка IFNA14, входящим в состав набора. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа, представлены на фиг. 14.
Из фигуры 14 следует, что в коже всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17-IFNA14, несущего целевой ген IFNA14 человека, произошло увеличение количества белка IFNA14 в сравнении с количеством белка IFNA14 в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего ген IFNA14 человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-IFNA14 и подтверждает реализуемость способа его применения, в частности при внутрикожном введении генотерапевтического ДНК-вектора в ткани человека.
Пример 19.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-IFNA14, несущего ген IFNA14 и реализуемости способа его применения для повышения уровня экспрессии белка IFNA14 в тканях человека путем введения аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-IFNA14.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-IFNA14, несущего ген IFNA14 и реализуемости способа его применения оценивали изменения количества белка IFNA14 в коже человека при введении в кожу пациента культуры аутологичных фибробластов этого пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-IFNA14.
Пациенту вводили в кожу предплечья соответствующую культуру аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-IFNA14, несущим ген IFNA14, и параллельно вводили плацебо, представляющее собой культуру аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим ген IFNA14.
Первичную культуру фибробластов человека выделяли из биоптатов кожи пациента. Используя устройство для взятия биопсии кожи Epitheasy 3.5 (Medax SRL, Италия) брали образец биоптата кожи из зоны, защищенной от действия ультрафиолета, а именно за ушной раковиной или с боковой внутренней поверхности в зоне локтевого сустава, размером около 10 кв. мм, массой - около 11 мг. Кожу пациента предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Культивирование первичной культуры клеток осуществляли при 37°С в атмосфере, содержащей 5 % СО2 в среде DMEM с 10 % фетальной телячьей сывороткой и ампициллином 100 Ед/мл. Пересев культуры и смену культуральной среды осуществляли каждые 2 дня. Общая продолжительность роста культуры не превышала 25-30 дней. Из культуры клеток отбирали аликвоту, содержащую 5×104 клеток. Культуру фибробластов пациента трансфицировали генотерапевтическим ДНК-вектором VTvaf17-IFNA14, несущим ген IFNA14 или плацебо – вектор VTvaf17, не несущий целевой ген IFNA14.
Трансфекцию осуществляли с помощью катионного полимера полиэтиленимина JETPEI (Polyplus Transfection, Франция), согласно инструкции фирмы-производителя. Клетки культивировали 72 часа и затем вводили пациенту. Введение пациенту культуры аутологичных фибробластов этого пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-IFNA14, и плацебо, представляющее собой культуру аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, осуществляли туннельным методом в область предплечья иглой 30G длиной 13 мм на глубину около 3 мм. Концентрация модифицированных аутологичных фибробластов в вводимой суспензии составляла примерно 5 млн клеток на 1 мл суспензии, количество вводимых клеток не превышало 15 млн. Очаги введения культуры аутологичных фибробластов располагались на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 4-е сутки после введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-IFNA14, несущим целевой ген, а именно, ген IFNA14 и плацебо. Взятие биопсии осуществляли из участков кожи пациента в зоне введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-IFNA14, несущим целевой ген, а именно, ген IFNA14 (C), культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген IFNA14 (плацебо) (B), а также из участков интактной кожи (A), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия). Кожу в зоне отбора биоптата пациентов предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка как это описано в примере 12.
Графики, полученные в результате анализа, представлены на фиг. 15.
Из фигуры 15 следует, что в коже пациента в области введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-IFNA14, несущим ген IFNA14, произошло увеличение количества белка IFNA14 в сравнении с количеством белка IFNA14 в области введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим ген IFNA14 (плацебо), что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-IFNA14 и подтверждает реализуемость способа его применения для повышения уровня экспрессии IFNA14 в тканях человека, в частности при введении аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-IFNA14.
Пример 20.
Подтверждение эффективности и реализуемости способа сочетанного применения генотерапевтического ДНК-вектора VTvaf17-IFNB1, несущего ген IFNB1, генотерапевтического ДНК-вектора VTvaf17-IFNA14, несущего ген IFNA14, генотерапевтического ДНК-вектора VTvaf17-IFNA2, несущего ген IFNA2, генотерапевтического ДНК-вектора VTvaf17-IL12A, несущего ген IL12A, генотерапевтического ДНК-вектора VTvaf17-IL12B, несущего ген IL12B, для повышения уровня экспрессии белков IFNB1, IFNA14, IFNA2, IL12A и IL12B в тканях млекопитающих.
Оценивали изменение количества белков IFNB1, IFNA14, IFNA2, IL12A и IL12B в зоне мышечной ткани при сочетанном введении в эту зону смеси генотерапевтических векторов. Исследование проводили на 3 лабораторных животных – самцах крысы линии Wistar 8 месячного возраста массой 240–290 г. В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Эквимолярную смесь генотерапевтических ДНК-векторов растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генетической конструкции готовили комплексы ДНК- cGMP grade in-vivo-jetPEI в соответствии с рекомендациями производителя.
Объем внутримышечно вводимого раствора составлял 0,1 мл с суммарным количеством ДНК 100 мкг. Введение раствора осуществляли с помощью инсулинового шприца. Через 2 сутки после процедуры крыс декапитировали.
Образцы отбирали на 2 сутки после введения генотерапевтических ДНК-векторов. Взятие биопсийного материала осуществляли из участков правой мышцы бедра в зоне введения смеси пяти генотерапевтических ДНК-векторов, несущих гены IFNB1, IFNA14, IFNA2, IL12A, IL12B (зона I), из участков левой мышцы бедра в зоне введения генотерапевтического ДНК-вектора VTvaf17 (плацебо) (зона II), а также из участков мышечной ткани, не подвергавшихся никаким манипуляциям ( зона III). Каждый образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторида, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевых белков как это описано в примере 11 (количественное определение белка IFNB1), примере 12 (количественное определение белка IFNA14), примере 13 (количественное определение белка IFNA2), примере 14 (количественное определение белка IL12A), примере 15 (количественное определение белка IL12B). Графики, полученные в результате анализа, представлены на фиг. 16.
Из фигур 16 следует, что в зоне I, в которую вводилась смесь генотерапевтических векторов: генотерапевтического ДНК-вектора VTvaf17-IFNB1, несущего целевой ген IFNB1, генотерапевтического ДНК-вектора VTvaf17-IFNA14, несущего целевой ген IFNA14, генотерапевтического ДНК-вектора VTvaf17-IFNA2, несущего целевой ген IFNA2, генотерапевтического ДНК-вектора VTvaf17-IL12A, несущего целевой ген IL12A, генотерапевтического ДНК-вектора VTvaf17-IL12B, несущего целевой ген IL12B, произошло увеличение количества белков IFNB1, IFNA14, IFNA2, IL12A и IL12B по сравнению с зоной II (зона плацебо) и зоной III (интактная зона). Полученные результаты свидетельствуют об эффективности сочетанного применения генотерапевтических ДНК-векторов и подтверждает реализуемость способа применения для повышения уровня экспрессии целевых белков в тканях млекопитающих.
Пример 21.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-IFNA2, несущего ген IFNA2 и реализуемости способа его применения для повышения уровня экспрессии белка IFNA2 в клетках млекопитающих.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-IFNA2, несущего ген IFNA2 оценивали изменение накопления мРНК целевого гена IFNA2 мононуклеарных клетках периферической крови быка через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17- IFNA2, несущим ген IFNA2 человека.
Мононуклеарные клетки периферической крови быка выделяли из 50 мл венозной крови путем центрифугирования в градиенте раствора фиколла 1,077 (Панэко, Р052п) и культивировали в среде RPMI Media 1640 (GIBCO®, 11875-085) с добавлением 10 % лошадиной сыворотки Horse Serum (ATCC® 30-2040™) в стандартных условиях. Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-IFNA2, несущим ген IFNA2 человека и ДНК-вектором VTvaf17, не несущим ген IFNA2 человека (контроль), выделение РНК, реакцию обратной транскрипции, ПЦР амплификации и анализ данных проводили как описано в примере 8. В качестве референтного гена использовали ген актина быка/ коровы (АСТ), приведенного в базе данных GenBank под номером AH001130.2. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности генов IFNA2 и АСТ. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов – кДНК генов IFNA2 и ACT, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1. (Bio-Rad, USA).
Графики, полученные в результате анализа представлены на фиг. 17.
Из фигуры 17 следует, что в результате трансфекции мононуклеарных клеток периферической крови быка генотерапевтическим ДНК-вектором VTvaf17-IFNA2, уровень специфической мРНК гена IFNA2 человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген IFNA2 на уровне мРНК. Представленные результаты подтверждают реализуемость способа применения генотерапевтическим ДНК-вектором VTvaf17-IFNA2 для повышения уровня экспрессии гена IFNA2 в клетках млекопитающих.
Пример 22.
Штамм Escherichia coli SCS110-AF/VTvaf17-IFNB1 или штамм Escherichia coli SCS110-AF/VTvaf17-IFNA14 или штамм Escherichia coli SCS110-AF/VTvaf17-IFNA2 или штамм Escherichia coli SCS110-AF/VTvaf17-IL12A или штамм Escherichia coli SCS110-AF/VTvaf17-IL12B, несущий генотерапевтический ДНК-вектор, и способ его получения.
Конструирование штамма для наработки в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: IFNB1, IFNA14, IFNA2, IL12A, IL12B а именно штамма Escherichia coli SCS110-AF/VTvaf17-IFNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA14, или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA2, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12A или штамма Escherichia coli SCS110-AF/VTvaf17-IL12B, несущего генотерапевтический ДНК-вектор VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A или VTvaf17-IL12B соответственно для его наработки с возможностью селекции без использования антибиотиков заключается в получении электрокомпетентных клеток штамма Escherichia coli SCS110-AF с проведением электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-IFNB1, или ДНК-вектором VTvaf17-IFNA14, или ДНК-вектором VTvaf17-IFNA2, или ДНК-вектором VTvaf17-IL12A, или ДНК-вектором VTvaf17-IL12B после чего клетки высеваются на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы, а также 10 мкг/мл хлорамфеникола. При этом штамм Escherichia coli SCS110-AF для наработки генотерапевтического ДНК-вектора VTvaf17 или генотерапевтических ДНК-векторов на его основе с возможностью положительной селекции без использования антибиотиков получали путем конструирования линейного фрагмента ДНК, содержащего регуляторный элемент RNA-in транспозона Tn10 для селекции без применения антибиотиков размером 64 п.н., ген левансахаразы sacB, продукт которого обеспечивает селекцию на сахарозо-содержащей среде размером 1422 п.н., ген устойчивости к хлорамфениколу catR, необходимый для отбора клонов штамма, в которых прошла гомологичная рекомбинация размером 763 п.н. и две гомологичные последовательности, обеспечивающие процесс гомологичной рекомбинации в области гена recA с одновременной его инактивацией размером 329 п.н. и 233 п.н., после чего проводили трансформацию клеток Escherichia coli путем электропорации и отбирали клоны, выжившие на среде, содержащей 10 мкг/мл хлорамфеникола.
Пример 23.
Способ масштабирования получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: IFNB1, IFNA14, IFNA2, IL12A, IL12B до промышленного масштаба.
Для подтверждения технологичности получения и возможности производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-IFNB1 (SEQ ID №1), или VTvaf17-IFNA14 (SEQ ID №2), или VTvaf17-IFNA2 (SEQ ID №3), или VTvaf17-IL12A (SEQ ID №4), или VTvaf17-IL12B (SEQ ID №5) проводили масштабную ферментацию штамма Escherichia coli SCS110-AF/VTvaf17-IFNB1, или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA14, или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA2, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12A, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12B, каждый из которых содержит генотерапевтический ДНК-вектор VTvaf17, несущий целевой ген, а именно IFNB1, или IFNA14, или IFNA2, или IL12A, или IL12B. Каждый штамм Escherichia coli SCS110-AF/VTvaf17-IFNB1, или Escherichia coli SCS110-AF/VTvaf17-IFNA14, или Escherichia coli SCS110-AF/VTvaf17-IFNA2, или Escherichia coli SCS110-AF/VTvaf17-IL12A или Escherichia coli SCS110-AF/VTvaf17-IL12B получали на базе штамма Escherichia coli SCS110-AF (Cell and Gene Therapy LLC, Великобритания) по примеру 22 путем электропорации компетентных клеток этого штамма генотерапевтическим ДНК-вектором VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B, несущим целевой ген, а именно, IFNB1, или IFNA14, или IFNA2, или IL12A или IL12B с последующим высевом трансформированных клеток на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы и отбором отдельных клонов.
Ферментацию полученного штамма Escherichia coli SCS110-AF/VTvaf17-IFNB1, несущего генотерапевтический ДНК-вектор VTvaf17-IFNB1 проводили в ферментере объемом 10 л с последующим выделением генотерапевтического ДНК-вектора VTvaf17-IFNB1.
Для ферментации штамма Escherichia coli SCS110-AF/VTvaf17-IFNB1 готовили среду, содержащую на 10 л: 100 г триптон, 50 г дрожжевой экстракт (Becton Dickinson, США), доводили водой до 8800 мл и автоклавировали при 121 0С 20 мин, затем добавляли 1200 мл 50% (вес/объем) сахарозы. Далее засевали в колбу затравочную культуру штамма Escherichia coli SCS110-AF/VTvaf17-IFNB1 в объеме 100 мл. Инкубировали в шейкере-инкубаторе 16 ч при 30°С. Переносили затравочную культуру в ферментер Techfors S (Infors HT, Швейцария), растили до достижения стационарной фазы. Контроль осуществляли измерением оптической плотности культуры при длине волны 600 нм. Клетки осаждали центрифугированием 30 мин при 5000-10000 g. Супернатант удаляли, клеточную массу ресуспендировали в 10% по объему фосфатно-солевого буфера. Повторно центрифугировали 30 мин при 5000-10000g. Супернатант удаляли, к клеточной массе добавляли раствор 20 мМ TrisCl, 1 мМ ЭДТА, 200 г/л сахароза, рН 8,0 в объеме 1000 мл, тщательно перемешивали до образования гомогенной суспензии. Добавляли раствор яичного лизоцима до конечной концентрации 100мкг/мл. Инкубировали 20 мин на льду при бережном перемешивании. Далее, добавляли 2500 мл раствора 0,2 М NaOH, 10 г/л додецилсульфат натрия, инкубировали 10 мин на льду при бережном перемешивании, затем добавляли 3500 мл раствора 3M ацетат натрия, 2М уксусная кислота, рН 5-5,5, инкубировали 10 мин на льду при бережном перемешивании. Полученный образец центрифугировали 20-30 мин при 15000 g или более. Раствор аккуратно декантировали, от остатков осадка избавлялись фильтрацией через грубый фильтр (фильтровальную бумагу). Добавляли РНКазу А (Sigma, США) до конечной концентрации 20 нг/мл, инкубировали ночь 16 ч при комнатной температуре. Раствор центрифугировали 20-30 мин при 15000g, затем фильтровали через мембранный фильтр с порами 0,45 мкм (Millipore, США). Далее проводили ультрафильтрацию через мембрану размером отсечения 100кДа (Millipore, США) и разбавляли до начального объема буфером 25 мМ TrisCl, pH 7.0. Операцию повторяли три – четыре раза. Наносили раствор, на колонку с 250 мл сорбента DEAE sepharose HP (GE, США), уравновешенную раствором 25 мМ TrisCl, pH 7.0. После нанесения образца колонку промывали тремя объемами этого же раствора, а затем проводили элюцию генотерапевтического ДНК-вектора VTvaf17-IFNB1 линейным градиентом от раствора 25 мМ TrisCl, pH 7.0 до раствора 25 мМ TrisCl, pH 7.0, 1М NaCl в объеме пяти объемов колонки. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм. Хроматографические фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-IFNB1, объединяли и проводили гель-фильтрацию на сорбенте Superdex 200 (GE, США). Колонку уравновешивали фосфатно-солевым буфером. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм, фракции анализировали электрофорезом в агарозном геле. Фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-IFNB1 объединяли и хранили при -20°С. Для оценки воспроизводимости техпроцесса обозначенные технологические операции повторяли пятикратно. Все технологические операции для штаммов Escherichia coli SCS110-AF/VTvaf17-IFNA14, или Escherichia coli SCS110-AF/VTvaf17-IFNA2, или Escherichia coli SCS110-AF/VTvaf17-IL12A или Escherichia coli SCS110-AF/VTvaf17-IL12B проводили аналогичным образом.
Воспроизводимость техпроцесса и количественные характеристики выхода конечного продукта подтверждают технологичность получения и возможность производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B.
Таким образом, созданный генотерапевтический ДНК-вектор с целевым геном может быть использован для введения в клетки организма животных и человека, характеризующихся сниженной или недостаточной экспрессией белка, кодируемого данным геном, обеспечивая таким образом достижение терапевтического эффекта.
Задача, поставленная в данном изобретении, решена, а именно: конструирование генотерапевтических ДНК-векторов для повышения уровня экспрессии генов IFNB1, IFNA14, IFNA2, IL12A, IL12B, сочетающих в себе следующие свойства:
I) Эффективность повышения экспрессии целевых генов в эукариотических клетках за счет полученных генотерапевтических векторов с минимальным размером;
II) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов и генов антибиотикорезистентности;
III) Технологичность получения и возможность наработки в штаммах в промышленных масштабах;
IV) Также решена задача по конструированию штаммов, несущих эти генотерапевтические ДНК-вектора для производства этих генотерапевтических ДНК-векторов.
Это подтверждается примерами:
для п. I - пример 1, 2, 3, 4, 5; 6; 7; 8; 9; 10; 11; 12; 13; 14; 15; 16; 17; 18, 19, 20, 21
для п. II - пример 1, 2, 3, 4, 5
для п. III и п. IV - пример 22, 23.
Промышленная применимость:
Все представленные выше примеры подтверждают промышленную применимость предлагаемого генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ген IFNB1, ген IFNA14, ген IFNA2, ген IL12A, ген IL12B для повышения уровня экспрессии этих целевых генов, штамма Escherichia coli SCS110-AF/VTvaf17-IFNB1 или Escherichia coli SCS110-AF/VTvaf17-IFNA14 или Escherichia coli SCS110-AF/VTvaf17-IFNA2 или Escherichia coli SCS110-AF/VTvaf17-IL12A или Escherichia coli SCS110-AF/VTvaf17-IL12B, несущего генотерапевтический ДНК-вектор, способа получения генотерапевтического ДНК-вектора, способа производства в промышленных масштабах генотерапевтического ДНК-вектора.
Перечень сокращений
VTvaf17 – вектор генотерапевтический, не содержащий последовательностей вирусных геномов и маркеров антибиотико-резистентности (vector therapeutic virus-antibiotic-free),
ДНК - дезоксирибонуклеиновая кислота,
кДНК - комплементарная дезоксирибонуклеиновая кислота,
РНК - рибонуклеиновая кислота,
мРНК - матричная рибонуклеиновая кислота,
п.н. – пар нуклеотидов,
ПЦР - полимеразная цепная реакция,
мл – миллилитр, мкл – микролитр,
куб. мм – кубический миллиметр,
л – литр,
мкг – микрограмм,
мг – миллиграмм,
г – грамм,
мкМ – микромоль,
мМ – миллимоль,
мин – минута,
сек – секунда,
об/мин - обороты в минуту,
нм – нанометр,
см – сантиметр,
мВт – милливатт,
о.е. ф-относительная единица флуоресценции,
РВС – фосфатно-солевой буфер,
PBMC – мононуклеарные клетки периферической крови.
СПИСОК ЛИТЕРАТУРЫ
1. Abraham S, Choi JG, Ortega NM, Zhang J, Shankar P, Swamy NM. Gene therapy with plasmids encoding IFN-β or IFN-α14 confers long-term resistance to HIV-1 in humanized mice. Oncotarget. 2016 Nov 29;7(48):78412-78420.
2. Denies S, Cicchelero L, Van Audenhove I, Sanders NN. Combination of interleukin-12 gene therapy, metronomic cyclophosphamide and DNA cancer vaccination directs all arms of the immune system towards tumor eradication. J Control Release. 2014 Aug 10;187:175-82.
3. Draft Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products, http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2015/05/WC500187020.pdf
4. Ejlerskov P, Hultberg JG, Wang J, Carlsson R, Ambjørn M, Kuss M, Liu Y, Porcu G, Kolkova K, Friis Rundsten C, Ruscher K, Pakkenberg B, Goldmann T, Loreth D,Prinz M, Rubinsztein DC, Issazadeh-Navikas S. Lack of Neuronal IFN-β-IFNAR Causes Lewy Body- and Parkinson's Disease-like Dementia. Cell. 2015 Oct 8;163(2):324-39.
5. Fondello C, Agnetti L, Glikin GC, Finocchiaro LME. Mechanisms Enhancing the Cytotoxic Effects of Bleomycin plus Suicide or Interferon-β Gene Lipofection in Metastatic Human Melanoma Cells. Anticancer Agents Med Chem. 2018 Jun 3.
6. Gay W, Lauret E, Boson B, Larghero J, Matheux F, Peyramaure S, Rousseau V, Dormont D, De Maeyer E, Le Grand R. Low autocrine interferon beta production as a gene therapy approach for AIDS: Infusion of interferon beta-engineered lymphocytes in macaques chronically infected with SIVmac251. Retrovirology. 2004 Sep 25;1:29.
7. Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal Products EMA/CAT/80183/2014
8. Hamana A, Takahashi Y, Tanioka A, Nishikawa M, Takakura Y. Safe and effective interferon-beta gene therapy for the treatment of multiple sclerosis by regulating biological activity through the design of interferon-beta-galectin-9 fusion proteins. Int J Pharm. 2018 Jan 30;536(1):310-317.
9. Harper MS, Guo K, Gibbert K, Lee EJ, Dillon SM, Barrett BS, McCarter MD, Hasenkrug KJ, Dittmer U, Wilson CC, Santiago ML. Interferon-alpha Subtypes in an Ex Vivo Model of Acute HIV-1 Infection: Expression, Potency and Effector Mechanisms. PLoS Pathog. 2015
10. Hornstein BD, Roman D, Arévalo-Soliz LM, Engevik MA, Zechiedrich L. Effects of Circular DNA Length on Transfection Efficiency by Electroporation into HeLa Cells. Ceña V, ed. PLoS ONE. 2016;11(12):e0167537. doi:10.1371/journal.pone.0167537.
11. Kim GS, Heo JR, Kim SU, Choi KC. Cancer-Specific Inhibitory Effects of Genetically Engineered Stem Cells Expressing Cytosine Deaminase and Interferon-β Against Choriocarcinoma in Xenografted Metastatic Mouse Models. Transl Oncol. 2018 Feb;11(1):74-85.
12. Li L, Petrovsky N. Molecular mechanisms for enhanced DNA vaccine immunogenicity. Expert Rev Vaccines. 2016;15(3):313-29
13. Mairhofer J, Grabherr R. Rational vector design for efficient non-viral gene delivery: challenges facing the use of plasmid DNA. Mol Biotechnol. 2008.39(2):97-104
14. Mizuno M., Yoshida J., Sugita K., Yagi K., Growthinhibition of glioma cells of different cell lines byhuman interferon-βproduced in the cells transfectedwith its gene by means of liposomes, J. Clin.Biochem. Nutr., 9:73-77, 1990
15. Okwor I, Uzonna JE. Pathways leading to interleukin-12 production and protective immunity in cutaneous leishmaniasis. Cell Immunol. 2016 Nov;309:32-36.
16. Razi Soofiyani S, Kazemi T, Lotfipour F, Mohammad Hosseini A, Shanehbandi D, Hallaj-Nezhadi S, Baradaran B. Gene therapy with IL-12 induced enhanced anti-tumor activity in fibrosarcoma mouse model. Artif Cells Nanomed Biotechnol. 2016 Dec;44(8):1988-1993. Epub 2016 Jan 13.
17. Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011 EMA/CAT/GTWP/44236/2009 Committee for advanced therapies
18. Sakai T, Hisaeda H, Nakano Y, et al. Gene gun-mediated delivery of an interleukin-12 expression plasmid protects against infections with the intracellular protozoan parasites Leishmania major and Trypanosoma cruzi in mice. Immunology 2000; 99: 615-24.
19. Sperber SJ, Gocke DJ, Haberzettl C, Kuk R, Schwartz B, Pestka S. Anti-HIV-1 activity of recombinant and hybrid species of interferon-alpha. J Interferon Res. 1992;12:363-8.
20. Tapia E, Pérez-Jiménez E, López-Fuertes L, Gonzalo R, Gherardi MM, Esteban M. The combination of DNA vectors expressing IL12 + IL-18 elicits high protective immune response against cutaneous leishmaniasis after priming with DNA-p36/LACK and the cytokines, followed by a booster with a vaccinia virus recombinant expressing p36/LACK. Microbes Infect 2003; 5: 73-84.
21. Vieillard V, Jouveshomme S, Leflour N, Jean-Pierre E, Debre P, De Maeyer E, Autran B. Transfer of human CD4(+) T lymphocytes producing beta interferon in Hu-PBL-SCID mice controls human immunodeficiency virus infection. J Virol. 1999 Dec;73(12):10281-8.
22. Waldner MJ, Neurath MF. Gene therapy using IL 12 family members in infection, auto immunity, and cancer. Curr Gene Ther. 2009 Aug;9(4):239-47.
23. Молекулярная биология, 2011, том 45, № 1, с. 44-55
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Селл энд Джин Терапи Лтд (CELL and GENE THERAPY Ltd), Общество с ограниченной ответственностью «Прорывные Инновационные Технологии»,
<120> Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов IFNB1, IFNA14, IFNA2, IL12A, IL12B для повышения уровня экспрессии этих целевых генов, способ его получения и применения, штамм Escherichia coli SCS110-AF/VTvaf17-IFNB1 или Escherichia coli SCS110-AF/VTvaf17-IFNA14 или Escherichia coli SCS110-AF/VTvaf17-IFNA2 или Escherichia coli SCS110-AF/VTvaf17-IL12A или Escherichia coli SCS110-AF/VTvaf17-IL12B, несущий генотерапевтический ДНК-вектор, способ его получения, способ производства в промышленных масштабах генотерапевтического ДНК-вектора.
<160> 5
<170> BiSSAP 1.3.6
<210> 1
<211> 3706
<212> DNA
<213> Homo Sapiens
<400> 1
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ctgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccgcaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatga ccaacaagtg tctcctccaa attgctctcc tgttgtgctt 1260
ctccactaca gctctttcca tgagctacaa cttgcttgga ttcctacaaa gaagcagcaa 1320
ttttcagtgt cagaagctcc tgtggcaatt gaatgggagg cttgaatact gcctcaagga 1380
caggatgaac tttgacatcc ctgaggagat taagcagctg cagcagttcc agaaggagga 1440
cgccgcattg accatctatg agatgctcca gaacatcttt gctattttca gacaagattc 1500
atctagcact ggctggaatg agactattgt tgagaacctc ctggctaatg tctatcatca 1560
gataaaccat ctgaagacag tcctggaaga aaaactggag aaagaagatt tcaccagggg 1620
aaaactcatg agcagtctgc acctgaaaag atattatggg aggattctgc attacctgaa 1680
ggccaaggag tacagtcact gtgcctggac catagtcaga gtggaaatcc taaggaactt 1740
ttacttcatt aacagactta caggttacct ccgaaactga attccctgtg acccctcccc 1800
agtgcctctc ctggccctgg aagttgccac tccagtgccc accagccttg tcctaataaa 1860
attaagttgc atcattttgt ctgactaggt gtccttctat aatattatgg ggtggagggg 1920
ggtggtatgg agcaaggggc aagttgggaa gacaacctgt agggcctgcg gggtctattg 1980
ggaaccaagc tggagtgcag tggcacaatc ttggctcact gcaatctccg cctcctgggt 2040
tcaagcgatt ctcctgcctc agcctcccga gttgttggga ttccaggcat gcatgaccag 2100
gctcagctaa tttttgtttt tttggtagag acggggtttc accatattgg ccaggctggt 2160
ctccaactcc taatctcagg tgatctaccc accttggcct cccaaattgc tgggattaca 2220
ggcgtgaacc actgctccct tccctgtcct tacgcgtaga attggtaaag agagtcgtgt 2280
aaaatatcga gttcgcacat cttgttgtct gattattgat ttttggcgaa accatttgat 2340
catatgacaa gatgtgtatc taccttaact taatgatttt gataaaaatc attaactagt 2400
ccatggctgc ctcgcgcgtt tcggtgatga cggtgaaaac ctctgacaca tgcagctccc 2460
ggagacggtc acagcttgtc tgtaagcgga tgccgggagc agacaagccc gtcagggcgc 2520
gtcagcgggt gttggcgggt gtcggggcgc agccatgacc cagtcacgta gcgatagcgg 2580
agtgtatact ggcttaacta tgcggcatca gagcagattg tactgagagt gcaccatatg 2640
cggtgtgaaa taccgcacag atgcgtaagg agaaaatacc gcatcaggcg ctcttccgct 2700
tcctcgctca ctgactcgct gcgctcggtc gttcggctgc ggcgagcggt atcagctcac 2760
tcaaaggcgg taatacggtt atccacagaa tcaggggata acgcaggaaa gaacatgtga 2820
gcaaaaggcc agcaaaaggc caggaaccgt aaaaaggccg cgttgctggc gtttttccat 2880
aggctccgcc cccctgacga gcatcacaaa aatcgacgct caagtcagag gtggcgaaac 2940
ccgacaggac tataaagata ccaggcgttt ccccctggaa gctccctcgt gcgctctcct 3000
gttccgaccc tgccgcttac cggatacctg tccgcctttc tcccttcggg aagcgtggcg 3060
ctttctcata gctcacgctg taggtatctc agttcggtgt aggtcgttcg ctccaagctg 3120
ggctgtgtgc acgaaccccc cgttcagccc gaccgctgcg ccttatccgg taactatcgt 3180
cttgagtcca acccggtaag acacgactta tcgccactgg cagcagccac tggtaacagg 3240
attagcagag cgaggtatgt aggcggtgct acagagttct tgaagtggtg gcctaactac 3300
ggctacacta gaagaacagt atttggtatc tgcgctctgc tgaagccagt taccttcgga 3360
aaaagagttg gtagctcttg atccggcaaa caaaccaccg ctggtagcgg tggttttttt 3420
gtttgcaagc agcagattac gcgcagaaaa aaaggatctc aagaagatcc tttgatcttt 3480
tctacggggt ctgacgctca gtggaacgaa aactcacgtt aagggatttt ggtcatgaga 3540
ttatcaaaaa ggatcttcac ctagatcctt ttaaattaaa aatgaagttt taaatcaatc 3600
taaagtatat atgagtaaac ttggtctgac agttaccaat gcttaatcag tgaggcacct 3660
atctcagcga tctgtctatt tcgttcatcc atagttgcct gactcc 3706
<210> 2
<211> 3712
<212> DNA
<213> Homo Sapiens
<400> 2
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ctgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccgcaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatgg cattgccctt tgctttaatg atggccctgg tggtgctcag 1260
ctgcaagtca agctgctctc tgggctgtaa tctgtctcaa acccacagcc tgaataacag 1320
gaggactttg atgctcatgg cacaaatgag gagaatctct cctttctcct gcctgaagga 1380
cagacatgac tttgaatttc cccaggagga atttgatggc aaccagttcc agaaagctca 1440
agccatctct gtcctccatg agatgatgca gcagaccttc aatctcttca gcacaaagaa 1500
ctcatctgct gcttgggatg agaccctcct agaaaaattc tacattgaac ttttccagca 1560
aatgaatgac ctggaagcct gtgtgataca ggaggttggg gtggaagaga ctcccctgat 1620
gaatgaggac tccatcctgg ctgtgaagaa atacttccaa agaatcactc tttatctgat 1680
ggagaagaaa tacagccctt gtgcctggga ggttgtcaga gcagaaatca tgagatccct 1740
ctctttttca acaaacttgc aaaaaagatt aaggaggaag gattgaattc cctgtgaccc 1800
ctccccagtg cctctcctgg ccctggaagt tgccactcca gtgcccacca gccttgtcct 1860
aataaaatta agttgcatca ttttgtctga ctaggtgtcc ttctataata ttatggggtg 1920
gaggggggtg gtatggagca aggggcaagt tgggaagaca acctgtaggg cctgcggggt 1980
ctattgggaa ccaagctgga gtgcagtggc acaatcttgg ctcactgcaa tctccgcctc 2040
ctgggttcaa gcgattctcc tgcctcagcc tcccgagttg ttgggattcc aggcatgcat 2100
gaccaggctc agctaatttt tgtttttttg gtagagacgg ggtttcacca tattggccag 2160
gctggtctcc aactcctaat ctcaggtgat ctacccacct tggcctccca aattgctggg 2220
attacaggcg tgaaccactg ctcccttccc tgtccttacg cgtagaattg gtaaagagag 2280
tcgtgtaaaa tatcgagttc gcacatcttg ttgtctgatt attgattttt ggcgaaacca 2340
tttgatcata tgacaagatg tgtatctacc ttaacttaat gattttgata aaaatcatta 2400
actagtccat ggctgcctcg cgcgtttcgg tgatgacggt gaaaacctct gacacatgca 2460
gctcccggag acggtcacag cttgtctgta agcggatgcc gggagcagac aagcccgtca 2520
gggcgcgtca gcgggtgttg gcgggtgtcg gggcgcagcc atgacccagt cacgtagcga 2580
tagcggagtg tatactggct taactatgcg gcatcagagc agattgtact gagagtgcac 2640
catatgcggt gtgaaatacc gcacagatgc gtaaggagaa aataccgcat caggcgctct 2700
tccgcttcct cgctcactga ctcgctgcgc tcggtcgttc ggctgcggcg agcggtatca 2760
gctcactcaa aggcggtaat acggttatcc acagaatcag gggataacgc aggaaagaac 2820
atgtgagcaa aaggccagca aaaggccagg aaccgtaaaa aggccgcgtt gctggcgttt 2880
ttccataggc tccgcccccc tgacgagcat cacaaaaatc gacgctcaag tcagaggtgg 2940
cgaaacccga caggactata aagataccag gcgtttcccc ctggaagctc cctcgtgcgc 3000
tctcctgttc cgaccctgcc gcttaccgga tacctgtccg cctttctccc ttcgggaagc 3060
gtggcgcttt ctcatagctc acgctgtagg tatctcagtt cggtgtaggt cgttcgctcc 3120
aagctgggct gtgtgcacga accccccgtt cagcccgacc gctgcgcctt atccggtaac 3180
tatcgtcttg agtccaaccc ggtaagacac gacttatcgc cactggcagc agccactggt 3240
aacaggatta gcagagcgag gtatgtaggc ggtgctacag agttcttgaa gtggtggcct 3300
aactacggct acactagaag aacagtattt ggtatctgcg ctctgctgaa gccagttacc 3360
ttcggaaaaa gagttggtag ctcttgatcc ggcaaacaaa ccaccgctgg tagcggtggt 3420
ttttttgttt gcaagcagca gattacgcgc agaaaaaaag gatctcaaga agatcctttg 3480
atcttttcta cggggtctga cgctcagtgg aacgaaaact cacgttaagg gattttggtc 3540
atgagattat caaaaaggat cttcacctag atccttttaa attaaaaatg aagttttaaa 3600
tcaatctaaa gtatatatga gtaaacttgg tctgacagtt accaatgctt aatcagtgag 3660
gcacctatct cagcgatctg tctatttcgt tcatccatag ttgcctgact cc 3712
<210> 3
<211> 3709
<212> DNA
<213> Homo Sapiens
<400> 3
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ctgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccgcaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatgg ccttgacctt tgctttactg gtggccctcc tggtgctcag 1260
ctgcaagtca agctgctctg tgggctgtga tctgcctcaa acccacagcc tgggtagcag 1320
gaggaccttg atgctcctgg cacagatgag gagaatctct cttttctcct gcttgaagga 1380
cagacatgac tttggatttc cccaggagga gtttggcaac cagttccaaa aggctgaaac 1440
catccctgtc ctccatgaga tgatccagca gatcttcaat ctcttcagca caaaggactc 1500
atctgctgct tgggatgaga ccctcctaga caaattctac actgaactct accagcagct 1560
gaatgacctg gaagcctgtg tgatacaggg ggtgggggtg acagagactc ccctgatgaa 1620
ggaggactcc attctggctg tgaggaaata cttccaaaga atcactctct atctgaaaga 1680
gaagaaatac agcccttgtg cctgggaggt tgtcagagca gaaatcatga gatctttttc 1740
tttgtcaaca aacttgcaag aaagtttaag aagtaaggaa tgaattccct gtgacccctc 1800
cccagtgcct ctcctggccc tggaagttgc cactccagtg cccaccagcc ttgtcctaat 1860
aaaattaagt tgcatcattt tgtctgacta ggtgtccttc tataatatta tggggtggag 1920
gggggtggta tggagcaagg ggcaagttgg gaagacaacc tgtagggcct gcggggtcta 1980
ttgggaacca agctggagtg cagtggcaca atcttggctc actgcaatct ccgcctcctg 2040
ggttcaagcg attctcctgc ctcagcctcc cgagttgttg ggattccagg catgcatgac 2100
caggctcagc taatttttgt ttttttggta gagacggggt ttcaccatat tggccaggct 2160
ggtctccaac tcctaatctc aggtgatcta cccaccttgg cctcccaaat tgctgggatt 2220
acaggcgtga accactgctc ccttccctgt ccttacgcgt agaattggta aagagagtcg 2280
tgtaaaatat cgagttcgca catcttgttg tctgattatt gatttttggc gaaaccattt 2340
gatcatatga caagatgtgt atctacctta acttaatgat tttgataaaa atcattaact 2400
agtccatggc tgcctcgcgc gtttcggtga tgacggtgaa aacctctgac acatgcagct 2460
cccggagacg gtcacagctt gtctgtaagc ggatgccggg agcagacaag cccgtcaggg 2520
cgcgtcagcg ggtgttggcg ggtgtcgggg cgcagccatg acccagtcac gtagcgatag 2580
cggagtgtat actggcttaa ctatgcggca tcagagcaga ttgtactgag agtgcaccat 2640
atgcggtgtg aaataccgca cagatgcgta aggagaaaat accgcatcag gcgctcttcc 2700
gcttcctcgc tcactgactc gctgcgctcg gtcgttcggc tgcggcgagc ggtatcagct 2760
cactcaaagg cggtaatacg gttatccaca gaatcagggg ataacgcagg aaagaacatg 2820
tgagcaaaag gccagcaaaa ggccaggaac cgtaaaaagg ccgcgttgct ggcgtttttc 2880
cataggctcc gcccccctga cgagcatcac aaaaatcgac gctcaagtca gaggtggcga 2940
aacccgacag gactataaag ataccaggcg tttccccctg gaagctccct cgtgcgctct 3000
cctgttccga ccctgccgct taccggatac ctgtccgcct ttctcccttc gggaagcgtg 3060
gcgctttctc atagctcacg ctgtaggtat ctcagttcgg tgtaggtcgt tcgctccaag 3120
ctgggctgtg tgcacgaacc ccccgttcag cccgaccgct gcgccttatc cggtaactat 3180
cgtcttgagt ccaacccggt aagacacgac ttatcgccac tggcagcagc cactggtaac 3240
aggattagca gagcgaggta tgtaggcggt gctacagagt tcttgaagtg gtggcctaac 3300
tacggctaca ctagaagaac agtatttggt atctgcgctc tgctgaagcc agttaccttc 3360
ggaaaaagag ttggtagctc ttgatccggc aaacaaacca ccgctggtag cggtggtttt 3420
tttgtttgca agcagcagat tacgcgcaga aaaaaaggat ctcaagaaga tcctttgatc 3480
ttttctacgg ggtctgacgc tcagtggaac gaaaactcac gttaagggat tttggtcatg 3540
agattatcaa aaaggatctt cacctagatc cttttaaatt aaaaatgaag ttttaaatca 3600
atctaaagta tatatgagta aacttggtct gacagttacc aatgcttaat cagtgaggca 3660
cctatctcag cgatctgtct atttcgttca tccatagttg cctgactcc 3709
<210> 4
<211> 3925
<212> DNA
<213> Homo Sapiens
<400> 4
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ctgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccgcaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatatcg tcgaccacca tgtggccccc tgggtcagcc tcccagccac 1260
cgccctcacc tgccgcggcc acaggtctgc atccagcggc tcgccctgtg tccctgcagt 1320
gccggctcag catgtgtcca gcgcgcagcc tcctccttgt ggctaccctg gtcctcctgg 1380
accacctcag tttggccaga aacctccccg tggccactcc agacccagga atgttcccat 1440
gccttcacca ctcccaaaac ctgctgaggg ccgtcagcaa catgctccag aaggccagac 1500
aaactctaga attttaccct tgcacttctg aagagattga tcatgaagat atcacaaaag 1560
ataaaaccag cacagtggag gcctgtttac cattggaatt aaccaagaat gagagttgcc 1620
taaattccag agagacctct ttcataacta atgggagttg cctggcctcc agaaagacct 1680
cttttatgat ggccctgtgc cttagtagta tttatgaaga cttgaagatg taccaggtgg 1740
agttcaagac catgaatgca aagcttctga tggatcctaa gaggcagatc tttctagatc 1800
aaaacatgct ggcagttatt gatgagctga tgcaggccct gaatttcaac agtgagactg 1860
tgccacaaaa atcctccctt gaagaaccgg atttttataa aactaaaatc aagctctgca 1920
tacttcttca tgctttcaga attcgggcag tgactattga tagagtgatg agctatctga 1980
atgcttccta aggtaccgaa ttccctgtga cccctcccca gtgcctctcc tggccctgga 2040
agttgccact ccagtgccca ccagccttgt cctaataaaa ttaagttgca tcattttgtc 2100
tgactaggtg tccttctata atattatggg gtggaggggg gtggtatgga gcaaggggca 2160
agttgggaag acaacctgta gggcctgcgg ggtctattgg gaaccaagct ggagtgcagt 2220
ggcacaatct tggctcactg caatctccgc ctcctgggtt caagcgattc tcctgcctca 2280
gcctcccgag ttgttgggat tccaggcatg catgaccagg ctcagctaat ttttgttttt 2340
ttggtagaga cggggtttca ccatattggc caggctggtc tccaactcct aatctcaggt 2400
gatctaccca ccttggcctc ccaaattgct gggattacag gcgtgaacca ctgctccctt 2460
ccctgtcctt acgcgtagaa ttggtaaaga gagtcgtgta aaatatcgag ttcgcacatc 2520
ttgttgtctg attattgatt tttggcgaaa ccatttgatc atatgacaag atgtgtatct 2580
accttaactt aatgattttg ataaaaatca ttaactagtc catggctgcc tcgcgcgttt 2640
cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca cagcttgtct 2700
gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg ttggcgggtg 2760
tcggggcgca gccatgaccc agtcacgtag cgatagcgga gtgtatactg gcttaactat 2820
gcggcatcag agcagattgt actgagagtg caccatatgc ggtgtgaaat accgcacaga 2880
tgcgtaagga gaaaataccg catcaggcgc tcttccgctt cctcgctcac tgactcgctg 2940
cgctcggtcg ttcggctgcg gcgagcggta tcagctcact caaaggcggt aatacggtta 3000
tccacagaat caggggataa cgcaggaaag aacatgtgag caaaaggcca gcaaaaggcc 3060
aggaaccgta aaaaggccgc gttgctggcg tttttccata ggctccgccc ccctgacgag 3120
catcacaaaa atcgacgctc aagtcagagg tggcgaaacc cgacaggact ataaagatac 3180
caggcgtttc cccctggaag ctccctcgtg cgctctcctg ttccgaccct gccgcttacc 3240
ggatacctgt ccgcctttct cccttcggga agcgtggcgc tttctcatag ctcacgctgt 3300
aggtatctca gttcggtgta ggtcgttcgc tccaagctgg gctgtgtgca cgaacccccc 3360
gttcagcccg accgctgcgc cttatccggt aactatcgtc ttgagtccaa cccggtaaga 3420
cacgacttat cgccactggc agcagccact ggtaacagga ttagcagagc gaggtatgta 3480
ggcggtgcta cagagttctt gaagtggtgg cctaactacg gctacactag aagaacagta 3540
tttggtatct gcgctctgct gaagccagtt accttcggaa aaagagttgg tagctcttga 3600
tccggcaaac aaaccaccgc tggtagcggt ggtttttttg tttgcaagca gcagattacg 3660
cgcagaaaaa aaggatctca agaagatcct ttgatctttt ctacggggtc tgacgctcag 3720
tggaacgaaa actcacgtta agggattttg gtcatgagat tatcaaaaag gatcttcacc 3780
tagatccttt taaattaaaa atgaagtttt aaatcaatct aaagtatata tgagtaaact 3840
tggtctgaca gttaccaatg cttaatcagt gaggcaccta tctcagcgat ctgtctattt 3900
cgttcatcca tagttgcctg actcc 3925
<210> 5
<211> 4684
<212> DNA
<213> Homo Sapiens
<400> 5
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ctgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccgcaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatgt gtcaccagca gttggtcatc tcttggtttt ccctggtttt 1260
tctggcatct cccctcgtgg ccatatggga actgaagaaa gatgtttatg tcgtagaatt 1320
ggattggtat ccggatgccc ctggagaaat ggtggtcctc acctgtgaca cccctgaaga 1380
agatggtatc acctggacct tggaccagag cagtgaggtc ttaggctctg gcaaaaccct 1440
gaccatccaa gtcaaagagt ttggagatgc tggccagtac acctgtcaca aaggaggcga 1500
ggttctaagc cattcgctcc tgctgcttca caaaaaggaa gatggaattt ggtccactga 1560
tattttaaag gaccagaaag aacccaaaaa taagaccttt ctaagatgcg aggccaagaa 1620
ttattctgga cgtttcacct gctggtggct gacgacaatc agtactgatt tgacattcag 1680
tgtcaaaagc agcagaggct cttctgaccc ccaaggggtg acgtgcggag ctgctacact 1740
ctctgcagag agagtcagag gggacaacaa ggagtatgag tactcagtgg agtgccagga 1800
ggacagtgcc tgcccagctg ctgaggagag tctgcccatt gaggtcatgg tggatgccgt 1860
tcacaagctc aagtatgaaa actacaccag cagcttcttc atcagggaca tcatcaaacc 1920
tgacccaccc aagaacttgc agctgaagcc attaaagaat tctcggcagg tggaggtcag 1980
ctgggagtac cctgacacct ggagtactcc acattcctac ttctccctga cattctgcgt 2040
tcaggtccag ggcaagagca agagagaaaa gaaagataga gtcttcacgg acaagacctc 2100
agccacggtc atctgccgca aaaatgccag cattagcgtg cgggcccagg accgctacta 2160
tagctcatct tggagcgaat gggcatctgt gccctgcagt taagcttggt accgaattcc 2220
ctgtgacccc tccccagtgc ctctcctggc cctggaagtt gccactccag tgcccaccag 2280
ccttgtccta ataaaattaa gttgcatcat tttgtctgac taggtgtcct tctataatat 2340
tatggggtgg aggggggtgg tatggagcaa ggggcaagtt gggaagacaa cctgtagggc 2400
ctgcggggtc tattgggaac caagctggag tgcagtggca caatcttggc tcactgcaat 2460
ctccgcctcc tgggttcaag cgattctcct gcctcagcct cccgagttgt tgggattcca 2520
ggcatgcatg accaggctca gctaattttt gtttttttgg tagagacggg gtttcaccat 2580
attggccagg ctggtctcca actcctaatc tcaggtgatc tacccacctt ggcctcccaa 2640
attgctggga ttacaggcgt gaaccactgc tcccttccct gtccttacgc gtagaattgg 2700
taaagagagt cgtgtaaaat atcgagttcg cacatcttgt tgtctgatta ttgatttttg 2760
gcgaaaccat ttgatcatat gacaagatgt gtatctacct taacttaatg attttgataa 2820
aaatcattaa ctagtccatg gctgcctcgc gcgtttcggt gatgacggtg aaaacctctg 2880
acacatgcag ctcccggaga cggtcacagc ttgtctgtaa gcggatgccg ggagcagaca 2940
agcccgtcag ggcgcgtcag cgggtgttgg cgggtgtcgg ggcgcagcca tgacccagtc 3000
acgtagcgat agcggagtgt atactggctt aactatgcgg catcagagca gattgtactg 3060
agagtgcacc atatgcggtg tgaaataccg cacagatgcg taaggagaaa ataccgcatc 3120
aggcgctctt ccgcttcctc gctcactgac tcgctgcgct cggtcgttcg gctgcggcga 3180
gcggtatcag ctcactcaaa ggcggtaata cggttatcca cagaatcagg ggataacgca 3240
ggaaagaaca tgtgagcaaa aggccagcaa aaggccagga accgtaaaaa ggccgcgttg 3300
ctggcgtttt tccataggct ccgcccccct gacgagcatc acaaaaatcg acgctcaagt 3360
cagaggtggc gaaacccgac aggactataa agataccagg cgtttccccc tggaagctcc 3420
ctcgtgcgct ctcctgttcc gaccctgccg cttaccggat acctgtccgc ctttctccct 3480
tcgggaagcg tggcgctttc tcatagctca cgctgtaggt atctcagttc ggtgtaggtc 3540
gttcgctcca agctgggctg tgtgcacgaa ccccccgttc agcccgaccg ctgcgcctta 3600
tccggtaact atcgtcttga gtccaacccg gtaagacacg acttatcgcc actggcagca 3660
gccactggta acaggattag cagagcgagg tatgtaggcg gtgctacaga gttcttgaag 3720
tggtggccta actacggcta cactagaaga acagtatttg gtatctgcgc tctgctgaag 3780
ccagttacct tcggaaaaag agttggtagc tcttgatccg gcaaacaaac caccgctggt 3840
agcggtggtt tttttgtttg caagcagcag attacgcgca gaaaaaaagg atctcaagaa 3900
gatcctttga tcttttctac ggggtctgac gctcagtgga acgaaaactc acgttaaggg 3960
attttggtca tgagattatc aaaaaggatc ttcacctaga tccttttaaa ttaaaaatga 4020
agttttaaat caatctaaag tatatatgag taaacttggt ctgacagtta ccaatgctta 4080
atcagtgagg cacctatctc agcgatctgt ctatttcgtt catccatagt tgcctgactc 4140
c 4141
<---
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ОЛИГОНУКЛЕОТИДОВ
IFNB1_F AGGATCCACCATGACCAACAAGTGTCTCCTC
IFNB1_R ATAGAATTCAGTTTCGGAGGTAACCTGTAAG
IFNB1_SF TGGCAATTGAATGGGAGGCT
IFNB1_SR GTCTCATTCCAGCCAGTGCT
IFNA14_F AGGATCCACCATGGCATTGCCCTTTGCTTTAATG
IFNA14_R TATGAATTCAATCCTTCCTCCTTAATCTTTTTTGC
IFNA14_SF GGCAACCAGTTCCAGAAAGC
IFNA14_SR CACACAGGCTTCCAGGTCAT
IFNA2_F AGGATCCACCATGGCCTTGACCTTTGCTTTAC
IFNA2_R TATGAATTCATTCCTTACTTCTTAAACTTTCTTG
IFNA2_SF AGCTGAATGACCTGGAAGCC
IFNA2_SR CTGCTCTGACAACCTCCCAG
IL12A_F ATCGTCGACCACCATGTGGCCCCCTGGGTCA
IL12A_R TTCGGTACCTTAGGAAGCATTCAGATAGCTCATC
IL12A_SF GCTCCAGAAGGCCAGACAAA
IL12A_SR GCCAGGCAACTCCCATTAGT
IL12B_F AGGATCCACCATGTGTCACCAGCAGTTGGTC
IL12B_R TGTAAGCTTAACTGCAGGGCACAGATGC
IL12B_SF CATCAAACCTGACCCACCCA
IL12B_SR GCTGAGGTCTTGTCCGTGAA
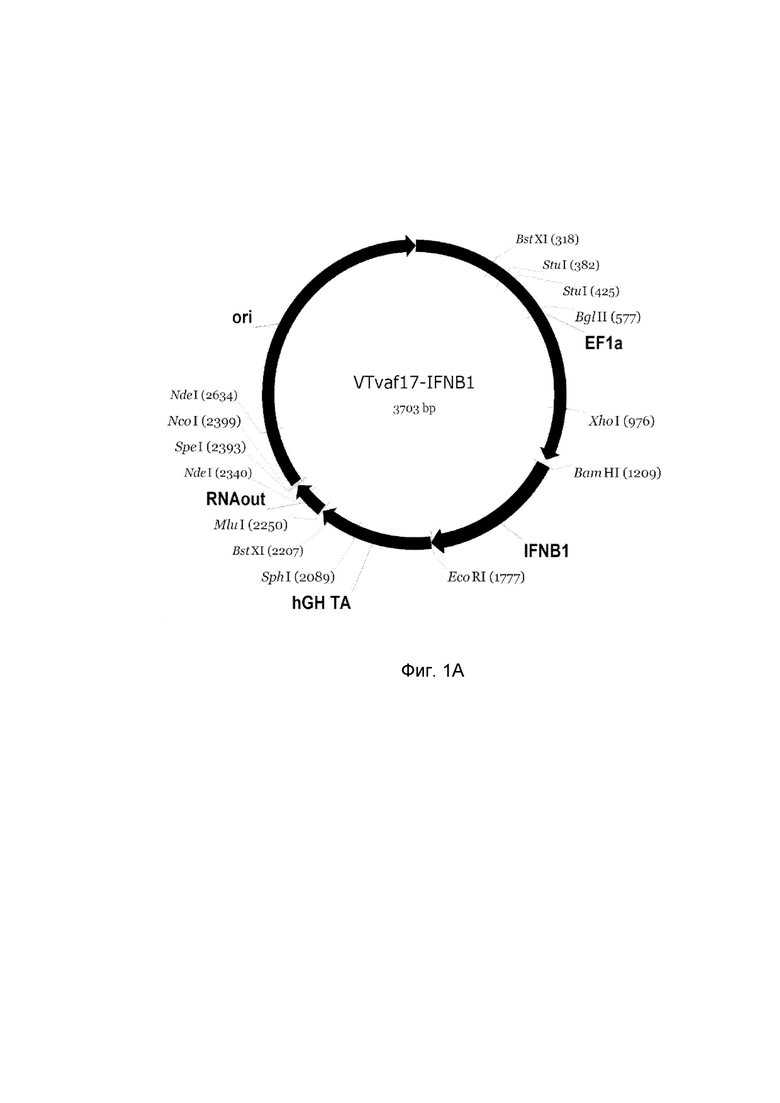
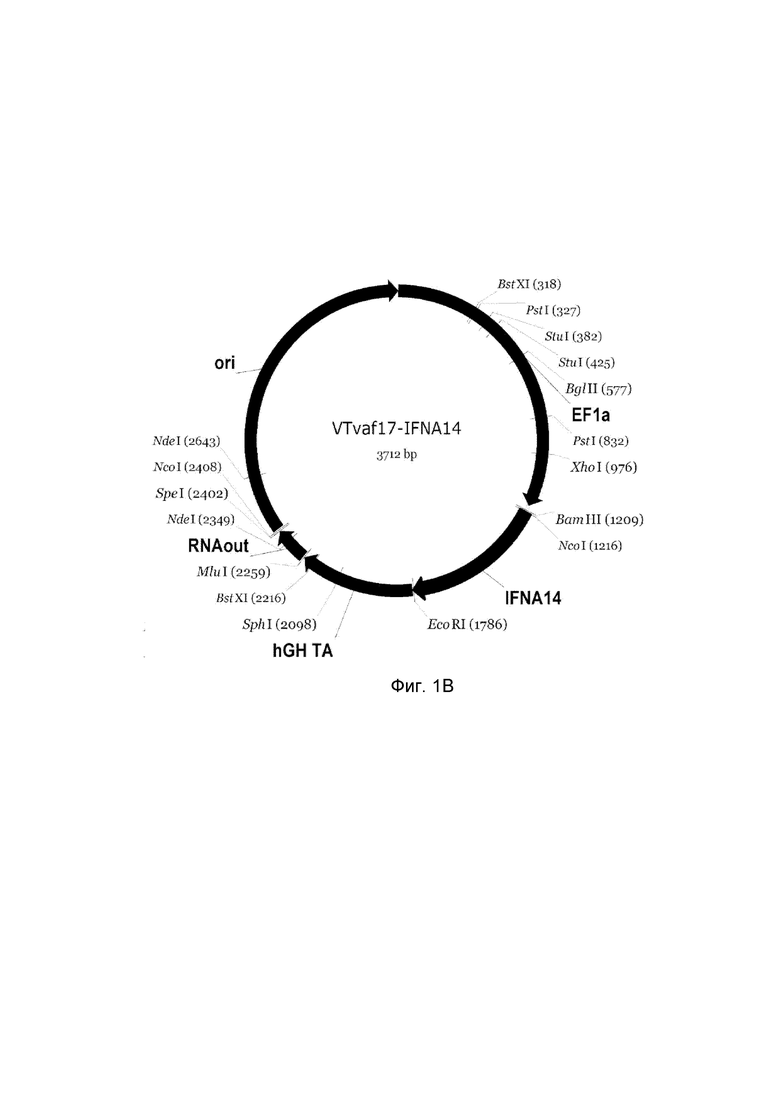
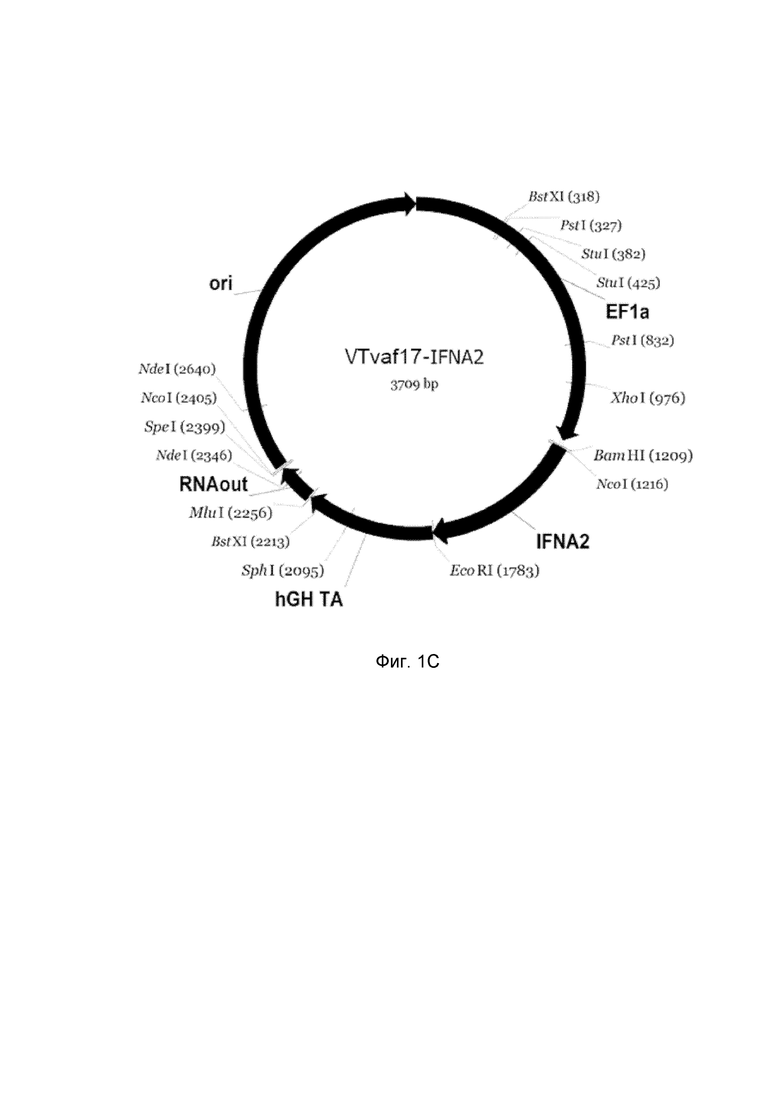
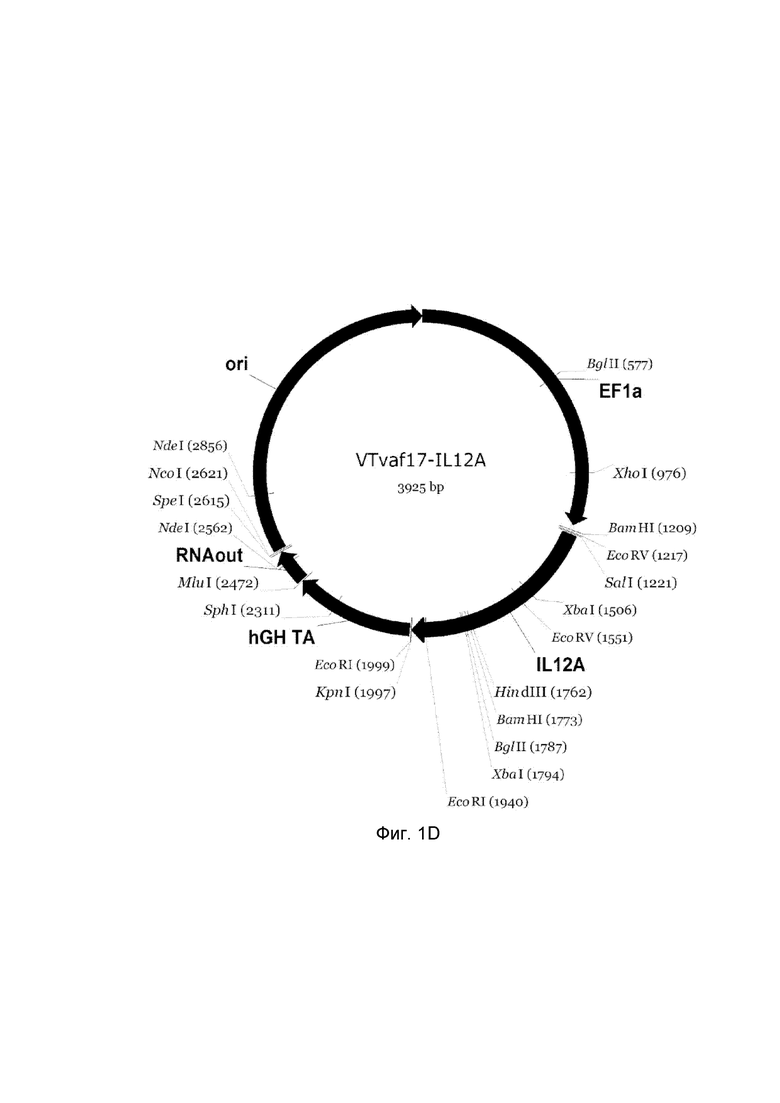
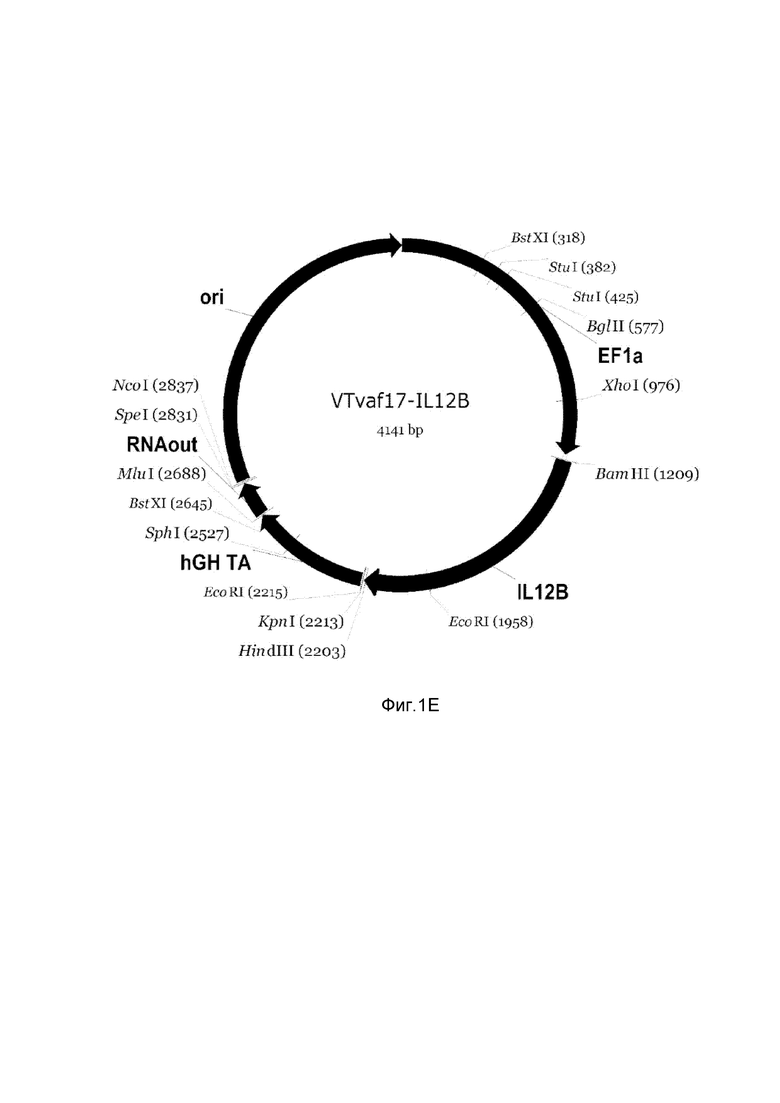
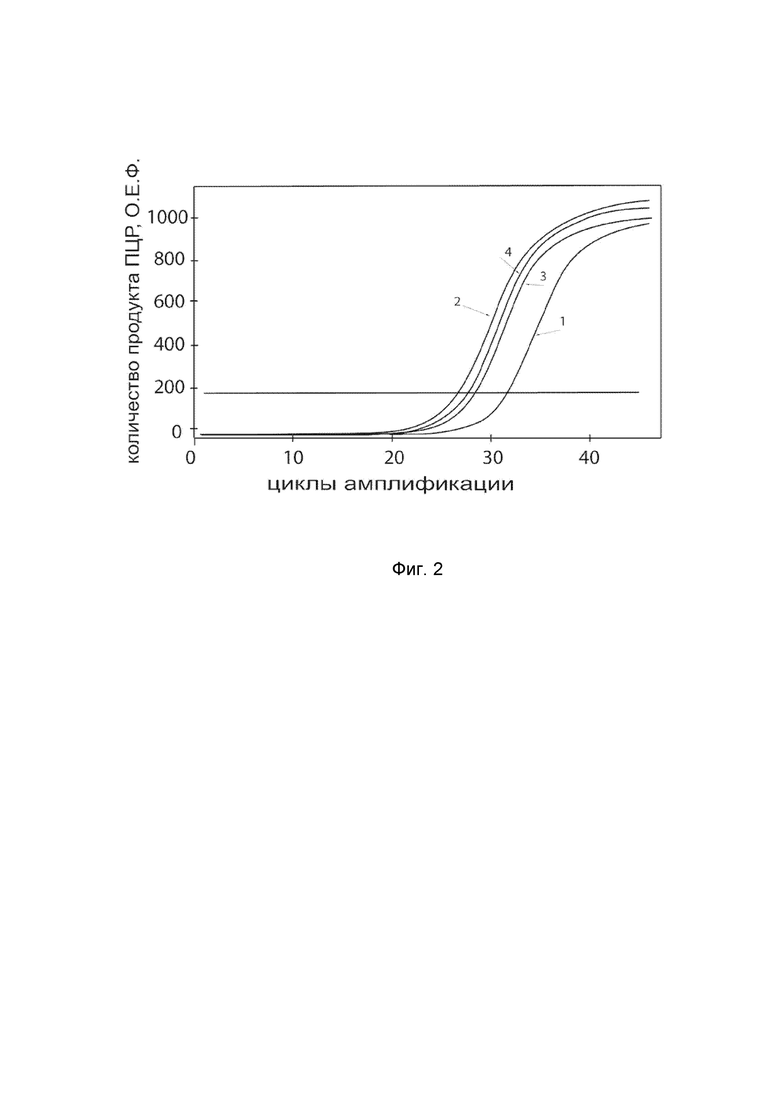
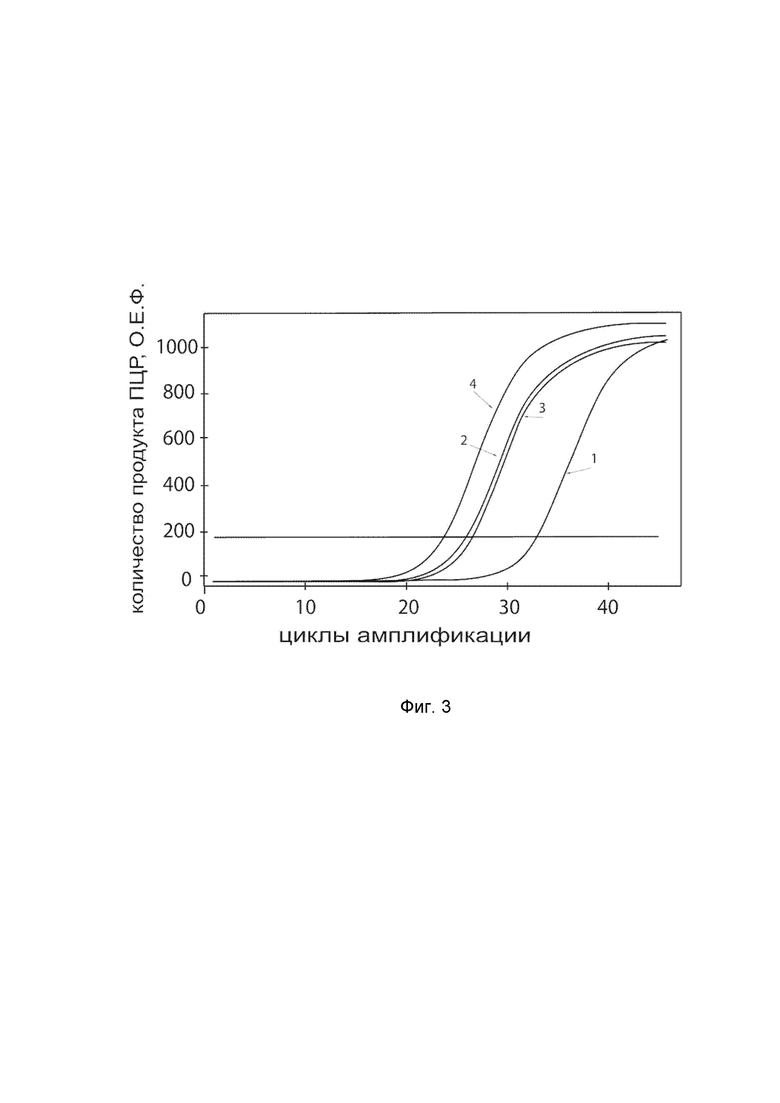
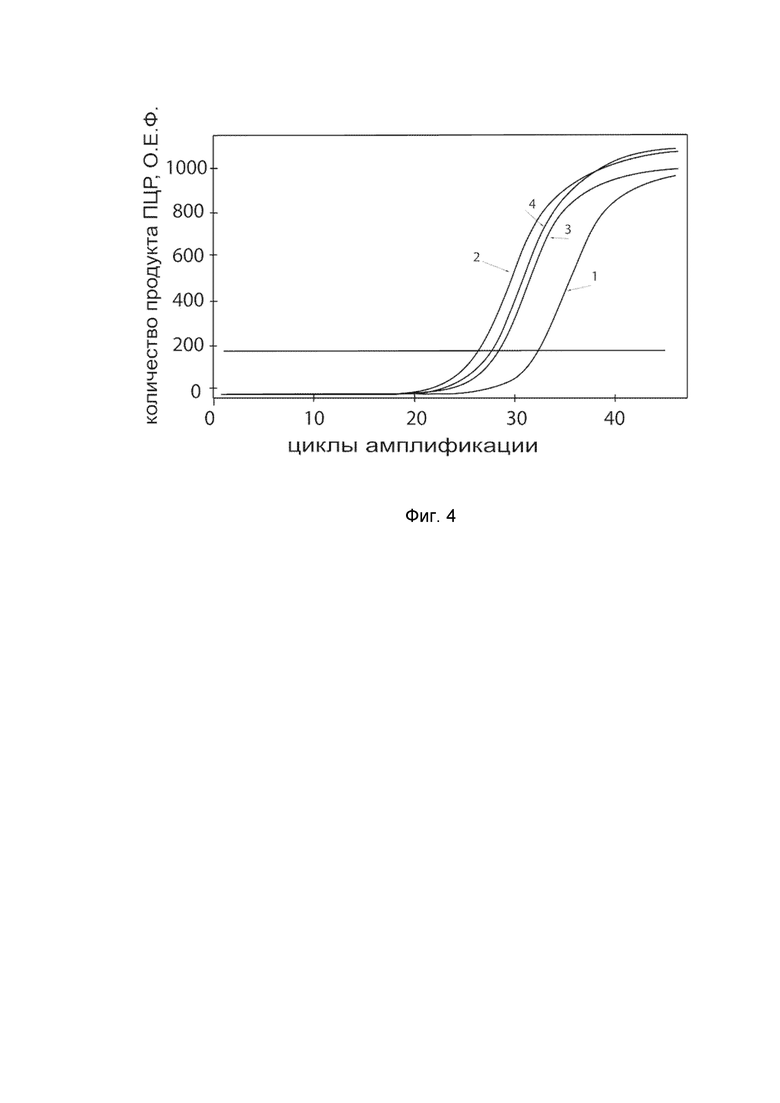
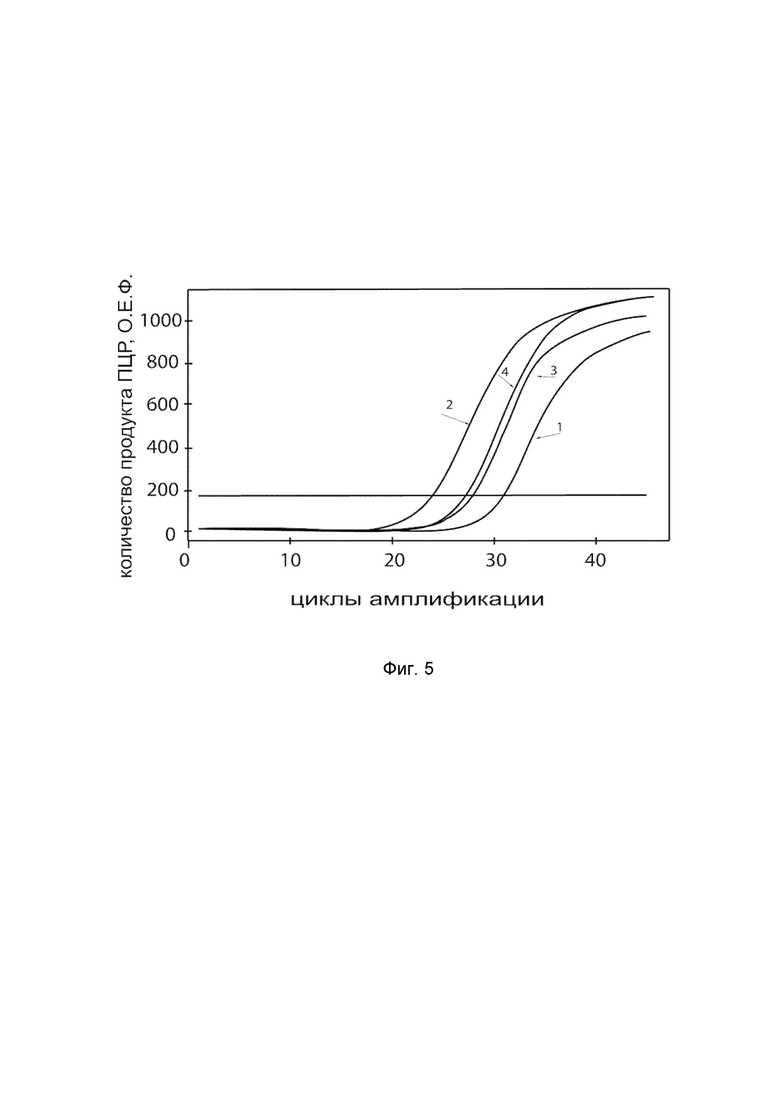
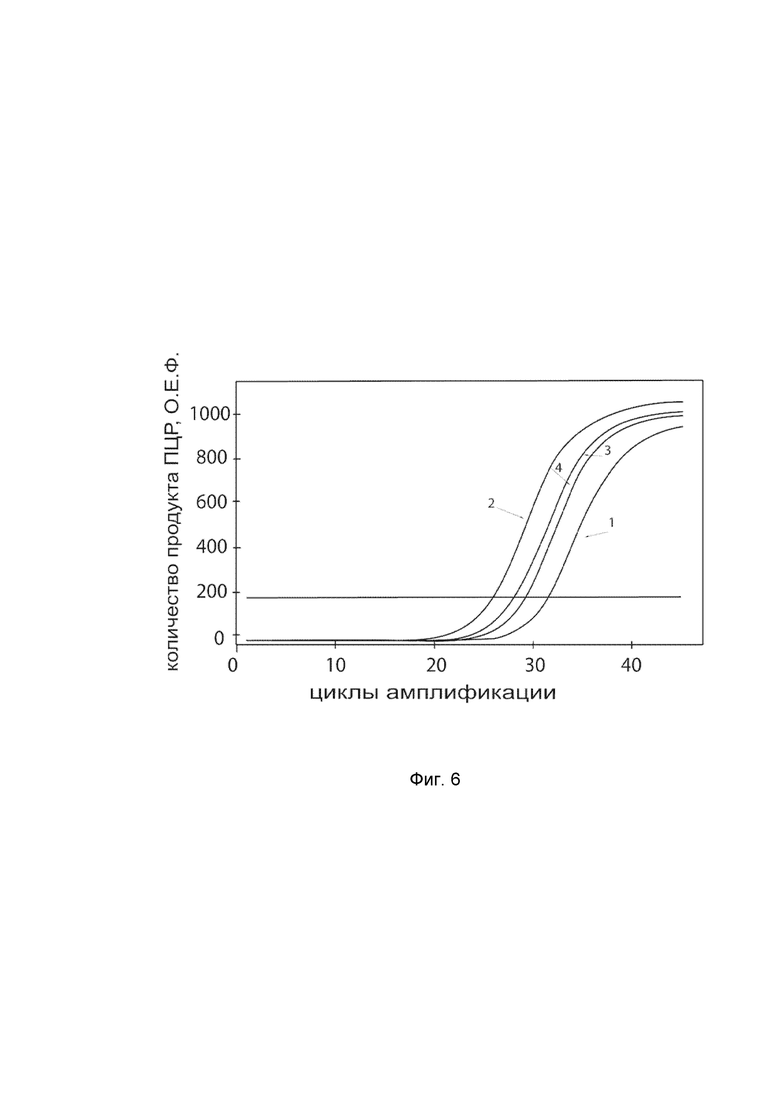
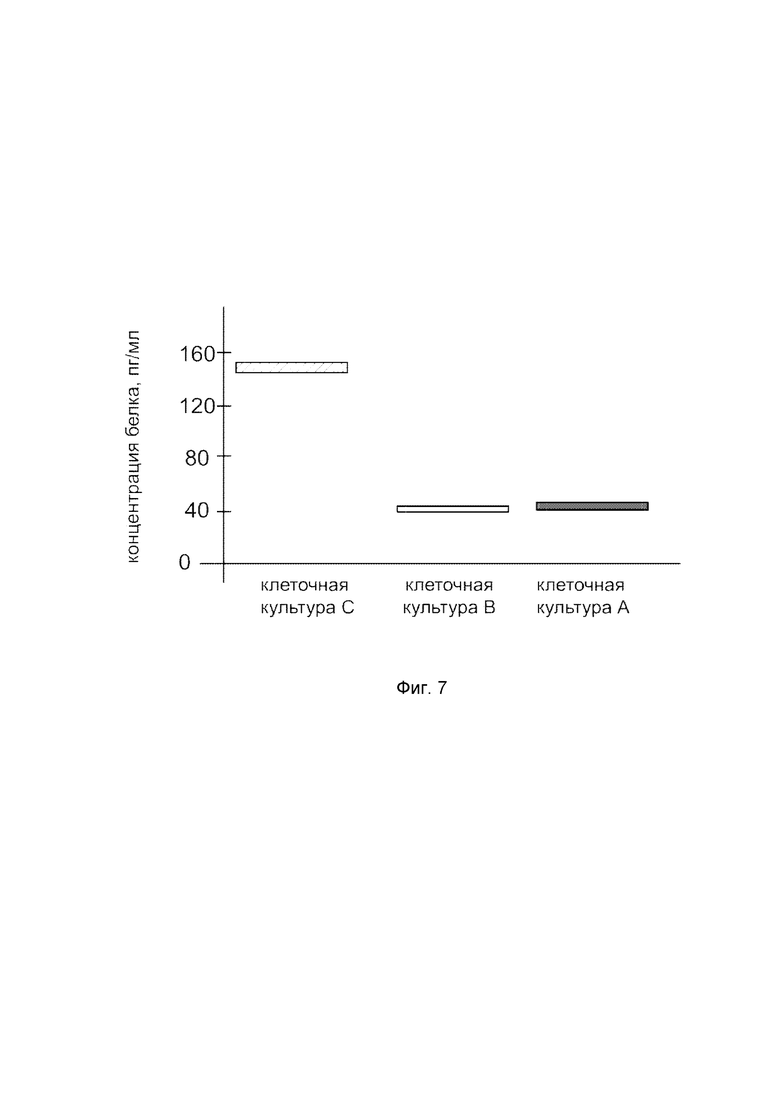
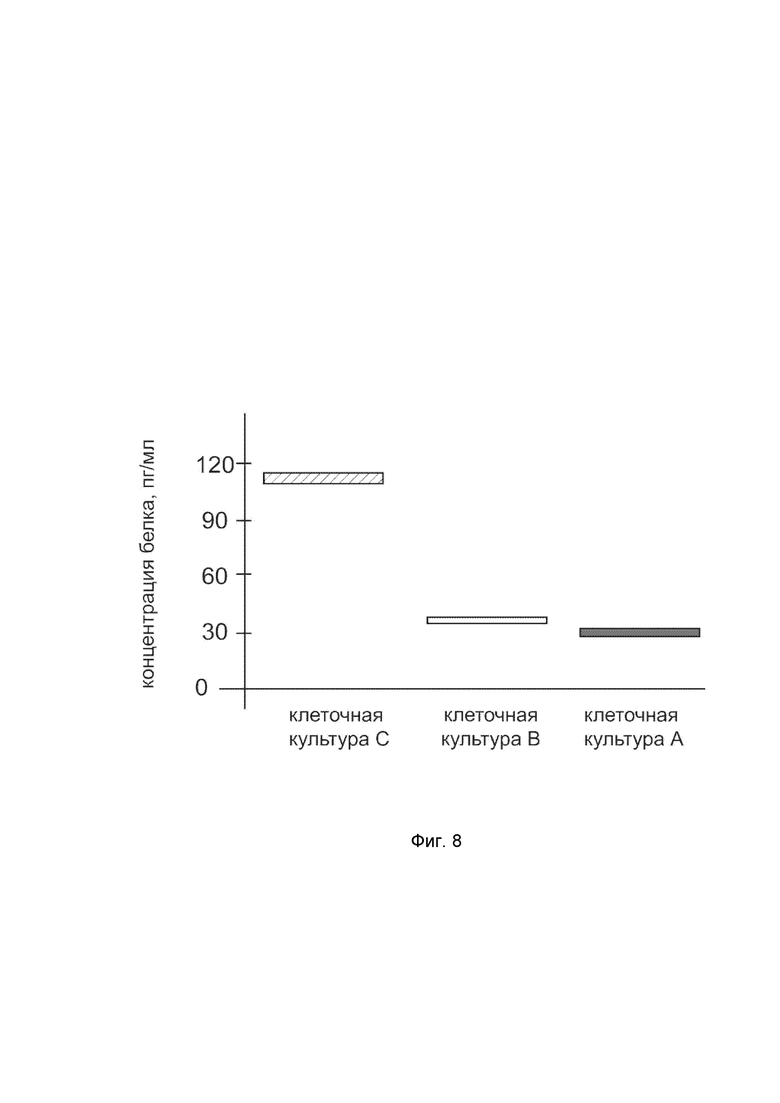

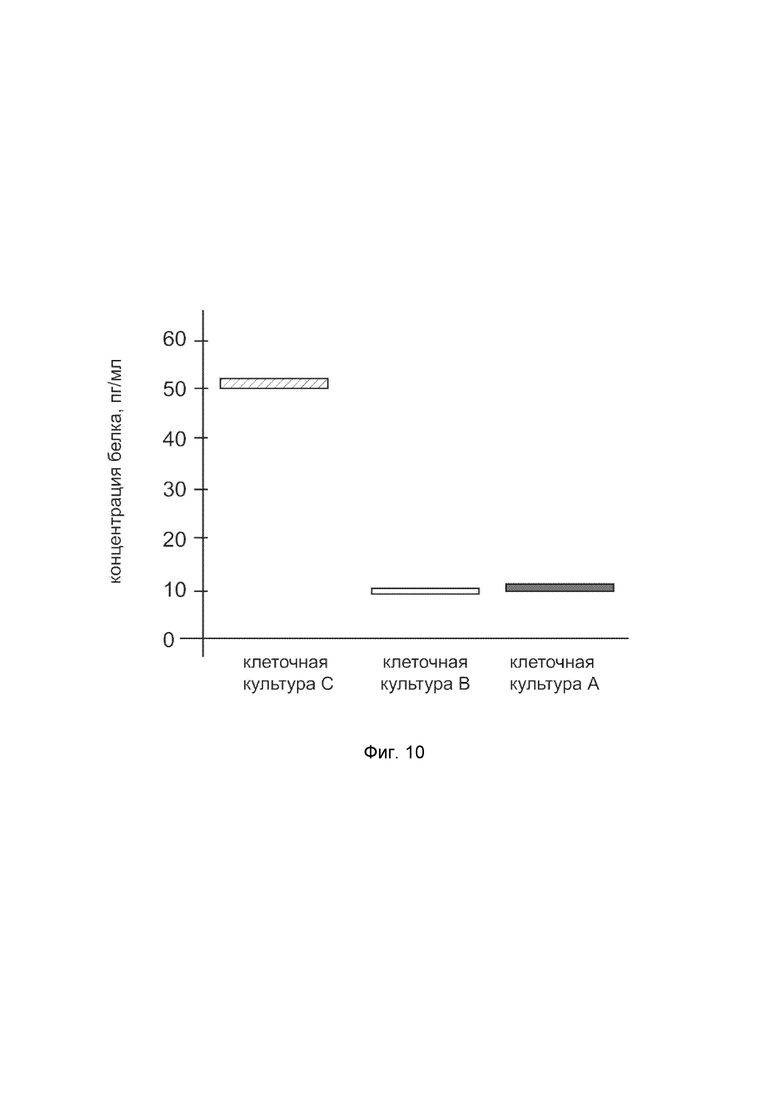

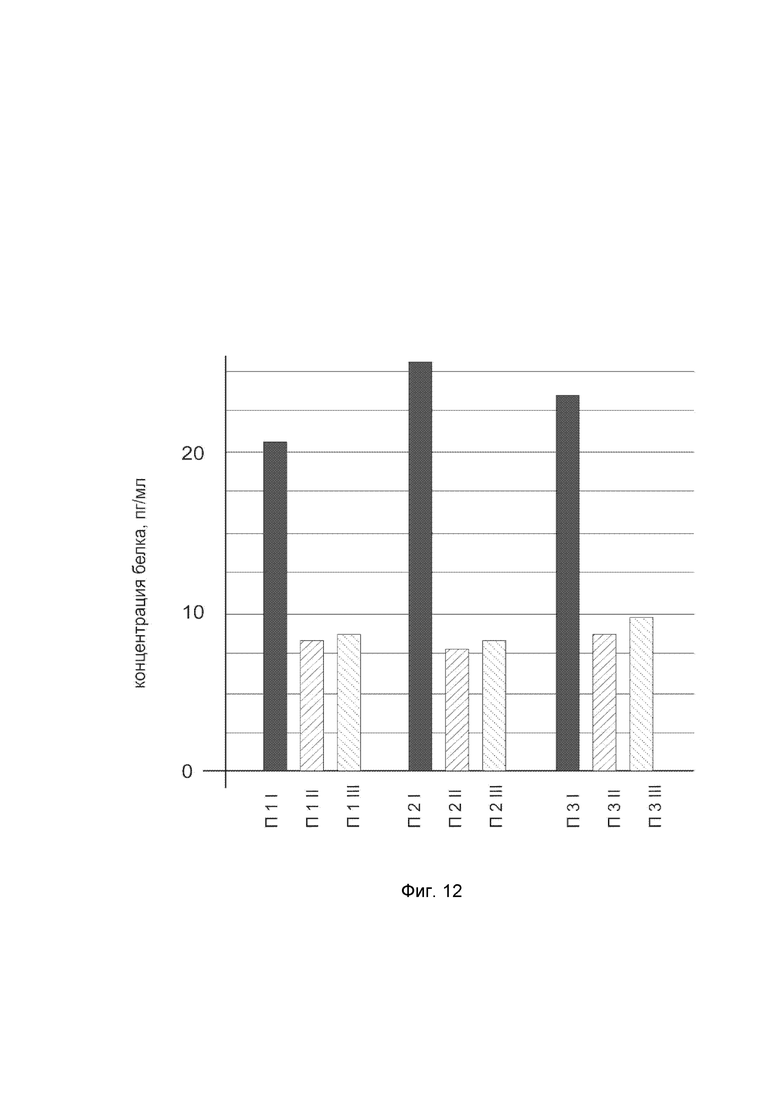


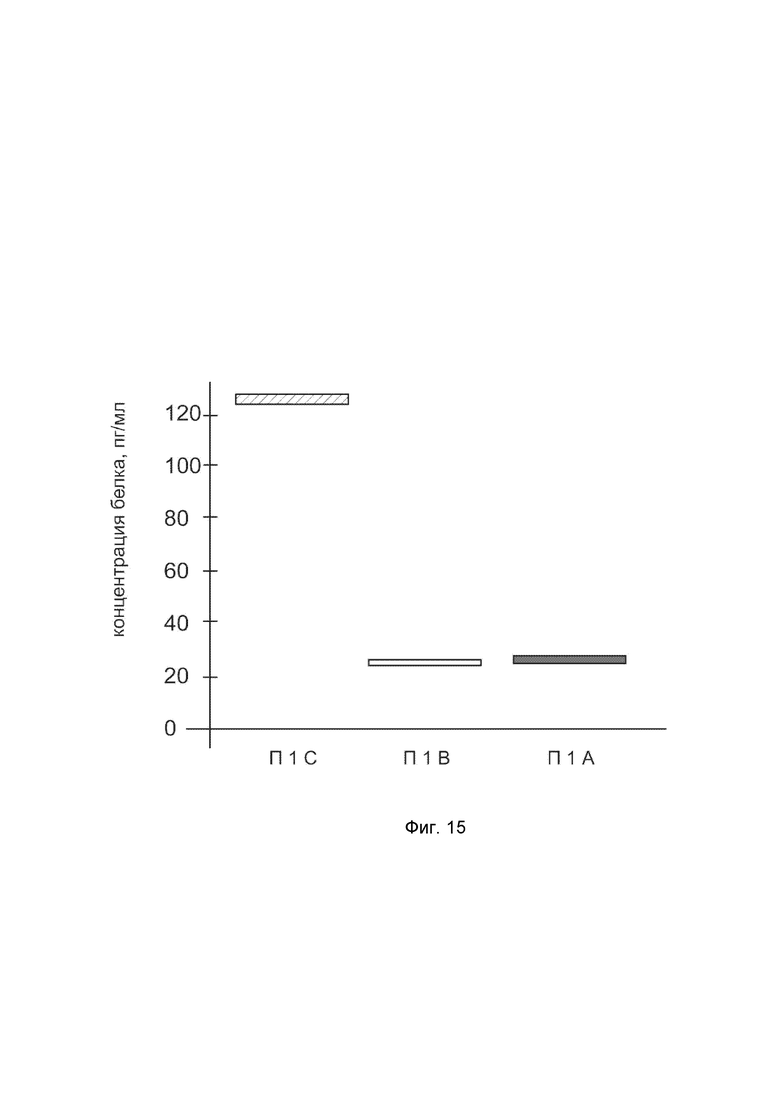
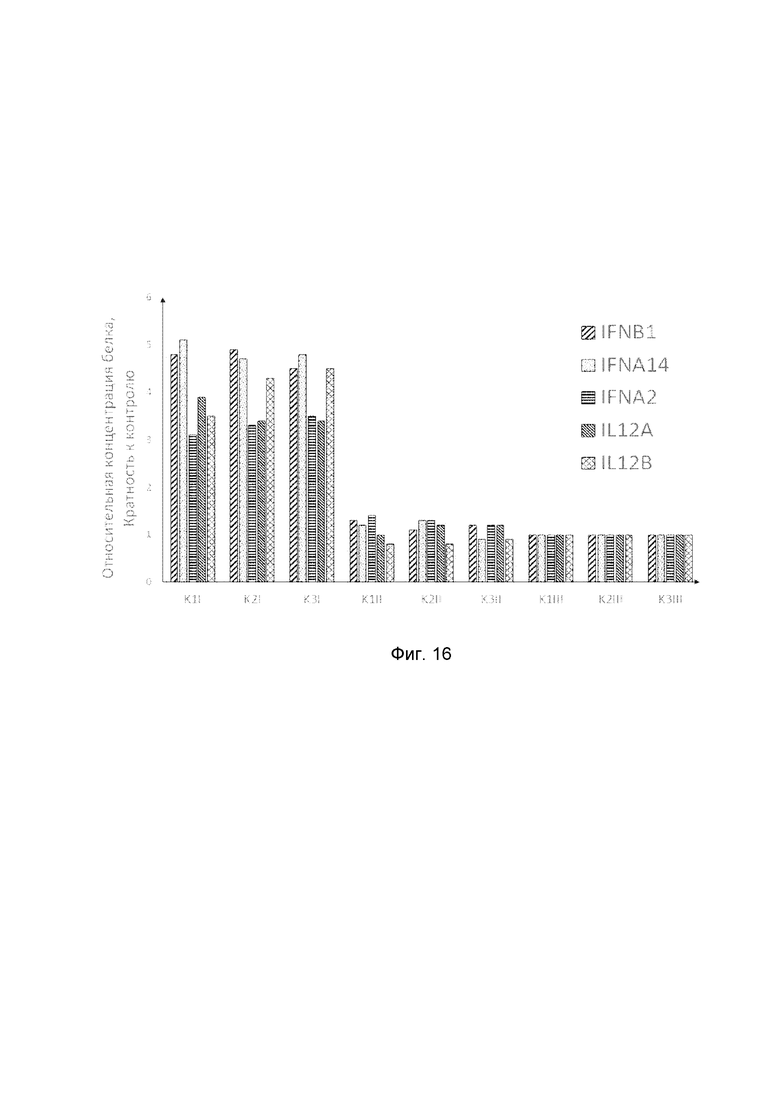
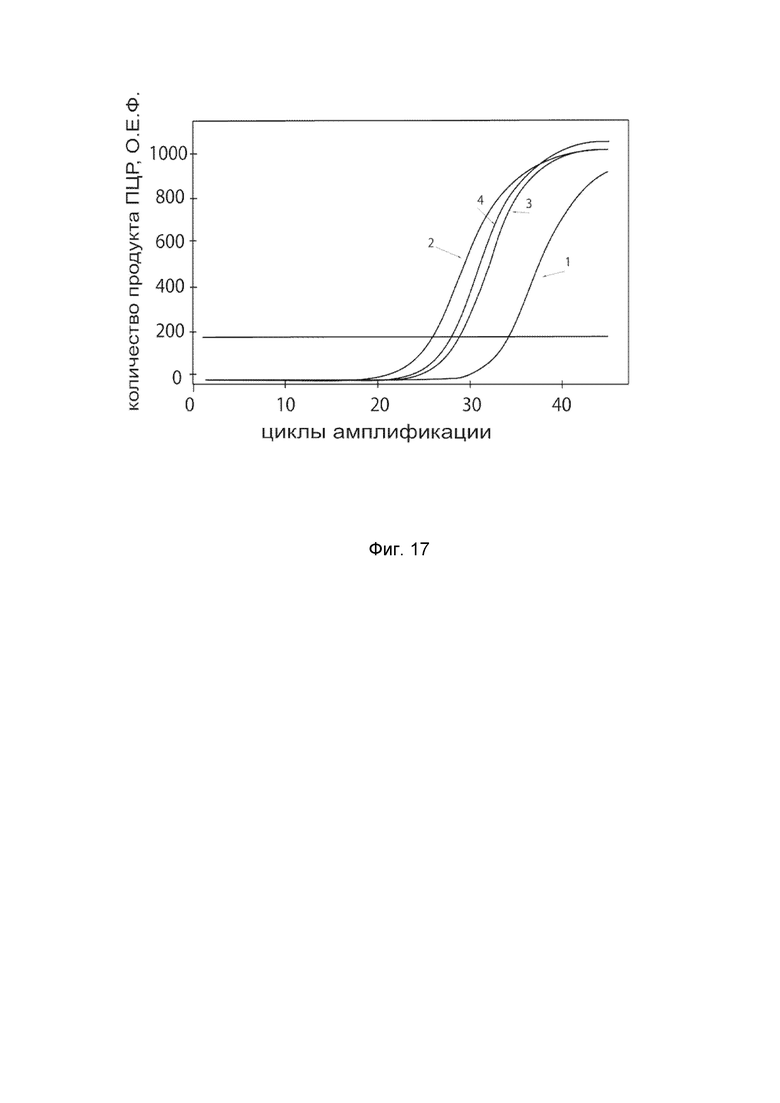
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания препаратов генной терапии. Создан генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов IFNB1, IFNA14, IFNA2, IL12A, IL12B для повышения уровня экспрессии этого целевого гена в организме человека и животных, при этом генотерапевтический ДНК-вектор VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B имеет нуклеотидную последовательность SEQ ID №1, или SEQ ID №2, или SEQ ID №3, или SEQ ID №4, или SEQ ID №5 соответственно. При этом каждый из созданных генотерапевтических ДНК-векторов: VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B за счет ограниченного размера векторной части VTvaf17, не превышающей 3200 п.н., обладает способностью эффективно проникать в клетки и экспрессировать клонированный в него целевой ген, выбранный из группы генов IFNB1, IFNA14, IFNA2, IL12A, IL12B соответственно. В составе генотерапевтического ДНК-вектора отсутствуют нуклеотидные последовательности вирусного происхождения и отсутствуют гены антибиотикорезистентности, обеспечивая возможность его безопасного применения для генетической терапии человека и животных. 14 н. и 2 з.п. ф-лы, 17 ил., 20 пр.
1. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, характеризующихся нарушением врожденного и адаптивного иммунитета, для терапии аутоиммунных, онкологических, вирусных заболеваний, связанных с дисбалансом иммунной системы, для иммуномодуляции, в том числе при противоопухолевой вакцинации в качестве генотерапевтического адъюванта, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена IFNB1, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-IFNB1, с нуклеотидной последовательностью SEQ ID №1.
2. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, характеризующихся нарушением врожденного и адаптивного иммунитета, для терапии аутоиммунных, онкологических, вирусных заболеваний, связанных с дисбалансом иммунной системы, для иммуномодуляции, в том числе при противоопухолевой вакцинации в качестве генотерапевтического адъюванта, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена IFNA14, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-IFNA14, с нуклеотидной последовательностью SEQ ID №2.
3. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, характеризующихся нарушением врожденного и адаптивного иммунитета, для терапии аутоиммунных, онкологических, вирусных заболеваний, связанных с дисбалансом иммунной системы, для иммуномодуляции в том числе при противоопухолевой вакцинации в качестве генотерапевтического адъюванта, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена IFNA2, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-IFNA2, с нуклеотидной последовательностью SEQ ID №3.
4. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, характеризующихся нарушением врожденного и адаптивного иммунитета, для терапии аутоиммунных, онкологических, вирусных заболеваний, связанных с дисбалансом иммунной системы, для иммуномодуляции, в том числе при противоопухолевой вакцинации в качестве генотерапевтического адъюванта, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена IL12A, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-IL12A, с нуклеотидной последовательностью SEQ ID №4.
5. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, характеризующихся нарушением врожденного и адаптивного иммунитета, для терапии аутоиммунных, онкологических, вирусных заболеваний, связанных с дисбалансом иммунной системы, для иммуномодуляции, в том числе при противоопухолевой вакцинации в качестве генотерапевтического адъюванта, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена IL12B, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-IL12B, с нуклеотидной последовательностью SEQ ID №5.
6. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген IFNB1, IFNA14, IFNA2, IL12A, IL12B по пп.1-4 или 5, отличающийся тем, что каждый из созданных генотерапевтических ДНК-векторов: VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B по пп.1-4 или 5, за счет ограниченного размера векторной части VTvaf17, не превышающей 3200 п.н., обладает способностью эффективно проникать в клетки человека и животных и экспрессировать клонированный в него целевой ген IFNB1, или IFNA14, или IFNA2, или IL12A, или IL12B .
7. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген IFNB1, IFNA14, IFNA2, IL12A, IL12B по пп.1-4 или 5, отличающийся тем, что в составе каждого из созданных генотерапевтических ДНК-векторов: VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B по пп.1-4 или 5, в качестве структурных элементов используются нуклеотидные последовательности, которые не являются генами антибиотикорезистентности, вирусными генами и регуляторными элементами вирусных геномов, обеспечивая возможность его безопасного применения для генетической терапии человека и животных.
8. Способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген IFNB1, IFNA14, IFNA2, IL12A, IL12B по пп.1-4 или 5, заключающийся в том, что каждый из генотерапевтических ДНК-векторов: VTvaf17-IFNB1, или VTvaf17-IFNA14, или VTvaf17-IFNA2, или VTvaf17-IL12A, или VTvaf17-IL12B получают следующим образом: кодирующую часть целевого гена IFNB1, или IFNA14, или IFNA2, или IL12A, или IL12B клонируют в генотерапевтический ДНК-вектор VTvaf17 и получают генотерапевтический ДНК-вектор VTvaf17-IFNB1, SEQ ID №1, или VTvaf17-IFNA14, SEQ ID №2, или VTvaf17-IFNA2, SEQ ID №3, или VTvaf17-IL12A, SEQ ID №4, или VTvaf17-IL12B, SEQ ID №5 соответственно, при этом кодирующую часть целевого гена IFNB1, или IFNA14, или IFNA2, или IL12A, или IL12B получают путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации с использованием созданных олигонуклеотидов и расщеплением продукта амплификации соответствующими эндонуклеазами рестрикции, причем клонирование в генотерапевтический ДНК-вектор VTvaf17 проводят по сайтам рестрикции Sail и Kpnl, или по сайтам рестрикции BamHI и EcoRI, причем селекцию проводят без антибиотиков,
при этом при получении генотерапевтического ДНК-вектора VTvaf17-IFNB1, SEQ ID №1 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
IFNB1_F AGGATCCACCATGACCAACAAGTGTCTCCTC
IFNB1_R ATAGAATTCAGTTTCGGAGGTAACCTGTAAG,
а расщепление продукта амплификации и клонирование кодирующей части гена IFNB1 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и EcoRI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-IFNA14, SEQ ID №2 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
IFNA14_F AGGАТССАССATGGСATTGССCTTTGСТТТAATG
IFNA14_R TATGAATTCAATCCTTCCTCCTTAATCTTTTTTGC,
а расщепление продукта амплификации и клонирование кодирующей части гена IFNA14 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и EcoRI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-IFNA2, SEQ ID №3 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
IFNA2_F AGGАТССАССATGGСCTTGACCTTTGCTTTAC
IFNA2_R TATGAATTCATTCCTTACTTCTTAAACTTTCTTG,
а расщепление продукта амплификации и клонирование кодирующей части гена IFNA2 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и EcoRI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-IL12A, SEQ ID №4 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
IL12A_F ATCGTCGACCACCATGTGGCCCCCTGGGTCA
IL12A_R TTCGGTACCTTAGGAAGCATTCAGATAGCTCATC,
а расщепление продукта амплификации и клонирование кодирующей части гена IL12A в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции Sail и Kpnl,
причем при получении генотерапевтического ДНК-вектора VTvaf17-IL12B, SEQ ID №5 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
IL12B_F AGGATCCACCATGTGTCACCAGCAGTTGGTC
IL12B_R TGTAAGCTTAACTGCAGGGCACAGATGC,
а расщепление продукта амплификации и клонирование кодирующей части гена IL12B в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и Hindi 11.
9. Способ использования генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген IFNB1, IFNA14, IFNA2, IL12A, IL12B по пп.1-4 и/или 5, для лечения заболеваний, характеризующихся нарушением врожденного и адаптивного иммунитета, для терапии аутоиммунных, онкологических, вирусных заболеваний, связанных с дисбалансом иммунной системы, для иммуномодуляции, в том числе при противоопухолевой вакцинации в качестве генотерапевтического адъюванта, заключающийся в трансфекции выбранным генотерапевтическим ДНК-вектором, несущим целевой ген на основе генотерапевтического ДНК-вектора VTvaf17, или несколькими выбранными генотерапевтическими ДНК-векторами, несущими целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, клеток органов и тканей пациента или животного, и/или во введении в органы и ткани пациента или животного аутологичных клеток этого пациента или животного, трансфицированных выбранным генотерапевтическим ДНК-вектором, несущим целевой ген на основе генотерапевтического ДНК-вектора VTvaf17 или несколькими выбранными генотерапевтическими ДНК-векторами, несущими целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17 и/или во введении в органы и ткани пациента или животного выбранного генотерапевтического ДНК-вектора, несущего целевой ген на основе генотерапевтического ДНК-вектора VTvaf17 или нескольких выбранных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, или в сочетании обозначенных способов.
10. Способ получения штамма для производства генотерапевтического ДНК-вектора по пп.1-4 или 5 для лечения заболеваний, характеризующихся нарушением врожденного и адаптивного иммунитета, для терапии аутоиммунных, онкологических, вирусных заболеваний, связанных с дисбалансом иммунной системы, для иммуномодуляции, в том числе при противоопухолевой вакцинации в качестве генотерапевтического адъюванта, заключающийся в получении электрокомпетентных клеток штамма Escherichia coli SCSI 10-AF с последующим проведением электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-IFNB1, или ДНК-вектором VTvaf17-IFNA14, или ДНК-вектором VTvaf17-IFNA2, или ДНК-вектором VTvaf17-IL12A, или ДНК-вектором VTvaf17-IL12B, после чего клетки высеивают на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы, а также 10 мкг/мл хлорамфеникола с получением в результате штамма Escherichia coli SCSI 10-AF/VTvaf17-IFNB1 или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA14, или штамма Escherichia coli SCS110-AF/VTvaf17-IFNA2, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12A, или штамма Escherichia coli SCS110-AF/VTvaf17-IL12B.
11. Штамм Escherichia coli SCS110-AFA/Tvaf17-IFNB1, полученный способом по п. 10, несущий генотерапевтический ДНК-вектор VTvaf17-IFNB1, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, характеризующихся нарушением врожденного и адаптивного иммунитета, для терапии аутоиммунных, онкологических, вирусных заболеваний, связанных с дисбалансом иммунной системы, для иммуномодуляции, в том числе при противоопухолевой вакцинации в качестве генотерапевтического адъюванта.
12. Штамм Escherichia coli SCS110-AF/VTvaf17-IFNA14, полученный способом по п. 10, несущий генотерапевтический ДНК-вектор VTvaf17-IFNA14, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, характеризующихся нарушением врожденного и адаптивного иммунитета, для терапии аутоиммунных, онкологических, вирусных заболеваний, связанных с дисбалансом иммунной системы, для иммуномодуляции, в том числе при противоопухолевой вакцинации в качестве генотерапевтического адъюванта.
13. Штамм Escherichia coli SCSI10-AF/VTvaf17-IFNA2, полученный способом по п. 10, несущий генотерапевтический ДНК-вектор VTvaf17-IFNA2, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, характеризующихся нарушением врожденного и адаптивного иммунитета, для терапии аутоиммунных, онкологических, вирусных заболеваний, связанных с дисбалансом иммунной системы, для иммуномодуляции, в том числе при противоопухолевой вакцинации в качестве генотерапевтического адъюванта.
14. Штамм Escherichia coli SCS110-AF/VTvaf17-IL12A, полученный способом по п. 10, несущий генотерапевтический ДНК-вектор VTvaf17-IL12A, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, характеризующихся нарушением врожденного и адаптивного иммунитета, для терапии аутоиммунных, онкологических, вирусных заболеваний, связанных с дисбалансом иммунной системы, для иммуномодуляции, в том числе при противоопухолевой вакцинации в качестве генотерапевтического адъюванта.
15. Штамм Escherichia coli SCSI 10-AF/VTvaf17-IL12B, полученный способом по п. 10, несущий генотерапевтический ДНК-вектор VTvaf17-IL12B, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, характеризующихся нарушением врожденного и адаптивного иммунитета, для терапии аутоиммунных, онкологических, вирусных заболеваний, связанных с дисбалансом иммунной системы, для иммуномодуляции, в том числе при противоопухолевой вакцинации в качестве генотерапевтического адъюванта.
16. Способ производства в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген IFNB1 или IFNA14 или IFNA2 или IL12A или IL12B, по пп.1-4 или 5, для лечения заболеваний, характеризующихся нарушением врожденного и адаптивного иммунитета, для терапии аутоиммунных, онкологических, вирусных заболеваний, связанных с дисбалансом иммунной системы, для иммуномодуляции, в том числе при противоопухолевой вакцинации в качестве генотерапевтического адъюванта, заключающийся в том, что генотерапевтический ДНК-вектор VTvaf17-IFNB1, или генотерапевтический ДНК-вектор VTvaf17-IFNA14, или генотерапевтический ДНК-вектор VTvaf17-IFNA2, или генотерапевтический ДНК-вектор VTvaf17-IL12A, или генотерапевтический ДНК-вектора VTvaf17-IL12B получают путем того, что засевают в колбу с приготовленной средой затравочную культуру, выбранную из штамма Escherichia coli SCS110-AFA/Tvaf 17-IFNB1, или штамма Escherichia coli SCSI 10-AF/VTvaf17-IFNA14, или штамма Escherichia coli SCSI 10-AF/VTvaf17-IFNA2, или штамма Escherichia coli SCSI 10-AF/VTvaf17-IL12A, или штамма Escherichia coli SCSI 10-AF/VTvaf17-IL12B, затем инкубируют затравочную среду в шейкере-инкубаторе и переносят ее в промышленный ферментер, после чего растят до достижения стационарной фазы, затем выделяют фракцию, содержащую целевой ДНК-продукт, многостадийно фильтруют и очищают хроматографическими методами.
| RU 2016101106 A, 22.08.2017 | |||
| US 4808523 A1, 28.02.1989 | |||
| WO 2003044203, 30.05.2003. |
Авторы
Даты
2020-04-30—Публикация
2018-11-29—Подача