Область техники
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания препаратов генной терапии.
Уровень техники
Генная терапия - это современный медицинский подход, направленный на лечение наследственных и приобретенных заболеваний путем введения нового генетического материала в клетки, ткани, органы пациента с целью компенсации или подавления функции мутантного гена и/или исправления генетического дефекта. Целью генной терапии является, в большинстве случаев, введение в организм генов, обеспечивающих транскрипцию и последующую трансляцию белковых молекул, кодируемых этими генами. В рамках описания настоящего изобретения под экспрессией гена подразумевается продукция белковой молекулы, аминокислотная последовательность которой кодируется этим геном.
Васкуляризация тканей может осуществляться васкулогенезом и ангиогенезом. Васкулогенез представляет собой образование кровеносных сосудов из мезенхимальных клеток в эмбриогенезе или эндотелиальных клеток-предшественников, мигрирующих из красного костного мозга в постнатальном периоде (постнатальный васкулогенез).
Ангиогенез - это процесс образования новых кровеносных сосудов в уже существующей сосудистой системе. Он играет важную роль в развитии и нормальном росте тканей, заживлении ран, репродуктивном цикле у женщин (развитие плаценты и желтого тела, овуляции), и вовлечен в патогенез различных заболеваний.
Представители семейства белков факторов роста эндотелия сосудов VEGF играют ключевую роль среди стимуляторов прорастания сосудов. Семейство VEGF включает 5 представителей VEGFA, VEGFB, VEGFC, VEGFD. VEGFA связывается с рецепторами VEGF (VEGFR) первого типа и VEGFR-2. VEGF-А стимулирует пролиферацию, миграцию и обеспечивает выживание эндотелиальных клеток. Большинство его эффектов связано с активацией рецепторов VEGFR-2.
Белок ангиогенин продукт гена ANG является одним из факторов ангиогенеза и принадлежит суперсемейству Рибонуклеаз А. Он обладает ферментативной РНКазной активностью, в отличие от других факторов ангиогенеза. Эндогенный ангиогенин необходим для пролиферации клеток, индуцируемой другими белками, как например VEGF. Как и в случае с VEGF, экспрессия ангиогенина может индуцироваться состоянием гипоксии. Белок, кодируемый ANG геном, является мощным медиатором образования новых кровеносных сосудов. Зрелый пептид обладает противомикробной активностью против некоторых бактерий и грибков, в том числе S.pneumoniae, и С. Albicans. Ангиогенин - один из ключевых белков, вовлеченных в процесс ангиогенеза в нормальных и опухолевых тканях. Ангиогенин взаимодействует с актином на поверхности эндотелиальных клеток, и путем эндоцитоза транспортируется в клеточное ядро, что в дальнейшем приводит к стимуляции процессов клеточной миграции, инвазии и пролиферации. Ангиогенин также способен связывать фоллистатин. Его активность in vivo регулируется взаимодействием с RNH1.
Факторы роста фибробластов (FGF1, FGF2), взаимодействуя с рецепторами - FGFR-1-4 являются мощными митогенами для эндотелиальных клеток, а также стимулирует их миграцию.
Ангиопоэтины ANGPT1 и ANGPT2 опосредуют свое действие через рецепторы эндотелиальных клеток Tie-2. ANGPT1 способствует выживанию эндотелиальных клеток, образованию контактов между ними, взаимодействию с перицитами, что стабилизирует образованные сосуды.
Белок гипоксией индуцированный фактор (HIF1α) - его активность увеличивается при снижении напряжения кислорода в крови. Показано, что этот фактор играет главную роль в системном ответе организма на гипоксию, синтезируется во многих тканях организма, в том числе в нервной ткани, где его экспрессия максимальна в нейронах. HIF1α, как известно, индуцирует транскрипцию более 60 генов, включая VEGF и эритропоэтин, участвующих в биологических процессах, таких как ангиогенез и эритропоэз, которые способствуют продвижению и увеличению доставки кислорода в гипоксические области. Этот белок также индуцирует транскрипцию генов, участвующих в пролиферации и выживаемости клеток, а также в метаболизме глюкозы и железа.
Фактор роста гепатоцитов (HGF) стимулирует регенерацию печеночной ткани, оказывает защитное действие на гепатоциты и другие клетки, предотвращая их апоптоз, а также оказывает антифиброзное действие, индуцируя синтез протеиназ внеклеточного матрикса. HGF стимулирует миграцию резидентных стволовых клеток сердца из мест их локализации в участки повреждения, в частности, при инфаркте миокарда - в зону инфаркта. Для продуцирования HGF используют ДНК, содержащую природный ген фактора роста гепатоцитов человека, однако при его использовании не удается получить высокий уровень экспрессии данного белка. Последовательность гена HGF, оптимизированная для получения больших количеств белка, представлена в материалах патента RU 2385936.
Фактор роста тромбоцитов С (PDGFC) - белок, один из многочисленных факторов роста, который играет важную роль в ангиогенезе. Содержится в α-гранулах в тромбоцитах, синтезируется в мегакариоцитах. В каждом тромбоците находится порядка тысячи молекул PDGFC. Этот белок - сильный стимулятор репарации тканей, рецепторы к которому расположены в сосудистой стенке на фибробластах и клетках гладкой мышечной ткани. PDGFC стимулирует пролиферацию этих клеток. Кроме того, PDGF увеличивает продукцию составляющих соединительной ткани (гликозаминогликанов, коллагена и др.).
Фактор стромальных клеток SDF1 (англ. Stromal cell-derived factor-1) - хемокин подсемейства СХС, который у человека закодирован геном CXCL12. SDF1 связывается с рецепторами CXCR4 и CXCR7 и играет важную роль в эмбриональном развитии и гематопоэзе. SDF1 выступает не только в роли хемоаттрактанта: в некоторых случаях он может стимулировать пролиферацию клеток и способствовать их выживанию.
Белок калликреин KLK4 входит в подгруппу сериновых протеаз, имеющих разнообразные физиологические функции. Научные данные свидетельствуют о том, что многие калликреины вовлечены в канцерогенез, а некоторые из них обладают потенциалом в качестве новых биомаркеров рака и других заболеваний. Этот ген является одним из пятнадцати элементов подсемейства калликреина, расположенных в кластере на хромосоме 19. KLK4 преимущественно экспрессируется в ядрах базальных клеток в эпителии простаты в соответствии с его распространением в клетках рака простаты in vitro. Калликреины могут способствовать ангиогенезу. Ряд исследований in vitro показывает, что калликреины поддерживают ангиогенез путем прямого или опосредованного разрушения внеклеточного матрикса.
Также известен фактор роста, выделяемый клетками эндокринных желез, который получил название прокинетицин-1 (PROK1). По своей структуре этот белок близок к семейству VEGF и поэтому первоначально был назван сосудистым эндотелиальным фактором роста, выделенным из эндокринных желез (EG-VEGF). Данная молекула вызывала пролиферацию, миграцию и образование мембранных разрывов в эндотелиальных клетках капилляров, полученных из эндокринных желез. При этом прокинетицин-1 практически не оказывал никакого влияния на другие типы тестируемых эндотелиальных и не эндотелиальных клеток. Подобно VEGF, прокинетицин-1 обладает сайтом связывания HIF-1, и его экспрессия индуцируется гипоксией. Оба фактора приводили к обширному ангиогенезу и формированию кисты при их доставке в яичник. Однако, в отличие VEGF, с помощью прокинетицина-1 удалось стимулировать ангиогенез в роговице или скелетной мышце. Экспрессия человеческого PROK1 обнаружена в клетках и тканях стероидогенных желез, яичников, семенников, надпочечников и плаценте и часто дополняет экспрессию VEGF, при этом предполагают, что эти молекулы действуют согласованно.
Белок прокинетицин-2 (PROK2) представляет собой близко связанный секретируемый белок с PROK1, индуцирует пролиферацию, выживаемость и миграцию клеток эндотелия сосудов коры надпочечников (LeCouter, J. et al, Proc Natl Acad Sci USA 100, 2685-2690 (2003)).
Белки PROK1 (EG-VEGF) и PROK2 (Bv8) охарактеризованы в качестве митогенов, избирательных к конкретным типам клеток эндотелия (LeCouter, J. et al, Nature 412(6850):877-84 (2001) и LeCouter, J. et al, Proc Natl Acad Sci USA 100, 2685-2690 (2003)). Этому семейству приписаны другие активности, включая ноцицепцию (Mollay, С. et al, выше), моторику желудочно-кишечного тракта (Li, M. et al, выше), регуляцию суточного двигательного ритма (Cheng, M.Y., et al., Nature All, 405-410 (2002)) и нейрогенез обонятельной луковицы (Matsumoto, S., et al, Proc Natl Acad Sci USA 103, 4140-4145 (2006)). Кроме того, Bv8 стимулировал получение гранулоцитарных и моноцитарных колоний in vitro (LeCouter, J. et al, (2003), выше; Dorsch, M. et al, J. Leukoc Biol 78(2), 426-34 (2005)). Bv8 охарактеризован в качестве хемоаттрактанта для макрофагов (LeCouter et al, Proc Natl Acad Sci USA.).
Гены, выбранные из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2 играют важную роль в организме человека и животных.
Показана связь низких/недостаточных концентраций этих белков с различными заболеваниями, которая, в ряде случаев, подтверждена нарушениями в нормальной экспрессии генов, кодирующих эти белки.
У нокаутных мышей по ANG гену наблюдается увеличение продукции форм активного кислорода по сравнению с диким типом, и повышенная чувствительность к агентам оксидативного стресса, пероксиду водорода, склонность к развитию реперфузионного синдрома, и холодовым повреждениям мозга. А также повышенный уровень окислительного повреждения мтДНК, структурные аномалии в миоцитах и митохондриях сердца. Предполагается, что ANG играет важную роль в защите митохондрий сердца от повреждений при реоксигенации in vivo. У мутантов также наблюдали брадикинин-индуцированную вазоконстрикцию. Отсутствие ANG аллеля у трансгенных мышей усиливает определенные аспекты старения, а именно уровень эндотелиальной дисфункции, ремоделирования сосудов, и инвазии лейкоцитов в сердечно-сосудистые ткани. [PMID: 12429206], [PMID: 11579147], [PMID: 14732290], [PMID: 10754271], [PMID: 18760274].
Известно, что ингибирование функции гена VEGFA может привести к бесплодию из-за блокировки функции желтого тела. Инактивация одиночного VEGF аллеля ведет к связанной с гаплонедостаточностью гибели эмбрионов из-за аномалий развития кровеносных сосудов примерно на 9-й день беременности. Дифференцировка ангиобластов не нарушена, но нарушены образование просветов сосудов, ответвлений и ангиогенез. Инактивация VEGF во время постнатального развития ведет к нарушению постнатального развития сосудов и жизнеспособности эндотелия, увеличивает смертность, задерживает рост и нарушает развитие печени, сердца и почек (Козырева Е.В., Давидян Л.Ю. https://www.science-education.ru/ru/article/view?id=20811).
Снижение экспрессии целого ряда генов калликреинов (KLK) продемонстрировано в раковых опухолях молочной железы, простаты и тестикул.
При генетическом дефекте SDF-1 у мышей развиваются тяжелые расстройства гемопоэза еще при эмбриогенезе, что связывают с нарушением миграции гемопоэтических стволовых клеток (ГСК) из органов раннего гемопоэза (печени, желточного мешка) в костный мозг. Введение человеческого SDF1 иммунодефицитным мышам в селезенку и костный мозг приводит к быстрому хоумингу введеных клеток костного мозга человека в эти же органы [http://gerontology-explorer.narod.ru/8ead2657-998b-4d77-9c83-8f8f80784343.html].
Таким образом, предшествующий уровень техники свидетельствует о том, что мутации в генах ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, или недостаточная экспрессия белков, кодируемых этими генами, связаны с развитием спектра заболеваний, включающих в себя, но не ограничивающихся такими патологиями, как расстройство гемопоэза, бесплодие, ишемические поражения миокарда, мозга и мышц нижних конечностей, раковые опухоли, нарушения онтогенеза и нейрогенеза, болезнь Паркенсона, фиброз печени, легочная гипертензия, нейродегенеративные заболевания, в частности боковой амиотрофический склероз (БАС)и другими патологическими состояниями. Этим обусловлено объединение генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2 в рамках данного патента в группу генов. Генетические конструкции, обеспечивающие экспрессию белков, кодируемых генами ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, входящими в группу генов, в составе того или иного вектора для генной терапии, могут быть использованы для разработки лекарственных препаратов для терапии различных заболеваний, включающих в себя, но не ограничивающихся такими патологиями, как расстройство гемопоэза, бесплодие, ишемические поражения миокарда, мозга и мышц нижних конечностей, раковые опухоли, нарушения онтогенеза и нейрогенеза, болезнь Паркенсона, фиброз печени, легочная гипертензия, нейродегенеративные заболевания, в частности боковой амиотрофический склероз (БАС) и другими патологическими состояниями.
Более того, приведенные данные свидетельствуют о том, что недостаточная экспрессия белков, кодируемых генами ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, входящими в группу генов, связана не только с патологическими состояниями, но и с предрасположенностью к их развитию. Также приведенные данные свидетельствуют о том, что недостаточная экспрессия белков, кодируемых генами ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, может не проявляться в явном виде в форме патологии, которая может быть однозначно описана в рамках существующих стандартов клинической практики (например, с применением кода МКБ), однако при этом вызывать состояния, которые неблагоприятны для человека и животных и связанны с ухудшением качества жизни.
Таким образом, повышение экспрессии гена, выбранного из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, и введенного в организм генотерапевтическим способом, актуально для коррекции состояний человека и животных, связанных с нарушением действия вышеназванных генов.
Для целей генной терапии используют специально сконструированные генотерапевтические векторы, которые разделяют на вирусные и невирусные. В последнее время все большее внимание уделяется разработке невирусных систем доставки генетического материала, среди которых лидируют плазмидные векторы. Данные векторы лишены недостатков, присущих вирусным векторам: в клетке-мишени они существуют в эписомальной форме, поэтому не происходит интеграции в геном; их производство достаточно дешево; отсутствие иммунного ответа и побочных реакций на введение плазмидного вектора делают их удобным инструментом генной терапии и генетической профилактики в качестве ДНК-вакцины (Li L, Petrovsky N. Molecular mechanisms for enhanced DNA vaccine immunogenicity. Expert Rev Vaccines. 2016; 15(3):313-29).
При этом имеются ограничения для использования плазмидных векторов для генной терапии: 1) наличие генов устойчивости к антибиотикам для наработки в штаммах-носителях, 2) наличие различных регуляторных элементов, представленных последовательностями вирусных геномов, 3) размер терапевтического плазмидного вектора, определяющий эффективность проникновения вектора в клетку-мишень.
Известно, что Европейское агентство по лекарственным средствам считает необходимым избегать введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011 EMA/CAT/GTWP/44236/2009 Committee for advanced therapies), а также рекомендует избегать наличия в составе терапевтических плазмидных векторов регуляторных элементов для повышения экспрессии целевых генов (промоторов, энхансеров, посттрансляционных регуляторных элементов), которые являютсячастями геномов различных вирусов (Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products / 23 March 2015, EMA/CAT/80183/2014, Committee for Advanced Therapies).
Также, существенным моментом является размер генотерапевтического вектора. Известно, что современные плазмидные векторы зачастую перегружены нефункциональными участками, серьезно увеличивающими размер вектора (Mairhofer J, Grabherr R. Rational vector design for efficient non-viral gene delivery: challenges facing the use of plasmid DNA. Mol Biotechnol. 2008.39(2):97-104), что порой не позволяет встраивать в состав вектора целевой ген нужного размера.
Известен способ накопления плазмидных векторов в штаммах Escherichia coli без использования антибиотиков (Cranenburgh RM, Hanak JA, Williams SG, Sherratt DJ.Escherichia coli strains that allow antibiotic-free plasmid selection and maintenance by repressor titration. Nucleic Acids Res. 2001. 29(5):E26). Былисозданыштаммы Escherichia coli DH1lacdapD и DH1lacP2dapD, вкоторыхген dapD, кодирующийфермент 2,3,4,5-тетрагидропиридин-2,6-дикарбоксилат-N-сукцинилтрансферазу, участвующийвбиосинтезе L-лизина, находитсяподконтролем lac-промотора. В отсутствие индуктора IPTG (изопропил-β-D-1-тиогалактопиранозид) эти штаммы подвержены лизису. Однако при введении мультикопийного вектора pORT, содержащего lac-оператор, индуцируется экспрессия гена dapD и, таким образом, трансформированные клоны могут быть отобраны и размножены. Однако, эти штаммы характеризуются низким уровнем трансформации и ее нестабильностью.
Известно решение по патентной заявке RU 2011152377 A, описывающей получение экспрессионного плазмидного вектора без устойчивости к антибиотику, которая содержит полинуклеотидную последовательность, кодирующую белок-репрессор. Экспрессия указанного белка-репрессора регулирует экспрессию токсичного генного продукта, встроенного в участок генома E. coli. Однако, как и все методы селекции, основанные на использовании белков-репрессоров, данный метод отличается нестабильностью трансформации и ее низкой эффективностью.
В патенте US 9644211 В2 описано получение минимального по размеру вектора. Данный вектор не содержит бактериальных геномных последовательностей и продуцируется путем parA-опосредованной рекомбинации, проходящей в специально полученном штамме E. coli. Недостатком данного метода получения минимального по размеру вектора является невозможность его использования при масштабировании производства.
Известно получение генотерапевтических векторов, в состав которых включены нуклеотидные последовательности, кодирующие белки васкуляризации тканей человека.
Например, известны лекарственные средства для лечения фиброза печени (Gene therapy by hepatocyte growth factor results in regression of experimental liver fibrosis RJGHC. - 2010. - Vol. 20. - No 4. - P. 22-28.), в которых в качестве основного действующего вещества использованы плазмидные конструкции, содержащие по отдельности гены фактора роста гепатоцитов (HGF) или урокиназы человека. Вышеупомянутые плазмидные генетические конструкции содержат белок-кодирующие участки ДНК соответствующих генов и при их введении в клетки млекопитающих в результате процессов транскрипции и трансляции обеспечивают синтез и последующую секрецию из клеток белков фактора роста гепатоцитов или урокиназы. Биологическая активность соответствующих белков обеспечивает поддержание функции и деления клеток печени-гепатоцитов, а также разрушение белков внеклеточного матрикса, откладывающихся в ткани при фиброзе. Способ лечения фиброза печени основан на многократном внутривенном введении указанных средств в количествах не более 3,75 мг/кг (для грызунов).
В заявке RU 2015117244 A описано использовании препарата, включающего смесь невирусных плазмидных конструкций pC4W-HGFopt и pVax1-UPAopt, содержащих гены HGF и урокиназы, которые при одновременном введении в клетки печени обеспечивают синтез и секрецию соответствующих белков, биологическая активность которых способствует излечиванию от фиброза печени. Заявляемый препарат относится к фармакологической группе биологических препаратов для генной терапии, гепатопротекторов. Введение препарата внутривенно, может стимулировать процесс восстановления поврежденной фиброзом печени, влияя на выживаемость гепатоцитов, способствуя разрушению отложений коллагена и других белков, замещающих при фиброзе паренхиму печени.
В патенте РФ 2491097 описана фармацевтическая композиция для терапии нейродегенеративных заболеваний, в частности бокового амиотрофического склероза (БАС), содержащей в эффективном количестве аденовирусный вектор, выполненный в виде нереплицирующейся наночастицы на основе генома аденовируса человека 5-го серотипа со вставкой гена ангиогенина ANG человека, продуцирующей в организме человека ангиогенин и нереплицирующейся наночастицы на основе генома аденовируса человека 5-го серотипа со вставкой гена фактора роста эндотелия сосудов VEGF человека, продуцирующей в организме человека фактор роста эндотелия сосудов. При этом ген ангиогенина человека и ген фактора роста эндотелия сосудов человека клонированы в две экспрессирующих кассеты одной нереплицирующейся наночастицы на основе генома аденовируса человека 5-го серотипа. Также описан способ терапии БАС, заключающийся во введении человеку терапевтически эффективной дозы указанной фармацевтической композиции.
В патенте РФ 2522778 описано средство для лечения ишемических поражений тканей, представляющему собой смесь с соотношением 1÷0,5-3 из двух культур мезенхимальных стволовых клеток, одна из которых модифицирована генетической конструкцией на основе вирусного вектора, обеспечивающего гиперпродукцию фактора роста эндотелия сосудов VEGF, а другая модифицирована генетической конструкцией на основе вирусного вектора, обеспечивающего гиперпродукцию ангиопоэтина ANGPT1. Описан также способ лечения ишемических поражений тканей, который заключается во введении путем нескольких инъекций (обкалывания) прямо в ишемизированную ткань, например, мышцы конечности или миокард, в культуральной среде, не содержащей сыворотки, смеси культур модифицированных мезенхимальных стволовых (стромальных) клеток, гиперпродуцирующих VEGF и ANGPT1 в концентрациях от 3 до 100 млн клеток в 1 мл раствора.
Генетически модифицированные мезенхимальные стромальные клетки жировой ткани получали с помощью трансформации этих клеток рекомбинантным аденоассоциированным вирусным вектором 2 серотипа - AAV Helper-Free System (Stratagene, США), в который были встроены оптимизированный ген VEGF 165 человека и оптимизированный ген ANGPT1.
Изобретение РФ 2170104 относится к новому способу in vivo представления и прямого переноса ДНК, кодирующей нужный заживляющий белок в репарационных клетках млекопитающих. Данный способ включает имплантирование матрицы, содержащей нужную ДНК в свежую рану. Репарационные клетки, обычно возникающие в жизнеспособной ткани, окружающей рану, пролифелируют и мигрируют в активированную генами матрицу, где они сталкиваются, поглощают и экспрессируют ДНК. Поэтому трансфицированные репарационные клетки действуют как биореакторы in situ (локализованные внутри раны), вырабатывающие агенты (РНК, кодированные ДНК, белки и т.д.), заживляющие рану. Данное изобретение относится к фармацевтическим композициям, которые могут быть использованы при осуществлении изобретения, т.е. при переносе нужной ДНК. Такие композиции включают подходящую матрицу в сочетании с нужной ДНК. Молекулы ДНК могут кодировать различные факторы, способствующие заживлению ран, включая внеклеточные, клеточно-поверхностные и внутриклеточные РНК и белки. В качестве целевого гена могут быть использованы, например, ген фактора роста гепацитов (HGF); ген фактора роста тромбоцитов (PDGF); гены основных факторов роста фибробластов (FGF1, FGF2 и т.д.); ген фактора роста эндотелия сосудов (VEGF) и др.
ДНК, кодирующая нужные продукты трансляции или транскрипции, может быть рекомбинантно встроена в многочисленные векторные системы, обеспечивающие широкомасштабную репликацию ДНК с целью получения активированных генами матриц. Используемые векторы включают, но не ограничиваются ими, векторы, полученные из рекомбинантной бактериофаговой ДНК, плазмидной ДНК или космидной ДНК. Например, могут быть использованы плазмидные векторы, такие как pBR322, pUC 19/18, pUC 118, 119 и серия векторов М13 мр. Бактериофаговые векторы могут включать способы переноса генов in vivo для заживления ран, патент №2170104gt10, способы переноса генов in vivo для заживления ран, патент №2170104gt11, способы переноса генов in vivo для заживления ран, патент №2170104gt18-23, способы переноса генов in vivo для заживления ран, патент №2170104ZAP/R, а также серию бактериофаговых векторов EMBL. Используемые космидные векторы включают, но не ограничиваются ими, pJB8, pCV 103, pCV 107, pCV 108, pTM, pMCS, pNNL, pHSG274, COS202, COS203, pWE15, pWE16 и серию векторов харомида 9. Альтернативно, могут быть сконструированы рекомбинантные вирусные векторы, включающие, но не ограниченные ими, векторы, полученные из вирусов, таких как вирус герпеса, ретровирусы, вакцинные вирусы, аденовирусы, адено-ассоциируемые вирусы или бычий папилломный вирус. Несмотря на то, что могут быть использованы интегрирующие вирусы, предпочтительными для заживления ран являются неинтегрирующие системы, не передающие генный продукт дочерним клеткам в течение многих поколений. Таким образом, генный продукт экспрессируется во время процесса заживления ран, и по мере того, как ген разбавляется в последующих поколениях, количество экспрессируемого генного продукта снижается.
В изобретении РФ 2486918 описан способ стимуляции восстановления периферической иннервации ткани после травмы, который заключается во введении терапевтически эффективного количества плазмидного вектора, содержащего нуклеотидную последовательность SEQ ID NO: 1, кодирующую мозговой нейротрофический фактор (BDNF), или плазмидного вектора, содержащего нуклеотидную последовательность, кодирующую человеческуюурокиназу uPA дикого типа (NM_002658), или их комбинации, или комбинации плазмидного вектора, содержащего нуклеотидную последовательность SEQ ID NO: 1, кодирующую BDNF с плазмидным вектором, содержащим оптимизированную нуклеотидную последовательность SEQ ID NO: 2, кодирующую фактор стромальных клеток SDF1. Способ позволяет ускорить восстановление структуры и проводимости периферических нервов после травм за счет локального увеличения продукции нейротрофических факторов.
При осуществлении изобретения впервые были сконструированы рекомбинантные плазмиды, содержащие оптимизированные последовательности кДНК (BDNFopt) и стромального фактора человека (SDF-1opt). При этом наилучшие результаты были получены при использовании в качестве вектора плазмиды pVax1 (#V260-20, Invitrogen). Также указано, что для клонирования могут быть использованы и другие плазмидные векторы, для которых характерна высококопийная репликация в Е. coli и высокий уровень экспрессии клонируемого гена в клетках млекопитающих. В заявке WO 2004081229 описано изобретение, которое содержит способы применения полипептидов Bv8 (PROK2) и EG-VEGF (PROK1) и соответствующих нуклеиновых кислот для содействия процессу кроветворения. Кроме того, содержит методы скрининга модуляторов для активности Bv8 и EG-VEGF. Кроме того, в заявке предусмотрены способы лечения с использованием полипептидов Bv8 и EG-VEGF или их антагонистов. Клонирование и экспрессия Bv8 описаны в заявке WO 2003020892.
Прототипом настоящего изобретения в части использования рекомбинантных ДНК-векторов для генной терапии являетсяпатент, US 9550998 (В2), в котором описан способ получения рекомбинантного вектора для генетической иммунизации. Полученный вектор представляет собой суперскрученный плазмидный ДНК-вектор, который предназначен для экспрессии клонированных генов в клетках животных и человека. Вектор состоит из области начала репликации (origin), регуляторных элементов, включающих промотор и энхансер цитомегаловируса человека, регуляторные элементы из Т-лимфотропного вируса человека. Накопление вектора производят в специальном штамме E. coli без использования антибиотиков за счет антисенс-комплементации гена sacB, введенного в штамм посредством бактериофага. Ограничением использования данного ДНК - вектора для генетической терапии является наличие в его составе регуляторных элементов, представляющих собой последовательности вирусных геномов.
Раскрытие изобретения.
Задачей изобретения является конструирование генотерапевтических ДНК-векторов на основе специально сконструированного генотерапевтического ДНК-вектора для повышения уровня экспрессиигена, выбранного из группы генов-гена ANG, кодирующегобелокангиогенин, гена ANGPT1, кодирующего белок ангиопоэтин 1, гена VEGFA, кодирующего белок фактора роста эндотелия сосудов А, гена FGF1, кодирующего белок фактора роста фибробластов 1, гена HIF1α, кодирующего белок гипоксией индуцированного фактора α, гена HGF, кодирующего белок фактора роста гепатоцитов, гена SDF1, кодирующего белок фактора стромальных клеток, гена KLK4, кодирующего белоккалликреин, гена PDGFC, кодирующего белок фактора роста тромбоцитов С, гена PROK1, кодирующего белок прокинетицин 1, гена PROK2, кодирующего белок прокинетицин 2, а также - конструирование штаммов, несущих эти генотерапевтические ДНК-векторы для производства их в промышленных масштабах.
При этом ДНК-векторы должны оптимально сочетать в себе следующие свойства:
I) возможность безопасного использования для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора генов антибиотикорезистентности;
II) длину, обеспечивающую эффективное проникновение в клетку-мишень;
III) наличие регуляторных элементов, обеспечивающих эффективную экспрессию целевых генов и, в то же время, не представляющих собой нуклеотидные последовательности вирусных геномов;
IV) технологичность получения и возможность наработки в промышленных масштабах.
Пункты I и III предусмотрены в данном техническом решении в соответствии с рекомендациями государственных регуляторов к лекарственным средствам для генной терапии, в частности, Европейского Агентства по лекарственным средствам.
Поставленная задача решается за счет того, что создан генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, для повышения уровня экспрессии этого целевого гена в организме человека и животных, при этом генотерапевтический ДНК-вектор VTvaf17- ANG или VTvaf17- ANGPT1 или VTvaf17- VEGFA или VTvaf17- FGF1 или VTvaf17- HIF1α или VTvaf17- HGF или VTvaf17- SDF1, или VTvaf17- KLK4 или VTvaf17- PDGFC, или VTvaf17- PROK1 или VTvaf17- PROK2, имеет нуклеотидную последовательность SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 или SEQ ID №6 или SEQ ID №7 или SEQ ID №8 или SEQ ID №9 или SEQ ID №10 или SEQ ID №11 соответственно. Каждый из созданных генотерапевтических ДНК-векторов: VTvaf17- ANG или VTvaf17- ANGPT1 или VTvaf17- VEGFA или VTvaf17- FGF1 или VTvaf17- HIF1α или VTvaf17- HGF или VTvaf17- SDF1, или VTvaf17- KLK4 или VTvaf17- PDGFC, или VTvaf17- PROK1, или VTvaf17- РRОK2 за счет ограниченного размера векторной части VTvaf17, не превышающего 3200 п.н, обладает способностью эффективно проникать в клетки и экспрессировать клонированный в него целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2. В составе генотерапевтического ДНК-вектора отсутствуют нуклеотидные последовательности вирусного происхождения и отсутствуют гены антибиотикорезистентности, обеспечивая возможность его безопасного применения для генетической терапии человека и животных.
Создан также способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, который заключается в том, что каждый генотерапевтический ДНК-вектор: VTvaf17- ANG или VTvaf17- ANGPT1 или VTvaf17- VEGFA или VTvaf17- FGF1 или VTvaf17-HIF1α или VTvaf17- HGF или VTvaf17- SDF1, или VTvaf17- KLK4 или VTvaf17- PDGFC, или VTvaf17- PROK1 или VTvaf17- PROK2 получают следующим образом: кодирующую часть целевого гена из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1A, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, клонируют в ДНК-вектор VTvaf17 и получают генотерапевтический ДНК-вектор VTvaf17- ANG, SEQ ID №1, или VTvaf17- ANGPT1, SEQ ID №2 или VTvaf17- VEGFA, SEQ ID №3, или VTvaf17- FGF1, SEQ ID №4 или VTvaf17- HIF1α, SEQ ID №5 или VTvaf17- HGF, SEQ ID №6 или VTvaf17- SDF1, SEQ ID №7 или VTvaf17- KLK4, SEQ ID №8 или VTvaf17- PDGFC, SEQ ID №9 или VTvaf17- PROK1, SEQ ID №10 или VTvaf17- PROK2, SEQ ID №11 соответственно.
Способ применения созданного генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, для повышения уровня экспрессии этих целевых генов заключается во введении выбранного генотерапевтического ДНК-вектора или нескольких выбранных генотерапевтических ДНК-векторов в клетки, органы и ткани человека или животного, и/или во введении в органы и ткани человека или животного аутологичных клеток человека или животного, трансфицированных выбранным генотерапевтическим ДНК-вектором или несколькими выбранными генотерапевтическими ДНК-векторами, или в сочетании обозначенных способов.
Способ получения штамма Escherichia coli SCS110-AF/VTvaf17- ANG или штамма Escherichia coli SCS110-AF/VTvaf17- ANGPT1 или штамма Escherichia coli SCS110-AF/VTvaf17- VEGFA или штамма Escherichia coli SCS110-AF/VTvaf17- FGF1, или штамма Escherichia coli SCS110-AF/VTvaf17-HIF1α или штамма Escherichia coli SCS110-AF/VTvaf17- HGF или штамма Escherichia coli SCS110-AF/VTvaf17- SDF1, или штамма Escherichia coli SCS110-AF/VTvaf17- KLK4 или штамма Escherichiacoli SCS110-AF/VTvaf17- PDGF или штамма Escherichia coli SCS110-AF/VTvaf17- PROK1 или штамма Escherichia coli SCS110-AF/VTvaf17- PROK2 заключается в электропорации компетентных клеток штамма Escherichia coli SCS110-AF созданным генотерапевтическим ДНК-вектором и последующей селекцией стабильных клонов штамма с использованием селективной среды.
Заявлен штамм Escherichia coli SCS110-AF/VTvaf17- ANG или Escherichia coli SCS110-AF/VTvaf17- ANGPT1 или Escherichia coli SCS110-AF/VTvaf17- VEGFA или Escherichia coli SCS110-AF/VTvaf17- FGF1, или Escherichia coli SCS110-AF/VTvaf17- HIF1α или Escherichia coli SCS110-AF/VTvaf17- HGF или Escherichia coli SCS110-AF/VTvaf17- SDF1, или Escherichia coli SCS110-AF/VTvaf17- KLK4 или Escherichia coli SCS110-AF/VTvaf17- PDGFC или Escherichia coli SCS110-AF/VTvaf17- PROK1 или Escherichia coli SCS110-AF/VTvaf17- PROK2, несущий генотерапевтический ДНК-вектор для его наработки с возможностью культивирования штамма без использования антибиотиков.
Способ производства в промышленных масштабах генотерапевтического ДНК-вектора заключается в масштабировании бактериальной культуры штамма до количеств, необходимых для наращивания бактериальной биомассы в промышленном ферментере, после чего биомассу используют для выделения фракции, содержащей целевой ДНК-продукт -генотерапевтический ДНК-вектор VTvaf17- ANG или VTvaf17- ANGPT1 или VTvaf17- VEGFA или VTvaf17- FGF1 или VTvaf17- HIF1α или VTvaf17- HGF или VTvaf17- SDF1, или VTvaf17- KLK4 или VTvaf17- PDGFC, или VTvaf17- PROK1, или VTvaf17- PROK2, многостадийно фильтруют и очищают хроматографическими методами.
При этом специалистам в данной области техники известно свойство вырожденности генетического кода, из которого следует, что под объем настоящего изобретения также подпадают варианты нуклеотидных последовательностей, отличающихся инсерцией, делецией или заменой нуклеотидов, которые не приводят к изменению полипептидной последовательности, кодируемой целевым геном, и/или не приводят к потере функциональной активности регуляторных элементов вектора VTvaf17. При этом специалистам в данной области техники известно явление генетического полиморфизма, из которого следует, что под объем настоящего изобретения также подпадают варианты нуклеотидных последовательностей генов из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, которые при этом кодируют различные варианты аминокислотных последовательностей белков ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, не отличающихся от приведенных по своей функциональной активности при физиологических условиях.
Способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, заключается в том, что кодирующую часть целевого гена ANG или ANGPT1 или VEGFA, или FGF1 или HIF1α или HGF или SDF1 или KLK4 или PDGFC или PROK1 или PROK2 получают путем выделения РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации кДНК с использованием специфических олигонуклеотидов и расщеплением продукта амплификации эндонуклеазами рестрикции, причем клонирование в генотерапевтический ДНК-вектор VTvaf17 проводят по сайтам рестрикции, обеспечивающим попадание рамки считывания целевых генов в экспрессионную кассету вектора VTvaf17.
Известно, что способность ДНК-векторов проникать в эукариотические клетки обусловлена, главным образом, размером вектора. При этом ДНК-вектора с наименьшим размером обладают более высокой проникающей способностью. Таким образом, отсутствие в составе вектора элементов, которые не несут функциональной нагрузки, но при этом увеличивают размер ДНК вектора, является предпочтительным. Данные особенности ДНК-векторов были учтены при получении генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, путем отсутствия в составе вектора крупных нефункциональных последовательностей и генов антибиотикорезистентности, что позволило, помимо технологических преимуществ и преимуществ в плане безопасности применения, значительно уменьшить размер полученного генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2. Таким образом, способность проникать в эукариотические клетки полученного генотерапевтического ДНК-вектора обусловлена ограниченным размером векторной части VTvaf17 (в которую входит промотор, ориджин репликации, сигнал полиаденилирования, полилинкер, элемент RNA-out), не превышающим 3200 п.н.
Способность проникать в эукариотические клетки и проявлять функциональную активность, то есть способность экспрессировать целевой ген, полученного генотерапевтического ДНК-вектора VTvaf17- ANG или VTvaf17- ANGPT1 или VTvaf17- VEGFA или VTvaf17- FGF1 или VTvaf17- HIF1α или VTvaf17- HGF или VTvaf17- SDF1, или VTvaf17- KLK4, или VTvaf17- PDGFC, или VTvaf17- PROK1, или VTvaf17- PROK2 подтверждают путем введения в эукариотические клетки полученного вектора и последующим анализом экспрессии специфической мРНК и/или белкового продукта целевого гена. При этом наличие специфической мРНК в клетках, в которые был введен генотерапевтический ДНК-вектор VTvaf17- ANG или VTvaf17- ANGPT1 или VTvaf17- VEGFA или VTvaf17- FGF1 или VTvaf17- HIF1α или VTvaf17- HGF или VTvaf17- SDF1, или VTvaf17- KLK4 или VTvaf17- PDGFC или VTvaf17- PROK1, или VTvaf17- PROK2 свидетельствует как о способности полученного вектора проникать в эукариотические клетки, так и о его способности экспрессировать мРНК целевого гена. При этом, как известно специалистам в данной области техники, наличие мРНК гена является обязательным условием, но не является доказательством трансляции белка, кодируемого целевым геном. Поэтому для подтверждения свойства генотерапевтического ДНК-вектора VTvaf17- ANG или VTvaf17- ANGPT1 или VTvaf17- VEGFA или VTvaf17- FGF1 или VTvaf17- HIF1α или VTvaf17- HGF или VTvaf17- SDF1, или VTvaf17- KLK4, или VTvaf17- PDGFC, или VTvaf17- PROK1, или VTvaf17- PROK2 экспрессировать целевой ген на уровне белка в эукариотических клетках, в которые был введен генотерапевтический ДНК-вектор, проводят с использованием иммунологических методов анализ концентрации белков, кодируемых целевыми генами. Наличие белка ANG или ANGPT1 или VEGFA или FGF1 или HIF1α или HGF или SDF1 или KLK4 или PDGFC или PROK1 или PROK2 подтверждает эффективность экспрессии целевых генов в эукариотических клетках и возможность повышения уровня концентрации белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2.
Способ применения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, для повышения уровня экспрессии этих целевых генов, заключается во введении генотерапевтического ДНК-вектора, несущего целевой ген или нескольких выбранных генотерапевтических ДНК-векторов, в клетки, органы и ткани человека или животного, и/или во введении в органы и ткани человека или животного аутологичных клеток, в которые был введен генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 или несколько выбранных генотерапевтических ДНК-векторов, или в сочетании обозначенных способов.
Указанные способы применения характеризуются отсутствием потенциальных рисков для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов и за счет отсутствия в составе генотерапевтического ДНК-вектора генов устойчивости к антибиотикам, что подтверждается отсутствием участков, гомологичных вирусным геномам и генам антибиотикорезистентности в нуклеотидных последовательностях генотерапевтического ДНК-вектора VTvaf17- ANG или генотерапевтического ДНК-вектора VTvaf17- ANGPT1 или генотерапевтического ДНК-вектора VTvaf17- VEGFA или генотерапевтического ДНК-вектора VTvaf17- FGF1 или генотерапевтического ДНК-вектора VTvaf17- HIF1α или генотерапевтического ДНК-вектора VTvaf17- HGF или генотерапевтического ДНК-вектора VTvaf17- SDF1, или генотерапевтического ДНК-вектора VTvaf17- KLK4 или генотерапевтического ДНК-вектора VTvaf17- PDGFC или генотерапевтического ДНК-вектора VTvaf17- PROK1 или генотерапевтического ДНК-вектора VTvaf17- PROK2 (SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 или SEQ ID №6 или SEQ ID №7 или SEQ ID №8 или SEQ ID №9 или SEQ ID №10 или SEQ ID №11 соответственно).
Как известно специалистам в данной области техники, гены антибиотикорезистентности в составе генотерапевтических ДНК-векторов используются с целью получения этих векторов в препаративных количествах путем наращивания бактериальной биомассы в питательной среде, содержащей селективный антибиотик. В рамках настоящего изобретения в целях возможности безопасного применения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген ANG или ANGPT1 или VEGFA или FGF1 или HIF1α или HGF или SDF1 или KLK4 или PDGFC или PROK1 или PROK2 использование селективных питательных сред, содержащих антибиотик, не представляется возможным. В качестве технологического решения для получения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, для возможности масштабирования до промышленных масштабов получения генотерапевтических векторов предлагается способ получения штаммов для наработки указанных генотерапевтических векторов на основе бактерии Escherichia coli SCSI 10-AF. Способ получения штамма Escherichia coli SCS110-AF/VTvaf17- ANG или штамма Escherichia coli SCS110-AF/VTvaf17- ANGPT1 или штамма Escherichia coli SCS110-AF/VTvaf17- VEGFA или штамма Escherichia coli SCS110-AF/VTvaf17- FGF1, или штамма Escherichia coli SCS110-AF/VTvaf17- HIF1α или штамма Escherichia coli SCS110-AF/VTvaf17- HGF или штамма Escherichia coli SCS110-AF/VTvaf17- SDF1, или штамма Escherichia coli SCS110-AF/VTvaf17- KLK4 или штамма Escherichiacoli SCS110-AF/VTvaf17- PDGFC или штамма Escherichia coli SCS110-AF/VTvaf17- PROK1 или штамма Escherichia coli SCS110-AF/VTvaf17- PROK2 заключается в получении компетентных клеток штамма Escherichia coli SCSI 10-AF с введением в эти клетки генотерапевтического ДНК-вектора VTvaf17- ANG или генотерапевтического ДНК-вектора VTvaf17- ANGPT1 или генотерапевтического ДНК-вектора VTvaf17- VEGFA или генотерапевтического ДНК-вектора VTvaf17- FGF1 или генотерапевтического ДНК-вектора VTvaf17- HIF1α или генотерапевтического ДНК-вектора VTvaf17- HGF или генотерапевтического ДНК-вектора VTvaf17- SDF1, или генотерапевтического ДНК-вектора VTvaf17- KLK4 или генотерапевтического ДНК-вектора VTvaf17- PDGFC, или генотерапевтического ДНК-вектора VTvaf17- PROK1 или генотерапевтического ДНК-вектора VTvaf17- PROK2 соответственно с помощью методов трансформации (электропорации). Полученные штаммыиспользуются для наработки генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, с возможностью использования сред без содержания антибиотиков.
Способ масштабирования получения бактериальной массы до промышленных масштабов для выделения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1A, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, заключается в том, что затравочную культуру штамма Escherichia coli SCS110-AF/VTvaf17-ANG или штамма Escherichia coli SCS110-AF/VTvaf17-ANGPT1 или штамма Escherichia coli SCS110-AF/VTvaf17- VEGFA или штамма Escherichia coli SCS110-AF/VTvaf17- FGF1 или штамма Escherichia coli SCS110-AF/VTvaf17-HIF1α или штамма Escherichia coli SCS110-AF/VTvaf17- HGF или штамма Escherichia coli SCS110-AF/VTvaf17- SDF1 или штамма Escherichia coli SCS110-AF/VTvaf17- KLK4 или штамма Escherichia coli SCS110-AF/VTvaf17- PDGFC или штамма Escherichia coli SCS110-AF/VTvaf17- PROK1 или штамма Escherichia coli SCS110-AF/VTvaf17- PROK2 инкубируют в объеме питательной среды без содержания антибиотика обеспечивающим подходящую динамику накопления биомассы, по достижению достаточного количества биомассы в логарифмической фазе роста, бактериальную культуру переносят в промышленный ферментер, после чего растят до достижения стационарной фазы роста, затем выделяют фракцию, содержащую целевой ДНК-продукт -генотерапевтический ДНК-вектор VTvaf17- ANG или VTvaf17- ANGPT1 или VTvaf17- VEGFA или VTvaf17- FGF1 или VTvaf17- HIF1α или VTvaf17- HGF или VTvaf17- SDF1 или VTvaf17- KLK4 или VTvaf17- PDGFC, или VTvaf17- PROK1 или VTvaf17- PROK2 многостадийно фильтруют и очищают хроматографическими методами. При этом специалистам в данной области техники понятно, что условия культивирования штаммов, состав питательных сред (за исключением содержания антибиотиков), используемое оборудование, методы очистки ДНК могут варьировать в рамках стандартных операционных процедур в зависимости от отдельно взятой производственной линии, но известные подходы к масштабированию, промышленному получению и очистке ДНК-векторов с использованием штамма Escherichia coli SCS110-AF/VTvaf17- ANG или штамма Escherichia coli SCS110-AF/VTvaf17- ANGPT1 или штамма Escherichia coli SCS110-AF/VTvaf17- VEGFA или штамма Escherichia coli SCS110-AF/VTvaf17- FGF1 или штамма Escherichia coli SCS110-AF/VTvaf17- HIF1α или штамма Escherichia coli SCS110-AF/VTvaf17- HGF или штамма Escherichia coli SCS110-AF/VTvaf17- SDF1 или штамма Escherichia coli SCS110-AF/VTvaf17- KLK4 или штамма Escherichia coli SCS110-AF/VTvaf17- PDGFC или штамма Escherichia coli SCS110-AF/VTvaf17- PROK1 или штамма Escherichia coli SCS110-AF/VTvaf17- PROK2 подпадают под объем настоящего изобретения.
Изобретение поясняется чертежами, где:
На фиг. 1
представлена схемагенотерапевтического ДНК-вектора VTvaf17, несущего целевой гена человека, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, который представляет собой кольцевую двуцепочечную молекулу ДНК, способную к автономной репликации в клетках бактерии Eshcerichiacoli.
На фиг. 1 приведены схемы, соответствующие:
А - генотерапевтический ДНК-вектор VTvaf17-ANG,
В - генотерапевтический ДНК-вектор VTvaf17-ANGPT1,
С - генотерапевтический ДНК-вектор VTvaf17-VEGFA,
D - генотерапевтический ДНК-вектор VTvaf17-FGF1,
Е - генотерапевтический ДНК-вектор VTvaf17- HIF1α,
F - генотерапевтический ДНК-вектор VTvaf17- HGF,
G - генотерапевтический ДНК-вектор VTvaf17- SDF1,
Н - генотерапевтический ДНК-вектор VTvaf17- KLK4,
I - генотерапевтический ДНК-вектор VTvaf17- PDGFC,
K - генотерапевтический ДНК-вектор VTvaf17- PROK1,
L - генотерапевтический ДНК-вектор VTvaf17- PROK2.
На схемах отмечены следующие структурные элементы вектора:
EF1a - промоторная область гена человеческого фактора элонгации EF1A с собственным энхансером, содержащимся в первом интроне гена. Служит для обеспечения высокого уровня транскрипции рекомбинантного гена в большинстве тканей человека.
Рамка считывания целевого гена, соответствующая кодирующей части гена ANG (фиг. 1A), или ANGPT1 (фиг. 1B), или VEGFA (фиг. 1C), или FGF1 (фиг. 1D), или HIF1α (фиг. 1E), или HGF (фиг. 1F), или SDF1 (фиг. 1G) или KLK4 (фиг. 1H), или PDGFC (фиг. 1I), или PROK1 (фиг. 1K), или PROK2 (фиг. 1L), соответственно;
hGH-TA - терминатор транскрипции и сайт полиаденилирования гена фактора роста человека;
(4) RNA-out - регуляторный элемент РНК-out транспозона Tn 10, обеспечивающий возможность положительной селекции без использования антибиотиков при использовании штамма Е. coli SCS 110;
ori - область начала репликации, участок служащий для автономной репликации с однонуклеотидной заменой для повышения копийности плазмиды в клетках большинства штаммов Е. Coli.
Отмечены уникальные сайты рестрикции Е. coli.
На фиг. 2
Представлены графики накопления мРНК целевого гена, а именно, гена ANG человека, в клетках первичной культурыфибробластов кожи человека HDFa (ATCCPCS-201-012) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17- ANG, с целью подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- ANG, несущего целевой ген ANG, где
1 - кДНК гена ANG до трансфекции генотерапевтическим ДНК-вектором VTvaf17- ANG;
2 - кДНК гена ANG после трансфекции генотерапевтическим ДНК-вектором VTvaf17- ANG;
3 - кДНК гена В2М до трансфекции генотерапевтическим ДНК-вектором VTvaf17- ANG;
4 - кДНК гена В2М после трансфекции генотерапевтическим ДНК-вектором VTvaf17- ANG.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 3
Представлены графики накопления мРНК целевого гена, а именно гена ANGPT1 человека, в клетках культуры фибробластов НТ 297.Т человека до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17- ANGPT1, с целью подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- ANGPT1, несущего целевой ген ANGPT1, где
1 - кДНК гена ANGPT1 до трансфекции генотерапевтическим ДНК-вектором VTvaf17- ANGPT1,
2 - кДНК гена ANGPT1 после трансфекции генотерапевтическим ДНК-вектором VTvaf17- ANGPT1,
3 - кДНК гена В2М до трансфекции генотерапевтическим ДНК-вектором VTvaf17- ANGPT1,
4 - кДНК гена В2М после трансфекции генотерапевтическим ДНК-вектором VTvaf17- ANGPT1.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 4
Представлены графики накопления мРНК целевого гена, а именно гена VEGFA человека в клетках культуры фибробластов крайней плоти Hs27 человека до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-VEGFAc целью подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- VEGFA, несущего целевой ген VEGFA, где
1 - кДНК гена VEGFA до трансфекции генотерапевтическим ДНК-вектором VTvaf17- VEGFA;
2 - кДНК гена VEGFA после трансфекции генотерапевтическим ДНК-вектором VTvaf17- VEGFA;
3 - кДНК гена В2М до трансфекции генотерапевтическим ДНК-вектором VTvaf17- VEGFA;
4 - кДНК гена В2М после трансфекции генотерапевтическим ДНК-вектором VTvaf17- VEGFA.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 5
Представлены графики накопления мРНК целевого гена, а именно гена FGF1 человека, в клетках культуры скелетных миобластов HSkM человека до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17- FGF1c целью подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- FGF1, несущего целевой ген FGF1, где
1 - кДНК гена FGF1 до трансфекции генотерапевтическим ДНК-вектором VTvaf17-FGF1;
2 - кДНК гена FGF1 после трансфекции генотерапевтическим ДНК-вектором VTvaf17- FGF1;
3 - кДНК гена В2М до трансфекции генотерапевтическим ДНК-вектором VTvaf17-FGF1;
4 - кДНК гена В2М в клетках после трансфекции генотерапевтическим ДНК-вектором VTvaf17- FGF1.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 6
Представлены графики накопления мРНК целевого гена, а именно гена HIF1α человека, в культурегладкомышечных клеток мочевого пузыря HBdSMc человека до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-HIF1α с целью подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- HIF1α, несущего целевой ген HIF1α, где
1 - кДНК гена HIF1α до трансфекции генотерапевтическим ДНК-вектором VTvaf17- HIF1α;
2 - кДНК гена HIF1α после трансфекции генотерапевтическим ДНК-вектором VTvaf17- HIF1α;
3 - кДНК гена В2М до трансфекции генотерапевтическим ДНК-вектором VTvaf17- HIF1α;
4 - кДНК гена В2М в клетках после трансфекции генотерапевтическим ДНК-вектором VTvaf17- HIF1α.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 7
Представлены графики накопления мРНК целевого гена, а именно гена HGF человека, в культуре гладкомышечных клеток аорты T/GHA VSMC человека до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17- HGF с целью подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- HGF, несущего целевой ген HGF, где:
1 - кДНК гена HGF до трансфекции генотерапевтическим ДНК-вектором VTvaf17- HGF;
2 - кДНК гена HGF после трансфекции генотерапевтическим ДНК-вектором VTvaf17- HGF;
3 - кДНК гена В2М до трансфекции генотерапевтическим ДНК-вектором VTvaf17- HGF;
4 - кДНК гена В2М в клетках после трансфекции генотерапевтическим ДНК-вектором VTvaf17- HGF.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 8
Представлены графики накопления мРНК целевого гена, а именно гена SDF1 человека, в клетках культуры кератиноцитов эпидермиса HEKa человека до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17- SDF1 с целью подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- SDF1, несущего целевой ген SDF1, где:
1 - кДНК гена SDF1 до трансфекции генотерапевтическим ДНК-вектором VTvaf17- SDF1;
2 - кДНК гена SDF1 после трансфекции генотерапевтическим ДНК-вектором VTvaf17- SDF1;
3 - кДНК гена В2М до трансфекции генотерапевтическим ДНК-вектором VTvaf17-SDF1;
4 - кДНК гена В2М в клетках после трансфекции генотерапевтическим ДНК-вектором VTvaf17- SDF1.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 9
Представлены графики накопления мРНК целевого гена, а именно гена KLK4 человека, в клетках культуры эндотелия пупочной вены HUVEC человека до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17- KLK4 с целью подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- KLK4, несущего целевой ген KLK4, где
1 - кДНК гена KLK4 до трансфекции генотерапевтическим ДНК-вектором VTvaf17- KLK4;
2 - кДНК гена KLK4 после трансфекции генотерапевтическим ДНК-вектором VTvaf17- KLK4;
3 -кДНК гена В2М до трансфекции генотерапевтическим ДНК-вектором VTvaf17- KLK4;
4 - кДНК гена В2М в клетках после трансфекции генотерапевтическим ДНК-вектором VTvaf17- KLK4.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 10
Представлены графики накопления мРНК целевого гена, а именно гена PDGFC человека, в клетках культуры меланоцитов эпидермиса НЕМа человека до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17- PDGFC с целью подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- PDGFC, несущего целевой ген PDGFC, где:
1 - кДНК гена PDGFC до трансфекции генотерапевтическим ДНК-вектором VTvaf17-PDGFC;
2 - кДНК гена PDGFC после трансфекции генотерапевтическим ДНК-вектором VTvaf17- PDGFC;
3 - кДНК гена В2М до трансфекции генотерапевтическим ДНК-вектором VTvaf17-PDGFC;
4 - кДНК гена В2М в клетках после трансфекции генотерапевтическим ДНК-вектором VTvaf17- PDGFC.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 11
Представлены графики накопления мРНК целевого гена, а именно гена PROK1 человека, в клетках культуры скелетных миобластов HSkM человека до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17- PROK1 с целью подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- PROK1, несущего целевой ген PROK1, где:
1 - кДНК гена PROK1 до трансфекции генотерапевтическим ДНК-вектором VTvaf17- PROK1;
2 - кДНК гена PROK1 после трансфекции генотерапевтическим ДНК-вектором VTvaf17- PROK1;
3 - кДНК гена В2М до трансфекции генотерапевтическим ДНК-вектором VTvaf17- PROK1;
4 - кДНК гена В2М в клетках после трансфекции генотерапевтическим ДНК-вектором VTvaf17- PROK1.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 12
Представлены графики накопления мРНК целевого гена, а именно гена PROK2 человека, в клетках первичной культуры эндотелия капилляров кожи НМЕС-1 до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17- PROK2 с целью подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- PROK2, несущего целевой ген PROK2, где
1 - кДНК гена PROK2 до трансфекции генотерапевтическим ДНК-вектором VTvaf17- PROK2;
2 - кДНК гена PROK2 после трансфекции генотерапевтическим ДНК-вектором VTvaf17- PROK2;
3 - кДНК гена В2М до трансфекции генотерапевтическим ДНК-вектором VTvaf17- PROK2;
4 - кДНК гена В2М в клетках после трансфекции генотерапевтическим ДНК-вектором VTvaf17- PROK2.
В качестве референтного гена использовали ген В2М (Бета-2-микроглобулин) приведенного в базе данных GenBank под номером NM 004048.2.
На фиг. 13
Представлена диаграмма концентрации белка ангиогенина в культуральной среде клеток фибробластов кожи человека HDFa (АТСС PCS-201-012) после трансфекции этих клеток ДНК-вектором VTvaf17-ANG, с целью оценки изменения количества белка ангиогенина в культуральной среде клеток фибробластов кожи человека HDFa (АТСС PCS-201-012), при трансфекции этих клеток ДНК-вектором VTvaf17-ANG, несущим ген ANG, где
культура А - первичная культурафибробластов кожи человека HDFa, трансфицированных водным раствором без плазмидной ДНК (контроль);
культура В - первичная культура фибробластов кожи человека HDFa, трансфицированных ДНК-вектором VTvaf17;
культура С - первичная культура фибробластов кожи человека HDFa, трансфицированных ДНК-вектором VTvaf17- ANG, несущим ген ANG.
На фиг. 14
Представлена диаграмма концентрации белка ангиопоэтина 1в культуральной среде клеток культуры фибробластов НТ 297.Т человека после трансфекции этих клеток ДНК-вектором VTvaf17- ANGPT1, с целью оценки изменения количества белка ангиопоэтина 1 в культуральной среде клеток культуры фибробластов НТ 297.Т человека, при трансфекции этих клеток ДНК-вектором VTvaf17- ANGPT1, несущим ген ANGPT1, где
культура А - культура фибробластов НТ 297.Т человека, трансфицированных водным раствором без плазмидной ДНК (контроль);
культура В - культура фибробластов НТ 297.Т человека, трансфицированных ДНК-вектором VTvaf17;
культура С - культура фибробластов НТ 297.Т человека, трансфицированных ДНК-вектором VTvaf17- ANGPT1, несущим ген ANGPT1.
На фиг. 15
Представлена диаграмма концентрации белка фактора роста эндотелия сосудов А в культуральной средефибробластов крайней плоти Hs27 человека после трансфекции этих клеток ДНК-вектором VTvaf17- VEGFA, с целью оценки изменения количества белка фактора роста эндотелия сосудов А в культуральной средефибробластов крайней плоти Hs27 человека, при трансфекции этих клеток ДНК-вектором VTvaf17- VEGFA, несущим ген VEGFA где
культура А - культура фибробластов крайней плоти Hs27 человека, трансфицированных водным раствором без плазмидной ДНК (контроль);
культура В - культура фибробластов крайней плоти Hs27 человека, трансфицированных ДНК-вектором VTvaf17;
культура С - культура фибробластов крайней плоти Hs27 человека, трансфицированных ДНК-вектором VTvaf17- VEGFA, несущим ген VEGFA.
На фиг. 16
Представлена диаграмма концентрации белка фактора роста фибробластов 1 в культуральной среде скелетных миобластов HSkM человека после трансфекции этих клеток ДНК-вектором VTvaf17-FGF1, с целью оценки изменения количества белка фактора роста фибробластов 1 в культуральной среде скелетных миобластов HSkM человека, при трансфекции этих клеток ДНК-вектором VTvaf17- FGF1, несущим ген FGF1, где
культура А - культура скелетных миобластов HSkM человека, трансфицированных водным раствором без плазмидной ДНК (контроль);
культура В - культура скелетных миобластов HSkM человека, трансфицированных ДНК-вектором VTvaf17;
культура С - культура скелетных миобластов HSkM человека, трансфицированных ДНК-вектором VTvaf17- FGF1, несущим ген FGF1.
На фиг. 17
Представлена диаграмма концентрации белка гипоксией индуцированного фактора 1αв культуральной среде гладкомышечных клеток мочевого пузыря HBdSMc человека после трансфекции этих клеток ДНК-вектором VTvaf17- HIF1α, с целью оценки изменения количества белка гипоксией индуцированного фактора 1α в культуральной среде гладкомышечных клеток мочевого пузыря HBdSMc человека, при трансфекции этих клеток ДНК-вектором VTvaf17- HIF1α, несущим ген HIF1α, где
культура А - культура гладкомышечных клеток мочевого пузыря HBdSMc человека, трансфицированных водным раствором без плазмидной ДНК (контроль);
культура В - культура гладкомышечных клеток мочевого пузыря HBdSMc человека, трансфицированных ДНК-вектором VTvaf17;
культура С - культура гладкомышечных клеток мочевого пузыря HBdSMc человека, трансфицированных ДНК-вектором VTvaf17- HIF1α, несущим ген HIF1α.
На фиг. 18
Представлена диаграмма концентрации белка фактора роста гепатоцитов в культуральной среде гладкомышечных клеток аорты T/GHA VSMC человека после трансфекции этих клеток ДНК-вектором VTvaf17- HGF, с целью оценки изменения количества белка фактора роста гепатоцитов в культуральной среде гладкомышечных клеток аорты T/GHA VSMC человека, при трансфекции этих клеток ДНК-вектором VTvaf17- HGF, несущим ген HGF, где
культура А - культура гладкомышечных клеток аорты T/GHA VSMC человека, трансфицированных водным раствором без плазмидной ДНК (контроль);
культура В - культура гладкомышечных клеток аорты T/GHA VSMC человека, трансфицированных ДНК-вектором VTvaf17;
культура С - культура гладкомышечных клеток аорты T/GHA VSMC человека, трансфицированных ДНК-вектором VTvaf17-HGF, несущим ген HGF.
На фиг. 19
Представлена диаграмма концентрации белка фактора стромальных клеток 1 в культуральной среде кератиноцитов эпидермиса HEKa человека после трансфекции этих клеток ДНК-вектором VTvaf17- SDF1, с целью оценки изменения количества белка фактора стромальных клеток 1 в культуральной среде кератиноцитов эпидермиса HEKa человека, при трансфекции этих клеток ДНК-вектором VTvaf17- SDF1, несущим ген SDF1, где
культура А - культура кератиноцитов эпидермиса HEKa человека, трансфицированных водным раствором без плазмидной ДНК (контроль);
культура В - культура кератиноцитов эпидермиса HEKa человека, трансфицированных ДНК-вектором VTvaf17;
культура С - культура кератиноцитов эпидермиса HEKa человека, трансфицированных ДНК-вектором VTvaf17- SDF1, несущим ген SDF1.
На фиг. 20
Представлена диаграмма концентрации белка калликреина в культуральной среде эндотелия пупочной вены HUVEC человека после трансфекции этих клеток ДНК-вектором VTvaf17- KLK4, с целью оценки изменения количества белка калликреина в культуральной среде эндотелия пупочной вены HUVEC человека, при трансфекции этих клеток ДНК-вектором VTvaf17- KLK4, несущим ген KLK4, где
культура А - культура эндотелия пупочной вены HUVEC человека, трансфицированных водным раствором без плазмидной ДНК (контроль);
культура В - культура эндотелия пупочной вены HUVEC человека, трансфицированных ДНК-вектором VTvaf17;
культура С - культура эндотелия пупочной вены HUVEC человека, трансфицированных ДНК-вектором VTvaf17- KLK4, несущим ген KLK4.
На фиг. 21
Представлена диаграмма концентрации белка фактора роста тромбоцитов С в культуральной среде меланоцитов эпидермиса НЕМа человека после трансфекции этих клеток ДНК-вектором VTvaf17- PDGFC, с целью оценки изменения количества белка фактора роста тромбоцитов С в культуральной среде меланоцитов эпидермиса НЕМа человека, при трансфекции этих клеток ДНК-вектором VTvaf17- PDGFC, несущим ген PDGFC, где
культура А - культура меланоцитов эпидермиса НЕМа человека, трансфицированных водным раствором без плазмидной ДНК (контроль);
культура В - культура меланоцитов эпидермиса НЕМа человека, трансфицированных ДНК-вектором VTvaf17;
культура С - культура меланоцитов эпидермиса НЕМа человека, трансфицированных ДНК-вектором VTvaf17- PDGFC, несущим ген PDGFC.
На фиг. 22
Представлена диаграмма концентрации белка прокинетицина-1 в культуральной среде скелетных миобластов HSkM человека после трансфекции этих клеток ДНК-вектором VTvaf17- PROK1, с целью оценки изменения количества белка прокинетицина-1 в культуральной среде скелетных миобластов HSkM человека, при трансфекции этих клеток ДНК-вектором VTvaf17- PROK1, несущим ген PROK1, где
культура А - культура скелетных миобластов HSkM человека, трансфицированных водным раствором без плазмидной ДНК (контроль);
культура В - культура скелетных миобластов HSkM человека, трансфицированных ДНК-вектором VTvaf17;
культура С - культура скелетных миобластов HSkM человека, трансфицированных ДНК-вектором VTvaf17- PROK1, несущим ген PROK1.
На фиг. 23
Представлена диаграмма концентрации белка прокинетицина-2 в культуральной среде эндотелия капилляров кожи НМЕС-1 человека после трансфекции этих клеток ДНК-вектором VTvaf17- PROK2, с целью оценки изменения количества белка прокинетицина-2 в культуральной средеэндотелия капилляров кожи НМЕС-1 человека, при трансфекции этих клеток ДНК-вектором VTvaf17- PROK2, несущим ген PROK2, где
культура А - культура эндотелия капилляров кожи НМЕС-1 человека, трансфицированных водным раствором без плазмидной ДНК (контроль);
культура В - культура эндотелия капилляров кожи НМЕС-1 человека, трансфицированных ДНК-вектором VTvaf17;
культура С - культура эндотелия капилляров кожи НМЕС-1 человека, трансфицированных ДНК-вектором VTvaf17- PROK2, несущим ген PROK2.
На фиг. 24
Представлена диаграмма концентрации белка ангиогенина ANG в биоптатах кожи трех пациентов после введения в кожу этих пациентов генотерапевтического ДНК-вектора VTvaf17- ANG с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка ангиогенина с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген ANG.
На фиг. 24 отмечены следующие элементы:
П1I - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17- ANG;
П1II - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III - биоптат кожи пациента П1 из интактного участка;
П2I - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17- ANG;
П2II - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III - биоптат кожи пациента П2 из интактного участка;
П3I - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17- ANG;
П3II - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III - биоптат кожи пациента П3 из интактного участка.
На фиг. 25
Представлена диаграмма концентрации белка ангиопоэтина ANGPT1 в биоптатах кожи человека после введения в кожу культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17- ANGPT1 с целью демонстрации способа применения путем введения аутологичных клеток, трансфицированных генотерапевтическим ДНК-вектором VTvaf17- ANGPT1.
На фиг. 25 отмечены следующие элементы:
П1А - биоптат кожи пациента П1 из интактного участка;
П1В - биоптат кожи пациента П1 в зоне введения аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17;
П1С - биоптат кожи пациента П1 в зоне введения культуры аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17- ANGPT1.
На фиг. 26
Представлена диаграмма концентрации белка фактора стромальных клеток SDF1 в биоптатах мышечной ткани пациента после введения в мышечную ткань этого пациента генотерапевтического ДНК-вектора VTvaf17- SDF1 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген SDF1.
На фиг. 26 отмечены следующие элементы:
П1I - биоптат мышечной ткани пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17- SDF1;
П1II - биоптат мышечной ткани пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III - биоптат мышечной ткани пациента П1 из интактного участка.
На фиг. 27
Представлена диаграмма изменения количества белков: белка ангиогенина (ANG), белка фактора роста эндотелия сосудов A (VEGFA), белка фактора роста фибробластов 1 (FGF1), белка прокинетицина-1 (PROK1) в кожных биоптатах крыс в зоне инъекционного введения:
в 1-й группе (КI) смесью генотерапевтических ДНК-векторов VTvaf17-ANG, VTvaf17-VEGFA, VTvaf17- FGF1, VTvaf17- PROK1;
во 2-й группе (KII) - раствором ДНК-вектора VTvaf17 (плацебо);
в 3-й группе (KIII) - физраствором.
На фиг. 28
Представлена диаграмма изменения количества белков: белка ангиогенина (ANG), белка гипоксией индуцированного фактора (HIF1α), белка фактора роста тромбоцитов С (PDGFC), белка прокинетицина-2 (PROK2) в биоптатах мышечной ткани в зоне предплечья пациента после инъекционного введения:
П1I - смеси генотерапевтических ДНК-векторов VTvaf17- ANG, VTvaf17- HIF1α, VTvaf17- PDGFC,VTvaf17- PROK2;
П1II - раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо);
П1III - интактная зона.
На фиг. 29
показаны графики накопления ампликонов кДНК целевого гена HGF в клетках гладкой мускулатуры аорты быка BAOSMC (Genlantis) до и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-HGF с целью демонстрации способа применения путем введения генотерапевтического ДНК-вектора в клетки животных.
На фиг. 29 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена HGF в клетках гладкой мускулатуры аорты быка BAOSMC до трансфекции генотерапевтическим ДНК-вектором VTvaf17-HGF;
2 - кДНК гена HGF в клетках гладкой мускулатуры аорты быка BAOSMC после трансфекции генотерапевтическим ДНК-вектором VTvaf17-HGF;
3 - кДНК гена ACT в клетках гладкой мускулатуры аорты быка BAOSMC до трансфекции генотерапевтическим ДНК-вектором VTvaf17-HGF;
4 - кДНК гена ACT в клетках в клетках гладкой мускулатуры аорты быка BAOSMC после трансфекции генотерапевтическим ДНК-вектором VTvaf17-HGF.
В качестве референтного гена использовали ген актина быка/коровы (ACT), приведенного в базе данных GenBank под номером АН001130.2.
Реализация изобретения
На основе генотерапевтического ДНК-вектора VTvaf17 размером 3165 п.н. созданы генотерапевтические ДНК-векторы, несущие целевые гены человека - ген ANG, кодирующий белок ангиогенин, ген ANGPT1, кодирующий белок ангиопоэтин 1, ген VEGFA, кодирующий белок фактора роста эндотелия сосудов А, ген FGF1, кодирующий о белок фактора роста фибробластов 1, ген HIF1α, кодирующий белок гипоксией индуцированного фактора α, ген HGF, кодирующий белок фактора роста гепатоцитов, ген SDF1, кодирующий белок фактора стромальных клеток, ген KLK4, кодирующий белок калликреин, ген PDGFC, кодирующий белок фактора роста тромбоцитов С, ген PROK1, кодирующий белок прокинетицин-1, ген PROK2, кодирующий белок прокинетицин-2 предназначенные для повышения уровня экспрессии этих целевых генов в тканях человека и животных. При этом способ получения каждого генотерапевтического ДНК-вектора, несущего целевые гены человека заключается в том, что в полилинкер генотерапевтического ДНК-вектора VTvaf17 клонируют белок-кодирующую последовательность целевого гена, выбранного из группы генов: ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2.
Способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2 заключается в том, что:
1. кодирующую часть гена ANG размером 448 п.н., или гена ANGPT1 размером 1501 п.н., или гена VEGFA размером 1242 п.н., или гена FGF1 размером 472 п.н. или гена HIF1α размером 2485 п.н., или гена HGF размером 2190 п.н., или гена SDF1 размером 284 п.н. или гена KLK4 размером 769 п.н., или гена PDGFC размером 1041 п.н. или гена PROK1 размером 328 п.н., или гена PROK2 размером 394 п.н. получали путем выделения суммарной РНК из биологического образца ткани здорового человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации, с использованием созданных для этого методом химического синтеза олигонуклеотидов, с последующим расщеплением продукта амплификации эндонуклеазами рестрикции Sall-Kpnl или Sall-EcoRI или BamHI-EcoRI или BamHI-Sall или BamHI-HindIll.
2. кодирующую часть целевого гена ANG или гена ANGPT1 или гена FGF1 или гена HIF1α или гена PDGFC или гена PROK2 клонировали в полилинкер генотерапевтического ДНК-вектора VTvaf17 по сайтам Sall-Kpnl, кодирующую часть целевого гена VEGFA клонировали в полилинкер генотерапевтического ДНК-вектора VTvaf17 по сайтам BamHI-HindIll, кодирующую часть целевого гена HGF клонировали в полилинкер генотерапевтического ДНК-вектора VTvaf17 по сайтам BamHI-Sall, кодирующую часть целевого гена SDF1 клонировали в полилинкер генотерапевтического ДНК-вектора VTvaf17 по сайтам BamHI-EcoRI, кодирующую часть целевого гена KLK4 или гена PROK1 клонировали в полилинкер генотерапевтического ДНК-вектора VTvaf17 по сайтам Sall-EcoRI, и в результате получали генотерапевтический ДНК-вектор VTvaf17- ANG, SEQID №1, или VTvaf17- ANGPT1, SEQID №2 или VTvaf17- VEGFA, SEQID №3, или VTvaf17- FGF1, SEQID №4 или VTvaf17- HIF1α, SEQID №5 или VTvaf17- HGF, SEQID №6 или VTvaf17-SDF1, SEQID №7 или VTvaf17- KLK4, SEQID №8 или VTvaf17- PDGFC, SEQID №9 или VTvaf17- PROK1, SEQID №10 или VTvaf17- PROK2, SEQID №11. Полученным генотерапевтическим ДНК-вектором VTvaf17, несущий целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2 трансформировали методом электропорации бактерии Escherichia coli SCS110-AF, а селекцию полученных клонов проводили без антибиотиков.
3. для подтверждения эффективности созданного генотерапевтического ДНК-вектора VTvaf17- ANG, SEQ ID №1, или VTvaf17- ANGPT1, SEQ ID №2 или VTvaf17- VEGFA, SEQ ID №3, или VTvaf17- FGF1, SEQ ID №4 или VTvaf17- HIF1α, SEQ ID №5 или VTvaf17- HGF, SEQ ID №6 или VTvaf17- SDF1, SEQ ID №7 или VTvaf17- KLK4, SEQ ID №8 или VTvaf17- PDGFC, SEQ ID №9 или VTvaf17- PROK1, SEQ ID №10 или VTvaf17- PROK2, SEQ ID №11 оценивали:
A) изменение накопления мРНК целевых генов в клетках человека и животного, после трансфекции различных клеточных линий генотерапевтическими ДНК-векторами (методом ПЦР в реальном времени-RT-PCR);
B) изменение количественного уровня целевых белков в культуральной среде клеток человека, после трансфекции различных клеточных линий генотерапевтическими ДНК-векторами (методом иммуноферментного анализа- ИФА);
С) изменение количественного уровня целевых белков в супернатанте биоптатов тканей человека и животного, после введения в эти ткани генотерапевтических ДНК-векторов (методом ИФА);
D) изменение количественного уровня целевых белков в супернатанте биоптатов тканей человека, после введения в эти ткани аутологичных клеток этого человека, трансфицированных генотерапевтическими ДНК-векторами (методом ИФА),
Для подтверждения реализуемости способа применения созданного генотерапевтического ДНК-вектора VTvaf17- ANG, SEQ ID №1, или VTvaf17- ANGPT1, SEQ ID №2 или VTvaf17-VEGFA, SEQ ID №3, или VTvaf17- FGF1, SEQ ID №4 или VTvaf17-HIF1α, SEQ ID №5 или VTvaf17- HGF, SEQ ID №6 или VTvaf17-SDF1, SEQ ID №7 или VTvaf17- KLK4, SEQ ID №8 или VTvaf17-PDGFC, SEQ ID №9 или VTvaf17- PROK1, SEQ ID №10 или VTvaf17- PROK2, SEQ ID №11 выполняли:
А) трансфекциюгенотерапевтическими ДНК-векторами различных клеточных линий человека и животного;
В) введение генотерапевтических ДНК-векторов в различные ткани человека и животного;
C) введение в ткани человека и животного смеси генотерапевтических ДНК-векторов;
D) введение в ткани человека аутологичных клеток, трансфицированных генотерапевтическими ДНК-векторами.
Для подтверждения получения штамма Escherichia coli SCS110-AF/VTvaf17- ANG или штамма Escherichia coli SCS110-AF/VTvaf17- ANGPT1 или штамма Escherichia coli SCS110-AF/VTvaf17- VEGFA или штамма Escherichia coli SCS110-AF/VTvaf17- FGF1 или штамма Escherichia coli SCS110-AF/VTvaf17- HIF1α или штамма Escherichia coli SCS110-AF/VTvaf17- HGF или штамма Escherichia coli SCS110-AF/VTvaf17-SDF1 или штамма Escherichia coli SCS110-AF/VTvaf17- KLK4 или штамма Escherichia coli SCS110-AF/VTvaf17- PDGFC или штамма Escherichia coli SCS110-AF/VTvaf17- PROK1 или штамма Escherichia coli SCS110-AF/VTvaf17- PROK2, проводили трансформацию, селекцию и последующее наращивание с выделением плазмидной ДНК.
Для подтверждения технологичности получения и возможности производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17- ANG, SEQ ID №1, или VTvaf17- ANGPT1, SEQ ID №2 или VTvaf17- VEGFA, SEQ ID №3, или VTvaf17-FGF1, SEQ ID №4 или VTvaf17- HIF1α, SEQ ID №5 или VTvaf17- HGF, SEQ ID №6 или VTvaf17- SDF1, SEQ ID №7 или VTvaf17- KLK4, SEQ ID №8 или VTvaf17- PDGFC, SEQ ID №9 или VTvaf17- PROK1, SEQ ID №10 или VTvaf17- PROK2, SEQ ID №11 выполняли:
А) ферментацию в промышленном масштабе штамма Escherichia coli SCS110-AF/VTvaf17- ANG или штамма Escherichia coli SCS110-AF/VTvaf17- ANGPT1 или штамма Escherichia coli SCS110-AF/VTvaf17- VEGFA или штамма Escherichia coli SCS110-AF/VTvaf17- FGF1, или штамма Escherichia coli SCS110-AF/VTvaf17- HIF1α или штамма Escherichia coli SCS110-AF/VTvaf17- HGF или штамма Escherichia coli SCS110-AF/VTvaf17-SDF1, или штамма Escherichia coli SCS110-AF/VTvaf17- KLK4 или штамма Escherichia coli SCS110-AF/VTvaf17- PDGFC или штамма Escherichia coli SCS110-AF/VTvaf17- PROK1 или штамма Escherichia coli SCS110-AF/VTvaf17- PROK2, каждый из которых содержит генотерапевтический ДНК-вектор VTvaf17, несущий белок-кодирующую последовательность целевого гена, выбранного из группы генов: ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2.
Пример 1.
Получение генотерапевтического ДНК-вектора VTvaf17-ANG, несущего целевой ген ANG.
Генотерапевтический ДНК-вектор VTvaf17-ANG конструировали клонированием кодирующей части гена ANG в ДНК-вектор VTvaf17 по сайтам рестрикции Sall-Kpnl. Кодирующую часть гена ANG размером 448 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и созданныхолигонуклеотидов
ANG_F TTTGTCGACCACCATGGTGATGGGCCTGGGCGTT
ANG_R AATGGTACCTTACGGACGACGGAAAATTGACTG
и ПЦР-амплификации с использованием коммерческого набора Phusion® High-FidelityDNAPolymerase (NewEnglandBiolabs, США) и созданных олигонуклеотидов.
Расщепление продукта амплификации кодирующей части гена ANG и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции Sail и Kpnl(NewEnglandBiolabs, США).
В результате получали ДНК-вектор VTvaf17- ANG размером 3618 п.н. несущий целевой ген, а именно, ген ANG, с нуклеотидной последовательностью SEQID №1, с возможностью селекции без антибиотиков со структурой изображенной на фиг. 1.А.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали объединением шести фрагментов ДНК, полученных из разных источников:
(а) область начала репликации (ori) получали путем ПЦР-амплификации участка коммерческой плазмиды pBR322 с внесением точечной мутации;
(б) промоторный регион EF1a получали путем ПЦР-амплификации участка геномной ДНК человека;
(в) терминатор транскрипции hGH-TA получали путем ПЦР-амплификации участка геномной ДНК человека;
(г) регуляторный участок транспозона Tn10 PHK-out получали путем синтеза из олигонуклеотидов|
(д) ген устойчивости к канамицину получали путем ПЦР-амплификации участка коммерческой плазмиды рЕТ-28 человека;
(е) полилинкер получали отжигом двух синтетических олигонуклеотидов.
ПЦР-амплификацию проводили с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs) в соответствии с инструкцией производителя. Фрагменты имеют перекрывающиеся области для возможности их объединения с последующей ПЦР-амплификацией. Объединяли фрагменты (а) и (б) с использованием олигонуклеотидов Ori-F и EF1-R, а также фрагменты (в), (г) и (д) с использованием олигонуклеотидов hGH-F и Kan-R. Далее, полученные участки объединяли путем рестрикции с последующим лигированием по сайтам BamHI и Ncol. В результате получали плазмиду, пока еще не содержащую полилинкер. Для его введения проводили расщепление плазмиды по сайтам BamHI и EcoRI, и лигирование с фрагментом (е). Таким образом, получали вектор размером 4182 п.н., несущий ген устойчивости к канамицину, который фланкирован сайтами рестрикции Spel. Далее этот участок выщепляли по сайтам рестрикции Spel, после чего оставшийся фрагмент лигировали сам на себя. Таким образом получали генотерапевтический ДНК-вектор VTvaf17 размером 3165 п.н., который является рекомбинантным, с возможностью селекции без антибиотиков.
Пример 2.
Получение генотерапевтического ДНК-вектора VTvaf17-ANGPT1, несущего целевой ген ANGPT1.
Генотерапевтический ДНК-вектор VTvaf17-ANGPT1 конструировали клонированием кодирующей части гена ANGPT1 в ДНК-вектор VTvaf17 по сайтам рестрикции Nhel и HindIll. Кодирующую часть гена ANGPT1 размером 1501 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и созданных олигонуклеотидов
ANGPT1_FTTTGTCGACCACCATGACAGTTTTCCTTTCCTTTGCTTTCC
ANGPT1_RAATGGTACCTCAAAAATCTAAAGGTCGAATCATCATAGTTG и ПЦР-амплификации с использованием коммерческого набора Phusion® High-FidelityDNAPolymerase (NewEnglandBiolabs, США) и созданных олигонуклеотидов.
Расщепление продукта амплификации кодирующей части гена ANGPT1 и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции Sall и Kpnl (NewEnglandBiolabs, США).
В результате получили ДНК-вектор VTvaf17-ANGPT1 размером 4660 п.н. несущий целевой ген, а именно, ген ANGPT1, с нуклеотидной последовательностью SEQID №2 с возможностью селекции без антибиотиков, со структурой изображенной на фиг. 1.В.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 3
Получение ДНК-вектора VTvaf17-VEGFA, несущего целевой ген VEGFA человека.
Генотерапевтический ДНК-вектор VTvaf17-VEGFA конструировали клонированием кодирующей части гена VEGFA в ДНК-вектор VTvaf17 по сайтам рестрикции BamHI-HindIll. Кодирующую часть гена VEGFA размером 1242 п.н. получали путем выделения суммарной РНК из биопсийного образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и созданных олигонуклеотидов
VEGFA_F
GGGGGATCCACCATGACGGACAGACAGACAGACACCGC
VEGFA_R
TTTGGATCCACCATGAACTTTCTGCTGTCTTGGGTGC
и ПЦР-амплификации с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США) и созданных олигонуклеотидов.
Расщепление продукта амплификации кодирующей части гена VEGFA и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI и HindIll(NewEnglandBiolabs, США).
В результате получили генотерапевтический ДНК-вектор VTvaf17-VEGFA размером 4395 п.н. несущий целевой ген, а именно VEGFA, с нуклеотидной последовательностью SEQID №3, с возможностью селекции без антибиотиков, со структурой изображенной на фиг. 1.С.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 4.
Получение генотерапевтического ДНК-вектора VTvaf17-FGF1, несущего целевой ген FGF1
Генотерапевтический ДНК-вектор VTvaf17- FGF1 конструировали клонированием кодирующей части гена FGF1 в ДНК-вектор VTvaf17 по сайтам рестрикции Sall-Kpnl. Кодирующую часть гена FGF1 размером 472 п.н. получали путем выделения суммарной РНК из биопсийного образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и созданных олигонуклеотидов
FGF_F TTTGTCGACCACCATGGCTGAAGGGGAAATCACC
FGF_R AATGGTACCTTAATCAGAAGAGACTGGCAGGGG
и ПЦР-амплификации с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США) и созданных олигонуклеотидов.
Расщепление продукта амплификации кодирующей части гена FGF1 и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции Sail и Kpnl (New England Biolabs, США).
В результате получили ДНК-вектор VTvaf17-FGF1 размером 3631 п.н. несущий целевой ген, а именно, ген FGF1, с нуклеотидной последовательностью SEQID №4, с возможностью селекции без антибиотиков со структурой изображенной на фиг. 1.D.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 5.
Получение генотерапевтического ДНК-вектора VTvaf17-HIF1α, несущего целевой ген HIF1α.
Генотерапевтический ДНК-вектор VTvaf17-HIF1α конструировали клонированием кодирующей части гена HIF1α в ДНК-вектор VTvaf17 по сайтам рестрикции Sall-Kpnl. Кодирующую часть гена HIF1α размером 2485 п.н. получали путем выделения суммарной РНК из биопсийного образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и созданных олигонуклеотидов
HIF_F TTTGTCGACCACCATGGAGGGCGCCGGCGGCGCGA
HIF_R
AATGGTACCTCAGTTAACTTGATCCAAAGCTCTGAGTAATTC
и ПЦР-амплификации с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США) и созданных олигонуклеотидов.
Расщепление продукта амплификации кодирующей части гена HIF1α и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции Sail и Kpnl (New England Biolabs, США).
В результате получили ДНК-вектор VTvaf17- HIF1α размером 5643 п.н. несущий целевой ген, а именно, ген HIF1α, с нуклеотидной последовательностью SEQ ID №5, с возможностью селекции без антибиотиков со структурой изображенной на фиг. 1.Е.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 6.
Получение генотерапевтического ДНК-вектора VTvaf17- HGF, несущего целевой ген HGF.
Генотерапевтический ДНК-вектор VTvaf17- HGF конструировали клонированием кодирующей части гена HGF в ДНК-вектор VTvaf17 по сайтам рестрикции BamHI-Sall. Кодирующую часть гена HGF размером 2190 п.н. получали путем выделения суммарной РНК из биопсийного образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и созданных олигонуклеотидов
HGF_F
TTTGGATCCACCATGTGGGTGACCAAACTCCTGCCA
HGF_R
AATGTCGACCTATGACTGTGGTACCTTATATGTTAAAAT
и ПЦР-амплификации с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США) и созданных олигонуклеотидов.
Расщепление продукта амплификации кодирующей части гена HGF и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI и Sall (New England Biolabs, США).
В результате получили ДНК-вектор VTvaf17- HGF размером 5349 п.н. несущий целевой ген, а именно, ген HGF, с нуклеотидной последовательностью SEQ ID №6, с возможностью селекции без антибиотиков со структурой изображенной на фиг. 1.F.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 7.
Получение генотерапевтического ДНК-вектора VTvaf17- SDF1, несущего целевой ген SDF1.
Генотерапевтический ДНК-вектор VTvaf17- SDF1 конструировали клонированием кодирующей части гена SDF1 в ДНК-вектор VTvaf17 по сайтам рестрикции BamHI-EcoRI.
Кодирующую часть гена SDF1 размером 284 п.н. получали путем выделения суммарной РНК из биопсийного образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и созданных олигонуклеотидов
SDF_F AGGATCCCACCATGAACGCCAAGGTCGTGGT
SDF_R TATGAATTCACATCTTGAACCTCTTGTTTAAAGC
и ПЦР-амплификации с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США) и созданных олигонуклеотидов.
Расщепление продукта амплификации кодирующей части гена SDF1 и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI и EcoRI (New England Biolabs, США).
В результате получили ДНК-вектор VTvaf17- SDF1 размером 3425 п.н. несущий целевой ген, а именно, ген SDF1, с нуклеотидной последовательностью SEQ ID №7, с возможностью селекции без антибиотиков со структурой изображенной на фиг. 1.G.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 8.
Получение генотерапевтического ДНК-вектора VTvaf17- KLK4, несущего целевой ген KLK4.
Генотерапевтический ДНК-вектор VTvaf17- KLK4 конструировали клонированием кодирующей части гена KLK4 в ДНК-вектор VTvaf17 по сайтам рестрикции Sall-EcoRI. Кодирующую часть гена KLK4 размером 769 п.н. получали путем выделения суммарной РНК из биопсийного образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и созданных олигонуклеотидов
KLK_F TTTGTCGACCACCATGGCCACAGCAGGAAATCCC
KLK_R TTTTTGAATTCTTAACTGGCCTGGACGGTTTTCTC
и ПЦР-амплификации с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США) и созданных олигонуклеотидов.
Расщепление продукта амплификации кодирующей части гена KLK4 и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции Sail и EcoRI (New England Biolabs, США).
В результате получили ДНК-вектор VTvaf17- KLK4 размером 3922 п.н. несущий целевой ген, а именно, ген KLK4, с нуклеотидной последовательностью SEQ ID №8, с возможностью селекции без антибиотиков со структурой изображенной на фиг. 1.Н.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 9.
Получение генотерапевтического ДНК-вектора VTvaf17-PDGFC, несущего целевой ген PDGFC.
Генотерапевтический ДНК-вектор VTvaf17- PDGFC конструировали клонированием кодирующей части гена PDGFC в ДНК-вектор VTvaf17 по сайтам рестрикции Sall-Kpnl. Кодирующую часть гена PDGFC размером 1041 п.н. получали путем выделения суммарной РНК из биопсийного образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и созданных олигонуклеотидов
PDGFC_F
TTTGTCGACCACCATGAGCCTCTTCGGGCTTCTCC
PDGFC_R AATGGTACCTATCCTCCTGTGCTCCCTCTGCAC
и ПЦР-амплификации с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США) и созданных олигонуклеотидов.
Расщепление продукта амплификации кодирующей части гена PDGFC и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции Sail и Kpnl (New England Biolabs, США).
В результате получили ДНК-вектор VTvaf17- PDGFC размером 4200 п.н. несущий целевой ген, а именно, ген PDGFC, с нуклеотидной последовательностью SEQ ID №9, с возможностью селекции без антибиотиков со структурой изображенной на фиг. 1.I.
При этом генотерапевтический ДНК-вектор VTvaf1 7 конструировали по Примеру 1.
Пример 10.
Получение генотерапевтического ДНК-вектора VTvaf17- PROK1, несущего целевой ген PROK1.
Генотерапевтический ДНК-вектор VTvaf17- PROK1 конструировали клонированием кодирующей части гена PROK1 в ДНК-вектор VTvaf17 по сайтам рестрикции Sall-EcoRI. Кодирующую часть гена PROK1 размером 328 п.н. получали путем выделения суммарной РНК из биопсийного образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и созданных олигонуклеотидов
PROK1_F
TATGTCGACCACCATGAGAGGTGCCACGCGAG
PROK1_R
TATGGAATTCGGTACGCTAAAAATTGATGTTCTTCAAGTCCA и ПЦР-амплификации с использованием коммерческого набора Phusion® High-FidelityDNAPolymerase (NewEnglandBiolabs, США) и созданных олигонуклеотидов.
Расщепление продукта амплификации кодирующей части гена PROK1 и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции Saill и EcoRI (New England Biolabs, США).
В результате получили ДНК-вектор VTvaf17- PROK1 размером 3481 п.н. несущий целевой ген, а именно, ген PROK1, с нуклеотидной последовательностью SEQ ID №10, с возможностью селекции без антибиотиков со структурой изображенной на фиг. 1.K.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 11.
Получение генотерапевтического ДНК-вектора VTvaf17- PROK2, несущего целевой ген PROK2.
Генотерапевтический ДНК-вектор VTvaf17- PROK2 конструировали клонированием кодирующей части гена PROK2 в ДНК-вектор VTvaf17 по сайтам рестрикции Sall-Kpnl. Кодирующую часть гена PROK2 размером 394 п.н. получали путем выделения суммарной РНК из биопсийного образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и созданных олигонуклеотидов
PROK2_F
TTTGTCGACCACCATGAGGAGCCTGTGCTGCG
PROK2_R
AATGGTACCTTACTTTTGGGCTAAACAAATAAATCGG
и ПЦР-амплификации с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США) и созданных олигонуклеотидов.
Расщепление продукта амплификации кодирующей части гена PROK2 и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции Sall и Kpnl (New England Biolabs, США).
В результате получили ДНК-вектор VTvaf17- PROK2 размером 3553 п.н. несущий целевой ген, а именно, ген PROK2, с нуклеотидной последовательностью SEQ ID №11, с возможностью селекции без антибиотиков со структурой изображенной на фиг. 1.L.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 12.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17- ANG, несущего целевой ген ANG. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген ANG.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- ANG оценивали изменения накопления мРНК целевого гена ANG, в клетках первичной культуры фибробластов кожи человека HDFa (ATCCPCS-201-012) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17- ANG.
Клетки первичной культуры фибробластов кожи человека HDF а выращивали в среде Fibroblast Basal Medium (АТСС PCS-201-030) с добавлением компонентов входящих в состав набора Fibroblast Growth Kit-Serum-Free (АТСС PCS-201-040) в атмосфере 5% CO2 при 37°С. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку.
Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisherScientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17- ANG проводили следующим образом. В пробирке №1 к 25 мкл среды Opti-MEM (Gibco) добавляли 1 мкл раствора ДНК-вектора VTvaf17-ANG(концентрация 500 нг/мкл) и 1 мкл реагента Р3000. Аккуратно перемешивали легким встряхиванием. В пробирке №2 к 25 мкл среды Opti-MEM (Gibco) добавляли 1 мкл раствора Lipofectamine 3000. Аккуратно перемешивали легким встряхиванием. Добавляли содержимое пробирки №1 к содержимому пробирки №2, инкубировали 5 мин при комнатной температуре. Полученный раствор по каплям добавляли к клеткам в объеме 40 мкл.
В качестве контроля использовали фибробласты кожи человека HDFа, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена(кДНК гена ANG до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано выше.
Суммарную РНК из трансфицированных клеток выделяли следующим образом. В лунку с клетками добавляли 1 мл TrizolReagent (ThermoFisherScientific) и гомогенизировали с последующим прогреванием в течении 5 мин при 65°С. Далее образец центрифугировали при 14000g в течении 10 мин и снова прогревали в течении 10 мин при 65°С. Далее добавляли 200 мкл хлороформа, плавно перемешивали и центрифугировали при 14000g в течении 10 мин. Затем отбирали водную фазу, добавляли к ней 1/10 объема 3М ацетата натрия рН5.2 и равный объем изопропилового спирта. Инкубировали образец при -20°С в течении 10 мин с последующим центрифугированием при 14 000g в течении 10 мин. Осадок промывали 1 мл 70% этилового спирта, высушивали на воздухе и растворяли в 10 мкл воды, свободной от РНКаз. Для определения уровня экспрессии мРНК гена ANG после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена ANG человека, использовали олигонуклеотиды

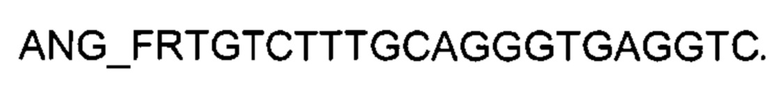
Длина продукта амплификации - 183 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили с помощью набора реагентов SYBRGreenQuantitectRT-PCRKit (Qiagen, США) в режиме реального времени в 20 мкл амплификационной смеси, содержащей: 25 мкл QuantiTectSYBRGreenRT-PCRMasterMix, 2,5 mM хлорида магния, по 0,5 мкМ каждого праймера, 5 мкл суммарной РНК. Реакцию осуществляли на амплификаторе CFX96 (Bio-Rad, USA) при следующих условиях: 1 цикл обратной транскрипции при 42°С 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 120 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов ANGи В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов ANG и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена ANG в культуре клетокфибробластов кожи человека HDFa после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17- ANG на фиг. 2 приведены графики накопления ПЦР-продуктов, из которых следует, что в результате трансфекции первичной культуры фибробластов кожи человека НDFагенотерапевтическим ДНК-вектором VTvaf17- ANG, уровень специфической мРНК гена ANG человекавырос многократно. Это свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17- ANG. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-ANG для повышения уровня экспрессии гена ANG в эукариотических клетках.
Пример 13.
Подтверждение эффективности генотерапевтического ДНК-вектора ANGPT1, несущего целевой ген ANGPT1. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген ANGPT1.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- ANGPT1, оценивали изменения накопления мРНК целевого гена ANGPT1, в клетках первичной культуры фибробластов кожи человека НТ 297.Т (АТСС® CRL-7782™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17- ANGPT1.
Клетки первичной культуры фибробластов кожи человека НТ 297.Т выращивали в среде Dulbecco's Modified Eagle's Medium согласно методики производителя (https://www.lqcstandards-atcc.orq/products/all/CRL-7782.aspx#culturemethod) в атмосфере 5% СО2 при 37°С. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку.
Клетки первичной культуры фибробластов кожи человека НТ 297.Т трансфицировали как описано в Примере 12.
Трансфекцию проводили генотерапевтическим ДНК-вектором VTvaf17- ANGPT1.
В качестве контроля использовали фибробласты кожи человека НТ 297.Т, трансфицированные генотерапевтическим ДНК-вектором ANGPT1, не содержащим вставку целевого гена (кДНК гена ANGPT1 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано в Примере 12.
Суммарную РНК из трансфицированных клеток выделяли как описано в Примере 12. Для определения уровня экспрессии мРНК гена ANGPT1 после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена ANGPT1 человека, использовали олигонуклеотиды


Длина продукта амплификации - 181 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили как описано в Примере 12при следующих условиях: 1 цикл обратной транскрипции при 42°С 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 120 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов ANGPT1 и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов ANGPT1 и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена ANGPT1 в культуре клеток фибробластов кожи человека НТ 297.Т после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17- ANGPT1 на фиг. 3 приведены графики накопления ПЦР-продуктов, из которых следует, что в результате трансфекции первичной культуры фибробластов кожи человека НТ 297.Т генотерапевтическим ДНК-вектором VTvaf17- ANGPT1, уровень специфической мРНК гена ANGPT1 человека вырос многократно. Это свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17- ANGPT1. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-ANGPT1 для повышения уровня экспрессии гена ANGPT1 в эукариотических клетках.
Пример 14.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-VEGFA, несущего целевой ген VEGFA. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген VEGFA.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- VEGFA, оценивали изменения накопления мРНК целевого гена VEGFA, в клетках первичной культуры фибробластов крайней плоти Hs27 (АТСС® CRL-1634™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17- VEGFA.
Клетки первичной культуры фибробластов крайней плоти Hs27 выращивали в среде Dulbecco's Modified Eagle's Medium согласно методики производителя (https://www.lgcstandards-atcc.org/products/all/CRL-1634.aspx#culturemethod) в атмосфере при 37°С. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку.
Клетки первичной культуры фибробластов крайней плоти Hs27 трансфицировали,как описано в Примере 12.
Трансфекцию проводили генотерапевтическим ДНК-вектором VTvaf17- VEGFA.
В качестве контроля использовали фибробласты крайней плоти Hs27, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена (кДНК гена VEGFA до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано в Примере 12.
Суммарную РНК из трансфицированных клеток выделяликак описано в Примере 12. Для определения уровня экспрессии мРНК гена VEGFA после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена VEGFA человека, использовали олигонуклеотиды

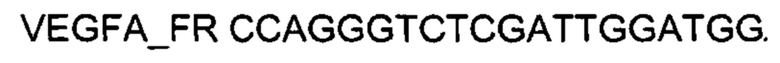
Длина продукта амплификации - 167 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили как описано в Примере 12при следующих условиях: 1 цикл обратной транскрипции при 42°С 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 120 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов VEGFA и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов VEGFA и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена VEGFA в культуре клеток фибробластов крайней плоти Hs27 после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17- VEGFA на фиг. 4 приведены графики накопления ПЦР-продуктов, из которых следует, что в результате трансфекции первичной культуры фибробластов крайней плоти Hs27 генотерапевтическим ДНК-вектором VTvaf17- VEGFA, уровень специфической мРНК гена VEGFA человека вырос многократно. Это свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17- VEGFA. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-VEGFA для повышения уровня экспрессии гена VEGFA в эукариотических клетках.
Пример 15.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-FGF1, несущего целевой ген FGF1. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген FGF1.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-FGF1, оценивали изменения накопления мРНК целевого гeнa FGF1, в клетках первичной культуры скелетных миобластов HSkM человека (А12555, Thermo Fisher Scientific) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17- FGF1.
Клетки первичной культуры скелетных миобластов HSkM человекавыращивали в среде Gibco® HSkM Differentiation Medium (DM) согласно методики производителя (https://www.thermofisher.com/order/catalog/product/A12555) в атмосфере 5% СО2 при 37°С. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку.
Клетки первичной культуры скелетных миобластов HSkM трансфицировали, как описано в Примере 12.
Трансфекцию проводили генотерапевтическим ДНК-вектором VTvaf17-FGF1.
В качестве контроля использовали скелетные миобласты HSkM человека, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена (кДНК гена FGF1 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано в Примере 12.
Суммарную РНК из трансфицированных клеток выделяли как описано в Примере 12. Для определения уровня экспрессии мРНК гена FGF1 после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена FGF1 человека, использовали олигонуклеотиды


Длина продукта амплификации - 189 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили как описано в Примере 12 при следующих условиях: 1 цикл обратной транскрипции при 42°С 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 120 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов FGF1 и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов FGF1 и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена FGF1 в культуре клеток скелетных миобластов HSkM после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17- FGF1 на фиг. 5 приведены графики накопления ПЦР-продуктов, из которых следует, что в результате трансфекции первичной культуры скелетных миобластов HSkM генотерапевтическим ДНК-вектором VTvaf17-FGF1, уровень специфической мРНК гена FGF1 человека вырос многократно. Это свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-FGF1. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17- FGF1 для повышения уровня экспрессии гена FGF1 в эукариотических клетках.
Пример 16.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-HIF1α, несущего целевой ген HIF1α. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген HIF1α.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-HIF1α, оценивали изменения накопления мРНК целевого гена HIF1α, в клетках первичной культуры гладкомышечных клеток мочевого пузыря HBdSMc человека (АТСС® PCS-420-012™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17- HIF1α.
Клетки первичной культуры гладкомышечных клеток мочевого пузыря HBdSMc выращивали в среде Vascular Cell Basal Medium (АТСС PCS-100-030) с добавлением компонентов входящих в состав набора для роста (АТСС PCS-100-042) в атмосфере 5% СО2 при 37°С. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку.
Клетки первичной культуры гладкомышечных клеток мочевого пузыря HBdSMc трансфицировали, как описано в Примере 12.
Трансфекцию проводили генотерапевтическим ДНК-вектором VTvaf17-HIF1α.
В качестве контроля использовали клетки первичной культуры гладкомышечных клеток мочевого пузыря HBdSMc, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена (кДНК гена HIF1α до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано в Примере 12.
Суммарную РНК из трансфицированных клеток выделяли как описано в Примере 12. Для определения уровня экспрессии мРНК гена HIF1α после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена HIF1α человека, использовали олигонуклеотиды

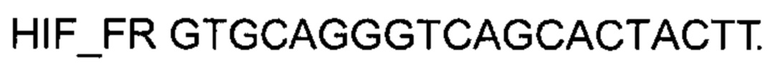
Длина продукта амплификации - 173 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили как описано в Примере 12 при следующих условиях: 1 цикл обратной транскрипции при 42°С 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 120 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов HIF1α и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов HIF1α и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена HIF1α в первичной культуре гладкомышечных клеток мочевого пузыря HBdSMc после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17- HIF1α на фиг. 6 приведены графики накопления ПЦР-продуктов, из которых следует, что в результате трансфекции первичной культуры гладкомышечных клеток мочевого пузыря HBdSMc генотерапевтическим ДНК-вектором VTvaf17-HIF1α, уровень специфической мРНК гена HIF1α человека вырос многократно. Это свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-HIF1α. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17- HIF1α для повышения уровня экспрессии гена HIF1α в эукариотических клетках.
Пример 17.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-HGF, несущего целевой ген HGF. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген HGF.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-HGF, оценивали изменения накопления мРНК целевого гена HGF, в первичной культуре гладкомышечных клеток аорты T/G HA-VSMC (АТСС® CRL-1999™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17- HGF.
Клетки первичной культуры гладкомышечных клеток аорты T/G HA-VSMC выращивали в среде F-12K Medium согласно методики производителя (https://www.lgcstandards-atcc.org/products/all/CRL-1999.aspx#culturemethod) в атмосфере при 37°С. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку.
Клетки первичной культуры гладкомышечных клеток аорты T/G HA-VSMC трансфицировали, как описано в Примере 12.
Трансфекцию проводили генотерапевтическим ДНК-вектором VTvaf17-HGF.
В качестве контроля использовали Клетки первичной культуры гладкомышечных клеток аорты T/G HA-VSMC, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена (кДНК гена HGF до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано в Примере 12.
Суммарную РНК из трансфицированных клеток выделяли как описано в Примере 12. Для определения уровня экспрессии мРНК гена HGF после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена HGF человека, использовали олигонуклеотиды
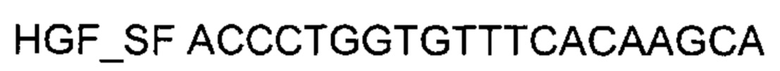

Длина продукта амплификации - 182 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили как описано в Примере 12 при следующих условиях: 1 цикл обратной транскрипции при 42°С 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 120 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов HGF и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов HGF и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена HGF в первичной культуре гладкомышечных клеток аорты T/G HA-VSMC после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17- HGF на фиг. 7 приведены графики накопления ПЦР-продуктов, из которых следует, что в результате трансфекции первичной культуры гладкомышечных клеток аорты T/G HA-VSMC генотерапевтическим ДНК-вектором VTvaf17-HGF, уровень специфической мРНК гена HGF человека вырос многократно. Это свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-HGF. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-HGF для повышения уровня экспрессии гена HGF в эукариотических клетках.
Пример 18.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-SDF1, несущего целевой ген SDF1. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген SDF1.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-SDF1, оценивали изменения накопления мРНК целевого гена SDF1, в клетках первичной культуры кератиноцитов эпидермиса HEKa (АТСС® PCS-200-011™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17- SDF1.
Клетки первичной культуры кератиноцитов эпидермиса HEKa выращивалив среде Dermal Cell Basal Medium (АТСС® PCS200030) с добавлением Keratinocyte Growth Kit (АТСС® PCS200040) в атмосфере 5% СО2 при 37°С. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку.
Клетки первичной культуры кератиноцитов эпидермиса HEKa трансфицировали, как описано в Примере 12.
Трансфекцию проводили генотерапевтическим ДНК-вектором VTvaf17-SDF1.
В качестве контроля использовали кератиноциты эпидермиса HEKa, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена (кДНК гена SDF1 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано в Примере 12.
Суммарную РНК из трансфицированных клеток выделяли как описано в Примере 12. Для определения уровня экспрессии мРНК гена SDF1 после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена SDF1 человека, использовали олигонуклеотиды

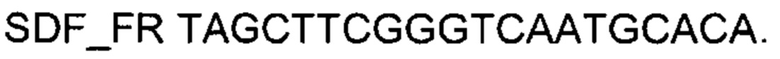
Длина продукта амплификации - 152 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили как описано в Примере 12 при следующих условиях: 1 цикл обратной транскрипции при 42°С 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 120 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов SDF1 и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов SDF1 и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена SDF1 в культуре кератиноцитов эпидермиса HEKa после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17-SDF1 нa фиг. 8 приведены графики накопления ПЦР-продуктов, из которых следует, что в результате трансфекции первичной культуры кератиноцитов эпидермиса HEKa генотерапевтическим ДНК-вектором VTvaf17-SDF1, уровень специфической мРНК гена SDF1 человека вырос многократно. Это свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-SDF1. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-SDF1 для повышения уровня экспрессии гена SDF1 в эукариотических клетках.
Пример 19.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-KLK4, несущего целевой ген KLK4. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген KLK4.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf 17-KLK4, оценивали изменения накопления мРНК целевого гена KLK4, в клетках первичной культуры эндотелия пупочной вены HUVEC (АТСС® PCS-100-010™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17- KLK4.
Клетки первичной культуры эндотелия пупочной вены HUVEC выращивалив среде Vascular Cell Basal Medium (АТСС PCS-100-030) согласно методики производителя (https://www.lgcstandards-atcc.org/products/all/PCS-100-010.aspx#cultureconditions) в атмосфере 5% СО2 при 37°С. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку.
Клетки первичной культуры эндотелия пупочной вены НUVЕС трансфицировали, как описано в Примере 12.
Трансфекцию проводили генотерапевтическим ДНК-вектором VTvaf17-KLK4.
В качестве контроля использовали клетки первичной культуры эндотелия пупочной вены HUVEC, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена (кДНК гена KLK4 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано в Примере 12.
Суммарную РНК из трансфицированных клеток выделяли как описано в Примере 12. Для определения уровня экспрессии мРНК гена KLK4 после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена KLK4 человека, использовали олигонуклеотиды


Длина продукта амплификации - 177 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили как описано в Примере 12 при следующих условиях: 1 цикл обратной транскрипции при 42°С 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 120 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов KLK4 и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов KLK4 и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена KLK4 в первичной культуре клеток эндотелия пупочной вены HUVEC после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17- KLK4 на фиг. 9 приведены графики накопления ПЦР-продуктов, из которых следует, что в результате трансфекции первичной культуры клеток эндотелия пупочной вены HUVEC генотерапевтическим ДНК-вектором VTvaf17-KLK4, уровень специфической мРНК гена KLK4 человека вырос многократно. Это свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-KLK4.
Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-KLK4 для повышения уровня экспрессии гена KLK4 в эукариотических клетках.
Пример 20
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-PDGFC, несущего целевой ген PDGFC. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген PDGFC.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-PDGFC, оценивали изменения накопления мРНК целевого гена PDGFC, в клетках первичной культуры меланоцитов эпидермиса НЕМа (АТСС® PCS-200-013™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17- PDGFC.
Клетки первичной культуры меланоцитов эпидермиса НЕМа выращивалив среде Dermal Cell Basal Medium (АТСС® PCS200030) согласно методики производителя (https://www.lgcstandards-atcc.org/products/all/PCS-200-013.aspx#cultureconditions) в атмосфере 5% СО2 при 37°С. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку.
Клетки первичной культуры меланоцитов эпидермиса НЕМатрансфицировали, как описано в Примере 12.
Трансфекцию проводили генотерапевтическим ДНК-вектором VTvaf17-PDGFC.
В качестве контроля использовали клетки первичной культуры меланоцитов эпидермиса НЕМа, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена (кДНК гена PDGFC до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано в Примере 12.
Суммарную РНК из трансфицированных клеток выделяли как описано в Примере 12. Для определения уровня экспрессии мРНК гена PDGFC после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена PDGFC человека, использовали олигонуклеотиды
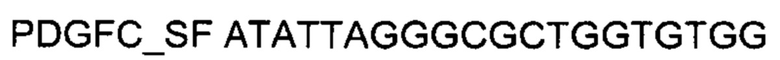

Длина продукта амплификации - 173 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили как описано в Примере 12 при следующих условиях: 1 цикл обратной транскрипции при 42°С 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 120 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов PDGFC и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов PDGFC и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена PDGFC в культуре клеток меланоцитов эпидермиса НЕМа после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17- PDGFC на фиг. 10 приведены графики накопления ПЦР-продуктов, из которых следует, что в результате трансфекции первичной культуры меланоцитов эпидермиса НЕМа генотерапевтическим ДНК-вектором VTvaf17-PDGFC, уровень специфической мРНК гена PDGFC человека вырос многократно. Это свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-PDGFC. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17- PDGFC для повышения уровня экспрессии гена PDGFC в эукариотических клетках.
Пример 21
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-PROK1, несущего целевой ген PROK1. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген PROK1.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- PROK1, оценивали изменения накопления мРНК целевого гена PROK1, в клетках первичной культуры скелетных миобластов HSkM человека (А12555, Thermo Fisher Scientific) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17- PROK1.
Клетки первичной культуры скелетных миобластов HSkM человека выращивали в среде Gibco® HSkM Differentiation Medium (DM) согласно методики производителя (https://www.thermofisher.com/order/cataloq/product/A12555) в атмосфере 5% СО2 при 37°С. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку.
Клетки первичной культуры скелетных миобластов HSkM трансфицировали, как описано в Примере 12.
Трансфекцию проводили генотерапевтическим ДНК-вектором VTvaf17- PROK1.
В качестве контроля использовали клетки первичной культуры скелетных миобластов HSkM, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащимвставку целевого гена (кДНК гена PROK1 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf 17, не содержащим вставку целевого гена на фигурах не показано). Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано в Примере 12.
Суммарную РНК из трансфицированных клеток выделяли как описано в Примере 12. Для определения уровня экспрессии мРНК гена PROK1 после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена PROK1 человека, использовали олигонуклеотиды
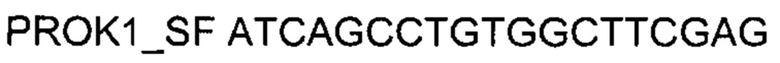
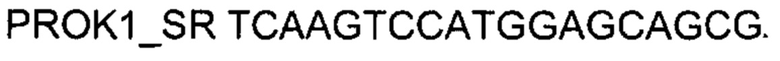
Длина продукта амплификации - 184 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили как описано в Примере 12 при следующих условиях: 1 цикл обратной транскрипции при 42°С 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 120 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов PROK1 и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов PROK1 и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена PROK1 в культуре клеток скелетных миобластов HSkM после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17- PROK1 на фиг. 11 приведены графики накопления ПЦР-продуктов, из которых следует, что в результате трансфекции первичной культуры скелетных миобластов HSkM генотерапевтическим ДНК-вектором VTvaf17- PROK1, уровень специфической мРНК гена PROK1 человека вырос многократно. Это свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17- PROK1. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17- PROK1 для повышения уровня экспрессии гена PROK1 в эукариотических клетках.
Пример 22
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-PROK2, несущего целевой ген PROK2. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген PROK2.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- PROK2, оценивали изменения накопления мРНК целевого гена PROK2, в клетках первичной культуры клеток эндотелия капилляров кожи НМЕС-1 (АТСС® CRL-3243™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17- PROK2.
Первичную культуру клеток эндотелия капилляров кожи НМЕС-1 выращивали в среде MCDB131 (без L-Glutamine) согласно методики производителя (https://www.lgcstandards-atcc.org/products/all/CRL-3243.aspx#culturemethod) при 37°С. Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку.
Клетки первичной культуры клеток эндотелия капилляров кожи НМЕС-1 трансфицировали, как описано в Примере 12.
Трансфекцию проводили генотерапевтическим ДНК-вектором VTvaf 17- PROK2.
В качестве контроля использовали клетки эндотелия капилляров кожи НМЕС-1, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена (кДНК гена PROK2 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано в Примере 12.
Суммарную РНК из трансфицированных клеток выделяли как описано в Примере 12. Для определения уровня экспрессии мРНК гена PROK2 после трансфекции использовали метод ПЦР в режиме реального времени (SYBR GreenRealTimePCR). Для амплификации кДНК, специфичной для гена PROK2 человека, использовали олигонуклеотиды


Длина продукта амплификации - 174 п.н. В качестве референтного гена использовали ген бета-2-микроглобулина В2М.
ПЦР-амплификацию проводили как описано в Примере 12 при следующих условиях: 1 цикл обратной транскрипции при 42°С 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°С - 30 сек и элонгацию 72°С - 120 сек. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов PROK2 и В2М. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов PROK2 и В2М, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1.
С целью подтверждения увеличения экспрессии гена PROK2 в культуре клеток эндотелия капилляров кожи НМЕС-1 после трансфекции данных клеток генотерапевтическим ДНК-вектором VTvaf17- PROK2 на фиг. 12 приведены графики накопления ПЦР-продуктов, из которых следует, что в результате трансфекции первичной культуры клеток эндотелия капилляров кожи НМЕС-1 генотерапевтическим ДНК-вектором VTvaf17-PROK2, уровень специфической мРНК гена PROK2 человека вырос многократно. Это свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17- PROK2. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-PROK2 для повышения уровня экспрессии гена PROK2 в эукариотических клетках.
Пример 23.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17- ANG, несущего целевой ген, а именно, ген ANG и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- ANG, несущего целевой ген, а именно, ген ANG и реализуемости способа его использования оценивалиизменение количества белка ангиогенина в культуральной среде фибробластов кожи человека HDFa (ATCCPCS-201-012) после трансфекции этих клеток ДНК-вектором VTvaf17- ANG, несущим ген ANG человека, как описано в Примере 12.
Для оценки изменения количества белка ангиогенина, использовали клетки первичной культуры фибробластов кожи человека HDFa (ATCCPCS-201-012), которые выращивали по примеру 12.
После трансфекции к 0,5 мл культуральной жидкости приливали 0,1 мл 1NHCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2N NaOH/0.5M HEPES (рН 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение продукта кДНК гена ANG проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ANG Human ELISA Kit (Abeam, США) согласно методике производителя http://www.abcam.com/ps/products/99/ab99970/documents/ab99970_Angiogenin%20(ANG)%20Human%20ELISA_Kit%20v3%20(website).pdf Оптическая плотность образцов измерялась при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness TechNology Inc., США) и пропорциональна концентрации белка ANG в пробе. Численное значение концентрации определяется с помощью калибровочной кривой, построенной по калибраторам с известной концентрацией белка ANG, входящим в состав набора. Разница между значениями оптической плотности (ОП) калибраторов поставленных в трех повторностях не превышала 10%.
Статистическую обработку полученных результатов, осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/).
Диаграмма, полученная в результате анализа представлена на фиг. 13, из которой следует, что трансфекция клеток первичной культуры фибробластов кожи человека HDFa (ATCCPCS-201-012) генотерапевтическим ДНК-вектором VTvaf17-ANG, несущим ген ANG, приводит к увеличению количества белка ангиогенина по сравнению с контрольными образцами, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-ANG и подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген ANG науровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-ANG для повышения уровня экспрессии ANG в эукариотических клетках.
Пример 24.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17- ANGPT1, несущего целевой ген, а именно, ген ANGPT1 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- ANGPT1, несущего целевой ген, а именно, ген ANGPT1 и реализуемости способа его использования оценивалиизменение количества белка ангиопоэтина 1 в культуральной среде фибробластов кожи человека НТ 297.Т (АТСС® CRL-7782™) после трансфекции этих клеток ДНК-вектором VTvaf17- ANGPT1, несущим ген ANGPT1 человека, как описано в Примере 13.
Для оценки изменения количества белка ангиопоэтина 1, использовали клетки фибробластов кожи человека НТ 297.Т, которые выращивали по примеру 13.
Количественное определение продукта кДНК гена ANGPT1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор ANGPT1 Human ELISA Kit (Abeam, США) согласно методике производителя https://www.abcam.com/ps/products/99/ab99972/documents/ab99972 А nqiopoietin%201%20(ANG1)%20Human%20ELISA_Kit%20v%204%20(website).pdf.
Оптическая плотность образцов измерялась при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness TechNology Inc., США) и пропорциональна концентрации белка ANGPT1 в пробе. Численное значение концентрации определяется с помощью калибровочной кривой, построенной по калибраторам с известной концентрацией белка ANGPT1, входящим в состав набора. Разница между значениями оптической плотности (ОП) калибраторов поставленных в трех повторностях не превышала 10%.
Статистическую обработку полученных результатов, осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/).
Диаграмма, полученная в результате анализа представлена на фиг. 14, из которой следует, что трансфекция клеток первичной культуры фибробластов кожи человека НТ 297.Т генотерапевтическим ДНК-вектором VTvaf17-ANGPT1, несущим ген ANGPT1, приводит к увеличению количества белка ангиопоэтинапо сравнению с контрольными образцами, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-ANGPT1 и подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген ANGPT1 науровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-ANGPT1 для повышения уровня экспрессии ANGPT1 в эукариотических клетках.
Пример 25.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17- VEGFA, несущего целевой ген, а именно, ген VEGFA и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- VEGFA, несущего целевой ген, а именно, ген VEGFA и реализуемости способа его использования оценивали изменение количества белка фактора роста эндотелия сосудов в культуральной среде клеток первичной культуры фибробластов крайней плоти Hs27 (АТСС® CRL-1634™) после трансфекции этих клеток ДНК-вектором VTvaf17- VEGFA, несущим ген VEGFA человека, как описано в Примере 14.
Для оценки изменения количества белка фактора роста эндотелия сосудов, использовали клетки первичной культуры фибробластов крайней плоти Hs27 (АТСС® CRL-1634™), которые выращивали по примеру 14.
Количественное определение продукта кДНК гена VEGFA проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор VEGFA Human ELISA Kit (Abeam, США) согласно методике производителя https://www.abcam.com/ps/products/119/ab19566/documents/ab119566%20-%20VEGFA%20Human%20ELISA%20Kit%20v5%20(website).pdf. Оптическая плотность образцов измерялась при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (AwarenessTechNology Inc., США) и пропорциональна концентрации белка VEGFA в пробе. Численное значение концентрации определяется с помощью калибровочной кривой, построенной по калибраторам с известной концентрацией белка VEGFA, входящим в состав набора. Разница между значениями оптической плотности (ОП) калибраторов поставленных в трех повторностях не превышала 10%.
Статистическую обработку полученных результатов, осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/).
Диаграмма, полученная в результате анализа представлена на фиг. 15, из которой следует, что трансфекция клеток первичной культуры фибробластов крайней плоти Hs27 генотерапевтическим ДНК-вектором VTvaf17-VEGFA, несущим ген VEGFA, приводит к увеличению количества белка фактора роста эндотелия сосудов по сравнению с контрольными образцами, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-VEGFA и подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген VEGFA на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-VEGFA для повышения уровня экспрессии VEGFA в эукариотических клетках.
Пример 26.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17- FGF1, несущего целевой ген, а именно, ген FGF1 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- FGF1, несущего целевой ген, а именно, ген FGF1 и реализуемости способа его использования оценивали изменение количества белка фактора роста фибробластов 1 в культуральной среде клеток первичной культуры скелетных миобластов HSkM человека (А12555, Thermo Fisher Scientific) после трансфекции этих клеток ДНК-вектором VTvaf17- FGF1, несущим ген FGF1 человека, как описано в Примере 15.
Для оценки изменения количества белка фактора роста фибробластов 1, использовали клетки скелетных миобластов HSkM человека (А12555, Thermo Fisher Scientific),которые выращивали по примеру 15.
Количественное определение продукта кДНК гена FGF1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор FGF1 Human ELISA Kit (Abeam, США) согласно методике производителя https://www.abcam.com/ps/products/219/ab219636/documents/ab219636_Hu%20FGF1_31%20Mar%202017%20(website).pdf. Оптическая плотность образцов измерялась при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness TechNologylnc, США) и пропорциональна концентрации белка FGF1 в пробе. Численное значение концентрации определяется с помощью калибровочной кривой, построенной по калибраторам с известной концентрацией белка FGF1, входящим в состав набора. Разница между значениями оптической плотности (ОП) калибраторов поставленных в трех повторностях не превышала 10%.
Статистическую обработку полученных результатов, осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/).
Диаграмма, полученная в результате анализа представлена на фиг. 16, из которой следует, что трансфекция клеток первичной культуры скелетных миобластов HSkM человека генотерапевтическим ДНК-вектором VTvaf17-FGF1, несущим ген FGF1, приводит к увеличению количества белка фактора роста фибробластов 1 по сравнению с контрольными образцами, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-FGF1 и подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген FGF1 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-FGF1 для повышения уровня экспрессии FGF1 в эукариотических клетках.
Пример 27.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17- HIF1α, несущего целевой ген, а именно, ген HIF1α и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- HIF1α, несущего целевой ген, а именно, ген HIF1α и реализуемости способа его использования оценивали изменение количества белка гипоксией индуцированного фактора альфа в культуральной среде клеток первичной культуры гладкомышечных клеток мочевого пузыря HBdSMc человека (АТСС® PCS-420-012™) после трансфекции этих клеток ДНК-вектором VTvaf17- HIF1a, несущим ген HIF1α человека, как описано в Примере 16.
Для оценки изменения количества белка гипоксией индуцированного фактора альфа, использовали клетки первичной культуры гладкомышечных клеток мочевого пузыря HBdSMc человека, которые выращивали по примеру 16.
Количественное определение продукта кДНК гена HIF1α проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human HIF1alpha ELISA Kit (Abcam, США) согласно методике производителя https://www.abcam.com/ps/products/171/ab171577/documents/ab171577_HIF1a_20180116_ACW%20(website).pdf.
Оптическая плотность образцов измерялась при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness TechNology Inc., США) и пропорциональна концентрации белка HIF1α в пробе. Численное значение концентрации определяется с помощью калибровочной кривой, построенной по калибраторам с известной концентрацией белка HIF1α, входящим в состав набора. Разница между значениями оптической плотности (ОП) калибраторов поставленных в трех повторностях не превышала 10%.
Статистическую обработку полученных результатов, осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/).
Диаграмма, полученная в результате анализа представлена на фиг. 17, из которой следует, что трансфекция клеток первичной культуры гладкомышечных клеток мочевого пузыря HBdSMc человека генотерапевтическим ДНК-вектором VTvaf17- HIF1α, несущим ген HIF1α, приводит к увеличению количества белка гипоксией индуцированного фактораальфа по сравнению с контрольными образцами, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-HIF1α и подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген HIF1α на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17- HIF1α для повышения уровня экспрессии HIF1α в эукариотических клетках.
Пример 28.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17- HGF, несущего целевой ген, а именно, ген HGF и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17- HGF, несущего целевой ген, а именно, ген HGF и реализуемости способа его использования оценивали изменение количества белка фактора роста гепатоцитов в культуральной среде гладкомышечных клеток аорты T/G HA-VSMC (АТСС® CRL-1999™) после трансфекции этих клеток ДНК-вектором VTvaf17- HGF, несущим ген HGF человека, как описано в Примере 17.
Для оценки изменения количества белка фактора роста гепатоцитов, использовали клетки первичной культуры гладкомышечных клеток аорты T/G HA-VSMC, которые выращивали по примеру 17.
Количественное определение продукта кДНК гена HGF проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human HGF ELISA Kit (Abeam, США) согласно методике производителя https://www.abcam.com/ps/products/100/ab100534/documents/ab100534%20HGF%20Human%20ELISA_Kit%20v3%20(website).pdf.
Оптическая плотность образцов измерялась при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness TechNology Inc., США) и пропорциональна концентрации белка HGF в пробе. Численное значение концентрации определяется с помощью калибровочной кривой, построенной по калибраторам с известной концентрацией белка HGF, входящим в состав набора. Разница между значениями оптической плотности (ОП) калибраторов поставленных в трех повторностях не превышала 10%.
Статистическую обработку полученных результатов, осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/).
Диаграмма, полученная в результате анализа представлена на фиг. 18, из которой следует, что трансфекция клеток первичной культуры гладкомышечных клеток аорты T/G HA-VSMC генотерапевтическим ДНК-вектором VTvaf17-HGF, несущим ген HGF, приводит к увеличению количества белка фактора роста гепатоцитов по сравнению с контрольными образцами, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-HGF и подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген HGF на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-HGF для повышения уровня экспрессии HGF в эукариотических клетках.
Пример 29.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-SDF1, несущего целевой ген, а именно, ген SDF1 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-SDF1, несущего целевой ген, а именно, ген SDF1 и реализуемости способа его использования оценивали изменение количества белка фактора стромальных клеток 1 в культуральной среде клеток первичной культуры кератиноцитов эпидермиса HEKa (АТСС® PCS-200-011™) после трансфекции этих клеток ДНК-вектором VTvaf17-SDF1, несущим ген SDF1 человека, как описано в Примере 18.
Для оценки изменения количества белка фактора стромальных клеток 1, использовали клетки первичной культуры кератиноцитов эпидермиса HEKa, которые выращивали по примеру 18.
Количественное определение продукта кДНК гена SDF1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human SDF1 ELISA Kit (Abcam, США) согласно методике производителя https://www.abcam.com/ps/products/100/ab100637/documents/ab100637%20SDF1%20alpha%20Human%20ELISA_Kit%20v4%20(website).pdf.
Оптическая плотность образцов измерялась при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness TechNology Inc., США) и пропорциональна концентрации белка SDF1 в пробе. Численное значение концентрации определяется с помощью калибровочной кривой, построенной по калибраторам с известной концентрацией белка SDF1, входящим в состав набора. Разница между значениями оптической плотности (ОП) калибраторов поставленных в трех повторностях не превышала 10%.
Статистическую обработку полученных результатов, осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/).
Диаграмма, полученная в результате анализа представлена на фиг. 19, из которой следует, что трансфекция клеток первичной культуры кератиноцитов эпидермиса HEKa генотерапевтическим ДНК-вектором VTvaf17-SDF1, несущим ген SDF1, приводит к увеличению количества белка фактора стромальных клеток 1 по сравнению с контрольными образцами, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-SDF1 и подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген SDF1 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-SDF1 для повышения уровня экспрессии SDF1 в эукариотических клетках.
Пример 30.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-KLK4, несущего целевой ген, а именно, ген KLK4 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-KLK4, несущего целевой ген, а именно, ген KLK4 и реализуемости способа его использования оценивали изменение количества белка калликреина в культуральной среде клеток первичной культуры эндотелия пупочной вены HUVEC (АТСС® PCS-100-010™) после трансфекции этих клеток ДНК-вектором VTvaf17-KLK4, несущим ген KLK4 человека, как описано в Примере 19.
Для оценки изменения количества белка калликреина, использовали клетки первичной культуры эндотелия пупочной вены HUVEC, которые выращивали по примеру 19.
Количественное определение продукта кДНК гена KLK4 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human kallikrein-related peptidase 4 (KLK4) ELISA Kit (MyBioSource, США) согласно методике производителя https://www.mybiosource.com/prods/ELISA-Kit/Human/kallikrein-related-peptidase-4/KLK4/datasheet.php?products_id=917102.
Оптическая плотность образцов измерялась при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness TechNology Inc., США) и пропорциональна концентрации белка KLK4 в пробе. Численное значение концентрации определяется с помощью калибровочной кривой, построенной по калибраторам с известной концентрацией белка KLK4, входящим в состав набора. Разница между значениями оптической плотности (ОП) калибраторов поставленных в трех повторностях не превышала 10%.
Статистическую обработку полученных результатов, осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/).
Диаграмма, полученная в результате анализа представлена на фиг. 20, из которой следует, что трансфекция клеток первичной культуры эндотелия пупочной вены HUVEC генотерапевтическим ДНК-вектором VTvaf17-KLK4, несущим ген KLK4, приводит к увеличению количества белка калликреина по сравнению с контрольными образцами, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-KLK4 и подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген KLK4 науровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-KLK4 для повышения уровня экспрессии KLK4 в эукариотических клетках.
Пример 31.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-PDGFC, несущего целевой ген, а именно, ген PDFGC и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-PDFGC, несущего целевой ген, а именно, ген PDGFC и реализуемости способа его использования оценивали изменение количества белка фактора роста тромбоцитов С в культуральной среде клеток первичной культуры меланоцитов эпидермиса НЕМа (АТСС® PCS-200-013™) после трансфекции этих клеток ДНК-вектором VTvaf17-PDGFC, несущим ген PDFGC человека, как описано в Примере 20.
Для оценки изменения количества белка фактора роста тромбоцитов С, использовали клетки первичной культуры меланоцитов эпидермиса НЕМа (АТСС® PCS-200-013™), которые выращивали по примеру 20.
Количественное определение продукта кДНК гена PDGFC проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human PDGFC ELISA Kit (MyBioSource, США) согласно методике производителя https://www.mybiosource.com/prods/ELISA-Kit/Human/PDGFC/datasheet.php?products_id=2501938.
Оптическая плотность образцов измерялась при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness TechNology Inc., США) и пропорциональна концентрации белка PDGFC в пробе.
Численное значение концентрации определяется с помощью калибровочной кривой, построенной по калибраторам с известной концентрацией белка с детекцией оптической плотности при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка PDGFC, входящим в состав набора. Разница между значениями оптической плотности (ОП) калибраторов поставленных в трех повторностях не превышала 10%.
Статистическую обработку полученных результатов, осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/).
Диаграмма, полученная в результате анализа представлена на фиг. 21, из которой следует, что трансфекция клеток первичной культуры меланоцитов эпидермиса НЕМа (АТСС® PCS-200-013™) генотерапевтическим ДНК-вектором VTvaf17-PDGFC, несущим ген PDGFC, приводит к увеличению количества белка фактора роста тромбоцитов С по сравнению с контрольными образцами, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-PDGFC и подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген PDGFC на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-PDGFC для повышения уровня экспрессии PDGFC в эукариотических клетках.
Пример 32.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-PROK1, несущего целевой ген, а именно, ген PROK1 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-PROK1, несущего целевой ген, а именно, ген PROK1, и реализуемости способа его использования оценивали изменение количества белка прокинетицина-1 в культуральной среде клеток первичной культуры скелетных миобластов HSkM человека (А12555, Thermo Fisher Scientific) после трансфекции этих клеток ДНК-вектором VTvaf17-PROK1, несущим ген PROK1 человека, как описано в Примере 21.
Для оценки изменения количества белка прокинетицина-1, использовали клетки скелетных миобластов HSkM человека (А12555, Thermo Fisher Scientific), которые выращивали по примеру 21.
Количественное определение продукта кДНК гена PROK1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор PROK1 elisa kit: Human EG-VEGF ELISA Kit (MyBioSource, США) согласно методике производителя https://www.mybiosource.com/images/tds/protocol_manuals/000000-799999/MBS175861.pdf Оптическая плотность образцов измерялась при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness TechNology Inc., США) и пропорциональна концентрации белка PROK1 в пробе. Численное значение концентрации определяется с помощью калибровочной кривой, построенной по калибраторам с известной концентрацией белка PROK1, входящим в состав набора. Разница между значениями оптической плотности (ОП) калибраторов поставленных в трех повторностях не превышала 10%.
Статистическую обработку полученных результатов, осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/).
Диаграмма, полученная в результате анализа представлена на фиг. 22, из которой следует, что трансфекция клеток первичной культуры скелетных миобластов HSkM человека генотерапевтическим ДНК-вектором VTvaf17-PROK1, несущим ген PROK1, приводит к увеличению количества белка прокинетицина-1 по сравнению с контрольными образцами, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-PROK1 и подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген PROK1 науровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-PROK1 для повышения уровня экспрессии PROK1 в эукариотических клетках.
Пример 33.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-PROK2, несущего целевой ген, а именно, ген PROK2 и реализуемости способа его использования.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-PROK2, несущего целевой ген, а именно, ген PROK2, и реализуемости способа его использования оценивали изменение количества белка прокинетицина-2 в культуральной среде клеток эндотелия капилляров кожи НМЕС-1 (АТСС® CRL-3243™) после трансфекции этих клеток ДНК-вектором VTvaf17-PROK2, несущим ген PROK2 человека, как описано в Примере 22.
Для оценки изменения количества белка прокинетицина-2, использовали первичную культуру клеток эндотелия капилляров кожи НМЕС-1 (АТСС® CRL-3243™), которые выращивали по примеру 22.
Количественное определение продукта кДНК гена PROK2 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human Prokineticin-2, PROK2 ELISA Kit (MyBioSource, США) согласно методике производителя https://www.mybiosource.com/images/tds/protocol_manuals/800000-9999999/MBS940962.pdf Оптическая плотность образцов измерялась при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness TechNology Inc., США) и пропорциональна концентрации белка PROK2 в пробе. Численное значение концентрации определяется с помощью калибровочной кривой, построенной по калибраторам с известной концентрацией белка PROK2, входящим в состав набора. Разница между значениями оптической плотности (ОП) калибраторов поставленных в трех повторностях не превышала 10%.
Статистическую обработку полученных результатов, осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/).
Диаграмма, полученная в результате анализа представлена на фиг. 23, из которой следует, что трансфекция клеток эндотелия капилляров кожи НМЕС-1 (АТСС® CRL-3243™) человека генотерапевтическим ДНК-вектором VTvaf17-PROK2, несущим ген PROK2, приводит к увеличению количества белка прокинетицина-2 по сравнению с контрольными образцами, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-PROK2 и подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген PROK2 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-PROK2 для повышения уровня экспрессии PROK2 в эукариотических клетках.
Пример 34.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-ANG, несущего ген ANG, для повышения экспрессии белка ANG в органах человека.
С целью анализа изменения количества белка ангиогенина трем пациентам вводили в кожу предплечья генотерапевтический ДНК-вектор VTvaf17-ANG, несущий ген ANG и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий ген ANG.
Пациент 1, мужчина 64 лет, (П1); пациент 2, женщина 66 лет, (П2); пациент 3, мужчина, 62 года, (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Генотерапевтический ДНК-вектор VTvaf17-ANG, который содержит ген ANG и генотерапевтический ДНК-вектор VTvaf17, используемый в качестве плацебо, растворяли в стерильной воде степени очистки Nuclease-Free. Комплексы ДНК- cGMP grade in-vivo-jetPEI готовили в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-ANG вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину 3 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-ANG - 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагались на участке предплечья на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков кожи пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-ANG, несущего ген ANG (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактных участков кожи (III), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl pH 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка ангиогенина методом твердофазного иммуноферментного анализа (ELISA), используя набор ANG Human ELISA Kit (Abeam, США), как описано в Примере 23 с детекцией оптической плотности при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка ангиогенина, входящим в состав набора. Диаграммы, полученные в результате анализа представлены на фиг. 24.
Из фигуры 24 следует, что в коже всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17-ANG, несущего целевой ген ANG человека, произошло увеличение количества белка ангиогенина в сравнении с количеством белкаангиогенина в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего ген ANG человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-ANG и подтверждает реализуемость способа его применения, в частности при введении генотерапевтического ДНК-вектора в органы человека.
Пример 35.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-ANGPT1, несущего ген ANGPT1 и реализуемости способа его применения для повышения уровня экспрессии белка ангиопоэтина в органах человека путем введения аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-ANGPT1.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-ANGPT1, несущего ген ANGPT1 и реализуемости способа его применения оценивали изменения количества белка ангиопоэтина в коже человека при введении в кожу пациента культуры аутологичных фибробластов этого пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-ANGPT1.
Пациенту вводили в кожу предплечья соответствующую культуру аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-ANGPT1, несущим ген ANGPT1, и параллельно вводили плацебо, представляющее собой культуру аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим ген ANGPT1.
Первичную культуру фибробластов человека выделяли из биоптатов кожи пациента. Используя устройство для взятия биопсии кожи Epitheasy 3.5 (Medax SRL, Италия) брали образец биоптата кожи из зоны, защищенной от действия ультрафиолета, а именно за ушной раковиной или с боковой внутренней поверхности в зоне локтевого сустава, размером около 10 кв. мм, массой - около 11 мг. Кожу пациента предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Культивирование первичной культуры клеток осуществляли при 37°С в атмосфере, содержащей 5% CO2 в среде DMEM с 10% фетальной телячьей сывороткой и ампициллином 100 Ед/мл. Пересев культуры и смену культуральной среды осуществляли каждые 2 дня. Общая продолжительность роста культуры не превышала 25-30 дней. Из культуры клеток отбирали аликвоту, содержащую 5×104 клеток. Культуру фибробластов пациента трансфицировали генотерапевтическим ДНК-вектором VTvaf17-ANGPT1, несущим ген ANGPT1 или плацебо - вектор VTvaf17, не несущий целевой ген ANGPT1.
Трансфекцию осуществляли с помощью катионного полимера полиэтиленимина JETPEI (Polyplus transfection, Франция), согласно инструкции фирмы-производителя. Клетки культивировали 72 часа и затем вводили пациенту. Введение пациенту культуры аутологичных фибробластов этого пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-ANGPT1, и плацебо, представляющее собой культуру аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, осуществляли туннельным методом в область предплечья иглой 30G длиной 13 мм на глубину около 3 мм. Концентрация модифицированных аутологичных фибробластов в вводимой суспензии составляла примерно 5 млн клеток на 1 мл суспензии, количество вводимых клеток не превышало 15 млн. Очаги введения культуры аутологичных фибробластов располагались на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 4-е сутки после введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-ANGPT1, несущим целевой ген, а именно, ген ANGPT1 и плацебо. Взятие биопсии осуществляли из участков кожи пациента в зоне введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-ANGPT1, несущим целевой ген ANGPT1 (С), культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген ANGPT1 (плацебо) (В), а также из участков интактной кожи (А), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия) и далее проводили манипуляции с полученными образцами по примеру 34.
Количество белка ангиопоэтина оценивали в супернатантах биоптатов кожи пациентов методом твердофазного иммуноферментного анализа (ИФА ELISA), используя набор ANGPT1 Human ELISA Kit (Abcam, США) согласно методике производителя (см. Пример 24) с детекцией оптической плотности при длине волны 450 нм при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка ангиопоэтина, входящим в состав набора. Диаграммы, полученные в результате анализа, представлены на фиг. 25.
Из фигуры 25 следует, что в коже пациента в области введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-ANGPT1, несущим ген ANGPT1, произошло увеличение количества белка ангиопоэтина в сравнении с количеством того же белка в области введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим ген ANGPT1 (плацебо), что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-ANGPT1 и подтверждает реализуемость способа его применения для повышения уровня экспрессии ANGPT1 в органах человека, в частности при введении в кожу аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-ANGPT1.
Пример 36.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-SDF1, несущего ген SDF1, для повышения экспрессии белка фактора стромальных клеток в тканях человека.
С целью анализа уровня экспрессии целевого гена SDF1 пациенту вводили генотерапевтический ДНК-вектор VTvaf17-SDF1 и параллельно вводили плацебо, представляющее собой векторную плазмиду VTvaf17 не содержащую кДНК гена SDF1 - в мышечную ткань в зоне предплечья.
В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Генотерапевтический ДНК-вектор VTvaf17-SDF1, который содержит ген SDF1 и генотерапевтический ДНК-вектор VTvaf17, используемый в качестве плацебо, растворяли в стерильной воде степени очистки Nuclease-Free. Комплексы ДНК-cGMP grade in-vivo-jetPEI готовили в соответствии с рекомендациями производителя.
Полученные комплексы использовали для введения пациенту. Введение осуществляли тоннельным методом иглой 30G на глубину 15-20 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17-SDF1 и плацебо - около 0,5 мл для каждого. Очаги введения ДНК-вектора и плацебо располагались на расстоянии 5-7 см друг от друга.
Биопсийные образцы брали на 3 сутки после введения генно-терапевтической субстанции. Взятие биопсии осуществляли из участков мышечной ткани в зоне введения генотерапевтического ДНК-вектора VTvaf17-SDF1 (П1I), а также из интактных участков мышцы (П1III) и в зоне введения плацебо (П1II), используя автоматическое устройство для взятия биопсии MAGNUM (компания BARD, USA), далее проводили манипуляции с полученными образцами по примеру 34.
Количественную оценку белка фактора стромальных клеток проводили в лизатах биоптатов мышечной ткани пациента методом твердофазного иммуноферментного анализа (ИФА ELISA), используя набор Human SDF1 ELISA Kit (Abeam, США), как описано в Примере 29.
Диаграммы, полученные в результате анализа, представлены на фиг. 26.
Показано, что, в мышечной ткани пациента в области введения генотерапевтического ДНК-вектора VTvaf17-SDF1 с кДНК гена SDF1, произошло увеличение соответствующего белка фактора стромальных клеток. Тогда как при введении плацебо количество белка фактора стромальных клеток в мышечной ткани не изменялась, что подтверждает увеличение экспрессии гена SDF1 при использовании генотерапевтического ДНК-вектора VTvaf17-SDF1. Это также свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-SDF1 и подтверждает реализуемость способа его применения, в частности при введении генотерапевтического ДНК-вектора в ткани человека.
Пример 37.
Подтверждение эффективности и реализуемости способа сочетанного применения генотерапевтического ДНК-вектора VTvaf17-ANG, несущего целевой ген ANG, генотерапевтического ДНК-вектора VTvaf17-VEGFA, несущего целевой ген VEGFA, генотерапевтического ДНК-вектора VTvaf17-FGF1, несущего целевой ген FGF1, генотерапевтического ДНК-вектора VTvaf17-PROK1, несущего целевой ген PROK1 для повышения уровня экспрессии белков ANG, VEGFA, FGF1PROK1 в органах\тканях млекопитающих.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-ANG, несущего целевой ген ANG, генотерапевтического ДНК-вектора VTvaf17-VEGFA, несущего целевой ген VEGFA, генотерапевтического ДНК-вектора VTvaf17-FGF1, несущего целевой ген FGF1, генотерапевтического ДНК-вектора VTvaf17-PROK1, несущего целевой ген PROK1 и реализуемости способа сочетанного применения данных векторов оценивали изменение количества белков : белка ангиогенина, белка фактора роста эндотелия сосудов А, белка фактора роста фибробластов 1, прокинетицина-1 соответственно в зонах внутрикожных инъекций крысыВистар (самцы, в возрасте 22-24 недель).
Была приготовлена смесь генотерапевтических ДНК-векторовв соотношении 1:1:1:1 (по массе) из лиофилизата ДНК-векторов VTvaf17-ANG, VTvaf17-VEGFA, VTvaf17-FGF1, VTvaf17-PROK1 путем растворения в стерильной воде степени очистки Nuclease-Free. В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Комплексы ДНК-cGMP grade in-vivo-jetPEI готовили в соответствии с рекомендациями производителя.
Было сформировано 3 группы животных по 11 особей в каждой. Всем животным под анестезией были сделаны внутрикожные инъекции:
в 1-й группе (KI) смесью генотерапевтических ДНК-векторов VTvaf17-ANG, VTvaf17-VEGFA, VTvaf17-FGF1, VTvaf17-PROK1 в объеме 150 мкл. (концентрация каждого генотерапевтического ДНК-вектора 1 мкг/мкл),
во 2-й группе (KII) - раствором ДНК-вектора VTvaf17 в объеме 150 мкл, с концентрацией ДНК-вектора 1 мкг/мкл, (плацебо),
в 3-й группе (KIII) - физраствором в объеме 150 мкл.
Биопсийные образцы отбирали через 72 часа после введения смеси генотерапевтических ДНК-векторов и плацебо. Взятие биопсии осуществлял и после некропсии животных из участков инъекций в зоне введения смеси четырех генотерапевтических ДНК-векторов, несущих целевые гены ANG VEGFA, FGF1, PPOK1 (1-й группы), в зоне введения раствора ДНК-вектора VTvaf17 (2-й группы), в зоне введения физраствора (3-й группы).Масса каждого биопсийного образца составляла около 20 мг. Далее проводили манипуляции с полученными образцами по примеру 34.
Количественное определение продуктов генов ANG VEGFA, FGF1, PROK1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя Наборы ANGHumanELISAKit (Abcam, США), VEGFAHumanELISAKit (Abcam, США), FGF1 HumanELISAKit (Abcam, США), PROK1 elisa kit: Human EG-VEGF ELISA Kit (MyBioSource, США). Подготовку тестируемых образцов, измерение и обработку результатов проводили как описано в Примерах 23, 25, 26, 32.
Диаграммы, полученные в результате анализа представлены на фиг. 27, на которой показано, что в зоне инъекций в коже у животных в области введения смеси четырех генотерапевтических ДНК-векторов: VTvaf17-ANG, VTvaf17-VEGFA, VTvaf17-FGF1, VTvaf17-PROK1 в 1-й группе животных произошло существенное увеличение количества белков: белка ангиогенина, белка фактора роста эндотелия сосудов А, белка фактора роста фибробластов 1, белка прокинетицина-1 в сравнении соответственно с количеством белков-белка ангиогенина, белка фактора роста эндотелия сосудов А, белка фактора роста фибробластов 1, белка прокинетицина-1 во 2-й и 3-й группе.
Приведенные результаты подтверждают реализуемость способа применения генотерапевтических ДНК-векторов VTvaf17-ANG, VTvaf17-VEGFA, VTvaf17-FGF1, VTvaf17-PROK1 и эффективность их использования для повышения уровня экспрессии белков-белка ангиогенина, белка фактора роста эндотелия сосудов А, белка фактора роста фибробластов 1, белка прокинетицина-1 в органах\тканях млекопитающих.
Пример 38.
Подтверждение эффективности и реализуемости способа сочетанного применения генотерапевтического ДНК-вектора VTvaf17-ANG, несущего целевой ген ANG, генотерапевтического ДНК-вектора VTvaf17-HIF1α, несущего целевой ген HIF1α, генотерапевтического ДНК-вектора VTvaf17-PDGFC, несущего целевой ген PDGFC, генотерапевтического ДНК-вектора VTvaf17-PROK2, несущего целевой ген PROK2 для повышения уровня экспрессии белков ANG, HIF1α, PDGFC, PROK2 в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-ANG, несущего целевой ген ANG, генотерапевтического ДНК-вектора VTvaf17-HIF1α, несущего целевой ген HIF1α, генотерапевтического ДНК-вектора VTvaf17-PDGFC, несущего целевой ген PDGFC, генотерапевтического ДНК-вектора VTvaf17-PROK2, несущего целевой ген PROK2 и реализуемости способа сочетанного применения данных векторов оценивали изменение количества белков: белка ангиогенина, белка гипоксией индуцированного фактора, белка фактора роста тромбоцитов С, белка прокинетицина-2 соответственно в мышечной ткани в зоне предплечья пациента.
Была приготовлена смесь генотерапевтических ДНК-векторов в соотношении 1:1:1:1 (по массе) из лиофилизата ДНК-векторов VTvaf17-ANG, VTvaf17-HIF1α, VTvaf17-PDGFC, VTvaf17-PROK2 путем растворения в стерильной воде степени очистки Nuclease-Free. Концентрация ДНК-векторов в смеси составляла 1 мг/мл. В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Комплексы ДНК- cGMP grade in-vivo-jetPEI готовили в соответствии с рекомендациями производителя. Раствор генотерапевтического ДНК-вектора VTvaf17 в концентрации 1 мг/мл был использован в качестве плацебо.
Полученную смесь ДНК векторов VTvaf17-ANG, VTvaf17-HIF1α, VTvaf17-PDGFC, VTvaf17-PROK2 и плацебо использовали для введения пациенту, которое осуществляли тоннельным методом иглой 30G на глубину 15-20 мм. Объем вводимого раствора смеси ДНК-векторов и плацебо - около 0,6 мл для каждого. Очаги введения смеси ДНК-векторов и плацебо располагались на расстоянии 7-8 см друг от друга.
Биопсийные образцы брали на 3 сутки после введения смеси ДНК-векторов и плацебо. Взятие биопсии осуществляли из участков мышечной ткани в зоне введения смеси ДНК векторов VTvaf17-ANG, VTvaf17-HIF1α, VTvaf17-PDGFC, VTvaf17-PROK2 (П1I), a также из интактных участков мышцы (П1III) и в зоне введения плацебо (П1II), используя автоматическое устройство для взятия биопсии MAGNUM (компания BARD, USA), далее проводили манипуляции с полученными образцами по примеру 34.
Количественное определение продуктов генов ANG, HIF1α, PDGFC, PROK2 проводили методом твердофазного иммуноферментного анализа (ELISA), используя наборы ANG Human ELISA Kit (Abeam, США), Human HIF1 alpha ELISA Kit (Abcam, США), Human PDGFC ELISA Kit (MyBioSource, США), Human Prokineticin-2, PROK2 ELISA Kit (MyBioSource, США). Измерение и обработку результатов проводили как описано в Примерах 23, 27, 31, 33.
Диаграммы, полученные в результате анализа представлены на фиг. 28, на которой показано, что в зоне инъекции в области введения смеси четырех генотерапевтических ДНК-векторов: VTvaf17-ANG, VTvaf17-HIF1α, VTvaf17-PDGFC, VTvaf17-PROK2 в произошло существенное увеличение количества белков: белка ангиогенина, белка гипоксией индуцированного фактора, белка фактора роста тромбоцитов С, белка прокинетицина-2 в сравнении соответственно с количеством данных белков в зоне инъекции в области введения плацебо ДНК-вектора VTvaf17.
Приведенные результаты подтверждают реализуемость способа применения генотерапевтических ДНК-векторов VTvaf17-ANG, VTvaf17-HIF1α, VTvaf17-PDGFC, VTvaf17-PROK2 и эффективность их использования для повышения уровня экспрессии белков - белка ангиогенина, белка гипоксией индуцированного фактора, белка фактора роста тромбоцитов С, белка прокинетицина-2 в тканях человека.
Пример 39.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-HGF, несущего ген HGF и реализуемости способа его применения для повышения уровня экспрессии белка HGF в клетках млекопитающих.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-HGF, несущего ген HGF оценивали изменение накопления мРНК целевого гена HGF в клетках в клетках гладкой мускулатуры аорты быка BAOSMC (Genlantis) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-HGF, несущим ген HGF человека по сравнению с контрольными клетками BEND, трансфицированными генотерапевтическим ДНК-вектором VTvaf17, не несущим ген HGF человека (плацебо).
Культуру клеток гладкой мускулатуры аорты быка BAOSMC (Genlantis) выращивали в среде Bovine Smooth Muscle Cell Growth Mediumm (Sigma B311F-500) с добавлением сыворотки рогатого скота до 10% (Панэко, Россия). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-HGF, несущим ген HGF человека и ДНК-вектором VTvaf17, не несущим ген HGF человека (контроль), выделение РНК, реакцию обратной транскрипции, ПЦР амплификацию и анализ данных проводили как описано в примере 17. В качестве референтного гена использовали ген актина быка/ коровы (ACT), приведенного в базе данных GenBank под номером АН001130.2. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности генов HGF и ACT. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов HGF и ACT, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1. (Bio-Rad, USA).
Графики, полученные в результате анализа представлены на фиг. 29.
Из фигуры 29 следует, что в результате трансфекции клеток гладкой мускулатуры аорты быка BAOSMC генотерапевтическим ДНК-вектором VTvaf17-HGF, уровень специфической мРНК гена HGF человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген HGF на уровне мРНК. Представленные результаты подтверждают реализуемость способа применения генотерапевтическим ДНК-вектором VTvaf17-HGF для повышения уровня экспрессии гена HGF в клетках млекопитающих.
Пример 40.
Штамм Escherichia coli SCS110-AF/VTvaf17-ANG или Escherichia coli SCS110-AFA/Tvaf17-ANGPT1 или Escherichia coli SCS110-AF/VTvaf17-VEGFA или Escherichia coli SCS110-AFA/Tvaf17-FGF1, или Escherichia coli SCS110-AF/VTvaf17-HIF1α или Escherichia coli SCS110-AFA/Tvaf17-HGF или Escherichia coli SCS110-AF/VTvaf17-SDF1, или Escherichia coli SCS110-AF/VTvaf17-KLK4 или Escherichia coli SCS110-AFA/Tvaf17-PDGFC, или Escherichia coli SCS110-AF/VTvaf17-PROK1 или Escherichia coli SCS110-AF/VTvaf17-PROK2 несущий генотерапевтический ДНК-вектор, способ его получения.
Конструирование штамма для наработки в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген ANG, или ANGPT1, или VEGFA, или FGF1, или HIF1A, или HGF, или SDF1, или KLK4, или PDGFC или PROK1, или PROK2: а именно штамма EscherichiacoliSCS110-AF/VTvaf17-ANG или штамма EscherichiacoliSCS110-AF/VTvaf17-ANGPT1 или штамма EscherichiacoliSCS110-AF/VTvaf17-VEGFA или штамма EscherichiacoliSCS110-AF/VTvaf17-FGF1, или штамма EscherichiacoliSCS110-AF/VTvaf17-HIF1α или штамма EscherichiacoliSCS110-AF/VTvaf17-HGF или штамма EscherichiacoliSCS110-AF/VTvaf17-SDF1, или штамма EscherichiacoliSCS110-AF/VTvaf17-KLK4 или штамма EscherichiacoliSCS110-AF/VTvaf17-PDGFC, или штамма Escherichia coli SCS110-AF/VTvaf17-PROK1 или штамма Escherichia coli SCS110-AF/VTvaf17-PROK2, несущего генотерапевтический ДНК-вектор VTvaf17-ANG или VTvaf17-ANGPT1 или VTvaf17-VEGFA или VTvaf17-FGF1 или VTvaf17-HIF1α или VTvaf17-HGF или VTvaf17-SDF1, или VTvaf17-KLK4 или VTvaf17-PDGFC или VTvaf17-PROK1, или VTvaf17-PROK2 соответственно для его наработки с возможностью селекции без использования антибиотиков заключается в получении электрокомпетентных клеток штамма EscherichiacoliSCS110-AF с проведением электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-ANG или VTvaf17-ANGPT1 или VTvaf17-VEGFA или VTvaf17-FGF1 или VTvaf17-HIF1α или VTvaf17-HGF или VTvaf17-SDF1, или VTvaf17-KLK4 или VTvaf17-PDGFC или VTvaf17-PROK1 или VTvaf17-PROK2, после чего клетки высеивали на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы, а также 10 мкг/мл хлорамфеникола. При этом штамм Escherichia coliSCS110-AF для наработки генотерапевтического ДНК-вектора VTvaf17 или генотерапевтических ДНК-векторов на его основе с возможностью положительной селекции без использования антибиотиков получали путем конструирования линейного фрагмента ДНК, содержащего регуляторный элемент RNA-in транспозона Tn10 для селекции без применения антибиотиков размером 64 п.н., ген левансахаразы sacB, продукт которого обеспечивает селекцию на сахарозо-содержащей среде размером 1422 п.н., генустойчивости к хлорамфениколу catR, необходимый для отбора клонов штамма, в которых прошла гомологичная рекомбинация размером 763 п.н. и две гомологичные последовательности, обеспечивающие процесс гомологичной рекомбинации в области гена recA с одновременной его инактивацией размером 329 п.н. и 233 п.н., после чего проводили трансформацию клеток Escherichia coli путем электропорации и отбирали клоны, выжившие на среде, содержащей 10 мкг/мл хлорамфеникола. Полученные штаммы для наработки были внесены в коллекции Национального биоресурсного центра - Всероссийская коллекция промышленных микроорганизмов (НБЦ ВКПМ), РФ и NCIMB Patent Deposit Service, UK с присвоением регистрационных номеров: штамм Escherichia coli SCS110-AF/VTvaf17-ANG - регистрационный № ВКПМ В-13280, дата депонирования 16.10.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43297, дата депонирования 13.12.2018; штамм Escherichia coli SCS110-AF/VTvaf17-ANGPT1 - регистрационный № ВКПМ B-13279, дата депонирования 16.10.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43300, дата депонирования 13.12.2018; штамм Escherichia coli SCS110-AF/VTvaf17-VEGFA - регистрационный № ВКПМ B-13344, дата депонирования 22.11.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43289, дата депонирования 22.11.2018; штамм Escherichia coli SCS110-AF/VTvaf17-FGF1 - регистрационный № ВКПМ В-13338, дата депонирования 22.11.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43282, дата депонирования 22.11.2018; штамм Escherichia coli SCS110-AF/VTvaf17-HIF1α - регистрационный № ВКПМ В-13383, дата депонирования 14.12.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43309, дата депонирования 13.12.2018; штамм Escherichia coli SCS110-AF/VTvaf17-HGF - регистрационный № ВКПМ В-13260, дата депонирования 24.10.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43207, дата депонирования 20.09.2018; штамм Escherichia coli SCS110-AF/VTvaf17-SDF1 - регистрационный № ВКПМ В-13342, дата депонирования 22.11.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43287, дата депонирования 22.11.2018; штамм Escherichia coli SCS110-AF/VTvaf17-KLK4 - регистрационный № ВКПМ B-13346, дата депонирования 22.11.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43283, дата депонирования 22.11.2018; штамм Escherichia coli SCS110-AF/VTvaf17-PDGFC - регистрационный № ВКПМ B-13340, дата депонирования 22.11.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43286, дата депонирования 22.11.2018; штамм Escherichia coli SCS110-AF/VTvaf17-PROK1 - регистрационный № ВКПМ B-13254, дата депонирования 24.10.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43209, дата депонирования 20.09.2018; штамм Escherichia coli SCS110-AF/VTvaf17-PROK2-регистрационный № ВКПМ B-13261, дата депонирования 24.10.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43210 дата депонирования 20.09.2018.
Пример 41.
Способ производства в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROM, PROK2.
Для подтверждения технологичности получения и возможности производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-ANG (SEQID №1), или VTvaf17-ANGPT1 (SEQID №2), или VTvaf17-VEGFA (SEQID №3), или VTvaf17-FGF1(SEQID №4), или VTvaf17-HIF1α (SEQ ID №5), или VTvaf17-HGF (SEQ ID №6), или VTvaf17-SDF1 (SEQ ID №7), или VTvaf17-KLK4 (SEQ ID №8), или VTvaf17-PDGFC (SEQ ID №9), VTvaf17-PROK1 (SEQ ID №10), VTvaf17-PROK2 (SEQ ID №11), каждый из которых несет целевой ген, а именно, ANG или ANGPT1 или VEGFA или FGF1 или HIF1α или HGF или SDF1 или KLK4 или PDGFC или PROK1 или PROK2 проводили масштабную ферментацию штамма EscherichiacoliSCS110-AF/VTvaf17-ANG или штамма EscherichiacoliSCS110-AF/VTvaf17-ANGPT1 или штамма EscherichiacoliSCS110-AF/VTvaf17-VEGFA или штамма EscherichiacoliSCS110-AF/VTvaf17-FGF1 или штамма EscherichiacoliSCS110-AF/VTvaf17-HIF1α или штамма EscherichiacoliSCS110-AF/VTvaf17-HGF или штамма EscherichiacoliSCS110-AF/VTvaf17-SDF1 или штамма EscherichiacoliSCS110-AF/VTvaf17-KLK4 или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFC, или штамма Escherichia coli SCS110-AF/VTvaf17-PROK1, или штамма Escherichia coli SCS110-AF/VTvaf17-PROK2, каждый из которых содержит генотерапевтический ДНК-вектор VTvaf17, несущий целевой ген, а именно, ANG или ANGPT1 или VEGFA или FGF1 или HIF1α или HGF или SDF1 или KLK4 или PDGFC или PROK1 или PROK2. Штамм EscherichiacoliSCS110-AF/VTvaf17-ANG или штамм EscherichiacoliSCS110-AF/VTvaf17-ANGPT1 или штамм EscherichiacoliSCS110-AF/VTvaf17-VEGFA или штамм EscherichiacoliSCS110-AF/VTvaf17-FGF1, или штамм EscherichiacoliSCS110-AF/VTvaf17-HIF1α или штамм EscherichiacoliSCS110-AF/VTvaf17-HGF или штамм EscherichiacoliSCS110-AF/VTvaf17-SDF1, или штамм EscherichiacoliSCS110-AF/VTvaf17-KLK4 или штамм EscherichiacoliSCS110-AF/VTvaf17-PDGFC или штамм Escherichia coli SCS110-AF/VTvaf17-PROK1, или штамм Escherichia coli SCS110-AF/VTvaf17-PROK2, получали на базе штамма EscherichiacoliSCS110-AF (CellandGeneTherapyLLC, PITLtd) no примеру 40 путем электропорации компетентных клеток этого штамма генотерапевтическим ДНК-вектором VTvaf17-ANG или VTvaf17-ANGPT1 или VTvaf17-VEGFA или VTvaf17-FGF1 или VTvaf17-HIF1α или VTvaf17-HGF или VTvaf17-SDF1 или VTvaf17-KLK4 или VTvaf17-PDGFC, или VTvaf17-PROK1, или VTvaf17-PROK2, несущим целевой ген, а именно, ANG или ANGPT1 или VEGFA или FGF1 или HIF1α или HGF или SDF1 или KLK4 или PDGFC, или PROK1, или PROK2, с последующим высевом трансформированных клеток на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы и отбором отдельных клонов.
Ферментацию полученного штамма EscherichiacoliSCS110-AF/VTvaf17-ANG, несущего генотерапевтический ДНК-вектор VTvaf17-ANG проводили в ферментере объемом 10 л с последующим выделением генотерапевтического ДНК-вектора VTvaf17-ANG.
Для ферментации штамма EscherichiacoliSCS110-AF/VTvaf17-ANG готовили среду, содержащую на 10 л: 100 г триптон, 50 г дрожжевой экстракт (BectonDickinson), доводили водой до 8800 мл и автоклавировали при 121°С 20 мин, затем добавляли 1200 мл 50% (вес/объем) сахарозы. Далее засевали в колбу затравочную культуру штамма EscherichiacoliSCS110-AF/VTvaf17-ANG в объеме 100 мл. Инкубировали в шейкере-инкубаторе 16 ч при 30°С. Переносили затравочную культуру в ферментер TechforsS (InforsHT, Швейцария), растили до достижения стационарной фазы. Контроль осуществляли измерением оптической плотности культуры при длине волны 600 нм. Клетки осаждали центрифугированием 30 мин при 5000-10000 g. Супернатант удаляли, клеточную массу ресуспендировали в 10% по объему фосфатно-солевого буфера. Повторно центрифугировали 30 мин при 5000-10000g. Супернатант удаляли, к клеточной массе добавляли раствор 20 мМ TrisCl, 1 мМ ЭДТА, 200 г/л сахароза, pH 8,0 в объеме 1000 мл, тщательно перемешивали до образования гомогенной суспензии. Добавляли раствор яичного лизоцима до конечной концентрации 100 мкг/мл. Инкубировали 20 мин на льду при бережном перемешивании. Далее, добавляли 2500 мл раствора 0,2 М NaOH, 10 г/л додецилсульфат натрия, инкубировали 10 мин на льду при бережном перемешивании, затем добавляли 3500 мл раствора 3М ацетат натрия, 2М уксусная кислота, pH 5-5,5, инкубировали 10 мин на льду при бережном перемешивании. Полученный образец центрифугировали 20-30 мин при 15000 g или более. Раствор аккуратно декантировали, от остатков осадка избавлялись фильтрацией через грубый фильтр (фильтровальную бумагу). Добавляли РНКазу A (Sigma) до конечной концентрации 20 нг/мл, инкубировали ночь 16 ч при комнатной температуре. Раствор центрифугировали 20-30 мин при 15000 g, затем фильтровали через мембранный фильтр с порами 0,45 мкм (Millipore). Далее проводили ультрафильтрацию через мембрану размером отсечения 100 кДа (Millipore) и разбавляли до начального объема буфером 25 мМ TrisCl, pH 7.0. Операцию повторяли три - четыре раза. Наносили раствор, на колонку с 250 мл сорбента DEAEsepharoseHP (GE, США), уравновешенную раствором 25 мМ TrisCl, pH 7.0. После нанесения образца колонку промывали тремя объемами этого же раствора, а затем проводили элюцию генотерапевтического ДНК-вектора VTvaf17-ANG линейным градиентом от раствора 25 мМ TrisCl, pH 7.0 до раствора 25 мМ TrisCl, pH 7.0, 1М NaCl в объеме пяти объемов колонки. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм. Хроматографические фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-ANG, объединяли и проводили гель-фильтрацию на сорбенте Superdex 200 (GE, США). Колонку уравновешивали фосфатно-солевым буфером. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм, фракции анализировали электрофорезом в агарозном геле. Фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-ANG объединяли и хранили при -20°С. Для оценки воспроизводимости техпроцесса обозначенные технологические операции повторяли пятикратно. Все технологические операции для штамма Escherichia coli SCS110-AF/VTvaf17-ANGPT1 или штамма Escherichia coli SCS110-AF/VTvaf17-VEGFA или штамма Escherichia coli SCS110-AF/VTvaf17-FGF1, или штамма Escherichia coli SCS110-AF/VTvaf17-HIF1α или штамма Escherichia coli SCS110-AF/VTvaf17-HGF или штамма Escherichia coli SCS110-AF/VTvaf17-SDF1, или штамма Escherichia coli SCS110-AF/VTvaf17-KLK4 или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFC или штамма Escherichia coli SCS110-AF/VTvaf17-PROK1, или штамма Escherichia coli SCS110-AF/VTvaf17-PROK2, проводили аналогичным образом.
Воспроизводимость техпроцесса и количественные характеристики выхода конечного продукта подтверждают технологичность получения и возможность производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17-ANG или VTvaf17-ANGPT1 или VTvaf17-VEGFA или VTvaf17-FGF1 или VTvaf17-HIF1α или VTvaf17-HGF или VTvaf17-SDF1 или VTvaf17-KLK4 или VTvaf17-PDGFC или VTvaf17-PROK1, или VTvaf17-PROK2.
Таким образом, созданный генотерапевтический ДНК-вектор с целевым геном может быть использован для введения в клетки организма животных и человека, характеризующихся сниженной или недостаточной экспрессией данного гена, обеспечивая таким образом достижение терапевтического эффекта.
Задача, поставленная в данном изобретении, а именно: конструирование генотерапевтических ДНК-векторов, несущих целевые гены человека на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с необходимостью повышения уровня экспрессии этих целевых генов оптимально сочетающего в себе:
I) возможность безопасного использования для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора генов антибиотикорезистентности;
II) длину, обеспечивающую эффективное проникновение в клетку-мишень;
III) наличие регуляторных элементов, обеспечивающих эффективную экспрессию целевых генов и, в то же время, не представляющих собой нуклеотидные последовательности вирусных геномов;
IV) технологичность получения и возможность наработки в промышленных масштабах, а также задача по конструированию штаммов, несущих эти генотерапевтические ДНК-вектора для производствав промышленных масштабах этих генотерапевтических ДНК-векторов решена, что подтверждается примерами:
для п. I - пример 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33; 34, 35, 36, 37, 38, 39, 40, 41;
для п. II - пример пример 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33; 34, 35, 36, 37, 38, 39, 40, 41;
для п. III - пример пример 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33; 34, 35, 36, 37, 38, 39, 40, 41;
для п. IV - пример 40, 41.
Промышленная применимость:
Все представленные выше примеры подтверждают промышленную применимость предлагаемого генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2 для повышения уровня экспрессии этих целевых генов, способа его получения и использования, штамма Escherichia coli SCS110-AF/VTvaf17-ANG или штамма Escherichia coli SCS110-AF/VTvaf17-ANGPT1 или штамма Escherichia coli SCS110-AF/VTvaf17-VEGFA или штамма Escherichia coli SCS110-AF/VTvaf17-FGF1, или штамма Escherichia coli SCS110-AF/VTvaf17-HIF1α или штамма Escherichia coli SCS110-AF/VTvaf17-HGF или штамма Escherichia coli SCS110-AF/VTvaf17-SDF1, или штамма Escherichia coli SCS110-AF/VTvaf17-KLK4 или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFC, или штамма Escherichia coli SCS110-AF/VTvaf17-PROK1, или штамма Escherichia coli SCS110-AF/VTvaf17-PROK2, несущего генотерапевтический ДНК-вектор, способа его получения, способа производства в промышленных масштабах генотерапевтического ДНК-вектора.
Перечень сокращений
VTvaf17 - вектор генотерапевтический, не содержащий последовательностей вирусных геномов и маркеров антибиотико-резистентности (vectortherapeuticvirus-antibiotic-free)
ДНК - дезоксирибонуклеиновая кислота,
кДНК - комплементарная дезоксирибонуклеиновая кислота,
РНК - рибонуклеиновая кислота,
мРНК - матричная рибонуклеиновая кислота,
п.н. - пар нуклеотидов,
ПЦР - полимеразная цепная реакция,
RT-PCR - ПЦР в режиме реального времени,
мл - миллилитр, мкл - микролитр,
куб. мм - кубический миллиметр,
л - литр,
мкг - микрограмм,
мг - миллиграмм,
г - грамм,
мкМ - микромоль,
мМ - миллимоль,
мин - минута,
сек - секунда,
об/мин - обороты в минуту,
нм - нанометр,
см - сантиметр,
мВт - милливатт,
о.е. ф-относительная единица флуоресценции,
РВС - фосфатно-солевой буфер.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Селл энд Джин Терапи Лтд (CELL and GENE THERAPY Ltd), Общество с ограниченной ответственностью «Прорывные Инновационные Технологии»,
<120> Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2 для повышения уровня экспрессии этих целевых генов, способ его получения и применения, штамм Escherichia coli SCS110-AF/VTvaf17-ANG или Escherichia coli SCS110-AF/VTvaf17-ANGPT1 или Escherichia coli SCS110-AF/VTvaf17-VEGFA или Escherichia coli SCS110-AF/VTvaf17-FGF1 или Escherichia coli SCS110-AF/VTvaf17-HIF1α или Escherichia coli SCS110-AF/VTvaf17-HGF или Escherichia coli SCS110-AF/VTvaf17-SDF1 или Escherichia coli SCS110-AF/VTvaf17-KLK4 или Escherichia coli SCS110-AF/VTvaf17-PDGFC или Escherichia coli SCS110-AF/VTvaf17- PROK1 или Escherichia coli SCS110-AF/VTvaf17- PROK2, несущий генотерапевтический ДНК-вектор, способ его получения, способ производства в промышленных масштабах генотерапевтического ДНК-вектора.
<160> 11
<170> BiSSAP 1.3.6
<210> 1
<211> 3618
<212> DNA
<213> Homo Sapiens
<400> 1
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatccga tatcgtcgac caccatggtg atgggcctgg gcgttttgtt 1260
gttggtcttc gtgctgggtc tgggtctgac cccaccgacc ctggctcagg ataactccag 1320
gtacacacac ttcctgaccc agcactatga tgccaaacca cagggccggg atgacagata 1380
ctgtgaaagc atcatgagga gacggggcct gacctcaccc tgcaaagaca tcaacacatt 1440
tattcatggc aacaagcgca gcatcaaggc catctgtgaa aacaagaatg gaaaccctca 1500
cagagaaaac ctaagaataa gcaagtcttc tttccaggtc accacttgca agctacatgg 1560
agggtccccc tggcctccat gccagtaccg agccacagcg gggttcagaa acgttgttgt 1620
tgcttgtgaa aatggcttac ctgtccactt ggatcagtca attttccgtc gtccgtaagg 1680
taccgaattc gaattccctg tgacccctcc ccagtgcctc tcctggccct ggaagttgcc 1740
actccagtgc ccaccagcct tgtcctaata aaattaagtt gcatcatttt gtctgactag 1800
gtgtccttct ataatattat ggggtggagg ggggtggtat ggagcaaggg gcaagttggg 1860
aagacaacct gtagggcctg cggggtctat tgggaaccaa gctggagtgc agtggcacaa 1920
tcttggctca ctgcaatctc cgcctcctgg gttcaagcga ttctcctgcc tcagcctccc 1980
gagttgttgg gattccaggc atgcatgacc aggctcagct aatttttgtt tttttggtag 2040
agacggggtt tcaccatatt ggccaggctg gtctccaact cctaatctca ggtgatctac 2100
ccaccttggc ctcccaaatt gctgggatta caggcgtgaa ccactgctcc cttccctgtc 2160
cttacgcgta gaattggtaa agagagtcgt gtaaaatatc gagttcgcac atcttgttgt 2220
ctgattattg atttttggcg aaaccatttg atcatatgac aagatgtgta tctaccttaa 2280
cttaatgatt ttgataaaaa tcattaacta gtccatggct gcctcgcgcg tttcggtgat 2340
gacggtgaaa acctctgaca catgcagctc ccggagacgg tcacagcttg tctgtaagcg 2400
gatgccggga gcagacaagc ccgtcagggc gcgtcagcgg gtgttggcgg gtgtcggggc 2460
gcagccatga cccagtcacg tagcgatagc ggagtgtata ctggcttaac tatgcggcat 2520
cagagcagat tgtactgaga gtgcaccata tgcggtgtga aataccgcac agatgcgtaa 2580
ggagaaaata ccgcatcagg cgctcttccg cttcctcgct cactgactcg ctgcgctcgg 2640
tcgttcggct gcggcgagcg gtatcagctc actcaaaggc ggtaatacgg ttatccacag 2700
aatcagggga taacgcagga aagaacatgt gagcaaaagg ccagcaaaag gccaggaacc 2760
gtaaaaaggc cgcgttgctg gcgtttttcc ataggctccg cccccctgac gagcatcaca 2820
aaaatcgacg ctcaagtcag aggtggcgaa acccgacagg actataaaga taccaggcgt 2880
ttccccctgg aagctccctc gtgcgctctc ctgttccgac cctgccgctt accggatacc 2940
tgtccgcctt tctcccttcg ggaagcgtgg cgctttctca tagctcacgc tgtaggtatc 3000
tcagttcggt gtaggtcgtt cgctccaagc tgggctgtgt gcacgaaccc cccgttcagc 3060
ccgaccgctg cgccttatcc ggtaactatc gtcttgagtc caacccggta agacacgact 3120
tatcgccact ggcagcagcc actggtaaca ggattagcag agcgaggtat gtaggcggtg 3180
ctacagagtt cttgaagtgg tggcctaact acggctacac tagaagaaca gtatttggta 3240
tctgcgctct gctgaagcca gttaccttcg gaaaaagagt tggtagctct tgatccggca 3300
aacaaaccac cgctggtagc ggtggttttt ttgtttgcaa gcagcagatt acgcgcagaa 3360
aaaaaggatc tcaagaagat cctttgatct tttctacggg gtctgacgct cagtggaacg 3420
aaaactcacg ttaagggatt ttggtcatga gattatcaaa aaggatcttc acctagatcc 3480
ttttaaatta aaaatgaagt tttaaatcaa tctaaagtat atatgagtaa acttggtctg 3540
acagttacca atgcttaatc agtgaggcac ctatctcagc gatctgtcta tttcgttcat 3600
ccatagttgc ctgactcc 3618
<210> 2
<211> 4660
<212> DNA
<213> Homo Sapiens
<400> 2
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatatcg tcgaccacca tgacagtttt cctttccttt gctttcctcg 1260
ctgccattct gactcacata gggtgcagca atcagcgccg aagtccagaa aacagtggga 1320
gaagatataa ccggattcaa catgggcaat gtgcctacac tttcattctt ccagaacacg 1380
atggcaactg tcgtgagagt acgacagacc agtacaacac aaacgctctg cagagagatg 1440
ctccacacgt ggaaccggat ttctcttccc agaaacttca acatctggaa catgtgatgg 1500
aaaattatac tcagtggctg caaaaacttg agaattacat tgtggaaaac atgaagtcgg 1560
agatggccca gatacagcag aatgcagttc agaaccacac ggctaccatg ctggagatag 1620
gaaccagcct cctctctcag actgcagagc agaccagaaa gctgacagat gttgagaccc 1680
aggtactaaa tcaaacttct cgacttgaga tacagctgct ggagaattca ttatccacct 1740
acaagctaga gaagcaactt cttcaacaga caaatgaaat cttgaagatc catgaaaaaa 1800
acagtttatt agaacataaa atcttagaaa tggaaggaaa acacaaggaa gagttggaca 1860
ccttaaagga agagaaagag aaccttcaag gcttggttac tcgtcaaaca tatataatcc 1920
aggagctgga aaagcaatta aacagagcta ccaccaacaa cagtgtcctt cagaagcagc 1980
aactggagct gatggacaca gtccacaacc ttgtcaatct ttgcactaaa gaaggtgttt 2040
tactaaaggg aggaaaaaga gaggaagaga aaccatttag agactgtgca gatgtatatc 2100
aagctggttt taataaaagt ggaatctaca ctatttatat taataatatg ccagaaccca 2160
aaaaggtgtt ttgcaatatg gatgtcaatg ggggaggttg gactgtaata caacatcgtg 2220
aagatggaag tctagatttc caaagaggct ggaaggaata taaaatgggt tttggaaatc 2280
cctccggtga atattggctg gggaatgagt ttatttttgc cattaccagt cagaggcagt 2340
acatgctaag aattgagtta atggactggg aagggaaccg agcctattca cagtatgaca 2400
gattccacat aggaaatgaa aagcaaaact ataggttgta tttaaaaggt cacactggga 2460
cagcaggaaa acagagcagc ctgatcttac acggtgctga tttcagcact aaagatgctg 2520
ataatgacaa ctgtatgtgc aaatgtgccc tcatgttaac aggaggatgg tggtttgatg 2580
cttgtggccc ctccaatcta aatggaatgt tctatactgc gggacaaaac catggaaaac 2640
tgaatgggat aaagtggcac tacttcaaag ggcccagtta ctccttacgt tccacaacta 2700
tgatgattcg acctttagat ttttgaggta ccgaattccc tgtgacccct ccccagtgcc 2760
tctcctggcc ctggaagttg ccactccagt gcccaccagc cttgtcctaa taaaattaag 2820
ttgcatcatt ttgtctgact aggtgtcctt ctataatatt atggggtgga ggggggtggt 2880
atggagcaag gggcaagttg ggaagacaac ctgtagggcc tgcggggtct attgggaacc 2940
aagctggagt gcagtggcac aatcttggct cactgcaatc tccgcctcct gggttcaagc 3000
gattctcctg cctcagcctc ccgagttgtt gggattccag gcatgcatga ccaggctcag 3060
ctaatttttg tttttttggt agagacgggg tttcaccata ttggccaggc tggtctccaa 3120
ctcctaatct caggtgatct acccaccttg gcctcccaaa ttgctgggat tacaggcgtg 3180
aaccactgct cccttccctg tccttacgcg tagaattggt aaagagagtc gtgtaaaata 3240
tcgagttcgc acatcttgtt gtctgattat tgatttttgg cgaaaccatt tgatcatatg 3300
acaagatgtg tatctacctt aacttaatga ttttgataaa aatcattaac tagtccatgg 3360
ctgcctcgcg cgtttcggtg atgacggtga aaacctctga cacatgcagc tcccggagac 3420
ggtcacagct tgtctgtaag cggatgccgg gagcagacaa gcccgtcagg gcgcgtcagc 3480
gggtgttggc gggtgtcggg gcgcagccat gacccagtca cgtagcgata gcggagtgta 3540
tactggctta actatgcggc atcagagcag attgtactga gagtgcacca tatgcggtgt 3600
gaaataccgc acagatgcgt aaggagaaaa taccgcatca ggcgctcttc cgcttcctcg 3660
ctcactgact cgctgcgctc ggtcgttcgg ctgcggcgag cggtatcagc tcactcaaag 3720
gcggtaatac ggttatccac agaatcaggg gataacgcag gaaagaacat gtgagcaaaa 3780
ggccagcaaa aggccaggaa ccgtaaaaag gccgcgttgc tggcgttttt ccataggctc 3840
cgcccccctg acgagcatca caaaaatcga cgctcaagtc agaggtggcg aaacccgaca 3900
ggactataaa gataccaggc gtttccccct ggaagctccc tcgtgcgctc tcctgttccg 3960
accctgccgc ttaccggata cctgtccgcc tttctccctt cgggaagcgt ggcgctttct 4020
catagctcac gctgtaggta tctcagttcg gtgtaggtcg ttcgctccaa gctgggctgt 4080
gtgcacgaac cccccgttca gcccgaccgc tgcgccttat ccggtaacta tcgtcttgag 4140
tccaacccgg taagacacga cttatcgcca ctggcagcag ccactggtaa caggattagc 4200
agagcgaggt atgtaggcgg tgctacagag ttcttgaagt ggtggcctaa ctacggctac 4260
actagaagaa cagtatttgg tatctgcgct ctgctgaagc cagttacctt cggaaaaaga 4320
gttggtagct cttgatccgg caaacaaacc accgctggta gcggtggttt ttttgtttgc 4380
aagcagcaga ttacgcgcag aaaaaaagga tctcaagaag atcctttgat cttttctacg 4440
gggtctgacg ctcagtggaa cgaaaactca cgttaaggga ttttggtcat gagattatca 4500
aaaaggatct tcacctagat ccttttaaat taaaaatgaa gttttaaatc aatctaaagt 4560
atatatgagt aaacttggtc tgacagttac caatgcttaa tcagtgaggc acctatctca 4620
gcgatctgtc tatttcgttc atccatagtt gcctgactcc 4660
<210> 3
<211> 4395
<212> DNA
<213> Homo Sapiens
<400> 3
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ctgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccgcaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatga cggacagaca gacagacacc gcccccagcc ccagctacca 1260
cctcctcccc ggccggcggc ggacagtgga cgcggcggcg agccgcgggc aggggccgga 1320
gcccgcgccc ggaggcgggg tggagggggt cggggctcgc ggcgtcgcac tgaaactttt 1380
cgtccaactt ctgggctgtt ctcgcttcgg aggagccgtg gtccgcgcgg gggaagccga 1440
gccgagcgga gccgcgagaa gtgctagctc gggccgggag gagccgcagc cggaggaggg 1500
ggaggaggaa gaagagaagg aagaggagag ggggccgcag tggcgactcg gcgctcggaa 1560
gccgggctca tggacgggtg aggcggcggt gtgcgcagac agtgctccag ccgcgcgcgc 1620
tccccaggcc ctggcccggg cctcgggccg gggaggaaga gtagctcgcc gaggcgccga 1680
ggagagcggg ccgccccaca gcccgagccg gagagggagc gcgagccgcg ccggccccgg 1740
tcgggcctcc gaaaccatga actttctgct gtcttgggtg cattggagcc ttgccttgct 1800
gctctacctc caccatgcca agtggtccca ggctgcaccc atggcagaag gaggagggca 1860
gaatcatcac gaagtggtga agttcatgga tgtctatcag cgcagctact gccatccaat 1920
cgagaccctg gtggacatct tccaggagta ccctgatgag atcgagtaca tcttcaagcc 1980
atcctgtgtg cccctgatgc gatgcggggg ctgctgcaat gacgagggcc tggagtgtgt 2040
gcccactgag gagtccaaca tcaccatgca gattatgcgg atcaaacctc accaaggcca 2100
gcacatagga gagatgagct tcctacagca caacaaatgt gaatgcagac caaagaaaga 2160
tagagcaaga caagaaaaaa aatcagttcg aggaaaggga aaggggcaaa aacgaaagcg 2220
caagaaatcc cggtataagt cctggagcgt gtacgttggt gcccgctgct gtctaatgcc 2280
ctggagcctc cctggccccc atccctgtgg gccttgctca gagcggagaa agcatttgtt 2340
tgtacaagat ccgcagacgt gtaaatgttc ctgcaaaaac acagactcgc gttgcaaggc 2400
gaggcagctt gagttaaacg aacgtacttg cagatgtgac aagccgaggc ggtgaaagct 2460
tggtaccgaa ttccctgtga cccctcccca gtgcctctcc tggccctgga agttgccact 2520
ccagtgccca ccagccttgt cctaataaaa ttaagttgca tcattttgtc tgactaggtg 2580
tccttctata atattatggg gtggaggggg gtggtatgga gcaaggggca agttgggaag 2640
acaacctgta gggcctgcgg ggtctattgg gaaccaagct ggagtgcagt ggcacaatct 2700
tggctcactg caatctccgc ctcctgggtt caagcgattc tcctgcctca gcctcccgag 2760
ttgttgggat tccaggcatg catgaccagg ctcagctaat ttttgttttt ttggtagaga 2820
cggggtttca ccatattggc caggctggtc tccaactcct aatctcaggt gatctaccca 2880
ccttggcctc ccaaattgct gggattacag gcgtgaacca ctgctccctt ccctgtcctt 2940
acgcgtagaa ttggtaaaga gagtcgtgta aaatatcgag ttcgcacatc ttgttgtctg 3000
attattgatt tttggcgaaa ccatttgatc atatgacaag atgtgtatct accttaactt 3060
aatgattttg ataaaaatca ttaactagtc catggctgcc tcgcgcgttt cggtgatgac 3120
ggtgaaaacc tctgacacat gcagctcccg gagacggtca cagcttgtct gtaagcggat 3180
gccgggagca gacaagcccg tcagggcgcg tcagcgggtg ttggcgggtg tcggggcgca 3240
gccatgaccc agtcacgtag cgatagcgga gtgtatactg gcttaactat gcggcatcag 3300
agcagattgt actgagagtg caccatatgc ggtgtgaaat accgcacaga tgcgtaagga 3360
gaaaataccg catcaggcgc tcttccgctt cctcgctcac tgactcgctg cgctcggtcg 3420
ttcggctgcg gcgagcggta tcagctcact caaaggcggt aatacggtta tccacagaat 3480
caggggataa cgcaggaaag aacatgtgag caaaaggcca gcaaaaggcc aggaaccgta 3540
aaaaggccgc gttgctggcg tttttccata ggctccgccc ccctgacgag catcacaaaa 3600
atcgacgctc aagtcagagg tggcgaaacc cgacaggact ataaagatac caggcgtttc 3660
cccctggaag ctccctcgtg cgctctcctg ttccgaccct gccgcttacc ggatacctgt 3720
ccgcctttct cccttcggga agcgtggcgc tttctcatag ctcacgctgt aggtatctca 3780
gttcggtgta ggtcgttcgc tccaagctgg gctgtgtgca cgaacccccc gttcagcccg 3840
accgctgcgc cttatccggt aactatcgtc ttgagtccaa cccggtaaga cacgacttat 3900
cgccactggc agcagccact ggtaacagga ttagcagagc gaggtatgta ggcggtgcta 3960
cagagttctt gaagtggtgg cctaactacg gctacactag aagaacagta tttggtatct 4020
gcgctctgct gaagccagtt accttcggaa aaagagttgg tagctcttga tccggcaaac 4080
aaaccaccgc tggtagcggt ggtttttttg tttgcaagca gcagattacg cgcagaaaaa 4140
aaggatctca agaagatcct ttgatctttt ctacggggtc tgacgctcag tggaacgaaa 4200
actcacgtta agggattttg gtcatgagat tatcaaaaag gatcttcacc tagatccttt 4260
taaattaaaa atgaagtttt aaatcaatct aaagtatata tgagtaaact tggtctgaca 4320
gttaccaatg cttaatcagt gaggcaccta tctcagcgat ctgtctattt cgttcatcca 4380
tagttgcctg actcc 4395
<210> 4
<211> 3631
<212> DNA
<213> Homo Sapiens
<400> 4
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatatcg tcgaccacca tggctgaagg ggaaatcacc accttcacag 1260
ccctgaccga gaagtttaat ctgcctccag ggaattacaa gaagcccaaa ctcctctact 1320
gtagcaacgg gggccacttc ctgaggatcc ttccggatgg cacagtggat gggacaaggg 1380
acaggagcga ccagcacatt cagctgcagc tcagtgcgga aagcgtgggg gaggtgtata 1440
taaagagtac cgagactggc cagtacttgg ccatggacac cgacgggctt ttatacggct 1500
cacagacacc aaatgaggaa tgtttgttcc tggaaaggct ggaggagaac cattacaaca 1560
cctatatatc caagaagcat gcagagaaga attggtttgt tggcctcaag aagaatggga 1620
gctgcaaacg cggtcctcgg actcactatg gccagaaagc aatcttgttt ctccccctgc 1680
cagtctcttc tgattaaggt accgaattcc ctgtgacccc tccccagtgc ctctcctggc 1740
cctggaagtt gccactccag tgcccaccag ccttgtccta ataaaattaa gttgcatcat 1800
tttgtctgac taggtgtcct tctataatat tatggggtgg aggggggtgg tatggagcaa 1860
ggggcaagtt gggaagacaa cctgtagggc ctgcggggtc tattgggaac caagctggag 1920
tgcagtggca caatcttggc tcactgcaat ctccgcctcc tgggttcaag cgattctcct 1980
gcctcagcct cccgagttgt tgggattcca ggcatgcatg accaggctca gctaattttt 2040
gtttttttgg tagagacggg gtttcaccat attggccagg ctggtctcca actcctaatc 2100
tcaggtgatc tacccacctt ggcctcccaa attgctggga ttacaggcgt gaaccactgc 2160
tcccttccct gtccttacgc gtagaattgg taaagagagt cgtgtaaaat atcgagttcg 2220
cacatcttgt tgtctgatta ttgatttttg gcgaaaccat ttgatcatat gacaagatgt 2280
gtatctacct taacttaatg attttgataa aaatcattaa ctagtccatg gctgcctcgc 2340
gcgtttcggt gatgacggtg aaaacctctg acacatgcag ctcccggaga cggtcacagc 2400
ttgtctgtaa gcggatgccg ggagcagaca agcccgtcag ggcgcgtcag cgggtgttgg 2460
cgggtgtcgg ggcgcagcca tgacccagtc acgtagcgat agcggagtgt atactggctt 2520
aactatgcgg catcagagca gattgtactg agagtgcacc atatgcggtg tgaaataccg 2580
cacagatgcg taaggagaaa ataccgcatc aggcgctctt ccgcttcctc gctcactgac 2640
tcgctgcgct cggtcgttcg gctgcggcga gcggtatcag ctcactcaaa ggcggtaata 2700
cggttatcca cagaatcagg ggataacgca ggaaagaaca tgtgagcaaa aggccagcaa 2760
aaggccagga accgtaaaaa ggccgcgttg ctggcgtttt tccataggct ccgcccccct 2820
gacgagcatc acaaaaatcg acgctcaagt cagaggtggc gaaacccgac aggactataa 2880
agataccagg cgtttccccc tggaagctcc ctcgtgcgct ctcctgttcc gaccctgccg 2940
cttaccggat acctgtccgc ctttctccct tcgggaagcg tggcgctttc tcatagctca 3000
cgctgtaggt atctcagttc ggtgtaggtc gttcgctcca agctgggctg tgtgcacgaa 3060
ccccccgttc agcccgaccg ctgcgcctta tccggtaact atcgtcttga gtccaacccg 3120
gtaagacacg acttatcgcc actggcagca gccactggta acaggattag cagagcgagg 3180
tatgtaggcg gtgctacaga gttcttgaag tggtggccta actacggcta cactagaaga 3240
acagtatttg gtatctgcgc tctgctgaag ccagttacct tcggaaaaag agttggtagc 3300
tcttgatccg gcaaacaaac caccgctggt agcggtggtt tttttgtttg caagcagcag 3360
attacgcgca gaaaaaaagg atctcaagaa gatcctttga tcttttctac ggggtctgac 3420
gctcagtgga acgaaaactc acgttaaggg attttggtca tgagattatc aaaaaggatc 3480
ttcacctaga tccttttaaa ttaaaaatga agttttaaat caatctaaag tatatatgag 3540
taaacttggt ctgacagtta ccaatgctta atcagtgagg cacctatctc agcgatctgt 3600
ctatttcgtt catccatagt tgcctgactc c 3631
<210> 5
<211> 5643
<212> DNA
<213> Homo Sapiens
<400> 5
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatatcg tcgaccacca tggagggcgc cggcggcgcg aacgacaaga 1260
aaaagataag ttctgaacgt cgaaaagaaa agtctcgaga tgcagccaga tctcggcgaa 1320
gtaaagaatc tgaagttttt tatgagcttg ctcatcagtt gccacttcca cataatgtga 1380
gttcgcatct tgataaggcc tctgtgatga ggcttaccat cagctatttg cgtgtgagga 1440
aacttctgga tgctggtgat ttggatattg aagatgacat gaaagcacag atgaattgct 1500
tttatttgaa agccttggat ggttttgtta tggttctcac agatgatggt gacatgattt 1560
acatttctga taatgtgaac aaatacatgg gattaactca gtttgaacta actggacaca 1620
gtgtgtttga ttttactcat ccatgtgacc atgaggaaat gagagaaatg cttacacaca 1680
gaaatggcct tgtgaaaaag ggtaaagaac aaaacacaca gcgaagcttt tttctcagaa 1740
tgaagtgtac cctaactagc cgaggaagaa ctatgaacat aaagtctgca acatggaagg 1800
tattgcactg cacaggccac attcacgtat atgataccaa cagtaaccaa cctcagtgtg 1860
ggtataagaa accacctatg acctgcttgg tgctgatttg tgaacccatt cctcacccat 1920
caaatattga aattccttta gatagcaaga ctttcctcag tcgacacagc ctggatatga 1980
aattttctta ttgtgatgaa agaattaccg aattgatggg atatgagcca gaagaacttt 2040
taggccgctc aatttatgaa tattatcatg ctttggactc tgatcatctg accaaaactc 2100
atcatgatat gtttactaaa ggacaagtca ccacaggaca gtacaggatg cttgccaaaa 2160
gaggtggata tgtctgggtt gaaactcaag caactgtcat atataacacc aagaattctc 2220
aaccacagtg cattgtatgt gtgaattacg ttgtgagtgg tattattcag cacgacttga 2280
ttttctccct tcaacaaaca gaatgtgtcc ttaaaccggt tgaatcttca gatatgaaaa 2340
tgactcagct attcaccaaa gttgaatcag aagatacaag tagcctcttt gacaaactta 2400
agaaggaacc tgatgcttta actttgctgg ccccagccgc tggagacaca atcatatctt 2460
tagattttgg cagcaacgac acagaaactg atgaccagca acttgaggaa gtaccattat 2520
ataatgatgt aatgctcccc tcacccaacg aaaaattaca gaatataaat ttggcaatgt 2580
ctccattacc caccgctgaa acgccaaagc cacttcgaag tagtgctgac cctgcactca 2640
atcaagaagt tgcattaaaa ttagaaccaa atccagagtc actggaactt tcttttacca 2700
tgccccagat tcaggatcag acacctagtc cttccgatgg aagcactaga caaagttcac 2760
ctgagcctaa tagtcccagt gaatattgtt tttatgtgga tagtgatatg gtcaatgaat 2820
tcaagttgga attggtagaa aaactttttg ctgaagacac agaagcaaag aacccatttt 2880
ctactcagga cacagattta gacttggaga tgttagctcc ctatatccca atggatgatg 2940
acttccagtt acgttccttc gatcagttgt caccattaga aagcagttcc gcaagccctg 3000
aaagcgcaag tcctcaaagc acagttacag tattccagca gactcaaata caagaaccta 3060
ctgctaatgc caccactacc actgccacca ctgatgaatt aaaaacagtg acaaaagacc 3120
gtatggaaga cattaaaata ttgattgcat ctccatctcc tacccacata cataaagaaa 3180
ctacaagtgc cacatcatca ccatatagag atactcaaag tcggacagcc tcaccaaaca 3240
gagcaggaaa aggagtcata gaacagacag aaaaatctca tccaagaagc cctaacgtgt 3300
tatctgtcgc tttgagtcaa agaactacag ttcctgagga agaactaaat ccaaagatac 3360
tagctttgca gaatgctcag agaaagcgaa aaatggaaca tgatggttca ctttttcaag 3420
cagtaggaat tggaacatta ttacagcagc cagacgatca tgcagctact acatcacttt 3480
cttggaaacg tgtaaaagga tgcaaatcta gtgaacagaa tggaatggag caaaagacaa 3540
ttattttaat accctctgat ttagcatgta gactgctggg gcaatcaatg gatgaaagtg 3600
gattaccaca gctgaccagt tatgattgtg aagttaatgc tcctatacaa ggcagcagaa 3660
acctactgca gggtgaagaa ttactcagag ctttggatca agttaactga ggtaccgaat 3720
tccctgtgac ccctccccag tgcctctcct ggccctggaa gttgccactc cagtgcccac 3780
cagccttgtc ctaataaaat taagttgcat cattttgtct gactaggtgt ccttctataa 3840
tattatgggg tggagggggg tggtatggag caaggggcaa gttgggaaga caacctgtag 3900
ggcctgcggg gtctattggg aaccaagctg gagtgcagtg gcacaatctt ggctcactgc 3960
aatctccgcc tcctgggttc aagcgattct cctgcctcag cctcccgagt tgttgggatt 4020
ccaggcatgc atgaccaggc tcagctaatt tttgtttttt tggtagagac ggggtttcac 4080
catattggcc aggctggtct ccaactccta atctcaggtg atctacccac cttggcctcc 4140
caaattgctg ggattacagg cgtgaaccac tgctcccttc cctgtcctta cgcgtagaat 4200
tggtaaagag agtcgtgtaa aatatcgagt tcgcacatct tgttgtctga ttattgattt 4260
ttggcgaaac catttgatca tatgacaaga tgtgtatcta ccttaactta atgattttga 4320
taaaaatcat tactagtcca tggctgcctc gcgcgtttcg gtgatgacgg tgaaaacctc 4380
tgacacatgc agctcccgga gacggtcaca gcttgtctgt aagcggatgc cgggagcaga 4440
caagcccgtc agggcgcgtc agcgggtgtt ggcgggtgtc ggggcgcagc catgacccag 4500
tcacgtagcg atagcggagt gtatactggc ttaactatgc ggcatcagag cagattgtac 4560
tgagagtgca ccatatgcgg tgtgaaatac cgcacagatg cgtaaggaga aaataccgca 4620
tcaggcgctc ttccgcttcc tcgctcactg actcgctgcg ctcggtcgtt cggctgcggc 4680
gagcggtatc agctcactca aaggcggtaa tacggttatc cacagaatca ggggataacg 4740
caggaaagaa catgtgagca aaaggccagc aaaaggccag gaaccgtaaa aaggccgcgt 4800
tgctggcgtt tttccatagg ctccgccccc ctgacgagca tcacaaaaat cgacgctcaa 4860
gtcagaggtg gcgaaacccg acaggactat aaagatacca ggcgtttccc cctggaagct 4920
ccctcgtgcg ctctcctgtt ccgaccctgc cgcttaccgg atacctgtcc gcctttctcc 4980
cttcgggaag cgtggcgctt tctcatagct cacgctgtag gtatctcagt tcggtgtagg 5040
tcgttcgctc caagctgggc tgtgtgcacg aaccccccgt tcagcccgac cgctgcgcct 5100
tatccggtaa ctatcgtctt gagtccaacc cggtaagaca cgacttatcg ccactggcag 5160
cagccactgg taacaggatt agcagagcga ggtatgtagg cggtgctaca gagttcttga 5220
agtggtggcc taactacggc tacactagaa gaacagtatt tggtatctgc gctctgctga 5280
agccagttac cttcggaaaa agagttggta gctcttgatc cggcaaacaa accaccgctg 5340
gtagcggtgg tttttttgtt tgcaagcagc agattacgcg cagaaaaaaa ggatctcaag 5400
aagatccttt gatcttttct acggggtctg acgctcagtg gaacgaaaac tcacgttaag 5460
ggattttggt catgagatta tcaaaaagga tcttcaccta gatcctttta aattaaaaat 5520
gaagttttaa atcaatctaa agtatatatg agtaaacttg gtctgacagt taccaatgct 5580
taatcagtga ggcacctatc tcagcgatct gtctatttcg ttcatccata gttgcctgac 5640
tcc 5643
<210> 6
<211> 5349
<212> DNA
<213> Homo Sapiens
<400> 6
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatgt gggtgaccaa actcctgcca gccctgctgc tgcagcatgt 1260
cctcctgcat ctcctcctgc tccccatcgc catcccctat gcagagggac aaaggaaaag 1320
aagaaataca attcatgaat tcaaaaaatc agcaaagact accctaatca aaatagatcc 1380
agcactgaag ataaaaacca aaaaagtgaa tactgcagac caatgtgcta atagatgtac 1440
taggaataaa ggacttccat tcacttgcaa ggcttttgtt tttgataaag caagaaaaca 1500
atgcctctgg ttccccttca atagcatgtc aagtggagtg aaaaaagaat ttggccatga 1560
atttgacctc tatgaaaaca aagactacat tagaaactgc atcattggta aaggacgcag 1620
ctacaaggga acagtatcta tcactaagag tggcatcaaa tgtcagccct ggagttccat 1680
gataccacac gaacacagct ttttgccttc gagctatcgg ggtaaagacc tacaggaaaa 1740
ctactgtcga aatcctcgag gggaagaagg gggaccctgg tgtttcacaa gcaatccaga 1800
ggtacgctac gaagtctgtg acattcctca gtgttcagaa gttgaatgca tgacctgcaa 1860
tggggagagt tatcgaggtc tcatggatca tacagaatca ggcaagattt gtcagcgctg 1920
ggatcatcag acaccacacc ggcacaaatt cttgcctgaa agatatcccg acaagggctt 1980
tgatgataat tattgccgca atcccgatgg ccagccgagg ccatggtgct atactcttga 2040
ccctcacacc cgctgggagt actgtgcaat taaaacatgc gctgacaata ctatgaatga 2100
cactgatgtt cctttggaaa caactgaatg catccaaggt caaggagaag gctacagggg 2160
cactgtcaat accatttgga atggaattcc atgtcagcgt tgggattctc agtatcctca 2220
cgagcatgac atgactcctg aaaatttcaa gtgcaaggac ctacgagaaa attactgccg 2280
aaatccagat gggtctgaat caccctggtg ttttaccact gatccaaaca tccgagttgg 2340
ctactgctcc caaattccaa actgtgatat gtcacatgga caagattgtt atcgtgggaa 2400
tggcaaaaat tatatgggca acttatccca aacaagatct ggactaacat gttcaatgtg 2460
ggacaagaac atggaagact tacatcgtca tatcttctgg gaaccagatg caagtaagct 2520
gaatgagaat tactgccgaa atccagatga tgatgctcat ggaccctggt gctacacggg 2580
aaatccactc attccttggg attattgccc tatttctcgt tgtgaaggtg ataccacacc 2640
tacaatagtc aatttagacc atcccgtaat atcttgtgcc aaaacgaaac aattgcgagt 2700
tgtaaatggg attccaacac gaacaaacat aggatggatg gttagtttga gatacagaaa 2760
taaacatatc tgcggaggat cattgataaa ggagagttgg gttcttactg cacgacagtg 2820
tttcccttct cgagacttga aagattatga agcttggctt ggaattcatg atgtccacgg 2880
aagaggagat gagaaatgca aacaggttct caatgtttcc cagctggtat atggccctga 2940
aggatcagat ctggttttaa tgaagcttgc caggcctgct gtcctggatg attttgttag 3000
tacgattgat ttacctaatt atggatgcac aattcctgaa aagaccagtt gcagtgttta 3060
tggctggggc tacactggat tgatcaacta tgatggccta ttacgagtgg cacatctcta 3120
tataatggga aatgagaaat gcagccagca tcatcgaggg aaggtgactc tgaatgagtc 3180
tgaaatatgt gctggggctg aaaagattgg atcaggacca tgtgaggggg attatggtgg 3240
cccacttgtt tgtgagcaac ataaaatgag aatggttctt ggtgtcattg ttcctggtcg 3300
tggatgtgcc attccaaatc gtcctggtat ttttgtccga gtagcatatt atgcaaaatg 3360
gatacacaaa attattttaa catataaggt accacagtca taggtcgaca agcttggtac 3420
cgaattccct gtgacccctc cccagtgcct ctcctggccc tggaagttgc cactccagtg 3480
cccaccagcc ttgtcctaat aaaattaagt tgcatcattt tgtctgacta ggtgtccttc 3540
tataatatta tggggtggag gggggtggta tggagcaagg ggcaagttgg gaagacaacc 3600
tgtagggcct gcggggtcta ttgggaacca agctggagtg cagtggcaca atcttggctc 3660
actgcaatct ccgcctcctg ggttcaagcg attctcctgc ctcagcctcc cgagttgttg 3720
ggattccagg catgcatgac caggctcagc taatttttgt ttttttggta gagacggggt 3780
ttcaccatat tggccaggct ggtctccaac tcctaatctc aggtgatcta cccaccttgg 3840
cctcccaaat tgctgggatt acaggcgtga accactgctc ccttccctgt ccttacgcgt 3900
agaattggta aagagagtcg tgtaaaatat cgagttcgca catcttgttg tctgattatt 3960
gatttttggc gaaaccattt gatcatatga caagatgtgt atctacctta acttaatgat 4020
tttgataaaa atcattaact agtccatggc tgcctcgcgc gtttcggtga tgacggtgaa 4080
aacctctgac acatgcagct cccggagacg gtcacagctt gtctgtaagc ggatgccggg 4140
agcagacaag cccgtcaggg cgcgtcagcg ggtgttggcg ggtgtcgggg cgcagccatg 4200
acccagtcac gtagcgatag cggagtgtat actggcttaa ctatgcggca tcagagcaga 4260
ttgtactgag agtgcaccat atgcggtgtg aaataccgca cagatgcgta aggagaaaat 4320
accgcatcag gcgctcttcc gcttcctcgc tcactgactc gctgcgctcg gtcgttcggc 4380
tgcggcgagc ggtatcagct cactcaaagg cggtaatacg gttatccaca gaatcagggg 4440
ataacgcagg aaagaacatg tgagcaaaag gccagcaaaa ggccaggaac cgtaaaaagg 4500
ccgcgttgct ggcgtttttc cataggctcc gcccccctga cgagcatcac aaaaatcgac 4560
gctcaagtca gaggtggcga aacccgacag gactataaag ataccaggcg tttccccctg 4620
gaagctccct cgtgcgctct cctgttccga ccctgccgct taccggatac ctgtccgcct 4680
ttctcccttc gggaagcgtg gcgctttctc atagctcacg ctgtaggtat ctcagttcgg 4740
tgtaggtcgt tcgctccaag ctgggctgtg tgcacgaacc ccccgttcag cccgaccgct 4800
gcgccttatc cggtaactat cgtcttgagt ccaacccggt aagacacgac ttatcgccac 4860
tggcagcagc cactggtaac aggattagca gagcgaggta tgtaggcggt gctacagagt 4920
tcttgaagtg gtggcctaac tacggctaca ctagaagaac agtatttggt atctgcgctc 4980
tgctgaagcc agttaccttc ggaaaaagag ttggtagctc ttgatccggc aaacaaacca 5040
ccgctggtag cggtggtttt tttgtttgca agcagcagat tacgcgcaga aaaaaaggat 5100
ctcaagaaga tcctttgatc ttttctacgg ggtctgacgc tcagtggaac gaaaactcac 5160
gttaagggat tttggtcatg agattatcaa aaaggatctt cacctagatc cttttaaatt 5220
aaaaatgaag ttttaaatca atctaaagta tatatgagta aacttggtct gacagttacc 5280
aatgcttaat cagtgaggca cctatctcag cgatctgtct atttcgttca tccatagttg 5340
cctgactcc 5349
<210> 7
<211> 3425
<212> DNA
<213> Homo Sapiens
<400> 7
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tcccaccatg aacgccaagg tcgtggtcgt gctggtcctc gtgctgaccg 1260
cgctctgcct cagcgacggg aagcccgtca gcctgagcta cagatgccca tgccgattct 1320
tcgaaagcca tgttgccaga gccaacgtca agcatctcaa aattctcaac actccaaact 1380
gtgcccttca gattgtagcc cggctgaaga acaacaacag acaagtgtgc attgacccga 1440
agctaaagtg gattcaggag tacctggaga aagctttaaa caagaggttc aagatgtgaa 1500
ttccctgtga cccctcccca gtgcctctcc tggccctgga agttgccact ccagtgccca 1560
ccagccttgt cctaataaaa ttaagttgca tcattttgtc tgactaggtg tccttctata 1620
atattatggg gtggaggggg gtggtatgga gcaaggggca agttgggaag acaacctgta 1680
gggcctgcgg ggtctattgg gaaccaagct ggagtgcagt ggcacaatct tggctcactg 1740
caatctccgc ctcctgggtt caagcgattc tcctgcctca gcctcccgag ttgttgggat 1800
tccaggcatg catgaccagg ctcagctaat ttttgttttt ttggtagaga cggggtttca 1860
ccatattggc caggctggtc tccaactcct aatctcaggt gatctaccca ccttggcctc 1920
ccaaattgct gggattacag gcgtgaacca ctgctccctt ccctgtcctt acgcgtagaa 1980
ttggtaaaga gagtcgtgta aaatatcgag ttcgcacatc ttgttgtctg attattgatt 2040
tttggcgaaa ccatttgatc atatgacaag atgtgtatct accttaactt aatgattttg 2100
ataaaaatca ttaactagtc catggctgcc tcgcgcgttt cggtgatgac ggtgaaaacc 2160
tctgacacat gcagctcccg gagacggtca cagcttgtct gtaagcggat gccgggagca 2220
gacaagcccg tcagggcgcg tcagcgggtg ttggcgggtg tcggggcgca gccatgaccc 2280
agtcacgtag cgatagcgga gtgtatactg gcttaactat gcggcatcag agcagattgt 2340
actgagagtg caccatatgc ggtgtgaaat accgcacaga tgcgtaagga gaaaataccg 2400
catcaggcgc tcttccgctt cctcgctcac tgactcgctg cgctcggtcg ttcggctgcg 2460
gcgagcggta tcagctcact caaaggcggt aatacggtta tccacagaat caggggataa 2520
cgcaggaaag aacatgtgag caaaaggcca gcaaaaggcc aggaaccgta aaaaggccgc 2580
gttgctggcg tttttccata ggctccgccc ccctgacgag catcacaaaa atcgacgctc 2640
aagtcagagg tggcgaaacc cgacaggact ataaagatac caggcgtttc cccctggaag 2700
ctccctcgtg cgctctcctg ttccgaccct gccgcttacc ggatacctgt ccgcctttct 2760
cccttcggga agcgtggcgc tttctcatag ctcacgctgt aggtatctca gttcggtgta 2820
ggtcgttcgc tccaagctgg gctgtgtgca cgaacccccc gttcagcccg accgctgcgc 2880
cttatccggt aactatcgtc ttgagtccaa cccggtaaga cacgacttat cgccactggc 2940
agcagccact ggtaacagga ttagcagagc gaggtatgta ggcggtgcta cagagttctt 3000
gaagtggtgg cctaactacg gctacactag aagaacagta tttggtatct gcgctctgct 3060
gaagccagtt accttcggaa aaagagttgg tagctcttga tccggcaaac aaaccaccgc 3120
tggtagcggt ggtttttttg tttgcaagca gcagattacg cgcagaaaaa aaggatctca 3180
agaagatcct ttgatctttt ctacggggtc tgacgctcag tggaacgaaa actcacgtta 3240
agggattttg gtcatgagat tatcaaaaag gatcttcacc tagatccttt taaattaaaa 3300
atgaagtttt aaatcaatct aaagtatata tgagtaaact tggtctgaca gttaccaatg 3360
cttaatcagt gaggcaccta tctcagcgat ctgtctattt cgttcatcca tagttgcctg 3420
actcc 3425
<210> 8
<211> 3922
<212> DNA
<213> Homo Sapiens
<400> 8
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatatcg tcgaccacca tggccacagc aggaaatccc tggggctggt 1260
tcctggggta cctcatcctt ggtgtcgcag gatcgctcgt ctctggtagc tgcagccaaa 1320
tcataaacgg cgaggactgc agcccgcact cgcagccctg gcaggcggca ctggtcatgg 1380
aaaacgaatt gttctgctcg ggcgtcctgg tgcatccgca gtgggtgctg tcagccgcac 1440
actgtttcca gaactcctac accatcgggc tgggcctgca cagtcttgag gccgaccaag 1500
agccagggag ccagatggtg gaggccagcc tctccgtacg gcacccagag tacaacagac 1560
ccttgctcgc taacgacctc atgctcatca agttggacga atccgtgtcc gagtctgaca 1620
ccatccggag catcagcatt gcttcgcagt gccctaccgc ggggaactct tgcctcgttt 1680
ctggctgggg tctgctggcg aacggcagaa tgcctaccgt gctgcagtgc gtgaacgtgt 1740
cggtggtgtc tgaggaggtc tgcagtaagc tctatgaccc gctgtaccac cccagcatgt 1800
tctgcgccgg cggagggcac gaccagaagg actcctgcaa cggtgactct ggggggcccc 1860
tgatctgcaa cgggtacttg cagggccttg tgtctttcgg aaaagccccg tgtggccaag 1920
ttggcgtgcc aggtgtctac accaacctct gcaaattcac tgagtggata gagaaaaccg 1980
tccaggccag ttaagaattc cctgtgaccc ctccccagtg cctctcctgg ccctggaagt 2040
tgccactcca gtgcccacca gccttgtcct aataaaatta agttgcatca ttttgtctga 2100
ctaggtgtcc ttctataata ttatggggtg gaggggggtg gtatggagca aggggcaagt 2160
tgggaagaca acctgtaggg cctgcggggt ctattgggaa ccaagctgga gtgcagtggc 2220
acaatcttgg ctcactgcaa tctccgcctc ctgggttcaa gcgattctcc tgcctcagcc 2280
tcccgagttg ttgggattcc aggcatgcat gaccaggctc agctaatttt tgtttttttg 2340
gtagagacgg ggtttcacca tattggccag gctggtctcc aactcctaat ctcaggtgat 2400
ctacccacct tggcctccca aattgctggg attacaggcg tgaaccactg ctcccttccc 2460
tgtccttacg cgtagaattg gtaaagagag tcgtgtaaaa tatcgagttc gcacatcttg 2520
ttgtctgatt attgattttt ggcgaaacca tttgatcata tgacaagatg tgtatctacc 2580
ttaacttaat gattttgata aaaatcatta actagtccat ggctgcctcg cgcgtttcgg 2640
tgatgacggt gaaaacctct gacacatgca gctcccggag acggtcacag cttgtctgta 2700
agcggatgcc gggagcagac aagcccgtca gggcgcgtca gcgggtgttg gcgggtgtcg 2760
gggcgcagcc atgacccagt cacgtagcga tagcggagtg tatactggct taactatgcg 2820
gcatcagagc agattgtact gagagtgcac catatgcggt gtgaaatacc gcacagatgc 2880
gtaaggagaa aataccgcat caggcgctct tccgcttcct cgctcactga ctcgctgcgc 2940
tcggtcgttc ggctgcggcg agcggtatca gctcactcaa aggcggtaat acggttatcc 3000
acagaatcag gggataacgc aggaaagaac atgtgagcaa aaggccagca aaaggccagg 3060
aaccgtaaaa aggccgcgtt gctggcgttt ttccataggc tccgcccccc tgacgagcat 3120
cacaaaaatc gacgctcaag tcagaggtgg cgaaacccga caggactata aagataccag 3180
gcgtttcccc ctggaagctc cctcgtgcgc tctcctgttc cgaccctgcc gcttaccgga 3240
tacctgtccg cctttctccc ttcgggaagc gtggcgcttt ctcatagctc acgctgtagg 3300
tatctcagtt cggtgtaggt cgttcgctcc aagctgggct gtgtgcacga accccccgtt 3360
cagcccgacc gctgcgcctt atccggtaac tatcgtcttg agtccaaccc ggtaagacac 3420
gacttatcgc cactggcagc agccactggt aacaggatta gcagagcgag gtatgtaggc 3480
ggtgctacag agttcttgaa gtggtggcct aactacggct acactagaag aacagtattt 3540
ggtatctgcg ctctgctgaa gccagttacc ttcggaaaaa gagttggtag ctcttgatcc 3600
ggcaaacaaa ccaccgctgg tagcggtggt ttttttgttt gcaagcagca gattacgcgc 3660
agaaaaaaag gatctcaaga agatcctttg atcttttcta cggggtctga cgctcagtgg 3720
aacgaaaact cacgttaagg gattttggtc atgagattat caaaaaggat cttcacctag 3780
atccttttaa attaaaaatg aagttttaaa tcaatctaaa gtatatatga gtaaacttgg 3840
tctgacagtt accaatgctt aatcagtgag gcacctatct cagcgatctg tctatttcgt 3900
tcatccatag ttgcctgact cc 3922
<210> 9
<211> 4200
<212> DNA
<213> Homo Sapiens
<400> 9
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatatcg tcgaccacca tgagcctctt cgggcttctc ctgctgacat 1260
ctgccctggc cggccagaga caggggactc aggcggaatc caacctgagt agtaaattcc 1320
agttttccag caacaaggaa cagaacggag tacaagatcc tcagcatgag agaattatta 1380
ctgtgtctac taatggaagt attcacagcc caaggtttcc tcatacttat ccaagaaata 1440
cggtcttggt atggagatta gtagcagtag aggaaaatgt atggatacaa cttacgtttg 1500
atgaaagatt tgggcttgaa gacccagaag atgacatatg caagtatgat tttgtagaag 1560
ttgaggaacc cagtgatgga actatattag ggcgctggtg tggttctggt actgtaccag 1620
gaaaacagat ttctaaagga aatcaaatta ggataagatt tgtatctgat gaatattttc 1680
cttctgaacc agggttctgc atccactaca acattgtcat gccacaattc acagaagctg 1740
tgagtccttc agtgctaccc ccttcagctt tgccactgga cctgcttaat aatgctataa 1800
ctgcctttag taccttggaa gaccttattc gatatcttga accagagaga tggcagttgg 1860
acttagaaga tctatatagg ccaacttggc aacttcttgg caaggctttt gtttttggaa 1920
gaaaatccag agtggtggat ctgaaccttc taacagagga ggtaagatta tacagctgca 1980
cacctcgtaa cttctcagtg tccataaggg aagaactaaa gagaaccgat accattttct 2040
ggccaggttg tctcctggtt aaacgctgtg gtgggaactg tgcctgttgt ctccacaatt 2100
gcaatgaatg tcaatgtgtc ccaagcaaag ttactaaaaa ataccacgag gtccttcagt 2160
tgagaccaaa gaccggtgtc aggggattgc acaaatcact caccgacgtg gccctggagc 2220
accatgagga gtgtgactgt gtgtgcagag ggagcacagg aggataggta ccgaattccc 2280
tgtgacccct ccccagtgcc tctcctggcc ctggaagttg ccactccagt gcccaccagc 2340
cttgtcctaa taaaattaag ttgcatcatt ttgtctgact aggtgtcctt ctataatatt 2400
atggggtgga ggggggtggt atggagcaag gggcaagttg ggaagacaac ctgtagggcc 2460
tgcggggtct attgggaacc aagctggagt gcagtggcac aatcttggct cactgcaatc 2520
tccgcctcct gggttcaagc gattctcctg cctcagcctc ccgagttgtt gggattccag 2580
gcatgcatga ccaggctcag ctaatttttg tttttttggt agagacgggg tttcaccata 2640
ttggccaggc tggtctccaa ctcctaatct caggtgatct acccaccttg gcctcccaaa 2700
ttgctgggat tacaggcgtg aaccactgct cccttccctg tccttacgcg tagaattggt 2760
aaagagagtc gtgtaaaata tcgagttcgc acatcttgtt gtctgattat tgatttttgg 2820
cgaaaccatt tgatcatatg acaagatgtg tatctacctt aacttaatga ttttgataaa 2880
aatcattaac tagtccatgg ctgcctcgcg cgtttcggtg atgacggtga aaacctctga 2940
cacatgcagc tcccggagac ggtcacagct tgtctgtaag cggatgccgg gagcagacaa 3000
gcccgtcagg gcgcgtcagc gggtgttggc gggtgtcggg gcgcagccat gacccagtca 3060
cgtagcgata gcggagtgta tactggctta actatgcggc atcagagcag attgtactga 3120
gagtgcacca tatgcggtgt gaaataccgc acagatgcgt aaggagaaaa taccgcatca 3180
ggcgctcttc cgcttcctcg ctcactgact cgctgcgctc ggtcgttcgg ctgcggcgag 3240
cggtatcagc tcactcaaag gcggtaatac ggttatccac agaatcaggg gataacgcag 3300
gaaagaacat gtgagcaaaa ggccagcaaa aggccaggaa ccgtaaaaag gccgcgttgc 3360
tggcgttttt ccataggctc cgcccccctg acgagcatca caaaaatcga cgctcaagtc 3420
agaggtggcg aaacccgaca ggactataaa gataccaggc gtttccccct ggaagctccc 3480
tcgtgcgctc tcctgttccg accctgccgc ttaccggata cctgtccgcc tttctccctt 3540
cgggaagcgt ggcgctttct catagctcac gctgtaggta tctcagttcg gtgtaggtcg 3600
ttcgctccaa gctgggctgt gtgcacgaac cccccgttca gcccgaccgc tgcgccttat 3660
ccggtaacta tcgtcttgag tccaacccgg taagacacga cttatcgcca ctggcagcag 3720
ccactggtaa caggattagc agagcgaggt atgtaggcgg tgctacagag ttcttgaagt 3780
ggtggcctaa ctacggctac actagaagaa cagtatttgg tatctgcgct ctgctgaagc 3840
cagttacctt cggaaaaaga gttggtagct cttgatccgg caaacaaacc accgctggta 3900
gcggtggttt ttttgtttgc aagcagcaga ttacgcgcag aaaaaaagga tctcaagaag 3960
atcctttgat cttttctacg gggtctgacg ctcagtggaa cgaaaactca cgttaaggga 4020
ttttggtcat gagattatca aaaaggatct tcacctagat ccttttaaat taaaaatgaa 4080
gttttaaatc aatctaaagt atatatgagt aaacttggtc tgacagttac caatgcttaa 4140
tcagtgaggc acctatctca gcgatctgtc tatttcgttc atccatagtt gcctgactcc 4200
<210> 10
<211> 3481
<212> DNA
<213> Homo Sapiens
<400> 10
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatatcg tcgaccacca tgagaggtgc cacgcgagtc tcaatcatgc 1260
tcctcctagt aactgtgtct gactgtgctg tgatcacagg ggcctgtgag cgggatgtcc 1320
agtgtggggc aggcacctgc tgtgccatca gcctgtggct tcgagggctg cggatgtgca 1380
ccccgctggg gcgggaaggc gaggagtgcc accccggcag ccacaagatc cccttcttca 1440
ggaaacgcaa gcaccacacc tgtccttgct tgcccaacct gctgtgctcc aggttcccgg 1500
acggcaggta ccgctgctcc atggacttga agaacatcaa tttttagcgt accgaattcc 1560
ctgtgacccc tccccagtgc ctctcctggc cctggaagtt gccactccag tgcccaccag 1620
ccttgtccta ataaaattaa gttgcatcat tttgtctgac taggtgtcct tctataatat 1680
tatggggtgg aggggggtgg tatggagcaa ggggcaagtt gggaagacaa cctgtagggc 1740
ctgcggggtc tattgggaac caagctggag tgcagtggca caatcttggc tcactgcaat 1800
ctccgcctcc tgggttcaag cgattctcct gcctcagcct cccgagttgt tgggattcca 1860
ggcatgcatg accaggctca gctaattttt gtttttttgg tagagacggg gtttcaccat 1920
attggccagg ctggtctcca actcctaatc tcaggtgatc tacccacctt ggcctcccaa 1980
attgctggga ttacaggcgt gaaccactgc tcccttccct gtccttacgc gtagaattgg 2040
taaagagagt cgtgtaaaat atcgagttcg cacatcttgt tgtctgatta ttgatttttg 2100
gcgaaaccat ttgatcatat gacaagatgt gtatctacct taacttaatg attttgataa 2160
aaatcattaa ctagtccatg gctgcctcgc gcgtttcggt gatgacggtg aaaacctctg 2220
acacatgcag ctcccggaga cggtcacagc ttgtctgtaa gcggatgccg ggagcagaca 2280
agcccgtcag ggcgcgtcag cgggtgttgg cgggtgtcgg ggcgcagcca tgacccagtc 2340
acgtagcgat agcggagtgt atactggctt aactatgcgg catcagagca gattgtactg 2400
agagtgcacc atatgcggtg tgaaataccg cacagatgcg taaggagaaa ataccgcatc 2460
aggcgctctt ccgcttcctc gctcactgac tcgctgcgct cggtcgttcg gctgcggcga 2520
gcggtatcag ctcactcaaa ggcggtaata cggttatcca cagaatcagg ggataacgca 2580
ggaaagaaca tgtgagcaaa aggccagcaa aaggccagga accgtaaaaa ggccgcgttg 2640
ctggcgtttt tccataggct ccgcccccct gacgagcatc acaaaaatcg acgctcaagt 2700
cagaggtggc gaaacccgac aggactataa agataccagg cgtttccccc tggaagctcc 2760
ctcgtgcgct ctcctgttcc gaccctgccg cttaccggat acctgtccgc ctttctccct 2820
tcgggaagcg tggcgctttc tcatagctca cgctgtaggt atctcagttc ggtgtaggtc 2880
gttcgctcca agctgggctg tgtgcacgaa ccccccgttc agcccgaccg ctgcgcctta 2940
tccggtaact atcgtcttga gtccaacccg gtaagacacg acttatcgcc actggcagca 3000
gccactggta acaggattag cagagcgagg tatgtaggcg gtgctacaga gttcttgaag 3060
tggtggccta actacggcta cactagaaga acagtatttg gtatctgcgc tctgctgaag 3120
ccagttacct tcggaaaaag agttggtagc tcttgatccg gcaaacaaac caccgctggt 3180
agcggtggtt tttttgtttg caagcagcag attacgcgca gaaaaaaagg atctcaagaa 3240
gatcctttga tcttttctac ggggtctgac gctcagtgga acgaaaactc acgttaaggg 3300
attttggtca tgagattatc aaaaaggatc ttcacctaga tccttttaaa ttaaaaatga 3360
agttttaaat caatctaaag tatatatgag taaacttggt ctgacagtta ccaatgctta 3420
atcagtgagg cacctatctc agcgatctgt ctatttcgtt catccatagt tgcctgactc 3480
c 3481
<210> 11
<211> 3553
<212> DNA
<213> Homo Sapiens
<400> 11
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatatcg tcgaccacca tgaggagcct gtgctgcgcc ccactcctgc 1260
tcctcttgct gctgccgccg ctgctgctca cgccccgcgc tggggacgcc gccgtgatca 1320
ccggggcttg tgacaaggac tcccaatgtg gtggaggcat gtgctgtgct gtcagtatct 1380
gggtcaagag cataaggatt tgcacaccta tgggcaaact gggagacagc tgccatccac 1440
tgactcgtaa aaacaatttt ggaaatggaa ggcaggaaag aagaaagagg aagagaagca 1500
aaaggaaaaa ggaggttcca ttttttgggc ggaggatgca tcacacttgc ccatgtctgc 1560
caggcttggc ctgtttacgg acttcattta accgatttat ttgtttagcc caaaagtaag 1620
gtaccgaatt ccctgtgacc cctccccagt gcctctcctg gccctggaag ttgccactcc 1680
agtgcccacc agccttgtcc taataaaatt aagttgcatc attttgtctg actaggtgtc 1740
cttctataat attatggggt ggaggggggt ggtatggagc aaggggcaag ttgggaagac 1800
aacctgtagg gcctgcgggg tctattggga accaagctgg agtgcagtgg cacaatcttg 1860
gctcactgca atctccgcct cctgggttca agcgattctc ctgcctcagc ctcccgagtt 1920
gttgggattc caggcatgca tgaccaggct cagctaattt ttgttttttt ggtagagacg 1980
gggtttcacc atattggcca ggctggtctc caactcctaa tctcaggtga tctacccacc 2040
ttggcctccc aaattgctgg gattacaggc gtgaaccact gctcccttcc ctgtccttac 2100
gcgtagaatt ggtaaagaga gtcgtgtaaa atatcgagtt cgcacatctt gttgtctgat 2160
tattgatttt tggcgaaacc atttgatcat atgacaagat gtgtatctac cttaacttaa 2220
tgattttgat aaaaatcatt aactagtcca tggctgcctc gcgcgtttcg gtgatgacgg 2280
tgaaaacctc tgacacatgc agctcccgga gacggtcaca gcttgtctgt aagcggatgc 2340
cgggagcaga caagcccgtc agggcgcgtc agcgggtgtt ggcgggtgtc ggggcgcagc 2400
catgacccag tcacgtagcg atagcggagt gtatactggc ttaactatgc ggcatcagag 2460
cagattgtac tgagagtgca ccatatgcgg tgtgaaatac cgcacagatg cgtaaggaga 2520
aaataccgca tcaggcgctc ttccgcttcc tcgctcactg actcgctgcg ctcggtcgtt 2580
cggctgcggc gagcggtatc agctcactca aaggcggtaa tacggttatc cacagaatca 2640
ggggataacg caggaaagaa catgtgagca aaaggccagc aaaaggccag gaaccgtaaa 2700
aaggccgcgt tgctggcgtt tttccatagg ctccgccccc ctgacgagca tcacaaaaat 2760
cgacgctcaa gtcagaggtg gcgaaacccg acaggactat aaagatacca ggcgtttccc 2820
cctggaagct ccctcgtgcg ctctcctgtt ccgaccctgc cgcttaccgg atacctgtcc 2880
gcctttctcc cttcgggaag cgtggcgctt tctcatagct cacgctgtag gtatctcagt 2940
tcggtgtagg tcgttcgctc caagctgggc tgtgtgcacg aaccccccgt tcagcccgac 3000
cgctgcgcct tatccggtaa ctatcgtctt gagtccaacc cggtaagaca cgacttatcg 3060
ccactggcag cagccactgg taacaggatt agcagagcga ggtatgtagg cggtgctaca 3120
gagttcttga agtggtggcc taactacggc tacactagaa gaacagtatt tggtatctgc 3180
gctctgctga agccagttac cttcggaaaa agagttggta gctcttgatc cggcaaacaa 3240
accaccgctg gtagcggtgg tttttttgtt tgcaagcagc agattacgcg cagaaaaaaa 3300
ggatctcaag aagatccttt gatcttttct acggggtctg acgctcagtg gaacgaaaac 3360
tcacgttaag ggattttggt catgagatta tcaaaaagga tcttcaccta gatcctttta 3420
aattaaaaat gaagttttaa atcaatctaa agtatatatg agtaaacttg gtctgacagt 3480
taccaatgct taatcagtga ggcacctatc tcagcgatct gtctatttcg ttcatccata 3540
gttgcctgac tcc 3553
<---
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ОЛИГОНУКЛЕОТИДОВ
(1) Олигонуклеотид ANG_F TTTGTCGACCACCATGGTGATGGGCCTGGGCGTT
(2) Олигонуклеотид ANG_R AATGGTACCTTACGGACGACGGAAAATTGACTG
(3) Олигонуклеотид ANG_SF TGGGCGTTTTGTTGTTGGTC
(4) Олигонуклеотид ANG_FR TGTCTTTGCAGGGTGAGGTC
(5) Олигонуклеотид ANGPT1_F TTTGTCGACCACCATGACAGTTTTCCTTTCCTTTGCTTTCC
(6) Олигонуклеотид ANGPT1_R AATGGTACCTCAAAAATCTAAAGGTCGAATCATCATAGTTG
(7) Олигонуклеотид ANGPT1_SF TGCAGAGAGATGCTCCACAC
(8) Олигонуклеотид ANGPT1_FR ATGGTAGCCGTGTGGTTCTG
(9) VEGFA_F GGGGGATCCACCATGACGGACAGACAGACAGACACCGC
(10) VEGFA_R TTTGGATCCACCATGAACTTTCTGCTGTCTTGGGTGC
(11) VEGFA_SF TCTGCTGTCTTGGGTGCATT
(12) VEGFA_SR CCAGGGTCTCGATTGGATGG
(13) Олигонуклеотид FGF_F TTTGTCGACCACCATGGCTGAAGGGGAAATCACC
(14) Олигонуклеотид FGF_R AATGGTACCTTAATCAGAAGAGACTGGCAGGGG
(15) Олигонуклеотид FGF_SF CAGTGGATGGGACAAGGGAC
(16) Олигонуклеотид FGF_FR GGTTCTCCTCCAGCCTTTCC
(17) Олигонуклеотид HIF_F TTTGTCGACCACCATGGAGGGCGCCGGCGGCGCGA
(18) Олигонуклеотид HIF_R AATGGTACCTCAGTTAACTTGATCCAAAGCTCTGAGTAATTC
(19) Олигонуклеотид HIF_SF TTTTGGCAGCAACGACACAG
(20) Олигонуклеотид HIF_FR GTGCAGGGTCAGCACTACTT
(21) Олигонуклеотид HGF_F TTTGGATCCACCATGTGGGTGACCAAACTCCTGCCA
(22) Олигонуклеотид HGF_R AATGTCGACCTATGACTGTGGTACCTTATATGTTAAAAT
(23) Олигонуклеотид HGF_SF ACCCTGGTGTTTCACAAGCA
(24) Олигонуклеотид HGF_FR GCAAGAATTTGTGCCGGTGT
(25) Олигонуклеотид SDF_F AGGATCCCACCATGAACGCCAAGGTCGTGGT
(26) Олигонуклеотид SDF_R TATGAATTCACATCTTGAACCTCTTGTTTAAAGC
(27) Олигонуклеотид SDF_SF TGAGCTACAGATGCCCATGC
(28) Олигонуклеотид SDF_FR TAGCTTCGGGTCAATGCACA
(29) Олигонуклеотид KLK_F TTTGTCGACCACCATGGCCACAGCAGGAAATCCC
(30) Олигонуклеотид KLK_R TTTTTGAATTCTTAACTGGCCTGGACGGTTTTCTC
(31) Олигонуклеотид KLK_SF CGGAGCATCAGCATTGCTTC
(32) Олигонуклеотид KLK_FR GAACATGCTGGGGTGGTACA
(33) Олигонуклеотид PDGFC_F TTTGTCGACCACCATGAGCCTCTTCGGGCTTCTCC
(34) Олигонуклеотид PDGFC_R AATGGTACCTATCCTCCTGTGCTCCCTCTGCAC
(35) Олигонуклеотид PDGFC_SF ATATTAGGGCGCTGGTGTGG
(36) Олигонуклеотид PDGFC_FR AGCACTGAAGGACTCACAGC
(37) Олигонуклеотид PROK1_F TATGTCGACCACCATGAGAGGTGCCACGCGAG
(38) Олигонуклеотид PROK1_R
TATGGAATTCGGTACGCTAAAAATTGATGTTCTTCAAGTCCA
(39) Олигонуклеотид PROK1_SF ATCAGCCTGTGGCTTCGAG
(40) Олигонуклеотид PROK1_SR TCAAGTCCATGGAGCAGCG
(41) Олигонуклеотид PROK2_F TTTGTCGACCACCATGAGGAGCCTGTGCTGCG
(42) Олигонуклеотид PROK2_R AATGGTACCTTACTTTTGGGCTAAACAAATAAATCGG
(43) Олигонуклеотид PROK2_SF ATGGGCAAACTGGGAGACAG
(44) Олигонуклеотид PROK2_SR ATGGGCAAACTGGGAGACAG
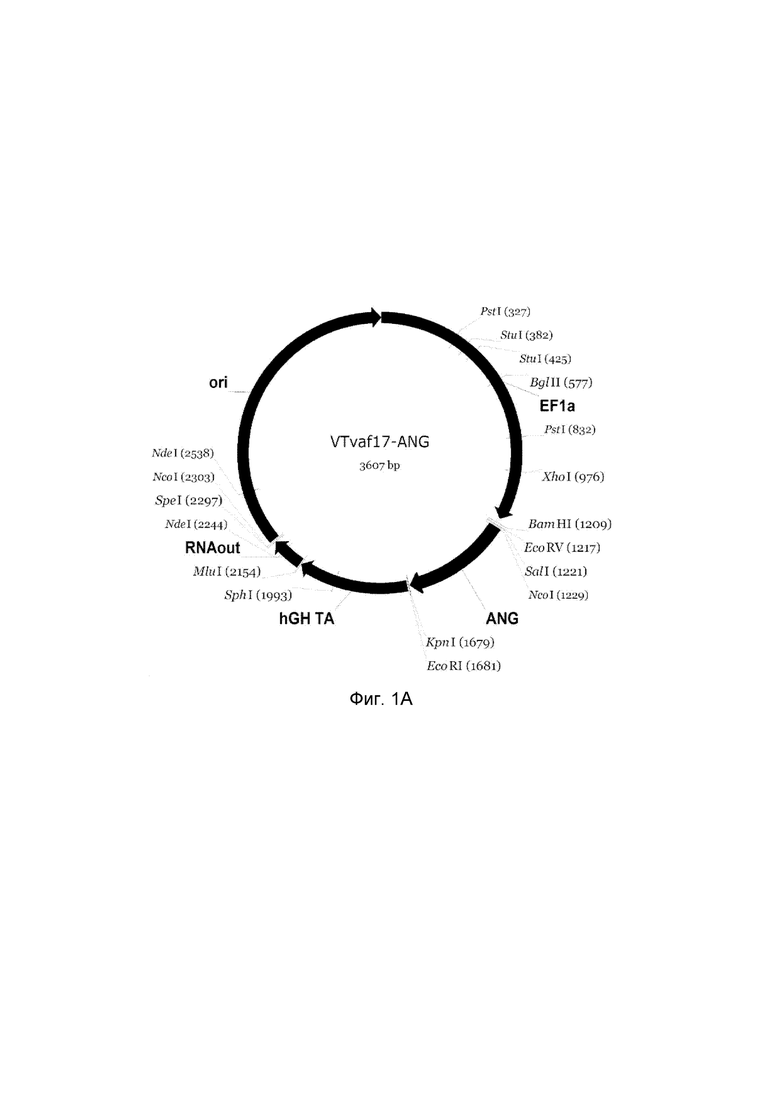
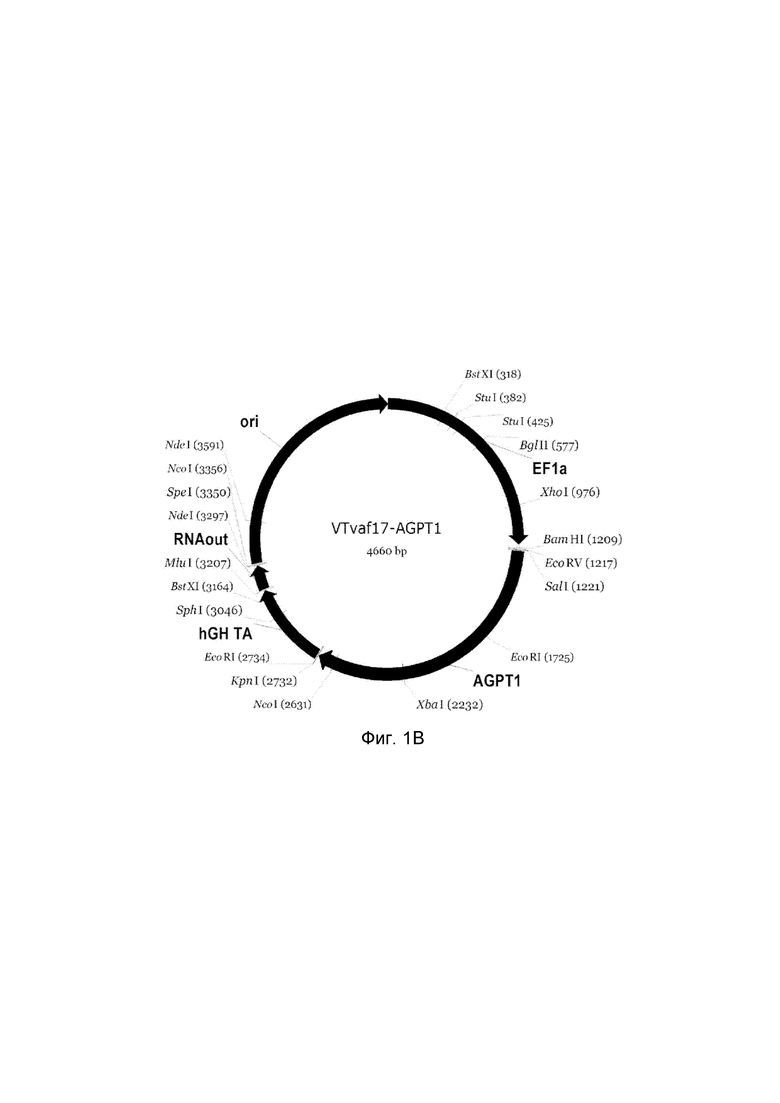
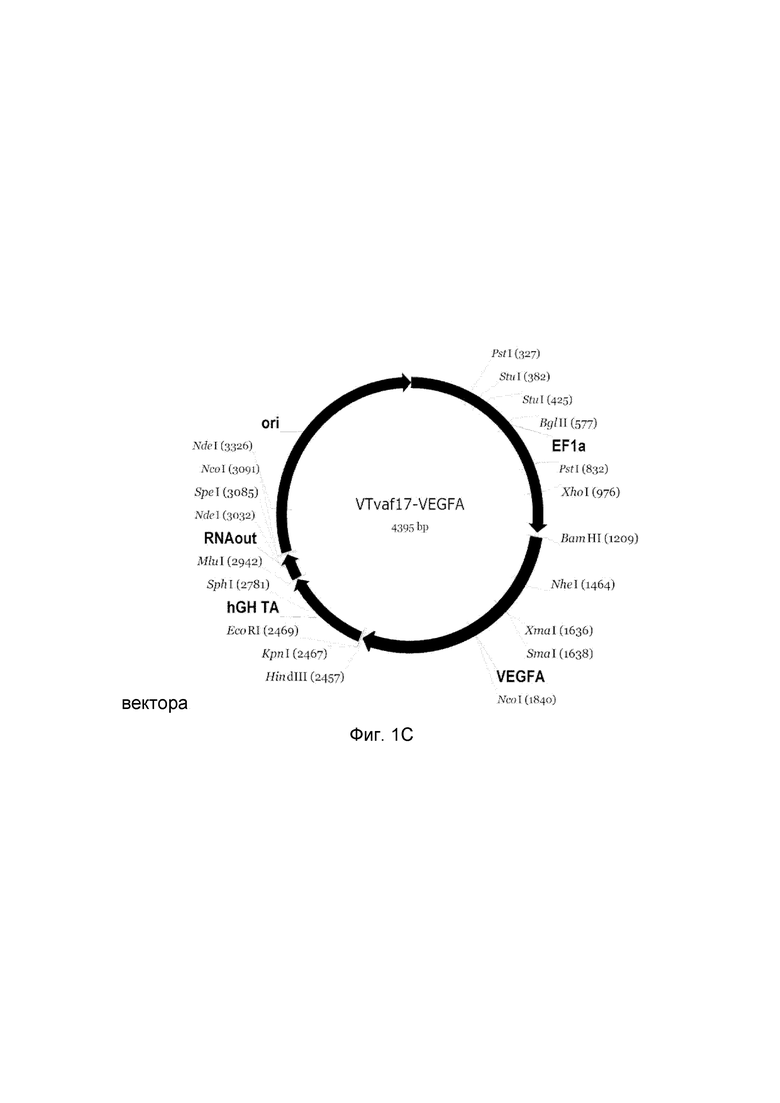


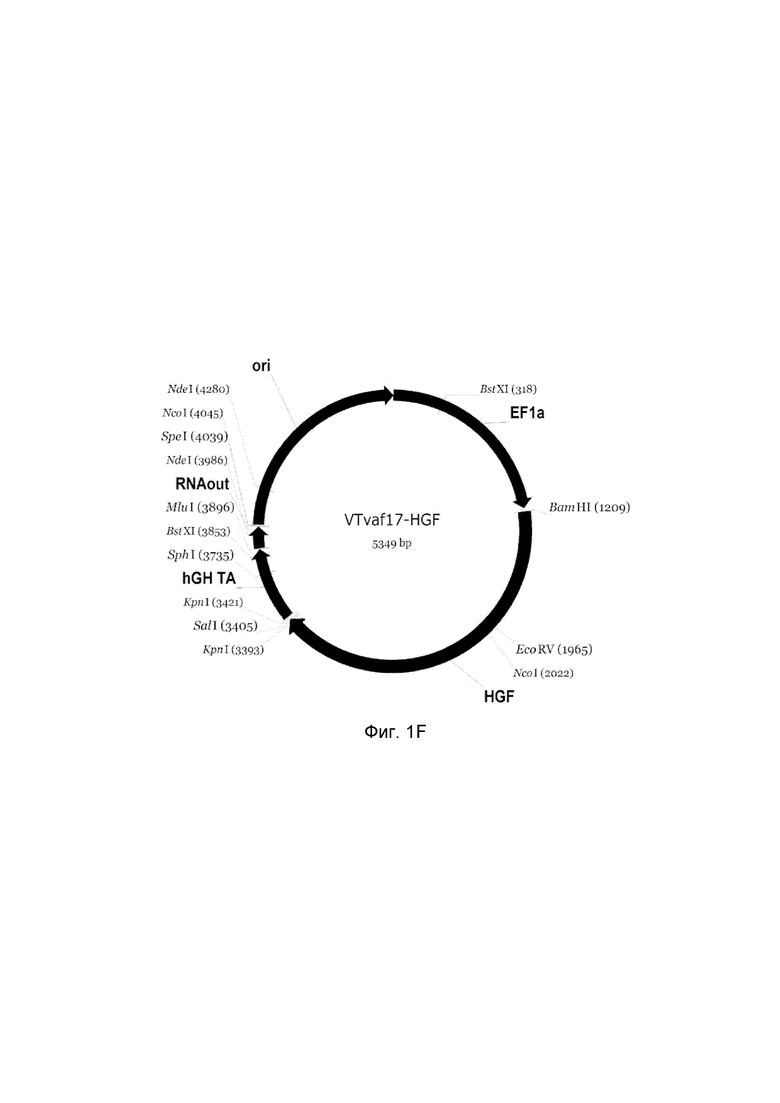
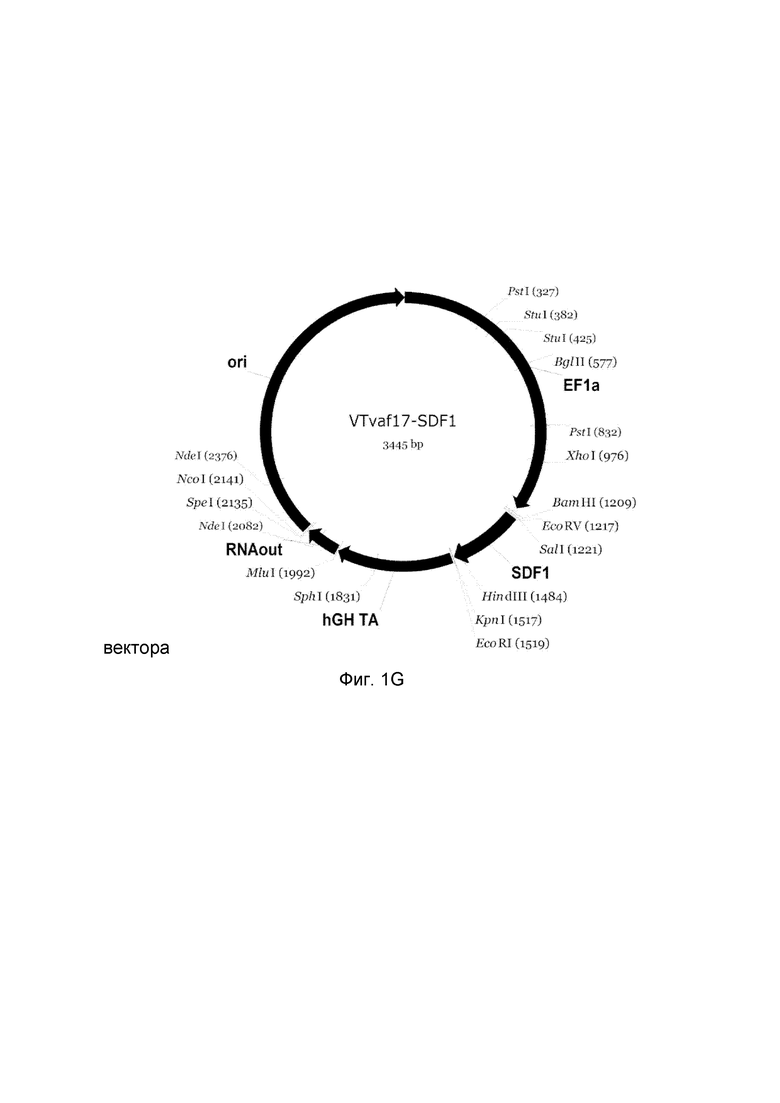
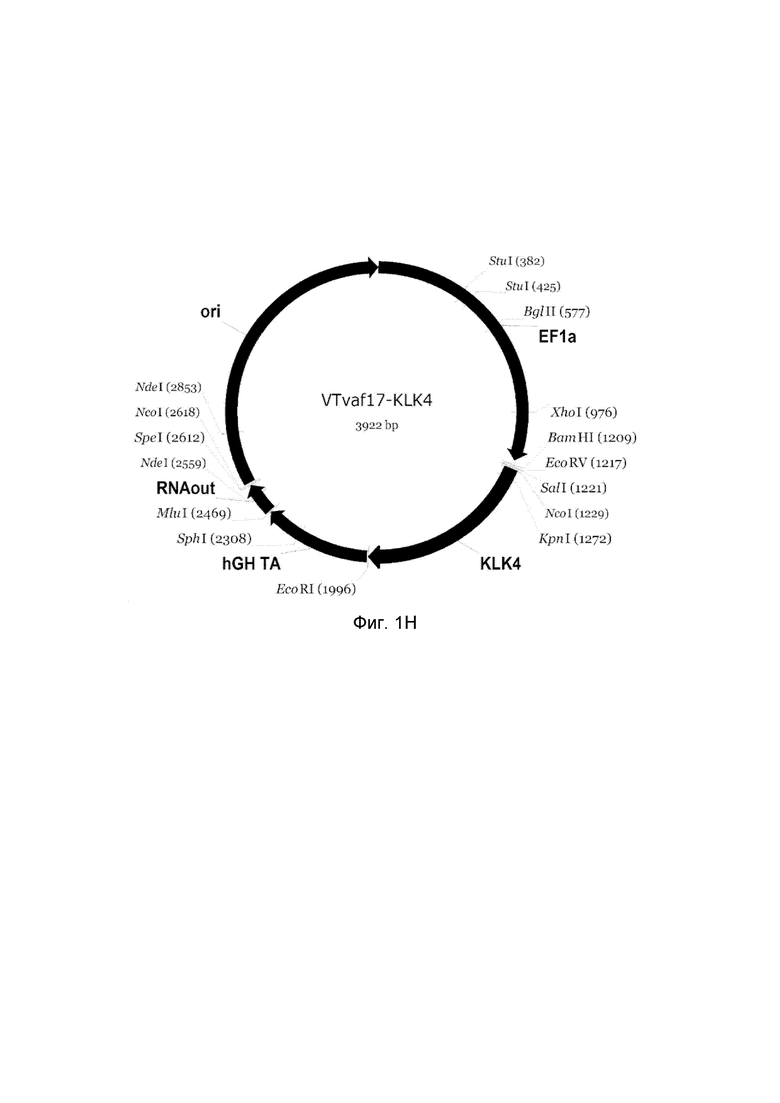

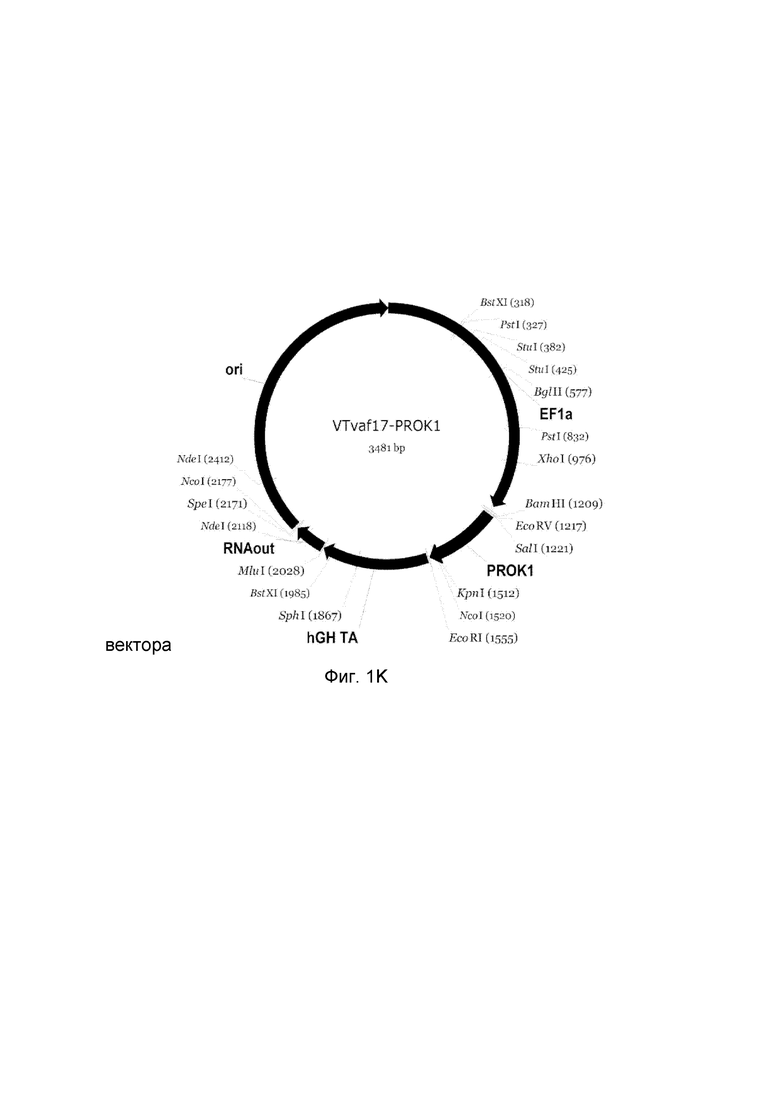
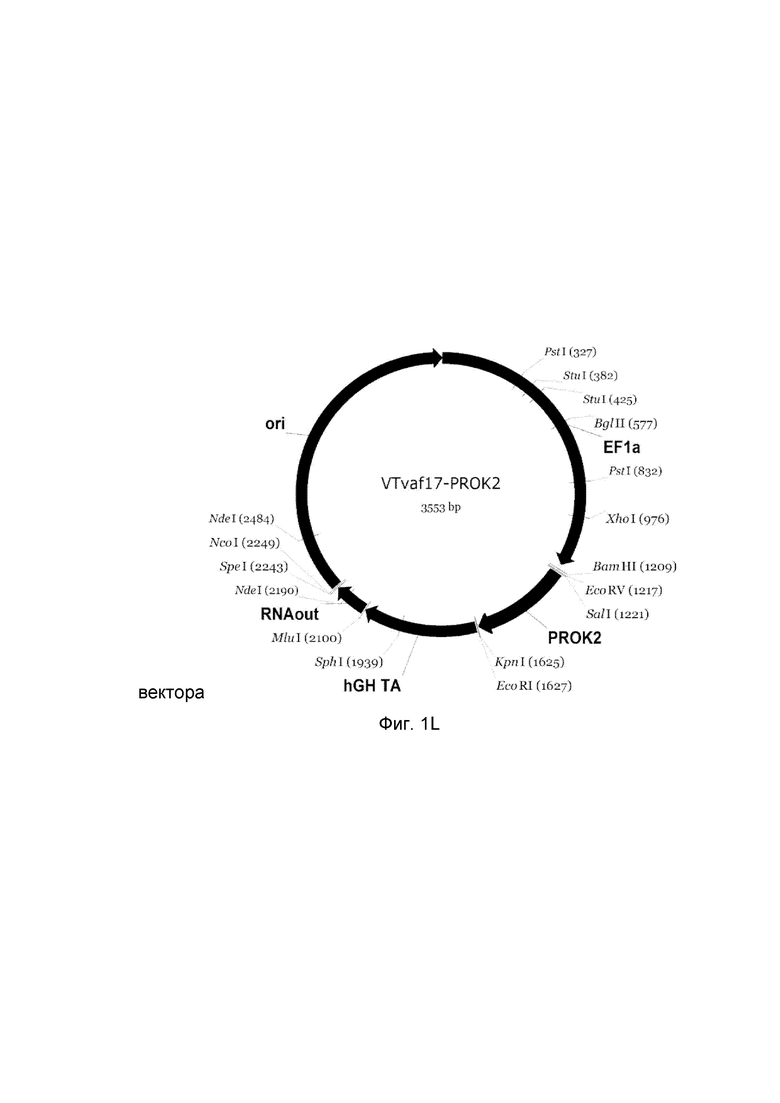
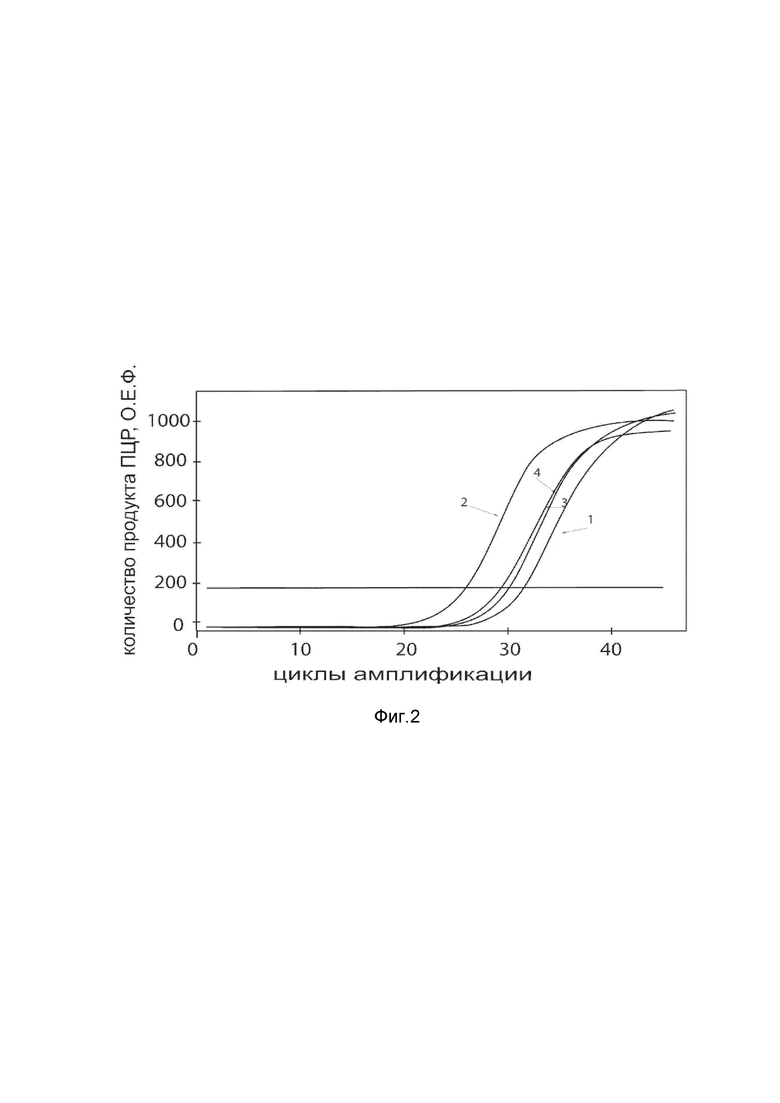
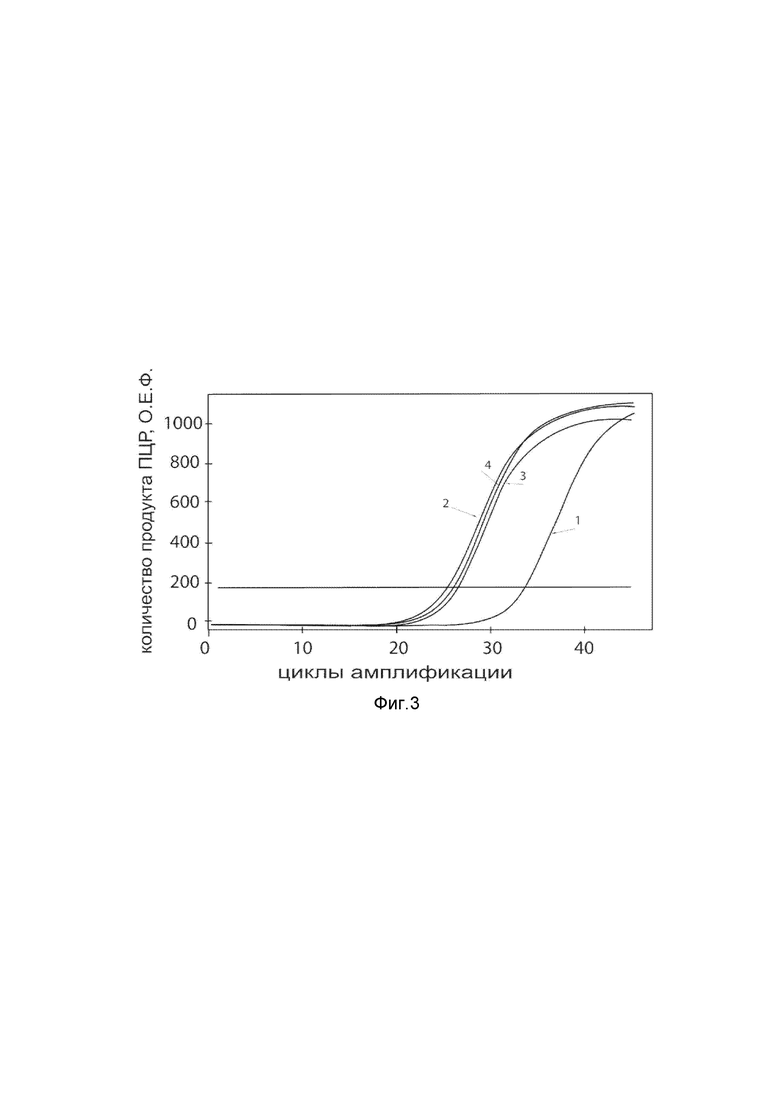
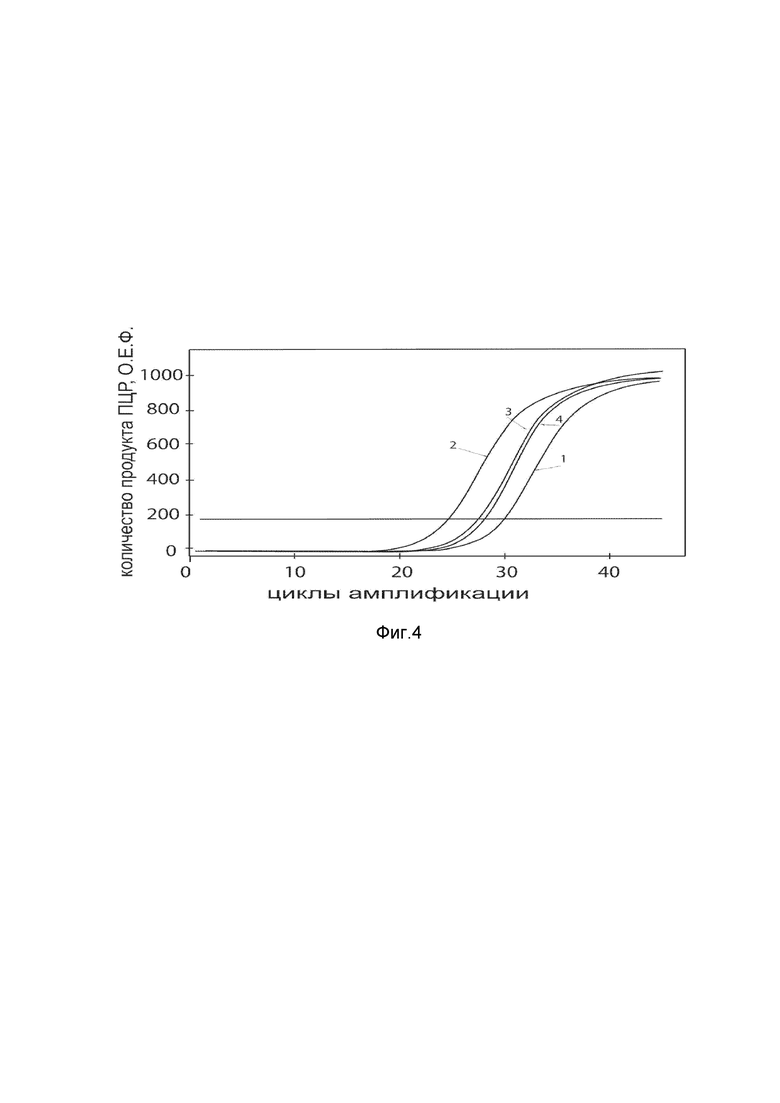
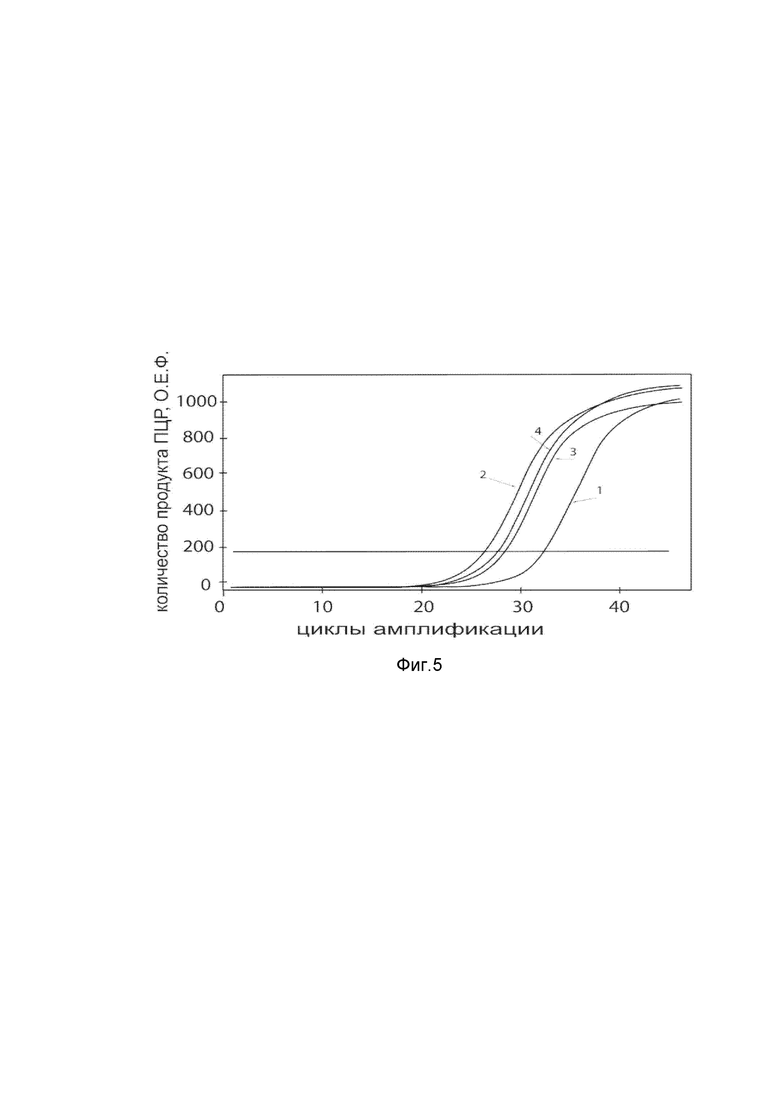
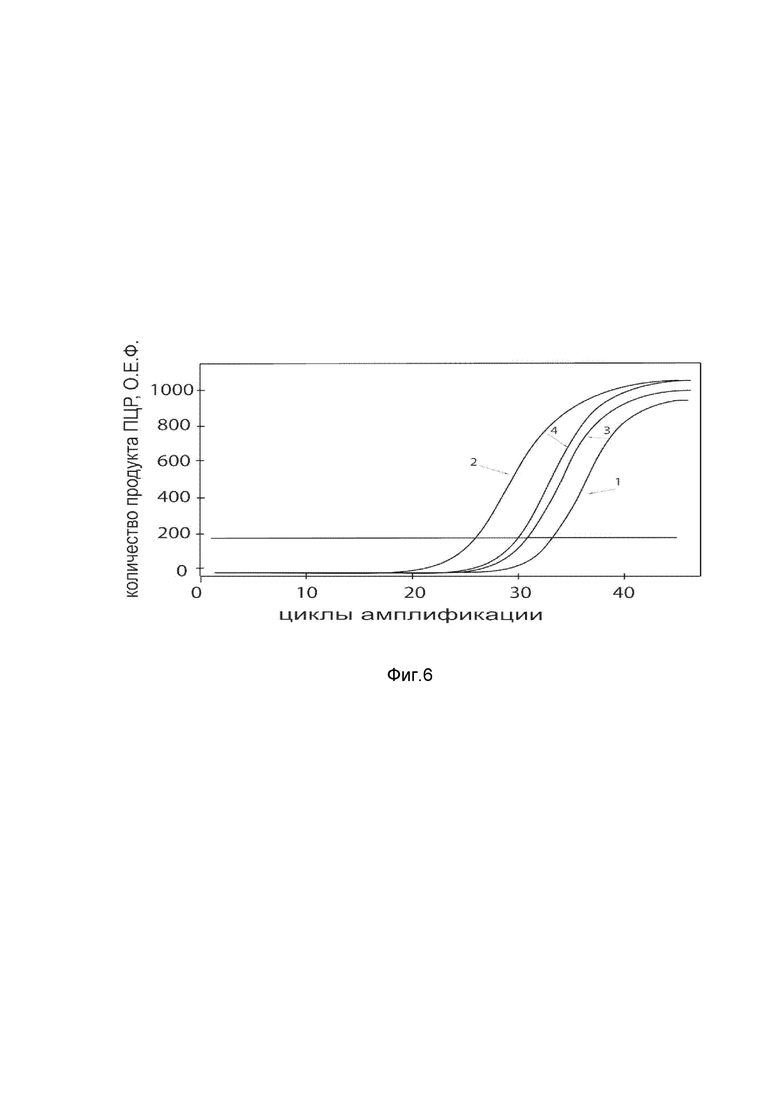
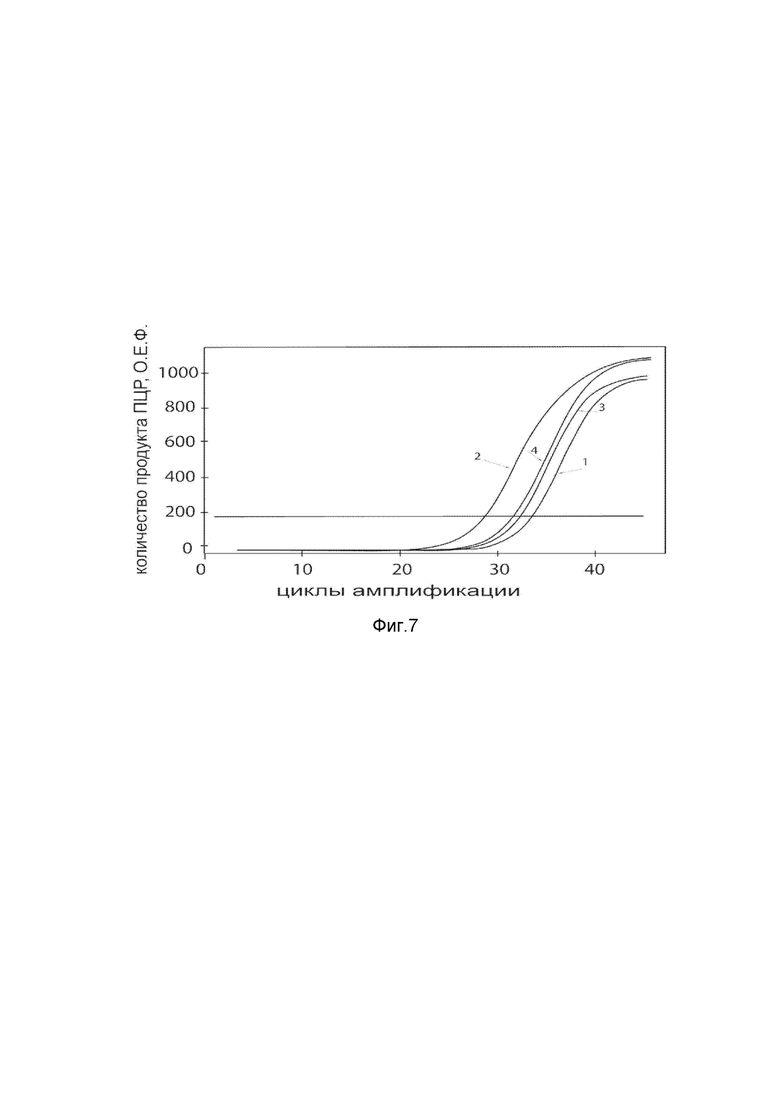
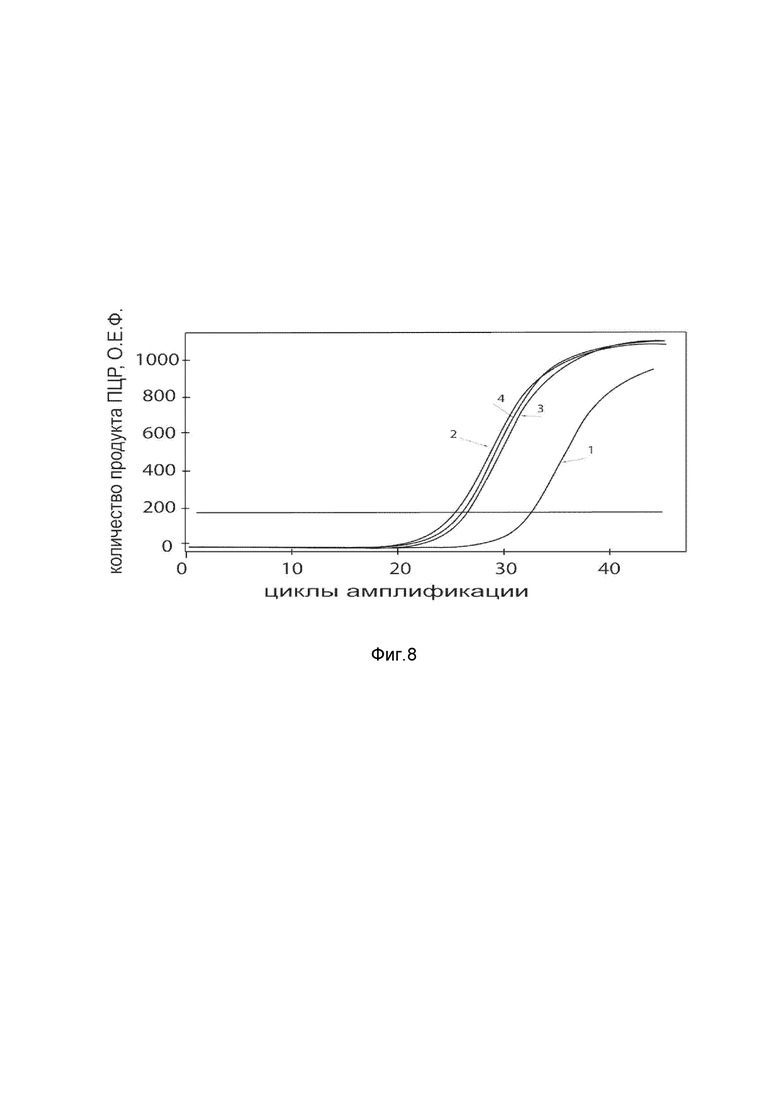
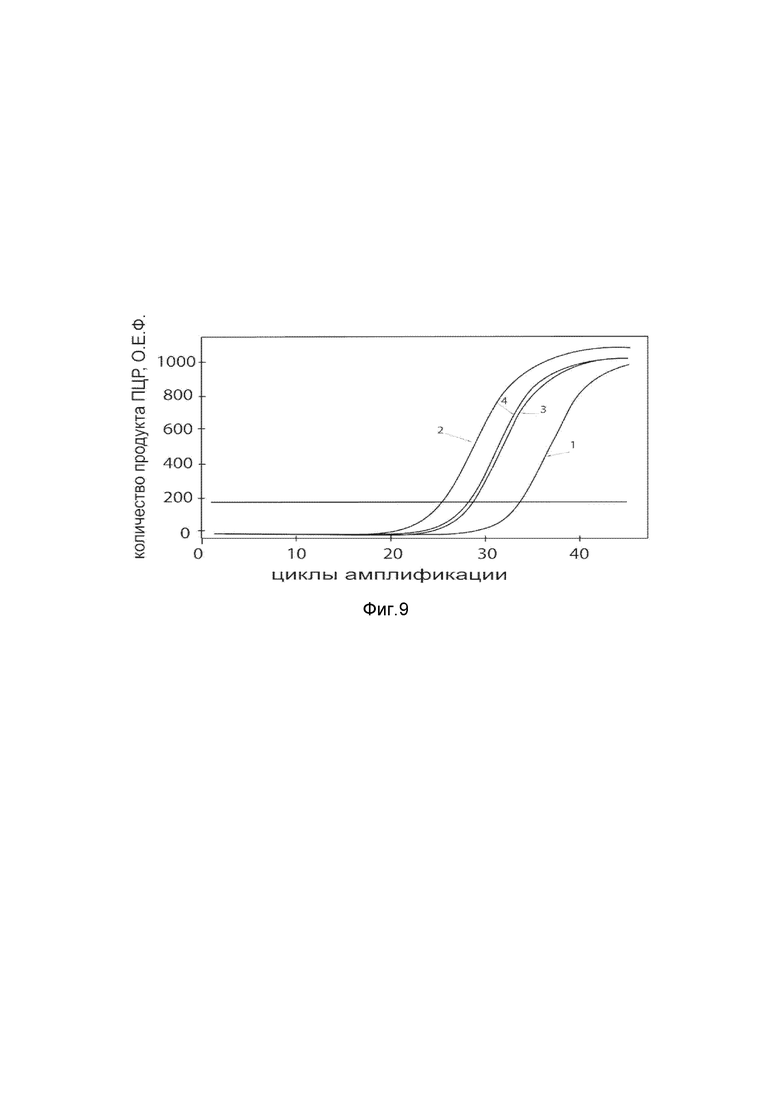
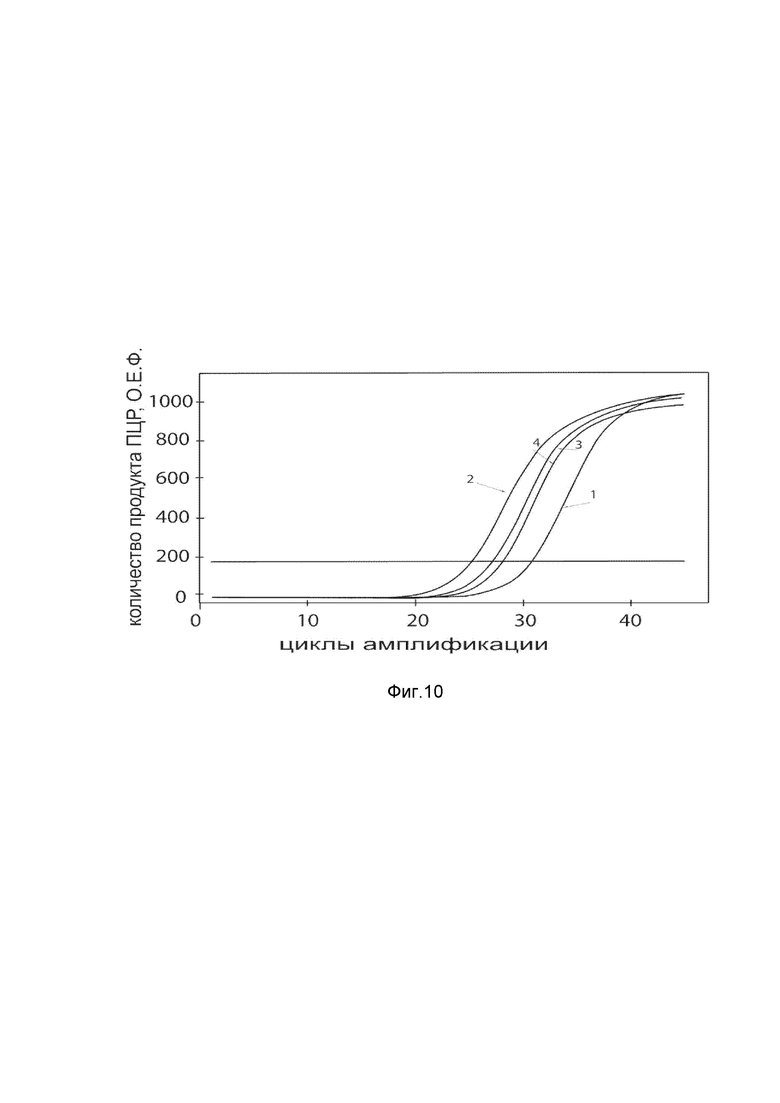
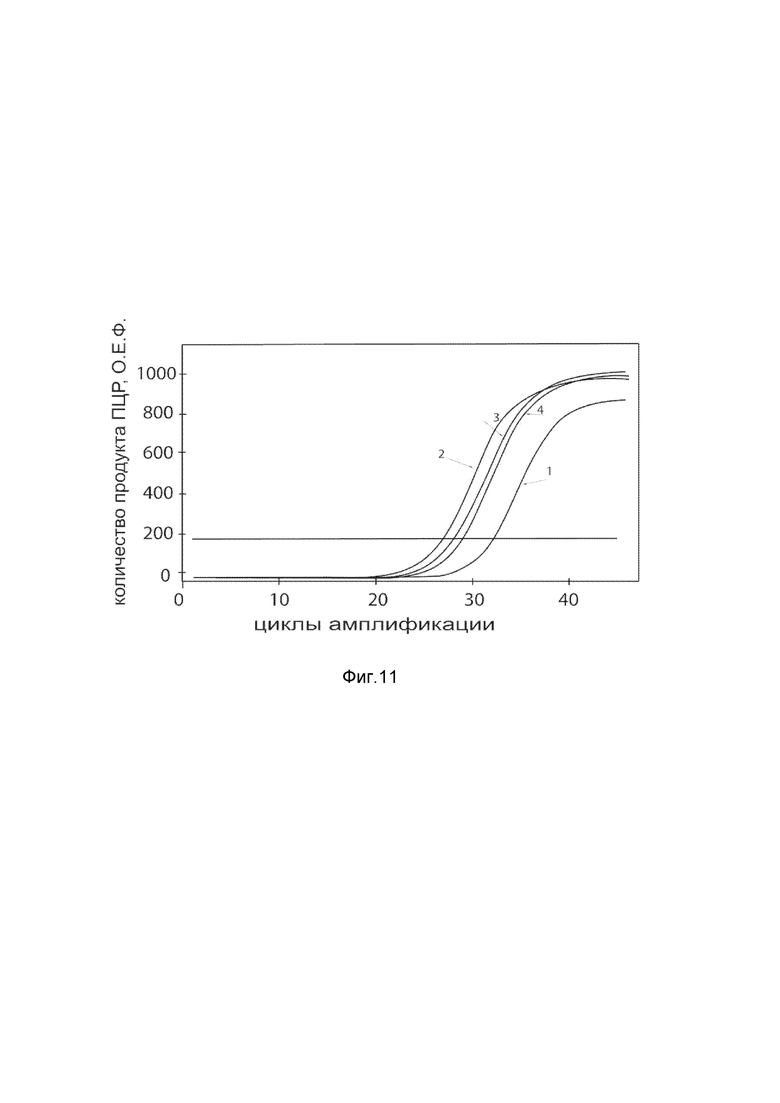

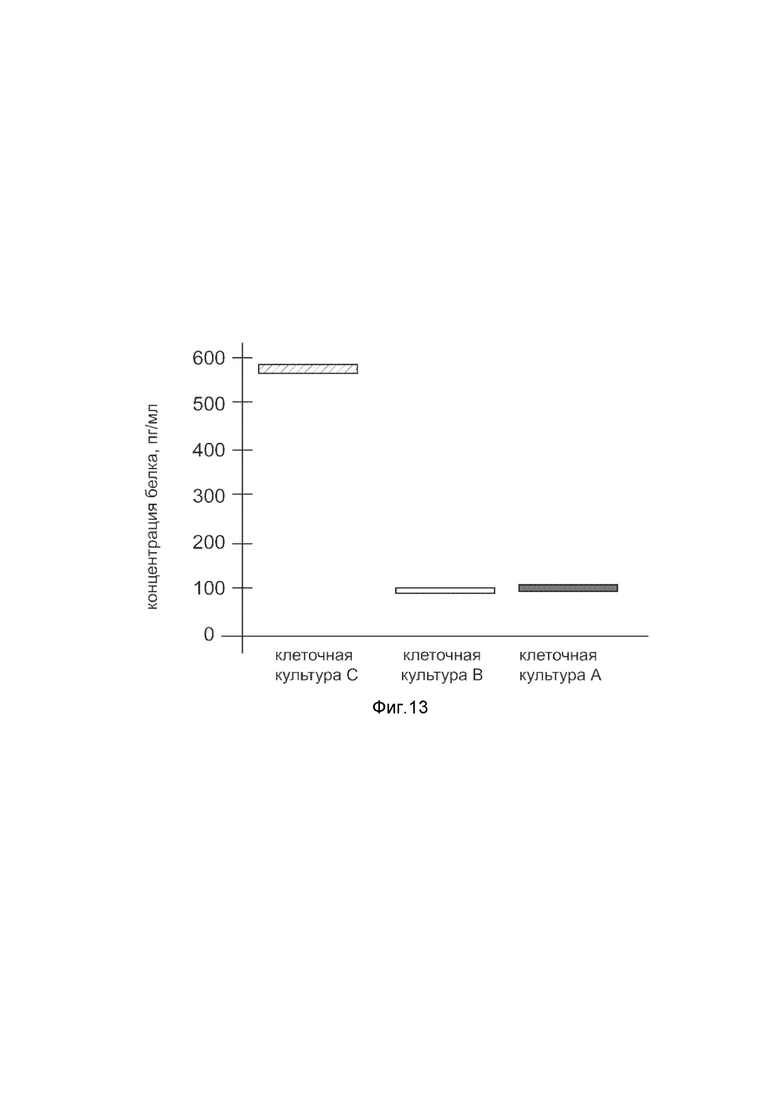

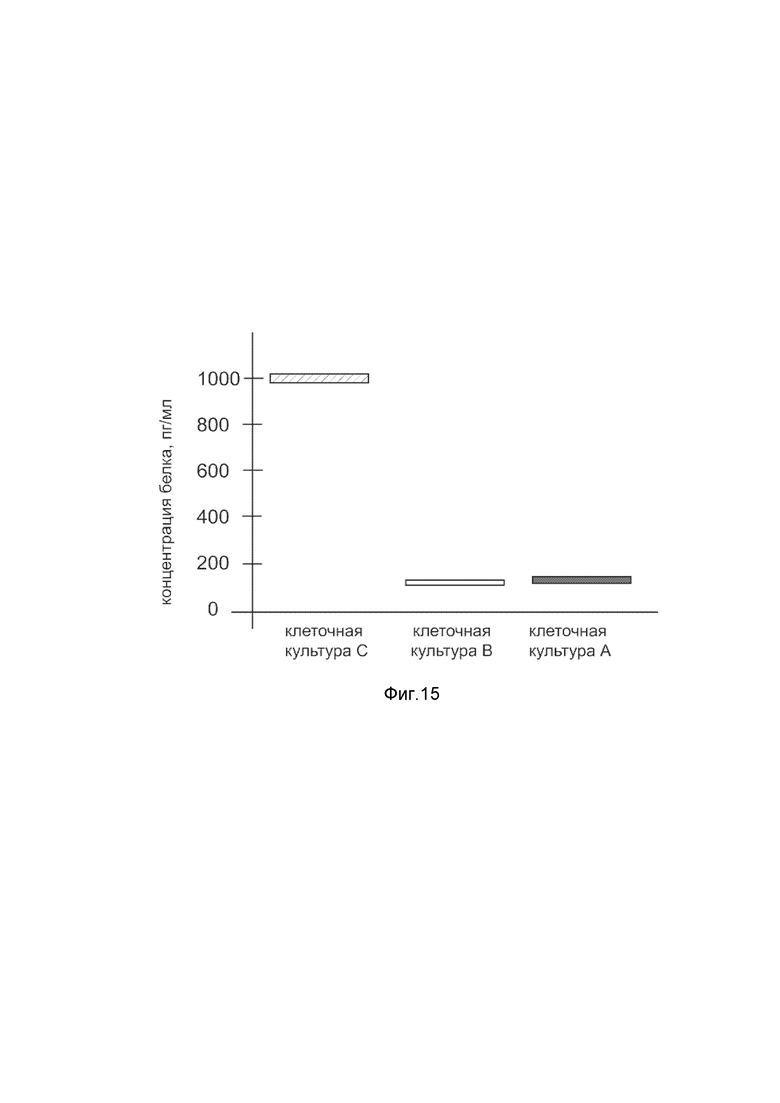
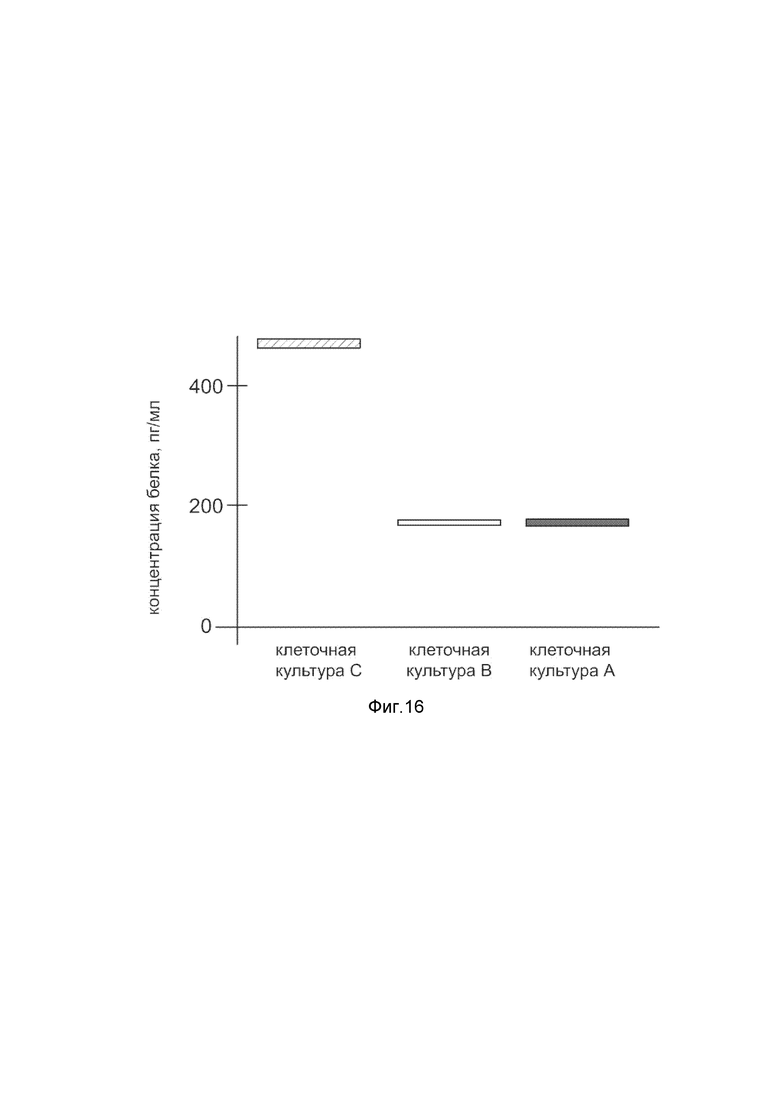
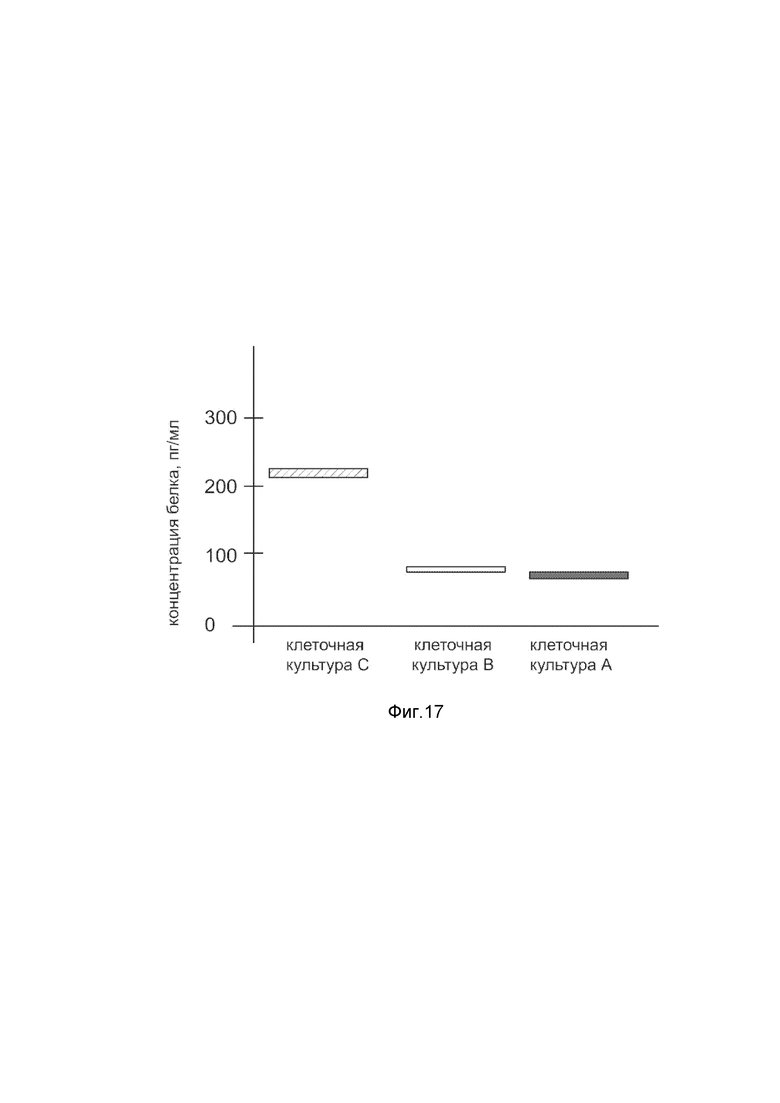
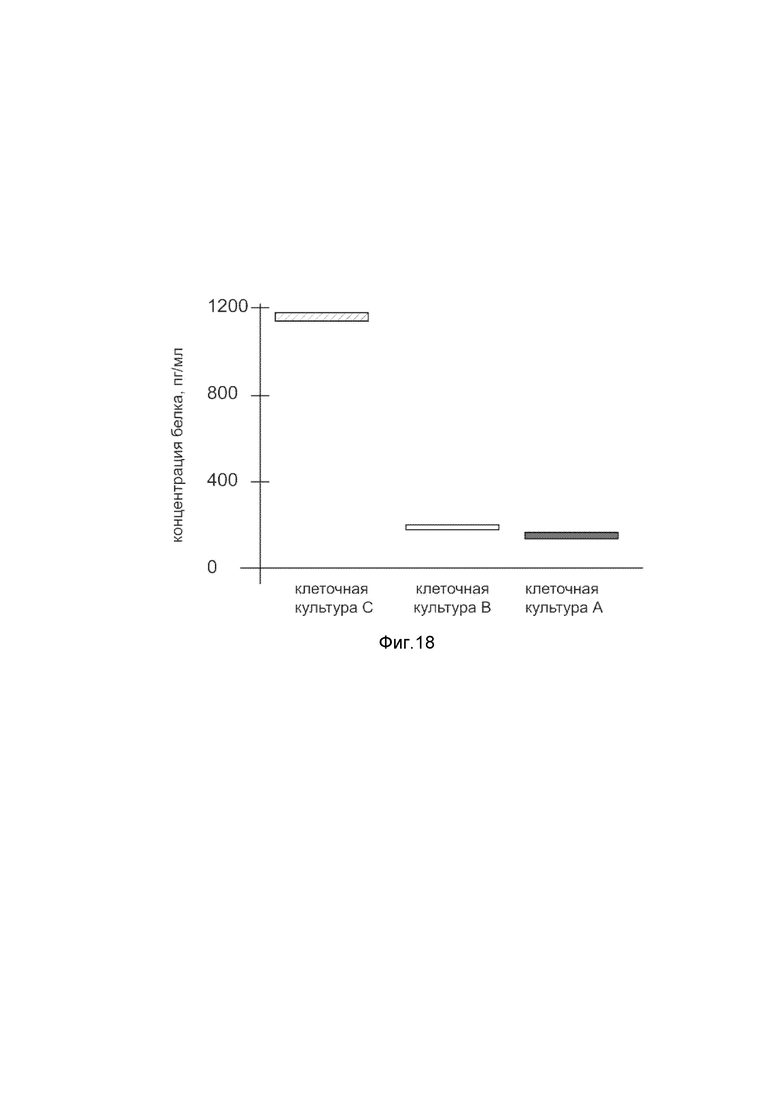
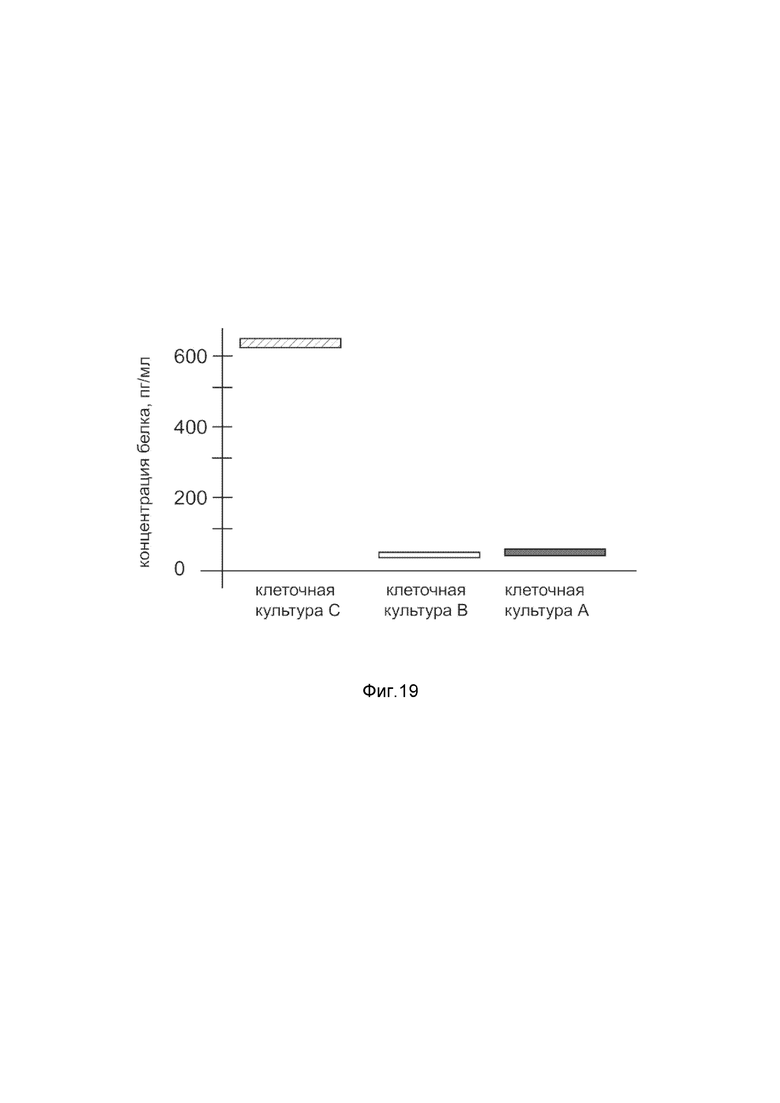
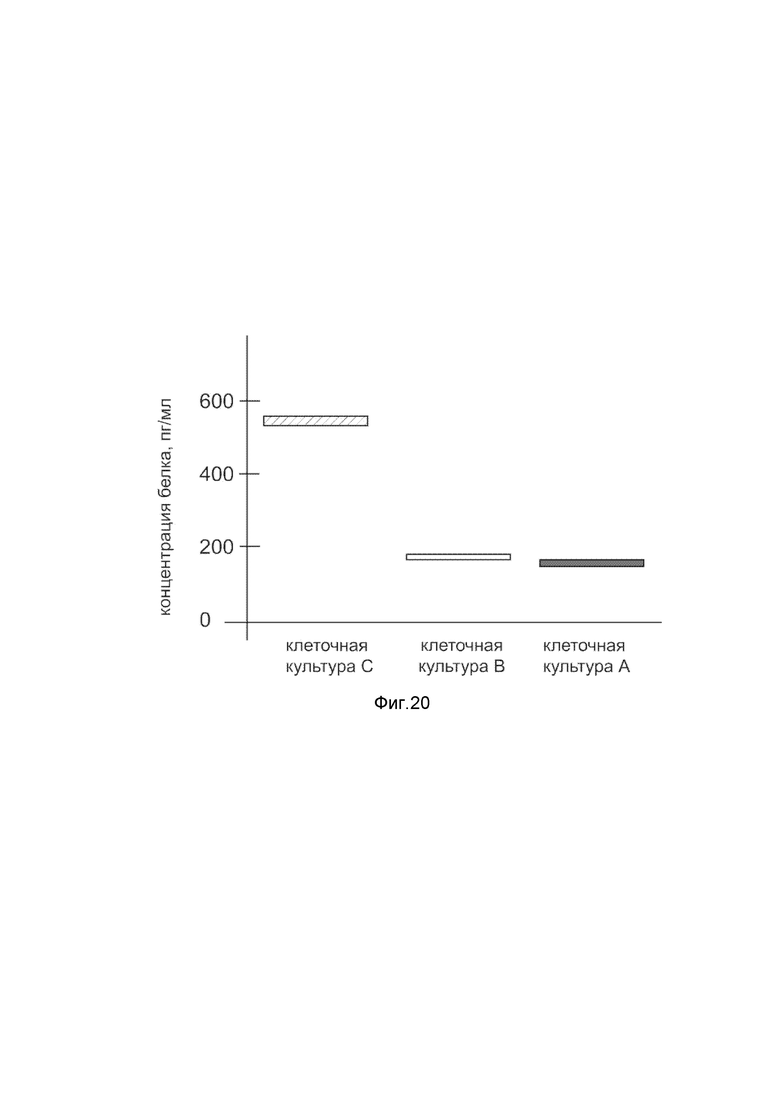
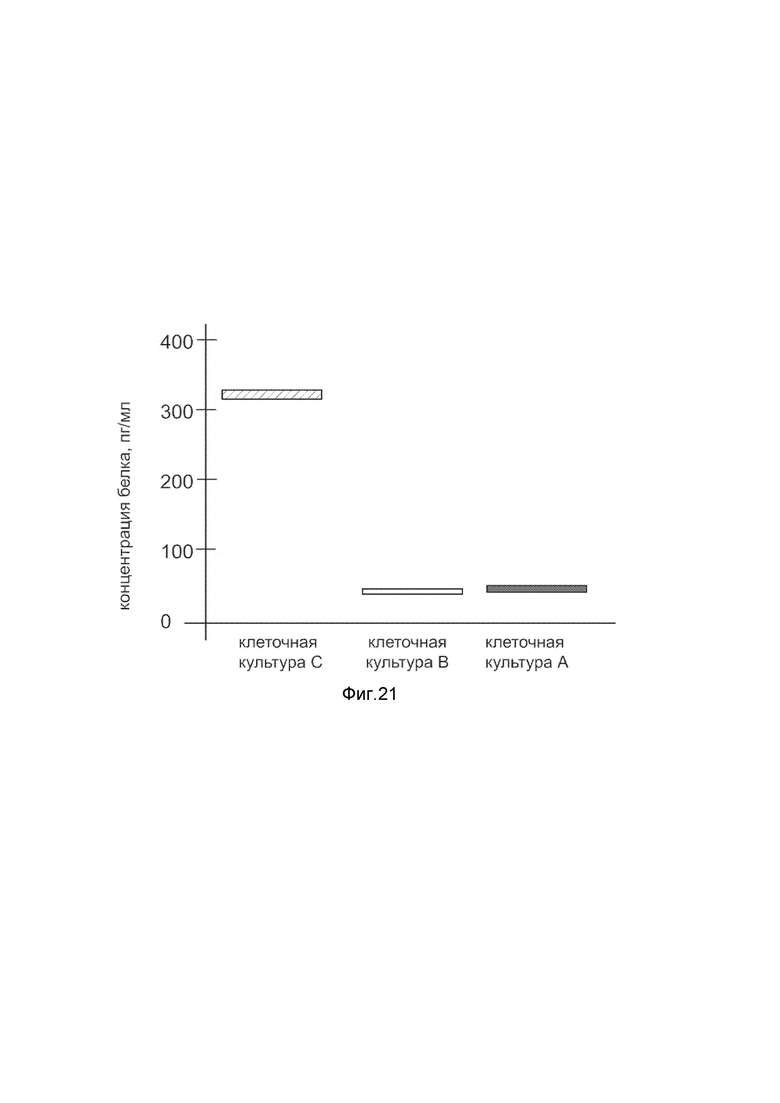
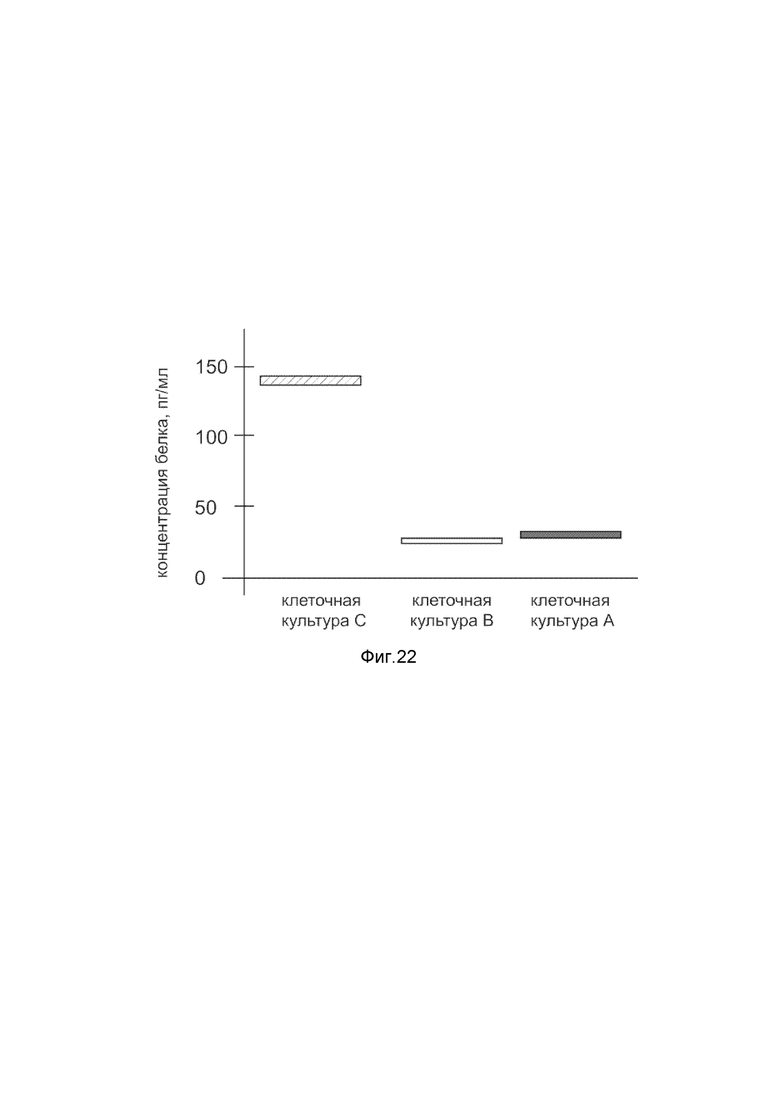
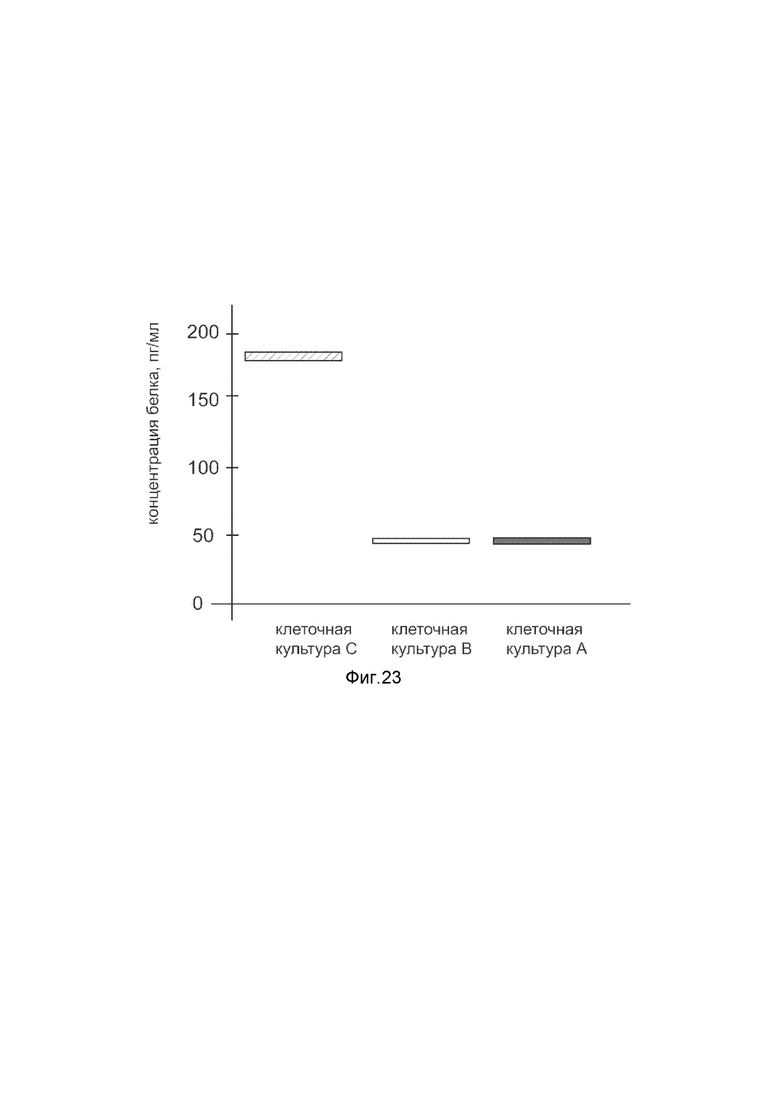
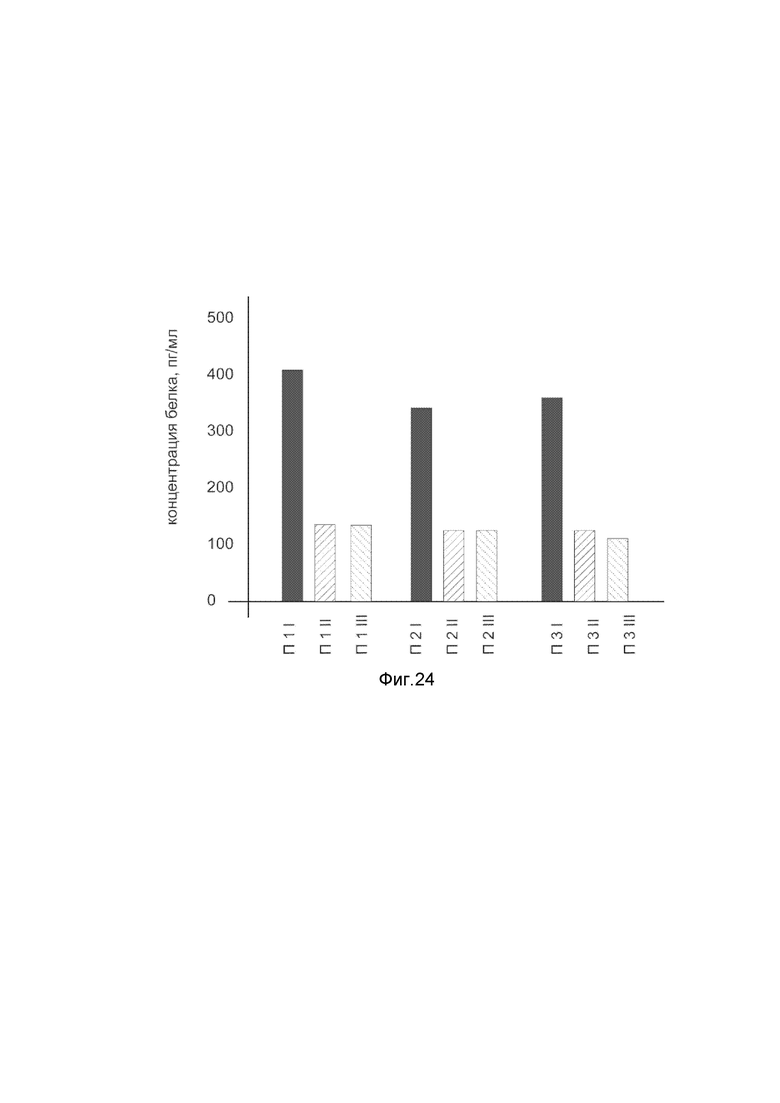
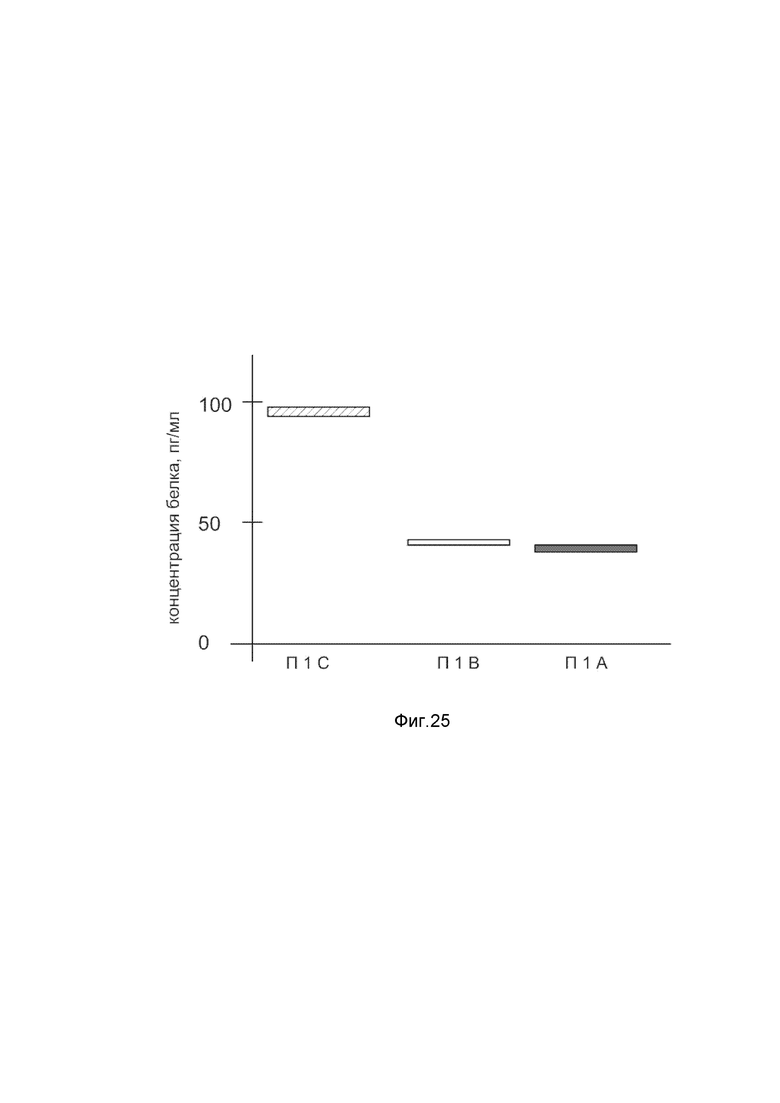
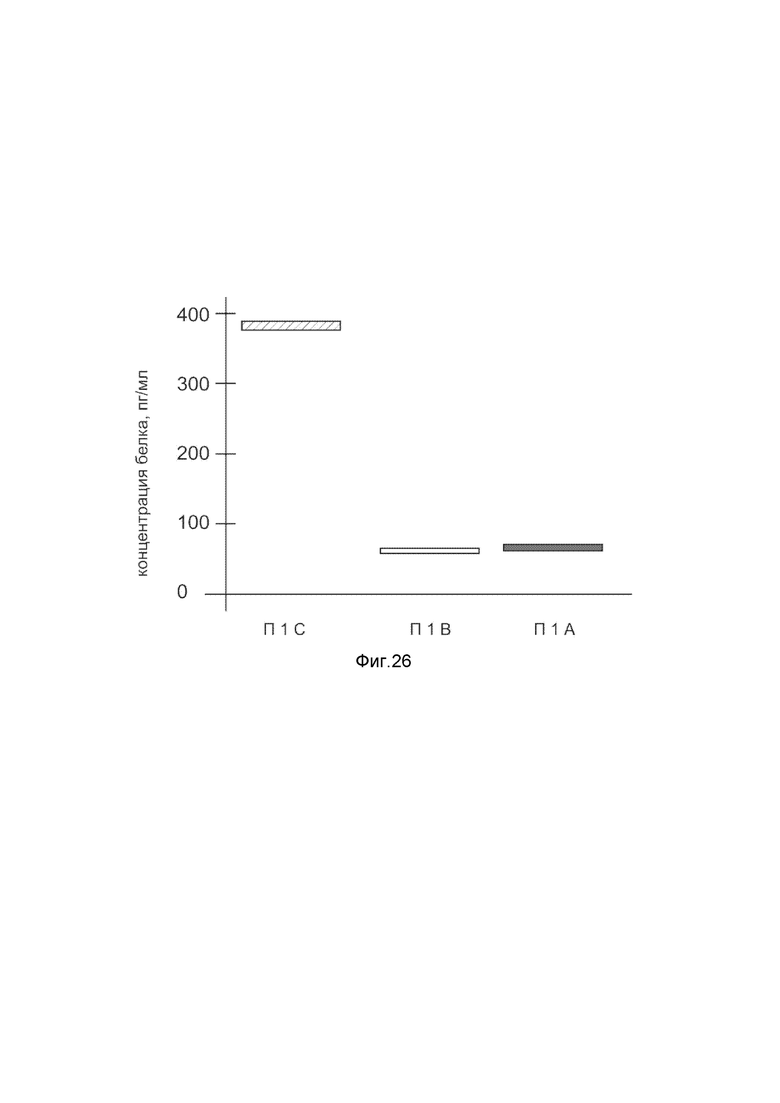
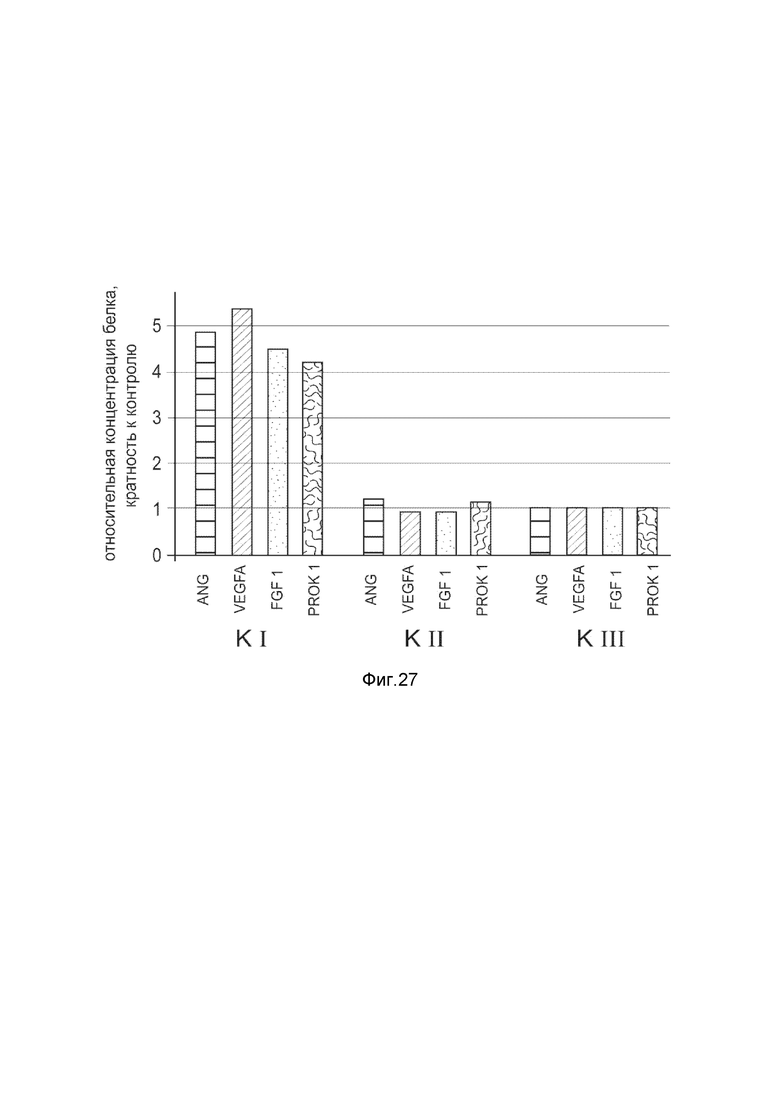
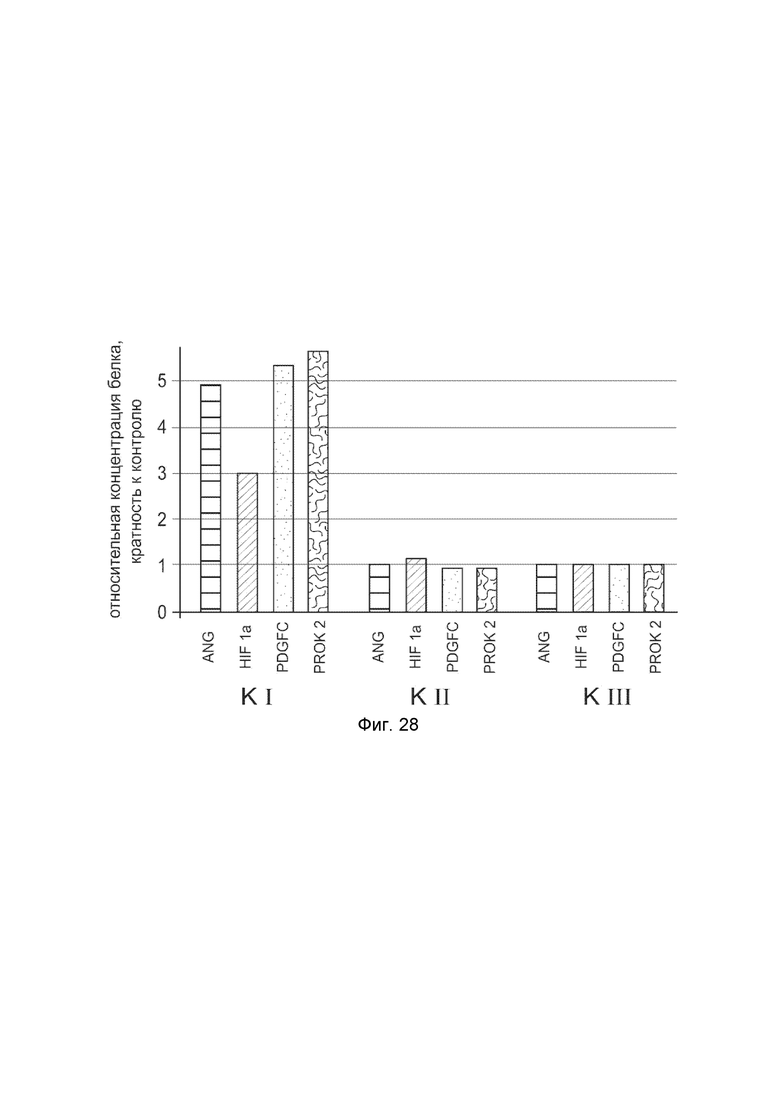
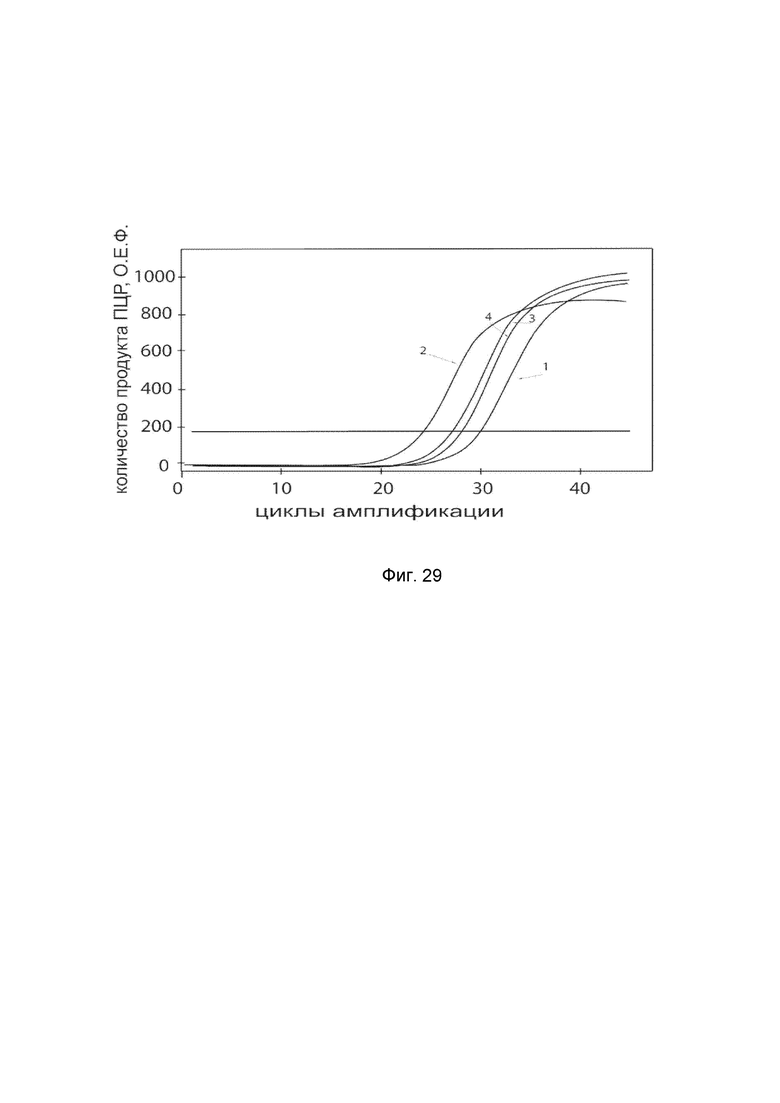
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания препаратов генной терапии. Предложен генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2, для повышения уровня экспрессии этого целевого гена в организме человека и животных. При этом генотерапевтический ДНК-вектор VTvaf17-ANG, или VTvaf17-ANGPT1, или VTvaf17-VEGFA, или VTvaf17-FGF1, или VTvaf17-HIF1α, или VTvaf17-HGF, или VTvaf17-SDF1, или VTvaf17-KLK4, или VTvaf17-PDGFC, или VTvaf17-PROK1, или VTvaf17-PROK2 имеет нуклеотидную последовательность SEQ ID №1, или SEQ ID №2, или SEQ ID №3, или SEQ ID №4, или SEQ ID №5, или SEQ ID №6, или SEQ ID №7, или SEQ ID №8, или SEQ ID №9, или SEQ ID №10, или SEQ ID №11 соответственно. Предложены также способ получения указанного вектора, применение вектора для повышения уровня экспрессии целевых генов, штамм Escherichia coli, несущий указанный вектор, а также способ производства в промышленных масштабах указанного вектора. Изобретение обеспечивает возможность его безопасного применения для генетической терапии человека и животных. 26 н. и 2 з.п. ф-лы, 29 ил., 41 пр.
1. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена ANG, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-ANG с нуклеотидной последовательностью SEQ ID №1.
2. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена ANGPT1, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17- ANGPT1 с нуклеотидной последовательностью SEQ ID №2.
3. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена VEGFA, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-VEGFA с нуклеотидной последовательностью SEQ ID №3.
4. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена FGF1, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-FGF1 с нуклеотидной последовательностью SEQ ID №4.
5. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена HIF1α, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-HIF1α с нуклеотидной последовательностью SEQ ID №5.
6. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена HGF, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-HGF с нуклеотидной последовательностью SEQ ID №6.
7. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена SDF1, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-SDF1 с нуклеотидной последовательностью SEQ ID №7.
8. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена KLK4, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-KLK4 с нуклеотидной последовательностью SEQ ID №8.
9. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена PDGFC, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17- PDGFC с нуклеотидной последовательностью SEQ ID №9.
10. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена PROK1, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-PROK1 с нуклеотидной последовательностью SEQ ID №10.
11. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена PROK2, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-PROK2 с нуклеотидной последовательностью SEQ ID №11.
12. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2 по пп.1-10 или 11, отличающийся тем, что каждый из созданных генотерапевтических ДНК-векторов: VTvaf17-ANG, или VTvaf17-ANGPT1, или VTvaf17-VEGFA, или VTvaf17-FGF1, или VTvaf17-HIF1α, или VTvaf17-HGF, или VTvaf17-SDF1, или VTvaf17-KLK4, или VTvaf17-PDGFC, или VTvaf17-PROK1, или VTvaf17-PROK2 по пп.1-10 или 11, за счет ограниченного размера векторной части VTvaf17, не превышающей 3200 п.н., обладает способностью эффективно проникать в клетки человека и животных и экспрессировать клонированный в него целевой ген ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2.
13. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2 по пп.1-10 или 11, отличающийся тем, что в составе каждого из созданных генотерапевтических ДНК-векторов: VTvaf17-ANG, или VTvaf17-ANGPT1, или VTvaf17-VEGFA, или VTvaf17-FGF1, или VTvaf17-HIF1α, или VTvaf17-HGF, или VTvaf17-SDF1, или VTvaf17-KLK4, или VTvaf17-PDGFC, или VTvaf17-PROK1, или VTvaf17-PROK2 по пп.1-10 или 11, в качестве структурных элементов используются нуклеотидные последовательности, которые не являются генами антибиотикорезистентности, вирусными генами и регуляторными элементами вирусных геномов, обеспечивая возможность его безопасного применения для генетической терапии человека и животных.
14. Способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2 по пп.1-10 или 11, заключающийся в том, что каждый из генотерапевтических ДНК-векторов: VTvaf17-ANG, или VTvaf17-ANGPT1, или VTvaf17-VEGFA, или VTvaf17-FGF1, или VTvaf17-HIF1α, или VTvaf17-HGF, или VTvaf17-SDF1, или VTvaf17-KLK4, или VTvaf17-PDGFC, или VTvaf17-PROK1, или VTvaf17-PROK2, получают следующим образом: кодирующую часть целевого гена ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2 по пп.1-10 или 11 клонируют в генотерапевтический ДНК-вектор VTvaf17 и получают генотерапевтический ДНК-вектор VTvaf17-ANG, SEQ ID №1, или VTvaf17-ANGPT1, SEQ ID №2, или VTvaf17-VEGFA, SEQ ID №3, или VTvaf17-FGF1, SEQ ID №4, или VTvaf17-HIF1α, SEQ ID №5, или VTvaf17-HGF, SEQ ID №6, или VTvaf17-SDF1, SEQ ID №7, или VTvaf17-KLK4, SEQ ID №8, или VTvaf17-PDGFC, SEQ ID №9, или VTvaf17-PROK1, SEQ ID №10, или VTvaf17-PROK2, SEQ ID №11 соответственно, при этом кодирующую часть целевого гена ANG, или ANGPT1, или VEGFA, или FGF1, или HIF1α, или HGF, или SDF1, или KLK4, или PDGFC, или PROK1, или PROK2 получают путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации с использованием созданных олигонуклеотидов и расщеплением продукта амплификации соответствующими эндонуклеазами рестрикции, причем клонирование в генотерапевтический ДНК-вектор VTvaf17 проводят по сайтам рестрикции NheI и HindIII, причем селекцию проводят без антибиотиков, при этом при получении генотерапевтического ДНК-вектора VTvaf17-ANG, SEQ ID №1 для проведения реакции обратной транскрипции и ПЦР-амплификации в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
ANG_F TTTGTCGACCACCATGGTGATGGGCCTGGGCGTT
ANG_R AATGGTACCTTACGGACGACGGAAAATTGACTG,
а расщепление продукта амплификации и клонирование кодирующей части гена ANG в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и EcoRI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-ANGPT1, SEQ ID №2 для проведения реакции обратной транскрипции и ПЦР-амплификации в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
ANGPT1_F TTTGTCGACCACCATGACAGTTTTCCTTTCCTTTGCTTTCC
ANGPT1_R AATGGTACCTCAAAAATCTAAAGGTCGAATCATCATAGTTG,
а расщепление продукта амплификации и клонирование кодирующей части гена ANGPT1 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SalI и KpnI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-VEGFA, SEQ ID №3 для проведения реакции обратной транскрипции и ПЦР-амплификации в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
VEGFA_F GGGGGATCCACCATGACGGACAGACAGACAGACACCGC
VEGFA_R TTTGGATCCACCATGAACTTTCTGCTGTCTTGGGTGC,
а расщепление продукта амплификации и клонирование кодирующей части гена VEGFA в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и HindIII,
причем при получении генотерапевтического ДНК-вектора VTvaf17-FGF1, SEQ ID №4 для проведения реакции обратной транскрипции и ПЦР-амплификации в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
FGF_F TTTGTCGACCACCATGGCTGAAGGGGAAATCACC
FGF_R AATGGTACCTTAATCAGAAGAGACTGGCAGGGG,
а расщепление продукта амплификации и клонирование кодирующей части гена FGF1 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SalI и KpnI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-HIF1α, SEQ ID №5 для проведения реакции обратной транскрипции и ПЦР-амплификации в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
HIF_F TTTGTCGACCACCATGGAGGGCGCCGGCGGCGCGA
HIF_R AATGGTACCTCAGTTAACTTGATCCAAAGCTCTGAGTAATTC,
а расщепление продукта амплификации и клонирование кодирующей части гена HIF1α в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SalI и KpnI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-HGF, SEQ ID №6 для проведения реакции обратной транскрипции и ПЦР-амплификации в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
HGF_F TTTGGATCCACCATGTGGGTGACCAAACTCCTGCCA
HGF_R AATGTCGACCTATGACTGTGGTACCTTATATGTTAAAAT,
а расщепление продукта амплификации и клонирование кодирующей части гена HGF в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и SalI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-SDF1, SEQ ID №7 для проведения реакции обратной транскрипции и ПЦР-амплификации в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
SDF_F AGGATCCCACCATGAACGCCAAGGTCGTGGT
SDF_R TATGAATTCACATCTTGAACCTCTTGTTTAAAGC,
а расщепление продукта амплификации и клонирование кодирующей части гена SDF1 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и EcoRI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-KLK4, SEQ ID №8 для проведения реакции обратной транскрипции и ПЦР-амплификации в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
KLK_F TTTGTCGACCACCATGGCCACAGCAGGAAATCCC
KLK_R TTTTTGAATTCTTAACTGGCCTGGACGGTTTTCTC,
а расщепление продукта амплификации и клонирование кодирующей части гена KLK4 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SalI и EcoRI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-PDGFC, SEQ ID №9 для проведения реакции обратной транскрипции и ПЦР-амплификации в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
PDGFC_F TTTGTCGACCACCATGAGCCTCTTCGGGCTTCTCC
PDGFC_R AATGGTACCTATCCTCCTGTGCTCCCTCTGCAC,
а расщепление продукта амплификации и клонирование кодирующей части гена PDGFC в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SalI и KpnI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-PROK1, SEQ ID №10 для проведения реакции обратной транскрипции и ПЦР-амплификации в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
PROK1_F
TATGTCGACCACCATGAGAGGTGCCACGCGAG
PROK1_R
TATGGAATTCGGTACGCTAAAAATTGATGTTCTTCAAGTCCA,
а расщепление продукта амплификации и клонирование кодирующей части гена PROK1 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SalI и EcoRI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-PROK2, SEQ ID №11 для проведения реакции обратной транскрипции и ПЦР-амплификации в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
PROK2_F
TTTGTCGACCACCATGAGGAGCCTGTGCTGCG
PROK2_R
AATGGTACCTTACTTTTGGGCTAAACAAATAAATCGG,
а расщепление продукта амплификации и клонирование кодирующей части гена PROK2 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SalI и KpnI.
15. Способ использования генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2 по пп.1-10 или 11, для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз, заключающийся в трансфекции выбранным генотерапевтическим ДНК-вектором, несущим целевой ген на основе генотерапевтического ДНК-вектора VTvaf17, или несколькими выбранными генотерапевтическими ДНК-векторами, несущими целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, клеток органов и тканей пациента или животного, и/или во введении в органы и ткани пациента или животного аутологичных клеток этого пациента или животного, трансфицированных выбранным генотерапевтическим ДНК-вектором, несущим целевой ген на основе генотерапевтического ДНК-вектора VTvaf17 или несколькими выбранными генотерапевтическими ДНК-векторами, несущими целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, и/или во введении в органы и ткани пациента или животного выбранного генотерапевтического ДНК-вектора, несущего целевой ген на основе генотерапевтического ДНК-вектора VTvaf17 или нескольких выбранных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, или в сочетании обозначенных способов.
16. Способ получения штамма для производства генотерапевтического ДНК-вектора по пп.1-10 или 11 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз, заключающийся в получении электрокомпетентных клеток штамма Escherichia coli SCS110-AF с последующим проведением электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-ANG, или генотерапевтическим ДНК-вектором VTvaf17-ANGPT1, или генотерапевтическим ДНК-вектором VTvaf17-VEGFA, или генотерапевтическим ДНК-вектором VTvaf17-FGF1, или генотерапевтическим ДНК-вектором VTvaf17-HIF1α, или генотерапевтическим ДНК-вектором VTvaf17-HGF, или генотерапевтическим ДНК-вектором VTvaf17-SDF1, или генотерапевтическим ДНК-вектором VTvaf17-KLK4, или генотерапевтическим ДНК-вектором VTvaf17-PDGFC, или генотерапевтическим ДНК-вектором VTvaf17-PROK1, или генотерапевтическим ДНК-вектором VTvaf17-PROK2, после чего клетки высеивают на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы, а также 10 мкг/мл хлорамфеникола с получением в результате штамма Escherichia coli SCS110-AF/VTvaf17-ANG, или штамма Escherichia coli SCS110-AF/VTvaf17-ANGPT1, или штамма Escherichia coli SCS110-AF/VTvaf17-VEGFA, или штамма Escherichia coli SCS110-AF/VTvaf17-FGF1, или штамма Escherichia coli SCS110-AF/VTvaf17-HIF1α, или штамма Escherichia coli SCS110-AF/VTvaf17-HGF, или штамма Escherichia coli SCS110-AF/VTvaf17-SDF1, или штамма Escherichia coli SCS110-AF/VTvaf17-KLK4, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFC, или штамма Escherichia coli SCS110-AF/VTvaf17-PROK1, или штамма Escherichia coli SCS110-AF/VTvaf17-PROK2.
17. Штамм Escherichia coli SCS110-AF/VTvaf17-ANG, полученный способом по п.16, несущий генотерапевтический ДНК-вектор VTvaf17-ANG, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз.
18. Штамм Escherichia coli SCS110-AF/VTvaf17-ANGPT1, полученный способом по п.16, несущий генотерапевтический ДНК-вектор VTvaf17- ANGPT1, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз.
19. Штамм Escherichia coli SCS110-AF/VTvaf17-VEGFA, полученный способом по п.16, несущий генотерапевтический ДНК-вектор VTvaf17- VEGFA, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз.
20. Штамм Escherichia coli SCS110-AF/VTvaf17-FGF1, полученный способом по п.16, несущий генотерапевтический ДНК-вектор VTvaf17- FGF1, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз.
21. Штамм Escherichia coli SCS110-AF/VTvaf17-HIF1α, полученный способом по п.16, несущий генотерапевтический ДНК-вектор VTvaf17-HIF1α, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз.
22. Штамм Escherichia coli SCS110-AF/VTvaf17-HGF, полученный способом по п.16, несущий генотерапевтический ДНК-вектор VTvaf17- HGF, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз.
23. Штамм Escherichia coli SCS110-AF/VTvaf17-SDF1, полученный способом по п.16, несущий генотерапевтический ДНК-вектор VTvaf17-SDF1, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз.
24. Штамм Escherichia coli SCS110-AF/VTvaf17-KLK4, полученный способом по п.16, несущий генотерапевтический ДНК-вектор VTvaf17-KLK4, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз.
25. Штамм Escherichia coli SCS110-AF/VTvaf17-PDGFC, полученный способом по п.16, несущий генотерапевтический ДНК-вектор VTvaf17-PDGFC, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-векторадля лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз.
26. Штамм Escherichia coli SCS110-AF/VTvaf17-PROK1, полученный способом по п.16, несущий генотерапевтический ДНК-вектор VTvaf17-PROK1, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз.
27. Штамм Escherichia coli SCS110-AF/VTvaf17-PROK2, полученный способом по п.16, несущий генотерапевтический ДНК-вектор VTvaf17-PROK2, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз.
28. Способ производства в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген ANG, ANGPT1, VEGFA, FGF1, HIF1α, HGF, SDF1, KLK4, PDGFC, PROK1, PROK2 по пп.1-10 или 11, для лечения заболеваний, связанных с недостаточной экспрессией целевого гена и характеризующихся нарушением васкуляризации тканей, ангиогенеза и гематопоэза, гипоксией, нарушением регенерации различных тканей, а именно для лечения заболеваний, включающих в себя такие патологии, как ишемические поражения миокарда, головного и спинного мозга, мышечных тканей конечностей, онкологические и нейродегенеративные заболевания, в том числе боковой амиотрофический склероз, заключающийся в том, что генотерапевтический ДНК-вектор VTvaf17-ANG, или генотерапевтический ДНК-вектор VTvaf17-ANGPT1, или генотерапевтический ДНК-вектор VTvaf17-VEGFA, или генотерапевтический ДНК-вектор VTvaf17-FGF1, или генотерапевтический ДНК-вектор VTvaf17-HIF1α, или генотерапевтический ДНК-вектор VTvaf17-HGF, или генотерапевтический ДНК-вектор VTvaf17-SDF1, или генотерапевтический ДНК-вектор VTvaf17-KLK4, или генотерапевтический ДНК-вектор VTvaf17-PDGFC, или генотерапевтический ДНК-вектор VTvaf17-PROK1, или генотерапевтический ДНК-вектор VTvaf17-PROK2 получают путем того, что засевают в колбу с приготовленной средой затравочную культуру, выбранную из штамма Escherichia coli SCS110-AF/VTvaf17-ANG, или штамма Escherichia coli SCS110-AF/VTvaf17-ANGPT1, или штамма Escherichia coli SCS110-AF/VTvaf17-VEGFA, или штамма Escherichia coli SCS110-AF/VTvaf17-FGF1, или штамма Escherichia coli SCS110-AF/VTvaf17-HIF1α, или штамма Escherichia coli SCS110-AF/VTvaf17-HGF, или штамма Escherichia coli SCS110-AF/VTvaf17-SDF1, или штамма Escherichia coli SCS110-AF/VTvaf17-KLK4, или штамма Escherichia coli SCS110-AF/VTvaf17-PDGFC, или штамма Escherichia coli SCS110-AF/VTvaf17-PROK1, или штамма Escherichia coli SCS110-AF/VTvaf17-PROK2, затем инкубируют затравочную среду в шейкере-инкубаторе и переносят ее в промышленный ферментер, после чего растят до достижения стационарной фазы, затем выделяют фракцию, содержащую целевой ДНК-продукт, многостадийно фильтруют и очищают хроматографическими методами.
| US 9550998 B2, 24.01.2017 | |||
| ПЛАЗМИДА БЕЗ УСТОЙЧИВОСТИ К АНТИБИОТИКУ | 2010 |
|
RU2548809C2 |
| СПОСОБ СТИМУЛИРОВАНИЯ ВОССТАНОВЛЕНИЯ ПЕРИФЕРИЧЕСКОЙ ИННЕРВАЦИИ ТКАНЕЙ С ПОМОЩЬЮ ВЕКТОРНЫХ КОНСТРУКЦИЙ | 2011 |
|
RU2486918C1 |
| СРЕДСТВО ДЛЯ ОСУЩЕСТВЛЕНИЯ ТЕРАПЕВТИЧЕСКОГО АНГИОГЕНЕЗА И СПОСОБ ЕГО ОСУЩЕСТВЛЕНИЯ | 2009 |
|
RU2449799C2 |
| VILLATE-BEITIAA I | |||
| ET AL | |||
| Non-viral vectors based on magnetoplexes, lipoplexes and polyplexes for VEGF gene delivery into central nervous system cells | |||
| International Journal of Pharmaceutics, 521 (2017), 130-140 | |||
| PARK H.-J | |||
| ET AL | |||
| Nonviral | |||
Авторы
Даты
2020-08-24—Публикация
2018-12-27—Подача