Область техники
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания препаратов генной терапии.
Уровень техники
Генная терапия - это современный медицинский подход, направленный на лечение наследственных и приобретенных заболеваний путем введения нового генетического материала в клетки пациента с целью компенсации или подавления функции мутантного гена и/или исправления генетического дефекта. Конечным продуктом экспрессии гена может являться молекула РНК или белка. Однако осуществление большей части физиологических процессов в организме связано с функциональной активностью белковых молекул, тогда как молекулы РНК являются либо промежуточным продуктом в синтезе белков, либо осуществляют регуляторные функции. Таким образом целью генной терапии является, в большинстве случаев, введение в организм генов, обеспечивающих транскрипцию и последующую трансляцию белковых молекул, кодируемых этими генами. В рамках описания настоящего изобретения под экспрессией гена подразумевается продукция белковой молекулы, аминокислотная последовательность которой кодируется этим геном.
Гены COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1, входящие в группу генов, играют ключевую роль в ряде процессов в организме человека и животных. Эти гены участвуют в формировании внеклеточного матрикса кожи и других органов, а также в ряде других процессов.
Основными компонентами внеклеточного матрикса дермы являются эластичные волокна, коллаген и протеогликаны (27). Эластичные волокна состоят из фибриллин-богатых микрофибрилл, гликопротеинов, эластинов и некоторых других белков (Kielty et al., 2002). Компоненты внеклеточного матрикса дермы связаны между собой посредством гиалуроновой кислоты, формируя таким образом дермальную сеть (Naylor et al., 2011). Длинные коллагеновые волокна, образуемые коллагеном I и III типов, переплетаются между собой, формируя внутридермальную сеть, которая заякорена на границе дермы и эпидермиса коллагеном VII типа (12).
При старении кожи, которое преимущественно обусловлено внутренними механизмами, коллаген и эластичные волокна дермы формируют ячеистую структуру (22). При старении, вызванном внешними факторами, как, например, под действием ультрафиолета, происходит утрата коллагенов I, III и, что наиболее значимо, VII типа (3; 30). Кроме того, длинные коллагеновые фибриллы, эластичные волокна, гликопротеины и глюкозоаминогликаны утрачивают способность формировать функциональную сеть внеклеточного матрикса дермы, вместо этого они образуют неструктурированные фрагменты в дерме (22). Эти изменения ВКМ усугубляются действием эластаз, которые вырабатываются нейтрофилами, мигрирующими в дерму в результате воспаления или воздействия ультрафиолета (14), а также активацией матриксных металлопротеиназ.
Помимо старения кожи, которое является в большинстве случаев естественным процессом, внеклеточный матрикс дермы может быть вовлечен в патогенез различных заболеваний, при этом нарушения могут быть прямо или косвенно связаны с экспрессий различных генов, участвующих в его формировании. Более того, поскольку большинство молекул внеклеточного матрикса участвуют в различных биологических процессах, не ограничивающихся кожей, патологические и неблагоприятные для организма состояния, вызванные недостаточной экспрессией ряда генов, могут иметь проявления в виде нарушения структуры кожи, которые, тем не менее, не ограничиваются только этой тканью. Например, семейство белков коллагенов, участвует в структурной организации и метаболизме многих тканей в организме, включая хрящи, кости, сухожилия, кожу и белую часть глаза (склеру). Было обнаружено, что отдельные мутации в генах, кодирующих коллагены (например, I, III или V типа) или коллаген-модифицирующие ферменты (например, лизилгидроксилаза, коллагеназа) вызывают разные формы синдрома Элерса-Данлоса, которые влияют на соединительные ткани (системная дисплазия соединительной ткани), поддерживающие кожу, кости, кровеносные сосуды и другие органы. Симптомы и признаки этого заболевания варьируют в широких пределах. Преобладающие симптомы включают гиперподвижность суставов, образование патологических рубцов и нарушение ранозаживляющей активности, ломкость сосудов и бархатистую, гиперрастяжимую кожу.
Коллаген типа I является наиболее распространенной формой коллагена в организме человека. Коллаген типа I состоит из двух про-α1 (I) цепей и одной pro-α2 (I) цепи. Ген COL1A1 кодирует pro-α1 (I) цепь, ген COL1A2 - pro-α2 (I).
Описана мутация в гене COL1A1, которая вызывает инфантильный кортикальный гиперостоз или болезнь Каффи. Это состояние характеризуется отеком мягких тканей (например, мышц), болью и чрезмерным образованием новой костной ткани (гиперостоз). Отклонения костей в основном затрагивают челюстную кость, ключицы (ключицы) и диафизы длинных костей конечностей.
Другим наследственным заболеванием, вызванным мутациями в генах коллагенов и вызывающим диффузную ненормальную хрупкость костей иногда сопровождающуюся нейросенсорной тугоухостью, голубыми склерами, несовершенным дентиногенезом и гипермобильностью суставов, является несовершенный остеогенез. У 90% людей с одним из основных типов заболевания имеются мутации в генах COL1A1 или COL1A2. При этом генотерапевтический подход обсуждается как одно из перспективных направлений терапии данного синдрома (Niyibizi et al., 2000). Также описан клинический случай экспериментального лечения, когда пациенту с несовершенным остеогенезом были введены мезенхимальные стволовые клетки костного мозга, экспрессирующие нормальные гены коллагенов, в результате чего был достигнут заметный терапевтический эффект (18).
Коллаген типа VII является основным структурным компонентом в коже, входит в состав закрепляющих фибрилл. Эти фибриллы находятся в области, которая представляет собой двухслойную мембрану, расположенную между эпидермисом и дермой. Коллагеновые фибриллы удерживают два слоя кожи вместе, соединяя мембрану эпидермального основания с дермой.
Коллаген VII типа кодируется геном COL7A1. Три белковые цепи pro-α1 (VII) скручиваются вместе, образуя трехцепочечную молекулу проколлагена. Молекулы проколлагена секретируются клеткой и обрабатываются ферментами для удаления дополнительных сегментов белка с концов. Как только эти концевые сегменты удалены формируются длинные тонкие пучки зрелого коллагена VII.
Мутации в гене COL7A1 вызывают буллезный эпидермолиз дистрофического типа. Буллезные поражения чаще всего возникают в зонах, подверженных незначительному травмированию, например, разгибательные поверхности локтей и тыльные поверхности рук и ног. При заживлении возникают шрамы, поверхностные эпидермальные кисты и гиперпигментация. У некоторых пациентов наблюдается дистрофия ногтей. Часто встречаются внекожные проявления, включающие поражения желудочно-кишечного и мочеполового трактов, внешних оболочек глаза, хроническую анемию, остеопороз, задержку роста. У пациентов с булезным эпидермолизом наблюдается высокий риск онкологических заболеваний, в частности образования агрессивных плоскоклеточных карцином. По данным международной ассоциации DEBRA International в мире рождается один больной на 50-100 тысяч человек.
Генотерапевтические подходы к лечению буллезного эпидермолиза включают различные экспериментальные подходы. В ряде работ для коррекции мутаций в гене COL7A1 были успешно использованы ex vivo технологии редактирования генома (Mencía et al., 2018), микроинъекции линейных молекул ДНК, кодирующих ген COL7A1 (19), интеграция кДНК с использованием ферментов-интеграз (23), интрадермальные инъекции лентивирусных векторов (34), технология репарации мутаций на основе TALEN нуклеаз (24), а также введение аутологичных клеток - фибробластов или кератиноцитов, модифицированных с использованием различных ретровирусных векторов (11, 6, 7). В настоящее время клинические испытания подобных подходов находятся на различных этапах исследований (NCT01263379, NCT02810951).
Важным этапом в формировании и стабилизации коллагеновых молекул являются посттрансляционные модификации - гидроксилирование пролина, необходимое для стабилизации тройной спирали коллагена, а также гидроксилирование лизина для последующего образования ковалентных связей между молекулами коллагена при сборке коллагеновых фибрилл. Ферменты, которые осуществляют эти процессы модификаций - пролил-4-гидроксилаза и лизил-5-гидроксилаза соответственно.
Фермент пролил-4-гидроксилаза состоит из 2-х альфа и 2-х бета субъединиц. Альфа субъединицы бывают нескольких типов и кодируются генами P4HA1 и P4HA2. Мутации в гене P4HA1 могут являться причиной одной из форм синдрома Элерса-Данлоса, описанного выше. Также описана мутация в гене P4HA1 человека, которая вызывает уникальный фенотип патологии, характеризующийся рано проявляющейся суставной гипермобильностью, суставными контрактурами, мышечной слабостью и дисплазией костей, а также близорукостью (35). Описано, что курение вызывает супрессию экспрессии гена P4HA1. Авторы работы связывают этот феномен с индукцией нарушений метаболизма коллагена в стенках сосудов курильщиков, и, как следствие, повышением частоты атеросклероза и аневризм (25). Мутации в гене P4HA2 вызывают миопию (21). Также супрессия транскрипции гена P4HA2 происходит в клетках лимфомы, что может быть связано с патогенезом онкологического процесса (9). Изменение экспрессии P4HA1 предлагается как один из способов скрининга эффективности антивозрастных косметических субстанций, полученных из растительного сырья (28).
Наряду с коллагеном в межклеточном матриксе соединительной ткани содержится большое количество эластина - белка, кодируемого геном ELN. Эластин выполняет важные функции в органах, подверженных постоянному растяжению и сжатию, например, в артериях, легких, коже, сухожилиях, различных сфинктерах (39). Эластиновые и коллагеновые волокна помогают органам восстанавливать исходные размеры после растяжения, например, при защемлении кожи или после опустошения мочевого пузыря (38). При снижении образования нормальной формы эластина поперечные сшивки между волокнами образуются в недостаточном количестве или не образуются вообще. Вследствие этого у эластических тканей снижается предел прочности на разрыв и появляются такие нарушения, как истончённость, вялость, растяжимость, т.е. утрачиваются их резиноподобные свойства. Клинически такие нарушения могут проявляться кардиоваскулярными изменениями (аневризмы и разрывы аорты, дефекты клапанов сердца), частыми пневмониями и эмфиземой лёгких (36). При нарушении синтеза эластина в организме в результате мутации гена ELN развивается суправульвулярный аортальный стеноз (Ewart et al., 1994). При этом генно-инженерный подход с использованием вирусных векторов, экспрессирующих ген ELN, был успешно применен для модификации клеток для клеточной терапии, направленной на заживление повреждения мягких тканей у лабораторных животных (16).
Ген PLOD1 кодирует фермент лизилгидроксилазу 1. Этот фермент модифицирует лизин с образованием гидроксилизина, Гидроксилизин в молекулах коллагена необходим для формирования поперечных связей между волокнами коллагена. Как и большинство предыдущих генов, связанных с синтезом и формированием внеклеточного матрикса, мутации в гене PLOD1 связаны с развитием синдрома Элерса-Данлоса (van Dijk et al., 2017). Также есть свидетельства того, что полиморфизм этого гена может быть ассоциирован с плотностью костной ткани и рисками остеопороза (31).
Ген CLCA2 кодирует белок-регулятор Са каналов и экспрессируется в различных эпителиальных тканях (в коже, эпителии роговицы глаза, пищевода, гортани и вагинальном эпителии) (2). В экспериментах на крысах было показано, что экспрессия этого гена в кератиноцитах кожи сильно снижается под воздействием ультрафиолета (1). При исследовании механизмов патогенеза атопического дерматита исследователи выяснили, что экспрессия этого гена необходима для защиты клеток каратиноцитов от апоптоза в условиях гиреросмотического шока (вызванного недостаточным количество воды), при этом при подавлении экспрессии CLCA2 происходит нарушение адгезии клеток в эпидермисе. Таким образом ген CLCA2 необходим для адаптации и выживания эпителиальных клеток в условиях недостаточной влажности (29).
Таким образом предшествующий уровень техники свидетельствует о том, что мутации в генах COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1 или недостаточная экспрессия белков, кодируемых этими генами, связаны с развитием спектра заболеваний, включающих в себя, но не ограничивающихся, наследственными и приобретенными патологическими состояниями связанными с нарушениями в организации внеклеточного матрикса кожи и других органов, влекущими за собой как патологические процессы, так и неблагоприятные состояния, которые укладываются в границы общепринятой нормы, но могут быть изменены в лучшую сторону, а также процессами не связанными напрямую с внеклеточным матриксом. Этим обусловлено объединение генов COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1 в рамках данного патента в группу генов. Генетические конструкции, обеспечивающие экспрессию белков, кодируемых генами из группы COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1, могут быть использованы для разработки лекарственных препаратов для предотвращения и терапии различных заболеваний и патологических и неблагоприятных состояний.
Более того, приведенные данные свидетельствуют о том, что недостаточная экспрессия белков, кодируемых генами COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1 входящими в группу генов, связана не только с патологическими состояниями, но и с предрасположенность к их развитию. Также приведенные данные свидетельствуют о том, что недостаточная экспрессия данных белков может не проявляться в явном виде в форме патологии, которая может быть однозначно описана в рамках существующих стандартов клинической практики (например, с применением кода МКБ), однако при этом вызывать состояния, которые неблагоприятны для человека и животных и связанны с ухудшением качества жизни.
Анализ подходов для повышения экспрессии целевых генов подразумевает возможность использования различных генотерапевтических векторов.
Генотерапевтические векторы разделяют на вирусные, клеточные и ДНК-векторы (8). В последнее время в генной терапии всё большее внимание уделяется разработке невирусных систем доставки генетического материала, среди которых лидируют плазмидные векторы. Плазмидные векторы лишены недостатков, присущих клеточным и вирусным векторам. В клетке-мишени они существуют в эписомальной форме, не интегрируют в геном, производство их достаточно дешево, отсутствие иммунного ответа и побочных реакций на введение плазмидного вектора делают их удобным инструментом генной терапии и генетической профилактики (ДНК-вакцины) (15).
Тем не менее, ограничениями для использования плазмидных векторов для генной терапии являются: 1) наличие генов устойчивости к антибиотикам для наработки в бактериальных штаммах, 2) наличие различных регуляторных элементов, представленных последовательностями вирусных геномов 3) размер терапевтического плазмидного вектора, определяющий эффективность проникновения вектора в клетку-мишень.
Известно, что Европейское агентство по лекарственным средствам считает необходимым избегать введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (26) (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011 EMA/CAT/GTWP/44236/2009 Committee for advanced therapies). Данная рекомендация связана, в первую очередь, с потенциальной опасностью проникновения ДНК-вектора или горизонтального переноса генов антибиотикорезистентности в клетки бактерий, представленных в организме в составе нормальной или оппортунистической микрофлоры. Помимо этого, наличие генов антибиотикорезистентности значительно увеличивает размер ДНК-вектора, что приводит к снижению эффективности его проникновения в эукариотические клетки.
Необходимо отметить, что гены антибиотикорезистентности также вносят принципиальный вклад в способ получения ДНК-векторов. В случае наличия генов антибиотикорезистентности штаммы для наработки ДНК-векторов обычно культивируются в среде, содержащей селективный антибиотик, что создает риск наличия следовых количеств антибиотика в недостаточно очищенных препаратах ДНК-векторов. Таким образом, получение ДНК-векторов для генной терапии, в которых отсутствуют гены антибиотикорезистентности, связано с получением штаммов, обладающих такой отличительной особенностью как способность к стабильной амплификации целевых ДНК-векторов в среде без содержания антибиотиков.
Кроме того, Европейское Медицинское Агентство рекомендует избегать наличия в составе терапевтических плазмидных векторов регуляторных элементов для повышения экспрессии целевых генов (промоторов, энхансеров, посттрансляционных регуляторных элементов), являющихся нуклеотидными последовательностями геномов различных вирусов (Draft Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products,http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2015/05/WC500187020.pdf). Данные последовательности, хотя и могут увеличивать уровень экспрессии целевого трансгена, однако создают риск рекомбинации с генетическим материалом вирусов дикого типа и интеграции в геном эукариотической клетки. Более того, целесообразность гиперэкспрессии того или иного гена в целях терапии остается нерешенным вопросом.
Также, существенным моментом является размер терапевтического вектора. Известно, что современные плазмидные векторы зачастую перегружены нефункциональными участками, серьезно увеличивающими размер вектора (17) (Mairhofer J, Grabherr R. // Mol Biotechnol. 2008.39(2):97-104). Например, ген устойчивости к ампициллину в векторах серии pBR322, как правило, состоит из не менее чем 1000 п.н., что составляет более 20% от размера самого вектора. При этом наблюдается обратная зависимость между размером вектора и его способностью проникать в эукариотические клетки - ДНК-векторы с небольшим размером эффективней проникаю в клетки человека и животных. Так, например, в серии экспериментов по трансфекции клеток HELA ДНК-векторами с размером от 383 до 4548 п.н. было показано, что разница в эффективности проникновения может достигать двух порядков (отличаться в 100 раз) (10) (Hornstein BD et al. // PLoS ONE. 2016;11(12): e0167537.).
Таким образом при выборе ДНК-вектора в целях безопасности и наибольшей эффективности следует отдавать предпочтение тем конструкциям, в которых не содержатся гены устойчивости к антибиотикам, последовательности вирусного происхождения и размер которых позволяет эффективно проникать в эукариотические клетки. Штамм для получения такого ДНК-вектора в количествах, достаточных для целей генной терапии, должен обеспечивать возможность стабильной амплификации ДНК-вектора с использованием питательных сред, не содержащих антибиотики.
Примером использования рекомбинантных ДНК-векторов для генной терапии является способ получения рекомбинантного вектора для генетической иммунизации по патенту US 9550998 В2. Плазмидный вектор представляет собой суперскученный плазмидный ДНК-вектор и предназначен для экспрессии клонированных генов в клетках животных и человека. Вектор состоит из ориджина репликации, регуляторных элементов, включающих промотор и энхансер цитомегаловируса человека, регуляторные элементы из Т-лимфотропного вируса человека.
Накопление вектора проводят в специальном штамме E. coli без использования антибиотиков за счет антисенс-комплементации гена sacB, введенного в штамм посредством бактериофага. Недостатком данного изобретения является наличие в составе ДНК-вектора регуляторных элементов, представляющих собой последовательности вирусных геномов.
Прототипами настоящего изобретения можно считать патенты и заявки описанные ниже.
В заявке WO2001042285A2 описан метод восстановления внеклеточного матрикса и предотвращения его деградации, в том числе, с использованием генотерапевтического подхода и векторов, экспрессирующих гены, содержащие последовательности, выбранные из группы последовательностей (SEQ1-SEQ21), экспрессия которых имеет место при формировании и поддержании внеклеточного матрикса. Недостатком данного изобретения является подход к выбору последовательностей, который в данном изобретении основан не на физиологической функции белков, кодируемых данными генами, а на анализе транскрипции различных последовательностей. Также в данном изобретении не приводится обоснования эффективности и безопасности использования того или иного вектора для генной терапии.
В заявке JPH0823979A описан генотерапевтический подход для улучшения формирования внеклеточного матрикса, в том числе, путем экспрессии коллагена и/или ферментов пролингидроксилаз, обеспечивающих биохимические реакции в процессе формирования коллагеновых волокон. Недостатком данного изобретения является ограниченность способа модуляции формирования внеклеточного матрикса только за счет обеспечения реакции гидроксилирования пролина в молекулах коллагена, также недостатком данного изобретения является использование бакуловирусных векторов.
В заявке WO2002094876A2 описан способ регуляции экспрессии муцина в тканях легких, одним из способов реализации которого является использование генотерапевтической конструкции, обеспечивающей экспрессию гена CLCA2. Недостатком данного изобретения является ограниченность способа использования и неопределенные требования безопасности используемых векторов.
Таким образом на настоящем уровне техники существует потребность в изобретении эффективного и безопасного генотерапевтического подхода, позволяющего повышать экспрессию генов, участвующих в формировании внеклеточного матрикса с учетом как непосредственных структурных молекул (таких как коллагены и эластин), так и ферментов, обеспечивающих их посттрансляционные модификации.
Раскрытие изобретения
Задачей изобретения является конструирование генотерапевтических ДНК-векторов для повышения уровня экспрессии генов, выбранных из группы: COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1 в организме человека и животных, сочетающих в себе следующие свойства:
I) Эффективность генотерапевтического ДНК-вектора для повышения уровня экспрессии целевых генов в эукариотических клетках.
II) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов.
III) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора генов антибиотикорезистентности.
IV) Технологичность получения и возможность наработки генотерапевтического ДНК-вектора в промышленных масштабах.
Пункты II и III предусмотрены в данном техническом решении в соответствии с рекомендациями государственных регуляторов к лекарственным средствам для генной терапии, в частности, Европейского Агентства по лекарственным средствам касательно отказа от введения маркеров антибиотикорезистентности в разрабатываемые плазмидные векторы для генной терапии (Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011, EMA/CAT/GTWP/44236/2009 Committee for advanced therapies) и касательно отказа от введения в разрабатываемые плазмидные векторы для генной терапии элементов вирусных геномов (Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products / 23 March 2015, EMA/CAT/80183/2014, Committee for Advanced Therapies).
Задачей изобретения также является конструирование штаммов, несущих эти генотерапевтические ДНК-вектора, для наработки и производства в промышленных масштабах генотерапевтических ДНК-векторов.
Поставленная задача решается за счет того, что создан генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1, для повышения уровня экспрессии этого целевого гена в организме человека и животных, при этом генотерапевтический ДНК-вектор VTvaf17-COL1A1 или VTvaf17-COL1A2 или VTvaf17-P4HA1 или VTvaf17-P4HA2 или VTvaf17-COL7A1 или VTvaf17-CLCA2 или VTvaf17-ELN или VTvaf17-PLOD1 имеет нуклеотидную последовательность SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 или SEQ ID №6 или SEQ ID №7 или SEQ ID №8 соответственно. Каждый из созданных генотерапевтических ДНК-векторов: VTvaf17- COL1A1 или VTvaf17-COL1A2 или VTvaf17-P4HA1 или VTvaf17-P4HA2 или VTvaf17-COL7A1 или VTvaf17-CLCA2 или VTvaf17-ELN или VTvaf17-PLOD1 за счет ограниченного размера векторной части VTvaf17, не превышающей 3200 п.н., обладает способностью эффективно проникать в клетки и экспрессировать клонированный в него целевой ген, выбранный из группы генов COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1 соответственно. В составе генотерапевтического ДНК-вектора отсутствуют нуклеотидные последовательности вирусного происхождения и отсутствуют гены антибиотикорезистентности, обеспечивая возможность его безопасного применения для генетической терапии человека и животных.
Создан также способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ген COL1A1, ген COL1A2, ген P4HA1, ген P4HA2, ген COL7A1, ген CLCA2, ген ELN, ген PLOD1, который заключается в том, что каждый из генотерапевтических ДНК-векторов: VTvaf17- COL1A1 или VTvaf17-COL1A2 или VTvaf17-P4HA1 или VTvaf17-P4HA2 или VTvaf17-COL7A1 или VTvaf17-CLCA2 или VTvaf17-ELN или VTvaf17-PLOD1 получают следующим образом: кодирующую часть целевого гена из группы COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1 клонируют в ДНК-вектор VTvaf17 и получают генотерапевтический ДНК-вектор VTvaf17-COL1A1, SEQ ID №1 или VTvaf17-COL1A2, SEQ ID №2 или VTvaf17-P4HA1, SEQ ID №3 или VTvaf17-P4HA2, SEQ ID №4 или VTvaf17-COL7A1, SEQ ID №5 или VTvaf17-CLCA2, SEQ ID №6 или VTvaf17-ELN, SEQ ID №7 или VTvaf17-PLOD1, SEQ ID №8 соответственно.
Способ применения созданного генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ген COL1A1, ген COL1A2, ген P4HA1, ген P4HA2, ген COL7A1, ген CLCA2, ген ELN, ген PLOD1 для повышения уровня экспрессии этих целевых генов, заключается во введении выбранного генотерапевтического ДНК-вектора или нескольких выбранных генотерапевтических ДНК-векторов в клетки, органы и ткани человека или животного, и/или во введении в органы и ткани человека или животного аутологичных клеток человека или животного, трансфицированных выбранным генотерапевтическим ДНК-вектором или несколькими выбранными генотерапевтическими ДНК-векторами, или в сочетании обозначенных способов.
Способ получения штамма Escherichia coli SCS110-AF/VTvaf17- COL1A1 или штамма Escherichia coli SCS110-AF/VTvaf17-COL1A2 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA1 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA2 или штамма Escherichia coli SCS110-AF/VTvaf17-COL7A1 или штамма Escherichia coli SCS110-AF/VTvaf17-CLCA2 или штамма Escherichia coli SCS110-AF/VTvaf17-ELN или штамма Escherichia coli SCS110-AF/VTvaf17-PLOD1 заключается в электропорации компетентных клеток штамма Escherichia coli SCS110-AF созданным генотерапевтическим ДНК-вектором и последующей селекцией стабильных клонов штамма с использованием селективной среды.
Заявлен штамм Escherichia coli SCS110-AF/VTvaf17-COL1A1 или штамм Escherichia coli SCS110-AF/VTvaf17-COL1A2 или штамм Escherichia coli SCS110-AF/VTvaf17-P4HA1 или штамм Escherichia coli SCS110-AF/VTvaf17-P4HA2 или штамм Escherichia coli SCS110-AF/VTvaf17-COL7A1 или штамм Escherichia coli SCS110-AF/VTvaf17-CLCA2 или штамм Escherichia coli SCS110-AF/VTvaf17-ELN или штамм Escherichia coli SCS110-AF/VTvaf17-PLOD1, несущий генотерапевтический ДНК-вектор для его наработки с возможностью культивирования штамма без использования антибиотиков.
Способ производства в промышленных масштабах генотерапевтического ДНК-вектора заключается в масштабировании бактериальной культуры штамма до количеств, необходимых для наращивания бактериальной биомассы в промышленном ферментере, после чего биомассу используют для выделения фракции, содержащей целевой ДНК-продукт - генотерапевтический ДНК-вектор VTvaf17-COL1A1 или VTvaf17-COL1A2 или VTvaf17-P4HA1 или VTvaf17-P4HA2 или VTvaf17-COL7A1 или VTvaf17-CLCA2 или VTvaf17-ELN или VTvaf17-PLOD1 многостадийно фильтруют и очищают хроматографическими методами.
Изобретение поясняется чертежами, где:
На фиг.1
приведена схема генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1, который представляет собой кольцевую двуцепочечную молекулу ДНК, способную к автономной репликации в клетках бактерии Escherichia coli.
На фиг.1 приведены схемы, соответствующие:
A - генотерапевтический ДНК-вектор VTvaf17- COL1A1;
B - генотерапевтический ДНК-вектор VTvaf17- COL1A2;
C - генотерапевтический ДНК-вектор VTvaf17- P4HA1;
D - генотерапевтический ДНК-вектор VTvaf17- P4HA2;
E - генотерапевтический ДНК-вектор VTvaf17- COL7A1;
F - генотерапевтический ДНК-вектор VTvaf17- CLCA2;
G - генотерапевтический ДНК-вектор VTvaf17- ELN;
H - генотерапевтический ДНК-вектор VTvaf17- PLOD1.
На схемах отмечены следующие структурные элементы вектора:
EF1a - промоторная область гена человеческого фактора элонгации EF1A с собственным энхансером, содержащимся в первом интроне гена. Служит для обеспечения высокого уровня транскрипции рекомбинантного гена в большинстве тканей человека;
Рамка считывания целевого гена, соответствующая кодирующей части гена COL1A1 (фиг. 1A), гена COL1A2 (фиг. 1B), гена P4HA1 (фиг. 1C), гена P4HA2 (фиг. 1D), гена COL7A1 (фиг. 1E), гена CLCA2 (фиг. 1F), гена ELN (фиг. 1G), гена PLOD1 (фиг. 1H) соответственно;
hGH-TA - терминатор транскрипции и сайт полиаденилирования гена фактора роста человека;
ori - ориджин репликации, служащий для автономной репликации с однонуклеотидной заменой для повышения копийности плазмиды в клетках большинства штаммов Escherichia coli;
RNA-out - регуляторный элемент РНК-out транспозона Tn 10, обеспечивающий возможность положительной селекции без использования антибиотиков при использовании штамма Escherichia coli SCS 110.
Отмечены уникальные сайты рестрикции.
На фиг.2 показаны графики накопления ампликонов кДНК целевого гена, а именно, гена COL1A1, в первичной культуре клеток фибробластов кожи человека HDFa (ATCC PCS-201-01) до их трансфекции и через 48 часов после трансфекции этих клеток генотерапевтическим ДНК-вектором VTvaf17-COL1A1 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.2 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена COL1A1 в первичной культуре клеток фибробластов кожи человека HDFa до трансфекции ДНК-вектором VTvaf17-COL1A1;
2 - кДНК гена COL1A1 в первичной культуре клеток фибробластов кожи человека HDFa после трансфекции ДНК-вектором VTvaf17-COL1A1;
3 - кДНК гена B2M в первичной культуре клеток фибробластов кожи человека HDFa до трансфекции ДНК-вектором VTvaf17-COL1A1;
4 - кДНК гена B2M в первичной культуре клеток фибробластов кожи человека HDFa после трансфекции ДНК-вектором VTvaf17-COL1A1.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.3 показаны графики накопления ампликонов кДНК целевого гена, а именно гена COL1A2, в первичной культуре клеток фибробластов кожи человека HDFa (ATCC PCS-201-01) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-COL1A2 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.3 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена COL1A2 в первичной культуре первичной культуры фибробластов кожи человека HDFa до трансфекции ДНК-вектором VTvaf17-COL1A2;
2 - кДНК гена COL1A2 первичной культуре первичной культуры фибробластов кожи человека HDFa после трансфекции ДНК-вектором VTvaf17-COL1A2;
3 - кДНК гена B2M в первичной культуре первичной культуры фибробластов кожи человека HDFa до трансфекции ДНК-вектором VTvaf17-COL1A2;
4 - кДНК гена B2M первичной культуре первичной культуры фибробластов кожи человека HDFa после трансфекции ДНК-вектором VTvaf17-COL1A2.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.4 показаны графики накопления ампликонов кДНК целевого гена, а именно гена P4HA1 в клетках фибробластов крайней плоти человека линии Hs27 (ATCC CRL-1634) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-P4HA1 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.4 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена P4HA1 в клетках фибробластов крайней плоти человека линии Hs27 до трансфекции ДНК-вектором VTvaf17-P4HA1;
2 - кДНК гена P4HA1 клетках фибробластов крайней плоти человека линии Hs27 после трансфекции ДНК-вектором VTvaf17-P4HA1;
3 - кДНК гена B2M клетках фибробластов крайней плоти человека линии Hs27 до трансфекции ДНК-вектором VTvaf17-P4HA1;
4 - кДНК гена B2M клетках фибробластов крайней плоти человека линии Hs27 после трансфекции ДНК-вектором VTvaf17-P4HA1.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.5 показаны графики накопления ампликонов кДНК целевого гена, а именно гена P4HA2, в клетках фибробластов крайней плоти человека линии Hs27 (ATCC CRL-1634) до их трансфекции и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-P4HA2 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.5 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена P4HA2 в клетках фибробластов крайней плоти человека линии Hs27 до трансфекции ДНК-вектором VTvaf17-P4HA2;
2 - кДНК гена P4HA2 в клетках фибробластов крайней плоти человека линии Hs27 после трансфекции ДНК-вектором VTvaf17-P4HA2;
3 - кДНК гена B2M в клетках фибробластов крайней плоти человека линии Hs27 до трансфекции ДНК-вектором VTvaf17-P4HA2;
4 - кДНК гена B2M в клетках фибробластов крайней плоти человека линии Hs27 после трансфекции ДНК-вектором VTvaf17-P4HA2.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.6 показаны графики накопления ампликонов кДНК целевого гена, а именно, гена COL7A1, в культуре фибробластов HT 297.T (ATCC® CRL-7782™) до их трансфекции и через 48 часов после трансфекции этих клеток генотерапевтическим ДНК-вектором VTvaf17-COL7A1 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.6 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена COL7A1 в первичной культуре клеток фибробластов HT 297.T до трансфекции ДНК-вектором VTvaf17-COL7A1;
2 - кДНК гена COL7A1 в первичной культуре клеток фибробластов HT 297.T после трансфекции ДНК-вектором VTvaf17-COL7A1;
3 - кДНК гена B2M в первичной культуре клеток фибробластов HT 297.T до трансфекции ДНК-вектором VTvaf17-COL7A1;
4 - кДНК гена B2M в первичной культуре клеток фибробластов HT 297.T после трансфекции ДНК-вектором VTvaf17-COL7A1;
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.7 показаны графики накопления ампликонов кДНК целевого гена, а именно, гена CLCA2, в культуре фибробластов HT 297.T (ATCC® CRL-7782™) до их трансфекции и через 48 часов после трансфекции этих клеток генотерапевтическим ДНК-вектором VTvaf17-CLCA2 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.7 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена CLCA2 в первичной культуре клеток фибробластов HT 297.T до трансфекции ДНК-вектором VTvaf17-CLCA2;
2 - кДНК гена CLCA2 в первичной культуре клеток фибробластов HT 297.T после трансфекции ДНК-вектором VTvaf17-CLCA2;
3 - кДНК гена B2M в первичной культуре клеток фибробластов HT 297.T до трансфекции ДНК-вектором VTvaf17-CLCA2;
4 - кДНК гена B2M в первичной культуре клеток фибробластов HT 297.T после трансфекции ДНК-вектором VTvaf17-CLCA2.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.8 показаны графики накопления ампликонов кДНК целевого гена, а именно, гена ELN, в первичной культуре клеток кератиноцитов эпидермиса человека HEKa (ATCC PCS-200-011) до их трансфекции и через 48 часов после трансфекции этих клеток генотерапевтическим ДНК-вектором VTvaf17-ELN с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.8 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена ELN в первичной культуре клеток кератиноцитов эпидермиса человека HEKa до трансфекции ДНК-вектором VTvaf17-ELN;
2 - кДНК гена ELN в первичной культуре клеток кератиноцитов эпидермиса человека HEKa после трансфекции ДНК-вектором VTvaf17-ELN;
3 - кДНК гена B2M в первичной культуре клеток кератиноцитов эпидермиса человека HEKa до трансфекции ДНК-вектором VTvaf17-ELN;
4 - кДНК гена B2M в первичной культуре клеток кератиноцитов эпидермиса человека HEKa после трансфекции ДНК-вектором VTvaf17-ELN.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.9 показаны графики накопления ампликонов кДНК целевого гена, а именно, гена PLOD1, в первичной культуре клеток меланоцитов эпидермиса HEMa (ATCC® PCS-200-013™) до их трансфекции и через 48 часов после трансфекции этих клеток генотерапевтическим ДНК-вектором VTvaf17-PLOD1 с целью оценки способности проникать в эукариотические клетки и функциональной активности, то есть экспрессии целевого гена на уровне мРНК.
На фиг.9 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена PLOD1 в первичной культуре клеток меланоцитов эпидермиса HEMa до трансфекции ДНК-вектором VTvaf17-PLOD1;
2 - кДНК гена PLOD1 в первичной культуре клеток меланоцитов эпидермиса HEMa после трансфекции ДНК-вектором VTvaf17-PLOD1;
3 - кДНК гена B2M в первичной культуре клеток меланоцитов эпидермиса HEMa до трансфекции ДНК-вектором VTvaf17-PLOD1;
4 - кДНК гена B2M в первичной культуре клеток меланоцитов эпидермиса HEMa после трансфекции ДНК-вектором VTvaf17-PLOD1.
В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2.
На фиг.10 показана диаграмма концентрации белка COL1A1 в клеточном лизате первичной культуры фибробластов кожи человека HDFa (ATCC PCS-201-01) после трансфекции этих клеток ДНК-вектором VTvaf17-COL1A1 с целью оценки функциональной активности, то есть экспрессии на уровне белка, по изменению количества белка COL1A1 в лизате клеток.
На фиг.10 отмечены следующие элементы:
культура А - культура клеток фибробластов кожи человека HDFa, трансфицированная водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура клеток фибробластов кожи человека HDFa, трансфицированных ДНК-вектором VTvaf17;
культура C - культура клеток фибробластов кожи человека HDFa, трансфицированных ДНК-вектором VTvaf17-COL1A1.
На фиг.11 показана диаграмма концентрации белка COL1A2 в лизате клеток первичной культуры фибробластов кожи человека HDFa (ATCC PCS-201-01) после трансфекции этих клеток ДНК-вектором VTvaf17-COL1A2 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген COL1A2.
На фиг.11 отмечены следующие элементы:
культура А - первичная культура клеток фибробластов кожи человека HDFa, трансфицированная водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - первичная культура клеток фибробластов кожи человека HDFa трансфицированная ДНК-вектором VTvaf17;
культура C - первичная культура клеток фибробластов кожи человека HDFa, трансфицированных ДНК-вектором VTvaf17-COL1A2.
На фиг.12 показана диаграмма концентрации белка P4HA1 в лизате клеток фибробластов крайней плоти человека линии Hs27 (ATCC CRL-1634) после трансфекции этих клеток ДНК-вектором VTvaf17-P4HA1 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген P4HA1.
На фиг.12 отмечены следующие элементы:
культура А - культура клеток фибробластов крайней плоти человека линии Hs27, трансфицированных водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура клеток фибробластов крайней плоти человека линии Hs27, трансфицированных ДНК-вектором VTvaf17;
культура C - культура клеток фибробластов крайней плоти человека линии Hs27, трансфицированных ДНК-вектором VTvaf17-P4HA1.
На фиг. 13 показана диаграмма концентрации белка P4HA2 в лизате клеток фибробластов крайней плоти человека линии Hs27 (ATCC CRL-1634) после трансфекции этих клеток ДНК-вектором VTvaf17-P4HA2 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген P4HA2.
На фиг.13 отмечены следующие элементы:
культура А - культура клеток фибробластов крайней плоти человека линии Hs27, трансфицированных водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура клеток фибробластов крайней плоти человека линии Hs27, трансфицированных ДНК-вектором VTvaf17;
культура C - культура клеток фибробластов крайней плоти человека линии Hs27 трансфицированных ДНК-вектором VTvaf17-P4HA2.
На фиг.14 показана диаграмма концентрации белка COL7A1 в клеточном лизате культуры фибробластов человека HT 297.T (ATCC® CRL-7782™) после трансфекции этих клеток ДНК-вектором VTvaf17-COL7A1 с целью оценки функциональной активности, то есть экспрессии на уровне белка, по изменению количества белка COL7A1 в лизате клеток.
На фиг.14 отмечены следующие элементы:
культура А - культура клеток фибробластов человека HT 297.T, трансфицированная водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура клеток фибробластов человека HT 297.T, трансфицированных ДНК-вектором VTvaf17;
культура C - культура клеток фибробластов человека HT 297.T, трансфицированных ДНК-вектором VTvaf17-COL7A1.
На фиг.15 показана диаграмма концентрации белка CLCA2 в клеточном лизате культуры фибробластов человека HT 297.T (ATCC® CRL-7782™) после трансфекции этих клеток ДНК-вектором VTvaf17-CLCA2 с целью оценки функциональной активности, то есть экспрессии на уровне белка, по изменению количества белка CLCA2 в лизате клеток.
На фиг.15 отмечены следующие элементы:
культура А - культура клеток фибробластов человека HT 297.T, трансфицированная водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура клеток фибробластов человека HT 297.T, трансфицированных ДНК-вектором VTvaf17;
культура C - культура клеток фибробластов человека HT 297.T, трансфицированных ДНК-вектором VTvaf17-CLCA2.
На фиг.16 показана диаграмма концентрации белка ELN в клеточном лизате культуры кератиноцитов эпидермиса человека HEKa (ATCC PCS-200-011) после трансфекции этих клеток ДНК-вектором VTvaf17-ELN с целью оценки функциональной активности, то есть экспрессии на уровне белка, по изменению количества белка ELN в лизате клеток.
На фиг.16 отмечены следующие элементы:
культура А - культура клеток кератиноцитов эпидермиса человека HEKa, трансфицированная водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура клеток кератиноцитов эпидермиса человека HEKa , трансфицированных ДНК-вектором VTvaf17;
культура C - культура клеток кератиноцитов эпидермиса человека HEKa, трансфицированных ДНК-вектором VTvaf17-ELN.
На фиг.17 показана диаграмма концентрации белка PLOD1 в клеточном лизате культуры меланоцитов эпидермиса человека HEMa (ATCC® PCS-200-013™) после трансфекции этих клеток ДНК-вектором VTvaf17-PLOD1 с целью оценки функциональной активности, то есть экспрессии на уровне белка, по изменению количества белка PLOD1 в лизате клеток.
На фиг.17 отмечены следующие элементы:
культура А - культура клеток меланоцитов эпидермиса человека HEMa, трансфицированная водным раствором дендримеров без плазмидной ДНК (контроль);
культура B - культура клеток меланоцитов эпидермиса человека HEMa, трансфицированных ДНК-вектором VTvaf17;
культура C - культура клеток меланоцитов эпидермиса человека HEMa, трансфицированных ДНК-вектором VTvaf17-PLOD1.
На фиг. 18 показана диаграмма концентрации белка P4HA2 в биоптатах кожи трех пациентов после введения в кожу этих пациентов генотерапевтического ДНК-вектора VTvaf17-P4HA2 с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген P4HA2.
На фиг.18 отмечены следующие элементы:
П1I - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17-P4HA2;
П1II - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III - биоптат кожи пациента П1 из интактного участка,
П2I - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17-P4HA2;
П2II - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III - биоптат кожи пациента П2 из интактного участка;
П3I - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17-P4HA2;
П3II - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III - биоптат кожи пациента П3 из интактного участка.
На фиг. 19 показана диаграмма концентрации белка P4HA1 в биоптатах кожи трех пациентов после введения в кожу этих пациентов генотерапевтического ДНК-вектора VTvaf17- P4HA1, с целью оценки функциональной активности, то есть экспрессии целевого гена на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген P4HA1.
На фиг.19 отмечены следующие элементы:
П1I - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17- P4HA1;
П1II - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III - биоптат интактного участка кожи пациента П1;
П2I - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17- P4HA1;
П2II - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III - биоптат интактного участка кожи пациента П2;
П3I - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17- P4HA1;
П3II - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III - биоптат интактного участка кожи пациента П3.
На фиг.20 показана диаграмма концентрации белка COL7A1, CLCA2, ELN и PLOD1 в биоптатах кожи трех пациентов после сочетанного введения в кожу этих пациентов генотерапевтического ДНК-вектора VTvaf17- COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1 с целью оценки их функциональной активности, то есть экспрессии целевых генов на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтических ДНК-векторов на основе генотерапевтического ДНК-вектора VTvaf17, несущих целевой ген COL7A1, CLCA2, ELN и PLOD1.
На фиг.20 отмечены следующие элементы:
П1I - биоптат кожи пациента П1 в зоне введения смеси генотерапевтического ДНК-вектора VTvaf17-COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1;
П1II - биоптат кожи пациента П1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П1III - биоптат кожи пациента П1 из интактного участка;
П2I - биоптат кожи пациента П2 в зоне введения смеси генотерапевтического ДНК-вектора VTvaf17-COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1;
П2II - биоптат кожи пациента П2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П2III - биоптат кожи пациента П2 из интактного участка;
П3I - биоптат кожи пациента П3 в зоне введения смеси генотерапевтического ДНК-вектора VTvaf17-COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1;
П3II - биоптат кожи пациента П3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
П3III - биоптат кожи пациента П3 из интактного участка.
На фиг. 21 показана диаграмма концентрации белка COL1A2 в биоптатах кожи человека после введения в кожу культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-COL1A2 с целью демонстрации способа применения путем введения аутологичных клеток, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-COL1A2.
На фиг.21 отмечены следующие элементы:
П1С - биоптат кожи пациента П1 в зоне введения культуры аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-COL1A2;
П1B - биоптат кожи пациента П1 в зоне введения аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17;
П1А - биоптат кожи пациента П1 из интактного участка.
На фиг. 22 показана диаграмма концентрации белка COL1A1, COL1A2, P4HA1 и P4HA2 в биоптатах кожи трех крыс после сочетанного введения в кожи этих животных генотерапевтических ДНК векторов: VTvaf17-COL1A1, VTvaf17-COL1A2, VTvaf17-P4HA1 и VTvaf17-P4HA2 с целью оценки их функциональной активности, то есть экспрессии целевых генов на уровне белка, и возможности повышения уровня экспрессии белка с помощью генотерапевтических ДНК-векторов на основе генотерапевтического ДНК-вектора VTvaf17, несущих целевой ген COL1A1, COL1A2, P4HA1 и P4HA2.
На фиг.22 отмечены следующие элементы:
К1I - биоптат кожи крысы К1 в зоне введения смеси генотерапевтических ДНК векторов: VTvaf17-COL1A1, VTvaf17- COL1A2, VTvaf17-P4HA1 и VTvaf17-P4HA2;
К1II - биоптат кожи крысы К1 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
К1III - биоптат контрольного интактного участка кожи крысы К1;
К2I - биоптат кожи крысы К2 в зоне введения смеси генотерапевтических ДНК векторов: VTvaf17-COL1A1, VTvaf17-COL1A2, VTvaf17-P4HA1 и VTvaf17-P4HA2;
К2II - биоптат кожи крысы К2 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
К2III - биоптат контрольного интактного участка кожи крысы К2;
К3I - биоптат кожи крысы К3 в зоне введения смеси генотерапевтических ДНК векторов: VTvaf17-COL1A1, VTvaf17- COL1A2, VTvaf17-P4HA1 и VTvaf17-P4HA2;
К3II - биоптат кожи крысы К3 в зоне введения генотерапевтического ДНК вектора VTvaf17 (плацебо);
К3III - биоптат контрольного интактного участка кожи крысы К3.
На фиг. 23 показаны графики накопления ампликонов кДНК целевого гена ELN в клетках фибробластов кожи быка (ScienCell, Кат. #B2300) до и через 48 часов после трансфекции этих клеток ДНК-вектором VTvaf17-ELN с целью демонстрации способа применения путем введения генотерапевтического ДНК-вектора животным
На фиг.23 отмечены кривые накопления ампликонов в ходе реакции, соответствующие:
1 - кДНК гена ELN в клетках фибробластов кожи быка до трансфекции генотерапевтическим ДНК-вектором VTvaf17-ELN;
2 - кДНК гена ELN в клетках фибробластов кожи быка после трансфекции генотерапевтическим ДНК-вектором VTvaf17-ELN;
3 - кДНК гена ACT в клетках фибробластов кожи быка до трансфекции генотерапевтическим ДНК-вектором VTvaf17-ELN;
4 - кДНК гена ACT в клетках фибробластов кожи быка после трансфекции генотерапевтическим ДНК-вектором VTvaf17-ELN.
В качестве референтного гена использовали ген актина быка/ коровы (АСТ), приведенного в базе данных GenBank под номером AH001130.2.
Реализация изобретения
На основе ДНК-вектора VTvaf17 размером 3165 п.н. созданы генотерапевтические ДНК-векторы, несущие целевые гены человека, предназначенные для повышения уровня экспрессии этих целевых генов в тканях человека и животных. При этом способ получения каждого генотерапевтического ДНК-вектора, несущего целевые гены заключается в том, что в полилинкер генотерапевтического ДНК-вектора VTvaf17 клонируют белок-кодирующую последовательность целевого гена, выбранного из группы генов: ген COL1A1 (кодирует белок COL1A1) , ген COL1A2 (кодирует белок COL1A2), ген P4HA1 (кодирует белок P4HA1), ген P4HA2 (кодирует белок P4HA2), ген COL7A1 (кодирует белок COL7A1), ген CLCA2 (кодирует белок CLCA2), ген ELN (кодирует белок ELN), ген PLOD1 (кодирует белок PLOD1) человека. Известно, что способность ДНК-векторов проникать в эукариотические клетки обусловлена, главным образом, размером вектора. При этом ДНК-вектора с наименьшим размером обладают более высокой проникающей способностью. Таким образом, предпочтительным является отсутствие в составе вектора элементов, которые не несут функциональной нагрузки, но при этом увеличивают размер ДНК-вектора. Данные особенности ДНК-векторов были учтены при получении генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1 путем отсутствия в составе вектора крупных нефункциональных последовательностей и генов антибиотикорезистентности, что позволило, помимо технологических преимуществ и преимуществ в плане безопасности применения, значительно уменьшить размер полученного генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1. Таким образом, способность проникать в эукариотические клетки полученного генотерапевтического ДНК-вектора обусловлена его небольшими размерами.
Каждый из генотерапевтических ДНК-векторов: ДНК-вектор VTvaf17- COL1A1 или VTvaf17-COL1A2 или VTvaf17-P4HA1 или VTvaf17-P4HA2 или VTvaf17-COL7A1 или VTvaf17-CLCA2 или VTvaf17-ELN или VTvaf17-PLOD1 получали следующим образом: кодирующую часть целевого гена COL1A1 или COL1A2 или P4HA1 или P4HA2 или COL7A1 или CLCA2 или ELN или PLOD1 клонировали в генотерапевтический ДНК-вектор VTvaf17 и получали генотерапевтический ДНК-вектор VTvaf17-COL1A1, SEQ ID №1 или VTvaf17-COL1A2, SEQ ID №2 или VTvaf17-P4HA1, SEQ ID №3 или VTvaf17-P4HA2, SEQ ID №4 или VTvaf17-COL7A1, SEQ ID №5 или VTvaf17-CLCA2, SEQ ID №6 или VTvaf17-ELN, SEQ ID №7 или VTvaf17-PLOD1, SEQ ID №8 соответственно. Кодирующую часть гена COL1A1 размером 4410 п.н., или гена COL1A2 размером 4116 п.н., или гена P4HA1 размером 1607 п.н., или гена P4HA2 размером 1605 п.н., или гена COL7A1 размером 8838 п.н., или гена CLCA2 размером 2833 п.н., или гена ELN размером 2068 п.н., или гена PLOD1 размером 2185 п.н. получали путем выделения суммарной РНК из биологического образца ткани здорового человека. Для получения первой цепи кДНК генов COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1 человека использовали реакцию обратной транскрипции. Амплификацию проводили с использованием созданных для этого методом химического синтеза олигонуклеотидов. Расщепление продукта амплификации специфическими эндонуклеазами рестрикции проводили с учетом оптимальной процедуры дальнейшего клонирования, причем клонирование в генотерапевтический ДНК-вектор VTvaf17 проводили по сайтам рестрикции BamHI, EcoRI, HindIII расположенными в полилинкере вектора VTvaf17. Выбор сайтов рестрикции проводили таким образом, чтобы клонированный фрагмент попадал в рамку считывания экспрессионной кассеты вектора VTvaf17, при этом белок-кодирующая последовательность не содержала сайты рестрикции для выбранных эндонуклеаз. При этом специалистам в данной области техники понятно, что методическая реализация получения генотерапевтического ДНК-вектора VTvaf17- COL1A1 или VTvaf17-COL1A2 или VTvaf17-P4HA1 или VTvaf17-P4HA2 или VTvaf17-COL7A1 или VTvaf17-CLCA2 или VTvaf17-ELN или VTvaf17-PLOD1 может варьировать в рамках выбора известных методов молекулярного клонирования генов, при этом эти способы подпадают под объем настоящего изобретения. Так, например, могут быть использованы различные последовательности олигонуклеотидов для амплификации гена COL1A1 или COL1A2 или P4HA1 или P4HA2 или COL7A1 или CLCA2 или ELN или PLOD1 различные эндонуклеазы рестрикции или такие лабораторные техники как безлигазное клонирование генов.
Генотерапевтический ДНК-вектор VTvaf17-COL1A1 или VTvaf17-COL1A2 или VTvaf17-P4HA1 или VTvaf17-P4HA2 или VTvaf17-COL7A1 или VTvaf17-CLCA2 или VTvaf17-ELN или VTvaf17-PLOD1 обладает нуклеотидной последовательностью SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 или SEQ ID №6 или SEQ ID №7 или SEQ ID №8 соответственно. При этом специалистам в данной области техники известно свойство вырожденности генетического кода, из которого следует, что под объем настоящего изобретения также подпадают варианты нуклеотидных последовательностей, отличающихся инсерцией, делецией или заменой нуклеотидов, которые не приводят к изменению полипептидной последовательности, кодируемой целевым геном, и/или не приводят к потере функциональной активности регуляторных элементов вектора VTvaf17. При этом специалистам в данной области техники известно явление генетического полиморфизма, из которого следует, что под объем настоящего изобретения также подпадают варианты нуклеотидных последовательностей генов из группы генов COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1, которые при этом кодируют различные варианты аминокислотных последовательностей белков COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1, не отличающихся от приведенных по своей функциональной активности при физиологических условиях.
Способность проникать в эукариотические клетки и функциональную активность, то есть способность экспрессировать целевой ген, полученного генотерапевтического ДНК-вектора VTvaf17- COL1A1 или VTvaf17-COL1A2 или VTvaf17-P4HA1 или VTvaf17-P4HA2 или VTvaf17-COL7A1 или VTvaf17-CLCA2 или VTvaf17-ELN или VTvaf17-PLOD1 подтверждают путем введения в эукариотические клетки полученного вектора и последующим анализом экспрессии специфической мРНК и/или белкового продукта целевого гена. Наличие специфической мРНК в клетках, в которые был введен генотерапевтический ДНК-вектор VTvaf17-COL1A1 или VTvaf17-COL1A2 или VTvaf17-P4HA1 или VTvaf17-P4HA2 или VTvaf17-COL7A1 или VTvaf17-CLCA2 или VTvaf17-ELN или VTvaf17-PLOD1 свидетельствует как о способности полученного вектора проникать в эукариотические клетки, так и о его способности экспрессировать мРНК целевого гена. При этом, как известно специалистам в данной области техники, наличие мРНК гена является обязательным условием, но не доказательством трансляции белка, кодируемого целевым геном. Поэтому для подтверждения свойства генотерапевтического ДНК-вектора VTvaf17-COL1A1 или VTvaf17-COL1A2 или VTvaf17-P4HA1 или VTvaf17-P4HA2 или VTvaf17-COL7A1 или VTvaf17-CLCA2 или VTvaf17-ELN или VTvaf17-PLOD1 экспрессировать целевой ген на уровне белка в эукариотических клетках, в которые был введен генотерапевтический ДНК-вектор, проводят анализ концентрации белков, кодируемых целевыми генами, с использованием иммунологических методов. Наличие белка COL1A1 или COL1A2 или P4HA1 или P4HA2 или COL7A1 или CLCA2 или ELN или PLOD1 подтверждает эффективность экспрессии целевых генов в эукариотических клетках и возможность повышения уровня концентрации белка с помощью генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1.
Таким образом для подтверждения эффективности экспрессии созданного генотерапевтического ДНК-вектора VTvaf17-COL1A1, несущего целевой ген, а именно, ген COL1A1, генотерапевтического ДНК-вектора VTvaf17-COL1A2, несущего целевой ген, а именно, ген COL1A2, генотерапевтического ДНК-вектора VTvaf17-P4HA1, несущего целевой ген, а именно, ген P4HA1, генотерапевтического ДНК-вектора VTvaf17- P4HA2, несущего целевой ген, а именно, ген P4HA2, генотерапевтического ДНК-вектора VTvaf17-COL7A1, несущего целевой ген, а именно, ген COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, несущего целевой ген, а именно, ген CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, несущего целевой ген, а именно, ген ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1, несущего целевой ген, а именно, ген PLOD1 использовали следующие методы:
А) ПЦР в реальном времени - изменение накопления ампликонов кДНК целевых генов в лизате клеток человека и животного, после трансфекции различных клеточных линий человека и животного генотерапевтическим ДНК-векторами;
B) Иммуноферментный анализ - изменение количественного уровня целевых белков в лизате клеток человека, после трансфекции различных клеточных линий человека генотерапевтическими ДНК-векторами;
C) Иммуноферментный анализ - изменение количественного уровня целевых белков в супернатанте биоптатов тканей человека и животного, после введения в эти ткани генотерапевтических ДНК-векторов;
D) Иммуноферментный анализ - изменение количественного уровня целевых белков в супернатанте биоптатов тканей человека, после введения в эти ткани аутологичных клеток этого человека, трансфицированных генотерапевтическими ДНК-векторами.
Для подтверждения реализуемости способа применения созданного генотерапевтического ДНК-вектора VTvaf17-COL1A1, несущего целевой ген, а именно, ген COL1A1, генотерапевтического ДНК-вектора VTvaf17-COL1A2, несущего целевой ген, а именно, ген COL1A2, генотерапевтического ДНК-вектора VTvaf17-P4HA1, несущего целевой ген, а именно, ген P4HA1, генотерапевтического ДНК-вектора VTvaf17- P4HA2, несущего целевой ген, а именно, ген P4HA2, генотерапевтического ДНК-вектора VTvaf17-COL7A1, несущего целевой ген, а именно, ген COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, несущего целевой ген, а именно, ген CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, несущего целевой ген, а именно, ген ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1, несущего целевой ген, а именно, ген PLOD1 выполняли:
А) трансфекцию генотерапевтическими ДНК-векторами различных клеточных линий человека и животного;
B) введение генотерапевтических ДНК-векторов в различные ткани человека и животного;
С) введение в ткани человека и животного смеси генотерапевтических ДНК-векторов;
D) введение в ткани человека аутологичных клеток, трансфицированных генотерапевтическими ДНК-векторами.
Указанные способы применения характеризуются отсутствием потенциальных рисков для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов, и за счет отсутствия в составе генотерапевтического ДНК-вектора генов устойчивости к антибиотикам, что подтверждается отсутствием участков, гомологичных вирусным геномам и генам антибиотикорезистентности в нуклеотидных последовательностях генотерапевтического ДНК-вектора VTvaf17- COL1A1 или генотерапевтического ДНК-вектора VTvaf17-COL1A2 или генотерапевтического ДНК-вектора VTvaf17-P4HA1 или генотерапевтического ДНК-вектора VTvaf17-P4HA2 или генотерапевтического ДНК-вектора VTvaf17-COL7A1 или генотерапевтического ДНК-вектора VTvaf17-CLCA2 или генотерапевтического ДНК-вектора VTvaf17-ELN или генотерапевтического ДНК-вектора VTvaf17-PLOD1 (SEQ ID №1 или SEQ ID №2 или SEQ ID №3 или SEQ ID №4 или SEQ ID №5 или SEQ ID №6 или SEQ ID №7 или SEQ ID №8 соответственно).
Как известно специалистам в данной области техники, гены антибиотикорезистентности в составе генотерапевтических ДНК-векторов используются с целью получения этих векторов в препаративных количествах путем наращивания бактериальной биомассы в питательной среде, содержащей селективный антибиотик. В рамках настоящего изобретения в целях возможности безопасного применения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген COL1A1 или COL1A2 или P4HA1 или P4HA2 или COL7A1 или CLCA2 или ELN или PLOD1, использование селективных питательных сред, содержащих антибиотик, не представляется возможным. В качестве технологического решения для получения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1 для возможности масштабирования до промышленных масштабов получения генотерапевтических векторов предлагается способ получения штаммов для наработки указанных генотерапевтических векторов на основе бактерии Escherichia coli SCS110-AF. Способ получения штамма Escherichia coli SCS110-AF/VTvaf17-COL1A1 или штамма Escherichia coli SCS110-AF/VTvaf17-COL1A2 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA1 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA2, или штамма Escherichia coli SCS110-AF/VTvaf17-COL7A1 или штамма Escherichia coli SCS110-AF/VTvaf17-CLCA2 или штамма Escherichia coli SCS110-AF/VTvaf17-ELN или штамма Escherichia coli SCS110-AF/VTvaf17-PLOD1 заключается в получении компетентных клеток штамма Escherichia coli SCS110-AF с введением в эти клетки генотерапевтического ДНК-вектора VTvaf17-COL1A1 или ДНК-вектора VTvaf17-COL1A2 или ДНК-вектора VTvaf17-P4HA1 или ДНК-вектора VTvaf17-P4HA2 или ДНК-вектора VTvaf17-COL7A1 или ДНК-вектора VTvaf17-CLCA2 или ДНК-вектора VTvaf17-ELN или ДНК-вектора VTvaf17-PLOD1 соответственно с помощью методов трансформации (электропорации), общеизвестных специалистам в данной области техники. Полученный штамм Escherichia coli SCS110-AF/VTvaf17-COL1A1 или штамм Escherichia coli SCS110-AF/VTvaf17-COL1A2 или штамм Escherichia coli SCS110-AF/VTvaf17-P4HA1 или штамм Escherichia coli SCS110-AF/VTvaf17-P4HA2 или штамм Escherichia coli SCS110-AF/VTvaf17-COL7A1 или штамм Escherichia coli SCS110-AF/VTvaf17-CLCA2 или штамм Escherichia coli SCS110-AF/VTvaf17-ELN или штамм Escherichia coli SCS110-AF/VTvaf17-PLOD1 используется для наработки генотерапевтического ДНК-вектора VTvaf17-COL1A1 или VTvaf17-COL1A2 или VTvaf17-P4HA1 или VTvaf17-P4HA2 или VTvaf17-COL7A1 или VTvaf17-CLCA2 или VTvaf17-ELN или VTvaf17-PLOD1 соответственно с возможностью использования сред без содержания антибиотиков.
Для подтверждения получения штамма Escherichia coli SCS110-AF/VTvaf17-COL1A1 или штамма Escherichia coli SCS110-AF/VTvaf17- COL1A2 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA1 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA2 или штамма Escherichia coli SCS110-AF/VTvaf17-COL7A1 или штамма Escherichia coli SCS110-AF/VTvaf17-CLCA2 или штамма Escherichia coli SCS110-AF/VTvaf17-ELN или штамма Escherichia coli SCS110-AF/VTvaf17-PLOD1 проводили трансформацию, селекцию и последующее наращивание с выделением плазмидной ДНК.
Для подтверждения технологичности получения и возможности масштабирования до промышленного производства генотерапевтического ДНК-вектора VTvaf17-COL1A1, несущего целевой ген, а именно, ген COL1A1 или VTvaf17-COL1A2, несущего целевой ген, а именно, ген COL1A2 или VTvaf17-P4HA1, несущего целевой ген, а именно, ген P4HA1 или VTvaf17-P4HA2, несущего целевой ген, а именно, ген P4HA2 или VTvaf17-COL7A1, несущего целевой ген, а именно, ген COL7A1 или VTvaf17-CLCA2, несущего целевой ген, а именно, ген CLCA2 или VTvaf17-ELN, несущего целевой ген, а именно, ген ELN или VTvaf17-PLOD1, несущего целевой ген, а именно, ген PLOD1 выполняли ферментацию в промышленном масштабе штамма Escherichia coli SCS110-AF/VTvaf17- COL1A1 или штамма Escherichia coli SCS110-AF/VTvaf17-COL1A2 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA1 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA2 или штамма Escherichia coli SCS110-AF/VTvaf17-COL7A1 или штамма Escherichia coli SCS110-AF/VTvaf17-CLCA2 или штамма Escherichia coli SCS110-AF/VTvaf17-ELN или штамма Escherichia coli SCS110-AF/VTvaf17-PLOD1, каждый из которых содержит генотерапевтический ДНК-вектор VTvaf17, несущий целевой ген, а именно COL1A1 или COL1A2 или P4HA1 или P4HA2 или COL7A1 или CLCA2 или ELN или PLOD1.
Способ масштабирования получения бактериальной массы до промышленных масштабов для выделения генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1 заключается в том, что затравочную культуру штамма Escherichia coli SCS110-AF/VTvaf17- COL1A1 или штамма Escherichia coli SCS110-AF/VTvaf17-COL1A2 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA1 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA2 или штамма Escherichia coli SCS110-AF/VTvaf17-COL7A1 или штамма Escherichia coli SCS110-AF/VTvaf17-CLCA2 или штамма Escherichia coli SCS110-AF/VTvaf17-ELN или штамма Escherichia coli SCS110-AF/VTvaf17-PLOD1 инкубируют в объеме питательной среды без содержания антибиотика, обеспечивающим подходящую динамику накопления биомассы, по достижению достаточного количества биомассы в логарифмической фазе роста, бактериальную культуру переносят в промышленный ферментер, после чего растят до достижения стационарной фазы роста, затем выделяют фракцию, содержащую целевой ДНК-продукт - генотерапевтический ДНК-вектор VTvaf17-COL1A1 или генотерапевтический ДНК-вектор VTvaf17-COL1A2 или генотерапевтический ДНК-вектор VTvaf17-P4HA1 или генотерапевтический ДНК-вектор VTvaf17-P4HA2 или генотерапевтический ДНК-вектор VTvaf17-COL7A1 или генотерапевтический ДНК-вектор VTvaf17-CLCA2 или генотерапевтический ДНК-вектор VTvaf17-ELN или генотерапевтический ДНК-вектор VTvaf17-PLOD1, многостадийно фильтруют и очищают хроматографическими методами. При этом специалистам в данной области техники понятно, что условия культивирования штаммов, состав питательных сред (за исключением содержания антибиотиков), используемое оборудование, методы очистки ДНК могут варьировать в рамках стандартных операционных процедур в зависимости от отдельно взятой производственной линии, но известные подходы к масштабированию, промышленному получению и очистке ДНК-векторов с использованием штамма Escherichia coli SCS110-AF/VTvaf17-COL1A1 или штамма Escherichia coli SCS110-AF/VTvaf17-COL1A2 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA1 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA2 или штамма Escherichia coli SCS110-AF/VTvaf17-COL7A1 или штамма Escherichia coli SCS110-AF/VTvaf17-CLCA2 или штамма Escherichia coli SCS110-AF/VTvaf17-ELN или штамма Escherichia coli SCS110-AF/VTvaf17-PLOD1 подпадают под объем настоящего изобретения.
Изобретение поясняется следующими примерами.
Пример 1.
Получение генотерапевтического ДНК-вектора VTvaf17-COL1A1, несущего целевой ген, а именно, гена COL1A1.
Генотерапевтический ДНК-вектор VTvaf17-COL1A1 конструировали клонированием кодирующей части гена COL1A1 размером 4410 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции NheI и HindIII. Кодирующую часть гена COL1A1 размером 4410 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
Col1A1_F CCAGCTAGCGTCTAGGGTCTAGACATGTTC
Col1A1_R TATAAGCTTCTACAGGAAGCAGACAGGGCCAAC
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США).
Генотерапевтический ДНК-вектор VTvaf17 конструировали объединением шести фрагментов ДНК, полученных из разных источников:
(а) ориджин репликации получали путем ПЦР-амплификации участка коммерческой плазмиды pBR322 с внесением точечной мутации;
(б) промоторный регион EF1а получали путем ПЦР-амплификации участка геномной ДНК человека;
(в) терминатор транскрипции hGH-TA получали путем ПЦР-амплификации участка геномной ДНК человека;
(г) регуляторный участок транспозона Tn10 РНК-out получали путем синтеза из олигонуклеотидов;
(д) ген устойчивости к канамицину получали путем ПЦР-амплификации участка коммерческой плазмиды pET-28 человека;
(е) полилинкер получали отжигом двух синтетических олигонуклеотидов.
ПЦР-амплификацию проводили с использованием коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США) в соответствии с инструкцией производителя. Фрагменты имеют перекрывающиеся области для возможности их объединения с последующей ПЦР-амплификацией. Объединяли фрагменты (а) и (б) с использованием олигонуклеотидов Ori-F и EF1-R, а также фрагменты (в), (г) и (д) с использованием олигонуклеотидов hGH-F и Kan-R. Далее, полученные участки объединяли путем рестрикции с последующим лигированием по сайтам BamHI и NcoI. В результате получали плазмиду, пока еще не содержащую полилинкер. Для его введения проводили расщепление плазмиды по сайтам BamHI и EcoRI, и лигирование с фрагментом (е). Таким образом, получали вектор размером 4182 п.н., несущий ген устойчивости к канамицину, который фланкирован сайтами рестрикции SpeI. Далее этот участок выщепляли по сайтам рестрикции SpeI, после чего оставшийся фрагмент лигировали сам на себя. Таким образом получали генотерапевтический ДНК-вектор VTvaf17 размером 3165 п.н., который является рекомбинантным, с возможностью селекции без антибиотиков.
Расщепление продукта амплификации кодирующей части гена COL1A1 и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции NheI и HindIII (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-COL1A1 размером 7563 п.н. с нуклеотидной последовательностью SEQ ID №1 и общей структурой изображенной на фиг.1A.
Пример 2.
Получение генотерапевтического ДНК-вектора VTvaf17-COL1A2, несущего целевой ген, а именно, гена COL1A2.
Генотерапевтический ДНК-вектор VTvaf17-COL1A2 конструировали клонированием кодирующей части гена COL1A2 размером 4116 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции NheI и HindIII. Кодирующую часть гена COL1A2 размером 4116 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
Col1A2_F CCAGCTAGCGTCTAAGTGCTAGACATGCTC
Col1A2_R CGAAGCTTTTATTTGAAACAGACTGGGCCA
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции NheI и HindIII (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-COL1A2 размером 7269 п.н. с нуклеотидной последовательностью SEQ ID №2 и общей структурой изображенной на фиг.1B.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 3
Получение ДНК-вектора VTvaf17-P4HA1, несущего целевой ген, а именно, гена P4HA1 человека.
Генотерапевтический ДНК-вектор VTvaf17-P4HA1 конструировали клонированием кодирующей части гена P4HA1 размером 1607 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции BamHI и KpnI. Кодирующую часть гена P4HA1 размером 1607 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
P4HA1_F AGGATCCACCATGATCTGGTATATATTAATTATAGG
P4HA1_R TTCGGTACCTATTCCAATTCTGACAACGTACAAG
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI и KpnI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-P4HA1 размером 4754 п.н. с нуклеотидной последовательностью SEQ ID №3 и общей структурой изображенной на фиг.1C.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 4.
Получение генотерапевтического ДНК-вектора VTvaf17-P4HA2, несущего целевой ген, а именно, гена P4HA2.
Генотерапевтический ДНК-вектор VTvaf17-P4HA2 конструировали клонированием кодирующей части гена P4HA2 размером 1605 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции BamHII и SalI. Кодирующую часть гена P4HA2 размером 1605 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген) и ПЦР-амплификации с использованием олигонуклеотидов:
P4HA2_F AGGATCCACCATGAAACTCTGGGTGTCTGCA
P4HA2_R CTTGTCGACTTAGTCAACTTCTGTTGATCCACA
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHII и SalI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-P4HA2 размером 4704 п.н. с нуклеотидной последовательностью SEQ ID №4 и общей структурой изображенной на фиг.1D.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 5.
Получение генотерапевтического ДНК-вектора VTvaf17-COL7A1, несущего целевой ген, а именно, гена COL7A1.
Генотерапевтический ДНК-вектор VTvaf17-COL7A1 конструировали клонированием кодирующей части гена COL7A1 размером 8838 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции SalI, EcoRI. Кодирующую часть гена COL7A1 размером 8838 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
COL7A1_F ATCGTCGACCACCATGACGCTGCGGCTTCTGGT
COL7A1_R ATAGAATTCAGTCCTGGGCAGTACCTGTC
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции SalI, EcoRI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-COL7A1 размером 11990 п.н. с нуклеотидной последовательностью SEQ ID №5 и общей структурой изображенной на фиг.1E.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 6.
Получение ДНК-вектора VTvaf17-CLCA2, несущего целевой ген, а именно, гена CLCA2 человека.
Генотерапевтический ДНК-вектор VTvaf17-CLCA2 конструировали клонированием кодирующей части гена CLCA2 размером 2833 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции BamHI и EcoRI. Кодирующую часть гена CLCA2 размером 2833 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген, Россия) и ПЦР-амплификации с использованием олигонуклеотидов:
CLCA2_F AGGATCCACCATGACCCAAAGGAGCATTGC
CLCA2_R ATAGAATTCATAATAATTTTGTTCCATTCTCTTTC
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHI и EcoRI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-CLCA2 размером 5974 п.н. с нуклеотидной последовательностью SEQ ID №6 и общей структурой изображенной на фиг.1F.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 7.
Получение генотерапевтического ДНК-вектора VTvaf17-ELN, несущего целевой ген, а именно, гена ELN.
Генотерапевтический ДНК-вектор VTvaf17-ELN конструировали клонированием кодирующей части гена ELN размером 2068 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции SalI и EcoRI. Кодирующую часть гена ELN размером 2068 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген) и ПЦР-амплификации с использованием олигонуклеотидов:
ELN_F TTTGTCGACCACCATGGCGGGTCTGACGGCGG
ELN_R TTTTTGAATTCTCATTTTCTCTTCCGGCCACAAGCTT
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции SalI и EcoRI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-ELN размером 5257 п.н. с нуклеотидной последовательностью SEQ ID №7 и общей структурой изображенной на фиг.1G.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 8.
Получение генотерапевтического ДНК-вектора VTvaf17-PLOD1, несущего целевой ген, а именно, гена PLOD1.
Генотерапевтический ДНК-вектор VTvaf17-PLOD1 конструировали клонированием кодирующей части гена PLOD1 размером 2185 п.н. в ДНК-вектор VTvaf17 размером 3165 п.н. по сайтам рестрикции BamHII и EcoRI. Кодирующую часть гена PLOD1 размером 2185 п.н. получали путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции с использованием коммерческого набора Mint-2 (Евроген) и ПЦР-амплификации с использованием олигонуклеотидов:
PLOD1_F GGATCCACCATGCGGCCCCTGCTGCTACT
PLOD1_R ATAGAATTCAGGGATCGACGAAGGAGACT
и коммерческого набора Phusion® High-Fidelity DNA Polymerase (New England Biolabs, США), расщепление продукта амплификации и ДНК-вектора VTvaf17 проводили эндонуклеазами рестрикции BamHII и EcoRI (New England Biolabs, США).
В результате получали ДНК-вектор VTvaf17-PLOD1 размером 5326 п.н. с нуклеотидной последовательностью SEQ ID №8 и общей структурой изображенной на фиг.1H.
При этом генотерапевтический ДНК-вектор VTvaf17 конструировали по Примеру 1.
Пример 9.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-COL1A1, несущего целевой ген, а именно, ген COL1A1, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена COL1A1, в первичной культуре фибробластов кожи человека HDFa (ATCC PCS-201-01) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-COL1A1, несущим ген COL1A1 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Для оценки изменения накопления мРНК целевого гена COL1A1, использовалась первичная культура фибробластов кожи человека HDFa. Клеточную культуру HDFa выращивали в стандартных условиях (37°С, 5% СО2) с использованием питательной среды Fibroblast Growth Kit-Serum-Free (ATCC® PCS-201-040). В процессе культивирования каждые 48 ч происходила смена ростовой среды.
Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-COL1A1, экспрессирующим ген COL1A1 человека, проводили с использованием Lipofectamine 3000 (ThermoFisher Scientific, США) согласно рекомендациям производителя. В пробирке №1 к 25 мкл среды Opti-MEM (Gibco, США) добавляли 1 мкл раствора ДНК-вектора VTvaf17-COL1A1 (концентрация 500 нг/мкл) и 1 мкл реагента Р3000. Аккуратно перемешивали легким встряхиванием. В пробирке №2 к 25 мкл среды Opti-MEM (Gibco, США) добавляли 1 мкл раствора Lipofectamin 3000. Аккуратно перемешивали легким встряхиванием. Добавляли содержимое пробирки №1 к содержимому пробирки №2, инкубировали 5 мин при комнатной температуре. Полученный раствор по каплям добавляли к клеткам в объеме 40 мкл.
В качестве контроля использовали клетки HDFa, трансфицированные генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена (кДНК гена COL1A1 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Подготовку контрольного вектора VTvaf17 для трансфекции проводили как описано выше.
Суммарную РНК из клеток HDFa выделяли с использованием Trizol Reagent (Invitrogen, США) согласно рекомендациям производителя. В лунку с клетками добавляли 1 мл Trizol Reagent и гомогенизировали с последующим прогреванием в течении 5 мин при 65°С. Далее образец центрифугировали при 14 000g в течении 10 мин и снова прогревали в течении 10 мин при 65°C. Далее добавляли 200 мкл хлороформа, плавно перемешивали и центрифугировали при 14 000g в течении 10 мин. Затем отбирали водную фазу, добавляли к ней 1/10 объема 3М ацетата натрия, рН 5.2 и равный объем изопропилового спирта. Инкубировали образец при -20°C в течении 10 мин с последующим центрифугированием при 14 000g в течении 10 мин. Осадок промывали 1 мл 70% этилового спирта, высушивали на воздухе и растворяли в 10 мкл воды, свободной от РНКаз. Определение уровня экспрессии мРНК гена COL1A1 после трансфекции проводили путем оценки динамики накопления ампликонов кДНК методом ПЦР в режиме реального времени. Для получения и амплификации кДНК, специфичной для гена COL1A1 человека, использовали олигонуклеотиды COL1A1_SF и COL1A1_SR:
Col1A1_SF TGACCTCAAGATGTGCCACT
Col1A1_SR CAGACATGCCTCTTGTCCTTG
Длина продукта амплификации - 195 п.н.
Реакцию обратной транскрипции и ПЦР-амплификацию проводили с помощью набора реагентов SYBR GreenQuantitect RT-PCR Kit (Qiagen, США) для ПЦР в режиме реального времени. Реакцию проводили в объеме 20 мкл, содержащих: 25 мкл QuantiTect SYBR Green RT-PCR MasterMix, 2,5 мM хлорида магния, по 0,5 мкМ каждого праймера, 5 мкл РНК. Реакцию осуществляли на амплификаторе CFX96 (Bio-Rad, США) при следующих условиях: 1 цикл обратной транскрипции при 42°С - 30 минут, денатурация 98°С - 15 мин, затем 40 циклов, включающих денатурацию 94°С - 15 сек, отжиг праймеров 60°C - 30 сек и элонгацию 72°С - 30 сек. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов COL1A1 и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество динамику накопления ампликонов кДНК генов COL1A1 и B2M оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 2.
Из фигуры 2 следует, что в результате трансфекции первичной культуры клеток фибробластов человека HDFa генотерапевтическим ДНК-вектором VTvaf17-COL1A1, уровень специфической мРНК гена COL1A1 человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген COL1A1 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-COL1A1 для повышения уровня экспрессии гена COL1A1 в эукариотических клетках.
Пример 10.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-COL1A2, несущего целевой ген, а именно, ген COL1A2, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена COL1A2, в первичной культуре фибробластов кожи человека HDFa (ATCC PCS-201-01) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-COL1A2, несущим ген COL1A2 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Первичную культуру клеток фибробластов кожи человека HDFa выращивали в среде Fibroblast Growth Kit-Serum-Free (ATCC® PCS-201-040) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-COL1A2, экспрессирующим ген COL1A2 человека, проводили как описано в примере 9. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве контроля использовали культуру клеток HDFa, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена COL1A2 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 9, за исключением олигонуклеотидов с отличающимися от примера 9 последовательностями. Для амплификации кДНК, специфичной для гена COL1A2 человека, использовали олигонуклеотиды COL1A2_SF и COL1A2_SR:
COL1A2_SF TGAACTTGTTGCTGAGGGCA
COL1A2_SR CCAGTTCTTGGCTGGGATGT
Длина продукта амплификации - 195 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов COL1A2 и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов COL1A2 и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 3.
Из фигуры 3 следует, что в результате трансфекции культуры фибробластов кожи человека HDFa генотерапевтическим ДНК-вектором VTvaf17-COL1A2, уровень специфической мРНК гена COL1A2 человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген COL1A2 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-COL1A2 для повышения уровня экспрессии гена COL1A2 в эукариотических клетках.
Пример 11.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-P4HA1, несущего целевой ген, а именно, ген P4HA1, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена P4HA1 в культуре клеток фибробластов крайней плоти человека линии Hs27 (ATCC CRL-1634) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-P4HA1, несущим ген P4HA1 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Культуру клеток фибробластов крайней плоти человека линии Hs27 выращивали в среде Dulbecco's Modified Eagle's Medium (DMEM) (ATCC® 30-2002™) с добавлением 10 % сыворотки крупного рогатого скота (ATCC® 30-2020™) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-P4HA1, экспрессирующим ген P4HA1 человека, проводили как описано в примере 9. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве контроля использовали культуру клеток линии Hs27, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена P4HA1 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 9, за исключением олигонуклеотидов с отличающимися от примера 9 последовательностями. Для амплификации кДНК, специфичной для гена P4HA1 человека, использовали олигонуклеотиды P4HA1_SF и P4HA1_SR:
P4HA1_SF AAAAGTGCCTGGCTCTCTGG
P4HA1_SR TGGCTCATCTTTCCGTGCAA
Длина продукта амплификации - 171 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов P4HA1 и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов P4HA1 и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 4.
Из фигуры 4 следует, что в результате трансфекции культуры клеток фибробластов крайней плоти человека линии Hs27 генотерапевтическим ДНК-вектором VTvaf17-P4HA1 уровень специфической мРНК гена P4HA1 человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген P4HA1 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-P4HA1 для повышения уровня экспрессии гена P4HA1 в эукариотических клетках.
Пример 12.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-P4HA2, несущего целевой ген, а именно, ген P4HA2, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена P4HA2, в культуре клеток фибробластов крайней плоти человека линии Hs27 (ATCC CRL-1634) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-P4HA2, несущим ген P4HA2 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Культуру клеток фибробластов крайней плоти человека линии Hs27 выращивали в среде Dulbecco's Modified Eagle's Medium (DMEM) (ATCC® 30-2002™) с добавлением 10 % сыворотки крупного рогатого скота (ATCC® 30-2020™) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-P4HA2, экспрессирующим ген P4HA2 человека, проводили как описано в примере 9. В качестве контроля использовали культуру клеток Hs27, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена P4HA2 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 9, за исключением олигонуклеотидов с отличающимися от примера 9 последовательностями. Для амплификации кДНК, специфичной для гена P4HA2 человека, использовали олигонуклеотиды P4HA2_SF и P4HA2_SR:
P4HA2_SF AGGTACCACCATGGCAACAG
P4HA2_SR GTCTTGGGATCACGAACGGT
Длина продукта амплификации - 179 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов P4HA2 и B2M. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов P4HA2 и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 5.
Из фигуры 5 следует, что в результате трансфекции культуры клеток фибробластов крайней плоти человека линии Hs27 генотерапевтическим ДНК-вектором VTvaf17-P4HA2, уровень специфической мРНК гена P4HA2 человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген P4HA2 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтическим ДНК-вектором VTvaf17-P4HA2 для повышения уровня экспрессии гена P4HA2 в эукариотических клетках.
Пример 13.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-COL7A1, несущего целевой ген, а именно, ген COL7A1, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена COL7A1, в культуре фибробластов человека HT 297.T (ATCC® CRL-7782™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-COL7A1, несущим ген COL7A1 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Культуру клеток фибробластов кожи человека линии HT 297.T выращивали в среде Dulbecco's Modified Eagle's Medium (DMEM) (ATCC® 30-2002™) с добавлением 10 % сыворотки крупного рогатого скота (ATCC® 30-2020™) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-COL7A1, экспрессирующим ген COL7A1 человека, проводили как описано в примере 9. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве контроля использовали культуру клеток HT 297.T, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена COL7A1 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 9, за исключением олигонуклеотидов с отличающимися от примера 9 последовательностями. Для амплификации кДНК, специфичной для гена COL7A1 человека, использовали олигонуклеотиды COL7A1 _SF и COL7A1 _SR:
COL7A1_SF CAAAGGAGAGATGGGGGAGC
COL7A1_SR ATCATTTCCACTGGGGCCTG
Длина продукта амплификации - 184 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов COL7A1 и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов COL7A1 и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 6.
Из фигуры 6 следует, что в результате трансфекции культуры клеток фибробластов человека HT 297.T генотерапевтическим ДНК-вектором VTvaf17-COL7A1, уровень специфической мРНК гена COL7A1 человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген COL7A1 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-COL7A1 для повышения уровня экспрессии гена COL7A1 в эукариотических клетках.
Пример 14.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-CLCA2, несущего целевой ген, а именно, ген CLCA2, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена CLCA2 в культуре фибробластов человека HT 297.T (ATCC® CRL-7782™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-CLCA2, несущим ген CLCA2 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Культуру клеток фибробластов кожи человека линии HT 297.T выращивали в среде Dulbecco's Modified Eagle's Medium (DMEM) (ATCC® 30-2002™) с добавлением 10 % сыворотки крупного рогатого скота (ATCC® 30-2020™) в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-CLCA2, экспрессирующим ген CLCA2 человека, проводили как описано в примере 9. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве контроля использовали культуру клеток линии HT 297.T, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена CLCA2 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 9, за исключением олигонуклеотидов с отличающимися от примера 9 последовательностями. Для амплификации кДНК, специфичной для гена CLCA2 человека, использовали олигонуклеотиды CLCA2_SF и CLCA2_SR:
CLCA2_SF GGAGGCTCCTTTTCAGTGCT
CLCA2_SR GTAGCCTGGCCCTGATCAAA
Длина продукта амплификации - 155 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов CLCA2 и B2M. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов CLCA2 и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 7.
Из фигуры 7 следует, что в результате трансфекции культуры клеток фибробластов человека HT 297.T генотерапевтическим ДНК-вектором VTvaf17-CLCA2 уровень специфической мРНК гена CLCA2 человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген CLCA2 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-CLCA2 для повышения уровня экспрессии гена CLCA2 в эукариотических клетках.
Пример 15.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-ELN, несущего целевой ген, а именно, ген ELN, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена ELN, в культуре кератиноцитов эпидермиса человека HEKa (ATCC PCS-200-011) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-ELN, несущим ген ELN человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Культуру клеток кератиноцитов эпидермиса человека HEKa выращивали в среде Keratinocyte Growth Kit (ATCC® PCS-200-040™) в стандартных условиях (37°С, 5% СО2). в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-ELN, экспрессирующим ген ELN человека, проводили как описано в примере 9. В качестве контроля использовали культуру клеток HEKa, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена ELN до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 9, за исключением олигонуклеотидов с отличающимися от примера 9 последовательностями. Для амплификации кДНК, специфичной для гена ELN человека, использовали олигонуклеотиды ELN _SF и ELN _SR:
ELN_SF CCAGTTTGGCCTAGTGGGAG
ELN_SR ATGGGAGACAATCCGAAGCC
Длина продукта амплификации - 159 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов ELN и B2M. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов ELN и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 8.
Из фигуры 8 следует, что в результате трансфекции культуры клеток кератиноцитов эпидермиса человека HEKa генотерапевтическим ДНК-вектором VTvaf17-ELN, уровень специфической мРНК гена ELN человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген ELN на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтическим ДНК-вектором VTvaf17-ELN для повышения уровня экспрессии гена ELN в эукариотических клетках.
Пример 16.
Подтверждение способности генотерапевтического ДНК-вектора VTvaf17-PLOD1, несущего целевой ген, а именно, ген PLOD1, проникать в эукариотические клетки и подтверждение его функциональной активности на уровне экспрессии мРНК целевого гена. Данный пример также демонстрирует реализуемость способа применения генотерапевтического ДНК-вектора, несущего целевой ген.
Оценивали изменения накопления мРНК целевого гена PLOD1, в культуре меланоцитов эпидермиса HEMa (ATCC® PCS-200-013™) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17-PLOD1, несущим ген PLOD1 человека. Количество мРНК определяли по динамике накопления ампликонов кДНК в реакции ПРЦ в реальном времени.
Культуру клеток меланоцитов эпидермиса человека линии HEMa выращивали в среде Dermal Cell Basal Medium (ATCC® PCS-200-030™) с добавлением Adult Melanocyte Growth Kit (ATCC® PCS-200-042™) в стандартных условиях (37°С, 5% СО2). в стандартных условиях (37°С, 5% СО2). Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент Lipofectamine 3000 (ThermoFisher Scientific, США). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-PLOD1, экспрессирующим ген PLOD1 человека, проводили как описано в примере 9. В качестве контроля использовали культуру клеток HEMa, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген (кДНК гена PLOD1 до и после трансфекции генотерапевтическим ДНК-вектором VTvaf17, не содержащим вставку целевого гена на фигурах не показано). Выделение РНК, реакцию обратной транскрипции и ПЦР в реальном времени проводили как описано в примере 9, за исключением олигонуклеотидов с отличающимися от примера 9 последовательностями. Для амплификации кДНК, специфичной для гена PLOD1 человека, использовали олигонуклеотиды PLOD1_SF и PLOD1_SR:
PLOD1_SF GCCTCCACCTTCACCATCAA
PLOD1_SR AAGGAGACTGCGATGTAGCG
Длина продукта амплификации - 197 п.н.
В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности кДНК генов PLOD1 и B2M. В качестве референтного гена использовали ген B2M (Бета-2-микроглобулин) приведенный в базе данных GenBank под номером NM 004048.2. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов PLOD1 и B2M, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1 (Bio-Rad, США). Графики, полученные в результате анализа представлены на фиг. 9.
Из фигуры 9 следует, что в результате трансфекции культуры клеток меланоцитов эпидермиса HEMa генотерапевтическим ДНК-вектором VTvaf17-PLOD1, уровень специфической мРНК гена PLOD1 человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген PLOD1 на уровне мРНК. Представленные результаты также подтверждают реализуемость способа применения генотерапевтическим ДНК-вектором VTvaf17-PLOD1 для повышения уровня экспрессии гена PLOD1 в эукариотических клетках.
Пример 17.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-COL1A1, несущего ген COL1A1, для повышения экспрессии белка COL1A1 в клетках млекопитающих.
Оценивали изменение количества белка COL1A1 в лизате фибробластов кожи человека HDFa (ATCC PCS-201-01) после трансфекции этих клеток ДНК-вектором VTvaf17-COL1A1, несущим ген COL1A1 человека.
Клеточную культуру фибробластов кожи человека HDFa выращивали как это описано в примере 9.
Для получения 90% конфлюэнтности, за 24 часа до постановки трансфекции клетки высевали в 24-луночный планшет из расчета 5×104 клеток/лунку. Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена COL1A1 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-COL1A1, несущий ген COL1A1 человека (C). Приготовление комплекса ДНК/дендример проводили по методике производителя (QIAGEN, SuperFect Transfection Reagent Handbook, 2002) с некоторыми изменениями. Для трансфекции клеток в одной лунке 24-луночного планшета к 1 мкг ДНК-вектора, растворенного в буфере ТЕ, добавляли культуральную среду до конечного объема 60 мкл, затем добавляли 5 мкл SuperFect Transfection Reagent и осторожно перемешивали пятикратным пипетированием. Комплекс инкубировали при комнатной температуре в течении 10-15 мин. Далее отбирали из лунок культуральную среду, лунки промывали 1 мл буфера PBS. К образовавшемуся комплексу добавляли 350 мкл среды, содержащей 10 мкг/мл гентамицина, осторожно перемешивали и добавляли к клеткам. Клетки инкубировали с комплексом 2-3 часа при 37°С в атмосфере, содержащей 5% СО2.
Затем осторожно удаляли среду, промывали клеточный монослой 1 мл буфера PBS. Затем добавляли среду, содержащую 10 мкг/мл гентамицина, и инкубировали 24-48 часов при 37°С в атмосфере 5% СО2.
После трансфекции клетки промывали три раза PBS, далее к клеткам добавляли 1 мл PBS и подвергали трехкратному замораживанию/оттаиванию. Далее суспензию центрифугировали при 15 000 об/мин в течение 15 мин, отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка COL1A1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human COL1A1 / Collagen I Alpha 1 ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences, LS-F22003-1) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка COL1A1, входящим в состав набора. Чувствительность метода составляла не менее 188 пг/мл, диапазон измерения - от 313 пг/мл до 20000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графические материалы, полученные в результате анализа представлены на фиг. 10.
Из фигуры 10 следует, что трансфекция клеток фибробластов кожи человека HDFa генотерапевтическим ДНК-вектором VTvaf17-COL1A1 приводит к увеличению количества белка COL1A1 по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген COL1A1 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-COL1A1 для повышения уровня экспрессии COL1A1 в эукариотических клетках.
Пример 18.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-COL1A2, несущего ген COL1A2, для повышения экспрессии белка COL1A2 в клетках млекопитающих.
Оценивали изменение количества белка COL1A2 в клеточном лизате фибробластов кожи человека HDFa (ATCC PCS-201-01) после трансфекции этих клеток ДНК-вектором VTvaf17-COL1A2, несущим ген COL1A2 человека. Клетки выращивали как описано в примере 10.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена COL1A2 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-COL1A2, несущий ген COL1A2 человека (С). Приготовление комплекса ДНК-дендример и трансфекцию клеток HDFa проводили как описано в примере 17.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение белка COL1A2 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human COL1A2 / Collagen I Alpha 2 ELISA Kit (Sandwich ELISA) (LifeSpan Biosciences, LS-F26740) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка COL1A2, входящим в состав набора. Чувствительность метода составляла не менее 100 пг/мл, диапазон измерения - от 500 пг/мл до 10000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графические материалы, полученные в результате анализа представлены на фиг. 11.
Из фигуры 11 следует, что трансфекция первичной культуры фибробластов кожи человека HDFa человека генотерапевтическим ДНК-вектором VTvaf17-COL1A2 приводит к увеличению количества белка COL1A2 по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген COL1A2 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-COL1A2 для повышения уровня экспрессии COL1A2 в эукариотических клетках.
Пример 19.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-P4HA1, несущего ген P4HA1, для повышения экспрессии белка P4HA1 в клетках млекопитающих.
Оценивали изменение количества белка P4HA1 в лизате клеток фибробластов крайней плоти человека линии Hs27 (ATCC CRL-1634) после трансфекции этих клеток ДНК-вектором VTvaf17-P4HA1, несущим ген P4HA1 человека. Клетки культивировали как описано в примере 11.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена P4HA1 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-P4HA1, несущий ген P4HA1 человека (C). Приготовление комплекса ДНК-дендример и трансфекцию клеток Hs27 проводили как описано в примере 17.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение белка P4HA1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human P4HA1 ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences, LS-F12242-1) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка P4HA1, входящим в состав набора. Чувствительность метода составляла не менее 625 пг/мл, диапазон измерения - от 625 пг/мл до 40000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графические материалы, полученные в результате анализа представлены на фиг. 12.
Из фигуры 12 следует, что трансфекция культуры клеток фибробластов крайней плоти человека линии Hs27 генотерапевтическим ДНК-вектором VTvaf17-P4HA1 приводит к увеличению количества белка P4HA1 по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген P4HA1 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-P4HA1 для повышения уровня экспрессии P4HA1 в эукариотических клетках.
Пример 20.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-P4HA2, несущего ген P4HA2, для повышения экспрессии белка P4HA2 в клетках млекопитающих.
Оценивали изменение количества белка P4HA2 в лизате культуры клеток фибробластов крайней плоти человека линии Hs27 (ATCC CRL-1634) после трансфекции этих клеток ДНК-вектором VTvaf17-P4HA2, несущим ген P4HA2 человека. Клетки культивировали как описано в примере 12.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена P4HA2 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-P4HA2, несущий ген P4HA2 человека (C). Приготовление комплекса ДНК-дендримеры и трансфекцию клеток Hs27 проводили как описано в примере 17.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка P4HA2 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human P4HA2 ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences, LS-F33689-1) с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка P4HA2, входящим в состав набора. Чувствительность метода составляла не менее 469 пг/мл, диапазон измерения - от 780 пг/мл до 50000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графические материалы, полученные в результате анализа, представлены на фиг. 13.
Из фигуры 13 следует, что трансфекция культуры клеток фибробластов крайней плоти человека линии Hs27 генотерапевтическим ДНК-вектором Vtvaf17-P4HA2 приводит к увеличению количества белка P4HA2 по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген P4HA2 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора Vtvaf17-P4HA2 для повышения уровня экспрессии P4HA2 в эукариотических клетках.
Пример 21.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора Vtvaf17-COL7A1, несущего ген COL7A1, для повышения экспрессии белка COL7A1 в клетках млекопитающих.
Оценивали изменение количества белка COL7A1 в лизате фибробластов человека HT 297.T (ATCC® CRL-7782™) после трансфекции этих клеток ДНК-вектором Vtvaf17-COL7A1, несущим ген COL7A1 человека. Клетки выращивали как описано в примере 13.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор Vtvaf17, не содержащий кДНК гена COL7A1 (В), в качестве трансфицируемых агентов - ДНК-вектор Vtvaf17-COL7A1, несущий ген COL7A1 человека (С). Приготовление комплекса ДНК-дендример и трансфекцию клеток HT 297.T проводили как описано в примере 17.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение белка COL7A1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human COL7A1 / Collagen VII ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences, LS-F11164-1) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка COL7A1, входящим в состав набора. Чувствительность метода составляла не менее 156 пг/мл, диапазон измерения - от 156 пг/мл до 10000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графические материалы, полученные в результате анализа представлены на фиг. 14.
Из фигуры 14 следует, что трансфекция фибробластов человека HT 297.T генотерапевтическим ДНК-вектором VTvaf17-COL7A1 приводит к увеличению количества белка COL7A1 по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген COL7A1 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-COL7A1 для повышения уровня экспрессии COL7A1 в эукариотических клетках.
Пример 22.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-CLCA2, несущего ген CLCA2, для повышения экспрессии белка CLCA2 в клетках млекопитающих.
Оценивали изменение количества белка CLCA2 в лизате фибробластов человека HT 297.T (ATCC® CRL-7782™) после трансфекции этих клеток ДНК-вектором VTvaf17-CLCA2, несущим ген CLCA2 человека. Клетки культивировали как описано в примере 14.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена CLCA2 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-CLCA2, несущий ген CLCA2 человека (C). Приготовление комплекса ДНК-дендример и трансфекцию клеток HT 297.T проводили как описано в примере 17.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка. Количественное определение белка CLCA2 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human Calcium activated chloride channel regulator 2 (CLCA2) ELISA Kit (MyBioSource, MBS7242681) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка CLCA2, входящим в состав набора. Чувствительность метода составляла не менее 1 пг/мл, диапазон измерения - от 50 пг/мл до 1000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графические материалы, полученные в результате анализа представлены на фиг. 15.
Из фигуры 15 следует, что трансфекция фибробластов человека HT 297.T генотерапевтическим ДНК-вектором VTvaf17-CLCA2 приводит к увеличению количества белка CLCA2 по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген CLCA2 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-CLCA2 для повышения уровня экспрессии CLCA2 в эукариотических клетках.
Пример 23.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-ELN, несущего ген ELN, для повышения экспрессии белка ELN в клетках млекопитающих.
Оценивали изменение количества белка ELN в лизате культуры кератиноцитов эпидермиса HEKa (ATCC PCS-200-011) после трансфекции этих клеток ДНК-вектором VTvaf17-ELN, несущим ген ELN человека. Клетки культивировали как описано в примере 15.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена ELN (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17-ELN, несущий ген ELN человека (C). Приготовление комплекса ДНК-дендримеры и трансфекцию клеток HEKa проводили как описано в примере 17.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка ELN проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Elastin ELISA Kit (Reddot Biotech, RD-ELN-Ra) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка ELN, входящим в состав набора. Чувствительность метода составляла не менее 12,7 пг/мл, диапазон измерения - от 31,25 пг/мл до 2000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа, представлены на фиг. 16.
Из фигуры 16 следует, что трансфекция культуры клеток кератиноцитов эпидермиса HEKa генотерапевтическим ДНК-вектором VTvaf17-ELN приводит к увеличению количества белка ELN по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген ELN на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-ELN для повышения уровня экспрессии ELN в эукариотических клетках.
Пример 24.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-PLOD1, несущего ген PLOD1, для повышения экспрессии белка PLOD1 в клетках млекопитающих.
Оценивали изменение количества белка PLOD1 в лизате культуры меланоцитов эпидермиса человека HEMa (ATCC® PCS-200-013™) после трансфекции этих клеток ДНК-вектором VTvaf17-PLOD1, несущим ген PLOD1 человека. Клетки культивировали как описано в примере 16.
Для трансфекции использовали реагент SuperFect Transfection Reagent 6-го поколения (Qiagen, Германия). В качестве контроля использовали водный раствор дендримеров без ДНК-вектора (А), ДНК-вектор VTvaf17, не содержащий кДНК гена PLOD1 (В), в качестве трансфицируемых агентов - ДНК-вектор VTvaf17- PLOD1, несущий ген PLOD1 человека (C). Приготовление комплекса ДНК-дендримеры и трансфекцию клеток HEMa проводили как описано в примере 17.
После трансфекции к 0,5 мл культуральной жидкости добавляли 0,1 мл 1N HCl, тщательно перемешивали и инкубировали 10 минут при комнатной температуре. Затем нейтрализовали смесь, добавляя 0,1 мл 1.2М NaOH/0.5M HEPES (pH 7-7,6) и тщательно перемешивали. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка PLOD1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор Human PLOD / PLOD1 ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences, LS-F9705-1) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка PLOD1, входящим в состав набора. Чувствительность метода составляла не менее 66 пг/мл, диапазон измерения - от 156 пг/мл до 10000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графики, полученные в результате анализа, представлены на фиг. 17.
Из фигуры 17 следует, что трансфекция культуры клеток меланоцитов эпидермиса человека HEMa генотерапевтическим ДНК-вектором VTvaf17- PLOD1 приводит к увеличению количества белка PLOD1 по сравнению с контрольными образцами, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген PLOD1 на уровне белка. Представленные результаты также подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-PLOD1 для повышения уровня экспрессии PLOD1 в эукариотических клетках.
Пример 25.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-P4HA2, несущего ген P4HA2, для повышения экспрессии белка P4HA2 в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-P4HA2, несущего целевой ген, а именно, ген P4HA2 и реализуемости способа его применения оценивали изменения количества белка P4HA2 в коже человека при введении в кожу человека генотерапевтического ДНК-вектора VTvaf17-P4HA2, несущего ген человека P4HA2.
С целью анализа изменения количества белка P4HA2 трем пациентам вводили в кожу предплечья генотерапевтический ДНК-вектор VTvaf17-P4HA2, несущий ген P4HA2 и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена P4HA2.
Пациент 1, женщина 44 года, (П1); пациент 2, женщина 61 год, (П2); пациент 3, мужчина, 50 лет, (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Генотерапевтический ДНК-вектор VTvaf17-P4HA2, который содержит кДНК гена P4HA2 и генотерапевтический ДНК-вектор VTvaf17, используемый в качестве плацебо, который не содержит кДНК гена P4HA2, каждый из которых растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генетической конструкции готовили комплексы ДНК- cGMP grade in-vivo-jetPEI в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-P4HA2, несущий ген P4HA2 вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину 3 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-P4HA2, несущего ген P4HA2 - 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагались на участке предплечья на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков кожи пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-P4HA2, несущего ген P4HA2 (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактных участков кожи (III), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка методом твердофазного иммуноферментного анализа (ELISA), используя набор Human P4HA2 ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences, LS-F33689-1) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка P4HA2, входящим в состав набора. Чувствительность метода составляла не менее 469 пг/мл, диапазон измерения - от 780 пг/мл до 50000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графические материалы, полученные в результате анализа, представлены на фиг. 18.
Из фигуры 18 следует, что в коже всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17-P4HA2, несущего целевой ген P4HA2 человека, произошло увеличение количества белка P4HA2 в сравнении с количеством белка P4HA2 в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего ген P4HA2 человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-P4HA2 и подтверждает реализуемость способа его применения, в частности при внутрикожном введении генотерапевтического ДНК-вектора в ткани человека.
Пример 26.
Подтверждение эффективности и реализуемости способа применения генотерапевтического ДНК-вектора VTvaf17-P4HA1, несущего ген P4HA1, для повышения экспрессии белка P4HA1 в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-P4HA1, несущего целевой ген P4HA1 и реализуемости способа его применения оценивали изменение количества белка P4HA1 в коже человека при введении генотерапевтического ДНК-вектора VTvaf17-P4HA1, несущего целевой ген, а именно, ген P4HA1 человека.
С целью анализа изменения количества белка P4HA1 трем пациентам вводили в кожу предплечья генотерапевтический ДНК-вектор VTvaf17-P4HA1, несущий ген P4HA1 с транспортной молекулой, и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена P4HA1 с транспортной молекулой.
Пациент 1, мужчина 59 лет, (П1); пациент 2, женщина 56 лет (П2); пациент 3, мужчина, 58 лет, (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция), пробоподготовку проводили в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и генотерапевтический ДНК вектор VTvaf17-P4HA1, несущий ген P4HA1 вводили в количестве 1 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину около 1 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и генотерапевтического ДНК вектора VTvaf17-P4HA1, несущего ген P4HA1 - 0,3 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагали на расстоянии 5 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генетических конструкций генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков кожи пациентов в зоне введения генотерапевтического ДНК вектора VTvaf17-P4HA1, несущего ген P4HA1 (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактного участка кожи (III), используя устройство для взятия биопсии кожи. Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка.
Количественное определение белка P4HA1 проводили методом твердофазного иммуноферментного анализа (ELISA), используя набор используя набор Human P4HA1 ELISA Kit (Sandwich ELISA) (LifeSpan BioSciences, LS-F12242-1) согласно методике производителя с детекцией оптической плотности при помощи автоматического биохимического и иммуноферментного анализатора ChemWell (Awareness Technology Inc., США). Чувствительность метода составляла 0.625 нг/мл, диапазон измерения 0.625 - 40 нг/мл.
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка P4HA1, входящим в состав набора. Чувствительность метода составляла не менее 625 пг/мл, диапазон измерения - от 625 пг/мл до 40000 пг/мл. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графические материалы, полученные в результате анализа представлены на фиг. 19.
Из фигуры 19 следует, что в коже всех трех пациентов в области введения генотерапевтического ДНК вектора VTvaf17-P4HA1, несущего целевой ген, а именно, ген P4HA1 человека, произошло увеличение количества белка P4HA1 в сравнении с количеством белка P4HA1 в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего ген P4HA1 человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-P4HA1 и подтверждает реализуемость способа его применения, в частности при внутрикожном введении генотерапевтического ДНК-вектора в ткани человека.
Пример 27.
Подтверждение эффективности и реализуемости способа сочетанного применения генотерапевтического ДНК-вектора VTvaf17-COL7A1, несущего ген COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, несущего ген CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, несущего ген ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1, несущего ген PLOD1, для повышения уровня экспрессии белков COL7A1, CLCA2, ELN и PLOD1 в тканях человека.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-COL7A1, несущего ген COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, несущего ген CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, несущего ген ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1, несущего ген PLOD1, и реализуемости способа их применения оценивали изменения количества белка COL7A1, CLCA2, ELN и PLOD1 в коже человека при сочетанном введении в кожу человека смеси генотерапевтического ДНК-вектора VTvaf17-COL7A1, несущего ген COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, несущего ген CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, несущего ген ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1, несущего ген PLOD1.
С целью анализа изменения количества белка COL7A1, CLCA2, ELN и PLOD1 трем пациентам вводили в кожу предплечья смесь генотерапевтического ДНК-вектора VTvaf17-COL7A1, несущего ген COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, несущего ген CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, несущего ген ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1, несущего ген PLOD1, и параллельно вводили плацебо, представляющее собой генотерапевтический ДНК-вектор VTvaf17, не содержащий кДНК гена COL7A1, CLCA2, ELN и PLOD1.
Пациент 1, женщина 38 лет (П1); пациент 2, мужчина 48 лет (П2); пациент 3, мужчина, 52 лет (П3). В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Смесь (в соотношении 1:1:1:1) генотерапевтического ДНК-вектора VTvaf17-COL7A1, несущего ген COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, несущего ген CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, несущего ген ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1, несущего ген PLOD1 и генотерапевтический ДНК-вектор VTvaf17, используемый в качестве плацебо, который не содержит кДНК генов COL7A1, CLCA2, ELN и PLOD1, растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генетической конструкции готовили комплексы ДНК- cGMP grade in-vivo-jetPEI в соответствии с рекомендациями производителя.
Генотерапевтический ДНК-вектор VTvaf17 (плацебо) и смесь генотерапевтического ДНК-вектора VTvaf17-COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1 вводили в количестве 4 мг для каждой генетической конструкции тоннельным методом иглой 30G на глубину 3 мм. Объем вводимого раствора генотерапевтического ДНК-вектора VTvaf17 (плацебо) и смеси генотерапевтического ДНК-вектора VTvaf17-COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2 генотерапевтического ДНК-вектора VTvaf17-ELN генотерапевтического ДНК-вектора VTvaf17-PLOD1 - 1,2 мл для каждой генетической конструкции. Очаги введения каждой генетической конструкции располагались на участке кожи предплечья на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 2-е сутки после введения генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков кожи пациентов в зоне введения смеси генотерапевтического ДНК-вектора VTvaf17-COL7A1, несущего ген COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, несущего ген CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, несущего ген ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1, несущего ген PLOD1 (I), генотерапевтического ДНК-вектора VTvaf17 (плацебо) (II), а также из интактных участков кожи (III), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия). Кожу пациентов в зоне отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевых белков как это описано в примере 21 (количественное определение белка COL7A1), примере 22 (количественное определение белка CLCA2), примере 23 (количественное определение белка ELN), примере 24 (количественное определение белка PLOD1).
Численное значение концентрации определяли с помощью калибровочной кривой, построенной по стандартным образцам с известной концентрацией белка COL7A1, CLCA2, ELN и PLOD1, входящим в состав каждого набора. Статистическую обработку полученных результатов осуществляли с помощью программного обеспечения для статистической обработки и визуализации данных R, версия 3.0.2 (https://www.r-project.org/). Графические материалы, полученные в результате анализа, представлены на фиг. 20.
Из фигуры 20 следует, что в коже всех трех пациентов в области введения смеси генотерапевтического ДНК-вектора VTvaf17-COL7A1, несущего ген COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, несущего ген CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, несущего ген ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1, несущего ген PLOD1 человека, произошло увеличение количества белка COL7A1, CLCA2, ELN и PLOD1 в сравнении с количеством белка COL7A1, CLCA2, ELN и PLOD1 в области введения генотерапевтического ДНК-вектора VTvaf17 (плацебо), не содержащего ген COL7A1, CLCA2, ELN и PLOD1 человека, что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-COL7A1, генотерапевтического ДНК-вектора VTvaf17-CLCA2, генотерапевтического ДНК-вектора VTvaf17-ELN, генотерапевтического ДНК-вектора VTvaf17-PLOD1 и подтверждает реализуемость способа их применения, в частности при внутрикожном сочетанном введении генотерапевтических ДНК-векторов в ткани человека.
Пример 28.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-COL1A2, несущего ген COL1A2 и реализуемости способа его применения для повышения уровня экспрессии белка COL1A2 в тканях человека путем введения аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-COL1A2.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-COL1A2, несущего ген COL1A2 и реализуемости способа его применения оценивали изменения количества белка COL1A2 в коже человека при введении в кожу пациента культуры аутологичных фибробластов этого пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-COL1A2.
Пациенту вводили в кожу предплечья соответствующую культуру аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-COL1A2, несущим ген COL1A2, и параллельно вводили плацебо, представляющее собой культуру аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим ген COL1A2.
Первичную культуру фибробластов человека выделяли из биоптатов кожи пациента. Используя устройство для взятия биопсии кожи Epitheasy 3.5 (Medax SRL, Италия) брали образец биоптата кожи из зоны, защищенной от действия ультрафиолета, а именно за ушной раковиной или с боковой внутренней поверхности в зоне локтевого сустава, размером около 10 кв. мм, массой - около 11 мг. Кожу пациента предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Культивирование первичной культуры клеток осуществляли при 37°С в атмосфере, содержащей 5 % СО2 в среде DMEM с 10 % фетальной телячьей сывороткой и ампициллином 100 Ед/мл. Пересев культуры и смену культуральной среды осуществляли каждые 2 дня. Общая продолжительность роста культуры не превышала 25-30 дней. Из культуры клеток отбирали аликвоту, содержащую 5×104 клеток. Культуру фибробластов пациента трансфицировали генотерапевтическим ДНК-вектором VTvaf17-COL1A2, несущим ген COL1A2 и плацебо - вектором VTvaf17, не несущим целевой ген COL1A2.
Трансфекцию осуществляли с помощью катионного полимера полиэтиленимина JETPEI (Polyplus Transfection, Франция), согласно инструкции фирмы-производителя. Клетки культивировали 72 часа и затем вводили пациенту. Введение пациенту культуры аутологичных фибробластов этого пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-COL1A2, и плацебо, представляющее собой культуру аутологичных фибробластов пациента, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, осуществляли туннельным методом в область предплечья иглой 30G длиной 13 мм на глубину около 3 мм. Концентрация модифицированных аутологичных фибробластов в вводимой суспензии составляла примерно 5 млн клеток на 1 мл суспензии, количество вводимых клеток не превышало 15 млн. Очаги введения культуры аутологичных фибробластов располагались на расстоянии 8-10 см друг от друга.
Биопсийные образцы отбирали на 4-е сутки после введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-COL1A2, несущим целевой ген, а именно, ген COL1A2 и плацебо. Взятие биопсии осуществляли из участков кожи пациента в зоне введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-COL1A2, несущим целевой ген, а именно, ген COL1A2 (C), культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим целевой ген COL1A2 (плацебо) (B), а также из участков интактной кожи (A), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL, Италия). Кожу в зоне отбора биоптата пациентов предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевого белка COL1A2 как это описано в примере 18.
Графические материалы, полученные в результате анализа, представлены на фиг. 21.
Из фигуры 21 следует, что в коже пациента в области введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-COL1A2, несущим ген COL1A2, произошло увеличение количества белка COL1A2 в сравнении с количеством белка COL1A2 в области введения культуры аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17, не несущим ген COL1A2 (плацебо), что свидетельствует об эффективности генотерапевтического ДНК-вектора VTvaf17-COL1A2 и подтверждает реализуемость способа его применения для повышения уровня экспрессии COL1A2 в тканях человека, в частности при введении аутологичных фибробластов, трансфицированных генотерапевтическим ДНК-вектором VTvaf17-COL1A2.
Пример 29.
Подтверждение эффективности и реализуемости способа сочетанного применения генотерапевтического ДНК-вектора VTvaf17-COL1A1, несущего ген COL1A1, генотерапевтического ДНК-вектора VTvaf17-COL1A2, несущего ген COL1A2, генотерапевтического ДНК-вектора VTvaf17-P4HA1, несущего ген P4HA1, генотерапевтического ДНК-вектора VTvaf17-P4HA2, несущего ген P4HA2, для повышения уровня экспрессии белков COL1A1, COL1A2, P4HA1 и P4HA2 в тканях млекопитающих.
Оценивали изменение количества белка COL1A1, COL1A2, P4HA1 и P4HA2 в коже крысы при введении трем крысам смеси генотерапевтических векторов.
В качестве транспортной системы использовали полиэтиленимин Transfection reagent cGMP grade in-vivo-jetPEI (Polyplus Transfection, Франция). Эквимолярную смесь генотерапевтических ДНК-векторов растворяли в стерильной воде степени очистки Nuclease-Free. Для получения генетической конструкции готовили комплексы ДНК- cGMP grade in-vivo-jetPEI в соответствии с рекомендациями производителя. Объем вводимого раствора составлял 0,05 мл с суммарным количеством ДНК 100 мкг. Введение раствора осуществляли тоннельным методом иглой 33G на глубину 0.5 мм в зону предварительно эпилированной кожи спины крысы.
Биопсийные образцы отбирали на 2 сутки после введения генотерапевтических ДНК-векторов. Взятие биопсии осуществляли из участков кожи в зоне введения смеси четырех генотерапевтических ДНК-векторов, несущих гены COL1A1, COL1A2, P4HA1, P4HA2 (зона I), зоны введения генотерапевтического ДНК-вектора VTvaf17 (плацебо) (зона II), а также из интактных участков кожи животного (зона III), используя устройство для взятия биопсии Epitheasy 3.5 (Medax SRL). Зону отбора биоптата предварительно промывали стерильным физиологическим раствором и анестезировали раствором лидокаина. Размер каждого биопсийного образца составлял около 10 куб. мм, масса - около 11 мг. Каждый образец помещали в буферный раствор, содержащий 50 мМ Трис-HCl рН 7.6, 100 мМ NaCl, 1 мМ ЭДТА и 1 мМ фенилметилсульфонилфторид, и гомогенизировали до получения однородной суспензии. Полученную суспензию центрифугировали в течение 10 мин при 14000g. Отбирали супернатант и использовали его для количественного определения целевых белков как это описано в примере 17 (количественное определение белка COL1A1), примере 18 (количественное определение белка COL1A2), примере 19 (количественное определение белка P4HA1), примере 20 (количественное определение белка P4HA2). Графические материалы, полученные в результате анализа, представлены на фиг. 22.
Из фигуры 22 следует, что в зоне кожи всех крыс (зона I), в которую вводилась смесь генотерапевтических векторов: генотерапевтического ДНК-вектора VTvaf17-COL1A1, несущего целевой ген COL1A1, генотерапевтического ДНК-вектора VTvaf17-COL1A2, несущего целевой ген COL1A2, генотерапевтического ДНК-вектора VTvaf17-P4HA1, несущего целевой ген P4HA1, генотерапевтического ДНК-вектора VTvaf17-P4HA2, несущего целевой ген P4HA2, произошло увеличение количества белков COL1A1, COL1A2, P4HA1, P4HA2 по сравнению с зоной II (зона плацебо) и зоной III (интактная зона). Полученные результаты свидетельствуют об эффективности сочетанного применения генотерапевтического ДНК-вектора VTvaf17-COL1A1, генотерапевтического ДНК-вектора VTvaf17-COL1A2, генотерапевтического ДНК-вектора VTvaf17-P4HA1, генотерапевтического ДНК-вектора VTvaf17-P4HA2, и подтверждает реализуемость способа их применения для повышения уровня экспрессии целевых белков в тканях млекопитающих.
Пример 30.
Подтверждение эффективности генотерапевтического ДНК-вектора VTvaf17-ELN, несущего ген ELN и реализуемости способа его применения для повышения уровня экспрессии белка ELN в клетках млекопитающих.
Для подтверждения эффективности генотерапевтического ДНК-вектора VTvaf17-ELN, несущего ген ELN оценивали изменение накопления мРНК целевого гена ELN в клетках фибробластов кожи быка BDF (ScienCell, Кат. #B2300) через 48 часов после их трансфекции генотерапевтическим ДНК-вектором VTvaf17- ELN, несущим ген ELN человека.
Клетки фибробластов кожи быка BDF выращивали в среде FM-2 (ScienCell, Кат. #2331). Трансфекцию генотерапевтическим ДНК-вектором VTvaf17-ELN, несущим ген ELN человека и ДНК-вектором VTvaf17, не несущим ген ELN человека (контроль), выделение РНК, реакцию обратной транскрипции, ПЦР амплификации и анализ данных проводили как описано в примере 15. В качестве референтного гена использовали ген актина быка/ коровы (АСТ), приведенного в базе данных GenBank под номером AH001130.2. В качестве положительного контроля использовали ампликоны, получаемых при ПЦР на матрицах, представляющих собой плазмиды в известных концентрациях, содержащие последовательности генов ELN и ACT. В качестве отрицательного контроля использовали деионизированную воду. Количество ПЦР продуктов - кДНК генов ELN и ACT, полученных в результате амплификации, оценивали в режиме реального времени с помощью программного обеспечения амплификатора Bio-RadCFXManager 2.1. (Bio-Rad, USA).
Графики, полученные в результате анализа, представлены на фиг. 23.
Из фигуры 23 следует, что в результате трансфекции клеток фибробластов кожи быка BDF генотерапевтическим ДНК-вектором VTvaf17-ELN, уровень специфической мРНК гена ELN человека вырос многократно, что подтверждает способность вектора проникать в эукариотические клетки и экспрессировать ген ELN на уровне мРНК. Представленные результаты подтверждают реализуемость способа применения генотерапевтического ДНК-вектора VTvaf17-ELN для повышения уровня экспрессии гена ELN в клетках млекопитающих.
Пример 31.
Штамм Escherichia coli SCS110-AF/VTvaf17-COL1A1 или штамм Escherichia coli SCS110-AF/VTvaf17-COL1A2 или штамм Escherichia coli SCS110-AF/VTvaf17-P4HA1 или штамм Escherichia coli SCS110-AF/VTvaf17-P4HA2 или штамм Escherichia coli SCS110-AF/VTvaf17-COL7A1 или штамм Escherichia coli SCS110-AF/VTvaf17-CLCA2 или штамм Escherichia coli SCS110-AF/VTvaf17-ELN или штамм Escherichia coli SCS110-AF/VTvaf17-PLOD1, несущий генотерапевтический ДНК-вектор, и способ его получения.
Конструирование штамма для наработки в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1, а именно штамма Escherichia coli SCS110-AF/VTvaf17- COL1A1 или штамма Escherichia coli SCS110-AF/VTvaf17-COL1A2 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA1 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA2 или штамма Escherichia coli SCS110-AF/VTvaf17-COL7A1 или штамма Escherichia coli SCS110-AF/VTvaf17-CLCA2 или штамма Escherichia coli SCS110-AF/VTvaf17-ELN или штамма Escherichia coli SCS110-AF/VTvaf17-PLOD1, несущего генотерапевтический ДНК-вектор VTvaf17-COL1A1 или VTvaf17-COL1A2 или VTvaf17-P4HA1 или VTvaf17-P4HA2 или VTvaf17-COL7A1 или VTvaf17-CLCA2 или VTvaf17-ELN или VTvaf17-PLOD1 соответственно для его наработки с возможностью селекции без использования антибиотиков заключается в получении электрокомпетентных клеток штамма Escherichia coli SCS110-AF с проведением электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-COL1A1 или ДНК-вектором VTvaf17-COL1A2 или генотерапевтическим ДНК-вектором VTvaf17-P4HA1 или генотерапевтическим ДНК-вектором VTvaf17-P4HA2 или генотерапевтическим ДНК-вектором VTvaf17-COL7A1 или генотерапевтическим ДНК-вектором VTvaf17-CLCA2 или генотерапевтическим ДНК-вектором VTvaf17-ELN или генотерапевтическим ДНК-вектором VTvaf17-PLOD1, после чего клетки высеваются на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы, а также 10 мкг/мл хлорамфеникола. При этом штамм Escherichia coli SCS110-AF для наработки генотерапевтического ДНК-вектора VTvaf17 или генотерапевтических ДНК-векторов на его основе с возможностью положительной селекции без использования антибиотиков получали путем конструирования линейного фрагмента ДНК, содержащего регуляторный элемент RNA-in транспозона Tn10 для селекции без применения антибиотиков размером 64 п.н., ген левансахаразы sacB, продукт которого обеспечивает селекцию на сахарозо-содержащей среде размером 1422 п.н., ген устойчивости к хлорамфениколу catR, необходимый для отбора клонов штамма, в которых прошла гомологичная рекомбинация размером 763 п.н. и две гомологичные последовательности, обеспечивающие процесс гомологичной рекомбинации в области гена recA с одновременной его инактивацией размером 329 п.н. и 233 п.н., после чего проводили трансформацию клеток Escherichia coli путем электропорации и отбирали клоны, выжившие на среде, содержащей 10 мкг/мл хлорамфеникола.
Полученные штаммы для наработки были внесены в коллекции Национального биоресурсного центра - Всероссийская коллекция промышленных микроорганизмов (НБЦ ВКПМ), РФ и NCIMB Patent Deposit Service, UK с присвоением регистрационных номеров:
штамм Escherichia coli SCS110-AF/VTvaf17-COL1A1 - регистрационный № ВКПМ В-13165, дата депонирования 11.05.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43033, дата депонирования 20.04.2018;
штамм Escherichia coli SCS110-AF/VTvaf17-COL1A2 - регистрационный № ВКПМ В-13164, дата депонирования 11.05.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43035, дата депонирования 20.04.2018;
штамм Escherichia coli SCS110-AF/VTvaf17-P4HA1 - регистрационный № ВКПМ В-13384, дата депонирования 14.12.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43311, дата депонирования 13.12.2018;
штамм Escherichia coli SCS110-AF/VTvaf17-P4HA2 - регистрационный № ВКПМ В-13388, дата депонирования 14.12.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43312, дата депонирования 13.12.2018;
штамм Escherichia coli SCS110-AF/VTvaf17-CLCA2 - регистрационный № ВКПМ В-13385, дата депонирования 14.12.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43308, дата депонирования 13.12.2018;
штамм Escherichia coli SCS110-AF/VTvaf17-ELN - регистрационный № ВКПМ В-13341, дата депонирования 22.11.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43281, дата депонирования 22.11.2018;
штамм Escherichia coli SCS110-AF/VTvaf17-PLOD1 - регистрационный № ВКПМ В-13387, дата депонирования 14.12.2018; INTERNATIONAL DEPOSITARY AUTHORITY № NCIMB 43313, дата депонирования 13.12.2018.
Пример 32.
Способ масштабирования получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1 до промышленного объема.
Для подтверждения технологичности получения и возможности производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17- COL1A1, (SEQ ID №1) или VTvaf17-COL1A2, (SEQ ID №2) или VTvaf17-P4HA1, (SEQ ID №3) или VTvaf17-P4HA2, (SEQ ID №4) или VTvaf17-COL7A1, (SEQ ID №5) или VTvaf17-CLCA2, (SEQ ID №6) или VTvaf17-ELN, (SEQ ID №7) или VTvaf17-PLOD1, (SEQ ID №8) проводили масштабную ферментацию штамма Escherichia coli SCS110-AF/VTvaf17-COL1A1 или штамма Escherichia coli SCS110-AF/VTvaf17- COL1A2 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA1 или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA2 или штамма Escherichia coli SCS110-AF/VTvaf17-COL7A1 или штамма Escherichia coli SCS110-AF/VTvaf17-CLCA2 или штамма Escherichia coli SCS110-AF/VTvaf17-ELN или штамма Escherichia coli SCS110-AF/VTvaf17-PLOD1, каждый из которых содержит генотерапевтический ДНК-вектор VTvaf17, несущий целевой ген, а именно COL1A1 или COL1A2 или P4HA1 или P4HA2 или COL7A1 или CLCA2 или ELN или PLOD1. Каждый штамм Escherichia coli SCS110-AF/VTvaf17-COL1A1 или Escherichia coli SCS110-AF/VTvaf17- COL1A2 или Escherichia coli SCS110-AF/VTvaf17-P4HA1 или Escherichia coli SCS110-AF/VTvaf17-P4HA2 или Escherichia coli SCS110-AF/VTvaf17-COL7A1 или Escherichia coli SCS110-AF/VTvaf17-CLCA2 или Escherichia coli SCS110-AF/VTvaf17-ELN или Escherichia coli SCS110-AF/VTvaf17-PLOD1 получали на базе штамма Escherichia coli SCS110-AF (Cell and Gene Therapy LLC, Великобритания) по примеру 31 путем электропорации компетентных клеток этого штамма генотерапевтическим ДНК-вектором VTvaf17- COL1A1 или VTvaf17-COL1A2 или VTvaf17-P4HA1 или VTvaf17-P4HA2 или VTvaf17-COL7A1 или VTvaf17-CLCA2 или VTvaf17-ELN или VTvaf17-PLOD1, несущим целевой ген, а именно, COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1 с последующим высевом трансформированных клеток на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы и отбором отдельных клонов.
Ферментацию полученного штамма Escherichia coli SCS110-AF/VTvaf17-COL1A1, несущего генотерапевтический ДНК-вектор VTvaf17- COL1A1 проводили в ферментере объемом 10 л с последующим выделением генотерапевтического ДНК-вектора VTvaf17-COL1A1.
Для ферментации штамма Escherichia coli SCS110-AF/VTvaf17- COL1A1 готовили среду, содержащую на 10 л: 100 г триптон, 50 г дрожжевой экстракт (Becton Dickinson, США), доводили водой до 8800 мл и автоклавировали при 121°С 20 мин, затем добавляли 1200 мл 50% (вес/объем) сахарозы. Далее засевали в колбу затравочную культуру штамма Escherichia coli SCS110-AF/VTvaf17-COL1A1 в объеме 100 мл. Инкубировали в шейкере-инкубаторе 16 ч при 30°С. Переносили затравочную культуру в ферментер Techfors S (Infors HT, Швейцария), растили до достижения стационарной фазы. Контроль осуществляли измерением оптической плотности культуры при длине волны 600 нм. Клетки осаждали центрифугированием 30 мин при 5000-10000 g. Супернатант удаляли, клеточную массу ресуспендировали в 10% по объему фосфатно-солевого буфера. Повторно центрифугировали 30 мин при 5000-10000g. Супернатант удаляли, к клеточной массе добавляли раствор 20 мМ TrisCl, 1 мМ ЭДТА, 200 г/л сахароза, рН 8,0 в объеме 1000 мл, тщательно перемешивали до образования гомогенной суспензии. Добавляли раствор яичного лизоцима до конечной концентрации 100мкг/мл. Инкубировали 20 мин на льду при бережном перемешивании. Далее, добавляли 2500 мл раствора 0,2 М NaOH, 10 г/л додецилсульфат натрия, инкубировали 10 мин на льду при бережном перемешивании, затем добавляли 3500 мл раствора 3M ацетат натрия, 2М уксусная кислота, рН 5-5,5, инкубировали 10 мин на льду при бережном перемешивании. Полученный образец центрифугировали 20-30 мин при 15000 g или более. Раствор аккуратно декантировали, от остатков осадка избавлялись фильтрацией через грубый фильтр (фильтровальную бумагу). Добавляли РНКазу А (Sigma, США) до конечной концентрации 20 нг/мл, инкубировали ночь 16 ч при комнатной температуре. Раствор центрифугировали 20-30 мин при 15000g, затем фильтровали через мембранный фильтр с порами 0,45 мкм (Millipore, США). Далее проводили ультрафильтрацию через мембрану размером отсечения 100кДа (Millipore, США) и разбавляли до начального объема буфером 25 мМ TrisCl, pH 7.0. Операцию повторяли три - четыре раза. Наносили раствор, на колонку с 250 мл сорбента DEAE sepharose HP (GE, США), уравновешенную раствором 25 мМ TrisCl, pH 7.0. После нанесения образца колонку промывали тремя объемами этого же раствора, а затем проводили элюцию генотерапевтического ДНК-вектора VTvaf17-COL1A1 линейным градиентом от раствора 25 мМ TrisCl, pH 7.0 до раствора 25 мМ TrisCl, pH 7.0, 1М NaCl в объеме пяти объемов колонки. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм. Хроматографические фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-COL1A1, объединяли и проводили гель-фильтрацию на сорбенте Superdex 200 (GE, США). Колонку уравновешивали фосфатно-солевым буфером. Контроль элюции осуществляли по оптической плотности сходящего раствора при 260 нм, фракции анализировали электрофорезом в агарозном геле. Фракции, содержащие генотерапевтический ДНК-вектор VTvaf17-COL1A1 объединяли и хранили при -20°С. Для оценки воспроизводимости техпроцесса обозначенные технологические операции повторяли пятикратно. Все технологические операции для штаммов Escherichia coli SCS110-AF/VTvaf17-COL1A2 или Escherichia coli SCS110-AF/VTvaf17-P4HA1 или Escherichia coli SCS110-AF/VTvaf17-P4HA2 или Escherichia coli SCS110-AF/VTvaf17-COL7A1 или Escherichia coli SCS110-AF/VTvaf17-CLCA2 или Escherichia coli SCS110-AF/VTvaf17-ELN или Escherichia coli SCS110-AF/VTvaf17-PLOD1 проводили аналогичным образом.
Воспроизводимость техпроцесса и количественные характеристики выхода конечного продукта подтверждают технологичность получения и возможность производства в промышленных масштабах генотерапевтического ДНК-вектора VTvaf17- COL1A1 или VTvaf17-COL1A2 или VTvaf17-P4HA1 или VTvaf17-P4HA2 или VTvaf17-COL7A1 или VTvaf17-CLCA2 или VTvaf17-ELN или VTvaf17-PLOD1.
Таким образом, созданный генотерапевтический ДНК-вектор с целевым геном может быть использован для введения в клетки организма животных и человека, характеризующихся сниженной или недостаточной экспрессией белка, кодируемого данным геном, обеспечивая таким образом достижение терапевтического эффекта.
Задача, поставленная в данном изобретении, а именно: конструирование генотерапевтических ДНК-векторов для повышения уровня экспрессии генов COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1, сочетающих в себе следующие свойства:
I) Эффективность повышения экспрессии целевых генов в эукариотических клетках за счет полученных генотерапевтических векторов с ограниченным размером векторной части;
II) Возможность безопасного применения для генетической терапии человека и животных за счет отсутствия в составе генотерапевтического ДНК-вектора регуляторных элементов, представляющих собой нуклеотидные последовательности вирусных геномов и генов антибиотикорезистентности;
III) Технологичность получения и возможность наработки в штаммах в промышленных масштабах;
IV) также задача по конструированию штаммов, несущих эти генотерапевтические ДНК-вектора для производства этих генотерапевтических ДНК-векторов решена, что подтверждается примерами:
для I - пример 1, 2, 3, 4, 5; 6; 7; 8; 9; 10; 11; 12; 13; 14; 15; 16; 17; 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30;
для II - пример 1, 2, 3, 4, 5; 6; 7; 8; 9; 10; 11; 12; 13; 14; 15; 16; 17; 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30;
для III - 1, 2, 3, 4, 5; 6; 7; 8, 31, 32;
для IV - пример 31, 32.
Промышленная применимость:
Все представленные выше примеры подтверждают промышленную применимость предлагаемого генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген, выбранный из группы генов: ген COL1A1, ген COL1A2, ген P4HA1, ген P4HA2, ген COL7A1, ген CLCA2, ген ELN, ген PLOD1 для повышения уровня экспрессии этих целевых генов, штамма Escherichia coli SCS110-AF/VTvaf17-COL1A1 или Escherichia coli SCS110-AF/VTvaf17- COL1A2 или Escherichia coli SCS110-AF/VTvaf17-P4HA1 или Escherichia coli SCS110-AF/VTvaf17-P4HA2 или Escherichia coli SCS110-AF/VTvaf17-COL7A1 или Escherichia coli SCS110-AF/VTvaf17-CLCA2 или Escherichia coli SCS110-AF/VTvaf17-ELN или Escherichia coli SCS110-AF/VTvaf17-PLOD1, несущего генотерапевтический ДНК-вектор, способа получения генотерапевтического ДНК-вектора, способа производства в промышленных масштабах генотерапевтического ДНК-вектора.
Перечень сокращений
VTvaf17 - вектор генотерапевтический, не содержащий последовательностей вирусных геномов и маркеров антибиотико-резистентности (vector therapeutic virus-antibiotic-free)
ДНК - дезоксирибонуклеиновая кислота
кДНК - комплементарная дезоксирибонуклеиновая кислота
РНК - рибонуклеиновая кислота
мРНК - матричная рибонуклеиновая кислота
п.н. - пар нуклеотидов
ПЦР - полимеразная цепная реакция
мл - миллилитр, мкл - микролитр
куб. мм - кубический миллиметр
л - литр
мкг - микрограмм
мг - миллиграмм
г - грамм
мкМ - микромоль
мМ - миллимоль
мин - минута
сек - секунда
об/мин - обороты в минуту
нм - нанометр
см - сантиметр
мВт - милливатт
о.е. ф-относительная единица флуоресценции
РВС - фосфатно-солевой буфер.
Список литературы
1. Bart G, Hämäläinen L, Rauhala L, Salonen P, Kokkonen M, Dunlop TW, Pehkonen P, Kumlin T, Tammi MI, Pasonen-Seppänen S, Tammi RH. rClca2 is associated with epidermal differentiation and is strongly downregulated by ultraviolet radiation. Br J Dermatol. 2014 Aug;171(2):376-87.
2. Connon CJ, Yamasaki K, Kawasaki S, Quantock AJ, Koizumi N, Kinoshita S. Calcium-activated chloride channel-2 in human epithelia. J Histochem Cytochem. 2004 Mar;52(3):415-8.
3. Craven et al., 1997.
4. Draft Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products, http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2015/05/WC500187020.pdf.
5. Ewart AK, Jin W, Atkinson D, Morris CA, Keating MT. Supravalvular aortic stenosis associated with a deletion disrupting the elastin gene. J Clin Invest. 1994 Mar;93(3):1071-7.
6. Georgiadis C, Syed F, Petrova A, Abdul-Wahab A, Lwin SM, Farzaneh F, Chan L, Ghani S, Fleck RA, Glover L, McMillan JR, Chen M, Thrasher AJ, McGrath JA, Di WL, Qasim W. Lentiviral Engineered Fibroblasts Expressing Codon-Optimized COL7A1 Restore Anchoring Fibrils in RDEB. J Invest Dermatol. 2016 Jan;136(1):284-92.
7. Goto M, Sawamura D, Ito K, Abe M, Nishie W, Sakai K, Shibaki A, Akiyama M, Shimizu H. Fibroblasts show more potential as target cells than keratinocytes in COL7A1 gene therapy of dystrophic epidermolysis bullosa. J Invest Dermatol. 2006 Apr;126(4):766-72.
8. Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal Products EMA/CAT/80183/2014.
9. Hatzimichael E, Lo Nigro C, Lattanzio L, Syed N, Shah R, Dasoula A, Janczar K, Vivenza D, Monteverde M, Merlano M, Papoudou-Bai A, Bai M, Schmid P, Stebbing J, Bower M, Dyer MJ, Karran LE, ElguetaKarstegl C, Farrell PJ, Thompson A, Briasoulis E, Crook T. The collagen prolyl hydroxylases are novel transcriptionally silenced genes in lymphoma. Br J Cancer. 2012 Oct 9;107(8):1423-32.
10. Hornstein BD, Roman D, Arévalo-Soliz LM, Engevik MA, Zechiedrich L. Effects of Circular DNA Length on Transfection Efficiency by Electroporation into HeLa Cells. Ceña V, ed. PLoS ONE. 2016;11(12):e0167537.
11. Jacków J, Titeux M, Portier S, Charbonnier S, Ganier C, Gaucher S, Hovnanian A. Gene-Corrected Fibroblast Therapy for Recessive Dystrophic Epidermolysis Bullosa using a Self-Inactivating COL7A1 Retroviral Vector. J Invest Dermatol. 2016 Jul;136(7):1346-1354.
12. Keene DR, Sakai LY, Lunstrum GP, Morris NP, Burgeson RE. Type VII collagen forms an extended network of anchoring fibrils. J Cell Biol. 1987 Mar;104(3):611-21.
13. Kielty CM, Sherratt MJ, Shuttleworth CA. Elastic fibres. J Cell Sci. 2002 Jul 15;115(Pt 14):2817-28.
14. Labat-Robert J. Cell-matrix interactions, alteration with aging and age associated diseases. A review. Pathol Biol (Paris). 2001 May;49(4):349-52.
15. Li L, Petrovsky N. Molecular mechanisms for enhanced DNA vaccine immunogenicity. Expert Rev Vaccines. 2016;15(3):313-29.
16. Li SH, Sun Z, Guo L, Han M, Wood MF, Ghosh N, Vitkin IA, Weisel RD, Li RK. Elastin overexpression by cell-based gene therapy preserves matrix and prevents cardiac dilation. J Cell Mol Med. 2012 Oct;16(10):2429-39.
17. Mairhofer J, Grabherr R. Rational vector design for efficient non-viral gene delivery: challenges facing the use of plasmid DNA. Mol Biotechnol. 2008.39(2):97-104.
18. Majka, Magdalena Janeczko, Jolanta Goździk, Danuta Jarocha, Aleksandra Auguściak-Duma, Joanna Witecka, Marta Lesiak, Halina Koryciak-Komarska, Aleksander L. Sieroń, Jacek Józef Pietrzyk, Cell therapy of a patient with type III osteogenesis imperfecta caused by mutation in COL1A2 gene and unstable collagen type I. Open Journal of Genetics, Vol.3 No.1, 2013.
19. Mecklenbeck S, Compton SH, Mejía JE, Cervini R, Hovnanian A, Bruckner-Tuderman L, Barrandon Y. A microinjected COL7A1-PAC vector restores synthesis of intact procollagen VII in a dystrophic epidermolysis bullosa keratinocyte cell line. Hum Gene Ther. 2002 Sep 1;13(13):1655-62.
20. Mencía Á, Chamorro C, Bonafont J, Duarte B, Holguin A, Illera N, Llames SG, Escámez MJ, Hausser I, Del Río M, Larcher F, Murillas R. Deletion of a Pathogenic Mutation-Containing Exon of COL7A1 Allows Clonal Gene Editing Correction of RDEB Patient Epidermal Stem Cells. Mol Ther Nucleic Acids. 2018 Jun 1;11:68-78.
21. Napolitano F, Di Iorio V, Testa F, Tirozzi A, Reccia MG, Lombardi L, Farina O, Simonelli F, Gianfrancesco F, Di Iorio G, Melone MAB, Esposito T, Sampaolo S. Autosomal-dominant myopia associated to a novel P4HA2 missense variant and defective collagen hydroxylation. Clin Genet. 2018 May;93(5):982-991.
22. Naylor EC, Watson RE, Sherratt MJ. Molecular aspects of skin ageing. Maturitas. 2011 Jul;69(3):249-56. Niyibizi C, Smith P, Mi Z, Robbins P, Evans C. Potential of gene therapy for treating osteogenesis imperfecta. Clin Orthop Relat Res. 2000 Oct;(379 Suppl): S126-33.
23. Ortiz-Urda S, Thyagarajan B, Keene DR, Lin Q, Fang M, Calos MP, Khavari PA. Stable nonviral genetic correction of inherited human skin disease. Nat Med. 2002 Oct;8(10):1166-70. Epub 2002 Sep 16. Erratum in: Nat Med. 2003 Feb;9(2):237.
24. Osborn MJ, Starker CG, McElroy AN, Webber BR, Riddle MJ, Xia L, DeFeo AP, Gabriel R, Schmidt M, von Kalle C, Carlson DF, Maeder ML, Joung JK, Wagner JE, Voytas DF, Blazar BR, Tolar J. TALEN-based gene correction for epidermolysis bullosa. Mol Ther. 2013 Jun;21(6):1151-9.
25. Raveendran M, Senthil D, Utama B, Shen Y, Dudley D, Wang J, Zhang Y, Wang XL. Cigarette suppresses the expression of P4Halpha and vascular collagen production.Biochem Biophys Res Commun. 2004 Oct 15;323(2):592-8.
26. Reflection paper on design modifications of gene therapy medicinal products during development / 14 December 2011 EMA/CAT/GTWP/44236/2009 Committee for advanced therapies.
27. Ritz-Timme et al., 2003.
28. Santos VJ. High Throughput Screen for molecules and metabolites with potential cosmetic application UNIVERSIDADE DE LISBOA, Mestrado em Microbiologia Aplicada,2010.
29. Seltmann K, Meyer M, Sulcova J, Kockmann T, Wehkamp U, Weidinger S, Auf dem Keller U, Werner S. Humidity-regulated CLCA2 protects the epidermis from hyperosmotic stress. Sci Transl Med. 2018 May 9;10(440).
30. Talwar HS, Griffiths CE, Fisher GJ, Hamilton TA, Voorhees JJ. Reduced type I and type III procollagens in photodamaged adult human skin. J Invest Dermatol.
31. 1995 Aug;105(2):285-90. Tasker PN, Macdonald H, Fraser WD, Reid DM, Ralston SH, Albagha OM. Association of PLOD1 polymorphisms with bone mineral density in a population-based study of women from the UK. Osteoporos Int. 2006;17(7):1078-85.
32. Uchinaka A, Kawaguchi N, Hamada Y, Miyagawa S, Saito A, Mori S, Sawa Y, Matsuura N. Transplantation of elastin-secreting myoblast sheets improves cardiac function in infarcted rat heart. Mol Cell Biochem. 2012 Sep;368(1-2):203-14.
33. van Dijk FS, Mancini GMS, Maugeri A, Cobben JM. Ehlers Danlos syndrome, kyphoscoliotic type due to Lysyl Hydroxylase 1 deficiency in two children without congenital or early onset kyphoscoliosis. Eur J Med Genet. 2017 Oct;60(10):536-540.
34. Woodley DT, Keene DR, Atha T, Huang Y, Ram R, Kasahara N, Chen M. Intradermal injection of lentiviral vectors corrects regenerated human dystrophic epidermolysis bullosa skin tissue in vivo. Mol Ther. 2004 Aug;10(2):318-26.
35. Zou Y, Donkervoort S, Salo AM, Foley AR, Barnes AM, Hu Y, Makareeva E, Leach ME, Mohassel P, Dastgir J, Deardorff MA, Cohn RD, DiNonno WO, Malfait F, Lek M,Leikin S, Marini JC, Myllyharju J, Bönnemann CG. P4HA1 mutations cause a unique congenital disorder of connective tissue involving tendon, bone, muscle and the eye. Hum Mol Genet. 2017 Jun 15;26(12):2207-2217.
36. Биохимия: Учеб. для вузов, под ред. Е.С. Северина., 2003. 779 с. ISBN 5-9231-0254-4.
37. Молекулярная биология, 2011, том 45, № 1, с. 44-55.
38. С.С. Кузнецов, В.В. Дуденкова, М.В. Кочуева, Е.Б. Киселева, Н.Ю. Игнатьева, О.Л. Захаркина, Е.А. Сергеева, К.В. Бабак, А.В. Масленникова. Многофотонная микроскопия в изучении морфологических особенностей радиационно-индуцированных повреждений мочевого пузыря. Современные технологии в медицине, 2016, том 8, номер 2, стр. 31-39.
39. Урология: учебник / Б.К. Комяков. - 2012. - 464 с.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Селл энд Джин Терапи Лтд (CELL and GENE THERAPY Ltd), Общество с ограниченной ответственностью «Прорывные Инновационные Технологии»,
<120> Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1 для повышения уровня экспрессии этих целевых генов, способ его получения и применения, штамм Escherichia coli SCS110-AF/VTvaf17-COL1A1 или Escherichia coli SCS110-AF/VTvaf17-COL1A2 или Escherichia coli SCS110-AF/VTvaf17-P4HA1 или Escherichia coli SCS110-AF/VTvaf17-P4HA2 или Escherichia coli SCS110-AF/VTvaf17-COL7A1 или Escherichia coli SCS110-AF/VTvaf17-CLCA2 или Escherichia coli SCS110-AF/VTvaf17-ELN или Escherichia coli SCS110-AF/VTvaf17- PLOD1 несущий генотерапевтический ДНК-вектор, способ его получения, способ производства в промышленных масштабах генотерапевтического ДНК-вектора.
<160> 8
<170> BiSSAP 1.3.6
<210> 1
<211> 7563
<212> DNA
<213> Homo Sapiens
<400> 1
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagct agcgtctagg gtctagacat gttcagcttt gtggacctcc ggctcctgct 1260
cctcttagcg gccaccgccc tcctgacgca cggccaagag gaaggccaag tcgagggcca 1320
agacgaagac atcccaccaa tcacctgcgt acagaacggc ctcaggtacc atgaccgaga 1380
cgtgtggaaa cccgagccct gccggatctg cgtctgcgac aacggcaagg tgttgtgcga 1440
tgacgtgatc tgtgacgaga ccaagaactg ccccggcgcc gaagtccccg agggcgagtg 1500
ctgtcccgtc tgccccgacg gctcagagtc acccaccgac caagaaacca ccggcgtcga 1560
gggacccaag ggagacactg gcccccgagg cccaagggga cccgcaggcc cccctggccg 1620
agatggcatc cctggacagc ctggacttcc cggacccccc ggaccccccg gacctcccgg 1680
accccctggc ctcggaggaa actttgctcc ccagctgtct tatggctatg atgagaaatc 1740
aaccggagga atttccgtgc ctggccccat gggtccctct ggtcctcgtg gtctccctgg 1800
cccccctggt gcacctggtc cccaaggctt ccaaggtccc cctggtgagc ctggcgagcc 1860
tggagcttca ggtcccatgg gtccccgagg tcccccaggt ccccctggaa agaatggaga 1920
tgatggggaa gctggaaaac ctggtcgtcc tggtgagcgt gggcctcctg ggcctcaggg 1980
tgctcgagga ttgcccggaa cagctggcct ccctggaatg aagggacaca gaggtttcag 2040
tggtttggat ggtgccaagg gagatgctgg tcctgctggt cctaagggtg agcctggcag 2100
ccctggtgaa aatggagctc ctggtcagat gggcccccgt ggcctgcctg gtgagagagg 2160
tcgccctgga gcccctggcc ctgctggtgc tcgtggaaat gatggtgcta ctggtgctgc 2220
cgggccccct ggtcccaccg gccccgctgg tcctcctggc ttccctggtg ctgttggtgc 2280
taagggtgaa gctggtcccc aagggccccg aggctctgaa ggtccccagg gtgtgcgtgg 2340
tgagcctggc ccccctggcc ctgctggtgc tgctggccct gctggaaacc ctggtgctga 2400
tggacagcct ggtgctaaag gtgccaatgg tgctcctggt attgctggtg ctcctggctt 2460
ccctggtgcc cgaggcccct ctggacccca gggccccggc ggccctcctg gtcccaaggg 2520
taacagcggt gaacctggtg ctcctggcag caaaggagac actggtgcta agggagagcc 2580
tggccctgtt ggtgttcaag gaccccctgg ccctgctgga gaggaaggaa agcgaggagc 2640
tcgaggtgaa cccggaccca ctggcctgcc cggaccccct ggcgagcgtg gtggacctgg 2700
tagccgtggt ttccctggcg cagatggtgt tgctggtccc aagggtcccg ctggtgaacg 2760
tggttctcct ggccccgctg gccccaaagg atctcctggt gaagctggtc gtcccggtga 2820
agctggtctg cctggtgcca agggtctgac tggaagccct ggcagccctg gtcctgatgg 2880
caaaactggc ccccctggtc ccgccggtca agatggtcgc cccggacccc caggcccacc 2940
tggtgcccgt ggtcaggctg gtgtgatggg attccctgga cctaaaggtg ctgctggaga 3000
gcccggcaag gctggagagc gaggtgttcc cggaccccct ggcgctgtcg gtcctgctgg 3060
caaagatgga gaggctggag ctcagggacc ccctggccct gctggtcccg ctggcgagag 3120
aggtgaacaa ggccctgctg gctcccccgg attccagggt ctccctggtc ctgctggtcc 3180
tccaggtgaa gcaggcaaac ctggtgaaca gggtgttcct ggagaccttg gcgcccctgg 3240
cccctctgga gcaagaggcg agagaggttt ccctggcgag cgtggtgtgc aaggtccccc 3300
tggtcctgct ggaccccgag gggccaacgg tgctcccggc aacgatggtg ctaagggtga 3360
tgctggtgcc cctggagctc ccggtagcca gggcgcccct ggccttcagg gaatgcctgg 3420
tgaacgtggt gcagctggtc ttccagggcc taagggtgac agaggtgatg ctggtcccaa 3480
aggtgctgat ggctctcctg gcaaagatgg cgtccgtggt ctgaccggcc ccattggtcc 3540
tcctggccct gctggtgccc ctggtgacaa gggtgaaagt ggtcccagcg gccctgctgg 3600
tcccactgga gctcgtggtg cccccggaga ccgtggtgag cctggtcccc ccggccctgc 3660
tggctttgct ggcccccctg gtgctgacgg ccaacctggt gctaaaggcg aacctggtga 3720
tgctggtgcc aaaggcgatg ctggtccccc tgggcctgcc ggacccgctg gaccccctgg 3780
ccccattggt aatgttggtg ctcctggagc caaaggtgct cgcggcagcg ctggtccccc 3840
tggtgctact ggtttccctg gtgctgctgg ccgagtcggt cctcctggcc cctctggaaa 3900
tgctggaccc cctggccctc ctggtcctgc tggcaaagaa ggcggcaaag gtccccgtgg 3960
tgagactggc cctgctggac gtcctggtga agttggtccc cctggtcccc ctggccctgc 4020
tggcgagaaa ggatcccctg gtgctgatgg tcctgctggt gctcctggta ctcccgggcc 4080
tcaaggtatt gctggacagc gtggtgtggt cggcctgcct ggtcagagag gagagagagg 4140
cttccctggt cttcctggcc cctctggtga acctggcaaa caaggtccct ctggagcaag 4200
tggtgaacgt ggtccccccg gtcccatggg cccccctgga ttggctggac cccctggtga 4260
atctggacgt gagggggctc ctgctgccga aggttcccct ggacgagacg gttctcctgg 4320
cgccaagggt gaccgtggtg agaccggccc cgctggaccc cctggtgctc ctggtgctcc 4380
tggtgcccct ggccccgttg gccctgctgg caagagtggt gatcgtggtg agactggtcc 4440
tgctggtccc gccggtcccg tcggccccgt cggcgcccgt ggccccgccg gaccccaagg 4500
cccccgtggt gacaagggtg agacaggcga acagggcgac agaggcataa agggtcaccg 4560
tggcttctct ggcctccagg gtccccctgg ccctcctggc tctcctggtg aacaaggtcc 4620
ctctggagcc tctggtcctg ctggtccccg aggtccccct ggctctgctg gtgctcctgg 4680
caaagatgga ctcaacggtc tccctggccc cattgggccc cctggtcctc gcggtcgcac 4740
tggtgatgct ggtcctgttg gtccccccgg ccctcctgga cctcctggtc cccctggtcc 4800
tcccagcgct ggtttcgact tcagcttcct gccccagcca cctcaagaga aggctcacga 4860
tggtggccgc tactaccggg ctgatgatgc caatgtggtt cgtgaccgtg acctcgaggt 4920
ggacaccacc ctcaagagcc tgagccagca gatcgagaac atccggagcc cagagggaag 4980
ccgcaagaac cccgcccgca cctgccgtga cctcaagatg tgccactctg actggaagag 5040
tggagagtac tggattgacc ccaaccaagg ctgcaacctg gatgccatca aagtcttctg 5100
caacatggag actggtgaga cctgcgtgta ccccactcag cccagtgtgg cccagaagaa 5160
ctggtacatc agcaagaacc ccaaggacaa gaggcatgtc tggttcggcg agagcatgac 5220
cgatggattc cagttcgagt atggcggcca gggctccgac cctgccgatg tggccatcca 5280
gctgaccttc ctgcgcctga tgtccaccga ggcctcccag aacatcacct accactgcaa 5340
gaacagcgtg gcctacatgg accagcagac tggcaacctc aagaaggccc tgctcctcaa 5400
gggctccaac gagatcgaga tccgcgccga gggcaacagc cgcttcacct acagcgtcac 5460
tgtcgatggc tgcacgagtc acaccggagc ctggggcaag acagtgattg aatacaaaac 5520
caccaagtcc tcccgcctgc ccatcatcga tgtggccccc ttggacgttg gtgccccaga 5580
ccaggaattc ggcttcgacg ttggccctgt ctgcttcctg tagaagcttg gtaccgaatt 5640
ccctgtgacc cctccccagt gcctctcctg gccctggaag ttgccactcc agtgcccacc 5700
agccttgtcc taataaaatt aagttgcatc attttgtctg actaggtgtc cttctataat 5760
attatggggt ggaggggggt ggtatggagc aaggggcaag ttgggaagac aacctgtagg 5820
gcctgcgggg tctattggga accaagctgg agtgcagtgg cacaatcttg gctcactgca 5880
atctccgcct cctgggttca agcgattctc ctgcctcagc ctcccgagtt gttgggattc 5940
caggcatgca tgaccaggct cagctaattt ttgttttttt ggtagagacg gggtttcacc 6000
atattggcca ggctggtctc caactcctaa tctcaggtga tctacccacc ttggcctccc 6060
aaattgctgg gattacaggc gtgaaccact gctcccttcc ctgtccttac gcgtagaatt 6120
ggtaaagaga gtcgtgtaaa atatcgagtt cgcacatctt gttgtctgat tattgatttt 6180
tggcgaaacc atttgatcat atgacaagat gtgtatctac cttaacttaa tgattttgat 6240
aaaaatcatt aactagtcca tggctgcctc gcgcgtttcg gtgatgacgg tgaaaacctc 6300
tgacacatgc agctcccgga gacggtcaca gcttgtctgt aagcggatgc cgggagcaga 6360
caagcccgtc agggcgcgtc agcgggtgtt ggcgggtgtc ggggcgcagc catgacccag 6420
tcacgtagcg atagcggagt gtatactggc ttaactatgc ggcatcagag cagattgtac 6480
tgagagtgca ccatatgcgg tgtgaaatac cgcacagatg cgtaaggaga aaataccgca 6540
tcaggcgctc ttccgcttcc tcgctcactg actcgctgcg ctcggtcgtt cggctgcggc 6600
gagcggtatc agctcactca aaggcggtaa tacggttatc cacagaatca ggggataacg 6660
caggaaagaa catgtgagca aaaggccagc aaaaggccag gaaccgtaaa aaggccgcgt 6720
tgctggcgtt tttccatagg ctccgccccc ctgacgagca tcacaaaaat cgacgctcaa 6780
gtcagaggtg gcgaaacccg acaggactat aaagatacca ggcgtttccc cctggaagct 6840
ccctcgtgcg ctctcctgtt ccgaccctgc cgcttaccgg atacctgtcc gcctttctcc 6900
cttcgggaag cgtggcgctt tctcatagct cacgctgtag gtatctcagt tcggtgtagg 6960
tcgttcgctc caagctgggc tgtgtgcacg aaccccccgt tcagcccgac cgctgcgcct 7020
tatccggtaa ctatcgtctt gagtccaacc cggtaagaca cgacttatcg ccactggcag 7080
cagccactgg taacaggatt agcagagcga ggtatgtagg cggtgctaca gagttcttga 7140
agtggtggcc taactacggc tacactagaa gaacagtatt tggtatctgc gctctgctga 7200
agccagttac cttcggaaaa agagttggta gctcttgatc cggcaaacaa accaccgctg 7260
gtagcggtgg tttttttgtt tgcaagcagc agattacgcg cagaaaaaaa ggatctcaag 7320
aagatccttt gatcttttct acggggtctg acgctcagtg gaacgaaaac tcacgttaag 7380
ggattttggt catgagatta tcaaaaagga tcttcaccta gatcctttta aattaaaaat 7440
gaagttttaa atcaatctaa agtatatatg agtaaacttg gtctgacagt taccaatgct 7500
taatcagtga ggcacctatc tcagcgatct gtctatttcg ttcatccata gttgcctgac 7560
tcc 7563
<210> 2
<211> 7269
<212> DNA
<213> Homo Sapiens
<400> 2
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagct agcgtctaag tgctagacat gctcagcttt gtggatacgc ggactttgtt 1260
gctgcttgca gtaaccttat gcctagcaac atgccaatct ttacaagagg aaactgtaag 1320
aaagggccca gccggagata gaggaccacg tggagaaagg ggtccaccag gccccccagg 1380
cagagatggt gaagatggtc ccacaggccc tcctggtcca cctggtcctc ctggcccccc 1440
tggtctcggt gggaactttg ctgctcagta tgatggaaaa ggagttggac ttggccctgg 1500
accaatgggc ttaatgggac ctagaggccc acctggtgca gctggagccc caggccctca 1560
aggtttccaa ggacctgctg gtgagcctgg tgaacctggt caaactggtc ctgcaggtgc 1620
tcgtggtcca gctggccctc ctggcaaggc tggtgaagat ggtcaccctg gaaaacccgg 1680
acgacctggt gagagaggag ttgttggacc acagggtgct cgtggtttcc ctggaactcc 1740
tggacttcct ggcttcaaag gcattagggg acacaatggt ctggatggat tgaagggaca 1800
gcccggtgct cctggtgtga agggtgaacc tggtgcccct ggtgaaaatg gaactccagg 1860
tcaaacagga gcccgtgggc ttcctggtga gagaggacgt gttggtgccc ctggcccagc 1920
tggtgcccgt ggcagtgatg gaagtgtggg tcccgtgggt cctgctggtc ccattgggtc 1980
tgctggccct ccaggcttcc caggtgcccc tggccccaag ggtgaaattg gagctgttgg 2040
taacgctggt cctgctggtc ccgccggtcc ccgtggtgaa gtgggtcttc caggcctctc 2100
cggccccgtt ggacctcctg gtaatcctgg agcaaacggc cttactggtg ccaagggtgc 2160
tgctggcctt cccggcgttg ctggggctcc cggcctccct ggaccccgcg gtattcctgg 2220
ccctgttggt gctgccggtg ctactggtgc cagaggactt gttggtgagc ctggtccagc 2280
tggctccaaa ggagagagcg gtaacaaggg tgagcccggc tctgctgggc cccaaggtcc 2340
tcctggtccc agtggtgaag aaggaaagag aggccctaat ggggaagctg gatctgccgg 2400
ccctccagga cctcctgggc tgagaggtag tcctggttct cgtggtcttc ctggagctga 2460
tggcagagct ggcgtcatgg gccctcctgg tagtcgtggt gcaagtggcc ctgctggagt 2520
ccgaggacct aatggagatg ctggtcgccc tggggagcct ggtctcatgg gacccagagg 2580
tcttcctggt tcccctggaa atatcggccc cgctggaaaa gaaggtcctg tcggcctccc 2640
tggcatcgac ggcaggcctg gcccaattgg ccccgctgga gcaagaggag agcctggcaa 2700
cattggattc cctggaccca aaggccccac tggtgatcct ggcaaaaacg gtgataaagg 2760
tcatgctggt cttgctggtg ctcggggtgc tccaggtcct gatggaaaca atggtgctca 2820
gggacctcct ggaccacagg gtgttcaagg tggaaaaggt gaacagggtc ccgctggtcc 2880
tccaggcttc cagggtctgc ctggcccctc aggtcccgct ggtgaagttg gcaaaccagg 2940
agaaaggggt ctccatggtg agtttggtct ccctggtcct gctggtccaa gaggggaacg 3000
cggtccccca ggtgagagtg gtgctgccgg tcctactggt cctattggaa gccgaggtcc 3060
ttctggaccc ccagggcctg atggaaacaa gggtgaacct ggtgtggttg gtgctgtggg 3120
cactgctggt ccatctggtc ctagtggact cccaggagag aggggtgctg ctggcatacc 3180
tggaggcaag ggagaaaagg gtgaacctgg tctcagaggt gaaattggta accctggcag 3240
agatggtgct cgtggtgctc ctggtgctgt aggtgcccct ggtcctgctg gagccacagg 3300
tgaccggggc gaagctgggg ctgctggtcc tgctggtcct gctggtcctc ggggaagccc 3360
tggtgaacgt ggtgaggtcg gtcctgctgg ccccaatgga tttgctggtc ctgctggtgc 3420
tgctggtcaa cctggtgcta aaggagaaag aggagccaaa gggcctaagg gtgaaaacgg 3480
tgttgttggt cccacaggcc ccgttggagc tgctggccca gctggtccaa atggtccccc 3540
cggtcctgct ggaagtcgtg gtgatggagg cccccctggt atgactggtt tccctggtgc 3600
tgctggacgg actggtcccc caggaccctc tggtatttct ggccctcctg gtccccctgg 3660
tcctgctggg aaagaagggc ttcgtggtcc tcgtggtgac caaggtccag ttggccgaac 3720
tggagaagta ggtgcagttg gtccccctgg cttcgctggt gagaagggtc cctctggaga 3780
ggctggtact gctggacctc ctggcactcc aggtcctcag ggtcttcttg gtgctcctgg 3840
tattctgggt ctccctggct cgagaggtga acgtggtcta ccaggtgttg ctggtgctgt 3900
gggtgaacct ggtcctcttg gcattgccgg ccctcctggg gcccgtggtc ctcctggtgc 3960
tgtgggtagt cctggagtca acggtgctcc tggtgaagct ggtcgtgatg gcaaccctgg 4020
gaacgatggt cccccaggtc gcgatggtca acccggacac aagggagagc gcggttaccc 4080
tggcaatatt ggtcccgttg gtgctgcagg tgcacctggt cctcatggcc ccgtgggtcc 4140
tgctggcaaa catggaaacc gtggtgaaac tggtccttct ggtcctgttg gtcctgctgg 4200
tgctgttggc ccaagaggtc ctagtggccc acaaggcatt cgtggcgata agggagagcc 4260
cggtgaaaag gggcccagag gtcttcctgg cttaaaggga cacaatggat tgcaaggtct 4320
gcctggtatc gctggtcacc atggtgatca aggtgctcct ggctccgtgg gtcctgctgg 4380
tcctaggggc cctgctggtc cttctggccc tgctggaaaa gatggtcgca ctggacatcc 4440
tggtacagtt ggacctgctg gcattcgagg ccctcagggt caccaaggcc ctgctggccc 4500
ccctggtccc cctggccctc ctggacctcc aggtgtaagc ggtggtggtt atgactttgg 4560
ttacgatgga gacttctaca gggctgacca gcctcgctca gcaccttctc tcagacccaa 4620
ggactatgaa gttgatgcta ctctgaagtc tctcaacaac cagattgaga cccttcttac 4680
tcctgaaggc tctagaaaga acccagctcg cacatgccgt gacttgagac tcagccaccc 4740
agagtggagc agtggttact actggattga ccctaaccaa ggatgcacta tggatgctat 4800
caaagtatac tgtgatttct ctactggcga aacctgtatc cgggcccaac ctgaaaacat 4860
cccagccaag aactggtata ggagctccaa ggacaagaaa cacgtctggc taggagaaac 4920
tatcaatgct ggcagccagt ttgaatataa tgtagaagga gtgacttcca aggaaatggc 4980
tacccaactt gccttcatgc gcctgctggc caactatgcc tctcagaaca tcacctacca 5040
ctgcaagaac agcattgcat acatggatga ggagactggc aacctgaaaa aggctgtcat 5100
tctacagggc tctaatgatg ttgaacttgt tgctgagggc aacagcaggt tcacttacac 5160
tgttcttgta gatggctgct ctaaaaagac aaatgaatgg ggaaagacaa tcattgaata 5220
caaaacaaat aagccatcac gcctgccctt ccttgatatt gcacctttgg acatcggtgg 5280
tgctgaccag gaattctttg tggacattgg cccagtctgt ttcaaataaa agcttggtac 5340
cgaattccct gtgacccctc cccagtgcct ctcctggccc tggaagttgc cactccagtg 5400
cccaccagcc ttgtcctaat aaaattaagt tgcatcattt tgtctgacta ggtgtccttc 5460
tataatatta tggggtggag gggggtggta tggagcaagg ggcaagttgg gaagacaacc 5520
tgtagggcct gcggggtcta ttgggaacca agctggagtg cagtggcaca atcttggctc 5580
actgcaatct ccgcctcctg ggttcaagcg attctcctgc ctcagcctcc cgagttgttg 5640
ggattccagg catgcatgac caggctcagc taatttttgt ttttttggta gagacggggt 5700
ttcaccatat tggccaggct ggtctccaac tcctaatctc aggtgatcta cccaccttgg 5760
cctcccaaat tgctgggatt acaggcgtga accactgctc ccttccctgt ccttacgcgt 5820
agaattggta aagagagtcg tgtaaaatat cgagttcgca catcttgttg tctgattatt 5880
gatttttggc gaaaccattt gatcatatga caagatgtgt atctacctta acttaatgat 5940
tttgataaaa atcattaact agtccatggc tgcctcgcgc gtttcggtga tgacggtgaa 6000
aacctctgac acatgcagct cccggagacg gtcacagctt gtctgtaagc ggatgccggg 6060
agcagacaag cccgtcaggg cgcgtcagcg ggtgttggcg ggtgtcgggg cgcagccatg 6120
acccagtcac gtagcgatag cggagtgtat actggcttaa ctatgcggca tcagagcaga 6180
ttgtactgag agtgcaccat atgcggtgtg aaataccgca cagatgcgta aggagaaaat 6240
accgcatcag gcgctcttcc gcttcctcgc tcactgactc gctgcgctcg gtcgttcggc 6300
tgcggcgagc ggtatcagct cactcaaagg cggtaatacg gttatccaca gaatcagggg 6360
ataacgcagg aaagaacatg tgagcaaaag gccagcaaaa ggccaggaac cgtaaaaagg 6420
ccgcgttgct ggcgtttttc cataggctcc gcccccctga cgagcatcac aaaaatcgac 6480
gctcaagtca gaggtggcga aacccgacag gactataaag ataccaggcg tttccccctg 6540
gaagctccct cgtgcgctct cctgttccga ccctgccgct taccggatac ctgtccgcct 6600
ttctcccttc gggaagcgtg gcgctttctc atagctcacg ctgtaggtat ctcagttcgg 6660
tgtaggtcgt tcgctccaag ctgggctgtg tgcacgaacc ccccgttcag cccgaccgct 6720
gcgccttatc cggtaactat cgtcttgagt ccaacccggt aagacacgac ttatcgccac 6780
tggcagcagc cactggtaac aggattagca gagcgaggta tgtaggcggt gctacagagt 6840
tcttgaagtg gtggcctaac tacggctaca ctagaagaac agtatttggt atctgcgctc 6900
tgctgaagcc agttaccttc ggaaaaagag ttggtagctc ttgatccggc aaacaaacca 6960
ccgctggtag cggtggtttt tttgtttgca agcagcagat tacgcgcaga aaaaaaggat 7020
ctcaagaaga tcctttgatc ttttctacgg ggtctgacgc tcagtggaac gaaaactcac 7080
gttaagggat tttggtcatg agattatcaa aaaggatctt cacctagatc cttttaaatt 7140
aaaaatgaag ttttaaatca atctaaagta tatatgagta aacttggtct gacagttacc 7200
aatgcttaat cagtgaggca cctatctcag cgatctgtct atttcgttca tccatagttg 7260
cctgactcc 7269
<210> 3
<211> 4754
<212> DNA
<213> Homo Sapiens
<400> 3
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatga tctggtatat attaattata ggaattctgc ttccccagtc 1260
tttggctcat ccaggctttt ttacttcaat tggtcagatg actgatttga tccatactga 1320
gaaagatctg gtgacttctc tgaaagatta tattaaggca gaagaggaca agttagaaca 1380
aataaaaaaa tgggcagaga agttagatcg gctaactagt acagcgacaa aagatccaga 1440
aggatttgtt gggcatccag taaatgcatt caaattaatg aaacgtctga atactgagtg 1500
gagtgagttg gagaatctgg tccttaagga tatgtcagat ggctttatct ctaacctaac 1560
cattcagaga cagtactttc ctaatgatga agatcaggtt ggggcagcca aagctctgtt 1620
acgtctccag gatacctaca atttggatac agataccatc tcaaagggta atcttccagg 1680
agtgaaacac aaatcttttc taacggctga ggactgcttt gagttgggca aagtggccta 1740
tacagaagca gattattacc atacggaact gtggatggaa caagccctaa ggcaactgga 1800
tgaaggcgag atttctacca tagataaagt ctctgttcta gattatttga gctatgcggt 1860
atatcagcag ggagacctgg ataaggcact tttgctcaca aagaagcttc ttgaactaga 1920
tcctgaacat cagagagcta atggtaactt aaaatatttt gagtatataa tggctaaaga 1980
aaaagatgtc aataagtctg cttcagatga ccaatctgat cagaaaacta caccaaagaa 2040
aaaaggggtt gctgtggatt acctgccaga gagacagaag tacgaaatgc tgtgccgtgg 2100
ggagggtatc aaaatgaccc ctcggagaca gaaaaaactc ttttgccgct accatgatgg 2160
aaaccgtaat cctaaattta ttctggctcc agctaaacag gaggatgaat gggacaagcc 2220
tcgtattatt cgcttccatg atattatttc tgatgcagaa attgaaatcg tcaaagacct 2280
agcaaaacca aggctgaggc gagccaccat ttcaaaccca ataacaggag acttggagac 2340
ggtacattac agaattagca aaagtgcctg gctctctggc tatgaaaatc ctgtggtgtc 2400
tcgaattaat atgagaatac aagatctaac aggactagat gtttccacag cagaggaatt 2460
acaggtagca aattatggag ttggaggaca gtatgaaccc cattttgact ttgcacggaa 2520
agatgagcca gatgctttca aagagctggg gacaggaaat agaattgcta catggctgtt 2580
ttatatgagt gatgtgtctg caggaggagc cactgttttt cctgaagttg gagctagtgt 2640
ttggcccaaa aaaggaactg ctgttttctg gtataatctg tttgccagtg gagaaggaga 2700
ttatagtaca cggcatgcag cctgtccagt gctagttggc aacaaatggg tatccaataa 2760
atggctccat gaacgtggac aagaatttcg aagaccttgt acgttgtcag aattggaata 2820
ggtaccgaat tccctgtgac ccctccccag tgcctctcct ggccctggaa gttgccactc 2880
cagtgcccac cagccttgtc ctaataaaat taagttgcat cattttgtct gactaggtgt 2940
ccttctataa tattatgggg tggagggggg tggtatggag caaggggcaa gttgggaaga 3000
caacctgtag ggcctgcggg gtctattggg aaccaagctg gagtgcagtg gcacaatctt 3060
ggctcactgc aatctccgcc tcctgggttc aagcgattct cctgcctcag cctcccgagt 3120
tgttgggatt ccaggcatgc atgaccaggc tcagctaatt tttgtttttt tggtagagac 3180
ggggtttcac catattggcc aggctggtct ccaactccta atctcaggtg atctacccac 3240
cttggcctcc caaattgctg ggattacagg cgtgaaccac tgctcccttc cctgtcctta 3300
cgcgtagaat tggtaaagag agtcgtgtaa aatatcgagt tcgcacatct tgttgtctga 3360
ttattgattt ttggcgaaac catttgatca tatgacaaga tgtgtatcta ccttaactta 3420
atgattttga taaaaatcat taactagtcc atggctgcct cgcgcgtttc ggtgatgacg 3480
gtgaaaacct ctgacacatg cagctcccgg agacggtcac agcttgtctg taagcggatg 3540
ccgggagcag acaagcccgt cagggcgcgt cagcgggtgt tggcgggtgt cggggcgcag 3600
ccatgaccca gtcacgtagc gatagcggag tgtatactgg cttaactatg cggcatcaga 3660
gcagattgta ctgagagtgc accatatgcg gtgtgaaata ccgcacagat gcgtaaggag 3720
aaaataccgc atcaggcgct cttccgcttc ctcgctcact gactcgctgc gctcggtcgt 3780
tcggctgcgg cgagcggtat cagctcactc aaaggcggta atacggttat ccacagaatc 3840
aggggataac gcaggaaaga acatgtgagc aaaaggccag caaaaggcca ggaaccgtaa 3900
aaaggccgcg ttgctggcgt ttttccatag gctccgcccc cctgacgagc atcacaaaaa 3960
tcgacgctca agtcagaggt ggcgaaaccc gacaggacta taaagatacc aggcgtttcc 4020
ccctggaagc tccctcgtgc gctctcctgt tccgaccctg ccgcttaccg gatacctgtc 4080
cgcctttctc ccttcgggaa gcgtggcgct ttctcatagc tcacgctgta ggtatctcag 4140
ttcggtgtag gtcgttcgct ccaagctggg ctgtgtgcac gaaccccccg ttcagcccga 4200
ccgctgcgcc ttatccggta actatcgtct tgagtccaac ccggtaagac acgacttatc 4260
gccactggca gcagccactg gtaacaggat tagcagagcg aggtatgtag gcggtgctac 4320
agagttcttg aagtggtggc ctaactacgg ctacactaga agaacagtat ttggtatctg 4380
cgctctgctg aagccagtta ccttcggaaa aagagttggt agctcttgat ccggcaaaca 4440
aaccaccgct ggtagcggtg gtttttttgt ttgcaagcag cagattacgc gcagaaaaaa 4500
aggatctcaa gaagatcctt tgatcttttc tacggggtct gacgctcagt ggaacgaaaa 4560
ctcacgttaa gggattttgg tcatgagatt atcaaaaagg atcttcacct agatcctttt 4620
aaattaaaaa tgaagtttta aatcaatcta aagtatatat gagtaaactt ggtctgacag 4680
ttaccaatgc ttaatcagtg aggcacctat ctcagcgatc tgtctatttc gttcatccat 4740
agttgcctga ctcc 4754
<210> 4
<211> 4764
<212> DNA
<213> Homo Sapiens
<400> 4
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatga aactctgggt gtctgcattg ctgatggcct ggtttggtgt 1260
cctgagctgt gtgcaggccg aattcttcac ctctattggg cacatgactg acctgattta 1320
tgcagagaaa gagctggtgc agtctctgaa agagtacatc cttgtggagg aagccaagct 1380
ttccaagatt aagagctggg ccaacaaaat ggaagccttg actagcaagt cagctgctga 1440
tgctgagggc tacctggctc accctgtgaa tgcctacaaa ctggtgaagc ggctaaacac 1500
agactggcct gcgctggagg accttgtcct gcaggactca gctgcaggtt ttatcgccaa 1560
cctctctgtg cagcggcagt tcttccccac tgatgaggac gagataggag ctgccaaagc 1620
cctgatgaga cttcaggaca catacaggct ggacccaggc acaatttcca gaggggaact 1680
tccaggaacc aagtaccagg caatgctgag tgtggatgac tgctttggga tgggccgctc 1740
ggcctacaat gaaggggact attatcatac ggtgttgtgg atggagcagg tgctaaagca 1800
gcttgatgcc ggggaggagg ccaccacaac caagtcacag gtgctggact acctcagcta 1860
tgctgtcttc cagttgggtg atctgcaccg tgccctggag ctcacccgcc gcctgctctc 1920
ccttgaccca agccacgaac gagctggagg gaatctgcgg tactttgagc agttattgga 1980
ggaagagaga gaaaaaacgt taacaaatca gacagaagct gagctagcaa ccccagaagg 2040
catctatgag aggcctgtgg actacctgcc tgagagggat gtttacgaga gcctctgtcg 2100
tggggagggt gtcaaactga caccccgtag acagaagagg cttttctgta ggtaccacca 2160
tggcaacagg gccccacagc tgctcattgc ccccttcaaa gaggaggacg agtgggacag 2220
cccgcacatc gtcaggtact acgatgtcat gtctgatgag gaaatcgaga ggatcaagga 2280
gatcgcaaaa cctaaacttg cacgagccac cgttcgtgat cccaagacag gagtcctcac 2340
tgtcgccagc taccgggttt ccaaaagctc ctggctagag gaagatgatg accctgttgt 2400
ggcccgagta aatcgtcgga tgcagcatat cacagggtta acagtaaaga ctgcagaatt 2460
gttacaggtt gcaaattatg gagtgggagg acagtatgaa ccgcacttcg acttctctag 2520
gcgacctttt gacagcggcc tcaaaacaga ggggaatagg ttagcgacgt ttcttaacta 2580
catgagtgat gtagaagctg gtggtgccac cgtcttccct gatctggggg ctgcaatttg 2640
gcctaagaag ggtacagctg tgttctggta caacctcttg cggagcgggg aaggtgacta 2700
ccgaacaaga catgctgcct gccctgtgct tgtgggctgc aagtgggtct ccaataagtg 2760
gttccatgaa cgaggacagg agttcttgag accttgtgga tcaacagaag ttgactaagt 2820
cgacaagctt ggtaccgaat tccctgtgac ccctccccag tgcctctcct ggccctggaa 2880
gttgccactc cagtgcccac cagccttgtc ctaataaaat taagttgcat cattttgtct 2940
gactaggtgt ccttctataa tattatgggg tggagggggg tggtatggag caaggggcaa 3000
gttgggaaga caacctgtag ggcctgcggg gtctattggg aaccaagctg gagtgcagtg 3060
gcacaatctt ggctcactgc aatctccgcc tcctgggttc aagcgattct cctgcctcag 3120
cctcccgagt tgttgggatt ccaggcatgc atgaccaggc tcagctaatt tttgtttttt 3180
tggtagagac ggggtttcac catattggcc aggctggtct ccaactccta atctcaggtg 3240
atctacccac cttggcctcc caaattgctg ggattacagg cgtgaaccac tgctcccttc 3300
cctgtcctta cgcgtagaat tggtaaagag agtcgtgtaa aatatcgagt tcgcacatct 3360
tgttgtctga ttattgattt ttggcgaaac catttgatca tatgacaaga tgtgtatcta 3420
ccttaactta atgattttga taaaaatcat taactagtcc atggctgcct cgcgcgtttc 3480
ggtgatgacg gtgaaaacct ctgacacatg cagctcccgg agacggtcac agcttgtctg 3540
taagcggatg ccgggagcag acaagcccgt cagggcgcgt cagcgggtgt tggcgggtgt 3600
cggggcgcag ccatgaccca gtcacgtagc gatagcggag tgtatactgg cttaactatg 3660
cggcatcaga gcagattgta ctgagagtgc accatatgcg gtgtgaaata ccgcacagat 3720
gcgtaaggag aaaataccgc atcaggcgct cttccgcttc ctcgctcact gactcgctgc 3780
gctcggtcgt tcggctgcgg cgagcggtat cagctcactc aaaggcggta atacggttat 3840
ccacagaatc aggggataac gcaggaaaga acatgtgagc aaaaggccag caaaaggcca 3900
ggaaccgtaa aaaggccgcg ttgctggcgt ttttccatag gctccgcccc cctgacgagc 3960
atcacaaaaa tcgacgctca agtcagaggt ggcgaaaccc gacaggacta taaagatacc 4020
aggcgtttcc ccctggaagc tccctcgtgc gctctcctgt tccgaccctg ccgcttaccg 4080
gatacctgtc cgcctttctc ccttcgggaa gcgtggcgct ttctcatagc tcacgctgta 4140
ggtatctcag ttcggtgtag gtcgttcgct ccaagctggg ctgtgtgcac gaaccccccg 4200
ttcagcccga ccgctgcgcc ttatccggta actatcgtct tgagtccaac ccggtaagac 4260
acgacttatc gccactggca gcagccactg gtaacaggat tagcagagcg aggtatgtag 4320
gcggtgctac agagttcttg aagtggtggc ctaactacgg ctacactaga agaacagtat 4380
ttggtatctg cgctctgctg aagccagtta ccttcggaaa aagagttggt agctcttgat 4440
ccggcaaaca aaccaccgct ggtagcggtg gtttttttgt ttgcaagcag cagattacgc 4500
gcagaaaaaa aggatctcaa gaagatcctt tgatcttttc tacggggtct gacgctcagt 4560
ggaacgaaaa ctcacgttaa gggattttgg tcatgagatt atcaaaaagg atcttcacct 4620
agatcctttt aaattaaaaa tgaagtttta aatcaatcta aagtatatat gagtaaactt 4680
ggtctgacag ttaccaatgc ttaatcagtg aggcacctat ctcagcgatc tgtctatttc 4740
gttcatccat agttgcctga ctcc 4764
<210> 5
<211> 11990
<212> DNA
<213> Homo Sapiens
<400> 5
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccgatatcg tcgaccacca tgacgctgcg gcttctggtg gccgcgctct 1260
gcgccgggat cctggcagag gcgccccgag tgcgagccca gcacagggag agagtgacct 1320
gcacgcgcct ttacgccgct gacattgtgt tcttactgga tggctcctca tccattggcc 1380
gcagcaattt ccgcgaggtc cgcagctttc tcgaagggct ggtgctgcct ttctctggag 1440
cagccagtgc acagggtgtg cgctttgcca cagtgcagta cagcgatgac ccacggacag 1500
agttcggcct ggatgcactt ggctctgggg gtgatgtgat ccgcgccatc cgtgagctta 1560
gctacaaggg gggcaacact cgcacagggg ctgcaattct ccatgtggct gaccatgtct 1620
tcctgcccca gctggcccga cctggtgtcc ccaaggtctg catcctgatc acagacggga 1680
agtcccagga cctggtggac acagctgccc aaaggctgaa ggggcagggg gtcaagctat 1740
ttgctgtggg gatcaagaat gctgaccctg aggagctgaa gcgagttgcc tcacagccaa 1800
cctccgactt cttcttcttc gtcaatgact tcagcatctt gaggacacta ctgcccctcg 1860
tttcccggag agtgtgcacg actgctggtg gcgtgcctgt gacccgacct ccggatgact 1920
cgacctctgc tccacgagac ctggtgctgt ctgagccaag cagccaatcc ttgagagtac 1980
agtggacagc ggccagtggc cctgtgactg gctacaaggt ccagtacact cctctgacgg 2040
ggctgggaca gccactgccg agtgagcggc aggaggtgaa cgtcccagct ggtgagacca 2100
gtgtgcggct gcggggtctc cggccactga ccgagtacca agtgactgtg attgccctct 2160
acgccaacag catcggggag gctgtgagcg ggacagctcg gaccactgcc ctagaagggc 2220
cggaactgac catccagaat accacagccc acagcctcct ggtggcctgg cggagtgtgc 2280
caggtgccac tggctaccgt gtgacatggc gggtcctcag tggtgggccc acacagcagc 2340
aggagctggg ccctgggcag ggttcagtgt tgctgcgtga cttggagcct ggcacggact 2400
atgaggtgac cgtgagcacc ctatttggcc gcagtgtggg gcccgccact tccctgatgg 2460
ctcgcactga cgcttctgtt gagcagaccc tgcgcccggt catcctgggc cccacatcca 2520
tcctcctttc ctggaacttg gtgcctgagg cccgtggcta ccggttggaa tggcggcgtg 2580
agactggctt ggagccaccg cagaaggtgg tactgccctc tgatgtgacc cgctaccagt 2640
tggatgggct gcagccgggc actgagtacc gcctcacact ctacactctg ctggagggcc 2700
acgaggtggc cacccctgca accgtggttc ccactggacc agagctgcct gtgagccctg 2760
taacagacct gcaagccacc gagctgcccg ggcagcgggt gcgagtgtcc tggagcccag 2820
tccctggtgc cacccagtac cgcatcattg tgcgcagcac ccagggggtt gagcggaccc 2880
tggtgcttcc tgggagtcag acagcattcg acttggatga cgttcaggct gggcttagct 2940
acactgtgcg ggtgtctgct cgagtgggtc cccgtgaggg cagtgccagt gtcctcactg 3000
tccgccggga gccggaaact ccacttgctg ttccagggct gcgggttgtg gtgtcagatg 3060
caacgcgagt gagggtggcc tggggacccg tccctggagc cagtggattt cggattagct 3120
ggagcacagg cagtggtccg gagtccagcc agacactgcc cccagactct actgccacag 3180
acatcacagg gctgcagcct ggaaccacct accaggtggc tgtgtcggta ctgcgaggca 3240
gagaggaggg ccctgctgca gtcatcgtgg ctcgaacgga cccactgggc ccagtgagga 3300
cggtccatgt gactcaggcc agcagctcat ctgtcaccat tacctggacc agggttcctg 3360
gcgccacagg atacagggtt tcctggcact cagcccacgg cccagagaaa tcccagttgg 3420
tttctgggga ggccacggtg gctgagctgg atggactgga gccagatact gagtatacgg 3480
tgcatgtgag ggcccatgtg gctggcgtgg atgggccccc tgcctctgtg gttgtgagga 3540
ctgcccctga gcctgtgggt cgtgtgtcga ggctgcagat cctcaatgct tccagcgacg 3600
ttctacggat cacctgggta ggggtcactg gagccacagc ttacagactg gcctggggcc 3660
ggagtgaagg cggccccatg aggcaccaga tactcccagg aaacacagac tctgcagaga 3720
tccggggtct cgaaggtgga gtcagctact cagtgcgagt gactgcactt gtcggggacc 3780
gcgagggcac acctgtctcc attgttgtca ctacgccgcc tgaggctccg ccagccctgg 3840
ggacgcttca cgtggtgcag cgcggggagc actcgctgag gctgcgctgg gagccggtgc 3900
ccagagcgca gggcttcctt ctgcactggc aacctgaggg tggccaggaa cagtcccggg 3960
tcctggggcc cgagctcagc agctatcacc tggacgggct ggagccagcg acacagtacc 4020
gcgtgaggct gagtgtccta gggccggctg gagaagggcc ctctgcagag gtgactgcgc 4080
gcactgagtc acctcgtgtt ccaagcattg aactacgtgt ggtggacacc tcgatcgact 4140
cggtgacttt ggcctggact ccagtgtcca gggcatccag ctacatccta tcctggcggc 4200
cactcagagg ccctggccag gaagtgcctg ggtccccgca gacacttcca gggatctcaa 4260
gctcccagcg ggtgacaggg ctagagcctg gcgtctctta catcttctcc ctgacgcctg 4320
tcctggatgg tgtgcggggt cctgaggcat ctgtcacaca gacgccagtg tgcccccgtg 4380
gcctggcgga tgtggtgttc ctaccacatg ccactcaaga caatgctcac cgtgcggagg 4440
ctacgaggag ggtcctggag cgtctggtgt tggcacttgg gcctcttggg ccacaggcag 4500
ttcaggttgg cctgctgtct tacagtcatc ggccctcccc actgttccca ctgaatggct 4560
cccatgacct tggcattatc ttgcaaagga tccgtgacat gccctacatg gacccaagtg 4620
ggaacaacct gggcacagcc gtggtcacag ctcacagata catgttggca ccagatgctc 4680
ctgggcgccg ccagcacgta ccaggggtga tggttctgct agtggatgaa cccttgagag 4740
gtgacatatt cagccccatc cgtgaggccc aggcttctgg gcttaatgtg gtgatgttgg 4800
gaatggctgg agcggaccca gagcagctgc gtcgcttggc gccgggtatg gactctgtcc 4860
agaccttctt cgccgtggat gatgggccaa gcctggacca ggcagtcagt ggtctggcca 4920
cagccctgtg tcaggcatcc ttcactactc agccccggcc agagccctgc ccagtgtatt 4980
gtccaaaggg ccagaagggg gaacctggag agatgggcct gagaggacaa gttgggcctc 5040
ctggcgaccc tggcctcccg ggcaggaccg gtgctcccgg cccccagggg ccccctggaa 5100
gtgccactgc caagggcgag aggggcttcc ctggagcaga tgggcgtcca ggcagccctg 5160
gccgcgccgg gaatcctggg acccctggag cccctggcct aaagggctct ccagggttgc 5220
ctggccctcg tggggacccg ggagagcgag gacctcgagg cccaaagggg gagccggggg 5280
ctcccggaca agtcatcgga ggtgaaggac ctgggcttcc tgggcggaaa ggggaccctg 5340
gaccatcggg cccccctgga cctcgtggac cactggggga cccaggaccc cgtggccccc 5400
cagggcttcc tggaacagcc atgaagggtg acaaaggcga tcgtggggag cggggtcccc 5460
ctggaccagg tgaaggtggc attgctcctg gggagcctgg gctgccgggt cttcccggaa 5520
gccctggacc ccaaggcccc gttggccccc ctggaaagaa aggagaaaaa ggtgactctg 5580
aggatggagc tccaggcctc ccaggacaac ctgggtctcc gggtgagcag ggcccacggg 5640
gacctcctgg agctattggc cccaaaggtg accggggctt tccagggccc ctgggtgagg 5700
ctggagagaa gggcgaacgt ggacccccag gcccagcggg atcccggggg ctgccagggg 5760
ttgctggacg tcctggagcc aagggtcctg aagggccacc aggacccact ggccgccaag 5820
gagagaaggg ggagcctggt cgccctgggg accctgcagt ggtgggacct gctgttgctg 5880
gacccaaagg agaaaaggga gatgtggggc ccgctgggcc cagaggagct accggagtcc 5940
aaggggaacg gggcccaccc ggcttggttc ttcctggaga ccctggcccc aagggagacc 6000
ctggagaccg gggtcccatt ggccttactg gcagagcagg acccccaggt gactcagggc 6060
ctcctggaga gaagggagac cctgggcggc ctggcccccc aggacctgtt ggcccccgag 6120
gacgagatgg tgaagttgga gagaaaggtg acgagggtcc tccgggtgac ccgggtttgc 6180
ctggaaaagc aggcgagcgt ggccttcggg gggcacctgg agttcggggg cctgtgggtg 6240
aaaagggaga ccagggagat cctggagagg atggacgaaa tggcagccct ggatcatctg 6300
gacccaaggg tgaccgtggg gagccgggtc ccccaggacc cccgggacgg ctggtagaca 6360
caggacctgg agccagagag aagggagagc ctggggaccg cggacaagag ggtcctcgag 6420
ggcccaaggg tgatcctggc ctccctggag cccctgggga aaggggcatt gaagggtttc 6480
ggggaccccc aggcccacag ggggacccag gtgtccgagg cccagcagga gaaaagggtg 6540
accggggtcc ccctgggctg gatggccgga gcggactgga tgggaaacca ggagccgctg 6600
ggccctctgg gccgaatggt gctgcaggca aagctgggga cccagggaga gacgggcttc 6660
caggcctccg tggagaacaa ggcctccctg gcccctctgg tccccctgga ttaccgggaa 6720
agccaggcga ggatgggaaa cctggcctga atggaaaaaa cggagaacct ggggaccctg 6780
gagaagacgg gaggaaggga gagaaaggag attcaggcgc ctctgggaga gaaggtcgtg 6840
atggccccaa gggtgagcgt ggagctcctg gtatccttgg accccagggg cctccaggcc 6900
tcccagggcc agtgggccct cctggccagg gttttcctgg tgtcccagga ggcacgggcc 6960
ccaagggtga ccgtggggag actggatcca aaggggagca gggcctccct ggagagcgtg 7020
gcctgcgagg agagcctgga agtgtgccga atgtggatcg gttgctggaa actgctggca 7080
tcaaggcatc tgccctgcgg gagatcgtgg agacctggga tgagagctct ggtagcttcc 7140
tgcctgtgcc cgaacggcgt cgaggcccca agggggactc aggcgaacag ggccccccag 7200
gcaaggaggg ccccatcggc tttcctggag aacgcgggct gaagggcgac cgtggagacc 7260
ctggccctca ggggccacct ggtctggccc ttggggagag gggccccccc gggccttccg 7320
gccttgccgg ggagcctgga aagcctggta ttcccgggct cccaggcagg gctgggggtg 7380
tgggagaggc aggaaggcca ggagagaggg gagaacgggg agagaaagga gaacgtggag 7440
aacagggcag agatggccct cctggactcc ctggaacccc tgggcccccc ggaccccctg 7500
gccccaaggt gtctgtggat gagccaggtc ctggactctc tggagaacag ggaccccctg 7560
gactcaaggg tgctaagggg gagccgggca gcaatggtga ccaaggtccc aaaggagaca 7620
ggggtgtgcc aggcatcaaa ggagaccggg gagagcctgg accgaggggt caggacggca 7680
acccgggtct accaggagag cgtggtatgg ctgggcctga agggaagccg ggtctgcagg 7740
gtccaagagg cccccctggc ccagtgggtg gtcatggaga ccctggacca cctggtgccc 7800
cgggtcttgc tggccctgca ggaccccaag gaccttctgg cctgaagggg gagcctggag 7860
agacaggacc tccaggacgg ggcctgactg gacctactgg agctgtggga cttcctggac 7920
cccccggccc ttcaggcctt gtgggtccac aggggtctcc aggtttgcct ggacaagtgg 7980
gggagacagg gaagccggga gccccaggtc gagatggtgc cagtggaaaa gatggagaca 8040
gagggagccc tggtgtgcca gggtcaccag gtctgcctgg ccctgtcgga cctaaaggag 8100
aacctggccc cacgggggcc cctggacagg ctgtggtcgg gctccctgga gcaaagggag 8160
agaagggagc ccctggaggc cttgctggag acctggtggg tgagccggga gccaaaggtg 8220
accgaggact gccagggccg cgaggcgaga agggtgaagc tggccgtgca ggggagcccg 8280
gagaccctgg ggaagatggt cagaaagggg ctccaggacc caaaggtttc aagggtgacc 8340
caggagtcgg ggtcccgggc tcccctgggc ctcctggccc tccaggtgtg aagggagatc 8400
tgggcctccc tggcctgccc ggtgctcctg gtgttgttgg gttcccgggt cagacaggcc 8460
ctcgaggaga gatgggtcag ccaggcccta gtggagagcg gggtctggca ggccccccag 8520
ggagagaagg aatcccagga cccctggggc cacctggacc accggggtca gtgggaccac 8580
ctggggcctc tggactcaaa ggagacaagg gagaccctgg agtagggctg cctgggcccc 8640
gaggcgagcg tggggagcca ggcatccggg gtgaagatgg ccgccccggc caggagggac 8700
cccgaggact cacggggccc cctggcagca ggggagagcg tggggagaag ggtgatgttg 8760
ggagtgcagg actaaagggt gacaagggag actcagctgt gatcctgggg cctccaggcc 8820
cacggggtgc caagggggac atgggtgaac gagggcctcg gggcttggat ggtgacaaag 8880
gacctcgggg agacaatggg gaccctggtg acaagggcag caagggagag cctggtgaca 8940
agggctcagc cgggttgcca ggactgcgtg gactcctggg accccagggt caacctggtg 9000
cagcagggat ccctggtgac ccgggatccc caggaaagga tggagtgcct ggtatccgag 9060
gagaaaaagg agatgttggc ttcatgggtc cccggggcct caagggtgaa cggggagtga 9120
agggagcctg tggccttgat ggagagaagg gagacaaggg agaagctggt cccccaggcc 9180
gccccgggct ggcaggacac aaaggagaga tgggggagcc tggtgtgccg ggccagtcgg 9240
gggcccctgg caaggagggc ctgatcggtc ccaagggtga ccgaggcttt gacgggcagc 9300
caggccccaa gggtgaccag ggcgagaaag gggagcgggg aaccccagga attgggggct 9360
tcccaggccc cagtggaaat gatggctctg ctggtccccc agggccacct ggcagtgttg 9420
gtcccagagg ccccgaagga cttcagggcc agaagggtga gcgaggtccc cccggagaga 9480
gagtggtggg ggctcctggg gtccctggag ctcctggcga gagaggggag caggggcggc 9540
cagggcctgc cggtcctcga ggcgagaagg gagaagctgc actgacggag gatgacatcc 9600
ggggctttgt gcgccaagag atgagtcagc actgtgcctg ccagggccag ttcatcgcat 9660
ctggatcacg acccctccct agttatgctg cagacactgc cggctcccag ctccatgctg 9720
tgcctgtgct ccgcgtctct catgcagagg aggaagagcg ggtaccccct gaggatgatg 9780
agtactctga atactccgag tattctgtgg aggagtacca ggaccctgaa gctccttggg 9840
atagtgatga cccctgttcc ctgccactgg atgagggctc ctgcactgcc tacaccctgc 9900
gctggtacca tcgggctgtg acaggcagca cagaggcctg tcaccctttt gtctatggtg 9960
gctgtggagg gaatgccaac cgttttggga cccgtgaggc ctgcgagcgc cgctgcccac 10020
cccgggtggt ccagagccag gggacaggta ctgcccagga ctgaattccc tgtgacccct 10080
ccccagtgcc tctcctggcc ctggaagttg ccactccagt gcccaccagc cttgtcctaa 10140
taaaattaag ttgcatcatt ttgtctgact aggtgtcctt ctataatatt atggggtgga 10200
ggggggtggt atggagcaag gggcaagttg ggaagacaac ctgtagggcc tgcggggtct 10260
attgggaacc aagctggagt gcagtggcac aatcttggct cactgcaatc tccgcctcct 10320
gggttcaagc gattctcctg cctcagcctc ccgagttgtt gggattccag gcatgcatga 10380
ccaggctcag ctaatttttg tttttttggt agagacgggg tttcaccata ttggccaggc 10440
tggtctccaa ctcctaatct caggtgatct acccaccttg gcctcccaaa ttgctgggat 10500
tacaggcgtg aaccactgct cccttccctg tccttacgcg tagaattggt aaagagagtc 10560
gtgtaaaata tcgagttcgc acatcttgtt gtctgattat tgatttttgg cgaaaccatt 10620
tgatcatatg acaagatgtg tatctacctt aacttaatga ttttgataaa aatcattaac 10680
tagtccatgg ctgcctcgcg cgtttcggtg atgacggtga aaacctctga cacatgcagc 10740
tcccggagac ggtcacagct tgtctgtaag cggatgccgg gagcagacaa gcccgtcagg 10800
gcgcgtcagc gggtgttggc gggtgtcggg gcgcagccat gacccagtca cgtagcgata 10860
gcggagtgta tactggctta actatgcggc atcagagcag attgtactga gagtgcacca 10920
tatgcggtgt gaaataccgc acagatgcgt aaggagaaaa taccgcatca ggcgctcttc 10980
cgcttcctcg ctcactgact cgctgcgctc ggtcgttcgg ctgcggcgag cggtatcagc 11040
tcactcaaag gcggtaatac ggttatccac agaatcaggg gataacgcag gaaagaacat 11100
gtgagcaaaa ggccagcaaa aggccaggaa ccgtaaaaag gccgcgttgc tggcgttttt 11160
ccataggctc cgcccccctg acgagcatca caaaaatcga cgctcaagtc agaggtggcg 11220
aaacccgaca ggactataaa gataccaggc gtttccccct ggaagctccc tcgtgcgctc 11280
tcctgttccg accctgccgc ttaccggata cctgtccgcc tttctccctt cgggaagcgt 11340
ggcgctttct catagctcac gctgtaggta tctcagttcg gtgtaggtcg ttcgctccaa 11400
gctgggctgt gtgcacgaac cccccgttca gcccgaccgc tgcgccttat ccggtaacta 11460
tcgtcttgag tccaacccgg taagacacga cttatcgcca ctggcagcag ccactggtaa 11520
caggattagc agagcgaggt atgtaggcgg tgctacagag ttcttgaagt ggtggcctaa 11580
ctacggctac actagaagaa cagtatttgg tatctgcgct ctgctgaagc cagttacctt 11640
cggaaaaaga gttggtagct cttgatccgg caaacaaacc accgctggta gcggtggttt 11700
ttttgtttgc aagcagcaga ttacgcgcag aaaaaaagga tctcaagaag atcctttgat 11760
cttttctacg gggtctgacg ctcagtggaa cgaaaactca cgttaaggga ttttggtcat 11820
gagattatca aaaaggatct tcacctagat ccttttaaat taaaaatgaa gttttaaatc 11880
aatctaaagt atatatgagt aaacttggtc tgacagttac caatgcttaa tcagtgaggc 11940
acctatctca gcgatctgtc tatttcgttc atccatagtt gcctgactcc 11990
<210> 6
<211> 5257
<212> DNA
<213> Homo Sapiens
<400> 6
ggatccgata tcgtcgacca ccatggcggg actgacggcg gcggccccgc ggcccggagt 60
cctcctgctc ctgctgtcca tcctccaccc ctctcggcct ggaggggtcc ctggggccat 120
tcctggtgga gttcctggag gagtctttta tccaggggct ggtctcggag cccttggagg 180
aggagcgctg gggcctggag gcaaacctct taagccagtt cccggagggc ttgcgggtgc 240
tggccttggg gcagggctcg gcgccttccc cgcagttacc tttccggggg ctctggtgcc 300
tggtggagtg gctgacgctg ctgcagccta taaagctgct aaggctggcg ctgggcttgg 360
tggtgtccca ggagttggtg gcttaggagt gtctgcaggt gcggtggttc ctcagcctgg 420
agccggagtg aagcctggga aagtgccggg tgtggggctg ccaggtgtat acccaggtgg 480
cgtgctccca ggagctcggt tccccggtgt gggggtgctc cctggagttc ccactggagc 540
aggagttaag cccaaggctc caggtgtagg tggagctttt gctggaatcc caggagttgg 600
accctttggg ggaccgcaac ctggagtccc actggggtat cccatcaagg cccccaagct 660
gcctggtggc tatggactgc cctacaccac agggaaactg ccctatggct atgggcccgg 720
aggagtggct ggtgcagcgg gcaaggctgg ttacccaaca gggacagggg ttggccccca 780
ggcagcagca gcagcggcag ctaaagcagc agcaaagttc ggtgctggag cagccggagt 840
cctccctggt gttggagggg ctggtgttcc tggcgtgcct ggggcaattc ctggaattgg 900
aggcatcgca ggcgttggga ctccagctgc agctgcagct gcagcagcag ccgctaaggc 960
agccaagtat ggagctgctg caggcttagt gcctggtggg ccaggctttg gcccgggagt 1020
agttggtgtc ccaggagctg gcgttccagg tgttggtgtc ccaggagctg ggattccagt 1080
tgtcccaggt gctgggatcc caggtgctgc ggttccaggg gttgtgtcac cagaagcagc 1140
tgctaaggca gctgcaaagg cagccaaata cggggccagg cccggagtcg gagttggagg 1200
cattcctact tacggggttg gagctggggg ctttcccggc tttggtgtcg gagtcggagg 1260
tatccctgga gtcgcaggtg tccctagtgt cggaggtgtt cccggagtcg gaggtgtccc 1320
gggagttggc atttcccccg aagctcaggc agcagctgcc gccaaggctg ccaagtacgg 1380
gttagttcct ggtgtcggcg tggctcctgg agttggcgtg gctcctggtg tcggtgtggc 1440
tcctggagtt ggcttggctc ctggagttgg cgtggctcct ggagttggtg tggctcctgg 1500
cgttggcgtg gctcccggca ttggccctgg tggagttgca gctgcagcaa aatccgctgc 1560
caaggtggct gccaaagccc agctccgagc tgcagctggg cttggtgctg gcatccctgg 1620
acttggagtt ggtgtcggcg tccctggact tggagttggt gctggtgttc ctggacttgg 1680
agttggtgct ggtgttcctg gcttcggggc agtacctgga gccctggttg ccgctaaagc 1740
agccaaatat ggagcagcag tgcctggggt ccttggaggg ctcggggctc tcggtggagt 1800
aggcatccca ggcggtgtgg tgggagccag acccgccgcc gccgctgccg cagccaaagc 1860
tgctgccaaa gccgcccagt ttggcctagt gggagccgct gggctcggag gactcggagt 1920
cggagggctt ggagttccag gtgttggggg ccttggaggt atacctccag ctgcagccgc 1980
taaagcagct aaatacggag tggcagcaag acctggcttc ggattgtctc ccattttccc 2040
aggtggggcc tgcctgggga aagcttgtgg ccggaagaga aaatgagaat tccgtgaggc 2100
tccggtgccc gtcagtgggc agagcgcaca tcgcccacag tccccgagaa gttgggggga 2160
ggggtcggca attgaaccgg tgcctagaga aagtggcgcg gggtaaactg ggaaagtgat 2220
gtcgtgtact ggctccgcct ttttcccgag ggtgggggag aaccgtatat aagtgcagta 2280
gtcgccgtga acgttctttt tcgcaacggg tttgccgcca gaacacaggt aagtgccgtg 2340
tgtggttccc gcgggcctgg cctctttacg ggttatggcc cttgcgtgcc ttgaattact 2400
tccacgcccc tggctgcagt acgtgattct tgatcccgag cttcgggttg gaagtgggtg 2460
ggagagttcg aggccttgcg cttaaggagc cccttcgcct cgtgcttgag ttgaggcctg 2520
gcttgggcgc tggggccgcc gcgtgcgaat ctggtggcac cttcgcgcct gtctcgctgc 2580
tttcgataag tctctagcca tttaaaattt ttgatgacct gctgcgacgc tttttttctg 2640
gcaagatagt cttgtaaatg cgggccaaga tctgcacact ggtatttcgg tttttggggc 2700
cgcgggcggc gacggggccc gtgcgtccca gcgcacatgt tcggcgaggc ggggcctgcg 2760
agcgcggcca ccgagaatcg gacgggggta gtctcaagct ggccggcctg ctctggtgcc 2820
tggcctcgcg ccgccgtgta tcgccccgcc ctgggcggca aggctggccc ggtcggcacc 2880
agttgcgtga gcggaaagat ggccgcttcc cggccctgct gcagggagct caaaatggag 2940
gacgcggcgc tcgggagagc gggcgggtga gtcacccaca caaaggaaaa gggcctttcc 3000
gtcctcagcc gtcgcttcat gtgactccac ggagtaccgg gcgccgtcca ggcacctcga 3060
ttagttctcg agcttttgga gtacgtcgtc tttaggttgg ggggaggggt tttatgcgat 3120
ggagtttccc cacactgagt gggtggagac tgaagttagg ccagcttggc acttgatgta 3180
attctccttg gaatttgccc tttttgagtt tggatcttgg ttcattctca agcctcagac 3240
agtggttcaa agtttttttc ttccatttca ggtgtcgtga aaactacccc taaaagccag 3300
gatccgatat cgtcgacaag cttggtaccg aattccctgt gacccctccc cagtgcctct 3360
cctggccctg gaagttgcca ctccagtgcc caccagcctt gtcctaataa aattaagttg 3420
catcattttg tctgactagg tgtccttcta taatattatg gggtggaggg gggtggtatg 3480
gagcaagggg caagttggga agacaacctg tagggcctgc ggggtctatt gggaaccaag 3540
ctggagtgca gtggcacaat cttggctcac tgcaatctcc gcctcctggg ttcaagcgat 3600
tctcctgcct cagcctcccg agttgttggg attccaggca tgcatgacca ggctcagcta 3660
atttttgttt ttttggtaga gacggggttt caccatattg gccaggctgg tctccaactc 3720
ctaatctcag gtgatctacc caccttggcc tcccaaattg ctgggattac aggcgtgaac 3780
cactgctccc ttccctgtcc ttacgcgtag aattggtaaa gagagtcgtg taaaatatcg 3840
agttcgcaca tcttgttgtc tgattattga tttttggcga aaccatttga tcatatgaca 3900
agatgtgtat ctaccttaac ttaatgattt tgataaaaat cattaactag tccatggctg 3960
cctcgcgcgt ttcggtgatg acggtgaaaa cctctgacac atgcagctcc cggagacggt 4020
cacagcttgt ctgtaagcgg atgccgggag cagacaagcc cgtcagggcg cgtcagcggg 4080
tgttggcggg tgtcggggcg cagccatgac ccagtcacgt agcgatagcg gagtgtatac 4140
tggcttaact atgcggcatc agagcagatt gtactgagag tgcaccatat gcggtgtgaa 4200
ataccgcaca gatgcgtaag gagaaaatac cgcatcaggc gctcttccgc ttcctcgctc 4260
actgactcgc tgcgctcggt cgttcggctg cggcgagcgg tatcagctca ctcaaaggcg 4320
gtaatacggt tatccacaga atcaggggat aacgcaggaa agaacatgtg agcaaaaggc 4380
cagcaaaagg ccaggaaccg taaaaaggcc gcgttgctgg cgtttttcca taggctccgc 4440
ccccctgacg agcatcacaa aaatcgacgc tcaagtcaga ggtggcgaaa cccgacagga 4500
ctataaagat accaggcgtt tccccctgga agctccctcg tgcgctctcc tgttccgacc 4560
ctgccgctta ccggatacct gtccgccttt ctcccttcgg gaagcgtggc gctttctcat 4620
agctcacgct gtaggtatct cagttcggtg taggtcgttc gctccaagct gggctgtgtg 4680
cacgaacccc ccgttcagcc cgaccgctgc gccttatccg gtaactatcg tcttgagtcc 4740
aacccggtaa gacacgactt atcgccactg gcagcagcca ctggtaacag gattagcaga 4800
gcgaggtatg taggcggtgc tacagagttc ttgaagtggt ggcctaacta cggctacact 4860
agaagaacag tatttggtat ctgcgctctg ctgaagccag ttaccttcgg aaaaagagtt 4920
ggtagctctt gatccggcaa acaaaccacc gctggtagcg gtggtttttt tgtttgcaag 4980
cagcagatta cgcgcagaaa aaaaggatct caagaagatc ctttgatctt ttctacgggg 5040
tctgacgctc agtggaacga aaactcacgt taagggattt tggtcatgag attatcaaaa 5100
aggatcttca cctagatcct tttaaattaa aaatgaagtt ttaaatcaat ctaaagtata 5160
tatgagtaaa cttggtctga cagttaccaa tgcttaatca gtgaggcacc tatctcagcg 5220
atctgtctat ttcgttcatc catagttgcc tgactcc 5257
<210> 7
<211> 5326
<212> DNA
<213> Homo Sapiens
<400> 7
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ttgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccacaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatgc ggcccctgct gctactggcc ctgctgggct ggctgctgct 1260
ggccgaagcg aagggcgacg ccaagccgga ggacaacctt ttagtcctca cggtggccac 1320
taaggagacc gagggattcc gtcgcttcaa gcgctcagct cagttcttca actacaagat 1380
ccaggcgctt ggcctagggg aggactggaa tgtggagaag gggacgtcgg caggtggagg 1440
gcagaaggtc cggctgctga agaaagctct ggagaagcac gcagacaagg aggatctggt 1500
cattctcttc gcagacagct atgacgtgct gtttgcatcg gggccccggg agctcctgaa 1560
gaagttccgg caggccagga gccaggtggt cttctctgct gaggagctca tctacccaga 1620
ccgcaggctg gagaccaagt atccggtggt gtccgatggc aagaggttcc tgggctctgg 1680
aggcttcatc ggttatgccc ccaacctcag caaactggtg gccgagtggg agggccagga 1740
cagcgacagc gatcagctgt tttacaccaa gatcttcttg gacccggaga agagggagca 1800
gatcaatatc accctggacc accgctgccg tatcttccag aacctggatg gagccttgga 1860
tgaggtcgtg ctcaagtttg aaatgggcca tgtgagagcg aggaacctgg cctatgacac 1920
cctcccggtc ctgatccatg gcaacgggcc aaccaagctg cagttgaact acctgggcaa 1980
ctacatcccg cgcttctgga ccttcgaaac aggctgcacc gtgtgtgacg aaggcttgcg 2040
cagcctcaag ggcattgggg atgaagctct gcccacggtc ctggtcggcg tgttcatcga 2100
acagcccacg ccgtttgtgt ccctgttctt ccagcggctc ctgcggctcc actaccccca 2160
gaaacacatg cgacttttca tccacaacca cgagcagcac cacaaggctc aggtggaaga 2220
gttcctggca cagcatggca gcgagtacca gtctgtgaag ctggtgggcc ctgaggtgcg 2280
gatggcgaat gcagatgcca ggaacatggg cgcagacctg tgccggcagg accgcagctg 2340
cacctactac ttcagcgtgg atgctgacgt ggccctgacc gagcccaaca gcctgcggct 2400
gctgatccaa cagaacaaga acgtcattgc cccgctgatg acccggcatg ggaggctgtg 2460
gtcgaacttc tggggggctc tcagtgcaga tggctactat gcccgttccg aggactacgt 2520
ggacattgtg caggggcggc gtgttggtgt ctggaatgtg ccctatattt caaacatcta 2580
cttgatcaag ggcagtgccc tgcggggtga gctgcagtcc tcagatctct tccaccacag 2640
caagctggac cccgacatgg ccttctgtgc caacatccgg cagcaggatg tgttcatgtt 2700
cctgaccaac cggcacaccc ttggccatct gctctcccta gacagctacc gcaccaccca 2760
cctgcacaac gacctctggg aggtgttcag caaccccgag gactggaagg agaagtacat 2820
ccaccagaac tacaccaaag ccctggcagg gaagctggtg gagacgccct gcccggatgt 2880
ctattggttc cccatcttca cggaggtggc ctgtgatgag ctggtggagg agatggagca 2940
ctttggccag tggtctctgg gcaacaacaa ggacaaccgc atccagggtg gctacgagaa 3000
cgtgccgact attgacatcc acatgaacca gatcggcttt gagcgggagt ggcacaaatt 3060
cctgctggag tacattgcgc ccatgacgga gaagctctac cccggctact acaccagggc 3120
ccagtttgac ctggcctttg tcgtccgcta caagcctgat gagcagccct cactgatgcc 3180
acaccatgat gcctccacct tcaccatcaa catcgccctg aaccgagtcg gggtggatta 3240
cgagggcggg ggctgtcggt tcctgcgcta caactgttcc atccgagccc caaggaaggg 3300
ctggaccctc atgcaccctg gacgactcac gcattaccat gaggggctcc ccaccaccag 3360
gggcacccgc tacatcgcag tctccttcgt cgatccctga attccctgtg acccctcccc 3420
agtgcctctc ctggccctgg aagttgccac tccagtgccc accagccttg tcctaataaa 3480
attaagttgc atcattttgt ctgactaggt gtccttctat aatattatgg ggtggagggg 3540
ggtggtatgg agcaaggggc aagttgggaa gacaacctgt agggcctgcg gggtctattg 3600
ggaaccaagc tggagtgcag tggcacaatc ttggctcact gcaatctccg cctcctgggt 3660
tcaagcgatt ctcctgcctc agcctcccga gttgttggga ttccaggcat gcatgaccag 3720
gctcagctaa tttttgtttt tttggtagag acggggtttc accatattgg ccaggctggt 3780
ctccaactcc taatctcagg tgatctaccc accttggcct cccaaattgc tgggattaca 3840
ggcgtgaacc actgctccct tccctgtcct tacgcgtaga attggtaaag agagtcgtgt 3900
aaaatatcga gttcgcacat cttgttgtct gattattgat ttttggcgaa accatttgat 3960
catatgacaa gatgtgtatc taccttaact taatgatttt gataaaaatc attaactagt 4020
ccatggctgc ctcgcgcgtt tcggtgatga cggtgaaaac ctctgacaca tgcagctccc 4080
ggagacggtc acagcttgtc tgtaagcgga tgccgggagc agacaagccc gtcagggcgc 4140
gtcagcgggt gttggcgggt gtcggggcgc agccatgacc cagtcacgta gcgatagcgg 4200
agtgtatact ggcttaacta tgcggcatca gagcagattg tactgagagt gcaccatatg 4260
cggtgtgaaa taccgcacag atgcgtaagg agaaaatacc gcatcaggcg ctcttccgct 4320
tcctcgctca ctgactcgct gcgctcggtc gttcggctgc ggcgagcggt atcagctcac 4380
tcaaaggcgg taatacggtt atccacagaa tcaggggata acgcaggaaa gaacatgtga 4440
gcaaaaggcc agcaaaaggc caggaaccgt aaaaaggccg cgttgctggc gtttttccat 4500
aggctccgcc cccctgacga gcatcacaaa aatcgacgct caagtcagag gtggcgaaac 4560
ccgacaggac tataaagata ccaggcgttt ccccctggaa gctccctcgt gcgctctcct 4620
gttccgaccc tgccgcttac cggatacctg tccgcctttc tcccttcggg aagcgtggcg 4680
ctttctcata gctcacgctg taggtatctc agttcggtgt aggtcgttcg ctccaagctg 4740
ggctgtgtgc acgaaccccc cgttcagccc gaccgctgcg ccttatccgg taactatcgt 4800
cttgagtcca acccggtaag acacgactta tcgccactgg cagcagccac tggtaacagg 4860
attagcagag cgaggtatgt aggcggtgct acagagttct tgaagtggtg gcctaactac 4920
ggctacacta gaagaacagt atttggtatc tgcgctctgc tgaagccagt taccttcgga 4980
aaaagagttg gtagctcttg atccggcaaa caaaccaccg ctggtagcgg tggttttttt 5040
gtttgcaagc agcagattac gcgcagaaaa aaaggatctc aagaagatcc tttgatcttt 5100
tctacggggt ctgacgctca gtggaacgaa aactcacgtt aagggatttt ggtcatgaga 5160
ttatcaaaaa ggatcttcac ctagatcctt ttaaattaaa aatgaagttt taaatcaatc 5220
taaagtatat atgagtaaac ttggtctgac agttaccaat gcttaatcag tgaggcacct 5280
atctcagcga tctgtctatt tcgttcatcc atagttgcct gactcc 5326
<210> 8
<211> 5974
<212> DNA
<213> Homo Sapiens
<400> 8
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaaa gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacgcccctg gctgcagtac gtgattcttg atcccgagct tcgggttgga 360
agtgggtggg agagttcgag gccttgcgct taaggagccc cttcgcctcg tgcttgagtt 420
gaggcctggc ctgggcgctg gggccgccgc gtgcgaatct ggtggcacct tcgcgcctgt 480
ctcgctgctt tcgataagtc tctagccatt taaaattttt gatgacctgc tgcgacgctt 540
tttttctggc aagatagtct tgtaaatgcg ggccaagatc tgcacactgg tatttcggtt 600
tttggggccg cgggcggcga cggggcccgt gcgtcccagc gcacatgttc ggcgaggcgg 660
ggcctgcgag cgcggccacc gagaatcgga cgggggtagt ctcaagctgg ccggcctgct 720
ctggtgcctg gcctcgcgcc gccgtgtatc gccccgccct gggcggcaag gctggcccgg 780
tcggcaccag ttgcgtgagc ggaaagatgg ccgcttcccg gccctgctgc agggagctca 840
aaatggagga cgcggcgctc gggagagcgg gcgggtgagt cacccgcaca aaggaaaagg 900
gcctttccgt cctcagccgt cgcttcatgt gactccacgg agtaccgggc gccgtccagg 960
cacctcgatt agttctcgag cttttggagt acgtcgtctt taggttgggg ggaggggttt 1020
tatgcgatgg agtttcccca cactgagtgg gtggagactg aagttaggcc agcttggcac 1080
ttgatgtaat tctccttgga atttgccctt tttgagtttg gatcttggtt cattctcaag 1140
cctcagacag tggttcaaag tttttttctt ccatttcagg tgtcgtgaaa actaccccta 1200
aaagccagga tccaccatga cccaaaggag cattgcaggt cctatttgca acctgaagtt 1260
tgtgactctc ctggttgcct taagttcaga actcccattc ctgggagctg gagtacagct 1320
tcaagacaat gggtataatg gattgctcat tgcaattaat cctcaggtac ctgagaatca 1380
gaacctcatc tcaaacatta aggaaatgat aactgaagct tcattttacc tatttaatgc 1440
taccaagaga agagtatttt tcagaaatat aaagatttta atacctgcca catggaaagc 1500
taataataac agcaaaataa aacaagaatc atatgaaaag gcaaatgtca tagtgactga 1560
ctggtatggg gcacatggag atgatccata caccctacaa tacagagggt gtggaaaaga 1620
gggaaaatac attcatttca cacctaattt cctactgaat gataacttaa cagctggcta 1680
cggatcacga ggccgagtgt ttgtccatga atgggcccac ctccgttggg gtgtgttcga 1740
tgagtataac aatgacaaac ctttctacat aaatgggcaa aatcaaatta aagtgacaag 1800
gtgttcatct gacatcacag gcatttttgt gtgtgaaaaa ggtccttgcc cccaagaaaa 1860
ctgtattatt agtaagcttt ttaaagaagg atgcaccttt atctacaata gcacccaaaa 1920
tgcaactgca tcaataatgt tcatgcaaag tttatcttct gtggttgaat tttgtaatgc 1980
aagtacccac aaccaagaag caccaaacct acagaaccag atgtgcagcc tcagaagtgc 2040
atgggatgta atcacagact ctgctgactt tcaccacagc tttcccatga atgggactga 2100
gcttccacct cctcccacat tctcgcttgt acaggctggt gacaaagtgg tctgtttagt 2160
gctggatgtg tccagcaaga tggcagaggc tgacagactc cttcaactac aacaagccgc 2220
agaattttat ttgatgcaga ttgttgaaat tcataccttc gtgggcattg ccagtttcga 2280
cagcaaagga gagatcagag cccagctaca ccaaattaac agcaatgatg atcgaaagtt 2340
gctggtttca tatctgccca ccactgtatc agctaaaaca gacatcagca tttgttcagg 2400
gcttaagaaa ggatttgagg tggttgaaaa actgaatgga aaagcttatg gctctgtgat 2460
gatattagtg accagcggag atgataagct tcttggcaat tgcttaccca ctgtgctcag 2520
cagtggttca acaattcact ccattgccct gggttcatct gcagccccaa atctggagga 2580
attatcacgt cttacaggag gtttaaagtt ctttgttcca gatatatcaa actccaatag 2640
catgattgat gctttcagta gaatttcctc tggaactgga gacattttcc agcaacatat 2700
tcagcttgaa agtacaggtg aaaatgtcaa acctcaccat caattgaaaa acacagtgac 2760
tgtggataat actgtgggca acgacactat gtttctagtt acgtggcagg ccagtggtcc 2820
tcctgagatt atattatttg atcctgatgg acgaaaatac tacacaaata attttatcac 2880
caatctaact tttcggacag ctagtctttg gattccagga acagctaagc ctgggcactg 2940
gacttacacc ctgaacaata cccatcattc tctgcaagcc ctgaaagtga cagtgacctc 3000
tcgcgcctcc aactcagctg tgcccccagc cactgtggaa gcctttgtgg aaagagacag 3060
cctccatttt cctcatcctg tgatgattta tgccaatgtg aaacagggat tttatcccat 3120
tcttaatgcc actgtcactg ccacagttga gccagagact ggagatcctg ttacgctgag 3180
actccttgat gatggagcag gtgctgatgt tataaaaaat gatggaattt actcgaggta 3240
ttttttctcc tttgctgcaa atggtagata tagcttgaaa gtgcatgtca atcactctcc 3300
cagcataagc accccagccc actctattcc agggagtcat gctatgtatg taccaggtta 3360
cacagcaaac ggtaatattc agatgaatgc tccaaggaaa tcagtaggca gaaatgagga 3420
ggagcgaaag tggggcttta gccgagtcag ctcaggaggc tccttttcag tgctgggagt 3480
tccagctggc ccccaccctg atgtgtttcc accatgcaaa attattgacc tggaagctgt 3540
aaaagtagaa gaggaattga ccctatcttg gacagcacct ggagaagact ttgatcaggg 3600
ccaggctaca agctatgaaa taagaatgag taaaagtcta cagaatatcc aagatgactt 3660
taacaatgct attttagtaa atacatcaaa gcgaaatcct cagcaagctg gcatcaggga 3720
gatatttacg ttctcacccc aaatttccac gaatggacct gaacatcagc caaatggaga 3780
aacacatgaa agccacagaa tttatgttgc aatacgagca atggatagga actccttaca 3840
gtctgctgta tctaacattg cccaggcgcc tctgtttatt ccccccaatt ctgatcctgt 3900
acctgccaga gattatctta tattgaaagg agttttaaca gcaatgggtt tgataggaat 3960
catttgcctt attatagttg tgacacatca tactttaagc aggaaaaaga gagcagacaa 4020
gaaagagaat ggaacaaaat tattatgaat tccctgtgac ccctccccag tgcctctcct 4080
ggccctggaa gttgccactc cagtgcccac cagccttgtc ctaataaaat taagttgcat 4140
cattttgtct gactaggtgt ccttctataa tattatgggg tggagggggg tggtatggag 4200
caaggggcaa gttgggaaga caacctgtag ggcctgcggg gtctattggg aaccaagctg 4260
gagtgcagtg gcacaatctt ggctcactgc aatctccgcc tcctgggttc aagcgattct 4320
cctgcctcag cctcccgagt tgttgggatt ccaggcatgc atgaccaggc tcagctaatt 4380
tttgtttttt tggtagagac ggggtttcac catattggcc aggctggtct ccaactccta 4440
atctcaggtg atctacccac cttggcctcc caaattgctg ggattacagg cgtgaaccac 4500
tgctcccttc cctgtcctta cgcgtagaat tggtaaagag agtcgtgtaa aatatcgagt 4560
tcgcacatct tgttgtctga ttattgattt ttggcgaaac catttgatca tatgacaaga 4620
tgtgtatcta ccttaactta atgattttga taaaaatcat taactagtcc atggctgcct 4680
cgcgcgtttc ggtgatgacg gtgaaaacct ctgacacatg cagctcccgg agacggtcac 4740
agcttgtctg taagcggatg ccgggagcag acaagcccgt cagggcgcgt cagcgggtgt 4800
tggcgggtgt cggggcgcag ccatgaccca gtcacgtagc gatagcggag tgtatactgg 4860
cttaactatg cggcatcaga gcagattgta ctgagagtgc accatatgcg gtgtgaaata 4920
ccgcacagat gcgtaaggag aaaataccgc atcaggcgct cttccgcttc ctcgctcact 4980
gactcgctgc gctcggtcgt tcggctgcgg cgagcggtat cagctcactc aaaggcggta 5040
atacggttat ccacagaatc aggggataac gcaggaaaga acatgtgagc aaaaggccag 5100
caaaaggcca ggaaccgtaa aaaggccgcg ttgctggcgt ttttccatag gctccgcccc 5160
cctgacgagc atcacaaaaa tcgacgctca agtcagaggt ggcgaaaccc gacaggacta 5220
taaagatacc aggcgtttcc ccctggaagc tccctcgtgc gctctcctgt tccgaccctg 5280
ccgcttaccg gatacctgtc cgcctttctc ccttcgggaa gcgtggcgct ttctcatagc 5340
tcacgctgta ggtatctcag ttcggtgtag gtcgttcgct ccaagctggg ctgtgtgcac 5400
gaaccccccg ttcagcccga ccgctgcgcc ttatccggta actatcgtct tgagtccaac 5460
ccggtaagac acgacttatc gccactggca gcagccactg gtaacaggat tagcagagcg 5520
aggtatgtag gcggtgctac agagttcttg aagtggtggc ctaactacgg ctacactaga 5580
agaacagtat ttggtatctg cgctctgctg aagccagtta ccttcggaaa aagagttggt 5640
agctcttgat ccggcaaaca aaccaccgct ggtagcggtg gtttttttgt ttgcaagcag 5700
cagattacgc gcagaaaaaa aggatctcaa gaagatcctt tgatcttttc tacggggtct 5760
gacgctcagt ggaacgaaaa ctcacgttaa gggattttgg tcatgagatt atcaaaaagg 5820
atcttcacct agatcctttt aaattaaaaa tgaagtttta aatcaatcta aagtatatat 5880
gagtaaactt ggtctgacag ttaccaatgc ttaatcagtg aggcacctat ctcagcgatc 5940
tgtctatttc gttcatccat agttgcctga ctcc 5974
<---
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ОЛИГОНУКЛЕОТИДОВ
(1) Col1A1_F CCAGCTAGCGTCTAGGGTCTAGACATGTTC
(2) Col1A1_R TATAAGCTTCTACAGGAAGCAGACAGGGCCAAC
(3) Col1A1_SF TGACCTCAAGATGTGCCACT
(4) Col1A1_SR CAGACATGCCTCTTGTCCTTG
(5) Col1A2_F CCAGCTAGCGTCTAAGTGCTAGACATGCTC
(6) Col1A2_R CGAAGCTTTTATTTGAAACAGACTGGGCCA
(7) Col1A2_SF TGAACTTGTTGCTGAGGGCA
(8) Col1A2_SR CCAGTTCTTGGCTGGGATGT
(9) P4HA1_F AGGATCCACCATGATCTGGTATATATTAATTATAGG
(10) P4HA1_R TTCGGTACCTATTCCAATTCTGACAACGTACAAG
(11) P4HA1_SF AAAAGTGCCTGGCTCTCTGG
(12) P4HA1_SR TGGCTCATCTTTCCGTGCAA
(13) P4HA2_F AGGATCCACCATGAAACTCTGGGTGTCTGCA
(14) P4HA2_R CTTGTCGACTTAGTCAACTTCTGTTGATCCACA
(15) P4HA2_SF AGGTACCACCATGGCAACAG
(16) P4HA2_SR GTCTTGGGATCACGAACGGT
(17) COL7A1_F ATCGTCGACCACCATGACGCTGCGGCTTCTGGT
(18) COL7A1_R ATAGAATTCAGTCCTGGGCAGTACCTGTC
(19) COL7A1_SF CAAAGGAGAGATGGGGGAGC
(20) COL7A1_SR ATCATTTCCACTGGGGCCTG
(21) ELN_F TTTGTCGACCACCATGGCGGGTCTGACGGCGG
(22) ELN_R TTTTTGAATTCTCATTTTCTCTTCCGGCCACAAGCTT
(23) ELN_SF CCAGTTTGGCCTAGTGGGAG
(24) ELN_SR ATGGGAGACAATCCGAAGCC
(25) PLOD1_F GGATCCACCATGCGGCCCCTGCTGCTACT
(26) PLOD1_R ATAGAATTCAGGGATCGACGAAGGAGACT
(27) PLOD1_SF GCCTCCACCTTCACCATCAA
(28) PLOD1_SR AAGGAGACTGCGATGTAGCG
(29) CLCA2_F AGGATCCACCATGACCCAAAGGAGCATTGC
(30) CLCA2_R ATAGAATTCATAATAATTTTGTTCCATTCTCTTTC
(31) CLCA2_SF GGAGGCTCCTTTTCAGTGCT
(32) CLCA2_SR GTAGCCTGGCCCTGATCAAA
<---
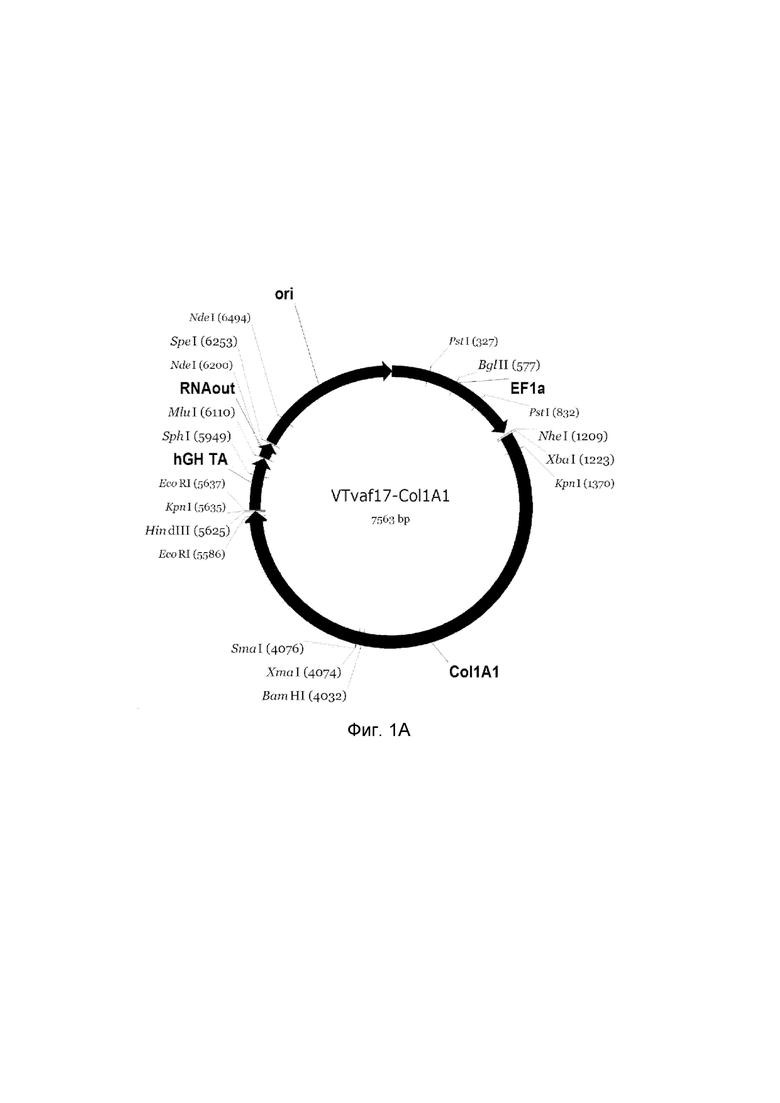
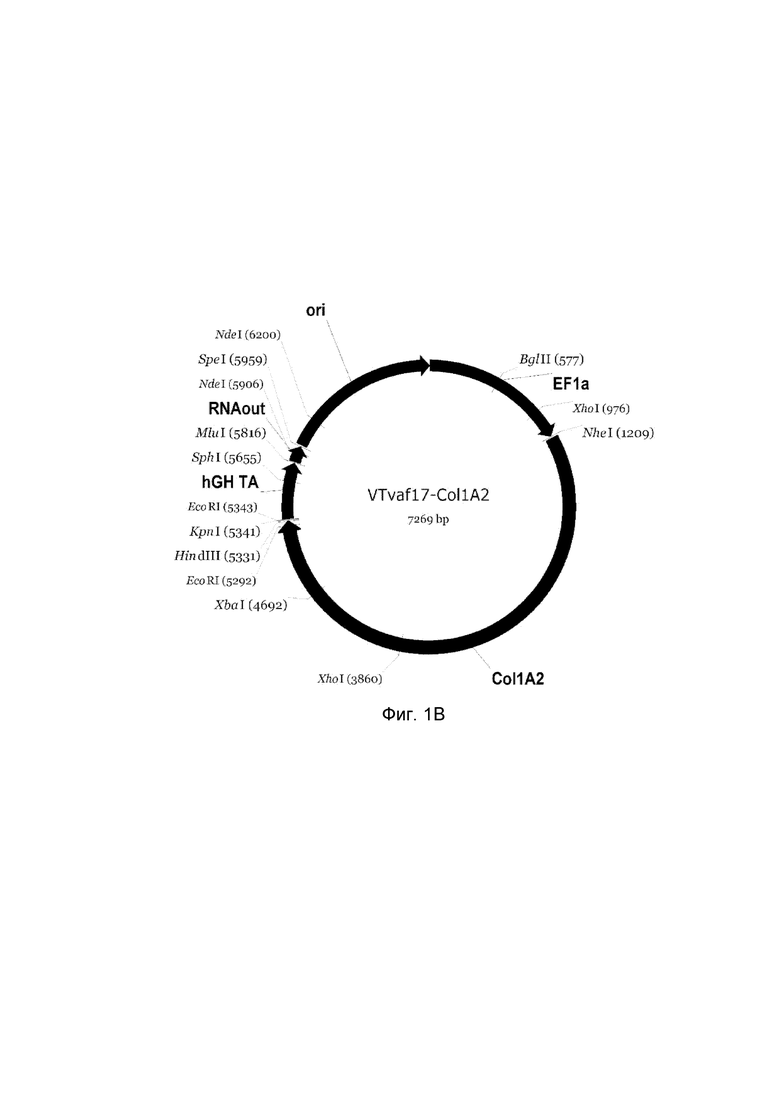
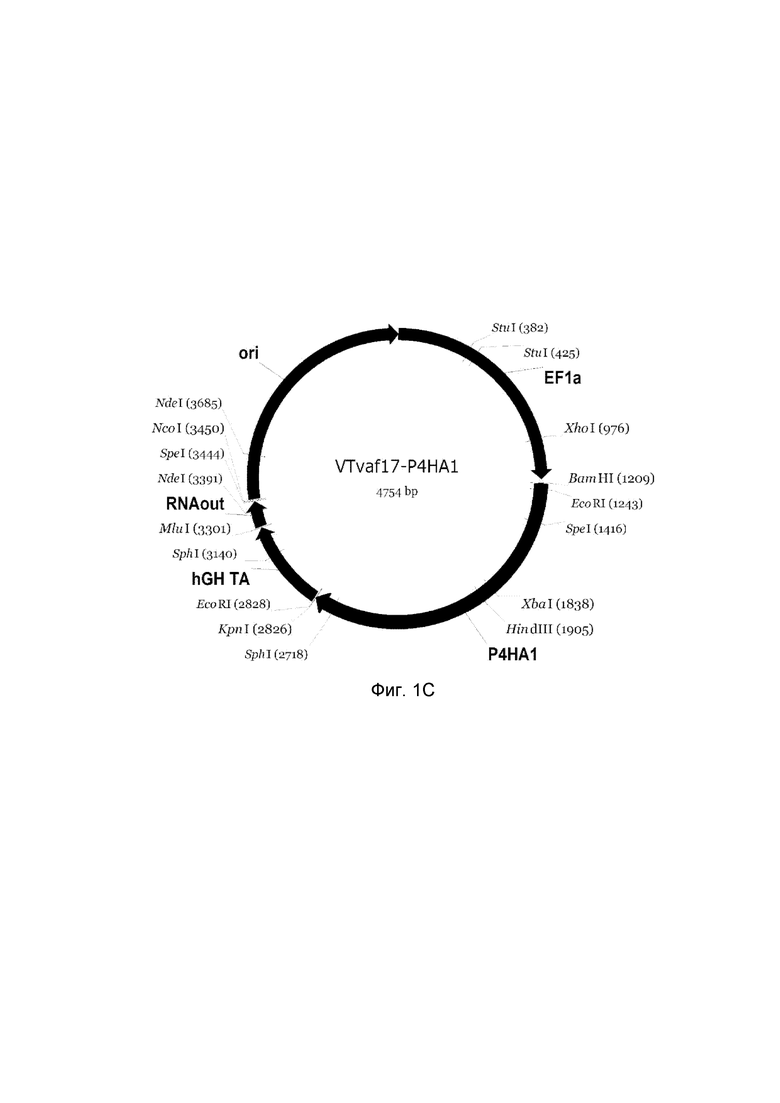
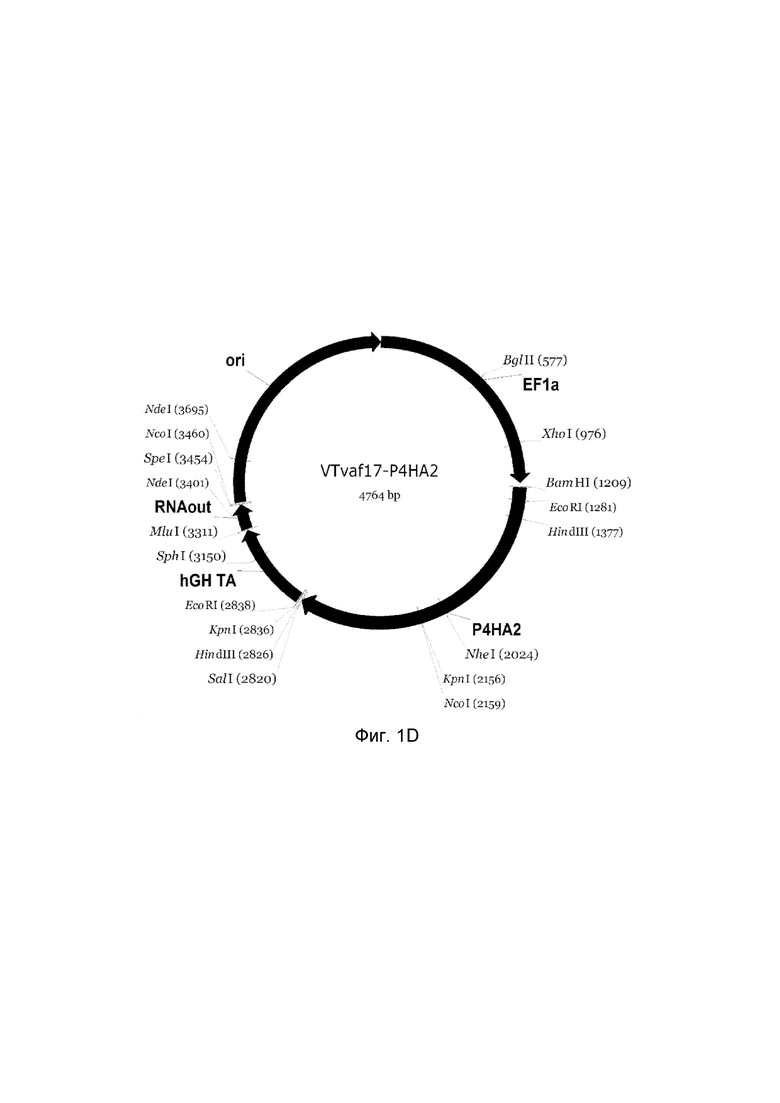

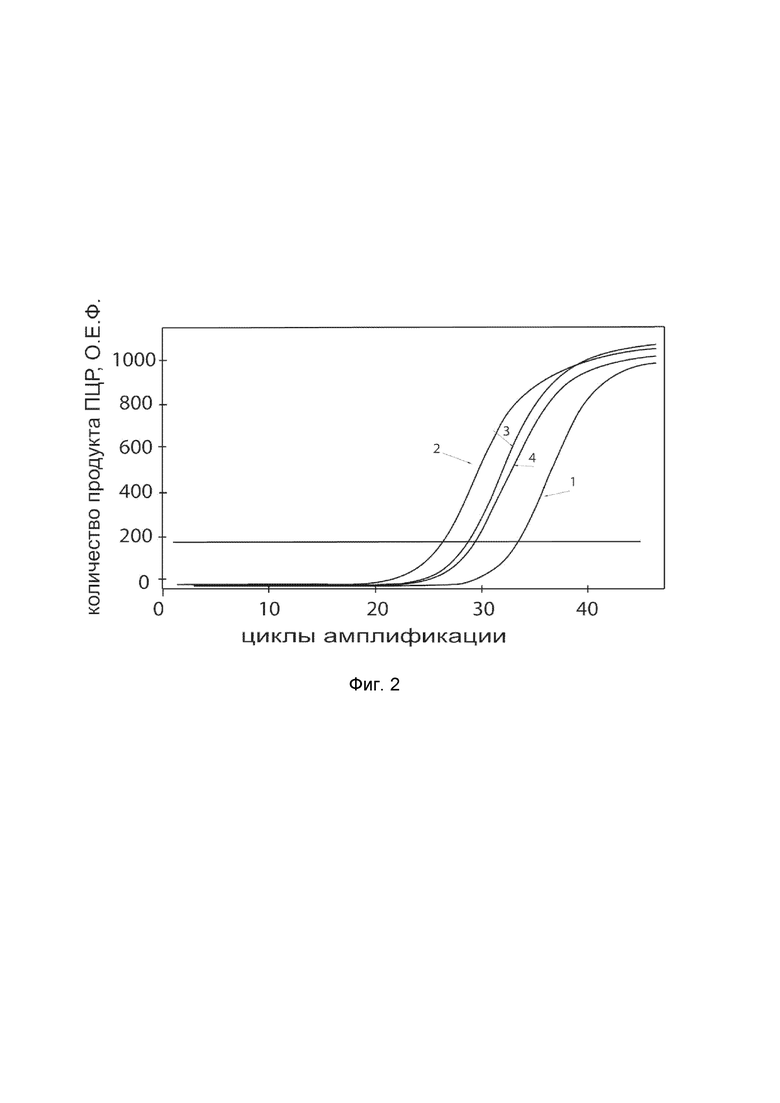
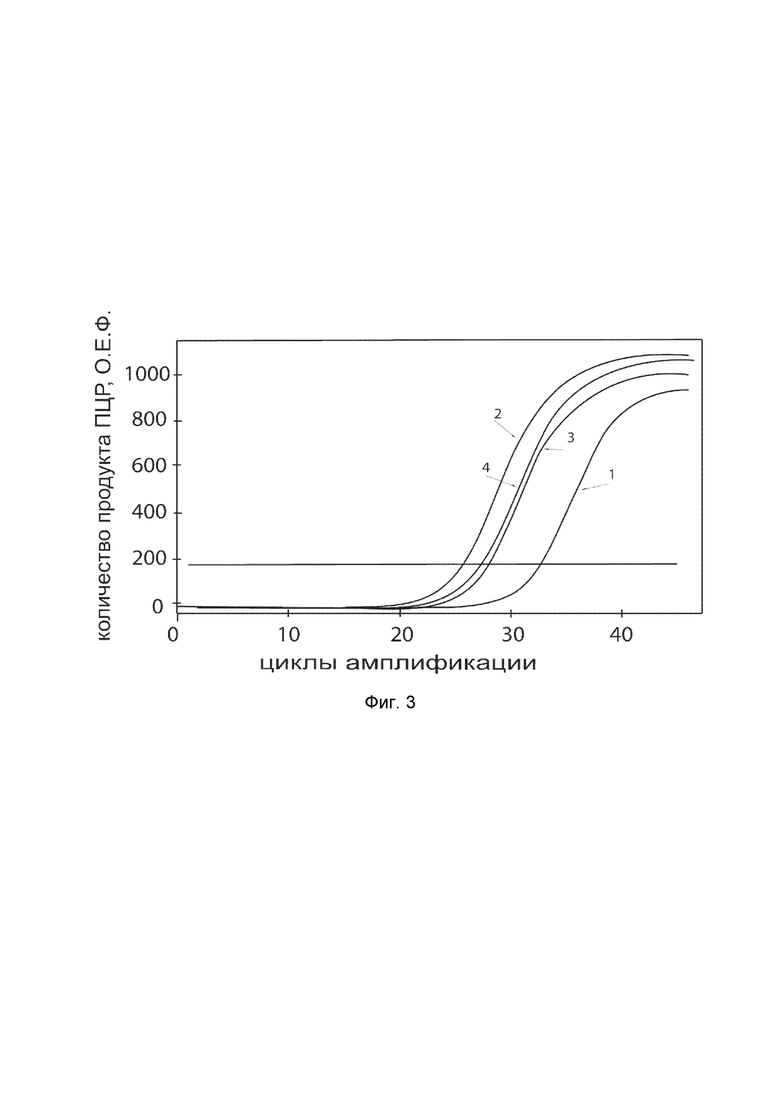
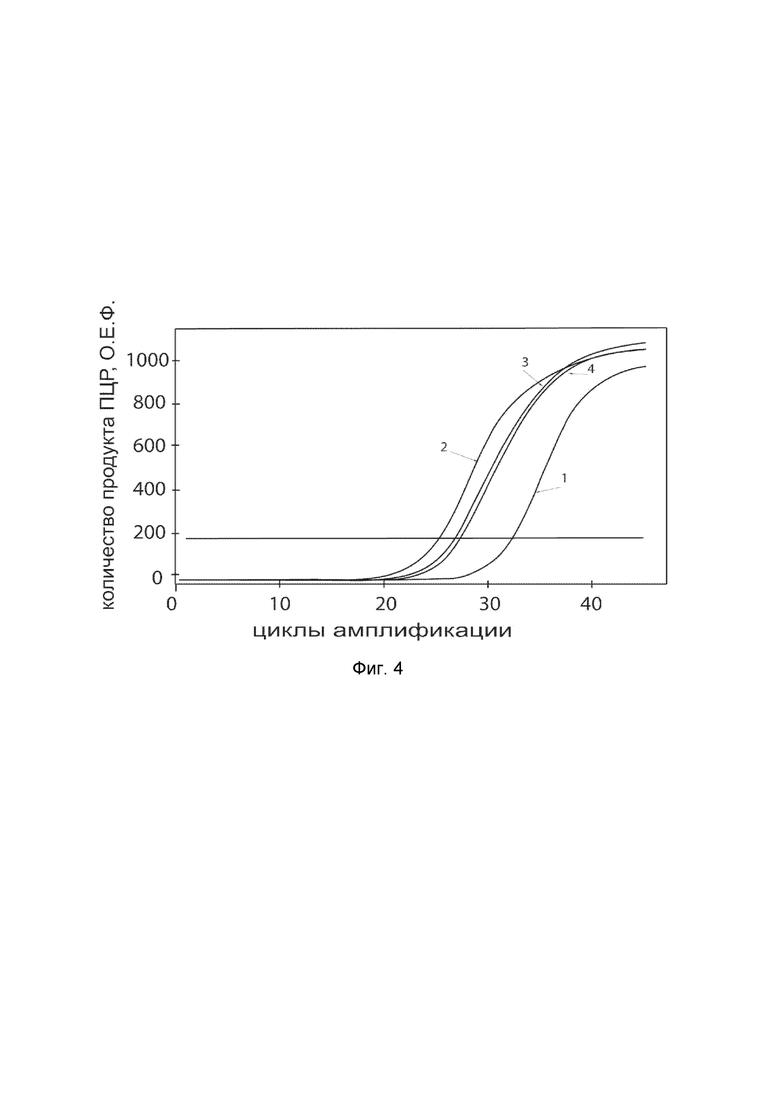
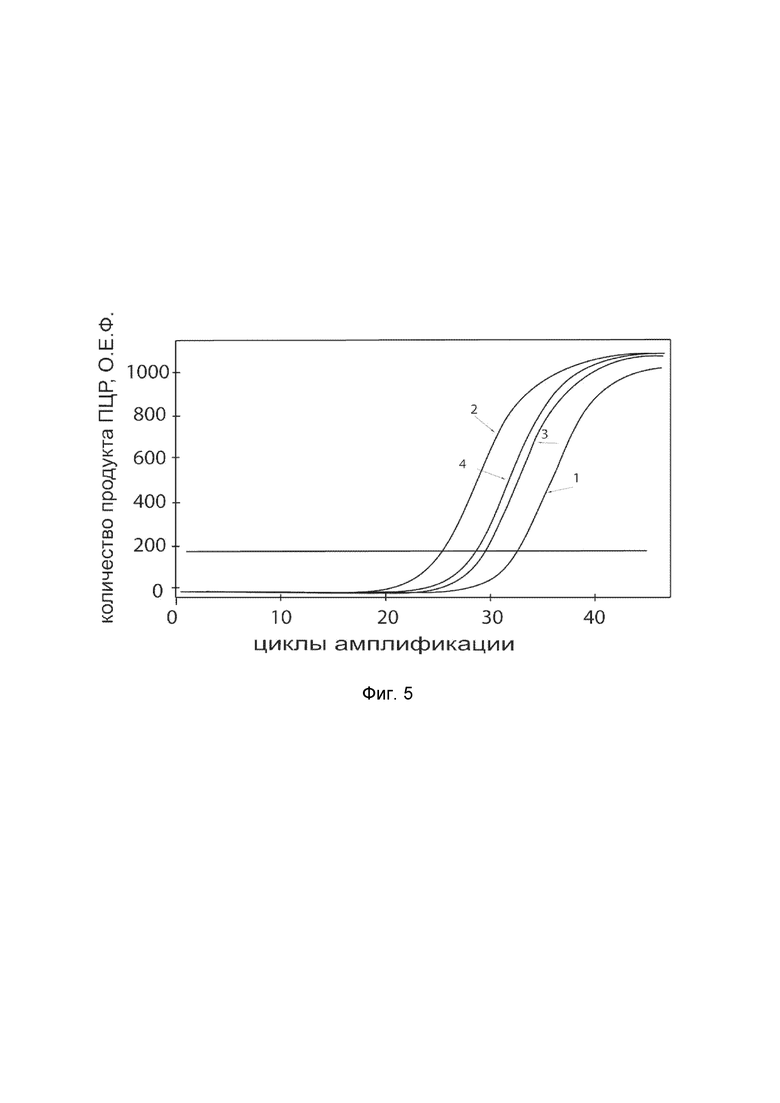

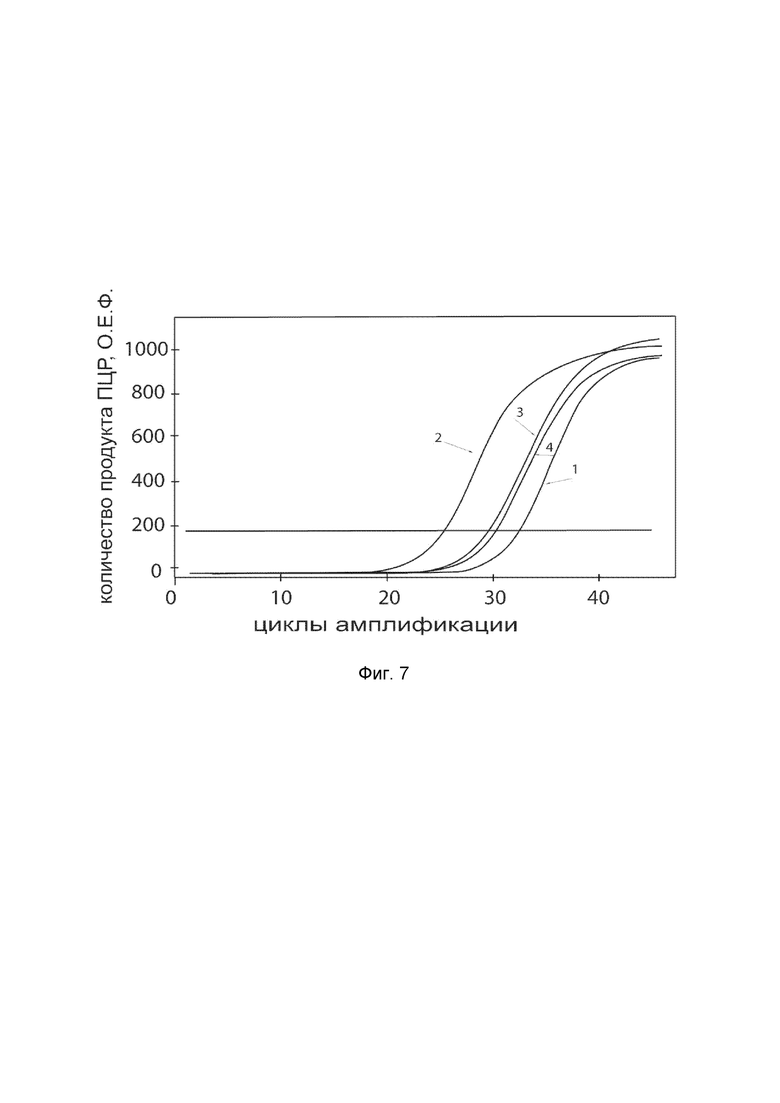
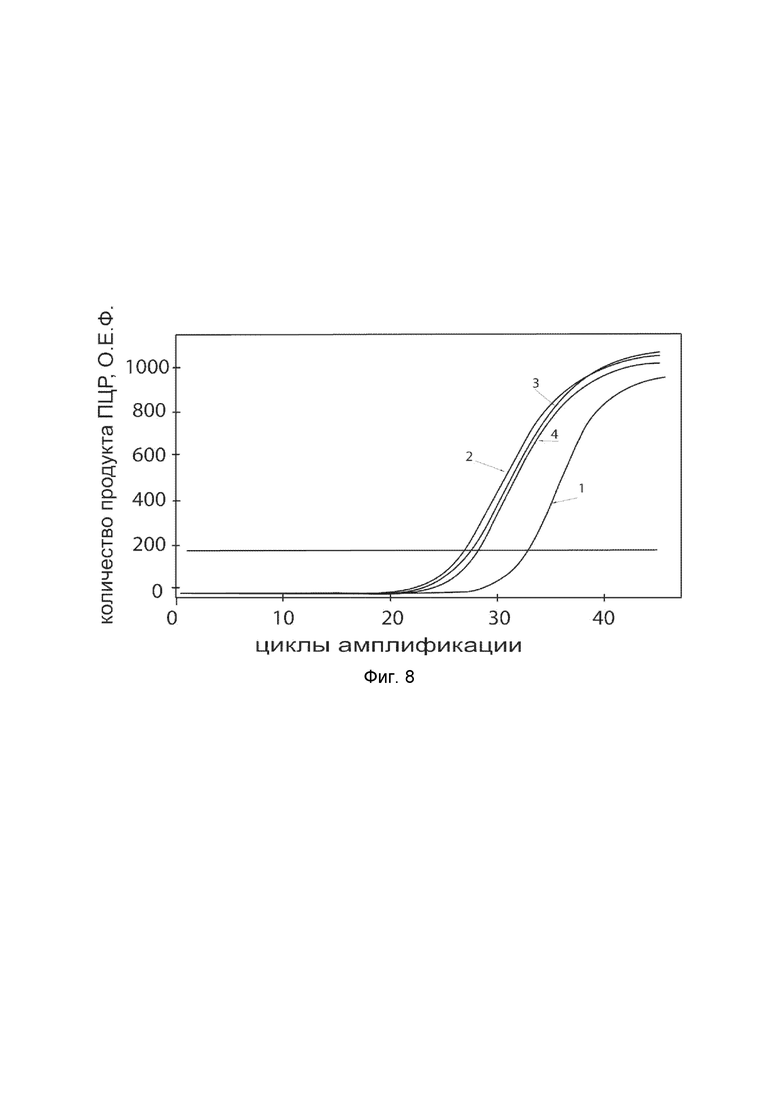
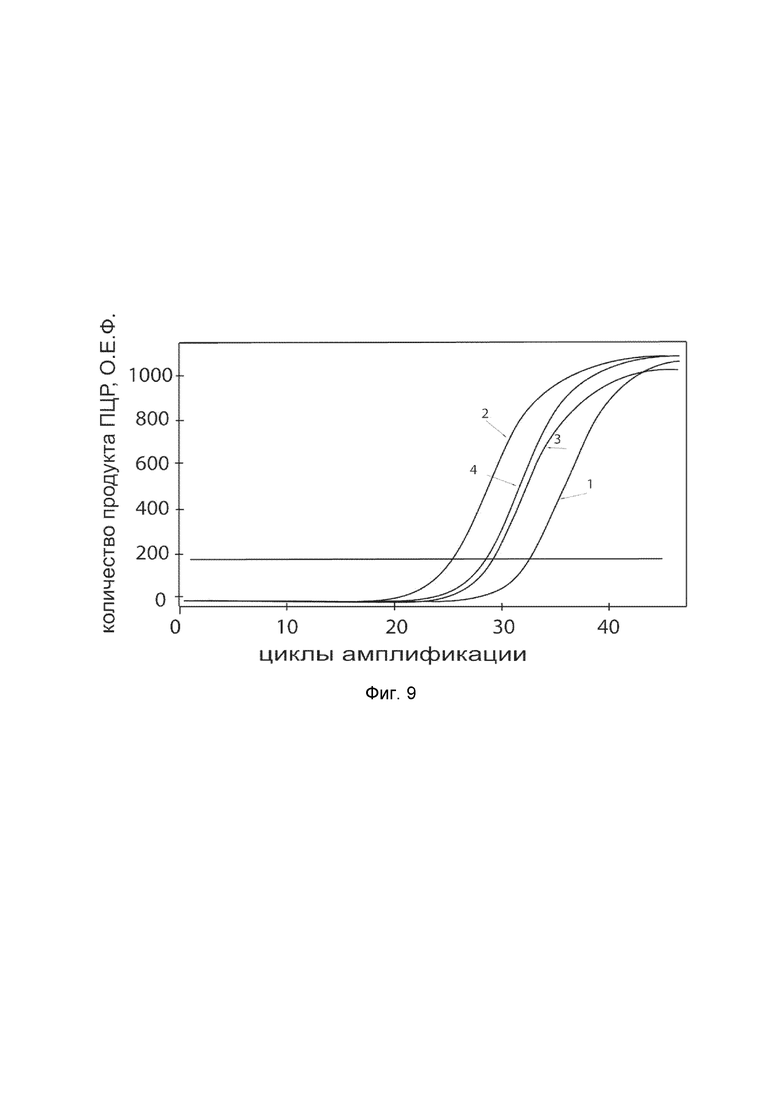
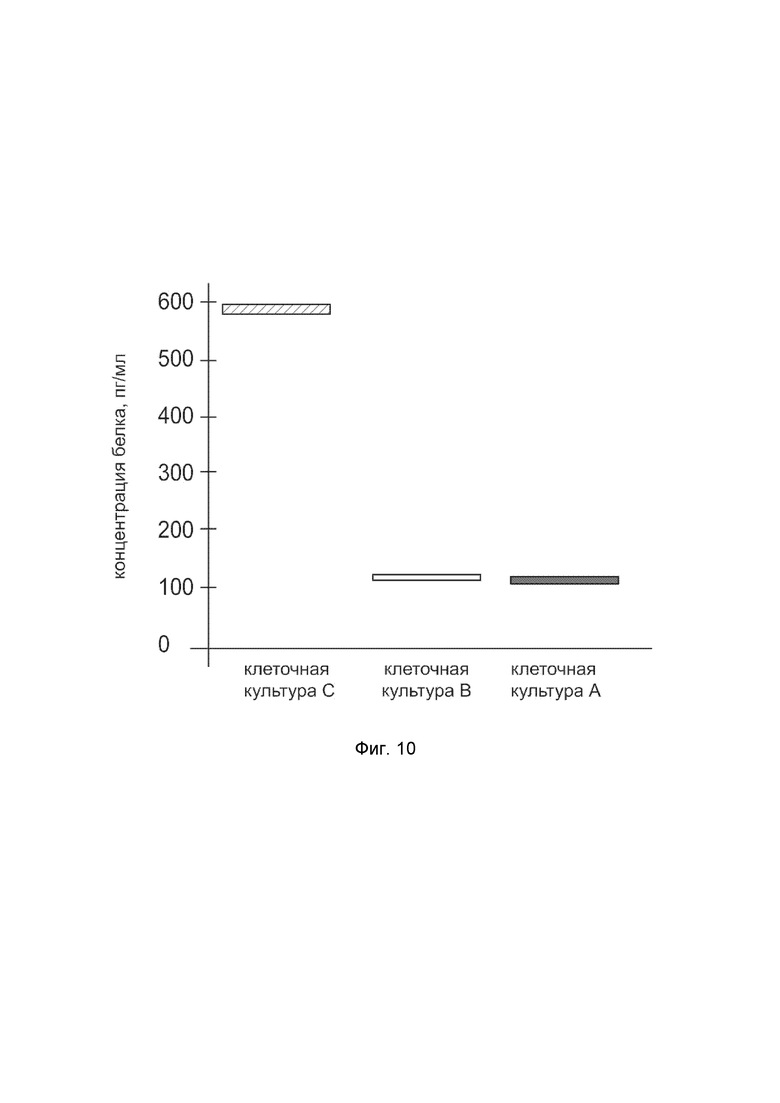

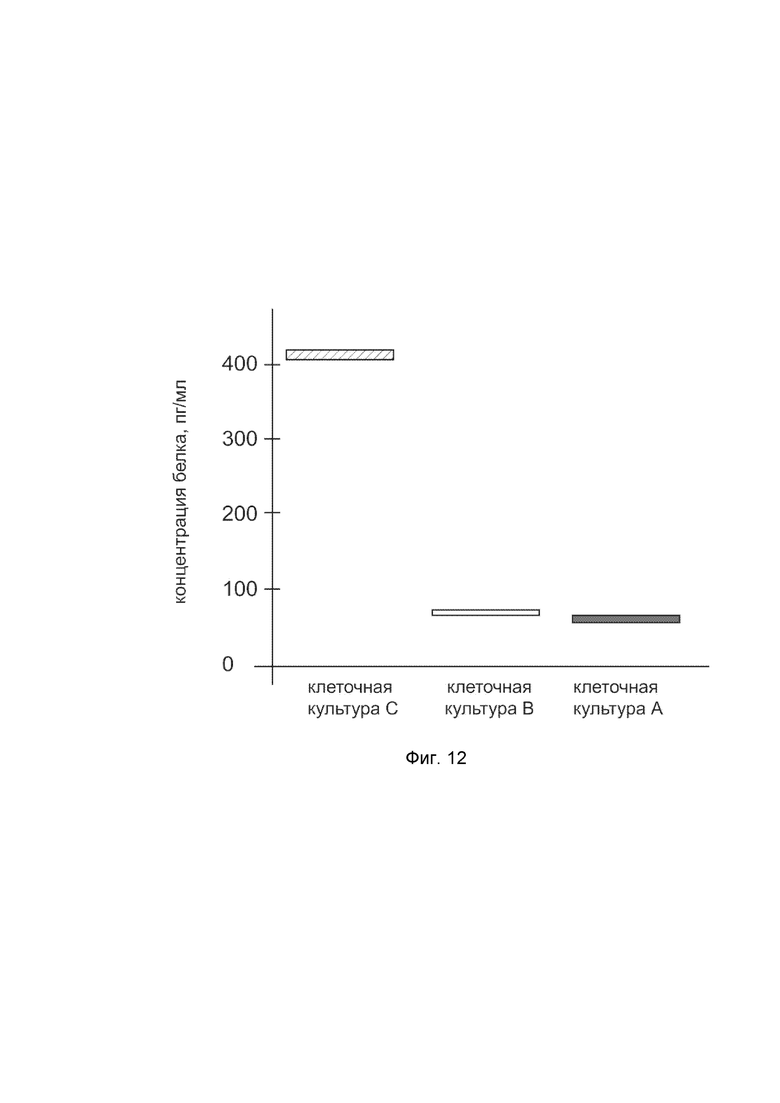
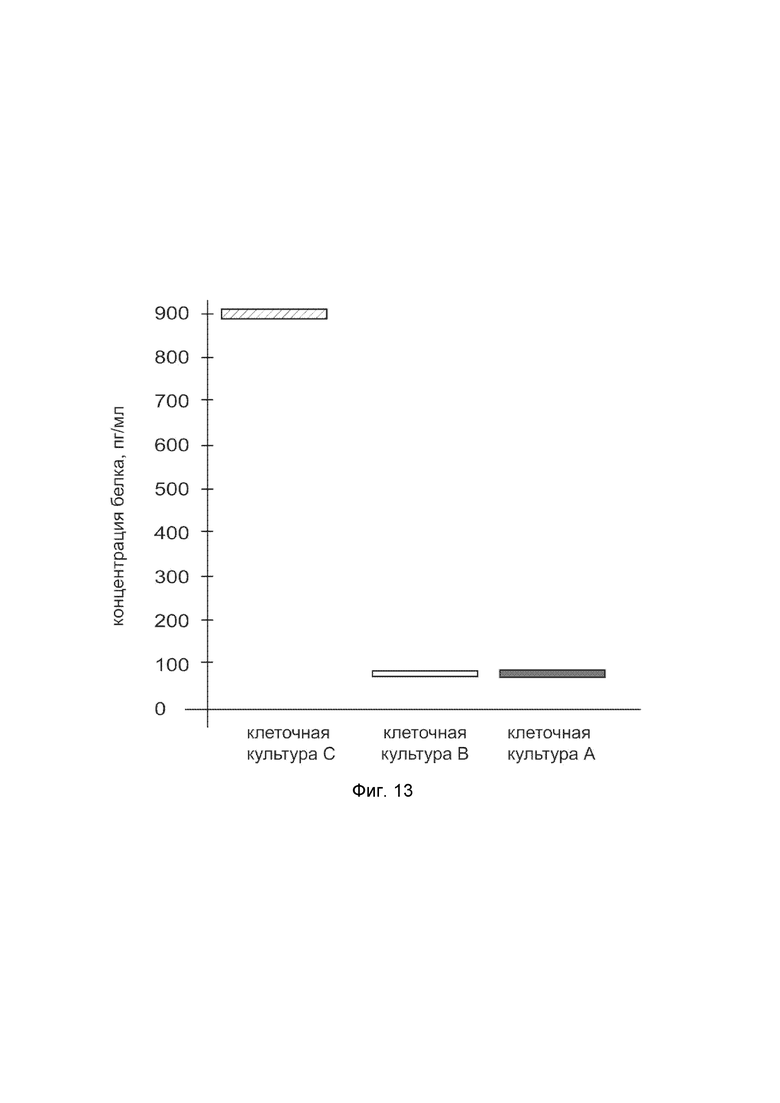
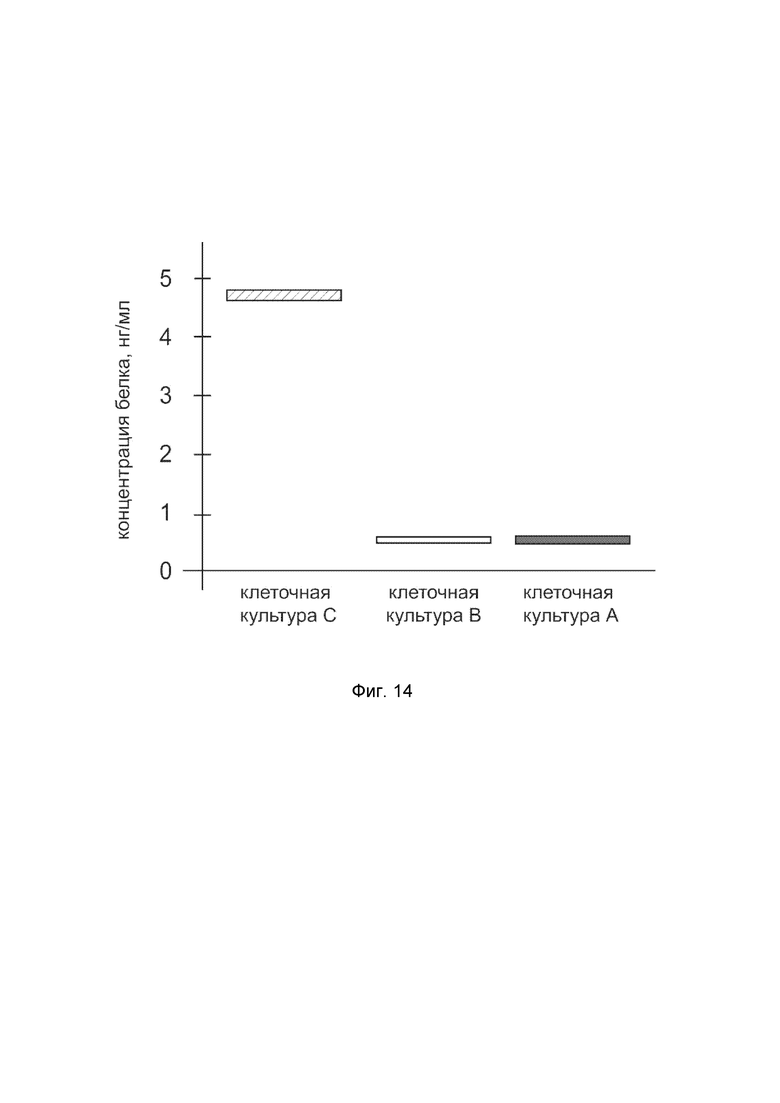
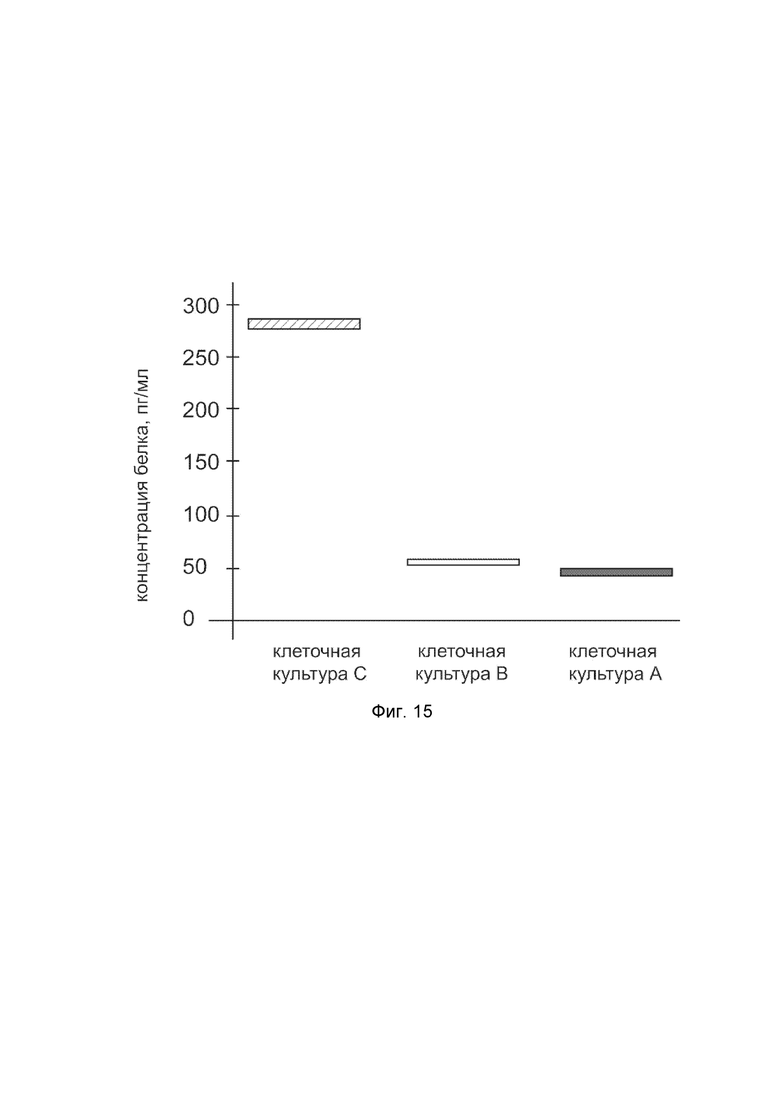
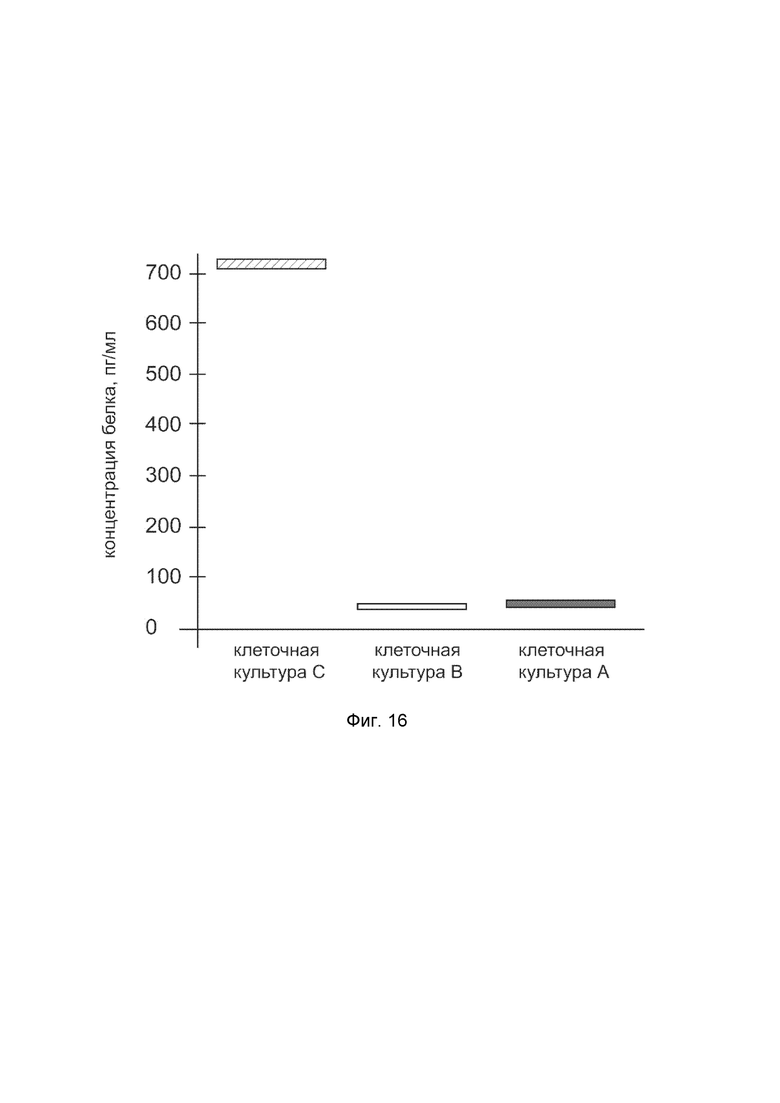
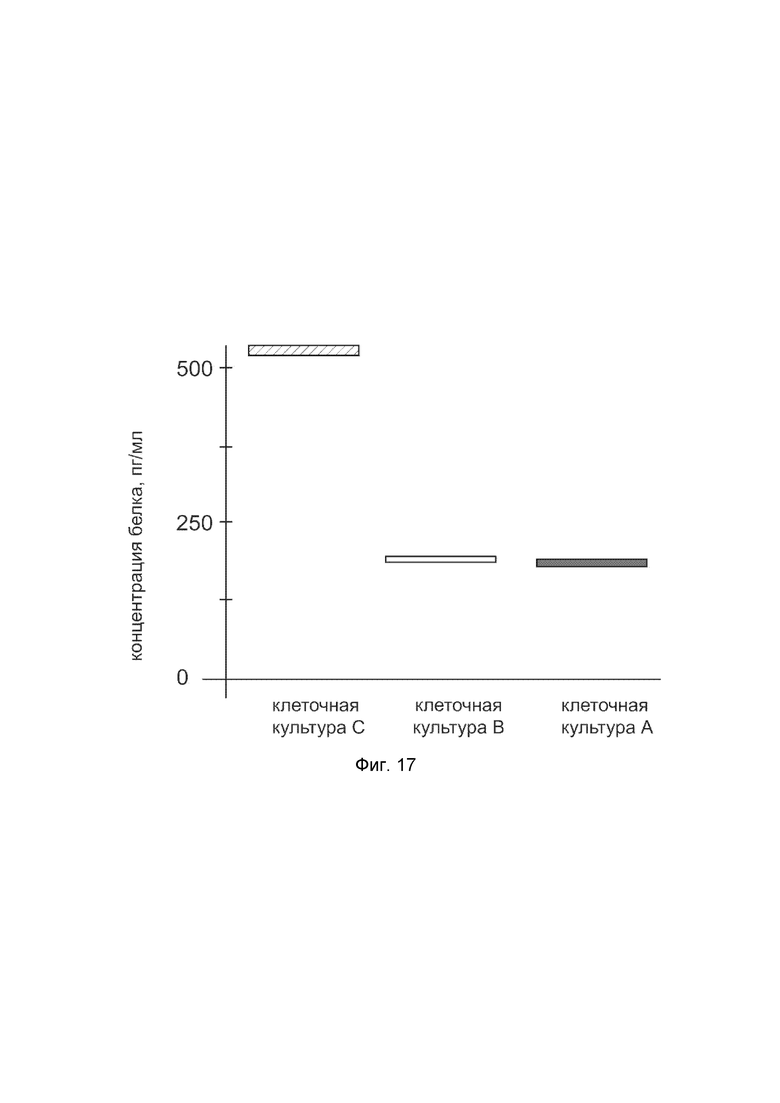
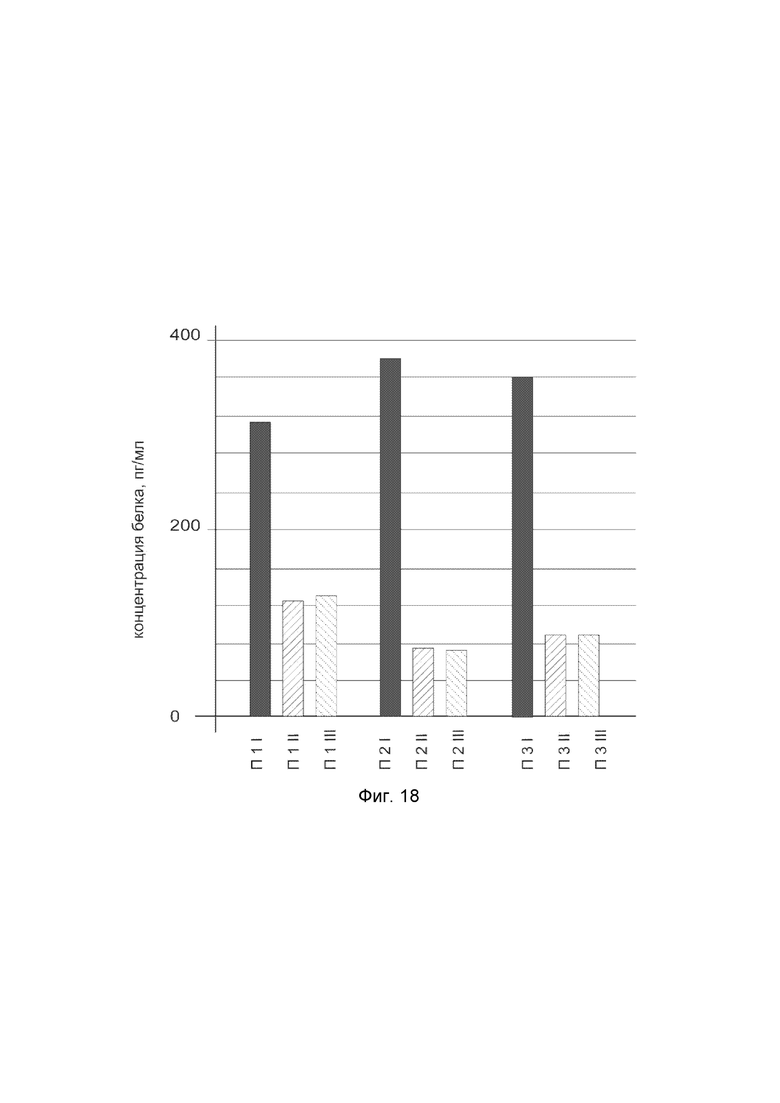
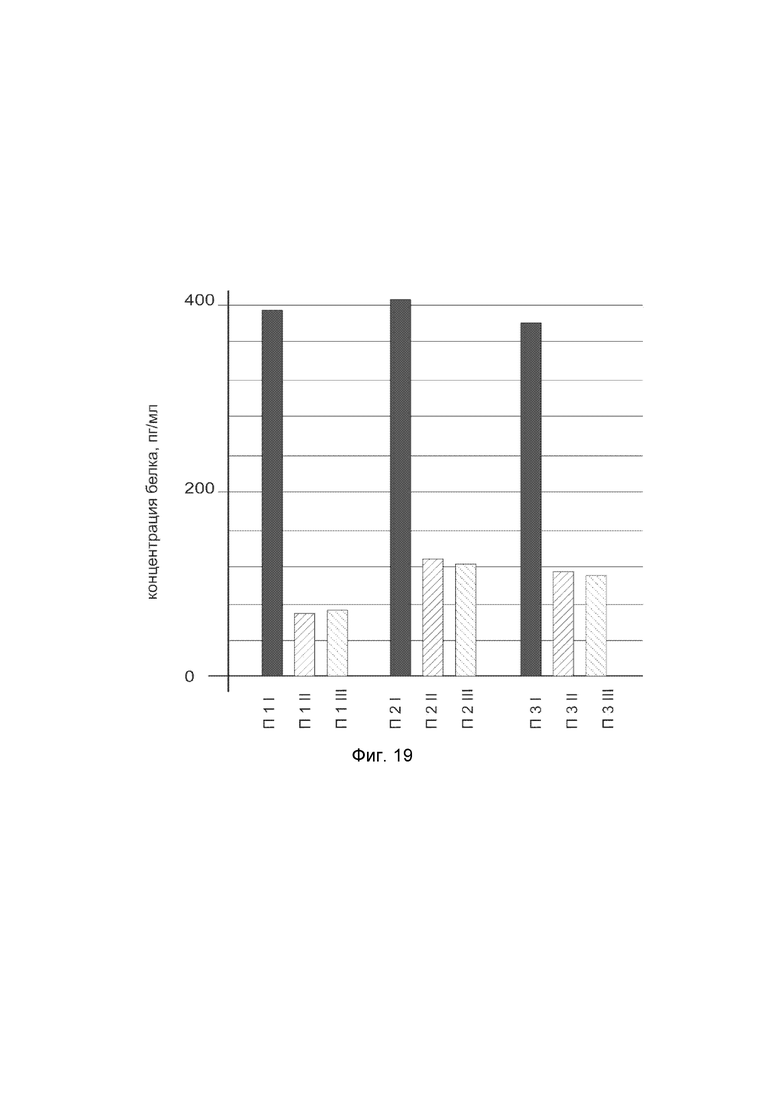
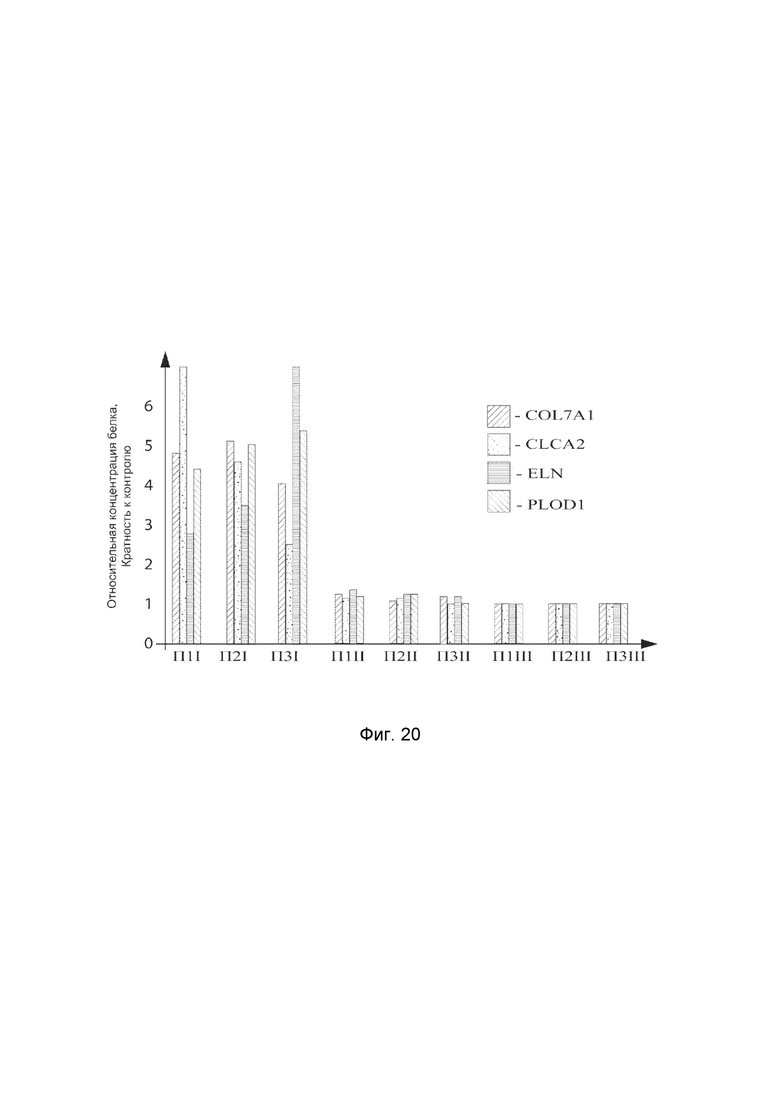
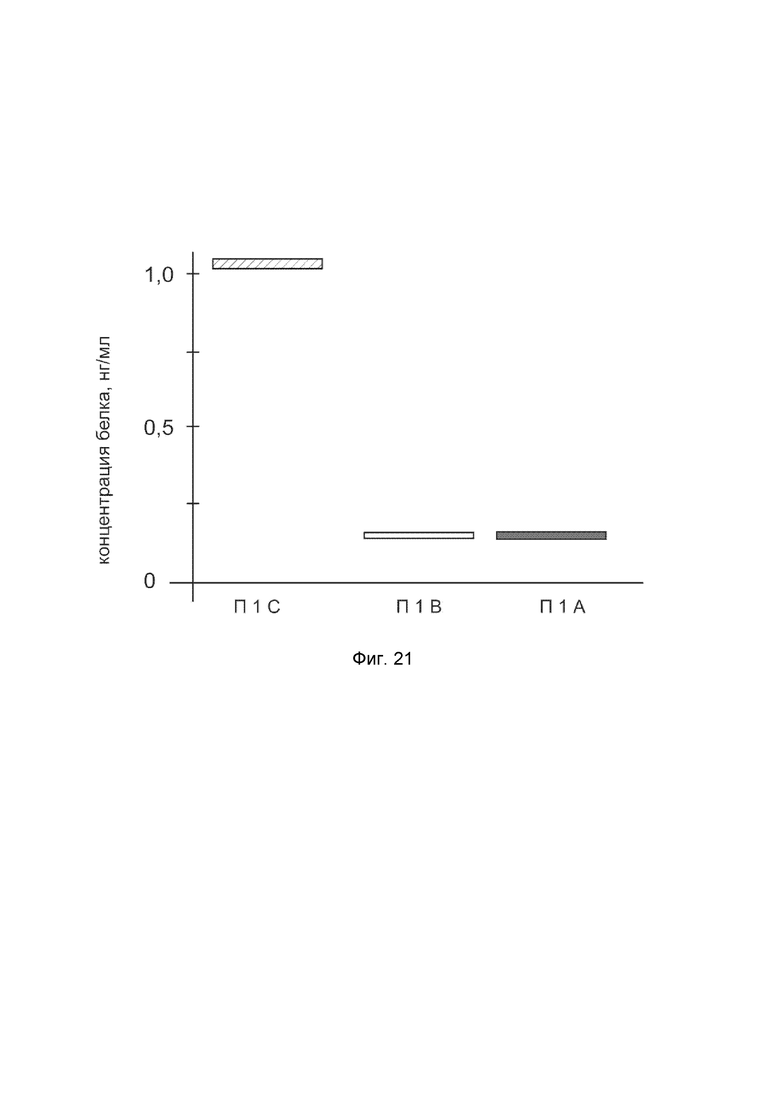
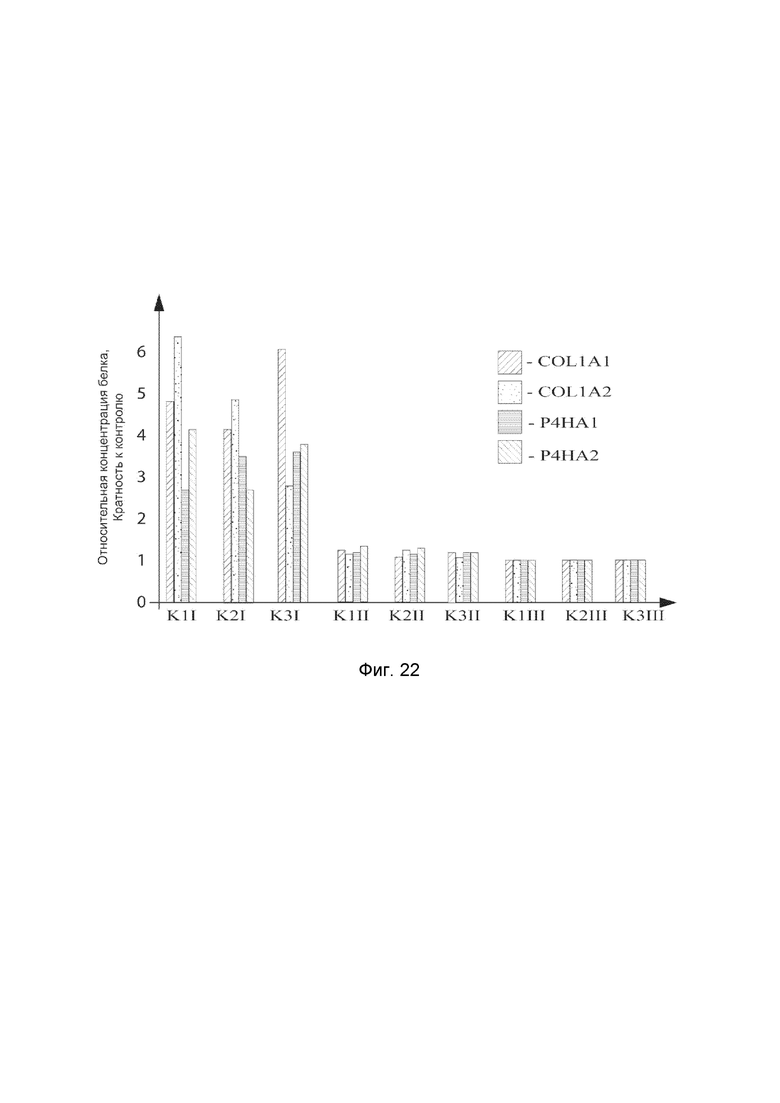
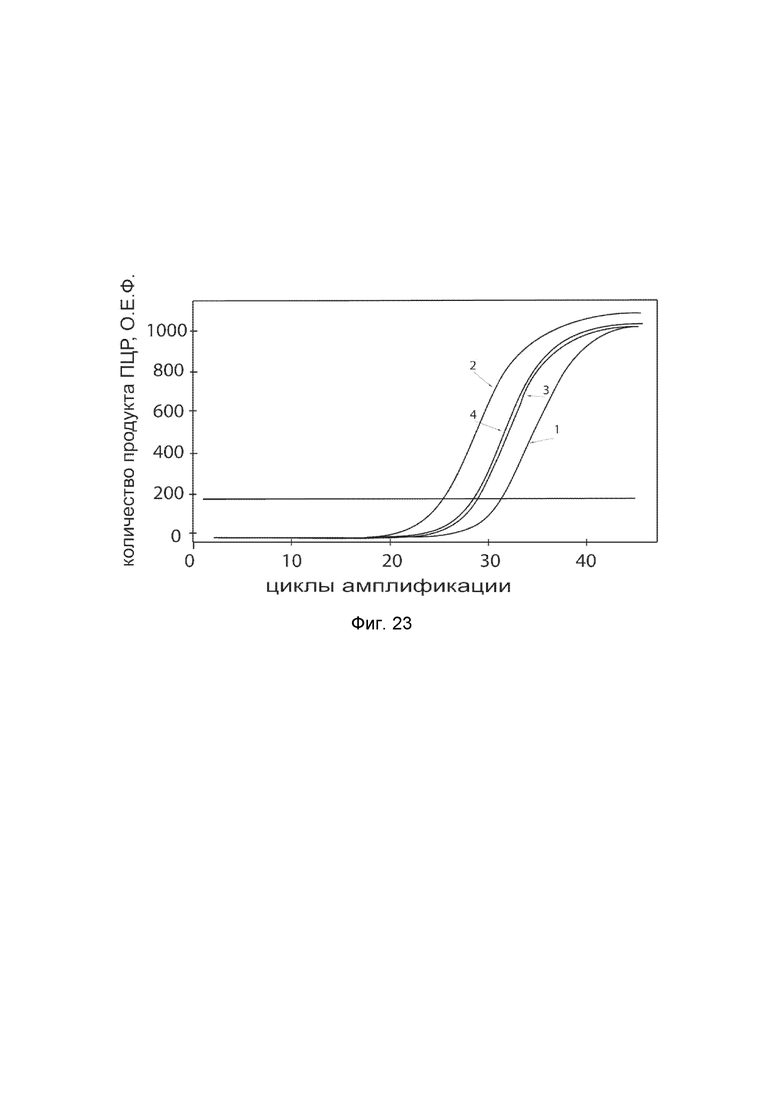
Изобретение относится к генной инженерии и может быть использовано в биотехнологии, медицине и сельском хозяйстве для создания препаратов генной терапии. Предложен генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген, выбранный из группы генов COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1, для повышения уровня экспрессии этого целевого гена в организме человека и животных. При этом генотерапевтический ДНК-вектор VTvaf17-COL1A1, или VTvaf17-COL1A2, или VTvaf17-P4HA1, или VTvaf17-P4HA2, или VTvaf17-COL7A1, или VTvaf17-CLCA2, или VTvaf17-ELN, или VTvaf17-PLOD1 имеет нуклеотидную последовательность SEQ ID №1, или SEQ ID №2, или SEQ ID №3, или SEQ ID №4, или SEQ ID №5, или SEQ ID №6, или SEQ ID №7, или SEQ ID №8 соответственно. Предложены также способ получения указанного вектора, применение вектора, штамм Escherichia coli, несущий указанный вектор, а также способ производства в промышленных масштабах указанного вектора. Изобретение обеспечивает возможность его безопасного применения для генетической терапии человека и животных. 20 н. и 2 з.п. ф-лы, 23 ил., 32 пр.
1. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, при этом генотерапевтический ДНК-вектор содержит генотерапевтический кодирующую часть целевого гена COL1A1, клонированную в ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-COL1A1, с нуклеотидной последовательностью SEQ ID №1.
2. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена COL1A2, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-COL1A2, с нуклеотидной последовательностью SEQ ID №2.
3. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена P4HA1, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-P4HA1, с нуклеотидной последовательностью SEQ ID №3.
4. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена P4HA2, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-P4HA2, с нуклеотидной последовательностью SEQ ID №4.
5. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена COL7A1, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-COL7A1, с нуклеотидной последовательностью SEQ ID №5.
6. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена CLCA2, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-CLCA2, с нуклеотидной последовательностью SEQ ID №6.
7. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена ELN, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-ELN, с нуклеотидной последовательностью SEQ ID №7.
8. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, при этом генотерапевтический ДНК-вектор содержит кодирующую часть целевого гена PLOD1, клонированную в генотерапевтический ДНК-вектор VTvaf17, с получением генотерапевтического ДНК-вектора VTvaf17-PLOD1, с нуклеотидной последовательностью SEQ ID №8.
9. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1, по пп. 1-7 или 8, отличающийся тем, что каждый из созданных генотерапевтических ДНК-векторов: VTvaf17-COL1A1, или VTvaf17-COL1A2, или VTvaf17-P4HA1, или VTvaf17-P4HA2, или VTvaf17-COL7A1, или VTvaf17-CLCA2, или VTvaf17-ELN, или VTvaf17-PLOD1 по пп. 1-7 или 8, за счет ограниченного размера векторной части VTvaf17, не превышающей 3200 п.н., обладает способностью эффективно проникать в клетки человека и животных и экспрессировать клонированный в него целевой ген COL1A1, или COL1A2, или P4HA1, или P4HA2, или COL7A1, или CLCA2, или ELN, или PLOD1.
10. Генотерапевтический ДНК-вектор на основе генотерапевтического ДНК-вектора VTvaf17, несущий целевой ген COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1, по пп. 1-7 или 8, отличающийся тем, что в составе каждого из созданных генотерапевтических ДНК-векторов: VTvaf17-COL1A1, или VTvaf17-COL1A2, или VTvaf17-P4HA1, или VTvaf17-P4HA2, или VTvaf17-COL7A1, или VTvaf17-CLCA2, или VTvaf17-ELN, или VTvaf17-PLOD1 по пп. 1-7 или 8, в качестве структурных элементов используются нуклеотидные последовательности, которые не являются генами антибиотикорезистентности, вирусными генами и регуляторными элементами вирусных геномов, обеспечивая возможность его безопасного применения для генетической терапии человека и животных.
11. Способ получения генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1, по пп. 1-7 или 8, заключающийся в том, что каждый из генотерапевтических ДНК-векторов: VTvaf17-COL1A1, или VTvaf17-COL1A2, или VTvaf17-P4HA1, или VTvaf17-P4HA2, или VTvaf17-COL7A1, или VTvaf17-CLCA2, или VTvaf17-ELN, или VTvaf17-PLOD1, получают следующим образом: кодирующую часть целевого гена COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1 по пп.1-7 или 8 клонируют в генотерапевтический ДНК-вектор VTvaf17 и получают генотерапевтический ДНК-вектор VTvaf17- COL1A1, SEQ ID №1, или VTvaf17-COL1A2, SEQ ID №2, или VTvaf17-P4HA1, SEQ ID №3, или VTvaf17-P4HA2, SEQ ID №4, или VTvaf17-COL7A1, SEQ ID №5, или VTvaf17-CLCA2, SEQ ID №6, или VTvaf17-ELN, SEQ ID №7, или VTvaf17-PLOD1, SEQ ID №8, соответственно, при этом кодирующую часть целевого гена COL1A1, или COL1A2, или P4HA1, или P4HA2, или COL7A1, или CLCA2, или ELN, или PLOD1 получают путем выделения суммарной РНК из биологического образца ткани человека с последующим проведением реакции обратной транскрипции и ПЦР-амплификации с использованием созданных олигонуклеотидов и расщеплением продукта амплификации соответствующими эндонуклеазами рестрикции, причем клонирование в генотерапевтический ДНК-вектор VTvaf17 проводят по сайтам рестрикции NheI и HindIII, причем селекцию проводят без антибиотиков,
при этом при получении генотерапевтического ДНК-вектора VTvaf17-COL1A1, SEQ ID №1 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
Col1A1_F CCAGCTAGCGTCTAGGGTCTAGACATGTTC,
Col1A1_R TATAAGCTTCTACAGGAAGCAGACAGGGCCAAC,
а расщепление продукта амплификации и клонирование кодирующей части гена COL1A1 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции NheI и HindIII,
причем при получении генотерапевтического ДНК-вектора VTvaf17-COL1A2, SEQ ID №2 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
Col1A2_F CCAGCTAGCGTCTAAGTGCTAGACATGCTC,
Col1A2_R CGAAGCTTTTATTTGAAACAGACTGGGCCA,
а расщепление продукта амплификации и клонирование кодирующей части гена COL1A2 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции NheI и HindIII,
причем при получении генотерапевтического ДНК-вектора VTvaf17-P4HA1, SEQ ID №3 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
P4HA1_F AGGATCCACCATGATCTGGTATATATTAATTATAGG,
P4HA1_R TTCGGTACCTATTCCAATTCTGACAACGTACAAG,
а расщепление продукта амплификации и клонирование кодирующей части гена P4HA1 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и KpnI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-P4HA2, SEQ ID №4 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
P4HA2_F AGGATCCACCATGAAACTCTGGGTGTCTGCA,
P4HA2_R CTTGTCGACTTAGTCAACTTCTGTTGATCCACA,
а расщепление продукта амплификации и клонирование кодирующей части гена P4HA2 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHII и SalI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-COL7A1, SEQID №5 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
COL7A1_F ATCGTCGACCACCATGACGCTGCGGCTTCTGGT
COL7A1_R ATAGAATTCAGTCCTGGGCAGTACCTGTC,
а расщепление продукта амплификации и клонирование кодирующей части гена COL7A1 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SalI, EcoRI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-CLCA2, SEQ ID №6 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
CLCA2_F AGGATCCACCATGACCCAAAGGAGCATTGC,
CLCA2_R ATAGAATTCATAATAATTTTGTTCCATTCTCTTTC,
а расщепление продукта амплификации и клонирование кодирующей части гена CLCA2 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHI и EcoRI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-ELN, SEQ ID №7 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
ELN_F TTTGTCGACCACCATGGCGGGTCTGACGGCGG,
ELN_R TTTTTGAATTCTCATTTTCTCTTCCGGCCACAAGCTT,
а расщепление продукта амплификации и клонирование кодирующей части гена ELN в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции SalI и EcoRI,
причем при получении генотерапевтического ДНК-вектора VTvaf17-PLOD1, SEQ ID №8 для проведения реакции обратной транскрипции и ПЦР-амплификации, в качестве созданных для этого олигонуклеотидов используют олигонуклеотиды
PLOD1_F GGATCCACCATGCGGCCCCTGCTGCTACT,
PLOD1_R ATAGAATTCAGGGATCGACGAAGGAGACT,
а расщепление продукта амплификации и клонирование кодирующей части гена PLOD1 в генотерапевтический ДНК-вектор VTvaf17 проводят с использованием эндонуклеаз рестрикции BamHII и EcoRI.
12. Способ использования генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1, по пп. 1-7 или 8 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, заключающийся в трансфекции выбранным генотерапевтическим ДНК-вектором, несущим целевой ген на основе генотерапевтического ДНК-вектора VTvaf17, или несколькими выбранными генотерапевтическими ДНК-векторами, несущими целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, клеток органов и тканей пациента или животного, и/или во введении в органы и ткани пациента или животного аутологичных клеток этого пациента или животного, трансфицированных выбранным генотерапевтическим ДНК-вектором, несущим целевой ген на основе генотерапевтического ДНК-вектора VTvaf17 или несколькими выбранными генотерапевтическими ДНК-векторами, несущими целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, и/или во введении в органы и ткани пациента или животного выбранного генотерапевтического ДНК-вектора, несущего целевой ген на основе генотерапевтического ДНК-вектора VTvaf17 или нескольких выбранных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, из созданных генотерапевтических ДНК-векторов, несущих целевые гены на основе генотерапевтического ДНК-вектора VTvaf17, или в сочетании обозначенных способов.
13. Способ получения штамма для производства генотерапевтического ДНК-вектора по пп. 1-7 или 8 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, заключающийся в получении электрокомпетентных клеток штамма Escherichia coli SCS110-AF с последующим проведением электропорации этих клеток генотерапевтическим ДНК-вектором VTvaf17-COL1A1, или генотерапевтическим ДНК-вектором VTvaf17-COL1A2, или генотерапевтическим ДНК-вектором VTvaf17-P4HA1, или генотерапевтическим ДНК-вектором VTvaf17-P4HA2, или генотерапевтическим ДНК-вектором VTvaf17-COL7A1, или генотерапевтическим ДНК-вектором VTvaf17-CLCA2, или генотерапевтическим ДНК-вектором VTvaf17-ELN, или генотерапевтическим ДНК-вектором VTvaf17-PLOD1, после чего клетки высеивают на чашки Петри с агаризованной селективной средой, содержащей дрожжевой экстракт, пептон, 6% сахарозы, а также 10 мкг/мл хлорамфеникола, с получением в результате штамма Escherichia coli SCS110-AF/VTvaf17-COL1A1, или штамма Escherichia coli SCS110-AF/VTvaf17-COL1A2, или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA1, или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA2, или штамма Escherichia coli SCS110-AF/VTvaf17-COL7A1, или штамма Escherichia coli SCS110-AF/VTvaf17-CLCA2, или штамма Escherichia coli SCS110-AF/VTvaf17-ELN, или штамма Escherichia coli SCS110-AF/VTvaf17-PLOD1.
14. Штамм Escherichia coli SCS110-AF/VTvaf17-COL1A1, полученный способом по п. 13, несущий генотерапевтический ДНК-вектор VTvaf17-COL1A1, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена.
15. Штамм Escherichia coli SCS110-AF/VTvaf17-COL1A2, полученный способом по п. 13, несущий генотерапевтический ДНК-вектор VTvaf17-COL1A2, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена.
16. Штамм Escherichia coli SCS110-AF/VTvaf17-P4HA1, полученный способом по п. 13, несущий генотерапевтический ДНК-вектор VTvaf17-P4HA1, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена.
17. Штамм Escherichia coli SCS110-AF/VTvaf17-P4HA2, полученный способом по п. 13, несущий генотерапевтический ДНК-вектор VTvaf17-P4HA2, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена.
18. Штамм Escherichia coli SCS110-AF/VTvaf17-COL7A1, полученный способом по п. 13, несущий генотерапевтический ДНК-вектор VTvaf17-COL7A1, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена.
19. Штамм Escherichia coli SCS110-AF/VTvaf17-CLCA2, полученный способом по п. 13, несущий генотерапевтический ДНК-вектор VTvaf17-CLCA2, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена.
20. Штамм Escherichia coli SCS110-AF/VTvaf17-ELN, полученный способом по п. 13, несущий генотерапевтический ДНК-вектор VTvaf17-ELN, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена.
21. Штамм Escherichia coli SCS110-AF/VTvaf17-PLOD1, полученный способом по п. 13, несущий генотерапевтический ДНК-вектор VTvaf17-PLOD1, для его наработки с возможностью селекции без использования антибиотиков при получении генотерапевтического ДНК-вектора для лечения заболеваний, связанных с недостаточной экспрессией целевого гена.
22. Способ производства в промышленных масштабах генотерапевтического ДНК-вектора на основе генотерапевтического ДНК-вектора VTvaf17, несущего целевой ген COL1A1, COL1A2, P4HA1, P4HA2, COL7A1, CLCA2, ELN, PLOD1, по пп. 1-7 или 8 для лечения заболеваний, связанных с недостаточной экспрессией целевого гена, заключающийся в том, что генотерапевтический ДНК-вектор VTvaf17-COL1A1, или генотерапевтический ДНК-вектор VTvaf17-COL1A2, или генотерапевтический ДНК-вектор VTvaf17-P4HA1, или генотерапевтический ДНК-вектор VTvaf17-P4HA2, или генотерапевтический ДНК-вектор VTvaf17-COL7A1, или генотерапевтический ДНК-вектор VTvaf17-CLCA2, или генотерапевтический ДНК-вектор VTvaf17-ELN, или генотерапевтический ДНК-вектор VTvaf17-PLOD1 получают путем того, что засевают в колбу с приготовленной средой затравочную культуру, выбранную из штамма Escherichia coli SCS110-AF/VTvaf17-COL1A1, или штамма Escherichia coli SCS110-AF/VTvaf17-COL1A2, или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA1, или штамма Escherichia coli SCS110-AF/VTvaf17-P4HA2, или штамма Escherichia coli SCS110-AF/VTvaf17-COL7A1, или штамма Escherichia coli SCS110-AF/VTvaf17-CLCA2, или штамма Escherichia coli SCS110-AF/VTvaf17-ELN, или штамма Escherichia coli SCS110-AF/VTvaf17-PLOD1, затем инкубируют затравочную среду в шейкере-инкубаторе и переносят ее в промышленный ферментер, после чего растят до достижения стационарной фазы, затем выделяют фракцию, содержащую целевой ДНК-продукт, многостадийно фильтруют и очищают хроматографическими методами.
| СПОСОБ КОРРЕКЦИИ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ КОЖИ ЧЕЛОВЕКА, СВЯЗАННЫХ СО СТАРЕНИЕМ | 2014 |
|
RU2574905C1 |
| Средство для лечения состояний человеческого организма, связанных с уменьшением уровня экспрессии гена Р4НА1 и/или уменьшением количества белка пролил 4-гидроксилазы альфа 1 на основе генно-терапевтических субстанций с геном Р4НА1, способ получения и использования | 2017 |
|
RU2658428C9 |
| WO 2001042285 A2, 14.06.2001 | |||
| WO 2002094876 A2, 28.11.2002 | |||
| WOODLEY D.T | |||
| ET AL | |||
| Intradermal injection of lentiviral vectors corrects regenerated human dystrophic epidermolysis bullosa skin tissue in vivo | |||
| Mol Ther | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
Авторы
Даты
2020-08-24—Публикация
2018-12-27—Подача