ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ОТСЫЛКИ МАТЕРИАЛА, ПРЕДСТАВЛЕННОГО В ЭЛЕКТРОННОМ ВИДЕ
[0001] В настоящую заявку посредством отсылки полностью включен машиночитаемый список нуклеотидных/аминокислотных последовательностей, представленный одновременно с настоящим описанием и указанный следующим образом: Один файл ASCII (текстовый) размером 45084 байт с названием "716746_ST25.TXT", созданный 1 мая 2014 года.
УРОВЕНЬ ТЕХНИКИ
[0002] Белок PD-1 (от англ. Programmed Death 1 -запрограммированная гибель 1 (также известный как Programmed Cell Death 1 - запрограммированная гибель клетки 1) представляет собой трансмембранный белок 1 типа размером 268 аминокислот, первоначально идентифицированный методом вычитающей гибридизации линии мышиных Т-клеток, подвергающихся апоптозу (Ishida et al., Embo J., 11: 3887-95 (1992)). PD-1 является представителем CD28/CTLA-4 семейства Т-клеточных регуляторов и экспрессируется на активированных Т-клетках, В-клетках и клетках миелоидного происхождения (Greenwald et al., Annu. Rev. Immunol., 23: 515-548 (2005); и Sharpe et al., Nat. Immunol., 8: 239-245 (2007)).
[0003] Были идентифицированы два лиганда PD-1, PD лиганд 1 (PD-L1) и PD лиганд 2 (PD-L2), которые относятся к суперсемейству белков B7 (Greenwald et al., выше). PD-L1 экспрессируется во множестве типов клеток, включая клетки легкого, сердца, тимуса, селезенки и почки (см., например, Freeman et al., J. Exp. Med., 192(7): 1027-1034 (2000); и Yamazaki et al., J. Immunol., 169(10): 5538-5545 (2002)). Экспрессия PD-L1 апрегулируется на макрофагах и дендритных клетках (ДК) в ответ на обработку липополисахаридами (ЛПС) и ГМ-КСФ, а также на Т-клетках и В-клетках при сигнализации через Т-клеточные и В-клеточные рецепторы. PD-L1 также экспрессируется во множестве линий опухолевых клеток мышей (см., например, Iwai et al., Proc. Natl. Acad. Sci. USA, 99(19): 12293-12297 (2002); и Blank et al., Cancer Res., 64(3): 1140-1145 (2004)). В отличие от этого PD-L2 демонстрирует более ограниченный профиль экспрессии и экспрессируется в основном антигенпрезентирующими клетками (например, дендритными клетками и макрофагами) и некоторыми линиями опухолевых клеток (см., например, Latchman et al., Nat. Immunol., 2(3): 261-238 (2001)). Высокая экспрессия PD-L1 в опухолях, на опухолевой клетке, строме или других клетках в микроокружении опухоли, коррелирует с плохим клиническим прогнозом, предположительно вследствие ингибирования эффекторных Т-клеток и апрегуляции регуляторных Т-клеток (Treg) в опухоли.
[0004] PD-1 негативно регулирует активацию Т-клеток, причем эта ингибирующая функция связана с иммунорецепторным тирозиновым переключающим мотивом (ITSM) в цитоплазматическом домене (см., например, Greenwald et al., supra; и Parry et al., Mol. Cell. Biol., 25: 9543-9553 (2005)). Дефицит PD-1 может привести к аутоиммунитету. Например, было показано, что у мышей C57BL/6 с нокаутом PD-1 развивался волчаночноподобный синдром (см., например, Nishimura et al., Immunity, 11: 141-1151 (1999)). У людей однонуклеотидный полиморфизм в гене PD-1 связывают с повышенной частотой возникновения системной красной волчанки, диабета 1-го типа, ревматоидного артрита, а также прогрессией рассеянного склероза (см., например, Nielsen et al., Tissue Antigens, 62(6): 492-497 (2003); Bertsias et al., Arthritis Rheum., 60(1): 207-218 (2009); Ni et al., Hum. Genet., 121(2): 223-232 (2007); Tahoori et al., Clin. Exp. Rheumatol., 29(5): 763-767 (2011); и Kroner et al., Ann. Neurol., 58(1): 50-57 (2005)). Аномальную экспрессию PD-1 также наблюдали при Т-клеточных дисфункциях при нескольких патологиях, таких как ускользание опухолей от иммунной системы и хронические вирусные инфекции (см., например, Barber et al., Nature, 439: 682-687 (2006); и Sharpe et al., выше).
[0005] Недавние исследования демонстрируют, что Т-клеточная супрессия, вызванная PD-1, также играет роль в подавлении противоопухолевого иммунитета. Например, PD-L1 экспрессируется на многих опухолях человека и мыши, при этом связывание PD-1 с PD-L1 на опухолях приводит к Т-клеточной супрессии и к ускользанию и защите опухоли от воздействия иммунной системы (Dong et al., Nat. Med., 8: 793-800 (2002)). Экспрессия PD-L1 опухолевыми клетками была непосредственно связана с их устойчивостью к лизису противоопухолевыми Т-клетками in vitro (Dong et al., выше; и Blank et al., Cancer Res., 64: 1140-1145 (2004)). PD-1 нокаутные мыши резистентны к прививанию опухолей (Iwai et al., Int. Immunol., 17: 133-144 (2005)), и Т-клетки PD-1 нокаутных мышей крайне эффективно вызывают отторжение опухоли при адоптивном переносе мышам с опухолями (Blank et al., выше). Блокирование PD-1 ингибиторных сигналов с использованием моноклонального антитела может усиливать противоопухолевый иммунитет у мышей (Iwai et al., выше; и Hirano et al., Cancer Res., 65: 1089-1096 (2005)), и высокие уровни экспрессии PD-L1 в опухолях связаны с плохим прогнозом при многих типах рака у человека (Hamanishi et al., Proc. Natl. Acad. Sci. USA, 104: 3360-335 (2007), Brown et al., J. Immunol., 170: 1257-1266 (2003); и Flies et al., Yale Journal of Biology and Medicine, 84(4): 409-421 (2011)).
[0006] Исходя из изложенного выше, были разработаны стратегии ингибирования активности PD-1 для лечения различных типов рака и для иммуностимуляции (например, для лечения инфекционных заболеваний) (см., например, Ascierto et al., Clin. Cancer. Res., 19 (5): 1009-1020 (2013)). В этом отношении, моноклональные антитела против PD-1 были созданы для лечения рака (см., например, Weber, Semin. Oncol., 37 (5): 430-4309 (2010); и Tang et al., Current Oncology Reports, 15(2): 98-104 (2013)). Например, ниволумаб (также известный как BMS-936558) вызывал полный или частичный ответ при немелкоклеточном раке легкого, меланоме и почечно-клеточном раке в Фазе I клинического исследования (см., например, Topalian, New England J. Med., 366: 2443-2454 (2012)), и в настоящее время проходит Фазу III клинических исследований. MK-3575 является гуманизированным моноклональным антителом, направленным против PD-1, которое проявляло противоопухолевую активность в Фазе I клинических исследований (см., например, Patnaik et al., 2012 American Society of Clinical Oncology (ASCO) Annual Meeting, Abstract # 2512). Кроме того, недавние факты указывают, что методы терапии, которые направленно воздействуют на PD-1, могут усилить иммунные ответы против таких патогенов, как ВИЧ (см., например, Porichis et al., Curr. HIV/AIDS Rep., 9(1): 81-90 (2012)). Тем не менее, несмотря на эти успехи, эффективность таких потенциальных методов терапии у людей может быть ограничена.
[0007] Таким образом, существует потребность в PD-1-связывающем средстве (например, антителе), которое связывает PD-1 с высокой аффинностью и эффективно нейтрализует активность PD-1. Изобретение относится к таким PD-1-связывающие средства.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0008] Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает аминокислотную последовательность определяющей комплементарность области 1 (CDR) SEQ ID NO: 1, аминокислотную последовательность CDR2 SEQ ID NO: 2 и аминокислотную последовательность CDR3 SEQ ID NO: 3, где необязательно (a) остаток 9 в SEQ ID NO: 1 заменен другим аминокислотным остатком, (b) один или более остатков 7, 8 и 9 в SEQ ID NO: 2 заменен другим аминокислотным остатком, (c) один или более остатков 1, 2 и 5 в SEQ ID NO: 3 заменен другим аминокислотным остатком, или (d) любая комбинация (a)-(c).
[0009] Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает аминокислотную последовательность определяющей комплементарность области 1 (CDR) SEQ ID NO: 12, аминокислотную последовательность CDR2 SEQ ID NO: 13 и аминокислотную последовательность CDR3 SEQ ID NO: 14, где необязательно (a) остаток 9 в SEQ ID NO: 12 заменен другим аминокислотным остатком, (b) остаток 8 и/или остаток 9 в SEQ ID NO: 13 заменен другим аминокислотным остатком, (c) остаток 5 в SEQ ID NO: 14 заменен другим аминокислотным остатком, или (d) любая комбинация (a)-(c).
[0010] Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает аминокислотную последовательность определяющей комплементарность области 1 (CDR) SEQ ID NO: 19, аминокислотную последовательность CDR2 SEQ ID NO: 20 и аминокислотную последовательность CDR3 SEQ ID NO: 21.
[0011] Изобретение также относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает аминокислотную последовательность, которая по меньшей мере на 90% идентична любой из SEQ ID NO: 4-11, SEQ ID NO: 15-18 и SEQ ID NO: 22-25.
[0012] Изобретение относится к выделенному полипептиду легкой цепи иммуноглобулина, который включает аминокислотную последовательность определяющей комплементарность области 1 (CDR) SEQ ID NO: 26 и аминокислотную последовательность CDR2 SEQ ID NO: 27.
[0013] Изобретение относится к выделенному полипептиду легкой цепи иммуноглобулина, который включает аминокислотную последовательность определяющей комплементарность области 1 (CDR) SEQ ID NO: 30 и аминокислотную последовательность CDR2 SEQ ID NO: 31, где необязательно остаток 12 в SEQ ID NO: 30 заменен другим аминокислотным остатком.
[0014] Изобретение относится к выделенному полипептиду легкой цепи иммуноглобулина, который включает аминокислотную последовательность определяющей комплементарность области 1 (CDR) SEQ ID NO: 35, аминокислотную последовательность CDR2 SEQ ID NO: 36 и аминокислотную последовательность CDR3 SEQ ID NO: 37, где необязательно (a) остаток 5 в SEQ ID NO: 36 заменен другим аминокислотным остатком, и/или (b) остаток 4 в SEQ ID NO: 37 заменен другим аминокислотным остатком.
[0015] Изобретение относится к выделенному полипептиду легкой цепи иммуноглобулина, который включает аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40 или SEQ ID NO: 41.
[0016] Кроме того, изобретение относится к выделенным или очищенным последовательностям нуклеиновых кислот, кодирующим вышеуказанные полипептиды иммуноглобулинов, векторам, включающим такие последовательности нуклеиновых кислот, выделенным PD-1-связывающим средствам, включающим предшествующие полипептиды иммуноглобулинов, последовательностям нуклеиновых кислот, кодирующим такие PD-1-связывающие средства, векторам, включающим такие последовательности нуклеиновых кислот, выделенным клеткам, включающим такие векторы, композициям, включающим такие PD-1-связывающие средства, или таким векторам с фармацевтически приемлемым носителем, а также способам лечения рака или инфекционных заболеваний у млекопитающих посредством введения эффективного количества таких композиций млекопитающим.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0017] Фигура 1 является диаграммой, на которой схематично представлены различные PD-1 антигенные конструкции, используемые для получения моноклональных антител против PD-1, как описано в примере 1.
[0018] Фигура 2 является графиком, на котором показаны экспериментальные результаты, демонстрирующие повышенную активность антагонистического антитела против TIM-3 в СКЛ анализе на CD4+ Т-клетках человека в присутствии низких уровней антитела против PD-1 APE2058.
[0019] Фигура 3 является графиком, на котором показаны экспериментальные результаты, демонстрирующие повышенную активность антагонистического антитела против LAG-3 в СКЛ анализе на CD4+ Т-клетках человека в присутствии низких уровней антитела против PD-1 APE2058.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0020] Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина и/или выделенному полипептиду легкой цепи иммуноглобулина или их фрагмент (например, антигенсвязывающий фрагмент). Термин "иммуноглобулин" или "антитело", при использовании в настоящем описании, относится к белку, который присутствует в крови или других физиологических жидкостях позвоночных, который используется иммунной системой для идентификации и нейтрализации чужеродных объектов, таких как бактерии и вирусы. Полипептид "выделен" в таком отношении, что он удален из его окружения. В предпочтительном варианте осуществления иммуноглобулин или антитело является белком, который включает по меньшей мере одну определяющую комплементарность область (CDR). CDR формируют "гипервариабельную область" антитела, которая отвечает за связывание антигена (дополнительно обсуждается ниже). Целый иммуноглобулин обычно состоит из четырех полипептидов: две идентичных копии полипептида тяжелой (H) цепи и две идентичных копии полипептида легкой (L) цепи. Каждая из тяжелых цепей содержит одну N-концевую вариабельную (VH) область и три C-концевых константных (CH1, CH2, и CH3) области, и каждая легкая цепь содержит одну N-концевую вариабельную (VL) область и одну C-концевую константную (CL) область. Легкие цепи антител могут относиться к одному из двух различных типов, каппа (κ) или лямбда (λ), основываясь на последовательностях аминокислот их константных доменов. В типичном иммуноглобулине каждая легкая цепь связана с тяжелой цепью дисульфидными связями, и две тяжелых цепи связаны друг с другом дисульфидными связями. Вариабельная область легкой цепи параллельна вариабельной области тяжелой цепи, а константная область легкой цепи параллельна первой константной области тяжелой цепи. Остальные константные области тяжелых цепей параллельны друг другу.
[0021] Вариабельные области каждой пары легкой и тяжелой цепей формируют антигенсвязывающий участок антитела. VH и VL области имеют одинаковую общую структуру, где каждая область включает четыре каркасных (FW или FR) области. Термин "каркасная область", при использовании в настоящем описании, относится к относительно консервативным аминокислотным последовательностям в пределах вариабельной области, которые расположены между гипервариабельными или определяющими комплементарность областями (CDR). В каждом вариабельном домене находится четыре каркасных области, которые обозначаются как FR1, FR2, FR3 и FR4. Каркасные области формируют β-складки, которые обеспечивают структурный каркас вариабельной области (см., например, Janeway et al. (eds.), Immunobiology, 5th Ed., Garland Publishing, New York, NY (2001)).
[0022] Каркасные области связаны тремя определяющими комплементарность областями(CDR). Как обсуждалось выше, три CDR, известные как CDR1, CDR2 и CDR3, формируют "гипервариабельную область" антитела, которая ответственна за связывание антигена. CDR формируют петли, соединяющие, и в некоторых случаях включающие часть бета-складчатой структуры, которая сформирована каркасными областями. Хотя константные области легкой и тяжелой цепей непосредственно не участвуют в связывании антитела с антигеном, константные области могут влиять на ориентацию вариабельных областей. Константные области также проявляют различные эффекторные функции, такие как участие в антителозависимом комплемент-опосредованном лизисе или в антителозависимой клеточной токсичности через взаимодействия с эффекторными молекулами и клетками.
[0023] Выделенный полипептид тяжелой цепи иммуноглобулина и выделенный полипептид легкой цепи иммуноглобулина по изобретению предпочтительно связывается с PD-1. Как обсуждалось выше, белок programmed death 1 (PD-1) (также известный как запрограммированная клеточная смерть 1) является трансмембранным белком типа 1 длиной 268 аминокислот (Ishida et al., выше). PD-1 является представителем CD28/CTLA-4 семейства Т-клеточных регуляторов и экспрессируется на активированных Т-клетках, В-клетках и клетках миелоидного происхождения (Greenwald et al., выше; и Sharpe et al., выше). PD-1 включает внеклеточный домен IgV, за которым следуют короткий внеклеточный центральный стебель, трансмембранная область и внутриклеточный хвост. Внутриклеточный хвост содержит два сайта фосфорилирования, расположенные в иммунорецепторном тирозиновом ингибиторном мотиве и иммунорецепторном тирозиновом переключающем мотиве, которые играют роль в способности PD-1 негативно регулировать сигнализацию Т-клеточных рецепторов (см., например, Ishida et al., выше; и Бланк et al., выше). Выделенный полипептид тяжелой цепи иммуноглобулина согласно изобретению и выделенный полипептид легкой цепи иммуноглобулина согласно изобретению могут образовывать средство, которое связывается с PD-1 и другим антигеном, образуя связывающее средство с "двойной активностью" (например, антитело с двойной специфичностью). Например, средство может связываться с PD-1 и с другим негативным регулятором иммунной системы таким как, например, ген активации лимфоцитов 3 (LAG-3) и/или белком с Т-клеточным иммуноглобулиновым доменом и муциновым доменом 3 (ТIМ-3).
[0024] Антитела, которые могут связываться с PD-1, и их производные известны из уровня техники (см., например, патент США 8168757; Topalian et al., выше; и Patnaik et al., выше). Антитела к PD-1 также коммерчески доступны из таких источников как, например, Abcam (Cambridge, МА).
[0025] Аминокислотная "замена" или "замещение" относится к замене одной аминокислоты в данном положении или остатке другой аминокислотой в том же положении или остатке в последовательности полипептида.
[0026] Аминокислоты в целом сгруппированы как "ароматические" или "алифатические". Ароматическая аминокислота включает ароматическое кольцо. Примеры "ароматических" аминокислот включают гистидин (H или His), фенилаланин (F или Phe), тирозин (Y или Tyr) и триптофан (W или Trp). Неароматические аминокислоты в целом сгруппированы как "алифатические". Примеры "алифатических" аминокислот включают глицин (G или Gly), аланин (A или Ala), валин (V или Val), лейцин (L или Leu), изолейцин (I или Ile), метионин (М или Met), серин (S или Ser), треонин (T или Thr), цистеин (C или Cys), (P или Pro), глутаминовую кислоту (E или Glu), аспарагиновую кислоту (A или Asp), аспарагин (N или Asn), глутамин (Q или Gln), лизин (K или Lys) и аргинин (R или Arg).
[0027] Алифатические аминокислоты могут быть подразделены на четыре подгруппы. "Большая алифатическая неполярная подгруппа" состоит из валина, лейцина и изолейцина. "Алифатическая слабо-полярная подгруппа" состоит из метионина, серина, треонина и цистеина. "Алифатическая полярная/заряженная подгруппа" состоит из глутаминовой кислоты, аспарагиновой кислоты, аспарагина, глутамина, лизина и аргинина. "Подгруппа с малым остатком" состоит из глицина и аланина. Группа заряженных/полярных аминокислот может быть подразделена на три подгруппы: "положительно заряженная подгруппа", состоящая из лизина и аргинина, "отрицательно заряженная подгруппа", состоящая из глутаминовой кислоты и аспарагиновой кислоты, и "полярной подгруппы", состоящей из аспарагина и глутамина.
[0028] Ароматические аминокислоты могут быть подразделены на две подгруппы: "подгруппу с азотным кольцом", состоящую из гистидина и триптофана, и "подгруппу фенила", состоящую из фенилаланина и тирозина.
[0029] Замена или замещение аминокислоты могут быть консервативными, полуконсервативными или неконсервативными. Фраза "консервативная замена аминокислоты" или "консервативная мутация" относится к замене одной аминокислоты другой аминокислотой с общим свойством. Функциональный способ определить общие свойства между отдельными аминокислотами состоит в том, чтобы проанализировать нормализованные частоты изменений аминокислоты между соответствующими белками гомологичных организмов (Schulz and Schirmer, Principles of Protein Structure, Springer-Verlag, New-York (1979)). Согласно таким исследованиям, могут быть определены группы аминокислот, где аминокислоты в пределах группы предпочтительно заменяются друг на друга, и поэтому больше всего напоминают друг друга по их воздействию на полную белковую структуру (Schulz and Schirmer, выше).
[0030] Примеры консервативных аминокислотных замен включают замены аминокислот в пределах подгрупп, описанных выше, например, лизина на аргинин и наоборот, таким образом, чтобы мог сохраняться положительный заряд, глутаминовой кислоты на аспарагиновую кислоту и наоборот, таким образом, чтобы мог сохраняться отрицательный заряд, серина на треонин, таким образом, чтобы могла сохраняться свободная -ОН, и глутамина на аспарагин, таким образом, чтобы могла сохраняться свободная -NH2.
[0031] "Полуконсервативные мутации" включают замены аминокислот в пределах тех же перечисленных выше групп, но не в той же подгруппе. Например, замена аспарагиновой кислоты на аспарагин или аспарагина на лизин включает аминокислоты в пределах одной и той же группы, но разных подгрупп. "Неконсервативные мутации" включают аминокислотные замены между различными группами, например, лизина на триптофан или фенилаланина на серин, и т.д.
[0032] Изобретение относится к полипептиду тяжелой цепи иммуноглобулина, который включает определяющую комплементарность область 1 (CDR) с аминокислотной последовательностью SEQ ID NO: 1, CDR2 с аминокислотной последовательностью SEQ ID NO: 2 и CDR3 с аминокислотной последовательностью SEQ ID NO: 3. В одном варианте осуществления изобретения выделенный полипептид тяжелой цепи иммуноглобулина включает, состоит из или состоит по существу из определяющей комплементарность области 1 (CDR) с аминокислотной последовательностью SEQ ID NO: 1, CDR2 с аминокислотной последовательностью SEQ ID NO: 2, и CDR3 с аминокислотной последовательностью SEQ ID NO: 3, где необязательно (a) остаток 9 из SEQ ID NO: 1 заменен другим аминокислотным остатком, (b) один или более из остатков 7, 8 и 9 из SEQ ID NO: 2 заменен другим аминокислотным остатком, (c) один или более из остатков 1, 2 и 5 из SEQ ID NO: 3 заменен другим аминокислотным остатком, или (d) любая комбинация (a)-(c). Когда полипептид тяжелой цепи иммуноглобулина согласно изобретению состоит по существу из CDR1 с аминокислотной последовательностью SEQ ID NO: 1, CDR2 с аминокислотной последовательностью SEQ ID NO: 2 и CDR3 с аминокислотной последовательностью SEQ ID NO: 3 и необязательных замен аминокислот, дополнительные вещества могут быть включены в указанный полипептид, которые существенно не влияют на полипептид (например, белковые молекулы, такие как биотин, которые облегчают очистку или выделение). Когда полипептид тяжелой цепи иммуноглобулина согласно изобретению состоит из CDR1 с аминокислотной последовательностью SEQ ID NO: 1, CDR2 с аминокислотной последовательностью SEQ ID NO: 2 и CDR3 с аминокислотной последовательностью SEQ ID NO: 3 и необязательных аминокислотных замен, полипептид не включает каких-либо дополнительных веществ (то есть, веществ, которые не являются эндогенными к полипептиду тяжелой цепи иммуноглобулина согласно изобретению).
[0033] В одном варианте осуществления изобретения выделенный полипептид иммуноглобулина включает CDR1 с аминокислотной последовательностью SEQ ID NO: 1, CDR2 с аминокислотной последовательностью SEQ ID NO: 2 и CDR3 с аминокислотной последовательностью SEQ ID NO: 3, за исключением того, что (a) остаток 9 из SEQ ID NO: 1 заменен другим аминокислотным остатком, (b) один или более из остатков 7, 8 и 9 из SEQ ID NO: 2 заменен другим аминокислотным остатком, (c) один или более из остатков 1, 2 и 5 из SEQ ID NO: 3 заменен другим аминокислотным остатком, или (d) любая комбинация (a)-(c). Например, выделенный полипептид тяжелой цепи иммуноглобулина может включать CDR1 с аминокислотной последовательностью SEQ ID NO: 1, CDR2 с аминокислотной последовательностью SEQ ID NO: 2 и CDR3 с аминокислотной последовательностью SEQ ID NO: 3, за исключением того, что остаток 9 из SEQ ID NO: 1 заменен другим аминокислотным остатком и один или более из остатков 7, 8 и 9 из SEQ ID NO: 2 заменен другим аминокислотным остатком. В альтернативе выделенный полипептид тяжелой цепи иммуноглобулина может включать CDR1 с аминокислотной последовательностью SEQ ID NO: 1, CDR2 с аминокислотной последовательностью SEQ ID NO: 2 и CDR3 с аминокислотной последовательностью SEQ ID NO: 3, за исключением того, что остаток 9 из SEQ ID NO: 1 заменен другим аминокислотным остатком, один или более из остатков 7, 8 и 9 из SEQ ID NO: 2 заменен другим аминокислотным остатком, и один или более из остатков 1, 2, и 5 из SEQ ID NO: 3 заменен другим аминокислотным остатком. В другом варианте осуществления, выделенный полипептид тяжелой цепи иммуноглобулина может включать CDR1 с аминокислотной последовательностью SEQ ID NO: 1, CDR2 с аминокислотной последовательностью SEQ ID NO: 2 и CDR3 с аминокислотной последовательностью SEQ ID NO: 3, за исключением того, что один или более остатков из 1, 2, и 5 из SEQ ID NO: 3 заменен другим аминокислотным остатком. Каждый остаток 9 из SEQ ID NO: 1, остатки 7, 8 и 9 из SEQ ID NO: 2, и остатки 1, 2 и 5 из SEQ ID NO: 3 может быть заменен любым подходящим остатком аминокислоты, который может быть тем же самым или различным в каждом положении. Например, остаток аминокислоты первого положения может быть заменен первым другим аминокислотным остатком, и остаток аминокислоты второго положения может быть заменен вторым другим аминокислотным остатком, где первые и вторые различные остатки аминокислоты представляют собой одно и то же или отличаются.
[0034] В одном варианте осуществления выделенный полипептид тяжелой цепи иммуноглобулина включает аминокислотную последовательность CDR1 с аминокислотной последовательностью SEQ ID NO: 1, CDR2 с аминокислотной последовательностью SEQ ID NO: 2 и CDR3 с аминокислотной последовательностью SEQ ID NO: 3, за исключением того, что остаток 9 из SEQ ID NO: 1 заменен остатком метионина (M). В другом варианте осуществления выделенный полипептид тяжелой цепи иммуноглобулина включает CDR1 с аминокислотной последовательностью SEQ ID NO: 1, CDR2 с аминокислотной последовательностью SEQ ID NO: 2 и CDR3 с аминокислотной последовательностью SEQ ID NO: 3, за исключением того, что (a) остаток 7 из SEQ ID NO: 2 заменен остатком аспарагина (N), (b) остаток 8 из SEQ ID NO: 2 заменен остатком серина (S), (c) остаток 9 из SEQ ID NO: 2 заменен остатком треонина (T), или (d) любая комбинация (a)-(c). В другом варианте осуществления выделенный полипептид тяжелой цепи иммуноглобулина включает CDR1 с аминокислотной последовательностью SEQ ID NO: 1, CDR2 с аминокислотной последовательностью SEQ ID NO: 2 и CDR3 с аминокислотной последовательностью SEQ ID NO: 3, за исключением того, что (a) остаток 1 из SEQ ID NO: 3 заменен остатком глутаминовой кислоты (E), (b) остаток 2 из SEQ ID NO: 3 заменен остатком тирозина (Y), (c) остаток 5 из SEQ ID NO: 3 заменен остатком серина (S), или (d) любая комбинация (a)-(c).
[0035] Примерные полипептиды тяжелой цепи иммуноглобулина как описано выше могут включать любые из следующих аминокислотных последовательностей: SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10 или SEQ ID NO: 11.
[0036] Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает, состоит по существу из или состоит из определяющей комплементарность области 1 (CDR) с аминокислотной последовательностью SEQ ID NO: 12, CDR2 с аминокислотной последовательностью SEQ ID NO: 13 и CDR3 с аминокислотной последовательностью SEQ ID NO: 14, где необязательно (a) остаток 9 из SEQ ID NO: 12 заменен другим аминокислотным остатком, (b) остаток 8 и/или остаток 9 из SEQ ID NO: 13 заменен другим аминокислотным остатком, (c) остаток 5 из SEQ ID NO: 14 заменен другим аминокислотным остатком, или (d) любая комбинация (a)-(c). Когда полипептид тяжелой цепи иммуноглобулина согласно изобретению состоит по существу из CDR1 с аминокислотной последовательностью SEQ ID NO: 12, CDR2 с аминокислотной последовательностью SEQ ID NO: 13 и CDR3 с аминокислотной последовательностью SEQ ID NO: 14 и дополнительных замен аминокислот, дополнительные вещества могут быть включены в полипептид, которые существенно не влияют на полипептид (например, белковые молекулы, такие как биотин, которые облегчают очистку или выделение). Когда полипептид тяжелой цепи иммуноглобулина согласно изобретению состоит из последовательности аминокислот из CDR1 с аминокислотной последовательностью SEQ ID NO: 12, CDR2 с аминокислотной последовательностью SEQ ID NO: 13 и CDR3 с аминокислотной последовательностью SEQ ID NO: 14 и необязательных замен аминокислот, полипептид не включает дополнительных веществ (то есть, веществ, которые не являются эндогенными к полипептиду тяжелой цепи иммуноглобулина согласно изобретению).
[0037] В одном варианте осуществления выделенный полипептид тяжелой цепи иммуноглобулина может включать CDR1 с аминокислотной последовательностью SEQ ID NO: 12, CDR2 с аминокислотной последовательностью SEQ ID NO: 13 и CDR3 с аминокислотной последовательностью SEQ ID NO: 14, за исключением того, что (a) остаток 9 из SEQ ID NO: 12 заменен другим аминокислотным остатком, (b) остаток 8 и/или остаток 9 из SEQ ID NO: 13 заменен другим аминокислотным остатком, (c) остаток 5 из SEQ ID NO: 14 заменен другим аминокислотным остатком, или (d) любая комбинация (a)-(c). Например, выделенный полипептид тяжелой цепи иммуноглобулина может включать CDR1 с аминокислотной последовательностью SEQ ID NO: 12, CDR2 с аминокислотной последовательностью SEQ ID NO: 13 и CDR3 с аминокислотной последовательностью SEQ ID NO: 14, за исключением того, что остаток 9 из SEQ ID NO: 12 заменен другим аминокислотным остатком, остаток 8 из SEQ ID NO: 13 и остаток 9 из SEQ ID NO: 13 заменен другим аминокислотным остатком. Альтернативно, выделенный полипептид тяжелой цепи иммуноглобулина может включать CDR1 с аминокислотной последовательностью SEQ ID NO: 12, CDR2 с аминокислотной последовательностью SEQ ID NO: 13 и CDR3 с аминокислотной последовательностью SEQ ID NO: 14, за исключением того, что остаток 9 из SEQ ID NO: 12 заменен другим аминокислотным остатком и остаток 5 из SEQ ID NO: 14 заменен другим аминокислотным остатком. В другом варианте осуществления выделенный полипептид тяжелой цепи иммуноглобулина может включать CDR1 с аминокислотной последовательностью SEQ ID NO: 12, CDR2 с аминокислотной последовательностью SEQ ID NO: 13 и CDR3 с аминокислотной последовательностью SEQ ID NO: 14, за исключением того, что остаток 9 из SEQ ID NO: 12 заменен другим аминокислотным остатком, остаток 8 из SEQ ID NO: 13 заменен другим аминокислотным остатком, остаток 9 из SEQ ID NO: 13 заменен другим аминокислотным остатком, и остаток 5 из SEQ ID NO: 14 заменен другим аминокислотным остатком. Каждый из остатка 9 из SEQ ID NO: 12, остатков 8 и 9 из SEQ ID NO: 13 и остатка 5 из SEQ ID NO: 14 могут быть заменены любым подходящим аминокислотным остатком, который может быть тем же самым или различаться по каждому положению. Например, остаток аминокислоты первого положения может быть заменен первым другим аминокислотным остатком, и остаток аминокислоты второго положения может быть заменен вторым другим аминокислотным остатком, где первый и второй другие аминокислотные остатки являются одинаковыми или различными. В одном варианте осуществления выделенный полипептид тяжелой цепи иммуноглобулина включает аминокислотную последовательность CDR1 с аминокислотной последовательностью SEQ ID NO: 12, CDR2 с аминокислотной последовательностью SEQ ID NO: 13 и CDR3 с аминокислотной последовательностью SEQ ID NO: 14, за исключением того, что остаток 9 из SEQ ID NO: 12 заменен остатком лейцина (L). В другом варианте осуществления, выделенный полипептид тяжелой цепи иммуноглобулина включает аминокислотную последовательность CDR1 с аминокислотной последовательностью SEQ ID NO: 12, CDR2 с аминокислотной последовательностью SEQ ID NO: 13 и CDR3 с аминокислотной последовательностью SEQ ID NO: 14, за исключением того, что (a) остаток 8 из SEQ ID NO: 13 заменен остатком тирозина (Y), и/или (b) остаток 9 из SEQ ID NO: 13 заменен остатком аланина (A). В другом варианте осуществления выделенный полипептид тяжелой цепи иммуноглобулина включает аминокислотную последовательность CDR1 с аминокислотной последовательностью SEQ ID NO: 12, CDR2 с аминокислотной последовательностью SEQ ID NO: 13 и CDR3 с аминокислотной последовательностью SEQ ID NO: 14 за исключением того, что остаток 5 из SEQ ID NO: 14 заменен остатком треонина (T).
[0038] Примерные полипептиды тяжелой цепи иммуноглобулина, как описано выше, могут включать любую из следующих последовательностей аминокислот: SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17 или SEQ ID NO: 18.
[0039] Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает, состоит по существу из или состоит из определяющей комплементарность области 1 (CDR) с аминокислотной последовательностью SEQ ID NO: 19, CDR2 с аминокислотной последовательностью SEQ ID NO: 20 и CDR3 с аминокислотной последовательностью SEQ ID NO: 21. Когда полипептид тяжелой цепи иммуноглобулина согласно изобретению состоит по существу из аминокислотной последовательности CDR1 с аминокислотной последовательностью SEQ ID NO: 19, CDR2 с аминокислотной последовательностью SEQ ID NO: 20 и CDR3 с аминокислотной последовательностью SEQ ID NO: 21, в полипептид могут быть включены дополнительные вещества, которые существенно не влияют на полипептид (например, белковые молекулы, такие как биотин, которые облегчают очистку или выделение). Когда полипептид тяжелой цепи иммуноглобулина согласно изобретению состоит из аминокислотной последовательности CDR1 с аминокислотной последовательностью SEQ ID NO: 19, CDR2 с аминокислотной последовательностью SEQ ID NO: 20 и CDR3 с аминокислотной последовательностью SEQ ID NO: 21, полипептид не включает дополнительных веществ (то есть, веществ, которые не являются эндогенными для тяжелой цепи полипептида иммуноглобулина согласно изобретению). Примерные полипептиды тяжелых цепей иммуноглобулина, как описано выше, могут включать любую из следующих аминокислотных последовательностей: SEQ ID NO: 22, SEQ ID NO: 23, SEQ ID NO: 24 или SEQ ID NO: 25.
[0040] Кроме того, одна или более аминокислот могут быть вставлены в вышеуказанные полипептиды тяжелых цепей иммуноглобулина. Любое количество любых подходящих аминокислот может быть вставлено в аминокислотную последовательность полипептида тяжелой цепи иммуноглобулина. В этом отношении, по меньшей мере одна аминокислота (например, 2 или более, 5 или более, или 10 или более аминокислот), но не более 20 аминокислот (например, 18 или менее, 15 или менее, или 12 или менее аминокислот), может быть вставлено в аминокислотную последовательность полипептида тяжелой цепи иммуноглобулина. Предпочтительно, 1-10 аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10 аминокислот) вставлены в аминокислотную последовательность полипептида тяжелой цепи иммуноглобулина. В этом отношении, аминокислота(ы) может быть вставлена в любой из вышеуказанных полипептидов тяжелой цепи иммуноглобулина в любом подходящем положении. Предпочтительно, аминокислота(ы) вставлена в CDR (например, CDR1, CDR2, или CDR3) полипептида тяжелой цепи иммуноглобулина.
[0041] Изобретение относится к выделенному полипептиду тяжелой цепи иммуноглобулина, который включает аминокислотную последовательность, которая по меньшей мере на 90% идентична (например, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, или на 100% идентична) к любой из SEQ ID NO: 4-11, SEQ ID NO: 15-18 и SEQ ID NO: 22-25. "Идентичность" последовательности нуклеиновой кислоты или аминокислот, как описано в настоящей заявке, может быть определена путем сравнения целевой последовательности нуклеиновой кислоты или аминокислот с референсной последовательностью нуклеиновой кислоты или аминокислот. Процентная идентичность представляет собой количество нуклеотидов или остатков аминокислот, которые являются одинаковыми (то есть, идентичными) между целевой последовательностью и референсной последовательностью, деленное на длину самой длинной последовательности (то есть, длину целевой последовательности или референсной последовательности, в зависимости от того, какая длиннее). Множество математических алгоритмов для получения оптимального выравнивания и вычисления идентичности между двумя или более последовательностями известно и включено во многие доступные компьютерные программы. Примеры таких программ включают CLUSTAL-W, T-Coffee и ALIGN (для выравнивания последовательностей нуклеиновых кислот и аминокислот), программы BLAST (например, BLAST 2.1, BL2SEQ и их более поздние версии) и программы FASTA (например, FASTA3x, FASTM и SSEARCH) (для выравнивания последовательностей и поисков подобия последовательностей). Алгоритмы выравнивания последовательностей также раскрыты, например, в Altschul et al., J. Molecular Biol., 215 (3): 403-410 (1990), Beigert et al., Proc. Natl. Acad. Sci. USA, 106 (10): 3770-3775 (2009), Durbin et al., eds, Biological Sequence Analysis: Probalistic Models of Proteins and Nucleic Acids, Cambridge University Press, Cambridge, UK (2009), Soding, Bioinformatics, 21(7): 951-960 (2005), Altschul et al., Nucleic Acids Res., 25(17): 3389-3402 (1997), и Gusfield, Algorithms on Strings, Trees and Sequences, Cambridge University Press, Cambridge UK (1997)).
[0042] Изобретение относится к полипептиду легкой цепи иммуноглобулина, который включает аминокислотную последовательность определяющей комплементарность области 1 (CDR) с аминокислотной последовательностью SEQ ID NO: 26 и CDR2 с аминокислотной последовательностью SEQ ID NO: 27. В одном варианте осуществления изобретения выделенный полипептид легкой цепи иммуноглобулина включает, состоит по существу из или состоит из CDR1 с аминокислотной последовательностью SEQ ID NO: 26 и CDR2 с аминокислотной последовательностью SEQ ID NO: 27. Когда полипептид легкой цепи иммуноглобулина согласно изобретению состоит по существу из последовательности аминокислот CDR1 SEQ ID NO: 26 и CDR2 с аминокислотной последовательностью SEQ ID NO: 27, в полипептид могут быть включены дополнительные вещества, которые существенно не влияют на полипептид (например, белковые молекулы, такие как биотин, которые облегчают очистку или выделение). Когда полипептид легкой цепи иммуноглобулина согласно изобретению состоит из CDR1 с аминокислотной последовательностью SEQ ID NO: 26 и CDR2 с аминокислотной последовательностью SEQ ID NO: 27, полипептид не включает каких-либо дополнительных веществ (то есть, веществ, которые не являются эндогенными для полипептида легкой цепи иммуноглобулина согласно изобретению). Примерные полипептиды легкой цепи иммуноглобулина, как описано выше, могут включать SEQ ID NO: 28 или SEQ ID NO: 29.
[0043] Изобретение относится к выделенному полипептиду легкой цепи иммуноглобулина, который включает определяющую комплементарность область 1 (CDR) с аминокислотной последовательностью SEQ ID NO: 30 и CDR2 с аминокислотной последовательностью SEQ ID NO: 31. В одном варианте осуществления изобретения выделенный полипептид легкой цепи иммуноглобулина включает, состоит из или состоит по существу из CDR1 с аминокислотной последовательностью SEQ ID NO: 30 и CDR2 с аминокислотной последовательностью SEQ ID NO: 31, где, необязательно, остаток 12 из SEQ ID NO: 30 заменен другим аминокислотным остатком. Когда полипептид легкой цепи иммуноглобулина согласно изобретению состоит по существу из CDR1 с аминокислотной последовательностью SEQ ID NO: 30 и CDR2 с аминокислотной последовательностью SEQ ID NO: 31 и необязательных аминокислотных замен, в полипептид могут быть включены дополнительные вещества, которые существенно не влияют на полипептид (например, белковые молекулы, такие как биотин, которые облегчают очистку или выделение). Когда полипептид легкой цепи иммуноглобулина согласно изобретению состоит из CDR1 с аминокислотной последовательностью SEQ ID NO: 30 и CDR2 с аминокислотной последовательностью SEQ ID NO: 31 и необязательных аминокислотных замен, полипептид не включает каких-либо дополнительных веществ (то есть, веществ, которые не являются эндогенными для полипептида легкой цепи иммуноглобулина согласно изобретению).
[0044] В этом отношении, например, выделенный полипептид легкой цепи иммуноглобулина может включать CDR1 с аминокислотной последовательностью SEQ ID NO: 30 и CDR2 с аминокислотной последовательностью SEQ ID NO: 31, за исключением того, что остаток 12 из SEQ ID NO: 30 заменен другим аминокислотным остатком. Остаток 12 из SEQ ID NO: 30 может быть заменен любым подходящим аминокислотным остатком. В одном варианте осуществления выделенный полипептид легкой цепи иммуноглобулина может включать CDR1 с аминокислотной последовательностью SEQ ID NO: 30 и CDR2 с аминокислотной последовательностью SEQ ID NO: 31, за исключением того, что остаток 12 из SEQ ID NO: 30 заменен остатком треонина (T). Примерные полипептиды легкой цепи иммуноглобулина, как описано выше, могут включать любую из следующих аминокислотных последовательностей: SEQ ID NO: 32, SEQ ID NO: 33 или SEQ ID NO: 34.
[0045] Изобретение относится к выделенному полипептиду легкой цепи иммуноглобулина, который включает определяющую комплементарность область 1 (CDR) с аминокислотной последовательностью SEQ ID NO: 35, CDR2 с аминокислотной последовательностью SEQ ID NO: 36 и CDR3 с аминокислотной последовательностью SEQ ID NO: 37. В одном варианте осуществления полипептид легкой цепи иммуноглобулина включает, состоит по существу из или состоит из CDR1 с аминокислотной последовательностью SEQ ID NO: 35, CDR2 с аминокислотной последовательностью SEQ ID NO: 36 и CDR3 с аминокислотной последовательностью SEQ ID NO: 37, где необязательно (a) остаток 5 из SEQ ID NO: 36 заменен другим аминокислотным остатком, и/или (b) остаток 4 из SEQ ID NO: 37 заменен другим аминокислотным остатком. Когда полипептид легкой цепи иммуноглобулина согласно изобретению состоит по существу из CDR1 с аминокислотной последовательностью SEQ ID NO: 35, CDR2 с аминокислотной последовательностью SEQ ID NO: 36 и CDR3 с аминокислотной последовательностью SEQ ID NO: 37 и необязательных замен аминокислот, дополнительные вещества могут быть включены в полипептид, которые существенно не влияют на полипептид (например, белковые молекулы, такие как биотин, которые облегчают очистку или выделение). Когда полипептид легкой цепи иммуноглобулина согласно изобретению состоит из CDR1 с аминокислотной последовательностью SEQ ID NO: 35, CDR2 с аминокислотной последовательностью SEQ ID NO: 36 и CDR3 с аминокислотной последовательностью SEQ ID NO: 37 и необязательных аминокислотных замен, полипептид не включает дополнительных веществ (то есть, веществ, которые не являются эндогенными к полипептиду легкой цепи иммуноглобулина согласно изобретению). В этом отношении, например, выделенный полипептид легкой цепи иммуноглобулина может включать CDR1 с аминокислотной последовательностью SEQ ID NO: 35, CDR2 с аминокислотной последовательностью SEQ ID NO: 36 и CDR3 с аминокислотной последовательностью SEQ ID NO: 37. В альтернативе выделенный полипептид легкой цепи иммуноглобулина может включать CDR1 с аминокислотной последовательностью SEQ ID NO: 35, CDR2 с аминокислотной последовательностью SEQ ID NO: 36 и CDR3 с аминокислотной последовательностью SEQ ID NO: 37, за исключением того, что (a) остаток 5 из SEQ ID NO: 36 заменен другим аминокислотным остатком, и/или (b) остаток 4 из SEQ ID NO: 37 заменен другим аминокислотным остатком. Каждый остаток 5 из SEQ ID NO: 36 и остаток 4 из SEQ ID NO: 37 может быть заменен любым подходящим аминокислотным остатком, который может быть одинаковым или различным в каждом положении. Например, остаток аминокислоты первого положения может быть заменен первым другим аминокислотным остатком, и остаток аминокислоты второго положения может быть заменен вторым другим аминокислотным остатком, где первый и второй различные аминокислотные остатки являются одинаковыми или различными.
[0046] В одном варианте осуществления выделенный полипептид легкой цепи иммуноглобулина включает CDR1 с аминокислотной последовательностью SEQ ID NO: 35, CDR2 с аминокислотной последовательностью SEQ ID NO: 36 и CDR3 с аминокислотной последовательностью SEQ ID NO: 37, за исключением того, что (a) остаток 5 из SEQ ID NO: 36 заменен остатком лейцина (L), и/или (b) остаток 4 из SEQ ID NO: 37 заменен остатком аспарагина (N). Примерные полипептиды легкой цепи иммуноглобулина, как описано выше, могут включать любую из следующих аминокислотных последовательностей: SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40 или SEQ ID NO: 41.
[0047] Кроме того, одна или более аминокислот могут быть вставлены в вышеуказанные полипептиды легкой цепи иммуноглобулина. Любое количество любых подходящих аминокислот может быть вставлено в аминокислотную последовательность полипептида легкой цепи иммуноглобулина. В этом отношении, по меньшей мере одна аминокислота (например, 2 или более, 5 или более или 10 или более аминокислот), но не более 20 аминокислот (например, 18 или менее, 15 или менее, или 12 или менее аминокислот), могут быть вставлены в аминокислотную последовательность полипептида легкой цепи иммуноглобулина. Предпочтительно, 1-10 аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10 аминокислот) вставлены в аминокислотные последовательности полипептида легкой цепи иммуноглобулина. В этом отношении, аминокислота(ы) может быть вставлена в любой из вышеуказанных полипептидов легкой цепи иммуноглобулина в любом подходящем местоположении. Предпочтительно, аминокислота(ы) вставлены в CDR (например, CDR1, CDR2 или CDR3) полипептида легкой цепи иммуноглобулина.
[0048] Изобретение относится к выделенному полипептиду легкой цепи иммуноглобулина, который включает аминокислотную последовательность, которая по меньшей мере на 90% идентична (например, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98%, по меньшей мере на 99%, или на 100% идентична) к любой из SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, и SEQ ID NO: 41. "Идентичность" последовательности нуклеиновой кислоты или аминокислот, как описано в настоящей заявке, может быть определена при использовании способов, описанных в настоящей заявке.
[0049] Изобретение относится к выделенному programmed death 1 (PD-1)-связывающему средству, включающему, по существу состоящему из или состоящему из выделенных аминокислотных последовательностей согласно изобретению, описанных в настоящей заявке. "Programmed death 1 (PD-1)-связывающее средство" представляет собой молекулу, предпочтительно протеиноподобную молекулу, которая специфично связывается с белком programmed death 1 (PD-1). Предпочтительно, PD-1-связывающее средство представляет собой антитело или его фрагмент (например, иммуногенный фрагмент). Выделенное PD-1-связывающее средство согласно изобретению включает, состоит по существу из или состоит из выделенного полипептида тяжелой цепи иммуноглобулина согласно изобретению и/или выделенного полипептида легкой цепи иммуноглобулина согласно изобретению. В одном варианте осуществления выделенное PD-1-связывающее средство включает, состоит по существу из или состоит из выделенного полипептида тяжелой цепи иммуноглобулина согласно изобретению или выделенного полипептида легкой цепи иммуноглобулина согласно изобретению. В другом варианте осуществления выделенное PD-1- связывающее средство включает, состоит по существу из или состоит из выделенного полипептида тяжелой цепи иммуноглобулина согласно изобретению и выделенного полипептида легкой цепи иммуноглобулина согласно изобретению.
[0050] Изобретение не ограничено выделенным PD-1- связывающим средством, которое включает, состоит по существу из или состоит из полипептида тяжелой цепи иммуноглобулина и/или полипептида легкой цепи, имеющих замены, вставки и/или делеции определенных аминокислотных остатков, раскрытых в настоящей заявке. Фактически, любой аминокислотный остаток полипептида тяжелой цепи иммуноглобулина согласно изобретению и/или полипептида легкой цепи иммуноглобулина согласно изобретению может быть заменен, в любой комбинации, другим аминокислотным остатком или может быть удален или вставлен, при условии, что биологическая активность PD-1-связывающего средства повышается или улучшается в результате замен, вставок и/или делеций аминокислот. "Биологическая активность" PD-1-связывающего средства относится, например, к аффинности связывания с PD-1 или определенным эпитопом PD-1, к нейтрализации или ингибированию связывания белка PD-1 с его лигандами PD-L1 и PD-L1, к нейтрализации или ингибированию активности белка PD-1 in vivo (например, IC50), к фармакокинетике и перекрестной реактивности (например, с нечеловеческими гомологами или ортологами белка PD-1, или с другими белками или тканями). Другие биологические свойства или характеристики антигенсвязывающего средства, известные из уровня техники, включают, например, авидность, селективность, растворимость, фолдинг, иммунотоксичность, экспрессию и состав. Вышеуказанные свойства или особенности можно наблюдать, измерять и/или оценивать с использованием стандартных методик, в том числе, без ограничения, ELISA, конкурентного ELISA, анализа методом поверхностного плазмонного резонанса (BIACORE™) или KINEXA™, in vitro или in vivo анализов нейтрализации, рецептор-лиганд связывающих анализов, анализов продукции и/или секреции цитокинов или факторов роста, а также анализов сигнализации и иммуногистохимических анализов.
[0051] Термины "ингибирует" или "нейтрализует", при использовании в настоящем описании относительно активности PD-1-связывающего средства, относятся к способности по существу антагонистически воздействовать, препятствовать, предотвращать, ограничивать, замедлять, нарушать, изменять, устранять, останавливать или вызывать изменение прогрессии или выраженности, например, биологической активности белка PD-1 или заболевания или состояния, связанного с белком PD-1. Выделенное PD-1-связывающее средство согласно изобретению предпочтительно ингибирует или нейтрализует активность белка PD-1 по меньшей мере приблизительно на 20%, приблизительно на 30%, приблизительно на 40%, приблизительно на 50%, приблизительно на 60%, приблизительно на 70%, приблизительно на 80%, приблизительно на 90%, приблизительно на 95%, приблизительно на 100%, или в диапазоне, определенном любыми двумя из предыдущих значений.
[0052] Выделенное PD-1-связывающее средство согласно изобретению может быть целым антителом, как описано в настоящей заявке, или фрагментом антитела. Термины "фрагмент антитела" и "функциональный фрагмент антитела" используются в настоящей заявке попеременно для обозначения одного или более фрагментов антитела, которые сохраняют способность специфично связываться с антигеном (см., в общем, Holliger et al., Nat. Biotech., 23(9): 1126-1129 (2005)). Выделенное PD-1 связывающее средство может содержать любой PD-1-связывающий фрагмент антитела. Фрагмент антитела предпочтительно включает, например, один или более CDR, вариабельную область (или ее часть), константную область (или ее часть) или комбинации перечисленного. Примеры фрагментов антитела включают, без ограничения перечисленными: (i) Fab фрагмент, который является моновалентным фрагментом, состоящим из VL, VH, CL и CH1 доменов, (ii) F(ab')2 фрагмент, который является бивалентным фрагментом, включающим два Fab фрагмента, связанных дисульфидным мостиком в шарнирной области, (iii) Fv фрагмент, состоящий из VL и VH доменов одного плеча антитела, (iv) Fab' фрагмент, который образуется в результате разрушения дисульфидного мостика F(ab')2 фрагмента, при использовании мягких восстанавливающих условий, (v) дисульфидно стабилизированный Fv фрагмент (dsFv) и (vi) доменное антитело (dAb), которое представляет собой полипептид одного домена вариабельной области антитела (VH или VL), который специфично связывает антиген.
[0053] В вариантах осуществления, где выделенное PD-1-связывающее средство включает фрагмент полипептида тяжелой цепи или легкой цепи иммуноглобулина, фрагмент может иметь любой размер до тех пор, пока фрагмент связывает и предпочтительно ингибирует активность PD-1 белка. В этом отношении, фрагмент полипептида тяжелой цепи иммуноглобулина предпочтительно включает приблизительно от 5 до 18 (например, приблизительно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18 или диапазон, определенный любыми двумя из предшествующих значений) аминокислот. Аналогично, фрагмент полипептида легкой цепи иммуноглобулина предпочтительно включает приблизительно от 5 до 18 (например, приблизительно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18 или диапазон, определенный любыми двумя из предшествующих значений) аминокислот.
[0054] В случае, когда PD-1-связывающее средство представляет собой антитело или фрагмент антитела, то антитело или фрагмент антитела предпочтительно включает константную область тяжелой цепи (Fc) любого подходящего класса. Предпочтительно, фрагмент антитела или антитело включает константную область тяжелой цепи, которая основана на антителах IgG1, IgG2 или IgG4 дикого типа или их вариантах.
[0055] PD-1-связывающее средство также может быть фрагментом одноцепочечного антитела. Примеры одноцепочечных фрагментов антитела включают, без ограничения: (i) одноцепочечный Fv (scFv), который является моновалентной молекулой, состоящей из двух доменов фрагмента Fv (то есть, VL и VH), соединенных синтетическим линкером, который обеспечивает синтез двух доменов в качестве одиночной полипептидной цепи (см., например, Bird et al., Science, 242: 423-426 (1988); Huston et al., Proc. Natl. Acad. Sci. USA, 85: 5879-5883 (1988); и Osbourn et al., Nat. Biotechnol., 16: 778 (1998)) и (ii) диатело, которое является димером полипептидных цепей, где каждая полипептидная цепь включает VH, связанный с VL пептидным линкером, который является слишком коротким, чтобы было возможным спаривание VH и VL на одной полипептидной цепи, обеспечивая таким образом спаривание между комплементарными доменами на различных VH-VL цепях полипептида с образованием димерной молекулы, имеющей два функциональных антиген-связывающих участка. Фрагменты антитела известны в уровне техники и описаны более подробно, например, в публикации заявки на патент США 2009/0093024 A1.
[0056] Выделенное PD-1-связывающее средство также может быть интраантителом или его фрагментом. Интраантитело представляет собой антитело, которое экспрессируется и которое функционирует внутриклеточно. Интраантитела обычно не имеют дисульфидных связей и способны модулировать экспрессию или активность целевых генов посредством своей специфической связывающей активности. Интраантитела включают однодоменные фрагменты, такие как выделенные VH и VL домены и scFv. Интраантитело может включать внутриклеточные сигналы миграции, присоединенные к N или C-концу интраантитела, для обеспечения экспрессии в высоких концентрациях во внутриклеточных компартментах, где расположен целевой белок. При взаимодействии с целевым геном интраантитело модулирует целевую функцию белка и/или достигает фенотипического/функционального выключения такими механизмами, как ускорение разрушения белка-мишени и изолирование целевого белка в нефизиологическом внутриклеточном компартменте. Другие механизмы опосредованной интраантителами инактивации генов могут зависеть от эпитопа, против которого направлено интраантитело, например, связывание с каталитическим участком на целевом белке или с эпитопами, которые участвуют в белок-белковых, белок-ДНК или белок-РНК взаимодействиях.
[0057] Выделенное PD-1-связывающее средство также может быть конъюгатом антитела. В этом отношении, выделенное PD-1-связывающее средство может быть конъюгатом (1) антитела, альтернативного каркаса или их фрагментами, и (2) белковой или небелковой молекулы, включающей PD-1-связывающее средство. Например, PD-1-связывающее средство может быть целым или частью антитела, конъюгированного с пептидом, флуоресцентной молекулой или химиотерапевтическим средством.
[0058] Выделенное PD-1-связывающее средство может являться человеческим антителом, нечеловеческим антителом или химерным антителом или может быть получено из них. Под "химерным" подразумевается антитело или его фрагмент, включающие человеческие и нечеловеческие области. Предпочтительно, выделенное PD-1-связывающее средство представляет собой гуманизированное антитело. "Гуманизированное" антитело представляет собой моноклональное антитело, включающее человеческий каркас антитела и по меньшей мере один CDR, полученный или происходящий из нечеловеческого антитела. Нечеловеческие антитела включают антитела, выделенные из любого не относящегося к человеку животного, такого как, например, грызун (например, мышь или крыса). Гуманизированное антитело может включать один, два или три CDR, полученных или происходящих из нечеловеческого антитела. В предпочтительном варианте осуществления изобретения CDRH3 PD-1-связывающего средства согласно изобретению получен или происходит из моноклонального антитела мыши, тогда как остальные вариабельные области и константная область PD-1-связывающего средства согласно изобретению получены или происходят из моноклонального антитела человека.
[0059] Антитело человека, нечеловеческое антитело, химерное антитело или гуманизированное антитело могут быть получены любым образом, включая in vitro источники (например, гибридому или клеточную линию, рекомбинантно продуцирующую антитело) и in vivo источники (например, грызуны). Способы получения антитела известны из уровня техники и описаны, например, в Köhler and Milstein, Eur. J. Immunol., 5: 511-519 (1976); Harlow and Lane (eds.), Antibodies: A Laboratory Manual, CSH Press (1988); и Janeway et al. (eds.), Immunobiology, 5th Ed., Garland Publishing, New York, NY (2001)). В некоторых вариантах осуществления антитело человека или химерное антитело могут быть получены при использовании трансгенного животного (например, мыши), у которого один или более эндогенных генов иммуноглобулина заменены одним или более человеческими генами иммуноглобулина. Примеры трансгенных мышей, у которых эндогенные гены антитела эффективно заменены генами человеческого антитела, включают, без ограничения, Medarex HUMAB-MOUSE™, Kirin TC MOUSE™ и Kyowa Kirin KM-MOUSE™ (см, например, Lonberg, Nat. Biotechnol., 23(9): 1117-25 (2005), и Lonberg, Handb. Exp. Pharmacol., 181: 69-97 (2008)). Гуманизированное антитело может быть получено при использовании любого подходящего метода, известного в уровне техники (см., например, An, Z. (ed.), Therapeutic Monoclonal Antibodies: From Bench to Clinic, John Wiley & Sons, Inc., Hoboken, New Jersey (2009)), включая, например, пересадку нечеловеческих CDR на человеческий каркас антитела (см., например, Kashmiri et al., Methods, 36(1): 25-34 (2005); и Hou et al., J. Biochem., 144(1): 115-120 (2008)). В одном варианте осуществления гуманизированное антитело может быть получено при использовании способов, описанных, например, в публикации заявки на патент США 2011/0287485 A1.
[0060] В предпочтительном варианте осуществления PD-1-связывающее средство связывает эпитоп белка PD-1, что вызывает блокирование связывания PD-1 с PD-L1. Изобретение также относится к выделенному или очищенному эпитопу белка PD-1, который блокирует связывание PD-1 с PD-L1 непрямым путем или аллостерически.
[0061] Изобретение также относится к одной или более выделенных или очищенных последовательностей нуклеиновых кислот, которые кодируют полипептид тяжелой цепи иммуноглобулина согласно изобретению, полипептид легкой цепи иммуноглобулина согласно изобретению и PD-1-связывающее средство согласно изобретению.
[0062] Термин "последовательность нуклеиновой кислоты" предназначен, чтобы включать полимер ДНК или РНК, то есть полинуклеотид, который может быть одноцепочечным или двухцепочечным и который может содержать неприродные или измененные нуклеотиды. Термины "нуклеиновая кислота" и "полинуклеотид", при использовании в настоящем описании, относятся к полимерной форме нуклеотидов любой длины, к рибонуклеотидам (РНК) или дезоксирибонуклеотидам (ДНК). Эти термины относятся к первичной структуре молекулы и, таким образом, включают двух- и одноцепочечную ДНК, и двух- и одноцепочечную РНК. Термины включают, как эквиваленты, аналоги РНК или ДНК, полученные из аналогов нуклеотидов и модифицированных полинуклеотидов, таких как, без ограничения перечисленными, метилированные и/или кэпированные полинуклеотиды. Нуклеиновые кислоты обычно связаны через фосфатные связи с формированием последовательностей нуклеиновых кислот или полинуклеотидов, хотя в уровне техники известно множество других связей (например, фосфоротиоаты, боранофосфаты и т.п.). Последовательности нуклеиновых кислот, кодирующие полипептиды тяжелой цепи иммуноглобулина согласно изобретению, включают, например, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54 и SEQ ID NO: 55. Последовательности нуклеиновых кислот, кодирующие полипептиды легкой цепи иммуноглобулина согласно изобретению, включают, например, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63 и SEQ ID NO: 64.
[0063] Изобретение также относится к вектору, включающему одну или более последовательностей нуклеиновых кислот, кодирующих полипептид тяжелой цепи иммуноглобулина согласно изобретению, полипептид легкой цепи иммуноглобулина согласно изобретению и/или PD-1-связывающее средство согласно изобретению. Вектор может быть, например, плазмидой, эписомой, космидой, вирусным вектором (например, ретровирусным или аденовирусным) или бактериофагом. Подходящие векторы и способы получения векторов известны в уровне техники (см., например, Sambrook et al., Molecular Cloning, a Laboratory Manual, 3rd edition, Cold Spring Harbor Press, Cold Spring Harbor, N.Y. (2001) и Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates and John Wiley & Sons, New York, N.Y. (1994)).
[0064] В дополнение к последовательности нуклеиновой кислоты, кодирующей полипептид тяжелой цепи иммуноглобулина согласно изобретению, полипептид легкой цепи иммуноглобулина согласно изобретению и/или PD-1-связывающее средство согласно изобретению, вектор предпочтительно включает последовательности регуляции экспрессии, такие как промоторы, энхансеры, сигналы полиаденилирования, терминаторы транскрипции, участки внутренней посадки рибосомы (IRES) и т.п., которые обеспечивают экспрессию кодирующей последовательности в клетке-хозяине. Примерные последовательности регуляции экспрессии известны в уровне техники и описаны, например, в Goeddel, Gene Expression Technology: Methods in Enzymology, Vol. 185, Academic Press, San Diego, Calif. (1990).
[0065] Большое количество промоторов, включая конститутивные, индуцируемые и репрессируемые промоторы из целого ряда различных источников, известны в уровне техники. Типичные источники промоторов включают, например, вирус, млекопитающее, насекомое, растение, дрожжи и бактерии, и подходящие промоторы из этих источников уже являются доступными или могут быть созданы искусственно, на основе общедоступных последовательностей, например, из депозитариев, таких как ATCC, а также из других коммерческих или индивидуальных источников. Промоторы могут быть однонаправленными (то есть, инициировать транскрипцию в одном направлении) или реверсивными (то есть, инициировать транскрипцию в 3' или в 5' направлении). Неограничивающие примеры промоторов включают, например, бактериальную систему экспрессии T7, бактериальную систему экспрессии pBAD (araA), промотор цитомегаловируса (CMV), промотор SV40, промотор RSV. Индуцируемые промоторы включают, например, Tet систему (патенты США 5464758 и 5814618), экдизон-индуцируемую систему (No et al., Proc. Natl. Acad. Sci., 93: 3346-3351 (1996)), систему T-REX™ (Invitrogen, Carlsbad, CA), систему LACSWITCH™ (Stratagene, San Diego, CA) и систему тамоксифен-индуцируемых рекомбиназ Cre-ERT (Indra et al., Nuc. Acid. Res., 27: 4324-4327 (1999); Nuc. Acid. Res., 28: e99 (2000); патент США 7112715; и Kramer & Fussenegger, Methods Mol. Biol., 308: 123-144 (2005)).
[0066] Термин "энхансер", при использовании в настоящем описании, относится к последовательности ДНК, которая увеличивает транскрипцию, например, последовательности нуклеиновой кислоты, с которой он функционально связан. Энхансеры могут быть расположены на удалении в несколько тысяч оснований от кодирующей области последовательности нуклеиновой кислоты и могут опосредовать связывание регуляторных факторов, профили метилирования ДНК или изменения в структуре ДНК. Большое количество энхансеров из множества различных источников известно в уровне техники и доступно в качестве или в клонированных полинуклеотидах (например, из депозитариев, таких как ATCC, а также из других коммерческих или индивидуальных источников). Ряд полинуклеотидов, включающих промоторы (такие как широко используемый CMV промотор), также включают энхансерные последовательности. Энхансеры могут быть расположены до, внутри или после кодирующих последовательностей.
[0067] Вектор также может включать "селективный маркерный ген". Термин "селективный маркерный ген", при использовании в настоящем описании, относится к последовательности нуклеиновой кислоты, которая позволяет специфично отбирать клетки, экспрессирующие последовательность нуклеиновой кислоты, в присутствии соответствующего селективного агента. Подходящие селективные маркерные гены известны в уровне техники и описаны, например, в публикациях международных заявок на патент WO 1992/008796 и WO 1994/028143; Wigler et al., Proc. Natl. Acad. Sci. USA, 77: 3567-3570 (1980); O'Hare et al., Proc. Natl. Acad. Sci. USA, 78: 1527-1531 (1981); Mulligan & Berg, Proc. Natl. Acad. Sci. USA, 78: 2072-2076 (1981); Colberre-Garapin et al., J. Mol. Biol., 150: 1-14 (1981); Santerre et al., Gene, 30: 147-156 (1984); Kent et al., Science, 237: 901-903 (1987); Wigler et al., Cell, 11: 223-232 (1977); Szybalska & Szybalski, Proc. Natl. Acad. Sci. USA, 48: 2026-2034 (1962); Lowy et al., Cell, 22: 817-823 (1980); патентах США 5122464 и 5770359.
[0068] В некоторых вариантах осуществления вектор представляет собой "эписомный вектор экспрессии" или "эписому", которая способна реплицироваться в клетке-хозяине и сохраняется как внехромосомный сегмент ДНК в клетке-хозяине при наличии подходящего селективного пресса (см., например, Conese et al., Gene Therapy, 11: 1735-1742 (2004)). Типичные коммерчески доступные эписомные вектора экспрессии включают, без ограничения, эписомные плазмиды, в которых используется ядерный антиген 1 вируса Эпштейна-Барр (EBNA1) и точка начала репликации вируса Эпштейна-Барр (EBV) (oriP). Векторы pREP4, pCEP4, pREP7 и pcDNA3.1 производства Invitrogen (Carlsbad, CA) и pBK-CMV производства Stratagene (La Jolla, CA) представляют собой неограничивающие примеры эписомного вектора, в котором используется T-антиген и точка начала репликации SV40 вместо EBNA1 и oriP.
[0069] Другие подходящие векторы включают интеграционные векторы экспрессии, которые могут случайно интегрироваться в ДНК клетки-хозяина, или могут включать рекомбинантный участок, обеспечивающий специфическую рекомбинацию между вектором экспрессии и хромосомой клетки-хозяина. В таких интеграционных векторах экспрессии для осуществления экспрессии целевого белка могут использоваться эндогенные последовательности регуляции экспрессии хромосом клетки-хозяина. Примеры векторов, которые интегрируются сайт-специфическим образом, включают, например, компоненты системы flp-in производства Invitrogen (Carlsbad, CA) (например, pcDNA™ 5/FRT), или системы cre-lox, которые могут присутствовать в векторах pExchange-6 Core производства Stratagene (La Jolla, CA). Примеры векторов, которые случайно интегрируются в хромосомы клетки-хозяина, включают, например, pcDNA3.1 (при встраивании в отсутствие T-антигена) производства Invitrogen (Carlsbad, CA), UCOE производства Millipore (Billerica, MA) и pCI или pFN10A (ACT) FLEXI™ производства Promega (Madison, WI).
[0070] Также могут использоваться вирусные векторы. Типичные коммерчески доступные вирусные векторы экспрессии включают, без ограничения, систему Per.C6 на основе аденовируса, производства Crucell, Inc. (Leiden, The Netherlands), pLP1 на основе лентивируса, производства Invitrogen (Carlsbad, CA), а также ретровирусные векторы pFB-ERV и pCFB-EGSH производства Stratagene (La Jolla, CA).
[0071] Последовательности нуклеиновых кислот, кодирующие последовательности аминокислот согласно изобретению, могут быть введены в клетку на одном векторе (то есть, в цис). Для регулирования экспрессии каждой последовательности нуклеиновой кислоты может использоваться однонаправленный промотор. В другом варианте осуществления комбинации двунаправленных и однонаправленных промоторов могут использоваться для регулирования экспрессии множества последовательностей нуклеиновых кислот. Последовательности нуклеиновых кислот, кодирующие последовательности аминокислот согласно изобретению, в альтернативе, могут быть введены в популяцию клеток на отдельных векторах (то есть в транс). Каждая из последовательностей нуклеиновых кислот в каждом из отдельных векторов может включать одни и те же или разные последовательности регуляции экспрессии. Отдельные векторы могут быть введены в клетки одновременно или последовательно.
[0072] Вектор(ы), включающий нуклеиновую кислоту(ы), кодирующую последовательности аминокислот согласно изобретению, может быть введен в клетку-хозяин, которая способна к экспрессии полипептидов, кодируемых таким образом, включая любую подходящую прокариотическую или эукариотическую клетку. Таким образом, изобретение относится к выделенной клетке, включающей вектор согласно изобретению. Предпочтительные клетки-хозяева представляют собой такие клетки, которые можно легко и надежно выращивать, которые обладают достаточно высокой скоростью роста, имеют хорошо изученные системы экспрессии и могут быть легко и эффективно трансформированы или трансфицированы.
[0073] Примеры подходящих прокариотических клеток включают, без ограничения перечисленными, клетки рода Bacillus (такие как Bacillus subtilis и Bacillus brevis), Escherichia (такие как E. coli), Pseudomonas, Streptomyces, Salmonella и Erwinia. Наиболее удобные прокариотические клетки включают различные штаммы Escherichia coli (например, K12, HB101 (ATCC No. 33694), DH5α, DH10, MC1061 (ATCC No. 53338) и CC102).
[0074] Предпочтительно вектор вводят в эукариотическую клетку. Подходящие эукариотические клетки известны из уровня техники и включают, например, клетки дрожжей, клетки насекомых и клетки млекопитающих. Примеры подходящих клеток дрожжей включают клетки из рода Kluyveromyces, Pichia, Rhino-sporidium, Saccharomyces и Schizosaccharomyces. Предпочтительные клетки дрожжей включают, например, Saccharomyces cerivisae и Pichia pastoris.
[0075] Подходящие клетки насекомых описаны, например, в Kitts et al., Biotechniques, 14: 810-817 (1993); Lucklow, Curr. Opin. Biotechnol., 4: 564-572 (1993); и Lucklow et al., J. Virol., 67: 4566-4579 (1993). Предпочтительные клетки насекомых включают Sf-9 и HI5 (Invitrogen, Carlsbad, CA).
[0076] Предпочтительно в изобретении используются клетки млекопитающих. Множество подходящих хозяйских клеток млекопитающих известны из уровня техники, и многие доступны из Американской коллекции клеточных культур (ATCC, Manassas, VA). Примеры подходящих клеток млекопитающих включают, без ограничения перечисленными, клетки яичника китайского хомячка (CHO) (ATCC No. CCL61), клетки CHO DHFR (Urlaub et al., Proc. Natl. Acad. Sci. USA, 97: 4216-4220 (1980)), эмбриональные клетки почки человека (HEK)293 или 293T (ATCC No. CRL1573), и клетки 3T3 (ATCC No. CCL92). Другими подходящими линиями клеток млекопитающих являются линии клеток обезьяны COS-1 (ATCC No. CRL1650) и COS-7 (ATCC No. CRL1651), а также линия клеток CV-1 (ATCC No. CCL70). Другие примеры хозяйских клеток млекопитающих включают линии клеток приматов и линии клеток грызунов, включая трансформированные клеточные линии. Нормальные диплоидные клетки, клетки штаммов, полученные из in vitro культуры первичной ткани, а также из первичных эксплантатов, также являются подходящими. Другие подходящие линии клеток млекопитающих включают, без ограничения, клетки нейробластомы мыши N2A, HeLa, клетки мыши L-929 и клеточные линии хомяка BHK или HaK, которые доступны из ATCC. Способы отбора подходящих клеток млекопитающих и способы трансформации, культивирования, амплификации, скрининга и очистки клеток известны из уровня техники.
[0077] Наиболее предпочтительно, клетка млекопитающего является клеткой человека. Например, клетка млекопитающего может быть человеческой лимфоидной или производной лимфоидной клеточной линией, такой как клеточная линия, происходящая из пре-B-лимфоцита. Примеры линий человеческих лимфоидных клеток включают, без ограничения, RAMOS (CRL-1596), Daudi (CCL-213), EB-3 (CCL-85), DT40 (CRL-2111), 18-81 (Jack et al., Proc. Natl. Acad. Sci. USA, 85: 1581-1585 (1988)), клетки Raji (CCL-86) и их производные.
[0078] Последовательность нуклеиновой кислоты, кодирующая последовательность аминокислот согласно изобретению, может быть введена в клетку "трансфекцией", "трансформацией" или "трансдукцией". "Трансфекция", "трансформация" или "трансдукция", при использовании в настоящем описании, относится к введению одного или более экзогенных полинуклеотидов в клетку-хозяина при использовании физических или химических методов. Множество методик трансфекции известны из уровня техники и включают, например, осаждение ДНК с фосфатом кальция (см., например, Murray E.J. (ed.), Methods in Molecular Biology, Vol. 7, Gene Transfer and Expression Protocols, Humana Press (1991)); DEAE-декстран; электропорацию; индуцированную катионными липосомами трансфекцию; бомбардировку микрочастицами вольфрама (Johnston, Nature, 346: 776-777 (1990)); и осаждение ДНК с фосфатом стронция (Brash et al., Mol. Cell Biol., 7: 2031-2034 (1987)). Фаговые или вирусные векторы могут быть введены в клетки-хозяева после выращивания инфекционных частиц в подходящих пакующих клетках, многие из которых коммерчески доступны.
[0079] Изобретение относится к композиции, включающей эффективное количество полипептида тяжелой цепи иммуноглобулина согласно изобретению, полипептида легкой цепи иммуноглобулина согласно изобретению, PD-1-связывающее средство согласно изобретению, последовательность нуклеиновой кислоты согласно изобретению, кодирующую любое из перечисленного выше, или вектор согласно изобретению, включающий последовательность нуклеиновой кислоты согласно изобретению. Предпочтительно, композиция является фармацевтически приемлемой (например, физиологически приемлемой) композицией, которая включает носитель, предпочтительно фармацевтически приемлемый (например, физиологически приемлемый) носитель, и аминокислотные последовательности согласно изобретению, антиген-связывающее средство или вектор. Любой подходящий носитель может использоваться в рамках изобретения, и такие носители хорошо известны из уровня техники. Выбор носителя будет определяться, отчасти, определенным участком, в который может быть введена композиция, а также определенным способом, который используется для введения композиции. Композиция необязательно может быть стерильной. Композиция может быть заморожена или лиофилизирована для хранения и восстановления в подходящем стерильном носителе перед применением. Композиции могут быть получены в соответствии со стандартными методиками, описанными, например, в Remington: The Science and Practice of Pharmacy, 21st Edition, Lippincott Williams & Wilkins, Philadelphia, PA (2001).
[0080] Изобретение также относится к способу лечения любого заболевания или нарушения, при котором нарушенная экспрессия (например, сверхэкспрессия) или повышенная активность белка PD-1 вызывает или способствует патологическим эффектам заболевания, или уменьшение уровней или активности белка PD-1 вызывает терапевтический эффект у млекопитающих, предпочтительно у людей. Изобретение также относится к способу лечения рака или инфекционного заболевания у млекопитающего. Способ включает введение вышеуказанной композиции млекопитающему, имеющему рак или инфекционное заболевание, вследствие чего осуществляется лечение рака или инфекционного заболевания у млекопитающего. Как обсуждается в настоящей заявке, PD-1 аномально экспрессируется во множестве раковых опухолей (см., например, Brown et al., J. Immunol., 170: 1257-1266 (2003); и Flies et. al., Yale Journal of Biology and Medicine, 84: 409-421 (2011)), при этом экспрессия PD-L1 у некоторых пациентов с почечно-клеточным раком коррелирует с агрессивностью опухоли. Способ согласно изобретению может применяться для лечения любого типа рака, известного в уровне техники, такого как, например, меланома, почечно-клеточный рак, рак легкого, рак мочевого пузыря, рак молочной железы, рак шейки матки, рак толстой кишки, рак желчного пузыря, рак гортани, рак печени, рак щитовидной железы, рак желудка, рак слюнной железы, рак предстательной железы, рак поджелудочной железы или карцинома Меркеля (см., например, Bhatia et al., Curr. Oncol. Rep., 13(6): 488-497 (2011)). Способ согласно изобретению может применяться для лечения любого типа инфекционного заболевания (то есть, заболевания или нарушения, вызванного бактерией, вирусом, грибком или паразитом). Примеры инфекционных заболеваний, которые можно лечить способом согласно изобретению, включают, без ограничения перечисленными, заболевания, вызванные вирусом иммунодефицита человека (ВИЧ), респираторно-синцитиальным вирусом (RSV), вирусом гриппа, вирусом лихорадки Денге, вирусом гепатита B (HBV, или вирусом гепатита C (HCV)). Введение композиции, включающей полипептид тяжелой цепи иммуноглобулина согласно изобретению, полипептид легкой цепи иммуноглобулина согласно изобретению, PD-1-связывающее средство согласно изобретению, последовательность нуклеиновой кислоты согласно изобретению, кодирующей любое из перечисленного, или вектора согласно изобретению, включающего последовательность нуклеиновой кислоты согласно изобретению, вызывает иммунный ответ против рака или инфекционного заболевания у млекопитающего. "Иммунный ответ" может вызывать, например, выработку антитела и/или активацию иммунных эффекторных клеток (например, Т-лимфоцитов).
[0081] При использовании в настоящем описании, термины "лечение" и т.п. относятся к получению требуемого фармакологического и/или физиологического эффекта. Предпочтительно, эффект является терапевтическим, то есть, эффектом частичного или полного излечения заболевания и/или неблагоприятного симптома, относящегося к заболеванию. В этой связи, способ согласно изобретению включает введение "терапевтически эффективного количества" PD-1-связывающего средства. "Терапевтически эффективное количество" относится к эффективному количеству, в дозировках и в течение периода времени, необходимых для получения требуемого терапевтического эффекта. Терапевтически эффективное количество может изменяться в зависимости от таких факторов, как состояние заболевания, возраст, пол и вес человека, а также способность PD-1-связывающего средства вызывать требуемую реакцию у человека. Например, терапевтически эффективное количество PD-1-связывающего средства согласно изобретению представляет собой количество, которое уменьшает биологическую активность белка PD-1 у человека и/или усиливает иммунный ответ против рака или инфекционного заболевания.
[0082] В альтернативе, фармакологический и/или физиологический эффект может быть профилактическим, то есть данный эффект полностью или частично предотвращает заболевание или его симптом. В соответствии с этим, способ согласно изобретению включает введение "профилактически эффективного количества" PD-1-связывающего средства. "Профилактически эффективное количество" относится к эффективному количеству, в дозировках и в течение периода времени, необходимых для получения требуемого профилактического результата (например, предотвращения возникновения заболевания).
[0083] Типичная дозировка может находиться, например, в диапазоне от 1 пг/кг до 20 мг/кг веса животного или человека; однако дозы ниже или выше этого примерного диапазона находятся в рамках изобретения. Ежедневная парентеральная доза может составлять от приблизительно 0,00001 мкг/кг до приблизительно 20 мг/кг общей массы тела (например, приблизительно 0,001 мкг/кг, приблизительно 0,1 мкг/кг, приблизительно 1 мкг/кг, приблизительно 5 мкг/кг, приблизительно 10 мкг/кг, приблизительно 100 мкг/кг, приблизительно 500 мкг/кг, приблизительно 1 мг/кг, приблизительно 5 мг/кг, приблизительно 10 мг/кг, или диапазон, определенный любыми двумя из предшествующих значений), предпочтительно от приблизительно 0,1 мкг/кг до приблизительно 10 мг/кг общей массы тела (например, приблизительно 0,5 мкг/кг, приблизительно 1 мкг/кг, приблизительно 50 мкг/кг, приблизительно 150 мкг/кг, приблизительно 300 мкг/кг, приблизительно 750 мкг/кг, приблизительно 1,5 мг/кг, приблизительно 5 мг/кг, или диапазон, определенный любыми двумя из предшествующих значений), более предпочтительно от приблизительно 1 мкг/кг до 5 мг/кг общей массы тела (например, приблизительно 3 мкг/кг, приблизительно 15 мкг/кг, приблизительно 75 мкг/кг, приблизительно 300 мкг/кг, приблизительно 900 мкг/кг, приблизительно 2 мг/кг, приблизительно 4 мг/кг, или диапазон, определенный любыми двумя из предшествующих значений), и еще более предпочтительно от приблизительно 0,5 до 15 мг/кг массы тела в сутки (например, приблизительно 1 мг/кг, приблизительно 2,5 мг/кг, приблизительно 3 мг/кг, приблизительно 6 мг/кг, приблизительно 9 мг/кг, приблизительно 11 мг/кг, приблизительно 13 мг/кг, или диапазон, определенный любыми двумя из предшествующих значений). Терапевтическая или профилактическая эффективность средства может быть проверена при периодическом обследовании проходящих лечение пациентов. При повторных введениях в течение нескольких дней или дольше, в зависимости от состояния, лечение может быть повторено, пока не будет достигнуто требуемое ослабление симптомов заболевания. Впрочем, другие схемы введения могут быть полезными и находятся в рамках изобретения. Требуемая дозировка может быть доставлена при однократном болюсном введении композиции, многократном болюсном введении композиции или при непрерывном инфузионном введении композиции.
[0084] Композиция, включающая эффективное количество полипептида тяжелой цепи иммуноглобулина согласно изобретению, полипептида легкой цепи иммуноглобулина согласно изобретению, PD-1-связывающего средства согласно изобретению, последовательность нуклеиновой кислоты согласно изобретению, кодирующую любое из перечисленного, или вектор согласно изобретению, включающий последовательность нуклеиновой кислоты согласно изобретению, может быть введена млекопитающему при использовании стандартных методик введения, включая пероральное, внутривенное, внутрибрюшинное, подкожное, легочное, трансдермальное, внутримышечное, внутриносовое, буккальное, подъязычное или суппозиторное введение. Композиция предпочтительно является подходящей для парентерального введения. Термин "парентеральный", при использовании в настоящем описании, включает внутривенное, внутримышечное, подкожное, ректальное, вагинальное и внутрибрюшинное введение. Более предпочтительно, композицию вводят млекопитающему при использовании периферического системного введения путем внутривенной, внутрибрюшинной или подкожной инъекции.
[0085] После введения млекопитающему (например, человеку), биологическая активность PD-1-связывающего средства согласно изобретению может быть измерена любым подходящим способом, известным из уровня техники. Например, биологическая активность может быть оценена определением стабильности специфического PD-1-связывающего средства. В одном варианте осуществления изобретения, PD-1-связывающее средство (например, антитело) имеет полупериод существования in vivo приблизительно от 30 минут до 45 дней (например, приблизительно 30 минут, приблизительно 45 минут, приблизительно 1 час, приблизительно 2 часа, приблизительно 4 часа, приблизительно 6 часов, приблизительно 10 часов, приблизительно 12 часов, приблизительно 1 день, приблизительно 5 дней, приблизительно 10 дней, приблизительно 15 дней, приблизительно 25 дней, приблизительно 35 дней, приблизительно 40 дней, приблизительно 45 дней, или диапазон, определенный любыми двумя из предшествующих значений). В другом варианте осуществления PD-1-связывающее средство имеет полупериод существования in vivo приблизительно от 2 часов до 20 дней (например, приблизительно 5 часов, приблизительно 10 часов, приблизительно 15 часов, приблизительно 20 часов, приблизительно 2 дня, приблизительно 3 дня, приблизительно 7 дней, приблизительно 12 дней, приблизительно 14 дней, приблизительно 17 дней, приблизительно 19 дней, или диапазон, определенный любыми двумя из предшествующих значений). В другом варианте осуществления PD-1-связывающее средство имеет полупериод существования in vivo приблизительно от 10 дней до приблизительно 40 дней (например, приблизительно 10 дней, приблизительно 13 дней, приблизительно 16 дней, приблизительно 18 дней, приблизительно 20 дней, приблизительно 23 дня, приблизительно 26 дней, приблизительно 29 дней, приблизительно 30 дней, приблизительно 33 дней, приблизительно 37 дней, приблизительно 38 дней, приблизительно 39 дней, приблизительно 40 дней, или диапазон, определенный любыми двумя из предшествующих значений).
[0086] Биологическая активность специфического PD-1-связывающего средства также может быть оценена путем определения его аффинности связывания с белком PD-1 или его эпитопом.
Термин "аффинность" относится к константе равновесия обратимого связывания двух средств и выражается через константу диссоциации (KD). Аффинность связывания средства с лигандом, такая как аффинность антитела к эпитопу, может составлять, например, от приблизительно 1 пикомоль (пкМ) до приблизительно 100 микромолей (мкМ) (например, от приблизительно 1 пикомоль (пкM) до приблизительно 1 наномоль (нм), от приблизительно 1 нм до приблизительно 1 микромоль (мкМ) или от приблизительно 1 мкМ до приблизительно 100 мкМ). В одном варианте осуществления PD-1-связывающее средство может связываться с белком PD-1 с KD меньше или равной 1 наномолю (например, 0,9 нм, 0,8 нм, 0,7 нм, 0,6 нм, 0,5 нм, 0,4 нм, 0,3 нм, 0,2 нм, 0,1 нм, 0,05 нм, 0,025 нм, 0,01 нм, 0,001 нм, или диапазоном, определенным любыми двумя из предшествующих значений). В другом варианте осуществления PD-1-связывающее средство может связываться с PD-1 с KD меньше или равной 200 пМ (например, 190 пМ, 175 пM, 150 пM, 125 пM, 110 пM, 100 пM, 90 пM, 80 пM, 75 пM, 60 пM, 50 пM, 40 пM, 30 пM, 25 пM, 20 пM, 15 пM, 10 пM, 5 пM, 1 пM, или диапазон, определенный любыми двумя из предшествующих значений). Аффинность иммуноглобулина к целевому антигену или эпитопу может быть измерена при использовании любого известного в уровне техники анализа. Такие способы включают, например, флуоресцентно активированный клеточный сортинг (FACS), отделяемые гранулы (например, магнитные гранулы), поверхностный плазмонный резонанс (SPR), конкуренцию в фазе раствора (KINEXA™), антигенный пэннинг и/или ELISA (см., например, Janeway et al. (eds.), Immunobiology, 5th ed., Garland Publishing, New York, NY, 2001).
[0087] PD-1-связывающее средство согласно изобретению можно вводить отдельно или в комбинации с другими лекарственными средствами (например, такими как адъювант). Например, PD-1-связывающее средство можно вводить в комбинации с другими средствами для лечения или профилактики заболеваний, раскрытых в настоящей заявке. В этом отношении, PD-1-связывающее средство может применяться в комбинации по меньшей мере с одним другим противоопухолевым средством, включая, например, любое химиотерапевтическое средство, известное из уровня техники, ионизирующее излучение, низкомолекулярные противоопухолевые средства, вакцины против рака, биологические методы лечения (например, другие моноклональные антитела, уничтожающие рак вирусы, генную терапию и адоптивный перенос Т-клеток) и/или хирургию. В случае, когда способ согласно изобретению воздействует на инфекционное заболевание, PD-1-связывающее средство может применяться в комбинации по меньшей мере с одним антибактериальным средством или по меньшей мере с одним противовирусным средством. В этом отношении, антибактериальное средство может представлять собой любой подходящий антибиотик, известный из уровня техники. Противовирусное средство может представлять собой любую вакцину любого подходящего типа, которая специфично направлена против определенного вируса (например, живые ослабленные вакцины, субъединичные вакцины, рекомбинантные векторные вакцины, и противовирусные терапии с применением низкомолекулярных соединений (например, ингибиторов вирусной репликации и аналогов нуклеозидов).
[0088] В другом варианте осуществления PD-1 связывающее средство может применяться в комбинации с другими средствами, которые ингибируют пути контрольных иммунных точек. Например, PD-1 связывающее средство согласно изобретению может быть введено в комбинации со средствами, которые ингибируют или антагонистически воздействуют на пути CTLA-4, TIM-3 или LAG-3. Комбинированное лечение, которое одновременно направлено против двух или более из таких путей контрольных иммунных точек, продемонстрировало улучшенную и потенциально синергическую противоопухолевую активность (см., например, Sakuishi et al., J. Exp. Med., 207: 2187-2194 (2010); Ngiow et al., Cancer Res., 71: 3540-3551 (2011); и Woo et al., Cancer Res., 72: 917-927 (2012)). В одном варианте осуществления PD-1 связывающее вещество согласно изобретению вводят в комбинации с антителом, которое связывается с TIM-3, и/или с антителом, которое связывается с LAG-3. В этом отношении, способ лечения рака или инфекционного заболевания согласно изобретению у млекопитающего может дополнительно включать введение млекопитающему композиции, включающей (i) антитело, которое связывается с белком TIM-3, и (ii) фармацевтически приемлемый носитель, или композиции, включающей (i) антитело, которое связывается с белком LAG-3, и (ii) фармацевтически приемлемый носитель.
[0089] В дополнение к терапевтическому применению, PD-1-связывающее средство, описанное в настоящей заявке, может применяться в области диагностики или научных исследований. В этом отношении, PD-1-связывающее средство может применяться в способе диагностики рака или инфекционного заболевания. Аналогичным образом, PD-1-связывающее средство может применяться в анализе для контроля уровня белка PD-1 у субъекта, обследуемого на наличие заболевания или нарушения, связанного с аномальной экспрессией PD-1. Применения в научных исследованиях включают, например, способы, в которых PD-1-связывающее средство и метку применяют для обнаружения белка PD-1 в образце, например, в физиологической жидкости человека или в экстракте ткани или клеток. PD-1-связывающее средство может применяться с или без модификации, такой как ковалентное или нековалентное мечение детектируемой молекулой. Например, детектируемая молекула может быть радиоизотопом (например, 3H, 14C, 32P, 35S, или 125I), флуоресцентным или хемилюминесцентным веществом (например, флуоресцентным изотиоционатом, родамином или люциферином), ферментом (например, щелочной фосфатазой, бета-галактозидазой, или пероксидазой хрена) или простетической группой. Любой способ, известный из уровня техники для раздельного конъюгирования антиген-связывающего средства (например, антитела) с детектируемой молекулой, может применяться в рамках изобретения (см., например, Hunter et al., Nature, 194: 495-496 (1962); David et al., Biochemistry, 13: 1014-1021 (1974); Pain et al., J. Immunol. Meth., 40: 219-230 (1981); и Nygren, J. Histochem. and Cytochem., 30: 407-412 (1982)).
[0090] Уровни белка PD-1 могут быть измерены при использовании PD-1-связывающего средства согласно изобретению любым подходящим способом, известным в уровне техники. Такие способы включают, например, радиоиммуноанализ (РИА) и FACS. Нормальные или стандартные значения экспрессии белка PD-1 могут быть установлены при использовании любой подходящей методики, например, при объединении образца, включающего или подозреваемого на наличие PD-1 полипептида, с PD-1-специфичным антителом в условиях, подходящих для формирования комплекса антиген-антитело. Антитело прямо или опосредованно мечено детектируемым веществом для облегчения обнаружения связанного или несвязанного антитела. Подходящие детектируемые вещества включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы и радиоактивные материалы (см., например, Zola, Monoclonal Antibodies: A Manual of Techniques, CRC Press, Inc. (1987)). Количество полипептида PD-1, экспрессируемого в образце, затем сравнивают со стандартным значением.
[0091] PD-1-связывающее средство можно быть предоставлено в наборе, то есть, в упакованной комбинации реагентов в установленных количествах с инструкциями по выполнению диагностического анализа. Если PD-1-связывающее средство мечено ферментом, набор предпочтительно включает субстраты и кофакторы, необходимые для фермента (например, предшественник субстрата, который обеспечивает детектируемый хромофор или флуорофор). Кроме того, в набор могут быть включены другие добавки, такие как стабилизаторы, буферы (например, блокирующий буфер или лизисный буфер) и т.п. Относительные количества различных реагентов могут изменяться для обеспечения в растворе концентраций реагентов, которые существенно оптимизируют чувствительность анализа. Реагенты могут быть представлены в виде сухих порошков (обычно лиофилизированных), включающих вспомогательные вещества, которые при растворении дают раствор реагента в требуемой концентрации.
[0092] Следующие примеры ниже иллюстрируют изобретение, но, безусловно, не должны рассматриваться как ограничивающие его объем.
ПРИМЕР 1
[0093] Данный пример демонстрирует способ получения моноклональных антител, направленных против PD-1 человека.
[0094] Несколько форм генов, кодирующих человеческий PD-1 и его лиганды PD-L1 и PD-L2, были получены в качестве антигенов для использования в иммунизации мыши, скрининга гибридомы и созревания аффинности CDR-привитых антител, и схематично представлены на фигуре 1. Полноразмерные гены PD-1 человека и яванского макака экспрессировали с их нативной лидерной последовательностью без добавления меток, с использованием вектора одиночной экспрессии с универсальными хроматин-раскрывающими элементами (UCOE) с гигромициновой селекцией (Millipore, Billerica, MA). Клетки СНО-K1 были стабильно трансфицированы липофектамином LTX (Life Technologies, Carlsbad, CA) согласно инструкциям производителя. После гигромициновой селекции клетки, экспрессирующие PD-1 на поверхности, идентифицировали с помощью проточной цитометрии при использовании PE-конъюгированного антитела мыши против PD-1 человека (BD Bioscience, Franklin Lakes, NJ) и субклонировали. Субклоны затем отбирали по высокой и однородной экспрессии PD-1.
[0095] Последовательности нуклеиновых кислот, кодирующих растворимые мономерные формы внеклеточного домена (ECD) PD-1 человека и яванского макака, были сконструированы с His-метками, присоединенными к C-концу ECD, или в виде растворимых димерных белков, слитых с Fc IgG2a мыши, как показано на фигуре 1. Последовательности нуклеиновых кислот, кодирующие растворимые димерные формы ECD PD-L1 и PD-L2 человека, были сконструированы в виде слитых белков с Fc IgG1 мыши, как показано на фигуре 1. Растворимые белки транзиентно экспрессировали в клетках HEK 293 или в стабильных линиях клеток CHO с использованием стандартных методик. Белки с His-меткой очищали из супернатанта клеточной культуры с помощью аффинной хроматографии на Ni-колонке, с последующей эксклюзионной хроматографией. Слитые белки IgG-Fc очищали при использовании аффинной хроматографии с белком A/G. Очищенные белки анализировали с помощью SDS-PAGE и эксклюзионной хроматографии для подтверждения гомогенности. Кроме того, идентичность и размер подтверждали с помощью масс-спектрометрии.
[0096] Для экспериментов FACS сортинга, очищенные белки пометили биотином при использовании NHS-сложноэфирного кросслинкера (Thermo-Fisher Scientific, Inc., Waltham, MA) или флуоресцентным красителем DyLight 650 (Thermo-Fisher Scientific, Inc., Waltham, MA) с использованием стандартных методик.
[0097] Мышей иммунизировали либо CHO-клетками, экспрессирующими полноразмерный PD-1 на клеточной поверхности, либо PD-1 ECD His белком. В частности, самки мышей BALB/c (7 недель) были приобретены в Harlan Laboratories, Inc. (Indianapolis, IN) и разделены на две группы. Через шесть дней адаптации одну группу животных иммунизировали четырьмя еженедельными дозами очищенного человеческого PD-1 ECD-His 50 мкг/мышь в эмульсии 1:1 с TITERMAX GOLD™ (Sigma Aldrich, St. Louis, MO). Иммунизацию выполняли подкожно в область подмышки и паха. Второй группе животных вводили четыре еженедельных дозы клеток CHO-K1, стабильно экспрессирующих полноразмерный PD-1 человека (5×106 клеток/мышь), подкожно в области подмышки и паха. Через десять дней у животных забирали кровь для измерения сывороточного титра против PD-1, и одно животное из каждой группы получали бустер-инъекцию растворимого человеческого PD-1 после 3-недельного перерыва. Через три дня селезенку, подмышечные/плечевые лимфатические узлы и паховые лимфатические узлы забирали у каждого животного. Моноклеточные суспензии клеток из всех тканей, собранных у обоих животных, объединяли и использовали для получения гибридом методом слияния клеток с использованием стандартных методик. Для слияния использовали две различных миеломных клеточных линии, F0 (как описано в de St. Groth and Scheidegger, J. Immunol. Methods, 35: 1-21 (1980)) и P3X63Ag8.653 (как описано в Kearney et al., J. Immunol., 123: 1548-1550 (1979)).
[0098] Супернатанты гибридом из 96-луночных планшетов подвергали скринингу на связывание с клоном клеток CHО-K1, стабильно трансфицированным последовательностью нуклеиновой кислоты, кодирующей полноразмерный PD-1 человека, и сравнивали со связыванием с нетрансфицированными клетками CHО-K1. В частности, супернатанты гибридом разводили 1:1 в PBS/2% FBS и инкубировали с равным объемом клеток PD-1 CHО-K1 (2,5×105 клеток в PBS/2% FBS) в течение 30 минут при 4°C. Клетки центрифугировали, один раз промывали PBS/1% FBS и инкубировали с APC-конъюгированным антителом козы против мышиного IgG (H+L) (Southern Biotechnology, Birmingham, AL) в течение 30 минут при 4°C. Клетки дважды промывали PBS/2% FBS, ресуспендировали в PBS с 2% FBS, 1% параформальдегида и анализировали флуоресценцию на биоанализаторе BD FACSARRAY™ (BD Biosciences, Franklin Lakes, NJ). Уровни IgG мыши определяли количественно с помощью ELISA.
[0099] На основе сильного связывания клеток СНО с PD-1, 46 исходных лунок размножали, и супернатанты тестировали на способность блокировать связывание DyL650-меченного PD-L1-mIgG1 Fc слитого белка с PD-1 клетками СНО. В частности, очищенные моноклональные антитела мыши инкубировали в дозозависимости от EC30 концентрации PD-L1-DyL650 (10 нМ), и ингибирование количественно определяли с помощью проточной цитометрии. Клетки из лунок, показывающие наилучшую PD-L1 блокирующую активность и самые высокие уровни мышиного IgG, субклонировали для дальнейшего анализа, включая очистку и секвенирование тяжелой и легкой цепи (VH и VL). Одиннадцать самых сильных блокаторов взаимодействия PD-1/PD-L1 отобрали для субклонирования. После подтверждения связывания PD-1 и блокирования PD-L1, отобранные субклоны размножили, и супернатант направили на очистку антитела. Очищенные антитела проверяли на связывание с PD-1 человека и яванского макака и на PD-L1 блокирующую активность. Значения KD определяли методом поверхностного плазмонного резонанса на BIACORE™ T200 (GE Healthcare, Waukesha, WI), и кинетические константы определяли при использовании программы оценки BIACORE™ T200 (GE Healthcare, Waukesha, WI). С этой целью антитела фиксировали на чипе BIACORE™ CM5, к которому были прикреплены GE антитела против IgG мыши. Мономер PD-1-His пропускали через фиксированное антитело при использовании двух- или трех-кратных серийных разведений, начиная с 500 нМ при самой высокой концентрации. Полученные сенсограммы точно аппроксимировали при использовании модели связывания 1:1 для вычисления скорости ассоциации и диссоциации и последующих аффинностей (KD).
[0100] Результаты данного примера демонстрируют способ получения моноклональных антител, которые связываются с PD-1 человека и яванского макака и блокируют связывание с лигандом PD-1.
ПРИМЕР 2
[0101] В данном примере описано конструирование и получение CDR-привитых и химерных моноклональных антител против PD-1.
[0102] Субклоны гибридом, которые продуцируют PD-1-связывающие антитела с PD-L1 блокирующей активностью, как описано в примере 1, изотипировали, подвергали ОТ-ПЦР для клонирования вариабельной области тяжелой цепи антитела (VH) и вариабельной области легкой цепи (VL), и секвенировали. В частности, РНК выделяли из осадка клеток клонов гибридом (5×105 клеток/осадок) с использованием набора RNEASY™ (Qiagen, Venlo, Netherlands), и получали кДНК, используя олиго-dT-праймерную систему SUPERSCRIPT™ III First-Strand Synthesis System (Life Technologies, Carlsbad, CA). При ПЦР амплификации VL использовали пул 9 или 11 вырожденных прямых праймеров к мышиным VL (см. Kontermann and Dubel, eds., Antibody Engineering, Springer-Verlag, Berlin (2001)) и обратный праймер к мышиной константной κ области. При ПЦР амплификации VH использовали пул 12 вырожденных прямых праймеров к мышиным VH (Kontermann and Dubel, выше) и обратный праймер к мышиной константной области γ1 или γ2a (на основе изотипирования очищенного антитела каждого клона) в соответствии с методикой, рекомендованной в SUPERSCRIPT™ III First-Strand Synthesis System (Life Technologies, Carlsbad, CA). Продукты ПЦР очищали и клонировали в pcDNA3.3-TOPO (Life Technologies, Carlsbad, CA). Отдельные колонии из каждого осадка клеток (24 тяжелых цепи и 48 легких цепей) отобрали и секвенировали при использовании стандартной методики секвенирования по Сэнгеру (Genewiz, Inc., South Plainfield, NJ). Последовательности вариабельных областей исследовали и выравнивали с ближайшей последовательностью V-области человеческой тяжелой цепи или легкой цепи зародышевой линии. Три антитела отбирали для CDR-прививания: (1) 9A2, включающее VH с SEQ ID NO: 4 и VL с SEQ ID NO: 28, (2) 10B11, включающее VH с SEQ ID NO: 15 и VL с SEQ ID NO: 32, и (3) 6E9, включающее VH с SEQ ID NO: 22 и VL с SEQ ID NO: 38.
[0103] CDR-привитые последовательности антитела сконструировали путем переноса CDR остатков каждого из описанных выше антител мыши в ближайший гомолог человеческой зародышевой линии. CDR-привитые вариабельные области антитела синтезировали и экспрессировали с константными областями человека IgG1/κ для анализа. Кроме того, сконструировали мышиные:человеческие химерные антитела при использовании вариабельных областей описанных выше антител мыши, связанных с константными областями IgG1/κ человека. Химерные и CDR-привитые антитела исследовали на связывание с PD-1 антигенами человека и яванского макака и на активность в PD-1/PD-L1 блокирующем анализе, как описано выше.
[0104] Функциональную антагонистическую активность химерных и CDR-привитых антител также исследовали в анализе со смешанной культурой человеческих CD4+ T-лимфоцитов (СКЛ), в котором активацию CD4+ Т-лимфоцитов в присутствии антител к PD-1 оценивали при измерении секреции IL-2. Поскольку PD-1 является негативным регулятором функции T-клеток, антагонизм PD-1, как ожидалось, приводит к увеличению активации Т-клеток, измеряемой по увеличению продукции IL-2. CDR-привитые антитела 9A2, 10B11 и 6E9 продемонстрировали антагонистическую активность и были отобраны для созревания аффинности.
[0105] Результаты данного примера демонстрируют способ получения химерных и CDR-привитых моноклональных антител, которые специфично связывают и ингибируют PD-1.
ПРИМЕР 3
[0106] Данный пример демонстрирует созревание аффинности моноклональных антител, направленных против PD-1.
[0107] CDR-привитые антитела, полученные из исходных мышиных моноклональных антител (9A2, 10B11, и 6E9), подвергали созреванию аффинности посредством in vitro соматической гипермутации. Каждое антитело презентировали на поверхности клеток HEK 293c18, используя систему SHM-XEL Deciduous (см. Bowers et al., Proc. Natl. Acad. Sci. USA, 108: 20455-20460 (2011); и публикацию заявки на патент США 2013/0035472). После получения стабильных эписомальных линий, вектор для экспрессии активация-индуцированной цитозин деаминазы (AID) трансфицировали в клетки, чтобы инициировать соматическую гипермутацию, как описано Bowers et al., выше. После многократных раундов FACS сортинга в условиях повышения строгости связывания антигена, ряд мутаций в вариабельной области каждого антитела идентифицировали и рекомбинировали для получения зрелых гуманизированных антител с улучшенными свойствами.
[0108] Группу из шести последовательностей аффинно-зрелых гуманизированных вариабельных областей тяжелой и легкой цепей подвергали спариванию (обозначены APE1922, APE1923, APE1924, APE1950, APE1963 и APE2058) и отбирали для исследования, как представлено в таблице 1. PD-1-связывающие свойства каждой из этих последовательностей антител анализировали при использовании поверхностного плазмонного резонанса (SPR) и анализа аффинности в растворе. Антитела экспрессировали в клетках HEK 293 как IgG1 антитела человека и сравнивали с референсным антителом, вариантом IgG1 человека BMS-936558, обозначенным BMS.
[0109] Исследования SPR выполняли при использовании BIACORE™ T200, и кинетические константы определяли при использовании программы оценки BIACORE™ T200. Экспериментальные параметры подбирали так, чтобы гарантировать, что насыщение будет достигнуто при максимальных концентрациях антигена, и что значения Rmax не будут превышать 30 RU. GE антитело против IgG человека (Fc-специфичное, приблизительно 7000 RU) иммобилизовали на чипе BIACORE™ CM5, используя EDC-активированную амин-связывающую химию. Затем антитела (0,5 мкг/мл, время прикрепления 60 секунд) прикрепляли, используя эту поверхность. Затем мономерный растворимый человеческий PD1-Avi-His пропускали через прикрепленное антитело (ассоциация 300 секунд, диссоциация 300 секунд) с использованием ряда трехкратного последовательного разведения от 500 нМ до 2 нМ. Прикрепленное антитело и антиген удаляли между каждым циклом, используя 3 М MgCl2 (время контакта 60 секунд), чтобы обеспечить новую поверхность связывания для каждой концентрации антигена. Полученные сенсограммы точно аппроксимировали при использовании модели связывания 1:1 для вычисления скоростей ассоциации и диссоциации (ka и kd, соответственно), а также аффинностей (KD).
[0110] Анализы аффинности в растворе выполняли при использовании анализа KINEXA™ 3000 (Sapidyne Instruments, Boise, Idaho), и результаты анализировали при использовании программы KINEXA™ Pro 3.2.6. Экспериментальные параметры подбирали так, чтобы получать максимальный сигнал только с одним антителом между 0,8 и 1,2 В, при этом ограничивая сигнал неспецифического связывания с чистым буфером до менее чем 10% от максимального сигнала. Азлактонные гранулы (50 мг) покрывали антигеном при разведении в растворе PD-1-Avi-His (50 мкг/мл в 1 мл) в 50 мМ Na2CO3. Раствор центрифугировали при комнатной температуре в течение 2 часов, и гранулы осаждали в микроцентрифуге PicoFuge и два раза промывали в блокирующем растворе (10 мг/мл BSA, 1 М Tris-HCl, pH 8,0). Гранулы ресуспендировали в блокирующем растворе (1 мл), центрифугировали при комнатной температуре в течение 1 часа и разбавляли в 25 объемах PBS/0,02% NaN3. Для измерения аффинности использовали вторичное антитело ALEXFLUOR™, меченное красителем 647, против человеческого IgG (500 нг/мл). Концентрации образцов антитела сохраняли постоянными (50 пМ или 75 пМ), тогда как антиген PD1-Avi-His титровали, используя трехкратные серийные разведения от 1 мкМ до 17 пМ. Все образцы разводили в PBS, 0,2% NaN3, 1 мг/мл BSA и уравновешивали при комнатной температуре в течение 30 часов. Дополнительно, образцы, содержащие только антитело и только буфер, анализировали для определения максимального сигнала и сигнала неспецифического связывания, соответственно. Результаты исследований аффинности приведены в таблице 1. Все отобранные антитела показали более высокие значения аффинности к PD-1, чем референсное антитело BMS, с наиболее высокой аффинностью у антитела APE2058.
ID NO:
ID NO:
ka (Mс)-1
kd (с-1)
KD (нМ)
KD (нМ)
[0111] Для оценки связывания антител с PD-1 клеточной поверхности, определяли связывание с клетками CHO, экспрессирующими PD-1 человека или яванского макака с помощью проточного цитометрического анализа, как описано выше. Кроме того, оценивали блокирование взаимодействия PD-1/PD-L1, используя меченный DyL650 PD-L1 (мышиный IgG1 Fc слитый белок) и PD-1-экспрессирующие CHO клетки, как описано выше. Высокие аффинности связывания с поверхностным клеточным PD-1 наблюдали для всех проверенных аффинно-зрелых последовательностей антитела, с 3-4 кратным превышением реакционной способности к PD-1 яванского макака в сравнении с PD-1 человека. Блокирование взаимодействия PD-1/PD-L1 было также эффективным в случае всех протестированных аффинно-зрелых последовательностей антитела, со значениями IC50 в нижнем диапазоне нМ. Эти результаты согласовывались с аффинностями связывания, полученными с помощью систем BIACORE™ и KINEXA™, а также со значениями EC50 на поверхности клетки.
[0112] Термическую стабильность отобранных антител оценивали при использовании анализа Thermofluor, как описано в McConnell et al., Protein Eng. Des. Sel., 26: 151 (2013). В этом анализе стабильность оценивают через способность гидрофобного флуоресцентного красителя связываться с гидрофобными карманами на поверхности белка, которые появляются при разворачивании белка. Для измерения термической стабильности определяют температуру (Тm), при которой разворачивается 50% белка. Этот анализ продемонстрировал, что все протестированные аффинно-зрелые последовательности антитела обладали высокой термической стабильностью, причем все они были более стабильными, чем референсное антитело. APE2058 было наиболее стабильным антителом, показав Тm более чем 10°C выше, чем Тm варианта IgG1 BMS-936558.
[0113] Снижение риска потенциальных проблем, связанных с in vivo фармакокинетикой тестируемых антител, проводили путем (a) исследования неспецифического связывания с мишененегативными клетками (см., например, Hotzel et al., mAbs, 4: 753-760 (2012)) и (b) измерения различных свойств диссоциации неонатального рецептора Fc (FcRn) (см., например, Wang et al., Drug Metab. Disp., 39: 1469-1477 (2011)). Для оценки неспецифического связывания, антитела тестировали на связывание с клетками HEK 293f при использовании анализа на основе проточенной цитометрии. Протестированные антитела сравнивали с двумя FDA-одобренными антителами, инфликсимабом и деносумабом. Результаты показали, что неспецифическое связывание было низким для всех антител. Для оценки FcRn связывания и диссоциации, в анализе на основе BIACORE™ тестировали и FcRn человека, и FcRn яванского макака. Антитела связывали FcRn при рН 6,0, и после доведения рН до 7,4 определяли остаточно связанное антитело. Результаты этого анализа представлены в таблице 2.
[0114] Результаты данного примера демонстрируют способ получения полипептидов тяжелых и легких цепей иммуноглобулина согласно изобретению, которые проявляют термостабильность и высокую аффинность к PD-1.
ПРИМЕР 4
[0115] В данном примере продемонстрирована in vitro активность полипептидов тяжелых и легких цепей иммуноглобулина согласно изобретению.
[0116] Функциональную антагонистическую активность VH и VL последовательностей, описанных в примере 3, тестировали в анализе СКЛ CD4+ человеческих T-лимфоцитов, как описано выше. Для определения функционального потенциала, определяли EC50 для каждого антитела в пяти отдельных экспериментах с использованием различных людей-доноров. Результаты представлены в таблице 3 и демонстрируют мощную активность каждого из отобранных антител, неотличимую от активности референсного антитела.
контроль
[0117] Результаты данного примера демонстрируют, что полипептиды тяжелой и легкой цепей иммуноглобулина согласно изобретению могут антагонизировать сигнализацию PD-1, что приводит к увеличению Т-клеточной активации.
ПРИМЕР 5
[0118] В данном примере продемонстрировано, что комбинация PD-1 связующего средства и антитела к LAG-3 или антитела к TIM-3 усиливает Т-клеточную активацию in vitro.
[0119] Чтобы установить параметры для комбинированных исследований, антитело к PD-1 APE2058 титровали в дозазависимости в СКЛ анализе с CD4+ T-клетками человека, описанном выше. Антагонистическое воздействие на сигнализацию PD-1 приводило к увеличению активации Т-клеток и соответствующему 4-5-кратному увеличению продукции IL-2.
[0120] По результатам титрования антитела APE2058 в нескольких СКЛ анализах, для комбинированных исследований с антагонистическими антителами к контрольным молекулам TIM-3 или LAG-3 были отобраны значение EC50 20 нг/мл и в 10 раз более низкая концентрация, которая соответствует приблизительному значению EC10 (2 нг/мл).
[0121] Полностью человеческое антитело к TIM-3 охарактеризовали в in vitro CD4+ T-клеточном анализе, как обладающее антагонистической активностью, измеряемой по увеличению продукции IL-2 в присутствии низких уровней антител к CD3 и к CD28. Антитело к TIM-3 продемонстрировало активность в СКЛ анализе со значением EC50 приблизительно 0,3 мкг/мл, как показано на фигуре 2 и в таблице 4, что приблизительно в 15 раз меньше активности, чем у одного антитела к PD-1 APE2058 (EC50 приблизительно 0,02 мкг/мл). В комбинации с 0,02 мкг/мл APE2058, антагонистическое антитело к TIM-3 стимулировало увеличенные уровни продукции IL-2 по сравнению с APE2058 или одним антителом к TIM-3, что приводит к 10-кратному уменьшению значений EC50, как показано на фигуре 2 и в таблице 4. Эти результаты демонстрируют, что увеличение активации Т-клеток происходит при комбинировании ингибирования PD-1 и TIM-3 контрольных путей.
[0122] Полностью человеческое антагонистическое антитело к LAG-3 (описанное в публикации заявки на патент США 2011/0150892) продемонстрировало мощную активность в блокировании связывания рекомбинантного растворимого LAG-3 с MHC класса II-положительными клетками. Это антитело, обозначенное в настоящей заявке как APE03109, оценивали на функциональную активность в СКЛ анализе на CD4+ T-клетках человека. APE03109 продемонстрировало активность в СКЛ со значением EC50 приблизительно 0,05 мкг/мл, как показано на фигуре 3 и в таблице 4, что близко к активности только одного антитела к PD-1. В комбинации с 0,02 мкг/мл антитела к PD-1 APE2058, антитело APE03109 стимулировало увеличение уровня продукции IL-2 по сравнению с APE2058 или одним APE03109, что приводит к 5-кратному уменьшению значений EC50.
[0123] Также исследовали динамику продукции IL-2 с одним антителом к LAG-3 APE03109 и в комбинации APE2058 и APE03109 в СКЛ анализе на CD4+ T-клетках человека. Сходное уменьшение значения EC50 при комбинировании 0,02 мкг/мл APE2058 и APE03109 наблюдали через 72 часа культивирования, как показано на фигуре 3. Через 96 часов культивирования различия в значениях EC50 не были заметны; однако уровни IL-2, продуцируемого в культурах, обработанных 0,02 мкг/мл антитела к PD-1 APE2058 и антитела к LAG-3 APE03109, почти удвоились по сравнению с культурами, обработанными одним APE03109 (2200 пг/мл и 1200 пг/мл). В согласовании с динамикой экспрессии LAG-3, через 24 часа не наблюдали увеличения продукции IL-2 при добавлении APE03109 к APE2058, хотя одно APE2058 показало дозозависимое увеличение продукции IL-2. В отдельных СКЛ экспериментах было также продемонстрировано, что при комбинировании APE2058 и APE03109 уровни продукции Т-клеточного цитокина IFN-γ увеличивались более чем на 50% через 48 часов.
[0124] Чтобы продемонстрировать, что комбинированные эффекты антитела к TIM-3 или антитела к LAG-3 в СКЛ CD4+ T-клеток человека были обусловлены мишенеспецифичностью, нерелевантное IgG1 антитело человека, APE0422, тестировали в комбинации с 0,02 мкг/мл антитела к PD-1 APE2058. При максимальной тестируемой концентрации (30 мкг/мл) антитело APE0422 не показывало воздействия на продукцию IL-2 по сравнению с одним антителом к PD-1.
Одно средство
с 2 нг/мл антитела к PD-1
с 20 нг/мл антитела к PD-1
увеличения
TIM-3
LAG-3
[0125] Результаты данного примера демонстрируют, что при комбинировании PD-1-связывающего средства согласно изобретению с антагонистическими антителами, направленными против TIM-3 или LAG-3, усиливается активация CD4+ Т-клеток in vitro.
[0126] Все ссылки, включая публикации, заявки на патент и патенты, цитируемые в настоящей заявке, включены посредством отсылки в той же степени, как если бы каждый источник был индивидуально и прямо включен посредством отсылки и полностью приведен в настоящей заявке.
[0127] Использование терминов "a" и "an", и "the", и "по меньшей мере один" и подобных отсылок в рамках описания изобретения (в особенности, в рамках последующей формулы) следует трактовать как охватывающее единственное и множественное число, если в настоящем описании не указано иное и иное прямо не следует из контекста. Использование термина "по меньшей мере один", сопровождаемое списком одного или более элементов (например, "по меньшей мере один из A и B"), следует трактовать как обозначающее, что один элемент выбран из перечисленных элементов (A или B), или как любую комбинацию двух или более из перечисленных элементов (A и B), если иное не указано в настоящем описании и прямо не следует из контекста. Термины "содержащий", "имеющий" и "включающий" следует трактовать, как открытые термины (то есть означающие "включающий, без ограничения перечисленным"), если не указано иное. Указание диапазонов значений в настоящей заявке предназначено только для того, чтобы служить кратким способом отсылки индивидуально к каждому отдельному значению, попадающему в диапазон, если в настоящей заявке не указано иное, при этом каждое отдельное значение включено в описание, как если бы оно было отдельно указано в настоящей заявке. Все способы, раскрытые в настоящей заявке, могут быть выполнены в любом подходящем порядке, если в настоящей заявке не указано иное или иное прямо не следует из контекста. Предложенное в настоящем описании применение всех без исключения примеров, или примерного выражения (например, "такой как"), предназначено исключительно для более полного понимания изобретения и не предполагает ограничения объема изобретения, если не заявлено иное. Ни одно выражение в описании не следует рассматривать, как указывающее на какой-либо незаявленный элемент в качестве существенного для осуществления изобретения.
[0128] В настоящей заявке описаны предпочтительные варианты осуществления настоящего изобретения, включая наилучший вариант осуществления изобретения, известный авторам изобретения. Вариации этих предпочтительных вариантов осуществления могут быть очевидными средним специалистам в данной области после прочтения предыдущего описания. Авторы изобретения ожидают, что специалисты будут использовать такие изменения соответствующим образом, при этом авторы изобретения предполагают, что изобретение можно применить иначе, нежели конкретно описано в настоящей заявке. Таким образом, настоящее изобретение включает все модификации и эквиваленты, описанные в прилагаемой формуле, в соответствии с действующим законодательством. Кроме того, изобретением охвачена любая комбинация описанных выше элементов во всех возможных их вариантах, если в настоящей заявке не указано иное или иное прямо не следует из контекста.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ANAPTYSBIO, INC.
<120> АНТИТЕЛА, НАПРАВЛЕННЫЕ к PROGRAMMED DEATH-1 (PD-1)
<130> 716746
<150> US 61/818,755
<151> 2013-05-02
<160> 64
<170> PatentIn version 3.5
<210> 1
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 1
Gly Phe Thr Phe Ser Ser Tyr Thr Leu Ser
1 5 10
<210> 2
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 2
Val Ile Ser Ser Gly Gly Asp Tyr Ala Tyr
1 5 10
<210> 3
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 3
Asp His Tyr Gly Thr Ser His Phe Ala Tyr
1 5 10
<210> 4
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 4
Asp Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Leu Ser Trp Val Arg Gln Thr Pro Gly Lys Arg Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Ser Gly Gly Asp Tyr Ala Tyr Tyr Pro Asp Ser Val
50 55 60
Gln Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ser Arg Asp His Tyr Gly Thr Ser His Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala Ala
115 120
<210> 5
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 5
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Leu Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Ser Gly Gly Asp Tyr Ala Tyr Tyr Pro Asp Ser Val
50 55 60
Gln Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp His Tyr Gly Thr Ser His Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 6
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 6
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Ser Gly Gly Asp Ser Ala Tyr Tyr Pro Asp Ser Val
50 55 60
Gln Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu His Tyr Gly Thr Ser His Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 7
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 7
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Ser Gly Gly Asn Ser Ala Tyr Tyr Pro Asp Ser Val
50 55 60
Gln Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu His Tyr Gly Thr Ser His Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 8
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 8
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Ser Gly Gly Asn Tyr Ala Tyr Tyr Pro Asp Ser Val
50 55 60
Gln Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu His Tyr Gly Thr Ser His Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 9
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 9
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Ser Gly Gly Asp Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Gln Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu His Tyr Gly Thr Ser His Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 10
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 10
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Ser Gly Gly Asn Ser Ala Tyr Tyr Pro Asp Ser Val
50 55 60
Gln Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Tyr Tyr Gly Ser Ser His Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 11
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 11
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Ser Gly Gly Asn Ser Ala Tyr Tyr Pro Asp Ser Val
50 55 60
Gln Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu His Tyr Gly Ser Ser His Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 12
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 12
Gly Phe Thr Phe Ser Ser Tyr Thr Met Ser
1 5 10
<210> 13
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 13
Val Ile Ser Ser Gly Gly Asn Ser Thr Tyr
1 5 10
<210> 14
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 14
Glu His Tyr Gly Ser Ser His Phe Ala Tyr
1 5 10
<210> 15
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 15
Asp Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Val Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Ser Gly Gly Asn Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Thr Arg Glu His Tyr Gly Ser Ser His Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala Ala
115 120
<210> 16
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 16
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Ser Gly Gly Asn Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu His Tyr Gly Ser Ser His Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 17
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 17
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Leu Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Ser Gly Gly Asn Tyr Ala Tyr Tyr Pro Asp Ser Val
50 55 60
Gln Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu His Tyr Gly Thr Ser His Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 18
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 18
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Leu Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Ser Gly Gly Asn Tyr Ala Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu His Tyr Gly Thr Ser His Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 19
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 19
Gly Phe Thr Phe Ser Ser Tyr Asp Met Ser
1 5 10
<210> 20
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 20
Thr Ile Ser Gly Gly Gly Ser Tyr Thr Tyr
1 5 10
<210> 21
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 21
Pro Tyr Tyr Ala Met Asp Tyr
1 5
<210> 22
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 22
Glu Val Met Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Gly Gly Gly Ser Tyr Thr Tyr Tyr Gln Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Ser Pro Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val
100 105 110
Thr Val Ser Ser Ala
115
<210> 23
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 23
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Gly Gly Gly Ser Tyr Thr Tyr Tyr Gln Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Pro Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser Ala
115
<210> 24
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 24
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Gly Gly Gly Ser Tyr Thr Tyr Tyr Gln Asp Ser Val
50 55 60
Lys Gly Arg Phe Ile Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Pro Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser Ala
115
<210> 25
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 25
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Arg Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Ile Ser Gly Gly Gly Ser Tyr Thr Tyr Tyr Gln Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Pro Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser Ala
115
<210> 26
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 26
Arg Ala Ser Glu Ser Val Asp Asn Phe Gly Ile Ser Phe Met Ser
1 5 10 15
<210> 27
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 27
Ala Ala Ser Asn Pro Gly Ser
1 5
<210> 28
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 28
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Phe
20 25 30
Gly Ile Ser Phe Met Ser Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Pro Gly Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Val Ser Gly Thr Asp Phe Ser Leu Asn Ile His
65 70 75 80
Pro Met Glu Glu Asp Asp Ala Ala Met Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 29
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 29
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Phe
20 25 30
Gly Ile Ser Phe Met Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Ala Ala Ser Asn Pro Gly Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 30
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 30
Arg Ala Ser Glu Ser Val Asp Lys Tyr Gly Ile Ser Phe Met Ser
1 5 10 15
<210> 31
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 31
Ala Ala Ser Asn Gln Gly Ser
1 5
<210> 32
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 32
Asp Ile Val Leu Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Leu Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Lys Tyr
20 25 30
Gly Ile Ser Phe Met Ser Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Gln Gly Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Ser Leu Asn Ile His
65 70 75 80
Pro Met Glu Glu Asp Asp Thr Ala Met Tyr Phe Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 33
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 33
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Glu Ser Val Asp Lys Tyr
20 25 30
Gly Ile Ser Phe Met Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Gln Gly Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 34
<211> 129
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 34
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Glu Ser Val Asp Lys Tyr
20 25 30
Gly Ile Thr Phe Met Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Gln Gly Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Lys
85 90 95
Glu Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu
<210> 35
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 35
Lys Ala Ser Gln Asp Val Gly Thr Ala Val Ala
1 5 10
<210> 36
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 36
Trp Ala Ser Thr Arg His Thr
1 5
<210> 37
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 37
Gln His Tyr Ser Ser Tyr Pro Trp Thr
1 5
<210> 38
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 38
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Asp Tyr Phe Cys Gln His Tyr Ser Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 39
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 39
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His Tyr Ser Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 40
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 40
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Tyr Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His Tyr Ser Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 41
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 41
Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Tyr Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His Tyr Asn Ser Tyr Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 42
<211> 362
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 42
gacgtgaagc tggtggagtc tgggggaggc ttagtgaagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt agttataccc tgtcttgggt tcgccagact 120
ccggggaaga ggctggagtg ggtcgcagtc attagtagtg gtggtgatta cgcctactat 180
ccagacagtg tgcagggccg attcaccatc tccagagaca atgccaagaa caccctgtac 240
ctgcaaatga acagtctgaa gtctgaggac acagccatgt attactgttc aagagatcac 300
tacggtacta gtcactttgc ttactggggc caagggactc tggtcactgt ctctgcagcc 360
tc 362
<210> 43
<211> 362
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 43
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cactttcagt agttataccc tgtcttgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagtc attagtagtg gtggtgatta cgcctactat 180
ccagacagtg tgcagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaagatcac 300
tacggtacta gtcactttgc ttactggggc caaggaaccc tggtcaccgt ctcctcagca 360
tc 362
<210> 44
<211> 362
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 44
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cactttcagt agttatacca tgtcttgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagtc attagtagtg gtggtgattc cgcctactat 180
ccagacagtg tgcagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaagagcac 300
tacggtacta gtcactttgc ttactggggc caaggaaccc tggtcaccgt ctcctcagca 360
tc 362
<210> 45
<211> 362
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 45
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cactttcagt agttatacca tgtcttgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagtc attagtagtg gtggtaattc cgcctactat 180
ccagacagtg tgcagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaagagcac 300
tacggtacta gtcactttgc ttactggggc caaggaaccc tggtcaccgt ctcctcagca 360
tc 362
<210> 46
<211> 362
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 46
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cactttcagt agttatacca tgtcttgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagtc attagtagtg gtggtaatta cgcctactat 180
ccagacagtg tgcagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaagagcac 300
tacggtacta gtcactttgc ttactggggc caaggaaccc tggtcaccgt ctcctcagca 360
tc 362
<210> 47
<211> 362
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 47
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cactttcagt agttatacca tgtcttgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagtc attagtagtg gtggtgattc cacctactat 180
ccagacagtg tgcagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaagagcac 300
tacggtacta gtcactttgc ttactggggc caaggaaccc tggtcaccgt ctcctcagca 360
tc 362
<210> 48
<211> 362
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 48
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cactttcagt agttatacca tgtcttgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagtc attagtagtg gtggtaattc cgcctactat 180
ccagacagtg tgcagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaagagtac 300
tacggttcta gtcactttgc ttactggggc caaggaaccc tggtcaccgt ctcctcagca 360
tc 362
<210> 49
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 49
gacgtgaagc tggtggagtc tgggggaggc ttagtgaagc ctggagggtc cctgaaagtc 60
tcctgtgcag cctctggatt cactttcagt agctatacca tgtcttgggt tcgccagact 120
ccggagaaga ggctggagtg ggtcgcagtc attagtagtg gtggtaattc cacctactat 180
ccagacagtg tgaagggccg attcaccatc tccagagaca atgccaagaa caccctgtac 240
ctgcaaatga gcagtctgaa gtctgaggac acagccatgt attactgtac aagagagcac 300
tacggtagta gtcactttgc ttactggggc caagggactc tggtcactgt ctctgcagcc 360
<210> 50
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 50
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cactttcagt agctatacca tgtcttgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagtc attagtagtg gtggtaattc cacctactat 180
ccagacagtg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaagagcac 300
tacggtagta gtcactttgc ttactggggc caaggaaccc tggtcaccgt ctcctcagca 360
<210> 51
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 51
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cactttcagt agctataccc tgtcttgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagtc attagtagtg gtggtaatta cgcctactat 180
ccagacagtg tgcagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gaaagagcac 300
tacggtacta gtcactttgc ttactggggc caaggaaccc tggtcaccgt ctcctcagca 360
<210> 52
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 52
gaagtgatgc tggtggagtc tgggggaggc ttagtgaagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt agctatgaca tgtcttgggt tcgccagact 120
ccggagaaga ggctggagtg ggtcgcaacc attagtggtg gtggtagtta cacctactat 180
caagacagtg tgaaggggcg attcaccatc tccagagaca atgccaagaa caccctgtac 240
ctgcaaatga gcagtctgag gtctgaggac acggccatgt attactgtgc ctccccttac 300
tatgctatgg actactgggg tcaaggaacc tcagtcaccg tctcctcagc a 351
<210> 53
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 53
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cactttcagt agctatgaca tgtcttgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcaacc attagtggtg gtggtagtta cacctactat 180
caagacagtg tgaaggggcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gtccccttac 300
tatgctatgg actactgggg gcaagggacc acggtcaccg tctcctcagc a 351
<210> 54
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 54
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cactttcagt agctatgaca tgtcttgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcaacc attagtggtg gtggtagtta cacctactat 180
caagacagtg tgaaggggcg gttcatcatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gtccccttac 300
tatgctatgg actactgggg gcaagggacc acggtcaccg tctcctcagc a 351
<210> 55
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 55
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cactttcagt agctatgaca tgtcttgggt ccgccgggct 120
ccagggaagg ggctggagtg ggtctcaacc attagtggtg gtggtagtta cacctactat 180
caagacagtg tgaaggggcg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccgtat attactgtgc gtccccttac 300
tatgctatgg actactgggg gcaagggacc acggtcaccg tctcctcagc a 351
<210> 56
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 56
gacattgtgc tgacccaatc tccagcttct ttggctgtgt ctctagggca gagggccacc 60
atctcctgca gagccagcga aagtgttgat aattttggca ttagttttat gagctggttc 120
caacagaaac caggacagcc acccaaactc ctcatctatg ctgcatccaa cccaggatcc 180
ggggtccctg ccaggtttag tggcagtgta tctgggacag acttcagcct caacatccat 240
cctatggagg aggatgatgc tgcaatgtat ttctgtcagc aaagtaagga ggttccgtac 300
acgttcggag gggggaccaa gctggaaata aaacgg 336
<210> 57
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 57
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca gagccagcga aagtgttgat aattttggca ttagttttat gagctggtac 120
caacagaaac ctggccaggc tcccaggctc ctcatctatg ctgcatccaa cccaggatcc 180
ggcatcccag ccaggttcag tggcagtggg tctgggacag acttcactct caccatcagc 240
agcctagagc ctgaagattt tgcagtttat tactgtcagc aaagtaagga ggttccgtac 300
acgtttggcc aggggaccaa gctggagatc aaacgg 336
<210> 58
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 58
gacattgtgc tgacccaatc tccagattct ttggctgtgt ctctagggct gagggccacc 60
atctcctgca gagccagcga aagtgttgat aaatatggca ttagttttat gagctggttc 120
caacagaaac caggacagcc acccaaactc ctcatctatg ctgcatccaa ccaaggatcc 180
ggggtccctg ccaggtttag tggcagtggg tctgggacag acttcagcct caacatccat 240
cctatggagg aggatgatac tgcaatgtat ttctgtcagc aaagtaagga ggttccgtac 300
acgttcggag gggggaccaa gctggaaata aaacgg 336
<210> 59
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 59
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc 60
atcaactgca gagccagcga aagtgttgat aaatatggca ttagttttat gagctggtac 120
cagcagaaac caggacagcc tcctaagctg ctcatttacg ctgcatccaa ccaaggatcc 180
ggggtccctg accgattcag tggcagcggg tctgggacag atttcactct caccatcagc 240
agcctgcagg ctgaagatgt ggcagtttat tactgtcagc aaagtaagga ggttccgtac 300
acgtttggcc aggggaccaa gctggagatc aaacgg 336
<210> 60
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 60
gacatcgtga tgacccagtc tccagactcc ctggctgtgt ctctgggcga gagggccacc 60
atcaactgca gagccagcga aagtgttgat aaatatggca ttacttttat gagctggtac 120
cagcagaaac caggacagcc tcctaagctg ctcatttacg ctgcatccaa ccaaggatcc 180
ggggtccctg accgattcag tggcagcggg tctgggacag atttcactct caccatcagc 240
agcctgcagg ctgaagatgt ggcagtttat tactgtcagc aaagtaagga ggttccgtac 300
acgtttggcc aggggaccaa gctggagatc aaacgg 336
<210> 61
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 61
gacattgtga tgacccagtc tcacaaattc atgtccacat cagtaggaga cagggtcagc 60
atcacctgca aggccagtca ggatgtgggt actgctgtag cctggtatca acagaaacca 120
gggcaatctc ctaaactact gatttactgg gcatccaccc ggcacactgg agtccctgat 180
cgcttcacag gcagtggatc tgggacagat ttcactctca ccattagcaa tgtgcagtct 240
gaagacttgg cagattattt ctgtcagcat tatagcagct atccgtggac gttcggtgga 300
ggcaccaaac tggaaatcaa acgg 324
<210> 62
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 62
gacatccagt tgacccagtc tccatccttc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgca aggccagtca ggatgtgggt actgctgtag cctggtatca gcaaaaacca 120
gggaaagccc ctaagctcct gatctattgg gcatccaccc ggcacactgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca caatcagcag cctgcagcct 240
gaagattttg caacttatta ctgtcagcat tatagcagct atccgtggac gtttggccag 300
gggaccaagc tggagatcaa acgg 324
<210> 63
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 63
gacatccagt tgacccagtc tccatccttc ctgtctgcat atgtaggaga cagagtcacc 60
atcacttgca aggccagtca ggatgtgggt actgctgtag cctggtatca gcaaaaacca 120
gggaaagccc ctaagctcct gatctattgg gcatccaccc tgcacactgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca caatcagcag cctgcagcct 240
gaagattttg caacttatta ctgtcagcat tatagcagct atccgtggac gtttggccag 300
gggaccaagc tggagatcaa acgg 324
<210> 64
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтетическая последовательность
<400> 64
gacatccagt tgacccagtc tccatccttc ctgtctgcat atgtaggaga cagagtcacc 60
atcacttgca aggccagtca ggatgtgggt actgctgtag cctggtatca gcaaaaacca 120
gggaaagccc ctaagctcct gatctattgg gcatccaccc ggcacactgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca caatcagcag cctgcagcct 240
gaagattttg caacttatta ctgtcagcat tataacagct atccgtggac gtttggccag 300
gggaccaagc tggagatcaa acgg 324
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К PD-1 И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2761640C2 |
| ИММУНОТЕРАПИЯ С ПРИМЕНЕНИЕМ АНТИТЕЛ, СВЯЗЫВАЮЩИХ БЕЛОК 1 ПРОГРАММИРУЕМОЙ СМЕРТИ КЛЕТОК (PD-1) | 2017 |
|
RU2768404C2 |
| АНТИТЕЛА К PD-1 СОБАК | 2014 |
|
RU2732604C2 |
| АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2788095C2 |
| Иммунотерапия с применением антител, связывающих лиганд 1 белка программируемой смерти клеток (PD-L1) | 2017 |
|
RU2766582C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ НА ОСНОВЕ АКТИВИРУЮЩИХ Т-КЛЕТКИ БИСПЕЦИФИЧЕСКИХ АНТИГЕНСВЯЗЫВАЮЩИХ МОЛЕКУЛ ПРОТИВ CD3 И ФОЛАТНОГО РЕЦЕПТОРА 1 (FOLR1) И АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХСЯ С ОСЬЮ PD-1 | 2015 |
|
RU2753902C2 |
| АНТИ-PD-1 АНТИТЕЛА | 2017 |
|
RU2752832C2 |
| ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНЫХ АНТИГЕННЫХ РЕЦЕПТОРОВ И ИНГИБИТОРОВ PD-1 | 2017 |
|
RU2809160C2 |
| АНТИТЕЛА ПРОТИВ PD-1 И КОМПОЗИЦИИ | 2016 |
|
RU2750675C1 |
| ВЫСОКОАФФИННЫЕ АНТИ-PD-1 И АНТИ-LAG-3 АНТИТЕЛА И ПОЛУЧЕННЫЕ ИЗ НИХ БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ | 2019 |
|
RU2782381C2 |
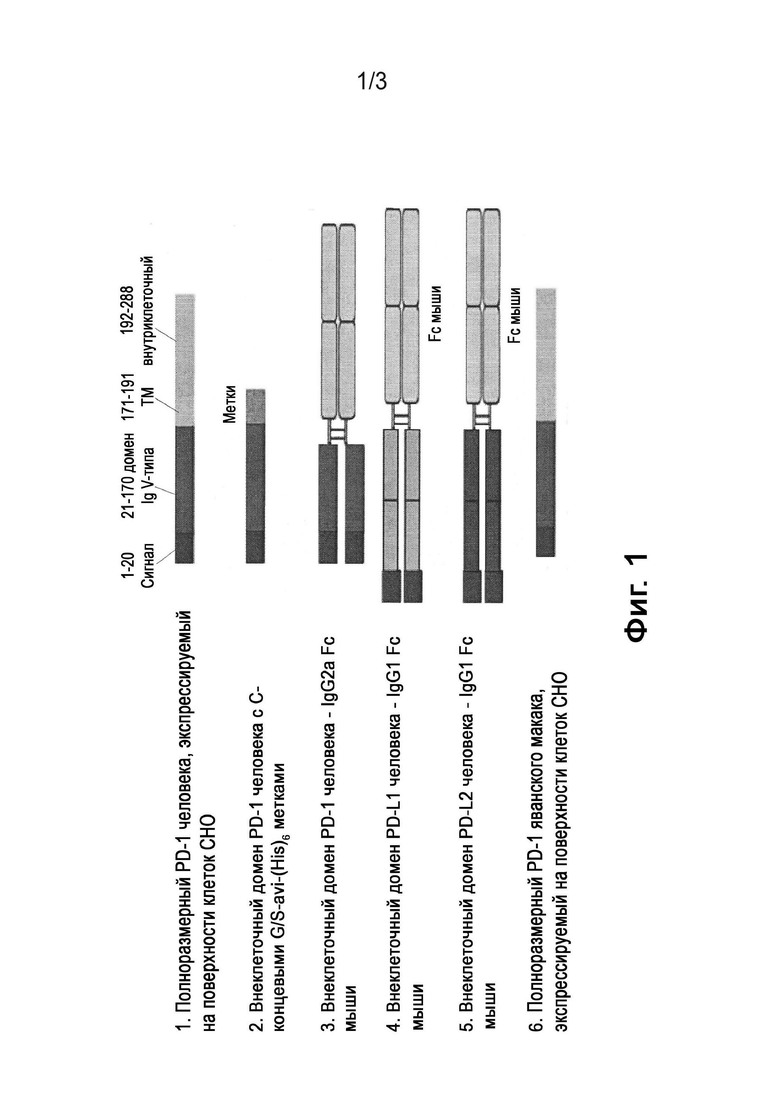
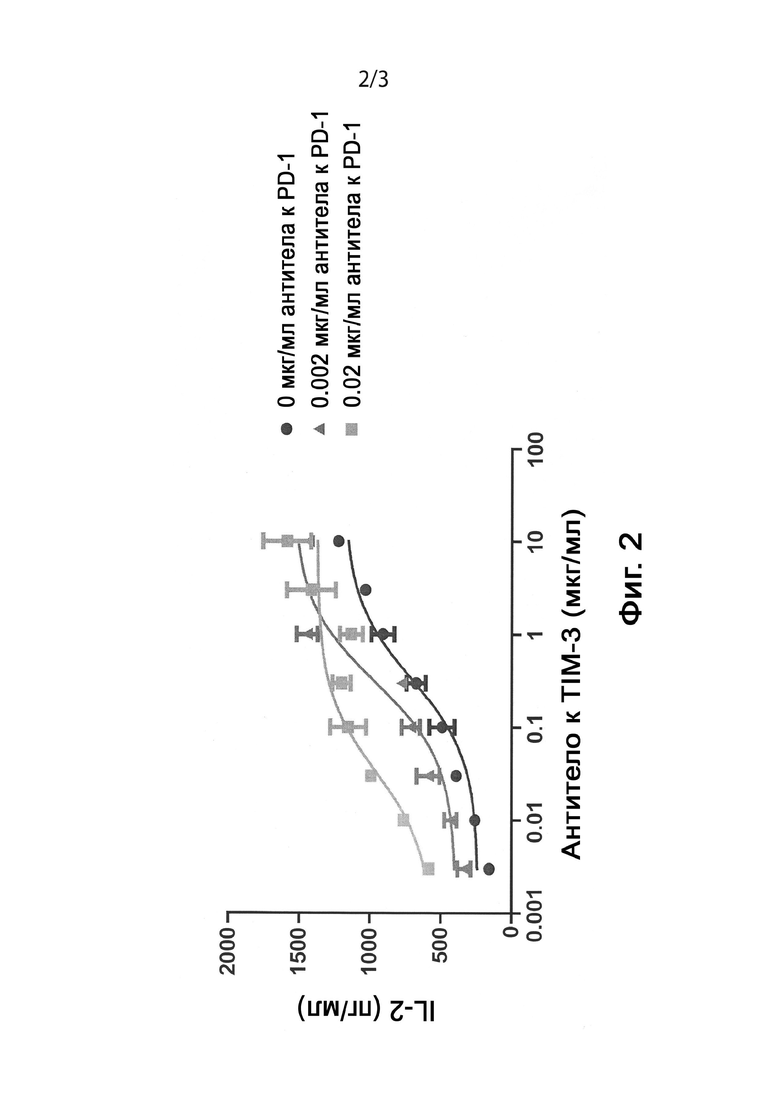
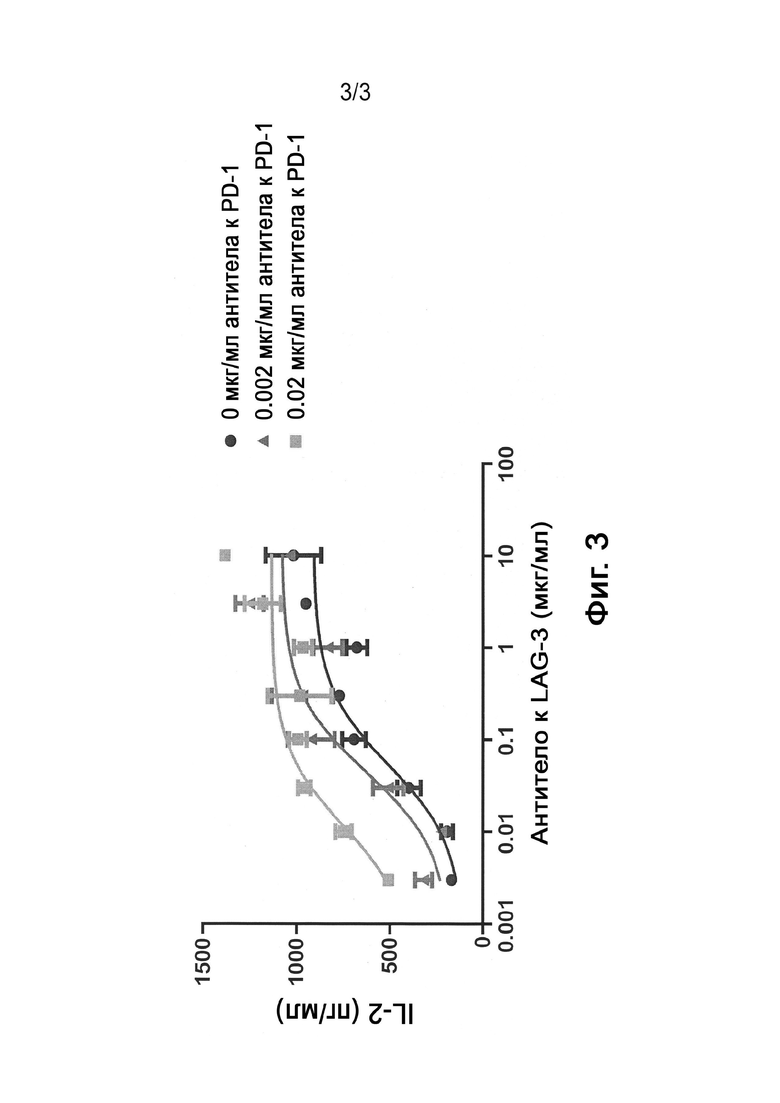
Изобретение относится к области биохимии, в частности к анти-PD-1-антителу, которое специфически связывается с PD-1 (белок 1 программируемой клеточной гибели). Также раскрыты нуклеиновая кислота, кодирующая указанное антитело; вектор экспрессии, линия клеток и клетка-хозяин, продуцирующие указанное антитело; фармацевтическая композиция, содержащие указанное антитело. Раскрыты способ получения указанного антитела; способ лечения и способ увеличение иммуногенности или активности иммунной клетки с помощью указанного антитела. Изобретение обладает способностью эффективно лечить заболевания, ассоциированные с PD-1. 12 н. и 33 з.п. ф-лы, 5 пр., 4 табл., 3 ил.
1. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела, содержащее:
полипептид вариабельной области тяжелой цепи иммуноглобулина (VH), включающий определяющую комплементарность область 1 (CDR), включающую аминокислотную последовательность SEQ ID NO: 19, CDR2, включающую аминокислотную последовательность SEQ ID NO: 20, и CDR3, включающую аминокислотную последовательность SEQ ID NO: 21; и
полипептид вариабельной области легкой цепи иммуноглобулина (LH), включающий CDR1, включающую аминокислотную последовательность SEQ ID NO: 35, CDR2, включающую аминокислотную последовательность SEQ ID NO: 36 за исключением того, что остаток 5 SEQ ID NO: 36 заменен остатком лейцина (L), и CDR3, включающую аминокислотную последовательность SEQ ID NO: 37,
причем антитело или антиген-связывающий фрагмент антитела специфично связывается с PD-1.
2. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по п.1, в котором
полипептид легкой цепи иммуноглобулина включает вариабельную область легкой цепи (VL) с аминокислотной последовательностью, по меньшей мере на 90% идентичной SEQ ID NO: 40; и
полипептид тяжелой цепи иммуноглобулина включает вариабельную область тяжелой цепи (VH) с аминокислотной последовательностью, по меньшей мере на 90% идентичной SEQ ID NO: 23,
причем PD-1-специфичное антитело или антиген-связывающий фрагмент антитела сохраняет биологическую активность PD-1-специфичного антитела или антиген-связывающего фрагмента антитела, включающего VL область, содержащую аминокислотную последовательность SEQ ID NO: 40, и VH область, содержащую аминокислотную последовательность SEQ ID NO: 23.
3. Антитело к белку запрограммированной гибели 1 (PD-1) или антиген-связывающий фрагмент антитела, содержащее:
вариабельную области легкой цепи иммуноглобулина (VL), содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 40; и
вариабельную области тяжелой цепи иммуноглобулина (VH), содержащую аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO: 23,
причем антитело или антиген-связывающий фрагмент антитела специфично связывается с PD-1 и сохраняет биологическую активность PD-1-специфичного антитела или антиген-связывающего фрагмента антитела, включающего VL область, содержащую аминокислотную последовательность SEQ ID NO: 40, и VH область, содержащую аминокислотную последовательность SEQ ID NO: 23.
4. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-3, в котором VL область содержит аминокислотную последовательность, по меньшей мере на 95% идентичную SEQ ID NO: 40.
5. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-4, в котором VH область содержит аминокислотную последовательность, по меньшей мере на 95% идентичную SEQ ID NO: 23.
6. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-5, в котором VL область содержит аминокислотную последовательность SEQ ID NO: 40.
7. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-5, в котором VH область содержит аминокислотную последовательность SEQ ID NO: 23.
8. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-5, в котором VL область содержит SEQ ID NO: 40, и VH область содержит SEQ ID NO: 23.
9. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-8, где антитело или антиген-связывающий фрагмент антитела представляет собой антигенсвязывающий фрагмент антитела.
10. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-9, где антитело или антиген-связывающий фрагмент антитела представляет собой антитело, включающее константную область (Fc) тяжелой цепи IgG1, IgG2 или IgG4.
11. Анти-PD-1-антитело по п.10, содержащее полипептид тяжелой цепи иммуноглобулина, включающий аминокислотную последовательность SEQ ID NO: 23, полипептид легкой цепи иммуноглобулина, включающий аминокислотную последовательность SEQ ID NO: 40, и константную область (Fc) тяжелой цепи IgG4.
12. Нуклеиновая кислота, кодирующая полипептид легкой цепи иммуноглобулина анти-PD-1-антитела или антиген-связывающего фрагмента антитела по любому из пп. 1-11.
13. Нуклеиновая кислота, кодирующая полипептид тяжелой цепи иммуноглобулина анти-PD-1-антитела или антиген-связывающего фрагмента антитела по любому из пп. 1-11.
14. Нуклеиновая кислота, кодирующая полипептид тяжелой цепи иммуноглобулина и полипептид легкой цепи иммуноглобулина анти-PD-1-антитела или антиген-связывающего фрагмента антитела по любому из пп. 1-11.
15. Вектор экспрессии, включающий нуклеиновую кислоту по любому из пп. 12-14.
16. Клетка-хозяин для экспрессии анти-PD-1-антитела или антиген-связывающего фрагмента антитела, включающая
i) вектор экспрессии, кодирующий полипептид легкой цепи иммуноглобулина анти-PD-1-антитела или антиген-связывающего фрагмента антитела по любому из пп. 1-11, и вектор экспрессии, кодирующий полипептид тяжелой цепи иммуноглобулина анти-PD-1-антитела или антиген-связывающего фрагмента антитела по любому из пп. 1-11, или
ii) вектор экспрессии, кодирующий полипептид тяжелой цепи и легкой цепи иммуноглобулина анти-PD-1-антитела или антиген-связывающего фрагмента антитела по любому из пп. 1-11.
17. Клетка-хозяин по п.16, представляющая собой клетку-хозяин млекопитающего.
18. Фармацевтическая композиция для лечения PD-1-ассоциированного заболевания, включающая эффективное количество антитела или антиген-связывающего фрагмента антитела по любому из пп. 1-11 и фармацевтически приемлемый носитель или разбавитель.
19. Фармацевтическая композиция по п.18, составленная для парентерального введения.
20. Способ получения анти-PD-1-антитела или антиген-связывающего фрагмента антитела по любому из пп. 1-11, включающий экспрессию одной или более нуклеиновых кислот, кодирующих тяжелую или легкую цепи иммуноглобулина антитела, в клетке in vitro.
21. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-11 или фармацевтическая композиция по п.18 или 19 для лечения рака, ассоциированного с суперэкспрессией белка PD-1 у человека.
22. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-11 или фармацевтическая композиция по п.18 или 19 для применения в качестве лекарственного средства для лечения рака.
23. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-11 или фармацевтическая композиция по п.18 или 19 для применения в качестве лекарственного средства для усиления иммунного ответа или увеличения активности иммунной клетки.
24. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-11 или фармацевтическая композиция по п.18 или 19 для применения по п.23, причем иммунный ответ или активность представляет собой клеточный иммунный ответ.
25. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-11 или фармацевтическая композиция по п.18 или 19 для применения по п.24, причем иммунный ответ или активность представляет собой Т-клеточный ответ.
26. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-11 или фармацевтическая композиция по п.18 или 19 для применения по любому из пп. 22-25 в комбинации с анти-TIM-3 антителом или анти-LAG-3 антителом.
27. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-11 или фармацевтическая композиция по п.18 или 19 для применения по любому из пп. 23-26, причем иммунная клетка представляет собой иммунную клетку человека.
28. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-11 или фармацевтическая композиция по п.18 или 19 для применения по п.27, причем у человека имеется инфекционное заболевание.
29. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-11 или фармацевтическая композиция по п.18 или 19 для применения по п.27, причем у человека имеется рак.
30. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-11 или фармацевтическая композиция по п.18 или 19 для применения по п.29, причем рак характеризуется экспрессией PD-1 или PD-L1.
31. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-11 или фармацевтическая композиция по п.18 или 19 для применения по п.30, причем рак выбран из группы, состоящей из: меланомы, почечно-клеточного рака, рака легкого, рака мочевого пузыря, рака молочной железы, рака шейки матки, рака толстой кишки, рака желчного пузыря, рака гортани, рака печени, рака щитовидной железы, рака желудка, рака слюнной железы, рака предстательной железы, рака поджелудочной железы и карциному Меркеля.
32. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-11 или фармацевтическая композиция по п.18 или 19 для применения по любому из пп. 21-31, причем время полужизни антитела составляет от 30 минут до 45 дней.
33. Анти-PD-1-антитело или антиген-связывающий фрагмент антитела по любому из пп. 1-11 или фармацевтическая композиция по п.18 или 19 для применения по любому из пп. 21-32, причем антитело связывается с PD-1 с KD менее 1 нM.
34. Линия клеток, содержащая одну или более нуклеиновых кислот, кодирующих тяжелую и легкую цепи иммуноглобулина анти-PD-1-антитела или антиген-связывающего фрагмента антитела по любому из пп. 1-11, и которая продуцирует анти-PD-1-антитела или антиген-связывающего фрагмента антитела.
35. Способ усиления иммунного ответа или увеличения активности иммунной клетки у человека, включающий введение человеку анти-PD-1-антитела или антиген-связывающего фрагмента антитела по любому из пп. 1-11 или фармацевтической композиции по п.18 или 19, в котором человек имеет PD-1-ассоциированное заболевание.
36. Способ по п.35, в котором иммунный ответ или активность представляет собой клеточный иммунный ответ.
37. Способ по п.35 или 36, в котором иммунный ответ или активность представляет собой Т-клеточный ответ.
38. Способ по любому из пп. 35-37, в котором у человека имеется инфекционное заболевание.
39. Способ по любому из пп. 35-38, в котором у человека имеется рак.
40. Способ лечения рака, асоциированного с суперэкспрессией белка PD-1, включающий введение человеку антитела по любому из пп. 1-11 или фармацевтической композиции по п.18 или 19.
41. Способ по п.39 или 40, в котором рак характеризуется экспрессией PD-1 или PD-L1.
42. Способ по любому из пп. 39-41, в котором рак выбран из группы, состоящей из: меланомы, почечно-клеточного рака, рака легкого, рака мочевого пузыря, рака молочной железы, рака шейки матки, рака толстой кишки, рака желчного пузыря, рака гортани, рака печени, рака щитовидной железы, рака желудка, рака слюнной железы, рака предстательной железы, рака поджелудочной железы и карциному Меркеля.
43. Способ по любому из пп. 35-42, в котором время полужизни антитела составляет от 30 минут до 45 дней.
44. Способ по любому из пп. 35-43, в котором антитело связывается с PD-1 с KD менее 1 нM.
45. Способ по любому из пп. 35-44, включающий введение антитела по любому из пп. 1-11 или фармацевтической композиции по п.17 или 18 в комбинации с анти-TIM-3 антителом или анти-LAG-3 антителом.
| WO 2013025779 A1, от 21.02.2013 | |||
| US 20130022600 A1, 24.01.2013 | |||
| US 20120237522 A1, 20.09.2012 | |||
| US 7414171 B2, 19.08.2008 | |||
| RU 2011133335 A, 20.02.2013. |
Авторы
Даты
2020-06-08—Публикация
2014-05-02—Подача