ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По настоящей заявке испрашивается приоритет по временной заявке США № 61/809097, поданной 5 апреля 2013 года и временной заявке США № 61/820461, поданной 7 мая 2013 года, содержание которых включено в настоящее описание в качестве ссылки в полном объеме.
УТВЕРЖДЕНИЕ О ПРАВАХ НА ИЗОБРЕТЕНИЕ, ОСУЩЕСТВЛЕННОЕ В СООТВЕТСТВИИ С ФЕДЕРАЛЬНО СПОНСИРУЕМЫМ ИССЛЕДОВАНИЕМ
[0002] Не предусмотрено.
ССЫЛКА НА СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПРЕДОСТАВЛЕННЫЙ В ЭЛЕКТРОННОЙ ФОРМЕ
[0003] Официальная копия списка последовательностей предоставлена в электронной форме через EFS-Web в качестве отформатированного списка последовательностей ASCII одновременно с описанием. Список последовательностей, содержащийся в этом отформатированном документе ASCII, является частью описания и включен в настоящее описание в качестве ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ
[0004] Настоящее изобретение относится к области геномной инженерии, в частности, к встраиванию экзогенных последовательностей в растения, включающему одновременное геномное редактирование множества аллелей множества геномов, в том числе в полиплоидных растениях.
УРОВЕНЬ ТЕХНИКИ
[0005] Чтобы удовлетворить возрастающую глобальную потребность в продуцировании продуктов питания, многие эффективные подходы для улучшения сельскохозяйственной производительности (например, увеличенный выход или сообщенная способами инженерии устойчивость к вредителям) основаны либо на мутационной селекции, либо на внесении новых генов в геномы сельскохозяйственных культур путем трансформации. Оба эти процесса по своему существу являются неспецифическими и относительно неэффективными. Например, общепринятые способы трансформации растений доставляют экзогенную ДНК, которая встраивается в геном в случайных положениях. Случайная природа этих способов приводит к необходимости получения и скрининга сотен уникальных случайных событий встраивания на конструкцию для идентификации и выделения трансгенных линий с желаемыми признаками. Более того, общепринятые способы трансформации создают несколько проблем для оценки трансгенов, включая: (a) трудность прогнозирования того, возникли ли плейотропные эффекты вследствие непреднамеренного разрушения генома; и (b) трудность сравнения влияния различных регуляторных элементов и конструкций трансгенов в одном трансгене-кандидате, поскольку такие сравнения осложняются случайным встраиванием в геном. В результате, общепринятая инженерия признаков растений является трудоемким и дорогостоящим процессом с низкой вероятностью успеха.
[0006] Прицельная модификация генов решает логистические проблемы общепринятых практик в растительных системах, и она является давно существующей, но труднодостижимой целью, как в базовых исследованиях биологии растений, так и в сельскохозяйственной биотехнологии. Однако, за исключением "нацеливания генов" посредством положительной-отрицательной селекции с лекарственным средством в рисе или использования предварительно встроенных способами инженерии участков рестрикции, направленная модификация во всех видах растений, как модельных, так и возделываемых, до не давнего времени оставалась труднодостижимой. Terada et al. (2002) Nat Biotechnol 20(10): 1030; Terada et al. (2007) Plant Physiol 144(2):846; D'Halluin et al. (2008) Plant Biotechnology J. 6(1):93.
[0007] Недавно были описаны способы и композиции для направленного расщепления геномной ДНК. Такие события направленного расщепления можно использовать, например, для индукции направленного мутагенеза или направленных делеций клеточных последовательностей ДНК, или для способствования направленной рекомбинации и встраиванию в заданный хромосомный локус. См., например, Urnov et al. (2010) Nature 435(7042):646-51; патенты США № 8586526; 8586363; 8409861; 8106255; 7888121; 8409861 и публикации патентов США 20030232410; 20050026157; 20090263900; 20090117617; 20100047805; 20100257638; 20110207221; 20110239315; 20110145940, содержание которых включено в качестве ссылки в полном объеме для всех целей. Расщепление можно проводить с использованием специфических нуклеаз, таких как модифицированные способами инженерии нуклеазы с цинковыми пальцами (ZFN), подобные активаторам транскрипции эффекторные нуклеазы (TALEN), или с использованием системы CRISPR/Cas с модифицированной способами инженерии crRNA/tracr РНК ("единая РНК-гид") для обеспечения специфического расщепления. В публикации патента США № 20080182332 описано применение неканонических нуклеаз с цинковыми пальцами (ZFN) для направленной модификации геномов растений; в патенте США № 8399218 описана опосредуемая ZFN направленная модификация локуса EPSPS растений; в патенте США № 8329986 описана направленная модификация локуса Zp15 растений и в патенте США № 8592645 описана направленная модификация генов растений, вовлеченных в биосинтез жирных кислот. Кроме того, в Moehle et al. (2007) Proc. Natl Acad, Sci. USA 104(9):3055-3060 описано использование сконструированных ZFN для направленного внесения гена в конкретный локус. В публикации патента США 20110041195 описаны способы получения гомозиготных диплоидных организмов.
[0008] Стэкинг трансгенов (или признаков) обладает большим потенциалом для продуцирования растений, однако он признан трудноосуществимым. См., например, Halpin (2005) Plant Biotechnology Journal 3:141-155. Кроме того, полиплоидия, когда организм имеет две или более дублированных (аутоплоидия) или родственных (аллоплоидных) парных наборов хромосом, возникает более часто в растениях, чем у животных. Например, пшеница имеет линии, которые являются диплоидными (два набора хромосом), тетраплоидными (четыре набора хромосом) и гексаплоидными (шесть наборов хромосом). Кроме того, многие важные с сельскохозяйственной точки зрения растения рода Brassica также являются аллотетраплоидными.
[0009] Таким образом, остается потребность в композициях и способах идентификации, селекции и быстрого усовершенствования стабильного направленного встраивания в точные положения в геноме растений, включая одновременную модификацию множества аллелей в различных геномах полиплоидных растений, для получения стабильных наследуемых генетических модификаций в растении и его потомстве.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0010] Настоящее изобретение относится к способам и композициям для прицельной трансформации, нацеливания на гены, направленной геномной модификации и экспрессии белков в растениях. В частности, настоящее изобретение относится к новой стратегии, свободной от трансгенных маркеров, для встраивания экзогенной последовательности и для стэкинга признаков, для которых используется дифференциальная селекция, в эндогенном локусе (например, локус синтазы ацетогидроксикислот (AHAS)). Эта стратегия облегчает получение растений, которые имеют один или несколько трансгенов (или один или несколько представляющих интерес генов (GOI), где трансгены не включают трансгенных генов селективных маркеров), точно расположенных в эндогенном локусе растений, например, в одном или нескольких паралогах AHAS. Способы и композиции, описанные в настоящем описании, обеспечивают как параллельный, так и последовательный стэкинг генов в геномах растений точно в одном и том же положении генома, включающий одновременное редактирование множества аллелей в множестве геномов полиплоидных видов растений. Кроме того, способы и композиции по изобретению позволяют свободную от селективного маркера селекцию экзогенного трансгена и/или геномную модификацию эндогенного гена, при которой в эндогенный ген вносится мутация, так что эндогенный ген продуцирует продукт, который приводит к толерантному к гербицидам растению (например, посредством использования известных мутаций в эндогенном гене, таких как известные мутации в гене AHAS, которые сообщают толерантность к гербицидам группы B, или гербицидам-ингибиторам ALS, таким как имидазолинон или сульфонилмочевина). Также предусматриваются клетки (например, клетки семян), клеточные линии, организмы (например, растения) и т.д., содержащие эти аллели со стэкингом трансгенов и/или одновременно модифицированные алели. Направленное редактирование генома (инсерции, делеции, мутации, стэкинг трансгенов) может приводить, например, к увеличенному выходу культуры, белку, кодирующему устойчивость к заболеванию, белку, который повышает рост, белку, кодирующему устойчивость к насекомым, белку, кодирующему толерантность к гербицидам и т.п. Увеличенный выход может включать, например, увеличенное количество плодов или выход зерна, увеличенную биомассу растения (или плодов или зерна растения), более высокое содержание мякоти плодов, более крупные растения, увеличенную сухую массу, увеличенное содержание сухого вещества, более высокую общую массу при сборе, увеличенную интенсивность и/или единообразие цвета культуры, измененные химические (например, масла, жирные кислоты, углеводы, белки) характеристики и т.д.
[0011] Таким образом, в одном аспекте в настоящем описании описаны способы и композиции для прицельной геномной модификации (например, стэкинг трансгенов) в одном или нескольких эндогенных аллелях гена растения. В определенных вариантах осуществления трансген(ы) встраивается в эндогенный локус генома растения (например, полиплоидного растения). Встраивание трансгена включает встраивание множества трансгенов, которое может осуществляться параллельно (одновременное встраивание одного или нескольких трансгенов в один или несколько аллелей) или последовательно. В определенных вариантах осуществления трансген не включает трансгенный маркер, но встроен в эндогенный локус, который модифицируется при встраивании трансгена, содержащего признак, как например, встраивание трансгена(ов) в эндогенный локус синтазы ацетоксикислот (AHAS) (например, 3'-нетранслируемая область локуса AHAS), так что происходит экспрессия трансгена и локус AHAS модифицируется, изменяя толерантность к гербицидам (например, гербициды группы B или гербициды-ингибиторы ALS, такие как имидазолинон или сульфонилмочевина). Трансген(ы) встраивают направленным образом с использованием одной или нескольких не встречающихся в природе нуклеаз, например, нуклеаз с цинковыми пальцами, мегануклеаз, TALEN и/или системы CRISPR/Cas с модифицированной способами инженерии единичной направляющей РНК-гидом. Трансген может содержать одну или несколько кодирующих последовательностей (например, белки), некодирующие последовательности и/или может продуцировать одну или несколько молекул РНК (например, мРНК, РНК-и, миРНК, кшРНК и т.д.). В определенных вариантах осуществления встраивание трансгена является одновременным (параллельным). В других вариантах осуществления осуществляют последовательное встраивание одного или нескольких трансгенов (GOI), например с использованием локуса AHAS, путем чередования различных гербицидных (группа B, или гербициды-ингибиторы ALS, такие как имидазолинон или сульфонилмочевина) химических агентов селекции и известных мутаций AHAS, сообщающих толерантность к этим конкретным гербицидам. Более того, любая из клеток растений, описанных в настоящем описании, может дополнительно включать один или несколько дополнительных трансгенов, где дополнительные трансгены встраиваются в геном отличающегося локуса (или отличающихся локусов) от аллеля(ей)-мишени для стэкинга трансгенов. Таким образом, в клетках, описанных в настоящем описании, множество эндогенных локусов может включать встроенные трансгены.
[0012] В другом аспекте в настоящем описании описаны полиплоидные клетки растений, в которых множество аллелей одного или нескольких генов в различных геномах (субгеномах) одновременно модифицированы. Направленные модификации могут повышать или снижать активность генов (например, активность эндогенного гена и/или активность встроенного трансгена) в полиплоидном растении, как например, мутации в AHAS, которые изменяют (например, повышают) толерантность к гербицидам.
[0013] В определенных вариантах осуществления направленная геномная модификация в полиплоидных клетках растений включает небольшую инсерцию и/или делецию, также известную как инсерция-делеция. Любая из клеток-растений, описанных в настоящем описании, может находиться в растении или в части растения (например, семена, цветы, плоды), например, любого из: пшеницы, сои, кукурузы, картофеля, люцерны, риса, ячменя, подсолнечника, томата, Arabidopsis, хлопка, видов Brassica (включая, но не ограничиваясь ими B. napus, B. rapa, B. oleracea, B. nigra, B. juncea, B. carinata), Brachypodium, тимофеевки луговой и т.п.
[0014] В другом аспекте в рамках настоящего изобретения описан ДНК-связывающий домен (например, белок с цинковыми пальцами (ZFP)), который специфически связывается с геном, вовлеченным в толерантность к гербицидам, например, геном AHAS. Белок с цинковыми пальцами может содержать один или несколько цинковых пальцев (например, 2, 3, 4, 5, 6, 7, 8, 9 или более цинковых пальцев), и его можно модифицировать способами инженерии для связывания с любой последовательностью в геноме полиплоидного растения. Любой из белков с цинковыми пальцами, описанный в настоящем описании, можно связываться с заданным участком кодирующей последовательности гена-мишени или в соседних последовательностях (например, промотор или другие элементы экспрессии). В определенных вариантах осуществления белок с цинковыми пальцами связывается с участком-мишенью в гене AHAS, например, как показано в таблице 3 и таблице 13. Области распознающей спирали иллюстративных связывающих AHAS цинковых пальцев представлены в таблице 2 и в таблице 12. Один или несколько компонентов связывающих доменов с цинковыми пальцами в белке с цинковыми пальцами может представлять собой канонический (C2H2) цинковый палец или неканонический (например, C3H) цинковый палец (например, N-концевой и/или C-концевой цинковый палец может представлять собой неканонический палец).
[0015] В другом аспекте в рамках настоящего изобретения описаны слитые белки, причем каждый слитый белок содержит ДНК-связывающий домен (например, белок с цинковыми пальцами), который специфически связывается с множеством аллелей гена в геномах полиплоидных растений. В определенных вариантах осуществления белки представляют собой слитые белки, содержащие белок с цинковыми пальцами и функциональный домен, например, домен активации транскрипции, домен репрессии транскрипции и/или домен расщепления (или половинный домен расщепления). В определенных вариантах осуществления слитый белок представляет собой нуклеазу с цинковыми пальцами (ZFN). Домены расщепления и половинные домены расщепления можно получать, например, из различных эндонуклеаз рестрикции и/или хоминг-эндонуклеаз. В одном варианте осуществления половинные домены расщепления происходят из нуклеазы рестрикции типа IIS (например, Fok I).
[0016] В других аспектах в рамках настоящего изобретения предусматриваются полинуклеотиды, кодирующие любой из ДНК-связывающих доменов и/или слитых белков, описанных в настоящем описании. В определенных вариантах осуществления в рамках настоящего изобретения описан экспрессирующий вектор, содержащий полинуклеотид, кодирующий один или несколько ДНК-связывающих доменов и/или слитых белков, описанных в настоящем описании, функционально связанных с промотором. В одном варианте осуществления один или несколько слитых белков представляют собой ZFN.
[0017] ДНК-связывающие домены и слитые белки, содержащие эти ДНК-связывающие домены, связываются с и/или расщепляют два или более эндогенных гена в полиплоидном геноме (например, ген AHAS) в кодирующей области гена или в некодирующей последовательности в гене или рядом с геном, например, такой как лидерная последовательность, трейлерная последовательность или интрон, или промоторная последовательность, или в нетранскрибируемой области, либо выше, либо ниже кодирующей области, например, в 3’-нетранслируемой области. В определенных вариантах осуществления ДНК-связывающие домены и/или слитые белки связываются с и/или расщепляют кодирующую последовательность или регуляторную последовательность гена-мишени.
[0018] В другом аспекте в рамках настоящего изобретения описаны композиции, содержащие один или несколько белков, слитых белков или полинуклеотидов, как описано в настоящем описании. Полиплоидные клетки растений содержат множество геномных аллельных мишеней. Таким образом, композиции, описанные в настоящем описании, могут содержать один или несколько ДНК-связывающих белков (и полинуклеотидов, кодирующих их), которые нацелены (и одновременно модифицируют) на множество аллелей, присутствующих в множестве геномов (также обозначаемых как субгеномы) полиплоидной клетки растения. ДНК-связывающие белки могут быть нацелены на все гены (паралоги), на один или несколько (но не все) выбранных аллелей.
[0019] В другом аспекте в рамках настоящего изобретения предусматривается способ одновременного изменения множества аллелей среди множества геномов полиплоидной клетки растения, причем способ включает экспрессию одного или нескольких белков ДНК-связывающего домена (например, белки с цинковыми пальцами, такими как нуклеазы с цинковыми пальцами) в клетке, чтобы изменялось множество аллелей полиплоидного растения. В определенных вариантах осуществления способ изменения экспрессии одного или нескольких генов AHAS в клетке растений включает экспрессию одного или нескольких белков, содержащих ДНК-связывающий домен (например, белки с цинковыми пальцами) в клетке, чтобы экспрессия AHAS изменялась. В определенных вариантах осуществления способы включают использование пары нуклеаз с цинковыми пальцами для внесения небольшой инсерции и/или делеции ("инсерция-делеция"), которая нарушает эндогенную экспрессию гена. В других вариантах осуществления способы включают использование пары нуклеаз с цинковыми пальцами для повышения экспрессии генов, например посредством направленного встраивания экзогенной последовательности (например, донорная последовательность, GOI или трансген) или экспрессии энхансерного элемента. Измененная экспрессия/функция гена может приводить к увеличенному фотосинтезу, увеличенной толерантности к гербицидам и/или модификациям роста в клетках растения.
[0020] В другом аспекте в рамках настоящего изобретения предусматриваются нуклеиновые кислоты и антитела, и способы их применения для обнаружения и/или измерения измененной экспрессии множества аллелей гена и их модификаций (например AHAS).
[0021] В другом аспекте, описанном в настоящем описании, предусматривается способ одновременной модификации одного или нескольких генов в полиплоидной клетке растения. В определенных вариантах осуществления способ включает: (a) введение в полиплоидную клетку-растения одного или нескольких экспрессирующих векторов, кодирующих одну или несколько нуклеаз (например, ZFN, TALEN, мегануклеазы и/или системы CRISPR/Cas), которые связываются с участком-мишенью в одном или нескольких генах в таких условиях, при которых нуклеазы расщепляют один или несколько эндогенных генов, тем самым модифицируя один или несколько эндогенных (например AHAS) генов. В других вариантах осуществления расщепляется более одного аллеля эндогенного гена, например, в полиплоидных растениях. В других вариантах осуществления расщепляется один или несколько аллелей более чем одного эндогенного гена. Более того, в любом из способов, описанных в настоящем описании, расщепление одного или нескольких генов может приводить к делеции, вставке и/или замене нуклеотидов в расщепленной области, например, так чтобы активность AHAS изменялась (например, повышалась или снижалась), тем самым, позволяя оценку, например, встраивания трансгена в модифицированных эндогенных генах или вблизи них.
[0022] В другом аспекте в рамках настоящего изобретения описан способ внесения одной или нескольких экзогенных последовательностей в геном клетки растения, причем способ включает стадии: (a) приведения в контакт клетки с одной или несколькими экзогенными последовательностями (например, донорный вектор, трансген или GOI, или их комбинации); и (b) экспрессии одной или нескольких нуклеаз (например, ZFN, TALEN, мегануклеазы и/или системы CRISPR/Cas), как описано в настоящем описании, в клетке, где одна или несколько нуклеаз расщепляют хромосомную ДНК; так что расщепление хромосомной ДНК на стадии (b) обеспечивает включение экзогенной последовательности в геном посредством гомологичной рекомбинации. В определенных вариантах осуществления хромосомную ДНК модифицируют так, чтобы в хромосомную последовательность (например, эндогенный ген) вносилась мутация для экспрессии продукта, который вызывает поддающийся селекции фенотип (например, толерантность к гербицидам). Множество экзогенных последовательностей можно встраивать одновременно (параллельно) или стадии можно повторять для последовательно присоединения трансгенов (стэкинг трансгенов). В определенных вариантах осуществления один или несколько трансгенов вносят в ген AHAS, например, в 3’-нетранслируемую область. В любом из способов, описанных в настоящем описании, одна или несколько нуклеаз может представлять собой слитую конструкцию между нуклеазным доменом (домен расщепления) (например, домен расщепления эндонуклеазы рестрикции типа IIs или мегануклеазы) и модифицированным способами инженерии связывающим доменом с цинковыми пальцами. В других вариантах осуществления нуклеаза включает эффекторный домен TAL, хоминг-эндонуклеазу и/или единую РНК-гид Crispr/Cas. В любом из способов, описанных в настоящем описании, экзогенная последовательность может кодировать белковый продукт и/или продуцировать молекулу РНК. В любом из способов, описанных в настоящем описании, экзогенную последовательность можно встраивать так, чтобы эндогенный локус, в который встроена экзогенная последовательность(и), был модифицирован для обеспечения одного или нескольких поддающихся измерению фенотипов или маркеров (например, толерантность к гербицидам посредством мутации эндогенного AHAS).
[0023] В другом аспекте в рамках настоящего изобретения описана клетка растений, содержащая заданную геномную модификацию одного или нескольких аллелей эндогенного гена в клетке растения, где геномная модификация позволяет расщепление сайт-специфической нуклеазой и где геномная модификация обеспечивает мутацию в эндогенном гене, так что эндогенный ген продуцирует продукт, который приводит к толерантной к гербициду клетке растения. В одном варианте осуществления геномная модификация включает встраивание одной или нескольких экзогенных последовательностей. В следующем варианте осуществления геномная модификация включает внесение одной или нескольких инсерций-делеций, которые приводят к мутации эндогенного гена. В дополнительном варианте осуществления эндогенный ген с геномной модификацией кодирует белок, который сообщает толерантность к гербицидам на основе сульфонилмочевины. В одном варианте осуществления эндогенный ген с геномной модификацией кодирует белок, который сообщает толерантность к гербицидам на основе имидазолинона. В следующем варианте осуществления экзогенная последовательность не кодирует трансгенный селективный маркер. В дополнительном варианте осуществления экзогенная последовательность кодирует белок, выбранный из группы, состоящей из белка, который повышает выход культуры, белка, кодирующего устойчивость к заболеванию, белка, который увеличивает рост, белка, кодирующего устойчивость к насекомым, белка, кодирующего толерантность к гербицидам и их комбинаций. В последующих вариантах осуществления увеличенный выход культуры включает увеличение выхода плодов, выхода зерна, биомассы, содержания мякоти плодов, размера, сухой массы, содержания сухого вещества, массы, интенсивности окрашивания, однородности окрашивания, измененных химических характеристик или их комбинаций. В определенных вариантах осуществления эндогенный ген представляет собой эндогенный ген синтазы ацетоксикислот (AHAS). В дополнительных вариантах осуществления в эндогенный ген встраивают две или более экзогенных последовательностей. В следующем аспекте клетка растений представляет собой полиплоидную клетку растений. В одном варианте осуществления сайт-специфическая нуклеаза содержит ДНК-связывающий домен с цинковыми пальцами и домен расщепления FokI. В другом варианте осуществления ДНК-связывающий домен с цинковыми пальцами кодирует белок, который связывается с участком-мишенью, выбранным из группы, состоящей из SEQ ID NO: 35-56 и 263-278. В следующем варианте осуществления растение выбрано из группы, состоящей из пшеницы, сои, кукурузы, картофеля, люцерны, риса, ячменя, подсолнечника, томата, Arabidopsis, хлопка, Brassica species и тимофеевки луговой.
[0024] В другом аспекте в рамках настоящего изобретения описано растение, часть растения, семя или плод, содержащие одну или несколько клеток растений, содержащих заданную геномную модификацию одного или нескольких аллелей эндогенного гена в клетке растения, где после геномной модификации следует расщепление сайт-специфической нуклеазой и где геномная модификация обеспечивает мутацию в эндогенном гене, так чтобы эндогенный ген продуцировал продукт, который приводит к толерантной к гербициду клетке растения.
[0025] В другом аспекте в рамках настоящего изобретения описан способ получения клетки растения, как описано в настоящем описании выше, причем способ включает экспрессию одной или нескольких сайт-специфических нуклеаз в клетке растения и модификацию одного или нескольких аллелей эндогенного гена в множестве геномов полиплоидной клетки растения. В одном варианте осуществления эндогенный ген представляет собой ген синтазы ацетоксикислот (AHAS). В следующем варианте осуществления модификация нарушает экспрессию эндогенного гена. В другом варианте осуществления модификация включает встраивание одной или нескольких экзогенных последовательностей в один или несколько аллелей эндогенного гена. Более того, растение, часть растения, семя или плод, содержащие одну или несколько клеток растений, полученных этим способом, описаны в настоящем описании в качестве аспекта изобретения.
[0026] В другом аспекте в рамках настоящего изобретения описан белок с цинковыми пальцами, который связывается с участком-мишенью, выбранным из группы, состоящей из SEQ ID NO: 35-56 и 263-278. В следующем варианте осуществления белки с цинковыми пальцами содержат области распознающей спирали, представленые в одном ряду таблицы 2 или таблицы 12.
[0027] В другом аспекте в рамках настоящего изобретения описан способ встраивания одной или нескольких экзогенных последовательностей в геном клетки растения, включающий: экспрессию одной или нескольких сайт-специфических нуклеаз в клетке растения, где одна или несколько нуклеаз нацелены на и расщепляют хромосомную ДНК одного или нескольких эндогенных локусов; встраивание одной или нескольких экзогенных последовательностей в один или несколько эндогенных локусов в геноме клетки растения, где один или несколько эндогенных локусов модифицирован так, чтобы в эндогенном гене присутствовала мутация для экспрессии продукта, который приводит к поддающемуся селекции фенотипу в клетке растения; и селекцию клеток растений, которые экспрессируют поддающийся селекции фенотип, где выбирают клетки растений, которые включают одну или несколько экзогенных последовательностей. В следующем варианте осуществления одна или несколько экзогенных последовательностей выбраны из группы, состоящей из донорного полинуклеотида, трансгена или любой их комбинации. В последующем варианте осуществления встраивание одной или нескольких экзогенных последовательностей происходит посредством гомологической рекомбинации и негомологичного соединения концов. В дополнительном варианте осуществления одна или несколько экзогенных последовательностей включены одновременно или последовательно в один или несколько эндогенных локусов. В следующих вариантах осуществления один или несколько эндогенных локусов содержат ген синтазы ацетоксикислот (AHAS). В одном варианте осуществления ген AHAS расположен на геноме A, B или D полиплоидного генома. В другом варианте осуществления одна или несколько экзогенных последовательностей встроены в ген AHAS. В другом варианте осуществления одна или несколько экзогенных последовательностей кодируют мутацию S653N AHAS. В одном варианте осуществления одна или несколько экзогенных последовательностей кодируют мутацию P197S AHAS. В следующем варианте осуществления сайт-специфическая нуклеаза выбрана из группы, состоящей из нуклеазы с цинковыми пальцами, нуклеазы эффекторного домена TAL, хоминг-эндонуклеазы и нуклеазы единой РНК-гида Crispr/Cas. В следующем варианте осуществления сайт-специфическая нуклеаза содержит ДНК-связывающий домен с цинковыми пальцами и домен расщепления FokI. В одном варианте осуществления одна или несколько экзогенных последовательностей кодируют трансген или продуцируют молекулу РНК. В следующем варианте осуществления трансген кодирует белок, выбранный из группы, состоящей из белка, который повышает выход культуры, белка, кодирующего устойчивость к заболеванию, белка, который повышает рост, белка, кодирующего устойчивость к насекомым, белка, кодирующего толерантность к гербицидам и их комбинаций. В следующих вариантах осуществления встраивание трансгена дополнительно включает внесение одной или нескольких инсерций-делеций, которые нарушают экспрессию одного или нескольких эндогенных локусов и вызывают поддающийся селекции фенотип. Следующие варианты осуществления способа дополнительно включают стадии: культивирования выбранных клеток растений, содержащих одну или несколько экзогенных последовательностей; и получение целого растения, содержащего одну или несколько экзогенных последовательностей, встроенных в один или несколько эндогенных локусов генома растений. В дополнительном варианте осуществления для селекции клеток растений используют агент селекции, содержащий имидазолинон, или агент селекции на основе сульфонилмочевины. В других вариантах осуществления целое растение, содержащее одну или несколько экзогенных последовательностей, встроенных в один или несколько эндогенных локусов генома растения, дополнительно модифицируют для включения дополнительной экзогенной последовательности в эндогенные локусы генома растений. В следующих вариантах осуществления одна или несколько экзогенных последовательностей не кодируют трансгенный селективный маркер.
[0028] В следующем аспекте также предусматривается клетка растений, полученная согласно любому из способов, описанных в настоящем описании.
[0029] В другом аспекте в рамках настоящего изобретения предусматривается растение, содержащее клетку растения, как описано в настоящем описании.
[0030] В другом аспекте в рамках настоящего изобретения предусматривается семя растения, содержащее клетку растения, которая получена, как описано в настоящем описании.
[0031] В другом аспекте в рамках настоящего изобретения предусматривается плод, полученный из растения, содержащего клетку растения, полученную, как описано в настоящем описании.
[0032] В любой из композиций (клеток или растений) или способов, описанных в настоящем описании, клетка растения может включать клетку однодольного или двудольного растения. В определенных вариантах осуществления клетка растения представляет собой клетку сельскохозяйственной культуры, например, пшеницы, томата (или другой плодовой культуры), картофеля, кукурузы, сои, люцерны и т.д.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0033] На фиг.1 представлена карта плазмиды pDAB109350.
[0034] На фиг.2 представлена карта плазмиды pDAB109360.
[0035] На фиг.3 представлена карта плазмиды pDAS000132.
[0036] На фиг.4 представлена карта плазмиды pDAS000133.
[0037] На фиг.5 представлена карта плазмиды pDAS000134.
[0038] На фиг.6 представлена карта плазмиды pDAS000135.
[0039] На фиг.7 представлена карта плазмиды pDAS000131.
[0040] На фиг.8 представлена карта плазмиды pDAS000153.
[0041] На фиг.9 представлена карта плазмиды pDAS000150.
[0042] На фиг.10 представлена карта плазмиды pDAS000143.
[0043] На фиг.11 представлена карта плазмиды pDAS000164.
[0044] На фиг.12 представлена карта плазмиды pDAS000433.
[0045] На фиг.13 представлена карта плазмиды pDAS000434.
[0046] На фиг.14, панели A и B, представлено схематическое изображение свободного от экзогенного маркера последовательного стэкинга трансгенов в эндогенном локусе AHAS в геноме пшеницы Triticum aestivum с использованием ZFN-опосредуемой осуществляемой путем NHEJ репарации ДНК. На фиг.14A представлена первая стопка трансгенов; на фиг.14B представлена вторая стопка трансгенов.
[0047] На фиг.15, панели A и B, представлена схема, на которой схематическое изображение свободного от экзогенного маркера последовательного стэкинга трансгенов в эндогенном локусе AHAS генома пшеницы Triticum aestivum с использованием ZFN-опосредуемой осуществляемой путем HDR репарации ДНК. На фиг.15A представлена первая стопка трансгенов; на фиг.15B представлена вторая стопка трансгенов.
[0048] На фиг.16 представлена схема, на которой показана линейная карта pDAS000435.
[0049] На фиг.17 представлена схема, на которой показана линейная карта pDAS000436.
[0050] На фиг.18 представлена карта плазмиды pDAS0000004.
[0051] На фиг.19 представлена карта плазмиды QA_pDAS000434.
ПОДРОБНОЕ ОПИСАНИЕ
[0052] Настоящее изобретение относится к способам и композициям для встраивания экзогенной последовательности, включая параллельное (одновременное) или последовательное встраивание экзогенной последовательности (включая стэкинг трансгенов) в видах растений, в том числе в полиплоидном растении. Способы и композиции, описанные в настоящем описании, являются преимущественными для обеспечения направленного встраивания в выбранный локус без использования экзогенного трансгенного маркера для оценки встраивания. В частности, было продемонстрировано, что дифференциальная селекция в эндогенном локусе в случае свободной от трансгенного маркера донорной конструкции смещает селекцию в сторону трансгенных объектов путем уменьшения числа восстановившихся побочных объектов с отсутствием встраивания (Shukla et al. (2009) Nature 459(7245):437-41). Кроме того, описание относится к геномной модификации (например, мутации) эндогенного локуса, которая может приводить к продуцированию продукта, который служит в качестве маркера (фенотип). Таким образом, настоящее изобретение относится к встраиванию экзогенной последовательности, включающему стэкинг трансгенов, в эндогенный локус, который может служить в качестве маркера для встраивания (например, локус AHAS, в котором единичные мутации могут сообщать толерантность к гербициду).
[0053] Встраивание экзогенной последовательности(ей) (например, в локус AHAS) облегчается направленным двухцепочечным расщеплением эндогенной последовательности, например, посредством расщепления последовательности, расположенной в 3'-нетранслируемой области. Расщепление нацеливают на эту область с использованием слитых белков, содержащих ДНК-связывающий домен, такой как ДНК-связывающий домен мегануклеазы, ДНК-связывающий домен лейциновой молнии, ДНК-связывающий домен TAL, белок с цинковыми пальцами (ZFP); или с использованием РНК Crispr/Cas или химерных комбинаций вышеупомянутых. Такое расщепление обеспечивает встраивание донорной последовательности(ей) нуклеиновой кислоты в или вблизи эндогенного участка расщепления. Встраивание экзогенных последовательностей может происходить посредством как зависимых от гомологии, так и независимых от гомологии механизмов и селекцию прицельно направленных событий осуществляют посредством скрининга селективного маркера (например, толерантность к определенным гербицидам группы B, или гербицидам-ингибиторам ALS, таким как имидазолинон или сульфонилмочевина), которые являются функциональными только в случае правильно нацеленных событий.
[0054] В определенных вариантах осуществления нуклеаза(ы) содержит один или несколько ZFN, один или несколько TALEN, одну или несколько мегануклеаз и/или одну или несколько нуклеазных систем CRISPR/Cas. ZFN и TALEN, как правило, содержат домен расщепления (или половинный домен расщепления) и ДНК-связывающий домен с цинковыми пальцами или ДНК-связывающий домен эффектора TALE, и они могут быть введены в качестве белков, в качестве полинуклеотидов, кодирующих эти белки, или в качестве комбинаций полипептидов и кодирующих полипептид полинуклеотидов. ZFN и TALEN могут функционировать в качестве димерных белков после димеризации половинных доменов расщепления. Описаны облигатные гетеродимерные нуклеазы, в которых мономеры нуклеазы связаны с "левым" и "правым" доменами распознавания, которые могут ассоциировать с образованием активной нуклеазы. См., например, патенты США № 8623618; 7914796; 8034598. Таким образом, учитывая соответствующие участки-мишени, "левый" мономер может образовывать активную нуклеазу с любым "правым" мономером. Это значительно повышает количество пригодных участков для нуклеазы, исходя из подтвержденных левых и правых доменов, которые можно использовать в различных комбинациях. Например, рекомбинация участков связывания четырех гомодимерных нуклеаз приводит к дополнительным двенадцати гетеродимерным нуклеазам. Более важно, что она обеспечивает системный подход для конструирования трансгена, так что каждая новая встроенная последовательность становится фланкированной уникальным участком связывания нуклеазы, который можно использовать для обратного вырезания или для нацеливания на дополнительные гены рядом с ним. Кроме того, этот способ может упрощать стратегии стэкинга в едином локусе, который запускается зависимыми от нуклеазы двухцепочечными разрывами.
[0055] Связывающий домен с цинковыми пальцами может представлять собой канонические (C2H2) цинковые пальцы или неканонические (например, C3H) цинковые пальцы. См., например, публикацию патента США № 20080182332. Более того, связывающий домен с цинковыми пальцами может содержать один или несколько цинковых пальцев (например, 2, 3, 4, 5, 6, 7, 8, 9 или более цинковых пальцев), и он может быть модифицирован способами инженерии для связывания с любой последовательностью в любом эндогенном гене, например, гене AHAS. Присутствие такого слитого белка (или белков) в клетке приводит к связыванию слитого белка(ов) с его (их) участком(ами) связывания и расщеплению в гене(ах)-мишени.
Общие сведения
[0056] Для применения на практике способов, а также получения и применения композиций, описанных в настоящем описании, используются, если нет иных указаний, общепринятые способы молекулярной биологии, биохимии, анализа структуры хроматина, компьютерной химии, клеточной культуры, рекомбинантных ДНК и сходных областей, которые входят в пределы квалификации в данной области. Эти способы полностью пояснены в литературе. См., например, Sambrook et al. MOLECULAR CLONING: A LABORATORY MANUAL, Second edition, Cold Spring Harbor Laboratory Press, 1989 и Third edition, 2001; Ausubel et al., CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, New York, 1987 и периодические переиздания; серию METHODS IN ENZYMOLOGY, Academic Press, San Diego; Wolffe, CHROMATIN STRUCTURE AND FUNCTION, Third edition, Academic Press, San Diego, 1998; METHODS IN ENZYMOLOGY, Vol. 304, "Chromatin" (P.M. Wassarman and A. P. Wolffe, eds.), Academic Press, San Diego, 1999; и METHODS IN MOLECULAR BIOLOGY, Vol. 119, "Chromatin Protocols" (P.B. Becker, ed.) Humana Press, Totowa, 1999.
Определения
[0057] Термины "нуклеиновая кислота", "полинуклеотид" и "олигонуклеотид" используют взаимозаменяемо, и они относятся к дезоксирибонуклеотидному или рибонуклеотидному полимеру, в линейной или кольцевой конформации, и либо в одноцепочечной, либо в двухцепочечной форме. Для целей настоящего описания эти термины не следует истолковывать как ограничивающие в отношении длины полимера. Термины могут охватывать известные аналоги природных нуклеотидов, а также нуклеотиды, которые являются модифицированными в частях оснований, сахаров и/или фосфатов (например, фосфоротиоатные остовы). Как правило, аналог конкретного нуклеотида имеет ту же специфичность спаривания оснований; т.е. аналог A будет образовывать пару с T.
[0058] Термины "полипептид", "пептид" и "белок" используют взаимозаменяемо для обозначения полимера из аминокислотных остатков. Также термин применим к полимерам аминокислот, в которых одна или несколько аминокислот являются химическими аналогами или модифицированными производными соответствующих встречающихся в природе аминокислот.
[0059] "Связывание" относится к специфичному в отношении последовательности нековалентному взаимодействию макромолекул (например, между белком и нуклеиновой кислотой). Не все компоненты связывающего взаимодействия должны быть специфичными в отношении последовательности (например, контактируют с фосфатными остатками в основной цепи ДНК), при условии, что взаимодействие в целом является специфическим для последовательности. Такие взаимодействия, как правило, характеризуются константой диссоциации (Kd) 10-6 M-1 или ниже. "Аффинность" относится к прочности связывания: увеличенная аффинность связывания коррелирует с низкой Kd.
[0060] "Связывающий белок" представляет собой белок, который способен связываться с другой молекулой. Связывающий белок может связываться, например, с молекулой ДНК (ДНК-связывающий белок), молекулой РНК (РНК-связывающий белок) и/или с молекулой белка (белок-связывающий белок). В случае белок-связывающего белка, он может связываться сам с собой (с образованием гомодимеров, гомотримеров и т.д.) и/или он может связываться с одной или несколькими молекулами другого белка или белков. Связывающий белок может иметь более одного типа активности связывания. Например, белки с цинковыми пальцами имеют активность связывания ДНК, активность связывания РНК и активность связывания белка.
[0061] "ДНК-связывающий белок с цинковыми пальцами" (или связывающий домен) представляет собой белок или домен в более крупном белке, который связывает ДНК специфическим для последовательности образом через один или несколько цинковых пальцев, которые представляют собой области аминокислотной последовательности в связывающем домене, структура которых стабилизирована координационной связью с ионом цинка. Термин "ДНК-связывающий белок с цинковыми пальцами" часто сокращенно обозначают как белок с цинковыми пальцами или ZFP.
[0062] "ДНК-связывающий домен TALE" или "TALE" представляет собой полипептид, содержащий один или несколько доменов/элементов с повторами TALE. Домены с повторами вовлечены в связывание TALE с распознаваемой им последовательностью ДНК-мишени. Единичный "элемент повтора" (также обозначаемый как "повтор"), как правило, имеет длину 33-35 аминокислот и включает гипервариабельные двойные остатки в положениях 12 и/или 13, обозначаемые как повторяющиеся вариабельные двойные остатки (RVD), вовлеченные в специфичность связывания ДНК. Повторы TALE проявляют по меньшей мере некоторую гомологию последовательности с другими последовательностями повтора TALE во встречающемся в природе белке TALE. См., например, патент США № 8586526.
[0063] Связывающие домены с цинковыми пальцами и TALE можно "конструировать способами инженерии" так, чтобы они связывались с заданной нуклеотидной последовательностью. Неограничивающими примерами способов инженерии белков с цинковыми пальцами являются конструирование и селекция. Сконструированный белок с цинковыми пальцами представляет собой белок, не встречающийся в природе, конструкция/композиция которого в основном является результатом рациональных критериев. Рациональные критерии для конструирования включают использование правил замены и компьютерных алгоритмов для обработки информации в базе данных, хранящей информацию о существующих конструкциях ZFP и/или TALE и данные о связывании. См., например, патенты США 6140081; 6453242 и 6534261; также см. WO 98/53058; WO 98/53059; WO 98/53060; WO 02/016536 и WO 03/016496.
[0064] "Отобранный путем селекции" белок с цинковыми пальцами или TALE представляет собой белок, не встречающийся в природе, получение которого обычно является результатом эмпирического процесса, такого как фаговый дисплей, ловушка взаимодействий или гибридная селекция. См. например, U.S. 8586526, U.S. 5789538; U.S. 5925523; U.S. 6007988; U.S. 6013453; U.S. 6200759; WO 95/19431; WO 96/06166; WO 98/53057; WO 98/54311; WO 00/27878; WO 01/60970, WO 01/88197 и WO 02/099084.
[0065] Термин "последовательность" относится к нуклеотидной последовательности любой длины, которая может представлять собой ДНК или РНК; может быть линейной, кольцевой или разветвленной и может быть либо одноцепочечной, либо двухцепочечной. Термин "донорная последовательность" относится к нуклеотидной последовательности, которая встроена в геном. Донорная последовательность может иметь любую длину, например от 2 до 10000 нуклеотидов (или любое целое число между ними или выше них), предпочтительно, приблизительно от 100 до 1000 нуклеотидов (или любое целое число между ними или выше них), более предпочтительно приблизительно от 200 до 500 нуклеотидов.
[0066] "Гомологичная неидентичная последовательность" относится к первой последовательности, которая обладает общей степенью идентичности последовательности со второй последовательностью, однако эта последовательность не идентична второй последовательности. Например, полинуклеотид, содержащий последовательность мутантного гена дикого типа, является гомологичным и неидентичным последовательности мутантного гена. В определенных вариантах осуществления степень гомологии между двумя последовательностями является достаточной для обеспечения гомологичной рекомбинации между ними с использованием нормальных клеточных механизмов. Две гомологичных неидентичных последовательности могут иметь любую длину и их степень негомологичности может составлять только один нуклеотид (например, для коррекции геномной точковой мутации посредством направленной гомологичной рекомбинации) или вплоть до 10 или более тысяч пар оснований (например, для встраивания гена в заданный эктопический участок в хромосоме). Два полинуклеотида, содержащих гомологичные неидентичные последовательности, не должны иметь одинаковую длину. Например, можно использовать экзогенный полинуклеотид (т.е. донорный полинуклеотид) длиной от 20 до 10000 нуклеотидов или пар нуклеотидов.
[0067] Способы определения идентичности последовательностей нуклеиновых кислот и аминокислотных последовательностей известны в данной области. Как правило, такие способы включают определение нуклеотидной последовательности мРНК для гена и/или определение аминокислотной последовательности, кодируемой ей, и сравнение этих последовательностью со второй нуклеотидной или аминокислотной последовательностью. Таким образом, также можно определять и сравнивать геномные последовательности. Как правило, идентичность относится к точному соответствию нуклеотида к нуклеотиду или аминокислоты к аминокислоте двух полинуклеотидных или полипептидных последовательностей, соответственно. Две или более последовательностей (полинуклеотидных или аминокислотных) можно сравнивать путем определения их процентной идентичности. Процентная идентичность двух последовательностей, как последовательностей нуклеиновых кислот, так и аминокислотных последовательностей, представляет собой число точных совпадений между двумя выровненными последовательностями, деленное на длину более коротких последовательностей и умноженное на 100. Приблизительное выравнивание последовательностей нуклеиновых кислот обеспечивается алгоритмом локальной гомологии Smith и Waterman, Advances in Applied Mathematics 2:482-489 (1981). Этот алгоритм можно использовать для аминокислотных последовательностей с использованием оценочной матрицы, разработанной Dayhoff, Atlas of Protein Sequences and Structure, M.O. Dayhoff ed., 5 suppl. 3:353-358, National Biomedical Research Foundation, Washington, D.C., USA, и нормализованной Gribskov, Nucl. Acids Res. 14(6):6745-6763 (1986). Иллюстративное осуществление этого алгоритма для определения процентной идентичности последовательностей представлено Genetics Computer Group (Madison, WI) в утилите "BestFit". Пригодные программы для вычисления процентной идентичности или сходства между последовательностями являются общеизвестными в данной области, например, другой программой для выравнивания является BLAST, используемая с параметрами по умолчанию. Например, BLASTN и BLASTP можно использовать с использованием следующих параметров по умолчанию: генетический код = стандарт; фильтр = нет; цепь= обе; пороговое значение= 60; ожидание= 10; матрица = BLOSUM62 (для BLASTP); описания = 50 последовательностей; сортировка по = наивысшему показателю; базы данных = неизбыточные, GenBank + EMBL + DDBJ + PDB + GenBank CDS translations + Swiss protein + Spupdate + PIR. Подробное описание этих программ может быть найдено в Интернете. Что касается последовательностей, описанных в настоящем описании, диапазон желаемых степеней идентичности последовательностей составляет приблизительно от 80% до 100% и любое целое число между ними. Как правило, процентная идентичность между последовательностями составляет по меньшей мере 70-75%, предпочтительно 80-82%, более предпочтительно 85-90%, еще более предпочтительно 92%, еще более предпочтительно 95% и наиболее предпочтительно 98% идентичность последовательности.
[0068] Альтернативно степень сходства последовательностей между полинуклеотидами можно определять гибридизацией полинуклеотидов в условиях, которые позволяют образование стабильных дуплексов между гомологичными областями с последующим расщеплением одноцепочечной специфической нуклеазой(ами) и определением размера расщепленных фрагментов. Две последовательности нуклеиновых кислоты или две полипептидных последовательности являются по существу гомологичными друг другу, когда последовательности проявляют по меньшей мере приблизительно 70%-75%, предпочтительно 80%-82%, более предпочтительно 85%-90%, даже более предпочтительно 92%, еще более предпочтительно 95% и наиболее предпочтительно 98% идентичность последовательности на протяжении определенной длины молекул, как определяют с использованием способов, описанных выше. Как используют в рамках изобретения, по существу гомологичный также относится к последовательностям, демонстрирующим полную идентичность указанной последовательности ДНК или полипептидной последовательности. Последовательности ДНК, которые являются по существу гомологичными, можно идентифицировать в эксперименте по саузерн-гибридизации, например, в жестких условиях, как определено для этой конкретной системы. Определение соответствующих условий гибридзации известно специалистам в данной области. См., например, Sambrook et al., выше; Nucleic Acid Hybridization: A Practical Approach, editors B.D. Hames and S.J. Higgins, (1985) Oxford; Washington, DC; IRL Press).
[0069] Селективную гибридизацию двух фрагментов нуклеиновой кислоты можно определять следующим образом. Степень идентичности последовательностей между двумя молекулами нуклеиновых кислот влияет на эффективность и жесткость событий гибридизации между такими молекулами. Частично идентичная последовательность нуклеиновой кислоты будет по меньшей мере частично ингибировать гибридизацию полностью идентичной последовательности с молекулой-мишенью. Ингибирование гибридизации полностью идентичной последовательности можно оценивать с использованием анализов гибридизации, которые хорошо известны в данной области (например, саузерн-блоттинг (ДНК), нозерн-блоттинг (РНК), гибридизация в растворе и т.п., см. Sambrook, et al., Molecular Cloning: A Laboratory Manual, Second Edition, (1989) Cold Spring Harbor, N.Y.). Такие анализы можно проводить с использованием различных степеней селективности, например, с использованием условий, варьирующих от низкой до высокой жесткости. Если используют условия низкой жесткости, отсутствие неспецифического связывания можно оценивать с использованием вторичного зонда, который лишен даже частичной степени идентичности последовательности (например, зонд, имеющий менее чем приблизительно 30% идентичность последовательности с молекулой-мишенью), так что в отсутствие событий неспецифического связывания вторичный зонд не будет гибридизовываться с мишенью.
[0070] При использовании системы обнаружения на основе гибридизации выбирают зонд нуклеиновой кислоты, который комплементарен эталонной последовательности нуклеиновой кислоты, а затем при выборе соответствующих условий, зонд и эталонная последовательность селективно гибридизуются или связываются друг с другом с образованием дуплексной молекулы. Молекула нуклеиновой кислоты, которая способна селективно гибридизоваться с эталонной последовательностью в умеренно жестких условиях гибридизации, как правило, гибридизуется в условиях, которые позволяют обнаружение последовательности нуклеиновой кислоты-мишени длиной по меньшей мере приблизительно 10-14 нуклеотидов, имеющей по меньшей мере приблизительно 70% идентичность последовательности с последовательностью выбранного зонда на основе нуклеиновой кислоты. Жесткие условия гибридизации, как правило, обеспечивают обнаружение последовательностей нуклеиновых кислот-мишеней длиной по меньшей мере приблизительно 10-14 нуклеотидов, обладающих идентичностью последовательности более 90-95% с последовательностью выбранного зонда нуклеиновой кислоты. Условия гибридизации, пригодные для гибридизации зонда/эталонной последовательности, где зонд и эталонная последовательность имеют определенную степень идентичности последовательностей, можно определять, как известно в данной области (см., например, Nucleic Acid Hybridization: A Practical Approach, editors B.D. Hames and S.J. Higgins, (1985) Oxford; Washington, DC; IRL Press).
[0071] Условия гибридизации хорошо известны специалистам в данной области. Жесткость гибридизации относится к степени, с которой условия гибридизации действуют против образования гибридов, содержащих несоответствующие нуклеотиды, причем более высокая жесткость коррелирует с более низкой допустимостью несоответствующих гибридов. Факторы, которые влияют на жесткость гибридизации, хорошо известны специалистам в данной области и включают, но не ограничиваются ими, температуру, pH, ионную силу и концентрацию органических растворителей, например, таких как формамид и диметилсульфоксид. Как известно специалистам в данной области, жесткость гибридизации возрастает при более высоких температурах, более низкой ионной силе и более низких концентрациях растворителя.
[0072] Что касается условий жесткости гибридизации, в данной области хорошо известно, что для установления конкретной жесткости можно использовать многочисленные эквивалентные условия путем варьирования, например, следующих факторов: длина и природа последовательностей зондов, состав оснований различных последовательностей, концентрации солей и других компонентов раствора для гибридизации, присутствие и отсутствие блокирующих агентов в растворах для гибридизации (например, сульфат декстрана и полиэтиленгликоль), температура реакции гибридизации и временные параметры, а также различные условия промывания. Выбор конкретного набора условий гибридизации осуществляют в соответствии со стандартными способами в данной области и (см., например, Sambrook, et al., Molecular Cloning: A Laboratory Manual, Second Edition, (1989) Cold Spring Harbor, N.Y.).
[0073] "Рекомбинация" относится к процессу обмена генетической информацией между двумя полинуклеотидами. Для целей настоящего описания "гомологичная рекомбинация (HR)" относится к специализированной форме такого обмена, который происходит, например, в процессе репарации двухцепочечных разрывов в клетках. Этот процесс требует гомологии нуклеотидных последовательностей, в котором используется "донорная" молекула для репарации матрицы молекулы-"мишени" (т.е. молекула, в которой произошел двухцепочечный разрыв) и он известен в качестве "некроссинговерной конверсии генов" или "конверсии коротких участков генов", поскольку он приводит к переносу генетической информации от донора к мишени. Без связи с какой-либо конкретной теорией, такой перенос может вовлекать коррекцию несоответствующих оснований в гетеродуплексной ДНК, которые образуются между разрушенной мишенью и донором, и/или "зависимую от синтеза гибридизацию цепей", в которой используется донор для ресинтеза генетической информации, которая станет частью мишени, и/или родственные процессы. Такая специализированная HR часто приводит к изменению последовательности молекулы-мишени, так что часть или вся последовательность донорного полинуклеотида включается в полинуклеотид-мишень.
[0074] "Расщепление" относится к разрыву ковалентного остова молекулы ДНК. Расщепление можно инициировать различными способами, включая, но не ограничиваясь ими, ферментативный или химический гидролиз фосфодиэфирной связи. Возможно как одноцепочечное расщепление, так и двухцепочечное расщепление, и двухцепочечное расщепление может происходить в результате двух отдельных событий одноцепочечного расщепления. Расщепление ДНК может приводить к образованию либо тупых концов, либо совмещающихся концов. В определенных вариантах осуществления слитые полипептиды используют для направленного расщепления двухцепочечной ДНК.
[0075] "Домен расщепления" содержит одну или несколько полипептидных последовательностей, которые обладают каталитической активностью расщепления ДНК. Домен расщепления может содержаться в одной полипептидной цепи или активность расщепления может быть результатом ассоциации двух (или более) полипептидов.
[0076] "Половинный домен расщепления" представляет собой полипептидную последовательность, которая, совместно со вторым полипептидом (либо идентичным, либо отличающимся) формирует комплекс, обладающий активностью расщепления (предпочтительно, активностью двухцепочечного расщепления).
[0077] "Модифицированный способами инженерии половинный домен расщепления" представляет собой половинный домен расщепления, который модифицирован так, чтобы он обязательно формировал гетеродимеры с другим половинным доменом расщепления (например, другой модифицированный способами инженерии половинный домен расщепления). Также см. патенты США № 7914796; 8034598; 8623618 и публикацию патента США № 2011/0201055, включенные в настоящее описание в качестве ссылок в полном объеме.
[0078] "Хроматин" представляет собой нуклеопротеиновую структуру, содержащую клеточный геном. Клеточный хроматин содержит нуклеиновую кислоту, в основном ДНК, и белок, включая гистоны и негистонные хромосомные белки. Основная часть хроматина эукариотических клеток существует в форме нуклеосом, где сердцевина нуклеосомы содержит приблизительно 150 пар оснований ДНК, связанных с октамером, содержащим по два каждого из гистонов H2A, H2B, H3 и H4; и между сердцевинами нуклеосом находится линкерная ДНК (вариабельной длины, в зависимости от организма). Молекула гистона H1, как правило, ассоциирована с линкерной ДНК. Для целей настоящего описания термин "хроматин" охватывает все типы нуклеопротеина, как прокариотических, так и эукариотических клеток. Клеточный хроматин включает как хромосомный, так и эписомный хроматин.
[0079] "Хромосома" представляет собой хроматиновый комплекс, содержащий весь геном клетки или его часть. Геном клетки часто характеризуется его кариотипом, который представляет собой набор всех хромосом, которые содержат геном клетки. Геном клетки может содержать одну или несколько хромосом.
[0080] "Эписома" представляет собой реплицирующуюся нуклеиновую кислоту, нуклеопротеиновый комплекс или другую структуру, содержащую нуклеиновую кислоту, которая не является частью хромосомного кариотипа клетки. Примеры эписом включают плазмиды и определенные вирусные геномы.
[0081] "Доступная область" представляет собой участок в клеточном хроматине, в котором участок мишень, присутствующий в нуклеиновой кислоте, может связываться с экзогенной молекулой, которая распознает участок-мишень. Без связи с какой-либо конкретной теорией полагают, что доступная область представляет собой область, которая не упаковывается в нуклеосомную структуру. Конкретная структура доступной области часто может быть обнаружена по ее чувствительности к химическим и ферментным зондам, например, нуклеазам.
[0082] "Участок-мишень" или "последовательность-мишень" представляет собой последовательность нуклеиновой кислоты, которая определяет часть нуклеиновой кислоты, с которой связывается связывающая молекула при условии, что существуют достаточные условия для связывания. Например, последовательность 5’-GAATTC-3’ представляет собой участок-мишень для эндонуклеазы рестрикции Eco RI. Кроме того, в таблице 3 и 13 приведены участки-мишени для связывания распознающих спиралей ZFP из таблицы 2 и таблицы 12.
[0083] "Экзогенная" молекула представляет собой молекулу, которая обычно не присутствует в клетке, но может быть введена в клетку одним или несколькими из генетических, биохимических или других способов. "Нормальное присутствие в клетке" определяют в отношении конкретной стадии развития и окружающих условий клетки. Таким образом, например, молекула, которая присутствует в клетках только на ранних стадиях развития цветка, представляет собой экзогенную молекулу в отношении клеток полностью развившегося цветка. Аналогично, молекула, индуцированная тепловым шоком, представляет собой экзогенную молекулу для клетки, не подвергнутой тепловому шоку. Экзогенная молекула может содержать, например, кодирующую последовательность для любого полипептида или его фрагмента, функционирующую версию эндогенной молекулы с нарушенной функцией или версию с нарушенной функцией нормально функционирующей эндогенной молекулы. Кроме того, экзогенная молекула может содержать кодирующую последовательность из другого вида, который является ортологичным для эндогенного гена в клетке-хозяине.
[0084] Экзогенная молекула может представлять собой, среди прочих, низкомолекулярное соединение, такое как получают в процессе комбинаторной химии, или макромолекулу, такую как белок, нуклеиновая кислота, углевод, липид, гликопротеин, липопротеин, полисахарид, любое модифицированное производное описанных выше молекул или любое комплекс, содержащий одну или несколько описанных выше молекул. Нуклеиновые кислоты включают ДНК и РНК, могут быть одноцепочечными или двухцепочечными; могут быть линейными, разветвленными или концевыми; и могут иметь любую длину. Нуклеиновые кислоты включают нуклеиновые кислоты, способные образовывать дуплексы, а также нуклеиновые кислоты, образующие триплексы. См., например, патенты США № 5176996 и 5422251. Белки включают, но не ограничиваются ими, ДНК-связывающие белки, факторы транскрипции, факторы, ремоделирующие хроматин, метилированные ДНК-связывающие белки, полимеразы, метилазы, деметилазы, ацетилазы, деацетилазы, киназы, фосфатазы, интегразы, рекомбиназы, лигазы, топоизомеразы, гиразы и хеликазы. Таким образом, термин включает "трансгены" или "представляющие интерес гены", которые представляют собой экзогенные последовательности, введенные в растительную клетку.
[0085] Экзогенная молекула может представлять собой молекулу того же типа, что и эндогенная молекула, например, экзогенный белок или нуклеиновая кислота. Например, экзогенная нуклеиновая кислота может содержать инфекционный вирусный геном, плазмиду или эписому, введенные в клетку, или хромосому, которая обычно не присутствует в клетке. Способы введения экзогенных молекул в клетки известны специалистам в данной области и включают, но не ограничиваются ими, трансформацию протопластов, опосредуемую карбидом кремния трансформацию (например, WHISKERS™), опосредуемую Agrobacterium трансформацию, опосредуемый липидами перенос (т.е. липосомы, включающие нейтральные и катионные липиды), электропорацию, прямую инъекцию, слияние клеток, бомбардировку частицами (например, с использованием "генной пушки"), сопреципитацию с фосфатом кальция, опосредуемый DEAE-декстраном перенос и опосредуемый вирусным вектором перенос.
[0086] Напротив, "эндогенная" молекула представляет собой молекулу, которая обычно присутствует в конкретной клетке на конкретной стадии развития в конкретных условиях окружающей среды. Например, эндогенная нуклеиновая кислота может содержать хромосому, геном митохондрии, хлоропласта или другой органеллы, или встречающуюся в природе эписомную нуклеиновую кислоту. Дополнительные эндогенные молекулы могут включать белки, например, факторы транскрипции и ферменты.
[0087] Как используют в рамках изобретения, термин "продукт экзогенной нуклеиновой кислоты" включает как полинуклеотидные, так и полипептидные продукты, например, продукты транскрипции (полинуклеотиды, такие как РНК) и продукты трансляции (полипептиды).
[0088] "Слитая" молекула представляет собой молекулу, в которой одна или несколько молекул субъединиц связаны, предпочтительно ковалентно. Молекулы субъединиц могут представлять собой один и тот же химический тип молекулы, или они могут представлять собой различные химические типы молекул. Примеры первого типа слитой молекулы включают, но не ограничиваются ими, слитые белки, например, слитый белок между ДНК-связывающим доменом (например, ДНК-связывающие домены ZFP, TALE и/или мегануклеазы) и нуклеазным (например, эндонуклеаза, мегануклеаза и т.д.) доменом (домен расщепления), и слитые нуклеиновые кислоты (например, нуклеиновая кислота, кодирующая слитый белок, описанный в настоящем описании). Примеры второго типа слитой молекулы включают, но не ограничиваются ими, слитую молекулу между образующей триплекс нуклеиновой кислотой и полипептидом, и слитую молекулу между связывающим малую бороздку соединением и нуклеиновой кислотой.
[0089] Экспрессия слитого белка в клетке может быть результатом доставки слитого белка в клетку или доставки полинуклеотида, кодирующего слитый белок, в клетку, в которой полинуклеотид транскрибируется и транскрипт транслируется с образованием слитого белка. В экспрессию белка в клетке также может быть вовлечен транс-сплайсинг, расщепление полипептида и лигирование полипептида. Способы доставки полинуклеотида и полипептида в клетки описаны в настоящем описании.
[0090] "Ген" для целей настоящего изобретения включает область ДНК, кодирующую продукт гена (см. ниже), а также все области ДНК, которые регулируют продукцию продукта гена, независимо от того, являются ли такие регуляторные соседними с кодирующими и/или транскрибируемыми последовательностями. Таким образом, ген включает, но не обязательно ограничивается ими, промоторные последовательности, последовательности терминации, последовательности регуляции трансляции, такие как участки связывания рибосом и участки внутренней посадки рибосом, энхансеры, сайленсеры, инсуляторы, пограничные элементы, ориджины репликации, участки прикрепления к матрице и области контроля локуса.
[0091] "Экспрессия гена" относится к конверсии информации, содержащейся в гене, в продукт гена. Продукт гена может представлять собой прямой продукт транскрипции гена (например, мРНК, тРНК, рРНК, антисмысловая РНК, рибозим, структурная РНК или любой другой тип РНК) или белок, продуцируемый посредством трансляции мРНК. Продукты гена также включают РНК, которая является модифицированной посредством процессов, таких как кэппирование, полиаденилирование, метилирование и редактирование, и белки, модифицированные, например, посредством метилирования, ацетилирования, фосфорилирования, убиквитинилирования, ADP-рибозилирования, миристоилирования и гликозилирования.
[0092] "Модулирование" экспрессии генов относится к изменению активности гена. Модулирование экспрессии может включать, но не ограничивается ими, активацию гена и репрессию гена.
[0093] "Трансгенный селективный маркер" относится к экзогенной последовательности, содержащей маркерный ген, функционально связанный с промотором и 3'-UTR, содержащимися в экспрессирующей кассете химерного гена. Неограничивающие примеры трансгенных селективных маркеров включают толерантность к гербицидам, устойчивость к антибиотикам и визуальные репортерные маркеры. Трансгенный селективный маркер может быть встроен вместе с донорной последовательностью посредством направленного встраивания. По существу, трансгенный селективный маркер экспрессирует продукт, который используют для оценки встраивания донора. Напротив, способы и композиции, описанные в настоящем описании, обеспечивают встраивание любой донорной последовательности без необходимости в совместном встраивании трансгенного селективного маркера, например, с использованием донора, который осуществляет мутацию эндогенного гена, в который он встроен, с образованием селективного маркера (т.е., селективный маркер, как используют в этом случае, не является трансгенным) из эндогенного локуса-мишени. Неограничивающие примеры селективных маркеров включают маркеры толерантности к гербицидам, включая мутантный ген AHAS, как описано в настоящем описании.
[0094] "Растительные" клетки включают, но не ограничиваются ими, клетки однодольных (односемядольных) или двудольных (двусемядольных) растений. Неограничивающие примеры однодольных растений включают злаковые растения, такие как кукуруза, рис, ячмень, овес, пшеница, сорго, рожь, сахарный тростник, ананас, лук, банан и кокос. Неограничивающие примеры двудольных растений включают табак, томат, подсолнечник, хлопок, сахарную свеклу, картофель, салат-латук, дыню, сою, канолу (рапс) и люцерну. Клетки растений могут происходить из любой части растения и/или их любой стадии развития растения.
[0095] "Представляющая интерес область" представляет собой любую область клеточного хроматина, например, такую как ген или некодирующая последовательность в гене или рядом с геном, в котором является желательным связывание экзогенной молекулы. Связывание может быть предназначено для цели направленного расщепления ДНК и/или направленной рекомбинации. Представляющая интерес область может находиться, например в хромосоме, эписоме, геноме органелл (например, митохондрий, хлоропластов) или геноме инфицирующего вируса. Представляющая интерес область может находиться в кодирующей области гена, в транскрибируемых некодирующих областях, например, таких как лидерные последовательности, трейлерные последовательности или интроны, или в нетранскрибируемых областях, либо выше, либо ниже кодирующей области. Представляющая интерес область может иметь длину, составляющую только одну нуклеотидную пару и вплоть до 2000 нуклеотидных пар, или она может представлять собой любое целое число нуклеотидных пар.
[0096] Термины "функциональная связь" и "функционально связанный" (или "эффективно связанный") используют взаимозаменяемо в отношении соседнего расположения двух или более компонентов (таких как элементы последовательности), где компоненты расположены так, что оба компонента нормально функционируют и обеспечивают возможность того, что по меньшей мере один из компонентов может опосредовать функцию, которая проявляется в отношении по меньшей мере одного из других компонентов. В качестве иллюстрации, последовательность регуляции транскрипции, такая как промотор, функционально связана с кодирующей последовательностью, если последовательность регуляции транскрипции контролирует уровень транскрипции кодирующей последовательности в ответ на присутствие или отсутствие одного или нескольких факторов регуляции транскрипции. Последовательность регуляции трансляции, как правило, функционально связана в цис-форме с кодирующей последовательностью, но она не должна быть непосредственно соседней с ней. Например, энхансер представляет собой последовательность регуляции транскрипции, которая функционально связана с кодирующей последовательностью, даже если они не являются соседними.
[0097] Что касается слитых полипептидов, термин "функционально связанный" может относиться к тому факту, что каждый из компонент выполняет свою функцию в связанном состоянии с другим компонентом, как если бы они не были связаны таким образом. Например, что касается слитого пептида, в котором ДНК-связывающий домен (ZFP, TALE) слит с доменом расщепления (например, эндонуклеазный домен, такой как домен FokI, домен мегануклеазы и т.д.), ДНК-связывающий домен и домен расщепления находятся в функциональной связи, если в слитом полипептиде часть ДНК-связывающего домена способна связывать ее участок-мишень и/или ее участок связывания, в то время как домен расщепления (нуклеазный домен) способен расщеплять ДНК вблизи участка-мишени. Нуклеазный домен также может проявлять способность связывания ДНК (например, нуклеаза, слитая с доменом ZFP или TALE, который также может связываться с ДНК). Аналогично, что касается слитого полипептида, в котором ДНК-связывающий домен слит с доменом активации или репрессии, ДНК-связывающий домен и домен активации или репрессии находятся в функциональной связи, если в слитом полипептиде часть ДНК-связывающего домена способна связывать ее участок-мишень и/или ее участок связывания, в то время как домен активации способен активировать экспрессию гена, или домен репрессии способен подавлять экспрессию гена. "Функциональный фрагмент" белка, полипептида или нуклеиновой кислоты представляет собой белок, полипептид или нуклеиновую кислоту, последовательность которых не является идентичной полноразмерному белку, полипептиду или нуклеиновой кислоты, но, тем не менее сохраняет ту же функцию, что и полноразмерный белок, полипептид или нуклеиновая кислота. Функциональный фрагмент может обладать большим, меньшим или тем же числом остатков, что и соответствующая нативная молекула, и/или может содержать одну или несколько аминокислотных или нуклеотидных замен. Способы определения функции нуклеиновой кислоты (например, кодирующая функция, способность гибридизации с другой нуклеиновой кислотой) хорошо известны в данной области. Аналогично, способы определения функции белка хорошо известны. Например, функцию связывания ДНК у полипептида можно определять, например, с использованием связывания с фильтром, сдвига электрофоретической подвижности или анализов иммунопреципитации. Расщепление ДНК можно анализировать гель-электрофорезом. См. Ausubel et al., выше. Способность белка взаимодействовать с другим белком можно определять, например, путем совместной иммунопреципитации, двухгибридных анализов или анализов комплементации, как генетических, так и биохимических. См., например, Fields et al. (1989) Nature 340:245-246; патент США № 5585245 и PCT WO 98/44350.
ДНК-связывающие домены
[0098] В способах, описанных в настоящем описании, можно использовать любой ДНК-связывающий домен. В определенных вариантах осуществления ДНК-связывающий домен содержит белок с цинковыми пальцами. Связывающий домен с цинковыми пальцами содержит один или несколько цинковых пальцев. Miller et al. (1985) EMBO J. 4:1609-1614; Rhodes (1993) Scientific American Feb.:56-65; патент США № 6453242. Связывающие домены с цинковыми пальцами, описанными в настоящем описании, обычно включают 2, 3, 4, 5, 6 или даже более цинковых пальцев.
[0099] Как правило, один домен с цинковыми пальцами имеет длину приблизительно 30 аминокислот. Структурные исследования продемонстрировали, что каждый домен (мотив) с цинковыми пальцами содержит бета-слои (удерживаемые бета-поворотом, который содержит два инвариантных остатка цистеина) и альфа-спираль (содержащую два инвариантных остатка гистидина), которые удерживаются в конкретной конформации посредством координации атома цинка двумя остатками цистеина и двумя остатками гистидина.
[0100] Цинковые пальцы включают как канонические C2H2 цинковые пальцы (т.е. цинковые пальцы, в которых ион цинка скоординирован двумя остатками цистеина и двумя остатками гистидина), так и неканонические цинковые пальцы, например, такие как C3H цинковые пальцы (цинковые пальцы, в которых ион цинка скоординирован тремя остатками цистеина и одним остатком гистидина) и C4 цинковые пальцы (цинковые пальцы, в которых ион цинка скоординирован четырьмя остатками цистеина). Также см. WO 02/057293, а также публикацию патента США № 20080182332 в отношении неканонических ZFP для применения в растениях.
[0101] Модифицированный способами инженерии связывающий домен с цинковыми пальцами может иметь новую специфичность связывания по сравнению со встречающимся в природе белком с цинковыми пальцами. Способы модификации способами инженерии включают, но не ограничиваются ими, рациональное конструирование и различные типы селекции. Рациональное конструирование включает, например, использование баз данных, включающих триплетные (или квадруплетные) нуклеотидные последовательности и индивидуальные аминокислотные последовательности цинковых пальцев, в которых каждая триплетная или квадруплетная нуклеотидная последовательность ассоциирована с одной или несколькими аминокислотными последовательностями цинковых пальцев, которые связывают конкретную триплетную или квадруплетную последовательность.
[0102] Иллюстративные способы селекции, включая фаговый дисплей и двухгибридные системы, описаны в патентах США 5789538; 5925523; 6007988; 6013453; 6410248; 6140466; 6200759 и 6242568; а также в WO 98/37186; WO 98/53057; WO 00/27878; WO 01/88197 и GB 2338237.
[0103] Повышение специфичности связывания в отношении связывающих доменов с цинковыми пальцами описано, например, в патенте США № 6794136.
[0104] Поскольку индивидуальный цинковый палец связывается с тринуклеотидной (т.е. триплетной) последовательностью (или четырехнуклеотидной последовательностью, которая может перекрываться на один нуклеотид с четырехнуклеотидным участком связывания соседнего цинкового пальца), длина последовательности, в которую встраивают связывающий домен с цинковыми пальцами для связывания (например, последовательности-мишени) будет определять число цинковых пальцев в модифицированном способами инженерии связывающем домене с цинковыми пальцами. Например, для ZFP, в которых домены с пальцами не связываются с перекрывающимися субучастками, последовательность-мишень из шести нуклеотидов связывается связывающим доменом с двумя пальцами; последовательность-мишень из девяти нуклеотидов связывается связывающим доменом с тремя пальцами и т.д. Как отмечалось в настоящем описании, участки связывания для индивидуальных цинковых пальцев (т.е. субучастков) в участке-мишени не должны быть непрерывными, однако они могут быть разделены одним или несколькими нуклеотидами, в зависимости от длины и природы аминокислотных последовательностей между цинковыми пальцами (т.е. линкеры между пальцами) в связывающем домене с множеством пальцев.
[0105] В связывающем домене с множеством цинковых пальцев соседние цинковые пальцы могут быть разделены аминокислотными линкерными последовательностями приблизительно из 5 аминокислот (так называемые "канонические" линкеры между пальцами) или, альтернативно, одним или несколькими неканоническими линкерами. См., например, патенты США № 6453242 и 6534261. Для модифицированных способами инженерии связывающих доменов с цинковыми пальцами, содержащих более трех пальцев, встраивание более длинных ("неканонических") межнуклеотидных линкеров между определенными цинковыми пальцами может быть желательным в некоторых случаях, поскольку это может повышать аффинность и/или специфичность связывания связывающего домена. См., например, патент США № 6479626 и WO 01/53480. Таким образом, связывающие домены с множеством цинковых пальцев также могут быть охарактеризованы в отношении присутствия и положения неканонических линкеров между пальцами. Например, связывающий домен из шести цинковых пальцев, содержащий три пальца (связанных двумя каноническими линкерами между пальцами), длинный линкер и три дополнительных пальца (связанных двумя каноническими линкерами между пальцами) обозначают как конфигурация 2×3. Аналогично, связывающий домен, содержащий два пальца (с каноническим линкером между ними), длинный линкер и два дополнительных пальца (связанных каноническим линкером) обозначают как конфигурация 2×2. Белок, содержащий три элемента из двух пальцев (в каждом из которых два пальца связаны каноническим линкером), и в котором каждый элемент из двух пальцев связан с соседним элементом с двумя пальцами длинным линкером, обозначают как конфигурация 3×2.
[0106] Присутствие длинного или неканонического линкера между двумя соседними цинковыми пальцами в связывающем домене с множеством пальцев часто позволяет связывание двух пальцев с субучастками, которые не являются непосредственно соседними в последовательности-мишени. Таким образом, могут существовать пропуски из одного или нескольких нуклеотидов между субучастками в участке-мишени; т.е. участок-мишень может содержать один или несколько нуклеотидов, с которыми не контактирует цинковый палец. Например, связывающий домен с цинковыми пальцами 2×2 может связываться с двумя последовательностями из шести нуклеотидов, разделенными одним нуклеотидом, т.е. он связывается с участком-мишенью из 13 нуклеотидов. Также см. Moore et al. (2001a) Proc. Natl. Acad. Sci. USA 98:1432-1436; Moore et al. (2001b) Proc. Natl. Acad. Sci. USA 98:1437-1441 и WO 01/53480.
[0107] Как рассмотрено выше, субучасток-мишень представляет собой трех- или четырехнуклеотидную последовательность, которая связывается одним цинковым пальцем. Для определенных целей элемент из двух пальцев обозначают как "связывающий модуль". Связывающий модуль можно получать, например, путем выбора двух соседних пальцев в контексте белка с множеством пальцев (как правило, три пальца), который связывает конкретную последовательность-мишень из шести нуклеотидов. Альтернативно модули можно конструировать посредством сборки индивидуальных цинковых пальцев. Также см. WO 98/53057 и WO 01/53480.
[0108] Альтернативно ДНК-связывающий домен может происходить из нуклеазы. Например, последовательности распознавания хоминг-эндонуклеаз и мегануклеаз, таких как I-SceI, I-CeuI, PI-PspI, PI-Sce, I-SceIV, I-CsmI, I-PanI, I-SceII, I-PpoI, I-SceIII, I-CreI, I-TevI, I-TevII и I-TevIII, известны. Также см. патент США № 5420032; патент США № 6833252; Belfort et al. (1997) Nucleic Acids Res. 25:3379-3388; Dujon et al. (1989) Gene 82:115-118; Perler et al. (1994) Nucleic Acids Res. 22, 1125-1127; Jasin (1996) Trends Genet. 12:224-228; Gimble et al. (1996) J. Mol. Biol. 263:163-180; Argast et al. (1998) J. Mol. Biol. 280:345-353 и каталог New England Biolabs. Кроме того, специфичность связывания ДНК хоминг-эндонуклеаз и мегануклеаз можно модифицировать способами инженерии, чтобы они связывались с неприродными участками-мишенями. См., например, Chevalier et al. (2002) Molec. Cell 10:895-905; Epinat et al. (2003) Nucleic Acids Res. 31:2952-2962; Ashworth et al. (2006) Nature 441:656-659; Paques et al. (2007) Current Gene Therapy 7:49-66; публикацию патента США № 20070117128. ДНК-связывающие домены хомингэндонуклеаз и мегануклеаз могут быть изменены в контексте нуклеазы в целом (т.е. так что нуклеаза включает собственный домен расщепления) или могут быть слиты с гетерологичным ДНК-связывающим доменом (например, белок с цинковыми пальцами или TALE) или с гетерологичным доменом расщепления. ДНК-связывающие домены, происходящие из мегануклеаз, также могут проявлять активность связывания ДНК.
[0109] В других вариантах осуществления ДНК-связывающий домен содержит встречающийся в природе или сконструированный (не встречающийся в природе) ДНК-связывающий домен эффектора TAL. См., например, патент США № 8586526, включенный в настоящее описание в качестве ссылки в полном объеме. Известно, что патогенные для растений бактерии рода Xanthomonas вызывают множество заболеваний в важных сельскохозяйственных культурах. Патогенность Xanthomonas зависит от консервативной системы секреции типа III (T3S), которая инъецирует более 25 различных эффекторных белков в растительную клетку. Среди этих инъецируемых белков находятся эффекторы, подобные активаторам транскрипции (TALE), которые имитируют активаторы транскрипции растений и манипулируют транскриптомом растений (см. Kay et al (2007) Science 318:648-651). Эти белки содержат ДНК-связывающий домен и домен активации транскрипции. Одним из наиболее хорошо охарактеризованных эффекторов TALE является AvrBs3 из Xanthomonas campestgris pv. Vesicatoria (см. Bonas et al (1989) Mol Gen Genet 218: 127-136 и WO2010079430). TALE содержат централизованный домен из тандемных повторов, причем каждый повтор содержит приблизительно 34 аминокислоты, которые являются ключевыми для специфичности этих белков в отношении связывания ДНК. Кроме того, они содержат последовательность ядерной локализации и кислотный домен активации транскрипции (для обзора см. Schornack S, et al (2006) J Plant Physiol 163(3): 256-272). Кроме того, в фитопатогенных бактериях Ralstonia solanacearum было выявлено два гена, обозначаемых brg11 и hpx17, которые гомологичны семейству AvrBs3 Xanthomonas в биоваре 1 R. solanacearum штамма GMI1000 и в биоваре 4 штамма RS1000 (См. Heuer et al (2007) Appl and Envir Micro 73(13): 4379-4384). Эти гены на 98,9% идентичны друг другу по нуклеотидной последовательности, но отличаются делецией 1575 п.н. в домене повтора hpx17. Однако продукты обоих генов имеют менее чем 40% идентичность последовательности с белками семейства AvrBs3 Xanthomonas.
[0110] Таким образом, в некоторых вариантах осуществления ДНК-связывающий домен, который связывается с участком-мишенью в локусе-мишени, представляет собой модифицированный способами инженерии домен из эффектора TAL, сходный с доменами, происходящими из патогенов растений Xanthomonas (см. Boch et al, (2009) Science 326: 1509-1512 и Moscou and Bogdanove, (2009) Science326: 1501) и Ralstonia (см. Heuer et al (2007) Applied and Environmental Microbiology 73(13): 4379-4384); патенты США № 8586526; 8420782 и 8440431. TALEN могут включать последовательности C-кэпа и/или N-кэпа (например, C-концевые и/или N-концевые укорочения основной цепи TALE (например, "+17", "+63" C-кэпы). См., например, патент США № 8586526.
[0111] В качестве другой альтернативы ДНК-связывающий домен может происходить из белка с лейциновой молнией. Лейциновые молнии представляют собой класс белков, которые вовлечены в белок-белковые взаимодействия во многих эукариотических регуляторных белках, которые являются важными факторами транскрипции, ассоциированными с экспрессией генов. Лейциновая молния относится к общему структурному мотиву в этих факторах транскрипции среди нескольких царств, включая животных, растения, дрожжи и т.д. Лейциновая молния образуется двумя полипептидами (гомодимер или гетеродимер), которые связываются с определенными последовательностями ДНК таким образом, что остатки лейцина равномерно отстоят друг от друга на протяжении α-спирали, так что остатки лейцина двух полипептидов оканчиваются на одной и той же поверхности спирали. Специфичность связывания лейциновых молний с ДНК можно использовать в ДНК-связывающих доменах, описанных в настоящем описании.
Домены расщепления
[0112] Как отмечалось выше, любой ДНК-связывающий домен может быть связан с доменом расщепления (нуклеазным доменом). Например, хоминг-эндонуклеазы можно модифицировать в отношении их специфичности связывания ДНК при сохранении нуклеазной функции. Кроме того, также белки с цинковыми пальцами можно подвергать слиянию с нуклеазным доменом (доменом расщепления) для получения нуклеазы с цинковыми пальцами (ZFN). Белки TALE можно связывать с нуклеазным доменом (доменом расщепления) для формирования TALEN.
[0113] Часть домена расщепления в слитых белках, описанных в настоящем описании, можно получать из любой эндонуклеазы или экзонуклеазы. Иллюстративные эндонуклеазы, из которых может происходить домен расщепления, включают, но не ограничиваются ими, эндонуклеазы рестрикциии и хоминг-эндонуклеазы. См., например, 2002-2003 Catalogue, New England Biolabs, Beverly, MA; и Belfort et al. (1997) Nucleic Acids Res. 25:3379-3388. Дополнительные ферменты, которые расщепляют ДНК, известны (например, нуклеаза S1; нуклеаза золотистой фасоли; панкреатическая ДНК-аза I; микрококковая нуклеаза; эндонуклеаза HO дрожжей; также см. Linn et al. (eds.) Nucleases, Cold Spring Harbor Laboratory Press, 1993). Известны неограничивающие примеры хоминг-эндонуклеаз и мегануклеаз, и они включают I-SceI, I-CeuI, PI-PspI, PI-Sce, I-SceIV, I-CsmI, I-PanI, I-SceII, I-PpoI, I-SceIII, I-CreI, I-TevI, I-TevII и I-TevIII. Также см. патент США № 5420032; патент США № 6833252; Belfort et al. (1997) Nucleic Acids Res. 25:3379-3388; Dujon et al. (1989) Gene 82:115-118; Perler et al. (1994) Nucleic Acids Res. 22, 11256-1127; Jasin (1996) Trends Genet. 12:224-228; Gimble et al. (1996) J. Mol. Biol. 263:163-180; Argast et al. (1998) J. Mol. Biol. 280:345-353 и каталог New England Biolabs. В качестве источника доменов расщепления и половинных доменов расщепления можно использовать один или несколько из этих ферментов (или их функциональных фрагментов).
[0114] Эндонуклеазы рестрикции (ферменты рестрикции) присутствуют во многих видах и способны к специфическому в отношении последовательности связыванию с ДНК (в участке распознавания), и расщеплению ДНК в или вблизи участка связывания. Определенные ферменты рестрикции (например, типа IIS) расщепляют ДНК в участках, удаленных от участка распознавания, и имеют отдельные домены связывания и расщепления. Например, фермент FokI типа IIS катализирует двухцепочечное расщепление ДНК на расстоянии 9 нуклеотидов от его участка распознавания на одной цепи и на расстоянии 13 нуклеотидов от его участка распознавания на другой цепи. См., например, патенты США 5356802; 5436150 и 5487994; а также Li et al. (1992) Proc. Natl. Acad. Sci. USA 89:4275-4279; Li et al. (1993) Proc. Natl. Acad. Sci. USA 90:2764-2768; Kim et al. (1994a) Proc. Natl. Acad. Sci. USA 91:883-887; Kim et al. (1994b) J. Biol. Chem. 269:31.978-31.982. Таким образом, в одном варианте осуществления слитые белки содержат домен расщепления (или половинный домен расщепления) из по меньшей мере одного фермента рестрикции типа IIS и один или несколько связывающих доменов с цинковыми пальцами, которые могут быть модифицированными способами инженерии или могут не быть модифицированными.
[0115] Иллюстративным ферментом рестрикции типа IIS, домен расщепления которого является отделимым от домена связывания, является FokI. Этот конкретный фермент активен в качестве димера. Bitinaite et al. (1998) Proc. Natl Acad. Sci. USA 95: 10.570-10.575. Таким образом, для целей настоящего изобретения часть фермента FokI, используемая в описанных слитых белках, считается половинным доменом расщепления. Таким образом, для направленного двухцепочечного расщепления и/или направленной замены клеточных последовательностей с использованием слитых конструкций цинковый палец-fokI можно использовать два слитых белка, каждый из которых содержит половинный домен расщепления FokI, чтобы восстановить каталитически активный домен расщепления. Альтернативно также можно использовать одну полипептидную молекулу, содержащую ДНК-связывающий домен и два половинных домена расщепления FokI. Параметры направленного расщепления и направленного изменения последовательности с использованием слитых конструкций цинковый палец-FokI представлены в настоящем описании.
[0116] Домен расщепления или половинный домен расщепления может представлять собой любую часть белка, которая сохраняет активность расщепления или которая сохраняет способность к мультимеризации (например, димеризации) с образованием функционального домена расщепления.
[0117] Иллюстративные ферменты рестрикции типа IIS описаны в публикации патента США № 20070134796, включенной в настоящее описание в полном объеме.
[0118] Для повышения специфичности расщепления также можно модифицировать домены расщепления. В определенных вариантах осуществления используют варианты домена расщепления и эти варианты минимизируют или препятствуют гомодимеризации половинных доменов расщепления. Все из аминокислотных остатков в положениях 446, 447, 479, 483, 484, 486, 487, 490, 491, 496, 498, 499, 500, 531, 534, 537 и 538 FokI являются мишенями для влияния на димеризацию половинных доменов расщепления FokI. Неограничивающие примеры таких модифицированных половинных доменов расщепления подробно описаны в патентах США № 7888121; 7914796 и 8034598, включенных в настоящее описание к качестве ссылок. Также см. примеры.
[0119] Дополнительные модифицированные способами инженерии половинные домены расщепления FokI, которые образуют облигатные гетеродимеры, также можно использовать в ZFN, описанных в настоящем описании. Иллюстративные модифицированные способами инженерии половинные домены расщепления Fok I, которые образуют облигатные гетеродимеры, включают пару, в которой первый половинный домен расщепления включает мутации аминокислотных остатков в положениях 490 и 538 Fok I и второй половинный домен расщепления включает мутации аминокислотных остаткаов 486 и 499.
[0120] Таким образом, в одном варианте осуществления мутация в положении 490 представляет собой замену Glu (E) на Lys (K); мутация в положении 538 представляет собой замену Iso (I) на Lys (K); мутация в положении 486 представляет собой замену Gln (Q) на Glu (E); и мутация в положении 499 представляет собой замену Iso (I) на Lys (K). В частности, модифицированные способами инженерии половинные домены расщепления, описанные в настоящем описании, получали путем внесения мутаций в положения 490 (E→K) и 538 (I→K) одного половинного домена расщепления с получением модифицированного способами инженерии половинного домена, обозначаемого как "E490K:I538K", и путем мутации положений 486 (Q→E) и 499 (I→L) другого половинного домена расщепления с получением модифицированного способами инженерии половинного домена, обозначаемого как "Q486E:I499L". Модифицированные способами инженерии половинные домены, описанные в настоящем описании, представляют собой облигатно гетеродимерные мутанты, в которых аберрантное расщепление минимизировано или устранено. См., например, патенты США № 7914796 и 8034598, содержание которых включено в настоящее описание в качестве ссылки в полном объеме для любых целей. В определенных вариантах осуществления модифицированный способами инженерии половинный домен расщепления содержит мутации в положениях 486, 499 и 496 (пронумерованы относительно FokI дикого типа), например, мутации, которые заменяют остаток Gln (Q) дикого типа в положении 486 на остаток Glu (E), остаток Iso (I) дикого типа в положении 499 на остаток Leu (L) и остаток Asn (N) дикого типа в положении 496 на остаток Asp (D) или Glu (E) (также обозначаемые как домены "ELD" и "ELE", соответственно). В других вариантах осуществления модифицированный способами инженерии половинный домен расщепления содержит мутации в положениях 490, 538 и 537 (пронумерованы относительно FokI дикого типа), например, мутации, которые заменяют остаток Glu (E) дикого типа в положении 490 на остаток Lys (K), остаток Iso (I) дикого типа в положении 538 на остаток Lys (K), и остаток His (H) дикого типа в положении 537 на остаток Lys (K) или остаток Arg (R) (также обозначаемые как домены "KKK" и "KKR", соответственно). В других вариантах осуществления модифицированный способами инженерии половинный домен расщепления содержит мутации в положениях 490 и 537 (пронумерованы относительно FokI дикого типа), например, мутации, которые заменяют остаток Glu (E) дикого типа в положении 490 на остаток Lys (K) и остаток His (H) дикого типа в положении 537 на остаток Lys (K) или остаток Arg (R) (также обозначаемые как домены "KIK" и "KIR", соответственно). (См. публикацию патента США № 20110201055). В других вариантах осуществления модифицированный способами инженерии половинный домен расщепления содержит мутации "Sharkey" и/или "Sharkey'" (см. Guo et al, (2010) J. Mol. Biol. 400(1):96-107).
[0121] Модифицированные способами инженерии половинные домены расщепления, описанные в настоящем описании, можно получать с использованием любого подходящего способа, например, сайт-направленного мутагенеза половинных доменов расщепления дикого типа (Fok I), как описано в патентах США № 7914796; 8034598 и 8623618; и в публикации патента США № 20110201055.
[0122] В других вариантах осуществления нуклеаза содержит модифицированный способами инженерии ДНК-связывающий домен TALE и нуклеазный домен (например, домен эндонуклеазы и/или мегануклеазы), также упоминаемые как TALEN. Описаны способы и композиции для конструирования этих белков TALEN для прочного сайт-специфического взаимодействия с последовательностью-мишенью по выбору пользователя (см. патент США № 8586526). В некоторых вариантах осуществления TALEN содержит домен расщепления (например, FokI) или половинный домен расщепления эндонуклеазы. В других вариантах осуществления TALE-нуклеаза представляет собой мега-TAL. Эти нуклеазы мега-TAL представляют собой слитые белки, содержащие ДНК-связывающий домен TALE и домен расщепления мегануклеазы. Домен расщепления мегануклеазы является активным в качестве мономера и не требует димеризации для активности. (См. Boissel et al., (2013) Nucl Acid Res: 1-13, doi: 10.1093/nar/gkt1224). Кроме того, нуклеазный домен также проявляет функциональность связывания ДНК.
[0123] В следующих варианта осуществления, нуклеаза содержит компактный TALEN (cTALEN). Эти одноцепочечные слитые белки связывают ДНК-связывающий домен TALE с нуклеазным доменом TevI. Слитый белок может выступать либо в качестве никазы, локализованной в области TALE, либо может создавать двухцепочечный разрыв, в зависимости от того, где расположен ДНК-связывающий домен TALE относительно нуклеазного домена TevI (см. Beurdeley et al (2013) Nat Comm: 1-8 DOI: 10.1038/ncomms2782). Любые TALEN можно использовать в комбинации с дополнительными TALEN (например, один или несколько TALEN (cTALEN или FokI-TALEN) с одной или несколькими мега-TAL).
[0124] Нуклеазы можно собирать in vivo в участке-мишени нуклеиновой кислоты с использованием так называемой технологии "разделенного фермента" (см., например, публикацию патента США № 20090068164). Компоненты таких разделенных ферментов можно экспрессировать либо на отдельных экспрессирующих конструкциях, либо их можно связывать в одну открытую рамку считывания, где индивидуальные компоненты разделены, например, саморасщепляющимся пептидом 2A или последовательностью IRES. Компоненты могут представлять собой индивидуальные связывающие домены с цинковыми пальцами или домены связывающего нуклеиновую кислоту домена мегануклеазы.
[0125] Нуклеазы можно подвергать скринингу в отношении активности перед применением, например, в хромосомной системе на основе дрожжей, описанной в патенте США № 8563314. Экспрессирущие конструкции нуклеазы можно без труда конструировать с использованием способов, известных в данной области. См., например, публикации патентов США 20030232410; 20050208489; 20050026157; 20050064474; 20060188987; 20060063231; и международную публикацию WO 07/014275. Экспрессия нуклеаз может находиться под контролем конститутивного промотора или индуцибельного промотора, например, промотора галактокиназы, который активируется (дерепрессируется) в присутствии рафинозы и/или галактозы и репрессируется в присутствии глюкозы.
[0126] В определенных вариантах осуществления нуклеаза содержит систему CRISPR/Cas. Локус CRISPR (кластеризованные регулярно расположенные короткие палиндромные повторы), который кодирует РНК-компоненты системы, и локус cas (ассоциированный с CRISPR), который кодирует белки (Jansen et al., 2002. Mol. Microbiol. 43: 1565-1575; Makarova el al., 2002. Nucleic Acids Res. 30: 482-496; Makarova et al., 2006. Biol. Direct 1: 7; Haft et al., 2005. PLoS Comput. Biol. 1: e60) формируют последовательности генов системы нуклеаз CRISPR/Cas. Локусы CRISPR в микробных хозяевах содержат комбинацию ассоциированных с CRISPR (Cas) генов, а также некодирующие РНК-элементы, способные программировать специфичность опосредуемого CRISPR расщепления нуклеиновых кислот.
[0127] CRISPR типа II представляет собой одну из наиболее охарактеризованных систем, и она осуществляет направленный разрыв двухцепочечной ДНК за четыре последовательных стадии. Во-первых, с локуса CRISPR транскрибируются две некодирующих РНК: матрица пре-crRNA и tracrRNA. Во-вторых, tracrRNA гибридизуется с областями повторов пре-crRNA и опосредует процессинг пре-crRNA в зрелые crRNA, содержащие индивидуальные спейсерные последовательности. В-третьих, зрелый комплекс crRNA:tracrRNA направляет Cas9 к ДНК-мишени через образование пар по принципу Уотсона-Крика между спейсером на crRNA и протоспейсером на ДНК-мишени рядом с соседним с протоспейсером мотивом (PAM), что является дополнительным требованием для распознавания мишени. Наконец, Cas9 опосредует расщепление ДНК-мишени, создавая двухцепочечный разрыв в протоспейсере. Активность Cas-системы CRISPR включает три стадии: (i) встраивание чужеродных последовательностей ДНК в матрицу CRISPR для предупреждения будущих атак в процессе, называемом "адаптацией", (ii) экспрессия соответствующих белков, а также экспрессия и процессинг матрицы, за которой следует (iii) РНК-опосредуемая интерференция в отношении чужеродной нуклеиновой кислоты. Таким образом, в бактериальной клетке несколько так называемых белков "Cas" вовлечено в природную функцию системы CRISPR/Cas и участвуют в таких функциях, как встраивание чужеродной ДНК и т.д.
[0128] В определенных вариантах осуществления белок Cas может представлять собой "функциональное производное" встречающегося в природе белка Cas. "Функциональное производное" полипептида с нативной последовательностью представляет собой соединение, обладающее качественным биологическим свойством, являющимся общим с полипептидом с нативной последовательностью. "Функциональные производные" включают, но не ограничиваются ими, фрагменты полипептида с нативной последовательностью и производные полипептида с нативной последовательностью и их фрагменты при условии, что они обладают общей биологической активностью с соответствующим полипептидом с нативной последовательностью. Биологическая активность, предусматриваемая в рамках настоящего изобретения, представляет собой способность функционального производного гидролизовать ДНК-субстрат на фрагменты. Термин "производное" охватывает как варианты аминокислотной последовательности полипептида, так и ковалентные модификации, и его слитые конструкции. Подходящие производные полипептида Cas или его фрагмента включают, но не ограничиваются ими, мутанты, слитые конструкции, ковалентные модификации белка Cas или его фрагмента. Белок Cas, который включает белок Cas или его фрагмент, а также производные белка Cas или его фрагмента, можно получать из клетки или синтезировать химически или путем комбинирования этих двух действий. Клетка может представлять собой клетку, которая в естественным путем продуцирует белок Cas, или клетку, которая естественным путем продуцирует белок Cas и модифицирована способами генной инженерии для продуцирования эндогенного белка Cas на более высоком уровне экспрессии или для продуцирования белка Cas с экзогенно введенной нуклеиновой кислоты, которая кодирует Cas, который является таким же или отличается от эндогенного Cas. В некоторых случаях клетка не продуцирует естественным образом белок Cas и она модифицирована способами генной инженерии для продуцирования белка Cas. См., например, временную заявку США № 61/823689.
[0129] Таким образом, нуклеаза содержит ДНК-связывающий домен, который специфически связывается с участком-мишенью в любом гене, в комбинации с нуклеазным доменом, который расщепляет ДНК в участке связывания или вблизи участка связывания.
Слитые белки
[0130] Способы разработки и конструирования слитых белков (и полинуклеотидов, кодирующих их) известны специалистам в данной области. Например, способы разработки и конструирования слитых белков, содержащих ДНК-связывающие домены (например, домены с цинковыми пальцами, TALE) и регуляторных доменов или доменов расщепления (или половинных доменов расщепления) и полинуклеотидов, кодирующих такие слитые белки, описаны в патентах США 8586526; 8592645; 8399218; 8329986; 7888121; 6453242 и 6534261, и в публикациях патентных заявок США 2007/0134796, включенных в настоящее описание в качестве ссылок в полном объеме. В определенных вариантах осуществления конструируют полинуклеотиды, кодирующие слитые белки. Эти полинуклеотиды можно встраивать в вектор и вектор можно вводить в клетку (см. ниже для дополнительного описания, касающегося векторов и способов введения полинуклеотидов в клетки).
[0131] В определенных вариантах осуществления способов, описанных в настоящем описании, нуклеаза с цинковыми пальцами или TALEN содержит слитый белок, содержащий связывающий домен с цинковыми пальцами или ДНК-связывающий домен TALE и нуклеазный домен (например, домен фермента рестрикции типа IIS и/или домен мегануклеазы). В определенных вариантах осуществления ZFN или TALEN содержат половинный домен расщепления из фермента рестрикции FokI и два таких слитых белка экспрессируются в клетке. Экспрессия двух слитых белков в клетках может быть результатом доставки двух белков в клетку; доставки одного белка и одной нуклеиновой кислоты, кодирующей один из белков, в клетку; доставки двух нуклеиновых кислот, каждая из которых кодирует один из белков, в клетку; или доставки одной нуклеиновой кислоты, кодирующей оба белка, в клетку. В дополнительном варианте осуществления слитый белок содержит одну полипептидную цепь, содержащую два половинных домена расщепления и домен с цинковыми пальцами или связывающий домен TALE. В этом случае, один слитый белок экспрессируется в клетке и, без связи с теорией полагают, что он расщепляет ДНК в результате образования внутримолекулярного димера половинных доменов расщепления.
[0132] В определенных вариантах осуществления компоненты слитых белков (например, слитых белков ZFP-FokI) организованы так, что ДНК-связывающий домен является наиболее близким к N-концу слитого белка, и половинный домен расщепления является наиболее близким к C-концу. Это отражает относительную ориентацию домена расщепления во встречающихся в природе димеризующихся доменах расщепления, таких как домены расщепления, происходящие из фермента FokI, в которых ДНК-связывающий домен является наиболее близким к N-концу и половинный домен расщепления является наиболее близким к С-концу. В этих вариантах осуществления димеризацию половинного домена расщепления для формирования функциональной нуклеазы осуществляют путем связывания слитых белков с участками на противоположных цепях ДНК, причем 5'-концы участков связывания располагаются проксимально друг относительно друга.
[0133] В дополнительных вариантах осуществления компоненты слитых белков (например, слитые конструкции ZFP-FokI) расположены так, что половинный домен расщепления является наиболее близким к N-концу слитого белка и домен с цинковыми пальцами является наиболее близким к С-концу. В этих вариантах осуществления димеризацию половинных доменов расщепления для формирования функциональной нуклеазы осуществляют путем связывания слитых белков с участками на противоположных цепях ДНК, причем 3’-концы участков связывания расположены проксимально друг относительно друга.
[0134] В дополнительных вариантах осуществления первый слитый белок содержит половинный домен расщепления, являющийся наиболее близким к N-концу слитого белка, и домен с цинковыми пальцами, являющийся наиболее близким к С-концу, и второй слитый белок организован так, что домен с цинковыми пальцами является наиболее близким к N-концу слитого белка и половинный домен расщепления является наиболее близким к С-концу. В этих вариантах осуществления оба слитых белка связываются с одной и той же цепью ДНК, причем участок связывания первого первого слитого белка, содержащий домен с цинковыми пальцами, являющийся наиболее близким к С-концу, расположен с 5’-стороны от участка связывания второго слитого белка, содержащего домен с цинковыми пальцами, являющийся наиболее близким к N-концу.
[0135] В определенных вариантах осуществления описанных слитых белков аминокислотную последовательность между доменом с цинковыми пальцами и доменом расщепления (или половинным доменом расщепления) обозначают как "ZC-линкер". ZC-линкер отличается от других линкеров, связывающих пальцы, которые описаны выше. См., например, патент США № 7888121 для деталей в отношении получения ZC-линкеров, которые оптимизируют расщепление.
[0136] В одном варианте осуществления изобретение относится к ZFN, включающей белок с цинковыми пальцами, имеющий одну или несколько из аминокислотных последовательностей распознающей спирали, представленных в таблице 2 (например, белок с цинковыми пальцами, состоящий из являющихся его компонентами доменов с цинковыми пальцами с распознающими спиралями, как показано в одном ряду таблицы 2). В другом варианте осуществления в рамках настоящего изобретения предусматривается экспрессирующий вектор ZFP, содержащий нуклеотидную последовательность, кодирующую ZFP, имеющий одну или несколько распознающих спиралей, показанных в таблицах 2 или 12. В другом варианте осуществления в рамках настоящего изобретения предусматривается ZFP, который связывается с участком-мишенью, как показано в таблицах 3 или 13, или полинуклеотид, кодирующий ZFP, который связывается с участком-мишенью, показанным в таблицах 3 или 13.
Участки-мишени
[0137] Описанные способы и композиции включают слитые белки, содержащие ДНК-связывающий домен (например, ZFP, TALE и т.д.) и регуляторный домен или домен расщепления (например, нуклеазный домен) (или половинный домен расщепления), в котором ДНК-связывающий домен посредством связывания с последовательностью в клеточном хроматине одного или нескольких генов растений индуцирует расщепление и направленное встраивание одной или нескольких экзогенных последовательностей (включая трансгены) вблизи последовательности-мишени.
[0138] Как указано в настоящем описании ДНК-связывающий домен можно модифицировать способами инженерии так, чтобы он связывался практически с любой желаемой последовательностью. Таким образом, после идентификации представляющей интерес области, содержащей последовательность, в которой являются желательными регуляция, расщепление или рекомбинация гена, один или несколько ДНК-связывающих доменов можно модифицировать способами инженерии так, чтобы они связывались с одной или несколькими последовательностями в представляющей интерес области. В определенных вариантах осуществления ДНК-связывающий домен содержит белок с цинковыми пальцами, который связывается с участком-мишенью в одном или нескольких генах AHAS, как показано в таблице 3 или таблице 13.
[0139] Выбор участка-мишени в представляющей интерес геномной области клеточного хроматина любого гена для связывания ДНК-связывающим доменом (например, участок-мишень) можно проводить, например, в соответствии со способами, описанными в патенте США № 6453242. Специалистам в данной области будет понятно, что также для выбора участка-мишени можно использовать простое визуальное исследование нуклеотидной последовательности. Таким образом, в заявленных способах можно использовать любые способы выбора участка-мишени.
[0140] Участки-мишени, как правило, состоят из множества соседних субучастков-мишеней. В случае белков с цинковыми пальцами субучасток-мишень относится к последовательности (обычно либо нуклеотидный триплет, либо нуклеотидный квадруплет, который может перекрываться на один нуклеотид с соседним квадруплетом), связываемой индивидуальными цинковым пальцем. См., например, патент США № 6794136. Если цепь, с который белок с цинковыми пальцами образует большинство контактов, представляет собой сконструированную "первичную цепь распознавания" или "первичную цепь контакта" цепи-мишени, некоторые белки с цинковыми пальцами связываются с триплетами из трех оснований в цепи-мишени и четвертым основанием на не являющейся мишенью цепи. Участок-мишень, как правило, имеет длину по меньшей мере 9 нуклеотидов и, таким образом, связывается связывающим доменом с цинковыми пальцами, содержащим по меньшей мере три цинковых пальца. Однако также является возможным связывание, например, связывающего домена с 4 пальцами с участком-мишенью из 12 нуклеотидов, связывающего домена с 5 пальцами с участком-мишенью из 15 нуклеотидов, или связывающего домена с 6 пальцами с участком-мишенью из 18-нуклеотидов. Как будет понятно, также является возможным связывание более крупных связывающих доменов (например, 7, 8, 9 пальцев и более) с более длинными участками-мишенями.
[0141] Для участка-мишени не является обязательным, чтобы он представлял собой участок из множества тройных нуклеотидов. Например, в случаях, в которых происходят перекрестные взаимодействия цепей (см., например, патент США 6453242 и 6794136), один или несколько индивидуальных цинковых пальцев связывающего домена с множеством цинковых пальцев могут связываться с перекрывающимися квадруплетными субучастками. В результате белок с тремя цинковыми пальцами может связывать последовательность из 10 нуклеотидов, где десятый нуклеотид является частью квадруплета, связываемого концевым пальцем, белок с четырьмя пальцами может связывать последовательность из 13 нуклеотидов, где тринадцатый нуклеотид является частью квадруплета, связываемого концевым пальцем, и т.д.
[0142] В определенных вариантах осуществления участок-мишень находится в локусе AHAS (включая нетранслируемые области, такие как 3'-нетранслируемая область AHAS). Неограничивающие примеры пригодных участков-мишеней AHAS представлены в таблице 3 и в таблице 13. Гены AHAS (также известные как AHAS/ALS), присутствуют во всех основных видах растений, включая, но не ограничиваясь ими, кукурузу, сою, хлопок, Arabidopsis, рис, подсолнечник, пшеницу, ячмень, сахарную свеклу и Brassica. Описаны конкретные аминокислотные модификации структурной последовательности гена AHAS, которые изменяют чувствительность конечных белков к различным структурным классам гербицидов без отрицательного влияния на характеристики растения. Например, толерантная к имидазолинону кукуруза (Zea mays L.) [Currie RS, Kwon CS and Penner D, Magnitude of imazethapyr resistance of corn (Zea mays) hybrids with altered acetolactate synthase. Weed Sci 43:578-582 (1995), Wright TR and Penner D, Corn (Zea mays) acetolactate synthase sensitivity to four classes of ALS-inhibiting herbicides. Weed Sci 46:8-12 (1998), Siehl DL, Bengtson AS, Brockman JP, Butler JH, Kraatz GW, Lamoreaux RJ and Subramanian MV, Patterns of cross tolerance to herbicides inhibiting acetohydroxyacid synthase in commercial corn hybrids designed for tolerance to imidazolinones. Crop Sci 36:274-278 (1996), and Bailey WA and Wilcut JW, Tolerance of imidazolinone-resistant corn (Zea mays) to diclosulam. Weed Technol 17:60-64 (2003)], рис (Oryza sativa L.) [Webster EP and Masson JA, Acetolactate synthase-inhibiting herbicides on imidazolinone-tolerant rice. Weed Sci 49:652-657 (2001) and, Gealy DR, Mitten DH and Rutger JN, Gene flow between red rice (Oryza sativa) and herbicide-resistant rice (O sativa): implications for weed management. Weed Technol 17:627-645 (2003)], пшеница обыкновенная (Triticum aestivum L.) [Newhouse K, Smith WA, Starrett MA, Schaefer TJ and Singh BK, Tolerance to imidazolinone herbicides in wheat. Plant Physiol 100:882-886 (1992), and Pozniak CJ and Hucl PJ, Genetic analysis of imidazolinone resistance in mutation-derived lines of common wheat. Crop Sci 44:23-30 (2004)] и масличный рапс (Brassica napus and B. juncea L. Czern.) [Shaner DL, Bascomb NF and Smith W, Imidazolinoneresistant crops: selection, characterization and management, in Herbicide resistant crops, edited by Duke SO, CRC Press, Boca Raton, pp 143-157 (1996) and Swanson EB, Herrgesell MJ, Arnoldo M, Sippell DW and Wong RSC, Microspore mutagenesis and selection: canola plants with field tolerance to the imidazolinones. Theor Appl Genet 78:525-530 (1989)], были получены посредством мутагенеза, селекции и общепринятых технологий разведения и они коммерчески производятся с 1992, 2003, 2002 и 1996 годов, соответственно. Несколько генов AHAS, кодирующих ферменты AHAS, которые являются толерантными к имидазолиноновым гербицидам, были открыты в растениях в качестве встречающихся в природе мутаций и посредством процесса химически-индуцируемого мутагенеза. Мутация S653N входит в пять наиболее распространенных единичных точковых мутаций в генах AHAS, которые приводят к толерантности к имидазолиноновым гербицидам в растениях (Tan, S., Evans, R.R., Dahmer, M.L., Singh, B.K., and Shaner, D.L. (2005) Imidazolinone-tolerant crops: History, current status and future. Pest Manag. Sci. 61:246-257).
[0143] Длина и природа аминокислотных линкерных последовательностей между индивидуальными цинковыми пальцами в связывающем домене с множеством пальцев также влияют на связывание с последовательностью-мишенью. Например, присутствие так называемого "неканонического линкера", "длинного линкера" или "структурированного линкера" между соседними цинковыми пальцами в связывающем домене с множеством пальцев может позволить этим пальцам связывать субучастки, которые не являются непосредственно соседними. Неограничивающие примеры таких линкеров описаны, например, в патентах США № 6479626 и 7851216. Таким образом, один или несколько субучастков в участке-мишени связывающего домена с цинковыми пальцами могут быть отделены друг от друга 1, 2, 3, 4, 5 или более нуклеотидами. Для предоставления только одного примера, связывающий домен с четырьмя цинковыми пальцами может связываться с участком-мишенью из 13 нуклеотидов, содержащим последовательно два соседних субучастка из 3 нуклеотидов, встроенный между ними нуклеотид и два соседних триплетных субучастка. Также см. публикации патентов США № 20090305419 и 20110287512 для композиций и способов связывания искусственных нуклеаз у участками-мишенями с разделением различным числом нуклеотидов. Расстояние между последовательностями (например, участками-мишенями) относится к числу нуклеотидов или пар нуклеотидов, встроенных между двумя последовательностями при измерении с обоих концов последовательностей, наиболее близко расположенных друг к другу.
[0144] В определенных вариантах осуществления ДНК-связывающие домены с функцией фактора транскрипции создают, например, путем конструирования слитых белков, содержащих ДНК-связывающий домен (например, ZFP или TALE) и домен регуляции транскрипции (например, домен активации или репрессии). Для функционирования фактора транскрипции простое связывание и достаточная близость к промотору обычно являются всем, что необходимо. Точное положение относительно промотора, ориентация и в определенных пределах расстояние не имеют большого значения. Этот признак обеспечивает значительную гибкость при выборе участков-мишеней для конструирования искусственных факторов транскрипции. Участок-мишень, распознаваемый ДНК-связывающим доменом, таким образом, может представлять собой любой подходящий участок в гене-мишени, который позволяет активацию или репрессию экспрессии гена, необязательно связанного с регуляторным доменом. Предпочтительные участки-мишени включают области, являющиеся соседними, нижележащими или вышележащими от участка начала транскрипции. Кроме того, предусматриваются участки-мишени, которые расположены в энхансерных областях, репрессорных участках, участках паузы РНК-полимеразы и определенных регуляторных участках (например, участки SP-1, элементы ответа на гипоксию, элементы распознавания ядерных рецепторов, участки связывания p53), участках в кодирующей области кДНК или в кодирующей области меток экспрессии последовательностей (EST).
[0145] В других вариантах осуществления конструируют ZFP с нуклеазной активностью. Экспрессия ZFN, содержащего слитый белок, содержащий связывающий домен с цинковыми пальцами и домен расщепления (или два слитых белка, каждый из которых содержит связывающий домен с цинковыми пальцами и половинный домен расщепления), в клетке обеспечивают расщепление вблизи последовательности-мишени. В определенных вариантах осуществления расщепление зависит от связывания двух молекул слитых молекул домен с цинковыми пальцами/половинный домен расщепления для разделения участков-мишеней. Два участка-мишени могут находиться на противоположных цепях ДНК или альтернативно оба участка-мишени могут находиться на одной цепи ДНК.
[0146] Для определения того, модулирует ли ZFP экспрессию генов, можно использовать различные анализы. Активность конкретного ZFP можно оценивать с использованием различных анализов in vitro и in vivo, путем измерения, например, уровней белка или мРНК, уровней продукта, активности фермента, активации транскрипции или репрессии репортерного гена, с использованием, например, иммуноанализов (например, ELISA и иммуногистохимические анализы с антителами), анализов гибридизации (например, защита от РНКаз, нозерн-анализы, гибридизация in situ, исследования с олигонуклеотидными матрицами), колориметрических анализов, анализов амплификации, анализов активности фермента, фенотипических анализов и т.п.
[0147] ZFP, как правило, сначала исследуют в отношении активности in vitro с использованием анализов ELISA, а затем с использованием экспрессирующей системы дрожжей. ZFP часто сначала исследуют с использованием системы временной экспрессии с репортерным геном, а затем регуляцию эндогенного гена-мишени исследуют в клетках или в целых растениях как in vivo, так и ex vivo. ZFP может рекомбинантным путем экспрессироваться в клетке, рекомбинантным путем экспрессироваться в клетках, трансплантированных в растение, или рекомбинантным путем экспрессироваться в трансгенном растении, а также может быть введен в качестве белка в растение или клетку с использованием носителей для доставки, описанных ниже. Клетки могут быть иммобилизованными, могут находиться в растворе, могут быть инъецированы в растение или могут быть встречающимися в природе в трансгенном или нетрансгенном растении.
[0148] Трансгенные и нетрансгенные растения также используют в качестве предпочтительных вариантов осуществления для исследования регуляции экспрессии эндогенного гена in vivo. Трансгенные растения могут стабильно экспрессировать представляющий интерес ZFP. Альтернативно можно использовать растения, которые временно экспрессируют представляющий интерес ZFP или в которые введен ZFP в носителе для доставки. Регуляцию экспрессии эндогенных генов исследуют с использованием любого из анализов, описанных в настоящем описании.
Способы направленного расщепления
[0149] Описанные способы и композиции можно использовать для расщепления ДНК в представляющей интерес области клеточного хроматина (например, в желательном или заданном участке генома, например, в или рядом с геном AHAS). Для такого направленного расщепления ДНК ДНК-связывающий домен (например, белок с цинковыми пальцами или TALE) конструируют так, чтобы он связывался с участком-мишенью или вблизи заданного участка расщепления, и слитый белок, содержащий сконструированный связывающий домен с цинковыми пальцами и домен расщепления, экспрессировался в клетке. При связывании ДНК-связывающей части слитого белка с участком-мишенью ДНК расщепляется вблизи участка-мишени доменом расщепления.
[0150] Альтернативно два слитых белка, каждый из которых содержит ДНК-связывающий домен и половинный домен расщепления, экспрессируются в клетке и связываются с участками-мишенями, которые расположены рядом таким образом, что функциональный домен расщепления восстанавливается и ДНК расщепляется вблизи участков-мишеней. В одном варианте осуществления расщепление происходит между участками-мишенями двух ДНК-связывающих доменов. Можно конструировать один или оба связывающих домена с цинковыми пальцами.
[0151] Для направленного расщепления с использованием слитого полипептида связывающий домен с цинковыми пальцами-домен расщепления, участок связывания может охватывать участок расщепления или ближний край участка связывания может находиться на расстоянии 1, 2, 3, 4, 5, 6, 10, 25, 50 или более нуклеотидов (или любое целое число между 1 и 50 нуклеотидом) от участка расщепления. Точное положение участка связывания относительно участка расщепления зависит от конкретного домена расщепления и длины линкера ZC. Для способов, в которых используют два слитых полипептида, каждый из которых содержит связывающий домен с цинковыми пальцами и половинный домен расщепления, участки связывания, как правило, охватывают с двух сторон участок расщепления. Таким образом, ближний край первого участка связывания может находиться на расстоянии 1, 2, 3, 4, 5, 6, 10, 25 или более нуклеотидов (или любое целое число между 1 и 50 нуклеотидами) с одной стороны участка расщепления, и ближний край второго участка связывания может находиться на расстоянии 1, 2, 3, 4, 5, 6, 10, 25 или более нуклеотидов (или любое целое число между 1 и 50 нуклеотидами) с другой стороны участка расщепления. Способы картирования участков расщепления in vitro и in vivo известны специалистам в данной области.
[0152] Таким образом, в способах, описанных в настоящем описании, может использоваться сконструированный связывающий домен с цинковыми пальцами с доменом расщепления. В этих случаях связывающий домен конструируют так, чтобы он связывался с последовательностью-мишенью в или вблизи участка, где является желательным расщепление. Cлитый белок или полинуклеотид, кодирующий его, вводят в клетку-хозяина. После введения в клетку или экспрессии в клетке, слитый белок связывается с последовательностью-мишенью и осуществляет расщепление в или вблизи последовательности-мишени. Точный участок расщепления зависит от природы домена расщепления и/или присутствия и/или природы линкерных последовательностей между связывающим доменом и доменом расщепления. В случаях, когда используют два слитых белка, каждый из которых содержит половинный домен расщепления, расстояние между ближними краями участков связывания может составлять 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 25 или более нуклеотидов (или любое целое число между 1 и 50 нуклеотидами). Оптимальные уровни расщепления также могут зависеть от расстояния между участками связывания на двух слитых белках (см., например, Smith et al. (2000) Nucleic Acids Res. 28:3361-3369; Bibikova et al. (2001) Mol. Cell. Biol. 21:289-297) и длины линкера ZC в каждом слитом белке. Также см. публикацию патента США 20050064474A1 и международные публикации патентов WO05/084190, WO05/014791 и WO03/080809.
[0153] В определенных вариантах осуществления домен расщепления содержит два половинных домена расщепления, оба из которых являются частью одного полипептида, содержащего связывающий домен, первый половинный домен расщепления и второй половинный домен расщепления. Половинные домены расщепления могут иметь одинаковую аминокислотную последовательность или различающиеся аминокислотные последовательности при условии, что они функционируют, расщепляя ДНК.
[0154] Половинные домены расщепления также могут быть предоставлены в отдельных молекулах. Например, в клетку можно вводить два слитых полипептида, где каждый полипептид содержит связывающий домен и половинный домен расщепления. Половинные домены расщепления могут иметь одинаковую аминокислотную последовательность или различные аминокислотные последовательности при условии, что они функционируют, расщепляя ДНК. Кроме того, связывающие домены связываются с последовательностями-мишенями, которые, как правило, расположены так, что при связывании слитых полипептидов два половинных домена расщепления присутствуют в пространственной ориентации друг относительно друга, которая позволяет восстановление домена расщепления (например, путем димеризации половинных доменов), тем самым, размещая половинные домены друг относительно друга так, чтобы образовывался функциональный домен расщепления, что приводит к расщеплению клеточного хроматина в представляющей интерес области. Как правило, расщепление восстановленным доменом расщепления происходит в участке, расположенном между двумя последовательностями-мишенями. Один или оба белка могут быть сконструированы так, чтобы они связывались с их участком-мишенью.
[0155] Два слитых белка могут связываться с представляющей интерес областью с одинаковой или противоположной полярностью, и участки их связывания (т.е. участки-мишени) могут быть разделены любым количеством нуклеотидов, например, от 0 до 200 нуклеотидов или любое целое число между ними. В определенных вариантах осуществления участки связывания двух слитых белков, каждый из которых содержит связывающий домен с цинковыми пальцами и половинный домен расщепления, могут быть расположены на расстоянии от 5 до 18 нуклеотидов, например, на расстоянии 5-8 нуклеотидов или на расстоянии 15-18 нуклеотидов, или на расстоянии 6 нуклеотидов, или на расстоянии 16 нуклеотидов при измерении от края каждого участка связывания, являющегося наиболее близким к другому участку связывания, и расщепление происходит между участками связывания.
[0156] Участок, в котором расщепляется ДНК, как правило, находится между участками связывания для двух слитых белков. Двухцепочечный разрыв ДНК часто происходит в результате двух одноцепочечных разрывов или "ников" со смещением 1, 2, 3, 4, 5, 6 или более нуклеотидов (например, расщепление двухцепочечной ДНК посредством нативной Fok I является результатом одноцепочечных разрывов, смещенных на 4 нуклеотидов). Таким образом, расщепление не обязательно происходит точно в противоположных участках каждой цепи ДНК. Кроме того, структура слитых белков и расстояние между участками-мишенями могут влиять на то, произойдет ли расщепление рядом с одной нуклеотидной парой или произойдет ли расщепление в нескольких участках. Однако для многих применений, включая направленную рекомбинацию и направленный мутагенез (см. ниже) расщепление в пределах нескольких нуклеотидов обычно является достаточным, и расщепление между конкретными парами оснований не требуется.
[0157] Как отмечалось выше, слитый белок(и) можно вводить в качестве полипептидов и/или полинуклеотидов. Например, два полинуклеотида, каждый из которых содержит последовательности, кодирующие один из упомянутых выше пептидов, можно вводить в клетку и, когда полипептиды экспрессируются и каждый из них связывается с его последовательностью-мишенью, происходит расщепление в последовательности-мишени или вблизи последовательности-мишени. Альтернативно в клетку вводят единый полинуклеотид, содержащий последовательности, кодирующие оба слитых полипептида. Полинуклеотиды могут представлять собой ДНК, РНК или любые модифицированные формы или аналоги, или ДНК и/или РНК.
[0158] Для повышения специфичности расщепления также в способах, описанных в настоящем описании, можно использовать дополнительные композиции. Например, единичные половинные домены расщепления могут проявлять ограниченную активность двухцепочечного расщепления. В способах, в которых в клетку вводят два слитых белка, каждый из которых содержит домен с тремя цинковыми пальцами и половинный домен расщепления, каждый белок обеспечивает участок-мишень приблизительно из 9 нуклеотидов. Хотя совокупная последовательность-мишень из 18 нуклеотидов, вероятно, будет уникальной в геномах млекопитающих и растений, любой данный участок-мишень из 9 нуклеотидов встречается, в среднем, приблизительно 23000 раз в геноме человека. Таким образом, может происходить неспецифическое расщепление вследствие сайт-специфического связывания одного половинного домена. Таким образом, способы, описанные в настоящем описании, предусматривают использование доминантно-негативного мутанта нуклеазы (или нуклеиновой кислоты, кодирующей ее), которая экспрессируется в клетке вместе с двумя слитыми белками. Доминантно-негативный мутант способен димеризоваться, но не способен индуцировать двухцепочечное расщепление, когда он димеризован. Путем предоставления слитым белкам доминантно-негативного мутанта в молярном избытке, только области, в которых связаны оба слитых белка, будут иметь достаточно высокую локальную концентрацию функциональных половинных доменов расщепления для димеризации и осуществления двухцепочечного расщепления.
[0159] В других вариантах осуществления нуклеазный домен(ы) представляют собой никазы, поскольку они могут индуцировать одноцепочечный разрыв. В определенных вариантах осуществления низказа содержит два нуклеазных домена, один из которых модифицирован (например, чтобы он был каталитически неактивным), чтобы нуклеаза осуществляла только одноцепочечный разрыв. Такие никазы описаны, например, в публикации патента США № 20100047805. Для индукции двухцепочечного разрыва можно использовать две никазы.
Экспрессирующие векторы
[0160] Нуклеиновую кислоту, кодирующую один или несколько слитых белков (например, ZFN, TALEN и т.д.), как описано в настоящем описании, можно клонировать в вектор для трансформации в прокариотические или эукариотические клетки для репликации и/или экспрессии. Векторы могут представлять собой прокариотические векторы (например, плазмиды или челночные векторы, векторы насекомых) или эукариотические векторы. Нуклеиновую кислоту, кодирующую слитый белок, также можно клонировать в экспрессирующий вектор для введения в клетку.
[0161] Для экспрессии слитых белков последовательности, кодирующие слитые белки, как правило, субклонируют в экспрессирующий вектор, который содержит промотор для контроля транскрипции. Пригодные прокариотические и эукариотические промоторы хорошо известны в данной области и описаны, например, в Sambrook et al., Molecular Cloning, A Laboratory Manual (2nd ed. 1989; 3rd ed., 2001); Kriegler, Gene Transfer and Expression: A Laboratory Manual (1990); и Current Protocols in Molecular Biology (Ausubel et al., выше), бактериальные экспрессирующие системы для экспрессии ZFP доступны, например, в E. coli, Bacillus sp. и Salmonella (Palva et al., Gene 22:229-235 (1983)). Наборы для таких экспрессирующих систем являются коммерчески доступными. Эукариотические экспрессирующие системы для клеток млекопитающих, дрожжей и насекомых хорошо известны специалистам в данной области и также являются коммерчески доступными.
[0162] Промотор, используемый для контроля экспрессии нуклеиновой кислоты, кодирующей слитый белок, зависит от конкретного применения. Например, сильный конститутивный промотор, подходящий для клетки-хозяина, как правило, используют для экспрессии и очистки слитых белков.
[0163] Напротив, когда слитый белок вводят in vivo для регуляции гена растений (см., раздел "Nucleic Acid Delivery to Plant Cells" ниже), используют либо конститутивный, либо регулируемый (например, в процессе развития, типом ткани или клеток, или окружающей средой), либо индуцибельный промотор, в зависимости от конкретного применения слитого белка. Неограничивающие примеры промоторов растений включают промоторные последовательности, происходящие из убиквитина-3 (ubi-3) A. thaliana (Callis, et al., 1990, J. Biol. Chem. 265-12486-12493); маннопинсинтазы (Δmas) A. tumefaciens (Petolino et al., патент США № 6730824); и/или вируса мозаки прожилок маниока (CsVMV) (Verdaguer et al., 1996, Plant Molecular Biology 31:1129-1139). Также см. примеры.
[0164] В дополнение к промотору экспрессирующий вектор, как правило, содержит элемент транскрипции или экспрессирующую кассету, которая содержит все дополнительные элементы, требуемые для экспрессии нуклеиновой кислоты в клетках-хозяевах, либо прокариотических, либо эукариотических. Таким образом, типичная экспрессирующая кассета содержит промотор (содержащий участки связывания рибосом), функционально связанный, например, с последовательностью нуклеиновой кислоты, кодирующей слитый белок, и сигналы, требуемые, например, для эффективного полиаденилирования транскрипта, терминации транскрипции и терминации трансляции. Дополнительные элементы кассеты могут включать, например, энхансеры, гетерологичные сигналы сплайсинга, последовательность 2A из вируса Thosea asigna (Mattion et al. (1996) J. Virol. 70:8124-8127) и/или сигнал ядерной локализации (NLS).
[0165] Конкретный экспрессирующий вектор, используемый для переноса генетической информации в клетку, выбирают в соответствии с предполагаемым применением слитых белков, например, экспрессией в растениях, животных, бактериях, грибах, простейших и т.д. (см. экспрессирующие векторы, описанные ниже). Стандартные экспрессирующие векторы бактерий и животных известны в данной области и подробно описаны, например, в публикации патента США 20050064474A1 и международных публикациях патентов WO 05/084190, WO 05/014791 и WO 03/080809.
[0166] Стандартные способы трансфекции можно использовать для получения линий клеток бактерий, растений, млекопитающих, дрожжей или насекомых, которые экспрессируют большие количества белков, которые затем можно очищать с использованием стандартных способов (см., например, Colley et al., J. Biol. Chem. 264:17619-17622 (1989); Guide to Protein Purification, Methods in Enzymology, vol. 182 (Deutscher, ed., 1990)). Трансформацию эукариотических и прокариотических клеток проводят стандартными способами (см., например, Morrison, J. Bact. 132:349-351 (1977); Clark-Curtiss & Curtiss, Methods in Enzymology 101:347-362 (Wu et al., eds., 1983).
[0167] Можно использовать любые хорошо известные методики введения чужерожных нуклеотидных последовательностей в такие клетки-хозяева. Они включают использование трансфекции с фосфатом кальция, использование полибрена, слияние протопластов, электропорацию, ультразвуковые способы (например, сонопорация), липосомы, микроинъекцию, оголенную ДНК, плазмидные векторы, вирусные векторы, опосредуемую Agrobacterium трансформацию, опосредуемую карбидом кремния (например, WHISKERS™) трансформацию, как эписомную, так и с встраиванием, и любые другие хорошо известные способы введения клонированной геномной ДНК, кДНК, синтетической ДНК или другого чужеродного генетического материала в клетку хозяина (см., например, Sambrook et al., выше). Необходимо только, чтобы конкретная используемая методика генной инженерии была способна успешно вводить по меньшей мере один ген в клетку-хозяина, способную экспрессировать представляющий интерес белок.
Доноры
[0168] Как отмечалось выше, также можно проводить встраивание одной или нескольких экзогенных последовательностей (также называемых "донорной последовательностью" или "донором" или "трансгеном"), например, для стэкинга. Донорная последовательность может содержать негомологичную последовательность, фланкированную двумя областями гомологии для обеспечения эффективной HDR в представляющем интерес положении. Кроме того, донорные последовательности могут содержать векторную молекулу, содержащую последовательности, которые являются негомологичными представляющей интерес области в клеточном хроматине. Донорная молекула может содержать несколько непрерывных областей гомологии с клеточным хроматином. Например, для направленного встраивания последовательностей, обычно не присутствующих в представляющей интерес области, указанные последовательности могут присутствовать в донорной молекуле нуклеиновой кислоты и могут фланкироваться областями гомологии с последовательностью в представляющей интерес области.
[0169] Донорный полинуклеотид может представлять собой ДНК или РНК, может быть одноцепочечным или двухцепочечным, и его можно вводить в клетку в линейной или кольцевой форме. См., например, публикации патентов США № 20100047805; 20110281361 и 20110207221. При введении в линейной форме концы донорной последовательности могут быть защищены (например, от экзонуклеолитической деградации) способами, известными специалистам в данной области. Например, один или несколько дидезоксинуклеотидных остатков добавляют на 3’-конец линейной молекулы и/или самокомплементарные олигонуклеотиды лигируют с одним или обоими концами. См., например, Chang et al. (1987) Proc. Natl. Acad. Sci. USA84:4959-4963; Nehls et al. (1996) Science 272:886-889. Дополнительные способы защиты экзогенных полинуклеотидов от деградации включают, но не ограничиваются ими, добавление концевой аминогруппы(ы) и использование модифицированных межнуклеотидных связей, например, таких как фосфоротиоаты, фосфорамидаты, и остатков O-метилрибозы или дезоксирибозы.
[0170] Полинуклеотид можно вводить в клетку в качестве части векторной молекулы, имеющей дополнительные последовательности, например, такие как ориджины репликации, промоторы и гены, кодирующие устойчивость к антибиотикам. Более того, донорные полинуклеотиды можно вводить в качестве оголенной нуклеиновой кислоты, в качестве нуклеиновой кислоты в комплексе со средством, таким как липосома или полоксамер, или ее можно доставлять посредством вирусов (например, аденовирус, AAV, вирус герпеса, ретровирус, лентивирус и лентивирус с дефектной интегразой (IDLV)). См., например, публикацию патента США № 20090117617.
[0171] Донор, как правило, встраивают так, чтобы экспрессия контролировалась эндогенным промотором в участке встраивания, а именно, промотором, который запускает экспрессию эндогенного гена, в который встроен донор. Однако будет очевидно, что донор может содержать промотор и/или энхансер, например конститутивный промотор, или индуцибельный или тканеспецифический промотор. Более того, донорную молекулу можно встраивать в эндогенный ген так чтобы экспрессировался весь эндогенный ген, часть эндогенного гена или эндогенный ген не экспрессировался.
[0172] Более того, хотя и не требуются для экспрессии, экзогенные последовательности также могут включать последовательности регуляции транскрипции или трансляции, например, промоторы, энхансеры, инсуляторы, участки внутренней посадки рибосомы, последовательности, кодирующие пептиды 2A, и/или сигналы полиаденилирования.
[0173] Донорную последовательность вводят в эндогенный ген (или множество аллелей гена), чтобы функция эндогенного гена изменялась так, чтобы он выступал в качестве эндогенного маркера для встраивания трансгена, тем самым, вызывая геномную модификацию. В определенных вариантах осуществления эндогенный локус, в который вводят трансген(ы), представляет собой локус AHAS. Известно несколько мутаций в гене AHAS, которые сообщают толерантность к гербицидам группы B или гербицидам-ингибиторам ALS (например, имидазолинон или сульфонилмочевина), включая единичную мутацию серина в положении 653 на аспарагин (S653N). См., например, Lee et al. (2011) Proc. Nat’l. Acad. Sci. USA 108: 8909-8913, и Tan, S., Evans, R.R., Dahmer, M.L., Singh, B.K., and Shaner, D.L. (2005) Imidazolinone-tolerant crops: History, current status and future. Pest Manag. Sci. 61:246-257.
[0174] AHAS представляет собой один из желаемых локусов, поскольку ген является транскрипционно активным на всех стадиях развития растений, он не подвержен сайленсингу (например, посредством ДНК, метилирования гистонов, i-РНК, и т.д.), причем встраивание нового гена или элемента трансформации растений в локусе не оказывает отрицательного влияния на агрономические свойства или качество растения-хозяина. Повсеместная природа локуса AHAS и явные коммерческие данные о том, что изменение локуса или локусов AHAS в каноле, кукурузе, подсолнечнике, хлопке, сое, сахарной свекле, пшенице и любом дргом растении не ухудшает агрономические свойства или качество, означают, что локусы AHAS представляют собой широкий класс предпочтительных локусов-мишеней среди всех имеющих коммерческое значение видов растений.
[0175] Встраивание донорной ДНК в локус AHAS дикого типа (чувствительный к гербицидам), как правило, вносит как экзогенную последовательность (например, трансген), так и мутацию эндогенного AHAS для осуществления геномной модификации, которая сообщает толерантность к имидазолинонам (т.е. продукт, который приводит к толерантности к гербицидам клетке растения), таким образом, позволяя регенерацию растений с правильным нацеливанием с использованием эндогенной системы селекции с имидазолиноном, а не трансгенной системы селективного маркера. Стэкинга второго трансгена в локусе AHAS можно достигать посредством встраивания донорной ДНК, которая вносит один или несколько дополнительных трансгенов и сообщает чувствительность к имидазолинонам, но толерантность к соединениям сульфонилмочевины (т.е. продукт, который приводит к толерантности к гербициду клетке-растения), таким образом, позволяя регенерацию растений с правильным нацеливанием с использованием сульфонилмочевины в качестве агента селекции. Стэкинга третьего трансгена можно достигать посредством встраивания донорной ДНК, которая вносит дополнительный трансген(ы) и сообщает чувствительность к сульфонилмочевине и толерантность к имидазолинонам, таким образом, обеспечивая регенерацию растений с правильным нацеливанием с использованием имидазолинона в качестве агента селекции. По существу, последующие раунды последовательного стэкинга трансгенов являются возможными с использованием донорных молекул, которые вносят мутации (например, модификация генома) AHAS дикого типа, таким образом, обеспечивая дифференциальное повторение циклов с сульфонилмочевиной и имидазолинонов в качестве агентов химической селекции.
Доставка нуклеиновых кислот в клетки растений
[0176] Как отмечалось выше, конструкции ДНК (например, нуклеаза(ы) и/или донор(ы)) можно вводить в (например, в геном) желаемого растения-хозяина различными общепринятыми способами. Для обзора таких способов см., например, Weissbach & Weissbach Methods for Plant Molecular Biology (1988, Academic Press, N.Y.) Section VIII, pp. 421-463; и Grierson & Corey, Plant Molecular Biology (1988, 2d Ed.), Blackie, London, Ch. 7-9. Также см. публикации патентов США № 20090205083; 20100199389; 20110167521 и 20110189775, включенные в настоящее описание в качестве ссылок в полном объеме. Будет очевидно, что одну или несколько конструкций ДНК можно использовать для применения на практике настоящего изобретения, например, нуклеаза(ы) могут содержаться в той же конструкции, что и конструкция(и), содержащая донор(ы), или в отличающихся конструкциях.
[0177] Конструкцию(и) ДНК можно вводить прямо в геномную ДНК клетки растения с использованием способов, таких как электропорация и микроинъекция протопластов клеток растений, или конструкции ДНК можно вводить прямо в ткань растения с использованием биолистических способов, таких как бомбардировка частицами с ДНК (см., например, Klein et al. (1987) Nature 327:70-73). Альтернативно конструкцию ДНК можно вводить в растительную клетку посредством трансформации наночастиц (см., например, публикацию патента США № 20090104700, которая включена в настоящее описание в качестве ссылки в полном объеме). Альтернативно конструкции ДНК можно комбинировать с подходящими пограничными областями T-ДНК/фланкирующими областями и встраивать в общепринятый вектор-хозяин Agrobacterium tumefaciens. Способы опосредуемой Agrobacterium tumefaciens трансформации, в том числе выключение онкогенов и разработка и применение бинарных векторов, хорошо описаны в научной литературе. См., например Horsch et al. (1984) Science 233:496-498, и Fraley et al. (1983) Proc. Nat'l. Acad. Sci. USA 80:4803.
[0178] Кроме того, перенос генов можно осуществлять с использованием бактерий, не являющихся агробактериями, или вирусов, таких как Rhizobium sp. NGR234, Sinorhizoboium meliloti, Mesorhizobium loti, вирус X картофеля, вирус мозаики цветной капусты и вирус мозаики прожилок маниока и/или вирус табачной мозаики, См., например, Chung et al. (2006) Trends Plant Sci. 11(1):1-4.
[0179] Функции вирулентности хозяина Agrobacterium tumefaciens будут обеспечивать встраивание T-цепи, содержащей конструкцию и соседний маркер, в ДНК клетки растения, когда клетка растения будет инфицирована бактериями с использованием бинарного вектора T-ДНК (Bevan (1984) Nuc. Acid Res. 12:8711-8721) или методики сокультивирования (Horsch et al. (1985) Science 227:1229-1231). Как правило, систему трансформации Agrobacterium используют для конструирования двудольных растений (Bevan et al. (1982) Ann. Rev. Genet 16:357-384; Rogers et al. (1986) Methods Enzymol. 118:627-641). Систему трансформации Agrobacterium также можно использовать для трансформации, а также переноса, ДНК в однодольные растения и клетки растений. См. патент США № 5591616; Hernalsteen et al. (1984) EMBO J 3:3039-3041; Hooykass-Van Slogteren et al. (1984) Nature 311:763-764; Grimsley et al. (1987) Nature 325:1677-179; Boulton et al. (1989) Plant Mol. Biol. 12:31-40; и Gould et al. (1991) Plant Physiol. 95:426-434.
[0180] Альтернативные способы переноса и трансформации генов включают, но не ограничиваются ими, трансформацию протопластов посредством опосредуемого кальцием, полиэтиленгликолем (PEG) или электропорацией захвата оголенной ДНК (см. Paszkowski et al. (1984) EMBO J 3:2717-2722, Potrykus et al. (1985) Molec. Gen. Genet. 199:169-177; Fromm et al. (1985) Proc. Nat. Acad. Sci. USA 82:5824-5828; и Shimamoto (1989) Nature 338:274-276), и посредством электропорации тканей растений (D'Halluin et al. (1992) Plant Cell 4:1495-1505). Дополнительные способы трансформации клеток растений включают микроинъекцию, опосредуемый карбидом кремния (например, WHISKERS™) захват ДНК (Kaeppler et al. (1990) Plant Cell Reporter 9:415-418) и бомбардировку микрочастицами (см. Klein et al. (1988) Proc. Nat. Acad. Sci. USA 85:4305-4309; и Gordon-Kamm et al. (1990) Plant Cell 2:603-618). Наконец, наночастицы, наноносители и проникающие в клетку пептиды можно использовать для доставки ДНК, РНК, пептидов и/или белков в клетки растений (см. WO/2011/26644, WO/2009/046384 и WO/2008/148223).
[0181] Описанные способы и композиции можно использовать для встраивания экзогенных последовательностей в ген AHAS. Это является полезным, поскольку экспрессия внесенного в геном растения трансгена критически зависит от его участка встраивания и, как отмечалось выше, AHAS обеспечивает подходящий участок для встраивания трансгена. Таким образом, можно встраивать гены, кодирующие, например, толерантность к гербицидам, устойчивость к насекомым, питательные добавки, антибиотики или терапевтические молекулы, посредством направленной рекомбинации, в области генома растений, благоприятные для их экспрессии.
[0182] Трансформированные клетки растений, которые получают любым из описанных выше способов трансформации, можно культивировать для регенерации всего растения, которое обладает трансформированным генотипом и, таким образом, желаемым фенотипом. Такие способы регенерации основаны на манипулировании определенными фитогормонами в культуральной среде для роста тканей, как правило, на основе биоцидного и/или гербицидного маркера, который вносят вместе с желаемыми нуклеотидными последовательностями. Регенерация растений из культивированных протопластов описана в Evans, et al., "Protoplasts Isolation and Culture", Handbook of Plant Cell Culture, pp. 124-176, Macmillan Publishing Company, New York, 1983; и Binding, Regeneration of Plants, Plant Protoplasts, pp. 21-73, CRC Press, Boca Raton, 1985. Регенерацию также можно осуществлять из каллюса растений, эксплантатов, органов, пыльцы, зародышей или их частей. Такие способы регенерации описаны, в основном, в Klee et al. (1987) Ann. Rev. of Plant Phys. 38:467-486.
[0183] Нуклеиновые кислоты, введенные в клетку растения, можно использовать для сообщения желаемых признаков по существу любому растению. Широкое множество растений и систем клеток растений можно модифицировать способами инженерии для достижения желаемых физиологических и агрономических характеристик, описанных в настоящем описании, с использованием конструкций нуклеиновых кислот по настоящему изобретению и различных способов трансформации, упомянутых выше. В предпочтительных вариантах осуществления растения и клетки растений, предназначенные для модификации способами инженерии, включают, но не ограничиваются ими, растения и клетки однодольных и двудольных растений, таких как культуры, включающих зерновые культуры (например, пшеница, кукуруза, рис, просо, ячмень), плодовые культуры (например, томат, яблоко, груша, клубника, апельсин), кормовые культуры (например, люцерна), корнеплодные культуры (например, морковь, картофель, сахарная свекла, ямс), листовые овощные культуры (например, салат-латук, шпинат); цветковые растения (например, петуния, роза, хризантема), хвойные и сосновые деревья (например, сосна, ель); растения, используемые для фиторекультивации (например, растения, накапливающие тяжелые металлы); масличные культуры (например, подсолнечник, рапс) и растения, используемые для экспериментальных целей (например, Arabidopsis). Таким образом, описанные способы и композиции применимы для широкого диапазона растений, включая, но не ограничиваясь ими, виды рода Asparagus, Avena, Brassica, Citrus, Citrullus, Capsicum, Cucurbita, Daucus, Erigeron, Glycine, Gossypium, Hordeum, Lactuca, Lolium, Lycopersicon, Malus, Manihot, Nicotiana, Orychophragmus, Oryza, Persea, Phaseolus, Pisum, Pyrus, Prunus, Raphanus, Secale, Solanum, Sorghum, Triticum, Vitis, Vigna и Zea.
[0184] Введение нуклеиновых кислот в клетку растения можно использовать для сообщения желаемых признаков по существу любому растению. В определенных вариантах осуществления встроенный трансген(ы) в клетках растения приводит к растениям, имеющим увеличенный выход плодов, увеличенную биомассу растения (или плода растения), более высокое содержание мякоти плода, концентрированное завязывание плодов, более крупные растения, увеличение сырой массы, увеличение сухой массы, увеличение сухой массы, более высокую общую массу при сборе урожая, увеличенную интенсивности и/или единообразие окрашивания культуры, измененные химические (например, масло, жирная кислота, углевод, белок) характеристики и т.д.
[0185] Специалисту в данной области будет понятно, что экзогенную последовательность можно временно включать в клетку растения. При введении экзогенной полинуклеотидной последовательности может использоваться клеточный аппарат клетки растения, в которую вводят последовательность. Экспрессию экзогенной полинуклеотидной последовательности, содержащей ZFN, который временно включен в клетку растения, можно анализировать путем анализа геномной ДНК последовательности-мишени для идентификации и определения каких-либо инсерций-делеций, инверсий или инсерций. Эти типы реорганизации являются результатом расщепления участка-мишени в последовательности геномной ДНК и последующей репарации ДНК. Кроме того, экспрессию экзогенной полинуклеотидной последовательности можно анализировать с использованием способов, которые позволяют исследование экспрессии маркерных генов, известных средним специалистам в данной области. Временная экспрессия маркерных генов была описана для различных растений, тканей и систем доставки ДНК. Системы временного анализа включают, но не ограничиваются ими, прямую доставку гена посредством электропорации или бомбардировки микрочастицами тканей в любом временном анализе растения с использованием любых представляющих интерес видов растений. Такие временные системы включают, но не ограничиваются ими, электропорацию протопластов из различных тканевых источников или бомбардировку частицами конкретных представляющих интерес тканей. Настоящее изобретение охватывает применение любой временной экспрессирующей системы для оценки сайт-специфической эндонуклеазы (например, ZFN) и для введения трансгенов и/или мутаций в ген-мишень (например, AHAS), чтобы достигнуть геномной модификации. Примеры тканей растений, предусматриваемых для временного исследования с использованием соответствующей системы доставки, включают, но не ограничиваются ими, ткани основания листьев, каллюс, семядоли, корни, эндосперм, зародыши, ткань цветка, пыльцу и эпидермальную ткань.
[0186] Специалисту в данной области будет понятно, что экзогенная полинуклеотидная последовательность может быть стабильно введена в трансгенные растения. После подтверждения того, что экзогенная полинуклеотидная последовательность является функциональной, ее можно вводить в другие растения посредством полового скрещивания. Можно использовать любой из стандартных способов разведения в зависимости от вида, подлежащего скрещиванию.
[0187] Трансформированную клетку растения, каллюс, ткань или растение можно идентифицировать и выделять посредством селекции и скрининга модифицированного способами инженерии материала растений в отношении фенотипа, кодируемого маркерами, присутствующими на экзогенной последовательности ДНК. Маркеры также могут быть описаны и обозначены как селективные маркеры или репортерные маркеры. Маркеры можно использовать для идентификации и селекции трансформированных растений ("трансформантов"). Как правило, маркер встраивается в геном клетки растения в качестве экзогенной последовательности. В некоторых примерах экзогенная маркерная последовательность встраивается в геном растения в сайт-специфических локусах-мишенях в качестве донорной последовательности, где донорная последовательность содержат мутации, которые приводят к толерантности к агенту селекции (например, гербициды и т.д.). В других примерах экзогенная маркерная последовательность встраивается в геном растения в качестве трансгена (т.е. "трансгенный селективный маркер"), где маркерный ген функционально связан с промотором и 3'-UTR, чтобы они составили химерную экспрессирующую ген кассету. Экспрессия маркерного гена приводит к экспрессии визуального маркерного белка или к толерантности к агенту селекции (например, гербицид, антибиотики и т.д.).
[0188] Например, селекцию можно проводить путем выращивания сконструированного растительного материала на среде, содержащей ингибиторное количество антибиотика или гербицида (т.е., также описываемых как агент селекции), к которому трансформированная генная конструкция сообщает толерантность. В одном варианте осуществления гены селективных маркеров включают гены толерантности к гербицидам.
[0189] Маркеры толерантности к гербицидам кодируют модифицированный белок-мишень, нечувствительный к гербициду, или фермент, который деградирует и детоксифицирует гербицид в растении до того, как он может действовать. Например, модифицированный белок-мишень, нечувствительный к гербициду, включает толерантность к глифосату. Растения, толерантные к глифосату, получают с использованием генов, кодирующих мутантный фермент-мишень 5-енолпирувилшикимат-3-фосфатсинтазу (EPSPS). Гены и мутанты EPSPS хорошо известны и включают мутантные гены 5-енолпирувилшикимат-3-фосфатсинтазы (EPSPS), dgt-28 и aroA. Такие гены обеспечивают толерантность к глифосату посредством введения рекомбинантных нуклеиновых кислот и/или различных форм мутагенеза нативных генов EPSP in vivo. Примеры ферментов, которые деградируют и детоксифицируют гербициды в растениях, включают толерантность к глюфосинат-аммонию, бромксинилу и 2,4-дихлорфеноксиацетату (2,4-D). Толерантности к этим гербицидам достигают посредством экспрессии бактериальных генов, которые кодируют ген pat или DSM-2, нитрилазы, aad-1 или aad-12 в клетке растения в качестве трансгена. Гены толерантности к фосфоносоединениям включают гены bar и pat из видов Streptomyces, включая Streptomyces hygroscopicus и Streptomyces viridichromogenes, и гены толерантности к пиридинокси или феноксипропионовым кислотам или циклогексонам (гены, кодирующие ингибитор ACC-азы). Иллюстративные гены, сообщающие толерантность к циклогександионам и/или арилоксифеноксипропионовой кислоте (включая Haloxyfop, Diclofop, Fenoxyprop, Fluazifop, Quizalofop) включают гены ацетилкофермент-A-карбоксилазы (ACC-азы), такие как; Acc1-S1, Acc1-S2 и Acc1-S3. В одном варианте осуществления гербициды могут ингибировать фотосинтез, включая триазин (гены psbA и 1s+) или бензонитрил (ген нитрилазы). Другие последовательности генов толерантности к гербицидам известны специалистам в данной области.
[0190] Маркеры устойчивости к антибиотикам кодируют фермент, который осуществляет деградацию и детоксифицирует антибиотик в растении до того, как он сможет действовать в растении. Известны различные типы антибиотиков, которые могут препятствовать росту и развитию растений при использовании в надлежащих концентрациях, такие как канамицин, хлорамфеникол, спектиномицин и гигромицин. Экзогенные последовательности можно получать (например, гены бактерий) и экспрессировать в качестве трансгена для разрушения антибиотика. Например, маркерные гены устойчивости к антибиотикам включают экзогенные последовательности, кодирующие устойчивость к антибиотикам, такие как гены, кодирующие неомицинфосфотрансферазу II (NEO), хлорамфениколацетилтрансферазу (CAT), щелочную фосфатазу, устойчивость к спектиномицину, устойчивость к канамицину и гигромицинфосфотрансферазу (HPT).
[0191] Кроме того, трансформированные растения и клетки растений также можно идентифицировать путем скрининга активности репортерного гена, который кодирует ген видимого маркера. Репортерные гены, как правило, предоставляют в качестве рекомбинантных конструкций нуклеиновых кислот, и они встраиваются в клетку растений в качестве трансгена. Для идентификации и селекции трансформантов можно использовать визуальное исследование белков, таких как белки репортерных генов, кодирующих β-глюкуронидазу (GUS), люциферазу, зеленый флуоресцентный белок (GFP), желтый флуоресцентный белок (YFP), DsRed, β-галактозидазу. Такие способы селекции и скрининга хорошо известны специалистам в данной области.
[0192] Описанный выше перечень маркерных генов не является ограничивающим. Настоящее изобретение охватывает любой репортерный ген или ген селективного маркера. Более того, должно быть понятно, что маркеры (например, маркеры толерантности к гербицидам) в основном используют для идентификации и селекции трансформированных растений по сравнению с признаком (например, признаки толерантности к гербицидам), который используют для обеспечения толерантности к гербицидам, используемым в полевых условиях, для борьбы с сорными видами.
[0193] Также для идентификации трансформантов растений или клеток растений, содержащих измененную геном-мишенью геномную ДНК, которая является результатом временной экспрессии сайт-специфической эндонуклеазы (например, ZFN) можно использовать физические и биохимические способы. Эти способы включают, но не ограничиваются ими: 1) саузерн-анализ или амплификацию с использованием ПЦР для обнаружения и определения структуры рекомбинантной ДНК-вставки; 2) нозерн-блоттинг, защиту от РНК-азы S1, удлинение праймера или амплификацию способом ПЦР с обратной транскриптазой для обнаружения и исследования РНК-транскриптов генных конструкций; 3) ферментативные анализы для обнаружения активности фермента или рибозима, где такие продукты генов кодируются генной конструкцией; 4) гель-электрофорез белков, способы вестерн-блоттинга, иммунопреципитацию или твердофазные иммуноферментные анализы (ELISA), где продуктами генной конструкции являются белки. Также для обнаружения присутствия или экспрессии рекомбинантной конструкции в конкретных органах и тканях можно использовать дополнительные способы, такие как гибридизация in situ, окрашивание ферментом и иммунное окрашивание. Способы проведения всех этих анализов хорошо известны специалистам в данной области.
[0194] Эффекты манипулирования генами с использованием способов, описанных в настоящем описании, можно наблюдать, например, с использованием нозерн-блоттинга РНК (например, мРНК), выделенной из представляющих интерес тканей. Как правило, если мРНК присутствует или количество мРНК возрастает, можно предположить, что соответствующий трансген экспрессируется. Можно использовать другие способы измерения активности гена и/или кодируемого полипептида. Можно использовать различные типы ферментативных анализов, в зависимости от используемого субстрата и способа обнаружения увеличения или снижения продукта реакции или побочного продукта. Кроме того, уровни экспрессированного полипептида можно измерять иммунохимически, т.е. с использованием ELISA, RIA, EIA и других анализов на основе антител, хорошо известных специалистам в данной области, таких как анализы с электрофоретической детекцией (либо путем окрашивания, либо путем вестерн-блоттинга). В качестве одного неограничивающего примера обнаружение белков AAD-1 и PAT с использованием анализа ELISA описано в публикации патента США № 20090093366, который включен в настоящее описание в качестве ссылки в полном объеме. Трансген может селективно экспрессироваться в некоторых тканях растения или на некоторых стадиях развития, или трансген может экспрессироваться по существу во всех тканях растений, по существу на протяжении всего их жизненного цикла. Однако также применим любой комбинаторный способ экспрессии.
[0195] Настоящее изобретение также охватывает семена трансгенных растений, описанных выше, где семя имеет трансген или генную конструкцию. Кроме того, настоящее изобретение охватывает потомство, клоны, клеточные линии или клетки трансгенных растений, описанных выше, где указанное потомство, клон, клеточная линия или клетка имеют трансген или генную конструкцию.
[0196] Слитые белки (например, ZFN) и экспрессирующие векторы, кодирующие слитые белки, можно вводить прямо в растение для регуляции генов, направленного расщепления и/или рекомбинации. В определенных вариантах осуществления растение содержит множество паралогичных генов-мишеней. Например, в случае AHAS, Brassica napus включает 5 паралогов и пшеница включает 3 паралога. Таким образом, один или несколько различных слитых белков или экспрессирующих векторов, кодирующих слитые белки, можно вводить в растение для нацеливания на один или несколько из этих паралогичных генов в растении.
[0197] Введение эффективных количеств осуществляют любыми путями, обычно используемыми для приведения слитых белков в тесный контакт с клеткой растения, подлежащей обработке. ZFP вводят любым подходящим способом, предпочтительно, с использованием приемлемых носителей. Пригодные способы введения таких модуляторов являются доступными и хорошо известны специалистам в данной области, и, хотя более одно способа можно использовать для введения конкретной композиции, конкретный путь часто обеспечивает более быструю и более эффективную реакцию, чем другой путь.
[0198] Также можно использовать носители и они определяются частично конкретной вводимой композицией, а также конкретным способом, используемым для введения композиции. Таким образом, существует широкое множество пригодных составов носителей, которые являются доступными.
ПРИМЕРЫ
Пример 1: Охарактеризация геномных последовательностей-мишеней AHAS
Идентификация последовательностей AHAS
[0199] Транскрибированные области трех гомеологичных генов AHAS были идентифицировали и определяли. Эти новые последовательности приведены в качестве SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3. В предшествующих попытках секвенирования были идентифицированы и генетически картированы гомеологичные копии генов AHAS из Triticum aestivum на длинных плечах хромосом 6A, 6B и 6D (Anderson et al., (2004) Weed Science 52:83-90; и, Li et al., (2008) Molecular Breeding 22:217-225). Анализ последовательности меток экспрессии последовательностей (EST) и геномных последовательностей, доступных в Genbank (Номера доступа: AY210405.1, AY210407.1, AY210406.1, AY210408.1, FJ997628.1, FJ997629.1, FJ997631.1, FJ997630.1, FJ997627.1, AY273827.1) использовали для определения транскрибируемой области для гомеологичных копий гена AHAS (SEQ ID NO: 1-3).
[0200] Новые некодирущие последовательности, расположенные выше или ниже транскрибированной области, были охарактеризованы впервые. Для полной охарактеризации этих некодирующих последовательностей транскрибированные последовательности для каждой из трех гомологичных копий гена AHAS использовали в качестве последовательностей запроса в BlastN™ для скрининга несобранных считанных последовательностей Roche 454™, которые были получены при полногеномном секвенировании методом "выстрела из дробового ружья" Triticum aestivum cv. Chinese Spring. Считанные последовательности ROCHE 454™ Triticum aestivum cv. Chinese Spring были получены для 5-кратного охвата последовательности. Сборку последовательность осуществляли с использованием программного обеспечения SEQUENCHER SOFTWARE™ (GeneCodes, Ann Arbor, MI) в Roche 454™. Считанные последовательности со значительным совпадением в BlastN™ (величина E<0,0001) использовали для охарактеризации этой нетранскрибируемой области. Проводили итеративные раунды анализа BlastN™ и сборки последовательностей. Каждая итерация включала собранную последовательность AHAS из предшествующей итерации, чтобы все последовательности составлялись в качестве единой непрерывной последовательности. В целом, было охарактеризовано 4384, 7590 и 6205 геномных последовательностей для гомеологичных генов AHAS, расположенных на хромосомах 6A, 6B и 6D, соответственно (SEQ ID NO: 4-6).
Анализ последовательностей генов AHAS, выделенных из Triticum aestivum cv. Bobwhite MPB26RH
[0201] Гомеологичные копии гена AHAS клонировали и секвенировали из Triticum aestivum cv. Bobwhite MPB26RH для получения нуклеотидной последовательности, пригодной для конструирования определенных белков с цинковыми пальцами, которые могли связываться с последовательностями с высокой степенью специфичности. Требовался анализ нуклеотидных последовательностей AHAS из Triticum aestivum cv. Bobwhite MPB26RH для подтверждения аннотации нуклеотидов, присутствующих в последовательностях генов AHAS Genbank и Roche 454™, и вследствие аллельного варьирования между cv. Bobwhite MPB26RH и другими сортами пшеницы, из которых были получены последовательности в Genbank и Roche 454™.
[0202] Конструировали набор праймеров для ПЦР (таблица 1) для амплификации генов AHAS. Праймеры конструировали на основе консенсусной последовательности, которую получали путем множественных выравниваний последовательностей, проведенных с использованием CLUSTALW™ (Thompson et al., (1994) Nucleic Acids Research 22:4673-80). Выровненные последовательности собирали на основе данных секвенирования cv. Chinese Spring, полученных при секвенировании Roche 454™, которое было осуществлено с 5-кратным охватом.
[0203] Как указано в таблице 1, праймеры для ПЦР конструировали для амплификации всех трех гомеологичных последовательностей или для амплификации только одной гомеологичной последовательности. Например, праймеры для ПЦР, использованные для амплификации транскрибированной области гена AHAS, конструировали для одновременной амплификации всех трех гомеологичных копий в одной мультиплексной реакции ПЦР. Праймеры для ПЦР, использованные для амплификации нетранскрибированной области, конструировали либо для амплификации всех трех гомеологичных копий, либо для амплификации только одной гомеологичной копии. Все из праймеров для ПЦР конструировали, чтобы они имели длину от 18 до 27 нуклеотидов и имели температуру плавления от 60 до 65°C, оптимально 63°C. Кроме того, несколько праймеров конструировали для помещения предпоследнего основания (которое содержало фосфоротиоатную связь и указано в таблице 1 в качестве звездочки [*]) над вариацией нуклеотидной последовательности, которая была характерной для копии гена из каждого субгенома пшеницы. В таблице 1 приведены праймеры для ПЦР, которые были сконструированы и синтезированы.
Последовательности праймеров, использованные для амплификации способом ПЦР последовательностей AHAS
рованный геном
cribed
cribed
cribed
cribed
cribed
cribed
Кодирующая = праймеры, сконструруированные для транскрибируемых областей
звездочкой (*) указано включение фосфоротиоатной последовательности
[0204] Специфическую для субгеномов амплификацию осуществляли с использованием ПЦР с включением-выключением (Yang et al., (2005) Biochemical and Biophysical Research Communications 328:265-72) с праймерами, которые были сконструированы так, чтобы предпоследнее основание (которое содержало фосфоротиоатную связь) помещалось над варьированием нуклеотидной последовательности, которое было характерным для копий генов из каждого субгенома пшеницы. Два различных набора условий ПЦР использовали для амплификации гомеологичных копий гена AHAS из cv. Bobwhite MPB26RH. Для транскрибируемых областей реакция ПЦР включала 0,2 мМ dNTP, 1X буфер IMMOLASE PCR™ (Bioline, Taunton, MA), 1,5 мМ MgCl2, 0,25 единиц IMMOLASE DNA POLYMERASE™ (Bioline, Taunton, MA), 0,2 мкм каждого из прямого и обратного праймеров и приблизительно 50 нг геномной ДНК. Реакционные смеси, содержавшие праймеры AHAS_1F1 и AHAS_1R1, дополняли 8% (об./об.) DMSO. Для нетранскрибируемых областей реакционные смеси для ПЦР содержали 0,2 мМ dNTP, 1X PHUSION GC BUFFER™ (New England Biolabs Ipswich, MA), 0,5 единиц полимеразы HOT-START PHUSION DNA™ polymerase (New England Biolabs), 0,2 мкм каждого из прямого и обратного праймеров и приблизительно 50 нг геномной ДНК. ПЦР проводили в конечном реакционном объеме 25 мкл с использованием термоциклера MJ PTC200® (BioRad, Hercules, CA). После проведения циклов ПЦР продукты реакции очищали и клонировали с использованием PGEM-T EASY VECTOR™ (Promega, Madison, WI) в клетки E.coli JM109. Плазмидную ДНК экстрагировали с использованием набора DNAEASY PLASMID DNA PURIFICATION KIT™ (Qiagen, Valencia, CA) и секвенировали по методу Сэнгера с использованием химических реагентов BIGDYE® v3.1 (Applied Biosystems, Carlsbad, CA) на автоматизированной платформе для капиллярного электрофореза ABI3730XL®. Анализ последовательности, проведенный с использованием SEQUENCHER SOFTWARE™ (GeneCodes, Ann Arbor, MI) использовали для получения консенсусной последовательности для каждой копии гомеологичного гена (SEQ ID NO: 25, SEQ ID NO: 26 и SEQ ID NO: 27) из cv. Bobwhite MPB26RH. CLUSTALW™ использовали для проведения множественного выравнивания консенсусных последовательностей, которое подтвердило варьирование гомеологичных последовательностей, различающее копии генов AHAS.
Пример 2: Конструирование связывающих доменов с цинковыми пальцами, специфичных к последовательностям генов AHAS
[0205] Белки с цинковыми пальцами, направленные против идентифицированных последовательностей ДНК гомеологичных копий генов AHAS, конструировали, как описано ранее. См., например, Urnov et al., (2005) Nature 435:646-551. Иллюстративная последовательность-мишень и распознающие спирали представлены в таблице 2 (конструкции областей распознающих спиралей) и таблице 3 (участки-мишени). В таблице 3 нуклеотиды в участке-мишени, которые контактируют с распознающими спиралями ZFP, указаны прописными буквами; не контактирующие нуклеотиды указаны строчными буквами. Участки-мишени нуклеазы с цинковыми пальцами (ZFN) находились в 4 областях в гене AHAS: область приблизительно на 500 п.н. выше аминокислотного остатка серина 653, вышележащая область, соседняя (в пределах 30 п.н.) с аминокислотным остатком серина 653, нижележащая область, соседняя (в пределах 80 п.н.) с аминокислотным остатком серина 653, и область, приблизительно на 400 п.н. ниже аминокислотного остатка серина 653.
Конструкции цинковых пальцев для AHAS
(N/A обозначает "не применимо")
SEQ ID NO: 183
Участок-мишень цинковых пальцев с AHAS
[0206] Конструкции цинковых пальцев для AHAS встраивали в экспрессирующие векторы цинковых пальцев, кодирующие белок, имеющий по меньшей мере один палец со структурой CCHC. См., публикацию патента США № 2008/0182332. В частности, последний палец в каждом белке имел основную цепь CCHC для распознающей спирали. Неканонические кодирующие последовательности для цинковых пальцев подвергали слиянию с нуклеазным доменом фермента рестрикции типа IIS FokI (аминокислоты 384-579 последовательности согласно Wah et al., (1998) Proc. Natl. Acad. Sci. USA 95:10564-10569) через ZC-линкер из четырех аминокислот и сигнал ядерной локализации opaque-2, происходящий из Zea mays, для получения нуклеаз с цинковыми пальцами (ZFN) для AHAS. См., патент США № 7888121.
[0207] Для оптимальных цинковых пальцев подтверждали активность расщепления с использованием системы на основе почкующихся дрожжей, для которой ранее было показано, что она идентифицирует активные нуклеазы. См., например, публикацию патента США № 2009/0111119; Doyon et al., (2008) Nat Biotechnology 26:702-708; Geurts et al., (2009) Science 325:433. Цинковые пальцы различных функциональных доменов выбирали для применения in vivo. Из многочисленных ZFN, которые были сконструированы, продуцированы и исследованы в отношении связывания с предполагаемыми геномными полинуклеотидными участками-мишенями AHAS, 13 ZFN были идентифицированы как обладающие активностью in vivo на высоких уровнях, и были выбраны для дальнейшего экспериментирования. Одиннадцать ZFN были сконструированы для связывания с тремя копиями гомеологичных генов и две ZFN (29989-2A-29988 и 30006-2A-30008) были сконструированы, чтобы они связывали только копию гена на хромосоме 6D. 13 ZFN были охарактеризованы как способные эффективно связывать и расщеплять уникальные геномные полинуклеотидные участки-мишени AHAS в растениях. Иллюстративные векторы описаны ниже.
Пример 3: Оценка расщепления нуклеазой с цинковыми пальцами генов AHAS с использованием временных анализов
Сборка конструкции ZFN
[0208] Плазмидные векторы, содержащие экспрессирующие констуркции гена ZFN, которые были идентифицированы с использованием дрожжевого анализа, как описано в примере 2, конструировали и получали с использованием навыков и способов, широко известных в данной области. Каждую последовательность, кодирующую ZFN, подвергали слиянию с последовательностью, кодирующей сигнал ядерной локализации opaque-2 (Maddaloni et al., (1989) Nuc. Acids Res. 17:7532), который помещали выше нуклеазы с цинковыми пальцами.
[0209] Экспрессию слитых белков запускали с использованием промотора из гена убиквитина Zea mays, который включает 5’ нетранслируемую область (UTR) (Toki et al., (1992) Plant Physiology 100;1503-07). Экспрессирующая кассета также включала 3'-UTR (содержащую терминатор транскрипции и участок полиаденилирования) из гена пероксидазы (Per5) Zea mays (публикация патента США № 2004/0158887). Между двумя слитыми белками нуклеазы с цинковыми пальцами, которые клонировали в конструкцию добавляли самогидролизующуюся последовательность 2A, кодирующую нуклеотидную последовательность из вируса Thosea asigna (Szymczak et al., (2004) Nat Biotechnol. 22:760-760).
[0210] Плазмидные векторы собирали с использованием технологии IN-FUSION™ Advantage Technology (Clontech, Mountain View, CA). Эндонуклеазы рестрикции получали от New England BioLabs (Ipswich, MA) и для лигирования ДНК использовали ДНК-лигазу T4 (Invitrogen, Carlsbad, CA). Получение плазмид проводили с использованием набора NUCLEOSPIN® Plasmid Kit (Macherey-Nagel Inc., Bethlehem, PA) или Plasmid Midi Kit (Qiagen) в соответствии с инструкциями поставщиков. Фрагменты ДНК выделяли с использованием QIAQUICK GEL EXTRACTION KIT™ (Qiagen) после агарозного трис-ацетатного гель-электрофореза. Скрининг колоний с реакциями лигирования первоначально проводили посредством рестрикционного расщепления ДНК, полученной минипрепаративными способами. Плазмидную ДНК выбранных клонов секвенировали у коммерческого поставщика, осуществляющего секвенирование (Eurofins MWG Operon, Huntsville, AL). Данные о последовательностях собирали и анализировали с использованием программного обеспечения SEQUENCHER™ (Gene Codes Corp., Ann Arbor, MI).
[0211] Полученные 13 плазмидных конструкций: pDAB109350 (ZFN 29732-2A-29730), pDAB109351 (ZFN 29732-2A-29731), pDAB109352 (ZFN 29753-2A-29754), pDAB109353 (ZFN 29968-2A-29967), pDAB109354 (ZFN 29965-2A-29964), pDAB109355 (ZFN 29968-2A-29966), pDAB109356 (ZFN 29969-2A-29967), pDAB109357 (ZFN 29971-2A-29970), pDAB109358 (ZFN 29989-2A-29988), pDAB109359 (ZFN 30006-2A-30008), pDAB109360 (ZFN 30012-2A-30018), pDAB109361 (ZFN 30014-2A-30018) и pDAB109385 (ZFN 29770-2A-29769) подтверждали посредством ферментативного расщепления и секвенирования ДНК.
[0212] Репрезентативные плазмиды pDAB109350 и pDAB109360 представлены на фиг.1 и фиг.2.
Получение ДНК из конструкций ZFN для трансфекции
[0213] Перед доставкой в протопласты Triticum aestivum плазмидную ДНК для каждой конструкции ZFN получали из культур E. coli с использованием PURE YIELD PLASMID MAXIPREP SYSTEM® (Promega Corporation, Madison, WI) или PLASMID MAXI KIT® (Qiagen, Valencia, CA) в соответствии с инструкциями поставщиков.
Выделение протопластов мезофилла пшеницы
[0214] Мезофильные протопласты линии пшеницы cv. Bobwhite MPB26RH получали для трансфекции с использованием опосредуемой полиэтиленгликолем (PEG) доставки ДНК следующим образом.
[0215] Зрелые семена подвергали поверхностной стерилизации путем погружения в 80% (об./об.) этанол на 30 с, ополаскивания два раза водопроводной водой, а затем промывания 20% DOMESTOS® (доступный хлор 0,8% об./об.) на ротационном шейкере при 140 об./мин. в течение 20 минут. DOMESTOS® удаляли путем декантации и семена ополаскивали четыре раза стерильной водой. Избыток воды удаляли путем помещения семян на фильтровальную бумагу WHATMAN™. Семена помещали в стерильную чашку PETRI™ на несколько слоев увлажненной стерильной фильтровальной бумаги WHATMAN™ и инкубировали в течение 24 ч при 24°C. После инкубации семена подвергали поверхностной стерилизации второй раз в 15% DOMESTOS® при встряхивании в течение 15 мин с последующим ополаскиванием стерильной водой, как описано выше. Семена помещали на застывшую среду Murashige и Skooge (MS) на 24 ч при 24°C. Наконец, семена третий раз подвергали поверхностной стерилизации в 10% DOMESTOS® при встряхивании в течение 10 мин с последующим ополаскиванием стерильной водой, как описано выше. Семена помещали бороздкой вниз на застывшую среду MS в количестве 10 семян на чашку PETRI™ и проращивали в темноте при 24°C в течение 14-21 суток.
[0216] Приблизительно 2-3 грамм материала листьев из проросших семян нарезали на фрагменты длиной 2-3 см и помещали в предварительно взвешенную чашку PETRI™. Листовое влагалище и пожелтевший материал листа удаляли. Приблизительно 10 мл смеси для ферментативного расщепления листьев (0,6M маннит, 10 мМ MES, 1,5% масс./об. целлюлазы R10, 0,3% масс./об. мацерозима, 1 мМ CaCl2, 0,1% бычий сывороточный альбумин, 0,025% об./об. плюроновой кислоты, 5 мМ β-меркаптоэтанол, pH 5,7) наносили пипеткой в чашку PETRI™ и материал листа нарезали поперечно на сегменты 1-2 мм с использованием острого лезвия скальпеля. Материал листьев нарезали в присутствии смеси для расщепления листьев для предупреждения повреждения вследствие высыхания материала листа. В чашку PETRI™ добавляли дополнительную смесь для ферментативного расщепления листьев до объема 10 мл на грамм сырой массы материала листьев и подвергали вакуумному (20" Hg (69 кПа)) давлению в течение 30 мин. Чашку PETRI™ накрывали Parafilm® и инкубировали при 28°C при осторожном ротационном встряхивании в течение 4-5 часов.
[0217] Мезофильные протопласты, высвободившиеся из сегментов листьев в смесь для ферментативного расщепления, выделяли из растительного дебриса путем пропускания расщепляемой суспензии через сито с размером ячеек 100 мкм в 50-мл пробирку для сбора. Для максимального увеличения выхода протопластов расщепленный материал листьев промывали три раза. Каждое промывание проводили путем добавления 10 мл буфера для промывания (20 мМ KCl, 4 мМ MES, 0,6M маннит, pH 5,6) в чашку PETRI™, осторожного вращения в течение 1 мин, а затем пропускания промывочного буфера через сито с размером ячеек 100 мкм в ту же 50-мл пробирку для сбора. Далее отфильтрованную суспензию протопластов пропускали через сито с размером ячеек 70 микрометров, а затем через сито с размером ячеек 40 микрометров. Далее аликвоты отфильтрованной суспензии протопластов объемом 6 мл переносили в 12-мл круглодонные пробирки для центрифугирования с крышками и центрифугировали при 70 g и 12°C в течение 10 мин. После центрифугирования супернатант удаляли и каждый осадок из протопластов ресуспендировали в 7 мл промывочного буфера. Протопласты осаждали второй раз посредством центрифугирования, как описано выше. Все протопласты ресуспендировали в 1 мл промывочного буфера и объединяли в две пробирки для центрифугирования. Объем промывочного буфера доводили до конечного объема 7 мл в каждой пробирке перед проведением центрифугирования, как описано выше. После удаления супернатанта осадки с протопластами ресуспендировали в 1 мл промывочного буфера и объединяли в одну пробирку. Выход мезофильных протопластов оценивали с использованием гемоцитометра Neubauer. Для определения доли выделенных живых клеток использовали краситель эванс голубой.
Опосредуемая PEG трансфекция мезофильных протопластов
[0218] Приблизительно 106 мезофильных протопластов добавляли в 12-мл круглодонную пробирку и осаждали центрифугированием при 70 g перед удалением супернатанта. Протопласты осторожно ресуспендировали в 600 мкл промывочного буфера, содержавшего 70 мкг плазмидной ДНК. Плазмидная ДНК состояла из конструкций нуклеазы с цинковыми пальцами, описанных выше. Далее в суспензию протопластов медленно добавляли равный объем 40% раствора PEG (40% масс./об. PEG 4000, 0,8M маннит, 1M Ca(NO3)2, pH 5,6) при одновременном перемешивании путем осторожного вращения пробирки. Суспензии протопластов позволяли инкубироваться в течение 15 мин при комнатной температуре без какого-либо встряхивания.
[0219] Дополнительный объем буфера 6 мл для промывания медленно добавляли в суспензию протопластов последовательными аликвотами 1 мл, 2 мл и 3 мл. Одновременное осторожное перемешивание использовали для поддержания однородной суспензии для каждой последовательной аликвоты. Половину суспензии протопластов переносили во вторую 12-мл круглодонную пробирку и в каждую пробирку медленно добавляли дополнительный объем буфера для промывания, составляющий 3 мл, при одновременном осторожном перемешивании. Протопласты осаждали центрифугированием при 70 g в течение 10 мин и супернатант удаляли. Каждый из осадков протопластов ресупендировали в 1 мл промывочного буфера, а затем протопласты из парных круглодонных пробирок объединяли в одну 12-мл пробирку. К объединенным протопластам добавляли дополнительные 7 мл промывочного буфера перед центрифугированием, как описано выше. Супернатант полностью удаляли и осадок протопластов ресуспендировали в 2 мл среды Qiao (0,44% масс./об. MS плюс витамины, 3 мМ MES, 0,0001% масс./об. 2,4-D, 0,6M глюкоза, pH 5,7). Суспензию протопластов переносили в стерильную 3-см чашку PETRI™ и инкубировали в темноте при 24°C в течение 72 ч.
Выделение геномной ДНК из протопластов мезофилла
[0220] Перенесенные протопласты переносили из 3-см чашки PETRI™ в 2-мл микроцентрифужную пробирку. Клетки осаждали центрифугированием при 70 g и супернатант удаляли. Для максимального увеличения выделения трансфицированных протопластов чашку PETRI™ ополаскивали три раза 1 мл промывочного буфера. Каждое ополаскивание проводили путем вращения промывочного буфера в чашке PETRI™ в течение 1 мин, после чего жидкость переносили в ту же 2-мл микроцентрифужную пробирку. В конце каждого ополаскивания клетки осаждали центрифугированием при 70 g и супернатант удаляли. Осажденные протопласты быстро замораживали в жидком азоте, а затем проводили лиофилизацию в течение 24 ч в LABCONCO FREEZONE 4,5® (Labconco, Kansas City, MO) при -40°C и давлении 133×10-3 mBar. Лиофилизированные клетки подвергали экстракции ДНК с использованием набора DNEASY® PLANT DNA EXTRACTION MINI KIT (Qiagen) в соответствии с инструкциями изготовителя, за исключением того, что разрушение ткани не требовалось и клетки протопластов добавляли прямо в лизирующий буфер.
ПЦР-анализ геномной ДНК протопластов в отношении расщепления последовательности ZFN
[0221] Для обеспечения эффективности расщепления и специфичности к участку-мишени ZFN, сконструированной для локуса гена AHAS, подлежащего исследованию, конструировали праймеры для ПЦР, предназначенные для амплификации фрагмента длиной вплоть до 300 п.н., в котором находились один или несколько участков-мишеней ZFN. Один из праймеров конструировали так, чтобы он находился в пределах окна из 100 п.н. для выявляемого участка(ов)-мишени ZFN. Эта стратегия конструирования обеспечила использование технологии короткого считывания Illumina для оценки целостности участка-мишени ZFN в трансфицированных протопластах. Кроме того, праймеры для ПЦР конструировали для амплификации гомеологичных копий гена AHAS и для установления вариаций нуклеотидной последовательности, которые различались между гомеологами, чтобы считанные последовательности Illumina могли быть однозначно отнесены к субгеному пшеницы, из которого они происходят.
[0222] Конструировали всего четыре набора праймеров для ПЦР для амплификации локусов участков-мишеней ZFN (таблица 4). Каждый набор праймеров синтезировали с последовательностями SP1 и SP2 Illumina на 5'-конце прямого и обратного праймера для обеспечения совместимости с химией секвенирования с коротким считыванием Illumina. Синтезированные праймеры также содержали фосфоротиоатную связь на предпоследних 5'- и 3'-нуклеотидах (указаны в таблице 4 в качестве звездочки [*]). 5'-фосфоротиоатная связь обеспечивала защиту от деградации экзонуклеазой последовательностей SP1 и SP2 Illumina, в то время как 3'-фосфоротиоатная связь повышала специфичность ПЦР в отношении амплификации последовательностей-мишеней AHAS с использованием ПЦР с включением-выключением (Yang et al., (2005)). Все праймеры для ПЦР конструировали, чтобы они имели длину от 18 до 27 нуклеотидов и имели температуру плавления от 60 до 65°C, оптимально 63°C.
[0223] В таблице 4 нуклеотиды, специфичные к гену AHAS, указаны прописными буквами; нуклеотиды, соответствующие последовательностям SP1 и SP2 Illumina, указаны строчными буквами. Каждый набор праймеров эмпирически исследовали в отношении амплификации трех копий гомеологичных генов AHAS посредством секвенирования по методу Сэнгера продуктов амплификации способом ПЦР.
Последовательности праймеров, использованные для оценки эффективности расщепления AHAS посредством ZFN и специфичности в отношении участка-мишени
[0224] Амплификацию способом ПЦР локусов участков-мишеней ZFN из геномной ДНК, экстрагированной из трансфицированных мезофильных протопластов пшеницы, использовали для получения требуемых специфических для локусов молекул ДНК в правильном формате для технологии секвенирования путем синтеза на основе Illumina. Каждый анализ ПЦР оптимизировали так, чтобы он функционировал с 200 нг исходной ДНК (приблизительно 12500 клеточных эквивалентов генома Triticum aestivum). Проводили множество реакций на трансфицированный образец, чтобы гарантировать анализ достаточного количества копий генома Triticum aestivum для надежной оценки эффективности ZFN и специфичности к участку-мишени. Проводили приблизительно шестнадцать анализов ПЦР на трансфицированный образец, что эквивалентно 200000 копиям генома Triticum aestivum, взятым из индивидуальных протопластов. Для каждого трансфицированного образца получали одну основную смесь для ПЦР. Для обеспечения оптимальной амплификации способом ПЦР участка-мишени ZFN (т.е. чтобы реагенты для ПЦР не стали ограничивающими и чтобы ПЦР оставалась на экспоненциальной стадии амплификации) первоначальный анализ проводили с использованием способа количественной ПЦР для определения оптимального числа циклов для заданной ткани. Первоначальную ПЦР проводили с необходимыми отрицательными контрольными реакциями на MX3000P THERMOCYCLER™ (Stratagene). Из выходных данных устройства для количественной ПЦР относительное увеличение флуоресценции наносили на график от цикла к циклу и определяли число циклов на анализ, которое будет обеспечивать достаточную амплификацию, одновременно не позволяя реакции стать ограниченной реагентами, в попытках уменьшить избыточное проведение циклов и смещение амплификации в сторону общих молекул. Неиспользованная основная смесь оставалась на льду до завершения количественного анализа способом ПЦР и определения оптимального числа циклов. Затем оставшуюся основную смесь распределяли аликвотами в желаемое количество реакционных пробирок (приблизительно 16 на анализ ZFN) и проводили амплификацию способом ПЦР в течение оптимального числа циклов. После амплификации образцы для того же участка-мишени ZFN объединяли и 200 мкл объединенного продукта на ZFN очищали с использованием QIAQUICK MINIELUTE PCR PURIFICATION KIT™ (Qiagen) в соответствии с инструкциями изготовителя.
[0225] Для обеспечения секвенирования образца с использованием технологии короткого считывания Illumina проводили дополнительный раунд ПЦР для внесения последовательностей P5 и P7 Illumina в амплифицированные фрагменты ДНК, а также штрихового кода последовательности, который можно использовать для однозначного отнесения данных считывания последовательностей к образцу, из которого они происходят. Это осуществляли с использованием праймеров, которые были частично комплементарными последовательностям SP1 и SP2, добавляемым на первом раунде амплификации, но также содержали штриховой код образца и последовательности P5 и P7. Оптимальное число циклов ПЦР, которое требовалось для добавления дополнительных последовательностей к матрице без избыточной амплификации общих фрагментов, определяли с использованием анализа циклов количественной ПЦР, как описано выше. После амплификации полученный продукт очищали с использованием AMPURE MAGNETIC BEADS® (Beckman-Coulter) с соотношением ДНК и гранул 1:1,7. Очищенный фрагмент ДНК титровали для секвенирования посредством технологии короткого считывания Illumina с использованием набора для количественного определения библиотек на основе ПЦР (KAPA) в соответствии с инструкциями изготовителя. Образцы получали путем секвенирования с использованием набора для образования кластеров CBOT (Illumina) и секвенировали на устройстве ILLUMINA GAIIx™ или HISEQ2000™ (Illumina) для получения данных считывания спаренной концевой последовательности из 100 п.н., в соответствии с инструкциями изготовителя.
Анализ данных для обнаружения NHEJ в участках-мишенях ZFN
[0226] После получения данных короткого считывания последовательностей Illumina для библиотек образцов, полученных для трансфицированных мезофильных протопластов, проводили биоинформатический анализ для идентификации делетированных нуклеотидов в участках-мишенях ZFN. Известно, что такие делеции являются индикаторами активности ZFN в растениях, которая является результатом репарации ДНК по типу негомологичного соединения концов (NHEJ).
[0227] Для идентификации считанных последовательностей с делециями NHEJ использовали предоставляемые поставщиком скрипты для обработки данных о последовательностях, полученных на устройстве HISEQ2000™ (Illumina) для первого компьютерного отнесения считанных коротких последовательностей к образцу протопласта, из которого они происходили. Отнесение образцов было основано на последовательности штрихового кода, которую вносили в процессе получения библиотеки, как описано ранее. В правильном отнесении образцов были уверены, поскольку штриховые коды из 6 п.н., использованные для получения образцов, имели по меньшей мере двухшаговое отличие последовательности друг от друга.
[0228] После отнесения к образцам все последовательности пропускали через фильтр качества. Фильтр качества был в выполнен в специально разработанном скрипте PERL. Считанные последовательности исключали, если существовало более трех неопределенных оснований, или если средний показатель Phred был менее 20, или если было три или более последовательно расположенных основания с показателем Phred менее 20, или если считанные последовательности были короче 40 нуклеотидов.
[0229] Далее качественные укороченные последовательности относили к субгеному пшеницы, из которого они происходили. Это осуществляли с использованием второго специально разработанного скрипта PERL, в котором отнесение к субгеному осуществляли на основе гаплотипа вариантов нуклеотидной последовательности, которые выявлялись праймерами для ПЦР, использованными для амплификации трех гомеологичных копий гена AHAS, как описано выше.
[0230] Наконец, для каждого образца определяли частоту делеций NHEJ в участке расщепления ZFN в последовательности, отнесенной к субгеному, с использованием третьего специально разработанного скрипта PERL и ручного манипулирования данными в Microsoft Excel 2010 (Microsoft Corporation). Это осуществляли путем подсчета частоты уникальных делеций NHEJ на каждом субгеноме в каждом образце.
[0231] Для оценки эффективности и специфичности расщепления исследованных ZFN использовали два подхода. Эффективность расщепления выражали (в частях на миллион считанных последовательностей) в качестве доли отнесенных к субгеному последовательностей, которые содержали делецию NHEJ в участке-мишени ZFN. Для идентификации ZFN с наилучшей активностью расщепления для каждой из четырех областей-мишеней генов AHAS специфическим для субгенома образом использовали ранжирование ZFN по их наблюдаемой эффективности расщепления.
[0232] Все из исследованных ZFN продемонстрировали распределение размера делеции NHEJ в соответствии с ожидаемым распределением для активности ZFN в растениях. Специфичность расщепления выражали в качестве соотношения эффективностей расщепления, наблюдаемых для трех субгеномов. Включение биологических реплик в анализ данных по существу не влияло на ранговый порядок активности и специфичности расщепления исследованных ZFN.
[0233] Из этих результатов были выбраны ZFN, кодированные на плазмиде pDAB109350 (т.е. ZFN 29732 и 29730) и pDAB109360 (т.е. ZFN 30012 и 30018) для нацеливания в растениях в последующих экспериментах, учитывая их характеристики значительной активности расщепления геномной ДНК в каждом из трех субгеномов пшеницы.
Пример 4: Оценка донорных конструкций для опосредуемого ZFN редактирования гена AHAS с использованием временных анализов
[0234] Для исследования опосредуемого ZFN геномного редактирования в эндогенном локусе гена AHAS в пшенице проводили серию экспериментов для оценки эффекта донорной конструкции в отношении эффективности репарации ДНК, осуществляемой путем гомологичной рекомбинации (HR) и путем негомологичного соединения концов (NHEJ). В этих экспериментах использовали временные анализы для мониторинга эффективности опосредуемого ZFN внесения ранее описанной мутации S653N, сообщающей толерантность к гербицидам класса имидазолинонов (Li et al., (2008) Molecular Breeding 22:217-225) в эндогенном локусе гена AHAS в пшенице или альтернативно для опосредуемого ZFN внесения участка последовательности для эндонуклеазы рестрикции EcoRI в двухцепочечный разрыв ДНК, внесенный в эндогенные гены AHAS посредством направленного расщепления ZFN.
Донорные конструкции для осуществляемой путем HR репарации ДНК
[0235] Донорные конструкции ДНК были основаны на плазмидном ДНК-векторе, содержавшем гомологичные плечи размером 750 п.н. (т.е. последовательность, идентичная гену AHAS), фланкирующие каждую сторону участка-мишени для расщепления посредством ZFN 29732 и 29730. Плазмидный ДНК-вектор конструировали для каждого из трех субгеномов пшеницы: pDAS000132 (фиг.3), pDAS000133 (фиг.4) и pDAS000134 (фиг.5) конструировали для генома A, B и D, соответственно (SEQ ID NO: 65, SEQ ID NO: 66 и SEQ ID NO: 67). Каждый плазмидный ДНК-вектор конструировали для внесения мутации S653N (AGC→ATT) в качестве геномной модификации, сообщающей толерантность гербицидам класса имидазолинонов в гомеологичной копии-мишени эндогенного гена AHAS посредством опосредуемой ZFN осуществляемой путем HR репарации ДНК. Также конструировали две дополнительных плазмидных конструкции ДНК для нацеливания на геном D. Первая плазмидная ДНК, pDAS000135 (SEQ ID NO: 68) (фиг.6), была идентична pDAS000134 за исключением того, что она содержала две дополнительных (синонимичных) однонуклеотидных точковых мутации, которые расположены на 15 п.н. выше и ниже мутации S653N. Вторая плазмидная ДНК, pDAS000131(SEQ ID: 69) (фиг.7), не содержала мутацию S653N, однако была сконструирована для внесения участка распознавания для эндонуклеазы рестрикции EcoRI (т.е., GAATTC) в двухцепочечном разрыве ДНК, внесенной посредством направленного расщепления посредством ZFN в копии эндогенного гена AHAS из генома D.
Донорные конструкции для осуществляемой путем NHEJ репарации ДНК
[0236] Для осуществляемой путем NHEJ репарации ДНК использовали два типа конструкций донорных ДНК.
[0237] Первым типом донорной конструкции была линейная двухцепочечная молекула ДНК, содержавшая последовательность из 41 п.н., которая не имела гомологии с эндогенными генами AHAS в пшенице. Конструировали две донорных молекулы ДНК, каждая из которых была нацелена на три гомеологичных копии гена AHAS. Обе донорные молекулы ДНК имели выступающие 5’- и 3’-концы для обеспечения лигирования в целях облегчения опосредуемой ZFN осуществляемой путем NHEJ репарации ДНК. Две донорных молекулы ДНК различались последовательностями на их выступающих 3’-концах. Первую донорную молекулу ДНК, pDAS000152 (SEQ ID NO: 74 и SEQ ID NO: 75), конструировали для обеспечения выступающих концов для лигирования, которые были совместимы с выступающими концами, создаваемыми расщеплением эндогенных генов AHAS посредством ZFN 29732 и 29730 (кодируемые на плазмиде pDAB109350) и для обеспечения встраивания донорной молекулы из 41 п.н. в эндогенный ген AHAS в участке двухцепочечного разрыва ДНК посредством осуществляемой путем NHEJ репарации ДНК. Вторую донорную молекулу ДНК, pDAS000149 (SEQ ID NO: 76 и SEQ ID NO: 77), конструировали для обеспечения выступающих концов для лигирования, которые были совместимыми с выступающими концами, полученными посредством двойного расщепления эндогенных генов AHAS посредством ZFN 29732 и 29730 (кодируемые на плазмиде pDAB109350) и ZFN 30012 и 30018 (кодируемые на плазмиде pDAB109360) и для замены эндогенной последовательности AHAS, содержавшейся между двухцепочечными разрывами ДНК, внесенными ZFN, донорной молекулой из 41 п.н. посредством осуществляемой путем NHEJ репарации ДНК.
[0238] Вторым типом донора был плазмидный ДНК-вектор, содержащий последовательность длиной 41 п.н., которая не имела гомологии с эндогенными генами AHAS в пшенице, и которая фланкировалась на каждой стороне последовательностью, которая распознавалась ZFN, использованными для внесения двухцепочечных разрывов ДНК в эндогенные гены AHAS. Эта донорная конструкция обеспечивала высвобождение в растении уникальной последовательности из 41 п.н. из плазмидной молекулы ДНК теми же ZFN, которые использовались для расщепления участков-мишеней в эндогенных генах AHAS и одновременного образования выступающих концов, которые были пригодными для лигирования выступающих концов высвобожденной последовательности из 41 п.н. в эндогенные гены AHAS посредством осуществляемой путем NHEJ репарации ДНК. Конструировали две донорных плазмидных молекулы ДНК, каждая из которых была нацелена на три гомеологичных копии гена AHAS. Первую донорную плазмидную молекулу, pDAS000153 (SED ID NO:78 и SEQ ID NO: 79) (фиг.8), конструировали для обеспечения лигирования выступающих концов на высвобожденном фрагменте ДНК из 41 п.н., которые были совместимыми с выступающими концами, образованными путем расщепления эндогенных генов AHAS посредством ZFN 29732 и 29730 (кодируемые на плазмиде pDAB109350). Вторую донорную плазмиду, pDAS000150 (SEQ ID NO: 80 и SEQ ID NO: 81) (фиг.9), конструировали для обеспечения выступающих концов для лигирования на высвобожденном фрагменте ДНК из 41 п.н., которые на одном конце были совместимы с выступающими концами, создаваемыми ZFN 29732 и 29730 (кодируемые на плазмиде pDAB109350), и на другом конце были совместимы с выступающими концами, создаваемыми ZFN 30012 и 30018 (кодируемые на плазмиде pDAB109360). Эта конструкция позволяла замену эндогенной последовательности AHAS, содержащейся между двумя двухцепочечными разрывами ДНК, созданными ZFN 29732 и 29730 и ZFN 30012 и 30018, последовательностью донорной молекулы из 41 п.н.
Синтез донорной ДНК для осуществляемой путем NHEJ и осуществляемой путем HDR репарации ДНК
[0239] Для конструирования плазмидных векторов использовали стандартные способы клонирования, широко известные специалистам в данной области. Перед доставкой в Triticum aestivum, плазмидную ДНК для каждой донорной конструкции получали из культур E. coli с использованием PURE YIELD PLASMID MAXIPREP SYSTEM® (Promega Corporation, Madison, WI) или PLASMID MAXI KIT® (Qiagen, Valencia, CA) в соответствии с инструкциями поставщиков.
[0240] Стандартную химию фосфорамидитов использовали для синтеза двухцепочечных донорных молекул ДНК (Integrated DNA Technologies, Coralville, IA). Для каждой донорной молекулы синтезировали пару комплементарных одноцепочечных олигомеров ДНК, каждый из которых имел две фосфоротиоатные связи на 5’-конце для обеспечения защиты от деградации эндонуклеазами в растениях. Одноцепочечные олигомеры ДНК очищали высокоэффективной жидкостной хроматографией для увеличения содержания полноразмерных молекул и очищали от химических остатков стадий синтеза с использованием Na+-обмена. Двухцепочечную донорную молекулу формировали путем отжига эквимолярных количеств двух комплементарных одноцепочечных олигомеров ДНК с использованием стандартных способов, широко известных специалисту в данной области. Перед доставкой в Triticum aestivum двухцепочечные молекулы ДНК разбавляли до требуемой концентрации в стерильной воде.
Выделение протопластов пшеницы, происходящих из соматического эмбриогенного каллюса
[0241] Протопласты, происходящие из соматического эмбриогенного каллюса (SEC), из донорной линии пшеницы cv. Bobwhite MPB26RH получали для трансфекции с использованием опосредуемой полиэтиленгликолем (PEG) доставки ДНК следующим образом:
[0242] Проростки донорной линии пшеницы выращивали в теплице с контролируемыми условиями, поддерживаемой при 18/16°C (день/ночь) и при световом периоде 16/8 часов (день/ночь) с освещением на уровне 800 ммоль м2 в секунду. Колосья пшеницы собирали через 12-14 суток после цветения и подвергали поверхностной стерилизацией путем погружения на 1 мин в 70% (об./об.) этанол. Колосья измельчали и незрелые семена стерилизовали в течение 15 мин в 17% (об./об.) отбеливателе при осторожном встряхивании с последующим ополаскиванием по меньшей мере три раза стерильной дистиллированной водой. Зародыши выделяли в асептических условиях из незрелых семян под препаровальной лупой. Ось зародыша удаляли с использованием острого скальпеля и выбрасывали. Щиток помещали в 9-см чашку PETRI™, содержавшую среду 2-4 без TIMENTIN™ неразрезанным щитком вверх. Всего 25 щитков высевали на 9-см чашки PETRI™. Образование соматического эмбриогенного каллюса (SEC) инициировали путем инкубации в темноте при 24°C в течение 3 недель. Через 3 недели SEC отделяли от неэмбриогенного каллюса, помещали на свежую среду 2-4 без TIMENTIN™ и инкубировали в течение дополнительных 3 недель в темноте при 24°C. Субкультивирование SEC повторяли всего три раза перед применением для получения протопластов.
[0243] Приблизительно один грамм SEC нарезали на фрагменты размером 1-2 мм с использованием острого лезвия в 10-см чашке PETRI™, содержавшей приблизительно 10 мл смеси для расщепления каллюса пшеницы (2,5% масс./об. целлюлаза RS, 0,2% масс./об. пектолиаза Y23, 0,1% масс./об. Driselase®, 14 мМ CaCl2, 0,8 мМ MgSO4, 0,7 мМ KH2PO4, 0,6M маннит, pH 5,8) для предотвращения дегидратации каллюса. В чашку PETRI™ добавляли дополнительную смесь для расщепления каллюса до объема 10 мл на грамм сырой массы каллюса и подвергали вакуумному (20" Hg (69 кПа)) давлению в течение 30 мин. Чашку PETRI™ накрывали Parafilm® и инкубировали при 28°C при осторожном ротационном встряхивании при 30-40 об./мин. в течение 4-5 часов.
[0244] Протопласты SEC, высвобожденные из каллюса, выделяли путем пропускания суспензии для расщепления через сито размером 100 мкм и в 50-мл пробирку для сбора. Для максимального увеличения выхода протопластов расщепленный материал каллюса промывали три раза. Каждое промывание проводили путем добавления 10 мл буфера для промывания SEC (0,6M маннит, 0,44% масс./об. MS, pH 5,8) в чашку PETRI™, осторожного вращения в течение 1 мин, а затем пропускания промывочного буфера через сито с размером ячеек 100 мкм в ту же 50-мл пробирку для сбора. Далее отфильтрованную суспензию протопластов пропускали через сито с размером ячеек 70 микрометров, а затем через сито с размером ячеек 40 микрометров. Далее аликвоты отфильтрованной суспензии протопластов объемом 6 мл переносили в 12-мл круглодонные пробирки для центрифугирования с крышками и центрифугировали при 70 g и 12°C в течение 10 мин. После центрифугирования супернатант удаляли, оставляя приблизительно 0,5 мл супернатанта, и каждый осадок из протопластов ресуспендировали в 7 мл 22% раствора сахарозы. На смесь сахароза/протопласты осторожно наслаивали 2 мл буфера для промывания SEC, следя за тем, чтобы не происходило смешения двух растворов. Протопласты центрифугировали второй раз, как описано выше. Полосу протопластов, видимую между буфером для промывания SEC и раствором сахарозы, собирали с использованием пипетки и помещали в чистую 12-мл круглодонную пробирку. Семь мл буфера для промывания SEC добавляли к протопластам и пробирки центрифугировали, как описано выше. Супернатант удаляли и протопласты SEC объединяли в одну пробирку и ресуспендировали в конечном объеме 1-2 мл буфера для промывания SEC. Выход протопластов SEC оценивали с использованием гемоцитометра Neubauer. Для определения доли выделенных живых клеток использовали краситель эванс голубой.
Опосредуемая PEG трансфекция протопластов SEC
[0245] Приблизительно два миллиона протопластов SEC добавляли в 12-мл круглодонную пробирку и осаждали центрифугированием при 70 g перед удалением супернатанта. Протопласты осторожно ресуспендировали в 480 мкл буфера для промывания SEC, содержавшего 70 мкг плазмидной ДНК. ДНК состояла из конструкций нуклеазы с цинковыми пальцами и донорной ДНК, описанных выше, причем каждая конструкция присутствовала в молярном соотношении, требуемом для проведения эксперимента. Далее 720 мкл 50% раствора PEG (50% масс./об. PEG 4000, 0,8M маннит, 1M Ca(NO3)2, pH 5,6) медленно добавляли в суспензию протопластов с одновременным перемешиванием путем осторожного вращения пробирки. Суспензии протопластов позволяли инкубироваться в течение 15 мин при комнатной температуре без какого-либо встряхивания.
[0246] Дополнительный объем буфера для промывания SEC, составляющий 7, мл медленно добавляли в суспензию протопластов последовательными аликвотами 1 мл, 2 мл и 3 мл. Одновременное осторожное перемешивание использовали для поддержания однородной суспензии для каждой последовательной аликвоты. Половину суспензии протопластов переносили во вторую 12-мл круглодонную пробирку и в каждую пробирку медленно добавляли дополнительный объем буфера для промывания SEC, составляющий 3 мл, при одновременном осторожном перемешивании. Протопласты осаждали центрифугированием при 70 g в течение 10 мин и супернатант удаляли. Каждый из осадков протопластов ресупендировали в 1 мл буфера для промывания SEC, а затем протопласты из парных круглодонных пробирок объединяли в одну 12-мл пробирку. К объединенным протопластам добавляли дополнительные 7 мл буфера для промывания SEC перед центрифугированием, как описано выше. Супернатант полностью удаляли и осадок протопластов ресуспендировали в 2 мл среды Qiao. Суспензию протопластов переносили в стерильную 3-см чашку PETRI™ и инкубировали в темноте при 24°C в течение 72 ч.
Выделение щитка из незрелых зиготических зародышей пшеницы
[0247] Щитки незрелых зиготических зародышей пшеницы из донорной линии пшеницы cv. Bobwhite MPB26RH получали для трансфекции с использованием биолистической доставки ДНК следующим образом.
[0248] Семена донорной линии пшеницы выращивали в теплице с контролируемыми условиями, поддерживаемой при 18/16°C (день/ночь) и при световом периоде 16/8 часов (день/ночь) с освещением на уровне 800 ммоль м2 в секунду. Колосья пшеницы собирали через 12-14 суток после цветения и подвергали поверхностной стерилизацией путем погружения на 1 мин в 70% (об./об.) этанол. Колосья измельчали и незрелые семена стерилизовали в течение 15 мин в 17% (об./об.) отбеливателе при осторожном встряхивании с последующим ополаскиванием по меньшей мере три раза стерильной дистиллированной водой. Зародыши выделяли в асептических условиях из незрелых семян под препаровальной лупой. Ось зародыша удаляли с использованием острого скальпеля и выбрасывали. Щиток помещали в 9-см чашку PETRI™, содержавшую осмотическую среду MS (E3 мальтоза), с неразрезанным щитком, ориентированным вверх. Всего 20 щитков высевали на 9-см чашки PETRI™. Полученные зародыши предварительно культивировали в темноте при 26°C в течение минимум 4 ч перед трансфекцией с использованием биолистической доставки ДНК.
Трансфекция щитка незрелых зиготических зародышей пшеницы посредством биолистической доставки ДНК
[0249] Золотые частицы для биолистической доставки ДНК получали путем добавления 40 мг частиц коллоидного золота размером 0,6 микрометров (BioRad) в 1 мл стерильной воды в 1,5-мл микропробирке. Золотые частицы ресуспендировали встряхиванием в течение 5 мин. Для получения достаточного материала для 10 бомбардировок, 50-мкл аликвоту суспензии золотых частиц переносили в 1,5-мл микропробирку, содержавшую 5 мкг ДНК, ресуспендированной в 5 мкл стерильной воды. После тщательного перемешивания путем встряхивания в микропробирку добавляли 50 мкл 2,5M CaCl2 и 20 мкл 0,1M спермидина при тщательном перемешивании после добавления каждого реагента. Покрытые ДНК золотые частицы осаждали центрифугированием в течение 1 мин при максимальной скорости в настольной микроцентрифуге. Супернатант удаляли и добавляли 1 мл 100% этанола для промывания и ресуспендирования золотых частиц. Золотые частицы осаждали центрифугированием, как описано выше, и супернатант выбрасывали. Покрытые ДНК золотые частицы ресуспендировали в 110 мкл 100% этанола и поддерживали на льду. После кратковременного встряхивания 10 мкл раствора золотых частиц помещали на мембрану-макропереносчик и позволяли высохнуть на воздухе.
[0250] PDS-1000/HE PARTICLE GUN DELIVERY SYSTEM™ (BioRad) использовали для трансфекции щитка незрелых зиготических зародышей пшеницы посредством биолистической доставки ДНК. Доставку покрытых ДНК золотых частиц проводили с использованием следующих условий: зазор 2,5 см, отверстие останавливающей пластины 0,8 см, заданное расстояние 6,0 см, вакуум 91,4-94,8 кПа, скорость вакуумного потока 5,0 и скорость вентилирующего потока 4,5. Щитки незрелых зиготических зародышей пшеницы бомбардировали с использованием разрывного диска с давлением 900 фунт./кв. дюйм (6,2 МПа). Каждую чашку PETRI™, содержавшую 20 щитков, бомбардировали один раз. После бомбардировки щитки инкубировали при 26°C в темноте в течение 16 ч, а затем переносили в среду для индукции каллюса. Щитки культивировали на среде для индукции каллюса в темноте при 26°C в течение 7 суток.
Выделение геномной ДНК из протопластов SEC
[0251] Геномную ДНК экстрагировали из протопластов SEC с использованием методики, описанной выше для мезофильных протопластов. Проводили дополнительную стадию очистки для уменьшения присутствия донорной ДНК, использованной для трансфекции. Это осуществляли с использованием гель-электрофореза для отделения геномной ДНК из протопластов SEC от донорной ДНК, использованной для трансфекции. Экстрагированную ДНК подвергали электрофорезу в течение 3 ч в 0,5% агарозном геле с использованием 0,5X TBE. ДНК визуализировали посредством окрашивания SYBR® Safe и полосу, соответствующую геномной ДНК из протопластов SEC, вырезали. Геномную ДНК очищали из агарозного геля с использованием QIAQUICK DNA Purification kit™ (Qiagen), в соответствии с инструкциями изготовителя, за исключением того, что колонку для очистки ДНК QIAQUICK™ заменяли ДНК-связывающей колонкой из DNEASY PLANT DNA EXTRACTION MINI KIT™ (Qiagen).
Выделение геномной ДНК из щитков незрелых зиготических зародышей
[0252] 20 щитков незрелых зиготических зародышей пшеницы, трансфицированных для каждой биолистической доставки ДНК, переносили в 15-мл пробирку и быстро замораживали в жидком азоте, а затем проводили лиофилизацию в течение 24 ч в LABCONCO FREEZONE 4,5® (Labconco, Kansas City, MO) при -40°C и давлении 133×10-3 мБар. Лиофилизированные каллюсы подвергали экстракции ДНК с использованием набора DNeasy® PLANT DNA EXTRACTION MAXI™ KIT (Qiagen) в соответствии с инструкциями изготовителя.
[0253] Проводили дополнительную стадию очистки для уменьшения присутствия донорной ДНК, использованной для трансфекции. Это осуществляли с использованием гель-электрофореза для отделения геномной ДНК из каллюса от донорной ДНК, использованной для трансфекции. Экстрагированную ДНК подвергали электрофорезу в течение 3 ч в 0,5% агарозном геле с использованием 0,5X TBE. ДНК визуализировали посредством окрашивания SYBR® Safe и полосу, соответствующую геномной ДНК из каллюсов, вырезали. Геномную ДНК очищали из агарозного геля с использованием набора QIAQUICK™ DNA PURIFICATION KIT (Qiagen), в соответствии с инструкциями изготовителя за исключением того, что колонку для очистки ДНК QIAQUICK™ заменяли ДНК-связывающей колонкой из набора DNeasy® PLANT DNA EXTRACTION MAXI™ kIT (Qiagen).
Анализ способом ПЦР геномной ДНК в отношении опосредуемого ZFN редактирования AHAS
[0254] Для исследования опосредуемого ZFN редактирования генома в эндогенных генах AHAS пшеницы с использованием осуществляемой путем HR и NHEJ репарации ДНК и оценки эффекта конструкции донорной ДНК на эффективность каждого пути репарации ДНК использовали анализы способом ПЦР для амплификации областей-мишеней AHAS из геномной ДНК трансфицированных клеток пшеницы. Анализы способом ПЦР проводили, как описано ранее, с получением требуемых специфических для локусов молекул ДНК в правильном формате для технологии секвенирования путем синтеза на основе Illumina. Каждый анализ проводили с использованием описанной выше пары праймеров (SEQ ID NO: 59 и SEQ ID NO: 60), которые были сконструированы для амплификации области, на которую нацелены ZFN 29732 и 29730 (кодируемые плазмидой pDAB109350) и ZFN 30012 и 30018 (кодируемые плазмидой pDAB109360) для каждой из трех гомеологичных копий генов AHAS. Проводили множество реакций на трансфицированный образец, чтобы обеспечить анализ достаточного количества копий генома Triticum aestivum для надежной оценки опосредуемого ZFN редактирования генов. Для трансфицированных протопластов SEC проводили вплоть до шестнадцати анализов способом ПЦР на трансфицированный образец, что эквивалентно 200000 копиям генома Triticum aestivum, взятым из индивидуальных протопластов. Для трансфицированных щитков незрелых зиготических зародышей проводили приблизительно сорок восемь анализов способом ПЦР на трансфицированный образец, что эквивалентно 600000 копий генома Triticum aestivum, взятым из индивидуальных протопластов. Каждый трансфицированный образец подготавливали для секвенирования с использованием набора CBOT CLUSTER GENERATION KIT™ (Illumina) и секвенировали на устройстве ILLUMINA GAIIx™ или HISEQ2000™ (Illumina) для получения данных считывания спаренной концевой последовательности из 100 п.н., как описано выше.
Анализ данных для обнаружения опосредуемого ZFN осуществляемого путем HR редактирования в локусе гена AHAS
[0255] После получения данных короткого считывания последовательностей Illumina для библиотек образцов, полученных для трансфицированных протопластов SEC и щитков незрелых зиготических зародышей пшеницы проводили анализы для идентификации молекулярных доказательств опосредуемого ZFN осуществляемого путем HR редактирования в участках-мишенях ZFN.
[0256] Для идентификации считанных последовательностей с молекулярными доказательствами осуществляемого путем HR редактирования гена считанные короткие последовательности сначала подвергали компьютерной обработке, как описано выше, для отнесения каждой считанной последовательности к образцу и субгеному, из которой она происходит, и для проведения фильтрации по качеству, чтобы обеспечить использование только последовательностей высокого качества для последующих анализов. Далее специально разработанные скрипты PERL и ручное манипулирование данными в MICROSOFT EXCEL 2010™ (Microsoft Corporation) использовали для идентификации считанных последовательностей, которые содержали последовательность как донорной молекулы ДНК, использованной для трансфекции, так и эндогенного локуса AHAS. Для обеспечения однозначного различения считанных последовательностей вследствие опосредуемого ZFN осуществляемого путем HR редактирования и последовательностей вследствие остатков (какой-либо) донорной ДНК, использованной для трансфекции, о молекулярных доказательствах редактирования генов утверждали, только если считанная последовательность также содержала делецию NHEJ в положении двухцепочечного разрыва ДНК, созданного ZFN; т.е. считанная последовательность продемонстрировала признаки результата несовершенной осуществляемой путем HR репарации ДНК. Частоту редактирования (выражаемую в частях на миллион считанных последовательностей) вычисляли в качестве доли отнесенной к субгеному последовательности, которая продемонстрировала признаки опосредуемого ZFN осуществляемого путем HR редактирования генов.
[0257] Из результатов для трех биологических реплик, выполненных для каждой конструкции пладмидной донорной ДНК, получали молекулярные доказательства увеличения количества считанных последовательностей, демонстрирующих опосредуемое ZFN осуществляемое путем HR редактирование в трех гомеологичных копиях эндогенных генов AHAS в пшенице (таблица 5 и таблица 6). Убедительные молекулярные доказательства были получены для добавления участка для эндонуклеазы рестрикции EcoRI в положении двухцепочечной ДНК, создаваемом ZFN 29732 и 29730, во всех трех гомеологичных копиях эндогенного гена AHAS как в образцах протопластов SEC, так и в образцах щитков незрелых зиготических зародышей, которые были трансфицированы pDAB109350 и pDAS000131. Частота опосредуемого ZFN осуществляемого путем HR редактирования генов была наиболее высокой в D-геноме, на который была нацелена донорная молекула ДНК. Аналогично, убедительные молекулярные доказательства были получены для внесения донорного полинуклеотида, содержавшего мутацию S653N во всех трех гомеологичных копиях эндогенных генов AHAS в образцах щитков незрелых зиготических эмбрионов, которые были трансфицированы pDAB109350 и любой из pDAS000132, pDAS000133 или pDAS000134; также наблюдали убедительные молекулярные доказательства для образцов протопластов SEC, трансфицированных pDAB109350 и pDAS000134. Частота опосредуемого ZFN осуществляемого путем HR редактирования генов вновь была наивысшей в субгеноме, для которого была сконструирована донорная ДНК. Важно, что частота редактирования в образцах протопластов SEC и щитков незрелых зиготических зародышей, трансфицированных pDAB109350 и pDAS000135, была более низкой (приблизительно в 10 раз), чем частота, наблюдаемая для образцов, трансфицированных pDAB109350 и pDAS000134. Этот результат был ожидаемым вследствие ухудшения эффективности осуществляемой путем HR репарации ДНК из-за присутствия фланкирующих мутаций в донорной конструкции pDAS00135.
Таблица 5
Средняя частота осуществляемого путем HR редактирования в частях на миллион (м.д.) для трех биологических реплик щитков, трансфицированных плазмидными донорными конструкциями ДНК. "na" обозначает "не применимо".
Средняя осуществляемая путем HR частота редактирования в частях на миллион (м.д.) для трех биологических реплик протопластов SEC, трансфицированных конструкциями плазмидной донорной ДНК. "na" обозначает "не применимо".
Анализ данных для обнаружения опосредуемого ZFN осуществляемого путем NHEJ редактирования генов AHAS
[0258] После получения данных короткого считывания последовательностей Illumina для библиотек образцов, полученных для трансфицированных протопластов SEC и щитков незрелых зиготических зародышей пшеницы проводили анализы для идентификации молекулярных доказательств опосредуемого ZFN осуществляемого путем NHEJ редактирования в участках-мишенях ZFN.
[0259] Для идентификации считанных последовательностей с молекулярными признаками осуществляемого путем NHEJ редактирования гена считанные короткие последовательности сначала подвергали компьютерной обработке, как описано выше, для отнесения каждой считанной последовательности к образцу и субгеному, из которой она происходит, и для проведения фильтрации по качеству, чтобы обеспечить использование только последовательностей высокого качества для последующих анализов. Далее специально разработанные скрипты PERL и ручное манипулирование данными в MICROSOFT EXCEL 2010™ (Microsoft Corporation) использовали для идентификации считанных последовательностей, которые содержали последовательность как донорной молекулы ДНК, использованной для трансфекции, так и эндогенного локуса AHAS. Частоту редактирования (выражаемую в частях на миллион считанных последовательностей) вычисляли в качестве доли отнесенной к субгеному последовательности, которая продемонстрировала признаки опосредуемого ZFN осуществляемого путем NHEJ редактирования генов.
[0260] Из результатов для трех биологических реплик, выполненных для каждой конструкции пладмидной донорной, получали молекулярные доказательства увеличения количества считанных последовательностей, демонстрирующих опосредуемое ZFN осуществляемое путем NHEJ редактирование в трех гомеологичных копиях эндогенных генов AHAS в пшенице (таблица 7 и таблица 8). Убедительные молекулярные доказательства были получены для встраивания линейной двухцепочечной донорной молекулы из 41 п.н. в положении двухцепочечного разрыва ДНК, внесенного посредством расщепления гомеологичных копий гена AHAS посредством ZFN 29732 и 29730 в образцах как протопластов SEC, так и щитков зрелых зиготических зародышей, которые были трансфицированы pDAB109350 и pDAS000152. Сходную эффективность редактирования наблюдали для трех субгеномов пшеницы в этих образцах. В противоположность этому, образцы протопластов SEC и щитков незрелых зиготических зародышей, трансфицированных pDAB109350 и pDAS000153, продемонстрировали ограниченные доказательства опосредуемого ZFN осуществляемого путем NHEJ редактирования, возможно вследствие необходимости предварительного высвобождения в растениях донорной последовательности из 41 п.н. из каркаса плазмиды. Молекулярные доказательства замены эндогенной последовательности AHAS донорной молекулы из 41 п.н. наблюдали как в протопластах SEC, так и в щитках незрелых зиготических зародышей, которые были трансфицированы pDAB109350, pDAB109360 и pDAS000149. Однако частота редактирования была значительно более низкой, чем частота, которую наблюдали для трансфекций, проведенных с использованием pDAB109350 и pDAS000152, предположительно вследствие необходимости двойного расщепления ZFN эндогенной последовательности AHAS. Были получены ограниченные доказательства замены эндогенной последовательности AHAS донорной молекулой из 41 п.н., для которой было необходимо высвобождение в растениях из остова плазмиды в образцах протопластов SEC и щитков незрелых зиготических зародышей, которые были трансфицированы pDAB109350, pDAB109360 и pDAS000150.
Средняя частота редактирования NHEJ в частях на миллион (м.д.) среди трех биологических реплик щитков, трансфицированных линейными двухцепочечными донорными конструкциями ДНК. "na" обозначает "не применимо".
Таблица 8: Средняя частота редактирования NHEJ в частях на миллион (м.д.) среди трех биологических реплик протопластов SEC, трансфицированных линейными двухцепочечными донорными конструкциями ДНК. "na" обозначает "не применимо".
[0261] В совокупности, эти результаты обеспечивают убедительное молекулярное доказательство точного опосредуемого ZFN осуществляемого путем NHEJ редактирования в эндогенном локусе AHAS в пшенице. Эти результаты демонстрируют, что на все три субгенома может быть нацелена одна ZFN и донор. Эти результаты отчетливо демонстрируют более высокую частоту редактирования для линейных донорных конструкций ДНК по сравнению с конструкциями плазмидной донорной ДНК. Предположительно, эти результаты являются результатом необходимой предварительной линеаризации в растениях плазмидных донорных молекул до того, как они смогут участвовать в опосредуемой NHEJ репарации ДНК. Результаты также указывают на то, что специфическое для субгенома осуществляемое путем NHEJ редактирование облегчается двухцепочечным разрывом. ZFN, которые были сконструированы для индукции двухцепочечных разрывов ДНК, приводили к специфическому для субгенома осуществляемому путем NHEJ редактированию гена при доставке донорной ДНК в клетки растений Triticum aestivum.
Пример 5: Разработка системы трансформации для получения растений с отредактированным AHAS
[0262] Эндогенный локус гена AHAS в пшенице был выбран в качестве модельного локуса для разработки системы трансформации для получения растений с прицельными геномными модификациями, индуцированными опосредуемым ZFN редактированием генов. Эндогенный ген AHAS был выбран в качестве модельного локуса вследствие его способности обеспечивать поддающийся селекции фенотип (т.е. толерантность к гербицидам группы B или гербицидам-ингибиторам ALS, таким как имидазолинон или сульфонилмочевина), наличие предварительной информации о специфической для субгенома кодирующей последовательности гена и знание о конкретных мутациях, сообщающих толерантность к гербицидам группы B или гербицидам-ингибиторам ALS после охарактеризации пшеницы посредством химически индуцированных мутаций в генах AHAS. Мутация S653N, сообщающая толерантность к гербицидам класса имидазолинонов, была выбрана в качестве мишени для опосредуемого ZFN редактирования генов вследствие доступности коммерческих сортов пшеницы, содержащих мутацию S653N, которые можно было использовать в качестве положительных контролей для разработки системы химической селекции для увеличения количества прицельно отредактированных объектов.
Молекулярная охарактеризация Triticum aestivum cv. Clearfield Janz
[0263] Triticum aestivum cv. Clearfield Janz, коммерческий сорт пшеницы обыкновенной, содержащий мутацию S653N в геноме D, выбирали для применения в качестве положительного контроля для разработки стратегии химической селекции для увеличения в количестве растений пшеницы с отредактированным AHAS, полученных посредством опосредуемого ZFN редактирования гена. Для получения генетически чистых исходных семян 48 проростков подвергали скринингу с 96 микросателлитными (SSR) маркерами с использованием технологии ПЦР Multiplex-Ready (Hayden et al., (2008) BMC Genomics 9;80). Семена с идентичными гаплотипами SSR использовали для получения семян, которые использовали в последующих экспериментах.
[0264] Чтобы убедиться, что растения пшеницы, использованные для продуцирования семян, содержали мутацию S653N, были разработаны анализы ПЦР для амплификации области гена AHAS, имеющей мутацию, из D-генома пшеницы. Специфическую для субгенома амплификацию осуществляли с использованием ПЦР с включением-выключением (Yang et al., (2005) Biochemical and Biophysical Research Communications 328:265-72) с праймерами AHAS-PS-6DF2 и AHAS-PS-6DR2 (SEQ ID NO: 82 и SEQ ID NO: 83), сконструированными так, чтобы предпоследнее основание (которое содержало фосфоротиоатную связь) размещалось над вариацией нуклеотидной последовательности, которая различала гомеологичные копии генов AHAS. Праймеры для ПЦР конструировали, чтобы они имели длину от 18 до 27 нуклеотидов и чтобы они имели температуру плавления от 60 до 65°C, оптимально 63°C. Амплифицированные продукты ПЦР очищали с использованием QIAQUICK MINIELUTE PCR PURIFICATION KIT™ (Qiagen) и секвенирвоали с использованием способа прямого секвенирования Сэнгера. Продукты секвенирования очищали этанолом, ацетатом натрия и EDTA в соответствии с протоколом BIGDYE® v3.1 (Applied Biosystems) и электрофорез проводили на автоматизирвоанной платформе для капиллярного электрофореза ABI3730XL®.
[0265] Анализ амплифицированных последовательностей генов AHAS с использованием SEQUENCHER v3.7™ (GeneCodes, Ann Arbor, MI) выявил сегрегацию по мутации S653N и позволил идентификацию растений, которые били гомозиготными (N653/N653) и гетерозиготными (N653/S653) по мутации S653N или гомозиготными (S653/S653) по аллелю чувствительности к гербицидам. Сбор семян от индивидуальных растений обеспечил источник семян, имеющий различные уровни зиготности по мутации S653N в генетическом фоне cv. Clearfield Janz.
Оптимизация условий химической селекции на основе Imazamox ™
[0266] Проводили серию экспериментов для определения оптимальных условий селекции для регенерации растений пшеницы с редактированием AHAS. Эти эксперименты были основаны на исследовании базальной толерантности к Imazamox™ донорной линии пшеницы cv. Bobwhite MPB26RH (генотип S653/S653) на стадиях индукции каллюса, регенерации растения и укоренения для общепринятой системы трансформации пшеницы. Сходные эксперименты проводили для определения базальной толерантности генотипов cv. Clearfield Janz, содержащих различные дозы мутации S653N; т.е. растений с генотипами N653/N653 и S653/S653.
[0267] Базальную толерантность донорной линии пшеницы cv. Bobwhite MPB26RH и базальную устойчивость генотипа (N653/N653) cv. Clearfield Janz к Imazamox® на стадии индукции каллюса определяли следующим образом: щитки незрелых зиготических зародышей из каждой линии пшеницы выделяли, как описано ранее, и помещали в 10-см чашки PETRI™, содержавшие среду CIM, дополненную 0, 50, 100, 200, 300, 400 и 500 нМ ImaZamox®, соответственно. В каждую чашку PETRI™ помещали двадцать щитков. Всего 60 щитков из каждой донорной линии пшеницы cv. Bobwhite MPB26RH и генотипа cv. Clearfield Janz исследовали в отношении ответа базальной толерантности и ответа базального устойчивости, соответственно, при каждой концентрации Imazamox®. После инкубации при 24°C в темноте в течение 4 недель регистрировали величину образования соматического эмбриоганного каллюса (SEC) при каждой концентрации Imazamox®. Результаты продемонстрировали, что образование SEC для cv. Bobwhite MPB26RH было снижено приблизительно на 70% при 100 нМ Imazamox®, по сравнению с необработанными образцами. Образование каллюса для генотипа cv. Clearfield Janz не изменялось относительно контроля без обработки при любых исследованных концентрациях Imazamox®.
[0268] Базальную толерантность донорной линии пшеницы cv. Bobwhite MPB26RH к Imazamox® на стадии регенерации растения определяли следующим образом: щитки незрелых зиготических зародышей из донорной линии пшеницы выделяли, как описано ранее, и помещали в 10-см чашки PETRI™, содержавшие среду CIM. Соматическому эмбриогенному каллюсу позволяли образоваться путем инкубации при 24°C в темноте в течение 4 недель. SEC переносили в 10-см чашки PETRI™, содержавшие среду DRM, дополненную 0, 100, 200, 300, 400, 500 и 1000 нМ Imazamox®, соответственно. В каждую чашку PETRI™ помещали двадцать CIM. Всего 60 CIM исследовали в отношении базального ответа толерантности при каждой концентрации Imazamox®. После инкубации в течение 2 недель при 24°C при световом периоде 16/8 (свет/темнота) в среде для роста регистрировали ответ в форме регенерации. Результаты продемонстрировали, что регенерация была снижена приблизительно на 80% при 200 нМ Imazamox®, по сравнению с необработанными образцами.
[0269] Базальную толерантность генотипа cv. Clearfield Janz (S653/S653) и базальную устойчивость генотипа cv. Clearfield Janz (N653/N653) к Imazamox® на стадии регенерации растения определяли с использованием модифицированного подхода, поскольку наблюдали, что cv. Clearfield Janz имеет низкий регенеративный ответ (т.е. низкий эмбриогенез) в культуре тканей. Семена каждого генотипа cv. Clearfield Janz проращивали с использованием асептического подхода, описанного выше, для получения мезофильных протопластов пшеницы. Проросшие ростки увеличивали в количестве in vitro путем субкультивирования на среде для увеличения в количестве. После увеличения в количестве растения для каждого генотипа переносили в 10-см чашки PETRI™, содержавшие среду для роста растений (MS +10 мкМ BA +0,8% агар), дополненную 0, 100, 300, 600, 900, 1200, 1500 и 3000 нМ Imazamox®, соответственно. В каждую чашку помещали десять растений PETRI™. Всего 30 растений на генотип исследовали в отношении базального ответа при каждой концентрации Imazamox®. После инкубации в течение 3 недель при 24°C при световом периоде 16/8 (свет/темнота) в теплице регистрировали ответ роста. Результаты показали, что рост растений для генотипа cv. Clearfield Janz (S653/S653) был значительно снижен в среде, содержавшей по меньшей мере 200 нМ Imazamox®, по сравнению с необработанными образцами. Этот ответ был сходным с ответом, наблюдаемым для генотипа cv. Bobwhite MPB26RH (S653/S653). Напротив, рост растений для генотипа cv. Clearfield Janz (N653/N653) не подавлялся значительно относительно необработанных образцов, до тех пор, пока концентрация Imazamox® не превысила 2000 нМ.
[0270] Базальную толерантность донорной линии пшеницы cv. Bobwhite MPB26RH к Imazamox® на стадии укоренения растений определяли следующим образом: щитки незрелых зиготических зародышей из донорной линии пшеницы выделяли, как описано выше, и помещали в 10-см чашки PETRI™, содержавшие среду CIM. Соматическому эмбриогенному каллюсу позволяли образовываться посредством инкубации при 24°C в темноте в течение 4 недель. SEC переносили в 10-чашки PETRI™, содержавшие среду DRM, и инкубировали в течение 2 недель при 24°C при световом периоде 16/8 (свет/темнота) для обеспечения регенерации растения. После регенерации растения переносили в 10-см чашки PETRI™, содержавшие среду RM, дополненную 0, 100, 200, 300, 400, 500 нМ Imazamox®, соответственно. В каждую чашку PETRI™ помещали двадцать регенерировавших растений. Всего 60 регенерировавших растений исследовали в отношении базального ответа толерантности при каждой концентрации Imazamox®. После инкубации в течение 3 недель при 24°C при световом периоде 16/8 (свет/темнота) в теплице, регистрировали ответ укоренения. Результаты показали, что укоренение было значительно ограничено при всех исследованных концентрациях Imazamox® по сравнению с необработанными образцами.
[0271] Базальную толерантность генотипа cv. Clearfield Janz (S653/S653) и базальную устойчивость генотипа cv. Clearfield Janz (N653/N653) к Imazamox® на стадии укоренения растений определяли с использованием модифицированного подхода, поскольку было выявлено, что cv. Clearfield Janz имеет низкий ответ регенерации (т.е. низкий эмбриогенез) в тканевой культуре. Семена для каждого генотипа cv. Clearfield Janz проращивали с использованием асептического подхода, описанного выше, для получения мезофильных протопластов пшеницы. Проросшие ростки увеличивали в количестве посредством субкультивирования in vitro на среде для увеличения в количестве. После увеличения в количестве растения каждого генотипа переносили в 10-см чашки PETRI™, содержавшие среду для укоренения растений (1/2 MS, 0,5 мг/л NAA, 0,8% агар), дополненную 0, 50, 100, 200 и 250 нМ Imazamox®, соответственно. В каждую чашку PETRI™ помещали три растения. Всего 6 растений на генотип исследовали в отношении базального ответа при каждой концентрации Imazamox®. После инкубации в течение 2 недель при 24°C при световом периоде 16/8 (свет/темнота) в теплице регистрировали ответ укоренения.
[0272] Результаты показали, что укоренение для генотипа cv. Clearfield Janz (N653/N653) было ограниченным по сравнению с необработанными образцами при 250 нМ Imazamox®. Укоренение было значительно ограниченным в генотипе cv. Clearfield Janz (S653/S653) при всех исследованных концентрациях Imazamox® по сравнению с необработанными образцами.
Конструирование и синтез донорной ДНК для опосредуемого ZFN осуществляемого путем NHEJ редактирования гена AHAS
[0273] Было сконструировано два типа донорной молекулы ДНК для обеспечения прицельного опосредуемого ZFN осуществляемого путем NHEJ редактирования эндогенных генов AHAS в пшенице. Обе донорных конструкции позволили внесение мутации S653N, о которой известно, что она сообщает толерантность к гербицидам класса имидазолинона (Li et al., (2008) Molecular Breeding 22:217-225).
[0274] Первая конструкция была основана на встраивании двухцепочечной донорной молекулы из 95 п.н. в положении двухцепочечного разрыва ДНК, внесенного расщеплением гомеологичной копии эндогенного гена AHAS посредством ZFN 29732 и 29730 (кодируемые на плазмиде pDAB109350). Донорая молекула ДНК pDAS000267 (SEQ ID NO: 84 и SEQ ID NO: 85) содержала два участка встраивания донорного полинуклеотида. 5’-конец содержал последовательность вблизи эндогенного гена AHAS, кодируемого в геноме D, начиная с участка-мишени для расщепления ZFN и оканчивая стоп-кодоном AHAS. В эту последовательность вносили шесть преднамеренных мутаций: две мутации кодировали мутацию S653N (AGC→AAT) и четыре мутации были синонимичными (в случае которых в донорную последовательность вносили молчащую мутацию). 3'-конец донорной молекулы содержал уникальную последовательность, которую можно было использовать для диагностической ПЦР для обнаружения событий опосредуемого ZFN осуществляемого путем NHEJ редактирования генов. Донорная молекула была сконструирована с выступающими 5'- и 3'-концами для обеспечения лигирования для облегчения опосредуемой ZFN осуществляемой путем NHEJ репарации ДНК.
[0275] Вторая конструкция была основана на замене эндогенной последовательности AHAS, расположенной между парой участков-мишеней ZFN, двухцепочечной донорной молекулой из 79 п.н. В частности, донор конструировали для замены эндогенной последовательности AHAS, высвобождаемой из хроматина при двойном расщеплении гомеологичной копии гена AHAS посредством ZFN 29732 и 29730 (кодируемые на плазмиде pDAB109350) и ZFN 30012 и 30018 (кодируемые на плазмиде pDAB109360). Донорная молекула pDAS000268 (SEQ ID NO: 86 и SEQ ID NO: 87) содержала последовательность, практически идентичную эндогенному гену AHAS, кодируемому в геноме D, начиная с участка расщепления ZFN 29732 и 29730, и оканчиваясь в участке расщепления ZFN 30012 и 30018. В эту последовательность вносили десять преднамеренных мутаций. Шесть мутаций были расположены на 5'-конце донора: две мутации кодировали мутацию S653N (AGC→AAT) и четыре мутации были синонимичными. Четыре мутации были расположены на 3'-конце донора и были расположены в некодирующей последовательности. Донорную молекулу конструировали с выступающими 5'- и 3'-концами для обеспечения лигирования для облегчения опосредуемой ZFN осуществляемой путем NHEJ репарации ДНК.
[0276] Для синтеза двухцепочечных донорных молекул ДНК использовали стандартную химию фосфорамидитов (Integrated DNA Technologies). Для каждой донорной молекулы синтезировали пару комплементарных одноцепочечных олигомеров ДНК, каждый из которых имел две фосфоротиоатные связи на 5’-конце для обеспечения защиты от деградации эндонуклеазами в растениях. Одноцепочечные олигомеры ДНК очищали высокоэффективной жидкостной хроматографией для увеличения содержания полноразмерных молекул и очищали от химических остатков стадий синтеза с использованием Na+-обмена. Двухцепочечную донорную молекулу формировали путем отжига эквимолярных количеств двух комплементарных одноцепочечных олигомеров ДНК с использованием стандартных способов, широко известных специалисту в данной области. Перед доставкой в Triticum aestivum, двухцепочечные молекулы ДНК разбавляли до требуемой концентрации в стерильной воде.
Конструирование и получение бинарного вектора, кодирующего AHAS (S653N)
[0277] Для конструирования бинарного вектора pDAS000143 (SEQ ID: 88) использовали стандартные способы клонирования (фиг.10). Экспрессирующая кассета с геном AHAS (S653N) состоит из промотора, 5'-нетранслируемой области и интрона из гена убиквитина (Ubi) из Zea mays (Toki et al., (1992) Plant Physiology 100; 1503-07), за которой следует кодирующая последовательность (1935 п.н.) гена AHAS из T. aestivum с мутацией пар оснований 1880 и 1181 с CG на AT для внесения аминокислотной замены с серина (S) на аспарагин (N) в аминокислотном остатке 653. Экспрессирующая кассета AHAS включала 3' нетранслируемую область (UTR) гена нопалинсинтазы (nos) из A. tumefaciens pTi15955 (Fraley et al.,(1983) Proceedings of the National Academy of Sciences U.S.A. 80(15); 4803-4807). Кассета для селекции содержала промотор, 5'-нетранслируемую область и интрон из гена актина 1 (Act1) Oryza sativa (McElroy et al., (1990) The Plant Cell 2(2); 163-171), за которым следовала синтетическая оптимизированная для растений версия гена фосфинотрицинацетилтрансферазы (PAT), выделенная из Streptomyces viridochromogenes, который кодирует белок, который сообщает устойчивость к ингибиторам глутаминсинтазы, включающим фосфинотрицин, глюфоссинат и биалафос (Wohlleben et al., (1988) Gene 70(1); 25-37). Эта кассета завершалась 3'-UTR из гена 35S вируса мозаики цветной капусты (CaMV) (Chenault et al., (1993) Plant Physiology 101 (4); 1395-1396).
[0278] Кассету для селекции синтезировали у коммерческого поставщика, осуществляющего синтез генов (GeneArt, Life Technologies), и ее клонировали в бинарный вектор Gateway с кассетой RfA Gateway, расположенной между геном убиквитина (Ubi) из Zea mays и 3' нетранслируемой областью (UTR), содержащей терминатор транскрипции и участок полиаденилирования гена нопалинсинтазы (nos) из A. tumefaciens pTi15955. Кодирующую последовательность AHAS(S653N) амплифицировали с фланкирующими участками attB и субклонировали в pDONR221. Полученный клон ENTRY использовали в реакционной смеси LR Clonase II™ (Invitrogen, Life Technologies) с бинарным вектором Gateway, кодирующим экспрессирущую кассету фосфинотрицинацетилтрансферазы (PAT). Клетки E. coli, трансформированные посредством всех реакций лигирования, первоначально подвергали скринингу посредством рестрикционного расщепления ДНК, полученной минипрепаративным способом. Эндонуклеазы получали от New England BioLabs и Promega. Получение плазмид проводили с использованием набора QIAPREP SPIN MINIPREP KIT™ или системы PURE YIELD PLASMID MAXIPREP SYSTEM™ (Promega Corporation, WI) в соответствии с инструкциями изготовителя. Плазмидную ДНК выбранных клонов секвенировали с использованием секвенирования по методу Сэнгера ABI и протокола циклического секвенирвоания BIGDYE TERMINATOR v3.1™ (Applied Biosystems, Life Technologies). Данные о последовательностях собирали и анализировали с использованием программного обеспечения SEQUENCHER™ (Gene Codes Corporation, Ann Arbor, MI).
Биолистичская система трансформации для получения растений пшеницы с редакцией AHAS
[0279] Приблизительно 23000 щитков незрелых зиготических зародышей из донорной линии пшеницы cv. Bobwhite MPB26RH получали для биолистической доставки ДНК, как описано выше. Покрытые ДНК золотые частицы получали, как описано выше, со следующими составами. Для трансфекций, проводимых с использованием pDAS000267, донорную ДНК смешивали в молярном соотношении 5:1 с плазмидной ДНК для pDAB109350 (кодирующая ZFN 29732 и 29730). Для трансфекций, проведенных с использованием pDAS000268, донорную ДНК смешивали в молярном соотношении 10:1:1 с плазмидной ДНК для pDAB109350 (кодирующая ZFN 29732 и 29730) и pDAB109360 (кодирующая ZFN 30012 и 30018). Трансфекции, проводимые с использованием pDAS000143, проводили с использованием золотых частиц, которые были покрыты только плазмидной ДНК для pDAS000143.
[0280] Биолистические трансфекции проводили, как описано выше. Всего 15620 щитков подвергали бомбардировке золотыми частицами, покрытыми ДНК, содержащей pDAS000267, всего 7310 щитков подвергали бомбардировке золотыми частицами, покрытыми ДНК, содержащей pDAS000268, и всего 2120 щитков подвергали бомбардировке золотыми частицами, покрытыми pDAS000143. После бомбардировки трансфицированные щитки инкубировали при 26°C в темноте в течение 16 ч, а затем переносили на среду для индукции каллюса.
[0281] Четыре различных стратегии химической селекции на основе Imazamox® использовали для увеличения содержания регенерировавших растений пшеницы, которые имели мутацию S653N, прицельно встроенную в одну или несколько гомеологичных копий эндогенного гена AHAS посредством опосредуемого ZFN осуществляемого путем NHEJ редактирования гена. Эти четыре стратегии химической селекции описаны в таблице 9. Для каждой стратегии щитки культивировали в темноте на среде для индукции каллюса при 24°C в течение 2 недель. Полученные каллюсы субкультивировали один раз на свежей среде для индукции каллюса и поддерживали в тех же условиях в течение дополнительных двух недель. Соматический эмбриогенный каллюс (SEC) переносили в среду для регенерации растений и культивировали в течение 2 недель при 24°C при световом периоде 16/8 (свет/темнота) в теплице. Регенерировавшие ростки переносили на среду для укоренения и культивировали в тех же условиях в течение 2-3 недель. Для увеличения строгости селекции регенерировавших растений, имеющих мутацию S653N, корни регенерировавших растений удаляли и растения вновь субкультивировали на среде для укоренения в тех же условиях. Ростки, укоренившиеся второй раз, переносили в почву и выращивали в тепличных условиях. Семена T1 собирали с индивидуальных растений после помещения в мешок индивидуальных колосьев для предотвращения случайного скрещивания.
[0282] Эксплантаты щитков, бомбардированные золотыми частицами, покрытыми pDAS000143, использовали для мониторинга строгости селекции для четырех стратегий химической селекции для регенерации растений пшеницы, содержавших мутацию S653N AHAS. Растения, трансформированные pDAS000143, подвергали регенерации с использованием процесса, описанного выше.
Стратегии химической селекции, использованные для регененрации растений пшеницы, которые имели мутацию S653N, прицельно внесенную в одну или несколько гомеологичных копий эндогенного гена AHAS посредством опосредуемого ZFN осуществляемого путем NHEJ редактирования генов. (IMI = Imazamox™)
[0283] В целом, 14 растений пшеницы с предполагаемым опосредуемым ZFN осуществляемым путем NHEJ редактированием AHAS было выделено после трансфекции 22930 щитков незрелых зиготических зародышей из донорной линии пшеницы cv. Bobwhite MPB26RH. Растения с предполагаемым редактированием были получены в случае всех четырех стратегий селекции для бомбардировки щитков золотыми частицами, покрытыми ДНК, содержащей pDAS000267. Два предположительно отредактированных растения было получено посредством второй стратегии селекции для щитков, бомбардированных золотыми частицами, покрытыми ДНК, содержащей pDAS000268. Всего 129 предполагаемых трансформированных растений пшеницы, содержащих по меньшей мере одну случайно встроенную копию донорного полинуклеотида AHAS (S653N), было выделено посредством четырех стратегий химической селекции.
Пример 6: Молекулярная охарактеризация отредактированных растений пшеницы
[0284] Растения пшеницы, полученные путем бомбардировки донорным полинуклеотидом, кодирующим мутацию S653N, получали и подвергали молекулярной охарактеризации для идентификации субгеномов, которые содержали встроенную мутацию S653N, которая возникла в результате встраивания донора в участке расщепления двойной цепи генома. Осуществляли две серии бомбардировок. Первый набор экспериментов проводили с pDAS000143 и второй набор экспериментов проводили с pDAS000267 и pDAS000268. Индивидуальные растения пшеницы получали для обоих наборов экспериментов и анализировали молекулярным способом для идентификации растений, которые содержали встроенную копию донорного полинуклеотида AHAS, кодирующего мутацию S653N.
[0285] Анализ с гидролизом зонда (аналогичный анализу на основе TAQMAN®) для количественного анализа способом ПЦР использовали для подтверждения того, что полученные растения пшеницы, которые были подвергнуты бомбардировке pDAS000143, содержали по меньшей мере одну случайно встроенную копию донорного полинуклеотида AHAS, кодирующего мутацию S653N. Подтверждение посредством анализа по методу Сэнгера показало, что растения пшеницы, полученные путем бомбардировки, проведенной с использованием pDAS000267 и pDAS000268, содержали донорный полинуклеотид S653N по меньшей мере в одной из гомеологичных копий гена AHAS в положении, ожидаемой для опосредуемого ZFN осуществляемого путем NHEJ редактирования генов.
Выделение геномной ДНК из регенерировавших растений пшеницы
[0286] Геномную ДНК экстрагировали из лиофилизированной ткани листьев, собранной из каждого регенерировавшего растения пшеницы. Свежесобранную ткань листьев быстро замораживали в жидком азоте и лиофилизировали в течение 24 ч в LABCONCO FREEZONE 4.5® (Labconco, Kansas City, MO) при -40°C и давлении 133×10-3 мБар. Лиофилизированный материал подвергали экстракции ДНК с использованием набора DNEASY® PLANT DNA EXTRACTION MINI KIT™ (Qiagen) в соответствии с инструкциями изготовителя.
Анализ способом ПЦР для подтверждения случайного встраивания донорного полинуклеотида AHAS, кодирующего мутацию S653N
[0287] Для подтверждения того, что регенерировавшие растения пшеницы после бомбардировки, проведенной с использованием pDAS000143, содержали по меньшей мере одну случайным образом встроенную копию донорного полинуклеотида AHAS, кодирующего мутацию S653N, использовали дуплексный анализ q-ПЦР с гидролизом зонда (аналогичный TAQMAN®) для амплификации эндогенной единичной копии гена пуроиндолина b (Pinb), из генома D гепсаплоидной пшеницы (Gautier et al., (2000) Plant Science 153, 81-91; SEQ ID NO: 89, SEQ ID NO: 90 и SEQ ID NO: 91 для последовательности прямого и обратного праймеров, и зонда, соответственно) и области промотора актина (Act1), присутствующей в pDAS000143 (SEQ ID NO: 92, SEQ ID NO: 93 и SEQ ID NO: 94 для последовательности прямого и обратного праймеров, и зонда, соответственно). Анализы q-ПЦР с гидролизом зонда проводили для 24 случайным образом выбранных растений пшеницы, которые были получены в результате каждой из четырех стратегий химической селекции. Оценку присутствия и оцененного числа копий pDAS00143 проводили способом, описанным Livak and Schmittgen (2001), Methods 25(4):402-8.
[0288] Из результатов было получено убедительное доказательство встраивания по меньшей мере одной копии донорного полинуклеотида AHAS, кодирующего мутацию S653N, в геном каждого из исследованных растений пшеницы. Эти результаты указывают на то, что четыре стратегии химической селекции обеспечили строгую селекцию для восстановления растений, экспрессирующих мутацию S653N.
Анализ способом ПЦР геномной ДНК в отношении опосредуемого ZFN редактирования AHAS
[0289] Для охарактеризации субгеномного положения и исхода опосредуемого ZFN осуществляемого путем NHEJ редактирования генов в выделенных растениях пшеницы, использовали ПЦР с праймерами AHAS_3F1 и AHAS_3R1 (SEQ ID NO: 95 и SEQ ID NO: 96) для амплификации области-мишени из гомеологичных копий генов AHAS. Полученные продукты ПЦР клонировали в плазмидный вектор и секвенировали по методу Сэнгера с использованием химических реагентов BIGDYE® v3.1 (Applied Biosystems) на автоматизированной платформе для капиллярного электрофореза ABI3730xl®. Секвенирование по методу Сэнгера вплоть до 120 независимых клонов плазмиды проводили, чтобы убедиться, что каждый аллель в эндогенных гомеологах AHAS был отсеквинирован. Анализ последовательности, проведенный с использованием SEQUENCHER SOFTWARE™, использовали для получения консенсусной последовательности для каждого аллеля из трех гомеологичных копий гена AHAS в каждом из восстановленных растений пшеницы и для определения субгеномного происхождения и последовательности каждого отредактированного аллеля.
[0290] Из результатов были получены убедительные доказательства прицельного опосредуемого ZFN осуществляемого путем NHEJ редактирования генов в эндогенных локусах AHAS для 11 из 12 восстановленных растений пшеницы, которые были трансформированы с использованием pDAB109350 и pDAS000267 (таблица 10), и обоих восстановленных растений пшеницы, которые были трансформированы с использованием pDAB109350, pDAB109360 и pDAS000268 (таблицы 11). Наблюдали растения с диапазоном исходов редактирования, включая: (1) независимые события с точным специфическим для субгенома редактированием аллелей; (2) события с одним точным редактированием в A-геноме, B-геноме и D-геноме; (3) события с одновременным редактированием в нескольких субгеномах; и, (4) события, демонстрирущие гемизиготное и гомозиготное специфическое для субгенома редактирование аллелей. Впервые описан способ, который можно использовать для внесения мутации в локус гена во всех трех геномах растения пшеницы. Растения пшеницы, содержащие встроенный донорный полинуклеотид AHAS, кодирующий мутацию S653N, проиллюстрированы; встраивание полинуклеотидной последовательности обеспечивает толерантность к гербицидам класса имидазолинонов. Использование опосредуемого ZFN редактирования генома в эндогенном локусе гена пшеницы обеспечивает внесение агрономических признаков (посредством мутации) без времязатратных способов разведения пшеницы, которые требуют стадий обратного скрещивания и интрогрессии, которые могут увеличить количество времени, требуемое для интрогрессии признака в три субгенома. Консенсусные последовательности, определенные по методу Сэнгера, для аллелей, присутствующих в каждом субгеноме отредактированных растений пшеницы, предоставлены в качестве SEQ ID NO: 97-180 в таблицах 10 и 11.
Исходы опосредуемого ZFN осуществляемого путем NHEJ редактирования AHAS для растений пшеницы, трансформированных с использованием pDAB109350 и pDAS000267
PE = точное редактирование; т.е. опосредуемое ZFN осуществляемое путем NHEJ редактирование генома вызывало спрогнозированный исход.
IE = неточное редактирование; т.е., опосредуемое ZFN осуществляемое путем NHEJ редактирование генома приводило к непрогнозируемому исходу.
UE = нередактированный аллель; т.е. аллель имел последовательность дикого типа.
nd = не обнаружено; т.е., достаточное количество независимых клонов плазмид было отсеквенировано чтобы заключить, что альтернативный аллель не присутствовал и что локус был гомозиготным для одного аллеля.
NHEJ = Негомологичное соединение концов; т.е. доказательства исхода в виде репарации ДНК путем негомологичного соединения концов, которая не привела к встраиванию донорной молекулы в участок расщепления ZFN.
Исходы опосредуемого ZFN осуществляемого путем NHEJ редактирования AHAS для растений пшеницы, трансформированных с использованием pDAB109350, pDAB109360 и pDAS000268.
PE = точное редактирование; т.е. опосредуемое ZFN осуществляемое путем NHEJ редактирование генома вызывало спрогнозированный исход.
IE = неточное редактирование; т.е., опосредуемое ZFN осуществляемое путем NHEJ редактирование генома приводило к непрогнозируемому исходу.
UE = нередактированный аллель; т.е. аллель имел последовательность дикого типа.
nd = не обнаружено; т.е., достаточное количество независимых клонов плазмид было отсеквенировано чтобы заключить, что альтернативный аллель не присутствовал и что локус был гомозиготным для одного аллеля.
Пример 7: Конструирование связывающих доменов с цинковыми пальцами, специфических к области в генах AHAS, кодирующей аминокислотный остаток P197
[0291] Белки с цинковыми пальцами, направленные против последовательности ДНК гомеологичных копий генов AHAS, конструировали, как описано выше (также см. пример 2). Иллюстративная последовательность-мишень и распознающие спирали представлены в таблице 12 (конструкции областей распознающих спиралей) и в таблице 13 (участки-мишени). В таблице 13 нуклеотиды в участке-мишени, которые контактируют с распознающими спиралями ZFP, указаны прописными буквами; нуклеотиды, которые не контактируют, указаны строчными буквами. Участки-мишени нуклеаз с цинковыми пальцами (ZFN) располагались выше (на от 2 до 510 нуклеотидов выше) области гена AHAS, кодирующей аминокислотный остаток пролина 197 (P197).
Конструкции цинковых пальцев для AHAS
(N/A обозначает "не применимо")
RSADLTR
RSDDLTR
RSDDLTR
RSDALTQ
ERGTLAR
RSDDLTR
QSGDLTR
DTGARLK
RSDDLTR
HRRSRDQ
DRSYRNT
RSADLSR
RSDHLSA
QSSDLRR
DRSNLSR
RSDDRKT
QSGDLTR
RRADRAK
RSDDLTR
TSSDRKK
RSADLTR
RNDDRKK
RSADLTR
DRSNLTR
ERGTLAR
RSDDLTR
DRSDLSR
DSSTRRR
RSDHLSE
HSRTRTK
RSDTLSE
NNRDRTK
ERGTLAR
DRSALAR
ERGTLAR
RSDDLTR
DRSDLSR
DSSTRRR
DRSNLTR
RSDHLSR
QQWDRKQ
DRSHLTR
DSSDRKK
DRSNLSR
VSSNLTS
DRSDLSR
DSSTRRR
DRSNLSR
QSGDLTR
DRSNLTR
ERGTLAR
RSDHLSR
RSDALSV
DSSHRTR
DSSDRKK
RSDNLTR
RSDNLAR
DRSALAR
DRSHLSR
TSGNLTR
RSDALSV
DSSHRTR
RSDNLSE
ARTGLRQ
ERGTLAR
DRSALAR
RSDNLAR
DRSALAR
DRSHLSR
TSGNLTR
RSDHLSR
TSSNRKT
DRSALAR
RSDALSV
DSSHRTR
RSDNLSE
ARTGLRQ
RSDDLSK
RSDNLTR
RSDSLSV
RSAHLSR
RSDALST
DRSTRTK
DSSDRKK
RSAHLSR
DRSDLSR
RSDHLSE
TSSDRTK
Участок-мишень AHAS для цинковых пальцев
[0292] Конструкции цинковых пальцев для AHAS встраивали в экспрессирующие векторы цинковых пальцев и подтверждали их активность расщепления с использованием системы почкующихся дрожжей, как описано в примере 2. Среди многочисленных ZFN, которые были сконструированы, продуцированы и исследованы в отношении связывания предполагаемых геномных полинуклеотидных участков-мишеней AHAS, 14 ZFN были идентифицированы как имеющие активность in vivo на высоких уровнях и выбраны для дальнейшего экспериментирования. Все 14 ZFN были сконструированы так, чтобы они связывались с тремя гомеологичными AHAS, и были охарактеризованы как способные эффективно связывать и расщеплять уникальные геномные полинуклеотидные участки-мишени AHAS в растениях.
Пример 8: Оценка расщепления нуклеазой с цинковыми пальцами генов AHAS с использованием временных анализов
Сборка конструкции ZFN
[0293] Плазмидные векторы, содержавшие экспрессирующие конструкции ZFN, для которых была подтверждена активность расщепления с использованием дрожжевой системы (как описано в примере 7), конструировали и получали, как описано в примере 3. 14 полученных плазмидных конструкций: pDAB111850 (ZFN 34456-2A-34457), pDAB111851 (ZFN 34458-2A-34459), pDAB111852 (ZFN 34460-2A-34461), pDAB111853 (ZFN 34462-2A-34463), pDAB111854 (ZFN 34464-2A-34465), pDAB111855 (ZFN 34470-2A-34471), pDAB111856 (ZFN 34472-2A-34473), pDAB111857 (ZFN 34474-2A-34475), pDAB111858 (ZFN 34476-2A-34477), pDAB111859 (ZFN 34478-2A-34479), pDAB111860 (ZFN 34480-2A-34481), pDAB111861 (ZFN 34482-2A-34483), pDAB111862 (ZFN 34484-2A-34485) и pDAB111863 (ZFN 34486-2A-34487) подтверждали посредством расщепления ферментом рестрикции и секвенированием ДНК.
Получение ДНК из конструкций ZFN для трансфекции
[0294] Перед доставкой в протопласты Triticum aestivum плазмидную ДНК для каждой конструкции ZFN получали из культур E. coli с использованием PURE YIELD PLASMID MAXIPREP SYSTEM® (Promega Corporation, Madison, WI) или PLASMID MAXI KIT® (Qiagen, Valencia, CA) в соответствии с инструкциями поставщиков.
Выделение и трансфекция мезофильных протопластов пшеницы
[0295] Мезофильные протопласты из донорной линии пшеницы cv. Bobwhite MPB26RH получали и трансфицировали с использованием опосредуемой полиэтиленгликолем (PEG) доставки ДНК, как описано выше в примере 3.
Анализ способом ПЦР геномной ДНК протопластов в отношении расщепления последовательности ZFN
[0296] Геномную ДНК выделяли из трансфицированных протопластов и использовали в анализах способом ПЦР для оценки эффективности расщепления и специфичности в отношении участков-мишеней для ZFN, сконструированных для области гена AHAS, кодирующей P197, как описано выше в примере 3. Для амплификации локусов участка-мишени ZFN использовали наборов праймеров для ПЦР, которые содержали фосфоротиоатную связь, как указано звездочкой [*] (таблица 14). Каждый набор праймеров конструировали в соответствии с критериями, описанными выше в примере 3.
Последовательности праймеров, использованные для оценки эффективности расщепления AHAS посредством ZFN и специфичности в отношении участка-мишени.
Анализ данных для обнаружения NHEJ в участках-мишенях ZFN
[0297] После получения данных короткого считывания последовательностей Illumina для библиотек образцов, полученных для трансфицированных мезофильных протопластов, проводили биоинформатический анализ (как описано выше в примере 3) для идентификации делетированных нуклеотидов в участках-мишенях ZFN. Известно, что такие делеции являются индикаторами активности ZFN в растениях, которая может быть результатом репарации ДНК по типу негомологичного соединения концов (NHEJ).
[0298] Для оценки эффективности и специфичности расщепления исследованных ZFN использовали два подхода. Эффективность расщепления выражали (в частях на миллион считанных последовательностей) в качестве доли отнесенных к субгеному последовательностей, которые содержали делецию NHEJ в участке-мишени ZFN (таблица 15). Ранжирование ZFN по их наблюдаемой эффективности расщепления использовали для идентификации ZFN с наилучшей активностью расщепления области-мишени генов AHAS специфическим для субгенома образом. Все из исследованных ZFN продемонстрировали распределение размеров делеций NHEJ, соответствующих распределением размером делеций, ожидаемых для активности ZFN в растениях. Специфичность расщепления выражали в качестве соотношения эффективностей расщепления, наблюдаемых для трех субгеномов.
Эффективность расщепления ZFN (выраженная в качестве количества событий NHEJ на миллион считанных последовательностей) и специфичность к участку-мишени.
[0299] Исходя из этих результатов были отобраны ZFN, кодируемые на плазмидах pDAB111855 (34470-2A-34471), pDAB111856 (34472-2A-34473) и pDAB111857 (34474-2A-34475) для нацеливания в растениях в последующих экспериментах, учитывая их характеристики значительной активности расщепления геномной ДНК в каждом из трех субгеномов пшеницы.
Пример 9: Искусственное скрещивание и молекулярный анализ для выделения растений со специфическими комбинациями прицельных геномных модификаций
[0300] Объекты пшеницы, которые получены путем трансформации конструкцией донорной ДНК и конструкциями нуклеаз с цинковыми пальцами, приводят к встраиванию последовательности донорной молекулы в одной или нескольких копиях эндогенного локуса-мишени. Как показано ранее в примере 6, опосредуемая ZFN модификация генома обеспечивает одновременное редактирование множества аллелей среди множества субгеномов. Затем искусственное скрещивание объектов трансформации можно использовать для выбора конкретных комбинаций прицельных геномных модификаций. Например, искусственное скрещивание объектов трансформации, полученных согласно примеру 5, которые включают прицельно модифицированные гены AHAS с мутацией S653N, можно использовать для получения растений пшеницы, которые имеют мутацию S653N либо в конкретном субгеноме, либо в любой комбинации множества субгеномов, либо во всех трех субгеномах.
[0301] Аналогично, затем можно использовать самоопыление трансгенных объектов, имеющих модификации генома в множестве копий эндогенного локуса-мишени для получения объектов пшеницы, которые имеют мутацию S653N только в конкретном субгеноме. Последующее самоопыление объектов трансформации является особенно пригодным для устранения нежелательных геномных модификаций из объекта, таких как неточное редактирование в одной или нескольких копиях эндогенного локуса-мишени.
[0302] Молекулярные и фенотипические анализы, такие как анализы, описанные ранее, можно использовать для отслеживания наследования конкретных геномных модификаций в потомстве, полученном путем искусственного скрещивания или самоопыления трансгенных объектов.
Наследование и экспрессия прицельных геномных модификаций в пшенице
[0303] Для подтверждения стабильной экспрессии и наследования фенотипа толерантности к гербицидам AHAS, сообщаемого мутацией S653N, которую содержат объекты трансформации пшеницы, полученные согласно примеру 5, семена T1 каждого из трансгенных объектов пшеницы подвергали молекулярному и фенотипическому анализу. Каждый из трех независимых трансгенных объектов пшеницы содержал встроенную мутацию S653N в гене AHAS, расположенном в геноме A.
[0304] Семена T1 были получены путем самоопыления каждого трансгенного объекта T0. Семена подвергали поверхностной стерилизации и проращивали in vitro путем субкультивирования стерилизованных семян на среде для увеличения в количестве. После выращивания в течение 10 суток при 24°C при световом периоде 16/8 (свет/темнота) корни проросших семян удаляли и проростки переносили на среду для укоренения, содержавшую 200 нМ IMAZAMOX® (имидазолинон). Семена инкубировали в течение 2-3 недель в тех же условиях и присутствие или отсутствие повторного роста корней регистрировали. Ткань листьев, собранную с каждого проростка, использовали для экстракции ДНК и проводили анализ способом ПЦР для исследования присутствия модифицированного гена AHAS с использованием праймеров AHAS_3F1 и AHAS_3R1 (SEQ ID NO: 95 и SEQ ID NO: 96), как описано выше. Электрофоретическое разделение полученных продуктов ПЦР на агарозном геле использовали для обнаружения присутствия модифицированного гена AHAS. Амплификация только фрагмента ПЦР из 750 п.н. указывала на отсутствие модифицированного гена AHAS. Для сравнения, амплификация только фрагмента из 850 п.н. указывала на присутствие модфицированного гена AHAS в гомозиготном состоянии. Более того, амплификация как фрагмента размером 750 п.н., так и размером 850 п.н., показала присутствие модифицированного гена AHAS в гемизиготном состоянии.
[0305] Далее использовали тест хи-квадрат для подтверждения наследования модифицированного гена AHAS в качестве единого генетического элемента. Ожидаемое менделевское наследование наблюдали в поколении T1 каждого из трех объектов трансформации пшеницы. Модифицированный ген AHAS сегрегировал в соотношении 3:1, которое ожидалось для продукции доминантного маркера в тесте ПЦР (таблица 16) в проростках T1. Аналогично, толерантность к IMAZAMOX® продемонстрировала сегрегацию 3:1, как и ожидалось для доминантного фенотипа AHAS толерантности к гербициду, сообщаемого мутацией S653N (таблица 17) в проростках T1.
Сегрегация модифицированного гена AHAS в проростках T1, полученных путем самоопыления трансформированных растений пшеницы из примера 5.
Сегрегация фенотипа толерантности к IMAZAMOX® в проростках T1, полученных путем самоопыления трансформированных растений пшеницы из примера 5.
[0306] Стабильность экспрессии модифицированного гена AHAS подтверждали по ее соответствию фенотипу AHAS толерантности к гербициду. Наблюдали полное соответствие между присутствием одной или нескольких копий модифицированного гена AHAS и толерантностью к IMAZAMOX®.
Самоопыление и искусственное скрещивание для выделения растений с конкретными комбинациями прицельных геномных модификаций
[0307] Искусственное скрещивание между объектами трансформации пшеницы, полученными согласно примеру 5, можно использовать для получения растений пшеницы, которые имеют мутацию S653N на конкретном субгеноме, на множестве субгеномов или на всех трех субгеномах.
[0308] Для получения гомозиготных растений пшеницы, имеющих мутацию S653N на конкретном субгеноме, трем объектам пшеницы из примера 5 позволяли самоопылиться и продуцировать семена T1. Три объекта: mb1k-7783-1-1, yw06-7762-2-1 и yw06-7834-1-1 были выбраны, чтобы они имели гемизиготные модификации генома AHAS на геноме A, геноме B и геноме D, соответственно. Приблизительно 15 семян T1 от каждого объекта проращивали и выращивали в условиях теплицы для получения семян T2. Материал листьев, собранный с растения T1, использовали для экстракции ДНК и анализы ПЦР проводили для определения зиготности модифицированного гена AHAS. Это исследование зиготности ПЦР было предназначено для амплификации фрагмента из каждой из трех гомеологичных копии эндогенного гена AHAS в области, содержащей участок связывания для ZFN 29732 и 29730 (кодируемые на плазмиде pDAB190350), и для включения вариации геномной нуклеотидной последовательности. Достаточная вариация геномной нуклеотидной последовательности была включена для различения гомеологов AHAS, чтобы полученные ампликоны можно было однозначно отнести (на уровне последовательности) к субгеному пшеницы, из которого они происходили. Пары праймеров синтезировали с использованием последовательностей SP1 и SP2 Illumina™ на 5'-конце для обеспечения совместимости с химией секвенирования путем синтеза Illumina™. Синтезированные праймеры также содержали фосфоротиоатную связь на предпоследних 5'- и 3'-нуклеотидах. 5'-фосфоротиоатная связь обеспечивала защиту от деградации экзонуклеазами последовательностей SP1 и SP2 Illumina™. Аналогично, 3'-фосфоротиоатная связь повышала специфичность ПЦР в отношении амплификации последовательностей-мишеней AHAS с использованием ПЦР с включением-выключением (Yang et al., (2005) Biochem. Biophys. Res. Commun., Mar. 4:328(1):265-72). Последовательности пар праймеров представлены в таблице 18.
Последовательности праймеров, использованные для оценки зиготности модифицированного гена AHAS в трансгенных объектах пшеницы из примера 5.
AGAAGATGCTTGAGAC*C
[309] Полученные ампликоны ПЦР получали для глубокого секвенирования, как описано ранее, и секвенировали на устройстве Illumina MiSEQ™ для получения считанных последовательностей со спаренными концами размером 250 п.н. в соответствии с инструкциями изготовителя. Полученные считанные последовательности подвергали компьютерной обработке, как описано выше, для отнесения каждой считанной последовательности к образцу (на основе штрих-кода) и субгеному, из которого они происходили (на основе вариации нуклеотидов, которая различала гомеологичные копии гена AHAS) и для проведения фильтрации по качеству, чтобы убедиться, что только высококачественные последовательности использовались для последующих анализов. Специально разработанные скрипты PERL и ручное манипулирование данными в MICROSOFT EXCEL 2010™ (Microsoft Corporation) использовали для обработки данных и определения зиготности модифицированного гена AHAS в каждом объекте пшеницы T1.
[0310] Поскольку встраивание pDAS000267 в эндогенный локус AHAS приводило к различию только 95 п.н. между аллелем дикого типа (немодифицированный) и полученным трансгенным аллелем (модифицированный), ожидалось, что анализ зиготности способом ПЦР будет амплифицировать как ген AHAS дикого типа, так и модифицированный ген AHAS. Следовательно, ожидалось, что растения T1, гомозиготные по модификации генома мишени, будут обеспечивать только считанные последовательности, которые образованы в результате амплификации трансгенного аллеля модифицированного локуса AHAS. Эти аллели поддавались различению на уровне последовательности вследствие шести мутаций, преднамеренно внесенных в экзон AHAS в pDAS000267 (например, две мутации, кодирующие мутацию S653N, и четыре кодон-оптимизированных синонимических мутации, расположенных в участке связывания ZFN 29732, препятствовали повторному расщеплению встроенного донора). Ожидалось, что растения T1, гемизиготные в отношении модификации генома-мишени, будут обеспечивать считанные последовательности, происходящие из как аллеля дикого типа, так и трансгенного аллеля в модифицированном локусе AHAS. В то же время, ожидалось, что растения T1 без модифицированного гена AHAS будут обеспечивать только считанные последовательности, происходящие из аллеля дикого типа в модифицированном локусе AHAS. Исходя из теста зиготности способом ПЦР, были идентифицированы растения T1, гомозиготные по мутации S653N только в геноме A, геноме B или геноме D (таблица 19).
Результаты анализа зиготности способом ПЦР для растений T1, полученных самоопылением трансгенных объектов пшеницы из примера 5.
2Число считанных последовательностей, происходящих из указанного субгенома и имеющих гаплотип последовательностей, соответствующий трансгенному (модифицированному) локусу AHAS. Использование "ED" обозначает "редактированный".
3Генотип растения T1, где прописными буквами и строчными буквами указано присутствие локусов AHAS дикого типа и трансгенных локусов на конкретном субгеноме, соответственно. Например, AaBBDD указывает на то, что растения T1 имеют гемизиготную модификацию генома AHAS на геноме A и гомозиготные локусы AHAS дикого типа на геномах B и D. Зиготность в каждом из трех эндогенных локусов AHAS определяют из частоты считанных последовательностей, соответствующих аллелям дикого типа и модифицированным аллелям, происходящим из каждого субгенома. Гемизиготные генотипы имеют сходную частоту аллелей дикого типа и модифицированных аллелей, происходящих из эндогенного локуса AHAS, где гомозиготные генотипы выявляют в основном аллели дикого типа или модифицированные аллели. Низкая частота альтернативных аллелей, происходящих из гомозиготных локусов AHAS, является следствием химеризма ПЦР между считанными последовательностями, происходящими из различных субгеномов.
[0311] Специалист в данной области может использовать последующие раунды искусственного скрещивания между различными объектами трансформации пшеницы в комбинации с описанным тестом зиготности ПЦР для получения гомозиготных растений пшеницы, имеющих мутацию S653N на любой комбинации множества субгеномов (например, геном A и геном B, геном A и геном D или геном B и геном D), или на всех трех субгеномах. Например, искусственное скрещивание растения T1 mb1k-7783-1-43 (т.е., генотип aaBBDD) с растением T1 yw06-7762-2-25 (т.е. генотип AAbbDD) приведет к семенам T2, которые являются гемизиготными по модифицированным генам AHAS в геноме A и геноме B; т.е. с генотипом AaBbDD. Затем выращивание и самоопыление растений T2 приведет к семенам T3, сегрегирующих по гомозиготным генотипам модифицированных генов AHAS на геномах A и B (т.е. генотип aabbDD), которые можно идентифицировать с использованием описанного анализа зиготности способом ПЦР.
Пример 10: Разработка системы трансформации для последовательного стэкинга экзогенных трансгенов в эндогенных локусах AHAS в пшенице
[0312] Эндогенный локус гена AHAS в пшенице был выбран в качестве модельного локуса для разработки опосредуемой ZFN экзогенной системы трансформации для получения растений, в которых один или несколько трансгенов прицельно располагали в одной геномной области. Система трансформации обеспечивает параллельный (одновременное встраивание одного или нескольких трансгенов) или последовательный стэкинг (последовательное встраивание одного или нескольких трансгенов) прицельно в одной геномной области. Кроме того, система трансформации включает одновременный параллельный и последовательный стэкинг в множестве аллелей среди множества субгеномов. В этой стратегии используется внесение мутаций в ген AHAS, которые сообщают толерантность к гербицидам группы B (например, ингибиторы ALS, такие как имидазолинон или сульфонилмочевина).
[0313] Опосредуемое ZFN встраивание донорной ДНК в локус AHAS дикого типа (чувствительный к гербицидам) использовали для внесения трансгена(ов) и мутации в эндогенный ген AHAS, которая сообщала толерантность к имидазолинонам, таким образом, позволяя регенерацию растений с правильным нацеливанием, которые обладают толерантностью к селективному агенту-имидазолинону.
[0314] Стэкинг второго трансгена(ов) в локусе AHAS осуществляют путем встраивания донорной ДНК, которая вносит один или несколько дополнительных трансгенов и сообщает чувствительность к имидазолинонам, но толерантность к соединениям сульфонилмочевины, таким образом, обеспечивая регенерацию растений с правильным нацеливанием с использованием в качестве селективного агента сульфонилмочевины.
[0315] Стэкинг третьего трансгена осуществляют путем встраивания донорной молекулы, которая вносит дополнительный трансген(ы) и сообщает чувствительность к сульфонилмочевине и толерантность к имидазолинонам, таким образом, позволяя регенерацию растений с правильным нацеливанием с использованием в качестве селективного агента имидазолинона.
[0316] По существу, является возможным продолжение раундов последовательного стэкинга трансгенов с использованием донорной ДНК, которая вносит трансген(ы) и мутации в эндогенный ген AHAS для дифференциального повторения циклов между агентами селекции на основе имидазолинонов и на основе соединений сульфонилмочевины. Трансгены можно встраивать в ген AHAS и подвергать стэкингу через каскад NHEJ и/или HDR. Желаемый каскад репарации и рекомбинации можно определять путем конструирования донорного трансгена. В одном варианте осуществления конструируют экзогенные последовательности, которые встраиваются и подвергаются стэкингу в гене AHAS, чтобы они содержали 5'- и 3'-область гомологии с участком геномного встраивания, т.е. геном AHAS. 5'- и 3'-области гомологии фланкируют груз (например, мутация AHAS и представляющий интерес ген). Таким образом, в такой конструкции будет использоваться каскад HDR для встраивания и стэкинга донорного полинуклеотида в хромосоме. В следующем варианте осуществления конструируют трансгены, которые встраиваются и подвергаются стэкингу в гене AHAS, чтобы они содержали участки одинарного или двойного расщепления ZFN, которые фланкируют груз (например, мутация AHAS и представляющий интерес ген). Таким образом, в такой конструкции используется каскад NHEJ для встраивания и стэкинга донорного полинуклеотида в хромосоме.
Конструирование и продуцирование донорной ДНК для первого последовательного стэкинга трансгенов в эндогенном локусе AHAS с использованием осуществляемой путем NHEJ репарации ДНК
[0317] Донорную ДНК для первого раунда стэкинга трансгенов конструировали для обеспечения прицельного встраивания в эндогенный локус AHAS посредством опосредуемой ZFN осуществляемой путем NHEJ репарации. Конструкция была основана на встраивании двухцепочечной донорной молекулы в положение двухцепочечного разрыва ДНК, внесенного посредством расщепления гомеологичной копии эндогенного гена AHAS посредством ZFN 29732 и 29730 (кодируемые на плазмиде pDAB109350, фиг. 1).
[0318] Остов донорной молекулы pDAS000433 (SEQ ID NO: 71; фиг. 12) содержал несколько признаков полинуклеотидной последовательности. 5'-конец содержал последовательность, которая была практически идентичной эндогенному гену AHAS, кодируемому в геноме D. Эта последовательность состояла из фрагмента, который охватывал область от участка-мишени для расщепления ZFN и до стоп-кодона AHAS. Кроме того, в последовательность было внесено семь преднамеренных мутаций: две мутации, которые кодировали мутацию S653N, и пять кодон-оптимизированных синонимичных мутаций, расположенных в участке связывания ZFN 29732. Пять кодон-оптимизированных синонимичных мутаций было включено для предупреждения повторного расщепления встроенного донора. Далее, за стоп-кодоном следовали 316 п.н. некодирующей последовательности, соответствующих консервативной 3'-нетранслируемой области (3'UTR) в гомеологах AHAS. Кроме того, после последовательности 3'UTR следовали участки связывания цинковых пальцев для ZFN 34480 и 34481 (кодируемые на плазмиде pDAB111860) и ZFN 34482 и 34483 (кодируемые на плазмиде pDAB111861). Эти участки связывания цинковых пальцев обеспечивают самостоятельное вырезание происходящей из донора последовательности AHAS (кодирующая последовательность и 3’UTR), встроенной в эндогенный локус в ходе второго раунда стэкинга трансгенов. После самостоятельно вырезающихся участков связывания цинковыми пальцами следовали два дополнительных участка связывания цинковыми пальцами, которые фланкировались случайной последовательностью размером 100 п.н. После этих двух дополнительных участков связывания цинковых пальцев следовала пара уникальных участков расщепления эндонуклеазой рестрикции, которую использовали для встраивания экспрессирующей кассеты трансгена (т.е. экспрессирующая кассета PAT, как описано ниже). После двух уникальных участков эндонуклеазы рестрикции находилась два дополнительных участка связывания цинковых пальцев, которые вновь фланкировались случайной последовательностью из 100 п.н. Включение четырех дополнительных участков связывания цинковых пальцев обеспечивает последующее вырезание трансгенов, встроенных в локус AHAS, посредством последовательного свободного от маркера стэкинга трансгенов, или продолжение последовательного стэкинга трансгенов в той же геномной области с использованием способа поочередного стэкинга.
[0319] Кассету основной цепи донора синтезировали у коммерческого поставщика, осуществляющего синтез генов (GeneArt, Life Technologies), с коротким участком дополнительной фланкирующей последовательности на 5’- и 3’-концах для обеспечения получения донорной молекулы с выступающими 5’- и 3’-концами, которые были совместимыми с выступающими концами для лигирования, образуемыми ZFN 29732 и 29730 (кодируемые на плазмиде pDAB109350) при расщеплении эндогенного локуса AHAS.
[0320] Экспрессирующую кассету PAT встраивали с использованием стандартных способов, известных специалисту в данной области, в кассету остова донора pDAS000433 между двумя уникальными участками эндонуклеазы рестрикции для получения кассеты донорной молекулы "QA_pDAS000434" (SEQ ID NO: 314; фиг. 19). Кассета для селекции PAT содержала промотор, 5' нетранслируемую область и интрон из гена актина (Act1) из Oryza sativa (McElroy et al., (1990) The Plant Cell, 2(2): 163-171), за которой следовала синтетическая оптимизированная для растений версия гена фосфинотрицинацетилтрансферазы (PAT), выделенная из Streptomyces viridochromogenes, который кодирует белок, который сообщает устойчивость к ингибиторам глутаминсинтазы, включающим фосфинотрицин, глюфосинат и биалафос (Wohlleben et al., (1988) Gene, 70(1): 25-37). Эта кассета оканчивалась 3' UTR, содержащей терминатор транскрипции и участки полиаденилирования из гена 35s вируса мозаики цветной капусты (CaMV) (Chenault et al., (1993) Plant Physiology 101 (4): 1395-1396). Плазмидную ДНК для "QA_pDAS000434" получали с использованием PURE YIELD PLASMID MAXIPREP SYSTEM™ (Promega Corporation, WI) в соответствии с инструкциями изготовителя.
[0321] Амплификацию способом ПЦР "QA_pDAS000434" с последующим расщеплением эндонуклеазой рестрикции BbsI использовали для получения линейных двухцепочечных молекул-доноров ДНК с выступающими 5'- и 3'-концами, которые были совместимы с выступающими концами для лигирования, образуемыми ZFN 29732 и 29730 (кодируемые на плазмиде pDAB109350) при расщеплении эндогенного локуса AHAS. Амплификацию способом ПЦР проводили с использованием праймеров AHAS_TSdnr1_F1 и AHAS_TSdnr1_R1 (SEQ ID NO: 297 и 298, соответственно), которые конструировали для короткого участка дополнительной последовательности, добавленной на 5’- и 3’-концы кассеты остова донора "QA_pDAS000434". Полученные ампликоны очищали с использованием набора для очистки Agencourt AMPure™ XP-PCR (Beckman Coulter) и расщепляли посредством BbsI (New England Biolabs). Ампликоны очищали второй раз с использованием набора для очистки Agencourt AMPure™ XP-PCR (Beckman Coulter) с последующим осаждением этанолом и ресуспендированием в стерильной воде при концентрации ДНК, пригодной для трансформации пшеницы. Для получения линейной двухцепочечной молекулы донорной ДНК использовали стандартные способы, известные специалисту в данной области.
Получение контрольного бинарного вектора, кодирующего AHAS (S653N)
[0322] Бинарный вектор pDAS000143 (SEQ ID NO: 88, фиг.10), содержащий кассету для экспрессии AHAS(S653N) и кассету для селекции PAT, конструировали и собирали с использованием навыков и технологий, широко известных в данной области, как описано ранее. Плазмидную ДНК для бинарной конструкции получали с использованием PURE YIELD PLASMID MAXIPREP SYSTEM™ (Promega Corporation, WI) в соответствии с инструкциями изготовителя. Бинарным вектором pDAS000143 трансформировали клетки пшеницы в качестве контроля.
Биолистическая трансформация для получения объектов пшеницы с первой последовательной стопкой трансгенов в эндогенном локусе AHAS с использованием осуществляемой посредством NHEJ репарации ДНК
[0323] Всего 55468 щитков незрелых зиготических зародышей из донорной линии пшеницы cv. Bobwhite MPB26RH получали для биолистической доставки ДНК, как описано ранее. Покрытые ДНК золотые частицы получали с составами, как описано выше. Для трансфекций, проведенных с использованием линейной двухцепочечной донорной ДНК, происходящей из "QA_pDAS000434" или pDAS000433, донорную ДНК смешивали в молярном соотношении 5:1 с плазмидной ДНК для pDAB109350 (кодирующая ZFN 29732 и 29730). Трансфекции, осуществляемые с использованием pDAS000143, проводили с использованием золотых частиц, которые были покрыты только плазмидной ДНК для pDAS000143.
[0324] Биолистические трансфекции проводили, как описано ранее. После бомбардировки трансфицированные щитки инкубировали при 26°C в темноте в течение 16 ч, а затем переносили на среду для индукции каллюса.
[0325] Для увеличения в количестве регенерировавших растений пшеницы с встроенной линейной двухцепочечной донорной молекулой использовали две различных стратегии селекции. Первую стратегию на основе IMAZAMOX® использовали для выделения объектов пшеницы, которые имели донорную молекулу, прицельно встроенную в одну или несколько гомеологичных копий эндогенного гена AHAS посредством опосредуемого ZFN осуществляемого посредством NHEJ редактирования генов. Ожидается, что такие объекты будут иметь фенотип AHAS толерантности к гербицидам, сообщаемый мутацией S653N. Вторую стратегию на основе BASTA® (DL-фосфинотрицин) использовали для восстановления объектов, которые имели донорную молекулу, встроенную либо в случайном (нецелевом) положении в геноме пшеницы, либо неточно встроенную в одну или несколько гомеологичных копий эндогенного гена AHAS посредством опосредуемого ZFN осуществляемого путем NHEJ редактирования генов. Ожидается, что эти объекты будут проявлять фенотип толерантности к гербициду BASTA®, сообщаемый геном PAT но не обязательно фенотип толерантности к гербициду AHAS, сообщаемый мутацией S653N. Целью второй стратегии химической селекции было обеспечение количественного определения частоты точного (на мишени) против случайного (вне мишени) встраивания донора, а также частоты точного и неточного встраивания в эндогенные локусы AHAS. Эти две стратегии химической стратегии описаны в таблице 20.
Стратегии химической селекции, использованные для регенерации растений пшеницы, которые имели встроенную донорную молекулу ("IMI" обозначает селекцию с ImazamoX® и "PPT" обозначает селекцию с BASTA®).
[0326] Всего 34546 и 23550 трансфицированных щитков подвергали селекции с IMAZAMOX® и BASTA®, соответственно. Для каждой стратегии щитки культивировали в темноте на среде для индукции каллюса при 24°C в течение 2 недель. Полученные каллюсы субкультивировали один раз на свежей среде для индукции каллюса и поддерживали в тех же условиях в течение дополнительных двух недель. Соматический эмбриогенный каллюс (SEC) переносили на среду для регенерации растений и культивировали в течение 2 недель при 24°C при световом периоде 16/8 (свет/темнота) в теплице. Регенерировавшие проростки переносили в среду для укоренения и культивировали в тех же условиях в течение 2-3 недель. Для селекции с IMAZAMOX® регенерировавшие растения субкультивировали в течение всего трех раз на среде для укоренения. В конце каждого раунда корни регенерировавших растений удаляли и растения вновь субкультивировали на среде для укоренения. Ростки с корнями переносили в почву и выращивали в тепличных условиях. Семена T1 собирали из индивидуальных растений, а затем помещали в мешки индивидуальные колосья для предотвращения случайного скрещивания.
[0327] Эксплантаты щитков, подвергнутые бомбардировке золотыми частицами, покрытыми pDAS000143, использовали для мониторинга жесткости селекции для обеих стратегий химической селекции с IMAZAMOX® и BASTA®. Растения, трансформированные pDAS000143, регенерировали с использованием процесса, описанного выше.
[0328] Всего 36 растений пшеницы восстанавливали после каждой стратегии химической селекции для эксплантатов щитков, трансфицированных pDAS000143. Молекулярное исследование этих объектов с использованием анализа гидролиза зонда, описанного в примере 6, подтвердило, что все восстановленные растения пшеницы содержали по меньшей мере одну случайным образом встроенную копию вставки pDAS000143. Эти результаты показали, что условия селекции с IMAZAMOX® и BASTA® были достаточно жесткими, чтобы гарантировать низкий уровень ускользания (т.е. восстановление растений пшеницы, которые не были трансформированными), одновременно обеспечивая восстановление объектов, содержащих одну или несколько встроенных копий AHAS (S653N) и донорных полинуклеотидов PAT, соответственно.
[0329] Растения пшеницы, имеющие фенотип AHAS толерантности к гербициду, сообщающий мутацию S653N, после селекции с IMAZAMOX® в конкретных условиях селекции, описанных выше, не восстанавливались. Поскольку ожидается, что после селекции с IMAZAMOX® восстанавливались только растения пшеницы, которые имеют прицельное встраивание донорной молекулы в одну или несколько копий гомеологичного гена AHAS, эти результаты указывают на то, что режим химической селекции был субоптимальным и что условия необходимо модифицировать для прицельного опосредуемого ZFN осуществляемого путем NHEJ встраивания донора pDAS000433 в эндогенный локус AHAS, или что масштаб трансформации не был пригодным для условий химической селекции, используемой в текущей работе. Напротив 1652 растений пшеницы восстановилось после селекции BASTA®. Поскольку ожидалось, что в случае BASTA® восстановятся растения пшеницы, которые имеют как направленное и так и ненаправленное (случайное) встраивание донора, молекулярная охарактеризациия этих объектов может различить направленное и ненаправленное встраивание донора, что может обеспечить руководство для оптимизации условий селекции IMAZAMOX®.
Молекулярная охарактеризация подвергнутых селекции с помощью BASTA ® растений пшеницы для доказательства стэкинга первого трансгена в эндогенном локусе AHAS
[0330] Всего 1162 растений пшеницы, восстановленных после селекции с BASTA®, подвергали молекулярной охарактеризации для оценки частоты направленного и ненаправленного (случайного) встраивания донора, а также частоты направленного точного и неточного встраивания донора в эндогенных локусах AHAS.
[0331] Для каждого растения пшеницы проводили три молекулярных анализа с использованием геномной ДНК, экстрагированной с использованием DNEASY® PLANT DNA EXTRACTION MINI KIT™ (Qiagen) из лиофилизированной ткани листьев, как описано выше.
[0332] Первый молекулярный тест использовали для подтверждения того, что регенерировавшие растения пшеницы содержали по меньшей мере одну встроенную копию линейной двухцепочечной ДНК, происходящей из "QA_pDAS000434". Этот тест вовлекал анализ способом ПЦР для амплификации области промотора актина (Act1), присутствующего в "QA_pDAS000434" (SEQ ID NO: 92 и 93 для прямого и обратного праймеров, соответственно), с последующим электрофоретическим разделением полученного ампликона на агарозном геле. Присутствие фрагмента ПЦР ожидаемого размера (218 п.н.) указало на встраивание по меньшей мере одной копии донорной молекулы. Из 1162 объектов пшеницы 1065 (92%) продуцировали фрагмент ПЦР ожидаемого размера.
[0333] Второй молекулярный тест использовали для идентификации растений пшеницы, имеющих молекулу донора, предположительно встроенную в одну или несколько копий эндогенного локуса AHAS. Этот тест включал анализ ПЦР с включением-выключением с использованием праймера, сконструированного для гибридизации с областью выше участка связывания для ZFN 29732 и 29730 (кодируемые на плазмиде pDAB190350) в каждой из гомеологичных копий эндогенного гена AHAS, и праймера, сконструированного для гибридизации с областью в пределах 100 п.н. от случайной последовательности, фланкирующей участок связывания ZFN 34480 и 34481 (кодируемые на плазмиде pDAB111860) в "QA_pDAS000434" (SEQ ID NO: 299 и 300 для прямого и обратного праймеров, соответственно). Каждый праймер конструировали с фосфоротиоатной связью, расположенной в предпоследнем основании, для максимизации удлинения праймеров в процессе амплификации способом ПЦР. Амплификацию фрагмента ПЦР размером более 300 п.н. при разделении электрофорезом на агарозном геле считали предположительным свидетельством направленного встраивания (по меньшей мере части) донорной молекулы в одну или несколько копий эндогенного гена AHAS. Из 1065 исследованных объектов пшеницы в 543 (51%) амплифицировался фрагмент ПЦР размером более 300 п.н.
[0334] Третий молекулярный анализ использовали для дальнейшей охарактеризации растений пшеницы, предположительно демонстрирующих свидетельство направленного встраивания донорной молекулы в одну или несколько копий эндогенного гена AHAS. Этот тест вовлекал анализ ПЦР с использованием пары праймеров, сконструированных для амплификации области размером 256 п.н. из трех гомеологичных копии эндогенного гена AHAS. Эта область содержала участок для связывания ZFN 29732 и 29730 (кодируемые на плазмиде pDAB190350) и для включения вариации геномной нуклеотидной последовательности. Была включена достаточная вариация геномной нуклеотидной последовательности для различения гомеологов AHAS, чтобы полученные ампликоны можно было однозначно отнести (на уровне последовательности) к субгеному пшеницы, из которого они происходят. Пары праймеров синтезировали с последовательностями SP1 и SP2 Illumina™ на 5'-конце, соответственно, для обеспечения совместимости с химией секвенирования путем синтеза Illumina™. Синтезированные праймеры также содержали фосфоротиоатную связь в предпоследних 5'- и 3'-нуклеотидах. 5'-фосфоротиоатная связь обеспечивала защиту от деградации экзонуклеазой последовательностей SP1 и SP2 Illumina™, в то время как 3'-фосфоротиоатная связь повышала специфичность ПЦР в отношении амплификации последовательностей-мишеней AHAS с использованием ПЦР с включением-выключением. Эти последовательности пары праймеров приведены в таблице 21.
Последовательности праймеров, использованные для дальнейшей охарактеризации растений пшеницы, имеющих предполагаемое свидетельство направленного встраивания донорной молекулы в одну или несколько копий эндогенного гена AHAS.
AGAAGATGCTTGAGAC*C
[0335] Ампликоны ПЦР, продуцированные в третьем молекулярном анализе, получали для глубокого секвенирования путем проведения дополнительного раунда ПЦР для внесения последовательностей P5 и P7 Illumina™ в амплифицированные фрагменты ДНК, а также последовательности штрих-кода, которую можно использовать для однозначного отнесения считанных последовательностей к образцу, из которого они происходят. Это осуществляли с использованием праймеров, которые были частично комплементарными последовательностям SP1 и SP2, присоединенным на первом раунде амплификации, но также содержали штрих-код образца и последовательности P5 и P7. После амплификации полученные продукты секвенировали на Illumina MiSEQ™ для получения считанных последовательностей со спаренными концами размером 250 п.н. в соответствии с инструкциями изготовителя.
[0336] Полученные считанные последовательности со спаренными концами размером 250 п.н. подвергали компьютерной обработке, как описано выше, для отнесения каждых считанных данных к образцу (исходя из штрих-кода) и субгеному, из которого они происходят (на основе нуклеотидного варьирования, которое различало гомеологичные копии гена AHAS), и для проведения фильтрации по качеству, чтобы убедиться, что только высококачественные последовательности использовались для последующих анализов. Специально разработанные скрипты PERL и ручное манипулирование данными в MICROSOFT EXCEL 2010™ (Microsoft Corporation) использовали, как описано ниже, для идентификации считанных данных, которые содержали доказательства направленного встраивания донора в одну или несколько копий эндогенного гена AHAS.
[0337] Поскольку участок для гибридизации праймера AHASs653ZFN.R3 (таблица 21) также присутствовал в 3'-нетранслируемой области (UTR) AHAS в "QA_pDAS000434", третий молекулярный анализ позволял различение между направленным и случайным встраиванием донора, а также между точным и неточным встраиванием донора в одну или несколько копий эндогенного локуса AHAS. Ожидается, что растения пшеницы, имеющие точное гемизиготное редактирование в мишени, будут обеспечивать считанные последовательности, которые образованы при амплификации как аллеля дикого типа (нередактированный), так и редактированных аллелей в каждом модифицированном локусе AHAS. Эти аллели являются различимыми на уровне последовательности посредством семи преднамеренных мутаций, внесенных в экзон AHAS в "QA_pDAS000434" (т.е. две мутации, кодирующие мутацию S653N, и пять кодон-оптимизированных синонимических мутаций, расположенных в участке связывания ZFN 29732, который включали для предупреждения повторного расщепления встроенного донора). Теоретически, частота данных считывания, соответствующих аллелям дикого типа и редактированным аллелям, должна иметь соотношение 1:1 для каждого эндогенного локуса AHAS с точным гемизиготным редактированием. Напротив, ожидается, что растения пшеницы, имеющие точное гомозиготное редактирование в мишени будут приводить только к считанным последовательностям, которые происходят из пары отредактированных аллелей в каждом модифицированном эндогенном локусе AHAS. Поскольку пару праймеров, использованную в третьем молекулярном анализе, конструировали для амплификации всех трех гомеологичных копий гена AHAS, ожидаемое образование считанных последовательностей, происходящих из всех трех субгеномов пшеницы, также можно использовать для обнаружения неточного встраивания донора в мишени (например, встраивание частичного фрагмента донора или встраивание донорного фрагмента в неправильной ориентации). Ожидается, что неточное встраивание донора в мишени приводит к амплификации только аллеля дикого типа (нередактированный), из каждого модифицированного эндогенного локуса AHAS вследствие конкуренции в ПЦР, способствующей амплификации более короткого фрагмента дикого типа. Следовательно, ожидается, что гемизиготное неточное встраивание донора в мишени приведет приблизительно к вдвое меньшему количеству считанных последовательностей, происходящих из субгенома, в котором произошло встраивание, по сравнению с нередактированными субгеномами. Для гомозиготного неточного встраивания в мишень ожидалось, что никакие считанные последовательности не будут происходить из субгенома, в который произошло встраивание. Напротив, ожидается, что встраивание донора вне мишени (случайное) приведет к равному соотношению считанных последовательностей, происходящих из всех трех гомеологичных копий гена AHAS.
[0338] Анализ последовательности 543 исследованных растений пшеницы выявил 38 объектов с молекулярными признаками встраивания донора в мишени в одной или нескольких копиях эндогенного гена AHAS. Объект di01-9632-1-1 имел точное гемизиготное встраивание донора в локусе AHAS, расположенном в геноме B. Эти результаты были показаны посредством присутствия как считанных последовательностей дикого типа, так и точно отредактированных считанных последовательностей, происходящих из генома B, и только аллелей дикого типа, происходящих из генома A и D (таблица 22). Два объекта имели неточное гемизиготное встраивание донора в локусах AHAS на геномах A и D, соответственно. Объект yl02-9453-1-2 имел как считанные последовательности дикого типа, так и неточно отредактированные считанные последовательности, происходящие из генома D, и только аллели дикого типа, происходящие из геномов A и B. Для сравнения, объект yl02-9552-21-1 имел как считанные последовательности дикого типа, так и неточно отредактированные считанные последовательности, происходящие из генома A и только аллели дикого типа, происходящие из других субгеномов.
[0339] Остальные 35 объектов продемонстрировали молекулярные признаки неточного встраивания донора по меньшей мере в одну копию эндогенного гена AHAS, где донорная молекула, вероятно, была укороченной или встроенной в неправильной ориентации (таблица 22). Эти объекты характеризоввались более низкой, чем ожидалось, частотой считанных последовательностей, происходящих из одного или нескольких субгеномов пшеницы. Например, объект yl02-9552-7-1 имел статистически значимую более низкую частоту считанных последовательностей AHAS дикого типа, происходящих из генома B, чем ожидалось для неотредактированного локуса. Остальные 453 объекта продемонстрировали только признаки случайного встраивания донора где-либо в геноме пшеницы, что указывает на то, что амплифицированный продукт из второго молекулярного анализа, наиболее вероятно, был результатом химеризма ПЦР. Консенсусные последовательности для отредактированных аллелей, присутствующих в субгеноме B, D и A объектов пшеницы di01-9632-1-1, yl02-9453-1-2 и yl02-9552-21-1 представлены в качестве SEQ ID NO: 303, 304 и 305, соответственно.
Молекулярные доказательства встраивания QA_pDAS000434 в одну или несколько гомеологичных копии эндогенного локуса AHAS.
[0340] В целом, 3% (38/1,162) из подвергнутых селекции с помощью BASTA® объектов пшеницы продемонстрировали молекулярные доказательства направленного встраивания донора в одну или несколько гомеологичных копий эндогенного гена AHAS.
Пример 11: Разработка системы трансформации для последовательного свободного от экзогенных маркеров стэкинга в эндогенных локусах AHAS в пшенице
[0341] Растения пшеницы, содержащие донорный встроенный полинуклеотидный в локус AHAS для внесения мутации S653N, получают описанными ранее способами. Например, регенерация объекта di01-9632-1-1 (таблица 23), демонстрирующего молекулярные доказательства точного гемизиготного встраивания "QA_pDAS000434" в геном B пшеницы, указывает на то, что донорную ДНК и конструкции нуклеаз с цинковыми пальцами можно использовать для встраивания последовательностей донорных молекул в одну или несколько копий эндогенного локуса-мишени AHAS в пшенице. Получение такого объекта, который является свободным от каких-либо дополнительных трансгенных селективных маркеров, является первоначальным действием при последовательном свободном от экзогенного трансгенного селективного маркера стэкинге донорного полинуклеотида в эндогенном локусе AHAS в геноме пшеницы. Отредактированные объекты растений получают посредством условий поочередной селекции, как описано ранее в примере 10.
[0342] Ранее описанные условия селекции можно модифицировать посредством ряда технологий. Для повышения восстановления растений пшеницы с точным внесением мутации S653N (кодируемой на "QA_pDAS000434" или pDAS000433) в одну или несколько копий эндогенного локуса AHAS без использования трансгенного селективного маркера можно использовать другие подходы.
[0343] Для повышения восстановления растений пшеницы с точным встраиванием мутации S653N в одну или несколько копий эндогенного локуса AHAS без использования трансгенного селективного маркера можно использовать два дополнительных подхода.
[0344] Например, условия селекции с IMAZAMOX® модифицируют включением различных стадий культивирования и/или более низких концентраций гербицида. Таким образом, селекцию на стадии регенерации растений уменьшают путем снижения концентрации IMAZAMOX®, добавляемой в среду для регенерации растений или в качестве другой альтернативы использование гербицида на этой стадии регенерации растений полностью устраняется. По существу, наблюдают более выраженный рост регенерировавших проростков, тем самым, обеспечивая более крупные проростки, которые являются менее чувствительными к повреждению ткани, когда их субкультивируют в среде для укоренения. Более того, может потребоваться отрезание проростков от эмбриогенного каллюса, из которого они происходят. Проростки меньшего размера являются более чувствительными к повреждению ткани, что может приводить к некрозу ткани и потенциальной потере трансформированных проростков в процессе субкультивирования. Поддержание селекции IMAZAMOX® на стадии индукции каллюса помогает ограничивать эмбриогенез из нетрансформированных клеток, в то время как ее поддержание на стадии укоренения обеспечит строгую селекцию проростков с точным встраиванием pDAS000433 в одной или нескольких копиях эндогенного локуса AHAS, которое требуется для обеспечения толерантных к гербицидам фенотипов AHAS, сообщаемых мутацией S653N. Успех таких стратегий селекции с IMAZAMOX® для получения точно отредактированных растений пшеницы был продемонстрирован в примере.
[0345] В другом примере отличающуюся систему трансформации используют для получения растений пшеницы с точно встроенной донорной ДНК. Например, трансформацию на основе протопластов можно использовать для получения индивидуальных каллюсов, где такой каллюс происходит из единичной клетки. Происходящие из протопластов каллюсы обеспечивают несколько преимуществ над каллюсом, полученным посредством бомбардировки микроснарядами щитков незрелых зиготических зародышей. В отличие от каллюса, который получен посредством бомбардировки микроснарядами и который является химерным, включая как трансформированные, так и с трансформированные клетки, происходящий из протопластов каллюс является клональным. Таким образом, выживание клеток в каллюсе, происходящем из трансформированного протопласта, в котором произошло точное встраивание pDAS000433, не может быть нарушено присутствием соседних нетрансформированных клеток при селекции с IMAZAMOX®. В случае каллюса, полученного путем бомбардировки микроснарядами, химерная композиция каллюса означает, что выживание точно трансформированных клеток может снижаться вследствие гибели окружающих нетрансформированных клеток при селекции с IMAZAMOX®. Системы трансформации на основе протопластов также обеспечивают преимущество масштабируемости по сравнению с бомбардировкой микроснарядами, поскольку значительно большее количество клеток может быть трансформировано для данного количества попыток, тем самым, обеспечивая более высокую вероятность выделения растений пшеницы с точным встраиванием pDAS000433 в одной или нескольких копиях эндогенного гена AHAS. Несколько систем трансформации на основе протопластов для пшеницы описано в опубликованной научной литературе (Qiao et al. (1992) Plant Cell Reports 11:262-265; Ahmed and Sagi (1993) Plant Cell Reports 12:175-179; Pauk et al.(1994) Plant Cell, Tissue and Organ Culture 38: 1-10; He et al. (1994) Plant Cell Reports 14: 92-196; Gu and Lang (1997) Plant Cell, Tissue and Organ Culture 50: 139-145; и Li et al. (1999) Plant Cell, Tissue and Organ Culture 58: 119-125).
[0346] Серию экспериментов проводят для определения оптимальных условий селекции для регенерации растений пшеницы, экспрессирующих мутацию AHAS(S653N), сообщающую толерантность к IMAZAMOX®, из системы трансформации на основе протопластов, такой как системы, описанные выше.
[0347] Условия селекции с IMAZAMOX® оптимизируют с использованием протопластов, происходящих из суспензионной культуры клеток, происходящих из соматического эмбриогенного каллюса (SEC) линии пшеницы cv. Bobwhite MPB26RH. В то время как протопласты, происходящие из Bobwhite MPB26RH, не являются тотипотентными (т.е. их нельзя использовать для регенерации целых растений), ожидается, что условия селекции для увеличения в количестве объектов, экспрессирующих мутацию AHAS(653N), будут применимы к любой системе трансформации на основе протопластов на основе тотипотентного генотипа пшеницы, которые будут понятны специалистам в данной области. Проведенные эксперименты устанавливают базальную толерантность донорной линии пшеницы дикого типа cv. Bobwhite MPB26RH (генотип S653/S653, который сообщает чувствительность к имидазолинонам) к IMAZAMOX®. Применение условий селекции с IMAZAMOX® строже, чем базальная толерантность, будет строго увеличивать в количестве трансформированные клетки, экспрессирующие мутацию AHAS(S653N).
[0348] Применимы другие способы трансформации. Например, можно получать суспензионную клеточную культуру для линии пшеницы cv. Bobwhite MPB26RH. Соматический эмбриогенный каллюс (SEC) индуцируют из незрелых зиготических зародышей линии пшеницы cv. Bobwhite MPB26RH, как описано выше. Быстрорастущую линию каллюса подвергают селекции после шести циклов субкультивирования на среде для индукции каллюса. Для каждого цикла субкультивирования быстрорастущие каллюсы переносят на новую индукционную среду и культивируют в темноте при 26°C в течение 14 суток.
[0349] Суспензионную культуру клеток инициируют путем переноса 1 грамма каллюсов быстрорастущей линии каллюса в колбу, содержащую 20 мл жидкой среды для роста и культивирвоания при 25°C в темноте на ротационном шейкере при 90 об./мин. Каждые семь суток суспензионную клеточную культуру субкультивируют, пропуская культуру через мелкоячеистую марлю для удаления комков клеток диаметром более 2 мм и замены двух третей культуральной среды свежей средой. После 3 месяцев повторяющейся фильтрации и субкультивирования получают быстрорастущую происходящую из SEC суспензионную клеточную культуру.
[0349] Далее протопласты выделяют из происходящей из SEC суспензионной культуры клеток. Приблизительно 4 грамма массы влажного вещества клеточных комков получают путем пропускания 7-дневной происходящей из SEC суспензионной культуры клеток через сито с мелкими ячейками. Клеточные комки расщепляют смесью для расщепления каллюса пшеницы, как описано выше, для высвобождения протопластов. Выход протопластов происходящей из SEC суспензионной культуры клеток оценивают с использованием гемоцитометра Neubauer™. Для определения доли живых выделенных клеток используют эванс синий.
[0350] Выбирают условия селекции культуры протопластов с гербицидом IMAZAMOX®. Для культивирования протопластов используют культуральную систему типа агарозных гранул. Приблизительно 1×106 протопластов осаждают осторожным центрифугированием и супернатант удаляюют. Протопласты ресуспендируют посредством осторожного встряхивания в 1 мл расплавленной агарозы 1,2% Sea-Plaque™, охлажденной до 40ºC и переносят в чашку Петри диаметром 3,5 см. После застывания агарозы в чашку Петри добавляют 1 мл культуральной среды и инкубируют при 25ºC в темноте в течение 1 недели. Агарозную пробку переносят в 20-см чашку Петри, содержащую 10 мл культуральной среды, и инкубируют при 25ºC в темноте на ротационном шейкере при 90 об./мин. Каждые 14 суток культуральную среду заменяют свежей средой. Деление клеток протопластов, как правило, наблюдают через 3 суток после погружения в агарозу с комками из множества клеток, видимыми после 7 суток.
[0351] Базальную толерантность линии пшеницы cv. Bobwhite MPB26RH к IMAZAMOX® определяют путем инкубации культур типа агарозных гранул в среде, дополненной 0, 50, 100, 200, 400 и 600 нМ IMAZAMOX® и оценки скорости роста каллюса через 2 недели. Концентрации IMAZAMOX® более 200 нМ препятствуют развитию каллюса, что указывает на то, что концентрации 200 нМ и выше являются оптимальными для увеличения в количестве и селекции клеток пшеницы, имеющих мутацию AHAS (S653N).
[0352] Осуществляют установление условий культивирования культуры ткани для получения трансгенных растений с донорным встроенным фрагментом, приводящим к мутации S653N в локусе AHAS. Отредактированные объекты растений используют для получения материала эксплантата (например, протопласты или щитки незрелых зиготических зародышей) для второго раунда трансфекции. Как описано в следующем примере, материал эксплантата затем котрансфицируют донорной молекулой ДНК и плазмидой, кодирующей ZFN, которая сконструирована для нацеливания на участок связывания цинковых пальцев, расположенный в генах AHAS выше области, кодирующей аминокислотный остаток P197.
Пример 12: Альтернативные системы трансформации для последовательного свободного от экзогенных маркеров стэкинга трансгенов в эндогенных локусах AHAS в пшенице
[0354] Молекулярные доказательства, предоставленные в примере 10 для регенерировавшего объекта растения пшеницы di01-9632-1-1, демонстрируют техническую осуществимость последовательного свободного от экзогенных маркеров стэкинга в эндогенных локусах AHAS в пшенице. Уточнение условий селекции IMAZAMOX® или применение отличающейся системы трансформации обеспечивают получение растений пшеницы с последовательным стэкингом трансгенов в эндогенном локусе AHAS. В этом примере описаны подходы для достижения свободного от экзогенных маркеров последовательного стэкинга трансгенов в эндогенном локусе AHAS путем чередования различных агентов селекции (например, имидазолинон и сульфонилмочевина) и соответствующих мутаций AHAS (например, S653N и P197S). Сначала определяли условия селекции с сульфонилмочевиной.
Оптимизация условий химической селекции; получение растений пшеницы с низкокопийной случайно встроенной T-ДНК с помощью экспрессирующих конструкций AHAS(P197S)
[0355] Бинарный вектор pDAS000164 (SEQ ID NO: 289, фиг.11), содержащий экспрессирующую кассету AHAS(P197S) и кассету для селекции PAT, конструировали и собирали с использованием навыков и технологий, широко известных в данной области. Экспрессирующая кассета AHAS (P197S) состояла из промотора, 5'-нетранслируемой области и интрона из гена убиквитина (Ubi) из Zea mays (Toki et al., (1992) Plant Physiology, 100: 1503-07), за которым следует кодирующая последовательность (1935 п.н.) гена AHAS из T. aestivum cv. Bobwhite MPB26RH с мутацией нуклеотида 511 с C на T для индукции аминокислотной замены пролина (P) на серин (S). Экспрессирующая кассета AHAS включала 3'-нетранслируемую область (UTR), содержащую терминатор транскрипции и участок аденилирования гена нопалинсинтазы (nos) из A. tumefaciens pTi15955 (Fraley et al., (1983) Proceedings of the National Academy of Sciences U.S.A., 80(15): 4803-4807). Кассета для селекции содержала промотор, 5'-нетранслируемую область и интрон из гена актина (Act1) из Oryza sativa (McElroy et al., (1990) The Plant Cell 2(2): 163-171), за которыми следовала синтетическая оптимизированная для растений версия гена фосфинотрицинацетилтрансферазы (PAT), выделенного из Streptomyces viridochromogenes, который кодирует белок, который сообщает устойчивость к ингибиторам глутаминсинтетазы. содержащим фосфинотрицин, глюфосинат и биалафос (Wohlleben et al., (1988) Gene, 70(1): 25-37). Эта кассета завершалась 3'-UTR, содержащей участки терминации транскрипции и участки полиаденилирования из гена 35s вируса мозаики цветной капусты (CaMV) (Chenault et al., (1993) Plant Physiology, 101 (4): 1395-1396).
[0356] Кассету для селекции синтезировали у коммерческого поставщика, осуществляющего синтез генов (GeneArt, Life Technologies), и ее клонировали в бинарный вектор Gateway®с кассетой RfA Gateway, расположенной между геном убиквитина (Ubi) из Zea mays и 3' нетранслируемой областью (UTR), содержащей терминатор транскрипции и участок полиаденилирования гена нопалинсинтазы (nos) из A. tumefaciens pTi15955. Кодирующую последовательность AHAS(P197S) амплифицировали с фланкирующими участками attB и субклонировали в pDONR221. Полученный клон ENTRY использовали в реакционной смеси LR Clonase II™ (Invitrogen, Life Technologies) с бинарным вектором Gateway, кодирующим экспрессирущую кассету фосфиноthрицинацетилтрансферазы (PAT). Колонии всех собранных плазмид сначала подвергали скринингу посредством рестрикционного расщепления ДНК, полученной минипрепаративным способом. Эндонуклеазы получали от New England BioLabs (NEB; Ipswich, MA) и Promega (Promega Corporation, WI). Получение плазмид проводили с использованием набора QIAPREP SPIN MINIPREP KIT™ или системы PURE YIELD PLASMID MAXIPREP SYSTEM™ (Promega Corporation, WI) в соответствии с инструкциями изготовителя. Плазмидную ДНК выбранных клонов секвенировали с использованием секвенирования по методу Сэнгера ABI и протокола циклического секвенирвоания Big Dye Terminator v3.1™ (Applied Biosystems, Life Technologies). Данные о последовательностях получали и анализировали с использованием программного обеспечения Sequencher™ (Gene Codes Corporation, Ann Arbor, MI).
[0357] Полученный бинарный экспрессирующий клон pDAS000164 трансформировали в штамм Agrobacterium tumefaciens EHA105. Трансгенные растения пшеницы со случайно встроенной T-ДНК получали посредством опосредуемой Agrobacterium трансформации с использованием донорной линии пшеницы cv. Bobwhite MPB26RH в соответствии с протоколом, сходным с Wu et al. (2008) Transgenic Research 17:425-436. Предполагаемые трансгенные объекты T0, которые экспрессируют экспрессирущие конструкции AHAS (P197), подвергали селекции в отношении толерантности к фосфинотрицину (PPT) - фенотипа, сообщаемого трансгенным селективным маркером PAT и переносили в почву. Растения T0 выращивали в тепличных условиях и получали семена T1.
[0358] Геномную ДНК из каждого растения T0 экстрагировали из ткани листьев с использованием протоколов, описанных ранее в примере 6, и исследовали в отношении присутствия или отсутствия остатков штамма Agrobacterium tumefaciens и в отношении числа встроенных копий T-ДНК, кодирующей AHAS(P197S). Присутствие или отсутствие штамма A. tumefaciens определяли с использованием дуплексного анализа q-ПЦР с гидролизом зонда (аналогичного TAQMAN™) для амплификации эндогенного гена убиквитина (SEQ ID NO: 290, SEQ ID NO: 291 и SEQ ID NO: 292 для последовательности прямого и обратного праймеров, и для последовательности зонда, соответственно) из генома пшеницы, и virC из pTiBo542 (SEQ ID NO: 293, SEQ ID NO: 294, и SEQ ID NO: 70 для последовательности прямого и обратного праймеров, и для последовательности зонда, соответственно). Число встроенных копий T-ДНК оценивали с использованием дуплексного анализа q-ПЦР с гидролизом зонда, как описано выше в примере 6, на основе гена пуроиндолина-b (Pinb) из генома D гексаплоидной пшеницы и области промотора актина (Act1), присутствующей на pDAS000164. В целом, было получено 35 независимых объектов T0 с менее чем тремя случайно встроенными копиями T-ДНК.
Оптимизация условий химической селекции; условий регенерации растений пшеницы на сульфометурон метиле
[0359] Проводили серию экспериментов для определения оптимальных условий селекции для регенерации растений пшеницы, экспрессирующих мутацию AHAS (P197S), сообщающую толерантность к гербицидам класса сульфонилмочевины. Эти эксперименты были основаны на исследовании базальной толерантности донорной линии пшеницы дикого типа cv. Bobwhite MPB26RH (генотип P197/P197, который сообщает чувствительность к соединениям соульфонилмочевины) на стадиях индукции каллюса, регенерации растения и укоренения для общепринятой системы трансформации пшеницы. Сходные эксперименты проводили для определения базальной толерантности трансгенных объектов cv. Bobwhite MPB26RH, которые имели случайным образом встроенную T-ДНК, экспрессирующую мутацию AHAS (P197S), которая сообщает толерантность к агентам селекции на основе сульфонилмочевины.
[0360] Базальную толерантность донорной линии пшеницы дикого типа к сульфометурону метилу на стадии индукции каллюса определяли следующим образом: щитки незрелых зиготических зародышей выделяли, как описано ранее в примере 4, и помещали в 10-см чашки Петри, содержавшие среду CIM, дополненную 0, 100, 500, 1000, 1500 и 2000 нМ сульфометурона метила, соответственно. В каждую чашку Петри помещали двадцать щитков. Всего 60 щитков исследовали при каждой концентрации сульфометурона метила. После инкубации при 24°C в темноте в течение 4 недель регистрировали величину образования соматического эмбриоганного каллюса (SEC) при каждой концентрации сульфометурона метила. Результаты продемонстрировали, что образование SEC для cv. Bobwhite MPB26RH было снижено приблизительно на 70% при 100 нМ сульфометурона метила по сравнению с необработанными образцами.
[0361] Базальную толерантность донорной линии пшеницы дикого типа к сульфометурону метилу на стадии регенерации растения определяли следующим образом: щитки незрелых зиготических зародышей из донорной линии пшеницы выделяли и помещали в 10-см чашки Петри, содержавшие среду CIM. Затем позволяли образоваться SEQ путем инкубации при 24°C в темноте в течение 4 недель. SEC переносили в 10-см чашки Петри, содержавшие среду DRM, дополненную 0, 100, 500, 1000, 1500, 2000, 2500 и 3000 нМ сульфометурона метила, соответственно. В каждую чашку Петри помещали двадцать CIM. Всего 60 CIM исследовали в отношении базального ответа толерантности при каждой концентрации сульфометурона метила. После инкубации в течение 2 недель при 24°C при световом периоде 16/8 (свет/темнота) в среде для роста регистрировали ответ регенерации. Результаты продемонстрировали, что регенерация растений была снижена приблизительно на 80% при 2000 нМ сульфометурона метила, по сравнению с необработанными образцами.
[0362] Базальную толерантность донорной линии пшеницы дикого типа к сульфометурону метилу на стадии укоренения растений определяли следующим образом: щитки незрелых зиготических зародышей выделяли и помещали в 10-см чашки Петри, содержавшие среду CIM. Затем позволяли образовываться SEC посредством инкубации при 24°C в темноте в течение 4 недель. SEC переносили в 10-чашки Петри, содержавшие среду DRM, и инкубировали в течение 2 недель при 24°C при световом периоде 16/8 (свет/темнота) для обеспечения регенерации растения. После регенерации растения переносили в 10-см чашки Петри, содержавшие среду RM, дополненную 0, 100, 200, 250, 300, 400, 500, 1000 и 2000 нМ сульфометурона метила, соответственно. В каждую чашку Петри помещали десять регенерировавших растений. Всего 30 регенерировавших растений исследовали в отношении базального ответа толерантности при каждой концентрации сульфометурона метила. После инкубации в течение 3 недель при 24°C при световом периоде 16/8 (свет/темнота) в теплице, регистрировали ответ укоренения. Результаты показали, что укоренение было значительно ингибировалось, при концентрациях сульфометурона метила выше 400 нМ, по сравнени с необработанными образцами.
[0363] Базальную толерантность трансгенных объектов пшеницы со случайным образом встроенной низкокопийной (≤ 3) T-ДНК, экспрессирующей мутацию AHAS (P197S) из pDAS000164, к сульфометурону метилу на стадии укоренения растений определяли следующим образом: четыре независимых трансгенных объекта отбирали и увеличивали в количестве in vitro посредством субкультивировния на среде для увеличения в количестве. После увеличения в количестве растения для каждого объекта переносили в 10-см чашки Петри, содержавшие среду RM, дополненную 0, 400, 450, 500, 550 и 600 нМ сульфометурона метила, соответственно. В каждую чашку Петри помещали четыре растения (по одному для каждого из четырех объектов). Всего 3 растения на объект исследовали в отношении базального ответа толерантности при каждой концентрации сульфометурона метила. После инкубации в течение 2 недель при 24°C при световом периоде 16/8 (свет/темнота) в теплице, регистрировали ответ укоренения. Результаты показали, что укоренение не ограничивалось по сравнению с необработанными контролями в любых исследованных концентрациях, что указывает на то, что мутация AHAS(P197S) сообщала высокую толерантность к сульфометурону метилу.
Конструирование и синтез донорной ДНК для первого последовательного стэкинга трансгенов в эндогенном локусе AHAS с использованием осуществляемой посредством NHEJ репарации ДНК
[0364] Донорную ДНК конструкции pDAS000433 (фиг.12) для первого раунда стэкинга трансгенов конструируют и синтезируют, как описано в примерах 10 и 11, для обеспечения прицельного встраивания донора (содержащего мутацию S653N) в эндогенном локусе AHAS посредством опосредуемой ZFN осуществляемой путем NHEJ репарации. Целые растения, которые являются устойчивыми к IMAZAMOX®, получают и подготавливают для второго раунда нацеливания.
Конструирование и синтез донорной ДНК для второго последовательного стэкинга трансгенов в эндогенном локусе AHAS с использованием осуществляемой путем NHEJ репарации ДНК
[0365] Донорную ДНК (pDAS000434; фиг.13; SEQ ID NO: 72), содержащую мутацию P197S для второго раунда стэкинга трансгенов, конструируют для обеспечения прицельного встраивания донора в тот же локус AHAS, на который осуществлено нацеливание при первом стэкинге трансгена посредством опосредуемой ZFN осуществляемой путем NHEJ репарации. Конструкция основана на встраивании двухцепочечной донорной молекулы в двухцепочечном разрыве ДНК, созданном путем расщепления копии гена AHAS, содержащей первый подвергнутый стэкингу трансген, посредством ZFN 34480 и 34481 (кодируемые на плазмиде pDAB111860) или ZFN 34482 и 34483 (кодируемые на плазмиде pDAB111861). Донорная молекула pDAS000434 содержит несколько участков полинуклеотидных последовательностей. 5'-конец содержит последовательность, практически идентичную эндогенному гену AHAS, кодируемому в геноме D, начиная с участка-мишени для расщепления ZFN и оканчивая на стоп-кодоне AHAS. В эту последовательность вносят несколько преднамеренных мутаций: мутации, кодирующие мутацию P197S, и кодон-оптимизированные синонимические мутации, распознаваемые в участке связывания ZFN 34481 и 34483 для предупреждения расщепления встроенного донора. После стоп-кодона расположена некодирующая последовательность из 316 п.н., соответствующая консервативной 3'-нетранслируемой области (3'UTR) в гомеологах AHAS. После последовательности 3'UTR следуют участки связывания цинковыми пальцами для ZFN 34474 и 34475 (кодируемые на плазмиде pDAB111857) и ZFN 34476 и 34477 (кодируемые на плазмиде pDAB111858). Эти участки связывания цинковыми пальцами позволяет самостоятельное вырезание происходящей из донора последовательности AHAS (кодирующая и 3'UTR), встроенной в эндогенном локусе, на следующем раунде стэкинга трансгенов. После самостоятельно вырезающихся участков связывания цинковыми пальцами следовали несколько дополнительных участков связывания цинковыми пальцами (каждый из которых отделен случайной последовательность из 100 п.н.), которые фланкировались уникальными участками расщепления эндонуклеазой рестрикции и которые обеспечивают встраивание экспрессирующей трансген кассеты (например, экспрессирующая кассета DGT-28, как описано в публикации патента США № 20130205440). Дополнительные участки связывания цинковыми пальцами обеспечивают последующее вырезание трансгенов, которые могут встраиваться в локус AHAS, посредством последовательного свободного от маркера стэкинга трансгенов, или продолжение последовательного стэкинга трансгенов в той же геномной области с использованием способа поочередного стэкинга. Донорную кассету синтезирует коммерческих поставщик, осуществляющий синтез генов (например, GeneArt, Life Sciences) с коротким участком дополнительной фланкирующей последовательности на 5'- и 3'-концах для обеспечения образования донорной молекулы с выступающими 5'- и 3'-концами, которые совместимы с выступающими концами для лигирования, образованными ZFN 34474 и 34475 (кодируемые на плазмиде pDAB111857) или ZFNs 34476 и 34477 (кодируемые на плазмиде pDAB111858), при расщеплении эндогенного локуса AHAS.
[0366] Донорную молекулу с выступающими 5'- и 3'-концами получают путем расщепления плазмидной ДНК, содержащей донорную молекулу, или ДНК после амплификации способом ПЦР, как описано для "QA_pDAS000434" и/или pDAS000433, эндонуклеазой рестрикции BbsI с использованием стандартных способов, известных специалисту в данной области.
Система трансформации для свободного от экзогенных маркеров последовательного стэкинга трансгенов в эндогенном локусе AHAS в пшенице с использованием осуществляемой путем NHEJ репарации ДНК
[0367] Трансгенные объекты пшеницы со стэкингом множества трансгенов в одном эндогенном локусе AHAS, получают посредством свободного от экзогенных маркеров последовательного стэкинга трансгенов посредством трансформации донорной pDAS000433 и ZFN 29732 и 29730 (кодируемые на плазмиде pDAB109350). Прицельное опосредуемой ZFN осуществляемое путем NHEJ встраивание донора вносит первый трансген и мутацию S653N, сообщающую толерантность к имидазолинонам, в локус AHAS, таким образом, обеспечивая регенерацию растений с правильным нацеливанием с использованием Imazamox® в качестве агента селекции, как описано выше в примере 5. На фиг.14a представлено встраивание. Последующая трансформация клеток пшеницы, происходящих из объектов с первым стэкингом трансгенов донором pDAS000434 и ZFN 34480 и 34481 (кодируемые на плазмиде pDAB111860) приводит к замене эндогенного хроматина, расположенного между участками связывания ZFN, расположенными выше P197, и в участке самостоятельного вырезания, встроенного при первом стэкинге трансгена донорной молекулы. Это приводит к встраиванию второго трансгена и мутации P197S, сообщающей толерантность сульфонилмочевине, таким образом, позволяя регенерацию растений с правильным нацеливанием с использованием сульфометурона метила в качестве агента селекции. В то же время встраивание второго донора устраняет мутацию S653N, таким образом, восстанавливая чувствительность к имидазолинонам (фиг. 14b). Специалисту в данной области будет понятно, что стэкинга третьего трансгена можно достигать посредством трансформации соответствующих нуклеаз с цинковыми пальцами и донора, который содержит дополнительный трансген и сообщает чувствительность к сульфонилмочевине и толерантность к имидазолинонам, таким образом, обеспечивая регенерацию растений с правильным нацеливанием с использованием Imazamox® в качестве агента селекции. По существу, продолжение раундов последовательного стэкинга трансгенов является возможным посредством трансформации донорами, которые вносят трансгены и мутации в эндогенные гены AHAS для дифференциального проведения циклов между агентами селекции на основе имидазолинона и сульфонилмочевины.
[0368] Система трансформации, используемая для регенерации растений пшеницы с последовательным стэкингом трансгенов в эндогенном локусе AHAS, основана на ранее описанном подходе биолистической доставки ДНК в щитки незрелых зиготических зародышей пшеницы или прямой доставки ДНК в протопласты пшеницы с использованием подходов, известных специалисту в данной области; например, с использованием способа He et al. (1994) Plant Cell Reports 14: 92-196, или любого из способов, описанных в примере 11.
Конструирование и синтез донорной ДНК для первого последовательного стэкинга трансгена в эндогенном локусе AHAS с использованием осуществляемой путем HDR репарации ДНК
[0369] Донорную ДНК для первого раунда стэкинга трансгенов конструируют для обеспечения прицельного встраивания донора в эндогенный локус AHAS посредством опосредуемой ZFN осуществляемой путем HDR гомологичной репарации. Конструкция основана на встраивании двухцепочечной донорной молекулы в положение двухцепочечного разрыва ДНК, созданного путем расщепления гомеологичной копии эндогенного гена AHAS посредством ZFN 29732 и 29730 (кодируемые на плазмиде pDAB109350). Донорная молекула (pDAS000435; фиг.16; SEQ ID NO: 295) является идентичной по последовательности pDAS000433 (фиг.12).
[0370] Донорную кассету синтезируют у коммерческого поставщика, осуществляющего синтез генов (например, GeneArt, Life Sciences, и т.д.) с плечами гомологии из 750 п.н. на каждом конце. Плечи гомологии на 5’ и 3’-концах донора соответствуют эндогенной последовательности AHAS непосредственно выше и ниже двухцепочечного разрыва ДНК, внесенного ZFN 29732 и 29730 (кодируемые на плазмиде pDAB109350).
Конструирование и синтез донорной ДНК для второго последовательного стэкинга трансгенов в эндогенном локусе AHAS с использованием осуществляемой посредством HDR репарации ДНК
[0371] Донорную ДНК для второго раунда стэкинга трансгенов конструируют для обеспечения прицельного встраивания донора в тот же локус AHAS, на который нацелен первый стэкинг трансгена через опосредуемую ZFN осуществляемую путем HDR гомологичную репарацию. Конструкция основана на встраивании двухцепочечной донорной молекулы в двухцепочечном разрыве ДНК, созданном расщеплением копии гена AHAS, содержащей первый подвергнутый стэкингу трансген, посредством ZFN 34480 и 34481 (кодируемые на плазмиде pDAB111860) или ZFN 34482 и 34483 (кодируемые на плазмиде pDAB111861). Донорная молекула (pDAS000436; фиг.17; SEQ ID NO: 296) идентична по последовательности pDAS000434 (фиг.13).
[0372] Донорную кассету синтезируют у коммерческого поставщика, осуществляющего синтез генов (например, GeneArt, Life Sciences, и т.д.) с плечами гомологии из 750 п.н. на каждом конце. Плечо гомологии на 5'-конце донора соответствует эндогенной последовательности AHAS, расположенной непосредственно выше двухцепочечного разрыва ДНК, внесенного ZFN 34480 и 34481 (кодируемые на плазмиде pDAB111860). Плечо гомологии на 3’-конце донора соответствует последовательности GOI-1, соседней с двухцепочечным разрывом ДНК, созданным ZFN 34480 и 34481 в донорной ДНК, встроенной при первовм стэкинге трансгена.
Система трансформации для свободного от экзогенных маркеров последовательного стэкинга трансгенов в эндогенном локусе AHAS в пшенице с использованием осуществляемой путем HDR репарации ДНК
[0373] Трансгенные объекты пшеницы со стэкингом множества трансгенов в одном эндогенном локусе AHAS получают посредством свободного от экзогенных маркеров последовательного стэкинга трансгенов, кодирующих признаки (без использования трансгенного маркера) посредством трансформации донорной pDAS000435 и ZFN 29732 и 29730 (кодируемые на плазмиде pDAB109350). Прицельное опосредуемое ZFN осуществляемое путем HDR встраивание донора вносит первый трансген и мутацию S653N, сообщающую толерантность к имидазолинонам, в локус AHAS, таким образом, обеспечивая регенерацию растений с правильным нацеливанием с использованием Imazamox® в качестве агента селекции, как описано выше в примере 5. На фиг. 15a представлено встраивание. Последующая трансформация клеток пшеницы, происходящих из объектов с первым стэкингом трансгенов донором pDAS000436 и ZFN 34480 и 34481 (кодируемые на плазмиде pDAB111860) приводит к замене эндогенного хроматина, расположенного между участками связывания ZFN, расположенными выше P197, и в участке самостоятельного вырезания, встроенного при первом стэкинге трансгена донорной молекулы. Это приводит к встраиванию второго трансгена и мутации P197S, сообщающей толерантность сульфонилмочевине. Затем встраивание второго трансгена позволяет регенерацию растений с правильным нацеливанием с использованием сульфометурона метила в качестве агента селекции. В то же время встраивание второго донора устраняет мутацию S653N, таким образом, восстанавливая чувствительность к имидазолинонам (фиг.15b). Как будет понятно специалисту в данной области, стэкинга третьего трансгена можно достигать посредством трансформации соответствующих нуклеаз с цинковыми пальцами и донора, который содержит дополнительный трансген и сообщает чувствительность к сульфонилмочевине и толерантность к имидазолинонам, таким образом, обеспечивая регенерацию растений с правильным нацеливанием с использованием Imazamox® в качестве агента селекции. По существу, продолжение раундов последовательного стэкинга трансгенов является возможным посредством трансформации донорами, которые вносят трансгены и мутации в эндогенные гены AHAS для дифференциального проведения циклов между агентами селекции на основе имидазолинона и сульфонилмочевины.
[0374] Система трансформации, используемая для регенерации растений пшеницы с последовательным стэкингом трансгенов в эндогенном локусе AHAS, основана на ранее описанном подходе биолистической доставки ДНК в щитки незрелых зиготических зародышей пшеницы или прямой доставки ДНК в протопласты пшеницы с использованием подходов, известных специалисту в данной области; например, с использованием способа He et al. (1994) Plant Cell Reports 14: 92-196, или любого из способов, описанных в примере 11.
Пример 13: Разработка системы трансформации для свободного от экзогенного маркера редактирования генома и локуса не поддающегося селекции признака в пшенице
[0375] Прицельная модификация генома в эндогенном локусе обеспечивает эффективный подход для модификации экспрессии признака. Получение экзогенных свободных от экзогенных маркеров с прицельными геномными модификациями в одном или нескольких локусах эндогенных не поддающихся селекции признаков обеспечивает возможности создания новых и ранее не существовавших высокоценных аллелей для улучшения культуры. В этом примере авторы настоящего изобретения описывают разработку системы трансформации для опосредуемого ZFN свободного от экзогенных маркеров прицельного редактирования генома в локусах не поддающихся селекции признаков, которые могут быть адаптированы для модификации признака как путем встраивания, так и не путем встраивания.
[0376] Система трансформации основана на двухстадийном процессе. На первой стадии используют опосредуемую ZFN прицельную модификацию генома для одновременной модификации двух независимых локусов в геноме растения; один локус модифицируют для сообщения толерантности к селективному маркеру, другой модифицируют для изменения экспрессии представляющего интерес не поддающегося селекции признака. Объекты трансформации T0, совместно отредактированные в обоих локусах, получают путем селекции по внесенному экзогенному селективному маркеру. На второй стадии свободные от маркера объекты с единственным модифицированным локусом признака отделяют посредством скрининга способом ПЦР сегрегирующих растений T1. Этот подход может быть адаптирован для прицельной модификации генома без встраивания, которая приводит либо к разрушению не поддающегося селекции эндогенного гена, либо к переделыванию (редактированию) нуклеотидной последовательности не поддающегося селекции эндогенного гена. Альтернативно подход можно адаптировать для прицельной модификации генома с встраиванием, при которой функция не поддающегося селекции эндогенного гена изменяется. В более широком смысле, этот подход можно адаптировать для прицельной модификации генома без встраивания, при которой предварительно встроенная экзогенная ДНК, например трансген, вырезается.
[0377] Эндогенный ген AHAS в пшенице был выбран в качестве модельного локуса для установления и подтверждения системы трансформации для свободного от экзогенного маркера редактирования генома в локусе не поддающегося селекции признака в пшенице.
Получение донорной ДНК для опосредуемого ZFN осуществляемого посредством NHEJ редактирования гена AHAS
[0378] Донорную молекулу ДНК pDAS000267 (SEQ ID NO: 84 и SEQ ID NO: 85) конструировали и синтезировали, как описано в примере 6. В кратком изложении, донорная ДНК состояла из двухцепочечной молекулы из 95 п.н., которая была сконструирована для встраивания в положении двухцепочечного разрыва ДНК, внесенного посредством расщепления гомеологичной копии эндогенного гена AHAS посредством ZFN 29732 и 29730 (кодируемые на плазмиде pDAB109350). Конструкция pDAS000267 состояла из двух частей. 5'-конец содержал последовательность, практически идентичную эндогенному гену AHAS, кодируемому в геноме D, начиная от участка-мишени расщепления ZFN и оканчиваясь стоп-кодоном AHAS. В эту последовательность вносили шесть преднамеренных мутаций: две мутации, кодируемые мутацией S653N (AGC→AAT) и четыре синонимических мутации (в которых молчащая мутация была включена в донорную последовательность). 3'-конец донорной молекулы содержал уникальную последовательность, которую можно было использовать для диагностической ПЦР для обнаружения событий опосредуемого ZFN осуществляемого путем NHEJ редактирования генов. Донорную молекулу конструировали с выступающими 5'- и 3'-концами для обеспечения выступающих концов для облегчения опосредуемой ZFN осуществляемой путем NHEJ репарации ДНК.
Получение конструкции ДНК ZFN
[0379] Плазмидную ДНК для pDAB109350 (фиг.1), кодирующую ZFN 29732 и 29730, получали из культур E. coli с использованием PURE YIELD PLASMID MAXIPREP SYSTEM® (Promega Corporation, Madison, WI) в соответствии с инструкциями изготовителя.
Конструирование и получение бинарного вектора, кодирующего кассету для селекции PAT
[0380] Для конструирования бинарного вектора pDAS000004 (SEQ ID:303; фиг. 18) использовали стандартные способы клонирования. Кассета для селекции PAT состояла из промотора, 5'-нетранслируемой области и интрона из гена актина (Act1) из Oryza sativa (McElroy et al., (1990) The Plant Cell 2(2): 163-171), за которой следовала синтетическая оптимизированная для растений версия фосфинотрицинацетилтрансферазы (PAT), выделенная из Streptomyces viridochromogenes, которая кодировала белок, который сообщает устойчивость к ингибиторам глутаминсинтазы, содержащим фосфинотрицин, глюфосинат и биалафос (Wohlleben et al., (1988) Gene, 70(1): 25-37). Эта кассета завершалась 3' UTR-содержавшей терминатор транскрипции и участки полиаденилирования из гена 35s вируса мозаики цветной капусты (CaMV) (Chenault et al., (1993) Plant Physiology 101 (4): 1395-1396).
[0381] Кассету для селекции синтезировали у коммерческого поставщика, осуществляющего синтез генов (GeneArt, Life Technologies), и ее клонировали в бинарный вектор Gateway. Колонии собранной плазмиды подвергали скринигу посредством рестрикционного расщепления ДНК, полученной минипрепаративным способом, с использованием эндонуклеаз рестрикции, полученных от New England BioLabs и Promega. Получение плазмид проводили с использованием набора QIAprep Spin Miniprep Kit™ в соответствии с инструкциями изготовителя. Плазмидную ДНК выбранных клонов секвенировали с использованием протокола циклического секвенирования ABI Sanger Sequencing и Big Dye Terminator v3.1™ (Applied Biosystems, Life Technologies). Данные о последовательности собирали и анализировали с использованием программного обеспечения sEQUENCHER™ (Gene Codes Corporation, Ann Arbor, MI). Плазмидную ДНК, использованную для трансфекции, получали из культур E. coli с использованием системы PURE YIELD PLASMID MAXIPREP SYSTEM® (Promega Corporation, Madison, WI) в соответствии с инструкциями изготовителя.
Биолистическая система трансформации для получения экзогенных свободных от маркера растений пшеницы с прицельными модификациями генома в эндогенных локусах не поддающихся селекции признаков
[0382] Приблизительно 2320 щитков незрелых зиготических зародышей из донорной линии пшеницы cv. Bobwhite MPB26RH получали для биолистической доставки ДНК, как описано выше. Покрытые ДНК золотые частицы получали, как описано выше, с использованием смеси ДНК, содержавшей 2,5 мкг донора pDAS000267 и плазмиды pDAB109350 (в молярном соотношении 7:1, соответственно) и 2,5 мкг плазмиды pDAS000004.
[0383] После бомбардировки трансфицированные щитки инкубировали при 26°C в темноте в течение 16 ч, а затем переносили на среду для индукции каллюса. Щитки культивировали в темноте на среде для индукции каллюса при 24°C в течение 2 недель. Полученные каллюсы субкультивировали один раз на свежей среде для индукции каллюса и поддерживали в тех же условиях в течение дополнительных двух недель. SEC переносили на среду для регенерации растений, содержавшую 5 мг/мл BASTA®, и культивировали в течение 2 недель при 24°C при световом периоде 16/8 (свет/темнота) в теплице. Регенерировавшие проростки переносили в среду для укоренения, содержавшую 5 мг/мл BASTA®, и культивировали в тех же условиях в течение 2-3 недель. Ожидалось, что регенерировавшие проростки, образующие корни, будут иметь одну или несколько копия кассеты для селекции PAT, случайным образом встроенной в геном растения. Корни эти проростков извлекали и растения вновь субкультивировали на среде для укоренения, содержавшей 200 нМ IMAZAMOX®, в тех же условиях в течение 2-3 недель. Ожидалось, что растения с повторно выросшими корнями, будут иметь мутацию S653N (в результате прицельного встраивания pDAS000267) в одну или несколько копий эндогенного гена AHAS.
[0384] Всего 170 растений пшеницы, обеспечивающих мощный рост корней на среде для укоренения, содержавших BASTA®, получали в результате трансфекции 2320 щитков незрелых зиготических зародышей из донорной линии пшеницы cv. Bobwhite MPB26RH. Из них два растения пшеницы образовывали корни при переносе на среду для укоренения, содержавшую IMAZAMOX®. Эти растения переносили в почву и выращивали в тепличных условиях с получением семян T1.
Оптимизация химической селекции BASTA® для увеличения в количестве объектов трансформации в системе трансформации на основе протопластов пшеницы
[0385] Серию экспериментов проводят для определения оптимальных условий селекции для регенерации растений пшеницы, экспрессирующих ген PAT, сообщающий толерантность к BASTA®, из системы трансформации на основе протопластов, такой как системы, описанные Qiao et al. (1992) Plant Cell Reports 11:262-265; Ahmed and Sagi (1993) Plant Cell Reports 12:175-179; Pauk et al.(1994) Plant Cell, Tissue and Organ Culture 38: 1-10; He et al. (1994) Plant Cell Reports 14: 92-196; Gu and Lang (1997) Plant Cell, Tissue and Organ Culture 50: 139-145; и Li et al. (1999) Plant Cell, Tissue and Organ Culture 58: 119-125.
[0386] Условия селекции BASTA® оптимизируют с использованием протопластов, происходящих из суспензионной культуры клеток, происходящих из соматического эмбриоганного каллюса (SEC), линии пшеницы cv. Bobwhite MPB26RH. В то время как протопласты, происходящие из Bobwhite MPB26RH не являются тотипотентыми (т.е. не могут использоваться для регенерации целых растений), ожидается, что условия селекции, установленные для увеличения в количестве объектов, которые экспрессируют ген PAT, являются применимыми для любой системе трансформации на основе протопластов на основе тотипотентного генотипа пшеницы. Эксперименты проводят и устанавливают базальную толерантность донорной линии пшеницы дикого типа MPB26RH к BASTA®. Условия селекции с BASTA® строже базальной толерантности идентифицируют и используют для селекции трансформированных клеток, экспрессирущих ген PAT.
Получение культур типа агарозных гранул и установление условий селекции с BASTA ®
[0387] Протопласты выделяют из полученной суспензионной культуры происходящих из SEC и используют для получения культур типа агарозных гранул, как описано выше. Базальную толерантность линии пшеницы cv. Bobwhite MPB26RH к BASTA® определяют путем инкубации культур типа агарозных гранул в среде, дополненной 0, 0,5, 2,5, 5, 7,5, 10, 20, 30, 40 и 50 мг/л BASTA® и оценки скорости роста каллюсов через 2 недели. Концентрации BASTA® (например, выше 20 мг/л), которые значительно препятствовали развитию каллюсов, являются оптимальными для увеличения в количестве и селекции клеток пшеницы, имеющих ген PAT.
Молекулярная охарактеризация трансформированных растений пшеницы с фенотипами толерантности к BASTA ® и IMAZAMOX®
[0388] Два растения пшеницы, имеющих фенотипы толерантности как к BASTA®, так и к IMAZAMOX®, подвергали молекулярной охарактеризации для идентификации эндогенного гена AHAS, который содержал мутацию S653N вследствие встраивания донора pDAS000267 в геномном участке двойного расщепления, внесенном ZFN 29732 и 29730, кодируемыми на pDAB109350.
[0389] Для каждого растения пшеницы проводили два молекулярных анализа с использованием геномной ДНК, экстрагированной посредством DNEASY® PLANT DNA EXTRACTION MINI KIT™ (Qiagen) из лиофилизированной ткани листьев, как описано выше.
[0390] Первый молекулярный тест использовали для подтверждения того, что регенерировавшие растения пшеницы имели по меньшей мере одну случайным образом встроенную копию гена PAT. Дуплексный анализ q-ПЦР с гидролизом зонда (агалогичный TAQMAN®) использовали для амплификации эндогенного однокопийного гена пуроиндолина-b (Pinb) из генома D гексаплоидной пшеницы (Gautier et al., (2000) Plant Science 153, 81-91; SEQ ID NO: 89, SEQ ID NO: 90 и SEQ ID NO: 91 для последовательности прямого праймера, обратного праймера, и последовательности зонда, соответственно) и области промотора актина (Act1), присутствующей на pDAS000004 (SEQ ID NO: 92, SEQ ID NO: 93 и SEQ ID NO: 94 для последовательности прямого праймера, обратного праймера, и последовательности зонда, соответственно). Оценку присутствия и оценку числа копий pDAS000004 проводили способом, описанным Livak and Schmittgen (2001), Methods 25(4):402-8. Из результатов были получены доказательства встраивания полинуклеотидной последовательности PAT в геном объектов растения пшеницы yc06-9110-1 и yr00-9311-1, соответственно.
[0391] Второй молекулярный тест использовали для охарактеризации субгеномного положения и исхода для опосредуемого ZFN осуществляемого путем NHEJ встраивания донора в эндогенные гены AHAS. ПЦР с праймерами AHASs653ZFN.F2 и AHASs653ZFN.R1 (SEQ ID NO: 301 и 302; таблица 18) использовали для амплификации фрагмента ДНК из каждой из трех гомеологичных копий эндогенного гена AHAS. Амплифицированный фрагмент содержал область, содержавшую участок связывания для ZFN 29732 и 29730 (кодируемые на плазмиде pDAB190350) и для включения вариации геномной нуклеотидной последовательности. Достаточная вариация геномной нуклеотидной последовательности была включена для различения гомеологов AHAS, так что полученные ампликоны можно было однозначно отнести (на уровне последовательности) к субгеному пшеницы, из которого они происходили. Полученные ампликоны получали для глубокого секвенирования, как описано в примере 12, и секвенировали на устройстве Illumina MiSEQ™ для получения считаных последовательностей со спаренными концами размером 250 п.н. в соответствии с инструкциями изготовителя. Полученные считанные последовательность подвергали компьютерной обработке, как описано выше, для отнесения каждой считанной последовательности к образцу (на основе штрих-кода) и субгеному, из которого они происходили (на основе нуклеотидной вариации, которая различала гомеологичные копии гена AHAS). Как описано в примере 9, встраивание pDAS000267 в эндогенный локус AHAS приводит к отличию в 95 п.н. между аллелем дикого типа (немодифицированный) и полученным трансгенным (модифицированным) аллелем. Таким образом, амплификация способом ПЦР как локуса AHAS дикого типа, так и модифицированного локуса AHAS. Специально разработанные скрипты PERL и манипулирование ручными данными в Microsoft Excel 2010™ (Microsoft Corporation) использовали для охарактеризации субгеномного положения и исхода встраивания донора в эндогенные гены AHAS.
[0392] Из результатов второго молекулярного анализа были продемонстрированы убедительные доказательства прицельного опосредуемого ZFN осуществляемого путем NHEJ редактирования генов в эндогенном локусе AHAS для обоих растений пшеницы. Объект yc06-9110-1 имел точное гемизиготное встраивание донора в геном B (таблица 24). Объект yr00-9311-1 имел одновременное встраивание донора в множество субгеномов. В геноме A наблюдали независимое редактирование обоих эндогенных локусов AHAS. Один аллель имел частичное встраивание донора, которое приводило к ожидаемому встраиванию мутации S653N для экспрессии фенотипа AHAS толерантности к гербициду. Однако, фрагмент, охватывающий нуклеотиды 24 п.н., был удален с 3’-конца донорной молекулы. Другой аллель имел встраивание полинуклеотидной последовательности из 51 п.н. неизвестного происхождения. Не было получено считанных последовательностей, происходящих из генома B, что указывает на независимое встраивание крупной полинуклеотидной последовательности в каждый из эндогенных локусов AHAS (таблица 24). Консенсусные последовательности для аллелей, присутствующих в каждом субгеноме для двух регенерировавших растений пшеницы представлены в качестве SEQ ID NO: 304-313. Отсутствие данных о последовательности, происходящей из pDAS0000004, в обоих объектах растений пшеницы указывает на то, что ген PAT, сообщающий толерантность к BASTA®. был случайным образом встроен в отличающийся локус в геноме растения.
Исходы опосредуемого ZFN осуществляемого путем NHEJ редактирования AHAS для растений пшеницы yc06-9110-1 и yr00-9311-1
"PE" указывает на точное редактирование; т.е. опосредуемое ZFN осуществляемое путем NHEJ редактирование генома вызывало спрогнозированный исход.
"IE" указывает на неточное редактирование; т.е. опосредуемое ZFN осуществляемое путем NHEJ редактирование генома вызывало непрогнозируемый геном.
"UE" указывает на нередактированный аллель; т.е. аллель имел последовательность дикого типа.
"nd" обозначает "не обнаружено".
[0393] Эти результаты впервые описывают способ трансформации, который можно использовать для получения свободных от экзогенного маркера растений пшеницы, имеющих прицельные модификации генома в одном или нескольких локусах не поддающихся селекции признаков. Иллюстрируются растения пшеницы, содержащие встроенный донорный полинуклеотид AHAS, кодирующий мутацию S653N, сообщающую толерантность к гербицидам класса имидазолинонов. Как будет понятно специалистам в данной области, растения без экзогенного трансгенного селективного маркера (например, PAT) можно восстанавливать путем скрининга растений T1, происходящих из этих объектов, с использованием анализов способом ПЦР, специфичных либо к PAT, либо к модифицированным генам AHAS.
[0394] Все патенты, патентные заявки и публикации, упомянутые в настоящем описании, включены в настоящее описание в качестве ссылки в полном объеме.
[0395] Хотя описание подробно предоставлено в качестве иллюстрации и примеров для ясности понимания, специалистам в данной области будет понятно, что различные изменения и модификации можно применять на практике без отклонения от сущности и объема изобретения. Таким образом, указанное выше описание и примеры не следует истолковывать как ограничивающие.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Dow AgroSciences LLC
Sangamo BioSciences, Inc.
<120> СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ВСТРАИВАНИЯ ЭКЗОГЕННОЙ ПОСЛЕДОВАТЕЛЬНОСТИ В ГЕНОМ РАСТЕНИЙ
<130> 72287-US-NP
<160> 314
<170> PatentIn version 3.5
<210> 1
<211> 2259
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность гомеологичного гена AHAS
<220>
<221> дополнительный признак
<222> (2207)..(2207)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (2210)..(2210)
<223> n представляет собой a, c, g или t
<400> 1
tcgcccaaac cctcgccgcc gccatggccg cagccacctc ccccgccgtc gcattctcgg 60
gcgccaccgc cgccgccatg cccaaacccg cccgccatcc tctcccgcgc caccagcccg 120
tctcgcgccg cgcgctcccc gcccgcgtcg tcaggtgttg cgccgcgtcc cccgccgcca 180
cctccgccgc gcctcccgca accgcgctcc ggccatgggg cccgtccgag ccccgcaagg 240
gcgccgacat cctcgtcgag gcgctcgagc gctgcggcat cgtcgacgtc ttcgcctacc 300
ccggcggcgc ctccatggag atccaccagg cgctgacgcg ctcgcccgtc atcaccaacc 360
acctcttccg ccacgagcag ggggaggcgt tcgcggcgtc cggctacgcc cgcgcgtccg 420
gccgcgtcgg cgtctgcgtc gccacctccg gcccgggggc caccaacctc gtctccgcgc 480
tcgccgacgc cctcctcgac tccatcccca tggtcgccat cacgggccag gtcccccgcc 540
gcatgatcgg cacggacgcg ttccaggaga cgcccatagt ggaggtcacg cgctccatca 600
ccaagcacaa ctacctggtc cttgacgtgg aggatatccc ccgcgtcatc caggaagcct 660
tcttccttgc atcctctggc cgcccggggc cggtgctagt tgatatcccc aaggacatcc 720
agcagcagat ggctgtgccc gtctgggaca ctccaatgag tttgccaggg tacatcgccc 780
gcctgcccaa gccaccatct actgaatcgc ttgagcaggt cctgcgtctg gttggcgagt 840
cacggcgccc aattctgtat gttggtggtg gctgcgctgc gtctggcgag gagttgcgcc 900
gctttgttga gcttactggg attccagtta caactactct gatgggcctt ggcaacttcc 960
ccagcgacga cccactgtct ctgcgcatgc ttgggatgca tggcactgtg tatgcaaatt 1020
atgcagtaga taaggctgac ctgttgctcg catttggtgt gcggtttgat gatcgtgtga 1080
ctgggaaaat cgaggctttt gcaagcaggt ccaagattga gcacattgac attgacccag 1140
ctgagattgg cagaacaagc agccacatgt ctccatttgt gcagatgtta agcttgcttt 1200
acaggggttg aatgatctat taaatgggag caaagcacaa cagggtctgg attttggtcc 1260
atggcacaag gagttggatc agcagaagag ggagtttcct ctaggattca agacttttgg 1320
cgaggccatc ccgccgcaat atgctatcca ggtactggat gagctgacaa aaggggaggc 1380
gatcattgcc actggtgttg ggcagcacca gatgtgggcg gctcagtatt acacttacaa 1440
gcggccacgg cagtggctgt cttcgtctgg tttgggggca atgggatttg ggttaccagc 1500
tgcagctggc gctgctgtgg ccaacccagg tgttacagtt gttgacattg atggtgatgg 1560
tagtttcctc atgaacattc aggagttggc gttgatccgc attgagaacc tcccagtgaa 1620
ggtgatgata ttgaacaacc agcatctggg aatggtggtg cagtgggagg ataggtttta 1680
caaggccaat cgggcgcaca cataccttgg caacccagaa aatgagagtg agatatatcc 1740
agattttgtg acgattgcta aaggattcaa cgttccagca gttcgagtga cgaagaagag 1800
cgaagtcact gcagcaatca agaagatgct tgagacccca gggccatact tgttggatat 1860
catagtcccg catcaggagc acgtgctgcc tatgatccca agcggtggtg ctttcaagga 1920
catgatcatg gagggtgatg gcaggacctc gtactgaaat ttcgacctac aagacctaca 1980
agtgtgacat gcgcaatcag catgatgccc gcgtgttgta tcaactacta ggggttcaac 2040
tgtgagccat gcgttttcta gtttgcttgt ttcattcata taagcttgta ttacttagtt 2100
ccgaaccctg tagttttgta gtctatgttc tcttttgtag ggatgtgctg tcataagatg 2160
tcatgcaagt ttcttgtcct acatatcaat aataagtact tccatgnaan aaaaaaaaaa 2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaa 2259
<210> 2
<211> 2265
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность гомеологичного гена AHAS
<220>
<221> дополнительный признак
<222> (2213)..(2213)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (2216)..(2216)
<223> n представляет собой a, c, g или t
<400> 2
tcgcccaaac cctcgccgcc gccatggccg cagccacctc ccccgccgtc gcattctcgg 60
gcgccgccgc cgccgccgcc gccataccca aacccgcccg ccagcctctc ccgcgccacc 120
agcccgcctc gcgccgcgcg ctccccgccc gcatcgtcag gtgctgcgcc gcgtcccccg 180
ccgccacctc cgtcgcgcct cccgccaccg cgctccggcc gtggggcccc tccgagcccc 240
gcaagggcgc cgacatcctc gtcgaggcgc tggagcgctg cggcatcgtc gacgtcttcg 300
cctaccctgg cggcgcgtcc atggagatcc accaggcgct gacgcgctcg ccagtcatca 360
ccaaccacct cttccgccac gagcaggggg aggcgttcgc ggcgtccggg tacgcccgcg 420
cgtccggccg cgtcggcgtc tgcgtcgcca cctccggccc gggggccacc aacctcgtct 480
ccgcgctcgc cgacgctctc ctcgactcca tccccatggt cgccatcacg ggccaggtcc 540
cccgccgcat gatcggcacg gatgcgttcc aggagacgcc catcgtggag gtcacgcgct 600
ccatcaccaa gcacaactac ctggtccttg acgtggagga tatcccccgc gtcatccagg 660
aagccttctt cctcgcatcc tctggccgcc cggggccggt gctggttgat atccccaagg 720
acatccagca gcagatggct gtgcctgtct gggacacgcc gatgagtttg ccagggtaca 780
tcgcccgcct gcccaagcca ccatctactg aatcgcttga gcaggtcctg cgtctggttg 840
gcgagtcacg gcgcccaatt ctgtatgttg gtggtggctg cgctgcatct ggtgaggagt 900
tgcgccgctt tgttgagctc actgggattc cagttacaac tactcttatg ggccttggca 960
acttccccag tgacgaccca ctgtctctgc gcatgctggg gatgcatggc actgtgtatg 1020
caaattatgc agtagataag gctgacctgt tgcttgcatt tggtgtgcgg tttgatgatc 1080
gtgtgaccgg gaaaatcgag gcttttgcaa gcaggtccaa gattgagcac attgacattg 1140
acccagctga gattggcaga acaagcagcc acatgtctcc atttgtgcag atgttaagct 1200
tgctttacag gggttgaatg ctctattaaa tgggagcaaa gcacaacagg gtctggattt 1260
tggtccatgg cacaaggagt tggatcagca gaagagggag tttcctctag gattcaagac 1320
ttttggtgag gccatcccgc cgcaatatgc tatccaggta ctggatgagc tgacaaaagg 1380
ggaggcgatc attgccaccg gtgttgggca gcatcagatg tgggcggctc agtattacac 1440
ttacaagcgg ccacggcagt ggctgtcttc atccggtttg ggtgcaatgg gatttgggtt 1500
gccagctgca gctggcgctg ctgtggccaa cccaggtgtt acagttgttg acattgatgg 1560
ggatggtagt ttcctcatga acattcagga gttggcgttg atccgtattg agaacctccc 1620
agtgaaggtg atgatattga acaaccagca tctgggaatg gtggtgcagt gggaggatag 1680
gttttacaag gccaaccggg cgcacacata ccttggcaac ccagaaaatg agagtgagat 1740
atatccagat tttgtgacga ttgctaaagg attcaacgtt ccggcagttc gtgtgacgaa 1800
gaagagcgaa gtcactgcag caatcaagaa gatgcttgag accccagggc catacttgtt 1860
ggatatcatt gtcccgcatc aggagcacgt gctgcctatg atcccaagcg gtggtgcttt 1920
taaggacatg atcatggagg gtgatggcag gacctcgtac tgaaatttcg acctacaaga 1980
cctacaagtg tgacatgcgc aatcagcatg atacctgcgt gttgtatcaa ctactggggg 2040
ttcaactgtg aaccatgcgt tttctagttt gcttgtttca ttcatataag cttgtgttac 2100
ttagttccga accgtgtagt tttgtagtct ctgttctctt ttgtagggat gtgctgtcat 2160
aagatatcat gcaagtttct tgtcctacat atcaataata agcacttcca tgnaanaaaa 2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaa 2265
<210> 3
<211> 2259
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность гомеологичного гена AHAS
<220>
<221> дополнительный признак
<222> (32)..(32)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (66)..(66)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (80)..(80)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (98)..(98)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (121)..(121)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (147)..(147)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (158)..(158)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (2207)..(2207)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (2210)..(2210)
<223> n представляет собой a, c, g или t
<400> 3
tcgcccaaac cctcgccgcc gccatggccg cngccacctc ccccgccgtc gcattctcgg 60
gcgccnccgc cgccgccatn cccaaacccg cccgccancc tctcccgcgc caccagcccg 120
nctcgcgccg cgcgctcccc gcccgcntcg tcaggtgntg cgccgcgtcc cccgccgcca 180
cctccgccgc gccccccgcc accgcgctcc ggccctgggg cccgtccgag ccccgcaagg 240
gcgccgacat cctcgtcgag gcgctcgagc gctgcggcat cgtcgacgta ttcgcctacc 300
ccggcggcgc gtccatggag atccaccagg cgctgacgcg ctcgcccgtc atcaccaacc 360
acctcttccg ccacgagcag ggggaggcgt tcgcggcgtc cggctacgcc cgcgcgtccg 420
gccgcgtcgg cgtctgcgtc gccacctccg gcccgggggc caccaacctc gtctccgcgc 480
tcgctgacgc cctcctcgac tccatcccca tggtcgccat cacgggccag gtcccccgcc 540
gcatgatcgg cacggacgcg ttccaggaga cgcccatagt ggaggtcacg cgctccatca 600
ccaagcacaa ctacctggtc cttgacgtgg aggatatccc ccgcgtcatc caggaagcct 660
tcttcctcgc gtcctctggc cgcccggggc cggtgctggt tgatatcccc aaggatatcc 720
agcagcagat ggccgtgcct atctgggaca cgccgatgag tttgccaggg tacatcgccc 780
gcctgcccaa gccaccatct actgaatcgc ttgagcaggt cctgcgtctg gttggcgagt 840
cacggcgccc aattctgtat gttggtggtg gctgcgctgc atccggcgag gagttgcgcc 900
gctttgttga gctcactggg attccggtta caactactct gatgggcctt ggcaacttcc 960
ccagcgacga cccactgtct ctgcgcatgc ttgggatgca tggcactgtg tatgcaaatt 1020
atgcagtcga taaggctgac ctgttgcttg catttggtgt gcggtttgat gatcgcgtga 1080
ctgggaaaat cgaggccttt gcaagcaggt ccaagattga gcacattgac attgacccag 1140
ctgagattgg cagaacaagc agccacatgt ctccatttgt gcagatgtta agcttgcttt 1200
acaggggttg aatgctctat taaatgggag caaagcacaa cagggtctgg attttggtcc 1260
atggcacaag gagttggatc agcagaagag ggagtttcct ctaggattca agacttttgg 1320
cgaggccatc ccgccgcaat atgctatcca ggtactggat gagctgacaa aaggggaggc 1380
gatcattgct actggtgttg ggcagcacca gatgtgggcg gctcagtatt acacttacaa 1440
gcggccacgg cagtggctgt cttcgtctgg tttgggggca atgggatttg ggttaccagc 1500
tgcagctggc gctgctgtgg ccaacccagg tgttacagtt gttgacattg atggagatgg 1560
tagtttcctc atgaacattc aggagttggc attgatccgt attgagaacc tccctgtgaa 1620
ggtgatgata ttgaacaacc agcatctggg aatggtggtg caatgggagg ataggtttta 1680
caaggccaat cgggcgcaca cataccttgg caacccagaa aatgagagtg agatatatcc 1740
agattttgtg acgattgcta aaggattcaa cgttccggca gttcgtgtga cgaagaagag 1800
cgaagtcact gcagcaatca agaagatgct tgagacccca gggccatact tgttggatat 1860
catcgtcccg catcaggagc acgtgctgcc tatgatccca agcggtggtg ctttcaagga 1920
catgatcatg gagggtgatg gcaggacctc gtactgaaat ttcgacctac aagacctaca 1980
agtgtgacat gcgcaatcag catggtgccc gcgtgttgta tcaactacta ggggttcaac 2040
tgtgaaccat gcgttttcta gtttgcttgt ttcattcata taagcttgtg ttacttagtt 2100
ccgaaccctg tagctttgta gtctatgctc tcttttgtag ggatgtgctg tcataagata 2160
tcatgcaagt ttcttgtcct acatatcaat aataagtact tccatgnaan aaaaaaaaaa 2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaa 2259
<210> 4
<211> 4357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность гомеологичного гена AHAS из субгенома A
<400> 4
cgttgtgcct tggcagtctc aggttgagcc ctcaccattg aagtagcatg ggtcattgga 60
ttgacccgat ttgacggcgg atctattgga tcttcccttt gtgtcgtttt atactggtat 120
agatgtttaa cacatatttg gaaaatatat tcaaaacatg tttctataaa aaagtttaaa 180
ctatacatgt ataatggaag tcatttataa gaaatgtttt acatgtataa aagatgtaca 240
tcatatgtgc aaaagtagac atgtgttaga aaaaataaac aaacaaatac ataaaaagaa 300
aatcaaagaa aaaacaaccc aaaaaaccaa agaaaataaa gaagaagaag aaaaagagaa 360
aaaacattga aaatcaaaga agaaaaaaac ataaagaaaa gaaaaccgaa aaatactggc 420
aaaaacacac aaaaaatgaa aagaaaaaat aaagaaaacc ggactttacc aatcgaacgg 480
agcgatcgga cacgaatgag cgaaggcatg catcgagcaa caccgctaat tgaccggccc 540
gtagtcgttc gcccgtagac cattcataag aatcggtatc ggagagacat aggggttctt 600
tggtttctaa ccatatcttg tcacacttta ccatacatca ccttagtcaa atctgatcaa 660
attaggtgag tatttggttc tagccacatc taaggcaaga tttgtttttc tgagcagtga 720
accccatatg tcatagacag aaaaattgtg aaaagattcc tttagacggt caaagcgtgg 780
ttaacaattt aatcaactca agtaagataa atgcgataaa tgtgacaaaa ataatgtgtt 840
atagaagtat gacaaaaata atcacaatcc aaacagtctg atagcttggc gagtgcaaaa 900
tagatacgaa atctctggtg atatcacacg ggtccaaaat aattgcttgt ttgagcatca 960
gcctttctgc acaaaaaaag ctagcccaaa caaacgagtg gcgtcccatc tgaaccacac 1020
gctcacccgc cgcgtgacag cgccaaagac aaaaccatca cccctcccca attccaaccc 1080
tctctccgcc tcacagaaat ctctcccctc gcccaaaccc tcgccgccgc catggccgcc 1140
gccacctccc ccgccgtcgc attctccggc gccgccgccg ccgccgccgc catgcccaag 1200
cccgcccgcc agcctctccc gcgccaccag cccgcctcgc gccgcgcgct ccccgcccgc 1260
gtcgtcaggt gctgcgccgc gccccccgct gctgccacct ccgccgcgcc ccccgccacc 1320
gcgctccggc cctggggccc gtccgagccc cgcaagggcg ccgacatcct cgtcgaggcg 1380
ctcgagcgct gcggcatcgt cgacgtattc gcctaccccg gcggcgcgtc catggagatc 1440
caccaggcgc tgacgcgctc gcccgtcatc accaaccacc tcttccgcca cgagcagggg 1500
gaggcgttcg cggcgtccgg ctacgcccgc gcgtccggcc gcgtcggcgt ctgcgtcgcc 1560
acctccggcc cgggggccac caacctcgtc tccgcgctcg ctgacgccct cctcgactcc 1620
atccccatgg tcgccatcac gggccaggtc ccccgccgca tgatcggcac ggacgcgttc 1680
caggagacgc ccatagtgga ggtcacgcgc tccatcacca agcacaacta cctggtcctt 1740
gacgtggagg atatcccccg cgtcatccag gaagccttct tcctcgcgtc ctctggccgc 1800
ccggggccgg tgctggttga tatccccaag gatatccagc agcagatggc cgtgcctatc 1860
tgggacacgc cgatgagttt gccagggtac atcgtcccgc ctgcccaagc caccatctac 1920
tgaatcgctt gagcaggtcc tgcgtctggt tggygagtca cggcgcccaa ttctgtatgt 1980
tggtggtggc tgcgctgcat ccggcgagga gttgcgccgc tttgttgagc tcactgggat 2040
tccggttaca actactctga tgggccttgg caacttcccc agcgacgacc cactgtctct 2100
gcgcatgctt gggatgcatg gcactgtgta tgcaaattat gcagtcgata aggctgacct 2160
gttgcttgca tttggtgtgc ggtttgatga tcgcgtgact gggaaaatcg aggcctttgc 2220
aagcaggtcc aagattgtgc acattgacat tgacccagct gagattggca agaacaagca 2280
gccacatgtc tccatttgtg cagatgttaa gcttgcttta caggggttga atgctctatt 2340
aaatgggagc aaagcacaac agggtctgga ttttggtcca tggcacaagg agttggatca 2400
gcagaagagg gagtttcctc taggattcaa gacttttggc gaggccatcc cgccgcaata 2460
tgctatccag gtactggatg agctgacaaa aggggaggcg atcattgcta ctggtgttgg 2520
gcagcaccag atgtgggcgg ctcagtatta cacttacaag cggccacggc agtggctgtc 2580
ttcgtctggt ttgggggcaa tgggatttgg gttaccagct gcagctggcg ctgctgtggc 2640
caacccaggt gttacagttg ttgacattga tggagatggt agtttcctca tgaacattca 2700
ggagttggca ttgatccgta ttgagaacct ccctgtgaag gtgatgatat tgaacaacca 2760
gcatctggga atggtggtgc aatgggagga taggttttac aaggccaatc gggcgcacac 2820
ataccttggc aacccagaaa atgagagtga gatatatcca gattttgtga cgattgctaa 2880
aggattcaac gttccggcag ttcgtgtgac gaagaagagc gaagtcactg cagcaatcaa 2940
gaagatgctt gagaccccag ggccatactt gttggatatc atcgtcccgc atcaggagca 3000
cgtgctgcct atgatcccaa gcggtggtgc tttcaaggac atgatcatgg agggtgatgg 3060
caggacctcg tactgaaatt tcgacctaca agacctacaa gtgtgacatg cgcaatcagc 3120
atggtgcccg cgtgttgtat caactactag gggttcaact gtgaaccatg cgttttctag 3180
tttgcttgtt tcattcatat aagcttgtgt tacttagttc cgaaccctgt agctttgtag 3240
tctatgctct cttttgtagg gatgtgctgt cataagatat catgcaagtt tcttgtccta 3300
catatcaata ataagtactt ccatggaata attctcagtt ctgttttgaa ttttgcatct 3360
tctcacaaac agtgtgctgg ttcctttctg ttactttaca tgtctgccgt gtccggttat 3420
gacataatga ccgatggagg gtggtcagca ggttttagac ggggagttga aacttttttt 3480
tggggggaag aaatctgaat acagttggga ggaaagataa aagcatatac cttgattaat 3540
ttattgagcc caatatccag cctaatttat caagcaatag gcagtgtagg gtgttggcat 3600
tcttctcttc cttgagatct ggtgtcggga ccccgattct aagtcacacc gatctagcat 3660
gtaacacctc atatcacttt gcggcctcac gcacggtatc ctcacgggtg tcgccttacc 3720
atggcccggg accgtttgcg ccttttggct cacgtatatg atggtgtcgc tagyatccat 3780
atgacagaga acccgggccg acatrgctag tcgtgaaccc aaagcggcac agacctatgg 3840
agacaggcat acatgaatca catcgagcat gtcggtcaac agcgtatgaa tccgggctgt 3900
agcactgggc taacaggact ccggggaacc cgggctgtag caggctaggc aggactccgg 3960
aagtcaccgc gtgacatttc cccgaaggga cagacatagg aacgaagtgg aacacatgcc 4020
ggccagtcaa gtgttctgag cagtagtgct gggctagcag gactccggtg aaccgggctg 4080
tagcggacta ctatggctcg aggtagcact agactacatt tccccataag agaggctkcc 4140
aaggataagc aactagattg tcggrtcycr srywttgtct ccgtgtgttg ttattgttgt 4200
catgcaagta tgtgttgtac aacatggcat cacaacataa cgcaaactca tatagatata 4260
ggctcagaga gccacatagc attaatacga acagggtcac atgacccatc attcagagca 4320
tacagcatga agcatcatgt ctgagtacag acactac 4357
<210> 5
<211> 7585
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность гомеологичного гена AHAS из субгенома B
<400> 5
ctgaaaattc aatatggccc tcgggcacca atgctcttgc ttccaatttt cataattccc 60
atttgtaaaa aacacaccac aaaaatcaca ctgtagtaat ctacatgttt gttgagccta 120
taaatcttca taaaataatt gagattaatg cggtttgtgc aaaaatatgg ggttggtcat 180
gtttctacat atttctattt gcatttcgtt aactggtgct tgttattttt gtacataatg 240
catatctcat tgttattatt tttaaccttt tgagatggta acgaagatcc aaacatgcat 300
agatgattct ccggatgatt ttttgtagcc tgcactagga actcccaaga gccagaaggt 360
tgggtttgta caagataaca tttgtttgaa cacactcata acctgcatgt gacatacatg 420
acgtaactta tagtgatgat tcgacaaatg tctctttgtc caattttgtt atatatcccg 480
tggcaacgca cgggcattcg actagtatat gtaaagatat caatgtgacg agtccccatg 540
gtcgttgcgc ttgtccacta ccggctcgct agaggcgact ctcacctaga agtcgctacg 600
agcaatacat agtcgttctg ggcgcagcta tgttctgcct tttgcgacgc tcaggcacgg 660
cttgcctaca gcctgagggt cgggctagga accactaatt gtgtcatgct gatgtcacaa 720
tgacatcatg catattttta ttttcgtttt tcgctttctc tttaatttta tttgtatttc 780
aaaatatttt atatattttt tgaatttttt caatgttgta tttgaaaaat gttaaacctg 840
tatagagaaa aatatttttg atatatataa aagtatataa catgaatgaa aaatgtataa 900
atgttaatta tgtgtaccaa aaatgttgat aacaattagc agtctcacat atttcaaaat 960
aaatgtatgt ggaattaaaa aatatgtgta tttaagttta aaaaaaatgt tcatgtaatg 1020
ttcgtaaaat gtttgataca ttcaataaaa attatgtcac atttgaataa ttcttctcaa 1080
gcttaacaaa tgcgctcatt atattatcaa aaattgtctg tacagtgtac acaaatgttt 1140
atgtagttca aaaaaaatgt tttttcagta aaaatatatt tgatcatgta ttttataaaa 1200
aactgtttaa tatatattta gaaaatatat tcaaaacatg tttctgtaaa aagttaaaac 1260
tatacatgta taatgtaagt catttataat aaatgtttta catgtataaa aaatgtacaa 1320
catatgtgca aaagtagaca tgtgttgaaa aaataaacaa ataactaaat aaaaagaaaa 1380
tcaaagaaaa acaccaaaaa ccaaagaaat aaataaaacc aaagtataaa gaagarraaa 1440
ggagaaaaaa cattgaaaat caaagaraaa aacataaaga agaaaaaaac cgaagaaaac 1500
tagcaaaaaa cacacacaca aaaaagaaaa tgaaaagaaa taataaagaa agccggactg 1560
aaccgatcaa acgcagcgat cgaacatgga tgagctaagg catgcatcga acaacacggc 1620
taattggccg gcccgtagtc gttcgcccgt agaccattcc tacgaatcgg taccggagag 1680
acataggggc tgtatggttc ctaaccatac cttgccacac tttgtcacac ctcatcttag 1740
gcaaatttaa tcaagttatg taggtgtttg gttttagcca catctaaggc aagatttatt 1800
ttcctgagca gtgaacccca tatgttatag acataaaaag tgtgggaaga ttccctttag 1860
tcaaactgtg gctaacaatt tattaagaat taacttaagt aagataggtg caacaaatgt 1920
agcaaaaata atgtggtata tatagcaaag atagccacaa ccgcgagtgg aaataccaga 1980
tacgagatct ctggtcatat cacacgagtc caaattaatt gctttgtttg aggttcagcc 2040
ttttgcataa aaaagctagc ccaaacaaac gagtggcgtc ccatctgaac cacacactca 2100
cccgccgcgt gacagcgcca aagacaaaac catcacccct ccccaattcc aaccctctct 2160
ctgcctcaca gaaatctctc cctcgcccaa accctcgccg ccgccatggc cgcagccacc 2220
tcccccgccg tcgcattctc gggcgccgcc gccgccgccg ccgccatacc caaacccgcc 2280
cgccagcctc tcccgcgcca ccagcccgcc tcgcgccgcg cgctccccgc ccgcatcgtc 2340
aggtgctgcg ccgcgtcccc cgccgccacc tccgtcgcgc ctcccgccac cgcgctccgg 2400
ccgtggggcc cctccgagcc ccgcaagggc gccgacatcc tcgtcgaggc gctggagcgc 2460
tgcggcatcg tcgacgtctt cgcctaccct ggcggcgcgt ccatggagat ccaccaggcg 2520
ctgacgcgct cgccagtcat caccaaccac ctcttccgcc acgagcaggg ggaggcgttc 2580
gcggcgtccg ggtacgcccg cgcgtccggc cgcgtcggcg tctgcgtcgc cacctccggc 2640
ccgggggcca ccaacctcgt ctccgcgctc gccgacgctc tcctcgactc catccccatg 2700
gtcgccatca cgggccaggt cccccgccgc atgatcggca cggatgcgtt ccaggagacg 2760
cccatcgtgg aggtcacgcg ctccatcacc aagcacaact acctggtcct tgacgtggag 2820
gatatccccc gcgtcatcca ggaagccttc ttcctcgcat cctctggccg cccggggccg 2880
gtgctggttg atatccccaa ggacatccag cagcagatgg ctgtgcctgt ctgggacacg 2940
ccgatgagtt tgccagggta catcgcccgc ctgcccaagc caccatctac tgaatcgctt 3000
gagcaggtcc tgcgtctggt tggcgagtca cggcgcccaa ttctgtatgt tggtggtggc 3060
tgcgctgcat ctggtgagga gttgcgccgc tttgttgagc tcactgggat tccagttaca 3120
actactctta tgggccttgg caacttcccc agtgacgacc cactgtctct gcgcatgctg 3180
gggatgcatg gcactgtgta tgcaaattat gcagtagata aggctgacct gttgcttgca 3240
tttggtgtgc ggtttgatga tcgtgtgacc gggaaaatcg aggcttttgc aagcaggtcc 3300
aagattgtgc acattgacat tgacccagct gagattggca agaacaagca gccacatgtc 3360
tccatttgtg cagatgttaa gcttgcttta caggggttga atgctctatt aaatgggagc 3420
aaagcacaac agggtctgga ttttggtcca tggcacaagg agttggatca gcagaagagg 3480
gagtttcctc taggattcaa gacttttggt gaggccatcc cgccgcaata tgctatccag 3540
gtactggatg agctgacaaa aggggaggcg atcattgcca ccggtgttgg gcagcatcag 3600
atgtgggcgg ctcagtatta cacttacaag cggccacggc agtggctgtc ttcatccggt 3660
ttgggtgcaa tgggatttgg gttgccagct gcagctggcg ctgctgtggc caacccaggt 3720
gttacagttg ttgacattga tggggatggt agtttcctca tgaacattca ggagttggcg 3780
ttgatccgta ttgagaacct cccagtgaag gtgatgatat tgaacaacca gcatctggga 3840
atggtggtgc agtgggagga taggttttac aaggccaacc gggcgcacac ataccttggc 3900
aacccagaaa atgagagtga gatatatcca gattttgtga cgattgctaa aggattcaac 3960
gttccggcag ttcgtgtgac gaagaagagc gaagtcactg cagcaatcaa gaagatgctt 4020
gagaccccag ggccatactt gttggatatc attgtcccgc atcaggagca cgtgctgcct 4080
atgatcccaa gcggtggtgc ttttaaggac atgatcatgg agggtgatgg caggacctcg 4140
tactgaaatt tcgacctaca agacctacaa gtgtgacatg cgcaatcagc atgatacctg 4200
cgtgttgtat caactactgg gggttcaact gtgaaccatg cgttttctag tttgcttgtt 4260
tcattcatat aagcttgtgt tacttagttc cgaaccgtgt agttttgtag tctctgttct 4320
cttttgtagg gatgtgctgt cataagatat catgcaagtt tcttgtccta catatcaata 4380
ataagcactt ccatggaata attctcagtt ctgttttgaa tttcacatct tctcacgaac 4440
agtgtgctgg ttcctttctg ttactttaca tgcctgccgt gtcaggttat gacataacga 4500
ccgatggagg attggagggt ggtcggctgg ttttagacgg ggaattgaaa catttttctg 4560
gaagaaatct gaatacagtt gggaggggaa atggaagcat atatttatcg agcccgctat 4620
ccaggctaat ttatcaagca ctagacagtg tagggtgttg gcattcttct cttccttgat 4680
atccggcttg agaggagaga ttgaggcttc ggctgtgttg gttgctgatt tctacagcat 4740
tttgagagag agagagagat gttgcaactg tgttttgtct tggttgcttg tacagagaaa 4800
gagatgacat ttagagatat gcagatcgtt taccagttgt gctgcgttta ttcgtactga 4860
ttgttgttat tgttgctatc atgtgcaaat tgttgtgatg gaaaatcaac aaaattttga 4920
tattttgcaa agcgagttgg attgaatgat ttgagaaatg gtgacttgtt gagtggcctt 4980
gagaattggt gtttcatagg tgtgcagttg gtaatgaaag gcggcggctt gaaatttccg 5040
aaaggcaggc aatgatactt tctgaaagtg atgttttttc ttccaggttt ccggtggaac 5100
aagtctacgt tgagccaatg tttgtcagct tattctgctc tttagtttca gttgttttgt 5160
tcacagattg ctgggcagag ccccatgatc ggctgagcct ccaggagatc cttgattgct 5220
cgactgcgga tacgttgaat cctttaaaat actataagct ccctagtttt agttttagag 5280
aactgagaat caattgaggg caacattagt cgattttggc ttccgatttt gactgggtcg 5340
cctccctggg tcctctacag ttttgtgggc cctatatgta agtgccccag tgttgtgggc 5400
tttctggtct tttctgatga aagcggcgtg gtggctgggg gctttagaat atttcattga 5460
ttaactaaaa caaatcagat ccctttttcc tgcttcatgt gtgtttgacc aatctttttt 5520
taaaaatttc tttgatttta tatttgatgg agtaaatctg gctgtgtcaa cggtagtcca 5580
ttcgaaacct ggaaatcgaa atcattgtac tgcaggtctg ttgcctgtta gtttgttctt 5640
atataagatc tttgacagtt tatgaatttg tctttggaat ttgtataaag tttcacagat 5700
agacaggccc tgttgttaaa tacgttcgtg caattaagtg taaacatatc tgccagtgat 5760
ttttctcggc tcgcattagt acgcataaat ttttagcact tctctgaatt ttctcatatg 5820
cagaccacct atgaaaaaaa cgacatgcaa gtaaataaaa cgatttcagg ttcatttagt 5880
agcaaaccgt ttttatgtcc tttaaaaatc aattagcaga gccactccat tcaccggtca 5940
gcagaaaaga agcatgtgtg tgtttttggg ctatcataga gctaaataaa tttgattccc 6000
atctgtaatg ttcatcgttg tttacatcag tgttggctgt cgtgtggtcg tggagactag 6060
cctgttcaga caatatgttt gacaagagtg ttgttttgtg agatgcggat gcggtgcttg 6120
catctgtact tgtttttgtg aataccagtt agatgatcag tttttgtgca cttcttgcca 6180
tgaatggctg ttaaattgtc actttttagg aacttgttgc cgtaatatca attaaataat 6240
caatttttgt gcatggtata tcaattagat ggtcattttt ttctagtaga gatgtctata 6300
catgccaatg caatgttcag agttgttcaa ggtctcgacg gcgcggcaaa gcgcgtccta 6360
tgcttctagt ttaagatgac aaccaaacac gacccaagtg tatgctatgc tcatccggtt 6420
ggtccttgtt gatgttcaat gggcgtgtct ccatgggcat cgacggcgac aatgttatct 6480
tcttcaactg tctgctatat gctcattggc atttttgaaa ctttgcaagc aaggtcgata 6540
acttggtctg gggatgttga cgcccctatg tatctagatt agggtgatgc tcccgccagt 6600
attttttgga cgattatcaa catttgcggc tggtatacta ttgtggctaa tcaacaaggt 6660
ttttttgtgt gtggctaatc aacaaggttt ggcgctcgat gtttttttaa tgtatttcga 6720
tgactcaatt tctacgtctg aacatttcat tgagccaaga ggcagaacaa caggtcacat 6780
gtaaccgcca gtgaaaaagg ttcaaagaag aaaaagatac gaacgacagc gagtttgtat 6840
kkcagttttc gaactaagag taacacggag trcagtagta cgatccttgt gtmyttctgt 6900
atttggwtak tttttttccg gagttgagta ttwgwaactt tcttgtgctt tttttaacat 6960
tagtacagat gcaagtgctc atacatacgc gctttttgat ttgtaacaat attatgaaag 7020
acgtagtaat tatgtttgca gatcaataaa gctagccatc gtgtggtgtt cccaagaaaa 7080
agatattcac tatagattca ctacatcttc taaaaaaact acactgtaga ttcactacag 7140
accaacagaa tattcatggt cacgtggata aaaacttact ttttgaaagt ctcaagcatt 7200
tggtttgatt ttaagaaaaa ataactgact ctatttttgt gtactccttg caacgaacct 7260
ggataaagat ggagccagtc cgttcctggt tactaggagt atccatttcc tgaagaccat 7320
ggagcaacca cggcggatcg ggcgatcggc agcctcccag ccggcgacca tggcggatgc 7380
cacgagcgca ggagcgacgc ctctcctccc tggcctcctc gacgacatcg taatctgtga 7440
gatccttgtc cgcctcgccc cccaaagcca tcctccgctg ccgcgccgtc acgccgtgcc 7500
tggcgccgca ccacctccac ccgcgacttc ctcctcgccc accacgcccg ccagcccgcc 7560
ctcctcatca cctccggcca cagtt 7585
<210> 6
<211> 6195
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность гомеологичного гена AHAS из субгенома D
<400> 6
aaatttttat aatattgttt ttccaaattt tatgtttaaa ctcatttttg ttcaattttt 60
tgtgaatata ttttaatcca ttgatagatt ttgaaaatat aataattttt ccaaaacatt 120
ctataatttc ataaaccttt ttaacatttc aagaataaga ttaggaaatt ttgattctta 180
aaatatattt ttaatcttgc aactacattt ttatatacaa ttacatgagc caatttattt 240
tggtagaaat caactgaaaa aacaaaagaa aaaattggaa tagcgggagt tctctgcgcg 300
aacttggggg gggggggcga caaccctcta tcaatgagct agggattcct attacatctc 360
gcctacaagc cgcactagtt ttttycccat ttgttttata tcggtttttt actacttttg 420
caccggtttt cttctggtat tatttcattt ttcttctata ctttctgttg ttttcttcgt 480
ttccccctcc tgtttttttg tctttttcta cagtttcctt gtttctttct ttggttttca 540
ccgatttact ttgtttttca cgtttttaaa ttttaatttt aatcttcaga tacataatta 600
acattcatta aattatatac ttttatgtca agttttttca tacacattgt gcattttata 660
catattagga ttcttaaata catgattaat attttattca gacatagagt acttgttttg 720
aacacttttt caaatacatg ttgaaataat ttattttatg atatgaaata tgttttttta 780
ttatgcaaac atttttatac actttatgtt tttttgaaat attacaaaat ttttgcttga 840
aacgtgtgaa cattttttaa aatgtaacat aattttttga atggtatgaa acttttttga 900
actgcgcgaa cattattttt acattgtata ttattttgat tcattttctg taagttatcg 960
cctgaattgc ttgaaaaacg tgattttttt taaatgccac atatattgtt tttgaatggt 1020
tcatgcattt tctgaaagtt gatcgaacat gtttttatat tgcattttta aaatgtaata 1080
accacttttg aaaattaact aatgtatttt cataatatat gtatttaata ttattaaaaa 1140
taaaaaaaag gtaaaagaaa aaacagatca acgcgatgag accccatggt tgttgcgctt 1200
gtccactacc ggctcactga agacgtctct cacagtagga gtcgctacga agaatacata 1260
gtcgcgctgg gcgcggttat gttccgcctg ttgcgacgcc caagcatggc ttgcctacag 1320
ctagagggtc gggctaggaa ccactaattg tgtcatgctg atgtcacaat gacatcatac 1380
atgcttttat tttaattttt cgctttctct ttaaattttt ttgtatttca aaatattctg 1440
tttttttaag aatgctagta ttgtatttga aaaatgttaa acctgtatag aaaaatatat 1500
aacatgaatg aaaaatgtat agatgttaat catgtgtaca aaaaatgatt gtgacaatta 1560
agaatgtcac atatttcaaa ataaatgtat gtggaatttt gaaaaaatgt gtatataatt 1620
ttttaatggt catgtaattt taaaaaaatg tgtgatacat tcaacaaaaa atatttcaca 1680
tttgaataat tcttcttgag cttaagaaat gtgttcatta tgttatcaat ttttttgtac 1740
agtgtacaaa aatgtttaca tagttcaaaa aaatgttttt cagtaaaatt acatttcatt 1800
gtgtatttaa tattttaaca cacatttgga aaatatattt gaaacatgtt tttgtaaaaa 1860
aaaatttaaa actatgcttg tactccctcc gtccgaaaaa ggtttacatg tataaaagtt 1920
ttttcggagg gagggattat aatgttagtc atttataaga aatgttttac atgtatgaaa 1980
atgtatagca tatgtgtaaa agtagacatg tgttgaaaaa aaaaagtaaa acaacccaaa 2040
aaaccaatga aaataaaata aaaccaaagt accaagaaga agaaaaggag aataaaccat 2100
tgaaaaacaa agaaaataaa aaacataaag aagaaagaaa cccaaagaaa actggcaaaa 2160
attagacaca gaaaagaaaa acgaaaaaat atataataaa raaaaccgga ctgaaccgat 2220
cggacacgga tgagcgaagg catgcatcga gcaacacagc taattggccg gcccatagtc 2280
gttcgcccgc agaccattca tacgaatcgg taccggagag acataggggc tatttggttt 2340
gtagccacat tttgtcatac tttgtgacac cgcatcttat gcaagtttga ccaaattagg 2400
tggatgttta gttctaacca catgtaaggg aagatttttt tttatgagca ttgaacccgt 2460
agacacaaaa agtgtaggaa gattacttta aacaagctaa agtgtggcta acaatttaag 2520
catctcaggt aagataagtg cgacaaatat ggcaaaaata atgtggtata tatgacaaag 2580
atagtcacaa tccaaacagc ccatagcctg gcgagtgcaa atagatacga gatctctggt 2640
gatatcacaa ccgtccaaat taattgcttg tttcagcatc agcctttttg cataaagaag 2700
ctagcccaat ctgaaccaca cactcacccg ccgcgtgaca gcgccaaaga caaaaacatc 2760
acccctcccc aattccaacc ctctctctgc ctcacagaaa tctcccccct cgcccaaacc 2820
ctcgccgccg ccatggccgc cgccacctcc cccgccgtcg cattctcggg cgccaccgcc 2880
gccgccatgc ccaaacccgc ccgccatcct ctcccgcgcc accagcccgt ctcgcgccgc 2940
gcgctccccg cccgcgtcgt caggtgttgc gccgcgtccc ccgccgccac ctccgccgcg 3000
cctcccgcaa ccgcgctccg gccctggggc ccgtccgagc cccgcaaggg cgccgacatc 3060
ctcgtcgagg cgctcgagcg ctgcggcatc gtcgacgtct tcgcctaccc cggcggcgcc 3120
tccatggaga tccaccaggc gctgacgcgc tcgcccgtca tcaccaacca cctcttccgc 3180
cacgagcagg gggaggcgtt cgcggcgtcc ggctacgccc gcgcgtccgg ccgcgtcggc 3240
gtctgcgtcg ccacctccgg cccgggggcc accaacctcg tctccgcgct cgccgacgcc 3300
ctcctcgact ccatccccat ggtcgccatc acgggccagg tcccccgccg catgatcggc 3360
acggacgcgt tccaggagac gcccatagtg gaggtcacgc gctccatcac caagcacaac 3420
tacctggtcc ttgacgtgga ggatatcccc cgcgtcatcc aggaagcctt cttccttgca 3480
tcctctggcc gcccggggcc ggtgctagtt gatatcccca aggacatcca gcagcagatg 3540
gctgtgcccg tctgggacac tccaatgagt ttgccagggt acatcgcccg cctgcccaag 3600
ccaccatcta ctgaatcgct tgagcaggtc ctgcgtctgg ttggcgagtc acggcgccca 3660
attctgtatg ttggtggtgg ctgcgctgcg tctggcgagg agttgcgccg ctttgttgag 3720
cttactggga ttccagttac aactactctg atgggccttg gcaacttccc cagcgacgac 3780
ccactgtctc tgcgcatgct tgggatgcat ggcactgtgt atgcaaatta tgcagtagat 3840
aaggctgacc tgttgctcgc atttggtgtg cggtttgatg atcgtgtgac tgggaaaatc 3900
gaggcttttg caagcaggtc caagattgtg cacattgaca ttgacccagc tgagattggc 3960
aagaacaagc agccacatgt ctccatttgt gcagatgtta agcttgcttt acaggggttg 4020
aatgatctat taaatgggag caaagcacaa cagggtctgg attttggtcc atggcacaag 4080
gagttggatc agcagaagag ggagtttcct ctaggattca agacttttgg cgaggccatc 4140
ccgccgcaat atgctatcca ggtactggat gagctgacaa aaggggaggc gatcattgcc 4200
actggtgttg ggcagcacca gatgtgggcg gctcagtatt acacttacaa gcggccacgg 4260
cagtggctgt cttcgtctgg tttgggggca atgggatttg ggttaccagc tgcagctggc 4320
gctgctgtgg ccaacccagg tgttacagtt gttgacattg atggtgatgg tagtttcctc 4380
atgaacattc aggagttggc gttgatccgc attgagaacc tcccagtgaa ggtgatgata 4440
ttgaacaacc agcatctggg aatggtggtg cagtgggagg ataggtttta caaggccaat 4500
cgggcgcaca cataccttgg caacccagaa aatgagagtg agatatatcc agattttgtg 4560
acgattgcta aaggattcaa cgttccagca gttcgagtga cgaagaagag cgaagtcact 4620
gcagcaatca agaagatgct tgagacccca gggccatact tgttggatat catagtcccg 4680
catcaggagc acgtgctgcc tatgatccca agcggtggtg ctttcaagga catgatcatg 4740
gagggtgatg gcaggacctc gtactgaaat ttcgacctac aagacctaca agtgtgacat 4800
gcgcaatcag catgatgccc gcgtgttgta tcaactacta ggggttcaac tgtgagccat 4860
gcgttttcta gtttgcttgt ttcattcata taagcttgta ttacttagtt ccgaaccctg 4920
tagttttgta gtctatgttc tcttttgtag ggatgtgctg tcataagatg tcatgcaagt 4980
ttcttgtcct acatatcaat aataagtact tccatggaat aattctcagt tctgttttga 5040
attttgcatc ttctcacaaa cagtgtgctg gttcctttct gttactttac atgtctgctg 5100
tgtcaggttc tgacataacg accgatggag ggtggtcggc aggttttaga aggggaattg 5160
aaactttttt ttgggaagaa gtctgaatac agttgggagg aaaaatagaa gtatatactt 5220
cgattaattt atcaagcccg ctatccagtc taatttatca agcactagac agtgtagggt 5280
gttggcattc ttctcttcct tgagatccgg cttgagagga gagaccgagg cttcggctgt 5340
gttggttgct gatttctaca gctttttgag atagagagag agatcctgca actgtggttt 5400
gtcttgctgc ttgtacagcg agagagacat tgagagatat gtagatcgtt taccagttgt 5460
gctgctgtta ttcgtactgg tactgattgt tgttactgtt gctatcatgt gcaaattgtt 5520
gtgatggaaa atcaacaaaa ttttgatatt ttgcaaagcg agttggattg aatgatttga 5580
gaaatggtga ctgctttccc tcagacttgt tgagtggcct tgagaattgg tgtttcatag 5640
gtggtgtatg cagttgctaa tgaaaggcga cggcttgaaa tttccgaaag gcagccaatg 5700
atactttctg aaagtgatgt ttttttcgtc caggtttccg gtggagcaag tctagacaca 5760
cgttgagcca atgtttgtca gcttattctg ctctttagtt tcagtttagg tgcagttgtt 5820
ttgtttacag attgctgggc agagccccgt gatcggctga gcctccaaga gatccttgct 5880
tgctcgactg cggatacgct gaatccttta aaacgctccc tagttttaag ttttagagaa 5940
ctgagaatca attgggggca acattactgg gtcgcctccc tgggcctcta cagttttgtg 6000
ggccctatat gtaagtgccc cagtgttgtg gggatttgcg gcgtggcggg cggcatttgc 6060
gtcctctctt cggcggcgct gtttccccct ccttcttgct gcttctggag gaggtggtcg 6120
gcggcgggtg ttgtgggggg tcgcattgga gcggcgcgaa cgccggtcct gctgcatctg 6180
ccgccattgg ttgtt 6195
<210> 7
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 7
tctgtaagtt atcgcctgaa ttgctt 26
<210> 8
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 8
cattgtgaca tcagcatgac acaa 24
<210> 9
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 9
aagcayggct tgcctacagc 20
<210> 10
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 10
aaccaaatrc ccctatgtct ctcc 24
<210> 11
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 11
cgttcgcccg tagaccattc 20
<210> 12
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 12
ggaggggtga tgkttttgtc ttt 23
<210> 13
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 13
tcgcccaaac cctcgcc 17
<210> 14
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 14
gggtcgtcrc tggggaagtt 20
<210> 15
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 15
gccttcttcc tygcrtcctc tgg 23
<210> 16
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 16
gcccgrttgg ccttgtaaaa cct 23
<210> 17
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 17
aycagatgtg ggcggctcag tat 23
<210> 18
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 18
gggatatgta ggacaagaaa cttgcatga 29
<210> 19
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (25)..(25)
<223> n представляет собой a, c, g или t
<400> 19
agggccatac ttgttggata tcatnc 26
<210> 20
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (22)..(22)
<223> n представляет собой a, c, g или t
<400> 20
gccaacaccc tacactgcct ant 23
<210> 21
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (21)..(21)
<223> n представляет собой a, c, g или t
<400> 21
tgcgcaatca gcatgatacc nt 22
<210> 22
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (21)..(21)
<223> n представляет собой a, c, g или t
<400> 22
acgtatccgc agtcgagcaa nt 22
<210> 23
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (24)..(24)
<223> n представляет собой a, c, g или t
<400> 23
gtagggatgt gctgtcataa gatng 25
<210> 24
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (20)..(20)
<223> n представляет собой a, c, g или t
<400> 24
ttggaggctc agccgatcan c 21
<210> 25
<211> 3053
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Гомеологичная копия гена AHAS из субгенома A
<400> 25
cgttcgcccg tagaccattc ataagaatcg gtatcggaga gacatagggg ttctttggtt 60
tctaaccata tcttgtcaca ctttaccata catcacctta gtcaaatctg atcaaattag 120
gtgagtattt ggttctagcc acatctaagg caagatttgt ttttctgagc agtgaacccc 180
atatgtcata gacagaaaaa ttgtgaaaag attcctttag acggtcaaag cgtggttaac 240
aatttaatca actcaagtaa gataaatgcg ataaatgtga caaaaataat gtgttataga 300
agtatgacaa aaataatcac aatccaaaca gtctgatagc ttggcgagtg caaaatagat 360
acgaaatctc tggtgatatc acacgggtcc aaaataattg cttgtttgag catcagcctt 420
tctgcacaaa aaaagctagc ccaaacaaac gagtggcgtc ccatctgaac cacacgctca 480
cccgccgcgt gacagcgcca aagacaaaac catcacccct ccccaattcc aaccctctct 540
ccgcctcaca gaaatctctc ccctcgccca aaccctcgcc gccgccatgg ccgccgccac 600
ctcccccgcc gtcgcattct ccggcgccgc cgccgccgcc gccgccatgc ccaagcccgc 660
ccgccagcct ctcccgcgcc accagcccgc ctcgcgccgc gcgctccccg cccgcgtcgt 720
caggtgctgc gccgcgcccc ccgctgctgc cacctccgcc gcgccccccg ccaccgcgct 780
ccggccctcg gggcccgtcc gagccccgca agggcgccga catcctcgtc gaggcgctcg 840
agcgctgcgg catcgtcgac gtattcgcct accccggcgg cgcgtccatg gagatccacc 900
aggcgctgac gcgctcgccc gtcatcacca accacctcct tccgccacga gcgaggggga 960
ggcgttcgcg gcgtccggct acgcccgcgc gtccggccgc gtcggcgtct gcgtcgccac 1020
ctccggcccg ggggccacca acctcgtctc cgcgctcgct gacgccctcc tcgactccat 1080
ccccatggtc gccatcacgg gccaggtccc ccgccgcatg atcggcacgg acgcgttcca 1140
ggagacgccc atagtggagg tcacgcgctc catcaccaag cacaactacc tggtccttga 1200
cgtggaggat atcccccgcg tcatccagga agccttcttc ctcgcgtcct ctggccgccc 1260
ggggccggtg ctggttgata tccccaagga tatccagcag cagatggccg tgcctatctg 1320
ggacacgccg atgagtttgc cagggtacat cgtcccgcct gcccaagcca ccatctactg 1380
aatcgcttga gcaggtcctg cgtctggttg gcgagtcacg gcgcccaatt ctgtatgttg 1440
gtggtggctg cgctgcatcc ggcgaggagt tgcgccgctt tgttgagctc actgggattc 1500
cggttacaac tactctgatg ggccttggca acttccccag cgacgaccca ctgtctctgc 1560
gcatgcttgg gatgcatggc actgtgtatg caaattatgc agtcgataag gctgacctgt 1620
tgcttgcatt tggtgtgcgg tttgatgatc gcgtgactgg gaaaatcgag gcctttgcaa 1680
gcaggtccaa gattgtgcac attgacattg acccagctga gattggcaag aacaagcagc 1740
cacatgtctc catttgtgca gatgttaagc ttgctttaca ggggttgaat gctctattaa 1800
atgggagcaa agcacaacag ggtctggatt ttggtccatg gcacaaggag ttggatcagc 1860
agaagaggga gtttcctcta ggattcaaga cttttggcga ggccatcccg ccgcaatatg 1920
ctatccaggt actggatgag ctgacaaaag gggaggcgat cattgctact ggtgttgggc 1980
agcaccagat gtgggcggct cagtattaca cttacaagcg gccacggcag tggctgtctt 2040
cgtctggttg ggggcaatgg gatttgggtt accagctgca gctggcgctg ctgtggccaa 2100
cccaggtgtt acagttgttg acattgatgg agatggtagt ttcctcatga acattcagga 2160
gttggcattg atccgtattg agaacctccc tgtgaaggtg atgatattga acaaccagca 2220
tctgggaatg gtggtgcaat gggaggatag gttttacaag gccaatcggg cgcacacata 2280
ccttggcaac ccagaaaatg agagtgagat atatccagat tttgtgacga ttgctaaagg 2340
attcaacgtt ccggcagttc gtgtgacgaa gaagagcgaa gtcactgcag caatcaagaa 2400
gatgcttgag accccagggc catacttgtt ggatatcatc gtcccgcatc aggagcacgt 2460
gctgcctatg atcccaagcg gtggtgcttt caaggacatg atcatggagg gtgatggcag 2520
gacctcgtac tgaaatttcg acctacaaga cctacaagtg tgacatgcgc aatcagcatg 2580
gtgcccgcgt gttgtatcaa ctactagggg ttcaactgtg aaccatgcgt tttctagttt 2640
gcttgtttca ttcatataag cttgtgttac ttagttccga accctgtagc tttgtagtct 2700
atgctctctt ttgtagggat gtgctgtcat aagatatcat gcaagtttct tgtcctacat 2760
atcaataata agtacttcca tggaataatt ctcagttctg ttttgaattt tgcatcttct 2820
cacaaacagt gtgctggttc ctttctgtta ctttacatgt ctgccgtgtc cggttatgac 2880
ataatgaccg atggagggtg gtcagcaggt tttagacggg gagttgaaac ttttttttgg 2940
ggggaagaaa tctgaataca gttgggagga aagataaaag catatacctt gattaattta 3000
ttgagcccaa tatccagcct aatttatcaa gcaataggca gtgtagggtg ttg 3053
<210> 26
<211> 3589
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Гомеологичная копия гена AHAS из субгенома B
<400> 26
cgttcgcccg tagaccattc ctacgaatcg gtaccggaga gacatagggg ctgtatggtt 60
cctaaccata ccttgccaca ctttgtcaca cctcatctta ggcaaattta atcaagttat 120
gtaggtgttt ggttttagcc acatctaagg caagatttat tttcctgagc agtgaacccc 180
atatgttata gacataaaaa gtgtgggaag attcccttta gtcaaactgt ggctaacaat 240
ttattaagaa ttaacttaag taagataggt gcaacaaatg tagcaaaaat aatgtggtat 300
atatagcaaa gatagccaca accgcgagtg gaaataccag atacgagatc tctggtcata 360
tcacacgagt ccaaattaat tgctttgttt gaggttcagc ctttttgcat aaaaaagcta 420
gcccaaacaa acgagtggcg tcccatctga accacacact cacccgccgc gtgacagcgc 480
caaagacaaa accatcaccc ctccccaatt ccaaccctct ctctgcctca cagaaatctc 540
tccctcgccc aaaccctcgc cgccgccatg gccgcagcca cctcccccgc cgtcgcattc 600
tcgggcgccg ccgccgccgc cgccgccata cccaaacccg cccgccagcc tctcccgcgc 660
caccagcccg cctcgcgccg cgcgctcccc gcccgcatcg tcaggtgctg cgccgcgtcc 720
cccgccgcca cctccgtcgc gcctcccgcc accgcgctcc ggccgtgggg cccctccgag 780
ccccgcaagg gcgccgacat cctcgtcgag gcgctggagc gctgcggcat cgtcgacgtc 840
ttcgcctacc ctggcggcgc gtccatggag atccaccagg cgctgacgcg ctcgccagtc 900
atcaccaacc acctcttccg ccacgagcag ggggaggcgt tcgcggcgtc cgggtacgcc 960
cgcgcgtccg gccgcgtcgg cgtctgcgtc gccacctccg gcccgggggc caccaacctc 1020
gtctccgcgc tcgccgacgc tctcctcgac tccatcccca tggtcgccat cacgggccag 1080
gtcccccgcc gcatgatcgg cacggatgcg ttccaggaga cgcccatcgt ggaggtcacg 1140
cgctccatca ccaagcacaa ctacctggtc cttgacgtgg aggatatccc ccgcgtcatc 1200
caggaagcct tcttcctcgc atcctctggc cgcccggggc cggtgctggt tgatatcccc 1260
aaggacatcc agcagcagat ggctgtgcct gtctgggaca cgccgatgag tttgccaggg 1320
tacatcgccc gcctgcccaa gccaccatct actgaatcgc ttgagcaggt cctgcgtctg 1380
gttggcgagt cacggcgccc aattctgtat gttggtggtg gctgcgctgc atctggtgag 1440
gagttgcgcc gctttgttga gctcactggg attccagtta caactactct tatgggcctt 1500
ggcaacttcc ccagtgacga cccactgtct ctgcgcatgc tggggatgca tggcactgtg 1560
tatgcaaatt atgcagtaga taaggctgac ctgttgcttg catttggtgt gcggtttgat 1620
gatcgtgtga ccgggaaaat cgaggctttt gcaagcaggt ccaagattgt gcacattgac 1680
attgacccag ctgagattgg caagaacaag cagccacatg tctccatttg tgcagatgtt 1740
aagcttgctt tacaggggtt gaatgctcta ttaaatggga gcaaagcaca acagggtctg 1800
gattttggtc catggcacaa ggagttggat cagcagaaga gggagtttcc tctaggattc 1860
aagacttttg gtgaggccat cccgccgcaa tatgctatcc aggtactgga tgagctgaca 1920
aaaggggagg cgatcattgc caccggtgtt gggcagcatc agatgtgggc ggctcagtat 1980
tacacttaca agcggccacg gcagtggctg tcttcatccg gtttgggtgc aatgggattt 2040
gggttgccag ctgcagctgg cgctgctgtg gccaacccag gtgttacagt tgttgacatt 2100
gatggggatg gtagtttcct catgaacatt caggagttgg cgttgatccg tattgagaac 2160
ctcccagtga aggtgatgat attgaacaac cagcatctgg gaatggtggt gcagtgggag 2220
gataggtttt acaaggccaa ccgggcgcac acataccttg gcaacccaga aaatgagagt 2280
gagatatatc cagattttgt gacgattgct aaaggattca acgttccggc agttcgtgtg 2340
acgaagaaga gcgaagtcac tgcagcaatc aagaagatgc ttgagacccc agggccatac 2400
ttgttggata tcattgtccc gcatcaggag cacgtgctgc ctatgatccc aagcggtggt 2460
gcttttaagg acatgatcat ggagggtgat ggcaggacct cgtactgaaa tttcgaccta 2520
caagacctac aagtgtgaca tgcgcaatca gcatgatacc tgcgtgttgt atcaactact 2580
gggggttcaa ctgtgaacca tgcgttttct agtttgcttg tttcattcat ataagcttgt 2640
gttacttagt tccgaaccgt gtagttttgt agtctctgtt ctcttttgta gggatgtgct 2700
gtcataagat atcatgcaag tttcttgtcc tacatatcaa taataagcac ttccatggaa 2760
taattctcag ttctgttttg aatttcacat cttctcacga acagtgtgct ggttcctttc 2820
tgttacttta catgcctgcc gtgtcaggtt atgacataac gaccgatgga ggattggagg 2880
gtggtcggct ggttttagac ggggaattga aacatttttc tggaagaaat ctgaatacag 2940
ttgggagggg aaatggaagc atatatttat cgagcccgct atccaggcta atttatcaag 3000
cactagacag tgtagggtgt tggcattctt ctcttccttg atatccggct tgagaggaga 3060
gattgaggct tcggctgtgt tggttgctga tttctacagc attttgagag agagagagag 3120
atgttgcaac tgtgttttgt cttggttgct tgtacagaga aagagatgac atttagagat 3180
atgcagatcg tttaccagtt gtgctgcgtt tattcgtact gattgttgtt attgttgcta 3240
tcatgtgcaa attgttgtga tggaaaatca acaaaatttt gatattttgc aaagcgagtt 3300
ggattgaatg atttgagaaa tggtgacttg ttgagtggcc ttgagaattg gtgtttcata 3360
ggtgtgcagt tggtaatgaa aggcggcggc ttgaaatttc cgaaaggcag gcaatgatac 3420
tttctgaaag tgatgttttt tcttccaggt ttccggtgga acaagtctac gttgagccaa 3480
tgtttgtcag cttattctgc tctttagttt cagttgtttt gttcacagat tgctgggcag 3540
agccccatga tcggctgagc ctccaggaga tccttgattg ctcgactgc 3589
<210> 27
<211> 3599
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Гомеологичная копия гена AHAS из субгенома D
<400> 27
cgttcgcccg tagaccattc atacgaatcg gtaccggaga gacatagggg ctatttggtt 60
tgtagccaca ttttgtcata ctttgtgaca ccgcatctta tgcaagtttg atcaaattag 120
gtggatgttt agttctaacc acatgtaagg gaagattttt ttttttatga gcattgaacc 180
cgtagacaca aaaagtgtag gaagattact ttaaacaagc taaagtgtgg ctaacaattt 240
aagcatctca ggtaagataa gtgcgacaaa tatggcaaaa ataatgtggt atatatgaca 300
aagatagtca caatccaaac agcccatagc ctggcgagtg caaatagata cgagatctct 360
ggtgatatca caaccgtcca aattaattgc ttgtttcagc atcagccttt ttgcataaag 420
aagctagccc aatctgaacc acacactcac ccgccgcgtg acagcgccaa agacaaaacc 480
atcacccctc cccaattcca accctctctc tgcctcacag aaatctcccc cctcgcccaa 540
accctcgccg ccgccatggc cgccgccacc tcccccgccg tcgcattctc gggcgccacc 600
gccgccgcca tgcccaaacc cgcccgccat cctctcccgc gccaccagcc cgtctcgcgc 660
cgcgcgctcc ccgcccgcgt cgtcaggtgt tgcgccgcgt cccccgccgc cacctccgcc 720
gcgcctcccg caaccgcgct ccggccctgg ggcccgtccg agccccgcaa gggcgccgac 780
atcctcgtcg aggcgctcga gcgctgcggc atcgtcgacg tcttcgccta ccccggcggc 840
gcctccatgg agatccacca ggcgctgacg cgctcgcccg tcatcaccaa ccacctcttc 900
cgccacgagc agggggaggc gttcgcggcg tccggctacg cccgcgcgtc cggccgcgtc 960
ggcgtctgcg tcgccacctc cggcccgggg gccaccaacc tcgtctccgc gctcgccgac 1020
gccctcctcg actccatccc catggtcgcc atcacgggcc aggtcccccg ccgcatgatc 1080
ggcacggacg cgttccagga gacgcccata gtggaggtca cgcgctccat caccaagcac 1140
aactacctgg tccttgacgt ggaggatatc ccccgcgtca tccaggaagc cttcttcctt 1200
gcatcctctg gccgcccggg gccggtgcta gttgatatcc ccaaggacat ccagcagcag 1260
atggctgtgc ccgtctggga cactccaatg agtttgccag ggtacatcgc ccgcctgccc 1320
aagccaccat ctactgaatc gcttgagcag gtcctgcgtc tggttggcga gtcacggcgc 1380
ccaattctgt atgttggtgg tggctgcgct gcgtctggcg aggagttgcg ccgctttgtt 1440
gagcttactg ggattccagt tacaactact ctgatgggcc ttggcaactt ccccagcgac 1500
gacccactgt ctctgcgcat gcttgggatg catggcactg tgtatgcaaa ttatgcagta 1560
gataaggctg acctgttgct cgcatttggt gtgcggtttg atgatcgtgt gactgggaaa 1620
atcgaggctt ttgcaagcag gtccaagatt gtgcacattg acattgaccc agctgagatt 1680
ggcaagaaca agcagccaca tgtctccatt tgtgcagatg ttaagcttgc tttacagggg 1740
ttgaatgatc tattaaatgg gagcaaagca caacagggtc tggattttgg tccatggcac 1800
aaggagttgg atcagcagaa gagggagttt cctctaggat tcaagacttt tggcgaggcc 1860
atcccgccgc aatatgctat ccaggtactg gatgagctga caaaagggga ggcgatcatt 1920
gccactggtg ttgggcagca ccagatgtgg gcggctcagt attacactta caagcggcca 1980
cggcagtggc tgtcttcgtc tggtttgggg gcaatgggat ttgggttacc agctgcagct 2040
ggcgctgctg tggccaaccc aggtgttaca gttgttgaca ttgatggtga tggtagtttc 2100
ctcatgaaca ttcaggagtt ggcgttgatc cgcattgaga acctcccagt gaaggtgatg 2160
atattgaaca accagcatct gggaatggtg gtgcagtggg aggataggtt ttacaaggcc 2220
aatcgggcgc acacatacct tggcaaccca gaaaatgaga gtgagatata tccagatttt 2280
gtgacgattg ctaaaggatt caacgttcca gcagttcgag tgacgaagaa gagcgaagtc 2340
actgcagcaa tcaagaagat gcttgagacc ccagggccat acttgttgga tatcatagtc 2400
ccgcatcagg agcacgtgct gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc 2460
atggagggtg atggcaggac ctcgtactga aatttcgacc tacaagacct acaagtgtga 2520
catgcgcaat cagcatgatg cccgcgtgtt gtatcaacta ctaggggttc aactgtgagc 2580
catgcgtttt ctagtttgct tgtttcattc atataagctt gtattactta gttccgaacc 2640
ctgtagtttt gtagtctatg ttctcttttg tagggatgtg ctgtcataag atgtcatgca 2700
agtttcttgt cctacatatc aataataagt acttccatgg aataattctc agttctgttt 2760
tgaattttgc atcttctcac aaacagtgtg ctggttcctt tctgttactt tacatgtctg 2820
ctgtgtcagg ttctgacata acgaccgatg gagggtggtc ggcaggtttt agaaggggaa 2880
ttgaaacttt tttttgggaa gaagtctgaa tacagttggg aggaaaaata gaagtatata 2940
cttcgattaa tttatcaagc ccgctatcca gtctaattta tcaagcacta gacagtgtag 3000
ggtgttggca ttcttctctt ccttgagatc cggcttgaga ggagagaccg aggcttcggc 3060
tgtgttggtt gctgatttct acagcttttt gagatagaga gagagatcct gcaactgtgg 3120
tttgtcttgc tgcttgtaca gcgagagaga cattgagaga tatgtagatc gtttaccagt 3180
tgtgctgctg ttattcgtac tggtactgat tgttgttact gttgctatca tgtgcaaatt 3240
gttgtgatgg aaaatcaaca aaattttgat attttgcaaa gcgagttgga ttgaatgatt 3300
tgagaaatgg tgactgcttt ccctcagact tgttgagtgg ccttgagaat tggtgtttca 3360
taggtggtgt atgcagttgc taatgaaagg cgacggcttg aaatttccga aaggcagcca 3420
atgatacttt ctgaaagtga tgtttttttc gtccaggttt ccggtggagc aagtctagac 3480
acacgttgag ccaatgtttg tcagcttatt ctgctcttta gtttcagttt aggtgcagtt 3540
gttttgttta cagattgctg ggcagagccc cgtgatcggc tgagcctcca agagatcct 3599
<210> 28
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 28
Asp Ser Thr Asn Arg Tyr Arg
1 5
<210> 29
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 29
Gln Ser Ala His Arg Thr Asn
1 5
<210> 30
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 30
Arg Asn Asp His Arg Ile Asn
1 5
<210> 31
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 31
Arg Ser Asp Val Leu Ser Ala
1 5
<210> 32
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 32
His Asn Ser Ser Leu Lys Asp
1 5
<210> 33
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 33
Gln Trp Gly Thr Arg Tyr Arg
1 5
<210> 34
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 34
Gln Arg Ser Asn Leu Asp Ser
1 5
<210> 35
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 35
ggatagcata ttgcggcggg atggcctc 28
<210> 36
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 36
gtactggatg agctgacaaa aggggagg 28
<210> 37
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 37
gtacctggat agcatattgc ggcgggat 28
<210> 38
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 38
agtacctgga tagcatattg cggcggga 28
<210> 39
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 39
gatgagctga caaaagggga ggcgatca 28
<210> 40
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 40
atgagctgac aaaaggggag gcgatcat 28
<210> 41
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 41
tcatccagta cctggatagc atattgcg 28
<210> 42
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 42
ctgacaaaag gggaggcgat cattgcca 28
<210> 43
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 43
aggcagcacg tgctcctgat gcgggact 28
<210> 44
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 44
taggcagcac gtgctcctga tgcgggac 28
<210> 45
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 45
gatcccaagc ggtggtgctt tcaaggac 28
<210> 46
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 46
tgatgcggga ctatgatatc caacaagt 28
<210> 47
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 47
gagcacgtgc tgcctatgat cccaagcg 28
<210> 48
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 48
tcttgtaggt cgaaatttca gtacgagg 28
<210> 49
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 49
ctacaagtgt gacatgcgca atcagcat 28
<210> 50
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 50
cttgtaggtc gaaa 14
<210> 51
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 51
caagtgtgac atgcgcaa 18
<210> 52
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 52
tcttgtaggt cgaaatttca gtacgagg 28
<210> 53
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 53
tcttgtaggt cgaaatttca gtacgagg 28
<210> 54
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 54
tacaagtgtg acatgcgcaa tcagcatg 28
<210> 55
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 55
cagaacctga cacagcagac atgtaaag 28
<210> 56
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 56
ataacgaccg atggagggtg gtcggcag 28
<210> 57
<211> 59
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (58)..(58)
<223> n представляет собой a, c, g или t
<400> 57
ancactcttt ccctacacga cgctcttccg atcttcctct aggattcaag acttttgng 59
<210> 58
<211> 57
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (56)..(56)
<223> n представляет собой a, c, g или t
<400> 58
gntgactgga gttcagacgt gtgctcttcc gatctcgtgg ccgcttgtaa gtgtana 57
<210> 59
<211> 56
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (55)..(55)
<223> n представляет собой a, c, g или t
<400> 59
ancactcttt ccctacacga cgctcttccg atctgagacc ccagggccat acttng 56
<210> 60
<211> 59
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (58)..(58)
<223> n представляет собой a, c, g или t
<400> 60
gntgactgga gttcagacgt gtgctcttcc gatctcaagc aaactagaaa acgcatgng 59
<210> 61
<211> 55
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (54)..(54)
<223> n представляет собой a, c, g или t
<400> 61
ancactcttt ccctacacga cgctcttccg atctatggag ggtgatggca gganc 55
<210> 62
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (59)..(59)
<223> n представляет собой a, c, g или t
<400> 62
gntgactgga gttcagacgt gtgctcttcc gatctatgac agcacatccc tacaaaagna 60
<210> 63
<211> 58
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (57)..(57)
<223> n представляет собой a, c, g или t
<400> 63
ancactcttt ccctacacga cgctcttccg atctaacagt gtgctggttc ctttctng 58
<210> 64
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (59)..(59)
<223> n представляет собой a, c, g или t
<400> 64
gntgactgga gttcagacgt gtgctcttcc gatcttytyy cctcccaact gtattcagna 60
<210> 65
<211> 1380
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000132
<400> 65
tgcaagcagg tccaagattg tgcacattga cattgaccca gctgagattg gcaagaacaa 60
gcagccacat gtctccattt gtgcagatgt taagcttgct ttacaggggt tgaatgctct 120
attaaatggg agcaaagcac aacagggtct ggattttggt ccatggcaca aggagttgga 180
tcagcagaag agggagtttc ctctaggatt caagactttt ggcgaggcca tcccgccgca 240
atatgctatc caggtactgg atgagctgac aaaaggggag gcgatcattg ctactggtgt 300
tgggcagcac cagatgtggg cggctcagta ttacacttac aagcggccac ggcagtggct 360
gtcttcgtct ggttgggggc aatgggattt gggttaccag ctgcagctgg cgctgctgtg 420
gccaacccag gtgttacagt tgttgacatt gatggagatg gtagtttcct catgaacatt 480
caggagttgg cattgatccg tattgagaac ctccctgtga aggtgatgat attgaacaac 540
cagcatctgg gaatggtggt gcaatgggag gataggtttt acaaggccaa tcgggcgcac 600
acataccttg gcaacccaga aaatgagagt gagatatatc cagattttgt gacgattgct 660
aaaggattca acgttccggc agttcgtgtg acgaagaaga gcgaagtcac tgcagcaatc 720
aagaagatgc ttgagacccc agggccatac ttgttggata tcatcgtccc gcatcaggag 780
cacgtgctgc ctatgatccc aaatggtggt gctttcaagg acatgatcat ggagggtgat 840
ggcaggacct cgtactgaaa tttcgaccta caagacctac aagtgtgaca tgcgcaatca 900
gcatggtgcc cgcgtgttgt atcaactact aggggttcaa ctgtgaacca tgcgttttct 960
agtttgcttg tttcattcat ataagcttgt gttacttagt tccgaaccct gtagctttgt 1020
agtctatgct ctcttttgta gggatgtgct gtcataagat atcatgcaag tttcttgtcc 1080
tacatatcaa taataagtac ttccatggaa taattctcag ttctgttttg aattttgcat 1140
cttctcacaa acagtgtgct ggttcctttc tgttacttta catgtctgcc gtgtccggtt 1200
atgacataat gaccgatgga gggtggtcag caggttttag acggggagtt gaaacttttt 1260
tttgggggga agaaatctga atacagttgg gaggaaagat aaaagcatat accttgatta 1320
atttattgag cccaatatcc agcctaattt atcaagcaat aggcagtgta gggtgttggc 1380
<210> 66
<211> 1572
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000133
<400> 66
tgcaagcagg tccaagattg tgcacattga cattgaccca gctgagattg gcaagaacaa 60
gcagccacat gtctccattt gtgcagatgt taagcttgct ttacaggggt tgaatgctct 120
attaaatggg agcaaagcac aacagggtct ggattttggt ccatggcaca aggagttgga 180
tcagcagaag agggagtttc ctctaggatt caagactttt ggtgaggcca tcccgccgca 240
atatgctatc caggtactgg atgagctgac aaaaggggag gcgatcattg ccaccggtgt 300
tgggcagcat cagatgtggg cggctcagta ttacacttac aagcggccac ggcagtggct 360
gtcttcatcc ggtttgggtg caatgggatt tgggttgcca gctgcagctg gcgctgctgt 420
ggccaaccca ggtgttacag ttgttgacat tgatggggat ggtagtttcc tcatgaacat 480
tcaggagttg gcgttgatcc gtattgagaa cctcccagtg aaggtgatga tattgaacaa 540
ccagcatctg ggaatggtgg tgcagtggga ggataggttt tacaaggcca accgggcgca 600
cacatacctt ggcaacccag aaaatgagag tgagatatat ccagattttg tgacgattgc 660
taaaggattc aacgttccgg cagttcgtgt gacgaagaag agcgaagtca ctgcagcaat 720
caagaagatg cttgagaccc cagggccata cttgttggat atcattgtcc cgcatcagga 780
gcacgtgctg cctatgatcc caaatggtgg tgcttttaag gacatgatca tggagggtga 840
tggcaggacc tcgtactgaa atttcgacct acaagaccta caagtgtgac atgcgcaatc 900
agcatgatac ctgcgtgttg tatcaactac tgggggttca actgtgaacc atgcgttttc 960
tagtttgctt gtttcattca tataagcttg tgttacttag ttccgaaccg tgtagttttg 1020
tagtctctgt tctcttttgt agggatgtgc tgtcataaga tatcatgcaa gtttcttgtc 1080
ctacatatca ataataagca cttccatgga ataattctca gttctgtttt gaatttcaca 1140
tcttctcacg aacagtgtgc tggttccttt ctgttacttt acatgcctgc cgtgtcaggt 1200
tatgacataa cgaccgatgg aggattggag ggtggtcggc tggttttaga cggggaattg 1260
aaacattttt ctggaagaaa tctgaataca gttgggaggg gaaatggaag catatattta 1320
tcgagcccgc tatccaggct aatttatcaa gcactagaca gtgtagggtg ttggcattct 1380
tctcttcctt gatatccggc ttgagaggag agattgaggc ttcggctgtg ttggttgctg 1440
atttctacag cattttgaga gagagagaga gatgttgcaa ctgtgttttg tcttggttgc 1500
ttgtacagag aaagagatga catttagaga tatgcagatc gtttaccagt tgtgctgcgt 1560
ttattcgtac tg 1572
<210> 67
<211> 1571
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000134
<400> 67
tgcaagcagg tccaagattg tgcacattga cattgaccca gctgagattg gcaagaacaa 60
gcagccacat gtctccattt gtgcagatgt taagcttgct ttacaggggt tgaatgatct 120
attaaatggg agcaaagcac aacagggtct ggattttggt ccatggcaca aggagttgga 180
tcagcagaag agggagtttc ctctaggatt caagactttt ggcgaggcca tcccgccgca 240
atatgctatc caggtactgg atgagctgac aaaaggggag gcgatcattg ccactggtgt 300
tgggcagcac cagatgtggg cggctcagta ttacacttac aagcggccac ggcagtggct 360
gtcttcgtct ggtttggggg caatgggatt tgggttacca gctgcagctg gcgctgctgt 420
ggccaaccca ggtgttacag ttgttgacat tgatggtgat ggtagtttcc tcatgaacat 480
tcaggagttg gcgttgatcc gcattgagaa cctcccagtg aaggtgatga tattgaacaa 540
ccagcatctg ggaatggtgg tgcagtggga ggataggttt tacaaggcca atcgggcgca 600
cacatacctt ggcaacccag aaaatgagag tgagatatat ccagattttg tgacgattgc 660
taaaggattc aacgttccag cagttcgagt gacgaagaag agcgaagtca ctgcagcaat 720
caagaagatg cttgagaccc cagggccata cttgttggat atcatagtcc cgcatcagga 780
gcacgtgctg cctatgatcc caatcggtgg tgctttcaag gacatgatca tggagggtga 840
tggcaggacc tcgtactgaa atttcgacct acaagaccta caagtgtgac atgcgcaatc 900
agcatgatgc ccgcgtgttg tatcaactac taggggttca actgtgagcc atgcgttttc 960
tagtttgctt gtttcattca tataagcttg tattacttag ttccgaaccc tgtagttttg 1020
tagtctatgt tctcttttgt agggatgtgc tgtcataaga tgtcatgcaa gtttcttgtc 1080
ctacatatca ataataagta cttccatgga ataattctca gttctgtttt gaattttgca 1140
tcttctcaca aacagtgtgc tggttccttt ctgttacttt acatgtctgc tgtgtcaggt 1200
tctgacataa cgaccgatgg agggtggtcg gcaggtttta gaaggggaat tgaaactttt 1260
ttttgggaag aagtctgaat acagttggga ggaaaaatag aagtatatac ttcgattaat 1320
ttatcaagcc cgctatccag tctaatttat caagcactag acagtgtagg gtgttggcat 1380
tcttctcttc cttgagatcc ggcttgagag gagagaccga ggcttcggct gtgttggttg 1440
ctgatttcta cagctttttg agatagagag agagatcctg caactgtggt ttgtcttgct 1500
gcttgtacag cgagagagac attgagagat atgtagatcg tttaccagtt gtgctgctgt 1560
tattcgtact g 1571
<210> 68
<211> 1571
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000135
<400> 68
tgcaagcagg tccaagattg tgcacattga cattgaccca gctgagattg gcaagaacaa 60
gcagccacat gtctccattt gtgcagatgt taagcttgct ttacaggggt tgaatgatct 120
attaaatggg agcaaagcac aacagggtct ggattttggt ccatggcaca aggagttgga 180
tcagcagaag agggagtttc ctctaggatt caagactttt ggcgaggcca tcccgccgca 240
atatgctatc caggtactgg atgagctgac aaaaggggag gcgatcattg ccactggtgt 300
tgggcagcac cagatgtggg cggctcagta ttacacttac aagcggccac ggcagtggct 360
gtcttcgtct ggtttggggg caatgggatt tgggttacca gctgcagctg gcgctgctgt 420
ggccaaccca ggtgttacag ttgttgacat tgatggtgat ggtagtttcc tcatgaacat 480
tcaggagttg gcgttgatcc gcattgagaa cctcccagtg aaggtgatga tattgaacaa 540
ccagcatctg ggaatggtgg tgcagtggga ggataggttt tacaaggcca atcgggcgca 600
cacatacctt ggcaacccag aaaatgagag tgagatatat ccagattttg tgacgattgc 660
taaaggattc aacgttccag cagttcgagt gacgaagaag agcgaagtca ctgcagcaat 720
caagaagatg cttgagaccc cagggccata cttgttggat atcatagtcc cgcatcagga 780
gcacgtgatg cctatgatcc caaatggtgg tgctttcaaa gacatgatca tggagggtga 840
tggcaggacc tcgtactgaa atttcgacct acaagaccta caagtgtgac atgcgcaatc 900
agcatgatgc ccgcgtgttg tatcaactac taggggttca actgtgagcc atgcgttttc 960
tagtttgctt gtttcattca tataagcttg tattacttag ttccgaaccc tgtagttttg 1020
tagtctatgt tctcttttgt agggatgtgc tgtcataaga tgtcatgcaa gtttcttgtc 1080
ctacatatca ataataagta cttccatgga ataattctca gttctgtttt gaattttgca 1140
tcttctcaca aacagtgtgc tggttccttt ctgttacttt acatgtctgc tgtgtcaggt 1200
tctgacataa cgaccgatgg agggtggtcg gcaggtttta gaaggggaat tgaaactttt 1260
ttttgggaag aagtctgaat acagttggga ggaaaaatag aagtatatac ttcgattaat 1320
ttatcaagcc cgctatccag tctaatttat caagcactag acagtgtagg gtgttggcat 1380
tcttctcttc cttgagatcc ggcttgagag gagagaccga ggcttcggct gtgttggttg 1440
ctgatttcta cagctttttg agatagagag agagatcctg caactgtggt ttgtcttgct 1500
gcttgtacag cgagagagac attgagagat atgtagatcg tttaccagtt gtgctgctgt 1560
tattcgtact g 1571
<210> 69
<211> 1573
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000131
<400> 69
tgcaagcagg tccaagattg tgcacattga cattgaccca gctgagattg gcaagaacaa 60
gcagccacat gtctccattt gtgcagatgt taagcttgct ttacaggggt tgaatgatct 120
attaaatggg agcaaagcac aacagggtct ggattttggt ccatggcaca aggagttgga 180
tcagcagaag agggagtttc ctctaggatt caagactttt ggcgaggcca tcccgccgca 240
atatgctatc caggtactgg atgagctgac aaaaggggag gcgatcattg ccactggtgt 300
tgggcagcac cagatgtggg cggctcagta ttacacttac aagcggccac ggcagtggct 360
gtcttcgtct ggtttggggg caatgggatt tgggttacca gctgcagctg gcgctgctgt 420
ggccaaccca ggtgttacag ttgttgacat tgatggtgat ggtagtttcc tcatgaacat 480
tcaggagttg gcgttgatcc gcattgagaa cctcccagtg aaggtgatga tattgaacaa 540
ccagcatctg ggaatggtgg tgcagtggga ggataggttt tacaaggcca atcgggcgca 600
cacatacctt ggcaacccag aaaatgagag tgagatatat ccagattttg tgacgattgc 660
taaaggattc aacgttccag cagttcgagt gacgaagaag agcgaagtca ctgcagcaat 720
caagaagatg cttgagaccc cagggccata cttgttggat atcatagtcc cgcatcagga 780
gcacgtgctg ccgaattcat cccaagcggt ggtgctttca aggacatgat catggagggt 840
gatggcagga cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa 900
tcagcatgat gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt 960
tctagtttgc ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt 1020
tgtagtctat gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg 1080
tcctacatat caataataag tacttccatg gaataattct cagttctgtt ttgaattttg 1140
catcttctca caaacagtgt gctggttcct ttctgttact ttacatgtct gctgtgtcag 1200
gttctgacat aacgaccgat ggagggtggt cggcaggttt tagaagggga attgaaactt 1260
ttttttggga agaagtctga atacagttgg gaggaaaaat agaagtatat acttcgatta 1320
atttatcaag cccgctatcc agtctaattt atcaagcact agacagtgta gggtgttggc 1380
attcttctct tccttgagat ccggcttgag aggagagacc gaggcttcgg ctgtgttggt 1440
tgctgatttc tacagctttt tgagatagag agagagatcc tgcaactgtg gtttgtcttg 1500
ctgcttgtac agcgagagag acattgagag atatgtagat cgtttaccag ttgtgctgct 1560
gttattcgta ctg 1573
<210> 70
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 70
tgagcctctc gtcgccgatc acat 24
<210> 71
<211> 1159
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000433
<400> 71
ccactcttgc cctacacgac actgaagacc ttatgattcc aaacggcggc gccttcaagg 60
acatgatcat ggagggtgat ggcaggacct cgtactgaaa tttcgaccta caagacctac 120
aagtgtgaca tgcgcaatca gcatggtgcc cgcgtgttgt atcaactact aggggttcaa 180
ctgtgaacca tgcgttttct agtttgcttg tttcattcat ataagcttgt gttacttagt 240
tccgaaccct gtagctttgt agtctatgct ctcttttgta gggatgtgct gtcataagat 300
atcatgcaag tttcttgtcc tacatatcaa taataagtac ttccatggaa taattctcag 360
ttctgttttg aattttgcat cttctcacaa acagtgtgct ggttcctttc tgttcgctga 420
cgccctcctc gactccatcc ccatggtcgc catcacgggc caggtccccc gccgcatgat 480
cggtagcgac ttcgtgggcg aggaaagcct ttcgtccaag gtggtccctc ctcgcaatct 540
tgttggatgg tgaatattat aaaagcctgc ccttctcgcg ggtaagactc ccgcccatcc 600
aggatgagga tgaccagcct tttgcagttt atccactagg gacaggattg catcctgccg 660
aaaccctgcc aagcttgagg tagcctccaa tttgacggtg ccgccagcga cgccgtctgg 720
aactgtcctt tttgaggacc actccgtttg tctagaggta cctggagatc atgacattaa 780
ggatgaccag ttcgtaaagg tcctgcggtg tctattgctt ttcataggtt aataagtgtt 840
tgctagactg tggtgaaagg ccaagactcc cgcccatctc tctatgcccg ggacaagtgc 900
caccccacag tggggcagga tgaggatgac caaagactcc cgcccatctc actagggaca 960
ggattggcct tttgcagttt atctctatgc ccgggacaag tgtatccgaa gtaaataaaa 1020
ccatcggact ctcgtataag actgtcgact cgaccggccg acgcataggt tcatttgaag 1080
ctgctattct atttaaattg aaactcggac ggtagcagtg tggtatgagg tcttcagcac 1140
actcggtaac tccagtcac 1159
<210> 72
<211> 2479
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000434
<400> 72
ccactcttgc cctacacgac actgaagacg tcgccattac cgggcaagtg acccgccgca 60
tgatcggcac ggacgcgttc caggagacgc ccatagtgga ggtcacgcgc tccatcacca 120
agcacaacta cctggtcctt gacgtggagg atatcccccg cgtcatccag gaagccttct 180
tccttgcatc ctctggccgc ccggggccgg tgctagttga tatccccaag gacatccagc 240
agcagatggc tgtgcccgtc tgggacactc caatgagttt gccagggtac atcgcccgcc 300
tgcccaagcc accatctact gaatcgcttg agcaggtcct gcgtctggtt ggcgagtcac 360
ggcgcccaat tctgtatgtt ggtggtggct gcgctgcgtc tggcgaggag ttgcgccgct 420
ttgttgagct tactgggatt ccagttacaa ctactctgat gggccttggc aacttcccca 480
gcgacgaccc actgtctctg cgcatgcttg ggatgcatgg cactgtgtat gcaaattatg 540
cagtagataa ggctgacctg ttgctcgcat ttggtgtgcg gtttgatgat cgtgtgactg 600
ggaaaatcga ggcttttgca agcaggtcca agattgtgca cattgacatt gacccagctg 660
agattggcaa gaacaagcag ccacatgtct ccatttgtgc agatgttaag cttgctttac 720
aggggttgaa tgatctatta aatgggagca aagcacaaca gggtctggat tttggtccat 780
ggcacaagga gttggatcag cagaagaggg agtttcctct aggattcaag acttttggcg 840
aggccatccc gccgcaatat gctatccagg tactggatga gctgacaaaa ggggaggcga 900
tcattgccac tggtgttggg cagcaccaga tgtgggcggc tcagtattac acttacaagc 960
ggccacggca gtggctgtct tcgtctggtt tgggggcaat gggatttggg ttaccagctg 1020
cagctggcgc tgctgtggcc aacccaggtg ttacagttgt tgacattgat ggtgatggta 1080
gtttcctcat gaacattcag gagttggcgt tgatccgcat tgagaacctc ccagtgaagg 1140
tgatgatatt gaacaaccag catctgggaa tggtggtgca gtgggaggat aggttttaca 1200
aggccaatcg ggcgcacaca taccttggca acccagaaaa tgagagtgag atatatccag 1260
attttgtgac gattgctaaa ggattcaacg ttccagcagt tcgagtgacg aagaagagcg 1320
aagtcactgc agcaatcaag aagatgcttg agaccccagg gccatacttg ttggatatca 1380
tagtcccgca tcaggagcac gtgctgccta tgatcccaag cggtggtgct ttcaaggaca 1440
tgatcatgga gggtgatggc aggacctcgt actgaaattt cgacctacaa gacctacaag 1500
tgtgacatgc gcaatcagca tggtgcccgc gtgttgtatc aactactagg ggttcaactg 1560
tgaaccatgc gttttctagt ttgcttgttt cattcatata agcttgtgtt acttagttcc 1620
gaaccctgta gctttgtagt ctatgctctc ttttgtaggg atgtgctgtc ataagatatc 1680
atgcaagttt cttgtcctac atatcaataa taagtacttc catggaataa ttctcagttc 1740
tgttttgaat tttgcatctt ctcacaaaca gtgtgctggt tcctttctgt tctacgcccg 1800
cgcgtccggc cgcgtcggcg tctgcgtcgc cacctccggc ccgggggcca ccaacctcgt 1860
ctccgtagcg acttcgtggg cgaggaaagc ctttcgtcca aggtggtccc tcctcgcaat 1920
cttgttggat ggtgaatatt ataaaagcct gcccttctcg cgggtgagtc catgctcaac 1980
accgtgcact agggacagga ttggcctttt gcagtttatc cactagggac aggattgcat 2040
cctgccgaaa ccctgccaag cttgaggtag cctccaattt gacggtgccg ccagcgacgc 2100
cgtctggaac tgtccttttt gaggaccact ccgtttgtct agaggtacct ggagatcatg 2160
acattaagga tgaccagttc gtaaaggtcc tgcggtgtct attgcttttc ataggttaat 2220
aagtgtttgc tagactgtgg tgaaaggccg ccttttgcag tttatctcta gaaagactgg 2280
agttgcagaa agactcccgc ccatccagga tgaggatgac catatccgaa gtaaataaaa 2340
ccatcggact ctcgtataag actgtcgact cgaccggccg acgcataggt tcatttgaag 2400
ctgctattct atttaaattg aaactcggac ggtagcagtg tggtatgagg tcttcagcac 2460
actcggtaac tccagtcac 2479
<210> 73
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 73
Gln Gln Trp Asp Arg Lys Gln
1 5
<210> 74
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000152
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (4)..(4)
<223> n представляет собой a, c, g или t
<400> 74
tnantggtta ggtgctggtg gtccgaaggt ccacgccgcc aactacg 47
<210> 75
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000152
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (4)..(4)
<223> n представляет собой a, c, g или t
<400> 75
cnantacgta gttggcggcg tggaccttcg gaccaccagc acctaac 47
<210> 76
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000149
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (4)..(4)
<223> n представляет собой a, c, g или t
<400> 76
tnantggtta ggtgctggtg gtccgaaggt ccacgccgcc aactacg 47
<210> 77
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000149
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (4)..(4)
<223> n представляет собой a, c, g или t
<400> 77
angngtcgta gttggcggcg tggaccttcg gaccaccagc acctaac 47
<210> 78
<211> 197
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000153
<400> 78
tggatatcat agtcccgcat caggagcacg tgctgcctat gatcccaagc ggtggtgctt 60
tcaaggacat gatcatgggt taggtgctgg tggtccgaag gtccacgccg ccaactacgt 120
ggatatcata gtcccgcatc aggagcacgt gctgcctatg atcccaagcg gtggtgcttt 180
caaggacatg atcatgg 197
<210> 79
<211> 197
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000153
<400> 79
ccatgatcat gtccttgaaa gcaccaccgc ttgggatcat aggcagcacg tgctcctgat 60
gcgggactat gatatccacg tagttggcgg cgtggacctt cggaccacca gcacctaacc 120
catgatcatg tccttgaaag caccaccgct tgggatcata ggcagcacgt gctcctgatg 180
cgggactatg atatcca 197
<210> 80
<211> 197
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000150
<400> 80
tggatatcat agtcccgcat caggagcacg tgctgcctat gatcccaagc ggtggtgctt 60
tcaaggacat gatcatgggt taggtgctgg tggtccgaag gtccacgccg ccaactacgg 120
atggcaggac ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat 180
cagcatgatg cccgcgt 197
<210> 81
<211> 197
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000150
<400> 81
acgcgggcat catgctgatt gcgcatgtca cacttgtagg tcttgtaggt cgaaatttca 60
gtacgaggtc ctgccatccg tagttggcgg cgtggacctt cggaccacca gcacctaacc 120
catgatcatg tccttgaaag caccaccgct tgggatcata ggcagcacgt gctcctgatg 180
cgggactatg atatcca 197
<210> 82
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (19)..(19)
<223> n представляет собой a, c, g или t
<400> 82
ggagttggcg ttgatccgnc 20
<210> 83
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (26)..(26)
<223> n представляет собой a, c, g или t
<400> 83
aactacaggg ttcggaacta agtaant 27
<210> 84
<211> 102
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000267
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (4)..(4)
<223> n представляет собой a, c, g или t
<400> 84
tnantgattc ccaatggcgg cgctttcaag gacatgatca tggagggtga tggcaggacc 60
tcgtactgaa atggtccgaa ggtccacgcc gccaactacg ag 102
<210> 85
<211> 102
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000267
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (4)..(4)
<223> n представляет собой a, c, g или t
<400> 85
cnantactcg tagttggcgg cgtggacctt cggaccattt cagtacgagg tcctgccatc 60
accctccatg atcatgtcct tgaaagcgcc gccattggga at 102
<210> 86
<211> 85
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000268
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (4)..(4)
<223> n представляет собой a, c, g или t
<400> 86
tnantgattc ccaatggcgg cgctttcaag gacatgatca tggagggtga tggcaggacc 60
tcgtactgaa atttgcaggt acaag 85
<210> 87
<211> 85
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000268
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (4)..(4)
<223> n представляет собой a, c, g или t
<400> 87
angngtcttg tacctgcaaa tttcagtacg aggtcctgcc atcaccctcc atgatcatgt 60
ccttgaaagc gccgccattg ggaat 85
<210> 88
<211> 6661
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000143
<400> 88
tggcaggata tattgtggtg taaacaaatt gacgcttaga caacttaata acacattgcg 60
gacgttttta atgtactgaa ttaacgccga attgaattcg agctcggtac cactggattt 120
tggttttagg aattagaaat tttattgata gaagtatttt acaaatacaa atacatacta 180
agggtttctt atatgctcaa cacatgagcg aaaccctata agaaccctaa ttcccttatc 240
tgggaactac tcacacatta ttctggagaa aaatagagag agatagattt gtagagagag 300
actggtgatt tttgcggact ctattagatc tgggtaactg gcctaactgg ccttggagga 360
gctggcaact caaaatccct ttgccaaaaa ccaacatcat gccatccacc atgcttgtat 420
ccagctgcgc gcaatgtacc ccgggctgtg tatcccaaag cctcatgcaa cctaacagat 480
ggatcgtttg gaaggcctat aacagcaacc acagacttaa aaccttgcgc ctccatagac 540
ttaagcaaat gtgtgtacaa tgtggatcct aggcccaacc tttgatgcct atgtgacacg 600
taaacagtac tctcaactgt ccaatcgtaa gcgttcctag ccttccaggg cccagcgtaa 660
gcaataccag ccacaacacc ctcaacctca gcaaccaacc aagggtatct atcttgcaac 720
ctctcgagat catcaatcca ctcttgtggt gtttgtggct ctgtcctaaa gttcactgta 780
gacgtctcaa tgtaatggtt aacgatatca caaaccgcgg ccatatcagc tgctgtagct 840
ggcctaatct caactggtct cctctccgga gacatggctt ctacctacaa aaaagctccg 900
cacgaggctg catttgtcac aaatcatgaa aagaaaaact accgatgaac aatgctgagg 960
gattcaaatt ctacccacaa aaagaagaaa gaaagatcta gcacatctaa gcctgacgaa 1020
gcagcagaaa tatataaaaa tataaaccat agtgcccttt tcccctcttc ctgatcttgt 1080
ttagcatggc ggaaatttta aaccccccat catctccccc aacaacggcg gatcgcagat 1140
ctacatccga gagccccatt ccccgcgaga tccgggccgg atccacgccg gcgagagccc 1200
cagccgcgag atcccgcccc tcccgcgcac cgatctgggc gcgcacgaag ccgcctctcg 1260
cccacccaaa ctaccaaggc caaagatcga gaccgagacg gaaaaaaaaa acggagaaag 1320
aaagaggaga ggggcggggt ggttaccggc gcggcggcgg cggaggggga ggggggagga 1380
gctcgtcgtc cggcagcgag gggggaggag gtggaggtgg tggtggtggt ggtggtaggg 1440
ttggggggat gggaggagag gggggggtat gtatatagtg gcgatggggg gcgtttcttt 1500
ggaagcggag ggagggccgg cctcgtcgct ggctcgcgat cctcctcgcg tttccggccc 1560
ccacgacccg gacccacctg ctgttttttc tttttctttt ttttctttct tttttttttt 1620
ttggctgcga gacgtgcggt gcgtgcggac aactcacggt gatagtgggg gggtgtggag 1680
actattgtcc agttggctgg actggggtgg gttgggttgg gttgggttgg gctgggcttg 1740
ctatggatcg tggatagcac tttgggcttt aggaacttta ggggttgttt ttgtaaatgt 1800
tttgagtcta agtttatctt ttatttttac tagaaaaaat acccatgcgc tgcaacgggg 1860
gaaagctatt ttaatcttat tattgttcat tgtgagaatt cgcctgaata tatatttttc 1920
tcaaaaatta tgtcaaatta gcatatgggt ttttttaaag atatttctta tacaaatccc 1980
tctgtattta caaaagcaaa cgaacttaaa acccgactca aatacagata tgcatttcca 2040
aaagcgaata aacttaaaaa ccaattcata caaaaatgac gtatcaaagt accgacaaaa 2100
acatcctcaa tttttataat agtagaaaag agtaaatttc actttgggcc accttttatt 2160
accgatattt tactttatac caccttttaa ctgatgtttt cacttttgac caggtaatct 2220
tacctttgtt ttattttgga ctatcccgac tctcttctca agcatatgaa tgacctcgag 2280
tatgctagtc tagagtcgac ctgcagggtg cagcgtgacc cggtcgtgcc cctctctaga 2340
gataatgagc attgcatgtc taagttataa aaaattacca catatttttt ttgtcacact 2400
tgtttgaagt gcagtttatc tatctttata catatattta aactttactc tacgaataat 2460
ataatctata gtactacaat aatatcagtg ttttagagaa tcatataaat gaacagttag 2520
acatggtcta aaggacaatt gagtattttg acaacaggac tctacagttt tatcttttta 2580
gtgtgcatgt gttctccttt ttttttgcaa atagcttcac ctatataata cttcatccat 2640
tttattagta catccattta gggtttaggg ttaatggttt ttatagacta atttttttag 2700
tacatctatt ttattctatt ttagcctcta aattaagaaa actaaaactc tattttagtt 2760
tttttattta ataatttaga tataaaatag aataaaataa agtgactaaa aattaaacaa 2820
atacccttta agaaattaaa aaaactaagg aaacattttt cttgtttcga gtagataatg 2880
ccagcctgtt aaacgccgtc gacgagtcta acggacacca accagcgaac cagcagcgtc 2940
gcgtcgggcc aagcgaagca gacggcacgg catctctgtc gctgcctctg gacccctctc 3000
gagagttccg ctccaccgtt ggacttgctc cgctgtcggc atccagaaat tgcgtggcgg 3060
agcggcagac gtgagccggc acggcaggcg gcctcctcct cctctcacgg cacggcagct 3120
acgggggatt cctttcccac cgctccttcg ctttcccttc ctcgcccgcc gtaataaata 3180
gacaccccct ccacaccctc tttccccaac ctcgtgttgt tcggagcgca cacacacaca 3240
accagatctc ccccaaatcc acccgtcggc acctccgctt caaggtacgc cgctcgtcct 3300
cccccccccc ccctctctac cttctctaga tcggcgttcc ggtccatggt tagggcccgg 3360
tagttctact tctgttcatg tttgtgttag atccgtgttt gtgttagatc cgtgctgcta 3420
gcgttcgtac acggatgcga cctgtacgtc agacacgttc tgattgctaa cttgccagtg 3480
tttctctttg gggaatcctg ggatggctct agccgttccg cagacgggat cgatttcatg 3540
attttttttg tttcgttgca tagggtttgg tttgcccttt tcctttattt caatatatgc 3600
cgtgcacttg tttgtcgggt catcttttca tgcttttttt tgtcttggtt gtgatgatgt 3660
ggtctggttg ggcggtcgtt ctagatcgga gtagaattct gtttcaaact acctggtgga 3720
tttattaatt ttggatctgt atgtgtgtgc catacatatt catagttacg aattgaagat 3780
gatggatgga aatatcgatc taggataggt atacatgttg atgcgggttt tactgatgca 3840
tatacagaga tgctttttgt tcgcttggtt gtgatgatgt ggtgtggttg ggcggtcgtt 3900
cattcgttct agatcggagt agaatactgt ttcaaactac ctggtgtatt tattaatttt 3960
ggaactgtat gtgtgtgtca tacatcttca tagttacgag tttaagatgg atggaaatat 4020
cgatctagga taggtataca tgttgatgtg ggttttactg atgcatatac atgatggcat 4080
atgcagcatc tattcatatg ctctaacctt gagtacctat ctattataat aaacaagtat 4140
gttttataat tattttgatc ttgatatact tggatgatgg catatgcagc agctatatgt 4200
ggattttttt agccctgcct tcatacgcta tttatttgct tggtactgtt tcttttgtcg 4260
atgctcaccc tgttgtttgg tgttacttct gcaggaggat cacaagtttg tacaaaaaag 4320
caggctatgg ccgccgccac ctcccccgcc gtcgcattct cgggcgccac cgccgccgcc 4380
atgcccaaac ccgcccgcca tcctctcccg cgccaccagc ccgtctcgcg ccgcgcgctc 4440
cccgcccgcg tcgtcaggtg ttgcgccgcg tcccccgccg ccacctccgc cgcgcctccc 4500
gcaaccgcgc tccggccctg gggcccgtcc gagccccgca agggcgccga catcctcgtc 4560
gaggcgctcg agcgctgcgg catcgtcgac gtcttcgcct accccggcgg cgcctccatg 4620
gagatccacc aggcgctgac gcgctcgccc gtcatcacca accacctctt ccgccacgag 4680
cagggggagg cgttcgcggc gtccggctac gcccgcgcgt ccggccgcgt cggcgtctgc 4740
gtcgccacct ccggcccggg ggccaccaac ctcgtctccg cgctcgccga cgccctcctc 4800
gactccatcc ccatggtcgc catcacgggc caggtccccc gccgcatgat cggcacggac 4860
gcgttccagg agacgcccat agtggaggtc acgcgctcca tcaccaagca caactacctg 4920
gtccttgacg tggaggatat cccccgcgtc atccaggaag ccttcttcct tgcatcctct 4980
ggccgcccgg ggccggtgct agttgatatc cccaaggaca tccagcagca gatggctgtg 5040
cccgtctggg acactccaat gagtttgcca gggtacatcg cccgcctgcc caagccacca 5100
tctactgaat cgcttgagca ggtcctgcgt ctggttggcg agtcacggcg cccaattctg 5160
tatgttggtg gtggctgcgc tgcgtctggc gaggagttgc gccgctttgt tgagcttact 5220
gggattccag ttacaactac tctgatgggc cttggcaact tccccagcga cgacccactg 5280
tctctgcgca tgcttgggat gcatggcact gtgtatgcaa attatgcagt agataaggct 5340
gacctgttgc tcgcatttgg tgtgcggttt gatgatcgtg tgactgggaa aatcgaggct 5400
tttgcaagca ggtccaagat tgtgcacatt gacattgacc cagctgagat tggcaagaac 5460
aagcagccac atgtctccat ttgtgcagat gttaagcttg ctttacaggg gttgaatgat 5520
ctattaaatg ggagcaaagc acaacagggt ctggattttg gtccatggca caaggagttg 5580
gatcagcaga agagggagtt tcctctagga ttcaagactt ttggcgaggc catcccgccg 5640
caatatgcta tccaggtact ggatgagctg acaaaagggg aggcgatcat tgccactggt 5700
gttgggcagc accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg 5760
ctgtcttcgt ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct 5820
gtggccaacc caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac 5880
attcaggagt tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac 5940
aaccagcatc tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg 6000
cacacatacc ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt 6060
gctaaaggat tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca 6120
atcaagaaga tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag 6180
gagcacgtgc tgcctatgat cccaaatggt ggtgctttca aggacatgat catggagggt 6240
gatggcagga cctcgtactg atacccagct ttcttgtaca aagtggtgat cctactagta 6300
gaaggagtgc gtcgaagcag atcgttcaaa catttggcaa taaagtttct taagattgaa 6360
tcctgttgcc ggtcttgcga tgattatcat ataatttctg ttgaattacg ttaagcatgt 6420
aataattaac atgtaatgca tgacgttatt tatgagatgg gtttttatga ttagagtccc 6480
gcaattatac atttaatacg cgatagaaaa caaaatatag cgcgcaaact aggataaatt 6540
atcgcgcgcg gtgtcatcta tgttactaga tcgaaagctt agcttgagct tggatcagat 6600
tgtcgtttcc cgccttcagt ttaaactatc agtgtttgac aggatatatt ggcgggtaaa 6660
c 6661
<210> 89
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 89
attttccatt cacttggccc 20
<210> 90
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 90
tgctatctgg ctcagctgc 19
<210> 91
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность зонда
<400> 91
atggtggaag ggcggttgtg a 21
<210> 92
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 92
ctcccgcgca ccgatctg 18
<210> 93
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 93
cccgcccctc tcctctttc 19
<210> 94
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность зонда
<400> 94
aagccgcctc tcgcccaccc a 21
<210> 95
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 95
aycagatgtg ggcggctcag tat 23
<210> 96
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 96
gggatatgta ggacaagaaa cttgcatga 29
<210> 97
<211> 880
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 97
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatt cccaatggcg gcgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatggtccga aggtccacgc cgccaactac gagtatgatc ccaagcggtg 600
gtgctttcaa ggacatgatc atggagggtg atggcaggac ctcgtactga aatttcgacc 660
tacaagacct acaagtgtga catgcgcaat cagcatggtg cccgcgtgtt gtatcaacta 720
ctaggggttc aactgtgaac catgcgtttt ctagtttgct tgtttcattc atataagctt 780
gtgttactta gttccgaacc ctgtagcttt gtagtctatg ctctcttttg tagggatgtg 840
ctgtcataag atatcatgca agtttcttgt cctacatatc 880
<210> 98
<211> 776
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 98
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gccttcccaa gcggtggtgc tttcaaggac atgatcatgg agggtgatgg caggacctcg 540
tactgaaatt tcgacctaca agacctacaa gtgtgacatg cgcaatcagc atggtgcccg 600
cgtgttgtat caactactag gggttcaact gtgaaccatg cgttttctag tttgcttgtt 660
tcattcatat aagcttgtgt tacttagttc cgaaccctgt agctttgtag tctatgctct 720
cttttgtagg gatgtgctgt cataagatat catgcaagtt tcttgtccta catatc 776
<210> 99
<211> 866
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 99
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtga 480
atggcggcgc tttcaaggac atgatcatgg agggtgatgg caggacctcg tactgaaatg 540
gtccgaaggt ccacgccgcc aactacgagt atgatcccaa gcggtggtgc ttttaaggac 600
atgatcatgg agggtgatgg caggacctcg tactgaaatt tcgacctaca agacctacaa 660
gtgtgacatg cgcaatcagc atgatacctg cgtgttgtat caactactgg gggttcaact 720
gtgaaccatg cgttttctag tttgcttgtt tcattcatat aagcttgtgt tacttagttc 780
cgaaccgtgt agttttgtag tctctgttct cttttgtagg gatgtgctgt cataagatat 840
catgcaagtt tcttgtccta catatc 866
<210> 100
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 100
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 101
<211> 867
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 101
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctaatgg cggcgctttc aaggacatga tcatggaggg tgatggcagg acctcgtact 540
gaaatggtcc gaaggtccac gccgccaact acgagtccca agcggtggtg ctttcaagga 600
catgatcatg gagggtgatg gcaggacctc gtactgaaat ttcgacctac aagacctaca 660
agtgtgacat gcgcaatcag catgatgccc gcgtgttgta tcaactacta ggggttcaac 720
tgtgagccat gcgttttcta gtttgcttgt ttcattcata taagcttgta ttacttagtt 780
ccgaaccctg tagttttgta gtctatgttc tcttttgtag ggatgtgctg tcataagatg 840
tcatgcaagt ttcttgtcct acatatc 867
<210> 102
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 102
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 103
<211> 763
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 103
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacaagcg 480
gtggtgcttt caaggacatg atcatggagg gtgatggcag gacctcgtac tgaaatttcg 540
acctacaaga cctacaagtg tgacatgcgc aatcagcatg gtgcccgcgt gttgtatcaa 600
ctactagggg ttcaactgtg aaccatgcgt tttctagttt gcttgtttca ttcatataag 660
cttgtgttac ttagttccga accctgtagc tttgtagtct atgctctctt ttgtagggat 720
gtgctgtcat aagatatcat gcaagtttct tgtcctacat atc 763
<210> 104
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 104
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 105
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 105
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 106
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 106
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 107
<211> 876
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 107
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat tcccaatggc ggcgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatggtccg aaggtccacg ccgccaacta cgagtcccaa gcggtggtgc 600
tttcaaggac atgatcatgg agggtgatgg caggacctcg tactgaaatt tcgacctaca 660
agacctacaa gtgtgacatg cgcaatcagc atgatgcccg cgtgttgtat caactactag 720
gggttcaact gtgagccatg cgttttctag tttgcttgtt tcattcatat aagcttgtat 780
tacttagttc cgaaccctgt agttttgtag tctatgttct cttttgtagg gatgtgctgt 840
cataagatgt catgcaagtt tcttgtccta catatc 876
<210> 108
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 108
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 109
<211> 880
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 109
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatt cccaatggcg gcgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatggtccga aggtccacgc cgccaactac gagtatgatc ccaagcggtg 600
gtgctttcaa ggacatgatc atggagggtg atggcaggac ctcgtactga aatttcgacc 660
tacaagacct acaagtgtga catgcgcaat cagcatggtg cccgcgtgtt gtatcaacta 720
ctaggggttc aactgtgaac catgcgtttt ctagtttgct tgtttcattc atataagctt 780
gtgttactta gttccgaacc ctgtagcttt gtagtctatg ctctcttttg tagggatgtg 840
ctgtcataag atatcatgca agtttcttgt cctacatatc 880
<210> 110
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 110
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 111
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 111
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 112
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 112
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 113
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 113
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 114
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 114
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 115
<211> 880
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 115
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatt cccaatggcg gcgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatggtccga aggtccacgc cgccaactac gagtatgatc ccaagcggtg 600
gtgctttcaa ggacatgatc atggagggtg atggcaggac ctcgtactga aatttcgacc 660
tacaagacct acaagtgtga catgcgcaat cagcatggtg cccgcgtgtt gtatcaacta 720
ctaggggttc aactgtgaac catgcgtttt ctagtttgct tgtttcattc atataagctt 780
gtgttactta gttccgaacc ctgtagcttt gtagtctatg ctctcttttg tagggatgtg 840
ctgtcataag atatcatgca agtttcttgt cctacatatc 880
<210> 116
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 116
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 117
<211> 1041
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<220>
<221> дополнительный признак
<222> (604)..(604)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (605)..(605)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (606)..(606)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (607)..(607)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (608)..(608)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (609)..(609)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (610)..(610)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (611)..(611)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (612)..(612)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (613)..(613)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (614)..(614)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (615)..(615)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (616)..(616)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (617)..(617)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (618)..(618)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (619)..(619)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (620)..(620)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (621)..(621)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (622)..(622)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (623)..(623)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (624)..(624)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (625)..(625)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (626)..(626)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (627)..(627)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (628)..(628)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (629)..(629)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (630)..(630)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (631)..(631)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (632)..(632)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (633)..(633)
<223> n представляет собой a, c, g или t
<400> 117
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgtagttggc ggcgctttca aggacatgat catggagggt gatgkcagga cctcgtactg 540
aaatggtccg aaggtccacg cctcgtatga aatggtccga aggtccacgc cgccaactac 600
gagnnnnnnn nnnnnnnnnn nnnnnnnnnn nnntatgatt cccaatggcg gcttcccaat 660
ggcggcgctt tcaaggacat gatcatggag ggtgatggca ggacctcgta ctgaaatggt 720
ccgaaggtcc acgccgccaa ctacgatgat cccaagcggt ggtgctttta aggacatgat 780
catggagggt gatggcagga cctcgtactg aaatttcgac ctacaagacc tacaagtgtg 840
acatgcgcaa tcagcatgat acctgcgtgt tgtatcaact actgggggtt caactgtgaa 900
ccatgcgttt tctagtttgc ttgtttcatt catataagct tgtgttactt agttccgaac 960
cgtgtagttt tgtagtctct gttctctttt gtagggatgt gctgtcataa gatatcatgc 1020
aagtttcttg tcctacatat c 1041
<210> 118
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 118
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 119
<211> 881
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 119
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat tcccaatggc ggcgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatggtccg aaggtccacg ccgccaacta cgagtatgat cccaagcggt 600
ggtgctttca aggacatgat catggagggt gatggcagga cctcgtactg aaatttcgac 660
ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat gcccgcgtgt tgtatcaact 720
actaggggtt caactgtgag ccatgcgttt tctagtttgc ttgtttcatt catataagct 780
tgtattactt agttccgaac cctgtagttt tgtagtctat gttctctttt gtagggatgt 840
gctgtcataa gatgtcatgc aagtttcttg tcctacatat c 881
<210> 120
<211> 918
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 120
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat tcccaatggc ggcgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaaatggtcc gaaggtccac gccgccacct cgtactgaaa tggtccraag 600
gtccacgccg ccaactacga gtatgatccc aagcggtggt gctttcaagg acatgatcat 660
ggagggtgat ggcaggacct cgtactgara tttcgaccta caagacctac aagtgtgaca 720
tgcgcaatca gcatgatgcc cgcgtgttgt atcaactact aggggttcaa ctgtgagcca 780
tgcgttttct agtttgcttg tttcattcat ataagcttgt attacttagt tccgaaccct 840
gtagttttgt agtctatgtt ctcttttgta gggatgtgct gtcataagat gtcatgcaag 900
tttcttgtcc tacatatc 918
<210> 121
<211> 880
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 121
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatt cccaatggcg gcgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatggtccga aggtccacgc cgccaactac gagtatgatc ccaagcggtg 600
gtgctttcaa ggacatgatc atggagggtg atggcaggac ctcgtactga aatttcgacc 660
tacaagacct acaagtgtga catgcgcaat cagcatggtg cccgcgtgtt gtatcaacta 720
ctaggggttc aactgtgaac catgcgtttt ctagtttgct tgtttcattc atataagctt 780
gtgttactta gttccgaacc ctgtagcttt gtagtctatg ctctcttttg tagggatgtg 840
ctgtcataag atatcatgca agtttcttgt cctacatatc 880
<210> 122
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 122
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 123
<211> 745
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 123
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatgct tttaaggaca 480
tgatcatgga gggtgatggc aggacctcgt actgaaattt cgacctacaa gacctacaag 540
tgtgacatgc gcaatcagca tgatacctgc gtgttgtatc aactactggg ggttcaactg 600
tgaaccatgc gttttctagt ttgcttgttt cattcatata agcttgtgtt acttagttcc 660
gaaccgtgta gttttgtagt ctctgttctc ttttgtaggg atgtgctgtc ataagatatc 720
atgcaagttt cttgtcctac atatc 745
<210> 124
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 124
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 125
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 125
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 126
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 126
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 127
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 127
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 128
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 128
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 129
<211> 881
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 129
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat tcccaatggc ggcgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatggtccg aaggtccacg ccgccaacta cgagtatgat cccaagcggt 600
ggtgctttta aggacatgat catggagggt gatggcagga cctcgtactg aaatttcgac 660
ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat acctgcgtgt tgtatcaact 720
actgggggtt caactgtgaa ccatgcgttt tctagtttgc ttgtttcatt catataagct 780
tgtgttactt agttccgaac cgtgtagttt tgtagtctct gttctctttt gtagggatgt 840
gctgtcataa gatatcatgc aagtttcttg tcctacatat c 881
<210> 130
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 130
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 131
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 131
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatcgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatggt 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 132
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 132
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatcgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatggt 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 133
<211> 880
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 133
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatt cccaatggcg gcgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatggtccga aggtccacgc cgccaactac gagtatgatc ccaagcggtg 600
gtgctttcaa ggacatgatc atggagggtg atggcaggac ctcgtactga aatttcgacc 660
tacaagacct acaagtgtga catgcgcaat cagcatggtg cccgcgtgtt gtatcaacta 720
ctaggggttc aactgtgaac catgcgtttt ctagtttgct tgtttcattc atataagctt 780
gtgttactta gttccgaacc ctgtagcttt gtagtctatg ctctcttttg tagggatgtg 840
ctgtcataag atatcatgca agtttcttgt cctacatatc 880
<210> 134
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 134
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 135
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 135
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 136
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 136
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 137
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 137
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 138
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 138
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 139
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 139
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 140
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 140
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 141
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 141
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 142
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 142
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 143
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 143
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 144
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 144
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 145
<211> 880
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 145
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatt cccaatggcg gcgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatggtccga aggtccacgc cgccaactac gagtatgatc ccaagcggtg 600
gtgctttcaa ggacatgatc atggagggtg atggcaggac ctcgtactga aatttcgacc 660
tacaagacct acaagtgtga catgcgcaat cagcatggtg cccgcgtgtt gtatcaacta 720
ctaggggttc aactgtgaac catgcgtttt ctagtttgct tgtttcattc atataagctt 780
gtgttactta gttccgaacc ctgtagcttt gtagtctatg ctctcttttg tagggatgtg 840
ctgtcataag atatcatgca agtttcttgt cctacatatc 880
<210> 146
<211> 880
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 146
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatt cccaatggcg gcgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatggtccga aggtccacgc cgccaactac gagtatgatc ccaagcggtg 600
gtgctttcaa ggacatgatc atggagggtg atggcaggac ctcgtactga aatttcgacc 660
tacaagacct acaagtgtga catgcgcaat cagcatggtg cccgcgtgtt gtatcaacta 720
ctaggggttc aactgtgaac catgcgtttt ctagtttgct tgtttcattc atataagctt 780
gtgttactta gttccgaacc ctgtagcttt gtagtctatg ctctcttttg tagggatgtg 840
ctgtcataag atatcatgca agtttcttgt cctacatatc 880
<210> 147
<211> 865
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 147
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctgcgct ttcaaggaca tgatcatgga gggtgatggc aggacctcgt actgaaatgg 540
tccgaaggtc cacgccgcca actacgagta tgatcccaag cggtggtgct tttaaggaca 600
tgatcatgga gggtgatggc aggacctcgt actgaaattt cgacctacaa gacctacaag 660
tgtgacatgc gcaatcagca tgatacctgc gtgttgtatc aactactggg ggttcaactg 720
tgaaccatgc gttttctagt ttgcttgttt cattcatata agcttgtgtt acttagttcc 780
gaaccgtgta gttttgtagt ctctgttctc ttttgtaggg atgtgctgtc ataagatatc 840
atgcaagttt cttgtcctac atatc 865
<210> 148
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 148
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 149
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 149
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 150
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 150
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 151
<211> 880
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 151
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatt cccaatggcg gcgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatggtccga aggtccacgc cgccaactac gagtatgatc ccaagcggtg 600
gtgctttcaa ggacatgatc atggagggtg atggcaggac ctcgtactga aatttcgacc 660
tacaagacct acaagtgtga catgcgcaat cagcatggtg cccgcgtgtt gtatcaacta 720
ctaggggttc aactgtgaac catgcgtttt ctagtttgct tgtttcattc atataagctt 780
gtgttactta gttccgaacc ctgtagcttt gtagtctatg ctctcttttg tagggatgtg 840
ctgtcataag atatcatgca agtttcttgt cctacatatc 880
<210> 152
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 152
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 153
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 153
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 154
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 154
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 155
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 155
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 156
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 156
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 157
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 157
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 158
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 158
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 159
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 159
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 160
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 160
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 161
<211> 881
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 161
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat tcccaatggc ggcgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatggtccg aaggtccacg ccgccaacta cgagtatgat cccaagcggt 600
ggtgctttca aggacatgat catggagggt gatggcagga cctcgtactg aaatttcgac 660
ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat gcccgcgtgt tgtatcaact 720
actaggggtt caactgtgag ccatgcgttt tctagtttgc ttgtttcatt catataagct 780
tgtattactt agttccgaac cctgtagttt tgtagtctat gttctctttt gtagggatgt 840
gctgtcataa gatgtcatgc aagtttcttg tcctacatat c 881
<210> 162
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 162
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 163
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 163
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 164
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 164
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 165
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 165
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 166
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 166
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 167
<211> 771
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 167
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgt 480
cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga cctcgtactg 540
aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat gcccgcgtgt 600
tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc ttgtttcatt 660
catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat gttctctttt 720
gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat c 771
<210> 168
<211> 854
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 168
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat tcccaatggc ggcgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatggtccg aaggtcaagc ggtggtgctt tcaaggacat gatcatggag 600
ggtgatggca ggacctcgta ctgaaatttc gacctacaag acctacaagt gtgacatgcg 660
caatcagcat gatgcccgcg tgttgtatca actactaggg gttcaactgt gagccatgcg 720
ttttctagtt tgcttgtttc attcatataa gcttgtatta cttagttccg aaccctgtag 780
ttttgtagtc tatgttctct tttgtaggga tgtgctgtca taagatgtca tgcaagtttc 840
ttgtcctaca tatc 854
<210> 169
<211> 843
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 169
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatt cccaatggcg gcgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttgcagg gtggtgcttt caaggacatg atcatggagg gtgatggcag 600
gacctcgtac tgaaatttcg acctacaaga cctacaagtg tgacatgcgc aatcagcatg 660
gtgcccgcgt gttgtatcaa ctactagggg ttcaactgtg aaccatgcgt tttctagttt 720
gcttgtttca ttcatataag cttgtgttac ttagttccga accctgtagc tttgtagtct 780
atgctctctt ttgtagggat gtgctgtcat aagatatcat gcaagtttct tgtcctacat 840
atc 843
<210> 170
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 170
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 171
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 171
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 172
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 172
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 173
<211> 854
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 173
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat tcccaatggc ggcgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatggtccg aaggtcaagc ggtggtgctt tcaaggacat gatcatggag 600
ggtgatggca ggacctcgta ctgaaatttc gacctacaag acctacaagt gtgacatgcg 660
caatcagcat gatgcccgcg tgttgtatca actactaggg gttcaactgt gagccatgcg 720
ttttctagtt tgcttgtttc attcatataa gcttgtatta cttagttccg aaccctgtag 780
ttttgtagtc tatgttctct tttgtaggga tgtgctgtca taagatgtca tgcaagtttc 840
ttgtcctaca tatc 854
<210> 174
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 174
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 175
<211> 859
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 175
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatt cccaatggcg gcgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttgcagg tacaagatcc caagcggtgg tgctttcaag gacatgatca 600
tggagggtga tggcaggacc tcgtactgaa atttcgacct acaagaccta caagtgtgac 660
atgcgcaatc agcatggtgc ccgcgtgttg tatcaactac taggggttca actgtgaacc 720
atgcgttttc tagtttgctt gtttcattca tataagcttg tgttacttag ttccgaaccc 780
tgtagctttg tagtctatgc tctcttttgt agggatgtgc tgtcataaga tatcatgcaa 840
gtttcttgtc ctacatatc 859
<210> 176
<211> 780
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 176
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggttgggg gcaatgggat ttgggttacc agctgcagct ggcgctgctg tggccaaccc 120
aggtgttaca gttgttgaca ttgatggaga tggtagtttc ctcatgaaca ttcaggagtt 180
ggcattgatc cgtattgaga acctccctgt gaaggtgatg atattgaaca accagcatct 240
gggaatggtg gtgcaatggg aggataggtt ttacaaggcc aatcgggcgc acacatacct 300
tggcaaccca gaaaatgaga gtgagatata tccagatttt gtgacgattg ctaaaggatt 360
caacgttccg gcagttcgtg tgacgaagaa gagcgaagtc actgcagcaa tcaagaagat 420
gcttgagacc ccagggccat acttgttgga tatcatcgtc ccgcatcagg agcacgtgct 480
gcctatgatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 540
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 600
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 660
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 720
ctctcttttg tagggatgtg ctgtcataag atatcatgca agtttcttgt cctacatatc 780
<210> 177
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 177
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 178
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 178
atcagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcat 60
ccggtttggg tgcaatggga tttgggttgc cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatgggg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgtattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caaccgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc ggcagttcgt gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcattgt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttta aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
acctgcgtgt tgtatcaact actgggggtt caactgtgaa ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtgttactt agttccgaac cgtgtagttt tgtagtctct 720
gttctctttt gtagggatgt gctgtcataa gatatcatgc aagtttcttg tcctacatat 780
c 781
<210> 179
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 179
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 180
<211> 781
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Встраивание донора является результатом амплифицированной области гена AHAS пшеницы
<400> 180
accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg ctgtcttcgt 60
ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct gtggccaacc 120
caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac attcaggagt 180
tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac aaccagcatc 240
tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg cacacatacc 300
ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt gctaaaggat 360
tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca atcaagaaga 420
tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag gagcacgtgc 480
tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt gatggcagga 540
cctcgtactg aaatttcgac ctacaagacc tacaagtgtg acatgcgcaa tcagcatgat 600
gcccgcgtgt tgtatcaact actaggggtt caactgtgag ccatgcgttt tctagtttgc 660
ttgtttcatt catataagct tgtattactt agttccgaac cctgtagttt tgtagtctat 720
gttctctttt gtagggatgt gctgtcataa gatgtcatgc aagtttcttg tcctacatat 780
c 781
<210> 181
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 181
Gln Ser Ser His Leu Thr Arg
1 5
<210> 182
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 182
Arg Ser Asp Asp Leu Thr Arg
1 5
<210> 183
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 183
Tyr Arg Trp Leu Leu Arg Ser
1 5
<210> 184
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 184
Gln Ser Gly Asp Leu Thr Arg
1 5
<210> 185
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 185
Gln Arg Asn Ala Arg Thr Leu
1 5
<210> 186
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 186
Arg Ser Asp Asn Leu Ser Val
1 5
<210> 187
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 187
Gln Lys Ile Asn Leu Gln Val
1 5
<210> 188
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 188
Asp Asp Trp Asn Leu Ser Gln
1 5
<210> 189
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 189
Arg Ser Ala Asn Leu Thr Arg
1 5
<210> 190
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 190
Gln Ser Gly His Leu Ala Arg
1 5
<210> 191
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 191
Asn Asp Trp Asp Arg Arg Val
1 5
<210> 192
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 192
Arg Ser Asp His Leu Ser Gln
1 5
<210> 193
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 193
Asp Ser Ser Thr Arg Lys Lys
1 5
<210> 194
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 194
Arg Ser Asp Val Leu Ser Glu
1 5
<210> 195
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 195
Asp Arg Ser Asn Arg Ile Lys
1 5
<210> 196
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 196
Arg Ser Asp Asn Leu Ser Asn
1 5
<210> 197
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 197
Thr Ser Ser Ser Arg Ile Asn
1 5
<210> 198
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 198
Asp Arg Ser Asn Leu Thr Arg
1 5
<210> 199
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 199
Gln Ser Ser Asp Leu Ser Arg
1 5
<210> 200
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 200
Gln Ser Ala His Arg Lys Asn
1 5
<210> 201
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 201
Asp Arg Ser His Leu Thr Arg
1 5
<210> 202
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 202
Gln Ser Gly His Leu Ser Arg
1 5
<210> 203
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 203
Arg Ser Asp Asn Leu Ser Glu
1 5
<210> 204
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 204
His Ser Asn Ala Arg Lys Thr
1 5
<210> 205
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 205
Thr Ser Gly Asn Leu Thr Arg
1 5
<210> 206
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 206
His Arg Thr Ser Leu Thr Asp
1 5
<210> 207
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 207
His Lys Tyr His Leu Arg Ser
1 5
<210> 208
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 208
Gln Trp Ser Thr Arg Lys Arg
1 5
<210> 209
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 209
Ser Pro Ser Ser Arg Arg Thr
1 5
<210> 210
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 210
Thr Ala Arg Gln Arg Asn Arg
1 5
<210> 211
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 211
Asp Arg Ser His Leu Ala Arg
1 5
<210> 212
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 212
Arg Ser Asp Ser Leu Ser Ala
1 5
<210> 213
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 213
Arg Ser Asp Ala Leu Ala Arg
1 5
<210> 214
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 214
Gln Lys Ser Asn Leu Ser Ser
1 5
<210> 215
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 215
Asp Ser Ser Asp Arg Lys Lys
1 5
<210> 216
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 216
Trp Trp Thr Ser Arg Ala Leu
1 5
<210> 217
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 217
Asp Arg Ser Asp Leu Ser Arg
1 5
<210> 218
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 218
Arg Ser Asp His Leu Ser Glu
1 5
<210> 219
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 219
Tyr Ser Trp Arg Leu Ser Gln
1 5
<210> 220
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 220
Arg Ser Asp Ser Leu Ser Val
1 5
<210> 221
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 221
Arg Asn Gln Asp Arg Lys Asn
1 5
<210> 222
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 222
Gln Ser Gly Asn Leu Ala Arg
1 5
<210> 223
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 223
Asp Arg Ser Ala Leu Ala Arg
1 5
<210> 224
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 224
Arg Ser Asp Asn Leu Ser Thr
1 5
<210> 225
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 225
Ala Gln Trp Gly Arg Thr Ser
1 5
<210> 226
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 226
Arg Ser Ala Asp Leu Thr Arg
1 5
<210> 227
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 227
Thr Asn Gln Asn Arg Ile Thr
1 5
<210> 228
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 228
Arg Ser Asp Ser Leu Leu Arg
1 5
<210> 229
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 229
Leu Gln His His Leu Thr Asp
1 5
<210> 230
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 230
Gln Asn Ala Thr Arg Ile Asn
1 5
<210> 231
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 231
Met Arg Asn Arg Leu Asn Arg
1 5
<210> 232
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 232
Asp Arg Ser Asn Leu Ser Arg
1 5
<210> 233
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 233
Trp Arg Ser Cys Arg Ser Ala
1 5
<210> 234
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 234
Gln Trp Phe Gly Arg Lys Asn
1 5
<210> 235
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 235
Gln Trp Phe Gly Arg Lys Asn
1 5
<210> 236
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 236
Arg Ser Asp Ala Leu Thr Gln
1 5
<210> 237
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 237
Glu Arg Gly Thr Leu Ala Arg
1 5
<210> 238
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 238
Asp Thr Gly Ala Arg Leu Lys
1 5
<210> 239
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 239
His Arg Arg Ser Arg Asp Gln
1 5
<210> 240
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 240
Asp Arg Ser Tyr Arg Asn Thr
1 5
<210> 241
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 241
Arg Ser Ala Asp Leu Ser Arg
1 5
<210> 242
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 242
Arg Ser Asp His Leu Ser Ala
1 5
<210> 243
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 243
Gln Ser Ser Asp Leu Arg Arg
1 5
<210> 244
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 244
Arg Ser Asp Asp Arg Lys Thr
1 5
<210> 245
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 245
Arg Arg Ala Asp Arg Ala Lys
1 5
<210> 246
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 246
Thr Ser Ser Asp Arg Lys Lys
1 5
<210> 247
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 247
Arg Asn Asp Asp Arg Lys Lys
1 5
<210> 248
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 248
Asp Ser Ser Thr Arg Arg Arg
1 5
<210> 249
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 249
His Ser Arg Thr Arg Thr Lys
1 5
<210> 250
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 250
Asn Asn Arg Asp Arg Thr Lys
1 5
<210> 251
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 251
Val Ser Ser Asn Leu Thr Ser
1 5
<210> 252
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 252
Arg Ser Asp Ala Leu Ser Val
1 5
<210> 253
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 253
Asp Ser Ser His Arg Thr Arg
1 5
<210> 254
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 254
Arg Ser Asp Asn Leu Thr Arg
1 5
<210> 255
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 255
Arg Ser Asp Asn Leu Ala Arg
1 5
<210> 256
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 256
Asp Arg Ser His Leu Ser Arg
1 5
<210> 257
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 257
Thr Ser Ser Asn Arg Lys Thr
1 5
<210> 258
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 258
Arg Ser Asp Asp Leu Ser Lys
1 5
<210> 259
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 259
Arg Ser Ala His Leu Ser Arg
1 5
<210> 260
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 260
Arg Ser Asp Ala Leu Ser Thr
1 5
<210> 261
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 261
Asp Arg Ser Thr Arg Thr Lys
1 5
<210> 262
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Связывающий мотив ZFN
<400> 262
Thr Ser Ser Asp Arg Thr Lys
1 5
<210> 263
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<400> 263
cngcggccat ggcggcggcg agggtttg 28
<210> 264
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<220>
<221> дополнительный признак
<222> (24)..(24)
<223> n представляет собой a, c, g или t
<400> 264
acctcccccg ccgtcgcatt ctcnggcg 28
<210> 265
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<220>
<221> дополнительный признак
<222> (20)..(20)
<223> n представляет собой a, c, g или t
<400> 265
ggccggacgc gcgggcgtan ccggacgc 28
<210> 266
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 266
cgtcggcgtc tgcgtcgcca cctccggc 28
<210> 267
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 267
acgccgacgc ggccggacgc gcgggcgt 28
<210> 268
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 268
gcgtcgccac ctccggcccg ggggccac 28
<210> 269
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 269
cagacgccga cgcggccgga cgcgcggg 28
<210> 270
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 270
gtcgccacct ccggcccggg ggccacca 28
<210> 271
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 271
gcgacgcaga cgccgacgcg gccggacg 28
<210> 272
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 272
cctccggccc gggggccacc aacctcgt 28
<210> 273
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<220>
<221> дополнительный признак
<222> (18)..(18)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (24)..(24)
<223> n представляет собой a, c, g или t
<400> 273
gggatggagt cgaggagngc gtcngcga 28
<210> 274
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 274
tggtcgccat cacgggccag gtcccccg 28
<210> 275
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ssss
<220>
<221> дополнительный признак
<222> (24)..(24)
<223> n представляет собой a, c, g или t
<400> 275
accatgggga tggagtcgag gagngcgt 28
<210> 276
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 276
ccatcacggg ccaggtcccc cgccgcat 28
<210> 277
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<220>
<221> дополнительный признак
<222> (26)..(26)
<223> n представляет собой a, c, g или t
<400> 277
cgaccatggg gatggagtcg aggagngc 28
<210> 278
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Участок-мишень ZFN
<400> 278
catcacgggc caggtccccc gccgcatg 28
<210> 279
<211> 55
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (54)..(54)
<223> n представляет собой a, c, g или t
<400> 279
ancactcttt ccctacacga cgctcttccg atcttcccca attccaaccc tctnc 55
<210> 280
<211> 56
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (55)..(55)
<223> n представляет собой a, c, g или t
<400> 280
gntgactgga gttcagacgt gtgctcttcc gatctcgtca gcgcctggtg gatcnt 56
<210> 281
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (53)..(53)
<223> n представляет собой a, c, g или t
<400> 281
ancactcttt ccctacacga cgctcttccg atctgcccgt ccgagccccg cana 54
<210> 282
<211> 56
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (55)..(55)
<223> n представляет собой a, c, g или t
<400> 282
gntgactgga gttcagacgt gtgctcttcc gatctcgtca gcgcctggtg gatcnt 56
<210> 283
<211> 53
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (52)..(52)
<223> n представляет собой a, c, g или t
<400> 283
ancactcttt ccctacacga cgctcttccg atctgcgctc gcccgtcatc anc 53
<210> 284
<211> 56
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (55)..(55)
<223> n представляет собой a, c, g или t
<400> 284
gntgactgga gttcagacgt gtgctcttcc gatctatggg gatggagtcg aggang 56
<210> 285
<211> 53
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (52)..(52)
<223> n представляет собой a, c, g или t
<400> 285
ancactcttt ccctacacga cgctcttccg atctcttccg ccacgagcag gng 53
<210> 286
<211> 56
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (55)..(55)
<223> n представляет собой a, c, g или t
<400> 286
gntgactgga gttcagacgt gtgctcttcc gatctatggg gatggagtcg aggang 56
<210> 287
<211> 54
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (53)..(53)
<223> n представляет собой a, c, g или t
<400> 287
ancactcttt ccctacacga cgctcttccg atcttcgtct ccgcgctcgc tgna 54
<210> 288
<211> 56
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> дополнительный признак
<222> (2)..(2)
<223> n представляет собой a, c, g или t
<220>
<221> дополнительный признак
<222> (55)..(55)
<223> n представляет собой a, c, g или t
<400> 288
gntgactgga gttcagacgt gtgctcttcc gatcttccac tatgggcgtc tcctng 56
<210> 289
<211> 6661
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000164
<400> 289
tggcaggata tattgtggtg taaacaaatt gacgcttaga caacttaata acacattgcg 60
gacgttttta atgtactgaa ttaacgccga attgaattcg agctcggtac cactggattt 120
tggttttagg aattagaaat tttattgata gaagtatttt acaaatacaa atacatacta 180
agggtttctt atatgctcaa cacatgagcg aaaccctata agaaccctaa ttcccttatc 240
tgggaactac tcacacatta ttctggagaa aaatagagag agatagattt gtagagagag 300
actggtgatt tttgcggact ctattagatc tgggtaactg gcctaactgg ccttggagga 360
gctggcaact caaaatccct ttgccaaaaa ccaacatcat gccatccacc atgcttgtat 420
ccagctgcgc gcaatgtacc ccgggctgtg tatcccaaag cctcatgcaa cctaacagat 480
ggatcgtttg gaaggcctat aacagcaacc acagacttaa aaccttgcgc ctccatagac 540
ttaagcaaat gtgtgtacaa tgtggatcct aggcccaacc tttgatgcct atgtgacacg 600
taaacagtac tctcaactgt ccaatcgtaa gcgttcctag ccttccaggg cccagcgtaa 660
gcaataccag ccacaacacc ctcaacctca gcaaccaacc aagggtatct atcttgcaac 720
ctctcgagat catcaatcca ctcttgtggt gtttgtggct ctgtcctaaa gttcactgta 780
gacgtctcaa tgtaatggtt aacgatatca caaaccgcgg ccatatcagc tgctgtagct 840
ggcctaatct caactggtct cctctccgga gacatggctt ctacctacaa aaaagctccg 900
cacgaggctg catttgtcac aaatcatgaa aagaaaaact accgatgaac aatgctgagg 960
gattcaaatt ctacccacaa aaagaagaaa gaaagatcta gcacatctaa gcctgacgaa 1020
gcagcagaaa tatataaaaa tataaaccat agtgcccttt tcccctcttc ctgatcttgt 1080
ttagcatggc ggaaatttta aaccccccat catctccccc aacaacggcg gatcgcagat 1140
ctacatccga gagccccatt ccccgcgaga tccgggccgg atccacgccg gcgagagccc 1200
cagccgcgag atcccgcccc tcccgcgcac cgatctgggc gcgcacgaag ccgcctctcg 1260
cccacccaaa ctaccaaggc caaagatcga gaccgagacg gaaaaaaaaa acggagaaag 1320
aaagaggaga ggggcggggt ggttaccggc gcggcggcgg cggaggggga ggggggagga 1380
gctcgtcgtc cggcagcgag gggggaggag gtggaggtgg tggtggtggt ggtggtaggg 1440
ttggggggat gggaggagag gggggggtat gtatatagtg gcgatggggg gcgtttcttt 1500
ggaagcggag ggagggccgg cctcgtcgct ggctcgcgat cctcctcgcg tttccggccc 1560
ccacgacccg gacccacctg ctgttttttc tttttctttt ttttctttct tttttttttt 1620
ttggctgcga gacgtgcggt gcgtgcggac aactcacggt gatagtgggg gggtgtggag 1680
actattgtcc agttggctgg actggggtgg gttgggttgg gttgggttgg gctgggcttg 1740
ctatggatcg tggatagcac tttgggcttt aggaacttta ggggttgttt ttgtaaatgt 1800
tttgagtcta agtttatctt ttatttttac tagaaaaaat acccatgcgc tgcaacgggg 1860
gaaagctatt ttaatcttat tattgttcat tgtgagaatt cgcctgaata tatatttttc 1920
tcaaaaatta tgtcaaatta gcatatgggt ttttttaaag atatttctta tacaaatccc 1980
tctgtattta caaaagcaaa cgaacttaaa acccgactca aatacagata tgcatttcca 2040
aaagcgaata aacttaaaaa ccaattcata caaaaatgac gtatcaaagt accgacaaaa 2100
acatcctcaa tttttataat agtagaaaag agtaaatttc actttgggcc accttttatt 2160
accgatattt tactttatac caccttttaa ctgatgtttt cacttttgac caggtaatct 2220
tacctttgtt ttattttgga ctatcccgac tctcttctca agcatatgaa tgacctcgag 2280
tatgctagtc tagagtcgac ctgcagggtg cagcgtgacc cggtcgtgcc cctctctaga 2340
gataatgagc attgcatgtc taagttataa aaaattacca catatttttt ttgtcacact 2400
tgtttgaagt gcagtttatc tatctttata catatattta aactttactc tacgaataat 2460
ataatctata gtactacaat aatatcagtg ttttagagaa tcatataaat gaacagttag 2520
acatggtcta aaggacaatt gagtattttg acaacaggac tctacagttt tatcttttta 2580
gtgtgcatgt gttctccttt ttttttgcaa atagcttcac ctatataata cttcatccat 2640
tttattagta catccattta gggtttaggg ttaatggttt ttatagacta atttttttag 2700
tacatctatt ttattctatt ttagcctcta aattaagaaa actaaaactc tattttagtt 2760
tttttattta ataatttaga tataaaatag aataaaataa agtgactaaa aattaaacaa 2820
atacccttta agaaattaaa aaaactaagg aaacattttt cttgtttcga gtagataatg 2880
ccagcctgtt aaacgccgtc gacgagtcta acggacacca accagcgaac cagcagcgtc 2940
gcgtcgggcc aagcgaagca gacggcacgg catctctgtc gctgcctctg gacccctctc 3000
gagagttccg ctccaccgtt ggacttgctc cgctgtcggc atccagaaat tgcgtggcgg 3060
agcggcagac gtgagccggc acggcaggcg gcctcctcct cctctcacgg cacggcagct 3120
acgggggatt cctttcccac cgctccttcg ctttcccttc ctcgcccgcc gtaataaata 3180
gacaccccct ccacaccctc tttccccaac ctcgtgttgt tcggagcgca cacacacaca 3240
accagatctc ccccaaatcc acccgtcggc acctccgctt caaggtacgc cgctcgtcct 3300
cccccccccc ccctctctac cttctctaga tcggcgttcc ggtccatggt tagggcccgg 3360
tagttctact tctgttcatg tttgtgttag atccgtgttt gtgttagatc cgtgctgcta 3420
gcgttcgtac acggatgcga cctgtacgtc agacacgttc tgattgctaa cttgccagtg 3480
tttctctttg gggaatcctg ggatggctct agccgttccg cagacgggat cgatttcatg 3540
attttttttg tttcgttgca tagggtttgg tttgcccttt tcctttattt caatatatgc 3600
cgtgcacttg tttgtcgggt catcttttca tgcttttttt tgtcttggtt gtgatgatgt 3660
ggtctggttg ggcggtcgtt ctagatcgga gtagaattct gtttcaaact acctggtgga 3720
tttattaatt ttggatctgt atgtgtgtgc catacatatt catagttacg aattgaagat 3780
gatggatgga aatatcgatc taggataggt atacatgttg atgcgggttt tactgatgca 3840
tatacagaga tgctttttgt tcgcttggtt gtgatgatgt ggtgtggttg ggcggtcgtt 3900
cattcgttct agatcggagt agaatactgt ttcaaactac ctggtgtatt tattaatttt 3960
ggaactgtat gtgtgtgtca tacatcttca tagttacgag tttaagatgg atggaaatat 4020
cgatctagga taggtataca tgttgatgtg ggttttactg atgcatatac atgatggcat 4080
atgcagcatc tattcatatg ctctaacctt gagtacctat ctattataat aaacaagtat 4140
gttttataat tattttgatc ttgatatact tggatgatgg catatgcagc agctatatgt 4200
ggattttttt agccctgcct tcatacgcta tttatttgct tggtactgtt tcttttgtcg 4260
atgctcaccc tgttgtttgg tgttacttct gcaggaggat cacaagtttg tacaaaaaag 4320
caggctatgg ccgccgccac ctcccccgcc gtcgcattct cgggcgccac cgccgccgcc 4380
atgcccaaac ccgcccgcca tcctctcccg cgccaccagc ccgtctcgcg ccgcgcgctc 4440
cccgcccgcg tcgtcaggtg ttgcgccgcg tcccccgccg ccacctccgc cgcgcctccc 4500
gcaaccgcgc tccggccctg gggcccgtcc gagccccgca agggcgccga catcctcgtc 4560
gaggcgctcg agcgctgcgg catcgtcgac gtcttcgcct accccggcgg cgcctccatg 4620
gagatccacc aggcgctgac gcgctcgccc gtcatcacca accacctctt ccgccacgag 4680
cagggggagg cgttcgcggc gtccggctac gcccgcgcgt ccggccgcgt cggcgtctgc 4740
gtcgccacct ccggcccggg ggccaccaac ctcgtctccg cgctcgccga cgccctcctc 4800
gactccatcc ccatggtcgc catcacgggc caggtctccc gccgcatgat cggcacggac 4860
gcgttccagg agacgcccat agtggaggtc acgcgctcca tcaccaagca caactacctg 4920
gtccttgacg tggaggatat cccccgcgtc atccaggaag ccttcttcct tgcatcctct 4980
ggccgcccgg ggccggtgct agttgatatc cccaaggaca tccagcagca gatggctgtg 5040
cccgtctggg acactccaat gagtttgcca gggtacatcg cccgcctgcc caagccacca 5100
tctactgaat cgcttgagca ggtcctgcgt ctggttggcg agtcacggcg cccaattctg 5160
tatgttggtg gtggctgcgc tgcgtctggc gaggagttgc gccgctttgt tgagcttact 5220
gggattccag ttacaactac tctgatgggc cttggcaact tccccagcga cgacccactg 5280
tctctgcgca tgcttgggat gcatggcact gtgtatgcaa attatgcagt agataaggct 5340
gacctgttgc tcgcatttgg tgtgcggttt gatgatcgtg tgactgggaa aatcgaggct 5400
tttgcaagca ggtccaagat tgtgcacatt gacattgacc cagctgagat tggcaagaac 5460
aagcagccac atgtctccat ttgtgcagat gttaagcttg ctttacaggg gttgaatgat 5520
ctattaaatg ggagcaaagc acaacagggt ctggattttg gtccatggca caaggagttg 5580
gatcagcaga agagggagtt tcctctagga ttcaagactt ttggcgaggc catcccgccg 5640
caatatgcta tccaggtact ggatgagctg acaaaagggg aggcgatcat tgccactggt 5700
gttgggcagc accagatgtg ggcggctcag tattacactt acaagcggcc acggcagtgg 5760
ctgtcttcgt ctggtttggg ggcaatggga tttgggttac cagctgcagc tggcgctgct 5820
gtggccaacc caggtgttac agttgttgac attgatggtg atggtagttt cctcatgaac 5880
attcaggagt tggcgttgat ccgcattgag aacctcccag tgaaggtgat gatattgaac 5940
aaccagcatc tgggaatggt ggtgcagtgg gaggataggt tttacaaggc caatcgggcg 6000
cacacatacc ttggcaaccc agaaaatgag agtgagatat atccagattt tgtgacgatt 6060
gctaaaggat tcaacgttcc agcagttcga gtgacgaaga agagcgaagt cactgcagca 6120
atcaagaaga tgcttgagac cccagggcca tacttgttgg atatcatagt cccgcatcag 6180
gagcacgtgc tgcctatgat cccaagcggt ggtgctttca aggacatgat catggagggt 6240
gatggcagga cctcgtactg atacccagct ttcttgtaca aagtggtgat cctactagta 6300
gaaggagtgc gtcgaagcag atcgttcaaa catttggcaa taaagtttct taagattgaa 6360
tcctgttgcc ggtcttgcga tgattatcat ataatttctg ttgaattacg ttaagcatgt 6420
aataattaac atgtaatgca tgacgttatt tatgagatgg gtttttatga ttagagtccc 6480
gcaattatac atttaatacg cgatagaaaa caaaatatag cgcgcaaact aggataaatt 6540
atcgcgcgcg gtgtcatcta tgttactaga tcgaaagctt agcttgagct tggatcagat 6600
tgtcgtttcc cgccttcagt ttaaactatc agtgtttgac aggatatatt ggcgggtaaa 6660
c 6661
<210> 290
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 290
gcgaagatcc aggacaagga 20
<210> 291
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 291
ctgcttaccg gcaaagatga g 21
<210> 292
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 292
ttcccccgga ccagcagcgt 20
<210> 293
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 293
ccgacgagaa agaccagcaa 20
<210> 294
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 294
cttaagttgt cgatcgggac tgt 23
<210> 295
<211> 2571
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000435
<400> 295
tgagattggc aagaacaagc agccacatgt ctccatttgt gcagatgtta agcttgcttt 60
acaggggttg aatgatctat taaatgggag caaagcacaa cagggtctgg attttggtcc 120
atggcacaag gagttggatc agcagaagag ggagtttcct ctaggattca agacttttgg 180
cgaggccatc ccgccgcaat atgctatcca ggtactggat gagctgacaa aaggggaggc 240
gatcattgcc actggtgttg ggcagcacca gatgtgggcg gctcagtatt acacttacaa 300
gcggccacgg cagtggctgt cttcgtctgg tttgggggca atgggatttg ggttaccagc 360
tgcagctggc gctgctgtgg ccaacccagg tgttacagtt gttgacattg atggtgatgg 420
tagtttcctc atgaacattc aggagttggc gttgatccgc attgagaacc tcccagtgaa 480
ggtgatgata ttgaacaacc agcatctggg aatggtggtg cagtgggagg ataggtttta 540
caaggccaat cgggcgcaca cataccttgg caacccagaa aatgagagtg agatatatcc 600
agattttgtg acgattgcta aaggattcaa cgttccagca gttcgagtga cgaagaagag 660
cgaagtcact gcagcaatca agaagatgct tgagacccca gggccatact tgttggatat 720
catagtcccg catcaggagc acgtgctgcc tatgattcca aacggcggcg ccttcaagga 780
catgatcatg gagggtgatg gcaggacctc gtactgaaat ttcgacctac aagacctaca 840
agtgtgacat gcgcaatcag catggtgccc gcgtgttgta tcaactacta ggggttcaac 900
tgtgaaccat gcgttttcta gtttgcttgt ttcattcata taagcttgtg ttacttagtt 960
ccgaaccctg tagctttgta gtctatgctc tcttttgtag ggatgtgctg tcataagata 1020
tcatgcaagt ttcttgtcct acatatcaat aataagtact tccatggaat aattctcagt 1080
tctgttttga attttgcatc ttctcacaaa cagtgtgctg gttcctttct gttcgctgac 1140
gccctcctcg actccatccc catggtcgcc atcacgggcc aggtcccccg ccgcatgatc 1200
ggtagcgact tcgtgggcga ggaaagcctt tcgtccaagg tggtccctcc tcgcaatctt 1260
gttggatggt gaatattata aaagcctgcc cttctcgcgg gtaagactcc cgcccatcca 1320
ggatgaggat gaccagcctt ttgcagttta tccactaggg acaggattgc atcctgccga 1380
aaccctgcca agcttgaggt agcctccaat ttgacggtgc cgccagcgac gccgtctgga 1440
actgtccttt ttgaggacca ctccgtttgt ctagaggtac ctggagatca tgacattaag 1500
gatgaccagt tcgtaaaggt cctgcggtgt ctattgcttt tcataggtta ataagtgttt 1560
gctagactgt ggtgaaaggc caagactccc gcccatctct ctatgcccgg gacaagtgcc 1620
accccacagt ggggcaggat gaggatgacc aaagactccc gcccatctca ctagggacag 1680
gattggcctt ttgcagttta tctctatgcc cgggacaagt gtatccgaag taaataaaac 1740
catcggactc tcgtataaga ctgtcgactc gaccggccga cgcataggtt catttgaagc 1800
tgctattcta tttaaattga aatcccaagc ggtggtgctt tcaaggacat gatcatggag 1860
ggtgatggca ggacctcgta ctgaaatttc gacctacaag acctacaagt gtgacatgcg 1920
caatcagcat gatgcccgcg tgttgtatca actactaggg gttcaactgt gagccatgcg 1980
ttttctagtt tgcttgtttc attcatataa gcttgtatta cttagttccg aaccctgtag 2040
ttttgtagtc tatgttctct tttgtaggga tgtgctgtca taagatgtca tgcaagtttc 2100
ttgtcctaca tatcaataat aagtacttcc atggaataat tctcagttct gttttgaatt 2160
ttgcatcttc tcacaaacag tgtgctggtt cctttctgtt actttacatg tctgctgtgt 2220
caggttctga cataacgacc gatggagggt ggtcggcagg ttttagaagg ggaattgaaa 2280
cttttttttg ggaagaagtc tgaatacagt tgggaggaaa aatagaagta tatacttcga 2340
ttaatttatc aagcccgcta tccagtctaa tttatcaagc actagacagt gtagggtgtt 2400
ggcattcttc tcttccttga gatccggctt gagaggagag accgaggctt cggctgtgtt 2460
ggttgctgat ttctacagct ttttgagata gagagagaga tcctgcaact gtggtttgtc 2520
ttgctgcttg tacagcgaga gagacattga gagatatgta gatcgtttac c 2571
<210> 296
<211> 3893
<212> ДНК
<213> Искусственная последовательность
<220>
<223> pDAS000436
<400> 296
atgacaaaga tagtcacaat ccaaacagcc catagcctgg cgagtgcaaa tagatacgag 60
atctctggtg atatcacaac cgtccaaatt aattgcttgt ttcagcatca gcctttttgc 120
ataaagaagc tagcccaatc tgaaccacac actcacccgc cgcgtgacag cgccaaagac 180
aaaaccatca cccctcccca attccaaccc tctctctgcc tcacagaaat ctcccccctc 240
gcccaaaccc tcgccgccgc catggccgcc gccacctccc ccgccgtcgc attctcgggc 300
gccaccgccg ccgccatgcc caaacccgcc cgccatcctc tcccgcgcca ccagcccgtc 360
tcgcgccgcg cgctccccgc ccgcgtcgtc aggtgttgcg ccgcgtcccc cgccgccacc 420
tccgccgcgc ctcccgcaac cgcgctccgg ccctggggcc cgtccgagcc ccgcaagggc 480
gccgacatcc tcgtcgaggc gctcgagcgc tgcggcatcg tcgacgtctt cgcctacccc 540
ggcggcgcct ccatggagat ccaccaggcg ctgacgcgct cgcccgtcat caccaaccac 600
ctcttccgcc acgagcaggg ggaggcgttc gcggcgtccg gctacgcccg cgcgtccggc 660
cgcgtcggcg tctgcgtcgc cacctccggc ccgggggcca ccaacctcgt ctccgcgctc 720
gccgacgccc tcctcgactc catccccatg gtcgccatta ccgggcaagt gacccgccgc 780
atgatcggca cggacgcgtt ccaggagacg cccatagtgg aggtcacgcg ctccatcacc 840
aagcacaact acctggtcct tgacgtggag gatatccccc gcgtcatcca ggaagccttc 900
ttccttgcat cctctggccg cccggggccg gtgctagttg atatccccaa ggacatccag 960
cagcagatgg ctgtgcccgt ctgggacact ccaatgagtt tgccagggta catcgcccgc 1020
ctgcccaagc caccatctac tgaatcgctt gagcaggtcc tgcgtctggt tggcgagtca 1080
cggcgcccaa ttctgtatgt tggtggtggc tgcgctgcgt ctggcgagga gttgcgccgc 1140
tttgttgagc ttactgggat tccagttaca actactctga tgggccttgg caacttcccc 1200
agcgacgacc cactgtctct gcgcatgctt gggatgcatg gcactgtgta tgcaaattat 1260
gcagtagata aggctgacct gttgctcgca tttggtgtgc ggtttgatga tcgtgtgact 1320
gggaaaatcg aggcttttgc aagcaggtcc aagattgtgc acattgacat tgacccagct 1380
gagattggca agaacaagca gccacatgtc tccatttgtg cagatgttaa gcttgcttta 1440
caggggttga atgatctatt aaatgggagc aaagcacaac agggtctgga ttttggtcca 1500
tggcacaagg agttggatca gcagaagagg gagtttcctc taggattcaa gacttttggc 1560
gaggccatcc cgccgcaata tgctatccag gtactggatg agctgacaaa aggggaggcg 1620
atcattgcca ctggtgttgg gcagcaccag atgtgggcgg ctcagtatta cacttacaag 1680
cggccacggc agtggctgtc ttcgtctggt ttgggggcaa tgggatttgg gttaccagct 1740
gcagctggcg ctgctgtggc caacccaggt gttacagttg ttgacattga tggtgatggt 1800
agtttcctca tgaacattca ggagttggcg ttgatccgca ttgagaacct cccagtgaag 1860
gtgatgatat tgaacaacca gcatctggga atggtggtgc agtgggagga taggttttac 1920
aaggccaatc gggcgcacac ataccttggc aacccagaaa atgagagtga gatatatcca 1980
gattttgtga cgattgctaa aggattcaac gttccagcag ttcgagtgac gaagaagagc 2040
gaagtcactg cagcaatcaa gaagatgctt gagaccccag ggccatactt gttggatatc 2100
atagtcccgc atcaggagca cgtgctgcct atgatcccaa gcggtggtgc tttcaaggac 2160
atgatcatgg agggtgatgg caggacctcg tactgaaatt tcgacctaca agacctacaa 2220
gtgtgacatg cgcaatcagc atggtgcccg cgtgttgtat caactactag gggttcaact 2280
gtgaaccatg cgttttctag tttgcttgtt tcattcatat aagcttgtgt tacttagttc 2340
cgaaccctgt agctttgtag tctatgctct cttttgtagg gatgtgctgt cataagatat 2400
catgcaagtt tcttgtccta catatcaata ataagtactt ccatggaata attctcagtt 2460
ctgttttgaa ttttgcatct tctcacaaac agtgtgctgg ttcctttctg ttctacgccc 2520
gcgcgtccgg ccgcgtcggc gtctgcgtcg ccacctccgg cccgggggcc accaacctcg 2580
tctccgtagc gacttcgtgg gcgaggaaag cctttcgtcc aaggtggtcc ctcctcgcaa 2640
tcttgttgga tggtgaatat tataaaagcc tgcccttctc gcgggtgagt ccatgctcaa 2700
caccgtgcac tagggacagg attggccttt tgcagtttat ccactaggga caggattgca 2760
tcctgccgaa accctgccaa gcttgaggta gcctccaatt tgacggtgcc gccagcgacg 2820
ccgtctggaa ctgtcctttt tgaggaccac tccgtttgtc tagaggtacc tggagatcat 2880
gacattaagg atgaccagtt cgtaaaggtc ctgcggtgtc tattgctttt cataggttaa 2940
taagtgtttg ctagactgtg gtgaaaggcc gccttttgca gtttatctct agaaagactg 3000
gagttgcaga aagactcccg cccatccagg atgaggatga ccatatccga agtaaataaa 3060
accatcggac tctcgtataa gactgtcgac tcgaccggcc gacgcatagg ttcatttgaa 3120
gctgctattc tatttaaatt gaactcgact ccatccccat ggtcgccatc acgggccagg 3180
tcccccgccg catgatcggt agcgacttcg tgggcgagga aagcctttcg tccaaggtgg 3240
tccctcctcg caatcttgtt ggatggtgaa tattataaaa gcctgccctt ctcgcgggta 3300
agactcccgc ccatccagga tgaggatgac cagccttttg cagtttatcc actagggaca 3360
ggattgcatc ctgccgaaac cctgccaagc ttgaggtagc ctccaatttg acggtgccgc 3420
cagcgacgcc gtctggaact gtcctttttg aggaccactc cgtttgactg gattttggtt 3480
ttaggaatta gaaattttat tgatagaagt attttacaaa tacaaataca tactaagggt 3540
ttcttatatg ctcaacacat gagcgaaacc ctataagaac cctaattccc ttatctggga 3600
actactcaca cattattctg gagaaaaata gagagagata gatttgtaga gagagactgg 3660
tgatttttgc ggactctatt agatctgggt aactggccta actggccttg gaggagctgg 3720
caactcaaaa tccctttgcc aaaaaccaac atcatgccat ccaccatgct tgtatccagc 3780
tgcgcgcaat gtaccccggg ctgtgtatcc caaagcctca tgcaacctaa cagatggatc 3840
gtttggaagg cctataacag caaccacaga cttaaaacct tgcgcctcca tag 3893
<210> 297
<211> 24
<212> ДНК
<213> искусственная последовательность
<220>
<223> AHASs653ZFN.F2 primer
<400> 297
gcaatcaaga agatgcttga gacc 24
<210> 298
<211> 24
<212> ДНК
<213> искусственная последовательность
<220>
<223> последовательность праймера AHASs653ZFN.R1
<400> 298
tcttttgtag ggatgtgctg tcat 24
<210> 299
<211> 21
<212> ДНК
<213> искусственная последовательность
<220>
<223> Прямой праймер pDAS434
<400> 299
gccaacccag gtgttacagt t 21
<210> 300
<211> 20
<212> ДНК
<213> искусственная последовательность
<220>
<223> Обратный праймер pDAS434
<400> 300
ggctggtcat cctcatcctg 20
<210> 301
<211> 57
<212> ДНК
<213> искусственная последовательность
<220>
<223> Праймер AHASs653ZFN.F2
<400> 301
acactctttc cctacacgac gctcttccga tctgcaatca agaagatgct tgagacc 57
<210> 302
<211> 57
<212> ДНК
<213> искусственная последовательность
<220>
<223> последовательность праймера AHASs653ZFN.R3
<400> 302
gtgactggag ttcagacgtg tgctcttccg atctcaagca aactagaaaa cgcatgg 57
<210> 303
<211> 11938
<212> ДНК
<213> искусственная последовательность
<220>
<223> pDAS0000004
<400> 303
tgatcacagg cagcaacgct ctgtcatcgt tacaatcaac atgctaccct ccgcgagatc 60
atccgtgttt caaacccggc agcttagttg ccgttcttcc gaatagcatc ggtaacatga 120
gcaaagtctg ccgccttaca acggctctcc cgctgacgcc gtcccggact gatgggctgc 180
ctgtatcgag tggtgatttt gtgccgagct gccggtcggg gagctgttgg ctggctggtg 240
gcaggatata ttgtggtgta aacaaattga cgcttagaca acttaataac acattgcgga 300
cgtttttaat gtactgaatt aacgccgaat tgaattcgag ctcggtacca ctggattttg 360
gttttaggaa ttagaaattt tattgataga agtattttac aaatacaaat acatactaag 420
ggtttcttat atgctcaaca catgagcgaa accctataag aaccctaatt cccttatctg 480
ggaactactc acacattatt ctggagaaaa atagagagag atagatttgt agagagagac 540
tggtgatttt tgcggactct attagatctg ggtaactggc ctaactggcc ttggaggagc 600
tggcaactca aaatcccttt gccaaaaacc aacatcatgc catccaccat gcttgtatcc 660
agctgcgcgc aatgtacccc gggctgtgta tcccaaagcc tcatgcaacc taacagatgg 720
atcgtttgga aggcctataa cagcaaccac agacttaaaa ccttgcgcct ccatagactt 780
aagcaaatgt gtgtacaatg tggatcctag gcccaacctt tgatgcctat gtgacacgta 840
aacagtactc tcaactgtcc aatcgtaagc gttcctagcc ttccagggcc cagcgtaagc 900
aataccagcc acaacaccct caacctcagc aaccaaccaa gggtatctat cttgcaacct 960
ctcgagatca tcaatccact cttgtggtgt ttgtggctct gtcctaaagt tcactgtaga 1020
cgtctcaatg taatggttaa cgatatcaca aaccgcggcc atatcagctg ctgtagctgg 1080
cctaatctca actggtctcc tctccggaga catggcttct acctacaaaa aagctccgca 1140
cgaggctgca tttgtcacaa atcatgaaaa gaaaaactac cgatgaacaa tgctgaggga 1200
ttcaaattct acccacaaaa agaagaaaga aagatctagc acatctaagc ctgacgaagc 1260
agcagaaata tataaaaata taaaccatag tgcccttttc ccctcttcct gatcttgttt 1320
agcatggcgg aaattttaaa ccccccatca tctcccccaa caacggcgga tcgcagatct 1380
acatccgaga gccccattcc ccgcgagatc cgggccggat ccacgccggc gagagcccca 1440
gccgcgagat cccgcccctc ccgcgcaccg atctgggcgc gcacgaagcc gcctctcgcc 1500
cacccaaact accaaggcca aagatcgaga ccgagacgga aaaaaaaaac ggagaaagaa 1560
agaggagagg ggcggggtgg ttaccggcgc ggcggcggcg gagggggagg ggggaggagc 1620
tcgtcgtccg gcagcgaggg gggaggaggt ggaggtggtg gtggtggtgg tggtagggtt 1680
ggggggatgg gaggagaggg gggggtatgt atatagtggc gatggggggc gtttctttgg 1740
aagcggaggg agggccggcc tcgtcgctgg ctcgcgatcc tcctcgcgtt tccggccccc 1800
acgacccgga cccacctgct gttttttctt tttctttttt ttctttcttt tttttttttt 1860
ggctgcgaga cgtgcggtgc gtgcggacaa ctcacggtga tagtgggggg gtgtggagac 1920
tattgtccag ttggctggac tggggtgggt tgggttgggt tgggttgggc tgggcttgct 1980
atggatcgtg gatagcactt tgggctttag gaactttagg ggttgttttt gtaaatgttt 2040
tgagtctaag tttatctttt atttttacta gaaaaaatac ccatgcgctg caacggggga 2100
aagctatttt aatcttatta ttgttcattg tgagaattcg cctgaatata tatttttctc 2160
aaaaattatg tcaaattagc atatgggttt ttttaaagat atttcttata caaatccctc 2220
tgtatttaca aaagcaaacg aacttaaaac ccgactcaaa tacagatatg catttccaaa 2280
agcgaataaa cttaaaaacc aattcataca aaaatgacgt atcaaagtac cgacaaaaac 2340
atcctcaatt tttataatag tagaaaagag taaatttcac tttgggccac cttttattac 2400
cgatatttta ctttatacca ccttttaact gatgttttca cttttgacca ggtaatctta 2460
cctttgtttt attttggact atcccgactc tcttctcaag catatgaatg acctcgagta 2520
tgctagtcta gagtcgacct gcaggcatgc aagcttagct tgagcttgga tcagattgtc 2580
gtttcccgcc ttcagtttat cacaagtttg tacaaaaaag caggctctgc agtgcagcgt 2640
gacccggtcg tgcccctctc tagagataat gagcattgca tgtctaagtt ataaaaaatt 2700
accacatatt ttttttgtca cacttgtttg aagtgcagtt tatctatctt tatacatata 2760
tttaaacttt actctacgaa taatataatc tatagtacta caataatatc agtgttttag 2820
agaatcatat aaatgaacag ttagacatgg tctaaaggac aattgagtat tttgacaaca 2880
ggactctaca gttttatctt tttagtgtgc atgtgttctc cttttttttt gcaaatagct 2940
tcacctatat aatacttcat ccattttatt agtacatcca tttagggttt agggttaatg 3000
gtttttatag actaattttt ttagtacatc tattttattc tattttagcc tctaaattaa 3060
gaaaactaaa actctatttt agttttttta tttaataatt tagatataaa atagaataaa 3120
ataaagtgac taaaaattaa acaaataccc tttaagaaat taaaaaaact aaggaaacat 3180
ttttcttgtt tcgagtagat aatgccagcc tgttaaacgc cgtcgacgag tctaacggac 3240
accaaccagc gaaccagcag cgtcgcgtcg ggccaagcga agcagacggc acggcatctc 3300
tgtcgctgcc tctggacccc tctcgagagt tccgctccac cgttggactt gctccgctgt 3360
cggcatccag aaattgcgtg gcggagcggc agacgtgagc cggcacggca ggcggcctcc 3420
tcctcctctc acggcacggc agctacgggg gattcctttc ccaccgctcc ttcgctttcc 3480
cttcctcgcc cgccgtaata aatagacacc ccctccacac cctctttccc caacctcgtg 3540
ttgttcggag cgcacacaca cacaaccaga tctcccccaa atccacccgt cggcacctcc 3600
gcttcaaggt acgccgctcg tcctcccccc ccccccctct ctaccttctc tagatcggcg 3660
ttccggtcca tggttagggc ccggtagttc tacttctgtt catgtttgtg ttagatccgt 3720
gtttgtgtta gatccgtgct gctagcgttc gtacacggat gcgacctgta cgtcagacac 3780
gttctgattg ctaacttgcc agtgtttctc tttggggaat cctgggatgg ctctagccgt 3840
tccgcagacg ggatcgattt catgattttt tttgtttcgt tgcatagggt ttggtttgcc 3900
cttttccttt atttcaatat atgccgtgca cttgtttgtc gggtcatctt ttcatgcttt 3960
tttttgtctt ggttgtgatg atgtggtctg gttgggcggt cgttctagat cggagtagaa 4020
ttctgtttca aactacctgg tggatttatt aattttggat ctgtatgtgt gtgccataca 4080
tattcatagt tacgaattga agatgatgga tggaaatatc gatctaggat aggtatacat 4140
gttgatgcgg gttttactga tgcatataca gagatgcttt ttgttcgctt ggttgtgatg 4200
atgtggtgtg gttgggcggt cgttcattcg ttctagatcg gagtagaata ctgtttcaaa 4260
ctacctggtg tatttattaa ttttggaact gtatgtgtgt gtcatacatc ttcatagtta 4320
cgagtttaag atggatggaa atatcgatct aggataggta tacatgttga tgtgggtttt 4380
actgatgcat atacatgatg gcatatgcag catctattca tatgctctaa ccttgagtac 4440
ctatctatta taataaacaa gtatgtttta taattatttt gatcttgata tacttggatg 4500
atggcatatg cagcagctat atgtggattt ttttagccct gccttcatac gctatttatt 4560
tgcttggtac tgtttctttt gtcgatgctc accctgttgt ttggtgttac ttctgcagga 4620
tggcctcctc cgagaacgtg atcaccgagt tcatgcgctt caaggtgcgc atggagggca 4680
ccgtgaacgg ccacgagttc gagatcgagg gcgaggggga gggcaggcca tacgagggcc 4740
acaacaccgt gaagctcaag gtgaccaagg gaggcccact cccattcgcc tgggacatcc 4800
tcagcccaca gttccagtac ggctccaagg tgtacgtgaa gcacccagcc gacatcccag 4860
actacaagaa gctcagcttc ccagagggct tcaagtggga gcgcgtgatg aacttcgagg 4920
acggcggcgt ggccaccgtg acccaagact ccagcctcca ggacggctgc ttcatctaca 4980
aggtgaagtt catcggcgtg aacttcccat ccgacggccc agtgatgcaa aagaagacca 5040
tgggctggga ggcctccacc gagaggctct acccaaggga cggcgtgctc aagggcgaga 5100
cccacaaggc cctcaagctc aaggacggcg gccactacct cgtcgagttc aagtccatct 5160
acatggccaa gaagccagtc cagctcccag gctactacta cgtggacgcc aagctcgaca 5220
tcacctccca caacgaggac tacaccatcg tcgagcagta cgagcgcacc gagggccgcc 5280
accacctgtt cctctgaaga aggagtgcgt cgaagcagat cgttcaaaca tttggcaata 5340
aagtttctta agattgaatc ctgttgccgg tcttgcgatg attatcatat aatttctgtt 5400
gaattacgtt aagcatgtaa taattaacat gtaatgcatg acgttattta tgagatgggt 5460
ttttatgatt agagtcccgc aattatacat ttaatacgcg atagaaaaca aaatatagcg 5520
cgcaaactag gataaattat cgcgcgcggt gtcatctatg ttactagatc gaacccagct 5580
ttcttgtaca aagtggtgat aaactatcag tgtttgacag gatatattgg cgggtaaacc 5640
taagagaaaa gagcgtttat tagaataatc ggatatttaa aagggcgtga aaaggtttat 5700
ccgttcgtcc atttgtatgt gcatgccaac cacagggttc ccctcgggat caaagtactt 5760
taaagtactt taaagtactt taaagtactt tgatccaacc cctccgctgc tatagtgcag 5820
tcggcttctg acgttcagtg cagccgtctt ctgaaaacga catgtcgcac aagtcctaag 5880
ttacgcgaca ggctgccgcc ctgccctttt cctggcgttt tcttgtcgcg tgttttagtc 5940
gcataaagta gaatacttgc gactagaacc ggagacatta cgccatgaac aagagcgccg 6000
ccgctggcct gctgggctat gcccgcgtca gcaccgacga ccaggacttg accaaccaac 6060
gggccgaact gcacgcggcc ggctgcacca agctgttttc cgagaagatc accggcacca 6120
ggcgcgaccg cccggagctg gccaggatgc ttgaccacct acgccctggc gacgttgtga 6180
cagtgaccag gctagaccgc ctggcccgca gcacccgcga cctactggac attgccgagc 6240
gcatccagga ggccggcgcg ggcctgcgta gcctggcaga gccgtgggcc gacaccacca 6300
cgccggccgg ccgcatggtg ttgaccgtgt tcgccggcat tgccgagttc gagcgttccc 6360
taatcatcga ccgcacccgg agcgggcgcg aggccgccaa ggcccgaggc gtgaagtttg 6420
gcccccgccc taccctcacc ccggcacaga tcgcgcacgc ccgcgagctg atcgaccagg 6480
aaggccgcac cgtgaaagag gcggctgcac tgcttggcgt gcatcgctcg accctgtacc 6540
gcgcacttga gcgcagcgag gaagtgacgc ccaccgaggc caggcggcgc ggtgccttcc 6600
gtgaggacgc attgaccgag gccgacgccc tggcggccgc cgagaatgaa cgccaagagg 6660
aacaagcatg aaaccgcacc aggacggcca ggacgaaccg tttttcatta ccgaagagat 6720
cgaggcggag atgatcgcgg ccgggtacgt gttcgagccg cccgcgcacg tctcaaccgt 6780
gcggctgcat gaaatcctgg ccggtttgtc tgatgccaag ctggcggcct ggccggccag 6840
cttggccgct gaagaaaccg agcgccgccg tctaaaaagg tgatgtgtat ttgagtaaaa 6900
cagcttgcgt catgcggtcg ctgcgtatat gatgcgatga gtaaataaac aaatacgcaa 6960
ggggaacgca tgaaggttat cgctgtactt aaccagaaag gcgggtcagg caagacgacc 7020
atcgcaaccc atctagcccg cgccctgcaa ctcgccgggg ccgatgttct gttagtcgat 7080
tccgatcccc agggcagtgc ccgcgattgg gcggccgtgc gggaagatca accgctaacc 7140
gttgtcggca tcgaccgccc gacgattgac cgcgacgtga aggccatcgg ccggcgcgac 7200
ttcgtagtga tcgacggagc gccccaggcg gcggacttgg ctgtgtccgc gatcaaggca 7260
gccgacttcg tgctgattcc ggtgcagcca agcccttacg acatatgggc caccgccgac 7320
ctggtggagc tggttaagca gcgcattgag gtcacggatg gaaggctaca agcggccttt 7380
gtcgtgtcgc gggcgatcaa aggcacgcgc atcggcggtg aggttgccga ggcgctggcc 7440
gggtacgagc tgcccattct tgagtcccgt atcacgcagc gcgtgagcta cccaggcact 7500
gccgccgccg gcacaaccgt tcttgaatca gaacccgagg gcgacgctgc ccgcgaggtc 7560
caggcgctgg ccgctgaaat taaatcaaaa ctcatttgag ttaatgaggt aaagagaaaa 7620
tgagcaaaag cacaaacacg ctaagtgccg gccgtccgag cgcacgcagc agcaaggctg 7680
caacgttggc cagcctggca gacacgccag ccatgaagcg ggtcaacttt cagttgccgg 7740
cggaggatca caccaagctg aagatgtacg cggtacgcca aggcaagacc attaccgagc 7800
tgctatctga atacatcgcg cagctaccag agtaaatgag caaatgaata aatgagtaga 7860
tgaattttag cggctaaagg aggcggcatg gaaaatcaag aacaaccagg caccgacgcc 7920
gtggaatgcc ccatgtgtgg aggaacgggc ggttggccag gcgtaagcgg ctgggttgtc 7980
tgccggccct gcaatggcac tggaaccccc aagcccgagg aatcggcgtg agcggtcgca 8040
aaccatccgg cccggtacaa atcggcgcgg cgctgggtga tgacctggtg gagaagttga 8100
aggccgcgca ggccgcccag cggcaacgca tcgaggcaga agcacgcccc ggtgaatcgt 8160
ggcaagcggc cgctgatcga atccgcaaag aatcccggca accgccggca gccggtgcgc 8220
cgtcgattag gaagccgccc aagggcgacg agcaaccaga ttttttcgtt ccgatgctct 8280
atgacgtggg cacccgcgat agtcgcagca tcatggacgt ggccgttttc cgtctgtcga 8340
agcgtgaccg acgagctggc gaggtgatcc gctacgagct tccagacggg cacgtagagg 8400
tttccgcagg gccggccggc atggccagtg tgtgggatta cgacctggta ctgatggcgg 8460
tttcccatct aaccgaatcc atgaaccgat accgggaagg gaagggagac aagcccggcc 8520
gcgtgttccg tccacacgtt gcggacgtac tcaagttctg ccggcgagcc gatggcggaa 8580
agcagaaaga cgacctggta gaaacctgca ttcggttaaa caccacgcac gttgccatgc 8640
agcgtacgaa gaaggccaag aacggccgcc tggtgacggt atccgagggt gaagccttga 8700
ttagccgcta caagatcgta aagagcgaaa ccgggcggcc ggagtacatc gagatcgagc 8760
tagctgattg gatgtaccgc gagatcacag aaggcaagaa cccggacgtg ctgacggttc 8820
accccgatta ctttttgatc gatcccggca tcggccgttt tctctaccgc ctggcacgcc 8880
gcgccgcagg caaggcagaa gccagatggt tgttcaagac gatctacgaa cgcagtggca 8940
gcgccggaga gttcaagaag ttctgtttca ccgtgcgcaa gctgatcggg tcaaatgacc 9000
tgccggagta cgatttgaag gaggaggcgg ggcaggctgg cccgatccta gtcatgcgct 9060
accgcaacct gatcgagggc gaagcatccg ccggttccta atgtacggag cagatgctag 9120
ggcaaattgc cctagcaggg gaaaaaggtc gaaaaggtct ctttcctgtg gatagcacgt 9180
acattgggaa cccaaagccg tacattggga accggaaccc gtacattggg aacccaaagc 9240
cgtacattgg gaaccggtca cacatgtaag tgactgatat aaaagagaaa aaaggcgatt 9300
tttccgccta aaactcttta aaacttatta aaactcttaa aacccgcctg gcctgtgcat 9360
aactgtctgg ccagcgcaca gccgaagagc tgcaaaaagc gcctaccctt cggtcgctgc 9420
gctccctacg ccccgccgct tcgcgtcggc ctatcgcggc cgctggccgc tcaaaaatgg 9480
ctggcctacg gccaggcaat ctaccagggc gcggacaagc cgcgccgtcg ccactcgacc 9540
gccggcgccc acatcaaggc accctgcctc gcgcgtttcg gtgatgacgg tgaaaacctc 9600
tgacacatgc agctcccgga gacggtcaca gcttgtctgt aagcggatgc cgggagcaga 9660
caagcccgtc agggcgcgtc agcgggtgtt ggcgggtgtc ggggcgcagc catgacccag 9720
tcacgtagcg atagcggagt gtatactggc ttaactatgc ggcatcagag cagattgtac 9780
tgagagtgca ccatatgcgg tgtgaaatac cgcacagatg cgtaaggaga aaataccgca 9840
tcaggcgctc ttccgcttcc tcgctcactg actcgctgcg ctcggtcgtt cggctgcggc 9900
gagcggtatc agctcactca aaggcggtaa tacggttatc cacagaatca ggggataacg 9960
caggaaagaa catgtgagca aaaggccagc aaaaggccag gaaccgtaaa aaggccgcgt 10020
tgctggcgtt tttccatagg ctccgccccc ctgacgagca tcacaaaaat cgacgctcaa 10080
gtcagaggtg gcgaaacccg acaggactat aaagatacca ggcgtttccc cctggaagct 10140
ccctcgtgcg ctctcctgtt ccgaccctgc cgcttaccgg atacctgtcc gcctttctcc 10200
cttcgggaag cgtggcgctt tctcatagct cacgctgtag gtatctcagt tcggtgtagg 10260
tcgttcgctc caagctgggc tgtgtgcacg aaccccccgt tcagcccgac cgctgcgcct 10320
tatccggtaa ctatcgtctt gagtccaacc cggtaagaca cgacttatcg ccactggcag 10380
cagccactgg taacaggatt agcagagcga ggtatgtagg cggtgctaca gagttcttga 10440
agtggtggcc taactacggc tacactagaa ggacagtatt tggtatctgc gctctgctga 10500
agccagttac cttcggaaaa agagttggta gctcttgatc cggcaaacaa accaccgctg 10560
gtagcggtgg tttttttgtt tgcaagcagc agattacgcg cagaaaaaaa ggatctcaag 10620
aagatccttt gatcttttct acggggtctg acgctcagtg gaacgaaaac tcacgttaag 10680
ggattttggt catgcatgat atatctccca atttgtgtag ggcttattat gcacgcttaa 10740
aaataataaa agcagacttg acctgatagt ttggctgtga gcaattatgt gcttagtgca 10800
tctaacgctt gagttaagcc gcgccgcgaa gcggcgtcgg cttgaacgaa tttctagcta 10860
gacattattt gccgactacc ttggtgatct cgcctttcac gtagtggaca aattcttcca 10920
actgatctgc gcgcgaggcc aagcgatctt cttcttgtcc aagataagcc tgtctagctt 10980
caagtatgac gggctgatac tgggccggca ggcgctccat tgcccagtcg gcagcgacat 11040
ccttcggcgc gattttgccg gttactgcgc tgtaccaaat gcgggacaac gtaagcacta 11100
catttcgctc atcgccagcc cagtcgggcg gcgagttcca tagcgttaag gtttcattta 11160
gcgcctcaaa tagatcctgt tcaggaaccg gatcaaagag ttcctccgcc gctggaccta 11220
ccaaggcaac gctatgttct cttgcttttg tcagcaagat agccagatca atgtcgatcg 11280
tggctggctc gaagatacct gcaagaatgt cattgcgctg ccattctcca aattgcagtt 11340
cgcgcttagc tggataacgc cacggaatga tgtcgtcgtg cacaacaatg gtgacttcta 11400
cagcgcggag aatctcgctc tctccagggg aagccgaagt ttccaaaagg tcgttgatca 11460
aagctcgccg cgttgtttca tcaagcctta cggtcaccgt aaccagcaaa tcaatatcac 11520
tgtgtggctt caggccgcca tccactgcgg agccgtacaa atgtacggcc agcaacgtcg 11580
gttcgagatg gcgctcgatg acgccaacta cctctgatag ttgagtcgat acttcggcga 11640
tcaccgcttc ccccatgatg tttaactttg ttttagggcg actgccctgc tgcgtaacat 11700
cgttgctgct ccataacatc aaacatcgac ccacggcgta acgcgcttgc tgcttggatg 11760
cccgaggcat agactgtacc ccaaaaaaac agtcataaca agccatgaaa accgccactg 11820
cgccgttacc accgctgcgt tcggtcaagg ttctggacca gttgcgtgag cgcatacgct 11880
acttgcatta cagcttacga accgaacagg cttatgtcca ctgggttcgt gcccgaat 11938
<210> 304
<211> 341
<212> ДНК
<213> искусственная последовательность
<220>
<223> yc06-9110-1 (A-геном; аллель WT)
<400> 304
gcaatcaaga agatgcttga gaccccaggg ccatacttgt tggatatcat cgtcccgcat 60
caggagcacg tgctgcctat gatcccaagc ggtggtgctt tcaaggacat gatcatggag 120
ggtgatggca ggacctcgta ctgaaatttc gacctacaag acctacaagt gtgacatgcg 180
caatcagcat ggtgcccgcg tgttgtatca actactaggg gttcaactgt gaaccatgcg 240
ttttctagtt tgcttgtttc attcatataa gcttgtgtta cttagttccg aaccctgtag 300
ctttgtagtc tatgctctct tttgtaggga tgtgctgtca t 341
<210> 305
<211> 341
<212> ДНК
<213> искусственная последовательность
<220>
<223> yc06-9110-1 (A-геном; аллель WT)
<400> 305
gcaatcaaga agatgcttga gaccccaggg ccatacttgt tggatatcat cgtcccgcat 60
caggagcacg tgctgcctat gatcccaagc ggtggtgctt tcaaggacat gatcatggag 120
ggtgatggca ggacctcgta ctgaaatttc gacctacaag acctacaagt gtgacatgcg 180
caatcagcat ggtgcccgcg tgttgtatca actactaggg gttcaactgt gaaccatgcg 240
ttttctagtt tgcttgtttc attcatataa gcttgtgtta cttagttccg aaccctgtag 300
ctttgtagtc tatgctctct tttgtaggga tgtgctgtca t 341
<210> 306
<211> 341
<212> ДНК
<213> искусственная последовательность
<220>
<223> yc06-9110-1 (B-геном ; аллель WT)
<400> 306
gcaatcaaga agatgcttga gaccccaggg ccatacttgt tggatatcat cgtcccgcat 60
caggagcacg tgctgcctat gatcccaagc ggtggtgctt tcaaggacat gatcatggag 120
ggtgatggca ggacctcgta ctgaaatttc gacctacaag acctacaagt gtgacatgcg 180
caatcagcat ggtgcccgcg tgttgtatca actactaggg gttcaactgt gaaccatgcg 240
ttttctagtt tgcttgtttc attcatataa gcttgtgtta cttagttccg aaccctgtag 300
ctttgtagtc tatgctctct tttgtaggga tgtgctgtca t 341
<210> 307
<211> 440
<212> ДНК
<213> искусственная последовательность
<220>
<223> yc06-9110-1 (B-геном ; аллель ED)
<400> 307
gcaatcaaga agatgcttga gaccccaggg ccatacttgt tggatatcat tgtcccgcat 60
caggagcacg tgctgcctat gattcccaat ggcggcgctt tcaaggacat gatcatggag 120
ggtgatggca ggacctcgta ctgaaatggt ccgaagtcca cgccgccaac tacgagtatg 180
atcccaagcg gtggtgcttt taaggacatg atcatggagg gtgatggcag gacctcgtac 240
tgaaatttcg acctacaaga cctacaagtg tgacatgcgc aatcagcatg atacctgcgt 300
gttgtatcaa ctactggggg ttcaactgtg aaccatgcgt tttctagttt gcttgtttca 360
ttcatataag cttgtgttac ttagttccga accgtgtagt tttgtagtct ctgttctctt 420
ttgtagggat gtgctgtcat 440
<210> 308
<211> 346
<212> ДНК
<213> искусственная последовательность
<220>
<223> yc06-9110-1 (D-геном ; аллель WT)
<400> 308
gcaatcaaga agatgcttga gaccccaggg ccatacttgt tggatatcat agtcccgcat 60
caggagcacg tgctgcctat gatcccaagc ggtggtgctt tcaaggacat gatcatggag 120
ggtgatggca ggacctcgta ctgaaatttc gacctacaag acctacaagt gtgacatgcg 180
caatcagcat gatgcccgcg tgttgtatca actactaggg gttcaactgt gagccatgcg 240
ttttctagtt tgcttgtttc attcatataa gcttgtatta cttagttccg aaccctgtag 300
ttttgtagtc tatgttctct tttgtaggga tgtgctgtca taagat 346
<210> 309
<211> 346
<212> ДНК
<213> искусственная последовательность
<220>
<223> yc06-9110-1 (D-геном ; аллель WT
<400> 309
gcaatcaaga agatgcttga gaccccaggg ccatacttgt tggatatcat agtcccgcat 60
caggagcacg tgctgcctat gatcccaagc ggtggtgctt tcaaggacat gatcatggag 120
ggtgatggca ggacctcgta ctgaaatttc gacctacaag acctacaagt gtgacatgcg 180
caatcagcat gatgcccgcg tgttgtatca actactaggg gttcaactgt gagccatgcg 240
ttttctagtt tgcttgtttc attcatataa gcttgtatta cttagttccg aaccctgtag 300
ttttgtagtc tatgttctct tttgtaggga tgtgctgtca taagat 346
<210> 310
<211> 437
<212> ДНК
<213> искусственная последовательность
<220>
<223> yr00-9311-1 (A-геном ; аллель ED)
<400> 310
gcaatcaaga agatgcttga gaccccaggg ccatacttgt tggatatcat cgtcccgcat 60
caggagcacg tgctgcctat gattcccaat ggcggcgctt tcaaggacat gatcatggag 120
ggtgatggca ggacctcgta ctgaaatggt ccgaaggtcc caagcggtgg tgctttcaag 180
gacatgatca tggagggtga tggcaggacc tcgtactgaa atttcgacct acaagaccta 240
cgacctacaa gacctacaag tgtgacatgc gcaatcagca tggtgcccgc gtgttgtatc 300
aactactagg ggttcaactg tgaaccatgc gttttctagt ttgcttgttt cattcatata 360
agcttgtgtt acttagttcc gaaccctgta gctttgtagt ctatgctctc ttttgtaggg 420
atgtgctgtc ataagat 437
<210> 311
<211> 387
<212> ДНК
<213> искусственная последовательность
<220>
<223> yr00-9311-1 (A-геном ; аллель ED)
<400> 311
gcaatcaaga agatgcttga gaccccaggg ccatacttgt tggatatcat cgtcccgcat 60
caggagcacg tgctgcccca tcaccctcca tgatcatgtc cttgaaagcg ccgcattggg 120
aataataatc ccaagcggtg gtgctttcaa ggacatgatc atggagggtg atggcaggac 180
ctcgtactga aatttcgacc tacaagacct acaagtgtga catgcgcaat cagcatggtg 240
cccgcgtgtt gtatcaacta ctaggggttc aactgtgaac catgcgtttt ctagtttgct 300
tgtttcattc atataagctt gtgttactta gttccgaacc ctgtagcttt gtagtctatg 360
ctctcttttg tagggatgtg ctgtcat 387
<210> 312
<211> 346
<212> ДНК
<213> искусственная последовательность
<220>
<223> yr00-9311-1 (D-геном ; аллель WT)
<400> 312
gcaatcaaga agatgcttga gaccccaggg ccatacttgt tggatatcat agtcccgcat 60
caggagcacg tgctgcctat gatcccaagc ggtggtgctt tcaaggacat gatcatggag 120
ggtgatggca ggacctcgta ctgaaatttc gacctacaag acctacaagt gtgacatgcg 180
caatcagcat gatgcccgcg tgttgtatca actactaggg gttcaactgt gagccatgcg 240
ttttctagtt tgcttgtttc attcatataa gcttgtatta cttagttccg aaccctgtag 300
ttttgtagtc tatgttctct tttgtaggga tgtgctgtca taagat 346
<210> 313
<211> 346
<212> ДНК
<213> искусственная последовательность
<220>
<223> yr00-9311-1 (D-геном ; аллель WT)
<400> 313
gcaatcaaga agatgcttga gaccccaggg ccatacttgt tggatatcat agtcccgcat 60
caggagcacg tgctgcctat gatcccaagc ggtggtgctt tcaaggacat gatcatggag 120
ggtgatggca ggacctcgta ctgaaatttc gacctacaag acctacaagt gtgacatgcg 180
caatcagcat gatgcccgcg tgttgtatca actactaggg gttcaactgt gagccatgcg 240
ttttctagtt tgcttgtttc attcatataa gcttgtatta cttagttccg aaccctgtag 300
ttttgtagtc tatgttctct tttgtaggga tgtgctgtca taagat 346
<210> 314
<211> 3336
<212> ДНК
<213> искусственная последовательность
<220>
<223> QA_pDAS000434
<400> 314
ccactcttgc cctacacgac actgaagacc ttatgattcc aaacggcggc gccttcaagg 60
acatgatcat ggagggtgat ggcaggacct cgtactgaaa tttcgaccta caagacctac 120
aagtgtgaca tgcgcaatca gcatggtgcc cgcgtgttgt atcaactact aggggttcaa 180
ctgtgaacca tgcgttttct agtttgcttg tttcattcat ataagcttgt gttacttagt 240
tccgaaccct gtagctttgt agtctatgct ctcttttgta gggatgtgct gtcataagat 300
atcatgcaag tttcttgtcc tacatatcaa taataagtac ttccatggaa taattctcag 360
ttctgttttg aattttgcat cttctcacaa acagtgtgct ggttcctttc tgttcgctga 420
cgccctcctc gactccatcc ccatggtcgc catcacgggc caggtccccc gccgcatgat 480
cggtagcgac ttcgtgggcg aggaaagcct ttcgtccaag gtggtccctc ctcgcaatct 540
tgttggatgg tgaatattat aaaagcctgc ccttctcgcg ggtaagactc ccgcccatcc 600
aggatgagga tgaccagcct tttgcagttt atccactagg gacaggattg catcctgccg 660
aaaccctgcc aagcttgagg tagcctccaa tttgacggtg ccgccagcga cgccgtctgg 720
aactgtcctt tttgaggacc actccgtttg tctagactag catactcgag gtcattcata 780
tgcttgagaa gagagtcggg atagtccaaa ataaaacaaa ggtaagatta cctggtcaaa 840
agtgaaaaca tcagttaaaa ggtggtataa agtaaaatat cggtaataaa aggtggccca 900
aagtgaaatt tactcttttc tactattata aaaattgagg atgtttttgt cggtactttg 960
atacgtcatt tttgtatgaa ttggttttta agtttattcg cttttggaaa tgcatatctg 1020
tatttgagtc gggttttaag ttcgtttgct tttgtaaata cagagggatt tgtataagaa 1080
atatctttaa aaaaacccat atgctaattt gacataattt ttgagaaaaa tatatattca 1140
ggcgaattct cacaatgaac aataataaga ttaaaatagc tttcccccgt tgcagcgcat 1200
gggtattttt tctagtaaaa ataaaagata aacttagact caaaacattt acaaaaacaa 1260
cccctaaagt tcctaaagcc caaagtgcta tccacgatcc atagcaagcc cagcccaacc 1320
caacccaacc caacccaccc cagtccagcc aactggacaa tagtctccac acccccccac 1380
tatcaccgtg agttgtccgc acgcaccgca cgtctcgcag ccaaaaaaaa aaaaagaaag 1440
aaaaaaaaga aaaagaaaaa acagcaggtg ggtccgggtc gtgggggccg gaaacgcgag 1500
gaggatcgcg agccagcgac gaggccggcc ctccctccgc ttccaaagaa acgcccccca 1560
tcgccactat atacataccc ccccctctcc tcccatcccc ccaaccctac caccaccacc 1620
accaccacct ccacctcctc ccccctcgct gccggacgac gagctcctcc cccctccccc 1680
tccgccgccg ccgcgccggt aaccaccccg cccctctcct ctttctttct ccgttttttt 1740
tttccgtctc ggtctcgatc tttggccttg gtagtttggg tgggcgagag gcggcttcgt 1800
gcgcgcccag atcggtgcgc gggaggggcg ggatctcgcg gctggggctc tcgccggcgt 1860
ggatccggcc cggatctcgc ggggaatggg gctctcggat gtagatctgc gatccgccgt 1920
tgttggggga gatgatgggg ggtttaaaat ttccgccatg ctaaacaaga tcaggaagag 1980
gggaaaaggg cactatggtt tatattttta tatatttctg ctgcttcgtc aggcttagat 2040
gtgctagatc tttctttctt ctttttgtgg gtagaatttg aatccctcag cattgttcat 2100
cggtagtttt tcttttcatg atttgtgaca aatgcagcct cgtgcggagc ttttttgtag 2160
gtagaagcca tgtctccgga gaggagacca gttgagatta ggccagctac agcagctgat 2220
atggccgcgg tttgtgatat cgttaaccat tacattgaga cgtctacagt gaactttagg 2280
acagagccac aaacaccaca agagtggatt gatgatctcg agaggttgca agatagatac 2340
ccttggttgg ttgctgaggt tgagggtgtt gtggctggta ttgcttacgc tgggccctgg 2400
aaggctagga acgcttacga ttggacagtt gagagtactg tttacgtgtc acataggcat 2460
caaaggttgg gcctaggatc cacattgtac acacatttgc ttaagtctat ggaggcgcaa 2520
ggttttaagt ctgtggttgc tgttataggc cttccaaacg atccatctgt taggttgcat 2580
gaggctttgg gatacacagc ccggggtaca ttgcgcgcag ctggatacaa gcatggtgga 2640
tggcatgatg ttggtttttg gcaaagggat tttgagttgc cagctcctcc aaggccagtt 2700
aggccagtta cccagatcta atagagtccg caaaaatcac cagtctctct ctacaaatct 2760
atctctctct atttttctcc agaataatgt gtgagtagtt cccagataag ggaattaggg 2820
ttcttatagg gtttcgctca tgtgttgagc atataagaaa cccttagtat gtatttgtat 2880
ttgtaaaata cttctatcaa taaaatttct aattcctaaa accaaaatcc agtggtacct 2940
ggagatcatg acattaagga tgaccagttc gtaaaggtcc tgcggtgtct attgcttttc 3000
ataggttaat aagtgtttgc tagactgtgg tgaaaggcca agactcccgc ccatctctct 3060
atgcccggga caagtgccac cccacagtgg ggcaggatga ggatgaccaa agactcccgc 3120
ccatctcact agggacagga ttggcctttt gcagtttatc tctatgcccg ggacaagtgt 3180
atccgaagta aataaaacca tcggactctc gtataagact gtcgactcga ccggccgacg 3240
cataggttca tttgaagctg ctattctatt taaattgaaa ctcggacggt agcagtgtgg 3300
tatgaggtct tcagcacact cggtaactcc agtcac 3336
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ОПОСРЕДОВАННОЙ НУКЛЕАЗОЙ НАПРАВЛЕННОЙ ИНТЕГРАЦИИ ТРАНСГЕНОВ | 2013 |
|
RU2650819C2 |
| НАЦЕЛИВАНИЕ НА КЛЕТКИ, ОПОСРЕДУЕМОЕ ХИМЕРНЫМ АНТИГЕННЫМ РЕЦЕПТОРОМ | 2018 |
|
RU2783316C2 |
| СКОНСТРУИРОВАННАЯ СПОСОБАМИ ИНЖЕНЕРИИ ПЛАТФОРМА ДЛЯ ВСТРАИВАНИЯ ТРАНСГЕНА (ETIP) ДЛЯ НАЦЕЛИВАНИЯ ГЕНОВ И СТЭКИНГА ПРИЗНАКОВ | 2013 |
|
RU2666916C2 |
| РЕДАКТИРОВАНИЕ ГЕНОВ С ИСПОЛЬЗОВАНИЕМ МОДИФИЦИРОВАННОЙ ДНК С ЗАМКНУТЫМИ КОНЦАМИ (зкДНК) | 2018 |
|
RU2811724C2 |
| МОДУЛЯТОРЫ ТАУ И СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИХ ДОСТАВКИ | 2017 |
|
RU2789459C2 |
| НАПРАВЛЕННАЯ РЕКОМБИНАЦИЯ МЕЖДУ ГОМОЛОГИЧНЫМИ ХРОМОСОМАМИ И ЕЕ ПРИМЕНЕНИЯ | 2018 |
|
RU2802791C2 |
| УНИВЕРСАЛЬНАЯ ДОНОРНАЯ СИСТЕМА ДЛЯ НАПРАВЛЕННОГО ВОЗДЕЙСТВИЯ НА ГЕНЫ | 2014 |
|
RU2687369C2 |
| ГЕТЕРОЗИГОТНЫЕ ПО CENH3 ОДНОДОЛЬНЫЕ РАСТЕНИЯ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ ДЛЯ ИНДУКЦИИ ГАПЛОИДОВ И ОДНОВРЕМЕННОГО РЕДАКТИРОВАНИЯ ГЕНОМА | 2021 |
|
RU2832578C1 |
| ЛОКУСЫ ФУНКЦИОНАЛЬНОСТИ FAD2 И СООТВЕТСТВУЮЩИЕ СПЕЦИФИЧНЫЕ К УЧАСТКУ-МИШЕНИ СВЯЗЫВАЮЩИЕ БЕЛКИ, СПОСОБНЫЕ ИНДУЦИРОВАТЬ НАПРАВЛЕННЫЕ РАЗРЫВЫ | 2013 |
|
RU2656159C2 |
| СПОСОБЫ ЗАЩИТЫ ПЛОДОВ СВИНЕЙ ОТ ИНФИЦИРОВАНИЯ ВИРУСОМ | 2018 |
|
RU2778405C2 |
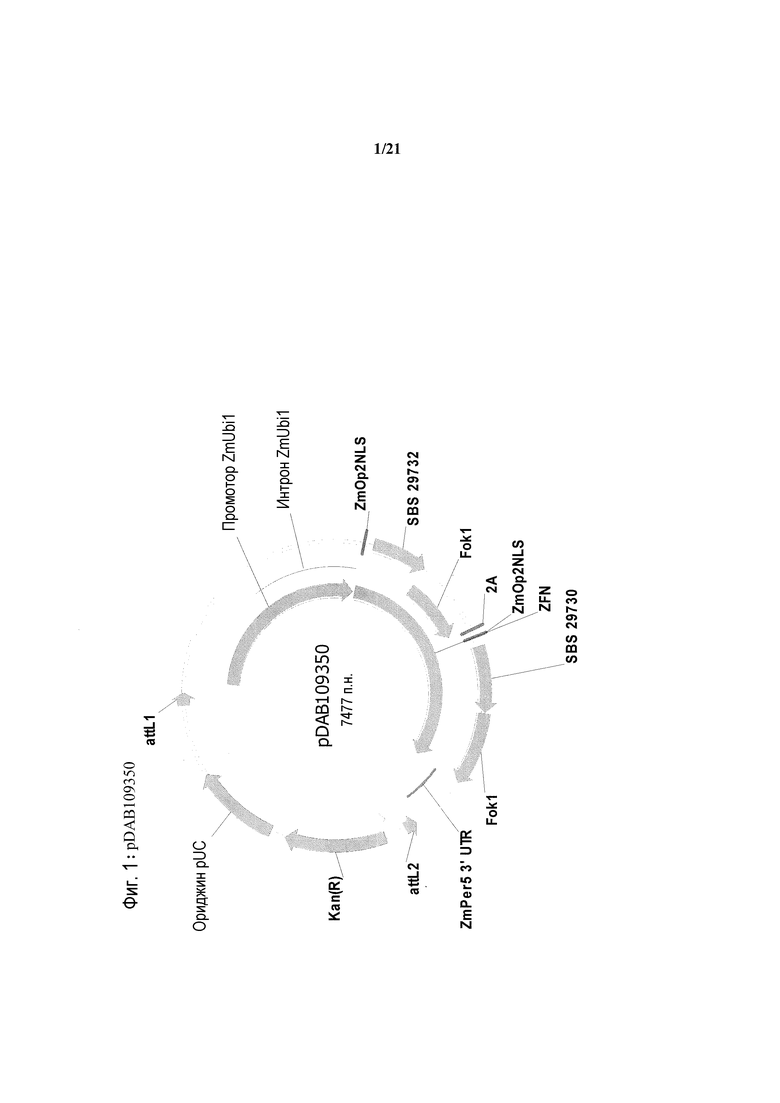
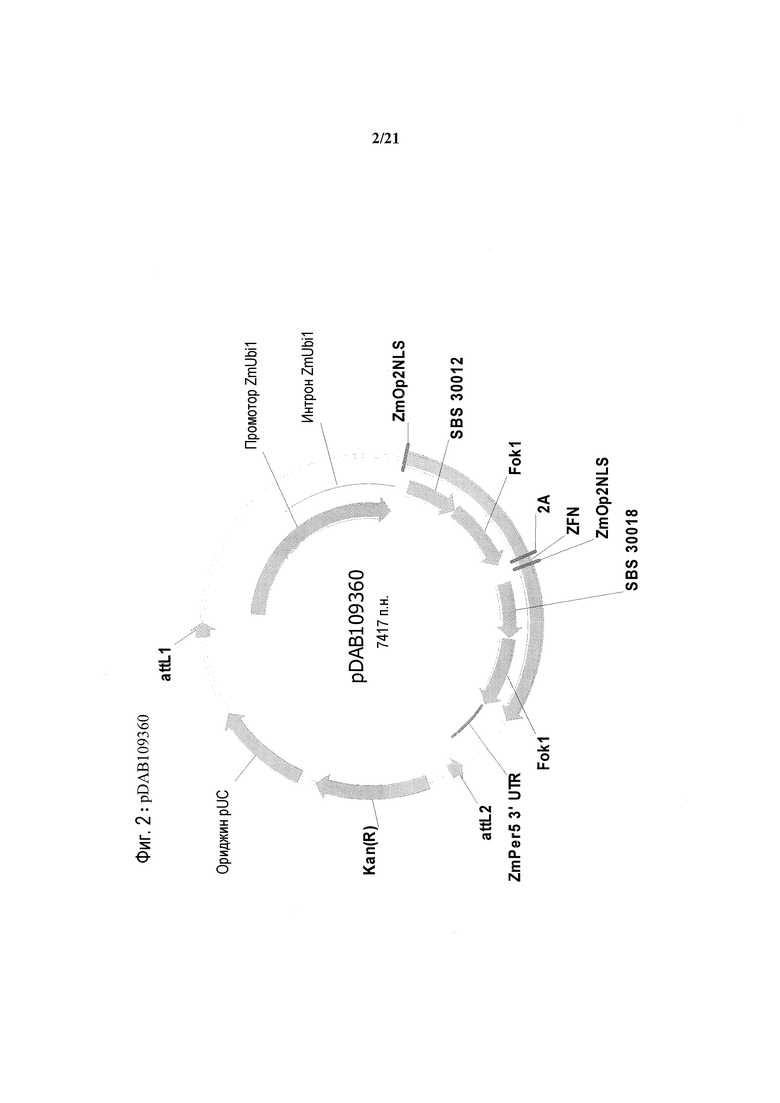
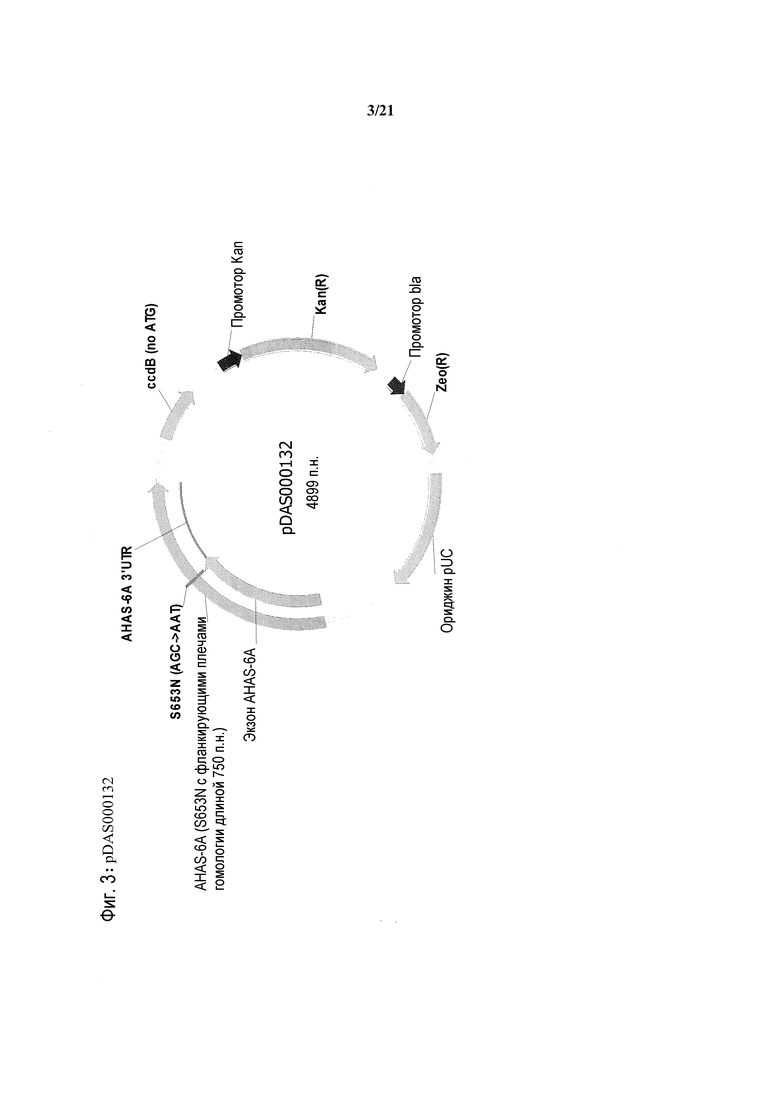
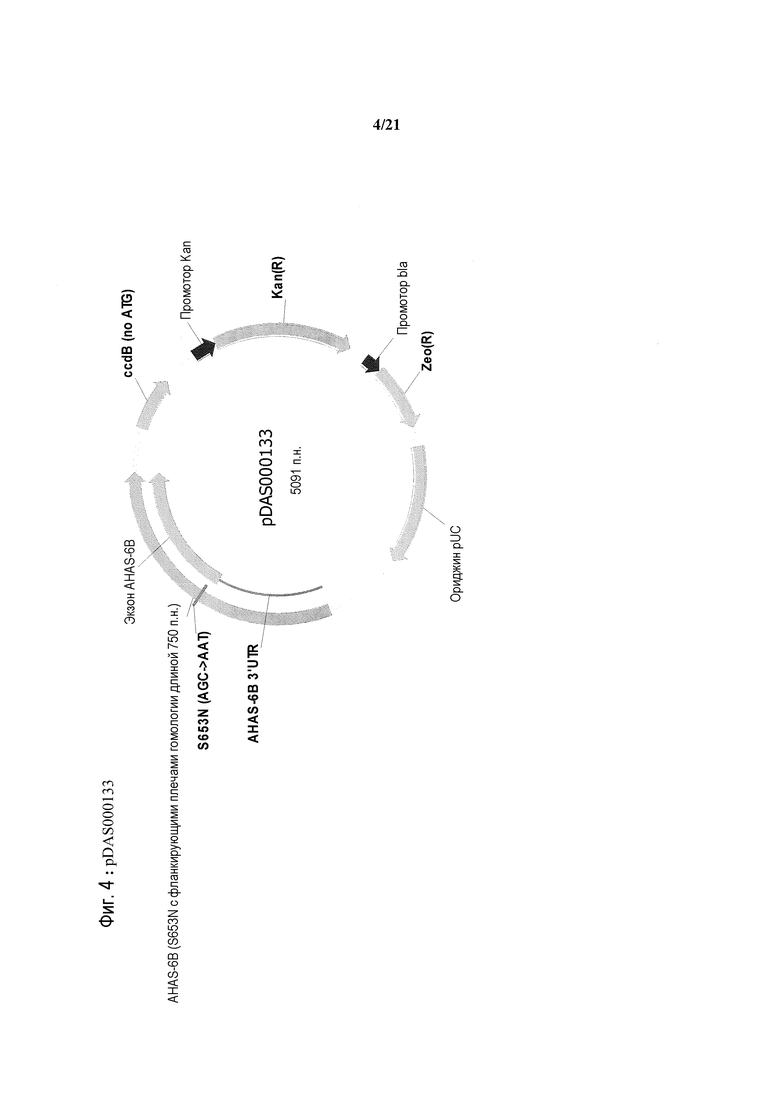
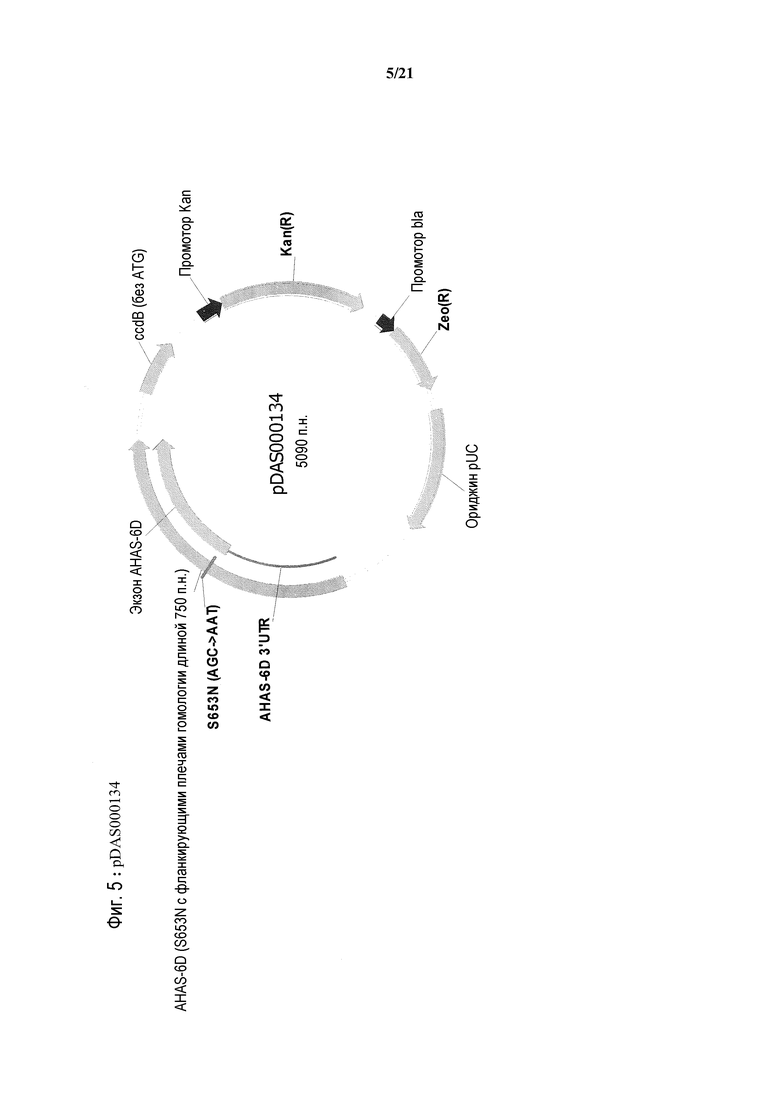
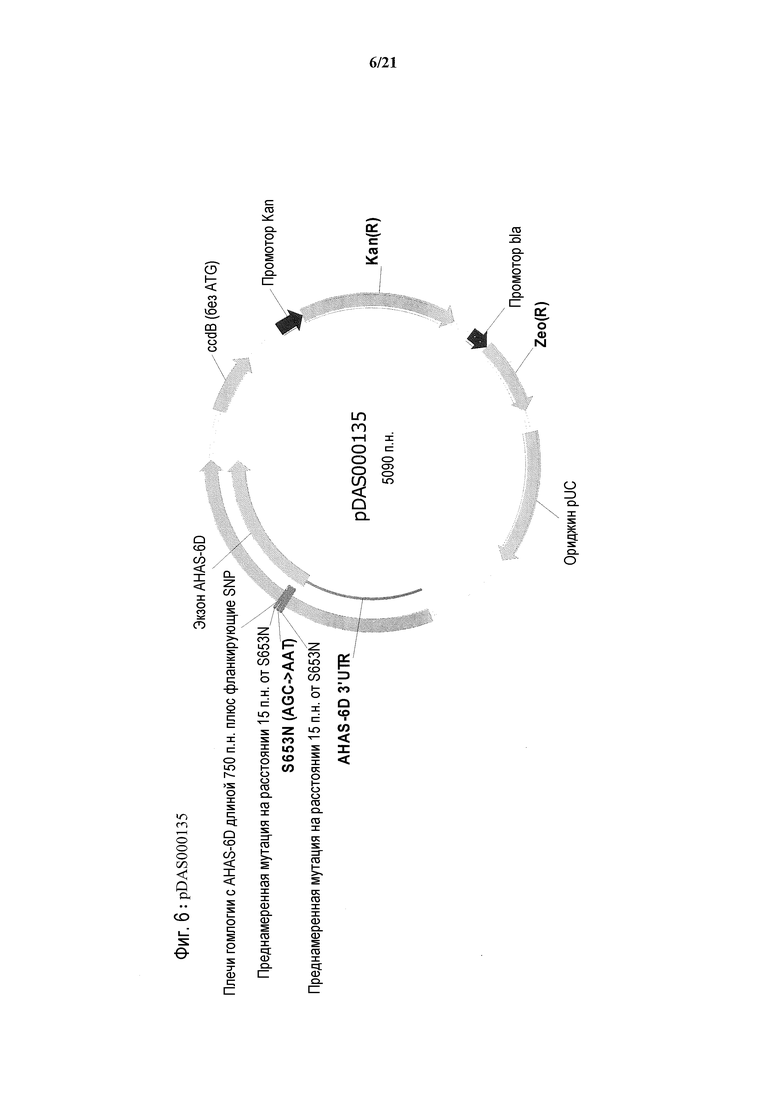
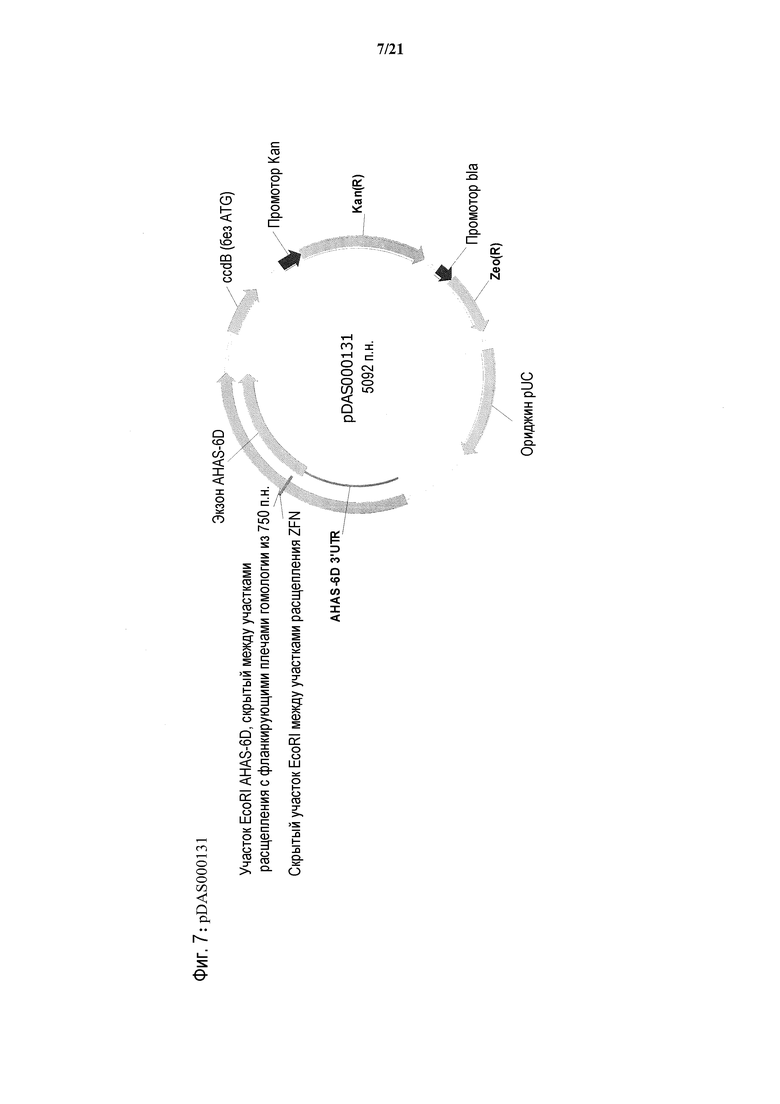

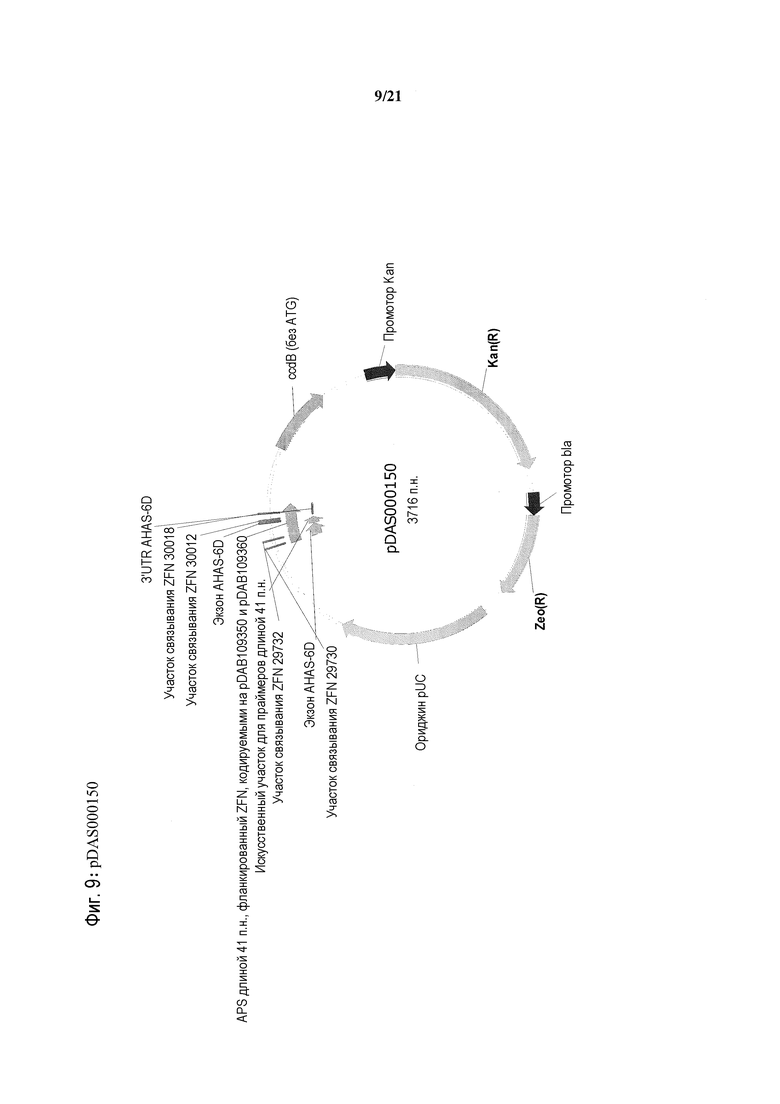
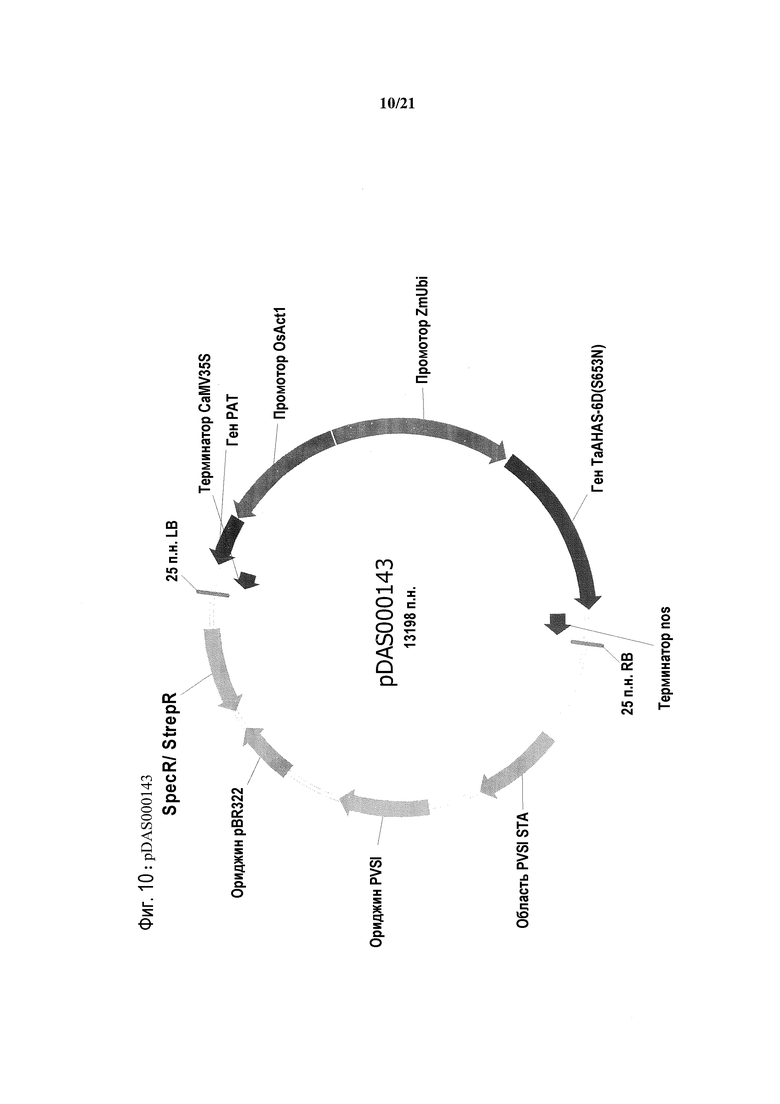
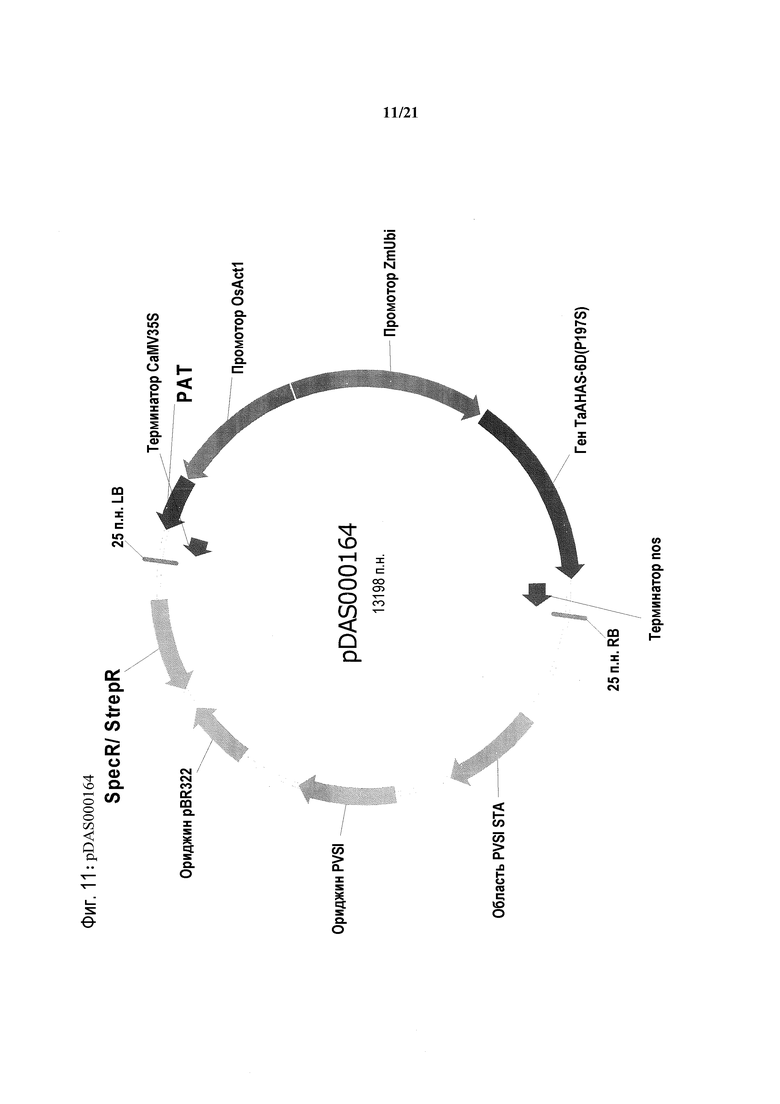
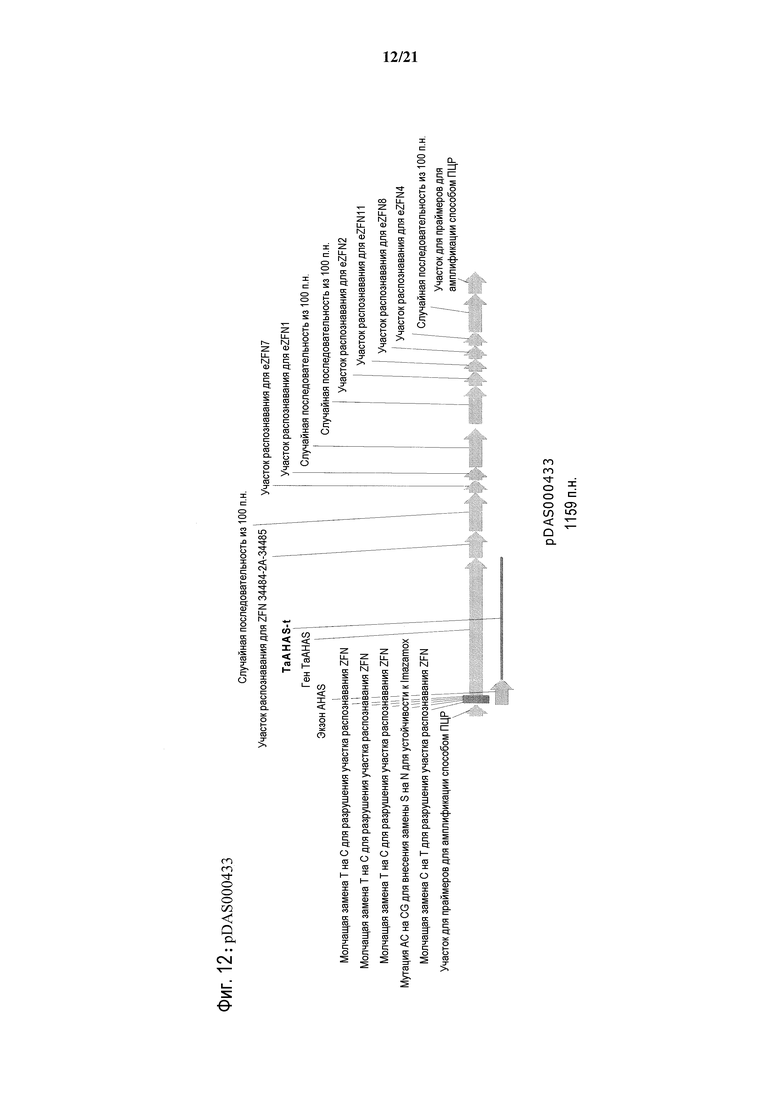

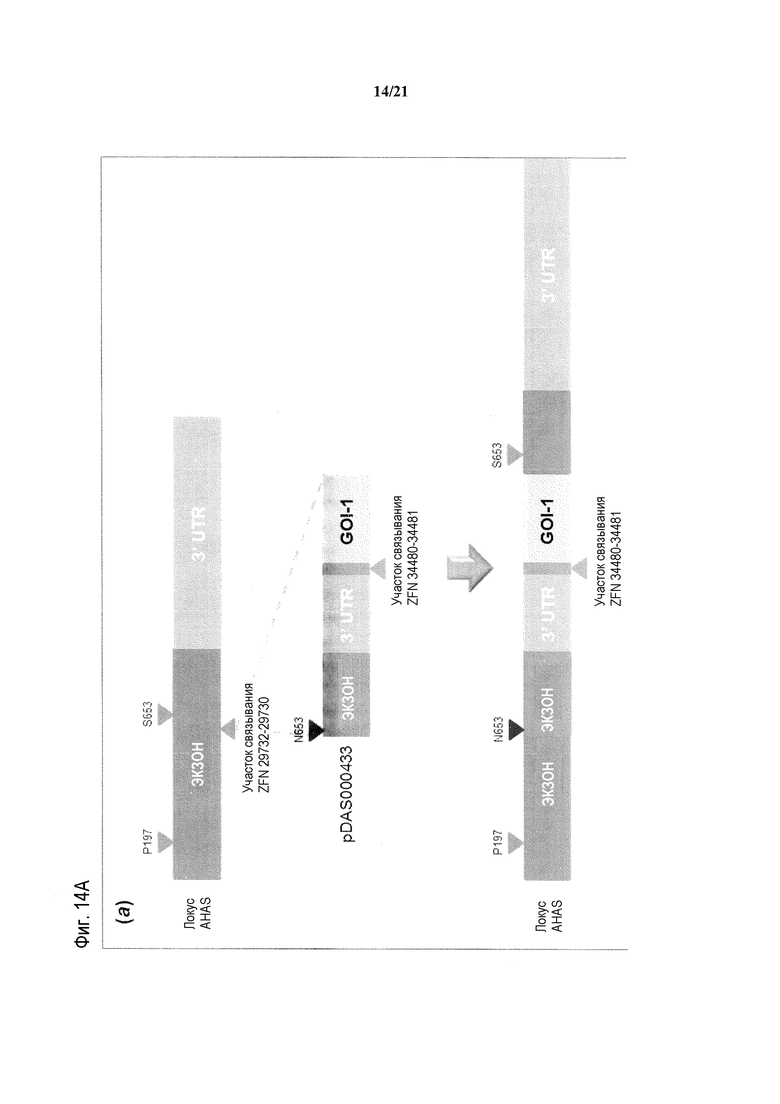
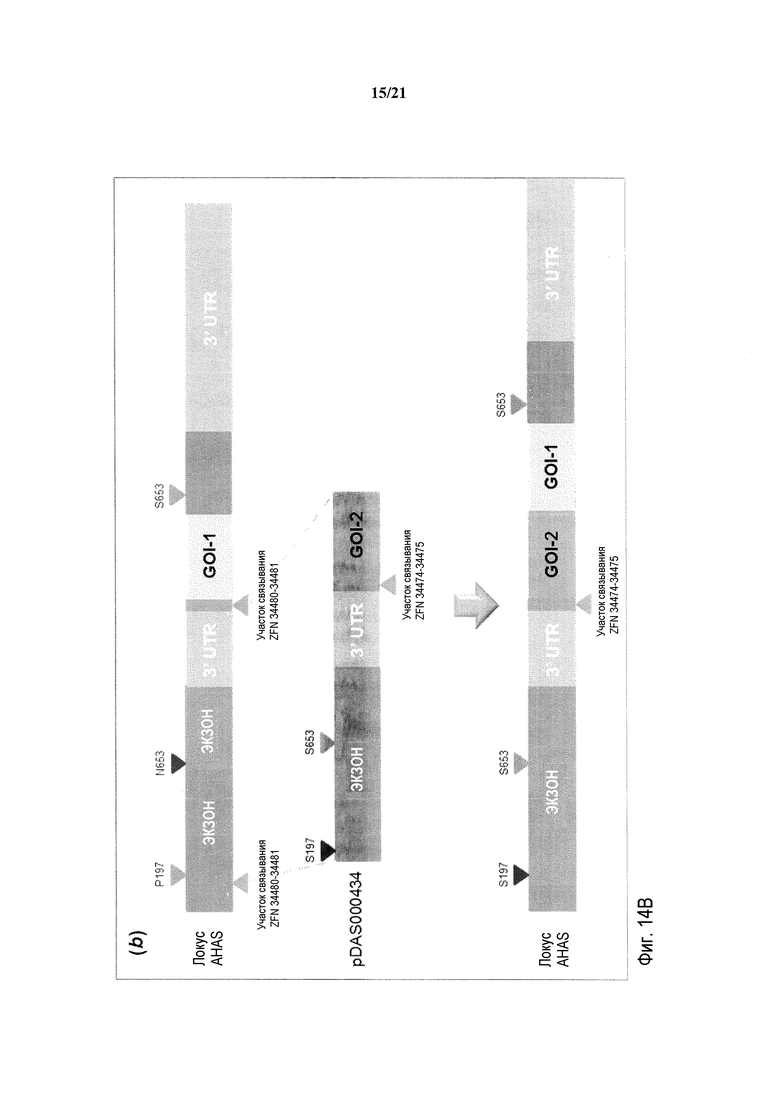
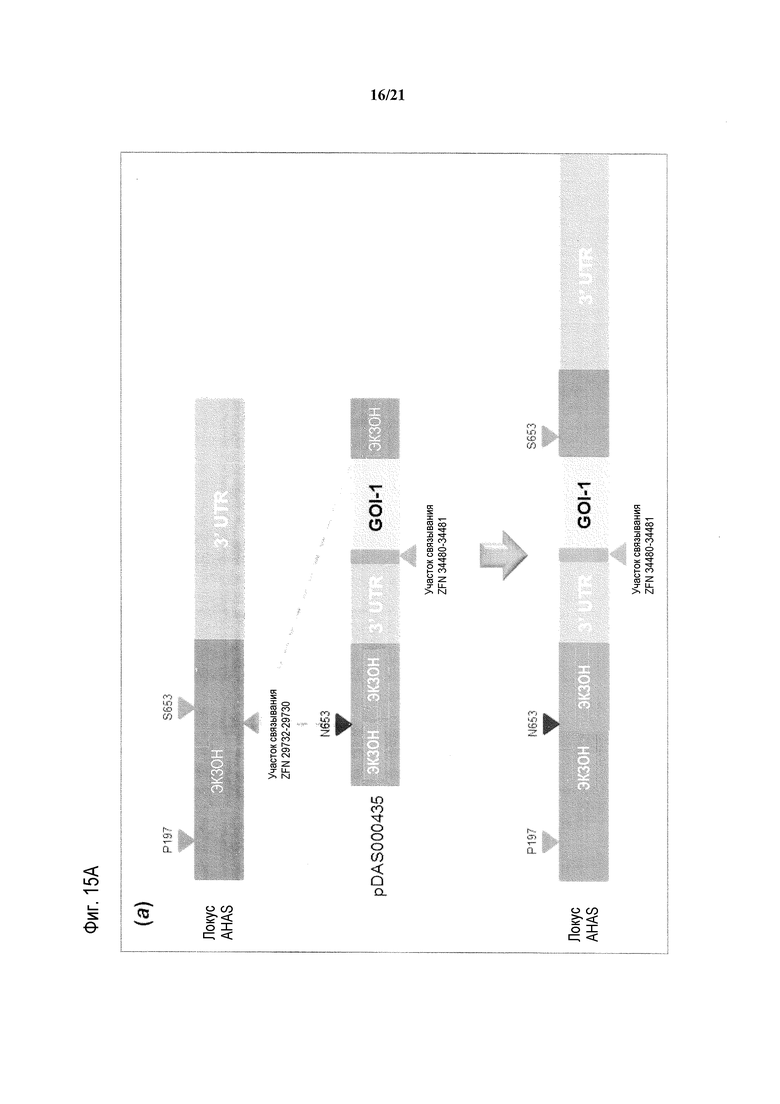
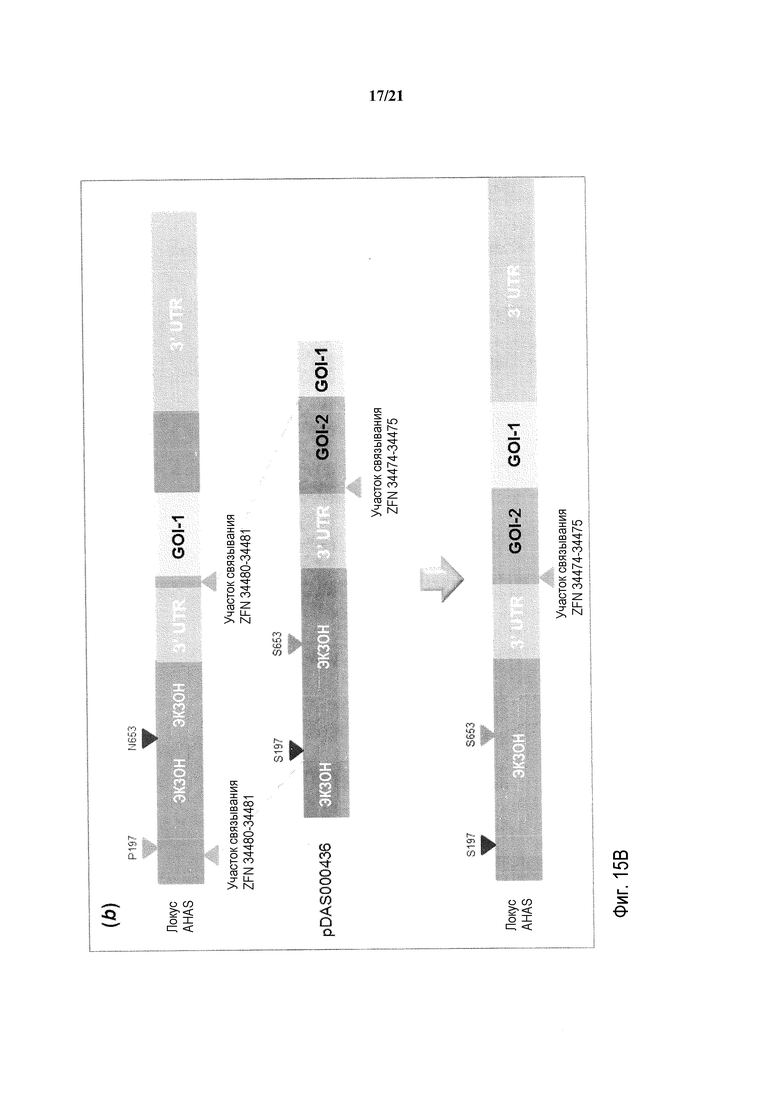


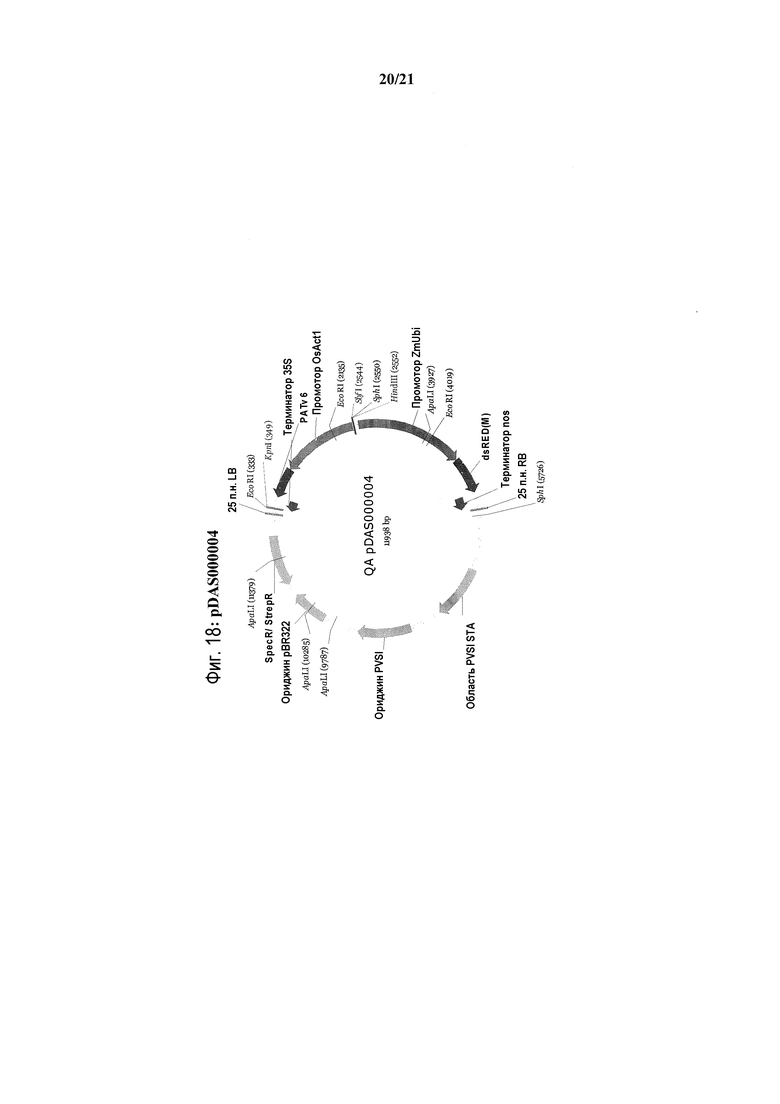
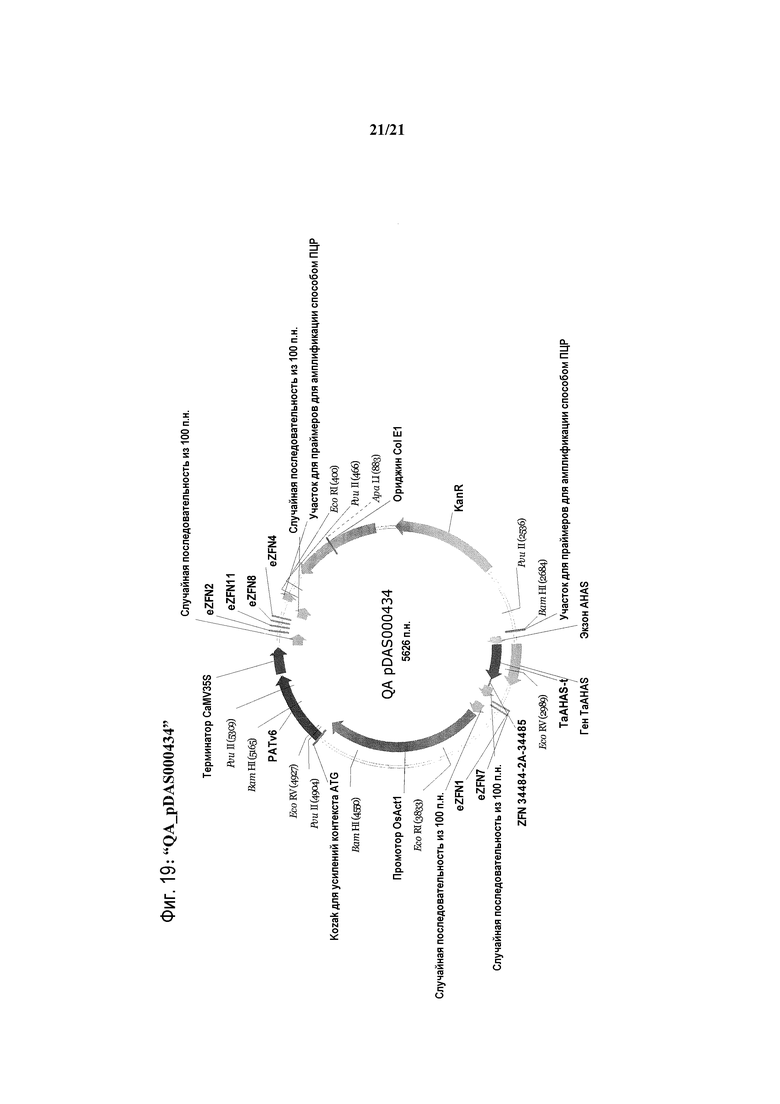
Изобретение относится к области биохимии, в частности к генетически модифицированной клетке растения с повышенной толерантностью к гербициду на основе ингибитора ацетолактатсинтазы (ALS), а также к растению, части растения, семени растения и плоду растения, содержащим вышеуказанную клетку. Также раскрыт способ получения вышеуказанной генетически модифицированной клетки растения, а также способ встраивания одной или нескольких экзогенных последовательностей в геном клетки растения. Изобретение также относится к нуклеазе с цинковыми пальцами для получения генетически модифицированной клетки растения, а также для использования в расщеплении гена AHAS. Изобретение позволяет эффективно повышать растению толерантностью к гербициду на основе ингибитора ацетолактатсинтазы (ALS). 9 н. и 11 з.п. ф-лы, 19 ил., 24 табл., 13 пр.
1. Генетически модифицированная клетка растения с повышенной толерантностью к гербициду на основе ингибитора ацетолактатсинтазы (ALS) по сравнению с клеткой растения, которая не является генетически модифицированной, где клетка растения содержит направленную геномную модификацию одного или нескольких аллелей эндогенного гена синтазы ацетогидроксикислот (AHAS) в клетке растения, где ингибитором ALS является имидазолинон или сульфонилмочевина, где клетка растения содержит сайт-специфическую нуклеазу c цинковыми пальцами, которая связывается с последовательностью, включающей участок-мишень, как показано в любой из SEQ ID NO: 35-56 или 263-278, где сайт-специфическая нуклеаза c цинковыми пальцами включает от четырех до шести доменов с цинковыми пальцами, причем каждый домен с цинковыми пальцами содержит область, распознающую спираль, где
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 181, 182, 182, 183, 184 и 185, и расщепляется на или вблизи участка-мишени SEQ ID NO: 35;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 186, 187, 188, 189, 190 и 191, и расщепляется на или вблизи участка-мишени SEQ ID NO: 36;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 182, 183, 184, 185, 192 и 193, и расщепляется на или вблизи участка-мишени SEQ ID NO: 37;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 182, 183, 184, 185, 194 и 195, и расщепляется на или вблизи участка-мишени SEQ ID NO: 38;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 196, 197, 198, 199 и 200, и расщепляется на или вблизи участка-мишени SEQ ID NO: 39;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 201, 202, 186, 187, 188 и 189, и расщепляется на или вблизи участка-мишени SEQ ID NO: 40;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 185, 194, 195, 203 и 204, и расщепляется на или вблизи участка-мишени SEQ ID NO: 41;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 201, 202, 196, 197 и 198, и расщепляется на или вблизи участка-мишени SEQ ID NO: 42;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 205, 206, 199, 207, 199 и 208, и расщепляется на или вблизи участка-мишени SEQ ID NO: 43;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 194, 209, 210, 211 и 212, и расщепляется на или вблизи участка-мишени SEQ ID NO: 44;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 213, 214, 182, 215 и 216, и расщепляется на или вблизи участка-мишени SEQ ID NO: 45;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 205, 217, 218, 219 и 220, и расщепляется на или вблизи участка-мишени SEQ ID NO: 46;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 221, 222, 199, 207 и 184, и расщепляется на или вблизи участка-мишени SEQ ID NO: 47;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 223, 224, 225 и 226, и расщепляется на или вблизи участка-мишени SEQ ID NO: 48;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 227, 228, 229, 230 и 231, и расщепляется на или вблизи участка-мишени SEQ ID NO: 49;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 223, 224, 225 и 226, и расщепляется на или вблизи участка-мишени SEQ ID NO: 50;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 232, 233, 234 и 186, и расщепляется на или вблизи участка-мишени SEQ ID NO: 51;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 204, 223, 224, 225 и 226, и расщепляется на или вблизи участка-мишени SEQ ID NO: 52;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 204, 223, 192 и 235, и расщепляется на или вблизи участка-мишени SEQ ID NO: 53;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 232, 233, 234 и 34, и расщепляется на или вблизи участка-мишени SEQ ID NO: 54;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 33, 233, 32 и 223, и расщепляется на или вблизи участка-мишени SEQ ID NO: 55;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 31, 30, 192, 29, 233 и 28, и расщепляется на или вблизи участка-мишени SEQ ID NO: 56;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 227, 182, 182, 236, 237 и 182, и расщепляется на или вблизи участка-мишени SEQ ID NO: 263;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO:184, 238, 182, 239 и 240, и расщепляется на или вблизи участка-мишени SEQ ID NO: 264;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 241, 242, 243, 233 и 244, и расщепляется на или вблизи участка-мишени SEQ ID NO: 265;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 245, 182, 246, 227 и 247, и расщепляется на или вблизи участка-мишени SEQ ID NO: 266;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 227, 198, 237, 182, 218 и 248, и расщепляется на или вблизи участка-мишени SEQ ID NO: 267;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 219, 249, 210, 250, 237 и 224, и расщепляется на или вблизи участка-мишени SEQ ID NO: 268;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 237, 182, 218, 248 и 198, и расщепляется на или вблизи участка-мишени SEQ ID NO: 269;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 249, 73, 201, 216, 233 и 251, и расщепляется на или вблизи участка-мишени SEQ ID NO: 270;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 218, 248, 233, 184 и 198, и расщепляется на или вблизи участка-мишени SEQ ID NO: 271;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 237, 249, 252, 253 и 216, и расщепляется на или вблизи участка-мишени SEQ ID NO: 272;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 254, 255, 224, 256 и 205, и расщепляется на или вблизи участка-мишени SEQ ID NO: 273;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 252, 253, 203, 254, 237 и 224, и расщепляется на или вблизи участка-мишени SEQ ID NO: 274;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 255, 224, 256, 205, 249 и 257, и расщепляется на или вблизи участка-мишени SEQ ID NO: 275;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 224, 252, 253, 203 и 254, и расщепляется на или вблизи участка-мишени SEQ ID NO: 276;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 258, 254, 221, 259, 260 и 261, и расщепляется на или вблизи участка-мишени SEQ ID NO: 277; или
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 216, 259, 218, 219 и 262, и расщепляется на или вблизи участка-мишени SEQ ID NO: 278,
и где геномная модификация встраивает экзогенную последовательность в ген AHAS, где экзогенная последовательность кодирует продукт, который приводит к толерантной к гербициду на основе ингибитора ALS клетке растения.
2. Клетка растения по п.1, дополнительно содержащая встраивание второй экзогенной последовательности в ген AHAS таким образом, что две или более экзогенных последовательности встроены в эндогенный ген AHAS.
3. Клетка растения по любому из пп.1, 2, где встроенная экзогенная последовательность вводит либо мутацию S653Т в гене AHAS, которая сообщает толерантность к гербицидам на основе имидазолинона, и/или мутацию P197S, которая сообщает толерантность к гербицидам на основе сульфонилмочевины.
4. Клетка растения по любому из пп.1, 2, где клетка растения представляет собой полиплоидную клетку растения.
5. Клетка растения по любому из пп.1-4, где растение выбрано из группы, состоящей из пшеницы, сои, кукурузы, картофеля, люцерны, риса, ячменя, подсолнечника, томата, Arabidopsis, хлопка, видов Brassica и тимофеевки луговой.
6. Растение, содержащее одну или несколько клеток растения по любому из пп.1-5, где растение проявляет повышенную толерантность к гербициду на основе ингибитора ALS по сравнению с растением, которое не содержит генетически модифицированных клеток растений.
7. Часть растения, содержащая одну или несколько клеток растения по любому из пп.1-5, где часть растения проявляет повышенную толерантность к гербициду на основе ингибитора ALS по сравнению с частью растения, которое не содержит генетически модифицированных клеток растений.
8. Семя, содержащее одну или несколько клеток растения по любому из пп.1-5, где семя проявляет повышенную толерантность к гербициду на основе ингибитора ALS по сравнению с семенем от растения, которое не содержит генетически модифицированных клеток растений.
9. Плод, содержащий одну или несколько клеток растения по любому из пп.1-5, где плод проявляет повышенную толерантность к гербициду на основе ингибитора ALS по сравнению с плодом от растения, которое не содержит генетически модифицированных клеток растений.
10. Способ получения генетически модифицированной клетки растения по любому из пп.1-5, включающий:
экспрессию сайт-специфических нуклеаз c цинковыми пальцами в клетке растения, где сайт-специфические нуклеазы с цинковыми пальцами включают от четырех до шести доменов с цинковыми пальцами, причем каждый домен с цинковыми пальцами содержит область, распознающую спираль, где
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 181, 182, 182, 183, 184 и 185, и расщепляется на или вблизи участка-мишени SEQ ID NO: 35;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 186, 187, 188, 189, 190 и 191, и расщепляется на или вблизи участка-мишени SEQ ID NO: 36;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 182, 183, 184, 185, 192 и 193, и расщепляется на или вблизи участка-мишени SEQ ID NO: 37;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 182, 183, 184, 185, 194 и 195, и расщепляется на или вблизи участка-мишени SEQ ID NO: 38;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 196, 197, 198, 199 и 200, и расщепляется на или вблизи участка-мишени SEQ ID NO: 39;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 201, 202, 186, 187, 188 и 189, и расщепляется на или вблизи участка-мишени SEQ ID NO: 40;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 185, 194, 195, 203 и 204, и расщепляется на или вблизи участка-мишени SEQ ID NO: 41;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 201, 202, 196, 197 и 198, и расщепляется на или вблизи участка-мишени SEQ ID NO: 42;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 205, 206, 199, 207, 199 и 208, и расщепляется на или вблизи участка-мишени SEQ ID NO: 43;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 194, 209, 210, 211 и 212, и расщепляется на или вблизи участка-мишени SEQ ID NO: 44;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 213, 214, 182, 215 и 216, и расщепляется на или вблизи участка-мишени SEQ ID NO: 45;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 205, 217, 218, 219 и 220, и расщепляется на или вблизи участка-мишени SEQ ID NO: 46;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 221, 222, 199, 207 и 184, и расщепляется на или вблизи участка-мишени SEQ ID NO: 47;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 223, 224, 225 и 226, и расщепляется на или вблизи участка-мишени SEQ ID NO: 48;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 227, 228, 229, 230 и 231, и расщепляется на или вблизи участка-мишени SEQ ID NO: 49;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 223, 224, 225 и 226, и расщепляется на или вблизи участка-мишени SEQ ID NO: 50;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 232, 233, 234 и 186, и расщепляется на или вблизи участка-мишени SEQ ID NO: 51;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 204, 223, 224, 225 и 226, и расщепляется на или вблизи участка-мишени SEQ ID NO: 52;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 204, 223, 192 и 235, и расщепляется на или вблизи участка-мишени SEQ ID NO: 53;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 232, 233, 234 и 34, и расщепляется на или вблизи участка-мишени SEQ ID NO: 54;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 33, 233, 32 и 223, и расщепляется на или вблизи участка-мишени SEQ ID NO: 55;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 31, 30, 192, 29, 233 и 28, и расщепляется на или вблизи участка-мишени SEQ ID NO: 56;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 227, 182, 182, 236, 237 и 182, и расщепляется на или вблизи участка-мишени SEQ ID NO: 263;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO:184, 238, 182, 239 и 240, и расщепляется на или вблизи участка-мишени SEQ ID NO: 264;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 241, 242, 243, 233 и 244, и расщепляется на или вблизи участка-мишени SEQ ID NO: 265;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 245, 182, 246, 227 и 247, и расщепляется на или вблизи участка-мишени SEQ ID NO: 266;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 227, 198, 237, 182, 218 и 248, и расщепляется на или вблизи участка-мишени SEQ ID NO: 267;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 219, 249, 210, 250, 237 и 224, и расщепляется на или вблизи участка-мишени SEQ ID NO: 268;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 237, 182, 218, 248 и 198, и расщепляется на или вблизи участка-мишени SEQ ID NO: 269;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 249, 73, 201, 216, 233 и 251, и расщепляется на или вблизи участка-мишени SEQ ID NO: 270;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 218, 248, 233, 184 и 198, и расщепляется на или вблизи участка-мишени SEQ ID NO: 271;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 237, 249, 252, 253 и 216, и расщепляется на или вблизи участка-мишени SEQ ID NO: 272;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 254, 255, 224, 256 и 205, и расщепляется на или вблизи участка-мишени SEQ ID NO: 273;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 252, 253, 203, 254, 237 и 224, и расщепляется на или вблизи участка-мишени SEQ ID NO: 274;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 255, 224, 256, 205, 249 и 257, и расщепляется на или вблизи участка-мишени SEQ ID NO: 275;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 224, 252, 253, 203 и 254, и расщепляется на или вблизи участка-мишени SEQ ID NO: 276;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 258, 254, 221, 259, 260 и 261, и расщепляется на или вблизи участка-мишени SEQ ID NO: 277; или
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 216, 259, 218, 219 и 262, и расщепляется на или вблизи участка-мишени SEQ ID NO: 278
в присутствии одной или нескольких экзогенных последовательностей, где экзогенные последовательности кодируют один или несколько продуктов, которые приводят к растительной клетке с толерантностью к гербициду на основе ингибитора ALS; и
где одна или несколько экзогенных последовательностей встроены в ген AHAS, после сайт-специфического расщепления гена AHAS нуклеазами c цинковыми пальцами.
11. Нуклеаза с цинковыми пальцами для использования в расщеплении гена AHAS, где нуклеаза c цинковыми пальцами включает от четырех до шести доменов с цинковыми пальцами, причем каждый домен с цинковыми пальцами содержит область, распознающую спираль,
где
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 181, 182, 182, 183, 184 и 185, и расщепляется на или вблизи участка-мишени SEQ ID NO: 35;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 186, 187, 188, 189, 190 и 191, и расщепляется на или вблизи участка-мишени SEQ ID NO: 36;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 182, 183, 184, 185, 194 и 195, и расщепляется на или вблизи участка-мишени SEQ ID NO: 37;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 182, 183, 185, 194 и 195, и расщепляется на или вблизи участка-мишени SEQ ID NO: 38;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 196, 197, 198, 199 и 200, и расщепляется на или вблизи участка-мишени SEQ ID NO: 39;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 201, 202, 186, 187, 188 и 189, и расщепляется на или вблизи участка-мишени SEQ ID NO: 40;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 185, 194, 195, 203 и 204, и расщепляется на или вблизи участка-мишени SEQ ID NO: 41;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 201, 202, 196, 197 и 198, и расщепляется на или вблизи участка-мишени SEQ ID NO: 42;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 205, 206, 199, 207, 199 и 208, и расщепляется на или вблизи участка-мишени SEQ ID NO: 43;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 194, 209, 210, 211 и 212, и расщепляется на или вблизи участка-мишени SEQ ID NO: 44;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 213, 214, 182, 215 и 216, и расщепляется на или вблизи участка-мишени SEQ ID NO: 45;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 205, 217, 218, 219 и 220, и расщепляется на или вблизи участка-мишени SEQ ID NO: 46;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 221, 222, 199, 207 и 184, и расщепляется на или вблизи участка-мишени SEQ ID NO: 47;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 223, 224, 225 и 226, и расщепляется на или вблизи участка-мишени SEQ ID NO: 48;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 227, 228, 229, 230 и 231, и расщепляется на или вблизи участка-мишени SEQ ID NO: 49;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 223, 224, 225 и 226, и расщепляется на или вблизи участка-мишени SEQ ID NO: 50;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 232, 233, 234 и 186, и расщепляется на или вблизи участка-мишени SEQ ID NO: 51;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 204, 223, 224, 225 и 226, и расщепляется на или вблизи участка-мишени SEQ ID NO: 52;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 204, 223, 192 и 235, и расщепляется на или вблизи участка-мишени SEQ ID NO: 53;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 232, 233, 234 и 34, и расщепляется на или вблизи участка-мишени SEQ ID NO: 54;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 33, 233, 32 и 223, и расщепляется на или вблизи участка-мишени SEQ ID NO: 55;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 31, 30, 192, 29, 233 и 28, и расщепляется на или вблизи участка-мишени SEQ ID NO: 56;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 227, 182, 182, 236, 237 и 182, и расщепляется на или вблизи участка-мишени SEQ ID NO: 263;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 238, 182, 239 и 240, и расщепляется на или вблизи участка-мишени SEQ ID NO: 264;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 241, 242, 243, 233 и 244, и расщепляется на или вблизи участка-мишени SEQ ID NO: 265;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 245, 182, 246, 227 и 247, и расщепляется на или вблизи участка-мишени SEQ ID NO: 266;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 227, 198, 237, 182, 218 и 248, и расщепляется на или вблизи участка-мишени SEQ ID NO: 267;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 219, 249, 210, 250, 237 и 224, и расщепляется на или вблизи участка-мишени SEQ ID NO: 268;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 237, 182, 218, 248 и 198, и расщепляется на или вблизи участка-мишени SEQ ID NO: 269;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 249, 73, 201, 216, 233 и 251, и расщепляется на или вблизи участка-мишени SEQ ID NO: 270;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 218, 248, 233, 184 и 198, и расщепляется на или вблизи участка-мишени SEQ ID NO: 271;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 237, 249, 252, 253 и 216, и расщепляется на или вблизи участка-мишени SEQ ID NO: 272;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 254, 255, 224, 256 и 205, и расщепляется на или вблизи участка-мишени SEQ ID NO: 273;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 252, 253, 203, 254, 237 и 224, и расщепляется на или вблизи участка-мишени SEQ ID NO: 274;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 255, 224, 256, 205, 249 и 257, и расщепляется на или вблизи участка-мишени SEQ ID NO: 275;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 224, 252, 253, 203 и 254, и расщепляется на или вблизи участка-мишени SEQ ID NO: 276;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 258, 254, 221, 259, 260 и 261, и расщепляется на или вблизи участка-мишени SEQ ID NO: 277; или
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 216, 259, 218, 219 и 262, и расщепляется на или вблизи участка-мишени SEQ ID NO: 278.
12. Нуклеаза с цинковыми пальцами для использования в способе по п.10, где нуклеаза c цинковыми пальцами включает от четырех до шести доменов с цинковыми пальцами, причем каждый домен с цинковыми пальцами содержит область, распознающую спираль,
где
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 181, 182, 182, 183, 184 и 185, и расщепляется на или вблизи участка-мишени SEQ ID NO: 35;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 186, 187, 188, 189, 190 и 191, и расщепляется на или вблизи участка-мишени SEQ ID NO: 36;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 182, 183, 184, 185, 194 и 195, и расщепляется на или вблизи участка-мишени SEQ ID NO: 37;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 182, 183, 185, 194 и 195, и расщепляется на или вблизи участка-мишени SEQ ID NO: 38;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 196, 197, 198, 199 и 200, и расщепляется на или вблизи участка-мишени SEQ ID NO: 39;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 201, 202, 186, 187, 188 и 189, и расщепляется на или вблизи участка-мишени SEQ ID NO: 40;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 185, 194, 195, 203 и 204, и расщепляется на или вблизи участка-мишени SEQ ID NO: 41;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 201, 202, 196, 197 и 198, и расщепляется на или вблизи участка-мишени SEQ ID NO: 42;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 205, 206, 199, 207, 199 и 208, и расщепляется на или вблизи участка-мишени SEQ ID NO: 43;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 194, 209, 210, 211 и 212, и расщепляется на или вблизи участка-мишени SEQ ID NO: 44;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 213, 214, 182, 215 и 216, и расщепляется на или вблизи участка-мишени SEQ ID NO: 45;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 205, 217, 218, 219 и 220, и расщепляется на или вблизи участка-мишени SEQ ID NO: 46;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 221, 222, 199, 207 и 184, и расщепляется на или вблизи участка-мишени SEQ ID NO: 47;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 223, 224, 225 и 226, и расщепляется на или вблизи участка-мишени SEQ ID NO: 48;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 227, 228, 229, 230 и 231, и расщепляется на или вблизи участка-мишени SEQ ID NO: 49;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 223, 224, 225 и 226, и расщепляется на или вблизи участка-мишени SEQ ID NO: 50;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 232, 233, 234 и 186, и расщепляется на или вблизи участка-мишени SEQ ID NO: 51;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 204, 223, 224, 225 и 226, и расщепляется на или вблизи участка-мишени SEQ ID NO: 52;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 204, 223, 192 и 235, и расщепляется на или вблизи участка-мишени SEQ ID NO: 53;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 232, 233, 234 и 34, и расщепляется на или вблизи участка-мишени SEQ ID NO: 54;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 33, 233, 32 и 223, и расщепляется на или вблизи участка-мишени SEQ ID NO: 55;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 31, 30, 192, 29, 233 и 28, и расщепляется на или вблизи участка-мишени SEQ ID NO: 56;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 227, 182, 182, 236, 237 и 182, и расщепляется на или вблизи участка-мишени SEQ ID NO: 263;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 238, 182, 239 и 240, и расщепляется на или вблизи участка-мишени SEQ ID NO: 264;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 241, 242, 243, 233 и 244, и расщепляется на или вблизи участка-мишени SEQ ID NO: 265;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 184, 245, 182, 246, 227 и 247, и расщепляется на или вблизи участка-мишени SEQ ID NO: 266;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 227, 198, 237, 182, 218 и 248, и расщепляется на или вблизи участка-мишени SEQ ID NO: 267;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 219, 249, 210, 250, 237 и 224, и расщепляется на или вблизи участка-мишени SEQ ID NO: 268;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 237, 182, 218, 248 и 198, и расщепляется на или вблизи участка-мишени SEQ ID NO: 269;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 249, 73, 201, 216, 233 и 251, и расщепляется на или вблизи участка-мишени SEQ ID NO: 270;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 218, 248, 233, 184 и 198, и расщепляется на или вблизи участка-мишени SEQ ID NO: 271;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 237, 249, 252, 253 и 216, и расщепляется на или вблизи участка-мишени SEQ ID NO: 272;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 254, 255, 224, 256 и 205, и расщепляется на или вблизи участка-мишени SEQ ID NO: 273;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 252, 253, 203, 254, 237 и 224, и расщепляется на или вблизи участка-мишени SEQ ID NO: 274;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 255, 224, 256, 205, 249 и 257, и расщепляется на или вблизи участка-мишени SEQ ID NO: 275;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 224, 252, 253, 203 и 254, и расщепляется на или вблизи участка-мишени SEQ ID NO: 276;
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 258, 254, 221, 259, 260 и 261, и расщепляется на или вблизи участка-мишени SEQ ID NO: 277; или
нуклеаза с цинковыми пальцами включает области распознавания спирали, упорядоченные следующим образом и показанные в SEQ ID NO: 216, 259, 218, 219 и 262, и расщепляется на или вблизи участка-мишени SEQ ID NO: 278.
13. Способ встраивания одной или нескольких экзогенных последовательностей в геном клетки растения, причем способ включает:
a) экспрессию одной или нескольких нуклеаз c цинковыми пальцами в соответствии с п.12 в клетке растения, где одна или несколько нуклеаз, которые связываются с последовательностью, включающей участок-мишень в гене AHAS, как показано в любой из SEQ ID NO: 35-56 или 263-278, и расщепляют эндогенный локус AHAS;
b) встраивание одной или нескольких экзогенных последовательностей в эндогенный локус AHAS в геноме клетки растения так, что эндогенный ген AHAS экспрессирует продукт, который приводит к поддающемуся селекции фенотипу в клетке растения; и
c) селекцию клеток растений, которые экспрессируют поддающийся селекции фенотип, где выбирают клетки растений, которые включают одну или несколько экзогенных последовательностей,
где предпочтительно одна или несколько экзогенных последовательностей выбраны из группы, состоящей из донорного полинуклеотида, трансгена или любой их комбинации.
14. Способ по п.13, где встраивание одной или нескольких экзогенных последовательностей происходит посредством гомологичной рекомбинации или негомологичного соединения концов.
15. Способ по п.13 или 14, где одну или несколько экзогенных последовательностей включают одновременно или последовательно в эндогенный локус AHAS.
16. Способ по п.13 или 14, где ген AHAS
(i) расположен на геноме A, B или D полиплоидного генома,
(ii) одна или несколько экзогенных последовательностей кодируют мутацию S653N AHAS или мутацию P197S AHAS.
17. Способ по п.13 или 14, где одна или несколько экзогенных последовательностей кодируют трансген или продуцируют молекулу РНК, где предпочтительно трансген кодирует белок, выбранный из группы, состоящей из белка, который повышает выход культуры, белка, кодирующего устойчивость к заболеванию, белка, который увеличивает рост, белка, кодирующего устойчивость к насекомым, белка, кодирующего толерантность к гербицидам, и их комбинации, и/или где встраивание трансгена дополнительно включает внесение одной или нескольких инсерций-делеций, которые нарушают экспрессию одного или нескольких эндогенных локусов и обеспечивают поддающийся селекции фенотип.
18. Способ по п.13 или 14, отличающийся тем, что дополнительно включает стадии:
d) культивирования выбранных клеток растений, содержащих одну или несколько экзогенных последовательностей; и
e) получения целого растения, содержащего одну или несколько экзогенных последовательностей, встроенных в один или несколько эндогенных локусов генома растения.
19. Способ по п.13 или 14, где для селекции клеток растений используют агент селекции, включающий агент селекции на основе имидазолинона или сульфонилмочевины.
20. Способ по п.18, где целое растение, содержащее одну или несколько экзогенных последовательностей, встроенных в один или несколько эндогенных локусов генома растения, далее модифицировано включением дополнительной экзогенной последовательности в эндогенные локусы генома растения или где одна или несколько экзогенных последовательностей не кодируют трансгенный селективный маркер.
| TOWNSEND ET al., High-frequency modification of plant genes using engineered zinc-finger nucleases, NATURE, 2009, vol | |||
| Устройство для механических испытаний лубовых волокон | 1922 |
|
SU459A1 |
| Орнито-геликоптер | 1919 |
|
SU442A1 |
| US20100287641 Al, 11.11.2010 | |||
| ЛУТОВА Л | |||
| А., Биотехнология высших растений, Издательство С | |||
| - Петербургского университета, 2010, стр | |||
| Способ крашения тканей | 1922 |
|
SU62A1 |
Авторы
Даты
2020-06-08—Публикация
2014-04-02—Подача