Изобретение относится к химии 1,4-дигидропиридина, а именно к новому способу получения диметилового эфира 2,6-диметил-4-(2-нитрофенил)-1,4-дигидропиридин-3,5-дикарбоновой кислоты (нифедипина) формулы (1). Соединение (1) эффективное коронарорасширяющее средство, вызывает длительное увеличение коронарного кровотока, обладает гипотензивным и спазмолитическим действием и широко применяется в медицине под названием нифедипин, коринфар, адалат, фенигидин и др.

В патенте DE 3312216 описывается синтез соединения (1) взаимодействием 2-(2-нитробензилиден)ацетоацетата формулы (2) с метил 3-аминокротонатом формулы (3) при кипячении в метаноле в течение 36 часов. Выход целевого продукта (1) после перекристаллизации составляет 70-75%.

Описан способ получения нифедипина (1) взаимодействием 2-(2-нитробензилиден)ацетоацетата формулы (2) с метил 3-аминокротонатом формулы (3) при нагревании в метаноле в присутствии низших алифатических кислот в качестве катализатора (Патент DE 4423445). Выход целевого продукта после перекристаллизации из метанола составляет 92%.
Оба описанных способа являются трехстадийными, кроме того, их общим недостатком является недостаточная хемоселективность процесса - в реакционной массе присутствует побочный продукт формулы (4), что требует перекристаллизации технических продуктов.
Известен двухстадийный способ получения нифедипина (1) взаимодействием 2-(2-нитробензилиден)ацетоацетата формулы (2) с метиловым эфиром ацетоуксусной кислоты и аммиаком при нагревании в метаноле в присутствии низших алифатических кислот в качестве катализатора (Патент CN 1421434). Выход целевого продукта после перекристаллизации из метанола составляет 70%.

Известны одностадийные (трехкомпонентные) способы получения нифедипина из 2-нитробензальдегида и метилового эфира ацетоуксусной кислоты.

В патенте US 3485847 описано получение нифедипина кипячением 2-нитробензальдегида, метилового эфира ацетоуксусной кислоты и водного аммиака в метаноле с выходом технического продукта 72%. Однако, чистота целевого нефедипина не обсуждается.
Описан способ получения нифедипина из 2-нитробензальдегида, метилового эфира ацетоуксусной кислоты и водного аммиака в среде метанола путем нагревания смеси в автоклаве при 100-103°С и давлении 20-2.2 бар (Патент AT 399873B). Способ обеспечивает выход нифедипина на уровне 48%. Помимо низкого выхода недостатками этого способа являются сложность технологического оформления процесса из-за необходимости работы под давлением.
В патенте РФ 92005275 описан метод получения нифедипина (1) из диацетата 2-нитробензальдегида, метилового эфира ацетоуксусной кислоты и водного аммиака. Реакцию ведут при 76-81°С в течение 5-8 ч в среде низшего алкилового спирта при мольном соотношении реагентов 1:(2,5-3,2):(3,4-3,9) соответственно. Очистка продукта производится перекристаллизацией из уксусной кислоты, причем выделение целевого продукта и очистку осуществляют при освещении красным источником света. Выход около 79%. Недостатками способа являются сложность аппаратурного оформления - необходимость проводить процесс получения и очистки при облучении красным светом, а также использование в качестве растворителя для перекристаллизации агрессивной уксусной кислоты.
Наиболее близким к предлагаемому способу является метод получения нифедипина (1) из 2-нитробензальдегида, метилового эфира ацетоуксусной кислоты и ацетата аммония в присутствии гетерогенного катализатора - карбоксилсодержащей целлюлозы (КЦ), полученной из вымытого хлопка в две стадии (обработка щелочью и окислительный гидролиз). Соотношение 2-нитробензальдегида, метилового эфира ацетоуксусной кислоты и ацетата аммония составляло 1:2:1.04, реакционную массу перемешивали на магнитной мешалке при 50°С в течение часа, затем реакционную массу промывали горячим этанолом, отфильтровывали катализатор, целевой продукт (1) высаживали водой и очищали перекристаллизацией из этанола. Выход 95-97%.
Основными недостатками способа являются необходимость приготовления катализатора (две стадии) и недостаточная хемоселективность процесса, поскольку для очистки технического продукта требуется перекристаллизация.
Целью изобретения является повышение хемоселективности реакции получения нифедипина путем использования более доступного гетерогенного катализатора и упрощение технологического процесса с сохранением высокого выхода целевого продукта.
Цель достигается проведением реакции в присутствии аэросила (коммерчески доступного наноразмерного оксида кремния, удельная поверхность 380 м2/г) в качестве катализатора. Процесс ведут путем перемешивания смеси 8.6 ммоль метилового эфира ацетоуксусной кислоты, 10.4 ммоль водного аммиака и 0.43 ммоль аэросила при 45°С в течение 30 минут, с последующим добавлением 4.3 ммоль 2-нитробензальдегида и перемешиванием при этой температуре еще 5 часов.
По окончании реакции избыток водного аммиака отгоняют. Для отделения аэросила к остатку добавляют горячий метанол или этанол и фильтруют суспензию горячей. Выпавший в маточном растворе осадок фильтруют и сушат на воздухе. По данным ВЭЖХ наблюдается практически 100%-ная конверсия исходного о-нитробензальдегида. В качестве основной примеси определен 2-(2-нитробензилиден)ацетоацетат формулы (2), при этом образования побочного продукта формулы (4) и каких-либо нитрозозамещенных продуктов не зафиксировано. Последнее может быть связано со стабилизацией нифедипина (и возможно, промежуточных продуктов и интермедиатов) при сорбции на поверхности оксида кремния. За счет снижения количества побочных продуктов дополнительной очистки целевого соединения не требуется, операция очистки упрощается. Способ обеспечивает выход нифедипина 91%.
Предлагаемый способ отличается от способа-прототипа использованием коммерчески доступного гетерогенного катализатора - наноразмерного оксида кремния, что повышает хемоселективность процесса и повышает устойчивость целевого продукта. Это происходит за счет особых свойств оксидов металлов, особенно наноразмерных - высокоразвитой поверхности и наличия активных центров различной природы [A. Davydov. Molecular Spectroscopy of Oxide Catalyst Surfaces. Wiley, 2002]. Сорбция реагентов способствует их активации и прохождению реакции в нужном направлении, а также ингибированию побочных процессов [Кинетика и катализ, 2010, №4, С. 590-596]. Использование этого явления в заявляемом изобретении позволяет достичь технического результата, заключающегося в увеличении хемоселективности реакции, а также в повышении стабильности целевого продукта при естественном освещении, что позволяет значительно упростить аппаратурное оформление процесса при сохранении высокого выхода целевого соединения формулы (1).
Пример 1.
Смешивают 1 г (8.6 ммоль) метилового эфира ацетоуксусной кислоты, 4 мл (10.4 ммоль) 25%-го водного аммиака и 26 мг (0.43 ммоль) аэросила. Реакционную смесь перемешивают 30 минут при 45°С, после чего добавляют 0,65 г (4.3 ммоль) 2-нитробензальдегида и перемешивают еще 5 часов при 45°С. По окончании реакции избыток водного аммиака отгоняют, к остатку добавляют горячий метанол или этанол и фильтруют суспензию горячей. Выпавший в маточном растворе осадок фильтруют и сушат на воздухе.
Выход 1.36 г (91%). Т.пл. 160-163°С. Спектр 1Н ЯМР (ДМСО-d6; J, Гц): 2.25 (с, 6H, -СН3); 3.51 (с, 6 H, -ОСН3); 5.49 (с, Н); 7.34 (т, Н, J = 8.1, J = 7.1, С(4) Ar ); 7.43 (д, Н, J = 8.1, С(6) Ar); 7.59 (т, Н, J = 7.1, С(5) Ar ); 7.69 (д, Н, J = 7.9, С(3) Ar); 9.00 (с, Н, -NH). Вычислено (%) для C17H18N2O6: С, 58.96; Н, 5.20; N, 8.09. Найдено (%) С, 59.39; Н, 5.20; N, 8.13. ИК-спектр (DRA), ν/см-1: 686, 712, 744, 793, 829, 858, 1021; 1053, 1100, 1120, 1189, 1225, 1309, 1348, 1431; 1494, 1528, 1621, 1646, 1678, 2952, 3058, 3101, 3330.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2,6-ДИМЕТИЛ-3,5-ДИ(КАРБОМЕТОКСИ)-4-(2-НИТРОФЕНИЛ)-1,4-ДИГИДРОПИРИДИНА (НИФЕДИПИНА) | 1992 |
|
RU2057122C1 |
| Способ получения 4-/2-нитрофенил/-2,6-диметил-3,5-дикарбметокси-1,4-дигидропиридина | 1982 |
|
SU1099842A3 |
| ЭТИЛОВЫЙ И 3-(N,N-ДИМЕТИЛАМИНО)-2,2-ДИМЕТИЛПРОПИЛОВЫЙ ДИЭФИР 2,5-ДИМЕТИЛ-4-(3-НИТРОФЕНИЛ)-1,4-ДИГИДРОПИРИДИН-3,5-ДИКАРБОНОВОЙ КИСЛОТЫ ГИДРОХЛОРИД, ОБЛАДАЮЩИЙ ПРОЛОНГИРОВАННЫМ АНТИГИПЕРТЕНЗИВНЫМ ЭФФЕКТОМ | 1991 |
|
RU2043341C1 |
| ПРОИЗВОДНЫЕ 1,4-ДИГИДРОПИРИДИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, ОБЛАДАЮЩАЯ ВАЗОАКТИВНЫМ ДЕЙСТВИЕМ | 1991 |
|
RU2081869C1 |
| Способ получения производных дигидропиридина | 1987 |
|
SU1831476A3 |
| Способ получения основных сложных эфиров 1,4-дигидропиридинкарбоновой кислоты или их солей | 1973 |
|
SU518127A3 |
| СПОСОБ ПОЛУЧЕНИЯ 3-ЭТИЛ-5-МЕТИЛОВЫЙ ЭФИР 2-[2-(N-ФТАЛИМИДО)-ЭТОКСИМЕТИЛ]-4-(2-ХЛОРФЕНИЛ)-1,4-ДИГИДРО-6-МЕТИЛ-3,5- ПИРИДИНДИКАРБОНОВОЙ КИСЛОТЫ | 1999 |
|
RU2161156C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1,4-ДИГИДРОПИРИДИНА | 1973 |
|
SU379091A1 |
| Способ получения 1,4-дигидропиридинов или их гидрохлоридов | 1983 |
|
SU1279528A3 |
| СПОСОБ ПОЛУЧЕНИЯ СОЛИ 3-ЭТИЛ-5-МЕТИЛ-2-(2-АМИНОЭТОКСИМЕТИЛ)-4-(2-ХЛОРФЕНИЛ)-6-МЕТИЛ-1,4-ДИГИДРО-3,5-ПИРИДИНДИКАРБОКСИЛАТА И БЕНЗОЛСУЛЬФОКИСЛОТЫ (БЕЗИЛАТА АМЛОДИПИНА) | 1998 |
|
RU2163597C2 |
Изобретение относится к области органической химии, а именно к способу получения диметилового эфира 2,6-диметил-4-(2-нитрофенил)-1,4-дигидропиридин-3,5-дикарбоновой кислоты (нифедипина) формулы (1) нагреванием 2-нитробензальдегида с метиловым эфиром ацетоуксусной кислоты и водным аммиаком без растворителя, отличающемуся тем, что реакцию проводят в присутствии аэросила (коммерчески доступного наноразмерного оксида кремния) при 45-50°С в течение 5-5.5 ч, соотношение 2-нитробензальдегида, метилового эфира ацетоуксусной кислоты и аммиака составляет 1:2:2.4, очистку целевого продукта осуществляют совместно со стадией отделения катализатора из горячего метанола или этанола. Технический результат: разработан одностадийный способ получения нифедипина с использованием доступного гетерогенного катализатора, отличающийся высоким выходом целевого продукта. 1 пр.
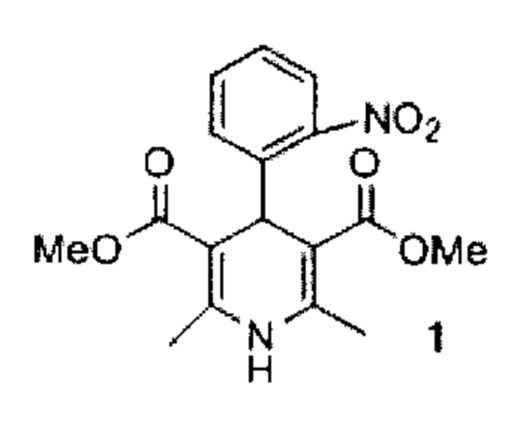
Способ получения диметилового эфира 2,6-диметил-4-(2-нитрофенил)-1,4-дигидропиридин-3,5-дикарбоновой кислоты формулы (1) нагреванием 2-нитробензальдегида с метиловым эфиром ацетоуксусной кислоты и водным аммиаком без растворителя, отличающийся тем, что реакцию проводят в присутствии аэросила (коммерчески доступного наноразмерного оксида кремния) при 45-50°С в течение 5-5.5 ч, соотношение 2-нитробензальдегида, метилового эфира ацетоуксусной кислоты и аммиака составляет 1:2:2.4, очистку целевого продукта осуществляют совместно со стадией отделения катализатора из горячего метанола или этанола.
| СПОСОБ ПОЛУЧЕНИЯ 2,6-ДИМЕТИЛ-3,5-ДИ(КАРБОМЕТОКСИ)-4-(2-НИТРОФЕНИЛ)-1,4-ДИГИДРОПИРИДИНА (НИФЕДИПИНА) | 1992 |
|
RU2057122C1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2020-06-17—Публикация
2019-11-12—Подача