ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет в соответствии с предварительной заявкой на патент США 62/455464, поданной 6 февраля 2017 года, содержание которой включено в данный документ посредством ссылки во всей своей полноте.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит перечень последовательностей, который был подан в электронном виде в формате ASCII и включен в данный документ посредством ссылки во всей своей полноте. Указанная копия в формате ASCII, созданная 30 января 2018 года, имеет название PAT057603-WO-PCT_SL.txt и размер 258837 байтов.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
CRISPR (короткие палиндромные повторы, регулярно расположенные группами) сформировались у бактерий в качестве адаптивной иммунной системы для защиты от воздействия вирусов. При воздействии вируса короткие сегменты вирусной ДНК встраиваются в локус CRISPR бактериального генома. РНК транскрибируется с части локуса CRISPR, который включает вирусную последовательность. Эта РНК, содержащая последовательность, комплементарную вирусному геному, опосредует нацеливание белка Cas9 на последовательность в вирусном геноме. Белок Cas9 расщепляет и тем самым обеспечивает сайленсинг вирусной мишени.
Недавно система CRISPR/Cas была адаптирована для редактирования генома в эукариотических клетках. Введение сайт-специфических одно- (SSB) или двухнитевых разрывов (DSB) обеспечивает возможность изменения целевой последовательности посредством, например, негомологичного соединения концов (NHEJ) или репарации, направляемой гомологией (HDR).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Не ограничиваясь теорией полагают, что настоящее изобретение частично основано на открытии того, что системы CRISPR, например, системы Cas9 CRISPR, например, описанные в данном документе, можно применять для модификации клеток (например, гематопоэтических стволовых клеток и клеток-предшественников (HSPC)), например, в неделеционном участке HPFH, описанном в данном документе, для повышения экспрессии фетального гемоглобина (HbF) и/или снижения экспрессии бета-глобина (например, гена бета-глобина, имеющего мутацию, вызывающую заболевание), например у потомства, например, у потомства красных кровяных клеток, модифицированных клеток, и на открытии того, что модифицированные клетки (например, модифицированные HSPC) можно применять для лечения гемоглобинопатий, например, серповидноклеточного заболевания и бета-талассемии. В одном аспекте в данном документе неожиданно было показано, что введение систем редактирования гена, например, систем CRISPR, например, описанных в данном документе, в клетки (например, HSPC), которые целенаправленно воздействуют на участки генома, для которых не существует известных карт мутации или делеции HPFH, обеспечивает образование модифицированных HSPC (например, HSPC, которые содержат одну или несколько вставок/делеций, например, описанных в данном документе), которые способны эффективно прививаться в организме, поддерживаться в течение длительного периода в привитом организме и дифференцироваться, в том числе в эритроциты с повышенной экспрессией фетального гемоглобина. Кроме того, такие модифицированные HSPC способны к культивированию ex vivo, например, в присутствии вещества, стимулирующего размножение стволовых клеток (например, описанного в данном документе), в условиях, которые обуславливают их размножение и пролиферацию при поддержании стволовости. При введении систем редактирования гена, например, систем CRISPR, например, описанных в данном документе, в HPSC, полученные от пациентов со серповидноклеточным заболеванием, модифицированные клетки, и их потомство (например, эритроидное потомство) неожиданно показало не только положительную регуляцию экспрессии фетального гемоглобина, но и также значительное снижение уровня серповидного бета-глобина и значительное снижение количества серповидных клеток, а также повышение количества нормальных красных кровяных клеток по сравнению с популяцией немодифицированных клеток.
Таким образом, в одном аспекте настоящего изобретения представлены системы CRISPR (например, системы Cas CRISPR, например, системы Cas9 CRISPR, например, системы Cas9 CRISPR из S. pyogenes), содержащие одну или несколько, например, одну молекулу gRNA, описанную в данном документе. Любую из молекул gRNA, описанных в данном документе, можно применять в таких системах и в способах и клетках, описанных в данном документе.
В одном аспекте настоящего изобретения представлена молекула gRNA, содержащая tracr и crRNA, где crRNA содержит нацеливающий домен, который
a) является комплементарным целевой последовательности неделеционного участка HFPH (например, неделеционного участка HFPH человека);
b) является комплементарным целевой последовательности в пределах геномной последовательности нуклеиновой кислоты от Chr11:5249833 до Chr11:5250237, - нить, hg38;
c) является комплементарным целевой последовательности в пределах геномной последовательности нуклеиновой кислоты от Chr11:5254738 до Chr11:5255164, - нить, hg38;
d) является комплементарным целевой последовательности в пределах геномной последовательности нуклеиновой кислоты в Chr11:5250094-5250237, - нить, hg38;
e) является комплементарным целевой последовательности в пределах геномной последовательности нуклеиновой кислоты в Chr11:5255022-5255164, - нить, hg38;
f) является комплементарным целевой последовательности в пределах геномной последовательности нуклеиновой кислоты в Chr11: 5249833-5249927, - нить, hg38;
g) является комплементарным целевой последовательности в пределах геномной последовательности нуклеиновой кислоты в Chr11: 5254738-5254851, - нить, hg38;
h) является комплементарным целевой последовательности в пределах геномной последовательности нуклеиновой кислоты в Chr11:5250139-5250237, - нить, hg38 или
i) их комбинации.
В ряде вариантов осуществления нацеливающий домен, содержит, например, состоит из, любую последовательность под SEQ ID NO: 1 - SEQ ID NO: 72. В ряде вариантов осуществления нацеливающий домен содержит, например, состоит из, любую из SEQ ID NO: 1, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 28, SEQ ID NO: 34, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 58, SEQ ID NO: 62, SEQ ID NO: 63, или SEQ ID NO: 67. В ряде вариантов осуществления нацеливающий домен содержит, например, состоит из, любую из a) SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 28, SEQ ID NO: 34, SEQ ID NO: 48, SEQ ID NO: 51, или SEQ ID NO: 67; или b) SEQ ID NO: 1, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 12, или SEQ ID NO: 54. В ряде вариантов осуществления молекула gRNA содержит нацеливающий домен, который содержит, например, состоит из SEQ ID NO: 8. В ряде вариантов осуществления молекула gRNA содержит нацеливающий домен, который содержит, например, состоит из SEQ ID NO: 67. В ряде вариантов осуществления молекула gRNA содержит нацеливающий домен, который содержит (например, состоит из них) фрагмент любой из приведенных выше последовательностей.
В любом из вышеупомянутых аспектов и вариантов осуществления молекула gRNA может дополнительно иметь участки и/или свойства, описанные в данном документе. В ряде вариантов осуществления молекула gRNA содержит фрагмент любого из вышеупомянутых нацеливающих доменов. В ряде вариантов осуществления нацеливающий домен содержит, например, состоит из, 17, 18, 19 или 20 последовательных нуклеиновых кислот из любой из указанных последовательностей нацеливающего домена. В ряде вариантов осуществления 17, 18, 19 или 20 последовательных нуклеиновых кислот из любой из указанных последовательностей нацеливающего домена представляют собой 17, 18, 19 или 20 последовательных нуклеиновых кислот, расположенных на 3'-конце указанной последовательности нацеливающего домена. В других вариантах осуществления 17, 18, 19 или 20 последовательных нуклеиновых кислот из любой из указанных последовательностей нацеливающего домена представляют собой 17, 18, 19 или 20 последовательных нуклеиновых кислот, расположенных на 5'-конце указанной последовательности нацеливающего домена. В других вариантах осуществления 17, 18, 19 или 20 последовательных нуклеиновых кислот из любой из указанных последовательностей нацеливающего домена не содержат нуклеиновую кислоту, расположенную на 5'- или 3'-конце указанной последовательности нацеливающего домена. В ряде вариантов осуществления нацеливающий домен состоит из указанной последовательности нацеливающего домена.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления часть crRNA и часть tracr гибридизуются с образованием "флагштока", включающего последовательность под SEQ ID NO: 182 или 183. В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления "флагшток" дополнительно включает первое удлинение "флагштока", расположенное в 3'-направлении по отношению к части crRNA "флагштока", где указанное первое удлинение "флагштока" включает последовательность под SEQ ID NO: 184. В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления "флагшток" дополнительно содержит второе удлинение "флагштока", расположенное в 3'-направлении по отношению к части crRNA "флагштока" и в случае присутствия первое удлинение "флагштока", где указанное второе удлинение "флагштока" содержит последовательность под SEQ ID NO: 185.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления tracr содержит последовательность под SEQ ID NO: 224 или SEQ ID NO: 225. В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления tracr содержит последовательность под SEQ ID NO: 232, необязательно дополнительно содержащую на 3'-конце дополнительные 1, 2, 3, 4, 5, 6 или 7 урациловых (U) нуклеотидов. В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления crRNA содержит в 5'-3'-направлении [нацеливающий домен]-: a) SEQ ID NO:182; b) SEQ ID NO: 183; c) SEQ ID NO: 199; d) SEQ ID NO: 200; e) SEQ ID NO: 201; f) SEQ ID NO: 202; или g) SEQ ID NO: 226.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления tracr содержит в 5'-3'-направлении a) SEQ ID NO: 187; b) SEQ ID NO: 188; c) SEQ ID NO: 203; d) SEQ ID NO: 204; e) SEQ ID NO: 224; f) SEQ ID NO: 225; g) SEQ ID NO: 232; h) SEQ ID NO: 227; i) (SEQ ID NO: 228; j) SEQ ID NO: 229; k) любую из приведенных выше a) - j), дополнительно включающих на 3'-конце по меньшей мере 1, 2, 3, 4, 5, 6 или 7 урациловых (U), нуклеотидов, например, 1, 2, 3, 4, 5, 6 или 7 урациловых (U) нуклеотидов; l) любую из приведенных выше a) - k), дополнительно включающих на 3'-конце по меньшей мере 1, 2, 3, 4, 5, 6 или 7 адениновых нуклеотидов (A), например, 1, 2, 3, 4, 5, 6 или 7 адениновых (А) нуклеотидов; или m) любую из приведенных выше a) - l), дополнительно включающих на 5'-конце (например, на 5'-конце) по меньшей мере 1, 2, 3, 4, 5, 6 или 7 адениновых (А) нуклеотидов, например, 1, 2, 3, 4, 5, 6 или 7 адениновых (А) нуклеотидов.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления нацеливающий домен и tracr расположены на отдельных молекулах нуклеиновой кислоты. В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления нацеливающий домен и tracr расположены на отдельных молекулах нуклеиновой кислоты, и молекула нуклеиновой кислоты, включающая нацеливающий домен, включает SEQ ID NO: 201, необязательно расположенную непосредственно в 3'-направлении по отношению к нацеливающему домену, и молекула нуклеиновой кислоты, содержащая tracr, включает, например, состоит из SEQ ID NO: 224. В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления часть crRNA "флагштока" включает SEQ ID NO: 201 или SEQ ID NO: 202. В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления tracr содержит последовательность под SEQ ID NO: 187 или 188, и необязательно в случае присутствия первого удлинения "флагштока" первое удлинение tracr, расположенное в 5'-направлении по отношению к SEQ ID NO: 187 или 188, при этом указанное первое удлинение tracr включает SEQ ID NO: 189.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления нацеливающий домен и tracr расположены на одной молекуле нуклеиновой кислоты, например, где tracr расположена в 3'-направлении по отношению к нацеливающему домену. В одном аспекте молекула gRNA включает петлю, расположенную в 3'-направлении по отношению к нацеливающему домену и в 5'-направлении по отношению к tracr. В ряде вариантов осуществления петля включает последовательность под SEQ ID NO: 186. В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления молекула gRNA содержит в 5'-3'-направлении [нацеливающий домен]-: (a) SEQ ID NO: 195; (b) SEQ ID NO: 196; (c) SEQ ID NO: 197; (d) SEQ ID NO: 198; (e) SEQ ID NO: 231 или (f) любую из (a) - (e), указанных выше, дополнительно содержащих на 3'-конце 1, 2, 3, 4, 5, 6 или 7 урациловых (U) нуклеотидов.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления нацеливающий домен и tracr расположены на одной молекуле нуклеиновой кислоты, и при этом указанная молекула нуклеиновой кислоты содержит, например, состоит из, указанный нацеливающий домен и SEQ ID NO: 231, необязательно расположенные непосредственно в 3'-направлении по отношению к указанному нацеливающему домену.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления одна или необязательно более одной из молекул нуклеиновой кислоты, содержащих молекулу gRNA, содержат
a) одну или несколько, например, три фосфотиоатные модификации на 3'-конце указанных молекулы или молекул нуклеиновой кислоты;
b) одну или несколько, например, три фосфотиоатные модификации на 5'-конце указанных молекулы или молекул нуклеиновой кислоты;
c) одну или несколько, например, три 2'-O-метиловые модификации на 3'-конце указанных молекулы или молекул нуклеиновой кислоты;
d) одну или несколько, например, три 2'-O-метиловые модификации на 5'-конце указанных молекулы или молекул нуклеиновой кислоты;
e) 2'-O-метиловую модификацию в каждом из 4-го по отношению к концевому, 3-го по отношению к концевому и 2-го по отношению к концевому 3'-остаткам указанных молекулы или молекул нуклеиновой кислоты;
f) 2'-O-метиловую модификацию в каждом из 4-го по отношению к концевому, 3-го по отношению к концевому и 2-го по отношению к концевому 5'-остаткам указанных молекулы или молекул нуклеиновой кислоты или
f) любую их комбинацию.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 74;
(b) SEQ ID NO: 75; или
(c) SEQ ID NO: 76.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 77, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 77, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 78, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 78, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 79;
(b) SEQ ID NO: 80; или
(c) SEQ ID NO: 81.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 82, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 82, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 83, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 83, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 84;
(b) SEQ ID NO: 85; или
(c) SEQ ID NO: 86.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 87, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 87, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 88, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 88, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 89;
(b) SEQ ID NO: 90; или
(c) SEQ ID NO: 91.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 92, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 92, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 93, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 93, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 94;
(b) SEQ ID NO: 95; или
(c) SEQ ID NO: 96.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 97, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 97, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 98, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 98, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 99;
(b) SEQ ID NO: 100; или
(c) SEQ ID NO: 101.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 102, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 102, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 103, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 103, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 104;
(b) SEQ ID NO: 105; или
(c) SEQ ID NO:106.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 107, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 107, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 108, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 108, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 109;
(b) SEQ ID NO: 110; или
(c) SEQ ID NO: 111.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 112, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 112, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 113, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 113, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 114;
(b) SEQ ID NO: 115; или
(c) SEQ ID NO:116.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 117, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 117, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 118, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 118, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 119;
(b) SEQ ID NO: 120; или
(c) SEQ ID NO: 121.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 122, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 122, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 123, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 123, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 124;
(b) SEQ ID NO: 125; или
(c) SEQ ID NO:126.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 127, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 127, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 128, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 128, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 129;
(b) SEQ ID NO: 130; или
(c) SEQ ID NO: 131.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 132, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 132, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 133, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 133, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 134;
(b) SEQ ID NO: 135; или
(c) SEQ ID NO: 136.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 137, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 137, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 138, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 138, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 139;
(b) SEQ ID NO: 140; или
(c) SEQ ID NO: 141.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 142, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 142, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 143, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 143, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 144;
(b) SEQ ID NO: 145; или
(c) SEQ ID NO:146.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 147, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 147, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 148, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 148, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 149;
(b) SEQ ID NO: 150; или
(c) SEQ ID NO: 151.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 152, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 152, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 153, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 153, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 154;
(b) SEQ ID NO: 155; или
(c) SEQ ID NO: 156.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 157, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 157, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 158, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 158, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 159;
(b) SEQ ID NO: 160; или
(c) SEQ ID NO: 161.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 162, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 162, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 163, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 163, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 164;
(b) SEQ ID NO: 165; или
(c) SEQ ID NO: 166.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 167, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 167, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 168, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 168, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 169;
(b) SEQ ID NO: 170; или
(c) SEQ ID NO: 171.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 172, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 172, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 173, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 173, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 174;
(b) SEQ ID NO: 175; или
(c) SEQ ID NO: 176.
В одном аспекте в настоящем изобретении представлена молекула gRNA, содержащая, например, состоящая из, последовательность:
(a) crRNA, содержащую, например, состоящую из SEQ ID NO: 177, и tracr, содержащую, например, состоящую из SEQ ID NO: 224;
(b) crRNA, содержащую, например, состоящую из SEQ ID NO: 177, и tracr, содержащую, например, состоящую из SEQ ID NO: 73;
(c) crRNA, содержащую, например, состоящую из SEQ ID NO: 178, и tracr, содержащую, например, состоящую из SEQ ID NO: 224; или
(d) crRNA, содержащую, например, состоящую из SEQ ID NO: 178, и tracr, содержащую, например, состоящую из SEQ ID NO: 73.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления в настоящем изобретении представлена молекула gRNA, где
a) если система CRISPR (например, описанный в данном документе RNP), содержащая молекулу gRNA, вводится в клетку, то вставка/делеция образуется в целевой последовательности, комплементарной нацеливающему домену молекулы gRNA, или рядом с целевой последовательностью; и/или
b) если система CRISPR (например, описанный в данном документе RNP), содержащая молекулу gRNA, вводится в клетку, то создается делеция, охватывающая последовательность, например, охватывающая по сути всю последовательность, между последовательностью, комплементарной нацеливающему домену gRNA (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG1, и последовательностью, комплементарной нацеливающему домену gRNA (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG2. В ряде вариантов осуществления вставка/делеция не охватывает нуклеотид неделеционного HPFH или сайта связывания фактора транскрипции.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления в настоящем изобретении представлена молекула gRNA, где если система CRISPR (например, описанный в данном документе RNP), содержащая молекулу gRNA, вводится в популяцию клеток, то вставка/делеция образуется в целевой последовательности, комплементарной нацеливающему домену молекулы gRNA, или рядом с целевой последовательностью в по меньшей мере приблизительно 15%, например, по меньшей мере приблизительно 17%, например, по меньшей мере приблизительно 20%, например, по меньшей мере приблизительно 30%, например, по меньшей мере приблизительно 40%, например, по меньшей мере приблизительно 50%, например, по меньшей мере приблизительно 55%, например, по меньшей мере приблизительно 60%, например, по меньшей мере приблизительно 70%, например, по меньшей мере приблизительно 75% клеток, относящихся к популяции. В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления вставка/делеция охватывает по меньшей мере один нуклеотид промоторного участка HBG1 или по меньшей мере один нуклеотид промоторного участка HBG2. В ряде вариантов осуществления по меньшей мере приблизительно 15% клеток популяции содержат вставку/делецию, которая охватывает по меньшей мере один нуклеотид промоторного участка HBG1, и вставку/делецию, которая охватывает по меньшей мере один нуклеотид промоторного участка HBG2. В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления процент клеток популяции, которые содержат вставку/делецию, которая охватывает по меньшей мере один нуклеотид промоторного участка HBG1, отличается от процента клеток популяции, которые содержат вставку/делецию, которая охватывает по меньшей мере один нуклеотид промоторного участка HBG2, на по меньшей мере приблизительно 5%, например, по меньшей мере приблизительно 10%, например, по меньшей мере приблизительно 20%, например, по меньшей мере приблизительно 30%. В ряде вариантов осуществления вставку/делецию определяют с помощью секвенирования нового поколения (NGS).
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления в настоящем изобретении представлена молекула gRNA, где если система CRISPR (например, описанный в данном документе RNP), содержащая молекулу gRNA, вводится в клетку, то экспрессия фетального гемоглобина повышается в указанной клетке или ее потомстве, например, в ее эритроидном потомстве, например, в ее потомстве, представляющем собой красную кровяную клетку. В ряде вариантов осуществления, если система CRISPR (например, описанный в данном документе RNP), содержащая молекулу gRNA, вводится в популяцию клеток, то процентное содержание F-клеток в указанной популяции или популяции их потомства, например, их эритроидном потомстве, например, в их потомстве, представляющем собой красную кровяную клетку, повышается на по меньшей мере приблизительно 15%, например, по меньшей мере приблизительно 17%, например, по меньшей мере приблизительно 20%, например, по меньшей мере приблизительно 25%, например, по меньшей мере приблизительно 30%, например, по меньшей мере приблизительно 35%, например, по меньшей мере приблизительно 40% по сравнению с процентным содержанием F-клеток в популяции клеток, в которые молекулу gRNA не вводили, или в популяции их потомства, например, их эритроидного потомства, например, их потомства, представляющего собой красные кровяные клетки. В ряде вариантов осуществления указанная клетка или ее потомство, например, ее эритроидное потомство, например, ее потомство, представляющее собой красные кровяные клетки, продуцируют по меньшей мере приблизительно 6 пикограмм (например, по меньшей мере приблизительно 7 пикограмм, по меньшей мере приблизительно 8 пикограмм, по меньшей мере приблизительно 9 пикограмм, по меньшей мере приблизительно 10 пикограмм или от приблизительно 8 до приблизительно 9 пикограмм, или от приблизительно 9 до приблизительно 10 пикограмм) фетального гемоглобина на клетку.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления в настоящем изобретении представлена молекула gRNA, где если система CRISPR (например, описанный в данном документе RNP), содержащая молекулу gRNA, вводится в клетку, то нецелевые вставки/делеции не образуются в указанной клетке, например, нецелевые вставки/делеции не образуются за пределами промоторных участков HBG1 и/или HBG2 (например, в пределах гена, например, кодирующего участка гена), что, например, можно выявить с помощью секвенирования нового поколения и/или анализа с помощью вставки нуклеотида.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления в настоящем изобретении представлена молекула gRNA, где если система CRISPR (например, описанный в данном документе RNP), содержащая молекулу gRNA, вводится в популяцию клеток, то нецелевая вставка/делеция, например, нецелевая вставка/делеция за пределами промоторных участков HBG1 и/или HBG2 (например, в пределах гена, например, кодирующего участка гена), выявляется в более приблизительно 5%, например, более приблизительно 1%, например, более приблизительно 0,1%, например, более приблизительно 0,01% клеток, относящихся к популяции клеток, что, например, можно выявить с помощью секвенирования нового поколения и/или анализа с помощью вставки нуклеотида.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления клетка представляет собой (или популяция клеток включает) клетку млекопитающего, примата или человека, например, представляет собой клетку человека, например, клетка представляет собой (или популяция клеток включает) HSPC, например, HSPC представляет собой CD34+, например, HSPC представляет собой CD34+CD90+. В ряде вариантов осуществления клетка является аутологичной по отношению к пациенту, которому назначено введение указанной клетки. В других вариантах осуществления клетка является аллогенной по отношению к пациенту, которому назначено введение указанной клетки.
В одном аспекте молекулы gRNA, системы редактирования генома (например, системы CRISPR) и/или способы, описанные в данном документе, относятся к клеткам, например, описанным в данном документе, которые имеют или приобретают в результате одно или несколько из следующих свойств:
(a) по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% клеток из популяции клеток, описанных в данном документе, содержат вставку/делецию в последовательности геномной ДНК, комплементарной нацеливающему домену молекулы gRNA, или рядом с этой последовательностью, описанной в данном документе, где необязательно вставка/делеция выбрана из вставки/делеции, перечисленной в таблице 2-7, где необязательно клетка из популяции не предусматривает делецию нуклеотида, расположенного между 5250092 и 5249833, - нить (hg38);
(b) клетка (например, популяция клеток), описанная в данном документе, способна к дифференцировке в дифференцированную клетку эритроидного ростка (например, красную кровяную клетку), и где указанная дифференцированная клетка характеризуется повышенным уровнем фетального гемоглобина, например, по сравнению с неизмененной клеткой (например, популяцией клеток);
(c) популяция клеток, описанная в данном документе, способна к дифференцировке в популяцию дифференцированных клеток, например, популяцию клеток эритроидного ростка (например, популяцию красных кровяных клеток), и где указанная популяция дифференцированных клеток характеризуется повышенным процентным содержанием F-клеток (например, процентным содержанием F-клеток, которое повышено на по меньшей мере приблизительно 15%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 30% или по меньшей мере приблизительно 40%), например, по сравнению с популяцией неизмененных клеток;
(d) клетка (например, популяция клеток), описанная в данном документе, способна к дифференцировке в дифференцированную клетку, например, клетку эритроидного ростка (например, красную кровяную клетку), и где указанная дифференцированная клетка (например, популяция дифференцированных клеток) продуцирует по меньшей мере приблизительно 6 пикограмм (например, по меньшей мере приблизительно 7 пикограмм, по меньшей мере приблизительно 8 пикограмм, по меньшей мере приблизительно 9 пикограмм, по меньшей мере приблизительно 10 пикограмм, или от приблизительно 8 до приблизительно 9 пикограмм, или от приблизительно 9 до приблизительно 10 пикограмм) фетального гемоглобина на клетку;
(e) нецелевые вставки/делеции не образуются в клетке, описанной в данном документе, например, нецелевые вставки/делеции не образуются за пределами промоторных участков HBG1 и/или HBG2 (например, в пределах гена, например, кодирующего участка гена), что, например, можно выявить с помощью секвенирования нового поколения и/или анализа с помощью вставки нуклеотида;
(f) нецелевую вставку/делецию, например, нецелевую вставку/делецию за пределами промоторных участков HBG1 и/или HBG2 (например, в пределах гена, например, кодирующего участка гена), не выявляют в более чем приблизительно 5%, например, в более чем приблизительно 1%, например, в более чем приблизительно 0,1%, например, в более чем приблизительно 0,01% клеток из популяции клеток, описанной в данном документе, что, например, можно выявить с помощью секвенирования нового поколения и/или анализа с помощью вставки нуклеотида;
(g) клетку, описанную в данном документе, или ее потомство можно выявить, например, выявить в костном мозге или выявить в периферической крови пациента, которому их трансплантировали через более 16 недель, более 20 недель или более 24 недели после трансплантации, что необязательно можно выявить с помощью выявления вставки/делеции в последовательности геномной ДНК, комплементарной нацеливающему домену молекулы gRNA по любому из пп. 1-22, или рядом с этой последовательностью, где необязательно вставка/делеция выбрана из вставки/делеции, перечисленной в таблице 2-7, где необязательно вставка/делеция представляет собой большую делеционную вставку/делецию;
(h) популяция клеток, описанная в данном документе, способна к дифференцировке в популяцию дифференцированных клеток, например, популяцию клеток эритроидного ростка (например, популяцию красных кровяных клеток), и где указанная популяция дифференцированных клеток включает сниженное процентное содержание серповидных клеток (например, процентное содержание серповидных клеток снижено на по меньшей мере приблизительно 15%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80% или по меньшей мере приблизительно 90%), например, по сравнению с популяцией неизмененных клеток; и/или
(i) клетка или популяция клеток, описанная в данном документе, способна к дифференцировке в популяцию дифференцированных клеток, например, популяцию клеток эритроидного ростка (например, популяцию красных кровяных клеток), и где указанная популяция дифференцированных клеток включает клетки, которые продуцируют сниженный уровень (например, уровень, сниженный на по меньшей мере приблизительно 15%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80% или по меньшей мере приблизительно 90%) гемоглобина серповидных клеток (HbS), например, по сравнению с популяцией неизмененных клеток.
В одном аспекте в настоящем изобретении представлена композиция, содержащая
1) одну или несколько молекул gRNA (в том числе первую молекулу gRNA), описанных в данном документе, например, gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления, и молекулу Cas9, например, описанную в данном документе;
2) одну или несколько молекул gRNA (в том числе первую молекулу gRNA), описанных в данном документе, например, gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления, и нуклеиновую кислоту, кодирующую молекулу Cas9, например, описанную в данном документе;
3) нуклеиновую кислоту, кодирующую одну или несколько молекул gRNA (в том числе первую молекулу gRNA), описанных в данном документе, например, gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления, и молекулу Cas9, например, описанную в данном документе;
4) нуклеиновую кислоту, кодирующую одну или несколько молекул gRNA (в том числе первую молекулу gRNA), описанных в данном документе, например, gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления, и нуклеиновую кислоту, кодирующую молекулу Cas9, например, описанную в данном документе; или
5) любую из указанных выше 1) - 4) и нуклеиновую кислоту, представляющую собой матрицу; или
6) любую из указанных выше 1) - 4) и нуклеиновую кислоту, содержащую последовательность, кодирующую нуклеиновую кислоту, представляющую собой матрицу.
В одном аспекте в настоящем изобретении представлена композиция, содержащая первую молекулу gRNA, описанную в данном документе, например, gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления, дополнительно содержащую молекулу Cas9, например, описанную в данном документе, например, где молекула Cas9 представляет собой активную или неактивную Cas9 из S. pyogenes, например, где молекула Cas9 содержит SEQ ID NO: 205. В ряде аспектов молекула Cas9 включает, например, состоит из (a) SEQ ID NO: 233; (b) SEQ ID NO: 234; (c) SEQ ID NO: 235; (d) SEQ ID NO: 236; (e) SEQ ID NO: 237; (f) SEQ ID NO: 238; (g) SEQ ID NO: 239; (h) SEQ ID NO: 240; (i) SEQ ID NO: 241; (j) SEQ ID NO: 242; (k) SEQ ID NO: 243 или (l) SEQ ID NO: 244.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления композиции первая молекула gRNA и молекула Cas9 присутствуют в рибонуклеарном белковом комплексе (RNP).
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления композиции в настоящем изобретении представлена композиция, дополнительно содержащая вторую молекулу gRNA; вторую молекулу gRNA и третью молекулу gRNA или вторую молекулу gRNA, необязательно третью молекулу gRNA и необязательно четвертую молекулу gRNA, где вторая молекула gRNA, необязательная третья молекула gRNA и необязательная четвертая молекула gRNA представляют собой молекулу gRNA, описанную в данном документе, например, представляют собой молекулу gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления молекулы gRNA, и где каждая молекула gRNA в композиции является комплементарной отличающейся целевой последовательности. В ряде вариантов осуществления две или более из первой молекулы gRNA, второй молекулы gRNA, необязательной третьей молекулы gRNA и необязательной четвертой молекулы gRNA являются комплементарными целевым последовательностям в пределах одного гена или участка. В ряде вариантов осуществления первая молекула gRNA, вторая молекула gRNA, необязательная третья молекула gRNA и необязательная четвертая молекула gRNA являются комплементарными целевым последовательностям в не более чем 6000 нуклеотидов, не более чем 5000 нуклеотидов, не более чем 500, не более чем 400 нуклеотидов, не более чем 300, не более чем 200 нуклеотидов, не более чем 100 нуклеотидов, не более чем 90 нуклеотидов, не более чем 80 нуклеотидов, не более чем 70 нуклеотидов, не более чем 60 нуклеотидов, не более чем 50 нуклеотидов, не более чем 40 нуклеотидов, не более чем 30 нуклеотидов, не более чем 20 нуклеотидов или не более чем 10 нуклеотидов. В ряде вариантов осуществления две или более из первой молекулы gRNA, второй молекулы gRNA, необязательной третьей молекулы gRNA и необязательной четвертой молекулы gRNA содержат по меньшей мере одну молекулу gRNA, которая содержит нацеливающий домен, комплементарный целевой последовательности промоторного участка HBG1, и по меньшей мере одну молекулу gRNA, которая содержит нацеливающий домен, комплементарный целевой последовательности промоторного участка HBG2. В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления композиции данная композиция содержит (например, состоит из них) первую молекулу gRNA и вторую молекулу gRNA, где первая молекула gRNA и вторая молекула gRNA являются (a) независимо выбранными и нацеливающими на неделеционный участок HPFH, например, описанный в данном документе, и являются комплементарными разным целевым последовательностям; (b) независимо выбранными из молекул gRNA согласно таблице 1 и являются комплементарными разным целевым последовательностям; c) независимо выбранными из молекул gRNA согласно таблице 2 и являются комплементарными различным целевым последовательностям; или (d) независимо выбранными из молекул gRNA согласно таблице 3a и являются комплементарными разным целевым последовательностям, (e) независимо выбранными из молекул gRNA согласно таблице 3b и являются комплементарными разным целевым последовательностям; или (f) независимо выбранными из молекул gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления, и являются комплементарными разным целевым последовательностям.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления композиции данная композиция содержит первую молекулу gRNA и вторую молекулу gRNA, где:
a) первая молекула gRNA является комплементарной целевой последовательности, включающей по меньшей мере 1 нуклеотид (например, включающей 20 последовательных нуклеотидов) в пределах:
i) Chr11:5249833 - Chr11:5250237 (hg38);
ii) Chr11:5250094-5250237 (hg38);
iii) Chr11: 5249833-5249927 (hg38) или
iv) Chr11:5250139-5250237 (hg38);
b) вторая молекула gRNA является комплементарной целевой последовательности, включающей по меньшей мере 1 нуклеотид (например, содержащей 20 последовательных нуклеотидов) в пределах:
i) Chr11:5254738 - Chr11:5255164 (hg38);
ii) Chr11:5255022-5255164 (hg38) или
iii) Chr11: 5254738-5254851 (hg38).
В одном аспекте, что касается компонентов в композиции, представляющих собой молекулу gRNA, то данная композиция состоит из первой молекулы gRNA и второй молекулы gRNA.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления композиции каждая из указанных молекул gRNA находится в рибонуклеарном белковом комплексе (RNP) с молекулой Cas9, например, описанной в данном документе.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления композиции данная композиция содержит нуклеиновую кислоту, представляющую собой матрицу, где нуклеиновая кислота, представляющая собой матрицу, включает нуклеотид, который соответствует нуклеотиду в целевой последовательности первой молекулы gRNA или рядом с ней. В ряде вариантов осуществления нуклеиновая кислота, представляющая собой матрицу, включает нуклеиновую кислоту, кодирующую: (a) бета-глобин человека, например, бета-глобин человека, включающий одну или несколько мутаций G16D, E22A и T87Q, или его фрагмент; или (b) гамма-глобин человека или его фрагмент.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления композиции данная композиция составлена в среде, подходящей для электропорации.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления композиции каждая из указанных молекул gRNA из указанной композиции находится в RNP с молекулой Cas9, описанной в данном документе, и где каждый указанный RNP находится в концентрации, составляющей менее приблизительно 10 мкМ, например, менее приблизительно 3 мкМ, например, менее приблизительно 1 мкМ, например, менее приблизительно 0,5 мкМ, например, менее приблизительно 0,3 мкМ, например, менее приблизительно 0,1 мкМ. В ряде вариантов осуществления RNP находится в концентрации приблизительно 1 мкМ. В ряде вариантов осуществления RNP находится в концентрации приблизительно 2 мкМ. В ряде вариантов осуществления указанная концентрация представляет собой концентрацию RNP в композиции, содержащей клетки, например, описанной в данном документе, где необязательно композиция, содержащая клетки и RNP, является подходящей для электропорации.
В одном аспекте в настоящем изобретении представлена последовательность нуклеиновой кислоты, которая кодирует одну или несколько молекул gRNA, описанных в данном документе, например, молекулу gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления. В ряде вариантов осуществления нуклеиновая кислота включает промотор, функционально связанный с последовательностью, которая кодирует одну или несколько молекул gRNA, например, промотор представляет собой промотор, распознаваемый РНК-полимеразой II или РНК-полимеразой III, или, например, промотор представляет собой промотор U6 или промотор HI.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления нуклеиновой кислоты данная нуклеиновая кислота дополнительно кодирует молекулу Cas9, например, молекулу Cas9, которая включает, например, состоит из любой из SEQ ID NO: 205, SEQ ID NO: 233, SEQ ID NO: 234, SEQ ID NO: 235, SEQ ID NO: 236, SEQ ID NO: 237, SEQ ID NO: 238, SEQ ID NO: 239, SEQ ID NO: 240, SEQ ID NO: 241, SEQ ID NO: 242, SEQ ID NO: 243 или SEQ ID NO: 244. В ряде вариантов осуществления указанная нуклеиновая кислота включает промотор, функционально связанный с последовательностью, которая кодирует молекулу Cas9, например, промотор EF-1, промотор гена CMV IE, промотор EF-1α, промотор убиквитина C или промотор фосфоглицераткиназы (PGK).
В одном аспекте в настоящем изобретении представлен вектор, включающий нуклеиновую кислоту согласно любому из вышеупомянутых аспектов и вариантов осуществления нуклеиновой кислоты. В ряде вариантах осуществления вектор выбран из группы, состоящей из лентивирусного вектора, аденовирусного вектора, вектора на основе аденоассоциированного вируса (AAV), вектора на основе вируса простого герпеса (HSV), плазмиды, миникольца, наноплазмиды и РНК-вектора.
В одном аспекте в настоящем изобретении представлен способ изменения клетки (например, популяции клеток), (например, изменения структуры (например, последовательности) нуклеиновой кислоты) в целевой последовательности или рядом с ней в пределах указанной клетки, предусматривающий приведение в контакт (например, введение в указанную клетку) указанной клетки (например, популяции клеток) с
1) одной или несколькими молекулами gRNA, описанными в данном документе (например, молекулой gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления), и молекулой Cas9, например, описанной в данном документе;
2) одной или несколькими молекулами gRNA, описанными в данном документе (например, молекулой gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления), и нуклеиновой кислотой, кодирующей молекулу Cas9, например, описанной в данном документе;
3) нуклеиновой кислотой, кодирующей одну или несколько молекул gRNA, описанных в данном документе (например, молекулой gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления), и молекулой Cas9, например, описанной в данном документе;
4) нуклеиновой кислотой, кодирующей одну или несколько молекул gRNA, описанных в данном документе (например, молекулой gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления), и нуклеиновой кислотой, кодирующей молекулу Cas9, например, описанной в данном документе;
5) любой из указанных выше 1) - 4) и нуклеиновой кислотой, представляющей собой матрицу;
6) любой из указанных выше 1) - 4) и нуклеиновой кислотой, содержащей последовательность, кодирующую нуклеиновую кислоту, представляющую собой матрицу;
7) композицией, описанной в данном документе, например, композицией согласно любому из вышеупомянутых аспектов и вариантов осуществления композиции; или
8) вектором, описанным в данном документе, например, вектором согласно любому из вышеупомянутых аспектов и вариантов осуществления вектора.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа молекула gRNA или нуклеиновая кислота, кодирующая молекулу gRNA, и молекула Cas9 или нуклеиновая кислота, кодирующая молекулу Cas9, составлены в одной композиции. В другом аспекте молекула gRNA или нуклеиновая кислота, кодирующая молекулу gRNA, и Cas9 молекула или нуклеиновая кислота, кодирующая молекула Cas9, составлены в более чем одной композиции. В одном аспекте более одной композиции доставляют одновременно или последовательно.
В одном аспекте способов, описанных в данном документе, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа клетка представляет собой клетку животного, например, клетка представляет собой клетку млекопитающего, примата или человека, например, клетка представляет собой гематопоэтическую стволовую клетку или клетку-предшественника (HSPC) (например, популяцию HSPC), например, клетка представляет собой клетку CD34+, например, клетка представляет собой клетку CD34+CD90+. В ряде вариантов осуществления способов, описанных в данном документе, клетка находится в композиции, содержащей популяцию клеток, которая была обогащена клетками CD34+. В ряде вариантов осуществления способов, описанных в данном документе, клетка (например, популяция клеток) была выделена из костного мозга, мобилизованной периферической крови или пуповинной крови. В ряде вариантов осуществления способов, описанных в данном документе, клетка является аутологичной или аллогенной, например, аутологичной, по отношению к пациенту, которому назначено введение указанной клетки.
В одном аспекте способов, описанных в данном документе, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа a) изменение дает в результате вставку/делецию в последовательности геномной ДНК, комплементарной нацеливающему домену одной или нескольких молекул gRNA, или рядом с этой последовательностью; или b) изменение дает в результате делецию, охватывающую последовательность, например, по сути всю последовательность, между последовательностью, комплементарной нацеливающему домену одной или нескольких молекул gRNA (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG1, и последовательностью, комплементарной нацеливающему домену одной или нескольких молекул gRNA (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG2. В ряде аспектов способа вставка/делеция представляет собой вставку из или делецию менее приблизительно 40 нуклеотидов, например, менее 30 нуклеотидов, например, менее 20 нуклеотидов, например, менее 10 нуклеотидов, например, представляет собой делецию одного нуклеотида.
В одном аспекте способов, описанных в данном документе, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа данный способ дает в результате популяцию клеток, где по меньшей мере приблизительно 15%, например, по меньшей мере приблизительно 17%, например, по меньшей мере приблизительно 20%, например, по меньшей мере приблизительно 30%, например, по меньшей мере приблизительно 40%, например, по меньшей мере приблизительно 50%, например, по меньшей мере приблизительно 55%, например, по меньшей мере приблизительно 60%, например, по меньшей мере приблизительно 70%, например, по меньшей мере приблизительно 75% популяции были изменены, например, предусматривают вставку/делецию.
В одном аспекте способов, описанных в данном документе, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа изменение дает в результате клетку (например, популяцию клеток), которая способна к дифференцировке в дифференцированную клетку эритроидного ростка (например, красную кровяную клетку), и где указанная дифференцированная клетка характеризуется повышенным уровнем фетального гемоглобина, например, по сравнению с неизмененной клеткой (например, популяцией клеток).
В одном аспекте способов, описанных в данном документе, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа изменение дает в результате популяцию клеток, которая способна к дифференцировке в популяцию дифференцированных клеток, например, популяцию клеток эритроидного ростка (например, популяцию красных кровяных клеток), и где указанная популяция дифференцированных клеток характеризуется повышенным процентный содержанием F-клеток (например, процентным содержанием F-клеток, которое повышено на по меньшей мере приблизительно 15%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 30% или по меньшей мере приблизительно 40%), например, по сравнению с популяцией необработанных клеток.
В одном аспекте способов, описанных в данном документе, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа изменение дает в результате клетку, которая способна к дифференцировке в дифференцированную клетку, например, клетку эритроидного ростка (например, красную кровяную клетку), и где указанная дифференцированная клетка продуцирует по меньшей мере приблизительно 6 пикограмм (например, по меньшей мере приблизительно 7 пикограмм, по меньшей мере приблизительно 8 пикограмм, по меньшей мере приблизительно 9 пикограмм, по меньшей мере приблизительно 10 пикограмм, или от приблизительно 8 до приблизительно 9 пикограмм, или от приблизительно 9 до приблизительно 10 пикограмм) фетального гемоглобина на клетку.
В одном аспекте в настоящем изобретении представлена клетка, измененная с помощью способа, описанного в данном документе, например, способа согласно любому из вышеупомянутых аспектов и вариантов осуществления способа.
В одном аспекте в настоящем изобретении представлена клетка, получаемая с помощью способа, описанного в данном документе, например, способа согласно любому из вышеупомянутых аспектов и вариантов осуществления способа.
В одном аспекте в настоящем изобретении представлена клетка, содержащая первую молекулу gRNA, описанную в данном документе, например, молекулу gRNA согласно любому из вышеупомянутых аспектов или вариантов осуществления, или композицию, описанную в данном документе, например, композицию согласно любому из вышеупомянутых аспектов или вариантов осуществления, нуклеиновую кислоту, описанную в данном документе, например, нуклеиновую кислоту согласно любому из вышеупомянутых аспектов или вариантов осуществления, или вектор, описанный в данном документе, например, вектор согласно любому из вышеупомянутых аспектов или вариантов осуществления.
В одном аспекте клетки, описанной в данном документе, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления клетки данная клетка дополнительно содержит молекулу Cas9, например, описанную в данном документе, например, молекулу Cas9, которая включает любую из SEQ ID NO: 205, SEQ ID NO: 233, SEQ ID NO: 234, SEQ ID NO: 235, SEQ ID NO: 236, SEQ ID NO: 237, SEQ ID NO: 238, SEQ ID NO: 239, SEQ ID NO: 240, SEQ ID NO: 241, SEQ ID NO: 242, SEQ ID NO: 243 или SEQ ID NO: 244.
В одном аспекте клетки, описанной в данном документе, в том числе в любом из вышеупомянутых аспектов или вариантов осуществления клетки данная клетка содержит, содержала или будет содержать вторую молекулу gRNA, описанную в данном документе, например, молекулу gRNA согласно любому из вышеупомянутых аспектов или вариантов осуществления, или нуклеиновую кислоту, кодирующую указанную молекулу gRNA, где первая молекула gRNA и вторая молекула gRNA включают неидентичные нацеливающие домены.
В одном аспекте клетки, описанной в данном документе, в том числе клетки согласно любому из вышеупомянутых аспектов и вариантов осуществления экспрессия фетального гемоглобина повышается в указанной клетке или ее потомстве (например, ее эритроидном потомстве, например, ее потомстве, представляющем собой красную кровяную клетку) по сравнению с клеткой или ее потомством такого же типа клетки, которые не были модифицированы для того, чтобы содержать молекулу gRNA.
В одном аспекте клетки, описанной в данном документе, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления клетки данная клетка способна к дифференцировке в дифференцированную клетку, например, клетку эритроидного ростка (например, красную кровяную клетку), и где указанная дифференцированная клетка характеризуется повышенным уровнем фетального гемоглобина, например, по сравнению с клеткой такого же типа, которая не была модифицирована с тем, чтобы содержать молекулу gRNA.
В одном аспекте клетки, описанной в данном документе, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления клетки дифференцированная клетка (например, клетка эритроидного ростка, например, красная кровяная клетка) продуцирует по меньшей мере приблизительно 6 пикограмм (например, по меньшей мере приблизительно 7 пикограмм, по меньшей мере приблизительно 8 пикограмм, по меньшей мере приблизительно 9 пикограмм, по меньшей мере приблизительно 10 пикограмм, или от приблизительно 8 до приблизительно 9 пикограмм, или от приблизительно 9 до приблизительно 10 пикограмм) фетального гемоглобина, например, по сравнению с дифференцированной клеткой такого же типа, которая не была модифицирована для того, чтобы содержать молекулу gRNA.
В одном аспекте клетки, описанной в данном документе, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления клетки данную клетку приводили в контакт, например, приводили в контакт ex vivo с веществом, стимулирующим размножение стволовых клеток, например, веществом, стимулирующим размножение стволовых клеток, выбранным из a) (1r,4r)-N1-(2-бензил-7-(2-метил-2H-тетразол-5-ил)-9H-пиримидо[4,5-b]индол-4-ил)циклогексан-1,4-диамина; b) метил-4-(3-пиперидин-1-илпропиламино)-9H-пиримидо[4,5-b]индол-7-карбоксилата; c) 4-(2-(2-(бензо[b]тиофен-3-ил)-9-изопропил-9H-пурин-6-иламино)этил)фенола; d) (S)-2-(6-(2-(lH-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-l-ола или e) их комбинации (например, комбинации (1r,4r)-N1-(2-бензил-7-(2-метил-2H-тетразол-5-ил)-9H-пиримидо[4,5-b]индол-4-ил)циклогексан-1,4-диамина и (S)-2-(6-(2-(lH-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ола). В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, представляет собой (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол.
В одном аспекте клетки, описанной в данном документе, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления клетки данная клетка содержит a) вставку в последовательности геномной ДНК, комплементарной нацеливающему домену молекулы gRNA, или рядом с этой последовательностью, описанной в данном документе, например, молекулы gRNA согласно любому из вышеупомянутых аспектов или вариантов осуществления; или b) делецию, охватывающую последовательность, например, по сути всю последовательность, между последовательностью, комплементарной нацеливающему домену молекулы gRNA, описанной в данном документе, например, молекулы gRNA согласно любому из вышеупомянутых аспектов или вариантов осуществления (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG1, и последовательностью, комплементарной нацеливающему домену молекулы gRNA, описанной в данном документе, например, молекулы gRNA согласно любому из вышеупомянутых аспектов или вариантов осуществления (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG2. В одном аспекте вставка представляет собой вставку из или делецию менее приблизительно 40 нуклеотидов, например, менее 30 нуклеотидов, например, менее 20 нуклеотидов, например, менее 10 нуклеотидов, например, вставка представляет собой делецию одного нуклеотида.
В одном аспекте клетки, описанной в данном документе, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления клетки данная клетка представляет собой клетку животного, например, клетка представляет собой клетку млекопитающего, примата или человека. В одном аспекте клетка представляет собой гематопоэтическую стволовую клетку и клетку-предшественника (HSPC) (например, популяцию HSPC), например, клетка представляет собой клетку CD34+, например, клетка представляет собой клетку CD34+CD90+. В ряде вариантов осуществления клетка (например, популяция клеток) была выделена из костного мозга, мобилизованной периферической крови или пуповинной крови. В ряде вариантов осуществления клетка является аутологичной по отношению к пациенту, которому назначено введение указанной клетки. В ряде вариантов осуществления клетка является аллогенной по отношению к пациенту, которому назначено введение указанной клетки.
В одном аспекте в настоящем изобретении представлена популяция клеток, описанных в данном документе, например, популяция клеток, которые включают клетку, описанную в данном документе, например, клетку согласно любому из вышеупомянутых аспектов и вариантов осуществления клетки. В ряде аспектов в настоящем изобретении представлена популяция клеток, где по меньшей мере приблизительно 50%, например, по меньшей мере приблизительно 60%, например, по меньшей мере приблизительно 70%, например, по меньшей мере приблизительно 80%, например, по меньшей мере приблизительно 90% (например, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99%) клеток из популяции представляют собой клетку, описанную в данном документе, например, клетку согласно любому из вышеупомянутых аспектов и вариантов осуществления клетки. В ряде аспектов популяция клеток (например, клетка, относящаяся к данной популяции клеток) способна к дифференцировке в популяцию дифференцированных клеток, например, популяцию клеток эритроидного ростка (например, популяцию красных кровяных клеток), и где указанная популяция дифференцированных клеток характеризуется повышенным процентным содержанием F-клеток (например, процентным содержанием F-клеток, которое повышено на по меньшей мере приблизительно 15%, по меньшей мере приблизительно 17%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 30% или по меньшей мере приблизительно 40%), например, по сравнению с популяцией немодифицированных клеток такого же типа. В ряде аспектов F-клетки популяции дифференцированных клеток продуцируют в среднем по меньшей мере приблизительно 6 пикограмм (например, по меньшей мере приблизительно 7 пикограмм, по меньшей мере приблизительно 8 пикограмм, по меньшей мере приблизительно 9 пикограмм, по меньшей мере приблизительно 10 пикограмм, или от приблизительно 8 до приблизительно 9 пикограмм, или от приблизительно 9 до приблизительно 10 пикограмм) фетального гемоглобина на клетку.
В одном аспекте, в том числе в любом из вышеупомянутых аспектов и вариантов осуществления популяции клетки в настоящем изобретении представлена популяция клеток, включающая 1) по меньшей мере 1e6 CD34+ клеток/кг веса тела пациента, которому назначено введение клеток; 2) по меньшей мере 2e6 CD34+ клеток/кг веса тела пациента, которому назначено введение клеток; 3) по меньшей мере 3e6 CD34+ клеток/кг веса тела пациента, которому назначено введение клеток; 4) по меньшей мере 4e6 CD34+ клеток/кг веса тела пациента, которому назначено введение клеток; или 5) от 2e6 до 10e6 CD34+ клеток/кг веса тела пациента, которому назначено введение клеток. В ряде вариантов осуществления по меньшей мере приблизительно 40%, например, по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80% или по меньшей мере приблизительно 90%) клеток из популяции представляют собой клетки CD34+. В ряде вариантов осуществления по меньшей мере приблизительно 5%, например, по меньшей мере приблизительно 10%, например, по меньшей мере приблизительно 15%, например, по меньшей мере приблизительно 20%, например, по меньшей мере приблизительно 30% клеток из популяции представляют собой клетки CD34+CD90+. В ряде вариантов осуществления популяция клеток получена из пуповинной крови, периферической крови (например, мобилизованной периферической крови) или костного мозга, например, получена из костного мозга. В ряде вариантов осуществления популяция клеток включает, например, состоит из клеток млекопитающего, например, клеток человека. В ряде вариантов осуществления популяция клеток является аутологичной по отношению к пациенту, которому назначено ее введение. В других вариантах осуществления популяция клеток является аллогенной по отношению к пациенту, которому назначено ее введение.
В одном аспекте в настоящем изобретении представлена композиция, содержащая клетку, описанную в данном документе, например, клетку согласно любому из вышеупомянутых аспектов и вариантов осуществления клетки, или популяцию клеток, описанную в данном документе, например, популяцию клеток согласно любому из вышеупомянутых аспектов и вариантов осуществления популяции клеток. В одном аспекте композиция содержит фармацевтически приемлемую среду, например, фармацевтически приемлемую среду, подходящую для криоконсервации.
В одном аспекте в настоящем изобретении представлен способ лечения гемоглобинопатии, предусматривающий введение пациенту описанной в данном документе клетки, например, клетки согласно любому из вышеупомянутых аспектов и вариантов осуществления клетки, описанной в данном документе популяции клеток, например, популяции клеток согласно любому из вышеупомянутых аспектов и вариантов осуществления популяции клеток, или композиции, описанной в данном документе, например, композиции согласно любому из вышеупомянутых аспектов и вариантов осуществления композиции.
В одном аспекте в настоящем изобретение представлен способ повышения экспрессии фетального гемоглобина у млекопитающего, предусматривающий введение пациенту описанной в данном документе клетки, например, клетки согласно любому из вышеупомянутых аспектов и вариантов осуществления клетки, описанной в данном документе популяции клеток, например, популяции клеток согласно любому из вышеупомянутых аспектов и вариантов осуществления популяции клеток, или описанной в данном документе композиции, например, композиции согласно любому из вышеупомянутых аспектов и вариантов осуществления композиции. В ряде аспектов гемоглобинопатия представляет собой бета-талассемию. В ряде аспектов гемоглобинопатия представляет собой серповидноклеточное заболевание.
В одном аспекте в настоящем изобретении представлен способ получения клетки (например, популяции клеток), предусматривающий
(a) обеспечение клетки (например, популяции клеток) (например, HSPC (например, популяции HSPC));
(b) культивирование указанной клетки (например, указанной популяции клеток) ex vivo в среде для культивирования клеток, содержащей вещество, стимулирующее размножение стволовых клеток; и
(c) введение в указанную клетку первой молекулы gRNA, например, описанной в данном документе, например, первой молекулы gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления молекулы gRNA; молекулы нуклеиновой кислоты, кодирующей первую молекулу gRNA; описанной в данном документе композиции, например, композиции согласно любому из вышеупомянутых аспектов и вариантов осуществления композиции; или описанного в данном документе вектора, например, вектора согласно любому из вышеупомянутых аспектов и вариантов осуществления. В ряде аспектов способа после указанного введения на стадии (c) указанная клетка (например, популяция клеток) способна к дифференцировке в дифференцированную клетку (например, популяцию дифференцированных клеток), например, клетку эритроидного ростка (например, популяцию клеток эритроидного ростка), например, красную кровяную клетку (например, популяцию красных кровяных клеток), и где указанная дифференцированная клетка (например, популяция дифференцированных клеток) продуцирует повышенный уровень фетального гемоглобина, например, по сравнению с той же клеткой, которую не подвергали стадии (c). В ряде аспектов способа вещество, стимулирующее размножение стволовых клеток, представляет собой a) (1r,4r)-N1-(2-бензил-7-(2-метил-2H-тетразол-5-ил)-9H-пиримидо[4,5-b]индол-4-ил)циклогексан-1,4-диамин; b) метил-4-(3-пиперидин-1-илпропиламино)-9H-пиримидо[4,5-b]индол-7-карбоксилат; c) 4-(2-(2-(бензо[b]тиофен-3-ил)-9-изопропил-9H-пурин-6-иламино)этил)фенол; d) (S)-2-(6-(2-(lH-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-l-ол или e) их комбинации (например, комбинацию (1r,4r)-N1-(2-бензил-7-(2-метил-2H-тетразол-5-ил)-9H-пиримидо[4,5-b]индол-4-ил)циклогексан-1,4-диамина и (S)-2-(6-(2-(lH-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ола). В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, представляет собой (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол. В ряде аспектов среда для культивирования клеток содержит тромбопоэтин (Tpo), лиганд Flt3 (Flt-3L) и фактор стволовых клеток человека (SCF). В ряде аспектов среда для культивирования клеток дополнительно содержит интерлейкин-6 (IL-6) человека. В ряде аспектов среда для культивирования клеток содержит тромбопоэтин (Tpo), лиганд Flt3 (Flt-3L) и фактор стволовых клеток человека (SCF), каждый из которых присутствуют в концентрации, находящейся в диапазоне от приблизительно 10 нг/мл до приблизительно 1000 нг/мл, например, каждый из которых присутствует в концентрации, составляющей приблизительно 50 нг/мл, например, каждый из которых присутствует в концентрации, составляющей 50 нг/мл. В ряде аспектов среда для культивирования клеток содержит интерлейкин-6 (IL-6) человека в концентрации, находящейся в диапазоне от приблизительно 10 нг/мл до приблизительно 1000 нг/мл, например, в концентрации, составляющей приблизительно 50 нг/мл, например, в концентрации, составляющей 50 нг/мл. В ряде аспектов среда для культивирования клеток содержит вещество, стимулирующее рост стволовых клеток, в концентрации, находящейся в диапазоне от приблизительно 1 нМ до приблизительно 1 мМ, например, в концентрации, находящейся в диапазоне от приблизительно 1 мкМ до приблизительно 100 нМ, например, в концентрации, находящейся в диапазоне от приблизительно 500 нМ до приблизительно 750 нМ. В ряде аспектов среда для культивирования клеток содержит вещество, стимулирующее рост стволовых клеток, в концентрации, составляющей приблизительно 500 нМ, например, в концентрации, составляющей 500 нМ. В ряде аспектов среда для культивирования клеток содержит вещество, стимулирующее рост стволовых клеток, в концентрации, составляющей приблизительно 750 нМ, например, в концентрации, составляющей 750 нМ.
В ряде аспектов способа получения клетки (например, популяции клеток) культивирование на стадии (b) предусматривает период культивирования перед введением на стадии (c), например, период культивирования перед введением на стадии (c) составляет по меньшей мере 12 часов, например, представляет собой период, составляющий от приблизительно 1 дня до приблизительно 12 дней, например, представляет собой период, составляющий от приблизительно 1 дня до приблизительно 6 дней, например, представляет собой период, составляющий от приблизительно 1 дня до приблизительно 3 дней, например, представляет собой период, составляющий от приблизительно 1 дня до приблизительно 2 дней, например, представляет собой период, составляющий приблизительно 2 дня. В ряде аспектов способа получения клетки (например, популяции клеток), в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа культивирование на стадии (b) предусматривает период культивирования после введения на стадии (c), например, период культивирования после введения на стадии (c) составляет по меньшей мере 12 часов, например, представляет собой период, составляющий от приблизительно 1 дня до приблизительно 12 дней, например, представляет собой период, составляющий от приблизительно 1 дня до приблизительно 6 дней, например, представляет собой период, составляющий от приблизительно 2 дней до приблизительно 4 дней, например, представляет собой период, составляющий приблизительно 2 дня, или представляет собой период, составляющий приблизительно 3 дня, или представляет собой период, составляющий приблизительно 4 дня. В ряде аспектов способа получения клетки (например, популяции клеток), в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа, популяция клеток увеличивается в по меньшей мере 4 раза, например, в по меньшей мере 5 раз, например, в по меньшей мере 10 раз, например, по сравнению с клетками, которые не культивируют в соответствии со стадией (b).
В ряде аспектов способа получения клетки (например, популяции клеток), в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа введение на стадии (c) предусматривает электропорацию. В ряде аспектов электропорация включает 1-5 импульсов, например, 1 импульс, и при этом импульсное напряжение каждого импульса находится в диапазоне от 700 вольт до 2000 вольт и характеризуется продолжительностью импульса, находящейся в диапазоне от 10 мс до 100 мс. В ряде аспектах электропорация включает, например, состоит из 1 импульса. В ряде аспектов напряжение импульса (или более одного импульса) находится в диапазоне от 1500 до 1900 вольт, например, составляет 1700 вольт. В ряде аспектах продолжительность импульса одного импульса или более одного импульса находится в диапазоне от 10 мс до 40 мс, например, составляет 20 мс.
В ряде аспектов способа получения клетки (например, популяции клеток), в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа клетка (например, популяция клеток), предусмотренная на стадии (a), представляет собой клетку человека (например, популяцию клеток человека). В ряде аспектов способа получения клетки (например, популяции клеток), в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа клетка (например, популяция клеток), предусмотренная на стадии (a), выделена из костного мозга, периферической крови (например, мобилизованной периферической крови) или пуповинной крови. В ряде аспектов способа получения клетки (например, популяции клеток), в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа клетка (например, популяция клеток), предусмотренная на стадии (a), выделена из костного мозга, например, выделена из костного мозга пациента, страдающего от гемоглобинопатии.
В ряде аспектов способа получения клетки (например, популяции клеток), в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа популяция клеток, предусмотренная на стадии (a), является обогащенной клетками CD34+.
В ряде аспектов способа получения клетки (например, популяции клеток), в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа после введения на стадии (c) клетку (например, популяцию клеток) подвергают криоконсервации.
В ряде аспектов способа получения клетки (например, популяции клеток), в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа после введения на стадии (c) клетка (например, популяция клеток) содержит a) вставку/делецию в последовательности геномной ДНК, комплементарной нацеливающему домену первой молекулы gRNA, или рядом с этой последовательностью; или b) делецию, охватывающую последовательность, например, по сути всю последовательность, между последовательностью, комплементарной нацеливающему домену первой молекулы gRNA (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG1, и последовательностью, комплементарной нацеливающему домену первой молекулы gRNA (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG2.
В ряде аспектов способа получения клетки (например, популяции клеток), в том числе в любом из вышеупомянутых аспектов и вариантов осуществления способа после введения на стадии (c) по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% клеток из популяции клеток предусматривают вставку/делецию в последовательности геномной ДНК, комплементарной нацеливающему домену первой молекулы gRNA, или рядом с этой последовательностью.
В одном аспекте в настоящем изобретении представлена клетка (например, популяция клеток), получаемая с помощью способа получения клетки (например, популяции клеток), описанного в данном документе, например, описанного в любом из вышеупомянутых аспектов и вариантов осуществления способа получения клетки.
В одном аспекте в настоящем изобретении представлен способ лечения гемоглобинопатии у пациента-человека, предусматривающий введение пациенту-человеку композиции, содержащей клетку, описанную в данном документе, например, клетку согласно любому из вышеупомянутых аспектов и вариантов осуществления клетки; или популяции клеток, описанной в данном документе, например, популяции клеток согласно любому из вышеупомянутых аспектов и вариантов осуществления популяции клеток. В ряде аспектов гемоглобинопатия представляет собой бета-талассемию. В ряде аспектов гемоглобинопатия представляет собой серповидноклеточное заболевание.
В одном аспекте в настоящем изобретении представлен способ повышения экспрессии фетального гемоглобина у пациента-человека, предусматривающий введение указанному пациенту-человеку композиции, содержащей клетку, описанную в данном документе, например, клетку согласно любому из вышеупомянутых аспектов и вариантов осуществления клетки; или популяции клеток, описанной в данном документе, например, популяции клеток согласно любому из вышеупомянутых аспектов и вариантов осуществления популяции клеток. В ряде аспектов у пациента-человека имеется бета-талассемия. В ряде аспектов у пациента-человека имеется серповидноклеточное заболевание.
В ряде аспектов способа лечения гемоглобинопатии или способа повышения экспрессии фетального гемоглобина пациенту-человеку вводят композицию, содержащую по меньшей мере приблизительно 1e6 клеток (например, клеток, описанных в данном документе) на кг веса тела пациента-человека, например, по меньшей мере приблизительно 1e6 клеток CD34+ (например, клеток, описанных в данном документе) на кг веса тела пациента-человека. В ряде аспектов способа лечения гемоглобинопатии или способа повышения экспрессии фетального гемоглобина пациенту-человеку вводят композицию, содержащую по меньшей мере приблизительно 2e6 клеток (например, клеток, описанных в данном документе) на кг веса тела пациента-человека, например, по меньшей мере приблизительно 2e6 клеток CD34+ (например, клеток, описанных в данном документе) на кг веса тела пациента-человека. В ряде аспектов способа лечения гемоглобинопатии или способа повышения экспрессии фетального гемоглобина пациенту-человеку вводят композицию, содержащую приблизительно 2e6 клеток (например, клеток, описанных в данном документе) на кг веса тела пациента-человека, например, приблизительно 2e6 клеток CD34+ (например, клеток, описанных в данном документе) на кг веса тела пациента-человека. В ряде аспектов способа лечения гемоглобинопатии или способа повышения экспрессии фетального гемоглобина пациенту-человеку вводят композицию, содержащую по меньшей мере приблизительно 3e6 клеток (например, клеток, описанных в данном документе) на кг веса тела пациента-человека, например, по меньшей мере приблизительно 3e6 клеток CD34+ (например, клеток, описанных в данном документе) на кг веса тела пациента-человека. В ряде аспектов способа лечения гемоглобинопатии или способа повышения экспрессии фетального гемоглобина пациенту-человеку вводят композицию, содержащую приблизительно 3e6 клеток (например, клеток, описанных в данном документе) на кг веса тела пациента-человека, например, приблизительно 3e6 клеток CD34+ (например, клеток, описанных в данном документе) на кг веса тела пациента-человека. В ряде аспектов способа лечения гемоглобинопатии или способа повышения экспрессии фетального гемоглобина пациенту-человеку вводят композицию, содержащую от приблизительно 2e6 до приблизительно 10e6 клеток (например, клеток, описанных в данном документе) на кг веса тела пациента-человека, например, от приблизительно 2e6 до приблизительно 10e6 клеток CD34+ (например, клеток, описанных в данном документе) на кг веса тела пациента-человека.
В одном аспекте в настоящем изобретение представлена молекула gRNA, описанная в данном документе, например, молекула gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления молекулы gRNA; композиция, описанная в данном документе, например, композиция согласно любому из вышеупомянутых аспектов и вариантов осуществления композиции, нуклеиновая кислота, описанная в данном документе, например, нуклеиновая кислота согласно любому из вышеупомянутых аспектов и вариантов осуществления нуклеиновой кислоты; вектор, описанный в данном документе, например, вектор согласно любому из вышеупомянутых аспектов и вариантов осуществления вектора; клетка, описанная в данном документе, например, клетка согласно любому из вышеупомянутых аспектов и вариантов осуществления клетки; или популяция клеток, описанная в данном документе, например, популяция клеток согласно любому из вышеупомянутых аспектов и вариантов осуществления популяции клеток, для применения в качестве лекарственного препарата.
В одном аспекте в настоящем изобретении представлена молекула gRNA, описанная в данном документе, например, молекула gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления молекулы gRNA; композиция, описанная в данном документе, например, композиция согласно любому из вышеупомянутых аспектов и вариантов осуществления композиции, нуклеиновая кислота, описанная в данном документе, например, нуклеиновая кислота согласно любому из вышеупомянутых аспектов и вариантов осуществления нуклеиновой кислоты; вектор, описанный в данном документе, например, вектор согласно любому из вышеупомянутых аспектов и вариантов осуществления вектора; клетка, описанная в данном документе, например, клетка согласно любому из вышеупомянутых аспектов и вариантов осуществления клетки; или популяция клеток, описанная в данном документе, например, популяция клеток согласно любому из вышеупомянутых аспектов и вариантов осуществления популяции клеток, для применения в получении лекарственного препарата.
В одном аспекте в настоящем изобретении представлена молекула gRNA, описанная в данном документе, например, молекула gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления молекулы gRNA; композиция, описанная в данном документе, например, композиция согласно любому из вышеупомянутых аспектов и вариантов осуществления композиции, нуклеиновая кислота, описанная в данном документе, например, нуклеиновая кислота согласно любому из вышеупомянутых аспектов и вариантов осуществления нуклеиновой кислоты; вектор, описанный в данном документе, например, вектор согласно любому из вышеупомянутых аспектов и вариантов осуществления вектора; клетка, описанная в данном документе, например, клетка согласно любому из вышеупомянутых аспектов и вариантов осуществления клетки; или популяция клеток, описанная в данном документе, например, популяция клеток согласно любому из вышеупомянутых аспектов и вариантов осуществления популяции клеток, для применения в лечении заболевания.
В одном аспекте в настоящем изобретении представлена молекула gRNA, описанная в данном документе, например, молекула gRNA согласно любому из вышеупомянутых аспектов и вариантов осуществления молекулы gRNA; композиция, описанная в данном документе, например, композиция согласно любому из вышеупомянутых аспектов и вариантов осуществления композиции, нуклеиновая кислота, описанная в данном документе, например, нуклеиновая кислота согласно любому из вышеупомянутых аспектов и вариантов осуществления нуклеиновой кислоты; вектор, описанный в данном документе, например, вектор согласно любому из вышеупомянутых аспектов и вариантов осуществления вектора; клетка, описанная в данном документе, например, клетка согласно любому из вышеупомянутых аспектов и вариантов осуществления клетки; или популяция клеток, описанная в данном документе, например, популяция клеток согласно любому из вышеупомянутых аспектов и вариантов осуществления популяции клеток, для применения в лечении заболевания, где заболевание представляет собой гемоглобинопатию, например, бета-талассемию или серповидноклеточное заболевание.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1. Индукция HbF через 7 дней после осуществления редактирования. Для каждой тестированной целевой последовательности gRNA процент клеток с индуцированной экспрессией HbF, с поправкой на исходные уровни на основе имитации трансфекции, показан в виде среднего значения, при этом планка погрешностей показывает стандартное отклонение. gRNA G8 к экзону 2 BCL11A служит в качестве положительного контроля. Пунктирной линией на уровне 17% обозначен пороговый уровень, выбранный для анализа. Различное выделение серым, представленное в условных обозначениях, показывает взаимосвязь степени индукции HbF со степенью редактирования целевых локусов HBG1 или HBG2.
Фигура 2. Эффективность редактирования в целевом локусе HBG1. Для каждой тестируемой gRNA процент вставок/делеций, выявленный с помощью NGS, показан в виде среднего значения, при этом планка погрешностей показывает стандартное отклонение. gRNA G8 к экзону 2 BCL11A служит в качестве положительного контроля. Две направляющие последовательности, для которых не получали данных в ходе проведения NGS, показаны стрелками.
Фигура 3. Эффективность редактирования в целевом локусе HBG2. Для каждой тестируемой gRNA процент вставок/делеций, выявленный с помощью NGS, показан в виде среднего значения, при этом планка погрешностей показывает стандартное отклонение. gRNA G8 к экзону 2 BCL11A служит в качестве положительного контроля. Шестнадцать направляющих последовательностей, для которых не получали данных в ходе проведения NGS, показаны стрелками.
Фигура 4. Обзор местоположения высокоэффективных целевых последовательностей gRNA (например, за счет которых экспрессия HbF повышается на >17% в день 7), сайтов связывания известных неделеционных полиморфизмов HPFH и фактора транскрипции в промоторном участке HBG1. На фигуре раскрыты SEQ ID NO: 293-312 соответственно в порядке встречаемости.
Фигура 5. Обзор местоположения высокоэффективных целевых последовательностей gRNA (например, за счет которых экспрессия HbF повышается на >17% в день 7), сайтов связывания известных неделеционных полиморфизмов HPFH и фактора транскрипции в промоторном участке HBG2. На фигуре раскрыты SEQ ID NO: 313-332 соответственно в порядке встречаемости.
Фигура 6. Эффективность редактирования в целевом локусе B2M в CD34+ HSPC за счет разных вариантов Cas9, оцененная с помощью NGS и проточной цитометрии. NLS=SV40 NLS; His6 (SEQ ID NO: 247) или His8 (SEQ ID NO: 248) означает 6 (SEQ ID NO: 247) или 8 (SEQ ID NO: 248) остатков гистидина соответственно; TEV=сайт расщепления вируса гравировки табака; Cas9=Cas9 дикого типа из S. pyogenes - мутации или варианты являются такими как указано).
Фигура 7. Выявление и количественное определение HbF-положительных клеток посредством проточной цитометрии через 7 (черные столбики), 14 (светло-серые столбики) или 21 (темно-серые столбики) день после эритроидной дифференцировки после электропорации клеток HSPC с использованием RNP, содержащим sgRNA с указанным нацеливающим доменом. В каждый момент времени вычитали процент клеток HbF+ для контрольных культур, не обработанных sgRNA. Приведено среднее значение+стандартное отклонение (n=2 технические повторности).
Фигура 8. Выявление и количественное определение HbF-положительных клеток с помощью проточной цитометрии через 7 (незакрашенные черные столбики), 14 (незакрашенные светло-серые столбики) или 21 (незакрашенные темно-серые столбики) день после эритроидной дифференцировки после электропорации клеток HSPC с использованием RNP, содержащим sgRNA указанного нацеливающего домена. В каждый момент времени вычитали процент клеток HbF+ для контрольных культур, не обработанных sgRNA. Показано среднее значение (столбик) для двух независимых клеточных доноров наряду со значением для каждого донора (круг=первый донор, треугольник=второй донор).
Фигура 9. Визуализация продуктов ПЦР, полученной в указанной реакции: P1, P2 или P3, описанных в примерах, из клеток после электропорации с использованием RNP, содержащим sgRNA указанного нацеливающего домена или контрольных клеток, не обработанных sgRNA. Ожидаемые продукты являются следующими. P1: 7,7 т. о. для аллеля дикого типа/небольшой вставки/делеции или 4,9 т. о. для аллеля инверсии, 2,8 т. о. для 4,9 т. о. аллеля делеции. P2: 3,8 т. о. для аллеля дикого типа/небольшой вставки, отсутствует продукт для 4,9 т. о. делеция или 4,9 т. о. аллеля инверсии. P3: 1,8 т. о. для 4,9 т. о. аллеля инверсии, отсутствует продукт для аллеля дикого типа/небольшой вставки или 4,9 т. о. аллеля делеции. L=эталонный ДНК-маркер молекулярной массы. *=ДНК из данной полосы выделяли и подвергали секвенированию нового поколения.
Фигура 10. Схема, на которой показано геномное местоположение сайтов связывания для праймера и зонда для анализа с помощью цифровой капельной ПЦР для количественного определения делеций размером 4,9 т. о. Праймеры (прямой 5,2 т. о. и обратный 5,2 т. о.) и зонд (зонд FAM) связываются с межгенным сайтом, расположенным ниже HBG2 и выше HBG1. У зонда имеется второй сайт связывания, расположенный выше HBG2, но этот участок не связывается с праймерами. Показаны области, в которых расположены нацеливающие домены в промоторах HBG1 и HBG2. Если последовательность, лежащая между двумя участками нацеливающего домена, удалена, то сайт связывания для праймера/зонда между HBG1 и HBG2 будет потерян.
Фигура 11. Схема сортировки субпопуляций HSPC для образца клеток после электропорации с использованием RNP, содержащим нацеливающий домен sgRNA GCR-0067. Показаны точечные диаграммы клеточной флуоресценции после иммуноокрашивания указанного маркера клеточной поверхности. Следующие популяции сортировали как показано: P5=CMP (CD34+CD45RA-CD38+), P9=MPP (CD34+CD45RA-CD38-CD90-CD49f-), P10=ST-HSC (CD34+CD45RA-CD38-CD90-CD49f+), P11=LT-HSC (CD34+CD45RA-CD38-CD90+CD49f+). Также проводили сортировку в отношении общего количества клеток CD34+ (не показано).
Фигура 12. Процент редактирования сортированных субпопуляций HSPC после электропорации с использованием RNP, содержащим sgRNA нацеливающего домена GCR-0067. Вставка/делеция HBG1 и вставка/делеция HBG2 показывают процент небольших вставок и делеций, идентифицированных с помощью секвенирования нового поколения ПЦР-ампликонов в нацеливающем домене промоторного участка HBG1 или HBG2 или рядом с ним соответственно (следует отметить, что аллели с ранее описанными делецией или инверсией размером 4,9 т. о. не являются амплифицированными). Делеция HBG1-HBG2 показывает процент аллелей с делецией размером 4,9 т. о., что определяли с помощью анализа цифровой капельной ПЦР, описанного в примерах. Полное редактирование представляет собой аппроксимацию, рассчитанную путем сложения процента делеции HBG1-HBG2 с процентом без делеции HBG1-HBG2, умноженным на процент вставки/делеции HBG2.
Фигура 13. На фигуре 13A показана сумма всех вставок/делеций, наблюдаемых в локусе HBG1 в указанном типе клеток после введения sgRNA, содержащей нацеливающий домен GCR-0067. Вставки/делеции располагаются с наиболее часто наблюдаемыми вставками/делециями в верхней части каждого столбика. В данном анализе количественно не определяли фракцию клеток, содержащих большую делецию размером 4,9 т. о. между локусами HBG1 и HBG2. Число в пределах столбика наиболее преобладающих вставок/делеций указывает на количество отличий по нуклеотидам от геномной последовательности дикого типа (- означает делецию; + означает вставку). На фигуре 13В показана сумма всех вставок/делеций, наблюдаемых в локусе HBG2 в указанном типе клеток после введения sgRNA, содержащей нацеливающий домен GCR-0067. Вставки/делеции располагаются с наиболее часто наблюдаемыми вставками/делециями в верхней части каждого столбика. В данном анализе количественно не определяли фракцию клеток, содержащих большую делецию размером 4,9 т. о. между локусами HBG1 и HBG2. Число в пределах столбика наиболее преобладающих вставок/делеций указывает на количество отличий по нуклеотидам от геномной последовательности дикого типа (- означает делецию; + означает вставку). CMP=клетки CD34+CD45RA-CD38+; MPP=клетки CD34+CD45RA-CD38-CD90-CD49f-; ST-HSC=клетки CD34+CD45RA-CD38-CD90-CD49f+ и LT-HSC=клетки CD34+CD45RA-CD38-CD90+CD49f+.
Фигура 14. Процент колоний, соответствующих указанному подтипу, CFU-GEMM (темно-серые столбики), CFU-G/M/GM (серые столбики средней яркости) или BFU-E/CFU-E (светло-серые столбики) после электропорации с использованием RNP, содержащим sgRNA указанного нацеливающего домена, или контрольные культуры, не обработанные sgRNA. Приведено среднее значение +/- стандартное отклонение (n=2 независимых донора).
Фигура 15. Кратность пролиферации от общего количества ядросодержащих клеток (TNC), CD34-положительных клеток (CD34+) и двойных положительных по CD34 и CD90 клеток (CD34+CD90+), как указано, в среде, содержащей соединение 4, после электропорации с использованием RNP, содержащим sgRNA нацеливающего домена GCR-0067, или контрольные культуры, не обработанные sgRNA. Приведено среднее значение +/- стандартное отклонение (n=2 независимых донора). Показано среднее значение (столбик) для трех независимых клеточных доноров наряду со значением для каждого донора (квадрат=донор A, треугольник=донор B, круг=донор C). Различия между отредактированными и контрольными культурами являлись не значимыми (ns), что было определено с помощью двухвыборочного t-критерия для независимых выборок (GraphPad Prism).
Фигура 16. Иллюстративное гейтирование клеточной популяции с помощью проточной цитометрии. Показаны точечные диаграммы клеточной флуоресценции после иммуноокрашивания указанных маркеров клеточной поверхности или изотипического контроля (изотипа). Гейты, очерченные жирными линиями, использовали для количественного определения процента указанной популяции и устанавливали для исключения меченных клеток изотипического контроля. Показаны только жизнеспособные клетки, предварительно гейтированные как DAPI-отрицательные и в пределах клеточных гейтов прямого светорассеяния и бокового светорассеяния, и полученные от донора C, подвергнутого электропорации только с использованием Cas9.
Фигура 17. Процент клеток с указанным фенотипом клеточной поверхности, определенный с помощью проточной цитометрии, после электропорации с использованием RNP, содержащим sgRNA нацеливающего домена GCR-0067 (черные столбики), или контрольные культуры, не обработанные sgRNA (серые столбики). Клетки выращивали в течение 2 дней после электропорации с использованием RNP в среде, содержащей соединение 4, и оценивали с помощью проточной цитометрии, что описано на фигуре 16. Указано среднее значение + стандартное отклонение (n=3 независимых донора). Не наблюдали значимых отличий между отредактированными и нередактированными клетками для указанной популяции, что определили посредством двухвыборочного t-критерия для независимых выборок (GraphPad Prism).
Фигура 18A. Количественное определение с помощью CE-MS субъединиц глобина в HSC, подвергнутых имитации редактирования, полученных от пациента с серповидноклеточным заболеванием (SCD1), подвергнутых имитации редактирования с использованием Cas9, но без sgRNA. После дифференцировки клеток в эритроидный росток клетки показали нормальный уровень a-глобина, отсутствие нормального уровня b-глобина из-за гомозиготности серповидных клеток, высокий уровень субъединиц b-глобина серповидных клеток и низкий уровень фетального g-глобина.
Фигура 18B. Количественное определение с помощью CE-MS субъединиц глобина в HSPC, подвергнутых редактированию генома, полученных от пациентов, имеющих серповидные клетки (SCD1). После редактирования HSC эритроидные клетки, полученные из образца от пациента, продемонстрировали повышение экспрессии фетального g-глобина на 40% и одновременное снижение экспрессии субъединиц b-глобина серповидных клеток на 50%.
Фигура 19. Схематический протокол исследования приживления клеток с отредактированным геном. Трансплантация HSC, подвергнутых редактированию гена с использованием Cas9 и sgRNA, содержащей нацеливающий домен CR001128 (sg1128). Пятьсот тысяч клеток CD34+ человека или подвергали имитации редактирования с использованием gRNA, или редактированию гена с использованием sg1128 с их последующим введением реципиентам NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG), облученным ионизирующим излучением в дозе 2 Гр. У мышей отбирали кровь на 4, 8, 12, 16 неделе, и клетки костного мозга отбирали через 16 недель после трансплантации.
Фигура 20. Восстановление костного мозга через 16 недель после трансплантации с применением экспериментального протокола, показанного на фигуре 19.
Фигура 21. Восстановление миелоидных, B- и T-лимфоидных клеток в периферической крови и костном мозге в нескольких моментах времени с применением экспериментального протокола, показанного на фигуре 19. N=5/группа, данные показаны от минимальных до максимальных значений, 4 независимых эксперимента.
Фигура 22. Схематическая диаграмма исследования трансплантации для оценки функции стволовых клеток HSC, подвергнутых редактированию с использованием sgRNA из промоторного участка гамма-глобина (sg-G0008, sg-G0051, sg-G0010, sg-G0048, sg-G0067), по сравнению с gRNA из специфического для эритроидных клеток энхансерного участка гена BCL11A (sg-G1128; также называемого sg1128). Клетки оставляли в культуре на 24 часа после электропорации. Условия культивирования как до, так и после электропорации являлись следующими: StemSpan SFEM+IL6, SCF, TPO, Flt3L; 750 нМ соединения 4.
Фигура 23. Приживление клеток человека и анализ клеточной линии дифференцировки через 20 недель у мышей NSG. Фигура 23A) химеризм клеток периферической крови через 18 недель; фигура 23B) распределение по клеточным линиям дифференцировки в периферической крови на 18 неделе. Анализ костного мозга: фигура 23C) анализ клеток костного мозга человека на 9 неделе; фигура 23D) приживление клеток CD45+ человека и распределение по клеточным линиям дифференцировки человека в костном мозге на 9 неделе; фигура 23E) приживление CD45+ человека в костном мозге на 20 неделе после пересадки; фигура 23F) распределение по клеточным линиям дифференцировки приживленных клеток в костном мозге на 20 неделе.
Фигура 24A. Эффективность приживления HSC, подвергнутых редактированию с использованием sgRNA с гомологией к промоторному участку гамма-глобина (sg-G0008, sg-G0051, sg-G0010, sg-G0048, sg-G0067), по сравнению с sgRNA из эритроид-специфического энхансерного участка гена BCL11A (sg1128). Показано приживление клеток человека у мышей NSG через 8 недель после трансплантации. N=10/группа, 3 независимых эксперимента. На графике показаны объединенные данные.
Фигура 24B. Эффективность приживления HSC, подвергнутых редактированию с использованием sgRNA с гомологией к промоторному участку гамма-глобина (sg-G0008, sg-G0051, sg-G0010, sg-G0048, sg-G0067), по сравнению с sgRNA из эритроид-специфического энхансерного участка гена BCL11A (sg1128). Показано приживление клеток человека у мышей NSG через 20 недель после трансплантации. N=10/группа, 3 независимых эксперимента. На графике показаны объединенные данные.
Фигура 25. Восстановление у мышей NSG нескольких клеточных линий дифференцировки, которым трансплантировали подвергнутую редактированию гена клетку CD34+. N=10/группа, данные из одного иллюстративного эксперимента.
Фигура 26. Высокую эффективность редактирования поддерживали до и после трансплантации. "До Xpt": эффективность редактирования и паттерн вставки/делеции отдельной sgRNA в клетках CD34+ человека, что измеряли с помощью NGS после редактирования, но до трансплантации. "Через 8 недель после Xpt": эффективность редактирования и паттерн вставки в клетках CD34+ человека через 8 недель после трансплантации костного мозга у мышей, что определено с помощью NGS. "Через 20 недель после Xpt": эффективность редактирования и паттерн вставки в клетках CD34+ человека через 20 недель после трансплантации костного мозга у мышей, что определено с помощью NGS. Электропорацию осуществляли в трех повторностях на группу, но данные представлены из одного иллюстративного эксперимента. Используемая в отношении данной фигуры "вставка/делеция" относится к суме всех вставок/делеций размером менее 200 нуклеотидов; "большая делеция" относится к делеции последовательности между прогнозируемыми сайтами связывания HBG1 и HBG2 для каждой gRNA.
Фигура 27. NGS-анализ клеток CD34+ после редактирования с использованием RNP. sgRNA, нацеливающие на специфические участки, показаны на оси x. Фигура 27A. NGS-анализ клеток CD34+ в день 2 после электропорации RNP. Фигура 27B. NGS-анализ всего костного мозга от мышей NSG, подвергнутых трансплантации отредактированными клетками CD34+ костного мозга, через (27B) 9 недель после трансплантации. Фигура 27C. NGS-анализ всего костного мозга от мышей NSG, подвергнутых трансплантации отредактированными клетками CD34+ костного мозга, через 20 недель после трансплантации. Инсерционные вставки/делеции показаны черным, делеционные вставки/делеции (за исключением больших делеций, предусматривающих вырезание участка между связывающими HBG1 и HBG2 целевыми последовательностями для каждой из gRNA sg-G51, sg-G48 и sg-G67) показаны серым. Общий % редактирования представлен высотой столбиков. N=10, данные представлены в виде среднего значения +SEM из одного независимого эксперимента.
Фигура 28. Подвергнутые редактированию гена прижившиеся на длительный срок HSC человека были способны продуцировать повышенный уровень HbF при дифференцировке эритроидной клетки. Пятьдесят тысяч клеток CD34+ человека отделяли от костного мозга мышей NSG путем сортировки через 8 недель или 20 недель после трансплантации. Отсортированные клетки высевали в среду для эритроидной дифференцировки на 14-21 дней. Зрелые красные кровяные клетки в культуре анализировали в отношении экспрессии HbF и измеряли количество клеток HbF+ с помощью проточной цитометрии. Имитационный контроль представляет собой клетки CD34+, подвергнутые редактированию с использованием Cas9, но без gRNA, и при этом трансплантированные мышам NSG аналогичным образом, как контрольной группе, подвергнутой редактированию гена. N=10/группа, 3 независимых эксперимента.
Фигура 29. Нецелевую активность в отношении HBG1 и/или HBG2 направляющих РНК оценивали с использованием способа олиго-вставки dsDNA в клетках HEK-293 со сверхэкспрессией Cas9. Показаны выявленные целевой сайт (незакрашенный круг) и потенциальные нецелевые сайты (закрашенные круги); на y-оси указана частота выявления. Все gRNA тестировали в формате dgRNA, при этом нацеливающий домен показан под идентификационным номером CRxxxxxx.
Фигура 30. Нецелевую активность в отношении HBG1 и/или HBG2 направляющих РНК оценивали с использованием способа олиго-вставки dsDNA в клетках HEK-293 со сверхэкспрессией Cas9. Показаны выявленные целевой сайт (незакрашенный круг) и потенциальные нецелевые сайты (закрашенные круги); на оси y указана частота выявления. gRNA тестировали либо в формате dgRNA, при этом нацеливающий домен показан под идентификационным номером CRxxxxx, либо в формате sgRNA, при этом нацеливающий домен показан под идентификационным номером Gxxxxxx.
Фигура 31A. Количество клеток CD34+ среди клеток, полученных из мобилизованной периферической крови здоровых индивидуумов после редактирования гена. Клетки размораживали в день 0, культивировали в течение 3 дней до электропорации в день 3. Подсчет количества клеток CD34+ согласно рекомендациям ISHAGE через 10 дней после электропорации. Два независимых эксперимента проводили в двух повторностях. Всего N=5. На графике показаны данные из эксперимента 1 со средним значением+SEM.
Фигура 31B. Размножение клеток CD34+, полученных из мобилизованной периферической крови здоровых индивидуумов после редактирования гена. Клетки размораживали в день 0, культивировали в течение 3 дней до электропорации в день 3. Увеличение общего количества мононуклеарных клеток в день 3, 7 и 10 после редактирования. Два независимых эксперимента проводили в двух повторностях. Всего N=5. На графике показаны данные из эксперимента 1 со средним значением+SEM.
Фигура 31C. Жизнеспособность клеток CD34+, полученных из мобилизованной периферической крови здоровых индивидуумов после редактирования гена. Клетки размораживали в день 0, культивировали в течение 3 дней до электропорации в день 3. Жизнеспособность мононуклеарных клеток в те же моменты времени после редактирования. Два независимых эксперимента проводили в двух повторностях. Всего N=5. На графике показаны данные из эксперимента 1 со средним значением+SEM.
Фигура 32A. Эффективность редактирования sg1128 и sg0067 в клетках CD34+, мобилизованных из периферической крови здоровых индивидуумов. Показан процент ВСТАВОК/ДЕЛЕЦИЙ, зарегистрированный с помощью NGS, после редактирования с использованием sg1128 (нацеливающий на BCL11A +58 участок ESH) и sg0067 (нацеливающий на кластер генов HbG-1 и HbG-2). В данном графике также показана общая эффективность редактирования для sg1128, поскольку только небольшие ВСТАВКИ/ДЕЛЕЦИИ образовывались за счет данной sgRNA. Более пяти независимых экспериментов проводили в двух повторностях или трех повторностях, n=2-3/эксперимент.
Фигура 32B. Эффективность редактирования sg1128 и sg0067 в клетках CD34+, мобилизованных из периферической крови здоровых индивидуумов. A. Процент ВСТАВОК/ДЕЛЕЦИЙ, зарегистрированный с помощью NGS, после редактирования с использованием sg0067 (нацеливающий на кластер генов HbG-1 и HbG-2). Показана общая эффективность редактирования и паттерн редактирования sg0067. Паттерн редактирования sg0067 состоит из большой делеции размером 5 т. о. (обозначенной черными столбиками) и меньших ВСТАВОК/ДЕЛЕЦИЙ (обозначенных серыми столбиками). Более пяти независимых экспериментов проводили в двух повторностях или трех повторностях, n=2-3/эксперимент.
Фигура 33. Кратность изменения транскрипции g-глобина в эритроидных клетках из образов от пациента после CRISPR-нокдауна BCL11A или образования вставки/делеции в участке HBG1/2. Клетки CD34+, полученные из мобилизованной периферической крови здоровых доноров, редактировали с помощью CRISPR и дифференцировали в эритроидный росток in vitro, как описано в предыдущих процедурах. В день 11 эритроидной дифференцировки клетки собирали из культуры и подвергали qPCR для измерения количества транскриптов g-глобина и b-глобина, нормализованных по GAPDH. Эксперимент проводили независимо дважды, каждый в двух повторностях, n=2-3/эксперимент. Данные показаны в виде среднего значения+SEM для объединенных доноров из одного исследования.
Фигура 34. Подсчет клеток HbF+ от здоровых индивидуумов после редактирования гена. Клетки CD34+, полученные из мобилизованной периферической крови здоровых доноров, редактировали с помощью CRISPR и дифференцировали в эритроидный росток in vitro, как описано в предыдущих процедурах. В день 10 эритроидной дифференцировки клетки окрашивали антителом к HbF-FITC для подсчета клеток HbF+ с помощью проточной цитометрии. Эксперимент проводили независимо дважды, каждый в двух повторностях, n=2-3/эксперимент. Данные показаны в виде среднего значения+SD из одного исследования.
Фигура 35A. Размножение и жизнеспособность клеток CD34+, полученных из периферической крови индивидуумов с серповидноклеточным заболеванием после редактирования гена. Клетки культивировали в течение 6-10 дней до электропорации. D0 означает день электропорации. Показано абсолютное количество клеток CD34+ согласно рекомендациям ISHAGE через 10 дней после электропорации. N=4, данные показаны в виде среднего значения+SEM. 4 независимых эксперимента проводили в двух повторностях. Столбики представляют собой в последовательности слева направо в каждый момент времени имитацию, sg1128, sg0067.
Фигура 35B. Размножение и жизнеспособность клеток CD34+, полученных из периферической крови индивидуумов с серповидноклеточным заболеванием после редактирования гена. Клетки культивировали в течение 6-10 дней до электропорации. D0 означает день электропорации. Показана процентная доля клеток CD34+ согласно рекомендациям ISHAGE через 10 дней после электропорации. N=4, данные показаны в виде среднего значения+SEM. 4 независимых эксперимента проводили в двух повторностях. Столбики представляют собой в последовательности слева направо в каждый момент времени имитацию, sg1128, sg0067.
Фигура 35C. Размножение и жизнеспособность клеток CD34+, полученных из периферической крови индивидуумов с серповидноклеточным заболеванием после редактирования гена. Клетки культивировали в течение 6-10 дней до электропорации. D0 означает день электропорации. Показано увеличение общего количества мононуклеарных клеток в день 3, 7 и 10 после редактирования. N=4, данные показаны в виде среднего значения+SEM. 4 независимых эксперимента проводили в двух повторностях. Столбики представляют собой в последовательности слева направо в каждый момент времени имитацию, sg1128, sg0067.
Фигура 35D. Размножение и жизнеспособность клеток CD34+, полученных из периферической крови индивидуумов с серповидноклеточным заболеванием после редактирования гена. Клетки культивировали в течение 6-10 дней до электропорации. D0 означает день электропорации. Показана жизнеспособность мононуклеарных клеток в день 3, 7 и 10 после редактирования. N=4, данные показаны в виде среднего значения+SEM. 4 независимых эксперимента проводили в двух повторностях. Столбики представляют собой в последовательности слева направо в каждый момент времени имитацию, sg1128, sg0067.
Фигура 36. Эффективность редактирования sg1128 и sg0067 в клетках CD34+ из образцов от пациента с серповидноклеточным заболеванием. Паттерн редактирования sg0067 был обозначен большой делецией (серый) и суммой небольших вставок/делеций (черный). Данные показаны в виде среднего значения+SEM для четырех независимых экспериментов по редактированию, осуществленных в двух повторностях с клетками CD34+ от четырех различных пациентов со серповидноклеточным заболеванием (SCD1-4).
Фигура 37. Способность HSPC к дифференцировке в несколько клеточных линий in vitro, измеренная с помощью анализа колониеобразующей активности. BFU-E = бурст-образующая единица, эритроид; CFU-GM = колониеобразующая единица, гранулоцит, моноцит; CFU-GEMM = колониеобразующая единица, гранулоцит, эритроид, моноцит, мегакариоцит. На графике показано три независимых эксперимента с клетками CD34+ от трех различных пациентов с серповидноклеточным заболеванием (SCD1-3). Эксперименты проводили в трех повторностях. Данные представляет собой среднее значение+SEM.
Фигура 38. Кратность изменение транскрипции g-глобина в эритроидных клетках из образов от пациента после CRISPR-нокдауна BCL11A или образования вставки/делеции в кластере генов g-глобина. Клетки CD34+, полученные от 3 пациентов с серповидноклеточным заболеванием (SCD1-3), редактировали с помощью CRISPR и подвергали дифференцировке в эритроидный росток in vitro, как описано в примерах. В день 11 эритроидной дифференцировки клетки собирали из культуры и подвергали qPCR для измерения количества транскриптов g-глобина и b-глобина, нормализованных по GAPDH. Эксперимент проводили в двух повторностях. Данные показаны в виде среднего значения+SEM для объединенных доноров.
Фигура 39. Подсчет клеток HbF+ в образцах от пациента с серповидноклеточным заболеванием после редактирования гена. Клетки CD34+, полученные от 3 пациентов с серповидноклеточным заболеванием (SCD1-3), редактировали с помощью CRISPR и подвергали дифференцировке в эритроидный росток in vitro, как описано в примерах. В дни 11, 14 и 21 эритроидной дифференцировки клетки окрашивали антителом к HbF-FITC для подсчета клеток HbF+ с помощью проточной цитометрии. Эксперимент проводили в двух повторностях. Данные показаны в виде среднего значения+SEM. В день 11 показаны результаты от SCD1-3; в день 14 показаны результаты от SCD-1 и SCD-2; в день 21 показаны результаты от SCD-2 и SCD-3.
Фигура 40. Измерение экспрессии фетального гемоглобина с помощью проточной цитометрии в образцах от пациента с серповидноклеточным заболеванием, подвергнутого редактированию гена. Клетки CD34+, полученные от 3 пациентов с серповидноклеточным заболеванием (SCD1-3), редактировали с помощью CRISPR и подвергали дифференцировке в эритроидный росток in vitro, как описано в примерах. В дни 11, 14 и 21 эритроидной дифференцировки клетки окрашивали антителом к HbF-FITC для измерения интенсивности экспрессии HbF в каждой клетке с помощью проточной цитометрии. Эксперимент проводили в двух повторностях. Данные показаны в виде среднего значения+SEM. MFI= средняя интенсивность флуоресценции. В день 11 показаны результаты от SCD1-3; в день 14 показаны результаты от SCD-1 и SCD-2; в день 21 показаны результаты от SCD-2 и SCD-3.
Фигура 41. Подсчет количества серповидных клеток по сравнению с нормальными клетками в образцах от пациента после редактирования с помощью CRISPR. Клетки CD34+, полученные от 3 пациентов с серповидноклеточным заболеванием (SCD1-3), редактировали с помощью CRISPR и подвергали дифференцировке в эритроидный росток in vitro, как описано в предыдущих процедурах. В день 21 эритроидной дифференцировки клетки подвергали воздействию камеры с определенным % гипоксии в течение 4 дней, фиксировали, а после этого проводили проточную цитометрию в сочетании с визуализацией одной клетки. На фигуре 41A (левая панель) показано изменение количества серповидных клеток в образцах от пациента, подвергнутого редактированию гена, что подсчитывали с помощью визуализации одной клетки. На фигуре 41B (правая панель) показано изменение количества нормальных клеток после редактирования гена в образцах от пациента, подвергнутого редактированию гена, что подсчитывали с помощью визуализации одной клетки. Проводили три независимых эксперимента, при этом каждый эксперимент в двух повторностях. Сорок тысяч изображений одной клетки регистрировали у каждого пациента. На графике показано среднее значение+SEM объединенных данных.
ОПРЕДЕЛЕНИЯ
Термины "система CRISPR", "система Cas" или "система CRISPR/Cas" относятся к набору молекул, содержащих РНК-направляемую нуклеазу или другую эффекторную молекулу и молекулу gRNA, которые вместе являются необходимыми и достаточными для управления и влияния на модификацию нуклеиновой кислоты в целевой последовательности с помощью РНК-направляемой нуклеазы или другой эффекторной молекулы. В одном варианте осуществления система CRISPR содержит gRNA и белок Cas, например, белок Cas9. Такие системы, содержащие Cas9 или модифицированную молекулу Cas9, упоминаются в данном документе как "системы Cas9" или "системы CRISPR/Cas9". В одном примере молекула gRNA и молекула Cas могут образовывать комплекс с образованием рибонуклеарного белкового (RNP) комплекса.
Термины "направляющая РНК", "молекула направляющей РНК", "молекула gRNA" или "gRNA" используются взаимозаменяемо и означают набор молекул нуклеиновой кислоты, которые способствую конкретному направлению РНК-направляемой нуклеазы или другой эффекторной молекулы (как правило, в комплексе с молекулой gRNA) к целевой последовательности. В некоторых вариантах осуществления, указанное направление осуществляется посредством гибридизации части gRNA с ДНК (например, посредством нацеливающего домена gRNA), и путем связывания части молекулы gRNA с РНК-направляемой нуклеазой или другой эффекторной (например, посредством по меньшей мере tracr gRNA). В ряде вариантов осуществления молекула gRNA состоит из одной непрерывной полинуклеотидной молекулы, называемой в данном документе как "одиночная направляющая РНК" или "sgRNA" и т. п. В других вариантах осуществления молекула gRNA состоит из множества, обычно двух полинуклеотидных молекул, которые сами способны к ассоциации, обычно посредством гибридизации называемых в данном документе как "двойная направляющая РНК" или "dgRNA" и т. п. Молекулы gRNA более подробно описаны ниже, но в целом включают нацеливающий домен и tracr. В ряде вариантов осуществления нацеливающий домен и tracr располагаются на одном полинуклеотиде. В других вариантах осуществления нацеливающий домен и tracr располагаются на отдельных полинуклеотидах.
Термин "нацеливающий домен", как он используется применительно к gRNA, представляет собой часть молекулы gRNA, которая распознает, например, является комплементарной целевой последовательности, например, целевой последовательности в пределах нуклеиновой кислоты клетки, например, в пределах гена.
Термин "crRNA", как он используется применительно к молекуле gRNA, представляет собой часть молекулы gRNA, которая содержит нацеливающий домен и участок, который взаимодействует с tracr с образованием участка типа "флагшток".
Термин "целевая последовательность" означает последовательность нуклеиновых кислот, комплементарную, например полностью комплементарную нацеливающему домену gRNA. В ряде вариантов осуществления целевая последовательность располагается в геномной ДНК. В одном варианте осуществления целевая последовательность является смежной с (либо на той же нити, либо на комплементарной нити ДНК) последовательностью мотива, смежного с протоспейсером (PAM), распознаваемой белком, обладающим нуклеазной или другой эффекторной активностью, например, с последовательностью PAM, распознаваемой Cas9. В ряде вариантов осуществления целевая последовательность представляет собой целевую последовательность в пределах гена или локуса, которая влияет на экспрессию гена глобина, например, которая влияет на экспрессию бета-глобина или фетального гемоглобина (HbF). В ряде вариантах осуществления целевая последовательность представляет собой целевую последовательность в пределах неделеционного участка HPFH, например, находится в пределах промоторного участка HBG1 и/или HBG2.
Термин "флагшток", используемый в данном документе применительно к молекуле gRNA, означает часть gRNA, где crRNA и tracr связываются или гибридизуются друг с другом.
Термин "tracr", используемый в данном документе применительно к молекуле gRNA, означает часть gRNA, которая связывается с нуклеазой или другой эффекторной молекулой. В ряде вариантов осуществления tracr содержит последовательность нуклеиновой кислоты, которая специфически связывается с Cas9. В ряде вариантов осуществления tracr содержит последовательность нуклеиновой кислоты, которая образует часть "флагштока".
Термины "Cas9" или "молекула Cas9" означают фермент из бактериальной системы CRISPR/Cas типа II, отвечающей за расщепление ДНК. Cas9 также включает белок дикого типа, а также его функциональные и нефункциональные мутанты. В ряде вариантов осуществления Cas9 представляет собой Cas9 из S. pyogenes.
Термин "комплементарный", используемый применительно к нуклеиновой кислоте, означает спаривание оснований, A с T или U и G с C. Термин комплементарный относится к молекулам нуклеиновой кислоты, которые являются полностью комплементарными, то есть образуют пары A с T или U и пары G с C по всей эталонной последовательности, а также к молекулам, которые на по меньшей мере 80%, 85%, 90%, 95%, 99% являются комплементарными.
"Нуклеиновая кислота, представляющая собой матрицу", используемая применительно к репарации, направляемой гомологией, или гомологичной рекомбинации, означает нуклеиновую кислоту, подлежащую вставке в сайте модификации посредством донорной последовательности системы CRISPR, предназначенной для репарации гена (вставки) в сайте разрезания.
"Вставка/делеция", как этот термин используется в данном документе, относится к нуклеиновой кислоте, содержащей одну или несколько вставок нуклеотидов, одну или несколько делеций нуклеотидов или комбинацию вставок и делеций нуклеотидов, по сравнению с эталонной нуклеиновой кислотой, которую в результате получают после воздействия композицией, содержащей молекулу gRNA, например, систему CRISPR. Вставки/делеции можно определить с помощью секвенирования нуклеиновой кислоты, например, с помощью NGS, после воздействия композицией, содержащей молекулу gRNA. Что касается сайта вставки/делеции, то вставка/делеция указана как располагающаяся "в" эталонном сайте или рядом с ним (например, сайте, комплементарном нацеливающему домену молекулы gRNA), если она содержит по меньшей мере одну вставку или делецию в пределах приблизительно 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 нуклеотида(нуклеотидов) эталонного сайта или перекрывается с частью или всем указанным эталонным сайтом (например, содержит по меньшей мере одно перекрывание вставки или делеции с или в пределах 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 нуклеотида сайта, комплементарного нацеливающему домену молекулы gRNA, например, молекулы gRNA, описанной в данном документе). В ряде вариантов осуществления вставка/делеция представляет собой большую делецию, например, охватывающую более приблизительно 1 т. о., более приблизительно 2 т. о., более приблизительно 3 т. о., более приблизительно 4 т. о., более приблизительно 5 т. о., более приблизительно 6 т. о., или более приблизительно 10 т. о. нуклеиновой кислоты. В ряде вариантов осуществления 5'-конец, 3'-конец или как 5'-, так и 3'-концы большой делеции расположены в целевой последовательности молекулы gRNA или рядом с ней, описанной в данном документе. В ряде вариантов осуществления большая делеция охватывает приблизительно 4,9 т. о. ДНК, расположенные между целевой последовательностью для молекулы gRNA, например, описанной в данном документе, расположенной в пределах промоторного участка HBG1, и целевой последовательностью для молекулы gRNA, например, описанной в данном документе, расположенной в пределах промоторного участка HBG2.
Термин "паттерн вставки/делеции", используемый в данном документе, относится к набору вставок/делеций, которые получают в результате воздействия композицией, содержащей молекулу gRNA. В одном варианте осуществления паттерн вставки/делеции состоит из трех верхних вставок/делеций по частоте возникновения. В одном варианте осуществления паттерн вставки/делеции состоит из пяти верхних вставок/делеций по частоте возникновения. В одном варианте осуществления паттерн вставки/делеции состоит из вставок/делеций, которые присутствует при частоте более приблизительно 1% относительно всех ридов секвенирования. В одном варианте осуществления паттерн вставки/делеции состоит из вставок/делеций, которые присутствует при частоте более приблизительно 5% относительно всех ридов секвенирования. В одном варианте осуществления паттерн вставки/делеции состоит из вставок/делеций, которые присутствует при частоте более приблизительно 10% относительно общего количества ридов секвенирования вставки/делеции (т. е. тех ридов, из которые не состоит немодифицированная эталонная последовательность нуклеиновой кислоты). В одном варианте осуществления паттерн вставки/делеции включает любые 3 из верхних наиболее часто наблюдаемых вставок/делеций. Паттерн вставки/делеции можно определить, например, с помощью способов, описанных в данном документе, например, с помощью секвенирования клеток из популяции клеток, которых подвергали действию молекулы gRNA.
Термин "нецелевая вставка/делеция", используемый в данном документе, относится к вставке в сайт, отличный от целевой последовательности нацеливающего домена молекулы gRNA, или рядом с ним. Такие сайты могут содержать, например, 1, 2, 3, 4, 5 или больше ошибочно спаренных нуклеотидов по сравнению с последовательностью нацеливающего домена gRNA. В иллюстративных вариантах осуществления такие сайты выявляют с применением целенаправленного секвенирования in silico прогнозируемых нецелевых сайтов или с помощью инсерционного способа, известного в данной области техники. По отношению к gRNA, описанным в данном документе, примеры нецелевых вставок/делеций представляют собой вставки/делеции, образовавшиеся в последовательностях за пределами промоторных участков HBG1 и/или HBG2. В иллюстративных вариантах осуществления нецелевая вставка/делеция образуется в последовательности гена, например, в пределах кодирующей последовательности гена.
Форма единственного числа относится к одному или нескольким (т. e. по меньшей мере одному) грамматическим объектам настоящей заявки. В качестве примера"элемент" означает один элемент или более одного элемента.
Термин "приблизительно" в отношении измеряемого значения, такого как количество, временная длительность и т. п., подразумевает охват варьирований, составляющий ±20%, или в некоторых случаях составляющий ±10%, или в некоторых случаях составляющий ±5%, или в некоторых случаях составляющий ±1%, или в некоторых случаях составляющий ±0,1% от указанного значения, поскольку такие варьирования являются подходящими для осуществления раскрытых способов.
Термин "антиген" или "Ag" означает молекулу, которая вызывает иммунный ответ. Этот иммунный ответ может предусматривать выработку антител либо активацию специфических иммунокомпетентных клеток или и первое, и второе. Специалисту в данной области техники будет понятно, что любая макромолекула, в том числе практически все белки или пептиды, могут служить в качестве антигена. Кроме того, антигены могут быть получены из рекомбинантной или геномной ДНК. Специалисту в данной области техники будет понятно, что любая ДНК, которая содержит нуклеотидную последовательность или частичную нуклеотидную последовательность, кодирующей белок, который вызывает иммунный ответ, тем самым кодирует "антиген", как этот термин используется в данном документе. Кроме того, специалисту в данной области техники будет понятно, что антиген не должен кодироваться исключительно полноразмерной нуклеотидной последовательностью гена. Очевидно, что настоящее изобретение охватывает без ограничения применение частичных нуклеотидных последовательностей более одного гена, и что эти нуклеотидные последовательности составлены в различных комбинациях для того, чтобы кодировать полипептиды, которые вызывают требуемый иммунный ответ. Более того, специалисту в данной области техники будет понятно, что антиген в целом не обязательно должен кодироваться "геном". Очевидно, что антиген может быть синтезирован или может быть получен из биологического образца или может представлять собой макромолекулу помимо полипептида. Такой биологический образец может включать без ограничения образец ткани, клетку или жидкость с другими биологическими компонентами.
Термин "аутологичный" относится к любому материалу, полученному от того же индивидуума, которому он позднее должен быть повторно введен.
Термин "аллогенный" относится к любому материалу, полученному от другого животного того же вида, как и индивидуум, которому данный материал вводят. Утверждают, что два или более индивидуума являются аллогенными по отношению друг к другу в том случае, если их гены в одном или нескольких локусах не являются идентичными. В некоторых аспектах аллогенные материалы от индивидуумов одного и того же вида могут быть достаточно генетически разнородными, чтобы происходило их антигенное взаимодействие.
Термин "ксеногенный" относится к трансплантату, полученному от животного другого вида.
Используемый в данном документе термин "полученный из" указывает на взаимосвязь между первой и второй молекулой. Он в общем относится к структурному сходству между первой молекулой и второй молекулой и не имеет дополнительного значения или не включает ограничения способа или источника первой молекулой, которая получена из второй молекулой.
Термин "кодирование/кодирующий" относится к внутренне свойству, присущему специфическим последовательностям нуклеотидов в полинуклеотиде, таком как ген, cDNA или mRNA, служить в качестве матриц для синтеза в ходе биологических процессов других полимеров и макромолекул, имеющих либо определенную последовательность нуклеотидов (т. е. rRNA, tRNA и mRNA), либо определенную последовательность аминокислот и биологические свойства, обусловленные ею. Таким образом, ген, cDNA или РНК кодирует белок, если в результате транскрипции и трансляции mRNA, соответствующей этому гену, продуцируется белок в клетке или другой биологической системе. Как кодирующая нить, нуклеотидная последовательность которой идентична последовательности mRNA и обычно представлена в перечнях последовательностей, так и некодирующая нить, используемая в качестве матрицы для транскрипции гена или cDNA, могут называться кодирующими белок или другой продукт этого гена или cDNA.
Если не указано иное, то "нуклеотидная последовательность, кодирующая аминокислотную последовательность" охватывает все нуклеотидные последовательности, которые являются вырожденными вариантами друг друга и которые кодируют одну и ту же аминокислотную последовательность. Фраза "нуклеотидная последовательность, которая кодирует белок или РНК", может также охватывать интроны в той мере, в которой нуклеотидная последовательность, кодирующая белок, может в каком-либо варианте содержать интрон(интроны).
Термины "эффективное количество" или "терапевтически эффективное количество" используются в данном документе взаимозаменяемо и означают количество соединения, состава, материала или композиции, описанных в данном документе, эффективное для достижения конкретного биологического результата.
Термин "эндогенный" означает любой материал из организма, клетки, ткани или системы или полученный в них.
Термин "экзогенный" означает любой материал, введенный в организм, клетку, ткань или систему или полученный за их пределами.
Термин "экспрессия" относится к транскрипции и/или трансляции конкретной нуклеотидной последовательности под управлением промотора.
Термин "вектор для переноса" относится к композиции, которая содержит выделенную нуклеиновую кислоту и которую можно применять для доставки выделенной нуклеиновой кислоты внутрь клетки. Из уровня техники известно множество векторов, в том числе без ограничения линейные полинуклеотиды, полинуклеотиды, ассоциированные с ионными или амфифильными соединениями, плазмиды и вирусы. Таким образом, термин "вектор для переноса" охватывает автономно реплицирующуюся плазмиду или вирус. Данный термин также следует истолковывать так, чтобы он дополнительно охватывал неплазмидные и невирусные соединения, которые облегчают перенос нуклеиновой кислоты в клетки, такие как, например, полилизиновое соединение, липосома и т. п. Примеры вирусных векторов для переноса включают без ограничения аденовирусные векторы, векторы на основе аденоассоциированного вируса, ретровирусные векторы, лентивирусные векторы и т. п.
Термин "экспрессионный вектор" означает вектор, который содержит рекомбинантный полинуклеотид, содержащий последовательности, контролирующие экспрессию, функционально связанные с нуклеотидной последовательностью, которая должна экспрессироваться. Экспрессионный вектор содержит достаточное количество элементов, действующих в цис-положении; а другие элементы для экспрессии могут обеспечиваться клеткой-хозяином или в системе для экспрессии in vitro. Экспрессионные векторы включают все векторы, известные в данной области техники, в том числе космиды, плазмиды (например, "голые" или содержащиеся в липосомах) и вирусы (например, лентивирусы, ретровирусы, аденовирусы и аденоассоциированные вирусы), в состав которых включен рекомбинантный полинуклеотид.
Термины "гомологичный" или "идентичность" относятся к идентичности последовательности субъединиц двух полимерных молекул, например, двух молекул нуклеиновой кислоты, таких как две молекулы ДНК, или две молекулы РНК, или двух молекул полипептидов. Если положение субъединицы в обеих из двух молекул занимает одна и та же мономерная субъединица, например, если положение в каждой из двух молекул ДНК занято аденином, то они являются гомологичными или идентичными по данному положению. Гомология между двумя последовательностями находится в прямой зависимости от количества совпадающих или гомологичных положений; например, если половина (например, пять положений в полимере длиной десять субъединиц) положений в двух последовательностях являются гомологичными, то эти две последовательности являются гомологичными на 50%; если 90% положений (например, 9 из 10) являются совпадающими или гомологичными, то две последовательности являются гомологичными на 90%.
Термин "выделенный" означает измененный относительно природного состояния или извлеченный из него. Например, нуклеиновая кислота или пептид, присутствующие в природных условиях в живом животном, не являются "выделенными", однако те же нуклеиновая кислота или пептид, частично или полностью отделенные от сопутствующих материалов в своем природном состоянии, являются "выделенными". Выделенные нуклеиновая кислота или белок могут существовать в практически очищенной форме или могут существовать в ненативной среде, такой как, например, клетка-хозяин.
Термин "функционально связанный" или "контроль транскрипции" относится к функциональной связи между регуляторной последовательностью и гетерологичной последовательностью нуклеиновой кислоты, приводящей к экспрессии последней. Например, первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты в тех случаях, когда первая последовательность нуклеиновой кислоты размещена в функциональной взаимосвязи со второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью, если промотор влияет на транскрипцию или экспрессию кодирующей последовательности. Функционально связанные последовательности ДНК могут быть смежными друг с другом и, например, в случае необходимости соединения двух участков, кодирующих белок, располагаются в одной и той же рамке считывания.
Термин "парентеральное введение" иммуногенной композиции включает, например, подкожную (s.c.), внутривенную (i.v.), внутримышечную (i.m.) или внутригрудинную инъекцию, методики внутриопухолевого или инфузионного введения.
Термин "нуклеиновая кислота" или "полинуклеотид" относится к дезоксирибонуклеиновым кислотам (ДНК) или рибонуклеиновым кислотам (РНК) и их полимерам в однонитевой или двухнитевой форме. Если специально не ограничено, то данный термин охватывает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые обладают свойствами связывания, сходными со свойствами эталонной нуклеиновой кислоты, и превращаются в процессе метаболизма посредством способа, сходного со способом для встречающихся в природе нуклеотидов. Если не указано иное, то конкретная последовательность нуклеиновой кислоты также в неявной форме охватывает ее варианты с консервативными модификациями (например, с заменами вырожденными кодонами), аллели, ортологи, SNP и комплементарные последовательности, а также конкретно указанную последовательность. В частности, замены вырожденными кодонами можно осуществлять за счет получения последовательностей, в которых в третьем положении одного или нескольких выбранных (или всех) кодонов произведена замена любым из канонических оснований и/или дезоксиинозиновыми остатками (Batzer et al., Nucleic Acid Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985); и Rossolini et al., Mol. Cell. Probes 8:91-98 (1994)).
Термины "пептид", "полипептид" и "белок" используются взаимозаменяемо и относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должны содержать по меньшей мере две аминокислоты, а ограничение в отношении максимального количества аминокислот, которые может содержать последовательность белка или пептида, не установлено. Полипептиды включают любой пептид или белок, содержащие две или более аминокислоты, соединенные друг с другом пептидными связями. Используемый в данном документе термин относится как к коротким цепям, которые также, как правило, упоминаются в уровне техники, например, в качестве пептидов, олигопептидов и олигомеров, так и к более длинным цепям, которые обычно упоминаются в уровне техники в качестве белков, которых существует множество типов. Например, "полипептиды" включают, среди прочего, биологически активные фрагменты, по сути гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитые белки. Полипептид включает природный пептид, рекомбинантный пептид или их комбинацию.
Термин "промотор" относится к последовательности ДНК, распознаваемой синтетическим аппаратом клетки или введенным синтетическим аппаратом, которая необходима для инициации специфической транскрипции полинуклеотидной последовательности.
Термин "промотор/регуляторная последовательность" относится к последовательности нуклеиновой кислоты, которая необходима для экспрессии продукта гена, функционально связанного с промотором/регуляторной последовательностью. В некоторых случаях эта последовательность может представлять собой коровую промоторную последовательность, а в других случаях эта последовательность может также содержать энхансерную последовательность и другие регуляторные элементы, которые необходимы для экспрессии продукта гена. Промотор/регуляторная последовательность может, например, представлять собой последовательность, которая обеспечивает экспрессию продукта гена тканеспецифическим образом.
Термин "конститутивный промотор" относится к нуклеотидной последовательности, которая, находясь в функциональной связи с полинуклеотидом, который кодирует или определяет продукт гена, вызывает продуцирование продукта гена в клетке в большинстве или во всех физиологических условиях клетки.
Термин "индуцируемый промотор" относится к нуклеотидной последовательности, которая, находясь в функциональной связи с полинуклеотидом, который кодирует или определяет продукт гена, вызывает продуцирование продукта гена в клетке по сути только в случае присутствия в клетке индуктора, который соответствует промотору.
Термин "тканеспецифический промотор" относится к нуклеотидной последовательности, которая, находясь в функциональной связи с полинуклеотидом, который кодирует или определяет ген, вызывает продуцирование продукта гена в клетке по сути только в том случае, если клетка является клеткой того типа ткани, который соответствует промотору.
Используемый в данном документе в связи с матричной РНК (mRNA), 5'-кэп (также называемый РНК-кэпом, 7-метилгуанозиновым РНК-кэпом или РНК-кэпом m7G) представляет собой модифицированный гуаниновый нуклеотид, который добавляется на "переднем" или 5'-конце эукариотической матричной РНК вскоре после начала транскрипции. 5'-кэп состоит из концевой группы, которая связана с первым транскрибированным нуклеотидом. Его присутствие является критически важным для распознавания рибосомой и защиты от РНКаз. Добавление кэпа сопряжено с транскрипцией и происходит совместно с транскрипцией, в результате чего каждое из этих событий влияет на другое. Вскоре после начала транскрипции 5'-конец синтезируемой mRNA связывается кэп-синтезирующим комплексом, ассоциированным с РНК-полимеразой. Этот ферментативный комплекс катализирует химические реакции, которые необходимы для кэпирования mRNA. Синтез проходит в виде многоступенчатой биохимической реакции. Кэпирующий компонент можно модифицировать для модулирования функциональных свойств mRNA, таких как ее стабильность или эффективность трансляции.
Используемое в данном документе выражение "РНК, транскрибированная in vitro" относится к РНК, предпочтительно mRNA, которая была синтезирована in vitro. Обычно РНК, транскрибированная in vitro, образуется из вектора транскрипции in vitro. Вектор транскрипции in vitro содержит матрицу, используемую для образования РНК, транскрибированной in vitro.
Используемый в данном документе термин "поли(А)" представляет собой ряд аденозиновых остатков, присоединенных путем полиаденилирования к mRNA. В предпочтительном варианте осуществления конструкции для транзиентной экспрессии длина поли(А) составляет от 50 до 5000 (SEQ ID NO: 190), предпочтительно более 64, более предпочтительно более 100, наиболее предпочтительно более 300 или 400. Последовательности поли(А) можно модифицировать химическим или ферментативным путем для модулирования функциональных свойств мРНК, таких как локализация, стабильность или эффективность трансляции.
Используемый в данном документе термин "полиаденилирование" относится к ковалентной связи полиаденилилового фрагмента или его модифицированного варианта с молекулой матричной РНК. В эукариотических организмах большинство молекул матричной РНК (mRNA) являются полиаденилированными на 3'-конце. 3'-концевой поли(А)-хвост представляет собой длинную последовательность адениновых нуклеотидов (часто из несколько сотен), добавленных к пре-mRNA под воздействием фермента полиаденилатполимеразы. У высших эукариот поли(А)-хвост добавляется к транскриптам, которые содержат определенную последовательность - сигнал полиаденилирования. Поли(А)-хвост и связанный с ним белок способствуют защите мРНК от разрушения экзонуклеазами. Полиаденилирование также важно для терминации транскрипции, экспорта mRNA из ядра и трансляции. Полиаденилирование происходит в ядре сразу после транскрипции ДНК в РНК, но дополнительно также может происходить позднее в цитоплазме. После завершения транскрипции цепь mRNA расщепляется под действием эндонуклеазного комплекса, ассоциированного с РНК-полимеразой. Сайт расщепления обычно характеризуется присутствием последовательности оснований AAUAAA рядом с сайтом расщепления. После того, как mRNA была расщеплена, на свободном 3'-конце в сайте расщепления добавляются аденозиновые остатки.
Используемое в данном документе, выражение "транзиентный" относится к экспрессии неинтегрированного трансгена в течение периода нескольких часов, дней или недель, где период времени экспрессии является меньшим периода времени для экспрессии гена в том случае, если он интегрирован в геном или содержится в стабильном плазмидном репликоне в клетке-хозяине.
Используемые в данном документе термины "лечить", "лечение" и "проведение лечения" относятся к снижению или ослаблению прогрессирования, тяжести и/или продолжительности нарушения, например, гемоглобинопатии, или к ослаблению тяжести одного или нескольких симптомов (предпочтительно одного или нескольких различимых симптомов) нарушения, например, гемоглобинопатии, в результате введения одного или нескольких средств для терапии (например, одного или нескольких терапевтических средств, таких как молекула gRNA, система CRISPR или модифицированная клетка по настоящему изобретению). В конкретных вариантах осуществления термины "лечить", "лечение" и "осуществление лечения" относятся к ослаблению по меньшей мере одного измеряемого физического параметра нарушения, представляющего собой гемоглобинопатию, не воспринимаемого пациентом. В других вариантах осуществления термины "лечить", "лечение" и "проведение лечения" относятся к подавлению прогрессирования нарушения либо физическим путем, например, путем стабилизации явного симптома, либо физиологическим путем, например, посредством стабилизации физического параметра, либо ими обоими. В других вариантах осуществления термины "лечить", "лечение" и "проведение лечения" относятся к снижению или стабилизации симптома гемоглобинопатии, например, серповидноклеточного заболевания или бета-талассемии.
Термин "путь передачи сигнала" относится к биохимической взаимосвязи между различными молекулами-переносчиками сигналов, которые играют роль в передаче сигнала от одной части клетки к другой части клетки. Фраза "рецептор клеточной поверхности" охватывает молекулы и комплексы молекул, способные принимать сигнал и передавать сигнал через мембрану клетки.
Термин "субъект" предполагается как включающий живые организмы, у которых можно вызвать иммунный ответ (например, млекопитающие, человек).
Термин "по сути очищенная" клетка относится к клетке, которая по сути не включает другие типы клеток. "По сути очищенная клетка" также относится к клетке, которая была отделена от других типов клеток, с которыми она обычно ассоциирована в своем существующем в природе состоянии. В некоторых случаях популяция по сути очищенных клеток относится к однородной популяции клеток. В других случаях данный термин просто относится к клетке, которая была отделена от клеток, с которыми она в природных условиях ассоциирована в своем природном состоянии. В некоторых аспектах клетки культивируют in vitro. В других аспектах клетки не культивируют in vitro.
Используемый в данном документе термин "терапевтический" означает лечение. Терапевтический эффект получают путем ослабления, подавления, ремиссии или устранения болезненного состояния.
Используемый в данном документе термин "профилактика" означает предупреждение или профилактическое лечение заболевания или болезненного состояния.
Термины "трансфицированный", или "трансформированный", или "трансдуцированный" относятся к процессу, в ходе которого экзогенную нуклеиновую кислоту и/или белок переносят или вводят в клетку-хозяина. "Трансфицированная", или "трансформированная", или "трансдуцированная" клетка представляет собой клетку, которая была трансфицирована, трансформирована или трансдуцирована экзогенной нуклеиновой кислотой и/или белком. Клетка включает первичного субъекта-клетку и его потомство.
Термин "специфически связывается" относится к молекуле, распознающей и связывающейся с партнером по связыванию (например, белок или нуклеиновую кислоту), присутствующем в образце, но при этом данная молекула практически не распознает или не связывает другие молекулы в образце.
Термин "биоэквивалент" относится к количеству средства, отличного от эталонного соединения, необходимого для получения эффекта, эквивалентного эффекту, вызываемому эталонной дозой или эталонным количеством эталонного соединения.
Как используется в данном документе "резистентный" относится к заболеванию, например гемоглобинопатии, которое не реагирует на лечение. В ряде вариантов осуществления резистентная гемоглобинопатия может быть устойчива к лечению до или в начале лечения. В других вариантах осуществления резистентная гемоглобинопатия может стать устойчивой в ходе лечения. Резистентную гемоглобинопатию также называют устойчивой гемоглобинопатией.
Используемый в данном документе термин "рецидивирующий" относится к возвращению заболевания (например, гемоглобинопатии) или признаков и симптомов заболевания, такого как гемоглобинопатия, после периода улучшения, например, после предшествующего лечения с помощью терапии, например, терапии гемоглобинопатии.
Диапазоны: во всем настоящем раскрытии различные аспекты настоящего изобретения могут быть представлены в формате диапазонов. Следует понимать, что описание в формате диапазонов служит лишь для удобства и краткости и не должно рассматриваться как строгое ограничение объема настоящего изобретения. Соответственно, описание диапазона следует рассматривать как конкретно раскрывающее все возможные поддиапазоны, а также отдельные числовые значения в пределах этого диапазона. Например, описание такого диапазона, как от 1 до 6, следует рассматривать как конкретно раскрывающее такие поддиапазоны, как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т. д., а также отдельные числа в этом диапазоне, например, 1, 2, 2,7, 3, 4, 5, 5,3 и 6. В качестве другого примера такой диапазон, как 95-99% идентичность, предусматривает любое с идентичностью 95%, 96%, 97%, 98% или 99% и включает такие поддиапазоны, как 96-99%, 96-98%, 96-97%, 97-99%, 97-98% и 98-99% идентичность. Это применимо независимо от ширины диапазона.
Термин "BCL11a" означает B-клеточной лимфомы/лейкемии 11A, ДНК-связывающий белок, специфичный в отношении последовательности проксимального участка корового промотора РНК-полимеразы II, и ген, кодирующий указанный белок, вместе со всеми интронами и экзонами. Данный ген кодирует белок "цинковые пальцы" типа C2H2. Было обнаружено, что BCL11A играет роль в подавлении продуцирования фетального гемоглобина. BCL11a также известный как B-Cell CLL/Lymphoma 11A (белок "цинковые пальцы"), CTIP1, EVI9, белок-гомолог сайта интеграции экотропного вируса 9, COUP-TF-взаимодействующий белок 1, белок "цинковые пальцы" 856, KIAA1809, BCL-11A, ZNF856, EVI-9 и B-Cell CLL/Lymphoma 11A. Термин охватывает все изоформы и сплайс-варианты BLC11a. Ген человека, кодирующий BCL11a, картирован в местоположении 2p16.1 на хромосоме (посредством Ensembl). Аминокислотные последовательности и последовательности нуклеиновых кислот человека и мыши можно найти в общедоступной базе данных, такой как GenBank, UniProt и Swiss-Prot., и геномную последовательность BCL11a человека можно найти в GenBank под номером NC_000002.12. Ген BCL11a относится к данному геномному местоположению, включающему все интроны и экзоны. Существует множество известных изотипов BCL11a.
Последовательность mRNA, кодирующая изоформу 1 BCL11a человека, можно найти под номером NM_022893.
Пептидная последовательность изоформы 1 BCL11a человека представляет собой


SEQ ID NO: 245 (идентификационный номер Q9H165-1; и NM_022893.3; и номер доступа ADL14508.1).
Последовательности других изоформ белка BCL11a представлены следующим образом.
Изоформа 2: Q9H165-2.
Изоформа 3: Q9H165-3.
Изоформа 4: Q9H165-4.
Изоформа 5: Q9H165-5.
Изоформа 6: Q9H165-6.
Используемый в данном документе белок BCL11a человека также охватывает белки, которые характеризуются по всей свой длине по меньшей мере приблизительно 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности с изоформой 1-6 BCL11a, при этом такие белки по-прежнему обладают по меньшей мере одной из функций BCL11a.
Используемый в данном документе термин "локус глобина", относится к участку хромосомы 11 человека, содержащей гены эмбрионального (ε), фетального (G(γ) и A(γ)), зрелого глобина (γ и β), регуляторные участки локуса и сайты гиперчувствительности к ДНКазе I.
Термин "комплементарный", используемый применительно к нуклеиновой кислоте, означает спаривание оснований, A с T или U и G с C. Термин комплементарный относится к молекулам нуклеиновой кислоты, которые являются полностью комплементарными, то есть образуют пары A с T или U и пары G с C по всей эталонной последовательности, а также к молекулам, которые на по меньшей мере 80%, 85%, 90%, 95%, 99% являются комплементарными.
Термин "неделеционное HPFH" относится к мутации, которая не предусматривает вставку или делецию одного или нескольких нуклеотидов, что приводит в результате к наследственному персистированию фетального гемоглобина, и характеризуется повышенным уровнем фетального гемоглобина в зрелых красных кровяных клетках. В иллюстративных вариантах осуществления неделеционное HPFH представляет собой мутацию, описанную в Nathan and Oski's Hematology and Oncology of Infancy and Childhood, 8th Ed., 2015, Orkin SH, Fisher DE, Look T, Lux SE, Ginsburg D, Nathan DG, Eds., Elsevier Saunders, полное содержание которого включено в данный документ посредством ссылки, например неделеционные мутации HPFH, описанные в таблице 21-5. Термин "неделеционный участок HPFH" относится к геномному сайту, который содержит неделеционное HPFH или расположен рядом с ним. В иллюстративных вариантах осуществления неделеционный участок HPFH представляет собой последовательность нуклеиновой кислоты промоторного участка HBG1 (от Chr11:5249833 до Chr11:5250237, hg38; - нить), последовательность нуклеиновой кислоты промоторного участка HBG2 (от Chr11:5254738 до Chr11:5255164, hg38; - нить) или их комбинации. В иллюстративных вариантах осуществления неделеционный участок HPFH включает один или несколько неделеционных HPFH, описанных в Nathan and Oski's Hematology and Oncology of Infancy and Childhood, 8th Ed., 2015, Orkin SH, Fisher DE, Look T, Lux SE, Ginsburg D, Nathan DG, Eds., Elsevier Saunders (например, описанные в таблице 21-5 в данном документе). В иллюстративных вариантах осуществления неделеционный участок HPFH представляет собой последовательность нуклеиновой кислоты в chr11:5250094-5250237, - нить, hg38; или последовательность нуклеиновой кислоты в chr11:5255022-5255164, - нить, hg38; или последовательность нуклеиновой кислоты в chr11: 5249833-5249927, - нить, hg38; или последовательность нуклеиновой кислоты в chr11: 5254738-5254851, - нить, hg38; или последовательность нуклеиновой кислоты в chr11:5250139-5250237, - нить, hg38; или их комбинации.
Используемый в данном документе термин "энхансер BCL11a" относится к последовательности нуклеиновой кислоты, которая влияет на, например, повышает, экспрессию или функцию BCL11a. См., например, Bauer et al., Science, vol. 342, 2013, pp. 253-257. Энхансер BCL11a может функционировать, например, только в некоторых типах клеток, например, в клетках эритроидного ростка. Одним примером энхансера BCL11a является последовательность нуклеиновой кислоты между экзоном 2 и экзоном 3 гена BCL11a (например, нуклеиновая кислота в или соответствующая положениям +55: Chr2:60497676-60498941; +58: Chr2:60494251-60495546; +62: Chr2:60490409-60491734, как записано в hg38). В одном варианте осуществления энхансер BCL11a представляет собой участок +62 в последовательности нуклеиновой кислоты между экзоном 2 и экзоном 3 гена BCL11a. В одном варианте осуществления энхансер BCL11a представляет собой участок +58 в последовательности нуклеиновой кислоты между экзоном 2 и экзоном 3 гена BCL11a. В одном варианте осуществления энхансер BCL11a представляет собой участок +55 в последовательности нуклеиновой кислоты между экзоном 2 и экзоном 3 гена BCL11a.
Термины "гематопоэтическая стволовая клетка и клетка-предшественник" или "HSPC" используют взаимозаменяемо и относятся к популяции клеток, содержащей как гематопоэтические стволовые клетки ("HSC"), так и гематопоэтические клетки-предшественники ("HPC"). Такие клетки характеризуются, например, как CD34+. В иллюстративных вариантах осуществления HSPC выделены из костного мозга. В других иллюстративных вариантах осуществления HSPC выделены из периферической крови. В других иллюстративных вариантах осуществления HSPC выделены из пуповинной крови. В одном варианте осуществления HSPC характеризуются как CD34+/CD38-/CD90+/CD45RA-. В ряде вариантов осуществления HSPC характеризуются как клетки CD34+/CD90+/CD49f+. В ряде вариантов осуществления HSPC характеризуются как клетки CD34+. В ряде вариантов осуществления HSPC характеризуются как клетки CD34+/CD90+. В ряде вариантов осуществления HSPC характеризуются как клетки CD34+/CD90+/CD45RA-.
"Вещество, стимулирующее рост стволовых клеток", используемое в данном документе, относится к соединению, которое стимулирует пролиферацию, например, увеличение количества клеток, например, HSPC, HSC и/или HPC, с более высокой скоростью по сравнению с теми же типами клеток при отсутствии указанного средства. В одном иллюстративном аспекте вещество, стимулирующее рост стволовых клеток, представляет собой ингибитор сигнального пути арил-гидрокарбонового рецептора. Дополнительные примеры веществ, стимулирующих рост стволовых клеток, представлены ниже. В ряде вариантов осуществления пролиферация, например, увеличение количества, осуществляется ex vivo.
"Приживление" или "приживленный" относится к внедрению клетки или ткани, например, популяции HSPC, в организм реципиента, например, субъекта-млекопитающего или субъекта-человека. В одном примере приживление включает рост, размножение и/или дифференцировку приживленных клеток у реципиента. В одном примере приживление HSPC включает дифференцировку и рост указанных HSPC до эритроидных клеток в организме реципиента.
Используемый в данном документе термин "гематопоэтические клетки-предшественники" (HPC) относится к примитивным гематопоэтическим клеткам, которые обладают ограниченной способностью к самообновлению и потенциалом к дифференцировке в несколько клеточных линий (например, миелоид, лимфоид), к дифференцировке в одну клеточную линию (например, миелоид или лимфоид) или к дифференцировке, ограниченной типом клетки (например, эритроидная клетка-предшественник) в зависимости от размещения в пределах гематопоэтической иерархии (Doulatov et al., Cell Stem Cell 2012).
"Гематопоэтические стволовые клетки" (HSC), используемые в данном документе, относятся к незрелым клеткам крови, обладающим способностью к самообновлению и дифференцировке в более зрелые клетки крови, включающие гранулоциты (например, програнулоциты, нейтрофилы, эозинофилы, базофилы), эритроциты (например, ретикулоциты, эритроциты), тромбоциты (например, мегакариобласты, продуцирующие тромбоциты мегакариоциты, тромбоциты) и моноциты (например, моноциты, макрофаги). HSC взаимозаменяемо описываются как стволовые клетки во всем описании. Из уровня техники известно, что такие клетки могут включать клетки CD34+ или могут не включать их. Клетки CD34+ представляют собой незрелые клетки, которые экспрессируют маркер клеточной поверхности CD34. Считается, что клетки CD34+ включают субпопуляцию клеток со свойствами стволовых клеток, определенными выше. Из уровня техники хорошо известно, что HSC представляют собой полипотентные клетки, которые могут давать начало примитивным клеткам-предшественникам (например, полипотентным клеткам-предшественникам) и/или клеткам-предшественникам, связанными c конкретными ростками кроветворения (например, лимфоидные клетки-предшественники). Стволовые клетки, связанные с конкретными ростками кроветворения, могут относится к T-клеточной линии дифференцировки, B-клеточной линии дифференцировки, линии дифференцировки дендритной клетки, линии дифференцировки клетки Лангерганса и/или специфической в отношении лимфоидной ткани линии дифференцировки клетки макрофага. Кроме того, HSC также относятся к долгоживущим HSC (LT-HSC) и короткоживущим HSC (ST-HSC). ST-HSC являются более активными и более пролиферирующими, чем LT-HSC. Однако LT-HSC характеризуются неограниченным самообновлением (т. е. они выживают в течение всей взрослой жизни), при этом ST-HSC характеризуются ограниченным самообновлением (т. е. они выживают только в течение ограниченного периода времени). Любые такие HSC можно использовать в любых способах, описанных в данном документе. Необязательно ST-HSC являются пригодными, поскольку они являются высоко пролиферативными, за счет чего быстро повышается количество HSC и их потомства. Гематопоэтические стволовые клетки необязательно получают из продуктов крови. Продукт крови включает продукт, полученный из организма или органа организма, содержащих клетки гематопоэтического происхождения. Такие источники включают нефракционированный костный мозг, пуповинную кровь, периферическую кровь (например, мобилизованную периферическую кровь, например, мобилизованную с помощью средства для мобилизации, такого как G-CSF или Plerixafor® (AMD3100), или комбинации G-CSF и Plerixafor® (AMD3100)), печень, тимус, лимфу и селезенку. Все из вышеупомянутых неочищенных или нефракционированных продуктов крови могут быть обогащены клетками, обладающими характеристиками гематопоэтической стволовой клетки, с помощью способов, известных специалистам в данной области техники. В одном варианте осуществления HSC характеризуются как CD34+/CD38-/CD90+/CD45RA-. В ряде вариантов осуществления HSC характеризуются как клетки CD34+/CD90+/CD49f+. В ряде вариантов осуществления HSC характеризуются как клетки CD34+. В ряде вариантов осуществления HSC характеризуются как клетки CD34+/CD90+. В ряде вариантов осуществления HSC характеризуются как клетки CD34+/CD90+/CD45RA-.
"Размножение" или "осуществление размножения" в контексте клеток относится к увеличению количества характерного типа клеток или типов клеток от исходной популяции клеток, которые могут являться идентичными или не являться такими. Исходные клетки, используемые для размножения, могут не являться такими же, как клетки, полученные после размножения.
"Популяция клеток" относится к эукариотическим клеткам млекопитающего, предпочтительно человека, выделенным из биологических источников, например, продуктов крови или тканей, и полученным более чем из одной клетки.
"Обогащенный", применительно в контексте популяции клеток, относится к популяции клеток, выбранной на основе присутствия одного или нескольких маркеров, например, CD34+.
Термин "клетки CD34+" относится к клеткам, которые экспрессируют на своей поверхности маркер CD34. Клетки CD34+ можно выявить и посчитать с использованием, например, проточной цитометрии и флуоресцентно меченного антитела к CD34.
"Обогащенный клетками CD34+" означает, что популяция клеток была выбрана на основе присутствия маркера CD34. Соответственно, процентное содержание клеток CD34+ в популяции клеток после проведения способа отбора выше, чем процентное содержание клеток CD34+ в исходной популяции клеток перед стадией отбора на основе маркеров CD34. Например, клетки CD34+ могут представлять собой по меньшей мере 50%, 60%, 70%, 80% или по меньшей мере 90% клеток в популяции клеток, обогащенной клетками CD34+.
Термины "клетка F" и "F-клетка" относятся к клеткам, обычно эритроцитам (например, красным кровяным клеткам), которые содержат и/или продуцируют (например, экспрессируют) фетальный гемоглобин. Например, F-клетка представляет собой клетку, которая содержит или продуцирует выявляемые уровни фетального гемоглобина. Например, F-клетка представляет собой клетку, которая содержит или продуцирует по меньшей мере 5 пикограмм фетального гемоглобина. В другом примере F-клетка представляет собой клетку, которая содержит или продуцирует по меньшей мере 6 пикограмм фетального гемоглобина. В другом примере F-клетка представляет собой клетку, которая содержит или продуцирует по меньшей мере 7 пикограмм фетального гемоглобина. В другом примере F-клетка представляет собой клетку, которая содержит или продуцирует по меньшей мере 8 пикограмм фетального гемоглобина. В другом примере F-клетка представляет собой клетку, которая содержит или продуцирует по меньшей мере 9 пикограмм фетального гемоглобина. В другом примере F-клетка представляет собой клетку, которая содержит или продуцирует по меньшей мере 10 пикограмм фетального гемоглобина. Уровни фетального гемоглобина можно измерить с использованием анализа, описанного в данном документе, или с помощью способа, известного в данной области техники, например, с помощью проточной цитометрии с применением реагента для выявления фетального гемоглобина, высокоэффективной жидкостной хроматографии, масс-спектрометрии или ферментного иммуносорбентного анализа.
Если не указано иное, все геномные или хромосомные координаты соответствуют hg38.
ПОДРОБНОЕ ОПИСАНИЕ
Молекулы gRNA, композиции и способы, описанные в данном документе, относятся к редактированию генома в эукариотических клетках с применением системы CRISPR/Cas9. В частности, молекулы gRNA, композиции и способы, описанные в данном документе, относятся к регуляции уровней глобина и применимы, например, в регуляции экспрессии и продуцирования генов и белка глобина. Молекулы gRNA, композиции и способы могут быть применимыми в лечении гемоглобинопатий.
I. Молекулы gRNA
Молекула gRNA может иметь ряд доменов, как описано более подробно ниже, однако,молекула gRNA, как правило, содержит по меньшей мере домен crRNA (содержащий нацеливающий домен) и tracr. Молекулы gRNA по настоящему изобретению, применяемые в качестве компонента системы CRISPR, являются применимыми для модификации (например, модификации последовательности) ДНК в целевом сайте или рядом с ним. Такие модификации включают делеции и/или вставки, которые приводят в результате к, например, сниженной или устраненной экспрессии функционального продукта гена, содержащего целевой сайт. Такие варианты применения и дополнительные варианты применения описаны более подробно ниже.
В одном варианте осуществления мономолекулярная или sgRNA содержит предпочтительно в 5'-3'-направлении: crRNA (которая содержит нацеливающий домен, комплементарный целевой последовательности, и участок, который образует часть "флагштока" (т. е. участок "флагшток" crRNA)); петлю и tracr (которая содержит домен, комплементарный участку "флагшток" crRNA, и домен, который дополнительно связывается с нуклеазой или другой эффекторной молекулой, например, молекулой Cas, например, молекулой Cas9), и может принимать следующую форму (в 5'-3'-направлении):
[нацеливающий домен] - [участок "флагшток" crRNA] -[необязательное первое удлинение "флагштока"] - [петля] -[необязательно первое удлинение tracr] - [участок "флагшток" tracr] - [домен связывания нуклеазы tracr].
В ряде вариантов осуществления домен связывания нуклеазы tracr связывается с белком Cas, например, белком Cas9.
В одном варианте осуществления бимолекулярная или dgRNA содержит два полинуклеотида; первый предпочтительно в 5'-3'-направлении: crRNA (которая содержит нацеливающий домен, комплементарный целевой последовательности, и участок, который образует часть "флагштока"; и второй предпочтительно в 5'-3'-направлении: tracr (которая содержит домен, комплементарный участку "флагшток" crRNA, и домен, который дополнительно связывается с нуклеазой или другой эффекторной молекулой, например, молекулой Cas, например, молекулой Cas9), и может принимать следующую форму (в 5'-3'-направлении):
полинуклеотид 1 (crRNA): [нацеливающий домен] -[участок "флагшток"] - [необязательное первое удлинение "флагштока"] - [необязательное второе удлинение "флагштока"].
Полинуклеотид 2 (tracr): [необязательное первое удлинение tracr] - [участок "флагшток" tracr] - [домен связывания нуклеазы tracr].
В ряде вариантов осуществления домен связывания нуклеазы tracr связывается с белком Cas, например, белком Cas9.
В некоторых аспектах нацеливающий домен содержит или состоит из последовательности нацеливающего домена, описанной в данном документе, например, нацеливающего домена, описанного в таблице 1, или нацеливающего домена, содержащего или состоящего из 17, 18, 19 или 20 (предпочтительно 20) последовательных нуклеотидов последовательности нацеливающего домена, описанной в таблице 1.
В некоторых аспектах "флагшток", например, участок "флагшток" crRNA, содержит в 5'-3'-направлении GUUUUAGAGCUA (SEQ ID NO: 182).
В некоторых аспектах "флагшток", например, участок "флагшток" crRNA, содержит в 5'-3'-направлении GUUUAAGAGCUA (SEQ ID NO: 183).
В некоторых аспектах петля содержит в 5'-3'-направлении GAAA (SEQ ID NO: 186).
В некоторых аспектах tracr содержит в 5'-3'-направлении UAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC (SEQ ID NO: 187) и предпочтительно используется в молекуле gRNA, содержащей SEQ ID NO: 182.
В некоторых аспектах tracr содержит в 5'-3'-направлении UAGCAAGUUUAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC (SEQ ID NO: 188) и предпочтительно используется в молекуле gRNA, содержащей SEQ ID NO: 183.
В некоторых аспектах gRNA может также содержать на 3'-конце дополнительные U нуклеиновые кислоты. Например, gRNA может содержать дополнительные 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 U нуклеиновых кислот (SEQ ID NO: 249) на 3'-конце. В одном варианте осуществления gRNA содержит дополнительные 4 U нуклеиновые кислоты на 3'-конце. В случае dgRNA один или несколько полинуклеотидов dgRNA (например, полинуклеотид, содержащий нацеливающий домен, и полинуклеотид содержащий tracr) могут содержать на 3'-конце дополнительные U нуклеиновые кислоты. Например, в случае dgRNA один или несколько полинуклеотидов dgRNA (например, полинуклеотид, содержащий нацеливающий домен, и полинуклеотид содержащий tracr) могут содержать дополнительные 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 U нуклеиновых кислот (SEQ ID NO: 249) на 3'-конце. В одном варианте осуществления в случае dgRNA один или несколько полинуклеотидов dgRNA (например, полинуклеотид, содержащий нацеливающий домен, и полинуклеотид содержащий tracr) содержат дополнительные 4 U нуклеиновые кислоты на 3'-конце. В одном варианте осуществления dgRNA только полинуклеотид, содержащий tracr, содержит дополнительную U нуклеиновую(нуклеиновые) кислоту(кислоты), например, 4 U нуклеиновые кислоты. В одном варианте осуществления dgRNA только полинуклеотид, содержащий нацеливающий домен, содержит дополнительную U нуклеиновую(нуклеиновые) кислоту(кислоты). В одном варианте осуществления dgRNA как полинуклеотид, содержащий нацеливающий домен, так и полинуклеотид, содержащий tracr, содержат дополнительные U нуклеиновые кислоты, например, 4 U нуклеиновые кислоты.
В некоторых аспектах gRNA может также содержать на 3'-конце дополнительные нуклеиновые кислоты А. Например, gRNA может содержать дополнительные 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 нуклеиновых кислот А (SEQ ID NO: 250) на 3'-конце. В одном варианте осуществления gRNA содержит дополнительные 4 нуклеиновые кислоты А на 3'-конце. В случае dgRNA один или несколько полинуклеотидов dgRNA (например, полинуклеотид, содержащий нацеливающий домен, и полинуклеотид содержащий tracr) могут содержать на 3'-конце дополнительные нуклеиновые кислоты А. Например, в случае dgRNA один или несколько полинуклеотидов dgRNA (например, полинуклеотид, содержащий нацеливающий домен, и полинуклеотид содержащий tracr) могут содержать дополнительные 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 нуклеиновых кислот А (SEQ ID NO: 250) на 3'-конце. В одном варианте осуществления в случае dgRNA один или несколько полинуклеотидов dgRNA (например, полинуклеотид, содержащий нацеливающий домен, и полинуклеотид содержащий tracr) содержат дополнительные 4 нуклеиновые кислоты А на 3'-конце. В одном варианте осуществления dgRNA только полинуклеотид, содержащий tracr, содержит дополнительную нуклеиновую(нуклеиновые) кислоту(кислоты) А, например, 4 нуклеиновые кислоты А. В одном варианте осуществления dgRNA только полинуклеотид, содержащий нацеливающий домен, содержит дополнительную нуклеиновую(нуклеиновые) кислоту(кислоты) А. В одном варианте осуществления dgRNA как полинуклеотид, содержащий нацеливающий домен, так и полинуклеотид, содержащий tracr, содержат дополнительные нуклеиновые кислоты U, например, 4 нуклеиновые кислоты А.
В ряде вариантов осуществления один или несколько полинуклеотидов молекулы gRNA могут содержать кэп на 5'-конце.
В одном варианте осуществления мономолекулярная или sgRNA содержит, предпочтительно в 5'-3'-направлении crRNA (которая содержит нацеливающий домен, комплементарный целевой последовательности; область "флагшток" crRNA; первое удлинение "флагштока"; петлю; первое удлинение tracr (которое содержит домен, комплементарный по меньшей мере части первого удлинения "флагштока"); и tracr (которая содержит домен, комплементарный области "флагшток" crRNA, и домен, который дополнительно связывается с молекулой Cas9). В некоторых аспектах нацеливающий домен содержит последовательность нацеливающего домена, описанную в данном документе, например, нацеливающего домена, описанного в таблице 1, или нацеливающего домена, содержащего или состоящего из 17, 18, 19 или 20 (предпочтительно 20) последовательных нуклеотидов последовательности нацеливающего домена, описанной в таблице 1, например 17, 18, 19, или 20 (предпочтительно 20) расположенных на 3'-конце последовательных нуклеотидов последовательности нацеливающего домена, описанной в таблице 1.
В ряде аспектов, предусматривающих первое удлинение "флагштока" и/или первое удлинение tracr, последовательности "флагштока", петли и tracr могут являться такими, как описано выше. В целом можно использовать любое первое удлинение "флагштока" и первое удлинение tracr, при условии, что они являются комплементарными. В ряде вариантов осуществления первое удлинение "флагштока" и первое удлинение tracr состоят из 3, 4, 5, 6, 7, 8, 9, 10 или больше комплементарных нуклеотидов.
В некоторых аспектах первое удлинение "флагштока" содержит в 5'-3'-направлении UGCUG (SEQ ID NO: 184). В некоторых аспектах первое удлинение "флагштока" состоит из SEQ ID NO: 184.
В некоторых аспектах первое удлинение tracr содержит в 5'-3'-направлении CAGCA (SEQ ID NO: 189). В некоторых аспектах первое удлинение tracr состоит из SEQ ID NO: 189.
В одном варианте осуществления dgRNA содержит две молекулы нуклеиновой кислоты. В некоторых аспектах dgRNA содержит первую нуклеиновую кислоту, которая содержит предпочтительно в 5'-3'-направлении нацеливающий домен, комплементарный целевой последовательности; участок "флагшток" crRNA; необязательно первое удлинение "флагштока"; и необязательно второе удлинение "флагштока"; и вторую нуклеиновую кислоту (которая может упоминаться в данном документе как tracr), и содержит по меньшей мере домен, который связывается с молекулой Cas, например, молекулой Cas9), содержащую предпочтительно в 5'-3'-направлении: необязательно первое удлинение tracr и tracr (которая содержит домен, комплементарный участку "флагшток" crRNA, и домен, который дополнительно связывается с Cas, например, молекулой Cas9). Вторая нуклеиновая кислота может дополнительно содержать на 3'-конце (например, в 3'-направлении относительно tracr) дополнительные U нуклеиновые кислоты. Например, tracr может содержать дополнительные 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 U нуклеиновых кислот (SEQ ID NO: 249) на 3'-конце (например, в 3'-направлении относительно tracr). Вторая нуклеиновая кислота может дополнительно или в качестве альтернативы содержать на 3'-конце (например, в 3'-направлении относительно tracr) дополнительные нуклеиновые кислоты A. Например, tracr может содержать дополнительные 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 нуклеиновых кислот А (SEQ ID NO: 250) на 3'-конце (например, в 3'-направлении относительно tracr). В некоторых аспектах нацеливающий домен содержит последовательность нацеливающего домена, описанную в данном документе, например, нацеливающего домена, описанного в таблице 1, или нацеливающего домена, содержащего или состоящего из 17, 18, 19 или 20 (предпочтительно 20) последовательных нуклеотидов последовательности нацеливающего домена, описанной в таблице 1.
В ряде аспектов, предусматривающих dgRNA, последовательности участка "флагшток" crRNA, необязательного первого удлинения "флагштока", необязательного первого удлинения tracr и tracr могут являться такими, как описано выше.
В некоторых аспектах необязательное второе удлинение "флагшток" содержит в 5'-3'-направлении UUUUG (SEQ ID NO: 185).
В ряде вариантов осуществления 1, 2, 3, 4 или 5 нуклеотидов, расположенных на 3'-конце, 1, 2, 3, 4 или 5 нуклеотидов, расположенных на 5'-конце, или 1, 2, 3, 4 или 5 нуклеотидов, расположенных как на 3'-, так и на 5'-конце молекулы gRNA (и в случае молекулы dgRNA, полинуклеотид, содержащий нацеливающий домен, и/или полинуклеотид, содержащий tracr) являются модифицированными нуклеиновыми кислотами, описанными более подробно в разделе XIII ниже.
Вкратце домены рассмотрены ниже.
1) Нацеливающий домен
Пособие по отбору нацеливающих доменов можно найти, например, в Fu Y et al. NAT BIOTECHNOL 2014 (doi: 10.1038/nbt.2808) и Sternberg SH et al. NATURE 2014 (doi: 10.1038/naturel3011).
Нацеливающий домен содержит нуклеотидную последовательность, которая является комплементарной, например, комплементарной на по меньшей мере 80, 85, 90, 95 или 99%, например, полностью комплементарной целевой последовательности целевой нуклеиновой кислоты. Нацеливающий домен является частью молекулы РНК, а значит будет содержать урациловое (U) основание, тогда как любая ДНК, кодирующая молекулу gRNA, будет содержать тиминовое (T) основание. Не ограничиваясь какой-либо теорией полагают, что комплементарность нацеливающего домена с целевой последовательностью способствует специфичности взаимодействия комплекса молекула gRNA/молекула Cas9 с целевой нуклеиновой кислотой. Известно, что в паре нацеливающего домена и целевой последовательности урациловые основания в нацеливающем домене будут образовывать пару с адениновыми основаниями в целевой последовательности.
В одном варианте осуществления нацеливающий домен составляет 5-50, например, 10-40, например, 10-30, например, 15-30, например, 15-25 нуклеотидов в длину. В одном варианте осуществления нацеливающий домен составляет 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 нуклеотидов в длину. В одном варианте осуществления нацеливающий домен составляет 16 нуклеотидов в длину. В одном варианте осуществления нацеливающий домен составляет 17 нуклеотидов в длину. В одном варианте осуществления нацеливающий домен составляет 18 нуклеотидов в длину. В одном варианте осуществления нацеливающий домен составляет 19 нуклеотидов в длину. В одном варианте осуществления нацеливающий домен составляет 20 нуклеотидов в длину. В ряде вариантов осуществления вышеуказанные 16, 17, 18, 19 или 20 нуклеотидов содержат 16, 17, 18, 19 или 20 нуклеотидов, расположенных на 5'-конце, из нацеливающего домена, описанного в таблице 1. В ряде вариантов осуществления вышеуказанные 16, 17, 18, 19 или 20 нуклеотидов содержат 16, 17, 18, 19 или 20 нуклеотидов, расположенных на 3'-конце, из нацеливающего домена, описанного в таблице 1.
Не ограничиваясь теорией полагают, что 8, 9, 10, 11 или 12 нуклеиновых кислот нацеливающего домена, расположенных на 3'-конце нацеливающего домена, являются важными для нацеливания на целевую последовательность, и могут таким образом называться "коровым" участком нацеливающего домена. В одном варианте осуществления коровый домен является полностью комплементарным целевой последовательности.
Нить целевой нуклеиновой кислоты, в отношении которой нацеливающий домен является комплементарным, называется в данном документе целевой последовательностью. В некоторых аспектах целевая последовательность расположена на хромосоме, например, представляет собой мишень в пределах гена. В некоторых аспектах целевая последовательность расположена в пределах экзона гена. В некоторых аспектах целевая последовательность расположена в пределах интрона гена. В некоторых аспектах целевая последовательность содержит или расположена рядом с (например, в пределах 10, 20, 30, 40, 50, 100, 200, 300, 400, 500 или 1000 нуклеиновых кислот) сайтом связывания регуляторного элемента, например, сайтом связывания промотора или фактор транскрипции представляющего интерес гена. Некоторые или все нуклеотиды домена могут содержать модификацию, например, модификацию, которую можно найти в разделе XIII в данном документе.
2) Участок "флагшток" crRNA
"Флагшток" содержит части как из crRNA, так и tracr. Участок "флагшток" crRNA является комплементарной части tracr, и в одном варианте осуществления имеет достаточную комплементарность с частью tracr с образованием двойного участка при по меньшей мере некоторых физиологических условиях, например, при нормальных физиологических условиях. В одном варианте осуществления участок "флагшток" crRNA составляет 5-30 нуклеотидов в длину. В одном варианте осуществления участок "флагшток" crRNA составляет 5-25 нуклеотидов в длину. Участок "флагшток" crRNA может иметь гомологию с существующей в природе частью последовательности повтора из бактериальной матрицы CRISPR, или быть полученным из нее. В одном варианте осуществления участок характеризуется по меньшей мере 50% гомологией с участком "флагшток" crRNA, раскрытым в данном документе, например, участком "флагшток" crRNA из S. pyogenes или S. thermophilus.
В одном варианте осуществления "флагшток", например, участок "флагшток" crRNA, содержит SEQ ID NO: 182. В одном варианте осуществления "флагшток", например, участок "флагшток" crRNA, содержит последовательность, характеризующуюся по меньшей мере 50%, 60%, 70%, 80%, 85%, 90%, 95% или 99% гомологией с последовательностью под SEQ ID NO: 182. В одном варианте осуществления "флагшток", например, участок "флагшток" crRNA, содержит по меньшей мере 5, 6, 7, 8, 9, 10 или 11 нуклеотидов из SEQ ID NO: 182. В одном варианте осуществления "флагшток", например, участок "флагшток" crRNA, содержит SEQ ID NO: 183. В одном варианте осуществления "флагшток" содержит последовательность, которая характеризуется по меньшей мере 50%, 60%, 70%, 80%, 85%, 90%, 95% или 99% гомологией с последовательностью под SEQ ID NO: 183. В одном варианте осуществления "флагшток", например, участок "флагшток" crRNA, содержит по меньшей мере 5, 6, 7, 8, 9, 10 или 11 нуклеотидов из SEQ ID NO: 183.
Некоторые или все нуклеотиды домена могут содержать модификацию, например, модификацию, описанную в разделе XIII в данном документе.
3) Первое удлинение "флагштока"
Если используют tracr, содержащую первое удлинение tracr, то crRNA может содержать первое удлинение "флагштока". В целом можно использовать любое первое удлинение "флагштока" и первое удлинение tracr, при условии, что они являются комплементарными. В ряде вариантов осуществления первое удлинение "флагштока" и первое удлинение tracr состоят из 3, 4, 5, 6, 7, 8, 9, 10 или больше комплементарных нуклеотидов.
Первое удлинение "флагштока" может содержать нуклеотиды, которые являются комплементарными, например, на 80%, 85%, 90%, 95% или 99%, например, полностью комплементарными нуклеотидам первого удлинения tracr. В некоторых аспектах нуклеотиды первого удлинения "флагштока", которые гибридизуются с комплементарными нуклеотидами первого удлинения tracr, являются смежными. В некоторых аспектах нуклеотиды первого удлинения "флагштока", которые гибридизуются с комплементарными нуклеотидами первого удлинения tracr, являются прерывистыми, например, содержат два или более участка гибридизации, разделенные нуклеотидами, которые не образуют пару оснований с нуклеотидами первого удлинения tracr. В некоторых аспектах первое удлинение "флагштока" содержит по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше нуклеотидов. В некоторых аспектах первое удлинение "флагштока" содержит в 5'-3'-направлении UGCUG (SEQ ID NO: 184). В некоторых аспектах первое удлинение "флагштока" состоит из SEQ ID NO: 184. В некоторых аспектах первое удлинение "флагштока" содержит нуклеиновую кислоту, которая на по меньшей мере 80%, 85%, 90%, 95% или 99% гомологична последовательности под SEQ ID NO: 184.
Некоторые или все нуклеотиды первого удлинения tracr могут содержать модификацию, например, модификацию, которую можно найти в разделе XIII в данном документе.
3) Петля
Петля служит для связи участка "флагшток" crRNA (или необязательно первого удлинения "флагштока" в случае его присутствия) с tracr (или необязательно первым удлинением tracr в случае его присутствия) sgRNA. Петля может связывать участок "флагшток" crRNA и tracr ковалентно или нековалентно. В одном варианте осуществления связь является ковалентной. В одном варианте осуществления петля ковалентно соединяет участок "флагшток" crRNA и tracr. В одном варианте осуществления петля ковалентно соединяет первое удлинение "флагштока" и первое удлинение tracr. В одном варианте осуществления петля представляет собой или содержит ковалентную связь, расположенную между участком "флагшток" crRNA и доменом tracr, который гибридизуется с участком "флагшток" crRNA. Как правило, петля содержит один или несколько, например, 2, 3, 4, 5, 6, 7, 8, 9, или 10 нуклеотидов.
В молекулах dgRNA две молекулы могут быть ассоциированы посредством гибридизации между по меньшей мере частью crRNA (например, участком "флагшток" crRNA) и по меньшей мере частью tracr (например, доменом tracr, который комплементарен участку "флагшток" crRNA).
Широкое разнообразие петель является приемлемым для использования в sgRNA. Петли могут состоять из ковалентной связи или являться настолько короткими, как и один или несколько нуклеотидов, например, 1, 2, 3, 4 или 5 нуклеотидов в длину. В одном варианте осуществления петля составляет 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20 или 25 или больше нуклеотидов в длину. В одном варианте осуществления петля составляет 2-50, 2-40, 2-30, 2-20, 2-10 или 2-5 нуклеотидов в длину. В одном варианте осуществления петля характеризуется гомологией с существующей в природе последовательностью или получена из нее. В одном варианте осуществления петля характеризуется по меньшей мере 50% гомологией с петлей, раскрытой в данном документе. В одном варианте осуществления петля содержит SEQ ID NO: 186.
Некоторые или все нуклеотиды домена могут содержать модификацию, например, модификацию, описанную в разделе XIII в данном документе.
4) Второе удлинение "флагштока"
В одном варианте осуществления dgRNA может содержать дополнительную последовательность, расположенную в 3'-направлении относительно участка "флагшток" crRNA или, если присутствует, первого удлинения "флагштока", упоминаемую в данном документе как второе удлинение "флагштока". В одном варианте осуществления второе удлинение "флагштока" составляет 2-10, 2-9, 2-8, 2-7, 2-6, 2-5 или 2-4 нуклеотида в длину. В одном варианте осуществления второе удлинение "флагштока" составляет 2, 3, 4, 5, 6, 7, 8, 9 или 10 или больше нуклеотидов в длину. В одном варианте осуществления второе удлинение "флагштока" содержит SEQ ID NO: 185.
5) Tracr
Tracr представляет собой последовательность нуклеиновой кислоты, требуемую для связывания нуклеазы, например, Cas9. Не ограничиваясь теорией полагают, что каждая разновидность Cas9 ассоциирована с определенной последовательностью tracr. Последовательности tracr используются как в системе sgRNA, так и в системе dgRNA. В одном варианте осуществления tracr содержит последовательность из tracr S. pyogenes или полученную из нее. В некоторых аспектах tracr имеет часть, которая гибридизуется с частью "флагшток" crRNA, например, характеризуется достаточной степенью комплементарностью с участком "флагшток" crRNA с образованием двойного участка в по меньшей мере некоторых физиологических условиях (иногда упоминаемого в данном документе как участок "флагшток" tracr или домен tracr, комплементарный участку "флагшток" crRNA). В ряде вариантов осуществления домен tracr, который гибридизуется с участком "флагшток" crRNA, содержит по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, или 20 нуклеотидов, которые гибридизуются с комплементарными нуклеотидами участка "флагшток" crRNA. В некоторых аспектах нуклеотиды tracr, которые гибридизуются с комплементарными нуклеотидами участка "флагшток" crRNA, являются смежными. В некоторых аспектах нуклеотиды tracr, которые гибридизуются с комплементарными нуклеотидами "флагшток" crRNA, являются прерывистыми, например, содержат два или более участка гибридизации, разделенные нуклеотидами, которые не образуют пару оснований с нуклеотидами участка "флагшток" crRNA. В некоторых аспектах часть tracr, которая гибридизуется с участком "флагшток" crRNA содержит в 5'-3'-направлении UAGCAAGUUAAAA (SEQ ID NO: 191). В некоторых аспектах часть tracr, которая гибридизуется с участком "флагшток" crRNA содержит в 5'-3'-направлении UAGCAAGUUUAAA (SEQ ID NO: 192). В ряде вариантов осуществления последовательность, которая гибридизуется с участком "флагшток" crRNA, расположена на tracr в 5'-направлении относительно последовательности tracr, которая дополнительно связывает нуклеазу, например, молекулу Cas, например, молекулу Cas9.
Tracr дополнительно содержит домен, который дополнительно связывается с нуклеазой, например, молекулой Cas, например, молекулой Cas9. Не ограничиваясь теорией полагают, что Cas9 от различных видов связывается с различными последовательностями tracr. В некоторых аспектах tracr содержит последовательность, которая связывается с молекулой Cas9 S. pyogenes. В некоторых аспектах tracr содержит последовательность, которая связывается с молекулой Cas9, раскрытой в данном документе. В некоторых аспектах домен, который дополнительно связывает молекулу Cas9, содержит в 5'-3'-направлении UAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC (SEQ ID NO: 193). В некоторых аспектах домен, который дополнительно связывает молекулу Cas9, содержит в 5'-3'-направлении UAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 194).
В некоторых вариантах осуществления tracr содержит SEQ ID NO: 187. В некоторых вариантах осуществления tracr содержит SEQ ID NO: 188.
Некоторые или все нуклеотиды tracr могут содержать модификацию, например, модификацию, которую можно найти в разделе XIII в данном документе. В ряде вариантов осуществления gRNA (например, sgRNA или tracr и/или crRNA из dgRNA), например, любой из компонентов gRNA или gRNA, описанных выше, содержит инвертированный с удаленным азотистым основанием остаток на 5'-конце, 3'-конце или как на 5'-, так и на 3'-конце gRNA. В ряде вариантов осуществления gRNA (например, sgRNA или tracr и/или crRNA из dgRNA), например, любой из компонентов gRNA или gRNA, описанных выше, содержит одну или несколько фосфотиоатных связей между остатками на 5'-конце полинуклеотида, например, фосфотиоатную связь между первыми двумя расположенными на 5'-конце остатками, между каждым из первых трех расположенных на 5'-конце остатков, между каждым из первых четырех расположенных на 5'-конце остатков или между каждым из первых пяти расположенных на 5'-конце остатков. В ряде вариантов осуществления компонент gRNA или gRNA может в качестве альтернативы или дополнительно содержать одну или несколько фосфотиоатных связей между остатками на 3'-конце полинуклеотида, например, фосфотиоатную связь между первыми двумя расположенными на 3'-конце остатками, между каждым из первых трех расположенных на 3'-конце остатков, между каждым из первых четырех расположенных на 3'-конце остатков или между каждым из первых пяти расположенных на 3'-конце остатков. В одном варианте осуществления gRNA (например, sgRNA или tracr и/или crRNA dgRNA), например, любой из компонентов gRNA или gRNA, описанных выше, содержит фосфотиоатную связь между каждым из первых четырех 5'-концевых остатков (например, содержит, например, состоит из, три фосфотиоатные связи на 5'-конце(концах)) и фосфотиоатную связь между каждым из первых четырех 3'-концевых остатков (например, содержит, например, состоит из, три фосфотиоатные связи на 3'-конце(концах)). В одном варианте осуществления любая из фосфотиоатных модификаций, описанных выше, объединена с инвертированным у удаленным азотистым основанием остатком на 5'-конце, 3'-конце или как на 5'-, так и на 3'-конце полинуклеотида. В таких вариантах осуществления инвертированный с удаленным азотистым основанием нуклеотид может быть связан с расположенным на 5'- и/или 3'-конце нуклеотидом посредством фосфатной связи или фосфотиоатной связи. В ряде вариантов осуществления gRNA (например, sgRNA или tracr и/или crRNA dgRNA), например, любой из компонентов gRNA или gRNA, описанных выше, содержит один или несколько нуклеотидов, которые включают 2'-O-метиловую модификацию. В ряде вариантов осуществления каждый из первых 1, 2, 3 или больше 5'-концевых остатков содержит 2'-O-метиловую модификацию. В ряде вариантов осуществления каждый из первых 1, 2, 3 или больше 3'-концевых остатков содержит 2'-O-метиловую модификацию. В ряде вариантов осуществления 4-ый по отношению к концевому, 3-ий по отношению к концевому и 2-ой по отношению к концевому 3'-остатки содержат 2'-O-метиловую модификацию. В ряде вариантов осуществления каждый из первых 1, 2, 3 или больше из 5'-концевых остатков содержит 2'-O-метиловую модификацию, и при этом каждый из первых 1, 2, 3 или больше 3'-концевых остатков содержит 2'-O-метиловую модификацию. В одном варианте осуществления каждый из первых 3 5'-концевых остатков содержит 2'-O-метиловую модификацию, и при этом каждый из первых 3 3'-концевых остатков содержит 2'-O-метиловую модификацию. В ряде вариантов осуществления каждый из первых 3 5'-концевых остатков содержит 2'-O-метиловую модификацию, и 4-й по отношению к концевому, 3-й по отношению к концевому и 2-й по отношению к концевому 3'-остатки содержат 2'-O-метиловую модификацию. В ряде вариантов осуществления любую из 2'-O-метиловых модификаций, например, описанных выше, можно объединять с одной или несколькими фосфотиоатными модификациями, например, описанными выше, и/или одной или несколькими инвертированными модификациями с удаленным азотистым основанием, например, описанными выше. В одном варианте осуществления gRNA (например, sgRNA или tracr и/или crRNA dgRNA), например, любой из компонентов gRNA или gRNA, описанных выше, содержит, например, состоит из, фосфотиоатную связь между каждым из первых четырех 5'-концевых остатков (например, содержит, например, состоит из, три фосфотиоатные связи на 5'-конце полинуклеотида(полинуклеотидов)), фосфотиоатную связь между каждым из первых четырех 3'-концевых остатков (например, содержит, например, состоит из, три фосфотиоатные связи на 5'-конце полинуклеотида(полинуклеотидов)), 2'-O-метиловую модификацию в каждом из первых трех 5'-концевых остатков и 2'-O-метиловую модификацию в каждом из первых трех 3'-концевых остатков. В одном варианте осуществления gRNA (например, sgRNA или tracr и/или crRNA dgRNA), например, любой из компонентов gRNA или gRNA, описанных выше, содержит, например, состоит из, фосфотиоатную связь между каждым из первых четырех 5'-концевых остатков (например, содержит, например, состоит из, три фосфотиоатные связи на 5'-конце полинуклеотида(полинуклеотидов)), фосфотиоатную связь между каждым из первых четырех 3'-концевых остатков (например, содержит, например, состоит из, три фосфотиоатные связи на 5'-конце полинуклеотида(полинуклеотидов)), 2'-O-метиловую модификацию в каждом из первых трех 5'-концевых остатков и 2'-O-метиловую модификацию в каждом из 4-го по отношению к концевому, 3-го по отношению к концевому и 2-го по отношению к концевому 3'-остатков.
В одном варианте осуществления gRNA (например, sgRNA или tracr и/или crRNA dgRNA), например, любой из компонентов gRNA или gRNA, описанных выше, содержит, например, состоит из, фосфотиоатную связь между каждым из первых четырех 5'-концевых остатков (например, содержит, например, состоит из, три фосфотиоатные связи на 5'-конце полинуклеотида(полинуклеотидов)), фосфотиоатную связь между каждым из первых четырех 3'-концевых остатков (например, содержит, например, состоит из, три фосфотиоатные связи на 5'-конце полинуклеотида(полинуклеотидов)), 2'-O-метиловую модификацию в каждом из первых трех 5'-концевых остатков, 2'-O-метиловую модификацию в каждом из первых трех 3'-концевых остатков и дополнительный инвертированный с удаленным азотистым основанием остаток в каждом из 5'- и 3'-концов.
В одном варианте осуществления gRNA (например, sgRNA или tracr и/или crRNA dgRNA), например, любой из компонентов gRNA или gRNA, описанных выше, содержит, например, состоит из, фосфотиоатную связь между каждым из первых четырех 5'-концевых остатков (например, содержит, например, состоит из, три фосфотиоатные связи на 5'-конце полинуклеотида(полинуклеотидов)), фосфотиоатную связь между каждым из первых четырех 3'-концевых остатков (например, содержит, например, состоит из трех фосфотиоатных связей на 5'-конце полинуклеотида(полинуклеотидов)), 2'-O-метиловую модификацию в каждом из первых трех 5'-концевых остатков и 2'-O-метиловую модификацию в каждом из 4-го по отношению к концевому, 3-го по отношению к концевому и 2-го по отношению к концевому 3'-остатков и дополнительный инвертированный с удаленным азотистым основанием остаток в каждом из 5'- и 3'-концов.
В одном варианте осуществления gRNA представляет собой dgRNA и содержит, например, состоит из,
crRNA:
mN*mN*mN*NNNNNNNNNNNNNNNNNGUUUUAGAGCUAU*mG*mC*mU (SEQ ID NO: 251), где m обозначает основание с 2'-O-метиловой модификацией, * обозначает фосфотиоатную связь, и N обозначают остатки нацеливающего домена, например, описанного в данном документе (необязательно с инвертированным с удаленным азотистым основанием остатком на 5'- и/или 3'-конце); и
tracr:
AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224) (необязательно с инвертированным с удаленным азотистым основанием остатком на 5'- и/или 3'-конце).
В одном варианте осуществления gRNA представляет собой dgRNA и содержит, например, состоит из,
crRNA:
mN*mN*mN*NNNNNNNNNNNNNNNNNGUUUUAGAGCUAU*мг*mC*mU (SEQ ID NO: 251), где m обозначает основание с 2'-O-метиловой модификацией, * обозначает фосфотиоатную связь, и N обозначают остатки нацеливающего домена, например, описанного в данном документе (необязательно с инвертированным с удаленным азотистым основанием остатком на 5'- и/или 3'-конце); и
tracr:
mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 246), где m обозначает основание с 2'-O-метиловой модификацией, * обозначает фосфотиоатную связь, и N обозначают остатки нацеливающего домена, например, описанного в данном документе (необязательно с инвертированным с удаленным азотистым основанием остатком на 5'- и/или 3'-конце).
В одном варианте осуществления gRNA представляет собой dgRNA и содержит, например, состоит из,
crRNA:
mN*mN*mN*NNNNNNNNNNNNNNNNNGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 252),где m обозначает основание с 2'-O-метиловой модификацией, * обозначает фосфотиоатную связь, и N обозначают остатки нацеливающего домена, например, описанного в данном документе (необязательно с инвертированным с удаленным азотистым основанием остатком на 5'- и/или 3'-конце); и
tracr:
AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224) (необязательно с инвертированным с удаленным азотистым основанием остатком на 5'- и/или 3'-конце).
В одном варианте осуществления gRNA представляет собой dgRNA и содержит, например, состоит из,
crRNA:
mN*mN*mN*NNNNNNNNNNNNNNNNNGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 252),где m обозначает основание с 2'-O-метиловой модификацией, * обозначает фосфотиоатную связь, и N обозначают остатки нацеливающего домена, например, описанного в данном документе (необязательно с инвертированным с удаленным азотистым основанием остатком на 5'- и/или 3'-конце); и
tracr:
mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 246), где m обозначает основание с 2'-O-метиловой модификацией, и * обозначает фосфотиоатную связь (необязательно с инвертированным с удаленным азотистым основания остатком на 5'- и/или 3'-конце).
В одном варианте осуществления gRNA представляет собой dgRNA и содержит, например, состоит из,
crRNA:
NNNNNNNNNNNNNNNNNNNNGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 253), где N обозначают остатки нацеливающего домена, например, описанного в данном документе (необязательно с инвертированным с удаленным азотистым основанием остатком на 5'- и/или 3'-конце); и
tracr:
mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 246), где m обозначает основание с 2'-O-метиловой модификацией, и * обозначает фосфотиоатную связь (необязательно с инвертированным с удаленным азотистым основания остатком на 5'- и/или 3'-конце).
В одном варианте осуществления gRNA представляет собой sgRNA и содержит, например, состоит из
NNNNNNNNNNNNNNNNNNNNGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 254), где m обозначает основание с 2'-O-метиловой модификацией, * обозначает фосфотиоатную связь, и N обозначают остатки нацеливающего домена, например, описанного в данном документе (необязательно с инвертированным с удаленным азотистым основанием остатком на 5'- и/или 3'-конце).
В одном варианте осуществления gRNA представляет собой sgRNA и содержит, например, состоит из
mN*mN*mN*NNNNNNNNNNNNNNNNNGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 255), где m обозначает основание с 2'-O-метиловой модификацией, * обозначает фосфотиоатную связь, и N обозначают остатки нацеливающего домена, например, описанного в данном документе (необязательно с инвертированным с удаленным азотистым основанием остатком на 5'- и/или 3'-конце).
В одном варианте осуществления gRNA представляет собой sgRNA и содержит, например, состоит из
mN*mN*mN*NNNNNNNNNNNNNNNNNGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 256), где m обозначает основание с 2'-O-метиловой модификацией, * обозначает фосфотиоатную связь, и N обозначают остатки нацеливающего домена, например, описанного в данном документе (необязательно с инвертированным с удаленным азотистым основанием остатком на 5'- и/или 3'-конце).
6) Первое удлинение tracr
Если gRNA содержит первое удлинение "флагштока", то tracr может содержать первое удлинение tracr. Первое удлинение tracr может содержать нуклеотиды, которые являются комплементарными, например, 80%, 85%, 90%, 95% или 99%, например, полностью комплементарными нуклеотидам первого удлинения "флагштока". В некоторых аспектах нуклеотиды первого удлинения tracr, которые гибридизуются с комплементарными нуклеотидами первого удлинения "флагштока", являются смежными. В некоторых аспектах нуклеотиды первого удлинения tracr, которые гибридизуются с комплементарными нуклеотидами первого удлинения "флагштока", являются прерывистыми, например, содержат два или более участка гибридизации, разделенные нуклеотидами, которые не образуют пару оснований с нуклеотидами первого удлинения "флагштока". В некоторых аспектах первое удлинение tracr содержит по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше нуклеотидов. В некоторых аспектах первое удлинение tracr содержит SEQ ID NO: 189. В некоторых аспектах первое удлинение tracr содержит нуклеиновую кислоту, которая на по меньшей мере 80%, 85%, 90%, 95% или 99% гомологична последовательности под SEQ ID NO: 189.
Некоторые или все нуклеотиды первого удлинения tracr могут содержать модификацию, например, модификацию, которую можно найти в разделе XIII в данном документе.
В некоторых вариантах осуществления sgRNA может содержать в 5'-3'-направлении расположенные в 3'-направлении относительно нацеливающего домена
a) GUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC (SEQ ID NO: 195);
b)
GUUUAAGAGCUAGAAAUAGCAAGUUUAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC (SEQ ID NO: 196);
c)
GUUUUAGAGCUAUGCUGGAAACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC (SEQ ID NO: 197);
d)
GUUUAAGAGCUAUGCUGGAAACAGCAUAGCAAGUUUAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC (SEQ ID NO: 198);
e) любую из a) - d), указанных выше, дополнительно содержащих на 3'-конце по меньшей мере 1, 2, 3, 4, 5, 6 или 7 урациловых (U) нуклеотидов, например, 1, 2, 3, 4, 5, 6 или 7 урациловых (U) нуклеотидов;
f) любую из a) - d), указанных выше, дополнительно содержащих на 3'-конце по меньшей мере 1, 2, 3, 4, 5, 6 или 7 адениновых (A) нуклеотидов, например, 1, 2, 3, 4, 5, 6 или 7 адениновых (A) нуклеотидов; или
g) любую из a) - f), указанных выше, дополнительно содержащих на 5'-конце (например, на 5'-конце, например, в 5'-направлении относительно нацеливающего домена) по меньшей мере 1, 2, 3, 4, 5, 6 или 7 адениновых (A) нуклеотидов, например, 1, 2, 3, 4, 5, 6 или 7 адениновых (A) нуклеотидов. В ряде вариантов осуществления любая из a) - g), указанных выше, расположена непосредственно в 3'-направлении относительно нацеливающего домена.
В одном варианте осуществления sgRNA по настоящему изобретению содержит, например, состоит из, в 5'-3'-направлении: [нацеливающий домен]- GUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 231).
В одном варианте осуществления sgRNA по настоящему изобретению содержит, например, состоит из, в 5'-3'-направлении: [нацеливающий домен]- GUUUAAGAGCUAUGCUGGAAACAGCAUAGCAAGUUUAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 227).
В некоторых вариантах осуществления dgRNA может содержать:
crRNA, содержащую в 5'-3'-направлении предпочтительно расположенные непосредственно в 3'-направлении относительно нацеливающего домена
a) GUUUUAGAGCUA (SEQ ID NO: 182);
b) GUUUAAGAGCUA (SEQ ID NO: 183);
c) GUUUUAGAGCUAUGCUG (SEQ ID NO: 199);
d) GUUUAAGAGCUAUGCUG (SEQ ID NO: 200);
e) GUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 201);
f) GUUUAAGAGCUAUGCUGUUUUG (SEQ ID NO: 202); или
g) GUUUUAGAGCUAUGCU (SEQ ID NO: 226):
и tracr, содержащую в 5'-3'-направлении:
a) UAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC (SEQ ID NO: 187);
b) UAGCAAGUUUAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC (SEQ ID NO: 188);
c) CAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC (SEQ ID NO: 203);
d) CAGCAUAGCAAGUUUAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC (SEQ ID NO: 204);
e) AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224);
f) AACAGCAUAGCAAGUUUAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 225);
g) AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC (SEQ ID NO: 232)
h) GUUUAAGAGCUAUGCUGGAAACAGCAUAGCAAGUUUAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 227);
i) AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUU (SEQ ID NO: 228);
j) GUUGGAACCAUUCAAAACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUU (SEQ ID NO: 229);
k) любую из a) - j), указанных выше, дополнительно содержащих на 3'-конце по меньшей мере 1, 2, 3, 4, 5, 6 или 7 урациловых (U) нуклеотидов, например, 1, 2, 3, 4, 5, 6 или 7 урациловых (U) нуклеотидов;
l) любую из a) - j), указанных выше, дополнительно содержащих на 3'-конце по меньшей мере 1, 2, 3, 4, 5, 6 или 7 адениновых (A) нуклеотидов, например, 1, 2, 3, 4, 5, 6 или 7 адениновых (A) нуклеотидов; или
m) любую из a) - l), указанных выше, дополнительно содержащих на 5'-конце (например, на 5'-конце) по меньшей мере 1, 2, 3, 4, 5, 6 или 7 адениновых (A) нуклеотидов, например, 1, 2, 3, 4, 5, 6 или 7 адениновых (A) нуклеотидов.
В одном варианте осуществления последовательность k), указанная выше, содержит 3'-концевую последовательность UUUUUU, например, если промотор U6 используют для транскрипции. В одном варианте осуществления последовательность k), указанная выше, содержит 3'-концевую последовательность UUUU, например, если промотор HI используют для транскрипции. В одном варианте осуществления последовательность k), указанная выше, содержит варьирующие количества 3'-концевых U в зависимости, например, от сигнала терминации используемого промотора pol-III. В одном варианте осуществления последовательность k), указанная выше, содержит вариабельную 3'-концевую последовательность, полученную из ДНК-матрицы, в случае использования промотора T7. В одном варианте осуществления последовательность k), указанная выше, содержит вариабельную 3'-концевую последовательность, полученную из ДНК-матрицы, например, в случае применения транскрипции in vitro для получения молекулы РНК. В одном варианте осуществления последовательность k), указанная выше, содержит вариабельную 3'-концевую последовательность, полученную из ДНК-матрицы, например, если промотор pol-II используют для управления транскрипцией.
В одном варианте осуществления crRNA содержит, например состоит из, нацеливающий домен и расположенную в 3'-направлении относительно нацеливающего домена (например, расположенную непосредственно в 3'-направлении относительно нацеливающего домена) последовательность, содержащую, например состоящую из, SEQ ID NO: 201, и при этом tracr содержит, например, состоит из AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В одном варианте осуществления crRNA содержит, например состоит из, нацеливающий домен и расположенную в 3'-направлении относительно нацеливающего домена (например, расположенную непосредственно в 3'-направлении относительно нацеливающего домена) последовательность, содержащую, например состоящую из, SEQ ID NO: 202, и при этом tracr содержит, например, состоит из AACAGCAUAGCAAGUUUAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 225).
В одном варианте осуществления crRNA содержит, например, состоит из, нацеливающий домен и расположенную в 3'-направлении относительно нацеливающего домена (например, расположенную непосредственно в 3'-направлении относительно нацеливающего домена) последовательность, содержащую, например, состоящую из GUUUUAGAGCUAUGCU (SEQ ID NO: 226), и при этом tracr содержит, например, состоит из GUUUAAGAGCUAUGCUGGAAACAGCAUAGCAAGUUUAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 227).
В одном варианте осуществления crRNA содержит, например, состоит из, нацеливающий домен и расположенную в 3'-направлении относительно нацеливающего домена (например, расположенную непосредственно в 3'-направлении относительно нацеливающего домена) последовательность, содержащую, например, состоящую из GUUUUAGAGCUAUGCU (SEQ ID NO: 226), и при этом tracr содержит, например, состоит из AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUU (SEQ ID NO: 228).
В одном варианте осуществления crRNA содержит, например, состоит из, нацеливающий домен и расположенную в 3'-направлении относительно нацеливающего домена (например, расположенную непосредственно в 3'-направлении относительно нацеливающего домена) последовательность, содержащую, например, состоящую из GUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 201), и при этом tracr содержит, например, состоит из GUUGGAACCAUUCAAAACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUU (SEQ ID NO: 229).
II. Нацеливающие домены gRNA, направленные на неделеционные участки HPFH
В таблице ниже представлены нацеливающие домены, направленные на неделеционные участки HPFH, для молекул gRNA по настоящему изобретению и для применения в различных аспектах по настоящему изобретению, например, в изменении экспрессии генов глобина, например, гена фетального гемоглобина или гена бета-гемоглобина.
Таблица 1. Нацеливающие домены gRNA, направленные на неделеционные участки HPFH. SEQ ID NO: относятся к последовательности нацеливающего домена gRNA
В таблице 2 ниже показаны те нацеливающие домены, которые, при встраивании в молекулу gRNA, приводят в результате к повышению на по меньшей мере 17% уровня фетального гемоглобина (например, в эритроидных клетках, дифференцированных из модифицированных HSPC) через 7 дней в соответствии со способами, описанными в примерах. Молекулы gRNA, содержащие любой из данных нацеливающих доменов, в совокупности упоминаются в данном документе как молекулы Tier 2 gRNA.
Таблица 2. Нацеливающие домены для молекул Tier 2 gRNA
В таблице 3a и таблице 3b ниже показаны те нацеливающие домены, которые при встраивании в молекулу gRNA приводят в результате к наиболее высокому повышению уровня фетального гемоглобина (например, в эритроидных клетках, дифференцированных из модифицированных HSPC) через 7 дней в соответствии со способами, описанными в примерах. Молекулы gRNA, содержащие данные нацеливающие домены, в совокупности упоминаются в данном документе как молекулы Tier 1 (например, Tirr 1a или Tier 1b) gRNA.
Таблица 3a. Нацеливающие домены для молекул Tier 1a gRNA
Таблица 3b. Нацеливающие домены для молекул Tier 1b gRNA
III. Способы конструирования gRNA
Способы конструирования gRNA описанные в данном документе, включают способы отбора, конструирования и проверки целевых последовательностей. Иллюстративные нацеливающие домены также представлены в данном документе. Нацеливающие домены, рассмотренные в данном документе, можно встраивать в gRNA, описанные в данном документе.
Способы отбора и проверки целевых последовательностей, а также анализы нецелевой активности описаны, например, в Mali el al., 2013 SCIENCE 339(6121): 823-826; Hsu et al, 2013 NAT BIOTECHNOL, 31 (9): 827-32; Fu et al, 2014 NAT BIOTECHNOL, doi: 10.1038/nbt.2808. PubMed PM ID: 24463574; Heigwer et al, 2014 NAT METHODS ll (2): 122-3. doi: 10.1038/nmeth.2812. PubMed PMID: 24481216; Bae el al, 2014 BIOINFORMATICS PubMed PMID: 24463181 ; Xiao A el al, 2014 BIOINFORMATICS PubMed PMID: 24389662.
Например, программное обеспечение можно применять использовать для оптимизации выбора gRNA в пределах целевой последовательности пользователя, например, для сведения к минимуму общей нецелевой активности в геноме. Нецелевая активность может быть отличной от расщепления. Для выбора каждой возможной gRNA, например, для использования с Cas9 S. pyogenes, с помощью данного средства можно индентифицировать все нецелевые последовательности (например, предшествующие либо NAG, либо NGG PAM) в геноме, которые содержат не более определенного количества (например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10) ошибочно спаренных пар оснований. Эффективность расщепления в каждой нецелевой последовательности может быть предсказана, например, с использованием экспериментально полученной схемы взвешивания. Каждую возможную gRNA затем ранжируют в соответствии с ее общим предсказанным нецелевым расщеплением; ведущими gRNA являются те, которые, вероятно, будут иметь наибольшее целевое и наименьшее нецелевое расщепление. Другие функции, например, автоматизированное конструирование реагента для конструкции на основе CRISPR, конструирование праймера для целевого анализа Surveyor и конструирование праймера для высокопроизводительного выявления и количественного определения нецелевого расщепления посредством секвенирования нового поколения, можно также включать в инструмент. Кандидатные молекулы gRNA можно оценивать с помощью способов, известных из уровня техники или описанных в данном документе.
Хотя алгоритмы программного обеспечения можно использовать для получения исходного перечня потенциальных молекул gRNA, эффективность разрезания и специфичность не обязательно будут отображать предсказанные значения, и молекулы gRNA, как правило, требуют осуществления скрининга в определенных клеточных линиях, например, первичных клеточных линиях человека, например, HSPC человека, например, клетках CD34+ человека, для определения, например, эффективности разрезания, образования вставки/делеции, специфичности разрезания и изменения требуемого фенотипа. Такие свойств можно анализировать с помощью способов, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0001 (SEQ ID NO: 1, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0001 #1:
AGUCCUGGUAUCCUCUAUGAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 74)
sgRNA GCR-0001 #2:
mA*мг*mU*CCUGGUAUCCUCUAUGAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 75)
sgRNA GCR-0001 #3:
mA*мг*mU*CCUGGUAUCCUCUAUGAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 76)
dgRNA GCR-0001 #1:
crRNA: AGUCCUGGUAUCCUCUAUGAGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 77)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0001 #2:
crRNA: mA*мг*mU*CCUGGUAUCCUCUAUGAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 78)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0001 #3:
crRNA: mA*мг*mU*CCUGGUAUCCUCUAUGAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 78)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0006 (SEQ ID NO: 6, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0006 #1:
AAAAACUGGAAUGACUGAAUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 79)
sgRNA GCR-0006 #2:
mA*mA*mA*AACUGGAAUGACUGAAUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 80)
sgRNA GCR-0006 #3:
mA*mA*mA*AACUGGAAUGACUGAAUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 81)
dgRNA GCR-0006 #1:
crRNA: AAAAACUGGAAUGACUGAAUGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 82)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0006 #2:
crRNA: mA*mA*mA*AACUGGAAUGACUGAAUGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 83)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0006 #3:
crRNA: mA*mA*mA*AACUGGAAUGACUGAAUGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 83)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0008 (SEQ ID NO: 8, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0008 #1:
GGAGAAGGAAACUAGCUAAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 84)
sgRNA GCR-0008 #2:
мг*мг*mA*GAAGGAAACUAGCUAAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 85)
sgRNA GCR-0008 #3:
мг*мг*mA*GAAGGAAACUAGCUAAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 86)
dgRNA GCR-0008 #1:
crRNA: GGAGAAGGAAACUAGCUAAAGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 87)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0008 #2:
crRNA: мг*мг*mA*GAAGGAAACUAGCUAAAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 88)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0008 #3:
crRNA: мг*мг*mA*GAAGGAAACUAGCUAAAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 88)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-009 (SEQ ID NO: 9, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0009 #1:
GUUUCCUUCUCCCAUCAUAGGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 89)
sgRNA GCR-0009 #2:
мг*mU*mU*UCCUUCUCCCAUCAUAGGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 90)
sgRNA GCR-0009 #3:
мг*mU*mU*UCCUUCUCCCAUCAUAGGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 91)
dgRNA GCR-0009 #1:
crRNA: GUUUCCUUCUCCCAUCAUAGGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 92)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0009 #2:
crRNA: мг*mU*mU*UCCUUCUCCCAUCAUAGGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 93)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0009 #3:
crRNA: мг*mU*mU*UCCUUCUCCCAUCAUAGGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 93)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0010 (SEQ ID NO: 10, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0010 #1:
GGGAGAAGGAAACUAGCUAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 94)
sgRNA GCR-0010 #2:
мг*мг*мг*AGAAGGAAACUAGCUAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 95)
sgRNA GCR-0010 #3:
мг*мг*мг*AGAAGGAAACUAGCUAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 96)
dgRNA GCR-0010 #1:
crRNA: GGGAGAAGGAAACUAGCUAAGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 97)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0010 #2:
crRNA: мг*мг*мг*AGAAGGAAACUAGCUAAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 98)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0010 #3:
crRNA: мг*мг*мг*AGAAGGAAACUAGCUAAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 98)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0011 (SEQ ID NO: 11, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0011 #1:
CACUGGAGCUAGAGACAAGAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 99)
sgRNA GCR-0011 #2:
mC*mA*mC*UGGAGCUAGAGACAAGAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 100)
sgRNA GCR-0011 #3:
mC*mA*mC*UGGAGCUAGAGACAAGAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 101)
dgRNA GCR-0011 #1:
crRNA: CACUGGAGCUAGAGACAAGAGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 102)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0011 #2:
crRNA: mC*mA*mC*UGGAGCUAGAGACAAGAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 103)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0011 #3:
crRNA: mC*mA*mC*UGGAGCUAGAGACAAGAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 103)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0012 (SEQ ID NO: 12, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0012 #1:
AGAGACAAGAAGGUAAAAAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 104)
sgRNA GCR-0012 #2:
mA*мг*mA*GACAAGAAGGUAAAAAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 105)
sgRNA GCR-0012 #3:
mA*мг*mA*GACAAGAAGGUAAAAAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 106)
dgRNA GCR-0012 #1:
crRNA: AGAGACAAGAAGGUAAAAAAGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 107)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0012 #2:
crRNA: mA*мг*mA*GACAAGAAGGUAAAAAAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 108)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0012 #3:
crRNA: mA*мг*mA*GACAAGAAGGUAAAAAAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 108)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0028 (SEQ ID NO: 28, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0028 #1:
GGCUAGGGAUGAAGAAUAAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 109)
sgRNA GCR-0028 #2:
мг*мг*mC*UAGGGAUGAAGAAUAAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 110)
sgRNA GCR-0028 #3:
мг*мг*mC*UAGGGAUGAAGAAUAAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 111)
dgRNA GCR-0028 #1:
crRNA: GGCUAGGGAUGAAGAAUAAAGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 112)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0028 #2:
crRNA: мг*мг*mC*UAGGGAUGAAGAAUAAAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 113)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0028 #3:
crRNA: мг*мг*mC*UAGGGAUGAAGAAUAAAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 113)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0034 (SEQ ID NO: 34, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0034 #1:
AAAAAUUGGAAUGACUGAAUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 114)
sgRNA GCR-0034 #2:
mA*mA*mA*AAUUGGAAUGACUGAAUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 115)
sgRNA GCR-0034 #3:
mA*mA*mA*AAUUGGAAUGACUGAAUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 116)
dgRNA GCR-0034 #1:
crRNA: AAAAAUUGGAAUGACUGAAUGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 117)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0034 #2:
crRNA: mA*mA*mA*AAUUGGAAUGACUGAAUGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 118)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0034 #3:
crRNA: mA*mA*mA*AAUUGGAAUGACUGAAUGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 118)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0045 (SEQ ID NO: 45, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0045 #1:
UGGUCAAGUUUGCCUUGUCAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 119)
sgRNA GCR-0045 #2:
mU*мг*мг*UCAAGUUUGCCUUGUCAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 120)
sgRNA GCR-0045 #3:
mU*мг*мг*UCAAGUUUGCCUUGUCAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 121)
dgRNA GCR-0045 #1:
crRNA: UGGUCAAGUUUGCCUUGUCAGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 122)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0045 #2:
crRNA: mU*мг*мг*UCAAGUUUGCCUUGUCAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 123)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0045 #3:
crRNA: mU*мг*мг*UCAAGUUUGCCUUGUCAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 123)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0046 (SEQ ID NO: 46, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0046 #1:
GGGAGAAGAAAACUAGCUAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 124)
sgRNA GCR-0046 #2:
мг*мг*мг*AGAAGAAAACUAGCUAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 125)
sgRNA GCR-0046 #3:
мг*мг*мг*AGAAGAAAACUAGCUAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 126)
dgRNA GCR-0046 #1:
crRNA: GGGAGAAGAAAACUAGCUAAGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 127)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0046 #2:
crRNA: мг*мг*мг*AGAAGAAAACUAGCUAAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 128)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0046 #3:
crRNA: мг*мг*мг*AGAAGAAAACUAGCUAAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 128)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0047 (SEQ ID NO: 47, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0047 #1:
GGCAAGGCUGGCCAACCCAUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 129)
sgRNA GCR-0047 #2:
мг*мг*mC*AAGGCUGGCCAACCCAUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 130)
sgRNA GCR-0047 #3:
мг*мг*mC*AAGGCUGGCCAACCCAUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 131)
dgRNA GCR-0047 #1:
crRNA: GGCAAGGCUGGCCAACCCAUGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 132)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0047 #2:
crRNA: мг*мг*mC*AAGGCUGGCCAACCCAUGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 133)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0047 #3:
crRNA: мг*мг*mC*AAGGCUGGCCAACCCAUGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 133)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0048 (SEQ ID NO: 48, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0048 #1:
ACGGCUGACAAAAGAAGUCCGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 134)
sgRNA GCR-0048 #2:
mA*mC*мг*GCUGACAAAAGAAGUCCGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 135)
sgRNA GCR-0048 #3:
mA*mC*мг*GCUGACAAAAGAAGUCCGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 136)
dgRNA GCR-0048 #1:
crRNA: ACGGCUGACAAAAGAAGUCCGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 137)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0048 #2:
crRNA: mA*mC*мг*GCUGACAAAAGAAGUCCGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 138)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0048 #3:
crRNA: mA*mC*мг*GCUGACAAAAGAAGUCCGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 138)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0050 (SEQ ID NO: 50, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0050 #1:
CCUGGCUAAACUCCACCCAUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 139)
sgRNA GCR-0050 #2:
mC*mC*mU*GGCUAAACUCCACCCAUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 140)
sgRNA GCR-0050 #3:
mC*mC*mU*GGCUAAACUCCACCCAUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 141)
dgRNA GCR-0050 #1:
crRNA: CCUGGCUAAACUCCACCCAUGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 142)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0050 #2:
crRNA: mC*mC*mU*GGCUAAACUCCACCCAUGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 143)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0050 #3:
crRNA: mC*mC*mU*GGCUAAACUCCACCCAUGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 143)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0051 (SEQ ID NO: 51, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0051 #1:
GGAGAAGAAAACUAGCUAAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 144)
sgRNA GCR-0051 #2:
мг*мг*mA*GAAGAAAACUAGCUAAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 145)
sgRNA GCR-0051 #3:
мг*мг*mA*GAAGAAAACUAGCUAAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 146)
dgRNA GCR-0051 #1:
crRNA: GGAGAAGAAAACUAGCUAAAGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 147)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0051 #2:
crRNA: мг*мг*mA*GAAGAAAACUAGCUAAAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 148)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0051 #3:
crRNA: мг*мг*mA*GAAGAAAACUAGCUAAAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 148)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0053 (SEQ ID NO: 53, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0053 #1:
CUUGUCAAGGCUAUUGGUCAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 149)
sgRNA GCR-0053 #2:
mC*mU*mU*GUCAAGGCUAUUGGUCAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 150)
sgRNA GCR-0053 #3:
mC*mU*mU*GUCAAGGCUAUUGGUCAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 151)
dgRNA GCR-0053 #1:
crRNA: CUUGUCAAGGCUAUUGGUCAGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 152)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0053 #2:
crRNA: mC*mU*mU*GUCAAGGCUAUUGGUCAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 153)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0053 #3:
crRNA: mC*mU*mU*GUCAAGGCUAUUGGUCAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 153)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0054 (SEQ ID NO: 54, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0054 #1:
AGUCCUGGUAUCUUCUAUGGGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 154)
sgRNA GCR-0054 #2:
mA*мг*mU*CCUGGUAUCUUCUAUGGGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 155)
sgRNA GCR-0054 #3:
mA*мг*mU*CCUGGUAUCUUCUAUGGGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 156)
dgRNA GCR-0054 #1:
crRNA: AGUCCUGGUAUCUUCUAUGGGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 157)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0054 #2:
crRNA: mA*мг*mU*CCUGGUAUCUUCUAUGGGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 158)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0054 #3:
crRNA: mA*мг*mU*CCUGGUAUCUUCUAUGGGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 158)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0058 (SEQ ID NO: 58, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0058 #1:
GUCCUGGUAUCUUCUAUGGUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 159)
sgRNA GCR-0058 #2:
мг*mU*mC*CUGGUAUCUUCUAUGGUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 160)
sgRNA GCR-0058 #3:
мг*mU*mC*CUGGUAUCUUCUAUGGUGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 161)
dgRNA GCR-0058 #1:
crRNA: GUCCUGGUAUCUUCUAUGGUGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 162)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0058 #2:
crRNA: мг*mU*mC*CUGGUAUCUUCUAUGGUGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 163)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0058 #3:
crRNA: мг*mU*mC*CUGGUAUCUUCUAUGGUGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 163)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0062 (SEQ ID NO: 62, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0062 #1:
CUUGACCAAUAGCCUUGACAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 164)
sgRNA GCR-0062 #2:
mC*mU*mU*GACCAAUAGCCUUGACAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 165)
sgRNA GCR-0062 #3:
mC*mU*mU*GACCAAUAGCCUUGACAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 166)
dgRNA GCR-0062 #1:
crRNA: CUUGACCAAUAGCCUUGACAGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 167)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0062 #2:
crRNA: mC*mU*mU*GACCAAUAGCCUUGACAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 168)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0062 #3:
crRNA: mC*mU*mU*GACCAAUAGCCUUGACAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 168)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0063 (SEQ ID NO: 63, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0063 #1:
CAAGGCUAUUGGUCAAGGCAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 169)
sgRNA GCR-0063 #2:
mC*mA*mA*GGCUAUUGGUCAAGGCAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 170)
sgRNA GCR-0063 #3:
mC*mA*mA*GGCUAUUGGUCAAGGCAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 171)
dgRNA GCR-0063 #1:
crRNA: CAAGGCUAUUGGUCAAGGCAGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 172)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0063 #2:
crRNA: mC*mA*mA*GGCUAUUGGUCAAGGCAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 173)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0063 #3:
crRNA: mC*mA*mA*GGCUAUUGGUCAAGGCAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 173)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
В ряде аспектов настоящего изобретения gRNA, содержащая нацеливающий домен GCR-0067 (SEQ ID NO: 67, немодифицированная последовательность подчеркнута снизу), например, одна из молекул gRNA, описанных ниже, является применимой в системах CRISPR, способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, в том числе в аспектах, предусматривающих более одной молекулы gRNA, например, описанной в данном документе:
sgRNA GCR-0067 #1:
ACUGAAUCGGAACAAGGCAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 174)
sgRNA GCR-0067 #2:
mA*mC*mU*GAAUCGGAACAAGGCAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCU*mU*mU*mU (SEQ ID NO: 175)
sgRNA GCR-0067 #3:
mA*mC*mU*GAAUCGGAACAAGGCAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCmU*mU*mU*U (SEQ ID NO: 176)
dgRNA GCR-0067 #1:
crRNA: ACUGAAUCGGAACAAGGCAAGUUUUAGAGCUAUGCUGUUUUG (SEQ ID NO: 177)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224)
dgRNA GCR-0067 #2:
crRNA: mA*mC*mU*GAAUCGGAACAAGGCAAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 178)
tracr: mA*mA*mC*AGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU*mU*mU*mU (SEQ ID NO: 73)
dgRNA GCR-0067 #3:
crRNA: mA*mC*mU*GAAUCGGAACAAGGCAAGUUUUAGAGCUAUGCUGUU*mU*mU*мг (SEQ ID NO: 178)
tracr: AACAGCAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (SEQ ID NO: 224).
В каждой из молекул gRNA, описанных выше, "*" обозначает фосфотиоатную связь между смежными нуклеотидами, а "mN" (где N=A, G, C или U) обозначает 2'-OMe модифицированный нуклеотид. В ряде вариантов осуществления любая из молекул gRNA, описанных в данном документе, например, описанных выше, образует комплекс с молекулой Cas9, например, описанной в данном документе, с образованием рибонуклеопротеинового комплекса (RNP). Такие RNP, в частности, являются применимыми в способах, клетках и других аспектах и вариантах осуществления настоящего изобретения, например, описанных в данном документе.
IV. Молекулы Cas
Молекулы Cas9
В предпочтительных вариантах осуществления молекула Cas представляет собой молекулу Cas9. Молекулы Cas9 от разных видов можно применять в способах и композициях, описанных в данном документе. Тогда как молекула Cas9 S. pyogenes является предметом большой части раскрытия в данном документе, молекулы Cas9, полученные из или на основе белков Cas9 от других видов, перечисленные в данном документе, можно также применять. Другими словами, другие молекулы Cas9, например, молекулы Cas9 S. thermophilus, Staphylococcus aureus и/или Neisseria meningitidis, можно применять в системах, способах и композициях, описанных в данном документе. Дополнительные разновидности Cas9 включают Acidovorax avenae, Actinobacillus pleuropneumoniae, Actinobacillus succinogenes, Actinobacillus suis, Actinomyces sp., cycliphilus denitrificans, Aminomonas paucivorans, Bacillus cereus, Bacillus smithii, Bacillus thuringiensis, Bacteroides sp., Blastopirellula marina, Bradyrhiz' obium sp., Brevibacillus latemsporus, Campylobacter coli, Campylobacter jejuni, Campylobacter lad, Candidatus Puniceispirillum, Clostridiu cellulolyticum, Clostridium perfringens, Corynebacterium accolens, Corynebacterium diphtheria, Corynebacterium matruchotii, Dinoroseobacter sliibae, Eubacterium dolichum, gamma proteobacterium, Gluconacetobacler diazotrophicus, Haemophilus parainfluenzae, Haemophilus sputorum, Helicobacter canadensis, Helicobacter cinaedi, Helicobacter mustelae, Ilyobacler polytropus, Kingella kingae, Lactobacillus crispatus, Listeria ivanovii, Listeria monocytogenes, Listeriaceae bacterium, Methylocystis sp., Methylosinus trichosporium, Mobiluncus mulieris, Neisseria bacilliformis, Neisseria cinerea, Neisseria flavescens, Neisseria lactamica. Neisseria sp., Neisseria wadsworthii, Nitrosomonas sp., Parvibaculum lavamentivorans, Pasteurella multocida, Phascolarctobacterium succinatutens, Ralstonia syzygii, Rhodopseudomonas palustris, Rhodovulum sp., Simonsiella muelleri, Sphingomonas sp., Sporolactobacillus vineae, Staphylococcus lugdunensis, Streptococcus sp., Subdoligranulum sp., Tislrella mobilis, Treponema sp., или Verminephrobacter eiseniae.
Используемый в данном документе термин молекула Cas9 относится к молекуле, которая может взаимодействовать с молекулой gRNA (например, последовательностью домена tracr) и вместе с молекулой gRNA локализоваться (например, нацеливаться или наводиться на сайт) в сайте, который содержит целевую последовательность и последовательность PAM.
В одном варианте осуществления молекула Cas9 способна к расщеплению целевой молекулы нуклеиновой кислоты, которая может упоминаться в данном документе как активная молекула Cas9. В одном варианте осуществления активная молекула Cas9 имеет одну или несколько следующих активностей: никазную активность, т. е. способность к расщеплению одинарной нити, например, некомплементарной нити или комплементарной нити молекулы нуклеиновой кислоты; двухнитевую нуклеазную активность, т. е. способность расщеплять обе нити двухнитевой нуклеиновой кислоты и создавать двухнитевой разрыв, которая в одном варианте осуществления представляет собой присутствие двух никазных активностей; эндонуклеазную активность; экзонуклеазную активность и хеликазную активность, т. е. способность раскручивать спиральную структуру двухнитевой нуклеиновой кислоты.
В одном варианте осуществления ферментативно активная молекула Cas9 расщепляет обе нити ДНК, что приводит в результате к двухнитевому разрыву. В одном варианте осуществления молекула Cas9 расщепляет только одну нить, например, нить, с которой gRNA гибридизуется, или нить, комплементарную нити, с которой gRNA гибридизуется. В одном варианте осуществления активная молекула Cas9 обладает активностью расщепления, ассоциированной с HNH-подобным доменом. В одном варианте осуществления активная молекула Cas9 обладает активностью расщепления, ассоциированной с N-концевым RuvC-подобным доменом. В одном варианте осуществления активная молекула Cas9 обладает активностью расщепления, ассоциированной с HNH-подобным доменом, и активностью расщепления, ассоциированной с N-концевым RuvC-подобным доменом. В одном варианте осуществления активная молекула Cas9 содержит активный или отвечающий за расщепление HNH-подобный домен и неактивный или не отвечающий за расщепление N-концевой RuvC-подобный домен. В одном варианте осуществления активная молекула Cas9 содержит неактивный или не отвечающий за расщепление HNH-подобный домен и активный или отвечающий за расщепление N-концевой RuvC-подобный домен.
В одном варианте осуществления способность активной молекулы Cas9 взаимодействовать с целевой нуклеиновой кислотой и расщеплять ее является зависимой от последовательности PAM. Последовательность PAM представляет собой последовательность в целевой нуклеиновой кислоте. В одном варианте осуществления расщепление целевой нуклеиновой кислоты происходит выше последовательности PAM. Активные молекулы Cas9 различных видов бактерий могут распознавать различные мотивы последовательности (например, последовательности PAM). В одном варианте осуществления активная молекула Cas9 S. pyogenes распознает мотив последовательности NGG и управляет расщеплением целевой последовательности нуклеиновой кислоты из 1-10, например, 3-5 пар оснований в 5'-направлении по отношению к данной последовательности. См., например, Mali el ai, SCIENCE 2013; 339(6121): 823-826. В одном варианте осуществления активная молекула Cas9 S. thermophilus распознает мотив последовательности NGGNG и NNAG AAW (W=A или T) и управляет расщеплением коровой целевой последовательности нуклеиновой кислоты из 1-10, например, 3-5 пар оснований в 5'-направлении по отношению к данным последовательностям. См., например, Horvath et al., SCIENCE 2010; 327(5962): 167-170, и Deveau et al, J BACTERIOL 2008; 190(4): 1390-1400. В одном варианте осуществления активная молекула Cas9 S. mulans распознает мотив последовательности NGG или NAAR (R - A или G) и управляет расщеплением коровой целевой последовательности нуклеиновой кислоты из 1-10, например, 3-5 пар оснований в 5'-направлении по отношению к данной последовательности. См., например, Deveau et al., J BACTERIOL 2008; 190(4): 1 390-1400.
В одном варианте осуществления активная молекула Cas9 S. aureus распознает мотив последовательности NNGRR (R=A или G) и управляет расщеплением целевой последовательности нуклеиновой кислоты из 1-10, например, 3-5 пар оснований в 5'-направлении по отношению к данной последовательности. См., например, Ran F. et al., NATURE, vol. 520, 2015, pp. 186-191. В одном варианте осуществления активная молекула Cas9 N. meningitidis распознает мотив последовательности NNNNGATT и управляет расщеплением целевой последовательности нуклеиновой кислоты из 1-10, например, 3-5 пар оснований в 5'-направлении по отношению к данной последовательности. См., например, Hou et al., PNAS EARLY EDITION 2013, 1-6. Способность молекулы Cas9 распознавать последовательность PAM можно определить, например, с применением анализа трансформации, описанного в Jinek et al, SCIENCE 2012, 337:816.
Некоторые молекулы Cas9 обладают способностью взаимодействовать с молекулой gRNA, и в сочетании с молекулой gRNA наводятся (например, нацеливаются или локализуются в коровый целевой домен) на коровый целевой домен, но неспособны к расщеплению целевой нуклеиновой кислоты или неспособны к расщеплению на эффективном уровне. Молекулы Cas9, не обладающие или не обладающие значительной активностью расщепления, могут называться в данном документе как неактивная молекула Cas9 (ферментативно неактивная Cas9), "мертвая"Cas9 или dCas9. Например, у неактивной молекулы Cas9 может отсутствовать активность расщепления, или она обладать значительно меньшей активностью, например, менее 20, 10, 5, 1 или 0,1% от активности расщепления эталонной молекулы Cas9, что измерено с помощью анализа, описанного в данном документе.
Иллюстративные существующие в природе молекулы Cas9 описаны в Chylinski et al, RNA Biology 2013; 10:5, 727-737. Такие молекулы Cas9 включают молекулы Cas9 кластера 1 бактериального семейства, кластера 2 бактериального семейства, кластера 3 бактериального семейства, кластера 4 бактериального семейства, кластера 5 бактериального семейства, кластера 6 бактериального семейства, кластера 7 бактериального семейства, кластера 8 бактериального семейства, кластера 9 бактериального семейства, кластера 10 бактериального семейства, кластера 11 бактериального семейства, кластера 12 бактериального семейства, кластера 13 бактериального семейства, кластера 14 бактериального семейства, кластера 1 бактериального семейства, кластера 16 бактериального семейства, кластера 17 бактериального семейства, кластера 18 бактериального семейства, кластера 19 бактериального семейства, кластера 20 бактериального семейства, кластера 21 бактериального семейства, кластера 22 бактериального семейства, кластера 23 бактериального семейства, кластера 24 бактериального семейства, кластера 25 бактериального семейства, кластера 26 бактериального семейства, кластера 27 бактериального семейства, кластера 28 бактериального семейства, кластера 29 бактериального семейства, кластера 30 бактериального семейства, кластера 31 бактериального семейства, кластера 32 бактериального семейства, кластера 33 бактериального семейства, кластера 34 бактериального семейства, кластера 35 бактериального семейства, кластера 36 бактериального семейства, кластера 37 бактериального семейства, кластера 38 бактериального семейства, кластера 39 бактериального семейства, кластера 40 бактериального семейства, кластера 41 бактериального семейства, кластера 42 бактериального семейства, кластера 43 бактериального семейства, кластера 44 бактериального семейства, кластера 45 бактериального семейства, кластера 46 бактериального семейства, кластера 47 бактериального семейства, кластера 48 бактериального семейства, кластера 49 бактериального семейства, кластера 50 бактериального семейства, кластера 51 бактериального семейства, кластера 52 бактериального семейства, кластера 53 бактериального семейства, кластера 54 бактериального семейства, кластера 55 бактериального семейства, кластера 56 бактериального семейства, кластера 57 бактериального семейства, кластера 58 бактериального семейства, кластера 59 бактериального семейства, кластера 60 бактериального семейства, кластера 61 бактериального семейства, кластера 62 бактериального семейства, кластера 63 бактериального семейства, кластера 64 бактериального семейства, кластера 65 бактериального семейства, кластера 66 бактериального семейства, кластера 67 бактериального семейства, кластера 68 бактериального семейства, кластера 69 бактериального семейства, кластера 70 бактериального семейства, кластера 71 бактериального семейства, кластера 72 бактериального семейства, кластера 73 бактериального семейства, кластера 74 бактериального семейства, кластера 75 бактериального семейства, кластера 76 бактериального семейства, кластера 77 бактериального семейства или кластера 78 бактериального семейства.
Иллюстративные существующие в природе молекулы Cas9 включают молекулу Cas9 кластера 1 бактериального семейства. Примеры включают молекулу Cas9 S. pyogenes (например, штамм SF370, MGAS 10270, MGAS 10750, MGAS2096, MGAS315, MGAS5005, MGAS6180, MGAS9429, NZ131 и SSI-1), S. thermophilus (например, штамм LMD-9), S. pseudoporcinus (например, штамм SPIN 20026), S. mutans (например, штамм UA 159, NN2025), S. macacae (например, штамм NCTC1 1558), S. gallolylicus (например, штамм UCN34, ATCC BAA-2069), S. equines (например, штамм ATCC 9812, MGCS 124), S. dysdalactiae (например, штамм GGS 124), S. bovis (например, штамм ATCC 700338), S. cmginosus (например, штамм F021 1), S. agalactia* (например, штамм NEM316, A909), Listeria monocytogenes (например, штамм F6854), Listeria innocua (L. innocua, например, штамм Clip l 1262), EtUerococcus italicus (например, штамм DSM 15952) или Enterococcus faecium (например, штамм 1231408). Дополнительные иллюстративные молекулы Cas9 представляют собой молекулу Cas9 Neisseria meningitidis (Hou et al. PNAS Early Edition 2013, 1-6) и молекулу Cas9 S. aureus.
В одном варианте осуществления молекула Cas9, например, активная молекула Cas9 или неактивная молекула Cas9 содержит аминокислотную последовательность, которая на 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% гомологична; отличаюется в не более чем 1%, 2%, 5%, 10%, 15%, 20%, 30%, или 40% аминокислотных остатков по сравнению с; отличается в по меньшей мере 1, 2, 5, 10 или 20 аминокислотах, но не более чем в 100, 80, 70, 60, 50, 40 или 30 аминокислотах от; или идентична любой последовательности молекулы Cas9, описанной в данном документе или последовательности существующей в природе молекулы Cas9, например, молекулы Cas9 из видов, перечисленных в данном документе или описанных в Chylinski et al., RNA Biology 2013, 10:5, Ί2Ί-Τ,1 Hou et al. PNAS Early Edition 2013, 1-6.
В одном варианте осуществления молекула Cas9 содержит аминокислотную последовательность, которая на 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99% гомологична; отличается в не более чем 1%, 2%, 5%, 10%, 15%, 20%, 30%, или 40% аминокислотных остатков по сравнению с; отличается в по меньшей мере 1, 2, 5, 10 или 20 аминокислотах, но не более чем в 100, 80, 70, 60, 50, 40 или 30 аминокислотах от; или идентична Cas9 S. pyogenes:




В ряде вариантов осуществления молекула Cas9 представляет собой вариант Cas9 S. pyogenes под SEQ ID NO: 205, который содержит одну или несколько мутаций по положительно заряженным аминокислотам (например, в лизине, аргинине или гистидине), за счет этих мутаций вводится незаряженная или неполярная аминокислота, например, аланин в указанное положение. В ряде вариантов осуществления мутация осуществляется по одной или нескольким положительно заряженным аминокислотам в nt-бороздке Cas9. В ряде вариантов осуществления молекула Cas9 представляет собой вариант Cas9 S. pyogenes под SEQ ID NO: 205, который содержит мутацию в положении 855 в SEQ ID NO: 205, например мутацию с заменой на незаряженную аминокислоту, например, аланин, в положении 855 SEQ ID NO: 205. В ряде вариантов осуществления молекула Cas9 содержит мутацию только в положении 855 в SEQ ID NO: 205 по сравнению с SEQ ID NO: 205, например, с заменой на незаряженную аминокислоту, например, аланин. В ряде вариантов осуществления молекула Cas9 представляет собой вариант Cas9 S. pyogenes под SEQ ID NO: 205, который содержит мутацию в положении 810, мутацию в положении 1003 и/или мутацию в положении 1060 в SEQ ID NO: 205, например мутацию с заменой на аланин в положении 810, положении 1003 и/или положении 1060 в SEQ ID NO: 205. В ряде вариантов осуществления молекула Cas9 содержит мутацию только в положении 810, положении 1003 и положении 1060 в SEQ ID NO: 205 по сравнению с SEQ ID NO: 205, при этом, например, каждая мутация осуществляется с заменой на незаряженную аминокислоту, например, аланин. В ряде вариантов осуществления молекула Cas9 представляет собой вариант Cas9 S. pyogenes под SEQ ID NO: 205, который содержит мутацию в положении 848, мутацию в положении 1003 и/или мутацию в положении 1060 в SEQ ID NO: 205, например мутацию с заменой на аланин в положении 848, положении 1003 и/или положении 1060 в SEQ ID NO: 205. В ряде вариантов осуществления молекула Cas9 содержит мутацию только в положении 848, положении 1003 и положении 1060 в SEQ ID NO: 205 по сравнению с SEQ ID NO: 205, при этом, например, каждая мутация осуществляется с заменой на незаряженную аминокислоту, например, аланин. В ряде вариантов осуществления молекула Cas9 представляет собой молекулу Cas9, описанную в публикации Slaymaker et al., Science Express, доступной в сети интернете с 1 декабря 2015 г. под Science DOI: 10.1126/science.aad5227.
В ряде вариантов осуществления молекула Cas9 представляет собой вариант Cas9 S. pyogenes под SEQ ID NO: 205, который содержит одну или несколько мутаций. В ряде вариантов осуществления вариант Cas9 содержит мутацию в положении 80 в SEQ ID NO: 205, например, содержит лейцин в положении 80 в SEQ ID NO: 205 (т. е. содержит, например, состоит из SEQ ID NO: 205 с мутацией C80L). В ряде вариантов осуществления вариант Cas9 содержит мутацию в положении 574 в SEQ ID NO: 205, например, содержит глутаминовую кислоту в положении 574 в SEQ ID NO: 205 (т. е. содержит, например, состоит из SEQ ID NO: 205 с мутацией C574E). В ряде вариантов осуществления вариант Cas9 содержит мутацию в положении 80 и мутацию в положении 574 в SEQ ID NO: 205, например, содержит лейцин в положении 80 в SEQ ID NO: 205 и глутаминовую кислоту в положении 574 в SEQ ID NO: 205 (т. е. содержит, например, состоит из SEQ ID NO: 205 с мутацией C80L и мутацией C574E). Не ограничиваясь теорией полагают, что такие мутации улучшают свойства растворения молекулы Cas9.
В ряде вариантов осуществления молекула Cas9 представляет собой вариант Cas9 S. pyogenes под SEQ ID NO: 205, который содержит одну или несколько мутаций. В ряде вариантов осуществления вариант Cas9 содержит мутацию в положении 147 в SEQ ID NO: 205, например, содержит тирозин в положении 147 в SEQ ID NO: 205 (т. е. содержит, например, состоит из SEQ ID NO: 205 с мутацией D147Y). В ряде вариантов осуществления вариант Cas9 содержит мутацию в положении 411 в SEQ ID NO: 205, например, содержит треонин в положении 411 в SEQ ID NO: 205 (т. е. содержит, например, состоит из SEQ ID NO: 205 с мутацией P411T). В ряде вариантов осуществления вариант Cas9 содержит мутацию в положении 147 и мутацию в положении 411 в SEQ ID NO: 205, например, содержит тирозин в положении 147 в SEQ ID NO: 205 и треонин в положение 411 SEQ ID NO: 205 (т. е. содержит, например, состоит из SEQ ID NO: 205 с мутацией D147Y и мутацией P411T). Не ограничиваясь теорией полагают, что такие мутации улучшают эффективность нацеливания молекулы Cas9, например, у дрожжей.
В ряде вариантов осуществления молекула Cas9 представляет собой вариант Cas9 S. pyogenes под SEQ ID NO: 205, который содержит одну или несколько мутаций. В ряде вариантов осуществления вариант Cas9 содержит мутацию в положении 1135 в SEQ ID NO: 205, например, содержит глутаминовую кислоту в положении 1135 в SEQ ID NO: 205 (т. е. содержит, например, состоит из SEQ ID NO: 205 с мутацией D1135E). Не ограничиваясь теорией полагают, что такие мутации улучшают селективность молекулы Cas9 в по отношению к последовательности PAM NGG в противоположность с последовательностью PAM NAG.
В ряде вариантов осуществления молекула Cas9 представляет собой вариант Cas9 S. pyogenes под SEQ ID NO: 205, который содержит одну или несколько мутаций, за счет которых которые вводится незаряженная или неполярная аминокислота, например, аланин, в определенные положения. В ряде вариантов осуществления молекула Cas9 представляет собой вариант Cas9 S. pyogenes под SEQ ID NO: 205, который содержит мутацию в положении 497, мутацию в положении 661, мутацию в положении 695 и/или мутацию в положении 926 в SEQ ID NO: 205, например мутацию с заменой на аланин в положении 497, положении 661, положении 695 и/или положении 926 в SEQ ID NO: 205. В ряде вариантов осуществления молекула Cas9 содержит мутацию только в положении 497, положении 661, положении 695 и положении 926 в SEQ ID NO: 205 по сравнению с SEQ ID NO: 205, при этом, например, каждая мутация осуществляется с заменой на незаряженную аминокислоту, например, аланин. Не ограничиваясь теорией полагают, что такие мутации снижают вероятность разрезания молекулой Cas9 в нецелевых сайтах.
Будет понятно, что мутации, описанные в данном документе для молекулы Cas9, можно объединять и можно объединять с любой из слитых молекул или других модификаций, описанных в данном документе, и с молекулой Cas9, тестируемой в анализах, описанных в данном документе.
Различные типы молекул Cas можно применять для практического осуществления настоящего изобретения, раскрытого в данном документе. В некоторых вариантах осуществления используют молекулы Cas из систем Cas типа II. В других вариантах осуществления используют молекулы Cas из других систем Cas. Например, можно использовать молекулы Cas типа I или типа III. Иллюстративные молекулы Cas (и системы Cas) описаны, например, в Haft et ai, PLoS COMPUTATIONAL BIOLOGY 2005, 1(6): e60 и Makarova et al, NATURE REVIEW MICROBIOLOGY 201 1, 9:467-477, содержание этих ссылочных материалов включено в данный документ посредством ссылки во всей их полноте.
В одном варианте осуществления молекула Cas9 обладает одной или несколькими из следующих активностей: никазной активностью; активностью к расщеплению двух нитей (например, эндонуклеазной и/или экзонуклеазной активностью); хеликазной активностью или способностью вместе с молекулой gRNA перемещаться к целевой нуклеиновой кислоте.
Измененные молекулы Cas9
Существующие в природе молекулы Cas9 обладают рядом свойств, включая никазную активность, нуклеазную активность (например, эндонуклеазную и/или экзонуклеазную активность); хеликазную активность; способность к функциональной ассоциации с молекулой gRNA и способность к нацеливанию на (или к перемещению к сайту) на сайт в нуклеиновой кислоте (например, распознавание и специфичность PAM). В одном варианте осуществления молекулы Cas9 могут иметь все такие свойства или подгруппу таких свойств. В типичных вариантах осуществления молекулы Cas9 обладают способностью к взаимодействию с молекулой gRNA, и в сочетании с молекулой gRNA к перемещению к сайту в нуклеиновой кислоте. Другие активности, например, специфичность по отношению к PAM, активность расщепления или хеликазная активность могут более широко варьироваться у молекул Cas9.
Молекулы Cas9 с необходимыми свойствами можно получать с помощью ряда способов, например, путем изменения исходных, например, существующих в природе молекул Cas9 с целью получения измененной молекулы Cas9, обладающей необходимым свойством. Например, можно вводить одну или несколько мутаций или отличий по сравнению с исходной молекулой Cas9. Такие мутации и отличия предусматривают замены (например, консервативные замены или замены заменимых аминокислот); вставки или делеции. В одном варианте осуществления молекула Cas9 может содержать одну или несколько мутаций или отличий, например, по меньшей мере 1, 2, 3, 4, 5, 10, 15, 20, 30, 40 или 50 мутаций, но менее 200, 100 или 80 мутаций по сравнению с эталонной молекулой Cas9.
В одном варианте осуществления мутация или мутации не оказывают значительного эффекта на активность Cas9, например активность Cas9, описанную в данном документе. В одном варианте осуществления мутация или мутации оказывают значительный эффект на активность Cas9, например активность Cas9, описанную в данном документе. В одном варианте осуществления иллюстративные активности представляют собой одну или несколько из специфичности по отношению к PAM, расщепляющей активности и хеликазной активности. Мутация(мутации) могут присутствовать, например, в одном или нескольких из RuvC-подобного домена, например, N-концевого RuvC-подобного домена; HNH-подобного домена; участка за пределами RuvC-подобного домена и HNH-подобного домена. В некоторых вариантах осуществления мутация(мутации) присутствуют в N-концевом RuvC-подобном домене. В некоторых вариантах осуществления мутация(мутации) присутствуют в HNH-подобном домене. В некоторых вариантах осуществления мутации присутствуют как в N-концевом RuvC-подобном домене, так и в HNH-подобном домене.
Может ли конкретная последовательность, например, замена, оказывать влияние на одну или несколько активностей, таких как нацеливающая активность, расщепляющая активность и т. д., можно оценивать или предсказывать, например, с помощью оценки того, является ли мутация консервативной, или с помощью способа, описанного в разделе IIΙ. В одном варианте осуществления "остаток заменимой аминокислоты", используемый в контексте молекулы Cas9, представляет собой остаток, который можно изменить по сравнению с последовательностью дикого типа молекулы Cas9, например, существующей в природе молекулы Cas9, например, активной молекулы Cas9, без устранения или более предпочтительно без значительного изменения активности Cas9 (например, расщепляющей активности), при этом изменение остатка "незаменимой" аминокислоты приводит в результате к значительной потере активности (например, расщепляющей активности).
Молекулы Cas9 с измененным распознаванием PAM или без распознавания PAM
Существующие в природе молекулы Cas9 могут распознавать конкретные последовательности PAM, например последовательности распознавания PAM, описанные выше для S. pyogenes, S. thermophilus, S. mutans, S. aureus и N. meningitidis.
В одном варианте осуществления молекула Cas9 характеризуется теми же видами специфичности по отношению к PAM, как и существующая в природе молекула Cas9. В других вариантах осуществления молекула Cas9 характеризуется специфичностью по отношению к PAM, не ассоциированной с существующей в природе молекулой Cas9, или со специфичностью по отношению к PAM, не ассоциированной с существующей в природе молекулой Cas9, с которой она имеет наивысшую гомологию последовательности. Например, существующую в природе молекулу Cas9 можно изменить, например, с целью изменения распознавания PAM, например, для изменения последовательности PAM, которую молекула Cas9 распознает, с целью для снижения количества нецелевых сайтов и/или улучшения специфичности; или для сокращения количества необходимых условий распознавания PAM. В одном варианте осуществления молекулу Cas9 можно изменить, например, с целью увеличения длины последовательности распознавания PAM и/или улучшения специфичности Cas9 до высокого уровня идентичности для снижения количества нецелевых сайтов и повышения специфичности. В одном варианте осуществления длина последовательности распознавания PAM составляет по меньшей мере 4, 5, 6, 7, 8, 9, 10 или 15 аминокислот в длину. Молекулы Cas9, которые распознают различные последовательности PAM и/или обладают сниженной нецелевой активностью, можно получать с применением направленной эволюции. Иллюстративные способы и системы, которые можно использовать для направленной эволюции молекул Cas9, описаны, например, в Esvelt el al, Nature 2011, 472(7344): 499-503. Кандидатные молекулы Cas9 можно оценивать, например, с помощью способов, описанных в данном документе.
Нерасщепляющие молекулы Cas9 и молекулы Cas9 с модифицированным расщеплением
В одном варианте осуществления молекула Cas9 обладает расщепляющим свойством, которое отличается от существующих в природе молекул Cas9, например, которое отличается от такого свойства у существующей в природе молекулы Cas9, обладающей наивысшей гомологией. Например, молекула Cas9 может отличатся от существующих в природе молекул Cas9, например, от молекулы Cas9 S. pyogenes по ряду следующих свойств: по ее способности модулировать, например, снижать или повышать расщепление двух нитей посредством введения разрыва (эндонуклеазная и/или экзонуклеазная активность), например, по сравнению с существующей в природе молекулой Cas9 (например, молекулой Cas9 S. pyogenes); по ее способности модулировать, например, снижать или повышать расщепление одной нити нуклеиновой кислоты, например, некомплементарной нити молекулы нуклеиновой кислоты или комплементарной нити молекулы нуклеиновой кислоты (никазная активность), например, по сравнению с существующей в природе молекулой Cas9 (например, молекулой Cas9 S. pyogenes); или по способности расщеплять молекулу нуклеиновой кислоты, например, двухнитевой или однонитевой молекулы нуклеиновой кислоты, который могут быть устранены.
Модифицированные с расщепляющей активностью молекулы Cas9
В одном варианте осуществления активная молекула Cas9 обладает одой или несколькими следующими активностями: расщепляющей активностью, ассоциированной с N-концевым RuvC-подобным доменом; расщепляющей активностью, ассоциированной с HNH-подобным доменом; расщепляющей активностью, ассоциированной с доменом HNH, и расщепляющей активностью, ассоциированной с N-концевым RuvC-подобным доменом.
В одном варианте осуществления молекула Cas9 представляет собой никазу Cas9, например, расщепляет только одну нить ДНК. В одном варианте осуществления никаза Cas9 содержит мутацию в положении 10 и/или мутацию в положении 840 в SEQ ID NO: 205, например, содержит мутацию D10A и/или H840A в SEQ ID NO: 205.
Нерасщепляющие неактивные молекулы Cas9
В одном варианте осуществления измененная молекула Cas9 представляет собой неактивную молекулу Cas9, которая не расщепляет молекулу нуклеиновой кислоты (будь то двухнитевые или однонитевые молекулы нуклеиновой кислоты) или расщепляет молекулу нуклеиновой кислоты со значительно меньшей эффективностью, например, составляющей менее 20, 10, 5, 1 или 0,1% от активности расщепления эталонной молекулы Cas9, что, например, измерено с помощью анализа, описанного в данном документе. Эталонная молекула Cas9 может представлять собой существующую в природе немодифицированную молекулу Cas9, например, существующую в природе молекулу Cas9, такую как молекулу Cas9 S. pyogenes, S. thermophilus, S. aureus или N. meningitidis. В одном варианте осуществления эталонная молекула Cas9 представляет собой существующую в природе молекулу Cas9, обладающую наивысшей идентичностью или гомологией последовательности. В одном варианте осуществления у неактивной молекулы Cas9 отсутствует значительной расщепляющая активность, ассоциированная с N-концевым RuvC-подобным доменом, и расщепляющая активностью, ассоциированная с HNH-подобным доменом.
В одном варианте осуществления молекула Cas9 представляет собой dCas9. Tsai et al. (2014), Nat. Biotech. 32:569-577.
Каталитически неактивная молекула Cas9 может быть слита с репрессором транскрипции. Неактивный слитый белок Cas9 образует комплекс с gRNA и направляется к последовательности ДНК, указанной нацеливающим доменом gRNA, но в отличие от активного Cas9 он не будет расщеплять целевую ДНК. Слияние эффекторного домена, такого как домен репрессии транскрипции, с неактивным Cas9 обеспечивает рекрутинг эффектора к любому сайту в ДНК, указанному с помощью gRNA. Сайт-специфическое нацеливание слитого белка Cas9 на промоторный участок гена может блокировать или оказывать влияние на связывание полимеразы с промоторным участком, например, слияние Cas9 с фактором транскрипции (например, активатором транскрипции) и/или связывание энхансера транскрипции с нуклеиновой кислотой с целью повышения или подавления активации транскрипции. В качестве альтернативы сайт-специфическое нацеливание Cas9, слитого с репрессором транскрипции, на промоторный участок гена можно использовать для снижения активации транскрипции.
Репрессоры транскрипции или репрессорные домены транскрипции, которые могут быть слиты с неактивной молекулой Cas9, могут включать Kruppel-ассоциированный бокс (KRAB или SKD), домен взаимодействия Mad mSIN3 (SID) или репрессорный домен ERF (ERD).
В другом варианте осуществления неактивная молекула Cas9 может быть слита с белком, который модифицирует хроматин. Например, неактивная молекула Cas9 может быть слита с белком гетерохроматина 1 (HP1), гистоновой лизиновой метилтрансферазой (например, SUV39H 1, SUV39H2, G9A, ESET/SETDB l, Pr-SET7/8, SUV4-20H 1, RIZ1), гистоновыми лизиновыми диметилазами (например, LSD1/BHC1 10, SpLsdl/Sw, l/Safl 10, Su(var)3-3, JMJD2A/JHDM3A, JMJD2B, JMJD2C/GASC1, JMJD2D, Rph l, JARID 1 A/RBP2, JARI DIB/PLU-I, JAR1D 1C/SMCX, JARID1 D/SMCY, Lid, Jhn2, Jmj2), гистоновыми лизиновыми дезацетилазами (например, HDAC1, HDAC2, HDAC3, HDAC8, Rpd3, Hos l, Cir6, HDAC4, HDAC5, HDAC7, HDAC9, Hdal, Cir3, SIRT 1, SIRT2, Sir2, Hst l, Hst2, Hst3, Hst4, HDAC 1 1) и ДНК-метилазами (DNMT1, DNMT2a/DMNT3b, MET1). Слитый белок на основе неактивной молекулы Cas9-модифицирующей хроматин можно использовать для изменения статуса хроматина для снижения экспрессии целевого гена.
Гетерологичную последовательность (например, репрессорный домен транскрипции) можно сливать с N- или C-концом неактивного белка Cas9. В альтернативном варианте осуществления гетерологичную последовательность (например, домен репрессии транскрипции) можно сливать с внутренней частью (т. е. частью, отличной от N-конца или C-конца) неактивного белка Cas9.
Способность комплекса молекула Cas9/молекула gRNA связываться с целевой нуклеиновой кислотой и расщеплять ее можно оценивать, например, с помощью способов, описанных в данном документе в разделе IIΙ. Активность молекулы Cas9, например, либо активной Cas9, либо неактивной Cas9, отдельно или в комплексе с молекулой gRNA, можно также оценивать с помощью способов, широко известных из уровня техники, включающих анализ экспрессии гена и анализы хроматина, например, иммунопреципитация хроматина (ChiP) и анализ хроматина in vivo (CiA).
Другие слитые молекулы на основе Cas9
В ряде вариантов осуществления молекула Cas9, например, Cas9 S. pyogenes, может дополнительно содержать одну или несколько аминокислотных последовательностей, которые придают дополнительную активность.
В некоторых аспектах молекула Cas9 может содержать одну или несколько последовательностей ядерной локализации (NLS), например по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, или более NLS. В некоторых вариантах осуществления молекула Cas9 содержит по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, или более NLS в или аминоконце или рядом с ним, по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более NLS в карбоксиконце или рядом с ним или их комбинацию (например, одну или несколько NLS на аминоконце и одну или несколько NLS на карбоксиконце). Если присутствует более одной NLS, то каждая может быть выбрана независимо из других так, что одна NLS может присутствовать в более чем одной копии и/или в комбинации с одной или несколькими другими NLS, присутствующими в одной или нескольких копиях. В некоторых вариантах осуществления NLS считается расположенной рядом с N- или C-концом, если ближайшая аминокислота NLS находится в пределах приблизительно 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 40, 50, или больше аминокислот вдоль полипептидной цепи от N- или C-конца. Как правило, NLS состоит из одной или нескольких коротких последовательностей положительно заряженных лизинов или аргининов, расположенных на поверхности белка, но при этом известны и другие типы NLS. Неограничивающие примеры NLS включают последовательность NLS, содержащую или полученную из NLS большого T-антигена вируса SV40, имеющего аминокислотную последовательность PKKKRKV (SEQ ID NO: 206); NLS из нуклеоплазмина (например, двойного NLS нуклеоплазмина с последовательностью KRPAATKKAGQAKKKK (SEQ ID NO: 207); NLS c-myc, имеющую аминокислотную последовательность PAAKRVKLD (SEQ ID NO: 208) или RQRRNELKRSP (SEQ ID NO: 209); NLS hRNPA1 M9, имеющую последовательность NQSSNFGPMKGGNFGGRSSGPYGGGGQYFAKPRNQGGY (SEQ ID NO: 210); последовательность RMRIZFKNKGKDTAELRRRRVEVSVELRKAKKDEQILKRRNV (SEQ ID NO: 211) домена IBB из импортина-альфа; последовательности VSRKRPRP (SEQ ID NO: 212) и PPKKARED (SEQ ID NO: 213) T-белка миомы; последовательность PQPKKKPL (SEQ ID NO: 214) p53 человека; последовательность SALIKKKKKMAP (SEQ ID NO: 215) c-ab1 IV мыши; последовательности DRLRR (SEQ ID NO: 216) и PKQKKRK (SEQ ID NO: 217) NS1 вируса гриппа; последовательность RKLKKKIKKL (SEQ ID NO: 218) дельта-антигена вируса гепатита; последовательность REKKKFLKRR (SEQ ID NO: 219) белка Mx1 мыши; последовательность KRKGDEVDGVDEVAKKKSKK (SEQ ID NO: 220) поли(ADP-рибоза)-полимеразы человека; и последовательность RKCLQAGMNLEARKTKK (SEQ ID NO: 221) глюкокортикоидных рецепторов стероидного гормона (человека). Другие подходящие последовательности NLS известны из уровня техники (например, Sorokin, Biochemistry (Moscow) (2007) 72:13, 1439-1457; Lange J Biol Chem. (2007) 282:8, 5101-5).
В одном варианте осуществления молекула Cas9, например, молекула Cas9 S. pyogenes, содержит последовательность NLS SV40, например, расположенную в направлении N-конца относительно молекулы Cas9. В одном варианте осуществления молекула Cas9, например, молекула Cas9 S. pyogenes, содержит последовательность NLS SV40, расположенную в направлении N-конца относительно молекулы Cas9, и последовательность NLS SV40, расположенную в направлении C-конца относительно молекулы Cas9. В одном варианте осуществления молекула Cas9, например, молекула Cas9 S. pyogenes, содержит последовательность NLS SV40, расположенную в направлении N-конца относительно молекулы Cas9, и последовательность NLS нуклеоплазмина, расположенную в направлении C-конца относительно молекулы Cas9. В любом из вышеупомянутых вариантов осуществления молекула может дополнительно содержать метку, например, His-метку, например, His(6)-метку (SEQ ID NO: 247) или His(8)-метку (SEQ ID NO: 248), например, на N-конце или C-конце.
В некоторых аспектах молекула Cas9 может содержать одну или несколько аминокислотных последовательностей, которые обеспечивают специфическое распознавание молекулы Cas9, например, метку. В одном варианте осуществления метка представляет собой гистидиновую метку, например, гистидиновую метку, содержащую по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10 или больше аминокислот, представляющих собой гистидин. В ряде вариантов осуществления гистидиновая метка представляет собой His6-метку (шесть гистидинов) (SEQ ID NO: 247). В других вариантах осуществления гистидиновая метка представляет собой His8-метку (восемь гистидинов) (SEQ ID NO: 248). В ряде вариантов осуществления гистидиновая метка может быть отделена от одной или нескольких других частей молекулы Cas9 посредством линкера. В ряде вариантов осуществления линкер представляет собой GGS. Примером такой слитой молекулы является молекула Cas9 iProt106520.
В некоторых аспектах молекула Cas9 может содержать одну или несколько аминокислотных последовательностей, которые распознаются протеазой (например, содержать сайт для расщепления протеазой). В ряде вариантов осуществления сайт расщепления представляет собой сайт расщепления из вируса гравировки табака (TEV), например, содержит последовательность ENLYFQG (SEQ ID NO: 230). В некоторых аспектах сайт для расщепления протеазой, например, сайт расщепления TEV, расположен между меткой, например, His-меткой, например, His6 (SEQ ID NO: 247) или His8-меткой (SEQ ID NO: 248), и остальной частью молекулы Cas9. Не ограничиваясь теорией полагают, что такое введение обеспечит возможность использования метки, например, для очистки молекулы Cas9, с последующим расщеплением, чтобы метка не влияла на функцию молекулы Cas9.
В ряде вариантов осуществления молекула Cas9 (например, молекула Cas9, описанная в данном документе) содержит N-концевой NLS и C-концевой NLS (например, содержит от N- к C-концу NLS-Cas9-NLS), при этом, например, каждая NLS представляет собой NLS SV40 (PKKKRKV (SEQ ID NO: 206)). В ряде вариантов осуществления молекула Cas9 (например, молекула Cas9, описанная в данном документе) содержит N-концевой NLS, C-концевой NLS и C-концевую His6-метку (SEQ ID NO: 247) (например, содержит от N- к C-концу NLS-Cas9-NLS-His-метку), при этом, например, каждый NLS представляет собой NLS SV40 (PKKKRKV (SEQ ID NO: 206)). В ряде вариантов осуществления молекула Cas9 (например, молекула Cas9, описанная в данном документе) содержит N-концевую His-метку (например, His6-метку (SEQ ID NO: 247)), N-концевую NLS и C-концевую NLS (например, содержит от N- к C-концу His-метку-NLS-Cas9-NLS), при этом, например, каждая NLS представляет собой NLS SV40 (PKKKRKV (SEQ ID NO: 206)). В ряде вариантов осуществления молекула Cas9 (например, молекула Cas9, описанная в данном документе) содержит N-концевой NLS и C-концевую His-метку (например, His6-метку (SEQ ID NO: 247)) (например, содержит от N- к C-концу His-метку-Cas9-NLS) при этом, например, NLS представляет собой NLS SV40 (PKKKRKV (SEQ ID NO: 206)). В ряде вариантов осуществления молекула Cas9 (например, молекула Cas9, описанная в данном документе) содержит N-концевой NLS и C-концевую His-метку (например, His6-метку (SEQ ID NO: 247)) (например, содержит от N- к C-концу NLS-Cas9-His-метку), например, при этом NLS представляет собой NLS SV40 (PKKKRKV (SEQ ID NO: 206)). В ряде вариантов осуществления молекула Cas9 (например, молекула Cas9, описанная в данном документе) содержит N-концевую His-метку (например, His8-метку (SEQ ID NO: 248)), N-концевой домен расщепления (например, домен расщепления вируса гравировки табака (TEV) (например, содержит последовательность ENLYFQG (SEQ ID NO: 230))), N-концевой NLS (например, NLS SV40; SEQ ID NO: 206) и C-концевой NLS (например, NLS SV40; SEQ ID NO: 206) (например, содержит от N- к C-концу His-метку-TEV-NLS-Cas9-NLS). В любом из вышеупомянутых вариантов осуществления Cas9 имеет последовательность под SEQ ID NO: 205. В качестве альтернативы в любом из вышеупомянутых вариантов осуществления Cas9 имеет последовательность варианта Cas9 под SEQ ID NO: 205, например, описанного в данном документе. В любом из вышеупомянутых вариантов осуществления молекула Cas9 содержит линкер между His-меткой и другой частью молекулы, например, линкер GGS. Аминокислотные последовательности иллюстративных молекул Cas9, описанных выше, представлены ниже. Идентификационные номера "iProt" соответствуют таким номерам на фигуре 60.
iProt105026 (также называемый iProt106154, iProt106331, iProt106545 и PID426303 в зависимости от получения белка) (SEQ ID NO: 233):
MAPKKKRKVD KKYSIGLDIG TNSVGWAVIT DEYKVPSKKF KVLGNTDRHS IKKNLIGALL FDSGETAEAT RLKRTARRRY TRRKNRICYL QEIFSNEMAK VDDSFFHRLE ESFLVEEDKK HERHPIFGNI VDEVAYHEKY PTIYHLRKKL VDSTDKADLR LIYLALAHMI KFRGHFLIEG DLNPDNSDVD KLFIQLVQTY NQLFEENPIN ASGVDAKAIL SARLSKSRRL ENLIAQLPGE KKNGLFGNLI ALSLGLTPNF KSNFDLAEDA KLQLSKDTYD DDLDNLLAQI GDQYADLFLA AKNLSDAILL SDILRVNTEI TKAPLSASMI KRYDEHHQDL TLLKALVRQQ LPEKYKEIFF DQSKNGYAGY IDGGASQEEF YKFIKPILEK MDGTEELLVK LNREDLLRKQ RTFDNGSIPH QIHLGELHAI LRRQEDFYPF LKDNREKIEK ILTFRIPYYV GPLARGNSRF AWMTRKSEET ITPWNFEEVV DKGASAQSFI ERMTNFDKNL PNEKVLPKHS LLYEYFTVYN ELTKVKYVTE GMRKPAFLSG EQKKAIVDLL FKTNRKVTVK QLKEDYFKKI ECFDSVEISG VEDRFNASLG TYHDLLKIIK DKDFLDNEEN EDILEDIVLT LTLFEDREMI EERLKTYAHL FDDKVMKQLK RRRYTGWGRL SRKLINGIRD KQSGKTILDF LKSDGFANRN FMQLIHDDSL TFKEDIQKAQ VSGQGDSLHE HIANLAGSPA IKKGILQTVK VVDELVKVMG RHKPENIVIE MARENQTTQK GQKNSRERMK RIEEGIKELG SQILKEHPVE NTQLQNEKLY LYYLQNGRDM YVDQELDINR LSDYDVDHIV PQSFLKDDSI DNKVLTRSDK NRGKSDNVPS EEVVKKMKNY WRQLLNAKLI TQRKFDNLTK AERGGLSELD KAGFIKRQLV ETRQITKHVA QILDSRMNTK YDENDKLIRE VKVITLKSKL VSDFRKDFQF YKVREINNYH HAHDAYLNAV VGTALIKKYP KLESEFVYGD YKVYDVRKMI AKSEQEIGKA TAKYFFYSNI MNFFKTEITL ANGEIRKRPL IETNGETGEI VWDKGRDFAT VRKVLSMPQV NIVKKTEVQT GGFSKESILP KRNSDKLIAR KKDWDPKKYG GFDSPTVAYS VLVVAKVEKG KSKKLKSVKE LLGITIMERS SFEKNPIDFL EAKGYKEVKK DLIIKLPKYS LFELENGRKR MLASAGELQK GNELALPSKY VNFLYLASHY EKLKGSPEDN EQKQLFVEQH KHYLDEIIEQ ISEFSKRVIL ADANLDKVLS AYNKHRDKPI REQAENIIHL FTLTNLGAPA AFKYFDTTID RKRYTSTKEV LDATLIHQSI TGLYETRIDL SQLGGDSRAD PKKKRKVHHH HHH
iProt106518 (SEQ ID NO: 234):
MAPKKKRKVD KKYSIGLDIG TNSVGWAVIT DEYKVPSKKF KVLGNTDRHS IKKNLIGALL FDSGETAEAT RLKRTARRRY TRRKNRILYL QEIFSNEMAK VDDSFFHRLE ESFLVEEDKK HERHPIFGNI VDEVAYHEKY PTIYHLRKKL VDSTDKADLR LIYLALAHMI KFRGHFLIEG DLNPDNSDVD KLFIQLVQTY NQLFEENPIN ASGVDAKAIL SARLSKSRRL ENLIAQLPGE KKNGLFGNLI ALSLGLTPNF KSNFDLAEDA KLQLSKDTYD DDLDNLLAQI GDQYADLFLA AKNLSDAILL SDILRVNTEI TKAPLSASMI KRYDEHHQDL TLLKALVRQQ LPEKYKEIFF DQSKNGYAGY IDGGASQEEF YKFIKPILEK MDGTEELLVK LNREDLLRKQ RTFDNGSIPH QIHLGELHAI LRRQEDFYPF LKDNREKIEK ILTFRIPYYV GPLARGNSRF AWMTRKSEET ITPWNFEEVV DKGASAQSFI ERMTNFDKNL PNEKVLPKHS LLYEYFTVYN ELTKVKYVTE GMRKPAFLSG EQKKAIVDLL FKTNRKVTVK QLKEDYFKKI EEFDSVEISG VEDRFNASLG TYHDLLKIIK DKDFLDNEEN EDILEDIVLT LTLFEDREMI EERLKTYAHL FDDKVMKQLK RRRYTGWGRL SRKLINGIRD KQSGKTILDF LKSDGFANRN FMQLIHDDSL TFKEDIQKAQ VSGQGDSLHE HIANLAGSPA IKKGILQTVK VVDELVKVMG RHKPENIVIE MARENQTTQK GQKNSRERMK RIEEGIKELG SQILKEHPVE NTQLQNEKLY LYYLQNGRDM YVDQELDINR LSDYDVDHIV PQSFLKDDSI DNKVLTRSDK NRGKSDNVPS EEVVKKMKNY WRQLLNAKLI TQRKFDNLTK AERGGLSELD KAGFIKRQLV ETRQITKHVA QILDSRMNTK YDENDKLIRE VKVITLKSKL VSDFRKDFQF YKVREINNYH HAHDAYLNAV VGTALIKKYP KLESEFVYGD YKVYDVRKMI AKSEQEIGKA TAKYFFYSNI MNFFKTEITL ANGEIRKRPL IETNGETGEI VWDKGRDFAT VRKVLSMPQV NIVKKTEVQT GGFSKESILP KRNSDKLIAR KKDWDPKKYG GFDSPTVAYS VLVVAKVEKG KSKKLKSVKE LLGITIMERS SFEKNPIDFL EAKGYKEVKK DLIIKLPKYS LFELENGRKR MLASAGELQK GNELALPSKY VNFLYLASHY EKLKGSPEDN EQKQLFVEQH KHYLDEIIEQ ISEFSKRVIL ADANLDKVLS AYNKHRDKPI REQAENIIHL FTLTNLGAPA AFKYFDTTID RKRYTSTKEV LDATLIHQSI TGLYETRIDL SQLGGDSRAD PKKKRKVHHH HHH
iProt106519 (SEQ ID NO: 235):
MGSSHHHHHH HHENLYFQGS MDKKYSIGLD IGTNSVGWAV ITDEYKVPSK KFKVLGNTDR HSIKKNLIGA LLFDSGETAE ATRLKRTARR RYTRRKNRIC YLQEIFSNEM AKVDDSFFHR LEESFLVEED KKHERHPIFG NIVDEVAYHE KYPTIYHLRK KLVDSTDKAD LRLIYLALAH MIKFRGHFLI EGDLNPDNSD VDKLFIQLVQ TYNQLFEENP INASGVDAKA ILSARLSKSR RLENLIAQLP GEKKNGLFGN LIALSLGLTP NFKSNFDLAE DAKLQLSKDT YDDDLDNLLA QIGDQYADLF LAAKNLSDAI LLSDILRVNT EITKAPLSAS MIKRYDEHHQ DLTLLKALVR QQLPEKYKEI FFDQSKNGYA GYIDGGASQE EFYKFIKPIL EKMDGTEELL VKLNREDLLR KQRTFDNGSI PHQIHLGELH AILRRQEDFY PFLKDNREKI EKILTFRIPY YVGPLARGNS RFAWMTRKSE ETITPWNFEE VVDKGASAQS FIERMTNFDK NLPNEKVLPK HSLLYEYFTV YNELTKVKYV TEGMRKPAFL SGEQKKAIVD LLFKTNRKVT VKQLKEDYFK KIECFDSVEI SGVEDRFNAS LGTYHDLLKI IKDKDFLDNE ENEDILEDIV LTLTLFEDRE MIEERLKTYA HLFDDKVMKQ LKRRRYTGWG RLSRKLINGI RDKQSGKTIL DFLKSDGFAN RNFMQLIHDD SLTFKEDIQK AQVSGQGDSL HEHIANLAGS PAIKKGILQT VKVVDELVKV MGRHKPENIV IEMARENQTT QKGQKNSRER MKRIEEGIKE LGSQILKEHP VENTQLQNEK LYLYYLQNGR DMYVDQELDI NRLSDYDVDH IVPQSFLKDD SIDNKVLTRS DKNRGKSDNV PSEEVVKKMK NYWRQLLNAK LITQRKFDNL TKAERGGLSE LDKAGFIKRQ LVETRQITKH VAQILDSRMN TKYDENDKLI REVKVITLKS KLVSDFRKDF QFYKVREINN YHHAHDAYLN AVVGTALIKK YPKLESEFVY GDYKVYDVRK MIAKSEQEIG KATAKYFFYS NIMNFFKTEI TLANGEIRKR PLIETNGETG EIVWDKGRDF ATVRKVLSMP QVNIVKKTEV QTGGFSKESI LPKRNSDKLI ARKKDWDPKK YGGFDSPTVA YSVLVVAKVE KGKSKKLKSV KELLGITIME RSSFEKNPID FLEAKGYKEV KKDLIIKLPK YSLFELENGR KRMLASAGEL QKGNELALPS KYVNFLYLAS HYEKLKGSPE DNEQKQLFVE QHKHYLDEII EQISEFSKRV ILADANLDKV LSAYNKHRDK PIREQAENII HLFTLTNLGA PAAFKYFDTT IDRKRYTSTK EVLDATLIHQ SITGLYETRI DLSQLGGDGG GSPKKKRKV
iProt106520 (SEQ ID NO: 236):
MAHHHHHHGG SPKKKRKVDK KYSIGLDIGT NSVGWAVITD EYKVPSKKFK VLGNTDRHSI KKNLIGALLF DSGETAEATR LKRTARRRYT RRKNRICYLQ EIFSNEMAKV DDSFFHRLEE SFLVEEDKKH ERHPIFGNIV DEVAYHEKYP TIYHLRKKLV DSTDKADLRL IYLALAHMIK FRGHFLIEGD LNPDNSDVDK LFIQLVQTYN QLFEENPINA SGVDAKAILS ARLSKSRRLE NLIAQLPGEK KNGLFGNLIA LSLGLTPNFK SNFDLAEDAK LQLSKDTYDD DLDNLLAQIG DQYADLFLAA KNLSDAILLS DILRVNTEIT KAPLSASMIK RYDEHHQDLT LLKALVRQQL PEKYKEIFFD QSKNGYAGYI DGGASQEEFY KFIKPILEKM DGTEELLVKL NREDLLRKQR TFDNGSIPHQ IHLGELHAIL RRQEDFYPFL KDNREKIEKI LTFRIPYYVG PLARGNSRFA WMTRKSEETI TPWNFEEVVD KGASAQSFIE RMTNFDKNLP NEKVLPKHSL LYEYFTVYNE LTKVKYVTEG MRKPAFLSGE QKKAIVDLLF KTNRKVTVKQ LKEDYFKKIE CFDSVEISGV EDRFNASLGT YHDLLKIIKD KDFLDNEENE DILEDIVLTL TLFEDREMIE ERLKTYAHLF DDKVMKQLKR RRYTGWGRLS RKLINGIRDK QSGKTILDFL KSDGFANRNF MQLIHDDSLT FKEDIQKAQV SGQGDSLHEH IANLAGSPAI KKGILQTVKV VDELVKVMGR HKPENIVIEM ARENQTTQKG QKNSRERMKR IEEGIKELGS QILKEHPVEN TQLQNEKLYL YYLQNGRDMY VDQELDINRL SDYDVDHIVP QSFLKDDSID NKVLTRSDKN RGKSDNVPSE EVVKKMKNYW RQLLNAKLIT QRKFDNLTKA ERGGLSELDK AGFIKRQLVE TRQITKHVAQ ILDSRMNTKY DENDKLIREV KVITLKSKLV SDFRKDFQFY KVREINNYHH AHDAYLNAVV GTALIKKYPK LESEFVYGDY KVYDVRKMIA KSEQEIGKAT AKYFFYSNIM NFFKTEITLA NGEIRKRPLI ETNGETGEIV WDKGRDFATV RKVLSMPQVN IVKKTEVQTG GFSKESILPK RNSDKLIARK KDWDPKKYGG FDSPTVAYSV LVVAKVEKGK SKKLKSVKEL LGITIMERSS FEKNPIDFLE AKGYKEVKKD LIIKLPKYSL FELENGRKRM LASAGELQKG NELALPSKYV NFLYLASHYE KLKGSPEDNE QKQLFVEQHK HYLDEIIEQI SEFSKRVILA DANLDKVLSA YNKHRDKPIR EQAENIIHLF TLTNLGAPAA FKYFDTTIDR KRYTSTKEVL DATLIHQSIT GLYETRIDLS QLGGDSRADP KKKRKV
iProt106521 (SEQ ID NO: 237):
MAPKKKRKVD KKYSIGLDIG TNSVGWAVIT DEYKVPSKKF KVLGNTDRHS IKKNLIGALL FDSGETAEAT RLKRTARRRY TRRKNRICYL QEIFSNEMAK VDDSFFHRLE ESFLVEEDKK HERHPIFGNI VDEVAYHEKY PTIYHLRKKL VDSTDKADLR LIYLALAHMI KFRGHFLIEG DLNPDNSDVD KLFIQLVQTY NQLFEENPIN ASGVDAKAIL SARLSKSRRL ENLIAQLPGE KKNGLFGNLI ALSLGLTPNF KSNFDLAEDA KLQLSKDTYD DDLDNLLAQI GDQYADLFLA AKNLSDAILL SDILRVNTEI TKAPLSASMI KRYDEHHQDL TLLKALVRQQ LPEKYKEIFF DQSKNGYAGY IDGGASQEEF YKFIKPILEK MDGTEELLVK LNREDLLRKQ RTFDNGSIPH QIHLGELHAI LRRQEDFYPF LKDNREKIEK ILTFRIPYYV GPLARGNSRF AWMTRKSEET ITPWNFEEVV DKGASAQSFI ERMTNFDKNL PNEKVLPKHS LLYEYFTVYN ELTKVKYVTE GMRKPAFLSG EQKKAIVDLL FKTNRKVTVK QLKEDYFKKI ECFDSVEISG VEDRFNASLG TYHDLLKIIK DKDFLDNEEN EDILEDIVLT LTLFEDREMI EERLKTYAHL FDDKVMKQLK RRRYTGWGRL SRKLINGIRD KQSGKTILDF LKSDGFANRN FMQLIHDDSL TFKEDIQKAQ VSGQGDSLHE HIANLAGSPA IKKGILQTVK VVDELVKVMG RHKPENIVIE MARENQTTQK GQKNSRERMK RIEEGIKELG SQILKEHPVE NTQLQNEKLY LYYLQNGRDM YVDQELDINR LSDYDVDHIV PQSFLKDDSI DNKVLTRSDK NRGKSDNVPS EEVVKKMKNY WRQLLNAKLI TQRKFDNLTK AERGGLSELD KAGFIKRQLV ETRQITKHVA QILDSRMNTK YDENDKLIRE VKVITLKSKL VSDFRKDFQF YKVREINNYH HAHDAYLNAV VGTALIKKYP KLESEFVYGD YKVYDVRKMI AKSEQEIGKA TAKYFFYSNI MNFFKTEITL ANGEIRKRPL IETNGETGEI VWDKGRDFAT VRKVLSMPQV NIVKKTEVQT GGFSKESILP KRNSDKLIAR KKDWDPKKYG GFDSPTVAYS VLVVAKVEKG KSKKLKSVKE LLGITIMERS SFEKNPIDFL EAKGYKEVKK DLIIKLPKYS LFELENGRKR MLASAGELQK GNELALPSKY VNFLYLASHY EKLKGSPEDN EQKQLFVEQH KHYLDEIIEQ ISEFSKRVIL ADANLDKVLS AYNKHRDKPI REQAENIIHL FTLTNLGAPA AFKYFDTTID RKRYTSTKEV LDATLIHQSI TGLYETRIDL SQLGGDSRAD HHHHHH
iProt106522 (SEQ ID NO: 238):
MAHHHHHHGG SDKKYSIGLD IGTNSVGWAV ITDEYKVPSK KFKVLGNTDR HSIKKNLIGA LLFDSGETAE ATRLKRTARR RYTRRKNRIC YLQEIFSNEM AKVDDSFFHR LEESFLVEED KKHERHPIFG NIVDEVAYHE KYPTIYHLRK KLVDSTDKAD LRLIYLALAH MIKFRGHFLI EGDLNPDNSD VDKLFIQLVQ TYNQLFEENP INASGVDAKA ILSARLSKSR RLENLIAQLP GEKKNGLFGN LIALSLGLTP NFKSNFDLAE DAKLQLSKDT YDDDLDNLLA QIGDQYADLF LAAKNLSDAI LLSDILRVNT EITKAPLSAS MIKRYDEHHQ DLTLLKALVR QQLPEKYKEI FFDQSKNGYA GYIDGGASQE EFYKFIKPIL EKMDGTEELL VKLNREDLLR KQRTFDNGSI PHQIHLGELH AILRRQEDFY PFLKDNREKI EKILTFRIPY YVGPLARGNS RFAWMTRKSE ETITPWNFEE VVDKGASAQS FIERMTNFDK NLPNEKVLPK HSLLYEYFTV YNELTKVKYV TEGMRKPAFL SGEQKKAIVD LLFKTNRKVT VKQLKEDYFK KIECFDSVEI SGVEDRFNAS LGTYHDLLKI IKDKDFLDNE ENEDILEDIV LTLTLFEDRE MIEERLKTYA HLFDDKVMKQ LKRRRYTGWG RLSRKLINGI RDKQSGKTIL DFLKSDGFAN RNFMQLIHDD SLTFKEDIQK AQVSGQGDSL HEHIANLAGS PAIKKGILQT VKVVDELVKV MGRHKPENIV IEMARENQTT QKGQKNSRER MKRIEEGIKE LGSQILKEHP VENTQLQNEK LYLYYLQNGR DMYVDQELDI NRLSDYDVDH IVPQSFLKDD SIDNKVLTRS DKNRGKSDNV PSEEVVKKMK NYWRQLLNAK LITQRKFDNL TKAERGGLSE LDKAGFIKRQ LVETRQITKH VAQILDSRMN TKYDENDKLI REVKVITLKS KLVSDFRKDF QFYKVREINN YHHAHDAYLN AVVGTALIKK YPKLESEFVY GDYKVYDVRK MIAKSEQEIG KATAKYFFYS NIMNFFKTEI TLANGEIRKR PLIETNGETG EIVWDKGRDF ATVRKVLSMP QVNIVKKTEV QTGGFSKESI LPKRNSDKLI ARKKDWDPKK YGGFDSPTVA YSVLVVAKVE KGKSKKLKSV KELLGITIME RSSFEKNPID FLEAKGYKEV KKDLIIKLPK YSLFELENGR KRMLASAGEL QKGNELALPS KYVNFLYLAS HYEKLKGSPE DNEQKQLFVE QHKHYLDEII EQISEFSKRV ILADANLDKV LSAYNKHRDK PIREQAENII HLFTLTNLGA PAAFKYFDTT IDRKRYTSTK EVLDATLIHQ SITGLYETRI DLSQLGGDSR ADPKKKRKV
iProt106658 (SEQ ID NO: 239):
MGSSHHHHHH HHENLYFQGS MDKKYSIGLD IGTNSVGWAV ITDEYKVPSK KFKVLGNTDR HSIKKNLIGA LLFDSGETAE ATRLKRTARR RYTRRKNRIC YLQEIFSNEM AKVDDSFFHR LEESFLVEED KKHERHPIFG NIVDEVAYHE KYPTIYHLRK KLVDSTDKAD LRLIYLALAH MIKFRGHFLI EGDLNPDNSD VDKLFIQLVQ TYNQLFEENP INASGVDAKA ILSARLSKSR RLENLIAQLP GEKKNGLFGN LIALSLGLTP NFKSNFDLAE DAKLQLSKDT YDDDLDNLLA QIGDQYADLF LAAKNLSDAI LLSDILRVNT EITKAPLSAS MIKRYDEHHQ DLTLLKALVR QQLPEKYKEI FFDQSKNGYA GYIDGGASQE EFYKFIKPIL EKMDGTEELL VKLNREDLLR KQRTFDNGSI PHQIHLGELH AILRRQEDFY PFLKDNREKI EKILTFRIPY YVGPLARGNS RFAWMTRKSE ETITPWNFEE VVDKGASAQS FIERMTNFDK NLPNEKVLPK HSLLYEYFTV YNELTKVKYV TEGMRKPAFL SGEQKKAIVD LLFKTNRKVT VKQLKEDYFK KIECFDSVEI SGVEDRFNAS LGTYHDLLKI IKDKDFLDNE ENEDILEDIV LTLTLFEDRE MIEERLKTYA HLFDDKVMKQ LKRRRYTGWG RLSRKLINGI RDKQSGKTIL DFLKSDGFAN RNFMQLIHDD SLTFKEDIQK AQVSGQGDSL HEHIANLAGS PAIKKGILQT VKVVDELVKV MGRHKPENIV IEMARENQTT QKGQKNSRER MKRIEEGIKE LGSQILKEHP VENTQLQNEK LYLYYLQNGR DMYVDQELDI NRLSDYDVDH IVPQSFLKDD SIDNKVLTRS DKNRGKSDNV PSEEVVKKMK NYWRQLLNAK LITQRKFDNL TKAERGGLSE LDKAGFIKRQ LVETRQITKH VAQILDSRMN TKYDENDKLI REVKVITLKS KLVSDFRKDF QFYKVREINN YHHAHDAYLN AVVGTALIKK YPKLESEFVY GDYKVYDVRK MIAKSEQEIG KATAKYFFYS NIMNFFKTEI TLANGEIRKR PLIETNGETG EIVWDKGRDF ATVRKVLSMP QVNIVKKTEV QTGGFSKESI LPKRNSDKLI ARKKDWDPKK YGGFDSPTVA YSVLVVAKVE KGKSKKLKSV KELLGITIME RSSFEKNPID FLEAKGYKEV KKDLIIKLPK YSLFELENGR KRMLASAGEL QKGNELALPS KYVNFLYLAS HYEKLKGSPE DNEQKQLFVE QHKHYLDEII EQISEFSKRV ILADANLDKV LSAYNKHRDK PIREQAENII HLFTLTNLGA PAAFKYFDTT IDRKRYTSTK EVLDATLIHQ SITGLYETRI DLSQLGGDGG GSPKKKRKV
iProt106745 (SEQ ID NO: 240):
MAPKKKRKVD KKYSIGLDIG TNSVGWAVIT DEYKVPSKKF KVLGNTDRHS IKKNLIGALL FDSGETAEAT RLKRTARRRY TRRKNRICYL QEIFSNEMAK VDDSFFHRLE ESFLVEEDKK HERHPIFGNI VDEVAYHEKY PTIYHLRKKL VDSTDKADLR LIYLALAHMI KFRGHFLIEG DLNPDNSDVD KLFIQLVQTY NQLFEENPIN ASGVDAKAIL SARLSKSRRL ENLIAQLPGE KKNGLFGNLI ALSLGLTPNF KSNFDLAEDA KLQLSKDTYD DDLDNLLAQI GDQYADLFLA AKNLSDAILL SDILRVNTEI TKAPLSASMI KRYDEHHQDL TLLKALVRQQ LPEKYKEIFF DQSKNGYAGY IDGGASQEEF YKFIKPILEK MDGTEELLVK LNREDLLRKQ RTFDNGSIPH QIHLGELHAI LRRQEDFYPF LKDNREKIEK ILTFRIPYYV GPLARGNSRF AWMTRKSEET ITPWNFEEVV DKGASAQSFI ERMTNFDKNL PNEKVLPKHS LLYEYFTVYN ELTKVKYVTE GMRKPAFLSG EQKKAIVDLL FKTNRKVTVK QLKEDYFKKI ECFDSVEISG VEDRFNASLG TYHDLLKIIK DKDFLDNEEN EDILEDIVLT LTLFEDREMI EERLKTYAHL FDDKVMKQLK RRRYTGWGRL SRKLINGIRD KQSGKTILDF LKSDGFANRN FMQLIHDDSL TFKEDIQKAQ VSGQGDSLHE HIANLAGSPA IKKGILQTVK VVDELVKVMG RHKPENIVIE MARENQTTQK GQKNSRERMK RIEEGIKELG SQILKEHPVE NTQLQNEKLY LYYLQNGRDM YVDQELDINR LSDYDVDHIV PQSFLKDDSI DNAVLTRSDK NRGKSDNVPS EEVVKKMKNY WRQLLNAKLI TQRKFDNLTK AERGGLSELD KAGFIKRQLV ETRQITKHVA QILDSRMNTK YDENDKLIRE VKVITLKSKL VSDFRKDFQF YKVREINNYH HAHDAYLNAV VGTALIKKYP KLESEFVYGD YKVYDVRKMI AKSEQEIGKA TAKYFFYSNI MNFFKTEITL ANGEIRKRPL IETNGETGEI VWDKGRDFAT VRKVLSMPQV NIVKKTEVQT GGFSKESILP KRNSDKLIAR KKDWDPKKYG GFDSPTVAYS VLVVAKVEKG KSKKLKSVKE LLGITIMERS SFEKNPIDFL EAKGYKEVKK DLIIKLPKYS LFELENGRKR MLASAGELQK GNELALPSKY VNFLYLASHY EKLKGSPEDN EQKQLFVEQH KHYLDEIIEQ ISEFSKRVIL ADANLDKVLS AYNKHRDKPI REQAENIIHL FTLTNLGAPA AFKYFDTTID RKRYTSTKEV LDATLIHQSI TGLYETRIDL SQLGGDSRAD PKKKRKVHHH HHH
iProt106746 (SEQ ID NO: 241):
MAPKKKRKVD KKYSIGLDIG TNSVGWAVIT DEYKVPSKKF KVLGNTDRHS IKKNLIGALL FDSGETAEAT RLKRTARRRY TRRKNRICYL QEIFSNEMAK VDDSFFHRLE ESFLVEEDKK HERHPIFGNI VDEVAYHEKY PTIYHLRKKL VDSTDKADLR LIYLALAHMI KFRGHFLIEG DLNPDNSDVD KLFIQLVQTY NQLFEENPIN ASGVDAKAIL SARLSKSRRL ENLIAQLPGE KKNGLFGNLI ALSLGLTPNF KSNFDLAEDA KLQLSKDTYD DDLDNLLAQI GDQYADLFLA AKNLSDAILL SDILRVNTEI TKAPLSASMI KRYDEHHQDL TLLKALVRQQ LPEKYKEIFF DQSKNGYAGY IDGGASQEEF YKFIKPILEK MDGTEELLVK LNREDLLRKQ RTFDNGSIPH QIHLGELHAI LRRQEDFYPF LKDNREKIEK ILTFRIPYYV GPLARGNSRF AWMTRKSEET ITPWNFEEVV DKGASAQSFI ERMTNFDKNL PNEKVLPKHS LLYEYFTVYN ELTKVKYVTE GMRKPAFLSG EQKKAIVDLL FKTNRKVTVK QLKEDYFKKI ECFDSVEISG VEDRFNASLG TYHDLLKIIK DKDFLDNEEN EDILEDIVLT LTLFEDREMI EERLKTYAHL FDDKVMKQLK RRRYTGWGRL SRKLINGIRD KQSGKTILDF LKSDGFANRN FMQLIHDDSL TFKEDIQKAQ VSGQGDSLHE HIANLAGSPA IKKGILQTVK VVDELVKVMG RHKPENIVIE MARENQTTQK GQKNSRERMK RIEEGIKELG SQILKEHPVE NTQLQNEALY LYYLQNGRDM YVDQELDINR LSDYDVDHIV PQSFLKDDSI DNKVLTRSDK NRGKSDNVPS EEVVKKMKNY WRQLLNAKLI TQRKFDNLTK AERGGLSELD KAGFIKRQLV ETRQITKHVA QILDSRMNTK YDENDKLIRE VKVITLKSKL VSDFRKDFQF YKVREINNYH HAHDAYLNAV VGTALIKKYP ALESEFVYGD YKVYDVRKMI AKSEQEIGKA TAKYFFYSNI MNFFKTEITL ANGEIRKAPL IETNGETGEI VWDKGRDFAT VRKVLSMPQV NIVKKTEVQT GGFSKESILP KRNSDKLIAR KKDWDPKKYG GFDSPTVAYS VLVVAKVEKG KSKKLKSVKE LLGITIMERS SFEKNPIDFL EAKGYKEVKK DLIIKLPKYS LFELENGRKR MLASAGELQK GNELALPSKY VNFLYLASHY EKLKGSPEDN EQKQLFVEQH KHYLDEIIEQ ISEFSKRVIL ADANLDKVLS AYNKHRDKPI REQAENIIHL FTLTNLGAPA AFKYFDTTID RKRYTSTKEV LDATLIHQSI TGLYETRIDL SQLGGDSRAD PKKKRKVHHH HHH
iProt106747 (SEQ ID NO: 242):
MAPKKKRKVD KKYSIGLDIG TNSVGWAVIT DEYKVPSKKF KVLGNTDRHS IKKNLIGALL FDSGETAEAT RLKRTARRRY TRRKNRICYL QEIFSNEMAK VDDSFFHRLE ESFLVEEDKK HERHPIFGNI VDEVAYHEKY PTIYHLRKKL VDSTDKADLR LIYLALAHMI KFRGHFLIEG DLNPDNSDVD KLFIQLVQTY NQLFEENPIN ASGVDAKAIL SARLSKSRRL ENLIAQLPGE KKNGLFGNLI ALSLGLTPNF KSNFDLAEDA KLQLSKDTYD DDLDNLLAQI GDQYADLFLA AKNLSDAILL SDILRVNTEI TKAPLSASMI KRYDEHHQDL TLLKALVRQQ LPEKYKEIFF DQSKNGYAGY IDGGASQEEF YKFIKPILEK MDGTEELLVK LNREDLLRKQ RTFDNGSIPH QIHLGELHAI LRRQEDFYPF LKDNREKIEK ILTFRIPYYV GPLARGNSRF AWMTRKSEET ITPWNFEEVV DKGASAQSFI ERMTNFDKNL PNEKVLPKHS LLYEYFTVYN ELTKVKYVTE GMRKPAFLSG EQKKAIVDLL FKTNRKVTVK QLKEDYFKKI ECFDSVEISG VEDRFNASLG TYHDLLKIIK DKDFLDNEEN EDILEDIVLT LTLFEDREMI EERLKTYAHL FDDKVMKQLK RRRYTGWGRL SRKLINGIRD KQSGKTILDF LKSDGFANRN FMQLIHDDSL TFKEDIQKAQ VSGQGDSLHE HIANLAGSPA IKKGILQTVK VVDELVKVMG RHKPENIVIE MARENQTTQK GQKNSRERMK RIEEGIKELG SQILKEHPVE NTQLQNEKLY LYYLQNGRDM YVDQELDINR LSDYDVDHIV PQSFLADDSI DNKVLTRSDK NRGKSDNVPS EEVVKKMKNY WRQLLNAKLI TQRKFDNLTK AERGGLSELD KAGFIKRQLV ETRQITKHVA QILDSRMNTK YDENDKLIRE VKVITLKSKL VSDFRKDFQF YKVREINNYH HAHDAYLNAV VGTALIKKYP ALESEFVYGD YKVYDVRKMI AKSEQEIGKA TAKYFFYSNI MNFFKTEITL ANGEIRKAPL IETNGETGEI VWDKGRDFAT VRKVLSMPQV NIVKKTEVQT GGFSKESILP KRNSDKLIAR KKDWDPKKYG GFDSPTVAYS VLVVAKVEKG KSKKLKSVKE LLGITIMERS SFEKNPIDFL EAKGYKEVKK DLIIKLPKYS LFELENGRKR MLASAGELQK GNELALPSKY VNFLYLASHY EKLKGSPEDN EQKQLFVEQH KHYLDEIIEQ ISEFSKRVIL ADANLDKVLS AYNKHRDKPI REQAENIIHL FTLTNLGAPA AFKYFDTTID RKRYTSTKEV LDATLIHQSI TGLYETRIDL SQLGGDSRAD PKKKRKVHHH HHH
iProt106884 (SEQ ID NO: 243):
MAPKKKRKVD KKYSIGLDIG TNSVGWAVIT DEYKVPSKKF KVLGNTDRHS IKKNLIGALL FDSGETAEAT RLKRTARRRY TRRKNRICYL QEIFSNEMAK VDDSFFHRLE ESFLVEEDKK HERHPIFGNI VDEVAYHEKY PTIYHLRKKL VDSTDKADLR LIYLALAHMI KFRGHFLIEG DLNPDNSDVD KLFIQLVQTY NQLFEENPIN ASGVDAKAIL SARLSKSRRL ENLIAQLPGE KKNGLFGNLI ALSLGLTPNF KSNFDLAEDA KLQLSKDTYD DDLDNLLAQI GDQYADLFLA AKNLSDAILL SDILRVNTEI TKAPLSASMI KRYDEHHQDL TLLKALVRQQ LPEKYKEIFF DQSKNGYAGY IDGGASQEEF YKFIKPILEK MDGTEELLVK LNREDLLRKQ RTFDNGSIPH QIHLGELHAI LRRQEDFYPF LKDNREKIEK ILTFRIPYYV GPLARGNSRF AWMTRKSEET ITPWNFEEVV DKGASAQSFI ERMTAFDKNL PNEKVLPKHS LLYEYFTVYN ELTKVKYVTE GMRKPAFLSG EQKKAIVDLL FKTNRKVTVK QLKEDYFKKI ECFDSVEISG VEDRFNASLG TYHDLLKIIK DKDFLDNEEN EDILEDIVLT LTLFEDREMI EERLKTYAHL FDDKVMKQLK RRRYTGWGAL SRKLINGIRD KQSGKTILDF LKSDGFANRN FMALIHDDSL TFKEDIQKAQ VSGQGDSLHE HIANLAGSPA IKKGILQTVK VVDELVKVMG RHKPENIVIE MARENQTTQK GQKNSRERMK RIEEGIKELG SQILKEHPVE NTQLQNEKLY LYYLQNGRDM YVDQELDINR LSDYDVDHIV PQSFLKDDSI DNKVLTRSDK NRGKSDNVPS EEVVKKMKNY WRQLLNAKLI TQRKFDNLTK AERGGLSELD KAGFIKRQLV ETRAITKHVA QILDSRMNTK YDENDKLIRE VKVITLKSKL VSDFRKDFQF YKVREINNYH HAHDAYLNAV VGTALIKKYP KLESEFVYGD YKVYDVRKMI AKSEQEIGKA TAKYFFYSNI MNFFKTEITL ANGEIRKRPL IETNGETGEI VWDKGRDFAT VRKVLSMPQV NIVKKTEVQT GGFSKESILP KRNSDKLIAR KKDWDPKKYG GFDSPTVAYS VLVVAKVEKG KSKKLKSVKE LLGITIMERS SFEKNPIDFL EAKGYKEVKK DLIIKLPKYS LFELENGRKR MLASAGELQK GNELALPSKY VNFLYLASHY EKLKGSPEDN EQKQLFVEQH KHYLDEIIEQ ISEFSKRVIL ADANLDKVLS AYNKHRDKPI REQAENIIHL FTLTNLGAPA AFKYFDTTID RKRYTSTKEV LDATLIHQSI TGLYETRIDL SQLGGDSRAD PKKKRKVHHH HHH
iProt 20109496 (SEQ ID NO: 244)
MAPKKKRKVDKKYSIGLDIGTNSVGWAVITDEYKVPSKKFKVLGNTDRHSIKKNLIGALLFDSGETAEATRLKRTARRRYTRRKNRILYLQEIFSNEMAKVDDSFFHRLEESFLVEEDKKHERHPIFGNIVDEVAYHEKYPTIYHLRKKLVDSTDKADLRLIYLALAHMIKFRGHFLIEGDLNPDNSDVDKLFIQLVQTYNQLFEENPINASGVDAKAILSARLSKSRRLENLIAQLPGEKKNGLFGNLIALSLGLTPNFKSNFDLAEDAKLQLSKDTYDDDLDNLLAQIGDQYADLFLAAKNLSDAILLSDILRVNTEITKAPLSASMIKRYDEHHQDLTLLKALVRQQLPEKYKEIFFDQSKNGYAGYIDGGASQEEFYKFIKPILEKMDGTEELLVKLNREDLLRKQRTFDNGSIPHQIHLGELHAILRRQEDFYPFLKDNREKIEKILTFRIPYYVGPLARGNSRFAWMTRKSEETITPWNFEEVVDKGASAQSFIERMTNFDKNLPNEKVLPKHSLLYEYFTVYNELTKVKYVTEGMRKPAFLSGEQKKAIVDLLFKTNRKVTVKQLKEDYFKKIEEFDSVEISGVEDRFNASLGTYHDLLKIIKDKDFLDNEENEDILEDIVLTLTLFEDREMIEERLKTYAHLFDDKVMKQLKRRRYTGWGRLSRKLINGIRDKQSGKTILDFLKSDGFANRNFMQLIHDDSLTFKEDIQKAQVSGQGDSLHEHIANLAGSPAIKKGILQTVKVVDELVKVMGRHKPENIVIEMARENQTTQKGQKNSRERMKRIEEGIKELGSQILKEHPVENTQLQNEKLYLYYLQNGRDMYVDQELDINRLSDYDVDHIVPQSFLKDDSIDNKVLTRSDKNRGKSDNVPSEEVVKKMKNYWRQLLNAKLITQRKFDNLTKAERGGLSELDKAGFIKRQLVETRQITKHVAQILDSRMNTKYDENDKLIREVKVITLKSKLVSDFRKDFQFYKVREINNYHHAHDAYLNAVVGTALIKKYPKLESEFVYGDYKVYDVRKMIAKSEQEIGKATAKYFFYSNIMNFFKTEITLANGEIRKRPLIETNGETGEIVWDKGRDFATVRKVLSMPQVNIVKKTEVQTGGFSKESILPKRNSDKLIARKKDWDPKKYGGFDSPTVAYSVLVVAKVEKGKSKKLKSVKELLGITIMERSSFEKNPIDFLEAKGYKEVKKDLIIKLPKYSLFELENGRKRMLASAGELQKGNELALPSKYVNFLYLASHYEKLKGSPEDNEQKQLFVEQHKHYLDEIIEQISEFSKRVILADANLDKVLSAYNKHRDKPIREQAENIIHLFTLTNLGAPAAFKYFDTTIDRKRYTSTKEVLDATLIHQSITGLYETRIDLSQLGGDSRADHHHHHH
Нуклеиновые кислоты, кодирующие молекулы Cas9
Нуклеиновые кислоты, кодирующие молекулы Cas9, например, активную молекулу Cas9 или неактивную молекулы Cas9, представлены в данном документе.
Иллюстративные нуклеиновые кислоты, кодирующие молекулы Cas9, описаны в Cong et al, SCIENCE 2013, 399(6121):819-823; Wang et al, CELL 2013, 153(4):910-918; Mali et al., SCIENCE 2013, 399(6121):823-826; Jinek et al, SCIENCE 2012, 337(6096):816-821.
В одном варианте осуществления нуклеиновая кислота, кодирующая молекулу Cas9, может представлять собой последовательность синтетической нуклеиновой кислоты. Например, молекула синтетической нуклеиновой кислоты может быть химически модифицирована так, как, например, описано в разделе XIII. В одном варианте осуществления mRNA Cas9 обладает одним или несколькими, например, всеми из следующих свойств: она кэппирована, полиаденилирована, замещена 5-метилцитидином и/или псевдоуридином.
В дополнение или в качестве альтернативы последовательность синтетической нуклеиновой кислоты может быть кодон-оптимизированной, например, по меньшей мере один нераспространенный кодон или менее распространенный кодон был заменен распространенным кодоном. Например, синтетическая нуклеиновая кислота может управлять синтезом оптимизированной матричной РНК (mRNA), например, оптимизированной для экспрессии в системе экспрессии млекопитающего, например, описанной в данном документе.
Ниже представлена иллюстративная кодон-оптимизированная последовательность нуклеиновой кислоты, кодирующая молекулу Cas9 S. pyogenes.


Ниже представлена иллюстративная кодон-оптимизированная последовательность нуклеиновой кислоты, кодирующая молекулу Cas9, содержащую SEQ ID NO: 244:
ATGGCTCCGAAGAAAAAGCGTAAAGTGGATAAAAAATACAGCATTGGTCTGGACATTGGCACGAACTCAGTGGGTTGGGCGGTCATCACGGATGAATATAAGGTCCCGTCAAAAAAGTTCAAAGTGCTGGGCAACACCGATCGCCATTCGATTAAAAAGAATCTGATCGGCGCGCTGCTGTTTGATAGCGGTGAAACCGCGGAAGCAACGCGTCTGAAACGTACCGCACGTCGCCGTTACACGCGCCGTAAAAATCGTATTCTGTATCTGCAGGAAATCTTTAGCAACGAAATGGCGAAAGTTGATGACTCATTTTTCCACCGCCTGGAAGAATCGTTTCTGGTCGAAGAAGACAAAAAGCATGAACGTCACCCGATTTTCGGTAATATCGTTGATGAAGTCGCGTACCATGAAAAATATCCGACGATTTACCATCTGCGTAAAAAACTGGTGGATTCAACCGACAAAGCCGATCTGCGCCTGATTTACCTGGCACTGGCTCATATGATCAAATTTCGTGGCCACTTCCTGATTGAAGGTGACCTGAACCCGGATAACTCTGACGTTGATAAGCTGTTCATCCAGCTGGTCCAAACCTATAATCAGCTGTTCGAAGAAAACCCGATCAATGCAAGTGGCGTTGATGCGAAGGCCATTCTGTCCGCTCGCCTGAGTAAATCCCGCCGTCTGGAAAACCTGATTGCACAACTGCCGGGCGAAAAGAAAAACGGCCTGTTTGGTAATCTGATCGCTCTGTCACTGGGTCTGACGCCGAACTTTAAATCGAATTTCGACCTGGCAGAAGATGCTAAGCTGCAGCTGAGCAAAGATACCTACGATGACGATCTGGACAACCTGCTGGCGCAAATTGGTGACCAGTATGCCGACCTGTTTCTGGCGGCCAAAAATCTGTCAGATGCCATTCTGCTGTCGGACATCCTGCGCGTGAACACCGAAATCACGAAAGCGCCGCTGTCAGCCTCGATGATTAAACGCTACGATGAACATCACCAGGACCTGACCCTGCTGAAAGCACTGGTTCGTCAGCAACTGCCGGAAAAGTACAAGGAAATTTTCTTTGACCAATCTAAGAACGGCTATGCAGGTTACATCGATGGCGGTGCTAGTCAGGAAGAATTCTACAAGTTCATCAAGCCGATCCTGGAAAAAATGGATGGCACGGAAGAACTGCTGGTGAAACTGAATCGTGAAGATCTGCTGCGTAAACAACGCACCTTTGACAACGGCAGCATTCCGCATCAGATCCACCTGGGTGAACTGCATGCGATTCTGCGCCGTCAGGAAGATTTTTATCCGTTCCTGAAAGACAACCGTGAAAAAATTGAAAAGATCCTGACGTTTCGCATCCCGTATTACGTTGGCCCGCTGGCGCGTGGTAATAGCCGCTTCGCCTGGATGACCCGCAAATCTGAAGAAACCATTACGCCGTGGAACTTTGAAGAAGTGGTTGATAAAGGTGCAAGCGCTCAGTCTTTTATCGAACGTATGACCAATTTCGATAAAAACCTGCCGAATGAAAAGGTCCTGCCGAAACATAGCCTGCTGTATGAATACTTTACCGTGTACAACGAACTGACGAAAGTGAAGTATGTTACCGAAGGCATGCGCAAACCGGCGTTTCTGTCTGGTGAACAGAAAAAAGCCATTGTGGATCTGCTGTTCAAGACCAATCGTAAAGTTACGGTCAAACAGCTGAAGGAAGATTACTTCAAAAAGATCGAAGAATTCGACAGCGTGGAAATTTCTGGCGTTGAAGATCGTTTCAACGCCAGTCTGGGTACCTATCATGACCTGCTGAAGATCATCAAGGACAAGGATTTTCTGGATAACGAAGAAAATGAAGACATTCTGGAAGATATCGTGCTGACCCTGACGCTGTTCGAAGATCGTGAAATGATTGAAGAACGCCTGAAAACGTACGCACACCTGTTTGACGATAAAGTTATGAAGCAGCTGAAACGCCGTCGCTATACCGGCTGGGGTCGTCTGTCTCGCAAACTGATTAATGGCATCCGCGATAAGCAAAGTGGTAAAACGATTCTGGATTTCCTGAAATCCGACGGCTTTGCCAACCGTAATTTCATGCAGCTGATCCATGACGATAGTCTGACCTTTAAGGAAGACATTCAGAAAGCACAAGTGTCAGGCCAGGGTGATTCGCTGCATGAACACATTGCGAACCTGGCCGGCTCCCCGGCTATTAAAAAGGGTATCCTGCAGACCGTCAAAGTCGTGGATGAACTGGTGAAGGTTATGGGCCGTCACAAACCGGAAAACATTGTGATCGAAATGGCGCGCGAAAATCAGACCACGCAAAAGGGTCAGAAAAACTCACGTGAACGCATGAAGCGCATTGAAGAAGGCATCAAAGAACTGGGTTCGCAGATTCTGAAAGAACATCCGGTTGAAAACACCCAGCTGCAAAATGAAAAACTGTACCTGTATTACCTGCAAAATGGCCGTGACATGTATGTCGATCAGGAACTGGACATCAACCGCCTGAGCGACTATGATGTCGACCACATTGTGCCGCAGAGCTTTCTGAAGGACGATTCTATCGATAATAAAGTGCTGACCCGTTCTGATAAGAACCGCGGTAAAAGCGACAATGTTCCGTCTGAAGAAGTTGTCAAAAAGATGAAGAACTACTGGCGTCAACTGCTGAATGCGAAGCTGATTACGCAGCGTAAATTCGATAACCTGACCAAGGCGGAACGCGGCGGTCTGAGTGAACTGGATAAGGCCGGCTTTATCAAACGTCAACTGGTGGAAACCCGCCAGATTACGAAACATGTTGCCCAGATCCTGGATTCCCGCATGAACACGAAATATGACGAAAATGATAAGCTGATTCGTGAAGTCAAAGTGATCACCCTGAAGAGTAAGCTGGTGTCCGATTTCCGTAAGGACTTTCAGTTCTACAAAGTTCGCGAAATTAACAATTACCATCACGCACACGATGCTTATCTGAATGCAGTGGTTGGCACCGCTCTGATCAAAAAGTATCCGAAACTGGAAAGCGAATTTGTGTATGGTGATTACAAAGTCTATGACGTGCGCAAGATGATTGCGAAAAGTGAACAGGAAATCGGCAAGGCGACCGCCAAGTACTTTTTCTATTCCAACATCATGAACTTTTTCAAGACCGAAATCACGCTGGCAAATGGCGAAATTCGTAAACGCCCGCTGATCGAAACCAACGGCGAAACGGGTGAAATTGTGTGGGATAAAGGTCGTGACTTCGCGACCGTTCGCAAAGTCCTGTCAATGCCGCAAGTGAATATCGTTAAAAAGACCGAAGTTCAGACGGGCGGTTTTAGTAAAGAATCCATCCTGCCGAAGCGTAACTCGGATAAACTGATTGCGCGCAAAAAGGATTGGGACCCGAAAAAGTACGGCGGTTTTGATAGTCCGACCGTTGCATATTCCGTCCTGGTCGTGGCTAAAGTTGAAAAAGGCAAGAGTAAAAAGCTGAAGTCCGTCAAAGAACTGCTGGGTATTACCATCATGGAACGTAGCTCTTTTGAAAAGAACCCGATTGACTTCCTGGAAGCCAAGGGCTACAAAGAAGTGAAAAAGGATCTGATTATCAAGCTGCCGAAATATTCGCTGTTCGAACTGGAAAACGGTCGTAAACGCATGCTGGCAAGCGCTGGCGAACTGCAGAAGGGTAATGAACTGGCACTGCCGTCTAAATATGTGAACTTTCTGTACCTGGCTAGCCATTATGAAAAACTGAAGGGTTCTCCGGAAGATAACGAACAGAAGCAACTGTTCGTTGAACAACATAAACACTACCTGGATGAAATCATCGAACAGATCTCAGAATTCTCGAAACGCGTCATTCTGGCGGATGCCAATCTGGACAAAGTGCTGAGCGCGTATAACAAGCATCGTGATAAACCGATTCGCGAACAGGCCGAAAATATTATCCACCTGTTTACCCTGACGAACCTGGGCGCACCGGCAGCTTTTAAATACTTCGATACCACGATCGACCGTAAGCGCTATACCAGCACGAAAGAAGTTCTGGATGCTACCCTGATTCATCAGTCAATCACCGGTCTGTATGAAACGCGTATTGACCTGAGCCAACTGGGCGGTGATAGCCGTGCCGACCATCACCATCACCATCACTAATAG (SEQ ID NO: 223)
Если указанные выше последовательности Cas9 слиты с пептидом или полипептидом на C-конце (например, неактивная Cas9 слита с репрессором транскрипции на C-конце), то подразумевается, что стоп-кодон будет удален.
Также в данном документе представлены нуклеиновые кислоты, векторы и клетки для получения молекулы Cas9, например молекулы Cas9, описанной в данном документе. Рекомбинантное получения полипептидных молекул можно осуществлять с применением методик, известных специалисту в данной области техники. В данном документе описаны молекулы и способы, предназначенные для рекомбинантного получения полипептидных молекул, таких как молекулы Cas9, например, описанные в данном документе. При использовании в связи с данным документом "рекомбинантные" молекулы и "рекомбинантное" получение включает все полипептиды (например, молекулы Cas9, например, описанные в данном документе), которые получают, экспрессируют, создают или выделяют с помощью рекомбинантных способов, как например, полипептиды, выделенные из животного (например, мыши), которые являются трансгенными или трансхромосомными по нуклеиновой кислоте, кодирующей представляющую интерес молекулу, гибридомы, полученные из них, молекулы, выделенные из клетки-хозяина, трансформированной для экспрессии молекулы, например, из трансфектомы, молекулы, выделенные из рекомбинантной, комбинаторной библиотеки, и молекулы, полученные, экспрессированные, созданные или выделенные с помощью любых других способов, которые предусматривают сплайсинг всего гена, кодирующего молекулу (или ее часть), или его части в другие последовательности ДНК. Рекомбинантное получение может осуществляться из клетки-хозяина, например, клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую молекулу, описанную в данном документе, например, молекулу Cas9, например, молекулу Cas9, описанную в данном документе.
В данном документе представлены молекулы нуклеиновой кислоты, кодирующие молекулу (например, молекулу Cas9 и/или молекулу gRNA), например, описанную в данном документе. В частности, представлены молекулы нуклеиновой кислоты, содержащие последовательность, кодирующую любую из последовательностей под любым из от SEQ ID NO: 233 до SEQ ID NO: 244, или кодирующую фрагмент под любым из от SEQ ID NO: 233 до SEQ ID NO: 244, или кодирующую полипептид, который на по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% гомологичен последовательности под любым из SEQ ID NO: 233 до SEQ ID NO: 244.
В данном документе представлены векторы, например, описанные в данном документе, содержащие любую из вышеописанных молекул нуклеиновой кислоты. В ряде вариантов осуществления указанные молекулы нуклеиновой кислоты функционально связаны с промотором, например, промотором, функционально активным в клетке-хозяине, в которую вводят вектор.
В данном документе представлены клетки-хозяева, содержащие одну или несколько молекул нуклеиновой кислоты и/или векторы, описанные в данном документе. В ряде вариантов осуществления клетка-хозяин представляет собой прокариотическую клетку-хозяина. В ряде вариантов осуществления клетка-хозяин представляет собой эукариотическую клетку-хозяина. В ряде вариантов осуществления клетка-хозяин представляет собой дрожжевую клетку или E. coli. В ряде вариантов осуществления клетка-хозяин представляет собой клетку млекопитающего, например, клетку человека. Такие клетки-хозяева можно использовать для получения рекомбинантной молекулы, описанной в данном документе, например, молекулы Cas9 или gRNA, например, описанных в данном документе.
VI. Функциональный анализ кандидатных молекул
Кандидатные молекулы Cas9, кандидатные молекулы gRNA, кандидатные комплексы молекула Cas9/молекула gRNA можно оценивать с помощью способов, известных из уровня техники или описанных в данном документе. Например, иллюстративные способы оценки эндонуклеазной активности молекулы Cas9 описаны, например, в Jinek el al., SCIENCE 2012; 337(6096):8 16-821.
VII. Нуклеиновые кислоты, представляющие собой матрицу (для введения нуклеиновых кислот)
Используемый в данном документе термин "нуклеиновая кислота, представляющая собой матрицу" или "донорная матрица" относится к нуклеиновой кислоте, подлежащей вставке в целевую последовательность или рядом с ней, которая была модифицирована, например, расщеплена с помощью системы CRISPR по настоящему изобретению. В одном варианте осуществления последовательность нуклеиновой кислоты в целевой последовательности или рядом с ней модифицируют с тем, чтобы она содержала некоторую часть или всю последовательность нуклеиновой кислоты, представляющей собой матрицу, как правило в сайте(сайтах) расщепления или рядом с ними. В одном варианте осуществления нуклеиновая кислота, представляющая собой матрицу, является однонитевой. В альтернативном варианте осуществления нуклеиновая кислота, представляющая собой матрицу, является двухнитевой. В одном варианте осуществления нуклеиновая кислота, представляющая собой матрицу, представляет собой ДНК, например, двухнитевую ДНК. В альтернативном варианте осуществления нуклеиновая кислота, представляющая собой матрицу, представляет собой однонитевую ДНК.
В ряде вариантов осуществления нуклеиновая кислота, представляющая собой матрицу, содержит последовательность, кодирующую белок глобин, например, бета-глобин, например, содержит ген бета-глобина. В одном варианте осуществления бета-глобин, кодируемый нуклеиновой кислотой, содержит одну или несколько мутаций, например, мутаций против серповидности. В одном варианте осуществления бета-глобин, кодируемый нуклеиновой кислотой, содержит мутацию T87Q. В одном варианте осуществления бета-глобин, кодируемый нуклеиновой кислотой, содержит мутацию G16D. В одном варианте осуществления бета-глобин, кодируемый нуклеиновой кислотой, содержит мутацию E22A. В одном варианте осуществления ген бета-глобина содержит мутации G16D, E22A и T87Q. В ряде вариантов осуществления нуклеиновая кислота, представляющая собой матрицу, дополнительно содержит один или несколько регуляторных элементов, например, промотор (например, промотор бета-глобина человека), 3'-энхансер и/или по меньшей мере часть регуляторных участков локуса глобина (например, один или несколько сайтов гиперчувствительности к ДНКазе I (например, HS2, HS3 и/или HS4 локуса глобина человека)).
В других вариантах осуществления нуклеиновая кислота, представляющая собой матрицу, содержит последовательность, кодирующую гамма-глобин, например, содержит ген гамма-глобина. В ряде вариантов осуществления нуклеиновая кислота, представляющая собой матрицу, содержит последовательность, кодирующую более одной копии белка гамма-глобина, например, содержит две или более, например, две последовательности гена гамма-глобина. В ряде вариантов осуществления нуклеиновая кислота, представляющая собой матрицу, дополнительно содержит один или несколько регуляторных элементов, например, промотор и/или энхансер.
В одном варианте осуществления нуклеиновая кислота, представляющая собой матрицу, изменяет структуру целевого положения посредством участия в событии репарации, направляемом гомологией. В одном варианте осуществления нуклеиновая кислота, представляющая собой матрицу, изменяет последовательность целевого положения. В одном варианте осуществления нуклеиновая кислота, представляющая собой матрицу, приводит в результате к встраиванию модифицированного или не существующего в природе основания в целевую нуклеиновую кислоту.
Мутации в гене или сигнальном пути, описанных в данном документе, можно корректировать с использованием одного из подходов, рассмотренных в данном документе. В одном варианте осуществления мутацию в гене или сигнальном пути, описанных в данном документе, корректируют с помощью репарации, направляемой гомологией (HDR), с использованием нуклеиновой кислоты, представляющей собой матрицу. В одном варианте осуществления мутацию в гене или сигнальном пути, описанных в данном документе, корректируют посредством гомологичной рекомбинации (HR) с использованием нуклеиновой кислоты, представляющей собой матрицу. В одном варианте осуществления мутацию в гене или сигнальном пути, описанных в данном документе, корректируют посредством репарации негомологичного соединения концов (NHEJ) с использованием нуклеиновой кислоты, представляющей собой матрицу. В других вариантах осуществления нуклеиновую кислоту, кодирующую представляющие интерес молекулы, можно вставлять в сайт, модифицированный с помощью системы CRISPR по настоящему изобретению, или рядом с ним. В ряде вариантов осуществления нуклеиновая кислота, представляющая собой матрицу, содержит регуляторные элементы, например, один или несколько промоторов и/или энхансеров, функционально связанных с последовательностью нуклеиновой кислоты, кодирующей представляющую интерес молекулу, например, описанную в данном документе.
HDR- или HR-репарация и нуклеиновые кислоты, представляющие собой матрицу
Описанную в данном документе индуцированную нуклеазой репарацию, управляемую гомологией (HDR), или гомологичную рекомбинацию (HR) можно использовать для изменения целевой последовательности и коррекции (например, репарации или редактирования) мутации в геноме. Не ограничиваясь теорией полагают, что изменение целевой последовательности возникает с помощью репарации на основе донорной матрицы или нуклеиновой кислоты, представляющей собой матрицу. Например, донорная матрица или нуклеиновая кислота, представляющая собой матрицу, обеспечивают изменение целевой последовательности. Предполагается, что плазмиду-донора или линейную двухнитевую матрицу можно использовать в качестве матрицы для гомологичной рекомбинации. Дополнительно предполагается, что однонитевую донорную матрицу можно использовать в качестве матрицы для изменения целевой последовательности с помощью альтернативных способов репарации, управляемой гомологией (например, однонитевой отжиг), между целевой последовательностью и донорной матрицей. Изменение под влиянием донорной матрицы целевой последовательности может зависеть от расщепления с помощью молекулы Cas9. Расщепление с помощью Cas9 может предусматривать двухнитевой разрыв, один однонитевой разрыв или два однонитевых разрыва.
В одном варианте осуществления мутацию можно корректировать либо с помощью одного двухнитевого разрыва или двух однонитевых разрывов. В одном варианте осуществления мутацию можно корректировать путем обеспечения матрицы и системы CRISPR/Cas9, которая создает (1) один двухнитевой разрыв, (2) два однонитевых разрыва, (3) два двухнитевых разрыва, при этом разрыв возникает на каждой стороне от целевой последовательности, (4) один двухнитевой разрыв и два однонитевых разрыва, при этом двухнитевой разрыв и два однонитевых разрыва возникают на каждой стороне от целевой последовательности, (5) четыре однонитевых разрыва, при этом пара однонитевых разрывов возникает на каждой стороне от целевой последовательности, или (6) один однонитевой разрыв.
Коррекция, опосредованная двухнитевым разрывом
В одном варианте осуществления двухнитевое расщепление осуществляется молекулой Cas9, обладающей расщепляющей активностью, ассоциированной с HNH-подобным доменом, и расщепляющей активностью, ассоциированной с RuvC-подобным доменом, например, N-концевым RuvC-подобным доменом, например, Cas9 дикого типа. В таких вариантах осуществления требуется только одна gRNA.
Коррекция, опосредованная однонитевым разрывом
В других вариантах осуществления два однонитевых разрыва или одноцепочечных разрыва осуществляются с помощью молекулы Cas9, обладающей никазной активностью, например, расщепляющей активностью, ассоциированной с HNH-подобным доменом, или расщепляющей активностью, ассоциированной с N-концевым RuvC-подобным доменом. Такие варианты осуществления требуют двух gRNA, одна для размещения каждого однонитевого разрыва. В одном варианте осуществления молекула Cas9, обладающая никазной активностью, расщепляет нить, с которой гибридизуется gRNA, но не нить, которая комплементарна нити, с которой гибридизуется gRNA. В одном варианте осуществления молекула Cas9, обладающая никазной активностью, не расщепляет нить, с которой гибридизуется gRNA, а наоборот, расщепляет нить, которая комплементарна нити, с которой гибридизуется gRNA.
В одном варианте осуществления никаза обладает активностью HNH, например, молекула Cas9, обладающая инактивированной активностью RuvC, например, молекула Cas9, имеющая мутацию в D10, например, мутацию D10A. D10A инактивирует RuvC; следовательно, никаза Cas9 обладает (только) активностью HNH и будет разрезать только нить, с которой гибридизуется gRNA (например, комплементарную нить, которая не несет PAM NGG на себе). В других вариантах осуществления молекулу Cas9, имеющую H840, например, мутацию H840A, можно использовать в качестве никазы. H840A инактивирует HNH; следовательно, никаза Cas9 обладает (только) активностью RuvC и разрезает некомплементарную нить (например, нить, которая имеет PAM NGG и последовательность которой идентична gRNA).
В одном варианте осуществления, в котором никазу и две gRNA используют для введения двух однонитевых разрывов, один однонитевой разрыв вводится в + нить и один однонитевой разрыв вводится в - нить целевой нуклеиновой кислоты. PAM обращены наружу. gRNA могут быть выбраны таким образом, что gRNA разделены посредством от приблизительно 0-50, 0-100 или 0-200 нуклеотидов. В одном варианте осуществления отсутствует перекрывание с целевой последовательностью, которая комплементарна нацеливающим доменам двух gRNA. В одном варианте осуществления gRNA не перекрываются и разделены посредством не более 50, 100 или 200 нуклеотидов. В одном варианте осуществления применение двух gRNA может повысить специфичность, например, путем снижения нецелевого связывания (Ran el al., CELL 2013).
В одном варианте осуществления однонитевой разрыв можно использовать для индуцирования HDR. В данном документе полагают, что один однонитевой разрыв можно использовать для повышения показателя HDR, HR или NHEJ в данном сайте расщепления.
Введение двухнитевого разрыва или однонитевого разрыва относительно целевого положения
Двухнитевой разрыв или однонитевой разрыв в одной из нитей должны осуществляться достаточно близко к местоположению цели с тем, чтобы произошла коррекция. В одном варианте осуществления расстояние составляет не более 50, 100, 200, 300, 350 или 400 нуклеотидов. Не ограничиваясь теорией полагают что, разрыв должен осуществляться достаточно близко к целевому положению с тем, чтобы разрыв находился в пределах участка, который подвергают опосредованному экзонуклеазой удалению в ходе отрезания концевых участков. Если расстояние между целевым положением и разрывом слишком большое, то мутация может не встраиваться в подлежащие отрезанию концевые участки и, следовательно, может не корректироваться, поскольку донорную последовательность можно использовать только для коррекции последовательности в пределах области отрезания концевых участков.
В одном варианте осуществления, в котором gRNA (мономолекулярная (или химерная) или модульная gRNA) и нуклеаза Cas9 индуцируют двухнитевой разрыв с целью индуцирования HDR- или HR-опосредованной коррекции, сайт расщепления расположен на расстоянии 0-200 п. о. (например, 0-175, 0-150, 0-125, 0-100, 0-75, 0-50, 0-25, 25-200, 25-175, 25-150, 25-125, 25-100, 25-75, 25-50, 50-200, 50-175, 50-150, 50-125, 50-100, 50-75, 75-200, 75-175, 75-150, 75-125, 75-100 п. о.) от местоположения цели. В одном варианте осуществления сайт расщепления расположен на расстоянии 0-100 п. о. (например, 0-75, 0-50, 0-25, 25-100, 25-75, 25-50, 50-100, 50-75 или 75-100 п. о.) от местоположения цели.
В одном варианте осуществления, в котором две gRNA (независимо мономолекулярная (или химерная) или модульная gRNA), образующие комплекс с никазами Cas9, индуцируют два однонитевых разрыва с целью индуцирования HDR-опосредованной коррекции, ближайший однонитевой разрыв расположен на расстоянии 0-200 п. о. (например, 0-175, 0-150, 0-125, 0-100, 0-75, 0-50, 0-25, 25-200, 25-175, 25-150, 25-125, 25-100, 25-75, 25-50, 50-200, 50-175, 50-150, 50-125, 50-100, 50-75, 75-200, 75-175, 75-150, 75-125, 75-100 п. о.) от местоположения мишени, и при этом два однонитевых разрыва будут предпочтительно располагаться в пределах 25-55 п. о. друг от друга (например, 25-50, 25-45, 25-40, 25-35, 25-30, 30-55, 30-50, 30-45, 30-40, 30-35, 35-55, 35-50, 35-45, 35-40, 40-55, 40-50, 40-45 п. о.) и не более 100 п. о. друг от друга (например, не более 90, 80, 70, 60, 50, 40, 30, 20, 10 или 5 п. о. друг от друга). В одном варианте осуществления сайт расщепления расположен на расстоянии 0-100 п. о. (например, 0-75, 0-50, 0-25, 25-100, 25-75, 25-50, 50-100, 50-75 или 75-100 п. о.) от местоположения цели.
В одном варианте осуществления две gRNA, например, независимо мономолекулярная (или химерная) или модульная gRNA, сконструированы с возможностью введения двухнитевого разрыва с обеих сторон местоположения цели. В альтернативном варианте осуществления три gRNA, например независимо мономолекулярная (или химерная) или модульная gRNA, сконструированы с возможностью введения двухнитевого разрыва (т. е. одна gRNA образует комплекс с нуклеазой Cas9) и двух однонитевых разрывов или парных однонитевых разрывов (т. е. две gRNA образуют комплекс с никазами Cas9) на любой стороне от местоположения цели (например, первую gRNA используют для нацеливания выше (т. е. в 5'-направлении) местоположения цели, и вторую gRNA используют для нацеливания ниже (т. е. в 3'-направлении) местоположения цели). В другом варианте осуществления четыре gRNA, например, независимо мономолекулярная (или химерная) или модульная gRNA, сконструированы с возможностью образования двух пар однонитевых разрывов (т. е. две пары двух gRNA образуют комплекс с никазами Cas9) на любой стороне от местоположения мишени (например, первую gRNA используют для нацеливания выше (т. е. в 5'-направлении) местоположения це, и вторую gRNA используют для нацеливания ниже (т. е. в 3'-направлении) местоположения цели). Двухнитевой(двухнитевые) разрыв(разрывы) или ближайшие из двух однонитевых разрывов в паре предпочтительно будут расположены в пределах 0-500 п. о. от местоположения цели (например, на расстоянии не более 450, 400, 350, 300, 250, 200, 150, l00, 50 или 25 п. о. от местоположения цели). При использовании никаз два однонитевых разрыва в паре расположены в пределах 25-55 п. о. друг от друга (например, 25-50, 25-45, 25-40, 25-35, 25-30, 50-55, 45-55, 40-55, 35-55, 30-55, 30-50, 35-50, 40-50, 45-50, 35-45 или 40-45 п. о.) и не более 100 п. о. друг от друга (например, не более 90, 80, 70, 60, 50, 40, 30, 20 или 10 п. о.).
В одном варианте осуществления две gRNA, например, независимо мономолекулярная (или химерная) или модульная gRNA, сконструированы с возможностью введения двухнитевого разрыва с обеих сторон местоположения цели. В альтернативном варианте осуществления три gRNA, например, независимо мономолекулярная (или химерная) или модульная gRNA, сконструированы с возможностью введения двухнитевого разрыва (т. е. одна gRNA образует комплекс с нуклеазой Cas9) и двух однонитевых разрывов или парных однонитевых разрывов (т. е. две gRNA образуют комплекс с никазами Cas9) на двух целевых последовательностях (например, первую gRNA используют для нацеливания выше (т. е. в 5'-направлении) целевой последовательности, и вторую gRNA используют для нацеливания ниже (т. е. в 3'-направлении) целевой последовательности сайта вставки. В другом варианте осуществления четыре gRNA, например, независимо мономолекулярная (или химерная) или модульная gRNA, сконструированы с возможностью образования двух пар однонитевых разрывов (т. е. две пары двух gRNA образуют комплекс с никазами Cas9) на любой стороне от сайта вставки (например, первую gRNA используют для нацеливания выше (т. е. в 5'-направлении) целевой последовательности, описанной в данном документе, и вторую gRNA используют для нацеливания ниже (т. е. в 3'-направлении) целевой последовательности, описанной в данном документе). Двухнитевой(двухнитевые) разрыв(разрывы) или ближайшие из двух однонитевых разрывов в паре предпочтительно будут расположены в пределах 0-500 п. о. от местоположения цели (например, на расстоянии не более 450, 400, 350, 300, 250, 200, 150, 100, 50 или 25 п. о. от местоположения цели). При использовании никаз два однонитевых разрыва в паре расположены в пределах 25-55 п. о. друг от друга (например, 25-50, 25-45, 25-40, 25-35, 25-30, 50-55, 45-55, 40-55, 35-55, 30-55, 30-50, 35-50, 40-50, 45-50, 35-45 или 40-45 п. о.) и не более 100 п. о. друг от друга (например, не более 90, 80, 70, 60, 50, 40, 30, 20 или 10 п. о.).
Длина плечей гомологии
Плечи гомологии должны простираться по крайней мере до участка, в котором может произойти отрезание концевых участков, например, с целью обеспечения отрезания однонитевого липкого конца для выявления комплементарного участка в пределах донорной матрицы. Общая длина может быть ограничена такими параметрами, как пределы размера плазмиды или вирусной упаковки. В одном варианте осуществления плечо гомологии не распространяется на повторяющиеся элементы, например, повторы ALU, повторы LINE. Матрица может иметь два плеча гомологии одинаковой или разной длины.
Иллюстративные значения длины плеча гомологии включают по меньшей мере 25, 50, 100, 250, 500, 750 или 1000 нуклеотидов.
Местоположение цели, используемое в данном документе, относится к сайту на целевой нуклеиновой кислоте (например, на хромосоме), который модифицируют с помощью зависимого от молекулы Cas9 способа. Например, местоположение цели можно модифицировать путем расщепления с помощью молекулы Cas9 целевой нуклеиновой кислоты и управляемой нуклеиновой кислотой, представляющей собой матрицу, модификации, например, коррекции местоположения цели. В одном варианте осуществления целевое положение может представлять собой сайт между двумя нуклеотидами, например, смежными нуклеотидами, на целевой нуклеиновой кислоте, в который добавляют один или несколько нуклеотидов. Местоположение мишени может содержать один или несколько нуклеотидов, которые являются измененными, например, откорректированными с помощью нуклеиновой кислоты, представляющей собой матрицу. В одном варианте осуществления местоположение цели находится в пределах целевой последовательности (например, последовательности, с которой связывается gRNA). В одном варианте осуществления местоположение цели расположено в 5'-направлении или 3'-направлении от целевой последовательности (например, последовательности, с которой связывается gRNA).
Как правило, последовательность, представляющая собой матрицу, подвергается опосредованной или опосредованной разрывом рекомбинации с целевой последовательностью. В одном варианте осуществления нуклеиновая кислота, представляющая собой матрицу, содержит последовательность, которая соответствует сайту на целевой последовательности, которая расщепляется посредством опосредованного Cas9 события расщепления. В одном варианте осуществления нуклеиновая кислота, представляющая собой матрицу, содержит последовательность, которая соответствует и первому сайту на целевой последовательности, который расщепляется в первом опосредованном Cas9 событии, и второму сайту на целевой последовательности, который расщепляется во втором опосредованном Cas9 событии.
В одном варианте осуществления нуклеиновая кислота, представляющая собой матрицу, может содержать последовательность, которая приводит в результате к изменению в кодирующей последовательности транслированной последовательности, например, которая приводит в результате к замене одной аминокислоты на другую в белковом продукте, например, к трансформации мутантного аллеля в аллель дикого типа, трансформации аллеля дикого типа в мутантный аллель и/или введению стоп-кодона, вставки аминокислотного остатка, делеции аминокислотного остатка или нонсенс-мутации.
В других вариантах осуществления нуклеиновая кислота, представляющая собой матрицу, может содержать последовательность, которая приводит в результате к изменению в некодирующей последовательности, например, изменению в экзоне или в 5'- или 3'-нетранслированном или нетранскрибированном участке. Такие изменения включают изменение в контрольном элементе, например, в промоторе, энхансере, и изменение в контрольном элементе, действующем в цис-положении или действующем в транс-положении.
Нуклеиновая кислота, представляющая собой матрицу, может содержать последовательность, которая при введении приводит в результате к
снижению активности элемента, осуществляющего положительный контроль;
повышению активности элемента, осуществляющего положительный контроль;
снижению активности элемента, осуществляющего отрицательный контроль;
повышению активности элемента, осуществляющего отрицательный контроль;
снижению экспрессии гена;
повышению экспрессии гена;
повышению устойчивости к нарушению или заболеванию;
повышению устойчивости к проникновению вируса;
коррекции мутации или изменению нежелательного аминокислотного остатка;
обеспечению, повышению, устранению или ослаблению биологического свойства продукта гена, например, повышению ферментативной активности фермента или к повышению способности продукта гена взаимодействовать с другой молекулой.
Нуклеиновая кислота, представляющая собой матрицу, может содержать последовательность, которая приводит в результате к
изменению в последовательности 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 1 1, 12 или больше нуклеотидов целевой последовательности.
В одном варианте осуществления нуклеиновая кислота, представляющая собой матрицу, составляет 20+/- 10, 30+/- 10, 40+/- 10, 50+/- 10, 60+/- 10, 70+/- 10, 80+/- 10, 90+/- 10, 100+/- 10, 1 10+/- 10, 120+/- 10, 130+/- 10, 140+/- 10, 150+/- 10, 160+/- 10, 170+/- 10, 1 80+/- 10, 190+/- 10, 200+/- 10, 210+/-10, 220+/- 10, 200-300, 300-400, 400-500, 500-600, 600-700, 700-800, 800-900, 900-1000, 1000-2000, 2000-3000 или более 3000 нуклеотидов в длину.
Нуклеиновая кислота, представляющая собой матрицу, содержит следующие компоненты:
[5'-плечо гомологии]-[вставочная последовательность]-[3'-плечо гомологии].
Плечи гомологии обеспечивают рекомбинацию в хромосоме, что может заменить нежелательный элемент, например, мутацию или сигнатуру, с помощью заменяющей последовательности. В одном варианте осуществления плечи гомологии фланкируют наиболее отдаленные сайты расщепления.
В одном варианте осуществления 3'-конец 5'-плеча гомологии представляет собой положение рядом с 5'-концом заменяющей последовательности. В одном варианте осуществления 5'-плечо гомологии может простираться на по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 150, 180, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, или 2000 нуклеотидов в 5'-направлении от 5'-конца заменяющей последовательности.
В одном варианте осуществления 5'-конец 3'-плеча гомологии представляет собой положение рядом с 3'-концом заменяющей последовательности. В одном варианте осуществления 3'-плечо гомологии может простираться на по меньшей мере 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 120, 150, 180, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1500, или 2000 нуклеотидов в 3'-направлении от 3'-конца заменяющей последовательности.
В данном документе полагают, что одно или оба плеча гомологии можно укоротить для избежания включения некоторых повторяющихся элементов последовательности, например, повторов Alu, элементов LINE. Например, 5'-плечо гомологии можно укоротить, чтобы не допустить повторяющегося элемента последовательности. В других вариантах осуществления 3'-плечо гомологии можно укоротить, чтобы не допустить повторяющегося элемента последовательности. В некоторых вариантах осуществления и 5-', и 3'-плечи гомологии можно укоротить, чтобы не допустить включения определенных повторяющихся элементов последовательности.
В данном документе полагают, что нуклеиновые кислоты, представляющие собой матрицу, для коррекции мутации можно сконструировать для использования в качестве однонитевого олигонуклеотида (ssODN). При использовании ssODN длина 5'- и 3'-плечей гомологии может находиться в диапазоне до приблизительно 200 пар оснований (п. о.), например, по меньшей мере до 25, 50, 75, 100, 125, 150, 175 или 200 п. о. в длину. Более длинные плечи гомологии также рассматриваются в случае ssODN, поскольку продолжает усовершенствоваться синтез олигонуклеотидов.
Подходы на основе NHEJ для целенаправленного воздействия на ген
Как описано в данном документе индуцированное нуклеазой негомологичное соединения концов (NHEJ) можно использовать для нокаутов, специфических по отношению к целевому гену. Индуцированное нуклеазой NHEJ можно также использовать для удаления (например, делеции) последовательности в гене, представляющем интерес.
Не ограничиваясь теорией полагают, что в одном варианте осуществления изменения в геноме, ассоциированные со способами описанными в данном документе, основаны на индуцированном нуклеазой NHEJ и пути репарации, опосредованном подверженному ошибкам NHEJ. NHEJ обеспечивает репарацию двухнитевого разрыва в ДНК посредством соединения двух концов; однако в целом исходная последовательность восстанавливается только в том случае, если два совместимых конца, именно в том виде, в котором они образовались в результате двухнитевого разрыва, идеально лигируются. Концы ДНК двухнитевого разрыва часто подвергают ферментативной обработке, что в результате приводит к добавлению или удалению нуклеотидов в одной или обеих нитях до повторного соединения концов. Это приводит в результате к присутствию мутаций по типу вставки и/или делеции (вставки/делеции) в последовательности ДНК в сайте, подвергнутом репарации с помощью NHEJ. Две трети таких мутаций могут изменять рамку считывания и, следовательно, продуцировать нефункциональный белок. Дополнительно мутации, которые сохраняют рамку считывания, но которые обеспечивают вставку или делецию в значительном количестве в последовательности, могут нарушить функциональность белка. Это явление локус-зависимое, поскольку мутации в ключевых функциональных доменах вероятно являются менее переносимыми, чем мутации во второстепенных участках белка.
Мутации по типу вставка/делеция, образованные посредством NHEJ, являются непрогнозируемыми по своей природе; однако в указанном сайте разрыва некоторые последовательности со вставкой/делецией являются благоприятными и в избытке присутствуют в популяции. Значения длины делеции могут широко варьироваться; чаще всего в диапазоне 1-50 п. о., но они могут легко доходить до более 100-200 п. о. Как правило, вставки более короткие и часто содержат короткие удвоения последовательностей, непосредственно окружающей сайт разрыва. Однако получение больших вставок возможно, и в таких случаях вставленная последовательность часто прослеживается в других участках генома или в плазмидной ДНК, присутствующих в клетках.
Поскольку NHEJ является мутагенным процессом, его также можно использовать для делеции небольших мотивов последовательности, при условии, что образование определенной конечной последовательности не требуется. Если двухнитевой разрыв подергается целенаправленному воздействию рядом с короткой целевой последовательностью, то мутации с введением делеции, обусловленные репарацией NHEJ часто охватывают и, следовательно, удаляют нежелательные нуклеотиды. Для делеции более длинных сегментов ДНК введение двух двухнитевых разрывов, один на каждой стороне последовательности, может приводить в результате к NHEJ между концами с удалением всей промежуточной последовательности. Оба данных подхода можно использовать для удаления определенных последовательностей ДНК; однако подверженное ошибкам NHEJ может по-прежнему обеспечивать мутации со вставкой в сайте для репарации.
Обе молекулы Cas9, обеспечивающие двухнитевое расщепление, и молекулы Cas9, обеспечивающие однонитевое расщепление, или никазы можно использовать в способах и композициях, описанных в данном документе, для образования NHEJ-опосредованных вставок/делеций. NHEJ-опосредованные вставки/делеции, целенаправленно воздействующие на ген, например, кодирующий участок, например, ранний кодирующий участок гена, представляющего интерес, можно использовать для нокаута (т. е. устранения экспрессии) гена, представляющего интерес. Например, ранний кодирующий участок гена, представляющего интерес, содержит последовательность, расположенную непосредственно после сайта инициации транскрипции, в пределах первого экзона кодирующей последовательности или в пределах 500 п. о. от сайта инициации транскрипции (например, менее 500, 450, 400, 350, 300, 250, 200, 150, 100 или 50 п. о.).
Введение двухнитевого или однонитевого разрывов относительно местоположения цели
В одном варианте осуществления, в котором gRNA и нуклеаза Cas9 образуют двухнитевой разрыв с целью индукции NHEJ-опосредованных вставок/делеций, gRNA, например, мономолекулярная (или химерная) или модулярная молекула gRNA, выполнена с возможностью введения одного двухнитевого разрыва в непосредственной близости от нуклеотида целевого положения. В одном варианте осуществления сайт расщепления расположен на расстоянии 0-500 п. о. от местоположения цели (например, менее 500, 400, 300, 200, 100, 50, 40, 30, 25, 20, 15, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 п. о. от местоположения цели).
В одном варианте осуществления, в котором две gRNA, образующие комплекс с никазами Cas9, индуцируют два однонитевых разрыва с целью индуцирования NHEJ-опосредованных вставок/делеций, две gRNA, например, независимо мономолекулярная (или химерная) или модульная gRNA, сконструированы с введением двух однонитевых разрывов для обеспечения NHEJ-репарации нуклеотида в местоположении цели. В одном варианте осуществления gRNA сконструированы с возможностью осуществления вырезания в том же положении, или в пределах нескольких нуклеотидов между ними на разных нитях, имитируя по сути двухнитевой разрыв. В одном варианте осуществления ближайший однонитевой разрыв расположен на расстоянии 0-30 п. о. от местоположения цели (например, менее 30, 25, 20, 1, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 п. о. от местоположения цели), и два однонитевых разрыва расположены в пределах 25-55 п. о. между ними (например, 25-50, 25-45, 25-40, 25-35, 25-30, 50-55, 45-55, 40-55, 35-55, 30-55, 30-50, 35-50, 40-50, 45-50, 35-45 или 40-45 п. о.) и не более 100 п. о. между ними (например, не более 90, 80, 70, 60, 50, 40, 30, 20 или 10 п. о.). В одном варианте осуществления gRNA сконструированы с возможностью введения однонитевого разрыва с любой стороны нуклеотида в местоположении цели.
Обе молекулы Cas9, обеспечивающие двухнитевое расщепление, и молекулы Cas9 или никазы, обеспечивающие однонитевое расщепление, можно использовать в способах и композициях, описанных в данном документе, с целью получения разрывов с обеих сторон местоположения цели. Двухнитевые или парные однонитевые разрывы могут быть получены с обеих сторон местоположения цели для удаления последовательности нуклеиновой кислоты между двумя разрезами (например, удаляется участок между двумя разрывами). В одном варианте осуществления две gRNA, например, независимо мономолекулярная (или химерная) или модульная gRNA, сконструированы с возможностью введения двухнитевого разрыва с обеих сторон местоположения цели (например, первую gRNA используют для нацеливания выше (т. е. в 5'-направлении) от мутации в гене или пути, описанных в данном документе, и вторую gRNA используют для нацеливания ниже (т. е. в 3'-направлении) от мутации в гене или пути, описанных в данном документе). В альтернативном варианте осуществления три gRNA, например, независимо мономолекулярная (или химерная) или модульная gRNA, сконструированы с возможностью введения двухнитевого разрыва (т. е. одна gRNA образует комплекс с нуклеазой Cas9) и двух однонитевых разрывов или парных однонитевых разрывов (т. е. две gRNA образуют комплекс с никазами Cas9) с любой стороны от местоположения цели (например, первую gRNA используют для нацеливания выше (т. е. в 5'-направлении) от мутации в гене или пути, описанных в данном документе, и вторую gRNA используют для нацеливания ниже (т. е. в 3'-направлении) от мутации в гене или пути, описанных в данном документе). В другом варианте осуществления четыре gRNA, например, независимо мономолекулярная (или химерная) или модульная gRNA, сконструированы с возможностью образования двух пар однонитевых разрывов (т. е. две пары двух gRNA образуют комплекс с никазами Cas9) с любой стороны от местоположения цели (например, первую gRNA используют для нацеливания выше (т. е. в 5'-направлении) от мутации в гене или пути, описанных в данном документе, и вторую gRNA используют для нацеливания ниже (т. е. в 3'-направлении) от мутации в гене или пути, описанных в данном документе). Двухнитевой(двухнитевые) разрыв(разрывы) или ближайшие из двух однонитевых разрывов в паре предпочтительно будут расположены в пределах 0-500 п. о. от местоположения цели (например, на расстоянии не более 450, 400, 350, 300, 250, 200, 150, 100, 50 или 25 п. о. от местоположения цели). При использовании никаз два однонитевых разрыва в паре расположены в пределах 25-55 п. о. друг от друга (например, 25-50, 25-45, 25-40, 25-35, 25-30, 50-55, 45-55, 40-55, 35-55, 30-55, 30-50, 35-50, 40-50, 45-50, 35-45 или 40-45 п. о.) и не более 100 п. о. друг от друга (например, не более 90, 80, 70, 60, 50, 40, 30, 20 или 10 п. о.).
В других вариантах осуществления вставка нуклеиновой кислоты, представляющей собой матрицу, может быть опосредована посредством микрогомологичного соединения концов (MMEJ). См., например, Saksuma et al., "MMEJ-assisted gene knock-in using TALENs and CRISPR-Cas9 with the PITCh systems." Nature Protocols 11, 118-133 (2016) doi:10.1038/nprot.2015.140, опубликованную в интернете 17 декабря 2015 г., содержание которой включено посредством ссылки во всей своей полноте.
VIII. Системы, содержащие более одной молекулы gRNA
Не ограничиваясь теорией в данном документе неожиданно было показано, что нацеливание двух целевых последовательностей (например, с помощью двух комплексов молекула gRNA/молекула Cas9, каждый из которых индуцирует одно- или двухнитевой разрыв в соответствующих им целевых последовательностях или рядом с ними), расположенных в непосредственной близости на непрерывной нуклеиновой кислоте, индуцирует вырезание (например, делецию) последовательности нуклеиновой кислоты (или по меньшей мере 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% последовательности нуклеиновой кислоты), расположенной между двумя целевыми последовательностями. В некоторых аспектах в настоящем изобретении представлено применение двух или более молекул gRNA, которые содержат нацеливающие домены, нацеливающие на целевые последовательности, расположенные в непосредственной близости на непрерывной нуклеиновой кислоте, например, хромосоме, например, гене или локусе гена, в том числе его интронах, экзонах и регуляторных элементах. Применение можно осуществлять, например, путем введения двух или более молекул gRNA вместе с одной или несколькими молекулами Cas9 (или нуклеиновой кислоты, кодирующей две или более молекулы gRNA и/или одну или несколько молекул Cas9) в клетку.
В некоторых аспектах целевые последовательности двух или более молекул gRNA расположены на расстоянии по меньшей мере 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 2000, 3000, 4000, 5000, 6000, 7000, 8000, 9000, 10,000, 11,000, 12,000, 13,000, 14,000, или 15,000 нуклеотидов от непрерывной нуклеиновой кислоты, но не более чем 25000 нуклеотидов от непрерывной нуклеиновой кислоты. В ряде вариантов осуществления целевые последовательности расположены на расстоянии от приблизительно 4000 до приблизительно 6000 нуклеотидов друг от друга. В одном варианте осуществления целевые последовательности расположены на расстоянии приблизительно 4000 нуклеотидов друг от друга. В одном варианте осуществления целевые последовательности расположены на расстоянии приблизительно 5000 нуклеотидов друг от друга. В одном варианте осуществления целевые последовательности расположены на расстоянии приблизительно 6000 нуклеотидов друг от друга.
В некоторых аспектах каждая из множества молекул gRNA нацеливает на последовательности в пределах одного и того же гена или локуса гена. В иллюстративном аспекте целевые последовательности для двух или более молекул gRNA расположены в промоторном участке HBG1. В иллюстративном аспекте целевые последовательности для двух или более молекул gRNA расположены в промоторном участке HBG2. В другом аспекте каждая из множества молекул gRNA нацеливает на последовательности в пределах 2 или более разных генов или локусов гена. В иллюстративном аспекте целевая последовательность для одной или нескольких молекул gRNA расположена в промоторном участке HBG1, и целевая последовательность для одной или нескольких других молекул gRNA расположена в промоторном участке HBG2.
В некоторых аспектах в настоящем изобретении представлены композиции и клетки, содержащие множество, например, 2 или более, например, 2 молекулы gRNA по настоящему изобретению, где множество молекул gRNA нацеливают на последовательности, расположенные на расстоянии менее 15000, менее 14000, менее 13000, менее 12000, менее 11000, менее 10000, менее 9000, менее 8000, менее 7000, менее 6000, менее 5000, менее 4000, менее 3000, менее 2000, менее 1000, менее 900, менее 800, менее 700, менее 600, менее 500, менее 400, менее 300, менее 200, менее 100, менее 90, менее 80, менее 70, менее 60, менее 50, менее 40 или менее 30 нуклеотидов друг от друга. В одном варианте осуществления целевые последовательности расположены на одной и той же нити нуклеиновой кислоты в виде дуплекса. В одном варианте осуществления целевые последовательности расположены на разных нитях нуклеиновой кислоты в виде дуплекса.
В одном варианте осуществления в настоящем изобретении представлен способ вырезания (например, делеции) нуклеиновой кислоты, расположенной между двумя сайтами связывания для gRNA, расположенными на расстоянии менее 25000, менее 20000, менее 15000, менее 14000, менее 13000, менее 12000, менее 11000, менее 10000, менее 9000, менее 8000, менее 7000, менее 6000, менее 5000, менее 4000, менее 3000, менее 2000, менее 1000, менее 900, менее 800, менее 700, менее 600, менее 500, менее 400, менее 300, менее 200, менее 100, менее 90, менее 80, менее 70, менее 60, менее 50, менее 40 или менее 30 нуклеотидов друг от друга на одной и той же или разных нитях нуклеиновой кислоты в виде дуплекса. В одном варианте осуществления способ предусматривает делецию более 50%, более 60%, более 70%, более 80%, более 85%, более 86%, более 87%, более 88%, более 89%, более 90%, более 91%, более 92%, более 93%, более 94%, более 95%, более 96%, более 97%, более 98%, более 99% или 100% нуклеотидов, расположенных между сайтами PAM, ассоциированными c каждым сайтом связывания для gRNA. В ряде вариантов осуществления делеция дополнительно охватывает один или несколько нуклеотидов в пределах одного или нескольких сайтов PAM, ассоциированных с каждым сайтом связывания для gRNA. В ряде вариантов осуществления делеция также охватывает один или несколько нуклеотидов за пределами участка между сайтами PAM, ассоциированными с каждым сайтом связывания для gRNA.
В одном аспекте две или более молекулы gRNA содержат нацеливающие домены, которые нацеливают на целевые последовательности, фланкирующие регуляторный элемент гена, например, сайт связывания промотора, энхансерный участок или репрессорный участок, таким образом, что вырезание промежуточной последовательности (или части промежуточной последовательности) вызывает положительную регуляцию или отрицательную регуляцию экспрессии представляющего интерес гена. В других вариантах осуществления две или более молекулы gRNA содержат нацеливающие домены, которые нацеливают на последовательности, фланкирующие ген, таким образом, что вырезание промежуточной последовательности (или ее части) приводит к делеции представляющего интерес гена.
В одном варианте осуществления каждая из двух или более молекул gRNA содержит нацеливающий домен, содержащий, например, состоящий из, нацеливающий домен последовательности из таблицы 1, например, из таблицы 2 или, например, из таблицы 3a или таблицы 3b. В ряде вариантов осуществления каждая из двух или более молекул gRNA содержит нацеливающий домен, содержащий, например, состоящий из, нацеливающий домен молекулы gRNA, который дает в результате по меньшей мере 15% положительную регуляцию количества F-клеток в популяции красных кровяных клеток, дифференцированных (например, в день 7 после редактирования) из HSPC, отредактированных с помощью указанной gRNA ex vivo с помощью способов, описанных в данном документе. В ряде аспектов две или более молекулы gRNA содержат нацеливающие домены, которые комплементарны последовательностям в том же гене или участке, например, промоторном участке HBG1 или промоторном участке HBG2. В ряде аспектов две или более молекулы gRNA содержат нацеливающие домены, которые комплементарны последовательностям разных генов или участков, например одному в промоторном участке HBG1 и одному в промоторном участке HBG2.
В одном аспекте две или более молекулы gRNA содержат нацеливающие домены, которые нацеливают на целевые последовательности, фланкирующие регуляторный элемент гена, например, сайт связывания промотора, энхансерный участок или репрессорный участок, таким образом, что вырезание промежуточной последовательности (или части промежуточной последовательности) вызывает положительную регуляцию или отрицательную регуляцию экспрессии представляющего интерес гена. В другом аспекте две или более молекулы gRNA содержат нацеливающие домены, нацеливающие на целевые последовательности, фланкирующие ген, таким образом, что вырезание промежуточной последовательности (или часть промежуточной последовательности) приводит к делеции представляющего интерес гена. В качестве примера две или более молекулы gRNA содержат нацеливающие домены, нацеливающие на целевые последовательности, фланкирующие ген HBG1 (например, одну молекулу gRNA, нацеливающую на целевую последовательность в промоторном участке HBG1, и вторую молекулу gRNA, нацеливающую на целевую последовательность в промоторном участке HBG2), таким образом, что происходит вырезание гена HBG1.
В одном варианте осуществления две или более молекулы gRNA содержат нацеливающие домены, которые содержат, например, состоят из, нацеливающие домены, выбранные из таблицы 1.
В ряде аспектов две или более молекулы gRNA содержат нацеливающие домены, содержащие, например, состоящие из, последовательности нацеливающего домена, перечисленные в таблице 2 выше. В аспектах две или более молекулы gRNA содержат нацеливающие домены, содержащие, например, состоящие из, последовательности нацеливающего домена gRNA, перечисленные в таблице 3a выше. В ряде аспектов две или более молекулы gRNA содержат нацеливающие домены, содержащие, например, состоящие из, последовательности нацеливающего домена, перечисленные в таблице 3b выше.
Молекулы gRNA, содержащие нацеливающие домены, которые нацеливают на последовательности в пределах неделеционного участка HPFH, например, промоторного участка HBG1 и/или HBG2, можно дополнительно использовать с молекулой gRNA, содержащей нацеливающий домен, комплементарный целевой последовательности в пределах, например, энхансерного участка BCL11a (например, энхансерного участка +55, +58 или +62 BCL11a), и/или с молекулой gRNA, содержащей нацеливающий домен, комплементарный целевой последовательности делеционного локуса HPFH. Такие делеционные локусы HPFH известны из уровня техники, например, описанные в Sankaran VG et al. NEJM (2011) 365:807-814 (включена в данный документ посредством ссылки во всей своей полноте).
IX. Свойства gRNA
В данном документе неожиданно было дополнительно показано, что для молекул одиночной gRNA целевые последовательности могут содержаться в более чем одном локусе (например, в локусах с высокой гомологией последовательности) и что если такие локусы находятся на одной и той же хромосоме, например, в пределах менее приблизительно 15000 нуклеотидов, менее приблизительно 14000 нуклеотидов, менее приблизительно 13000 нуклеотидов, менее приблизительно 12000 нуклеотидов, менее приблизительно 11000 нуклеотидов, менее приблизительно 10000 нуклеотидов, менее приблизительно 9000 нуклеотидов, менее приблизительно 8000 нуклеотидов, менее приблизительно 7000 нуклеотидов, менее приблизительно 6000 нуклеотидов, менее приблизительно 5000 нуклеотидов, менее приблизительно 4000 нуклеотидов или менее приблизительно 3000 нуклеотидов (например, на расстоянии от приблизительно 4000 до приблизительно 6000 нуклеотидов друг от друга), то такая молекула gRNA может приводить к вырезанию промежуточной последовательности (или ее части), за счет чего обеспечивается полезный эффект, например, повышение экспрессии фетального гемоглобина в эритроидных клетках, дифференцированных из модифицированных HSPC (описанных в данном документе). Таким образом, в одном аспекте в настоящем изобретении представлены молекулы gRNA, целевые последовательности которых содержаться в двух локусах, например, локусах на одной и той же хромосоме, например, целевые последовательности которых содержаться в промоторном участке HBG1 и в промоторном участке HBG2 (например, описанных в таблице 1). Не ограничиваясь теорией полагают, что такие gRNA могут приводить к разрезанию генома в более чем одном местоположении (например, в целевой последовательности в каждом из двух участков) и что последующая репарация может приводить к делеции промежуточной последовательности нуклеиновой кислоты. Опять-таки не ограничиваясь теорией полагают, что делеция указанной промежуточной последовательности может оказывать требуемый эффект в отношении экспрессии или функции одного или нескольких белков.
Кроме того, неожиданно было показано, что молекулы gRNA, которые содержат нацеливающий домен, комплементарный последовательности только в одном гене или участке, например, который комплементарен целевой последовательности в промоторном участке HBG1 (но не в промоторном участке HBG2) или который комплементарен целевой последовательности в промоторном участке HBG2 (но не в промоторном участке HBG1), могут приводить к значительному повышению экспрессии фетального гемоглобина в эритроидных клетках, дифференцированных из модифицированных HSPC (описанных в данном документе). Таким образом, в ряде аспектов в настоящем изобретении представлены молекулы gRNA, которые содержат нацеливающий домен, который комплементарен целевой последовательности в одном неделеционном участке HPFH, например, в пределах промоторного участка HBG1 или HBG2 (например, описанных в таблице 1), но для которого не характерно полная (например, на 100%) комплементарное соответствие с целевой последовательностью в любом другом гене или участке.
Дополнительно в данном документе неожиданно было показано, что молекулы gRNA и системы CRISPR, содержащие указанные молекулы gRNA, обеспечивают получение сходных или идентичных паттернов вставок/делеций в нескольких экспериментах с использованием одного и того же типа клетки, способа доставки и компонентов crRNA/tracr. Не ограничиваясь теорией полагают, что некоторые паттерны вставок/делеций могут быть более преимущественными, чем другие. Например, вставки/делеции, которые преимущественно включают вставки и/или делеции, являющиеся результатом "мутации со сдвигом рамки считывания" (например, вставка или делеции 1 или 2 пар оснований или любая вставка или делеция, где n/3 не равняется целому числу (где n=количеству нуклеотидов во вставке или делеции)), могут быть полезными в снижении или устранении экспрессии функционального белка. Аналогичным образом вставки/делеции, которые преимущественно включают "большие делеции" (делеции более 10, 11, 12, 13, 14, 15, 20, 25 или 30 нуклеотидов, например, более 1 т. о., более 2 т. о., более 3 т. о., более 5 т. о. или более 10 т. о., например, охватывающие последовательность, расположенную между первым и вторым сайтом связывания для gRNA, например, описанной в данном документе), могут также быть полезными, например, в удалении ключевых регуляторных последовательностей, таких как сайты связывания промотора, или изменении структуры или функции локуса, который может аналогичным образом оказывать влияние на экспрессию функционального белка. Хотя паттерны вставок/делеций, индуцированные данными gRNA/системой CRISPR, как было неожиданно обнаружено, согласованно воспроизводятся для указанного типа клеток, gRNA и системы CRISPR, описанные в данном документе, в данной клетке как следствие не будет получена ни одна структура с одиночной вставкой/делецией при введении gRNA/системы CRISPR.
Таким образом, в настоящем изобретении представлены молекулы gRNA, которые обеспечивают создание благоприятного паттерна вставки/делеции или структуры с ними, например, которые обеспечивают паттерны вставок/делеций или структуры с ними, преимущественно состоящие из больших делеций. Такие молекулы gRNA могут быть выбраны путем оценки паттерна вставки/делеции или структуры с ними, созданных посредством кандидатной молекулы gRNA в тестируемой клетке (например, клетке HEK293) или в клетке, представляющей интерес, например, клетке HSPC, с помощью NGS, как описано в данном документе. Как показано в разделе "Примеры", были разработаны молекулы gRNA, которые при введении в необходимую популяцию клеток, приводят к получению популяции клеток, содержащей значительную долю клеток, имеющих большую делецию в целевой последовательности gRNA или рядом с ней. В некоторых случаях показатель образования большой делеционной вставки/делеции составляет не более 75%, 80%, 85%, 90% или больше. Таким образом, в настоящем изобретении представлена популяция клеток, которые содержат по меньшей мере приблизительно 40% клеток (например, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или по меньшей мере приблизительно 99%), имеющих большую делецию, например, описанную в данном документе, в целевом для описанной в данном документе молекулы gRNA сайте или рядом с ним. В настоящем изобретении также представлена популяция клеток, которые содержат по меньшей мере приблизительно 50% клеток (например, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или по меньшей мере приблизительно 99%), имеющих большую делецию, например, описанную в данном документе, в целевом для описанной в данном документе молекулы gRNA сайте или рядом с ним.
Таким образом, в настоящем изобретении представлены способы отбора молекул gRNA для применения в терапевтических способах по настоящему изобретению, предусматривающие: 1) обеспечение множества молекул gRNA, предназначенных для мишени, представляющей интерес, 2) осуществление оценки паттерна вставки/делеции или структуры с ними, созданных путем использования указанных молекул gRNA, 3) отбор молекулы gRNA, которая обеспечивает образование паттерна вставки/делеции или структуры с ними, состоящих преимущественно из мутаций со сдвигом рамки считывания, больших делеций или их комбинации, и 4) использованием указанной отобранной gRNA в способах по настоящему изобретению.
Таким образом, в настоящем изобретении представлены способы отбора молекул gRNA для применения в терапевтических способах по настоящему изобретению, предусматривающие: 1) обеспечение множества молекул gRNA, предназначенных для мишени, представляющей интерес, например, которая содержит целевые последовательности в более чем одном местоположении, 2) осуществление оценки паттерна вставки/делеции или структуры с ними, созданных посредством использования указанных молекул gRNA, 3) отбор молекулы gRNA, которая обеспечивает вырезание последовательности, содержащей последовательность нуклеиновой кислоты, расположенную между двумя целевыми последовательностями, например, в по меньшей мере приблизительно 25% или более клеток из популяции клеток, которые подвергали воздействию указанных молекул gRNA, и 4) использование указанной отобранной молекулы gRNA в способах по настоящему изобретению.
В настоящем изобретении дополнительно представлены способы изменения клеток и измененные клетки, где с помощью данных gRNA/системы CRISPR в данном типе клеток неизменно получают конкретный паттерн вставки/делеции. Паттерны вставок/делеций, содержащие наиболее важные 5 наиболее часто встречающихся вставок/делеций, наблюдаемых при использовании gRNA/систем CRISPR, описанных в данном документе, можно определить с применением приведенных в качестве примеров способов, и они раскрыты, например, в разделе "Примеры". Как показано в разделе "Примеры", получали популяции клеток, где значительная доля клеток содержит одну из наиболее важных 5 вставок/делеций (например, популяции клеток, где одна из наиболее важных 5 вставок/делеций присутствует у более 30%, более 40%, более 50%, более 60% или более клеток в популяции. Таким образом, в настоящем изобретении представлены клетки, например, HSPC (описанные в данном документе), которые содержат вставку/делецию из любой из наиболее важных 5 вставок/делеций, наблюдаемых в случае использования данных gRNA/системы CRISPR. В настоящем изобретении дополнительно представлена популяции клеток, например, HSPC (описанных в данном документе), которые при оценке, например, с помощью NGS, содержат высокую процентную долю клеток, содержащих одну из наиболее важных 5 вставок/делеций, описанных в данном документе, для данных gRNA/системы CRISPR. При использовании в связи с анализом паттерна вставки/делеции "высокая процентная доля" означает по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или по меньшей мере приблизительно 99%) клеток в популяции, содержащих одну из наиболее важных 5 вставок/делеций, описанных в данном документе, для данных gRNA/системы CRISPR. В других вариантах осуществления популяция клеток содержит по меньшей мере приблизительно 25% (например, от приблизительно 25% до приблизительно 60%, например, от приблизительно 25% до приблизительно 50%, например, от приблизительно 25% до приблизительно 40%, например, от приблизительно 25% до приблизительно 35%) клеток, которые имеют одну из наиболее важных 5 вставок/делеций, описанных в данном документе, для данных gRNA/системы CRISPR.
Также было обнаружено, что определенные молекулы gRNA не обеспечивают образование вставок/делеций в нецелевых последовательностях (например, нецелевых последовательностях за пределами промоторного участка HBG1 и/или HBG2) в геноме целевого типа клеток или обеспечивают образование вставок/делеций в нецелевых сайтах (например, нецелевых последовательностях за пределами промоторного участка HBG1 и/или HBG2) с очень низкими показателями частоты (например, < 5% клеток в популяции) по сравнению с частотой образования вставки/делеции в целевом сайте. Таким образом, в настоящем изобретении представлены молекулы gRNA и системы CRISPR, для которых не характерно образование нецелевой вставки/делеции в целевом типе клеток или которые обеспечивают образование нецелевой вставки/делеции с частотой менее 5%, например, вставки/делеции в любом нецелевом сайте за пределами промоторного участка HBG1 и/или HBG2 с частотой менее 5%. В ряде вариантов осуществления в настоящем изобретении представлены молекулы gRNA и системы CRISPR, для которых не характерно образование любой нецелевой вставки/делеции в целевом типе клеток. Таким образом, в настоящем изобретении дополнительно представлена клетка, например, популяция клеток, например, HSPC, например, описанные в данном документе, которые содержат вставку/делецию в целевом для описанной в данном документе молекулы gRNA сайте или рядом с ним (например, вставку/делецию со сдвигом рамки считывания, или любую из наиболее важных 5 вставок/делеций, получаемых за счет данных gRNA/системы CRISPR, например, описанных в данном документе), но не содержат вставку/делецию в любом нецелевом для молекулы gRNA сайте, например, вставку/делецию в любом нецелевом сайте за пределами промоторного участка HBG1 и/или HBG2. В других вариантах осуществления в настоящем изобретении дополнительно представлена популяция клеток, например, HSPC, например, описанных в данном документе, которая содержит по меньшей мере 20%, например, по меньшей мере 30%, например, по меньшей мере 40%, например, по меньшей мере 50%, например, по меньшей мере 60%, например, по меньшей мере 70%, например, по меньшей мере 75% клеток, которые имеют вставку/делецию в целевом для описанной в данном документе молекулы gRNA сайте или рядом с ним (например, вставку/делецию со сдвигом рамки считывания, или любую из наиболее важных 5 вставок/делеций, получаемых за счет данных gRNA/системы CRISPR, например, описанных в данном документе), но которая содержит менее 5%, например, менее 4%, менее 3%, менее 2% или менее 1% клеток, содержащих вставку/делецию в любом нецелевом для молекулы gRNA сайте, например, вставку/делецию в любом нецелевом сайте за пределами промоторного участка HBG1 и/или HBG2. В других вариантах осуществления в настоящем изобретении дополнительно представлена популяция клеток, например, HSPC, например, описанных в данном документе, которая содержит по меньшей мере 20%, например, по меньшей мере 30%, например, по меньшей мере 40%, например, по меньшей мере 50%, например, по меньшей мере 60%, например, по меньшей мере 70%, например, по меньшей мере 75%, например, по меньшей мере 80%, например, по меньшей мере 90%, например, по меньшей мере 95% клеток, которые имеют вставку/делецию в пределах промоторного участка HBG1 и/или HBG2 (например, в последовательности, которая на по меньшей мере 90% гомологична целевой последовательности для gRNA, или рядом с ней), но которая содержит менее 5%, например, менее 4%, менее 3%, менее 2% или менее 1% клеток, содержащих вставку/делецию в любом нецелевом сайте за пределами промоторного участка HBG1 и/или HBG2 или рядом с ним. В ряде вариантов осуществления нецелевая вставка/делеция образуется в пределах последовательности гена, например, в пределах кодирующей последовательности гена. В ряде вариантов осуществления нецелевая вставка/делеция не образуется в пределах последовательности гена, например, в пределах кодирующей последовательности гена, в клетке, представляющей интерес, например, описанной в данном документе.
X. Доставка/конструкции
Компоненты, например, молекулу Cas9 или молекулу gRNA или обе, можно доставлять, составлять или вводить в различных формах. В качестве неограничивающего примера молекулу gRNA и молекулу Cas9 можно составлять (в одной или нескольких композициях), непосредственно доставлять или вводить в клетку, в которой требуется осуществить событие редактирования генома. В качестве альтернативы нуклеиновую кислоту, кодирующую один или несколько компонентов, например, молекулу Cas9 или молекулу gRNA или обе, можно составлять (в одной или нескольких композициях), доставлять или вводить. В одном аспекте молекула gRNA обеспечивается в виде ДНК, кодирующей молекулу gRNA, и молекула Cas9 обеспечивается в виде ДНК, кодирующей молекулу Cas9. В одном варианте осуществления молекула gRNA и молекула Cas9 кодируются отдельными молекулами нуклеиновой кислоты. В одном варианте осуществления молекула gRNA и молекула Cas9 кодируются одной и той же молекулой нуклеиновой кислоты. В одном аспекте молекула gRNA обеспечивается в виде РНК, а молекула Cas9 обеспечивается в виде ДНК, кодирующей молекулу Cas9. В одном варианте осуществления молекула gRNA обеспечивается с одной или несколькими модификациями, например, описанными в данном документе. В одном аспекте молекула gRNA обеспечивается в виде РНК, а молекула Cas9 обеспечивается в виде mRNA, кодирующей молекулу Cas9. В одном аспекте молекула gRNA обеспечивается в виде РНК, а молекула Cas9 обеспечивается в виде белка. В одном варианте осуществления молекулы gRNA и Cas9 обеспечиваются в виде рибонуклеопротеинового комплекса (RNP). В одном аспекте молекула gRNA обеспечивается в виде ДНК, кодирующей молекулу gRNA, а молекула Cas9 обеспечивается в виде белка.
Доставка, например, доставка RNP, (например, в клетки HSPC, описанные в данном документе), может быть осуществлена с помощью, например, электропорации (например, как известно из уровня техники) или другого способа, который делает клеточную мембрану проницаемой для молекул нуклеиновой кислоты и/или полипептидов. В ряде вариантов осуществления систему CRISPR, например, RNP, описанный в данном документе, доставляют с помощью электропорации с использованием 4D-Nucleofector (Lonza), например, с использованием программы CM-137 на 4D-Nucleofector (Lonza). В ряде вариантов осуществления систему CRISPR, например, RNP, описанный в данном документе, доставляют с помощью электропорации с приложением напряжения от приблизительно 800 вольт до приблизительно 2000 вольт, например, от приблизительно 1000 вольт до приблизительно 1800 вольт, например, от приблизительно 1200 вольт до приблизительно 1800 вольт, например, от приблизительно 1400 вольт до приблизительно 1800 вольт, например, от приблизительно 1600 вольт до приблизительно 1800 вольт, например, приблизительно 1700 вольт, например, при напряжении 1700 вольт. В ряде вариантов осуществления ширина/длительность импульса составляет от приблизительно 10 мс до приблизительно 50 мс, например, от приблизительно 10 мс до приблизительно 40 мс, например, от приблизительно 10 мс до приблизительно 30 мс, например, от приблизительно 15 мс до приблизительно 25 мс, например, приблизительно 20 мс, например, 20 мс. В ряде вариантов осуществления используют 1, 2, 3, 4, 5 или больше, например, 2 импульса, например, 1 импульс. В одном варианте осуществления систему CRISPR, например, RNP, описанный в данном документе, доставляют с помощью электропорации с приложением напряжения в приблизительно 1700 вольт (например, 1700 вольт), ширины импульса приблизительно 20 мс (например, 20 мс), с использованием одного (1) импульса. В ряде вариантов осуществления электропорацию осуществляют с использованием устройства для электропорации Neon. Дополнительные методики для того, чтобы придать мембране проницаемость, известны из уровня техники и включают, например, сжатие клетки (например, как описано в WO2015/023982 и WO2013/059343, содержание которых включено в данный документ посредством ссылки во всей своей полноте), использование наноигл (например, описанных в Chiappini et al., Nat. Mat., 14; 532-39, или US2014/0295558, содержание которых включено в данный документ посредством ссылки во всей своей полноте) и использование нанотрубок (например, описанных в Xie, ACS Nano, 7(5); 4351-58, содержание которой включено в данный документ посредством ссылки во всей своей полноте).
Если доставляют компонент, кодируемый ДНК, то ДНК, как правило, будет содержать участок, обеспечивающий контроль экспрессии, например, представляющий собой промотор. Применимые промоторы для последовательностей молекулы Cas9 включают промоторы, обеспечивающие контроль, CMV, EF-1-альфа, MSCV, PGK, CAG. Применимые промоторы для gRNA включают промоторы H1, EF-1a и U6. Промоторы со сходной или отличающейся эффективностью могут быть выбраны для регулирования экспрессии компонентов. Последовательности, кодирующие молекулу Cas9, могут содержать сигнал ядерной локализации (NLS), например, NLS SV40. В одном варианте осуществления промотор для молекулы Cas9 или молекулы gRNA может независимо быть индуцируемым, тканеспецифическим или специфическим для конкретной клетки.
Основанная на ДНК доставка молекулы Cas9 и/или молекулы gRNA
ДНК, кодирующую молекулы Cas9 и/или молекулы gRNA, можно вводить субъектам или доставлять в клетки с помощью известных из уровня техники способов или как описано в данном документе. Например, ДНК, кодирующую Cas9 и/или кодирующую gRNA, можно доставлять, например, с помощью векторов (например, вирусных или невирусных векторов), способов без использования вектора (например, с использованием "голой" ДНК или комплексов с ДНК) или их комбинации.
В некоторых вариантах осуществления ДНК, кодирующую Cas9 и/или gRNA, доставляют с помощью вектора (например, вирусного вектора/вируса, плазмиды, миникольца или наноплазмиды).
Вектор может содержать последовательность, которая кодирует молекулу Cas9 и/или молекулу gRNA. Вектор может также содержать последовательность, кодирующую сигнальный пептид (например, для ядерной локализации, ядрышковой локализации, митохондриальной локализации), слитую, например, с последовательностью, кодирующей молекулу Cas9. Например, вектор может содержать одну или несколько последовательностей ядерной локализации (например, из SV40), слитых с последовательностью, кодирующей молекулу Cas9.
В векторы могут быть включены один или несколько регуляторных/контролирующих элементов, например, промотор, энхансер, интрон, сигнал полиаденилирования, консенсусная последовательность Козак, сайты внутренней посадки рибосомы (IRES), последовательность 2A и акцептор или донор сплайсинга. В некоторых вариантах осуществления промотор распознается РНК-полимеразой II (например, промотор CMV). В других вариантах осуществления промотор распознается РНК-полимеразой III (например, промотор U6). В некоторых вариантах осуществления промотор представляет собой регулируемый промотор (например, индуцируемый промотор). В других вариантах осуществления промотор представляет собой конститутивный промотор. В некоторых вариантах осуществления промотор представляет собой тканеспецифический промотор. В некоторых вариантах осуществления промотор представляет собой вирусный промотор. В других вариантах осуществления промотор представляет собой невирусный промотор.
В некоторых вариантах осуществления вектор или носитель для доставки представляет собой миникольцо. В некоторых вариантах осуществления вектор или носитель для доставки представляет собой наноплазмиду.
В некоторых вариантах осуществления вектор или носитель для доставки представляет собой вирусный вектор (например, для получения рекомбинантных вирусов). В некоторых вариантах осуществления вирус представляет собой ДНК-содержащий вирус (например, dsDNA- или ssDNA-содержащий вирус). В других вариантах осуществления вирус представляет собой РНК-содержащий вирус (например, ssRNA-содержащий вирус).
Иллюстративные вирусные векторы/вирусы включают, например, ретровирусы, лентивирусы, аденовирус, аденоассоциированный вирус (AAV), вирусы осповакцины, поксвирусы и вирусы простого герпеса. Технология с использованием вирусных векторов хорошо известна из уровня техники и описана, например, в Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1-4, Cold Spring Harbor Press, NY) и в других руководствах по вирусологии и молекулярной биологии.
В некоторых вариантах осуществления вирус инфицирует делящиеся клетки. В других вариантах осуществления вирус инфицирует неделящиеся клетки. В некоторых вариантах осуществления вирус инфицирует как делящиеся, так и неделящиеся клетки. В некоторых вариантах осуществления вирус может интегрироваться в геном хозяина. В некоторых вариантах осуществления вирус сконструирован таким образом, что он обладает пониженной иммуногенностью, например, при введении человеку. В некоторых вариантах осуществления вирус является репликационно-компетентным. В других вариантах осуществления вирус является репликационно-дефектным, например, содержащим замену одного или нескольких кодирующих участков генов, необходимых для дополнительных циклов репликации и/или упаковки вириона, на другие гены или их делецию. В некоторых вариантах осуществления вирус вызывает временную экспрессию молекулы Cas9 и/или молекулы gRNA. В других вариантах осуществления вирус вызывает длительную, например, в течение по меньшей мере 1 недели, 2 недель, 1 месяца, 2 месяцев, 3 месяцев, 6 месяцев, 9 месяцев, 1 года, 2 лет, или постоянную экспрессию молекулы Cas9 и/или молекулы gRNA. Упаковывающая способность вирусов может варьировать, например, от по меньшей мере приблизительно 4 т. о. до по меньшей мере приблизительно 30 т. о., например, по меньшей мере приблизительно 5 т. о., 10 т. о., 15 т. о., 20 т. о., 25 т. о., 30 т. о., 35 т. о., 40 т. о., 45 т. о. или 50 т. о.
В некоторых вариантах осуществления ДНК, кодирующую Cas9 и/или gRNA, доставляют с помощью рекомбинантного ретровируса. В некоторых вариантах осуществления ретровирус (например, вирус лейкоза мышей Молони) содержит обратную транскриптазу, например, обеспечивающую возможность интеграции в геном хозяина. В некоторых вариантах осуществления ретровирус является репликационно-компетентным. В других вариантах осуществления ретровирус является репликационно-дефектным, например, содержащим замену одного из нескольких кодирующих участков генов, необходимых для дополнительных циклов репликации и/или упаковки вириона, другими генами или их делецию.
В некоторых вариантах осуществления ДНК, кодирующую Cas9 и/или gRNA, доставляют с помощью рекомбинантного лентивируса. Например, лентивирус является репликационно-дефектным, например, не содержит одного или нескольких генов, необходимых для репликации вируса.
В некоторых вариантах осуществления ДНК, кодирующую Cas9 и/или gRNA, доставляют с помощью рекомбинантного аденовируса. В некоторых вариантах осуществления аденовирус сконструирован таким образом, что он обладает сниженной иммуногенностью для человека.
В некоторых вариантах осуществления ДНК, кодирующую Cas9 и/или gRNA, доставляют с помощью рекомбинантного AAV. В некоторых вариантах осуществления AAV может встраивать свой геном в геном клетки-хозяина, например, целевой клетки, описанной в данном документе. В некоторых вариантах осуществления AAV представляет собой самокомплементарный аденоассоциированный вирус (scAAV), например, scAAV, упаковывающий обе нити, которые гибридизуются вместе с образованием двунитевой ДНК. Серотипы AAV, которые могут использоваться в раскрытых способах, включают, например, AAV1, AAV2, модифицированный AAV2 (например, с модификациями Y444F, Y500F, Y730F и/или S662V), AAV3, модифицированный AAV3 (например, с модификацией Y705F, Y731F и/или T492V), AAV4, AAV5, AAV6, модифицированный AAV6 (например, с модификациями S663V и/или T492V), AAV8, AAV8.2, AAV9, AAV rh 10, и псевдотипированный AAV, такой как AAV2/8, AAV2/5 и AAV2/6, также могут использоваться в раскрытых способах.
В некоторых вариантах осуществления ДНК, кодирующую Cas9 и/или gRNA, доставляют с помощью гибридного вируса, например, гибрида одного или нескольких вирусов, описанных в данном документе.
Упаковывающую клетку используют для сборки вирусной частицы, способной инфицировать хозяина или целевую клетку. Такая клетка включает клетку 293, которая может обеспечивать упаковку аденовируса, и клетку ψ2 или клетку PA317, которая может обеспечивать упаковку ретровируса. Вирусный вектор, используемый в генной терапии, обычно получают с помощью клеточной линии-продуцента, которая обеспечивает упаковку вектора на основе нуклеиновой кислоты в вирусную частицу. Вектор, как правило, содержит минимальное количество последовательностей вируса, необходимых для упаковки и последующей интеграции в хозяина или целевую клетку (при необходимости), при этом другие последовательности вируса заменяют экспрессионной кассетой, кодирующей белок, подлежащий экспрессии. Например, вектор на основе AAV, используемый в генной терапии, как правило, содержит только последовательности инвертированных концевых повторов (ITR) из генома AAV, которые необходимы для упаковки и экспрессии гена в хозяине или целевой клетке. Отсутствующие функциональные элементы вируса обеспечиваются в транс-положении с помощью упаковывающей клеточной линии. В последующем вирусная ДНК упаковывается в клеточной линии, которая содержит плазмиду-помощника, кодирующую другие гены AAV, а именно rep и cap, но не содержащую последовательностей ITR. Клеточную линию также инфицируют аденовирусом в качестве помощника. Вирус-помощник способствует репликации вектора на основе AAV и экспрессии генов AAV плазмидой-помощником. Плазмида-помощник не упаковывается в значительных количествах вследствие отсутствия последовательностей ITR. Контаминацию аденовирусом можно снизить, например, с помощью тепловой обработки, к которой аденовирус более чувствителен, чем AAV.
В одном варианте осуществления вирусный вектор обладает способностью распознавать тип клеток и/или тип ткани. Например, вирусный вектор может быть псевдотипирован отличающимся/альтернативным гликопротеином оболочки вируса; сконструирован с рецептором, специфическим в отношении типа клеток (например, генетическая модификация гликопротеинов оболочки вируса с включением нацеливающих лигандов, таких как пептидный лиганд, одноцепочечное антитело, фактор роста); и/или сконструирован таким образом, что он содержит молекулярный мостик с двойной специфичностью, при этом один конец распознает гликопротеин вируса, а другой конец распознает фрагмент поверхности целевой клетки (например, лиганд-рецептор, моноклональное антитело, авидин-биотин и химическая конъюгация).
В одном варианте осуществления вирусный вектор обеспечивает специфическую в отношении типа клеток экспрессию. Например, при конструировании может быть введен тканеспецифический промотор для ограничения экспрессии трансгена (Cas 9 и gRNA) только целевой клеткой. Специфичность вектора также может быть опосредована микроРНК-зависимым контролем экспрессии трансгена. В одном варианте осуществления вирусный вектор обладает повышенной эффективностью слияния вирусного вектора и мембраны целевой клетки. Например, слитый белок, такой как гемагглютинин (HA), способный к слиянию, может быть включен для повышения поглощения вируса в клетки. В одном варианте осуществления вирусный вектор обладает способностью к ядерной локализации. Например, вирус, для которого требуется разрушение клеточной стенки (в ходе клеточного деления), и который, следовательно, не будет инфицировать неделящуюся клетку, может быть изменен со встраиванием пептида ядерной локализации в матричный белок вируса, что тем самым обеспечивает возможность трансдукции непролиферирующих клеток.
В некоторых вариантах осуществления ДНК, кодирующую Cas9 и/или gRNA, доставляют с помощью способа без использования вектора (например, с применением "голой" ДНК или комплексов ДНК). Например, ДНК можно доставлять с помощью, к примеру, органически модифицированных диоксида кремния или соли кремневой кислоты (Ormosil), электропорации, генной пушки, сонопорации, магнитофекции, опосредованной липидами трансфекции, дендримеров, неорганических наночастиц, фосфатов кальция или их комбинации.
В некоторых вариантах осуществления ДНК, кодирующую Cas9 и/или gRNA, доставляют с помощью комбинации вектора и способа без использования вектора. Например, виросома включает липосому, объединенную с инактивированным вирусом (например, ВИЧ или вирусом гриппа), которая может приводить к более эффективному переносу генов, например, в эпителиальную клетку дыхательных путей, чем способ с использованием вируса или липосомы по отдельности.
В одном варианте осуществления носитель для доставки представляет собой невирусный вектор. В одном варианте осуществления невирусный вектор представляет собой неорганическую наночастицу (например, с полезной нагрузкой, присоединенной к поверхности наночастицы). Иллюстративные неорганические наночастицы включают, например, магнитные наночастицы (например, Fe lvln02) или диоксид кремния. Наружная поверхность наночастицы может быть конъюгирована с положительно заряженным полимером (например, полиэтиленимином, полилизином, полисерином), что позволяет присоединять (например, посредством конъюгирования или захвата) полезную нагрузку. В одном варианте осуществления невирусный вектор представляет собой органическую наночастицу (например, средство для удержания полезной нагрузки внутри наночастицы). Иллюстративные органические наночастицы включают, например, липосомы SNALP, которые содержат катионные липиды вместе с нейтральными вспомогательными липидами, которые покрыты полиэтиленгликолем (PEG), и комплекс протамина и нуклеиновой кислоты, покрытый липидным слоем.
Иллюстративные липиды и/или полимеры для переноса систем CRISPR или нуклеиновой кислоты, например, векторов, кодирующих системы CRISPR или их компоненты, включают, например, описанные в патентных документах WO2011/076807, WO2014/136086, WO2005/060697, WO2014/140211, WO2012/031046, WO2013/103467, WO2013/006825, WO2012/006378, WO2015/095340 и WO2015/095346, содержание каждого из вышеуказанного включено в данный документ посредством ссылки во всей своей полноте. В одном варианте осуществления носитель содержит модификации, связанные с нацеливанием, для увеличения поглощения целевой клеткой наночастиц и липосом, например, специфические для конкретной клетки антигены, моноклональные антитела, одноцепочечные антитела, аптамеры, полимеры, сахара и проникающие в клетку пептиды. В одном варианте осуществления в носителе испльзуются фузогенные и дестабилизирующие эндосомы пептиды/полимеры. В одном варианте осуществления носитель подвергается инициируемым действием кислоты конформационным изменениям (например, для ускорения эндосомального высвобождения молекулы-карго). В одном варианте осуществления расщепляемый под действием стимулирующего фактора полимер используют, например, для обеспечения высвобождения в определенный клеточный компартмент. Например, можно использовать катионные полимеры, связанные дисульфидной связью, которые расщепляются в восстанавливающей среде клетки.
В одном варианте осуществления носитель для доставки представляет собой биологический невирусный носитель для доставки. В одном варианте осуществления носитель представляет собой аттенуированную бактерию (например, природную или сконструированную искусственно так, чтобы она была инвазивной, но аттенуированной для предотвращения патогенеза и экспрессирующую трансген (например, Listeria monocytogenes, определенные штаммы Salmonella, Bifidobacterium longum и модифицированная Escherichia coli), бактерии, обладающие питательным и тканеспецифическим тропизмом к тканям, специфическим в отношении мишени, бактерии, содержащие модифицированные поверхностные белки для изменения специфичности в отношении целевой ткани). В одном варианте осуществления носитель представляет собой генетически модифицированный бактериофаг (например, сконструированные фаги, имеющие большую упаковывающую емкость, менее иммуногенные, содержащие последовательности для поддержания плазмид млекопитающего и имеющие встроенные нацеливающие лиганды). В одном варианте осуществления носитель представляет собой вирусоподобную частицу млекопитающего. Например, модифицированные вирусные частицы могут быть получены (например, путем очистки "пустых" частиц с последующей сборкой ex vivo вируса с требуемой молекулой-карго). Носитель также может быть сконструирован так, чтобы включать нацеливающие лиганды с изменением специфичности в отношении целевой ткани. В одном варианте осуществления носитель представляет собой биологическую липосому. Например, биологическая липосома представляет собой частицу на основе фосфолипидов, полученную из клеток человека (например, "теней" эритроцитов, которые представляют собой красные кровяные клетки, распавшиеся на сферические структуры, полученные от субъекта (например, нацеливания на ткань можно достигать путем присоединения различных ткане- или клеточноспецифичных лигандов), или секреторные экзосомы представляют собой мембраносвязанные нановезикулы, полученные от субъекта (т. е. пациента) (30-100 нм), эндоцитозного происхождения (например, могут быть получены из различных типов клеток и, следовательно, могут поглощаться клетками без необходимости в нацеливающих лигандах).
В одном варианте осуществления доставляют одну или несколько молекул нуклеиновой кислоты (например, молекул ДНК), отличных от компонентов системы Cas, например, от компонента, представляющего собой молекулу Cas9, и/или компонента, представляющего собой молекулу gRNA, описанных в данном документе. В одном варианте осуществления молекула нуклеиновой кислоты доставляется одновременно с доставкой одного или нескольких компонентов системы Cas. В одном варианте осуществления молекула нуклеиновой кислоты доставляется до или после (например, менее приблизительно 30 минут, 1 часа, 2 часов, 3 часов, 6 часов, 9 часов, 12 часов, 1 дня, 2 дней, 3 дней, 1 недели, 2 недель или 4 недель) доставки одного или нескольких компонентов системы Cas9. В одном варианте осуществления молекула нуклеиновой кислоты доставляется с помощью средства, отличного от того, с помощью которого доставляют один или несколько компонентов системы Cas9, например, компонент, представляющий собой молекулу Cas9, и/или компонент, представляющий собой молекулу gRNA. Молекула нуклеиновой кислоты может быть доставлена с помощью любых способов доставки, описанных в данном документе. Например, молекула нуклеиновой кислоты может быть доставлена с помощью вирусного вектора, например, интеграционно-дефектного лентивируса, а компонент, представляющий собой молекулу Cas9, и/или компонент, представляющий собой молекулу gRNA, могут быть доставлены с помощью электропорации, вследствие чего, например, может быть снижена токсичность, обусловленная нуклеиновыми кислотами (например, ДНК). В одном варианте осуществления молекула нуклеиновой кислоты кодирует терапевтический белок, например, белок, описанный в данном документе. В одном варианте осуществления молекула нуклеиновой кислоты кодирует молекулу РНК, например, молекулу РНК, описанную в данном документе. Доставка РНК, кодирующей молекулу Cas9
РНК, кодирующую молекулы Cas9 (например, молекулы активной Cas9, молекулы неактивной Cas9 или слитые белки на основе неактивной Cas9) и/или молекулы gRNA, можно доставлять в клетки, например, целевые клетки, описанные в данном документе, с помощью известных из уровня техники способов или описанных в данном документе. Например, РНК, кодирующую Cas9 и/или кодирующую gRNA, можно доставлять, например, с помощью микроинъекции, электропорации, опосредованной липидами трансфекции, опосредованной пептидами доставки или их комбинации.
Доставка молекулы Cas9 в виде белка
Молекулы Cas9 (например, молекулы активной Cas9, молекулы неактивной Cas9 или слитые белки на основе неактивной Cas9) можно доставлять в клетки с помощью известных из уровня техники способов или описанных в данном документе. Например, молекулы белка Cas9 можно доставлять, например, с помощью микроинъекции, электропорации, опосредованной липидами трансфекции, опосредованной пептидами доставки, сжатия клетки или истирания (например, с помощью наноигл) или их комбинации. Доставка может сопровождаться доставкой ДНК, кодирующей gRNA, или gRNA, например, путем предварительного образования комплекса gRNA и белка Cas9 в виде рибонуклеопротеинового комплекса (RNP).
В одном аспекте молекулу Cas9, например, описанную в данном документе, доставляют в виде белка, а молекулу gRNA доставляют в виде одной или нескольких РНК (например, в виде dgRNA или sgRNA, описанных в данном документе). В ряде вариантов осуществления перед доставкой в клетку обеспечивают образование комплекса белка Cas9 с молекулой gRNA, например, как описано в данном документе, в виде рибонуклеопротеинового комплекса ("RNP"). В ряде вариантов осуществления RNP можно доставлять в клетки, например, описанные в данном документе, с помощью любого известного из уровня техники способа, например, электропорации. Как описано в данном документе и не ограничиваясь теорией полагают, что может быть предпочтительным применять молекулу gRNA и молекулу Cas9, которые дают высокий % редактирования в целевой последовательности (например, > 85%, > 90%, > 95%, > 98% или > 99%) в целевой клетке, например, описанной в данном документе, даже при сниженной концентрации RNP, доставляемого в клетку. Опять-таки не ограничиваясь теорией полагают, что доставка RNP в сниженной или низкой концентрации, содержащего молекулу gRNA, которая дает высокий % редактирования в целевой последовательности в целевой клетке (в том числе при низкой концентрации RNP), может быть полезной, поскольку она может обеспечивать снижение частоты и количества событий нецелевого редактирования. В одном аспекте, где подлежит применению RNP в низкой или сниженной концентрации, следующую иллюстративную процедуру можно использовать для получения RNP с молекулой dgRNA:
1. Обеспечение молекулы Cas9 и tracr в растворе в высокой концентрации (например, в концентрации, превышающей конечную концентрацию RNP, подлежащего доставке в клетку) и обеспечение возможности уравновешивания двух компонентов.
2. Обеспечение молекулы crRNA и обеспечение возможности уравновешивания компонентов (с образованием таким образом раствора RNP с высокой концентрацией).
3. Разбавление раствора RNP до требуемой концентрации.
4. Доставка указанного RNP в указанной требуемой концентрации в целевые клетки, например, с помощью электропорации.
Вышеуказанную процедуру можно модифицировать для применения с молекулами sgRNA, пропуская вышеуказанную стадию 2, а на стадии 1 предоставлять молекулу Cas9 и молекулу sgRNA в растворе в высокой концентрации и обеспечивать возможность уравновешивания компонентов. В ряде вариантов осуществления молекулу Cas9 и каждый компонент gRNA обеспечивают в растворе в соотношении 1:2 (Cas9:gRNA), например, в молярном соотношении Cas9:молекула gRNA 1:2. Если используют молекулы dgRNA, то соотношение, например молярное соотношение, составляет 1:2:2 (Cas9:tracr:crRNA). В ряде вариантов осуществления RNP образуется при концентрации 20 мкМ или выше, например, при концентрации от приблизительно 20 мкМ до приблизительно 50 мкМ. В ряде вариантов осуществления RNP образуется при концентрации 10 мкМ или выше, например, при концентрации от приблизительно 10 мкМ до приблизительно 30 мкМ. В ряде вариантов осуществления RNP разбавляют до конечной концентрации 10 мкМ или меньше (например, до концентрации от приблизительно 0,01 мкМ до приблизительно 10 мкМ) в растворе, содержащем целевую клетку (например, описанную в данном документе), для доставки в указанную целевую клетку. В ряде вариантов осуществления RNP разбавляют до конечной концентрации 3 мкМ или меньше (например, до концентрации от приблизительно 0,01 мкМ до приблизительно 3 мкМ) в растворе, содержащем целевую клетку (например, описанную в данном документе), для доставки в указанную целевую клетку. В ряде вариантов осуществления RNP разбавляют до конечной концентрации 1 мкМ или меньше (например, до концентрации от приблизительно 0,01 мкМ до приблизительно 1 мкМ) в растворе, содержащем целевую клетку (например, описанную в данном документе), для доставки в указанную целевую клетку. В ряде вариантов осуществления RNP разбавляют до конечной концентрации 0,3 мкМ или меньше (например, до концентрации от приблизительно 0,01 мкМ до приблизительно 0,3 мкМ) в растворе, содержащем целевую клетку (например, описанную в данном документе), для доставки в указанную целевую клетку. В ряде вариантов осуществления RNP обеспечивают в конечной концентрации, составляющей приблизительно 3 мкМ, в растворе, содержащем целевую клетку (например, описанную в данном документе), для доставки в указанную целевую клетку. В ряде вариантов осуществления RNP обеспечивают в конечной концентрации, составляющей приблизительно 2 мкМ, в растворе, содержащем целевую клетку (например, описанную в данном документе), для доставки в указанную целевую клетку. В ряде вариантов осуществления RNP обеспечивают в конечной концентрации, составляющей приблизительно 1 мкМ, в растворе, содержащем целевую клетку (например, описанную в данном документе), для доставки в указанную целевую клетку. В ряде вариантов осуществления RNP обеспечивают в конечной концентрации, составляющей приблизительно 0,3 мкМ, в растворе, содержащем целевую клетку (например, описанную в данном документе), для доставки в указанную целевую клетку. В ряде вариантов осуществления RNP обеспечивают в конечной концентрации, составляющей приблизительно 0,1 мкМ, в растворе, содержащем целевую клетку (например, описанную в данном документе), для доставки в указанную целевую клетку. В ряде вариантов осуществления RNP обеспечивают в конечной концентрации, составляющей приблизительно 0,05 мкМ, в растворе, содержащем целевую клетку (например, описанную в данном документе), для доставки в указанную целевую клетку. В ряде вариантов осуществления RNP обеспечивают в конечной концентрации, составляющей приблизительно 0,03 мкМ, в растворе, содержащем целевую клетку (например, описанную в данном документе), для доставки в указанную целевую клетку. В ряде вариантов осуществления RNP обеспечивают в конечной концентрации, составляющей приблизительно 0,01 мкМ, в растворе, содержащем целевую клетку (например, описанную в данном документе), для доставки в указанную целевую клетку. В ряде вариантов осуществления RNP составляют в среде, подходящей для электропорации. В ряде вариантов осуществления RNP доставляют в клетки, например, в клетки HSPC, например, описанные в данном документе, с помощью электропорации, например, с использованием условий электропорации, описанных в данном документе.
В ряде аспектов компоненты системы редактирования генаов(например, системы CRISPR) и/или нуклеиновую кислоту, кодирующую один или несколько компонентов системы редактирования генов (например, системы CRISPR), вводят в клетки путем механического нарушения структуры клеток, например, путем пропускания указанных клеток через пору или канал, за счет чего клетки сжимаются. Такое нарушение можно осуществлять в растворе, содержащем компоненты системы редактирования генов (например, системы CRISPR) и/или нуклеиновую кислоту, кодирующую один или несколько компонентов системы редактирования генов (например, системы CRISPR), например, как описано в данном документе. В ряде вариантов осуществления нарушение осуществляют с использованием системы TRIAMF, например, как описано в данном документе, например, в разделе "Примеры" и в заявке на патент согласно PCT PCT/US17/54110 (включенной в данный документ посредством ссылки во всей своей полноте).
Бимодальная или отличающаяся доставка компонентов
Раздельная доставка компонентов системы Cas, например, компонента, представляющего собой молекулу Cas9, и компонента, представляющего собой молекулу gRNA, и более конкретно доставка компонентов с помощью отличающихся способов может повышать эффективность, например, за счет улучшения специфичности в отношении ткани и безопасности.
В одном варианте осуществления молекула Cas9 и молекула gRNA доставляются с помощью разных способов или, как их в некоторых случаях называют в данном документе, отличающихся способов. Разные или отличающиеся способы, используемые в данном документе, означают способы доставки, с помощью которых рассматриваемая молекула-компонент, например, молекула Cas9, молекула gRNA или нуклеиновая кислота, представляющая собой матрицу, наделяется разными фармакодинамическими или фармакокинетическими свойствами. Например, способы доставки могут обеспечивать разное распределение в ткани, разный период полужизни или разное распределение во времени, например, в определенных компартменте, ткани или органе.
Некоторые способы доставки, например, доставка с помощью вектора на основе нуклеиновой кислоты, который сохраняется в клетке или в потомстве клетки, например, за счет автономной репликации или вставки в нуклеиновую кислоту клетки, приводят к более стойким экспрессии и присутствию компонента.
XI. Способы лечения
Системы на основе Cas9, например, одна или несколько молекул gRNA и одна или несколько молекул Cas9, описанные в данном документе, являются применимыми для лечения заболевания у млекопитающего, например, у человека. Термины "лечить", "подвергнутый лечению" "проведение лечения" и "лечение" включают введение систем на основе cas9, например, одной или нескольких молекул gRNA и одной или нескольких молекул cas9 в клетки для предупреждения или задержки проявления симптомов, осложнений или биохимических признаков заболевания, облегчения симптомов или приостановки или подавления дальнейшего развития заболевания, состояния или нарушения. Лечение может также предусматривать введение одной или нескольких (например, популяции) клеток, например, HSPC, которые были модифицированы путем введения молекулы gRNA (или более одной молекулы gRNA) по настоящему изобретению или путем введения системы CRISPR, описанной в данном документе, или с помощью любого из способов получения указанных клеток, описанных в данном документе, для предупреждения или задержки проявления симптомов, осложнений или биохимических признаков заболевания, облегчения симптомов или приостановки или подавления дальнейшего развития заболевания, состояния или нарушения. Лечение может быть профилактическим (для предупреждения или задержки возникновения заболевания или для предупреждения проявления его клинических или субклинических симптомов) или терапевтическим для подавления или облегчения симптомов после проявления заболевания. Лечение можно оценивать с помощью терапевтических показателей, описанных в данном документе. Таким образом, способы "лечения" по настоящему изобретению также предусматривают введение субъекту клеток, измененных путем введения системы cas9 (например, одной или нескольких молекул gRNA и одной или нескольких молекул Cas9) в указанные клетки, с целью излечения, снижения тяжести или ослабления одного или нескольких симптомов заболевания или состояния, с целью продления здорового состояния или выживаемости субъекта сверх ожидаемого в отсутствие такого лечения. Например, "лечение" включает облегчение симптома заболевания у субъекта на по меньшей мере 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или больше.
Системы на основе Cas9, которые содержат молекулы gRNA, содержащие нацеливающие домены, описанные в данном документе, например, в таблице 1, и способы и клетки (например, описанные в данном документе) являются применимыми для лечения гемоглобинопатий.
Гемоглобинопатии
Гемоглобинопатии охватывают целый ряд анемий генетического происхождения, при которых наблюдаются сниженная выработка и/или увеличенное разрушение (гемолиз) красных кровяных клеток (RBC). К ним также относятся генетические дефекты, обуславливающие выработку аномальных форм гемоглобина c сопутствующей нарушенной способностью поддержания концентрации кислорода. Ряд таких нарушений включает неспособность вырабатывать нормальный β-глобин в достаточных количествах, тогда как другие включают полную неспособность вырабатывать нормальный β-глобин. Такие нарушения, ассоциированные с белком β-глобином, в целом относятся к β-гемоглобинопатиям. Например, β-талассемию обуславливают частичное или полное нарушение экспрессии гена β-глобина, что приводит к дефициту или отсутствию HbA. Серповидноклеточную анемию обуславливает точечная мутация в структурном гене β-глобина, что приводит к выработке аномального (серповидного) гемоглобина (HbS). HbS склонен к полимеризации, особенно в бескислородных условиях. HbS-содержащие RBC являются более хрупкими, чем обычные RBC и легче подвергаются гемолизу, что в конечном итоге приводит к анемии.
В одном варианте осуществления коррекцию генетического дефекта в альфа-глобине или бета-глобине осуществляют, например, с помощью гомологичной рекомбинации с использованием молекулы Cas9 и молекулы gRNA, например, систем CRISPR, описанных в данном документе.
В одном варианте осуществления ген, кодирующий копию альфа-глобина или бета-глобина дикого типа (например, не подвергнутую мутации), вставляют в геном клетки, например, в сайт "безопасной гавани", например, в сайт "безопасной гавани" AAVS1, с помощью гомологичной рекомбинации с использованием системы CRISPR и способов, описанных в данном документе.
В одном варианте осуществления нацеливание на ген, ассоциированный с гемоглобинопатиями, осуществляют с использованием молекулы Cas9 и молекулы gRNA, описанных в данном документе. Иллюстративные мишени включают, например, гены, ассоциированные с контролем генов гамма-глобина. В одном варианте осуществления мишень представляет собой неделеционный участок HPFH.
Фетальный гемоглобин (также гемоглобин F, или HbF, или α2γ2) представляет собой тетрамер из двух полипептидов альфа-глобина, характерного для взрослого человека, и двух полипептидов гамма-глобина, подобного бета-глобину, характерного для плода. HbF является основным белком-переносчиком кислорода у плода человека на протяжении последних семи месяцев внутриутробного развития и у новорожденного до примерно 6 месяцев. Функционально основное отличие фетального гемоглобина от гемоглобина взрослого человека состоит в том, что он способен связывать кислород с большей аффинностью, чем "взрослая" форма, обеспечивая развивающемуся плоду лучший доступ кислорода из кровотока матери.
У новорожденных фетальный гемоглобин почти полностью заменяется "взрослой" формой гемоглобина через примерно 6 месяцев после рождения. У взрослых людей выработка фетального гемоглобина может быть повторно активизирована фармакологическим способом, которая является полезной в лечении заболеваний, таких как гемоглобинопатии. Например, у определенных пациентов с гемоглобинопатиями более высокие уровни экспрессии гамма-глобина могут частично компенсировать дефектную или нарушенную выработку продукта гена бета-глобина, что может ослаблять тяжесть клинических проявлений при таких заболеваниях. Повышенные уровни HbF или количества F-клеток (эритроцитов, содержащих HbF) могут ослаблять тяжесть заболевания, относящегося к гемоглобинопатиям, например, большой бета-талассемии и серповидноклеточной анемии.
Как было неожиданно обнаружено, повышенные уровни HbF или количества F-клеток могут быть ассоциированы с образованием вставки/делеции в одном или нескольких неделеционных участках HPFH в клетках, например, HSPC, и/или клетках, дифференцированных из HSPC (например, HSPC, модифицированных с использованием одной или нескольких молекул gRNA, описанных в данном документе). В одном варианте осуществления клетка представляет собой гематопоэтическую стволовую клетку или клетку-предшественника.
Серповидноклеточные заболевания
Серповидноклеточное заболевание представляет собой группу нарушений, затрагивающих гемоглобин. У людей с данным нарушением присутствуют нетипичные молекулы гемоглобина (гемоглобин S), которые могут изменять форму красных кровяных телец в форму серпа или полумесяца. Характерные признаки данного нарушения включают низкое количество красных кровяных клеток (анемия), рецидивирующие инфекции и периодические эпизоды боли.
Мутации в гене HBB вызывают серповидноклеточное заболевание. Ген HBB создает условия для образования бета-глобина. Различные варианты бета-глобина являются следствием различных мутаций в гене HBB. Вследствие одной конкретной мутации в гене HBB образуется аномальный вариант бета-глобина, известный под названием гемоглобин S (HbS). Другие мутации в гене HBB приводят к образованию дополнительных аномальных вариантов бета-глобина, таких как гемоглобин C (HbC) и гемоглобин E (HbE). Мутации в гене HBB также могут обуславливать необычно низкий уровень бета-глобина, т. е. бета-талассемию.
У людей с серповидноклеточным заболеванием по меньшей мере одна из бета-глобиновых субъединиц гемоглобина заменена гемоглобином S. При серповидноклеточной анемии, которая является распространенной формой серповидноклеточного заболевания, гемоглобином S заменены обе бета-глобиновые субъединицы гемоглобина. При других типах серповидноклеточного заболевания только одна бета-глобиновая субъединица гемоглобина заменена гемоглобином S. Другая бета-глобиновая субъединица заменена другим аномальным вариантом, таким как гемоглобин C. Например, у людей с серповидноклеточным заболеванием, представляющим собой гемоглобиноз C (HbSC), присутствуют молекулы гемоглобина с гемоглобином S и гемоглобином C вместо бета-глобина. Если мутации, в результате которых образуется гемоглобин S, и бета-талассемия происходят одновременно, то у индивидуумов возникает заболевание гемоглобиноз S-бета-талассемия (HbSBetaThal).
Бета-талассемия
Бета-талассемия представляет собой заболевание крови, при котором снижается выработка гемоглобина. У людей с бета-талассемией низкие уровни гемоглобина приводят к нехватке кислорода во многих частях организма. У пораженных индивидуумов также имеется недостаток красных кровяных клеток (анемия), который может обуславливать бледность кожи, слабость, усталость и более серьезные осложнения. Люди с бета-талассемией имеют повышенный риск развития аномальных тромбов.
Бета-талассемия подразделяется на два типа в зависимости от тяжести симптомов: большую талассемию (также известную как анемия Кули) и среднюю талассемию. Среди данных двух типов большая талассемия является более тяжелой формой.
Мутации в гене HBB обуславливают бета-талассемию. Ген HBB создает условия для образования бета-глобина. Некоторые мутации в гене HBB препятствуют выработке любой формы бета-глобина. Отсутствие бета-глобина относится к бета-ноль (B°) талассемии. Другие мутации в гене HBB обеспечивают возможность образования некоторой формы бета-глобина, но в сниженных количествах, т. е., бета-плюс (B+) талассемия. У людей с обоими типами диагностировали большую талассемию и среднюю талассемию.
В одном варианте осуществления комплекс молекула Cas9/молекула gRNA, целенаправленно воздействующий на первый ген или локус, используют для лечения нарушения, обусловленного вторым геном, например, мутацией во втором гене. В качестве примера целенаправленное воздействие на первый ген, например, с помощью редактирования или доставки полезной нагрузки, может компенсировать влияние второго гена, например, мутантного второго гена, или подавлять дополнительное повреждение, вызванное этим геном. В одном варианте осуществления аллель(аллели) первого гена, носителем которого(которых) является субъект, не является(не являются) причиной нарушения. Например, как показано в данном документе, молекулы gRNA, которые индуцируют образование вставки/делеции в неделеционном участке HPFH, например, в промоторном участке HBG1 и/или HBG2, могут приводить к повышению экспрессии фетального гемоглобина в эритроидных клетках, дифференцированных из модифицированных HSPC (описанных в данном документе), и не ограничиваясь теорией полагают, что такое повышение экспрессии фетального гемоглобина компенсирует воздействие гена HBB, содержащего мутацию, приводящую к образованию серповидной формы, и создает условия для его коррекции.
В одном аспекте настоящее изобретение относится к лечению млекопитающего, например человека, нуждающегося в повышении уровня фетального гемоглобина (HbF).
В одном аспекте настоящее изобретение относится к лечению млекопитающего, например человека, у которого была диагностирована гемоглобинопатия или у которого имеется риск ее развития.
В одном аспекте гемоглобинопатия представляет собой β-гемоглобинопатию. В одном аспекте гемоглобинопатия представляет собой серповидноклеточное заболевание. В одном аспекте гемоглобинопатия представляет собой бета-талассемию.
Способы лечения гемоглобинопатий
В другом аспекте в настоящем изобретении представлены способы лечения. В ряде аспектов молекулы gRNA, системы CRISPR и/или клетки по настоящему изобретению используют для лечения нуждающегося в этом пациента. В ряде аспектов пациентом является млекопитающее, например человек. В ряде аспектов у пациента имеется гемоглобинопатия. В ряде вариантов осуществления у пациента имеется серповидноклеточное заболевание. В ряде вариантов осуществления у пациента имеется бета-талассемия.
В одном аспекте способ лечения предусматривает введение млекопитающему, например человеку одной или нескольких молекул gRNA, например, одной или нескольких молекул gRNA, содержащих нацеливающий домен, описанный в таблице 1, и одной или нескольких молекул cas9, описанных в данном документе.
В одном аспекте способ лечения предусматривает введение млекопитающему популяции клеток, где популяция клеток представляет собой популяцию клеток от млекопитающего, например человека, которому были введены одна или несколько молекул gRNA, например, одна или несколько молекул gRNA, содержащих нацеливающий домен, описанный в таблице 1, и одна или несколько молекул cas9, описанных в данном документе, например, система CRISPR, описанная в данном документе. В одном варианте осуществления введение одной или нескольких молекул gRNA или систем CRISPR в клетку осуществляют in vivo. В одном варианте осуществления введение одной или нескольких молекул gRNA или систем CRISPR в клетку осуществляют ex vivo.
В одном аспекте способ лечения предусматривает введение млекопитающему, например человеку, эффективного количества популяции клеток, содержащей клетки, которые содержат или в одновременно содержали одну или несколько молекул gRNA, например, одну или несколько молекул gRNA, содержащих нацеливающий домен, описанный в таблице 1, и одну или несколько молекул cas9, описанных в данном документе, или потомство указанных клеток. В одном варианте осуществления клетки являются аллогенными по отношению к млекопитающему. В одном варианте осуществления клетки являются аутологичными по отношению к млекопитающему. В одном варианте осуществления клетки отбирают у млекопитающего, проводят с ними манипуляции ex vivo и вводят млекопитающему.
В ряде аспектов клетки, которые содержат или одновременно содержали одну или несколько молекул gRNA, например, одну или несколько молекул gRNA, содержащих нацеливающий домен, описанный в таблице 1, и одну или несколько молекул cas9, описанных в данном документе, или потомство указанных клеток представляют собой стволовые клетки или клетки-предшественники. В одном аспекте стволовые клетки являются гематопоэтическими стволовыми клетками. В одном аспекте клетки-предшественники являются гематопоэтическими клетками-предшественниками. В одном аспекте клетки содержат и гематопоэтические стволовые клетки, и гематопоэтические клетки-предшественники, например, представляют собой HSPC. В одном аспекте клетки содержат CD34+ клетки, например, состоят из них. В одном аспекте клетки по сути не содержат CD34- клеток. В одном аспекте клетки содержат CD34+/CD90+ стволовые клетки, например, состоят из них. В одном аспекте клетки содержат CD34+/CD90- клетки, например, состоят из них. В одном аспекте клетки представляют собой популяцию, содержащую один или несколько типов клеток, описанных выше или описанных в данном документе.
В одном варианте осуществления в настоящем изобретении представлен способ лечения гемоглобинопатии, например, серповидноклеточного заболевания или бета-талассемии, или способ повышения экспрессии фетального гемоглобина у млекопитающего, например у нуждающегося в этом человека, при этом способ предусматривает:
a) получение, например, отбор у или выделение популяции HSPC (например, CD34+ клеток) от млекопитающего;
b) помещение указанных клеток ex vivo, например, в среду для культивирования клеток, необязательно в присутствии эффективного количества композиции, содержащей по меньшей мере одно вещество, стимулирующее размножение стволовых клеток, за счет чего указанная популяция HSPC (например, CD34+ клеток) увеличивается в большей степени, чем необработанная популяция;
c) приведение популяции HSPC (например, CD34+ клеток) в контакт с эффективным количеством композиции, содержащей по меньшей мере одну молекулу gRNA, содержащую нацеливающий домен, описанный в данном документе, например, нацеливающий домен, описанный в таблице 1, или нуклеиновую кислоту, кодирующую указанную молекулу gRNA, и по меньшей мере одну молекулу cas9, например, описанную в данном документе, или нуклеиновую кислоту, кодирующую указанную молекулу cas9, например, один или несколько RNP, описанных в данном документе, например, с системой CRISPR, описанной в данном документе;
d) осуществление по меньшей мере одной модификации в по меньшей мере части клеток в популяции (например, в по меньшей мере части HSPC, например, CD34+ клеток в популяции), за счет чего, например, при дифференцировке указанных HSPC в клетки эритроидного ростка, например, красные кровяные клетки, повышается экспрессия фетального гемоглобина, например, по сравнению с клетками, которые не приводили в контакт в соответствии со стадией c); и
f) возвращение популяции клеток, содержащей указанные модифицированные HSPC (например, CD34+ клетки), млекопитающему.
В одном аспекте HSPC являются аллогенными по отношению к млекопитающему, которому их возвращают. В одном аспекте HSPC являются аутологичными по отношению к млекопитающему, которому их возвращают. В ряде аспектов HSPC выделены из костного мозга. В ряде аспектов HSPC выделены из периферической крови, например, мобилизованной периферической крови. В ряде аспектов мобилизованная периферическая кровь выделена у субъекта, которому вводили G-CSF. В ряде аспектов мобилизованная периферическая кровь выделена у субъекта, которому вводили средство для мобилизации, отличное от G-CSF, например, Plerixafor® (AMD3100). В других аспектах мобилизованная периферическая кровь выделена у субъекта, которому вводили комбинацию G-CSF и Plerixafor® (AMD3100). В ряде аспектов HSPC выделены из пуповинной крови. В ряде вариантов осуществления клетки получены от пациента с гемоглобинопатией, например, пациента с серповидноклеточным заболеванием или пациента с талассемией, например, бета-талассемией.
В дополнительных вариантах осуществления способа способ дополнительно предусматривает после получения популяции HSPC (например, CD34+ клеток), например, из источника, описанного выше, стадию обогащения популяции клеток по HSPC (например, CD34+ клетками). В ряде вариантов осуществления способа после указанного обогащения популяция клеток, например, HSPC, по сути не содержит CD34- клеток.
В ряде вариантов осуществления популяция клеток, которую возвращают млекопитающему, содержит по меньшей мере 70% жизнеспособных клеток. В ряде вариантов осуществления популяция клеток, которую возвращают млекопитающему, содержит по меньшей мере 75% жизнеспособных клеток. В ряде вариантов осуществления популяция клеток, которую возвращают млекопитающему, содержит по меньшей мере 80% жизнеспособных клеток. В ряде вариантов осуществления популяция клеток, которую возвращают млекопитающему, содержит по меньшей мере 85% жизнеспособных клеток. В ряде вариантов осуществления популяция клеток, которую возвращают млекопитающему, содержит по меньшей мере 90% жизнеспособных клеток. В ряде вариантов осуществления популяция клеток, которую возвращают млекопитающему, содержит по меньшей мере 95% жизнеспособных клеток. В ряде вариантов осуществления популяция клеток, которую возвращают млекопитающему, содержит по меньшей мере 99% жизнеспособных клеток. Жизнеспособность можно определить путем окрашивания репрезентативной части популяции клеток на предмет присутствия маркера жизнеспособности клеток, как, например, известно из уровня техники.
В другом варианте осуществления в настоящем изобретении представлен способ лечения гемоглобинопатии, например, серповидноклеточного заболевания или бета-талассемии, или способ повышения экспрессии фетального гемоглобина у млекопитающего, например нуждающегося в этом человека, при этом способ предусматривает стадии:
a) получения, например, сбора у или выделения популяции HSPC (например, CD34+ клеток) от млекопитающего, например, из костного мозга млекопитающего;
b) выделения CD34+ клеток из популяции клеток стадии a);
c) помещения указанных CD34+ клеток ex vivo и культивирования указанных клеток, например, в среде для культивирования клеток в присутствии эффективного количества композиции, содержащей по меньшей мере одно вещество, стимулирующее размножение стволовых клеток, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, в концентрации от приблизительно 0,5 до приблизительно 0,75 микромоль, за счет чего указанная популяция CD34+ клеток увеличивается в большей степени, чем необработанная популяция;
d) введения в клетки из популяции CD34+ клеток эффективного количества композиции, содержащей молекулу Cas9, например, описанную в данном документе, и молекулу gRNA, например, описанную в данном документе, например, где необязательно молекула Cas9 и молекула gRNA находятся в форме RNP, например, описанного в данном документе, и где необязательно указанное введение осуществляют с помощью электропорации, например, описанной в данном документе, указанного RNP в указанные клетки;
e) осуществления по меньшей мере одной генетической модификации в по меньшей мере части клеток в популяции (например, в по меньшей мере части HSPC, например, CD34+ клеток, в популяции), за счет чего вставка/делеция, например описанная в данном документе, создается в геномном сайте, комплементарном нацеливающему домену gRNA, введенной на стадии d), или рядом с ним;
f) необязательного дополнительного культивирования указанных клеток после указанного введения, например, в среде для культивирования клеток в присутствии эффективного количества композиции, содержащей по меньшей мере одно вещество, стимулирующее размножение стволовых клеток, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, в концентрации от приблизительно 0,5 до приблизительно 0,75 микромоль, за счет чего количество клеток увеличивается в по меньшей мере 2 раза, например, по меньшей мере 4 раза, например, по меньшей мере 5 раз;
g) осуществления криоконсервации указанных клеток и
h) возвращения клеток млекопитающему, где
клетки, возвращаемые млекопитающему содержат клетки, у которых 1) сохраняется способность к дифференцировке в клетки эритроидного ростка, например, красные кровяные клетки; 2) при дифференцировке в красные кровяные клетки продуцируется повышенный уровень фетального гемоглобина, например, по сравнению с клетками, не модифицированными с помощью gRNA на стадии e), например, продуцируется по меньшей мере 6 пикограмм фетального гемоглобина на клетку.
В одном аспекте HSPC являются аллогенными по отношению к млекопитающему, которому их возвращают. В одном аспекте HSPC являются аутологичными по отношению к млекопитающему, которому их возвращают. В ряде аспектов HSPC выделены из костного мозга. В ряде аспектов HSPC выделены из периферической крови, например, мобилизованной периферической крови. В ряде аспектов мобилизованная периферическая кровь выделена у субъекта, которому вводили G-CSF. В ряде аспектов мобилизованная периферическая кровь выделена у субъекта, которому вводили средство для мобилизации, отличное от G-CSF, например, Plerixafor® (AMD3100). В других аспектах мобилизованная периферическая кровь выделена у субъекта, которому вводили комбинацию G-CSF и Plerixafor® (AMD3100). В ряде аспектов HSPC выделены из пуповинной крови. В ряде вариантов осуществления клетки получены от пациента с гемоглобинопатией, например, пациента с серповидноклеточным заболеванием или пациента с талассемией, например, бета-талассемией.
В ряде вариантов осуществления вышеописанного способа изложенная стадия b) приводит к получению популяции клеток, которая по сути не содержит CD34- клеток.
В дополнительных вариантах осуществления способа способ дополнительно предусматривает после получения популяции HSPC (например, CD34+ клеток), например, из источника, описанного выше, обогащение популяции клеток по HSPC (например, CD34+ клетками).
В дополнительных вариантах осуществления данных способов популяцию модифицированных HSPC (например, CD34+ стволовых клеток), обладающих способностью к дифференцировке с обеспечением повышенной экспрессии фетального гемоглобина, подвергают криоконсервации и хранят до тех пор, пока ее не будут повторно вводить млекопитающему. В ряде вариантов осуществления подвергнутую криоконсервации популяцию HSPC, обладающую способностью к дифференцировке в клетки эритроидного ростка, например, красные кровяные клетки, и/или при дифференцировке в клетки эритроидного ростка, например, красные кровяные клетки, к продуцированию повышенного уровня фетального гемоглобина, размораживают, а затем повторно вводят млекопитающему. В дополнительном варианте осуществления данных способов способ предусматривает проведение химиотерапии и/или лучевой терапии с удалением или снижением количества эндогенных гематопоэтических клеток-предшественников или стволовых клеток у млекопитающего. В дополнительном варианте осуществления данных способов способ не предусматривает стадии проведения химиотерапии и/или лучевой терапии с удалением или снижением количества эндогенных гематопоэтических клеток-предшественников или стволовых клеток у млекопитающего. В дополнительном варианте осуществления данных способов способ предусматривает осуществление химиотерапии и/или лучевой терапии с частичным снижением количества (например, частичной лимфодеплецией) эндогенных гематопоэтических клеток-предшественников или стволовых клеток у млекопитающего. В ряде вариантов осуществления пациент получает лечение с использованием дозы бусульфана, обеспечивающей полную лимфодеплецию, перед повторным введением модифицированных HSPC млекопитающему. В ряде вариантов осуществления пациент получает лечение с использованием дозы бусульфана, обеспечивающей частичную лимфодеплецию, перед повторным введением модифицированных HSPC млекопитающему.
В ряде вариантов осуществления клетки приводят в контакт с RNP, содержащим молекулу Cas9, например, описанную в данном документе, в комплексе с gRNA, нацеливающей на неделеционный участок HPFH, например, описанный в данном документе (например, содержащей нацеливающий домен, указанный в таблице 1.
В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, представляет собой соединение 1. В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, представляет собой соединение 2. В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, представляет собой соединение 3. В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, представляет собой (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол. В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, представляет собой (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол и присутствует в концентрации 2-0,1 микромоль, например, 1-0,25 микромоль, например, 0,75-0,5 микромоль. В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, представляет собой молекулу, описанную в WO2010/059401 (например, молекулу, описанную в примере 1 в WO2010/059401).
В ряде вариантов осуществления клетки, например, HSPC, например, описанные в данном документе, культивируют ex vivo в течение периода, составляющего от приблизительно 1 часа до приблизительно 15 дней, например, периода, составляющего от приблизительно 12 часов до приблизительно 12 дней, например, периода, составляющего от приблизительно 12 часов до 4 дней, например, периода, составляющего от приблизительно 1 дня до приблизительно 4 дней, например, периода, составляющего от приблизительно 1 дня до приблизительно 2 дней, например, периода, составляющего приблизительно 1 день, или периода, составляющего приблизительно 2 дня, до стадии приведения клеток в контакт с системой CRISPR, например, описанной в данном документе. В ряде вариантов осуществления указанное культивирование до указанной стадии приведения в контакт осуществляют в композиции (например, среде для культивирования клеток), содержащей вещество, стимулирующее размножение стволовых клеток, например, описанное в данном документе, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол в концентрации от приблизительно 0,25 мкМ до приблизительно 1 мкМ, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол в концентрации приблизительно 0,75-0,5 микромоль. В ряде вариантов осуществления клетки культивируют ex vivo в течение периода, составляющего не более приблизительно 1 день, например, не более приблизительно 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 час, после стадии приведения клеток в контакт с системой CRISPR, например, описанной в данном документе, например, в среде для культивирования клеток, которая содержит вещество, стимулирующее размножение стволовых клеток, например, описанное в данном документе, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол в концентрации от приблизительно 0,25 мкМ до приблизительно 1 мкМ, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол в концентрации приблизительно 0,75-0,5 микромоль. В других вариантах осуществления клетки культивируют ex vivo в течение периода, составляющего от приблизительно 1 часа до приблизительно 15 дней, например, периода, составляющего от приблизительно 12 часов до приблизительно 10 дней, например, периода, составляющего от приблизительно 1 дня до приблизительно 10 дней, например, периода, составляющего от приблизительно 1 дня до приблизительно 5 дней, например, периода, составляющего от приблизительно 1 дня до приблизительно 4 дней, например, периода, составляющего от приблизительно 2 дней до приблизительно 4 дней, например, периода, составляющего приблизительно 2 дня, приблизительно 3 дня или приблизительно 4 дня, после стадии приведения клеток в контакт с системой CRISPR, например, описанной в данном документе, в среде для культивирования клеток, которая, например, содержит вещество, стимулирующее размножение стволовых клеток, например, описанное в данном документе, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол в концентрации от приблизительно 0,25 мкМ до приблизительно 1 мкМ, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол в концентрации приблизительно 0,75-0,5 микромоль. В ряде вариантов осуществления клетки культивируют ex vivo (например, культивируют до указанной стадии приведения в контакт и/или культивируют после указанной стадии приведения в контакт) в течение периода, составляющего от приблизительно 1 часа до приблизительно 20 дней, например, периода, составляющего приблизительно 6-12 дней, например, периода, составляющего приблизительно 6, приблизительно 7, приблизительно 8, приблизительно 9, приблизительно 10, приблизительно 11 или приблизительно 12 дней.
В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит по меньшей мере приблизительно 1 миллион клеток (например, по меньшей мере приблизительно 1 миллион CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит по меньшей мере приблизительно 2 миллиона клеток (например, по меньшей мере приблизительно 2 миллиона CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит по меньшей мере приблизительно 3 миллиона клеток (например, по меньшей мере приблизительно 3 миллиона CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит по меньшей мере приблизительно 4 миллиона клеток (например, по меньшей мере приблизительно 4 миллиона CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит по меньшей мере приблизительно 5 миллионов клеток (например, по меньшей мере приблизительно 5 миллионов CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит по меньшей мере приблизительно 6 миллионов клеток (например, по меньшей мере приблизительно 6 миллионов CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит по меньшей мере 1 миллион клеток (например, по меньшей мере 1 миллион CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит по меньшей мере 2 миллиона клеток (например, по меньшей мере 2 миллиона CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит по меньшей мере 3 миллиона клеток (например, по меньшей мере 3 миллиона CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит по меньшей мере 4 миллиона клеток (например, по меньшей мере 4 миллиона CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит по меньшей мере 5 миллионов клеток (например, по меньшей мере 5 миллионов CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит по меньшей мере 6 миллионов клеток (например, по меньшей мере 6 миллионов CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит приблизительно 1 миллион клеток (например, приблизительно 1 миллион CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит приблизительно 2 миллиона клеток (например, приблизительно 2 миллиона CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит приблизительно 3 миллиона клеток (например, приблизительно 3 миллиона CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит приблизительно 4 миллиона клеток (например, приблизительно 4 миллиона CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит приблизительно 5 миллионов клеток (например, приблизительно 5 миллионов CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит приблизительно 6 миллионов клеток (например, приблизительно 6 миллионов CD34+ клеток) на кг. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит приблизительно 2×106 клеток (например, приблизительно 2×106 CD34+ клеток) на кг веса тела пациента. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит по меньшей мере 2×106 клеток (например, приблизительно 2×106 CD34+ клеток) на кг веса тела пациента. В ряде вариантов осуществления популяция клеток, содержащая модифицированные HSPC, которую возвращают млекопитающему, содержит от 2×106 клеток (например, приблизительно 2×106 CD34+ клеток) на кг веса тела пациента до 10×106 клеток (например, приблизительно 2×106 CD34+ клеток) на кг веса тела пациента. В ряде вариантов осуществления клетки, содержащие модифицированные клетки, вводят пациенту посредством инфузии. В ряде вариантов осуществления перед введением пациенту клеток, содержащих модифицированные HSPC, посредством инфузии пациент получает лечение с помощью лимфодеплеционной терапии, например, получает лечение с использованием бусульфана, например, получает лечение с использованием бусульфана по схеме, обеспечивающей полную лимфодеплецию, или, например, получает лечение с использованием бусульфана по схеме лимфодеплеции сниженной интенсивности.
В ряде вариантов осуществления любой из вышеописанных способов приводит к тому, что у пациента по меньшей мере 80% его циркулирующих CD34+ клеток имеют вставку/делецию в геномном сайте, комплементарном нацеливающему домену молекулы gRNA, используемой в способе, или рядом с ним, что, например, измеряют через по меньшей мере 15 дней, например, по меньшей мере 20, по меньшей мере 30, по меньшей мере 40, по меньшей мере 50 или по меньшей мере 60 дней после повторного введения клеток млекопитающему. Не ограничиваясь теорией, в данном документе неожиданно было выявлено, что вставки/делеции и паттерны вставок/делеций (включающие большие делеции) наблюдаются при введении в HSPC систем редактирования генов, например, систем CRISPR, например, систем CRISPR, содержащих молекулу gRNA, нацеливающую на участок HBG1 и/или HBG2, например, описанный в данном документе, и трансплантации таких клеток в организмы, при этом за счет определенных gRNA получают клетки, содержащие вставки/делеции и паттерны вставок/делеций (в том числе большие вставки/делеции), которые продолжают выявляться у подвергнутой редактированию популяции клеток и у их потомства в организме и сохраняются в течение более 8 недель, 12 недель, 16 недель или 20 недель. Не ограничиваясь теорией полагают, что популяция клеток, содержащая паттерн вставки/делеции или конкретную вставку/делецию (в том числе большую делецию), которые сохраняются в выявляемой популяции клеток, например, дольше 16 недель или дольше 20 недель после введения в организм (например, пациенту), может быть полезной в обеспечении длительного ослабления интенсивности заболевания или состояния, например, описанных в данном документе (например, гемоглобинопатии, например, серповидноклеточного заболевания или талассемии), чем клетки (или их потомство), у которых при введении в организм или пациенту утрачивается одна или несколько вставок/делеций (в том числе большие делеции). В ряде вариантов осуществления сохраняющиеся вставка/делеция или паттерн вставки/делеции ассоциированы с повышенной экспрессией фетального гемоглобина (например, в потомстве указанных клеток, представляющем собой эритроидные клетки). Таким образом, в ряде вариантов осуществления в настоящем изобретении представлена популяция клеток, например, HSPC, например, описанных в данном документе, которые содержат одну или несколько вставок/делеций (в том числе большую делецию), которые сохраняются (например, продолжают выявляться, например, у популяции клеток или их потомства) в крови и/или костном мозге) в течение более 8 недель, более 12 недель, более 16 недель или более 20 недель после введения в организм, например, пациенту.
В ряде вариантов осуществления любой из вышеописанных способов приводит к тому, что у пациента по меньшей мере 20% его CD34+ клеток костного мозга содержат вставку/делецию в геномном сайте, комплементарном нацеливающему домену молекулы gRNA, используемой в способе, или рядом с ним, что, например, измеряют через по меньшей мере 15 дней, например, по меньшей мере 20, по меньшей мере 30, по меньшей мере 40, по меньшей мере 50 или по меньшей мере 60 дней после повторного введения клеток млекопитающему.
В ряде вариантов осуществления HSPC, которые повторно вводят млекопитающему, способны к дифференцировке in vivo в клетки эритроидного ростка, например, красные кровяные клетки, и при этом указанные дифференцированные клетки проявляют повышенные уровни фетального гемоглобина, например, продуцируют по меньшей мере 6 пикограмм фетального гемоглобина на клетку, например, по меньшей мере 7 пикограмм фетального гемоглобина на клетку, по меньшей мере 8 пикограмм фетального гемоглобина на клетку, по меньшей мере 9 пикограмм фетального гемоглобина на клетку, по меньшей мере 10 пикограмм фетального гемоглобина на клетку, например, от приблизительно 9 до приблизительно 10 пикограмм фетального гемоглобина на клетку, например, за счет чего осуществляется лечение гемоглобинопатии у млекопитающего.
Будет понятно, что если клетку характеризуют как имеющую повышенный уровень фетального гемоглобина, это включает варианты осуществления, в которых потомство, например дифференцированное потомство данной клетки характеризуется повышенным уровнем фетального гемоглобина. Например, в способах, описанных в данном документе, в измененной или модифицированной CD34+ клетке (или популяция клеток) может не экспрессироваться повышенный уровень фетального гемоглобина, но при дифференцировке в клетки эритроидного ростка, например, красные кровяные клетки, в клетках экспрессируется повышенный уровень фетального гемоглобина, например, повышенный уровень фетального гемоглобина по сравнению с немодифицированной или неизмененной клеткой в аналогичных условиях.
XII. Способы культивирования и способы получения клеток
В настоящем изобретении представлены способы культивирования клеток, например, HSPC, например, гематопоэтических стволовых клеток, например, CD34+ клеток, модифицированных или подлежащих модификации с помощью молекул gRNA, описанных в данном документе.
Ингибиторы пути репарации ДНК
Не ограничиваясь теорией полагают, что паттерн вставок/делеций, получаемый с помощью указанной молекулы gRNA в конкретной целевой последовательности, является продуктом каждого из активных механизмов репарации ДНК в клетке (например, негомологичного соединения концов, микрогомологичного соединения концов и т. д.). Не ограничиваясь теорией полагают, что особенно оптимальная вставка/делеция может быть выбрана или обогащена путем приведения клеток, подлежащих редактированию, в контакт с ингибитором пути репарации ДНК, который не обеспечивает требуемой вставки/делеции. Таким образом, молекулы gRNA, системы CRISPR, способы и другие аспекты настоящего изобретения можно использовать в комбинации с такими ингибиторами. Примеры таких ингибиторов включают ингибиторы, описанные, например, в WO2014/130955, содержание которой включено в данный документ посредством ссылки во всей его полноте. В одном варианте осуществления данный ингибитор представляет собой ингибитор DNAPKc, например, NU7441.
Вещества, стимулирующие размножение стволовых клеток
В одном аспекте настоящее изобретение относится к культивированию клеток, например, HSPC, например, CD34+ клеток, модифицированных или подлежащих модификации с использованием молекулы gRNA, описанной в данном документе, с одним или несколькими средствами, что дает повышенную скорость размножения, повышенный уровень размножения или повышенное приживление по сравнению с клетками, не обработанными данным средством. Такие средства называются в данном документе веществами, стимулирующими размножение стволовых клеток.
В одном аспекте одно или несколько средств, которые дают повышенную скорость размножения или повышенный уровень размножения по сравнению с клетками, не обработанными средством, например, веществом, стимулирующим размножение стволовых клеток, предусматривают средство, которое представляет собой ингибитор пути арил-гидрокарбонового рецептора (AHR). В ряде аспектов вещество, стимулирующее размножение стволовых клеток, представляет собой соединение, раскрытое в WO2013/110198, или соединение, раскрытое в WO2010/059401, содержание которых включено посредством ссылки во всей своей полноте.
В одном аспекте одно или несколько средств, которые дают повышенную скорость размножения или повышенный уровень размножения по сравнению с клетками, не обработанными средством, представляют собой производное пиримидо[4,5-b]индола, например, раскрытое в WO2013/110198, содержание которого включено в данный документ посредством ссылки во всей своей полноте. В одном варианте осуществления средство представляет собой соединение 1 ((1r,4r)-N1-(2-бензил-7-(2-метил-2H-тетразол-5-ил)-9H-пиримидо[4,5-b]индол-4-ил)циклогексан-1,4-диамин).
Соединение 1
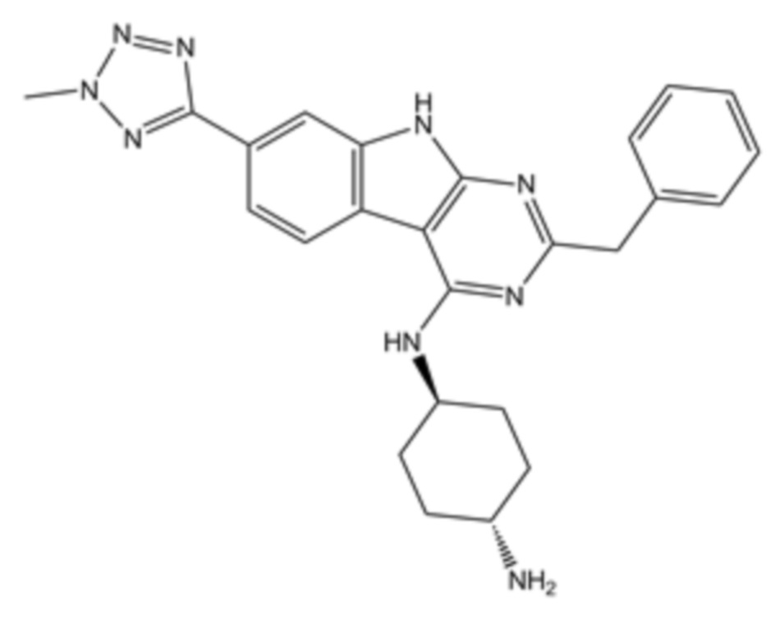
В другом аспекте средство представляет собой соединение 2 (метил-4-(3-пиперидин-1-илпропиламино)-9H-пиримидо[4,5-b]индол-7-карбоксилат).
Соединение 2
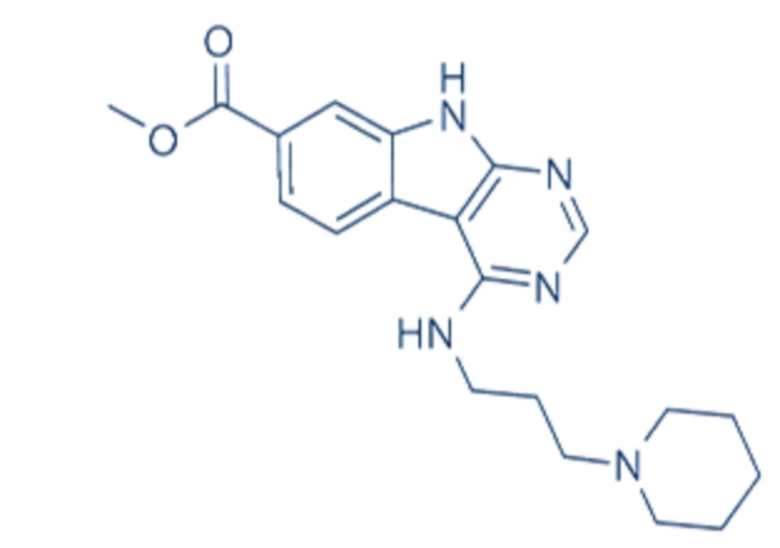
В другом аспекте одно или несколько средств, которые дают повышенную скорость размножения или повышенный уровень размножения по сравнению с клетками, не обработанными средством, представляют собой средство, раскрытое в WO2010/059401, содержание которого включено в данный документ посредством ссылки во всей своей полноте.
В одном варианте осуществления вещество, стимулирующее размножение стволовых клеток, представляет собой соединение 3: 4-(2-(2-(бензо[b]тиофен-3-ил)-9-изопропил-9H-пурин-6-иламино)этил)фенол, т. е. представляет собой соединение из примера 1 в WO2010/059401, характеризующееся следующей структурой.
Соединение 3
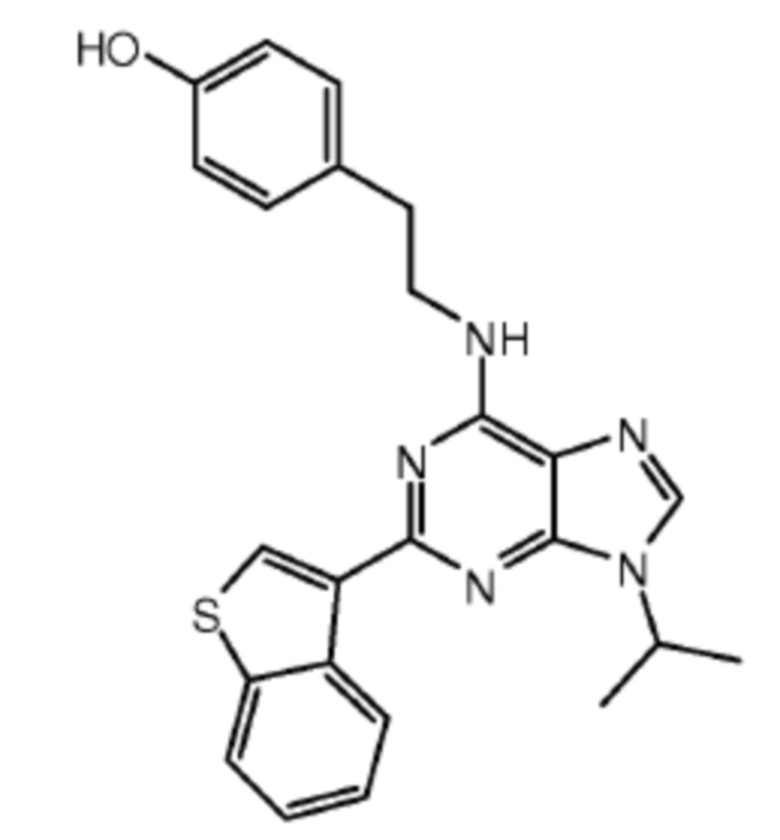
В другом аспекте вещество, стимулирующее размножение стволовых клеток, представляет собой (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол ((S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, т. е. представляет собой соединение 157S в соответствии с WO2010/059401, характеризующееся следующей структурой.
(S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол
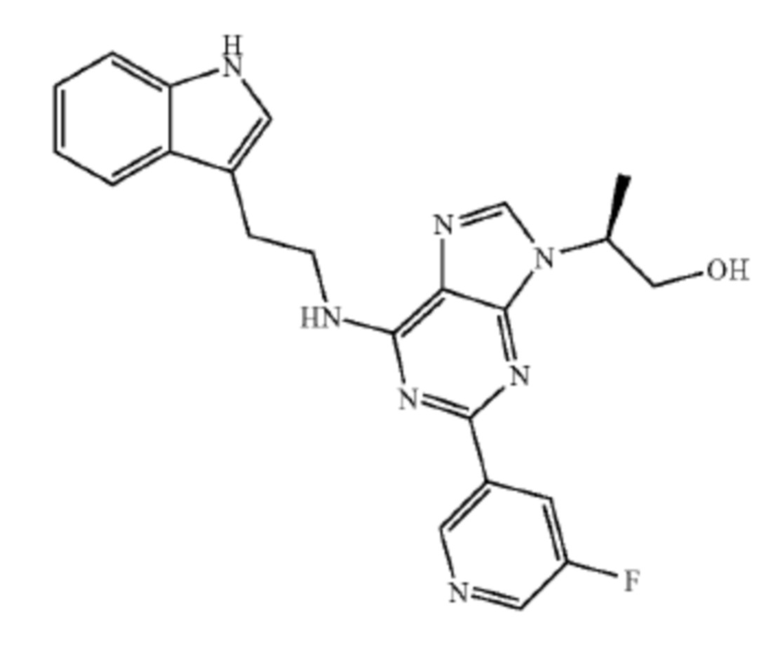
В ряде вариантов осуществления популяцию HSPC приводят в контакт с веществом, стимулирующим размножение стволовых клеток, например, соединением 1, соединением 2, соединением 3, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-олом или их комбинацией (например, комбинацией соединения 1 и (s)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ола), до введения системы CRISPR (например, молекулы gRNA и/или молекулы Cas9 по настоящему изобретению) в указанные HSPC. В ряде вариантов осуществления популяцию HSPC приводят в контакт с веществом, стимулирующим размножение стволовых клеток, например, соединением 1, соединением 2, соединением 3, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-олом или их комбинацией (например, комбинацией соединения 1 и (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ола), после введения системы CRISPR (например, молекулы gRNA и/или молекулы Cas9 по настоящему изобретению) в указанные HSPC. В ряде вариантов осуществления популяцию HSPC приводят в контакт с веществом, стимулирующим размножение стволовых клеток, например, соединением 1, соединением 2, соединением 3, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-олом или их комбинацией (например, комбинацией соединения 1 и (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ола), как до введения системы CRISPR (например, молекулы gRNA и/или молекулы Cas9 по настоящему изобретению) в указанные HSPC, так и после него.
В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, присутствует в количестве, эффективном для повышения уровня размножения HSPC по сравнению с уровнем у HSPC в той же среде, но при отсутствии вещества, стимулирующего размножение стволовых клеток. В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, присутствует в концентрации, находящейся в диапазоне от приблизительно 0,01 до приблизительно 10 мкМ, например, от приблизительно 0,1 мкМ до приблизительно 1 мкМ. В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, присутствует в среде для культивирования клеток в концентрации, составляющей приблизительно 1 мкМ, приблизительно 950 нМ, приблизительно 900 нМ, приблизительно 850 нМ, приблизительно 800 нМ, приблизительно 750 нМ, приблизительно 700 нМ, приблизительно 650 нМ, приблизительно 600 нМ, приблизительно 550 нМ, приблизительно 500 нМ, приблизительно 450 нМ, приблизительно 400 нМ, приблизительно 350 нМ, приблизительно 300 нМ, приблизительно 250 нМ, приблизительно 200 нМ, приблизительно 150 нМ, приблизительно 100 нМ, приблизительно 50 нМ, приблизительно 25 нМ или приблизительно 10 нМ. В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, присутствует в концентрации, находящейся в диапазоне от приблизительно 500 нМ до приблизительно 750 нМ.
В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, представляет собой (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, который присутствует в среде для культивирования клеток в концентрации, находящейся в диапазоне от приблизительно 0,01 до приблизительно 10 микромоль (мкМ). В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, представляет собой (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, который присутствует в среде для культивирования клеток в концентрации, находящейся в диапазоне от приблизительно 0,1 до приблизительно 1 микромоль (мкМ). В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, представляет собой (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, который присутствует в среде для культивирования клеток в концентрации, составляющей приблизительно 0,75 микромоль (мкМ). В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, представляет собой (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, который присутствует в среде для культивирования клеток в концентрации, составляющей приблизительно 0,5 микромоль (мкМ). В ряде вариантов осуществления любого из вышеуказанного среда для культивирования клеток дополнительно содержит соединение 1.
В ряде вариантов осуществления вещество, стимулирующее размножение стволовых клеток, представляет собой смесь соединения 1 и (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ола.
В ряде вариантов осуществления клетки по настоящему изобретению приводят в контакт с одной или несколькими молекулами вещества, стимулирующего размножение стволовых клеток, в течение достаточного периода времени и в достаточном количестве для обеспечения 2-10000-кратного размножения CD34+ клеток, например, 2-1000-кратного размножения CD34+ клеток, например, 2-100-кратного размножения CD34+ клеток, например, 20-200-кратного размножения CD34+ клеток. Как описано в данном документе, приведение в контакт с одним или несколькими веществами, стимулирующими размножение стволовых клеток, можно осуществлять до приведения клеток в контакт с системой CRISPR, например, описанной в данном документе, после приведения клеток в контакт с системой CRISPR, например, описанной в данном документе, или с их комбинацией. В одном варианте осуществления клетки приводят в контакт с одной или несколькими молекулами вещества, стимулирующего размножение стволовых клеток, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ола, в течение достаточного периода времени и в достаточном количестве для обеспечения по меньшей мере 2-кратного размножения CD34+ клеток, например, CD34+ клеток, содержащих вставку/делецию в целевом сайте, характеризующемся комплементарностью с нацеливающим доменом gRNA из системы CRISPR/Cas9, введенной в указанную клетку, или рядом с ним. В одном варианте осуществления клетки приводят в контакт с одной или несколькими молекулами вещества, стимулирующего размножение стволовых клеток, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ола, в течение достаточного периода времени и в достаточном количестве для обеспечения по меньшей мере 4-кратного размножения CD34+ клеток, например, CD34+ клеток, содержащих вставку/делецию в целевом сайте, характеризующемся комплементарностью с нацеливающим доменом gRNA из системы CRISPR/Cas9, введенной в указанную клетку, или рядом с ним. В одном варианте осуществления клетки приводят в контакт с одной или несколькими молекулами вещества, стимулирующего размножение стволовых клеток, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ола, в течение достаточного периода времени и в достаточном количестве для обеспечения по меньшей мере 5-кратного размножения CD34+ клеток, например, CD34+ клеток, содержащих вставку/делецию в целевом сайте, характеризующемся комплементарностью с нацеливающим доменом gRNA из системы CRISPR/Cas9, введенной в указанную клетку, или рядом с ним. В одном варианте осуществления клетки приводят в контакт с одной или несколькими молекулами вещества, стимулирующего размножение стволовых клеток, в течение достаточного периода времени и в достаточном количестве для обеспечения по меньшей мере 10-кратного размножения CD34+ клеток. В одном варианте осуществления клетки приводят в контакт с одной или несколькими молекулами вещества, стимулирующего размножение стволовых клеток, в течение достаточного периода времени и в достаточном количестве для обеспечения по меньшей мере 20-кратного размножения CD34+ клеток. В одном варианте осуществления клетки приводят в контакт с одной или несколькими молекулами вещества, стимулирующего размножение стволовых клеток, в течение достаточного периода времени и в достаточном количестве для обеспечения по меньшей мере 30-кратного размножения CD34+ клеток. В одном варианте осуществления клетки приводят в контакт с одной или несколькими молекулами вещества, стимулирующего размножение стволовых клеток, в течение достаточного периода времени и в достаточном количестве для обеспечения по меньшей мере 40-кратного размножения CD34+ клеток. В одном варианте осуществления клетки приводят в контакт с одной или несколькими молекулами вещества, стимулирующего размножение стволовых клеток, в течение достаточного периода времени и в достаточном количестве для обеспечения по меньшей мере 50-кратного размножения CD34+ клеток. В одном варианте осуществления клетки приводят в контакт с одной или несколькими молекулами вещества, стимулирующего размножение стволовых клеток, в течение достаточного периода времени и в достаточном количестве для обеспечения по меньшей мере 60-кратного размножения CD34+ клеток. В ряде вариантов осуществления клетки приводят в контакт с одним или несколькими веществами, стимулирующими размножение стволовых клеток, в течение периода, составляющего приблизительно 1-60 дней, например, приблизительно 1-50 дней, например, приблизительно 1-40 дней, например, приблизительно 1-30 дней, например, 1-20 дней, например, приблизительно 1-10 дней, например, приблизительно 7 дней, например, приблизительно 1-5 дней, например, приблизительно 2-5 дней, например, приблизительно 2-4 дня, например, приблизительно 2 дня или, например, приблизительно 4 дня.
В ряде вариантов осуществления клетки, например, HSPC, например, описанные в данном документе, культивируют ex vivo в течение периода, составляющего от приблизительно 1 часа до приблизительно 10 дней, например, периода, составляющего от приблизительно 12 часов до приблизительно 5 дней, например, периода, составляющего от приблизительно 12 часов до 4 дней, например, периода, составляющего от приблизительно 1 дня до приблизительно 4 дней, например, периода, составляющего от приблизительно 1 дня до приблизительно 2 дней, например, периода, составляющего приблизительно 1 день, или периода, составляющего приблизительно 2 дня, до стадии приведения клеток в контакт с системой CRISPR, например, описанной в данном документе. В ряде вариантов осуществления указанное культивирование до указанной стадии приведения в контакт осуществляют в композиции (например, среде для культивирования клеток), содержащей вещество, стимулирующее размножение стволовых клеток, например, описанное в данном документе, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол в концентрации от приблизительно 0,25 мкМ до приблизительно 1 мкМ, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол в концентрации приблизительно 0,75-0,5 микромоль. В ряде вариантов осуществления клетки культивируют ex vivo в течение периода, составляющего не более приблизительно 1 день, например, не более приблизительно 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, или 1 час, после стадии приведения клеток в контакт с системой CRISPR, например, описанной в данном документе, например, в среде для культивирования клеток, которая содержит вещество, стимулирующее размножение стволовых клеток, например, описанное в данном документе, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, в концентрации от приблизительно 0,25 мкМ до приблизительно 1 мкМ, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол в концентрации приблизительно 0,75-0,5 микромоль. В других вариантах осуществления клетки культивируют ex vivo в течение периода, составляющего от приблизительно 1 часа до приблизительно 14 дней, например, периода, составляющего от приблизительно 12 часов до приблизительно 10 дней, например, периода, составляющего от приблизительно 1 дня до приблизительно 10 дней, например, периода, составляющего от приблизительно 1 дня до приблизительно 5 дней, например, периода, составляющего от приблизительно 1 дня до приблизительно 4 дней, например, периода, составляющего от приблизительно 2 дней до приблизительно 4 дней, например, периода, составляющего приблизительно 2 дня, приблизительно 3 дня или приблизительно 4 дня, после стадии приведения клеток в контакт с системой CRISPR, например, описанной в данном документе, в среде для культивирования клеток, например, которая содержит вещество, стимулирующее размножение стволовых клеток, например, описанное в данном документе, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол в концентрации от приблизительно 0,25 мкМ до приблизительно 1 мкМ, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол в концентрации приблизительно 0,75-0,5 микромоль.
В ряде вариантов осуществления среда для культивирования клеток представляет собой среду с известным химическим составом. В ряде вариантов осуществления среда для культивирования клеток может дополнительно содержать, например, StemSpan SFEM (StemCell Technologies; № кат. 09650). В ряде вариантов осуществления среда для культивирования клеток может в качестве альтернативы или в дополнение содержать, например, HSC Brew, GMP (Miltenyi). В ряде вариантов осуществления среда для культивирования клеток не содержит сыворотку крови. В ряде вариантов осуществления среда может быть дополнена тромбопоэтином (TPO), лигандом Flt3 (Flt-3L) человека, фактором стволовых клеток (SCF) человека, интерлейкином-6 человека, L-глутамином и/или пенициллином/стрептомицином. В ряде вариантов осуществления среду дополняют тромбопоэтином (TPO), лигандом Flt3 (Flt-3L) человека, фактором стволовых клеток (SCF) человека, интерлейкином-6 человек и L-глутамином. В других вариантах осуществления среду дополняют тромбопоэтином (TPO), лигандом Flt3 (Flt-3L) человека, фактором стволовых клеток (SCF) человека и интерлейкином-6 человека. В других вариантах осуществления среду дополняют тромбопоэтином (TPO), лигандом Flt3 (Flt-3L) человека и фактором стволовых клеток (SCF) человека, но не интерлейкином-6 человека. В других вариантах осуществления среду дополняют лигандом Flt3 (Flt-3L) человека, фактором стволовых клеток (SCF) человека, но не тромбопоэтином (TPO) человека или интерлейкином-6 человека. В случае присутствия в среде тромбопоэтина (TPO), лиганда Flt3 (Flt-3L) человека, фактора стволовых клеток (SCF) человека, интерлейкина-6 человека и/или L-глутамина, при этом каждый из них присутствует в концентрации, находящейся в диапазоне от приблизительно 1 нг/мл до приблизительно 1000 нг/мл, например, концентрации, находящейся в диапазоне от приблизительно 10 нг/мл до приблизительно 500 нг/мл, например, концентрации, находящейся в диапазоне от приблизительно 10 нг/мл до приблизительно 100 нг/мл, например, концентрации, находящейся в диапазоне от приблизительно 25 нг/мл до приблизительно 75 нг/мл, например, концентрации, составляющей приблизительно 50 нг/мл. В ряде вариантов осуществления каждый из дополняемых компонентов присутствует в одной и той же концентрации. В других вариантах осуществления каждый из дополняемых компонентов присутствует в разной концентрации. В одном варианте осуществления среда содержит StemSpan SFEM (StemCell Technologies; № кат. 09650), 50 нг/мл тромбопоэтина (Tpo), 50 нг/мл лиганда Flt3 (Flt-3L) человека, 50 нг/мл фактора стволовых клеток (SCF) человека и 50 нг/мл интерлейкина-6 (IL-6) человека. В одном варианте осуществления среда содержит StemSpan SFEM (StemCell Technologies; № кат. 09650), 50 нг/мл тромбопоэтина (Tpo), 50 нг/мл лиганда Flt3 (Flt-3L) человека и 50 нг/мл фактора стволовых клеток (SCF) человека и не содержит IL-6. В ряде вариантов осуществления среда дополнительно содержит вещество, стимулирующее размножение стволовых клеток, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол в концентрации 0,75 мкМ. В ряде вариантов осуществления среда дополнительно содержит вещество, стимулирующее размножение стволовых клеток, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол в концентрации 0,5 мкМ. В ряде вариантов осуществления среда дополнительно содержит 1% L-глутамина и 2% пенициллина/стрептомицина. В ряде вариантов осуществления среда для культивирования клеток не содержит сыворотки крови.
XII. Комбинированная терапия
В настоящем изобретение предполагается применение молекул gRNA, описанных в данном документе, или клеток (например, гематопоэтических стволовых клеток, например, CD34+ клеток), модифицированных с помощью молекул gRNA, описанных в данном документе, в комбинации с одним или несколькими другими тактиками терапии и/или средствами. Таким образом, в дополнение к применению молекул gRNA или клеток, модифицированных с помощью молекул gRNA, описанных в данном документе, субъекту также можно вводить одно или несколько средств "стандартной" терапии для лечения гемоглобинопатий.
Одно или несколько дополнительных средств терапии для лечения гемоглобинопатий могут включать, например, дополнительную трансплантацию стволовых клеток, например, трансплантацию гематопоэтических стволовых клеток. Трансплантация стволовых клеток может быть аллогенной или аутологичной.
Одно или несколько дополнительных средств терапии, предназначенных для лечения гемоглобинопатий, могут включать, например, гемотрансфузию и/или терапию путем хелатирования железа (например, удаления). Известные средства-хелаторы железа включают, например, дефероксамин и деферазирокс.
Одно или несколько дополнительных средств терапии, предназначенных для лечения гемоглобинопатий, могут включать, например, добавки с фолиевой кислотой или гидроксимочевину (например, 5-гидроксимочевину). Одним или несколькими дополнительными средствами терапии, предназначенными для лечения гемоглобинопатий, может быть гидроксимочевина. В ряде вариантов осуществления гидроксимочевину можно вводить в дозе, составляющей, например, 10-35 мг/кг в сутки, например, 10-20 мг/кг в сутки. В ряде вариантов осуществления гидроксимочевину вводят в дозе, составляющей 10 мг/кг в сутки. В ряде вариантов осуществления гидроксимочевину вводят в дозе, составляющей 10 мг/кг в сутки. В ряде вариантов осуществления гидроксимочевину вводят в дозе, составляющей 20 мг/кг в сутки. В ряде вариантов осуществления гидроксимочевину вводят до введения клетки (или популяции клеток), например, CD34+ клетки (или популяции клеток) по настоящему изобретению, например, описанной в данном документе, и/или после него.
Одно или несколько дополнительных терапевтических средств могут включать, например, антитело к p-селектину, например, SelG1 (Selexys). Антитела к p-селектину описаны, например, в публикации по PCT WO1993/021956, публикации по PCT WO1995/034324, публикации по PCT WO2005/100402, публикации по PCT WO2008/069999, публикации заявки на патент США US2011/0293617, патенте США № 5800815, патенте США № 6667036, патенте США № 8945565, патенте США № 8377440 и патенте США № 9068001, содержание каждого из которых включено в данный документ во всей своей полноте.
Одно или несколько дополнительных средств могут включать, например, малую молекулу, которая обеспечивает повышение экспрессии фетального гемоглобина. Примеры таких молекул включают TN1 (например, описанный в Nam, T. et al., ChemMedChem 2011, 6, 777-780, DOI: 10.1002/cmdc.201000505, включенной в данный документ посредством ссылки).
Одно или несколько дополнительных средств терапии могут также включать ионизирующее облучение или другие средства терапии, предназначенные для разрушения костного мозга, известные из уровня техники. Примером такого средства терапии является бусульфан. Такую дополнительную терапию можно проводить до введения субъекту клеток по настоящему изобретению. В одном варианте осуществления предусмотрены способы лечения, описанные в данном документе (например, способы лечения, которые включают введение клеток (например, HSPC), модифицированных с помощью способов, описанных в данном документе (например, модифицированных с помощью системы CRISPR, описанной в данном документе, например, для повышения выработки HbF)), при этом способ не включает стадии разрушения костного мозга. В ряде вариантов осуществления способы включают стадию частичного разрушения костного мозга.
Средства терапии, описанные в данном документе (например, предусматривающие введение популяции HSPC, например, HSPC, модифицированных с использованием системы CRISPR, описанной в данном документе), также можно комбинировать с дополнительным терапевтическим средством. В одном варианте осуществления дополнительное терапевтическое средство представляет собой ингибитор HDAC, например, панобиностат. В одном варианте осуществления дополнительное терапевтическое средство представляет собой соединение, описанное в публикации по PCT № WO2014/150256, например, соединение, описанное в таблице 1 в WO2014/150256, например, GBT440. Другие примеры ингибиторов HDAC включают, например, субероиланилид гидроксамовой кислоты (SAHA). Одно или несколько дополнительных средств могут включать, например, ингибитор метилирования ДНК. Было показано, что такие средства повышают индуцирование выработки HbF в клетках, характеризующихся сниженной активностью BCL11a (например, Jian Xu et al, Science 334, 993 (2011); DOI: 0.1126/science.1211053, включена в данный документ посредством ссылки). Другие ингибиторы HDAC включают любой ингибитор HDAC, известный из уровня техники, например, трихостатин A, токсин HC, DACI-2, FK228, DACI-14, депудицин, DACI-16, тубицин, NK57, MAZ1536, NK125, скриптаид, пироксамид, MS-275, ITF-2357, MCG-D0103, CRA-024781, CI-994 и LBH589 (см., например, Bradner JE, et al., PNAS, 2010 (vol. 107:28), 12617-12622, включенную в данный документ посредством ссылки во всей своей полноте).
Молекулы gRNA, описанные в данном документе, или клетки (например, гематопоэтические стволовые клетки, например, CD34+ клетки), модифицированные с помощью молекул gRNA, описанных в данном документе, и сочетанное терапевтическое средство или средство сочетанной терапии можно вводить в одном и том же составе или раздельно. В случае раздельного введения молекулы gRNA, описанные в данном документе, или клетки, модифицированные с помощью молекул gRNA, описанных в данном документе, можно вводить до введения сочетанного терапевтического средства или средства сочетанной терапии, после него или одновременно с ним. Введение одного средства может предшествовать или следовать введению другого средства с интервалами, варьирующими от нескольких минут до нескольких недель. В ряде вариантов осуществления, где два или более разных вида терапевтических средств используют по отдельности для субъекта, обычно обеспечивают, чтобы между каждой доставкой не проходил значительный период времени, за счет чего данные разные виды средств по-прежнему будут способны оказывать преимущественный эффект комбинации в отношении целевых тканей или клеток.
XIII. Модифицированные нуклеозиды, нуклеотиды и нуклеиновые кислоты
Модифицированные нуклеозиды и модифицированные нуклеотиды могут присутствовать в нуклеиновых кислотах, например, в частности gRNA, но также и в других формах РНК, например, mRNA, в средстве для RNAi или siRNA. Описываемый в данном документе "нуклеозид" определяется как соединение, содержащее молекулу сахара с пятью атомами углерода (пентозу или рибозу) или ее производное и органическое основание, пурин или пиримидин, или его производное. Описываемый в данном документе "нуклеотид" определяется как нуклеозид, дополнительно содержащий фосфатную группу.
Модифицированные нуклеозиды и нуклеотиды могут включать одно или несколько из:
(i) изменения, например, замены, одного или обеих несвязывающих атомов кислорода фосфата и/или одного или нескольких связывающих атомов кислорода фосфата в остове, содержащем фосфодиэфирную связь;
(ii) изменения, например, замены, составного компонента сахара рибозы, например, 2'-гидроксила в сахаре рибозе;
(iii) полной замены фосфатного фрагмента линкерами, представляющими собой "дефосфо-группу";
(iv) модификации или замены существующего в природе нуклеотидного основания, в том числе неканоническим нуклеотидным основанием;
(v) замены или модификации рибозофосфатного остова;
(vi) модификации 3'-конца или 5'-конца олигонуклеотида, например, удаления, модификации или замены концевой фосфатной группы или конъюгации фрагмента, кэпа или линкера; и
(vii) модификации или замены сахара.
Вышеперечисленные модификации можно объединять с получением модифицированных нуклеозидов и нуклеотидов, которые могут содержать две, три, четыре или более модификаций. Например, модифицированный нуклеозид или нуклеотид может содержать модифицированный сахар и модифицированное нуклеотидное основание. В одном варианте осуществления каждое основание в gRNA является модифицированным, например, все основания содержат модифицированную фосфатную группу, например, все содержат фосфотиоатные группы. В одном варианте осуществления все или по сути все фосфатные группы в одномолекулярной или модульной молекуле gRNA заменены фосфотиоатными группами. В ряде вариантов осуществления одно или несколько из пяти 3'-концевых оснований и/или одно или несколько из пяти 5'-концевых оснований в gRNA модифицированы фосфотиоатной группой.
В одном варианте осуществления модифицированные нуклеотиды, например, нуклеотиды, содержащие модификации, описанные в данном документе, могут быть встроены в нуклеиновую кислоту, например, "модифицированную нуклеиновую кислоту". В некоторых вариантах осуществления модифицированные нуклеиновые кислоты содержат один, два, три или более модифицированных нуклеотидов. В некоторых вариантах осуществления по меньшей мере 5% (например, по меньшей мере приблизительно 5%, по меньшей мере приблизительно 10%, по меньшей мере приблизительно 15%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или приблизительно 100%) положений в модифицированной нуклеиновой кислоте занимают модифицированные нуклеотиды.
Немодифицированные нуклеиновые кислоты могут быть подвержены деградации, например, нуклеазами клетки. Например, нуклеазы могут гидролизовать фосфодиэфирные связи нуклеиновой кислоты. Соответственно, в одном аспекте модифицированные нуклеиновые кислоты, описанные в данном документе, могут содержать один или несколько модифицированных нуклеозидов или нуклеотидов, например, с целью привнесения устойчивости к нуклеазам.
В некоторых вариантах осуществления модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты, описанные в данном документе, при их введении в популяцию клеток могут обеспечивать проявление сниженного естественного иммунного ответа как in vivo, так и ex vivo. Термин "естественный иммунный ответ" подразумевает ответ клетки на экзогенные нуклеиновые кислоты, в том числе однонитевые нуклеиновые кислоты, обычно вирусного или бактериального происхождения, который включает индуцирование экспрессии цитокинов и высвобождения, в частности, интерферонов, а также гибели клетки. В некоторых вариантах осуществления модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты, описанные в данном документе, могут обеспечивать нарушение связывания партнера по взаимодействию с большой бороздкой с нуклеиновой кислотой. В некоторых вариантах осуществления модифицированные нуклеозиды, модифицированные нуклеотиды и модифицированные нуклеиновые кислоты, описанные в данном документе, при их введении в популяцию клеток могут обеспечивать проявление сниженного естественного иммунного ответа как in vivo, так и ex vivo, а также обеспечивать нарушение связывания партнера по взаимодействию с большой бороздкой с нуклеиновой кислотой.
Определения химических групп
Подразумевается, что используемый в данном документе термин "алкил" относится к насыщенной углеводородной группе, которая содержит прямую цепь или является разветвленной. Иллюстративные алкильные группы включают метил (Me), этил (Et), пропил (например, н-пропил и изопропил), бутил (например, н-бутил, изобутил, трет-бутил), пентил (например, н-пентил, изопентил, неопентил) и т. п. Алкильная группа может содержать от 1 до приблизительно 20, от 2 до приблизительно 20, от 1 до приблизительно 12, от 1 до приблизительно 8, от 1 до приблизительно 6, от 1 до приблизительно 4 или от 1 до приблизительно 3 атомов углерода.
Используемый в данном документе термин "арил" относится к моноциклическим или полициклическим (например, содержащим 2, 3 или 4 конденсированных кольца) ароматическим углеводородам, таким как, например, фенил, нафтил, антраценил,
фенантренил, инданил, инденил и т. п. В некоторых вариантах осуществления арильные группы содержат от 6 до приблизительно 20 атомов углерода.
Используемый в данном документе термин "алкенил" относится к алифатической группе, содержащей по меньшей мере одну двойную связь. Используемый в данном документе термин "алкинил" относится к прямой или разветвленной углеводородной цепи, содержащей 2-12 атомов углерода и характеризующейся наличием одной или нескольких тройных связей. Примеры алкинильных групп включают без ограничения этинил, пропаргил и 3-гексинил.
Используемый в данном документе термин "арилалкил" или "аралкил" относится к алкильному фрагменту, в котором атом водорода алкила заменен арильной группой. Аралкил включает группы, в которых более одного атома водорода были заменены арильной группой. Примеры "арилалкила" или "аралкила" включают бензильные, 2-фенилэтильные, 3-фенилпропильные, 9-флуоренильные, бензгидрильные и тритильные группы.
Используемый в данном документе термин "циклоалкил" относится к циклическим, бициклическим, трициклическим или полициклическим неароматическим углеводородным группам, содержащим от 3 до 12 атомов углерода. Примеры циклоалкильных фрагментов включают без ограничения циклопропил, циклопентил и циклогексил.
Используемый в данном документе термин "гетероциклил" относится к одновалентному радикалу гетероциклической кольцевой системы. Иллюстративные гетероциклилы включают без ограничения тетрагидрофуранил, тетрагидротиенил, пирролидинил, пирролидонил, пиперидинил, пирролинил, пиперазинил, диоксанил, диоксоланил, диазепинил, оксазепинил, тиазепинил и морфолинил.
Используемый в данном документе термин "гетероарил" означает одновалентный радикал гетероароматической кольцевой системы. Примеры гетероарильных фрагментов включают без ограничения имидазолил, оксазолил, тиазолил, триазолил, пирролил, фуранил, индолил, тиофенил, пиразолил, пиридинил, пиразинил, пиридазинил, пиримидинил, индолизинил, пуринил, нафтиридинил, хинолил и птеридинил.
Модификации фосфатного остова
Фосфатная группа
В некоторых вариантах осуществления фосфатная группа модифицированного нуклеотида может быть модифицирована путем замены одного или нескольких атомов кислорода отличающимся заместителем. Кроме того, модифицированный нуклеотид, например, модифицированный нуклеотид, присутствующий в модифицированной нуклеиновой кислоте, может содержать полную замену немодифицированного фосфатного фрагмента на модифицированный фосфат, описанный в данном документе. В некоторых вариантах осуществления модификация фосфатного остова может включать изменения, которые приводят к образованию либо незаряженного линкера, либо заряженного линкера с асимметричным распределением заряда.
Примеры модифицированных фосфатных групп включают фосфотиоат, фосфоселенаты, боранофосфаты, сложные эфиры боранофосфата, гидрофосфонаты, фосфоамидаты, алкил- или арилфосфонаты и сложные фосфотриэфиры. В некоторых вариантах осуществления один из атомов кислорода фосфата, не образующих мостиковой связи, в фрагменте, представляющем собой фосфатный остов, может быть заменен любой из следующих групп: серой (S), селеном (Se), BR3 (где R может представлять собой, например, водород, алкил или арил), C (например, алкильной группой, арильной группой и т. п.), H, NR2 (где R может представлять собой, например, водород, алкил или арил) или OR (где R может представлять собой, например, алкил или арил). Атом фосфора в немодифицированной фосфатной группе является ахиральным. Однако замена одного из атомов кислорода, не образующих мостиковой связи, одним из вышеуказанных атомов или групп атомов может делать атом фосфора хиральным; то есть атом фосфора в фосфатной группе, модифицированной таким образом, представляет собой стереогенный центр. Стереогенный атом фосфора может иметь либо "R"-конфигурацию (называемую в данном документе Rp), либо "S"-конфигурацию (называемую в данном документе Sp).
У фосфодитиоатов оба атома кислорода, не образующие мостиковой связи, заменены атомом серы. Атом фосфора в фосфодитиоатах является ахиральным центром, который препятствует образованию диастереоизомеров олигорибонуклеотидов. В некоторых вариантах осуществления модификации одного или обоих атомов кислорода, не образующих мостиковую связь, также могут включать замену атомов кислорода, не образующих мостиковую связь, группой, независимо выбранной из S, Se, B, C, H, N и OR (R может представлять собой, например, алкил или арил).
Линкер, представляющий собой фосфат, также может быть модифицирован путем замены атома кислорода, образующего мостиковую связь (т. е. атома кислорода, который обеспечивает связывание фосфата с нуклеозидом), атомом азота (фосфоамидаты, содержащие мостиковую связь), серы (фосфотиоаты, содержащие мостиковую связь) и углерода (метиленфосфонаты, содержащие мостиковую связь). Замена может происходить при одном из связывающих атомов кислорода или при обоих связывающих атомах кислорода.
Замена фосфатной группы
Фосфатная группа может быть заменена соединяющими группами, не содержащими атом фосфора. В некоторых вариантах осуществления заряженная фосфатная группа может быть заменена нейтральным фрагментом.
Примеры фрагментов, которыми можно заменять фосфатную группу, могут включать без ограничения, например, метилфосфонат, гидроксиламино, силоксан, карбонат, карбоксиметил, карбамат, амид, простой тиоэфир, линкер, представляющий собой оксид этилена, сульфонат, сульфонамид, тиоформацеталь, формацеталь, оксим, метиленимино, метиленметилимино, метиленгидразо, метилендиметилгидразо и метиленоксиметилимино.
Замена рибозофосфатного остова
Также можно сконструировать каркасы, которые могут имитировать нуклеиновые кислоты, где фосфатный линкер и сахар рибоза заменены устойчивыми к нуклеазам заменителями нуклеозидов или нуклеотидов. В некоторых вариантах осуществления нуклеотидные основания могут быть присоединены посредством остова заменителя. Примеры могут включать без ограничения морфолино, циклобутил, пирролидин и заменители нуклеозидов, представляющие собой пептидонуклеиновую кислоту (PNA).
Модификации сахара
Модифицированные нуклеозиды и модифицированные нуклеотиды могут содержать одну или несколько модификаций сахарной группы. Например, 2'-гидроксильная группа (OH) может быть модифицирована рядом различных "окси"- или "дезокси"-заместителей или заменена ими. В некоторых вариантах осуществления модификации 2'-гидроксильной группы могут повышать стабильность нуклеиновой кислоты, поскольку гидроксил уже не может подвергаться депротонированию с образованием 2'-алкоксидного иона. 2'-алкоксид может катализировать деградацию посредством внутримолекулярной нуклеофильной атаки на атом фосфора линкера.
Примеры "окси"-модификаций 2'-гидроксильной группы могут включать алкокси или арилокси (OR, где "R" может представлять собой, например, алкил, циклоалкил, арил, аралкил, гетероарил или сахар); полиэтиленгликоли (PEG), O(CH2CH2O)nCH2CH2OR, где R может представлять собой, например, H или необязательно замещенный алкил, а n может представлять собой целое число от 0 до 20 (например, от 0 до 4, от 0 до 8, от 0 до 10, от 0 до 16, от 1 до 4, от 1 до 8, от 1 до 10, от 1 до 16, от 1 до 20, от 2 до 4, от 2 до 8, от 2 до 10, от 2 до 16, от 2 до 20, от 4 до 8, от 4 до 10, от 4 до 16 и от 4 до 20). В некоторых вариантах осуществления "окси"-модификация 2'-гидроксильной группы может включать "запертые" нуклеиновые кислоты (LNA), в которых 2'-гидроксил может быть соединен, например, с помощью Ci-6алкиленового или Cj-6гетероалкиленового мостика, с атомом 4'-углерода в той же молекуле сахара рибозы, где иллюстративные мостики могут включать метиленовые, пропиленовые, эфирные или аминосодержащие мостики; O-амино (где амино может представлять собой, например, NH2; алкиламино, диалкиламино, гетероциклил, ариламино, диариламино, гетероариламино или дигетероариламино, этилендиамин или полиамино) и аминоалкокси, О(CH2)n-амино, (где амино может представлять собой, например, NH2; алкиламино, диалкиламино, гетероциклил, ариламино, диариламино, гетероариламино или дигетероариламино, этилендиамин или полиамино). В некоторых вариантах осуществления "окси"-модификация 2'-гидроксильной группы может включать метоксиэтильную группу (MOE) (OCH2CH2OCH3, например, PEG-производное).
"Дезокси"-модификации могут включать атом водорода (т. е. дезоксирибозные сахара, например, в частях липких концов частично dsRNA); атом галогена (например, бром, хлор, фтор или йод); амино (где амино может представлять собой, например, NH2; алкиламино, диалкиламино, гетероциклил, ариламино, диариламино, гетероариламино, дигетероариламино или аминокислота); NH(CH2CH2NH)nCH2CH2-амино (где амино может являться таким, например, как описано в данном документе), -NHC(O)R (где R может представлять собой, например, алкил, циклоалкил, арил, аралкил, гетероарил или сахар), циано; меркапто; алкилтиоалкил; тиоалкокси и алкил, циклоалкил, арил, алкенил и алкинил, которые могут быть необязательно замещены, например, амино, как описано в данном документе.
Сахарная группа может также содержать один или несколько атомов углерода, которые имеют стереохимическую конфигурацию, противоположную такой конфигурации у соответствующего атома углерода в рибозе. Таким образом, модифицированная нуклеиновая кислота может содержать нуклеотиды, содержащие, например, арабинозу в качестве сахара. Нуклеотидный "мономер" может иметь альфа-связь в Γ-положении в молекуле сахара, например, альфа-нуклеозиды. Модифицированные нуклеиновые кислоты могут также содержать сахара "с удаленным основанием", которые не содержат нуклеотидного основания в C-. Данные сахара с удаленным азотистым основанием могут также быть дополнительно модифицированы по одному или нескольким атомам, составляющим молекулу сахара. Модифицированные нуклеиновые кислоты также могут включать один или несколько видов сахара, которые присутствуют в L-форме, например, L-нуклеозиды.
Обычно РНК содержит сахарную группу рибозу, которая представляет собой 5-членное кольцо, содержащее атом кислорода. Иллюстративные модифицированные нуклеозиды и модифицированные нуклеотиды могут содержать без ограничения замену атома кислорода в рибозе (например, атомом серы (S), селена (Se) или алкиленом, таким как, например, метилен или этилен); добавление двойной связи (например, с заменой рибозы циклопентенилом или циклогексенилом); сужение кольца рибозы (например, с образованием 4-членного кольца циклобутана или оксетана); расширение кольца рибозы (например, с образованием 6- или 7-членного кольца, содержащего дополнительный атом углерода или гетероатом, такой как, например, ангидрогексит, алтрит, маннит, циклогексанил, циклогексенил и морфолино, которое также содержит фосфоамидатный остов). В некоторых вариантах осуществления модифицированные нуклеотиды могут включать полициклические формы (например, трицикло и "незапертые" формы, такие как гликоль-нуклеиновая кислота (GNA) (например, R-GNA или S-GNA, где рибоза заменена гликолевыми звеньями, присоединеными фосфодиэфирными связями), треозо-нуклеиновая кислота (TNA, где рибоза заменена на a-L-треофуранозил-(3'-→2')).
Модификации нуклеотидного основания
Модифицированные нуклеозиды и модифицированные нуклеотиды, описанные в данном документе, которые могут быть включены в модифицированную нуклеиновую кислоту, могут содержать модифицированное нуклеотидное основание. Примеры нуклеотидных оснований включают без ограничения аденин (A), гуанин (G), цитозин (C) и урацил (U). Данные нуклеотидные основания могут быть модифицированы или полностью заменены с получением модифицированных нуклеозидов и модифицированных нуклеотидов, которые могут быть встроены в модифицированные нуклеиновые кислоты. Нуклеотидное основание нуклеотида может быть независимо выбрано из пурина, пиримидина, аналога пурина или пиримидина. В некоторых вариантах осуществления нуклеотидное основание может включать, например, существующее в природе основание и его синтетические производные.
Урацил
В некоторых вариантах осуществления модифицированное нуклеотидное основание представляет собой модифицированный урацил. Иллюстративные нуклеотидные основания и нуклеозиды, содержащие модифицированный урацил, включают без ограничения псевдоуридин (ψ), пиридин-4-он-рибонуклеозид, 5-азауридин, 6-азауридин, 2-тио-5-азауридин, 2-тиоуридин (s2U), 4-тиоуридин (s4U), 4-тиопсевдоуридин, 2-тиопсевдоуридин, 5-гидроксиуридин (ho5U), 5-аминоаллилуридин, 5-галогенуридин (например, 5-йодуридин или 5-бромуридин), 3-метилуридин (m3U), 5-метоксиуридин (mo5U), уридин-5-оксиуксусную кислоту (cmo5U), сложный метиловый эфир уридин-5-оксиуксусной кислоты (mcmo^U), 5-карбоксиметилуридин (cmsU), 1-карбоксиметилпсевдоуридин, 5-карбоксигидроксиметилуридин (chm5U), сложный метиловый эфир 5-карбоксигидроксиметилуридина (mchm5U), 5-метоксикарбонилметилуридин (mcm5U), 5-метоксикарбонилметил-2-тиоуридин (mcm5s2U), 5-аминометил-2-тиоуридин (nm5s2U), 5-метиламинометилуридин (mnm5U), 5-метиламинометил-2-тиоуридин (mnm5s2U), 5-метиламинометил-2-селеноуридин (mnm5se2U), 5-карбамоилметилуридин (ncm5U), 5-карбоксиметиламинометилуридин (cmnm5U), 5-карбоксиметиламинометил-2-тиоуридин (cmnm\s2U), 5-пропинилуридин, 1-пропинилпсевдоуридин, 5-тауринометилуридин (xcm5U), 1-тауринометилпсевдоуридин, 5-тауринометил-2-тиоуридин (Trn5s2U), 1-тауринометил-4-тиопсевдоуридин, 5-метилуридин (m5U, т. е. содержащий нуклеотидное основание дезокситимин), 1-метилпсевдоуридин (ιτι'ψ), 5-метил-2-тиоуридин (m5s2U), 1-метил-4-тиопсевдоуридин (m' s \|/), 4-тио-1-метилпсевдоуридин, 3-метилпсевдоуридин (m'V), 2-тио-1-метилпсевдоуридин, 1-метил-1-деазапсевдоуридин, 2-тио-1-метил-1-деазапсевдоуридин, дигидроуридин (D), дигидропсевдоуридин, 5,6-дигидроуридин, 5-метилдигидроуридин (m5D), 2-тиодигидроуридин, 2-тиодигидропсевдоуридин, 2-метоксиуридин, 2-метокси-4-тиоуридин, 4-метоксипсевдоуридин, 4-метокси-2-тиопсевдоуридин, N1-метилпсевдоуридин, 3-(3-амино-3-карбоксипропил)уридин (acp3U), 1-метил-3-(3-амино-3-карбоксипропилпсевдоуридин, 5-(изопентениламинометил)уридин (inm5U), 5-(изопентениламинометил)-2-тиоуридин (inm5s2U), α-тиоуридин, 2'-О-метилуридин (Um), 5,2'-O-диметилуридин (m5Um), 2'-O-метилпсевдоуридин (ψπι), 2-тио-2'-O-метилуридин (s2Um), 5-метоксикарбонилметил-2'-O-метилуридин (mcm5Um), 5-карбамоилметил-2'-O-метилуридин (ncm5Um), 5-карбоксиметиламинометил-2'-О-метилуридин (cmnm5Um), 3,2'-О-диметилуридин (m3Um), 5-(изопентениламинометил)-2'-О-метилуридин (inm5Um), 1-тиоуридин, дезокситимидин, 2'-F-арауридин, 2'-F-уридин, 2'-OH-арауридин, 5-(2-карбометоксивинил)уридин, 5-[3-(1-E-пропениламино)уридин, пиразоло[3,4-d]пиримидины, ксантин и гипоксантин.
Цитозин
В некоторых вариантах осуществления модифицированное нуклеотидное основание представляет собой модифицированный цитозин. Иллюстративные нуклеотидные основания и нуклеозиды, содержащие модифицированный цитозин, включают без ограничения 5-азацитидин, 6-азацитидин, псевдоизоцитидин, 3-метилцитидин (m3C), N4-ацетилцитидин (act), 5-формилцитидин (f5C), N4-метилцитидин (m4C), 5-метилцитидин (m5C), 5-галогенцитидин (например, 5-йодцитидин), 5-гидроксиметилцитидин (hm5C), 1-метилпсевдоизоцитидин, пирролоцитидин, пирролопсевдоизоцитидин, 2-тиоцитидин (s2C), 2-тио-5-метилцитидин, 4-тиопсевдоизоцитидин, 4-тио-1-метилпсевдоизоцитидин, 4-тио-1-метил-1-деазапсевдоизоцитидин, 1-метил-1-деазапсевдоизоцитидин, зебуларин, 5-азазебуларин, 5-метилзебуларин, 5-аза-2-тиозебуларин, 2-тиозебуларин, 2-метоксицитидин, 2-метокси-5-метилцитидин, 4-метоксипсевдоизоцитидин, 4-метокси-1-метилпсевдоизоцитидин, лизидин (k2C), α-тиоцитидин, 2'-О-метилцитидин (Cm), 5,2'-O-диметилцитидин (m5Cm), N4-ацетил-2'-O-метилцитидин (ac4Cm), N4,2'-O-диметилцитидин (m4Cm), 5-формил-2'-O-метилцитидин (f5Cm), N4,N4,2'-O-триметилцитидин (m42Cm), 1-тиоцитидин, 2'-F-арацитидин, 2'-F-цитидин и 2'-OH-арацитидин.
Аденин
В некоторых вариантах осуществления модифицированное нуклеотидное основание представляет собой модифицированный аденин. Иллюстративные нуклеотидные основания и нуклеозиды, содержащие модифицированный аденин, включают без ограничения 2-аминопурин, 2,6-диаминопурин, 2-амино-6-галогенпурин (например, 2-амино-6-хлорпурин), 6-галогенпурин (например, 6-хлорпурин), 2-амино-6-метилпурин, 8-азидоаденозин, 7-деазааденин, 7-деаза-8-азааденин, 7-деаза-2-аминопурин, 7-деаза-8-аза-2-аминопурин, 7-деаза-2,6-диаминопурин, 7-деаза-8-аза-2,6-диаминопурин, 1-метиладенозин (m'A), 2-метиладенин (m A), N6-метиладенозин (m6A), 2-метилтио-N6-метиладенозин (ms2m6A), N6-изопентениладенозин (i6A), 2-метилтио-N6-изопентениладенозин (ms2i6A), N6-(цис-гидроксиизопентенил)аденозин (io6A), 2-метилтио-N6-(цис-гидроксиизопентенил)аденозин (ms2io6A), N6-глицинилкарбамоиладенозин (g6A), N6-треонилкарбамоиладенозин (t6A), N6-метил-N6-треонилкарбамоиладенозин (m6t6A), 2-метилтио-N6-треонилкарбамоиладенозин (ms2g6A), N6,N6-диметиладенозин (m62A), N6-гидроксинорвалилкарбамоиладенозин (hn6A), 2-метилтио-N6-гидроксинорвалилкарбамоиладенозин (ms2hn6A), N6-ацетиладенозин (ac6A), 7-метиладенин, 2-метилтиоаденин, 2-метоксиаденин, α-тиоаденозин, 2'-О-метиладенозин (Am), N6,2'-О-диметиладенозин (m5Am), N6-метил-2'-дезоксиаденозин, N6,N6,2'-О-триметиладенозин (m62Am), 1,2'-О-диметиладенозин (m' Am), 2'-О-рибозиладенозин (фосфат) (Ar(p)), 2-амино-N6-метилпурин, 1-тиоаденозин, 8-азидоаденозин, 2'-F-арааденозин, 2'-F-аденозин, 2'-OH-арааденозин и N6-(19-аминопентаоксанонадецил)-аденозин.
Гуанин
В некоторых вариантах осуществления модифицированное нуклеотидное основание представляет собой модифицированный гуанин. Иллюстративные нуклеотидные основания и нуклеозиды, содержащие модифицированный гуанин, включают без ограничения инозин (I), 1-метилинозин (m 'l), виозин (imG), метилвиозин (mimG), 4-деметилвиозин (imG-14), изовиозин (imG2), вибутозин (yW), пероксивибутозин (o2yW), гидроксивибутозин (OHyW), недостаточно модифицированный гидроксивибутозин (OHyW*), 7-деазагуанозин, квеуозин (Q), эпоксиквеуозин (oQ), галактозилквеуозин (galQ), маннозилквеуозин (manQ), 7-циано-7-деазагуанозин (preQ0), 7-аминометил-7-деазагуанозин (preQi), археозин (G+), 7-деаза-8-азагуанозин, 6-тиогуанозин, 6-тио-7-деазагуанозин, 6-тио-7-деаза-8-азагуанозин, 7-метилгуанозин (m7G), 6-тио-7-метилгуанозин, 7-метилинозин, 6-метоксигуанозин, 1-метилгуанозин (m'G), N2-метилгуанозин (m2G), N2,N2-диметилгуанозин (m22G), N2,7-диметилгуанозин (m2,7G), N2,N2,7-диметилгуанозин (m2,2,7G), 8-оксогуанозин, 7-метил-8-оксогуанозин, 1-метилтиогуанозин, N2-метил-6-тиогуанозин, N2,N2-диметил-6-тиогуанозин, α-тиогуанозин, 2'-О-метилгуанозин (Gm), N2-метил-2'-О-метилгуанозин (m m), N2,N2-диметил-2'-О-метилгуанозин (m22Gm), 1-метил-2'-О-метилгуанозин (m'Gm), N2,7-диметил-2'-О-метилгуанозин (m2,7Gm), 2'-О-метилинозин (Im), 1,2'-О-диметилинозин (m'Im), О6-фенил-2'-дезоксиинозин, 2'-О-рибозилгуанозин (фосфат) (Gr(p)), 1-тиогуанозин, О6-метилгуанозин, О6-метил-2'-дезоксигуанозин, 2'-F-арагуанозин и 2'-F-гуанозин.
m), N2,N2-диметил-2'-О-метилгуанозин (m22Gm), 1-метил-2'-О-метилгуанозин (m'Gm), N2,7-диметил-2'-О-метилгуанозин (m2,7Gm), 2'-О-метилинозин (Im), 1,2'-О-диметилинозин (m'Im), О6-фенил-2'-дезоксиинозин, 2'-О-рибозилгуанозин (фосфат) (Gr(p)), 1-тиогуанозин, О6-метилгуанозин, О6-метил-2'-дезоксигуанозин, 2'-F-арагуанозин и 2'-F-гуанозин.
Модифицированные gRNA
В некоторых вариантах осуществления модифицированные нуклеиновые кислоты могут представлять собой модифицированные gRNA. В некоторых вариантах осуществления gRNA могут быть модифицированы на 3'-конце. В данном варианте осуществления gRNA могут быть модифицированы по 3'-концевому U рибозы. Например, две концевые гидроксильные группы U-рибозы могут быть окислены до альдегидных групп с сопутствующим раскрытием кольца рибозы с получением модифицированного нуклеозида, где U может представлять собой немодифицированный или модифицированный уридин.
В другом варианте осуществления 3'-концевой U может быть модифицирован с помощью 2',3'-циклического фосфата, где U может представлять собой немодифицированный или модифицированный уридин. В некоторых вариантах осуществления молекулы gRNA могут содержать на 3'-концевые нуклеотиды, которые могут быть стабилизированы с целью придания устойчивости к деградации, например, путем встраивания одного или нескольких модифицированных нуклеотидов, описанных в данном документе. В данном варианте осуществления, например, уридины могут быть заменены модифицированными уридинами, например, 5-(2-амино)пропилуридином и 5-бромуридином или любым из модифицированных уридинов, описанных в данном документе; аденозины и гуанозины могут быть заменены модифицированными аденозинами и гуанозинами, например, с модификацией в 8-положении, например, 8-бромгуанозином или любым из модифицированных аденозинов или гуанозинов, описанных в данном документе. В некоторых вариантах осуществления деазануклеотиды, например, 7-деазааденозин, могут быть встроены в gRNA. В некоторых вариантах осуществления O- и N-алкилированные нуклеотиды, например, N6-метиладенозин, могут быть встроены в gRNA. В некоторых вариантах осуществления могут быть встроены рибонуклеотиды с модифицированным сахаром, например, где группа 2'-OH- заменена группой, выбранной из H, -OR, -R (где R может представлять собой, например, метил, алкил, циклоалкил, арил, аралкил, гетероарил или сахар), галогена, -SH, -SR (где R может представлять собой, например, алкил, циклоалкил, арил, аралкил, гетероарил или сахар), амино (где амино может представлять собой, например, NH2; алкиламино, диалкиламино, гетероциклил, ариламино, диариламино, гетероариламино, дигетероариламино или аминокислоту) или циано (-CN). В некоторых вариантах осуществления фосфатный остов может быть модифицирован таким образом, как описано в данном документе, например, с помощью фосфотиоатной группы. В некоторых вариантах осуществления каждый из нуклеотидов в участке липкого конца gRNA может независимо представлять собой модифицированный или немодифицированный нуклеотид, в том числе без ограничения модифицированный в 2'-положении сахара, такой как, 2-F, 2'-O-метилтимидин (T), 2'-O-метоксиэтил-5-метилуридин (Teo), 2'-O-метоксиэтиладенозин (Aeo), 2'-O-метоксиэтил-5-метилцитидин (m5Ceo) и любые их комбинации.
В одном варианте осуществления один, или несколько, или все нуклеотиды в однонитевом липком конце молекулы РНК, например, молекулы gRNA, представляют собой дезоксинуклеотиды.
Фармацевтические композиции
Фармацевтические композиции по настоящему изобретению могут содержать молекулу gRNA, описанную в данном документе, например, множество молекул gRNA, описанных в данном документе, или клетку (например, популяцию клеток, например, популяцию гематопоэтических стволовых клеток, например, CD34+ клеток), представляющую собой одну или несколько клеток, модифицированных с помощью одной или нескольких молекул gRNA, описанных в данном документе, в комбинации с одним или несколькими фармацевтически или физиологически приемлемыми носителями, разбавителями или вспомогательными веществами. Такие композиции могут содержать буферы, такие как нейтральный буферный солевой раствор, фосфатно-буферный солевой раствор и т. п.; углеводы, такие как глюкоза, манноза, сахароза или декстраны, маннит; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатирующие вещества, такие как EDTA или глутатион; адъюванты (например, гидроксид алюминия) и консерванты. Композиции по настоящему изобретению в одном аспекте составляют для внутривенного введения.
Фармацевтические композиции по настоящему изобретению можно вводить с помощью способа, отвечающего требованиям к лечению (или предупреждению) данного заболевания. Количество и частота введения будут определяться на основании таких факторов, как состояние пациента, а также тип и тяжесть заболевания у пациента, хотя подходящие дозы могут быть определены путем клинических испытаний.
В одном варианте осуществления фармацевтическая композиция по сути не содержит, например, в ней отсутствуют выявляемые уровни, загрязнителя, например, выбранного из группы, состоящей из эндотоксина, микоплазмы, мышиных антител, смешанной сыворотки крови человека, бычьего сывороточного альбумина, компонентов среды для культивирования, нежелательных компонентов системы CRISPR, бактерии и гриба. В одном варианте осуществления бактерия представляет собой по меньшей мере бактерию, выбранную из группы, состоящей из Alcaligenes faecalis, Candida albicans, Escherichia coli, Haemophilus influenza, Neisseria meningitides, Pseudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumonia и Streptococcus pyogenes группы A.
Введение заявленных композиций можно осуществлять с помощью любого подходящего способа, в том числе аэрозольной ингаляции, инъекции, приема внутрь, трансфузии, имплантации или трансплантации. Композиции, описанные в данном документе, можно вводить пациенту трансартериально, подкожно, внутрикожно, внутрь опухоли, интранодально, интрамедуллярно, внутримышечно, с помощью внутривенной (i.v.) инъекции или интраперитонеально. В одном аспекте композиции по настоящему изобретению вводят пациенту с помощью внутрикожной или подкожной инъекции. В одном аспекте композиции по настоящему изобретению вводят с помощью i.v. инъекции.
Дозировка вышеуказанных средств для лечения, подлежащих введению пациенту, будет варьироваться в зависимости от точной природы состояния, лечение которого осуществляют, и реципиента лечения. Определение доз для введения человеку можно осуществлять в соответствии с принятыми в данной области техники практическими подходами.
Клетки
Настоящее изобретение также относится к клеткам, содержащим молекулу gRNA по настоящему изобретению или нуклеиновую кислоту, кодирующую указанные молекулы gRNA.
В одном аспекте клетки представляют собой клетки, полученные с помощью способа, описанного в данном документе.
В ряде вариантов осуществления клетки представляют собой гематопоэтические стволовые клетки (например, гематопоэтические стволовые клетки и клетки-предшественники; HSPC), например, CD34+ стволовые клетки. В ряде вариантов осуществления клетки представляют собой CD34+/CD90+ стволовые клетки. В ряде вариантов осуществления клетки представляют собой CD34+/CD90- стволовые клетки. В ряде вариантов осуществления клетки представляют собой гематопоэтические стволовые клетки человека. В ряде вариантов осуществления клетки являются аутологичными. В ряде вариантов осуществления клетки являются аллогенными.
В ряде вариантов осуществления клетки получены из костного мозга, например, аутологичного костного мозга. В ряде вариантов осуществления клетки получены из периферической крови, например, мобилизованной периферической крови, например, аутологичной мобилизованной периферической крови. В ряде вариантов осуществления, в которых используют мобилизованную периферическую кровь, клетки выделены у пациентов, которым вводили средство для мобилизации. В ряде вариантов осуществления средство для мобилизации представляет собой G-CSF. В ряде вариантов осуществления средство для мобилизации представляет собой Plerixafor® (AMD3100). В ряде вариантов осуществления средство для мобилизации представляет собой комбинацию G-CSF и Plerixafor® (AMD3100)). В ряде вариантов осуществления клетки получены из пуповинной крови, например, аллогенной пуповинной крови. В ряде вариантов осуществления клетки получены от пациента с гемоглобинопатией, например, пациента с серповидноклеточным заболеванием или пациента с талассемией, например, бета-талассемией.
В ряде вариантов осуществления клетки являются клетками млекопитающего. В ряде вариантов осуществления клетки являются клетками человека. В ряде вариантов осуществления клетки получены от пациента с гемоглобинопатией, например, пациента с серповидноклеточным заболеванием или пациента с талассемией, например, бета-талассемией.
В одном аспекте в настоящем изобретении представлена клетка, содержащая модификацию или изменение, например, вставку/делецию в последовательности нуклеиновой кислоты, характеризующейся комплементарностью с молекулой gRNA или молекулами gRNA, например, описанными в данном документе, введенными в указанные клетки, например, в качестве части системы CRISPR, описанной в данном документе, или рядом с ней (например, в пределах 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 нуклеотида от нее). В ряде вариантов осуществления клетка представляет собой CD34+ клетку. В ряде вариантов осуществления у измененной или модифицированной клетки, например, CD34+ клетки, сохраняется способность к дифференцировке в клетки нескольких линий дифференцировки, например, сохраняется способность к дифференцировке в клетки эритроидного ростка. В ряде вариантов осуществления измененная или модифицированная клетка, например, CD34+ клетка, подвергается или способна подвергаться по меньшей мере 2-кратному, по меньшей мере 3-кратному, по меньшей мере 4-кратному, по меньшей мере 5-кратному, по меньшей мере 6-кратному, по меньшей мере 7-кратному, по меньшей мере 8-кратному, по меньшей мере 9-кратному или по меньшей мере 10-кратному или большему удвоению в культуре, например, в культуре, содержащей вещество, стимулирующее размножение стволовых клеток, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол. В ряде вариантов осуществления измененная или модифицированная клетка, например, CD34+ клетка, подвергается или способна подвергаться по меньшей мере 5-кратному, например, приблизительно 5-кратному, удвоению в культуре, например, в культуре, содержащей молекулу вещества, стимулирующего размножение стволовых клеток, например, описанного в данном документе, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол. В ряде вариантов осуществления измененная или модифицированная клетка, например, CD34+ клетка, характеризуется дифференцировкой в клетку, например, в клетку эритроидного ростка, например, в красную кровяную клетку, и/или способна дифференцироваться в такую клетку, которая характеризуется повышенным уровнем фетального гемоглобина (например, уровнем экспрессии и/или уровнем белка), например, по меньшей мере 20% повышением уровня белка, представляющего собой фетальный гемоглобин, по сравнению с аналогичной немодифицированной или неизмененной клеткой. В ряде вариантов осуществления измененная или модифицированная клетка, например, CD34+ клетка, характеризуется дифференцировкой в клетку, например, в клетку эритроидного ростка, например, в красную кровяную клетку, и/или способна дифференцироваться в такую клетку, которая характеризуется повышенным уровнем фетального гемоглобина (например, уровнем экспрессии и/или уровнем белка) по сравнению с аналогичной немодифицированной или неизмененной клеткой, например, продуцирует по меньшей мере 6 пикограмм, например, по меньшей мере 7 пикограмм, по меньшей мере 8 пикограмм, по меньшей мере 9 пикограмм или по меньшей мере 10 пикограмм фетального гемоглобина. В ряде вариантов осуществления измененная или модифицированная клетка, например, CD34+ клетка, характеризуется дифференцировкой в клетку, например, в клетку эритроидного ростка, например, в красную кровяную клетку, и/или способна дифференцироваться в такую клетку, которая характеризуется повышенным уровнем фетального гемоглобина (например, уровнем экспрессии и/или уровнем белка) по сравнению с аналогичной немодифицированной или неизмененной клеткой, например, продуцирует от приблизительно 6 до приблизительно 12, от приблизительно 6 до приблизительно 7, от приблизительно 7 до приблизительно 8, от приблизительно 8 до приблизительно 9, от приблизительно 9 до приблизительно 10, от приблизительно 10 до приблизительно 11 или от приблизительно 11 до приблизительно 12 пикограмм фетального гемоглобина.
В одном аспекте в настоящем изобретении представлена популяция клеток, содержащая клетки, характеризующиеся модификацией или изменением, например, вставкой/делецией, в последовательности нуклеиновой кислоты, характеризующейся комплементарностью с молекулой gRNA или молекулами gRNA, например, описанными в данном документе, введенными в указанные клетки, например, в качестве части системы CRISPR, описанной в данном документе, или рядом с ней (например, в пределах 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 нуклеотида от нее). В ряде вариантов осуществления по меньшей мере 50%, например, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% клеток в популяции характеризуются модификацией или изменением (например, характеризуются по меньшей мере одной модификацией или изменением), что, например, измеряют с помощью NGS, например, как описано в данном документе, например, через два дня после введения gRNA и/или системы CRISPR по настоящему изобретению. В ряде вариантов осуществления по меньшей мере 90%, например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% клеток в популяции характеризуются модификацией или изменением (например, характеризуются по меньшей мере одной модификацией или изменением), что, например, измеряют с помощью NGS, например, как описано в данном документе, например, через два дня после введения gRNA и/или системы CRISPR по настоящему изобретению. В ряде вариантов осуществления популяция клеток содержит CD34+ клетки, например, содержит по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или по меньшей мере приблизительно 98% CD34+ клеток. В ряде вариантов осуществления у популяции клеток, содержащей измененные или модифицированные клетки, например, CD34+ клетки, сохраняется способность к образованию клеток нескольких линий дифференцировки, например, дифференцировки в них, например, сохраняется способность образования клеток эритроидного ростка, например, дифференцировки в них. В ряде вариантов осуществления популяция клеток, например, популяция CD34+ клеток, подвергается или способна подвергаться по меньшей мере 2-кратному, по меньшей мере 3-кратному, по меньшей мере 4-кратному, по меньшей мере 5-кратному, по меньшей мере 6-кратному, по меньшей мере 7-кратному, по меньшей мере 8-кратному, по меньшей мере 9-кратному или по меньшей мере 10-кратному или большему удвоению популяции в культуре, например, в культуре, содержащей вещество, стимулирующее размножение стволовых клеток, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол. В ряде вариантов осуществления популяция измененных или модифицированных клеток, например, популяция CD34+ клеток, подвергается или способна подвергаться по меньшей мере 5-кратному, например, приблизительно 5-кратному, удвоению популяции в культуре, например, в культуре, содержащей молекулу вещества, стимулирующего размножение стволовых клеток, например, описанного в данном документе, например, (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол. В ряде вариантов осуществления популяция клеток, содержащая измененные или модифицированные клетки, например, CD34+ клетки, характеризуется дифференцировкой в популяцию клеток, например, в популяцию клеток эритроидного ростка, например, в популяцию красных кровяных клеток, и/или способна к дифференцировке в такую популяцию клеток, которые характеризуются повышенным уровнем фетального гемоглобина (например, уровнем экспрессии и/или уровнем белка), например, по меньшей мере 20% повышением уровня белка, представляющего собой фетальный гемоглобин, по сравнению с аналогичными немодифицированными или неизмененными клетками. В ряде вариантах осуществления популяция клеток, содержащая измененные или модифицированные клетки, например, CD34+ клетки, характеризуется дифференцировкой в популяцию клеток, например, в популяцию клеток эритроидного ростка, например, в популяцию красных кровяных клеток, и/или способна к дифференцировке в такую популяцию клеток, которые характеризуются повышенным уровнем фетального гемоглобина (например, уровнем экспрессии и/или уровнем белка) по сравнению с аналогичными немодифицированными или неизмененными клетками, например, содержит клетки, которые продуцируют по меньшей мере 6 пикограмм, например, по меньшей мере 7 пикограмм, по меньшей мере 8 пикограмм, по меньшей мере 9 пикограмм или по меньшей мере 10 пикограмм фетального гемоглобина на клетку. В ряде вариантов осуществления популяция измененных или модифицированных клеток, например, CD34+ клеток, характеризуется дифференцировкой в популяцию клеток, например, в популяцию клеток эритроидного ростка, например, в популяцию красных кровяных клеток, и/или способна к дифференцировке в такую популяцию клеток, которые характеризуются повышенным уровнем фетального гемоглобина (например, уровнем экспрессии и/или уровнем белка) по сравнению с аналогичной немодифицированной или неизмененной клеткой, например, содержит клетки, которые продуцируют от приблизительно 6 до приблизительно 12, от приблизительно 6 до приблизительно 7, от приблизительно 7 до приблизительно 8, от приблизительно 8 до приблизительно 9, от приблизительно 9 до приблизительно 10, от приблизительно 10 до приблизительно 11 или от приблизительно 11 до приблизительно 12 пикограмм фетального гемоглобина на клетку.
В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e3 клеток. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e4 клеток. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e5 клеток. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e6 клеток. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e7 клеток. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e8 клеток. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e9 клеток. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e10 клеток. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e11 клеток. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e12 клеток. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e13 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e6 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 2e6 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 3e6 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 4e6 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 5e6 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 6e6 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 7e6 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 8e6 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 9e6 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e7 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 2e7 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 3e7 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 4e7 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 5e7 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 6e7 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 7e7 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 8e7 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 9e7 клеток на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e8 клеток на килограмм веса тела пациента, которому назначено их введение. В любом из вышеупомянутых вариантов осуществления популяция клеток может содержать по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или по меньшей мере приблизительно 99%) HSPC, например, CD34+ клеток. В любом из вышеупомянутых вариантов осуществления популяция клеток может содержать приблизительно 60% HSPC, например, CD34+ клеток. В одном варианте осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 3e7 клеток и содержит приблизительно 2e7 HSPC, например, CD34+ клеток. Как используется по всей настоящей заявке, экспоненциальное представление числа [число]e[число] используется в своем обычном значении. Таким образом, например, 2e6 эквивалентно 2×106 или 2000000.
В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1,5e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 2e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 3e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 4e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 5e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 6e6 HSPC, например, CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 7e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 8e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 9e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 2e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 3e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 4e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 5e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 6e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 7e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 8e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 9e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 1e8 HSPC, например, CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 2e8 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 3e8 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 4e8 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит по меньшей мере приблизительно 5e8 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение.
В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 1e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 1,5e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 2e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 3e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 4e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 5e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 6e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 7e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 8e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 9e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 1e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 2e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 3e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 4e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 5e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 6e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 7e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 8e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 9e7 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 1e8 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 2e8 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 3e8 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 4e8 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит приблизительно 5e8 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение.
В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит от приблизительно 2e6 до приблизительно 10e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение. В ряде вариантов осуществления популяция клеток, например описанная в данном документе, содержит от 2e6 до 10e6 HSPC, например CD34+ клеток, на килограмм веса тела пациента, которому назначено их введение.
Клетки по настоящему изобретению могут содержать молекулу gRNA по настоящему изобретению или нуклеиновую кислоту, кодирующую указанную молекулу gRNA, и молекулу Cas9 по настоящему изобретению или нуклеиновую кислоту, кодирующую указанную молекулу Cas9. В одном варианте осуществления клетки по настоящему изобретению могут содержать рибонуклеопротеиновый (RNP) комплекс, который содержит молекулу gRNA по настоящему изобретению и молекулу Cas9 по настоящему изобретению.
Клетки по настоящему изобретению предпочтительно модифицированы ex vivo с тем, чтобы содержать молекулу gRNA по настоящему изобретению, например, с помощью способа, описанного в данном документе, например, с помощью электропорации или с помощью TRIAMF (как описано в заявке на патент PCT/US2017/54110, включенной в данный документ посредством ссылки во всей своей полноте).
Клетки по настоящему изобретению включают клетки, в которых была изменена, например снижена или подавлена, экспрессия одного или нескольких генов за счет введения системы CRISPR, содержащей gRNA по настоящему изобретению. Например, клетки по настоящему изобретению могут характеризоваться сниженным уровнем экспрессии бета-глобина (например, бета-гемоглобина, содержащего мутацию, приводящую к образованию серповидной формы) по сравнению с немодифицированными клетками. В качестве другого примера клетки по настоящему изобретению могут характеризоваться повышенным уровнем экспрессии фетального гемоглобина по сравнению с немодифицированныму клетками. В качестве альтернативы или в дополнение клетка по настоящему изобретению может давать начало другому типу клетки, например, эритроциту, например, дифференцироваться в него, который характеризуется повышенным уровнем экспрессии фетального гемоглобина по сравнению с клетками, дифференцировавшимися из немодифицированных клеток. В ряде вариантов осуществления повышение уровня фетального гемоглобина составляет по меньшей мере приблизительно 20%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 40% или по меньшей мере приблизительно 50%. В качестве альтернативы или в дополнение клетка по настоящему изобретению может давать начало другому типу клетки, например, эритроциту, например, дифференцироваться в него, который характеризуется сниженным уровнем экспрессии бета-глобина (например, бета-гемоглобина, содержащего мутацию, приводящую к образованию серповидной формы, также называемого в данном документе бета-глобином, характерным для серповидной формы) по сравнению с клетками, дифференцированными из немодифицированных клеток. В ряде вариантов осуществления снижение уровня бета-глобина, характерного для серповидной формы, составляет по меньшей мере приблизительно 20%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 40% или по меньшей мере приблизительно 50%.
Клетки по настоящему изобретению включают клетки, в которых была изменена, например снижена или подавлена, экспрессия одного или нескольких генов за счет введения системы CRISPR, содержащей gRNA по настоящему изобретению. Например, клетки по настоящему изобретению могут характеризоваться сниженным уровнем экспрессии бета-гемоглобина, например, мутированного бета-гемоглобина или бета-гемоглобина дикого типа, по сравнению с немодифицированными клетками. В другом аспекте в настоящем изобретении представлены клетки, которые получены, например дифференцированы, из клеток, в которые была введена система CRISPR, содержащая gRNA по настоящему изобретению. В таких аспектах клетки, в которые была введена система CRISPR, содержащая gRNA по настоящему изобретению, могут не характеризоваться сниженным уровнем бета-гемоглобина, например, мутированного бета-гемоглобина или бета-гемоглобина дикого типа, но клетки, полученные, например дифференцированные, из указанных клеток характеризуются сниженным уровнем бета-гемоглобина, например, мутированного бета-гемоглобина или бета-гемоглобина дикого типа. В ряде вариантов осуществления получение, например дифференцировка, осуществляется in vivo (например, у пациента, например, у пациента с гемоглобинопатией, например, у пациента с серповидноклеточным заболеванием или талассемией, например, бета-талассемией). В ряде вариантов осуществления клетки, в которые была введена система CRISPR, содержащая gRNA по настоящему изобретению, представляют собой CD34+ клетки, а клетки, полученные, например дифференцированные, из них относятся к эритроидному ростку, например, красные кровяные клетки.
Клетки по настоящему изобретению включают клетки, в которых была изменена, например повышена или усилена, экспрессия одного или нескольких генов за счет введения системы CRISPR, содержащей gRNA по настоящему изобретению. Например, клетки по настоящему изобретению могут характеризоваться повышенным уровнем экспрессии фетального гемоглобина по сравнению с немодифицированными клетками. В другом аспекте в настоящем изобретении представлены клетки, которые получены, например дифференцированы, из клеток, в которые была введена система CRISPR, содержащая gRNA по настоящему изобретению. В таких аспектах клетки, в которые была введена система CRISPR, содержащая gRNA по настоящему изобретению, могут не характеризоваться повышенным уровнем фетального гемоглобина, но клетки, полученные, например дифференцированные, из указанных клеток характеризуются повышенным уровнем фетального гемоглобина. В ряде вариантов осуществления получение, например дифференцировка, осуществляется in vivo (например, у пациента, например, у пациента с гемоглобинопатией, например, у пациента с серповидноклеточным заболеванием или талассемией, например, бета-талассемией). В ряде вариантов осуществления клетки, в которые была введена система CRISPR, содержащая gRNA по настоящему изобретению, представляют собой CD34+ клетки, а клетки, полученные, например дифференцированные, из них относятся к эритроидному ростку, например, красные кровяные клетки.
В другом аспекте настоящее изобретение относится к клеткам, которые содержат вставку/делецию в (например, в пределах) последовательности нуклеиновой кислоты, характеризующейся комплементарностью с молекулой gRNA (например, целевой последовательностью молекулы gRNA) или молекулами gRNA, введенными в указанные клетки, или рядом с ней (например, в пределах 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 нуклеотида от нее). В ряде вариантов осуществления вставка/делеция представляет собой вставку/делецию со сдвигом рамки считывания. В ряде вариантов осуществления клетка содержит большую делецию, например, делецию 1 т. о., 2 т. о., 3 т. о., 4 т. о., 5 т. о., 6 т. о. или больше. В ряде вариантов осуществления большая делеция охватывает нуклеиновые кислоты, расположенные между двумя сайтами связывания для молекулы gRNA или молекул gRNA, введенных в указанные клетки. В ряде вариантов осуществления делеция охватывает, например состоит из, приблизительно 4900 нуклеотидов, расположенных между целевой последовательностью для gRNA, описанной в данном документе, расположенной в промоторном участке HBG1, и целевой последовательностью для gRNA, описанной в данном документе, расположенной в промоторном участке HBG2. В ряде вариантов осуществления вставка/делеция, например, делеция, не охватывает нуклеотид, расположенный между 5250092 и 5249833, - нить (hg38).
В одном аспекте настоящее изобретение относится к популяции клеток (например, описанной в данном документе), например, популяции HSPC, которая содержит клетки, содержащие вставку/делецию в последовательности нуклеиновой кислоты, характеризующейся комплементарностью с молекулой gRNA или молекулами gRNA, например, описанными в данном документе, введенными в указанные клетки, например, описанные в данном документе, или рядом с ней (например, в пределах 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 нуклеотида от нее). В ряде вариантов осуществления вставка/делеция представляет собой вставку/делецию со сдвигом рамки считывания. В ряде вариантов осуществления популяция клеток содержит клетки, которые содержат большую делецию, например, делецию размером 1 т. о., 2 т. о., 3 т. о., 4 т. о., 5 т. о., 6 т. о. или больше. В ряде вариантов осуществления большая делеция охватывает нуклеиновые кислоты, расположенные между двумя сайтами связывания для молекулы gRNA или молекул gRNA, введенных в указанные клетки. В ряде вариантов осуществления делеция охватывает, например состоит из, приблизительно 4900 нуклеотидов, расположенных между целевой последовательностью для gRNA, описанной в данном документе, расположенной в промоторном участке HBG1, и целевой последовательностью для gRNA, описанной в данном документе, расположенной в промоторном участке HBG2. В ряде вариантов осуществления менее 1%, 0,5%, 0,1% или 0,001% клеток в популяции (например, ни одна клетка в популяции не содержит) содержат делецию нуклеотида, расположенного между 5250092 и 5249833, - нить (hg38). В ряде вариантов осуществления 20% - 100% клеток популяции содержат указанную большую делецию, вставку/делецию или вставки/делеции. В ряде вариантов осуществления 30% - 100% клеток популяции содержат указанную большую делецию, вставку/делецию или вставки/делеции. В ряде вариантов осуществления 40% - 100% клеток популяции содержат указанную большую делецию, вставку/делецию или вставки/делеции. В ряде вариантов осуществления 50% - 100% клеток популяции содержат указанную большую делецию, вставку/делецию или вставки/делеции. В ряде вариантов осуществления 60% - 100% клеток популяции содержат указанную большую делецию, вставку/делецию или вставки/делеции. В ряде вариантов осуществления 70% - 100% клеток популяции содержат указанную большую делецию, вставку/делецию или вставки/делеции. В ряде вариантов осуществления 80% - 100% клеток популяции содержат указанную большую делецию, вставку/делецию или вставки/делеции. В ряде вариантов осуществления 90% - 100% клеток популяции содержат указанную большую делецию, вставку/делецию или вставки/делеции. В ряде вариантов осуществления у популяции клеток сохраняется способность к дифференцировке во множество типов клеток, например, сохраняется способность к дифференцировке в клетки эритроидного ростка, например, в красные кровяные клетки, например, у субъекта, например, человека. В ряде вариантов осуществления у подвергнутых редактированию клеток (например, клеток HSPC, например, CD34+ клетки, например, любой субпопуляции CD34+ клетки, например, описанной в данном документе) сохраняется способность (и/или активность к) пролиферации, например, в культуре клеток, например, по меньшей мере 5-кратной, по меньшей мере 10-кратной, по меньшей мере 15-кратной, по меньшей мере 20-кратной, по меньшей мере 25-кратной, по меньшей мере 30-кратной, по меньшей мере 35-кратной, по меньшей мере 40-кратной, по меньшей мере 45-кратной, по меньшей мере 50-кратной или большей пролиферации, например, через 1, 2, 3, 4, 5, 6, 7 или больше дней (например, через приблизительно 1 или приблизительно 2 дня) культивирования в культуре клеток, например, в среде для культивирования клеток, описанной в данном документе, например, среде для культивирования клеток, содержащей одно или несколько веществ, стимулирующих размножение стволовых клеток, например, соединение 4. В ряде вариантов осуществления у подвергнутых редактированию и дифференцированных клеток (например, красных кровяных клеток) сохраняется способность к пролиферации, например, по меньшей мере 5-кратной, по меньшей мере 10-кратной, по меньшей мере 15-кратной, по меньшей мере 20-кратной, по меньшей мере 25-кратной, по меньшей мере 30-кратной, по меньшей мере 35-кратной, по меньшей мере 40-кратной, по меньшей мере 45-кратной, по меньшей мере 50-кратной или большей пролиферации через 7 дней культивирования в среде для эритроидной дифференцироки (EDM), например, описанной в разделе "Примеры", и/или по меньшей мере 30-кратной, по меньшей мере 35-кратной, по меньшей мере 40-кратной, по меньшей мере 45-кратной, по меньшей мере 50-кратной, по меньшей мере 55-кратной, по меньшей мере 60-кратной, по меньшей мере 65-кратной, по меньшей мере 70-кратной, по меньшей мере 75-кратной, по меньшей мере 80-кратной, по меньшей мере 85-кратной, по меньшей мере 90-кратной, по меньшей мере 95-кратной, по меньшей мере 100-кратной, по меньшей мере 110-кратной, по меньшей мере 120-кратной, по меньшей мере 130-кратной, по меньшей мере 140-кратной, по меньшей мере 150-кратной, по меньшей мере 200-кратной, по меньшей мере 300-кратной, по меньшей мере 400-кратной, по меньшей мере 500-кратной, по меньшей мере 600-кратной, по меньшей мере 700-кратной, по меньшей мере 800-кратной, по меньшей мере 900-кратной, по меньшей мере 1000-кратной, по меньшей мере 1100-кратной, по меньшей мере 1200-кратной, по меньшей мере 1300-кратной, по меньшей мере 1400-кратной, по меньшей мере 1500-кратной или большей пролиферации через 21 день культивирования, например, в среде для эритроидной дифференцировки (EDM), например, описанной в разделе "Примеры", или у субъекта (например, млекопитающего, например, человека).
В одном варианте осуществления в настоящем изобретении представлена популяция клеток, например, CD34+ клеток, из которых по меньшей мере 90%, например, по меньшей мере 95%, например, по меньшей мере 98% клеток популяции содержат большую делецию или одну или несколько вставок/делеций, например, описанных в данном документе. Не ограничиваясь теорией полагают, что введение молекулы gRNA или системы CRISPR, описанных в данном документе, в популяцию клеток обеспечивает получение паттерна вставок/делеций и/или большой делеции в указанной популяции, и, таким образом, каждая клетка в популяции, которая содержит вставку/делецию и/или большую делецию может не характеризоваться одной и той же вставкой/делецией и/или большой делецией. В ряде вариантов осуществления вставка/делеция и/или большая делеция охватывает одну или несколько нуклеиновых кислот в сайте, комплементарном нацеливающему домену молекулы gRNA, описанной в данном документе, или рядом с ним; где у указанных клеток сохраняется способность к дифференцировке в клетки эритроидного ростка, например, красные кровяные клетки; и/или где указанные клетки, дифференцированные из популяции клеток, характеризуются повышенным уровнем фетального гемоглобина (например, популяция характеризуется более высоким % F-клеток) по сравнению с клетками, дифференцированными из аналогичной популяции немодифицированных клеток. В ряде вариантов осуществления популяция клеток подвергается по меньшей мере 2-кратному размножению ex vivo, например, в среде, содержащей одно или несколько веществ, стимулирующих размножение стволовых клеток, например, содержащей (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол. В ряде вариантов осуществления популяция клеток подвергается по меньшей мере 5-кратному размножению ex vivo, например, в среде, содержащей одно или несколько веществ, стимулирующих размножение стволовых клеток, например, содержащей (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол.
В ряде вариантов осуществления размер вставки/делеции составляет менее приблизительно 50 нуклеотидов, например, менее приблизительно 45, менее приблизительно 40, менее приблизительно 35, менее приблизительно 30 или менее приблизительно 25 нуклеотидов. В ряде вариантов осуществления размер вставки/делеции составляет менее приблизительно 25 нуклеотидов. В ряде вариантов осуществления размер вставки/делеции составляет менее приблизительно 20 нуклеотидов. В ряде вариантов осуществления размер вставки/делеции составляет менее приблизительно 15 нуклеотидов. В ряде вариантов осуществления размер вставки/делеции составляет менее приблизительно 10 нуклеотидов. В ряде вариантов осуществления размер вставки/делеции составляет менее приблизительно 9 нуклеотидов. В ряде вариантов осуществления размер вставки/делеции составляет менее приблизительно 9 нуклеотидов. В ряде вариантов осуществления размер вставки/делеции составляет менее приблизительно 7 нуклеотидов. В ряде вариантов осуществления размер вставки/делеции составляет менее приблизительно 6 нуклеотидов. В ряде вариантов осуществления размер вставки/делеции составляет менее приблизительно 5 нуклеотидов. В ряде вариантов осуществления размер вставки/делеции составляет менее приблизительно 4 нуклеотидов. В ряде вариантов осуществления размер вставки/делеции составляет менее приблизительно 3 нуклеотидов. В ряде вариантов осуществления размер вставки/делеции составляет менее приблизительно 2 нуклеотидов. В любом из вышеуказанных вариантов осуществления размер вставки/делеции составляет по меньшей мере 1 нуклеотид. В ряде вариантов осуществления размер вставки/делеции составляет 1 нуклеотид. В ряде вариантов осуществления большая делеция охватывает приблизительно 1 т. о. ДНК. В ряде вариантов осуществления большая делеция охватывает приблизительно 2 т. о. ДНК. В ряде вариантов осуществления большая делеция охватывает приблизительно 3 т. о. ДНК. В ряде вариантов осуществления большая делеция охватывает приблизительно 4 т. о. ДНК. В ряде вариантов осуществления большая делеция охватывает приблизительно 5 т. о. ДНК. В ряде вариантов осуществления большая делеция охватывает приблизительно 6 т. о. ДНК. В ряде вариантов осуществления большая делеция охватывает приблизительно 4,9 т. о. ДНК, например, расположенных между целевой последовательностью в промоторном участке HBG1 и целевой последовательностью в промоторном участке HBG2.
В ряде вариантов осуществления популяция клеток (например, описанная в данном документе) содержит паттерн вставок/делеций и/или большие делеции, предусматривающие любые 1, 2, 3, 4, 5 или 6 наиболее часто выявляемых вставок/делеций, ассоциированных с системой CRISPR содержащей молекулу gRNA, описанную в данном документе, например, содержит 1, 2, 3, 4, 5 или 6 вставок/делеций и больших делеций, описанных в таблице 7-2 (например, содержит 1, 2, 3, 4, 5 или 6 вставок/делеций и больших делеций, выявляемых в целевой последовательности HBG1 или рядом с ней, и/или содержит 1, 2, 3, 4, 5 или 6 вставок/делеций и больших делеций, выявляемых в целевой последовательности HBG2 или рядом с ней). В ряде вариантов осуществления вставки/делеции и/или большие делеции выявляют с помощью способа, описанного в данном документе, например, с помощью NGS или qPCR.
В одном аспекте клетка или популяция клеток (например, описанные в данном документе) не содержат вставку/делецию или большую делецию в нецелевом сайте, что, например, выявляют с помощью способа, описанного в данном документе.
В ряде вариантов осуществления потомство, например, дифференцированное потомство, например, эритроидное (например, красная кровяная клетка) потомство клетки или популяции клеток, описанных в данном документе (например, полученных от пациента с серповидноклеточным заболеванием), продуцирует бета-глобин, характерный для серповидной формы, на более низком уровне и/или гамма-глобин на более высоком уровне, чем немодифицированные клетки. В ряде вариантов осуществления потомство, например, дифференцированное потомство, например, эритроидное (например, красная кровяная клетка) потомство клетки или популяции клеток, описанных в данном документе (например, полученных от пациента с серповидноклеточным заболеванием), продуцирует бета-глобин, характерный для серповидной формы, на более низком уровне и гамма-глобин на более высоком уровне, чем немодифицированные клетки. В ряде вариантов осуществления бета-глобин, характерный для серповидной формы, продуцируется на уровне, который на по меньшей мере приблизительно 20%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 40% или по меньшей мере приблизительно 50% меньше, чем у немодифицированных клеток. В ряде вариантов осуществления гамма-глобин продуцируется на уровне, который на по меньшей мере приблизительно 20%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60% или по меньшей мере приблизительно 70% выше, чем у немодифицированных клеток.
В одном аспекте в настоящем изобретении представлена популяция модифицированных HSPC или эритроидных клеток, дифференцированных из указанных HSPC (например, дифференцированных ex vivo или у пациента), например, описанных в данном документе, где по меньшей мере 15%, по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45%, по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% клеток представляют собой F-клетки. В ряде вариантов осуществления популяция клеток содержит (или способна к дифференцировке, например in vivo, в популяцию эритроцитов, которая содержит) более высокую процентную долю F-клеток, чем аналогичная популяция клеток, в случае которых не вводили молекулу gRNA или молекулы gRNA, например, описанные в данном документе. В ряде вариантов осуществления популяция клеток характеризуется (или способна к дифференцировке, например in vivo, в популяцию эритроцитов, которая характеризуется) по меньшей мере 20% повышением, например, по меньшей мере 21% повышением, по меньшей мере 22% повышением, по меньшей мере 23% повышением, по меньшей мере 24% повышением, по меньшей мере 25% повышением, по меньшей мере 26% повышением, по меньшей мере 27% повышением, по меньшей мере 28% повышением или по меньшей мере 29% повышением количества F-клеток по сравнению с аналогичной популяцией клеток, в случае которых не вводили молекулу gRNA или молекулы gRNA, например, описанные в данном документе. В ряде вариантов осуществления популяция клеток характеризуется (или способна к дифференцировке, например in vivo, в популяцию эритроцитов, которая характеризуется) по меньшей мере 30% повышением, по меньшей мере 35% повышением, по меньшей мере 40% повышением, по меньшей мере 45% повышением, по меньшей мере 50% повышением, по меньшей мере 55% повышением, по меньшей мере 60% повышением, по меньшей мере 65% повышением, по меньшей мере 70% повышением, по меньшей мере 75% повышением, по меньшей мере 80% повышением, по меньшей мере 85% повышением, по меньшей мере 90% повышением или по меньшей мере 95% повышением количества F-клеток по сравнению с аналогичной популяцией клеток, в случае которых не вводили молекулу gRNA или молекулы gRNA, например, описанные в данном документе. В ряде вариантов осуществления популяция клеток характеризуется (или способна к дифференцировке, например in vivo, в популяцию эритроцитов, которая характеризуется) 10-90%, 20% - 80%, 20% - 70%, 20% - 60%, 20% - 50%, 20% - 40%, 20% - 30%, 25% - 80%, 25% - 70%, 25% - 60%, 25% - 50%, 25% - 40%, 25% - 35%, 25% - 30%, 30% - 80%, 30% - 70%, 30% - 60%, 30% - 50%, 30% - 40% или 30% - 35% повышением количества F-клеток по сравнению с аналогичной популяцией клеток, в случае которых не вводили молекулу gRNA или молекулы gRNA, например, описанные в данном документе. В ряде вариантов осуществления популяция клеток, например, полученная с помощью способа, описанного в данном документе, содержит достаточное количество клеток и/или характеризуется достаточным повышением % F-клеток для обеспечения лечения гемоглобинопатии, например, описанной в данном документе, например серповидноклеточного заболевания и/или бета-талассемии, у нуждающегося в этом пациента, при ее введении указанному пациенту, например, в терапевтически эффективном количестве. В ряде вариантов осуществления повышение количества F-клеток измеряют в анализе эритроидной дифференцировки, например, описанном в данном документе.
В ряде вариантов осуществления в том числе в любом из вариантов осуществления и аспектов, описанных в данном документе, настоящее изобретение относится к клетке, например, популяции клеток, например, модифицированных с помощью любых из gRNA, способов и/или систем CRISPR, описанных в данном документе, содержащих F-клетки, которые продуцируют по меньшей мере 6 пикограмм фетального гемоглобина на клетку. В ряде вариантов осуществления F-клетки продуцируют по меньшей мере 7 пикограмм фетального гемоглобина на клетку. В ряде вариантов осуществления F-клетки продуцируют по меньшей мере 8 пикограмм фетального гемоглобина на клетку. В ряде вариантов осуществления F-клетки продуцируют по меньшей мере 9 пикограмм фетального гемоглобина на клетку. В ряде вариантов осуществления F-клетки продуцируют по меньшей мере 10 пикограмм фетального гемоглобина на клетку. В ряде вариантов осуществления F-клетки продуцируют в среднем от 6,0 до 7,0 пикограмм, от 7,0 до 8,0, от 8,0 до 9,0, от 9,0 до 10,0, от 10,0 до 11,0 или от 11,0 до 12,0 пикограмм фетального гемоглобина на клетку.
В ряде вариантов осуществления клетка или популяция клеток, например, описанные в данном документе (например, содержащие вставку/делецию, например, большую делецию или вставку/делецию, описанные в таблице 7-2) (или их потомство), поддаются выявлению среди клеток субъекта, которому назначено их введение, например, остаются выявляемыми за счет выявления вставки/делеции, например, с использованием способа, описанного в данном документе. В ряде вариантов осуществления клетка или популяция клеток (или их потомство) поддаются выявлению у субъекта, которому назначено их введение, в течение по меньшей мере 10 недель, по меньшей мере 14 недель, по меньшей мере 16 недель, по меньшей мере 18 недель, по меньшей мере 20 недель, по меньшей мере 30 недель, по меньшей мере 40 недель, по меньшей мере 50 недель или дольше после введения указанных клетки или популяции клеток указанному субъекту.
В ряде вариантов осуществления одна или несколько вставок/делеций (например, большая делеция или вставка/делеция, описанные в таблице 7-2) поддаются выявлению в клетках (например, клетках, например CD34+ клетках, костного мозга и/или периферической крови) субъекта, которому были введены клетки или популяция клеток, описанные в данном документе, например, остаются выявляемыми с помощью способа, описанного в данном документе, например, с помощью NGS. В ряде вариантов осуществления одна или несколько вставок/делеций поддаются выявлению в клетках (например, клетках, например CD34+ клетках, костного мозга и/или периферической крови) субъекта, которому были введены клетки или популяция клеток, описанные в данном документе, в течение по меньшей мере 10 недель, по меньшей мере 14 недель, по меньшей мере 16 недель, по меньшей мере 18 недель, по меньшей мере 20 недель, по меньшей мере 30 недель, по меньшей мере 40 недель, по меньшей мере 50 недель или дольше после введения клетки или популяции клеток, описанных в данном документе, указанному субъекту. В ряде вариантов осуществления уровень выявления указанных одной или нескольких вставок/делеций не уменьшается со временем или уменьшается на менее 5%, менее 10%, менее 15%, менее 20%, менее 30%, менее 40% или менее 50% (например, по сравнению с уровнем выявления вставки/делеции до трансплантации или по сравнению с уровнем выявления через 2 недели после трансплантации или через 8 недель после трансплантации), например, при измерении через 20 недель после трансплантации по сравнению с уровнем выявления (например, процентной долей клеток, содержащих одну или несколько вставок/делеций), измеренным до трансплантации или измеренным через 2 недели после трансплантации или через 8 недель после трансплантации.
В ряде вариантов осуществления в том числе в любом из вышеупомянутых вариантов осуществления клетка и/или популяция клеток по настоящему изобретению содержит, например состоит из, клетки, которые не содержат нуклеиновую кислоту, кодирующую молекулу Cas9.
Способы лечения
Временные рамки доставки
В одном варианте осуществления доставляют одну или несколько молекул нуклеиновой кислоты (например, молекул ДНК), отличных от компонентов системы Cas, например, от компонента, представляющего собой молекулу Cas9, и/или компонента, представляющего собой молекулу gRNA, описанных в данном документе. В одном варианте осуществления молекулу нуклеиновой кислоты доставляют одновременно с осуществлением доставки одного или нескольких компонентов системы Cas. В одном варианте осуществления доставку молекулы нуклеиновой кислоты осуществляют до или после (например, через менее приблизительно 30 минут, 1 часа, 2 часов, 3 часов, 6 часов, 9 часов, 12 часов, 1 дня, 2 дней, 3 дней, 1 недели, 2 недель или 4 недель) доставки одного или нескольких компонентов системы Cas. В одном варианте осуществления молекулу нуклеиновой кислоты доставляют с помощью средства, отличного от того, с помощью которого доставляют один или несколько компонентов системы Cas, например, компонент, представляющий собой молекулу Cas9, и/или компонент, представляющий собой молекулу gRNA. Молекула нуклеиновой кислоты может быть доставлена с помощью любых способов доставки, описанных в данном документе. Например, молекула нуклеиновой кислоты может быть доставлена с помощью вирусного вектора, например, интеграционно-дефектного лентивируса, а компонент, представляющий собой молекулу Cas9, и/или компонент, представляющий собой молекулу gRNA, могут быть доставлены с помощью электропорации, вследствие чего, например, может быть снижена токсичность, обусловленная нуклеиновыми кислотами (например, ДНК). В одном варианте осуществления молекула нуклеиновой кислоты кодирует терапевтический белок, например, белок, описанный в данном документе. В одном варианте осуществления молекула нуклеиновой кислоты кодирует молекулу РНК, например, молекулу РНК, описанную в данном документе.
Бимодальная или отличающаяся доставка компонентов
Раздельная доставка компонентов системы Cas, например, компонента, представляющего собой молекулу Cas9, и компонента, представляющего собой молекулу gRNA, и более конкретно доставка компонентов с помощью отличающихся способов может повышать эффективность, например, за счет улучшения специфичности в отношении ткани и безопасности. В одном варианте осуществления молекула Cas9 и молекула gRNA доставляются с помощью разных способов или, как их в некоторых случаях называют в данном документе, отличающихся способов. Разные или отличающиеся способы, используемые в данном документе, относятся к способам доставки, посредством которых рассматриваемым молекуле-компоненту, например, молекуле Cas9, молекуле gRNA, нуклеиновой кислоте, представляющей собой матрицу, или полезной нагрузке придаются различные фармакодинамические или фармакокинетические свойства. Например, способы доставки могут обеспечивать разное распределение в ткани, разный период полужизни или разное распределение во времени, например, в выбранных компартменте, ткани или органе.
Некоторые способы доставки, например, доставка с помощью вектора на основе нуклеиновой кислоты, который сохраняется в клетке или в потомстве клетки, например, с помощью автономной репликации или вставки в нуклеиновую кислоту клетки, приводят к более устойчивой экспрессии и присутствию компонента. Примеры включают опосредованную вирусом доставку, например, аденоассоциированным вирусом или лентивирусом.
В качестве примера компоненты, например молекула Cas9 и молекула gRNA, могут быть доставлены с помощью способов, которые отличаются с позиции обеспечения конечного периода полужизни или сохранения доставленного компонента в организме или в конкретном компартменте, ткани или органе. В одном варианте осуществления молекула gRNA может быть доставлена с помощью таких способов. Компонент, представляющий собой молекулу Cas9, может быть доставлен с помощью способа, который приводит к меньшему сохранению или меньшему воздействию их в организме или конкретных компартменте, или ткани, или органе.
В более общем смысле в одном варианте осуществления первый способ доставки применяют для доставки первого компонента, а второй способ доставки применяют для доставки второго компонента. Первый способ доставки придает первое фармакодинамическое или фармакокинетическое свойство. Первое фармакодинамическое свойство может представлять собой, например, распределение, сохранение компонента или нуклеиновой кислоты, которая кодирует компонент, в организме, компартменте, ткани или органе, или их воздействие. Второй способ доставки придает второе фармакодинамическое или фармакокинетическое свойство. Второе фармакодинамическое свойство может представлять собой, например, распределение, сохранение компонента или нуклеиновой кислоты, которая кодирует компонент, в организме, компартменте, ткани или органе, или их воздействие.
В одном варианте осуществления первое фармакодинамическое или фармакокинетическое свойство, например, распределение, сохранение или воздействие, более ограничено, чем второе фармакодинамическое или фармакокинетическое свойство.
В одном варианте осуществления первый способ доставки выбран для оптимизации, например сведения к минимуму, фармакодинамического или фармакокинетического свойства, например, распределения, сохранения или воздействия.
В одном варианте осуществления второй способ доставки выбран для оптимизации, например повышения до максимума, фармакодинамического или фармакокинетического свойства, например, распределения, сохранения или воздействия.
В одном варианте осуществления первый способ доставки предусматривает применение относительно устойчивого элемента, например, нуклеиновой кислоты, например, плазмиды или вирусного вектора, например, AAV или лентивируса. Поскольку такие векторы являются относительно устойчивыми, то продукт, транскрибированный из них, будет относительно устойчивым.
В одном варианте осуществления второй способ доставки предусматривает относительно временный элемент, например, РНК или белок.
В одном варианте осуществления первый компонент предусматривает gRNA, и способ доставки обеспечивает относительную устойчивость, например, gRNA транскрибируется из плазмиды или вирусного вектора, например, AAV или лентивируса. Транскрипция этих генов будет иметь незначительные физиологические последствия, поскольку гены не кодируют белковый продукт, а gRNA не способны действовать изолированно. Второй компонент, молекула Cas9, доставляется временным образом, например в виде mRNA или в виде белка, с обеспечением присутствия и активности полного комплекса молекула Cas9/молекула gRNA лишь в течение короткого периода времени.
Кроме того, компоненты могут быть доставлены в различных молекулярных формах или с помощью различных векторов для доставки, которые дополняют друг друга для повышения безопасности и специфичности в отношении тканей.
Применение отличающихся способов доставки может повышать активность, безопасность и эффективность. Например, может быть снижена вероятность потенциальной нецелевой модификации. Доставка иммуногенных компонентов, например молекул Cas9, с помощью способов, обеспечивающих меньшую устойчивость, может снижать иммуногенность, поскольку пептиды фермента Cas бактериального происхождения презентируются на поверхности клетки молекулами MHC. Двухкомпонентная система доставки может нивелировать данные недостатки.
Отличающиеся способы доставки можно применять для доставки компонентов в разные, но перекрывающиеся целевые участки. Образование активного комплекса сводится к минимуму за пределами перекрытия целевых участков. Таким образом, в одном варианте осуществления первый компонент, например молекула gRNA, доставляется с помощью первого способа доставки, который приводит к первому пространственному распределению, например, в ткани. Второй компонент, например, молекула Cas9, доставляется с помощью второго способа доставки, который приводит ко второму пространственному распределению, например, в ткани. В одном варианте осуществления первый способ предусматривает первый элемент, выбранный из липосомы, наночастицы, например полимерной наночастицы, и нуклеиновой кислоты, например, вирусного вектора. Второй способ предусматривает второй элемент, выбранный из группы. В одном варианте осуществления первый способ доставки предусматривает первый нацеливающий элемент, например, специфичные в отношении клетки рецептор или антитело, а второй способ доставки не включает данный элемент. В одном варианте осуществления второй способ доставки предусматривает второй нацеливающий элемент, например, второй специфичный в отношении клетки рецептор или второе антитело.
Если молекула Cas9 доставляется в вирусном векторе для доставки, липосоме или полимерной наночастице, то существует возможность доставки в несколько тканей и проявления терапевтической активности в них, тогда как целесообразным может быть нацеливание лишь на одну ткань. Двухкомпонентная система доставки может решить данную проблему и повысить специфичность в отношении ткани. Если молекула gRNA и молекула Cas9 упакованы в отдельных носителях для доставки с разным, но перекрывающимся тропизмом к ткани, тогда полностью функциональный комплекс образуется только в ткани, на которую целенаправленно воздействуют оба вектора.
Кандидатные молекулы Cas, например, молекулы Cas9, кандидатные молекулы gRNA, кандидатные комплексы молекула Cas9/молекула gRNA и кандидатные системы CRISPR можно оценивать с помощью способов, известных из уровня техники или описанных в данном документе. Например, иллюстративные способы оценки эндонуклеазной активности молекулы Cas9 описаны, например, в Jinek el al., SCIENCE 2012; 337(6096):8 16-821.
Дополнительные аспекты описаны в пронумерованных вариантах осуществления ниже.
Варианты осуществления
1. Молекула gRNA, содержащая tracr и crRNA, где crRNA содержит нацеливающий домен, который
a) является комплементарным целевой последовательности неделеционного участка HFPH (например, неделеционного участка HPFH человека);
b) является комплементарным целевой последовательности в пределах геномной последовательности нуклеиновой кислоты от Chr11:5249833 до Chr11:5250237, - нить, hg38;
c) является комплементарным целевой последовательности в пределах геномной последовательности нуклеиновой кислоты от Chr11:5254738 до Chr11:5255164, - нить, hg38;
d) является комплементарным целевой последовательности в пределах геномной последовательности нуклеиновой кислоты в Chr11:5250094-5250237, - нить, hg38;
e) является комплементарным целевой последовательности в пределах геномной последовательности нуклеиновой кислоты в Chr11:5255022-5255164, - нить, hg38;
f) является комплементарным целевой последовательности в пределах геномной последовательности нуклеиновой кислоты в Chr11: 5249833-5249927, - нить, hg38;
g) является комплементарным целевой последовательности в пределах геномной последовательности нуклеиновой кислоты в Chr11: 5254738-5254851, - нить, hg38;
h) является комплементарным целевой последовательности в пределах геномной последовательности нуклеиновой кислоты в Chr11:5250139-5250237, - нить, hg38 или
i) их комбинации.
2. Молекула gRNA согласно варианту осуществления 1, где нацеливающий домен содержит, например, состоит из, любую из SEQ ID NO: 1 - SEQ ID NO: 72 или их фрагмент.
3. Молекула gRNA согласно варианту осуществления 2, где нацеливающий домен содержит, например, состоит из, любую из SEQ ID NO: 1, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 28, SEQ ID NO: 34, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 58, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 67, или их фрагмент.
4. Молекула gRNA согласно варианту осуществления 2, где нацеливающий домен содержит, например, состоит из, любую из
a) SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 28, SEQ ID NO: 34, SEQ ID NO: 48, SEQ ID NO: 51, SEQ ID NO: 67, или их фрагмент; или
b) SEQ ID NO: 1, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 54, или их фрагмент.
5. Молекула gRNA согласно любому из вариантов осуществления 2-4, где нацеливающий домен содержит, например, состоит из 17, 18, 19 или 20 последовательных нуклеиновых кислот из любой из указанных последовательностей нацеливающего домена.
6. Молекула gRNA согласно варианту осуществления 5, где 17, 18, 19 или 20 последовательных нуклеиновых кислот из любой из указанных последовательностей нацеливающего домена представляют собой 17, 18, 19 или 20 последовательных нуклеиновых кислот, расположенных на 3'-конце указанной последовательности нацеливающего домена.
7. Молекула gRNA согласно варианту осуществления 5, где 17, 18, 19 или 20 последовательных нуклеиновых кислот из любой из указанных последовательностей нацеливающего домена представляют собой 17, 18, 19 или 20 последовательных нуклеиновых кислот, расположенных на 5'-конце указанной последовательности нацеливающего домена.
8. Молекула gRNA согласно варианту осуществления 5, где 17, 18, 19 или 20 последовательных нуклеиновых кислот из любой из указанных последовательностей нацеливающего домена не содержат нуклеиновую кислоту, расположенную на 5'- или 3'-конце указанной последовательности нацеливающего домена.
9. Молекула gRNA согласно любому из вариантов осуществления 2-8, где нацеливающий домен состоит из указанной последовательности нацеливающего домена.
10. Молекула gRNA согласно любому из предыдущих вариантов осуществления, где часть crRNA и часть tracr гибридизуются с образованием "флагштока", содержащего SEQ ID NO: 182 или 183.
11. Молекула gRNA согласно варианту осуществления 10, где "флагшток" дополнительно содержит первое удлинение "флагштока", расположенное в 3'-направлении по отношению к части crRNA "флагштока", где указанное первое удлинение "флагштока" содержит SEQ ID NO: 184.
12. Молекула gRNA согласно варианту осуществления 10 или 11, где "флагшток" дополнительно содержит второе удлинение "флагштока", расположенное в 3'-направлении по отношению к части crRNA "флагштока", и в случае присутствия первое удлинение "флагштока", где указанное второе удлинение "флагштока" содержит SEQ ID NO: 185.
13. Молекула gRNA согласно любому из вариантов осуществления 1-12, где tracr содержит SEQ ID NO: 224 или SEQ ID NO: 225.
14. Молекула gRNA согласно любому из вариантов осуществления 1-13, где tracr содержит SEQ ID NO: 232, необязательно дополнительно содержащую на 3'-конце дополнительные 1, 2, 3, 4, 5, 6 или 7 урациловых (U) нуклеотидов.
15. Молекула gRNA согласно любому из вариантов осуществления 1-14, где crRNA содержит в 5'-3'-направлении [нацеливающий домен]-:
a) SEQ ID NO: 182;
b) SEQ ID NO: 183;
c) SEQ ID NO: 199;
d) SEQ ID NO: 200;
e) SEQ ID NO: 201;
f) SEQ ID NO: 202; или
g) SEQ ID NO: 226.
16. Молекула gRNA согласно любому из вариантов осуществления 1-9 или 15, где tracr содержит в 5'-3'-направлении:
a) SEQ ID NO: 187;
b) SEQ ID NO: 188;
c) SEQ ID NO: 203;
d) SEQ ID NO: 204;
e) SEQ ID NO: 224;
f) SEQ ID NO: 225;
g) SEQ ID NO: 232;
h) SEQ ID NO: 227;
i) (SEQ ID NO: 228;
j) SEQ ID NO: 229;
k) любую из a) - j), указанных выше, дополнительно содержащих на 3'-конце по меньшей мере 1, 2, 3, 4, 5, 6 или 7 урациловых (U) нуклеотидов, например, 1, 2, 3, 4, 5, 6 или 7 урациловых (U) нуклеотидов;
l) любую из a) - k), указанных выше, дополнительно содержащих на 3'-конце по меньшей мере 1, 2, 3, 4, 5, 6 или 7 адениновых (A) нуклеотидов, например, 1, 2, 3, 4, 5, 6 или 7 адениновых (A) нуклеотидов; или
m) любую из a) - l), указанных выше, дополнительно содержащих на 5'-конце (например, на 5'-конце) по меньшей мере 1, 2, 3, 4, 5, 6 или 7 адениновых (A) нуклеотидов, например, 1, 2, 3, 4, 5, 6 или 7 адениновых (A) нуклеотидов.
17. Молекула gRNA согласно любому из вариантов осуществления 1-9, где нацеливающий домен и tracr расположены на отдельных молекулах нуклеиновой кислоты, и где молекула нуклеиновой кислоты, содержащая нацеливающий домен, содержит SEQ ID NO: 201, необязательно расположенную непосредственно в 3'-направлении по отношению к нацеливающему домену, и молекула нуклеиновой кислоты, содержащая tracr, содержит, например, состоит из, SEQ ID NO: 224.
18. Молекула gRNA согласно любому из вариантов осуществления 13-14, где часть crRNA "флагштока" содержит SEQ ID NO: 201 или SEQ ID NO: 202.
19. Молекула gRNA согласно любому из вариантов осуществления 1-12, где tracr содержит SEQ ID NO: 187 или 188, и необязательно в случае присутствия первого удлинения "флагштока" первое удлинение tracr, расположенное в 5'-направлении по отношению к SEQ ID NO: 187 или 188, при этом указанное первое удлинение tracr содержит SEQ ID NO: 189.
20. Молекула gRNA согласно любому из вариантов осуществления 1-19, где нацеливающий домен и tracr расположены на отдельных молекулах нуклеиновой кислоты.
21. Молекула gRNA согласно любому из вариантов осуществления 1-19, где нацеливающий домен и tracr расположены на одной молекуле нуклеиновой кислоты, и при этом tracr расположена в 3'-направлении по отношению к нацеливающему домену.
22. Молекула gRNA согласно варианту осуществления 21, дополнительно содержащая петлю, расположенную в 3'-направлении по отношению к нацеливающему домену и в 5'-направлении по отношению к tracr.
23. Молекула gRNA согласно варианту осуществления 22, где петля содержит SEQ ID NO: 186.
24. Молекула gRNA согласно любому из вариантов осуществления 1-9, содержащая в 5'-3'-направлении [нацеливающий домен]-:
(a) SEQ ID NO: 195;
(b) SEQ ID NO: 196;
(c) SEQ ID NO: 197;
(d) SEQ ID NO: 198;
(e) SEQ ID NO: 231; или
(f) любую из (a) - (e), указанных выше, дополнительно содержащих на 3'-конце 1, 2, 3, 4, 5, 6 или 7 урациловых (U) нуклеотидов.
25. Молекула gRNA согласно любому из вариантов осуществления 1-9 или 21-24, где нацеливающий домен и tracr расположены на одной молекуле нуклеиновой кислоты, и при этом указанная молекула нуклеиновой кислоты содержит, например, состоит из, указанный нацеливающий домен и SEQ ID NO: 231, необязательно расположенные непосредственно в 3'-направлении по отношению к указанному нацеливающему домену.
26. Молекула gRNA согласно любому из вариантов осуществления 1-25, где одна или необязательно более одной из молекул нуклеиновой кислоты, содержащих молекулу gRNA, содержат
a) одну или несколько, например, три фосфотиоатные модификации на 3'-конце указанных молекулы или молекул нуклеиновой кислоты;
b) одну или несколько, например, три фосфотиоатные модификации на 5'-конце указанных молекулы или молекул нуклеиновой кислоты;
c) одну или несколько, например, три 2'-O-метиловые модификации на 3'-конце указанных молекулы или молекул нуклеиновой кислоты;
d) одну или несколько, например, три 2'-O-метиловые модификации на 5'-конце указанных молекулы или молекул нуклеиновой кислоты;
e) 2'-O-метиловую модификацию в каждом из 4-го по отношению к концевому, 3-го по отношению к концевому и 2-го по отношению к концевому 3'-остаткам указанных молекулы или молекул нуклеиновой кислоты;
f) 2'-O-метиловую модификацию в каждом из 4-го по отношению к концевому, 3-го по отношению к концевому и 2-го по отношению к концевому 5'-остаткам указанных молекулы или молекул нуклеиновой кислоты или
f) любую их комбинацию.
27. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 74;
(b) SEQ ID NO: 75; или
(c) SEQ ID NO: 76.
28. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 77, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 77, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 78, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 78, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
29. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 79;
(b) SEQ ID NO: 80; или
(c) SEQ ID NO: 81.
30. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 82, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 82, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 83, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 83, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
31. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 84;
(b) SEQ ID NO: 85; или
(c) SEQ ID NO: 86.
32. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 87, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 87, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 88, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 88, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
33. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 89;
(b) SEQ ID NO: 90; или
(c) SEQ ID NO: 91.
34. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 92, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 92, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 93, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 93, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
35. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 94;
(b) SEQ ID NO: 95; или
(c) SEQ ID NO: 96.
36. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 97, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 97, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 98, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 98, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
37. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 99;
(b) SEQ ID NO: 100; или
(c) SEQ ID NO: 101.
38. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 102, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 102, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 103, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 103, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
39. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 104;
(b) SEQ ID NO: 105; или
(c) SEQ ID NO:106.
40. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 107, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 107, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 108, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 108, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
41. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 109;
(b) SEQ ID NO: 110; или
(c) SEQ ID NO: 111.
42. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 112, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 112, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 113, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 113, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
43. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 114;
(b) SEQ ID NO: 115; или
(c) SEQ ID NO:116.
44. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 117, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 117, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 118, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 118, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
45. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 119;
(b) SEQ ID NO: 120; или
(c) SEQ ID NO: 121.
46. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 122, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 122, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 123, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 123, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
47. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 124;
(b) SEQ ID NO: 125; или
(c) SEQ ID NO:126.
48. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 127, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 127, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 128, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 128, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
49. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 129;
(b) SEQ ID NO: 130; или
(c) SEQ ID NO: 131.
50. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 132, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 132, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 133, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 133, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
51. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 134;
(b) SEQ ID NO: 135; или
(c) SEQ ID NO:136.
52. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 137, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 137, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 138, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 138, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
53. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 139;
(b) SEQ ID NO: 140; или
(c) SEQ ID NO: 141.
54. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 142, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 142, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 143, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 143, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
55. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 144;
(b) SEQ ID NO: 145; или
(c) SEQ ID NO:146.
56. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 147, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 147, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 148, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 148, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
57. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 149;
(b) SEQ ID NO: 150; или
(c) SEQ ID NO: 151.
58. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 152, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 152, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 153, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 153, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
59. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 154;
(b) SEQ ID NO: 155; или
(c) SEQ ID NO:156.
60. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 157, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 157, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 158, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 158, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
61. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 159;
(b) SEQ ID NO: 160; или
(c) SEQ ID NO: 161.
62. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 162, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 162, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 163, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 163, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
63. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 164;
(b) SEQ ID NO: 165; или
(c) SEQ ID NO:166.
64. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 167, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 167, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 168, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 168, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
65. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 169;
(b) SEQ ID NO: 170; или
(c) SEQ ID NO: 171.
66. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 172, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 172, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 173, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 173, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
67. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из, последовательность:
(a) SEQ ID NO: 174;
(b) SEQ ID NO: 175; или
(c) SEQ ID NO:176.
68. Молекула gRNA согласно варианту осуществления 1, содержащая, например, состоящая из,
(a) crRNA, содержащей, например, состоящей из, SEQ ID NO: 177, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224;
(b) crRNA, содержащей, например, состоящей из, SEQ ID NO: 177, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73;
(c) crRNA, содержащей, например, состоящей из, SEQ ID NO: 178, и tracr, содержащей, например, состоящей из, SEQ ID NO: 224; или
(d) crRNA, содержащей, например, состоящей из, SEQ ID NO: 178, и tracr, содержащей, например, состоящей из, SEQ ID NO: 73.
69. Молекула gRNA согласно любому из вариантов осуществления 1-68, где
a) если система CRISPR (например, описанный в данном документе RNP), содержащая молекулу gRNA, вводится в клетку, то вставка/делеция образуется в целевой последовательности, комплементарной нацеливающему домену молекулы gRNA, или рядом с целевой последовательностью; и/или
b) если система CRISPR (например, описанный в данном документе RNP), содержащая молекулу gRNA, вводится в клетку, то создается делеция, охватывающая последовательность, например, охватывающая по сути всю последовательность, между последовательностью, комплементарной нацеливающему домену gRNA (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG1, и последовательностью, комплементарной нацеливающему домену gRNA (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG2.
70. Молекула gRNA согласно варианту осуществления 69, где вставка/делеция не охватывает нуклеотид, расположенный между 5250092 и 5249833, - нить (hg38), где необязательно вставка/делеция не охватывает нуклеотид неделеционного HPFH или сайта связывания фактора транскрипции.
71. Молекула gRNA согласно любому из вариантов осуществления 1-70, где если система CRISPR (например, описанный в данном документе RNP), содержащая молекулу gRNA, вводится в популяцию клеток, то вставка/делеция образуется в целевой последовательности, комплементарной нацеливающему домену молекулы gRNA, или рядом с целевой последовательностью, в по меньшей мере приблизительно 15%, например, по меньшей мере приблизительно 17%, например, по меньшей мере приблизительно 20%, например, по меньшей мере приблизительно 30%, например, по меньшей мере приблизительно 40%, например, по меньшей мере приблизительно 50%, например, по меньшей мере приблизительно 55%, например, по меньшей мере приблизительно 60%, например, по меньшей мере приблизительно 70%, например, по меньшей мере приблизительно 75%, например, по меньшей мере приблизительно 80%, например, по меньшей мере приблизительно 85%, например, по меньшей мере приблизительно 90%, например, по меньшей мере приблизительно 95% клеток популяции.
72. Молекула gRNA согласно любому из вариантов осуществления 69-71, где вставка/делеция охватывает по меньшей мере один нуклеотид промоторного участка HBG1 или по меньшей мере один нуклеотид промоторного участка HBG2.
73. Молекула gRNA согласно любому из вариантов осуществления 71-72, где по меньшей мере приблизительно 15% клеток популяции содержат вставку/делецию, которая охватывает по меньшей мере один нуклеотид промоторного участка HBG1, и вставку/делецию, которая охватывает по меньшей мере один нуклеотид промоторного участка HBG2.
74. Молекула gRNA согласно варианту осуществления 71-73, где процентная доля клеток в популяции, которые содержат вставку/делецию, которая охватывает по меньшей мере один нуклеотид промоторного участка HBG1, отличается от процентной доли клеток в популяции, которые содержат вставку/делецию, которая охватывает по меньшей мере один нуклеотид промоторного участка HBG2, на по меньшей мере приблизительно 5%, например, по меньшей мере приблизительно 10%, например, по меньшей мере приблизительно 20%, например, по меньшей мере приблизительно 30%.
75. Молекула gRNA согласно любому из вариантов осуществления 69-74, где вставку/делецию определяют с помощью секвенирования нового поколения (NGS).
76. Молекула gRNA согласно любому из вариантов осуществления 1-75, где если система CRISPR (например, описанный в данном документе RNP), содержащая молекулу gRNA, вводится в клетку, то экспрессия фетального гемоглобина повышается в указанной клетке или ее потомстве, например, в ее эритроидном потомстве, например, в ее потомстве, представляющем собой красную кровяную клетку.
77. Молекула gRNA согласно варианту осуществления 76, где если система CRISPR (например, описанный в данном документе RNP), содержащая молекулу gRNA, вводится в популяцию клеток, то процентное содержание F-клеток в указанной популяции или популяции их потомства, например, их эритроидном потомстве, например, в их потомстве, представляющем собой красную кровяную клетку, повышается на по меньшей мере приблизительно 15%, например, по меньшей мере приблизительно 17%, например, по меньшей мере приблизительно 20%, например, по меньшей мере приблизительно 25%, например, по меньшей мере приблизительно 30%, например, по меньшей мере приблизительно 35%, например, по меньшей мере приблизительно 40% по сравнению с процентным содержанием F-клеток в популяции клеток, в которые молекулу gRNA не вводили, или в популяции их потомства, например, их эритроидного потомства, например, их потомства, представляющего собой красные кровяные клетки.
78. Молекула gRNA согласно любому из вариантов осуществления 76, где указанная клетка или ее потомство, например, ее эритроидное потомство, например, ее потомство, представляющее собой красные кровяные клетки, продуцируют по меньшей мере приблизительно 6 пикограмм (например, по меньшей мере приблизительно 7 пикограмм, по меньшей мере приблизительно 8 пикограмм, по меньшей мере приблизительно 9 пикограмм, по меньшей мере приблизительно 10 пикограмм или от приблизительно 8 до приблизительно 9 пикограмм, или от приблизительно 9 до приблизительно 10 пикограмм) фетального гемоглобина на клетку.
79. Молекула gRNA согласно любому из вариантов осуществления 1-78, где если система CRISPR (например, описанный в данном документе RNP), содержащая молекулу gRNA, вводится в клетку, то нецелевые вставки/делеции не образуются в указанной клетке, например, нецелевые вставки/делеции не образуются за пределами промоторных участков HBG1 и/или HBG2, что, например, можно выявить с помощью секвенирования нового поколения и/или анализа с помощью вставки нуклеотида.
80. Молекула gRNA согласно любому из вариантов осуществления 1-78, где если система CRISPR (например, описанный в данном документе RNP), содержащая молекулу gRNA, вводится в популяцию клеток, то нецелевая вставка/делеция, например, нецелевая вставка/делеция за пределами промоторных участков HBG1 и/или HBG2, выявляется в более приблизительно 5%, например, более приблизительно 1%, например, более приблизительно 0,1%, например, более приблизительно 0,01% клеток, относящихся к популяции клеток, что, например, можно выявить с помощью секвенирования нового поколения и/или анализа с помощью вставки нуклеотида.
81. Молекула gRNA согласно любому из вариантов осуществления 69-80, где клетка представляет собой (или популяция клеток содержит) клетку млекопитающего, примата или человека, например, представляет собой клетку человека.
82. Молекула gRNA согласно варианту осуществления 81, где клетка представляет собой (или популяция клеток содержит) HSPC.
83. Молекула gRNA согласно варианту осуществления 82, где HSPC является CD34+.
84. Молекула gRNA согласно варианту осуществления 83, где HSPC является CD34+CD90+.
85. Молекула gRNA согласно любому из вариантов осуществления 69-84, где клетка является аутологичной по отношению к пациенту, которому назначено введение указанной клетки.
86. Молекула gRNA согласно любому из вариантов осуществления 69-84, где клетка является аллогенной по отношению к пациенту, которому назначено введение указанной клетки.
87. Композиция, содержащая
1) одну или несколько молекул gRNA (в том числе первую молекулу gRNA) согласно любому из вариантов осуществления 1-86 и молекулу Cas9;
2) одну или несколько молекул gRNA (в том числе первую молекулу gRNA) согласно любому из вариантов осуществления 1-86 и нуклеиновую кислоту, кодирующую молекулу Cas9;
3) нуклеиновую кислоту, кодирующую одну или несколько молекул gRNA (в том числе первую молекулу gRNA) согласно любому из вариантов осуществления 1-86 и молекулу Cas9;
4) нуклеиновую кислоту, кодирующую одну или несколько молекул gRNA (в том числе первую молекулу gRNA) согласно любому из вариантов осуществления 1-86, и нуклеиновую кислоту, кодирующую молекулу Cas9; или
5) любую из указанных выше 1) - 4) и нуклеиновую кислоту, представляющую собой матрицу; или
6) любую из указанных выше 1) - 4) и нуклеиновую кислоту, содержащую последовательность, кодирующую нуклеиновую кислоту, представляющую собой матрицу.
88. Композиция, содержащая первую молекулу gRNA согласно любому из вариантов осуществления 1-86, необязательно дополнительно содержащую молекулу Cas9.
89. Композиция согласно варианту осуществления 87 или 88, где молекула Cas9 представляет собой активную или неактивную Cas9 из S. pyogenes.
90. Композиция согласно варианту осуществления 87-89, где молекула Cas9 содержит SEQ ID NO: 205.
91. Композиция согласно вариантам осуществления 87-89, где молекула Cas9 содержит, например, состоит из
(a) SEQ ID NO: 233;
(b) SEQ ID NO: 234;
(c) SEQ ID NO: 235;
(d) SEQ ID NO: 236;
(e) SEQ ID NO: 237;
(f) SEQ ID NO: 238;
(g) SEQ ID NO: 239;
(h) SEQ ID NO: 240;
(i) SEQ ID NO: 241;
(j) SEQ ID NO: 242;
(k) SEQ ID NO: 243; или
(l) SEQ ID NO: 244.
92. Композиция согласно любому из вариантов осуществления 88-91, где первая молекула gRNA и молекула Cas9 присутствуют в рибонуклеопротеиновом комплексе (RNP).
93. Композиция согласно любому из вариантов осуществления 87-92, дополнительно содержащая вторую молекулу gRNA; вторую молекулу gRNA и третью молекулу gRNA или вторую молекулу gRNA, необязательно третью молекулу gRNA и необязательно четвертую молекулу gRNA, где вторая молекула gRNA, необязательная третья молекула gRNA и необязательная четвертая молекула gRNA представляют собой молекулу gRNA согласно любому из вариантов осуществления 1-68, и где каждая молекула gRNA в композиции является комплементарной отличающейся целевой последовательности.
94. Композиция согласно варианту осуществления 93, где две или более из первой молекулы gRNA, второй молекулы gRNA, необязательной третьей молекулы gRNA и необязательной четвертой молекулы gRNA являются комплементарными целевым последовательностям в пределах одного гена или участка.
95. Композиция согласно варианту осуществления 93 или 94, где первая молекула gRNA, вторая молекула gRNA, необязательная третья молекула gRNA и необязательная четвертая молекула gRNA являются комплементарными целевым последовательностям в не более чем 6000 нуклеотидов, не более чем 5000 нуклеотидов, не более чем 500, не более чем 400 нуклеотидов, не более чем 300, не более чем 200 нуклеотидов, не более чем 100 нуклеотидов, не более чем 90 нуклеотидов, не более чем 80 нуклеотидов, не более чем 70 нуклеотидов, не более чем 60 нуклеотидов, не более чем 50 нуклеотидов, не более чем 40 нуклеотидов, не более чем 30 нуклеотидов, не более чем 20 нуклеотидов или не более чем 10 нуклеотидов.
96. Композиция согласно варианту осуществления 93, где две или более из первой молекулы gRNA, второй молекулы gRNA, необязательной третьей молекулы gRNA и необязательной четвертой молекулы gRNA содержат по меньшей мере одну молекулу gRNA, которая содержит нацеливающий домен, комплементарный целевой последовательности промоторного участка HBG1, и по меньшей мере одну молекулу gRNA, которая содержит нацеливающий домен, комплементарный целевой последовательности промоторного участка HBG2.
97. Композиция согласно любому из вариантов осуществления 94-95, содержащая первую молекулу gRNA и вторую молекулу gRNA, где первая молекула gRNA и вторая молекула gRNA являются
(a) независимо выбранными из молекул gRNA согласно варианту осуществления 1 и являются комплементарными разным целевым последовательностям;
(b) независимо выбранными из молекул gRNA согласно варианту осуществления 2 и являются комплементарными разным целевым последовательностям;
c) независимо выбранными из молекул gRNA согласно варианту осуществления 3 и являются комплементарными разным целевым последовательностям; или
(d) независимо выбранными из молекул gRNA согласно варианту осуществления 4 и являются комплементарными разным целевым последовательностям; или
(e) независимо выбранными из молекул gRNA согласно любому из вариантов осуществления 27-68 и являются комплементарными разным целевым последовательностям.
98. Композиция согласно любому из вариантов осуществления 94-96, содержащая первую молекулу gRNA и вторую молекулу gRNA, где
a) первая молекула gRNA является комплементарной целевой последовательности, содержащей по меньшей мере 1 нуклеотид (например, содержащей 20 последовательных нуклеотидов) в пределах:
i) Chr11:5249833 - Chr11:5250237 (hg38);
ii) Chr11:5250094-5250237 (hg38);
iii) Chr11: 5249833-5249927 (hg38) или
iv) Chr11:5250139-5250237 (hg38);
b) вторая молекула gRNA является комплементарной целевой последовательности, содержащей по меньшей мере 1 нуклеотид (например, содержащей 20 последовательных нуклеотидов) в пределах:
i) Chr11:5254738 - Chr11:5255164 (hg38);
ii) Chr11:5255022-5255164 (hg38) или
iii) Chr11: 5254738-5254851 (hg38).
99. Композиция согласно любому из вариантов осуществления 87-108, где что касается компонентов в композиции, представляющих собой молекулу gRNA, то данная композиция состоит из первой молекулы gRNA и второй молекулы gRNA.
100. Композиция согласно любому из вариантов осуществления 87-109, где каждая из указанных молекул gRNA находится в рибонуклеопротеиновом комплексе (RNP) с молекулой Cas9, описанной в данном документе, например, молекулой Cas9 согласно любому из вариантов осуществления 90 или 91.
101. Композиция согласно любому из вариантов осуществления 87-100, содержащая нуклеиновую кислоту, представляющую собой матрицу, где нуклеиновая кислота, представляющая собой матрицу, содержит нуклеотид, который соответствует нуклеотиду в целевой последовательности первой молекулы gRNA или рядом с ней.
102. Композиция согласно любому из вариантов осуществления 101, где нуклеиновая кислота, представляющая собой матрицу, предусматривает нуклеиновую кислоту, кодирующую:
(a) бета-глобин человека, например, бета-глобин человека, содержащий одну или несколько мутаций G16D, E22A и T87Q, или его фрагмент; или
(b) гамма-глобин человека или его фрагмент.
103. Композиция согласно любому из вариантов осуществления 87-102, составленная в среде, подходящей для электропорации.
104. Композиция согласно любому из вариантов осуществления 87-103, где каждая из указанных молекул gRNA находится в RNP с молекулой Cas9, описанной в данном документе, и где каждый из указанного RNP находится в концентрации, составляющей менее приблизительно 10 мкМ, например, менее приблизительно 3 мкМ, например, менее приблизительно 1 мкМ, например, менее приблизительно 0,5 мкМ, например, менее приблизительно 0,3 мкМ, например, менее приблизительно 0,1 мкМ, где необязательно концентрация указанного RNP составляет приблизительно 2 мкМ или составляет приблизительно 1 мкМ, где необязательно композиция дополнительно содержит популяцию клеток, например, HSPC.
105. Последовательность нуклеиновой кислоты, которая кодирует одну или несколько молекул gRNA согласно любому из вариантов осуществления 1-68.
106. Последовательность нуклеиновой кислоты согласно варианту осуществления 105, где нуклеиновая кислота содержит промотор, функционально связанный с последовательностью, которая кодирует одну или несколько молекул gRNA.
107. Последовательность нуклеиновой кислоты согласно варианту осуществления 106, где промотор представляет собой промотор, распознаваемый РНК-полимеразой II или РНК-полимеразой III.
108. Последовательность нуклеиновой кислоты согласно варианту осуществления 107, где промотор представляет собой промотор U6 или промотор HI.
109. Последовательность нуклеиновой кислоты согласно любому из вариантов осуществления 105-108, где нуклеиновая кислота дополнительно кодирует молекулу Cas9.
110. Последовательность нуклеиновой кислоты согласно варианту осуществления 109, где молекула Cas9 содержит любую из SEQ ID NO: 205, SEQ ID NO: 233, SEQ ID NO: 234, SEQ ID NO: 235, SEQ ID NO: 236, SEQ ID NO: 237, SEQ ID NO: 238, SEQ ID NO: 239, SEQ ID NO: 240, SEQ ID NO: 241, SEQ ID NO: 242, SEQ ID NO: 243 или SEQ ID NO: 244.
111. Последовательность нуклеиновой кислоты согласно любому из вариантов осуществления 109-110, где указанная нуклеиновая кислота содержит промотор, функционально связанный с последовательностью, которая кодирует молекулу Cas9.
112. Последовательность нуклеиновой кислоты согласно варианту осуществления 111, где промотор представляет собой промотор EF-1, промотор гена IE CMV, промотор EF-1α, промотор убиквитина C или промотор фосфоглицераткиназы (PGK).
113. Вектор, содержащий нуклеиновую кислоту согласно любому из вариантов осуществления 105-112.
114. Вектор согласно варианту осуществления 113, где вектор выбран из группы, состоящей из лентивирусного вектора, аденовирусного вектора, вектора на основе аденоассоциированного вируса (AAV), вектора на основе вируса простого герпеса (HSV), плазмиды, миникольца, наноплазмиды и РНК-вектора.
115. Способ изменения клетки (например, популяции клеток), (например, изменения структуры (например, последовательности) нуклеиновой кислоты) в целевой последовательности или рядом с ней в пределах указанной клетки, предусматривающий приведение в контакт (например, введение в указанную клетку) указанной клетки (например, популяции клеток) с
1) одной или несколькими молекулами gRNA согласно любому из вариантов осуществления 1-68 и молекулой Cas9;
2) одной или несколькими молекулами gRNA согласно любому из вариантов осуществления 1-68 и нуклеиновой кислотой, кодирующей молекулу Cas9;
3) нуклеиновой кислотой, кодирующей одну или несколько молекул gRNA согласно любому из вариантов осуществления 1-68, и молекулой Cas9;
4) нуклеиновой кислотой, кодирующей одну или несколько молекул gRNA согласно любому из вариантов осуществления 1-68, и нуклеиновой кислотой, кодирующей молекулу Cas9;
5) любой из указанных выше 1) - 4) и нуклеиновой кислотой, представляющей собой матрицу;
6) любой из указанных выше 1) - 4) и нуклеиновой кислотой, содержащей последовательность, кодирующую нуклеиновую кислоту, представляющую собой матрицу;
7) композицией согласно любому из вариантов осуществления 87-104 или
8) вектором согласно любому из вариантов осуществления 113-114.
116. Способ согласно варианту осуществления 115, где молекула gRNA или нуклеиновая кислота, кодирующая молекулу gRNA, и Cas9 молекула или нуклеиновая кислота, кодирующая молекулу Cas9, составлены в одной композиции.
117. Способ согласно варианту осуществления 115, где молекула gRNA или нуклеиновая кислота, кодирующая молекулу gRNA, и Cas9 молекула или нуклеиновая кислота, кодирующая молекулу Cas9, составлены в более чем одной композиции.
118. Способ согласно варианту осуществления 117, где более одной композиции доставляют одновременно или последовательно.
119. Способ согласно любому из вариантов осуществления 115-118, где клетка представляет собой клетку животного.
120. Способ согласно любому из вариантов осуществления 115-118, где клетка представляет собой клетку млекопитающего, примата или человека.
121. Способ согласно варианту осуществления 120, где клетка представляет собой гематопоэтическую стволовую клетку или клетку-предшественника (HSPC) (например, популяцию HSPC).
122. Способ согласно любому из вариантов осуществления 115-121, где клетка представляет собой CD34+ клетку.
123. Способ согласно любому из вариантов осуществления 115-122, где клетка представляет CD34+CD90+ клетку.
124. Способ согласно любому из вариантов осуществления 115-123, где клетка находится в композиции, содержащей популяцию клеток, которая была обогащена CD34+ клетками.
125. Способ согласно любому из вариантов осуществления 115-124, где клетка (например, популяция клеток) была выделена из костного мозга, мобилизованной периферической крови или пуповинной крови.
126. Способ согласно любому из вариантов осуществления 115-125, где клетка является аутологичной или аллогенной по отношению к пациенту, которому назначено введение указанной клетки, где необязательно пациент представляет собой пациента с гемоглобинопатией, где необязательно у пациента имеется серповидноклеточное заболевание или талассемия, необязательно бета-талассемия.
127. Способ согласно любому из вариантов осуществления 115-126, где
a) изменение дает в результате вставку/делецию в последовательности геномной ДНК, комплементарной нацеливающему домену одной или нескольких молекул gRNA, или рядом с этой последовательностью; и/или
b) изменение дает в результате делецию, охватывающую последовательность, например, по сути всю последовательность, между последовательностью, комплементарной нацеливающему домену одной или нескольких молекул gRNA (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG1, и последовательностью, комплементарной нацеливающему домену одной или нескольких молекул gRNA (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG2, где необязательно делеция не охватывает нуклеотид, расположенный между 5250092 и 5249833, - нить (hg38).
128. Способ согласно варианту осуществления 127, где вставка/делеция представляет собой вставку или делецию менее приблизительно 40 нуклеотидов, например, менее 30 нуклеотидов, например, менее 20 нуклеотидов, например, менее 10 нуклеотидов.
129. Способ согласно варианту осуществления 128, где вставка/делеция представляет собой делецию одного нуклеотида.
130. Способ согласно любому из вариантов осуществления 127-129, где способ дает в результате популяцию клеток, где по меньшей мере приблизительно 15%, например, по меньшей мере приблизительно 17%, например, по меньшей мере приблизительно 20%, например, по меньшей мере приблизительно 30%, например, по меньшей мере приблизительно 40%, например, по меньшей мере приблизительно 50%, например, по меньшей мере приблизительно 55%, например, по меньшей мере приблизительно 60%, например, по меньшей мере приблизительно 70%, например, по меньшей мере приблизительно 75%, например, по меньшей мере приблизительно 80%, например, по меньшей мере приблизительно 85%, например, по меньшей мере приблизительно 90%, например, по меньшей мере приблизительно 95% популяции были изменены, например, содержат вставку/делецию, где необязательно вставка/делеция выбрана из вставки/делеции, указанной в таблице 2-7, где необязательно клетки популяции не содержат делеции нуклеотида, расположенного между 5250092 и 5249833, - нить (hg38).
131. Способ по любому из вариантов осуществления 115-130, где изменение дает в результате клетку (например, популяцию клеток), которая способна к дифференцировке в дифференцированную клетку эритроидного ростка (например, красную кровяную клетку), и где указанная дифференцированная клетка характеризуется повышенным уровнем фетального гемоглобина, например, по сравнению с неизмененной клеткой (например, популяцией клеток).
132. Способ согласно любому из вариантов осуществления 115-131, где изменение дает в результате популяцию клеток, которая способна к дифференцировке в популяцию дифференцированных клеток, например, популяцию клеток эритроидного ростка (например, популяцию красных кровяных клеток), и где указанная популяция дифференцированных клеток характеризуется повышенным процентным содержанием F-клеток (например, процентным содержанием F-клеток, которое повышено на по меньшей мере приблизительно 15%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 30% или по меньшей мере приблизительно 40%), например, по сравнению с популяцией неизмененных клеток.
133. Способ согласно любому из вариантов осуществления 115-131, где изменение дает в результате клетку, которая способна к дифференцировке в дифференцированную клетку, например, клетку эритроидного ростка (например, красную кровяную клетку), и где указанная дифференцированная клетка продуцирует по меньшей мере приблизительно 6 пикограмм (например, по меньшей мере приблизительно 7 пикограмм, по меньшей мере приблизительно 8 пикограмм, по меньшей мере приблизительно 9 пикограмм, по меньшей мере приблизительно 10 пикограмм, или от приблизительно 8 до приблизительно 9 пикограмм, или от приблизительно 9 до приблизительно 10 пикограмм) фетального гемоглобина на клетку.
134. Клетка, измененная с помощью способа согласно любому из вариантов осуществления 115-133, или клетка, получаемая с помощью способа согласно любому из вариантов осуществления 115-133.
135. Клетка, содержащая вставку/делецию, описанную в таблице 7-2, где необязательно клетка не предусматривает делецию нуклеотида, расположенного между 5250092 и 5249833, - нить (hg38).
136. Клетка, содержащая первую молекулу gRNA согласно любому из вариантов осуществления 1-68, или композицию согласно любому из вариантов осуществления 87-104, нуклеиновую кислоту согласно любому из вариантов осуществления 105-112 или вектор согласно любому из вариантов осуществления 113-114.
137. Клетка согласно варианту осуществления 136, содержащая молекулу Cas9.
138. Клетка согласно варианту осуществления 137, где молекула Cas9 содержит любую из SEQ ID NO: 205, SEQ ID NO: 233, SEQ ID NO: 234, SEQ ID NO: 235, SEQ ID NO: 236, SEQ ID NO: 237, SEQ ID NO: 238, SEQ ID NO: 239, SEQ ID NO: 240, SEQ ID NO: 241, SEQ ID NO: 242, SEQ ID NO: 243 или SEQ ID NO: 244.
139. Клетка согласно любому из вариантов осуществления 134-138, где клетка содержит, содержала или будет содержать вторую молекулу gRNA согласно любому из вариантов осуществления 1-68 или нуклеиновую кислоту, кодирующую вторую молекулу gRNA согласно любому из вариантов осуществления 1-68, где первая молекула gRNA и вторая молекула gRNA содержат неидентичные нацеливающие домены.
140. Клетка согласно любому из вариантов осуществления 134-139, где экспрессия фетального гемоглобина является повышенной в указанной клетке или ее потомстве (например, ее эритроидном потомстве, например, ее потомстве, представляющем собой красную кровяную клетку) по сравнению с клеткой или ее потомством такого же типа клетки, которые не были модифицированы с тем, чтобы содержать молекулу gRNA.
141. Клетка согласно любому из вариантов осуществления 134-139, где клетка способна к дифференцировке в дифференцированную клетку, например, клетку эритроидного ростка (например, красную кровяную клетку), и где указанная дифференцированная клетка характеризуется повышенным уровнем фетального гемоглобина, например, по сравнению с клеткой такого же типа, которая не была модифицирована с тем, чтобы содержать молекулу gRNA.
142. Клетка согласно любому из вариантов осуществления 140-141, где дифференцированная клетка (например, клетка эритроидного ростка, например, красная кровяная клетка) продуцирует по меньшей мере приблизительно 6 пикограмм (например, по меньшей мере приблизительно 7 пикограмм, по меньшей мере приблизительно 8 пикограмм, по меньшей мере приблизительно 9 пикограмм, по меньшей мере приблизительно 10 пикограмм, или от приблизительно 8 до приблизительно 9 пикограмм, или от приблизительно 9 до приблизительно 10 пикограмм) фетального гемоглобина, например, по сравнению с дифференцированной клеткой такого же типа, которая не была модифицирована с тем, чтобы содержать молекулу gRNA.
143. Клетка согласно любому из вариантов осуществления 134-142, которую приводили в контакт с веществом, стимулирующим размножение стволовых клеток.
144. Клетка согласно варианту осуществления 143, где вещество, стимулирующее размножение стволовых клеток, представляет собой
a) (1r,4r)-N1-(2-бензил-7-(2-метил-2H-тетразол-5-ил)-9H-пиримидо[4,5-b]индол-4-ил)циклогексан-1,4-диамин;
b) метил-4-(3-пиперидин-1-илпропиламино)-9H-пиримидо[4,5-b]индол-7-карбоксилат;
c) 4-(2-(2-(бензо[b]тиофен-3-ил)-9-изопропил-9H-пурин-6-иламино)этил)фенол;
d) (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол или
e) их комбинации (например, комбинацию (1r,4r)-N1-(2-бензил-7-(2-метил-2H-тетразол-5-ил)-9H-пиримидо[4,5-b]индол-4-ил)циклогексан-1,4-диамина и (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ола).
145. Клетка согласно варианту осуществления 144, где вещество, стимулирующее размножение стволовых клеток, представляет собой (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол.
146. Клетка, например, клетка согласно любому из вариантов осуществления 134-145, содержащая
a) вставку/делецию в последовательности геномной ДНК, комплементарной нацеливающему домену молекулы gRNA согласно любому из вариантов осуществления 1-68, или рядом с этой последовательностью; и/или
b) делецию, охватывающую последовательность, например, по сути всю последовательность, между последовательностью, комплементарной нацеливающему домену молекулы gRNA согласно любому из вариантов осуществления 1-68 (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG1, и последовательностью, комплементарной нацеливающему домену молекулы gRNA согласно любому из вариантов осуществления 1-68 (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG2, где необязательно делеция не охватывает нуклеотид, расположенный между 5250092 и 5249833, - нить (hg38).
147. Клетка согласно варианту осуществления 146, где вставка/делеция представляет собой вставку или делецию менее приблизительно 40 нуклеотидов, например, менее 30 нуклеотидов, например, менее 20 нуклеотидов, например, менее 10 нуклеотидов.
148. Клетка согласно любому из вариантов осуществления 146-147, где вставка/делеция представляет собой делецию одного нуклеотида.
149. Клетка согласно любому из вариантов осуществления 134-148, где клетка представляет собой клетку животного.
150. Клетка согласно варианту осуществления 149, где клетка представляет собой клетку млекопитающего, примата или человека.
151. Клетка согласно любому из вариантов осуществления 134-150, где клетка представляет собой гематопоэтическую стволовую клетку или клетку-предшественника (HSPC) (например, популяцию HSPC).
152. Клетка согласно любому из вариантов осуществления 134-151, где клетка представляет собой CD34+ клетку.
153. Клетка согласно варианту осуществления 152, где клетка представляет собой CD34+CD90+ клетку.
154. Клетка согласно любому из вариантов осуществления 134-153, где клетка (например, популяция клеток) была выделена из костного мозга, мобилизованной периферической крови или пуповинной крови.
155. Клетка согласно любому из вариантов осуществления 134-154, где клетка является аутологичной по отношению к пациенту, которому назначено введение указанной клетки, где необязательно пациент представляет собой пациентов с гемоглобинопатией, где необязательно у пациента имеется серповидноклеточное заболевание или талассемия, необязательно бета-талассемия.
156. Клетка согласно любому из вариантов осуществления 134-154, где клетка является аллогенной по отношению к пациенту, которому назначено введение указанной клетки.
157. Популяция клеток, содержащая клетку согласно любому из вариантов осуществления 134-156.
158. Популяция клеток согласно варианту осуществления 157, где по меньшей мере приблизительно 50%, например, по меньшей мере приблизительно 60%, например, по меньшей мере приблизительно 70%, например, по меньшей мере приблизительно 80%, например, по меньшей мере приблизительно 90% (например, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99%) клеток популяции представляют собой клетку согласно любому из вариантов осуществления 134-156.
159. Популяция клеток согласно любому из вариантов осуществления 157-158, где популяция клеток способна к дифференцировке в популяцию дифференцированных клеток, например, популяцию клеток эритроидного ростка (например, популяцию красных кровяных клеток), и где указанная популяция дифференцированных клеток характеризуется повышенным процентным содержанием F-клеток (например, процентным содержанием F-клеток, которое повышено на по меньшей мере приблизительно 15%, по меньшей мере приблизительно 17%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 30% или по меньшей мере приблизительно 40%), например, по сравнению с популяцией немодифицированных клеток такого же типа.
160. Популяция клеток согласно варианту осуществления 159, где F-клетки популяции дифференцированных клеток продуцируют в среднем по меньшей мере приблизительно 6 пикограмм (например, по меньшей мере приблизительно 7 пикограмм, по меньшей мере приблизительно 8 пикограмм, по меньшей мере приблизительно 9 пикограмм, по меньшей мере приблизительно 10 пикограмм, или от приблизительно 8 до приблизительно 9 пикограмм, или от приблизительно 9 до приблизительно 10 пикограмм) фетального гемоглобина на клетку.
161. Популяция клеток согласно любому из вариантов осуществления 157-160, содержащая
1) по меньшей мере 1e6 CD34+ клеток/кг веса тела пациента, которому клетки назначены для введения;
2) по меньшей мере 2e6 CD34+ клеток/кг веса тела пациента, которому клетки назначены для введения;
3) по меньшей мере 3e6 CD34+ клеток/кг веса тела пациента, которому клетки назначены для введения;
4) по меньшей мере 4e6 CD34+ клеток/кг веса тела пациента, которому клетки назначены для введения; или
5) от 2e6 до 10e6 CD34+ клеток/кг веса тела пациента, которому клетки назначены для введения.
162. Популяция клеток согласно любому из вариантов осуществления 157-161, где по меньшей мере приблизительно 40%, например, по меньшей мере приблизительно 50% (например, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80% или по меньшей мере приблизительно 90%) клеток в популяции представляют собой CD34+ клетки.
163. Популяция клеток согласно варианту осуществления 162, где по меньшей мере приблизительно 10%, например, по меньшей мере приблизительно 15%, например, по меньшей мере приблизительно 20%, например, по меньшей мере приблизительно 30% клеток в популяции представляют собой CD34+CD90+ клетки.
164. Популяция клеток согласно любому из вариантов осуществления 157-163, где популяция клеток получена из пуповинной крови, периферической крови (например, мобилизованной периферической крови) или костного мозга, например, получена из костного мозга.
165. Популяция клеток согласно любому из вариантов осуществления 157-164, где популяция клеток содержит, например, состоит из, клетки млекопитающего, например, клетки человека, где необязательно популяция клеток получена от пациента, страдающего гемоглобинопатией, например, серповидноклеточным заболеванием или талассемией, например, бета-талассемией.
166. Популяция клеток согласно любому из вариантов осуществления 157-165, где популяция клеток является (i) аутологичной по отношению к пациенту, которому она назначена для введения, или (ii) аллогенной по отношению к пациенту, которому она назначена для введения.
167. Популяция клеток (например, CD34+ клеток), например, согласно любому из вариантов осуществления 157-165, содержащая паттерн вставки/делеции, описанный в таблице 7-2, где необязательно вставки/делеции паттерна вставки/делеции, описанного в таблице 7-2, выявляются в по меньшей мере 20%, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или по меньшей мере 95% клеток популяции.
168. Композиция, содержащая клетку согласно любому из вариантов осуществления 134-156 или популяцию клеток согласно любому из вариантов осуществления 157-167.
169. Композиция согласно варианту осуществления 168, содержащая фармацевтически приемлемую среду, например, фармацевтически приемлемую среду, подходящую для криоконсервации.
170. Способ лечения гемоглобинопатии, предусматривающий введение пациенту клетки согласно любому из вариантов осуществления 134-156, популяции клеток согласно любому из вариантов осуществления 157-167 или композиции согласно любому из вариантов осуществления 168-169.
171. Способ повышения экспрессии фетального гемоглобина у млекопитающего, предусматривающий введение пациенту клетки согласно любому из вариантов осуществления 134-156, популяции клеток согласно любому из вариантов осуществления 157-167 или композиции согласно любому из вариантов осуществления 168-169.
172. Способ согласно варианту осуществления 170, где гемоглобинопатия представляет собой бета-талассемию или серповидноклеточное заболевание.
173. Способ получения клетки (например, популяции клеток), предусматривающий
(a) обеспечение клетки (например, популяции клеток) (например, HSPC (например, популяции HSPC));
(b) культивирование указанной клетки (например, указанной популяции клеток) ex vivo в среде для культивирования клеток, содержащей вещество, стимулирующее размножение стволовых клеток; и
(c) введение в указанную клетку первой молекулы gRNA согласно любому из вариантов осуществления 1-86, молекулы нуклеиновой кислоты, кодирующей первую молекулу gRNA согласно любому из вариантов осуществления 1-86, композиции согласно любому из вариантов осуществления 87-104 или 168-169, нуклеиновой кислоты согласно любому из вариантов осуществления 105-112 или вектора согласно любому из вариантов осуществления 113-114.
174. Способ согласно варианту осуществление 173, где после указанного введения на стадии (c) указанная клетка (например, популяция клеток) способна к дифференцировке в дифференцированную клетку (например, популяцию дифференцированных клеток), например, клетку эритроидного ростка (например, популяцию клеток эритроидного ростка), например, красную кровяную клетку (например, популяцию красных кровяных клеток), и где указанная дифференцированная клетка (например, популяция дифференцированных клеток) продуцирует повышенный уровень фетального гемоглобина, например, по сравнению с такой же клеткой, которую не подвергали стадии (c).
175. Способ согласно любому из вариантов осуществления 173-174, где вещество, стимулирующее размножение стволовых клеток, представляет собой
a) (1r,4r)-N1-(2-бензил-7-(2-метил-2H-тетразол-5-ил)-9H-пиримидо[4,5-b]индол-4-ил)циклогексан-1,4-диамин;
b) метил-4-(3-пиперидин-1-илпропиламино)-9H-пиримидо[4,5-b]индол-7-карбоксилат;
c) 4-(2-(2-(бензо[b]тиофен-3-ил)-9-изопропил-9H-пурин-6-иламино)этил)фенол;
d) (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол или
e) их комбинации (например, комбинацию (1r,4r)-N1-(2-бензил-7-(2-метил-2H-тетразол-5-ил)-9H-пиримидо[4,5-b]индол-4-ил)циклогексан-1,4-диамина и (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ола).
176. Способ согласно варианту осуществления 175, где вещество, стимулирующее размножение стволовых клеток, представляет собой (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол.
177. Способ согласно любому из вариантов осуществления 173-176, где среда для культивирования клеток содержит тромбопоэтин (Tpo), лиганд Flt3 (Flt-3L) и фактор стволовых клеток (SCF) человека.
178. Способ согласно варианту осуществления 177, где среда для культивирования клеток дополнительно содержит интерлейкин-6 (IL-6) человека.
179. Способ согласно варианту осуществления 177-178, где среда для культивирования клеток содержит тромбопоэтин (Tpo), лиганд Flt3 (Flt-3L) и фактор стволовых клеток (SCF) человека, каждый из которых присутствует в концентрации, находящейся в диапазоне от приблизительно 10 нг/мл до приблизительно 1000 нг/мл.
180. Способ согласно варианту осуществления 179, где среда для культивирования клеток содержит тромбопоэтин (Tpo), лиганд Flt3 (Flt-3L) и фактор стволовых клеток (SCF) человека, каждый из которых присутствует в концентрации, составляющей приблизительно 50 нг/мл, например, в концентрации, составляющей 50 нг/мл.
181. Способ согласно любому из вариантов осуществления 178-180, где среда для культивирования клеток содержит интерлейкин-6 (IL-6) человека в концентрации, находящейся в диапазоне от приблизительно 10 нг/мл до приблизительно 1000 нг/мл.
182. Способ согласно варианту осуществления 181, где среда для культивирования клеток содержит интерлейкин-6 (IL-6) человека в концентрации, составляющей приблизительно 50 нг/мл, например, в концентрации, составляющей 50 нг/мл.
183. Способ согласно любому из вариантов осуществления 173-182, где среда для культивирования клеток содержит вещество, стимулирующее размножение стволовых клеток, в концентрации, находящейся в диапазоне от приблизительно 1 нМ до приблизительно 1 мМ.
184. Способ согласно варианту осуществления 183, где среда для культивирования клеток содержит вещество, стимулирующее размножение стволовых клеток, в концентрации, находящейся в диапазоне от приблизительно 1 мкМ до приблизительно 100 нМ.
185. Способ согласно варианту осуществления 184, где среда для культивирования клеток содержит вещество, стимулирующее размножение стволовых клеток, в концентрации, находящейся в диапазоне от приблизительно 500 нМ до приблизительно 750 нМ.
186. Способ согласно варианту осуществления 185, где среда для культивирования клеток содержит вещество, стимулирующее размножение стволовых клеток, в концентрации, составляющей приблизительно 500 нМ, например, в концентрации, составляющей 500 нМ.
187. Способ согласно варианту осуществления 186, где среда для культивирования клеток содержит вещество, стимулирующее размножение стволовых клеток, в концентрации, составляющей приблизительно 750 нМ, например, в концентрации, составляющей 750 нМ.
188. Способ согласно любому из вариантов осуществления 173-187, где культивирование на стадии (b) предусматривает период культивирования перед введением на стадии (c).
189. Способ согласно варианту осуществления 188, где период культивирования перед введением на стадии (c) составляет по меньшей мере 12 часов, например, представляет собой период, составляющий от приблизительно 1 дня до приблизительно 12 дней, например, представляет собой период, составляющий от приблизительно 1 дня до приблизительно 6 дней, например, представляет собой период, составляющий от приблизительно 1 дня до приблизительно 3 дней, например, представляет собой период, составляющий от приблизительно 1 дня до приблизительно 2 дней, например, представляет собой период, составляющий приблизительно 2 дня, или период, составляющий приблизительно 1 день.
190. Способ согласно любому из вариантов осуществления 173-189, где культивирование на стадии (b) предусматривает период культивирования после введения на стадии (c).
191. Способ согласно варианту осуществления 190, где период культивирования после введения на стадии (c) составляет по меньшей мере 12 часов, например, представляет собой период, составляющий от приблизительно 1 дня до приблизительно 12 дней, например, представляет собой период, составляющий от приблизительно 1 дня до приблизительно 6 дней, например, представляет собой период, составляющий от приблизительно 2 дней до приблизительно 4 дней, например, представляет собой период, составляющий приблизительно 2 дня, или представляет собой период, составляющий приблизительно 3 дня, или представляет собой период, составляющий приблизительно 4 дня.
192. Способ согласно любому из вариантов осуществления 173-191, где популяция клеток увеличивается в по меньшей мере 4 раза, например, в по меньшей мере 5 раз, например, в по меньшей мере 10 раз, например, по сравнению с клетками, которые не культивируют в соответствии со стадией (b).
193. Способ согласно любому из вариантов осуществления 173-192, где введение на стадии (c) предусматривает электропорацию.
194. Способ согласно варианту осуществления 193, где электропорация предусматривает 1-5 импульсов, например, 1 импульс, и при этом импульсное напряжение каждого импульса находится в диапазоне от 700 вольт до 2000 вольт и характеризуется продолжительностью импульса, находящейся в диапазоне от 10 мс до 100 мс.
195. Способ согласно варианту осуществления 194, где электропорация предусматривает 1 импульс.
196. Способ согласно любому из вариантов осуществления 194-195, где напряжение импульса находится в диапазоне от 1500 до 1900 вольт, например, составляет 1700 вольт.
197. Способ согласно любому из вариантов осуществления 194-196, где продолжительность импульса находится в диапазоне от 10 мс до 40 мс, например, составляет 20 мс.
198. Способ согласно любому из вариантов осуществления 173-197, где клетка (например, популяция клеток), предусмотренная на стадии (a), представляет собой клетку человека (например, популяцию клеток человека).
199. Способ согласно варианту осуществления 198, где клетка (например, популяция клеток), предусмотренная на стадии (a), выделена из костного мозга, периферической крови (например, мобилизованной периферической крови) или пуповинной крови.
200. Способ согласно варианту осуществления 199, где
(i) клетка (например, популяция клеток), предусмотренная на стадии (a), выделена из костного мозга, например, выделена из костного мозга пациента, страдающего гемоглобинопатией, где необязательно гемоглобинопатия представляет собой серповидноклеточное заболевание или талассемию, где необязательно талассемия представляет собой бета-талассемию; или
(ii) клетка (например, популяция клеток), предусмотренная на стадии (a), выделена из периферической крови, например, выделена из периферической крови пациента, страдающего гемоглобинопатией, где необязательно гемоглобинопатия представляет собой серповидноклеточное заболевание или талассемию, где необязательно талассемия представляет собой бета-талассемию; где необязательно периферическая кровь представляет собой мобилизованную периферическую кровь, где необязательно мобилизованная периферическая кровь подвергнута мобилизации с применением плериксафора, G-CSF или их комбинации.
201. Способ согласно любому из вариантов осуществления 173-200, где популяция клеток, предусмотренная на стадии (a), является обогащенной клетками CD34+.
202. Способ согласно любому из вариантов осуществления 173-201, где после введения на стадии (c) клетку (например, популяцию клеток) подвергают криоконсервации.
203. Способ согласно любому из вариантов осуществления 173-202, где после введения на стадии (c) клетка (например, популяция клеток) содержит
a) вставку/делецию в последовательности геномной ДНК, комплементарной нацеливающему домену первой молекулы gRNA, или рядом с этой последовательностью; и/или
b) делецию, охватывающую последовательность, например, по сути всю последовательность, между последовательностью, комплементарной нацеливающему домену первой молекулы gRNA (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG1, и последовательностью, комплементарной нацеливающему домену первой молекулы gRNA (например, на по меньшей мере 90% комплементарной нацеливающему домену gRNA, например, полностью комплементарной нацеливающему домену gRNA) в промоторном участке HBG2, где необязательно вставка/делеция, например, делеция, не охватывает нуклеотид, расположенный между 5250092 и 5249833, - нить (hg38).
204. Способ согласно любому из вариантов осуществления 173-203, где после введения на стадии (c) по меньшей мере приблизительно 40%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% клеток, относящихся к популяции клеток, содержат вставку/делецию в последовательности геномной ДНК, комплементарной нацеливающему домену первой молекулы gRNA, или рядом с этой последовательностью, где необязательно клетка, относящаяся к популяции, не предусматривает делецию нуклеотида, расположенного между 5250092 и 5249833, - нить (hg38).
205. Клетка (например, популяция клеток), получаемая с помощью способа согласно любому из вариантов осуществления 173-204.
206. Способ лечения гемоглобинопатии, предусматривающий введение пациенту-человеку композиции, содержащей клетку согласно любому из вариантов осуществления 134-156, популяцию клеток согласно любому из вариантов осуществления 157-167 или клетку (например, популяцию клеток) согласно варианту осуществления 205.
207. Способ повышения экспрессии фетального гемоглобина у пациента-человек, предусматривающий введение указанному пациенту-человеку композиции, содержащей клетку согласно любому из вариантов осуществления 134-156, популяцию клеток согласно любому из вариантов осуществления 157-167 или клетку (например, популяцию клеток) согласно варианту осуществления 205.
208. Способ согласно варианту осуществления 206, где гемоглобинопатия представляет собой бета-талассемию или серповидноклеточное заболевание.
209. Способ согласно любому из вариантов осуществления 206-208, где пациенту-человеку вводят композицию, содержащую по меньшей мере приблизительно 1e6 клеток согласно варианту осуществления 205 на кг веса тела пациента-человека, например, по меньшей мере приблизительно 1e6 клеток CD34+ согласно варианту осуществления 205 на кг веса тела пациента-человека.
210. Способ согласно варианту осуществления 209, где пациенту-человеку вводят композицию, содержащую по меньшей мере приблизительно 2e6 клеток согласно варианту осуществления 205 на кг веса тела пациента-человека, например, по меньшей мере приблизительно 2e6 клеток CD34+ согласно варианту осуществления 205 на кг веса тела пациента-человека.
211. Способ согласно варианту осуществления 209, где пациенту-человеку вводят композицию, содержащую от приблизительно 2e6 до приблизительно 10e6 клеток согласно варианту осуществления 205 на кг веса тела пациента-человека, например, от по меньшей мере приблизительно 2e6 до приблизительно 10e6 клеток CD34+ согласно варианту осуществления 205 на кг веса тела пациента-человека.
212. Молекула gRNA согласно любому из вариантов осуществления 1-86, композиция согласно любому из вариантов осуществления 87-114 или 168-169, нуклеиновая кислота согласно любому из вариантов осуществления 105-112, вектор согласно любому из вариантов осуществления 113-114, клетка согласно любому из вариантов осуществления 134-156 или 205 или популяция клеток согласно любому из вариантов осуществления 157-167 для применения в качестве лекарственного препарата.
213. Молекула gRNA согласно любому из вариантов осуществления 1-86, композиция согласно любому из вариантов осуществления 87-114 или 168-169, нуклеиновая кислота согласно любому из вариантов осуществления 105-112, вектор согласно любому из вариантов осуществления 113-114, клетка согласно любому из вариантов осуществления 134-156 или 205 или популяция клеток согласно любому из вариантов осуществления 157-167 для применения в получении лекарственного препарата.
214. Молекула gRNA согласно любому из вариантов осуществления 1-86, композиция согласно любому из вариантов осуществления 87-114 или 168-169, нуклеиновая кислота согласно любому из вариантов осуществления 105-112, вектор согласно любому из вариантов осуществления 113-114, клетка согласно любому из вариантов осуществления 134-156 или 205 или популяция клеток согласно любому из вариантов осуществления 157-167 для применения в лечении заболевания.
215. Молекула gRNA согласно любому из вариантов осуществления 1-86, композиция согласно любому из вариантов осуществления 87-114 или 168-169, нуклеиновая кислота согласно любому из вариантов осуществления 105-112, вектор согласно любому из вариантов осуществления 113-114, клетка согласно любому из вариантов осуществления 134-156 или 205 или популяция клеток согласно любому из вариантов осуществления 157-167 для применения в лечении заболевания, где заболевание представляет собой гемоглобинопатию.
216. Молекула gRNA согласно любому из вариантов осуществления 1-86, композиция согласно любому из вариантов осуществления 87-114 или 168-169, нуклеиновая кислота согласно любому из вариантов осуществления 105-112, вектор согласно любому из вариантов осуществления 113-114, клетка согласно любому из вариантов осуществления 134-156 или 205 или популяция клеток согласно любому из вариантов осуществления 157-167 для применения в лечении заболевания, где гемоглобинопатия представляет собой бета-талассемию или серповидноклеточное заболевание.
ПРИМЕРЫ
Пример 1. Иллюстративные общие способы
Отбор и конструирование направляющей последовательности
Исходный отбор направляющей последовательности проводили in silico с использованием эталонного генома человека и определенных пользователем геномных участков, представляющих интерес (например, гена, экзона гена, некодирующего регуляторного участка и т. д.), для идентификации PAM в участках, представляющих интерес. В отношении каждого идентифицированного PAM проводили анализы и регистрировали статистические данные. Молекулы gRNA дополнительно отбирали и ранжировали на основании количества способов определения эффективности и результативности, например, описанных в данном документе. В данном примере представлены подробности экспериментальных процедур, которые можно применять для анализа систем CRISPR, gRNA и других аспектов настоящего изобретения, описанных в данном документе. Любые модификации данных общих процедур, используемых в конкретном эксперименте, упомянуты в данном примере.
Во всем разделе "Примеры" в нижеизложенных экспериментах использовали либо молекулы sgRNA, либо молекулы dgRNA. Если не указано иное, в случаях использования молекулы dgRNA gRNA содержала следующее:
crRNA: [нацеливающий домен]-[SEQ ID NO: 201],
tracr (trRNA): SEQ ID NO: 224.
Если не указано иное, в экспериментах, в которых использовали молекулу sgRNA, применяли следующую последовательность:
[нацеливающий домен]-[SEQ ID NO: 195]-UUUU.
Секвенирование нового поколения (NGS) и анализ эффективности целевого расщепления и образования вставки/делеции
Для определения эффективности редактирования (например, расщепления) мишени, локализованной в геноме, использовали глубокое секвенирование с идентификацией присутствия вставок и делеций, введенных посредством негомологичного соединения концов.
Вкратце, конструировали праймеры для ПЦР, связывающиеся с участками, расположенными вокруг целевого сайта, и осуществляли ПЦР-амплификацию геномной области, представляющей интерес, в подвергнутых редактированию и не подвергнутых редактированию образцах. Полученные в результате ампликоны переводили в библиотеки для секвенирования с помощью Illumina и проводили их секвенирование. Риды секвенирования выравнивали относительно эталонного генома человека и подвергали анализу с определением вариантов, позволяющему определять варианты последовательности и их частоту встречаемости в целевом участке, представляющем интерес. Данные отфильтровывали с помощью различных фильтров для проверки качества данных, и известные варианты или варианты, идентифицированные только в нередактированных образцах, исключали. Процентную долю редактирования определяли в виде процентной доли всех событий вставок или делеций, происходящих в целевом сайте, представляющем интерес (т. е. ридов со вставкой и делецией в целевом сайте относительно общего количества ридов (ридов дикого типа и мутантных ридов) в целевом сайте). Подробное описание процесса анализа с помощью NGS представлено в примере 2.1.
Получение RNP
Добавление crRNA и trRNA к белку Cas9 приводит к образованию рибонуклеопротеинового комплекса (RNP) с активной Cas9, который опосредует связывание с целевым участком, определяемым crRNA, и специфическое расщепление геномной ДНК, на которую осуществляется нацеливание. Образование данного комплекса обеспечивали путем загрузки в Cas9 с использованием trRNA и crRNA, что, как полагают, вызывает конформационные изменения в Cas9, позволяющие ей связываться с dsDNA и расщеплять ее.
crRNA и trRNA по отдельности денатурировали при 95°C в течение 2 минут и давали им отстояться до достижения комнатной температуры. Белок Cas9 (10 мг/мл) добавляли в 5X буфер CCE (20 мМ HEPES, 100 мМ KCl, 5 мМ MgCl2, 1 мМ DTT, 5% глицерин), в который затем добавляли trRNA и разные crRNA (в отдельные реакционные смеси) и инкубировали при 37°C в течение 10 минут, за счет чего образовывался активный комплекс RNP. Комплекс доставляли с помощью электропорации и других способов в разные клетки, в том числе HEK-293 и CD34+ гематопоэтические клетки.
Доставка RNP в CD34+ HSC
RNP с Cas9 доставляли в CD34+ HSC.
CD34+ HSC оттаивали и культивировали (в количестве ~500000 клеток/мл) в течение ночи в среде StemSpan SFEM (StemCell Technologies) с добавленными IL12, SCF, TPO, Flt3L и пенициллином/стрептомицином. Из каждой реакционной смеси для доставки RNP отбирали аликвоту, составляющую примерно 90000 клеток, и осаждали их центрифугированием. Затем клетки ресуспендировали в 60 мкл буфера P3 для нуклеофекции (Lonza), к которому впоследствии добавляли активный RNP. Затем HSC подвергали электропорации (например, подвергали нуклеофекции с использованием программы CA-137 на нуклеофекторе Lonza) в трех повторностях (20 мкл/электропорация). Сразу же после осуществления электропорации к HSC добавляли среду StemSpan SFEM (с IL12, SCF, TPO, Flt3L и пенициллином/стрептомицином), которые культивировали в течение по меньшей мере 24 часов. Затем HSC собирали и подвергали анализам с помощью T7E1, NGS и/или анализам экспрессии поверхностных маркеров.
Функциональный анализ HSC
CD34+ HSC можно анализировать в отношении фенотипа стволовых клеток с использованием известных методик, таких как проточная цитометрия или анализ колониеобразующей активности in vitro. В качестве примера клетки анализировали с помощью анализа колониеобразующей активности (CFC) in vitro с использованием набора Methocult H4034 Optimum (StemCell Technologies), используя протокол производителя. Вкратце, 500-2000 клеток CD34+ в объеме <= 100 мкл добавляли к 1-1,25 мл среды Methocult. Смесь энергично перемешивали вихревой мешалкой в течение 4-5 секунд с целью тщательного смешивания, затем оставляли на по меньшей мере 5 минут при комнатной температуре. С помощью шприца 1-1,25 мл смеси MethoCult+клетки переносили в чашку размером 35 мм или лунку 6-луночного планшета. Число колоний и морфологию оценивали через 12-14 дней согласно протоколу производителя.
Ксенотрансплантация in vivo
Функциональные характеристики HSC определяли по их способности к самообновлению и дифференцировке в несколько клеточных линий. Данные функциональные свойства можно оценить только in vivo. Золотым стандартом определения функции HSC у человека является их ксенотрансплантация мыши NOD-SCID гамма (NSG), которая с помощью ряда мутаций приобретает серьезную иммунную недостаточность, и, таким образом, может выступать в качестве реципиента клеток человека. HSC после редактирования трансплантировали мышам NSG для подтверждения того, что индуцированное редактирование не влияет на функцию HSC. Периодический анализ периферической крови использовали для оценки человеческого химеризма и развития линии клеток, и вторичную трансплантацию через 20 недель использовали для установления наличия функциональных HSC, как описано более подробно в данных примерах.
Пример 2.1. Редактирование неделеционного участка HPFH в гематопоэтических стволовых клетках и клетка-предшественниках (HSPC) с использованием CRISPR-Cas9 для повторной активации экспрессии фетального глобина в эритроидных клетках взрослого человека
Способы
Культура клеток CD34+ человека. Клетки CD34+ человека выделяли из мобилизованной с помощью G-CSF периферической крови у взрослых доноров (AllCells) с использованием иммуноселекции (Miltenyi) согласно инструкциям производителя и размножали в течение 4-6 дней с использованием StemSpan SFEM (StemCell Technologies; № кат. 09650), дополненной по 50 нг/мл каждого из тромбопоэтинов (Tpo, Life Technologies, № кат. PHC9514), лиганда Flt3 (Flt-3L, Life Technologies, № кат. PHC9413), фактора стволовых клеток человека (SCF, Life Technologies, № кат. PHC2113) и интерлейкина-6 человека (IL-6, Life Technologies, № кат. PHC0063), а также 1x антибиотика/противогрибкового средства (Gibco, № кат. 10378-016) и 500 нМ соединения 4. В рамках данного примера (включая подразделы данного примера), в тех случаях, когда в протоколе указано, что клетки "размножали", использовали данную среду. В рамках данного примера (включая подразделы данного примера) данную среду также называют "средой для размножения стволовых клеток" или "средой для размножения".
Сборка рибонуклеопротеиновых (RNP) комплексов на основе Cas9 и направляющей РНК, получение HSPC и электропорация RNP в HSPC. Рибонуклеопротеиновые комплексы (RNP) на основе Cas9-направляющая РНК получали непосредственно перед электропорацией. Для получения RNP с использованием двойных направляющих РНК (dgRNA) по 6 мкг каждой из crRNA (в 4,5 мкл) и tracr (в 2,52 мкл) сначала подвергали денатурации при 95°C в течение 2 мин. в отдельных пробирках, а затем охлаждали до комнатной температуры. Для получения белка Cas9 12 мкг белка CAS9 (в 2 мкл) смешивали с 1 мкл 10 x буфера CCE (20 мМ HEPES, 100 мМ KCl, 5 мМ MgCl2, 5% глицерин и 1 мМ DTT, добавленный в свежеприготовленном виде). Сначала tracr смешивали с препаратом Cas9 и инкубировали при 37°C в течение 5 мин. Затем к комплексам tracr/CAS9 добавляли crRNA и инкубировали в течение 5 мин. при 37°C. Для условия отсутствия/контрольного условия к комплексам tracr/CAS9 добавляли среду-носитель вместо crRNA. HSPC собирали путем центрифугирования и ресуспендировали в буфере P3 + добавка, идущая в комплекте c набором для электропорации Lonza (№ кат. V4XP-3032, Lonza Amaxa P3 primary cell 4-D nucleofection X Kit S), при плотности клеток 2,8×106/мл. RNP смешивали с 40 мкл клеток путем пипетирования содержимого пипеткой и инкубировали при к. т. в течение 2 мин. Из расчета на каждую повторность по 21 мкл смеси RNP/клетки переносили в среду из набора Lonza Amaxa P3 primary cell 4-D nucleofection X Kit S. Электропорацию проводили с использованием системы для трансфекции Lonza (X-модуль 4D-нуклеофектора) с применением протокола CM-137. Электропорации с использованием 21 мкл проводили в двух повторностях.
Эритропоэз in vitro и FACS-анализ HbF-содержащих эритроидных клеток. После электропорации клетки сразу же переносили в 250 мкл предварительного нагретой среды для эритроидной дифференцировки (EDM), состоящей из IMDM (GE Life Sciences, № кат. SH30228.01), 330 мкг/мл голотрансферина человека (Invitria, № по кат. 777TRF029), 10 мкг/мл рекомбинантного инсулина человека (Gibco, № кат. A1138211), 2 МЕ/мл гепарина (Sigma, № партии H3393), 5% сыворотки крови группы AB человека (Sigma, № кат. H4522), 2,5 Ед/мл эритропоэтина человека (Peprotech, № 100-064) и 1x антибиотика/противогрибкового средства (Gibco, № кат. 10378-016). В ходе начального периода культивирования, который длился до дня 7 включительно, EDM также дополняли 1,38 мкМ гидрокортизона (Sigma H8672), 100 нг/мл SCF человека (Life Technologies, № кат. PHC2113) и 5 нг/мл IL-3 человека (Peprotech, № 10779-598) с получением EDM-I. Через 4 дня культуру клеток разбавляли свежеприготовленной средой. Культуры поддерживали в общей сложности в течение 7 дней в условиях культивирования, описанных выше, после чего половину клеток анализировали в отношении экспрессии HbF с помощью внутриклеточного окрашивания. Вкратце, клетки промывали однократно с использованием PBS, ресуспендировали в красителе из набора LIVE/DEAD® Fixable Violet Dead Cell Stain (ThermoFisher L34963; 1:1000 в PBS) и инкубировали в течение 30 мин. Затем клетки промывали и окрашивали с помощью антител к CD71, конъюгированных с BV711 (Fisher Scientific Company Llc. BD 563767), и антител к CD235a, конъюгированных с APC (BD 551336), в разбавлениях 1/50 в течение 30 мин. Затем клетки промывали с последующей фиксацией с помощью фиксирующего буфера (Biolegend, № кат. 420801) и пермеабилизировали с помощью 1x промывочного буфера для пермеабилизации при внутриклеточном окрашивании (Biolegend, № кат. 421002) согласно инструкциям производителя. Затем клетки инкубировали с антителом к HbF, конъюгированным с PE, в разбавлении 1/40 (Life Technologies, № партии MHFH04) в 50 мкл 1x промывочного буфера для пермеабилизации при внутриклеточном окрашивании в течение 20 мин. при комнатной температуре. Клетки дважды промывали с помощью 0,2 мл 1x промывочного буфера для пермеабилизации при внутриклеточном окрашивании, и ресуспендировали в окрашивающем буфере, и анализировали в отношении экспрессии HbF на проточном цитометре LSRFortessa (BD Biosciences). Результаты анализировали с применением Flowjo, и данные представляли в виде % HbF-положительных клеток (F-клеток) в популяции жизнеспособных CD71-положительных эритроидных клеток.
Из оставшихся клеток, культивированных в течение 7 дней, 80000 клеток из расчета на условие переносили в культуральную среду EDM-II для дополнительной дифференцировки до дня 11 включительно. EDM-II состоит из EDM-I, дополненной только 100 нг/мл SCF. В день 11 проводили подсчет клеток, и 200000 клеток из расчета на условие переносили в EDM без дополнительных добавок. В день 14 клетки окрашивали для анализа экспрессии HbF аналогично тому, как в день 7, но окрашивание на поверхностные маркеры исключали для предотвращения агрегации клеток.
Получение и секвенирование нового поколения (NGS) геномной ДНК. Геномную ДНК получали из отредактированных и нередактированных HSPC через 7 дней после электропорации с использованием раствора для экстракции ДНК Quick Extract (Epicentre, № кат. QE09050). Для определения эффективности редактирования и паттернов вставок и делеций (вставок/делеций) получали продукты ПЦР с использованием праймеров, фланкирующих целевые сайты, которые затем подвергали секвенированию нового поколения (NGS), как описано в литературе. Процент редактирования соответствующих последовательностей в нередактированных образцах (подвергнутых электропорации с использованием RNP, состоящих только из Cas9 и tracr), как правило, составлял менее 1% и никогда не превышал 3%.
Получение библиотеки для NGS и секвенирование ампликонов. ПЦР-ампликоны очищали с использованием 1,8x количества гранул Agencourt AmpureXP (Beckman Coulter), следуя рекомендациям производителя. Количественную оценку ампликонов осуществляли с использованием набора для анализа Quant-iT PicoGreen dsDNA (Life Technologies), следуя рекомендациям производителя. Библиотеки для секвенирования Illumina получали с использованием набора для получения библиотеки ДНК Nextera (Illumina), следуя рекомендациям производителя со следующими изменениями. Тагментацию проводили в конечном объеме 5 мкл с использованием 5 нг очищенного продукта ПЦР, 0,15 мкл фермента для тагментации Nextera и буфера для тагментации, ранее описанного Wang et al (PMID: 24071908; включен в данный документ посредством ссылки). Тагментированные ампликоны затем подвергали ПЦР-амплификации в конечном объеме 50 мкл с использованием реагентов в следующих конечных концентрациях: 0,2 мМ dNTP (Life Technologies), 0,2 мкМ индексных праймеров для ПЦР Illumina (Integrated DNA Technologies), 1x буфера для ДНК-полимеразы Phusion (New England Biolabs) и 1 ЕД ДНК-полимеразы Phusion (New England Biolabs). Используемые условия амплификации при ПЦР представляли собой следующие: 72°C в течение 3 мин., 98°C в течение 2 мин. и 15 циклов при 98°C в течение 10 с, 63°C в течение 30 с и 72°C в течение 3 мин. Библиотеки для секвенирования затем очищали с использованием 1,0x количества гранул Agencourt AmpureXP (Beckman Coulter), следуя рекомендациям производителя. Количественную оценку библиотек для секвенирования осуществляли с использованием набора для анализа Quant-iT PicoGreen dsDNA (Life Technologies), следуя рекомендациям производителя, и объединяли в эквимолярном количестве для секвенирования. Библиотеки для секвенирования секвенировали при длине ридов спаренных концов 150 пар оснований на секвенаторе MiSeq, следуя рекомендациям производителя (Illumina). Обеспечивали минимум 1000-кратный секвенирующий охват из расчета на один ампликон.
Контроль качества (QC) данных, полученных путем секвенирования с помощью NGS, и анализ вариантов. Программное обеспечение для анализа MiSeq Illumina (MiSeq reporter, версия 2.6.2, Illumina) с использованием стандартных параметров применяли для получения данных секвенирования конкретных ампликонов в файлах формата FASTQ (Cock et al, Nucleic Acids Res. 2010, 38(6):1767-71, PMID: 20015970). Затем файлы формата FASTQ обрабатывали с помощью последовательного анализа вариантов собственной разработки, состоящего из ряда общедоступных пакетов программного обеспечения, объединенных вместе с помощью стандартного сценария обертки скриптов на языке Perl. Используемую последовательность действий делили на пять стадий.
Стадия 1, QC праймеров для ПЦР, а также целевой и нецелевой последовательностей. Как для целевых, так и для нецелевых сайтов последовательность нацеливающего домена gRNA из 20 нуклеотидов с последовательностью PAM и последовательности праймеров для ПЦР, специфичных в отношении мишени (левая и правая без дополнительных последовательностей Illumina) выравнивали относительно эталонной последовательности генома человека (сборка GRCh38) с использованием средства поиска BLAST (версия 2.2.29+, Altschul et al, J Mol Biol., 1990, 215(3):403-10, PMID: 2231712). Помечали целевые и нецелевые сайты с несколькими местоположениями в геноме.
Стадия 2, разворачивание файла секвенатора. Файлы формата FASTQ.GZ, полученные на секвенаторе Illumina, разворачивали до файлов формата FASTQ с использованием скрипта gzip (версия 1.3.12) и подсчитывали количество ридов на файл. Файлы без ридов не включали в дальнейший анализ.
Стадия 3, выравнивание секвенированных ридов и тримминг по качеству. Секвенированные риды в файлах формата FASTQ выравнивали относительно эталонной последовательности генома человека (сборка GRCh38) с использованием алгоритма выравнивания BWA-MEM (версия 0.7.4-r385, Li and Durbin, Bioinformatics, 2009, 25(14):1754-60, PMID: 19451168), используя 'жесткое отсекание' для удаления 3'-концов в ридах последовательностей Illumina и оснований c низким качеством. Полученные в результате выровненные риды в файле формата BAM (Li et al, Bioinformatics, 2009 25(16):2078-9, PMID: 19505943) конвертировали в файлы формата FASTQ с использованием скрипта SAMtools (версия 0.1.19-44428cd, Li et al, Bioinformatics, 2009 25(16):2078-9, PMID: 19505943). Затем последовательности из файла формата FASTQ снова выравнивали относительно эталонной последовательности генома человека (сборка GRCh38) с использованием алгоритма выравнивания BWA-MEM, но в этот раз без 'жесткого отсекания'.
Стадия 4, анализ вариантов (c SNP и ВСТАВКАМИ/ДЕЛЕЦИЯМИ). Файлы формата BAM с выровненными ридами обрабатывали с использованием системы поиска вариантов VarDict (версия 1.0 'совместимая с Cas9', модифицированная разработчиком ZhongWu Lai, Lai et al, Nucleic Acids Res., 2016, 44(11):e108, PMID: 27060149) с установленным пределом выявления частоты аллелей >=0,0001 для идентификации вариантов (с SNP и вставками/делециями). Система поиска VarDict, совместимая с Cas9, основана на общедоступном пакете программ, но выполнена с возможностью перемещения неоднозначных результатов поиска вариантов, полученных вследствие повторяющихся последовательностей в участке выравнивания с событиями вариации, в сторону потенциального сайта разрезания нуклеазой Cas9 в последовательности нацеливающего домена gRNA, расположенной на расстоянии 3 оснований от 5'-конца последовательности PAM. Скрипт SAMtools использовали для расчета охвата ридами на ампликон образца с определением того, были ли охвачены целевые и нецелевые сайты при >1000-кратном охвате последовательности. Сайты с <1000-кратным охватом последовательности помечали.
Стадия 5, фильтрация по dbSNP и сравнительный анализ обработанных/необработанных образцов. Идентифицированные варианты фильтровали по известным вариантам (SNP и вставки/делеции), выявленным в dbSNP (сборка 142, Shery et al, Nucleic Acids Res. 2001, 29(1):308-11, PMID: 11125122). Варианты в обработанных образцах дополнительно фильтровали для исключения: 1) вариантов, идентифицированных в нередактированных контрольных образцах; 2) вариантов с ошибками чтения цепи в VarDict 2:1 (где количество прямых и обратных ридов, подтверждающих эталонную последовательность, является сбалансированным, но в случае неэталонного результата поиска вариантов является несбалансированным); 3) вариантов, расположенных на расстоянии >5 п. о. с любой стороны от потенциального сайта разрезания для Cas9; 4) вариантов с однонуклеотидным полиморфизмом.
Результаты
Авторы настоящего изобретения показали в данном документе неожиданный результат, что нацеленное разрывание конкретных последовательностей (например, посредством создания вставки/делеции в данных последовательностях или рядом с ними) в пределах промоторных участков HBG1 или HBG2 ослабляет репрессию экспрессии γ-глобина, обеспечивая возможность продуцирования красных кровяных клеток, содержащих повышенный уровень белка HbF (клеток, экспрессирующих фетальный гемоглобин, которые иногда называются в данном документе "F-клетками"). Повышенный уровень HbF предотвращает образование серповидных форм красных кровяных клеток в бескислородных условиях и будет оказывать терапевтический/лечебный эффект у пациентов как с β-талассемией, так и с SCD. В данном отношении аутологичную трансплантацию гематопоэтических стволовых клеток (HSCT) с использованием HSC, подвергнутых редактированию генома ex vivo, от пациентов с SCD также объединяли с технологией усиления размножения стволовых клеток, например, с использованием ингибитора арил-гидрокарбонового рецептора (AHR), например, описанного в патентном документе WO2010/059401 (содержание которого включено посредством ссылки во всей его полноте), например соединения 4, с обеспечением улучшения размножения ex vivo и увеличением дозы доставляемых генномодифицированных HSC.
Для обеспечения эффективного редактирования генома посредством программируемой нуклеазы Cas9 большое значение имеет успешная доставка направляющей РНК (gRNA) и белка Cas9 в целевые клетки и ткани. В данном документе авторы настоящего изобретения показали, что доставка предварительно полученных комплексов gRNA/Cas9 в виде рибонуклеопротеиновых комплексов (RNP) с помощью электропорации приводит к эффективному и специфическому редактированию генома почти сразу же после доставки, и что они разрушаются в клетках, снижая нецелевые эффекты. В отличие от этого применение плазмидных и вирусных векторных систем, используемых для доставки Cas9, приводит к длительной экспрессии фермента, которая может усугублять нецелевые эффекты, ассоциированные с системой. Кроме того, доставка RNP в целевые клетки не требует дополнительных средств, что может значительно облегчить внедрение технологии редактирования генома в терапевтических целях в клиническую практику.
Рекомбинантный белок Cas9 S. pyogenes (SEQ ID NO: 236) выделяли из Escherichia coli и обеспечивали образование комплексов с синтетическими двойными gRNA (dgRNA), состоящими из crRNA и tracr, с получением рибонуклеопротеиновых (RNP) комплексов. Перечень нацеливающих доменов gRNA, используемых в исследовании, и их последовательности показаны в таблице 1. Большинство последовательностей gRNA содержат последовательности, точно соответствующие мишеням, или характеризуются ошибочным спариванием только 1 или 2 пар оснований в обоих промоторных участках HBG1 и HBG2. Данная ситуация обусловлена дупликацией генов HBG в пределах локуса бета-глобина человека. Комплексы RNP вводили в CD34+ HSPC с помощью электропорации, как описано в разделе "Материалы и способы". Клетки размножали перед доставкой комплексов RNP. Не ограничиваясь теорией полагают, что активно делящиеся клетки могут способствовать поглощению комплексов RNP, доставляемых с помощью электропорации.
Таблица 4. Перечень gRNA, нацеливающих на промоторные участки HBG1 и HBG2, используемых в данном исследовании. Все молекулы gRNA тестировали в двух повторностях в формате dgRNA, описанном выше.
HSPC с отредактированным и нередактированным геномом анализировали с помощью проточной цитометрии в отношении уровней экспрессии фетального глобина и трансферринового рецептора (CD71), являющегося маркером клеточной поверхности эритроидных клеток, с использованием антител, конъюгированных с флуоресцентными красителями. Жизнеспособные клетки идентифицировали и гейтировали c исключением нежизнеспособных клеток по результатам окрашивания фиолетовым красителем Live Dead Violet. Редактирование генома не оказывало отрицательного влияния на эритроидную дифференцировку, поскольку культивированные клетки характеризовались процентными долями клеток CD71+, сопоставимыми с таковыми у эритробластов, аналогичных нередактированным клеткам. Доставка данных RNP с gRNA в HSPC приводила к повышенной процентной доле потомства эритроидных клеток, содержащих HbF (не более 62,75%), по сравнению с клетками с имитированной электропорацией (16,9%) в день 7 после электропорации (таблица 4). Дополнительная оценка уровней индуцирования выработки HbF в день 14 подтвердила высокие уровни индуцирования у наиболее эффективных последовательностей dgRNA (таблица 4), хотя фоновые уровни HbF, выявленные у контролей, были выше по сравнению с днем 7. Также параллельно наблюдали индуцирование выработки HbF-положительных клеток с помощью dgRNA, содержащей нацеливающий домен g8, целенаправленно воздействующий на экзон 2 BCL11A, и несколько gRNA, нацеливающих на участки HBG1 или HBG2, что приводило к большим уровням F-клеток в %, чем g8. Продукты ПЦР промоторных участков HBG1 и HBG2 из геномной ДНК, выделенной через 7 дней после электропорации, также подвергали секвенированию нового поколения (NGS) с определением процентной доли отредактированных аллелей в популяции клеток. Высокие процентные доли редактирования генома в промоторных участках HBG1 и HBG2 наблюдали во многих культурах клеток, подвергнутых электропорации с использованием RNP, содержащих Cas9, crRNA с указанным нацеливающим доменом и tracr (таблица 4, фигура 1), но не в контрольных клетках, в которые нацеливающий домен не доставляли (RNP, содержащие только Cas9 и tracr). В частности, обработки с использованием dgRNA, которые приводили к более чем 17% повышению содержания HbF+ клеток по сравнению с фоновым уровнем в случае контроля с имитированной трансфекцией в день 7, характеризовались отредактированными аллелями в любом из целевых локусов HBG1 или HBG2 в диапазоне от 5,92% до 77,84% (таблица 4, фигура 2 и фигура 3). Некоторые направляющие последовательности с избирательной специфичностью в отношении промоторного участка HBG1 или HBG2 демонстрировали преимущественное редактирование в локусе, в отношении которого они специфичны (например, GCR-0001, GCR-0011 и GCR-0012 обеспечивают более эффективное редактирование HBG1, а GCR-0034, GCR-0046, GCR-0051, GCR-0052, GCR-0054 и GCR-0058 обеспечивают более эффективное редактирование HBG2). Примечательным и неожиданным исключением из данной корреляции является GCR-0008, который, хотя и является специфичным в отношении целевой последовательности локуса HBG1, но обеспечивает эффективное редактирование обоих локусов HBG1 и HBG2, а также приводит к высокому индуцированию выработки HbF. GCR-0008 характеризуется ошибочным спариванием одной пары оснований с целевой последовательностью в локусе HBG2, что свидетельствует о том, что эффективное целевое редактирование происходит в данном сайте. Целевая последовательность для некоторых из 72 тестируемых gRNA картируется на участках, перекрывающихся или расположенных рядом с несколькими аннотированными мутациями у человека, ассоциированными с наследственной персистенцией фетального гемоглобина (HPFH), обусловленной его устойчивой экспрессией, а также на известных сайтах связывания факторов транскрипции в проксимальных по отношению к промотору областях как HBG1, так и HBG2 (фигура 4 и фигура 5). Неожиданно, кластер наиболее эффективных gRNA нацеливал на последовательности, расположенные за пределами данных известных областей промоторного функционального элемента в генах HBG1 и HBG2 (например, картированные на chr11:5250094-5250237; hg38 и chr11:5255022-5255164; hg38 (фигура 4 и фигура 5) соответственно). Эти gRNA включают GCR-0001, GCR-0006, GCR-0008, GCR-0009, GCR-0010, GCR-0011, GCR-0012, GCR-0034, GCR-0046, GCR-0048, GCR-0051, GCR-0054, GCR-0058 и GCR-0067. Другая высокоактивная gRNA (GCR-0028) нацеливает на сайт связывания фактора транскрипции (TATA-бокс) в проксимальной по отношению к промотору области как HBG1, так и HBG2, которая не ассоциирована с мутациями неделеционного HPFH (chr11: 5249833-5249927; hg38 и chr11: 5254738-5254851; hg38 (фигура 4 и фигура 5) соответственно).
Пример 2.2. Редактирование промоторного участка гамма-глобина в HSPC для повторной активации экспрессии фетального глобина в эритроидных клетках взрослого человека - оценка выбранных сайтов с использованием CRISPR-Cas9 с форматом sgRNA
Способы
Способы соответствуют таким способам из примера 2.1 со следующими модификациями.
Культура клеток CD34+ человека. Клетки CD34+ человека получали из костного мозга здоровых взрослых доноров (Lonza, № кат. 2M-101D). Клетки оттаивали, затем размножали в течение 6 дней.
Сборка рибонуклеопротеиновых (RNP) комплексов на основе Cas9 и направляющей РНК, получение HSPC и электропорация RNP в HSPC. Для получения RNP с использованием одиночных направляющих RNA (sgRNA) 12 мкг каждой из sgRNA, 12 мкг белка CAS9 и 1 мкл 10 x буфера CCE (20 мМ HEPES, 100 мМ KCL, 5 мМ MgCl2, 5% глицерин и 1 мМ DTT, добавленный в свежеприготовленном виде) объединяли в общем объеме 10 мкл, затем инкубировали при 37°C в течение 5 мин. Для условия отсутствия/контрольного условия добавляли среду-носитель вместо sgRNA. Плотность клеток в буфере P3 + добавка составляла 3,9×106/мл.
Эритропоэз in vitro и FACS-анализ HbF-содержащих эритроидных клеток. В день 11 клетки переносили в EDM без дополнительных добавок. В день 14 и день 18 клетки осаждали центрифугированием и ресуспендировали в свежеприготовленной EDM без дополнительных добавок. В день 14 и день 21 отбирали аликвоту клеток для анализа экспрессии HbF. Клетки окрашивали аналогично тому, как в день 7, но окрашивание на поверхностные маркеры исключали для предотвращения агрегации клеток, и антитело к HbF использовали в разведении 1:20.
Получение и секвенирование нового поколения (NGS) геномной ДНК. Геномную ДНК получали из отредактированных и нередактированных HSPC через 3 дня после электропорации с использованием раствора для экстракции ДНК Quick Extract (Epicentre, № кат. QE09050). Описанный ниже анализ с помощью NGS показал отсутствие существенного редактирования в контрольных образцах, подвергнутых электропорации с использованием Cas9 в отдельности.
Получение библиотеки для NGS и секвенирование ампликонов проводили так, как описано в примере 2.1. QC данных секвенирования с помощью NGS и анализ вариантов проводили так, как описано в примере 2.1.
Результаты
Авторы настоящего изобретения показали в данном документе, что нацеленное разрывание конкретных последовательностей в пределах промоторных участков HBG1 или HBG2, приводящее к продуцированию F-клеток, также можно осуществлять с использованием gRNA в формате sgRNA.
Таблица 5. Перечень выбранных gRNA, нацеливающих на промоторные участки HBG1 и HBG2, используемых в данном исследовании. Все молекулы gRNA тестировали в двух повторностях в формате sgRNA, описанном выше.
HSPC, полученные из костного мозга взрослого человека, подвергали электропорации с использованием комплексов RNP, полученных из рекомбинантного белка Cas9 S. pyogenes (SEQ ID NO: 236) и указанной gRNA в формате sgRNA. Полученные в результате HSPC с отредактированным и нередактированным геномом анализировали с помощью проточной цитометрии в отношении уровней экспрессии фетального глобина и трансферринового рецептора (CD71), являющегося маркером клеточной поверхности эритроидных клеток, с использованием антител, конъюгированных с флуоресцентными красителями. Жизнеспособные клетки идентифицировали и гейтировали c исключением нежизнеспособных клеток по результатам окрашивания фиолетовым красителем Live Dead Violet. Доставка данных RNP с gRNA в HSPC приводила к повышенной процентной доле потомства эритроидных клеток, содержащих HbF (не более 74,6%), по сравнению с клетками с имитированной электропорацией (39,0%) в день 7 после электропорации (таблица 5). Дополнительная оценка уровней индуцирования выработки HbF в день 14 и день 21 подтвердила высокие уровни индуцирования у наиболее эффективных последовательностей sgRNA (таблица 5). Продукты ПЦР промоторных участков HBG1 и HBG2 из геномной ДНК, выделенной через 3 дня после электропорации, также подвергали секвенированию нового поколения (NGS) с определением процентной доли отредактированных аллелей в популяции клеток. Высокие процентные доли редактирования генома (исключая большие делеции) в промоторных участках HBG1 и HBG2 наблюдали во многих культурах клеток, подвергнутых электропорации с использованием RNP, содержащих Cas9 и sgRNA с указанным нацеливающим доменом (таблица 5), но не в контрольных клетках, в которые sgRNA не доставляли (только Cas9).
В данное исследование включали выбранные сайты для нацеливания, обеспечивающие >17% повышение содержания HbF+ эритроидных клеток в день 7 согласно примеру 2.1. План эксперимента отличался от ранее описанного в примере 2.1 двумя существенными особенностями: форматом gRNA (sgRNA вместо dgRNA) и источником HSPC (от другого донора и полученные из костного мозга, а не из мобилизованной периферической крови). Не ограничиваясь теорией полагают, что различия в исходных значениях процентной доли клеток HbF+ в нередактированных культурах клеток между исследованиями могут быть обусловлены существенными различиями в источниках HSPC. Несмотря на такие различия, все сайты для нацеливания, за исключением GCR-47, по-прежнему были ассоциированы с >17% повышением содержания эритроидных клеток HbF+ в день 7 (фигура 7). В случае с GCR-0067 данное повышение сохранялось до дня 21 (фигура 7). Кроме того, образование вставок/делеций в HBG1, HBG2 или обоих на уровне >25% наблюдали в случае с GCR-0008, GCR-0048, GCR-0051, GCR-0053, GCR-0063 и GCR-0067 (таблица 5). Как и в случае формата dgRNA (таблица 4), GCR-0008 в формате sgRNA был ассоциирован с эффективным редактированием как в целевом сайте HBG1, так и в нецелевом сайте HBG2 (таблица 5). В данном исследовании не было определено, ассоциирован ли более низкий уровень индуцирования выработки клеток HbF+ с помощью GCR-0047 со сниженным уровнем редактирования. Примечательно, что >17% повышение индуцированных клеток HbF+ в день 7 и день 14 было ассоциировано с последовательностями, нацеливающими на последовательности за пределами известных областей промоторного функционального элемента в генах HBG1 и HBG2 (например, картированные на chr11:5250094-5250237; hg38 и chr11:5255022-5255164; hg38 (фигура 4 и фигура 5) соответственно), в частности, GCR-0001, GCR-0008, GCR-0010, GCR-0048, GCR-0051, GCR-0054 и GCR-0067 (фигура 7). Из них GCR-0008, GCR-0048 и GCR-0067 также характеризовались >10% повышением содержания клеток HbF+ в день 21 и >25% образованием вставок/делеций в HBG1, HBG2 или обоих (таблица 5 и фигура 7).
Пример 2.3. Редактирование промоторного участка гамма-глобина в HSPC для повторной активации экспрессии фетального глобина в эритроидных клетках взрослого человека - дополнительный анализ паттернов редактирования с использованием CRISPR-Cas9 с форматом sgRNA
Способы
Способы соответствуют таким способам из примера 2.1 со следующими модификациями.
Культура клеток CD34+ человека. Клетки CD34+ человека получали из костного мозга здоровых взрослых доноров (Lonza, № кат. 2M-101D и Hemacare, № кат. BM34-C). Клетки оттаивали, затем размножали в течение 6 дней.
Сборка рибонуклеопротеиновых (RNP) комплексов на основе Cas9 и направляющей РНК, получение HSPC и электропорация RNP в HSPC. Для получения RNP с использованием одиночных направляющих RNA (sgRNA) 12 мкг каждой из sgRNA, 12 мкг белка CAS9 и 1 мкл 10 x буфера CCE (20 мМ HEPES, 100 мМ KCL, 5 мМ MgCl2, 5% глицерин и 1 мМ DTT, добавленный в свежеприготовленном виде) объединяли в общем объеме 10 мкл, затем инкубировали при 37°C в течение 5 мин. Для условия отсутствия/контрольного условия добавляли среду-носитель вместо sgRNA. Плотность клеток в буфере P3 + добавка составляла 3,9×106/мл.
Эритропоэз in vitro и FACS-анализ HbF-содержащих эритроидных клеток. В день 11 клетки переносили в EDM без дополнительных добавок. В день 14 и день 18 клетки осаждали центрифугированием и ресуспендировали в свежеприготовленной EDM без дополнительных добавок. В день 14 и день 21 отбирали аликвоту клеток для анализа экспрессии HbF. Клетки окрашивали аналогично тому, как в день 7, но окрашивание на поверхностные маркеры исключали для предотвращения агрегации клеток, и антитело к HbF использовали в разведении 1:20.
Получение и секвенирование нового поколения (NGS) геномной ДНК. Геномную ДНК получали из отредактированных и нередактированных HSPC через 3 дня после электропорации с использованием раствора для экстракции ДНК Quick Extract (Epicentre, № кат. QE09050). Описанный ниже анализ с помощью NGS показал отсутствие существенного редактирования в контрольных образцах, подвергнутых электропорации с использованием Cas9 в отдельности.
Получение библиотеки для NGS и секвенирование ампликонов проводили так, как описано в примере 2.1. QC данных секвенирования с помощью NGS и анализ вариантов проводили так, как описано в примере 2.1.
Неколичественная ПЦР для выявления инверсий и больших делеций. Для амплификации gDNA в участке HBG1 и HBG2 использовали следующие наборы праймеров. P1: прямой праймер 5'-TGCTGAGATGAAACAGGCGT-3' (SEQ ID NO: 257), обратный праймер 5'-TTAGGCATCCACAAGGGCTG-3' (SEQ ID NO: 258), размер ожидаемого продукта в случае делеции между целевыми/нецелевыми сайтами HBG1 и HBG2 ~ 2,8 т. о., размер ожидаемого продукта в случае инверсии между целевыми/нецелевыми сайтами HBG1 и HBG2 ~ 7,7 т. о., размер ожидаемого продукта в случае отсутствия большой делеции или инверсии (нередактированные или меньшие вставки/делеции в целевых/нецелевых сайтах HBG1 и/или HBG2 отдельно) ~ 7,7 т. о. P2: прямой праймер 5'-GCTCTACAAATGGAACCCAACC-3' (SEQ ID NO: 259), обратный праймер 5'-CTGCTCTGATCTCTAACACCTCA-3' (SEQ ID NO: 260), отсутствие ожидаемого продукта в случае делеции между целевыми/нецелевыми сайтами HBG1 и HBG2, отсутствие ожидаемого продукта в случае инверсии между целевыми/нецелевыми сайтами HBG1 и HBG2, размер ожидаемого продукта в случае отсутствия большой делеции или инверсии (нередактированные или меньшие вставки/делеции в целевых/нецелевых сайтах HBG1 и/или HBG2 по отдельности) ~ 3,8 т. о. P3: прямой праймер 5'-GAAGATACAGCTTGCCTCCGA-3' (SEQ ID NO: 261), обратный праймер 5'-TTGCTGAGATGAAACAGGCGT-3' (SEQ ID NO: 262), отсутствие ожидаемого продукта в случае делеции между целевыми/нецелевыми сайтами HBG1 и HBG2, размер ожидаемого продукта в случае инверсии между целевыми/нецелевыми сайтами HBG1 и HBG2 ~ 1,75 т. о., отсутствие ожидаемого продукта в случае отсутствия большой делеции или инверсии (не подвергнутые редактированию или меньшие вставки/делеции в целевых/нецелевых сайтах HBG1 и/или HBG2 отдельно). Продукты ПЦР визуализировали на агарозном геле наряду с эталонным маркером молекулярной массы, состоящим из полос, соответствующих 0,5, 1, 1,5, 2, 3, 4, 5, 6, 8 и 10 т. о. (L; New England Biolabs, № по каталогу N3232L). Выбранные продукты выделяли так, как указано, и подвергали NGS, как описано в примере 2.1.
Количественное определение больших делеций. Количественное определение больших делеций между сайтами для нацеливания в промоторах HBG1 и HBG2 осуществляли с помощью цифровой капельной ПЦР (ddPCR) в формате неконкурентного анализа для определения количества копий согласно рекомендациям производителя. Вкратце, gDNA объединяли с супермиксом ddPCR SuperMix для работы с зондами при ddPCR (без dUTP) (BioRad, № кат. 1863024), рестриктазой HindIII-HF (NEB, № кат. R3104S) и каждой из смесей праймеров и зондов, переносили в картридж DG8 вместе с маслом для получения капель для работы с зондами (BioRad, № кат. 1863005) и с помощью устройства для создания капель QX200 (BioRad) получали капли. Капли подвергали ПЦР на амплификаторе C1000 Touch с реакционным блоком в формате 96-луночного планшета с глубокими лунками (BioRad) с последующим выявлением с помощью считывающего устройства для капельной ПЦР QX200 (BioRad). Количество копий на мкл определяли с помощью анализа с применением программного обеспечения QuantaSoft (BioRad). Набор праймеров и зонда, разработанных по индивидуальному заказу (Life Technologies, № кат. APZW76R, PN4331348, прямой праймер: ACGGATAAGTAGATATTGAGGTAAGC (SEQ ID NO: 263), обратный праймер: GTCTCTTTCAGTTAGCAGTGG (SEQ ID NO: 264), TaqMan-зонд FAM: ACTGCGCTGAAACTGTGGCTTTATAG (SEQ ID NO: 265)) использовали для амплификации gDNA в пределах межгенного участка HBG1-HBG2. Эталонный ген РНКазы P человека из набора TaqMan для анализа количества копий (Thermo Fisher, № кат. 4403326) использовали в качестве эталонного ампликона. Количество копий на мкл для ампликонов HBG1-HBG2 и гена РНКазы P находилось в пределах заявленного производителем линейного диапазона. Процентную долю делеций рассчитывали путем умножения аргумента "1 минус соотношение количества копий на мкл для амликонов HBG1-HBG2 и гена РНКазы P" на 100%. У нередактированных контрольных образцов рассчитанная процентная доля делеций составляла 2,4%, что может соответствовать фоновому уровню в данном анализе.
Результаты
Авторы настоящего изобретения показали в данном документе, что нацеленное разрывание конкретных последовательностей в пределах промоторных участков HBG1 и HBG2, приводящее к продуцированию F-клеток, ассоциировано как со вставками/деляциями в целевом или нецелевом сайте HBG1 или HBG2, так и с делециями и инверсиями промежуточного участка. Анализ ампликонов с помощью NGS подтвердил данное наблюдение.
Таблица 6. Перечень выбранных gRNA, нацеливающих на промоторные участки HBG1 и HBG2, используемых в данном исследовании для редактирования клеток от первого независимого донора. Все молекулы gRNA тестировали в двух повторностях в формате sgRNA, описанном выше.
Таблица 7. Перечень выбранных gRNA, нацеливающих на промоторные участки HBG1 и HBG2, используемых в данном исследовании для редактирования клеток от второго независимого донора. Все молекулы gRNA тестировали в двух повторностях в формате sgRNA, описанном выше.
HSPC, полученные из костного мозга 2 независимых взрослых доноров, подвергали электропорации с использованием комплексов RNP, образованных из рекомбинантного белка Cas9 S. pyogenes (SEQ ID NO: 236) и указанной gRNA в формате sgRNA. Оцениваемые sgRNA содержали последовательности, нацеливающие на последовательности за пределами известных областей промоторного функционального элемента в генах HBG1 и HBG2 (например, картированные на chr11:5250094-5250237; hg38 и chr11:5255022-5255164; hg38 (фигура 4 и фигура 5) соответственно). Полученные в результате HSPC с отредактированным и нередактированным геномом анализировали с помощью проточной цитометрии в отношении уровней экспрессии фетального глобина и трансферринового рецептора (CD71), являющегося маркером клеточной поверхности эритроидных клеток, с использованием антител, конъюгированных с флуоресцентными красителями. Жизнеспособные клетки идентифицировали и гейтировали c исключением нежизнеспособных клеток по результатам окрашивания фиолетовым красителем Live Dead Violet. Доставка данных RNP с gRNA в HSPC приводила к повышенной процентной доле потомства эритроидных клеток, содержащих HbF, по сравнению с клетками с имитированной электропорацией в дни 7, 14 и 21 после электропорации (таблицы 6 и 7). Все включенные сайты для нацеливания были ассоциированы с >17% повышением содержания эритроидных клеток HbF+ от обоих доноров во все моменты времени - дни 7, 14 и 21 (фигура 8). Продукты ПЦР промоторных участков HBG1 и HBG2 из геномной ДНК, выделенной через 3 дня после электропорации, также подвергали секвенированию нового поколения (NGS) с определением процентной доли отредактированных аллелей в популяции клеток. Высокие процентные доли редактирования генома в обоих промоторных участках HBG1 и HBG2 (от 53% до 92% вставок/делеций) наблюдали в культурах клеток от обоих доноров, подвергнутых электропорации с использованием RNP, содержащих Cas9 и sgRNA с нацеливающими доменами GCR-0008, GCR-0048, GCR-0051 и GCR-0067 (таблицы 6 и 7), но не в контрольных клетках, в которые sgRNA не доставляли (только Cas9). Нацеливающий домен GCR-0010 был ассоциирован с меньшими, но значимыми процентными долями редактирования в обоих промоторных участках HBG1 и HBG2 (от 17% до 28% вставок/делеций) в культурах клеток от обоих доноров; тогда как GCR-0001 был ассоциирован с эффективным и селективным редактированием в HBG1 (59% и 62%) по сравнению с HBG2 (1% и 1%) у двух доноров (таблицы 6 и 7).
Нацеливающие домены GCR-0048 и GCR-0067 присутствовали как в HBG1, так и в HBG2, а другие нацеливающие домены присутствовали либо в HBG1 (GCR-0001, GCR-0008 и GCR-0010), либо в HBG2 (GCR-0051), при этом потенциальный нецелевой сайт с ошибочным спариванием пар оснований находился в другом промоторе. Одновременное расщепление в целевых/нецелевых сайтах HBG1 и HBG2 может потенциально приводить к образованию делеции и/или инверсии промежуточной геномной последовательности размером 4,9 т. о., которую также иногда называют в данном документе '4,9 т. о.' или 'HBG1-HBG2' или 'большой' инверсией или делецией. Таким образом, в совокупности три разные ПЦР-реакции использовали для выявления наличия геномов с делецией или инверсией в данном участке. Реакцию с P2 разрабатывали так, чтобы геномные последовательности без делеции или инверсии HBG1-HBG2 амплифицировались с получением продукта размером 3,8 т. о., тогда как последовательности с делецией или инверсией HBG1-HBG2 не амплифицировались. Полосу, соответствующую примерно данному размеру, выявляли во всех образцах (фигура 9), что согласуется с выявлением меньших вставок/делеций в каждом отдельном сайте для нацеливания HBG1 или HBG2 (таблицы 6 и 7). Реакцию с P3 разрабатывали так, чтобы геномные последовательности с инверсией HBG1-HBG2 амплифицировались с получением продукта размером 1,7 т. о., тогда как последовательности без данной инверсии или с делецией HBG1-HBG2/без нее не амплифицировались. Полосу, соответствующую примерно данному размеру, выявляли в культурах, подвергнутых электропорации с использованием RNP, содержащих Cas9 и sgRNA с указанными нацеливающими доменами, но не выявляли в нередактированных контрольных культурах (фигура 9). И наконец, реакцию с P1 разрабатывали с обеспечением охвата обоих участков HBG1 и HBG2, на которые осуществлялось нацеливание, так, чтобы при амплификации как последовательностей без делеции HBG1-HBG2, так и последовательностей с инверсией участка HBG1-HBG2 получать продукт размером 7,7 т. о., тогда как в результате амплификации последовательностей, содержащих делецию HBG1-HBG2, получать продукт размером 2,8 т. о. И действительно, не редактированные контрольные образцы характеризовались ярко выраженной верхней полосой, соответствующей примерно 8 т. о., и потенциально неспецифической полосой небольшой интенсивности, соответствующей примерно 2,8 т. о. В отличие от этого, культуры, подвергнутые электропорации с использованием RNP, содержащих Cas9 и sgRNA с указанными нацеливающими доменами, характеризовались ярко выраженной полосой, соответствующей примерно 2,8 т. о., и полосой слабой интенсивности, соответствующей примерно 8 т. о. (фигура 9). ДНК из каждой полосы, обозначенной звездочкой, выделяли и подвергали секвенированию нового поколения для подтверждения ее идентичности ампликону предсказанной последовательности (с инверсией или делецией HBG1-HBG2 или без них, как описано).
Для дополнительного определения характеристик последовательности участка, охватывающего сайты редактирования HBG1 и HBG2, разрабатывали четвертое условие для ПЦР длинных фрагментов (P4) с обеспечением возможности амплификации участка размером 6192 п. о., охватывающего сайты редактирования HBG1 и HBG2 для gRNA GCR-0001, GCR-0008, GCR-0010, GCR-0048, GCR-0051 и GCR-0067. В результате амплификации образцов с отредактированным геномом получали ампликоны двух размеров (1,2 т. о. и 6,2 т. о.), тогда как в случае нередактированных образцов получали ампликоны только одного размера (6,2 т. о.). Анализ последовательностей ампликонов размером 6,2 т. о. и 1,2 т. о. показал, что ампликоны размером 1,2 т. о. являются результатом делеции 4,9 т. о. между сайтами разрезания HBG1 и HBG2, тогда как ампликон размером 6,2 т. о. состоит из аллелей дикого типа и аллелей с различными вставками/делециями в сайтах редактирования HBG1 и HBG2. Анализ посредством секвенирования также показал низкий уровень инверсий между сайтами разрезания HBG1 и HBG2, при этом последовательность, вырезаемая между данными двумя сайтами, повторно встраивалась в геном в противоположном направлении. Данный анализ не является количественным, однако вероятность инверсии является очень низкой, поскольку ее выявляли в секвенированных ридах, охватывающих сайты разрезания HBG1 и HBG2, только в небольшой процентной доле (<1%).
В совокупности данные результаты свидетельствуют о том, что в дополнение к вставкам/делециям в целевом/нецелевом сайте HBG1 либо HBG2 культуры, подвергнутые электропорации с использованием RNP, содержащих Cas9 и sgRNA с указанными нацеливающими доменами, содержат отредактированные аллели с делецией или инверсией промежуточного участка HBG1-HBG2. Таким образом, постредактирование данного аллеля может представлять собой инверсию HBG1-HBG1, делецию HBG1-HBG2, вставку/делецию, локализованную в сайте HBG1, вставку/делецию, локализованную в сайте HBG2, или вставку/делецию, локализованную в сайте HBG1, вместе с вставкой/делецией, локализованной в сайте HBG2, без модификации промежуточного участка. Наиболее распространенные варианты с паттерном целевого редактирования-репарации, полученные путем редактирования с помощью gRNA GCR-0001, GCR-0008, GCR-0010, GCR-0048, GCR-0051 и GCR-0067, показаны в таблице 7-2. Показанные варианты представляют собой локализованные вставки/делеции, полученные в локусах HBG1 и HBG2, и большие делеции размером 4,9 т.о., полученные путем вырезания последовательности между сайтами разрезания HBG1 и HBG2. Локализованные вставки/делеции характеризовали с помощью ПЦР- и NGS-анализов, описанных в примере 2.1. Количественный анализ посредством ddPCR разрабатывали для определения частоты аллелей с большой делецией промежуточного участка от HBG1 до HBG2 размером 4,9 т. о. (фигура 10). Вкратце, количество копий участка, расположенного выше промотора HBG1 (показан на фигуре 10 между прямым и обратным праймерами 5,2 т.о.), определяли по отношению к количеству копий в локусе RPPH1, как описано в способах. Показатели частоты аллелей для локализованных меньших вставок/делеций рассчитывали не по отношению к общей частоте вставок/делеций, поскольку амплификация сайта HBG1 или HBG2 для NGS не будет происходить в аллелях, содержащих инверсию или делецию размером 4,9 т. о. Например, в случае с gRNA GCR-0001 частота делеции размером 4,9 т. о. составляет 35,2%, при этом остальные 64,8% (100% - 35,2%, без учета инверсий) приходятся на комбинацию аллелей дикого типа и аллелей с меньшими локализованными вставками/делециями. Следовательно, 9%-я частота делеции одной пары оснований, включающей основание A, будет составлять 5,8% от общей частоты вставок/делеций, т. е. 9% из 64,8%. Значения частоты аллелей, показанные в таблице 7-2, несколько варьируют в экспериментах, и их не следует рассматривать как абсолютные значения.
Таблица 7-2. Варианты с наиболее важным паттерном целевого редактирования-репарации (в совокупности для любой молекулы gRNA, также называемым в данном документе "патерном вставки/делеции"), полученные посредством редактирования клеток от первого донора с использованием gRNA GCR-0001, GCR-0008, GCR-0010, GCR-0048, GCR-0051 и GCR-0067. Показаны размер варианта, тип варианта (Ins=вставка, Del=делеция), эталонный аллель, вариантный аллель, исходное и конечное положение варианта относительно хромосомы 11 эталонного генома сборки hg38 и частота аллелей. Для локуса HBG2, подвергнутого редактированию с использованием gRNA GCR-0001, не было показано существенных локализованных вставок/делеций, но результаты qPCR указывали на делецию размером 4,9 т. о. *Целевой сайт HBG1/2 с ошибочным спариванием пар оснований.
(п. о.)
(HBG1)
(HBG1)
(HBG2)
(HBG1)
(HBG2)
(HBG1)
(HBG2)
(HBG1)
(HBG2)
(HBG1)
(HBG2)
Высокие значения частоты общего редактирования в локусе гамма-глобина, включая высокие значения частоты больших делеций размером 4,9 т. о. между сайтами промоторов HBG1 и HBG2, на которые осуществлялось нацеливание, наблюдали после электропорации клеток с использованием RNP, содержащих sgRNA с указанным нацеливающим доменом. Показанные паттерны целевого редактирования идентифицировали в клетках, которые характеризовались повышенным содержанием F-клеток после описанной эритроидной дифференцировки. В ряде вариантов осуществления паттерн вставок/делеций для любой молекулы gRNA, описанной в данном документе, включает наиболее частые 1, 2, 3, 4, 5 или 6 вставок/делеций, выявляемых в локусе HBG1. В ряде вариантов осуществления паттерн вставок/делеций для любой молекулы gRNA, описанной в данном документе, включает наиболее частые 1, 2, 3, 4, 5 или 6 вставок/делеций, выявляемых в локусе HBG2. В ряде вариантов осуществления паттерн вставок/делеций для любой молекулы gRNA, описанной в данном документе, включает наиболее частые 1, 2, 3, 4, 5 или 6 вставок/делеций, выявляемых в локусе HBG1, и наиболее частые 1, 2, 3, 4, 5 или 6 вставок/делеций, выявляемых в локусе HBG2, например, описанных в таблице 7-2 (но без двойного учета делеции размером примерно 4,9 т. о.).
Пример 2.4. Иллюстративные паттерны редактирования у выделенных субпопуляций HSPC после редактирования промоторного участка гамма-глобина
Способы
Способы соответствуют таким способам из примера 2.1 со следующими модификациями.
Культура клеток CD34+ человека. Клетки CD34+ человека выделяли из мобилизованной с помощью G-CSF периферической крови от взрослых доноров (Hemacare, № кат. M001F-GCSF-3) с использованием иммуноселекции (Miltenyi) согласно инструкциям производителя и размножали в течение 2 дней перед электропорацией с использованием комплексов RNP.
Сборка рибонуклеопротеиновых (RNP) комплексов на основе Cas9 и направляющей РНК, получение HSPC и электропорация RNP в HSPC. Для получения RNP с использованием одиночных направляющих RNA (sgRNA) 12 мкг каждой из sgRNA, 12 мкг белка CAS9 и 1 мкл 10 x буфера для CCE (20 мМ HEPES, 100 мМ KCL, 5 мМ MgCl2, 5% глицерин и 1 мМ DTT, добавленный в свежеприготовленном виде) объединяли в общем объеме 10 мкл, затем инкубировали при 37°C в течение 5 мин. Плотность клеток в буфере P3 + добавка составляла 1,3×108/мл. Электропорацию с использованием GCR-0067 проводили в семи повторностях, и после проведения электропорации клетки объединяли. Для условия отсутствия/контрольного условия клетки переносили непосредственно из буфера P3 в среду для размножения без проведения электропорации или добавления Cas9. После проведения электропорации с использованием комплексов RNP клетки размножали в течение дополнительных 3 дней перед осуществлением сортировки клеток посредством проточной цитометрии.
Сортировка клеток посредством проточной цитометрии с целью анализа эффективности редактирования в субпопуляциях гематопоэтических стволовых клеток и клеток-предшественников. Отредактированные культуры клеток через 3 дня после электропорации собирали и инкубировали с антителом к CD34 (BD Biosciences, № кат. 348057), антителом к CD38 (BD Biosciences, № кат. 560677), антителом к CD90 (BD Biosciences, № кат. 559869), антителом к CD45RA (BD Biosciences, № кат. 563963), антителом к CD49f (BD Biosciences, № кат. 562598) в буфере для окрашивания при FACS, состоящем из HBSS (GE Life Sciences, № кат. SH30588.01), дополненного 2% FBS (Omega Scientific, № кат. FB-11) и 2 мМ EDTA (Corning, № кат. 46-034-CL). Клетки промывали буфером для окрашивания при FACS и жизнеспособность клеток определяли путем добавления DAPI (4',6-диамидино-2-фенилиндола). Многоцветный FACS-анализ проводили на клеточном сортере FACS Aria (BD Biosciences). Установление различий между отрицательными и положительными популяциями клеток осуществляли с помощью гейтов, установленных с использованием контрольных окрашенных культур клеток, в которых каждое антитело по отдельности заменяли изотипическим и неспецифическим контрольным антителом, конъюгированным с соответствующим флуорохромом (BD Biosciences, №№ кат. 550854, 554680, 563437, 557872 и 562602). Чистоту сортированных клеток подтверждали с помощью послесортировочной проверки чистоты.
Получение и секвенирование нового поколения (NGS) геномной ДНК. Геномную ДНК получали из нередактированных HSPC и отсортированных субпопуляций редактированных HSPC через 3 дня после электропорации с использованием набора DNeasy Blood & Tissue (Qiagen, № кат. 69504). Описанный ниже анализ с помощью NGS показал отсутствие существенного редактирования в контрольных нередактированных образцах.
Получение библиотеки для NGS и секвенирование ампликонов проводили так, как описано в примере 2.1. QC данных секвенирования с помощью NGS и анализ вариантов проводили так, как описано в примере 2.1.
Количественное определение больших делеций. Количественное определение больших делеций между сайтами для нацеливания в промоторах HBG1 и HBG2 осуществляли с помощью цифровой капельной ПЦР (ddPCR) в формате неконкурентного анализа для определения количества копий согласно рекомендациям производителя. Вкратце, gDNA объединяли с супермиксом ddPCR SuperMix для работы с зондами при ddPCR (без dUTP) (BioRad, № кат. 1863024), рестриктазой HindIII-HF (NEB, № кат. R3104S) и каждой из смесей праймеров и зондов, переносили в картридж DG8 вместе с маслом для получения капель для работы с зондами (BioRad, № кат. 1863005) и с помощью устройства для создания капель QX200 (BioRad) получали капли. Капли подвергали ПЦР на амплификаторе C1000 Touch с реакционным блоком в формате 96-луночного планшета с глубокими лунками (BioRad) с последующим выявлением с помощью считывающего устройства для капельной ПЦР QX200 (BioRad). Количество копий на мкл определяли с помощью анализа с применением программного обеспечения QuantaSoft (BioRad). Набор праймеров и зонда, разработанных по индивидуальному заказу (Life Technologies, № кат. APZW76R, PN4331348, прямой праймер: ACGGATAAGTAGATATTGAGGTAAGC (SEQ ID NO: 270), обратный праймер: GTCTCTTTCAGTTAGCAGTGG (SEQ ID NO: 271), TaqMan-зонд FAM: ACTGCGCTGAAACTGTGGCTTTATAG (SEQ ID NO: 272)) использовали для амплификации gDNA в пределах межгенного участка HBG1-HBG2. Эталонный ген РНКазы P человека из набора TaqMan для анализа количества копий (Thermo Fisher, № кат. 4403326) использовали в качестве эталонного ампликона. Количество копий на мкл для ампликонов HBG1-HBG2 и гена РНКазы P находилось в пределах заявленного производителем линейного диапазона. Процентную долю делеций рассчитывали путем умножения аргумента "1 минус соотношение количества копий на мкл для амликонов HBG1-HBG2 и гена РНКазы P" на 100%. У нередактированных контрольных образцов рассчитанная процентная доля делеций составляла не более 13%, что может соответствовать фоновому уровню в данном анализе.
Результаты
Не ограничиваясь теорией полагают, что популяция CD34+ HSPC содержит клетки с различным потенциалом к приживлению, самообновлению и дифференцировке в определенный тип клеток с дополнительными маркерами, обеспечивающими дополнительное обогащение клетками с общими свойствами, в том числе гематопоэтическими стволовыми клетками для долговременного приживления (Notta, Science, 2011 Jul 8;333(6039):218-21. doi: 10.1126/science.1201219; Huntsman, Blood. 2015 Sep 24;126(13):1631-3. doi: 10.1182/blood-2015-07-660670; каждая включена в данный документ посредством ссылки во всей своей полноте). Не ограничиваясь теорией полагают, что такие субпопуляции могут обладать особым терапевтическим преимуществом при трансплантации клеток, подвергнутых редактированию генов, поскольку они могут восстанавливать гематопоэтическую систему в разные моменты времени после трансплантации. Таким образом, клетки подвергали проточной цитометрии для определения эффективности редактирования в субпопуляциях HSPC. Выделяли пять популяций клеток, из которых первая представляла собой клетки CD34+, а последующие получали с помощью одновременной сортировки в 4-х направлениях по клеткам CD34+CD45RA-CD38+, CD34+CD45RA-CD38-CD90-CD49f+, CD34+CD45RA-CD38-CD90+CD49f+ и CD34+CD45RA-CD38-CD90-CD49f- с использованием показанной (на фигуре 11) стратегии. Каждую из данных отсортированных популяций анализировали в отношении редактирования посредством индивидуального секвенирования участков, локализованных в целевых сайтах HBG1 и HBG2, а также посредством выявления делеции промежуточного участка HBG1-HBG2. Значения частоты делеции (т. е. вырезания) HBG1-HBG2 были сопоставимо высокими во всех субпопуляциях, находясь в диапазоне от 69 до 81 процента (фигура 12). Локальную амплификацию в промоторном участке HBG1 и HBG2 по отдельности и NGS использовали для определения % редактирования в каждом сайте (небольшие вставки/делеции). Аллели с инверсиями или делециями, обусловленными целенаправленным воздействием в обоих промоторах, не будут амплифицироваться в анализе. Среди аллелей без делеции или инверсии HBG1-HBG2 редактирование было одинаково высоким во всех субпопуляциях, находясь в диапазоне от 53 до 73 процентов для HBG1 и от 75 до 91 процента для HBG2. Минимальное общее редактирование вычисляли путем сложения процентной доли геномов с делецией HBG1-HBG2 с процентной долей геномов без делеции HBG1-HBG2 с редактированием в HBG2 (минимальное общее редактирование = % с делецией плюс % без делеции [100 минус % с делецией без учета инверсий] умножить на % отредактированных в HBG2). Локализованные небольшие вставки/делеции в HBG1 не включали, поскольку не смогли определить какую долю от % редактирования в HBG1 составляет аллель со вставками/делециями, локализованными только в HBG1, и какую долю составляет аллель со вставками/делециями, совместно присутствующими как в HBG1, так и HBG2. Было подсчитано, что минимальное общее редактирование находится в диапазоне от 92 до 97 процентов во всех субпопуляциях. Паттерны редактирования для вставок/делеций, локализованных в целевых сайтах HBG1 и HBG2, также были сходными во всех субпопуляциях, при этом наиболее часто наблюдаемые паттерны редактирования были общими для всех субпопуляций. Для всех субпопуляций и каждого сайта, HBG1 или HBG2, три наиболее важные паттерны вставок/делеций включали делецию 6 п. о., делецию 5 п. о. и делецию 1 п. о. (фигура 13A (локус HBG1); фигура 13B (локус HBG2)). Подводя итог, сопоставимые значения частоты редактирования и паттерны среди общих HSPC и субфракций, включая определенные долговременно приживляющиеся гематопоэтические стволовые клетки CD34+CD45RA-CD38-CD90+CD49f+, поддерживают применимость описанного в данном документе подхода к редактированию генов для трансплантации HSPC.
Пример 2.5. Колониеобразующая способность у HSPC после редактирования промоторного участка гамма-глобина
Способы
Способы соответствуют таким способам из примера 2.1 со следующими модификациями.
Культура клеток CD34+ человека. Клетки CD34+ человека получали из костного мозга от здоровых взрослых доноров (№ кат. Lonza 2M-101D). Клетки оттаивали, затем размножали в течение 2 дней перед электропорацией с использованием комплексов RNP.
Сборка рибонуклеопротеиновых (RNP) комплексов на основе Cas9 и направляющей РНК, получение HSPC и электропорация RNP в HSPC. Для получения RNP с использованием одиночных направляющих RNA (sgRNA) 12 мкг каждой из sgRNA, 12 мкг белка CAS9 и 1 мкл 10 x буфера CCE (20 мМ HEPES, 100 мМ KCL, 5 мМ MgCl2, 5% глицерин и 1 мМ DTT, добавленный в свежеприготовленном виде) объединяли в общем объеме 10 мкл, затем инкубировали при 37°C в течение 5 мин. Плотность клеток в буфере P3 + добавка составляла 6,64×106/мл. Электропорацию клеток от каждого из двух независимых доноров проводили в двух повторностях. Для условия отсутствия/контрольного условия добавляли среду-носитель вместо sgRNA. После проведения электропорации с использованием комплексов RNP клетки возвращали в среду для размножения.
Получение и секвенирование нового поколения (NGS) геномной ДНК. Геномную ДНК получали из нередактированных HSPC и отсортированных субпопуляций редактированных HSPC через 3 дня после электропорации с использованием набора DNeasy Blood & Tissue (Qiagen, № кат. 69504). Описанный ниже анализ с помощью NGS показал отсутствие существенного редактирования в контрольных образцах, подвергнутых электропорации с использованием Cas9 в отдельности.
Получение библиотеки для NGS и секвенирование ампликонов проводили так, как описано в примере 2.1. QC данных секвенирования с помощью NGS и анализ вариантов проводили так, как описано в примере 2.1.
Количественное определение больших делеций. Количественное определение больших делеций между сайтами для нацеливания в промоторах HBG1 и HBG2 осуществляли с помощью цифровой капельной ПЦР (ddPCR) в формате неконкурентного анализа для определения количества копий согласно рекомендациям производителя. Вкратце, gDNA объединяли с супермиксом ddPCR SuperMix для работы с зондами при ddPCR (без dUTP) (BioRad, № кат. 1863024), рестриктазой HindIII-HF (NEB, № кат. R3104S) и каждой из смесей праймеров и зондов, переносили в картридж DG8 вместе с маслом для получения капель для работы с зондами (BioRad, № кат. 1863005) и с помощью устройства для создания капель QX200 (BioRad) получали капли. Капли подвергали ПЦР на амплификаторе C1000 Touch с реакционным блоком в формате 96-луночного планшета с глубокими лунками (BioRad) с последующим выявлением с помощью считывающего устройства для капельной ПЦР QX200 (BioRad). Количество копий на мкл определяли с помощью анализа с применением программного обеспечения QuantaSoft (BioRad). Набор праймеров и зонда, разработанных по индивидуальному заказу (Life Technologies, № кат. APZW76R, PN4331348, прямой праймер: ACGGATAAGTAGATATTGAGGTAAGC (SEQ ID NO: 273), обратный праймер: GTCTCTTTCAGTTAGCAGTGG (SEQ ID NO: 274), TaqMan-зонд FAM: ACTGCGCTGAAACTGTGGCTTTATAG (SEQ ID NO: 275)) использовали для амплификации gDNA в пределах межгенного участка HBG1-HBG2. Эталонный ген РНКазы P человека из набора TaqMan для анализа количества копий (Thermo Fisher, № кат. 4403326) использовали в качестве эталонного ампликона. Количество копий на мкл для ампликонов HBG1-HBG2 и гена РНКазы P находилось в пределах заявленного производителем линейного диапазона. Процентную долю делеций рассчитывали путем умножения аргумента "1 минус соотношение количества копий на мкл для амликонов HBG1-HBG2 и гена РНКазы P" на 100%. У нередактированных контрольных образцов рассчитанная процентная доля делеций составляла не более 9%, что может соответствовать фоновому уровню в данном анализе.
Анализа колониеобразующей активности клеток. Через два дня после доставки RNP осуществляли подсчет жизнеспособных клеток с помощью проточной цитометрии на LSRFortessa (BD Biosciences) с использованием пробирок TruCount (BD Biosciences, № кат. 340334) согласно рекомендациям производителя. Нежизнеспособные клетки определяли с помощью DAPI (4',6-диамидино-2-фенилиндола). Анализ проводили с использованием программного обеспечения FlowJo (Tree Star). Для анализа колониеобразующей активности (CFU) клетки и 1x антибиотика/противогрибкового средства (Gibco, № кат. 10378-016) добавляли в метилцеллюлозную среду (StemCell Technologies) из набора MethoCult H4034 Optimum (Stemcell Technologies) и высевали в объеме 1 мл в планшеты SmartDish (StemCell Technologies) в трех повторностях. Чашки для культивирования инкубировали в увлажненном инкубаторе при 37°C. Визуальную оценку культур проводили в день 14 после высевания с использованием StemVision (Stemcell Technologies). Колонии подсчитывали вручную с использованием программного обеспечения для маркировки колоний Colony Marker software (Stemcell Technologies). Количество колоний на лунку (среднее для трех лунок) делили на количество клеток, высеянных на мл Methocult (в диапазоне от 226 до 318), и умножали на 1000 с получением количества CFU на 1000 клеток.
Результаты
Авторы настоящего изобретения показали в данном документе, что HSPC являются функциональными в анализе колониеобразующей активности после нацеленного разрывания специфических последовательностей в пределах промоторных участков HBG1 и HBG2, ассоциированных с продуцированием F-клеток. HSPC с отредактированным и нередактированным геномом оценивали в отношении состава клеток-предшественников и потенциала к дифференцировке с помощью анализа колониеобразующей активности. Колонии подсчитывали и относили к категории полученных из эритроидных клеток-предшественников (CFU эритроидного ряда [CFU-E] и взрывообразующая единица эритроидного ряда [BFU-E]), клеток-предшественников гранулоцитов и/или макрофагов (CFU гранулоцита, макрофага [CFU-GM]; CFU гранулоцита [CFU-G] и CFU макрофага [CFU-M]) или плюрипотентных клеток-предшественников (CFU гранулоцита, эритроцита, макрофага, мегакариоцита [CFU-GEMM]).
Таблица 8. Перечень выбранных gRNA, нацеливающих на промоторные участки HBG1 и HBG2, используемых в данном исследовании для редактирования клеток от первого независимого донора.
Таблица 9. Перечень выбранных gRNA, нацеливающих на промоторные участки HBG1 и HBG2, используемых в данном исследовании для редактирования клеток от второго независимого донора.
Образцы от обоих доноров, подвергнутые электропорации с использованием RNP с указанными gRNA, характеризовались эффективным редактированием, при этом они содержали как вставки/делеции, локализованные в целевых/нецелевых сайтах промоторного участка HBG1 и HBG2, так и делеции промежуточного участка (таблицы 8 и 9). Отредактированные культуры были ассоциированы со снижением общей колониеобразующей способности (таблицы 8 и 9), что, вероятно, указывает на сниженную приспособляемость клеток, подвергнутых редактированию. Несмотря на данное снижение общего количества колоний, в образце от по меньшей мере одного донора наблюдали все из колоний клеток эритроидного ряда, гранулоцитов/макрофагов и плюрипотентных клеток (таблицы 8 и 9). Кроме того, были минимальные различия в доле типов колоний между нередактированными и отредактированными образцами (фигура 14), что указывает на то, что культуры клеток, подвергнутые редактированию в данных целевых сайтах, не обладали способностью к смещенной дифференцировке.
Пример 2.6. Клеточная пролиферация HSPC in vitro после редактирования промоторного участка гамма-глобина
Способы
Способы соответствуют таким способам из примера 2.1 со следующими модификациями.
Культура клеток CD34+ человека. Клетки CD34+ человека получали из костного мозга здоровых взрослых доноров (Lonza, № кат. 2M-101D и Hemacare, № кат. BM34-C). Клетки оттаивали, затем размножали в течение 2 дней перед электропорацией с использованием комплексов RNP.
Сборка рибонуклеопротеиновых (RNP) комплексов на основе Cas9 и направляющей РНК, получение HSPC и электропорация RNP в HSPC. Для получения RNP с использованием одиночных направляющих RNA (sgRNA) 12 мкг каждой из sgRNA, 12 мкг белка CAS9 и 1 мкл 10 x буфера CCE (20 мМ HEPES, 100 мМ KCL, 5 мМ MgCl2, 5% глицерин и 1 мМ DTT, добавленный в свежеприготовленном виде) объединяли в общем объеме 10 мкл, затем инкубировали при 37°C в течение 5 мин. Плотность клеток в буфере P3 + добавка составляла от 1×107 до 2,5×107/мл. Электропорацию клеток от каждого из трех независимых доноров проводили в одной повторности. Для условия отсутствия/контрольного условия добавляли среду-носитель вместо sgRNA. После проведения электропорации с использованием комплексов RNP клетки возвращали в среду для размножения.
Получение и секвенирование нового поколения (NGS) геномной ДНК. Геномную ДНК получали из нередактированных и отредактированных HSPC через 3 дня после электропорации с использованием раствора для экстракции ДНК Quick Extract (Epicentre, № кат. QE09050) или набора DNeasy Blood & Tissue (Qiagen, № кат. 69504). Описанный ниже анализ с помощью NGS показал отсутствие существенного редактирования в контрольных образцах, подвергнутых электропорации с использованием Cas9 в отдельности.
Получение библиотеки для NGS и секвенирование ампликонов проводили так, как описано в примере 2.1. QC данных секвенирования с помощью NGS и анализ вариантов проводили так, как описано в примере 2.1.
Пролиферация и фенотипирование клеток. Через два дня после доставки RNP осуществляли подсчет жизнеспособных клеток с помощью проточной цитометрии на LSRFortessa (BD Biosciences) с использованием пробирок TruCount (BD Biosciences, № кат. 340334) согласно рекомендациям производителя. Нежизнеспособные клетки определяли с помощью DAPI (4',6-диамидино-2-фенилиндола), а присутствие в составе клеток CD34+ и CD34+CD90+ определяли путем добавления антитела к CD34 (BD Biosciences, № кат. 348057, BD Biosciences, № кат. 340666 или eBioscience, № кат. 25-0349-425) и антитела к CD90 (BD Biosciences, № кат. 559869) в буфер для окрашивания при FACS, состоящий из HBSS (GE Life Sciences, № кат. SH30588.01), дополненный 2% FBS (Omega Scientific, № кат. FB-11) и 2 мМ EDTA (Corning, № кат. 46-034-CL). Анализ проводили с использованием программного обеспечения FlowJo (Tree Star). Затем клетки высевали в среду для размножения в количестве 2,0×104 либо 1,0×105 жизнеспособных клеток/мл и культивировали в течение 7 дней. В культуры, которые высевали в количестве 1,0×105/мл, в ходе периода культивирования добавляли свежеприготовленную среду для 3- или 4-кратного разбавления. Через 7 дней культивирования клетки еще раз подсчитывали так, как указано выше. Через 7 дней культивирования клетки дополнительно анализировали в отношении экспрессии поверхностных маркеров после окрашивания с использованием следующих панелей антител. Панель 1: антитела, специфичные к CD38 (конъюгат с FITC, BD Biosciences № 340926, клон HB7), эпитопу 1 CD133 (конъюгат с PE, Miltenyi № 130-080-801, клон AC133), CD34 (конъюгат с PerCP, BD Biosciences № 340666, клон 8G12), CD90 (конъюгат с APC, BD Biosciences № 559869, клон 5E10), CD45RA (конъюгат с Pe-Cy7, eBioscience № 25-0458-42, клон HI100). Панель 2: CD34 (конъюгат с PerCP, BD Biosciences № 340666, клон 8G12), CD33 (конъюгат с PE-Cy7, BD Biosciences № 333946, клон P67.6), CD14 (конъюгат с APC-H7, BD Biosciences № 560270, клон MϕP9), CD15 (конъюгат с PE, Biolegend № 301905, клон HI98). Панель 3: CD34 (конъюгат с PerCP, BD Biosciences № 340666, клон 8G12), CD41a (конъюгат с APC-H7, BD Biosciences № 561422, клон HIP8), CD71 (конъюгат с FITC, BD Biosciences № 555536, клон M-A712), CD19 (конъюгат с PE, BD Biosciences № 340720, клон SJ25C1), CD56 (конъюгат с APC, Biolegend № 318310, клон HCD56). Соответствующие панели антител изотипического контроля использовали для параллельного окрашивания культур. Нежизнеспособные клетки определяли путем окрашивания с помощью DAPI (4',6-диамидино-2-фенилиндола). Окрашенные образцы анализировали в отношении экспрессии белков клеточной поверхности на проточном цитометре LSRFortessa (BD Biosciences). Результаты анализировали с использованием Flowjo и данные представляли в виде % DAPI-отрицательной популяции жизнеспособных клеток.
Результаты
Авторы настоящего изобретения показали в данном документе, что HSPC могут размножаться с типичным составом клеток in vitro после нацеленного разрывания специфических последовательностей в пределах промоторных участков HBG1 и HBG2, ассоциированных с продуцированием F-клеток. HSPC с отредактированным и нередактированным геномом оценивали в отношении способности к пролиферации и состава клеток в условиях культивирования, стимулирующих размножение HSPC. Образцы от независимых доноров, подвергнутые электропорации с использованием RNP, содержащих GCR-0067, характеризовались эффективным редактированием (таблица 9-2).
Таблица 9-2. Процент ампликонов, отредактированных с помощью указанной gRNA в промоторном участке HBG1 или HBG2, в клетках от трех независимых доноров.
Отредактированные культуры были ассоциированы со снижением общей пролиферативной способности, что, вероятно, указывает на несколько сниженную приспособляемость клеток, подвергнутых редактированию, хотя это не достигало уровня значимости у всех трех независимых доноров клеток (фигура 15). Подобные снижения наблюдали в обогащенной CD34+CD90+ популяции гематопоэтическиех стволовых клеток, как и в общей популяции CD34+, что указывает на то, что на данную популяцию дифференцировка не оказывала воздействия (фигура 15). В данных условиях культивирования ожидается, что будут присутствовать как HSPC, так и дифференцированное потомство, следовательно, состав клеток дополнительно анализировали в отношении экспрессии более обширной панели маркеров клеточной поверхности. Различия данных популяций клеток проиллюстрированы на фигуре 16. Состав клеток был подобным в культурах с отредактированным и нередактированным геномом у всех трех независимых доноров клеток, при этом значимого отличия в указанной популяции не наблюдали при использовании двухвыборочного t-критерия для независимых выборок (фигура 17). Большие планки погрешностей для популяции CD33+ являются результатом, полученным для одного донора в культурах клеток как с отредактированным геномом, так и нередактированным геномом, в которых содержалось незначительное количество клеток CD33+ (фигура 17).
Пример 3. Оценка вариантов Cas9
Оценка в гематопоэтических стволовых клетках CD34+
Авторы настоящего изобретения оценивали 14 очищенных белков Cas9 из Streptococcus pyogenes (SPyCas9) путем измерения их эффективности в нокауте гена бета-2-микроглобулина (B2M) в первичных гематопоэтических стволовых клетках человека (HSC). Эти белки делили на 3 группы. Первая группа состояла из вариантов SPyCas9 с улучшенной селективностью (Slaymaker et al. 2015, Science 351: 84 (e1.0, e1.1 и K855A); Kleinstiver et al. 2016, Nature 529: 490 (HF)). Вторая группа состояла из SPyCas9 дикого типа с различными количествами и/или положениями сигнала ядерной локализации SV40 (NLS) и 6x гистидиновой (His6) (SEQ ID NO: 247) или 8x гистидиновой (His8) метки (SEQ ID NO: 248) с сайтом расщепления TEV или без него, а также белка SPyCas9 с двумя цистеиновыми заменами (C80L, C574E), которые, как сообщалось, стабилизируют Cas9 для исследований структурных характеристик (Nishimasu et al. 2014, Cell 156:935). Третья группа состояла из тех же рекомбинантных SPyCas9, полученных с помощью разных способов (фигура 6). Нокаут B2M определяли с помощью FACS и секвенирования нового поколения (NGS).
Способы
Материалы
1. Устройство для электропорации Neon (Invitrogen, MPK5000)
2. Набор для электропорации Neon (Invitrogen, MPK1025)
3. crRNA (последовательность нацеливающего доменаGGCCACGGAGCGAGACAUCU (SEQ ID NO: 276), комплементарная последовательности в гене B2M, слитая с SEQ ID NO: 201)
4. tracrRNA (SEQ ID NO: 224).
5. Буфер для хранения Cas9: 20 мМ Tris-Cl, pH 8,0, 200 мМ KCl, 10 мМ MgCl2
6. CD34+ HSC, полученные из костного мозга (Lonza, 2M-101C)
7. Среда для культивирования клеток (Stemcell Technologies, StemSpam SFEM II со StemSpam CC-100)
8. Промывочный буфер для FACS: 2% FCS в PBS
9. Блокирующий буфер для FACS: из расчета на мл PBS добавляют 0,5 мкг IgG мыши, 150 мкг реагента, блокирующего Fc, 20 мкл FCS
10. Суспензия Chelex: 10% Chelex 100 (bioRad, № кат. 142-1253) в H2O
11. Антитело к B2M: Biolegend, № кат. 316304
Способ
Клетки оттаивали и выращивали, следуя рекомендациям Lonza, добавляли среду каждые 2-3 дня. В день 5 клетки осаждали центрифугированием при 200 x g в течение 15 мин., один раз промывали с помощью PBS, ресуспендировали клетки в буфере T из набора NEON в количестве 2×104/мкл, помещали на лед. Разбавляли белок Cas 9 с помощью буфера для хранения Cas9 до 5 мг/мл. Восстанавливали crRNA и tracrRNA до 100 мкМ с помощью H2O. Рибонуклеопротеиновый комплекс (RNP) получали путем смешивания по 0,8 мкл каждого из белка CAS 9, crRNA и tracrRNA с 0,6 мкл буфера для хранения Cas9, инкубировали при комнатной температуре в течение 10 мин. Смешивали 7 мкл HSC с комплексом RNP в течение двух минут и переносили все 10 мкл в микродозатор Neon, осуществляли электропорацию при 1700 вольт, в течение 20 мс и за 1 импульс. После электропорации клетки сразу же переносили в лунку 24-луночного планшета, содержащую 1 мл среды, предварительно уравновешенной при 37°C, 5% CO2. Через 72 ч после электропорации клетки собирали для анализа с помощью FACS и NGS.
FACS: 250 мкл клеток из каждой лунки 24-луночного планшета переносили в лунки 96-луночного планшета с U-образным дном и клетки осаждали центрифугированием. Однократно промывали с помощью 2% FCS (фетальной телячьей сыворотки)-PBS. В клетки добавляли 50 мкл блокирующего буфера для FACS и инкубировали на льду в течение 10 минут, добавляли 1 мкл меченного с помощью FITC антитела к B2M и инкубировали в течение 30 минут. Однократно промывали с использованием 150 мкл промывочного буфера для FACS с последующей дополнительной промывкой с использованием 200 мкл промывочного буфера для FACS. Клетки ресуспендировали в 200 мкл буфера FACS для FACS-анализа.
Подготовка образцов для NGS: 250 мкл суспензии клеток из каждой лунки 24-луночного планшета переносили в пробирку типа эппендорф объемом 1,5 мл, добавляли 1 мл PBS и клетки осаждали центрифугированием. Добавляли 100 мкл суспензии Chelex, инкубировали при 99°C в течение 8 минут и перемешивали на вортексе в течение 10 секунд с последующими инкубированием при 99°C в течение 8 минут, перемешиванием на вортексе в течение 10 секунд. Смолу осаждали центрифугированием при 10000 x g в течение 3 минут и надосадочную жидкость, содержащую лизат, использовали для ПЦР. Отбирали 4 мкл лизата и проводили ПЦР-реакцию с использованием специфичных к b2m праймеров (b2mg67F: CAGACAGCAAACTCACCCAGT (SEQ ID NO: 277), b2mg67R: CTGACGCTTATCGACGCCCT (SEQ ID NO: 278)), используя набор Titanium (Clonetech, № кат. 639208) и следуя инструкциям производителя. Использовали следующие условия для ПЦР: 5 минут при 98°C в течение 1 цикла; 15 секунд при 95°C, 15 секунд при 62°C и 1 минута при 72°C в течение 30 циклов и в завершении 3 минуты при 72°C в течение 1 цикла. Продукт ПЦР использовали для NGS.
Получение библиотеки для NGS и секвенирование ампликонов проводили так, как описано в примере 2.1. QC данных секвенирования с помощью NGS и анализ вариантов проводили так, как описано в примере 2.1.
Статистический анализ. Процентную долю клеток с KO по B2M, определенную с помощью FACS, и процент вставок/делеций, определенный с помощью NGS, использовали для оценки эффективности расщепления CAS 9. Эксперимент планировали с использованием Cas9 в качестве фиксированного эффекта. В каждом эксперименте использовали вложения по донорам в качестве вложенных случайных эффектов. Следовательно, смешанную линейную модель использовали для анализа данных, полученных после проведения FACS и NGS.
Результаты
С целью нормализации вариаций между различными экспериментами и донорами авторы настоящего изобретения графически представляли активность каждого белка относительно iProt105026, - оригинальной конструкции с двумя NLS SV40, фланкирующими SPyCas9 дикого типа, и His6-меткой (SEQ ID NO: 247) на C-конце белка (фигура 6). Статистический анализ показал, что по сравнению с эталонным белком Cas9 iProt105026 белки iProt106331, iProt106518, iProt106520 и iProt106521 значимо не отличались по нокауту B2M в HSC, тогда как другие тестируемые варианты (PID426303, iProt106519, iProt106522, iProt106545, iProt106658, iProt106745, iProt106746, iProt106747, iProt106884) отличались с высоким уровнем значимости от эталонного iProt105026 по нокауту B2M в HSC. Обнаружили, что перемещение His6-метки (SEQ ID NO: 247) от C-конца на N-конец (iProt106520) не влияет на активность белка (фигура 6). Одного NLS было достаточно для поддержания активности, только если его помещали на C-конец белка (iProt106521 по сравнению с iProt106522, фигура 6). Очищенные белки, полученные в способе 1, характеризовались неизменно более высокой эффективностью нокаута, чем белки, полученные в способах 2 и 3 (iProt106331 по сравнению с iProt106545 и PID426303, фигура 6). В целом варианты SPyCas9 c отмеченной улучшенной селективностью были не столь активными, как SPyCas9 дикого типа (iProt106745, iProt106746 и iProt106747, фигура 6). Примечательно, что iProt106884 не разрезал сайт для нацеливания. Это согласуется с сообщением Kleinstiver et al о том, что данный вариант оказался неспособным осуществлять разрезание в 20% включительно допустимых сайтов для нацеливания в клетках млекопитающего (Kleinstiver et al. 2016, Nature 529: 490). И наконец, вариант Cas9 с двумя цистеиновыми заменами (iProt106518) сохранял высокие уровни ферментативной активности (фигура 6).
Пример 4. Количественное определение изменений субъединиц гемоглобина после редактирования гена с помощью капиллярного электрофореза-масс-спектрометрии
После редактирования гена в HSC в дополнение к определению продуцирования фетального гемоглобина с помощью проточной цитометрии также определяли изменения отдельных субъединиц гемоглобина в эритроидных клетках с помощью капиллярного электрофореза-масс-спектрометрии (CE-MS). Клетки CD34+, полученные из периферической крови от пациентов с серповидноклеточным заболеванием, подвергали имитирующему редактированию в присутствии белка Cas9 (с двумя NLS и одной His-меткой, iProt106331) и в отсутствие направляющей РНК либо подвергали редактированию гена в присутствии и белка Cas9, и направляющей РНК sg0067 и осуществляли дифференцировку в клетки эритроидного ростка при культивировании, как описано ранее. В день 14 эритроидной дифференцировки одинаковое количество клеток в случае каждого условия окрашивали с помощью конъюгированного с FITC антитела, распознающего фетальный гемоглобин (HbF), и клетки подвергали проточной цитометрии с количественным определением индуцирования выработки HbF после редактирования гена. Проточная цитометрия показала 30-50% повышение экспрессии HbF+ клеток (таблица 10). Параллельно различные количества эритроидных клеток (6, 12, 66 и 99 миллионов) на условие собирали и подвергали CE-MS с количественным определением субъединиц альфа-глобина, нормального бета-глобина (HbB), бета-глобина, характерного для серповидной формы (HbS), и фетального гамма-глобина (HbF), и данные нормализовали относительно начального количества клеток. С помощью CE-MS можно было выявить все субъединицы глобина в концентрации всего лишь 600 клеток/мкл. Результаты показали, что отредактированные образцы от пациентов с серповидноклеточным заболеванием характеризовались ~40% повышением уровня гамма-глобина и одновременным 50% снижением уровня бета-глобина, характерного для серповидной формы (фигура 18).
Таблица 10. Описание обработки и количества клеток в образцах, в отношении которых проводили количественное определение субъединиц глобина с помощью CE-MS. Экспрессию фетального гемоглобина в данных образцах также измеряли с помощью проточной цитометрии с использованием антитела к HbF, конъюгированного с флуорофором.
Пример 5. Подвергнутые редактированию гена гематопоэтические стволовые клетки (HSC) характеризовались способностью к долговременному приживлению и поддержанию восстановления в несколько клеточных линий дифференцировки
Для оценки функции стволовых клеток у подвергнутых редактированию гена HSC отредактированные HSC человека трансплантировали мышам с иммунной недостаточностью для исследования долговременной регенерации гематопоэтических клеток. Пятьсот тысяч клеток CD34+, полученных из костного мозга человека, оттаивали в день 0, подвергали электропорации в день 3 с использованием комплекса RNP для имитации (Cas9 в отдельности и без gRNA) или комплекса RNP, образованного с Cas9 и sgRNA, содержащей нацеливающий домен CR001128 (иногда называемый в данном документе sg1128) (AUCAGAGGCCAAACCCUUCCGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUU (SEQ ID NO: 181), содержащий последовательность нацеливающего домена AUCAGAGGCCAAACCCUUCC (SEQ ID NO: 180)). Затем клетки поддерживали в такой же концентрации и в среде, описанной в примере 2.1, и в день 6 культивирования все клетки из каждого варианта обработки трансплантировали мышам NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG), подвергнутым воздействию сублетальным ионизирующим облучением в дозе 2 грей (фигура 19). Авторы настоящего изобретения наблюдали примерно 30-40% приживление клеток человека в костном мозге реципиентов через 16 недель после трансплантации. Кроме того, данный уровень приживления был сравним с таким уровнем у контроля с имитированной обработкой, что свидетельствует о том, что редактирование гена не нарушает способность HSC к долговременному приживлению (фигура 20). У подвергнутых редактированию гена трансплантированных HSC сохранялась способность к регенерации в нормальные миелоидные, B-лимфоидные и T-лимфоидные клетки через 4, 8, 12, 16 недель после трансплантации (фигура 21). Эти данные демонстрируют, что подвергнутые редактированию гена HSC характеризовались способностью к долговременному приживлению и поддержанию нормального восстановления в несколько клеточных линий дифференцировки, в том числе до 16 недель включительно после трансплантации.
Пример 6. Подвергнутые редактированию гена прижившиеся на длительный срок HSC характеризовались способностью к устойчивому продуцированию фетального гемоглобина (HbF)
В отдельном исследовании авторы настоящего изобретения оценивали функцию стволовых клеток у HSC, подвергнутых редактированию гена с использованием gRNA из промоторного участка гамма-глобина (sg-G0008, sg-G0051, sg-G0010, sg-G0048, sg-G0067 в таблице 11), по сравнению с gRNA из специфического для эритроидных клеток энхансерного участка гена BCL11A (sg-G1128). HSC человека, отредактированные с использованием данных gRNA, трансплантировали мышам NSG с иммунной недостаточностью для исследования регенерации гематопоэтических клеток (фигура 22).
Таблица 11. Направляющие РНК, используемые в исследовании по трансплантации, сконструированные для нацеливания на промоторный участок гамма-глобина.
Процедура эксперимента
Оттаивание и культивирование CD34+
Клетки CD34+ из костного мозга оттаивали и культивировали. Каждый флакон, содержащий 1 миллион клеток CD34+ из костного мозга, вынимали из жидкого азота, опрыскивали 70% этанолом и подвергали быстрому оттаиванию на водяной бане при 37°C до тех пор, пока не оставался небольшой ледяной осадок. Флакон опрыскивали 70% этанолом и протирали. Используя пипетку на 5 мл, содержимое флакона переносили в пробирку Falcon объемом 50 мл. Содержимое криофлакона ополаскивали однократно с помощью 1 мл предварительного нагретой IMDM, 10% FBS и по каплям добавляли в пробирку Falcon объемом 50 мл; 25 мл предварительного нагретой IMDM, 10% FBS медленно добавляли в течение 2 мин. к клеткам, слегка взбалтывая с целью смешивания. Клетки центрифугировали при 300g в течение 10 мин. Двадцать восемь миллионов клеток CD34+ культивировали в StemSpan SFEM + 100 нг/мл SCF/IL6/Flt3L/TPO + 500 нМ соединения 4 + 1X пенициллина/стрептомицина из расчета 0,2-0,5×10e6 клеток/мл.
Электропорация с использованием RNP
Через сорок восемь часов после оттаивания клетки подвергали электропорации с использованием 1) только Cas9 или 2) комплекса RNP с Cas9, содержащего sg1128 (описанного выше) или одну из sgRNA, приведенных в таблице 11. Вкратце, RNP получали с использованием белка Cas9 и sgRNA в молярном соотношении 1:2 с получением смеси RNP с 10 мкМ Cas9 и 20 мкМ sgRNA. 5 мкл 10 мкМ RNP добавляли к 1 миллиону клеток CD34+ в 20 мкл буфера P3 (Lonza). 22 мкл смеси для электропорации переносили в одну лунку 96-луночного планшета для электропорации и осуществляли электропорацию с использованием программы CA-137 на системе Lonza Amaxa 96-well Shuttle или Lonza Nucleofector. Сразу же после электропорации 80 мкл среды для культивирования (StemSpan SFEM + 100 нг/мл SCF/IL6/Flt3L/TPO + 500 нМ соединения 4 + 1X пенициллина/стрептомицина) добавляли к подвергнутому электропорации образцу.
Через двадцать четыре часа после электропорации каждой мыши трансплантировали клетки в количестве 500 тыс, что эквивалентно исходным клеткам. 30000-100000 клеток использовали для эритроидной дифференцировки с целью оценки индукции выработки HbF после редактирования. Оставшиеся клетки оставляли в культуре в течение дополнительных 24 ч (общее время после электропорации 48 ч) для анализа с помощью NGS частоты редактирования.
Трансплантация
Десять мышей NSG/условие подвергали воздействию ионизирующим облучением за 4-24 ч до трансплантации в дозе 200 рад с применением устройства для рентгеновского облучения RadSource или в дозе 2 грей с применением устройства для облучения изотопом цезий 138. Мышам трансплантировали клетки в пятьсоттысячном эквиваленте исходным клеткам посредством инъекции в хвостовую вену. После трансплантации мышам проводили антибиотикотерапию в течение 4-8 недель. Мышей обрабатывали в соответствии с процедурами Институционального комитета по уходу за животными и следуя утвержденному IACUC протоколу. Через 4, 8, 12, 16 и 20 недель посредством пункции хвостовой вены отбирали периферическую кровь для анализа приживления и линии дифференцировки. Через 8-9 недель и 20 недель костный мозг отбирали для анализа (с помощью проточной цитометрии, qPCR с использованием набора Taqman и NGS, описанных в предыдущих протоколах, например, в примере 2.1), а также для сортировки клеток hCD45+CD34+ для эритроидной дифференцировки, описанной в предыдущих протоколах. В неделю 20 осуществляли сортировку клеток hCD45+CD34+ и осуществляли их эритроидную дифференцировку.
На фигуре 22 показана схематическая диаграмма исследования трансплантации для оценки функции стволовых клеток у HSC, подвергнутых редактированию с использованием sgRNA из промоторного участка гамма-глобина (sg-G0008, sg-G0051, sg-G0010, sg-G0048, sg-G0067), по сравнению с gRNA из специфического для эритроидных клеток энхансерного участка гена BCL11A (sg-G1128; также называемого sg1128). Пятьсот тысяч клеток CD34+ человека оттаивали в день 0, подвергали электропорации с использованием комплекса RNP для имитации (Cas9 в отдельности и без gRNA) или комплекса RNP, полученного с Cas9 (NLS-Cas9-NLS-His6 ("His6" раскрыт под SEQ ID NO: 247)) и разными gRNA, в день 3. В день 6 все клетки из каждого варианта условия собирали и трансплантировали мышам NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG), подвергнутым воздействию сублетального ионизирующего излучения в дозе 2 Гр (фигура 22). У мышей отбирали кровь через 4, 8, 12, 16 и 20 недель после трансплантации. Через 8 и 20 недель после трансплантации также собирали клетки из костного мозга животных для исследования приживления клеток человека в костном мозге.
Результаты
Подвергаемые редактированию HSC характеризовались способностью к долговременному приживлению и поддержанию дифференцировки в несколько клеточных линий у мышей NSG
Результаты показали, что sgRNA из промоторного участка гамма-глобина обеспечивали в среднем 20-40% приживление в костном мозге через 8 недель после трансплантации, сопоставимое с sg-G1128. В то время как приживление в ранние моменты времени может обеспечиваться короткоживущими гематопоэтическими клетками-предшественниками, приживление в более поздние моменты времени (20 недель) является доказательством восстановления за счет длительно пролиферирующих HSC. В случае тестируемых sgRNA наблюдали 5-22% приживление в костном мозге через 20 недель после трансплантации (фигуры 23A-F и 24A, а также 24B). Важно отметить, что для достижения такого уровня приживления инъецировали каждой мыши только ~500000 клеток CD34+, подвергнутых имитирующему редактированию или редактированию генома. Данный уровень приживления был сопоставим с такими уровнями в других исследованиях с трансплантацией 1 миллиона клеток CD34+, подвергнутых редактированию генома, что указывает на высокую эффективность приживления данных клеток. Кроме того, наблюдали нормальное восстановление миелоидных, B-лимфоидных и T-лимфоидных клеток через 4, 8, 12, 16, 20 недель после трансплантации (фигуры 23A-F и 25) при сравнении всех групп, подвергнутых редактированию гена, с контролем, представляющим собой имитацию редактирования. Эти данные демонстрируют то, что за счет нацеливания gRNA на промоторный участок гамма-глобина, который не картируется на любом известном HPFH, стратегия редактирования генома не влияет ни на способность к приживлению длительно пролиферирующих HSC, ни изменяет их функцию восстановления в несколько клеточных линий дифференцировки при трансплантации новому хозяину. Для сравнения, авторы настоящего изобретения смогли добиться стойкого приживления путем введения на 50% меньшего количества клеток по сравнению с другими известными стратегиями. Подводя итог, HSC, отредактированные с использованием данных sgRNA, способны к долговременному приживлению со стойким восстановлением в несколько клеточных линий дифференцировки в нише гематопоэтических стволовых клеток для поддержания длительного гемопоэза.
Высокая эффективность редактирования поддерживалась до и после трансплантации
Исследовали эффективность редактирования с использованием тестируемых sgRNA с помощью NGS, как описано в процедуре эксперимента. Через три дня после редактирования гена 100000 клеток CD34+ человека, подвергнутых редактированию гена, вместе с клетками CD34+, подвергнутыми имитирующему редактированию, подвергали анализу с помощью NGS. Оставшиеся клетки трансплантировали реципиентам NSG, как описано ранее. Через 8 недель и 20 недель после трансплантации отбирали клетки из костного мозга мышей NSG, которым осуществляли трансплантацию, и 100000 отсортированных клеток CD45+ человека подвергали NGS для измерения эффективности редактирования. Результаты показывают, что при использовании sgRNA sg-G1128, sg-G0048 и sg-G0067 достигалось 80-90% редактирование, тогда как для sg-G0010 продемонстрировано ~45% редактирование (фигура 26). При сравнении эффективности редактирования перед трансплантацией и через 8 или 20 недели после трансплантации результаты показали, что события редактирования в популяциях гематопоэтических стволовых клеток и клеток-предшественников сохранялись в течение длительного времени на протяжении всего периода трансплантации. Эти данные демонстрирует длительную выживаемость отредактированных клеток у индивидуума, которому осуществляли трансплантацию. Авторы настоящего изобретения даже наблюдали несколько повышенную эффективность редактирования для sg-G1128 через 20 недель после трансплантации, что означает то, что отредактированные клетки были отобраны из микроокружения костного мозга или обладали преимуществом в выживаемости после трансплантации.
При трансплантации в другой независимой повторности в анализе с помощью NGS выявили ряд событий редактирования, достигнутых с использованием тестируемых gRNA, при этом sg-G1128 приводила к более 90% редактированию через два дня после электропорации (фиг. 8A). Редактирование также выявляли в клетках CD34+ человека, выделенных через 9 и 20 недель после трансплантации (фиг. 27B и 27C).
У подвергнутых редактированию гена прижившихся на длительный срок HSC сохранялось повышенное продуцирование фетального гемоглобина
У мышей NSG не обеспечивается развитие клеток эритроидного ряда, поскольку у данных мышей отсутствует необходимый цитокин человека, обеспечивающий созревание клеток эритроидного ряда. Однако приживленные HSC человека можно собрать из костного мозга мыши, поместить в среду для эритроидной дифференцировки (как описано в другом месте в данным примерах) с индуцированием эритроидной дифференцировки. Данные показывают, что подвергнутые редактированию приживленные через 20 недель HSC были способны продуцировать HbF на более высоком уровне по сравнению с подвергнутыми имитирующему редактированию и трансплантированными HSC (фигура 28).
Пример 7. Анализ паттерна нецелевой вставки/делеции
Идентификация потенциальных нецелевых локусов для gRNA in silico
Потенциальные нецелевые локусы для подсовокупности участков HGB1/HBG2 для gRNA GCR-0001, GCR-0008, GCR-0010, GCR-0048, GCR-0051 и GCR-0067 идентифицировали следующим образом. В случае каждой gRNA 20-нуклеотидную последовательность нацеливающего домена в gRNA выравнивали относительно эталонной последовательности генома человека (сборка GRCh38) с использованием средства для выравнивания последовательностей BFAST (версия 0.6.4f, Homer et al, PLoS One, 2009, 4(11), e7767, PMID: 19907642) с использованием стандартных параметров, допускающих не более 5 ошибочно спаренных нуклеотидов. Идентифицированные локусы фильтровали с тем, чтобы они содержали только сайты, которые являются 5'-смежными с канонической последовательностью PAM 5'-NGG-3' Cas9 (т. е. 5'-нецелевой локус-PAM-3'). С использованием скрипта BEDTools (версия 2.11.2, Quinlan and Hall, Bioinformatics, 2010 26(6):841-2, PMID: 20110278) сайты с 5 ошибочно спаренными нуклеотидами дополнительно фильтровали в базе данных аннотаций генов RefSeq (Pruitt et al, Nucleic Acids Res., 2014 42(Database issue):D756-63, PMID: 24259432) с тем, чтобы они содержали лишь локусы, аннотированные как экзоны. Количества потенциальных нецелевых локусов, идентифицированных для участков HGB1/HBG2 для gRNA, показаны в таблице 12.
Таблица 12. Показаны количества нецелевых локусов, идентифицированных in silico для участка HBG1/HBG2 для gRNA GCR-0001, GCR-0008, GCR-0010, GCR-0048, GCR-0051 и GCR-0067 с 0, 1, 2, 3 и 4 ошибочно спаренными нуклеотидами и 5 ошибочно спаренными нуклеотидами в пределах экзонов согласно RefSeq. *gRNA GCR-0048 и GCR-0067 характеризуются двумя точными совпадениями целевых сайтов, по одному на локус HBG. + включает одну или две ошибки спаривания в гомологичных целевых участках HBG1 или HBG2.
Анализ нецелевых сайтов в CD34+ HSPC
Экстракция геномной ДНК
Геномную ДНК выделяли из 3-х дневной культуры клеток CD34+ HSPC, полученных из костного мозга, отредактированных с помощью RNP, и нередактированных, с использованием набора Quick-DNA Miniprep kit (Zymo Research), следуя рекомендациям производителя.
Конструирование праймеров для ПЦР, предназначенных для целевой амплификации потенциальных нецелевых сайтов
Ампликоны для ПЦР, нацеливающиеся на потенциальные нецелевые локусы с 0-3 ошибочными спариваниями нуклеотидов (и целевой локус), идентифицированные для участка HBG1/HBG2 для gRNA (GCR-0001, GCR-0008, GCR-0010, GCR-0048, GCR-0051 и GCR-0067), конструировали с использованием Primer3 (версия 2.3.6, Untergasser et al, Nucleic Acids Res., 2012 40(15):e115, PMID: 22730293) с использованием стандартных параметров, ориентированных на размер ампликона в диапазоне примерно 160-300 пар оснований в длину, с последовательностью нацеливающего домена gRNA, локализованной в центре ампликона. Полученные в результате последовательности пар праймеров для ПЦР и ампликонов проверяли на специфичность посредством BLAST-поиска (версии 2.2.19, Altschul et al, J Mol Biol., 1990, 215(3):403-10, PMID: 2231712) последовательностей, сравнивая с эталонной последовательностью генома человека (сборка GRCh38). Пары праймеров, которые давали более одной последовательности ампликона, исключали и повторно конструировали. В таблице 3 показано количество успешно сконструированных пар праймеров для ПЦР.
Получение библиотеки для секвенирования в Illumina, количественное определение и секвенирование
Геномную ДНК из отредактированных с использованием RNP (2 повторности на gRNA) и нередактированных (2 повторности на gRNA) HSPC количественно определяли с применением набора Quant-iT PicoGreen dsDNA (Thermo Fisher, № кат. P7581), следуя рекомендациям производителя. Библиотеки для секвенирования в Illumina, нацеливающиеся на отдельные нецелевые локусы (и целевой локус), создавали для каждого образца с использованием двух последовательных реакций ПЦР. При первой ПЦР амплифицировали целевой локус с использованием целевых специфических праймеров для ПЦР (сконструированных выше), которые были снабжены концевыми универсальными последовательностями, совместимыми с секвенированием в Illumina. При второй ПЦР к первому ПЦР-ампликону добавляли дополнительные последовательности, совместимые с секвенированием в Illumina, включающие штрих-коды для образцов, чтобы обеспечить возможность мультиплексирования в ходе секвенирования. ПЦР 1 проводили в конечном объеме 10 мкл, при этом каждая реакционная смесь содержала примерно 6,5 нг gDNA (эквивалентно примерно 1000 клеткам), пару праймеров для ПЦР 1 (Integrated DNA Technologies) в конечной концентрации 0,25 мкМ и смесь Q5 Hot Start Master Mix в 1x конечной концентрации (New England BioLabs, № кат. 102500-140). Левые праймеры для ПЦР 1 были снабжены 5'-концевой (т. е. 5'-концевая последовательность-целевой специфический левый праймер-3') последовательностью 5'-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAG-3' (SEQ ID NO: 279), а правые праймеры были снабжены 5'-концевой (т. е. 5'-концевая последовательность-целевой специфический правый праймер-3') последовательностью 5'-GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAG-3' (SEQ ID NO: 280). ПЦР 1 проводили в амплификаторе с использованием следующих условий амплификации: 1 цикл 98°C в течение 1 мин; 25 циклов 98°C в течение 10 с, 63°C в течение 20 с и 72°C в течение 30 с; 1 цикл при 72°C в течение 2 мин. Полученный продукт ПЦР 1 затем разбавляли 1 к 100 с использованием безнуклеазной воды (Ambion, № кат. AM9932) и использовали для проведения ПЦР 2. ПЦР 2 проводили в конечном объеме 10 мкл, при этом каждая реакционная смесь содержала 2 мкл разбавленного продукта ПЦР 1, пару праймеров для ПЦР 2 (Integrated DNA Technologies) в конечной концентрации 0,5 мкМ и смесь Q5 Hot Start Master Mix в 1x конечной концентрации (New England BioLabs, № кат. 102500-140). Используемая для ПЦР 2 последовательность левого праймера представляла собой 5'-AATGATACGGCGACCACCGAGATCTACACNNNNNNNNTCGTCGGCAGCGTC-3' (SEQ ID NO: 281), а используемая для ПЦР 2 последовательность правого праймера представляла собой 5'- AATGATACGGCGACCACCGAGATCTACACNNNNNNNNTCGTCGGCAGCGTC
→
CAAGCAGAAGACGGCATACGAGATNNNNNNNNGTCTCGTGGGCTCGG (SEQ ID NO: 282), где NNNNNNNN обозначает последовательность штрих-кода из 8 нуклеотидов, используемую для мультиплексирования в качестве части стандартной технологии секвенирования Illumina. ПЦР 2 проводили в амплификаторе с использованием следующих условий амплификации: 1 цикл 72°C в течение 3 мин.; 1 цикл 98°C в течение 2 мин.; 15 циклов 98°C в течение 10 с, 63°C в течение 30 с и 72°C в течение 2 мин. Ампликоны, полученные в ПЦР 2, уже представляющие собой библиотеку, пригодную для секвенирования в Illumina, очищали с использованием гранул Agencourt AMPure XP (Beckman Coulter, № кат. A63882), следуя рекомендациям производителя. Очищенные библиотеки для секвенирования в Illumina затем количественно анализировали с использованием стандартных количественных способов qPCR с применением смеси Power SYBR Green PCR (Life Technologies, № кат. 4367660) и праймеров, специфичных к концевым последовательностям в библиотеке для секвенирования в Illumina (последовательность прямого праймера 5'-CAAGCAGAAGACGGCATACGA-3' (SEQ ID NO: 283) и последовательность обратного праймера 5'-AATGATACGGCGACCACCGAGA-3' (SEQ ID NO: 284)). Библиотеки для секвенирования в Illumina затем объединяли в эквимолярных концентрациях и подвергали секвенированию Illumina на инструменте MiSeq (Illumina, № кат. SY-410-1003) с парными концевыми считываниями фрагментов размером 300 пар оснований, используя набор MiSeq Reagent Kit v3 (Illumina, № кат. MS-102-3003), следуя рекомендациям производителя. В каждой повторности для каждого локуса получали 1000-кратный минимальный охват последовательности. ПЦР, очистку, объединение и секвенирование отредактированных и нередактированных образцов проводили по отдельности во избежание любой возможность перекрестной контаминации образцов или полученных из них ПЦР-ампликонов.
Контроль качества (QC) данных, полученных путем секвенирования с помощью NGS, и анализ вариантов
Способы соответствуют таким способам из примера 2.1 со следующими модификациями. Для стадии 5 анализа учитывали сайты с объединенной частотой вставки/делеции >2% (редактирование у более примерно 10-20 клеток), а потенциальные активные сайты для редактирования дополнительно оценивали на уровне выравнивания ридов с использованием Integrative Genome Viewer (IGV версии 2.3, Robinson et al, Nat Biotechnol. 2011, 9(1):24-6, PMID: 21221095), что позволяло визуально оценивать выравнивание ридов с эталонной последовательностью генома.
Количественное определение больших делеций.
Количественное определение больших делеций между сайтами для нацеливания в промоторах HBG1 и HBG2 осуществляли с помощью цифровой капельной ПЦР (ddPCR) в формате неконкурентного анализа для определения количества копий согласно рекомендациям производителя. Вкратце, gDNA объединяли с супермиксом ddPCR SuperMix для работы с зондами при ddPCR (без dUTP) (BioRad, № кат. 1863024), рестриктазой HindIII-HF (NEB, № кат. R3104S) и каждой из смесей праймеров и зондов, переносили в картридж DG8 вместе с маслом для получения капель для работы с зондами (BioRad, № кат. 1863005) и с помощью устройства для создания капель QX200 (BioRad) получали капли. Капли подвергали ПЦР на амплификаторе C1000 Touch с реакционным блоком в формате 96-луночного планшета с глубокими лунками (BioRad) с последующим выявлением с помощью считывающего устройства для капельной ПЦР QX200 (BioRad). Количество копий на мкл определяли с помощью анализа с применением программного обеспечения QuantaSoft (BioRad). Набор праймеров и зонда, разработанных по индивидуальному заказу (Life Technologies, № кат. APZW76R, PN4331348, прямой праймер: ACGGATAAGTAGATATTGAGGTAAGC (SEQ ID NO: 285), обратный праймер: GTCTCTTTCAGTTAGCAGTGG (SEQ ID NO: 286), TaqMan-зонд FAM: ACTGCGCTGAAACTGTGGCTTTATAG (SEQ ID NO: 287)) использовали для амплификации gDNA в пределах межгенного участка HBG1-HBG2. Эталонный ген РНКазы P человека из набора TaqMan для анализа количества копий (Thermo Fisher, № кат. 4403326) использовали в качестве эталонного ампликона. Количество копий на мкл для ампликонов HBG1-HBG2 и гена РНКазы P находилось в пределах заявленного производителем линейного диапазона. Процентную долю делеций рассчитывали путем умножения аргумента "1 минус соотношение количества копий на мкл для амликонов HBG1-HBG2 и гена РНКазы P" на 100%. У нередактированных контрольных образцов рассчитанная процентная доля делеций составляла не более 2%, что может соответствовать фоновому уровню в данном анализе.
Результаты анализа in silico нецелевого участка HBG1/HBG2
В таблице 13 показано количество успешно охарактеризованных нецелевых сайтов. Неохарактеризованные сайты обладали недостатками для конструирования специфичных к ним праймеров для ПЦР или ПЦР-амплификации, и они подлежат дополнительной оценке.
gRNA GCR-0001. Целевой сайт HBG1 показал стойкое локализованное редактирование со средним значением частоты вставки/делеции, составляющим примерно 58%, при этом гомологичный целевой участок HBG2 с двумя ошибками спаривания (здесь и ниже показан буквами в нижнем регистре) относительно последовательности нацеливающего домена gRNA (5'-AGTCCTGGTATCtTCTATGg - PAM-3', PAM=TGG (SEQ ID NO: 288)) показал минимальное локализованное редактирование. Однако анализ с помощью ddPCR делеции размером 4,9 т.о. показал, что они возникают с частотой примерно 34%. В дополнительном анализе идентифицировали один положительный нецелевой сайт со средним значением частоты вставки/делеции, составляющим примерно 26% в обеих повторностях. Этот сайт характеризуется 3 ошибками спаривания относительно последовательности нацеливающего домена gRNA (5'-AtTCCcaGTATCCTCTATGA-PAM-3', PAM=TGG (SEQ ID NO: 289)) и локализован в межгенном участке на хромосоме Y в положении пар оснований 21470475-21470497. Остается неясным, оказывает ли редактирование в данном нецелевом сайте какой-либо отрицательный эффект на экспрессию генов или жизнеспособность клеток, поэтому требуется дополнительный анализ.
gRNA GCR-0008. Целевой сайт в HBG1 продемонстрировал стойкое локализованное редактирование со средним значением частоты вставки/делеции, составляющим примерно 88%. Гомологичный целевой сайт в HBG2 с одной ошибкой спаривания относительно последовательности нацеливающего домена gRNA (5'-GGAGAAGaAAACTAGCTAAA- PAM-3', PAM=GGG (SEQ ID NO: 290)) продемонстрировал стойкое локализованное редактирование со средним значением частоты вставки/делеции, составляющим примерно 85%. Анализ с помощью ddPCR делеции размером 4,9 т.о. показал, что они возникают с частотой примерно 50%. В других сайтах редактирование выявлено не было.
gRNA GCR-0010. Целевой сайт в HBG1 продемонстрировал стойкое локализованное редактирование со средним значением частоты вставки/делеции, составляющим примерно 32%. Гомологичный целевой сайт в HBG2 с одной ошибкой спаривания относительно последовательности нацеливающего домена gRNA (5'- GGGAGAAGaAAACTAGCTAA- PAM-3', PAM=AGG (SEQ ID NO: 291)) продемонстрировал стойкое локализованное редактирование со средним значением частоты вставки/делеции, составляющим примерно 27%. Анализ с помощью ddPCR делеции размером 4,9 т.о. показал, что они возникают с частотой примерно 33%. В других сайтах редактирование выявлено не было.
gRNA GCR-0048. Целевые сайты в HBG1 и HBG2 продемонстрировали стойкое целевое редактирование со средним значением частоты вставки/делеции, составляющим примерно 86% для обеих сайтов. Анализ с помощью ddPCR делеции размером 4,9 т.о. показал, что они возникают с частотой примерно 45%. В других сайтах редактирование выявлено не было.
gRNA GCR-0051. Целевой сайт в HBG2 продемонстрировал стойкое локализованное редактирование со средним значением частоты вставки/делеции, составляющим примерно 88%. Гомологичный целевой сайт в HBG1 с одной ошибкой спаривания относительно последовательности нацеливающего домена gRNA (5'- GGAGAAGgAAACTAGCTAAA- PAM-3', PAM=GGG (SEQ ID NO: 292)) продемонстрировал стойкое локализованное редактирование со средним значением частоты вставки/делеции, составляющим примерно 59%. Анализ с помощью ddPCR делеции размером 4,9 т.о. показал, что они возникают с частотой примерно 40%. В других сайтах редактирование выявлено не было.
gRNA GCR-0067. Целевые сайты в HBG1 и HBG2 продемонстрировали стойкое целевое редактирование со средним значением частоты вставки/делеции, составляющим соответственно примерно 74% и 78%. Анализ с помощью ddPCR делеции размером 4,9 т.о. показал, что они возникают с частотой примерно 62%. В других сайтах редактирование выявлено не было.
Значения частоты локализованной вставки/делеции, описанные выше, не приведены относительно общей частоты вставки/делеции, и при этом не берется во внимание значение частоты для делеции размером более 4,9 т.о.
Таблица 13. Показаны количества нецелевых сайтов с ошибками спаривания 0-3 оснований, идентифицированных in silico для участка HBG1/HBG2 для gRNA GCR-0001, GCR-0008, GCR-0010, GCR-0048, GCR-0051 и GCR-0067, количества сайтов, успешно охарактеризованных в HSPC с отредактированным геномом, и количества сайтов, которые продемонстрировали редактирование.
Анализ нецелевых сайтов без смещения
Анализ на основе олигонуклеотидной вставки (см., например, Tsai et al., Nature Biotechnology. 33, 187-197; 2015) использовали для определения потенциальных нецелевых геномных сайтов, расщепляемых Cas9, которая целенаправленно воздействует на HBG1 и/или HBG2. В таких экспериментах Cas9GFP-экспрессирующие клетки HEK293 (HEK-293_Cas9GFP) трансфицировали с использованием gRNA (15 нМ crRNA:tracr) и олигонуклеотида, подлежащего вставке (10 нМ), с использованием Lipofectamine® RNAiMAX. Данный анализ основан на идентификации олигонуклеотида, встроенного в двухнитевой разрыв в геноме, который может быть обусловлен расщеплением Cas9 или может и не быть им обусловлен.
В одном эксперименте gRNA (двойные направляющие РНК, содержащие нацеливающий домен, указанный на фигуре 29), нацеливающиеся на HBG1 и/или HBG2, подвергали скринингу в клетках HEK-293_Cas9GFP, и результаты представлены в виде графика на фигуре 29. В отдельном эксперименте использовали ту же методологию для проведения скрининга некоторых одинаковых, а также дополнительных gRNA (в том числе двойной направляющей и одиночной направляющей РНК, содержащих нацеливающий домен, указанный на фигуре 30), нацеливающих на HBG1 и/или HBG2 в клетках HEK-293_Cas9GFP, и результаты представлены в виде графика на фигуре 30. В эксперименте с данными, изображенными на фигуре 30, использовали альтернативную олигонуклеотидную вставку с пропорциональным содержанием G/C и минимизированной комплементарностью с геномом человека, а также другие модификации стадий ПЦР по сравнению с опубликованными в Tsai et al. способами, что улучшало чувствительность и сокращало количество ложноположительных результатов. В обеих экспериментах с помощью данного анализа выявляли высокоэффективное редактирование в предсказанных целевых последовательностях и одном или нескольких потенциальных нецелевых сайтах.
Хотя путем выявления олигонуклеотидной вставки в сайтах в геноме, отличных от целевого сайта, идентифицировали потенциальные нецелевые эффекты Cas9, целевое глубокое секвенирование потенциальных нецелевых сайтов может использоваться для определения того, являются ли потенциальные сайты истинными нецелевыми сайтами, расщепляемыми Cas9. Для этой цели проводили эксперимент, в котором клетки HEK-293_Cas9GFP подобным образом трансфицировали с использованием gRNA (crRNA:tracr при концентрации 25 нМ), которые применяли в предшествующих двух экспериментах, но без олигонуклеотидной вставки. Глубокое секвенирование ампликонов, полученных для каждого из идентифицированных потенциальных нецелевых сайтов, изображенных на фигурах 29 и 30, использовали для того, чтобы идентифицировать, присутствовали ли вставки/делеции (показатель события расщепления за счет Cas9) в потенциальных нецелевых сайтах в клеточной линии HEK-293_Cas9GFP. Результаты данного эксперимента демонстрируют, что большинство потенциальных нецелевых сайтов, идентифицированных с помощью анализа на основе олигонуклеотидной вставки, не имели выявляемых вставок/делеций после трансфекции с использованием gRNA, за несколькими исключениями, представленными в таблице 14 ниже. Следует отметить, что клетки HEK-293_Cas9GFP, использованные в данных экспериментах для выявления потенциальных нецелевых мишеней, характеризуются конститутивной сверхэкспрессией Cas9, что, вероятно, приводит к большему количеству потенциальных нецелевых "хитов" по сравнению с тактикой временной доставки (например, доставки RNP) в разные типы клеток, представляющие интерес (например, CD34+ HSC).
Таблица 14. Нецелевые сайты, валидированные в клеточной линии HEK-293_Cas9GFP
Используя способы, описанные в данном документе, потенциальные нецелевые сайты исследовали в CD34+ HSPC, отредактированных с помощью sgRNA/Cas9, и они показали отсутствие редактирования в клетках типа CD34+.
Пример 8
Процедура эксперимента
Клетки CD34+, полученные из мобилизованной периферической крови (mPB) здоровых доноров, культивировали и подвергали генному редактирование в тех же условиях, которые ранее описаны в пример 6. Клетки характеризовали по их биологической функции с применением тех же способов, которые описаны в предыдущих абзацах.
Клетки CD34+, полученные из мобилизованной периферической крови, сохраняют свои количество, способность к росту и жизнеспособность после редактирования
Количество клеток CD34+, трансплантированных пациенту, непосредственно коррелирует с успешностью приживления трансплантата костного мозга. Следовательно, подсчитывали процентную долю клеток CD34+ на протяжении 10-дневного периода после генного редактирования с использованием клинически приемлемого способа согласно рекомендациям ISHAGE. Результаты показывают, что редактирование с использованием sg1128 или sg0067 не оказывало влияния на количество клеток CD34+ (фигура 31) по сравнению с контролем, представляющим собой имитацию редактирования. В случае общей продолжительности способа авторов настоящего изобретения с использованием клеток, в котором клетки поддерживали в культуре в течение 3 дней после электропорации, процентная доля клеток CD34+ сохранялась на уровне примерно 90% (фигура 31A). Редактирование гена также не оказывало влияния на способность клетки CD34+ к размножению (фигура 31B) и их жизнеспособность после электропорации, которая варьировала в диапазоне 70-90% (фигура 31C). Наблюдали ~2-кратный рост клеток в день 3 после электропорации, ~10-кратный рост в день 7 после электропорации и 15-25-кратный рост в день 10 после электропорации (фигура 31B).
Клетки CD34+, полученные из мобилизованной периферической крови здоровых индивидуумов, демонстрируют показатели эффективности редактирования, подобные таким показателям для клеток из источника, представляющего собой костный мозг, или клеток CD34+ от пациентов с серповидноклеточным заболеванием
Sg1128 демонстрирует приблизительно 70-75% эффективность редактирования в клетках CD34+, полученных из mPB от здоровых доноров, при этом sg0067 показала >95% общей эффективности редактирования (в том числе большую делецию размером 5 т. о. и небольшие вставки/делеции) (фигура 32). Показатели эффективности в случае использования таких sgRNA были подобными в клетках из разных источников, в том числе клетках CD34+, полученных из костного мозга здоровых доноров, или клетках CD34+, полученных из периферической крови пациентов с серповидноклеточным заболеванием (см. другие примеры). Важно отметить, что как эффективность редактирования, так и паттерн редактирования для каждой sgRNA в значительной степени совпадали среди всех доноров, принимавших участие в испытании.
Нокдаун BCL11A с использованием CRISPR или мутация в кластере гена g-глобина повышает количество транскриптов g-глобина и продуцирование F-клеток
Нокдаун BCL11A с использованием sg1128 или введение мутации в потенциальном сайте связывания BCL11A в кластере гена g-глобина с использованием sg0067 в значительной степени увеличивали количество транскриптов гена g-глобина (фигура 33), что приводило к 15-20% положительной регуляции продуцирования F-клеток по сравнению с контролем, представляющим собой имитацию редактирования (фигура 34). И в заключение, sg1128 и sg0067 могут редактировать клетки CD34+ с высокой эффективностью и создают в высокой степени совпадающие паттерны редактирования. К завершению 6-дневной процедуры обработки клеток в отредактированных клетках сохранялось примерно 90% клеток CD34+. Способность к размножению и жизнеспособность клеток не нарушалась при использовании процедуры генного редактирования. Отредактированные клетки CD34+, при дифференцировке в эритроциты, экспрессировали транскрипты g-глобина на значительно более высоком уровне, что приводило к увеличению продуцирования количества F-клеток. Это повышение экспрессии гемоглобина и количества F-клеток может восстанавливать гематологические показатели при серповидноклеточном заболевании.
Пример 9. Приживление in vivo и характеристика HSPC c отредактированным геном, полученных от пациентов с серповидноклеточным заболеванием
Процедура эксперимента
Клетки CD34+ от пациентов с серповидноклеточным заболеванием культивировали и подвергали генному редактированию в таких же условиях, как описаны ранее в примере 8. Клетки характеризовали по их биологической функции с применением тех же способов, которые описаны в предыдущих примерах.
У клеток CD34+, полученных от индивидуумов с серповидноклеточным заболеванием, сохранялись их иммунный фенотип CD34+ и жизнеспособность после редактирования
Гематопоэтические стволовые клетки и клетки-предшественники (HSPC), сохраняющие свое состояние стволовой клетки, должны экспрессировать CD34. Это является одним из важнейших клинических маркеров, который ассоциируется со способностью к приживлению гематопоэтической стволовой клетки после трансплантации и успешностью приживления трансплантата, что непосредственно коррелирует с количеством трансплантированных клеток CD34+. Таким образом, подсчитывали количество клеток CD34+, полученных из периферической крови индивидуумов с серповидноклеточным заболеванием после редактирования, с применением клинически приемлемого способа согласно рекомендациям ISHAGE. Результаты показывают, что проведение редактирования с помощью sg1128 или sg0067 не оказывало воздействия на количество клеток CD34+ (фигура 35A и фигура 35B) по сравнению с контролем, представляющим собой имитацию редактирования. Процентная доля клеток CD34+ сохранялась на уровне ~80% в день 3 после редактирования (фигура 35B). Редактирование гена также не оказывало воздействия на способность полученных от пациента клеток CD34+ к размножению (фигура 35C), и при этом их жизнеспособность после электропорации (электропорации в момент времени D0) превышала 75% во всех временных точках, измерение в которых проводили на протяжении 10-дневного периода (фигура 35D).
Клетки CD34+, полученные от индивидуумов с серповидноклеточным заболеванием, демонстрируют показатели эффективности редактирования, подобные показателям редактирования для клеток CD34+ от здоровых доноров
Sg1128 демонстрирует приблизительно 65% эффективность редактирования в клетках CD34+, полученных от пациентов с серповидноклеточным заболеванием, при этом sg0067 продемонстрировала 80-95% эффективность редактирования в образцах от пациентов (фигура 36). Уровень эффективности редактирования подобен эффективности редактирования, достигнутой с применением клеток CD34+, полученных из костного мозга либо мобилизованной периферической крови от здоровых доноров. Паттерны редактирования для каждой направляющей РНК, что измерено с помощью NGS (как описано в примере 2.1), также в значительной степени совпадали у различных пациентов.
Генное редактирование не нарушает способность клеток CD34+, полученных от индивидуумов с серповидноклеточным заболеванием, к дифференцировке в несколько клеточных линий in vitro
Гематопоэтические стволовые клетки и клетки-предшественники, подвергнутые генному редактированию, были в полной мере способны к дифференцировке в эритроидную, гранулоцитарную, моноцитарную и мегакариоцитарную линии клеток дифференцировки, что измерено с помощью анализов колониеобразующей активности (фигура 37).
Нокдаун BCL11A с использованием CRISPR или мутация в кластере гена g-глобина повышает количество транскриптов g-глобина, продуцирование F-клеток и экспрессию фетального гемоглобина
Нокдаун sg1128 с помощью BCL11A либо создание вставок/делеций в кластере g-глобина с помощью sg0067 в значительной степени увеличивали количество транскриптов g-глобина (фигура 38) и повышали количество F-клеток, что измерили с помощью проточной цитометрии (фигура 39). Кроме того, интенсивность экспрессии фетального гемоглобина в F-клетках также улучшалась из расчета на каждую клетку, что измерили с помощью проточной цитометрии (фигура 40).
Редактирование гена в клетках CD34+, полученных от пациента, привело к значительному снижению количества серповидных клеток и к повышению количества нормальных клеток
И наконец, чтобы установить, способно ли редактирование гена восстанавливать нормальную морфологию серповидноклеточных форм, CRISPR-редактированные клетки CD34+, полученные от пациента с серповидноклеточным заболеванием, подвергали дифференцировке в красные кровяные клетки и подвергали такие клетки инкубированию в камере с определенным уровнем гипоксии в течение 4 дней с целью индуцирования образования у клеток серповидноклеточной структуры. Клетки одновременно окрашивали с использованием антитела к HbF, конъюгированного с FITC, фиксировали в камере и проводили визуальный анализ с помощью проточной цитометрии с захватом одного изображения на каждую одну клетку. С помощью проточной цитометрии в сочетании с визуализацией одной клетки можно различать серповидную клетку и нормальную клетку на основе длины клетки и экспрессии HbF с высокой пропускной способностью (40000 изображений отдельных клеток от каждого пациента использовали для анализа данных). Результаты показывают, что редактирование гена с помощью sg1128 или sg0067 было способно снижать количество серповидных клеток на примерно 40% (фигура 41A) и одновременно повышать количество нормальных клеток на 1,2 раза (фигура 41B). Сочетанный эффект снижения количества серповидных клеток и одновременного увеличения количества нормальных красных кровяных клеток принесет значительную пользу пациентам при внедрении в клиническую практику.
И в заключение, sg1128 и sg0067 могут редактировать клетки CD34+, полученные от пациентов с серповидноклеточным заболеванием, с высокой эффективностью и создают в высокой степени схожие паттерны редактирования. Процент клеток CD34+, способность клеток к размножению и жизнеспособность клеток не снижались после проведения процедуры редактирования гена при сравнении отредактированных клеток с контрольной группой, подвергнутой имитации редактирования. Отредактированные клетки CD34+, при дифференцировке в эритроциты, экспрессировали транскрипты g-глобина на значительно более высоком уровне. Это приводило к увеличенному количеству F-клеток, а также повышало экспрессию HbF на клетку. Увеличение количества F-клеток с высокой экспрессией HbF и снижение количества серповидных форм красных кровяных клеток отражено в данных, полученных с помощью проточной цитометрии в сочетании с визуализацией одной клетки. Наблюдали 50% снижение серповидных клеток в группе клеток с отредактированным геном и одновременное повышение в 1,2 раза нормальных красных кровяных клеток, экспрессирующих высокий уровень HbF, в группе с отредактированным геном по сравнению с контролем, представляющим собой имитацию редактирования. Этот сочетанный эффект снижения количества серповидных клеток с сопутствующим повышением количества нормальных красных кровяных клеток, экспрессирующих высокий уровень HbF, после редактирования гена должен в значительной степени приносить пользу пациентам при внедрении в клиническую практику. Вместе такие данные оказывают поддержку в пользу дальнейшей разработки CRISPR/Cas-опосредованного редактирования генома в качестве средства клеточной терапии для лечения b-глобинопатий.
При возникновении каких-либо разногласий между каким-либо перечнем последовательностей и любой последовательностью, указанными в данном описании, последовательность, указанная в данном описании, должна считаться правильной последовательностью. Если не указано иное, то все местоположения в геноме приведены в соответствии с hg38.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
Все публикации, патенты и патентные заявки, упомянутые в данном документе, настоящим включены в данный документ посредством ссылки в полном их объеме, как если бы каждая отдельная публикация, патент или патентная заявка были конкретно и отдельно указаны как включенные посредством ссылки. В случае противоречия настоящая заявка, в том числе любые определения, будет иметь преимущественную силу.
ЭКВИВАЛЕНТЫ
Специалисты в данной области техники определят или смогут установить, используя лишь стандартные эксперименты, множество эквивалентов конкретных вариантов осуществления настоящего изобретения, описанного в данном документе. Несмотря на то, что настоящее изобретение было раскрыто со ссылкой на конкретные аспекты, очевидно, что другие аспекты и варианты настоящего изобретения могут быть разработаны другими специалистами в данной области техники без отступления от фактической сути и объема настоящего изобретения. Предполагается, что прилагаемую формулу изобретению следует истолковывать как включающую все такие аспекты и эквивалентные варианты.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> NOVARTIS AG
INTELLIA THERAPEUTICS, INC.
<120> КОМПОЗИЦИИ И СПОСОБЫ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЛЕЧЕНИЯ ГЕМОГЛОБИНOПАТИЙ
<130> PAT057603-WO-PCT
<140>
<141>
<150> 62/455,464
<151> 2017-02-06
<160> 332
<170> PatentIn версия 3.5
<210> 1
<211> 20
<212> РНК
<213> Homo sapiens
<400> 1
aguccuggua uccucuauga 20
<210> 2
<211> 20
<212> РНК
<213> Homo sapiens
<400> 2
aauuagcagu auccucuugg 20
<210> 3
<211> 20
<212> РНК
<213> Homo sapiens
<400> 3
agaauaaauu agagaaaaac 20
<210> 4
<211> 20
<212> РНК
<213> Homo sapiens
<400> 4
aaaaauuagc aguauccucu 20
<210> 5
<211> 20
<212> РНК
<213> Homo sapiens
<400> 5
aaaauuagca guauccucuu 20
<210> 6
<211> 20
<212> РНК
<213> Homo sapiens
<400> 6
aaaaacugga augacugaau 20
<210> 7
<211> 20
<212> РНК
<213> Homo sapiens
<400> 7
cucccaucau agaggauacc 20
<210> 8
<211> 20
<212> РНК
<213> Homo sapiens
<400> 8
ggagaaggaa acuagcuaaa 20
<210> 9
<211> 20
<212> РНК
<213> Homo sapiens
<400> 9
guuuccuucu cccaucauag 20
<210> 10
<211> 20
<212> РНК
<213> Homo sapiens
<400> 10
gggagaagga aacuagcuaa 20
<210> 11
<211> 20
<212> РНК
<213> Homo sapiens
<400> 11
cacuggagcu agagacaaga 20
<210> 12
<211> 20
<212> РНК
<213> Homo sapiens
<400> 12
agagacaaga agguaaaaaa 20
<210> 13
<211> 20
<212> РНК
<213> Homo sapiens
<400> 13
aaauuagcag uauccucuug 20
<210> 14
<211> 20
<212> РНК
<213> Homo sapiens
<400> 14
guccugguau ccucuaugau 20
<210> 15
<211> 20
<212> РНК
<213> Homo sapiens
<400> 15
guauccucua ugaugggaga 20
<210> 16
<211> 20
<212> РНК
<213> Homo sapiens
<400> 16
ccuagccagc cgccggcccc 20
<210> 17
<211> 20
<212> РНК
<213> Homo sapiens
<400> 17
auuaagcagc aguauccucu 20
<210> 18
<211> 20
<212> РНК
<213> Homo sapiens
<400> 18
uauccaguga ggccaggggc 20
<210> 19
<211> 20
<212> РНК
<213> Homo sapiens
<400> 19
cauugagaua guguggggaa 20
<210> 20
<211> 20
<212> РНК
<213> Homo sapiens
<400> 20
ccagugaggc caggggccgg 20
<210> 21
<211> 20
<212> РНК
<213> Homo sapiens
<400> 21
guggggaagg ggcccccaag 20
<210> 22
<211> 20
<212> РНК
<213> Homo sapiens
<400> 22
agaauaaauu agagaaaaau 20
<210> 23
<211> 20
<212> РНК
<213> Homo sapiens
<400> 23
ccaggggccg gcggcuggcu 20
<210> 24
<211> 20
<212> РНК
<213> Homo sapiens
<400> 24
ugaggccagg ggccggcggc 20
<210> 25
<211> 20
<212> РНК
<213> Homo sapiens
<400> 25
caguuccaca cacucgcuuc 20
<210> 26
<211> 20
<212> РНК
<213> Homo sapiens
<400> 26
ccgccggccc cuggccucac 20
<210> 27
<211> 20
<212> РНК
<213> Homo sapiens
<400> 27
guuugccuug ucaaggcuau 20
<210> 28
<211> 20
<212> РНК
<213> Homo sapiens
<400> 28
ggcuagggau gaagaauaaa 20
<210> 29
<211> 20
<212> РНК
<213> Homo sapiens
<400> 29
agaaguccug guaucuucua 20
<210> 30
<211> 20
<212> РНК
<213> Homo sapiens
<400> 30
caggggccgg cggcuggcua 20
<210> 31
<211> 20
<212> РНК
<213> Homo sapiens
<400> 31
acuggauacu cuaagacuau 20
<210> 32
<211> 20
<212> РНК
<213> Homo sapiens
<400> 32
uuaagcagca guauccucuu 20
<210> 33
<211> 20
<212> РНК
<213> Homo sapiens
<400> 33
cccuggcuaa acuccaccca 20
<210> 34
<211> 20
<212> РНК
<213> Homo sapiens
<400> 34
aaaaauugga augacugaau 20
<210> 35
<211> 20
<212> РНК
<213> Homo sapiens
<400> 35
uuagaguauc cagugaggcc 20
<210> 36
<211> 20
<212> РНК
<213> Homo sapiens
<400> 36
cccaugggug gaguuuagcc 20
<210> 37
<211> 20
<212> РНК
<213> Homo sapiens
<400> 37
aggcaaggcu ggccaaccca 20
<210> 38
<211> 20
<212> РНК
<213> Homo sapiens
<400> 38
uagaguaucc agugaggcca 20
<210> 39
<211> 20
<212> РНК
<213> Homo sapiens
<400> 39
uaucugucug aaacgguccc 20
<210> 40
<211> 20
<212> РНК
<213> Homo sapiens
<400> 40
auugagauag uguggggaag 20
<210> 41
<211> 20
<212> РНК
<213> Homo sapiens
<400> 41
cuucaucccu agccagccgc 20
<210> 42
<211> 20
<212> РНК
<213> Homo sapiens
<400> 42
gcuauugguc aaggcaaggc 20
<210> 43
<211> 20
<212> РНК
<213> Homo sapiens
<400> 43
augcaaauau cugucugaaa 20
<210> 44
<211> 20
<212> РНК
<213> Homo sapiens
<400> 44
gcauugagau agugugggga 20
<210> 45
<211> 20
<212> РНК
<213> Homo sapiens
<400> 45
uggucaaguu ugccuuguca 20
<210> 46
<211> 20
<212> РНК
<213> Homo sapiens
<400> 46
gggagaagaa aacuagcuaa 20
<210> 47
<211> 20
<212> РНК
<213> Homo sapiens
<400> 47
ggcaaggcug gccaacccau 20
<210> 48
<211> 20
<212> РНК
<213> Homo sapiens
<400> 48
acggcugaca aaagaagucc 20
<210> 49
<211> 20
<212> РНК
<213> Homo sapiens
<400> 49
cgagugugug gaacugcuga 20
<210> 50
<211> 20
<212> РНК
<213> Homo sapiens
<400> 50
ccuggcuaaa cuccacccau 20
<210> 51
<211> 20
<212> РНК
<213> Homo sapiens
<400> 51
ggagaagaaa acuagcuaaa 20
<210> 52
<211> 20
<212> РНК
<213> Homo sapiens
<400> 52
cucccaccau agaagauacc 20
<210> 53
<211> 20
<212> РНК
<213> Homo sapiens
<400> 53
cuugucaagg cuauugguca 20
<210> 54
<211> 20
<212> РНК
<213> Homo sapiens
<400> 54
aguccuggua ucuucuaugg 20
<210> 55
<211> 20
<212> РНК
<213> Homo sapiens
<400> 55
auauuugcau ugagauagug 20
<210> 56
<211> 20
<212> РНК
<213> Homo sapiens
<400> 56
gcuaaacucc acccaugggu 20
<210> 57
<211> 20
<212> РНК
<213> Homo sapiens
<400> 57
acguuccaga agcgagugug 20
<210> 58
<211> 20
<212> РНК
<213> Homo sapiens
<400> 58
guccugguau cuucuauggu 20
<210> 59
<211> 20
<212> РНК
<213> Homo sapiens
<400> 59
uauuugcauu gagauagugu 20
<210> 60
<211> 20
<212> РНК
<213> Homo sapiens
<400> 60
uaagcagcag uauccucuug 20
<210> 61
<211> 20
<212> РНК
<213> Homo sapiens
<400> 61
ggaaugacug aaucggaaca 20
<210> 62
<211> 20
<212> РНК
<213> Homo sapiens
<400> 62
cuugaccaau agccuugaca 20
<210> 63
<211> 20
<212> РНК
<213> Homo sapiens
<400> 63
caaggcuauu ggucaaggca 20
<210> 64
<211> 20
<212> РНК
<213> Homo sapiens
<400> 64
aaggcuggcc aacccauggg 20
<210> 65
<211> 20
<212> РНК
<213> Homo sapiens
<400> 65
acucgcuucu ggaacgucug 20
<210> 66
<211> 20
<212> РНК
<213> Homo sapiens
<400> 66
auuugcauug agauagugug 20
<210> 67
<211> 20
<212> РНК
<213> Homo sapiens
<400> 67
acugaaucgg aacaaggcaa 20
<210> 68
<211> 20
<212> РНК
<213> Homo sapiens
<400> 68
ccaugggugg aguuuagcca 20
<210> 69
<211> 20
<212> РНК
<213> Homo sapiens
<400> 69
aagcagcagu auccucuugg 20
<210> 70
<211> 20
<212> РНК
<213> Homo sapiens
<400> 70
agaguaucca gugaggccag 20
<210> 71
<211> 20
<212> РНК
<213> Homo sapiens
<400> 71
gagugugugg aacugcugaa 20
<210> 72
<211> 20
<212> РНК
<213> Homo sapiens
<400> 72
uagucuuaga guauccagug 20
<210> 73
<211> 74
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 73
aacagcauag caaguuaaaa uaaggcuagu ccguuaucaa cuugaaaaag uggcaccgag 60
ucggugcuuu uuuu 74
<210> 74
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 74
aguccuggua uccucuauga guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 75
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 75
aguccuggua uccucuauga guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 76
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 76
aguccuggua uccucuauga guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 77
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 77
aguccuggua uccucuauga guuuuagagc uaugcuguuu ug 42
<210> 78
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 78
aguccuggua uccucuauga guuuuagagc uaugcuguuu ug 42
<210> 79
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 79
aaaaacugga augacugaau guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 80
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 80
aaaaacugga augacugaau guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 81
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 81
aaaaacugga augacugaau guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 82
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 82
aaaaacugga augacugaau guuuuagagc uaugcuguuu ug 42
<210> 83
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 83
aaaaacugga augacugaau guuuuagagc uaugcuguuu ug 42
<210> 84
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 84
ggagaaggaa acuagcuaaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 85
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 85
ggagaaggaa acuagcuaaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 86
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 86
ggagaaggaa acuagcuaaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 87
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 87
ggagaaggaa acuagcuaaa guuuuagagc uaugcuguuu ug 42
<210> 88
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 88
ggagaaggaa acuagcuaaa guuuuagagc uaugcuguuu ug 42
<210> 89
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 89
guuuccuucu cccaucauag guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 90
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 90
guuuccuucu cccaucauag guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 91
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 91
guuuccuucu cccaucauag guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 92
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 92
guuuccuucu cccaucauag guuuuagagc uaugcuguuu ug 42
<210> 93
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 93
guuuccuucu cccaucauag guuuuagagc uaugcuguuu ug 42
<210> 94
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 94
gggagaagga aacuagcuaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 95
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 95
gggagaagga aacuagcuaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 96
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 96
gggagaagga aacuagcuaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 97
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 97
gggagaagga aacuagcuaa guuuuagagc uaugcuguuu ug 42
<210> 98
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 98
gggagaagga aacuagcuaa guuuuagagc uaugcuguuu ug 42
<210> 99
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 99
cacuggagcu agagacaaga guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 100
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 100
cacuggagcu agagacaaga guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 101
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 101
cacuggagcu agagacaaga guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 102
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 102
cacuggagcu agagacaaga guuuuagagc uaugcuguuu ug 42
<210> 103
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 103
cacuggagcu agagacaaga guuuuagagc uaugcuguuu ug 42
<210> 104
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 104
agagacaaga agguaaaaaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 105
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 105
agagacaaga agguaaaaaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 106
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 106
agagacaaga agguaaaaaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 107
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 107
agagacaaga agguaaaaaa guuuuagagc uaugcuguuu ug 42
<210> 108
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 108
agagacaaga agguaaaaaa guuuuagagc uaugcuguuu ug 42
<210> 109
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 109
ggcuagggau gaagaauaaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 110
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 110
ggcuagggau gaagaauaaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 111
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 111
ggcuagggau gaagaauaaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 112
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 112
ggcuagggau gaagaauaaa guuuuagagc uaugcuguuu ug 42
<210> 113
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 113
ggcuagggau gaagaauaaa guuuuagagc uaugcuguuu ug 42
<210> 114
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 114
aaaaauugga augacugaau guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 115
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 115
aaaaauugga augacugaau guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 116
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 116
aaaaauugga augacugaau guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 117
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 117
aaaaauugga augacugaau guuuuagagc uaugcuguuu ug 42
<210> 118
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 118
aaaaauugga augacugaau guuuuagagc uaugcuguuu ug 42
<210> 119
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 119
uggucaaguu ugccuuguca guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 120
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 120
uggucaaguu ugccuuguca guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 121
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 121
uggucaaguu ugccuuguca guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 122
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 122
uggucaaguu ugccuuguca guuuuagagc uaugcuguuu ug 42
<210> 123
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 123
uggucaaguu ugccuuguca guuuuagagc uaugcuguuu ug 42
<210> 124
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 124
gggagaagaa aacuagcuaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 125
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 125
gggagaagaa aacuagcuaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 126
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 126
gggagaagaa aacuagcuaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 127
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 127
gggagaagaa aacuagcuaa guuuuagagc uaugcuguuu ug 42
<210> 128
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 128
gggagaagaa aacuagcuaa guuuuagagc uaugcuguuu ug 42
<210> 129
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 129
ggcaaggcug gccaacccau guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 130
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 130
ggcaaggcug gccaacccau guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 131
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 131
ggcaaggcug gccaacccau guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 132
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 132
ggcaaggcug gccaacccau guuuuagagc uaugcuguuu ug 42
<210> 133
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 133
ggcaaggcug gccaacccau guuuuagagc uaugcuguuu ug 42
<210> 134
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 134
acggcugaca aaagaagucc guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 135
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 135
acggcugaca aaagaagucc guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 136
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 136
acggcugaca aaagaagucc guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 137
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 137
acggcugaca aaagaagucc guuuuagagc uaugcuguuu ug 42
<210> 138
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 138
acggcugaca aaagaagucc guuuuagagc uaugcuguuu ug 42
<210> 139
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 139
ccuggcuaaa cuccacccau guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 140
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 140
ccuggcuaaa cuccacccau guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 141
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 141
ccuggcuaaa cuccacccau guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 142
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 142
ccuggcuaaa cuccacccau guuuuagagc uaugcuguuu ug 42
<210> 143
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 143
ccuggcuaaa cuccacccau guuuuagagc uaugcuguuu ug 42
<210> 144
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 144
ggagaagaaa acuagcuaaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 145
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 145
ggagaagaaa acuagcuaaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 146
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 146
ggagaagaaa acuagcuaaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 147
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 147
ggagaagaaa acuagcuaaa guuuuagagc uaugcuguuu ug 42
<210> 148
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 148
ggagaagaaa acuagcuaaa guuuuagagc uaugcuguuu ug 42
<210> 149
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 149
cuugucaagg cuauugguca guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 150
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 150
cuugucaagg cuauugguca guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 151
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 151
cuugucaagg cuauugguca guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 152
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 152
cuugucaagg cuauugguca guuuuagagc uaugcuguuu ug 42
<210> 153
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 153
cuugucaagg cuauugguca guuuuagagc uaugcuguuu ug 42
<210> 154
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 154
aguccuggua ucuucuaugg guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 155
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 155
aguccuggua ucuucuaugg guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 156
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 156
aguccuggua ucuucuaugg guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 157
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 157
aguccuggua ucuucuaugg guuuuagagc uaugcuguuu ug 42
<210> 158
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 158
aguccuggua ucuucuaugg guuuuagagc uaugcuguuu ug 42
<210> 159
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 159
guccugguau cuucuauggu guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 160
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 160
guccugguau cuucuauggu guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 161
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 161
guccugguau cuucuauggu guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 162
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 162
guccugguau cuucuauggu guuuuagagc uaugcuguuu ug 42
<210> 163
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 163
guccugguau cuucuauggu guuuuagagc uaugcuguuu ug 42
<210> 164
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 164
cuugaccaau agccuugaca guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 165
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 165
cuugaccaau agccuugaca guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 166
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 166
cuugaccaau agccuugaca guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 167
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 167
cuugaccaau agccuugaca guuuuagagc uaugcuguuu ug 42
<210> 168
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 168
cuugaccaau agccuugaca guuuuagagc uaugcuguuu ug 42
<210> 169
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 169
caaggcuauu ggucaaggca guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 170
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 170
caaggcuauu ggucaaggca guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 171
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 171
caaggcuauu ggucaaggca guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 172
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 172
caaggcuauu ggucaaggca guuuuagagc uaugcuguuu ug 42
<210> 173
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 173
caaggcuauu ggucaaggca guuuuagagc uaugcuguuu ug 42
<210> 174
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 174
acugaaucgg aacaaggcaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 175
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 175
acugaaucgg aacaaggcaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 176
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 176
acugaaucgg aacaaggcaa guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 177
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 177
acugaaucgg aacaaggcaa guuuuagagc uaugcuguuu ug 42
<210> 178
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 178
acugaaucgg aacaaggcaa guuuuagagc uaugcuguuu ug 42
<210> 179
<400> 179
000
<210> 180
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 180
aucagaggcc aaacccuucc 20
<210> 181
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 181
aucagaggcc aaacccuucc guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 182
<211> 12
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 182
guuuuagagc ua 12
<210> 183
<211> 12
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 183
guuuaagagc ua 12
<210> 184
<211> 5
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 184
ugcug 5
<210> 185
<211> 5
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 185
uuuug 5
<210> 186
<211> 4
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 186
gaaa 4
<210> 187
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 187
uagcaaguua aaauaaggcu aguccguuau caacuugaaa aaguggcacc gagucggugc 60
<210> 188
<211> 60
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 188
uagcaaguuu aaauaaggcu aguccguuau caacuugaaa aaguggcacc gagucggugc 60
<210> 189
<211> 5
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 189
cagca 5
<210> 190
<211> 5000
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> MISC_FEATURE
<222> (1)..(5000)
<223> /примечание="Эта последовательность может охватывать 50-5000 нуклеотидов"
<220>
<221> источник
<223> /примечание="См. поданное описание для подробного описания замен и
предпочтительных вариантов осуществления"
<400> 190
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2040
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2100
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2160
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2280
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2340
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2400
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2460
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2520
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2580
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2640
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2700
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2760
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2820
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2880
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2940
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3000
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3060
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4980
aaaaaaaaaa aaaaaaaaaa 5000
<210> 191
<211> 13
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 191
uagcaaguua aaa 13
<210> 192
<211> 13
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 192
uagcaaguuu aaa 13
<210> 193
<211> 47
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 193
uaaggcuagu ccguuaucaa cuugaaaaag uggcaccgag ucggugc 47
<210> 194
<211> 51
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 194
uaaggcuagu ccguuaucaa cuugaaaaag uggcaccgag ucggugcuuu u 51
<210> 195
<211> 76
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 195
guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc cguuaucaac uugaaaaagu 60
ggcaccgagu cggugc 76
<210> 196
<211> 76
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 196
guuuaagagc uagaaauagc aaguuuaaau aaggcuaguc cguuaucaac uugaaaaagu 60
ggcaccgagu cggugc 76
<210> 197
<211> 86
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 197
guuuuagagc uaugcuggaa acagcauagc aaguuaaaau aaggcuaguc cguuaucaac 60
uugaaaaagu ggcaccgagu cggugc 86
<210> 198
<211> 86
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 198
guuuaagagc uaugcuggaa acagcauagc aaguuuaaau aaggcuaguc cguuaucaac 60
uugaaaaagu ggcaccgagu cggugc 86
<210> 199
<211> 17
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 199
guuuuagagc uaugcug 17
<210> 200
<211> 17
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 200
guuuaagagc uaugcug 17
<210> 201
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 201
guuuuagagc uaugcuguuu ug 22
<210> 202
<211> 22
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 202
guuuaagagc uaugcuguuu ug 22
<210> 203
<211> 65
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 203
cagcauagca aguuaaaaua aggcuagucc guuaucaacu ugaaaaagug gcaccgaguc 60
ggugc 65
<210> 204
<211> 65
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 204
cagcauagca aguuuaaaua aggcuagucc guuaucaacu ugaaaaagug gcaccgaguc 60
ggugc 65
<210> 205
<211> 1368
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 205
Met Asp Lys Lys Tyr Ser Ile Gly Leu Asp Ile Gly Thr Asn Ser Val
1 5 10 15
Gly Trp Ala Val Ile Thr Asp Glu Tyr Lys Val Pro Ser Lys Lys Phe
20 25 30
Lys Val Leu Gly Asn Thr Asp Arg His Ser Ile Lys Lys Asn Leu Ile
35 40 45
Gly Ala Leu Leu Phe Asp Ser Gly Glu Thr Ala Glu Ala Thr Arg Leu
50 55 60
Lys Arg Thr Ala Arg Arg Arg Tyr Thr Arg Arg Lys Asn Arg Ile Cys
65 70 75 80
Tyr Leu Gln Glu Ile Phe Ser Asn Glu Met Ala Lys Val Asp Asp Ser
85 90 95
Phe Phe His Arg Leu Glu Glu Ser Phe Leu Val Glu Glu Asp Lys Lys
100 105 110
His Glu Arg His Pro Ile Phe Gly Asn Ile Val Asp Glu Val Ala Tyr
115 120 125
His Glu Lys Tyr Pro Thr Ile Tyr His Leu Arg Lys Lys Leu Val Asp
130 135 140
Ser Thr Asp Lys Ala Asp Leu Arg Leu Ile Tyr Leu Ala Leu Ala His
145 150 155 160
Met Ile Lys Phe Arg Gly His Phe Leu Ile Glu Gly Asp Leu Asn Pro
165 170 175
Asp Asn Ser Asp Val Asp Lys Leu Phe Ile Gln Leu Val Gln Thr Tyr
180 185 190
Asn Gln Leu Phe Glu Glu Asn Pro Ile Asn Ala Ser Gly Val Asp Ala
195 200 205
Lys Ala Ile Leu Ser Ala Arg Leu Ser Lys Ser Arg Arg Leu Glu Asn
210 215 220
Leu Ile Ala Gln Leu Pro Gly Glu Lys Lys Asn Gly Leu Phe Gly Asn
225 230 235 240
Leu Ile Ala Leu Ser Leu Gly Leu Thr Pro Asn Phe Lys Ser Asn Phe
245 250 255
Asp Leu Ala Glu Asp Ala Lys Leu Gln Leu Ser Lys Asp Thr Tyr Asp
260 265 270
Asp Asp Leu Asp Asn Leu Leu Ala Gln Ile Gly Asp Gln Tyr Ala Asp
275 280 285
Leu Phe Leu Ala Ala Lys Asn Leu Ser Asp Ala Ile Leu Leu Ser Asp
290 295 300
Ile Leu Arg Val Asn Thr Glu Ile Thr Lys Ala Pro Leu Ser Ala Ser
305 310 315 320
Met Ile Lys Arg Tyr Asp Glu His His Gln Asp Leu Thr Leu Leu Lys
325 330 335
Ala Leu Val Arg Gln Gln Leu Pro Glu Lys Tyr Lys Glu Ile Phe Phe
340 345 350
Asp Gln Ser Lys Asn Gly Tyr Ala Gly Tyr Ile Asp Gly Gly Ala Ser
355 360 365
Gln Glu Glu Phe Tyr Lys Phe Ile Lys Pro Ile Leu Glu Lys Met Asp
370 375 380
Gly Thr Glu Glu Leu Leu Val Lys Leu Asn Arg Glu Asp Leu Leu Arg
385 390 395 400
Lys Gln Arg Thr Phe Asp Asn Gly Ser Ile Pro His Gln Ile His Leu
405 410 415
Gly Glu Leu His Ala Ile Leu Arg Arg Gln Glu Asp Phe Tyr Pro Phe
420 425 430
Leu Lys Asp Asn Arg Glu Lys Ile Glu Lys Ile Leu Thr Phe Arg Ile
435 440 445
Pro Tyr Tyr Val Gly Pro Leu Ala Arg Gly Asn Ser Arg Phe Ala Trp
450 455 460
Met Thr Arg Lys Ser Glu Glu Thr Ile Thr Pro Trp Asn Phe Glu Glu
465 470 475 480
Val Val Asp Lys Gly Ala Ser Ala Gln Ser Phe Ile Glu Arg Met Thr
485 490 495
Asn Phe Asp Lys Asn Leu Pro Asn Glu Lys Val Leu Pro Lys His Ser
500 505 510
Leu Leu Tyr Glu Tyr Phe Thr Val Tyr Asn Glu Leu Thr Lys Val Lys
515 520 525
Tyr Val Thr Glu Gly Met Arg Lys Pro Ala Phe Leu Ser Gly Glu Gln
530 535 540
Lys Lys Ala Ile Val Asp Leu Leu Phe Lys Thr Asn Arg Lys Val Thr
545 550 555 560
Val Lys Gln Leu Lys Glu Asp Tyr Phe Lys Lys Ile Glu Cys Phe Asp
565 570 575
Ser Val Glu Ile Ser Gly Val Glu Asp Arg Phe Asn Ala Ser Leu Gly
580 585 590
Thr Tyr His Asp Leu Leu Lys Ile Ile Lys Asp Lys Asp Phe Leu Asp
595 600 605
Asn Glu Glu Asn Glu Asp Ile Leu Glu Asp Ile Val Leu Thr Leu Thr
610 615 620
Leu Phe Glu Asp Arg Glu Met Ile Glu Glu Arg Leu Lys Thr Tyr Ala
625 630 635 640
His Leu Phe Asp Asp Lys Val Met Lys Gln Leu Lys Arg Arg Arg Tyr
645 650 655
Thr Gly Trp Gly Arg Leu Ser Arg Lys Leu Ile Asn Gly Ile Arg Asp
660 665 670
Lys Gln Ser Gly Lys Thr Ile Leu Asp Phe Leu Lys Ser Asp Gly Phe
675 680 685
Ala Asn Arg Asn Phe Met Gln Leu Ile His Asp Asp Ser Leu Thr Phe
690 695 700
Lys Glu Asp Ile Gln Lys Ala Gln Val Ser Gly Gln Gly Asp Ser Leu
705 710 715 720
His Glu His Ile Ala Asn Leu Ala Gly Ser Pro Ala Ile Lys Lys Gly
725 730 735
Ile Leu Gln Thr Val Lys Val Val Asp Glu Leu Val Lys Val Met Gly
740 745 750
Arg His Lys Pro Glu Asn Ile Val Ile Glu Met Ala Arg Glu Asn Gln
755 760 765
Thr Thr Gln Lys Gly Gln Lys Asn Ser Arg Glu Arg Met Lys Arg Ile
770 775 780
Glu Glu Gly Ile Lys Glu Leu Gly Ser Gln Ile Leu Lys Glu His Pro
785 790 795 800
Val Glu Asn Thr Gln Leu Gln Asn Glu Lys Leu Tyr Leu Tyr Tyr Leu
805 810 815
Gln Asn Gly Arg Asp Met Tyr Val Asp Gln Glu Leu Asp Ile Asn Arg
820 825 830
Leu Ser Asp Tyr Asp Val Asp His Ile Val Pro Gln Ser Phe Leu Lys
835 840 845
Asp Asp Ser Ile Asp Asn Lys Val Leu Thr Arg Ser Asp Lys Asn Arg
850 855 860
Gly Lys Ser Asp Asn Val Pro Ser Glu Glu Val Val Lys Lys Met Lys
865 870 875 880
Asn Tyr Trp Arg Gln Leu Leu Asn Ala Lys Leu Ile Thr Gln Arg Lys
885 890 895
Phe Asp Asn Leu Thr Lys Ala Glu Arg Gly Gly Leu Ser Glu Leu Asp
900 905 910
Lys Ala Gly Phe Ile Lys Arg Gln Leu Val Glu Thr Arg Gln Ile Thr
915 920 925
Lys His Val Ala Gln Ile Leu Asp Ser Arg Met Asn Thr Lys Tyr Asp
930 935 940
Glu Asn Asp Lys Leu Ile Arg Glu Val Lys Val Ile Thr Leu Lys Ser
945 950 955 960
Lys Leu Val Ser Asp Phe Arg Lys Asp Phe Gln Phe Tyr Lys Val Arg
965 970 975
Glu Ile Asn Asn Tyr His His Ala His Asp Ala Tyr Leu Asn Ala Val
980 985 990
Val Gly Thr Ala Leu Ile Lys Lys Tyr Pro Lys Leu Glu Ser Glu Phe
995 1000 1005
Val Tyr Gly Asp Tyr Lys Val Tyr Asp Val Arg Lys Met Ile Ala
1010 1015 1020
Lys Ser Glu Gln Glu Ile Gly Lys Ala Thr Ala Lys Tyr Phe Phe
1025 1030 1035
Tyr Ser Asn Ile Met Asn Phe Phe Lys Thr Glu Ile Thr Leu Ala
1040 1045 1050
Asn Gly Glu Ile Arg Lys Arg Pro Leu Ile Glu Thr Asn Gly Glu
1055 1060 1065
Thr Gly Glu Ile Val Trp Asp Lys Gly Arg Asp Phe Ala Thr Val
1070 1075 1080
Arg Lys Val Leu Ser Met Pro Gln Val Asn Ile Val Lys Lys Thr
1085 1090 1095
Glu Val Gln Thr Gly Gly Phe Ser Lys Glu Ser Ile Leu Pro Lys
1100 1105 1110
Arg Asn Ser Asp Lys Leu Ile Ala Arg Lys Lys Asp Trp Asp Pro
1115 1120 1125
Lys Lys Tyr Gly Gly Phe Asp Ser Pro Thr Val Ala Tyr Ser Val
1130 1135 1140
Leu Val Val Ala Lys Val Glu Lys Gly Lys Ser Lys Lys Leu Lys
1145 1150 1155
Ser Val Lys Glu Leu Leu Gly Ile Thr Ile Met Glu Arg Ser Ser
1160 1165 1170
Phe Glu Lys Asn Pro Ile Asp Phe Leu Glu Ala Lys Gly Tyr Lys
1175 1180 1185
Glu Val Lys Lys Asp Leu Ile Ile Lys Leu Pro Lys Tyr Ser Leu
1190 1195 1200
Phe Glu Leu Glu Asn Gly Arg Lys Arg Met Leu Ala Ser Ala Gly
1205 1210 1215
Glu Leu Gln Lys Gly Asn Glu Leu Ala Leu Pro Ser Lys Tyr Val
1220 1225 1230
Asn Phe Leu Tyr Leu Ala Ser His Tyr Glu Lys Leu Lys Gly Ser
1235 1240 1245
Pro Glu Asp Asn Glu Gln Lys Gln Leu Phe Val Glu Gln His Lys
1250 1255 1260
His Tyr Leu Asp Glu Ile Ile Glu Gln Ile Ser Glu Phe Ser Lys
1265 1270 1275
Arg Val Ile Leu Ala Asp Ala Asn Leu Asp Lys Val Leu Ser Ala
1280 1285 1290
Tyr Asn Lys His Arg Asp Lys Pro Ile Arg Glu Gln Ala Glu Asn
1295 1300 1305
Ile Ile His Leu Phe Thr Leu Thr Asn Leu Gly Ala Pro Ala Ala
1310 1315 1320
Phe Lys Tyr Phe Asp Thr Thr Ile Asp Arg Lys Arg Tyr Thr Ser
1325 1330 1335
Thr Lys Glu Val Leu Asp Ala Thr Leu Ile His Gln Ser Ile Thr
1340 1345 1350
Gly Leu Tyr Glu Thr Arg Ile Asp Leu Ser Gln Leu Gly Gly Asp
1355 1360 1365
<210> 206
<211> 7
<212> БЕЛОК
<213> Вирус обезьян 40
<400> 206
Pro Lys Lys Lys Arg Lys Val
1 5
<210> 207
<211> 16
<212> БЕЛОК
<213> Неустановленное
<220>
<221> источник
<223> /примечание="Описание незивестного: Последовательность двусоставного
NLS из нуклеоплазмина"
<400> 207
Lys Arg Pro Ala Ala Thr Lys Lys Ala Gly Gln Ala Lys Lys Lys Lys
1 5 10 15
<210> 208
<211> 9
<212> БЕЛОК
<213> Неустановленное
<220>
<221> источник
<223> /примечание="Описание незивестного: Последовательность NLS из C-myc"
<400> 208
Pro Ala Ala Lys Arg Val Lys Leu Asp
1 5
<210> 209
<211> 11
<212> БЕЛОК
<213> Неустановленное
<220>
<221> источник
<223> /примечание="Описание незивестного: Последовательность NLS из C-myc"
<400> 209
Arg Gln Arg Arg Asn Glu Leu Lys Arg Ser Pro
1 5 10
<210> 210
<211> 38
<212> БЕЛОК
<213> Homo sapiens
<400> 210
Asn Gln Ser Ser Asn Phe Gly Pro Met Lys Gly Gly Asn Phe Gly Gly
1 5 10 15
Arg Ser Ser Gly Pro Tyr Gly Gly Gly Gly Gln Tyr Phe Ala Lys Pro
20 25 30
Arg Asn Gln Gly Gly Tyr
35
<210> 211
<211> 42
<212> БЕЛОК
<213> Неустановленное
<220>
<221> источник
<223> /примечание="Описание незивестного: Последовательность домена IBB из
импортина-альфа"
<400> 211
Arg Met Arg Ile Glx Phe Lys Asn Lys Gly Lys Asp Thr Ala Glu Leu
1 5 10 15
Arg Arg Arg Arg Val Glu Val Ser Val Glu Leu Arg Lys Ala Lys Lys
20 25 30
Asp Glu Gln Ile Leu Lys Arg Arg Asn Val
35 40
<210> 212
<211> 8
<212> БЕЛОК
<213> Неустановленное
<220>
<221> источник
<223> /примечание="Описание незивестного: Последовательность из T-белка
миомы"
<400> 212
Val Ser Arg Lys Arg Pro Arg Pro
1 5
<210> 213
<211> 8
<212> БЕЛОК
<213> Неустановленное
<220>
<221> источник
<223> /примечание="Описание незивестного: Последовательность из T-белка
миомы"
<400> 213
Pro Pro Lys Lys Ala Arg Glu Asp
1 5
<210> 214
<211> 8
<212> БЕЛОК
<213> Homo sapiens
<400> 214
Pro Gln Pro Lys Lys Lys Pro Leu
1 5
<210> 215
<211> 12
<212> БЕЛОК
<213> Mus musculus
<400> 215
Ser Ala Leu Ile Lys Lys Lys Lys Lys Met Ala Pro
1 5 10
<210> 216
<211> 5
<212> БЕЛОК
<213> Вирус гриппа
<400> 216
Asp Arg Leu Arg Arg
1 5
<210> 217
<211> 7
<212> БЕЛОК
<213> Вирус гриппа
<400> 217
Pro Lys Gln Lys Lys Arg Lys
1 5
<210> 218
<211> 10
<212> БЕЛОК
<213> Вирус гепатита дельта
<400> 218
Arg Lys Leu Lys Lys Lys Ile Lys Lys Leu
1 5 10
<210> 219
<211> 10
<212> БЕЛОК
<213> Mus musculus
<400> 219
Arg Glu Lys Lys Lys Phe Leu Lys Arg Arg
1 5 10
<210> 220
<211> 20
<212> БЕЛОК
<213> Homo sapiens
<400> 220
Lys Arg Lys Gly Asp Glu Val Asp Gly Val Asp Glu Val Ala Lys Lys
1 5 10 15
Lys Ser Lys Lys
20
<210> 221
<211> 17
<212> БЕЛОК
<213> Homo sapiens
<400> 221
Arg Lys Cys Leu Gln Ala Gly Met Asn Leu Glu Ala Arg Lys Thr Lys
1 5 10 15
Lys
<210> 222
<211> 4107
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 222
atggataaaa agtacagcat cgggctggac atcggtacaa actcagtggg gtgggccgtg 60
attacggacg agtacaaggt accctccaaa aaatttaaag tgctgggtaa cacggacaga 120
cactctataa agaaaaatct tattggagcc ttgctgttcg actcaggcga gacagccgaa 180
gccacaaggt tgaagcggac cgccaggagg cggtatacca ggagaaagaa ccgcatatgc 240
tacctgcaag aaatcttcag taacgagatg gcaaaggttg acgatagctt tttccatcgc 300
ctggaagaat cctttcttgt tgaggaagac aagaagcacg aacggcaccc catctttggc 360
aatattgtcg acgaagtggc atatcacgaa aagtacccga ctatctacca cctcaggaag 420
aagctggtgg actctaccga taaggcggac ctcagactta tttatttggc actcgcccac 480
atgattaaat ttagaggaca tttcttgatc gagggcgacc tgaacccgga caacagtgac 540
gtcgataagc tgttcatcca acttgtgcag acctacaatc aactgttcga agaaaaccct 600
ataaatgctt caggagtcga cgctaaagca atcctgtccg cgcgcctctc aaaatctaga 660
agacttgaga atctgattgc tcagttgccc ggggaaaaga aaaatggatt gtttggcaac 720
ctgatcgccc tcagtctcgg actgacccca aatttcaaaa gtaacttcga cctggccgaa 780
gacgctaagc tccagctgtc caaggacaca tacgatgacg acctcgacaa tctgctggcc 840
cagattgggg atcagtacgc cgatctcttt ttggcagcaa agaacctgtc cgacgccatc 900
ctgttgagcg atatcttgag agtgaacacc gaaattacta aagcacccct tagcgcatct 960
atgatcaagc ggtacgacga gcatcatcag gatctgaccc tgctgaaggc tcttgtgagg 1020
caacagctcc ccgaaaaata caaggaaatc ttctttgacc agagcaaaaa cggctacgct 1080
ggctatatag atggtggggc cagtcaggag gaattctata aattcatcaa gcccattctc 1140
gagaaaatgg acggcacaga ggagttgctg gtcaaactta acagggagga cctgctgcgg 1200
aagcagcgga cctttgacaa cgggtctatc ccccaccaga ttcatctggg cgaactgcac 1260
gcaatcctga ggaggcagga ggatttttat ccttttctta aagataaccg cgagaaaata 1320
gaaaagattc ttacattcag gatcccgtac tacgtgggac ctctcgcccg gggcaattca 1380
cggtttgcct ggatgacaag gaagtcagag gagactatta caccttggaa cttcgaagaa 1440
gtggtggaca agggtgcatc tgcccagtct ttcatcgagc ggatgacaaa ttttgacaag 1500
aacctcccta atgagaaggt gctgcccaaa cattctctgc tctacgagta ctttaccgtc 1560
tacaatgaac tgactaaagt caagtacgtc accgagggaa tgaggaagcc ggcattcctt 1620
agtggagaac agaagaaggc gattgtagac ctgttgttca agaccaacag gaaggtgact 1680
gtgaagcaac ttaaagaaga ctactttaag aagatcgaat gttttgacag tgtggaaatt 1740
tcaggggttg aagaccgctt caatgcgtca ttggggactt accatgatct tctcaagatc 1800
ataaaggaca aagacttcct ggacaacgaa gaaaatgagg atattctcga agacatcgtc 1860
ctcaccctga ccctgttcga agacagggaa atgatagaag agcgcttgaa aacctatgcc 1920
cacctcttcg acgataaagt tatgaagcag ctgaagcgca ggagatacac aggatgggga 1980
agattgtcaa ggaagctgat caatggaatt agggataaac agagtggcaa gaccatactg 2040
gatttcctca aatctgatgg cttcgccaat aggaacttca tgcaactgat tcacgatgac 2100
tctcttacct tcaaggagga cattcaaaag gctcaggtga gcgggcaggg agactccctt 2160
catgaacaca tcgcgaattt ggcaggttcc cccgctatta aaaagggcat ccttcaaact 2220
gtcaaggtgg tggatgaatt ggtcaaggta atgggcagac ataagccaga aaatattgtg 2280
atcgagatgg cccgcgaaaa ccagaccaca cagaagggcc agaaaaatag tagagagcgg 2340
atgaagagga tcgaggaggg catcaaagag ctgggatctc agattctcaa agaacacccc 2400
gtagaaaaca cacagctgca gaacgaaaaa ttgtacttgt actatctgca gaacggcaga 2460
gacatgtacg tcgaccaaga acttgatatt aatagactgt ccgactatga cgtagaccat 2520
atcgtgcccc agtccttcct gaaggacgac tccattgata acaaagtctt gacaagaagc 2580
gacaagaaca ggggtaaaag tgataatgtg cctagcgagg aggtggtgaa aaaaatgaag 2640
aactactggc gacagctgct taatgcaaag ctcattacac aacggaagtt cgataatctg 2700
acgaaagcag agagaggtgg cttgtctgag ttggacaagg cagggtttat taagcggcag 2760
ctggtggaaa ctaggcagat cacaaagcac gtggcgcaga ttttggacag ccggatgaac 2820
acaaaatacg acgaaaatga taaactgata cgagaggtca aagttatcac gctgaaaagc 2880
aagctggtgt ccgattttcg gaaagacttc cagttctaca aagttcgcga gattaataac 2940
taccatcatg ctcacgatgc gtacctgaac gctgttgtcg ggaccgcctt gataaagaag 3000
tacccaaagc tggaatccga gttcgtatac ggggattaca aagtgtacga tgtgaggaaa 3060
atgatagcca agtccgagca ggagattgga aaggccacag ctaagtactt cttttattct 3120
aacatcatga atttttttaa gacggaaatt accctggcca acggagagat cagaaagcgg 3180
ccccttatag agacaaatgg tgaaacaggt gaaatcgtct gggataaggg cagggatttc 3240
gctactgtga ggaaggtgct gagtatgcca caggtaaata tcgtgaaaaa aaccgaagta 3300
cagaccggag gattttccaa ggaaagcatt ttgcctaaaa gaaactcaga caagctcatc 3360
gcccgcaaga aagattggga ccctaagaaa tacgggggat ttgactcacc caccgtagcc 3420
tattctgtgc tggtggtagc taaggtggaa aaaggaaagt ctaagaagct gaagtccgtg 3480
aaggaactct tgggaatcac tatcatggaa agatcatcct ttgaaaagaa ccctatcgat 3540
ttcctggagg ctaagggtta caaggaggtc aagaaagacc tcatcattaa actgccaaaa 3600
tactctctct tcgagctgga aaatggcagg aagagaatgt tggccagcgc cggagagctg 3660
caaaagggaa acgagcttgc tctgccctcc aaatatgtta attttctcta tctcgcttcc 3720
cactatgaaa agctgaaagg gtctcccgaa gataacgagc agaagcagct gttcgtcgaa 3780
cagcacaagc actatctgga tgaaataatc gaacaaataa gcgagttcag caaaagggtt 3840
atcctggcgg atgctaattt ggacaaagta ctgtctgctt ataacaagca ccgggataag 3900
cctattaggg aacaagccga gaatataatt cacctcttta cactcacgaa tctcggagcc 3960
cccgccgcct tcaaatactt tgatacgact atcgaccgga aacggtatac cagtaccaaa 4020
gaggtcctcg atgccaccct catccaccag tcaattactg gcctgtacga aacacggatc 4080
gacctctctc aactgggcgg cgactag 4107
<210> 223
<211> 4164
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 223
atggctccga agaaaaagcg taaagtggat aaaaaataca gcattggtct ggacattggc 60
acgaactcag tgggttgggc ggtcatcacg gatgaatata aggtcccgtc aaaaaagttc 120
aaagtgctgg gcaacaccga tcgccattcg attaaaaaga atctgatcgg cgcgctgctg 180
tttgatagcg gtgaaaccgc ggaagcaacg cgtctgaaac gtaccgcacg tcgccgttac 240
acgcgccgta aaaatcgtat tctgtatctg caggaaatct ttagcaacga aatggcgaaa 300
gttgatgact catttttcca ccgcctggaa gaatcgtttc tggtcgaaga agacaaaaag 360
catgaacgtc acccgatttt cggtaatatc gttgatgaag tcgcgtacca tgaaaaatat 420
ccgacgattt accatctgcg taaaaaactg gtggattcaa ccgacaaagc cgatctgcgc 480
ctgatttacc tggcactggc tcatatgatc aaatttcgtg gccacttcct gattgaaggt 540
gacctgaacc cggataactc tgacgttgat aagctgttca tccagctggt ccaaacctat 600
aatcagctgt tcgaagaaaa cccgatcaat gcaagtggcg ttgatgcgaa ggccattctg 660
tccgctcgcc tgagtaaatc ccgccgtctg gaaaacctga ttgcacaact gccgggcgaa 720
aagaaaaacg gcctgtttgg taatctgatc gctctgtcac tgggtctgac gccgaacttt 780
aaatcgaatt tcgacctggc agaagatgct aagctgcagc tgagcaaaga tacctacgat 840
gacgatctgg acaacctgct ggcgcaaatt ggtgaccagt atgccgacct gtttctggcg 900
gccaaaaatc tgtcagatgc cattctgctg tcggacatcc tgcgcgtgaa caccgaaatc 960
acgaaagcgc cgctgtcagc ctcgatgatt aaacgctacg atgaacatca ccaggacctg 1020
accctgctga aagcactggt tcgtcagcaa ctgccggaaa agtacaagga aattttcttt 1080
gaccaatcta agaacggcta tgcaggttac atcgatggcg gtgctagtca ggaagaattc 1140
tacaagttca tcaagccgat cctggaaaaa atggatggca cggaagaact gctggtgaaa 1200
ctgaatcgtg aagatctgct gcgtaaacaa cgcacctttg acaacggcag cattccgcat 1260
cagatccacc tgggtgaact gcatgcgatt ctgcgccgtc aggaagattt ttatccgttc 1320
ctgaaagaca accgtgaaaa aattgaaaag atcctgacgt ttcgcatccc gtattacgtt 1380
ggcccgctgg cgcgtggtaa tagccgcttc gcctggatga cccgcaaatc tgaagaaacc 1440
attacgccgt ggaactttga agaagtggtt gataaaggtg caagcgctca gtcttttatc 1500
gaacgtatga ccaatttcga taaaaacctg ccgaatgaaa aggtcctgcc gaaacatagc 1560
ctgctgtatg aatactttac cgtgtacaac gaactgacga aagtgaagta tgttaccgaa 1620
ggcatgcgca aaccggcgtt tctgtctggt gaacagaaaa aagccattgt ggatctgctg 1680
ttcaagacca atcgtaaagt tacggtcaaa cagctgaagg aagattactt caaaaagatc 1740
gaagaattcg acagcgtgga aatttctggc gttgaagatc gtttcaacgc cagtctgggt 1800
acctatcatg acctgctgaa gatcatcaag gacaaggatt ttctggataa cgaagaaaat 1860
gaagacattc tggaagatat cgtgctgacc ctgacgctgt tcgaagatcg tgaaatgatt 1920
gaagaacgcc tgaaaacgta cgcacacctg tttgacgata aagttatgaa gcagctgaaa 1980
cgccgtcgct ataccggctg gggtcgtctg tctcgcaaac tgattaatgg catccgcgat 2040
aagcaaagtg gtaaaacgat tctggatttc ctgaaatccg acggctttgc caaccgtaat 2100
ttcatgcagc tgatccatga cgatagtctg acctttaagg aagacattca gaaagcacaa 2160
gtgtcaggcc agggtgattc gctgcatgaa cacattgcga acctggccgg ctccccggct 2220
attaaaaagg gtatcctgca gaccgtcaaa gtcgtggatg aactggtgaa ggttatgggc 2280
cgtcacaaac cggaaaacat tgtgatcgaa atggcgcgcg aaaatcagac cacgcaaaag 2340
ggtcagaaaa actcacgtga acgcatgaag cgcattgaag aaggcatcaa agaactgggt 2400
tcgcagattc tgaaagaaca tccggttgaa aacacccagc tgcaaaatga aaaactgtac 2460
ctgtattacc tgcaaaatgg ccgtgacatg tatgtcgatc aggaactgga catcaaccgc 2520
ctgagcgact atgatgtcga ccacattgtg ccgcagagct ttctgaagga cgattctatc 2580
gataataaag tgctgacccg ttctgataag aaccgcggta aaagcgacaa tgttccgtct 2640
gaagaagttg tcaaaaagat gaagaactac tggcgtcaac tgctgaatgc gaagctgatt 2700
acgcagcgta aattcgataa cctgaccaag gcggaacgcg gcggtctgag tgaactggat 2760
aaggccggct ttatcaaacg tcaactggtg gaaacccgcc agattacgaa acatgttgcc 2820
cagatcctgg attcccgcat gaacacgaaa tatgacgaaa atgataagct gattcgtgaa 2880
gtcaaagtga tcaccctgaa gagtaagctg gtgtccgatt tccgtaagga ctttcagttc 2940
tacaaagttc gcgaaattaa caattaccat cacgcacacg atgcttatct gaatgcagtg 3000
gttggcaccg ctctgatcaa aaagtatccg aaactggaaa gcgaatttgt gtatggtgat 3060
tacaaagtct atgacgtgcg caagatgatt gcgaaaagtg aacaggaaat cggcaaggcg 3120
accgccaagt actttttcta ttccaacatc atgaactttt tcaagaccga aatcacgctg 3180
gcaaatggcg aaattcgtaa acgcccgctg atcgaaacca acggcgaaac gggtgaaatt 3240
gtgtgggata aaggtcgtga cttcgcgacc gttcgcaaag tcctgtcaat gccgcaagtg 3300
aatatcgtta aaaagaccga agttcagacg ggcggtttta gtaaagaatc catcctgccg 3360
aagcgtaact cggataaact gattgcgcgc aaaaaggatt gggacccgaa aaagtacggc 3420
ggttttgata gtccgaccgt tgcatattcc gtcctggtcg tggctaaagt tgaaaaaggc 3480
aagagtaaaa agctgaagtc cgtcaaagaa ctgctgggta ttaccatcat ggaacgtagc 3540
tcttttgaaa agaacccgat tgacttcctg gaagccaagg gctacaaaga agtgaaaaag 3600
gatctgatta tcaagctgcc gaaatattcg ctgttcgaac tggaaaacgg tcgtaaacgc 3660
atgctggcaa gcgctggcga actgcagaag ggtaatgaac tggcactgcc gtctaaatat 3720
gtgaactttc tgtacctggc tagccattat gaaaaactga agggttctcc ggaagataac 3780
gaacagaagc aactgttcgt tgaacaacat aaacactacc tggatgaaat catcgaacag 3840
atctcagaat tctcgaaacg cgtcattctg gcggatgcca atctggacaa agtgctgagc 3900
gcgtataaca agcatcgtga taaaccgatt cgcgaacagg ccgaaaatat tatccacctg 3960
tttaccctga cgaacctggg cgcaccggca gcttttaaat acttcgatac cacgatcgac 4020
cgtaagcgct ataccagcac gaaagaagtt ctggatgcta ccctgattca tcagtcaatc 4080
accggtctgt atgaaacgcg tattgacctg agccaactgg gcggtgatag ccgtgccgac 4140
catcaccatc accatcacta atag 4164
<210> 224
<211> 74
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 224
aacagcauag caaguuaaaa uaaggcuagu ccguuaucaa cuugaaaaag uggcaccgag 60
ucggugcuuu uuuu 74
<210> 225
<211> 74
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 225
aacagcauag caaguuuaaa uaaggcuagu ccguuaucaa cuugaaaaag uggcaccgag 60
ucggugcuuu uuuu 74
<210> 226
<211> 16
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 226
guuuuagagc uaugcu 16
<210> 227
<211> 90
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 227
guuuaagagc uaugcuggaa acagcauagc aaguuuaaau aaggcuaguc cguuaucaac 60
uugaaaaagu ggcaccgagu cggugcuuuu 90
<210> 228
<211> 67
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 228
agcauagcaa guuaaaauaa ggcuaguccg uuaucaacuu gaaaaagugg caccgagucg 60
gugcuuu 67
<210> 229
<211> 85
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 229
guuggaacca uucaaaacag cauagcaagu uaaaauaagg cuaguccguu aucaacuuga 60
aaaaguggca ccgagucggu gcuuu 85
<210> 230
<211> 7
<212> БЕЛОК
<213> Вирус гравировки табака
<400> 230
Glu Asn Leu Tyr Phe Gln Gly
1 5
<210> 231
<211> 80
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 231
guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc cguuaucaac uugaaaaagu 60
ggcaccgagu cggugcuuuu 80
<210> 232
<211> 67
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 232
aacagcauag caaguuaaaa uaaggcuagu ccguuaucaa cuugaaaaag uggcaccgag 60
ucggugc 67
<210> 233
<211> 1393
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 233
Met Ala Pro Lys Lys Lys Arg Lys Val Asp Lys Lys Tyr Ser Ile Gly
1 5 10 15
Leu Asp Ile Gly Thr Asn Ser Val Gly Trp Ala Val Ile Thr Asp Glu
20 25 30
Tyr Lys Val Pro Ser Lys Lys Phe Lys Val Leu Gly Asn Thr Asp Arg
35 40 45
His Ser Ile Lys Lys Asn Leu Ile Gly Ala Leu Leu Phe Asp Ser Gly
50 55 60
Glu Thr Ala Glu Ala Thr Arg Leu Lys Arg Thr Ala Arg Arg Arg Tyr
65 70 75 80
Thr Arg Arg Lys Asn Arg Ile Cys Tyr Leu Gln Glu Ile Phe Ser Asn
85 90 95
Glu Met Ala Lys Val Asp Asp Ser Phe Phe His Arg Leu Glu Glu Ser
100 105 110
Phe Leu Val Glu Glu Asp Lys Lys His Glu Arg His Pro Ile Phe Gly
115 120 125
Asn Ile Val Asp Glu Val Ala Tyr His Glu Lys Tyr Pro Thr Ile Tyr
130 135 140
His Leu Arg Lys Lys Leu Val Asp Ser Thr Asp Lys Ala Asp Leu Arg
145 150 155 160
Leu Ile Tyr Leu Ala Leu Ala His Met Ile Lys Phe Arg Gly His Phe
165 170 175
Leu Ile Glu Gly Asp Leu Asn Pro Asp Asn Ser Asp Val Asp Lys Leu
180 185 190
Phe Ile Gln Leu Val Gln Thr Tyr Asn Gln Leu Phe Glu Glu Asn Pro
195 200 205
Ile Asn Ala Ser Gly Val Asp Ala Lys Ala Ile Leu Ser Ala Arg Leu
210 215 220
Ser Lys Ser Arg Arg Leu Glu Asn Leu Ile Ala Gln Leu Pro Gly Glu
225 230 235 240
Lys Lys Asn Gly Leu Phe Gly Asn Leu Ile Ala Leu Ser Leu Gly Leu
245 250 255
Thr Pro Asn Phe Lys Ser Asn Phe Asp Leu Ala Glu Asp Ala Lys Leu
260 265 270
Gln Leu Ser Lys Asp Thr Tyr Asp Asp Asp Leu Asp Asn Leu Leu Ala
275 280 285
Gln Ile Gly Asp Gln Tyr Ala Asp Leu Phe Leu Ala Ala Lys Asn Leu
290 295 300
Ser Asp Ala Ile Leu Leu Ser Asp Ile Leu Arg Val Asn Thr Glu Ile
305 310 315 320
Thr Lys Ala Pro Leu Ser Ala Ser Met Ile Lys Arg Tyr Asp Glu His
325 330 335
His Gln Asp Leu Thr Leu Leu Lys Ala Leu Val Arg Gln Gln Leu Pro
340 345 350
Glu Lys Tyr Lys Glu Ile Phe Phe Asp Gln Ser Lys Asn Gly Tyr Ala
355 360 365
Gly Tyr Ile Asp Gly Gly Ala Ser Gln Glu Glu Phe Tyr Lys Phe Ile
370 375 380
Lys Pro Ile Leu Glu Lys Met Asp Gly Thr Glu Glu Leu Leu Val Lys
385 390 395 400
Leu Asn Arg Glu Asp Leu Leu Arg Lys Gln Arg Thr Phe Asp Asn Gly
405 410 415
Ser Ile Pro His Gln Ile His Leu Gly Glu Leu His Ala Ile Leu Arg
420 425 430
Arg Gln Glu Asp Phe Tyr Pro Phe Leu Lys Asp Asn Arg Glu Lys Ile
435 440 445
Glu Lys Ile Leu Thr Phe Arg Ile Pro Tyr Tyr Val Gly Pro Leu Ala
450 455 460
Arg Gly Asn Ser Arg Phe Ala Trp Met Thr Arg Lys Ser Glu Glu Thr
465 470 475 480
Ile Thr Pro Trp Asn Phe Glu Glu Val Val Asp Lys Gly Ala Ser Ala
485 490 495
Gln Ser Phe Ile Glu Arg Met Thr Asn Phe Asp Lys Asn Leu Pro Asn
500 505 510
Glu Lys Val Leu Pro Lys His Ser Leu Leu Tyr Glu Tyr Phe Thr Val
515 520 525
Tyr Asn Glu Leu Thr Lys Val Lys Tyr Val Thr Glu Gly Met Arg Lys
530 535 540
Pro Ala Phe Leu Ser Gly Glu Gln Lys Lys Ala Ile Val Asp Leu Leu
545 550 555 560
Phe Lys Thr Asn Arg Lys Val Thr Val Lys Gln Leu Lys Glu Asp Tyr
565 570 575
Phe Lys Lys Ile Glu Cys Phe Asp Ser Val Glu Ile Ser Gly Val Glu
580 585 590
Asp Arg Phe Asn Ala Ser Leu Gly Thr Tyr His Asp Leu Leu Lys Ile
595 600 605
Ile Lys Asp Lys Asp Phe Leu Asp Asn Glu Glu Asn Glu Asp Ile Leu
610 615 620
Glu Asp Ile Val Leu Thr Leu Thr Leu Phe Glu Asp Arg Glu Met Ile
625 630 635 640
Glu Glu Arg Leu Lys Thr Tyr Ala His Leu Phe Asp Asp Lys Val Met
645 650 655
Lys Gln Leu Lys Arg Arg Arg Tyr Thr Gly Trp Gly Arg Leu Ser Arg
660 665 670
Lys Leu Ile Asn Gly Ile Arg Asp Lys Gln Ser Gly Lys Thr Ile Leu
675 680 685
Asp Phe Leu Lys Ser Asp Gly Phe Ala Asn Arg Asn Phe Met Gln Leu
690 695 700
Ile His Asp Asp Ser Leu Thr Phe Lys Glu Asp Ile Gln Lys Ala Gln
705 710 715 720
Val Ser Gly Gln Gly Asp Ser Leu His Glu His Ile Ala Asn Leu Ala
725 730 735
Gly Ser Pro Ala Ile Lys Lys Gly Ile Leu Gln Thr Val Lys Val Val
740 745 750
Asp Glu Leu Val Lys Val Met Gly Arg His Lys Pro Glu Asn Ile Val
755 760 765
Ile Glu Met Ala Arg Glu Asn Gln Thr Thr Gln Lys Gly Gln Lys Asn
770 775 780
Ser Arg Glu Arg Met Lys Arg Ile Glu Glu Gly Ile Lys Glu Leu Gly
785 790 795 800
Ser Gln Ile Leu Lys Glu His Pro Val Glu Asn Thr Gln Leu Gln Asn
805 810 815
Glu Lys Leu Tyr Leu Tyr Tyr Leu Gln Asn Gly Arg Asp Met Tyr Val
820 825 830
Asp Gln Glu Leu Asp Ile Asn Arg Leu Ser Asp Tyr Asp Val Asp His
835 840 845
Ile Val Pro Gln Ser Phe Leu Lys Asp Asp Ser Ile Asp Asn Lys Val
850 855 860
Leu Thr Arg Ser Asp Lys Asn Arg Gly Lys Ser Asp Asn Val Pro Ser
865 870 875 880
Glu Glu Val Val Lys Lys Met Lys Asn Tyr Trp Arg Gln Leu Leu Asn
885 890 895
Ala Lys Leu Ile Thr Gln Arg Lys Phe Asp Asn Leu Thr Lys Ala Glu
900 905 910
Arg Gly Gly Leu Ser Glu Leu Asp Lys Ala Gly Phe Ile Lys Arg Gln
915 920 925
Leu Val Glu Thr Arg Gln Ile Thr Lys His Val Ala Gln Ile Leu Asp
930 935 940
Ser Arg Met Asn Thr Lys Tyr Asp Glu Asn Asp Lys Leu Ile Arg Glu
945 950 955 960
Val Lys Val Ile Thr Leu Lys Ser Lys Leu Val Ser Asp Phe Arg Lys
965 970 975
Asp Phe Gln Phe Tyr Lys Val Arg Glu Ile Asn Asn Tyr His His Ala
980 985 990
His Asp Ala Tyr Leu Asn Ala Val Val Gly Thr Ala Leu Ile Lys Lys
995 1000 1005
Tyr Pro Lys Leu Glu Ser Glu Phe Val Tyr Gly Asp Tyr Lys Val
1010 1015 1020
Tyr Asp Val Arg Lys Met Ile Ala Lys Ser Glu Gln Glu Ile Gly
1025 1030 1035
Lys Ala Thr Ala Lys Tyr Phe Phe Tyr Ser Asn Ile Met Asn Phe
1040 1045 1050
Phe Lys Thr Glu Ile Thr Leu Ala Asn Gly Glu Ile Arg Lys Arg
1055 1060 1065
Pro Leu Ile Glu Thr Asn Gly Glu Thr Gly Glu Ile Val Trp Asp
1070 1075 1080
Lys Gly Arg Asp Phe Ala Thr Val Arg Lys Val Leu Ser Met Pro
1085 1090 1095
Gln Val Asn Ile Val Lys Lys Thr Glu Val Gln Thr Gly Gly Phe
1100 1105 1110
Ser Lys Glu Ser Ile Leu Pro Lys Arg Asn Ser Asp Lys Leu Ile
1115 1120 1125
Ala Arg Lys Lys Asp Trp Asp Pro Lys Lys Tyr Gly Gly Phe Asp
1130 1135 1140
Ser Pro Thr Val Ala Tyr Ser Val Leu Val Val Ala Lys Val Glu
1145 1150 1155
Lys Gly Lys Ser Lys Lys Leu Lys Ser Val Lys Glu Leu Leu Gly
1160 1165 1170
Ile Thr Ile Met Glu Arg Ser Ser Phe Glu Lys Asn Pro Ile Asp
1175 1180 1185
Phe Leu Glu Ala Lys Gly Tyr Lys Glu Val Lys Lys Asp Leu Ile
1190 1195 1200
Ile Lys Leu Pro Lys Tyr Ser Leu Phe Glu Leu Glu Asn Gly Arg
1205 1210 1215
Lys Arg Met Leu Ala Ser Ala Gly Glu Leu Gln Lys Gly Asn Glu
1220 1225 1230
Leu Ala Leu Pro Ser Lys Tyr Val Asn Phe Leu Tyr Leu Ala Ser
1235 1240 1245
His Tyr Glu Lys Leu Lys Gly Ser Pro Glu Asp Asn Glu Gln Lys
1250 1255 1260
Gln Leu Phe Val Glu Gln His Lys His Tyr Leu Asp Glu Ile Ile
1265 1270 1275
Glu Gln Ile Ser Glu Phe Ser Lys Arg Val Ile Leu Ala Asp Ala
1280 1285 1290
Asn Leu Asp Lys Val Leu Ser Ala Tyr Asn Lys His Arg Asp Lys
1295 1300 1305
Pro Ile Arg Glu Gln Ala Glu Asn Ile Ile His Leu Phe Thr Leu
1310 1315 1320
Thr Asn Leu Gly Ala Pro Ala Ala Phe Lys Tyr Phe Asp Thr Thr
1325 1330 1335
Ile Asp Arg Lys Arg Tyr Thr Ser Thr Lys Glu Val Leu Asp Ala
1340 1345 1350
Thr Leu Ile His Gln Ser Ile Thr Gly Leu Tyr Glu Thr Arg Ile
1355 1360 1365
Asp Leu Ser Gln Leu Gly Gly Asp Ser Arg Ala Asp Pro Lys Lys
1370 1375 1380
Lys Arg Lys Val His His His His His His
1385 1390
<210> 234
<211> 1393
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 234
Met Ala Pro Lys Lys Lys Arg Lys Val Asp Lys Lys Tyr Ser Ile Gly
1 5 10 15
Leu Asp Ile Gly Thr Asn Ser Val Gly Trp Ala Val Ile Thr Asp Glu
20 25 30
Tyr Lys Val Pro Ser Lys Lys Phe Lys Val Leu Gly Asn Thr Asp Arg
35 40 45
His Ser Ile Lys Lys Asn Leu Ile Gly Ala Leu Leu Phe Asp Ser Gly
50 55 60
Glu Thr Ala Glu Ala Thr Arg Leu Lys Arg Thr Ala Arg Arg Arg Tyr
65 70 75 80
Thr Arg Arg Lys Asn Arg Ile Leu Tyr Leu Gln Glu Ile Phe Ser Asn
85 90 95
Glu Met Ala Lys Val Asp Asp Ser Phe Phe His Arg Leu Glu Glu Ser
100 105 110
Phe Leu Val Glu Glu Asp Lys Lys His Glu Arg His Pro Ile Phe Gly
115 120 125
Asn Ile Val Asp Glu Val Ala Tyr His Glu Lys Tyr Pro Thr Ile Tyr
130 135 140
His Leu Arg Lys Lys Leu Val Asp Ser Thr Asp Lys Ala Asp Leu Arg
145 150 155 160
Leu Ile Tyr Leu Ala Leu Ala His Met Ile Lys Phe Arg Gly His Phe
165 170 175
Leu Ile Glu Gly Asp Leu Asn Pro Asp Asn Ser Asp Val Asp Lys Leu
180 185 190
Phe Ile Gln Leu Val Gln Thr Tyr Asn Gln Leu Phe Glu Glu Asn Pro
195 200 205
Ile Asn Ala Ser Gly Val Asp Ala Lys Ala Ile Leu Ser Ala Arg Leu
210 215 220
Ser Lys Ser Arg Arg Leu Glu Asn Leu Ile Ala Gln Leu Pro Gly Glu
225 230 235 240
Lys Lys Asn Gly Leu Phe Gly Asn Leu Ile Ala Leu Ser Leu Gly Leu
245 250 255
Thr Pro Asn Phe Lys Ser Asn Phe Asp Leu Ala Glu Asp Ala Lys Leu
260 265 270
Gln Leu Ser Lys Asp Thr Tyr Asp Asp Asp Leu Asp Asn Leu Leu Ala
275 280 285
Gln Ile Gly Asp Gln Tyr Ala Asp Leu Phe Leu Ala Ala Lys Asn Leu
290 295 300
Ser Asp Ala Ile Leu Leu Ser Asp Ile Leu Arg Val Asn Thr Glu Ile
305 310 315 320
Thr Lys Ala Pro Leu Ser Ala Ser Met Ile Lys Arg Tyr Asp Glu His
325 330 335
His Gln Asp Leu Thr Leu Leu Lys Ala Leu Val Arg Gln Gln Leu Pro
340 345 350
Glu Lys Tyr Lys Glu Ile Phe Phe Asp Gln Ser Lys Asn Gly Tyr Ala
355 360 365
Gly Tyr Ile Asp Gly Gly Ala Ser Gln Glu Glu Phe Tyr Lys Phe Ile
370 375 380
Lys Pro Ile Leu Glu Lys Met Asp Gly Thr Glu Glu Leu Leu Val Lys
385 390 395 400
Leu Asn Arg Glu Asp Leu Leu Arg Lys Gln Arg Thr Phe Asp Asn Gly
405 410 415
Ser Ile Pro His Gln Ile His Leu Gly Glu Leu His Ala Ile Leu Arg
420 425 430
Arg Gln Glu Asp Phe Tyr Pro Phe Leu Lys Asp Asn Arg Glu Lys Ile
435 440 445
Glu Lys Ile Leu Thr Phe Arg Ile Pro Tyr Tyr Val Gly Pro Leu Ala
450 455 460
Arg Gly Asn Ser Arg Phe Ala Trp Met Thr Arg Lys Ser Glu Glu Thr
465 470 475 480
Ile Thr Pro Trp Asn Phe Glu Glu Val Val Asp Lys Gly Ala Ser Ala
485 490 495
Gln Ser Phe Ile Glu Arg Met Thr Asn Phe Asp Lys Asn Leu Pro Asn
500 505 510
Glu Lys Val Leu Pro Lys His Ser Leu Leu Tyr Glu Tyr Phe Thr Val
515 520 525
Tyr Asn Glu Leu Thr Lys Val Lys Tyr Val Thr Glu Gly Met Arg Lys
530 535 540
Pro Ala Phe Leu Ser Gly Glu Gln Lys Lys Ala Ile Val Asp Leu Leu
545 550 555 560
Phe Lys Thr Asn Arg Lys Val Thr Val Lys Gln Leu Lys Glu Asp Tyr
565 570 575
Phe Lys Lys Ile Glu Glu Phe Asp Ser Val Glu Ile Ser Gly Val Glu
580 585 590
Asp Arg Phe Asn Ala Ser Leu Gly Thr Tyr His Asp Leu Leu Lys Ile
595 600 605
Ile Lys Asp Lys Asp Phe Leu Asp Asn Glu Glu Asn Glu Asp Ile Leu
610 615 620
Glu Asp Ile Val Leu Thr Leu Thr Leu Phe Glu Asp Arg Glu Met Ile
625 630 635 640
Glu Glu Arg Leu Lys Thr Tyr Ala His Leu Phe Asp Asp Lys Val Met
645 650 655
Lys Gln Leu Lys Arg Arg Arg Tyr Thr Gly Trp Gly Arg Leu Ser Arg
660 665 670
Lys Leu Ile Asn Gly Ile Arg Asp Lys Gln Ser Gly Lys Thr Ile Leu
675 680 685
Asp Phe Leu Lys Ser Asp Gly Phe Ala Asn Arg Asn Phe Met Gln Leu
690 695 700
Ile His Asp Asp Ser Leu Thr Phe Lys Glu Asp Ile Gln Lys Ala Gln
705 710 715 720
Val Ser Gly Gln Gly Asp Ser Leu His Glu His Ile Ala Asn Leu Ala
725 730 735
Gly Ser Pro Ala Ile Lys Lys Gly Ile Leu Gln Thr Val Lys Val Val
740 745 750
Asp Glu Leu Val Lys Val Met Gly Arg His Lys Pro Glu Asn Ile Val
755 760 765
Ile Glu Met Ala Arg Glu Asn Gln Thr Thr Gln Lys Gly Gln Lys Asn
770 775 780
Ser Arg Glu Arg Met Lys Arg Ile Glu Glu Gly Ile Lys Glu Leu Gly
785 790 795 800
Ser Gln Ile Leu Lys Glu His Pro Val Glu Asn Thr Gln Leu Gln Asn
805 810 815
Glu Lys Leu Tyr Leu Tyr Tyr Leu Gln Asn Gly Arg Asp Met Tyr Val
820 825 830
Asp Gln Glu Leu Asp Ile Asn Arg Leu Ser Asp Tyr Asp Val Asp His
835 840 845
Ile Val Pro Gln Ser Phe Leu Lys Asp Asp Ser Ile Asp Asn Lys Val
850 855 860
Leu Thr Arg Ser Asp Lys Asn Arg Gly Lys Ser Asp Asn Val Pro Ser
865 870 875 880
Glu Glu Val Val Lys Lys Met Lys Asn Tyr Trp Arg Gln Leu Leu Asn
885 890 895
Ala Lys Leu Ile Thr Gln Arg Lys Phe Asp Asn Leu Thr Lys Ala Glu
900 905 910
Arg Gly Gly Leu Ser Glu Leu Asp Lys Ala Gly Phe Ile Lys Arg Gln
915 920 925
Leu Val Glu Thr Arg Gln Ile Thr Lys His Val Ala Gln Ile Leu Asp
930 935 940
Ser Arg Met Asn Thr Lys Tyr Asp Glu Asn Asp Lys Leu Ile Arg Glu
945 950 955 960
Val Lys Val Ile Thr Leu Lys Ser Lys Leu Val Ser Asp Phe Arg Lys
965 970 975
Asp Phe Gln Phe Tyr Lys Val Arg Glu Ile Asn Asn Tyr His His Ala
980 985 990
His Asp Ala Tyr Leu Asn Ala Val Val Gly Thr Ala Leu Ile Lys Lys
995 1000 1005
Tyr Pro Lys Leu Glu Ser Glu Phe Val Tyr Gly Asp Tyr Lys Val
1010 1015 1020
Tyr Asp Val Arg Lys Met Ile Ala Lys Ser Glu Gln Glu Ile Gly
1025 1030 1035
Lys Ala Thr Ala Lys Tyr Phe Phe Tyr Ser Asn Ile Met Asn Phe
1040 1045 1050
Phe Lys Thr Glu Ile Thr Leu Ala Asn Gly Glu Ile Arg Lys Arg
1055 1060 1065
Pro Leu Ile Glu Thr Asn Gly Glu Thr Gly Glu Ile Val Trp Asp
1070 1075 1080
Lys Gly Arg Asp Phe Ala Thr Val Arg Lys Val Leu Ser Met Pro
1085 1090 1095
Gln Val Asn Ile Val Lys Lys Thr Glu Val Gln Thr Gly Gly Phe
1100 1105 1110
Ser Lys Glu Ser Ile Leu Pro Lys Arg Asn Ser Asp Lys Leu Ile
1115 1120 1125
Ala Arg Lys Lys Asp Trp Asp Pro Lys Lys Tyr Gly Gly Phe Asp
1130 1135 1140
Ser Pro Thr Val Ala Tyr Ser Val Leu Val Val Ala Lys Val Glu
1145 1150 1155
Lys Gly Lys Ser Lys Lys Leu Lys Ser Val Lys Glu Leu Leu Gly
1160 1165 1170
Ile Thr Ile Met Glu Arg Ser Ser Phe Glu Lys Asn Pro Ile Asp
1175 1180 1185
Phe Leu Glu Ala Lys Gly Tyr Lys Glu Val Lys Lys Asp Leu Ile
1190 1195 1200
Ile Lys Leu Pro Lys Tyr Ser Leu Phe Glu Leu Glu Asn Gly Arg
1205 1210 1215
Lys Arg Met Leu Ala Ser Ala Gly Glu Leu Gln Lys Gly Asn Glu
1220 1225 1230
Leu Ala Leu Pro Ser Lys Tyr Val Asn Phe Leu Tyr Leu Ala Ser
1235 1240 1245
His Tyr Glu Lys Leu Lys Gly Ser Pro Glu Asp Asn Glu Gln Lys
1250 1255 1260
Gln Leu Phe Val Glu Gln His Lys His Tyr Leu Asp Glu Ile Ile
1265 1270 1275
Glu Gln Ile Ser Glu Phe Ser Lys Arg Val Ile Leu Ala Asp Ala
1280 1285 1290
Asn Leu Asp Lys Val Leu Ser Ala Tyr Asn Lys His Arg Asp Lys
1295 1300 1305
Pro Ile Arg Glu Gln Ala Glu Asn Ile Ile His Leu Phe Thr Leu
1310 1315 1320
Thr Asn Leu Gly Ala Pro Ala Ala Phe Lys Tyr Phe Asp Thr Thr
1325 1330 1335
Ile Asp Arg Lys Arg Tyr Thr Ser Thr Lys Glu Val Leu Asp Ala
1340 1345 1350
Thr Leu Ile His Gln Ser Ile Thr Gly Leu Tyr Glu Thr Arg Ile
1355 1360 1365
Asp Leu Ser Gln Leu Gly Gly Asp Ser Arg Ala Asp Pro Lys Lys
1370 1375 1380
Lys Arg Lys Val His His His His His His
1385 1390
<210> 235
<211> 1399
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 235
Met Gly Ser Ser His His His His His His His His Glu Asn Leu Tyr
1 5 10 15
Phe Gln Gly Ser Met Asp Lys Lys Tyr Ser Ile Gly Leu Asp Ile Gly
20 25 30
Thr Asn Ser Val Gly Trp Ala Val Ile Thr Asp Glu Tyr Lys Val Pro
35 40 45
Ser Lys Lys Phe Lys Val Leu Gly Asn Thr Asp Arg His Ser Ile Lys
50 55 60
Lys Asn Leu Ile Gly Ala Leu Leu Phe Asp Ser Gly Glu Thr Ala Glu
65 70 75 80
Ala Thr Arg Leu Lys Arg Thr Ala Arg Arg Arg Tyr Thr Arg Arg Lys
85 90 95
Asn Arg Ile Cys Tyr Leu Gln Glu Ile Phe Ser Asn Glu Met Ala Lys
100 105 110
Val Asp Asp Ser Phe Phe His Arg Leu Glu Glu Ser Phe Leu Val Glu
115 120 125
Glu Asp Lys Lys His Glu Arg His Pro Ile Phe Gly Asn Ile Val Asp
130 135 140
Glu Val Ala Tyr His Glu Lys Tyr Pro Thr Ile Tyr His Leu Arg Lys
145 150 155 160
Lys Leu Val Asp Ser Thr Asp Lys Ala Asp Leu Arg Leu Ile Tyr Leu
165 170 175
Ala Leu Ala His Met Ile Lys Phe Arg Gly His Phe Leu Ile Glu Gly
180 185 190
Asp Leu Asn Pro Asp Asn Ser Asp Val Asp Lys Leu Phe Ile Gln Leu
195 200 205
Val Gln Thr Tyr Asn Gln Leu Phe Glu Glu Asn Pro Ile Asn Ala Ser
210 215 220
Gly Val Asp Ala Lys Ala Ile Leu Ser Ala Arg Leu Ser Lys Ser Arg
225 230 235 240
Arg Leu Glu Asn Leu Ile Ala Gln Leu Pro Gly Glu Lys Lys Asn Gly
245 250 255
Leu Phe Gly Asn Leu Ile Ala Leu Ser Leu Gly Leu Thr Pro Asn Phe
260 265 270
Lys Ser Asn Phe Asp Leu Ala Glu Asp Ala Lys Leu Gln Leu Ser Lys
275 280 285
Asp Thr Tyr Asp Asp Asp Leu Asp Asn Leu Leu Ala Gln Ile Gly Asp
290 295 300
Gln Tyr Ala Asp Leu Phe Leu Ala Ala Lys Asn Leu Ser Asp Ala Ile
305 310 315 320
Leu Leu Ser Asp Ile Leu Arg Val Asn Thr Glu Ile Thr Lys Ala Pro
325 330 335
Leu Ser Ala Ser Met Ile Lys Arg Tyr Asp Glu His His Gln Asp Leu
340 345 350
Thr Leu Leu Lys Ala Leu Val Arg Gln Gln Leu Pro Glu Lys Tyr Lys
355 360 365
Glu Ile Phe Phe Asp Gln Ser Lys Asn Gly Tyr Ala Gly Tyr Ile Asp
370 375 380
Gly Gly Ala Ser Gln Glu Glu Phe Tyr Lys Phe Ile Lys Pro Ile Leu
385 390 395 400
Glu Lys Met Asp Gly Thr Glu Glu Leu Leu Val Lys Leu Asn Arg Glu
405 410 415
Asp Leu Leu Arg Lys Gln Arg Thr Phe Asp Asn Gly Ser Ile Pro His
420 425 430
Gln Ile His Leu Gly Glu Leu His Ala Ile Leu Arg Arg Gln Glu Asp
435 440 445
Phe Tyr Pro Phe Leu Lys Asp Asn Arg Glu Lys Ile Glu Lys Ile Leu
450 455 460
Thr Phe Arg Ile Pro Tyr Tyr Val Gly Pro Leu Ala Arg Gly Asn Ser
465 470 475 480
Arg Phe Ala Trp Met Thr Arg Lys Ser Glu Glu Thr Ile Thr Pro Trp
485 490 495
Asn Phe Glu Glu Val Val Asp Lys Gly Ala Ser Ala Gln Ser Phe Ile
500 505 510
Glu Arg Met Thr Asn Phe Asp Lys Asn Leu Pro Asn Glu Lys Val Leu
515 520 525
Pro Lys His Ser Leu Leu Tyr Glu Tyr Phe Thr Val Tyr Asn Glu Leu
530 535 540
Thr Lys Val Lys Tyr Val Thr Glu Gly Met Arg Lys Pro Ala Phe Leu
545 550 555 560
Ser Gly Glu Gln Lys Lys Ala Ile Val Asp Leu Leu Phe Lys Thr Asn
565 570 575
Arg Lys Val Thr Val Lys Gln Leu Lys Glu Asp Tyr Phe Lys Lys Ile
580 585 590
Glu Cys Phe Asp Ser Val Glu Ile Ser Gly Val Glu Asp Arg Phe Asn
595 600 605
Ala Ser Leu Gly Thr Tyr His Asp Leu Leu Lys Ile Ile Lys Asp Lys
610 615 620
Asp Phe Leu Asp Asn Glu Glu Asn Glu Asp Ile Leu Glu Asp Ile Val
625 630 635 640
Leu Thr Leu Thr Leu Phe Glu Asp Arg Glu Met Ile Glu Glu Arg Leu
645 650 655
Lys Thr Tyr Ala His Leu Phe Asp Asp Lys Val Met Lys Gln Leu Lys
660 665 670
Arg Arg Arg Tyr Thr Gly Trp Gly Arg Leu Ser Arg Lys Leu Ile Asn
675 680 685
Gly Ile Arg Asp Lys Gln Ser Gly Lys Thr Ile Leu Asp Phe Leu Lys
690 695 700
Ser Asp Gly Phe Ala Asn Arg Asn Phe Met Gln Leu Ile His Asp Asp
705 710 715 720
Ser Leu Thr Phe Lys Glu Asp Ile Gln Lys Ala Gln Val Ser Gly Gln
725 730 735
Gly Asp Ser Leu His Glu His Ile Ala Asn Leu Ala Gly Ser Pro Ala
740 745 750
Ile Lys Lys Gly Ile Leu Gln Thr Val Lys Val Val Asp Glu Leu Val
755 760 765
Lys Val Met Gly Arg His Lys Pro Glu Asn Ile Val Ile Glu Met Ala
770 775 780
Arg Glu Asn Gln Thr Thr Gln Lys Gly Gln Lys Asn Ser Arg Glu Arg
785 790 795 800
Met Lys Arg Ile Glu Glu Gly Ile Lys Glu Leu Gly Ser Gln Ile Leu
805 810 815
Lys Glu His Pro Val Glu Asn Thr Gln Leu Gln Asn Glu Lys Leu Tyr
820 825 830
Leu Tyr Tyr Leu Gln Asn Gly Arg Asp Met Tyr Val Asp Gln Glu Leu
835 840 845
Asp Ile Asn Arg Leu Ser Asp Tyr Asp Val Asp His Ile Val Pro Gln
850 855 860
Ser Phe Leu Lys Asp Asp Ser Ile Asp Asn Lys Val Leu Thr Arg Ser
865 870 875 880
Asp Lys Asn Arg Gly Lys Ser Asp Asn Val Pro Ser Glu Glu Val Val
885 890 895
Lys Lys Met Lys Asn Tyr Trp Arg Gln Leu Leu Asn Ala Lys Leu Ile
900 905 910
Thr Gln Arg Lys Phe Asp Asn Leu Thr Lys Ala Glu Arg Gly Gly Leu
915 920 925
Ser Glu Leu Asp Lys Ala Gly Phe Ile Lys Arg Gln Leu Val Glu Thr
930 935 940
Arg Gln Ile Thr Lys His Val Ala Gln Ile Leu Asp Ser Arg Met Asn
945 950 955 960
Thr Lys Tyr Asp Glu Asn Asp Lys Leu Ile Arg Glu Val Lys Val Ile
965 970 975
Thr Leu Lys Ser Lys Leu Val Ser Asp Phe Arg Lys Asp Phe Gln Phe
980 985 990
Tyr Lys Val Arg Glu Ile Asn Asn Tyr His His Ala His Asp Ala Tyr
995 1000 1005
Leu Asn Ala Val Val Gly Thr Ala Leu Ile Lys Lys Tyr Pro Lys
1010 1015 1020
Leu Glu Ser Glu Phe Val Tyr Gly Asp Tyr Lys Val Tyr Asp Val
1025 1030 1035
Arg Lys Met Ile Ala Lys Ser Glu Gln Glu Ile Gly Lys Ala Thr
1040 1045 1050
Ala Lys Tyr Phe Phe Tyr Ser Asn Ile Met Asn Phe Phe Lys Thr
1055 1060 1065
Glu Ile Thr Leu Ala Asn Gly Glu Ile Arg Lys Arg Pro Leu Ile
1070 1075 1080
Glu Thr Asn Gly Glu Thr Gly Glu Ile Val Trp Asp Lys Gly Arg
1085 1090 1095
Asp Phe Ala Thr Val Arg Lys Val Leu Ser Met Pro Gln Val Asn
1100 1105 1110
Ile Val Lys Lys Thr Glu Val Gln Thr Gly Gly Phe Ser Lys Glu
1115 1120 1125
Ser Ile Leu Pro Lys Arg Asn Ser Asp Lys Leu Ile Ala Arg Lys
1130 1135 1140
Lys Asp Trp Asp Pro Lys Lys Tyr Gly Gly Phe Asp Ser Pro Thr
1145 1150 1155
Val Ala Tyr Ser Val Leu Val Val Ala Lys Val Glu Lys Gly Lys
1160 1165 1170
Ser Lys Lys Leu Lys Ser Val Lys Glu Leu Leu Gly Ile Thr Ile
1175 1180 1185
Met Glu Arg Ser Ser Phe Glu Lys Asn Pro Ile Asp Phe Leu Glu
1190 1195 1200
Ala Lys Gly Tyr Lys Glu Val Lys Lys Asp Leu Ile Ile Lys Leu
1205 1210 1215
Pro Lys Tyr Ser Leu Phe Glu Leu Glu Asn Gly Arg Lys Arg Met
1220 1225 1230
Leu Ala Ser Ala Gly Glu Leu Gln Lys Gly Asn Glu Leu Ala Leu
1235 1240 1245
Pro Ser Lys Tyr Val Asn Phe Leu Tyr Leu Ala Ser His Tyr Glu
1250 1255 1260
Lys Leu Lys Gly Ser Pro Glu Asp Asn Glu Gln Lys Gln Leu Phe
1265 1270 1275
Val Glu Gln His Lys His Tyr Leu Asp Glu Ile Ile Glu Gln Ile
1280 1285 1290
Ser Glu Phe Ser Lys Arg Val Ile Leu Ala Asp Ala Asn Leu Asp
1295 1300 1305
Lys Val Leu Ser Ala Tyr Asn Lys His Arg Asp Lys Pro Ile Arg
1310 1315 1320
Glu Gln Ala Glu Asn Ile Ile His Leu Phe Thr Leu Thr Asn Leu
1325 1330 1335
Gly Ala Pro Ala Ala Phe Lys Tyr Phe Asp Thr Thr Ile Asp Arg
1340 1345 1350
Lys Arg Tyr Thr Ser Thr Lys Glu Val Leu Asp Ala Thr Leu Ile
1355 1360 1365
His Gln Ser Ile Thr Gly Leu Tyr Glu Thr Arg Ile Asp Leu Ser
1370 1375 1380
Gln Leu Gly Gly Asp Gly Gly Gly Ser Pro Lys Lys Lys Arg Lys
1385 1390 1395
Val
<210> 236
<211> 1396
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 236
Met Ala His His His His His His Gly Gly Ser Pro Lys Lys Lys Arg
1 5 10 15
Lys Val Asp Lys Lys Tyr Ser Ile Gly Leu Asp Ile Gly Thr Asn Ser
20 25 30
Val Gly Trp Ala Val Ile Thr Asp Glu Tyr Lys Val Pro Ser Lys Lys
35 40 45
Phe Lys Val Leu Gly Asn Thr Asp Arg His Ser Ile Lys Lys Asn Leu
50 55 60
Ile Gly Ala Leu Leu Phe Asp Ser Gly Glu Thr Ala Glu Ala Thr Arg
65 70 75 80
Leu Lys Arg Thr Ala Arg Arg Arg Tyr Thr Arg Arg Lys Asn Arg Ile
85 90 95
Cys Tyr Leu Gln Glu Ile Phe Ser Asn Glu Met Ala Lys Val Asp Asp
100 105 110
Ser Phe Phe His Arg Leu Glu Glu Ser Phe Leu Val Glu Glu Asp Lys
115 120 125
Lys His Glu Arg His Pro Ile Phe Gly Asn Ile Val Asp Glu Val Ala
130 135 140
Tyr His Glu Lys Tyr Pro Thr Ile Tyr His Leu Arg Lys Lys Leu Val
145 150 155 160
Asp Ser Thr Asp Lys Ala Asp Leu Arg Leu Ile Tyr Leu Ala Leu Ala
165 170 175
His Met Ile Lys Phe Arg Gly His Phe Leu Ile Glu Gly Asp Leu Asn
180 185 190
Pro Asp Asn Ser Asp Val Asp Lys Leu Phe Ile Gln Leu Val Gln Thr
195 200 205
Tyr Asn Gln Leu Phe Glu Glu Asn Pro Ile Asn Ala Ser Gly Val Asp
210 215 220
Ala Lys Ala Ile Leu Ser Ala Arg Leu Ser Lys Ser Arg Arg Leu Glu
225 230 235 240
Asn Leu Ile Ala Gln Leu Pro Gly Glu Lys Lys Asn Gly Leu Phe Gly
245 250 255
Asn Leu Ile Ala Leu Ser Leu Gly Leu Thr Pro Asn Phe Lys Ser Asn
260 265 270
Phe Asp Leu Ala Glu Asp Ala Lys Leu Gln Leu Ser Lys Asp Thr Tyr
275 280 285
Asp Asp Asp Leu Asp Asn Leu Leu Ala Gln Ile Gly Asp Gln Tyr Ala
290 295 300
Asp Leu Phe Leu Ala Ala Lys Asn Leu Ser Asp Ala Ile Leu Leu Ser
305 310 315 320
Asp Ile Leu Arg Val Asn Thr Glu Ile Thr Lys Ala Pro Leu Ser Ala
325 330 335
Ser Met Ile Lys Arg Tyr Asp Glu His His Gln Asp Leu Thr Leu Leu
340 345 350
Lys Ala Leu Val Arg Gln Gln Leu Pro Glu Lys Tyr Lys Glu Ile Phe
355 360 365
Phe Asp Gln Ser Lys Asn Gly Tyr Ala Gly Tyr Ile Asp Gly Gly Ala
370 375 380
Ser Gln Glu Glu Phe Tyr Lys Phe Ile Lys Pro Ile Leu Glu Lys Met
385 390 395 400
Asp Gly Thr Glu Glu Leu Leu Val Lys Leu Asn Arg Glu Asp Leu Leu
405 410 415
Arg Lys Gln Arg Thr Phe Asp Asn Gly Ser Ile Pro His Gln Ile His
420 425 430
Leu Gly Glu Leu His Ala Ile Leu Arg Arg Gln Glu Asp Phe Tyr Pro
435 440 445
Phe Leu Lys Asp Asn Arg Glu Lys Ile Glu Lys Ile Leu Thr Phe Arg
450 455 460
Ile Pro Tyr Tyr Val Gly Pro Leu Ala Arg Gly Asn Ser Arg Phe Ala
465 470 475 480
Trp Met Thr Arg Lys Ser Glu Glu Thr Ile Thr Pro Trp Asn Phe Glu
485 490 495
Glu Val Val Asp Lys Gly Ala Ser Ala Gln Ser Phe Ile Glu Arg Met
500 505 510
Thr Asn Phe Asp Lys Asn Leu Pro Asn Glu Lys Val Leu Pro Lys His
515 520 525
Ser Leu Leu Tyr Glu Tyr Phe Thr Val Tyr Asn Glu Leu Thr Lys Val
530 535 540
Lys Tyr Val Thr Glu Gly Met Arg Lys Pro Ala Phe Leu Ser Gly Glu
545 550 555 560
Gln Lys Lys Ala Ile Val Asp Leu Leu Phe Lys Thr Asn Arg Lys Val
565 570 575
Thr Val Lys Gln Leu Lys Glu Asp Tyr Phe Lys Lys Ile Glu Cys Phe
580 585 590
Asp Ser Val Glu Ile Ser Gly Val Glu Asp Arg Phe Asn Ala Ser Leu
595 600 605
Gly Thr Tyr His Asp Leu Leu Lys Ile Ile Lys Asp Lys Asp Phe Leu
610 615 620
Asp Asn Glu Glu Asn Glu Asp Ile Leu Glu Asp Ile Val Leu Thr Leu
625 630 635 640
Thr Leu Phe Glu Asp Arg Glu Met Ile Glu Glu Arg Leu Lys Thr Tyr
645 650 655
Ala His Leu Phe Asp Asp Lys Val Met Lys Gln Leu Lys Arg Arg Arg
660 665 670
Tyr Thr Gly Trp Gly Arg Leu Ser Arg Lys Leu Ile Asn Gly Ile Arg
675 680 685
Asp Lys Gln Ser Gly Lys Thr Ile Leu Asp Phe Leu Lys Ser Asp Gly
690 695 700
Phe Ala Asn Arg Asn Phe Met Gln Leu Ile His Asp Asp Ser Leu Thr
705 710 715 720
Phe Lys Glu Asp Ile Gln Lys Ala Gln Val Ser Gly Gln Gly Asp Ser
725 730 735
Leu His Glu His Ile Ala Asn Leu Ala Gly Ser Pro Ala Ile Lys Lys
740 745 750
Gly Ile Leu Gln Thr Val Lys Val Val Asp Glu Leu Val Lys Val Met
755 760 765
Gly Arg His Lys Pro Glu Asn Ile Val Ile Glu Met Ala Arg Glu Asn
770 775 780
Gln Thr Thr Gln Lys Gly Gln Lys Asn Ser Arg Glu Arg Met Lys Arg
785 790 795 800
Ile Glu Glu Gly Ile Lys Glu Leu Gly Ser Gln Ile Leu Lys Glu His
805 810 815
Pro Val Glu Asn Thr Gln Leu Gln Asn Glu Lys Leu Tyr Leu Tyr Tyr
820 825 830
Leu Gln Asn Gly Arg Asp Met Tyr Val Asp Gln Glu Leu Asp Ile Asn
835 840 845
Arg Leu Ser Asp Tyr Asp Val Asp His Ile Val Pro Gln Ser Phe Leu
850 855 860
Lys Asp Asp Ser Ile Asp Asn Lys Val Leu Thr Arg Ser Asp Lys Asn
865 870 875 880
Arg Gly Lys Ser Asp Asn Val Pro Ser Glu Glu Val Val Lys Lys Met
885 890 895
Lys Asn Tyr Trp Arg Gln Leu Leu Asn Ala Lys Leu Ile Thr Gln Arg
900 905 910
Lys Phe Asp Asn Leu Thr Lys Ala Glu Arg Gly Gly Leu Ser Glu Leu
915 920 925
Asp Lys Ala Gly Phe Ile Lys Arg Gln Leu Val Glu Thr Arg Gln Ile
930 935 940
Thr Lys His Val Ala Gln Ile Leu Asp Ser Arg Met Asn Thr Lys Tyr
945 950 955 960
Asp Glu Asn Asp Lys Leu Ile Arg Glu Val Lys Val Ile Thr Leu Lys
965 970 975
Ser Lys Leu Val Ser Asp Phe Arg Lys Asp Phe Gln Phe Tyr Lys Val
980 985 990
Arg Glu Ile Asn Asn Tyr His His Ala His Asp Ala Tyr Leu Asn Ala
995 1000 1005
Val Val Gly Thr Ala Leu Ile Lys Lys Tyr Pro Lys Leu Glu Ser
1010 1015 1020
Glu Phe Val Tyr Gly Asp Tyr Lys Val Tyr Asp Val Arg Lys Met
1025 1030 1035
Ile Ala Lys Ser Glu Gln Glu Ile Gly Lys Ala Thr Ala Lys Tyr
1040 1045 1050
Phe Phe Tyr Ser Asn Ile Met Asn Phe Phe Lys Thr Glu Ile Thr
1055 1060 1065
Leu Ala Asn Gly Glu Ile Arg Lys Arg Pro Leu Ile Glu Thr Asn
1070 1075 1080
Gly Glu Thr Gly Glu Ile Val Trp Asp Lys Gly Arg Asp Phe Ala
1085 1090 1095
Thr Val Arg Lys Val Leu Ser Met Pro Gln Val Asn Ile Val Lys
1100 1105 1110
Lys Thr Glu Val Gln Thr Gly Gly Phe Ser Lys Glu Ser Ile Leu
1115 1120 1125
Pro Lys Arg Asn Ser Asp Lys Leu Ile Ala Arg Lys Lys Asp Trp
1130 1135 1140
Asp Pro Lys Lys Tyr Gly Gly Phe Asp Ser Pro Thr Val Ala Tyr
1145 1150 1155
Ser Val Leu Val Val Ala Lys Val Glu Lys Gly Lys Ser Lys Lys
1160 1165 1170
Leu Lys Ser Val Lys Glu Leu Leu Gly Ile Thr Ile Met Glu Arg
1175 1180 1185
Ser Ser Phe Glu Lys Asn Pro Ile Asp Phe Leu Glu Ala Lys Gly
1190 1195 1200
Tyr Lys Glu Val Lys Lys Asp Leu Ile Ile Lys Leu Pro Lys Tyr
1205 1210 1215
Ser Leu Phe Glu Leu Glu Asn Gly Arg Lys Arg Met Leu Ala Ser
1220 1225 1230
Ala Gly Glu Leu Gln Lys Gly Asn Glu Leu Ala Leu Pro Ser Lys
1235 1240 1245
Tyr Val Asn Phe Leu Tyr Leu Ala Ser His Tyr Glu Lys Leu Lys
1250 1255 1260
Gly Ser Pro Glu Asp Asn Glu Gln Lys Gln Leu Phe Val Glu Gln
1265 1270 1275
His Lys His Tyr Leu Asp Glu Ile Ile Glu Gln Ile Ser Glu Phe
1280 1285 1290
Ser Lys Arg Val Ile Leu Ala Asp Ala Asn Leu Asp Lys Val Leu
1295 1300 1305
Ser Ala Tyr Asn Lys His Arg Asp Lys Pro Ile Arg Glu Gln Ala
1310 1315 1320
Glu Asn Ile Ile His Leu Phe Thr Leu Thr Asn Leu Gly Ala Pro
1325 1330 1335
Ala Ala Phe Lys Tyr Phe Asp Thr Thr Ile Asp Arg Lys Arg Tyr
1340 1345 1350
Thr Ser Thr Lys Glu Val Leu Asp Ala Thr Leu Ile His Gln Ser
1355 1360 1365
Ile Thr Gly Leu Tyr Glu Thr Arg Ile Asp Leu Ser Gln Leu Gly
1370 1375 1380
Gly Asp Ser Arg Ala Asp Pro Lys Lys Lys Arg Lys Val
1385 1390 1395
<210> 237
<211> 1386
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 237
Met Ala Pro Lys Lys Lys Arg Lys Val Asp Lys Lys Tyr Ser Ile Gly
1 5 10 15
Leu Asp Ile Gly Thr Asn Ser Val Gly Trp Ala Val Ile Thr Asp Glu
20 25 30
Tyr Lys Val Pro Ser Lys Lys Phe Lys Val Leu Gly Asn Thr Asp Arg
35 40 45
His Ser Ile Lys Lys Asn Leu Ile Gly Ala Leu Leu Phe Asp Ser Gly
50 55 60
Glu Thr Ala Glu Ala Thr Arg Leu Lys Arg Thr Ala Arg Arg Arg Tyr
65 70 75 80
Thr Arg Arg Lys Asn Arg Ile Cys Tyr Leu Gln Glu Ile Phe Ser Asn
85 90 95
Glu Met Ala Lys Val Asp Asp Ser Phe Phe His Arg Leu Glu Glu Ser
100 105 110
Phe Leu Val Glu Glu Asp Lys Lys His Glu Arg His Pro Ile Phe Gly
115 120 125
Asn Ile Val Asp Glu Val Ala Tyr His Glu Lys Tyr Pro Thr Ile Tyr
130 135 140
His Leu Arg Lys Lys Leu Val Asp Ser Thr Asp Lys Ala Asp Leu Arg
145 150 155 160
Leu Ile Tyr Leu Ala Leu Ala His Met Ile Lys Phe Arg Gly His Phe
165 170 175
Leu Ile Glu Gly Asp Leu Asn Pro Asp Asn Ser Asp Val Asp Lys Leu
180 185 190
Phe Ile Gln Leu Val Gln Thr Tyr Asn Gln Leu Phe Glu Glu Asn Pro
195 200 205
Ile Asn Ala Ser Gly Val Asp Ala Lys Ala Ile Leu Ser Ala Arg Leu
210 215 220
Ser Lys Ser Arg Arg Leu Glu Asn Leu Ile Ala Gln Leu Pro Gly Glu
225 230 235 240
Lys Lys Asn Gly Leu Phe Gly Asn Leu Ile Ala Leu Ser Leu Gly Leu
245 250 255
Thr Pro Asn Phe Lys Ser Asn Phe Asp Leu Ala Glu Asp Ala Lys Leu
260 265 270
Gln Leu Ser Lys Asp Thr Tyr Asp Asp Asp Leu Asp Asn Leu Leu Ala
275 280 285
Gln Ile Gly Asp Gln Tyr Ala Asp Leu Phe Leu Ala Ala Lys Asn Leu
290 295 300
Ser Asp Ala Ile Leu Leu Ser Asp Ile Leu Arg Val Asn Thr Glu Ile
305 310 315 320
Thr Lys Ala Pro Leu Ser Ala Ser Met Ile Lys Arg Tyr Asp Glu His
325 330 335
His Gln Asp Leu Thr Leu Leu Lys Ala Leu Val Arg Gln Gln Leu Pro
340 345 350
Glu Lys Tyr Lys Glu Ile Phe Phe Asp Gln Ser Lys Asn Gly Tyr Ala
355 360 365
Gly Tyr Ile Asp Gly Gly Ala Ser Gln Glu Glu Phe Tyr Lys Phe Ile
370 375 380
Lys Pro Ile Leu Glu Lys Met Asp Gly Thr Glu Glu Leu Leu Val Lys
385 390 395 400
Leu Asn Arg Glu Asp Leu Leu Arg Lys Gln Arg Thr Phe Asp Asn Gly
405 410 415
Ser Ile Pro His Gln Ile His Leu Gly Glu Leu His Ala Ile Leu Arg
420 425 430
Arg Gln Glu Asp Phe Tyr Pro Phe Leu Lys Asp Asn Arg Glu Lys Ile
435 440 445
Glu Lys Ile Leu Thr Phe Arg Ile Pro Tyr Tyr Val Gly Pro Leu Ala
450 455 460
Arg Gly Asn Ser Arg Phe Ala Trp Met Thr Arg Lys Ser Glu Glu Thr
465 470 475 480
Ile Thr Pro Trp Asn Phe Glu Glu Val Val Asp Lys Gly Ala Ser Ala
485 490 495
Gln Ser Phe Ile Glu Arg Met Thr Asn Phe Asp Lys Asn Leu Pro Asn
500 505 510
Glu Lys Val Leu Pro Lys His Ser Leu Leu Tyr Glu Tyr Phe Thr Val
515 520 525
Tyr Asn Glu Leu Thr Lys Val Lys Tyr Val Thr Glu Gly Met Arg Lys
530 535 540
Pro Ala Phe Leu Ser Gly Glu Gln Lys Lys Ala Ile Val Asp Leu Leu
545 550 555 560
Phe Lys Thr Asn Arg Lys Val Thr Val Lys Gln Leu Lys Glu Asp Tyr
565 570 575
Phe Lys Lys Ile Glu Cys Phe Asp Ser Val Glu Ile Ser Gly Val Glu
580 585 590
Asp Arg Phe Asn Ala Ser Leu Gly Thr Tyr His Asp Leu Leu Lys Ile
595 600 605
Ile Lys Asp Lys Asp Phe Leu Asp Asn Glu Glu Asn Glu Asp Ile Leu
610 615 620
Glu Asp Ile Val Leu Thr Leu Thr Leu Phe Glu Asp Arg Glu Met Ile
625 630 635 640
Glu Glu Arg Leu Lys Thr Tyr Ala His Leu Phe Asp Asp Lys Val Met
645 650 655
Lys Gln Leu Lys Arg Arg Arg Tyr Thr Gly Trp Gly Arg Leu Ser Arg
660 665 670
Lys Leu Ile Asn Gly Ile Arg Asp Lys Gln Ser Gly Lys Thr Ile Leu
675 680 685
Asp Phe Leu Lys Ser Asp Gly Phe Ala Asn Arg Asn Phe Met Gln Leu
690 695 700
Ile His Asp Asp Ser Leu Thr Phe Lys Glu Asp Ile Gln Lys Ala Gln
705 710 715 720
Val Ser Gly Gln Gly Asp Ser Leu His Glu His Ile Ala Asn Leu Ala
725 730 735
Gly Ser Pro Ala Ile Lys Lys Gly Ile Leu Gln Thr Val Lys Val Val
740 745 750
Asp Glu Leu Val Lys Val Met Gly Arg His Lys Pro Glu Asn Ile Val
755 760 765
Ile Glu Met Ala Arg Glu Asn Gln Thr Thr Gln Lys Gly Gln Lys Asn
770 775 780
Ser Arg Glu Arg Met Lys Arg Ile Glu Glu Gly Ile Lys Glu Leu Gly
785 790 795 800
Ser Gln Ile Leu Lys Glu His Pro Val Glu Asn Thr Gln Leu Gln Asn
805 810 815
Glu Lys Leu Tyr Leu Tyr Tyr Leu Gln Asn Gly Arg Asp Met Tyr Val
820 825 830
Asp Gln Glu Leu Asp Ile Asn Arg Leu Ser Asp Tyr Asp Val Asp His
835 840 845
Ile Val Pro Gln Ser Phe Leu Lys Asp Asp Ser Ile Asp Asn Lys Val
850 855 860
Leu Thr Arg Ser Asp Lys Asn Arg Gly Lys Ser Asp Asn Val Pro Ser
865 870 875 880
Glu Glu Val Val Lys Lys Met Lys Asn Tyr Trp Arg Gln Leu Leu Asn
885 890 895
Ala Lys Leu Ile Thr Gln Arg Lys Phe Asp Asn Leu Thr Lys Ala Glu
900 905 910
Arg Gly Gly Leu Ser Glu Leu Asp Lys Ala Gly Phe Ile Lys Arg Gln
915 920 925
Leu Val Glu Thr Arg Gln Ile Thr Lys His Val Ala Gln Ile Leu Asp
930 935 940
Ser Arg Met Asn Thr Lys Tyr Asp Glu Asn Asp Lys Leu Ile Arg Glu
945 950 955 960
Val Lys Val Ile Thr Leu Lys Ser Lys Leu Val Ser Asp Phe Arg Lys
965 970 975
Asp Phe Gln Phe Tyr Lys Val Arg Glu Ile Asn Asn Tyr His His Ala
980 985 990
His Asp Ala Tyr Leu Asn Ala Val Val Gly Thr Ala Leu Ile Lys Lys
995 1000 1005
Tyr Pro Lys Leu Glu Ser Glu Phe Val Tyr Gly Asp Tyr Lys Val
1010 1015 1020
Tyr Asp Val Arg Lys Met Ile Ala Lys Ser Glu Gln Glu Ile Gly
1025 1030 1035
Lys Ala Thr Ala Lys Tyr Phe Phe Tyr Ser Asn Ile Met Asn Phe
1040 1045 1050
Phe Lys Thr Glu Ile Thr Leu Ala Asn Gly Glu Ile Arg Lys Arg
1055 1060 1065
Pro Leu Ile Glu Thr Asn Gly Glu Thr Gly Glu Ile Val Trp Asp
1070 1075 1080
Lys Gly Arg Asp Phe Ala Thr Val Arg Lys Val Leu Ser Met Pro
1085 1090 1095
Gln Val Asn Ile Val Lys Lys Thr Glu Val Gln Thr Gly Gly Phe
1100 1105 1110
Ser Lys Glu Ser Ile Leu Pro Lys Arg Asn Ser Asp Lys Leu Ile
1115 1120 1125
Ala Arg Lys Lys Asp Trp Asp Pro Lys Lys Tyr Gly Gly Phe Asp
1130 1135 1140
Ser Pro Thr Val Ala Tyr Ser Val Leu Val Val Ala Lys Val Glu
1145 1150 1155
Lys Gly Lys Ser Lys Lys Leu Lys Ser Val Lys Glu Leu Leu Gly
1160 1165 1170
Ile Thr Ile Met Glu Arg Ser Ser Phe Glu Lys Asn Pro Ile Asp
1175 1180 1185
Phe Leu Glu Ala Lys Gly Tyr Lys Glu Val Lys Lys Asp Leu Ile
1190 1195 1200
Ile Lys Leu Pro Lys Tyr Ser Leu Phe Glu Leu Glu Asn Gly Arg
1205 1210 1215
Lys Arg Met Leu Ala Ser Ala Gly Glu Leu Gln Lys Gly Asn Glu
1220 1225 1230
Leu Ala Leu Pro Ser Lys Tyr Val Asn Phe Leu Tyr Leu Ala Ser
1235 1240 1245
His Tyr Glu Lys Leu Lys Gly Ser Pro Glu Asp Asn Glu Gln Lys
1250 1255 1260
Gln Leu Phe Val Glu Gln His Lys His Tyr Leu Asp Glu Ile Ile
1265 1270 1275
Glu Gln Ile Ser Glu Phe Ser Lys Arg Val Ile Leu Ala Asp Ala
1280 1285 1290
Asn Leu Asp Lys Val Leu Ser Ala Tyr Asn Lys His Arg Asp Lys
1295 1300 1305
Pro Ile Arg Glu Gln Ala Glu Asn Ile Ile His Leu Phe Thr Leu
1310 1315 1320
Thr Asn Leu Gly Ala Pro Ala Ala Phe Lys Tyr Phe Asp Thr Thr
1325 1330 1335
Ile Asp Arg Lys Arg Tyr Thr Ser Thr Lys Glu Val Leu Asp Ala
1340 1345 1350
Thr Leu Ile His Gln Ser Ile Thr Gly Leu Tyr Glu Thr Arg Ile
1355 1360 1365
Asp Leu Ser Gln Leu Gly Gly Asp Ser Arg Ala Asp His His His
1370 1375 1380
His His His
1385
<210> 238
<211> 1389
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 238
Met Ala His His His His His His Gly Gly Ser Asp Lys Lys Tyr Ser
1 5 10 15
Ile Gly Leu Asp Ile Gly Thr Asn Ser Val Gly Trp Ala Val Ile Thr
20 25 30
Asp Glu Tyr Lys Val Pro Ser Lys Lys Phe Lys Val Leu Gly Asn Thr
35 40 45
Asp Arg His Ser Ile Lys Lys Asn Leu Ile Gly Ala Leu Leu Phe Asp
50 55 60
Ser Gly Glu Thr Ala Glu Ala Thr Arg Leu Lys Arg Thr Ala Arg Arg
65 70 75 80
Arg Tyr Thr Arg Arg Lys Asn Arg Ile Cys Tyr Leu Gln Glu Ile Phe
85 90 95
Ser Asn Glu Met Ala Lys Val Asp Asp Ser Phe Phe His Arg Leu Glu
100 105 110
Glu Ser Phe Leu Val Glu Glu Asp Lys Lys His Glu Arg His Pro Ile
115 120 125
Phe Gly Asn Ile Val Asp Glu Val Ala Tyr His Glu Lys Tyr Pro Thr
130 135 140
Ile Tyr His Leu Arg Lys Lys Leu Val Asp Ser Thr Asp Lys Ala Asp
145 150 155 160
Leu Arg Leu Ile Tyr Leu Ala Leu Ala His Met Ile Lys Phe Arg Gly
165 170 175
His Phe Leu Ile Glu Gly Asp Leu Asn Pro Asp Asn Ser Asp Val Asp
180 185 190
Lys Leu Phe Ile Gln Leu Val Gln Thr Tyr Asn Gln Leu Phe Glu Glu
195 200 205
Asn Pro Ile Asn Ala Ser Gly Val Asp Ala Lys Ala Ile Leu Ser Ala
210 215 220
Arg Leu Ser Lys Ser Arg Arg Leu Glu Asn Leu Ile Ala Gln Leu Pro
225 230 235 240
Gly Glu Lys Lys Asn Gly Leu Phe Gly Asn Leu Ile Ala Leu Ser Leu
245 250 255
Gly Leu Thr Pro Asn Phe Lys Ser Asn Phe Asp Leu Ala Glu Asp Ala
260 265 270
Lys Leu Gln Leu Ser Lys Asp Thr Tyr Asp Asp Asp Leu Asp Asn Leu
275 280 285
Leu Ala Gln Ile Gly Asp Gln Tyr Ala Asp Leu Phe Leu Ala Ala Lys
290 295 300
Asn Leu Ser Asp Ala Ile Leu Leu Ser Asp Ile Leu Arg Val Asn Thr
305 310 315 320
Glu Ile Thr Lys Ala Pro Leu Ser Ala Ser Met Ile Lys Arg Tyr Asp
325 330 335
Glu His His Gln Asp Leu Thr Leu Leu Lys Ala Leu Val Arg Gln Gln
340 345 350
Leu Pro Glu Lys Tyr Lys Glu Ile Phe Phe Asp Gln Ser Lys Asn Gly
355 360 365
Tyr Ala Gly Tyr Ile Asp Gly Gly Ala Ser Gln Glu Glu Phe Tyr Lys
370 375 380
Phe Ile Lys Pro Ile Leu Glu Lys Met Asp Gly Thr Glu Glu Leu Leu
385 390 395 400
Val Lys Leu Asn Arg Glu Asp Leu Leu Arg Lys Gln Arg Thr Phe Asp
405 410 415
Asn Gly Ser Ile Pro His Gln Ile His Leu Gly Glu Leu His Ala Ile
420 425 430
Leu Arg Arg Gln Glu Asp Phe Tyr Pro Phe Leu Lys Asp Asn Arg Glu
435 440 445
Lys Ile Glu Lys Ile Leu Thr Phe Arg Ile Pro Tyr Tyr Val Gly Pro
450 455 460
Leu Ala Arg Gly Asn Ser Arg Phe Ala Trp Met Thr Arg Lys Ser Glu
465 470 475 480
Glu Thr Ile Thr Pro Trp Asn Phe Glu Glu Val Val Asp Lys Gly Ala
485 490 495
Ser Ala Gln Ser Phe Ile Glu Arg Met Thr Asn Phe Asp Lys Asn Leu
500 505 510
Pro Asn Glu Lys Val Leu Pro Lys His Ser Leu Leu Tyr Glu Tyr Phe
515 520 525
Thr Val Tyr Asn Glu Leu Thr Lys Val Lys Tyr Val Thr Glu Gly Met
530 535 540
Arg Lys Pro Ala Phe Leu Ser Gly Glu Gln Lys Lys Ala Ile Val Asp
545 550 555 560
Leu Leu Phe Lys Thr Asn Arg Lys Val Thr Val Lys Gln Leu Lys Glu
565 570 575
Asp Tyr Phe Lys Lys Ile Glu Cys Phe Asp Ser Val Glu Ile Ser Gly
580 585 590
Val Glu Asp Arg Phe Asn Ala Ser Leu Gly Thr Tyr His Asp Leu Leu
595 600 605
Lys Ile Ile Lys Asp Lys Asp Phe Leu Asp Asn Glu Glu Asn Glu Asp
610 615 620
Ile Leu Glu Asp Ile Val Leu Thr Leu Thr Leu Phe Glu Asp Arg Glu
625 630 635 640
Met Ile Glu Glu Arg Leu Lys Thr Tyr Ala His Leu Phe Asp Asp Lys
645 650 655
Val Met Lys Gln Leu Lys Arg Arg Arg Tyr Thr Gly Trp Gly Arg Leu
660 665 670
Ser Arg Lys Leu Ile Asn Gly Ile Arg Asp Lys Gln Ser Gly Lys Thr
675 680 685
Ile Leu Asp Phe Leu Lys Ser Asp Gly Phe Ala Asn Arg Asn Phe Met
690 695 700
Gln Leu Ile His Asp Asp Ser Leu Thr Phe Lys Glu Asp Ile Gln Lys
705 710 715 720
Ala Gln Val Ser Gly Gln Gly Asp Ser Leu His Glu His Ile Ala Asn
725 730 735
Leu Ala Gly Ser Pro Ala Ile Lys Lys Gly Ile Leu Gln Thr Val Lys
740 745 750
Val Val Asp Glu Leu Val Lys Val Met Gly Arg His Lys Pro Glu Asn
755 760 765
Ile Val Ile Glu Met Ala Arg Glu Asn Gln Thr Thr Gln Lys Gly Gln
770 775 780
Lys Asn Ser Arg Glu Arg Met Lys Arg Ile Glu Glu Gly Ile Lys Glu
785 790 795 800
Leu Gly Ser Gln Ile Leu Lys Glu His Pro Val Glu Asn Thr Gln Leu
805 810 815
Gln Asn Glu Lys Leu Tyr Leu Tyr Tyr Leu Gln Asn Gly Arg Asp Met
820 825 830
Tyr Val Asp Gln Glu Leu Asp Ile Asn Arg Leu Ser Asp Tyr Asp Val
835 840 845
Asp His Ile Val Pro Gln Ser Phe Leu Lys Asp Asp Ser Ile Asp Asn
850 855 860
Lys Val Leu Thr Arg Ser Asp Lys Asn Arg Gly Lys Ser Asp Asn Val
865 870 875 880
Pro Ser Glu Glu Val Val Lys Lys Met Lys Asn Tyr Trp Arg Gln Leu
885 890 895
Leu Asn Ala Lys Leu Ile Thr Gln Arg Lys Phe Asp Asn Leu Thr Lys
900 905 910
Ala Glu Arg Gly Gly Leu Ser Glu Leu Asp Lys Ala Gly Phe Ile Lys
915 920 925
Arg Gln Leu Val Glu Thr Arg Gln Ile Thr Lys His Val Ala Gln Ile
930 935 940
Leu Asp Ser Arg Met Asn Thr Lys Tyr Asp Glu Asn Asp Lys Leu Ile
945 950 955 960
Arg Glu Val Lys Val Ile Thr Leu Lys Ser Lys Leu Val Ser Asp Phe
965 970 975
Arg Lys Asp Phe Gln Phe Tyr Lys Val Arg Glu Ile Asn Asn Tyr His
980 985 990
His Ala His Asp Ala Tyr Leu Asn Ala Val Val Gly Thr Ala Leu Ile
995 1000 1005
Lys Lys Tyr Pro Lys Leu Glu Ser Glu Phe Val Tyr Gly Asp Tyr
1010 1015 1020
Lys Val Tyr Asp Val Arg Lys Met Ile Ala Lys Ser Glu Gln Glu
1025 1030 1035
Ile Gly Lys Ala Thr Ala Lys Tyr Phe Phe Tyr Ser Asn Ile Met
1040 1045 1050
Asn Phe Phe Lys Thr Glu Ile Thr Leu Ala Asn Gly Glu Ile Arg
1055 1060 1065
Lys Arg Pro Leu Ile Glu Thr Asn Gly Glu Thr Gly Glu Ile Val
1070 1075 1080
Trp Asp Lys Gly Arg Asp Phe Ala Thr Val Arg Lys Val Leu Ser
1085 1090 1095
Met Pro Gln Val Asn Ile Val Lys Lys Thr Glu Val Gln Thr Gly
1100 1105 1110
Gly Phe Ser Lys Glu Ser Ile Leu Pro Lys Arg Asn Ser Asp Lys
1115 1120 1125
Leu Ile Ala Arg Lys Lys Asp Trp Asp Pro Lys Lys Tyr Gly Gly
1130 1135 1140
Phe Asp Ser Pro Thr Val Ala Tyr Ser Val Leu Val Val Ala Lys
1145 1150 1155
Val Glu Lys Gly Lys Ser Lys Lys Leu Lys Ser Val Lys Glu Leu
1160 1165 1170
Leu Gly Ile Thr Ile Met Glu Arg Ser Ser Phe Glu Lys Asn Pro
1175 1180 1185
Ile Asp Phe Leu Glu Ala Lys Gly Tyr Lys Glu Val Lys Lys Asp
1190 1195 1200
Leu Ile Ile Lys Leu Pro Lys Tyr Ser Leu Phe Glu Leu Glu Asn
1205 1210 1215
Gly Arg Lys Arg Met Leu Ala Ser Ala Gly Glu Leu Gln Lys Gly
1220 1225 1230
Asn Glu Leu Ala Leu Pro Ser Lys Tyr Val Asn Phe Leu Tyr Leu
1235 1240 1245
Ala Ser His Tyr Glu Lys Leu Lys Gly Ser Pro Glu Asp Asn Glu
1250 1255 1260
Gln Lys Gln Leu Phe Val Glu Gln His Lys His Tyr Leu Asp Glu
1265 1270 1275
Ile Ile Glu Gln Ile Ser Glu Phe Ser Lys Arg Val Ile Leu Ala
1280 1285 1290
Asp Ala Asn Leu Asp Lys Val Leu Ser Ala Tyr Asn Lys His Arg
1295 1300 1305
Asp Lys Pro Ile Arg Glu Gln Ala Glu Asn Ile Ile His Leu Phe
1310 1315 1320
Thr Leu Thr Asn Leu Gly Ala Pro Ala Ala Phe Lys Tyr Phe Asp
1325 1330 1335
Thr Thr Ile Asp Arg Lys Arg Tyr Thr Ser Thr Lys Glu Val Leu
1340 1345 1350
Asp Ala Thr Leu Ile His Gln Ser Ile Thr Gly Leu Tyr Glu Thr
1355 1360 1365
Arg Ile Asp Leu Ser Gln Leu Gly Gly Asp Ser Arg Ala Asp Pro
1370 1375 1380
Lys Lys Lys Arg Lys Val
1385
<210> 239
<211> 1399
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 239
Met Gly Ser Ser His His His His His His His His Glu Asn Leu Tyr
1 5 10 15
Phe Gln Gly Ser Met Asp Lys Lys Tyr Ser Ile Gly Leu Asp Ile Gly
20 25 30
Thr Asn Ser Val Gly Trp Ala Val Ile Thr Asp Glu Tyr Lys Val Pro
35 40 45
Ser Lys Lys Phe Lys Val Leu Gly Asn Thr Asp Arg His Ser Ile Lys
50 55 60
Lys Asn Leu Ile Gly Ala Leu Leu Phe Asp Ser Gly Glu Thr Ala Glu
65 70 75 80
Ala Thr Arg Leu Lys Arg Thr Ala Arg Arg Arg Tyr Thr Arg Arg Lys
85 90 95
Asn Arg Ile Cys Tyr Leu Gln Glu Ile Phe Ser Asn Glu Met Ala Lys
100 105 110
Val Asp Asp Ser Phe Phe His Arg Leu Glu Glu Ser Phe Leu Val Glu
115 120 125
Glu Asp Lys Lys His Glu Arg His Pro Ile Phe Gly Asn Ile Val Asp
130 135 140
Glu Val Ala Tyr His Glu Lys Tyr Pro Thr Ile Tyr His Leu Arg Lys
145 150 155 160
Lys Leu Val Asp Ser Thr Asp Lys Ala Asp Leu Arg Leu Ile Tyr Leu
165 170 175
Ala Leu Ala His Met Ile Lys Phe Arg Gly His Phe Leu Ile Glu Gly
180 185 190
Asp Leu Asn Pro Asp Asn Ser Asp Val Asp Lys Leu Phe Ile Gln Leu
195 200 205
Val Gln Thr Tyr Asn Gln Leu Phe Glu Glu Asn Pro Ile Asn Ala Ser
210 215 220
Gly Val Asp Ala Lys Ala Ile Leu Ser Ala Arg Leu Ser Lys Ser Arg
225 230 235 240
Arg Leu Glu Asn Leu Ile Ala Gln Leu Pro Gly Glu Lys Lys Asn Gly
245 250 255
Leu Phe Gly Asn Leu Ile Ala Leu Ser Leu Gly Leu Thr Pro Asn Phe
260 265 270
Lys Ser Asn Phe Asp Leu Ala Glu Asp Ala Lys Leu Gln Leu Ser Lys
275 280 285
Asp Thr Tyr Asp Asp Asp Leu Asp Asn Leu Leu Ala Gln Ile Gly Asp
290 295 300
Gln Tyr Ala Asp Leu Phe Leu Ala Ala Lys Asn Leu Ser Asp Ala Ile
305 310 315 320
Leu Leu Ser Asp Ile Leu Arg Val Asn Thr Glu Ile Thr Lys Ala Pro
325 330 335
Leu Ser Ala Ser Met Ile Lys Arg Tyr Asp Glu His His Gln Asp Leu
340 345 350
Thr Leu Leu Lys Ala Leu Val Arg Gln Gln Leu Pro Glu Lys Tyr Lys
355 360 365
Glu Ile Phe Phe Asp Gln Ser Lys Asn Gly Tyr Ala Gly Tyr Ile Asp
370 375 380
Gly Gly Ala Ser Gln Glu Glu Phe Tyr Lys Phe Ile Lys Pro Ile Leu
385 390 395 400
Glu Lys Met Asp Gly Thr Glu Glu Leu Leu Val Lys Leu Asn Arg Glu
405 410 415
Asp Leu Leu Arg Lys Gln Arg Thr Phe Asp Asn Gly Ser Ile Pro His
420 425 430
Gln Ile His Leu Gly Glu Leu His Ala Ile Leu Arg Arg Gln Glu Asp
435 440 445
Phe Tyr Pro Phe Leu Lys Asp Asn Arg Glu Lys Ile Glu Lys Ile Leu
450 455 460
Thr Phe Arg Ile Pro Tyr Tyr Val Gly Pro Leu Ala Arg Gly Asn Ser
465 470 475 480
Arg Phe Ala Trp Met Thr Arg Lys Ser Glu Glu Thr Ile Thr Pro Trp
485 490 495
Asn Phe Glu Glu Val Val Asp Lys Gly Ala Ser Ala Gln Ser Phe Ile
500 505 510
Glu Arg Met Thr Asn Phe Asp Lys Asn Leu Pro Asn Glu Lys Val Leu
515 520 525
Pro Lys His Ser Leu Leu Tyr Glu Tyr Phe Thr Val Tyr Asn Glu Leu
530 535 540
Thr Lys Val Lys Tyr Val Thr Glu Gly Met Arg Lys Pro Ala Phe Leu
545 550 555 560
Ser Gly Glu Gln Lys Lys Ala Ile Val Asp Leu Leu Phe Lys Thr Asn
565 570 575
Arg Lys Val Thr Val Lys Gln Leu Lys Glu Asp Tyr Phe Lys Lys Ile
580 585 590
Glu Cys Phe Asp Ser Val Glu Ile Ser Gly Val Glu Asp Arg Phe Asn
595 600 605
Ala Ser Leu Gly Thr Tyr His Asp Leu Leu Lys Ile Ile Lys Asp Lys
610 615 620
Asp Phe Leu Asp Asn Glu Glu Asn Glu Asp Ile Leu Glu Asp Ile Val
625 630 635 640
Leu Thr Leu Thr Leu Phe Glu Asp Arg Glu Met Ile Glu Glu Arg Leu
645 650 655
Lys Thr Tyr Ala His Leu Phe Asp Asp Lys Val Met Lys Gln Leu Lys
660 665 670
Arg Arg Arg Tyr Thr Gly Trp Gly Arg Leu Ser Arg Lys Leu Ile Asn
675 680 685
Gly Ile Arg Asp Lys Gln Ser Gly Lys Thr Ile Leu Asp Phe Leu Lys
690 695 700
Ser Asp Gly Phe Ala Asn Arg Asn Phe Met Gln Leu Ile His Asp Asp
705 710 715 720
Ser Leu Thr Phe Lys Glu Asp Ile Gln Lys Ala Gln Val Ser Gly Gln
725 730 735
Gly Asp Ser Leu His Glu His Ile Ala Asn Leu Ala Gly Ser Pro Ala
740 745 750
Ile Lys Lys Gly Ile Leu Gln Thr Val Lys Val Val Asp Glu Leu Val
755 760 765
Lys Val Met Gly Arg His Lys Pro Glu Asn Ile Val Ile Glu Met Ala
770 775 780
Arg Glu Asn Gln Thr Thr Gln Lys Gly Gln Lys Asn Ser Arg Glu Arg
785 790 795 800
Met Lys Arg Ile Glu Glu Gly Ile Lys Glu Leu Gly Ser Gln Ile Leu
805 810 815
Lys Glu His Pro Val Glu Asn Thr Gln Leu Gln Asn Glu Lys Leu Tyr
820 825 830
Leu Tyr Tyr Leu Gln Asn Gly Arg Asp Met Tyr Val Asp Gln Glu Leu
835 840 845
Asp Ile Asn Arg Leu Ser Asp Tyr Asp Val Asp His Ile Val Pro Gln
850 855 860
Ser Phe Leu Lys Asp Asp Ser Ile Asp Asn Lys Val Leu Thr Arg Ser
865 870 875 880
Asp Lys Asn Arg Gly Lys Ser Asp Asn Val Pro Ser Glu Glu Val Val
885 890 895
Lys Lys Met Lys Asn Tyr Trp Arg Gln Leu Leu Asn Ala Lys Leu Ile
900 905 910
Thr Gln Arg Lys Phe Asp Asn Leu Thr Lys Ala Glu Arg Gly Gly Leu
915 920 925
Ser Glu Leu Asp Lys Ala Gly Phe Ile Lys Arg Gln Leu Val Glu Thr
930 935 940
Arg Gln Ile Thr Lys His Val Ala Gln Ile Leu Asp Ser Arg Met Asn
945 950 955 960
Thr Lys Tyr Asp Glu Asn Asp Lys Leu Ile Arg Glu Val Lys Val Ile
965 970 975
Thr Leu Lys Ser Lys Leu Val Ser Asp Phe Arg Lys Asp Phe Gln Phe
980 985 990
Tyr Lys Val Arg Glu Ile Asn Asn Tyr His His Ala His Asp Ala Tyr
995 1000 1005
Leu Asn Ala Val Val Gly Thr Ala Leu Ile Lys Lys Tyr Pro Lys
1010 1015 1020
Leu Glu Ser Glu Phe Val Tyr Gly Asp Tyr Lys Val Tyr Asp Val
1025 1030 1035
Arg Lys Met Ile Ala Lys Ser Glu Gln Glu Ile Gly Lys Ala Thr
1040 1045 1050
Ala Lys Tyr Phe Phe Tyr Ser Asn Ile Met Asn Phe Phe Lys Thr
1055 1060 1065
Glu Ile Thr Leu Ala Asn Gly Glu Ile Arg Lys Arg Pro Leu Ile
1070 1075 1080
Glu Thr Asn Gly Glu Thr Gly Glu Ile Val Trp Asp Lys Gly Arg
1085 1090 1095
Asp Phe Ala Thr Val Arg Lys Val Leu Ser Met Pro Gln Val Asn
1100 1105 1110
Ile Val Lys Lys Thr Glu Val Gln Thr Gly Gly Phe Ser Lys Glu
1115 1120 1125
Ser Ile Leu Pro Lys Arg Asn Ser Asp Lys Leu Ile Ala Arg Lys
1130 1135 1140
Lys Asp Trp Asp Pro Lys Lys Tyr Gly Gly Phe Asp Ser Pro Thr
1145 1150 1155
Val Ala Tyr Ser Val Leu Val Val Ala Lys Val Glu Lys Gly Lys
1160 1165 1170
Ser Lys Lys Leu Lys Ser Val Lys Glu Leu Leu Gly Ile Thr Ile
1175 1180 1185
Met Glu Arg Ser Ser Phe Glu Lys Asn Pro Ile Asp Phe Leu Glu
1190 1195 1200
Ala Lys Gly Tyr Lys Glu Val Lys Lys Asp Leu Ile Ile Lys Leu
1205 1210 1215
Pro Lys Tyr Ser Leu Phe Glu Leu Glu Asn Gly Arg Lys Arg Met
1220 1225 1230
Leu Ala Ser Ala Gly Glu Leu Gln Lys Gly Asn Glu Leu Ala Leu
1235 1240 1245
Pro Ser Lys Tyr Val Asn Phe Leu Tyr Leu Ala Ser His Tyr Glu
1250 1255 1260
Lys Leu Lys Gly Ser Pro Glu Asp Asn Glu Gln Lys Gln Leu Phe
1265 1270 1275
Val Glu Gln His Lys His Tyr Leu Asp Glu Ile Ile Glu Gln Ile
1280 1285 1290
Ser Glu Phe Ser Lys Arg Val Ile Leu Ala Asp Ala Asn Leu Asp
1295 1300 1305
Lys Val Leu Ser Ala Tyr Asn Lys His Arg Asp Lys Pro Ile Arg
1310 1315 1320
Glu Gln Ala Glu Asn Ile Ile His Leu Phe Thr Leu Thr Asn Leu
1325 1330 1335
Gly Ala Pro Ala Ala Phe Lys Tyr Phe Asp Thr Thr Ile Asp Arg
1340 1345 1350
Lys Arg Tyr Thr Ser Thr Lys Glu Val Leu Asp Ala Thr Leu Ile
1355 1360 1365
His Gln Ser Ile Thr Gly Leu Tyr Glu Thr Arg Ile Asp Leu Ser
1370 1375 1380
Gln Leu Gly Gly Asp Gly Gly Gly Ser Pro Lys Lys Lys Arg Lys
1385 1390 1395
Val
<210> 240
<211> 1393
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 240
Met Ala Pro Lys Lys Lys Arg Lys Val Asp Lys Lys Tyr Ser Ile Gly
1 5 10 15
Leu Asp Ile Gly Thr Asn Ser Val Gly Trp Ala Val Ile Thr Asp Glu
20 25 30
Tyr Lys Val Pro Ser Lys Lys Phe Lys Val Leu Gly Asn Thr Asp Arg
35 40 45
His Ser Ile Lys Lys Asn Leu Ile Gly Ala Leu Leu Phe Asp Ser Gly
50 55 60
Glu Thr Ala Glu Ala Thr Arg Leu Lys Arg Thr Ala Arg Arg Arg Tyr
65 70 75 80
Thr Arg Arg Lys Asn Arg Ile Cys Tyr Leu Gln Glu Ile Phe Ser Asn
85 90 95
Glu Met Ala Lys Val Asp Asp Ser Phe Phe His Arg Leu Glu Glu Ser
100 105 110
Phe Leu Val Glu Glu Asp Lys Lys His Glu Arg His Pro Ile Phe Gly
115 120 125
Asn Ile Val Asp Glu Val Ala Tyr His Glu Lys Tyr Pro Thr Ile Tyr
130 135 140
His Leu Arg Lys Lys Leu Val Asp Ser Thr Asp Lys Ala Asp Leu Arg
145 150 155 160
Leu Ile Tyr Leu Ala Leu Ala His Met Ile Lys Phe Arg Gly His Phe
165 170 175
Leu Ile Glu Gly Asp Leu Asn Pro Asp Asn Ser Asp Val Asp Lys Leu
180 185 190
Phe Ile Gln Leu Val Gln Thr Tyr Asn Gln Leu Phe Glu Glu Asn Pro
195 200 205
Ile Asn Ala Ser Gly Val Asp Ala Lys Ala Ile Leu Ser Ala Arg Leu
210 215 220
Ser Lys Ser Arg Arg Leu Glu Asn Leu Ile Ala Gln Leu Pro Gly Glu
225 230 235 240
Lys Lys Asn Gly Leu Phe Gly Asn Leu Ile Ala Leu Ser Leu Gly Leu
245 250 255
Thr Pro Asn Phe Lys Ser Asn Phe Asp Leu Ala Glu Asp Ala Lys Leu
260 265 270
Gln Leu Ser Lys Asp Thr Tyr Asp Asp Asp Leu Asp Asn Leu Leu Ala
275 280 285
Gln Ile Gly Asp Gln Tyr Ala Asp Leu Phe Leu Ala Ala Lys Asn Leu
290 295 300
Ser Asp Ala Ile Leu Leu Ser Asp Ile Leu Arg Val Asn Thr Glu Ile
305 310 315 320
Thr Lys Ala Pro Leu Ser Ala Ser Met Ile Lys Arg Tyr Asp Glu His
325 330 335
His Gln Asp Leu Thr Leu Leu Lys Ala Leu Val Arg Gln Gln Leu Pro
340 345 350
Glu Lys Tyr Lys Glu Ile Phe Phe Asp Gln Ser Lys Asn Gly Tyr Ala
355 360 365
Gly Tyr Ile Asp Gly Gly Ala Ser Gln Glu Glu Phe Tyr Lys Phe Ile
370 375 380
Lys Pro Ile Leu Glu Lys Met Asp Gly Thr Glu Glu Leu Leu Val Lys
385 390 395 400
Leu Asn Arg Glu Asp Leu Leu Arg Lys Gln Arg Thr Phe Asp Asn Gly
405 410 415
Ser Ile Pro His Gln Ile His Leu Gly Glu Leu His Ala Ile Leu Arg
420 425 430
Arg Gln Glu Asp Phe Tyr Pro Phe Leu Lys Asp Asn Arg Glu Lys Ile
435 440 445
Glu Lys Ile Leu Thr Phe Arg Ile Pro Tyr Tyr Val Gly Pro Leu Ala
450 455 460
Arg Gly Asn Ser Arg Phe Ala Trp Met Thr Arg Lys Ser Glu Glu Thr
465 470 475 480
Ile Thr Pro Trp Asn Phe Glu Glu Val Val Asp Lys Gly Ala Ser Ala
485 490 495
Gln Ser Phe Ile Glu Arg Met Thr Asn Phe Asp Lys Asn Leu Pro Asn
500 505 510
Glu Lys Val Leu Pro Lys His Ser Leu Leu Tyr Glu Tyr Phe Thr Val
515 520 525
Tyr Asn Glu Leu Thr Lys Val Lys Tyr Val Thr Glu Gly Met Arg Lys
530 535 540
Pro Ala Phe Leu Ser Gly Glu Gln Lys Lys Ala Ile Val Asp Leu Leu
545 550 555 560
Phe Lys Thr Asn Arg Lys Val Thr Val Lys Gln Leu Lys Glu Asp Tyr
565 570 575
Phe Lys Lys Ile Glu Cys Phe Asp Ser Val Glu Ile Ser Gly Val Glu
580 585 590
Asp Arg Phe Asn Ala Ser Leu Gly Thr Tyr His Asp Leu Leu Lys Ile
595 600 605
Ile Lys Asp Lys Asp Phe Leu Asp Asn Glu Glu Asn Glu Asp Ile Leu
610 615 620
Glu Asp Ile Val Leu Thr Leu Thr Leu Phe Glu Asp Arg Glu Met Ile
625 630 635 640
Glu Glu Arg Leu Lys Thr Tyr Ala His Leu Phe Asp Asp Lys Val Met
645 650 655
Lys Gln Leu Lys Arg Arg Arg Tyr Thr Gly Trp Gly Arg Leu Ser Arg
660 665 670
Lys Leu Ile Asn Gly Ile Arg Asp Lys Gln Ser Gly Lys Thr Ile Leu
675 680 685
Asp Phe Leu Lys Ser Asp Gly Phe Ala Asn Arg Asn Phe Met Gln Leu
690 695 700
Ile His Asp Asp Ser Leu Thr Phe Lys Glu Asp Ile Gln Lys Ala Gln
705 710 715 720
Val Ser Gly Gln Gly Asp Ser Leu His Glu His Ile Ala Asn Leu Ala
725 730 735
Gly Ser Pro Ala Ile Lys Lys Gly Ile Leu Gln Thr Val Lys Val Val
740 745 750
Asp Glu Leu Val Lys Val Met Gly Arg His Lys Pro Glu Asn Ile Val
755 760 765
Ile Glu Met Ala Arg Glu Asn Gln Thr Thr Gln Lys Gly Gln Lys Asn
770 775 780
Ser Arg Glu Arg Met Lys Arg Ile Glu Glu Gly Ile Lys Glu Leu Gly
785 790 795 800
Ser Gln Ile Leu Lys Glu His Pro Val Glu Asn Thr Gln Leu Gln Asn
805 810 815
Glu Lys Leu Tyr Leu Tyr Tyr Leu Gln Asn Gly Arg Asp Met Tyr Val
820 825 830
Asp Gln Glu Leu Asp Ile Asn Arg Leu Ser Asp Tyr Asp Val Asp His
835 840 845
Ile Val Pro Gln Ser Phe Leu Lys Asp Asp Ser Ile Asp Asn Ala Val
850 855 860
Leu Thr Arg Ser Asp Lys Asn Arg Gly Lys Ser Asp Asn Val Pro Ser
865 870 875 880
Glu Glu Val Val Lys Lys Met Lys Asn Tyr Trp Arg Gln Leu Leu Asn
885 890 895
Ala Lys Leu Ile Thr Gln Arg Lys Phe Asp Asn Leu Thr Lys Ala Glu
900 905 910
Arg Gly Gly Leu Ser Glu Leu Asp Lys Ala Gly Phe Ile Lys Arg Gln
915 920 925
Leu Val Glu Thr Arg Gln Ile Thr Lys His Val Ala Gln Ile Leu Asp
930 935 940
Ser Arg Met Asn Thr Lys Tyr Asp Glu Asn Asp Lys Leu Ile Arg Glu
945 950 955 960
Val Lys Val Ile Thr Leu Lys Ser Lys Leu Val Ser Asp Phe Arg Lys
965 970 975
Asp Phe Gln Phe Tyr Lys Val Arg Glu Ile Asn Asn Tyr His His Ala
980 985 990
His Asp Ala Tyr Leu Asn Ala Val Val Gly Thr Ala Leu Ile Lys Lys
995 1000 1005
Tyr Pro Lys Leu Glu Ser Glu Phe Val Tyr Gly Asp Tyr Lys Val
1010 1015 1020
Tyr Asp Val Arg Lys Met Ile Ala Lys Ser Glu Gln Glu Ile Gly
1025 1030 1035
Lys Ala Thr Ala Lys Tyr Phe Phe Tyr Ser Asn Ile Met Asn Phe
1040 1045 1050
Phe Lys Thr Glu Ile Thr Leu Ala Asn Gly Glu Ile Arg Lys Arg
1055 1060 1065
Pro Leu Ile Glu Thr Asn Gly Glu Thr Gly Glu Ile Val Trp Asp
1070 1075 1080
Lys Gly Arg Asp Phe Ala Thr Val Arg Lys Val Leu Ser Met Pro
1085 1090 1095
Gln Val Asn Ile Val Lys Lys Thr Glu Val Gln Thr Gly Gly Phe
1100 1105 1110
Ser Lys Glu Ser Ile Leu Pro Lys Arg Asn Ser Asp Lys Leu Ile
1115 1120 1125
Ala Arg Lys Lys Asp Trp Asp Pro Lys Lys Tyr Gly Gly Phe Asp
1130 1135 1140
Ser Pro Thr Val Ala Tyr Ser Val Leu Val Val Ala Lys Val Glu
1145 1150 1155
Lys Gly Lys Ser Lys Lys Leu Lys Ser Val Lys Glu Leu Leu Gly
1160 1165 1170
Ile Thr Ile Met Glu Arg Ser Ser Phe Glu Lys Asn Pro Ile Asp
1175 1180 1185
Phe Leu Glu Ala Lys Gly Tyr Lys Glu Val Lys Lys Asp Leu Ile
1190 1195 1200
Ile Lys Leu Pro Lys Tyr Ser Leu Phe Glu Leu Glu Asn Gly Arg
1205 1210 1215
Lys Arg Met Leu Ala Ser Ala Gly Glu Leu Gln Lys Gly Asn Glu
1220 1225 1230
Leu Ala Leu Pro Ser Lys Tyr Val Asn Phe Leu Tyr Leu Ala Ser
1235 1240 1245
His Tyr Glu Lys Leu Lys Gly Ser Pro Glu Asp Asn Glu Gln Lys
1250 1255 1260
Gln Leu Phe Val Glu Gln His Lys His Tyr Leu Asp Glu Ile Ile
1265 1270 1275
Glu Gln Ile Ser Glu Phe Ser Lys Arg Val Ile Leu Ala Asp Ala
1280 1285 1290
Asn Leu Asp Lys Val Leu Ser Ala Tyr Asn Lys His Arg Asp Lys
1295 1300 1305
Pro Ile Arg Glu Gln Ala Glu Asn Ile Ile His Leu Phe Thr Leu
1310 1315 1320
Thr Asn Leu Gly Ala Pro Ala Ala Phe Lys Tyr Phe Asp Thr Thr
1325 1330 1335
Ile Asp Arg Lys Arg Tyr Thr Ser Thr Lys Glu Val Leu Asp Ala
1340 1345 1350
Thr Leu Ile His Gln Ser Ile Thr Gly Leu Tyr Glu Thr Arg Ile
1355 1360 1365
Asp Leu Ser Gln Leu Gly Gly Asp Ser Arg Ala Asp Pro Lys Lys
1370 1375 1380
Lys Arg Lys Val His His His His His His
1385 1390
<210> 241
<211> 1393
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 241
Met Ala Pro Lys Lys Lys Arg Lys Val Asp Lys Lys Tyr Ser Ile Gly
1 5 10 15
Leu Asp Ile Gly Thr Asn Ser Val Gly Trp Ala Val Ile Thr Asp Glu
20 25 30
Tyr Lys Val Pro Ser Lys Lys Phe Lys Val Leu Gly Asn Thr Asp Arg
35 40 45
His Ser Ile Lys Lys Asn Leu Ile Gly Ala Leu Leu Phe Asp Ser Gly
50 55 60
Glu Thr Ala Glu Ala Thr Arg Leu Lys Arg Thr Ala Arg Arg Arg Tyr
65 70 75 80
Thr Arg Arg Lys Asn Arg Ile Cys Tyr Leu Gln Glu Ile Phe Ser Asn
85 90 95
Glu Met Ala Lys Val Asp Asp Ser Phe Phe His Arg Leu Glu Glu Ser
100 105 110
Phe Leu Val Glu Glu Asp Lys Lys His Glu Arg His Pro Ile Phe Gly
115 120 125
Asn Ile Val Asp Glu Val Ala Tyr His Glu Lys Tyr Pro Thr Ile Tyr
130 135 140
His Leu Arg Lys Lys Leu Val Asp Ser Thr Asp Lys Ala Asp Leu Arg
145 150 155 160
Leu Ile Tyr Leu Ala Leu Ala His Met Ile Lys Phe Arg Gly His Phe
165 170 175
Leu Ile Glu Gly Asp Leu Asn Pro Asp Asn Ser Asp Val Asp Lys Leu
180 185 190
Phe Ile Gln Leu Val Gln Thr Tyr Asn Gln Leu Phe Glu Glu Asn Pro
195 200 205
Ile Asn Ala Ser Gly Val Asp Ala Lys Ala Ile Leu Ser Ala Arg Leu
210 215 220
Ser Lys Ser Arg Arg Leu Glu Asn Leu Ile Ala Gln Leu Pro Gly Glu
225 230 235 240
Lys Lys Asn Gly Leu Phe Gly Asn Leu Ile Ala Leu Ser Leu Gly Leu
245 250 255
Thr Pro Asn Phe Lys Ser Asn Phe Asp Leu Ala Glu Asp Ala Lys Leu
260 265 270
Gln Leu Ser Lys Asp Thr Tyr Asp Asp Asp Leu Asp Asn Leu Leu Ala
275 280 285
Gln Ile Gly Asp Gln Tyr Ala Asp Leu Phe Leu Ala Ala Lys Asn Leu
290 295 300
Ser Asp Ala Ile Leu Leu Ser Asp Ile Leu Arg Val Asn Thr Glu Ile
305 310 315 320
Thr Lys Ala Pro Leu Ser Ala Ser Met Ile Lys Arg Tyr Asp Glu His
325 330 335
His Gln Asp Leu Thr Leu Leu Lys Ala Leu Val Arg Gln Gln Leu Pro
340 345 350
Glu Lys Tyr Lys Glu Ile Phe Phe Asp Gln Ser Lys Asn Gly Tyr Ala
355 360 365
Gly Tyr Ile Asp Gly Gly Ala Ser Gln Glu Glu Phe Tyr Lys Phe Ile
370 375 380
Lys Pro Ile Leu Glu Lys Met Asp Gly Thr Glu Glu Leu Leu Val Lys
385 390 395 400
Leu Asn Arg Glu Asp Leu Leu Arg Lys Gln Arg Thr Phe Asp Asn Gly
405 410 415
Ser Ile Pro His Gln Ile His Leu Gly Glu Leu His Ala Ile Leu Arg
420 425 430
Arg Gln Glu Asp Phe Tyr Pro Phe Leu Lys Asp Asn Arg Glu Lys Ile
435 440 445
Glu Lys Ile Leu Thr Phe Arg Ile Pro Tyr Tyr Val Gly Pro Leu Ala
450 455 460
Arg Gly Asn Ser Arg Phe Ala Trp Met Thr Arg Lys Ser Glu Glu Thr
465 470 475 480
Ile Thr Pro Trp Asn Phe Glu Glu Val Val Asp Lys Gly Ala Ser Ala
485 490 495
Gln Ser Phe Ile Glu Arg Met Thr Asn Phe Asp Lys Asn Leu Pro Asn
500 505 510
Glu Lys Val Leu Pro Lys His Ser Leu Leu Tyr Glu Tyr Phe Thr Val
515 520 525
Tyr Asn Glu Leu Thr Lys Val Lys Tyr Val Thr Glu Gly Met Arg Lys
530 535 540
Pro Ala Phe Leu Ser Gly Glu Gln Lys Lys Ala Ile Val Asp Leu Leu
545 550 555 560
Phe Lys Thr Asn Arg Lys Val Thr Val Lys Gln Leu Lys Glu Asp Tyr
565 570 575
Phe Lys Lys Ile Glu Cys Phe Asp Ser Val Glu Ile Ser Gly Val Glu
580 585 590
Asp Arg Phe Asn Ala Ser Leu Gly Thr Tyr His Asp Leu Leu Lys Ile
595 600 605
Ile Lys Asp Lys Asp Phe Leu Asp Asn Glu Glu Asn Glu Asp Ile Leu
610 615 620
Glu Asp Ile Val Leu Thr Leu Thr Leu Phe Glu Asp Arg Glu Met Ile
625 630 635 640
Glu Glu Arg Leu Lys Thr Tyr Ala His Leu Phe Asp Asp Lys Val Met
645 650 655
Lys Gln Leu Lys Arg Arg Arg Tyr Thr Gly Trp Gly Arg Leu Ser Arg
660 665 670
Lys Leu Ile Asn Gly Ile Arg Asp Lys Gln Ser Gly Lys Thr Ile Leu
675 680 685
Asp Phe Leu Lys Ser Asp Gly Phe Ala Asn Arg Asn Phe Met Gln Leu
690 695 700
Ile His Asp Asp Ser Leu Thr Phe Lys Glu Asp Ile Gln Lys Ala Gln
705 710 715 720
Val Ser Gly Gln Gly Asp Ser Leu His Glu His Ile Ala Asn Leu Ala
725 730 735
Gly Ser Pro Ala Ile Lys Lys Gly Ile Leu Gln Thr Val Lys Val Val
740 745 750
Asp Glu Leu Val Lys Val Met Gly Arg His Lys Pro Glu Asn Ile Val
755 760 765
Ile Glu Met Ala Arg Glu Asn Gln Thr Thr Gln Lys Gly Gln Lys Asn
770 775 780
Ser Arg Glu Arg Met Lys Arg Ile Glu Glu Gly Ile Lys Glu Leu Gly
785 790 795 800
Ser Gln Ile Leu Lys Glu His Pro Val Glu Asn Thr Gln Leu Gln Asn
805 810 815
Glu Ala Leu Tyr Leu Tyr Tyr Leu Gln Asn Gly Arg Asp Met Tyr Val
820 825 830
Asp Gln Glu Leu Asp Ile Asn Arg Leu Ser Asp Tyr Asp Val Asp His
835 840 845
Ile Val Pro Gln Ser Phe Leu Lys Asp Asp Ser Ile Asp Asn Lys Val
850 855 860
Leu Thr Arg Ser Asp Lys Asn Arg Gly Lys Ser Asp Asn Val Pro Ser
865 870 875 880
Glu Glu Val Val Lys Lys Met Lys Asn Tyr Trp Arg Gln Leu Leu Asn
885 890 895
Ala Lys Leu Ile Thr Gln Arg Lys Phe Asp Asn Leu Thr Lys Ala Glu
900 905 910
Arg Gly Gly Leu Ser Glu Leu Asp Lys Ala Gly Phe Ile Lys Arg Gln
915 920 925
Leu Val Glu Thr Arg Gln Ile Thr Lys His Val Ala Gln Ile Leu Asp
930 935 940
Ser Arg Met Asn Thr Lys Tyr Asp Glu Asn Asp Lys Leu Ile Arg Glu
945 950 955 960
Val Lys Val Ile Thr Leu Lys Ser Lys Leu Val Ser Asp Phe Arg Lys
965 970 975
Asp Phe Gln Phe Tyr Lys Val Arg Glu Ile Asn Asn Tyr His His Ala
980 985 990
His Asp Ala Tyr Leu Asn Ala Val Val Gly Thr Ala Leu Ile Lys Lys
995 1000 1005
Tyr Pro Ala Leu Glu Ser Glu Phe Val Tyr Gly Asp Tyr Lys Val
1010 1015 1020
Tyr Asp Val Arg Lys Met Ile Ala Lys Ser Glu Gln Glu Ile Gly
1025 1030 1035
Lys Ala Thr Ala Lys Tyr Phe Phe Tyr Ser Asn Ile Met Asn Phe
1040 1045 1050
Phe Lys Thr Glu Ile Thr Leu Ala Asn Gly Glu Ile Arg Lys Ala
1055 1060 1065
Pro Leu Ile Glu Thr Asn Gly Glu Thr Gly Glu Ile Val Trp Asp
1070 1075 1080
Lys Gly Arg Asp Phe Ala Thr Val Arg Lys Val Leu Ser Met Pro
1085 1090 1095
Gln Val Asn Ile Val Lys Lys Thr Glu Val Gln Thr Gly Gly Phe
1100 1105 1110
Ser Lys Glu Ser Ile Leu Pro Lys Arg Asn Ser Asp Lys Leu Ile
1115 1120 1125
Ala Arg Lys Lys Asp Trp Asp Pro Lys Lys Tyr Gly Gly Phe Asp
1130 1135 1140
Ser Pro Thr Val Ala Tyr Ser Val Leu Val Val Ala Lys Val Glu
1145 1150 1155
Lys Gly Lys Ser Lys Lys Leu Lys Ser Val Lys Glu Leu Leu Gly
1160 1165 1170
Ile Thr Ile Met Glu Arg Ser Ser Phe Glu Lys Asn Pro Ile Asp
1175 1180 1185
Phe Leu Glu Ala Lys Gly Tyr Lys Glu Val Lys Lys Asp Leu Ile
1190 1195 1200
Ile Lys Leu Pro Lys Tyr Ser Leu Phe Glu Leu Glu Asn Gly Arg
1205 1210 1215
Lys Arg Met Leu Ala Ser Ala Gly Glu Leu Gln Lys Gly Asn Glu
1220 1225 1230
Leu Ala Leu Pro Ser Lys Tyr Val Asn Phe Leu Tyr Leu Ala Ser
1235 1240 1245
His Tyr Glu Lys Leu Lys Gly Ser Pro Glu Asp Asn Glu Gln Lys
1250 1255 1260
Gln Leu Phe Val Glu Gln His Lys His Tyr Leu Asp Glu Ile Ile
1265 1270 1275
Glu Gln Ile Ser Glu Phe Ser Lys Arg Val Ile Leu Ala Asp Ala
1280 1285 1290
Asn Leu Asp Lys Val Leu Ser Ala Tyr Asn Lys His Arg Asp Lys
1295 1300 1305
Pro Ile Arg Glu Gln Ala Glu Asn Ile Ile His Leu Phe Thr Leu
1310 1315 1320
Thr Asn Leu Gly Ala Pro Ala Ala Phe Lys Tyr Phe Asp Thr Thr
1325 1330 1335
Ile Asp Arg Lys Arg Tyr Thr Ser Thr Lys Glu Val Leu Asp Ala
1340 1345 1350
Thr Leu Ile His Gln Ser Ile Thr Gly Leu Tyr Glu Thr Arg Ile
1355 1360 1365
Asp Leu Ser Gln Leu Gly Gly Asp Ser Arg Ala Asp Pro Lys Lys
1370 1375 1380
Lys Arg Lys Val His His His His His His
1385 1390
<210> 242
<211> 1393
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 242
Met Ala Pro Lys Lys Lys Arg Lys Val Asp Lys Lys Tyr Ser Ile Gly
1 5 10 15
Leu Asp Ile Gly Thr Asn Ser Val Gly Trp Ala Val Ile Thr Asp Glu
20 25 30
Tyr Lys Val Pro Ser Lys Lys Phe Lys Val Leu Gly Asn Thr Asp Arg
35 40 45
His Ser Ile Lys Lys Asn Leu Ile Gly Ala Leu Leu Phe Asp Ser Gly
50 55 60
Glu Thr Ala Glu Ala Thr Arg Leu Lys Arg Thr Ala Arg Arg Arg Tyr
65 70 75 80
Thr Arg Arg Lys Asn Arg Ile Cys Tyr Leu Gln Glu Ile Phe Ser Asn
85 90 95
Glu Met Ala Lys Val Asp Asp Ser Phe Phe His Arg Leu Glu Glu Ser
100 105 110
Phe Leu Val Glu Glu Asp Lys Lys His Glu Arg His Pro Ile Phe Gly
115 120 125
Asn Ile Val Asp Glu Val Ala Tyr His Glu Lys Tyr Pro Thr Ile Tyr
130 135 140
His Leu Arg Lys Lys Leu Val Asp Ser Thr Asp Lys Ala Asp Leu Arg
145 150 155 160
Leu Ile Tyr Leu Ala Leu Ala His Met Ile Lys Phe Arg Gly His Phe
165 170 175
Leu Ile Glu Gly Asp Leu Asn Pro Asp Asn Ser Asp Val Asp Lys Leu
180 185 190
Phe Ile Gln Leu Val Gln Thr Tyr Asn Gln Leu Phe Glu Glu Asn Pro
195 200 205
Ile Asn Ala Ser Gly Val Asp Ala Lys Ala Ile Leu Ser Ala Arg Leu
210 215 220
Ser Lys Ser Arg Arg Leu Glu Asn Leu Ile Ala Gln Leu Pro Gly Glu
225 230 235 240
Lys Lys Asn Gly Leu Phe Gly Asn Leu Ile Ala Leu Ser Leu Gly Leu
245 250 255
Thr Pro Asn Phe Lys Ser Asn Phe Asp Leu Ala Glu Asp Ala Lys Leu
260 265 270
Gln Leu Ser Lys Asp Thr Tyr Asp Asp Asp Leu Asp Asn Leu Leu Ala
275 280 285
Gln Ile Gly Asp Gln Tyr Ala Asp Leu Phe Leu Ala Ala Lys Asn Leu
290 295 300
Ser Asp Ala Ile Leu Leu Ser Asp Ile Leu Arg Val Asn Thr Glu Ile
305 310 315 320
Thr Lys Ala Pro Leu Ser Ala Ser Met Ile Lys Arg Tyr Asp Glu His
325 330 335
His Gln Asp Leu Thr Leu Leu Lys Ala Leu Val Arg Gln Gln Leu Pro
340 345 350
Glu Lys Tyr Lys Glu Ile Phe Phe Asp Gln Ser Lys Asn Gly Tyr Ala
355 360 365
Gly Tyr Ile Asp Gly Gly Ala Ser Gln Glu Glu Phe Tyr Lys Phe Ile
370 375 380
Lys Pro Ile Leu Glu Lys Met Asp Gly Thr Glu Glu Leu Leu Val Lys
385 390 395 400
Leu Asn Arg Glu Asp Leu Leu Arg Lys Gln Arg Thr Phe Asp Asn Gly
405 410 415
Ser Ile Pro His Gln Ile His Leu Gly Glu Leu His Ala Ile Leu Arg
420 425 430
Arg Gln Glu Asp Phe Tyr Pro Phe Leu Lys Asp Asn Arg Glu Lys Ile
435 440 445
Glu Lys Ile Leu Thr Phe Arg Ile Pro Tyr Tyr Val Gly Pro Leu Ala
450 455 460
Arg Gly Asn Ser Arg Phe Ala Trp Met Thr Arg Lys Ser Glu Glu Thr
465 470 475 480
Ile Thr Pro Trp Asn Phe Glu Glu Val Val Asp Lys Gly Ala Ser Ala
485 490 495
Gln Ser Phe Ile Glu Arg Met Thr Asn Phe Asp Lys Asn Leu Pro Asn
500 505 510
Glu Lys Val Leu Pro Lys His Ser Leu Leu Tyr Glu Tyr Phe Thr Val
515 520 525
Tyr Asn Glu Leu Thr Lys Val Lys Tyr Val Thr Glu Gly Met Arg Lys
530 535 540
Pro Ala Phe Leu Ser Gly Glu Gln Lys Lys Ala Ile Val Asp Leu Leu
545 550 555 560
Phe Lys Thr Asn Arg Lys Val Thr Val Lys Gln Leu Lys Glu Asp Tyr
565 570 575
Phe Lys Lys Ile Glu Cys Phe Asp Ser Val Glu Ile Ser Gly Val Glu
580 585 590
Asp Arg Phe Asn Ala Ser Leu Gly Thr Tyr His Asp Leu Leu Lys Ile
595 600 605
Ile Lys Asp Lys Asp Phe Leu Asp Asn Glu Glu Asn Glu Asp Ile Leu
610 615 620
Glu Asp Ile Val Leu Thr Leu Thr Leu Phe Glu Asp Arg Glu Met Ile
625 630 635 640
Glu Glu Arg Leu Lys Thr Tyr Ala His Leu Phe Asp Asp Lys Val Met
645 650 655
Lys Gln Leu Lys Arg Arg Arg Tyr Thr Gly Trp Gly Arg Leu Ser Arg
660 665 670
Lys Leu Ile Asn Gly Ile Arg Asp Lys Gln Ser Gly Lys Thr Ile Leu
675 680 685
Asp Phe Leu Lys Ser Asp Gly Phe Ala Asn Arg Asn Phe Met Gln Leu
690 695 700
Ile His Asp Asp Ser Leu Thr Phe Lys Glu Asp Ile Gln Lys Ala Gln
705 710 715 720
Val Ser Gly Gln Gly Asp Ser Leu His Glu His Ile Ala Asn Leu Ala
725 730 735
Gly Ser Pro Ala Ile Lys Lys Gly Ile Leu Gln Thr Val Lys Val Val
740 745 750
Asp Glu Leu Val Lys Val Met Gly Arg His Lys Pro Glu Asn Ile Val
755 760 765
Ile Glu Met Ala Arg Glu Asn Gln Thr Thr Gln Lys Gly Gln Lys Asn
770 775 780
Ser Arg Glu Arg Met Lys Arg Ile Glu Glu Gly Ile Lys Glu Leu Gly
785 790 795 800
Ser Gln Ile Leu Lys Glu His Pro Val Glu Asn Thr Gln Leu Gln Asn
805 810 815
Glu Lys Leu Tyr Leu Tyr Tyr Leu Gln Asn Gly Arg Asp Met Tyr Val
820 825 830
Asp Gln Glu Leu Asp Ile Asn Arg Leu Ser Asp Tyr Asp Val Asp His
835 840 845
Ile Val Pro Gln Ser Phe Leu Ala Asp Asp Ser Ile Asp Asn Lys Val
850 855 860
Leu Thr Arg Ser Asp Lys Asn Arg Gly Lys Ser Asp Asn Val Pro Ser
865 870 875 880
Glu Glu Val Val Lys Lys Met Lys Asn Tyr Trp Arg Gln Leu Leu Asn
885 890 895
Ala Lys Leu Ile Thr Gln Arg Lys Phe Asp Asn Leu Thr Lys Ala Glu
900 905 910
Arg Gly Gly Leu Ser Glu Leu Asp Lys Ala Gly Phe Ile Lys Arg Gln
915 920 925
Leu Val Glu Thr Arg Gln Ile Thr Lys His Val Ala Gln Ile Leu Asp
930 935 940
Ser Arg Met Asn Thr Lys Tyr Asp Glu Asn Asp Lys Leu Ile Arg Glu
945 950 955 960
Val Lys Val Ile Thr Leu Lys Ser Lys Leu Val Ser Asp Phe Arg Lys
965 970 975
Asp Phe Gln Phe Tyr Lys Val Arg Glu Ile Asn Asn Tyr His His Ala
980 985 990
His Asp Ala Tyr Leu Asn Ala Val Val Gly Thr Ala Leu Ile Lys Lys
995 1000 1005
Tyr Pro Ala Leu Glu Ser Glu Phe Val Tyr Gly Asp Tyr Lys Val
1010 1015 1020
Tyr Asp Val Arg Lys Met Ile Ala Lys Ser Glu Gln Glu Ile Gly
1025 1030 1035
Lys Ala Thr Ala Lys Tyr Phe Phe Tyr Ser Asn Ile Met Asn Phe
1040 1045 1050
Phe Lys Thr Glu Ile Thr Leu Ala Asn Gly Glu Ile Arg Lys Ala
1055 1060 1065
Pro Leu Ile Glu Thr Asn Gly Glu Thr Gly Glu Ile Val Trp Asp
1070 1075 1080
Lys Gly Arg Asp Phe Ala Thr Val Arg Lys Val Leu Ser Met Pro
1085 1090 1095
Gln Val Asn Ile Val Lys Lys Thr Glu Val Gln Thr Gly Gly Phe
1100 1105 1110
Ser Lys Glu Ser Ile Leu Pro Lys Arg Asn Ser Asp Lys Leu Ile
1115 1120 1125
Ala Arg Lys Lys Asp Trp Asp Pro Lys Lys Tyr Gly Gly Phe Asp
1130 1135 1140
Ser Pro Thr Val Ala Tyr Ser Val Leu Val Val Ala Lys Val Glu
1145 1150 1155
Lys Gly Lys Ser Lys Lys Leu Lys Ser Val Lys Glu Leu Leu Gly
1160 1165 1170
Ile Thr Ile Met Glu Arg Ser Ser Phe Glu Lys Asn Pro Ile Asp
1175 1180 1185
Phe Leu Glu Ala Lys Gly Tyr Lys Glu Val Lys Lys Asp Leu Ile
1190 1195 1200
Ile Lys Leu Pro Lys Tyr Ser Leu Phe Glu Leu Glu Asn Gly Arg
1205 1210 1215
Lys Arg Met Leu Ala Ser Ala Gly Glu Leu Gln Lys Gly Asn Glu
1220 1225 1230
Leu Ala Leu Pro Ser Lys Tyr Val Asn Phe Leu Tyr Leu Ala Ser
1235 1240 1245
His Tyr Glu Lys Leu Lys Gly Ser Pro Glu Asp Asn Glu Gln Lys
1250 1255 1260
Gln Leu Phe Val Glu Gln His Lys His Tyr Leu Asp Glu Ile Ile
1265 1270 1275
Glu Gln Ile Ser Glu Phe Ser Lys Arg Val Ile Leu Ala Asp Ala
1280 1285 1290
Asn Leu Asp Lys Val Leu Ser Ala Tyr Asn Lys His Arg Asp Lys
1295 1300 1305
Pro Ile Arg Glu Gln Ala Glu Asn Ile Ile His Leu Phe Thr Leu
1310 1315 1320
Thr Asn Leu Gly Ala Pro Ala Ala Phe Lys Tyr Phe Asp Thr Thr
1325 1330 1335
Ile Asp Arg Lys Arg Tyr Thr Ser Thr Lys Glu Val Leu Asp Ala
1340 1345 1350
Thr Leu Ile His Gln Ser Ile Thr Gly Leu Tyr Glu Thr Arg Ile
1355 1360 1365
Asp Leu Ser Gln Leu Gly Gly Asp Ser Arg Ala Asp Pro Lys Lys
1370 1375 1380
Lys Arg Lys Val His His His His His His
1385 1390
<210> 243
<211> 1393
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 243
Met Ala Pro Lys Lys Lys Arg Lys Val Asp Lys Lys Tyr Ser Ile Gly
1 5 10 15
Leu Asp Ile Gly Thr Asn Ser Val Gly Trp Ala Val Ile Thr Asp Glu
20 25 30
Tyr Lys Val Pro Ser Lys Lys Phe Lys Val Leu Gly Asn Thr Asp Arg
35 40 45
His Ser Ile Lys Lys Asn Leu Ile Gly Ala Leu Leu Phe Asp Ser Gly
50 55 60
Glu Thr Ala Glu Ala Thr Arg Leu Lys Arg Thr Ala Arg Arg Arg Tyr
65 70 75 80
Thr Arg Arg Lys Asn Arg Ile Cys Tyr Leu Gln Glu Ile Phe Ser Asn
85 90 95
Glu Met Ala Lys Val Asp Asp Ser Phe Phe His Arg Leu Glu Glu Ser
100 105 110
Phe Leu Val Glu Glu Asp Lys Lys His Glu Arg His Pro Ile Phe Gly
115 120 125
Asn Ile Val Asp Glu Val Ala Tyr His Glu Lys Tyr Pro Thr Ile Tyr
130 135 140
His Leu Arg Lys Lys Leu Val Asp Ser Thr Asp Lys Ala Asp Leu Arg
145 150 155 160
Leu Ile Tyr Leu Ala Leu Ala His Met Ile Lys Phe Arg Gly His Phe
165 170 175
Leu Ile Glu Gly Asp Leu Asn Pro Asp Asn Ser Asp Val Asp Lys Leu
180 185 190
Phe Ile Gln Leu Val Gln Thr Tyr Asn Gln Leu Phe Glu Glu Asn Pro
195 200 205
Ile Asn Ala Ser Gly Val Asp Ala Lys Ala Ile Leu Ser Ala Arg Leu
210 215 220
Ser Lys Ser Arg Arg Leu Glu Asn Leu Ile Ala Gln Leu Pro Gly Glu
225 230 235 240
Lys Lys Asn Gly Leu Phe Gly Asn Leu Ile Ala Leu Ser Leu Gly Leu
245 250 255
Thr Pro Asn Phe Lys Ser Asn Phe Asp Leu Ala Glu Asp Ala Lys Leu
260 265 270
Gln Leu Ser Lys Asp Thr Tyr Asp Asp Asp Leu Asp Asn Leu Leu Ala
275 280 285
Gln Ile Gly Asp Gln Tyr Ala Asp Leu Phe Leu Ala Ala Lys Asn Leu
290 295 300
Ser Asp Ala Ile Leu Leu Ser Asp Ile Leu Arg Val Asn Thr Glu Ile
305 310 315 320
Thr Lys Ala Pro Leu Ser Ala Ser Met Ile Lys Arg Tyr Asp Glu His
325 330 335
His Gln Asp Leu Thr Leu Leu Lys Ala Leu Val Arg Gln Gln Leu Pro
340 345 350
Glu Lys Tyr Lys Glu Ile Phe Phe Asp Gln Ser Lys Asn Gly Tyr Ala
355 360 365
Gly Tyr Ile Asp Gly Gly Ala Ser Gln Glu Glu Phe Tyr Lys Phe Ile
370 375 380
Lys Pro Ile Leu Glu Lys Met Asp Gly Thr Glu Glu Leu Leu Val Lys
385 390 395 400
Leu Asn Arg Glu Asp Leu Leu Arg Lys Gln Arg Thr Phe Asp Asn Gly
405 410 415
Ser Ile Pro His Gln Ile His Leu Gly Glu Leu His Ala Ile Leu Arg
420 425 430
Arg Gln Glu Asp Phe Tyr Pro Phe Leu Lys Asp Asn Arg Glu Lys Ile
435 440 445
Glu Lys Ile Leu Thr Phe Arg Ile Pro Tyr Tyr Val Gly Pro Leu Ala
450 455 460
Arg Gly Asn Ser Arg Phe Ala Trp Met Thr Arg Lys Ser Glu Glu Thr
465 470 475 480
Ile Thr Pro Trp Asn Phe Glu Glu Val Val Asp Lys Gly Ala Ser Ala
485 490 495
Gln Ser Phe Ile Glu Arg Met Thr Ala Phe Asp Lys Asn Leu Pro Asn
500 505 510
Glu Lys Val Leu Pro Lys His Ser Leu Leu Tyr Glu Tyr Phe Thr Val
515 520 525
Tyr Asn Glu Leu Thr Lys Val Lys Tyr Val Thr Glu Gly Met Arg Lys
530 535 540
Pro Ala Phe Leu Ser Gly Glu Gln Lys Lys Ala Ile Val Asp Leu Leu
545 550 555 560
Phe Lys Thr Asn Arg Lys Val Thr Val Lys Gln Leu Lys Glu Asp Tyr
565 570 575
Phe Lys Lys Ile Glu Cys Phe Asp Ser Val Glu Ile Ser Gly Val Glu
580 585 590
Asp Arg Phe Asn Ala Ser Leu Gly Thr Tyr His Asp Leu Leu Lys Ile
595 600 605
Ile Lys Asp Lys Asp Phe Leu Asp Asn Glu Glu Asn Glu Asp Ile Leu
610 615 620
Glu Asp Ile Val Leu Thr Leu Thr Leu Phe Glu Asp Arg Glu Met Ile
625 630 635 640
Glu Glu Arg Leu Lys Thr Tyr Ala His Leu Phe Asp Asp Lys Val Met
645 650 655
Lys Gln Leu Lys Arg Arg Arg Tyr Thr Gly Trp Gly Ala Leu Ser Arg
660 665 670
Lys Leu Ile Asn Gly Ile Arg Asp Lys Gln Ser Gly Lys Thr Ile Leu
675 680 685
Asp Phe Leu Lys Ser Asp Gly Phe Ala Asn Arg Asn Phe Met Ala Leu
690 695 700
Ile His Asp Asp Ser Leu Thr Phe Lys Glu Asp Ile Gln Lys Ala Gln
705 710 715 720
Val Ser Gly Gln Gly Asp Ser Leu His Glu His Ile Ala Asn Leu Ala
725 730 735
Gly Ser Pro Ala Ile Lys Lys Gly Ile Leu Gln Thr Val Lys Val Val
740 745 750
Asp Glu Leu Val Lys Val Met Gly Arg His Lys Pro Glu Asn Ile Val
755 760 765
Ile Glu Met Ala Arg Glu Asn Gln Thr Thr Gln Lys Gly Gln Lys Asn
770 775 780
Ser Arg Glu Arg Met Lys Arg Ile Glu Glu Gly Ile Lys Glu Leu Gly
785 790 795 800
Ser Gln Ile Leu Lys Glu His Pro Val Glu Asn Thr Gln Leu Gln Asn
805 810 815
Glu Lys Leu Tyr Leu Tyr Tyr Leu Gln Asn Gly Arg Asp Met Tyr Val
820 825 830
Asp Gln Glu Leu Asp Ile Asn Arg Leu Ser Asp Tyr Asp Val Asp His
835 840 845
Ile Val Pro Gln Ser Phe Leu Lys Asp Asp Ser Ile Asp Asn Lys Val
850 855 860
Leu Thr Arg Ser Asp Lys Asn Arg Gly Lys Ser Asp Asn Val Pro Ser
865 870 875 880
Glu Glu Val Val Lys Lys Met Lys Asn Tyr Trp Arg Gln Leu Leu Asn
885 890 895
Ala Lys Leu Ile Thr Gln Arg Lys Phe Asp Asn Leu Thr Lys Ala Glu
900 905 910
Arg Gly Gly Leu Ser Glu Leu Asp Lys Ala Gly Phe Ile Lys Arg Gln
915 920 925
Leu Val Glu Thr Arg Ala Ile Thr Lys His Val Ala Gln Ile Leu Asp
930 935 940
Ser Arg Met Asn Thr Lys Tyr Asp Glu Asn Asp Lys Leu Ile Arg Glu
945 950 955 960
Val Lys Val Ile Thr Leu Lys Ser Lys Leu Val Ser Asp Phe Arg Lys
965 970 975
Asp Phe Gln Phe Tyr Lys Val Arg Glu Ile Asn Asn Tyr His His Ala
980 985 990
His Asp Ala Tyr Leu Asn Ala Val Val Gly Thr Ala Leu Ile Lys Lys
995 1000 1005
Tyr Pro Lys Leu Glu Ser Glu Phe Val Tyr Gly Asp Tyr Lys Val
1010 1015 1020
Tyr Asp Val Arg Lys Met Ile Ala Lys Ser Glu Gln Glu Ile Gly
1025 1030 1035
Lys Ala Thr Ala Lys Tyr Phe Phe Tyr Ser Asn Ile Met Asn Phe
1040 1045 1050
Phe Lys Thr Glu Ile Thr Leu Ala Asn Gly Glu Ile Arg Lys Arg
1055 1060 1065
Pro Leu Ile Glu Thr Asn Gly Glu Thr Gly Glu Ile Val Trp Asp
1070 1075 1080
Lys Gly Arg Asp Phe Ala Thr Val Arg Lys Val Leu Ser Met Pro
1085 1090 1095
Gln Val Asn Ile Val Lys Lys Thr Glu Val Gln Thr Gly Gly Phe
1100 1105 1110
Ser Lys Glu Ser Ile Leu Pro Lys Arg Asn Ser Asp Lys Leu Ile
1115 1120 1125
Ala Arg Lys Lys Asp Trp Asp Pro Lys Lys Tyr Gly Gly Phe Asp
1130 1135 1140
Ser Pro Thr Val Ala Tyr Ser Val Leu Val Val Ala Lys Val Glu
1145 1150 1155
Lys Gly Lys Ser Lys Lys Leu Lys Ser Val Lys Glu Leu Leu Gly
1160 1165 1170
Ile Thr Ile Met Glu Arg Ser Ser Phe Glu Lys Asn Pro Ile Asp
1175 1180 1185
Phe Leu Glu Ala Lys Gly Tyr Lys Glu Val Lys Lys Asp Leu Ile
1190 1195 1200
Ile Lys Leu Pro Lys Tyr Ser Leu Phe Glu Leu Glu Asn Gly Arg
1205 1210 1215
Lys Arg Met Leu Ala Ser Ala Gly Glu Leu Gln Lys Gly Asn Glu
1220 1225 1230
Leu Ala Leu Pro Ser Lys Tyr Val Asn Phe Leu Tyr Leu Ala Ser
1235 1240 1245
His Tyr Glu Lys Leu Lys Gly Ser Pro Glu Asp Asn Glu Gln Lys
1250 1255 1260
Gln Leu Phe Val Glu Gln His Lys His Tyr Leu Asp Glu Ile Ile
1265 1270 1275
Glu Gln Ile Ser Glu Phe Ser Lys Arg Val Ile Leu Ala Asp Ala
1280 1285 1290
Asn Leu Asp Lys Val Leu Ser Ala Tyr Asn Lys His Arg Asp Lys
1295 1300 1305
Pro Ile Arg Glu Gln Ala Glu Asn Ile Ile His Leu Phe Thr Leu
1310 1315 1320
Thr Asn Leu Gly Ala Pro Ala Ala Phe Lys Tyr Phe Asp Thr Thr
1325 1330 1335
Ile Asp Arg Lys Arg Tyr Thr Ser Thr Lys Glu Val Leu Asp Ala
1340 1345 1350
Thr Leu Ile His Gln Ser Ile Thr Gly Leu Tyr Glu Thr Arg Ile
1355 1360 1365
Asp Leu Ser Gln Leu Gly Gly Asp Ser Arg Ala Asp Pro Lys Lys
1370 1375 1380
Lys Arg Lys Val His His His His His His
1385 1390
<210> 244
<211> 1386
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 244
Met Ala Pro Lys Lys Lys Arg Lys Val Asp Lys Lys Tyr Ser Ile Gly
1 5 10 15
Leu Asp Ile Gly Thr Asn Ser Val Gly Trp Ala Val Ile Thr Asp Glu
20 25 30
Tyr Lys Val Pro Ser Lys Lys Phe Lys Val Leu Gly Asn Thr Asp Arg
35 40 45
His Ser Ile Lys Lys Asn Leu Ile Gly Ala Leu Leu Phe Asp Ser Gly
50 55 60
Glu Thr Ala Glu Ala Thr Arg Leu Lys Arg Thr Ala Arg Arg Arg Tyr
65 70 75 80
Thr Arg Arg Lys Asn Arg Ile Leu Tyr Leu Gln Glu Ile Phe Ser Asn
85 90 95
Glu Met Ala Lys Val Asp Asp Ser Phe Phe His Arg Leu Glu Glu Ser
100 105 110
Phe Leu Val Glu Glu Asp Lys Lys His Glu Arg His Pro Ile Phe Gly
115 120 125
Asn Ile Val Asp Glu Val Ala Tyr His Glu Lys Tyr Pro Thr Ile Tyr
130 135 140
His Leu Arg Lys Lys Leu Val Asp Ser Thr Asp Lys Ala Asp Leu Arg
145 150 155 160
Leu Ile Tyr Leu Ala Leu Ala His Met Ile Lys Phe Arg Gly His Phe
165 170 175
Leu Ile Glu Gly Asp Leu Asn Pro Asp Asn Ser Asp Val Asp Lys Leu
180 185 190
Phe Ile Gln Leu Val Gln Thr Tyr Asn Gln Leu Phe Glu Glu Asn Pro
195 200 205
Ile Asn Ala Ser Gly Val Asp Ala Lys Ala Ile Leu Ser Ala Arg Leu
210 215 220
Ser Lys Ser Arg Arg Leu Glu Asn Leu Ile Ala Gln Leu Pro Gly Glu
225 230 235 240
Lys Lys Asn Gly Leu Phe Gly Asn Leu Ile Ala Leu Ser Leu Gly Leu
245 250 255
Thr Pro Asn Phe Lys Ser Asn Phe Asp Leu Ala Glu Asp Ala Lys Leu
260 265 270
Gln Leu Ser Lys Asp Thr Tyr Asp Asp Asp Leu Asp Asn Leu Leu Ala
275 280 285
Gln Ile Gly Asp Gln Tyr Ala Asp Leu Phe Leu Ala Ala Lys Asn Leu
290 295 300
Ser Asp Ala Ile Leu Leu Ser Asp Ile Leu Arg Val Asn Thr Glu Ile
305 310 315 320
Thr Lys Ala Pro Leu Ser Ala Ser Met Ile Lys Arg Tyr Asp Glu His
325 330 335
His Gln Asp Leu Thr Leu Leu Lys Ala Leu Val Arg Gln Gln Leu Pro
340 345 350
Glu Lys Tyr Lys Glu Ile Phe Phe Asp Gln Ser Lys Asn Gly Tyr Ala
355 360 365
Gly Tyr Ile Asp Gly Gly Ala Ser Gln Glu Glu Phe Tyr Lys Phe Ile
370 375 380
Lys Pro Ile Leu Glu Lys Met Asp Gly Thr Glu Glu Leu Leu Val Lys
385 390 395 400
Leu Asn Arg Glu Asp Leu Leu Arg Lys Gln Arg Thr Phe Asp Asn Gly
405 410 415
Ser Ile Pro His Gln Ile His Leu Gly Glu Leu His Ala Ile Leu Arg
420 425 430
Arg Gln Glu Asp Phe Tyr Pro Phe Leu Lys Asp Asn Arg Glu Lys Ile
435 440 445
Glu Lys Ile Leu Thr Phe Arg Ile Pro Tyr Tyr Val Gly Pro Leu Ala
450 455 460
Arg Gly Asn Ser Arg Phe Ala Trp Met Thr Arg Lys Ser Glu Glu Thr
465 470 475 480
Ile Thr Pro Trp Asn Phe Glu Glu Val Val Asp Lys Gly Ala Ser Ala
485 490 495
Gln Ser Phe Ile Glu Arg Met Thr Asn Phe Asp Lys Asn Leu Pro Asn
500 505 510
Glu Lys Val Leu Pro Lys His Ser Leu Leu Tyr Glu Tyr Phe Thr Val
515 520 525
Tyr Asn Glu Leu Thr Lys Val Lys Tyr Val Thr Glu Gly Met Arg Lys
530 535 540
Pro Ala Phe Leu Ser Gly Glu Gln Lys Lys Ala Ile Val Asp Leu Leu
545 550 555 560
Phe Lys Thr Asn Arg Lys Val Thr Val Lys Gln Leu Lys Glu Asp Tyr
565 570 575
Phe Lys Lys Ile Glu Glu Phe Asp Ser Val Glu Ile Ser Gly Val Glu
580 585 590
Asp Arg Phe Asn Ala Ser Leu Gly Thr Tyr His Asp Leu Leu Lys Ile
595 600 605
Ile Lys Asp Lys Asp Phe Leu Asp Asn Glu Glu Asn Glu Asp Ile Leu
610 615 620
Glu Asp Ile Val Leu Thr Leu Thr Leu Phe Glu Asp Arg Glu Met Ile
625 630 635 640
Glu Glu Arg Leu Lys Thr Tyr Ala His Leu Phe Asp Asp Lys Val Met
645 650 655
Lys Gln Leu Lys Arg Arg Arg Tyr Thr Gly Trp Gly Arg Leu Ser Arg
660 665 670
Lys Leu Ile Asn Gly Ile Arg Asp Lys Gln Ser Gly Lys Thr Ile Leu
675 680 685
Asp Phe Leu Lys Ser Asp Gly Phe Ala Asn Arg Asn Phe Met Gln Leu
690 695 700
Ile His Asp Asp Ser Leu Thr Phe Lys Glu Asp Ile Gln Lys Ala Gln
705 710 715 720
Val Ser Gly Gln Gly Asp Ser Leu His Glu His Ile Ala Asn Leu Ala
725 730 735
Gly Ser Pro Ala Ile Lys Lys Gly Ile Leu Gln Thr Val Lys Val Val
740 745 750
Asp Glu Leu Val Lys Val Met Gly Arg His Lys Pro Glu Asn Ile Val
755 760 765
Ile Glu Met Ala Arg Glu Asn Gln Thr Thr Gln Lys Gly Gln Lys Asn
770 775 780
Ser Arg Glu Arg Met Lys Arg Ile Glu Glu Gly Ile Lys Glu Leu Gly
785 790 795 800
Ser Gln Ile Leu Lys Glu His Pro Val Glu Asn Thr Gln Leu Gln Asn
805 810 815
Glu Lys Leu Tyr Leu Tyr Tyr Leu Gln Asn Gly Arg Asp Met Tyr Val
820 825 830
Asp Gln Glu Leu Asp Ile Asn Arg Leu Ser Asp Tyr Asp Val Asp His
835 840 845
Ile Val Pro Gln Ser Phe Leu Lys Asp Asp Ser Ile Asp Asn Lys Val
850 855 860
Leu Thr Arg Ser Asp Lys Asn Arg Gly Lys Ser Asp Asn Val Pro Ser
865 870 875 880
Glu Glu Val Val Lys Lys Met Lys Asn Tyr Trp Arg Gln Leu Leu Asn
885 890 895
Ala Lys Leu Ile Thr Gln Arg Lys Phe Asp Asn Leu Thr Lys Ala Glu
900 905 910
Arg Gly Gly Leu Ser Glu Leu Asp Lys Ala Gly Phe Ile Lys Arg Gln
915 920 925
Leu Val Glu Thr Arg Gln Ile Thr Lys His Val Ala Gln Ile Leu Asp
930 935 940
Ser Arg Met Asn Thr Lys Tyr Asp Glu Asn Asp Lys Leu Ile Arg Glu
945 950 955 960
Val Lys Val Ile Thr Leu Lys Ser Lys Leu Val Ser Asp Phe Arg Lys
965 970 975
Asp Phe Gln Phe Tyr Lys Val Arg Glu Ile Asn Asn Tyr His His Ala
980 985 990
His Asp Ala Tyr Leu Asn Ala Val Val Gly Thr Ala Leu Ile Lys Lys
995 1000 1005
Tyr Pro Lys Leu Glu Ser Glu Phe Val Tyr Gly Asp Tyr Lys Val
1010 1015 1020
Tyr Asp Val Arg Lys Met Ile Ala Lys Ser Glu Gln Glu Ile Gly
1025 1030 1035
Lys Ala Thr Ala Lys Tyr Phe Phe Tyr Ser Asn Ile Met Asn Phe
1040 1045 1050
Phe Lys Thr Glu Ile Thr Leu Ala Asn Gly Glu Ile Arg Lys Arg
1055 1060 1065
Pro Leu Ile Glu Thr Asn Gly Glu Thr Gly Glu Ile Val Trp Asp
1070 1075 1080
Lys Gly Arg Asp Phe Ala Thr Val Arg Lys Val Leu Ser Met Pro
1085 1090 1095
Gln Val Asn Ile Val Lys Lys Thr Glu Val Gln Thr Gly Gly Phe
1100 1105 1110
Ser Lys Glu Ser Ile Leu Pro Lys Arg Asn Ser Asp Lys Leu Ile
1115 1120 1125
Ala Arg Lys Lys Asp Trp Asp Pro Lys Lys Tyr Gly Gly Phe Asp
1130 1135 1140
Ser Pro Thr Val Ala Tyr Ser Val Leu Val Val Ala Lys Val Glu
1145 1150 1155
Lys Gly Lys Ser Lys Lys Leu Lys Ser Val Lys Glu Leu Leu Gly
1160 1165 1170
Ile Thr Ile Met Glu Arg Ser Ser Phe Glu Lys Asn Pro Ile Asp
1175 1180 1185
Phe Leu Glu Ala Lys Gly Tyr Lys Glu Val Lys Lys Asp Leu Ile
1190 1195 1200
Ile Lys Leu Pro Lys Tyr Ser Leu Phe Glu Leu Glu Asn Gly Arg
1205 1210 1215
Lys Arg Met Leu Ala Ser Ala Gly Glu Leu Gln Lys Gly Asn Glu
1220 1225 1230
Leu Ala Leu Pro Ser Lys Tyr Val Asn Phe Leu Tyr Leu Ala Ser
1235 1240 1245
His Tyr Glu Lys Leu Lys Gly Ser Pro Glu Asp Asn Glu Gln Lys
1250 1255 1260
Gln Leu Phe Val Glu Gln His Lys His Tyr Leu Asp Glu Ile Ile
1265 1270 1275
Glu Gln Ile Ser Glu Phe Ser Lys Arg Val Ile Leu Ala Asp Ala
1280 1285 1290
Asn Leu Asp Lys Val Leu Ser Ala Tyr Asn Lys His Arg Asp Lys
1295 1300 1305
Pro Ile Arg Glu Gln Ala Glu Asn Ile Ile His Leu Phe Thr Leu
1310 1315 1320
Thr Asn Leu Gly Ala Pro Ala Ala Phe Lys Tyr Phe Asp Thr Thr
1325 1330 1335
Ile Asp Arg Lys Arg Tyr Thr Ser Thr Lys Glu Val Leu Asp Ala
1340 1345 1350
Thr Leu Ile His Gln Ser Ile Thr Gly Leu Tyr Glu Thr Arg Ile
1355 1360 1365
Asp Leu Ser Gln Leu Gly Gly Asp Ser Arg Ala Asp His His His
1370 1375 1380
His His His
1385
<210> 245
<211> 835
<212> БЕЛОК
<213> Homo sapiens
<400> 245
Met Ser Arg Arg Lys Gln Gly Lys Pro Gln His Leu Ser Lys Arg Glu
1 5 10 15
Phe Ser Pro Glu Pro Leu Glu Ala Ile Leu Thr Asp Asp Glu Pro Asp
20 25 30
His Gly Pro Leu Gly Ala Pro Glu Gly Asp His Asp Leu Leu Thr Cys
35 40 45
Gly Gln Cys Gln Met Asn Phe Pro Leu Gly Asp Ile Leu Ile Phe Ile
50 55 60
Glu His Lys Arg Lys Gln Cys Asn Gly Ser Leu Cys Leu Glu Lys Ala
65 70 75 80
Val Asp Lys Pro Pro Ser Pro Ser Pro Ile Glu Met Lys Lys Ala Ser
85 90 95
Asn Pro Val Glu Val Gly Ile Gln Val Thr Pro Glu Asp Asp Asp Cys
100 105 110
Leu Ser Thr Ser Ser Arg Gly Ile Cys Pro Lys Gln Glu His Ile Ala
115 120 125
Asp Lys Leu Leu His Trp Arg Gly Leu Ser Ser Pro Arg Ser Ala His
130 135 140
Gly Ala Leu Ile Pro Thr Pro Gly Met Ser Ala Glu Tyr Ala Pro Gln
145 150 155 160
Gly Ile Cys Lys Asp Glu Pro Ser Ser Tyr Thr Cys Thr Thr Cys Lys
165 170 175
Gln Pro Phe Thr Ser Ala Trp Phe Leu Leu Gln His Ala Gln Asn Thr
180 185 190
His Gly Leu Arg Ile Tyr Leu Glu Ser Glu His Gly Ser Pro Leu Thr
195 200 205
Pro Arg Val Gly Ile Pro Ser Gly Leu Gly Ala Glu Cys Pro Ser Gln
210 215 220
Pro Pro Leu His Gly Ile His Ile Ala Asp Asn Asn Pro Phe Asn Leu
225 230 235 240
Leu Arg Ile Pro Gly Ser Val Ser Arg Glu Ala Ser Gly Leu Ala Glu
245 250 255
Gly Arg Phe Pro Pro Thr Pro Pro Leu Phe Ser Pro Pro Pro Arg His
260 265 270
His Leu Asp Pro His Arg Ile Glu Arg Leu Gly Ala Glu Glu Met Ala
275 280 285
Leu Ala Thr His His Pro Ser Ala Phe Asp Arg Val Leu Arg Leu Asn
290 295 300
Pro Met Ala Met Glu Pro Pro Ala Met Asp Phe Ser Arg Arg Leu Arg
305 310 315 320
Glu Leu Ala Gly Asn Thr Ser Ser Pro Pro Leu Ser Pro Gly Arg Pro
325 330 335
Ser Pro Met Gln Arg Leu Leu Gln Pro Phe Gln Pro Gly Ser Lys Pro
340 345 350
Pro Phe Leu Ala Thr Pro Pro Leu Pro Pro Leu Gln Ser Ala Pro Pro
355 360 365
Pro Ser Gln Pro Pro Val Lys Ser Lys Ser Cys Glu Phe Cys Gly Lys
370 375 380
Thr Phe Lys Phe Gln Ser Asn Leu Val Val His Arg Arg Ser His Thr
385 390 395 400
Gly Glu Lys Pro Tyr Lys Cys Asn Leu Cys Asp His Ala Cys Thr Gln
405 410 415
Ala Ser Lys Leu Lys Arg His Met Lys Thr His Met His Lys Ser Ser
420 425 430
Pro Met Thr Val Lys Ser Asp Asp Gly Leu Ser Thr Ala Ser Ser Pro
435 440 445
Glu Pro Gly Thr Ser Asp Leu Val Gly Ser Ala Ser Ser Ala Leu Lys
450 455 460
Ser Val Val Ala Lys Phe Lys Ser Glu Asn Asp Pro Asn Leu Ile Pro
465 470 475 480
Glu Asn Gly Asp Glu Glu Glu Glu Glu Asp Asp Glu Glu Glu Glu Glu
485 490 495
Glu Glu Glu Glu Glu Glu Glu Glu Leu Thr Glu Ser Glu Arg Val Asp
500 505 510
Tyr Gly Phe Gly Leu Ser Leu Glu Ala Ala Arg His His Glu Asn Ser
515 520 525
Ser Arg Gly Ala Val Val Gly Val Gly Asp Glu Ser Arg Ala Leu Pro
530 535 540
Asp Val Met Gln Gly Met Val Leu Ser Ser Met Gln His Phe Ser Glu
545 550 555 560
Ala Phe His Gln Val Leu Gly Glu Lys His Lys Arg Gly His Leu Ala
565 570 575
Glu Ala Glu Gly His Arg Asp Thr Cys Asp Glu Asp Ser Val Ala Gly
580 585 590
Glu Ser Asp Arg Ile Asp Asp Gly Thr Val Asn Gly Arg Gly Cys Ser
595 600 605
Pro Gly Glu Ser Ala Ser Gly Gly Leu Ser Lys Lys Leu Leu Leu Gly
610 615 620
Ser Pro Ser Ser Leu Ser Pro Phe Ser Lys Arg Ile Lys Leu Glu Lys
625 630 635 640
Glu Phe Asp Leu Pro Pro Ala Ala Met Pro Asn Thr Glu Asn Val Tyr
645 650 655
Ser Gln Trp Leu Ala Gly Tyr Ala Ala Ser Arg Gln Leu Lys Asp Pro
660 665 670
Phe Leu Ser Phe Gly Asp Ser Arg Gln Ser Pro Phe Ala Ser Ser Ser
675 680 685
Glu His Ser Ser Glu Asn Gly Ser Leu Arg Phe Ser Thr Pro Pro Gly
690 695 700
Glu Leu Asp Gly Gly Ile Ser Gly Arg Ser Gly Thr Gly Ser Gly Gly
705 710 715 720
Ser Thr Pro His Ile Ser Gly Pro Gly Pro Gly Arg Pro Ser Ser Lys
725 730 735
Glu Gly Arg Arg Ser Asp Thr Cys Glu Tyr Cys Gly Lys Val Phe Lys
740 745 750
Asn Cys Ser Asn Leu Thr Val His Arg Arg Ser His Thr Gly Glu Arg
755 760 765
Pro Tyr Lys Cys Glu Leu Cys Asn Tyr Ala Cys Ala Gln Ser Ser Lys
770 775 780
Leu Thr Arg His Met Lys Thr His Gly Gln Val Gly Lys Asp Val Tyr
785 790 795 800
Lys Cys Glu Ile Cys Lys Met Pro Phe Ser Val Tyr Ser Thr Leu Glu
805 810 815
Lys His Met Lys Lys Trp His Ser Asp Arg Val Leu Asn Asn Asp Ile
820 825 830
Lys Thr Glu
835
<210> 246
<211> 74
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 246
aacagcauag caaguuaaaa uaaggcuagu ccguuaucaa cuugaaaaag uggcaccgag 60
ucggugcuuu uuuu 74
<210> 247
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетическая
6xHis метка"
<400> 247
His His His His His His
1 5
<210> 248
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетическая
8xHis метка"
<400> 248
His His His His His His His His
1 5
<210> 249
<211> 10
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<220>
<221> MISC_FEATURE
<222> (1)..(10)
<223> /примечание="Эта последовательность может охватывать 1-10 нуклеотидов"
<400> 249
uuuuuuuuuu 10
<210> 250
<211> 10
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<220>
<221> MISC_FEATURE
<222> (1)..(10)
<223> /примечание="Эта последовательность может охватывать 1-10 нуклеотидов"
<400> 250
aaaaaaaaaa 10
<210> 251
<211> 36
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестное или другое
<400> 251
nnnnnnnnnn nnnnnnnnnn guuuuagagc uaugcu 36
<210> 252
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестное или другое
<400> 252
nnnnnnnnnn nnnnnnnnnn guuuuagagc uaugcuguuu ug 42
<210> 253
<211> 42
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестное или другое
<400> 253
nnnnnnnnnn nnnnnnnnnn guuuuagagc uaugcuguuu ug 42
<210> 254
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестное или другое
<400> 254
nnnnnnnnnn nnnnnnnnnn guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 255
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестное или другое
<400> 255
nnnnnnnnnn nnnnnnnnnn guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 256
<211> 100
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> модифицированное_основание
<222> (1)..(20)
<223> a, c, u, g, неизвестное или другое
<400> 256
nnnnnnnnnn nnnnnnnnnn guuuuagagc uagaaauagc aaguuaaaau aaggcuaguc 60
cguuaucaac uugaaaaagu ggcaccgagu cggugcuuuu 100
<210> 257
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 257
tgctgagatg aaacaggcgt 20
<210> 258
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 258
ttaggcatcc acaagggctg 20
<210> 259
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 259
gctctacaaa tggaacccaa cc 22
<210> 260
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 260
ctgctctgat ctctaacacc tca 23
<210> 261
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 261
gaagatacag cttgcctccg a 21
<210> 262
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 262
ttgctgagat gaaacaggcg t 21
<210> 263
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 263
acggataagt agatattgag gtaagc 26
<210> 264
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 264
gtctctttca gttagcagtg g 21
<210> 265
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
зонд"
<400> 265
actgcgctga aactgtggct ttatag 26
<210> 266
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 266
ccctttagct agttttcttc 20
<210> 267
<211> 16
<212> ДНК
<213> Homo sapiens
<400> 267
ggacttcttt tgtcag 16
<210> 268
<211> 15
<212> ДНК
<213> Homo sapiens
<400> 268
ttagctagtt tcctt 15
<210> 269
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 269
ccctttagct agttttcttc 20
<210> 270
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 270
acggataagt agatattgag gtaagc 26
<210> 271
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 271
gtctctttca gttagcagtg g 21
<210> 272
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
зонд"
<400> 272
actgcgctga aactgtggct ttatag 26
<210> 273
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 273
acggataagt agatattgag gtaagc 26
<210> 274
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 274
gtctctttca gttagcagtg g 21
<210> 275
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
зонд"
<400> 275
actgcgctga aactgtggct ttatag 26
<210> 276
<211> 20
<212> РНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
олигонуклеотид"
<400> 276
ggccacggag cgagacaucu 20
<210> 277
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 277
cagacagcaa actcacccag t 21
<210> 278
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 278
ctgacgctta tcgacgccct 20
<210> 279
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 279
tcgtcggcag cgtcagatgt gtataagaga cag 33
<210> 280
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 280
gtctcgtggg ctcggagatg tgtataagag acag 34
<210> 281
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<220>
<221> модифицированное_основание
<222> (30)..(37)
<223> a, c, t, g, неизвестное или другое
<400> 281
aatgatacgg cgaccaccga gatctacacn nnnnnnntcg tcggcagcgt c 51
<210> 282
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<220>
<221> модифицированное_основание
<222> (25)..(32)
<223> a, c, t, g, неизвестное или другое
<400> 282
caagcagaag acggcatacg agatnnnnnn nngtctcgtg ggctcgg 47
<210> 283
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 283
caagcagaag acggcatacg a 21
<210> 284
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 284
aatgatacgg cgaccaccga ga 22
<210> 285
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 285
acggataagt agatattgag gtaagc 26
<210> 286
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
праймер"
<400> 286
gtctctttca gttagcagtg g 21
<210> 287
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
зонд"
<400> 287
actgcgctga aactgtggct ttatag 26
<210> 288
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 288
agtcctggta tcttctatgg tgg 23
<210> 289
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 289
attcccagta tcctctatga tgg 23
<210> 290
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 290
ggagaagaaa actagctaaa ggg 23
<210> 291
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 291
gggagaagaa aactagctaa agg 23
<210> 292
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 292
ggagaaggaa actagctaaa ggg 23
<210> 293
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 293
ggagaaggaa actagctaaa 20
<210> 294
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 294
actgaatcgg aacaaggcaa 20
<210> 295
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 295
gggagaagga aactagctaa 20
<210> 296
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 296
aaaaactgga atgactgaat 20
<210> 297
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 297
agagacaaga aggtaaaaaa 20
<210> 298
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 298
agtcctggta tcctctatga 20
<210> 299
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 299
cactggagct agagacaaga 20
<210> 300
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 300
acggctgaca aaagaagtcc 20
<210> 301
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 301
gggagaagaa aactagctaa 20
<210> 302
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 302
aaaaattgga atgactgaat 20
<210> 303
<211> 492
<212> ДНК
<213> Homo sapiens
<400> 303
tggtacatgc tttagcttta aactacaggc ctcactggag ctagagacaa gaaggtaaaa 60
aacggctgac aaaagaagtc ctggtatcct ctatgatggg agaaggaaac tagctaaagg 120
gaagaataaa ttagagaaaa actggaatga ctgaatcgga acaaggcaaa ggctataaaa 180
aaaattagca gtatcctctt gggggcccct tccccacact atctcaatgc aaatatctgt 240
ctgaaacggt ccctggctaa actccaccca tgggttggcc agccttgcct tgaccaatag 300
ccttgacaag gcaaacttga ccaatagtct tagagtatcc agtgaggcca ggggccggcg 360
gctggctagg gatgaagaat aaaaggaagc acccttcagc agttccacac actcgcttct 420
ggaacgtctg aggttatcaa taagctccta gtccagacgc catgggtcat ttcacagagg 480
aggacaaggc ta 492
<210> 304
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 304
gtttccttct cccatcatag 20
<210> 305
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 305
cctggctaaa ctccacccat 20
<210> 306
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 306
cttgaccaat agccttgaca 20
<210> 307
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 307
ggctagggat gaagaataaa 20
<210> 308
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<400> 308
Met Gly His Phe Thr Glu Glu Asp Lys Ala
1 5 10
<210> 309
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 309
ggcaaggctg gccaacccat 20
<210> 310
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 310
cttgtcaagg ctattggtca 20
<210> 311
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 311
caaggctatt ggtcaaggca 20
<210> 312
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 312
tggtcaagtt tgccttgtca 20
<210> 313
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 313
ggagaaggaa actagctaaa 20
<210> 314
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 314
gggagaagga aactagctaa 20
<210> 315
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 315
actgaatcgg aacaaggcaa 20
<210> 316
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 316
gtcctggtat cttctatggt 20
<210> 317
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 317
agtcctggta tcttctatgg 20
<210> 318
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 318
ggagaagaaa actagctaaa 20
<210> 319
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 319
aaaaactgga atgactgaat 20
<210> 320
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 320
cactggagct agagacaaga 20
<210> 321
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 321
acggctgaca aaagaagtcc 20
<210> 322
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 322
gggagaagaa aactagctaa 20
<210> 323
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 323
aaaaattgga atgactgaat 20
<210> 324
<211> 500
<212> ДНК
<213> Homo sapiens
<400> 324
acaatccctg aacttttcaa aaattggtac atgctttaac tttaaactac aggcctcact 60
ggagctacag acaagaaggt gaaaaacggc tgacaaaaga agtcctggta tcttctatgg 120
tgggagaaga aaactagcta aagggaagaa taaattagag aaaaattgga atgactgaat 180
cggaacaagg caaaggctat aaaaaaaatt aagcagcagt atcctcttgg gggccccttc 240
cccacactat ctcaatgcaa atatctgtct gaaacggtcc ctggctaaac tccacccatg 300
ggttggccag ccttgccttg accaatagcc ttgacaaggc aaacttgacc aatagtctta 360
gagtatccag tgaggccagg ggccggcggc tggctaggga tgaagaataa aaggaagcac 420
ccttcagcag ttccacacac tcgcttctgg aacgtctgag gttatcaata agctcctagt 480
ccagacgcca tgggtcattt 500
<210> 325
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 325
cctggctaaa ctccacccat 20
<210> 326
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 326
cttgaccaat agccttgaca 20
<210> 327
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 327
ggctagggat gaagaataaa 20
<210> 328
<211> 4
<212> БЕЛОК
<213> Homo sapiens
<400> 328
Met Gly His Phe
1
<210> 329
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 329
ggcaaggctg gccaacccat 20
<210> 330
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 330
cttgtcaagg ctattggtca 20
<210> 331
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 331
caaggctatt ggtcaaggca 20
<210> 332
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 332
tggtcaagtt tgccttgtca 20
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| HPV-СПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2018 |
|
RU2804664C2 |
| Конструкции для направленного редактирования генов и способы с их применением | 2020 |
|
RU2832109C2 |
| Средство разрезания ДНК на основе Cas9 белка из бактерии Capnocytophaga ochracea | 2021 |
|
RU2778156C1 |
| СПОСОБЫ ПОЛУЧЕНИЯ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ РЕКОМБИНАНТНЫЙ РЕЦЕПТОР, И РОДСТВЕННЫЕ КОМПОЗИЦИИ | 2019 |
|
RU2835579C2 |
| СРЕДСТВО РАЗРЕЗАНИЯ ДНК НА ОСНОВЕ CAS9 БЕЛКА ИЗ БАКТЕРИИ DEMEQUINA SEDIMINICOLA | 2019 |
|
RU2722933C1 |
| ЛИНИЯ КЛЕТОК, СОДЕРЖАЩАЯ НОВЫЙ МАРКЕР ОТБОРА, И ЕЕ ПРИМЕНЕНИЕ ДЛЯ ПРОДУЦИРОВАНИЯ БЕЛКОВ | 2020 |
|
RU2820830C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИММУНООНКОЛОГИИ | 2016 |
|
RU2771624C2 |
| CD19-СПЕЦИФИЧЕСКИЙ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР И ЕГО ПРИМЕНЕНИЯ | 2014 |
|
RU2727447C2 |
| ПРИМЕНЕНИЕ CAS9 БЕЛКА ИЗ БАКТЕРИИ PASTEURELLA PNEUMOTROPICA ДЛЯ МОДИФИКАЦИИ ГЕНОМНОЙ ДНК В КЛЕТКАХ | 2019 |
|
RU2724470C1 |
| НОВЫЕ ФЕРМЕНТЫ И СИСТЕМЫ CRISPR | 2016 |
|
RU2737537C2 |
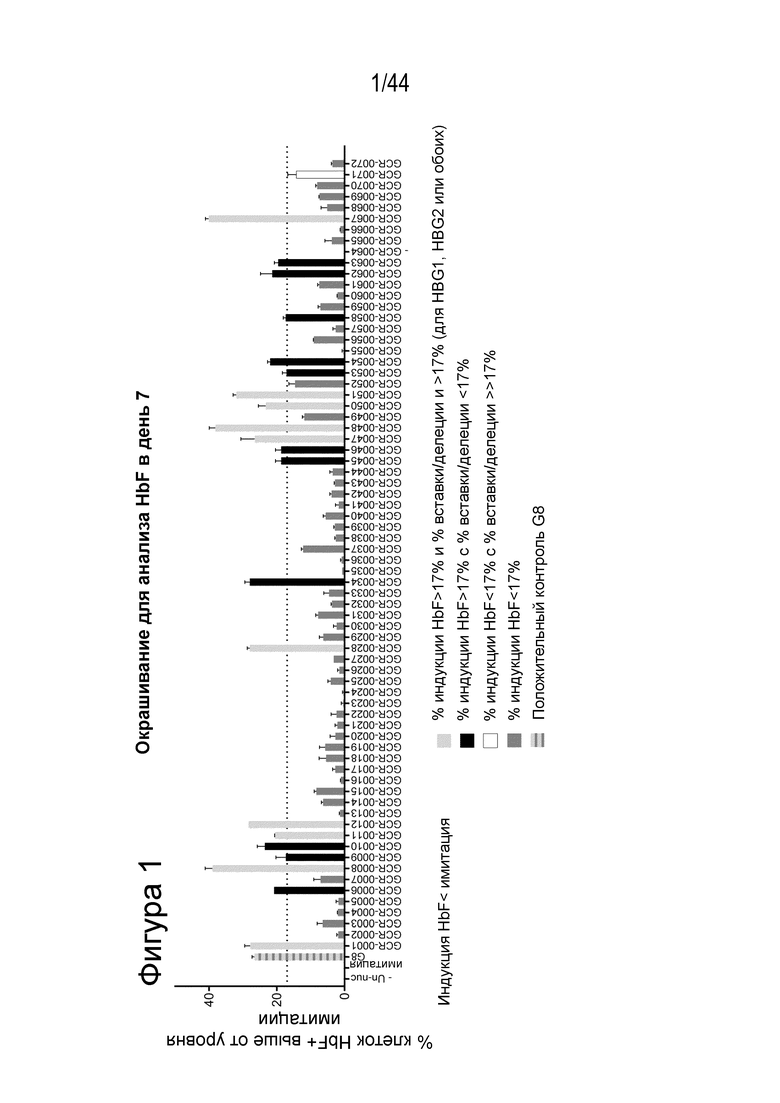

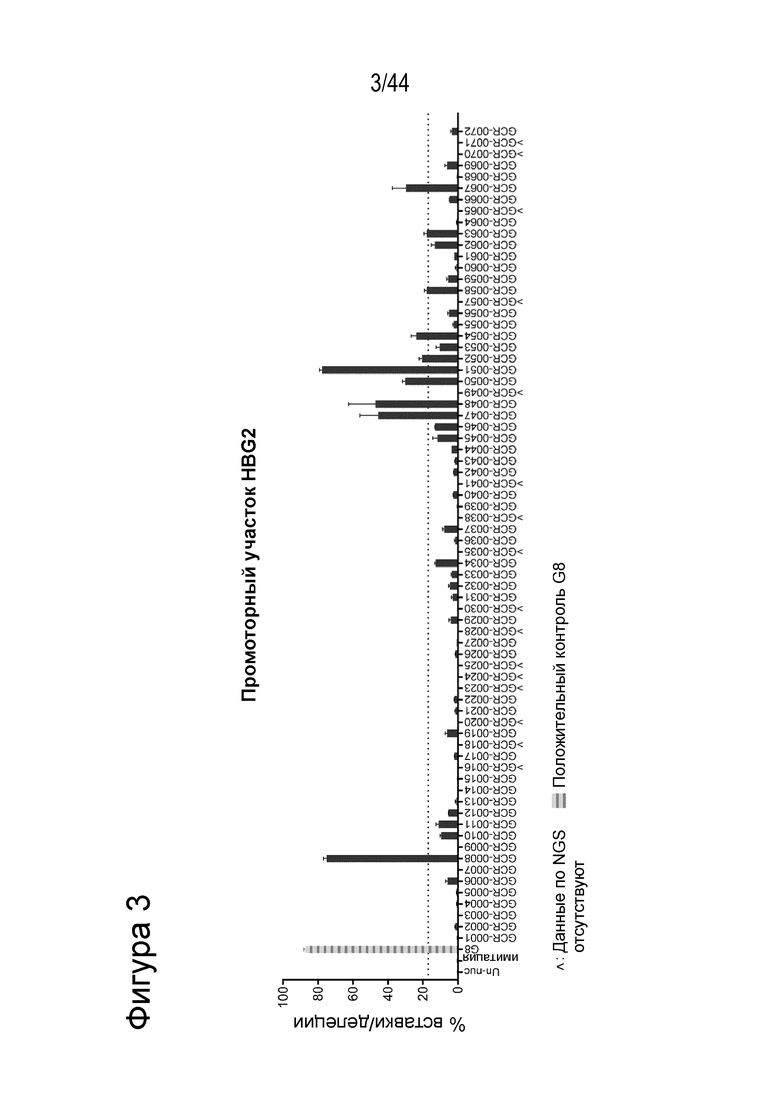
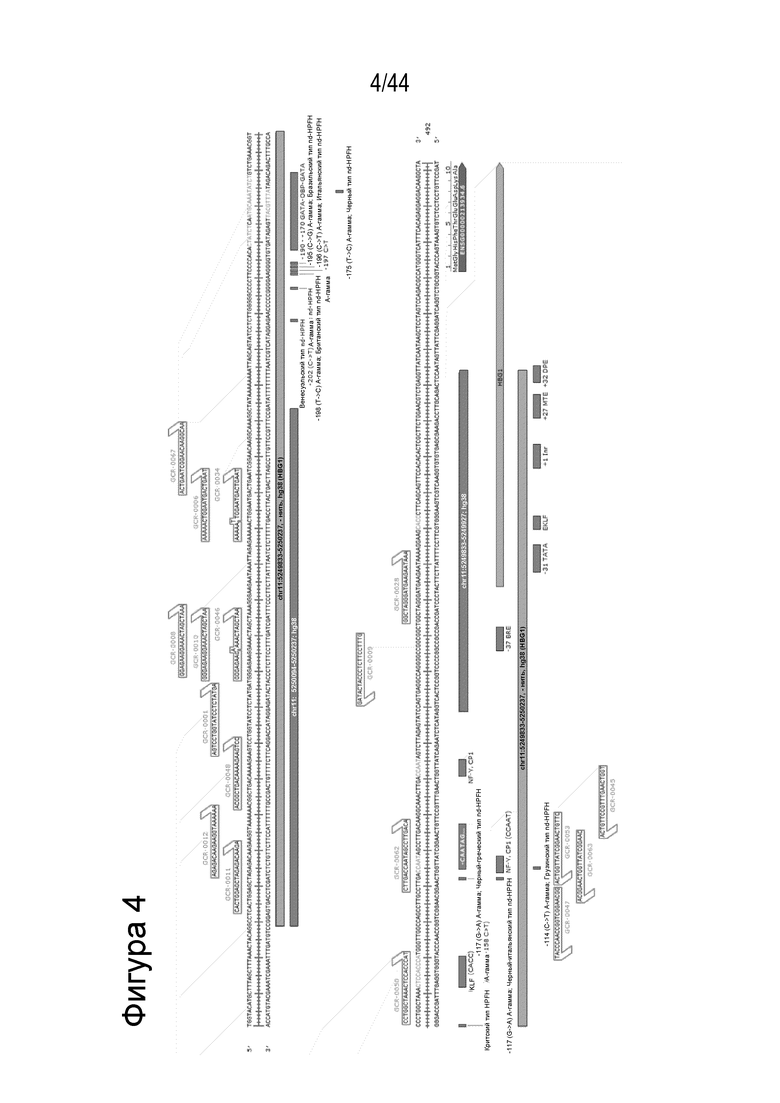
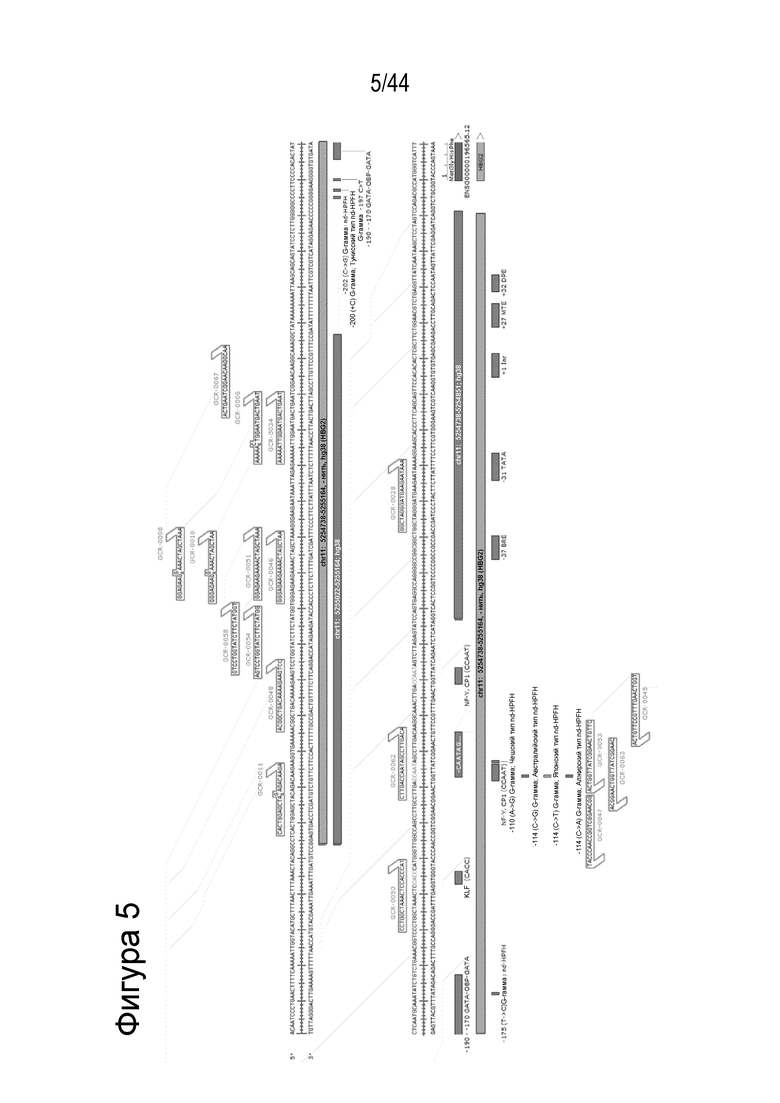
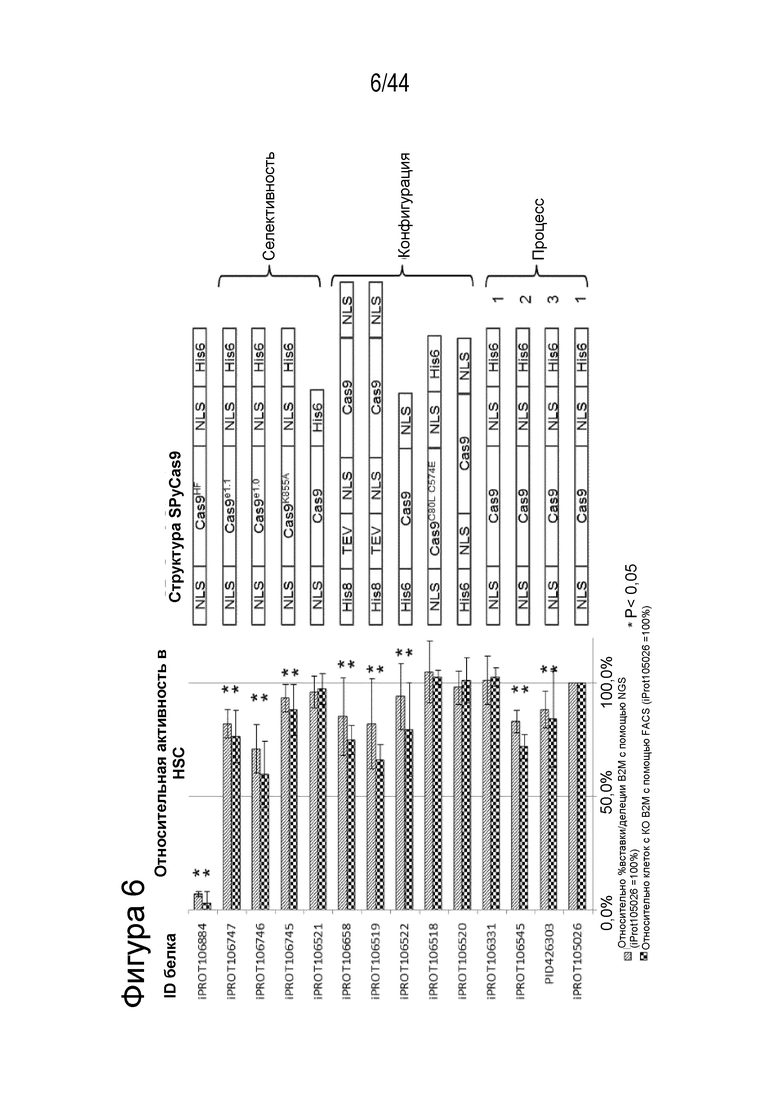
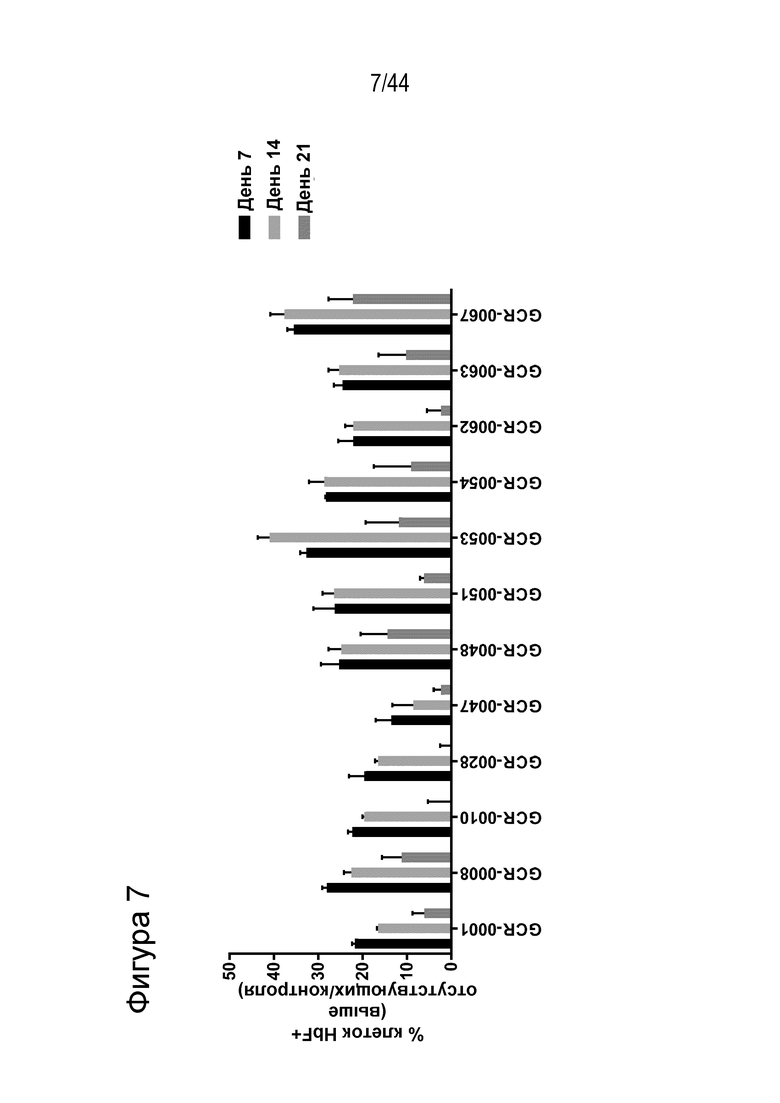
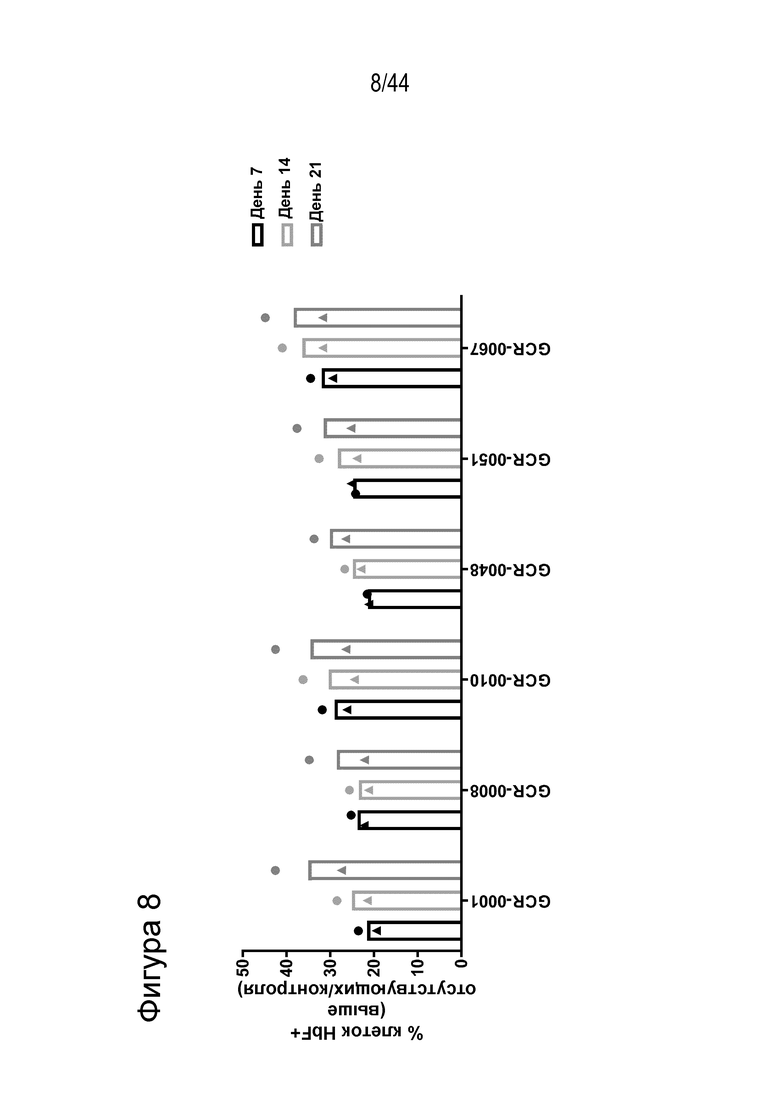
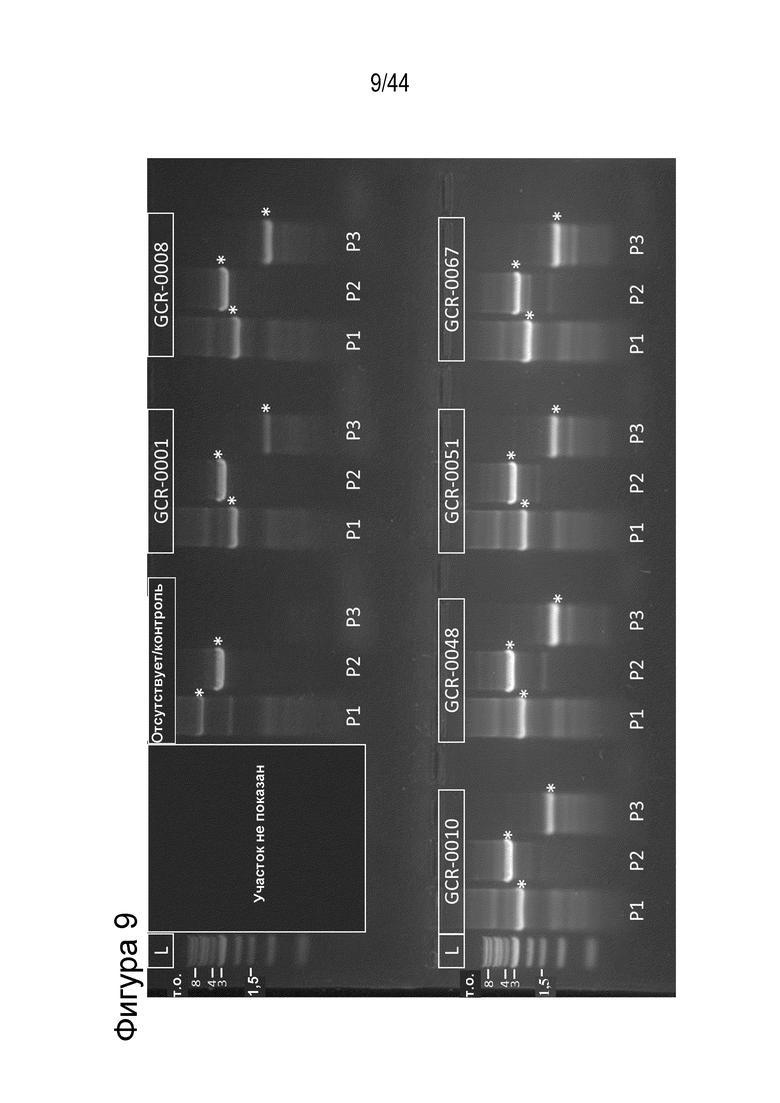
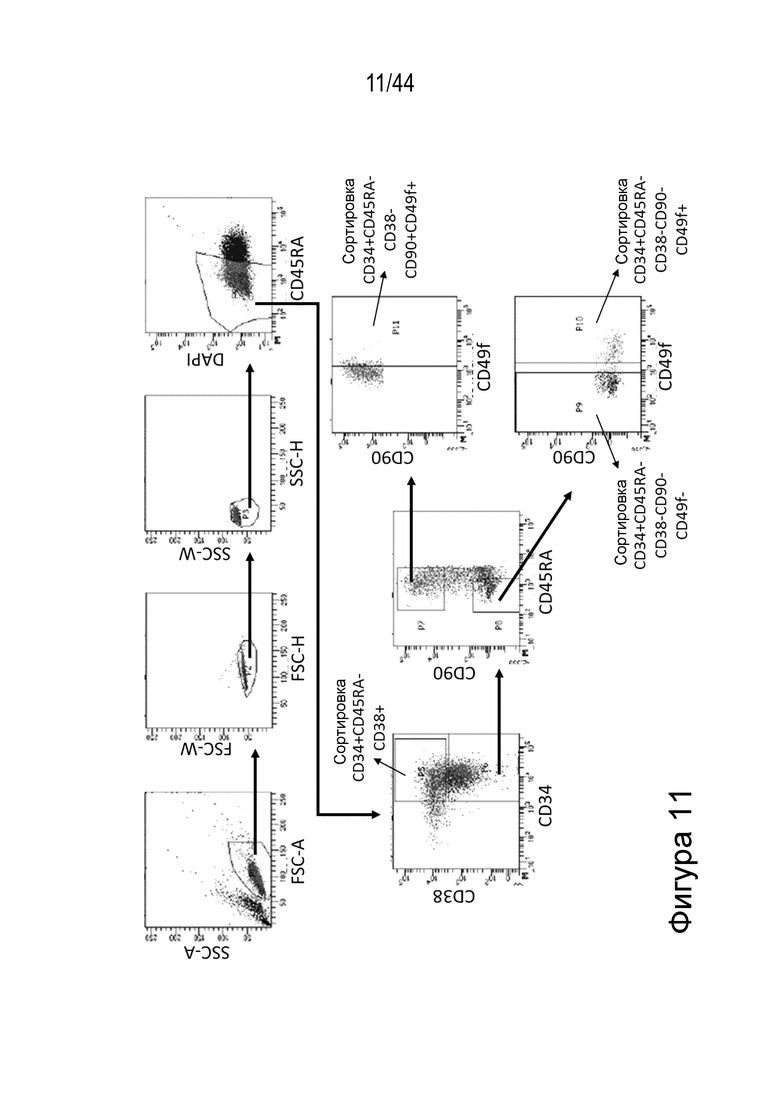


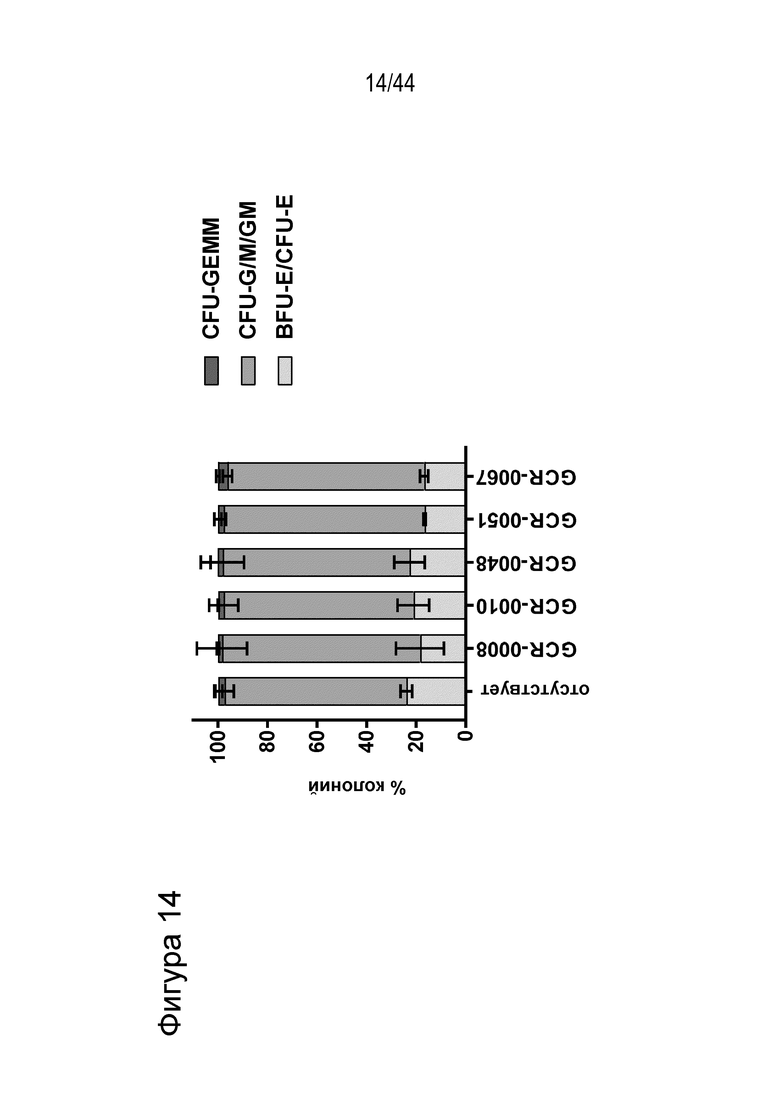
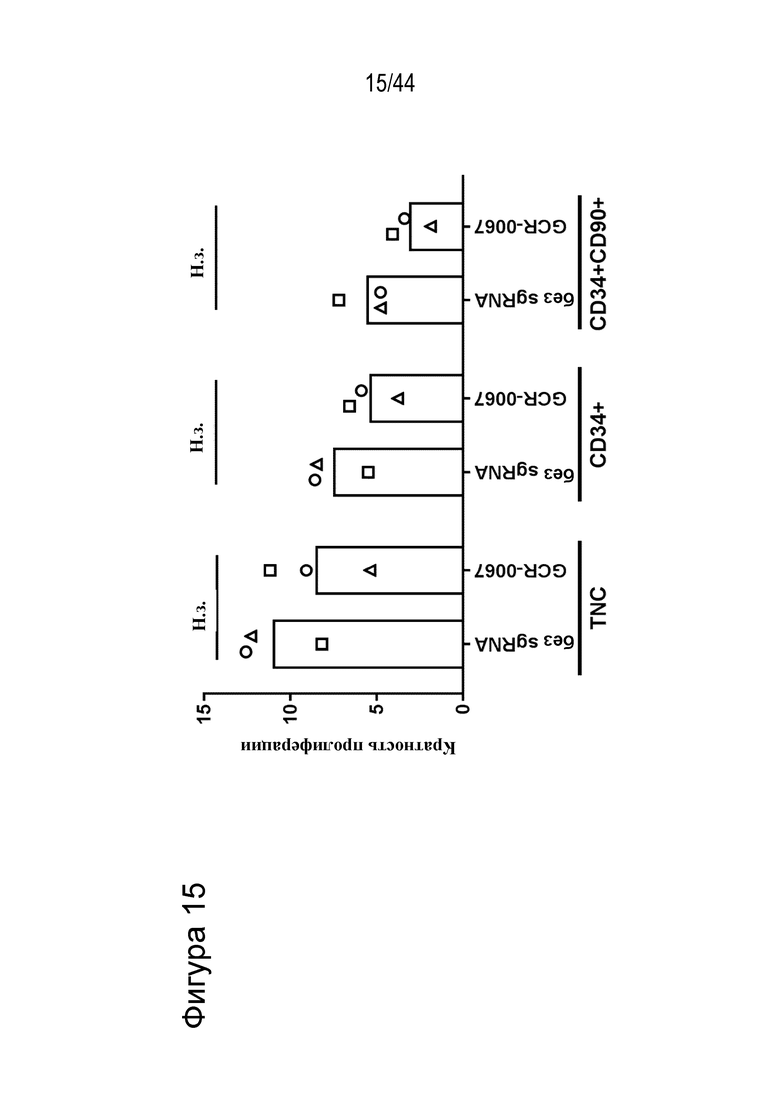

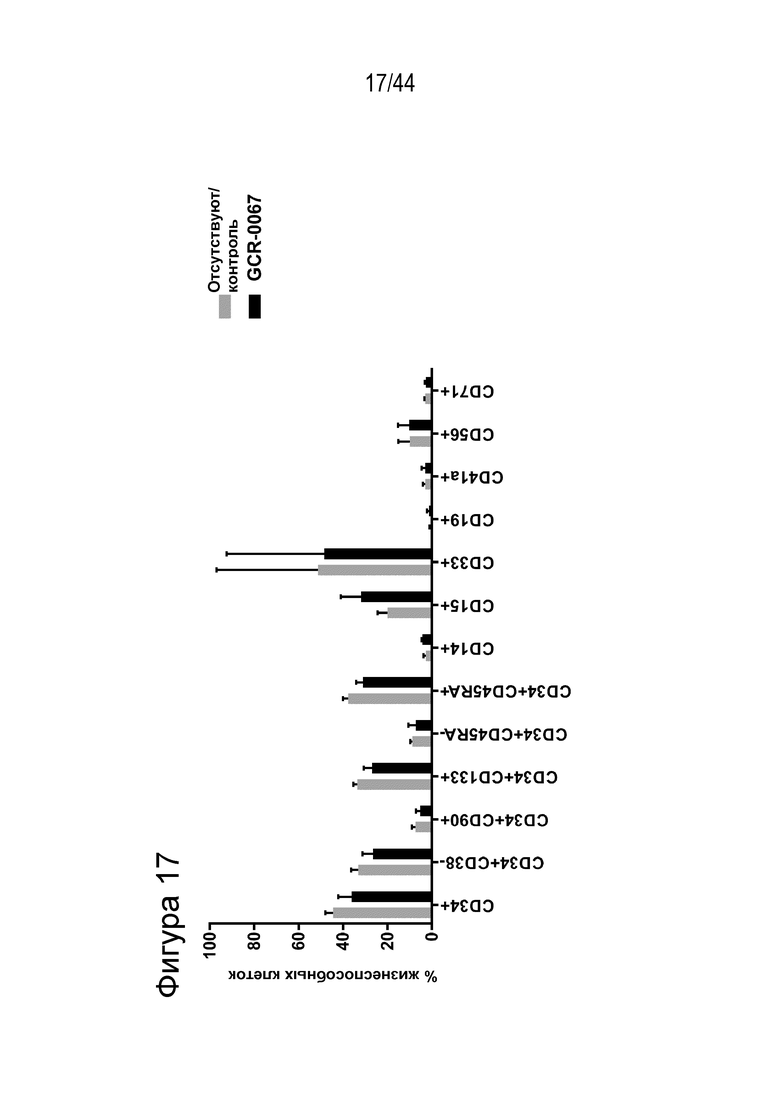
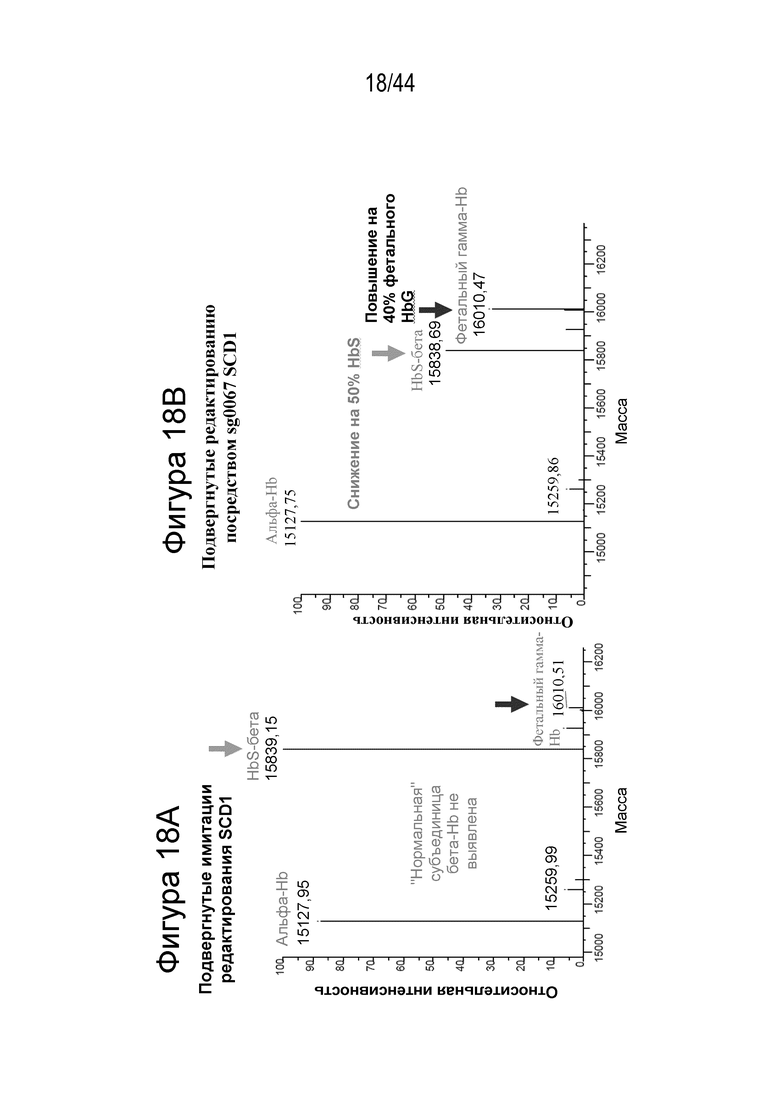
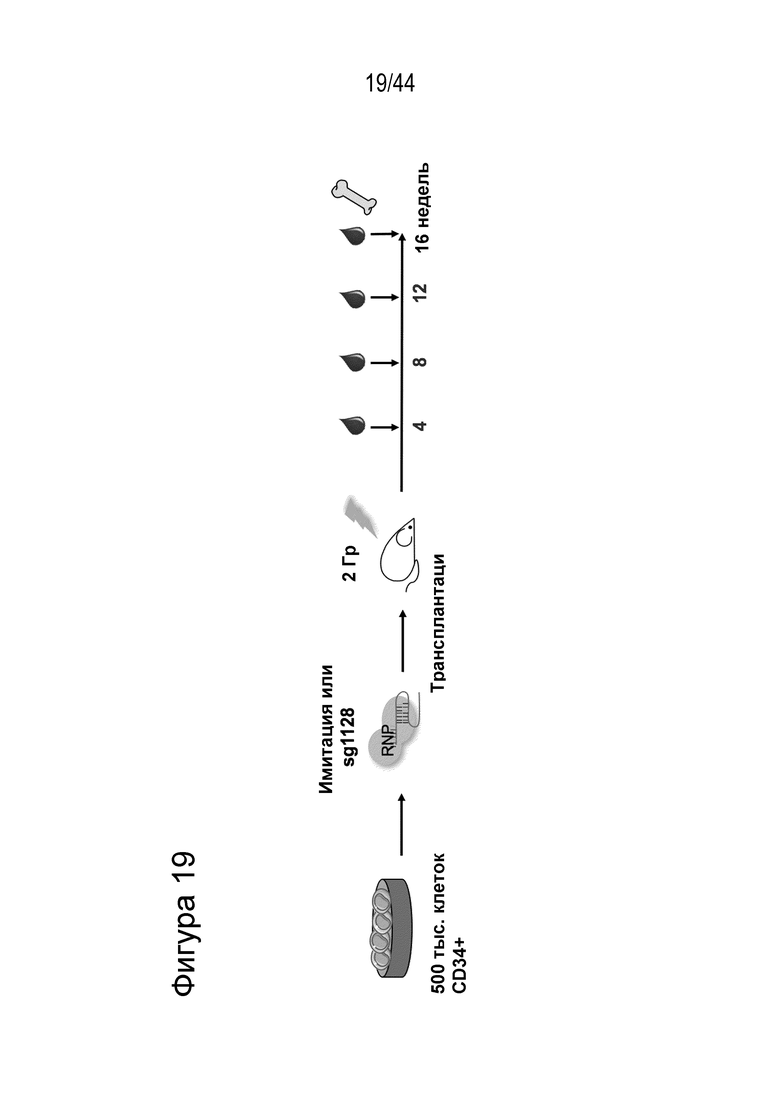
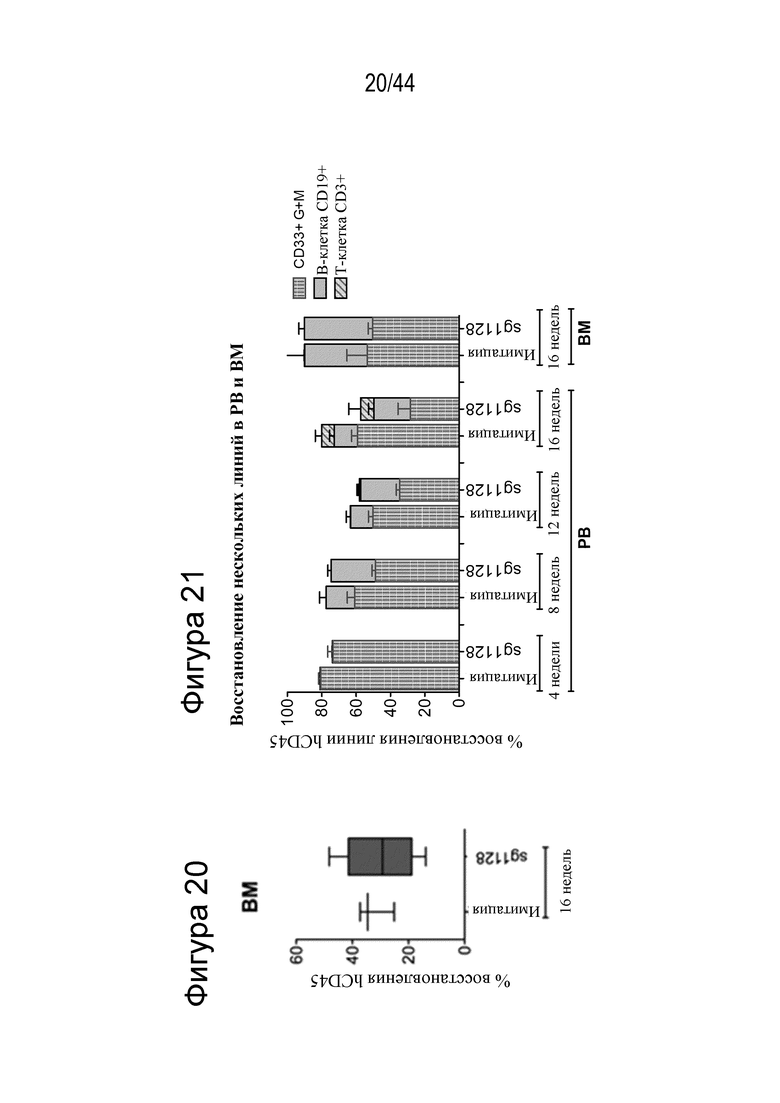
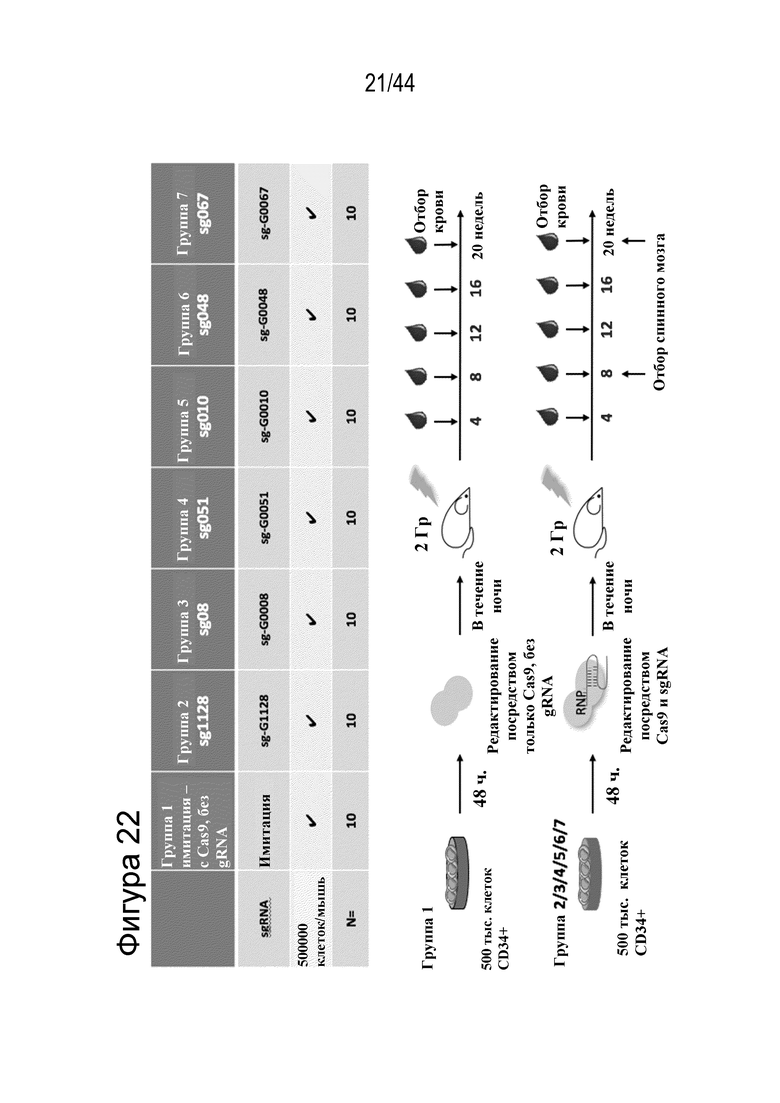
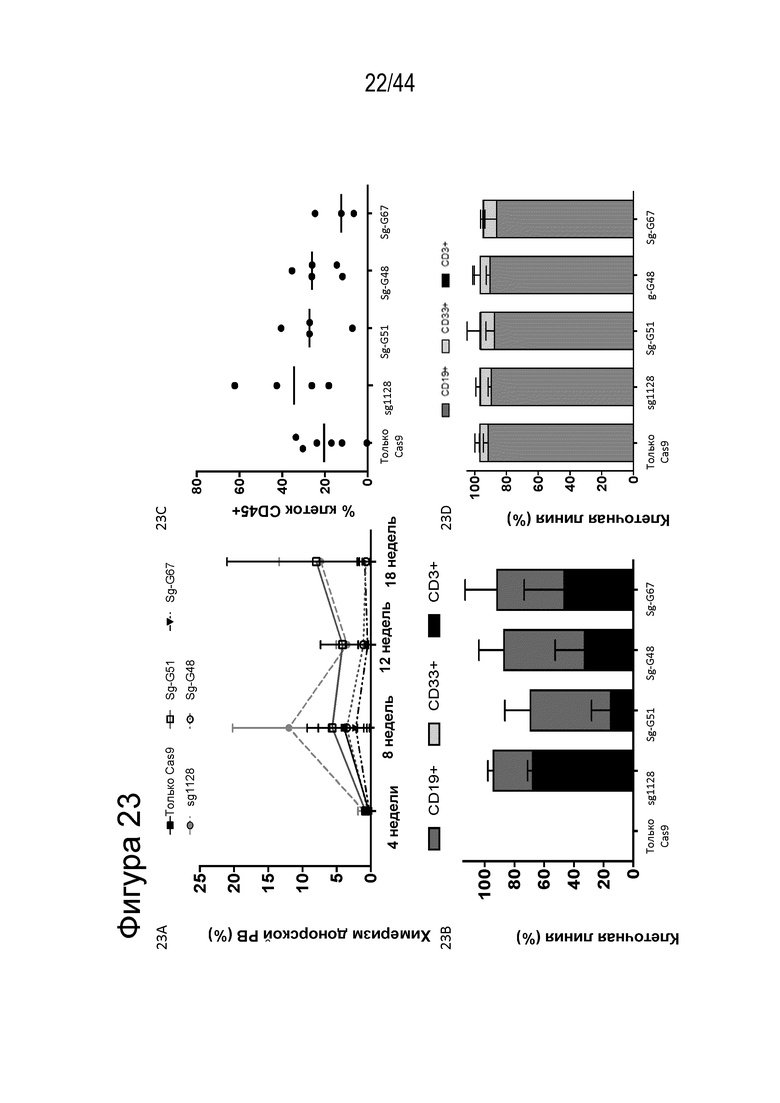
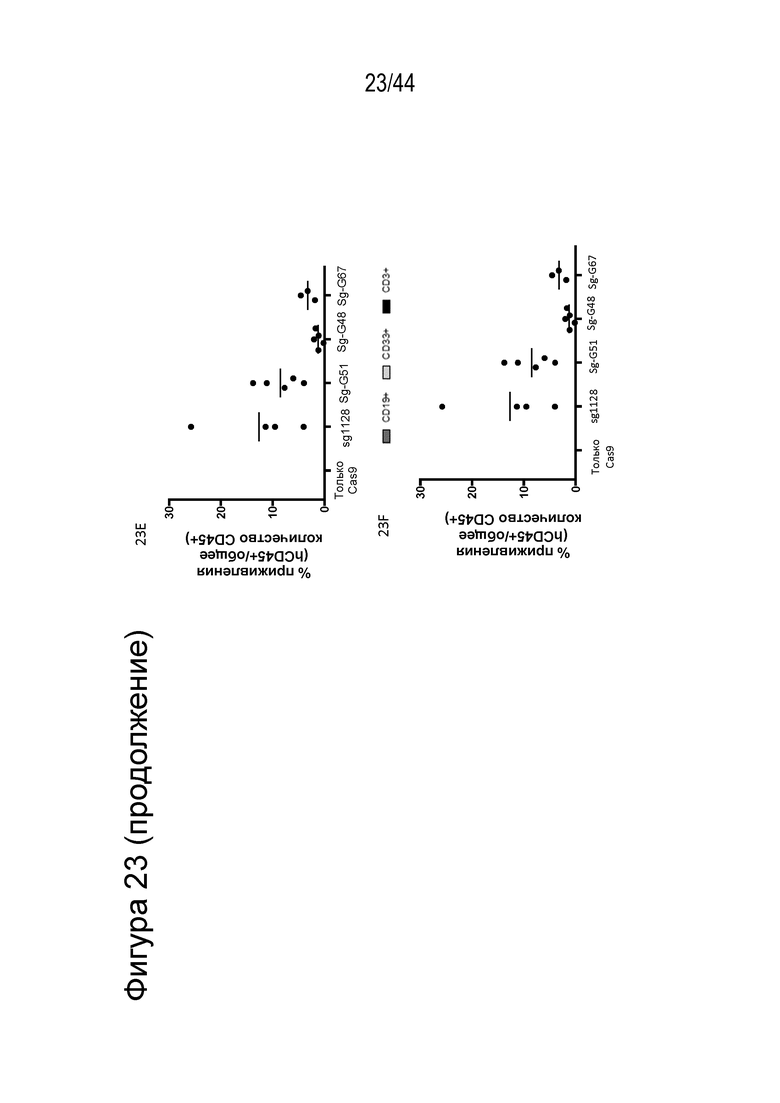
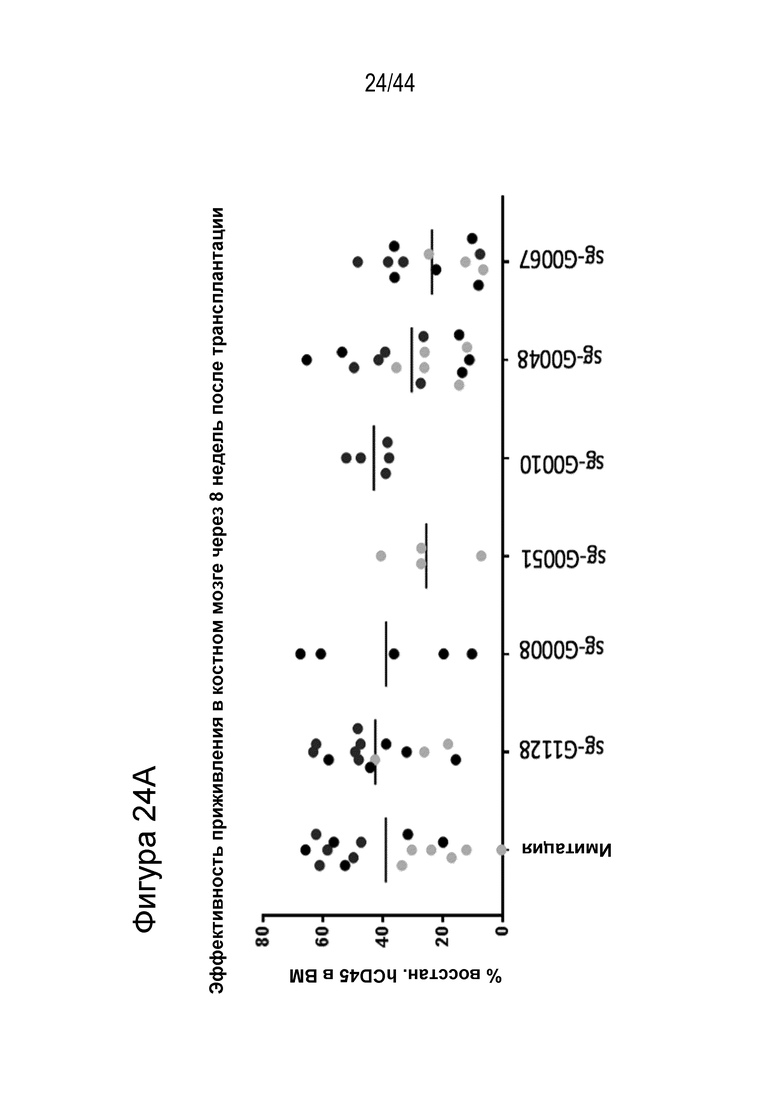
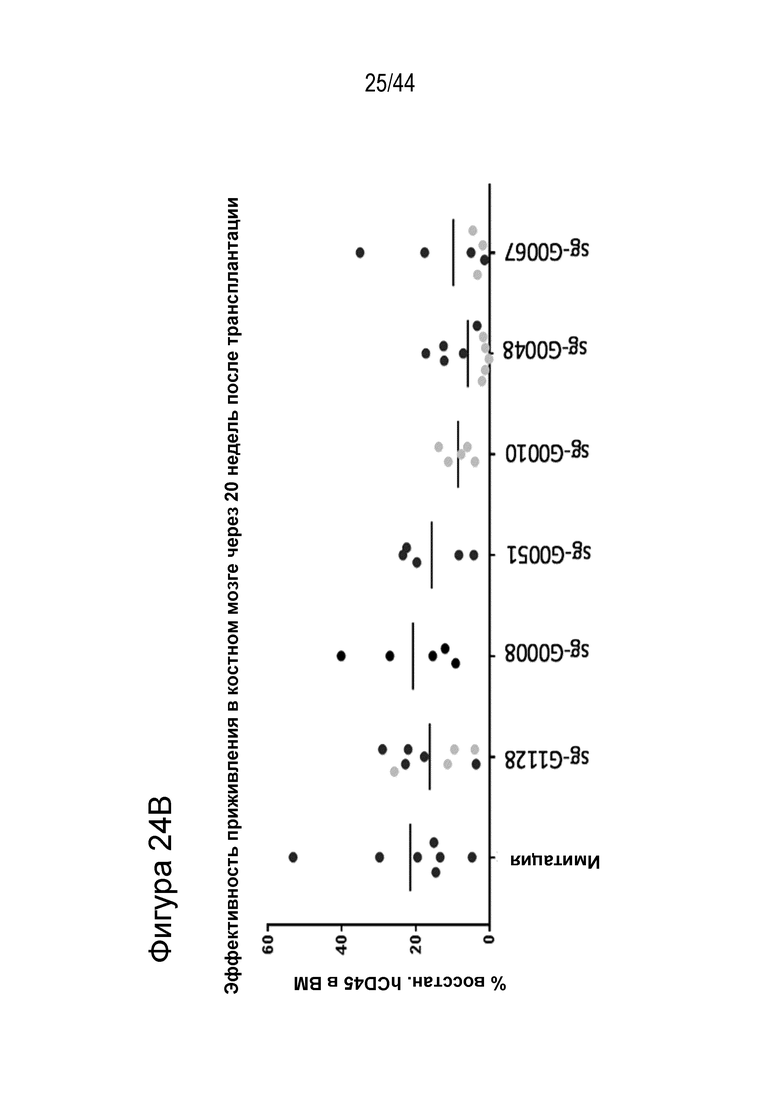
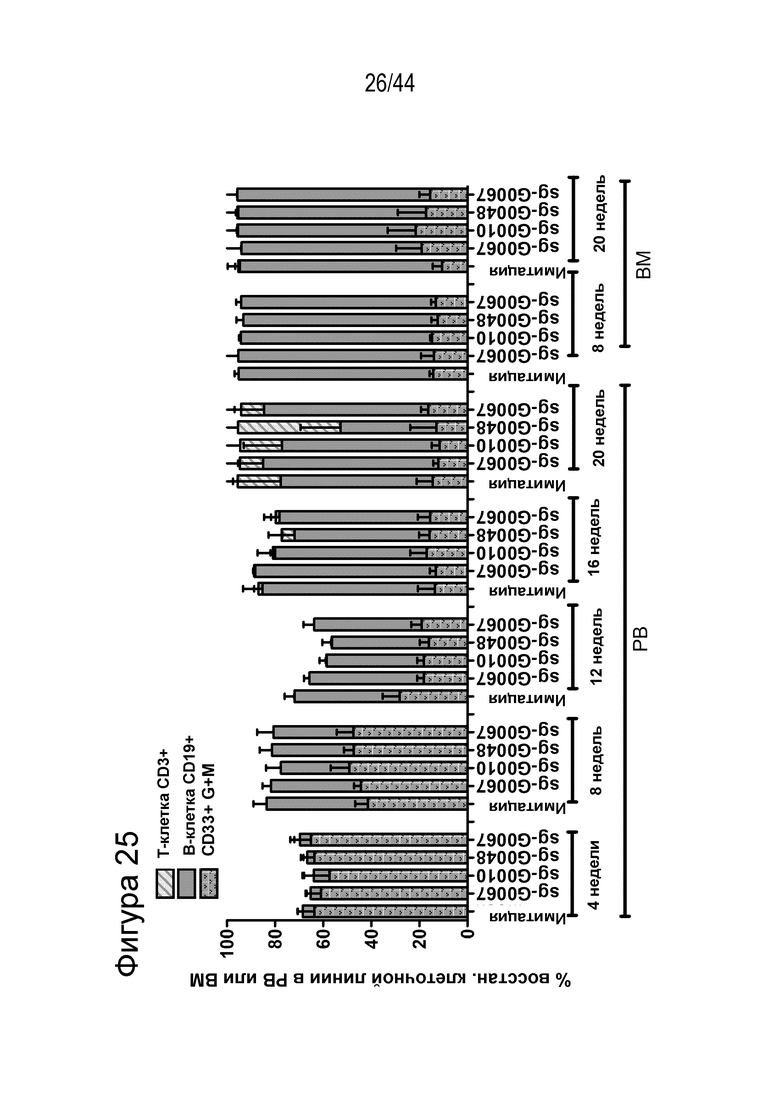
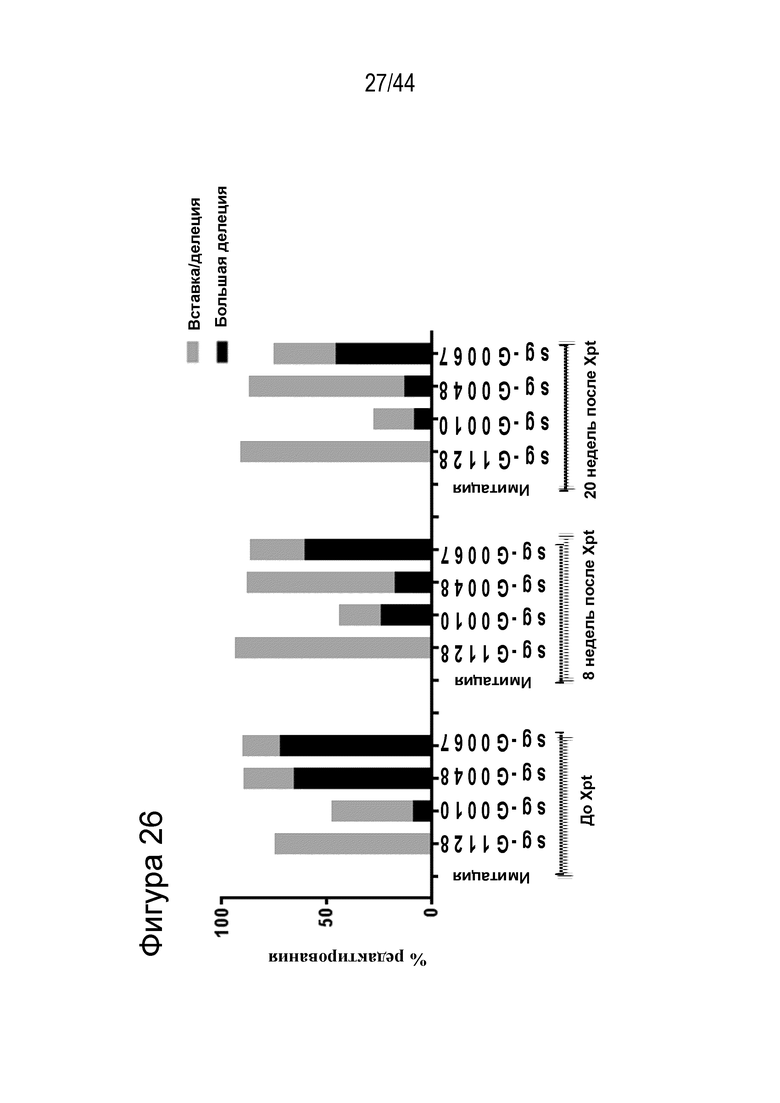
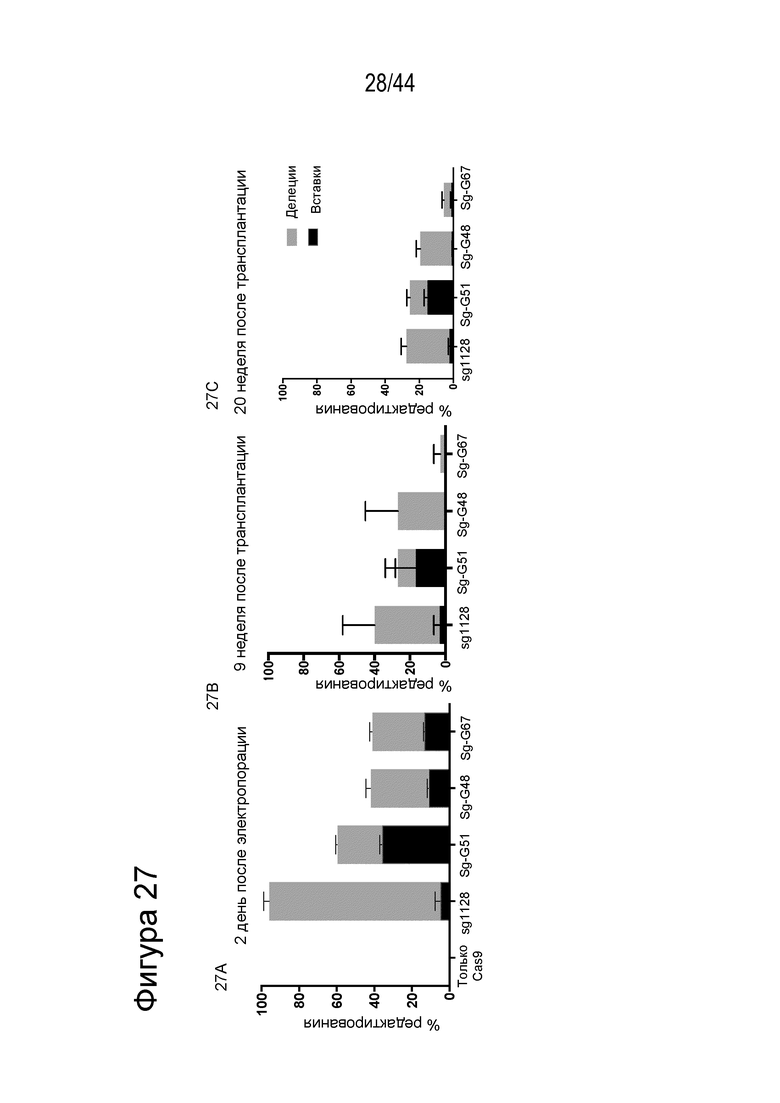
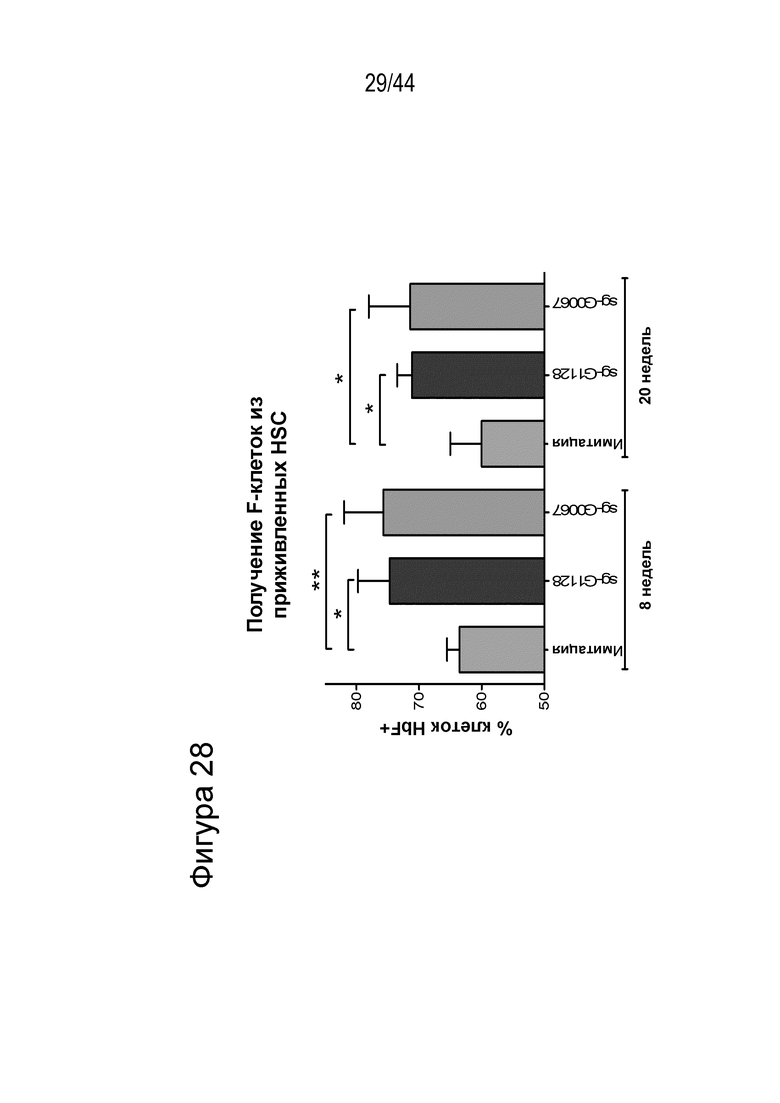
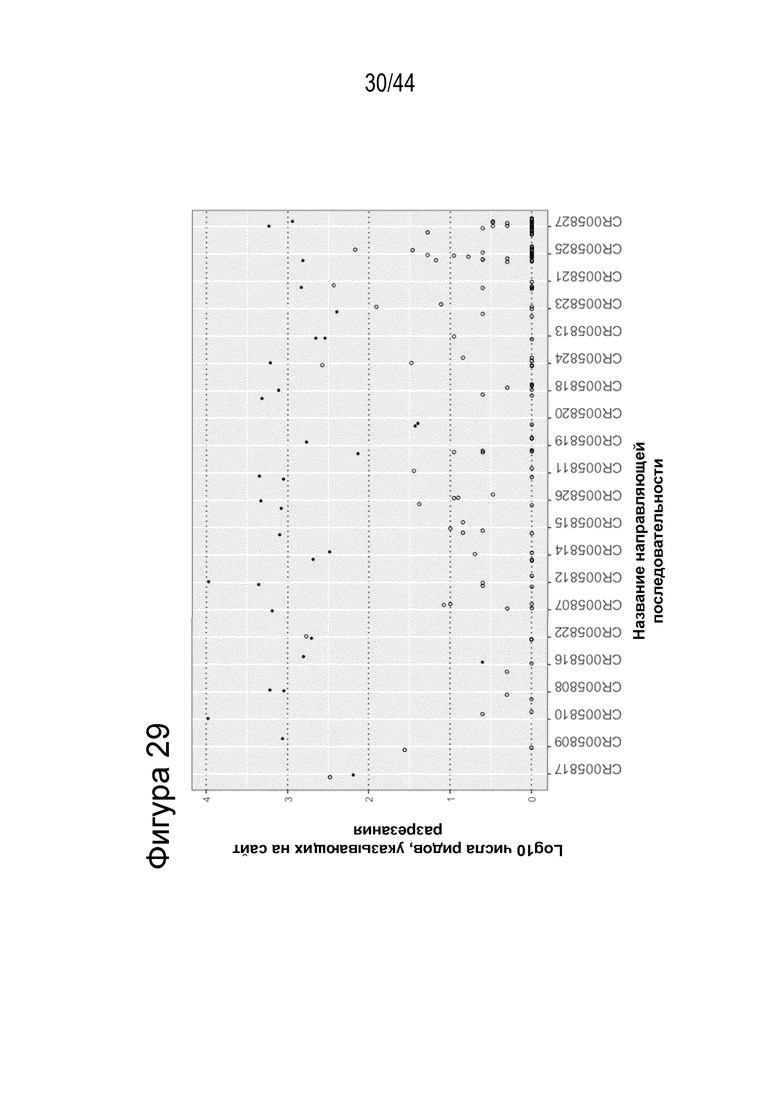
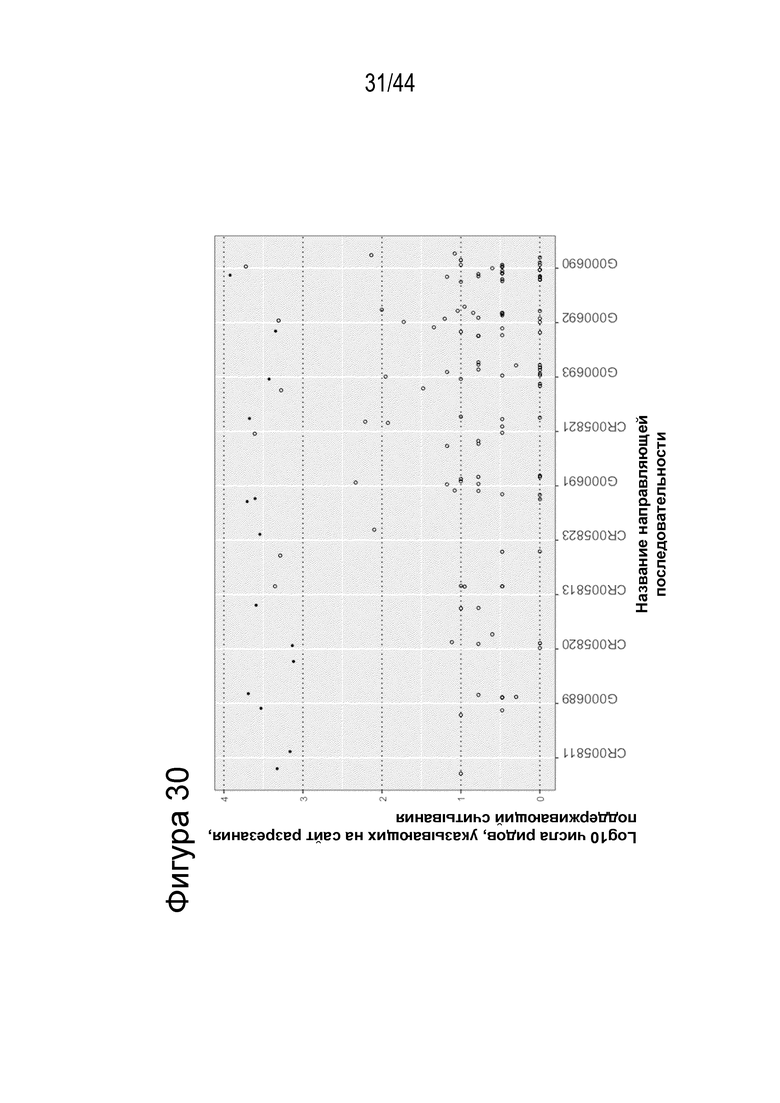
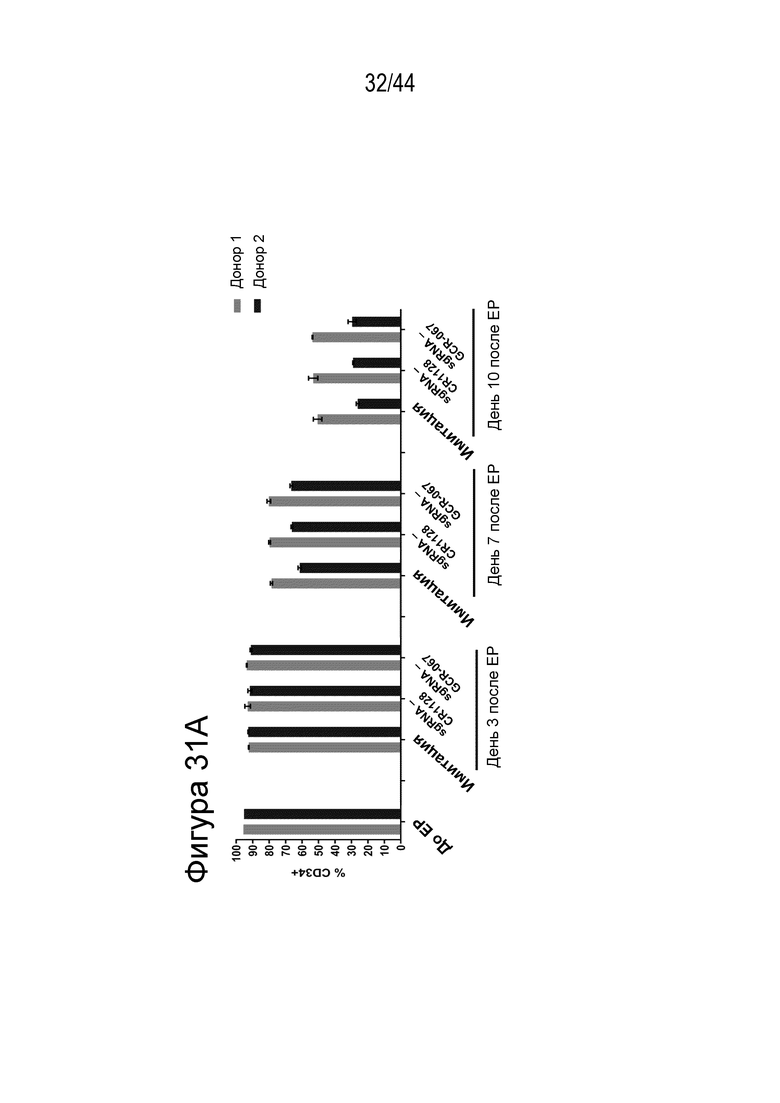
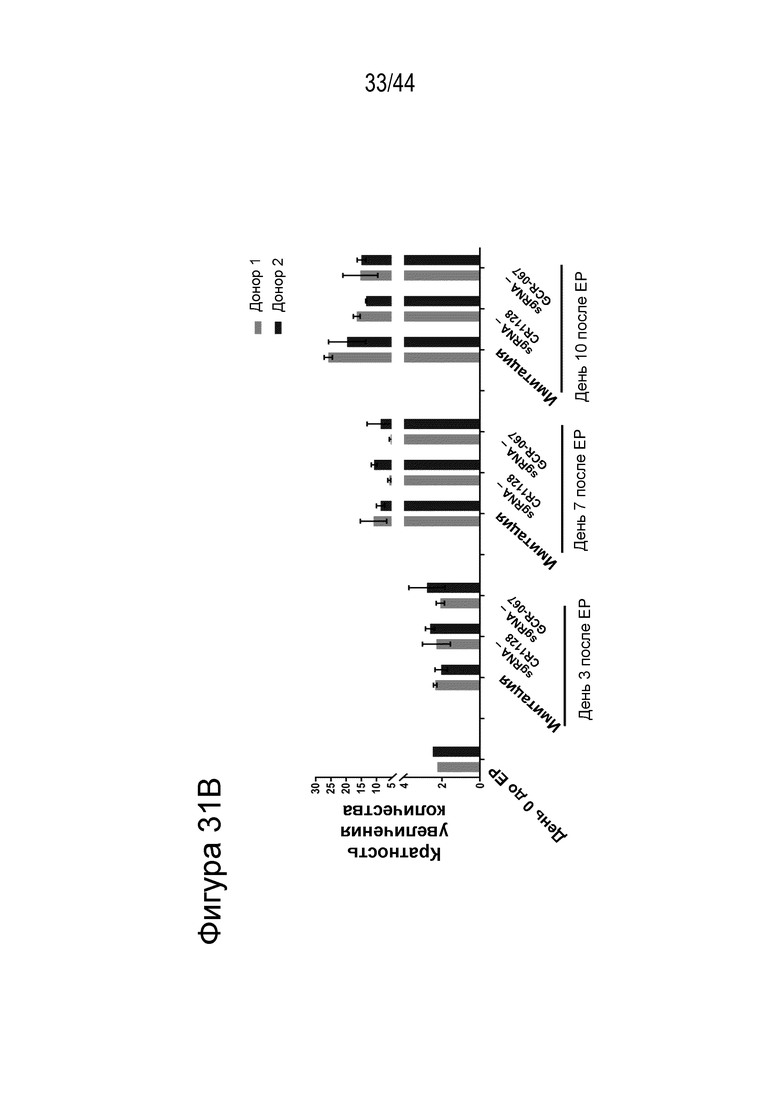
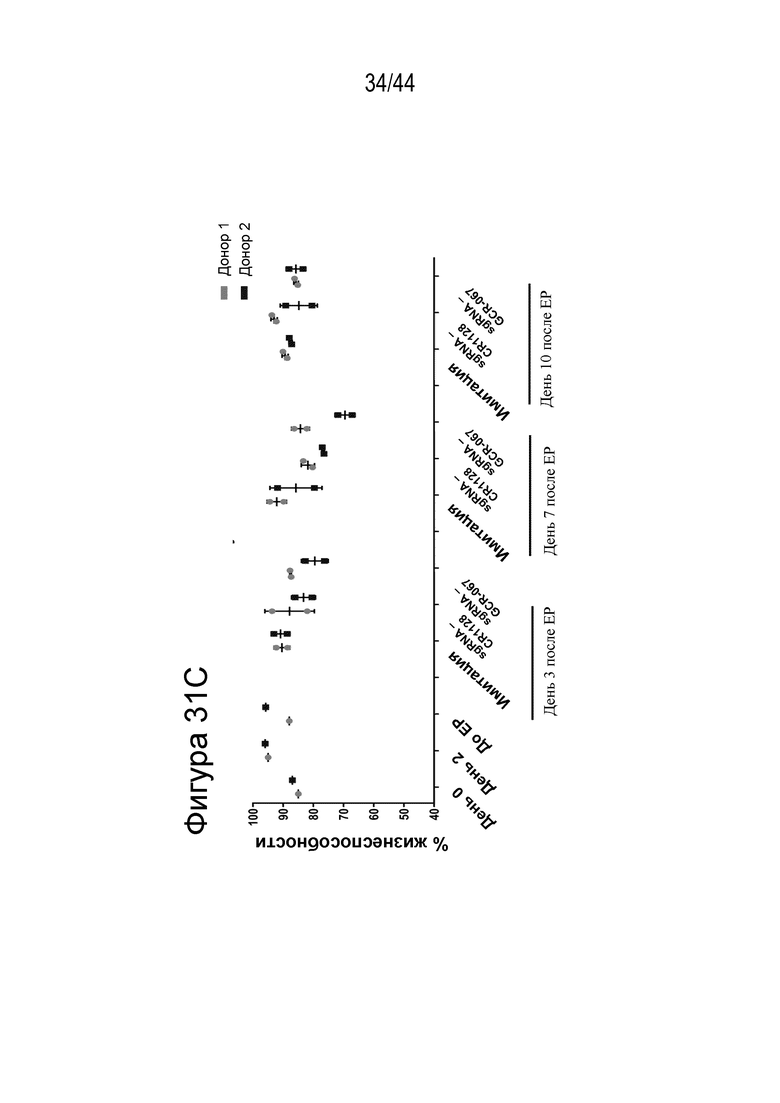
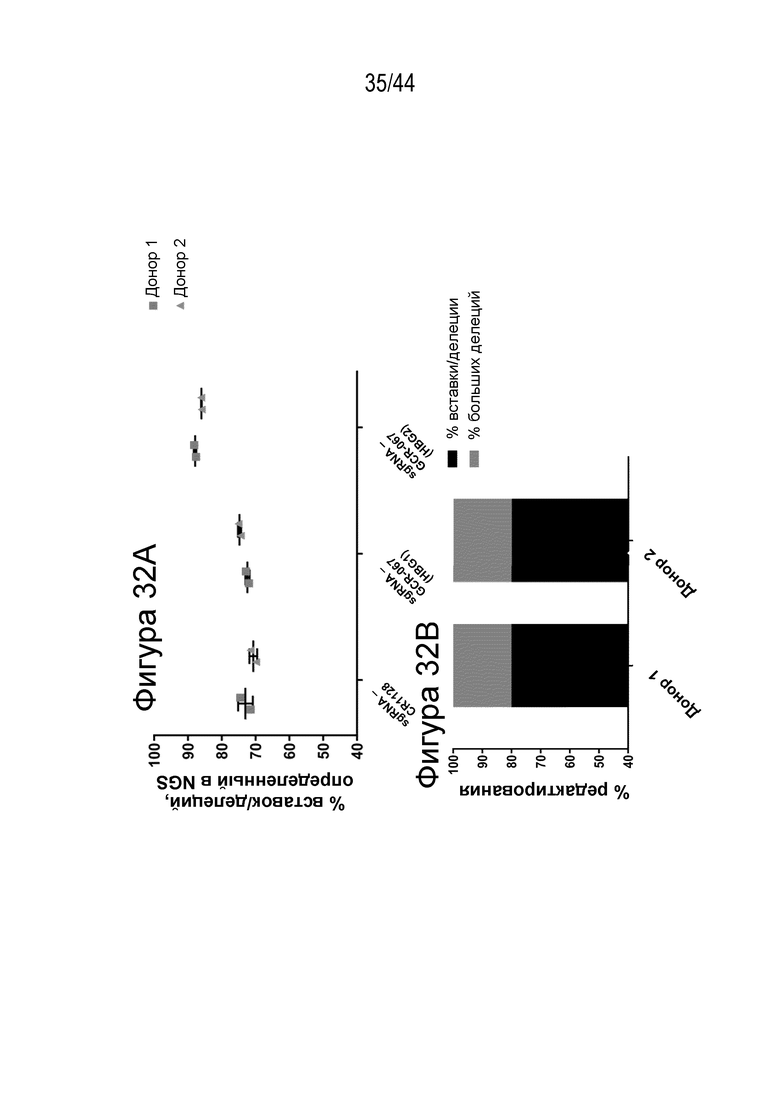
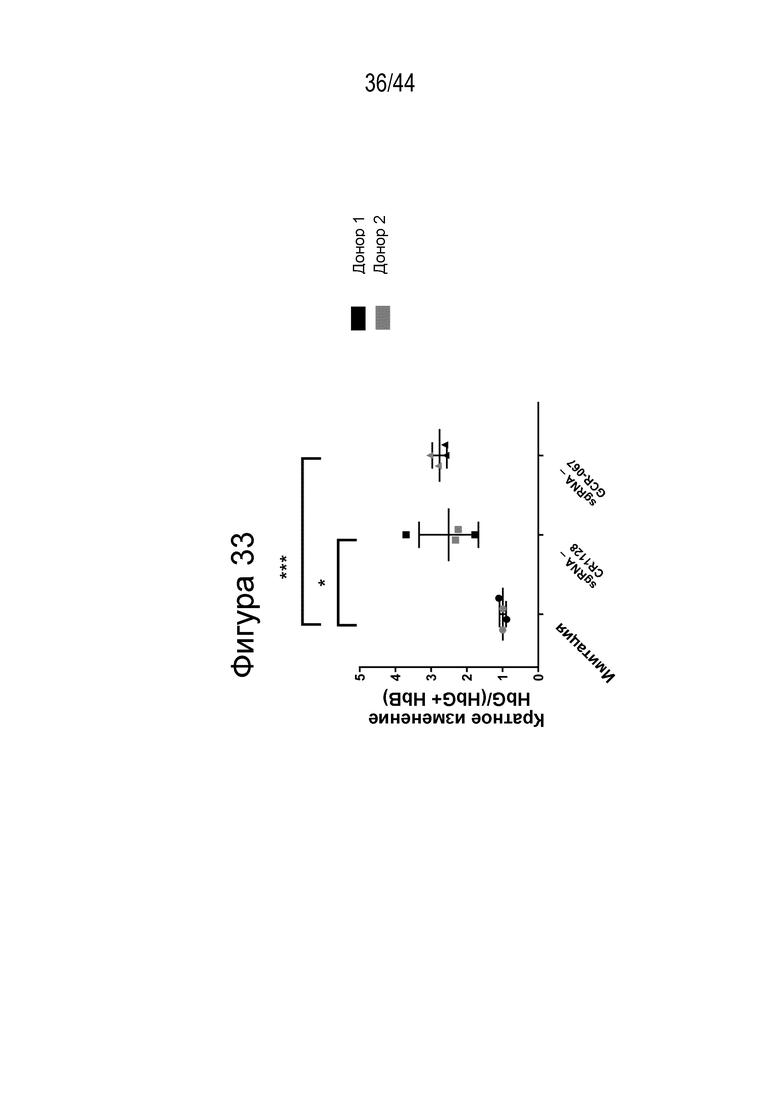
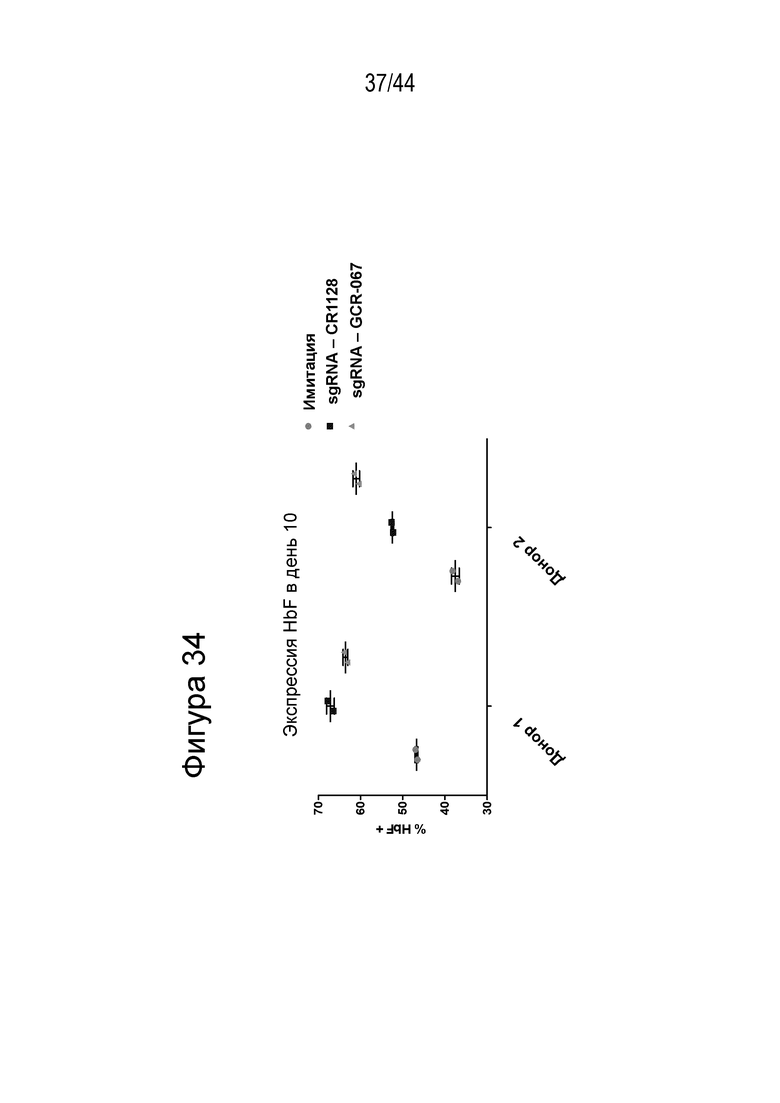

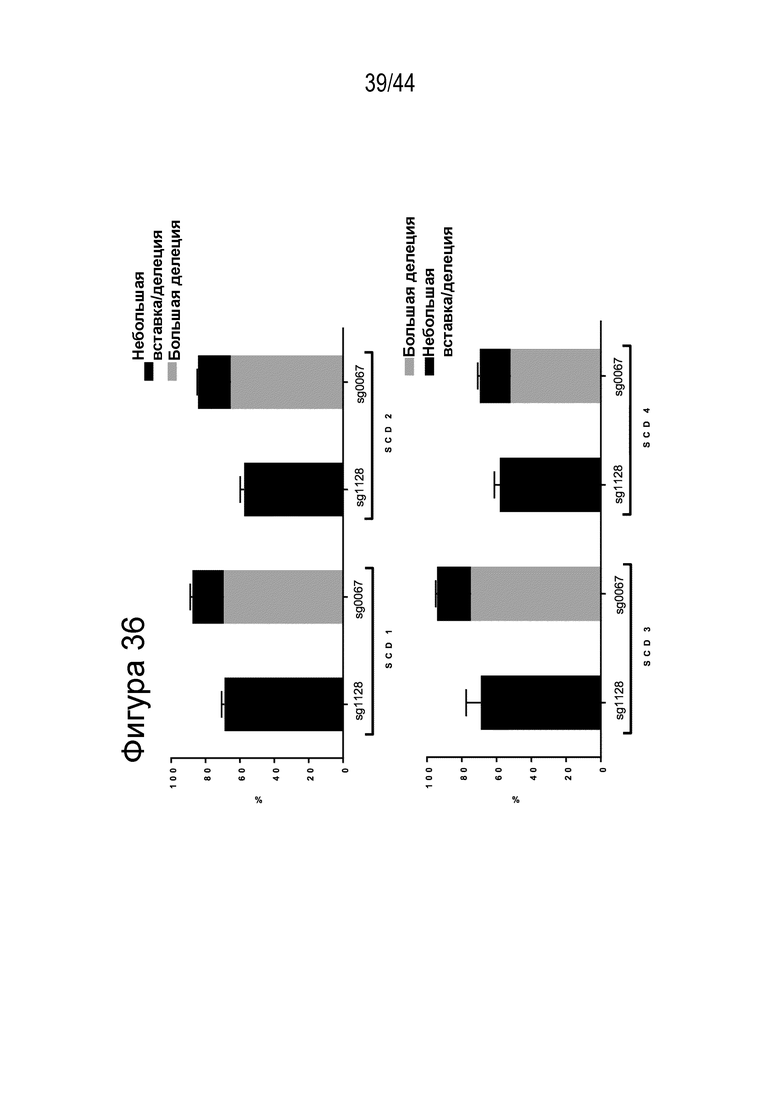
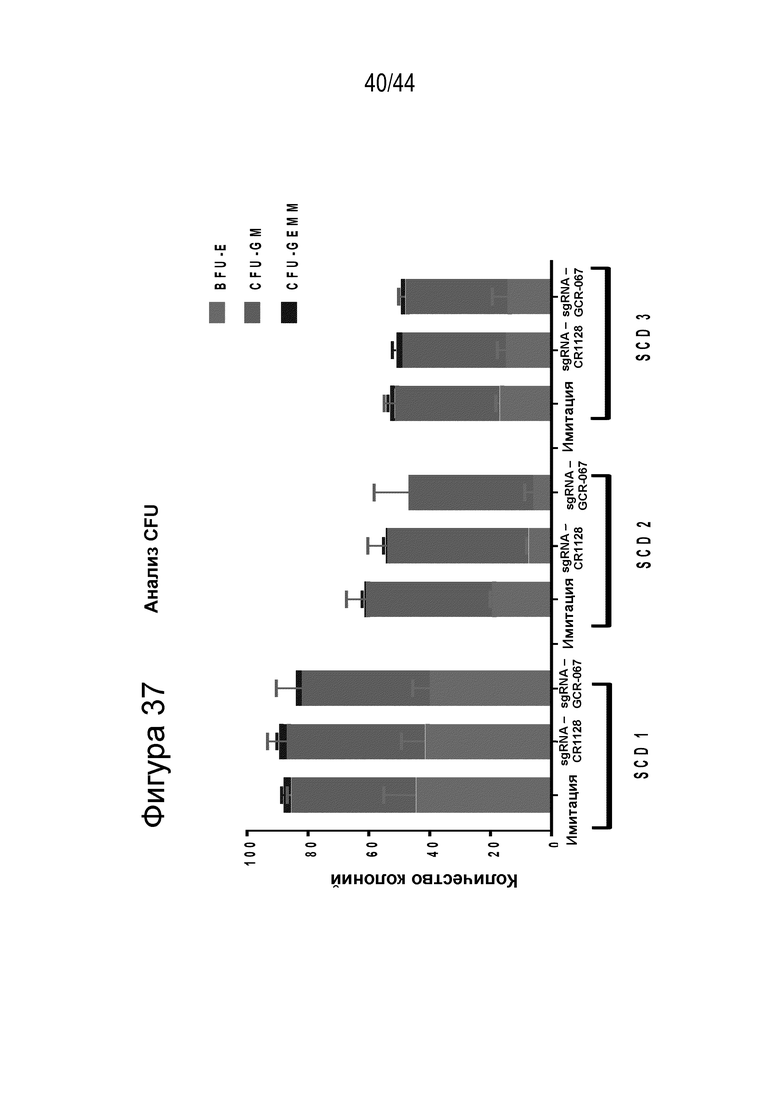
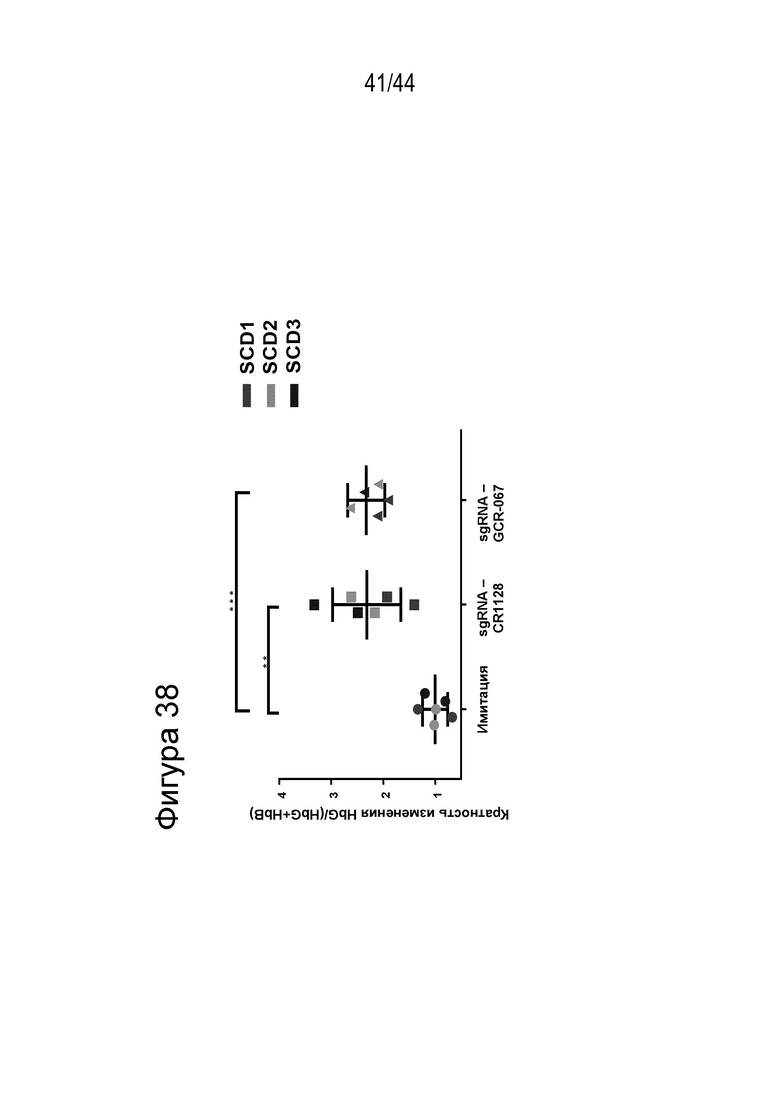
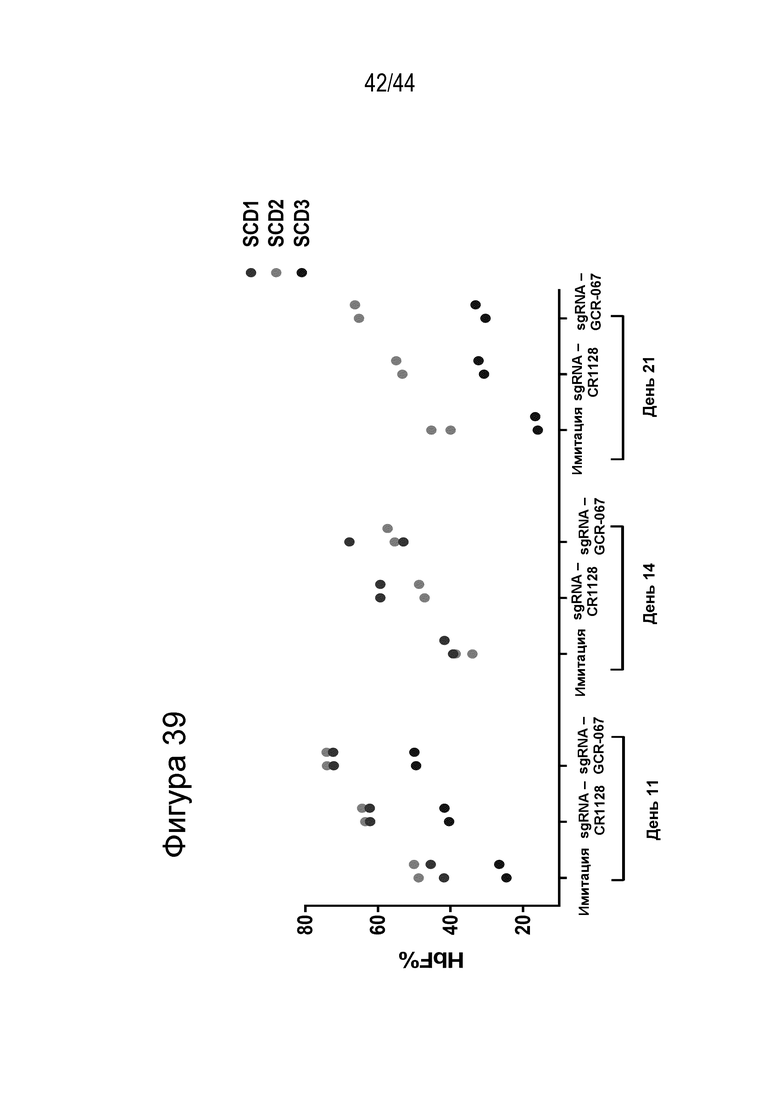
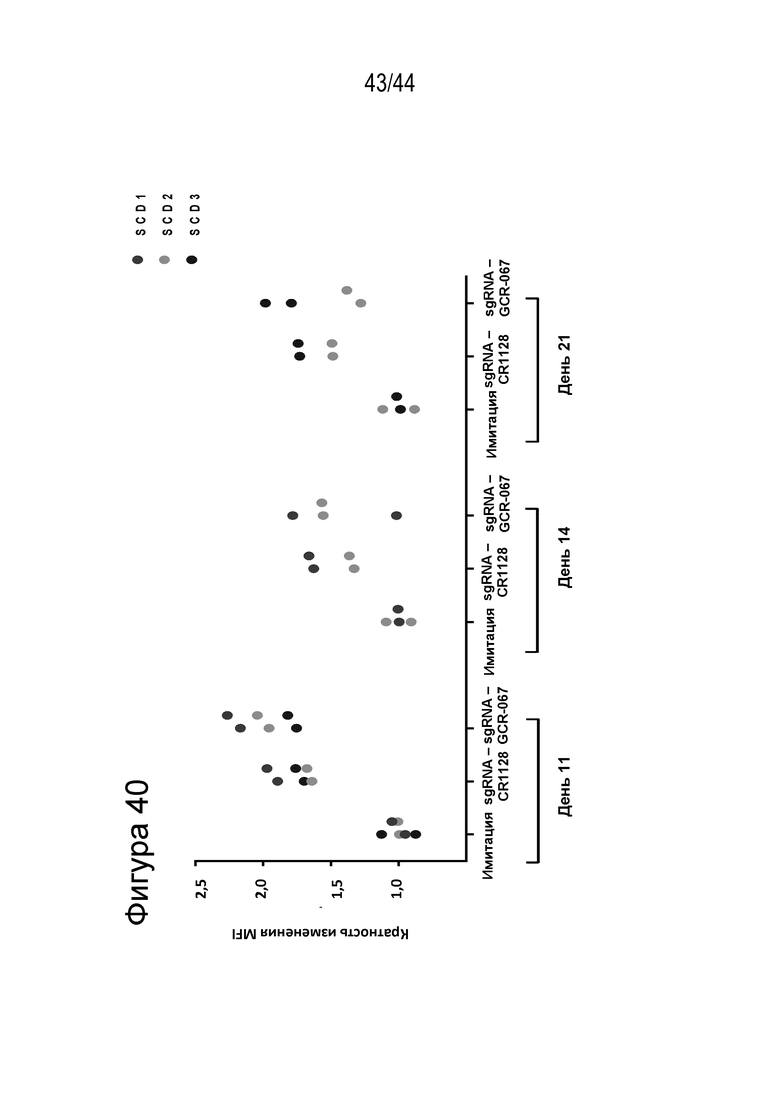
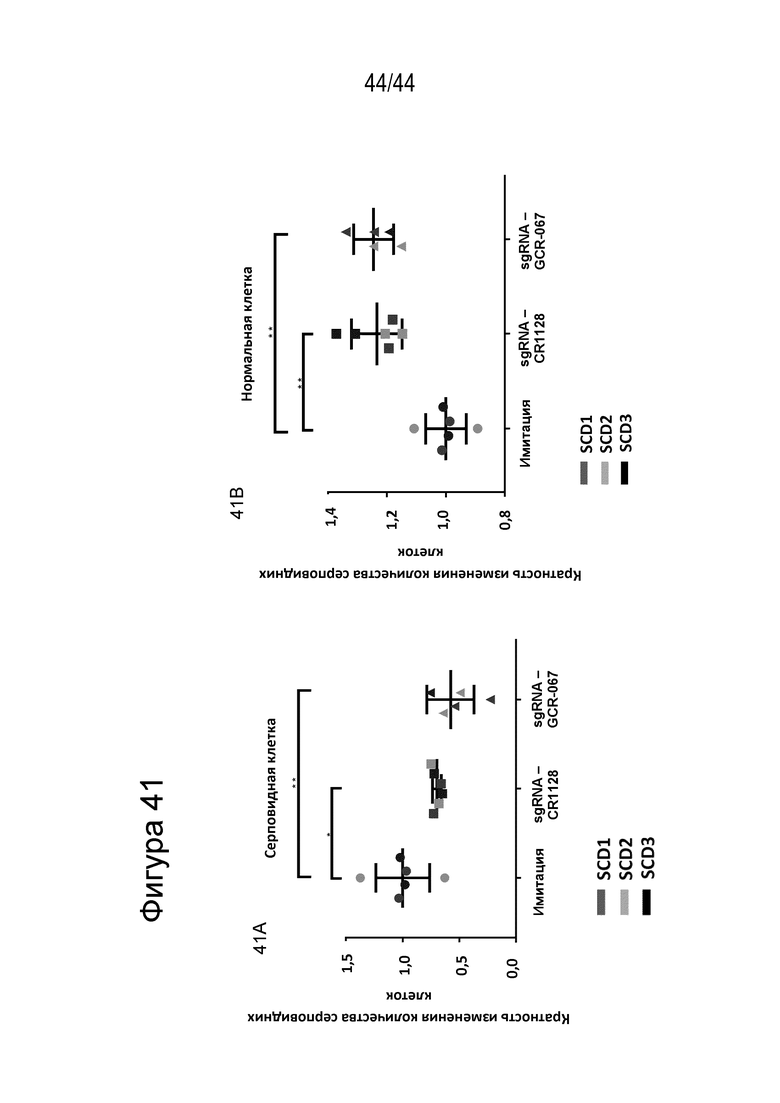
Изобретение относится к области биотехнологии, в частности к молекуле gRNA для опосредования редактирования промоторных участков субъединицы гемоглобина гамма-1 (HBG1) или субъединицы гемоглобина гамма-2 (HBG2) в клетке с помощью Cas9 для повышения экспрессии фетального гемоглобина у субъекта, содержащей tracr и crRNA. Также раскрыта композиция для опосредования редактирования промоторных участков HBG1 или HBG2 в клетке с помощью Cas9. Изобретение также относится к способу изменения клетки in vitro в целевой последовательности или в пределах 20 нуклеотидов от целевой последовательности в указанной клетке и к способу получения клетки. Изобретение позволяет эффективно редактировать промоторные участки субъединицы гемоглобина гамма-1 (HBG1) или субъединицы гемоглобина гамма-2 (HBG2) в клетке с помощью Cas9 для повышения экспрессии фетального гемоглобина у субъекта. 7 н. и 27 з.п. ф-лы, 41 ил., 14 табл., 9 пр.
1. Молекула gRNA для опосредования редактирования промоторных участков субъединицы гемоглобина гамма-1 (HBG1) или субъединицы гемоглобина гамма-2 (HBG2) в клетке с помощью Cas9 для повышения экспрессии фетального гемоглобина у субъекта, содержащая tracr и crRNA, где crRNA содержит нацеливающий домен с SEQ ID NO: 67.
2. Молекула gRNA по п. 1, содержащая в 5'-3'-направлении [нацеливающий домен]-SEQ ID NO: 231, где нацеливающий домен содержит SEQ ID NO: 67.
3. Молекула gRNA по п. 1, содержащая в 5'-3'-направлении [нацеливающий домен]-SEQ ID NO: 195, где нацеливающий домен содержит SEQ ID NO: 67.
4. Молекула gRNA по п. 2, где нацеливающий домен и полинуклеотид SEQ ID NO: 231 расположены на одной молекуле нуклеиновой кислоты, где полинуклеотид SEQ ID NO: 231 расположен непосредственно в 3'-конце от нацеливающего домена.
5. Молекула gRNA по п. 3, где нацеливающий домен и полинуклеотид SEQ ID NO: 195 расположены на одной молекуле нуклеиновой кислоты, где полинуклеотид SEQ ID NO: 195 расположен непосредственно со стороны 3' от нацеливающего домена.
6. Молекула gRNA по п. 1, состоящая из, в 5'-3'-направлении, [нацеливающего домена]-SEQ ID NO: 231, где нацеливающий домен содержит SEQ ID NO: 67.
7. Молекула gRNA по п. 1, состоящая из, в 5'-3'-направлении, [нацеливающего домена]-SEQ ID NO: 195, где нацеливающий домен содержит SEQ ID NO: 67.
8. Молекула gRNA по любому из пп. 1-7, содержащая:
(a) одну или более фосфотиоатных модификаций на 3'-конце указанной молекулы gRNA;
(b) одну или более фосфотиоатных модификаций на 5'-конце указанной молекулы gRNA;
(c) одну или более 2'-O-метиловых модификаций на 3'-конце указанной молекулы gRNA;
(d) одну или более 2'-О-метиловых модификаций на 5'-конце указанной молекулы gRNA; или
(e) любую их комбинацию.
9. Молекула gRNA по п. 8, содержащая:
(a) 2'-О-метиловую модификацию каждого из 4-го, 3-го и 2-го концевых 3'-остатков указанной молекулы gRNA;
(b) 2'-О-метиловую модификацию каждого из 4-го, 3-го и 2-го концевых 5'-остатков указанной молекулы gRNA; или
(c) их комбинацию.
10. Молекула gRNA по п. 1, содержащая последовательность SEQ ID NO: 174, SEQ ID NO: 175 или SEQ ID NO: 176.
11. Молекула gRNA по п. 1, состоящая из последовательности SEQ ID NO: 174, SEQ ID NO: 175 или SEQ ID NO: 176.
12. Молекула gRNA по п. 1, состоящая из:
(a) crRNA, содержащей SEQ ID NO: 177, и tracr, содержащей SEQ ID NO: 224;
(b) crRNA, содержащей SEQ ID NO: 177, и tracr, содержащей SEQ ID NO: 73;
(c) crRNA, содержащей SEQ ID NO: 178, и tracr, содержащей SEQ ID NO: 224; или
(d) crRNA, содержащей SEQ ID NO: 178, и tracr, содержащей SEQ ID NO: 73.
13. Молекула gRNA по любому из пп. 1-7 и 10-12, где, если система CRISPR, содержащая молекулу gRNA, вводится в клетку, то вставка/делеция образуется в целевой последовательности, комплементарной нацеливающему домену молекулы gRNA, или в пределах 20 нуклеотидов от с указанной целевой последовательности.
14. Молекула gRNA по п. 13, где вставка/делеция не охватывает нуклеотид, расположенный между 5250092 и 5249833, - нить (hg38).
15. Молекула gRNA по любому из пп. 1-7 и 10-12, где если система CRISPR, содержащая молекулу gRNA, вводится в популяцию клеток, то вставка/делеция образуется в целевой последовательности, комплементарной нацеливающему домену молекулы gRNA, или в пределах 20 нуклеотидов от указанной целевой последовательности, комплементарной нацеливающему домену молекулы gRNA в по меньшей мере 15% клеток указанной популяции.
16. Молекула gRNA по любому из пп. 1-7 и 10-12, где если система CRISPR, содержащая молекулу gRNA, вводится в одну или более клеток или популяцию клеток, экспрессия фетального гемоглобина повышается в указанной клетке или популяции клеток или их потомстве.
17. Молекула gRNA по п. 13, где указанная клетка получена от пациента, страдающего гемоглобинопатией.
18. Молекула gRNA по п. 17, где клетка представляет собой HSPC.
19. Молекула gRNA по п. 17, где клетка является аутологичной или аллогенной по отношению к пациенту, которому назначено введение указанной клетки.
20. Композиция для опосредования редактирования промоторных участков субъединицы гемоглобина гамма-1 (HBG1) или субъединицы гемоглобина гамма-2 (HBG2) в клетке с помощью Cas9 для повышения экспрессии фетального гемоглобина у субъекта, содержащая:
a) одну или более молекул gRNA по любому из пп. 1-19 и молекулу Cas9;
b) одну или более молекул gRNA по любому из пп. 1-19 и нуклеиновую кислоту, кодирующую молекулу Cas9;
c) нуклеиновую кислоту, кодирующую одну или более молекул gRNA по любому из пп. 1-7 или 10-19, и молекулу Cas9;
d) нуклеиновую кислоту, кодирующую одну или более молекул gRNA по любому из пп. 1-7 и 10-19, и нуклеиновую кислоту, кодирующую молекулу Cas9; или
e) любую из указанных выше a) - d) и нуклеиновую кислоту, представляющую собой матрицу; или
f) любую из указанных выше a) - d) и нуклеиновую кислоту, содержащую последовательность, кодирующую матричную нуклеиновую кислоту.
21. Композиция для опосредования редактирования промоторных участков HBG1 или HBG2 в клетке с помощью Cas9, содержащая молекулу gRNA по любому из пп. 1-19, которая дополнительно содержит молекулу Cas9, где молекула Cas9 представляет собой активную или неактивную Cas9 из S. pyogenes.
22. Композиция по п. 21, где молекула Cas9 содержит:
(a) SEQ ID NO: 233;
(b) SEQ ID NO: 234;
(c) SEQ ID NO: 235;
(d) SEQ ID NO: 236;
(e) SEQ ID NO: 237;
(f) SEQ ID NO: 238;
(g) SEQ ID NO: 239;
(h) SEQ ID NO: 240;
(i) SEQ ID NO: 241;
(j) SEQ ID NO: 242;
(k) SEQ ID NO: 243;
(l) SEQ ID NO: 244; или
(m) SEQ ID NO: 205; или
(n) последовательность, которая по меньшей мере на 95% гомологична любой из (a)-(m).
23. Композиция по п. 21, где
(a) молекула gRNA и молекула Cas9 присутствуют в рибонуклеарном белковом комплексе (RNP); и/или
(b) каждая из указанных молекул gRNA находится в RNP с молекулой Cas9, описанной в данном документе, и где каждый из указанных RNP находится в концентрации, составляющей менее 10 мкM, менее 3 мкM, менее 1 мкM, менее 0,5 мкM, менее 0,3 мкM или менее 0,1 мкM.
24. Нуклеиновая кислота, которая кодирует одну или более молекул gRNA по любому из пп. 1-7.
25. Вектор для опосредования редактирования промоторных участков HBG1 или HBG2 в клетке с помощью Cas9, содержащий нуклеиновую кислоту по п. 24.
26. Вектор по п. 25, где указанный вектор выбран из лентивирусного вектора, аденовирусного вектора, вектора на основе аденоассоциированного вируса (AAV), вектора на основе вируса простого герпеса (HSV), плазмиды, миникольца, наноплазмиды и РНК-вектора.
27. Способ изменения клетки in vitro в целевой последовательности или в пределах 20 нуклеотидов от целевой последовательности в указанной клетке, предусматривающий приведение указанной клетки в контакт с:
a) одной или более молекулами gRNA по любому из пп. 1-19 и молекулой Cas9;
b) одной или более молекулами gRNA по любому из пп. 1-19 и нуклеиновой кислотой, кодирующей молекулу Cas9;
c) нуклеиновой кислотой, кодирующей одну или более молекул gRNA по любому из пп. 1-7 и 10-19, и молекулой Cas9;
d) нуклеиновой кислотой, кодирующей одну или более молекул gRNA по любому из пп. 1-7 и 10-19, и нуклеиновой кислотой, кодирующей молекулу Cas9;
e) любой из указанных выше a) - d) и матричной нуклеиновой кислотой;
f) любой из указанных выше a) - d) и нуклеиновой кислотой, содержащей последовательность, кодирующую матричную нуклеиновую кислоту;
g) композицией по любому из пп. 20-22; или
(h) вектором по п. 25 или 26.
28. Способ по п. 27, где указанную клетку получают от пациента, страдающего гемоглобинопатией.
29. Способ по п. 27, где указанная клетка является аутологичной или аллогенной по отношению к пациенту, которому назначено введение указанной клетки.
30. Способ получения клетки, предусматривающий
(a) обеспечение клетки;
(b) культивирование указанной клетки ex vivo в среде для культивирования клеток, содержащей вещество, стимулирующее размножение стволовых клеток; и
(c) введение в указанную клетку молекулы gRNA по любому из пп. 1-19, молекулы нуклеиновой кислоты, кодирующей молекулу gRNA по любому из пп. 1-7 или 10-19, композиции по любому из пп. 20-23, нуклеиновой кислоты по п. 24 или вектора по п. 25.
31. Способ по п. 30, где вещество, стимулирующее размножение стволовых клеток, представляет собой:
a) (1r,4r)-N1-(2-бензил-7-(2-метил-2H-тетразол-5-ил)-9H-пиримидо[4,5-b]индол-4-ил)циклогексан-1,4-диамин;
b) метил-4-(3-пиперидин-1-илпропиламино)-9H-пиримидо[4,5-b]индол-7-карбоксилат;
c) 4-(2-(2-(бензо[b]тиофен-3-ил)-9-изопропил-9H-пурин-6-иламино)этил)фенол;
d) (S)-2-(6-(2-(1H-индол-3-ил)этиламино)-2-(5-фторпиридин-3-ил)-9H-пурин-9-ил)пропан-1-ол или
e) комбинации a) - d).
32. Способ по п. 30, где среда для культивирования клеток содержит тромбопоэтин (Tpo), лиганд Flt3 (Flt-3L) и фактор стволовых клеток (SCF) человека.
33. Способ по п. 30, где среда для культивирования клеток содержит вещество, стимулирующее размножение стволовых клеток, в концентрации, находящейся в диапазоне от 1 нМ до 1 мM.
34. Способ по п. 30, где популяция клеток, предусмотренная на стадии (a), является обогащенной клетками CD34+.
| WO 2015089486 A2, 18.06.2015 | |||
| WO 2013126794 A1, 29.08.2013 | |||
| LETTRE G | |||
| et al | |||
| Fetal haemoglobin in sickle-cell disease: from genetic epidemiology to new therapeutic strategies, Lancet, 2016, v | |||
| Аппарат для получения газа под высоким давлением для работы в поршневом или турбинном двигателе | 1922 |
|
SU387A1 |
| Снегоочиститель для трамвайных путей | 1925 |
|
SU2554A1 |
| ШАПЧЕНКО А.В | |||
| и др | |||
| Серповидно-клеточная анемия | |||
| Случай из клинической практики, КАРДИОСОМАТИКА, 2013, т | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Устройство для устранения мешающего действия зажигательной электрической системы двигателей внутреннего сгорания на радиоприем | 1922 |
|
SU52A1 |
Авторы
Даты
2025-02-04—Публикация
2018-02-05—Подача