Изобретение относится к биотехнологии, в частности, к генетической инженерии, и предназначено для биосинтеза в нейронах млекопитающих образующей шпильку малой РНК (shRNA), обеспечивающую подавление экспрессии селективного сайленсера серотонинового 5-НТ1А рецептора в мозге мышей, приводя тем самым к усилению экспрессии 5-НТ1А рецептора и, как следствие, оказывая антидепрессантный эффект.
Депрессия является самым распространенным среди психических расстройств человека и значительно снижает качество жизни. В развитых странах от депрессии страдают более 20 процентов населения. Возможность избирательной фармакологической коррекции депрессивного поведения может быть чрезвычайно полезна для повышения уровня жизни населения страны, однако механизмы и патогенез этих поведенческих отклонений недостаточно изучены, что препятствует разработке современных препаратов.
Имеется множество данных об участии медиатора головного мозга, серотонина, в патогенезе депрессии. Классические антидепрессанты направлены на блокаду тренспортера серотонина, осуществляющего обратный захват этого важнейшего нейромедиатора из синаптической щели обратно в пресинаптическую терминаль. Однако, значительный процент пациентов нечувствителен к данному классу препаратов. Кроме того, для эффективной коррекции депрессивного поведения классические антидепрессанты необходимо применять хронически.
Данные последних лет указывают на ключевую роль серотониновых 5-НТ1А рецепторов в регуляции функционального состояния серотониновой системы мозга [1]. Кроме того, имеется множество данных, демонстрирующих вовлечение 5-НТ1А рецепторов в механизмы депрессии [2-7], депрессивных психозов [8], суицидального поведения [9-11], а также в механизмы действия антидепрессантов [6, 12]. Более того, комбинация антагонистов 5-НТ1А ауторецепторов с классическими антидепрессантами была предложена для более эффективного купирования депрессии [13]. Тем не менее, до настоящего момента 5-НТ1А рецепторы не рассматривались как самостоятельная мишень для антидепрессантов нового поколения. Кроме того, механизмы регуляции функционального состояния этих рецепторов все еще недостаточно изучены.
В 2000 году в промоторе гена, кодирующего ключевой рецептор серотониновой системы мозга - 5-НТ1А рецептор, был обнаружен сайт связывания (через DRE-элемент) селективного сайленсера, подавляющего экспрессию гена рецептора [14]. Позднее был выявлен ген Freud-1, продукт которого, связываясь с DRE-элементом в промоторе гена 5-НТ1А рецептора, приводит к подавлению экспрессии гена рецептора в мозге [15]. При удалении фрагмента промотора, содержащего DRE-элемент, происходит резкое увеличение экспрессии гена, кодирующего 5-НТ1А рецептор, в то время как при гиперэкспрессии Freud-1 обнаружено подавление экспрессии гена 5-НТ1А рецептора, а также снижение уровня самого белка 5-НТ1А рецептора. м-РНК Freud-1 обнаружена в ядрах шва среднего мозга, гиппокампе, коре и гипоталамусе, а белок Freud-1 солокализован с 5-НТ1А рецептором [15]. Имеется несколько работ, указывающих на участие селективного сайленсера гена 5-НТ1А рецептора в развитии психопатологии [16, 17].
В то же время, имеется множество данных о ключевой роли 5-НТ1А рецепторов в регуляции функционального состояния серотониновой системы мозга [1], а также о вовлечении 5-НТ1А рецепторов в механизмы возникновения тревожности [4, 5], агрессивного поведения [18, 19] и депрессивных расстройств [8]. Важно отметить, что агонисты 5-НТ1А рецепторов обладают выраженными антидепрессивными [20, 21] и анксиолитическими [22, 23] свойствами, что нашло широкое применение в клинике.
Известно несколько вариантов рекомбинантой плазмидной ДНК, кодирующей 5-НТ1А рецептор и обеспечивающей экспрессию этого рецептора в нейронах млекопитающих (https://www.vectorbiolabs.com/product/aav-211683-human-htr1a-over-expression-aav/). Данные плазмидные ДНК несут ген 5-НТ1А под контролем CMV промотора, что позволяет ему экспрессироваться во всех типах клеток. Эти плазмиды могут кодировать репортерный ген (опционально), как, например, EGFP. Данные плазмиды созданы на основе адено-ассоциированных вирусов, что позволяет запаковывать их в вирусный капсид, обеспечивающий доставку плазмидной ДНК в нейроны.
Однако, известные плазмиды приводят к усилению экспрессии 5-НТ1А рецептора в десятки раз. Поскольку 5-НТ1А рецептор является ключевым регулятором функциональной активности серотониновой системы мозга, при значительном усилении его экспрессии включаются множественные механизмы, которые могут привести к непредсказуемым последствиям. Вероятно, с этим связано отсутствие исследований с использованием данных плазмид. С другой стороны, существуют мыши стабильно сверх-экспрессирующие ген 5-НТ1А рецептора [24]. Эти мыши демонстрируют сниженное тревожное поведение, однако, эти животные позволяют скорее исследовать компенсаторные механизмы, возникающие при стабильно повышенной экспрессии 5-НТ1А рецептора с момента формирования мозга.
Плазмидных ДНК, аналогичных или близких к заявляемой по технической сущности и функциональному назначению, в литературе не описано.
Задачей изобретения является получение плазмидной ДНК, транскрибирующей в нейронах млекопитающих образующую шпильку малую РНК (shRNA), обеспечивающую подавление экспрессии селективного сайленсера серотонинового 5-НТ1А рецептора в мозге млекопитающих, приводя тем самым к усилению экспрессии 5-НТ1А рецептора.
Технический результат: получение плазмиды, кодирующей shRNA, обеспечивающую подавление экспрессии селективного сайленсера серотонинового 5-НТ1А рецептора в мозге млекопитающих и обладающей свойствами, обеспечивающими возможность ее упаковки в адено-ассоциированный вирусный капсид.
Указанный результат достигается путем конструирования рекомбинантной плазмидной ДНК (плазмиды) AAV SynH1-2_shRNA Freud-1, кодирующей shRNA, обеспечивающей подавление экспрессии селективного сайленсера серотонинового 5-НТ1А рецептора в мозге млекопитающих. Кроме того, полученная плазмида может быть упакована в адено-ассоциированный вирусный капсид, обеспечивающий доставку конструкта в нейроны млекопитающих.
Транскрипция плазмиды AAV SynH1-2_shRNA Freud-1 в нейронах млекопитающих приводит к снижению экспрессии селективного сайленсера серотонинового 5-НТ1А рецептора Freud-1, приводя тем самым к усилению экспрессии 5-НТ1А рецептора и, как следствие, оказывая антидепрессантное действие.
Сущность заявляемого изобретения заключается в следующем.
Генно-инженерными методами получают плазмиду AAV SynH1-2_shRNA Freud-1, а также зеленый флуоресцентный белок, необходимый для контроля эффективности экспрессии плазмиды в нейронах млекопитающих.
Полученную плазмиду упаковывают в адено-ассоциированный вирусный капсид, обеспечивающий доставку конструкта в нейроны млекопитающих. Транскрипция shRNA в нейронах гиппокампа мышей обеспечивает подавление селективного сайленсера серотонинового 5-НТ1А рецептора Freud-1, приводя тем самым к усилению экспрессии 5-НТ1А рецептора и оказывая антидепрессантное действие.
Исходным генетическим материалом для конструирования плазмиды AAV SynH1-2_shRNA Freud-1 служат следующие генно-инженерные исходные конструкции:
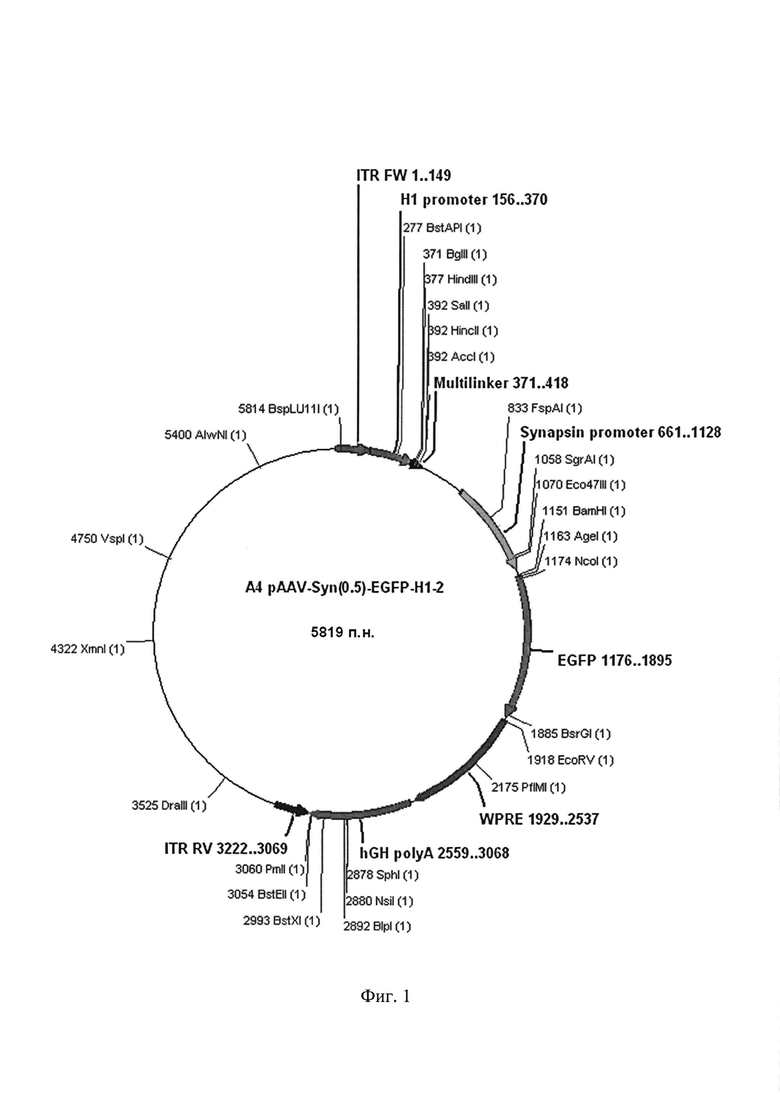
а) Исходная плазмида AAV-Syn(0.5)-EGFP-H1-2, содержащая находящийся под контролем гистонового H1 промотора мультилинкер, несущий сайты узнавания для эндонуклеаз рестрикции BglII и SalI, а также Зеленый Флуоресцентный Белок под контролем синапсинового промотора [25].
б) искусственно синтезированная смысловая олигонуклеотидная цепь, содержащая последовательность нуклеотидов, кодирующую образующую шпильку малую РНК (shRNA), комплиментарную гену, кодирующему селективный сайленсер серотонинового 5-НТ1А рецептора Freud-1 в мозге мыши, фланкированная сайтами узнавания для эндонуклеаз рестрикции BglII и SalI (в направлении 5'-3'):
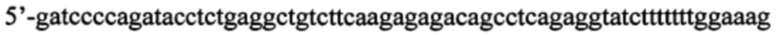
в) искусственно синтезированная антисмысловая олигонуклеотидная цепь, комплиментарная смысловой, фланкированная сайтами узнавания для эндонуклеаз рестрикции BglII и SalI (в направлении 5'-3'):
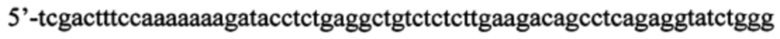
г) олигонуклеотидные праймеры для выявления наличия вставки последовательности нуклеотидов, кодирующих образующую шпильку малую РНК (shRNA), в мультилинкер плазмиды AAV-Syn(0.5)-EGFP-H1-2 (в направлении 5'-3').
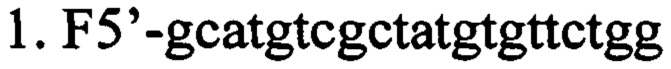
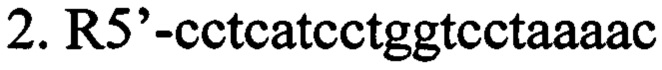
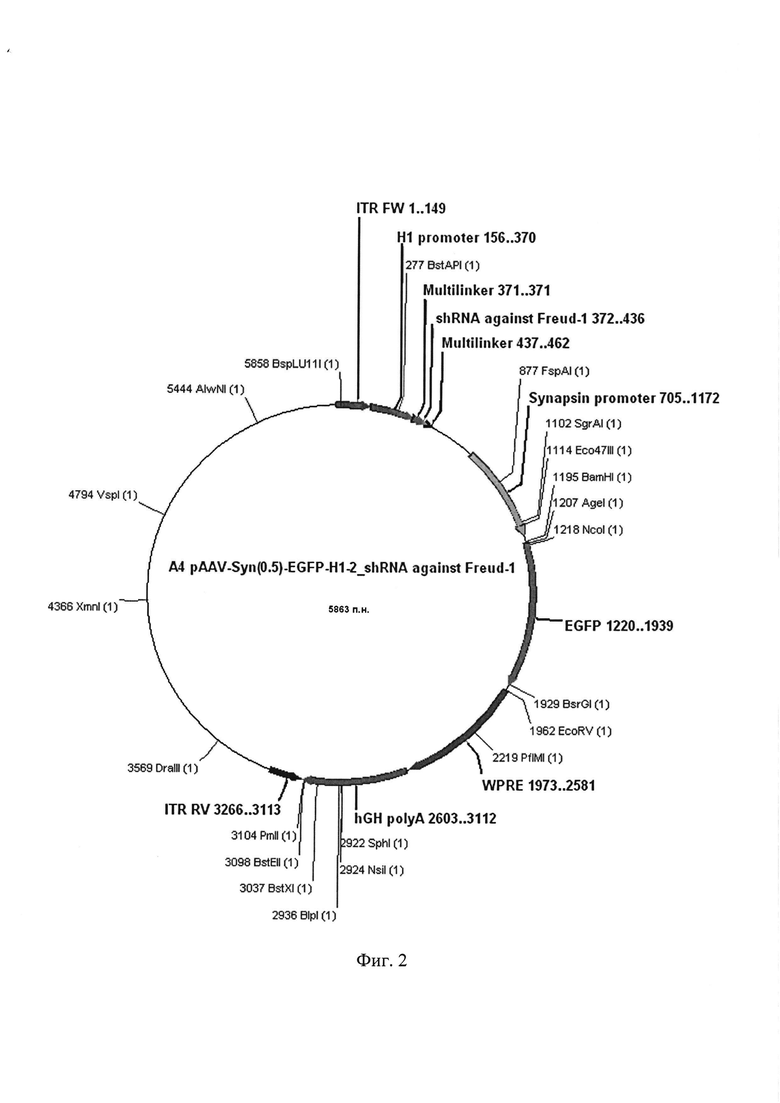
Полученная в результате плазмида AAV SynH1-2_shRNA Freud-1, кодирующая образующую шпильку малую РНК, подавляющую экспрессию гена, кодирующего селективный сайленсер 5-НТ1А рецептора Freud-1 в мозге млекопитающих, характеризуется следующими признаками:
- имеет размер 5863 п.н.;
- кодирует образующую шпильку малую РНК, подавляющую экспрессию гена, кодирующего селективный саленсер серотонинового 5-НТ1А рецептора - Freud-1 в мозге мышей;
- состоит из следующих элементов:
а) фланкированного инвертированными повторами (inverted terminal repeat (ITR)) фрагмента плазмиды, содержащего гистоновый H1 промотер (281 п.н.), вставку последовательности нуклеотидов, кодирующую образующую шпильку малую РНК (shRNA) комплиментарную гену, кодирующему селективный сайленсер серотонинового 5-НТ1А рецептора Freud-1 в мозге мыши (66 п.н.), Зеленый Флуоресцентный Белок (720 п.н.) под контролем синапсинового промотора (468 п.н.), посттрансляционный регулятор (WPRE, Posttrascriptional Response Element (609 п.н.) и сайт hGH polyA (509 п.н.)
б) нефланкированного инвертированными повторами фрагмента плазмиды (2597 п.н.), содержащего ген устойчивости к ампицилину, необходимый для селекции целевых плазмид на этапе клонирования, а также ориджин репликации плазмиды.
в) уникальные сайты узнавания эндонуклеазами рестрикции, имеющие следующие координаты: BamH1 - 1195, AgeI - 1207, EcorV - 1962.
Упаковку плазмиды AAV SynH1-2_shRNA Freud-1 в адено-ассоциированный вирусный капсид осуществляют с использованием полученной плазмиды с помощью ее котрансфекции с плазмидами-помощниками AAV-DJ и pHelper (Cell Biolabs, Inc., USA) в HEK (human embryonic kidney)-293FT клетки [25]. Эффективность трансфекции контролируют посредством микроскопического анализа флуоресценции (зеленый флуоресцентный белок - оригинальная плазмида, красный флуоресцентный белок - плазмиды-помощники). Сбор вирусных частиц осуществляют через 48 часов, согласно протоколу, описанному в работе [26]. Количество полученных вирусных частиц определяют с помощью количественного ПЦР в реальном времени с системой праймеров и зондом (F5'-cctggttgctgtctctttatgagg; R5'-tgacaggtggtggcaatgc; зонд 5'-FAM-cgttgtcaggcaacgtggcgtggtg-TAMARA-3'). В качестве стандарта для определения количества вирусных частиц используют серию разведений оригинальной плазмиды известной концентрации. Количество полученных описанным способом вирусных частиц составляет 109.
Полученный адено-ассоциированный вирус обладает способностью проникать в нейроны мыши in vivo при его интрацеребральном введении. Эффективность трансфекции оригинальной плазмиды AAV SynH1-2_shRNA Freud-1 в нейроны определяют по интенсивности экспрессии зеленого флуоресцентного белка. Транскрипция плазмиды AAV SynH1-2_shRNA Freud-1 в нейронах гиппокампа мышей линии C57Bl6 приводит к подавлению экспрессии гена селективного сайленсера 5-НТ1А рецептора Freud-1 и, способствует тем самым усилению экспрессии 5-НТ1А рецептора и, как следствие, оказывая in vivo антидепрессантный эффект.
Изобретение иллюстрируется следующими фигурами:
Фиг. 1. Графическая карта исходной плазмиды AAV-Syn(0.5)-EGFP-Н1-2, содержащей находящийся под контролем гистонового H1 промотора мультилинкер, несущий сайты узнавания для эндонуклеаз рестрикции BglII и SalI [25], а также ген, кодирующий зеленый флуоресцентный белок под контролем синапсинового промотора.
Фиг. 2. Графическая карта оригинальной плазмиды AAV SynH1-2_shRNA Freud-1, кодирующей образующую шпильку малую РНК, обеспечивающую подавление экспрессии селективного сайленсера серотонинового 5-НТ1А рецептора в мозге мышей
Фиг. 3. Нуклеотидная последовательность плазмидной ДНК AAV SynH1-2_shRNA Freud-1,
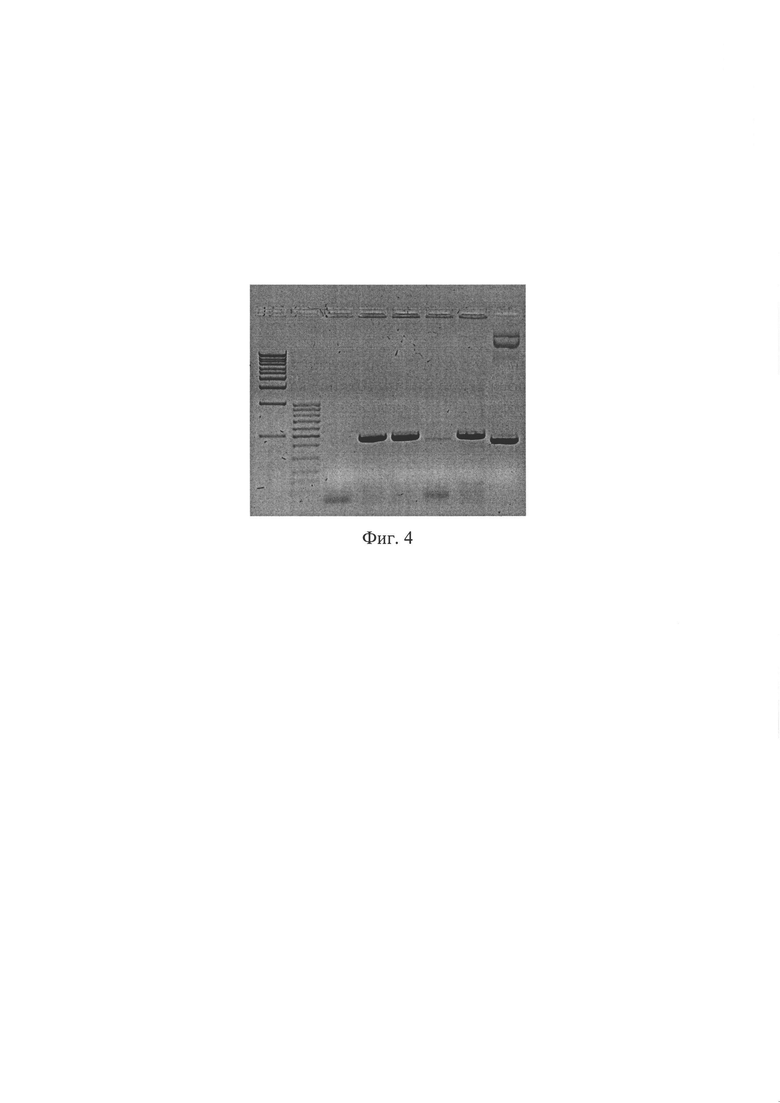
Фиг. 4. Электрофореграмма продуктов ПЦР с праймерами для определения наличия вставки по сайтам узнавания для эндонуклеаз BglII и SalI. Длина ПЦР продукта без вставки - 404 п.н., со вставкой 469 п.н. Дорожка 1 - маркер молекулярного веса (1 kB); дорожка 2 - маркер молекулярного веса (100 bp); дорожки 3-7 - ПЦР продукты, полученные с использованием плазмид, клонированных в разных колониях Е. coli, в качестве матрицы; дорожка 8 - ПЦР продукты, полученные с использованием исходной плазмиды AAV-Syn(0.5)-EGFP-H1-2 в качестве матрицы.
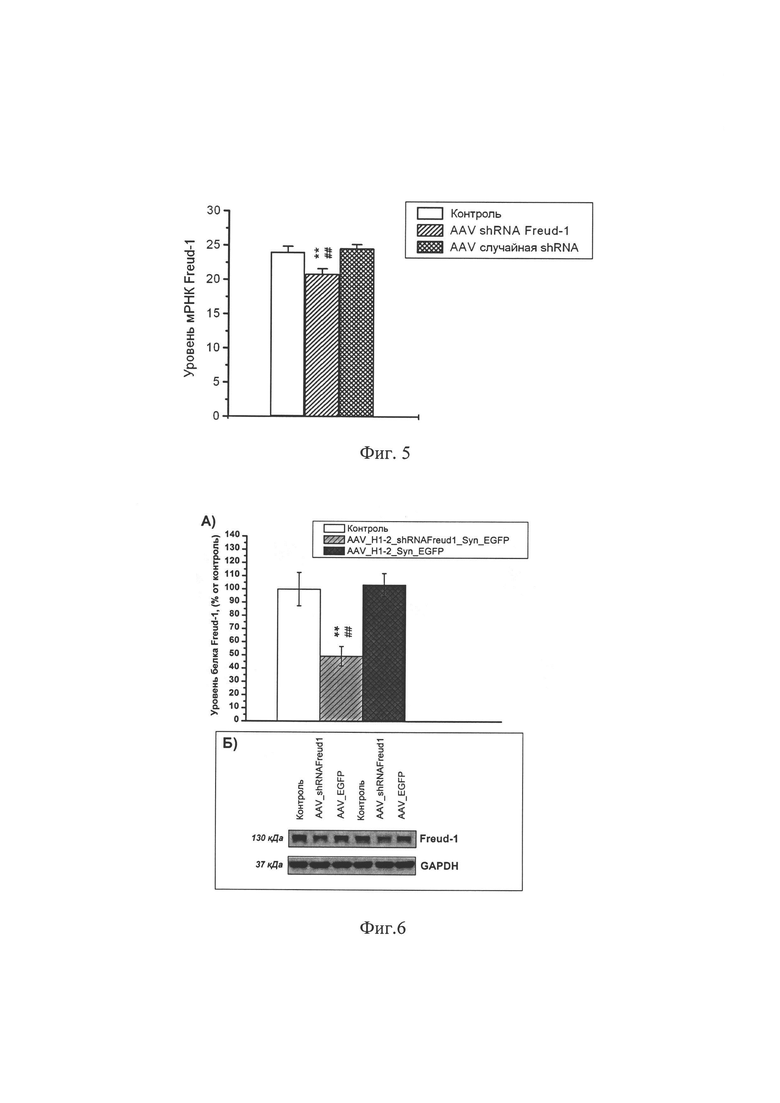
Фиг. 5. Экспрессия гена селективного сайленсера 5-НТ1А рецептора Freud-1 в гиппокампе мышей C57Bl6 через 43 дня после интрагиппокампального введения адено-ассоциированного вируса, несущего плазмиду AAV SynH1-2_shRNA Freud-1, либо плазмиду, кодирующую не имеющую сродства к геному мыши, случайную shRNA, либо чистого буфера того же состава, что был использован для разведения вируса. ** р<0.01 по сравнению с мышами, получившими инъекцию чистого буфера; ## р<0.01 по сравнению с мышами, получившими инъекцию адено-ассоциированного вируса, несущего плазмиду кодирующую не имеющую сродства к геному мыши случайную shRNA.
Фиг. 6. Уровень белка Freud-1 в гиппокампе мышей C57Bl6 через 43 дня после интрагиппокампального введения адено-ассоциированного вируса, несущего плазмиду AAV SynH1-2_shRNA Freud-1, либо плазмиду, кодирующую не имеющую сродства к геному мыши случайную shRNA, либо чистого буфера того же состава, что был использован для разведения вируса. ** р<0.01 по сравнению с мышами, получившими иньекцию чистого буфера; ## р<0.01 по сравнению с мышами, получившими инъекцию адено-ассоциированного вируса, несущего плазмиду кодирующую не имеющую сродства к геному мыши случайную shRNA.
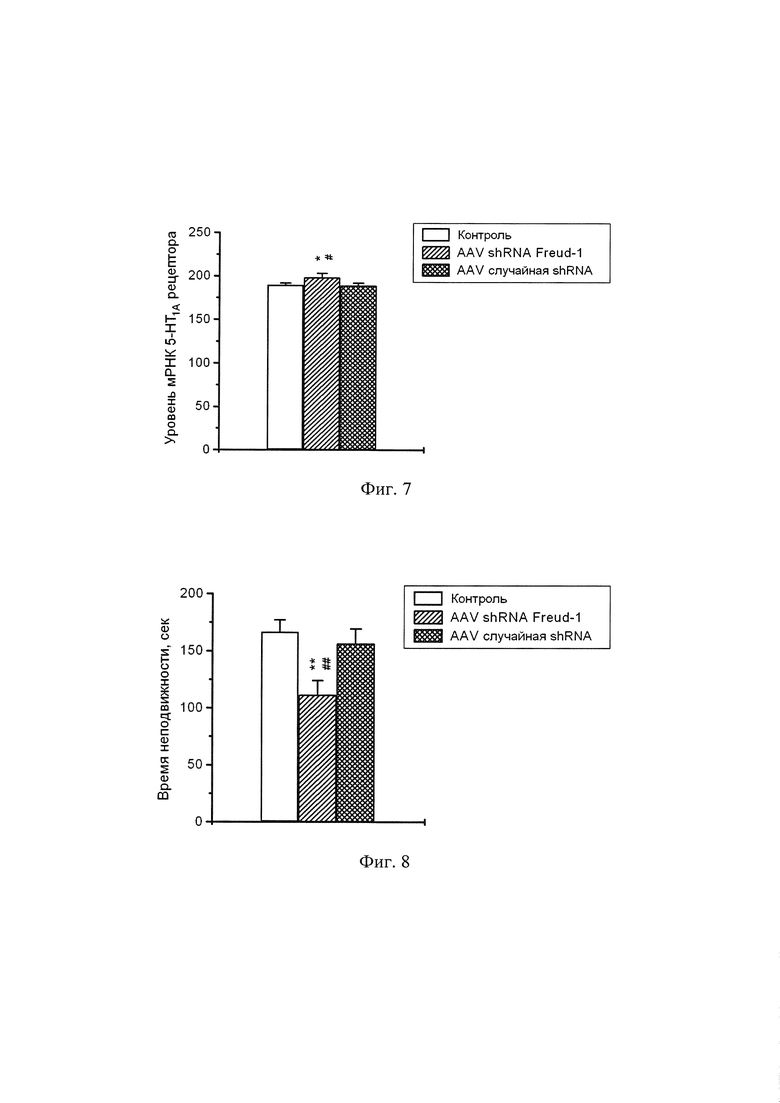
Фиг. 7. Экспрессия гена 5-НТ1А рецептора в гиппокампе мышей C57Bl6 через 43 дня после интрагиппокампального введения адено-ассоциированного вируса, несущего плазмиду AAV SynH1-2_shRNA Freud-1, либо плазмиду, кодирующую не имеющую сродства к геному мыши случайную shRNA, либо чистого буфера того же состава, что был использован для разведения вируса. * р<0.05 по сравнению с мышами, получившими иньекцию чистого буфера; # р<0.05 по сравнению с мышами, получившими инъекцию адено-ассоциированного вируса, несущего плазмиду кодирующую не имеющую сродства к геному мыши случайную shRNA.
Фиг. 8. Время неподвижности мышей C57Bl6 через 40 дней после интрагиппокампального введения адено-ассоциированного вируса, несущего плазмиду AAV SynH1-2_shRNA Freud-1, либо плазмиду, кодирующую не имеющую сродства к геному мыши случайную shRNA, либо чистого буфера того же состава, что был использован для разведения вируса, в тесте принудительного плавания. ** р<0.01 по сравнению с мышами, получившими инъекцию чистого буфера; ## р<0.01 по сравнению с мышами, получившими иньекцию адено-ассоциированного вируса, несущего плазмиду кодирующую не имеющую сродства к геному мыши случайную shRNA.
Для лучшего понимания сущности предлагаемого изобретения, оно иллюстрируются следующими примерами конкретного осуществления.
Пример 1. Получение двуцепочечного фрагмента ДНК, кодирующего образующую шпильку малую РНК (shRNA) комплиментарную гену, кодирующему селективный сайленсер серотонинового 5-НТ1А рецептора Freud-1 в мозге мыши.
На основе опубликованной в базе данных Genebank последовательности гена Freud-1 подбирают комплиментарную последовательность смысловой цепи shRNA длиной 19 нуклеотидных остатков. Через линкер, длиной 9 нуклеотидных остатков с 3'-конца добавляют обратную и комплиментарную данному олигонуклеотиду последовательность. Затем с 3'-конца добавляют терминатор транскрипции и сайт узнавания для эндонуклеазы SalI. С 5'-конца добавляют сайт узнавания для эндонуклеазы BglII через линкер длиной в 3 нуклеотидных остатка.
К полученной последовательности нуклеотидов (в данном случае 5'-gatccccagatacctctgaggctgtcttcaagagagacagcctcagaggtatctttttttggaaag) подбирают антисмысловую цепь - обратную комплиментарную последовательность, фланкированную сайтами узнавания для эндонуклеаз BglII с 3'-конца и SalI с 5'-конца, так, чтобы при отжиге со смысловой цепью получились липкие концы (в данном случае 5'-tcgactttccaaaaaaagatacctctgaggctgtctctcttgaagacagcctcagaggtatctggg).
После синтеза выбранных последовательностей, полученные олигонуклеотиды отжигают друг на друга после 10 сек денатурации при 95°С. В результате получают двуцепочечный фрагмент ДНК, кодирующий shRNA, комплиментарную гену, кодирующему селективный сайленсер серотонинового 5-НТ1А рецептора Freud-1 в мозге мышей и фланкированный сайтами узнавания для эндонуклеаз BglII с 5'-конца и SalI с 3'-конца.
Пример 2. Конструирование плазмидной ДНК AAV SynH1-2_shRNA Freud-1, кодирующей образующую шпильку малую РНК, подавляющую экспрессию гена, кодирующего селективный сайленсер серотонинового 5-НТ1А рецептора - Freud-1 в мозге мышей.
Исходную плазмиду AAV-Syn(0.5)-EGFP-H1-2 (Фиг. 1) модифицируют с целью вставки двуцепочечного фрагмента ДНК, кодирующего shRNA, комплиментарную гену, кодирующему селективный сайленсер серотонинового 5-НТ1А рецептора Freud-1 в мозге мыши, полученного в примере 1. Для этого плазмидную ДНК гидролизуют эндонуклеазами BglII и SalI, после чего полученный вектор лигируют с двуцепочечным фрагментом ДНК, полученным в примере 1, при помощи Т4 ДНК лигазы.
Клонирование полученной плазмиды AAV SynH1-2_shRNA Freud-1 (Фиг. 2). Для этого компетентные клетки E.coli трансформируют полученной в результате лигирования плазмидой AAV SynH1-2_shRNA Freud-1. Селекцию трансформированных клеток E.coli производят с помощью бактериальной среды с ампицилином.
Пример 3. Верификация клонированной плазмиды AAV SynH1-2_shRNA Freud-1
ПЦР-анализ. Данный способ верификации плазмиды AAV SynH1-2_shRNA Freud-1 основан на разнице в размерах оригинальной и исходной плазмид, за счет вставки двуцепочечного фрагмента ДНК, кодирующего shRNA комплиментарную гену Freud-1. Анализ проводится при помощи ПЦР с праймерами (F5'-gcatgtcgctatgtgttctgg; R5'-cctcatcctggtcctaaaac). ПЦР проводят в 25 мкл реакционной смеси, содержащей 0.5 ед. акт. Taq ДНК-полимеразы (Fermentas), 12.5 пмоль каждого олигонуклеотида, 0.2 мМ каждого дезоксинуклеозидтрифосфата, 75 мМ Трис-HCl (рН 8.8 при 25°С), 20 мМ (NH4)2SO4, 0.01% детергента tween-20, 2.5 мМ MgSO4. Проводят 30 циклов по схеме: 95°С/20 сек, 60°С/30 сек, 72°С/40 сек после 3 минут денатурации при 95°С. ПЦР продукты разделяют в 2% агарозном геле и окрашивают SYBR Safe (Life Technologies, USA). ПЦР продукты, полученные в данной реакции, имеют следующие размеры: без вставки - 404 п.н., со вставкой 469 п.н. (Фиг. 4).
Первичная нуклеотидная последовательность полученной плазмиды ДНК AAV SynH1-2_shRNA Freud-1, представленная на Фиг. 3, была определена методом Сэнгера с использованием набора "BigDye® Terminator v3.1" (Applied Biosystems) и автоматического капиллярного секвенатора ABI 3730 XL Genetic Analyser (Applied Biosystems).
Пример 4. Упаковка плазмиды AAV SynH1-2_shRNA Freud-1 в адено-ассоциированный вирусный капсид.
Сборка адено-ассоциированного вируса осуществляется с использованием полученной плазмиды с помощью ее котрансфекции с плазмидами-помощниками AAV-DJ и pHelper (Cell Biolabs, Inc., USA) в HEK (human embryonic kidney)-293FT клетки. Эффективность трансфекции контролируется посредством микроскопического анализа флуоресценции (зеленый флуоресцентный белок - оригинальная плазмида, красный флуоресцентный белок - плазмиды-помощники). Сбор вирусных частиц осуществляется через 48 часов согласно протоколу, описанному в работе [26]. Количество полученных вирусных частиц определяется с помощью количественного ПЦР в реальном времени с системой праймеров и зондом (F5'-cctggttgctgtctctttatgagg; R5'-tgacaggtggtggcaatgc; зонд 5'-FAM-cgttgtcaggcaacgtggcgtggtg-TAMRA-3'). В качестве стандарта для определения количества вирусных частиц используется серия разведений оригинальной плазмиды известной концентрации. Количество вирусных частиц оценивается по количеству вирусных геномов, определяемых в образеце, предварительно обработанном протеиназой К и используемом в качестве матрицы для количественного ПЦР. ПЦР проводится в 50 мкл реакционной смеси, содержащей 0.5 ед. акт. Taq ДНК-полимеразы (Fermentas), 12.5 пмоль каждого олигонуклеотида, 0.2 мМ каждого дезоксинуклеозидтрифосфата, 75 мМ Трис-HCl (рН 8.8 при 25°С), 20 мМ (NH4)2SO4, 0.01% детергента tween-20, 2.5 мМ MgSO4. Проводят 40 циклов по схеме: 95°С/15 сек, 60°С/30 сек после 10 секунд денатурации при 95°С. Количество полученных описанным способом вирусных частиц составляет 109.
Пример 5. Исследование эффектов экспрессии плазмиды AAV SynH1-2_shRNA Freud-1 в нейронах гиппокампа мыши.
Адено-ассоциированный вирус, несущий плазмиду AAV SynH1-2_shRNA Freud-1, вводят в гипокамп мышей. Для этого адено-ассоциированный вирус, несущий плазмиду AAV SynH1-2_shRNA Freud-1, разводят в буфере, содержащем 150 мМ NaCl и 10 мМ Tris (рН=7.4) до концентрации 108 вирусных частиц в микролитре. Данные плазмиды вводят мышам линии C57Bl6 непосредственно в гиппокамп с использованием стереотаксической установки (TSE Systems, Germany) согласно следующим координатам: АР: -1 мм, L: -1.0 мм, DV: 2 мм и АР: -1.0 мм, L: +1.0 мм, DV: 2 мм) [27]. В качестве контроля отдельным группам мышей аналогичным образом вводят чистый буфер, либо адено-ассоциированный вирус, несущий плазмиду, кодирующую не имеющую сродства к геному мыши случайную shRNA. Объем вводимой в гиппокамп жидкости составляет 5 мкл на каждый гиппокамп. Перед центральным введением животных наркотизируют при помощи смеси 2,2,2-трибромэтанола и 2-метил-2-бутанола (Sigma, USA). Через 40 дней после введения генетических конструктов или чистого буфера животных тестируют на депрессивно-подобное поведение в тесте вынужденного плавания. Через два дня животных декапитируют и на льду выделяют гиппокам. Структуры мозга хранятся при -80°С до процедуры выделения РНК или белка.
Для оценки экспрессии гена Freud-1 из гиппокампа мышей, получивших инъекцию адено-ассоциированного вируса, несущего плазмиду AAV SynH1-2_shRNA Freud-1, плазмиду, кодирующую не имеющую сродства к геному мыши случайную shRNA, либо чистый буфер, выделяют общую РНК. Общую РНК выделяют с помощью реагента Trizol (Bio Rad, USA) согласно инструкции производителя. Реакцию обратной транскрипции проводят с использованием статистического праймера. Экспрессию гена Freud-1 оценивают при помощи количественного ПЦР в реальном времени с использованием системы двух стандартов [28]. В качестве внешнего стандарта для количественной оценки уровня мРНК целевого гена используют серию разведений геномной ДНК мыши известной концентрации. В качестве внутреннего стандарта, необходимого для контроля выделения РНК и реакции обратной транскрипции, используют эндогенную мРНК гена домашнего хозяйства (конкретно, глицеральдегид-3-фосфат дегидрогеназу (Г-3-ФД)). Число копий кДНК генов Freud-1 и Г-3-ФД оценивают методом ПЦР в реальном времени с использованием детекции флуоресценции SYBR Green I (R-414 Master mix, Синтол, Россия) и системы праймеров F5'-gcaaagaagggcaacatcatc; R5'-tagcagaggtgggtgtagtgg для Freud-1 или F5'-gcaaggtcatcccagagctg; R5'-gtccaccaccctgttgctgtag для Г-3-ФД. Экспрессия гена выражается как отношение числа копий кДНК целевого гена на 100 копий кДНК Г-3-ФД.
Исследование экспрессии гена Freud-1 в гиппокампе мышей, получивших инъекцию адено-ассоциированного вируса, несущего плазмиду AAV SynH1-2_shRNA Freud-1, либо плазмиду, кодирующую не имеющую сродства к геному мыши случайную shRNA, либо чистый буфер показало, что кодируемая плазмидой shRNA против гена Freud-1 существенно (р<0.01) снижает экспрессию целевого гена, по сравнению с обоими используемыми контролями (случайная shRNA и чистый буфер) (Фиг. 5).
Оценку уровня белка Freud-1 проводили при помощи Вестерн-блот анализа. Общий белок выделяли, гомогенизируя образцы гиппокампа в лизирующем буфере, содержащем 300 мМ NaCl, 100 мМ Tris, рН=8, 4 мМ EDTA, 0,2% Triton Х-100, 1 mM NaVO4, 2 mM PMSF и коктейль ингибиторов протеаз. Инкубировали 1 час на льду, затем центрифугировали на 12000g 15 мин при 4°С и отбирали супернатант.
Концентрацию общего белка оценивали с помощью ВСА метода, используя коммерческий набор Pierce ВСА Protein Assay Kit (Thermo Fisher Scientific Inc., USA) и спектрофотометр NanoDrop 2000C (Thermo Fisher Scientific Inc., USA). В дальнейшем образцы приводили к равной концентрации с помощью 4-кратного Лемли буфера и денатурировали с помощью нагрева в течение 10 минут при 95°С. Образцы (15 мкг на дорожку) разделяли с помощью 8%-го SDS-PAGE гель-электрофореза и переносили на нитроцеллюлозую мембрану (Bio-Rad Laboratories, Inc., США), используя Trans-Blot Turbo Transfer System (Bio-Rad Laboratories, Inc., США). В качестве маркера использовали смесь Precision Plus Protein Kaleidoscope Standards (Bio-Rad Laboratories, Inc., США).
Для иммунодетекции белка мембрану блокировали с 5%-ным сухим обезжиренным молоком Blotting-Grade Blocker (Bio-Rad Laboratories, Inc., США), разведенном в TBS-T буфере (Tris Bufferd Saline, Bio-Rad Laboratories, Inc., США) с добавлением 0,1% Tween 20), в течение часа при комнатной температуре и инкубировали с первичными моноклональными антителами кролика к Freud-1 (1:5000, recombinant anti-CC2D1A antibody [EPR18421] (ab191472), Abcam, UK) при 4°C в течение ночи. Отмывали мембрану буфером TBS-T, добавляли вторичные поликлональные антитела козы, направленные против иммуноглобулинов кролика, конъюгированные с пероксидазой хрена (1:10000, G-21234, Invitrogen, США), и инкубировали в течение часа при комнатной температуре. Повторяли отмывку мембраны. В качестве внутреннего контроля были использованы поликлональные антитела кролика к GAPDH, конъюгированные с пероксидазой хрена (1:500; Santa Cruz Biotechnology Inc., США). Все связанные антитела визуализировали с помощью Clarity Western ECL Substrate (Bio-Rad Laboratories, Inc., США) в соответствии с инструкцией производителя и сканера C-DiGit для документации хемилюминесцентных блотов (LI-COR, США). Полученное изображение денситометрировали, и количественно оценивали содержание белка при помощи программы Scion Image (Scion Corporation, www.scioncorp.com). Экспрессию белка выражали в относительных единицах, нормировали на экспрессию GAPDH, которая конститутивна для клеток мозга, и представляли, как процент от контрольных животных.
Исследование уровня белка Freud-1 в гиппокампе мышей, получивших инъекцию адено-ассоциированного вируса, несущего плазмиду AAV SynH1-2_shRNA Freud-1, либо плазмиду, кодирующую не имеющую сродства к геному мыши случайную shRNA, либо чистый буфер показало, что кодируемая плазмидой shRNA против гена Freud-1 существенно (р<0.01) снижает количество сайленсера по сравнению с обоими используемыми контролями (случайная shRNA и чистый буфер) (Фиг. 6).
Экспрессию гена 5-НТ1А рецептора также оценивали при помощи количественного ПЦР в реальном времени с использованием системы двух стандартов [28]. Число копий кДНК генов 5-НТ1А рецептора Freud-1 и Г-3-ФД оценивали методом ПЦР в реальном времени с использованием детекции флуоресценции SYBR Green I (R-414 Master mix, Синтол, Россия) и системы праймеров F5'-gactgccaccctctgccctatatc; R5'-tcagcaaggcaaacaattccag для 5-НТ1А рецептора или F5'-gcaaggtcatcccagagctg; R5'-gtccaccaccctgttgctgtag для Г-3-ФД. Экспрессия гена выражается как отношение числа копий кДНК целевого гена на 100 копий кДНК Г-3-ФД.
Исследование экспрессии гена 5-НТ1А рецептора в гиппокампе мышей, получивших инъекцию адено-ассоциированного вируса, несущего плазмиду AAV SynH1-2_shRNA Freud-1, либо плазмиду, кодирующую не имеющую сродства к геному мыши случайную shRNA, либо чистый буфер показало, что кодируемая плазмидой shRNA против гена Freud-1 существенно (р<0.05) повышает экспрессию гена 5-НТ1А рецептора по сравнению с обоими используемыми контролями (случайная shRNA и чистый буфер) (Фиг. 7).
Исследование депрессивно-подобного поведения мышей, с нокдауном гена, кодирующего селективный саленсер 5-НТ1А рецепторов - Freud-1. Депрессивно-подобное поведение мышей, получивших инъекцию адено-ассоциированного вируса, несущего плазмиду AAV SynH1-2_shRNA Freud-1, либо плазмиду, кодирующую не имеющую сродства к геному мыши случайную shRNA, либо чистый буфер, проводили с помощью теста вынужденного плавания (forced swim test, FST). Тест проводили с использованием установки, состоящей из прямоугольного пластикового резервуара с боковыми матовыми непрозрачными гранями и полупрозрачным дном (14×14×22 см), освещенный снизу двумя галогеновыми лампами мощностью 12 Вт. Животное помещали в резервуар, заполненный на 3/4 водой (25-26°С). После 120 с адаптации в течение 4 мин регистрировали суммарное время неподвижности [29].
Исследование депрессивно-подобного поведения у подопытных мышей показало, что кодируемая плазмидой shRNA против гена Freud-1 существенно (р<0.01) снижает выраженность депрессивно-подобного поведения мышей линии C57Bl6 по сравнению с обоими используемыми контролями (случайная shRNA и чистый буфер) (Фиг. 8).
Таким образом, впервые получена плазмида AAV SynH1-2_shRNA Freud-1, кодирующая синтез shRNA, направленной на подавление экспрессии гена селективного сайленсера 5-НТ1А рецептора Freud-1.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Popova N.K., Naumenko V.S. 2013. 5-HT1A receptor as a key player in the brain 5-HT system. Reviews in the neurosciences. 24, 191-204.
2. Fuller R.W. 1991. Role of serotonin in therapy of depression and related disorders. The Journal of clinical psychiatry. 52 Suppl, 52-57.
3. Heisler L.K., Chu H.M., Brennan T.J., Danao J.A., Bajwa P., Parsons L.H., Tecott L.H. 1998. Elevated anxiety and antidepressant-like responses in serotonin 5-HT1A receptor mutant mice. Proc Natl Acad Sci USA. 95, 15049-15054.
4. Overstreet D.H., Commissaris R.C., De La Garza R., 2nd, File S.E., Knapp D.J., Seiden L.S. 2003. Involvement of 5-HT1A receptors in animal tests of anxiety and depression: evidence from genetic models. Stress. 6, 101-110.
5. Ramboz S., Oosting R., Amara D.A., Kung H.F., Blier P., Mendelsohn M., Mann J.J., Brunner D., Hen R. 1998. Serotonin receptor 1A knockout: an animal model of anxiety-related disorder. Proc Natl Acad Sci USA. 95, 14476-14481.
6. Richardson-Jones J.W., Craige C.P., Guiard B.P., Stephen A., Metzger K.L., Kung H.F., Gardier A.M., Dranovsky A., David D.J., Beck S.G., Hen R., Leonardo E.D. 2010. 5-HT1A autoreceptor levels determine vulnerability to stress and response to antidepressants. Neuron. 65, 40-52.
7. Albert P.R., Le Francois В., Millar A.M. 2011. Transcriptional dysregulation of 5-HT1A autoreceptors in mental illness. Molecular brain. 4, 21.
8. Maes M., Meltzer H.Y. 1995. The serotonin hypothesis of major depression. Psychopharmacology: The Fourth Generation of Progress. 933-944.
9. Lowther S., De Paermentier F., Cheetham S.C., Crompton M.R., Katona C.L., Horton R.W. 1997. 5-HT1A receptor binding sites in post-mortem brain samples from depressed suicides and controls. J Affect Disord. 42, 199-207.
10. Arango V., Underwood M.D., Boldrini M., Tamir H., Kassir S.A., Hsiung S., Chen J.J., Mann J.J. 2001. Serotonin 1A receptors, serotonin transporter binding and serotonin transporter mRNA expression in the brainstem of depressed suicide victims. Neuropsychopharmacology. 25, 892-903.
11. Stockmeier C.A., Shapiro L.A., Dilley G.E., Kolli T.N., Friedman L., Rajkowska G. 1998. Increase in serotonin-1A autoreceptors in the midbrain of suicide victims with major depression-postmortem evidence for decreased serotonin activity. The Journal of neuroscience: the official journal of the Society for Neuroscience. 18, 7394-7401.
12. Albert P.R., Lemonde S. 2004. 5-HT1A receptors, gene repression, and depression: guilt by association. The Neuroscientist: a review journal bringing neurobiology, neurology and psychiatry. 10, 575-593.
13. Zhang H., Wang W., Jiang Z., Shang J., Zhang L. 2010. Differential involvement of 5-HT(1A) and 5-HT(1B/1D) receptors in human interferon-alpha-induced immobility in the mouse forced swimming test. Arzneimittelforschung. 60, 109-115.
14. Ou X.M., Jafar-Nejad H., Storring J.M., Meng J.H., Lemonde S., Albert P.R. 2000. Novel dual repressor elements for neuronal cell-specific transcription of the rat 5-HT1A receptor gene. J Biol Chem. 275, 8161-8168.
15. Ou X.M., Lemonde S., Jafar-Nejad H., Bown C.D., Goto A., Rogaeva A., Albert P.R. 2003. Freud-1: A neuronal calcium-regulated repressor of the 5-HT1A receptor gene. The Journal of neuroscience: the official journal of the Society for Neuroscience. 23, 7415-7425.
16. Rogaeva A., Albert P.R. 2007. The mental retardation gene CC2D1A/Freud-1 encodes a long isoform that binds conserved DNA elements to repress gene transcription. Eur J Neurosci. 26, 965-974.
17. Rogaeva A., Galaraga K., Albert P.R. 2007. The Freud-1/CC2D1A family: transcriptional regulators implicated in mental retardation. J Neurosci Res. 85, 2833-2838.
18. de Boer S.F., Lesourd M., Mocaer E., Koolhaas J.M. 1999. Selective antiaggressive effects of alnespirone in resident-intruder test are mediated via 5-hydroxytryptamine1A receptors: A comparative pharmacological study with 8-hydroxy-2-dipropylaminotetralin, ipsapirone, buspirone, eltoprazine, and WAY-100635. J Pharmacol Exp Ther. 288, 1125-1133.
19. Pruus K., Skrebuhhova-Malmros Т., Rudissaar R., Matto V., Allikmets L. 2000. 5-HT1A receptor agonists buspirone and gepirone attenuate apomorphine-induced aggressive behaviour in adult male Wistar rats. J Physiol Pharmacol. 51, 833-846.
20. Robinson D.S., Alms D.R., Shrotriya R.C., Messina M., Wickramaratne P. 1989. Serotonergic anxiolytics and treatment of depression. Psychopathology. 22 Suppl 1, 27-36.
21. Blier P., de Montigny C. 1994. Current advances and trends in the treatment of depression. Trends Pharmacol Sci. 15, 220-226.
22. Handley S.L. 1995. 5-Hydroxytryptamine pathways in anxiety and its treatment. Pharmacol Ther. 66, 103-148.
23. Rakel R.E. 1990. Long-term buspirone therapy for chronic anxiety: a multicenter international study to determine safety. South Med J. 83, 194-198.
24. Kusserow H., Davies В., Hortnagl H., Voigt I., Stroh Т., Bert В., Deng D.R., Fink H., Veh R.W., Theuring F. 2004. Reduced anxiety-related behaviour in transgenic mice overexpressing serotonin 1A receptors. Brain Res Mol Brain Res. 129, 104-116.
25. Wirth A., Chen-Wacker C., Wu Y.W., Gorinski N., Filippov M.A., Pandey G., Ponimaskin E. 2013. Dual lipidation of the brain-specific Cdc42 isoform regulates its functional properties. The Biochemical journal. 456, 311-322.
26. Grimm D., Kay M.A., Kleinschmidt J.A. 2003. Helper virus-free, optically controllable, and two-plasmid-based production of adeno-associated virus vectors of serotypes 1 to 6. Mol Ther. 7, 839-850.
27. Slotnick B.M., Leonard C.M. 1975. A stereotaxic atlas of the albino mouse forebrain. Rockville, Maryland: U.S. Dept. of Health, Education and Welfare.
28. Naumenko V.S., Osipova D.V., Kostina E.V., Kulikov A.V. 2008. Utilization of a two-standard system in real-time PCR for quantification of gene expression in the brain. J Neurosci Methods. 170, 197-203.
29. Cervo L., Canetta A., Calcagno E., Burbassi S., Sacchetti G., Caccia S., Fracasso C., Albani D., Forloni G., Invernizzi R.W. 2005. Genotype-dependent activity of tryptophan hydroxylase-2 determines the response to citalopram in a mouse model of depression. The Journal of neuroscience: the official journal of the Society for Neuroscience. 25, 8165-8172.
Перечень последовательностей
<110>
Федеральное государственное бюджетное научное учреждение «Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук» (ИЦиГ СО РАН)
<120>
Рекомбинантная плазмидная ДНК AAV SynH1-2_shRNA Freud-1, обеспечивающая синтез shРНК, подавляющей экспрессию гена, кодирующего селективный сайленсер 5-НТ1А рецептора Freud-1, в мозге млекопитающих
<160>
Номер SEQ ID NO 1
<210>
1
<211>
5863
<212>
Plasmid DNA
<213>
--->
<400>
1
1 CCTGCAGGCA GCTGCGCGCT CGCTCGCTCA CTGAGGCCGC CCGGGCAAAG CCCGGGCGTC
61 GGGCGACCTT TGGTCGCCCG GCCTCAGTGA GCGAGCGAGC GCGCAGAGAG GGAGTGGCCA
121 ACTCCATCAC TAGGGGTTCC TGCGGCCGCA CGCGTGAACG CTGACGTCAT CAACCCGCTC
181 CAAGGAATCG CGGGCCCAGT GTCACTAGGC GGGAACACCC AGCGCGCGTG CGCCCTGGCA
241 GGAAGATGGC TGTGAGGGAC AGGGGAGTGG CGCCCTGCAA TATTTGCATG TCGCTATGTG
301 TTCTGGGAAA TCACCATAAA CGTGAAATGT CTTTGGATTT GGGAATCTTA TAAGTTCTGT
361 ATGAGACCAC AGATCCCCAG ATACCTCTGA GGCTGTCTTC AAGAGAGACA GCCTCAGAGG
421 TATCTTTTTT TGGAAAGTCG ACCTCGAGGG GGGGCCCGGT ACCCAGCTTT TGTTCCCTTT
481 AGTGAGGGAC GCGTTCTAGA AATATTAAGG TACGGGAGGT ACTTGGAGCG GCCGCAATAA
541 AATATCTTTA TTTTCATTAC ATCTGTGTGT TGGTTTTTTG TGTGAATCGA TAGTACTAAC
601 ATACGCTCTC CATCAAAACA AAACGAAACA AAACAAACTA GCAAAATAGG CTGTCCCCAG
661 TGCAAGTGCA GGTGCCAGAA CATTTCTCTA TTCTAGACTC GAGCTGCAGA GGGCCCTGCG
721 TATGAGTGCA AGTGGGTTTT AGGACCAGGA TGAGGCGGGG TGGGGGTGCC TACCTGACGA
781 CCGACCCCGA CCCACTGGAC AAGCACCCAA CCCCCATTCC CCAAATTGCG CATCCCCTAT
841 CAGAGAGGGG GAGGGGAAAC AGGATGCGGC GAGGCGCGTG CGCACTGCCA GCTTCAGCAC
901 CGCGGACAGT GCCTTCGCCC CCGCCTGGCG GCGCGCGCCA CCGCCGCCTC AGCACTGAAG
961 GCGCGCTGAC GTCACTCGCC GGTCCCCCGC AAACTCCCCT TCCCGGCCAC CTTGGTCGCG
1021 TCCGCGCCGC CGCCGGCCCA GCCGGACCGC ACCACGCGAG GCGCGAGATA GGGGGGCACG
1081 GGCGCGACCA TCTGCGCTGC GGCGCCGGCG ACTCAGCGCT GCCTCAGTCT GCGGTGGGCA
1141 GCGGAGGAGT CGTGTCGTGC CTGAGAGCGC AGTCGAGAAT TCAAGCTGCT AGCAAGGATC
1201 CCCGGGTACC GGTCGCCACC ATGGTGAGCA AGGGCGAGGA GCTGTTCACC GGGGTGGTGC
1261 CCATCCTGGT CGAGCTGGAC GGCGACGTAA ACGGCCACAA GTTCAGCGTG TCCGGCGAGG
1321 GCGAGGGCGA TGCCACCTAC GGCAAGCTGA CCCTGAAGTT CATCTGCACC ACCGGCAAGC
1381 TGCCCGTGCC CTGGCCCACC CTCGTGACCA CCCTGACCTA CGGCGTGCAG TGCTTCAGCC
1441 GCTACCCCGA CCACATGAAG CAGCACGACT TCTTCAAGTC CGCCATGCCC GAAGGCTACG
1501 TCCAGGAGCG CACCATCTTC TTCAAGGACG ACGGCAACTA CAAGACCCGC GCCGAGGTGA
1561 AGTTCGAGGG CGACACCCTG GTGAACCGCA TCGAGCTGAA GGGCATCGAC TTCAAGGAGG
1621 ACGGCAACAT CCTGGGGCAC AAGCTGGAGT ACAACTACAA CAGCCACAAC GTCTATATCA
1681 TGGCCGACAA GCAGAAGAAC GGCATCAAGG TGAACTTCAA GATCCGCCAC AACATCGAGG
1741 ACGGCAGCGT GCAGCTCGCC GACCACTACC AGCAGAACAC CCCCATCGGC GACGGCCCCG
1801 TGCTGCTGCC CGACAACCAC TACCTGAGCA CCCAGTCCGC CCTGAGCAAA GACCCCAACG
1861 AGAAGCGCGA TCACATGGTC CTGCTGGAGT TCGTGACCGC CGCCGGGATC ACTCTCGGCA
1921 TGGACGAGCT GTACAAGTAA AGCGGCCGCG ACTCTAGAAT TCGATATCAA GCTAGCTTAT
1981 CGATAATCAA CCTCTGGATT ACAAAATTTG TGAAAGATTG ACTGGTATTC TTAACTATGT
2041 TGCTCCTTTT ACGCTATGTG GATACGCTGC TTTAATGCCT TTGTATCATG CTATTGCTTC
2101 CCGTATGGCT TTCATTTTCT CCTCCTTGTA TAAATCCTGG TTGCTGTCTC TTTATGAGGA
2161 GTTGTGGCCC GTTGTCAGGC AACGTGGCGT GGTGTGCACT GTGTTTGCTG ACGCAACCCC
2221 CACTGGTTGG GGCATTGCCA CCACCTGTCA GCTCCTTTCC GGGACTTTCG CTTTCCCCCT
2281 CCCTATTGCC ACGGCGGAAC TCATCGCCGC CTGCCTTGCC CGCTGCTGGA CAGGGGCTCG
2341 GCTGTTGGGC ACTGACAATT CCGTGGTGTT GTCGGGGAAA TCATCGTCCT TTCCTTGGCT
2401 GCTCGCCTGT GTTGCCACCT GGATTCTGCG CGGGACGTCC TTCTGCTACG TCCCTTCGGC
2461 CCTCAATCCA GCGGACCTTC CTTCCCGCGG CCTGCTGCCG GCTCTGCGGC CTCTTCCGCG
2521 TCTTCGCCTT CGCCCTCAGA CGAGTCGGAT CTCCCTTTGG GCCGCCTCCC CGCATCGATA
2581 CCGTCGATCG ACCTCGAGAG ATCGATCTAC GGGTGGCATC CCTGTGACCC CTCCCCAGTG
2641 CCTCTCCTGG CCCTGGAAGT TGCCACTCCA GTGCCCACCA GCCTTGTCCT AATAAAATTA
2701 AGTTGCATCA TTTTGTCTGA CTAGGTGTCC TTCTATAATA TTATGGGGTG GAGGGGGGTG
2761 GTATGGAGCA AGGGGCAAGT TGGGAAGACA ACCTGTAGGG CCTGCGGGGT CTATTGGGAA
2821 CCAAGCTGGA GTGCAGTGGC ACAATCTTGG CTCACTGCAA TCTCCGCCTC CTGGGTTCAA
2881 GCGATTCTCC TGCCTCAGCC TCCCGAGTTG TTGGGATTCC AGGCATGCAT GACCAGGCTC
2941 AGCTAATTTT TGTTTTTTTG GTAGAGACGG GGTTTCACCA TATTGGCCAG GCTGGTCTCC
3001 AACTCCTAAT CTCAGGTGAT CTACCCACCT TGGCCTCCCA AATTGCTGGG ATTACAGGCG
3061 TGAACCACTG CTCCCTTCCC TGTCCTTCTG ATTTTGTAGG TAACCACGTG CGGACCGAGC
3121 GGCCGCAGGA ACCCCTAGTG ATGGAGTTGG CCACTCCCTC TCTGCGCGCT CGCTCGCTCA
3181 CTGAGGCCGG GCGACCAAAG GTCGCCCGAC GCCCGGGCTT TGCCCGGGCG GCCTCAGTGA
3241 GCGAGCGAGC GCGCAGCTGC CTGCAGGGGC GCCTGATGCG GTATTTTCTC CTTACGCATC
3301 TGTGCGGTAT TTCACACCGC ATACGTCAAA GCAACCATAG TACGCGCCCT GTAGCGGCGC
3361 ATTAAGCGCG GCGGGTGTGG TGGTTACGCG CAGCGTGACC GCTACACTTG CCAGCGCCCT
3421 AGCGCCCGCT CCTTTCGCTT TCTTCCCTTC CTTTCTCGCC ACGTTCGCCG GCTTTCCCCG
3481 TCAAGCTCTA AATCGGGGGC TCCCTTTAGG GTTCCGATTT AGTGCTTTAC GGCACCTCGA
3541 CCCCAAAAAA CTTGATTTGG GTGATGGTTC ACGTAGTGGG CCATCGCCCT GATAGACGGT
3601 TTTTCGCCCT TTGACGTTGG AGTCCACGTT CTTTAATAGT GGACTCTTGT TCCAAACTGG
3661 AACAACACTC AACCCTATCT CGGGCTATTC TTTTGATTTA TAAGGGATTT TGCCGATTTC
3721 GGCCTATTGG TTAAAAAATG AGCTGATTTA ACAAAAATTT AACGCGAATT TTAACAAAAT
3781 ATTAACGTTT ACAATTTTAT GGTGCACTCT CAGTACAATC TGCTCTGATG CCGCATAGTT
3841 AAGCCAGCCC CGACACCCGC CAACACCCGC TGACGCGCCC TGACGGGCTT GTCTGCTCCC
3901 GGCATCCGCT TACAGACAAG CTGTGACCGT CTCCGGGAGC TGCATGTGTC AGAGGTTTTC
3961 ACCGTCATCA CCGAAACGCG CGAGACGAAA GGGCCTCGTG ATACGCCTAT TTTTATAGGT
4021 TAATGTCATG ATAATAATGG TTTCTTAGAC GTCAGGTGGC ACTTTTCGGG GAAATGTGCG
4081 CGGAACCCCT ATTTGTTTAT TTTTCTAAAT ACATTCAAAT ATGTATCCGC TCATGAGACA
4141 ATAACCCTGA TAAATGCTTC AATAATATTG AAAAAGGAAG AGTATGAGTA TTCAACATTT
4201 CCGTGTCGCC CTTATTCCCT TTTTTGCGGC ATTTTGCCTT CCTGTTTTTG CTCACCCAGA
4261 AACGCTGGTG AAAGTAAAAG ATGCTGAAGA TCAGTTGGGT GCACGAGTGG GTTACATCGA
4321 ACTGGATCTC AACAGCGGTA AGATCCTTGA GAGTTTTCGC CCCGAAGAAC GTTTTCCAAT
4381 GATGAGCACT TTTAAAGTTC TGCTATGTGG CGCGGTATTA TCCCGTATTG ACGCCGGGCA
4441 AGAGCAACTC GGTCGCCGCA TACACTATTC TCAGAATGAC TTGGTTGAGT ACTCACCAGT
4501 CACAGAAAAG CATCTTACGG ATGGCATGAC AGTAAGAGAA TTATGCAGTG CTGCCATAAC
4561 CATGAGTGAT AACACTGCGG CCAACTTACT TCTGACAACG ATCGGAGGAC CGAAGGAGCT
4621 AACCGCTTTT TTGCACAACA TGGGGGATCA TGTAACTCGC CTTGATCGTT GGGAACCGGA
4681 GCTGAATGAA GCCATACCAA ACGACGAGCG TGACACCACG ATGCCTGTAG CAATGGCAAC
4741 AACGTTGCGC AAACTATTAA CTGGCGAACT ACTTACTCTA GCTTCCCGGC AACAATTAAT
4801 AGACTGGATG GAGGCGGATA AAGTTGCAGG ACCACTTCTG CGCTCGGCCC TTCCGGCTGG
4861 CTGGTTTATT GCTGATAAAT CTGGAGCCGG TGAGCGTGGG TCTCGCGGTA TCATTGCAGC
4921 ACTGGGGCCA GATGGTAAGC CCTCCCGTAT CGTAGTTATC TACACGACGG GGAGTCAGGC
4981 AACTATGGAT GAACGAAATA GACAGATCGC TGAGATAGGT GCCTCACTGA TTAAGCATTG
5041 GTAACTGTCA GACCAAGTTT ACTCATATAT ACTTTAGATT GATTTAAAAC TTCATTTTTA
5101 ATTTAAAAGG ATCTAGGTGA AGATCCTTTT TGATAATCTC ATGACCAAAA TCCCTTAACG
5161 TGAGTTTTCG TTCCACTGAG CGTCAGACCC CGTAGAAAAG ATCAAAGGAT CTTCTTGAGA
5221 TCCTTTTTTT CTGCGCGTAA TCTGCTGCTT GCAAACAAAA AAACCACCGC TACCAGCGGT
5281 GGTTTGTTTG CCGGATCAAG AGCTACCAAC TCTTTTTCCG AAGGTAACTG GCTTCAGCAG
5341 AGCGCAGATA CCAAATACTG TCCTTCTAGT GTAGCCGTAG TTAGGCCACC ACTTCAAGAA
5401 CTCTGTAGCA CCGCCTACAT ACCTCGCTCT GCTAATCCTG TTACCAGTGG CTGCTGCCAG
5461 TGGCGATAAG TCGTGTCTTA CCGGGTTGGA CTCAAGACGA TAGTTACCGG ATAAGGCGCA
5521 GCGGTCGGGC TGAACGGGGG GTTCGTGCAC ACAGCCCAGC TTGGAGCGAA CGACCTACAC
5581 CGAACTGAGA TACCTACAGC GTGAGCTATG AGAAAGCGCC ACGCTTCCCG AAGGGAGAAA
5641 GGCGGACAGG TATCCGGTAA GCGGCAGGGT CGGAACAGGA GAGCGCACGA GGGAGCTTCC
5701 AGGGGGAAAC GCCTGGTATC TTTATAGTCC TGTCGGGTTT CGCCACCTCT GACTTGAGCG
5761 TCGATTTTTG TGATGCTCGT CAGGGGGGCG GAGCCTATGG AAAAACGCCA GCAACGCGGC
CTTTTTACGG TTCCTGGCCT TTTGCTGGCC TTTTGCTCAC ATGT – 5863
<---







Изобретение относится к области биотехнологии, конкретно к рекомбинантым экспрессионным плазмидам, и может быть использовано для синтеза образующей шпильку малой РНК (shРНК), подавляющей экспрессию гена, кодирующего селективный сайленсер 5-НТ1А рецептора Freud-1, в мозге млекопитающих. Сконструирована плазмида AAV SynH1-2_shRNA Freud-1, которая упакована в адено-ассоциированный вирусный капсид для обеспечения доставки конструкта в нейроны млекопитающих. Транскрипция кодируемой плазмидой AAV SynH1-2_shRNA Freud-1 shРНК в нейронах мыши снижает экспрессию селективного сайленсера серотонинового 5-HT1A рецептора Freud-1, приводя тем самым к усилению экспрессии 5-НТ1А рецептора в мозге мышей и, как следствие, оказывая антидепрессантное действие. 5 пр., 8 ил.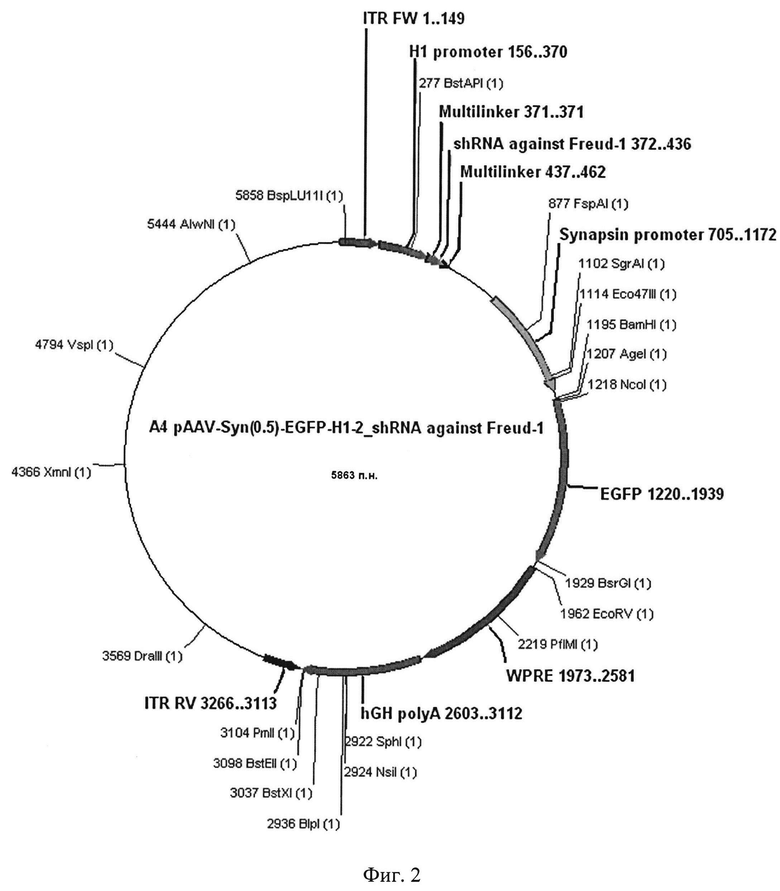
Рекомбинантная плазмидная ДНК AAV SynH1-2_shRNA Freud-1, обеспечивающая синтез shРНК, подавляющей экспрессию гена, кодирующего селективный сайленсер 5-НТ1А рецептора Freud-1, в мозге млекопитающих, размером 5863 п.н., имеющая нуклеотидную последовательность SEQ ID NO 1, содержащая в соответствии с графической картой:
- фланкированный инвертированными повторами (ITR) фрагмент плазмиды, содержащий гистоновый H1 промотер длиной 281 п.н. и вставку последовательности нуклеотидов, кодирующую образующую шпильку малую РНК (shRNA), комплиментарную гену, кодирующему селективный сайленсер серотонинового 5-НТ1А рецептора Freud-1 в мозге мыши длиной 65 п.н.;
- зеленый флуоресцентный белок длиной 720 п.н. под контролем синапсинового промотора длиной 468 п.н.;
- посттрансляционный регулятор длиной 609 п.н. и сайт hGH polyA длиной 509 п.н.;
- нефланкированный инвертированными повторами фрагмент плазмиды длиной 2597 п.н., содержащий ген устойчивости к ампицилину, необходимый для селекции целевых плазмид на этапе клонирования, а также ориджин репликации плазмиды;
- уникальные сайты узнавания эндонуклеазами рестрикции, имеющие следующие координаты: BamH1 - 1195, AgeI - 1207, EcorV - 1962.
| VANTREASE J.E | |||
| etal., 5-HT1A Receptors of the Nucleus TractusSolitarii Facilitate Sympathetic Recovery Following Hypotensive Hemorrhage in Rats, Am | |||
| J | |||
| Physiol | |||
| HeartCirc | |||
| Physiol., 2015, v.309, n.2, p.H335-h344 | |||
| НАУМЕНКО В.С | |||
| и др., О роли селективного сайленсераFREUD-1 в регуляции экспрессии гена 5-НТ1-рецептора мозга, МОЛЕКУЛЯРНАЯ БИОЛОГИЯ, |
Авторы
Даты
2020-07-15—Публикация
2019-12-18—Подача