ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной патентной заявки США № 62/555110, поданной 7 сентября 2017 года, и предварительной патентной заявки США № 62/566824, поданной 2 октября 2017 года, полное содержание которых, таким образом, включенно в качестве ссылки в полном объеме для всех целей.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит список последовательностей, который был подан в электронном виде в формате ASCII, и включен, таким образом, в качестве ссылки в полном объеме. Указанная копия ASCII, созданная 6 сентября 2018 года, называется DFY-038WO_SL.txt и имеет размер 321395 байт.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к мультиспецифическим связывающим белкам, которые связываются с NKG2D, CD16 и опухолеассоциированным антигеном.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Злокачественная опухоль продолжает оставаться серьезной проблемой для здоровья, несмотря на значительные исследовательские усилия и научные достижения, описанные в литературе по лечению этого заболевания. Некоторые из наиболее часто диагностируемых злокачественных опухолей включают рак предстательной железы, рак молочной железы, рак легких и колоректальный рак. Рак предстательной железы является наиболее распространенной формой злокачественной опухоли у мужчин. Рак молочной железы остается основной причиной смерти у женщин. Злокачественные опухоли крови и костного мозга, включая множественные миеломы, лейкоз и лимфомы, также являются часто диагностируемыми типами злокачественных опухолей. Существующие варианты лечения этих злокачественных опухолей эффективны не для всех пациентов и/или могут иметь существенные побочные эффекты. Другие типы злокачественных опухолей также остаются сложными для лечения с использованием существующих терапевтических вариантов.
Желательна иммунотерапия злокачественных опухолей, потому что она высокоспецифична и может способствовать разрушению злокачественных клеток с помощью собственной иммунной системы пациента. Слитые белки, такие как биспецифические привлекающие Т-клетки активаторы представляют собой иммунотерапию злокачественных опухолей, описанную в литературе, которая связывается с опухолевыми клетками и Т-клетками для облегчения разрушения опухолевых клеток. Антитела, которые связывают определенные опухолеассоциированные антигены и определенные иммунные клетки, были описаны в литературе. См., например WO 2016/134371 и WO 2015/095412.
Клетки-естественные киллеры (НК) являются компонентом врожденной иммунной системы и составляют примерно 15% циркулирующих лимфоцитов. NK-клетки проникают практически во все ткани и первоначально характеризовались своей способностью эффективно убивать опухолевые клетки без необходимости предварительной сенсибилизации. Активированные NK-клетки убивают клетки-мишени с помощью цитотоксических Т-клеток, т.е. через цитолитические гранулы, которые содержат перфорин и гранзимы, а также через пути рецептора смерти. Активированные NK-клетки также секретируют воспалительные цитокины, такие как IFN-гамма, и хемокины, которые способствуют привлечению других лейкоцитов к ткани-мишени.
NK-клетки отвечают на сигналы через ряд активирующих и ингибирующих рецепторов на их поверхности. Например, когда NK-клетки встречают здоровые клетки собственного организма, их активность ингибируется за счет активации иммуноглобулиноподобных рецепторов клеток-киллеров (KIR). Альтернативно, когда NK-клетки сталкиваются с чужеродными или злокачественными клетками, они активируются через свои активирующие рецепторы (например, член D группы 2 естественных киллеров (NKG2D), NCR, DNAM1). NK-клетки также активируются константной областью некоторых иммуноглобулинов через рецепторы CD16 на их поверхности. Общая чувствительность НК-клеток к активации зависит от суммы стимулирующих и ингибиторных сигналов.
Молекула адгезии эпителиальных клеток (EpCAM) представляет собой трансмембранный гликопротеин, опосредующий Ca2+-независимую гомотипическую межклеточную адгезию в эпителии. EpCAM также участвует в передаче клеточных сигналов, миграцию, пролиферацию и дифференцировку. Кроме того, EpCAM обладает онкогенным потенциалом из-за способности активировать c-myc, e-fabp и циклины A и E. Поскольку EpCAM экспрессируется исключительно в эпителии и неоплазиях эпителиального происхождения, EpCAM можно использовать в качестве диагностического маркера для различных злокачественных опухолей, таких как рак головы и шеи, рак яичников, рак мочевого пузыря, рак молочной железы, колоректальный рак, рак предстательной железы, рак желудка, рак печени, рак пищевода и рак легких. По-видимому, он играет роль в образовании опухоли и метастазировании карцином, поэтому он также может выступать в качестве потенциального прогностического маркера и в качестве потенциальной мишени для стратегий иммунотерапии.
CA125, также известный как муцин 16, является членом муцинового семейства гликопротеинов. CA-125 нашел применение в качестве опухолевого маркера или биомаркера, который может повышаться в крови некоторых пациентов с определенными типами злокачественных опухолей, включая рак яичников, злокачественную опухоль эндометрия и рак поджелудочной железы. Было показано, что CA-125 играет роль в развитии образования опухоли и опухолевой пролиферации с помощью нескольких различных механизмов, включая подавление ответа клеток-естественных киллеров и, тем самым, защищая злокачественные клетки от иммунного ответа; и путем роста клеток и стимулирования клеточной подвижности.
Натрий-зависимый фосфат-транспортный белок 2b (NaPi2b) участвует в активной транспортировке фосфата в клетки посредством совместного транспорта с Na+. Например, он является основным белком транспорта фосфатов в мембране щеточной каймы кишечника и играет роль в синтезе поверхностно-активного вещества в легочных альвеолах. NaPi2b также является антигеном, экспрессируемым в ряде злокачественных опухолей, таких как рак легких, рак яичников и рак щитовидной железы.
Нектин 4 является членом семейства нектинов, которое представляет собой семейство клеточных молекул адгезии, участвующих в Ca2+-зависимой клеточной адгезии. Нектины повсеместно экспрессируются и играют адгезивную роль в широком спектре тканей, такую как адгезивное соединение эпителия или химический синапс нейрональной ткани. Это также ассоциированный с опухолью антиген, экспрессирующийся в злокачественных опухолях, таких как рак мочевого пузыря, рак молочной железы, рак яичников, рак поджелудочной железы, колоректальный рак и рак легких.
Ганглиозиды вовлечены во многие физиологические процессы, включая рост, дифференцировку, миграцию и апоптоз посредством модуляции как клеточных сигнальных процессов, так и межклеточных взаимодействий и взаимодействий клетка-матрикс. GM1 представляет собой ганглиозид, фукозил-GM1 представляет собой ганглиозид с уникальной структурой, в которой терминальная галактоза является α-1,2-фукозилированной на невосстанавливающемся конце. Он экспрессируется в очень немногих нормальных тканях, но встречается в ряде злокачественных опухолей, таких как мелкоклеточный рак легких, нейробластома, рак печени. Таким образом, фукозил-GM1 рассматривается в качестве кандидатного опухолевого маркера и целевого антигена в иммунотерапии антителами для мелкоклеточного рака легких, нейробластомы, рака печени.
Белки ADAM (дезинтегрин и металлопротеиназа) играют доминирующую роль в отщеплении белкового эктодомена мембраносвязанных молекул. Они стали известны как важнейшие регуляторы межклеточной передачи сигналов во время развития и гомеостаза, и, как полагают, способствуют патологиям, таким как злокачественная опухоль, где их регуляция изменена. ADAM8, член семейства ADAM, сверхэкспрессирован в раке поджелудочной железы, раке молочной железы, раке легких и злокачественной опухоли почки. Было показано, что ADAM9 расщепляет и высвобождает ряд молекул с важными ролями в образовании опухоли и ангиогенезе, например, EGF, FGFR2IIIb, Tie-2, Flk-1, EphB4, CD40, VCAM-1 и VE-кадгерин. ADAM9 сверхэкспрессирован в злокачественной опухоли почки, раке молочной железы, раке легких, раке печени, раке поджелудочной железы, меланоме, раке матки, раке предстательной железы, остеосаркоме и злокачественной опухоли головного мозга.
SLC44A4, также известный как CTL4, является членом семейства растворимых белков-переносчиков, известных как белки, подобные транспортеру холина (CTL1-5). Было показано, что SLC44A4 не участвует в транспорте холина, но он связан с синтезом и транспортом ацетилхолина, а также с поглощением тиамина пирофосфата, фосфорилированной формы витамина B1. SLC44A4 обычно экспрессируется на апикальной поверхности секреторных эпителиальных клеток, но он заметно активируется в ряде эпителиальных опухолей, в частности, раке поджелудочной железы, раке предстательной железы и раке желудка.
CA19-9 является общим термином для сиалированного углеводного антигена системы Льюис. Он сверхэкспрессирован в злокачественных опухолях органов пищеварения, таких как рак поджелудочной железы, колоректальный рак, холангиокарцинома и рак печени. Таким образом, это наиболее часто применяемый сывороточный опухолевый маркер для диагностики вышеупомянутых злокачественных опухолей.
СУЩНОСТЬ
Изобретение относится к мультиспецифическим связывающим белкам, которые связываются с опухолеассоциированным антигеном (выбранным из любого из антигенов, представленных в таблице 11) и с рецептором NKG2D и рецептором CD16 на клетках-естественных киллерах. Такие белки могут задействовать более одного вида рецепторов, активирующих NK-клетки, и могут блокировать связывание природных лигандов с NKG2D. В определенных вариантах осуществления белки могут быть агонистами NK-клеток у людей и у других видов, таких как грызуны и яванские макаки. Различные аспекты и варианты осуществления изобретения более подробно описаны ниже.
Таким образом, один из аспектов изобретения относится к белку, который включает первый антигенсвязывающий участок, который связывается с NKG2D; второй антигенсвязывающий участок, который связывается с антигеном, выбранным из EpCAM, антигена злокачественной опухоли 125 (CA125), натрий-фосфатного котранспортера 2B (NaPi2b), молекулы клеточной адгезии нектина-4 (Nectin4), фукозил-GM1 (моносиалотетрагексозилганглиозид), белка 8, содержащего домен дезинтегрина и металлопротеиназы (ADAM8), белка 9, содержащего домен дезинтегрина и металлопротеиназы (ADAM9), члена 4 семейства 44 растворимых переносчиков (SLC44A4) и сиалилированного антигена Льюиса (CA19-9); и Fc-домен антитела, его часть, достаточную для связывания CD16, или третий антигенсвязывающий участок, который связывает CD16. Каждый антигенсвязывающий участок может включать в себя вариабельный домен тяжелой цепи антитела и вариабельный домен легкой цепи антитела (например, расположенные как в антителе или слитые вместе из scFv), или один или более антигенсвязывающих участков могут быть однодоменным антителом, таким как антитело VHH, как антитело верблюда, или антитело VNAR, подобное тем, которые содержатся в хрящевой рыбе.
Изобретение относится к мультиспецифическим связывающим белкам, которые связываются с рецептором NKG2D, CD16 и антигеном, выбранным из EpCAM, антигена злокачественной опухоли 125 (CA125), натрий-фосфатного котранспортера 2B (NaPi2b), молекулы клеточной адгезии нектина-4 (Nectin4), фукозил-GM1 (моносиалотетрагексозилганглиозид), белка 8, содержащего домен дезинтегрина и металлопротеиназы (ADAM8), белка 9, содержащего домен дезинтегрина и металлопротеиназы (ADAM9), члена 4 семейства 44 растворимых переносчиков (SLC44A4) и сиалилированного антигена Льюиса (CA19-9).
Некоторые белки по настоящему изобретению включают Fab-фрагмент, связанный с Fc-доменом антитела или его частью, достаточной для связывания CD16, или третий антигенсвязывающий участок, который связывается с CD16.
Некоторые белки по настоящему изобретению включают Fab-фрагмент, где часть тяжелой цепи Fab-фрагмента содержит вариабельный домен тяжелой цепи и домен CH1, и где вариабельный домен тяжелой цепи связан с доменом CH1.
Некоторые белки по настоящему изобретению включают Fab-фрагмент, связанный с Fc-доменом антитела.
В одном из аспектов, изобретение относится к белку, включающему (а) первый антигенсвязывающий участок, содержащий Fab-фрагмент, который связывается с NKG2D; (b) второй антигенсвязывающий участок, содержащий одноцепочечный вариабельный фрагмент (scFv), который связывается с EpCAM; и (c) Fc-домен антитела или его часть, достаточную для связывания с CD16, или третий антигенсвязывающий участок, который связывается с CD16. Настоящее изобретение относится к белку, в котором первый антигенсвязывающий участок, который связывается с NKG2D, представляет собой Fab-фрагмент, а второй антигенсвязывающий участок, который связывается с опухолеассоциированным антигеном, EpCAM представляет собой scFv.
Конкретные белки, описанные в настоящем изобретении, включают в себя scFv, нацеленный на EpCAM и включающий вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, связанные с Fc-доменом антитела или его частью, достаточной для связывания с CD16, или с третьим антигенсвязывающим участком, который связывается с CD16, посредством шарнира, содержащего Ala-Ser или Gly-Ala-Ser. Некоторые белки по настоящему изобретению включают в себя scFv, нацеленный на EpCAM и связанный с Fc-доменом антитела. Некоторые белки по настоящему изобретению включают вариабельный домен тяжелой цепи scFv, нацеленного на EpCAM, образующий дисульфидный мостик с вариабельным доменом легкой цепи scFv.
Некоторые белки по настоящему изобретению включают an scFv, нацеленный на EpCAM, в котором дисульфидный мостик образуется между C44 из вариабельного домена тяжелой цепи и C100 из вариабельного домена легкой цепи.
Некоторые белки по настоящему изобретению включают scFv, нацеленный на EpCAM и связанный с Fc-доменом антитела, в котором вариабельный домен легкой цепи scFv расположен у N-конца вариабельного домена тяжелой цепи scFv и связан с вариабельным доменом тяжелой цепи scFv через гибкий линкер (GlyGlyGlyGlySer)4 (G4S)4) (SEQ ID NO:206), и Fab-фрагмент, который связывается с NKG2D, связанный с Fc-доменом антитела.
Некоторые белки по настоящему изобретению включают scFv, нацеленный на EpCAM, в котором вариабельный домен тяжелой цепи расположен у N-конца или C-конца вариабельного домена легкой цепи scFv.
Некоторые белки по настоящему изобретению включают scFv, нацеленный на EpCAM, в котором вариабельный домен легкой цепи scFv расположен у N-конца вариабельного домена тяжелой цепи scFv.
Один из аспектов изобретения относится к белку, включающему (a) первый антигенсвязывающий участок, содержащий одноцепочечный вариабельный фрагмент (scFv), который связывается с NKG2D; (b) второй антигенсвязывающий участок, который связывается с EpCAM; и (c) Fc-домен антитела или его часть, достаточную для связывания с CD16, или третий антигенсвязывающий участок, который связывается с CD16. В определенных вариантах осуществления белок по настоящему изобретению дополнительно содержит дополнительный антигенсвязывающий участок, который связывается с EpCAM. В определенных вариантах осуществления второй антигенсвязывающий участок белка, описанного в настоящем изобретении, представляет собой Fab-фрагмент который связывается с EpCAM. В определенных вариантах осуществления второй и дополнительный антигенсвязывающие участки белка, описанные в настоящем изобретении, представляют собой Fab-фрагменты, которые связываются с EpCAM.
В определенных вариантах осуществления второй и дополнительный антигенсвязывающие участки белка, описанного в настоящем изобретении, представляют собой scFv, которые связываются с EpCAM. В определенных вариантах осуществления вариабельный домен тяжелой цепи scFv, который связывается с NKG2D, расположен у N-конца или C-конца вариабельного домена легкой цепи scFv. В определенных вариантах осуществления вариабельный домен легкой цепи расположен у N-конца вариабельного домена тяжелой цепи scFv, который связывается с NKG2D.
В определенных вариантах осуществления scFv, который связывается с NKG2D, связан с Fc-доменом антитела или или его частью, достаточной для связывания с CD16, или с третьим антигенсвязывающим участком который связывается с CD16. В определенных вариантах осуществления scFv, который связывается с NKG2D, связан с Fc-доменом антитела или или его частью, достаточной для связывания с CD16, или с третьим антигенсвязывающим участком который связывается с CD16, посредством шарнира, включающего Ala-Ser (например, в TriNKET, который содержит дополнительный антигенсвязывающий участок, который связывается с EpCAM, CA125, NaPi2b, Nectin4, Fucosyl-GM1, ADAM8, ADAM9, SLC44A4, или CA19-9) или Gly-Ala-Ser (например, в TriNKET, который не содержит дополнительного антигенсвязывающего участка, который связывается с EpCAM, CA125, NaPi2b, Nectin4, Fucosyl-GM1, ADAM8, ADAM9, SLC44A4, или CA19-9). В определенных вариантах осуществления scFv, который связывается с NKG2D, связан с C-концом Fc-домена антитела или его частью, достаточной для связывания с CD16, или с третьим антигенсвязывающим участком который связывается с CD16, посредством гибкого линкера, включающего G4S. В определенных вариантах осуществления C-конец Fc-домена антитела связан с N-концом вариабельного домена легкой цепи scFv, который связывается с NKG2D.
В определенных вариантах осуществления, в scFv, который связывается с NKG2D, образуется дисульфидный мостик между вариабельным доменом тяжелой цепи scFv и вариабельным доменом легкой цепи scFv. В определенных вариантах осуществления дисульфидный мостик образуется между C44 из вариабельного домена тяжелой цепи и C100 из вариабельного домена легкой цепи.
Некоторые белки по настоящему изобретению включают последовательность, выбранную из SEQ ID NO:210 и SEQ ID NO:211.
Некоторые белки по настоящему изобретению включают scFv, связанный с Fc-доменом антитела, где scFv, связанный с Fc-доменом антитела представлен последовательностью, выбранной из SEQ ID NO:208 и SEQ ID NO:209.
Некоторые белки по настоящему изобретению включают последовательность SEQ ID NO:205 и SEQ ID NO:213.
Некоторые белки по настоящему изобретению включают последовательность, по меньшей мере, на 90% идентичную аминокислотной последовательности, выбранной из SEQ ID NO:210 и SEQ ID NO:211.
Некоторые белки по настоящему изобретению включают последовательность, по меньшей мере, на 95% идентичную аминокислотной последовательности, выбранной из SEQ ID NO:210 и SEQ ID NO:211.
Некоторые белки по настоящему изобретению включают последовательность, по меньшей мере, на 99% идентичную аминокислотной последовательности, выбранной из SEQ ID NO:210 и SEQ ID NO:211.
Некоторые белки по настоящему изобретению включают аминокислотную последовательность SEQ ID NO:203.
Некоторые белки по настоящему изобретению включают аминокислотную последовательность SEQ ID NO:203 и SEQ ID NO:204.
Некоторые белки по настоящему изобретению включают аминокислотную последовательность, по меньшей мере, на 90% идентичную аминокислотной последовательности SEQ ID NO:203. Некоторые белки по настоящему изобретению включают аминокислотную последовательность, по меньшей мере, на 95% идентичную аминокислотной последовательности SEQ ID NO:203. Некоторые белки по настоящему изобретению включают аминокислотную последовательность, по меньшей мере, на 99% идентичную аминокислотной последовательности SEQ ID NO:203.
Первый антигенсвязывающий участок, который связывается с NKG2D, в некоторых вариантах осуществления может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:1, такой как домен с аминокислотной последовательностью, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичной SEQ ID NO:1, и/или включающий аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:105), CDR2 (SEQ ID NO:106), и CDR3 (SEQ ID NO:107) из SEQ ID NO:1. Вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:1 можно соединять с рядом вариабельных доменов легких цепей для образования участка связывания NKG2D. Например, первый антигенсвязывающий участок, который включает вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:1, может дополнительно включать вариабельный домен легкой цепи, выбранный из любой из последовательностей, относящихся к SEQ ID NO:2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38 и 40. Например, первый антигенсвязывающий участок включает вариабельный домен тяжелой цепи с аминокислотными последовательностями, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичными SEQ ID NO:1, и вариабельный домен легкой цепи с аминокислотными последовательностями, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичными любой из последовательностей, выбранных из SEQ ID NO:2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38 и 40.
Альтернативно, первый антигенсвязывающий участок может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:41, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:42. Например, вариабельный домен тяжелой цепи первого антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:41, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:43), CDR2 (SEQ ID NO:44), и CDR3 (SEQ ID NO:45) из SEQ ID NO:41. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:42, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:46), CDR2 (SEQ ID NO:47), и CDR3 (SEQ ID NO:48) из SEQ ID NO:42.
В других вариантах осуществления первый антигенсвязывающий участок может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:49, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:50. Например, вариабельный домен тяжелой цепи первого антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:49, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:51), CDR2 (SEQ ID NO:52), и CDR3 (SEQ ID NO:53) из SEQ ID NO:49. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:50, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:54), CDR2 (SEQ ID NO:55), и CDR3 (SEQ ID NO:56) из SEQ ID NO:50.
Альтернативно, первый антигенсвязывающий участок может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:57, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:58, такие как с аминокислотными последовательностями, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичными SEQ ID NO:57, и, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичными SEQ ID NO:58, соответственно.
В другом варианте осуществления первый антигенсвязывающий участок может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:59, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:60, Например, вариабельный домен тяжелой цепи первого антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:59, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:109), CDR2 (SEQ ID NO:110), и CDR3 (SEQ ID NO:111) из SEQ ID NO:59. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:60, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:112), CDR2 (SEQ ID NO:113), и CDR3 (SEQ ID NO:114) из SEQ ID NO:60.
Первый антигенсвязывающий участок, который связывается с NKG2D, в некоторых вариантах осуществления может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:61, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:62. Например, вариабельный домен тяжелой цепи первого антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:61, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:63), CDR2 (SEQ ID NO:64), и CDR3 (SEQ ID NO:65) из SEQ ID NO:61. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:62, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:66), CDR2 (SEQ ID NO:67), и CDR3 (SEQ ID NO:68) из SEQ ID NO:62.
В некоторых вариантах осуществления первый антигенсвязывающий участок может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:69, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:70. Например, вариабельный домен тяжелой цепи первого антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:69, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:71), CDR2 (SEQ ID NO:72), и CDR3 (SEQ ID NO:73) из SEQ ID NO:69. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:70, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:74), CDR2 (SEQ ID NO:75), и CDR3 (SEQ ID NO:76) из SEQ ID NO:70.
В некоторых вариантах осуществления первый антигенсвязывающий участок может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:77, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:78. Например, вариабельный домен тяжелой цепи первого антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:77, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:79), CDR2 (SEQ ID NO:80), и CDR3 (SEQ ID NO:81) из SEQ ID NO:77. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:78, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:82), CDR2 (SEQ ID NO:83), и CDR3 (SEQ ID NO:84) из SEQ ID NO:78.
В некоторых вариантах осуществления первый антигенсвязывающий участок может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:85, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:86. Например, вариабельный домен тяжелой цепи первого антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:85, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:87), CDR2 (SEQ ID NO:88), и CDR3 (SEQ ID NO:89) из SEQ ID NO:85. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:86, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:90), CDR2 (SEQ ID NO:91), и CDR3 (SEQ ID NO:92) из SEQ ID NO:86.
В некоторых вариантах осуществления первый антигенсвязывающий участок может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:93, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:94. Например, вариабельный домен тяжелой цепи первого антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:93, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:95), CDR2 (SEQ ID NO:96), и CDR3 (SEQ ID NO:97) из SEQ ID NO:93. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:94, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:98), CDR2 (SEQ ID NO:99), и CDR3 (SEQ ID NO:100) из SEQ ID NO:94.
В некоторых вариантах осуществления первый антигенсвязывающий участок может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:101, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:102, такие как с аминокислотными последовательностями, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичные SEQ ID NO:101, и, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичные SEQ ID NO:102, соответственно.
В некоторых вариантах осуществления первый антигенсвязывающий участок может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:103, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:104, такие как с аминокислотными последовательностями, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичными SEQ ID NO:103, и, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичными SEQ ID NO:104, соответственно.
В некоторых вариантах осуществления второй антигенсвязывающий участок может связываться с EpCAM и может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:115, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:119. Например, вариабельный домен тяжелой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:115, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:116), CDR2 (SEQ ID NO:117), и CDR3 (SEQ ID NO:118) из SEQ ID NO:115. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:119, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:120), CDR2 (SEQ ID NO:121), и CDR3 (SEQ ID NO:122) из SEQ ID NO:119.
В некоторых вариантах осуществления второй антигенсвязывающий участок может связываться с EpCAM и может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:123, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:127. Например, вариабельный домен тяжелой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:123, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:124), CDR2 (SEQ ID NO:125), и CDR3 (SEQ ID NO:126) из SEQ ID NO:123. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:127, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:128), CDR2 (SEQ ID NO:129), и CDR3 (SEQ ID NO:130) из SEQ ID NO:127.
В некоторых вариантах осуществления второй антигенсвязывающий участок может связываться с EpCAM и может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:131, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:135. Например, вариабельный домен тяжелой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:131, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:132), CDR2 (SEQ ID NO:133), и CDR3 (SEQ ID NO:134) из SEQ ID NO:131. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:135, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:136), CDR2 (SEQ ID NO:137), и CDR3 (SEQ ID NO:138) из SEQ ID NO:135.
В некоторых вариантах осуществления второй антигенсвязывающий участок может связываться с EpCAM и может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:139, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:143. Например, вариабельный домен тяжелой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:139, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:140), CDR2 (SEQ ID NO:141), и CDR3 (SEQ ID NO:142) из SEQ ID NO:139. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:143, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:144), CDR2 (SEQ ID NO:145), и CDR3 (SEQ ID NO:146) из SEQ ID NO:143.
В некоторых вариантах осуществления второй антигенсвязывающий участок может связываться с CA125 и может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:155, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:159. Например, вариабельный домен тяжелой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:155, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:156), CDR2 (SEQ ID NO:157), и CDR3 (SEQ ID NO:158) из SEQ ID NO:155. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:159, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:160), CDR2 (SEQ ID NO:161), и CDR3 (SEQ ID NO:162) из SEQ ID NO:159.
В некоторых вариантах осуществления второй антигенсвязывающий участок может связываться с CA125 и может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:163, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:167. Например, вариабельный домен тяжелой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:163, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:164), CDR2 (SEQ ID NO:165), и CDR3 (SEQ ID NO:166) из SEQ ID NO:163. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:167, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:168), CDR2 (SEQ ID NO:169), и CDR3 (SEQ ID NO:170) из SEQ ID NO:167.
В некоторых вариантах осуществления второй антигенсвязывающий участок может связываться с NaPi2b и может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:171, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:175. Например, вариабельный домен тяжелой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:171, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:172), CDR2 (SEQ ID NO:173), и CDR3 (SEQ ID NO:174) из SEQ ID NO:171. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:175, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:176), CDR2 (SEQ ID NO:177), и CDR3 (SEQ ID NO:178) из SEQ ID NO:175.
В некоторых вариантах осуществления второй антигенсвязывающий участок может связываться с нектином-4 и может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:179, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:183. Например, вариабельный домен тяжелой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:179, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:180), CDR2 (SEQ ID NO:181), и CDR3 (SEQ ID NO:182) из SEQ ID NO:179. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:183, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:184), CDR2 (SEQ ID NO:185), и CDR3 (SEQ ID NO:186) из SEQ ID NO:183.
В некоторых вариантах осуществления второй антигенсвязывающий участок может связываться с фукозил-GM1 и может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:187, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:191. Например, вариабельный домен тяжелой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:187, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:188), CDR2 (SEQ ID NO:189), и CDR3 (SEQ ID NO:190) из SEQ ID NO:187. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:191, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:192), CDR2 (SEQ ID NO:193), и CDR3 (SEQ ID NO:194) из SEQ ID NO:191.
В некоторых вариантах осуществления второй антигенсвязывающий участок может связываться с SLC44A4 и может включать вариабельный домен тяжелой цепи, относящийся к SEQ ID NO:195, и вариабельный домен легкой цепи, относящийся к SEQ ID NO:199. Например, вариабельный домен тяжелой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:195, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:196), CDR2 (SEQ ID NO:197), и CDR3 (SEQ ID NO:198) из SEQ ID NO:195. Аналогично, вариабельный домен легкой цепи второго антигенсвязывающего участка может быть, по меньшей мере, на 90% (например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100%) идентичен SEQ ID NO:199, и/или включать аминокислотные последовательности, идентичные последовательностям CDR1 (SEQ ID NO:200), CDR2 (SEQ ID NO:201), и CDR3 (SEQ ID NO:202) из SEQ ID NO:199.
В некоторых вариантах осуществления второй антигенсвязывающий участок включает вариабельный домен легкой цепи, с аминокислотной последовательностью, идентичной аминокислотной последовательности вариабельного домена легкой цепи, присутствующей в первом антигенсвязывающем участке.
В некоторых вариантах осуществления белок включает часть Fc-домена антитела, достаточную для связывания CD16, где Fc-домен антитела содержит домены шарнира и CH2, и/или аминокислотные последовательности, по меньшей мере, на 90% идентичные аминокислотной последовательности 234-332 человеческого антитела IgG.
Некоторые белки по настоящему изобретению связываются с NKG2D с KD 10 нМ или с более слабой аффинностью.
Также предлагаются составы, содержащие один из этих белков; клетки, содержащие одну или более нуклеиновых кислот, экспрессирующих эти белки, и способы усиления гибели опухолевых клеток с использованием этих белков.
Другой аспект изобретения относится к способу лечения злокачественной опухоли у пациента. Способ включает введение нуждающемуся в этом пациенту терапевтически эффективного количества мультиспецифического связывающего белка, описываемого в настоящем документе. Примеры злокачественных опухолей для лечения с использованием мультиспецифических связывающих белков включают, например, рак головы и шеи, рак яичников, рак мочевого пузыря, рак молочной железы, колоректальный рак, рак предстательной железы, рак желудка, рак печени, рак пищевода, и рак легких.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
ФИГ. 1 представляет гетеродимерное, мультиспецифическое антитело (триспецифичный связывающий белок (TriNKET)). Каждое плечо может представлять либо NKG2D-связывающий домен, либо связывающий домен для опухолеассоциированного антигена. В некоторых вариантах осуществления связывающие домены для NKG2D и опухолеассоциированного антигена могут иметь общую легкую цепь.
ФИГ. 2 представляет гетеродимерное, мультиспецифическое антитело. Или NKG2D-связывающий домен или связывающий домен для опухолеассоциированного антигена могут принимать формат scFv (правое плечо).
ФИГ. 3 представляет собой линейные графики, демонстрирующие аффинность связывания NKG2D-связывающих доменов (перечисленных как клоны) с человеческим рекомбинантным NKG2D в анализе ELISA.
ФИГ. 4 представляет собой линейные графики, демонстрирующие аффинность связывания NKG2D-связывающих доменов (перечисленных как клоны) с обезьяньим рекомбинантным NKG2D в анализе ELISA.
ФИГ. 5 представляет собой линейные графики, демонстрирующие аффинность связывания NKG2D-связывающих доменов (перечисленных как клоны) с мышиным рекомбинантным NKG2D в анализе ELISA.
ФИГ. 6 представляет собой линейчатые диаграммы, демонстрирующие связывание NKG2D-связывающих доменов (перечисленных как клоны) с клетками EL4, экспрессирующими человеческий NKG2D при помощи проточной цитометрии и показывающие кратность средней интенсивность флуоресценции (MFI) по сравнению с фоном (FOB).
ФИГ. 7 представляет собой линейчатые диаграммы, демонстрирующие связывание NKG2D-связывающих доменов (перечисленных как клоны) с клетками EL4, экспрессирующими мышиный NKG2D при помощи проточной цитометрии и показывающие кратность средней интенсивность флуоресценции (MFI) по сравнению с фоном (FOB).
ФИГ. 8 представляет собой линейные графики, демонстрирующие специфическую аффинность связывания NKG2D-связывающих доменов (перечисленных как клоны) с рекомбинантным человеческим NKG2D-Fc путем конкуренции с природным лигандом ULBP-6.
ФИГ. 9 представляет собой линейные графики, демонстрирующие специфическую аффинность связывания NKG2D-связывающих доменов (перечисленных как клоны) с рекомбинантным человеческим NKG2D-Fc путем конкуренции с природным лигандом MICA.
ФИГ. 10 представляет собой линейные графики, демонстрирующие специфическую аффинность связывания NKG2D-связывающих доменов (перечисленных как клоны) с рекомбинантным человеческим NKG2D-Fc путем конкуренции с природным лигандом Rae-1 дельта.
ФИГ. 11 представляет собой линейчатые диаграммы, показывающие активацию человеческого NKG2D при помощи NKG2D-связывающих доменов (перечисленных как клоны) путем количественной оценки процента TNF-α-положительных клеток, которые экспрессируют слитые белки человеческого NKG2D-CD3 зета.
ФИГ. 12 представляет собой линейчатые диаграммы, показывающие активацию мышиного NKG2D при помощи NKG2D-связывающих доменов (перечисленных как клоны) путем количественной оценки процента TNF-α-положительных клеток, которые экспрессируют слитые белки мышиного NKG2D-CD3 зета.
ФИГ. 13 представляет собой линейчатые диаграммы, показывающие активацию человеческих NK-клеток при помощи NKG2D-связывающих доменов (перечисленных как клоны).
ФИГ. 14 представляет собой линейчатые диаграммы, показывающие активацию человеческих NK-клеток при помощи NKG2D-связывающих доменов (перечисленных как клоны).
ФИГ. 15 представляет собой линейчатые диаграммы, показывающие активацию мышиных NK-клеток при помощи NKG2D-связывающих доменов (перечисленных как клоны).
ФИГ. 16 представляет собой линейчатые диаграммы, показывающие активацию мышиных NK-клеток при помощи NKG2D-связывающих доменов (перечисленных как клоны).
ФИГ. 17 представляет собой линейчатые диаграммы, показывающие цитотоксический эффект NKG2D-связывающих доменов (перечисленных как клоны) на опухолевые клетки.
ФИГ. 18 представляет собой линейчатые диаграммы, показывающие температуру плавления NKG2D-связывающих доменов (перечисленных как клоны), измеренную путем дифференциальной сканирующей флуорометрии.
ФИГ. 19A-19C представляют собой линейчатые диаграммы синергетической активации NK-клеток с использованием CD16- и NKG2D-связывания. ФИГ. 19А демонстрирует уровни CD107a; ФИГ. 19B демонстрирует уровни IFN-γ; ФИГ. 19C демонстрирует уровни CD107a и IFN-γ. Графики показывают среднее (n=2)±SD. Данные представляют собой выборку пяти независимых экспериментов с использованием пяти разных здоровых доноров.
ФИГ. 20 представляет триспецифический связывающий белок (TriNKET) в форме Triomab, который представляет собой трифункциональное биспецифическое антитело, которое поддерживает IgG-подобную форму. Эта химера состоит из двух полу-антител, каждое с одной легкой и одной тяжелой цепью, которые происходят из двух родительских антител. Форма Triomab может быть гетеродимерной конструкцией, содержащей 1/2 крысиного антитела и 1/2 мышиного антитела.
ФИГ. 21 представляет TriNKET в форме KiH с общей легкой цепью, в которой используется технология выступы-во-впадины (KIH). KiH представляет собой гетеродимер, содержащий 2 Fab-фрагмента, связывающихся с мишенью 1 и 2, и Fc, стабилизированный мутациями гетеродимеризации. TriNKET в формате KiH может быть гетеродимерной конструкцией с двумя Fab-фрагментами, связывающимися с мишенью 1 и мишенью 2, и с двумя разными тяжелыми цепями и общей легкой цепью, которая соединяется с обеими тяжелыми цепями.
ФИГ. 22 представляет TriNKET в форме иммуноглобулина с двойным вариабельным доменом (DVD-Ig™), которая объединяет мишень-связывающие домены двух моноклональных антител с помощью гибких природных линкеров и дает четырехвалентную IgG-подобную молекулу. DVD-Ig™ представляет собой гомодимерную конструкцию, в которой вариабельный домен, нацеленный на антиген 2, слит с N-концом вариабельного домена Fab-фрагмента, нацеленного на антиген 1. Форма DVD-Ig™ содержит нормальный Fc.
ФИГ. 23 представляет TriNKET в форме Fab с ортогональной зоной контакта (Ortho-Fab), которая представляет собой гетеродимерную конструкцию, включающую два фрагмента Fab, связывающихся с мишенью 1 и мишенью 2 и слитых с Fc. Спаривание легкая цепь (LC)-тяжелая цепь (HC) обеспечивается ортогональной зоной контакта. Гетеродимеризация обеспечивается мутациями в Fc.
ФИГ. 24 представляет TriNKET в формате Ig 2-в-1.
ФИГ. 25 представляет TriNKET в форме ES, которая представляет собой гетеродимерную конструкцию, включающую два различных фрагмента Fab, связывающихся с мишенью 1 и мишенью 2 и слитых с Fc. Гетеродимеризация обеспечивается мутациями для электростатического взаимодействия в Fc.
ФИГ. 26 представляет TriNKET в форме Fab-фрагмента с обменом плечами: антитела, которые обмениваются плечами Fab путем обмена тяжелой цепи и присоединенной легкой цепи (полу-молекула) на пару тяжелая-легкая цепи от другой молекулы, что приводит к получению биспецифических антител. Форма Fab Arm Exchange (cFae) представляет собой гетеродимер, включающий два фрагмента Fab, связывающихся с мишенью 1 и мишенью 2, и Fc, стабилизированный мутациями гетеродимеризации.
ФИГ. 27 представляет TriNKET в форме SEED Body, которая представляет собой гетеродимер, включающий два фрагмента Fab, связывающихся с мишенью 1 и мишенью 2, и Fc, стабилизированный мутациями гетеродимеризации.
ФИГ. 28 представляет TriNKET в форме LuZ-Y, в которой используют лейциновую молнию для индуцирования гетеродимеризации двух различных HC. Форма LuZ-Y представляет собой гетеродимер, включающий два различных scFab, связывающихся с мишенью 1 и мишенью 2 и слитых с Fc. Гетеродимеризация обеспечивается мотивами лейциновой молнии, слитыми с C-концом Fc.
ФИГ. 29 представляет TriNKET в форме Cov-X-Body.
ФИГ. 30A и 30B представляют TriNKET в формах κλ-Body, которые представляют собой гетеродимерные конструкции с двумя различными Fab-фрагментами, слитыми с Fc, стабилизированным мутациями гетеродимеризации: один Fab-фрагмент, нацеленный на антиген 1, содержит LC каппа, и второй Fab-фрагмент, нацеленный на антиген 2, содержит LC лямбда. ФИГ. 30A представляет пример одной из форм κλ-Body; ФИГ. 30B представляет пример другого κλ-Body.
ФИГ. 31 представляет гетеродимерную конструкцию Oasc-Fab, которая включает Fab-фрагмент, связывающийся с мишенью 1 и scFab, связывающийся с мишенью 1, оба слиты с Fc-доменом. Гетеродимеризация обеспечивается мутациями в Fc-домене.
ФИГ. 32 представляет DuetMab, которое является гетеродимерной конструкцией с двумя различными Fab-фрагментами, связывающимися с мишенями 1 и 2, и Fc, стабилизированным мутациями гетеродимеризации. Fab-фрагменты 1 и 2 содержат различные мостики S-S, которые обеспечивают правильное спаривание легкой цепи и тяжелой цепи.
ФИГ. 33 представляет CrossmAb, которое является гетеродимерной конструкцией с двумя различными Fab-фрагментами, связывающимися с мишенями 1 и 2, и Fc, стабилизированный мутациями гетеродимеризации. Домены CL и CH1, и домены VH и VL меняют местами, например, CH1 слит в линию с VL, в то время как CL слит в линию с VH.
ФИГ. 34 представляет Fit-Ig, который представляет собой гомодимерную конструкцию, Fab-фрагмент, связывающийся с антигеном 2, слит с N-концом HC Fab-фрагмента, который связывается с антигеном 1. Конструкция содержит Fc дикого типа.
ФИГ. 35 иллюстрирует триспецифическое антитело (TriNKET), которое содержит scFv, связывающий опухолеассоциированный антиген, Fab, нацеленный на NKG2D, и гетеродимеризованную константную область антитела/домен («CD-домен») который связывается с CD16 (формат scFv-Fab). Формат антитела указан в настоящем документе как F3'-TriNKET.
ФИГ. 36 иллюстрирует пример триспецифичных антител (TriNKET), который включает первый антигенсвязывающий участок scFv, который связывается с NKG2D, второй антигенсвязывающий участок, который связывается с опухолеассоциированным антигеном (например, EpCAM), дополнительный антигенсвязывающий участок, который связывается с опухолеассоциированным антигеном (например, EpCAM) и гетеродимеризованная константная область антитела, которая связывается с CD16. Эти форматы антител указаны в настоящем документе как F4-TriNKET.
ФИГ. 37 представляет собой линейные графики, демонстрирующие, что TriNKET и мАТ связываются с EPCAM, который экспрессируется на человеческих клетках колоректального рака H747.
ФИГ. 38 представляет собой линейные графики, демонстрирующие, что TriNKET и мАТ связываются с EPCAM, который экспрессируется на человеческих клетках рака легкого HCC827.
ФИГ. 39 представляет собой линейные графики, демонстрирующие, что TriNKET и мАТ связываются с EPCAM, который экспрессируется на человеческих клетках колоректального рака HCT116.
ФИГ. 40A и ФИГ. 40B представляют собой линейные графики, показывающие TriNKET-опосредованный лизис клеток H747 при помощи покоящихся человеческих NK-клеток от двух различных доноров. Соотношение эффектор-мишень составляло 10:1.
ФИГ. 41A и ФИГ. 41B представляют собой линейные графики, показывающие TriNKET-опосредованный лизис клеток HCC827 при помощи покоящихся человеческих NK-клеток от двух различных доноров. Соотношение эффектор-мишень составляло 10:1.
ФИГ. 42A и ФИГ. 42B представляют собой линейные графики, показывающие TriNKET-опосредованный лизис клеток MCF7 при помощи покоящихся человеческих NK-клеток от двух различных доноров. Соотношение эффектор-мишень составляло 10:1.
ФИГ 43A и ФИГ. 43B представляют собой линейные графики, показывающие TriNKET-опосредованный лизис клеток HCT116 при помощи покоящихся человеческих NK-клеток от двух различных доноров. Соотношение эффектор-мишень составляло 10:1.
ПОДРОБНОЕ ОПИСАНИЕ
Изобретение относится к мультиспецифичным связывающим белкам, которые связываются с EPCAM на злокачественной клетке и с рецептором NKG2D и рецептором CD16 на клетках-естественных киллерах, чтобы активировать клетки-естественные киллеры, к фармацевтическим композициям, содержащим такие мультиспецифичные связывающие белки, и к терапевтическим способам с использованием таких мультиспецифичных белков и фармацевтических композиций, в том числе для лечения злокачественной опухоли. Различные аспекты изобретения изложены ниже в разделах; однако аспекты изобретения, описанные в одном конкретном разделе, не ограничиваются каким-либо конкретным разделом.
Чтобы облегчить понимание настоящего изобретения, ряд терминов и фраз определены ниже.
Термины «a» и «an», как применяют в настоящем документе, означают «один или более» и включают множественное число до тех пор, пока подходит контекст.
Как применяют в настоящем документе, термин «антигенсвязывающий участок» относится к той части молекулы иммуноглобулина, которая участвует в связывании антигена. В антителах человека антигенсвязывающий участок образован аминокислотными остатками N-концевых вариабельных ("V") областей тяжелой ("H") и легкой ("L") цепей. Три высоко дивергентных участка в пределах V-областей тяжелых и легких цепей обозначены как «гипервариабельные области», которые расположены между более консервативными фланкирующими участками, известными как «каркасные области» или «FR». Таким образом, термин «FR» относится к аминокислотным последовательностям, которые естественным образом обнаруживаются между и рядом с гипервариабельными областями в иммуноглобулинах. В молекуле антитела человека три гипервариабельные области легкой цепи и три гипервариабельные области тяжелой цепи расположены друг относительно друга в трехмерном пространстве с образованием антигенсвязывающей поверхности. Антигенсвязывающая поверхность комплементарна трехмерной поверхности связанного антигена, и три гипервариабельные области каждой из тяжелых и легких цепей, обозначают как «определяющие комплементарность области» или «CDR». У некоторых животных, таких как верблюд и хрящевые рыбы, антигенсвязывающий участок образован одной цепью антитела, образуя «однодоменное антитело». Антигенсвязывающие участки могут существовать в интактном антителе, в антигенсвязывающем фрагменте антитела, который сохраняет антигенсвязывающую поверхность, или в рекомбинантном полипептиде, таком как scFv, при помощи пептидного линкера для соединения вариабельного домена тяжелой цепи с вариабельным доменом свободных цепей в одном полипептиде.
Как применяют в настоящем документе термин «опухолеассоцированный антиген» означает любой антиген, включая в качестве неограничивающих примеров белок, гликопротеин, ганглиозид, углевод, липид, которые связаны с злокачественной опухолью. Такой антиген можно экспрессировать на злокачественных клетках или в микроокружении опухоли, таком как кровеносные сосуды, связанные с опухолью, внеклеточный матрикс, мезенхимальная строма или иммунные инфильтраты.
Как применяют в настоящем документе, термины «индивидуум» и «пациент» относятся к организму, который будут лечить способами и составами, описываемыми в настоящем документе. Такие организмы предпочтительно в качестве неограничивающих примеров включают, млекопитающих (например, мышей, обезьян, лошадей, крупный рогатый скот, свиней, собак, кошек и т. д.).
Как применяют в настоящем документе, термин «эффективное количество» относится к количеству соединения (например, соединения по настоящему изобретению), достаточному для достижения полезных или желаемых результатов. Эффективное количество можно вводить в одном или более введениях, применениях или дозировках, и оно не ограничено конкретным составом или способом введения. Как применяют в настоящем документе, термин «лечение» включает любой эффект, например, уменьшение, снижение, модуляцию, улучшение или устранение, которое приводит к улучшению состояния, заболевания, нарушения и т.п., или ослаблению его симптома.
Как применяют в настоящем документе, термин «фармацевтическая композиция» относится к комбинации активного средства с носителем, инертным или активным, делающим композицию особенно подходящей для диагностического или терапевтического применения in vivo или ex vivo.
Как применяют в настоящем документе, термин «фармацевтически приемлемый носитель» относится к любому из стандартных фармацевтических носителей, такому как раствор фосфатно-солевого буфера, вода, эмульсии (например, такие как эмульсии масло/вода или вода/масло), и к различным типам увлажнителей. Композиции могут также включать стабилизаторы и консерванты. Для примеров носителей, стабилизаторов и адъювантов, см. например, Martin, Remington's Pharmaceutical Sciences, 15th Ed., Mack Publ. Co., Easton, PA [1975].
Как применяют в настоящем документе, термин «фармацевтически приемлемая соль» относится к любой фармацевтически приемлемой соли (например, кислоты или основания) соединения по настоящему изобретению, которая при введении индивидууму способна обеспечить соединение по настоящему изобретению или его активный метаболит или его остаток. Как известно специалистам в данной области, «соли» соединений по настоящему изобретению могут быть получены из неорганических или органических кислот и оснований. Примеры кислот в качестве неограничивающих примеров включают соляную, бромистоводородную, серную, азотную, хлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, янтарную, толуол-п-сульфоновую, винную, уксусную, лимонную, метансульфоновую, этансульфоновую, муравьиную, бензойную, малоновую, нафталин-2-сульфоновую, бензолсульфоновую кислоту, и т.п. Другие кислоты, так как щавелевая, хотя сами по себе не являются фармацевтически приемлемыми, могут быть использованы для получения солей, полезных в качестве промежуточных соединений при получении соединений по изобретению и их фармацевтически приемлемых солей присоединения кислот.
Примеры оснований в качестве неограничивающих примеров включают в себя гидроксиды щелочных металлов (например, натрия), гидроксиды щелочноземельных металлов (например, магния), аммиак и соединения формулы NW4+, где W представляет собой C1-4 алкил и т.п.
Примеры солей в качестве неограничивающих примеров включают в себя ацетат, адипат, альгинат, аспартат, бензоат, бензолсульфонат, бисульфаты, бутират, цитрат, камфорат, камфорсульфонат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, флюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гидрохлорид, гидробромид, йодогидрат, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, 2-нафталинсульфонат, никотинат, оксалат, пальмоат, пектинат, персульфат, фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, тозилат, ундеканоат и т.п. Другие примеры солей включают анионы соединений по настоящему изобретению, соединенные с подходящим катионом, таким как Na+, NH4+, и NW4+ (где W представляет собой C1-4 алкильную группу) и т.п.
Для использования в терапевтических целях соли соединений по настоящему изобретению рассматриваются как фармацевтически приемлемые. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, для получения или очистки фармацевтически приемлемого соединения.
На всем протяжении описания, где композиции описаны как имеющие, включающие или содержащие конкретные компоненты, или где процессы и способы описаны как имеющие, включающие или содержащие конкретные этапы, предполагается, что, дополнительно, существуют композиции по настоящему изобретению, которые состоят по существу из, или состоят из перечисленных компонентов, и что существуют процессы и способы по настоящему изобретению, которые состоят по существу или состоят из перечисленных этапов обработки.
Как правило, в композициях указан процент по массе, если не указано иное. Дополнительно, если переменная не сопровождается определением, тогда имеет преимущество предыдущее определение переменной.
I.БЕЛКИ
Изобретение относится к мультиспецифическим связывающим белкам, которые связываются с рецептором NKG2D и рецептором CD16 на клетках-естественных киллерах, и с опухолеассоциированным антигеном, выбранным из любого антигена из представленных в таблице 11. Мультиспецифические связывающие белки подходят для фармацевтических композиций и терапевтических способов, описываемых в настоящем документе. Связывание мультиспецифических связывающих белков с рецептором NKG2D и рецептором CD16 на клетках-естественных киллерах повышает активность клетки-естественного киллера относительно разрушения опухолевых клеток, экспрессирующих опухолеассоциированный антиген, выбранный из любого антигена из представленных в таблице 11. Связывание мультиспецифических связывающих белков с клетками, экспрессирующими опухолеассоциированный антиген, приводит к сближению злокачественных клеток с клеткой-естественным киллером, что облегчает прямое и непрямое разрушение злокачественных клеток клеткой-естественным киллером. Дополнительное описание некотоорых примеров мультиспецифических связывающих белков приведено далее.
Первый компонент мультиспецифических связывающих белков связывается с клетками, экспрессирующими рецептор NKG2D, которые могут в качестве неограничивающих примеров включать NK-клетки, γδ T-клетки и CD8+αβ T-клетки. При связывании NKG2D мультиспецифические связывающие белки могут блокировать связывание природных лигандов, таких как ULBP6 (связывающий белок 6 для UL16) и MICA (белок A, родственный цепи главного комплекса гистосовместимости класса I), с NKG2D и активацию рецепторов NKG2D.
Второй компонент мультиспецифических связывающих белков связывается с опухолеассоциированным антигеном, выбранным из любого антигена из представленных в таблице 11. Клетки, экспрессирующие опухолеассоциированный антиген, обнаруживаются при лейкозах, таких как, например, острый миелолейкоз и T-клеточный лейкоз.
Третий компонент мультиспецифических связывающих белков связывается с клетками, экспрессирующими CD16, рецептор Fc на поврехности лейкоцитов, включая клетки-естественные киллеры, макрофаги, нейтрофилы, эозинофилы, тучные клетки, и фолликулярные дендритные клетки.
Мультиспецифические связывающие белки, описываемые в настоящем документе, могут принимать различные форматы. Например, один из форматов представляет собой гетеродимерное мультиспецифическое антитело, включающий первую тяжелую цепь иммуноглобулина, первую легкую цепь иммуноглобулина, вторую тяжелую цепь иммуноглобулина и вторую легкую цепь иммуноглобулина (рис. 1). Первая тяжелая цепь иммуноглобулина включает первый Fc-домен (шарнир-CH2-CH3), первый вариабельный домен тяжелой цепи и необязательно первый CH1-домен тяжелой цепи. Первая легкая цепь иммуноглобулина включает в себя первый вариабельный домен и константный домен легкой цепи. Первая легкая цепь иммуноглобулина вместе с первой тяжелой цепью иммуноглобулина образует антигенсвязывающий участок, который связывается с NKG2D. Вторая тяжелая цепь иммуноглобулина содержит второй Fc-домен (шарнир-CH2-CH3), второй вариабельный домен тяжелой цепи и необязательно второй CH1-домен тяжелой цепи. Вторая легкая цепь иммуноглобулина включает в себя второй вариабельный домен легкой цепи и второй константный домен легкой цепи. Вторая легкая цепь иммуноглобулина вместе со второй тяжелой цепью иммуноглобулина образует антигенсвязывающий участок, который связывается с опухольассоциированным антигеном, выбранным из любого из антигенов, представленных в таблице 11. Первый Fc-домен и второй Fc-домен вместе могут связываться с CD16 (фиг. 1). В некоторых вариантах осуществления первая легкая цепь иммуноглобулина идентична второй легкой цепи иммуноглобулина.
Другой пример формата включает гетеродимерное мультиспецифическое антитело, включающее первую тяжелую цепь иммуноглобулина, вторую тяжелую цепь иммуноглобулина и легкую цепь иммуноглобулина (фиг. 2). Первая тяжелая цепь иммуноглобулина включает первый Fc-домен (шарнир-CH2-CH3), слитый или через линкер, или через шарнир антитела с одноцепочечным вариабельным фрагментом (scFv), состоящим из вариабельного домена тяжелой цепи и вариабельного домена легкой цепи, которые спариваются и связываются с NKG2D, или связываются с опухолеассоциированным антигеном, выбраным из любого из антигенов, представленных в таблице 11. Вторая тяжелая цепь иммуноглобулина включает второй Fc-домен (шарнир-CH2-CH3), второй вариабельный домен тяжелой цепи и необязательно CH1-домен тяжелой цепи. Легкая цепь иммуноглобулина включает вариабельный домен легкой цепи и константный домен легкой цепи. Вторая тяжелая цепь иммуноглобулина соединяется с легкой цепью иммуноглобулина и связывается с NKG2D или связывается с опухолеассоциированным антигеном, выбраным из любого из антигенов, представленных в таблице 11. Первый Fc-домен и второй Fc-домен вместе могут связываться с CD16 (рис. 2).
Один или более дополнительных мотивов связывания могут быть слиты с C-концом константной области CH3-домена, необязательно через линкерную последовательность. В определенных вариантах осуществления антигенсвязывающий мотив представляет собой одноцепочечную или дисульфид-стабилизированную вариабельную область (scFv), образуя четырехвалентную или трехвалентную молекулу.
В некоторых вариантах осуществления мультиспецифический связывающий белок находится в форме Triomab, которая представляет собой трифункциональное биспецифическое антитело, которое поддерживает IgG-подобную форму. Эта химера состоит из двух полу-антител, каждое с одной легкой и одной тяжелой цепью, которые происходят из двух родительских антител.
В некоторых вариантах осуществления мультиспецифический связывающий белок находится в форме KiH с общей легкой цепью (LC), которая включает технологию выступы-во-впадины (KIH). KIH включает сконструированные CH3-домены для создания либо «выступа», либо «впадины» в каждой тяжелой цепи для содействия гетеродимеризации. Концепция технологии «Выступы-во-впадины (KiH)» заключалась в том, чтобы ввести «выступ» в одном домене CH3 (CH3A) путем замены небольшого остатка на громоздкий (например, T366WCH3A в нумерации ЕС). Для размещения «выступа» была создана дополнительная поверхность «впадины» на другом домене CH3 (CH3B) путем замены ближайших соседних остатков к выступу более мелкими (например, T366S/L368A/Y407VCH3B). Мутация «впадины» была оптимизирована с помощью структурно-направленного скрининга фаговой библиотеки (Atwell S, Ridgway JB, Wells JA, Carter P., Stable heterodimers from remodeling the domain interface of a homodimer using a phage display library, J. Mol. Biol. (1997) 270(1):26-35). Рентгеновская кристаллическая структура вариантов KiH Fc (Elliott JM, Ultsch M, Lee J, Tong R, Takeda K, Spiess C, et al., Antiparallel conformation of knob and hole aglycosylated half-antibody homodimers is mediated by a CH2-CH3 hydrophobic interaction. J. Mol. Biol. (2014) 426(9):1947-57; Mimoto F, Kadono S, Katada H, Igawa T, Kamikawa T, Hattori K. Crystal structure of a novel asymmetrically engineered Fc variant with improved affinity for FcγRs. Mol. Immunol. (2014) 58(1):132-8) показала, что гетеродимеризация термодинамически поддерживается гидрофобными взаимодействиями, обусловленными стерической комплементарностью на внутренней границе раздела между CH3-доменами, тогда как границы выступ-выступ и впадина-впадина не способствуют гомодимеризации вследствие стерического препятствия и нарушения благоприятных взаимодействий, соответственно.
В некоторых вариантах осуществления мультиспецифический связывающий белок находится в форме иммуноглобулина с двойным вариабельным доменом (DVD-Ig™), которая сочетает мишень-связывающие домены двух моноклональных антител с помощью гибких природных линкеров и дает четырехвалентную IgG-подобную молекулу.
В некоторых вариантах осуществления мультиспецифический связывающий белок находится в форме Fab с ортогональной зоной контакта (Ortho-Fab). В подходе орто-Fab IgG (Lewis SM, Wu X, Pustilnik A, Sereno A, Huang F, Rick HL, et al., Generation of bispecific IgG antibodies by structure-based design of an orthogonal Fab interface. Nat. Biotechnol. (2014) 32(2):191-8), дизайн областей на основе структуры вводит комплементарные мутации в зону контакта LC и HCVH-CH1 только в одном Fab-фрагменте, без каких-либо изменений в другом Fab-фрагменте.
В некоторых вариантах осуществления мультиспецифический связывающий белок находится в формате Ig 2-в-1. В некоторых вариантах осуществления мультиспецифический связывающий белок находится в форме ES, которая представляет собой гетеродимерную конструкцию, включающую два различных Fab-фрагмента, связывающихся с мишенью 1 и мишенью 2 и слитых с Fc. Гетеродимеризация обеспечивается мутациями для электростатического взаимодействия в Fc.
В некоторых вариантах осуществления мультиспецифический связывающий белок находится в форме κλ-Body, которая представляет собой гетеродимерную конструкцию с двумя различными Fab-фрагментами, слитыми с Fc, стабилизированным мутациями гетеродимеризации: Fab-фрагмент, нацеленный на антиген 1, содержит LC каппа, в то время как второй Fab-фрагмент, нацеленный на антиген 2, содержит LC лямбда. ФИГ. 30A представляет пример одной из форм κλ-Body; ФИГ. 30B представляет пример другого κλ-Body.
В некоторых вариантах осуществления мультиспецифический связывающий белок находится в форме Fab-фрагмента с обменом плечами (антитела, которые обмениваются плечами Fab путем обмена тяжелой цепи и присоединенной легкой цепи (полу-молекула) на пару тяжелая-легкая цепи от другой молекулы, что приводит к получению биспецифических антител).
В некоторых вариантах осуществления мультиспецифический связывающий белок находится в форме SEED Body. Платформа для конструирования доменов с обменом цепями (SEED) была разработана для создания асимметричных и биспецифических антитело-подобных молекул, которые расширяют терапевтическое применение природных антител. Эта платформа для конструирования белков основана на обмене структурно связанных последовательностей иммуноглобулина в консервативных CH3-доменах. Конструкция SEED позволяет эффективно генерировать гетеродимеры AG/GA, при этом препятствуя гомодимеризации AG и GA CH3-доменов SEED. (Muda M. et al., Protein Eng. Des. Sel. (2011, 24 (5): 447-54))
В некоторых вариантах осуществления мультиспецифический связывающий белок находится в форме LuZ-Y, в которой используют лейциновую молнию для индуцирования гетеродимеризации двух различных HC. (Wranik, BJ. et al., J. Biol. Chem. (2012), 287:43331-9).
В некоторых вариантах осуществления мультиспецифический связывающий белок находится в форме Cov-X-Body. В биспецифических CovX- Body, два разных пептида соединяют вместе с помощью разветвленного азетидинонового линкера и сливают с каркасом антитела в мягких условиях сайт-специфическим образом. В то время как фармакофоры отвечают за функциональную активность, каркас антитела обеспечивает длительное полувыведение и Ig-подобное распределение. Фармакофоры могут быть химически оптимизированы или заменены другими фармакофорами для получения оптимизированных или уникальных биспецифических антител. (Doppalapudi VR et al., PNAS (2010), 107(52);22611-22616).
В некоторых вариантах осуществления мультиспецифический связывающий белок находится в гетеродимерной форме Oasc-Fab, которая включает Fab-фрагмент, связывающийся с мишенью 1, и scFab, связывающийся с мишенью 1, слитые с Fc. Гетеродимеризация обеспечивается мутациями в Fc.
В некоторых вариантах осуществления мультиспецифический связывающий белок находится в форме DuetMab, которая является гетеродимерной конструкцией с двумя различными Fab-фрагментами, связывающимися с антигенами 1 и 2, и Fc, стабилизированным мутациями гетеродимеризации. Fab-фрагменты 1 и 2 содержат различные мостики S-S, которые обеспечивают правильное спаривание легкой цепи и тяжелой цепи.
В некоторых вариантах осуществления мультиспецифический связывающий белок находится в форме CrossmAb, которая является гетеродимерной конструкцией с двумя различными Fab-фрагментами, связывающимися с мишенями 1 и 2, слитыми с Fc, стабилизированным мутациями гетеродимеризации. Домены CL и CH1, и домены VH и VL меняют местами, например, CH1 слит в линию с VL, в то время как CL слит в линию с VH.
В некоторых вариантах осуществления мультиспецифический связывающий белок находится в форме Fit-Ig, которая представляет собой гомодимерную конструкцию, где Fab-фрагмент, связывающийся с антигеном 2, слит с N-концом HC Fab-фрагмента, который связывается с антигеном 1. Конструкция содержит Fc дикого типа
В таблице 1 перечислены пептидные последовательности вариабельных доменов тяжелых цепей цепочек и вариабельных доменов легких цепей, которые в комбинации могут связываться с NKG2D. NKG2D-связывающие домены могут различаться по своей аффинности связывания с NKG2D, однако все они активируют человеческий NKG2D и NK-клетки.
Таблица 1
(SEQ ID NO:1)
CDR1 (SEQ ID NO:105) - GSFSGYYWS
CDR2 (SEQ ID NO:106) -
EIDHSGSTNYNPSLKS
CDR3 (SEQ ID NO:107) -
ARARGPWSFDP
(SEQ ID NO:2)
(SEQ ID NO:3)
(SEQ ID NO:4)
(A40)
(SEQ ID NO:5)
(SEQ ID NO:6)
(SEQ ID NO:7)
(SEQ ID NO:8)
(SEQ ID NO:9)
(SEQ ID NO:10)
(SEQ ID NO:11)
(SEQ ID NO:12)
(C26)
(SEQ ID NO:13)
(SEQ ID NO:14)
(SEQ ID NO:15)
(SEQ ID NO:16)
(SEQ ID NO:17)
(SEQ ID NO:18)
(SEQ ID NO:19)
(SEQ ID NO:20)
(SEQ ID NO:21)
(SEQ ID NO:22)
(SEQ ID NO:23)
(SEQ ID NO:24)
(SEQ ID NO:25)
(SEQ ID NO:26)
(SEQ ID NO:27)
(SEQ ID NO:28)
(SEQ ID NO:29)
(SEQ ID NO:30)
(SEQ ID NO:31)
(SEQ ID NO:32)
(SEQ ID NO:33)
(SEQ ID NO:34)
(SEQ ID NO:35)
(SEQ ID NO:36)
(SEQ ID NO:37)
(SEQ ID NO:38)
(F47)
(SEQ ID NO:39)
(SEQ ID NO:40)
(SEQ ID NO:41)
CDR1 (SEQ ID NO:43) -
GTFSSYAIS
CDR2 (SEQ ID NO:44) -
GIIPIFGTANYAQKFQG
CDR3 (SEQ ID NO:45) -
ARGDSSIRHAYYYYGMDV
(SEQ ID NO:42)
CDR1 (SEQ ID NO:46) -
KSSQSVLYSSNNKNYLA
CDR2 (SEQ ID NO:47) -
WASTRES
CDR3 (SEQ ID NO:48) -
QQYYSTPIT
(F43)
(SEQ ID NO:49)
CDR1 (SEQ ID NO:51) -
GSISSSSYYWG
CDR2 (SEQ ID NO:52) -
SIYYSGSTYYNPSLKS
CDR3 (SEQ ID NO:53) -
ARGSDRFHPYFDY
(SEQ ID NO:50)
CDR1 (SEQ ID NO:54) -
RASQSVSRYLA
CDR2 (SEQ ID NO:55) -
DASNRAT
CDR3 (SEQ ID NO:56) -
QQFDTWPPT
(F04)
(SEQ ID NO:57)
(SEQ ID NO:58)
(SEQ ID NO:59)
CDR1 (SEQ ID NO:109) - GTFSSYAIS
CDR2 (SEQ ID NO:110) - GIIPIFGTANYAQKFQG
CDR3 (SEQ ID NO:111) - ARRGRKASGSFYYYYGMDV
(SEQ ID NO:60)
CDR1 (SEQ ID NO:112) - ESSQSLLNSGNQKNYLT
CDR2 (SEQ ID NO:113) - WASTRES
CDR3 (SEQ ID NO:114) - QNDYSYPYT
(E79)
(SEQ ID NO:61)
CDR1 (SEQ ID NO:63) - YTFTSYYMH
CDR2 (SEQ ID NO:64) - IINPSGGSTSYAQKFQG
CDR3 (SEQ ID NO:65) - ARGAPNYGDTTHDYYYMDV
(SEQ ID NO:62)
CDR1 (SEQ ID NO:66) - RASQSVSSNLA
CDR2 (SEQ ID NO:67) - GASTRAT
CDR3 (SEQ ID NO:68) - QQYDDWPFT
(F63)
(SEQ ID NO:69)
CDR1 (SEQ ID NO:71) - YTFTGYYMH
CDR2 (SEQ ID NO:72) - WINPNSGGTNYAQKFQG
CDR3 (SEQ ID NO:73) - ARDTGEYYDTDDHGMDV
(SEQ ID NO:70)
CDR1 (SEQ ID NO:74) - RASQSVSSNLA
CDR2 (SEQ ID NO:75) - GASTRAT
CDR3 (SEQ ID NO:76) - QQDDYWPPT
(A44)
(SEQ ID NO:77)
CDR1 (SEQ ID NO:79) - FTFSSYAMS
CDR2 (SEQ ID NO:80) - AISGSGGSTYYADSVKG
CDR3 (SEQ ID NO:81) - AKDGGYYDSGAGDY
(SEQ ID NO:78)
CDR1 (SEQ ID NO:82) - RASQGIDSWLA
CDR2 (SEQ ID NO:83) - AASSLQS
CDR3 (SEQ ID NO:84) - QQGVSYPRT
(A49)
(SEQ ID NO:85)
CDR1 (SEQ ID NO:87) - FTFSSYSMN
CDR2 (SEQ ID NO:88) - SISSSSSYIYYADSVKG
CDR3 (SEQ ID NO:89) - ARGAPMGAAAGWFDP
(SEQ ID NO:86)
CDR1 (SEQ ID NO:90) - RASQGISSWLA
CDR2 (SEQ ID NO:91) - AASSLQS
CDR3 (SEQ ID NO:92) - QQGVSFPRT
(E78)
(SEQ ID NO:93)
CDR1 (SEQ ID NO:95) - YTFTSYYMH
CDR2 (SEQ ID NO:96) - IINPSGGSTSYAQKFQG
CDR3 (SEQ ID NO:97) - AREGAGFAYGMDYYYMDV
(SEQ ID NO:94)
CDR1 (SEQ ID NO:98) - RASQSVSSYLA
CDR2 (SEQ ID NO:99) - DASNRAT
CDR3 (SEQ ID NO:100) - QQSDNWPFT
Альтернативно, вариабельный домен тяжелой цепи, представленный SEQ ID NO:101, можно соединять с вариабельным доменом легкой цепи, представленным SEQ ID NO:102, для образования антигенсвязывающего участка, который может связываться с NKG2D, как показано в US 9273136.
SEQ ID NO:101
QVQLVESGGGLVKPGGSLRLSCAASGFTFSSYGMHWVRQAPGKGLEWVAFIRYDGSNKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDRGLGDGTYFDYWGQGTTVTVSS
SEQ ID NO:102
QSALTQPASVSGSPGQSITISCSGSSSNIGNNAVNWYQQLPGKAPKLLIYYDDLLPSGVSDRFSGSKSGTSAFLAISGLQSEDEADYYCAAWDDSLNGPVFGGGTKLTVL
Альтернативно, вариабельный домен тяжелой цепи, представленный SEQ ID NO:103, можно соединять с вариабельным доменом легкой цепи, представленным SEQ ID NO:104, для образования антигенсвязывающего участка, который может связываться с NKG2D, как показано в US 7879985.
SEQ ID NO:103
QVHLQESGPGLVKPSETLSLTCTVSDDSISSYYWSWIRQPPGKGLEWIGHISYSGSANYNPSLKSRVTISVDTSKNQFSLKLSSVTAADTAVYYCANWDDAFNIWGQGTMVTVSS
SEQ ID NO:104
EIVLTQSPGTLSLSPGERATLSCRASQSVSSSYLAWYQQKPGQAPRLLIYGASSRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYGSSPWTFGQGTKVEIK
Таблица 2 перечисляет пептидные последовательности вариабельных доменов тяжелых цепей и вариабельных доменов легких цепей которые, в комбинации, можгут связываться с EpCAM.
(SEQ ID NO:115)
CDR1 (SEQ ID NO:116) - GYTFTNY
CDR2 (SEQ ID NO:117) - NTYTGE
CDR3 (SEQ ID NO:118) - FAIKGDY
(SEQ ID NO:119)
CDR1(SEQ ID NO:120) - KSLLHSNGITYLY
CDR2 (SEQ ID NO:121) - QMSNLAS
CDR3 (SEQ ID NO:122) - AQNLEIPRT
(SEQ ID NO:123)
CDR1 (SEQ ID NO:124) - GFTFSSY
CDR2 (SEQ ID NO:125) - SYDGSN
CDR3 (SEQ ID NO:126) - DMGWGSGWRPYYYYGMDV
CDR1 (SEQ ID NO:128) - QSISSYLN
CDR2 (SEQ ID NO:129) - WASTRES
CDR3 (SEQ ID NO:130) - QQSYDIPYT
CDR1 (SEQ ID NO:132) - GYTFTNY
CDR2 (SEQ ID NO:133) - NTYTGE
CDR3 (SEQ ID NO:134) - FAIKGDY
CDR1 (SEQ ID NO:136) - KSLLHSNGITYLY
CDR2 (SEQ ID NO:137) - QMSNLAS
CDR3 (SEQ ID NO:138) - AQNLEIPRT
(MT110)
(SEQ ID NO:139)
CDR1 (SEQ ID NO:140) - GYAFTNY
CDR2 (SEQ ID NO:141) - FPGSGN
CDR3 (SEQ ID NO:142) - LRNWDEPMDY
(SEQ ID NO:143)
CDR1 (SEQ ID NO:144) - QSLLNSGNQKNYLT
CDR2 (SEQ ID NO:145) - WASTRES
CDR3 (SEQ ID NO:146) - QNDYSYPLT
Альтернативно, новые антигенсвязывающие участки, которые могут связываться с EpCAM, можно выявлять путем скрининга по связыванию с аминокислотной последовательностью, определяемой SEQ ID NO:147.
SEQ ID NO:147
MAPPQVLAFGLLLAAATATFAAAQEECVCENYKLAVNCFVNNNRQCQCTSVGAQNTVICSKLAAKCLVMKAEMNGSKLGRRAKPEGALQNNDGLYDPDCDESGLFKAKQCNGTSMCWCVNTAGVRRTDKDTEITCSERVRTYWIIIELKHKAREKPYDSKSLRTALQKEITTRYQLDPKFITSILYENNVITIDLVQNSSQKTQNDVDIADVAYYFEKDVKGESLFHSKKMDLTVNGEQLDLDPGQTLIYYVDEKAPEFSMQGLKAGVIAVIVVVVIAVVAGIVVLVISRKKRMAKYEKAEIKEMGEMHRELNA
Антигенсвязывающие участки, которые могут связываться с антигеном CA125, можно выявлять путем скрининга по связыванию с аминокислотной последовательностью, определяемой SEQ ID NO:148.
SEQ ID NO:148
MLKPSGLPGSSSPTRSLMTGSRSTKATPEMDSGLTGATLSPKTSTGAIVVTEHTLPFTSPDKTLASPTSSVVGRTTQSLGVMSSALPESTSRGMTHSEQRTSPSLSPQVNGTPSRNYPATSMVSGLSSPRTRTSSTEGNFTKEASTYTLTVETTSGPVTEKYTVPTETSTTEGDSTETPWDTRYIPVKITSPMKTFADSTASKENAPVSMTPAETTVTDSHTPGRTNPSFGTLYSSFLDLSPKGTPNSRGETSLELILSTTGYPFSSPEPGSAGHSRISTSAPLSSSASVLDNKISETSIFSGQSLTSPLSPGVPEARASTMPNSAIPFSMTLSNAETSAERVRSTISSLGTPSISTKQTAETILTFHAFAETMDIPSTHIAKTLASEWLGSPGTLGGTSTSALTTTSPSTTLVSEETNTHHSTSGKETEGTLNTSMTPLETSAPGEESEMTATLVPTLGFTTLDSKIRSPSQVSSSHPTRELRTTGSTSGRQSSSTAAHGSSDILRATTSSTSKASSWTSESTAQQFSEPQHTQWVETSPSMKTERPPASTSVAAPITTSVPSVVSGFTTLKTSSTKGIWLEETSADTLIGESTAGPTTHQFAVPTGISMTGGSSTRGSQGTTHLLTRATASSETSADLTLATNGVPVSVSPAVSKTAAGSSPPGGTKPSYTMVSSVIPETSSLQSSAFREGTSLGLTPLNTRHPFSSPEPDSAGHTKISTSIPLLSSASVLEDKVSATSTFSHHKATSSITTGTPEISTKTKPSSAVLSSMTLSNAATSPERVRNATSPLTHPSPSGEETAGSVLTLSTSAETTDSPNIHPTGTLTSESSESPSTLSLPSVSGVKTTFSSSTPSTHLFTSGEETEETSNPSVSQPETSVSRVRTTLASTSVPTPVFPTMDTWPTRSAQFSSSHLVSELRATSSTSVTNSTGSALPKISHLTGTATMSQTNRDTFNDSAAPQSTTWPETSPRFKTGLPSATTTVSTSATSLSATVMVSKFTSPATSSMEATSIREPSTTILTTETTNGPGSMAVASTNIPIGKGYITEGRLDTSHLPIGTTASSETSMDFTMAKESVSMSVSPSQSMDAAGSSTPGRTSQFVDTFSDDVYHLTSREITIPRDGTSSALTPQMTATHPPSPDPGSARSTWLGILSSSPSSPTPKVTMSSTFSTQRVTTSMIMDTVETSRWNMPNLPSTTSLTPSNIPTSGAIGKSTLVPLDTPSPATSLEASEGGLPTLSTYPESTNTPSIHLGAHASSESPSTIKLTMASVVKPGSYTPLTFPSIETHIHVSTARMAYSSGSSPEMTAPGETNTGSTWDPTTYITTTDPKDTSSAQVSTPHSVRTLRTTENHPKTESATPAAYSGSPKISSSPNLTSPATKAWTITDTTEHSTQLHYTKLAEKSSGFETQSAPGPVSVVIPTSPTIGSSTLELTSDVPGEPLVLAPSEQTTITLPMATWLSTSLTEEMASTDLDISSPSSPMSTFAIFPPMSTPSHELSKSEADTSAIRNTDSTTLDQHLGIRSLGRTGDLTTVPITPLTTTWTSVIEHSTQAQDTLSATMSPTHVTQSLKDQTSIPASASPSHLTEVYPELGTQGRSSSEATTFWKPSTDTLSREIETGPTNIQSTPPMDNTTTGSSSSGVTLGIAHLPIGTSSPAETSTNMALERRSSTATVSMAGTMGLLVTSAPGRSISQSLGRVSSVLSESTTEGVTDSSKGSSPRLNTQGNTALSSSLEPSYAEGSQMSTSIPLTSSPTTPDVEFIGGSTFWTKEVTTVMTSDISKSSARTESSSATLMSTALGSTENTGKEKLRTASMDLPSPTPSMEVTPWISLTLSNAPNTTDSLDLSHGVHTSSAGTLATDRSLNTGVTRASRLENGSDTSSKSLSMGNSTHTSMTYTEKSEVSSSIHPRPETSAPGAETTLTSTPGNRAISLTLPFSSIPVEEVISTGITSGPDINSAPMTHSPITPPTIVWTSTGTIEQSTQPLHAVSSEKVSVQTQSTPYVNSVAVSASPTHENSVSSGSSTSSPYSSASLESLDSTISРРНКITSWLWDLTTSLPTTTWPSTSLSEALSSGHSGVSNPSSTTTEFPLFSAASTSAAKQRNPETETHGPQNTAASTLNTDASSVTGLSETPVGASISSEVPLPMAITSRSDVSGLTSESTANPSLGTASSAGTKLTRTISLPTSESLVSFRMNKDPWTVSIPLGSHPTTNTETSIPVNSAGPPGLSTVASDVIDTPSDGAESIPTVSFSPSPDTEVTTISHFPEKTTHSFRTISSLTHELTSRVTPIPGDWMSSAMSTKPTGASPSITLGERRTITSAAPTTSPIVLTASFTETSTVSLDNETTVKTSDILDARKTNELPSDSSSSSDLINTSIASSTMDVTKTASISPTSISGMTASSSPSLFSSDRPQVPTSTTETNTATSPSVSSNTYSLDGGSNVGGTPSTLPPFTITHPVETSSALLAWSRPVRTFSTMVSTDTASGENPTSSNSVVTSVPAPGTWTSVGSTTDLPAMGFLKTSPAGEAHSLLASTIEPATAFTPHLSAAVVTGSSATSEASLLTTSESKAIHSSPQTPTTPTSGANWETSATPESLLVVTETSDTTLTSKILVTDTILFSTVSTPPSKFPSTGTLSGASFPTLLPDTPAIPLTATEPTSSLATSFDSTPLVTIASDSLGTVPETTLTMSETSNGDALVLKTVSNPDRSIPGITIQGVTESPLHPSSTSPSKIVAPRNTTYEGSITVALSTLPAGTTGSLVFSQSSENSETTALVDSSAGLERASVMPLTTGSQGMASSGGIRSGSTHSTGTKTFSSLPLTMNPGEVTAMSEITTNRLTATQSTAPKGIPVKPTSAESGLLTPVSASSSPSKAFASLTTAPPTWGIPQSTLTFEFSEVPSLDTKSASLPTPGQSLNTIPDSDASTASSSLSKSPEKNPRARMMTSTKAISASSFQSTGFTETPEGSASPSMAGHEPRVPTSGTGDPRYASESMSYPDPSKASSAMTSTSLASKLTTLFSTGQAARSGSSSSPISLSTEKETSFLSPTASTSRKTSLFLGPSMARQPNILVHLQTSALTLSPTSTLNMSQEEPPELTSSQTIAEEEGTTAETQTLTFTPSETPTSLLPVSSPTEPTARRKSSPETWASSISVPAKTSLVETTDGTLVTTIKMSSQAAQGNSTWPAPAEETGSSPAGTSPGSPEMSTTLKIMSSKEPSISPEIRSTVRNSPWKTPETTVPMETTVEPVTLQSTALGSGSTSISHLPTGTTSPTKSPTENMLATERVSLSPSPPEAWTNLYSGTPGGTRQSLATMSSVSLESPTARSITGTGQQSSPELVSKTTGMEFSMWHGSTGGTTGDTHVSLSTSSNILEDPVTSPNSVSSLTDKSKHKTETWVSTTAIPSTVLNNKIMAAEQQTSRSVDEAYSSTSSWSDQTSGSDITLGASPDVTNTLYITSTAQTTSLVSLPSGDQGITSLTNPSGGKTSSASSVTSPSIGLETLRANVSAVKSDIAPTAGHLSQTSSPAEVSILDVTTAPTPGISTTITTMGTNSISTTTPNPEVGMSTMDSTPATERRTTSTEHPSTWSSTAASDSWTVTDMTSNLKVARSPGTISTMHTTSFLASSTELDSMSTPHGRITVIGTSLVTPSSDASAVKTETSTSERTLSPSDTTASTPISTFSRVQRMSISVPDILSTSWTPSSTEAEDVPVSMVSTDHASTKTDPNTPLSTFLFDSLSTLDWDTGRSLSSATATTSAPQGATTPQELTLETMISPATSQLPFSIGHITSAVTPAAMARSSGVTFSRPDPTSKKAEQTSTQLPTTTSAHPGQVPRSAATTLDVIPHTAKTPDATFQRQGQTALTTEARATSDSWNEKEKSTPSAPWITEMMNSVSEDTIKEVTSSSSVLRTLNTLDINLESGTTSSPSWKSSPYERIAPSESTTDKEAIHPSTNTVETTGWVTSSEHASHSTIPAHSASSKLTSPVVTTSTREQAIVSMSTTTWPESTRARTEPNSFLTIELRDVSPYMDTSSTTQTSIISSPGSTAITKGPRTEITSSKRISSSFLAQSMRSSDSPSEAITRLSNFPAMTESGGMILAMQTSPPGATSLSAPTLDTSATASWTGTPLATTQRFTYSEKTTLFSKGPEDTSQPSPPSVEETSSSSSLVPIHATTSPSNILLTSQGHSPSSTPPVTSVFLSETSGLGKTTDMSRISLEPGTSLPPNLSSTAGEALSTYEASRDTKAIHHSADTAVTNMEATSSEYSPIPGHTKPSKATSPLVTSHIMGDITSSTSVFGSSETTEIETVSSVNQGLQERSTSQVASSATETSTVITHVSSGDATTHVTKTQATFSSGTSISSPHQFITSTNTFTDVSTNPSTSLIMTESSGVTITTQTGPTGAATQGPYLLDTSTMPYLTETPLAVTPDFMQSEKTTLISKGPKDVSWTSPPSVAETSYPSSLTPFLVTTIPPATSTLQGQHTSSPVSATSVLTSGLVKTTDMLNTSMEPVTNSPQNLNNPSNEILATLAATTDIETIHPSINKAVTNMGTASSAHVLHSTLPVSSEPSTATSPMVPASSMGDALASISIPGSETTDIEGEPTSSLTAGRKENSTLQEMNSTTESNIILSNVSVGAITEATKMEVPSFDATFIPTPAQSTKFPDIFSVASSRLSNSPPMTISTHMTTTQTGSSGATSKIPLALDTSTLETSAGTPSVVTEGFAHSKITTAMNNDVKDVSQTNPPFQDEASSPSSQAPVLVTTLPSSVAFTPQWHSTSSPVSMSSVLTSSLVKTAGKVDTSLETVTSSPQSMSNTLDDISVTSAATTDIETTHPSINTVVTNVGTTGSAFESHSTVSAYPEPSKVTSPNVTTSTMEDTTISRSIPKSSKTTRTETETTSSLTPKLRETSISQEITSSTETSTVPYKELTGATTEVSRTDVTSSSSTSFPGPDQSTVSLDISTETNTRLSTSPIMTESAEITITTQTGPHGATSQDTFTMDPSNTTPQAGIHSAMTHGFSQLDVTTLMSRIPQDVSWTSPPSVDKTSSPSSFLSSPAMTTPSLISSTLPEDKLSSPMTSLLTSGLVKITDILRTRLEPVTSSLPNFSSTSDKILATSKDSKDTKEIFPSINTEETNVKANNSGHESHSPALADSETPKATTQMVITTTVGDPAPSTSMPVHGSSETTNIKREPTYFLTPRLRETSTSQESSFPTDTSFLLSKVPTGTITEVSSTGVNSSSKISTPDHDKSTVPPDTFTGEIPRVFTSSIKTKSAEMTITTQASPPESASHSTLPLDTSTTLSQGGTHSTVTQGFPYSEVTTLMGMGPGNVSWMTTPPVEETSSVSSLMSSPAMTSPSPVSSTSPQSIPSSPLPVTALPTSVLVTTTDVLGTTSPESVTSSPPNLSSITHERPATYKDTAHTEAAMHHSTNTAVTNVGTSGSGHKSQSSVLADSETSKATPLMSTTSTLGDTSVSTSTPNISQTNQIQTEPTASLSPRLRESSTSEKTSSTTETNTAFSYVPTGAITQASRTEISSSRTSISDLDRPTIAPDISTGMITRLFTSPIMTKSAEMTVTTQTTTPGATSQGILPWDTSTTLFQGGTHSTVSQGFPHSEITTLRSRTPGDVSWMTTPPVEETSSGFSLMSPSMTSPSPVSSTSPESIPSSPLPVTALLTSVLVTTTNVLGTTSPEPVTSSPPNLSSPTQERLTTYKDTAHTEAMHASMHTNTAVANVGTSISGHESQSSVPADSHTSKATSPMGITFAMGDTSVSTSTPAFFETRIQTESTSSLIPGLRDTRTSEEINTVTETSTVLSEVPTTTTTEVSRTEVITSSRTTISGPDHSKMSPYISTETITRLSTFPFVTGSTEMAITNQTGPIGTISQATLTLDTSSTASWEGTHSPVTQRFPHSEETTTMSRSTKGVSWQSPPSVEETSSPSSPVPLPAITSHSSLYSAVSGSSPTSALPVTSLLTSGRRKTIDMLDTHSELVTSSLPSASSFSGEILTSEASTNTETIHFSENTAETNMGTTNSMHKLHSSVSIHSQPSGHTPPKVTGSMMEDAIVSTSTPGSPETKNVDRDSTSPLTPELKEDSTALVMNSTTESNTVFSSVSLDAATEVSRAEVTYYDPTFMPASAQSTKSPDISPEASSSHSNSPPLTISTHKTIATQTGPSGVTSLGQLTLDTSTIATSAGTPSARTQDFVDSETTSVMNNDLNDVLKTSPFSAEEANSLSSQAPLLVTTSPSPVTSTLQEHSTSSLVSVTSVPTPTLAKITDMDTNLEPVTRSPQNLRNTLATSEATTDTHTMHPSINTAVANVGTTSSPNEFYFTVSPDSDPYKATSAVVITSTSGDSIVSTSMPRSSAMKKIESETTFSLIFRLRETSTSQKIGSSSDTSTVFDKAFTAATTEVSRTELTSSSRTSIQGTEKPTMSPDTSTRSVTMLSTFAGLTKSEERTIATQTGPHRATSQGTLTWDTSITTSQAGTHSAMTHGFSQLDLSTLTSRVPEYISGTSPPSVEKTSSSSSLLSLPAITSPSPVPTTLPESRPSSPVHLTSLPTSGLVKTTDMLASVASLPPNLGSTSHKIPTTSEDIKDTEKMYPSTNIAVTNVGTTTSEKESYSSVPAYSEPPKVTSPMVTSFNIRDTIVSTSMPGSSEITRIEMESTFSLAHGLKGTSTSQDPIVSTEKSAVLHKLTTGATETSRTEVASSRRTSIPGPDHSTESPDISTEVIPSLPISLGITESSNMTIITRTGPPLGSTSQGTFTLDTPTTSSRAGTHSMATQEFPHSEMTTVMNKDPEILSWTIPPSIEKTSFSSSLMPSPAMTSPPVSSTLPKTIHTTPSPMTSLLTPSLVMTTDTLGTSPEPTTSSPPNLSSTSHEILTTDEDTTAIEAMHPSTSTAATNVETTSSGHGSQSSVLADSEKTKATAPMDTTSTMGHTTVSTSMSVSSETTKIKRESTYSLTPGLRETSISQNASFSTDTSIVLSEVPTGTTAEVSRTEVTSSGRTSIPGPSQSTVLPEISTRTMTRLFASPTMTESAEMTIPTQTGPSGSTSQDTLTLDTSTTKSQAKTHSTLTQRFPHSEMTTLMSRGPGDMSWQSSPSLENPSSLPSLLSLPATTSPPPISSTLPVTISSSPLPVTSLLTSSPVTTTDMLHTSPELVTSSPPKLSHTSDERLTTGKDTTNTEAVHPSTNTAASNVEIPSSGHESPSSALADSETSKATSPMFITSTQEDTTVAISTPHFLETSRIQKESISSLSPKLRETGSSVETSSAIETSAVLSEVSIGATTEISRTEVTSSSRTSISGSAESTMLPEISTTRKIIKFPTSPILAESSEMTIKTQTSPPGSTSESTFTLDTSTTPSLVITHSTMTQRLPHSEITTLVSRGAGDVPRPSSLPVEETSPPSSQLSLSAMISPSPVSSTLPASSHSSSASVTSLLTPGQVKTTEVLDASAEPETSSPPSLSSTSVEILATSEVTTDTEKIHPFSNTAVTKVGTSSSGHESPSSVLPDSETTKATSAMGTISIMGDTSVSTLTPALSNTRKIQSEPASSLTTRLRETSTSEETSLATEANTVLSKVSTGATTEVSRTEAISFSRTSMSGPEQSTMSQDISIGTIPRISASSVLTESAKMTITTQTGPSESTLESTLNLNTATTPSWVETHSIVIQGFPHPEMTTSMGRGPGGVSWPSPPFVKETSPPSSPLSLPAVTSPHPVSTTFLAHIPPSPLPVTSLLTSGPATTTDILGTSTEPGTSSSSSLSTTSHERLTTYKDTAHTEAVHPSTNTGGTNVATTSSGYKSQSSVLADSSPMCTTSTMGDTSVLTSTPAFLETRRIQTELASSLTPGLRESSGSEGTSSGTKMSTVLSKVPTGATTEISKEDVTSIPGPAQSTISPDISTRTVSWFSTSPVMTESAEITMNTHTSPLGATTQGTSTLDTSSTTSLTMTHSTISQGFSHSQMSTLMRRGPEDVSWMSPPLLEKTRPSFSLMSSPATTSPSPVSSTLPESISSSPLPVTSLLTSGLAKTTDMLHKSSEPVTNSPANLSSTSVEILATSEVTTDTEKTHPSSNRTVTDVGTSSSGHESTSFVLADSQTSKVTSPMVITSTMEDTSVSTSTPGFFETSRIQTEPTSSLTLGLRKTSSSEGTSLATEMSTVLSGVPTGATAEVSRTEVTSSSRTSISGFAQLTVSPETSTETITRLPTSSIMTESAEMMIKTQTDPPGSTPESTHTVDISTTPNWVETHSTVTQRFSHSEMTTLVSRSPGDMLWPSQSSVEETSSASSLLSLPATTSPSPVSSTLVEDFPSASLPVTSLLNPGLVITTDRMGISREPGTSSTSNLSSTSHERLTTLEDTVDTEDMQPSTHTAVTNVRTSISGHESQSSVLSDSETPKATSPMGTTYTMGETSVSISTSDFFETSRIQIEPTSSLTSGLRETSSSERISSATEGSTVLSEVPSGATTEVSRTEVISSRGTSMSGPDQFTISPDISTEAITRLSTSPIMTESAESAITIETGSPGATSEGTLTLDTSTTTFWSGTHSTASPGFSHSEMTTLMSRTPGDVPWPSLPSVEEASSVSSSLSSPAMTSTSFFSTLPESISSSPHPVTALLTLGPVKTTDMLRTSSEPETSSPPNLSSTSAEILATSEVTKDREKIHPSSNTPVVNVGTVIYKHLSPSSVLADLVTTKPTSPMATTSTLGNTSVSTSTPAFPETMMTQPTSSLTSGLREISTSQETSSATERSASLSGMPTGATTKVSRTEALSLGRTSTPGPAQSTISPEISTETITRISTPLTTTGSAEMTITPKTGHSGASSQGTFTLDTSSRASWPGTHSAATHRSPHSGMTTPMSRGPEDVSWPSRPSVEKTSPPSSLVSLSAVTSPSPLYSTPSESSHSSPLRVTSLFTPVMMKTTDMLDTSLEPVTTSPPSMNITSDESLATSKATMETEAIQLSENTAVTQMGTISARQEFYSSYPGLPEPSKVTSPVVTSSTIKDIVSTTIPASSEITRIEMESTSTLTPTPRETSTSQEIHSATKPSTVPYKALTSATIEDSMTQVMSSSRGPSPDQSTMSQDISTEVITRLSTSPIKTESTEMTITTQTGSPGATSRGTLTLDTSTTFMSGTHSTASQGFSHSQMTALMSRTPGDVPWLSHPSVEEASSASFSLSSPVMTSSSPVSSTLPDSIHSSSLPVTSLLTSGLVKTTELLGTSSEPETSSPPNLSSTSAEILAITEVTTDTEKLEMTNVVTSGYTHESPSSVLADSVTTKATSSMGITYPTGDTNVLTSTPAFSDTSRIQTKSKLSLTPGLMETSISEETSSATEKSTVLSSVPTGATTEVSRTEAISSSRTSIPGPAQSTMSSDTSMETITRISTPLTRKESTDMAITPKTGPSGATSQGTFTLDSSSTASWPGTHSATTQRFPQSVVTTPMSRGPEDVSWPSPLSVEKNSPPSSLVSSSSVTSPSPLYSTPSGSSHSSPVPVTSLFTSIMMKATDMLDASLEPETTSAPNMNITSDESLAASKATTETEAIHVFENTAASHVETTSATEELYSSSPGFSEPTKVISPVVTSSSIRDNMVSTTMPGSSGITRIEIESMSSLTPGLRETRTSQDITSSTETSTVLYKMPSGATPEVSRTEVMPSSRTSIPGPAQSTMSLDISDEVVTRLSTSPIMTESAEITITTQTGYSLATSQVTLPLGTSMTFLSGTHSTMSQGLSHSEMTNLMSRGPESLSWTSPRFVETTRSSSSLTSLPLTTSLSPVSSTLLDSSPSSPLPVTSLILPGLVKTTEVLDTSSEPKTSSSPNLSSTSVEIPATSEIMTDTEKIHPSSNTAVAKVRTSSSVHESHSSVLADSETTITIPSMGITSAVDDTTVFTSNPAFSETRRIPTEPTFSLTPGFRETSTSEETTSITETSAVLYGVPTSATTEVSMTEIMSSNRIHIPDSDQSTMSPDIITEVITRLSSSSMMSESTQMTITTQKSSPGATAQSTLTLATTTAPLARTHSTVPPRFLHSEMTTLMSRSPENPSWKSSLFVEKTSSSSSLLSLPVTTSPSVSSTLPQSIPSSSFSVTSLLTPGMVKTTDTSTEPGTSLSPNLSGTSVEILAASEVTTDTEKIHPSSSMAVTNVGTTSSGHELYSSVSIHSEPSKATYPVGTPSSMAETSISTSMPANFETTGFEAEPFSHLTSGFRKTNMSLDTSSVTPTNTPSSPGSTHLLQSSKTDFTSSAKTSSPDWPPASQYTEIPVDIITPFNASPSITESTGITSFPESRFTMSVTESTHHLSTDLLPSAETISTGTVMPSLSEAMTSFATTGVPRAISGSGSPFSRTESGPGDATLSTIAESLPSSTPVPFSSSTFTTTDSSTIPALHEITSSSATPYRVDTSLGTESSTTEGRLVMVSTLDTSSQPGRTSSSPILDTRMTESVELGTVTSAYQVPSLSTRLTRTDGIMEHITKIPNEAAHRGTIRPVKGPQTSTSPASPKGLHTGGTKRMETTTTALKTTTTALKTTSRATLTTSVYTPTLGTLTPLNASMQMASTIPTEMMITTPYVFPDVPETTSSLATSLGAETSTALPRTTPSVFNRESETTASLVSRSGAERSPVIQTLDVSSSEPDTTASWVIHPAETIPTVSKTTPNFFHSELDTVSSTATSHGADVSSAIPTNISPSELDALTPLVTISGTDTSTTFPTLTKSPHETETRTTWLTHPAETSSTIPRTIPNFSHHESDATPSIATSPGAETSSAIPIMTVSPGAEDLVTSQVTSSGTDRNMTIPTLTLSPGEPKTIASLVTHPEAQTSSAIPTSTISPAVSRLVTSMVTSLAAKTSTTNRALTNSPGEPATTVSLVTHPAQTSPTVPWTTSIFFHSKSDTTPSMTTSHGAESSSAVPTPTVSTEVPGVVTPLVTSSRAVISTTIPILTLSPGEPETTPSMATSHGEEASSAIPTPTVSPGVPGVVTSLVTSSRAVTSTTIPILTFSLGEPETTPSMATSHGTEAGSAVPTVLPEVPGMVTSLVASSRAVTSTTLPTLTLSPGEPETTPSMATSHGAEASSTVPTVSPEVPGVVTSLVTSSSGVNSTSIPTLILSPGELETTPSMATSHGAEASSAVPTPTVSPGVSGVVTPLVTSSRAVTSTTIPILTLSSSEPETTPSMATSHGVEASSAVLTVSPEVPGMVTSLVTSSRAVTSTTIPTLTISSDEPETTTSLVTHSEAKMISAIPTLAVSPTVQGLVTSLVTSSGSETSAFSNLTVASSQPETIDSWVAHPGTEASSVVPTLTVSTGEPFTNISLVTHPAESSSTLPRTTSRFSHSELDTMPSTVTSPEAESSSAISTTISPGIPGVLTSLVTSSGRDISATFPTVPESPHESEATASWVTHPAVTSTTVPRTTPNYSHSEPDTTPSIATSPGAEATSDFPTITVSPDVPDMVTSQVTSSGTDTSITIPTLTLSSGEPETTTSFITYSETHTSSAIPTLPVSPGASKMLTSLVISSGTDSTTTFPTLTETPYEPETTAIQLIHPAETNTMVPRTTPKFSHSKSDTTLPVAITSPGPEASSAVSTTTISPDMSDLVTSLVPSSGTDTSTTFPTLSETPYEPETTATWLTHPAETSTTVSGTIPNFSHRGSDTAPSMVTSPGVDTRSGVPTTTIPPSIPGVVTSQVTSSATDTSTAIPTLTPSPGEPETTASSATHPGTQTGFTVPIRTVPSSEPDTMASWVTHPPQTSTPVSRTTSSFSHSSPDATPVMATSPRTEASSAVLTTISPGAPEMVTSQITSSGAATSTTVPTLTHSPGMPETTALLSTHPRTETSKTFPASTVFPQVSETTASLTIRPGAETSTALPTQTTSSLFTLLVTGTSRVDLSPTASPGVSAKTAPLSTHPGTETSTMIPTSTLSLGLLETTGLLATSSSAETSTSTLTLTVSPAVSGLSSASITTDKPQTVTSWNTETSPSVTSVGPPEFSRTVTGTTMTLIPSEMPTPPKTSHGEGVSPTTILRTTMVEATNLATTGSSPTVAKTTTTFNTLAGSLFTPLTTPGMSTLASESVTSRTSYNHRSWISTTSSYNRRYWTPATSTPVTSTFSPGISTSSIPSSTAATVPFMVPFTLNFTITNLQYEEDMRHPGSRKFNATERELQGLLKPLFRNSSLEYLYSGCRLASLRPEKDSSATAVDAICTHRPDPEDLGLDRERLYWELSNLTNGIQELGPYTLDRNSLYVNGFTHRSSMPTTSTPGTSTVDVGTSGTPSSSPSPTTAGPLLMPFTLNFTITNLQYEEDMRRTGSRKFNTMESVLQGLLKPLFKNTSVGPLYSGCRLTLLRPEKDGAATGVDAICTHRLDPKSPGLNREQLYWELSKLTNDIEELGPYTLDRNSLYVNGFTHQSSVSTTSTPGTSTVDLRTSGTPSSLSSPTIMAAGPLLVPFTLNFTITNLQYGEDMGHPGSRKFNTTERVLQGLLGPIFKNTSVGPLYSGCRLTSLRSEKDGAATGVDAICIHHLDPKSPGLNRERLYWELSQLTNGIKELGPYTLDRNSLYVNGFTHRTSVPTSSTPGTSTVDLGTSGTPFSLPSPATAGPLLVLFTLNFTITNLKYEEDMHRPGSRKFNTTERVLQTLLGPMFKNTSVGLLYSGCRLTLLRSEKDGAATGVDAICTHRLDPKSPGVDREQLYWELSQLTNGIKELGPYTLDRNSLYVNGFTHWIPVPTSSTPGTSTVDLGSGTPSSLPSPTTAGPLLVPFTLNFTITNLKYEEDMHCPGSRKFNTTERVLQSLLGPMFKNTSVGPLYSGCRLTLLRSEKDGAATGVDAICTHRLDPKSPGVDREQLYWELSQLTNGIKELGPYTLDRNSLYVNGFTHQTSAPNTSTPGTSTVDLGTSGTPSSLPSPTSAGPLLVPFTLNFTITNLQYEEDMHHPGSRKFNTTERVLQGLLGPMFKNTSVGLLYSGCRLTLLRPEKNGAATGMDAICSHRLDPKSPGLNREQLYWELSQLTHGIKELGPYTLDRNSLYVNGFTHRSSVAPTSTPGTSTVDLGTSGTPSSLPSPTTAVPLLVPFTLNFTITNLQYGEDMRHPGSRKFNTTERVLQGLLGPLFKNSSVGPLYSGCRLISLRSEKDGAATGVDAICTHHLNPQSPGLDREQLYWQLSQMTNGIKELGPYTLDRNSLYVNGFTHRSSGLTTSTPWTSTVDLGTSGTPSPVPSPTTTGPLLVPFTLNFTITNLQYEENMGHPGSRKFNITESVLQGLLKPLFKSTSVGPLYSGCRLTLLRPEKDGVATRVDAICTHRPDPKIPGLDRQQLYWELSQLTHSITELGPYTLDRDSLYVNGFTQRSSVPTTSTPGTFTVQPETSETPSSLPGPTATGPVLLPFTLNFTITNLQYEEDMRRPGSRKFNTTERVLQGLLMPLFKNTSVSSLYSGCRLTLLRPEKDGAATRVDAVCTHRPDPKSPGLDRERLYWKLSQLTHGITELGPYTLDRHSLYVNGFTHQSSMTTTRTPDTSTMHLATSRTPASLSGPMTASPLLVLFTINFTITNLRYEENMHHPGSRKFNTTERVLQGLLRPVFKNTSVGPLYSGCRLTLLRPKKDGAATKVDAICTYRPDPKSPGLDREQLYWELSQLTHSITELGPYTLDRDSLYVNGFTQRSSVPTTSIPGTPTVDLGTSGTPVSKPGPSAASPLLVLFTLNFTITNLRYEENMQHPGSRKFNTTERVLQGLLRSLFKSTSVGPLYSGCRLTLLRPEKDGTATGVDAICTHHPDPKSPRLDREQLYWELSQLTHNITELGPYALDNDSLFVNGFTHRSSVSTTSTPGTPTVYLGASKTPASIFGPSAASHLLILFTLNFTITNLRYEENMWPGSRKFNTTERVLQGLLRPLFKNTSVGPLYSGCRLTLLRPEKDGEATGVDAICTHRPDPTGPGLDREQLYLELSQLTHSITELGPYTLDRDSLYVNGFTHRSSVPTTSTGVVSEEPFTLNFTINNLRYMADMGQPGSLKFNITDNVMQHLLSPLFQRSSLGARYTGCRVIALRSVKNGAETRVDLLCTYLQPLSGPGLPIKQVFHELSQQTHGITRLGPYSLDKDSLYLNGYNEPGPDEPPTTPKPATTFLPPLSEATTAMGYHLKTLTLNFTISNLQYSPDMGKGSATFNSTEGVLQHLLRPLFQKSSMGPFYLGCQLISLRPEKDGAATGVDTTCTYHPDPVGPGLDIQQLYWELSQLTHGVTQLGFYVLDRDSLFINGYAPQNLSIRGEYQINFHIVNWNLSNPDPTSSEYITLLRDIQDKVTTLYKGSQLHDTFRFCLVTNLTMDSVLVTVKALFSSNLDPSLVEQVFLDKTLNASFHWLGSTYQLVDIHVTEMESSVYQPTSSSSTQHFYLNFTITNLPYSQDKAQPGTTNYQRNKRNIEDALNQLFRNSSIKSYFSDCQVSTFRSVPNRHHTGVDSLCNFSPLARRVDRVAIYEEFLRMTRNGTQLQNFTLDRSSVLVDGYSPNRNEPLTGNSDLPFWAVILIGLAGLLGVITCLICGVLVTTRRRKKEGEYNVQQQCPGYYQSHLDLEDLQ
Антигенсвязывающие участки, которые могут связываться с опухолеассоциированным антигеном NaPi2b, можно выявлять путем скрининга по связыванию с аминокислотной последовательностью, определяемой SEQ ID NO:149.
SEQ ID NO:149
MAPWPELGDAQPNPDKYLEGAAGQQPTAPDKSKETNKTDNTEAPVTKIELLPSYSTATLIDEPTEVDDPWNLPTLQDSGIKWSERDTKGKILCFFQGIGRLILLLGFLYFFVCSLDILSSAFQLVGGKMAGQFFSNSSIMSNPLLGLVIGVLVTVLVQSSSTSTSIVVSMVSSSLLTVRAAIPIIMGANIGTSITNTIVALMQVGDRSEFRRAFAGATVHDFFNWLSVLVLLPVEVATHYLEIITQLIVESFHFKNGEDAPDLLKVITKPFTKLIVQLDKKVISQIAMNDEKAKNKSLVKIWCKTFTNKTQINVTVPSTANCTSPSLCWTDGIQNWTMKNVTYKENIAKCQHIFVNFHLPDLAVGTILLILSLLVLCGCLIMIVKILGSVLKGQVATVIKKTINTDFPFPFAWLTGYLAILVGAGMTFIVQSSSVFTSALTPLIGIGVITIERAYPLTLGSNIGTTTTAILAALASPGNALRSSLQIALCHFFFNISGILLWYPIPFTRLPIRMAKGLGNISAKYRWFAVFYLIIFFFLIPLTVFGLSLAGWRVLVGVGVPVVFIIILVLCLRLLQSRCPRVLPKKLQNWNFLPLWMRSLKPWDAVVSKFTGCFQMRCCCCCRVCCRACCLLCDCPKCCRCSKCCEDLEEAQEGQDVPVKAPETFDNITISREAQGEVPASDSKTECTAL
Антигенсвязывающие участки, которые могут связываться с опухолеассоциированным антигеном нектин-4, можно выявлять путем скрининга по связыванию с аминокислотной последовательностью, определяемой SEQ ID NO:150.
SEQ ID NO:150
MPLSLGAEMWGPEAWLLLLLLLASFTGRCPAGELETSDVVTVVLGQDAKLPCFYRGDSGEQVGQVAWARVDAGEGAQELALLHSKYGLHVSPAYEGRVEQPPPPRNPLDGSVLLRNAVQADEGEYECRVSTFPAGSFQARLRLRVLVPPLPSLNPGPALEEGQGLTLAASCTAEGSPAPSVTWDTEVKGTTSSRSFKHSRSAAVTSEFHLVPSRSMNGQPLTCVVSHPGLLQDQRITHILHVSFLAEASVRGLEDQNLWHIGREGAMLKCLSEGQPPPSYNWTRLDGPLPSGVRVDGDTLGFPPLTTEHSGIYVCHVSNEFSSRDSQVTVDVLDPQEDSGKQVDLVSASVVVVGVIAALLFCLLVVVVVLMSRYHRRKAQQMTQKYEEELTLTRENSIRRLHSHHTDPRSQPEESVGLRAEGHPDSLKDNSSCSVMSEEPEGRSYSTLTTVREIETQTELLSPGSGRAEEEEDQDEGIKQAMNHFVQENGTLRAKPTGNGIYINGRGHLV
Антигенсвязывающие участки, которые могут связываться с опухолеассоциированным антигеном Fucosyl-GM1, можно выявлять путем скрининга по связыванию с моносиалотетрагексозилганглиозидом.
Антигенсвязывающие участки, которые могут связываться с опухолеассоциированным антигеном ADAM8, можно выявлять путем скрининга по связыванию с аминокислотной последовательностью, определяемой SEQ ID NO:151.
SEQ ID NO:151
LGATGHNFTLHLRKNRDLLGSGYTETYTAANGSEVTEQPRGQDHCFYQGHVEGYPDSAASLSTCAGLRGFFQVGSDLHLIEPLDEGGEGGRHAVYQAEHLLQTAGTCGVSDDSLGSLLGPRTAAVFRPRPGDSLPSRETRYVELYVVVDNAEFQMLGSEAAVRHRVLEVVNHVDKLYQKLNFRVVLVGLEIWNSQDRFHVSPDPSVTLENLLTWQARQRTRRHLHDNVQLITGVDFTGTTVGFARVSAMCSHSSGAVNQDHSKNPVGVACTMAHEMGHNLGMDHDENVQGCRCQERFEAGRCIMAGSIGSSFPRMFSDCSQAYLESFLERPQSVCLANAPDLSHLVGGPVCGNLFVERGEQCDCGPPEDCRNRCCNSTTCQLAEGAQCAHGTCCQECKVKPAGELCRPKKDMCDLEEFCDGRHPECPEDAFQENGTPCSGGYCYNGACPTLAQQCQAFWGPGGQAAEESCFSYDILPGCKASRYRADMCGVLQCKGGQQPLGRAICIVDVCHALTTEDGTAYEPVPEGTRCGPEKVCWKGRCQDLHVYRSSNCSAQCHNHGVCNHKQECHCHAGWAPPHCAKLLTEVHAASGSLPVFVVVVLVLLAVVLVTLAGIIVYRKARSRILSRNVAPKTTMGRSNPLFHQAASRVPAKGGAPAPSRGPQELVPTTHPGQPARHPASSVALKRPPPAPPVTVSSPPFPVPVYTRQAPKQVIKPTFAPPVPPVKPGAGAANPGPAEGAVGPKVALKPPIQRKQGAGAPTAP
Антигенсвязывающие участки, которые могут связываться с опухолеассоциированным антигеном ADAM9, можно выявлять путем скрининга по связыванию с аминокислотной последовательностью, определяемой SEQ ID NO:152.
SEQ ID NO:152
MGSGARFPSGTLRVRWLLLLGLVGPVLGAARPGFQQTSHLSSYEIITPWRLTRERREAPRPYSKQVSYVIQAEGKEHIIHLERNKDLLPEDFVVYTYNKEGTLITDHPNIQNHCHYRGYVEGVHNSSIALSDCFGLRGLLHLENASYGIEPLQNSSHFEHIIYRMDDVYKEPLKCGVSNKDIEKETAKDEEEEPPSMTQLLRRRRAVLPQTRYVELFIVVDKERYDMMGRNQTAVREEMILLANYLDSMYIMLNIRIVLVGLEIWTNGNLINIVGGAGDVLGNFVQWREKFLITRRRHDSAQLVLKKGFGGTAGMAFVGTVCSRSHAGGINVFGQITVETFASIVAHELGHNLGMNHDDGRDCSCGAKSCIMNSGASGSRNFSSCSAEDFEKLTLNKGGNCLLNIPKPDEAYSAPSCGNKLVDAGEECDCGTPKECELDPCCEGSTCKLKSFAECAYGDCCKDCRFLPGGTLCRGKTSECDVPEYCNGSSQFCQPDVFIQNGYPCQNNKAYCYNGMCQYYDAQCQVIFGSKAKAAPKDCFIEVNSKGDRFGNCGFSGNEYKKCATGNALCGKLQCENVQEIPVFGIVPAIIQTPSRGTKCWGVDFQLGSDVPDPGMVNEGTKCGAGKICRNFQCVDASVLNYDCDVQKKCHGHGVCNSNKNCHCENGWAPPNCETKGYGGSVDSGPTYNEMNTALRDGLLVFFFLIVPLIVCAIFIFIKRDQLWRSYFRKKRSQTYESDGKNQANPSRQPGSVPRHVSPVTPPREVPIYANRFAVPTYAAKQPQQFPSRPPPPQPKVSSQGNLIPARPAPAPPLYSSLT
Антигенсвязывающие участки, которые могут связываться с опухолеассоциированным антигеном SLC44A4, можно выявлять путем скрининга по связыванию с аминокислотной последовательностью, определяемой SEQ ID NO:153.
SEQ ID NO:153
MGGKQRDEDDEAYGKPVKYDPSFRGPIKNRSCTDVICCVLFLLFILGYIVVGIVAWLYGDPRQVLYPRNSTGAYCGMGENKDKPYLLYFNIFSCILSSNIISVAENGLQCPTPQVCVSSCPEDPWTVGKNEFSQTVGEVFYTKNRNFCLPGVPWNMTVITSLQQELCPSFLLPSAPALGRCFPWTNVTPPALPGITNDTTIQQGISGLIDSLNARDISVKIFEDFAQSWYWILVALGVALVLSLLFILLLRLVAGPLVLVLILGVLGVLAYGIYYCWEEYRVLRDKGASISQLGFTTNLSAYQSVQETWLAALIVLAVLEAILLLMLIFLRQRIRIAIALLKEASKAVGQMMSTMFYPLVTFVLLLICIAYWAMTALYLATSGQPQYVLWASNISSPGCEKVPINTSCNPTAHLVNSSCPGLMCVFQGYSSKGLIQRSVFNLQIYGVLGLFWTLNWVLALGQCVLAGAFASFYWAFHKPQDIPTFPLISAFIRTLRYHTGSLAFGALILTLVQIARVILEYIDHKLRGVQNPVARCIMCCFKCCLWCLEKFIKFLNRNAYIMIAIYGKNFCVSAKNAFMLLMRNIVRVVVLDKVTDLLLFFGKLLVVGGVGVLSFFFFSGRIPGLGKDFKSPHLNYYWLPIMTSILGAYVIASGFFSVFGMCVDTLFLCFLEDLERNNGSLDRPYYMSKSLLKILGKKNEAPPDNKKRKK
Антигенсвязывающие участки, которые могут связываться с опухолеассоциированным антигеном CA19-9, можно выявлять путем скрининга по связыванию с аминокислотной последовательностью, определяемой SEQ ID NO:154.
SEQ ID NO:154
MACSRPPSQCEPTSLPPGPPAGRRHLPLSRRRREMSSNKEQRSAVFVILFALITILILYS
SNSANEVFHYGSLRGRSRRPVNLKKWSITDGYVPILGNKTLPSRCHQCVIVSSSSHLLGTKLGPEIERAECTIRMNDAPTTGYSADVGNKTTYRVVAHSSVFRVLRRPQEFVNRTPETVFIFWGPPSKMQKPQGSLVRVIQRAGLVFPNMEAYAVSPGRMRQFDDLFRGETGKDREKSHSWLSTGWFTMVIAVELCDHVHVYGMVPPNYCSQRPRLQRMPYHYYEPKGPDECVTYIQNEHSRKGNHHRFITEKRVFSSWAQLYGITFSHPSWT
Альтернативно, Таблица 3 перечисляет пептидные последовательности вариабельных доменов тяжелых цепей и вариабельных доменов легких цепей, которые, в комбинации, могут связываться с CA125 (абаговомаб, софитузумаб), NaPi2b (лифастузумаб), нектином-4 (энфортумаб), фукозил-GM1 (описанные в публикации патентной заявки США №20130142789, конкретные последовательности включены посредством ссылки в настоящий документ), или SLC44A4 (описанные в публикации международной заявки № WO2010111018, конкретные последовательности включены посредством ссылки в настоящий документ).
(SEQ ID NO:155)
CDR1 (SEQ ID NO:156) - GYTFTNY
CDR2 (SEQ ID NO:157) - YPGDGN
CDR3 (SEQ ID NO:158) - GEGNYAWFAY
(SEQ ID NO:159)
CDR1(SEQ ID NO:160) - ENIYSYLA
CDR2 (SEQ ID NO:161) - NAKTLAG
CDR3 (SEQ ID NO:162) - QHHYGILPT
(SEQ ID NO:163)
CDR1 (SEQ ID NO:164) - GYSITNDY
CDR2 (SEQ ID NO:165) - SYSGY
CDR3 (SEQ ID NO:166) - WTSGLDY
(SEQ ID NO:167)
CDR1 (SEQ ID NO:168) - DLIHNWLA
CDR2 (SEQ ID NO:169) - GATSLET
CDR3 (SEQ ID NO:170) - QQYWTTPFT
(SEQ ID NO:171)
CDR1 (SEQ ID NO:172) - GFSFSDF
CDR2 (SEQ ID NO:173) - GRVAFH
CDR3 (SEQ ID NO:174) - HRGFDVGHFDF
CDR1 (SEQ ID NO:176) - ETLVHSSGNTYLE
CDR2 (SEQ ID NO:177) - RVSNRFS
CDR3 (SEQ ID NO:178) - FQGSFNPLT
(SEQ ID NO:179)
CDR1 (SEQ ID NO:180) - GFTFSSY
CDR2 (SEQ ID NO:181) - SSSSST
CDR3 (SEQ ID NO:182) - AYYYGMDV
(SEQ ID NO:183)
CDR1(SEQ ID NO:184) - QGISGWLA
CDR2 (SEQ ID NO:185) - AASTLQS
CDR3 (SEQ ID NO:186) - QQANSFPPT
(SEQ ID NO:187)
CDR1 (SEQ ID NO:188) - GFTFSRY
CDR2 (SEQ ID NO:189) - SRSGRD
CDR3 (SEQ ID NO:190) - TVTTYYYDFGMDV
CDR1 (SEQ ID NO:192) - QGISSWLA
CDR2 (SEQ ID NO:193) - AASSLQS
CDR3 (SEQ ID NO:194) - QQYNSYPPT
(SEQ ID NO:195)
CDR1 (SEQ ID NO:196) - GFTFSSY
CDR2 (SEQ ID NO:197) - SYDGSK
CDR3 (SEQ ID NO:198) - DGGDYVRYHYYGMDV
(SEQ ID NO:199)
CDR1 (SEQ ID NO:200) - QGISYYLA
CDR2 (SEQ ID NO:201) - DTSSLQS
CDR3 (SEQ ID NO:202) - QRYDSAPLT
Ниже перечислены примеры scFv, связанного с константной областью антитела, который также включает мутации, которые обеспечивают гетеродимеризацию двух полипептидных цепей. ScFv, содержащий вариабельный домен тяжелых цепей (VH) и вариабельный домен легких цепей (VL) из антитела к NKG2D, используют для получения мультиспецифического белка по настоящему изобретению. Каждая последовательность представляет собой VL-(G4S)4-VH-шарнир (AS или GAS)-Fc, содержащий мутации для гетеродимеризации (подчеркнуто). VL и VH содержат S-S мостик 100VL-44VH (подчеркнут), и могут быть из любого антитела, нацеленного на опухоль или связывающегося с NKG2D. Ala-Ser (AS, выделено жирным шрифтом и подчеркнуто) включены в последовательность изгиба шарнира для баланса между гибкостью и оптимальной геометрией. В определенных вариантах осуществления можно добавить дополнительный Gly к N-концу последовательности AS, создавая шарнир с последовательностью Gly-Ala-Ser (GAS, выделено жирным шрифтом и подчеркнуто). В определенных вариантах осуществления к последовательности AS в шарнире можно добавлять дополнительную последовательность Thr-Lys-Gly. Линкер (G4S)4 подчеркнут в последовательностях, перечисленных в абзаце ниже.
TriNKET по настоящему изобретению представляет собой NKG2D-связывающий-F4-TriNKET-EpCAM, включающий первый полипептид с последовательностью SEQ ID NO:203 (F4-EpCAMFc-AJцепьB-NKG2D-связывающий scFv), и второй полипептид с последовательностью SEQ ID NO:204 (анти-EpCAM HC-шарнир-Fc). NKG2D-связывающий-F4-TriNKET-EpCAM также содержит две легкие цепи, нацеленные на EpCAM, каждая из которых содержит анти-EpCAM VL-Константный домен, включающий последовательность SEQ ID NO:214. Например, в структуре на ФИГ. 36, когда Fab-фрагменты нацелены на EpCAM, NKG2D-связывающий-F4-TriNKET-EpCAM содержит SEQ ID NO:203 и SEQ ID NO:214, образующие одно плечо TriNKET, и SEQ ID NO:204 и SEQ ID NO:214, образующие второе плечо TriNKET.
Каждое из плеч содержит Fab-фрагмент, связывающий EpCAM, который содержит часть тяжелой цепи, содержащую вариабельный домен тяжелой цепи и CH1-домен, в которой вариабельный домен тяжелой цепи соединен с CH1-доменом; и часть легкой цепи, содержащую вариабельный домен легкой цепи и константный домен легкой цепи, (SEQ ID NO: 214). В первом плече (например, в F4-EpCAMFc-AJцепьB-NKG2D-связывающем scFv) CH1-домен связан с доменом Fc, который связан с scFv, нацеленным на NKG2D, образуя полипептид, содержащий последовательность SEQ ID NO: 203. Во втором плече домен CH1-домен связан с доменом Fc, образуя полипептид, содержащий последовательность SEQ ID NO: 204.
Например, F4-EpCAMFc-AJцепьB-NKG2D-связывающий scFv (SEQ ID NO:203) содержит вариабельный домен тяжелой цепи, нацеленный на EpCAM (VH) (SEQ ID NO:139) и CH1-домен, соединенный с Fc-доменом (шарнир-CH2-CH3), который C-концом связан с одноцепочечным вариабельным фрагментом (scFv) который связывается с NKG2D. Fc-домен в SEQ ID NO:203 содержит замену S354C, которая образует дисульфидную связь с заменой Y349C в другом Fc-домене (SEQ ID NO:204, описан ниже). Fc-домен в SEQ ID NO:203 сожержит замены Q347R, D399V, и F405T. scFv, который связывается с NKG2D, представлен аминокислотной последовательностью SEQ ID NO:205, и включает вариабельный домен легкой цепи (VL) связанный с вариабельным доменом тяжелой цепи (VH) через линкер (G4S)4 линкер, GGGGSGGGGSGGGGSGGGGS (SEQ ID NO:206). VL и VH внутри SEQ ID NO:205 соединены VL-(G4S)4-VH; VL и VH содержат 100VL-44VH мостик S-S (полученный путем замен G100C и G44C, соответственно) (цистеиновые остатки выделены жирным курсивом и подчеркнуты). Как представлено в SEQ ID NO:203, C-конец Fc-домена связан с N-концом scFv (SEQ ID NO:205) через короткий линкер SGSGGGGS (SEQ ID NO:207).
NKG2D-связывающий scFv
DIQMTQSPSSVSASVGDRVTITCRASQGISSWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGVSFPRTFGCGTKVEIKGGGGSGGGGSGGGGSGGGGSEVQLVESGGGLVKPGGSLRLSCAASGFTFSSYSMNWVRQAPGKCLEWVSSISSSSSYIYYADSVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCARGAPMGAAAGWFDPWGQGTLVTVSS (SEQ ID NO:205)
F4-EpCAMFc-AJцепьB-NKG2D-связывающий scFv

Анти-EpCAM HC-шарнир-Fc (SEQ ID NO:204) содержит вариабельный домен тяжелой цепи, нацеленный на EpCAM, и CH1-домен, соединенный с Fc-доменом (шарнир-CH2-CH3). Fc-домен в SEQ ID NO:204 содержит замену Y349C, которая образует дисульфидную связь с заменой S354C в CH3-домене Fc, связанного с NKG2D-связывающим scFv (SEQ ID NO:203). В SEQ ID NO:204, Fc-домен также содержит замены K360E и K409W.
Анти-EpCAM VH-CH1-Fc


Анти-EpCAM VL-константный домен (SEQ ID NO:214) содержит часть легкой цепи, нацеленную на EpCAM и включающую вариабельный домен легкой цепи и константный домен легкой цепи.
Анти-EpCAM VL-Константный домен
ELVMTQSPSSLTVTAGEKVTMSCKSSQSLLNSGNQKNYLTWYQQKPGQPPKLLIYWASTRESGVPDRFTGSGSGTDFTLTISSVQAEDLAVYYCQNDYSYPLTFGAGTKLEIKGRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:214)
В иллюстративном варианте осуществления, Fc-домен связанный с NKG2D-связывающим scFv-фрагментом, содержит мутации K360E и K409W, а Fc-домен, связанный с EPCAM Fab-фрагментом, содержит комплементарные мутации Q347R, D399V и F405T для образования гетеродимера.
В иллюстративном варианте осуществления, Fc-домен связанный с NKG2D-связывающим scFv-фрагментом, содержит замену Y349C в CH3-домене, которая образует дисульфидную связь с заменой S354C в Fc-домене, не связанном с NKG2D-связывающим scFv.
Другой TriNKET по настоящему изобретению представляет собой NKG2D-связывающий-F3'-TriNKET-EPCAM, последовательности которого описаны ниже (CDR (нумерация по Kabat) подчеркнуты).
Некоторые TriNKET по настоящему изобретению находятся в форме A49-F3'-TriNKET-EPCAM, последовательности которой представлены ниже (CDR (нумерация по Kabat) подчеркнуты).
A49-F3'-TriNKET-EPCAM включает одноцепочечный вариабельный фрагмент (scFv), который связывается с EPCAM (SEQ ID NO:208 и 209 представляют собой примеры последовательностей таких EPCAM-связывающих scFv полипептидов), связанный с Fc-доменом через шарнир, включающий Gly-Ala-Ser (например, в SEQ ID NO:210 и SEQ ID NO:211); и NKG2D-связывающий Fab-фрагмент («A49»), включающий часть тяжелой цепи с вариабельным доменом тяжелой цепи (SEQ ID NO:85) и CH1-доменом, и часть легкой цепи с вариабельным доменом легкой цепи (SEQ ID NO:86) и константным доменом легкой цепи, где вариабельный домен тяжелой цепи соединен с CH1-доменом, и CH1-домен динен с Fc-доменом. Fc-домен, связанный с Fab, нацеленным на EpCAM, содержит замены Q347R, D399V, и F405T для образования гетеродимера с Fab, содержащим замены K360E и K409W (см., например, SEQ ID NO:212, описанную ниже).
EPCAM-связывающий scFv по настоящему изобретению может включать вариабельный домен тяжелой цепи, соединенный с вариабельным доменом легкой цепи при помощи линкера (G4S)4 (представлен как VL(G4S)4VH или LH, где VL расположен N-концом к VH, и представлен как VH(G4S)4VL или HL, где VH расположен N-концом к VL). SEQ ID NO:208 и 209 представляют собой примеры последовательностей таких EPCAM-связывающих scFv полипептидов. VL и VH, содержащиеся в scFv (SEQ ID NO:208 или 209), включают S-S мостик 100VL-44VH (полученный из замен G100C и G44C, соответственно) (цистеиновые остатки выделены жирным курсивом и подчеркнуты в последовательностях ниже below). (G4S)4 представляет собой выделенную жирным и подчеркнутую последовательность GGGGSGGGGSGGGGSGGGGS (SEQ ID NO:206) в SEQ ID NO:208 и SEQ ID NO:209.
EPCAM (MT110LH) scFv

EPCAM (MT100HL) scFv

SEQ ID NO:210 и SEQ ID NO:211 представляют две последовательности EPCAM-связывающего scFv, который может быть связан с Fc-доменом через шарнир, содержащий (выделенажирным и подчернута). Fc-домен, связанный с scFv, содержит замены Q347R, D399V, и F405T.
EPCAM (MT110LH) scFv-Fc

EPCAM (MT110HL) scFv-Fc

SEQ ID NO:212 представляет часть тяжелой цепи Fab-фрагмента, которая содержит вариабельный домен тяжелой цепи (SEQ ID NO:85) из участка связывания NKG2D и CH1-домен, соединенный с Fc-доменом. Fc-домен в SEQ ID NO:212 содержит замену Y349C в CH3-домене, которая образует дисульфидную связь с заменой S354C в Fc, связанном с EpCAM-связывающим scFv (например, SEQ ID NO:210 и SEQ ID NO:211). В SEQ ID NO:212, Fc-домен также содержит замены K360E и K409W.
A49-VH
EVQLVESGGGLVKPGGSLRLSCAASGFTFSSYSMNWVRQAPGKGLEWVSSISSSSSYIYYADSVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCARGAPMGAAAGWFDPWGQGTLVTVSS (SEQ ID NO:85)
A49 VH-CH1-Fc
EVQLVESGGGLVKPGGSLRLSCAASGFTFSSYSMNWVRQAPGKGLEWVSSISSSSSYIYYADSVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCARGAPMGAAAGWFDPWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVCTLPPSRDELTENQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSWLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO:212)
SEQ ID NO:213 представляет часть легкой цепи Fab-фрагмента, содержащую вариабельный домен легкой цепи (SEQ ID NO:86) из участка связывания NKG2D и константный домен легкой цепи.
A49 - VL
DIQMTQSPSSVSASVGDRVTITCRASQGISSWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGVSFPRTFGGGTKVEIK (SEQ ID NO:86)
A49 LC VL - Константный домен
DIQMTQSPSSVSASVGDRVTITCRASQGISSWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGVSFPRTFGGGTKVEIK RTVAAPSPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO:213)
В иллюстративном варианте осуществления, Fc-домен, связанный с NKG2D-связывающим Fab-фрагментом, содержит мутации Q347R, D399V, и F405T, и Fc-домен, связанный с EPCAM scFv, содержит комплементарные мутации K360E и K409W для образования гетеродимера. В иллюстративном варианте осуществления, Fc-домен, связанный с NKG2D-связывающим Fab-фрагментом, содержит замену S354C в CH3-домене, которая образует дисульфидную связь с заменой Y349C в Fc, связанном с EPCAM-связывающим scFv.
В Fc-домене, связывание CD16 опосредуется шарнирной областью и CH2 доменом. Например, в человеческом IgG1, взаимодействие с CD16 исходно сфокусировано на аминокислотных остатках Asp 265-Glu 269, Asn 297-Thr 299, Ala 327-Ile 332, Leu 234-Ser 239, и углеводном остатке N-ацетил-D-глюкозамине CH2-домене (см., Sondermann et al., Nature, 406 (6793):267-273). Основываясь на известных доменах, можно выбрать мутации для улучшения или уменьшения аффинности связывания с CD16, например, с помощью библиотеки фагового дисплея или библиотеки кDНК на поврехности дрожжей, или их можно разработать на основе известной трехмерной структуры взаимодействия.
Сборка тяжелых цепей гетеродимерного антитела может быть выполнена путем экспрессии тяжелых цепей двух разных антител в одной и той же клетке, что может привести к сборке гомодимеров ктяжелой цепи каждого антитела, а также сборки гетеродимеров. Преимущественной сборки гетеродимеров можно достичь путем включения различных мутаций в CH3-домен константной области тяжелой цепи каждого антитела, как показано в US13/494870, US16/028850, US11/533709, US12/875015, US13/289934, US14/773418, US12/811207, US13/866756, US14/647480, и US14/830336. Например, мутации могут быть произведены в CH-домене на основе человека IgG1 и включать различные пары замен аминокислот в первом полипептиде и втором полипептиде, которые позволяют этим двум цепям селективно образовывать гетеродимеры друг с другом. Положения аминокислотных замен, показанные ниже, пронумерованы в соответствии с индексом ЕС, как в Кабат.
В одном сценарии замена аминокислот в первом полипептиде заменяет исходную аминокислоту более крупной аминокислотой, выбранной из аргинина (R), фенилаланина (F), тирозина (Y) или триптофана (W), и, по меньшей мере, одна замена аминокислот во втором полипептиде заменяет исходные аминокислоты на аминокислоты меньшего размера, выбранные из аланина (A), серина (S), треонина (T) или валина (V), так что замена на большие аминокислоты (выпуклость) вписывается в замены на меньшую аминокислоту (полость). Например, один полипептид может включать замену T366W, а другой может включать три замены, включая T366S, L368A и Y407V.
Вариабельный домен тяжелой цепи антитела по изобретению необязательно может быть соединен с аминокислотной последовательностью, по меньшей мере, на 90% идентичной константной области антитела, такой как константная область IgG, включая шарнир, CH2- и CH3-домены с наличием или отсутствием CH1-домена. В некоторых вариантах осуществления аминокислотная последовательность константной области, по меньшей мере, на 90% идентична константной области антитела человека, такой как константная область IgG1, константная область IgG2, константная область IgG3, или константная область IgG4 человека. В некоторых других вариантах осуществления, аминокислотная последовательность константной области, по меньшей мере, на 90% идентична константной области антитела от другого млекопитающего, такого как кролик, собака, кошка, мышь, или лошадь. Одна или более мутаций могут быть включены в константную область по сравнению с константной областью человеческого IgG1, например at Q347, Y349, L351, S354, E356, E357, K360, Q362, S364, T366, L368, K370, N390, K392, T394, D399, S400, D401, F405, Y407, K409, T411 и/или K439. Примеры замен включают, например, Q347E, Q347R, Y349S, Y349K, Y349T, Y349D, Y349E, Y349C, T350V, L351K, L351D, L351Y, S354C, E356K, E357Q, E357L, E357W, K360E, K360W, Q362E, S364K, S364E, S364H, S364D, T366V, T366I, T366L, T366M, T366K, T366W, T366S, L368E, L368A, L368D, K370S, N390D, N390E, K392L, K392M, K392V, K392F, K392D, K392E, T394F, T394W, D399R, D399K, D399V, S400K, S400R, D401K, F405A, F405T, Y407A, Y407I, Y407V, K409F, K409W, K409D, T411D, T411E, K439D, и K439E.
В определенных вариантах осуществления мутации, которые могут быть включены в CH1 константной области человеческого IgG1, могут быть по аминокислоте V125, F126, P127, T135, T139, A140, F170, P171 и/или V173. В определенных вариантах осуществления мутации, которые могут быть включены в Cκ константной области человеческого IgG1, могут быть по аминокислоте E123, F116, S176, V163, S174 и/или T164.
Альтернативно, замены аминокислот могут быть выбраны из следующих наборов замен, показанных в таблице 4.
Альтернативно, замены аминокислот могут быть выбраны из следующих наборов замен, показанных в таблице 5.
Альтернативно, замены аминокислот могут быть выбраны из следующих наборов замен, показанных в таблице 6.
Альтернативно, по меньшей мере, одна замена аминокислоты в каждой полипептидной цепи может быть выбрана из таблицы 7.
Альтернативно, по меньшей мере, одна замена аминокислоты может быть выбрана из следующих наборов замен в таблице 8, где положение/положения, указанные в колонке первого полипептида замещены любой известной отрицательно заряженной аминокислотой, и положение/положения, указанные в колонке второго полипептида замещены любой известной положительно заряженной аминокислотой.
Альтернативно, по меньшей мере, одна замена аминокислоты может быть выбрана из следующих наборов замен в таблице 9, где положение/положения, указанные в колонке первого полипептида замещены любой известной положительно заряженной аминокислотой, и положение/положения, указанные в колонке второго полипептида замещены любой известной отрицательно заряженной аминокислотой.
Альтернативно, замены аминокислот могут быть выбраны из следующих наборов замен, показанных в таблице 10.
Альтернативно, или кроме того, структурную стабильность гетеромультимерного белка можно повысить путем введения S354C на любой из первой или второй полипептидных цепей, и Y349C на противоположных полипептидных цепях, которые образуют искусственный дисульфидный мостик в зоне контакта двух полипептидов.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по положению T366, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из T366, L368 и Y407.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из T366, L368 и Y407, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по положению T366.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из E357, K360, Q362, S364, L368, K370, T394, D401, F405, и T411, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из Y349, E357, S364, L368, K370, T394, D401, F405 и T411.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из Y349, E357, S364, L368, K370, T394, D401, F405 и T411, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из E357, K360, Q362, S364, L368, K370, T394, D401, F405, и T411.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из L351, D399, S400 и Y407, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из T366, N390, K392, K409 и T411.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из T366, N390, K392, K409 и T411, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из L351, D399, S400 и Y407.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из Q347, Y349, K360, и K409, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из Q347, E357, D399 и F405.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из Q347, E357, D399 и F405, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из Y349, K360, Q347 и K409.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из K370, K392, K409 и K439, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из D356, E357 и D399.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из D356, E357 и D399, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из K370, K392, K409 и K439.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из L351, E356, T366 и D399, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из Y349, L351, L368, K392 и K409.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из Y349, L351, L368, K392 и K409, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по одному или более положениям, выбранным из группы, состоящей из L351, E356, T366 и D399.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по замене S354C, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по замене Y349C.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по замене Y349C, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по замене S354C.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по заменам K360E и K409W, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по заменам O347R, D399V и F405T.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по заменам O347R, D399V и F405T, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по заменам K360E и K409W.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по замене T366W, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по заменам T366S, T368A, и Y407V.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по заменам T366S, T368A, и Y407V, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по замене T366W.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по заменам T350V, L351Y, F405A, и Y407V, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по заменам T350V, T366L, K392L, и T394W.
В некоторых вариантах осуществления аминокислотная последовательность одной из полипептидных цепей константной области антитела отличается от аминокислотной последовательности константной области IgG1 по заменам T350V, T366L, K392L, и T394W, и аминокислотная последовательность другой полипептидной цепи константной области антитела отличается от аминокислотной последовательности константной области IgG1 по заменам T350V, L351Y, F405A, и Y407V.
Мультиспецифические белки, описанные выше, можно получать с использованием технологии рекомбинантных ДНК, хорошо известной специалисту в данной области. Например, первую последовательность нуклеиновой кислоты, кодирующую первую тяжелую цепь иммуноглобулина, можно клонировать в первый экспрессирующий вектор; вторую последовательность нуклеиновой кислоты, кодирующую вторую тяжелую цепь иммуноглобулина, можно клонировать во второй экспрессирующий вектор; третью последовательность нуклеиновой кислоты, кодирующую легкую цепь иммуноглобулина, можно клонировать в третий экспрессирующий вектор; и первые, и вторые, и третьи экспрессирующие молекулы могут вместе стабильно трансфицировать клетки-хозяева для получения мультимерных белков.
Для достижения максимального выхода мультиспецифического белка можно исследовать различные соотношения первого, второго и третьего экспрессирующих векторов, чтобы определить оптимальное соотношение для трансфекции клеток-хозяев. После трансфекции отдельные клоны можно выделять для генерации банка клеток с использованием известных в данной области способов, таких как лимитирующее разведение, ELISA, FACS, микроскопия или Clonepix.
Клоны можно культивировать в условиях, подходящих для биореактора промышленного масштаба и поддерживать экспрессию мультиспецифического белка. Мультиспецифические белки можно выделять и очищать с использованием известных в данной области способов, включая центрифугирование, глубокую фильтрацию, лизис клеток, гомогенизацию, замораживание-оттаивание, аффинную очистку, гель-фильтрацию, ионообменную хроматографию, гидрофобное взаимодействие, ионообменную хроматографию и смешанную хроматографию.
II. Характеристики мультиспецифических белков
Мультиспецифические белки, описываемые в настоящем документе включают участок связывания NKG2D, участок связывания CD16, и участок связывания опухолеассоциированного антигена, выбранного из любого из антигенов, представленных в таблице 11. В некоторых вариантах осуществления мультиспецифические белки одновременно связываются с клетками, экспрессирующими NKG2D и/или CD16, такими как NK-клетки, и с опухолевыми клетками, экспрессирующими опухолеассоциированный антиген, выбранный из любого из антигенов, представленных в таблице 11. Связывание мультиспецифических белков с NK-клетками может повышать активность NK-клеток относительно разрушения опухолевых клеток.
Таблица 11
В некоторых вариантах осуществления мультиспецифические белки связываются с опухолеассоциированным антигеном, выбранным из любого из антигенов, представленных в таблице 11, с аффинностью, аналогичной афинности соответствующего моноклонального антитела (т.е., моноклонального антитела с участком, связывающим такой же опухолеассоциированный антиген, как и участок, включенный в мультиспецифические белки (антиген, выбранный из любого из антигенов, представленных в таблице 11)). В некоторых вариантах осуществления мультиспецифические белки являются более эффективными, чем соответствующие моноклональные антитела, в уничтожении опухолевых клеток, экспрессирующих опухолеассоциированный антиген, выбранный из любого из антигенов, представленных в таблице 11.
В определенных вариантах осуществления мультиспецифические белки, описываемые в настоящем документе, которые включают участок связывания для NKG2D и участок связывания для опухолеассоциированного антигена, выбранного из любого из антигенов, представленных в таблице 11, активируют первичные NK-клетки человека, когда совместно культивируются с клетками, экспрессирующими опухолеассоциированный антиген. Активация NK-клеток отмечена повышением дегрануляции CD107a и выработки цитокина IFN-γ. Кроме того, по сравнению с соответствующим моноклональным антителом для опухолеассоциированного антигена, выбранного из любого из антигенов, представленных в таблице 11, мультиспецифические белки могут показывать превосходящую активацию NK-клеток человека в присутствии клеток, экспрессирующих опухолеассоциированный антиген.
В определенных вариантах осуществления мультиспецифические белки, описываемые в настоящем документе, которые включают участок связывания для NKG2D и участок связывания для опухолеассоциированного антигена, выбранного из любого из антигенов, представленных в таблице 11, повышают активность покоящихся и IL-2-активированных NK-клеток человека, которые совместно культивируются с клетками, экспрессирующими опухолеассоциированный антиген.
В определенных вариантах осуществления по сравнению с соответствующим моноклональным антителом, которое связывается с опухолеассоциированным антигеном, выбранным из любого из антигенов, представленных в таблице 11, мультиспецифические белки предлагают преимущество в нацеливании на опухолевые клетки, которые экспрессируют опухолеассоциированный антиген. Мультиспецифические связывающие белки, описываемые в настоящем документе, могут быть более эффективным для уменьшения роста опухоли и уничтожения злокачественных клеток.
В определенных вариантах осуществления EpCAM-нацеленный F4-TriNKET (например, NKG2D-связывающий-F4-TriNKET-EpCAM) уничтожает клетки-мишени более эффективно, чем родительское мАТ, нацеленное на EpCAM. В определенных вариантах осуществления F4-TriNKET также уничтожает клетки-мишени более эффективно, чем F3'-TriNKET (например, NKG2D-связывающий-F3'-TriNKET-EpCAM), что может быть отражением более сильного связывания F4-TriNKET с клетками-мишенями.
III. Терапевтические применения
Изобретение относится к способам лечения злокачественной опухоли с использованием мультиспецифического связывающего белка, описываемого в настоящем документе, и/или фармацевтической композиции, описываемой в настоящем документе. Способы можно использовать для лечения ряда злокачественных опухолей, которые экспрессируют EPCAM, путем введения нуждающемуся в этом пациенту терапевтически эффективного количества мультиспецифического связывающего белка, описываемого в настоящем документе.
Терапевтический способ можно охарактеризовать в зависимости от злокачественной опухоли, подлежащей лечению. Например, в определенных вариантах осуществления злокачественная опухоль представляет собой острый миелолейкоз, множественную миелому, диффузную крупноклеточную B-клеточную лимфому, тимому, аденокистозную карциному, злокачественную опухоль желудочно-кишечного тракта, злокачественную опухоль почки, рак молочной железы, глиобластому, рак легких, рак яичников, злокачественную опухоль головного мозга, рак предстательной железы, рак поджелудочной железы или меланому.
В других конкретных вариантах осуществления злокачественная опухоль представляет собой солидную опухоль. В других конкретных вариантах осуществления злокачественная опухоль представляет собой рак толстого кишечника, рак мочевого пузыря, рак шейки матки, злокачественную опухоль эндометрия, рак пищевода, лейкоз, рак печени, злокачественную опухоль прямой кишки, рак желудка, рак яичка, или рак матки. Еще в одних вариантах осуществления, злокачественная опухоль представляет собой васкуляризированную опухоль, плоскоклеточную карциному, аденокарциному, мелкоклеточную карциному, меланому, глиому, нейробластому, саркому (например, ангиосаркому или хондросаркому), злокачественную опухоль глотки, злокачественную опухоль околоушных желез, злокачественную опухоль желчевыводящих путей, рак щитовидной железы, акральную лентигинозную меланому, актинические кератозы, острый лимфоцитарный лейкоз, острый миелолейкоз, аденокистозную карциному, аденомы, аденосаркому, аденосквамозную карциному, злокачественную опухоль анального канала, злокачественную опухоль заднего прохода, анально-ректальную злокачественную опухоль, астроцитарную опухоль, карциному бартолиниевых желез, базально-клеточную карциному, злокачественную опухоль желчного пузыря, злокачественную опухоль кости, злокачественную опухоль костного мозга, злокачественную опухоль бронхов, карциному бронхиальных лимфатических узлов, карциноид, холангиокарциному, хондросаркому, папиллому/карциному сосудистого сплетения, хронический лимфоцитарный лейкоз, хронический миелолейкоз, светлоклеточную карциному, злокачественную опухоль соединительной ткани, цистаденому, злокачественную опухоль пищеварительной системы, злокачественную опухоль двенадцатиперстной кишки, злокачественную опухоль эндокринной системы, опухоль эндодермального синуса, гиперплазию эндометрия, саркома стромы эндометрия, аденокарциному эндометриоида, злокачественную опухоль эндотелиальных клеток, эпендимальную злокачественную опухоль, злокачественную опухоль эпителиальных клеток, саркому Юинга, злокачественную опухоль глаза и орбиты, злокачественную опухоль женских половых органов, узловую фокальную гиперплазию, рак желчного пузыря, злокачественную опухоль привратника желудка, злокачественную опухоль луковицы желудка, гастриному, глиобластому, глюкагоному, злокачественную опухоль сердца, гемангиобластомы, гемангиоэндотелиому, гемангиомы, аденому печени, печеночный аденоматоз, гепатобилиарную злокачественную опухоль, печеночноклеточную карциному, болезнь Ходжкина, злокачественную опухоль тонкой кишки, инсулинoму, интраэпителиальную неоплазию, межэпителиальную плоскоклеточную неоплазию, злокачественную опухоль внутрипеченочного желчного протока, инвазивную плоскоклеточную карциному, злокачественную опухоль тощей кишки, злокачественную опухоль сустава, саркому Капоши, злокачественную опухоль таза, крупноклеточную карциному, злокачественную опухоль толстой кишки, лейомиосаркому, меланомы типа злокачественного лентиго, лимфому, злокачественную опухоль мужских половых органов, злокачественную меланому, злокачественные мезотелиальные опухоли, медуллобластому, медуллоэпителиому, злокачественную опухоль менингеальной оболочки, злокачественную опухоль мезотелия, метастатическую карциному, злокачественную опухоль ротовой полости, мукоэпидермоидную карциному, множественную миелому, злокачественную опухоль мышечной ткани, злокачественную опухоль назального тракта, злокачественную опухоль нервной системы, нейроэпителиальную аденокарциному, узловую меланому, неэпителиальный рак кожи, неходжкинскую лимфому, овсяноклеточную карциному, злокачественную опухоль олигодендроглии, злокачественную опухоль пероральной полость, остеосаркому, папиллярную серозную аденокарциному, злокачественную опухоль пениса, злокачественную опухоль гортани, опухоли гипофиза, плазмоцитому, псевдосаркому, легочную бластому, злокачественную опухоль прямой кишки, почечноклеточную карциному, злокачественную опухоль дыхательной системы, ретинобластому, рабдомиосаркому, саркому, серозную карциному, злокачественную опухоль синуса, рак кожи, мелкоклеточную карциному, злокачественную опухоль тонкого кишечника, злокачественную опухоль гладкой мышечной ткани, злокачественную опухоль мягких тканей, соматостатин-секретирующую опухоль, злокачественную опухоль позвоночника, плоскоклеточную карциному, злокачественную опухоль поперечнополосатой мышечной ткани, злокачественную опухоль субмезотелия, поврехностную распространяющуюся меланому, T-клеточный лейкоз, злокачественную опухоль языка, недифференцированную карциному, злокачественную опухоль мочеточника, злокачественную опухоль уретры, рак мочевого пузыря, злокачественную опухоль мочеиспускательной системы, злокачественную опухоль шейки матки, злокачественную опухоль тела матки, увеальную меланому, злокачественную опухоль влагалища, веррукозную карциному, ВИПому, злокачественную опухоль, хорошо дифференцированную карциному, или опухоль Вильмса.
В других конкретных вариантах осуществления злокачественная опухоль представляет собой неходжкинскую лимфому, такую как B-клеточная лимфома или T-клеточная лимфома. В определенных вариантах осуществления неходжкинская лимфома представляет собой B-клеточную лимфому, такую как диффузная крупноклеточная B-клеточная лимфома, первичная медиастинальная B-клеточная лимфома, фолликулярная лимфома, мелкоклеточная лимфома, лимфома мантийных клеток, B-клеточная лимфома маргинальной зоны, экстраузловая B-клеточная лимфома маргинальной зоны, узловая B-клеточная лимфома маргинальной зоны, B-клеточная лимфома маргинальной зоны селезенки, лимфома Беркитта, лимфоплазмоцитарная лимфома, волосатоклеточный лейкоз, или первичная лимфома центральной нервной системы (ЦНС). В других конкретных вариантах осуществления неходжкинская лимфома представляет собой Т-клеточную лимфому, такую как лимфома предшественников T-лимфобластов, лимфома периферических T-клеток, лимфома T-клеток кожи, ангиоиммунобластная T-клеточная лимфома, экстраузловая лимфома естественных киллеров киллер/T-клеток, T-клеточная лимфома энтеропатического типа, подкожная панникулитоподобная Т-клеточная лимфома, анапластическая крупноклеточная лимфома, или лимфома периферических T-клеток.
Злокачественную опухоль, подлежащую лечению, можно охарактеризовать по наличию определенного антигена, экспрессируемого на поверхности злокачественной клетки. В определенных вариантах осуществления злокачественная клетка может экспрессировать один или более следующих антигенов в дополнение к EpCAM: CD2, CD19, CD20, CD30, CD38, CD40, CD52, CD70, EGFR/ERBB1, IGF1R, HER3/ERBB3, HER4/ERBB4, MUC1, TROP2, cMET, SLAMF7, PSCA, MICA, MICB, TRAILR1, TRAILR2, MAGE-A3, B7.1, B7.2, CTLA4, и PD1.
В некоторых других вариантах осуществления, когда второй участок связывания связывает EpCAM, злокачественная опухоль для лечения выбрана из рака головы и шеи, рака яичников, рака мочевого пузыря, рака молочной железы, колоректального рака, рака предстательной железы, рака желудка, рака печени, рака пищевода, и рака легких. В некоторых других вариантах осуществления, когда второй участок связывания связывает антиген, выбранный из антигена злокачественной опухоли 125 (CA125), натрий-фосфатного котранспортера 2B (NaPi2b), молекулы клеточной адгезии нектина-4 (Nectin4), фукозил-GM1 (моносиалтетрагексозилганглиозида), белка 8, содержащего домен дизинтегрина и металлопротеиназы (ADAM8), белка 9, содержащего домен дизинтегрина и металлопротеиназы (ADAM9), члена 4 семейства 44 растворимых переносчиков (SLC44A4), и сиалированного антигена Льюиса (CA19-9), злокачественная опухоль для лечения выбрана из рака яичников, злокачественной опухоли эндометрия, рака поджелудочной железы, рака легких, рака щитовидной железы, рака мочевого пузыря, рака молочной железы, колоректального рака, мелкоклеточного рака легких, нейробластомы, рака печени, злокачественной опухоли почки, меланомы, рака шейки матки, рака предстательной железы, остеосаркомы, злокачественной опухоли головного мозга, рака желудка, холангиокарциномы.
IV. Комбинированное лечение
Другой аспект изобретения относится к комбинированному лечению. Мультиспецифический связывающий белок, описываемый в настоящем документе, можно использовать в комбинации с дополнительными терапевтическими средствами для лечения злокачественной опухоли.
Примеры терапевтических средств, которые можно использовать в качестве части комбинированного лечения для лечения злокачественной опухоли, включают, например, облучение, митомицин, третиноин, рибомустин, гемцитабин, винкристин, этопозид, кладрибин, митобронитол, метотрексат, доксорубицин, карбоквон, пентостатин, нитракрин, зиностатин, цетрореликс, летрозол, ралтитрексед, даунорубицин, фадрозол, фотемустин, тималфазин, собузоксан, недаплатин, цитарабин, бикалутамид, винорелбин, веснаринон, амиглютетимид, амсакрин, проглюмид, эллиптиния ацетат, кетансерин, доксифлуридин, этретинат, изотретиноин, стрептозоцин, нимустин, виндезин, флутамид, дрогенил, бутоцин, кармофур, разоксан, сизофилан, карбоплатин, митолактол, тегафур, ифосфамид, преднимустин, пицибанил, левамизол, тенипозид, импросульфан, эноцитабин, лизурид, оксиметолон, тамоксифен, прогестерон, мепитиостан, эпитиостанол, форместан, интерферон-альфа, интерферон-2 альфа, интерферон-бета, интерферон-гамма (ИФН-γ), колониестимулирующий фактор-1, колониестимулирующий фактор-2, денилейкин дифтитокс, интерлейкин-2, высвобождающий фактор лютеинизирующего гормона, и вариации указанных выше веществ, которые могут проявлять дифференциальное связывание с их родственным рецептором, а также увеличивать или уменьшать время полувыведения из сыворотки.
Дополнительным классом веществ, которые можно использовать как часть комбинированной терапии при лечении рака, являются ингибиторы контрольных точек иммунного ответа. Типичные ингибиторы контрольных точек иммунного ответа включают вещества, которые ингибируют один или более из (i) цитотоксического T-лимфоцит-ассоциированного антигена 4 (CTLA4), (ii) белка 1 программируемой гибели клеток (PD1), (iii) PDL1, (iv) LAG3, (v ) B7-H3, (vi) B7-H4 и (vii) TIM3. Ингибитор CTLA4 ипилимумаб был одобрен Управлением по контролю за продуктами и лекарствами США для лечения меланомы.
Другими агентами, которые можно использовать в качестве части комбинированной терапии при лечении рака, являются моноклональные антитела, которые нацелены на мишени, не связанные с контрольными точками (например, герцептин) и нецитотоксические средства (например, ингибиторы тирозинкиназы).
Другие категории противораковых средств включают, например: (i) ингибитор, выбранный из ингибитора ALK, ингибитора ATR, антагониста A2A, ингибитора эксцизионной репарации оснований, ингибитора Bcr-Abl тирозинкиназы, ингибитора тирозинкиназы Брутона, ингибитора CDC7, ингибитора CHK1, ингибитора циклин-зависимой киназы, ингибитора ДНК-протеинкиназы, ингибитора и ДНК-ПК и mTOR, ингибитора DNMT1, ингибитора DNMT1 плюс 2-хлор-дезоксиаденозина, ингибитора HDAC, ингибитора пути передачи сигнала Hedgehog, ингибитора IDO, ингибитора JAK, ингибитора mTOR, ингибитора MEK, ингибитора MELK, ингибитора MTH1, ингибитора PARP, ингибитора фосфоинозитид-3-киназы, ингибитора и PARP1, и DHODH, ингибитора протеасомы, ингибитора топоизомеразы-II, ингибитора тирозинкиназы, ингибитора VEGFR, и ингибитора WEE1; (ii) агонист OX40, CD137, CD40, GITR, CD27, HVEM, TNFRSF25, или ICOS; и (iii) цитокин, выбранный из IL-12, IL-15, GM-CSF, и G-CSF.
Белки по изобретению также можно использовать в качестве дополнения к хирургическому удалению первичного поражения.
Можно выбирать количество мультиспецифического связывающего белка и дополнительного терапевтического средства и относительное время введения для достижения желаемого комбинированного терапевтического эффекта. Например, при введении комбинированного лечения пациенту, нуждающемуся в таком введении, терапевтические средства в комбинации, или фармацевтическая композиция или композиции, содержащие терапевтические средства, можно вводить в любом порядке, таком как, например, последовательно, параллельно, вместе, одновременно и т. п. Кроме того, например, мультиспецифический связывающий белок можно вводить в то время, когда дополнительное терапевтическое средство (средства) оказывает свое профилактическое или терапевтическое действие, или наоборот.
V. Фармацевтические композиции
Настоящее изобретение также относится к фармацевтическим композициям, которые содержат терапевтически эффективное количество белка, описываемого в настоящем документе. Композицию можно формулировать для применения в ряде систем доставки лекарственных средств. Один или более физиологически приемлемых эксципиентов или носителей также могут быть включены в композицию для надлежащего состава. Подходящие составы для применения в настоящем изобретении можно найти в Remington's Pharmaceutical Sciences, Mack Publishing Company, Philadelphia, Па., 17th ed., 1985. Для краткого обзора способов доставки лекарственных средств, см., например, Langer (Science 249:1527-1533, 1990).
Фармацевтические композиции могут содержать терапевтически эффективное количество мультиспецифического связывающего белка, содержащего сайт для антигенов (перечислены в таблице 11).
Состав для внутривенной доставки лекарственного средства по настоящему изобретению может содержаться в пакете, ручке или шприце. В определенных вариантах осуществления пакет может быть соединен с каналом, содержащим трубку и/или иглу. В определенных вариантах осуществления состав может быть лиофилизированным составом или жидким составом. В определенных вариантах осуществления состав может быть высушен замораживанием (лиофилизирован) и содержится примерно в 12-60 флаконах В определенных вариантах осуществления состав может быть лиофилизирован, и 45 мг лиофилизированного состава может содержаться в одном флаконе. В одном флаконе может содержаться 100 мг лиофилизированного состава. В определенных вариантах разрешения лиофилизированный состав из 12, 27 или 45 флаконов объединяют для получения терапевтической дозы белка в составе для внутривенного введения лекарственного средства. В определенных вариантах осуществления состав может быть жидким составом и храниться как приблизительно от 250 мг/флакон до приблизительно 1000 мг/флакон. В определенных вариантах осуществления состав может быть жидким составом и храниться в виде приблизительно 600 мг/флакон. В определенных вариантах осуществления состав может представлять собой жидкий состав и храниться в виде приблизительно 250 мг/флакон.
Белок может существовать в жидком водном фармацевтическом составе, включая терапевтически эффективное количество белка в буферном растворе, образующем состав.
Эти композиции можно стерилизовать общепринятыми способами стерилизации или можно стерильно фильтровать. Полученные водные растворы могут быть упакованы можно упаковывать для применения «как есть» или лиофилизировать. Лиофилизированнный препарат комбинируют со стерильным водным носителем до введения. рН препаратов, как правило, будет между 3 и 11, более предпочтительно между 5 и 9 или между 6 и 8, и наиболее предпочтительно между 7 и 8, такой как от 7 до 7,5. Полученные композиции в твердой форме можно упаковывать в упаковки с множеством единиц однократной дозы, каждая из которых содержит фиксированное количество указанного выше агента или агентов. Композиция в твердой форме также может быть упакована в контейнер для гибкого количества.
В определенных вариантах осуществления настоящее изобретение относится к составу с увеличенным сроком годности, включающему белок по настоящему изобретению в комбинации с маннитом, моногидратом лимонной кислоты, цитратом натрия, дифосфат натрия дигидратом, натрий дигидроген фосфат дигидратом, хлоридом натрия, полисорбатом 80, водой, и гидроксидом натрия.
В определенных вариантах осуществления получают водный состав, включающий белок по настоящему изобретению в pH-забуференном растворе. Буфер по настоящему изобретению может иметь pH в диапазоне приблизительно от 4 до приблизительно 8, например, приблизительно от 4,5 до приблизительно 6,0, или приблизительно от 4,8 до приблизительно 5,5, или может иметь pH приблизительно от 5,0 до приблизительно 5,2. Диапазоны, промежуточные по отношению к указанным выше значениям pH, также должны быть частью этого изобретения. Например, диапазоны значений, использующие комбинацию любого из приведенных выше значений в качестве верхнего и/или нижнего пределов, должны быть включены. Примеры буферов, которые будут контролировать pH в пределах этого диапазона, включают ацетат (например, ацетат натрия), сукцинат (такой как сукцинат натрия), глюконат, гистидин, цитрат и другие буферы на основе органических кислот.
В определенных вариантах осуществления состав включает буферную систему, которая содержит цитрат и фосфат для поддержания pH в диапазоне приблизительно от 4 до приблизительно 8. В определенных вариантах осуществления диапазон pH может составлять приблизительно от 4,5 до 6,0 или приблизительно от рН 4,8 до приблизительно 5,5, или в диапазоне рН приблизительно от 5,0 до приблизительно 5,2. В определенных вариантах осуществления буферная система включает моногидрат лимонной кислоты, цитрат натрия, дифосфат натрия дигидрат и/или натрий дигидроген фосфат дигидрат. В определенных вариантах осуществления буферная система включает приблизительно 1,3 мг/мл лимонной кислоты (например, 1,305 мг/мл), приблизительно 0,3 мг/мл цитрата натрия (например, 0,305 мг/мл), приблизительно 1,5 мг/мл дифосфат натрия дигидрата (например, 1,53 мг/мл), приблизительно 0,9 мг/мл натрия дигидроген фосфат дигидрата (например, 0,86) и приблизительно 6,2 мг/мл хлорида натрия (например , 6,165 мг/мл). В определенных вариантах осуществления буферная система включает 1-1,5 мг/мл лимонной кислоты, от 0,25 до 0,5 мг/мл цитрат натрия, от 1,25 до 1,75 мг/мл дифосфат натрия дигидрата и от 7 до 1,1 мг/мл натрий дигидроген фосфат дигидрата и от 6,0 до 6,4 мг/мл хлорид натрия. В определенных условиях рН состава корректируют с помощью гидроксида натрия.
Полиол, который действует как средство для тоничности и может стабилизировать антитело, также можно включать в состав. Полиол добавляют в состав в количестве, которое может варьироваться в зависимости от желаемой изотоничности состава. В определенных вариантах разрешения водный состав может быть изотоническим. Количество добавляемого полиола также может быть изменено относительно молекулярной массы полиола. Например, меньшее количество моносахаридов (например, маннит) можно добавлять по сравнению с дисахаридами (такими как трегалоза). В определенных вариантах осуществления полиол, который можно использовать в составе как средство придания тоничности, представляет собой маннит. В определенных вариантах осуществления концентрация маннита может быть примерно от 5 до примерно 20 мг/мл. В определенных вариантах осуществления концентрация маннита может составлять примерно от 7,5 до 15 мг/мл. В определенных вариантах осуществления концентрация маннита может составлять примерно 10-14 мг/мл. В определенных вариантах осуществления концентрация маннита может составлять примерно 12 мг/мл. В определенных вариантах осуществления в состав можно включать полиол сорбит.
В состав также можно добавлять детергент или поверхностно-активное вещество. Типичные детергенты включают неионные детергенты, такие как полисорбаты (например, полисорбаты 20, 80 и т.д.) или полоксамеры (например, полоксамер 188). Количество добавленного детергента таково, что оно уменьшает агрегацию сформулированного антитела и/или сводит к минимуму образование частиц в составе и/или уменьшает адсорбцию В определенных вариантах осуществления состав может включать входить поверхностно-активное вещество, такое какполисорбат. В определенных вариантах осуществления состав может содержать детергент полисорбат 80 или Твин 80. Твин 80 представляет собой термин, используемый для описания полиоксиэтилен (20) сорбитанмоноолеата (см. Fiedler, Lexikon der Hifsstoffe, Editio Cantor Verlag Aulendorf, 4th ed., 1996). В определенных вариантах осуществления состав может содержать приблизительно от 0,1 мг/мл и приблизительно до 10 мг/мл полисорбата 80 или приблизительно от 0,5 мг/мл и приблизительно до 5 мг мл. В определенных вариантах осуществления в состав можно добавлять приблизительно 0,1% полисорбата 80.
В вариантах осуществления, белковый продукт по настоящему изобретению формулируют в виде жидкого состава. Жидкий состав может быть представлен в концентрации 10 мг/мл в флаконе USP/Ph Eur типа I 50R, закрытом резиновой пробкой и герметизированным алюминиевым обжимным уплотнением. Пробка может быть изготовлена из эластомера, соответствующего USP и Ph Eur. В определенных вариантах осуществления флаконы могут быть заполнены 61,2 мл раствора белкового продукта, чтобы обеспечить извлекаемый объем 60 мл. В определенных вариантах осуществления жидкость может быть разбавлена 0,9% физиологическим раствором.
В определенных вариантах осуществления жидкий состав по изобретению можно получать в виде раствора с концентрацией 10 мг/мл в комбинации с сахаром в стабилизирующих уровнях. В определенных вариантах осуществления жидкий состав можно получать в водном носителе. В определенных вариантах осуществления стабилизатор можно добавлять в количестве, не большем того, которое может привести к нежелательной вязкости или непригодности для внутривенного введения. В определенных вариантах осуществления сахар может быть дисахаридами, например, сахарозой. В определенных вариантах осуществления жидкий состав также может включать один или более из буферного средства, поверхностно-активного вещества и консерванта.
В определенных вариантах осуществления pH жидкого состава можно устанавливать, добавляя фармацевтически приемлемую кислоту и/или основание. В определенных вариантах осуществления фармацевтически приемлемая кислота может быть соляной кислотой. В определенных вариантах осуществления основание может быть гидроксидом натрия.
В дополнение к агрегации, дезамидирование является распространенным вариантом продукта пептидов и белков, которое может происходить во время ферментации, сбора/очищения клеток, очистки, хранения лекарственного вещества/лекарственного продукта и во время анализа образца. Дезамидирование представляет собой потерю NH3 из белка, образующего сукцинимидное промежуточное соединение, которое может подвергаться гидролизу. Сукцинимидное промежуточное соединение приводит к снижению массы родительского пептида на 17 дальтон. Последующий гидролиз приводит к увеличению массы на 18 Дальтон. Выделение сукцинимидного промежуточного соединения затруднено из-за нестабильности в водных условиях. Таким образом, дезамидирование, как правило, определяют как увеличение массы на 1 дальтон. Дезамидирование аспарагина приводит либо к аспарагиновой, либо к изоаспарагиновой кислоте. Параметры, влияющие на скорость дезамидирования, включают pH, температуру, диэлектрическую проницаемость растворителя, ионную силу, первичную последовательность, локальную полипептидную конформацию и третичную структуру. Аминокислотные остатки, соседствующие с Asn в пептидной цепи, влияют на показатели дезамидирования. Gly и Ser, следующие за Asn в последовательностях белков, приводят к более высокой восприимчивости к дезамидированию.
В определенных вариантах осуществления жидкий состав по настоящему изобретению можно хранить в условиях pH и влажности, предотвращающих дезаминирование белкового продукта.
Водный носитель, представляющий интерес, в настоящем документе является фармацевтически приемлемым (безопасным и нетоксичным для введения человеку) и пригодным для получения жидкого состава. Примеры носителей включают стерильную воду для инъекций (SWFI), бактериостатическую воду для инъекций (BWFI), pH-забуференный раствор (например, фосфатно-солевой буфер), стерильный физиологический раствор, раствор Рингера или раствор декстрозы.
Консервант можно необязательно добавлять в составы в настоящем документе, чтобы уменьшить бактериальное действие. Добавление консерванта может, например, облегчить производство многоразового (с многократной дозой) состава.
Составы для внутривенного (в/в) введения могут быть предпочтительным способом введения, в частности, в случаях, когда пациент находится в госпитале после трансплантации, получая все лекарственные средства через в/в введение. В определенных вариантах осуществления жидкий состав разбавляют 0,9% хлоридом натрия раствор перед введением. В определенных вариантах осуществления разведенный лекарственный продукт для инъекции является изотоническим и подходит для введения путем внутривенного вливания.
В определенных вариантах осуществления солевые или буферные компоненты можно добавлять в количестве 10 мМ-200 мМ. Соли и/или буферы являются фармацевтически приемлемыми и получены из различныхизвестных кислот (неорганических и органических) с «основаниеобразующими» металлами или аминами. В определенных вариантах осуществления буфер может быть фосфатным буфером. В определенных вариантах осуществления буфер может быть глицинатом, карбонатом, цитратом, в этом случае, ионы натрия, калия или аммония могут служить в качестве противоиона.
Консервант можно необязательно добавлять в составы в настоящем документе, чтобы уменьшить бактериальное действие. Добавление консерванта может, например, облегчить производство многоразового (с многократной дозой) состава.
Водный носитель, представляющий интерес, в настоящем документе является фармацевтически приемлемым (безопасным и нетоксичным для введения человеку) и пригодным для получения жидкого состава. Примеры носителей включают стерильную воду для инъекций (SWFI), бактериостатическую воду для инъекций (BWFI), pH-забуференный раствор (например, фосфатно-солевой буфер), стерильный физиологический раствор, раствор Рингера или раствор декстрозы.
Белок по настоящему изобретению может существовать в виде лиофилизированного состава, включающего белки и лиопротектор. Липротектор может быть сахаром, например, дисахаридами. В определенных вариантах осуществления лиопротектор может быть сахарозой или мальтозой. Лиофилизированный состав также может включать один или более из буферного средства, поверхностно-активного вещества и консерванта.
Количество сахарозы или мальтозы, подходящее для стабилизации лиофилизированного лекарственного продукта может находиться в массовом отношении, по меньшей мере, 1:2 белка к сахарозе или мальтозе. В определенных вариантах осуществления массовое отношение белка к сахарозе или мальтозе может составлять от 1:2 до 1:5.
В определенных вариантах осуществления pH состава перед лиофилизацией можно устанавливать, добавляя фармацевтически приемлемую кислоту и/или основание. В определенных вариантах осуществления фармацевтически приемлемая кислота может быть соляной кислотой. В определенных вариантах осуществления основание может быть гидроксидом натрия.
Перед лиофилизацией, pH раствора, содержащего белок по настоящему изобретению, можно корректировать от 6 до 8. В определенных вариантах осуществления диапазон pH для лиофилизированного лекарственного продукта может быть от 7 до 8.
В определенных вариантах осуществления солевые или буферные компоненты можно добавлять в количестве 10 мМ-200 мМ. Соли и/или буферы являются фармацевтически приемлемыми и получены из различныхизвестных кислот (неорганических и органических) с «основаниеобразующими» металлами или аминами. В определенных вариантах осуществления буфер может быть фосфатным буфером. В определенных вариантах осуществления буфер может быть глицинатом, карбонатом, цитратом, в этом случае, ионы натрия, калия или аммония могут служить в качестве противоиона.
В определенных вариантах осуществления можно добавлять «наполнитель» можно добавлять. «Наполнитель» представляет собой соединение, которое добавляет массу лиофилизированной смеси и вносит вклад в физическую структуру лиофилизированной массы (например, облегчает производство по существу однородной лиофилизированной массы, которая сохраняет открытопористую структуру). Примеры наполнителей включают маннит, глицин, полиэтиленгликоль и сорбит. Лиофилизированные составы по настоящему изобретению могут содержать такие наполнители.
Консервант можно необязательно добавлять в составы в настоящем документе, чтобы уменьшить бактериальное действие. Добавление консерванта может, например, облегчить производство многоразового (с многократной дозой) состава.
В определенных вариантах осуществления лиофилизированный лекарственный продукт можно восстанавливать водным носителем. Водный носитель, представляющий интерес, в настоящем документе является фармацевтически приемлемым (безопасным и нетоксичным для введения человеку) и пригодным для получения жидкого состава. Примеры носителей включают стерильную воду для инъекций (SWFI), бактериостатическую воду для инъекций (BWFI), pH-забуференный раствор (например, фосфатно-солевой буфер), стерильный физиологический раствор, раствор Рингера или раствор декстрозы.
В определенных вариантах осуществления лиофилизированный лекарственный продукт восстанавливают или стерильной водой для инъекций, USP (SWFI) или 0,9% хлоридом натрия для инъекций, USP. После восстановления лиофилизированный порошок растворяют в растворе.
В определенных вариантах осуществления лиофилизированный белковый продукт по настоящему изобретению востанавливают приблизительно до 4,5 мл водой для инъекций и разводят 0,9% физиологическим раствором (раствором хлорида натрия).
Фактические уровни дозировки активных ингредиентов в фармацевтических композициях по настоящему изобретению могут варьироваться для получения количества активного ингредиента, которое эффективно для достижения желаемого терапевтического ответа для конкретного пациента, композиции и способа введения, без токсичности для пациента.
Конкретная доза может представлять собой унифицированную дозу для каждого пациента, например, 50-5000 мг белка. Альтернативно, доза пациента может быть адаптирована к приблизительной массе тела или площади поверхности пациента. Другие факторы, определяющие подходящую дозировку, могут включать заболевание или состояние, подлежащее лечению или профилактике, тяжесть заболевания, способ введения, возраст, пол и медицинское состояние пациента. Специалисты в данной области регулярно проводят дальнейшие уточнения расчетов, необходимых для определения подходящей дозировки для лечения, особенно в свете информации о дозировке и анализах описываемой в в настоящем документе. Доза также может быть определена путем использования известных анализов для определения доз, используемых в сочетании с соответствующими данными доза-ответ. Доза для индивидуального пациента может быть скорректирована по мере мониторинга прогрессирования заболевания. Уровни нацеленной конструкции или комплекса в крови пациента для того, чтобы увидеть есть ли необходимость скорректировать дозу для достижения или поддержания эффективной концентрации. Можно использовать фармакогеномику для определения того, какие нацеленные конструкции и/или комплексы и их дозы наиболее вероятно будут эффективны для данного индивидуума (Schmitz et al., Clinica Chimica Acta 308: 43-53, 2001; Steimer et al., Clinica Chimica Acta 308: 33-41, 2001).
В основном, дозировки, основанные на массе тела, составляют приблизительно от 0,01 мкг до приблизительно 100 мг на кг массы тела, так как приблизительно от 0,01 мкг до приблизительно 100 мг/кг массы тела, приблизительно от 0,01 мкг до приблизительно 50 мг/кг массы тела, приблизительно от 0,01 мкг до приблизительно 10 мг/кг массы тела, приблизительно от 0,01 мкг до приблизительно 1 мг/кг массы тела, приблизительно от 0,01 мкг до приблизительно 100 мкг/кг массы тела, приблизительно от 0,01 мкг до приблизительно 50 мкг/кг массы тела, приблизительно от 0,01 мкг до приблизительно 10 мкг/кг массы тела, приблизительно от 0,01 мкг до приблизительно 1 мкг/кг массы тела, приблизительно от 0,01 мкг до приблизительно 0,1 мкг/кг массы тела, приблизительно от 0,1 мкг до приблизительно 100 мг/кг массы тела, приблизительно от 0,1 мкг до приблизительно 50 мг/кг массы тела, приблизительно от 0,1 мкг до приблизительно 10 мг/кг массы тела, приблизительно от 0,1 мкг до приблизительно 1 мг/кг массы тела, приблизительно от 0,1 мкг до приблизительно 100 мкг/кг массы тела, приблизительно от 0,1 мкг до приблизительно 10 мкг/кг массы тела, приблизительно от 0,1 мкг до приблизительно 1 мкг/кг массы тела, приблизительно от 1 мкг до приблизительно 100 мг/кг массы тела, приблизительно от 1 мкг до приблизительно 50 мг/кг массы тела, приблизительно от 1 мкг до приблизительно 10 мг/кг массы тела, приблизительно от 1 мкг до приблизительно 1 мг/кг массы тела, приблизительно от 1 мкг до приблизительно 100 мкг/кг массы тела, приблизительно от 1 мкг до приблизительно 50 мкг/кг массы тела, приблизительно от 1 мкг до приблизительно 10 мкг/кг массы тела, приблизительно от 10 мкг до приблизительно 100 мг/кг массы тела, приблизительно от 10 мкг до приблизительно 50 мг/кг массы тела, приблизительно от 10 мкг до приблизительно 10 мг/кг массы тела, приблизительно от 10 мкг до приблизительно 1 мг/кг массы тела, приблизительно от 10 мкг до приблизительно 100 мкг/кг массы тела, приблизительно от 10 мкг до приблизительно 50 мкг/кг массы тела, приблизительно от 50 мкг до приблизительно 100 мг/кг массы тела, приблизительно от 50 мкг до приблизительно 50 мг/кг массы тела, приблизительно от 50 мкг до приблизительно 10 мг/кг массы тела, приблизительно от 50 мкг до приблизительно 1 мг/кг массы тела, приблизительно от 50 мкг до приблизительно 100 мкг/кг массы тела, приблизительно от 100 мкг до приблизительно 100 мг/кг массы тела, приблизительно от 100 мкг до приблизительно 50 мг/кг массы тела, приблизительно от 100 мкг до приблизительно 10 мг/кг массы тела, приблизительно от 100 мкг до приблизительно 1 мг/кг массы тела, приблизительно от 1 мг до приблизительно 100 мг/кг массы тела, приблизительно от 1 мг до приблизительно 50 мг/кг массы тела, приблизительно от 1 мг до приблизительно 10 мг/кг массы тела, приблизительно от 10 мг до приблизительно 100 мг/кг массы тела, приблизительно от 10 мг до приблизительно 50 мг/кг массы тела, приблизительно от 50 мг до приблизительно 100 мг/кг массы тела.
Дозы можно вводить один или более раз в день, еженедельно, ежемесячно или ежегодно или даже один раз каждые 2-20 лет. Специалисты в данной области могут легко оценить частоту повторения для дозирования на основе измеренной продолжительности обработки и концентраций наводящейся на мишень конструкции или комплекса в телесных жидкостях или тканях. Введение по настоящему изобретению может быть внутривенным, внутриартериальным, интраперитонеальным, внутримышечным, подкожным, интраплевральным, интратекальным, внутриполостным, путем перфузии через катетер или путем прямой внутриочаговой инъекции. Можно вводить один или более раз в день, один или более раз в неделю, один или более раз в месяц и один или более раз ежегодно.
Вышеприведенное описание описывает множество аспектов и вариантов осуществления изобретения. Патентная заявка специально рассматривает все комбинации и сочетания аспектов и вариантов осуществления.
ПРИМЕРЫ
Изобретение, которое к настоящему моменту, в основном, описано, будет более понятно со ссылкой на следующие примеры примеры, которые включены только в целях иллюстрации определенных аспектов и вариантов осуществления настоящего изобретения и не предназначены для ограничения изобретения.
Пример 1 - NKG2D-связывающие домены связываются с NKG2D
NKG2D-связывающие домены связываются с очищенным рекомбинантным NKG2D
Последовательности нуклеиновой кислоты эктодоменов NKG2D человека, мыши или макаки сливали с последовательностями нуклеиновой кислоты, кодирующей Fc-домены человеческого IgG1 и вводили в клетки млекопитающих для экспрессии. После очистки слитые белки NKG2D-Fc адсорбировали в лунках микропланшетов. После блокирования лунок бычьим сывороточным альбумином для предотвращения неспецифического связывания, NKG2D-связывающие домены титровали и добавляли в лунки, предварительно покрытые слитыми белками NKG2D-Fc. Связывание первичного антитела определяли с использованием вторичного антитела, которое конъюгировано с пероксидазой хрена и специфически распознает легкую цепь каппа человека, чтобы избежать перекрестной реактивности Fc. 3,3',5,5'-тетраметилбензидин (TMB), субстрат для пероксидазы хрена, добавляли в лунки для визуализации сигнала связывания, оптическую плотность которого измеряли при 450 нМ и корректировали при 540 нМ. Клон NKG2D-связывающего домена, контроль изотипа или положительный контроль (включающий вариабельные домены тяжелой цепи и легкой цепи, выбранные из SEQ ID NO: 101-104, или клоны к мышиному NKG2D MI-6 и CX-5, доступные в eBioscience) добавляли в каждую лунку.
Контроль изотипа показал минимальное связывание с рекомбинантными белками NKG2D-Fc, в то время как положительный контроль наиболее сильно связывался с рекомбинантными антигенами. NKG2D-связывающие домены, продуцируемые всеми клонами, демонстрировали связывание с рекомбинантными белками NKG2D-Fc человека, мыши и макаки, хотя с разными аффиностями от клона к клону. Как правило, каждый анти-NKG2D-клон, связавшийся с рекомбинантным NKG2D-Fc человека (фиг. 3) и макаки (фиг. 4), имеет сходную аффинность, но более низкую аффинность к рекомбинантному NKG2D-Fc мыши (фиг. 5).
NKG2D-связывающие домены связываются с клетками, экспрессирующими NKG2D
Линии клеток мышиной лимфомы EL4 были сконструированы для экспрессии рецепторов химерного антигена NKG2D-сигнальный домен зета CD3 человека или мыши. NKG2D-связывающий клон, контроль изотипа или положительный контроль использовали в концентрации 100 нМ для окрашивания внеклеточного NKG2D, экспрессированного на клетках EL4. Связывание антител определяли с использованием вторичных антител против человеческого IgG, конъюгированных с флуорофором. Клетки анализировали с помощью проточной цитометрии и рассчитывали кратность по отношению к фоновым значениям (FOB) с использованием средней интенсивности флуоресценции (MFI) NKG2D-экспрессирующих клеток по сравнению с родительскими клетками EL4.
NKG2D-связывающие домены, продуцируемые всеми клонами, связались с клетками EL4, экспрессирующими NKG2D человека и мыши. Антитела положительного контроля (содержащие вариабельные домены тяжелой цепи и легкой цепи, выбранные из SEQ ID NO: 101-104 или антимышиные клоны NKG2D MI-6 и CX-5, доступные в eBioscience) дали наилучшую FOB сигнала связывания. Аффинность связывания NKG2D- для каждого клона была сходной между клетками, экспрессирующими человеческий NKG2D (фигура 6) и мышиный (фигура 7) NKG2D.
Пример 2 - NKG2D-связывающие домены блокируют связывание природного лиганда с NKG2D
Конкуренция с ULBP-6
Рекомбинантные человеческие белки NKG2D-Fc адсорбировали в лунках микропланшета, и лунки блокировали бычьим сывороточным альбумином для уменьшения неспецифического связывания. Насыщающую концентрацию ULBP-6-His-биотина добавляли в лунки с последующим добавлением клонов домена, связывающего NKG2D. После двухчасовой инкубации лунки промывали, и детектировали ULBP-6-His-биотин, который оставался связанным с лунками, покрытыми NKG2D-Fc, с помощью стрептавидина, конъюгированного с пероксидазой хрена и субстратом TMB. Оптическую плотность измеряли при 450 нМ и корректировали при 540 нМ. После вычитания фона рассчитывали специфическое связывание NKG2D-связывающих доменов с белками NKG2D-Fc по проценту ULBP-6-His-биотина, который блокировался от связывания с белками NKG2D-Fc в лунках. Антитело положительного контроля (содержащее вариабельные домены тяжелой цепи и легкой цепи, выбранные из SEQ ID NO: 101-104) и различные NKG2D-связывающие домены блокировали связывание ULBP-6 с NKG2D, в то время как контроль изотипа показал незначительную конкуренцию с ULBP-6 (фиг. 8).
Последовательность ULBP-6 представлена SEQ ID NO:108
MAAAAIPALLLCLPLLFLLFGWSRARRDDPHSLCYDITVIPKFRPGPRWCAVQGQVDEKTFLHYDCGNKTVTPVSPLGKKLNVTMAWKAQNPVLREVVDILTEQLLDIQLENYTPKEPLTLQARMSCEQKAEGHSSGSWQFSIDGQTFLLFDSEKRMWTTVHPGARKMKEKWENDKDVAMSFHYISMGDCIGWLEDFLMGMDSTLEPSAGAPLAMSSGTTQLRATATTLILCCLLIILPCFILPGI (SEQ ID NO:108)
Конкуренция с MICA
Рекомбинантные человеческие белки MICA-Fc адсорбировали в лунках микропланшета, и лунки блокировали бычьим сывороточным альбумином для уменьшения неспецифического связывания. NKG2D-Fc-биотин добавляли к лункам, а затем NKG2D-связывающие домены. После инкубации и промывания, NKG2D-Fc-биотин, который оставался связанным с MICA-Fc, покрывающим лунки, детектировали с использованием стрептавидина-HRP и субстрата TMB. Оптическую плотность измеряли при 450 нМ и корректировали при 540 нМ. После вычитания фона рассчитывали специфическое связывание NKG2D-связывающих доменов с белками NKG2D-Fc по проценту NKG2D-Fc-биотина, который был блокирован от связывания с MICA-Fc, покрывающим лунки. Антитело положительного контроля (содержащее вариабельные домены тяжелой цепи и легкой цепи, выбранные из SEQ ID NO: 101-104) и различные NKG2D-связывающие домены блокировали связывание MICA с NKG2D, в то время как контроль изотипа показал незначительную конкуренцию с MICA (фиг. 9).
Конкуренция с Rae-1 дельта
Рекомбинантный мышиный Rae-1delta-Fc (приобретенный у R&D Systems) адсорбировали в лунках микропланшета, и лунки блокировали бычьим сывороточным альбумином для уменьшения неспецифического связывания. Мышиный NKG2D-Fc-биотин добавляли к лункам, а затем NKG2D-связывающие домены. После инкубации и промывания, NKG2D-Fc-биотин, который оставался связанным с Rae-1delta-Fc, покрывающим лунки, детектировали с использованием стрептавидина-HRP и субстрата TMB. Оптическую плотность измеряли при 450 нМ и корректировали при 540 нМ. После вычитания фона рассчитывали специфическое связывание NKG2D-связывающих доменов с белками NKG2D-Fc по проценту NKG2D-Fc-биотина, который был блокирован от связывания с Rae-1delta-Fc, покрывающим лунки. Положительный контроль (содержащий вариабельные домены тяжелой цепи и легкой цепи, выбранные из SEQ ID NO: 101-104, или клоны против мышиного NKG2D MI-6 и CX-5, доступные у eBioscience) и различные клоны доменов, связывающих NKG2D, блокировали связывание Rae-1delta с мышиным NKG2D, в то время как контрольное изотипическое антитело показало незначительную конкуренцию с Rae-1delta (фиг. 10).
Пример 3 - Клоны доменов, связывающих NKG2D, активируют NKG2D
Последовательности нуклеиновой кислоты человеческого и мышиного NKG2D сливали с последовательностями нуклеиновой кислоты, кодирующей сигнальный домен CD3 зета для получения конструкций химерного рецептора антигена (CAR). Конструкции NKG2D-CAR затем клонировали в ретровирусный вектор с использованием сборки Гибсона и трансфицировали клетки expi293 для продукции ретровирусов. Клетки EL4 инфицировали вирусами, содержащими NKG2D-CAR, вместе с 8 мкг/мл полибрена. Через 24 часа после заражения, анализировали уровни экспрессии NKG2D-CAR в клетках EL4 путем проточной цитометрии, и выбирали клоны, которые экспрессировали высокие уровни NKG2D-CAR на клеточной поверхности.
Чтобы определить, активируют ли NKG2D-связывающие домены NKG2D, их адсорбировали в лунки микропланшета, а клетки NKG2D-CAR EL4 культивировали на лунках с покрытием из фрагмента антитела в течение 4 часов в присутствии брефелдина-A и монензина. Внутриклеточный TNF-α, показатель активации NKG2D, анализировали проточной цитометрией. Процент TNF-α-положительных клеток нормализовали по клеткам, обработанным положительным контролем. Все NKG2D-связывающие домены активировали и человеческий NKG2D (рис. 11), и мышиный NKG2D (рис. 12).
Пример 4 - NKG2D-связывающие домены активируют NK-клетки
Первичные человеческие NK-клетки
Мононуклеарные клетки периферической крови (РВМС) выделяли из лейкоцитарного слоя периферической крови человека с использованием центрифугирования в градиенте плотности. NK-клетки (CD3-CD56+) выделяли из PBMC с использованием отрицательного отбора с помощью магнитных шариков, и чистота выделенных NK-клеток обычно составляла >95%. Затем выделенные NK-клетки культивировали в среде, содержащей 100 нг/мл IL-2, в течение 24-48 часов, после чего их переносили в лунки микропланшета, на котором были адсорбированы NKG2D-связывающие домены, и культивировали в среде, содержащей конъюгированное с флуорофором анти-CD107a антитело, брефелдин-А и монензин. После культивирования NK-клетки анализировали проточной цитометрией с использованием антител против CD3, CD56 и IFN-γ, конъюгированных с флуорофором. Окрашивание CD107a и IFN-γ анализировали в клетках CD3-CD56+ для оценки активации NK-клеток. Увеличение количества двойных положительных клеток CD107a/IFN-γ свидетельствует о лучшей активации NK-клеток за счет вовлечения двух активирующих рецепторов, а не одного рецептора. NKG2D-связывающие домены и положительный контроль (например, вариабельный домен тяжелой цепи, представленный SEQ ID NO: 101 или SEQ ID NO: 103, и вариабельный домен легкой цепи, представленный SEQ ID NO: 102 или SEQ ID NO: 104), показали более высокий процент NK-клеток, становящихся CD107a+ и IFN-γ+, чем контроль изотипа (фиг. 13 и фиг. 14 представляют данные из двух независимых экспериментов, каждый из которых использует PBMC другого донора для получения NK-клеток).
Первичные мышиные NK-клетки
Селезенки получали от мышей C57Bl/6 и измельчали через сито с ячейками 70 мкм для получения суспензии отдельных клеток. Клетки осаждали и ресуспендировали в лизирующем буфере ACK (приобретенном у Thermo Fisher Scientific #A1049201; 155 мМ хлорида аммония, 10 мМ бикарбоната калия, 0,01 мМ EDTA) для удаления эритроцитов. Оставшиеся клетки культивировали с 100 нг/мл hIL-2 в течение 72 часов, а затем собирали и готовили для выделения NK-клеток. Затем NK-клетки (CD3-NK1.1+) выделяли из клеток селезенки с использованием способа отрицательного истощения с использованием магнитных шариков, как правило, с чистотой >90%. Очищенные NK-клетки культивировали в среде, содержащей 100 нг мл mIL-15, в течение 48 часов, после чего их переносили в лунки микропланшета, на котором были адсорбированы NKG2D-связывающие домены, и культивировали в среде, содержащей конъюгированное с флуорофором анти-CD107a антитело, брефелдин-А и монензин. После культивирования в лунках, покрытых NKG2D-связывающими доменами, NK-клетки анализировали проточной цитометрией с использованием антител против CD3, NK1.1 и IFN-γ, конъюгированных с флуорофором. Окрашивание CD107a и IFN-γ анализировали в клетках CD3-NK1.1+ для оценки активации NK-клеток. Увеличение количества двойных положительных клеток CD107a/IFN-γ свидетельствует о лучшей активации NK-клеток за счет вовлечения двух активирующих рецепторов, а не одного рецептора. NKG2D-связывающие домены и положительный контроль (выбранный из клонов против мышиного NKG2D MI-6 и CX-5, доступных в eBioscience) показали более высокий процент клеток NK, становящихся CD107a+ и IFN-γ+, чем контроль изотипа (фиг. 15 и фиг.16 представляют данные из двух независимых экспериментов, в каждом из которых использовались различные мыши для приготовления NK-клеток).
Пример 5 - NKG2D-связывающие домены дают возможность цитотоксичности опухолевых клеток-мишеней
Анализы активации первичных NK-клеток человека и мыши продемонстрировали повышенные маркеры цитотоксичности для NK-клеток после инкубации с NKG2D-связывающими доменами. Чтобы определить, приводит ли это к усилению лизиса опухолевых клеток, был использован клеточный анализ, в котором каждый NKG2D-связывающий домен превращали в моноспецифическое антитело. Область Fc была использована в качестве одного нацеливающего плеча, тогда как области Fab-фрагмента (NKG2D-связывающий домен) действовали в качестве другого нацеливающего плеча для активации NK-клеток. Клетки THP-1, которые имеют человеческое происхождение и экспрессируют высокие уровни Fc-рецепторов, использовали в качестве опухолевой мишени и использовали набор для цитотоксичности Perkin Elmer DELFIA. Клетки THP-1 метили реагентом BATDA и ресуспендировали по 105/мл в культуральной среде. Меченые клетки THP-1 затем объединяли с антителами NKG2D и выделенными мышиными NK-клетками в лунках планшета для микротитрования при 37°С в течение 3 часов. После инкубации удаляли 20 мкл супернатанта культуры, смешивали с 200 мкл раствора европия и инкубировали при встряхивании в течение 15 минут в темноте. Флуоресценцию измеряли с течением времени с помощью спектрофотометра для чтения планшетов PheraStar, оборудованного модулем флуоресценции с разрешением по времени (возбуждение 337 нМ, излучение 620 нМ), и специфический лизис рассчитывали в соответствии с инструкциями к набору.
Положительный контроль, ULBP-6, естественный лиганд для NKG2D, конъюгированный с Fc, показал повышенный специфический лизис клеток-мишеней THP-1 мышиными NK-клетками. Антитела к NKG2D также усиливали специфический лизис клеток-мишеней THP-1, тогда как контрольное изотипическое антитело показало снижение специфического лизиса. Пунктирная линия указывает на специфический лизис клеток THP-1 мышиными NK-клетками без добавления антител (фигура 17).
Пример 6 - Антитела к NKG2D показывают высокую термостабильность
Температуру плавления NKG2D-связывающие доменов анализировали с помощью дифференциальной сканирующей флуориметрии. Экстраполированная кажущаяся температура плавления была высокой по сравнению с типичными антителами IgG1 (рис. 18).
Пример 7 - Синергетическая активация человеческих NK-клеток за счет перекрестного сшивания NKG2D и CD16
Анализ активации первичных NK-клеток человека
Мононуклеарные клетки периферической крови (РВМС) выделяли из лейкоцитарного слоя периферической крови человека с использованием центрифугирования в градиенте плотности. NK-клетки очищали от РВМС с использованием отрицательных магнитных шариков (StemCell #17955). NK-клетки были >90% CD3-CD56+, как определено проточной цитометрией. Затем клетки размножали 48 часов в среде, содержащей 100 нг/мл hIL-2 (Peprotech #200-02), перед использованием в анализах активации. Антитела наносили на 96-луночный планшет с плоским дном в концентрации 2 мкг/мл (анти-CD16, Biolegend # 302013) и 5 мкг/мл (анти-NKG2D, R & D # MAB139) в 100 мкл стерильного PBS на ночь при 4°С с последующим тщательным промыванием лунок для удаления избытка антител. Для оценки дегрануляции IL-2-активированные NK-клетки ресуспендировали при 5×105 клеток/мл в культуральной среде, дополненной 100 нг/мл человеческого IL-2 (hIL2) и 1 мкг/мл APC-конъюгированного анти-CD107a мАТ ( Biolegend # 328619). Затем на чашки, покрытые антителами, добавляли 1×105 клеток/лунку. Ингибиторы транспорта белка Брефелдин А (BFA, Biolegend # 420601) и Монензин (Biolegend # 420701) добавляли в конечном разведении 1:1000 и 1:270, соответственно. Клетки на планшетах инкубировали в течение 4 часов при 37°С в 5% СО2. Для внутриклеточного окрашивания IFN-γ NK-клетки метили анти-CD3 (Biolegend # 300452) и анти-CD56 мАТ (Biolegend # 318328), а затем фиксировали, пермеабилизировали и метили анти-IFN-γ мАТ (Biolegend # 506507). NK-клетки анализировали на экспрессию CD107a и IFN-γ методом проточной цитометрии после отбора на живых CD56+ CD3-клетках.
Чтобы исследовать относительную активность комбинации рецепторов, проводили перекрестное сшивание NKG2D или CD16 и совместное перекрестное сшивание обоих рецепторов посредством стимуляции, связанной с пластиной. Как показано на фигуре 19 (фигуры 19A-19C), комбинированная стимуляция CD16 и NKG2D приводила к сильно повышенным уровням CD107a (дегрануляция) (фигура 19A) и/или продукции IFN-γ (фигура 19B). Пунктирные линии представляют аддитивный эффект отдельных стимуляций каждого рецептора.
Уровни CD107a и внутриклеточную продукцию IFN-γ активированными IL-2 NK-клетками анализировали после 4 часов стимуляции, связанной с пластиной, с анти-CD16, анти-NKG2D или комбинацией обоих моноклональных антител. Графики показывают среднее (n=2) ± Sd. ФИГ. 19A демонстрирует уровни CD107a; ФИГ. 19B демонстрирует уровни IFN-γ; ФИГ. 19C демонстрирует уровни CD107a и IFN-γ. Данные, показанные на фиг. 19А-19С, представляют пять независимых экспериментов с использованием пяти различных здоровых доноров.
Пример 8 - Опосредованная триспецифическим связывающим белком (TriNKET) повышенная цитотоксичность клеток-мишеней
Оценка связывания TriNKET или мАТ с клеткой, экспрессирующей человеческие антигены злокачественных опухолей
Линии раковых клеток человека, экспрессирующие EPCAM, использовали для оценки связывания опухолевого антигена при помощи TriNKET, полученных из клона MT110, нацеленного на EPCAM, в форматах F4 и F3'. Линии клеток человека H747, HCC827 и HCT116 были использованы для оценки связывания TriNKET и мАТ с клеткой, экспрессирующей EPCAM. TriNKET или мАТ разбавляли и инкубировали с соответствующими клетками. Связывание детектировали с использованием вторичного антитела против человеческого IgG, конъюгированного с флуорофором. Клетки анализировали проточной цитометрией, связывание MFI с клетками, экспрессирующими EPCAM, нормализовали по окрашенным контролям с человеческим рекомбинантным IgG1, для получения кратности по сравнению с фоновыми значениями.
На фиг. 37 показано связывание триспецифических связывающих белков (TriNKET) по настоящему изобретению (A49-F4-TriNKET-MT110 и A49-F3'-TriNKET-MT110) и родительского моноклонального антитела (мАТ) с клетками колоректального рака человека H747, экспрессирующими EpCAM. ФИГ. 38 показывает связывание триспецифических связывающих белков (TriNKET) по настоящему изобретению (A49-F4-TriNKET-MT110 и A49-F3'-TriNKET-MT110) и родительского моноклонального антитела (мАТ) с клетками рака легких человека HCC827, экспрессирующими EpCAM. ФИГ. 39 показывает связывание триспецифических связывающих белков (TriNKET) по настоящему изобретению (A49-F4-TriNKET-MT110 и A49-F3'-TriNKET-MT110) и родительского моноклонального антитела (мАТ) с клетками колоректального рака человека HCT116, экспрессирующими EpCAM. Общее связывание было более сильным с F4-TriNKET по сравнению с F3'-TriNKET, который включает EPCAM-связывающее MT110.
Анализ цитотоксичности первичных NK-клеток человека
РВМС выделяли из лейкоцитарного слоя периферической крови человека с использованием центрифугирования в градиенте плотности. Выделенные РВМС отмывали и готовили для выделения NK-клеток. NK-клетки выделяли, используя метод отрицательного отбора с магнитными шариками. Достигнутая чистота выделенных NK-клеток обычно превышала 90% CD3-CD56+. Выделенные NK-клетки инкубировали в течение ночи без цитокина и использовали на следующий день в анализах на цитотоксичность.
Анализ цитотоксичности DELFIA
Линии раковых клеток человека, экспрессирующие представляющую интерес мишень, собирали из культуры, промывали HBS и ресуспендировали в ростовой среде по 106 клеток/мл для мечения реагентом BATDA (Perkin Elmer, AD0116). Следовали инструкциям производителя по мечению клеток-мишеней. После мечения клетки промывали 3 раза HBS и ресуспендировали по 0,5×105 клеток/мл в культуральной среде. Для приготовления фоновых лунок аликвоту меченых клеток откладывали в сторону, и клетки извлекали из среды. 100 мкл среды аккуратно добавляли в лунки в трех повторах, чтобы не повредить осажденные клетки. 100 мкл BATDA-меченных клеток добавляли в каждую лунку 96-луночного планшета. Лунки были сохранены для спонтанного высвобождения из клеток-мишеней и подготовлены для лизиса клеток-мишеней путем добавления 1% Тритона-Х. Моноклональные антитела или TriNKET против интересующей опухолевой мишени разводили в культуральной среде, и 50 мкл разведенного мАТ или TriNKET добавляли в каждую лунку. Покоящиеся NK-клетки собирали из культуры, промывали и ресуспендировали при 1,0×105-2,0×106 клеток/мл в культуральной среде в зависимости от требуемого соотношения эффектор к клетке-мишени. 50 мкл NK-клеток добавляли в каждую лунку планшета для обеспечения общего объема культуры 200 мкл. Планшет инкубировали при 37°С с 5% СО2 в течение 2-4 часов перед проведением анализа.
После культивирования в течение 2-3 часов планшет извлекали из инкубатора и клетки осаждали центрифугированием при 200×g в течение 5 минут. 20 мкл культурального супернатанта переносили в чистый микропланшет, предоставленный производителем, и 200 мкл раствора европия при комнатной температуре добавляли в каждую лунку. Планшет защищали от света и инкубировали на шейкере при 250 об/мин в течение 15 минут. Планшет считывали, используя прибор SpectraMax® i3X (Molecular Devices), и рассчитывали процент специфического лизиса (% специфического лизиса = (Экспериментальное высвобождение - спонтанное высвобождение)/(Максимальное высвобождение - спонтанное высвобождение))×100).
ФИГ. 40А и ФИГ. 40B TriNKET-опосредованная цитотоксичность покоящихся человеческих NK-клеток от двух разных здоровых доноров против раковых клеток H747 человека. ФИГ. 41А и ФИГ. 41B TriNKET-опосредованная цитотоксичность покоящихся человеческих NK-клеток от двух разных здоровых доноров против раковых клеток HCC827 человека. ФИГ. 42А и ФИГ. 42B TriNKET-опосредованная цитотоксичность покоящихся человеческих NK-клеток от двух разных здоровых доноров против раковых клеток человека MCF7. ФИГ. 43А и ФИГ. 43B TriNKET-опосредованная цитотоксичность покоящихся человеческих NK-клеток от двух разных здоровых доноров против раковых клеток HCT116 человека. F4-TriNKET, нацеленный на EPCAM, убивал клетки-мишени более эффективно, чем родительское мАТ, нацеленное на EPCAM. F4-TriNKET также убивал клетки-мишени более активно, чем F3'-TriNKET, что может быть отражением более сильного связывания F4-TriNKET с клетками-мишенями.
ВКЛЮЧЕНИЕ ПУТЕМ ССЫЛКИ
Полное содержание каждого из патентных документов и научных статей, упомянутых в настоящем документе, включено в качестве ссылки для любых целей.
ЭКВИВАЛЕНТЫ
Изобретение может быть воплощено в других конкретных формах без отступления от сущности изобретения или его существенных характеристик. Указанн выше варианты осуществления, таким образом, должны рассматриваться во всех отношениях как иллюстративные, а не ограничивающие изобретение, описываемое в настоящем документе. Таким образом, объем изобретения указан в прилагаемой формуле изобретения, а не в указанном выше описании, и все изменения, которые находятся в пределах значения и диапазона эквивалентности формулы изобретения, должны быть включены в нее.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> DRAGONFLY THERAPEUTICS, INC.
<120> БЕЛКИ, СВЯЗЫВАЮЩИЕ NKG2D, CD16 И ОПУХОЛЕАССОЦИИРОВАННЫЙ
АНТИГЕН
<130> DFY-038WO
<150> 62/566,824
<151> 2017-10-02
<150> 62/555,110
<151> 2017-09-07
<160> 214
<170> PatentIn version 3.5
<210> 1
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 1
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 2
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 2
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 3
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 3
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 4
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 4
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Ile Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 5
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 5
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 6
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr His Ser Phe Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 7
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 7
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 8
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Asn Ser Tyr Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 9
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 9
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 10
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 10
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 11
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 11
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Gly Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 12
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 12
Glu Leu Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ser Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Asp Ile Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 13
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 13
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 14
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 14
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gly Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 15
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 15
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 16
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 16
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Lys Glu Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 17
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 17
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 18
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 18
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 19
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 19
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 20
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 20
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asp Ile Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 21
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 21
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 22
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 22
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asp Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 23
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 23
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 24
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 24
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gly Ser Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 25
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 25
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 26
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 26
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gln Ser Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 27
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 27
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 28
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 28
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Ser Phe Ser Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 29
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 29
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 30
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 30
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Glu Ser Tyr Ser Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 31
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 31
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 32
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 32
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asp Ser Phe Ile Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 33
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 33
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 34
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 34
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gln Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 35
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 35
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 36
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 36
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr His Ser Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 37
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 37
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 38
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 38
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Glu Leu Tyr Ser Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 39
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 39
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 40
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 40
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asp Thr Phe Ile Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 41
<211> 125
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 41
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Ser Ser Ile Arg His Ala Tyr Tyr Tyr Tyr Gly Met
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 42
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 42
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Thr Pro Ile Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 43
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 43
Gly Thr Phe Ser Ser Tyr Ala Ile Ser
1 5
<210> 44
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 44
Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 45
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 45
Ala Arg Gly Asp Ser Ser Ile Arg His Ala Tyr Tyr Tyr Tyr Gly Met
1 5 10 15
Asp Val
<210> 46
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 46
Lys Ser Ser Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 47
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 47
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 48
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 48
Gln Gln Tyr Tyr Ser Thr Pro Ile Thr
1 5
<210> 49
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 49
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Gly Ser Asp Arg Phe His Pro Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 50
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 50
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Arg Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Phe Asp Thr Trp Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 51
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 51
Gly Ser Ile Ser Ser Ser Ser Tyr Tyr Trp Gly
1 5 10
<210> 52
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 52
Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 53
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 53
Ala Arg Gly Ser Asp Arg Phe His Pro Tyr Phe Asp Tyr
1 5 10
<210> 54
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 54
Arg Ala Ser Gln Ser Val Ser Arg Tyr Leu Ala
1 5 10
<210> 55
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 55
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 56
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 56
Gln Gln Phe Asp Thr Trp Pro Pro Thr
1 5
<210> 57
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 57
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 58
<211> 106
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 58
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Glu Gln Tyr Asp Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 59
<211> 126
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 59
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Arg Lys Ala Ser Gly Ser Phe Tyr Tyr Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 60
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 60
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Glu Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Pro Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 61
<211> 126
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 61
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Pro Asn Tyr Gly Asp Thr Thr His Asp Tyr Tyr Tyr
100 105 110
Met Asp Val Trp Gly Lys Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 62
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 62
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asp Asp Trp Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 63
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 63
Tyr Thr Phe Thr Ser Tyr Tyr Met His
1 5
<210> 64
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 64
Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 65
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 65
Ala Arg Gly Ala Pro Asn Tyr Gly Asp Thr Thr His Asp Tyr Tyr Tyr
1 5 10 15
Met Asp Val
<210> 66
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 66
Arg Ala Ser Gln Ser Val Ser Ser Asn Leu Ala
1 5 10
<210> 67
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 67
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 68
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 68
Gln Gln Tyr Asp Asp Trp Pro Phe Thr
1 5
<210> 69
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 69
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Thr Gly Glu Tyr Tyr Asp Thr Asp Asp His Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 70
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 70
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Asp Tyr Trp Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 71
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 71
Tyr Thr Phe Thr Gly Tyr Tyr Met His
1 5
<210> 72
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 72
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 73
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 73
Ala Arg Asp Thr Gly Glu Tyr Tyr Asp Thr Asp Asp His Gly Met Asp
1 5 10 15
Val
<210> 74
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 74
Arg Ala Ser Gln Ser Val Ser Ser Asn Leu Ala
1 5 10
<210> 75
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 75
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 76
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 76
Gln Gln Asp Asp Tyr Trp Pro Pro Thr
1 5
<210> 77
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 77
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Gly Gly Tyr Tyr Asp Ser Gly Ala Gly Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 78
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 78
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Asp Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Val Ser Tyr Pro Arg
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 79
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 79
Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5
<210> 80
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 80
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 81
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 81
Ala Lys Asp Gly Gly Tyr Tyr Asp Ser Gly Ala Gly Asp Tyr
1 5 10
<210> 82
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 82
Arg Ala Ser Gln Gly Ile Asp Ser Trp Leu Ala
1 5 10
<210> 83
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 83
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 84
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 84
Gln Gln Gly Val Ser Tyr Pro Arg Thr
1 5
<210> 85
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 85
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Pro Met Gly Ala Ala Ala Gly Trp Phe Asp Pro Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 86
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 86
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Val Ser Phe Pro Arg
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 87
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 87
Phe Thr Phe Ser Ser Tyr Ser Met Asn
1 5
<210> 88
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 88
Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 89
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 89
Ala Arg Gly Ala Pro Met Gly Ala Ala Ala Gly Trp Phe Asp Pro
1 5 10 15
<210> 90
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 90
Arg Ala Ser Gln Gly Ile Ser Ser Trp Leu Ala
1 5 10
<210> 91
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 91
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 92
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 92
Gln Gln Gly Val Ser Phe Pro Arg Thr
1 5
<210> 93
<211> 125
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 93
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Ala Gly Phe Ala Tyr Gly Met Asp Tyr Tyr Tyr Met
100 105 110
Asp Val Trp Gly Lys Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 94
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 94
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Asp Asn Trp Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 95
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 95
Tyr Thr Phe Thr Ser Tyr Tyr Met His
1 5
<210> 96
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 96
Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 97
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 97
Ala Arg Glu Gly Ala Gly Phe Ala Tyr Gly Met Asp Tyr Tyr Tyr Met
1 5 10 15
Asp Val
<210> 98
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 98
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1 5 10
<210> 99
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 99
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 100
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 100
Gln Gln Ser Asp Asn Trp Pro Phe Thr
1 5
<210> 101
<211> 121
<212> Белок
<213> Homo sapiens
<400> 101
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Arg Gly Leu Gly Asp Gly Thr Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 102
<211> 110
<212> Белок
<213> Homo sapiens
<400> 102
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Leu Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Leu Leu Pro Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Phe Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 103
<211> 115
<212> Белок
<213> Homo sapiens
<400> 103
Gln Val His Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Asp Asp Ser Ile Ser Ser Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly His Ile Ser Tyr Ser Gly Ser Ala Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Asn Trp Asp Asp Ala Phe Asn Ile Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 104
<211> 108
<212> Белок
<213> Homo sapiens
<400> 104
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 105
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 105
Gly Ser Phe Ser Gly Tyr Tyr Trp Ser
1 5
<210> 106
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 106
Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 107
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 107
Ala Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro
1 5 10
<210> 108
<211> 246
<212> Белок
<213> Homo sapiens
<400> 108
Met Ala Ala Ala Ala Ile Pro Ala Leu Leu Leu Cys Leu Pro Leu Leu
1 5 10 15
Phe Leu Leu Phe Gly Trp Ser Arg Ala Arg Arg Asp Asp Pro His Ser
20 25 30
Leu Cys Tyr Asp Ile Thr Val Ile Pro Lys Phe Arg Pro Gly Pro Arg
35 40 45
Trp Cys Ala Val Gln Gly Gln Val Asp Glu Lys Thr Phe Leu His Tyr
50 55 60
Asp Cys Gly Asn Lys Thr Val Thr Pro Val Ser Pro Leu Gly Lys Lys
65 70 75 80
Leu Asn Val Thr Met Ala Trp Lys Ala Gln Asn Pro Val Leu Arg Glu
85 90 95
Val Val Asp Ile Leu Thr Glu Gln Leu Leu Asp Ile Gln Leu Glu Asn
100 105 110
Tyr Thr Pro Lys Glu Pro Leu Thr Leu Gln Ala Arg Met Ser Cys Glu
115 120 125
Gln Lys Ala Glu Gly His Ser Ser Gly Ser Trp Gln Phe Ser Ile Asp
130 135 140
Gly Gln Thr Phe Leu Leu Phe Asp Ser Glu Lys Arg Met Trp Thr Thr
145 150 155 160
Val His Pro Gly Ala Arg Lys Met Lys Glu Lys Trp Glu Asn Asp Lys
165 170 175
Asp Val Ala Met Ser Phe His Tyr Ile Ser Met Gly Asp Cys Ile Gly
180 185 190
Trp Leu Glu Asp Phe Leu Met Gly Met Asp Ser Thr Leu Glu Pro Ser
195 200 205
Ala Gly Ala Pro Leu Ala Met Ser Ser Gly Thr Thr Gln Leu Arg Ala
210 215 220
Thr Ala Thr Thr Leu Ile Leu Cys Cys Leu Leu Ile Ile Leu Pro Cys
225 230 235 240
Phe Ile Leu Pro Gly Ile
245
<210> 109
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 109
Gly Thr Phe Ser Ser Tyr Ala Ile Ser
1 5
<210> 110
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 110
Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 111
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 111
Ala Arg Arg Gly Arg Lys Ala Ser Gly Ser Phe Tyr Tyr Tyr Tyr Gly
1 5 10 15
Met Asp Val
<210> 112
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 112
Glu Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu
1 5 10 15
Thr
<210> 113
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 113
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 114
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 114
Gln Asn Asp Tyr Ser Tyr Pro Tyr Thr
1 5
<210> 115
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 115
Glu Val Gln Leu Val Gln Ser Gly Pro Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Val Arg Ile Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Ser Thr Tyr Ala Asp Ser Phe
50 55 60
Lys Gly Arg Phe Thr Phe Ser Leu Asp Thr Ser Ala Ser Ala Ala Tyr
65 70 75 80
Leu Gln Ile Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Ala Ile Lys Gly Asp Tyr Trp Gly Gln Gly Thr Leu Leu
100 105 110
Thr Val Ser Ser Glu
115
<210> 116
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 116
Gly Tyr Thr Phe Thr Asn Tyr
1 5
<210> 117
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 117
Asn Thr Tyr Thr Gly Glu
1 5
<210> 118
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 118
Phe Ala Ile Lys Gly Asp Tyr
1 5
<210> 119
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 119
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Thr Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Leu Tyr Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Ser Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Ile Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Leu Lys
100 105 110
Arg
<210> 120
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 120
Lys Ser Leu Leu His Ser Asn Gly Ile Thr Tyr Leu Tyr
1 5 10
<210> 121
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 121
Gln Met Ser Asn Leu Ala Ser
1 5
<210> 122
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 122
Ala Gln Asn Leu Glu Ile Pro Arg Thr
1 5
<210> 123
<211> 128
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 123
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Met Gly Trp Gly Ser Gly Trp Arg Pro Tyr Tyr Tyr Tyr
100 105 110
Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala
115 120 125
<210> 124
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 124
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 125
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 125
Ser Tyr Asp Gly Ser Asn
1 5
<210> 126
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 126
Asp Met Gly Trp Gly Ser Gly Trp Arg Pro Tyr Tyr Tyr Tyr Gly Met
1 5 10 15
Asp Val
<210> 127
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 127
Glu Leu Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ser Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Asp Ile Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 128
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 128
Gln Ser Ile Ser Ser Tyr Leu Asn
1 5
<210> 129
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 129
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 130
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 130
Gln Gln Ser Tyr Asp Ile Pro Tyr Thr
1 5
<210> 131
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 131
Glu Val Gln Leu Val Gln Ser Gly Pro Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Val Arg Ile Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Ser Thr Tyr Ala Asp Ser Phe
50 55 60
Lys Gly Arg Phe Thr Phe Ser Leu Asp Thr Ser Ala Ser Ala Ala Tyr
65 70 75 80
Leu Gln Ile Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Phe Ala Ile Lys Gly Asp Tyr Trp Gly Gln Gly Thr Leu Leu
100 105 110
Thr Val Ser Ser Ala
115
<210> 132
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 132
Gly Tyr Thr Phe Thr Asn Tyr
1 5
<210> 133
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 133
Asn Thr Tyr Thr Gly Glu
1 5
<210> 134
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 134
Phe Ala Ile Lys Gly Asp Tyr
1 5
<210> 135
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 135
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Thr Lys Ser Leu Leu His Ser
20 25 30
Asn Gly Ile Thr Tyr Leu Tyr Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Leu Leu Ile Tyr Gln Met Ser Asn Leu Ala Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Ser Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Ala Gln Asn
85 90 95
Leu Glu Ile Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Leu Lys
100 105 110
Arg
<210> 136
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 136
Lys Ser Leu Leu His Ser Asn Gly Ile Thr Tyr Leu Tyr
1 5 10
<210> 137
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 137
Gln Met Ser Asn Leu Ala Ser
1 5
<210> 138
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 138
Ala Gln Asn Leu Glu Ile Pro Arg Thr
1 5
<210> 139
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 139
Glu Val Gln Leu Leu Glu Gln Ser Gly Ala Glu Leu Val Arg Pro Gly
1 5 10 15
Thr Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn
20 25 30
Tyr Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp
35 40 45
Ile Gly Asp Ile Phe Pro Gly Ser Gly Asn Ile His Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala
65 70 75 80
Tyr Met Gln Leu Ser Ser Leu Thr Phe Glu Asp Ser Ala Val Tyr Phe
85 90 95
Cys Ala Arg Leu Arg Asn Trp Asp Glu Pro Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 140
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 140
Gly Tyr Ala Phe Thr Asn Tyr
1 5
<210> 141
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 141
Phe Pro Gly Ser Gly Asn
1 5
<210> 142
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 142
Leu Arg Asn Trp Asp Glu Pro Met Asp Tyr
1 5 10
<210> 143
<211> 114
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 143
Glu Leu Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Ile
100 105 110
Lys Gly
<210> 144
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 144
Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu Thr
1 5 10
<210> 145
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 145
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 146
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 146
Gln Asn Asp Tyr Ser Tyr Pro Leu Thr
1 5
<210> 147
<211> 314
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 147
Met Ala Pro Pro Gln Val Leu Ala Phe Gly Leu Leu Leu Ala Ala Ala
1 5 10 15
Thr Ala Thr Phe Ala Ala Ala Gln Glu Glu Cys Val Cys Glu Asn Tyr
20 25 30
Lys Leu Ala Val Asn Cys Phe Val Asn Asn Asn Arg Gln Cys Gln Cys
35 40 45
Thr Ser Val Gly Ala Gln Asn Thr Val Ile Cys Ser Lys Leu Ala Ala
50 55 60
Lys Cys Leu Val Met Lys Ala Glu Met Asn Gly Ser Lys Leu Gly Arg
65 70 75 80
Arg Ala Lys Pro Glu Gly Ala Leu Gln Asn Asn Asp Gly Leu Tyr Asp
85 90 95
Pro Asp Cys Asp Glu Ser Gly Leu Phe Lys Ala Lys Gln Cys Asn Gly
100 105 110
Thr Ser Met Cys Trp Cys Val Asn Thr Ala Gly Val Arg Arg Thr Asp
115 120 125
Lys Asp Thr Glu Ile Thr Cys Ser Glu Arg Val Arg Thr Tyr Trp Ile
130 135 140
Ile Ile Glu Leu Lys His Lys Ala Arg Glu Lys Pro Tyr Asp Ser Lys
145 150 155 160
Ser Leu Arg Thr Ala Leu Gln Lys Glu Ile Thr Thr Arg Tyr Gln Leu
165 170 175
Asp Pro Lys Phe Ile Thr Ser Ile Leu Tyr Glu Asn Asn Val Ile Thr
180 185 190
Ile Asp Leu Val Gln Asn Ser Ser Gln Lys Thr Gln Asn Asp Val Asp
195 200 205
Ile Ala Asp Val Ala Tyr Tyr Phe Glu Lys Asp Val Lys Gly Glu Ser
210 215 220
Leu Phe His Ser Lys Lys Met Asp Leu Thr Val Asn Gly Glu Gln Leu
225 230 235 240
Asp Leu Asp Pro Gly Gln Thr Leu Ile Tyr Tyr Val Asp Glu Lys Ala
245 250 255
Pro Glu Phe Ser Met Gln Gly Leu Lys Ala Gly Val Ile Ala Val Ile
260 265 270
Val Val Val Val Ile Ala Val Val Ala Gly Ile Val Val Leu Val Ile
275 280 285
Ser Arg Lys Lys Arg Met Ala Lys Tyr Glu Lys Ala Glu Ile Lys Glu
290 295 300
Met Gly Glu Met His Arg Glu Leu Asn Ala
305 310
<210> 148
<211> 14507
<212> Белок
<213> Homo sapiens
<400> 148
Met Leu Lys Pro Ser Gly Leu Pro Gly Ser Ser Ser Pro Thr Arg Ser
1 5 10 15
Leu Met Thr Gly Ser Arg Ser Thr Lys Ala Thr Pro Glu Met Asp Ser
20 25 30
Gly Leu Thr Gly Ala Thr Leu Ser Pro Lys Thr Ser Thr Gly Ala Ile
35 40 45
Val Val Thr Glu His Thr Leu Pro Phe Thr Ser Pro Asp Lys Thr Leu
50 55 60
Ala Ser Pro Thr Ser Ser Val Val Gly Arg Thr Thr Gln Ser Leu Gly
65 70 75 80
Val Met Ser Ser Ala Leu Pro Glu Ser Thr Ser Arg Gly Met Thr His
85 90 95
Ser Glu Gln Arg Thr Ser Pro Ser Leu Ser Pro Gln Val Asn Gly Thr
100 105 110
Pro Ser Arg Asn Tyr Pro Ala Thr Ser Met Val Ser Gly Leu Ser Ser
115 120 125
Pro Arg Thr Arg Thr Ser Ser Thr Glu Gly Asn Phe Thr Lys Glu Ala
130 135 140
Ser Thr Tyr Thr Leu Thr Val Glu Thr Thr Ser Gly Pro Val Thr Glu
145 150 155 160
Lys Tyr Thr Val Pro Thr Glu Thr Ser Thr Thr Glu Gly Asp Ser Thr
165 170 175
Glu Thr Pro Trp Asp Thr Arg Tyr Ile Pro Val Lys Ile Thr Ser Pro
180 185 190
Met Lys Thr Phe Ala Asp Ser Thr Ala Ser Lys Glu Asn Ala Pro Val
195 200 205
Ser Met Thr Pro Ala Glu Thr Thr Val Thr Asp Ser His Thr Pro Gly
210 215 220
Arg Thr Asn Pro Ser Phe Gly Thr Leu Tyr Ser Ser Phe Leu Asp Leu
225 230 235 240
Ser Pro Lys Gly Thr Pro Asn Ser Arg Gly Glu Thr Ser Leu Glu Leu
245 250 255
Ile Leu Ser Thr Thr Gly Tyr Pro Phe Ser Ser Pro Glu Pro Gly Ser
260 265 270
Ala Gly His Ser Arg Ile Ser Thr Ser Ala Pro Leu Ser Ser Ser Ala
275 280 285
Ser Val Leu Asp Asn Lys Ile Ser Glu Thr Ser Ile Phe Ser Gly Gln
290 295 300
Ser Leu Thr Ser Pro Leu Ser Pro Gly Val Pro Glu Ala Arg Ala Ser
305 310 315 320
Thr Met Pro Asn Ser Ala Ile Pro Phe Ser Met Thr Leu Ser Asn Ala
325 330 335
Glu Thr Ser Ala Glu Arg Val Arg Ser Thr Ile Ser Ser Leu Gly Thr
340 345 350
Pro Ser Ile Ser Thr Lys Gln Thr Ala Glu Thr Ile Leu Thr Phe His
355 360 365
Ala Phe Ala Glu Thr Met Asp Ile Pro Ser Thr His Ile Ala Lys Thr
370 375 380
Leu Ala Ser Glu Trp Leu Gly Ser Pro Gly Thr Leu Gly Gly Thr Ser
385 390 395 400
Thr Ser Ala Leu Thr Thr Thr Ser Pro Ser Thr Thr Leu Val Ser Glu
405 410 415
Glu Thr Asn Thr His His Ser Thr Ser Gly Lys Glu Thr Glu Gly Thr
420 425 430
Leu Asn Thr Ser Met Thr Pro Leu Glu Thr Ser Ala Pro Gly Glu Glu
435 440 445
Ser Glu Met Thr Ala Thr Leu Val Pro Thr Leu Gly Phe Thr Thr Leu
450 455 460
Asp Ser Lys Ile Arg Ser Pro Ser Gln Val Ser Ser Ser His Pro Thr
465 470 475 480
Arg Glu Leu Arg Thr Thr Gly Ser Thr Ser Gly Arg Gln Ser Ser Ser
485 490 495
Thr Ala Ala His Gly Ser Ser Asp Ile Leu Arg Ala Thr Thr Ser Ser
500 505 510
Thr Ser Lys Ala Ser Ser Trp Thr Ser Glu Ser Thr Ala Gln Gln Phe
515 520 525
Ser Glu Pro Gln His Thr Gln Trp Val Glu Thr Ser Pro Ser Met Lys
530 535 540
Thr Glu Arg Pro Pro Ala Ser Thr Ser Val Ala Ala Pro Ile Thr Thr
545 550 555 560
Ser Val Pro Ser Val Val Ser Gly Phe Thr Thr Leu Lys Thr Ser Ser
565 570 575
Thr Lys Gly Ile Trp Leu Glu Glu Thr Ser Ala Asp Thr Leu Ile Gly
580 585 590
Glu Ser Thr Ala Gly Pro Thr Thr His Gln Phe Ala Val Pro Thr Gly
595 600 605
Ile Ser Met Thr Gly Gly Ser Ser Thr Arg Gly Ser Gln Gly Thr Thr
610 615 620
His Leu Leu Thr Arg Ala Thr Ala Ser Ser Glu Thr Ser Ala Asp Leu
625 630 635 640
Thr Leu Ala Thr Asn Gly Val Pro Val Ser Val Ser Pro Ala Val Ser
645 650 655
Lys Thr Ala Ala Gly Ser Ser Pro Pro Gly Gly Thr Lys Pro Ser Tyr
660 665 670
Thr Met Val Ser Ser Val Ile Pro Glu Thr Ser Ser Leu Gln Ser Ser
675 680 685
Ala Phe Arg Glu Gly Thr Ser Leu Gly Leu Thr Pro Leu Asn Thr Arg
690 695 700
His Pro Phe Ser Ser Pro Glu Pro Asp Ser Ala Gly His Thr Lys Ile
705 710 715 720
Ser Thr Ser Ile Pro Leu Leu Ser Ser Ala Ser Val Leu Glu Asp Lys
725 730 735
Val Ser Ala Thr Ser Thr Phe Ser His His Lys Ala Thr Ser Ser Ile
740 745 750
Thr Thr Gly Thr Pro Glu Ile Ser Thr Lys Thr Lys Pro Ser Ser Ala
755 760 765
Val Leu Ser Ser Met Thr Leu Ser Asn Ala Ala Thr Ser Pro Glu Arg
770 775 780
Val Arg Asn Ala Thr Ser Pro Leu Thr His Pro Ser Pro Ser Gly Glu
785 790 795 800
Glu Thr Ala Gly Ser Val Leu Thr Leu Ser Thr Ser Ala Glu Thr Thr
805 810 815
Asp Ser Pro Asn Ile His Pro Thr Gly Thr Leu Thr Ser Glu Ser Ser
820 825 830
Glu Ser Pro Ser Thr Leu Ser Leu Pro Ser Val Ser Gly Val Lys Thr
835 840 845
Thr Phe Ser Ser Ser Thr Pro Ser Thr His Leu Phe Thr Ser Gly Glu
850 855 860
Glu Thr Glu Glu Thr Ser Asn Pro Ser Val Ser Gln Pro Glu Thr Ser
865 870 875 880
Val Ser Arg Val Arg Thr Thr Leu Ala Ser Thr Ser Val Pro Thr Pro
885 890 895
Val Phe Pro Thr Met Asp Thr Trp Pro Thr Arg Ser Ala Gln Phe Ser
900 905 910
Ser Ser His Leu Val Ser Glu Leu Arg Ala Thr Ser Ser Thr Ser Val
915 920 925
Thr Asn Ser Thr Gly Ser Ala Leu Pro Lys Ile Ser His Leu Thr Gly
930 935 940
Thr Ala Thr Met Ser Gln Thr Asn Arg Asp Thr Phe Asn Asp Ser Ala
945 950 955 960
Ala Pro Gln Ser Thr Thr Trp Pro Glu Thr Ser Pro Arg Phe Lys Thr
965 970 975
Gly Leu Pro Ser Ala Thr Thr Thr Val Ser Thr Ser Ala Thr Ser Leu
980 985 990
Ser Ala Thr Val Met Val Ser Lys Phe Thr Ser Pro Ala Thr Ser Ser
995 1000 1005
Met Glu Ala Thr Ser Ile Arg Glu Pro Ser Thr Thr Ile Leu Thr
1010 1015 1020
Thr Glu Thr Thr Asn Gly Pro Gly Ser Met Ala Val Ala Ser Thr
1025 1030 1035
Asn Ile Pro Ile Gly Lys Gly Tyr Ile Thr Glu Gly Arg Leu Asp
1040 1045 1050
Thr Ser His Leu Pro Ile Gly Thr Thr Ala Ser Ser Glu Thr Ser
1055 1060 1065
Met Asp Phe Thr Met Ala Lys Glu Ser Val Ser Met Ser Val Ser
1070 1075 1080
Pro Ser Gln Ser Met Asp Ala Ala Gly Ser Ser Thr Pro Gly Arg
1085 1090 1095
Thr Ser Gln Phe Val Asp Thr Phe Ser Asp Asp Val Tyr His Leu
1100 1105 1110
Thr Ser Arg Glu Ile Thr Ile Pro Arg Asp Gly Thr Ser Ser Ala
1115 1120 1125
Leu Thr Pro Gln Met Thr Ala Thr His Pro Pro Ser Pro Asp Pro
1130 1135 1140
Gly Ser Ala Arg Ser Thr Trp Leu Gly Ile Leu Ser Ser Ser Pro
1145 1150 1155
Ser Ser Pro Thr Pro Lys Val Thr Met Ser Ser Thr Phe Ser Thr
1160 1165 1170
Gln Arg Val Thr Thr Ser Met Ile Met Asp Thr Val Glu Thr Ser
1175 1180 1185
Arg Trp Asn Met Pro Asn Leu Pro Ser Thr Thr Ser Leu Thr Pro
1190 1195 1200
Ser Asn Ile Pro Thr Ser Gly Ala Ile Gly Lys Ser Thr Leu Val
1205 1210 1215
Pro Leu Asp Thr Pro Ser Pro Ala Thr Ser Leu Glu Ala Ser Glu
1220 1225 1230
Gly Gly Leu Pro Thr Leu Ser Thr Tyr Pro Glu Ser Thr Asn Thr
1235 1240 1245
Pro Ser Ile His Leu Gly Ala His Ala Ser Ser Glu Ser Pro Ser
1250 1255 1260
Thr Ile Lys Leu Thr Met Ala Ser Val Val Lys Pro Gly Ser Tyr
1265 1270 1275
Thr Pro Leu Thr Phe Pro Ser Ile Glu Thr His Ile His Val Ser
1280 1285 1290
Thr Ala Arg Met Ala Tyr Ser Ser Gly Ser Ser Pro Glu Met Thr
1295 1300 1305
Ala Pro Gly Glu Thr Asn Thr Gly Ser Thr Trp Asp Pro Thr Thr
1310 1315 1320
Tyr Ile Thr Thr Thr Asp Pro Lys Asp Thr Ser Ser Ala Gln Val
1325 1330 1335
Ser Thr Pro His Ser Val Arg Thr Leu Arg Thr Thr Glu Asn His
1340 1345 1350
Pro Lys Thr Glu Ser Ala Thr Pro Ala Ala Tyr Ser Gly Ser Pro
1355 1360 1365
Lys Ile Ser Ser Ser Pro Asn Leu Thr Ser Pro Ala Thr Lys Ala
1370 1375 1380
Trp Thr Ile Thr Asp Thr Thr Glu His Ser Thr Gln Leu His Tyr
1385 1390 1395
Thr Lys Leu Ala Glu Lys Ser Ser Gly Phe Glu Thr Gln Ser Ala
1400 1405 1410
Pro Gly Pro Val Ser Val Val Ile Pro Thr Ser Pro Thr Ile Gly
1415 1420 1425
Ser Ser Thr Leu Glu Leu Thr Ser Asp Val Pro Gly Glu Pro Leu
1430 1435 1440
Val Leu Ala Pro Ser Glu Gln Thr Thr Ile Thr Leu Pro Met Ala
1445 1450 1455
Thr Trp Leu Ser Thr Ser Leu Thr Glu Glu Met Ala Ser Thr Asp
1460 1465 1470
Leu Asp Ile Ser Ser Pro Ser Ser Pro Met Ser Thr Phe Ala Ile
1475 1480 1485
Phe Pro Pro Met Ser Thr Pro Ser His Glu Leu Ser Lys Ser Glu
1490 1495 1500
Ala Asp Thr Ser Ala Ile Arg Asn Thr Asp Ser Thr Thr Leu Asp
1505 1510 1515
Gln His Leu Gly Ile Arg Ser Leu Gly Arg Thr Gly Asp Leu Thr
1520 1525 1530
Thr Val Pro Ile Thr Pro Leu Thr Thr Thr Trp Thr Ser Val Ile
1535 1540 1545
Glu His Ser Thr Gln Ala Gln Asp Thr Leu Ser Ala Thr Met Ser
1550 1555 1560
Pro Thr His Val Thr Gln Ser Leu Lys Asp Gln Thr Ser Ile Pro
1565 1570 1575
Ala Ser Ala Ser Pro Ser His Leu Thr Glu Val Tyr Pro Glu Leu
1580 1585 1590
Gly Thr Gln Gly Arg Ser Ser Ser Glu Ala Thr Thr Phe Trp Lys
1595 1600 1605
Pro Ser Thr Asp Thr Leu Ser Arg Glu Ile Glu Thr Gly Pro Thr
1610 1615 1620
Asn Ile Gln Ser Thr Pro Pro Met Asp Asn Thr Thr Thr Gly Ser
1625 1630 1635
Ser Ser Ser Gly Val Thr Leu Gly Ile Ala His Leu Pro Ile Gly
1640 1645 1650
Thr Ser Ser Pro Ala Glu Thr Ser Thr Asn Met Ala Leu Glu Arg
1655 1660 1665
Arg Ser Ser Thr Ala Thr Val Ser Met Ala Gly Thr Met Gly Leu
1670 1675 1680
Leu Val Thr Ser Ala Pro Gly Arg Ser Ile Ser Gln Ser Leu Gly
1685 1690 1695
Arg Val Ser Ser Val Leu Ser Glu Ser Thr Thr Glu Gly Val Thr
1700 1705 1710
Asp Ser Ser Lys Gly Ser Ser Pro Arg Leu Asn Thr Gln Gly Asn
1715 1720 1725
Thr Ala Leu Ser Ser Ser Leu Glu Pro Ser Tyr Ala Glu Gly Ser
1730 1735 1740
Gln Met Ser Thr Ser Ile Pro Leu Thr Ser Ser Pro Thr Thr Pro
1745 1750 1755
Asp Val Glu Phe Ile Gly Gly Ser Thr Phe Trp Thr Lys Glu Val
1760 1765 1770
Thr Thr Val Met Thr Ser Asp Ile Ser Lys Ser Ser Ala Arg Thr
1775 1780 1785
Glu Ser Ser Ser Ala Thr Leu Met Ser Thr Ala Leu Gly Ser Thr
1790 1795 1800
Glu Asn Thr Gly Lys Glu Lys Leu Arg Thr Ala Ser Met Asp Leu
1805 1810 1815
Pro Ser Pro Thr Pro Ser Met Glu Val Thr Pro Trp Ile Ser Leu
1820 1825 1830
Thr Leu Ser Asn Ala Pro Asn Thr Thr Asp Ser Leu Asp Leu Ser
1835 1840 1845
His Gly Val His Thr Ser Ser Ala Gly Thr Leu Ala Thr Asp Arg
1850 1855 1860
Ser Leu Asn Thr Gly Val Thr Arg Ala Ser Arg Leu Glu Asn Gly
1865 1870 1875
Ser Asp Thr Ser Ser Lys Ser Leu Ser Met Gly Asn Ser Thr His
1880 1885 1890
Thr Ser Met Thr Tyr Thr Glu Lys Ser Glu Val Ser Ser Ser Ile
1895 1900 1905
His Pro Arg Pro Glu Thr Ser Ala Pro Gly Ala Glu Thr Thr Leu
1910 1915 1920
Thr Ser Thr Pro Gly Asn Arg Ala Ile Ser Leu Thr Leu Pro Phe
1925 1930 1935
Ser Ser Ile Pro Val Glu Glu Val Ile Ser Thr Gly Ile Thr Ser
1940 1945 1950
Gly Pro Asp Ile Asn Ser Ala Pro Met Thr His Ser Pro Ile Thr
1955 1960 1965
Pro Pro Thr Ile Val Trp Thr Ser Thr Gly Thr Ile Glu Gln Ser
1970 1975 1980
Thr Gln Pro Leu His Ala Val Ser Ser Glu Lys Val Ser Val Gln
1985 1990 1995
Thr Gln Ser Thr Pro Tyr Val Asn Ser Val Ala Val Ser Ala Ser
2000 2005 2010
Pro Thr His Glu Asn Ser Val Ser Ser Gly Ser Ser Thr Ser Ser
2015 2020 2025
Pro Tyr Ser Ser Ala Ser Leu Glu Ser Leu Asp Ser Thr Ile Ser
2030 2035 2040
Arg Arg Asn Ala Ile Thr Ser Trp Leu Trp Asp Leu Thr Thr Ser
2045 2050 2055
Leu Pro Thr Thr Thr Trp Pro Ser Thr Ser Leu Ser Glu Ala Leu
2060 2065 2070
Ser Ser Gly His Ser Gly Val Ser Asn Pro Ser Ser Thr Thr Thr
2075 2080 2085
Glu Phe Pro Leu Phe Ser Ala Ala Ser Thr Ser Ala Ala Lys Gln
2090 2095 2100
Arg Asn Pro Glu Thr Glu Thr His Gly Pro Gln Asn Thr Ala Ala
2105 2110 2115
Ser Thr Leu Asn Thr Asp Ala Ser Ser Val Thr Gly Leu Ser Glu
2120 2125 2130
Thr Pro Val Gly Ala Ser Ile Ser Ser Glu Val Pro Leu Pro Met
2135 2140 2145
Ala Ile Thr Ser Arg Ser Asp Val Ser Gly Leu Thr Ser Glu Ser
2150 2155 2160
Thr Ala Asn Pro Ser Leu Gly Thr Ala Ser Ser Ala Gly Thr Lys
2165 2170 2175
Leu Thr Arg Thr Ile Ser Leu Pro Thr Ser Glu Ser Leu Val Ser
2180 2185 2190
Phe Arg Met Asn Lys Asp Pro Trp Thr Val Ser Ile Pro Leu Gly
2195 2200 2205
Ser His Pro Thr Thr Asn Thr Glu Thr Ser Ile Pro Val Asn Ser
2210 2215 2220
Ala Gly Pro Pro Gly Leu Ser Thr Val Ala Ser Asp Val Ile Asp
2225 2230 2235
Thr Pro Ser Asp Gly Ala Glu Ser Ile Pro Thr Val Ser Phe Ser
2240 2245 2250
Pro Ser Pro Asp Thr Glu Val Thr Thr Ile Ser His Phe Pro Glu
2255 2260 2265
Lys Thr Thr His Ser Phe Arg Thr Ile Ser Ser Leu Thr His Glu
2270 2275 2280
Leu Thr Ser Arg Val Thr Pro Ile Pro Gly Asp Trp Met Ser Ser
2285 2290 2295
Ala Met Ser Thr Lys Pro Thr Gly Ala Ser Pro Ser Ile Thr Leu
2300 2305 2310
Gly Glu Arg Arg Thr Ile Thr Ser Ala Ala Pro Thr Thr Ser Pro
2315 2320 2325
Ile Val Leu Thr Ala Ser Phe Thr Glu Thr Ser Thr Val Ser Leu
2330 2335 2340
Asp Asn Glu Thr Thr Val Lys Thr Ser Asp Ile Leu Asp Ala Arg
2345 2350 2355
Lys Thr Asn Glu Leu Pro Ser Asp Ser Ser Ser Ser Ser Asp Leu
2360 2365 2370
Ile Asn Thr Ser Ile Ala Ser Ser Thr Met Asp Val Thr Lys Thr
2375 2380 2385
Ala Ser Ile Ser Pro Thr Ser Ile Ser Gly Met Thr Ala Ser Ser
2390 2395 2400
Ser Pro Ser Leu Phe Ser Ser Asp Arg Pro Gln Val Pro Thr Ser
2405 2410 2415
Thr Thr Glu Thr Asn Thr Ala Thr Ser Pro Ser Val Ser Ser Asn
2420 2425 2430
Thr Tyr Ser Leu Asp Gly Gly Ser Asn Val Gly Gly Thr Pro Ser
2435 2440 2445
Thr Leu Pro Pro Phe Thr Ile Thr His Pro Val Glu Thr Ser Ser
2450 2455 2460
Ala Leu Leu Ala Trp Ser Arg Pro Val Arg Thr Phe Ser Thr Met
2465 2470 2475
Val Ser Thr Asp Thr Ala Ser Gly Glu Asn Pro Thr Ser Ser Asn
2480 2485 2490
Ser Val Val Thr Ser Val Pro Ala Pro Gly Thr Trp Thr Ser Val
2495 2500 2505
Gly Ser Thr Thr Asp Leu Pro Ala Met Gly Phe Leu Lys Thr Ser
2510 2515 2520
Pro Ala Gly Glu Ala His Ser Leu Leu Ala Ser Thr Ile Glu Pro
2525 2530 2535
Ala Thr Ala Phe Thr Pro His Leu Ser Ala Ala Val Val Thr Gly
2540 2545 2550
Ser Ser Ala Thr Ser Glu Ala Ser Leu Leu Thr Thr Ser Glu Ser
2555 2560 2565
Lys Ala Ile His Ser Ser Pro Gln Thr Pro Thr Thr Pro Thr Ser
2570 2575 2580
Gly Ala Asn Trp Glu Thr Ser Ala Thr Pro Glu Ser Leu Leu Val
2585 2590 2595
Val Thr Glu Thr Ser Asp Thr Thr Leu Thr Ser Lys Ile Leu Val
2600 2605 2610
Thr Asp Thr Ile Leu Phe Ser Thr Val Ser Thr Pro Pro Ser Lys
2615 2620 2625
Phe Pro Ser Thr Gly Thr Leu Ser Gly Ala Ser Phe Pro Thr Leu
2630 2635 2640
Leu Pro Asp Thr Pro Ala Ile Pro Leu Thr Ala Thr Glu Pro Thr
2645 2650 2655
Ser Ser Leu Ala Thr Ser Phe Asp Ser Thr Pro Leu Val Thr Ile
2660 2665 2670
Ala Ser Asp Ser Leu Gly Thr Val Pro Glu Thr Thr Leu Thr Met
2675 2680 2685
Ser Glu Thr Ser Asn Gly Asp Ala Leu Val Leu Lys Thr Val Ser
2690 2695 2700
Asn Pro Asp Arg Ser Ile Pro Gly Ile Thr Ile Gln Gly Val Thr
2705 2710 2715
Glu Ser Pro Leu His Pro Ser Ser Thr Ser Pro Ser Lys Ile Val
2720 2725 2730
Ala Pro Arg Asn Thr Thr Tyr Glu Gly Ser Ile Thr Val Ala Leu
2735 2740 2745
Ser Thr Leu Pro Ala Gly Thr Thr Gly Ser Leu Val Phe Ser Gln
2750 2755 2760
Ser Ser Glu Asn Ser Glu Thr Thr Ala Leu Val Asp Ser Ser Ala
2765 2770 2775
Gly Leu Glu Arg Ala Ser Val Met Pro Leu Thr Thr Gly Ser Gln
2780 2785 2790
Gly Met Ala Ser Ser Gly Gly Ile Arg Ser Gly Ser Thr His Ser
2795 2800 2805
Thr Gly Thr Lys Thr Phe Ser Ser Leu Pro Leu Thr Met Asn Pro
2810 2815 2820
Gly Glu Val Thr Ala Met Ser Glu Ile Thr Thr Asn Arg Leu Thr
2825 2830 2835
Ala Thr Gln Ser Thr Ala Pro Lys Gly Ile Pro Val Lys Pro Thr
2840 2845 2850
Ser Ala Glu Ser Gly Leu Leu Thr Pro Val Ser Ala Ser Ser Ser
2855 2860 2865
Pro Ser Lys Ala Phe Ala Ser Leu Thr Thr Ala Pro Pro Thr Trp
2870 2875 2880
Gly Ile Pro Gln Ser Thr Leu Thr Phe Glu Phe Ser Glu Val Pro
2885 2890 2895
Ser Leu Asp Thr Lys Ser Ala Ser Leu Pro Thr Pro Gly Gln Ser
2900 2905 2910
Leu Asn Thr Ile Pro Asp Ser Asp Ala Ser Thr Ala Ser Ser Ser
2915 2920 2925
Leu Ser Lys Ser Pro Glu Lys Asn Pro Arg Ala Arg Met Met Thr
2930 2935 2940
Ser Thr Lys Ala Ile Ser Ala Ser Ser Phe Gln Ser Thr Gly Phe
2945 2950 2955
Thr Glu Thr Pro Glu Gly Ser Ala Ser Pro Ser Met Ala Gly His
2960 2965 2970
Glu Pro Arg Val Pro Thr Ser Gly Thr Gly Asp Pro Arg Tyr Ala
2975 2980 2985
Ser Glu Ser Met Ser Tyr Pro Asp Pro Ser Lys Ala Ser Ser Ala
2990 2995 3000
Met Thr Ser Thr Ser Leu Ala Ser Lys Leu Thr Thr Leu Phe Ser
3005 3010 3015
Thr Gly Gln Ala Ala Arg Ser Gly Ser Ser Ser Ser Pro Ile Ser
3020 3025 3030
Leu Ser Thr Glu Lys Glu Thr Ser Phe Leu Ser Pro Thr Ala Ser
3035 3040 3045
Thr Ser Arg Lys Thr Ser Leu Phe Leu Gly Pro Ser Met Ala Arg
3050 3055 3060
Gln Pro Asn Ile Leu Val His Leu Gln Thr Ser Ala Leu Thr Leu
3065 3070 3075
Ser Pro Thr Ser Thr Leu Asn Met Ser Gln Glu Glu Pro Pro Glu
3080 3085 3090
Leu Thr Ser Ser Gln Thr Ile Ala Glu Glu Glu Gly Thr Thr Ala
3095 3100 3105
Glu Thr Gln Thr Leu Thr Phe Thr Pro Ser Glu Thr Pro Thr Ser
3110 3115 3120
Leu Leu Pro Val Ser Ser Pro Thr Glu Pro Thr Ala Arg Arg Lys
3125 3130 3135
Ser Ser Pro Glu Thr Trp Ala Ser Ser Ile Ser Val Pro Ala Lys
3140 3145 3150
Thr Ser Leu Val Glu Thr Thr Asp Gly Thr Leu Val Thr Thr Ile
3155 3160 3165
Lys Met Ser Ser Gln Ala Ala Gln Gly Asn Ser Thr Trp Pro Ala
3170 3175 3180
Pro Ala Glu Glu Thr Gly Ser Ser Pro Ala Gly Thr Ser Pro Gly
3185 3190 3195
Ser Pro Glu Met Ser Thr Thr Leu Lys Ile Met Ser Ser Lys Glu
3200 3205 3210
Pro Ser Ile Ser Pro Glu Ile Arg Ser Thr Val Arg Asn Ser Pro
3215 3220 3225
Trp Lys Thr Pro Glu Thr Thr Val Pro Met Glu Thr Thr Val Glu
3230 3235 3240
Pro Val Thr Leu Gln Ser Thr Ala Leu Gly Ser Gly Ser Thr Ser
3245 3250 3255
Ile Ser His Leu Pro Thr Gly Thr Thr Ser Pro Thr Lys Ser Pro
3260 3265 3270
Thr Glu Asn Met Leu Ala Thr Glu Arg Val Ser Leu Ser Pro Ser
3275 3280 3285
Pro Pro Glu Ala Trp Thr Asn Leu Tyr Ser Gly Thr Pro Gly Gly
3290 3295 3300
Thr Arg Gln Ser Leu Ala Thr Met Ser Ser Val Ser Leu Glu Ser
3305 3310 3315
Pro Thr Ala Arg Ser Ile Thr Gly Thr Gly Gln Gln Ser Ser Pro
3320 3325 3330
Glu Leu Val Ser Lys Thr Thr Gly Met Glu Phe Ser Met Trp His
3335 3340 3345
Gly Ser Thr Gly Gly Thr Thr Gly Asp Thr His Val Ser Leu Ser
3350 3355 3360
Thr Ser Ser Asn Ile Leu Glu Asp Pro Val Thr Ser Pro Asn Ser
3365 3370 3375
Val Ser Ser Leu Thr Asp Lys Ser Lys His Lys Thr Glu Thr Trp
3380 3385 3390
Val Ser Thr Thr Ala Ile Pro Ser Thr Val Leu Asn Asn Lys Ile
3395 3400 3405
Met Ala Ala Glu Gln Gln Thr Ser Arg Ser Val Asp Glu Ala Tyr
3410 3415 3420
Ser Ser Thr Ser Ser Trp Ser Asp Gln Thr Ser Gly Ser Asp Ile
3425 3430 3435
Thr Leu Gly Ala Ser Pro Asp Val Thr Asn Thr Leu Tyr Ile Thr
3440 3445 3450
Ser Thr Ala Gln Thr Thr Ser Leu Val Ser Leu Pro Ser Gly Asp
3455 3460 3465
Gln Gly Ile Thr Ser Leu Thr Asn Pro Ser Gly Gly Lys Thr Ser
3470 3475 3480
Ser Ala Ser Ser Val Thr Ser Pro Ser Ile Gly Leu Glu Thr Leu
3485 3490 3495
Arg Ala Asn Val Ser Ala Val Lys Ser Asp Ile Ala Pro Thr Ala
3500 3505 3510
Gly His Leu Ser Gln Thr Ser Ser Pro Ala Glu Val Ser Ile Leu
3515 3520 3525
Asp Val Thr Thr Ala Pro Thr Pro Gly Ile Ser Thr Thr Ile Thr
3530 3535 3540
Thr Met Gly Thr Asn Ser Ile Ser Thr Thr Thr Pro Asn Pro Glu
3545 3550 3555
Val Gly Met Ser Thr Met Asp Ser Thr Pro Ala Thr Glu Arg Arg
3560 3565 3570
Thr Thr Ser Thr Glu His Pro Ser Thr Trp Ser Ser Thr Ala Ala
3575 3580 3585
Ser Asp Ser Trp Thr Val Thr Asp Met Thr Ser Asn Leu Lys Val
3590 3595 3600
Ala Arg Ser Pro Gly Thr Ile Ser Thr Met His Thr Thr Ser Phe
3605 3610 3615
Leu Ala Ser Ser Thr Glu Leu Asp Ser Met Ser Thr Pro His Gly
3620 3625 3630
Arg Ile Thr Val Ile Gly Thr Ser Leu Val Thr Pro Ser Ser Asp
3635 3640 3645
Ala Ser Ala Val Lys Thr Glu Thr Ser Thr Ser Glu Arg Thr Leu
3650 3655 3660
Ser Pro Ser Asp Thr Thr Ala Ser Thr Pro Ile Ser Thr Phe Ser
3665 3670 3675
Arg Val Gln Arg Met Ser Ile Ser Val Pro Asp Ile Leu Ser Thr
3680 3685 3690
Ser Trp Thr Pro Ser Ser Thr Glu Ala Glu Asp Val Pro Val Ser
3695 3700 3705
Met Val Ser Thr Asp His Ala Ser Thr Lys Thr Asp Pro Asn Thr
3710 3715 3720
Pro Leu Ser Thr Phe Leu Phe Asp Ser Leu Ser Thr Leu Asp Trp
3725 3730 3735
Asp Thr Gly Arg Ser Leu Ser Ser Ala Thr Ala Thr Thr Ser Ala
3740 3745 3750
Pro Gln Gly Ala Thr Thr Pro Gln Glu Leu Thr Leu Glu Thr Met
3755 3760 3765
Ile Ser Pro Ala Thr Ser Gln Leu Pro Phe Ser Ile Gly His Ile
3770 3775 3780
Thr Ser Ala Val Thr Pro Ala Ala Met Ala Arg Ser Ser Gly Val
3785 3790 3795
Thr Phe Ser Arg Pro Asp Pro Thr Ser Lys Lys Ala Glu Gln Thr
3800 3805 3810
Ser Thr Gln Leu Pro Thr Thr Thr Ser Ala His Pro Gly Gln Val
3815 3820 3825
Pro Arg Ser Ala Ala Thr Thr Leu Asp Val Ile Pro His Thr Ala
3830 3835 3840
Lys Thr Pro Asp Ala Thr Phe Gln Arg Gln Gly Gln Thr Ala Leu
3845 3850 3855
Thr Thr Glu Ala Arg Ala Thr Ser Asp Ser Trp Asn Glu Lys Glu
3860 3865 3870
Lys Ser Thr Pro Ser Ala Pro Trp Ile Thr Glu Met Met Asn Ser
3875 3880 3885
Val Ser Glu Asp Thr Ile Lys Glu Val Thr Ser Ser Ser Ser Val
3890 3895 3900
Leu Arg Thr Leu Asn Thr Leu Asp Ile Asn Leu Glu Ser Gly Thr
3905 3910 3915
Thr Ser Ser Pro Ser Trp Lys Ser Ser Pro Tyr Glu Arg Ile Ala
3920 3925 3930
Pro Ser Glu Ser Thr Thr Asp Lys Glu Ala Ile His Pro Ser Thr
3935 3940 3945
Asn Thr Val Glu Thr Thr Gly Trp Val Thr Ser Ser Glu His Ala
3950 3955 3960
Ser His Ser Thr Ile Pro Ala His Ser Ala Ser Ser Lys Leu Thr
3965 3970 3975
Ser Pro Val Val Thr Thr Ser Thr Arg Glu Gln Ala Ile Val Ser
3980 3985 3990
Met Ser Thr Thr Thr Trp Pro Glu Ser Thr Arg Ala Arg Thr Glu
3995 4000 4005
Pro Asn Ser Phe Leu Thr Ile Glu Leu Arg Asp Val Ser Pro Tyr
4010 4015 4020
Met Asp Thr Ser Ser Thr Thr Gln Thr Ser Ile Ile Ser Ser Pro
4025 4030 4035
Gly Ser Thr Ala Ile Thr Lys Gly Pro Arg Thr Glu Ile Thr Ser
4040 4045 4050
Ser Lys Arg Ile Ser Ser Ser Phe Leu Ala Gln Ser Met Arg Ser
4055 4060 4065
Ser Asp Ser Pro Ser Glu Ala Ile Thr Arg Leu Ser Asn Phe Pro
4070 4075 4080
Ala Met Thr Glu Ser Gly Gly Met Ile Leu Ala Met Gln Thr Ser
4085 4090 4095
Pro Pro Gly Ala Thr Ser Leu Ser Ala Pro Thr Leu Asp Thr Ser
4100 4105 4110
Ala Thr Ala Ser Trp Thr Gly Thr Pro Leu Ala Thr Thr Gln Arg
4115 4120 4125
Phe Thr Tyr Ser Glu Lys Thr Thr Leu Phe Ser Lys Gly Pro Glu
4130 4135 4140
Asp Thr Ser Gln Pro Ser Pro Pro Ser Val Glu Glu Thr Ser Ser
4145 4150 4155
Ser Ser Ser Leu Val Pro Ile His Ala Thr Thr Ser Pro Ser Asn
4160 4165 4170
Ile Leu Leu Thr Ser Gln Gly His Ser Pro Ser Ser Thr Pro Pro
4175 4180 4185
Val Thr Ser Val Phe Leu Ser Glu Thr Ser Gly Leu Gly Lys Thr
4190 4195 4200
Thr Asp Met Ser Arg Ile Ser Leu Glu Pro Gly Thr Ser Leu Pro
4205 4210 4215
Pro Asn Leu Ser Ser Thr Ala Gly Glu Ala Leu Ser Thr Tyr Glu
4220 4225 4230
Ala Ser Arg Asp Thr Lys Ala Ile His His Ser Ala Asp Thr Ala
4235 4240 4245
Val Thr Asn Met Glu Ala Thr Ser Ser Glu Tyr Ser Pro Ile Pro
4250 4255 4260
Gly His Thr Lys Pro Ser Lys Ala Thr Ser Pro Leu Val Thr Ser
4265 4270 4275
His Ile Met Gly Asp Ile Thr Ser Ser Thr Ser Val Phe Gly Ser
4280 4285 4290
Ser Glu Thr Thr Glu Ile Glu Thr Val Ser Ser Val Asn Gln Gly
4295 4300 4305
Leu Gln Glu Arg Ser Thr Ser Gln Val Ala Ser Ser Ala Thr Glu
4310 4315 4320
Thr Ser Thr Val Ile Thr His Val Ser Ser Gly Asp Ala Thr Thr
4325 4330 4335
His Val Thr Lys Thr Gln Ala Thr Phe Ser Ser Gly Thr Ser Ile
4340 4345 4350
Ser Ser Pro His Gln Phe Ile Thr Ser Thr Asn Thr Phe Thr Asp
4355 4360 4365
Val Ser Thr Asn Pro Ser Thr Ser Leu Ile Met Thr Glu Ser Ser
4370 4375 4380
Gly Val Thr Ile Thr Thr Gln Thr Gly Pro Thr Gly Ala Ala Thr
4385 4390 4395
Gln Gly Pro Tyr Leu Leu Asp Thr Ser Thr Met Pro Tyr Leu Thr
4400 4405 4410
Glu Thr Pro Leu Ala Val Thr Pro Asp Phe Met Gln Ser Glu Lys
4415 4420 4425
Thr Thr Leu Ile Ser Lys Gly Pro Lys Asp Val Ser Trp Thr Ser
4430 4435 4440
Pro Pro Ser Val Ala Glu Thr Ser Tyr Pro Ser Ser Leu Thr Pro
4445 4450 4455
Phe Leu Val Thr Thr Ile Pro Pro Ala Thr Ser Thr Leu Gln Gly
4460 4465 4470
Gln His Thr Ser Ser Pro Val Ser Ala Thr Ser Val Leu Thr Ser
4475 4480 4485
Gly Leu Val Lys Thr Thr Asp Met Leu Asn Thr Ser Met Glu Pro
4490 4495 4500
Val Thr Asn Ser Pro Gln Asn Leu Asn Asn Pro Ser Asn Glu Ile
4505 4510 4515
Leu Ala Thr Leu Ala Ala Thr Thr Asp Ile Glu Thr Ile His Pro
4520 4525 4530
Ser Ile Asn Lys Ala Val Thr Asn Met Gly Thr Ala Ser Ser Ala
4535 4540 4545
His Val Leu His Ser Thr Leu Pro Val Ser Ser Glu Pro Ser Thr
4550 4555 4560
Ala Thr Ser Pro Met Val Pro Ala Ser Ser Met Gly Asp Ala Leu
4565 4570 4575
Ala Ser Ile Ser Ile Pro Gly Ser Glu Thr Thr Asp Ile Glu Gly
4580 4585 4590
Glu Pro Thr Ser Ser Leu Thr Ala Gly Arg Lys Glu Asn Ser Thr
4595 4600 4605
Leu Gln Glu Met Asn Ser Thr Thr Glu Ser Asn Ile Ile Leu Ser
4610 4615 4620
Asn Val Ser Val Gly Ala Ile Thr Glu Ala Thr Lys Met Glu Val
4625 4630 4635
Pro Ser Phe Asp Ala Thr Phe Ile Pro Thr Pro Ala Gln Ser Thr
4640 4645 4650
Lys Phe Pro Asp Ile Phe Ser Val Ala Ser Ser Arg Leu Ser Asn
4655 4660 4665
Ser Pro Pro Met Thr Ile Ser Thr His Met Thr Thr Thr Gln Thr
4670 4675 4680
Gly Ser Ser Gly Ala Thr Ser Lys Ile Pro Leu Ala Leu Asp Thr
4685 4690 4695
Ser Thr Leu Glu Thr Ser Ala Gly Thr Pro Ser Val Val Thr Glu
4700 4705 4710
Gly Phe Ala His Ser Lys Ile Thr Thr Ala Met Asn Asn Asp Val
4715 4720 4725
Lys Asp Val Ser Gln Thr Asn Pro Pro Phe Gln Asp Glu Ala Ser
4730 4735 4740
Ser Pro Ser Ser Gln Ala Pro Val Leu Val Thr Thr Leu Pro Ser
4745 4750 4755
Ser Val Ala Phe Thr Pro Gln Trp His Ser Thr Ser Ser Pro Val
4760 4765 4770
Ser Met Ser Ser Val Leu Thr Ser Ser Leu Val Lys Thr Ala Gly
4775 4780 4785
Lys Val Asp Thr Ser Leu Glu Thr Val Thr Ser Ser Pro Gln Ser
4790 4795 4800
Met Ser Asn Thr Leu Asp Asp Ile Ser Val Thr Ser Ala Ala Thr
4805 4810 4815
Thr Asp Ile Glu Thr Thr His Pro Ser Ile Asn Thr Val Val Thr
4820 4825 4830
Asn Val Gly Thr Thr Gly Ser Ala Phe Glu Ser His Ser Thr Val
4835 4840 4845
Ser Ala Tyr Pro Glu Pro Ser Lys Val Thr Ser Pro Asn Val Thr
4850 4855 4860
Thr Ser Thr Met Glu Asp Thr Thr Ile Ser Arg Ser Ile Pro Lys
4865 4870 4875
Ser Ser Lys Thr Thr Arg Thr Glu Thr Glu Thr Thr Ser Ser Leu
4880 4885 4890
Thr Pro Lys Leu Arg Glu Thr Ser Ile Ser Gln Glu Ile Thr Ser
4895 4900 4905
Ser Thr Glu Thr Ser Thr Val Pro Tyr Lys Glu Leu Thr Gly Ala
4910 4915 4920
Thr Thr Glu Val Ser Arg Thr Asp Val Thr Ser Ser Ser Ser Thr
4925 4930 4935
Ser Phe Pro Gly Pro Asp Gln Ser Thr Val Ser Leu Asp Ile Ser
4940 4945 4950
Thr Glu Thr Asn Thr Arg Leu Ser Thr Ser Pro Ile Met Thr Glu
4955 4960 4965
Ser Ala Glu Ile Thr Ile Thr Thr Gln Thr Gly Pro His Gly Ala
4970 4975 4980
Thr Ser Gln Asp Thr Phe Thr Met Asp Pro Ser Asn Thr Thr Pro
4985 4990 4995
Gln Ala Gly Ile His Ser Ala Met Thr His Gly Phe Ser Gln Leu
5000 5005 5010
Asp Val Thr Thr Leu Met Ser Arg Ile Pro Gln Asp Val Ser Trp
5015 5020 5025
Thr Ser Pro Pro Ser Val Asp Lys Thr Ser Ser Pro Ser Ser Phe
5030 5035 5040
Leu Ser Ser Pro Ala Met Thr Thr Pro Ser Leu Ile Ser Ser Thr
5045 5050 5055
Leu Pro Glu Asp Lys Leu Ser Ser Pro Met Thr Ser Leu Leu Thr
5060 5065 5070
Ser Gly Leu Val Lys Ile Thr Asp Ile Leu Arg Thr Arg Leu Glu
5075 5080 5085
Pro Val Thr Ser Ser Leu Pro Asn Phe Ser Ser Thr Ser Asp Lys
5090 5095 5100
Ile Leu Ala Thr Ser Lys Asp Ser Lys Asp Thr Lys Glu Ile Phe
5105 5110 5115
Pro Ser Ile Asn Thr Glu Glu Thr Asn Val Lys Ala Asn Asn Ser
5120 5125 5130
Gly His Glu Ser His Ser Pro Ala Leu Ala Asp Ser Glu Thr Pro
5135 5140 5145
Lys Ala Thr Thr Gln Met Val Ile Thr Thr Thr Val Gly Asp Pro
5150 5155 5160
Ala Pro Ser Thr Ser Met Pro Val His Gly Ser Ser Glu Thr Thr
5165 5170 5175
Asn Ile Lys Arg Glu Pro Thr Tyr Phe Leu Thr Pro Arg Leu Arg
5180 5185 5190
Glu Thr Ser Thr Ser Gln Glu Ser Ser Phe Pro Thr Asp Thr Ser
5195 5200 5205
Phe Leu Leu Ser Lys Val Pro Thr Gly Thr Ile Thr Glu Val Ser
5210 5215 5220
Ser Thr Gly Val Asn Ser Ser Ser Lys Ile Ser Thr Pro Asp His
5225 5230 5235
Asp Lys Ser Thr Val Pro Pro Asp Thr Phe Thr Gly Glu Ile Pro
5240 5245 5250
Arg Val Phe Thr Ser Ser Ile Lys Thr Lys Ser Ala Glu Met Thr
5255 5260 5265
Ile Thr Thr Gln Ala Ser Pro Pro Glu Ser Ala Ser His Ser Thr
5270 5275 5280
Leu Pro Leu Asp Thr Ser Thr Thr Leu Ser Gln Gly Gly Thr His
5285 5290 5295
Ser Thr Val Thr Gln Gly Phe Pro Tyr Ser Glu Val Thr Thr Leu
5300 5305 5310
Met Gly Met Gly Pro Gly Asn Val Ser Trp Met Thr Thr Pro Pro
5315 5320 5325
Val Glu Glu Thr Ser Ser Val Ser Ser Leu Met Ser Ser Pro Ala
5330 5335 5340
Met Thr Ser Pro Ser Pro Val Ser Ser Thr Ser Pro Gln Ser Ile
5345 5350 5355
Pro Ser Ser Pro Leu Pro Val Thr Ala Leu Pro Thr Ser Val Leu
5360 5365 5370
Val Thr Thr Thr Asp Val Leu Gly Thr Thr Ser Pro Glu Ser Val
5375 5380 5385
Thr Ser Ser Pro Pro Asn Leu Ser Ser Ile Thr His Glu Arg Pro
5390 5395 5400
Ala Thr Tyr Lys Asp Thr Ala His Thr Glu Ala Ala Met His His
5405 5410 5415
Ser Thr Asn Thr Ala Val Thr Asn Val Gly Thr Ser Gly Ser Gly
5420 5425 5430
His Lys Ser Gln Ser Ser Val Leu Ala Asp Ser Glu Thr Ser Lys
5435 5440 5445
Ala Thr Pro Leu Met Ser Thr Thr Ser Thr Leu Gly Asp Thr Ser
5450 5455 5460
Val Ser Thr Ser Thr Pro Asn Ile Ser Gln Thr Asn Gln Ile Gln
5465 5470 5475
Thr Glu Pro Thr Ala Ser Leu Ser Pro Arg Leu Arg Glu Ser Ser
5480 5485 5490
Thr Ser Glu Lys Thr Ser Ser Thr Thr Glu Thr Asn Thr Ala Phe
5495 5500 5505
Ser Tyr Val Pro Thr Gly Ala Ile Thr Gln Ala Ser Arg Thr Glu
5510 5515 5520
Ile Ser Ser Ser Arg Thr Ser Ile Ser Asp Leu Asp Arg Pro Thr
5525 5530 5535
Ile Ala Pro Asp Ile Ser Thr Gly Met Ile Thr Arg Leu Phe Thr
5540 5545 5550
Ser Pro Ile Met Thr Lys Ser Ala Glu Met Thr Val Thr Thr Gln
5555 5560 5565
Thr Thr Thr Pro Gly Ala Thr Ser Gln Gly Ile Leu Pro Trp Asp
5570 5575 5580
Thr Ser Thr Thr Leu Phe Gln Gly Gly Thr His Ser Thr Val Ser
5585 5590 5595
Gln Gly Phe Pro His Ser Glu Ile Thr Thr Leu Arg Ser Arg Thr
5600 5605 5610
Pro Gly Asp Val Ser Trp Met Thr Thr Pro Pro Val Glu Glu Thr
5615 5620 5625
Ser Ser Gly Phe Ser Leu Met Ser Pro Ser Met Thr Ser Pro Ser
5630 5635 5640
Pro Val Ser Ser Thr Ser Pro Glu Ser Ile Pro Ser Ser Pro Leu
5645 5650 5655
Pro Val Thr Ala Leu Leu Thr Ser Val Leu Val Thr Thr Thr Asn
5660 5665 5670
Val Leu Gly Thr Thr Ser Pro Glu Pro Val Thr Ser Ser Pro Pro
5675 5680 5685
Asn Leu Ser Ser Pro Thr Gln Glu Arg Leu Thr Thr Tyr Lys Asp
5690 5695 5700
Thr Ala His Thr Glu Ala Met His Ala Ser Met His Thr Asn Thr
5705 5710 5715
Ala Val Ala Asn Val Gly Thr Ser Ile Ser Gly His Glu Ser Gln
5720 5725 5730
Ser Ser Val Pro Ala Asp Ser His Thr Ser Lys Ala Thr Ser Pro
5735 5740 5745
Met Gly Ile Thr Phe Ala Met Gly Asp Thr Ser Val Ser Thr Ser
5750 5755 5760
Thr Pro Ala Phe Phe Glu Thr Arg Ile Gln Thr Glu Ser Thr Ser
5765 5770 5775
Ser Leu Ile Pro Gly Leu Arg Asp Thr Arg Thr Ser Glu Glu Ile
5780 5785 5790
Asn Thr Val Thr Glu Thr Ser Thr Val Leu Ser Glu Val Pro Thr
5795 5800 5805
Thr Thr Thr Thr Glu Val Ser Arg Thr Glu Val Ile Thr Ser Ser
5810 5815 5820
Arg Thr Thr Ile Ser Gly Pro Asp His Ser Lys Met Ser Pro Tyr
5825 5830 5835
Ile Ser Thr Glu Thr Ile Thr Arg Leu Ser Thr Phe Pro Phe Val
5840 5845 5850
Thr Gly Ser Thr Glu Met Ala Ile Thr Asn Gln Thr Gly Pro Ile
5855 5860 5865
Gly Thr Ile Ser Gln Ala Thr Leu Thr Leu Asp Thr Ser Ser Thr
5870 5875 5880
Ala Ser Trp Glu Gly Thr His Ser Pro Val Thr Gln Arg Phe Pro
5885 5890 5895
His Ser Glu Glu Thr Thr Thr Met Ser Arg Ser Thr Lys Gly Val
5900 5905 5910
Ser Trp Gln Ser Pro Pro Ser Val Glu Glu Thr Ser Ser Pro Ser
5915 5920 5925
Ser Pro Val Pro Leu Pro Ala Ile Thr Ser His Ser Ser Leu Tyr
5930 5935 5940
Ser Ala Val Ser Gly Ser Ser Pro Thr Ser Ala Leu Pro Val Thr
5945 5950 5955
Ser Leu Leu Thr Ser Gly Arg Arg Lys Thr Ile Asp Met Leu Asp
5960 5965 5970
Thr His Ser Glu Leu Val Thr Ser Ser Leu Pro Ser Ala Ser Ser
5975 5980 5985
Phe Ser Gly Glu Ile Leu Thr Ser Glu Ala Ser Thr Asn Thr Glu
5990 5995 6000
Thr Ile His Phe Ser Glu Asn Thr Ala Glu Thr Asn Met Gly Thr
6005 6010 6015
Thr Asn Ser Met His Lys Leu His Ser Ser Val Ser Ile His Ser
6020 6025 6030
Gln Pro Ser Gly His Thr Pro Pro Lys Val Thr Gly Ser Met Met
6035 6040 6045
Glu Asp Ala Ile Val Ser Thr Ser Thr Pro Gly Ser Pro Glu Thr
6050 6055 6060
Lys Asn Val Asp Arg Asp Ser Thr Ser Pro Leu Thr Pro Glu Leu
6065 6070 6075
Lys Glu Asp Ser Thr Ala Leu Val Met Asn Ser Thr Thr Glu Ser
6080 6085 6090
Asn Thr Val Phe Ser Ser Val Ser Leu Asp Ala Ala Thr Glu Val
6095 6100 6105
Ser Arg Ala Glu Val Thr Tyr Tyr Asp Pro Thr Phe Met Pro Ala
6110 6115 6120
Ser Ala Gln Ser Thr Lys Ser Pro Asp Ile Ser Pro Glu Ala Ser
6125 6130 6135
Ser Ser His Ser Asn Ser Pro Pro Leu Thr Ile Ser Thr His Lys
6140 6145 6150
Thr Ile Ala Thr Gln Thr Gly Pro Ser Gly Val Thr Ser Leu Gly
6155 6160 6165
Gln Leu Thr Leu Asp Thr Ser Thr Ile Ala Thr Ser Ala Gly Thr
6170 6175 6180
Pro Ser Ala Arg Thr Gln Asp Phe Val Asp Ser Glu Thr Thr Ser
6185 6190 6195
Val Met Asn Asn Asp Leu Asn Asp Val Leu Lys Thr Ser Pro Phe
6200 6205 6210
Ser Ala Glu Glu Ala Asn Ser Leu Ser Ser Gln Ala Pro Leu Leu
6215 6220 6225
Val Thr Thr Ser Pro Ser Pro Val Thr Ser Thr Leu Gln Glu His
6230 6235 6240
Ser Thr Ser Ser Leu Val Ser Val Thr Ser Val Pro Thr Pro Thr
6245 6250 6255
Leu Ala Lys Ile Thr Asp Met Asp Thr Asn Leu Glu Pro Val Thr
6260 6265 6270
Arg Ser Pro Gln Asn Leu Arg Asn Thr Leu Ala Thr Ser Glu Ala
6275 6280 6285
Thr Thr Asp Thr His Thr Met His Pro Ser Ile Asn Thr Ala Val
6290 6295 6300
Ala Asn Val Gly Thr Thr Ser Ser Pro Asn Glu Phe Tyr Phe Thr
6305 6310 6315
Val Ser Pro Asp Ser Asp Pro Tyr Lys Ala Thr Ser Ala Val Val
6320 6325 6330
Ile Thr Ser Thr Ser Gly Asp Ser Ile Val Ser Thr Ser Met Pro
6335 6340 6345
Arg Ser Ser Ala Met Lys Lys Ile Glu Ser Glu Thr Thr Phe Ser
6350 6355 6360
Leu Ile Phe Arg Leu Arg Glu Thr Ser Thr Ser Gln Lys Ile Gly
6365 6370 6375
Ser Ser Ser Asp Thr Ser Thr Val Phe Asp Lys Ala Phe Thr Ala
6380 6385 6390
Ala Thr Thr Glu Val Ser Arg Thr Glu Leu Thr Ser Ser Ser Arg
6395 6400 6405
Thr Ser Ile Gln Gly Thr Glu Lys Pro Thr Met Ser Pro Asp Thr
6410 6415 6420
Ser Thr Arg Ser Val Thr Met Leu Ser Thr Phe Ala Gly Leu Thr
6425 6430 6435
Lys Ser Glu Glu Arg Thr Ile Ala Thr Gln Thr Gly Pro His Arg
6440 6445 6450
Ala Thr Ser Gln Gly Thr Leu Thr Trp Asp Thr Ser Ile Thr Thr
6455 6460 6465
Ser Gln Ala Gly Thr His Ser Ala Met Thr His Gly Phe Ser Gln
6470 6475 6480
Leu Asp Leu Ser Thr Leu Thr Ser Arg Val Pro Glu Tyr Ile Ser
6485 6490 6495
Gly Thr Ser Pro Pro Ser Val Glu Lys Thr Ser Ser Ser Ser Ser
6500 6505 6510
Leu Leu Ser Leu Pro Ala Ile Thr Ser Pro Ser Pro Val Pro Thr
6515 6520 6525
Thr Leu Pro Glu Ser Arg Pro Ser Ser Pro Val His Leu Thr Ser
6530 6535 6540
Leu Pro Thr Ser Gly Leu Val Lys Thr Thr Asp Met Leu Ala Ser
6545 6550 6555
Val Ala Ser Leu Pro Pro Asn Leu Gly Ser Thr Ser His Lys Ile
6560 6565 6570
Pro Thr Thr Ser Glu Asp Ile Lys Asp Thr Glu Lys Met Tyr Pro
6575 6580 6585
Ser Thr Asn Ile Ala Val Thr Asn Val Gly Thr Thr Thr Ser Glu
6590 6595 6600
Lys Glu Ser Tyr Ser Ser Val Pro Ala Tyr Ser Glu Pro Pro Lys
6605 6610 6615
Val Thr Ser Pro Met Val Thr Ser Phe Asn Ile Arg Asp Thr Ile
6620 6625 6630
Val Ser Thr Ser Met Pro Gly Ser Ser Glu Ile Thr Arg Ile Glu
6635 6640 6645
Met Glu Ser Thr Phe Ser Leu Ala His Gly Leu Lys Gly Thr Ser
6650 6655 6660
Thr Ser Gln Asp Pro Ile Val Ser Thr Glu Lys Ser Ala Val Leu
6665 6670 6675
His Lys Leu Thr Thr Gly Ala Thr Glu Thr Ser Arg Thr Glu Val
6680 6685 6690
Ala Ser Ser Arg Arg Thr Ser Ile Pro Gly Pro Asp His Ser Thr
6695 6700 6705
Glu Ser Pro Asp Ile Ser Thr Glu Val Ile Pro Ser Leu Pro Ile
6710 6715 6720
Ser Leu Gly Ile Thr Glu Ser Ser Asn Met Thr Ile Ile Thr Arg
6725 6730 6735
Thr Gly Pro Pro Leu Gly Ser Thr Ser Gln Gly Thr Phe Thr Leu
6740 6745 6750
Asp Thr Pro Thr Thr Ser Ser Arg Ala Gly Thr His Ser Met Ala
6755 6760 6765
Thr Gln Glu Phe Pro His Ser Glu Met Thr Thr Val Met Asn Lys
6770 6775 6780
Asp Pro Glu Ile Leu Ser Trp Thr Ile Pro Pro Ser Ile Glu Lys
6785 6790 6795
Thr Ser Phe Ser Ser Ser Leu Met Pro Ser Pro Ala Met Thr Ser
6800 6805 6810
Pro Pro Val Ser Ser Thr Leu Pro Lys Thr Ile His Thr Thr Pro
6815 6820 6825
Ser Pro Met Thr Ser Leu Leu Thr Pro Ser Leu Val Met Thr Thr
6830 6835 6840
Asp Thr Leu Gly Thr Ser Pro Glu Pro Thr Thr Ser Ser Pro Pro
6845 6850 6855
Asn Leu Ser Ser Thr Ser His Glu Ile Leu Thr Thr Asp Glu Asp
6860 6865 6870
Thr Thr Ala Ile Glu Ala Met His Pro Ser Thr Ser Thr Ala Ala
6875 6880 6885
Thr Asn Val Glu Thr Thr Ser Ser Gly His Gly Ser Gln Ser Ser
6890 6895 6900
Val Leu Ala Asp Ser Glu Lys Thr Lys Ala Thr Ala Pro Met Asp
6905 6910 6915
Thr Thr Ser Thr Met Gly His Thr Thr Val Ser Thr Ser Met Ser
6920 6925 6930
Val Ser Ser Glu Thr Thr Lys Ile Lys Arg Glu Ser Thr Tyr Ser
6935 6940 6945
Leu Thr Pro Gly Leu Arg Glu Thr Ser Ile Ser Gln Asn Ala Ser
6950 6955 6960
Phe Ser Thr Asp Thr Ser Ile Val Leu Ser Glu Val Pro Thr Gly
6965 6970 6975
Thr Thr Ala Glu Val Ser Arg Thr Glu Val Thr Ser Ser Gly Arg
6980 6985 6990
Thr Ser Ile Pro Gly Pro Ser Gln Ser Thr Val Leu Pro Glu Ile
6995 7000 7005
Ser Thr Arg Thr Met Thr Arg Leu Phe Ala Ser Pro Thr Met Thr
7010 7015 7020
Glu Ser Ala Glu Met Thr Ile Pro Thr Gln Thr Gly Pro Ser Gly
7025 7030 7035
Ser Thr Ser Gln Asp Thr Leu Thr Leu Asp Thr Ser Thr Thr Lys
7040 7045 7050
Ser Gln Ala Lys Thr His Ser Thr Leu Thr Gln Arg Phe Pro His
7055 7060 7065
Ser Glu Met Thr Thr Leu Met Ser Arg Gly Pro Gly Asp Met Ser
7070 7075 7080
Trp Gln Ser Ser Pro Ser Leu Glu Asn Pro Ser Ser Leu Pro Ser
7085 7090 7095
Leu Leu Ser Leu Pro Ala Thr Thr Ser Pro Pro Pro Ile Ser Ser
7100 7105 7110
Thr Leu Pro Val Thr Ile Ser Ser Ser Pro Leu Pro Val Thr Ser
7115 7120 7125
Leu Leu Thr Ser Ser Pro Val Thr Thr Thr Asp Met Leu His Thr
7130 7135 7140
Ser Pro Glu Leu Val Thr Ser Ser Pro Pro Lys Leu Ser His Thr
7145 7150 7155
Ser Asp Glu Arg Leu Thr Thr Gly Lys Asp Thr Thr Asn Thr Glu
7160 7165 7170
Ala Val His Pro Ser Thr Asn Thr Ala Ala Ser Asn Val Glu Ile
7175 7180 7185
Pro Ser Ser Gly His Glu Ser Pro Ser Ser Ala Leu Ala Asp Ser
7190 7195 7200
Glu Thr Ser Lys Ala Thr Ser Pro Met Phe Ile Thr Ser Thr Gln
7205 7210 7215
Glu Asp Thr Thr Val Ala Ile Ser Thr Pro His Phe Leu Glu Thr
7220 7225 7230
Ser Arg Ile Gln Lys Glu Ser Ile Ser Ser Leu Ser Pro Lys Leu
7235 7240 7245
Arg Glu Thr Gly Ser Ser Val Glu Thr Ser Ser Ala Ile Glu Thr
7250 7255 7260
Ser Ala Val Leu Ser Glu Val Ser Ile Gly Ala Thr Thr Glu Ile
7265 7270 7275
Ser Arg Thr Glu Val Thr Ser Ser Ser Arg Thr Ser Ile Ser Gly
7280 7285 7290
Ser Ala Glu Ser Thr Met Leu Pro Glu Ile Ser Thr Thr Arg Lys
7295 7300 7305
Ile Ile Lys Phe Pro Thr Ser Pro Ile Leu Ala Glu Ser Ser Glu
7310 7315 7320
Met Thr Ile Lys Thr Gln Thr Ser Pro Pro Gly Ser Thr Ser Glu
7325 7330 7335
Ser Thr Phe Thr Leu Asp Thr Ser Thr Thr Pro Ser Leu Val Ile
7340 7345 7350
Thr His Ser Thr Met Thr Gln Arg Leu Pro His Ser Glu Ile Thr
7355 7360 7365
Thr Leu Val Ser Arg Gly Ala Gly Asp Val Pro Arg Pro Ser Ser
7370 7375 7380
Leu Pro Val Glu Glu Thr Ser Pro Pro Ser Ser Gln Leu Ser Leu
7385 7390 7395
Ser Ala Met Ile Ser Pro Ser Pro Val Ser Ser Thr Leu Pro Ala
7400 7405 7410
Ser Ser His Ser Ser Ser Ala Ser Val Thr Ser Leu Leu Thr Pro
7415 7420 7425
Gly Gln Val Lys Thr Thr Glu Val Leu Asp Ala Ser Ala Glu Pro
7430 7435 7440
Glu Thr Ser Ser Pro Pro Ser Leu Ser Ser Thr Ser Val Glu Ile
7445 7450 7455
Leu Ala Thr Ser Glu Val Thr Thr Asp Thr Glu Lys Ile His Pro
7460 7465 7470
Phe Ser Asn Thr Ala Val Thr Lys Val Gly Thr Ser Ser Ser Gly
7475 7480 7485
His Glu Ser Pro Ser Ser Val Leu Pro Asp Ser Glu Thr Thr Lys
7490 7495 7500
Ala Thr Ser Ala Met Gly Thr Ile Ser Ile Met Gly Asp Thr Ser
7505 7510 7515
Val Ser Thr Leu Thr Pro Ala Leu Ser Asn Thr Arg Lys Ile Gln
7520 7525 7530
Ser Glu Pro Ala Ser Ser Leu Thr Thr Arg Leu Arg Glu Thr Ser
7535 7540 7545
Thr Ser Glu Glu Thr Ser Leu Ala Thr Glu Ala Asn Thr Val Leu
7550 7555 7560
Ser Lys Val Ser Thr Gly Ala Thr Thr Glu Val Ser Arg Thr Glu
7565 7570 7575
Ala Ile Ser Phe Ser Arg Thr Ser Met Ser Gly Pro Glu Gln Ser
7580 7585 7590
Thr Met Ser Gln Asp Ile Ser Ile Gly Thr Ile Pro Arg Ile Ser
7595 7600 7605
Ala Ser Ser Val Leu Thr Glu Ser Ala Lys Met Thr Ile Thr Thr
7610 7615 7620
Gln Thr Gly Pro Ser Glu Ser Thr Leu Glu Ser Thr Leu Asn Leu
7625 7630 7635
Asn Thr Ala Thr Thr Pro Ser Trp Val Glu Thr His Ser Ile Val
7640 7645 7650
Ile Gln Gly Phe Pro His Pro Glu Met Thr Thr Ser Met Gly Arg
7655 7660 7665
Gly Pro Gly Gly Val Ser Trp Pro Ser Pro Pro Phe Val Lys Glu
7670 7675 7680
Thr Ser Pro Pro Ser Ser Pro Leu Ser Leu Pro Ala Val Thr Ser
7685 7690 7695
Pro His Pro Val Ser Thr Thr Phe Leu Ala His Ile Pro Pro Ser
7700 7705 7710
Pro Leu Pro Val Thr Ser Leu Leu Thr Ser Gly Pro Ala Thr Thr
7715 7720 7725
Thr Asp Ile Leu Gly Thr Ser Thr Glu Pro Gly Thr Ser Ser Ser
7730 7735 7740
Ser Ser Leu Ser Thr Thr Ser His Glu Arg Leu Thr Thr Tyr Lys
7745 7750 7755
Asp Thr Ala His Thr Glu Ala Val His Pro Ser Thr Asn Thr Gly
7760 7765 7770
Gly Thr Asn Val Ala Thr Thr Ser Ser Gly Tyr Lys Ser Gln Ser
7775 7780 7785
Ser Val Leu Ala Asp Ser Ser Pro Met Cys Thr Thr Ser Thr Met
7790 7795 7800
Gly Asp Thr Ser Val Leu Thr Ser Thr Pro Ala Phe Leu Glu Thr
7805 7810 7815
Arg Arg Ile Gln Thr Glu Leu Ala Ser Ser Leu Thr Pro Gly Leu
7820 7825 7830
Arg Glu Ser Ser Gly Ser Glu Gly Thr Ser Ser Gly Thr Lys Met
7835 7840 7845
Ser Thr Val Leu Ser Lys Val Pro Thr Gly Ala Thr Thr Glu Ile
7850 7855 7860
Ser Lys Glu Asp Val Thr Ser Ile Pro Gly Pro Ala Gln Ser Thr
7865 7870 7875
Ile Ser Pro Asp Ile Ser Thr Arg Thr Val Ser Trp Phe Ser Thr
7880 7885 7890
Ser Pro Val Met Thr Glu Ser Ala Glu Ile Thr Met Asn Thr His
7895 7900 7905
Thr Ser Pro Leu Gly Ala Thr Thr Gln Gly Thr Ser Thr Leu Asp
7910 7915 7920
Thr Ser Ser Thr Thr Ser Leu Thr Met Thr His Ser Thr Ile Ser
7925 7930 7935
Gln Gly Phe Ser His Ser Gln Met Ser Thr Leu Met Arg Arg Gly
7940 7945 7950
Pro Glu Asp Val Ser Trp Met Ser Pro Pro Leu Leu Glu Lys Thr
7955 7960 7965
Arg Pro Ser Phe Ser Leu Met Ser Ser Pro Ala Thr Thr Ser Pro
7970 7975 7980
Ser Pro Val Ser Ser Thr Leu Pro Glu Ser Ile Ser Ser Ser Pro
7985 7990 7995
Leu Pro Val Thr Ser Leu Leu Thr Ser Gly Leu Ala Lys Thr Thr
8000 8005 8010
Asp Met Leu His Lys Ser Ser Glu Pro Val Thr Asn Ser Pro Ala
8015 8020 8025
Asn Leu Ser Ser Thr Ser Val Glu Ile Leu Ala Thr Ser Glu Val
8030 8035 8040
Thr Thr Asp Thr Glu Lys Thr His Pro Ser Ser Asn Arg Thr Val
8045 8050 8055
Thr Asp Val Gly Thr Ser Ser Ser Gly His Glu Ser Thr Ser Phe
8060 8065 8070
Val Leu Ala Asp Ser Gln Thr Ser Lys Val Thr Ser Pro Met Val
8075 8080 8085
Ile Thr Ser Thr Met Glu Asp Thr Ser Val Ser Thr Ser Thr Pro
8090 8095 8100
Gly Phe Phe Glu Thr Ser Arg Ile Gln Thr Glu Pro Thr Ser Ser
8105 8110 8115
Leu Thr Leu Gly Leu Arg Lys Thr Ser Ser Ser Glu Gly Thr Ser
8120 8125 8130
Leu Ala Thr Glu Met Ser Thr Val Leu Ser Gly Val Pro Thr Gly
8135 8140 8145
Ala Thr Ala Glu Val Ser Arg Thr Glu Val Thr Ser Ser Ser Arg
8150 8155 8160
Thr Ser Ile Ser Gly Phe Ala Gln Leu Thr Val Ser Pro Glu Thr
8165 8170 8175
Ser Thr Glu Thr Ile Thr Arg Leu Pro Thr Ser Ser Ile Met Thr
8180 8185 8190
Glu Ser Ala Glu Met Met Ile Lys Thr Gln Thr Asp Pro Pro Gly
8195 8200 8205
Ser Thr Pro Glu Ser Thr His Thr Val Asp Ile Ser Thr Thr Pro
8210 8215 8220
Asn Trp Val Glu Thr His Ser Thr Val Thr Gln Arg Phe Ser His
8225 8230 8235
Ser Glu Met Thr Thr Leu Val Ser Arg Ser Pro Gly Asp Met Leu
8240 8245 8250
Trp Pro Ser Gln Ser Ser Val Glu Glu Thr Ser Ser Ala Ser Ser
8255 8260 8265
Leu Leu Ser Leu Pro Ala Thr Thr Ser Pro Ser Pro Val Ser Ser
8270 8275 8280
Thr Leu Val Glu Asp Phe Pro Ser Ala Ser Leu Pro Val Thr Ser
8285 8290 8295
Leu Leu Asn Pro Gly Leu Val Ile Thr Thr Asp Arg Met Gly Ile
8300 8305 8310
Ser Arg Glu Pro Gly Thr Ser Ser Thr Ser Asn Leu Ser Ser Thr
8315 8320 8325
Ser His Glu Arg Leu Thr Thr Leu Glu Asp Thr Val Asp Thr Glu
8330 8335 8340
Asp Met Gln Pro Ser Thr His Thr Ala Val Thr Asn Val Arg Thr
8345 8350 8355
Ser Ile Ser Gly His Glu Ser Gln Ser Ser Val Leu Ser Asp Ser
8360 8365 8370
Glu Thr Pro Lys Ala Thr Ser Pro Met Gly Thr Thr Tyr Thr Met
8375 8380 8385
Gly Glu Thr Ser Val Ser Ile Ser Thr Ser Asp Phe Phe Glu Thr
8390 8395 8400
Ser Arg Ile Gln Ile Glu Pro Thr Ser Ser Leu Thr Ser Gly Leu
8405 8410 8415
Arg Glu Thr Ser Ser Ser Glu Arg Ile Ser Ser Ala Thr Glu Gly
8420 8425 8430
Ser Thr Val Leu Ser Glu Val Pro Ser Gly Ala Thr Thr Glu Val
8435 8440 8445
Ser Arg Thr Glu Val Ile Ser Ser Arg Gly Thr Ser Met Ser Gly
8450 8455 8460
Pro Asp Gln Phe Thr Ile Ser Pro Asp Ile Ser Thr Glu Ala Ile
8465 8470 8475
Thr Arg Leu Ser Thr Ser Pro Ile Met Thr Glu Ser Ala Glu Ser
8480 8485 8490
Ala Ile Thr Ile Glu Thr Gly Ser Pro Gly Ala Thr Ser Glu Gly
8495 8500 8505
Thr Leu Thr Leu Asp Thr Ser Thr Thr Thr Phe Trp Ser Gly Thr
8510 8515 8520
His Ser Thr Ala Ser Pro Gly Phe Ser His Ser Glu Met Thr Thr
8525 8530 8535
Leu Met Ser Arg Thr Pro Gly Asp Val Pro Trp Pro Ser Leu Pro
8540 8545 8550
Ser Val Glu Glu Ala Ser Ser Val Ser Ser Ser Leu Ser Ser Pro
8555 8560 8565
Ala Met Thr Ser Thr Ser Phe Phe Ser Thr Leu Pro Glu Ser Ile
8570 8575 8580
Ser Ser Ser Pro His Pro Val Thr Ala Leu Leu Thr Leu Gly Pro
8585 8590 8595
Val Lys Thr Thr Asp Met Leu Arg Thr Ser Ser Glu Pro Glu Thr
8600 8605 8610
Ser Ser Pro Pro Asn Leu Ser Ser Thr Ser Ala Glu Ile Leu Ala
8615 8620 8625
Thr Ser Glu Val Thr Lys Asp Arg Glu Lys Ile His Pro Ser Ser
8630 8635 8640
Asn Thr Pro Val Val Asn Val Gly Thr Val Ile Tyr Lys His Leu
8645 8650 8655
Ser Pro Ser Ser Val Leu Ala Asp Leu Val Thr Thr Lys Pro Thr
8660 8665 8670
Ser Pro Met Ala Thr Thr Ser Thr Leu Gly Asn Thr Ser Val Ser
8675 8680 8685
Thr Ser Thr Pro Ala Phe Pro Glu Thr Met Met Thr Gln Pro Thr
8690 8695 8700
Ser Ser Leu Thr Ser Gly Leu Arg Glu Ile Ser Thr Ser Gln Glu
8705 8710 8715
Thr Ser Ser Ala Thr Glu Arg Ser Ala Ser Leu Ser Gly Met Pro
8720 8725 8730
Thr Gly Ala Thr Thr Lys Val Ser Arg Thr Glu Ala Leu Ser Leu
8735 8740 8745
Gly Arg Thr Ser Thr Pro Gly Pro Ala Gln Ser Thr Ile Ser Pro
8750 8755 8760
Glu Ile Ser Thr Glu Thr Ile Thr Arg Ile Ser Thr Pro Leu Thr
8765 8770 8775
Thr Thr Gly Ser Ala Glu Met Thr Ile Thr Pro Lys Thr Gly His
8780 8785 8790
Ser Gly Ala Ser Ser Gln Gly Thr Phe Thr Leu Asp Thr Ser Ser
8795 8800 8805
Arg Ala Ser Trp Pro Gly Thr His Ser Ala Ala Thr His Arg Ser
8810 8815 8820
Pro His Ser Gly Met Thr Thr Pro Met Ser Arg Gly Pro Glu Asp
8825 8830 8835
Val Ser Trp Pro Ser Arg Pro Ser Val Glu Lys Thr Ser Pro Pro
8840 8845 8850
Ser Ser Leu Val Ser Leu Ser Ala Val Thr Ser Pro Ser Pro Leu
8855 8860 8865
Tyr Ser Thr Pro Ser Glu Ser Ser His Ser Ser Pro Leu Arg Val
8870 8875 8880
Thr Ser Leu Phe Thr Pro Val Met Met Lys Thr Thr Asp Met Leu
8885 8890 8895
Asp Thr Ser Leu Glu Pro Val Thr Thr Ser Pro Pro Ser Met Asn
8900 8905 8910
Ile Thr Ser Asp Glu Ser Leu Ala Thr Ser Lys Ala Thr Met Glu
8915 8920 8925
Thr Glu Ala Ile Gln Leu Ser Glu Asn Thr Ala Val Thr Gln Met
8930 8935 8940
Gly Thr Ile Ser Ala Arg Gln Glu Phe Tyr Ser Ser Tyr Pro Gly
8945 8950 8955
Leu Pro Glu Pro Ser Lys Val Thr Ser Pro Val Val Thr Ser Ser
8960 8965 8970
Thr Ile Lys Asp Ile Val Ser Thr Thr Ile Pro Ala Ser Ser Glu
8975 8980 8985
Ile Thr Arg Ile Glu Met Glu Ser Thr Ser Thr Leu Thr Pro Thr
8990 8995 9000
Pro Arg Glu Thr Ser Thr Ser Gln Glu Ile His Ser Ala Thr Lys
9005 9010 9015
Pro Ser Thr Val Pro Tyr Lys Ala Leu Thr Ser Ala Thr Ile Glu
9020 9025 9030
Asp Ser Met Thr Gln Val Met Ser Ser Ser Arg Gly Pro Ser Pro
9035 9040 9045
Asp Gln Ser Thr Met Ser Gln Asp Ile Ser Thr Glu Val Ile Thr
9050 9055 9060
Arg Leu Ser Thr Ser Pro Ile Lys Thr Glu Ser Thr Glu Met Thr
9065 9070 9075
Ile Thr Thr Gln Thr Gly Ser Pro Gly Ala Thr Ser Arg Gly Thr
9080 9085 9090
Leu Thr Leu Asp Thr Ser Thr Thr Phe Met Ser Gly Thr His Ser
9095 9100 9105
Thr Ala Ser Gln Gly Phe Ser His Ser Gln Met Thr Ala Leu Met
9110 9115 9120
Ser Arg Thr Pro Gly Asp Val Pro Trp Leu Ser His Pro Ser Val
9125 9130 9135
Glu Glu Ala Ser Ser Ala Ser Phe Ser Leu Ser Ser Pro Val Met
9140 9145 9150
Thr Ser Ser Ser Pro Val Ser Ser Thr Leu Pro Asp Ser Ile His
9155 9160 9165
Ser Ser Ser Leu Pro Val Thr Ser Leu Leu Thr Ser Gly Leu Val
9170 9175 9180
Lys Thr Thr Glu Leu Leu Gly Thr Ser Ser Glu Pro Glu Thr Ser
9185 9190 9195
Ser Pro Pro Asn Leu Ser Ser Thr Ser Ala Glu Ile Leu Ala Ile
9200 9205 9210
Thr Glu Val Thr Thr Asp Thr Glu Lys Leu Glu Met Thr Asn Val
9215 9220 9225
Val Thr Ser Gly Tyr Thr His Glu Ser Pro Ser Ser Val Leu Ala
9230 9235 9240
Asp Ser Val Thr Thr Lys Ala Thr Ser Ser Met Gly Ile Thr Tyr
9245 9250 9255
Pro Thr Gly Asp Thr Asn Val Leu Thr Ser Thr Pro Ala Phe Ser
9260 9265 9270
Asp Thr Ser Arg Ile Gln Thr Lys Ser Lys Leu Ser Leu Thr Pro
9275 9280 9285
Gly Leu Met Glu Thr Ser Ile Ser Glu Glu Thr Ser Ser Ala Thr
9290 9295 9300
Glu Lys Ser Thr Val Leu Ser Ser Val Pro Thr Gly Ala Thr Thr
9305 9310 9315
Glu Val Ser Arg Thr Glu Ala Ile Ser Ser Ser Arg Thr Ser Ile
9320 9325 9330
Pro Gly Pro Ala Gln Ser Thr Met Ser Ser Asp Thr Ser Met Glu
9335 9340 9345
Thr Ile Thr Arg Ile Ser Thr Pro Leu Thr Arg Lys Glu Ser Thr
9350 9355 9360
Asp Met Ala Ile Thr Pro Lys Thr Gly Pro Ser Gly Ala Thr Ser
9365 9370 9375
Gln Gly Thr Phe Thr Leu Asp Ser Ser Ser Thr Ala Ser Trp Pro
9380 9385 9390
Gly Thr His Ser Ala Thr Thr Gln Arg Phe Pro Gln Ser Val Val
9395 9400 9405
Thr Thr Pro Met Ser Arg Gly Pro Glu Asp Val Ser Trp Pro Ser
9410 9415 9420
Pro Leu Ser Val Glu Lys Asn Ser Pro Pro Ser Ser Leu Val Ser
9425 9430 9435
Ser Ser Ser Val Thr Ser Pro Ser Pro Leu Tyr Ser Thr Pro Ser
9440 9445 9450
Gly Ser Ser His Ser Ser Pro Val Pro Val Thr Ser Leu Phe Thr
9455 9460 9465
Ser Ile Met Met Lys Ala Thr Asp Met Leu Asp Ala Ser Leu Glu
9470 9475 9480
Pro Glu Thr Thr Ser Ala Pro Asn Met Asn Ile Thr Ser Asp Glu
9485 9490 9495
Ser Leu Ala Ala Ser Lys Ala Thr Thr Glu Thr Glu Ala Ile His
9500 9505 9510
Val Phe Glu Asn Thr Ala Ala Ser His Val Glu Thr Thr Ser Ala
9515 9520 9525
Thr Glu Glu Leu Tyr Ser Ser Ser Pro Gly Phe Ser Glu Pro Thr
9530 9535 9540
Lys Val Ile Ser Pro Val Val Thr Ser Ser Ser Ile Arg Asp Asn
9545 9550 9555
Met Val Ser Thr Thr Met Pro Gly Ser Ser Gly Ile Thr Arg Ile
9560 9565 9570
Glu Ile Glu Ser Met Ser Ser Leu Thr Pro Gly Leu Arg Glu Thr
9575 9580 9585
Arg Thr Ser Gln Asp Ile Thr Ser Ser Thr Glu Thr Ser Thr Val
9590 9595 9600
Leu Tyr Lys Met Pro Ser Gly Ala Thr Pro Glu Val Ser Arg Thr
9605 9610 9615
Glu Val Met Pro Ser Ser Arg Thr Ser Ile Pro Gly Pro Ala Gln
9620 9625 9630
Ser Thr Met Ser Leu Asp Ile Ser Asp Glu Val Val Thr Arg Leu
9635 9640 9645
Ser Thr Ser Pro Ile Met Thr Glu Ser Ala Glu Ile Thr Ile Thr
9650 9655 9660
Thr Gln Thr Gly Tyr Ser Leu Ala Thr Ser Gln Val Thr Leu Pro
9665 9670 9675
Leu Gly Thr Ser Met Thr Phe Leu Ser Gly Thr His Ser Thr Met
9680 9685 9690
Ser Gln Gly Leu Ser His Ser Glu Met Thr Asn Leu Met Ser Arg
9695 9700 9705
Gly Pro Glu Ser Leu Ser Trp Thr Ser Pro Arg Phe Val Glu Thr
9710 9715 9720
Thr Arg Ser Ser Ser Ser Leu Thr Ser Leu Pro Leu Thr Thr Ser
9725 9730 9735
Leu Ser Pro Val Ser Ser Thr Leu Leu Asp Ser Ser Pro Ser Ser
9740 9745 9750
Pro Leu Pro Val Thr Ser Leu Ile Leu Pro Gly Leu Val Lys Thr
9755 9760 9765
Thr Glu Val Leu Asp Thr Ser Ser Glu Pro Lys Thr Ser Ser Ser
9770 9775 9780
Pro Asn Leu Ser Ser Thr Ser Val Glu Ile Pro Ala Thr Ser Glu
9785 9790 9795
Ile Met Thr Asp Thr Glu Lys Ile His Pro Ser Ser Asn Thr Ala
9800 9805 9810
Val Ala Lys Val Arg Thr Ser Ser Ser Val His Glu Ser His Ser
9815 9820 9825
Ser Val Leu Ala Asp Ser Glu Thr Thr Ile Thr Ile Pro Ser Met
9830 9835 9840
Gly Ile Thr Ser Ala Val Asp Asp Thr Thr Val Phe Thr Ser Asn
9845 9850 9855
Pro Ala Phe Ser Glu Thr Arg Arg Ile Pro Thr Glu Pro Thr Phe
9860 9865 9870
Ser Leu Thr Pro Gly Phe Arg Glu Thr Ser Thr Ser Glu Glu Thr
9875 9880 9885
Thr Ser Ile Thr Glu Thr Ser Ala Val Leu Tyr Gly Val Pro Thr
9890 9895 9900
Ser Ala Thr Thr Glu Val Ser Met Thr Glu Ile Met Ser Ser Asn
9905 9910 9915
Arg Ile His Ile Pro Asp Ser Asp Gln Ser Thr Met Ser Pro Asp
9920 9925 9930
Ile Ile Thr Glu Val Ile Thr Arg Leu Ser Ser Ser Ser Met Met
9935 9940 9945
Ser Glu Ser Thr Gln Met Thr Ile Thr Thr Gln Lys Ser Ser Pro
9950 9955 9960
Gly Ala Thr Ala Gln Ser Thr Leu Thr Leu Ala Thr Thr Thr Ala
9965 9970 9975
Pro Leu Ala Arg Thr His Ser Thr Val Pro Pro Arg Phe Leu His
9980 9985 9990
Ser Glu Met Thr Thr Leu Met Ser Arg Ser Pro Glu Asn Pro Ser
9995 10000 10005
Trp Lys Ser Ser Leu Phe Val Glu Lys Thr Ser Ser Ser Ser Ser
10010 10015 10020
Leu Leu Ser Leu Pro Val Thr Thr Ser Pro Ser Val Ser Ser Thr
10025 10030 10035
Leu Pro Gln Ser Ile Pro Ser Ser Ser Phe Ser Val Thr Ser Leu
10040 10045 10050
Leu Thr Pro Gly Met Val Lys Thr Thr Asp Thr Ser Thr Glu Pro
10055 10060 10065
Gly Thr Ser Leu Ser Pro Asn Leu Ser Gly Thr Ser Val Glu Ile
10070 10075 10080
Leu Ala Ala Ser Glu Val Thr Thr Asp Thr Glu Lys Ile His Pro
10085 10090 10095
Ser Ser Ser Met Ala Val Thr Asn Val Gly Thr Thr Ser Ser Gly
10100 10105 10110
His Glu Leu Tyr Ser Ser Val Ser Ile His Ser Glu Pro Ser Lys
10115 10120 10125
Ala Thr Tyr Pro Val Gly Thr Pro Ser Ser Met Ala Glu Thr Ser
10130 10135 10140
Ile Ser Thr Ser Met Pro Ala Asn Phe Glu Thr Thr Gly Phe Glu
10145 10150 10155
Ala Glu Pro Phe Ser His Leu Thr Ser Gly Phe Arg Lys Thr Asn
10160 10165 10170
Met Ser Leu Asp Thr Ser Ser Val Thr Pro Thr Asn Thr Pro Ser
10175 10180 10185
Ser Pro Gly Ser Thr His Leu Leu Gln Ser Ser Lys Thr Asp Phe
10190 10195 10200
Thr Ser Ser Ala Lys Thr Ser Ser Pro Asp Trp Pro Pro Ala Ser
10205 10210 10215
Gln Tyr Thr Glu Ile Pro Val Asp Ile Ile Thr Pro Phe Asn Ala
10220 10225 10230
Ser Pro Ser Ile Thr Glu Ser Thr Gly Ile Thr Ser Phe Pro Glu
10235 10240 10245
Ser Arg Phe Thr Met Ser Val Thr Glu Ser Thr His His Leu Ser
10250 10255 10260
Thr Asp Leu Leu Pro Ser Ala Glu Thr Ile Ser Thr Gly Thr Val
10265 10270 10275
Met Pro Ser Leu Ser Glu Ala Met Thr Ser Phe Ala Thr Thr Gly
10280 10285 10290
Val Pro Arg Ala Ile Ser Gly Ser Gly Ser Pro Phe Ser Arg Thr
10295 10300 10305
Glu Ser Gly Pro Gly Asp Ala Thr Leu Ser Thr Ile Ala Glu Ser
10310 10315 10320
Leu Pro Ser Ser Thr Pro Val Pro Phe Ser Ser Ser Thr Phe Thr
10325 10330 10335
Thr Thr Asp Ser Ser Thr Ile Pro Ala Leu His Glu Ile Thr Ser
10340 10345 10350
Ser Ser Ala Thr Pro Tyr Arg Val Asp Thr Ser Leu Gly Thr Glu
10355 10360 10365
Ser Ser Thr Thr Glu Gly Arg Leu Val Met Val Ser Thr Leu Asp
10370 10375 10380
Thr Ser Ser Gln Pro Gly Arg Thr Ser Ser Ser Pro Ile Leu Asp
10385 10390 10395
Thr Arg Met Thr Glu Ser Val Glu Leu Gly Thr Val Thr Ser Ala
10400 10405 10410
Tyr Gln Val Pro Ser Leu Ser Thr Arg Leu Thr Arg Thr Asp Gly
10415 10420 10425
Ile Met Glu His Ile Thr Lys Ile Pro Asn Glu Ala Ala His Arg
10430 10435 10440
Gly Thr Ile Arg Pro Val Lys Gly Pro Gln Thr Ser Thr Ser Pro
10445 10450 10455
Ala Ser Pro Lys Gly Leu His Thr Gly Gly Thr Lys Arg Met Glu
10460 10465 10470
Thr Thr Thr Thr Ala Leu Lys Thr Thr Thr Thr Ala Leu Lys Thr
10475 10480 10485
Thr Ser Arg Ala Thr Leu Thr Thr Ser Val Tyr Thr Pro Thr Leu
10490 10495 10500
Gly Thr Leu Thr Pro Leu Asn Ala Ser Met Gln Met Ala Ser Thr
10505 10510 10515
Ile Pro Thr Glu Met Met Ile Thr Thr Pro Tyr Val Phe Pro Asp
10520 10525 10530
Val Pro Glu Thr Thr Ser Ser Leu Ala Thr Ser Leu Gly Ala Glu
10535 10540 10545
Thr Ser Thr Ala Leu Pro Arg Thr Thr Pro Ser Val Phe Asn Arg
10550 10555 10560
Glu Ser Glu Thr Thr Ala Ser Leu Val Ser Arg Ser Gly Ala Glu
10565 10570 10575
Arg Ser Pro Val Ile Gln Thr Leu Asp Val Ser Ser Ser Glu Pro
10580 10585 10590
Asp Thr Thr Ala Ser Trp Val Ile His Pro Ala Glu Thr Ile Pro
10595 10600 10605
Thr Val Ser Lys Thr Thr Pro Asn Phe Phe His Ser Glu Leu Asp
10610 10615 10620
Thr Val Ser Ser Thr Ala Thr Ser His Gly Ala Asp Val Ser Ser
10625 10630 10635
Ala Ile Pro Thr Asn Ile Ser Pro Ser Glu Leu Asp Ala Leu Thr
10640 10645 10650
Pro Leu Val Thr Ile Ser Gly Thr Asp Thr Ser Thr Thr Phe Pro
10655 10660 10665
Thr Leu Thr Lys Ser Pro His Glu Thr Glu Thr Arg Thr Thr Trp
10670 10675 10680
Leu Thr His Pro Ala Glu Thr Ser Ser Thr Ile Pro Arg Thr Ile
10685 10690 10695
Pro Asn Phe Ser His His Glu Ser Asp Ala Thr Pro Ser Ile Ala
10700 10705 10710
Thr Ser Pro Gly Ala Glu Thr Ser Ser Ala Ile Pro Ile Met Thr
10715 10720 10725
Val Ser Pro Gly Ala Glu Asp Leu Val Thr Ser Gln Val Thr Ser
10730 10735 10740
Ser Gly Thr Asp Arg Asn Met Thr Ile Pro Thr Leu Thr Leu Ser
10745 10750 10755
Pro Gly Glu Pro Lys Thr Ile Ala Ser Leu Val Thr His Pro Glu
10760 10765 10770
Ala Gln Thr Ser Ser Ala Ile Pro Thr Ser Thr Ile Ser Pro Ala
10775 10780 10785
Val Ser Arg Leu Val Thr Ser Met Val Thr Ser Leu Ala Ala Lys
10790 10795 10800
Thr Ser Thr Thr Asn Arg Ala Leu Thr Asn Ser Pro Gly Glu Pro
10805 10810 10815
Ala Thr Thr Val Ser Leu Val Thr His Pro Ala Gln Thr Ser Pro
10820 10825 10830
Thr Val Pro Trp Thr Thr Ser Ile Phe Phe His Ser Lys Ser Asp
10835 10840 10845
Thr Thr Pro Ser Met Thr Thr Ser His Gly Ala Glu Ser Ser Ser
10850 10855 10860
Ala Val Pro Thr Pro Thr Val Ser Thr Glu Val Pro Gly Val Val
10865 10870 10875
Thr Pro Leu Val Thr Ser Ser Arg Ala Val Ile Ser Thr Thr Ile
10880 10885 10890
Pro Ile Leu Thr Leu Ser Pro Gly Glu Pro Glu Thr Thr Pro Ser
10895 10900 10905
Met Ala Thr Ser His Gly Glu Glu Ala Ser Ser Ala Ile Pro Thr
10910 10915 10920
Pro Thr Val Ser Pro Gly Val Pro Gly Val Val Thr Ser Leu Val
10925 10930 10935
Thr Ser Ser Arg Ala Val Thr Ser Thr Thr Ile Pro Ile Leu Thr
10940 10945 10950
Phe Ser Leu Gly Glu Pro Glu Thr Thr Pro Ser Met Ala Thr Ser
10955 10960 10965
His Gly Thr Glu Ala Gly Ser Ala Val Pro Thr Val Leu Pro Glu
10970 10975 10980
Val Pro Gly Met Val Thr Ser Leu Val Ala Ser Ser Arg Ala Val
10985 10990 10995
Thr Ser Thr Thr Leu Pro Thr Leu Thr Leu Ser Pro Gly Glu Pro
11000 11005 11010
Glu Thr Thr Pro Ser Met Ala Thr Ser His Gly Ala Glu Ala Ser
11015 11020 11025
Ser Thr Val Pro Thr Val Ser Pro Glu Val Pro Gly Val Val Thr
11030 11035 11040
Ser Leu Val Thr Ser Ser Ser Gly Val Asn Ser Thr Ser Ile Pro
11045 11050 11055
Thr Leu Ile Leu Ser Pro Gly Glu Leu Glu Thr Thr Pro Ser Met
11060 11065 11070
Ala Thr Ser His Gly Ala Glu Ala Ser Ser Ala Val Pro Thr Pro
11075 11080 11085
Thr Val Ser Pro Gly Val Ser Gly Val Val Thr Pro Leu Val Thr
11090 11095 11100
Ser Ser Arg Ala Val Thr Ser Thr Thr Ile Pro Ile Leu Thr Leu
11105 11110 11115
Ser Ser Ser Glu Pro Glu Thr Thr Pro Ser Met Ala Thr Ser His
11120 11125 11130
Gly Val Glu Ala Ser Ser Ala Val Leu Thr Val Ser Pro Glu Val
11135 11140 11145
Pro Gly Met Val Thr Ser Leu Val Thr Ser Ser Arg Ala Val Thr
11150 11155 11160
Ser Thr Thr Ile Pro Thr Leu Thr Ile Ser Ser Asp Glu Pro Glu
11165 11170 11175
Thr Thr Thr Ser Leu Val Thr His Ser Glu Ala Lys Met Ile Ser
11180 11185 11190
Ala Ile Pro Thr Leu Ala Val Ser Pro Thr Val Gln Gly Leu Val
11195 11200 11205
Thr Ser Leu Val Thr Ser Ser Gly Ser Glu Thr Ser Ala Phe Ser
11210 11215 11220
Asn Leu Thr Val Ala Ser Ser Gln Pro Glu Thr Ile Asp Ser Trp
11225 11230 11235
Val Ala His Pro Gly Thr Glu Ala Ser Ser Val Val Pro Thr Leu
11240 11245 11250
Thr Val Ser Thr Gly Glu Pro Phe Thr Asn Ile Ser Leu Val Thr
11255 11260 11265
His Pro Ala Glu Ser Ser Ser Thr Leu Pro Arg Thr Thr Ser Arg
11270 11275 11280
Phe Ser His Ser Glu Leu Asp Thr Met Pro Ser Thr Val Thr Ser
11285 11290 11295
Pro Glu Ala Glu Ser Ser Ser Ala Ile Ser Thr Thr Ile Ser Pro
11300 11305 11310
Gly Ile Pro Gly Val Leu Thr Ser Leu Val Thr Ser Ser Gly Arg
11315 11320 11325
Asp Ile Ser Ala Thr Phe Pro Thr Val Pro Glu Ser Pro His Glu
11330 11335 11340
Ser Glu Ala Thr Ala Ser Trp Val Thr His Pro Ala Val Thr Ser
11345 11350 11355
Thr Thr Val Pro Arg Thr Thr Pro Asn Tyr Ser His Ser Glu Pro
11360 11365 11370
Asp Thr Thr Pro Ser Ile Ala Thr Ser Pro Gly Ala Glu Ala Thr
11375 11380 11385
Ser Asp Phe Pro Thr Ile Thr Val Ser Pro Asp Val Pro Asp Met
11390 11395 11400
Val Thr Ser Gln Val Thr Ser Ser Gly Thr Asp Thr Ser Ile Thr
11405 11410 11415
Ile Pro Thr Leu Thr Leu Ser Ser Gly Glu Pro Glu Thr Thr Thr
11420 11425 11430
Ser Phe Ile Thr Tyr Ser Glu Thr His Thr Ser Ser Ala Ile Pro
11435 11440 11445
Thr Leu Pro Val Ser Pro Gly Ala Ser Lys Met Leu Thr Ser Leu
11450 11455 11460
Val Ile Ser Ser Gly Thr Asp Ser Thr Thr Thr Phe Pro Thr Leu
11465 11470 11475
Thr Glu Thr Pro Tyr Glu Pro Glu Thr Thr Ala Ile Gln Leu Ile
11480 11485 11490
His Pro Ala Glu Thr Asn Thr Met Val Pro Arg Thr Thr Pro Lys
11495 11500 11505
Phe Ser His Ser Lys Ser Asp Thr Thr Leu Pro Val Ala Ile Thr
11510 11515 11520
Ser Pro Gly Pro Glu Ala Ser Ser Ala Val Ser Thr Thr Thr Ile
11525 11530 11535
Ser Pro Asp Met Ser Asp Leu Val Thr Ser Leu Val Pro Ser Ser
11540 11545 11550
Gly Thr Asp Thr Ser Thr Thr Phe Pro Thr Leu Ser Glu Thr Pro
11555 11560 11565
Tyr Glu Pro Glu Thr Thr Ala Thr Trp Leu Thr His Pro Ala Glu
11570 11575 11580
Thr Ser Thr Thr Val Ser Gly Thr Ile Pro Asn Phe Ser His Arg
11585 11590 11595
Gly Ser Asp Thr Ala Pro Ser Met Val Thr Ser Pro Gly Val Asp
11600 11605 11610
Thr Arg Ser Gly Val Pro Thr Thr Thr Ile Pro Pro Ser Ile Pro
11615 11620 11625
Gly Val Val Thr Ser Gln Val Thr Ser Ser Ala Thr Asp Thr Ser
11630 11635 11640
Thr Ala Ile Pro Thr Leu Thr Pro Ser Pro Gly Glu Pro Glu Thr
11645 11650 11655
Thr Ala Ser Ser Ala Thr His Pro Gly Thr Gln Thr Gly Phe Thr
11660 11665 11670
Val Pro Ile Arg Thr Val Pro Ser Ser Glu Pro Asp Thr Met Ala
11675 11680 11685
Ser Trp Val Thr His Pro Pro Gln Thr Ser Thr Pro Val Ser Arg
11690 11695 11700
Thr Thr Ser Ser Phe Ser His Ser Ser Pro Asp Ala Thr Pro Val
11705 11710 11715
Met Ala Thr Ser Pro Arg Thr Glu Ala Ser Ser Ala Val Leu Thr
11720 11725 11730
Thr Ile Ser Pro Gly Ala Pro Glu Met Val Thr Ser Gln Ile Thr
11735 11740 11745
Ser Ser Gly Ala Ala Thr Ser Thr Thr Val Pro Thr Leu Thr His
11750 11755 11760
Ser Pro Gly Met Pro Glu Thr Thr Ala Leu Leu Ser Thr His Pro
11765 11770 11775
Arg Thr Glu Thr Ser Lys Thr Phe Pro Ala Ser Thr Val Phe Pro
11780 11785 11790
Gln Val Ser Glu Thr Thr Ala Ser Leu Thr Ile Arg Pro Gly Ala
11795 11800 11805
Glu Thr Ser Thr Ala Leu Pro Thr Gln Thr Thr Ser Ser Leu Phe
11810 11815 11820
Thr Leu Leu Val Thr Gly Thr Ser Arg Val Asp Leu Ser Pro Thr
11825 11830 11835
Ala Ser Pro Gly Val Ser Ala Lys Thr Ala Pro Leu Ser Thr His
11840 11845 11850
Pro Gly Thr Glu Thr Ser Thr Met Ile Pro Thr Ser Thr Leu Ser
11855 11860 11865
Leu Gly Leu Leu Glu Thr Thr Gly Leu Leu Ala Thr Ser Ser Ser
11870 11875 11880
Ala Glu Thr Ser Thr Ser Thr Leu Thr Leu Thr Val Ser Pro Ala
11885 11890 11895
Val Ser Gly Leu Ser Ser Ala Ser Ile Thr Thr Asp Lys Pro Gln
11900 11905 11910
Thr Val Thr Ser Trp Asn Thr Glu Thr Ser Pro Ser Val Thr Ser
11915 11920 11925
Val Gly Pro Pro Glu Phe Ser Arg Thr Val Thr Gly Thr Thr Met
11930 11935 11940
Thr Leu Ile Pro Ser Glu Met Pro Thr Pro Pro Lys Thr Ser His
11945 11950 11955
Gly Glu Gly Val Ser Pro Thr Thr Ile Leu Arg Thr Thr Met Val
11960 11965 11970
Glu Ala Thr Asn Leu Ala Thr Thr Gly Ser Ser Pro Thr Val Ala
11975 11980 11985
Lys Thr Thr Thr Thr Phe Asn Thr Leu Ala Gly Ser Leu Phe Thr
11990 11995 12000
Pro Leu Thr Thr Pro Gly Met Ser Thr Leu Ala Ser Glu Ser Val
12005 12010 12015
Thr Ser Arg Thr Ser Tyr Asn His Arg Ser Trp Ile Ser Thr Thr
12020 12025 12030
Ser Ser Tyr Asn Arg Arg Tyr Trp Thr Pro Ala Thr Ser Thr Pro
12035 12040 12045
Val Thr Ser Thr Phe Ser Pro Gly Ile Ser Thr Ser Ser Ile Pro
12050 12055 12060
Ser Ser Thr Ala Ala Thr Val Pro Phe Met Val Pro Phe Thr Leu
12065 12070 12075
Asn Phe Thr Ile Thr Asn Leu Gln Tyr Glu Glu Asp Met Arg His
12080 12085 12090
Pro Gly Ser Arg Lys Phe Asn Ala Thr Glu Arg Glu Leu Gln Gly
12095 12100 12105
Leu Leu Lys Pro Leu Phe Arg Asn Ser Ser Leu Glu Tyr Leu Tyr
12110 12115 12120
Ser Gly Cys Arg Leu Ala Ser Leu Arg Pro Glu Lys Asp Ser Ser
12125 12130 12135
Ala Thr Ala Val Asp Ala Ile Cys Thr His Arg Pro Asp Pro Glu
12140 12145 12150
Asp Leu Gly Leu Asp Arg Glu Arg Leu Tyr Trp Glu Leu Ser Asn
12155 12160 12165
Leu Thr Asn Gly Ile Gln Glu Leu Gly Pro Tyr Thr Leu Asp Arg
12170 12175 12180
Asn Ser Leu Tyr Val Asn Gly Phe Thr His Arg Ser Ser Met Pro
12185 12190 12195
Thr Thr Ser Thr Pro Gly Thr Ser Thr Val Asp Val Gly Thr Ser
12200 12205 12210
Gly Thr Pro Ser Ser Ser Pro Ser Pro Thr Thr Ala Gly Pro Leu
12215 12220 12225
Leu Met Pro Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Gln Tyr
12230 12235 12240
Glu Glu Asp Met Arg Arg Thr Gly Ser Arg Lys Phe Asn Thr Met
12245 12250 12255
Glu Ser Val Leu Gln Gly Leu Leu Lys Pro Leu Phe Lys Asn Thr
12260 12265 12270
Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg
12275 12280 12285
Pro Glu Lys Asp Gly Ala Ala Thr Gly Val Asp Ala Ile Cys Thr
12290 12295 12300
His Arg Leu Asp Pro Lys Ser Pro Gly Leu Asn Arg Glu Gln Leu
12305 12310 12315
Tyr Trp Glu Leu Ser Lys Leu Thr Asn Asp Ile Glu Glu Leu Gly
12320 12325 12330
Pro Tyr Thr Leu Asp Arg Asn Ser Leu Tyr Val Asn Gly Phe Thr
12335 12340 12345
His Gln Ser Ser Val Ser Thr Thr Ser Thr Pro Gly Thr Ser Thr
12350 12355 12360
Val Asp Leu Arg Thr Ser Gly Thr Pro Ser Ser Leu Ser Ser Pro
12365 12370 12375
Thr Ile Met Ala Ala Gly Pro Leu Leu Val Pro Phe Thr Leu Asn
12380 12385 12390
Phe Thr Ile Thr Asn Leu Gln Tyr Gly Glu Asp Met Gly His Pro
12395 12400 12405
Gly Ser Arg Lys Phe Asn Thr Thr Glu Arg Val Leu Gln Gly Leu
12410 12415 12420
Leu Gly Pro Ile Phe Lys Asn Thr Ser Val Gly Pro Leu Tyr Ser
12425 12430 12435
Gly Cys Arg Leu Thr Ser Leu Arg Ser Glu Lys Asp Gly Ala Ala
12440 12445 12450
Thr Gly Val Asp Ala Ile Cys Ile His His Leu Asp Pro Lys Ser
12455 12460 12465
Pro Gly Leu Asn Arg Glu Arg Leu Tyr Trp Glu Leu Ser Gln Leu
12470 12475 12480
Thr Asn Gly Ile Lys Glu Leu Gly Pro Tyr Thr Leu Asp Arg Asn
12485 12490 12495
Ser Leu Tyr Val Asn Gly Phe Thr His Arg Thr Ser Val Pro Thr
12500 12505 12510
Ser Ser Thr Pro Gly Thr Ser Thr Val Asp Leu Gly Thr Ser Gly
12515 12520 12525
Thr Pro Phe Ser Leu Pro Ser Pro Ala Thr Ala Gly Pro Leu Leu
12530 12535 12540
Val Leu Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Lys Tyr Glu
12545 12550 12555
Glu Asp Met His Arg Pro Gly Ser Arg Lys Phe Asn Thr Thr Glu
12560 12565 12570
Arg Val Leu Gln Thr Leu Leu Gly Pro Met Phe Lys Asn Thr Ser
12575 12580 12585
Val Gly Leu Leu Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg Ser
12590 12595 12600
Glu Lys Asp Gly Ala Ala Thr Gly Val Asp Ala Ile Cys Thr His
12605 12610 12615
Arg Leu Asp Pro Lys Ser Pro Gly Val Asp Arg Glu Gln Leu Tyr
12620 12625 12630
Trp Glu Leu Ser Gln Leu Thr Asn Gly Ile Lys Glu Leu Gly Pro
12635 12640 12645
Tyr Thr Leu Asp Arg Asn Ser Leu Tyr Val Asn Gly Phe Thr His
12650 12655 12660
Trp Ile Pro Val Pro Thr Ser Ser Thr Pro Gly Thr Ser Thr Val
12665 12670 12675
Asp Leu Gly Ser Gly Thr Pro Ser Ser Leu Pro Ser Pro Thr Thr
12680 12685 12690
Ala Gly Pro Leu Leu Val Pro Phe Thr Leu Asn Phe Thr Ile Thr
12695 12700 12705
Asn Leu Lys Tyr Glu Glu Asp Met His Cys Pro Gly Ser Arg Lys
12710 12715 12720
Phe Asn Thr Thr Glu Arg Val Leu Gln Ser Leu Leu Gly Pro Met
12725 12730 12735
Phe Lys Asn Thr Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu
12740 12745 12750
Thr Leu Leu Arg Ser Glu Lys Asp Gly Ala Ala Thr Gly Val Asp
12755 12760 12765
Ala Ile Cys Thr His Arg Leu Asp Pro Lys Ser Pro Gly Val Asp
12770 12775 12780
Arg Glu Gln Leu Tyr Trp Glu Leu Ser Gln Leu Thr Asn Gly Ile
12785 12790 12795
Lys Glu Leu Gly Pro Tyr Thr Leu Asp Arg Asn Ser Leu Tyr Val
12800 12805 12810
Asn Gly Phe Thr His Gln Thr Ser Ala Pro Asn Thr Ser Thr Pro
12815 12820 12825
Gly Thr Ser Thr Val Asp Leu Gly Thr Ser Gly Thr Pro Ser Ser
12830 12835 12840
Leu Pro Ser Pro Thr Ser Ala Gly Pro Leu Leu Val Pro Phe Thr
12845 12850 12855
Leu Asn Phe Thr Ile Thr Asn Leu Gln Tyr Glu Glu Asp Met His
12860 12865 12870
His Pro Gly Ser Arg Lys Phe Asn Thr Thr Glu Arg Val Leu Gln
12875 12880 12885
Gly Leu Leu Gly Pro Met Phe Lys Asn Thr Ser Val Gly Leu Leu
12890 12895 12900
Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg Pro Glu Lys Asn Gly
12905 12910 12915
Ala Ala Thr Gly Met Asp Ala Ile Cys Ser His Arg Leu Asp Pro
12920 12925 12930
Lys Ser Pro Gly Leu Asn Arg Glu Gln Leu Tyr Trp Glu Leu Ser
12935 12940 12945
Gln Leu Thr His Gly Ile Lys Glu Leu Gly Pro Tyr Thr Leu Asp
12950 12955 12960
Arg Asn Ser Leu Tyr Val Asn Gly Phe Thr His Arg Ser Ser Val
12965 12970 12975
Ala Pro Thr Ser Thr Pro Gly Thr Ser Thr Val Asp Leu Gly Thr
12980 12985 12990
Ser Gly Thr Pro Ser Ser Leu Pro Ser Pro Thr Thr Ala Val Pro
12995 13000 13005
Leu Leu Val Pro Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Gln
13010 13015 13020
Tyr Gly Glu Asp Met Arg His Pro Gly Ser Arg Lys Phe Asn Thr
13025 13030 13035
Thr Glu Arg Val Leu Gln Gly Leu Leu Gly Pro Leu Phe Lys Asn
13040 13045 13050
Ser Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu Ile Ser Leu
13055 13060 13065
Arg Ser Glu Lys Asp Gly Ala Ala Thr Gly Val Asp Ala Ile Cys
13070 13075 13080
Thr His His Leu Asn Pro Gln Ser Pro Gly Leu Asp Arg Glu Gln
13085 13090 13095
Leu Tyr Trp Gln Leu Ser Gln Met Thr Asn Gly Ile Lys Glu Leu
13100 13105 13110
Gly Pro Tyr Thr Leu Asp Arg Asn Ser Leu Tyr Val Asn Gly Phe
13115 13120 13125
Thr His Arg Ser Ser Gly Leu Thr Thr Ser Thr Pro Trp Thr Ser
13130 13135 13140
Thr Val Asp Leu Gly Thr Ser Gly Thr Pro Ser Pro Val Pro Ser
13145 13150 13155
Pro Thr Thr Thr Gly Pro Leu Leu Val Pro Phe Thr Leu Asn Phe
13160 13165 13170
Thr Ile Thr Asn Leu Gln Tyr Glu Glu Asn Met Gly His Pro Gly
13175 13180 13185
Ser Arg Lys Phe Asn Ile Thr Glu Ser Val Leu Gln Gly Leu Leu
13190 13195 13200
Lys Pro Leu Phe Lys Ser Thr Ser Val Gly Pro Leu Tyr Ser Gly
13205 13210 13215
Cys Arg Leu Thr Leu Leu Arg Pro Glu Lys Asp Gly Val Ala Thr
13220 13225 13230
Arg Val Asp Ala Ile Cys Thr His Arg Pro Asp Pro Lys Ile Pro
13235 13240 13245
Gly Leu Asp Arg Gln Gln Leu Tyr Trp Glu Leu Ser Gln Leu Thr
13250 13255 13260
His Ser Ile Thr Glu Leu Gly Pro Tyr Thr Leu Asp Arg Asp Ser
13265 13270 13275
Leu Tyr Val Asn Gly Phe Thr Gln Arg Ser Ser Val Pro Thr Thr
13280 13285 13290
Ser Thr Pro Gly Thr Phe Thr Val Gln Pro Glu Thr Ser Glu Thr
13295 13300 13305
Pro Ser Ser Leu Pro Gly Pro Thr Ala Thr Gly Pro Val Leu Leu
13310 13315 13320
Pro Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Gln Tyr Glu Glu
13325 13330 13335
Asp Met Arg Arg Pro Gly Ser Arg Lys Phe Asn Thr Thr Glu Arg
13340 13345 13350
Val Leu Gln Gly Leu Leu Met Pro Leu Phe Lys Asn Thr Ser Val
13355 13360 13365
Ser Ser Leu Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg Pro Glu
13370 13375 13380
Lys Asp Gly Ala Ala Thr Arg Val Asp Ala Val Cys Thr His Arg
13385 13390 13395
Pro Asp Pro Lys Ser Pro Gly Leu Asp Arg Glu Arg Leu Tyr Trp
13400 13405 13410
Lys Leu Ser Gln Leu Thr His Gly Ile Thr Glu Leu Gly Pro Tyr
13415 13420 13425
Thr Leu Asp Arg His Ser Leu Tyr Val Asn Gly Phe Thr His Gln
13430 13435 13440
Ser Ser Met Thr Thr Thr Arg Thr Pro Asp Thr Ser Thr Met His
13445 13450 13455
Leu Ala Thr Ser Arg Thr Pro Ala Ser Leu Ser Gly Pro Met Thr
13460 13465 13470
Ala Ser Pro Leu Leu Val Leu Phe Thr Ile Asn Phe Thr Ile Thr
13475 13480 13485
Asn Leu Arg Tyr Glu Glu Asn Met His His Pro Gly Ser Arg Lys
13490 13495 13500
Phe Asn Thr Thr Glu Arg Val Leu Gln Gly Leu Leu Arg Pro Val
13505 13510 13515
Phe Lys Asn Thr Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu
13520 13525 13530
Thr Leu Leu Arg Pro Lys Lys Asp Gly Ala Ala Thr Lys Val Asp
13535 13540 13545
Ala Ile Cys Thr Tyr Arg Pro Asp Pro Lys Ser Pro Gly Leu Asp
13550 13555 13560
Arg Glu Gln Leu Tyr Trp Glu Leu Ser Gln Leu Thr His Ser Ile
13565 13570 13575
Thr Glu Leu Gly Pro Tyr Thr Leu Asp Arg Asp Ser Leu Tyr Val
13580 13585 13590
Asn Gly Phe Thr Gln Arg Ser Ser Val Pro Thr Thr Ser Ile Pro
13595 13600 13605
Gly Thr Pro Thr Val Asp Leu Gly Thr Ser Gly Thr Pro Val Ser
13610 13615 13620
Lys Pro Gly Pro Ser Ala Ala Ser Pro Leu Leu Val Leu Phe Thr
13625 13630 13635
Leu Asn Phe Thr Ile Thr Asn Leu Arg Tyr Glu Glu Asn Met Gln
13640 13645 13650
His Pro Gly Ser Arg Lys Phe Asn Thr Thr Glu Arg Val Leu Gln
13655 13660 13665
Gly Leu Leu Arg Ser Leu Phe Lys Ser Thr Ser Val Gly Pro Leu
13670 13675 13680
Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg Pro Glu Lys Asp Gly
13685 13690 13695
Thr Ala Thr Gly Val Asp Ala Ile Cys Thr His His Pro Asp Pro
13700 13705 13710
Lys Ser Pro Arg Leu Asp Arg Glu Gln Leu Tyr Trp Glu Leu Ser
13715 13720 13725
Gln Leu Thr His Asn Ile Thr Glu Leu Gly Pro Tyr Ala Leu Asp
13730 13735 13740
Asn Asp Ser Leu Phe Val Asn Gly Phe Thr His Arg Ser Ser Val
13745 13750 13755
Ser Thr Thr Ser Thr Pro Gly Thr Pro Thr Val Tyr Leu Gly Ala
13760 13765 13770
Ser Lys Thr Pro Ala Ser Ile Phe Gly Pro Ser Ala Ala Ser His
13775 13780 13785
Leu Leu Ile Leu Phe Thr Leu Asn Phe Thr Ile Thr Asn Leu Arg
13790 13795 13800
Tyr Glu Glu Asn Met Trp Pro Gly Ser Arg Lys Phe Asn Thr Thr
13805 13810 13815
Glu Arg Val Leu Gln Gly Leu Leu Arg Pro Leu Phe Lys Asn Thr
13820 13825 13830
Ser Val Gly Pro Leu Tyr Ser Gly Cys Arg Leu Thr Leu Leu Arg
13835 13840 13845
Pro Glu Lys Asp Gly Glu Ala Thr Gly Val Asp Ala Ile Cys Thr
13850 13855 13860
His Arg Pro Asp Pro Thr Gly Pro Gly Leu Asp Arg Glu Gln Leu
13865 13870 13875
Tyr Leu Glu Leu Ser Gln Leu Thr His Ser Ile Thr Glu Leu Gly
13880 13885 13890
Pro Tyr Thr Leu Asp Arg Asp Ser Leu Tyr Val Asn Gly Phe Thr
13895 13900 13905
His Arg Ser Ser Val Pro Thr Thr Ser Thr Gly Val Val Ser Glu
13910 13915 13920
Glu Pro Phe Thr Leu Asn Phe Thr Ile Asn Asn Leu Arg Tyr Met
13925 13930 13935
Ala Asp Met Gly Gln Pro Gly Ser Leu Lys Phe Asn Ile Thr Asp
13940 13945 13950
Asn Val Met Gln His Leu Leu Ser Pro Leu Phe Gln Arg Ser Ser
13955 13960 13965
Leu Gly Ala Arg Tyr Thr Gly Cys Arg Val Ile Ala Leu Arg Ser
13970 13975 13980
Val Lys Asn Gly Ala Glu Thr Arg Val Asp Leu Leu Cys Thr Tyr
13985 13990 13995
Leu Gln Pro Leu Ser Gly Pro Gly Leu Pro Ile Lys Gln Val Phe
14000 14005 14010
His Glu Leu Ser Gln Gln Thr His Gly Ile Thr Arg Leu Gly Pro
14015 14020 14025
Tyr Ser Leu Asp Lys Asp Ser Leu Tyr Leu Asn Gly Tyr Asn Glu
14030 14035 14040
Pro Gly Pro Asp Glu Pro Pro Thr Thr Pro Lys Pro Ala Thr Thr
14045 14050 14055
Phe Leu Pro Pro Leu Ser Glu Ala Thr Thr Ala Met Gly Tyr His
14060 14065 14070
Leu Lys Thr Leu Thr Leu Asn Phe Thr Ile Ser Asn Leu Gln Tyr
14075 14080 14085
Ser Pro Asp Met Gly Lys Gly Ser Ala Thr Phe Asn Ser Thr Glu
14090 14095 14100
Gly Val Leu Gln His Leu Leu Arg Pro Leu Phe Gln Lys Ser Ser
14105 14110 14115
Met Gly Pro Phe Tyr Leu Gly Cys Gln Leu Ile Ser Leu Arg Pro
14120 14125 14130
Glu Lys Asp Gly Ala Ala Thr Gly Val Asp Thr Thr Cys Thr Tyr
14135 14140 14145
His Pro Asp Pro Val Gly Pro Gly Leu Asp Ile Gln Gln Leu Tyr
14150 14155 14160
Trp Glu Leu Ser Gln Leu Thr His Gly Val Thr Gln Leu Gly Phe
14165 14170 14175
Tyr Val Leu Asp Arg Asp Ser Leu Phe Ile Asn Gly Tyr Ala Pro
14180 14185 14190
Gln Asn Leu Ser Ile Arg Gly Glu Tyr Gln Ile Asn Phe His Ile
14195 14200 14205
Val Asn Trp Asn Leu Ser Asn Pro Asp Pro Thr Ser Ser Glu Tyr
14210 14215 14220
Ile Thr Leu Leu Arg Asp Ile Gln Asp Lys Val Thr Thr Leu Tyr
14225 14230 14235
Lys Gly Ser Gln Leu His Asp Thr Phe Arg Phe Cys Leu Val Thr
14240 14245 14250
Asn Leu Thr Met Asp Ser Val Leu Val Thr Val Lys Ala Leu Phe
14255 14260 14265
Ser Ser Asn Leu Asp Pro Ser Leu Val Glu Gln Val Phe Leu Asp
14270 14275 14280
Lys Thr Leu Asn Ala Ser Phe His Trp Leu Gly Ser Thr Tyr Gln
14285 14290 14295
Leu Val Asp Ile His Val Thr Glu Met Glu Ser Ser Val Tyr Gln
14300 14305 14310
Pro Thr Ser Ser Ser Ser Thr Gln His Phe Tyr Leu Asn Phe Thr
14315 14320 14325
Ile Thr Asn Leu Pro Tyr Ser Gln Asp Lys Ala Gln Pro Gly Thr
14330 14335 14340
Thr Asn Tyr Gln Arg Asn Lys Arg Asn Ile Glu Asp Ala Leu Asn
14345 14350 14355
Gln Leu Phe Arg Asn Ser Ser Ile Lys Ser Tyr Phe Ser Asp Cys
14360 14365 14370
Gln Val Ser Thr Phe Arg Ser Val Pro Asn Arg His His Thr Gly
14375 14380 14385
Val Asp Ser Leu Cys Asn Phe Ser Pro Leu Ala Arg Arg Val Asp
14390 14395 14400
Arg Val Ala Ile Tyr Glu Glu Phe Leu Arg Met Thr Arg Asn Gly
14405 14410 14415
Thr Gln Leu Gln Asn Phe Thr Leu Asp Arg Ser Ser Val Leu Val
14420 14425 14430
Asp Gly Tyr Ser Pro Asn Arg Asn Glu Pro Leu Thr Gly Asn Ser
14435 14440 14445
Asp Leu Pro Phe Trp Ala Val Ile Leu Ile Gly Leu Ala Gly Leu
14450 14455 14460
Leu Gly Val Ile Thr Cys Leu Ile Cys Gly Val Leu Val Thr Thr
14465 14470 14475
Arg Arg Arg Lys Lys Glu Gly Glu Tyr Asn Val Gln Gln Gln Cys
14480 14485 14490
Pro Gly Tyr Tyr Gln Ser His Leu Asp Leu Glu Asp Leu Gln
14495 14500 14505
<210> 149
<211> 690
<212> Белок
<213> Homo sapiens
<400> 149
Met Ala Pro Trp Pro Glu Leu Gly Asp Ala Gln Pro Asn Pro Asp Lys
1 5 10 15
Tyr Leu Glu Gly Ala Ala Gly Gln Gln Pro Thr Ala Pro Asp Lys Ser
20 25 30
Lys Glu Thr Asn Lys Thr Asp Asn Thr Glu Ala Pro Val Thr Lys Ile
35 40 45
Glu Leu Leu Pro Ser Tyr Ser Thr Ala Thr Leu Ile Asp Glu Pro Thr
50 55 60
Glu Val Asp Asp Pro Trp Asn Leu Pro Thr Leu Gln Asp Ser Gly Ile
65 70 75 80
Lys Trp Ser Glu Arg Asp Thr Lys Gly Lys Ile Leu Cys Phe Phe Gln
85 90 95
Gly Ile Gly Arg Leu Ile Leu Leu Leu Gly Phe Leu Tyr Phe Phe Val
100 105 110
Cys Ser Leu Asp Ile Leu Ser Ser Ala Phe Gln Leu Val Gly Gly Lys
115 120 125
Met Ala Gly Gln Phe Phe Ser Asn Ser Ser Ile Met Ser Asn Pro Leu
130 135 140
Leu Gly Leu Val Ile Gly Val Leu Val Thr Val Leu Val Gln Ser Ser
145 150 155 160
Ser Thr Ser Thr Ser Ile Val Val Ser Met Val Ser Ser Ser Leu Leu
165 170 175
Thr Val Arg Ala Ala Ile Pro Ile Ile Met Gly Ala Asn Ile Gly Thr
180 185 190
Ser Ile Thr Asn Thr Ile Val Ala Leu Met Gln Val Gly Asp Arg Ser
195 200 205
Glu Phe Arg Arg Ala Phe Ala Gly Ala Thr Val His Asp Phe Phe Asn
210 215 220
Trp Leu Ser Val Leu Val Leu Leu Pro Val Glu Val Ala Thr His Tyr
225 230 235 240
Leu Glu Ile Ile Thr Gln Leu Ile Val Glu Ser Phe His Phe Lys Asn
245 250 255
Gly Glu Asp Ala Pro Asp Leu Leu Lys Val Ile Thr Lys Pro Phe Thr
260 265 270
Lys Leu Ile Val Gln Leu Asp Lys Lys Val Ile Ser Gln Ile Ala Met
275 280 285
Asn Asp Glu Lys Ala Lys Asn Lys Ser Leu Val Lys Ile Trp Cys Lys
290 295 300
Thr Phe Thr Asn Lys Thr Gln Ile Asn Val Thr Val Pro Ser Thr Ala
305 310 315 320
Asn Cys Thr Ser Pro Ser Leu Cys Trp Thr Asp Gly Ile Gln Asn Trp
325 330 335
Thr Met Lys Asn Val Thr Tyr Lys Glu Asn Ile Ala Lys Cys Gln His
340 345 350
Ile Phe Val Asn Phe His Leu Pro Asp Leu Ala Val Gly Thr Ile Leu
355 360 365
Leu Ile Leu Ser Leu Leu Val Leu Cys Gly Cys Leu Ile Met Ile Val
370 375 380
Lys Ile Leu Gly Ser Val Leu Lys Gly Gln Val Ala Thr Val Ile Lys
385 390 395 400
Lys Thr Ile Asn Thr Asp Phe Pro Phe Pro Phe Ala Trp Leu Thr Gly
405 410 415
Tyr Leu Ala Ile Leu Val Gly Ala Gly Met Thr Phe Ile Val Gln Ser
420 425 430
Ser Ser Val Phe Thr Ser Ala Leu Thr Pro Leu Ile Gly Ile Gly Val
435 440 445
Ile Thr Ile Glu Arg Ala Tyr Pro Leu Thr Leu Gly Ser Asn Ile Gly
450 455 460
Thr Thr Thr Thr Ala Ile Leu Ala Ala Leu Ala Ser Pro Gly Asn Ala
465 470 475 480
Leu Arg Ser Ser Leu Gln Ile Ala Leu Cys His Phe Phe Phe Asn Ile
485 490 495
Ser Gly Ile Leu Leu Trp Tyr Pro Ile Pro Phe Thr Arg Leu Pro Ile
500 505 510
Arg Met Ala Lys Gly Leu Gly Asn Ile Ser Ala Lys Tyr Arg Trp Phe
515 520 525
Ala Val Phe Tyr Leu Ile Ile Phe Phe Phe Leu Ile Pro Leu Thr Val
530 535 540
Phe Gly Leu Ser Leu Ala Gly Trp Arg Val Leu Val Gly Val Gly Val
545 550 555 560
Pro Val Val Phe Ile Ile Ile Leu Val Leu Cys Leu Arg Leu Leu Gln
565 570 575
Ser Arg Cys Pro Arg Val Leu Pro Lys Lys Leu Gln Asn Trp Asn Phe
580 585 590
Leu Pro Leu Trp Met Arg Ser Leu Lys Pro Trp Asp Ala Val Val Ser
595 600 605
Lys Phe Thr Gly Cys Phe Gln Met Arg Cys Cys Cys Cys Cys Arg Val
610 615 620
Cys Cys Arg Ala Cys Cys Leu Leu Cys Asp Cys Pro Lys Cys Cys Arg
625 630 635 640
Cys Ser Lys Cys Cys Glu Asp Leu Glu Glu Ala Gln Glu Gly Gln Asp
645 650 655
Val Pro Val Lys Ala Pro Glu Thr Phe Asp Asn Ile Thr Ile Ser Arg
660 665 670
Glu Ala Gln Gly Glu Val Pro Ala Ser Asp Ser Lys Thr Glu Cys Thr
675 680 685
Ala Leu
690
<210> 150
<211> 510
<212> Белок
<213> Homo sapiens
<400> 150
Met Pro Leu Ser Leu Gly Ala Glu Met Trp Gly Pro Glu Ala Trp Leu
1 5 10 15
Leu Leu Leu Leu Leu Leu Ala Ser Phe Thr Gly Arg Cys Pro Ala Gly
20 25 30
Glu Leu Glu Thr Ser Asp Val Val Thr Val Val Leu Gly Gln Asp Ala
35 40 45
Lys Leu Pro Cys Phe Tyr Arg Gly Asp Ser Gly Glu Gln Val Gly Gln
50 55 60
Val Ala Trp Ala Arg Val Asp Ala Gly Glu Gly Ala Gln Glu Leu Ala
65 70 75 80
Leu Leu His Ser Lys Tyr Gly Leu His Val Ser Pro Ala Tyr Glu Gly
85 90 95
Arg Val Glu Gln Pro Pro Pro Pro Arg Asn Pro Leu Asp Gly Ser Val
100 105 110
Leu Leu Arg Asn Ala Val Gln Ala Asp Glu Gly Glu Tyr Glu Cys Arg
115 120 125
Val Ser Thr Phe Pro Ala Gly Ser Phe Gln Ala Arg Leu Arg Leu Arg
130 135 140
Val Leu Val Pro Pro Leu Pro Ser Leu Asn Pro Gly Pro Ala Leu Glu
145 150 155 160
Glu Gly Gln Gly Leu Thr Leu Ala Ala Ser Cys Thr Ala Glu Gly Ser
165 170 175
Pro Ala Pro Ser Val Thr Trp Asp Thr Glu Val Lys Gly Thr Thr Ser
180 185 190
Ser Arg Ser Phe Lys His Ser Arg Ser Ala Ala Val Thr Ser Glu Phe
195 200 205
His Leu Val Pro Ser Arg Ser Met Asn Gly Gln Pro Leu Thr Cys Val
210 215 220
Val Ser His Pro Gly Leu Leu Gln Asp Gln Arg Ile Thr His Ile Leu
225 230 235 240
His Val Ser Phe Leu Ala Glu Ala Ser Val Arg Gly Leu Glu Asp Gln
245 250 255
Asn Leu Trp His Ile Gly Arg Glu Gly Ala Met Leu Lys Cys Leu Ser
260 265 270
Glu Gly Gln Pro Pro Pro Ser Tyr Asn Trp Thr Arg Leu Asp Gly Pro
275 280 285
Leu Pro Ser Gly Val Arg Val Asp Gly Asp Thr Leu Gly Phe Pro Pro
290 295 300
Leu Thr Thr Glu His Ser Gly Ile Tyr Val Cys His Val Ser Asn Glu
305 310 315 320
Phe Ser Ser Arg Asp Ser Gln Val Thr Val Asp Val Leu Asp Pro Gln
325 330 335
Glu Asp Ser Gly Lys Gln Val Asp Leu Val Ser Ala Ser Val Val Val
340 345 350
Val Gly Val Ile Ala Ala Leu Leu Phe Cys Leu Leu Val Val Val Val
355 360 365
Val Leu Met Ser Arg Tyr His Arg Arg Lys Ala Gln Gln Met Thr Gln
370 375 380
Lys Tyr Glu Glu Glu Leu Thr Leu Thr Arg Glu Asn Ser Ile Arg Arg
385 390 395 400
Leu His Ser His His Thr Asp Pro Arg Ser Gln Pro Glu Glu Ser Val
405 410 415
Gly Leu Arg Ala Glu Gly His Pro Asp Ser Leu Lys Asp Asn Ser Ser
420 425 430
Cys Ser Val Met Ser Glu Glu Pro Glu Gly Arg Ser Tyr Ser Thr Leu
435 440 445
Thr Thr Val Arg Glu Ile Glu Thr Gln Thr Glu Leu Leu Ser Pro Gly
450 455 460
Ser Gly Arg Ala Glu Glu Glu Glu Asp Gln Asp Glu Gly Ile Lys Gln
465 470 475 480
Ala Met Asn His Phe Val Gln Glu Asn Gly Thr Leu Arg Ala Lys Pro
485 490 495
Thr Gly Asn Gly Ile Tyr Ile Asn Gly Arg Gly His Leu Val
500 505 510
<210> 151
<211> 764
<212> Белок
<213> Homo sapiens
<400> 151
Leu Gly Ala Thr Gly His Asn Phe Thr Leu His Leu Arg Lys Asn Arg
1 5 10 15
Asp Leu Leu Gly Ser Gly Tyr Thr Glu Thr Tyr Thr Ala Ala Asn Gly
20 25 30
Ser Glu Val Thr Glu Gln Pro Arg Gly Gln Asp His Cys Phe Tyr Gln
35 40 45
Gly His Val Glu Gly Tyr Pro Asp Ser Ala Ala Ser Leu Ser Thr Cys
50 55 60
Ala Gly Leu Arg Gly Phe Phe Gln Val Gly Ser Asp Leu His Leu Ile
65 70 75 80
Glu Pro Leu Asp Glu Gly Gly Glu Gly Gly Arg His Ala Val Tyr Gln
85 90 95
Ala Glu His Leu Leu Gln Thr Ala Gly Thr Cys Gly Val Ser Asp Asp
100 105 110
Ser Leu Gly Ser Leu Leu Gly Pro Arg Thr Ala Ala Val Phe Arg Pro
115 120 125
Arg Pro Gly Asp Ser Leu Pro Ser Arg Glu Thr Arg Tyr Val Glu Leu
130 135 140
Tyr Val Val Val Asp Asn Ala Glu Phe Gln Met Leu Gly Ser Glu Ala
145 150 155 160
Ala Val Arg His Arg Val Leu Glu Val Val Asn His Val Asp Lys Leu
165 170 175
Tyr Gln Lys Leu Asn Phe Arg Val Val Leu Val Gly Leu Glu Ile Trp
180 185 190
Asn Ser Gln Asp Arg Phe His Val Ser Pro Asp Pro Ser Val Thr Leu
195 200 205
Glu Asn Leu Leu Thr Trp Gln Ala Arg Gln Arg Thr Arg Arg His Leu
210 215 220
His Asp Asn Val Gln Leu Ile Thr Gly Val Asp Phe Thr Gly Thr Thr
225 230 235 240
Val Gly Phe Ala Arg Val Ser Ala Met Cys Ser His Ser Ser Gly Ala
245 250 255
Val Asn Gln Asp His Ser Lys Asn Pro Val Gly Val Ala Cys Thr Met
260 265 270
Ala His Glu Met Gly His Asn Leu Gly Met Asp His Asp Glu Asn Val
275 280 285
Gln Gly Cys Arg Cys Gln Glu Arg Phe Glu Ala Gly Arg Cys Ile Met
290 295 300
Ala Gly Ser Ile Gly Ser Ser Phe Pro Arg Met Phe Ser Asp Cys Ser
305 310 315 320
Gln Ala Tyr Leu Glu Ser Phe Leu Glu Arg Pro Gln Ser Val Cys Leu
325 330 335
Ala Asn Ala Pro Asp Leu Ser His Leu Val Gly Gly Pro Val Cys Gly
340 345 350
Asn Leu Phe Val Glu Arg Gly Glu Gln Cys Asp Cys Gly Pro Pro Glu
355 360 365
Asp Cys Arg Asn Arg Cys Cys Asn Ser Thr Thr Cys Gln Leu Ala Glu
370 375 380
Gly Ala Gln Cys Ala His Gly Thr Cys Cys Gln Glu Cys Lys Val Lys
385 390 395 400
Pro Ala Gly Glu Leu Cys Arg Pro Lys Lys Asp Met Cys Asp Leu Glu
405 410 415
Glu Phe Cys Asp Gly Arg His Pro Glu Cys Pro Glu Asp Ala Phe Gln
420 425 430
Glu Asn Gly Thr Pro Cys Ser Gly Gly Tyr Cys Tyr Asn Gly Ala Cys
435 440 445
Pro Thr Leu Ala Gln Gln Cys Gln Ala Phe Trp Gly Pro Gly Gly Gln
450 455 460
Ala Ala Glu Glu Ser Cys Phe Ser Tyr Asp Ile Leu Pro Gly Cys Lys
465 470 475 480
Ala Ser Arg Tyr Arg Ala Asp Met Cys Gly Val Leu Gln Cys Lys Gly
485 490 495
Gly Gln Gln Pro Leu Gly Arg Ala Ile Cys Ile Val Asp Val Cys His
500 505 510
Ala Leu Thr Thr Glu Asp Gly Thr Ala Tyr Glu Pro Val Pro Glu Gly
515 520 525
Thr Arg Cys Gly Pro Glu Lys Val Cys Trp Lys Gly Arg Cys Gln Asp
530 535 540
Leu His Val Tyr Arg Ser Ser Asn Cys Ser Ala Gln Cys His Asn His
545 550 555 560
Gly Val Cys Asn His Lys Gln Glu Cys His Cys His Ala Gly Trp Ala
565 570 575
Pro Pro His Cys Ala Lys Leu Leu Thr Glu Val His Ala Ala Ser Gly
580 585 590
Ser Leu Pro Val Phe Val Val Val Val Leu Val Leu Leu Ala Val Val
595 600 605
Leu Val Thr Leu Ala Gly Ile Ile Val Tyr Arg Lys Ala Arg Ser Arg
610 615 620
Ile Leu Ser Arg Asn Val Ala Pro Lys Thr Thr Met Gly Arg Ser Asn
625 630 635 640
Pro Leu Phe His Gln Ala Ala Ser Arg Val Pro Ala Lys Gly Gly Ala
645 650 655
Pro Ala Pro Ser Arg Gly Pro Gln Glu Leu Val Pro Thr Thr His Pro
660 665 670
Gly Gln Pro Ala Arg His Pro Ala Ser Ser Val Ala Leu Lys Arg Pro
675 680 685
Pro Pro Ala Pro Pro Val Thr Val Ser Ser Pro Pro Phe Pro Val Pro
690 695 700
Val Tyr Thr Arg Gln Ala Pro Lys Gln Val Ile Lys Pro Thr Phe Ala
705 710 715 720
Pro Pro Val Pro Pro Val Lys Pro Gly Ala Gly Ala Ala Asn Pro Gly
725 730 735
Pro Ala Glu Gly Ala Val Gly Pro Lys Val Ala Leu Lys Pro Pro Ile
740 745 750
Gln Arg Lys Gln Gly Ala Gly Ala Pro Thr Ala Pro
755 760
<210> 152
<211> 819
<212> Белок
<213> Homo sapiens
<400> 152
Met Gly Ser Gly Ala Arg Phe Pro Ser Gly Thr Leu Arg Val Arg Trp
1 5 10 15
Leu Leu Leu Leu Gly Leu Val Gly Pro Val Leu Gly Ala Ala Arg Pro
20 25 30
Gly Phe Gln Gln Thr Ser His Leu Ser Ser Tyr Glu Ile Ile Thr Pro
35 40 45
Trp Arg Leu Thr Arg Glu Arg Arg Glu Ala Pro Arg Pro Tyr Ser Lys
50 55 60
Gln Val Ser Tyr Val Ile Gln Ala Glu Gly Lys Glu His Ile Ile His
65 70 75 80
Leu Glu Arg Asn Lys Asp Leu Leu Pro Glu Asp Phe Val Val Tyr Thr
85 90 95
Tyr Asn Lys Glu Gly Thr Leu Ile Thr Asp His Pro Asn Ile Gln Asn
100 105 110
His Cys His Tyr Arg Gly Tyr Val Glu Gly Val His Asn Ser Ser Ile
115 120 125
Ala Leu Ser Asp Cys Phe Gly Leu Arg Gly Leu Leu His Leu Glu Asn
130 135 140
Ala Ser Tyr Gly Ile Glu Pro Leu Gln Asn Ser Ser His Phe Glu His
145 150 155 160
Ile Ile Tyr Arg Met Asp Asp Val Tyr Lys Glu Pro Leu Lys Cys Gly
165 170 175
Val Ser Asn Lys Asp Ile Glu Lys Glu Thr Ala Lys Asp Glu Glu Glu
180 185 190
Glu Pro Pro Ser Met Thr Gln Leu Leu Arg Arg Arg Arg Ala Val Leu
195 200 205
Pro Gln Thr Arg Tyr Val Glu Leu Phe Ile Val Val Asp Lys Glu Arg
210 215 220
Tyr Asp Met Met Gly Arg Asn Gln Thr Ala Val Arg Glu Glu Met Ile
225 230 235 240
Leu Leu Ala Asn Tyr Leu Asp Ser Met Tyr Ile Met Leu Asn Ile Arg
245 250 255
Ile Val Leu Val Gly Leu Glu Ile Trp Thr Asn Gly Asn Leu Ile Asn
260 265 270
Ile Val Gly Gly Ala Gly Asp Val Leu Gly Asn Phe Val Gln Trp Arg
275 280 285
Glu Lys Phe Leu Ile Thr Arg Arg Arg His Asp Ser Ala Gln Leu Val
290 295 300
Leu Lys Lys Gly Phe Gly Gly Thr Ala Gly Met Ala Phe Val Gly Thr
305 310 315 320
Val Cys Ser Arg Ser His Ala Gly Gly Ile Asn Val Phe Gly Gln Ile
325 330 335
Thr Val Glu Thr Phe Ala Ser Ile Val Ala His Glu Leu Gly His Asn
340 345 350
Leu Gly Met Asn His Asp Asp Gly Arg Asp Cys Ser Cys Gly Ala Lys
355 360 365
Ser Cys Ile Met Asn Ser Gly Ala Ser Gly Ser Arg Asn Phe Ser Ser
370 375 380
Cys Ser Ala Glu Asp Phe Glu Lys Leu Thr Leu Asn Lys Gly Gly Asn
385 390 395 400
Cys Leu Leu Asn Ile Pro Lys Pro Asp Glu Ala Tyr Ser Ala Pro Ser
405 410 415
Cys Gly Asn Lys Leu Val Asp Ala Gly Glu Glu Cys Asp Cys Gly Thr
420 425 430
Pro Lys Glu Cys Glu Leu Asp Pro Cys Cys Glu Gly Ser Thr Cys Lys
435 440 445
Leu Lys Ser Phe Ala Glu Cys Ala Tyr Gly Asp Cys Cys Lys Asp Cys
450 455 460
Arg Phe Leu Pro Gly Gly Thr Leu Cys Arg Gly Lys Thr Ser Glu Cys
465 470 475 480
Asp Val Pro Glu Tyr Cys Asn Gly Ser Ser Gln Phe Cys Gln Pro Asp
485 490 495
Val Phe Ile Gln Asn Gly Tyr Pro Cys Gln Asn Asn Lys Ala Tyr Cys
500 505 510
Tyr Asn Gly Met Cys Gln Tyr Tyr Asp Ala Gln Cys Gln Val Ile Phe
515 520 525
Gly Ser Lys Ala Lys Ala Ala Pro Lys Asp Cys Phe Ile Glu Val Asn
530 535 540
Ser Lys Gly Asp Arg Phe Gly Asn Cys Gly Phe Ser Gly Asn Glu Tyr
545 550 555 560
Lys Lys Cys Ala Thr Gly Asn Ala Leu Cys Gly Lys Leu Gln Cys Glu
565 570 575
Asn Val Gln Glu Ile Pro Val Phe Gly Ile Val Pro Ala Ile Ile Gln
580 585 590
Thr Pro Ser Arg Gly Thr Lys Cys Trp Gly Val Asp Phe Gln Leu Gly
595 600 605
Ser Asp Val Pro Asp Pro Gly Met Val Asn Glu Gly Thr Lys Cys Gly
610 615 620
Ala Gly Lys Ile Cys Arg Asn Phe Gln Cys Val Asp Ala Ser Val Leu
625 630 635 640
Asn Tyr Asp Cys Asp Val Gln Lys Lys Cys His Gly His Gly Val Cys
645 650 655
Asn Ser Asn Lys Asn Cys His Cys Glu Asn Gly Trp Ala Pro Pro Asn
660 665 670
Cys Glu Thr Lys Gly Tyr Gly Gly Ser Val Asp Ser Gly Pro Thr Tyr
675 680 685
Asn Glu Met Asn Thr Ala Leu Arg Asp Gly Leu Leu Val Phe Phe Phe
690 695 700
Leu Ile Val Pro Leu Ile Val Cys Ala Ile Phe Ile Phe Ile Lys Arg
705 710 715 720
Asp Gln Leu Trp Arg Ser Tyr Phe Arg Lys Lys Arg Ser Gln Thr Tyr
725 730 735
Glu Ser Asp Gly Lys Asn Gln Ala Asn Pro Ser Arg Gln Pro Gly Ser
740 745 750
Val Pro Arg His Val Ser Pro Val Thr Pro Pro Arg Glu Val Pro Ile
755 760 765
Tyr Ala Asn Arg Phe Ala Val Pro Thr Tyr Ala Ala Lys Gln Pro Gln
770 775 780
Gln Phe Pro Ser Arg Pro Pro Pro Pro Gln Pro Lys Val Ser Ser Gln
785 790 795 800
Gly Asn Leu Ile Pro Ala Arg Pro Ala Pro Ala Pro Pro Leu Tyr Ser
805 810 815
Ser Leu Thr
<210> 153
<211> 710
<212> Белок
<213> Homo sapiens
<400> 153
Met Gly Gly Lys Gln Arg Asp Glu Asp Asp Glu Ala Tyr Gly Lys Pro
1 5 10 15
Val Lys Tyr Asp Pro Ser Phe Arg Gly Pro Ile Lys Asn Arg Ser Cys
20 25 30
Thr Asp Val Ile Cys Cys Val Leu Phe Leu Leu Phe Ile Leu Gly Tyr
35 40 45
Ile Val Val Gly Ile Val Ala Trp Leu Tyr Gly Asp Pro Arg Gln Val
50 55 60
Leu Tyr Pro Arg Asn Ser Thr Gly Ala Tyr Cys Gly Met Gly Glu Asn
65 70 75 80
Lys Asp Lys Pro Tyr Leu Leu Tyr Phe Asn Ile Phe Ser Cys Ile Leu
85 90 95
Ser Ser Asn Ile Ile Ser Val Ala Glu Asn Gly Leu Gln Cys Pro Thr
100 105 110
Pro Gln Val Cys Val Ser Ser Cys Pro Glu Asp Pro Trp Thr Val Gly
115 120 125
Lys Asn Glu Phe Ser Gln Thr Val Gly Glu Val Phe Tyr Thr Lys Asn
130 135 140
Arg Asn Phe Cys Leu Pro Gly Val Pro Trp Asn Met Thr Val Ile Thr
145 150 155 160
Ser Leu Gln Gln Glu Leu Cys Pro Ser Phe Leu Leu Pro Ser Ala Pro
165 170 175
Ala Leu Gly Arg Cys Phe Pro Trp Thr Asn Val Thr Pro Pro Ala Leu
180 185 190
Pro Gly Ile Thr Asn Asp Thr Thr Ile Gln Gln Gly Ile Ser Gly Leu
195 200 205
Ile Asp Ser Leu Asn Ala Arg Asp Ile Ser Val Lys Ile Phe Glu Asp
210 215 220
Phe Ala Gln Ser Trp Tyr Trp Ile Leu Val Ala Leu Gly Val Ala Leu
225 230 235 240
Val Leu Ser Leu Leu Phe Ile Leu Leu Leu Arg Leu Val Ala Gly Pro
245 250 255
Leu Val Leu Val Leu Ile Leu Gly Val Leu Gly Val Leu Ala Tyr Gly
260 265 270
Ile Tyr Tyr Cys Trp Glu Glu Tyr Arg Val Leu Arg Asp Lys Gly Ala
275 280 285
Ser Ile Ser Gln Leu Gly Phe Thr Thr Asn Leu Ser Ala Tyr Gln Ser
290 295 300
Val Gln Glu Thr Trp Leu Ala Ala Leu Ile Val Leu Ala Val Leu Glu
305 310 315 320
Ala Ile Leu Leu Leu Met Leu Ile Phe Leu Arg Gln Arg Ile Arg Ile
325 330 335
Ala Ile Ala Leu Leu Lys Glu Ala Ser Lys Ala Val Gly Gln Met Met
340 345 350
Ser Thr Met Phe Tyr Pro Leu Val Thr Phe Val Leu Leu Leu Ile Cys
355 360 365
Ile Ala Tyr Trp Ala Met Thr Ala Leu Tyr Leu Ala Thr Ser Gly Gln
370 375 380
Pro Gln Tyr Val Leu Trp Ala Ser Asn Ile Ser Ser Pro Gly Cys Glu
385 390 395 400
Lys Val Pro Ile Asn Thr Ser Cys Asn Pro Thr Ala His Leu Val Asn
405 410 415
Ser Ser Cys Pro Gly Leu Met Cys Val Phe Gln Gly Tyr Ser Ser Lys
420 425 430
Gly Leu Ile Gln Arg Ser Val Phe Asn Leu Gln Ile Tyr Gly Val Leu
435 440 445
Gly Leu Phe Trp Thr Leu Asn Trp Val Leu Ala Leu Gly Gln Cys Val
450 455 460
Leu Ala Gly Ala Phe Ala Ser Phe Tyr Trp Ala Phe His Lys Pro Gln
465 470 475 480
Asp Ile Pro Thr Phe Pro Leu Ile Ser Ala Phe Ile Arg Thr Leu Arg
485 490 495
Tyr His Thr Gly Ser Leu Ala Phe Gly Ala Leu Ile Leu Thr Leu Val
500 505 510
Gln Ile Ala Arg Val Ile Leu Glu Tyr Ile Asp His Lys Leu Arg Gly
515 520 525
Val Gln Asn Pro Val Ala Arg Cys Ile Met Cys Cys Phe Lys Cys Cys
530 535 540
Leu Trp Cys Leu Glu Lys Phe Ile Lys Phe Leu Asn Arg Asn Ala Tyr
545 550 555 560
Ile Met Ile Ala Ile Tyr Gly Lys Asn Phe Cys Val Ser Ala Lys Asn
565 570 575
Ala Phe Met Leu Leu Met Arg Asn Ile Val Arg Val Val Val Leu Asp
580 585 590
Lys Val Thr Asp Leu Leu Leu Phe Phe Gly Lys Leu Leu Val Val Gly
595 600 605
Gly Val Gly Val Leu Ser Phe Phe Phe Phe Ser Gly Arg Ile Pro Gly
610 615 620
Leu Gly Lys Asp Phe Lys Ser Pro His Leu Asn Tyr Tyr Trp Leu Pro
625 630 635 640
Ile Met Thr Ser Ile Leu Gly Ala Tyr Val Ile Ala Ser Gly Phe Phe
645 650 655
Ser Val Phe Gly Met Cys Val Asp Thr Leu Phe Leu Cys Phe Leu Glu
660 665 670
Asp Leu Glu Arg Asn Asn Gly Ser Leu Asp Arg Pro Tyr Tyr Met Ser
675 680 685
Lys Ser Leu Leu Lys Ile Leu Gly Lys Lys Asn Glu Ala Pro Pro Asp
690 695 700
Asn Lys Lys Arg Lys Lys
705 710
<210> 154
<211> 333
<212> Белок
<213> Homo sapiens
<400> 154
Met Ala Cys Ser Arg Pro Pro Ser Gln Cys Glu Pro Thr Ser Leu Pro
1 5 10 15
Pro Gly Pro Pro Ala Gly Arg Arg His Leu Pro Leu Ser Arg Arg Arg
20 25 30
Arg Glu Met Ser Ser Asn Lys Glu Gln Arg Ser Ala Val Phe Val Ile
35 40 45
Leu Phe Ala Leu Ile Thr Ile Leu Ile Leu Tyr Ser Ser Asn Ser Ala
50 55 60
Asn Glu Val Phe His Tyr Gly Ser Leu Arg Gly Arg Ser Arg Arg Pro
65 70 75 80
Val Asn Leu Lys Lys Trp Ser Ile Thr Asp Gly Tyr Val Pro Ile Leu
85 90 95
Gly Asn Lys Thr Leu Pro Ser Arg Cys His Gln Cys Val Ile Val Ser
100 105 110
Ser Ser Ser His Leu Leu Gly Thr Lys Leu Gly Pro Glu Ile Glu Arg
115 120 125
Ala Glu Cys Thr Ile Arg Met Asn Asp Ala Pro Thr Thr Gly Tyr Ser
130 135 140
Ala Asp Val Gly Asn Lys Thr Thr Tyr Arg Val Val Ala His Ser Ser
145 150 155 160
Val Phe Arg Val Leu Arg Arg Pro Gln Glu Phe Val Asn Arg Thr Pro
165 170 175
Glu Thr Val Phe Ile Phe Trp Gly Pro Pro Ser Lys Met Gln Lys Pro
180 185 190
Gln Gly Ser Leu Val Arg Val Ile Gln Arg Ala Gly Leu Val Phe Pro
195 200 205
Asn Met Glu Ala Tyr Ala Val Ser Pro Gly Arg Met Arg Gln Phe Asp
210 215 220
Asp Leu Phe Arg Gly Glu Thr Gly Lys Asp Arg Glu Lys Ser His Ser
225 230 235 240
Trp Leu Ser Thr Gly Trp Phe Thr Met Val Ile Ala Val Glu Leu Cys
245 250 255
Asp His Val His Val Tyr Gly Met Val Pro Pro Asn Tyr Cys Ser Gln
260 265 270
Arg Pro Arg Leu Gln Arg Met Pro Tyr His Tyr Tyr Glu Pro Lys Gly
275 280 285
Pro Asp Glu Cys Val Thr Tyr Ile Gln Asn Glu His Ser Arg Lys Gly
290 295 300
Asn His His Arg Phe Ile Thr Glu Lys Arg Val Phe Ser Ser Trp Ala
305 310 315 320
Gln Leu Tyr Gly Ile Thr Phe Ser His Pro Ser Trp Thr
325 330
<210> 155
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 155
Gln Val Lys Leu Gln Glu Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Asp Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asp Gly Asn Thr Arg Tyr Thr His Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Ala Ser Glu Asp Ser Gly Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Glu Gly Asn Tyr Ala Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser Ala
115 120
<210> 156
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 156
Gly Tyr Thr Phe Thr Asn Tyr
1 5
<210> 157
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 157
Tyr Pro Gly Asp Gly Asn
1 5
<210> 158
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 158
Gly Glu Gly Asn Tyr Ala Trp Phe Ala Tyr
1 5 10
<210> 159
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 159
Asp Ile Glu Leu Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Gln Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp His Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Asn Ala Lys Thr Leu Ala Gly Gly Val Ser Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr His Phe Ser Leu Lys Ile Lys Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Ile Tyr Tyr Cys Gln His His Tyr Gly Ile Leu Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 160
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 160
Glu Asn Ile Tyr Ser Tyr Leu Ala
1 5
<210> 161
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 161
Asn Ala Lys Thr Leu Ala Gly
1 5
<210> 162
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 162
Gln His His Tyr Gly Ile Leu Pro Thr
1 5
<210> 163
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 163
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Ser Ile Thr Asn Asp
20 25 30
Tyr Ala Trp Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Gly Tyr Ile Ser Tyr Ser Gly Tyr Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Phe Thr Ile Ser Arg Asp Thr Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Thr Ser Gly Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala
115
<210> 164
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 164
Gly Tyr Ser Ile Thr Asn Asp Tyr
1 5
<210> 165
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 165
Ser Tyr Ser Gly Tyr
1 5
<210> 166
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 166
Trp Thr Ser Gly Leu Asp Tyr
1 5
<210> 167
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 167
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Asp Leu Ile His Asn Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Thr Ser Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Trp Thr Thr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 168
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 168
Asp Leu Ile His Asn Trp Leu Ala
1 5
<210> 169
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 169
Gly Ala Thr Ser Leu Glu Thr
1 5
<210> 170
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 170
Gln Gln Tyr Trp Thr Thr Pro Phe Thr
1 5
<210> 171
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 171
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Asp Phe
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Thr Ile Gly Arg Val Ala Phe His Thr Tyr Tyr Pro Asp Ser Met
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Arg Gly Phe Asp Val Gly His Phe Asp Phe Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 172
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 172
Gly Phe Ser Phe Ser Asp Phe
1 5
<210> 173
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 173
Gly Arg Val Ala Phe His
1 5
<210> 174
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 174
His Arg Gly Phe Asp Val Gly His Phe Asp Phe
1 5 10
<210> 175
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 175
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ser Ser Glu Thr Leu Val His Ser
20 25 30
Ser Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Leu Leu Ile Tyr Arg Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser Phe Asn Pro Leu Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 176
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 176
Glu Thr Leu Val His Ser Ser Gly Asn Thr Tyr Leu Glu
1 5 10
<210> 177
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 177
Arg Val Ser Asn Arg Phe Ser
1 5
<210> 178
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 178
Phe Gln Gly Ser Phe Asn Pro Leu Thr
1 5
<210> 179
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 179
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Asn Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Ser Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Ser
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Tyr Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala
115
<210> 180
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 180
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 181
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 181
Ser Ser Ser Ser Ser Thr
1 5
<210> 182
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 182
Ala Tyr Tyr Tyr Gly Met Asp Val
1 5
<210> 183
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 183
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Gly Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Phe Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Asn Ser Phe Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 184
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 184
Gln Gly Ile Ser Gly Trp Leu Ala
1 5
<210> 185
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 185
Ala Ala Ser Thr Leu Gln Ser
1 5
<210> 186
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 186
Gln Gln Ala Asn Ser Phe Pro Pro Thr
1 5
<210> 187
<211> 122
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 187
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Ser Val Gln Pro Gly Glu
1 5 10 15
Ser Leu Arg Leu Ser Cys Val Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Lys Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Arg Ser Gly Arg Asp Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Gly Thr Val Thr Thr Tyr Tyr Tyr Asp Phe Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 188
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 188
Gly Phe Thr Phe Ser Arg Tyr
1 5
<210> 189
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 189
Ser Arg Ser Gly Arg Asp
1 5
<210> 190
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 190
Thr Val Thr Thr Tyr Tyr Tyr Asp Phe Gly Met Asp Val
1 5 10
<210> 191
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 191
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 192
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 192
Gln Gly Ile Ser Ser Trp Leu Ala
1 5
<210> 193
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 193
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 194
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 194
Gln Gln Tyr Asn Ser Tyr Pro Pro Thr
1 5
<210> 195
<211> 125
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 195
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Met Ser Tyr Asp Gly Ser Lys Lys Phe Tyr Thr Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Gly Gly Asp Tyr Val Arg Tyr His Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala
115 120 125
<210> 196
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 196
Gly Phe Thr Phe Ser Ser Tyr
1 5
<210> 197
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 197
Ser Tyr Asp Gly Ser Lys
1 5
<210> 198
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 198
Asp Gly Gly Asp Tyr Val Arg Tyr His Tyr Tyr Gly Met Asp Val
1 5 10 15
<210> 199
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 199
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Ile Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Tyr Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Thr Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Leu Ser Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asp Ser Ala Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 200
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 200
Gln Gly Ile Ser Tyr Tyr Leu Ala
1 5
<210> 201
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 201
Asp Thr Ser Ser Leu Gln Ser
1 5
<210> 202
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 202
Gln Arg Tyr Asp Ser Ala Pro Leu Thr
1 5
<210> 203
<211> 706
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 203
Glu Val Gln Leu Leu Glu Gln Ser Gly Ala Glu Leu Val Arg Pro Gly
1 5 10 15
Thr Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn
20 25 30
Tyr Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp
35 40 45
Ile Gly Asp Ile Phe Pro Gly Ser Gly Asn Ile His Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala
65 70 75 80
Tyr Met Gln Leu Ser Ser Leu Thr Phe Glu Asp Ser Ala Val Tyr Phe
85 90 95
Cys Ala Arg Leu Arg Asn Trp Asp Glu Pro Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Arg Val Tyr
340 345 350
Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Val Ser Asp Gly Ser Phe Thr Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Ser Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser
450 455 460
Pro Ser Ser Val Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys
465 470 475 480
Arg Ala Ser Gln Gly Ile Ser Ser Trp Leu Ala Trp Tyr Gln Gln Lys
485 490 495
Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln
500 505 510
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
515 520 525
Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr
530 535 540
Cys Gln Gln Gly Val Ser Phe Pro Arg Thr Phe Gly Cys Gly Thr Lys
545 550 555 560
Val Glu Ile Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
565 570 575
Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly
580 585 590
Gly Gly Leu Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala
595 600 605
Ser Gly Phe Thr Phe Ser Ser Tyr Ser Met Asn Trp Val Arg Gln Ala
610 615 620
Pro Gly Lys Cys Leu Glu Trp Val Ser Ser Ile Ser Ser Ser Ser Ser
625 630 635 640
Tyr Ile Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg
645 650 655
Asp Asn Ala Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala
660 665 670
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Gly Ala Pro Met Gly Ala
675 680 685
Ala Ala Gly Trp Phe Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val
690 695 700
Ser Ser
705
<210> 204
<211> 449
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 204
Glu Val Gln Leu Leu Glu Gln Ser Gly Ala Glu Leu Val Arg Pro Gly
1 5 10 15
Thr Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn
20 25 30
Tyr Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp
35 40 45
Ile Gly Asp Ile Phe Pro Gly Ser Gly Asn Ile His Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala
65 70 75 80
Tyr Met Gln Leu Ser Ser Leu Thr Phe Glu Asp Ser Ala Val Tyr Phe
85 90 95
Cys Ala Arg Leu Arg Asn Trp Asp Glu Pro Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Cys
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Glu Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Trp Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly
<210> 205
<211> 249
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 205
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Val Ser Phe Pro Arg
85 90 95
Thr Phe Gly Cys Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
115 120 125
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly Ser
130 135 140
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Ser
145 150 155 160
Met Asn Trp Val Arg Gln Ala Pro Gly Lys Cys Leu Glu Trp Val Ser
165 170 175
Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val Lys
180 185 190
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr Leu
195 200 205
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Ala Pro Met Gly Ala Ala Ala Gly Trp Phe Asp Pro Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser
245
<210> 206
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 206
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 207
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности:синтетический пептид
<400> 207
Ser Gly Ser Gly Gly Gly Gly Ser
1 5
<210> 208
<211> 253
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 208
Glu Leu Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Leu Thr Phe Gly Cys Gly Thr Lys Leu Glu Ile
100 105 110
Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu Gln Ser Gly Ala Glu
130 135 140
Leu Val Arg Pro Gly Thr Ser Val Lys Ile Ser Cys Lys Ala Ser Gly
145 150 155 160
Tyr Ala Phe Thr Asn Tyr Trp Leu Gly Trp Val Lys Gln Arg Pro Gly
165 170 175
His Cys Leu Glu Trp Ile Gly Asp Ile Phe Pro Gly Ser Gly Asn Ile
180 185 190
His Tyr Asn Glu Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys
195 200 205
Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Phe Glu Asp
210 215 220
Ser Ala Val Tyr Phe Cys Ala Arg Leu Arg Asn Trp Asp Glu Pro Met
225 230 235 240
Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
245 250
<210> 209
<211> 253
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 209
Glu Val Gln Leu Leu Glu Gln Ser Gly Ala Glu Leu Val Arg Pro Gly
1 5 10 15
Thr Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn
20 25 30
Tyr Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Cys Leu Glu Trp
35 40 45
Ile Gly Asp Ile Phe Pro Gly Ser Gly Asn Ile His Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala
65 70 75 80
Tyr Met Gln Leu Ser Ser Leu Thr Phe Glu Asp Ser Ala Val Tyr Phe
85 90 95
Cys Ala Arg Leu Arg Asn Trp Asp Glu Pro Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Leu Val Met
130 135 140
Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly Glu Lys Val Thr
145 150 155 160
Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys
165 170 175
Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu
180 185 190
Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val Pro Asp Arg Phe
195 200 205
Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Val
210 215 220
Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn Asp Tyr Ser Tyr
225 230 235 240
Pro Leu Thr Phe Gly Cys Gly Thr Lys Leu Glu Ile Lys
245 250
<210> 210
<211> 482
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 210
Glu Leu Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Leu Thr Phe Gly Cys Gly Thr Lys Leu Glu Ile
100 105 110
Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu Gln Ser Gly Ala Glu
130 135 140
Leu Val Arg Pro Gly Thr Ser Val Lys Ile Ser Cys Lys Ala Ser Gly
145 150 155 160
Tyr Ala Phe Thr Asn Tyr Trp Leu Gly Trp Val Lys Gln Arg Pro Gly
165 170 175
His Cys Leu Glu Trp Ile Gly Asp Ile Phe Pro Gly Ser Gly Asn Ile
180 185 190
His Tyr Asn Glu Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys
195 200 205
Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Phe Glu Asp
210 215 220
Ser Ala Val Tyr Phe Cys Ala Arg Leu Arg Asn Trp Asp Glu Pro Met
225 230 235 240
Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Ala Ser
245 250 255
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
260 265 270
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
275 280 285
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
290 295 300
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
305 310 315 320
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
325 330 335
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
340 345 350
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
355 360 365
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Arg Val
370 375 380
Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
385 390 395 400
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
405 410 415
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
420 425 430
Val Leu Val Ser Asp Gly Ser Phe Thr Leu Tyr Ser Lys Leu Thr Val
435 440 445
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
450 455 460
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
465 470 475 480
Pro Gly
<210> 211
<211> 482
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 211
Glu Val Gln Leu Leu Glu Gln Ser Gly Ala Glu Leu Val Arg Pro Gly
1 5 10 15
Thr Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn
20 25 30
Tyr Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Cys Leu Glu Trp
35 40 45
Ile Gly Asp Ile Phe Pro Gly Ser Gly Asn Ile His Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala
65 70 75 80
Tyr Met Gln Leu Ser Ser Leu Thr Phe Glu Asp Ser Ala Val Tyr Phe
85 90 95
Cys Ala Arg Leu Arg Asn Trp Asp Glu Pro Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Leu Val Met
130 135 140
Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly Glu Lys Val Thr
145 150 155 160
Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser Gly Asn Gln Lys
165 170 175
Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu
180 185 190
Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val Pro Asp Arg Phe
195 200 205
Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Val
210 215 220
Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn Asp Tyr Ser Tyr
225 230 235 240
Pro Leu Thr Phe Gly Cys Gly Thr Lys Leu Glu Ile Lys Gly Ala Ser
245 250 255
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
260 265 270
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
275 280 285
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
290 295 300
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
305 310 315 320
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
325 330 335
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
340 345 350
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
355 360 365
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Arg Val
370 375 380
Tyr Thr Leu Pro Pro Cys Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
385 390 395 400
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
405 410 415
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
420 425 430
Val Leu Val Ser Asp Gly Ser Phe Thr Leu Tyr Ser Lys Leu Thr Val
435 440 445
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
450 455 460
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
465 470 475 480
Pro Gly
<210> 212
<211> 451
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 212
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Pro Met Gly Ala Ala Ala Gly Trp Phe Asp Pro Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
210 215 220
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
225 230 235 240
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
245 250 255
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
260 265 270
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
275 280 285
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
290 295 300
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
305 310 315 320
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
325 330 335
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
340 345 350
Val Cys Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Glu Asn Gln Val
355 360 365
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
370 375 380
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
385 390 395 400
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Trp Leu Thr
405 410 415
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
420 425 430
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
435 440 445
Ser Pro Gly
450
<210> 213
<211> 210
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 213
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Val Ser Phe Pro Arg
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val
115 120 125
Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp
130 135 140
Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr
145 150 155 160
Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr
165 170 175
Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val
180 185 190
Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly
195 200 205
Glu Cys
210
<210> 214
<211> 221
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 214
Glu Leu Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Ile
100 105 110
Lys Gly Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
115 120 125
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
130 135 140
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
145 150 155 160
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
165 170 175
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
180 185 190
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
195 200 205
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<---
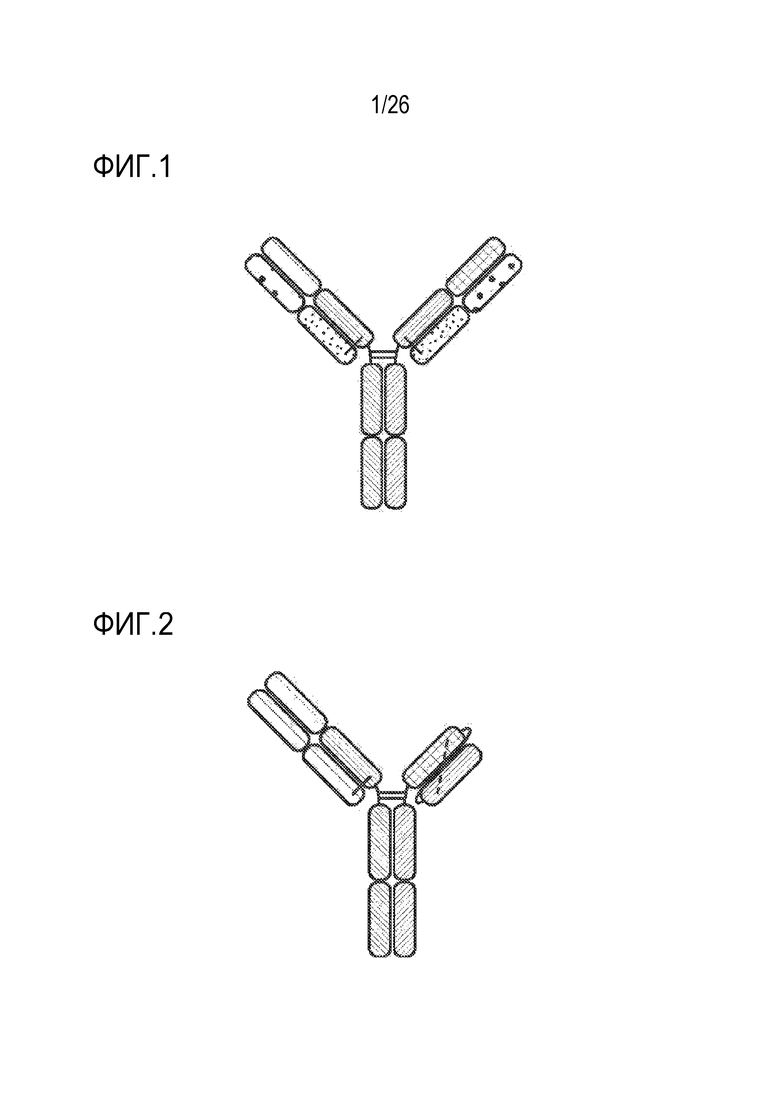
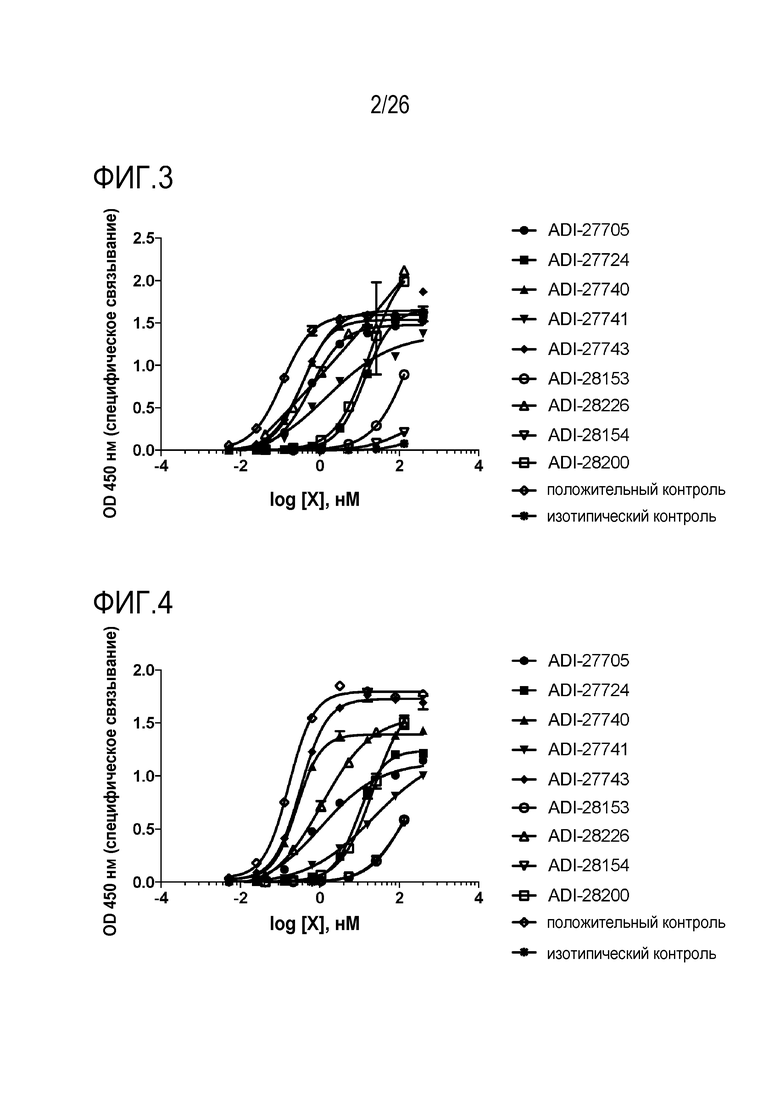
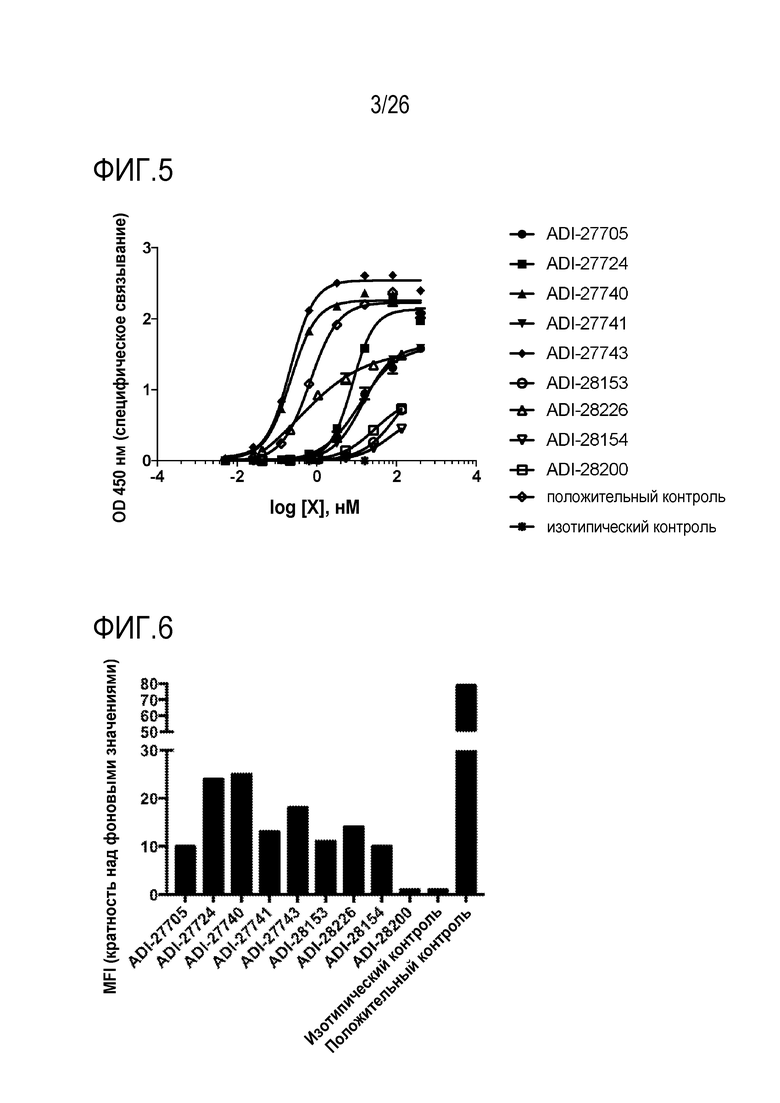

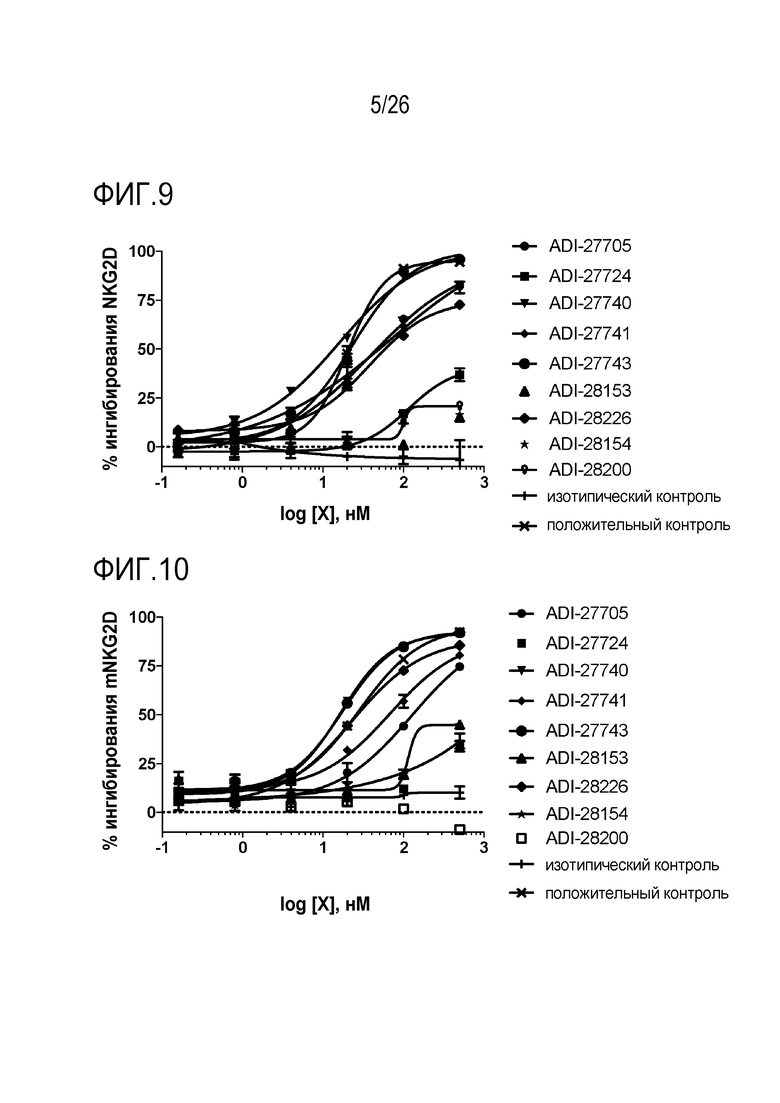
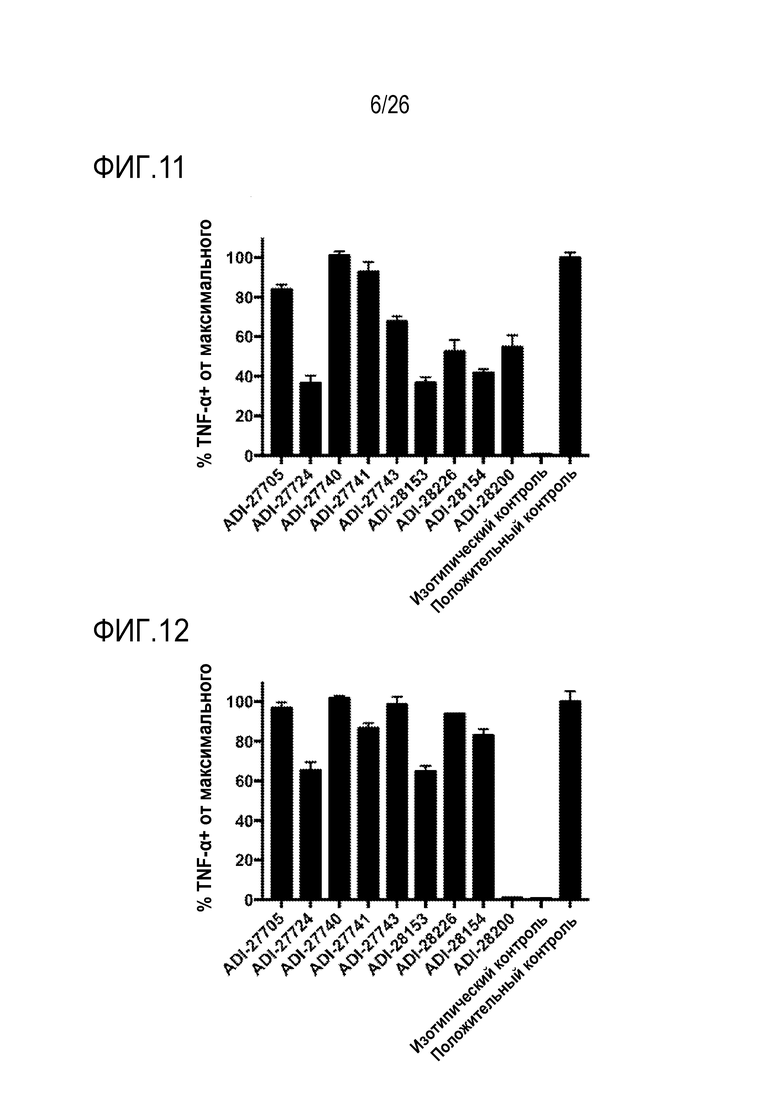
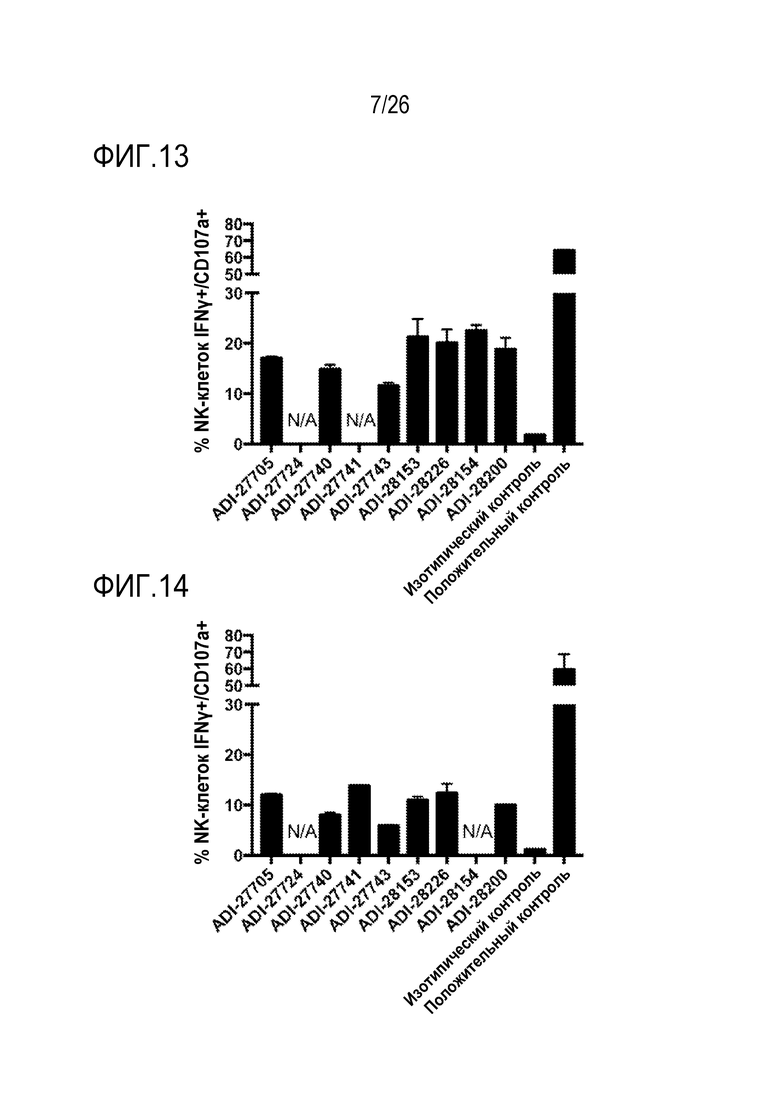
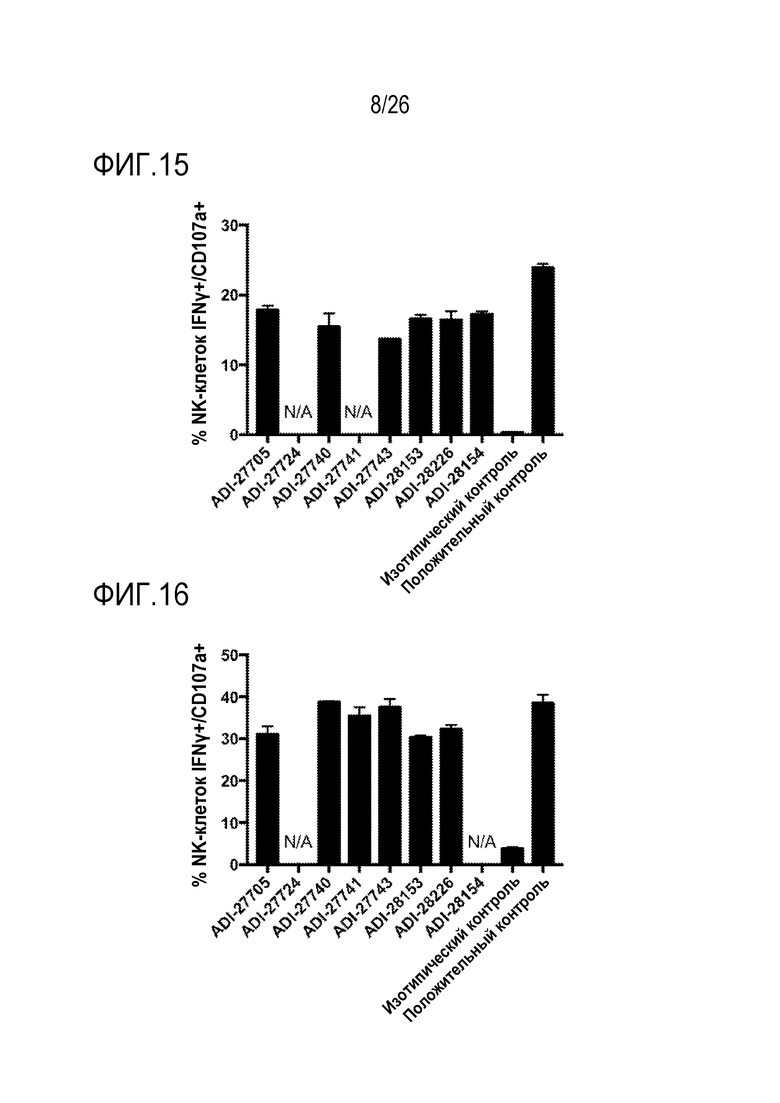

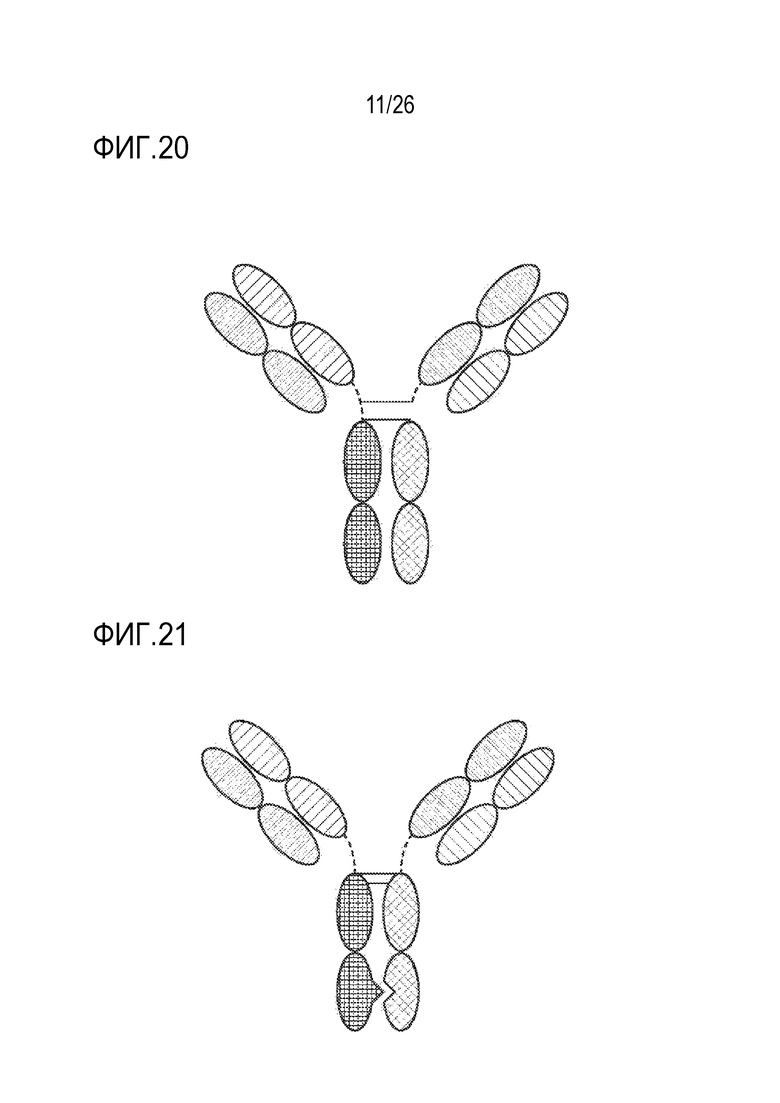
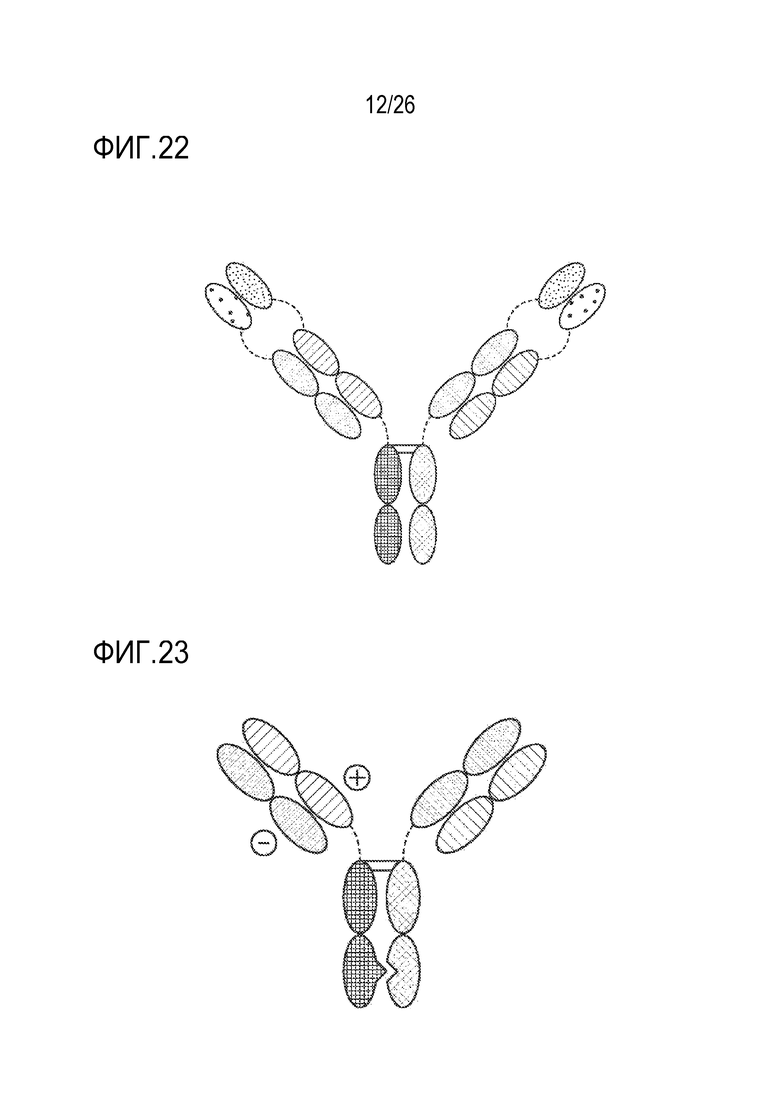
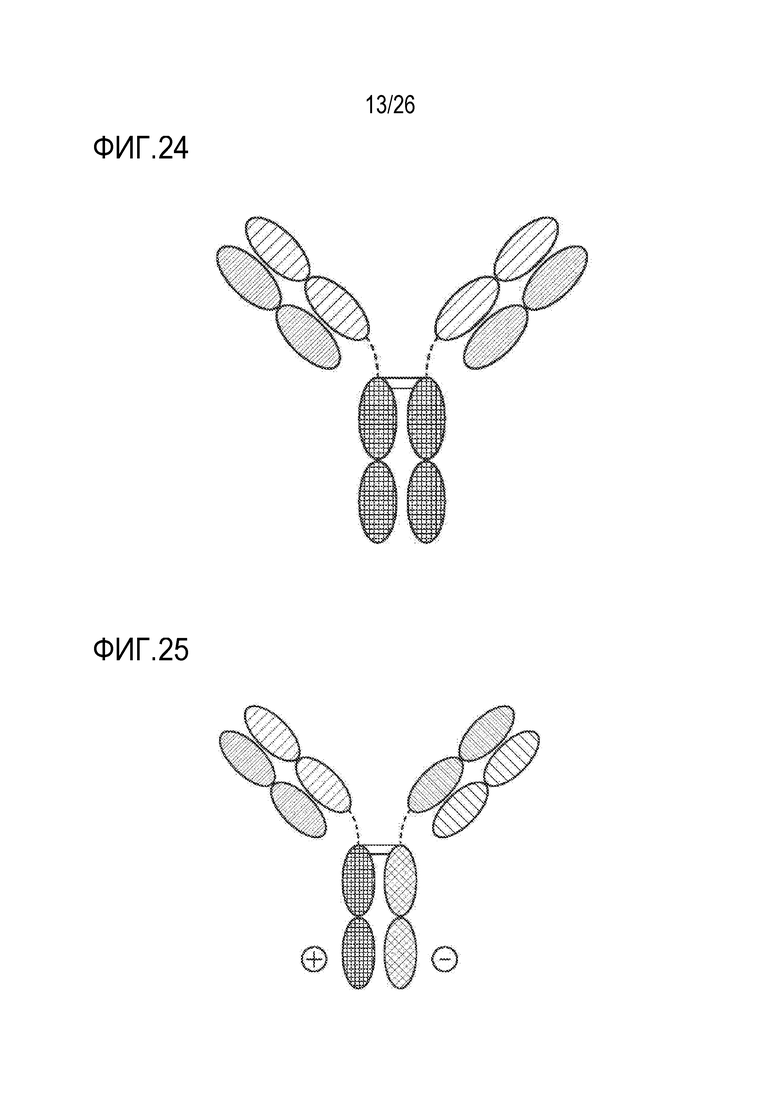
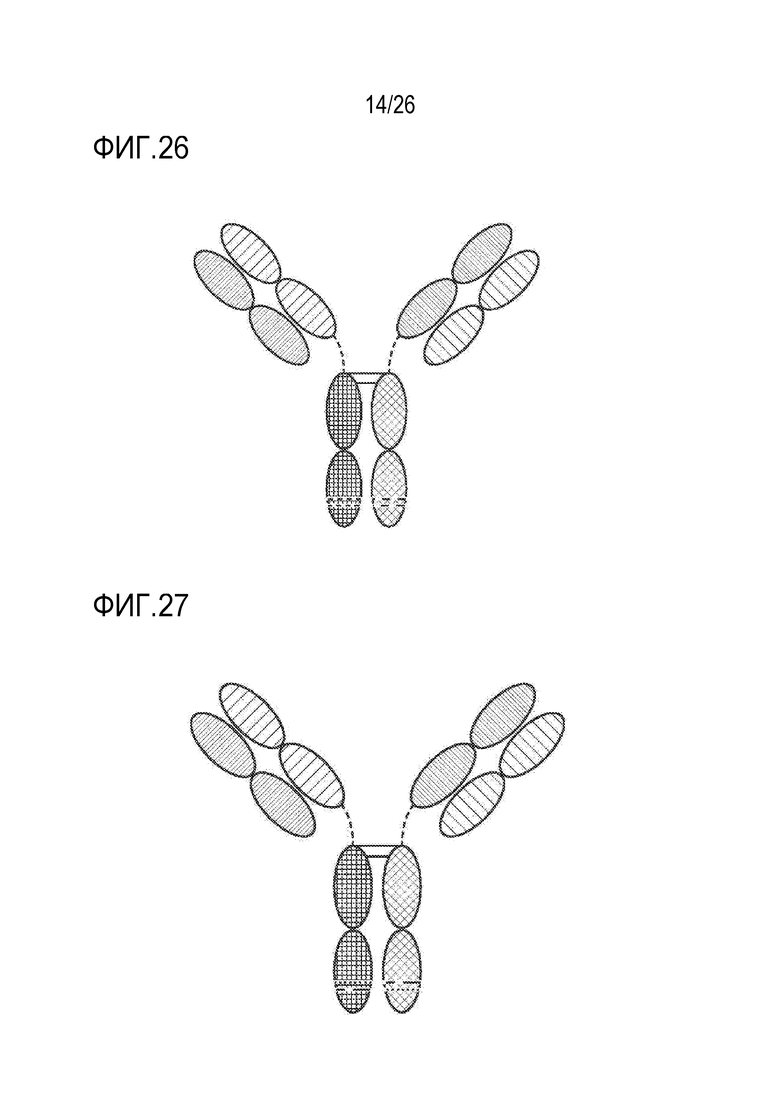

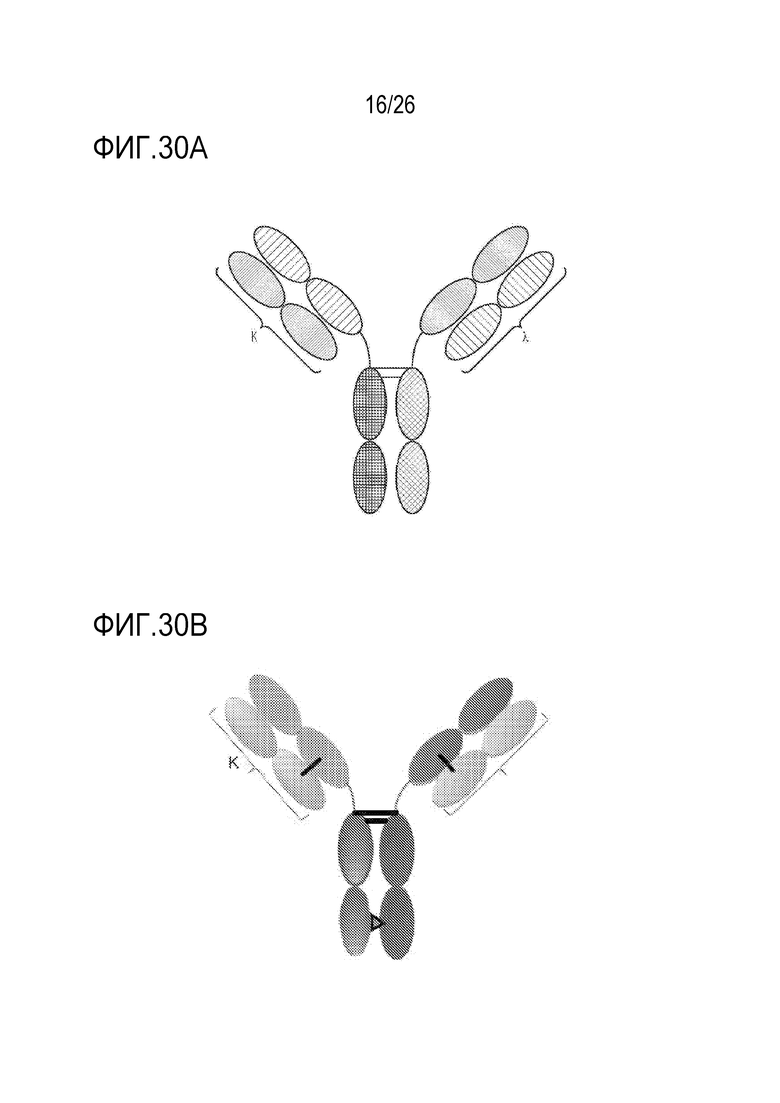
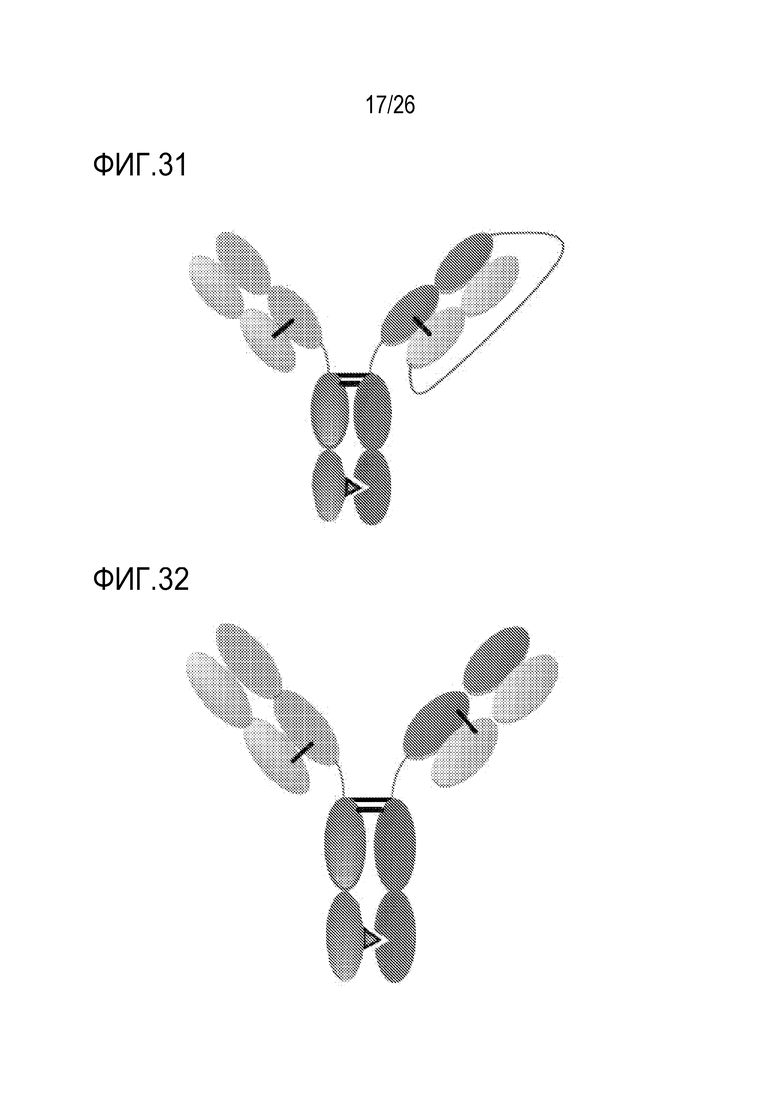
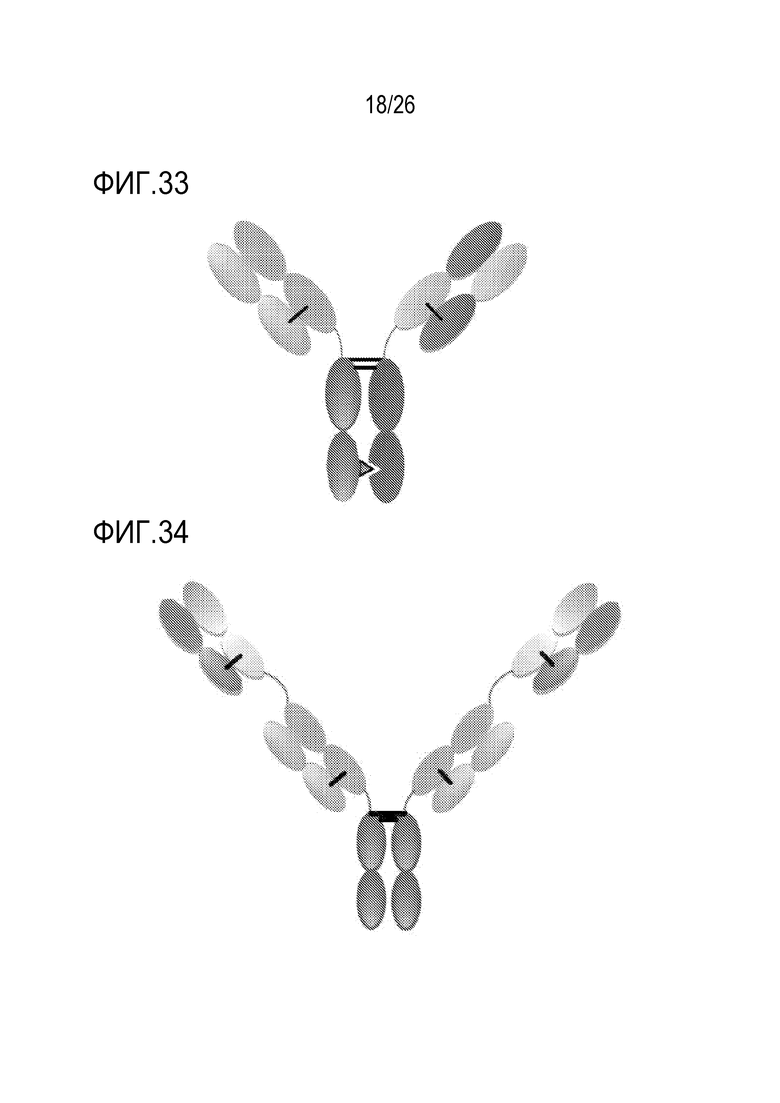
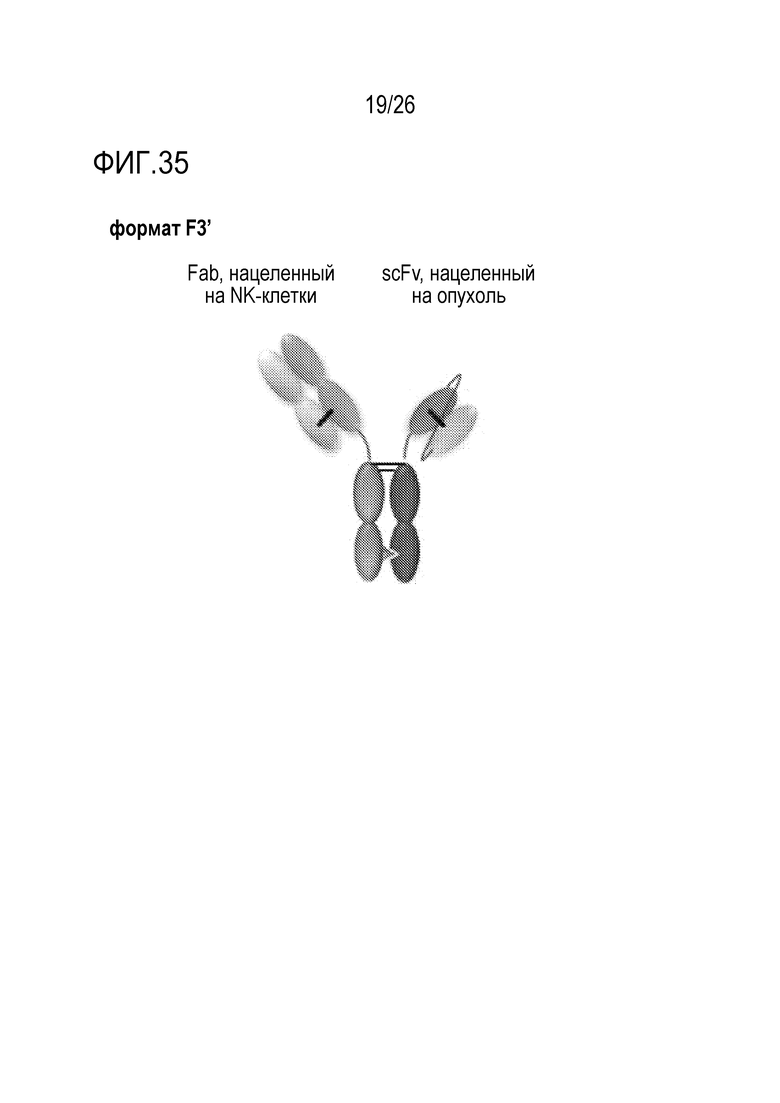


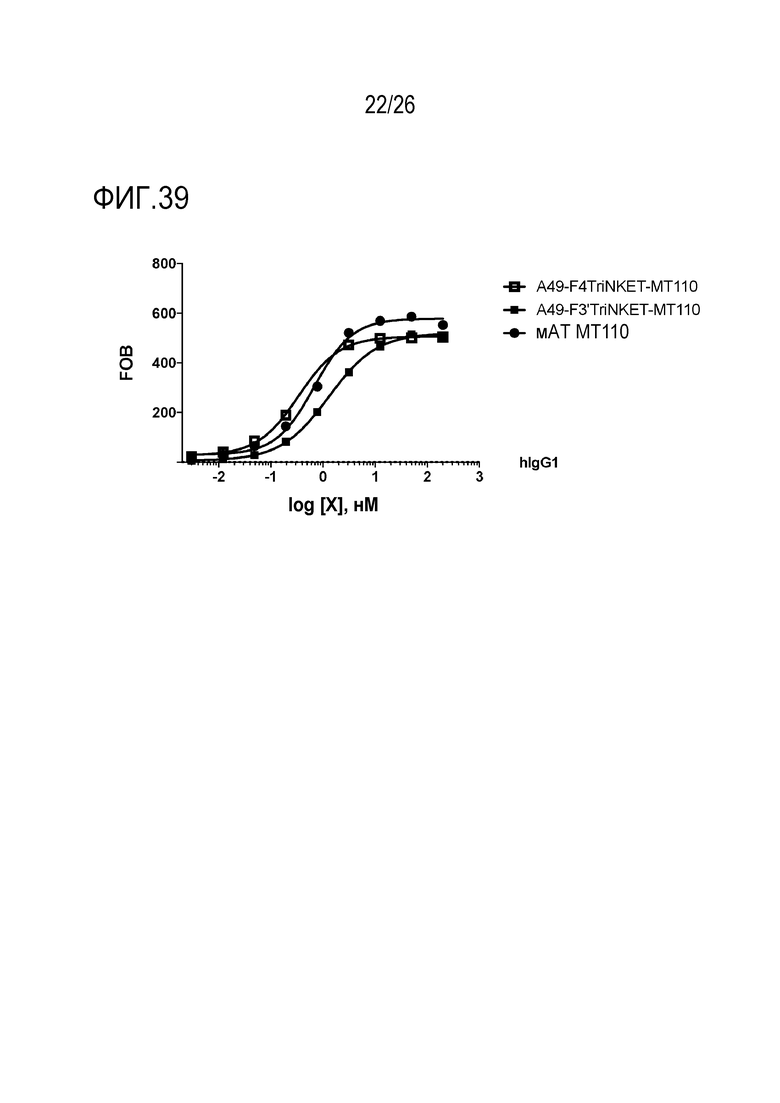

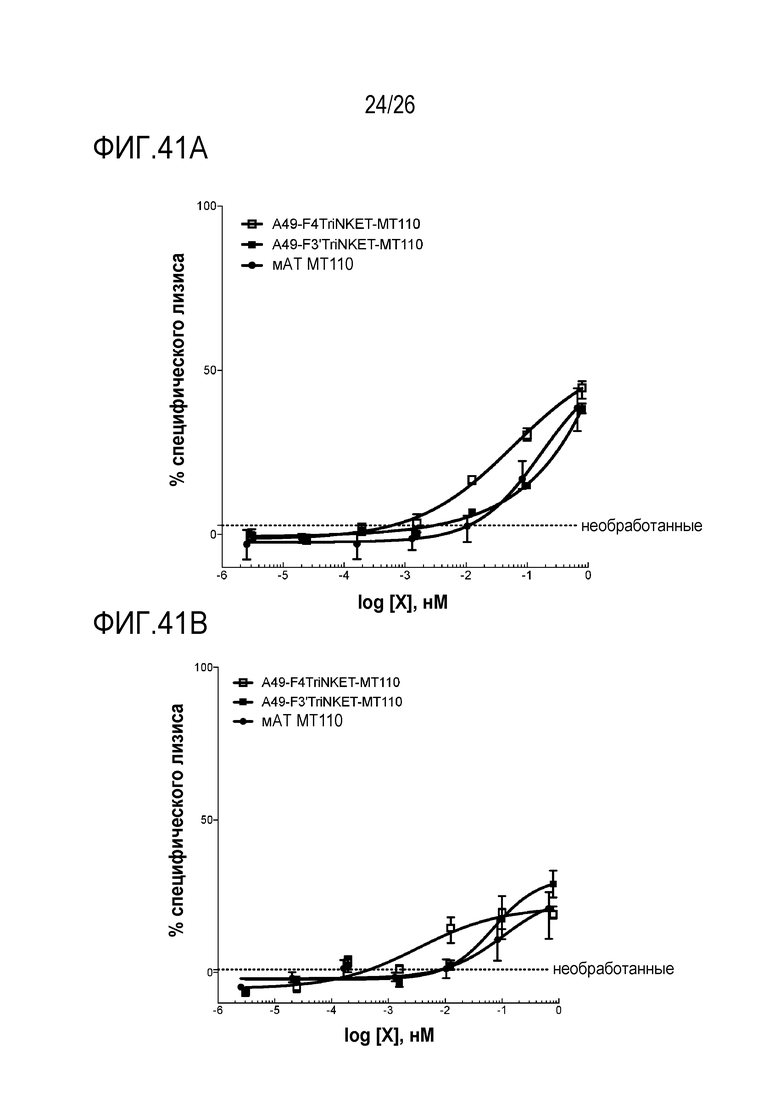
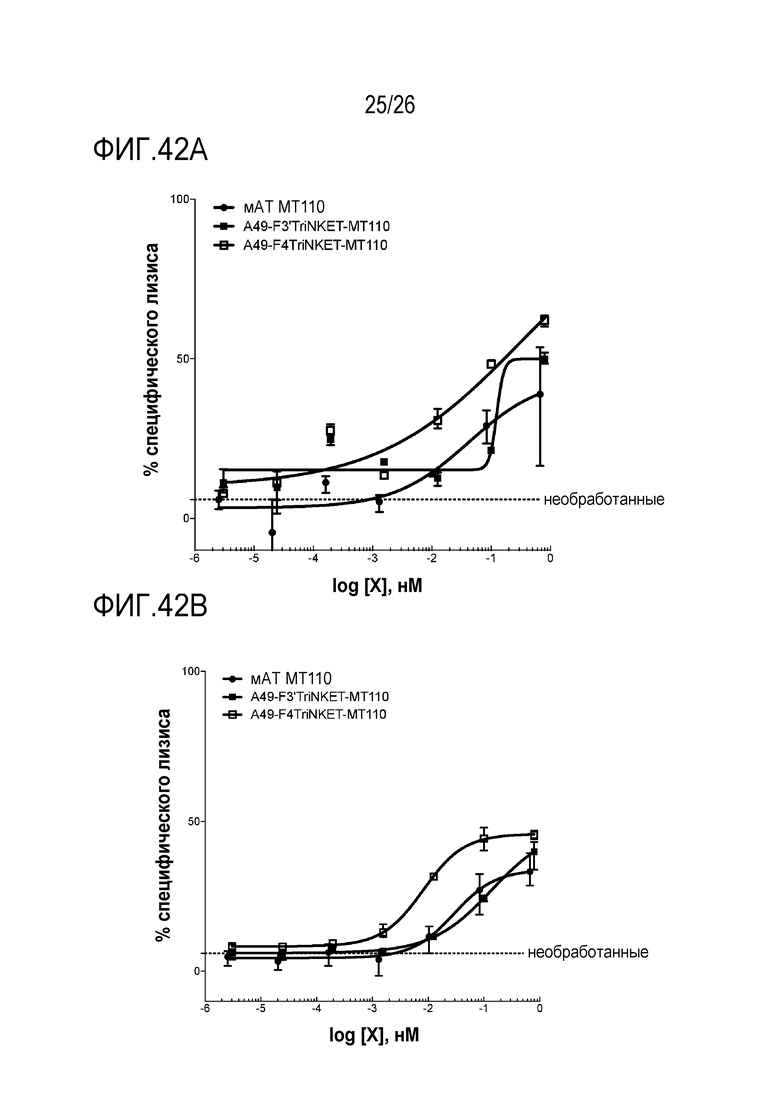
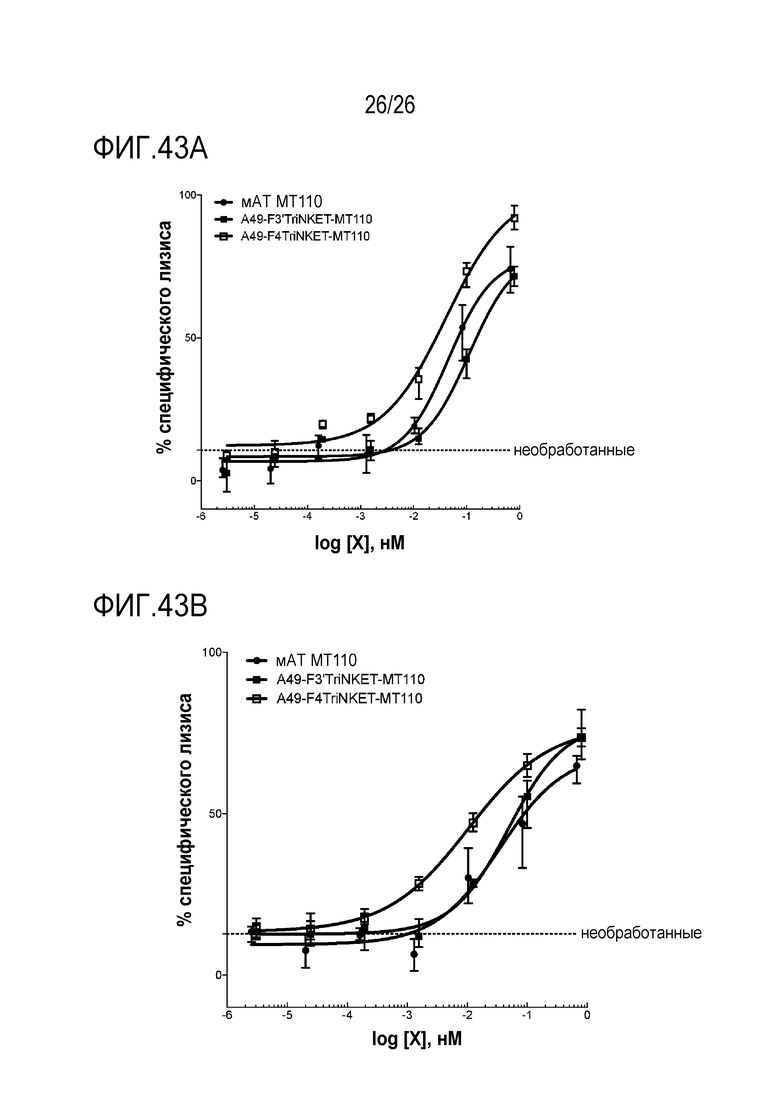
Настоящее изобретение относится к области биотехнологии, в частности к новым мультиспецифическим связывающим антителам, и может быть использовано в медицине. Изобретение раскрывает белок, молекула которого содержит домены, специфическим образом связывающиеся с рецептором NKG2D, с CD16 и с опухолеассоциированным антигеном нектином-4. Изобретение может быть использовано при иммунотерапии злокачественных опухолей, клетки которых экспрессируют нектин-4 на своей поверхности. 6 н. и 22 з.п. ф-лы, 8 пр., 11 табл., 43 ил.
1. Триспецифический связывающий белок, который связывает NKG2D, нектин-4 и CD16, содержащий:
(a) первый антигенсвязывающий участок, содержащий вариабельный домен тяжелой цепи (VH) и вариабельный домен легкой цепи (VL) антитела против члена D группы 2 естественных киллеров (NKG2D), который связывается с NKG2D;
(b) второй антигенсвязывающий участок, содержащий домен VH и домен VL антитела против молекулы клеточной адгезии нектина-4 (Nectin4), который связывается с опухолеассоциированным антигеном нектином-4; и
(c) Fc-домен антитела IgG1 человека или его часть, достаточная для связывания с CD16, или третий антигенсвязывающий участок, содержащий домен VH и домен VL анти-CD16 антитела, который связывается с CD16,
где каждый из антигенсвязывающих участков содержит часть молекулы иммуноглобулина, которая участвует в связывании антигена.
2. Триспецифический связывающий белок по п. 1, где первый антигенсвязывающий участок связывается с NKG2D у людей, не являющихся человеком приматов и грызунов.
3. Триспецифический связывающий белок по п. 1, где вариабельный домен тяжелой цепи и вариабельный домен легкой цепи присутствуют в одном полипептиде.
4. Триспецифический связывающий белок по п. 1, где вариабельный домен тяжелой цепи и вариабельный домен легкой цепи второго антигенсвязывающего участка присутствуют в одном полипептиде.
5. Триспецифический связывающий белок по п. 4, где вариабельный домен легкой цепи первого антигенсвязывающего участка имеет аминокислотную последовательность, идентичную аминокислотной последовательности вариабельного домена легкой цепи второго антигенсвязывающего участка.
6. Триспецифический связывающий белок по любому из пп. 1-5, где первый антигенсвязывающий участок содержит аминокислотную последовательность вариабельного домена тяжелой цепи, по меньшей мере на 90% идентичную аминокислотной последовательности, выбранной из SEQ ID NO: 1, SEQ ID NO: 41, SEQ ID NO: 49, SEQ ID NO: 57, SEQ ID NO: 59 и SEQ ID NO: 85.
7. Триспецифический связывающий белок по любому из пп. 1-5, где первый антигенсвязывающий участок содержит аминокислотную последовательность вариабельного домена тяжелой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 41, и аминокислотную последовательность вариабельного домена легкой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 42.
8. Триспецифический связывающий белок по любому из пп.1-5 или 7, где первый антигенсвязывающий участок содержит последовательность CDR1 тяжелой цепи, идентичную аминокислотной последовательности SEQ ID NO: 43, последовательность CDR2 тяжелой цепи, идентичную аминокислотной последовательности SEQ ID NO: 44, последовательность CDR3 тяжелой цепи, идентичную аминокислотной последовательности SEQ ID NO: 45, последовательность CDR1 легкой цепи, идентичную аминокислотной последовательности SEQ ID NO: 46, последовательность CDR2 легкой цепи, идентичную аминокислотной последовательности SEQ ID NO: 47, и последовательность CDR3 легкой цепи, идентичную аминокислотной последовательности SEQ ID NO: 48.
9. Триспецифический связывающий белок по любому из пп. 1-5, где первый антигенсвязывающий участок содержит аминокислотную последовательность вариабельного домена тяжелой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 49, и аминокислотную последовательность вариабельного домена легкой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 50.
10. Триспецифический связывающий белок по любому из пп.1-5 или 9, где первый антигенсвязывающий участок содержит последовательность CDR1 тяжелой цепи, идентичную аминокислотной последовательности SEQ ID NO: 51, последовательность CDR2 тяжелой цепи, идентичную аминокислотной последовательности SEQ ID NO: 52, последовательность CDR3 тяжелой цепи, идентичную аминокислотной последовательности SEQ ID NO: 53, последовательность CDR1 легкой цепи, идентичную аминокислотной последовательности SEQ ID NO: 54, последовательность CDR2 легкой цепи, идентичную аминокислотной последовательности SEQ ID NO: 55, и последовательность CDR3 легкой цепи, идентичную аминокислотной последовательности SEQ ID NO: 56.
11. Триспецифический связывающий белок по любому из пп. 1-5, где первый антигенсвязывающий участок содержит аминокислотную последовательность вариабельного домена тяжелой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 57, и аминокислотную последовательность вариабельного домена легкой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 58.
12. Триспецифический связывающий белок по любому из пп. 1-5, где первый антигенсвязывающий участок содержит аминокислотную последовательность вариабельного домена тяжелой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 59, и аминокислотную последовательность вариабельного домена легкой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 60.
13. Триспецифический связывающий белок по любому из пп.1-5 или 12, где первый антигенсвязывающий участок содержит последовательность CDR1 тяжелой цепи, идентичную аминокислотной последовательности SEQ ID NO: 109, последовательность CDR2 тяжелой цепи, идентичную аминокислотной последовательности SEQ ID NO: 110, последовательность CDR3 тяжелой цепи, идентичную аминокислотной последовательности SEQ ID NO: 111, последовательность CDR1 легкой цепи, идентичную аминокислотной последовательности SEQ ID NO: 112, последовательность CDR2 легкой цепи, идентичную аминокислотной последовательности SEQ ID NO: 113, и последовательность CDR3 легкой цепи, идентичную аминокислотной последовательности SEQ ID NO: 114.
14. Триспецифический связывающий белок по любому из пп. 1-5, где первый антигенсвязывающий участок содержит аминокислотную последовательность вариабельного домена тяжелой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 101, и аминокислотную последовательность вариабельного домена легкой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 102.
15. Триспецифический связывающий белок по любому из пп. 1-5, где первый антигенсвязывающий участок содержит аминокислотную последовательность вариабельного домена тяжелой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 103, и аминокислотную последовательность вариабельного домена легкой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 104.
16. Триспецифический связывающий белок по любому из пп.1-5, где первый антигенсвязывающий участок содержит последовательность CDR1 тяжелой цепи, идентичную аминокислотной последовательности SEQ ID NO: 105, последовательность CDR2 тяжелой цепи, идентичную аминокислотной последовательности SEQ ID NO: 106, последовательность CDR3 тяжелой цепи, идентичную аминокислотной последовательности SEQ ID NO: 107.
17. Триспецифический связывающий белок по любому из пп. 1-5, где первый антигенсвязывающий участок содержит аминокислотную последовательность вариабельного домена тяжелой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 85, и аминокислотную последовательность вариабельного домена легкой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 86.
18. Триспецифический связывающий белок по любому из пп. 1 или 6-16, где второй антигенсвязывающий участок связывает нектин-4 и содержит аминокислотную последовательность вариабельного домена тяжелой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 179, и аминокислотную последовательность вариабельного домена легкой цепи, по меньшей мере на 90% идентичную SEQ ID NO: 183.
19. Триспецифический связывающий белок по любому из пп. 1, 6-16 или 18, где второй антигенсвязывающий сайт включает:
CDR1 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 180;
CDR2 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 181;
CDR3 тяжелой цепи, содержащую аминокислотную последовательность SEQ ID NO: 182;
CDR1 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 184;
CDR2 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 185; и
CDR3 легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 186.
20. Триспецифический связывающий белок по любому из пп. 1-19, где Fc-домен антитела содержит шарнир и CH2-домены человеческого антитела IgG1.
21. Триспецифический связывающий белок по п. 20, где Fc-домен содержит аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 234-332 человеческого антитела IgG1.
22. Триспецифический связывающий белок по п. 21, где Fc-домен содержит аминокислотную последовательность, по меньшей мере на 90% идентичную Fc-домену человеческого IgG1, и отличается по одному или более положениям, выбранным из группы, состоящей из Q347, Y349, L351, S354, E356, E357, K360, Q362, S364, T366, L368, K370, N390, K392, T394, D399, S400, D401, F405, Y407, K409, T411 и K439.
23. Триспецифический связывающий белок по любому из пп. 1-22, где белок связывается с NKG2D с KD 10 нМ или более слабой аффинностью.
24. Фармацевтический состав для лечения злокачественной опухоли, содержащий эффективное количество триспецифического белка по любому из пп. 1-23 и фармацевтически приемлемый носитель.
25. Клетка-хозяин для экспрессии белка по любому из пп. 1-23, содержащая один или более экспрессионных векторов, обеспечивающих продукцию/получение белка по любому из пп. 1-23.
26. Способ прямого или косвенного усиления гибели экспрессирующей нектин-4 опухолевой клетки, включающий воздействие триспецифического белка по любому из пп. 1-23 нa опухолевую клетку и клетки-естественные киллеры.
27. Способ лечения злокачественной опухоли, где способ включает введение пациенту триспецифического белка по любому из пп. 1-23 или состава по п. 24, где подлежащая лечению злокачественная опухоль выбрана из группы, состоящей из рака яичников, злокачественной опухоли эндометрия, рака поджелудочной железы, рака легких, рака щитовидной железы, рака мочевого пузыря, рака молочной железы, колоректального рака, мелкоклеточного рака легких, нейробластомы, рака печени, злокачественной опухоли почки, меланомы, рака шейки матки, рака предстательной железы, остеосаркомы, злокачественной опухоли головного мозга, рака желудка и холангиокарциномы.
28. Способ прямого или косвенного усиления гибели опухолевой клетки, включающий воздействие триспецифического белка по любому из пп. 1-23 нa экспрессирующую нектин-4 опухолевую клетку и клетку-естественного киллера in vitro или ex vivo.
| US 20150056206 A1, 26.02.2015 | |||
| US 20170029529 A1, 02.02.2017 | |||
| WO 2017081190 A1, 18.05.2017 | |||
| US 20140112926 A1, 24.04.2014 | |||
| AHMAD Z.A | |||
| et al.: "scFv antibody: principles and clinical application", Clin | |||
| Dev | |||
| Immunol., 2012, v | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| US 20120269723 A1, 25.10.2012 | |||
| WO 2016134371 A2, 25.08.2016 | |||
| RU 2015143457 A1, 19.04.2017. | |||
Авторы
Даты
2024-04-03—Публикация
2018-09-07—Подача