Перекрестная ссылка на родственные заявки
[0001] По этой заявке испрашивается приоритет временной заявки на патент США № 62/641988, поданной 12 марта 2018 г., временной заявки на патент США № 62/794517, поданной 18 января 2019 г., и временной заявки на патент США № 62/812225, поданной 28 февраля 2019 г. По заявке также испрашивается приоритет заявки на европейский патент EP 19161964.2, поданной 11 марта 2019 г.; которые в полном объеме включены в настоящее описание посредством ссылки.
Представление списка последовательностей в электронном виде в текстовом файле ASCII
[0002] Настоящая заявка содержит список последовательностей, который был представлен в текстовом файле ascii и который в полном объеме включен в настоящий документ посредством ссылки: компьютерно-читаемая форма (crf) списка последовательностей (название файла 750322001640seqlist.txt, дата записи: 11 марта 2019 г., размер: 14 кб).
Область техники, к которой относится изобретение
[0003] Настоящее изобретение, в общем, относится к иммунным клеткам, содержащим антиген и адъювант, способам получения таких модифицированных иммунных клеток и способам применения таких модифицированных иммунных клеток для лечения заболевания, ассоциированного с ВПЧ, профилактики заболевания, ассоциированного с впч, и для модуляции иммунного ответа у человека с заболеванием, ассоцированным с ВПЧ.
Уровень техники
[0004] Папилломавирусы представляют небольшие безоболочечные днк-вирусы с размером вириона приблизительно 55 нм в диаметре. Полностью охарактеризовано более 100 генотипов ВПЧ, и предполагается, что существует большее их количество. ВПЧ является известной причиной рака шейки матки, а также некоторых видов рака вульвы, влагалища, полового члена, орофарингеального рака, рака анального канала и прямой кишки. несмотря на то, что большинство инфекций ВПЧ протекают бессимптомно и проходят спонтанно, стойкие инфекции, вызванные одним из онкогенных типов ВПЧ, могут прогрессировать до предракового состояния или рака. Другие заболевания, ассоциированные с ВПЧ, могут включать обычные бородавки, подошвенные бородавки, плоские бородавки, аногенитальные бородавки, анальные поражения, эпидермодисплазию, очаговую эпителиальную гиперплазию, папилломы в ротовой полости, веррукозные кисты, папилломатоз гортани, плоскоклеточные интраэпителиальные поражения (sil), цервикальные интраэпителиальные поражения, интраэпителиальную неоплазию вульвы (vin) и интраэпителиальную неоплазию влагалища (vain).
[0005] Многие из известных типов вируса папилломы человека (ВПЧ) вызывают доброкачественные поражения, некоторые из которых являются онкогенными. На основании эпидемиологических и филогенетических взаимосвязей типы ВПЧ классифицируются на пятнадцать «типов высокого онкогенного риска» (ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 и 82) и три «типа вероятного высокого онкогенного риска» (ВПЧ 26, 53 и 66), которые вместе, как известно, проявляются в виде изменений шейки матки низкой и высокой степени и рака, а также других аногенитальных типов рака, таких как рак вульвы, влагалища, полового члена, анального канала и рак кожи перианальной области, а также опухоли головы и шеи. Недавно также была описана связь ВПЧ типов 16 и 18 высокого онкогенного риска с раком молочной железы. Одиннадцать типов ВПЧ, классифицируемых как «типы низкого онкогенного риска» (ВПЧ 6, 11, 40, 42, 43, 44, 54, 61, 70, 72 и 81), как известно, проявляются в виде доброкачественных изменений шейки матки низкой степени, генитальных бородавок и рецидивирующего респираторного папилломатоза. Кожные типы ВПЧ 5, 8 и 92 связаны с раком кожи. При некоторых формах рака, ассоциированных с ВПЧ, иммунная система угнетена и, соответственно, противоопухолевый ответ значительно нарушен. См. Suresh and Burtness, Am. J. Hematol. Oncol., 13 (6): 20-27 (2017).
[0006] Иммунотерапию можно разделить на два основных типа вмешательств: пассивную и активную. Протоколы пассивной стратегии включают введение предварительно активированных и/или сконструированных клеток, терапевтических антител, специфичных для заболевания, и/или цитокинов. Стратегии активной иммунотерапии направлены на стимуляцию эффекторных функций иммунной системы in vivo. Несколько действующих в настоящее время активных протоколов включают стратегии вакцинации ассоциированными с заболеванием пептидами, лизатами или аллогенными цельными клетками, инфузию аутологичных DC в качестве носителей для доставки опухолевого антигена и введение модуляторов иммунных контрольных точек. См. Papaioannou, Nikos E. et al., Annals of translational medicine 4.14 (2016). Адоптивную иммунотерапию можно использовать для модуляции иммунного ответа, усиления противоопухолевой активности и достижения цели лечения или профилактики рака, ассоциированного с ВПЧ.
[0007] Цитотоксические CD8+ Т-лимфоциты (CTL) и CD4+ Т-хелперы (Th), стимулированные антигенами, ассоциированными с заболеванием, обладают потенциалом нацеливать и уничтожать патологические клетки. Способы, описанные здесь, используются для получения модифицированных иммунных клеток de novo с высокой пропускной способностью и эффективностью, тем самым для индукции сильного Т-клеточного ответа на антигены ВПЧ.
[0008] Все ссылки, цитированные в настоящем описании, включая патентные заявки и публикации, в полном объеме включены здесь посредством ссылки. Патентные публикации WO2017041050, WO2016070136 в полном объеме включены здесь посредством ссылки.
Сущность изобретения
[0009] В некоторых аспектах изобретение относится к способу лечения заболевания, ассоциированного с вирусом папилломы человека (ВПЧ), у субъекта, включающему введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, где адъювант присутствует внутриклеточно. В некоторых аспектах изобретение относится к способу профилактики заболевания, ассоциированного с ВПЧ, у субъекта, включающему введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, где адъювант присутствует внутриклеточно. В некоторых аспектах изобретение относится к способу модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, включающему введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, где адъювант присутствует внутриклеточно.
[0010] В некоторых вариантах осуществления изобретение относится к способу лечения заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген впч и адъювант, где адъювант присутствует внутриклеточно; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген впч и адъювант прошли через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых вариантах осуществления изобретение относится к способу профилактики заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген впч и адъювант, где адъювант присутствует внутриклеточно; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ и адъювант прошли через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых вариантах осуществления изобретение относится к способу модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с впч, включающему введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, где адъювант присутствует внутриклеточно; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген впч и адъювант прошли через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена впч и адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых вариантах осуществления диаметр сужения меньше диаметра клетки. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 20% до 99% от диаметра клетки. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 20% до приблизительно 60% от диаметра клетки. В некоторых вариантах осуществления сужение находится в канале. В некоторых вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение.
[0011] В некоторых вариантах осуществления антиген впч и/или адъювант находятся в цитозоле и/или эндосомах. В некоторых вариантах осуществления антиген и/или адъювант находятся во многих компартментах клетки. В некоторых вариантах осуществления модифицированная иммунная клетка дополнительно содержит антиген впч и/или адъювант вне клетки. В некоторых вариантах осуществления концентрация адъюванта, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкм до приблизительно 1 мм. В некоторых вариантах осуществления концентрация антигена впч, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкм до приблизительно 1 мм. В некоторых вариантах осуществления соотношение антигена впч и адъюванта, инкубированных с пертурбированной входной клеткой, составляет от приблизительно 10000:1 до приблизительно 1:10000.
[0012] В некоторых вариантах осуществления иммунный ответ усиливается. В некоторых вариантах осуществления иммунный ответ усиливается на антиген впч.
[0013] В некоторых вариантах осуществления адъювант представляет cpg odn, ifn-α, агонисты sting, агонисты rig-i или поли i:c. В некоторых вариантах осуществления адъювант представляет cpg odn. В некоторых вариантах осуществления cpg odn представляет cpg odn 1018, cpg odn 1826 или cpg odn 2006. В некоторых вариантах осуществления модифицированная иммунная клетка содержит более одного адъюванта.
[0010] В некоторых вариантах осуществления антиген впч представляет пул множества полипептидов, которые вызывают ответ против одного и того же или разных антигенов впч.
[0015] В некоторых вариантах осуществления антиген в пуле множества антигенов не снижает иммунный ответ, направленный против других антигенов в пуле множества антигенов. В некоторых вариантах осуществления антиген ВПЧ представляет полипептид, содержащий антигенный эпитоп ВПЧ и одну или более гетерологичных пептидных последовательностей. В некоторых вариантах осуществления антиген ВПЧ образует комплекс сам с собой, с другими антигенами или с адъювантом. В некоторых вариантах осуществления антиген ВПЧ представляет антиген ВПЧ-16 или ВПЧ-18. В некоторых вариантах осуществления антиген ВПЧ состоит из HLA-A2-рестриктированного эпитопа. В некоторых вариантах осуществления антиген ВПЧ представляет антиген ВПЧ E6 или антиген ВПЧ E7. В некоторых вариантах осуществления модифицированная иммунная клетка содержит антиген ВПЧ E6 и антиген ВПЧ E7. В некоторых вариантах осуществления антиген ВПЧ представляет полипептид, содержащий антигенный эпитоп, фланкированный на N-конце и/или C-конце одной или более гетерологичными пептидными последовательностями. В некоторых вариантах осуществления, HLA-A2-рестриктированный пептид, содержит аминокислотную последовательность согласно любой из SEQ ID NO:1-4. В некоторых вариантах осуществления N-концевой фланкирующий полипептид содержит аминокислотную последовательность согласно любой из SEQ ID NO: 5-10 и/или C-концевой фланкирующий полипептид содержит аминокислотную последовательность согласно любой из SEQ ID NO: 11-17. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность, по меньшей мере, с 90% сходством с любой из SEQ ID NO: 18-26. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность, по меньшей мере, с 90% сходством с SEQ ID NO: 23. В некоторых вариантах осуществления антиген ВПЧ способен процессироваться в пептид, рестриктированный классом I MHC. В некоторых вариантах осуществления антиген ВПЧ способен процессироваться в пептид, рестриктированный классом II MHC.
[0016] В некоторых вариантах осуществления модифицированная иммунная клетка содержит адъювант в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления модифицированная иммунная клетка содержит антиген ВПЧ в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления соотношение антигена ВПЧ и адъюванта составляет от приблизительно 10000:1 до приблизительно 1:10000.
[0017] В некоторых вариантах осуществления модифицированная иммунная клетка дополнительно содержит агент, который повышает жизнеспособность и/или функцию модифицированной иммунной клетки по сравнению с соответствующей модифицированной иммунной клеткой, которая не включает агент. В некоторых вариантах осуществления агент представляет собой соединение, усиливающее эндоцитоз, стабилизирующий агент или кофактор. В некоторых вариантах осуществления агент представляет альбумин. В некоторых вариантах осуществления альбумин представляет мышиный, бычий или человеческий альбумин. В некоторых вариантах осуществления агент представляет катион двухвалентного металла, глюкозу, АТФ, калий, глицерин, трегалозу, D-сахарозу, PEG1500, L-аргинин, L-глутамин или ЭДТА. В некоторых вариантах осуществления агент включает сывороточный альбумин мыши (MSA). В некоторых вариантах осуществления модифицированные иммунные клетки дополнительно модифицируют для увеличения экспрессии одной или более костимулирующих молекул. В некоторых вариантах осуществления костимулирующая молекула представляет B7-H2, B7-1, B7-2, CD70, LIGHT, HVEM, CD40, 4-1BBL, OX40L, TL1A, GITRL, CD30L, TIM4, SLAM, CD48, CD58, CD155 или CD112. В некоторых вариантах осуществления клетка содержит нуклеиновую кислоту, которая приводит к повышенной экспрессии одной или более костимулирующих молекул.
[0018] В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку, дендритную клетку, моноцит, макрофаг, миелоидную клетку, гранулоцит, нейтрофил, тучную клетку, естественную клетку-киллер, врожденную лимфоидную клетку, базофил или гематопоэтическую клетку-предшественник. В некоторых вариантах осуществления иммунная клетка не является В-клеткой.
[0019] В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса I. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса II. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для снижения экспрессии молекул MHC класса I и/или молекул MHC класса II. В некоторых вариантах осуществления дополнительная модификация включает снижение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием siРНК, shРНК, CRISPR/Cas9, ZFN, TALEN, Cre-рекомбиназы или мегануклеазы. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для повышения экспрессии молекул MHC класса I и/или молекул MHC класса II. В некоторых вариантах осуществления дополнительная модификация включает повышение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием РНК или плазмидной ДНК. В некоторых вариантах осуществления в аллогенном контексте врожденный иммунный ответ, развившийся у субъекта в ответ на введение дополнительно модифицированных Т-клеток, снижен, в аллогенном контексте, по сравнению с врожденным иммунным ответом, развившимся у субъекта в ответ на введение соответствующих модифицированных Т-клеток, которые не содержат дополнительную модификацию. В некоторых вариантах осуществления период полужизни в кровотоке дополнительно модифицированных Т-клеток у субъекта, которому они были введены, модулируется по сравнению с периодом полужизни в кровотоке соответствующих модифицированных Т-клеток, которые не включают дополнительную модификацию, у субъекта, которому они были введены. В некоторых вариантах осуществления Т-клетка включает одно или более из Т-хелперов, цитотоксических Т-клеток, Т-клеток памяти, CIK-клеток и естественных Т-клеток-киллеров. В некоторых вариантах осуществления Т-клетка включает одно или более из CD3+ Т-клеток, CD4+ Т-клеток, CD8+ Т-клеток, CD45RA+ Т-клеток, CD45RO+ Т-клеток и γδ-Т-клеток. В некоторых вариантах осуществления модифицированная клетка является аллогенной для субъекта. В некоторых вариантах осуществления модифицированная клетка является аутологичной для субъекта. В некоторых вариантах осуществления субъект предварительно кондиционирован к модулированному воспалению и/или модулированному иммунному ответу.
[0020] В некоторых вариантах осуществления способы дополнительно включают введение субъекту адъюванта. В некоторых вариантах осуществления адъювант представляет собой IFNα или CpG ODN. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, и адъювант, вводят одновременно. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, и адъювант, вводят последовательно. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят до введения адъюванта. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят после введения адъюванта.
[0021] В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят в комбинации с введением ингибитора иммунных контрольных точек. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, и ингибитор иммунных контрольных точек, вводят одновременно. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, и ингибитор иммунных контрольных точек, вводят последовательно. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят до введения ингибитора иммунных контрольных точек. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят после введения ингибитора иммунных контрольных точек. В некоторых вариантах осуществления ингибитор иммунных контрольных точек нацелен на одно или более из PD-1, PD-L1, CTLA-4, LAG3 или TIM-3. В некоторых вариантах осуществления ингибитор иммунных контрольных точек нацелен на одно или более из PD-1, PD-L1, CTLA-4, LAG3, TIM-3, TIGIT, VISTA, TIM1, B7-H4 (VTCN1) или BTLA.
[0022] В некоторых вариантах осуществления введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии цитотоксических Т-лимфоцитов (CTL), специфических для антигена ВПЧ. В некоторых вариантах осуществления введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии Т(Th)-хелперов, специфических для антигена.
[0023] В некоторых вариантах осуществления эффективное количество композиции составляет от приблизительно 1×106 до приблизительно 1×1012 модифицированных иммунных клеток. В некоторых вариантах осуществления способ включает многократное введение композиции, содержащей модифицированные иммунные клетки. В некоторых вариантах осуществления способ включает первое введение композиции, содержащей модифицированные иммунные клетки, с последующим вторым введением композиции, содержащей модифицированные иммунные клетки. В некоторых вариантах осуществления второе введение проводят приблизительно через один месяц после первого введения.
[0024] В некоторых вариантах осуществления заболевание, ассоциированное с ВПЧ, представляет собой рак, ассоциированный с ВПЧ. В некоторых вариантах осуществления изобретения рак, ассоциированный с ВПЧ, представляет собой рак шейки матки, рак анального канала, орофарингеальный рак, рак влагалища, рак вульвы, рак полового члена, рак кожи или опухоли головы и шеи. В некоторых вариантах осуществления изобретения заболевание, ассоциированное с ВПЧ, представляет собой инфекционное заболевание, ассоциированное с ВПЧ.
[0025] В некоторых аспектах изобретение относится к способу лечения заболевания, ассоциированного с вирусом папилломы человека (ВПЧ), у субъекта, включающему введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки включают антиген ВПЧ, содержащий аминокислотную последовательность, по меньшей мере, с 90% сходством с любой из SEQ ID NO: 18-25. В некоторых аспектах изобретение относится к способу профилактики заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки включают антиген ВПЧ, содержащий аминокислотную последовательность, по меньшей мере, с 90% сходством с любой из SEQ ID NO: 18-25. В некоторых аспектах изобретение относится к способу модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки включают антиген ВПЧ, содержащий аминокислотную последовательность, по меньшей мере, с 90% сходством с любой из SEQ ID NO: 18-25. В некоторых вариантах осуществления модифицированные иммунные клетки включают антиген ВПЧ, содержащий аминокислотную последовательность согласно любой из SEQ ID NO: 18-25. В некоторых вариантах осуществления модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность SEQ ID NO: 23.
[0026] В некоторых аспектах изобретение относится к способу лечения заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки включают антиген ВПЧ, содержащий аминокислотную последовательность по меньшей мере с 90% сходством с любой из SEQ ID NO: 18-25; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ прошел через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клетокВ некоторых аспектах изобретение относится к способу профилактики заболевания, ассоциированного с ВПЧ, у субъекта, включающему введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность, по меньшей мере, с 90% сходством с любой из SEQ ID NO: 18-25; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ прошел через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых аспектах изобретение относится к способу модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность, по меньшей мере, с 90% сходством с любой из SEQ ID NO: 18-25; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ прошел через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых вариантах осуществления модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность согласно любой из SEQ ID NO: 18-25. В некоторых вариантах осуществления модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность SEQ ID NO: 23. В некоторых вариантах осуществления диаметр сужения меньше диаметра клетки. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 20% до 99% от диаметра клетки. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 20% до приблизительно 60% от диаметра клетки. В некоторых вариантах осуществления сужение находится в канале. В некоторых вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение.
[0027] В некоторых вариантах осуществления способ дополнительно включает введение субъекту адъюванта. В некоторых вариантах осуществления адъювант представляет собой IFNα или CpG ODN. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, и адъювант, вводят одновременно. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, и адъювант, вводят последовательно. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят до введения адъюванта. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят после введения адъюванта. В некоторых вариантах осуществления модифицированная иммунная клетка дополнительно содержит адъювант. В некоторых вариантах осуществления пертурбированную иммунную клетку на стадии b инкубируют с антигеном ВПЧ и адъювантом. В некоторых вариантах осуществления антиген ВПЧ и/или адъювант находятся в цитозоле и/или эндосомах. В некоторых вариантах осуществления антиген и/или адъювант находятся во многих компартментах клетки. В некоторых вариантах осуществления модифицированная иммунная клетка дополнительно содержит антиген ВПЧ и/или адъювант вне клетки.
[0028] В некоторых вариантах осуществления концентрация адъюванта, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления концентрация антигена ВПЧ, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления соотношение антигена ВПЧ и адъюванта, инкубированных с пертурбированной входной клеткой, составляет от приблизительно 10000:1 до приблизительно 1:10000.
[0029] В некоторых вариантах осуществления иммунный ответ усиливается. В некоторых вариантах осуществления иммунный ответ усиливается на антиген ВПЧ.
[0030] В некоторых вариантах осуществления изобретения адъювант представляет собой CpG ODN, IFN-α, агонисты STING, агонисты RIG-I или поли I:C. В некоторых вариантах осуществления адъювант представляет собой CpG ODN. В некоторых вариантах осуществления CpG ODN представляет собой CpG ODN 1018, CpG ODN 1826 или CpG ODN 2006. В некоторых вариантах осуществления модифицированная иммунная клетка содержит более одного адъюванта.
[0031] В некоторых вариантах осуществления антиген ВПЧ представляет собой пул множества полипептидов, которые вызывают ответ против одного и того же или разных антигенов ВПЧ. В некоторых вариантах осуществления антиген в пуле множества антигенов не снижает иммунный ответ, направленный против других антигенов в пуле множества антигенов. В некоторых вариантах осуществления антиген ВПЧ представляет собой полипептид, содержащий антигенный эпитоп ВПЧ и одну или более гетерологичных пептидных последовательностей. В некоторых вариантах осуществления антиген ВПЧ комплексуется сам с собой, с другими антигенами или с адъювантом. В некоторых вариантах осуществления антиген ВПЧ представляет собой антиген ВПЧ-16 или ВПЧ-18. В некоторых вариантах осуществления антиген ВПЧ состоит из HLA-A2-рестриктированного эпитопа. В некоторых вариантах осуществления антиген ВПЧ представляет собой антиген ВПЧ E6 или антиген ВПЧ E7. В некоторых вариантах осуществления модифицированная иммунная клетка содержит антиген ВПЧ E6 и антиген ВПЧ E7. В некоторых вариантах осуществления антиген ВПЧ представляет собой полипептид, содержащий антигенный эпитоп, фланкированный на N-конце и/или C-конце одной или более гетерологичными пептидными последовательностями. В некоторых вариантах осуществления антиген ВПЧ способен процессироваться в пептид, рестриктированный классом I MHC. В некоторых вариантах осуществления антиген ВПЧ способен процессироваться в пептид, рестриктированный классом II MHC.
[0032] В некоторых вариантах осуществления модифицированная иммунная клетка содержит адъювант в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления модифицированная иммунная клетка содержит антиген ВПЧ в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления соотношение антигена ВПЧ и адъюванта составляет от приблизительно 10000:1 до приблизительно 1:10000.
[0033] В некоторых вариантах осуществления модифицированная иммунная клетка дополнительно содержит агент, который повышает жизнеспособность и/или функцию модифицированной иммунной клетки по сравнению с соответствующей модифицированной иммунной клеткой, которая не включает агента. В некоторых вариантах осуществления агент представляет собой соединение, усиливающее эндоцитоз, стабилизирующий агент или кофактор. В некоторых вариантах осуществления агент представляет собой альбумин. В некоторых вариантах осуществления альбумин представляет собой мышиный, бычий и человеческий альбумин. В некоторых вариантах осуществления агент представляет собой катион двухвалентного металла, глюкозу, АТФ, калий, глицерин, трегалозу, D-сахарозу, PEG1500, L-аргинин, L-глутамин или ЭДТА. В некоторых вариантах осуществления агент включает сывороточный альбумин мыши (MSA). В некоторых вариантах осуществления модифицированные иммунные клетки дополнительно модифицируют для повышения экспрессии одной или более костимулирующих молекул. В некоторых вариантах осуществления костимулирующая молекула представляет собой B7-H2, B7-1, B7-2, CD70, LIGHT, HVEM, CD40, 4-1BBL, OX40L, TL1A, GITRL, CD30L, TIM4, SLAM, CD48, CD58, CD155 или CD112. В некоторых вариантах осуществления клетка содержит нуклеиновую кислоту, которая приводит к повышенной экспрессии одной или более костимулирующих молекул.
[0034] В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку, дендритную клетку, моноцит, макрофаг, миелоидную клетку, гранулоцит, нейтрофил, тучную клетку, естественную клетку-киллер, врожденную лимфоидную клетку, базофил или гематопоэтическую клетку-предшественник. В некоторых вариантах осуществления иммунная клетка не является В-клеткой.
[0035] В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса I. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса II. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для снижения экспрессии молекул MHC класса I и/или молекул MHC класса II. В некоторых вариантах осуществления дополнительная модификация включает снижение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием siРНК, shРНК, CRISPR/Cas9, ZFN, TALEN, Cre-рекомбиназы или мегануклеазы. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для повышения экспрессии молекул MHC класса I и/или молекул MHC класса II. В некоторых вариантах осуществления дополнительная модификация включает повышение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием РНК или плазмидной ДНК. В некоторых вариантах осуществления в аллогенном контексте врожденный иммунный ответ, развившийся у субъекта в ответ на введение дополнительно модифицированных Т-клеток, снижен, в аллогенном контексте, по сравнению с врожденным иммунным ответом, развившимся у субъекта в ответ на введение соответствующих модифицированных Т-клеток, которые не содержат дополнительную модификацию. В некоторых вариантах осуществления период полужизни в кровотоке дополнительно модифицированных Т-клеток у субъекта, которому они были введены, модулируется по сравнению с периодом полужизни в кровотоке соответствующих модифицированных Т-клеток, которые не включают дополнительную модификацию, у субъекта, которому они были введены. В некоторых вариантах осуществления Т-клетка включает одно или более из Т-хелперов, цитотоксических Т-клеток, Т-клеток памяти, CIK-клеток и естественных Т-клеток-киллеров. В некоторых вариантах осуществления Т-клетка включает одно или более из CD3+ Т-клеток, CD4+ Т-клеток, CD8+ Т-клеток, CD45RA+ Т-клеток, CD45RO+ Т-клеток и γδ-Т-клеток. В некоторых вариантах осуществления модифицированная клетка является аллогенной для субъекта. В некоторых вариантах осуществления модифицированная клетка является аутологичной для субъекта. В некоторых вариантах осуществления субъект предварительно кондиционирован к модулированному воспалению и/или модулированному иммунному ответу.
[0036] В некоторых вариантах осуществления способы дополнительно включают введение субъекту адъюванта. В некоторых вариантах осуществления адъювант представляет собой IFNα или CpG ODN. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, и адъювант, вводят одновременно. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, и адъювант, вводят последовательно. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят до введения адъюванта. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят после введения адъюванта.
[0037] В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят в комбинации с введением ингибитора иммунных контрольных точек. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, и ингибитор иммунных контрольных точек, вводят одновременно. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, и ингибитор иммунных контрольных точек, вводят последовательно. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят до введения ингибитора иммунных контрольных точек. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят после введения ингибитора иммунных контрольных точек. В некоторых вариантах осуществления ингибитор иммунных контрольных точек нацелен на одно или более из PD-1, PD-L1, CTLA-4, LAG3 или TIM-3. В некоторых вариантах осуществления ингибитор иммунных контрольных точек нацелен на одно или более из PD-1, PD-L1, CTLA-4, LAG3, TIM-3, TIGIT, VISTA, TIM1, B7-H4 (VTCN1) или BTLA.
[0038] В некоторых вариантах осуществления введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии цитотоксических Т-лимфоцитов (CTL), специфических для антигена ВПЧ. В некоторых вариантах осуществления введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии Т(Th)-хелперов, специфических для антигена.
[0039] В некоторых вариантах осуществления эффективное количество композиции составляет от приблизительно 1×106 до приблизительно 1×1012 модифицированных иммунных клеток. В некоторых вариантах осуществления способ включает многократное введение композиции, содержащей модифицированные иммунные клетки. В некоторых вариантах осуществления способ включает первое введение композиции, содержащей модифицированные иммунные клетки, с последующим вторым введением композиции, содержащей модифицированные иммунные клетки. В некоторых вариантах осуществления второе введение проводят приблизительно через один месяц после первого введения.
[0040] В некоторых вариантах осуществления заболевание, ассоциированное с ВПЧ, представляет собой рак, ассоциированный с ВПЧ. В некоторых вариантах осуществления изобретения рак, ассоциированный с ВПЧ, представляет собой рак шейки матки, рак анального канала, орофарингеальный рак, рак влагалища, рак вульвы, рак полового члена, рак кожи или опухоли головы и шеи. В некоторых вариантах осуществления изобретения заболевание, ассоциированное с ВПЧ, представляет собой инфекционное заболевание, ассоциированное с ВПЧ.
[0041] В некоторых аспектах изобретение относится к композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно CpG ODN и антиген ВПЧ, по меньшей мере, с 90% сходством с любой из SEQ ID NO: 18-25. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность, по меньшей мере, с 90% сходством с SEQ ID NO: 23. В некоторых вариантах осуществления модифицированные иммунные клетки содержат внутриклеточно CpG ODN и антиген ВПЧ, где антиген ВПЧ содержит аминокислотную последовательность согласно любой из SEQ ID NO: 18-25. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность SEQ ID NO: 23.
[0042] В некоторых вариантах осуществления модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ и CpG ODN прошли через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ и CpG ODN в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и CpG ODN в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток клетки. В некоторых вариантах осуществления диаметр сужения меньше диаметра клетки. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 20% до приблизительно 99% от диаметра клетки. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 20% до приблизительно 60% от диаметра клетки. В некоторых вариантах осуществления сужение находится в канале. В некоторых вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение.
[0043] В некоторых вариантах осуществления композиция дополнительно содержит адъювант. В некоторых вариантах осуществления антиген ВПЧ и/или CpG ODN находятся в цитозоле и/или эндосомах. В некоторых вариантах осуществления антиген и/или CpG ODN находятся во многих компартментах клетки. В некоторых вариантах осуществления модифицированная иммунная клетка дополнительно содержит антиген ВПЧ и/или CpG ODN на поверхности клетки. В некоторых вариантах осуществления концентрация CpG ODN, инкубированных с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления концентрация антигена ВПЧ, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления соотношение антигена ВПЧ и CpG ODN, инкубированных с пертурбированной входной клеткой, составляет от приблизительно 10000:1 до приблизительно 1:10000. В некоторых вариантах осуществления CpG ODN представляет собой CpG ODN 1018, CpG ODN 1826 или CpG ODN 2006. В некоторых вариантах осуществления модифицированная иммунная клетка содержит более одного адъюванта. В некоторых вариантах осуществления адъювант включает CpG ODN, IFN-α, агонисты STING, агонисты RIG-I или поли I:C.
[0044] В некоторых вариантах осуществления антиген ВПЧ представляет собой пул множества полипептидов, которые вызывают ответ против одного и того же или разных антигенов ВПЧ. В некоторых вариантах осуществления антиген в пуле множества антигенов не снижает иммунный ответ, направленный против других антигенов в пуле множества антигенов. В некоторых вариантах осуществления антиген ВПЧ представляет собой полипептид, содержащий антигенный эпитоп ВПЧ и одну или более гетерологичных пептидных последовательностей. В некоторых вариантах осуществления антиген ВПЧ обрезует комплекс сам с собой, с другими антигенами, с адъювантом или с CpG ODN. В некоторых вариантах осуществления антиген ВПЧ состоит из HLA-A2-рестриктированного эпитопа. В некоторых вариантах осуществления антиген ВПЧ представляет собой полипептид, содержащий антигенный эпитоп, фланкированный на N-конце и/или C-конце одной или более гетерологичными пептидными последовательностями.
[0045] В некоторых вариантах осуществления модифицированная иммунная клетка содержит CpG ODN в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления модифицированная иммунная клетка содержит антиген ВПЧ в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления соотношение антигена ВПЧ и CpG ODN составляет от приблизительно 10000:1 до приблизительно 1:10000.
[0046] В некоторых аспектах изобретение включает композицию, содержащую модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, где антиген ВПЧ содержит аминокислотную последовательность, по меньшей мере, с 90% сходством с любой из SEQ ID NO: 18-25. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% сходством с SEQ ID NO: 23. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность согласно любой из SEQ ID NO: 18-25. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность SEQ ID NO: 23.
[0047] В некоторых вариантах осуществления модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ прошел через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых вариантах осуществления диаметр сужения меньше диаметра клетки. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 20% до приблизительно 99% от диаметра клетки. В некоторых вариантах осуществления диаметр сужения составляет приблизительно 20% до приблизительно 60% от диаметра клетки. В некоторых вариантах осуществления сужение находится в канале. В некоторых вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение.
[0048] В некоторых вариантах осуществления композиция дополнительно содержит адъювант. В некоторых вариантах осуществления антиген ВПЧ и/или адъювант находятся в цитозоле и/или эндосомах. В некоторых вариантах осуществления антиген и/или адъювант находятся во многих компартментах клетки. В некоторых вариантах осуществления модифицированная иммунная клетка дополнительно содержит антиген ВПЧ и/или адъювант на поверхности клетки. В некоторых вариантах осуществления концентрация адъюванта, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления концентрация антигена ВПЧ, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления соотношение антигена ВПЧ и адъюванта, инкубированных с пертурбированной входной клеткой, составляет от приблизительно 10000:1 до приблизительно 1:10000. В некоторых вариантах осуществления адъювант представляет собой CpG ODN, IFN-α, агонисты STING, агонисты RIG-I или поли I:C. В некоторых вариантах осуществления адъювант представляет собой CpG ODN. В некоторых вариантах осуществления CpG ODN представляет собой CpG ODN 1018, CpG ODN 1826 или CpG ODN 2006. В некоторых вариантах осуществления модифицированная иммунная клетка содержит более одного адъюванта.
[0049] В некоторых вариантах осуществления антиген ВПЧ представляет собой пул множества полипептидов, которые вызывают ответ против одного и того же или разных антигенов ВПЧ. В некоторых вариантах осуществления антиген в пуле множества антигенов не снижает иммунный ответ, направленный против других антигенов в пуле множества антигенов. В некоторых вариантах осуществления антиген ВПЧ представляет собой полипептид, содержащий антигенный эпитоп ВПЧ и одну или более гетерологичных пептидных последовательностей. В некоторых вариантах осуществления антиген ВПЧ комплексуется сам с собой, с другими антигенами или с адъювантом. В некоторых вариантах осуществления антиген ВПЧ состоит из HLA-A2-рестриктированного эпитопа. В некоторых вариантах осуществления модифицированная иммунная клетка содержит адъювант в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления модифицированная иммунная клетка содержит антиген ВПЧ в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления отношение антигена ВПЧ к адъюванту составляет от приблизительно 10000:1 до приблизительно 1:10000. В некоторых вариантах осуществления антиген ВПЧ способен процессироваться в пептид, рестриктированный классом I MHC. В некоторых вариантах осуществления антиген ВПЧ способен процессироваться в пептид, рестриктированный классом II MHC.
[0050] В некоторых вариантах осуществления модифицированная иммунная клетка дополнительно содержит агент, который повышает жизнеспособность и/или функцию модифицированной иммунной клетки по сравнению с соответствующей модифицированной иммунной клеткой, которая не включает агента. В некоторых вариантах осуществления агент представляет собой соединение, усиливающее эндоцитоз, стабилизирующий агент или кофактор. В некоторых вариантах осуществления агент представляет собой альбумин. В некоторых вариантах осуществления альбумин представляет собой мышиный, бычий и человеческий альбумин. В некоторых вариантах осуществления агент представляет собой катион двухвалентного металла, глюкозу, АТФ, калий, глицерин, трегалозу, D-сахарозу, PEG1500, L-аргинин, L-глутамин или ЭДТА. В некоторых вариантах осуществления агент включает MSA. В некоторых вариантах осуществления клетки дополнительно модифицируют для повышения экспрессии одной или более костимулирующих молекул. В некоторых вариантах осуществления костимулирующая молекула представляет собой B7-H2 (ICOSL), B7-1 (CD80), B7-2 (CD86), CD70, LIGHT, HVEM, CD40, 4-1BBL, OX40L, TL1A, GITRL, CD30L, TIM4, SLAM, CD48, CD58, CD155 или CD112. В некоторых вариантах осуществления клетка содержит нуклеиновую кислоту, которая приводит к повышенной экспрессии одной или более костимулирующих молекул.
[0051] В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку, дендритную клетку, моноцит, макрофаг, миелоидную клетку, гранулоцит, нейтрофил, тучную клетку, естественную клетку-киллер, врожденную лимфоидную клетку, базофил или гематопоэтическую клетку-предшественник. В некоторых вариантах осуществления иммунная клетка не является В-клеткой. В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса I. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса II. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для снижения экспрессии молекул MHC класса I и/или молекул MHC класса II. В некоторых вариантах осуществления дополнительная модификация включает снижение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием siРНК, shРНК, CRISPR/Cas9, ZFN, TALEN, Cre-рекомбиназы или мегануклеазы. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для повышения экспрессии молекул MHC класса I и/или молекул MHC класса II. В некоторых вариантах осуществления дополнительная модификация включает повышение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием РНК или плазмидной ДНК. В некоторых вариантах осуществления в аллогенном контексте врожденный иммунный ответ, развившийся у субъекта в ответ на введение дополнительно модифицированных Т-клеток, снижен, в аллогенном контексте, по сравнению с врожденным иммунным ответом, развившимся у субъекта в ответ на введение соответствующих модифицированных Т-клеток, которые не содержат дополнительную модификацию. В некоторых вариантах осуществления период полужизни в кровотоке дополнительно модифицированных Т-клеток у субъекта, которому они были введены, модулируется по сравнению с периодом полужизни в кровотоке соответствующих модифицированных Т-клеток, которые не включают дополнительную модификацию, у субъекта, которому они были введены.
[0052] В некоторых вариантах осуществления изобретения Т-клетка включает одно или более из Т-хелперов, цитотоксических Т-клеток, Т-клеток памяти, CIK-клеток и естественных Т-клеток-киллеров. В некоторых вариантах осуществления Т-клетка включает одно или более из CD3+ Т-клеток, CD4+ Т-клеток, CD8+ Т-клеток, CD45RA+ Т-клеток, CD45RO+ Т-клеток и γδ-Т-клеток. В некоторых вариантах осуществления модифицированная клетка является аллогенной для субъекта. В некоторых вариантах осуществления модифицированная клетка является аутологичной для субъекта. В некоторых вариантах осуществления субъект предварительно кондиционирован к модулированному воспалению и/или модулированному иммунному ответу.
[0053] В некоторых вариантах осуществления композиция дополнительно содержит ингибитор иммунных контрольных точек. В некоторых вариантах осуществления ингибитор иммунных контрольных точек нацелен на одно или более из PD-1, PD-L1, CTLA-4, LAG3, TIM-3, LAG3, TIGIT, VISTA, TIM1, B7-H4 (VTCN1) или BTLA. В некоторых вариантах осуществления введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии цитотоксических Т-лимфоцитов (CTL), специфических для антигена ВПЧ. В некоторых вариантах осуществления введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии Т(Th)-хелперов, специфических для антигена.
[0054] В некоторых вариантах осуществления эффективное количество композиции составляет от приблизительно 1×106 до приблизительно 1×1012 модифицированных иммунных клеток. В некоторых вариантах осуществления антиген содержит аминокислотную последовательность, по меньшей мере, с 90% сходством с SEQ ID NO: 23. В некоторых вариантах осуществления антиген содержит аминокислотную последовательность SEQ ID NO: 23.
[0055] В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку, дендритную клетку, моноцит, макрофаг, миелоидную клетку, гранулоцит, нейтрофил, тучную клетку, естественную клетку-киллер, врожденную лимфоидную клетку, базофил или гематопоэтическую клетку-предшественник. В некоторых вариантах осуществления иммунная клетка не является В-клеткой. В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса I. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса II. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для снижения экспрессии молекул MHC класса I и/или молекул MHC класса II. В некоторых вариантах осуществления дополнительная модификация включает снижение экспрессии молекул MHC класса I и/или MHC класса II с использованием siРНК, shРНК, CRISPR/Cas9, ZFN, TALEN, Cre-рекомбиназы или мегануклеазы. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для повышения экспрессии молекул MHC класса I и/или молекул MHC класса II. В некоторых вариантах осуществления дополнительная модификация включает повышение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием РНК или плазмидной ДНК. В некоторых вариантах осуществления в аллогенном контексте врожденный иммунный ответ, развившийся у субъекта в ответ на введение дополнительно модифицированных Т-клеток, снижен, в аллогенном контексте, по сравнению с врожденным иммунным ответом, развившимся у субъекта в ответ на введение соответствующих модифицированных Т-клеток, которые не содержат дополнительную модификацию. В некоторых вариантах осуществления период полужизни в кровотоке дополнительно модифицированных Т-клеток у субъекта, которому они были введены, модулируется по сравнению с периодом полужизни в кровотоке соответствующих модифицированных Т-клеток, которые не включают дополнительную модификацию, у субъекта, которому они были введены.
[0056] В некоторых вариантах осуществления Т-клетка включает одно или более из Т-хелперов, цитотоксических Т-клеток, Т-клеток памяти, CIK-клеток и естественных Т-клеток-киллеров. В некоторых вариантах осуществления Т-клетка включает одно или более из CD3+ Т-клеток, CD4+ Т-клеток, CD8+ Т-клеток, CD45RA+ Т-клеток, CD45RO+ Т-клеток и γδ-Т-клеток. В некоторых вариантах осуществления модифицированная клетка является аллогенной для субъекта. В некоторых вариантах осуществления модифицированная клетка является аутологичной для субъекта. В некоторых вариантах осуществления субъект предварительно кондиционирован к модулированному воспалению и/или модулированному иммунному ответу.
[0057] В некоторых вариантах осуществления композиция дополнительно содержит ингибитор иммунных контрольных точек. В некоторых вариантах осуществления ингибитор иммунных контрольных точек нацелен на одно или более из PD-1, PD-L1, CTLA-4, LAG3 или TIM-3. В некоторых вариантах осуществления введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии цитотоксических Т-лимфоцитов (CTL), специфических для антигена ВПЧ. В некоторых вариантах осуществления введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии Т(Th)-хелперов, специфических для антигена.
[0058] В некоторых вариантах осуществления эффективное количество композиции составляет от приблизительно 1×106 до приблизительно 1×1012 модифицированных иммунных клеток. В некоторых вариантах осуществления антиген содержит аминокислотную последовательность, по меньшей мере, с 90% сходством с SEQ ID NO: 23. В некоторых вариантах осуществления антиген содержит аминокислотную последовательность SEQ ID NO: 23.
[0059] В некоторых аспектах изобретение относится к способу лечения или профилактики заболевания, ассоциированного с ВПЧ, у субъекта, включающему введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, где адъювант присутствует внутриклеточно; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, содержащую антиген ВПЧ, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген и адъювант прошли через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с адъювантом в течение достаточного периода времени для обеспечения проникновения адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых аспектах изобретение относится к способу лечения или профилактики заболевания, ассоциированного с ВПЧ, у субъекта, включающему введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, где адъювант присутствует внутриклеточно; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, содержащей адъювант, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ прошел через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток.
[0060] В некоторых вариантах осуществления диаметр сужения меньше диаметра клетки. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 20% до приблизительно 99% от диаметра клетки. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 20% до приблизительно 60% от диаметра клетки. В некоторых вариантах осуществления сужение находится в канале. В некоторых вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение.
[0061] В некоторых вариантах осуществления антиген ВПЧ и/или адъювант находятся в цитозоле и/или эндосомах. В некоторых вариантах осуществления антиген и/или адъювант находятся во многих компартментах клетки. В некоторых вариантах осуществления концентрация адъюванта, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления концентрация антигена ВПЧ, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0062] В некоторых вариантах осуществления изобретения адъювант представляет собой CpG ODN, IFN-α, агонисты STING, агонисты RIG-I или поли I:C. В некоторых вариантах осуществления адъювант представляет собой CpG ODN. В некоторых вариантах осуществления CpG ODN представляет собой CpG ODN 1018, CpG ODN 1826 или CpG ODN 2006.
[0063] В некоторых вариантах осуществления антиген ВПЧ представляет собой антиген ВПЧ-16 или ВПЧ-18. В некоторых вариантах осуществления антиген ВПЧ представляет собой антиген ВПЧ E6 или антиген ВПЧ E7. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность, по меньшей мере, с 90% сходством с любой из SEQ ID NO: 18-25. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность согласно любой из SEQ ID NO: 18-25. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность, по меньшей мере, с 90% сходством с SEQ ID NO: 23. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность SEQ ID NO: 23.
[0064] В некоторых аспектах изобретение относится к способу лечения или профилактики заболевания, ассоциированного с ВПЧ, у субъекта, включающему введение субъекту модифицированной иммунной клетки, ассоциированной с антигеном ВПЧ, где модифицированную иммунную клетку получают способом, включающим стадии: а) инкубация входной клетки с антигеном ВПЧ и/или адъювантом в течение достаточного периода времени для обеспечения связывания антигена ВПЧ с входной клеткой; тем самым получая модифицированную иммунную клетку, ассоциированную с антигеном. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-25. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность SEQ ID NO: 23. В некоторых вариантах осуществления адъювант представляет собой CpG ODN. В некоторых вариантах осуществления CpG ODN представляет собой CpG ODN 1018, CpG ODN 1826 или CpG ODN 2006.
Краткое описание фигур
[0065] На фиг. 1А представлена репрезентативная схема по группам обработки и схема опыта. На фиг. 1B приведены результаты оценки роста опухолей, измеренные по формуле ((длина × ширина2)/2), по сравнению с мышами из необработанной группы (без адоптивного переноса Т-клеток) и обработанных групп B-E, показанных на фиг. 1A.
[0066] На фиг. 2A представлена репрезентативная схема оценки антигенов E7. На фиг. 2B показано влияние последовательности SLP на продуцирующие IFN-γ CD8+ Т-клетки, продуцированные в ответ на вакцинацию TAPC.
[0067] На фиг. 3 представлен график, показывающий способность E6 SLP индуцировать антигенспецифический иммунный ответ в Т-клетках E6 респондерах на человеческой модели in vitro.
[0068] На фиг. 4 показана способность E7 SLP индуцировать антигенспецифический иммунный ответ в Т-клетках E711-20 респондерах, а также влияние последовательности SLP на активацию Т-клеток APC (Tapc), полученных с использованием устройства SQZ, на человеческой модели in vitro.
[0069] На фиг. 5 приведены результаты исследования по оценке дозы антигена для Т-клеток APC, полученных с использованием устройства SQZ, на человеческой модели in vitro.
[0070] На фиг. 6 показаны результаты опыта по определению вариабельности донора Т-клеток APC, полученных с использованием устройства SQZ, на человеческой модели in vitro.
[0071] На фиг. 7A представлена схема опыта по сравнению силы иммунных ответов с использованием различных адъювантов. На фиг. 7B приведены результаты опыта по сравнению силы иммунных ответов с использованием поли I:C и CpG ODN.
[0072] На фиг. 8A представлена схема опыта по оценке влияния концентрации CpG ODN на иммунные ответы. На фиг. 8B приведены результаты опыта по оценке влияния концентрации CpG ODN на иммунные ответы.
[0073] На фиг. 9A представлена схема опыта по оценке схемы введения CpG ODN на иммунные ответы. На фиг. 9В приведены результаты опыта по оценке схемы введения CpG ODN на иммунные ответы.
[0074] На фиг. 10A представлена схема опыта по оценке влияния комбинации внутриклеточной доставки и системного введения адъюванта на противоопухолевую активность TAPC. На фиг. 10B приведены Т-клеточные ответы для каждой опытной группы, и на фиг. 10C показан рост опухолей для каждой опытной группы. На фиг. 10D показан рост опухолей после повторной прививки опухолевых клеток у животных, получавших SQZ (E7 + CpG), по сравнению с необработанными животными.
[0075] На фиг. 11A представлена схема опыта по оценке влияния комбинирования нескольких антигенов ВПЧ на противоопухолевую активность TAPC. На фиг. 11B показаны Т-клеточные ответы у животных в каждой опытной группе, и на фиг. 11C показан рост опухолей для каждой опытной группы.
[0076] На фиг. 12A приведены результаты опыта по оценке значения пути введения адъюванта CpG, для E7-специфического противоопухолевого эффекта TAPC. Приведена схема введения. На фиг. 12B показан объем опухолей во временной динамике у отдельных мышей в каждой группе обработки.
[0077] На фиг. 13 представлена схема опыта по оценке способности совместно введенных адъювантов приводить к инфильтрации опухолей Е7-специфическими Т-клетками. Т-клеточные ответы показаны на нижней панели.
[0078] На фиг. 14A представлена схема опыта по определению схемы вакцинации в режиме прайм и буст TAPC, нагруженных синтетическим длинным пептидом E7 (SLP) + CpG. На фиг. 14B показан рост опухолей для каждой опытной группы.
[0079] На фиг. 15 приведены результаты опыта, показывающего, что SQZ’d TAPC могут презентировать антиген непосредственно.
[0080] На фиг. 16 показано, что доставка адъюванта с помощью устройства SQZ не вызывает достоверного изменения уровней цитокинов в Т-клетках in vitro.
[0081] На фиг. 17 показано, что доставка антигена +/- адъювант с помощью SQZ достоверно не изменяет уровни цитокинов в сыворотке крови in vivo.
[0082] На фиг. 18 показано, что доставка с использованием устройства SQZ ВПЧ-E7, содержащего клеточные лизаты, в дендритные клетки (в виде APC) с последующим совместным культивированием SQZ дендритных клеток с CD8 Т-клетками-респондерами приводит к более сильному Т-клеточному ответу по сравнению с доставкой тех же лизатов в дендритные клетки посредством эндоцитоза.
[0083] На фиг. 19A представлена репрезентативная схема опыта по оценке способности В-клеток в виде APC индуцировать эндогенный ответ. На фиг. 19В показаны уровни IFN-γ-положительных CD8+ Т-клеток, индуцированных введением B9-23, полученные в ответ на вакцинацию BAPC, нагруженные OVA. На фиг. 19С показаны уровни IFN-γ-положительных CD8+ Т-клеток, индуцированных введением E7, полученные в ответ на вакцинацию BAPC, нагруженные E7.
[0084] На фиг. 20A показан объем опухолей во временной динамике в опыте по определению способности В-клеток, нагруженных с использованием SQZ, функционировать в качестве APC для профилактики роста опухолей, ассоциированных с ВПЧ. На фиг. 20В показаны соответствующие данные по выживаемости во временной динамике в опыте оценки профилактики роста опухолей, ассоциированных с ВПЧ, В-клеточными APC.
[0085] На фиг.21А показан объем опухолей во временной динамике в опыте по определению способности В-клеток, нагруженных с использованием SQZ, функционировать в качестве APC для лечения опухолей, ассоциированных с ВПЧ. На фиг. 20В показаны соответствующие данные по выживаемости во временной динамике в опыте оценки терапии опухолей, ассоциированных с ВПЧ, В-клеточными APC.
[0086] На фиг. 22A показан объем опухолей во временной динамике в опыте по определению способности В-клеток, нагруженных с использованием SQZ, функционировать в качестве APC для терапии опухолей, ассоциированных с ВПЧ. На фиг. 22B показаны профили и процентное содержание различных фенотипов опухоль-инфильтрирующих клеток, которые подверглись рекрутменту в опухоли.
[0087] На фиг. 23 показана секреция IFN-γ E7 респондерами в виде антигенспецифического ответа in vitro на BAPC SQZ, нагруженные ВПЧ16 E7 SLP.
[0088] На фиг.24 показаны относительные уровни рекрутмента опухоль-инфильтрирующих лимфоцитов (TIL) к опухолям, в которые с вводили TAPC, нагруженные ВПЧ16 E7 SLP с использованием SQZ, с совместным введением адъюванта или без него.
[0089] На фиг.25 показан объем опухолей во временной динамике в опыте по оценке способности Т-клеток, нагруженных с использованием устройства SQZ, функционировать в качестве APC для профилактики роста опухолей, ассоциированных с ВПЧ, в отношении краткосрочной (опухоли на правом боку, привитые на сутки 0), а также долгосрочной защиты (опухоли на левом боку, привитые на сутки 60).
[0090] На фиг.26 показан объем опухолей во временной динамике в опыте по оценке влияния дозы Т-клеток, совместного введения адъюванта, а также количества введений (схема прайм против схемы прайм/буст) на способность Т-клеток, нагруженных с использованием SQZ, функционировать в качестве APC для лечения опухолей, ассоциированных с ВПЧ. «P» обозначает прайм, и «B» обозначает буст на фиг. 26.
[0091] На фиг. 27A показан объем опухолей во временной динамике в опыте по определению способности В-клеток, нагруженных с использованием SQZ, функционировать в качестве APC для терапии опухолей, ассоциированных с ВПЧ, по сравнению с В-клетками, подвергнутыми электропорации, и с пептидной вакциной в высокой дозе (п/к SLP). На фиг. 27B приведены соответствующие данные по выживаемости во временной динамике после терапии B-клетками APC опухолей, ассоциированных ВПЧ, по сравнению с подвергнутыми электропорации B-клетками и пептидной вакциной в высокой дозе.
[0092] На фиг. 28A представлена репрезентативная схема опыта по оценке способности спленоцитов в качестве APC индуцировать эндогенный ответ. На фиг. 28В показаны уровни IFN-γ-положительных CD8+ Т-клеток, индуцированных введением B9-23, генерируемых в ответ на вакцинацию спленоцитамиAPC, нагруженными OVA. На фиг. 28С показаны уровни IFN-γ-положительных CD8+ Т-клеток, индуцированные введением E7, генерируемых в ответ на вакцинацию спленоцитамиAPC, нагруженными E7.
[0093] На фиг. 29A показан объем опухолей во временной динамике в опыте по определению способности спленоцитов, нагруженных с использованием SQZ, функционировать в качестве APC для терапии опухолей, ассоциированных с ВПЧ. На фиг. 29B показаны соответствующие данные по выживаемости во временной динамике после терапии спленоцитами APC опухолей, ассоциированных с ВПЧ.
[0094] На фиг. 30 показана секреция IFN-γ E7 респондерами в виде антигенспецифического ответа in vitro на PBMCAPC SQZ, нагруженные ВПЧ16 E7 SLP.
Подробное описание изобретения
[0095] В некоторых аспектах настоящее изобретение относится к способам лечения и профилактики заболеваний, ассоциированных с ВПЧ, и/или модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, включающим введение субъекту композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант. В некоторых аспектах настоящее изобретение относится к способам лечения и профилактики заболевания, ассоциированного с ВПЧ, и/или модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант; где модифицированные иммунные клетки получают сначала пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген и адъювант прошли через них, с образованием пертурбированной входной клетки; и затем инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. Некоторые аспекты настоящего изобретения относятся к способам получения композиции, содержащей модифицированные иммунные клетки, где иммунная клетка проходит через сужение, где сужение деформирует клетку, тем самым вызывая пертурбацию клетки так, что антиген ВПЧ и/или адъювант проникает в иммунную клетку, предназначенную для модификации.
[0096] В некоторых аспектах настоящее изобретение относится к способам лечения и профилактики заболевания, ассоциированного с ВПЧ, и/или модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, включающим введение субъекту композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ. В некоторых аспектах настоящее изобретение относится к способам лечения и профилактики заболевания, ассоциированного с ВПЧ, и/или модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ, где модифицированные иммунные клетки получают сначала пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген прошел через них, с образованием пертурбированной входной клетки; и затем инкубацией пертурбированной входной клетки с антигеном ВПЧ в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. Некоторые аспекты настоящего изобретения относятся к способам получения композиции, содержащей модифицированные иммунные клетки, где иммунная клетка проходит через сужение, где сужение деформирует клетку, вызывая тем самым пертурбацию клетки так, что антиген ВПЧ проникает в иммунную клетку, предназначенную для модификации. В некоторых дополнительных вариантах осуществления способ лечения и профилактики заболевания, ассоциированного с ВПЧ, и/или модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, дополнительно включает введение субъекту адъюванта. В некоторых вариантах осуществления композиция модифицированных иммунных клеток дополнительно содержит адъювант (например, олигонуклеотид CpG (CpG ODN) или IFNα. В некоторых вариантах осуществления модифицированные иммунные клетки дополнительно содержат внутриклеточно адъювант, такой как CpG ODN.
Общие методы
[0097] Методики и процедуры, описанные или упомянутые в настоящем описании, в общем хорошо понятны и обычно используются специалистами в данной области техники с использованием обычных методологий, например, таких как широко используемые методологии, описанные в руководствах Molecular Cloning: A Laboratory Manual (Sambrook et al., 4th ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 2012); Current Protocols in Molecular Biology (F.M. Ausubel, et al. eds., 2003); в серийных изданиях Methods in Enzymology (Academic Press, Inc.); PCR 2: A Practical Approach (M.J. MacPherson, B.D. Hames and G.R. Taylor eds., 1995); Antibodies, A Laboratory Manual (Harlow and Lane, eds., 1988); Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications (R.I. Freshney, 6th ed., J. Wiley and Sons, 2010); Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., Academic Press, 1998); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, Plenum Press, 1998); Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., J. Wiley and Sons, 1993-8); Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds., 1996); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Ausubel et al., eds., J. Wiley and Sons, 2002); Immunobiology (C.A. Janeway et al., 2004); Antibodies (P. Finch, 1997); Antibodies: A Practical Approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal Antibodies: A Practical Approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using Antibodies: A Laboratory Manual (E. Harlow and D. Lane, Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J. D. Capra, eds., Harwood Academic Publishers, 1995); и Cancer: Principles and Practice of Oncology (V.T. DeVita et al., eds., J.B. Lippincott Company, 2011).
Определения
[0098] В целях интерпретации этого описания будут использоваться следующие определения, и, где это уместно, термины, используемые в единственном числе, также будут включать термины во множественном числе и наоборот. В случае, если какое-либо определение, приведенное ниже, противоречит любому документу, включенному здесь посредством ссылки, то приведенное определение имеет преимущественную силу.
[0099] В контексте настоящего описания формы единственного числа включают формы множественного числа, если не указано иное.
[0100] Подразумевается, что аспекты и варианты осуществления изобретения, описанные здесь, включают аспекты и варианты «содержащий», «состоящий» и «состоящий по существу из».
[0101] В рамках изобретения, термин «приблизительно» относится к обычному диапазону ошибки для соответствующего значения, хорошо известному специалисту в данной области техники. Ссылка на «приблизительно» перед значением или параметром в настоящем описании включает (и описывает) варианты осуществления, которые относятся к данным значениям или параметрам как таковым.
[0102] В рамках изобретения, термин «лечение» представляет собой подход для получения благоприятных или желаемых клинических результатов. В рамках изобретения, термин «лечение» охватывает любое введение или применение терапевтического средства для лечения заболевания у млекопитающего, включая человека. Для целей данного изобретения благоприятные или желаемые клинические результаты включают, не ограничиваясь этим, любое одно или более из следующего: облегчение одного или более симптомов, снижение степени тяжести заболевания, предупреждение или замедление распространения (например, метастазирования, например метастазирования в легкие или лимфатические узлы) заболевания, предупреждение или замедление рецидива заболевания, задержку или замедление прогрессирования заболевания, ослабление болезненного состояния, подавление заболевания или прогрессирования заболевания, подавление или замедление развития заболевания или его прогрессирования, остановку его развития и ремиссию (частичную или полную). Под термином «лечение» также подразумевается уменьшение патологических последствий пролиферативного заболевания. Способы по изобретению предусматривают любой один или более из этих аспектов лечения.
[0103] В контексте рака, термин «лечение» включает любое или все из следующего: ингибирование роста опухолевых клеток, ингибирование репликации опухолевых клеток, уменьшение общей опухолевой нагрузки и облегчение одного или более симптомов, ассоциированных с заболеванием.
[0104] В рамках изобретения, термин «пора» относится к просвету, включая, помимо прочего, отверстие, разрыв, полость, апертуру, пертурбацию, щель или перфорацию в материале. В некоторых примерах (где указано) термин относится к поре на поверхности по настоящему раскрытию. В других примерах (где указано) пора может относиться к поре в клеточной мембране.
[0105] В рамках изобретения, термин «мембрана» относится к избирательному барьеру или пластине, содержащим поры. Термин включает гибкую пластинчатую структуру, которая функционирует в качестве границы или выстилки. В некоторых примерах этот термин относится к поверхности или фильтру, содержащим поры. Данный термин отличается от термина «клеточная мембрана».
[0106] В рамках изобретения, термин «фильтр» относится к пористому изделию, которое позволяет избирательно проходить веществу через поры. В некоторых примерах термин относится к поверхности или мембране, содержащей поры.
[0107] В рамках изобретения, термин «гетерогенный» относится к чему-либо, что является смешанным или неоднородным по структуре или составу. В некоторых примерах данный термин относится к порам, имеющим различные размеры, форму или распределение на данной поверхности.
[0108] В рамках изобретения, термин «гомогенный» относится к чему-либо, что является постоянным или однородным по структуре или составу везде. В некоторых примерах термин относится к порам, имеющим постоянный размер, форму или распределение на данной поверхности.
[0109] В рамках изобретения, термин «гомологичная» относится к молекуле, происходящей из одного и того же организма. В некоторых примерах термин относится к нуклеиновой кислоте или белку, которые обычно встречаются или экспрессируются в данном организме.
[0110] Термин «гетерологичная» в том смысле, в котором он относится к последовательностям нуклеиновых кислот, таким как кодирующие последовательности и контрольные последовательности, обозначает последовательности, которые обычно не связаны вместе и/или обычно не ассоциированы с конкретной клеткой. Таким образом, «гетерологичная» область конструкции нуклеиновой кислоты или вектора представляет собой сегмент нуклеиновой кислоты внутри или присоединенный к другой молекуле нуклеиновой кислоты, который не встречается в ассоциации с другой молекулой в природе. Например, гетерологичная область конструкции нуклеиновой кислоты может включать кодирующую последовательность, фланкированную последовательностями, не встречается в ассоциации с кодирующей последовательностью в природе. Другим примером гетерологичной кодирующей последовательности является конструкция, где сама кодирующая последовательность не встречается в природе (например, синтетические последовательности, имеющие кодоны, отличные от нативного гена). Аналогично клетка, трансформированная конструкцией, которая обычно отсутствует в клетке, будет считаться гетерологичной для целей настоящего изобретения. Аллельные варианты или встречающиеся в природе мутационные события не приводят к возникновению гетерологичной ДНК, в рамках изобретения.
[0111] Термин «гетерологичная», в том смысле, в котором он относится к аминокислотным последовательностям, таким как пептидные последовательности и полипептидные последовательности, обозначает последовательности, которые обычно не связаны вместе и/или обычно не ассоциированы с конкретной клеткой. Таким образом, «гетерологичная» область пептидной последовательности представляет собой сегмент из аминокислот внутри или присоединенный к другой молекуле аминокислоты, который не встречается в ассоциации с другой молекулой в природе. Например, гетерологичная область пептидной конструкции может включать аминокислотную последовательность пептида, фланкированную последовательностями, не встречающимися в ассоциации с аминокислотной последовательностью пептида в природе. Другим примером гетерологичной пептидной последовательности является конструкция, где сама пептидная последовательность не встречается в природе (например, синтетические последовательности, содержащие аминокислоты, отличающиеся от кодированных нативным геном). Аналогично клетка, трансформированная вектором, который экспрессирует аминокислотную конструкцию, которая обычно отсутствует в клетке, будет считаться гетерологичной для целей настоящего изобретения. Аллельные варианты или встречающиеся в природе мутации не приводят к возникновению гетерологичных пептидов, в рамках изобретения.
[0112] В рамках изобретения, термин «ингибировать» может относиться к действию блокирования, снижения, элиминации или иного противодействия присутствию или активности конкретной мишени. Ингибирование может относиться к частичному ингибированию или полному ингибированию. Например, ингибирование иммунного ответа может относиться к любому действию, приводящему к блокаде, снижению, элиминации или любому другому антагонизму иммунного ответа. В других примерах ингибирование экспрессии нуклеиновой кислоты может включать, помимо прочего, снижение транскрипции нуклеиновой кислоты, уменьшение количества мРНК (например, сайленсинг транскрипции мРНК), деградацию мРНК, ингибирование трансляции мРНК и так далее.
[0113] В рамках изобретения, термин «супрессировать» может относиться к действию уменьшения, снижения, отмены, ограничения, сокращения или иного понижения присутствия или активности конкретной мишени. Супрессия может относиться к частичной супрессии или полной супрессии. Например, супрессия иммунного ответа может относиться к любому действию, приводящему к уменьшению, снижению, отмене, ограничению, сокращению или иному понижению иммунного ответа. В других примерах супрессия экспрессии нуклеиновой кислоты может включать, помимо прочего, снижение транскрипции нуклеиновой кислоты, уменьшение количества мРНК (например, сайленсинг транскрипции мРНК), деградацию мРНК, ингибирование трансляции мРНК и так далее.
[0114] В рамках изобретения, термин «усиливать» может относиться к действию улучшения, повышения, наращивания или иного увеличения присутствия или активности конкретной мишени. Например, усиление иммунного ответа может относиться к любому действию, приводящему к улучшению, повышению, наращиванию или иному увеличению иммунного ответа. В одном иллюстративном примере усиление иммунного ответа может относиться к применению антигена и/или адъюванта для улучшения, повышения, наращивания или иного увеличения иммунного ответа. В других примерах усиление экспрессии нуклеиновой кислоты может включать, помимо прочего, увеличение транскрипции нуклеиновой кислоты, увеличение количества мРНК (например, повышение транскрипции мРНК), уменьшение деградации мРНК, повышение трансляции мРНК и так далее.
[0115] В рамках изобретения, термин «модулировать» может относиться к действию изменения, внесения изменения, варьирования или иной модификации присутствия или активности конкретной мишени. Например, модуляция иммунного ответа может относиться к любому действию, приводящему к изменению, внесению изменения, варьированию или иной модификации иммунного ответа. В некоторых примерах термин «модулировать» относится к повышению присутствия или активности конкретной мишени. В некоторых примерах термин «модулировать» относится к снижению присутствия или активности конкретной мишени. В других примерах, модуляция экспрессии нуклеиновой кислоты может включать, не ограничиваясь этим, изменение транскрипции нуклеиновой кислоты, изменение количества мРНК (например, повышение транскрипции мРНК), соответствующее изменение деградации мРНК, изменение трансляции мРНК и так далее.
[0116] В рамках изобретения, термин «индуцировать» может относиться к действию инициирования, побуждения, стимулирования, установления или иного получения результата. Например, индукция иммунного ответа может относиться к любому действию, приводящему к инициированию, побуждению, стимулированию, установлению или иному получению желаемого иммунного ответа. В других примерах индукция экспрессии нуклеиновой кислоты может включать, не ограничиваясь этим, инициацию транскрипции нуклеиновой кислоты, инициацию трансляции мРНК и так далее.
[0117] В данном контексте «мононуклеарные клетки периферической крови» или «PBMC» относятся к гетерогенной популяции клеток крови, имеющих круглое ядро. Примеры клеток, которые могут встречаться в популяции PBMC, включают лимфоциты, такие как T-клетки, B-клетки, NK-клетки (включая NKT-клетки и CIK-клетки), и моноциты, такие как макрофаги и дендритные клетки. В рамках изобретения, термин «множество PBMC» относится к препарату PBMC, содержащему клетки, по меньшей мере, двух типов клеток крови. В некоторых вариантах осуществления множество PBMC включает два или более типа из Т-клеток, В-клеток, NK-клеток, макрофагов или дендритных клеток. В некоторых вариантах осуществления множество PBMC включает три или более типа из Т-клеток, В-клеток, NK-клеток, макрофагов или дендритных клеток. В некоторых вариантах осуществления множество PBMC включает четыре или более типа из Т-клеток, В-клеток, NK-клеток, макрофагов или дендритных клеток. В некоторых вариантах осуществления множество PBMC включает Т-клетки, В-клетки, NK-клетки, макрофаги и дендритные клетки.
[0118] PBMC можно выделить способами, известными в данной области. Например, PBMC можно получить из периферической крови субъекта на основе плотности PBMC по сравнению с другими клетками крови. В некоторых вариантах осуществления PBMC получают из периферической крови субъекта с использованием фиколла (например, градиент фиколла). В некоторых вариантах осуществления изобретения PBMC получают из периферической крови человека с использованием системы разделения клеток ELUTRA®.
[0119] В некоторых вариантах осуществления популяцию PBMC выделяют из организма субъекта. В некоторых вариантах осуществления множество PBMC представляет собой аутологичную популяцию PBMC, где популяцию получают от конкретного субъекта, обрабатывают любым из способов, описанных здесь, и возвращают конкретному субъекту. В некоторых вариантах осуществления множество PBMC представляет собой аллогенную популяцию PBMC, где популяцию получают от одного субъекта, обрабатывают любым из способов, описанных здесь, и вводят второму субъекту.
[0120] В некоторых вариантах осуществления множество PBMC представляет собой восстановленный препарат PBMC. В некоторых вариантах осуществления множество PBMC можно получить смешиванием клеток, обычно встречаемых в популяции PBMC; например, смешиванием двух или более популяций из Т-клеток, В-клеток, NK-клеток или моноцитов.
[0121] В рамках изобретения, термин «полинуклеотид» или «нуклеиновая кислота» относится к полимерной форме из нуклеотидов любой длины, будь то рибонуклеотиды или дезоксирибонуклеотиды. Таким образом, данный термин включает, не ограничиваясь этим, одно-, двух- или полицепочечную ДНК или РНК, геномную ДНК, кДНК, гибриды ДНК-РНК или полимер, содержащий пуриновые и пиримидиновые основания, или другие природные, химически или биохимически модифицированные, неприродные или дериватизированные азотистые основания. Остов полинуклеотида может включать сахара и фосфатные группы (которые обычно можно встретить в РНК или ДНК) или модифицированные или замещенные сахара или фосфатные группы. Альтернативно, остов полинуклеотида может включать полимер из синтетических субъединиц, таких как фосфорамидаты и фосфоротиоаты, и, таким образом, может представлять олигодезоксинуклеозидфосфорамидат (P-NH2), смешанный фосфоротиоатный-фосфодиэфирный олигомер или смешанный фосфоридиэфирный олигомер. Кроме того, двухцепочечный полинуклеотид можно получить из одноцепочечного полинуклеотидного продукта химического синтеза посредством синтеза комплементарной цепи и отжига цепей в соответствующих условиях или посредством синтеза комплементарной цепи de novo с использованием ДНК-полимеразы с соответствующим праймером.
[0122] Термины «полипептид» и «белок» используются взаимозаменяемо для обозначения полимера из аминокислотных остатков и не ограничиваются минимальной длиной. Такие полимеры из аминокислотных остатков могут содержать природные или неприродные аминокислотные остатки и включают, не ограничиваясь этим, пептиды, олигопептиды, димеры, тримеры и мультимеры из аминокислотных остатков. Данное определение охватывает как полноразмерные белки, так и их фрагменты. Термины также включают постэкспрессионные модификации полипептида, например гликозилирование, сиалирование, ацетилирование, фосфорилирование и тому подобное. Кроме того, для целей настоящего изобретения «полипептид» относится к белку, который включает модификации, такие как делеции, добавления и замены (обычно консервативные по природе), в нативной последовательности, при условии, что белок сохраняет желаемую активность. Такие модификации могут быть преднамеренными, например, посредством сайт-направленного мутагенеза, или могут быть случайными, например, за счет мутаций хозяев, которые продуцируют белки, или ошибок в результате амплификации ПЦР.
[0123] В рамках изобретения, термин «адъювант» относится к веществу, которое модулирует и/или вызывает иммунный ответ. Обычно адъювант вводят вместе с антигеном для усиления иммунного ответа на антиген по сравнению с одним антигеном. Здесь описаны различные адъюванты.
[0124] Термины «CpG-олигодезоксинуклеотид» и «CpG ODN» относятся к молекулам ДНК длиной от 10 до 30 нуклеотидов, содержащим динуклеотид цитозина и гуанина, разделенные фосфатом (также называемый здесь динуклеотидом «CpG», или «CpG»). CpG ODN по настоящему изобретению содержат, по меньшей мере, один неметилированный динуклеотид CpG. То есть, цитозин в динуклеотиде CpG не метилирован (т.е. не является 5-метилцитозином). CpG ODN могут иметь частичный или полный фосфоротиоатный (PS) остов.
[0125] В рамках изобретения, термин «фармацевтически приемлемый» или «фармакологически совместимый» означает вещество, которое не является нежелательным с биологической или иной точки зрения, например, это вещество может быть включено в фармацевтическую композицию, которую вводят пациенту, не вызывая каких-либо значительных нежелательных биологических эффектов или негативного взаимодействия с любыми другими компонентами композиции, в которой оно содержится. Фармацевтически приемлемые носители или эксципиенты предпочтительно соответствуют требуемым стандартам токсикологических и производственных испытаний и/или включены в Руководство по неактивным ингредиентам, Управления по контролю качества пищевых продуктов и лекарственных препаратов США.
[0126] Для любых описанных здесь структурных и функциональных характеристик методы определения этих характеристик известны в данной области техники.
Микрофлюидные системы и их компоненты
Микрофлюидные каналы для обеспечения сужений, деформирующих клетки
В некоторых аспектах настоящее изобретение относится к способам лечения и профилактики заболевания, ассоциированного с ВПЧ, и/или модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант; где модифицированные иммунные клетки получают сначала пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген и адъювант прошли через них, с образованием пертурбированной входной клетки; и затем инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых вариантах осуществления сужение находится в микрофлюидном канале. В некоторых вариантах осуществления несколько сужений могут быть размещены параллельно и/или последовательно внутри микрофлюидного канала. Типичные микрофлюидные каналы, содержащие сужения, деформирующие клетки, для применения в способах, раскрытых здесь, описаны в WO2013059343. Примеры поверхностей, имеющих поры, для применения в способах, раскрытых здесь, описаны в WO2017041050.
[0127] В некоторых вариантах осуществления микрофлюидный канал включает просвет и сконфигурирован таким образом, что иммунная клетка, суспендированная в буфере, может проходить через него, где микрофлюидный канал имеет сужение. Микрофлюидный канал может быть изготовлен из любого из ряда материалов, включая кремний, металл (например, нержавеющую сталь), пластик (например, полистирол), керамику, стекло, кристаллические подложки, аморфные подложки или полимеры (например, полиметилметакрилат (PMMA), PDMS, циклический олефиновый сополимер (COC) и т.д.). Изготовление микрофлюидного канала может быть выполнено любым методом, известным в данной области техники, включая сухое травление, влажное травление, фотолитографию, литье под давлением, лазерную абляцию или шаблоны SU-8.
[0128] В некоторых вариантах осуществления сужение внутри микрофлюидного канала включает входной участок, центральную точку и выходной участок. В некоторых вариантах осуществления длина, глубина и ширина сужения внутри микрофлюидного канала могут варьировать. В некоторых вариантах осуществления диаметр сужения внутри микрофлюидного канала является функцией диаметра иммунной клетки. В некоторых вариантах осуществления диаметр сужения внутри микрофлюидного канала составляет от приблизительно 20% до приблизительно 99% от диаметра иммунной клетки. В некоторых вариантах осуществления диаметр сужения составляет приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 99% от диаметра иммунной клетки. В некоторых вариантах осуществления диметр сужения составляет приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 99% от минимального поперечного сечения иммунной клетки. В некоторых вариантах осуществления канал имеет ширину сужения от приблизительно 2 мкм до приблизительно 10 мкм или любую ширину или диапазон ширины между ними. Например, ширина сужения может составлять приблизительно 2 мкм, приблизительно 3 мкм, приблизительно 4 мкм, приблизительно 5 мкм, приблизительно 6 мкм или приблизительно 7 мкм. В некоторых вариантах осуществления канал имеет длину сужения приблизительно 10 мкм и ширину сужения приблизительно 4 мкм. Поперечное сечение канала, входная часть, центральная точка и выходная часть также могут варьировать. Например, поперечные сечения могут быть круглыми, эллиптическими, удлиненными, квадратными, шестиугольными или треугольными по форме. Входной участок определяет угол сужения, где угол сужения оптимизирован для уменьшения закупорки канала и оптимизирован для улучшенной доставки соединения в иммунную клетку. Угол выходной части также может варьировать. Например, угол выходного участка конфигурирован так, чтобы снизить вероятность турбулентности, которая может привести к отсутствию ламинарного потока. В некоторых вариантах осуществления стенки входного участка и/или выходного участка являются линейными. В других вариантах осуществления стенки входного участка и/или выходного участка изогнуты. Скорость потока через канал также можно регулировать. В некоторых вариантах осуществления скорость потока через канал составляет от приблизительно 0,001 мл/см2/с до приблизительно 100 л/см2/с или любая скорость или диапазон скоростей между ними.
[0129] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, диаметр сужения является функцией диаметра PBMC, например среднего диаметра множества PBMC или среднего диаметра субпопуляции внутри множества PBMC. В некоторых вариантах осуществления диаметр клетки измеряется минимальным расстоянием в поперечном сечении клетки (например, клетки внутри множества PBMC).
[0130] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, диаметр сужения составляет от приблизительно 10% до приблизительно 99% от среднего диаметра множества входных PBMC. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 10% до приблизительно 90%, от приблизительно 10% до приблизительно 80%, от приблизительно 10% до приблизительно 70%, от приблизительно 20% до приблизительно 60%, от приблизительно 40% до приблизительно 60% или от приблизительно 30% до приблизительно 45% от среднего диаметра множества входных PBMC. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 10% до приблизительно 20%, от приблизительно 20% до приблизительно 30%, от приблизительно 30% до приблизительно 40%, от приблизительно 40% до приблизительно 50%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70%, от приблизительно 70% до приблизительно 80%, от приблизительно 80% до приблизительно 90% или от приблизительно 90% до приблизительно 99% от среднего диаметра множества входных PBMC. В некоторых вариантах осуществления диаметр сужения составляет приблизительно 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99% от среднего диаметра множества входных PBMC.
[0131] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, диаметр сужения составляет от приблизительно 10% до приблизительно 99% от среднего диаметра субпопуляции клеток, имеющих наименьший диаметр среди множества входных PBMC. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 10% до приблизительно 90%, от приблизительно 10% до приблизительно 80%, от приблизительно 10% до приблизительно 70%, от приблизительно 20% до приблизительно 60%, от приблизительно 40% до приблизительно 60%, от приблизительно 30% до приблизительно 45%, от приблизительно 50% до приблизительно 99%, от приблизительно 50% до приблизительно 90%, от приблизительно 50% до приблизительно 80%, от приблизительно 50% до приблизительно 70%, от приблизительно 60% до приблизительно 90%, от приблизительно 60% до приблизительно 80%, или от приблизительно 60% до приблизительно 70% от среднего диаметра субпопуляции клеток, имеющих наименьший диаметр во множестве входных PBMC. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 10% до приблизительно 20%, от приблизительно 20% до приблизительно 30%, от приблизительно 30% до приблизительно 40%, от приблизительно 40% до приблизительно 50%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70%, от приблизительно 70% до приблизительно 80%, от приблизительно 80% до приблизительно 90% или от приблизительно 90% до приблизительно 99% от среднего диаметра субпопуляции клеток, имеющих наименьший диаметр в пределах множество входных PBMC. В некоторых вариантах осуществления диаметр сужения составляет приблизительно 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99% от среднего диаметра субпопуляции клеток, имеющих наименьший диаметр во множестве введенных PBMC. В некоторых вариантах осуществления субпопуляция клеток, имеющих наименьший средний диаметр среди множества входных PBMC, представляет собой популяцию лимфоцитов, где диаметр популяции лимфоцитов составляет от приблизительно 6 мкм до приблизительно 10 мкм. В некоторых вариантах осуществления средний диаметр популяции лимфоцитов составляет приблизительно 7 мкм. В некоторых вариантах осуществления популяция лимфоцитов представляет собой популяцию Т-клеток. В некоторых вариантах осуществления лимфоциты представляют Т-клетки. В некоторых вариантах осуществления субпопуляция клеток, имеющих наименьший средний диаметр среди множества входных PBMC, представляет собой Т-клетки.
[0132] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, диаметр сужения составляет от приблизительно 10% до приблизительно 99% от среднего диаметра субпопуляции клеток, имеющих наибольший диаметр во множестве входных PBMC. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 10% до приблизительно90%, от приблизительно 10% до приблизительно 80%, от приблизительно 10% до приблизительно 70%, от приблизительно 20% до приблизительно 60%, от приблизительно 40% до приблизительно 60%, от приблизительно 30% до приблизительно 45%, от приблизительно 15% до приблизительно 30%, от приблизительно 15% до приблизительно 20%, от приблизительно 20% до приблизительно 25%, от приблизительно 25% до приблизительно 30%, от приблизительно 20% до приблизительно 30%, от приблизительно 30% до приблизительно 70% или от приблизительно 30% до приблизительно 60% среднего диаметра субпопуляции клеток, имеющих наибольший диаметр во множестве введенных PBMC. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 5% до приблизительно 10%, от приблизительно 10% до приблизительно 20%, от приблизительно 20% до приблизительно 30%, от приблизительно 30% до приблизительно 40%, от приблизительно 40% до приблизительно 50%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70%, от приблизительно 70% до приблизительно 80%, от приблизительно 80% до приблизительно 90% или от приблизительно 90% до приблизительно 99% от среднего диаметра субпопуляции клеток, имеющих наибольший диаметр во множестве входных PBMC. В некоторых вариантах осуществления диаметр сужения составляет приблизительно 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99% от среднего диаметра субпопуляции клеток, имеющих наибольший диаметр во множестве входных PBMC. В некоторых вариантах осуществления субпопуляция клеток, имеющих самый большой средний диаметр во множестве входных PBMC, представляет собой популяцию моноцитов, где диаметр популяции моноцитов составляет от приблизительно 15 мкм до приблизительно 25 мкм. В некоторых вариантах осуществления средний диаметр популяции моноцитов составляет приблизительно 20 мкм. В некоторых вариантах осуществления субпопуляция клеток, имеющих наибольший средний диаметр во множестве входных PBMC, представляет собой моноциты.
[0133] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, диаметр сужения составляет от приблизительно 3 мкм до приблизительно 15 мкм. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 3 мкм до приблизительно 10 мкм. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 4 мкм до приблизительно 10 мкм. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 4,2 мкм до приблизительно 6 мкм. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 4,2 мкм до приблизительно 4,8 мкм. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 2 мкм до приблизительно 14 мкм, от приблизительно 4 мкм до приблизительно 12 мкм, от приблизительно 6 мкм до приблизительно 9 мкм, от приблизительно 4 мкм до приблизительно 6 мкм, от приблизительно 4 мкм до приблизительно 5 мкм, от приблизительно 3,5 мкм до приблизительно 7 мкм, от приблизительно 3,5 мкм до приблизительно 6,3 мкм, от приблизительно 3,5 мкм до приблизительно 5,6 мкм, от приблизительно 3,5 мкм до приблизительно 4,9 мкм, от приблизительно 4,2 мкм до приблизительно 6,3 мкм, от приблизительно 4,2 мкм до приблизительно 5,6 мкм или от приблизительно 4,2 мкм до приблизительно 4,9 мкм. В некоторых вариантах осуществления диаметр сужения составляет приблизительно 2 мкм, 2,5 мкм, 3 мкм, 3,5 мкм, 4 мкм, 4,5 мкм, 5 мкм, 5,5 мкм, 6 мкм, 6,5 мкм, 7 мкм, 7,5 мкм, 8 мкм, 8,5 мкм, 9 мкм, 9,5 мкм, 10 мкм, 10,5 мкм, 11 мкм, 11,5 мкм, 12 мкм, 12,5 мкм, 13 мкм, 13,5 мкм, 14 мкм, 14,5 мкм или 15 мкм. В некоторых вариантах осуществления диаметр сужения составляет приблизительно 4,0 мкм, 4,1 мкм, 4,2 мкм, 4,3 мкм, 4,4 мкм, 4,5 мкм, 4,6 мкм, 4,7 мкм, 4,8 мкм, 4,9 мкм или 5,0 мкм. В некоторых вариантах осуществления диаметр сужения составляет приблизительно 4,5 мкм.
[0134] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, входная иммунная клетка проходит через сужение со скоростью потока от приблизительно 0,001 мл/мин до приблизительно 200 мл/мин или с любой скоростью или диапазоном скоростей между ними. В некоторых вариантах осуществления скорость потока составляет от приблизительно 0,001 мл/мин до приблизительно 175 мл/мин, от приблизительно 0,001 мл/мин до приблизительно 150 мл/мин, от приблизительно 0,001 мл/мин до приблизительно 125 мл/мин, от приблизительно 0,001 мл/мин до приблизительно 100 мл/мин, от приблизительно 0,001 мл/мин до приблизительно 50 мл/мин, от приблизительно 0,001 мл/мин до приблизительно 25 мл/мин, от приблизительно 0,001 мл/мин до приблизительно 10 мл/мин, от приблизительно 0,001 мл/мин до приблизительно 7,5 мл/мин, от приблизительно 0,001 мл/мин до приблизительно 5,0 мл/мин, от приблизительно 0,001 мл/мин до приблизительно 2,5 мл/мин, от приблизительно 0,001 мл/мин до приблизительно 1 мл/мин, от приблизительно 0,001 мл/мин до приблизительно 0,1 мл/мин или от приблизительно 0,001 мл/мин до приблизительно 0,01 мл/мин. В некоторых вариантах осуществления скорость потока составляет от приблизительно 0,001 мл/мин до приблизительно 200 мл/мин, от приблизительно 0,01 мл/мин до приблизительно 200 мл/мин, от приблизительно 0,1 мл/мин до приблизительно 200 мл/мин от приблизительно 1 мл/мин до приблизительно 200 мл/мин, от приблизительно 10 мл/мин до приблизительно 200 мл/мин, от приблизительно 50 мл/мин до приблизительно 200 мл/мин, от приблизительно 75 мл/мин до приблизительно 200 мл/мин, от приблизительно 100 мл/мин до приблизительно 200 мл/мин, от приблизительно 150 мл/мин до приблизительно 200 мл/мин, от приблизительно 0,5 мл/мин до приблизительно 200 мл/мин, от приблизительно 1 мл/мин до приблизительно 200 мл/мин, от приблизительно 2,5 мл/мин до приблизительно 200 мл/мин, от приблизительно 5 мл/мин до приблизительно 200 мл/мин, от приблизительно 7,5 мл/мин до приблизительно 200 мл/мин, от приблизительно 10 мл/мин до приблизительно 200 мл/мин, от приблизительно 25 мл/мин до приблизительно 200 мл/мин или от приблизительно 175 мл/мин до приблизительно 200 мл/мин. В некоторых вариантах осуществления входная иммунная клетка проходит через сужение со скоростью потока от приблизительно 10 мл/мин до приблизительно 200 мл/мин. В некоторых вариантах осуществления входная иммунная клетка проходит через сужение со скоростью приблизительно 100 мл/мин.
[0135] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, сужение может иметь любую форму, известную в данной области; например, 3-мерную форму или 2-мерную форму. 2-мерная форма, такая как форма поперечного сечения, сужения может быть, без ограничения, круглой, эллиптической, сферической, квадратной, звездообразной, треугольной, многоугольной, пятиугольной, шестиугольной, семиугольной или восьмиугольной. 3-мерная форма сужения может быть, без ограничения, цилиндрической, конической или кубоидальной. В некоторых вариантах осуществления форма поперечного сечения сужения представляет собой прямоугольник. В некоторых вариантах осуществления форма поперечного сечения сужения представляет собой щель. В некоторых вариантах осуществления форма поперечного сечения сужения представляет собой щель, имеющую ширину от приблизительно 4 мкм до приблизительно 10 мкм и/или глубину от приблизительно 1 мкм до приблизительно 200 мкм. В некоторых вариантах осуществления форма поперечного сечения сужения представляет собой щель, имеющую ширину от приблизительно 3 мкм до приблизительно 6 мкм и/или глубину от приблизительно 20 мкм до приблизительно 120 мкм. В некоторых вариантах осуществления форма поперечного сечения сужения представляет собой щель, имеющую ширину от приблизительно 4,2 мкм до приблизительно 6 мкм и/или глубину от приблизительно 20 мкм до приблизительно 120 мкм. В некоторых вариантах осуществления форма поперечного сечения сужения представляет собой щель, имеющую ширину от приблизительно 4,2 мкм до приблизительно 6 мкм и/или глубину от приблизительно 40 мкм до приблизительно 120 мкм. В некоторых вариантах осуществления форма поперечного сечения сужения представляет собой щель, имеющую ширину от приблизительно 4,2 мкм до приблизительно 6 мкм и/или глубину от приблизительно 20 мкм до приблизительно 80 мкм. В некоторых вариантах осуществления форма поперечного сечения сужения представляет собой щель, имеющую ширину приблизительно 4,5 мкм и/или глубину приблизительно 80 мкм. В некоторых вариантах осуществления щель имеет длину от приблизительно 5 мкм до приблизительно 50 мкм. В некоторых вариантах осуществления щель имеет длину от приблизительно 10 мкм до приблизительно 30 мкм. В некоторых вариантах осуществления щель имеет длину от приблизительно 2 мкм до приблизительно 50 мкм. В некоторых вариантах осуществления щель имеет длину от приблизительно 2 мкм до приблизительно 5 мкм, от приблизительно 5 мкм до приблизительно 10 мкм, от приблизительно 10 мкм до приблизительно 15 мкм, от приблизительно 15 мкм до приблизительно 20 мкм, от приблизительно 20 мкм до приблизительно 25 мкм, от приблизительно 25 мкм до приблизительно 30 мкм, от приблизительно 30 мкм до приблизительно о 35 мкм, от приблизительно 35 мкм до приблизительно 40 мкм, от приблизительно 40 мкм до приблизительно 45 мкм или от приблизительно 45 мкм до приблизительно 50 мкм. В некоторых вариантах осуществления щель имеет длину приблизительно 10 мкм.
Поверхность, имеющая поры для обеспечения сужений, деформирующих клетки
[0136] В некоторых аспектах настоящее изобретение относится к способам лечения и профилактики заболевания, ассоциированного с ВПЧ, и/или усиления иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и адъювант; где модифицированные иммунные клетки получают сначала пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген и адъювант прошли через них, с образованием пертурбированной входной клетки; и затем инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение. В некоторых вариантах осуществления сужение представляет собой пору или находится в поре. В некоторых вариантах осуществления пора находится на поверхности. Примеры поверхностей, имеющих поры, для применения в способах, раскрытых здесь, описаны в WO2017041050.
[0137] Поверхности, описанные здесь, могут быть изготовлены из любого из множества материалов и принимать любую из множества форм. В некоторых вариантах осуществления поверхность представляет собой фильтр. В некоторых вариантах осуществления поверхность представляет собой мембрану. В некоторых вариантах осуществления фильтр представляет собой тангенциальный фильтр с поперечным потоком. В некоторых вариантах осуществления поверхность представляет собой губку или губчатую матрицу. В некоторых вариантах поверхность представляет собой матрицу.
[0138] В некоторых вариантах осуществления поверхность представляет собой поверхность с извилистыми линиями. В некоторых вариантах осуществления поверхность с извилистыми линиями содержит ацетат целлюлозы. В некоторых вариантах осуществления поверхность содержит материал, выбранный, без ограничения, из синтетических или природных полимеров, поликарбоната, кремния, стекла, металла, сплава, нитрата целлюлозы, серебра, ацетата целлюлозы, нейлона, полиэфира, полиэфирсульфона, полиакрилонитрила (PAN), полипропилена, PVDF, политетрафторэтилена, смешанного эфира целлюлозы, фарфора и керамики.
[0139] Поверхность, описанная здесь, может иметь любую форму, известную в данной области техники; например 3-мерную форму. 2-мерная форма поверхности может быть, без ограничения, круглой, эллиптической, сферической, квадратной, звездообразной, треугольной, многоугольной, пятиугольной, шестиугольной, семиугольной или восьмиугольной. В некоторых вариантах осуществления поверхность имеет круглую форму. В некоторых вариантах осуществления 3-мерная форма поверхности является цилиндрической, конической или кубической.
[0140] Поверхность может иметь различную ширину и толщину поперечного сечения. В некоторых вариантах осуществления ширина поперечного сечения поверхности составляет от приблизительно 1 мм до приблизительно 1 м или любая ширина поперечного сечения или диапазон ширины поперечного сечения между ними. В некоторых вариантах осуществления поверхность имеет определенную толщину. В некоторых вариантах осуществления толщина поверхности одинакова. В некоторых вариантах осуществления толщина поверхности может варьировать. Например, в некоторых вариантах осуществления участки поверхности могут быть толще или тоньше, чем другие участки поверхности. В некоторых вариантах осуществления толщина поверхности варьируется от приблизительно 1% до приблизительно 90% или любого процента или диапазона процентов между ними. В некоторых вариантах осуществления поверхность имеет толщину от приблизительно 0,01 мкм до приблизительно 5 мм или любую толщину или диапазон толщины между ними.
[0141] В некоторых вариантах осуществления сужение представляет собой пору или находится внутри поры. Ширина поперечного сечения пор связана с типом иммунной клетки, подлежащей обработке. В некоторых вариантах осуществления размер пор является функцией диаметра иммунной клетки или кластера иммунных клеток, подлежащих обработке. В некоторых вариантах осуществления размер пор является таким, что иммунная клетка подвергается пертурбации при прохождении через пору. В некоторых вариантах осуществления размер пор меньше диаметра иммунной клетки. В некоторых вариантах осуществления размер пор составляет от приблизительно 10% до приблизительно 99% от диаметра иммунной клетки. В некоторых вариантах осуществления размер пор составляет приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 99% от диаметра иммунной клетки. Оптимальный размер пор или ширина поперечного сечения пор могут варьировать в зависимости от области применения и/или типа иммунной клетки. В некоторых вариантах осуществления размер пор составляет от приблизительно 2 мкм до приблизительно 14 мкм. В некоторых вариантах осуществления размер пор составляет приблизительно 2 мкм, приблизительно 3 мкм, приблизительно 4 мкм, приблизительно 5 мкм, приблизительно 8 мкм, приблизительно 10 мкм, приблизительно 12 мкм или приблизительно 14 мкм. В некоторых вариантах осуществления ширина поперечного сечения составляет от приблизительно 2 мкм до приблизительно 14 мкм. В некоторых вариантах осуществления поперечное сечение пор составляет приблизительно 2 мкм, приблизительно 3 мкм, приблизительно 4 мкм, приблизительно 5 мкм, приблизительно 8 мкм, приблизительно 10 мкм, приблизительно 12 мкм или приблизительно 14 мкм.
[0142] Входы и выходы канала поры могут иметь разные углы. Угол поры может быть выбран для минимизации закупорки поры при прохождении через нее иммунных клеток. Например, угол входа или выхода может составлять от приблизительно 0 до приблизительно 90 градусов. В некоторых вариантах осуществления входной или выходной участок может составлять более 90 градусов. В некоторых вариантах осуществления поры имеют одинаковые углы входа и выхода. В некоторых вариантах осуществления поры имеют разные углы входа и выхода. В некоторых вариантах осуществления грань поры гладкая, например округлая или изогнутая. Гладкая грань поры имеет непрерывную, плоскую и ровную поверхность без выступов, гребней или неровностей. В некоторых вариантах осуществления грань поры острая. Острая грань поры имеет тонкий край, заостренный или под острым углом. В некоторых вариантах осуществления канал для пор является прямым. Прямой канал поры не содержит искривлений, изгибов, углов или других неровностей. В некоторых вариантах осуществления канал поры изогнут. Изогнутый канал поры изогнут или отклоняется от прямой линии. В некоторых вариантах осуществления канал поры имеет несколько изгибов, например, приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10 или более изгибов. В некоторых вариантах осуществления скорость потока через пору составляет от приблизительно 0,001 мл/см2/с до приблизительно 100 л/см2/с или любая скорость или диапазон скоростей между ними.
[0143] Поры могут иметь любую форму, известную в данной области техники, в том числе 2-мерную или 3-мерную форму. Форма поры (например, форма поперечного сечения) может быть, без ограничения, круглой, эллиптической, сферической, квадратной, звездообразной, треугольной, многоугольной, пятиугольной, шестиугольной, семиугольной и восьмиугольной. В некоторых вариантах осуществления поперечное сечение поры имеет круглую форму. В некоторых вариантах осуществления 3-мерная форма поры является цилиндрической или конической. В некоторых вариантах осуществления пора имеет рифленую форму входа и выхода. В некоторых вариантах осуществления форма пор является однородной (т.е. постоянной или регулярной) среди пор на данной поверхности. В некоторых вариантах осуществления форма пор является неоднородной (т.е. смешанной или варьирующей) среди пор на данной поверхности.
[0144] Поверхности, описанные здесь, могут иметь диапазон общего числа пор. В некоторых вариантах осуществления поры составляют от приблизительно 10% до приблизительно 80% от общей площади поверхности. В некоторых вариантах осуществления поверхность содержит в целом от приблизительно 1,0×105 до приблизительно 1,0×1030 пор или любое количество или диапазон чисел между ними. В некоторых вариантах осуществления поверхность содержит от приблизительно 10 до приблизительно 1,0×1015 пор/мм2 площади поверхности.
[0145] Поры могут быть распределены многочисленными способами на данной поверхности. В некоторых вариантах осуществления поры распределены параллельно на данной поверхности. В одном таком примере поры распределены рядом друг с другом в одном направлении и на одинаковом расстоянии друг от друга в пределах данной поверхности. В некоторых вариантах осуществления распределение пор является упорядоченным или однородным. В одном таком примере поры распределены в регулярном системном порядке или на одинаковом расстоянии друг от друга на данной поверхности. В некоторых вариантах осуществления распределение пор является произвольным или неоднородным. В одном таком примере поры распределены в нерегулярном, неупорядоченном порядке или на разных расстояниях друг от друга на данной поверхности. В некоторых вариантах осуществления несколько поверхностей распределены последовательно. Многочисленные поверхности могут быть однородными или неоднородными по размеру, форме и/или шероховатости поверхности. Многочисленные поверхности могут дополнительно содержать поры с однородным или неоднородным размером пор, формой и/или количеством, тем самым обеспечивая одновременную доставку ряда соединений в различные типы иммунных клеток.
[0146] В некоторых вариантах осуществления индивидуальная пора имеет одинаковый размер по ширине (т.е. постоянную ширину по длине канала поры). В некоторых вариантах осуществления индивидуальная пора имеет переменную ширину (т.е. увеличивающуюся или уменьшающуюся ширину по длине канала поры). В некоторых вариантах осуществления поры на данной поверхности имеют одинаковую индивидуальную глубину пор. В некоторых вариантах осуществления поры на данной поверхности имеют разную индивидуальную глубину пор. В некоторых вариантах осуществления поры непосредственно примыкают друг к другу. В некоторых вариантах осуществления поры удалены друг от друга на расстоянии. В некоторых вариантах осуществления поры отделены друг от друга на расстоянии от приблизительно 0,001 мкм до приблизительно 30 мм или любом расстоянии или диапазоне расстояний между ними.
[0147] В некоторых вариантах осуществления поверхность покрыта материалом. Материал может быть выбран из любого материала, известного в данной области техники, включая, помимо прочего, тефлон, адгезивное покрытие, поверхностно-активные вещества, белки, молекулы адгезии, антитела, антикоагулянты, факторы, которые модулируют клеточную функцию, нуклеиновые кислоты, липиды, углеводы или трансмембранные белки. В некоторых вариантах осуществления поверхность покрыта поливинилпирролидоном (ПВП). В некоторых вариантах осуществления материал ковалентно присоединен к поверхности. В некоторых вариантах осуществления материал нековалентно присоединен или адсорбирован на поверхности. В некоторых вариантах осуществления поверхностные молекулы высвобождаются, когда иммунные клетки проходят через поры.
[0148] В некоторых вариантах осуществления поверхность имеет модифицированные химические свойства. В некоторых вариантах поверхность является полярной. В некоторых вариантах поверхность является гидрофильной. В некоторых вариантах осуществления поверхность является неполярной. В некоторых вариантах поверхность является гидрофобной. В некоторых вариантах поверхность заряжена. В некоторых вариантах осуществления поверхность заряжена положительно и/или отрицательно. В некоторых вариантах осуществления поверхность может быть заряжена положительно в некоторых участках и отрицательно заряжена в других участках. В некоторых вариантах осуществления поверхность имеет общий положительный или общий отрицательный заряд. В некоторых вариантах осуществления поверхность может быть любой: гладкой, электрополированной, шероховатой или обработанной плазмой. В некоторых вариантах осуществления поверхность содержит цвиттер-ионное или диполярное соединение. В некоторых вариантах осуществления поверхность обработана плазмой.
[0149] В некоторых вариантах осуществления поверхность находится в более крупном модуле. В некоторых вариантах осуществления поверхность находится внутри шприца, такого как пластиковый или стеклянный шприц. В некоторых вариантах осуществления поверхность находится внутри держателя пластикового фильтра. В некоторых вариантах осуществления поверхность находится внутри наконечника пипетки.
Пертурбации клеток
В некоторых вариантах осуществления изобретение относится к способам модуляции иммунного ответа пропусканием клеточной суспензии, содержащей иммунную клетку, через сужение, тем самым вызывая пертурбацию иммунной клетки, так что антиген и/или адъювант проникает в иммунную клетку, где пертурбация в иммунной клетке представляет собой отверстие в иммунной клетке, которое позволяет веществу снаружи иммунной клетки перемещаться в иммунную клетку (например, щель, разрыв, полость, апертуру, пору, разрыв, брешь, перфорацию). В некоторых вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение. Деформация может быть вызвана, например, механической деформацией и/или усилиями сдвига. В некоторых вариантах осуществления пертурбация представляет собой пертурбацию мембраны иммунной клетки. В некоторых вариантах осуществления пертурбация носит временный характер. В некоторых вариантах осуществления пертурбация Т-клетки продолжается от приблизительно 1,0×10-9 с до приблизительно 2 ч или любое время или диапазон времени между ними. В некоторых вариантах осуществления пертурбация иммунной клетки продолжается от приблизительно 1,0×10-9 с до приблизительно 1 с, от приблизительно 1 с до приблизительно 1 мин или от приблизительно 1 мин до приблизительно 1 ч. В некоторых вариантах осуществления пертурбация иммунной клетки продолжается в пределах от приблизительно 1,0×10-9 до приблизительно 1,0×10-1, от приблизительно 1,0×10-9 до приблизительно 1,0×10-2, от приблизительно 1,0×10-9 до приблизительно 1,0×10-3, от приблизительно 1,0×10-9 до приблизительно 1,0×10-4, от приблизительно 1,0×10-9 до приблизительно 1,0×10-5, от приблизительно 1,0×10-9 до приблизительно 1,0×10-6, от приблизительно 1,0×10-9 до приблизительно 1,0×10-7 или от приблизительно 1,0×10-9 до приблизительно 1,0×10-8 с. В некоторых вариантах осуществления пертурбация иммунной клетки продолжается в течение любого из значений от приблизительно 1,0×10-8 до приблизительно 1,0×10-1, от приблизительно 1,0×10-7 до приблизительно 1,0×10-1, от приблизительно 1,0×10-6 до приблизительно 1,0×10-1, от приблизительно 1,0×10-5 до приблизительно 1,0×10-1, от приблизительно 1,0×10-4 до приблизительно 1,0×10-1, от приблизительно 1,0×10-3 до приблизительно 1,0×10-1 или от приблизительно 1,0×10-2 до приблизительно 1,0×10-1 с. Пертурбации иммунной клетки (например, поры или отверстия), создаваемые способами, описанными здесь, не образуются в результате сборки белковых субъединиц с образованием мультимерной пористой структуры, такой как структура, созданная комплементом или бактериальными гемолизинами.
[0150] Когда иммунная клетка проходит через сужение, то сужение временно приводит к нарушению мембраны иммунной клетки, что делает возможным пассивную диффузию вещества через пертурбацию. В некоторых вариантах осуществления иммунная клетка деформируется только в течение короткого периода времени, порядка 100 мкс, чтобы минимизировать вероятность активации апоптотических путей посредством клеточных сигнальных механизмов, хотя возможны другие интервалы продолжительности (например, в диапазоне от наносекунд до часов). В некоторых вариантах осуществления иммунная клетка деформируется в течение от приблизительно 1,0×10-9 с до приблизительно 2 ч или в течение любого времени или в диапазоне времени между ними. В некоторых вариантах осуществления иммунная клетка деформируется в течение от приблизительно 1,0×10-9 с до приблизительно 1 с, от приблизительно 1 с до приблизительно 1 мин или от приблизительно 1 мин до приблизительно 1 ч. В некоторых вариантах осуществления иммунная клетка деформируется в пределах от приблизительно 1,0×10-9 до приблизительно 11,0×10-1, от приблизительно 1,0×10-9 до приблизительно 1,0×10-2, от приблизительно 1,0×10-9 до приблизительно 1,0×10-3, от приблизительно 1,0×10-9 до приблизительно 1,0×10-4, от приблизительно 1,0×10-9 до приблизительно 1,0×10-5, от приблизительно 1,0×10-9 до приблизительно 1,0×10-6, от приблизительно 1,0×10-9 до приблизительно 1,0×10-7 или от приблизительно 1,0×10-9 до приблизительно 1,0×10-8 с. В некоторых вариантах осуществления иммунная клетка деформируется в течение любого из значений времени от приблизительно 1,0×10-8 до приблизительно 1,0×10-1, от приблизительно 1,0×10-7 до приблизительно 1,0×10-1, от приблизительно 1,0×10-6 до приблизительно 1,0×10-1, от приблизительно 1,0×10-5 до приблизительно 1,0×10-1, от приблизительно 1,0×10-4 до приблизительно 1,0×10-1, от приблизительно 1,0×10-3 до приблизительно 1,0×10-1 или от приблизительно 1,0×10-2 до приблизительно 1,0×10-1 с. В некоторых вариантах осуществления деформация иммунной клетки включает деформацию иммунной клетки в течение времени в диапазоне, без ограничения, от приблизительно 1 мкс до, по меньшей мере, приблизительно 750 мкс, например, по меньшей мере, приблизительно 1 мкс, 10 мкс, 50 мкс, 100 мкс, 500 мкс или 750 мкс.
[0151] В некоторых вариантах осуществления изобретения проникновение антигена и/или адъюванта в иммунную клетку происходит одновременно с прохождением иммунной клетки через сужение и/или пертурбацией иммунной клетки. В некоторых вариантах осуществления прохождение соединения в иммунную клетку происходит после того, как иммунная клетка проходит через сужение. В некоторых вариантах осуществления изобретения проникновение соединения в иммунную клетку происходит приблизительно через несколько минут после того, как иммунная клетка проходит через сужение. В некоторых вариантах осуществления прохождение соединения в иммунную клетку происходит в течение от приблизительно 1,0×10-2 с, по меньшей мере, до приблизительно 30 мин после того, как Т-клетка проходит через сужение. Например, проникновение соединения в иммунную клетку происходит в течение от приблизительно 1,0×10-2 с до приблизительно 1 с, от приблизительно 1 с до приблизительно 1 мин или от приблизительно 1 мин до приблизительно 30 мин после того, как иммунная клетка проходит через сужение. В некоторых вариантах осуществления проникновение соединения в иммунную клетку происходит в течение от приблизительно 1,0×10-2 с до приблизительно 10 мин, от приблизительно 1,0×10-2 с до приблизительно 5 мин, от приблизительно 1,0×10-2 с до приблизительно 1 мин, от приблизительно 1,0×10-2 с до приблизительно 50 с, от приблизительно 1,0×10-2 с до приблизительно 30 с, от приблизительно 1,0×10-2 с до приблизительно 10 с, от приблизительно 1,0×10-2 с до приблизительно 1 с или от приблизительно 1,0×10-2 с до приблизительно 0,1 с после того, как иммунная клетка прошла через сужение. В некоторых вариантах осуществления изобретения проникновение соединения в иммунную клетку происходит в течение от приблизительно 1,0×10-1 с до приблизительно 10 мин, от приблизительно 1 с до приблизительно 10 мин, от приблизительно 10 с до приблизительно 10 мин, от приблизительно 50 с до приблизительно 10 мин, от приблизительно 1 мин до 10 мин или от приблизительно 5 мин до приблизительно 10 мин после того, как иммунная клетка прошла через сужение. В некоторых вариантах осуществления пертурбация в иммунной клетке после того, как она прошла через сужение, устраняется в пределах порядка пяти минут после того, как иммунная клетка прошла через сужение.
[0152] В некоторых вариантах осуществления жизнеспособность клеток после прохождения через сужение составляет от приблизительно 5% до приблизительно 100%. В некоторых вариантах осуществления жизнеспособность клеток после прохождения через сужение составляет, по меньшей мере, приблизительно 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95% или 99%. В некоторых вариантах осуществления жизнеспособность клеток измеряется в течение от приблизительно 1,0×10-2 с до, по меньшей мере, приблизительно 10 суток после того, как иммунная клетка прошла через сужение. Например, жизнеспособность клеток измеряется в течение от приблизительно 1,0×10-2 с до приблизительно 1 с, от приблизительно 1 с до приблизительно 1 мин, от приблизительно 1 мин до приблизительно 30 мин или от приблизительно 30 мин до приблизительно 2 ч после того, как иммунная клетка прошла через сужение. В некоторых вариантах осуществления жизнеспособность клеток измеряется в течение от приблизительно 1,0×10-2 с до приблизительно 2 ч, от приблизительно 1,0×10-2 с до приблизительно 1 ч, от приблизительно 1,0×10-2 с до приблизительно 30 мин, от приблизительно 1,0×10-2 с до приблизительно 1 мин, от приблизительно 1,0×10-2 с до приблизительно 30 с, от приблизительно 1,0×10-2 с до приблизительно 1 с или от приблизительно 1,0×10-2 с до приблизительно 0,1 с после того, как Т-клетка прошла через сужение. В некоторых вариантах осуществления жизнеспособность клеток измеряется в течение от приблизительно 1,5 ч до приблизительно 2 ч, от приблизительно 1 ч до приблизительно 2 ч, от приблизительно 30 мин до приблизительно 2 ч, от приблизительно 15 мин до приблизительно 2 ч, от приблизительно 1 мин до приблизительно 2 ч, от приблизительно 30 с до приблизительно 2 ч или от приблизительно 1 с до приблизительно 2 ч после того, как иммунная клетка прошла через сужение. В некоторых вариантах осуществления жизнеспособность клеток измеряется в течение от приблизительно 2 ч до приблизительно 5 ч, от приблизительно 5 ч до приблизительно 12 ч, от приблизительно 12 ч до приблизительно 24 ч или от приблизительно 24 ч до приблизительно 10 суток после того, как иммунная клетка прошла через сужение.
Параметры доставки
[0153] Ряд параметров может оказывать влияние на доставку соединения к иммунной клетке для модуляции иммунного ответа способами, описанными здесь. В некоторых вариантах осуществления суспензия клеток контактирует с соединением до, одновременно или после прохождения через сужение. Иммунная клетка может проходить через сужение, будучи суспендированной в растворе, который включает доставляемое соединение, хотя соединение может быть добавлено к клеточной суспензии после того, как иммунные клетки прошли через сужение. В некоторых вариантах осуществления доставляемое соединение находится в покрытии, нанесенном на сужение.
[0154] Примеры параметров, которые могут влиять на доставку соединения в иммунную клетку, включают, помимо прочего, размеры сужения, угол входа в сужение, поверхностные свойства сужений (например, шероховатость, химическая модификация, гидрофильное, гидрофобное и т.д.), рабочие скорости потока (например, время прохождения клетки через сужение), концентрация иммунных клеток, концентрация соединения в клеточной суспензии и время, в течение которого иммунная клетка восстанавливается или инкубируется после прохождения через сужение, могут влиять на прохождение доставленного соединения в иммунную клетку. Дополнительные параметры, влияющие на доставку соединения в иммунную клетку, могут включать скорость прохождения иммунной клетки в сужении, скорость сдвига в сужении, вязкость клеточной суспензии, компонент скорости, перпендикулярный скорости потока, и время нахождения в сужении. Такие параметры могут быть разработаны для контроля доставки соединения. В некоторых вариантах осуществления концентрация иммунных клеток находится в диапазоне от приблизительно 10 до, по меньшей мере, приблизительно 1012 клеток/мл или любая концентрация или диапазона концентраций между ними. В некоторых вариантах осуществления концентрации соединения для доставки могут находиться в диапазоне от приблизительно 10 нг/мл до приблизительно 1 г/мл или любая концентрация или диапазон концентраций между ними. В некоторых вариантах осуществления концентрации соединения для доставки могут находиться в диапазоне от приблизительно 1 пМ до, по меньшей мере, приблизительно 2 М или любая концентрация или диапазон концентраций между ними.
[0155] Температуру, используемую в способах по настоящему изобретению, можно регулировать, чтобы оказывать влияние на доставку соединения и жизнеспособность клеток. В некоторых вариантах осуществления способ проводят при температуре от приблизительно -5°C до приблизительно 45°C. Например, способы можно проводить при комнатной температуре (например, приблизительно 20°C), физиологической температуре (например, приблизительно 37°C), более высокой, чем физиологическая температура (например, выше, чем от приблизительно 37°С до 45°C или выше), или пониженной температуре (например, от приблизительно -5°C до приблизительно 4°C), или температуре между этими примерными температурами.
[0156] Для подачи иммунных клеток для прохождения через сужения можно использовать различные методы. Например, давление может создаваться насосом на входной стороне (например, компрессором), вакуум может создаваться вакуумным насосом на выходной стороне, капиллярное действие может прилагаться через трубку и/или система может быть с гравитационной подачей. Также можно использовать проточные системы с вытеснением (например, шприцевой насос, перистальтический насос, ручной шприц или пипетка, поршни и т.д.). В некоторых вариантах осуществления иммунные клетки проходят через сужения за счет создания положительного или отрицательного давления. В некоторых вариантах осуществления иммунные клетки пропускают через сужения за счет создания постоянного или переменного давления. В некоторых вариантах осуществления давление создают с помощью шприца. В некоторых вариантах осуществления положительное давление создают с использованием газа (например, из газового баллона). В некоторых вариантах осуществления давление прикладывают с помощью насоса. В некоторых вариантах осуществления насос представляет собой перистальтический насос или диафрагменный насос. В некоторых вариантах осуществления давление создают с помощью вакуума. В некоторых вариантах осуществления иммунные клетки проходят через сужения за счет g-силы. В некоторых вариантах осуществления иммунные клетки проходят через сужения за счет центробежной силы. В некоторых вариантах осуществления иммунные клетки проходят через сужения под действием капиллярного давления.
[0157] В некоторых вариантах осуществления поток жидкости направляет иммунные клетки через сужения. В некоторых вариантах осуществления поток жидкости представляет собой турбулентный поток до того, как иммунные клетки проходят через сужение. Турбулентный поток представляет собой поток жидкости, скорость которого в данной точке неравномерно изменяется по величине и направлению. В некоторых вариантах осуществления поток жидкости через сужение является ламинарным. Ламинарный поток представляет собой непрерывный поток в жидкости вблизи твердой границы, где направление потока в каждой точке остается постоянным. В некоторых вариантах осуществления поток жидкости представляет собой турбулентный поток после того, как иммунные клетки прошли через сужение. Скорость, с которой иммунные клетки проходят через сужения, можно варьировать. В некоторых вариантах осуществления иммунные клетки проходят через сужения с постоянной скоростью. В некоторых вариантах осуществления иммунные клетки проходят через сужения с переменной скоростью клеток.
[0158] В еще одних вариантах осуществления используется комбинированная обработка для модуляции иммунного ответа пропусканием клеточной суспензии, содержащей иммунную клетку, через сужение, где сужение деформирует иммунную клетку, тем самым вызывая пертурбацию иммунной клетки так, что антиген и/или адъювант проникает в иммунную клетку, например, способами, описанными здесь, с последующим воздействием электрического поля ниже сужения. В некоторых вариантах осуществления Т-клетка проходит через электрическое поле, создаваемое, по меньшей мере, одним электродом после прохождения через сужение. В некоторых вариантах осуществления электрическое поле способствует доставке соединений во вторую область внутри иммунной клетки, такую как ядро иммунной клетки. Например, комбинация деформирующего клетки сужения и электрического поля доставляет плазмиду, кодирующую антитело, в иммунную клетку (например, ядро клетки), что приводит к продукции антитела de novo. В некоторых вариантах осуществления один или несколько электродов находятся вблизи сужения, деформирующего клетку, для создания электрического поля. В некоторых вариантах осуществления электрическое поле составляет от приблизительно 0,1 кВ/м до приблизительно 100 МВ/м или любое число или диапазон чисел между ними. В некоторых вариантах осуществления используется интегральная схема для подачи электрического сигнала для возбуждения электродов. В некоторых вариантах осуществления иммунные клетки подвергаются воздействию электрического поля в течение длительности импульса от приблизительно 1 нс до приблизительно 1 с и в течение периода от приблизительно 100 нс до приблизительно 10 с или любое время или диапазон времени между указанными значениями.
Клеточные суспензии для доставки в иммунные клетки
[0159] Клеточная суспензия может представлять собой смешанную или очищенную популяцию иммунных клеток. В некоторых вариантах осуществления суспензия клеток представляет собой смешанную популяцию клеток, например цельную кровь или PBMC. В дополнительных вариантах осуществления смешанная популяция клеток представляет собой смесь определенных или очищенных популяций. В некоторых вариантах осуществления суспензия клеток представляет собой очищенную популяцию клеток, например очищенную популяцию иммунных клеток.
[0160] Состав клеточной суспензии (например, осмолярность, концентрация соли, содержание сыворотки, титр клеток, pH и т.д.) может оказывать влияние на доставку соединения для модуляции иммунного ответа. В некоторых вариантах осуществления суспензия содержит цельную кровь. Альтернативно клеточная суспензия представляет собой смесь клеток в физиологическом растворе или физиологической среде, отличной от крови. В некоторых вариантах осуществления клеточная суспензия содержит водный раствор. В некоторых вариантах осуществления водный раствор содержит клеточную культуральную среду (забуференный фосфатом физиологический раствор) PBS, соли, ионы металлов, сахара, факторы роста, продукты животного происхождения, наполнители, поверхностно-активные вещества, смазывающие агенты, липиды, витамины, аминокислоты, белки, ингибиторы клеточного цикла и/или агент, влияющий на полимеризацию актина. В некоторых вариантах осуществления среда для культивирования клеток представляет собой X-VIVO™ 10, X-VIVO™ 15, DMEM, Opti-MEM®, IMDM или RPMI. Кроме того, буферный раствор может включать один или более смазывающих агентов (плюроники или другие поверхностно-активные вещества), которые могут быть разработаны, например, для снижения или устранения закупоривания сужения и повышения жизнеспособности клеток. Примеры поверхностно-активных веществ включают, без ограничения, полоксамер, полисорбаты, сахара или сахарные спирты, такие как маннит, сорбит, сыворотку животного и белок альбумин.
[0161] В некоторых конфигурациях с определенными типами иммунных клеток, иммунные клетки можно инкубировать в одном или нескольких растворах, которые способствуют доставке соединения внутрь иммунной клетки. В некоторых вариантах осуществления водный раствор содержит агент, влияющий на полимеризацию актина. В некоторых вариантах осуществления агент, влияющий на полимеризацию актина, представляет собой латрункулин A, цитохалазин и/или колхицин. Например, иммунные клетки можно инкубировать в растворе для деполимеризации, таком как раствор лантрункулина A (0,1 мкг/мл), в течение 1 ч перед доставкой для деполимеризации актинового цитоскелета. В качестве дополнительного примера, иммунные клетки можно инкубировать в 10 мкМ растворе колхицина (Sigma) в течение 2 ч перед доставкой для деполимеризации сети микротрубочек.
[0162] В некоторых вариантах осуществления популяцию клеток обогащают перед использованием в раскрытых способах. Например, клетки получают из жидкости организма, например периферической крови, и необязательно обогащают или очищают для концентрирования иммунных клеток. Клетки могут быть обогащены любыми способами, известными в данной области, включая, помимо прочего, магнитное разделение клеток, сортинг флуоресцентно-активированных клеток (FACS) или центрифугирование в градиенте плотности.
[0163] Вязкость клеточной суспензии также может оказывать влияние на способы, раскрытые здесь. В некоторых вариантах осуществления вязкость клеточной суспензии находится в диапазоне от приблизительно 8,9×10-4 Па·с до приблизительно 4,0×10-3 Па·с или любое значение или диапазон значений между ними. В некоторых вариантах осуществления вязкость находится в диапазоне от приблизительно 8,9×10-4 Па·с до приблизительно 4,0×10-3 Па·с или любое значение или диапазон значений между ними. В некоторых вариантах вязкость находится в диапазоне от приблизительно 8,9×10-4 Па·с до приблизительно 4,0×10-3 Па·с, от приблизительно 8,9×10-4 Па·с до приблизительно 3,0×10-3 Па·с, от приблизительно 8,9×10-4 Па·с до приблизительно 2,0×10-3 Па·с или от приблизительно 8,9×10-3 Па·с до приблизительно 1,0×10-3 Па·с. В некоторых вариантах осуществления вязкость находится в диапазоне от приблизительно 0,89 сП до приблизительно 4,0 сП, от приблизительно 0,89 сП до приблизительно 3,0 сП, от приблизительно 0,89 сП до приблизительно 2,0 сП или от приблизительно 0,89 сП до приблизительно 1,0 сП. В некоторых вариантах осуществления наблюдается истончение сдвига, при котором вязкость клеточной суспензии уменьшается в условиях деформации сдвига. Вязкость можно измерить любым методом, известным в данной области техники, включая, помимо прочего, вискозиметры, такие как стеклянный капиллярный вискозиметр, или реометры. Вискозиметр измеряет вязкость при одном условии потока, в то время как реометр используется для измерения вязкости, которая изменяется в зависимости от условий потока. В некоторых вариантах осуществления вязкость измеряется для жидкости с истончением сдвига, такой как кровь. В некоторых вариантах осуществления вязкость измеряется при температуре в диапазоне от приблизительно -5°C до приблизительно 45°C. Например, вязкость измеряется при комнатной температуре (например, приблизительно 20°C), физиологической температуре (например, приблизительно 37°C), при температуре выше, чем физиологическая температура (например, от приблизительно 37°C до 45°C или выше), пониженной температуре (например, от приблизительно -5°C до приблизительно 4°C) или при температуре между этими примерными значениями температуры.
Антигены и адъюванты для усиления иммунного ответа
[0164] Некоторые аспекты настоящего изобретения относятся к способу лечения пациента введением пациенту иммунных клеток, модифицированных в соответствии со способами, описанными здесь. В некоторых вариантах осуществления иммунные клетки предназначены для применения в иммунотерапии. В некоторых аспектах изобретение относится к способу лечения заболевания, ассоцированного с вирусом папилломы человека (ВПЧ), у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант. В некоторых аспектах изобретение относится к способу лечения заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген и адъювант прошли через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение.
[0165] В некоторых аспектах изобретение относится к способу профилактики заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант. В некоторых аспектах изобретение относится к способу профилактики заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ и адъювант прошли через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение.
[0166] В некоторых аспектах изобретение относится к способу модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант. В некоторых аспектах изобретение относится к способу модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, содержащую антиген ВПЧ, через микрофлюидный канал, который включает деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ и адъювант прошли через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение. В некоторых вариантах осуществления иммунный ответ усиливается. В некоторых вариантах осуществления иммунный ответ усиливается на антиген ВПЧ.
[0167] Некоторые аспекты изобретения обеспечивают доставку антигенов субъекту с заболеванием, ассоциированным с ВПЧ, для усиления иммунного ответа на антиген введением иммунной клетки, содержащей внутриклеточно антиген, где антиген доставляется в клетку любым из способов, описанных здесь. В некоторых вариантах осуществления антиген представляет собой единственный антиген. В некоторых вариантах осуществления антиген представляет собой смесь антигенов. Антиген представляет собой вещество, которое стимулирует специфический иммунный ответ, такой как иммунный ответ, опосредованный клетками или антителами. Антигены связываются с рецепторами, экспрессированными иммунными клетками, такими как рецепторы Т-клеток (TCR), которые специфичны для определенного антигена. Затем связывание антиген-рецептор запускает внутриклеточные сигнальные пути, которые приводят к нижестоящим иммунным эффекторным путям, таким как активация клеток, продукция цитокинов, миграция клеток, секреция цитотоксических факторов и продукция антител.
[0168] В некоторых вариантах осуществления модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, содержащую антиген ВПЧ, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ и адъювант прошли через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В дополнительных вариантах осуществления диаметр сужения меньше диаметра клетки. В некоторых вариантах осуществления диаметр сужения меньше диаметра иммунных клеток. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 20% до приблизительно 99% от диаметра клетки. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 20% до приблизительно 60% от диаметра клетки. В некоторых вариантах осуществления диаметр сужения составляет приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90%, приблизительно 95% или приблизительно 99% от диаметра клетки. В некоторых вариантах осуществления диаметр сужения составляет от приблизительно 20% до приблизительно 30%, от приблизительно 30% до приблизительно 40%, от приблизительно 40% до приблизительно 50%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70%, от приблизительно 70% до приблизительно 80%, от приблизительно 80% до приблизительно 90%, от приблизительно 90% до приблизительно 95% или от приблизительно 95% до приблизительно 99% от диаметра клетки. В некоторых вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение. В некоторых вариантах осуществления сужение находится в канале. В некоторых вариантах осуществления сужение находится в микрофлюидном канале. В некоторых вариантах осуществления сужение находится внутри фильтра. В еще одних вариантах осуществления сужение представляет собой пору на фильтре.
[0169] В некоторых вариантах осуществления модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и адъювант. В некоторых вариантах осуществления антиген ВПЧ и/или адъювант находятся в цитозоле и/или эндосомах. В некоторых вариантах осуществления антиген и/или адъювант находятся во многих компартментах клетки. В дополнительных вариантах осуществления антиген и/или адъювант находятся в компартментах клетки, включая одно или более из эндоплазматического ретикулума (ER), аппарата Гольджи, лизосомы или экзосом. В некоторых вариантах осуществления антиген и адъювант находятся в одном компартменте. В некоторых вариантах осуществления антиген и адъювант находятся в разных компартментах друг от друга. Например, в некоторых вариантах осуществления антиген находится в цитозоле, тогда как адъювант находится в эндосоме. В некоторых вариантах осуществления модифицированная иммунная клетка дополнительно содержит антиген ВПЧ и/или адъювант вне клетки.
[0170] В некоторых вариантах осуществления концентрация адъюванта, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,01 мкМ до приблизительно 10 мМ. Например, в некоторых вариантах осуществления концентрация адъюванта, инкубированного с пертурбированной входной клеткой, составляет менее приблизительно 0,01 мкМ, приблизительно 0,1 мкМ, приблизительно 1 мкМ, приблизительно 10 мкМ, приблизительно 100 мкМ, приблизительно 1 мМ или приблизительно 10 мМ. В некоторых вариантах осуществления концентрация адъюванта, инкубированного с пертурбированной входной клеткой, составляет выше приблизительно 10 мМ. В некоторых вариантах осуществления концентрация адъюванта, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,01 мкМ до приблизительно 0,1 мкМ, от приблизительно 0,1 мкМ до приблизительно 1 мкМ, от приблизительно 1 мкМ до приблизительно 10 мкМ, от приблизительно 10 мкМ до приблизительно 100 мкМ, от приблизительно 100 мкМ до приблизительно 1 мМ или от приблизительно 1 мМ до приблизительно 10 мМ. В некоторых вариантах осуществления концентрация адъюванта, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0171] В некоторых вариантах осуществления концентрация антигена ВПЧ, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,01 мкМ до приблизительно 10 мМ. Например, в некоторых вариантах осуществления концентрация антигена ВПЧ, инкубированного с пертурбированной входной клеткой, составляет менее приблизительно 0,01 мкМ, приблизительно 0,1 мкМ, приблизительно 1 мкМ, приблизительно 10 мкМ, приблизительно 100 мкМ, приблизительно 1 мМ или приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена ВПЧ, инкубированного с пертурбированной входной клеткой, составляет выше приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена ВПЧ, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,01 мкМ до приблизительно 0,1 мкМ, от приблизительно 0,1 мкМ до приблизительно 1 мкМ, от приблизительно 1 мкМ до приблизительно 10 мкМ, от приблизительно 10 мкМ до приблизительно 100 мкМ, от приблизительно 100 мкМ до приблизительно 1 мМ или от приблизительно 1 мМ до приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена ВПЧ, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0172] В некоторых вариантах осуществления молярное соотношение антигена ВПЧ и адъюванта, инкубированных с пертурбированной входной клеткой, составляет от приблизительно 10000:1 до приблизительно 1:10000. Например, в некоторых вариантах осуществления молярное соотношение антигена ВПЧ и адъюванта, инкубированных с пертурбированной входной клеткой, составляет приблизительно любое из 10000:1, приблизительно 1000:1, приблизительно 100:1, приблизительно 10:1, приблизительно 1:1, приблизительно 1:10, приблизительно 1:100, приблизительно 1:1000 или приблизительно 1:10000. В некоторых вариантах осуществления молярное соотношение антигена ВПЧ и адъюванта, инкубированных с пертурбированной входной клеткой, составляет любое от приблизительно 10000:1 до приблизительно 1000:1, от приблизительно 1000:1 до приблизительно 100:1, от приблизительно 100:1 до приблизительно 10:1, от приблизительно 10:1 до приблизительно 1:1, от приблизительно 1:1 до приблизительно 1:10, от приблизительно 1:10 до приблизительно 1:100, от приблизительно 1:100 до приблизительно 1:1000, от приблизительно 1:1000 и приблизительно 1:10000.
[0173] В некоторых вариантах осуществления модифицированная иммунная клетка содержит адъювант в концентрации от приблизительно 0,01 мкМ до приблизительно 10 мМ. Например, в некоторых вариантах осуществления иммунная клетка содержит адъювант в любой концентрации, составляющей ниже приблизительно 0,01 мкМ, приблизительно 0,1 мкМ, приблизительно 1 мкМ, приблизительно 10 мкМ, приблизительно 100 мкМ, приблизительно 1 мМ или приблизительно 10 мМ. В некоторых вариантах осуществления иммунная клетка содержит адъювант в концентрации выше приблизительно 10 мМ. В некоторых вариантах осуществления иммунная клетка содержит адъювант в любой концентрации от приблизительно 0,1 мкМ до приблизительно 1 мкМ, от приблизительно 1 мкМ до приблизительно 10 мкМ, от приблизительно 10 мкМ до приблизительно 100 мкМ, от приблизительно 100 мкМ до приблизительно 1 мМ или от приблизительно 1 до приблизительно 10 мМ. В некоторых вариантах осуществления модифицированная иммунная клетка содержит адъювант в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0174] В некоторых вариантах осуществления концентрация антигена ВПЧ в модифицированной иммунной клетке составляет от приблизительно 0,01 мкМ до приблизительно 10 мМ. Например, в некоторых вариантах осуществления концентрация антигена ВПЧ в модифицированной иммунной клетке составляет ниже приблизительно 0,01 мкМ, приблизительно 0,1 мкМ, приблизительно 1 мкМ, приблизительно 10 мкМ, приблизительно 100 мкМ, приблизительно 1 мМ или приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена ВПЧ в модифицированной иммунной клетке составляет выше приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена ВПЧ в модифицированной иммунной клетке составляет от приблизительно 0,1 мкМ до приблизительно 1 мкМ, от приблизительно 1 мкМ до приблизительно 10 мкМ, от приблизительно 10 мкМ до приблизительно 100 мкМ, от приблизительно 100 мкМ до приблизительно 1 мМ или от приблизительно 1 до приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена ВПЧ в модифицированной иммунной клетке составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0175] В некоторых вариантах осуществления молярное соотношение антигена ВПЧ и адъюванта, инкубированных в модифицированной иммунной клетке составляет от приблизительно 10000:1 до приблизительно 1:10000. Например, в некоторых вариантах осуществления молярное соотношение антигена ВПЧ и адъюванта, инкубированных в модифицированной иммунной клетке составляет приблизительно 10000:1, приблизительно 1000:1, приблизительно 100:1, приблизительно 10:1, приблизительно 1:1, приблизительно 1:10, приблизительно 1:100, приблизительно 1:1000 или приблизительно 1:10000. В некоторых вариантах осуществления молярное соотношение антигена ВПЧ и адъюванта, инкубированных в модифицированной иммунной клетке составляет от приблизительно 10000:1 до приблизительно 1000:1, от приблизительно 1000:1 до приблизительно 100:1, от приблизительно 100:1 до приблизительно 10:1, от приблизительно 10:1 до приблизительно 1:1, от приблизительно 1:1 до приблизительно 1:10, от приблизительно 1:10 до приблизительно 1:100, от приблизительно 1:100 до приблизительно 1:1000, от приблизительно 1:1000 до приблизительно 1:10000.
[0176] В некоторых вариантах осуществления антиген представляет собой полипептидный антиген. В некоторых вариантах осуществления антиген модифицирован липидом. В некоторых вариантах осуществления модифицированный антиген модифицирован полисахаридом или углеводным фрагментом. В некоторых вариантах осуществления антиген ассоциирован с вирусом. В некоторых вариантах осуществления антиген представляет собой вирусный антиген. Типичные вирусные антигены включают антигены ВПЧ. В дополнительных вариантах осуществления антиген представляет собой антиген ВПЧ. В некоторых вариантах осуществления антиген ВПЧ выбран из группы, состоящей из: ВПЧ-16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73 и 82. ВПЧ-16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 и 82 относятся к типам с высоким онкогенным риском, тогда как ВПЧ-26, 53 и 66 являются «типами вероятного высокого онкогенного риска». В некоторых вариантах осуществления антиген ВПЧ представляет собой полипептид, содержащий антигенный эпитоп ВПЧ и одну или более гетерологичных пептидных последовательностей. В некоторых вариантах осуществления антиген представляет собой антиген ВПЧ-16 или антиген ВПЧ-18. В некоторых вариантах осуществления антиген ВПЧ состоит из HLA-A2-рестриктированного эпитопа. Гены ВПЧ Е6 и Е7 являются онкогенами вируса, и экспрессия этих генов требуется для злокачественной трансформации. Белки ВПЧ E6 и E7 нацелены на ряд негативных регуляторов клеточного цикла, в первую очередь на p105Rb и p53 соответственно, и таким образом препятствуют регуляции клеточного цикла. В дополнительных вариантах осуществления антиген ВПЧ представляет собой антиген ВПЧ E6 или антиген ВПЧ E7. В некоторых вариантах осуществления модифицированные иммунные клетки содержат антиген ВПЧ E6 и антиген ВПЧ E7. В некоторых вариантах осуществления антиген ВПЧ представляет собой полипептид, содержащий иммуногенный эпитоп, фланкированный на N-конце и/или C-конце одной или более гетерологичными пептидными последовательностями. В некоторых вариантах осуществления антиген ВПЧ представляет собой эпитоп ВПЧ E7, фланкированный последовательностями полипептида ВПЧ E6 (E7.6). В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-26. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность SEQ ID NO: 23. В некоторых вариантах осуществления антиген HPV содержит аминокислотную последовательность согласно любой из SEQ ID NO: 18-26. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность SEQ ID NO: 23.
[0177] В некоторых вариантах осуществления антиген происходит из клеточного лизата, такого как лизат патологических клеток. В некоторых вариантах осуществления антиген находится в клеточном лизате. В некоторых вариантах осуществления антиген происходит из опухолевого лизата. В некоторых вариантах антиген происходит из лизата опухолевых клеток, ассоциированных с ВПЧ. В некоторых вариантах осуществления изобретения рак, ассоциированный с ВПЧ, представляет собой любое из опухолей головы и шеи, рака шейки матки, рака вульвы, рака влагалища, рака полового члена, рака анального канала, рака перианально области, аногенитального рака, рака ротовой полости или рака слюнной железы.
[0178] В некоторых аспектах изобретение относится к способу лечения рака, ассоциированного с вирусом папилломы человека (ВПЧ), у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-26. В некоторых аспектах изобретение относится к способу лечения заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-26; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген прошел через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение.
[0179] В некоторых аспектах изобретение относится к способу профилактики заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-26. В некоторых аспектах изобретение относится к способу профилактики заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-26; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ прошел через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение.
[0180] В некоторых аспектах изобретение относится к способу модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-26. В некоторых аспектах изобретение относится к способу модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-26; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ прошел через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В некоторых вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение. В некоторых вариантах осуществления иммунный ответ усиливается. В некоторых вариантах осуществления иммунный ответ усиливается на антиген ВПЧ.
[0181] В некоторых вариантах осуществления антиген ВПЧ представляет собой пул множества полипептидов, которые вызывают ответ против одного и того же или разных антигенов ВПЧ. В некоторых вариантах осуществления антигены, содержащиеся в пуле множества антигенов, не снижают иммунный ответ, направленный против других антигенов. Например, при использовании пула антигенов ВПЧ E6 и E7 соответствующие иммунные ответы, направленные на антигены ВПЧ E6 и E7, будут сравнимы с использованием только одного ВПЧ E6 или только одного ВПЧ E7 в качестве антигена, соответственно.
[0182] В некоторых вариантах осуществления антиген ВПЧ представляет собой полипептид, содержащий иммуногенный эпитоп ВПЧ и одну или более гетерологичных пептидных последовательностей. В некоторых вариантах осуществления один или более антигенов ВПЧ образуют комплекс сами с собой, с другими антигенами или с адъювантом.
[0183] В рамках изобретения, термин «адъювант» относится к веществу, которое прямо или опосредованно модулирует и/или индуцирует иммунный ответ. Обычно адъювант вводят вместе с антигеном для усиления иммунного ответа на антиген по сравнению с одним антигеном. Следовательно, адъюванты можно использовать для усиления ответной реакции иммунных клеток (например, Т-клеточного ответа) на антиген. В некоторых вариантах осуществления изобретение относится к иммунным клеткам, модифицированным для включения внутриклеточно антигена ВПЧ и внутриклеточно адъюванта. В некоторых вариантах осуществления иммунные клетки, пертурбируют, как здесь описано, инкубируют как с антигеном ВПЧ, так и с адъювантом. Типичные включенные внутриклеточно адъюванты включают, без ограничения, CpG ODN, интерферон-(IFN-α), стимулятор генов интерферона (STING), агонисты гена I индуцируемого ретиноевой кислотой (RIG-I), и полиинозиновую:полицитидиловую кислоту (поли I:C) В некоторых вариантах осуществления адъювант представляет собой CpG ODN, IFN-α, агонисты STING, агонисты RIG-I или поли I:C. В конкретных вариантах осуществления адъювант представляет собой полинуклеотид CpG ODN. В некоторых вариантах осуществления адъювант CpG ODN выбран из группы, состоящей из CpG ODN 1018, CpG ODN 1585, CpG ODN 2216, CpG ODN 2336, CpG ODN 1668, CpG ODN 1826, CPG ODN 2006, CpG ODN 2007, CpG ODN BW006, CpG ODN D-SL01, CpG ODN 2395, CpG ODN M362, CpG ODN D-SL03. В некоторых вариантах осуществления адъювант CpG ODN представляет собой олигонуклеотид CpG ODN 1826 (TCCATGACGTTCCTGACGTT; SEQ ID NO: 30) или CpG ODN 2006 (также известный как CpG ODN 7909) (TCGTCGTTTGTCGTTTTTGTCGTT; SEQ ID NO: 31). В некоторых вариантах осуществления агонист RIG-I содержит полиинозиновую:полицитидиловую кислоту (поли I:C). Многочисленные адъюванты также можно использовать в сочетании с антигенами для усиления индукции иммунного ответа. В некоторых вариантах осуществления модифицированная иммунная клетка содержит более одного адъюванта. Многочисленные адъюванты также можно использовать в сочетании с антигенами для усиления индукции иммунного ответа. В некоторых вариантах осуществления модифицированная иммунная клетка содержит более одного адъюванта. В некоторых вариантах осуществления модифицированная иммунная клетка содержит любую комбинацию адъювантов CpG ODN, IFN-α, агонистов STING, агонистов RIG-I или поли I:C.
[0184] Примерные адъюванты включают, без ограничения, CpG ODN, интерферон-α (IFN-α), полиинозиновую:полицитидиловую кислоту (поли I:C), имиквимод (R837), резиквимод (R848) или липополисахарид (LPS). В некоторых вариантах осуществления адъювант представляет собой CpG ODN, LPS, IFN-α, агонисты STING, агонисты RIG-I, поли I:C, R837, R848, агонист TLR3, агонист TLR4 или агонист TLR 9. В конкретных вариантах осуществления адъювант представляет собой CpG ODN. В некоторых вариантах осуществления адъювант представляет собой CpG ODN. В некоторых вариантах осуществления CpG ODN представляет собой CpG ODN класса A, CpG ODN класса B или CpG ODN класса C. В некоторых вариантах осуществления адъювант CpG ODN выбран из группы, состоящей из CpG ODN 1018, CpG ODN 1585, CpG ODN 2216, CpG ODN 2336, CpG ODN 1668, CpG ODN 1826, CPG ODN 2006, CpG ODN 2007, CpG ODN BW006, CpG ODN D-SL01, CpG ODN 2395, CpG ODN M362, CpG ODN D-SL03. В некоторых вариантах осуществления адъювант CpG ODN представляет собой олигонуклеотид CpG ODN 1826 (TCCATGACGTTCCTGACGTT; SEQ ID NO: 30) или CpG ODN 2006 (также известный как CpG ODN 7909) (TCGTCGTTTGTCGTTTTTGTCGTT; SEQ ID NO: 31). В некоторых вариантах осуществления адъювант представляет собой CpG ODN 7909. В некоторых вариантах осуществления агонист RIG-I содержит полиинозиновую: полицитидиловую кислоту (поли I:C). Многочисленные адъюванты также можно использовать в сочетании с антигенами для усиления индукции иммунного ответа. В некоторых вариантах осуществления модифицированная иммунная клетка содержит более одного адъюванта. Многочисленные адъюванты также можно использовать в сочетании с антигенами для усиления индукции иммунного ответа. В некоторых вариантах осуществления модифицированная иммунная клетка содержит более одного адъюванта. В некоторых вариантах осуществления модифицированная иммунная клетка включает любую комбинацию адъювантов CpG ODN, LPS, IFN-α, агонистов STING, агонистов RIG-I, поли I:C, R837, R848, агониста TLR3, агониста TLR4 или агониста TLR 9.
[0185] В любом из вариантов осуществления, описанных здесь, если не указано иное, то адъювант может относиться к (а) адъюванту, который инкубируют с пертурбированной входной иммунной клеткой и проходит в нее, (b) адъюванту, инкубированному с PBMC, для PBMC для кодиционирования, (c) адъюванту, совместно вводимому субъекту с модифицированными иммунными клетками.
[0186] В некоторых вариантах осуществления модифицированная иммунная клетка дополнительно содержит агент, который повышает жизнеспособность и/или функцию модифицированной иммунной клетки по сравнению с соответствующей модифицированной иммунной клеткой, которая не включает агента. В некоторых вариантах осуществления агент представляет собой соединение, усиливающее эндоцитоз, стабилизирующий агент или кофактор. В некоторых вариантах осуществления стабилизирующий агент образует комплекс с антигеном ВПЧ и/или адъювантом. В некоторых вариантах осуществления стабилизирующий агент увеличивает растворимость и/или период полужизни в растворе антигена ВПЧ и/или адъюванта. В некоторых вариантах осуществления множество модифицированных иммунных клеток обладают большей жизнеспособностью, чем соответствующие модифицированные иммунные клетки, которые не содержат стабилизирующий агент. В некоторых вариантах осуществления агент представляет собой альбумин. В дополнительных вариантах осуществления альбумин представляет собой мышиный, бычий или человеческий альбумин. В дополнительных вариантах осуществления агент представляет собой катион двухвалентного металла, глюкозу, АТФ, калий, глицерин, трегалозу, D-сахарозу, PEG1500, L-аргинин, L-глутамин или ЭДТА. В некоторых вариантах осуществления катион двухвалентного металла представляет собой один или более из Mg2+, Zn2+ или Ca2+. В некоторых вариантах осуществления агент включает MSA.
[0187] В некоторых вариантах осуществления согласно любому из способов или композиций, описанных здесь, модифицированная иммунная клетка дополнительно содержит агент, который повышает жизнеспособность и/или функцию модифицированной иммунной клетки по сравнению с соответствующим множеством модифицированных иммунных клеток, которые не содержит агента. В некоторых вариантах осуществления модифицированная иммунная клетка дополнительно содержит агент, который повышает жизнеспособность и/или функцию модифицированной иммунной клетки в цикле замораживания-оттаивания по сравнению с соответствующей модифицированной иммунной клеткой, которая не включает агент. В некоторых вариантах осуществления агент представляет собой агент для криоконсервации и/или агент для гипотермической консервации. В некоторых вариантах осуществления изобретения агент для криоконсервации и агент для гипотермической консервации не вызывают более 10% или 20% клеточной гибели в модифицированной иммунной клетке, содержащей агент, по сравнению с соответствующей модифицированной иммунной клеткой, которая не содержит агент, до любого цикла замораживания-оттаивания. В некоторых вариантах осуществления, по меньшей мере, приблизительно 70%, приблизительно 80% или приблизительно 90% модифицированных иммунных клеток являются жизнеспособными после 1, 2, 3, 4, 5 циклов замораживания-оттаивания. В некоторых вариантах осуществления агент представляет собой соединение, усиливающее эндоцитоз, стабилизирующий агент или кофактор. В некоторых вариантах осуществления агент представляет собой альбумин. В некоторых вариантах осуществления альбумин представляет собой мышиный, бычий или человеческий альбумин. В некоторых вариантах осуществления агент представляет собой альбумин человека. В некоторых вариантах осуществления агент представляет собой одно или более из следующего: катион двухвалентного металла, глюкоза, АТФ, калий, глицерин, трегалоза, D-сахароза, PEG1500, L-аргинин, L-глутамин или ЭДТА. В некоторых вариантах осуществления катион двухвалентного металла представляет собой один или более из Mg2+, Zn2+ или Ca2+. В некоторых вариантах осуществления агент представляет собой одно или более из следующего: пируват натрия, аденин, трегалоза, декстроза, манноза, сахароза, сывороточный альбумин человека (HSA), ДМСО, HEPES, глицерин, глутатион, инозин, двухосновный фосфат натрия, одноосновный фосфат натрия, ионы металла натрия, ионы металла калия, ионы металла магния, хлорид, ацетат, глюконат, сахароза, гидроксид калия или гидроксид натрия. В некоторых вариантах осуществления агент представляет собой одно или более из следующего: пируват натрия, аденин, Rejuvesol®, трегалоза, декстроза, манноза, сахароза, сывороточный альбумин человека (HSA), PlasmaLyte®, DMSO, Cryostor® CS2, Cryostor® CS5, Cryostor® CS10, Cryostor® CS15, HEPES, глицерин, глутатион, HypoThermosol®.
[0188] В некоторых вариантах осуществления модифицированные иммунные клетки дополнительно модифицируют для повышения экспрессии одной или более костимулирующих молекул. В дополнительных вариантах осуществления костимулирующая молекула представляет собой B7-H2 (ICOSL), B7-1 (CD80), B7-2 (CD86), CD70, LIGHT, HVEM, CD40, 4-1BBL, OX40L, TL1A, GITRL, CD30L, TIM4, SLAM, CD48, CD58, CD155 или CD112. В некоторых вариантах осуществления клетка содержит нуклеиновую кислоту, которая приводит к повышенной экспрессии одной или более костимулирующих молекул.
[0189] В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку, дендритную клетку, моноцит, макрофаг, миелоидную клетку, гранулоцит, нейтрофил, тучную клетку, естественную клетку-киллер, врожденную лимфоидную клетку, базофил или гематопоэтическую клетку-предшественник. В некоторых вариантах осуществления иммунная клетка не является В-клеткой. В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку. В некоторых вариантах осуществления иммунная клетка представляет собой другую клетку, отличную от В-клетки. В некоторых вариантах осуществления модифицированная Т-клетка включает одно или более из Т-хелперов, цитотоксических Т-клеток, Т-клеток памяти, CIK-клеток или естественных Т-клеток-киллеров. В некоторых вариантах осуществления Т-клетка включает одно или более из CD3+ Т-клеток, CD4+ Т-клеток, CD8+ Т-клеток, CD45RA+ Т-клеток, CD45RO+ Т-клеток и γδ-Т-клеток. Экспрессия MHC в аллогенных Т-клетках может приводить к врожденному иммунному ответу, развившемуся у субъекта в ответ на их введение, и приводит к сокращению периода полужизни таких Т-клеток. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса I. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса II. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для снижения экспрессии молекул MHC класса I и/или молекул MHC класса II. В конкретных вариантах осуществления дополнительная модификация включает снижение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием siРНК, shРНК, CRISPR/Cas9, ZFN, TALEN, Cre-рекомбиназы или мегануклеазы. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для увеличения экспрессии молекул MHC класса I и/или молекул MHC класса II. В конкретных вариантах осуществления дополнительная модификация включает повышение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием мРНК, плазмидной ДНК или кДНК. В некоторых вариантах осуществления в аллогенном контексте врожденный иммунный ответ, развившийся у субъекта в ответ на введение дополнительно модифицированных Т-клеток, снижен, в аллогенном контексте, по сравнению с врожденным иммунным ответом, развившимся у субъекта в ответ на введение соответствующих модифицированных Т-клеток, которые не содержат дополнительную модификацию. В некоторых вариантах осуществления период полужизни в кровотоке дополнительно модифицированных Т-клеток у субъекта, которому они были введены, модифицируется по сравнению с периодом полужизни в кровотоке соответствующих модифицированных Т-клеток, которые не содержат дополнительных модификаций, у субъекта, которому они были введены. В некоторых вариантах осуществления модифицированная Т-клетка включает одно или более из Т-хелперов, цитотоксических Т-клеток, Т-клеток памяти, CIK-клеток или естественных Т-клеток-киллеров. В некоторых вариантах осуществления Т-клетка включает одно или более из CD3+ Т-клеток, CD4+ Т-клеток, CD8+ Т-клеток, CD45RA+ Т-клеток, CD45RO+ Т-клеток или γδ-Т-клеток.
[0190] Иммунные клетки и другие клетки можно использовать в качестве источника аутологичных или аллогенных клеток. В некоторых вариантах осуществления модифицированная иммунная клетка является аллогенной для субъекта. В других вариантах осуществления модифицированная иммунная клетка является аутологичной для субъекта. В некоторых вариантах осуществления субъект, подлежащий лечению, предварительно кондиционирован к модуляции воспаления.
[0191] Адъюванты можно использовать для дополнительного усиления иммунного ответа на антигены ВПЧ. В некоторых вариантах осуществления способ лечения дополнительно включает введение субъекту адъюванта. Типичный адъювант включает, без ограничения, IFN-α, CpG ODN, агонисты STING, агонисты RIG-I и поли I:C. В некоторых вариантах осуществления адъювант представляет собой IFN-α или CpG ODN. В некоторых вариантах осуществления адъювант представляет собой IFN-α, CpG ODN, агонисты STING, агонисты RIG-I или поли I:C. В некоторых вариантах осуществления адъювант включает любую комбинацию IFN-α, CpG ODN, агонистов STING, агонистов RIG-I или поли I:C.
[0192] В некоторых вариантах осуществления способ включает многократное введение модифицированных иммунных клеток. В некоторых вариантах осуществления способ включает от приблизительно 3 до приблизительно 9 введений модифицированных иммунных клеток. В некоторых вариантах осуществления способ включает приблизительно одно из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 введений модифицированных иммунных клеток. В некоторых вариантах осуществления способ включает непрерывное введение модифицированных иммунных клеток при необходимости. В некоторых вариантах осуществления временной интервал между двумя последовательными введениями модифицированных иммунных клеток составляет от приблизительно 1 суток до приблизительно 30 суток. В некоторых вариантах осуществления временной интервал между двумя последовательными введениями модифицированных иммунных клеток составляет приблизительно 21 сутки. В некоторых вариантах осуществления временной интервал между двумя последовательными введениями модифицированных иммунных клеток составляет приблизительно одно из 1, 2, 3, 4, 5, 6, 7, 8, 10, 12, 14, 16, 20, 25. , 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или 150 суток. В некоторых вариантах осуществления модифицированные иммунные клетки представляют множество модифицированных PBMC. В некоторых вариантах осуществления модифицированные иммунные клетки представляют кондиционированное множество модифицированных PBMC. Способы кондиционирования PBMC предоставлены в предварительной заявке на патент США № 62/812225 и в заявке на европейский патент № EP 19161964.2, которые в полном объеме включены здесь посредством ссылки.
[0193] В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки и адъювант, вводят одновременно. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки и адъювант, вводят последовательно.
[0194] В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят до введения адъюванта. Например, композицию, содержащую модифицированные иммунные клетки, вводят за от приблизительно 1 ч до приблизительно 1 недели до введения адъюванта. Например, в некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят приблизительно за 1 ч, приблизительно 2 ч, приблизительно 3 ч, приблизительно 4 ч, приблизительно 6 ч, приблизительно 8 ч, приблизительно 10 ч, приблизительно 12 ч, приблизительно 14 ч, приблизительно 16 ч, приблизительно 18 ч, приблизительно 20 ч, приблизительно 24 ч, приблизительно 30 ч, приблизительно 36 ч, приблизительно 42 ч, приблизительно 48 ч, приблизительно 60 ч, приблизительно 3 суток, приблизительно 4 суток, приблизительно 5 суток, приблизительно 6 суток или приблизительно 7 суток до введения адъюванта. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят за от приблизительно 1 ч до приблизительно 2 ч, от приблизительно 2 ч до приблизительно 3 ч, от приблизительно 3 ч до приблизительно 4 ч, от приблизительно 4 ч до приблизительно 6 ч, от приблизительно 6 ч до приблизительно 8 ч, от приблизительно 8 ч до приблизительно 10 ч, от приблизительно 10 ч до приблизительно 12 ч, от приблизительно 12 ч до приблизительно 14 ч, от приблизительно 14 ч до приблизительно 16 ч, от приблизительно 16 ч до приблизительно 18 ч, от приблизительно 18 ч до приблизительно 20 ч, от приблизительно 20 ч до приблизительно 24 ч, от приблизительно 24 ч до приблизительно 30 ч, от приблизительно 30 ч до приблизительно 36 ч, от приблизительно 36 ч до приблизительно 42 ч, от приблизительно 42 ч до приблизительно 48 ч, от приблизительно 48 ч до приблизительно 60 ч, от приблизительно 60 ч до приблизительно 3 суток, от приблизительно 3 суток до приблизительно 4 суток, от приблизительно 4 суток до приблизительно 5 суток, от приблизительно 5 суток до приблизительно 6 суток, от приблизительно 6 суток до приблизительно 7 суток до введения адъюванта.
[0195] В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят после введения адъюванта. Например, композицию, содержащую модифицированные иммунные клетки, вводят через от приблизительно 1 ч до приблизительно 1 недели после введения адъюванта. Например, в некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят приблизительно через 1 ч, приблизительно 2 ч, приблизительно 3 ч, приблизительно 4 ч, приблизительно 6 ч, приблизительно 8 ч, приблизительно 10 ч, приблизительно 12 ч, приблизительно 14 ч, приблизительно 16 ч, приблизительно 18 ч, приблизительно 20 ч, приблизительно 24 ч, приблизительно 30 ч, приблизительно 36 ч, приблизительно 42 ч, приблизительно 48 ч, приблизительно 60 ч, приблизительно 3 суток, приблизительно 4 суток, приблизительно 5 суток, приблизительно 6 суток или приблизительно 7 суток после введения адъюванта. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят через от приблизительно 1 ч до приблизительно 2 ч, от приблизительно 2 ч до приблизительно 3 ч, от приблизительно 3 ч до приблизительно 4 ч, от приблизительно 4 ч до приблизительно 6 ч, от приблизительно 6 ч до приблизительно 8 ч, от приблизительно 8 ч до приблизительно 10 ч, от приблизительно 10 ч до приблизительно 12 ч, от приблизительно 12 ч до приблизительно 14 ч, от приблизительно 14 ч до приблизительно 16 ч, от приблизительно 16 ч до приблизительно 18 ч, от приблизительно 18 ч до приблизительно 20 ч, от приблизительно 20 ч до приблизительно 24 ч, от приблизительно 24 ч до приблизительно 30 ч, от приблизительно 30 ч до приблизительно 36 ч, от приблизительно 36 ч до приблизительно 42 ч, от приблизительно 42 ч до приблизительно 48 ч, от приблизительно 48 ч до приблизительно 60 ч, от приблизительно 60 ч до приблизительно 3 суток, от приблизительно 3 суток до приблизительно 4 суток, от приблизительно 4 суток до приблизительно 5 суток, от приблизительно 5 суток до приблизительно 6 суток, от приблизительно 6 суток до приблизительно 7 суток после введения адъюванта.
[0196] Иммунные контрольные точки являются регуляторами иммунной системы и контролируют ответные иммунные реакции. Ингибиторы иммунных контрольных точек можно использовать для способствования усилению иммунного ответа. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят в комбинации с введением ингибитора иммунных контрольных точек. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, и ингибитор иммунных контрольных точек, вводят одновременно. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки и ингибитор иммунных контрольных точек, вводят последовательно.
[0197] В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят до введения ингибитора иммунных контрольных точек. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят после введения ингибитора иммунных контрольных точек. Например, композицию, содержащую модифицированные иммунные клетки, вводят за от приблизительно 1 ч до приблизительно 1 недели до введения ингибитора иммунных контрольных точек. Например, в некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят приблизительно за 1 ч, приблизительно 2 ч, приблизительно 3 ч, приблизительно 4 ч, приблизительно 6 ч, приблизительно 8 ч, приблизительно 10 ч, приблизительно 12 ч, приблизительно 14 ч. ч, приблизительно 16 ч, приблизительно 18 ч, приблизительно 20 ч, приблизительно 24 ч, приблизительно 30 ч, приблизительно 36 ч, приблизительно 42 ч, приблизительно 48 ч, приблизительно 60 ч, приблизительно 3 суток, приблизительно 4 суток, приблизительно 5 суток, приблизительно за 6 суток или приблизительно за 7 суток до введения ингибитора иммунных контрольных точек. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят за от приблизительно 1 ч до приблизительно 2 ч, от приблизительно 2 ч до приблизительно 3 ч, от приблизительно 3 ч до приблизительно 4 ч, от приблизительно 4 ч до приблизительно 6 ч, от приблизительно 6 ч до приблизительно 8 ч, от приблизительно 8 ч до приблизительно 10 ч, от приблизительно 10 ч до приблизительно 12 ч, от приблизительно 12 ч до приблизительно 14 ч, от приблизительно 14 ч до приблизительно 16 ч, от приблизительно 16 ч до приблизительно 18 ч, от приблизительно 18 ч до приблизительно 20 ч, от приблизительно 20 ч до приблизительно 24 ч, от приблизительно 24 ч до приблизительно 30 ч, от приблизительно 30 ч до приблизительно 36 ч, от приблизительно 36 ч до приблизительно 42 ч, от приблизительно 42 ч до приблизительно 48 ч, от приблизительно 48 ч до приблизительно 60 ч, от приблизительно 60 ч до приблизительно 3 суток, от приблизительно 3 суток до приблизительно 4 дня, или от приблизительно 4 суток до приблизительно 5 суток, от приблизительно 5 суток до приблизительно 6 суток, от приблизительно 6 суток до приблизительно 7 суток до введения ингибитора иммунных контрольных точек.
[0198] В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят после введения ингибитора иммунных контрольных точек. Например, композицию, содержащую модифицированные иммунные клетки, вводят через от приблизительно 1 ч до приблизительно 1 недели после введения ингибитора иммунных контрольных точек. Например, в некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят приблизительно через 1 ч, приблизительно 2 ча, приблизительно 3 ч, приблизительно 4 ч, приблизительно 6 ч, приблизительно 8 ч, приблизительно 10 ч, приблизительно 12 ч, приблизительно 14 ч, приблизительно 16 ч, приблизительно 18 ч, приблизительно 20 ч, приблизительно 24 ч, приблизительно 30 ч, приблизительно 36 ч, приблизительно 42 ч, приблизительно 48 ч, приблизительно 60 ч, приблизительно 3 суток, приблизительно 4 суток, приблизительно 5 суток, приблизительно 6 суток или приблизительно 7 суток после введения ингибитора иммунных контрольных точек. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят через от приблизительно 1 ч до приблизительно 2 ч, от приблизительно 2 ч до приблизительно 3 ч, от приблизительно 3 ч до приблизительно 4 ч, от приблизительно 4 ч до приблизительно 6 ч, от приблизительно 6 ч до приблизительно 8 ч, от приблизительно 8 ч до приблизительно 10 ч, от приблизительно 10 ч до приблизительно 12 ч, от приблизительно 12 ч до приблизительно 14 ч, от приблизительно 14 ч до приблизительно 16 ч, от приблизительно 16 ч до приблизительно 18 ч, от приблизительно 18 ч до приблизительно 20 ч, от приблизительно 20 ч до приблизительно 24 ч, от приблизительно 24 ч до приблизительно 30 ч, от приблизительно 30 ч до приблизительно 36 ч, от приблизительно 36 ч до приблизительно 42 ч, от приблизительно 42 ч до приблизительно 48 ч, от приблизительно 48 ч до приблизительно 60 ч, от приблизительно 60 ч до приблизительно 3 суток, от приблизительно 3 суток до приблизительно 4 суток, или от приблизительно через 4 суток до приблизительно 5 суток, от приблизительно 5 суток до приблизительно 6 суток, от приблизительно 6 суток до приблизительно 7 суток после введения ингибитора иммунных контрольных точек.
[0199] В некоторых вариантах осуществления способ включает многократное введение композиции, содержащей модифицированные иммунные клетки, и/или многократное введение ингибитора иммунных контрольных точек. Например, в некоторых вариантах осуществления способ включает два введения, три введения, четыре введения, пять введений, шесть введений, семь введений, восемь введений, девять введений, десять введений, одиннадцать введений, двенадцать введений, тринадцать введений, четырнадцать введений или пятнадцать введений композиции, содержащей модифицированные иммунные клетки и/или ингибитора иммунных контрольных точек. Например, в некоторых вариантах осуществления способ включает менее пяти введений, менее десяти введений, менее пятнадцати введений, менее двадцати введений, менее двадцати пяти введений, менее тридцати введений, менее пятидесяти введений, менее семидесяти пяти введений, менее ста или менее двухсот введений композиции, содержащей модифицированные иммунные клетки и/или ингибитора иммунных контрольных точек.
[0200] Типичный ингибитор иммунных контрольных точек нацелен, без ограничения, на PD-1, PD-L1, CTLA-4, LAG3 или TIM-3. В некоторых вариантах осуществления ингибитор иммунных контрольных точек нацелен на одно или более из PD-1, PD-L1, CTLA-4, LAG3 или TIM-3. В некоторых вариантах осуществления ингибитор иммунных контрольных точек представляет собой одно или более из: антитела, которое связывается с PD-1, антитела, которое связывается с PD-L1, антитела, которое связывается с CTLA-4, антитела, которое связывается с LAG3, или антитела, которое связывается с TIM-3. В дополнительных вариантах осуществления антитело может представлять полноразмерное антитело или любые варианты, например, не ограничиваясь этим, фрагмент антитела, одноцепочечный вариабельный фрагмент (ScFv) или антигенсвязывающий фрагмент (Fab). В дополнительных вариантах осуществления антитело может быть биспецифическим, триспецифическим или мультиспецифическим. В некоторых вариантах осуществления ингибитор иммунных контрольных точек представляет собой одно или более химических соединений, которые связываются или ингибируют одно или более из PD-1, PD-L1, CTLA-4, LAG3 или TIM-3. В некоторых вариантах осуществления ингибитор иммунных контрольных точек представляет собой один или более пептидов, которые связываются и/или ингибируют одно или более из PD-1, PD-L1, CTLA-4, LAG3 или TIM-3.
[0201] Другой примерный ингибитор иммунных контрольных точек нацелен, без ограничения, на TIGIT, VISTA, TIM1, B7-H4 (VTCN1) или BTLA. В некоторых вариантах осуществления ингибитор иммунных контрольных точек нацелен на одно или более из TIGIT, VISTA, TIM1, B7-H4(VTCN1) или BTLA. В некоторых вариантах осуществления ингибитор иммунных контрольных точек представляет собой одно или более из: антитела, которое связывается с TIGIT, антитела, которое связывается с VISTA, антитела, которое связывается с TIM1, антитела, которое связывается с B7-H4 (VTCN1), или антитела, которое связывается с BTLA. В дополнительных вариантах осуществления антитело может представлять полноразмерное антитело или любые варианты, например, не ограничиваясь этим, фрагмент антитела, одноцепочечный вариабельный фрагмент (ScFv) или антигенсвязывающий фрагмент (Fab). В дополнительных вариантах осуществления антитело может быть биспецифическим, триспецифическим или мультиспецифическим. В некоторых вариантах осуществления ингибитор иммунных контрольных точек представляет собой одно или более химических соединений, которые связываются и/или ингибируют одно или более из PD-1, PD-L1, CTLA-4, LAG3, TIM-3, TIGIT, VISTA, TIM1, B7-H4 (VTCN1) или BTLA. В некоторых вариантах осуществления ингибитор иммунных контрольных точек представляет собой один или более пептидов, которые связываются и/или ингибируют одно или более из PD-1, PD-L1, CTLA-4, LAG3, TIM-3, TIGIT, VISTA, TIM1, B7-H4(VTCN1) или BTLA.
[0202] Химиотерапию или лучевую терапию можно использовать в комбинации с любой из модифицированных иммунных клеток, описанных здесь, для достижения аддитивных или синергических эффектов против рака, например, рака, ассоциированного с ВПЧ. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят в комбинации с введением химиотерапевтического препарата. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, и химиотерапевтический препарат вводят одновременно. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, и химиотерапевтический препарат вводят последовательно.
[0203] В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят до введения химиотерапевтического препарата. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят после введения химиотерапевтического препарата. Например, композицию, содержащую модифицированные иммунные клетки, вводят за от приблизительно 1 ч до приблизительно 1 недели до введения химиотерапевтического препарата. Например, в некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят за приблизительно 1 ч, приблизительно 2 ч, приблизительно 3 ч, приблизительно 4 ч, приблизительно 6 ч, приблизительно 8 ч, приблизительно 10 ч, приблизительно 12 ч, приблизительно 14 ч. ч, приблизительно 16 ч, приблизительно 18 ч, приблизительно 20 ч, приблизительно 24 ч, приблизительно 30 ч, приблизительно 36 ч, приблизительно 42 ч, приблизительно 48 ч, приблизительно 60 ч, приблизительно 3 суток, приблизительно 4 суток, приблизительно 5 суток, приблизительно за 6 суток или приблизительно за 7 суток до введения химиотерапевтического препарата. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят за от приблизительно 1 ч до приблизительно 2 ч, от приблизительно 2 ч до приблизительно 3 ч, от приблизительно 3 ч до приблизительно 4 ч, от приблизительно 4 ч до приблизительно 6 ч, от приблизительно 6 ч до приблизительно 8 ч, от приблизительно 8 ч до приблизительно 10 ч, от приблизительно 10 ч до приблизительно 12 ч, от приблизительно 12 ч до приблизительно 14 ч, от приблизительно 14 ч до приблизительно 16 ч, от приблизительно 16 ч до приблизительно 18 ч, от приблизительно 18 ч до приблизительно 20 ч, от приблизительно 20 ч до приблизительно 24 ч, от приблизительно 24 ч до приблизительно 30 ч, от приблизительно 30 ч до приблизительно 36 ч, от приблизительно 36 ч до приблизительно 42 ч, от приблизительно 42 ч до приблизительно 48 ч, от приблизительно 48 ч до приблизительно 60 ч, от приблизительно 60 ч до приблизительно 3 суток, от приблизительно 3 суток до приблизительно 4 суток, или от приблизительно 4 суток до приблизительно 5 суток, от приблизительно 5 суток до приблизительно 6 суток, от приблизительно 6 суток до приблизительно 7 суток до введения химиотерапевтического препарата.
[0204] В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят после введения химиотерапевтического препарата. Например, композицию, содержащую модифицированные иммунные клетки, вводят через от приблизительно 1 ч до приблизительно 1 недели после введения химиотерапевтического препарата. Например, в некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят приблизительно через 1 ч, приблизительно 2 ч, приблизительно 3 ч, приблизительно 4 ч, приблизительно 6 ч, приблизительно 8 ч, приблизительно 10 ч, приблизительно 12 ч, приблизительно 14 ч. ч, приблизительно 16 ч, приблизительно 18 ч, приблизительно 20 ч, приблизительно 24 ч, приблизительно 30 ч, приблизительно 36 ч, приблизительно 42 ч, приблизительно 48 ч, приблизительно 60 ч, приблизительно 3 суток, приблизительно 4 суток, приблизительно 5 суток, приблизительно через 6 суток или приблизительно через 7 суток после введения химиотерапевтического препарата. В некоторых вариантах осуществления композицию, содержащую модифицированные иммунные клетки, вводят через от приблизительно 1 ч до приблизительно 2 ч, от приблизительно 2 ч до приблизительно 3 ч, от приблизительно 3 ч до приблизительно 4 ч, от приблизительно 4 ч до приблизительно 6 ч, от приблизительно 6 ч до приблизительно 8 ч, от приблизительно 8 ч до приблизительно 10 ч, от приблизительно 10 ч до приблизительно 12 ч, от приблизительно 12 ч до приблизительно 14 ч, от приблизительно 14 ч до приблизительно 16 ч, от приблизительно 16 ч до приблизительно 18 ч, от приблизительно 18 ч до приблизительно 20 ч, от приблизительно 20 ч до приблизительно 24 ч, от приблизительно 24 ч до приблизительно 30 ч, от приблизительно 30 ч до приблизительно 36 ч, от приблизительно 36 ч до приблизительно 42 ч, от приблизительно 42 ч до приблизительно 48 ч, от приблизительно 48 ч до приблизительно 60 ч, от приблизительно 60 ч до приблизительно 3 суток, от приблизительно 3 суток до приблизительно 4 суток, или от приблизительно 4 суток до приблизительно 5 суток, от приблизительно 5 суток до приблизительно 6 суток, от приблизительно 6 суток до приблизительно 7 суток после введения химиотерапевтического препарата.
[0205] В некоторых вариантах осуществления способ включает многократное введение композиции, содержащей модифицированные иммунные клетки, и/или многократное введение химиотерапевтического препарата. Например, в некоторых вариантах осуществления способ включает два введения, три введения, четыре введения, пять введений, шесть введений, семь введений, восемь введений, девять введений, десять введений, одиннадцать введений, двенадцать введений, тринадцать введений, четырнадцать введений или пятнадцать введений композиции, содержащей модифицированные иммунные клетки, и/или введений химиотерапевтического препарата. Например, в некоторых вариантах осуществления способ включает менее пяти введений, менее десяти введений, менее пятнадцати введений, менее двадцати введений, менее двадцати пяти введений, менее тридцати введений, менее пятидесяти введений, менее чем семидесяти пять введений, менее ста или менее двухсот введений композиции, содержащей модифицированные иммунные клетки, и/или введений химиотерапевтического препарата.
[0206] Типичная химиотерапия может быть зависимой от клеточного цикла или независимой от клеточного цикла. В некоторых вариантах осуществления химиотерапия включает один или более химиотерапевтических препаратов. В некоторых вариантах осуществления химиотерапевтический препарат может быть нацелен на одно или более из клеточного деления, ДНК или метаболизма в опухоли. В некоторых вариантах осуществления химиотерапевтический препарат представляет собой препарат на основе платины, такой как, не ограничиваясь этим, цисплатин, оксалиплатин или карбоплатин. В некоторых вариантах осуществления химиотерапевтический препарат представляет собой таксан (такой как доцетаксел или паклитаксел). В некоторых вариантах осуществления химиотерапевтический препарат представляет собой 5-фторурацил, доксорубицин или иринотекан. В некоторых вариантах осуществления химиотерапевтический препарат представляет собой одно или более из следующего: алкилирующий агент, антиметаболит, противоопухолевый антибиотик, ингибитор топоизомеразы или ингибитор митоза. В некоторых вариантах осуществления химиотерапия включает цисплатин. В некоторых вариантах осуществления один или более видов химиотерапии или ингибиторов иммунных контрольных точек можно комбинировать с любой из модифицированных иммунных клеток, описанных здесь, для лечения или профилактики заболевания, ассоциированного с ВПЧ.
[0207] Лучевую терапию можно использовать в комбинации с любой из модифицированных Т-клеток, описанных здесь, для достижения аддитивных или синергических эффектов против рака, например, рака, ассоциированного с ВПЧ. В некоторых вариантах осуществления композицию, содержащую модифицированные Т-клетки, вводят в комбинации с лучевой терапией. В некоторых вариантах осуществления композицию, содержащую модифицированные Т-клетки, вводят и лучевую терапию проводят одновременно. В некоторых вариантах осуществления композицию, содержащую модифицированные Т-клетки, вводят и лучевую терапию проводят последовательно. В некоторых вариантах осуществления композицию, содержащую модифицированные Т-клетки, вводят в комбинации с лучевой терапией, в комбинации с химиотерапией и/или в комбинации с ингибитором иммунных контрольных точек.
[0208] В некоторых вариантах осуществления композицию, содержащую модифицированные Т-клетки, вводят до проведения лучевой терапии. В некоторых вариантах осуществления композицию, содержащую модифицированные Т-клетки, вводят после лучевой терапии. Например, композицию, содержащую модифицированные Т-клетки, вводят за от приблизительно 1 ч до приблизительно 1 недели до проведения лучевой терапии. Например, в некоторых вариантах осуществления композицию, содержащую модифицированные Т-клетки, вводят за приблизительно 1 ч, приблизительно 2 ч, приблизительно 3 ч, приблизительно 4 ч, приблизительно 6 ч, приблизительно 8 ч, приблизительно 10 ч, приблизительно 12 ч, приблизительно 14 ч, приблизительно 16 ч, приблизительно 18 ч, приблизительно 20 ч, приблизительно 24 ч, приблизительно 30 ч, приблизительно 36 ч, приблизительно 42 ч, приблизительно 48 ч, приблизительно 60 ч, приблизительно 3 суток, приблизительно 4 суток, приблизительно 5 суток, приблизительно за 6 суток или приблизительно за 7 суток до проведения лучевой терапии. В некоторых вариантах осуществления композицию, содержащую модифицированные Т-клетки, вводят за от приблизительно 1 ч до приблизительно 2 ч, от приблизительно 2 ч до приблизительно 3 ч, от приблизительно 3 ч до приблизительно 4 ч, от приблизительно 4 ч до приблизительно 6 ч, от приблизительно 6 ч до приблизительно 8 ч, от приблизительно 8 ч до приблизительно 10 ч, от приблизительно 10 ч до приблизительно 12 ч, от приблизительно 12 ч до приблизительно 14 ч, от приблизительно 14 ч до приблизительно 16 ч, от приблизительно 16 ч до приблизительно 18 ч, от приблизительно 18 ч до приблизительно 20 ч, от приблизительно 20 ч до приблизительно 24 ч, от приблизительно 24 ч до приблизительно 30 ч, от приблизительно 30 ч до приблизительно 36 ч, от приблизительно 36 ч до приблизительно 42 ч, от приблизительно 42 ч до приблизительно 48 ч, от приблизительно 48 ч до приблизительно 60 ч, от приблизительно 60 ч до приблизительно 3 суток, от приблизительно 3 суток до приблизительно 4 дня, от приблизительно 4 суток до приблизительно 5 суток, от приблизительно 5 суток до приблизительно 6 суток, от приблизительно 6 суток до приблизительно 7 суток до проведения лучевой терапии.
[0209] В некоторых вариантах осуществления композицию, содержащую модифицированные Т-клетки, вводят после проведения лучевой терапии. Например, композицию, содержащую модифицированные Т-клетки, вводят через от приблизительно 1 ч до приблизительно 1 недели после проведения лучевой терапии. Например, в некоторых вариантах осуществления композицию, содержащую модифицированные Т-клетки, вводят через приблизительно 1 ч, приблизительно 2 ч, приблизительно 3 ч, приблизительно 4 ч, приблизительно 6 ч, приблизительно 8 ч, приблизительно 10 ч, приблизительно 12 ч, приблизительно 14 ч, приблизительно 16 ч, приблизительно 18 ч, приблизительно 20 ч, приблизительно 24 ч, приблизительно 30 ч, приблизительно 36 ч, приблизительно 42 ч, приблизительно 48 ч, приблизительно 60 ч, приблизительно 3 суток, приблизительно 4 суток, приблизительно 5 суток, приблизительно 6 суток или приблизительно 7 суток после проведения лучевой терапии. В некоторых вариантах осуществления композицию, содержащую модифицированные Т-клетки, вводят через от приблизительно 1 ч до приблизительно 2 ч, от приблизительно 2 ч до приблизительно 3 ч, от приблизительно 3 ч до приблизительно 4 ч, от приблизительно 4 ч до приблизительно 6 ч, от приблизительно 6 ч до приблизительно 8 ч, от приблизительно 8 ч до приблизительно 10 ч, от приблизительно 10 ч до приблизительно 12 ч, от приблизительно 12 ч до приблизительно 14 ч, от приблизительно 14 ч до приблизительно 16 ч, от приблизительно 16 ч до приблизительно 18 ч, от приблизительно 18 ч до приблизительно 20 ч, от приблизительно 20 ч до приблизительно 24 ч, от приблизительно 24 ч до приблизительно 30 ч, от приблизительно 30 ч до приблизительно 36 ч, от приблизительно 36 ч до приблизительно 42 ч, от приблизительно 42 ч до приблизительно 48 ч, от приблизительно 48 ч до приблизительно 60 ч, от приблизительно 60 ч до приблизительно 3 суток, от приблизительно 3 суток до приблизительно 4 суток, от приблизительно 4 суток и приблизительно 5 суток, от приблизительно 5 суток до приблизительно 6 суток, от приблизительно 6 суток до приблизительно 7 суток после проведения лучевой терапии.
[0210] В некоторых вариантах осуществления способ включает многократное введение композиции, содержащей модифицированные Т-клетки, и/или многократное проведение лучевой терапии. Например, в некоторых вариантах осуществления способ включает два введения, три введения, четыре введения, пять введений, шесть введений, семь введений, восемь введений, девять введений, десять введений, одиннадцать введений, двенадцать введений, тринадцать введений, четырнадцать введений или пятнадцать введений композиции, содержащей модифицированные Т-клетки, и/или проведений лучевой терапии. Например, в некоторых вариантах осуществления способ включает менее пяти введений, менее десяти введений, менее пятнадцати введений, менее двадцати введений, менее двадцати пяти введений, менее тридцати введений, менее пятидесяти введений, менее чем семидесяти пять введений, менее ста или менее двухсот введений композиции, содержащей модифицированные Т-клетки, и/или проведений лучевой терапии.
[0211] Когда антигены ВПЧ процессируются и презентируются на MHC иммунным клеткам, то иммунный ответ против презентированного эпитопа ВПЧ может быть запущен или усилен. В некоторых вариантах осуществления антиген ВПЧ способен процессироваться в пептид, рестриктированный классом I MHC. В некоторых вариантах осуществления антиген ВПЧ способен процессироваться в пептид, рестриктированный классом II MHC. В некоторых вариантах осуществления иммунный ответ усиливается. В дополнительных вариантах осуществления иммунный ответ усиливается на антиген ВПЧ. В некоторых вариантах осуществления введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии цитотоксических Т-лимфоцитов (CTL), специфических для антигена ВПЧ. В некоторых вариантах осуществления введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии Т(Th)-хелперных клеток, специфических для антигена.
[212] В некоторых вариантах осуществления эффективное количество композиции составляет от приблизительно 1×106 до приблизительно 1×1012 модифицированных иммунных клеток. В некоторых вариантах осуществления эффективное количество композиции включает любое из приблизительно 1×106, приблизительно 1×107, приблизительно 1×108, приблизительно 1×109, приблизительно 1×1010, приблизительно 1×1011 или приблизительно 1×1012 модифицированных иммунных клеток. В некоторых вариантах осуществления эффективное количество композиции содержит любое количество от приблизительно 1×106 до приблизительно 1×107, от приблизительно 1×107 до приблизительно 1×108, от приблизительно 1×108 до приблизительно 1×109, от приблизительно 1×107 до приблизительно 1×108, от приблизительно 1×108 до приблизительно 1×109 от приблизительно 1×109 до приблизительно 1×1010, от приблизительно 1×1010 до приблизительно 1×1011 или от приблизительно 1×1011 до приблизительно 1×1012 модифицированных иммунных клеток.
[213] В некоторых вариантах осуществления способ включает многократное введение композиции, содержащей модифицированные иммунные клетки. Например, в некоторых вариантах осуществления способ включает два введения, три введения, четыре введения, пять введений, шесть введений, семь введений, восемь введений, девять введений, десять введений, одиннадцать введений, двенадцать введений, тринадцать введений, четырнадцать введений или пятнадцать введений композиции, содержащей модифицированные иммунные клетки. Например, в некоторых вариантах осуществления способ включает менее пяти введений, менее десяти введений, менее пятнадцати введений, менее двадцати введений, менее двадцати пяти введений, менее тридцати введений, менее пятидесяти введений, менее чем семидесяти пять введений, менее ста или менее двухсот введений композиции, содержащей модифицированные иммунные клетки. Например, в некоторых вариантах осуществления способ включает первое введение композиции, содержащей модифицированные иммунные клетки, с последующим вторым введением композиции, содержащей модифицированные иммунные клетки. Время введения также можно изменить для достижения желаемых результатов. В некоторых вариантах осуществления первое введение композиции субъекту имеет место перед вторым введением композиции. В некоторых вариантах осуществления первое введение проводят субъекту более чем за приблизительно 1 неделю, приблизительно 2 недели, приблизительно 3 недели, приблизительно 4 недели, приблизительно 1 месяц, приблизительно 2 месяца, приблизительно 3 месяца, приблизительно 4 месяца, приблизительно 5 месяцев, приблизительно 6 месяцев, приблизительно 7 месяцев, приблизительно 8 месяцев, приблизительно 9 месяцев, приблизительно 10 месяцев, приблизительно 11 месяцев, приблизительно 12 месяцев, приблизительно 18 месяцев или приблизительно 24 месяцев до второго введения.
[214] В некоторых вариантах осуществления способ включает многократное введение модифицированной Т-клетки. В некоторых вариантах осуществления способ включает любое из приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10 или более приблизительно 10 введений. В некоторых вариантах осуществления временной интервал между двумя последовательными введениями модифицированной Т-клетки составляет от приблизительно 1 суток до приблизительно 1 месяца. В некоторых вариантах осуществления введение осуществляется ежедневно, один раз в 2 суток, один раз в 3 суток, один раз в 4 суток, один раз в 5 суток, один раз в 6 суток, один раз в неделю, раз в две недели или один раз в месяц. В некоторых вариантах последовательное введение продолжается до одного года или более.
[0215] В некоторых аспектах композицию, содержащую модифицированные клетки, можно использовать для лечения, профилактики заболевания, ассоциированного с ВПЧ, и/или модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ. В некоторых вариантах осуществления заболевание, ассоциированное с ВПЧ, представляет собой рак, ассоциированный с ВПЧ. В некоторых вариантах осуществления изобретения рак, ассоциированный с ВПЧ, представляет собой рак шейки матки, рак анального канала, орофарингеальный рак, рак влагалища, рак вульвы, рак полового члена, рак кожи или опухоли головы и шеи. В некоторых вариантах осуществления изобретения заболевание, ассоциированное с ВПЧ, представляет собой инфекционное заболевание, ассоциированное с ВПЧ. Другие заболевания, ассоциированные с ВПЧ, могут включать обычные бородавки, подошвенные бородавки, плоские бородавки, аногенитальные бородавки, анальные поражения, эпидермодисплазию, очаговую эпителиальную гиперплазию, папилломы в ротовой полости, веррукозную кисту и папилломатоз гортани.
[0216] В некоторых аспектах изобретение относится к применению модифицированных иммунных клеток для лечения заболевания, ассоциированного с ВПЧ, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант. В некоторых аспектах изобретение относится к применению модифицированных иммунных клеток для лечения заболевания, ассоциированного с ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, так что к входной клетке прикладывается деформирующая сила, когда она проходит через сужение, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ и адъювант прошли через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток.
[0217] В некоторых аспектах изобретение относится к композиции, содержащей модифицированные иммунные клетки для производства лекарственного средства, используемого для лечения заболевания, ассоциированного с ВПЧ, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант. В некоторых аспектах изобретение относится к композиции, содержащей модифицированные иммунные клетки для производства лекарственного средства, используемого для лечения заболевания, ассоциированного с ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген HPV и внутриклеточно адъювант; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, так что к входной клетке прикладывается деформирующая сила, когда она проходит через сужение, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ и адъювант прошли через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток.
[0218] В некоторых аспектах изобретение относится к композиции, содержащей модифицированные иммунные клетки, для применения в способе терапевтического лечения, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант. В некоторых аспектах изобретение относится к композиции, содержащей модифицированные иммунные клетки, для применения в способе терапевтического лечения, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, так что к входной клетке прикладывается деформирующая сила, когда она проходит через сужение, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ и адъювант прошли через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток.
[0219] В некоторых аспектах изобретение относится к композиции, содержащей модифицированные иммунные клетки, для применения в способе лечения рака, инфекционного заболевания или заболевания, ассоциированного с вирусом, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант. В некоторых аспектах изобретение относится к композиции, содержащей модифицированные иммунные клетки для применения в лечении заболевания, ассоциированного с ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант; где модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, так что к входной клетке прикладывается деформирующая сила, когда она проходит через сужение, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ и адъювант прошли через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток.
[0220] В некоторых аспектах данное изобретение относится к способу лечения или профилактики заболевания, ассоциированного с ВПЧ, у субъекта, включающему введение субъекту модифицированной иммунной клетки, ассоциированной с антигеном ВПЧ, где модифицированную иммунную клетку получают способом, включающим стадии: а) инкубация входной клетки с антигеном ВПЧ и/или адъювантом в течение достаточного периода времени для обеспечения связывания антигена ВПЧ с клеточной поверхностью входной клетки; тем самым получая модифицированную иммунную клетку, ассоциированную с антигеном.
[0221] В некоторых вариантах осуществления модифицированные иммунные клетки по настоящему изобретению не вызывают толерогенности у субъекта. В некоторых вариантах осуществления модифицированные иммунные клетки не подавляют иммунный ответ у субъекта. В некоторых вариантах осуществления модифицированные иммунные клетки не содержат толерогенного фактора. В некоторых вариантах осуществления модифицированные иммунные клетки не вводят в комбинации с толерогенным фактором. В некоторых вариантах осуществления модифицированные иммунные клетки не вводят до, одновременно или после введения толерогенного фактора.
Композиции
[0222] В некоторых аспектах изобретение относится к композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно CpG ODN. В других аспектах изобретение относится к композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ, где антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-26. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% сходством с SEQ ID NO: 23. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность SEQ ID NO: 23. В некоторых вариантах осуществления модифицированные иммунные клетки получают: а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ прошел через них, с образованием пертурбированной входной клетки; и b) инкубацией пертурбированной входной клетки с антигеном ВПЧ в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку; с получением, тем самым, модифицированных иммунных клеток. В дополнительных вариантах осуществления к входной клетке прикладывается деформирующая сила, когда она проходит через сужение. В некоторых вариантах осуществления композиция дополнительно содержит внутриклеточно адъювант.
[0223] В некоторых вариантах осуществления антиген ВПЧ и/или адъювант находятся в цитозоле или эндосомах. В некоторых вариантах осуществления антиген и/или адъювант находятся во многих компартментах клетки. В дополнительных вариантах осуществления антиген и/или адъювант находятся в компартментах клетки, включающих эндоплазматический ретикулум (ER), аппарат Гольджи, лизосомы, экзосомы, поверхность клетки или клеточную мембрану. В некоторых вариантах осуществления антиген и адъювант находятся в одном компартменте. В некоторых вариантах осуществления антиген и адъювант находятся в разных компартментах друг от друга. Например, в некоторых вариантах осуществления антиген находятся в цитозоле, тогда как адъювант находится в эндосоме. В некоторых вариантах осуществления модифицированная иммунная клетка дополнительно содержит антиген ВПЧ и/или адъювант вне клетки.
[0224] В некоторых вариантах осуществления антиген представляет собой полипептидный антиген. В некоторых вариантах осуществления антиген представляет собой модифицированный антиген. Например, антигены могут быть слиты с терапевтическими агентами или нацеливающими пептидами. В некоторых вариантах осуществления модифицированный антиген слит с полипептидом. В некоторых вариантах осуществления антиген модифицирован липидом. В некоторых вариантах осуществления антиген модифицирован полисахаридом или углеводным фрагментом. В некоторых вариантах осуществления антиген ассоциирован с вирусом. В некоторых вариантах осуществления антиген представляет собой вирусный антиген. Типичные вирусные антигены включают антигены ВПЧ. В дополнительных вариантах осуществления антиген представляет собой антиген ВПЧ. В некоторых вариантах осуществления антиген ВПЧ выбран из группы, состоящей из: ВПЧ-16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73 и 82. ВПЧ-16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 и 82 относятся к типам высокого онкогенного риска, в то время как ВПЧ-26, 53 и 66 являются «типами вероятного высокого онкогенного риска» в возникновении рака. В некоторых вариантах осуществления антиген представляет собой антиген ВПЧ-16 или антиген ВПЧ-18. В некоторых вариантах осуществления антиген ВПЧ состоит из HLA-A2-рестриктированного эпитопа. Гены ВПЧ Е6 и Е7 являются онкогенами вируса, и экспрессия этих генов требуется для злокачественной трансформации. Белки E6 и E7 нацелены на ряд негативных регуляторов клеточного цикла, в первую очередь на p105Rb и p53 соответственно, и таким образом препятствуют регуляции клеточного цикла. В дополнительных вариантах осуществления антиген ВПЧ представляет собой антиген ВПЧ E6 или антиген ВПЧ E7. В некоторых вариантах осуществления модифицированные иммунные клетки содержат антиген ВПЧ E6 и ВПЧ антиген E7. В некоторых вариантах осуществления антиген ВПЧ представляет собой полипептид, содержащий иммуногенный эпитоп, фланкированный на N-конце и/или C-конце одной или более гетерологичными пептидными последовательностями. В некоторых вариантах осуществления антиген ВПЧ представляет собой эпитоп ВПЧ E7, фланкированный последовательностями из полипептида ВПЧ E6. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-26. В некоторых вариантах осуществления антиген ВПЧ содержит аминокислотную последовательность SEQ ID NO: 23.
[0225] Адъювант при добавлении к иммуногенному агенту неспецифически усиливает или потенцирует иммунный ответ на агент у реципиента-хозяина при воздействии смеси. Следовательно, адъюванты можно использовать для усиления ответной реакции иммунных клеток (например, Т-клеточного ответа) на антиген. В некоторых вариантах осуществления поврежденные клетки инкубируют как с антигеном ВПЧ, так и с адъювантом. Примеры внутриклеточных адъювантов включают, без ограничения, CpG ODN, интерферон-α (IFN-α), стимулятор генов интерферона (STING), агонисты гена I (RIG-I), индуцируемые ретиноевой кислотой, и полиинозиновую: полицитидиловую кислоту (поли I:C). В некоторых вариантах осуществления адъювант представляет собой CpG ODN, IFN-, агонисты STING, агонисты RIG-I или поли I:C. В конкретных вариантах осуществления адъювант представляет собой полинуклеотид CpG ODN. В некоторых вариантах осуществления адъювант CpG ODN состоит из выбранных из группы CpG ODN 1585, CpG ODN2216, CpG ODN 2336, CpG ODN 1668, CpG ODN 1826, CPG ODN 2006, CpG ODN 2007, CpG ODN BW006, CpG ODN D-SL01, CpG ODN 2395, CpG ODN M362, CpG ODN D-SL03 (InvivoGen). В некоторых вариантах осуществления адъювант CpG ODN представляет собой олигонуклеотид CpG ODN 1826 (TCCATGACGTTCCTGACGTT; SEQ ID NO: 30) или CpG ODN 2006 (также известный как CpG ODN 7909) (TCGTCGTTTGTCGTTTTTGTCGTT; SEQ ID NO: 31). Многочисленные адъюванты также можно использовать в сочетании с антигенами для усиления индукции иммунного ответа. В некоторых вариантах осуществления модифицированная иммунная клетка содержит более одного адъюванта. В некоторых вариантах осуществления модифицированная иммунная клетка содержит любую комбинацию адъювантов CpG ODN, IFN-α, агонистов STING, агонистов RIG-I и поли I:C.
[0226] В некоторых вариантах осуществления модифицированная иммунная клетка содержит адъювант в концентрации от приблизительно 0,01 мкМ до приблизительно 10 мМ. Например, в некоторых вариантах осуществления модифицированная иммунная клетка содержит адъювант в любой концентрации, составляющей ниже приблизительно 0,01 мкМ, приблизительно 0,1 мкМ, приблизительно 1 мкМ, приблизительно 10 мкМ, приблизительно 100 мкМ, приблизительно 1 мМ или приблизительно 10 мМ. В некоторых вариантах осуществления модифицированная иммунная клетка содержит адъювант в концентрации выше приблизительно 10 мМ. В некоторых вариантах осуществления модифицированная иммунная клетка содержит адъювант в любой концентрации ниже приблизительно 0,01 мкМ, приблизительно 0,1 мкМ, приблизительно 1 мкМ, приблизительно 10 мкМ, приблизительно 100 мкМ, приблизительно 1 мМ или приблизительно 10 мМ. В некоторых вариантах осуществления модифицированная иммунная клетка содержит адъювант в любой концентрации выше приблизительно 10 мМ. В некоторых вариантах осуществления модифицированная иммунная клетка содержит адъювант в любой концентрации от приблизительно 0,1 мкМ до приблизительно 1 мкМ, от приблизительно 1 мкМ до приблизительно 10 мкМ, от приблизительно 10 мкМ до приблизительно 100 мкМ, от приблизительно 100 мкМ до приблизительно 1 мМ или от 1 мМ до приблизительно 10 мМ.
[0227] В некоторых вариантах осуществления модифицированная иммунная клетка содержит антиген ВПЧ в концентрации от приблизительно 0,01 мкМ до приблизительно 10 мМ. Например, в некоторых вариантах осуществления модифицированная иммунная клетка содержит адъювант в любой концентрации ниже приблизительно 0,01 мкМ, приблизительно 0,1 мкМ, приблизительно 1 мкМ, приблизительно 10 мкМ, приблизительно 100 мкМ, приблизительно 1 мМ или приблизительно 10 мМ. В некоторых вариантах осуществления модифицированная иммунная клетка содержит адъювант в концентрации выше приблизительно 10 мМ. В некоторых вариантах осуществления модифицированная иммунная клетка содержит антиген ВПЧ в любой концентрации ниже приблизительно 0,01 мкМ, приблизительно 0,1 мкМ, приблизительно 1 мкМ, приблизительно 10 мкМ, приблизительно 100 мкМ, приблизительно 1 мМ или приблизительно 10 мМ. В некоторых вариантах осуществления модифицированная иммунная клетка содержит адъювант в любой концентрации выше приблизительно 10 мМ. В некоторых вариантах осуществления модифицированная иммунная клетка содержит антиген ВПЧ в любой концентрации от приблизительно 0,1 мкМ до приблизительно 1 мкМ, от приблизительно 1 мкМ до приблизительно 10 мкМ, от приблизительно 10 мкМ до приблизительно 100 мкМ, от приблизительно 100 мкМ до приблизительно 1 мМ или от 1 мМ до приблизительно 10 мМ.
[0228] В некоторых вариантах осуществления соотношение антигена ВПЧ и адъюванта составляет от приблизительно 10000:1 до приблизительно 1: 10000. Например, в некоторых вариантах осуществления соотношение антигена ВПЧ и адъюванта составляет приблизительно 10000:1, приблизительно 1000:1, приблизительно 200:1, приблизительно 100:1, приблизительно 10:1, приблизительно 1:1, приблизительно 1:10, приблизительно 1:100, приблизительно 1:1000 или приблизительно 1:10000. В некоторых вариантах осуществления соотношение антигена ВПЧ и адъюванта составляет от приблизительно 10000:1 до приблизительно 1000:1, от приблизительно 1000:1 до приблизительно 100:1, от приблизительно 100:1 до приблизительно 10:1, от приблизительно 10:1 и приблизительно 1:1, от приблизительно 1:1 до приблизительно 1:10, от приблизительно 1:10 до приблизительно 1:100, от приблизительно 1:100 до приблизительно 1:1000, от приблизительно 1:1000 до приблизительно 1:10000.
[0229] В некоторых вариантах осуществления модифицированная иммунная клетка дополнительно содержит агент, который повышает жизнеспособность и/или функцию модифицированной иммунной клетки по сравнению с соответствующей модифицированной иммунной клеткой, которая не включает агента. В некоторых вариантах осуществления агент представляет собой соединение, усиливающее эндоцитоз, стабилизирующий агент или кофактор. В некоторых вариантах осуществления стабилизирующий агент образует комплекс с антигеном ВПЧ и/или адъювантом. В некоторых вариантах осуществления стабилизирующий агент увеличивает растворимость и/ или период полужизни в растворе антигена ВПЧ и/или адъюванта. В некоторых вариантах осуществления множество модифицированных иммунных клеток обладают более высокой жизнеспособностью, чем соответствующие модифицированные иммунные клетки, которые не содержат стабилизирующий агент. В некоторых вариантах осуществления агент представляет собой альбумин. В дополнительных вариантах осуществления альбумин представляет собой мышиный, бычий или человеческий альбумин. В дополнительных вариантах осуществления агент представляет собой катион двухвалентного металла, глюкозу, АТФ, калий, глицерин, трегалозу, D-сахарозу, PEG1500, L-аргинин, L-глутамин или ЭДТА. В некоторых вариантах осуществления катион двухвалентного металла представляет собой один или более из Mg2+, Zn2+ или Ca2+. В некоторых вариантах осуществления агент включает MSA.
[0230] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, модифицированная иммунная клетка дополнительно содержит агент, который повышает жизнеспособность и/или функцию модифицированной иммунной клетки по сравнению с соответствующим множеством модифицированных иммунных клеток, которые не содержат агента. В некоторых вариантах осуществления модифицированная иммунная клетка дополнительно содержит агент, который повышает жизнеспособность и/или функцию модифицированной иммунной клетки в цикле замораживания-оттаивания по сравнению с соответствующей модифицированной иммунной клеткой, которая не включает агента. В некоторых вариантах осуществления агент представляет собой агент для криоконсервации и/или агент для гипотермической консервации. В некоторых вариантах осуществления агент для криоконсервации и агент для гипотермической консервации вызывают не более чем 10% или 20% клеточной гибели в модифицированной иммунной клетке, содержащей агент, по сравнению с соответствующей модифицированной иммунной клеткой, которая не включает агента, до любого цикла замораживания-оттаивания. В некоторых вариантах осуществления, по меньшей мере, приблизительно 70%, приблизительно 80% или приблизительно 90% модифицированных иммунных клеток являются жизнеспособными после 1, 2, 3, 4, 5 циклов замораживания-оттаивания. В некоторых вариантах осуществления агент представляет собой соединение, усиливающее эндоцитоз, стабилизирующий агент или кофактор. В некоторых вариантах осуществления агент представляет собой альбумин. В некоторых вариантах осуществления альбумин представляет собой мышиный, бычий или человеческий альбумин. В некоторых вариантах осуществления агент представляет собой альбумин человека. В некоторых вариантах осуществления агент представляет собой одно или более из следующего: катион двухвалентного металла, глюкоза, АТФ, калий, глицерин, трегалоза, D-сахароза, PEG1500, L-аргинин, L-глутамин или ЭДТА. В некоторых вариантах осуществления катион двухвалентного металла представляет собой один или более из Mg2+, Zn2+ или Ca2+. В некоторых вариантах осуществления агент представляет собой одно или более из следующего: пируват натрия, аденин, трегалоза, декстроза, манноза, сахароза, сывороточный альбумин человека (HSA), ДМСО, HEPES, глицерин, глутатион, инозин, двухосновный фосфат натрия, одноосновный фосфат натрия, ионы металла натрия, ионы металла калия, ионы металла магния, хлорид, ацетат, глюконат, сахароза, гидроксид калия или гидроксид натрия. В некоторых вариантах осуществления агент представляет собой одно или более из следующего: пируват натрия, аденин, Rejuvesol®, трегалоза, декстроза, манноза, сахароза, сывороточный альбумин человека (HSA), PlasmaLyte®, DMSO, Cryostor® CS2, Cryostor® CS5, Cryostor® CS10, Cryostor® CS15, HEPES, глицерин, глутатион, HypoThermosol®.
[0231] В некоторых вариантах осуществления модифицированные иммунные клетки дополнительно модифицируют для повышения экспрессии одной или более костимулирующих молекул. В дополнительных вариантах осуществления костимулирующая молекула представляет собой B7-H2 (ICOSL), B7-1 (CD80), B7-2 (CD86), CD70, LIGHT, HVEM, CD40, 4-1BBL, OX40L, TL1A, GITRL, CD30L. , TIM4, SLAM, CD48, CD58, CD155 или CD112. В некоторых вариантах осуществления клетка содержит нуклеиновую кислоту, которая приводит к повышенной экспрессии одной или более костимулирующих молекул.
[0232] В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку, дендритную клетку, моноцит, макрофаг, миелоидную клетку, гранулоцит, нейтрофил, тучную клетку, естественную клетку-киллер, врожденную лимфоидную клетку, базофил или гематопоэтическую клетку-предшественник. В некоторых вариантах осуществления иммунная клетка не является В-клеткой. В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку. В некоторых вариантах осуществления иммунная клетка представляет собой другую клетку, отличную от В-клетки. В некоторых вариантах осуществления модифицированная Т-клетка включает одно или более из Т-хелперов, цитотоксических Т-клеток, Т-клеток памяти, CIK-клеток или естественных Т-клеток-киллеров. В некоторых вариантах осуществления Т-клетка включает одно или более из CD3+ Т-клеток, CD4+ Т-клеток, CD8+ Т-клеток, CD45RA+ Т-клеток, CD45RO+ Т-клеток и γδ-Т-клеток. Экспрессия MHC в аллогенных Т-клетках может приводить к врожденному иммунному ответу, развившемуся у субъекта в ответ на их введение, и приводит к сокращению периода полужизни таких Т-клеток. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса I. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса II. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для снижения экспрессии молекул MHC класса I и/или молекул MHC класса II. В конкретных вариантах осуществления дополнительная модификация включает снижение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием siРНК, shРНК, CRISPR/Cas9, ZFN, TALEN, Cre-рекомбиназы или мегануклеазы. В некоторых вариантах осуществления Т-клетка содержит дополнительную модификацию для увеличения экспрессии молекул MHC класса I и/или молекул MHC класса II. В конкретных вариантах осуществления дополнительная модификация включает повышение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием мРНК, плазмидной ДНК или кДНК. В некоторых вариантах осуществления в аллогенном контексте врожденный иммунный ответ, развившийся у субъекта в ответ на введение дополнительно модифицированных Т-клеток, снижен, в аллогенном контексте, по сравнению с врожденным иммунным ответом, развившимся у субъекта в ответ на введение соответствующих модифицированных Т-клеток, которые не содержат дополнительную модификацию. В некоторых вариантах осуществления период полужизни в кровотоке дополнительно модифицированных Т-клеток у субъекта, которому они были введены, увеличивается по сравнению с периодом полужизни в кровотоке соответствующих модифицированных Т-клеток, которые не содержат дополнительных модификаций, у субъекта, которому они были введены. В некоторых вариантах осуществления модифицированная Т-клетка включает одно или более из Т-хелперов, цитотоксических Т-клеток, Т-клеток памяти, CIK-клеток или естественных Т-клеток-киллеров. В некоторых вариантах осуществления Т-клетка включает одно или более из CD3+ Т-клеток, CD4+ Т-клеток, CD8+ Т-клеток, CD45RA+ Т-клеток, CD45RO+ Т-клеток или γδ-Т-клеток.
[0233] Иммунные клетки и другие клетки можно использовать в качестве источника аутологичных или аллогенных клеток. В некоторых вариантах осуществления модифицированная иммунная клетка является аллогенной для субъекта. В других вариантах осуществления модифицированная иммунная клетка является аутологичной для субъекта. В некоторых вариантах осуществления у субъекта, подлежащего лечению, предварительно кондиционирован к снижению воспаления или модуляции иммунного ответа.
Композиции PBMC
[0234] В рамках изобретения, PBMC могут быть выделены лейкаферезом из цельной крови, полученной от субъекта. Также обеспечиваются композиции PBMC, восстановленные смешиванием различных пулов PBMC от одного и того же субъекта или разных субъектов. В других примерах PBMC также могут быть восстановлены смешиванием различных популяций клеток в смешанную клеточную композицию с созданным профилем. В некоторых вариантах осуществления популяции клеток, используемые для восстановления PBMC, представляют смешанные популяции клеток (например, смесь одного или более из T-клеток, B-клеток, NK-клеток или моноцитов). В некоторых вариантах осуществления популяции клеток, используемые для восстановления PBMC, представляют очищенные популяции клеток (например, очищенные T-клетки, B-клетки, NK-клетки или моноциты). В дополнительных примерах разные популяции клеток, используемые для воссоздания композиции PBMC, могут быть выделены от одного и того же субъекта (например, аутологичные) или выделены от разных субъектов (например, аллогенные и/или гетерологичные).
[0235] Следовательно, в некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, множество входных PBMC включает одно или более из Т-клеток, В-клеток, NK-клеток, моноцитов, дендритных клеток или NK-T-клеток. В некоторых вариантах осуществления множество входных PBMC включает Т-клетки, В-клетки, NK-клетки, моноциты, дендритные клетки или NK-T-клетки. В некоторых вариантах осуществления множество входных PBMC включает одно или более из CD3+ T-клеток, CD20+ B-клеток, CD14+ моноцитов, CD56+ NK-клеток. В некоторых вариантах осуществления множество входных PBMC включает Т-клетки, B-клетки, NK-клетки и моноциты, и отношение Т-клеток, B-клеток, NK-клеток и моноцитов к общему количеству PBMC во множестве входных PBMC по существу составляет такое же, как отношение Т-клеток, В-клеток, NK-клеток и моноцитов к общему количеству PBMC в цельной крови. В некоторых вариантах осуществления множество входных PBMC включает Т-клетки, B-клетки, NK-клетки и моноциты, и отношение Т-клеток, B-клеток, NK-клеток и моноцитов к общему количеству PBMC во множестве входных PBMC по существу составляет то же, что и отношение Т-клеток, В-клеток, NK-клеток и моноцитов к общему количеству PBMC в продукте лейкафереза из цельной крови. В некоторых вариантах осуществления множество входных PBMC включает Т-клетки, B-клетки, NK-клетки и моноциты, и соотношение Т-клеток, B-клеток, NK-клеток и моноцитов к общему количеству PBMC во множестве входных PBMC отличается не более, чем на 1%, 2%, 5%, 10%, 15%, 20%, 25%, 30%, 40% или 50% от отношения Т-клеток, В-клеток, NK-клеток и моноцитов к общему количеству PBMC в цельной крови. В некоторых вариантах осуществления множество входных PBMC включает Т-клетки, B-клетки, NK-клетки и моноциты, и соотношение Т-клеток, B-клеток, NK-клеток и моноцитов к общему количеству PBMC во множестве входных PBMC отличается не более чем на 10% от отношения Т-клеток, В-клеток, NK-клеток и моноцитов к общему количеству PBMC в цельной крови. В некоторых вариантах осуществления множество входных PBMC включает Т-клетки, B-клетки, NK-клетки и моноциты, и отношение Т-клеток, B-клеток, NK-клеток и моноцитов к общему количеству PBMC во множестве входных PBMC отличается не более, чем на 1%, 2%, 5%, 10%, 15%, 20%, 25%, 30%, 40% или 50% от отношения Т-клеток, В-клеток, NK-клеток и моноцитов к общему количеству PBMC в продукте лейкафереза из цельной крови. В некоторых вариантах осуществления множество входных PBMC включает Т-клетки, B-клетки, NK-клетки и моноциты, и отношение Т-клеток, B-клеток, NK-клеток и моноцитов к общему количеству PBMC во множестве входных PBMC отличается не более, чем на 10% от отношения Т-клеток, В-клеток, NK-клеток и моноцитов к общему количеству PBMC в продукте лейкафереза из цельной крови.
[0236] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, от приблизительно 25% до приблизительно 70% модифицированных PBMC являются Т-клетками. В некоторых вариантах осуществления от приблизительно 2,5% до приблизительно 14% модифицированных PBMC являются B-клетками. В некоторых вариантах осуществления от приблизительно 3,5% до приблизительно 35% модифицированных PBMC представляют NK-клетки. В некоторых вариантах осуществления от приблизительно 4% до приблизительно 25% модифицированных PBMC представляют NK-клетки. В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, по меньшей мере, от приблизительно 90% до приблизительно 99% входных PBMC состоит из Т-клеток, В-клеток, NK-клеток и моноцитов. В некоторых вариантах осуществления, по меньшей мере, от приблизительно 80% до приблизительно 85%, от приблизительно 85% до приблизительно 90%, от приблизительно 90% до приблизительно 95% или от приблизительно 95% до приблизительно 99% входных PBMC состоит из Т-клеток, B-клеток, NK-клеток и моноцитов. В некоторых вариантах осуществления, по меньшей мере, приблизительно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93 %, 94%, 95%, 96%, 97%, 98% или 99% входных PBMC состоит из T-клеток, B-клеток, NK-клеток и моноцитов. В некоторых вариантах осуществления, по меньшей мере, приблизительно 90% вводимых PBMC состоит из Т-клеток, В-клеток, NK-клеток и моноцитов. В некоторых вариантах осуществления входные PBMC состоят из Т-клеток, В-клеток, NK-клеток и моноцитов.
[0237] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, по меньшей мере, от приблизительно 90% до приблизительно 99% модифицированных PBMC состоит из Т-клеток, В-клеток, NK-клеток и моноцитов. В некоторых вариантах осуществления, по меньшей мере, от приблизительно 80% до приблизительно 85%, от приблизительно 85% до приблизительно 90%, от приблизительно 90% до приблизительно 95% или от приблизительно 95% до приблизительно 99% модифицированных РВМС состоит из Т-клеток, B-клеток, NK-клеток и моноцитов. В некоторых вариантах осуществления, по меньшей мере, приблизительно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% модифицированных PBMC состоит из T-клеток, B-клеток, NK-клеток и моноцитов. В некоторых вариантах осуществления, по меньшей мере, приблизительно 90% модифицированных PBMC состоят из Т-клеток, В-клеток, NK-клеток и моноцитов. В некоторых вариантах осуществления модифицированные PBMC состоят из Т-клеток, В-клеток, NK-клеток и моноцитов.
[0238] В некоторых вариантах осуществления согласно любому из способов или композиций, описанных здесь, иммунная клетка представляет собой множество PBMC, и, по меньшей мере, приблизительно 15%, 20%, 25%, 30%, 35%, 40 %, 45%, 50%, 55%, 60%, 65%, 70% или 75% входных PBMC является Т-клетками. В некоторых вариантах осуществления, по меньшей мере, приблизительно 25% входных PBMC представляют Т-клетки. В некоторых вариантах осуществления, по меньшей мере, приблизительно 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 4%, 5%, 6%, 7%, 7,5%, 8%, 9%, 10 %, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 25% или 30% входных PBMC является B-клетками. В некоторых вариантах осуществления, по меньшей мере, приблизительно 2,5% входных PBMC представляет собой B-клетки. В некоторых вариантах осуществления, по меньшей мере, приблизительно 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 4%, 5%, 6%, 7%, 7,5%, 8%, 9%, 10 %, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 25% или 30% входных PBMC является NK-клетками. В некоторых вариантах осуществления, по меньшей мере, приблизительно 3,5% входных PBMC представляет собой NK-клетки. В некоторых вариантах осуществления, по меньшей мере, приблизительно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 12%, 14%, 16%, 18 %, 20%, 25%, 30%, 35% или 40% входных PBMC является моноцитами. В некоторых вариантах осуществления, по меньшей мере, приблизительно 4% входных РВМС представляют моноциты. В некоторых вариантах осуществления, по меньшей мере, приблизительно 25% входных PBMC представляет собой Т-клетки; по меньшей мере, приблизительно 2,5% входных PBMC является B-клетками; по меньшей мере, приблизительно 3,5% входных PBMC является NK-клетками; и, по меньшей мере, приблизительно 4% входных PBMC является моноцитами.
[0239] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, иммунная клетка представляет собой множество PBMC, и по меньшей мере, приблизительно 10%, 15%, 20%, 25%, 30%, 35 %, 40%, 45%, 50%, 55%, 60%, 65% или 70% модифицированных PBMC является Т-клетками. В некоторых вариантах осуществления, по меньшей мере, приблизительно 20% модифицированных PBMC является Т-клетками. В некоторых вариантах осуществления, по меньшей мере, приблизительно 0,25%, 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 4%, 5%, 6%, 7%, 7,5%, 8%, 9 %, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 25% или 30% модифицированных PBMC является B-клетками. В некоторых вариантах осуществления, по меньшей мере, приблизительно 2% модифицированных PBMC представляет собой B-клетки. В некоторых вариантах осуществления, по меньшей мере, приблизительно 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 4%, 5%, 6%, 7%, 7,5%, 8%, 9%, 10 %, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 25% или 30% модифицированных PBMC является NK-клетками. В некоторых вариантах осуществления, по меньшей мере, приблизительно 3% модифицированных PBMC представляет собой NK-клетки. В некоторых вариантах осуществления, по меньшей мере, приблизительно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 12%, 14%, 16%, 18 %, 20%, 25%, 30%, 35% или 40% модифицированных PBMC является моноцитами. В некоторых вариантах осуществления, по меньшей мере, приблизительно 3% модифицированных PBMC представляет собой моноциты. В некоторых вариантах осуществления, по меньшей мере, приблизительно 20% модифицированных PBMC представляет собой Т-клетки; по меньшей мере, приблизительно 2% модифицированных PBMC представляют B-клетки; по меньшей мере, приблизительно 3% модифицированных PBMC являются NK-клетками; и, по меньшей мере, приблизительно 3% модифицированных РВМС представляет собой моноциты.
[0240] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, иммунная клетка представляет собой множество PBMC, и не более чем приблизительно 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% или 90% входных PBMC является Т-клетками. В некоторых вариантах осуществления не более приблизительно 70% входных PBMC является Т-клетками. В некоторых вариантах осуществления не более чем приблизительно 5%, 10%, 12%, 14%, 16%, 18%, 20%, 22%, 25%, 30%, 35%, 40% или 50% входных PBMC является В-клетками. В некоторых вариантах осуществления не более 14% входных PBMC представляет собой B-клетки. В некоторых вариантах осуществления не более чем приблизительно 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50% или 60% входных PBMC является NK-клетками. В некоторых вариантах осуществления не более приблизительно 35% входных PBMC является NK-клетками. В некоторых вариантах осуществления не более чем приблизительно 5%, 10%, 12%, 14%, 16%, 18%, 20%, 22%, 25%, 30%, 35%, 40% или 50% входных PBMC является моноцитами. В некоторых вариантах осуществления не более приблизительно 4% входных PBMC представляет собой моноциты. В некоторых вариантах осуществления не более приблизительно 25% входных PBMC представляет собой Т-клетки; не более чем приблизительно 2,5% входных PBMC является B-клетками; не более чем приблизительно 3,5% входных PBMC является NK-клетками; и не более чем приблизительно 4% входных PBMC является моноцитами.
[0241] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, иммунная клетка представляет собой множество PBMC, и не более чем приблизительно 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65% или 70% модифицированных PBMC является Т-клетками. В некоторых вариантах осуществления не более чем приблизительно 20% модифицированных PBMC представляет собой Т-клетки. В некоторых вариантах осуществления не более чем приблизительно 0,25%, 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 4%, 5%, 6%, 7%, 7,5%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 25% или 30% модифицированных PBMC является B-клетками. В некоторых вариантах осуществления не более приблизительно 2% модифицированных PBMC является B-клетками. В некоторых вариантах осуществления не более чем приблизительно 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 4%, 5%, 6%, 7%, 7,5%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 25% или 30% модифицированных PBMC является NK-клетками. В некоторых вариантах осуществления не более приблизительно 3% модифицированных PBMC представляет собой NK-клетки. В некоторых вариантах осуществления не более чем приблизительно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 12%, 14%, 16%, 18%, 20%, 25%, 30%, 35% или 40% модифицированных PBMC является моноцитами. В некоторых вариантах осуществления не более приблизительно 3% модифицированных PBMC является моноцитами. В некоторых вариантах осуществления не более чем приблизительно 20% модифицированных PBMC является Т-клетками; не более чем приблизительно 2% модифицированных PBMC является B-клетками; не более чем приблизительно 3% модифицированных PBMC является NK-клетками; и не более приблизительно 3% модифицированных PBMC является моноцитами.
[0242] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, иммунная клетка представляет собой множество PBMC, и от приблизительно 20% до 25%, от 25% до 30%, от 30% до 35%, От 35% до 40%, от 40% до 45%, от 45% до 50%, от 50% до 55%, от 55% до 60%, от 60% до 65%, от 65% до 70% или от 70% до 75% модифицированных PBMC представляет собой Т-клетки. В некоторых вариантах осуществления от приблизительно 25% до приблизительно 70% модифицированных PBMC является Т-клетками. В некоторых вариантах осуществления от приблизительно 1% до 2,5%, от 2,5% до 4%, от 4% до 6%, от 6% до 8%, от 8% до 10%, от 10% до 12%, от 12% до 14%, от 14% до 16%, от 16% до 20% или от 20% до 25% модифицированных PBMC является B-клетками. В некоторых вариантах осуществления от приблизительно 2,5% до приблизительно 14% модифицированных PBMC является B-клетками. В некоторых вариантах осуществления от приблизительно 1% до 2%, от 2% до 3,5%, от 3,5% до 5%, от 5% до 8%, от 8% до 10%, от 10% до 12%, от 12% до 14%, от 14% до 16%, от 16% до 20% или от 20% до 25% модифицированных PBMC является B-клетками. В некоторых вариантах осуществления от приблизительно 3,5% до приблизительно 35% модифицированных PBMC представляет собой NK-клетки. В некоторых вариантах осуществления любое из значений от приблизительно 2% до 4%, от 4% до 6%, от 6% до 8%, от 8% до 10%, от 10% до 12%, от 12% до 14%, от 14% до 16%, От 16% до 20%, от 20% до 25%, от 25% до 30%, от 30% до 35% или от 35% до 40% модифицированных PBMC является моноцитами. В некоторых вариантах осуществления от приблизительно 4% до приблизительно 25% модифицированных PBMC является моноцитами.
[0243] В рамках изобретения, PBMC также можно получить после манипулирования составом смешанной клеточной популяции мононуклеарных клеток крови (таких как лимфоциты и моноциты). В некоторых случаях входные PBMC генерируются после уменьшения (например, истощения) определенных субпопуляций (таких как B-клетки) в смешанной клеточной популяции мононуклеарных клеток крови. Состав в смешанной клеточной популяции мононуклеарных клеток крови у субъекта можно изменять, чтобы сделать популяцию клеток более похожей на продукт лейкафереза из цельной крови того же субъекта. В других примерах составом в смешанной клеточной популяции мононуклеарных клеток крови (например, спленоцитов мыши) также можно манипулировать, чтобы сделать популяцию клеток более близкой к человеческим PBMC, выделенным из продукта лейкафереза из цельной крови человека.
[0244] В некоторых вариантах осуществления опосредованная конструкцией доставка существенно не модулирует жизнеспособность различных субпопуляций (таких как B-клетки, Т-клетки, NK-клетки или моноциты) внутри PBMC. В некоторых вариантах осуществления процесс кондиционирования существенно не влияет на жизнеспособность различных субпопуляций внутри PBMC. В некоторых вариантах осуществления дополнительное добавление агентов (включая, не ограничиваясь этим, любое из: агенты для биоконсервации или агенты, которые усиливают функцию и/или жизнеспособность PBMC) не оказывают существенного влияния на жизнеспособность различных субпопуляций внутри PBMC. Следовательно, в некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, процент Т-клеток во множестве модифицированных PBMC и процент T-клеток во множестве входных PBMC различаются не более чем приблизительно на 10% по количеству. В некоторых вариантах осуществления процентное содержание Т-клеток во множестве модифицированных РВМС и процентное содержание Т-клеток во множестве входных РВМС различаются не более чем приблизительно на любое значение из 5%, 8%, 10%, 12%, 14%, 16%, 18% или 20% по количеству. В некоторых вариантах осуществления процентное содержание B-клеток во множестве модифицированных PBMC и процентное содержание B-клеток во множестве входных PBMC различаются не более чем приблизительно на 10% по количеству. В некоторых вариантах осуществления процентное содержание В-клеток во множестве модифицированных РВМС и процентное содержание В-клеток во множестве входных РВМС различаются не более чем приблизительно на любое значение из 5%, 8%, 10%, 12%, 14%, 16%, 18% или 20% по количеству. В некоторых вариантах осуществления процент NK-клеток во множестве модифицированных PBMC и процент NK-клеток во множестве входных PBMC различаются не более чем приблизительно на 10% по количеству. В некоторых вариантах осуществления процент NK-клеток во множестве модифицированных PBMC и процент NK-клеток во множестве входных PBMC различаются не более чем приблизительно на любое значение из 5%, 8%, 10%, 12%, 14%, 16%, 18% или 20% по количеству. В некоторых вариантах осуществления процентное содержание моноцитов во множестве модифицированных РВМС и процент моноцитов во множестве входных РВМС отличаются по количеству не более чем приблизительно на 10% по количеству. В некоторых вариантах осуществления процент моноцитов во множестве модифицированных РВМС и процент моноцитов во множестве входных РВМС различаются не более чем приблизительно на любое значение из 5%, 8%, 10%, 12%, 14%, 16 %, 18% или 20% по количеству.
Кондиционирование PBMC
[0245] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, множество модифицированных PBMC подвергают кондиционированию. В дополнительных вариантах осуществления множество модифицированных PBMC является зрелыми. В некоторых вариантах осуществления множество PBMC кондиционируют после доставки, опосредованной сужением. Следовательно, в некоторых вариантах осуществления способ получения множества модифицированных РВМС дополнительно включает инкубация множества модифицированных РВМС, содержащих антиген и/или адъювант, со вторым адъювантом в течение достаточного периода времени, чтобы модифицированные РВМС, содержащие антиген, подверглись кондиционированию, тем самым получая кондиционированное множество модифицированных PBMC, содержащих антиген и/или адъювант. В некоторых вариантах осуществления способ дополнительно включает выделение множества модифицированных PBMC, содержащих антиген и/или адъювант, из клеточной суспензии перед инкубацией с адъювантом для кондиционирования модифицированных PBMC.
[0246] В некоторых вариантах осуществления концентрация антигена, инкубированного с модифицированными РВМС, составляет от приблизительно 0,01 мкМ до приблизительно 10 мМ. Например, в некоторых вариантах осуществления концентрация антигена, инкубированного с модифицированными РВМС, составляет ниже приблизительно 0,01 мкМ, приблизительно 0,1 мкМ, приблизительно 1 мкМ, приблизительно 10 мкМ, приблизительно 100 мкМ, приблизительно 1 мМ или приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с модифицированными PBMC, выше приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с модифицированными РВМС, составляет от приблизительно 0,01 мкМ до приблизительно 0,1 мкМ, от приблизительно 0,1 мкМ до приблизительно 1 мкМ, от приблизительно 1 мкМ до приблизительно 10 мкМ, от приблизительно 10 мкМ до приблизительно 100 мкМ, от приблизительно 100 мкМ до приблизительно 1 мМ или от 1 мМ до приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с модифицированными PBMC, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с модифицированными РВМС, составляет от приблизительно 0,1 мкМ до приблизительно 10 мкМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с модифицированными PBMC, составляет 1 мкМ.
[0247] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, множество модифицированных PBMC инкубируют с адъювантом в течение от приблизительно 1 ч до приблизительно 24 ч для кондиционирования модифицированных PBMC. В некоторых вариантах осуществления множество модифицированных РВМС инкубируют с адъювантом в течение от приблизительно 2 ч до приблизительно 10 ч для кондиционирования модифицированных РВМС. В некоторых вариантах осуществления множество модифицированных РВМС инкубируют с адъювантом в течение от приблизительно 3 ч до приблизительно 6 ч для кондиционирования модифицированных РВМС. В некоторых вариантах осуществления множество модифицированных РВМС инкубируют с адъювантом в течение приблизительно 1 ч, 2 ч, 3 ч, 3,5 ч, 4 ч, 4,5 ч, 5 ч, 5,5 ч, 6 ч, 8 ч, 12 ч, 16 ч, 20 ч или 24 ч для кондиционирования модифицированных PBMC. В некоторых вариантах осуществления множество модифицированных PBMC инкубируют с адъювантом в течение приблизительно 4 ч для кондиционирования модифицированных PBMC.
[0248] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, множество PBMC кондиционируют перед доставкой, опосредованной сужением. Следовательно, в некоторых вариантах осуществления способ получения множества модифицированных PBMC дополнительно включает инкубация множества входных PBMC с адъювантом в течение достаточного периода времени для кондиционирования входных PBMC, тем самым получая кондиционированное множество входных PBMC. В некоторых вариантах осуществления обеспечивается кондиционированное множество модифицированных PBMC, содержащих антиген, полученное способом, включающим стадии: a) инкубация множества входных PBMC с адъювантом в течение периода времени, достаточного для кондиционирования входных PBMC, тем самым получая кондиционированное множество входных PBMC; b) пропускание клеточной суспензии, содержащей кондиционированное множество входных PBMC, через деформирующее клетки сужение, где диаметр сужения является функцией диаметра входных PBMC в суспензии, тем самым вызывая пертурбации входных PBMC, достаточно большие для проникновения антигена с образованием кондиционированного множества нарушенных входных PBMC; и c) инкубация кондиционированного множества нарушенных входных PBMC с антигеном в течение периода времени, достаточного для поступления антигена в пертурбированные входные PBMC, тем самым получая кондиционированное множество модифицированных PBMC, содержащих антиген. В некоторых вариантах осуществления способ дополнительно включает отделение кондиционированного множества входных PBMC от кондиционирующего адъюванта перед пропусканием кондиционированного множества входных PBMC через сужение, деформирующее клетки.
[0249] В некоторых вариантах осуществления концентрация антигена, инкубированного с входными РВМС, составляет от приблизительно 0,01 мкМ до приблизительно 10 мМ. Например, в некоторых вариантах осуществления концентрация антигена, инкубированного с входными РВМС, составляет ниже приблизительно 0,01 мкМ, приблизительно 0,1 мкМ, приблизительно 1 мкМ, приблизительно 10 мкМ, приблизительно 100 мкМ, приблизительно 1 мМ или приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с входными РВМС, составляет выше приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с входными РВМС, составляет от приблизительно 0,01 мкМ до приблизительно 0,1 мкМ, от приблизительно 0,1 мкМ до приблизительно 1 мкМ, от приблизительно 1 мкМ до приблизительно 10 мкМ, от приблизительно 10 мкМ до приблизительно 100 мкМ, от приблизительно 100 мкМ до приблизительно 1 мМ или от 1 мМ до приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с входными РВМС, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с входными РВМС, составляет от приблизительно 0,1 мкМ до приблизительно 10 мкМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с входными PBMC, составляет 1 мкМ.
[0250] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, множество входных PBMC инкубируют с адъювантом в течение от приблизительно 1 до приблизительно 24 ч для кондиционирования входных PBMC. В некоторых вариантах осуществления множество входных РВМС инкубируют с адъювантом в течение от приблизительно 2 ч до приблизительно 10 ч для кондиционирования входных РВМС. В некоторых вариантах осуществления множество входных РВМС инкубируют с адъювантом в течение от приблизительно 3 ч до приблизительно 6 ч для кондиционирования входных РВМС. В некоторых вариантах осуществления множество входных РВМС инкубируют с адъювантом в течение приблизительно 1 ч, 2 ч, 3 ч, 3,5 ч, 4 ч, 4,5 ч, 5 ч, 5,5 ч, 6 ч, 8 ч, 12 ч, 16 ч, 20 ч или 24 ч для кондиционирования входных PBMC. В некоторых вариантах осуществления множество входных РВМС инкубируют с адъювантом в течение приблизительно 4 ч для кондиционирования входных РВМС.
[0251] В некоторых вариантах осуществления обеспечивается кондиционированное множество PBMC, содержащих антиген, полученных инкубацией множества PBMC, содержащих антиген, с адъювантом в течение достаточного периода времени для кондиционирования PBMC, тем самым получая кондиционированное множество PBMC, содержащих антиген. В некоторых вариантах осуществления обеспечивается кондиционированное множество PBMC, включающее антиген, полученное инкубацией множества PBMC с адъювантом в течение достаточного периода времени для кондиционирования PBMC перед введением антигена в PBMC, тем самым получая кондиционированное множество PBMC, содержащее антиген.
[0252] В некоторых вариантах осуществления согласно любому из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, концентрация антигена, инкубированного с PBMC, составляет от приблизительно 0,01 мкМ до приблизительно 10 мМ. Например, в некоторых вариантах осуществления концентрация антигена, инкубированного с PBMC, составляет ниже приблизительно 0,01 мкМ, приблизительно 0,1 мкМ, приблизительно 1 мкМ, приблизительно 10 мкМ, приблизительно 100 мкМ, приблизительно 1 мМ или приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с PBMC, составляет выше приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с PBMC, составляет от приблизительно 0,01 мкМ до приблизительно 0,1 мкМ, от приблизительно 0,1 мкМ до приблизительно 1 мкМ, от приблизительно 1 мкМ до приблизительно 10 мкМ, от приблизительно 10 мкМ до приблизительно 100 мкМ, от приблизительно 100 мкМ до приблизительно 1 мМ или от 1 мМ до приблизительно 10 мМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с PBMC, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с PBMC, составляет от приблизительно 0,1 мкМ до приблизительно 10 мкМ. В некоторых вариантах осуществления концентрация антигена, инкубированного с PBMC, составляет 1 мкМ.
[0253] В некоторых вариантах осуществления в соответствии с любым из способов или композиций, описанных здесь, где иммунная клетка представляет собой множество PBMC, множество PBMC инкубируют с адъювантом в течение от приблизительно 1 до приблизительно 24 ч для кондиционирования PBMC. В некоторых вариантах осуществления множество PBMC инкубируют с адъювантом в течение от приблизительно 2 ч до приблизительно 10 ч для кондиционирования PBMC. В некоторых вариантах осуществления множество РВМС инкубируют с адъювантом в течение от приблизительно 3 ч до приблизительно 6 ч для кондиционирования РВМС. В некоторых вариантах осуществления множество PBMC инкубируют с адъювантом в течение приблизительно 1 ч, 2 ч, 3 ч, 3,5 ч, 4 ч, 4,5 ч, 5 ч, 5,5 ч, 6 ч, 8 ч, 12 ч, 16 ч, 20 ч или 24 ч для кондиционирования PBMC. В некоторых вариантах осуществления множество PBMC инкубируют с адъювантом в течение приблизительно 4 ч для кондиционирования PBMC.
[0254] В некоторых вариантах осуществления одна или более костимулирующих молекул подвергаются положительной регуляции в кондиционированном множестве модифицированных PBMC по сравнению с некондиционированным множеством модифицированных PBMC. В некоторых вариантах осуществления одна или более костимулирующих молекул подвергаются положительной регуляции в субпопуляции клеток в кондиционированном множестве модифицированных PBMC по сравнению с субпопуляцией клеток в некондиционированном множестве модифицированных PBMC. В некоторых вариантах осуществления одна или более костимулирующих молекул подвергаются положительной регуляции в B-клетках кондиционированного множества модифицированных PBMC по сравнению с B-клетками в некондиционированном множестве модифицированных PBMC. В некоторых вариантах осуществления костимулирующая молекула представляет собой CD80 и/или CD86. В некоторых вариантах осуществления костимулирующая молекула представляет собой CD86. В некоторых вариантах осуществления CD80 и/или CD86 подвергаются положительной регуляции в B-клетках кондиционированного множества модифицированных PBMC приблизительно в 1,2, 1,5, 1,8, 2, 3, 4, 5 и 5 раз, 8 раз или более чем в 10 раз по сравнению с В-клетками в некондиционированном множестве модифицированных PBMC. В некоторых вариантах осуществления CD80 и/или CD86 подвергаются положительной регуляции в B-клетках кондиционированного множества модифицированных PBMC в любом из значений от приблизительно 1,2 раз до приблизительно 1,5 раз, от приблизительно 1,5 раз до приблизительно 1,8 раз, от приблизительно 1,8 раз до приблизительно 2 раз, от приблизительно 2 раз до приблизительно 3 раз, от приблизительно 3 раз до приблизительно 4 раз, от приблизительно 4 раз до приблизительно 5 раз, от приблизительно 5 раз до приблизительно 8 раз, от приблизительно 8 раз до приблизительно 10 раз, от приблизительно 10 до приблизительно 20 раз, от приблизительно 20 до приблизительно 50 раз, от приблизительно 50 до приблизительно 100 раз, от приблизительно 100 до приблизительно 200 раз, от приблизительно 200 раз до приблизительно 500 раз или более чем приблизительно в 500 раз по сравнению с В-клетками в некондиционированном множестве модифицированных PBMC. В некоторых вариантах осуществления экспрессия одного или более из IFN-γ, IL-6, MCP-1, MIP-1β, IP-10 или TNF-α повышается в кондиционированном множестве модифицированных PBMC по сравнению с некондиционированным множеством модифицированные PBMC. В некоторых вариантах осуществления экспрессия одного или более из IFN-γ, IL-6, MCP-1, MIP-1β, IP-10 или TNF-α увеличивается в субпопуляции клеток в кондиционированном множестве по сравнению с субпопуляцией клеток в некондиционированном множестве модифицированных PBMC. В некоторых вариантах осуществления экспрессия одного или более из IFN-γ, IL-6, MCP-1, MIP-1β, IP-10 или TNF-α увеличивается приблизительно в 1,2, 1,5, 1,8 раза, 2 раза, 3 раза, 4 раза, 5 раз, 8 раз или более чем в 10 раз в кондиционированном множестве модифицированных PBMC по сравнению с некондиционированном множеством модифицированных PBMC. В некоторых вариантах осуществления экспрессия одного или более из IFN-γ, IL-6, MCP-1, MIP-1β, IP-10 или TNF-α увеличивается в любом значении от приблизительно 1,2 до приблизительно 1,5 раза, от приблизительно 1,5 раза до приблизительно 1,8, от приблизительно 1,8 раза до приблизительно 2 раза, от приблизительно 2 раза до приблизительно 3 раза, от приблизительно 3 раза до приблизительно 4 раза, от приблизительно 4 раза до приблизительно 5 раз, от приблизительно 5 раз до приблизительно 8 раз, от приблизительно 8 раз до приблизительно 10 раз, от приблизительно 10 раз до приблизительно 20 раз, от приблизительно 20 раз до приблизительно 50 раз, от приблизительно 50 раз до приблизительно 100 раз, от приблизительно 100 до приблизительно 200 раз, от приблизительно 200 раз до приблизительно 500 раз или более чем приблизительно в 500 раз в кондиционированном множестве модифицированных PBMC по сравнению с некондицинированным множеством модифицированных PBMC.
Применения
[0255] В некоторых аспектах настоящее изобретение относится к способам лечения и профилактики заболевания, ассоциированного с ВПЧ, и/или модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, включающим введение субъекту композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно антиген ВПЧ и внутриклеточно адъювант. В некоторых вариантах осуществления клетку выделяют от пациента, модифицируют в соответствии с раскрытыми способами и вводят обратно пациенту. Например, популяцию иммунных клеток выделяют от пациента, пропускают через сужение для достижения доставки антигена ВПЧ и адъюванта, и затем повторно инфузируют пациенту для усиления терапевтического иммунного ответа на антиген ВПЧ. В некоторых вариантах осуществления клетку выделяют от субъекта с заболеванием, ассоциированным с ВПЧ, модифицируют в соответствии с раскрытыми способами и вводят обратно субъекту. Например, популяцию иммунных клеток выделяют от субъекта с ВПЧ-ассоциированным заболеванием, пропускают через сужение для достижения доставки антигена ВПЧ и адъюванта, и затем повторно вводят пациенту для индукции или усиления иммунного ответа на антиген ВПЧ у субъекта.
[0256] В некоторых вариантах осуществления антиген ВПЧ и/или адъювант, предназначенные для доставки, подвергают очистке. В некоторых вариантах осуществления соединение составляет, по меньшей мере, приблизительно 60% по массе (сухой массе) представляющего интерес соединения. В некоторых вариантах осуществления очищенное соединение составляет, по меньшей мере, приблизительно 75%, 90% или 99% представляющего интерес соединения. В некоторых вариантах осуществления очищенное соединение представляет собой, по меньшей мере, приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 98%, 99% или 100% (мас./мас.) представляющего интерес соединения. Чистоту определяют любыми известными методами, включая, без ограничения, колоночную хроматографию, тонкослойную хроматографию, анализ ВЭЖХ, ЯМР, масс-спектрометрию или SDS-PAGE. Очищенная ДНК или РНК определяется как ДНК или РНК, не содержащая экзогенных нуклеиновых кислот, углеводов и липидов.
[0257] В некоторых вариантах осуществления изобретение относится к способам лечения субъекта с заболеванием, ассоциированным с ВПЧ, введением субъекту клетки, модифицированной пропусканием через сужение, так что антиген ВПЧ и адъювант проникают в клетку. В некоторых вариантах осуществления клетка является аутологичной клеткой. Например, иммунную клетку выделяют у субъекта (например, пациента), модифицируют в соответствии с раскрытыми способами и вводят обратно субъекту. В некоторых вариантах осуществления иммунную клетку выделяют у субъекта, модифицируют в соответствии с раскрытыми способами и вводят обратно тому же субъекту. В некоторых вариантах осуществления клетка представляет собой аллогенную клетку. Например, клетку выделяют от другого человека, модифицируют в соответствии с раскрытыми методами и вводят первому человеку (например, пациенту). В некоторых вариантах осуществления клетку выделяют у субъекта, модифицируют в соответствии с раскрытыми способами и вводят другому субъекту.
[0258] Любой из способов, описанных здесь, осуществляется in vitro, ex vivo или in vivo. Для применений in vivo устройство может быть имплантировано в просвет сосуда, например стент, встроенный в артерию или вену. В некоторых вариантах осуществления способы используются как часть прикроватной системы для обработки ex vivo клеток пациента и немедленного повторного введения клеток пациенту. В некоторых вариантах осуществления способ может быть осуществлен в типичной больничной лаборатории с минимально подготовленным техническим специалистом. В некоторых вариантах осуществления может использоваться система лечения, проводимая пациентом.
Системы и наборы
[0259] В некоторых аспектах изобретение обеспечивает систему, содержащую один или более компонентов из сужения, суспензии иммунных клеток, антигенов или адъювантов ВПЧ для применения в способах, раскрытых здесь. Система может включать любой вариант осуществления, описанный для способов, раскрытых выше, включая микрофлюидные каналы или поверхность, имеющую поры для создания деформирующих клетки сужений, суспензии клеток, пертурбации клеток, параметры доставки, соединения и/или применения и т.д. В некоторых вариантах осуществления деформирующие клетку сужения по размеру рассчитаны на доставку в иммунные клетки. В некоторых вариантах осуществления параметры доставки, такие как рабочие скорости потока, концентрация клеток и соединений, температура, скорость клетки в сужении и состав клеточной суспензии (например, осмолярность, концентрация соли, содержание сыворотки, концентрация клеток, pH, и т.д.) оптимизированы для максимального ответа соединения для супрессии иммунного ответа или индукции толерантности.
[0260] Также обеспечиваются наборы или промышленные изделия для применения в лечении людей с заболеванием, ассоциированным с ВПЧ. В некоторых вариантах осуществления набор включает модифицированную иммунную клетку, содержащую внутриклеточно антиген ВПЧ и внутриклеточно адъювант. В некоторых вариантах осуществления набор включает одно или более из сужения, суспензии иммунных клеток, антигенов ВПЧ или адъювантов для применения в создании модифицированных иммунных клеток для применения в лечении субъекта с заболеванием, ассоциированным с ВПЧ. В некоторых вариантах осуществления наборы включают композиции, описанные здесь (например, микрофлюидный канал или поверхность, содержащую поры, клеточные суспензии и/или соединения) в подходящей упаковке. Подходящие упаковочные материалы известны в данной области и включают, например, флаконы (такие как герметичные флаконы), сосуды, ампулы, бутыли, банки, гибкую упаковку (например, герметичные майларовые или пластиковые пакеты) и тому подобное. Данные промышленные изделия можно дополнительно стерилизовать и/или герметично закрыть.
[0261] В изобретении также обеспечиваются наборы, включающие компоненты способов, описанных здесь, и они могут дополнительно содержать инструкции по осуществлению указанных способов лечения субъекта с заболеванием, ассоциированным с ВПЧ, и/или инструкции по введению антигена ВПЧ и адъюванта в иммунную клетку. Наборы, описанные здесь, могут дополнительно включать другие материалы, включая буферы, разбавители, фильтры, иглы, шприцы и вкладыши с инструкциями по выполнению любого из описанных здесь способов; например, инструкции по лечению субъекта с заболеванием, ассоциированным с ВПЧ, или инструкции по модификации иммунной клетки для включения внутриклеточно антигена ВПЧ и/или внутриклеточно адъюванта.
Примерные варианты осуществления
[0262] Вариант осуществления 1. Способ лечения заболевания, ассоциированного с вирусом папилломы человека (ВПЧ), у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, где адъювант присутствует внутриклеточно.
[0263] Вариант осуществления 2. Способ профилактики заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, где адъювант присутствует внутриклеточно.
[0264] Вариант осуществления 3. Способ модуляции иммунного ответа у субъекта с заболеванием, ассоциированным ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, где адъювант присутствует внутриклеточно.
[0265] Вариант осуществления 4. Способ лечения заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, где адъювант присутствует внутриклеточно;
где модифицированные иммунные клетки получают:
а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген и адъювант прошли через них, с образованием пертурбированной входной клетки; и
b) инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку;
с получением, тем самым, модифицированных иммунных клеток.
[0266] Вариант осуществления 5. Способ профилактики заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, где адъювант присутствует внутриклеточно;
где модифицированные иммунные клетки получают:
а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ и адъювант прошли через них, с образованием пертурбированной входной клетки; и
b) инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку;
с получением, тем самым, модифицированных иммунных клеток.
[0267] Вариант осуществления 6. Способ модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, включающий введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, где адъювант присутствует внутриклеточно;
где модифицированные иммунные клетки получают:
а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ и адъювант прошли через них, с образованием пертурбированной входной клетки; и
b) инкубацией пертурбированной входной клетки с антигеном ВПЧ и адъювантом в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и адъюванта в пертурбированную входную клетку;
с получением, тем самым, модифицированных иммунных клеток.
[0268] Вариант осуществления 7. Способ согласно любому из вариантов осуществления 4-6, где диаметр сужения меньше диаметра клетки.
[0269] Вариант осуществления 8. Способ согласно любому из вариантов осуществления 4-7, где диаметр сужения составляет от приблизительно 20% до 99% от диаметра клетки.
[0270] Вариант осуществления 9. Способ согласно любому из вариантов осуществления 4-8, где диаметр сужения составляет от приблизительно 20% до менее чем приблизительно 60% от диаметра клетки.
[0271] Вариант осуществления 10. Способ согласно любому из вариантов осуществления 4-9, где сужение находится в канале.
[0272] Вариант осуществления 11. Способ по любому из вариантов осуществления 4-10, где к входной клетке прикладывается деформирующая сила, когда она проходит через сужение.
[0273] Вариант осуществления 12. Способ согласно любому из вариантов осуществления 1-11, где антиген ВПЧ и/или адъювант находятся в цитозоле и/или эндосомах.
[0274] Вариант осуществления 13. Способ согласно любому из вариантов осуществления 1-12, где антиген и/или адъювант находятся во многих компартментах клетки.
[0275] Вариант осуществления 14. Способ согласно любому из вариантов осуществления 1-13, где модифицированная иммунная клетка дополнительно содержит антиген ВПЧ и/или адъювант вне клетки.
[0276] Вариант осуществления 15. Способ согласно любому из вариантов осуществления 1-14, где концентрация адъюванта, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0277] Вариант осуществления 16. Способ согласно любому из вариантов осуществления 1-15, где концентрация антигена ВПЧ, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0278] Вариант осуществления 17. Способ согласно любому из вариантов осуществления 4-16, где соотношение антигена ВПЧ и адъюванта, инкубированных с пертурбированной входной клеткой, составляет от приблизительно 10000:1 до приблизительно 1:10000.
[0279] Вариант осуществления 18. Способ согласно вариантам осуществления 3 или 6, где иммунный ответ усиливается.
[0280] Вариант осуществления 19. Способ согласно варианту осуществления 18, где иммунный ответ усиливается на антиген ВПЧ.
[0281] Вариант осуществления 20. Способ согласно любому из вариантов осуществления 1-19, где адъювант представляет собой CpG ODN, IFN-α, агонисты STING, агонисты RIG-I или поли I:C.
[0282] Вариант осуществления 21, где адъювант представляет собой CpG ODN.
[0283] Вариант осуществления 22. Способ согласно варианту осуществления 21, где CpG ODN представляет собой CpG ODN 1018, CpG ODN 1826 или CpG ODN 2006.
[0284] Вариант осуществления 23. Способ согласно любому из вариантов осуществления 1-22, где модифицированная иммунная клетка содержит более одного адъюванта.
[0285] Вариант осуществления 24. Способ согласно любому из вариантов осуществления 1-23, где антиген ВПЧ представляет собой пул множества полипептидов, которые вызывают ответ против одного и того же и/или разных антигенов ВПЧ.
[0286] Вариант осуществления 25. Способ согласно варианту осуществления 24, где антиген в пуле множества антигенов не снижает иммунный ответ, направленный на другие антигены в пуле множества антигенов.
[0287] Вариант 26. Способ согласно любому из вариантов осуществления 1-25, где антиген ВПЧ представляет собой полипептид, содержащий антигенный эпитоп ВПЧ и одну или более гетерологичных пептидных последовательностей.
[0288] Вариант осуществления 27. Способ согласно любому из вариантов осуществления 1-26, где антиген ВПЧ образует комплекс с самим собой, с другими антигенами или с адъювантом.
[0289] Вариант осуществления 28. Способ согласно любому из вариантов осуществления 1-27, где ВПЧ представляет собой антиген, полученный из клеточного лизата.
[0290] Вариант 29. Способ согласно любому из вариантов осуществления 1-28, где антиген ВПЧ представляет собой антиген типа ВПЧ-16 или ВПЧ-18.
[0291] Вариант осуществления 30. Способ согласно варианту осуществления 29, где антиген ВПЧ состоит из HLA-A2-рестриктированного эпитопа.
[0292] Вариант осуществления 31. Способ согласно любому из вариантов осуществления 1-30, где антиген ВПЧ представляет собой антиген типа ВПЧ E6 или антиген ВПЧ E7.
[0293] Вариант осуществления 32. Способ согласно любому из вариантов осуществления 1-31, где модифицированная иммунная клетка содержит антиген ВПЧ E6 и антиген ВПЧ E7.
[0294] Вариант осуществления 33. Способ согласно любому из вариантов осуществления 1-32, где антиген ВПЧ представляет собой полипептид, содержащий антигенный эпитоп, который фланкирован на N-конце и/или C-конце одной или более гетерологичными пептидными последовательностями.
[0295] Вариант осуществления 34. Способ согласно варианту осуществления 33, где антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-26.
[0296] Вариант осуществления 35. Способ согласно варианту осуществления 34, где антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% сходством с SEQ ID NO: 23.
[0297] Вариант осуществления 36. Способ согласно любому из вариантов осуществления 1-35, где антиген ВПЧ способен процессироваться в пептид, рестриктированный классом I MHC.
[0298] Вариант осуществления 37. Способ согласно любому из вариантов осуществления 1-36, где антиген ВПЧ способен процессироваться в пептид, рестриктированный классом II MHC.
[0299] Вариант осуществления 38. Способ согласно любому из вариантов осуществления 1-37, где модифицированная иммунная клетка содержит адъювант в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0300] Вариант осуществления 39. Способ согласно любому из вариантов осуществления 1-38, где модифицированная иммунная клетка содержит антиген ВПЧ в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0301] Вариант осуществления 40. Способ согласно любому из вариантов осуществления 1-39, где соотношение антигена ВПЧ и адъюванта составляет от приблизительно 10000:1 до приблизительно 1:10000.
[0302] Вариант осуществления 41. Способ согласно любому из вариантов осуществления 1-40, где модифицированная иммунная клетка дополнительно содержит агент, который повышает жизнеспособность и/или функцию модифицированной иммунной клетки по сравнению с соответствующей модифицированной иммунной клеткой, которая не содержат агента.
[0303] Вариант осуществления 42. Способ согласно варианту осуществления 41, где агент представляет собой соединение, усиливающее эндоцитоз, стабилизирующий агент или кофактор.
[0304] Вариант 43. Способ согласно варианту осуществления 41, где агент представляет собой альбумин.
[0305] Вариант осуществления 44. Способ согласно варианту осуществления 43, где альбумин представляет собой мышиный, бычий или человеческий альбумин.
[0306] Вариант осуществления 45. Способ согласно варианту осуществления изобретения 41, где агент представляет собой катион двухвалентного металла, глюкозу, АТФ, калий, глицерин, трегалозу, D-сахарозу, PEG1500, L-аргинин, L-глутамин или ЭДТА.
[0307] Вариант осуществления 46. Способ согласно варианту осуществления 41, где агент включает сывороточный альбумин мыши (MSA).
[0308] Вариант осуществления 47. Способ согласно любому из вариантов осуществления 1-46, где модифицированные иммунные клетки дополнительно модифицируют для повышения экспрессии одной или более костимулирующих молекул.
[0309] Вариант осуществления 48. Способ согласно варианту осуществления 47, где костимулирующая молекула представляет собой B7-H2, B7-1, B7-2, CD70, LIGHT, HVEM, CD40, 4-1BBL, OX40L, TL1A, GITRL, CD30L, TIM4, SLAM, CD48, CD58, CD155 или CD112.
[0310] Вариант осуществления 49. Способ согласно вариантам осуществления 47 или 48, где клетка содержит нуклеиновую кислоту, которая приводит к повышенной экспрессии одной или более костимулирующих молекул.
[0311] Вариант осуществления 50. Способ согласно любому из вариантов осуществления 1-49, где иммунная клетка представляет собой Т-клетку, дендритную клетку, моноцит, макрофаг, миелоидную клетку, гранулоцит, нейтрофил, тучную клетку, естественную клетку-киллер, врожденную лимфоидную клетку, базофил или гемопоэтическую клетку-предшественник.
[0312] Вариант осуществления 51. Способ согласно любому из вариантов осуществления 1-50, где иммунная клетка не является B-клеткой.
[0313] Вариант осуществления 52. Способ по любому из вариантов осуществления 1-50, где иммунная клетка представляет собой В-клетку.
[0314] Вариант осуществления 53. Способ согласно любому из вариантов осуществления 1-51, где иммунная клетка представляет собой Т-клетку.
[0315] Вариант осуществления 54. Способ согласно любому из вариантов осуществления 1-49, где иммунные клетки представляют смешанную популяцию клеток.
[0316] Вариант осуществления 55. Способ согласно варианту осуществления 54, где иммунные клетки представляют множество PBMC.
[0317] Вариант 56. Способ согласно варианту осуществления 53, где Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса I.
[0318] Вариант осуществления 57. Способ согласно варианту 53, где Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса II.
[0319] Вариант осуществления 58. Способ согласно вариантам осуществления 56 или 57, где Т-клетка содержит дополнительную модификацию для снижения экспрессии молекул MHC класса I и/или молекул MHC класса II.
[0320] Вариант осуществления 59. Способ согласно вариантам осуществления 56 или 57, где дополнительная модификация включает снижение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием siРНК, shРНК, CRISPR/Cas9, ZFN, TALEN, Cre-рекомбиназы или мегануклеазы.
[0321] Вариант осуществления 60. Способ согласно вариантам осуществления 56 или 57, где Т-клетка содержит дополнительную модификацию для повышения экспрессии молекул MHC класса I и/или молекул MHC класса II.
[0322] Вариант осуществления 61. Способ согласно варианту осуществления 56 или 57, где дополнительная модификация включает повышение экспрессии молекул МНС класса I и/или молекул МНС класса II с использованием РНК или плазмидной ДНК.
[0323] Вариант осуществления 62. Способ согласно любому из вариантов осуществления 53 и 56-59, где в аллогенном контексте врожденный иммунный ответ, развившийся у субъекта в ответ на введение дополнительно модифицированных Т-клеток, снижен, в аллогенном контексте, по сравнению с врожденным иммунным ответом, развившимся у субъекта в ответ на введение соответствующих модифицированных Т-клеток, которые не содержат дополнительную модификацию.
[0324] Вариант осуществления 63. Способ согласно любому из вариантов осуществления 53 и 56-59, где период полужизни в кровотоке дополнительно модифицированных Т-клеток у субъекта, которому они были введены, модулируется по сравнению с периодом полужизни в кровотоке соответствующих модифицированных Т-клеток, которые не содержат дополнительной модификации, у субъекта, которому они были введены.
[0325] Вариант осуществления 64. Способ согласно любому из вариантов осуществления 53 и 56-63, где Т-клетка включает одно или более из Т-хелперов, цитотоксических Т-клеток, Т-клеток памяти, CIK-клеток и естественных Т-клеток-киллеров.
[0326] Вариант осуществления 65. Способ согласно любому из вариантов осуществления 53 и 56-63, где Т-клетка включает одно или более из CD3+ Т-клеток, CD4+ Т-клеток, CD8+ Т-клеток, CD45RA+ Т-клеток, CD45RO+ Т-клеток и γδ-Т-клеток.
[0327] Вариант осуществления 66. Способ согласно любому из вариантов осуществления 1-65, где модифицированная клетка является аллогенной для субъекта.
[0328] Вариант осуществления 67. Способ согласно любому из вариантов осуществления 1-65, где модифицированная клетка является аутологичной для субъекта.
[0329] Вариант осуществления 68. Способ согласно любому из вариантов осуществления 1-67, где субъект предварительно кондиционирован к модулированному воспалению и/или модулированному иммунному ответу.
[0330] Вариант осуществления 69. Способ согласно любому из вариантов осуществления 1-68, дополнительно включающий введение субъекту адъюванта.
[0331] Вариант осуществления 70. Способ согласно варианту осуществления 69, где адъювант представляет собой IFNα или CpG ODN.
[0332] Вариант осуществления 71. Способ согласно вариантам осуществления 69 или 70, где композицию, содержащую модифицированные иммунные клетки, и адъювант, вводят одновременно.
[0333] Вариант осуществления 72. Способ согласно вариантам осуществления 69 или 70, где композицию, содержащую модифицированные иммунные клетки, и адъювант, вводят последовательно.
[0334] Вариант осуществления 73. Способ согласно варианту осуществления 72, где композицию, содержащую модифицированные иммунные клетки, вводят до введения адъюванта.
[0335] Вариант осуществления 74. Способ согласно варианту осуществления 72, где композицию, содержащую модифицированные иммунные клетки, вводят после введения адъюванта.
[0336] Вариант осуществления 75. Способ согласно любому из вариантов осуществления 1-74, где композицию, содержащую модифицированные иммунные клетки, вводят в комбинации с введением ингибитора иммунных контрольных точек.
[0337] Вариант осуществления 76. Способ согласно варианту осуществления 75, где композицию, содержащую модифицированные иммунные клетки и ингибитор иммунных контрольных точек, вводят одновременно.
[0338] Вариант осуществления 77. Способ согласно варианту осуществления 75, где композицию, содержащую модифицированные иммунные клетки, и ингибитор иммунных контрольных точек, вводят последовательно.
[0339] Вариант осуществления 78. Способ согласно варианту осуществления 77, где композицию, содержащую модифицированные иммунные клетки, вводят до введения ингибитора иммунных контрольных точек.
[0340] Вариант осуществления 79. Способ согласно варианту осуществления 77, где композицию, содержащую модифицированные иммунные клетки, вводят после введения ингибитора иммунных контрольных точек.
[0341] Вариант осуществления 80. Способ согласно любому из вариантов осуществления 75-79, где ингибитор иммунных контрольных точек нацелен на одно или более из PD-1, PD-L1, CTLA-4, LAG3, TIM-3, TIGIT, VISTA, TIM1, B7-H4 (VTCN1) или BTLA.
[0342] Вариант осуществления 81. Способ согласно любому из вариантов осуществления 1-80, где композицию, содержащую модифицированные иммунные клетки, вводят в комбинации с введением химиотерапевтического препарата.
[0343] Вариант осуществления 82. Способ согласно варианту осуществления 81, где композицию, содержащую модифицированные иммунные клетки, и химиотерапевтический препарат вводят одновременно.
[0344] Вариант осуществления 83. Способ согласно варианту осуществления 81, где композицию, содержащую модифицированные иммунные клетки, и химиотерапевтический препарат вводят последовательно.
[0345] Вариант осуществления 84. Способ согласно варианту осуществления 83, где композицию, содержащую модифицированные иммунные клетки, вводят до введения химиотерапевтического препарата.
[0346] Вариант осуществления изобретения 85. Способ согласно варианту осуществления изобретения 83, где композицию, содержащую модифицированные иммунные клетки, вводят после введения химиотерапевтического препарата.
[0347] Вариант осуществления 86. Способ согласно любому из вариантов осуществления 81-85, где химиотерапия включает препарат на основе платины.
[0348] Вариант осуществления 87. Способ согласно любому из вариантов осуществления 81-86, где химиотерапия включает цисплатин.
[0349] Вариант осуществления 88. Способ согласно любому из вариантов осуществления 1-87, где введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии цитотоксических Т-лимфоцитов (CTL), специфических для антигена ВПЧ.
[0350] Вариант осуществления 89. Способ согласно любому из вариантов осуществления 1-87, где введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии Т(Th)-хелперов, специфических для антигена.
[0351] Вариант осуществления 90. Способ согласно любому варианту осуществления 1-89, где эффективное количество композиции содержит от приблизительно 1×106 до приблизительно 1×1012 модифицированных иммунных клеток.
[0352] Вариант осуществления 91. Способ согласно любому из вариантов осуществления 1-90, где способ включает многократные введения композиции, содержащей модифицированные иммунные клетки.
[0353] Вариант осуществления 92. Способ согласно варианту осуществления 91, где способ включает первое введение композиции, содержащей модифицированные иммунные клетки, с последующим вторым введением композиции, содержащей модифицированные иммунные клетки.
[0354] Вариант осуществления 93. Способ согласно варианту осуществления 92, где второе введение проводят приблизительно через один месяц после первого введения.
[0355] Вариант осуществления 94. Способ согласно любому из вариантов осуществления 1-93, где заболевание, ассоциированное с ВПЧ, представляет собой рак, ассоциированный с ВПЧ.
[0356] Вариант осуществления 95. Способ согласно варианту осуществления 94, где рак, ассоциированный с ВПЧ, представляет собой рак шейки матки, рак анального канала, орофарингеальный рак, рак влагалища, рак вульвы, рак полового члена, рак кожи или опухоли головы и шеи.
[0357] Вариант осуществления 96. Способ согласно любому из вариантов осуществления 1-95, где заболевание, ассоциированное с ВПЧ, представляет собой инфекционное заболевание, ассоциированное с ВПЧ.
[0358] Вариант осуществления 97. Способ лечения заболевания, ассоциированного с вирусом папилломы человека (ВПЧ), у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-25.
[0359] Вариант осуществления 98. Способ профилактики заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-25.
[0360] Вариант осуществления 99. Способ модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-25.
[0361] Вариант осуществления 100. Способ лечения заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-25;
где модифицированные иммунные клетки получают:
а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген прошел через них, с образованием пертурбированной входной клетки; и
b) инкубацией пертурбированной входной клетки с антигеном ВПЧ в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку;
с получением, тем самым, модифицированных иммунных клеток.
[0362] Вариант осуществления 101. Способ профилактики заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, где модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-25;
где модифицированные иммунные клетки получают:
а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ прошел через них, с образованием пертурбированной входной клетки; и
b) инкубацией пертурбированной входной клетки с антигеном ВПЧ в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку;
с получением, тем самым, модифицированных иммунных клеток.
[0363] Вариант осуществления 102. Способ модуляции иммунного ответа у субъекта с заболеванием, ассоциированным с ВПЧ, включающий введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, содержащий аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-25;
где модифицированные иммунные клетки получают:
а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ прошел через них, с образованием пертурбированной входной клетки; и
b) инкубацией пертурбированной входной клетки с антигеном ВПЧ в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку;
с получением, тем самым, модифицированных иммунных клеток.
[0364] Вариант 103. Способ согласно любому из вариантов 100-102, где диаметр сужения меньше диаметра клетки.
[0365] Вариант осуществления 104. Способ согласно любому из вариантов осуществления 100-103, где диаметр сужения составляет от приблизительно 20% до 99% от диаметра клетки.
[0366] Вариант осуществления 105. Способ согласно любому из вариантов осуществления 100-104, где диаметр сужения составляет от приблизительно 20% до менее чем приблизительно 60% от диаметра клетки.
[0367] Вариант осуществления 106. Способ согласно любому из вариантов осуществления 100-105, где сужение находится в канале.
[0368] Вариант 107. Способ согласно любому из вариантов 100-106, где к входной клетке прикладывается деформирующая сила, когда она проходит через сужение.
[0369] Вариант осуществления 108. Способ согласно любому из вариантов осуществления 86-107, дополнительно включающий введение субъекту адъюванта.
[0370] Вариант осуществления 109. Способ согласно варианту осуществления 108, где адъювант представляет собой IFNα или CpG ODN.
[0371] Вариант осуществления изобретения 110. Способ согласно вариантам осуществления 108 или 109, где композицию, содержащую модифицированные иммунные клетки и адъювант, вводят одновременно.
[0372] Вариант осуществления 111. Способ согласно вариантам осуществления 108 или 109, где композицию, содержащую модифицированные иммунные клетки, и адъювант, вводят последовательно.
[0373] Вариант осуществления 112. Способ согласно варианту осуществления 111, где композицию, содержащую модифицированные иммунные клетки, вводят до введения адъюванта.
[0374] Вариант осуществления 113. Способ согласно варианту осуществления 111, где композицию, содержащую модифицированные иммунные клетки, вводят после введения адъюванта.
[0375] Вариант осуществления 114. Способ согласно любому из вариантов осуществления 97-113, где модифицированная иммунная клетка дополнительно содержит адъювант.
[0376] Вариант осуществления 115. Способ согласно любому из вариантов осуществления 100-113, где пертурбированную иммунную клетку на стадии b инкубируют с антигеном ВПЧ и адъювантом.
[0377] Вариант осуществления 116. Способ согласно варианту осуществления 114 или 115, где антиген ВПЧ и/или адъювант находятся в цитозоле и/или эндосомах.
[0378] Вариант осуществления 117. Способ согласно любому из вариантов осуществления 114-116, где антиген и/или адъювант находятся во многих компартментах клетки.
[0379] Вариант осуществления 118. Способ согласно любому из вариантов осуществления 114-117, где модифицированная иммунная клетка дополнительно содержит антиген ВПЧ и/или адъювант вне клетки.
[0380] Вариант осуществления 119. Способ согласно любому из вариантов осуществления 115-118, где концентрация адъюванта, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0381] Вариант осуществления 120. Способ согласно любому из вариантов осуществления 115-119, где концентрация антигена ВПЧ, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0382] Вариант осуществления 121. Способ согласно любому из вариантов осуществления 115-120, где соотношение антигена ВПЧ и адъюванта, инкубированных с пертурбированной входной клеткой, составляет от приблизительно 10000:1 до приблизительно 1:10000.
[0383] Вариант осуществления 122. Способ согласно вариантам осуществления 99 или 102, где иммунный ответ усиливается.
[0384] Вариант осуществления 123. Способ согласно варианту осуществления 122, где иммунный ответ усиливается на антиген ВПЧ.
[0385] Вариант осуществления 124. Способ согласно любому из вариантов осуществления 114-123, где адъювант представляет собой CpG ODN, IFN-α, агонисты STING, агонисты RIG-I или поли I:C.
[0386] Вариант осуществления 125. Способ согласно варианту осуществления 124, где адъювант представляет собой CpG ODN.
[0387] Вариант осуществления 126. Способ согласно варианту осуществления 125, где CpG ODN представляет собой CpG ODN 1018, CpG ODN 1826 или CpG ODN 2006.
[0388] Вариант осуществления 127. Способ согласно любому из вариантов осуществления 114-126, где модифицированная иммунная клетка содержит более одного адъюванта.
[0389] Вариант осуществления 128. Способ согласно любому из вариантов осуществления 97-127, где антиген ВПЧ представляет собой пул множества полипептидов, которые вызывают ответ против одного и того же и/или разных антигенов ВПЧ.
[0390] Вариант осуществления 129. Способ согласно варианту осуществления 128, где антиген в пуле множества антигенов не снижает иммунный ответ, направленный на другие антигены в пуле нескольких антигенов.
[0391] Вариант осуществления 130. Способ согласно любому из вариантов осуществления 97-129, где антиген ВПЧ представляет собой полипептид, содержащий антигенный эпитоп ВПЧ и одну или более гетерологичных пептидных последовательностей.
[0392] Вариант осуществления 131. Способ согласно любому из вариантов осуществления 97-130, где антиген ВПЧ образует комплекс с самим собой, с другими антигенами или с адъювантом.
[0393] Вариант осуществления 132. Способ согласно любому из вариантов осуществления 97-131, где антиген ВПЧ состоит из HLA-A2-рестриктированного эпитопа.
[0394] Вариант осуществления 133. Способ согласно любому из вариантов осуществления 97-132, где антиген ВПЧ способен процессироваться в пептид, рестриктированный классом I MHC.
[0395] Вариант осуществления 134. Способ согласно любому из вариантов осуществления 97-133, где антиген ВПЧ способен процессироваться в пептид, рестриктированный классом II MHC.
[0396] Вариант осуществления 135. Способ согласно любому из вариантов осуществления 114-134, где модифицированная иммунная клетка содержит адъювант в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0397] Вариант осуществления 136. Способ согласно любому из вариантов осуществления 97-135, где модифицированная иммунная клетка содержит антиген ВПЧ в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0398] Вариант осуществления 137. Способ согласно любому из вариантов осуществления 114-136, где соотношение антигена ВПЧ и адъюванта составляет от приблизительно 10000:1 до приблизительно 1:10000.
[0399] Вариант осуществления 138. Способ согласно любому из вариантов осуществления 97-137, где модифицированная иммунная клетка дополнительно содержит агент, который повышает жизнеспособность и/или функцию модифицированной иммунной клетки по сравнению с соответствующей модифицированной иммунной клеткой, которая не содержит агента.
[0400] Вариант осуществления 139. Способ согласно варианту осуществления 138, где агент представляет собой соединение, усиливающее эндоцитоз, стабилизирующий агент или кофактор.
[0401] Вариант осуществления 140. Способ согласно варианту осуществления 138, где агент представляет собой альбумин.
[0402] Вариант осуществления изобретения 141. Способ согласно варианту осуществления изобретения 140, где альбумин представляет собой мышиный, бычий или человеческий альбумин.
[0403] Вариант осуществления изобретения 142. Способ согласно варианту осуществления изобретения 138, где агент представляет собой катион двухвалентного металла, глюкозу, АТФ, калий, глицерин, трегалозу, D-сахарозу, PEG1500, L-аргинин, L-глутамин или ЭДТА.
[0404] Вариант 143. Способ согласно варианту 138, где агент включает MSA.
[0405] Вариант осуществления 144. Модифицированная Т-клетка по любому из вариантов осуществления 97-143, где клетки дополнительно модифицированы для повышения экспрессии одной или более костимулирующих молекул.
[0406] Вариант осуществления 145. Модифицированная Т-клетка согласно варианту осуществления 144, где костимулирующая молекула представляет собой B7-H2 (ICOSL), B7-1 (CD80), B7-2 (CD86), CD70, LIGHT, HVEM, CD40, 4-1BBL, OX40L, TL1A, GITRL, CD30L, TIM4, SLAM, CD48, CD58, CD155 или CD112.
[0407] Вариант осуществления 146. Модифицированная Т-клетка согласно вариантам осуществления 144 или 145, где клетка содержит нуклеиновую кислоту, которая приводит к повышенной экспрессии одной или более костимулирующих молекул.
[0408] Вариант осуществления. Способ согласно любому из вариантов осуществления 97-146, где иммунная клетка представляет собой Т-клетку, дендритную клетку, моноцит, макрофаг, миелоидную клетку, гранулоцит, нейтрофил, тучную клетку, естественную клетку-киллер, врожденную лимфоидную клетку, базофил или гемопоэтическую клетку-предшественник.
[0409] Вариант осуществления 148. Способ по любому из вариантов осуществления 97-147, где иммунная клетка не является B-клеткой.
[0410] Вариант осуществления 149. Способ по любому из вариантов осуществления 97-148, где иммунная клетка представляет собой B-клетку.
[0411] Вариант осуществления 150. Способ по любому из вариантов осуществления 97-148, где иммунная клетка представляет собой Т-клетку.
[0412] Вариант осуществления 151. Способ по любому из вариантов осуществления 97-148, где иммунная клетка представляет собой смешанную популяцию клеток.
[0413] Вариант осуществления 152. Способ по варианту осуществления 151, где иммунная клетка представляет собой множество PBMC.
[0414] Вариант осуществления 153. Способ согласно варианту осуществления 150, где Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса I.
[0415] Вариант осуществления 154. Способ по варианту осуществления 150, где Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса II.
[0416] Вариант осуществления 155. Способ согласно варианту осуществления 153 или 154, где Т-клетка содержит дополнительную модификацию для уменьшения экспрессии молекул MHC класса I и/или молекул MHC класса II.
[0417] Вариант осуществления 156. Способ согласно вариантам осуществления 153 или 154, где дополнительная модификация включает снижение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием siРНК, shРНК, CRISPR/Cas9, ZFN, TALEN, Cre-рекомбиназы или мегануклеазы.
[0418] Вариант осуществления 157. Способ согласно вариантам осуществления 153 или 154, где Т-клетка содержит дополнительную модификацию для увеличения экспрессии молекул MHC класса I и/или молекул MHC класса II.
[0419] Вариант осуществления 158. Способ согласно вариантам осуществления 153 или 154, где дополнительная модификация включает повышение экспрессии молекул МНС класса I и/или молекул МНС класса II с использованием РНК или плазмидной ДНК.
[0420] Вариант осуществления 159. Способ согласно любому из вариантов осуществления 150 и 153-156, где в аллогенном контексте врожденный иммунный ответ, развившийся у субъекта в ответ на введение дополнительно модифицированных Т-клеток, снижен, в аллогенном контексте, по сравнению с врожденным иммунным ответом, развившимся у субъекта в ответ на введение соответствующих модифицированных Т-клеток, которые не содержат дополнительную модификацию.
[0421] Вариант осуществления 160. Способ согласно любому из вариантов осуществления 150 и 153-156, где период полужизни в кровотоке дополнительно модифицированных Т-клеток у субъекта, которому они были введены, модулируется по сравнению с периодом полужизни в кровотоке соответствующих модифицированных Т-клеток, которые не содержат дополнительной модификации у субъекта, которому они были введены.
[0422] Вариант осуществления 161. Способ согласно любому из вариантов осуществления 150 и 153-160, где Т-клетка включает одно или более из Т-хелперов, цитотоксических Т-клеток, Т-клеток памяти, CIK-клеток и естественных Т-клеток-киллеров.
[0423] Вариант осуществления 162. Способ согласно любому из вариантов осуществления 150 и 153-160, где Т-клетка включает одно или более из CD3+Т-клеток, CD4+ Т-клеток, CD8+ Т-клеток, CD45RA+ Т-клеток, CD45RO+ Т-клеток и γδ-Т-клеток.
[0424] Вариант осуществления 163. Способ согласно любому из вариантов осуществления 97-162, где модифицированная клетка является аллогенной для субъекта.
[0425] Вариант осуществления 164. Способ согласно любому из вариантов осуществления 97-162, где модифицированная клетка является аутологичной для субъекта.
[426] Вариант осуществления 165. Способ согласно любому из вариантов осуществления 97-164, где субъект предварительно кондиционирован к модулированному воспалению и/или модулированному иммунному ответу.
[0427] Вариант осуществления 166. Способ согласно любому из вариантов осуществления 97-165, где композицию, содержащую модифицированные иммунные клетки, вводят в комбинации с введением ингибитора иммунных контрольных точек.
[0428] Вариант осуществления 167. Способ согласно варианту осуществления 166, где композицию, содержащую модифицированные иммунные клетки, и ингибитор иммунных контрольных точек, вводят одновременно.
[0429] Вариант осуществления 168. Способ согласно варианту осуществления 166, где композицию, содержащую модифицированные иммунные клетки, и ингибитор иммунных контрольных точек, вводят последовательно.
[0430] Вариант осуществления 169. Способ согласно варианту осуществления 168, где композицию, содержащую модифицированные иммунные клетки, вводят до введения ингибитора иммунных контрольных точек.
[0431] Вариант осуществления изобретения 170. Способ согласно варианту осуществления изобретения 168, где композицию, содержащую модифицированные иммунные клетки, вводят после введения ингибитора иммунных контрольных точек.
[0432] Вариант осуществления 171. Способ согласно любому из вариантов осуществления 152-156, где ингибитор иммунных контрольных точек нацелен на одно или более из PD-1, PD-L1, CTLA-4, LAG3, TIM-3, TIGIT, VISTA, TIM1, B7-H4 (VTCN1) или BTLA.
[0433] Вариант осуществления 172. Способ согласно любому из вариантов осуществления 97-171, где композицию, содержащую модифицированные иммунные клетки, вводят в комбинации с введением химиотерапевтического препарата.
[434] Вариант осуществления 173. Способ согласно варианту осуществления 172, где композицию, содержащую модифицированные иммунные клетки, и химиотерапевтический препарат вводят одновременно.
[0435] Вариант осуществления 174. Способ согласно варианту осуществления 172, где композицию, содержащую модифицированные иммунные клетки, и химиотерапевтический препарат вводят последовательно.
[0436] Вариант осуществления 175. Способ согласно варианту осуществления 174, где композицию, содержащую модифицированные иммунные клетки, вводят до введения химиотерапевтического препарата.
[0437] Вариант осуществления 176. Способ согласно варианту осуществления 174, где композицию, содержащую модифицированные иммунные клетки, вводят после введения химиотерапевтического препарата.
[0438] Вариант осуществления 177. Способ согласно любому из вариантов осуществления 172-176, где химиотерапия включает цисплатин.
[0439] Вариант осуществления 178. Способ согласно любому из вариантов осуществления 97-177, где введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии цитотоксических Т-лимфоцитов (CTL), специфических для антигена ВПЧ.
[0440] Вариант осуществления 179. Способ согласно любому из вариантов осуществления 97-177, где введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии T(Th)-хелперов, специфических для антигена ВПЧ.
[0441] Вариант осуществления 180. Способ согласно любому из вариантов осуществления 97-179, где эффективное количество композиции включает от приблизительно 1×106 до приблизительно 1×1012 модифицированных иммунных клеток.
[0442] Вариант осуществления 181. Способ согласно любому из вариантов осуществления 97-180, где способ включает многократные введения композиции, содержащей модифицированные иммунные клетки.
[0443] Вариант осуществления 182. Способ согласно варианту осуществления 181, где способ включает первое введение композиции, содержащей модифицированные иммунные клетки, с последующим вторым введением композиции, содержащей модифицированные иммунные клетки.
[0444] Вариант 183. Способ по варианту осуществления 182, где второе введение проводят приблизительно через один месяц после первого введения.
[0445] Вариант осуществления 184. Способ согласно любому из вариантов осуществления 97-183, где заболевание, ассоциированное с ВПЧ, представляет собой рак, ассоциированный с ВПЧ.
[0446] Вариант осуществления изобретения 185. Способ согласно варианту осуществления изобретения 184, где рак, ассоциированный с ВПЧ, представляет собой рак шейки матки, рак анального канала, орофарингеальный рак, рак влагалища, рак вульвы, рак полового члена, рак кожи или опухоли головы и шеи.
[0447] Вариант осуществления 186. Композиция, содержащая модифицированные иммунные клетки, где модифицированные иммунные клетки содержат внутриклеточно CpG ODN и антиген ВПЧ с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-25.
[0448] Вариант осуществления 187. Композиция согласно варианту осуществления 166, где антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% сходством с SEQ ID NO: 23.
[0449] Вариант осуществления 188. Композиция согласно варианту осуществления 186 или 187, где модифицированные иммунные клетки получают:
а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ и CpG ODN прошли через них, с образованием пертурбированной входной клетки; и
b) инкубацией пертурбированной входной клетки с антигеном ВПЧ и CpG ODN в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ и CpG ODN в пертурбированную входную клетку;
с получением, тем самым, модифицированных иммунных клеток.
[0450] Вариант осуществления 189. Композиция согласно варианту осуществления 188, где диаметр сужения меньше диаметра клетки.
[0451] Вариант осуществления 190. Композиция согласно вариантам осуществления 188 или 189, где диаметр сужения составляет от приблизительно 20% до приблизительно 99% от диаметра клетки.
[0452] Вариант осуществления 191. Композиция согласно любому из вариантов осуществления 188-190, где диаметр сужения составляет от приблизительно 20% до менее, чем приблизительно 60% от диаметра клетки.
[0453] Вариант осуществления 192. Композиция согласно любому из вариантов осуществления 188-191, где сужение находится в канале.
[0454] Вариант осуществления 193. Композиция согласно любому из вариантов осуществления 188-192, где к входной клетке прикладывается деформирующая сила, когда она проходит через сужение,
[0455] Вариант осуществления 194. Композиция согласно любому из вариантов осуществления 186-193, где композиция дополнительно содержит адъювант.
[0456] Вариант осуществления 195. Композиция согласно любому из вариантов осуществления 186-194, где антиген ВПЧ и/или CpG ODN находится в цитозоле и/или эндосомах.
[0457] Вариант осуществления 196. Композиция согласно любому из вариантов осуществления 186-195, где антиген и/или CpG ODN находится во многих компартментах клетки.
[0458] Вариант осуществления 197. Композиция согласно любому из вариантов осуществления 186-196, где модифицированная иммунная клетка дополнительно содержит антиген ВПЧ и/или CpG ODN на поверхности клетки.
[0459] Вариант осуществления 198. Композиция согласно любому из вариантов осуществления 188-197, где концентрация CpG ODN, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0460] Вариант осуществления 199. Композиция согласно любому из вариантов осуществления 188-198, где концентрация антигена ВПЧ, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0461] Вариант осуществления 200. Композиция согласно любому из вариантов осуществления 188-199, где соотношение антигена ВПЧ и CpG ODN, инкубированных с пертурбированной входной клеткой, составляет от приблизительно 10000:1 до приблизительно 1:10000.
[0462] Вариант осуществления 201. Композиция согласно любому из вариантов осуществления 186-200, где CpG ODN представляет собой CpG ODN 1018, CpG ODN 1826 или CpG ODN 2006.
[0463] Вариант осуществления 202. Композиция согласно любому из вариантов осуществления 186-201, где модифицированная иммунная клетка содержит более одного адъюванта.
[0464] Вариант осуществления. Композиция согласно варианту осуществления 202, где адъювант включает CpG ODN, IFN-α, агонисты STING, агонисты RIG-I или поли I:C.
[0465] Вариант осуществления 204. Композиция согласно любому из вариантов осуществления 186-203, где антиген ВПЧ представляет собой пул множества полипептидов, которые вызывают ответ против одного и того же или разных антигенов ВПЧ.
[0466] Вариант осуществления 205. Композиция согласно варианту осуществления 204, где антиген в пуле множества антигенов не снижает иммунный ответ, направленный на другие антигены в пуле множества антигенов.
[0467] Вариант осуществления 206. Композиция согласно любому из вариантов осуществления 186-205, где антиген ВПЧ представляет собой полипептид, содержащий антигенный эпитоп ВПЧ и одну или более гетерологичных пептидных последовательностей.
[0468] Вариант осуществления 207. Композиция согласно любому из вариантов осуществления 186-206, где антиген ВПЧ образует комплекс с самим собой, с другими антигенами, с адъювантом или с CpG ODN.
[0469] Вариант осуществления 208. Композиция согласно вариантам осуществления 186-207, где антиген ВПЧ состоит из HLA-A2-рестриктированного эпитопа.
[0470] Вариант осуществления 209. Композиция согласно любому из вариантов осуществления 186-208, где антиген ВПЧ представляет собой полипептид, содержащий антигенный эпитоп, фланкированный на N-конце и/или C-конце одной или более гетерологичными пептидными последовательностями.
[0471] Вариант осуществления 210. Композиция согласно любому из вариантов осуществления 186-209, где модифицированная иммунная клетка содержит CpG ODN в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0472] Вариант осуществления 212. Композиция согласно любому из вариантов осуществления 186-211, где соотношение антигена ВПЧ и CpG ODN составляет от приблизительно 10000:1 до приблизительно 1:10000.
[0473] Вариант осуществления 213. Композиция, содержащая модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ, где антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-25.
[0474] Вариант осуществления 214. Композиция согласно варианту осуществления 213, где антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% сходством с SEQ ID NO: 23.
[0475] Вариант осуществления 215. Композиция согласно варианту осуществления 213 или 214, где модифицированные иммунные клетки получают:
а) пропусканием клеточной суспензии, содержащей входную клетку, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ прошел через них, с образованием пертурбированной входной клетки; и
b) инкубацией пертурбированной входной клетки с антигеном ВПЧ в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку;
с получением, тем самым, модифицированных иммунных клеток.
[0476] Вариант 216. Композиция согласно варианту 215, где диаметр сужения меньше диаметра клетки.
[0477] Вариант осуществления 217. Композиция согласно любому из вариантов осуществления 215-216, где диаметр сужения составляет от приблизительно 20% до приблизительно 99% от диаметра клетки.
[0478] Вариант осуществления 218. Композиция согласно любому из вариантов осуществления 215-217, где диаметр сужения составляет от приблизительно 20% до менее, чем приблизительно 60% от диаметра клетки.
[0479] Вариант осуществления 219. Композиция согласно любому из вариантов осуществления 215-218, где сужение находится в канале.
[0480] Вариант осуществления 220. Композиция согласно любому из вариантов осуществления 215-219, где к входной клетке прикладывается деформирующая сила, когда она проходит через сужение.
[0481] Вариант осуществления 221. Композиция согласно любому из вариантов осуществления 213-220, где композиция дополнительно содержит адъювант.
[0482] Вариант осуществления 222. Композиция согласно любому из вариантов осуществления 213-221, где антиген ВПЧ и/или адъювант находятся в цитозоле и/или эндосомах.
[0483] Вариант осуществления 223. Композиция согласно любому из вариантов осуществления 213-222, где антиген и/или адъювант находятся во многих компартментах клетки.
[0484] Вариант осуществления 224. Композиция согласно любому из вариантов осуществления 213-223, где модифицированная иммунная клетка дополнительно содержит антиген ВПЧ и/или адъювант на поверхности клетки.
[0485] Вариант осуществления 225. Композиция согласно любому из вариантов осуществления 215-224, где концентрация адъюванта, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0486] Вариант осуществления 226. Композиция согласно любому из вариантов осуществления 215-225, где концентрация антигена ВПЧ, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0487] Вариант осуществления 227. Композиция согласно любому из вариантов осуществления 215-226, где соотношение антигена ВПЧ и адъюванта, инкубированных с пертурбированной входной клеткой, составляет от приблизительно 10000:1 до приблизительно 1:10000.
[0488] Вариант осуществления 228. Композиция согласно любому из вариантов осуществления 213-227, где адъювант представляет собой CpG ODN, IFN-α, агонисты STING, агонисты RIG-I или поли I:C.
[0489] Вариант осуществления 229. Композиция согласно варианту осуществления 228, где адъювант представляет собой CpG ODN.
[0490] Вариант осуществления 230. Композиция согласно варианту осуществления 229, где CpG ODN представляет собой CpG ODN 1018, CpG ODN 1826 или CpG ODN 2006.
[0491] Вариант осуществления 231. Композиция согласно любому из вариантов осуществления 213-230, где модифицированная иммунная клетка включает более одного адъюванта.
[0492] Вариант осуществления 232. Композиция согласно любому из вариантов осуществления 213-231, где антиген ВПЧ представляет собой пул множества полипептидов, которые вызывают ответ против одного и того же или разных антигенов ВПЧ.
[0493] Вариант осуществления 233. Композиция согласно варианту осуществления 232, где антиген в пуле множества антигенов не снижает иммунный ответ, направленный на другие антигены в пуле множества антигенов.
[0494] Вариант осуществления 234. Композиция согласно любому из вариантов осуществления 213-233, где антиген ВПЧ представляет собой полипептид, содержащий антигенный эпитоп ВПЧ и одну или более гетерологичных пептидных последовательностей.
[0495] Вариант осуществления 235. Композиция согласно любому из вариантов осуществления 213-234, где антиген ВПЧ образует комплекс с самим собой, с другими антигенами или с адъювантом.
[0496] Вариант осуществления 236. Композиция согласно вариантам осуществления 213-235, где антиген ВПЧ состоит из HLA-A2-рестриктированного эпитопа.
[0497] Вариант осуществления 237. Композиция согласно любому из вариантов осуществления 213-236, где модифицированная иммунная клетка содержит адъювант в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0498] Вариант осуществления 238. Композиция согласно любому из вариантов осуществления 213-237, где модифицированная иммунная клетка содержит антиген ВПЧ в концентрации от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0499] Вариант осуществления 239. Композиция согласно любому из вариантов осуществления 213-238, где соотношение антигена ВПЧ и адъюванта составляет от приблизительно 10000:1 до приблизительно 1:10000.
[0500] Вариант осуществления 240. Композиция согласно любому из вариантов осуществления 186-239, где антиген ВПЧ способен процессироваться в пептид, рестриктированный классом I MHC.
[0501] Вариант осуществления 241. Композиция согласно любому из вариантов осуществления 186-240, где антиген ВПЧ способен процессироваться в пептид, рестриктированный классом II MHC.
[0502] Вариант осуществления 242. Композиция согласно любому из вариантов осуществления 186-241, где модифицированная иммунная клетка дополнительно содержит агент, который повышает жизнеспособность и/или функцию модифицированной иммунной клетки по сравнению с соответствующей модифицированной иммунной клеткой, которая не содержат агента.
[0503] Вариант осуществления 243. Композиция согласно варианту осуществления 242, где агент представляет собой соединение, усиливающее эндоцитоз, стабилизирующий агент или кофактор.
[0504] Вариант осуществления 244. Композиция согласно варианту осуществления 242, где агент представляет собой альбумин.
[0505] Вариант осуществления 245. Композиция согласно варианту осуществления 244, где альбумин представляет собой мышиный, бычий или человеческий альбумин.
[0506] Вариант осуществления 246. Композиция согласно варианту осуществления 242, где агент представляет собой двухвалентный катион металла, глюкозу, АТФ, калий, глицерин, трегалозу, D-сахарозу, PEG1500, L-аргинин, L-глутамин или ЭДТА.
[0507] Вариант осуществления 247. Композиция согласно варианту осуществления 242, где агент включает MSA.
[0508] Вариант осуществления 248. Композиция согласно любому из вариантов осуществления 186-247, где клетки дополнительно модифицированы для повышения экспрессии одной или более костимулирующих молекул.
[0509] Вариант осуществления 249. Композиция согласно варианту осуществления 248, где костимулирующая молекула представляет собой B7-H2 (ICOSL), B7-1 (CD80), B7-2 (CD86), CD70, LIGHT, HVEM, CD40, 4- 1BBL, OX40L, TL1A, GITRL, CD30L, TIM4, SLAM, CD48, CD58, CD155 или CD112.
[0510] Вариант осуществления 250. Композиция согласно вариантам осуществления 248 или 249, где клетка содержит нуклеиновую кислоту, которая приводит к повышенной экспрессии одной или более костимулирующих молекул.
[0511] Вариант осуществления 251. Композиция согласно любому из вариантов осуществления 186-250, где иммунная клетка представляет собой Т-клетку, дендритную клетку, моноцит, макрофаг, миелоидную клетку, гранулоцит, нейтрофил, тучную клетку, естественную клетку-киллер, врожденную лимфоидную клетку, базофил или гемопоэтическую клетку-предшественник.
[0512] Вариант осуществления 252. Композиция согласно любому из вариантов осуществления 186-251, где иммунная клетка не является В-клеткой.
[0513] Вариант осуществления 253. Композиция согласно любому из вариантов осуществления 186-252, где иммунная клетка представляет собой Т-клетку.
[0514] Вариант осуществления 254. Композиция согласно варианту осуществления 253, где Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса I.
[0515] Вариант осуществления 255. Композиция согласно варианту осуществления 253, где Т-клетка содержит дополнительную модификацию для модуляции экспрессии молекул MHC класса II.
[0516] Вариант осуществления 256. Композиция согласно вариантам осуществления 254 или 255, где Т-клетка содержит дополнительную модификацию для уменьшения экспрессии молекул MHC класса I и/или молекул MHC класса II.
[0517] Вариант осуществления 257. Композиция согласно вариантам осуществления 254 или 255, где дополнительная модификация включает снижение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием siРНК, shРНК, CRISPR/Cas9, ZFN, TALEN, Cre-рекомбиназы или мегануклеазы.
[0518] Вариант осуществления 258. Композиция согласно вариантам осуществления 254 или 255, где Т-клетка содержит дополнительную модификацию для увеличения экспрессии молекул MHC класса I и/или молекул MHC класса II.
[0519] Вариант осуществления 259. Композиция согласно вариантам осуществления 254 или 255, где дополнительная модификация включает увеличение экспрессии молекул MHC класса I и/или молекул MHC класса II с использованием РНК или плазмидной ДНК.
[0520] Вариант осуществления 260. Композиция согласно любому из вариантов осуществления 253-257, где в аллогенном контексте врожденный иммунный ответ, развившийся у субъекта в ответ на введение дополнительно модифицированных Т-клеток, снижен, в аллогенном контексте, по сравнению с врожденным иммунным ответом, развившимся у субъекта в ответ на введение соответствующих модифицированных Т-клеток, которые не содержат дополнительную модификацию.
[0521] Вариант осуществления 261. Композиция согласно любому из вариантов осуществления 253-257, где период полужизни в кровотоке дополнительно модифицированных Т-клеток у субъекта, которому они были введены, модулируется по сравнению с периодом полужизни в кровотоке соответствующих модифицированных Т-клеток, которые не содержат дополнительной модификации, у субъекта, которому они были введены.
[0522] Вариант осуществления 262. Композиция согласно любому из вариантов осуществления 253-261, где Т-клетка включает одно или более из Т-хелперов, цитотоксических Т-клеток, Т-клеток памяти, клеток CIK и естественных Т-клеток-киллеров.
[0523] Вариант осуществления 263. Композиция согласно любому из вариантов осуществления 253-261, где Т-клетка включает одно или более из CD3+ Т-клеток, CD4+ Т-клеток, CD8+ Т-клеток, CD45RA+ Т-клеток, CD45RO+ Т-клеток и γδ-Т-клеток.
[0524] Вариант осуществления 264. Композиция согласно любому из вариантов осуществления 186-263, где модифицированная клетка является аллогенной для субъекта.
[0525] Вариант осуществления 265. Композиция согласно любому из вариантов осуществления 186-263, где модифицированная клетка является аутологичной для субъекта.
[0526] Вариант осуществления 266. Композиция согласно любому из вариантов осуществления 186-265, где субъект предварительно кондиционирован к модулированному воспалению и/или модулированному иммунному ответу.
[0527] Вариант осуществления 267. Композиция согласно любому из вариантов осуществления 186-266, где композиция дополнительно содержит ингибитор иммунных контрольных точек.
[0528] Вариант осуществления 268. Композиция согласно варианту осуществления 267, где ингибитор иммунных контрольных точек нацелен на одно или более из PD-1, PD-L1, CTLA-4, LAG3, TIM-3, TIGIT, VISTA, TIM1, B7-H4 (VTCN1) или BTLA.
[0529] Вариант осуществления 269. Композиция согласно любому из вариантов осуществления 186-268, где введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии цитотоксических Т-лимфоцитов (CTL), специфических для антигена ВПЧ.
[0530] Вариант осуществления 270. Композиция согласно любому из вариантов осуществления 186-268, где введение композиции, содержащей модифицированные иммунные клетки, субъекту приводит к активации и/или экспансии Т(Th)-хелперов, специфических для антигена.
[0531] Вариант осуществления 271. Композиция согласно любому из вариантов осуществления 186-270, где эффективное количество композиции включает от приблизительно 1×106 до приблизительно 1×1012 модифицированных иммунных клеток.
[0532] Вариант осуществления 272. Композиция, содержащая антиген, где антиген содержит аминокислотную последовательность с по меньшей мере 90% сходством с SEQ ID NO: 23.
[0533] Вариант осуществления 273. Композиция согласно варианту осуществления 272, где антиген содержит аминокислотную последовательность SEQ ID NO: 23.
[0534] Вариант осуществления 274. Способ лечения или профилактики заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, при этом адъювант присутствует внутриклеточно;
где модифицированные иммунные клетки получают:
а) пропусканием клеточной суспензии, содержащей входную клетку, содержащую антиген ВПЧ, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген и адъювант прошли через них, с образованием пертурбированной входной клетки; и
b) инкубацией пертурбированной входной клетки с адъювантом в течение достаточного периода времени для обеспечения проникновения адъюванта в пертурбированную входную клетку;
с получением, тем самым, модифицированных иммунных клеток.
[0535] Вариант осуществления 275. Способ лечения или профилактики заболевания, ассоциированного с ВПЧ, у субъекта, где способ включает введение субъекту эффективного количества композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, где адъювант присутствует внутриклеточно;
где модифицированные иммунные клетки получают:
а) пропусканием клеточной суспензии, содержащей входную клетку, содержащую адъювант, через деформирующее клетку сужение, где диаметр сужения является функцией диаметра входной клетки в суспензии, тем самым вызывая пертурбации входной клетки, достаточно большие для того, чтобы антиген ВПЧ прошел через них, с образованием пертурбированной входной клетки; и
b) инкубацией пертурбированной входной клетки с антигеном ВПЧ в течение достаточного периода времени для обеспечения проникновения антигена ВПЧ в пертурбированную входную клетку;
с получением, тем самым, модифицированных иммунных клеток.
[0536] Вариант 276. Способ согласно вариантам осуществления 274 или 275, где диаметр сужения меньше диаметра клетки.
[0537] Вариант осуществления 277. Способ согласно любому из вариантов осуществления 274-276, где диаметр сужения составляет от приблизительно 20% до 99% от диаметра клетки.
[0538] Вариант осуществления 278. Способ согласно любому из вариантов осуществления 274-277, где диаметр сужения составляет от приблизительно 20% до менее, чем приблизительно 60% от диаметра клетки.
[0539] Вариант осуществления 279. Способ согласно любому из вариантов осуществления 274-278, где сужение находится в канале.
[0540] Вариант осуществления 280. Способ согласно любому из вариантов осуществления 274-279, где к входной клетке прикладывается деформирующая сила, когда она проходит через сужение.
[0541] Вариант осуществления 281. Способ согласно любому из вариантов осуществления 274-280, где антиген ВПЧ и/или адъювант находятся в цитозоле и/или эндосомах.
[0542] Вариант осуществления 282. Способ согласно любому из вариантов осуществления 274-281, где антиген и/или адъювант находятся во многих компартментах клетки.
[0543] Вариант осуществления 283. Способ согласно варианту осуществления 274, где концентрация адъюванта, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0544] Вариант осуществления 284. Способ согласно варианту осуществления 275, где концентрация антигена ВПЧ, инкубированного с пертурбированной входной клеткой, составляет от приблизительно 0,1 мкМ до приблизительно 1 мМ.
[0545] Вариант осуществления 285. Способ согласно любому из вариантов осуществления 274-285, где адъювант представляет собой CpG ODN, IFN-α, агонисты STING, агонисты RIG-I или поли I:C.
[0546] Вариант осуществления 286. Способ согласно варианту осуществления 285, где адъювант представляет собой CpG ODN.
[0547] Вариант осуществления 287. Способ согласно варианту осуществления 286, где CpG ODN представляет собой CpG ODN 1018, CpG ODN 1826 или CpG ODN 2006.
[0548] Вариант осуществления 288. Способ согласно любому из вариантов осуществления 274-287, где антиген ВПЧ происходит из клеточного лизата.
[549] Вариант осуществления 289. Способ согласно любому из вариантов осуществления 274-288, где антиген ВПЧ представляет собой антиген ВПЧ-16 или ВПЧ-18.
[0550] Вариант осуществления 290. Способ согласно любому из вариантов осуществления 274-289, где антиген ВПЧ представляет собой антиген ВПЧ E6 или антиген ВПЧ E7.
[0551] Вариант осуществления 291. Способ согласно варианту осуществления 290, где антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-25.
[0552] Вариант осуществления 292. Способ согласно варианту осуществления 289, где антиген ВПЧ содержит аминокислотную последовательность из любой из SEQ ID NO: 18-25.
[0553] Вариант осуществления изобретения 293. Способ согласно варианту осуществления изобретения 290, где антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% сходством с SEQ ID NO: 23.
[0554] Вариант осуществления 294. Способ согласно варианту осуществления 290, где антиген ВПЧ содержит аминокислотную последовательность SEQ ID NO: 23.
[0555] Вариант осуществления 295. Способ лечения или профилактики заболевания, ассоциированного с ВПЧ, у субъекта, включающий введение субъекту модифицированной иммунной клетки, ассоциированной с антигеном ВПЧ, где модифицированная иммунная клетка получена способом, включающим стадии:
а) инкубация входной клетки с антигеном ВПЧ и/или адъювантом в течение достаточного периода времени для обеспечения связывания антигена ВПЧ с входной клеткой;
тем самым получая модифицированную иммунную клетку, ассоциированную с антигеном.
[0556] Вариант осуществления 296. Способ согласно варианту осуществления 295, где антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% сходством с любой из SEQ ID NO: 18-25.
[0557] Вариант осуществления 297. Способ согласно варианту осуществления 296, где антиген ВПЧ содержит аминокислотную последовательность SEQ ID NO: 23.
[0558] Вариант осуществления 298. Способ согласно любому из вариантов осуществления 295-297, где адъювант представляет собой CpG ODN.
[0559] Вариант осуществления 299. Способ согласно варианту осуществления 298, где CpG ODN представляет собой CpG ODN 1018, CpG ODN 1826 или CpG ODN 2006.
[0560] Вариант осуществления 300. Композиция, содержащая модифицированные иммунные клетки согласно любому из вариантов осуществления 186-273, для применения в качестве лекарственного средства.
[0561] Вариант осуществления 301. Композиция, содержащая модифицированные иммунные клетки согласно любому из вариантов осуществления 186-273, для применения в способе лечения организма человека или животного хирургическим путем, терапией или диагностикой.
[0562] Вариант осуществления 302. Композиция, содержащая модифицированные иммунные клетки согласно любому из вариантов осуществления 186-273, для применения в лечении рака, инфекционного заболевания или заболевания, ассоциированного с вирусом.
[0563] Вариант осуществления 303. Композиция, содержащая модифицированные иммунные клетки согласно любому из вариантов осуществления 186-273, где рак представляет собой опухоли головы и шеи, рак шейки матки, рак вульвы, рак влагалища, рак полового члена, рак анального канала, рак перианальной области, аногенитальный рак, рак ротовой полости или рак слюнной железы.
[0564] Вариант осуществления 304. Композиция, содержащая модифицированные иммунные клетки согласно любому из вариантов осуществления 300-303, где модифицированные PBMC вводят до, одновременно или после введения ингибитора иммунных контрольных точек.
[0565] Вариант осуществления 305. Композиция согласно варианту осуществления 304, где ингибитор иммунных контрольных точек нацелен на любое из PD-1, PD-L1, CTLA-4, LAG3, VISTA и TIM-3.
[0566] Вариант осуществления 306. Композиция согласно варианту осуществления 305, где ингибитор иммунных контрольных точек нацелен на PD-1.
[0567] Вариант осуществления 307. Композиция согласно варианту осуществления 305, где ингибитор иммунных контрольных точек нацелен на PD-L1.
[0568] Вариант осуществления 308. Композиция согласно любому из вариантов осуществления 300-307, где модифицированные PBMC вводят до, одновременно или после введения терапевтического агента.
[0569] Вариант осуществления 309. Композиция согласно варианту осуществления 308, где терапевтический агент представляет собой химиотерапевтический препарат.
[0570] Вариант осуществления изобретения 310. Композиция согласно варианту осуществления 309, где инфекционное заболевание ассоциировано с ВИЧ, HPV, EBV, MCV, HBV или HCV.
Примеры
[0571] Специалисты в данной области техники понимают, что несколько вариантов осуществления возможны в пределах объема и сущности этого изобретения. Далее изобретение будет описано более подробно со ссылкой на следующие неограничивающие примеры. Следующие приведенные ниже примеры дополнительно иллюстрируют изобретение, но, конечно, они не должны рассматриваться как ограничивающие его объем.
Пример 1
[0572] Для определения минимальной эффективной клеточной дозы TAPC, необходимой для ингибирования роста опухолей в терапевтическом опыте, тестировали четыре различных дозы TAPC по схеме прайм/буст на опухолевой модели TC1, где строили график зависимости площади опухолей от времени.
[0573] Самкам мышей C57BL/6J в заднюю область правого бока вводили опухолевые клетки TC1 (50 тыс. клеток/мышь) на сутки 0. На сутки 4 (прайм) и 7 (буст), выделяли Т-клетки от самок мышей-доноров C57BL/6J и с использованием устройства SQZ нагружали 200 мкг/мл CpG ODN 1826 и предварительно приготовленным комплексом 40 мкМ E7 SLP (GQAEPDRAHYNIVTFSSKSDSTLRLSVQSTHVDIR; SEQ ID NO: 25) + 40 мкМ сывороточного альбумина мыши (MSA). Животным (10 мышей/группу) внутривенно вводили соответствующую дозу Т-клеток, нагруженных E7 + MSA + CpG (50 тыс. клеток/мл), и рост опухолей TC-1 измеряли, начиная через 1 неделю после имплантации опухолей, два раза в неделю и сравнивали с ростом опухолей у необработанных мышей. Репрезентативная схема по группам обработки и схема опыта приведены на фиг. 1А.
[0574] Результаты оценки роста опухолей, измеренного по формуле ((длина× ширина2)/2), сравнивали с ростом опухолей у мышей из необработанной группы (без адоптивного переноса Т-клеток), и из групп обработки B-E, показанных на фиг. 1В, представлены на фиг. 1A. Все опытные условия обработки приводили к полному уменьшению опухолей, что свидетельствует о том, что в самой низкой испытанной дозе клеток (2,5 тыс. клеток на стадии прайм, 1 тыс. клеток на стадии буст) можно было достичь аналогичного уменьшения опухолей, что и с более высокими дозами клеток, где с каждой дозой достигалась статистическая значимость по сравнению с необработанными контрольными мышами на сутки 18 (#P <0,0001).
Пример 2
[0575] Для определения в конструировании E7 SLP, два разных E7 SLP, нативный E7 SLP и один, в нативной последовательности которой все цистеины заменяли серином, обрабатывались SQZ’d с получением T APC вместе с совместным введением CpG, и каждое условие опыта оценивали на продукцию IFN-γ с использованием ICS.
[0576] Выделяли Т-клетки от самок мышей-доноров C57BL/6J и нагружали с использованием устройства SQZ различными дозами (слева - 200 мкг/мл, справа - 25 мкг/мл) CpG ODN 1826 и предварительно приготовленным комплексом 40 мкМ нативного E7 или классического SLP + 40 мкМ сывороточного альбумина мыши (MSA), или Т-клетки инкубировали в тех же условиях в отсутствии обработки SQZ и использовали в качестве отрицательного контроля (Endo - группы B и D). Животным (5 мышей/группу) внутривенно вводили 5 тыс. нагруженных или инкубированных Т-клеток в объеме 100 мкл (50 тыс. клеток/мл). На сутки 8 отбирали селезенки и количественно определяли процент CD8+ Т-клеток, продуцирующих IFN-γ, с использованием ICS. Репрезентативная схема по группам обработки и схема опыта приведены на фиг. 2A.
[0577] Процент CD8+ Т-клеток, продуцирующих IFN-γ, был самым высоким в контрольной группе Endo с использованием cE7, что достоверно не отличалось от SQZ с cE7 или Endo с nE7. Неожиданно отсутствовали преимущества SQZ по сравнению с Endo, но наблюдали заметное снижение % CD8+ Т-клеток, продуцирующих IFN-γ, с SQZ nE7 по сравнению со всеми другими вариантами опыта. Полученные данные показывают, что последовательность SLP оказывает влияние на % CD8+ Т-клеток, продуцирующих IFN-γ, генерируемых в ответ на вакцинацию Т APC, особенно когда антиген нагружали в Т-клетку с использованием устройства SQZ.
Пример 3
[0578] Для определения способности E6 SLP индуцировать антигенспецифический иммунный ответ в Т-клетках E6 респондерах на человеческой модели in vitro, первичные человеческие Т-клетки нагружали E6 SLP, и измеряли секрецию IFN-γ клетками-респондерами с помощью ELISA.
[0579] Человеческие Т-клетки выделяли из PBMC HLA-A02+ доноров (10 тыс. клеток/мл), и 50 мкМ E6 SLP, содержащего HLA-A02-рестриктированный минимальный эпитоп E629-38 (LPQLSTELQTTIHDIILECVYSKQQQLLRREVYDFAF; SEQ ID NO: 18) доставляли внутриклеточно с помощью устройства SQZ, и уровень IFN-γ, измеренный с помощью ELISA, сравнивали между опытными условиями с SQZ и контролем, где E6 SLP инкубировали с TAPC в отсутствии обработки SQZing (Endo). Затем TAPC совместно культивировали с E6-специфическими CD8+ клетками-респондерами в соотношении стимулятор:эффектор 1:1 и культивировали в присутствии IL-2 (100 Е/мл). Через 18 ч супернатант собирали из каждого опытного условия и уровень продукции IFN-γ оценивали с помощью ELISA IFN-γ (Biolegend).
[0580] Тестированный E6 SLP при внутриклеточной доставке с использованием устройства SQZ приводил к > 10-кратному увеличению продукции IFN-γ при совместном культивировании с CD8+ T-клетками-респондерами E6 (#P <0,0001), как показано на фиг. 3. Полученные данные показывают способность Т APC индуцировать антигенспецифический иммунный ответ на несколько антигенов ВПЧ (E6 и E7).
Пример 4
[0581] Для определения способности E7 SLP индуцировать антигенспецифический иммунный ответ в Т-клетках E711-20 респондерах, а также влияния последовательности SLP на активацию SQZ APC Т-клеток (Tapc) на человеческой модели in vitro, первичные человеческие Т-клетки от нескольких доноров нагружали разными E7 SLP, и измеряли секрецию IFN-γ клетками-респондерами с помощью ELISA.
[0582] Человеческие Т-клетки выделяли из PBMC HLA-A02+доноров (10 тыс. клеток/мл), и 50 мкМ OL-E71-35 (MHGDTPTLHEYMLDLQPETTDLYCYEQLNDSSEEE; SEQ ID NO: 22) или E7.6 (QLCTELQTYMLDLQQPET:QLCTELQTYMLDLQQPET; 23) SLP доставляли внутриклеточно с помощью устройства SQZ, и уровень IFN-γ, измеренный с помощью ELISA, сравнивали между условиями с SQZ и контролем, где E7 SLP инкубировали с Tapc в отсутствии обработки SQZing (Endo). Затем TAPC совместно культивировали с E711-20-специфическими CD8+ клетками-респондерами в соотношении стимулятор:эффектор 4:1 и культивировали в присутствии IL-2 (100 Е/мл). Через 24 ч супернатант собирали из каждого опытного условия и оценивали уровень продукции IFN-γ с помощью ELISA IFN-γ (Biolegend).
[0583] Нативный OL-E71-35 SLP вызывал минимальную ответную выработку IFN-γ при доставке с использованием SQZ по сравнению с Endo (фиг. 4). Однако E7.6, который содержит минимальный эпитоп E7 (YMLDLQPETT; SEQ ID NO: 3), вставленный между фланкирующими областями другого реактивного SLP (E621-45 - QLCTELQTXXXXXXXXXXYCKQQLL), индуцировал более высокую ответную выработку IFN-γ по сравнению с сопоставимым контролем Endo для всех трех тестированных доноров по сравнению с контролями Endo (*P <0,05, **P <0,01; #P <0,0001). Полученные результаты подчеркивают значение последовательности фланкирующей области для иммуногенности SLP и обеспечивают поддержку того, что фланкирующие области других SLP, о которых известно, что они являются реактивными, можно использовать в сочетании с ортогональными минимальными эпитопами для достижения повышенных иммунных ответов.
Пример 5
[0584] Для определения дозы антигена для SQZ Т-клеток APC на человеческой модели in vitro, первичные Т-клетки человека нагружали E7 SLP в различных дозах и оценивали на IFN-γ с помощью ELISA.
[0585] Человеческие Т-клетки выделяли из PBMC HLA-A02+ доноров (10 тыс. клеток/мл), и различные дозы (50 и 100 мкМ) E7 SLP (QLCTELQTYMLDLQPETTYCKQQLL; SEQ ID NO: 23) доставляли внутриклеточно с помощью устройства SQZ, и уровень IFN-γ, измеренный с помощью ELISA, сравнивали между опытными условиями с SQZ и контролем, где E7 SLP инкубировали с T APC в отсутствии SQZing (Endo). Затем Т APC совместно культивировали с E711-20-специфичными CD8+ клетками-респондерами в соотношении стимулятор:эффектор 4:1 и культивировали в присутствии IL-2 (100 Е/мл). Через 24 ч супернатант собирали из каждого опытного условия и оценивали уровень продукции IFN-γ с помощью ELISA IFN-γ (Biolegend). Кроме того, использовали активированный пептидом положительный контроль, где клетки B-LCL инкубировали в присутствии минимального эпитопа E7 (YMLDLQPETT; SEQ ID NO: 3) в течение 1 ч перед постановкой ELISA.
[0586] Для трех тестированных доноров последовательное увеличение продуцированного IFN-γ имело место во всех опытных условиях с SQZ по сравнению с сопоставимым контролем (Endo), где SLP инкубировали с Т-клеткой в отсутствии SQZ (фиг. 5). Доноры 1 и 3 демонстрировали статистически значимое увеличение при использовании 50 мкМ E7 SLP (8668 - *P <0,05; 8299 - #P <0,0001) и тенденцию к достижению статистической значимости при более высоком уровне 100 мкМ E7 SLP. Несмотря на то, что отсутствовала статистически значимая разница между дозами 50 и 100 мкМ для любого донора, ответная выработка IFN-γ на 50 мкМ E7 SLP была неизменно равной или более высокой.
Пример 6
[0587] Для определения варибельности доноров для SQZ T-клеток APC на человеческой модели in vitro, а также определения оптимальных комбинаций и доз E6 и E7 SLP, которые индуцируют достоверный иммунный ответ против E7, первичные Т-клетки человека от нескольких HLA-A02+ доноров нагружали E6 и E7 SLP и оценивали на продукцию IFN-γ с помощью ELISA.
[0588] Человеческие Т-клетки выделяли из PBMC HLA-A02+ доноров (10 тыс. клеток/мл), и 25 или 50 мкМ E6 SLP (QLCTELQTTIHDIILECVYCKQQLL) и E7.6 SLP (QLCTELQTYMLDLQPETTYCKQQLL); SEQ ID NO: 23 доставляли внутриклеточно с использованием устройства SQZ, и уровни IFN-γ, измеренные с помощью ELISA, сравнивали между опытными условиями с SQZ и контролем, где SLP инкубировали с TAPC в отсутствии SQZing (Endo). Применяли активированный пептидом положительный контроль, где клетки B-LCL инкубировали в присутствии минимального эпитопа E7 (YMLDLQPETT; SEQ ID NO: 3) одновременно с генерацией TAPC. Затем TAPC и положительный контроль совместно культивировали с E711-20-специфическими CD8+ клетками-респондерами в соотношении стимулятор:эффектор 4:1 и культивировали в присутствии IL-2 (100 Е/мл). Через 24 ч супернатант собирали из каждого опытного условия и оценивали уровень продукции IFN-γ с помощью ELISA IFN-γ (Biolegend).
[0589] Пять из семи доноров демонстрировали последовательное увеличение продукции IFN-γ при обработке SQZ E6+E7 SLP по сравнению с сопоставимым контролем (Endo), где SLP инкубировали с Т-клеткой в отсутствии SQZ (доноры 1-3, 5-6: *P <0,05, **P <0,01, ***P <0,005), как показано на фиг. 6. Из двух доноров, у которых не было статистически значимого увеличения при обработке SQZ'd T APC относительно контроля Endo, у обоих доноров (доноры 4 и 7) имела место ситуация, при которой наблюдали детектируемое увеличение с одной дозой тестированных SQZ'd T APC (донор 4 - 50 мкМ, донор 7 - 25 мкМ), имеющая тенденцию к достижению статистической значимости. В совокупности полученные данные показывают, что, хотя разные донорные Т APC обладают разной иммуностимулирующей активностью, очевидно, что последовательное увеличение продукции IFN-γ у нескольких доноров и что E7-специфический иммунный ответ все еще является достоверным в сочетании с несколькими антигенами/SLP, в данном случае антигеном Е6, специфическим для ВПЧ.
Пример 7
[0590] Для определения адъюванта, который приводит к наиболее сильному иммунному ответу, исследовали влияние двух адъювантов, которые функционируют на разных путях, на способность Т АРС индуцировать антигенспецифический ответ in vivo. Данный эффект количественно оценивали с помощью окрашивания на тетрамер и ICS с использованием проточной цитометрии.
[0591] Выделяли Т-клетки от самок мышей-доноров C57BL/6J и нагружали с использованием устройства SQZ 400 мкг/мл Ova + различными концентрациями высокомолекулярной и низкомолекулярной поли I:C (10, 30, 100, 300, 1000 мкг/мл) и сравнивали с Т-клетками, инкубированными в тех же условиях в отсутствии обработки SQZ в качестве отрицательного контроля (Endo - группы C и E). Т-клетки SQZ’d с Ova + 200 мкг/мл CpG использовали в качестве положительного контроля (группа F). На сутки 0 мышам (5 мышей/группу, 3 необработанных) вводили 5 тыс. нагруженных или инкубированных Т-клеток в объеме 100 мкл (50 тыс. клеток/мл). На сутки 7 отбирали селезенки и определяли количественно Ova-специфические Т-клетки окрашиванием на тетрамер с использованием проточной цитометрии, также некоторые спленоциты пермеабилизовали и фиксировали в течение ночи. На следующий сутки (сутки 8) определяли уровни IFN-γ с помощью ICS, где PMA/иономицин использовали в качестве положительного контроля. Репрезентативная схема по группам обработки и схема опыта приведены на фиг. 7A.
[0592] % CD8+ Т-клеток, продуцирующих тетрамер или IFN-γ, был самым высоким в группе с адъювантом CpG, тогда как все условия с адъювантом высокомолекулярной и низкомолекулярной поли I:C не увеличивали процент Ova-специфических или IFN-γ-продуцирующих CD8+ Т-клеток по сравнению с необработанным контролем (фиг. 7B). Поскольку поли I:C является агонистом TLR3, и CpG является агонистом TLR9, то полученные данные подтверждают преимущество CpG над поли I:C при использовании в качестве адъюванта в вакцинации T APC, одновременно предполагая, что активация TLR3 может быть неблагоприятной в таких условиях.
Пример 8
[0593] Для определения концентрации адъюванта CpG, которая приводит к наиболее сильному иммунному ответу, тестировали влияние нескольких доз CpG на способность T APC индуцировать антигенспецифический ответ in vivo. Данный эффект количественно оценивали с помощью окрашивания на тетрамер и ICS с использованием проточной цитометрии.
[0594] Т-клетки выделяли от самок мышей-доноров C57BL/6J и нагружали с использованием устройства SQZ 400 мкг/мл Ova + различными концентрациями CpG 1826 (50, 100, 200 мкг/мл) и сравнивали с Т-клетками, инкубированными в тех же условиях в отсутствии SQZ в качестве отрицательного контроля (Endo - группы B, D и F). На сутки 0 мышам (5 мышей/группу, 3 необработанных) вводили 5 тыс. нагруженных или инкубированных Т-клеток в объеме 100 мкл (50 тыс. клеток/мл). На сутки 7 отбирали селезенки и определяли количественно Ova-специфические Т-клетки окрашиванием на тетрамер с использованием проточной цитометрии, также некоторые спленоциты пермеабилизовали и фиксировали в течение ночи. На следующие сутки (сутки 8) определяли уровни IFN-γ с помощью ICS, где PMA/иономицин использовали в качестве положительного контроля. Репрезентативная схема по группам обработки и схема опыта приведены на фиг. 8A.
[0595] % CD8+ Т-клеток, продуцирующих тетрамер или IFN-γ, был самым высоким в группе с 200 мкг/мл CpG и достоверно отличался от соответствующего контроля Endo (*P <0,05 для тетрамера, #P <0,0001 для IFN-γ), для пептида класса I/MHC-I, в то время как во всех других опытных условиях отсутствовала индукция достоверного ответа по сравнению с необработанным контролем или их соответствующим контролем Endo (фиг. 8B). Активацию Ova-специфических Т-клеток наблюдали только с пептидом I класса, что поддерживает представление о прямой презентации антигенов Ova для осуществления ответа CD8+ Т-клеток.
Пример 9
[0596] Для оценки схемы введения адъюванта CpG, которая приводит к сильному иммунному ответу, исследовали влияние нескольких схем введения CpG на способность T APC индуцировать антигенспецифический ответ in vivo. Данный эффект количественно оценивали с помощью окрашивания на тетрамер и ICS с использованием проточной цитометрии.
[0597] Т-клетки выделяли от самок мышей-доноров C57BL/6J и нагружали с использованием SQZ 400 мкг/мл Ova, и мышам (5 мышей/ группу, 3 необработанных) вводили 5 тыс. нагруженных или инкубированных Т-клеток в объеме 100 мкл (50 тыс. клеток/мл). Системное совместное введение CpG 1826 (25 мкг/мл) мышам-донорам проводили в то же время, что и праймирование T APC (сутки 0) или через 1 или 2 суток после праймирования (сутки 1 или 2 соответственно) и сравнивали с T-клетками, инкубированными в тех же условиях в отсутствии SQZ, которые использовали в качестве отрицательного контроля (группы B, D и F). Т-клетки, подвергшиеся обработке SQZ’d с (Ova + 200 мкг/мл CpG) использовали в качестве положительного контроля (группа H). На сутки 7 отбирали селезенки и определяли количественно Ova-специфические Т-клетки окрашиванием на тетрамер с использованием проточной цитометрии, также некоторые спленоциты пермеабилизовали и фиксировали в течение ночи. На следующие сутки (сутки 8) определяли уровни IFN-γ с помощью ICS, где PMA/иономицин использовали в качестве положительного контроля. Репрезентативная схема по группам обработки и схема опыта приведены на фиг. 9A.
[0598] % тетрамер- или IFN-γ-продуцирующих CD8+ Т-клеток был самым высоким в группе, где Ova и CpG совместно доставляли в T APC, в то время как совместное введение в тот же день, когда проводили праймирование (группа B), было единственным совместным введением в группе с CpG, когда имел место некоторый уровень специфической активации для Ova, имеющий тенденцию к статистической значимости (фиг. 9B). Однако полученные данные подтверждают наблюдение о том, что совместная доставка антигена + CpG может привести к наиболее высокой активации Ova-специфических CD8+ Т-клеток, в то время как отсрочка системного введения CpG приводит к более низким ответам по сравнению с одновременным праймированием и совместным введением адъюванта.
Пример 10
[0599] Для определения комбинации внутриклеточного и системного введения адъюванта для проявления противоопухолевой активности T APC, в сравнительном аспекте оценивали несколько способов введения CpG в сравнении с IFN-γ в сочетании с E7-специфическими T APC по изобретению у мышей в опыте по оценке профилактического эффекта на опухолевой модели TC-1. Антигенспецифические Т-клеточные ответы измеряли окрашиванием на тетрамер и использованием проточной цитометрией, в то время как противоопухолевый эффект измеряли по предупреждению роста опухолей.
[0600] На сутки -14 (прайм) и -7 (буст) выделяли Т-клетки от самок мышей-доноров C57BL/6J и нагружали с использованием устройства SQZ предварительно приготовленным комплексом 40 мкМ SLP E7 (GQAEPDRAHYNIVTFSSKSDSTLRLSVQSTHVDIR; SEQ ID NO: 25) + 40 мкМ сывороточного альбумина мыши (MSA) (группы B и C) или E7 SLP + MSA + 200 мкг/мл CpG ODN 1826 (группы D, E и F). Самкам мышей-реципиентов C57BL/6J (10 мышей/группу) внутривенно вводили 100 мкл нагруженных Т-клеток (5 тыс. клеток/животное), в то время как животные групп B и E также получали внутривенно CpG (25 мкг), и мыши из групп C и F получали внутривенно IFN-γ (10 тыс. МЕ). На сутки -8 и -3 у мышей отбирали 100 мкл крови и количественно определяли % E7-специфических CD8+ Т-клеток окрашиванием на тетрамер и проточной цитометрией. На сутки 0 мышам-реципиентам прививали в заднюю область правого бока опухолевые клетки TC1 (100 тыс. клеток/мышь), и измеряли рост опухолей TC-1 два раза в неделю, начиная с суток 11, и сравнивали с ростом опухолей у необработанных мышей. Репрезентативная схема по группам обработки и схема опыта приведены на фиг. 10А.
[0601] Процент E7-специфических Т-клеток измеряли у мышей окрашиванием на тетрамер E7 после введения прайм-дозы (сутки -8) и буст-дозы (сутки -3) E7 + MSA или E7 + MSA + CpG SQZ'd T-клеток +/- одновременное введение CpG или IFN-γ (фиг. 10B). Наиболее высокую относительную долю E7-специфических Т-клеток отмечали в группах с совместным введением SQZ E7 + CpG и SQZ (E7 + CpG) + IFN-γ. Относительное количество E7-специфических CD8+ T-клеток после введения прайм-дозы было неожиданно ниже при совместном введении SQZ (E7 + CpG) + CpG по сравнению с совместным введением SQZ E7 + CpG (*P <0,05), тогда как совместное введение IFN-γ с SQZ (E7 + CpG) T-клетками приводило к достоверно большему количеству E7-специфических T-клеток, чем совместное введение CpG с SQZ (E7 + CpG) T-клетками (* P <0,05). После введения буст-дозы (сутки -3) наблюдали аналогичную тенденцию, когда в группах с совместным введением SQZ E7 + CpG и группах с совместным введением SQZ (E7 + CpG) + IFN-γ имел место наиболее высокий % E7-специфических Т-клеток. Однако самый высокий ответ получали в группе с совместным введением SQZ (E7 + CpG) + IFN-γ, что было достоверно выше, чем при совместном введении SQZ E7 + IFN-γ и одновременном введении SQZ (E7 + CpG) + CpG, показывая, что совместное введение IFN-γ приводит к более высокому проценту антигенспецифических Т-клеток при использовании в сочетании с SQZ (E7 + CpG) T-клетками. Результаты оценки роста опухолей, измеренного по формуле ((длина × ширина2)/2), сравнивали с мышами из необработанной группы (без адоптивного переноса Т-клеток) и из обработанных групп B-F, и они приведены на фиг. 10C. Наиболее высокое снижение роста опухолей и повышение выживаемости в группе с совместным введением SQZ (E7 + CpG) + IFN-γ хорошо согласуется с окрашиванием на тетрамер, показывая, что наиболее высокая индукция E7-специфических Т-клеток приводит к наиболее высокой противоопухолевой активности. Интересно отметить, что, несмотря на низкий % E7-специфических Т-клеток в группе SQZ (E7 + CpG), такая обработка также обеспечивала очень высокий уровень противоопухолевой активности, и это была единственная другая группа (в дополнение к SQZ (E7 + CpG) + совместное введение IFN-γ), в которой увеличивалась выживаемость всех мышей в период последних 60 суток. Несмотря, что это было несколько ниже, чем в ранее указанных группах D и F, в группах C и E наблюдали заметное повышение выживаемости и ингибирование роста опухолей. На сутки 78 7 мышам без опухолей из группы D повторно прививали 50 тыс. клеток в противоположный бок (слева) и сравнивали с необработанными животными соответствующего возраста (10 мышей) (фиг. 10D). У мышей из группы D после повторной прививки наблюдали достоверное снижение роста опухолей по сравнению с необработанными мышами, получившими первую прививку (*** P <0,005), подтверждая, что данный противоопухолевый эффект сохраняется в течение последних 2 месяцев.
Пример 11
[0602] Для определения эффекта комбинирования нескольких антигенов ВПЧ в проявлении противоопухолевой активности T APC, синтетические длинные пептиды E6 и E7 (SLP) по отдельности и в комбинации с E7-специфическими T APC по изобретению оценивали на профилактический эффект на мышиной опухолевой модели TC-1. Е7-специфические Т-клеточные ответы измеряли окрашиванием на тетрамер и проточной цитометрией, тогда как противоопухолевый эффект измеряли по предупреждению роста опухолей.
[0603] На сутки -14 (прайм) и -8 (буст) выделяли Т-клетки от самок мышей-доноров C57BL/6J и нагружали с использованием устройства SQZ предварительно приготовленным комплексом 20 мкМ мышиного сывороточного альбумина (MSA) + 20 мкМ E6 (VYSKQQLLRREVYDFAFRDLSIVYRDGNPYAVSDK; SEQ ID NO: 21) и/или E7 SLP (GQAEPDRAHYNIVTFSSKSDSTLRLSVQSTHVDIR; SEQ ID NO: 25) или комбинацией обоих +/- 200 мкг/мл CpG ODN 1826 в соответствии с таблицей XX. Т-клетки, инкубированные в аналогичных условиях, что и группа B, в отсутствии SQZ, использовали в качестве отрицательного контроля (группа C). Самкам мышей-реципиентов C57BL/6J (5-10 мышей/группу) внутривенно вводили 100 мкл нагруженных Т-клеток (5 тыс. клеток/животное). На сутки -3 у мышей отбирали 100 мкл крови и количественно определяли % E7-специфических CD8+ Т-клеток с использованием окрашивания на тетрамер и проточной цитометрии. На сутки 0 мышам-реципиентам прививали в заднюю область правого бока опухолевые клетки TC1 (100 тыс. клеток/мышь), и рост опухолей TC-1 измеряли два раза в неделю, начиная с суток 11, и сравнивали с ростом опухолей у необработанных мышей. Репрезентативная схема по группам обработки и схема опыта приведены на фиг. 11A.
[0604] Процент E7-специфических Т-клеток измеряли у мышей по окрашиванию на тетрамер E7 после введения буст-дозы (сутки -3), где наиболее высокий эффект наблюдали с CpG + E7 SQZ T APC (группа B), как показано на фиг. 11B. Интересно отметить, что ответы в группе B были достоверно выше, чем ответные реакции в вариантах опыта без обработки и с комбинацией E7 и E6 (группа F - #P <0,0001), свидетельствуя о том, что добавление E6 SLP «притупляет» E7-специфический ответ. Группа B достоверно отличалась от других групп обработки, за исключением контрольной группы Endo (группа C), когда результаты по группе B были заметно выше и имели тенденцию к статистической значимости. Как показано на фиг. 11C, рост опухолей, измеренный по формуле ((длина × ширина2)/2), сравнивали с мышами из необработанной группы (без адоптивного переноса Т-клеток) и с группами обработки B-G, представленной на фиг. 11А. Предупреждение интенсивного роста опухолей имело место в группах с Т-клетками SQZ’d с E7 + CpG, а также с Т-клетками, которые инкубировали в присутствии E7 + CpG в отсутствии SQZ. В группах D-F имел место некоторый уровень ингибирования роста опухолей по сравнению с необработанными (группа A) и E6 + CpG SQZ’d Т-клетками (группа G), но во всех была меньшая эффективность, чем в группах B и C.
Пример 12
[0605] Для определения значения пути введения адъюванта CpG для проявления противоопухолевой активности E7-специфических Т APC, доставляли SLP E7 в Т-клетки в комбинации с CpG или только доставляли в Т-клетки, или совместно вводили системно животному-реципиенту, и противоопухолевый эффект оценивали по ингибированию роста опухоли.
[0606] На сутки 0 мышам-реципиентам вводили в заднюю область правого бока опухолевые клетки TC1 (50 тыс. клеток/мышь). На сутки 10 (прайм) и 20 (буст) выделяли Т-клетки от самок мышей-доноров C57BL/6J и нагружали с использованием SQZ предварительно приготовленным комплексом 20 мкМ мышиного сывороточного альбумина (MSA) + 20 мкМ E7 (GQAEPDRAHYNIVTFSSKSDSTLRLSVQSTHVDIR; SEQ ID NO: 25), и ODN 1826 совместно доставляли (группа D) с помощью SQZ в дозе 200 мкг/мл или совместно вводили животным системно в дозе 25 мкг/мышь (группа C), и сравнивали с необработанным контролем (группа A) и с системным введением только CpG (группа B). Мышей-реципиентов (8-10 мышей/группу) обрабатывали 100 мкл нагруженных Т-клеток (5 тыс. клеток/животное). Рост опухолей ТС-1 измеряли два раза в неделю, начиная с суток 10. Репрезентативная схема по группам обработки и схема опыта приведены на фиг. 12А.
[0607] На модели ВПЧ-ассоциированной опухоли (TC-1), используемой для оценки терапевтического эффекта, T APC, которые были обработаны SQZ'd с E7 SLP, приводили к достоверному снижению опухолевой нагрузки по сравнению с необработанным контролем и введением только CpG (сутки 17: группа C - P <0,05; сутки 20: группы C и D - P <0,0001) (фиг. 12B). Полученные данные показывают, что в опыте с оценкой терапевтической эффективности, как системное совместное введение, так и внутриклеточная доставка адъюванта CpG приводит к достоверному снижению опухолевой нагрузки по сравнению с необработанным контролем или введением одного адъюванта.
Пример 13
[0608] Для оценки способности совместно вводимых адъювантов приводить к инфильтрации опухоли E7-специфическими Т-клетками, сравнивали CpG по сравнению с IFN-γ в комбинации с E7-специфическими T APC по изобретению, на мышиной опухолевой модели TC-1 оценивали терапевтическую активность. Антигенспецифические Т-клеточные ответы измеряли в инфильтрирующих опухоль лимфоцитах по окрашиванию на тетрамер и проточной цитометрией.
[0609] На сутки 0 мышам-реципиентам прививали в заднюю область правого бока опухолевые клетки TC1 (50 тыс. клеток/мышь). На сутки 10 выделяли Т-клетки от самок мышей-доноров C57BL/6J и нагружали с помощью SQZ предварительно приготовленным комплексом 20 мкМ E7 SLP (GQAEPDRAHYNIVTFSSKSDSTLRLSVQSTHVDIR; SEQ ID NO: 25) + 20 мкМ сывороточного альбумина мыши (MSA). Нагруженные SQZ Т-клетки (5 тыс. клеток/животное) вводили отдельно (группа C), в комбинации с CpG ODN 1826 (25 мкг/мышь - группа D) или IFN-γ (10 тыс. МЕ/мышь - группа E) и вводили внутривенно в общем объеме 100 мкл. Мышам также вводили системно CpG (25 мкг - группа A) или только IFN-γ (10 тыс. МЕ - группа B). На сутки 17 опухоли отбирали, выделяли CD8+ инфильтрирующие опухоль Т-клетки и оценивали E7-специфическую реактивность окрашиванием на тетрамер. Репрезентативная схема по группам обработки и схема опыта приведены на фиг. 13.
[0610] Процент E7-специфических CD8+ Т-клеток измеряли у мышей окрашиванием на тетрамер E7 через 7 суток после праймирования (сутки 17), и репрезентативный пример процента E7-специфических Т-клеток из CD8+ клеток показан на нижней панели на фиг. 13. Несмотря на то, что инъекция только адъювантов не генерировала заметного количества E7-специфических Т-клеток, SQZ-опосредованная доставка E7 SLP приводила к 40% увеличению E7-специфических T-клеток, и E7-специфические T-клетки в комбинации с CpG и IFN-γ приводили к еще более высокому проценту антигенспецифических Т-клеток (70% и 80% соответственно). Полученные данные показывают, что более сильный Е7-специфический Т-клеточный ответ генерируется, когда Т-клетки, нагруженные E7 SLP, вводят в комбинации с системными адъювантами, такими как CpG или IFN-γ.
Пример 14
[0611] Для определения схемы вакцинации в режиме прайм-буст T APC, нагруженные синтетическим длинным пептидом E7 (SLP) + CpG, использовали на мышиной опухолевой модели TC-1 для оценки терапевтической активности, с обработкой вакциной T APC по изобретению на разные временные точки и с разным числом буст-обработок. Противоопухолевый эффект оценивали по ингибированию роста опухолей.
[0612] На сутки 0 мышам-реципиентам прививали в заднюю область правого бока опухолевые клетки TC1 (50 тыс. клеток/мышь), и рост опухолей TC-1 измеряли два раза в неделю, начиная с суток 11, и сравнивали с ростом опухолей у необработанных контрольных мышей. На сутки 3 или 6 выделяли Т-клетки от самок мышей-доноров C57BL/6J и нагружали с использованием SQZ предварительно приготовленным комплексом 20 мкМ мышиного сывороточного альбумина (MSA) + 20 мкМ E7 SLP (GQAEPDRAHYNIVTFSSKSDSTLRLSVQSTHVDIR; SEQ ID NO: 25) + 200 мкг/мл CpG ODN 1826 в соответствии с таблицей XX с последующей внутривенной инъекцией мышам-реципиентам 100 мкл нагруженных Т-клеток (5 тыс. клеток/животное). Репрезентативная схема по группам обработки и схема опыта приведены на фиг. 14A.
[0613] Ингибирование роста опухолей имело место во всех группах с Т-клетками SQZ’d с E7 + CpG, при этом статистическую значимость по сравнению с необработанным контролем наблюдали на сутки 20 (сутки 20 - все группы P <0,05; сутки 24 - все группы P <0,0001). Полученные данные показывают, что схема введения вакцины T APC может «работать» одинаково хорошо при праймировании на сутки 6 по сравнению с сутками 3, и не было заметного положительного эффекта от добавления второй буст-дозы на сутки 21.
Пример 15
[0614] Для лучшего понимания механизма презентации антигена Т-клетками, в которые был внутриклеточно доставлен антиген с помощью SQZ, Ova доставляли в Т-клетки или инкубировали в отсутствии SQZ с Т-клетками дикого типа, и вводили мышам дикого типа или мышам с нокаутом MHC-I. Отбирали селезенки и количественно определяли уровень пролиферации Ova-специфических Т-клеток (OT-I) с помощью окрашивания CFSE.
[0615] На сутки 0 Т-клетки от самок мышей-доноров OT-I выделяли и метили 2 мкМ CFSE, и 2,5 тыс. клеток вводили ретроорбитально (RO) в 100 мкл PBS мышам дикого типа или мышам с нокаутом MHC-I. Также на сутки 0 400 мкг/мл Ova нагружали или инкубировали с Т-клетками, выделенными от мышей-доноров CD45.1 (4 мыши/группу), и 5 тыс. Т-клеток вводили ретроорбитально. На сутки 3 отбирали селезенки и оценивали уровень пролиферации Ova-специфических Т-клеток с помощью окрашивания CFSE.
[0616] Степень пролиферации Ova-специфических Т-клеток оценивали по включению CFSE метки в Ova-реактивные OT-I CD8+ T-клетки. Для определения механизма презентации антиген-нагруженных TAPC, мышей с дефицитом MHC-I использовали в качестве мышей-реципиентов. Такой прием будет предотвращать презентацию антигенов Ova эндогенными мышиными APC за счет непрямого поглощения антигена погибающими SQZ’d Т-клетками и перекрестной презентации на MHC-I адоптивно перенесенным клеткам OT-I. Было обнаружено, что когда у мышей-реципиентов отсутствует MHC-I, то пролиферация Ova-специфических OT-I клеток все еще имеет место, свидетельствуя о том, что SQZ’d T APCs презентируют антиген непосредственно (фиг. 15). Полученные данные подтверждают прямую презентацию антигена, который был доставлен SQZ-опосредованно внутриклеточно.
Пример 16
[0617] Для оценки возможности SQZ изменять продукцию цитокинов, в Т-клетки доставляли CpG с использованием устройства SQZ и оценивали на способность изменять уровни цитокинов Т-клеток на мышиной модели in vitro. Уровни цитокинов в супернатанте определяли с использованием тест-набора для мультиплексного анализа цитокинов.
[0618] Самок мышей-реципиентов C57BL/6J праймировали Т-клетками от самок мышей-доноров C57BL/6J, выделяли и обрабатывали с использованием SQZ’d 200 мкг/мл CpG, и супернатанты собирали через 24 ч (N = 2). В супернатантах определяли цитокинов с помощью тест-набора для мультиплексного анализа цитокинов Millipore Milliplex и выражали в виде кратного изменения относительно необработанных Т-клеток.
[0619] Отсутствовали достоверные изменения между уровнями цитокинов в супернатанте Т-клеток, нагруженных CpG с использованием SQZ, по сравнению с необработанными контрольными клетками (фиг. 16). Полученные данные показывают, что доставка адъюванта с использованием SQZ достоверно не изменяет уровни цитокинов Т-клеток in vitro.
Пример 17
[0620] Для оценки возможности SQZ изменять продукцию цитокинов, в T-клетки доставляли Ova или Ova + CpG с использованием устройства SQZ и оценивали на способность изменять уровни цитокинов в сыворотке крови на мышиной модели in vivo. Цитокины сыворотки были профилированы с использованием тест-набора для мультиплексного анализа цитокинов.
[0621] Самок мышей-реципиентов C57BL/6J праймировали Т-клетками от самок мышей-доноров C57BL/6J, обрабатывали SQZ с доставкой 400 мкг/мл Ova или Ova + 200 мкг/мл CpG, и кровь отбирали из хвостовой вены через 6 ч и сердечной пункцией через 24 ч после праймирования. В сыворотке определяли уровни цитокинов с помощью тест-набора для мультиплексного анализа цитокинов Millipore Milliplex и выражали в виде кратного изменения по сравнению с необработанными Т-клетками.
[0622] Отсутствовали достоверные изменения между уровнями цитокинов в сыворотке мышей, праймированных Т-клетками, нагруженными Ova или Ova + CpG с использованием SQZ (фиг. 17). Кроме того, не наблюдали достоверных различий на 6 ч и 24 ч после праймирования. Полученные данные показывают, что доставка SQZ антигена +/- адъюванта существенно не изменяет уровни цитокинов в сыворотке in vivo.
Пример 18
[0623] Для оценки способности дендритных клеток, происходящих из первичных моноцитов человека (MoDC), индуцировать на ВПЧ E7-специфический иммунный ответ в Т-клетках E7 респондерах с использованием лизата опухолевых клеток (TCL) в качестве источника антигена на человеческой модели in vitro, первичные человеческие MoDC загружали лизатом из опухолевых клеток CaSki, и измеряли процент экспрессии 4-1BB с использованием проточной цитометрии.
[0624] Человеческие моноциты выделяли из PBMC HLA-A02+ доноров, и незрелые MoDC получали добавлением rhIL-4 (1000 Е/мл) и rhGM-CSF (800 Е/мл) на 4-6 суток, с восполнением цитокин-содержащей среды через 3 суток. Линию клеток рака шейки матки CaSki использовали в качестве источника антигена и TCL из клеток CaSki (23 мг/мл) доставляли внутриклеточно в MoDC (1×106 клеток/мл) с помощью устройства SQZ или CaSki TCL инкубировали с MoDC в отсутствии SQZing (Эндо). Дополнительно использовали активацию пептидом в качестве контроля, в котором MoDC инкубировали в присутствии известного реактивного эпитопа E7 (YMLDLQPETT; SEQ ID NO: 3 - 0,1 мкМ - положительный контроль). Во всех опытных условиях проводили культивирование в течение 1 ч с LPS (60 МЕ/мл) и rhIFN-β (20000 МЕ/мл) для активации MoDC, с последующей инкубацией в течение 16-24 ч в среде, содержащей LPS 60 МЕ/мл (без IFN-γ). Затем MoDC совместно культивировали в течение 16-24 ч с E7-реактивными Т-клетками (Astarte) при соотношении стимулятор:респондер 3:1. После совместного культивирования измеряли процент экспрессии 4-1BB в E7-реактивных CD8+ Т-клетках с помощью проточной цитометрии.
[0625] Лизат CaSki, полученный из ВПЧ-положительной клеточной линии рака шейки матки, которая, как известно, экспрессирует антиген ВПЧ E7 на высоком уровне, при внутриклеточной доставке с использованием SQZ, приводил к 20% увеличению процента E7-реактивных CD8+ Т-клеток, экспрессирующих 4-1BB, и маркер антиген-специфической активации в сравнении с необработанным контррлем и с сопоставимым контролем Endo (#P <0,0001). Полученные результаты показывают способность внутриклеточных TCL, полученных с помощью SQZ, индуцировать антигенспецифический иммунный ответ на антиген ВПЧ E7 в первичных MoDC человека, обеспечивая поддержку для применения TCL в качестве комплексного источника антигена для других показаний, когда онкогенные антигены могут быть неизвестны.
Пример 19
[0626] Для оценки эндогенного ответа на антигенпрезентирующие клетки (APC), которые были загружены антигеном с помощью SQZ, B-клетки нагружали с использованием SQZ, и измеряли уровни воспалительных цитокинов с помощью внутриклеточного окрашивания цитокинов (ICS).
[0627] Выделяли мышиные В-клетки (BAPC) от мышей C56BL/6J и нагружали с использованием SQZ 400 мкг/мл белка Ova или 20 мкМ пептида ВПЧ E7 16, затем вводили мышам-донорам вместе с 1 мкМ CpG1826 (5 мышей/ группу). На сутки 7 спленоциты отбирали у необработанных мышей, а также у мышей, обработанных BAPC, нагруженных SQZ, повторно индуцированных пептидом Ins B9-23, и затем проводили внутриклеточное окрашивание цитокинов (ICS) для анализа IFN-α с помощью проточной цитометрии (фиг. 19A).
[0628] Как для модельного антигена Ova (фиг. 19B), так и для ВПЧ E7, ассоциированного с заболеванием (фиг. 19C) результаты показали, что спленоциты мышей, обработанных BAPC, нагруженными SQZ, демонстрировали статистически значимое увеличение продукции IFN-α при повторной стимуляции с помощью Ova или ВПЧ E7 соответственно (в обоих случаях P <0,005) по сравнению со спленоцитами, полученными от необработанных мышей. В совокупности полученные данные показывают, что В-клетки можно сконструировать таким образом, чтобы индуцировать антигенспецифические ответы на многочисленные антигены in vivo.
Пример 20
[0629] Для определения способности B-клеток, нагруженных с использованием SQZ, функционировать в качестве антигенпрезентирующих клеток (BAPC) для профилактики роста опухолей, мышей обрабатывали BAPC, нагруженные антигенами с помощью SQZ, с последующей прививкой опухолевых клеток TC-1. Ингибирование роста опухолей измеряли для оценки эффективности профилактической активности вакцины in vivo.
[0630] Для тестирования профилактической активности В-клеточной вакцины на основе антигена ВПЧ, т.е. BAPC, нагруженных антигенами ВПЧ с использованием SQZ, наблюдали за ростом опухолей TC-1, E7 SLP доставляли с использованием устройства SQZ в В-клетки и вводили мышам перед прививкой опухолей. В частности, на сутки -7 выделяли мышиные B-клетки (BAPC) у мышей C56BL/6J и нагружали пептидом ВПЧ E7 16, используя SQZ, затем вводили мышам-донорам вместе с 1 мкМ CpG1826 (10 мышей/группу). На сутки 0 прививали опухолевые клетки TC-1 (1E6 клеток/мл в 100 мкл) подкожно в заднюю область правого бока каждой мыши. TC-1 представляет собой линию опухолевых клеток, которая, как известно, экспрессирует антигены ВПЧ E6 и E7. Объемы опухолей измеряли во временной динамике, и мышей подвергали эвтаназии на сутки 48 или когда их опухоли достигали объеме > 1500 мм3, в зависимости от того, что наступало раньше.
[0631] Рост опухолей резко ингибировался у мышей, получавших BAPC, нагруженные E7, при этом у 8 из 10 мышей в опытной группе опухоли отсутствовали (TF) на протяжении всего исследования по сравнению с 0 из 10 мышей в контрольной группе (фиг. 20А). Вакцина BAPC также приводила к статистически значимому повышению (P <0,0001) выживаемости мышей, иммунизированных BAPC, по сравнению с контролем, при этом средняя выживаемость для группы с обработкой составляла > 60 суток по сравнению с 32 сутками в контрольной группе (фиг. 20B). В совокупности полученные данные показывают, что B-клетки, нагруженные антигеном с использованием SQZ, могут функционировать в качестве эффективной вакцины на основе APC для антигенспецифической профилактики роста опухолей.
Пример 21
[0632] Для определения способности B-клеток, нагруженных с использованием SQZ, функционировать в качестве антигенпрезентирующих клеток (BAPC) для терапии опухолей, мышам прививали опухолевые клетки TC-1 с последующей терапевтической иммунизацией BAPC, нагруженных антигенами. Ингибирование роста опухолей измеряли для оценки терапевтической эффективности вакцины in vivo.
[0633] Для тестирования способности терапевтической B-клеточной вакцины на основе антигена ВПЧ, т.е. BAPC, нагруженных антигенами ВПЧ с использованием SQZ, наблюдали за ростом опухолей TC-1, E7 SLP доставляли в B-клетки с использованием SQZ и вводили мышам после прививки опухолей. В частности, на сутки 0 опухолевые клетки TC-1 (50 тыс. клеток/мышь) вводили подкожно в правый бок мышей C56BL/6J (10 мышей/группу). TC-1 представляет собой линию опухолевых клеток, которая, как известно, экспрессирует антигены ВПЧ E6 и E7. На сутки 9 мышей либо оставляли необработанными, либо праймировали 1 тыс. клеток/мышь мышиных B-клеток (BAPC), нагруженных E7 SLP с использованием SQZ. Объемы опухолей измеряли во временной динамике, и мышей подвергали эвтаназии на сутки 48 или когда их опухоли достигали объема > 1500 мм3, в зависимости от того, что наступало раньше.
[0634] Рост опухолей резко ингибировался у мышей, которые получали BAPC, нагруженные E7, при этом средний объем опухолей оставался на уровне < 500 мм3 во время исследования (фиг. 21A). Выживаемость мышей, получавших BAPC, нагруженных E7, также была достоверно повышена (P <0,0001), при этом средняя выживаемость в опытной группе составляла > 60 суток по сравнению с 38 сутками в контрольной группе. В совокупности эти данные показывают, что B-клетки, нагруженные антигеном с использованием SQZ, могут функционировать в качестве эффективной вакцины на основе APC для антигенспецифической терапии опухолей.
Пример 22
[0635] Для определения способности нагруженных B-клеток с использованием SQZ способствовать рекрутменту инфильтрирующих опухоль лимфоцитов (TIL) в опухоли, мышей, несущих опухоль, обрабатывали нагруженными B-клеточными APC (прайм и буст), а также измеряли ингибирование роста опухолей в дополнение к анализу опухолей на количество и относительный процент антигенспецифических Т-клеток с помощью проточной цитометрии.
[0636] На сутки 0 опухолевые клетки TC-1 (50 тыс. клеток/мышь) вводили подкожно в правый бок мышей C56BL/6J (20 мышей/группу). На сутки 14 мышей праймировали (i) 150 мкг/мышь E7 SLP + 50 мкг CpG1826, который вводили подкожно (п/к SLP), или (ii) мышиных B-клеток, подвергнутых активации 1 мкг/мл минимального эпитопа E7 + 1 мкМ CpG. (мин. эпит.), вводили ретроорбитально, или (iii) В-клетками, нагруженными (SQZ) E7 SLP (20 мкМ) + 1 мкМ CpG (5 М клеток/мышь), которые вводили ретроорбитально. Объем опухолей измеряли во временной динамике до достижения объема > 1500 мм3 или к суткам 34, в зависимости от того, что наступало раньше. На сутки 27 подгруппу животных (5 мышей/группу) подвергали эвтаназии, опухоли извлекали, выделяли Т-клетки и анализировали проточной цитометрией.
[0637] В условиях настоящего опыта для оценки терапевтической активности, как описано, только обработка п/к SLP и SQZ приводила к заметному ингибированию роста опухолей, и только обработка SQZ приводила к регрессии опухолей относительно максимального объема, наблюдаемого на сутки 19 (фиг. 22A). Анализ рекрутмента TIL в опухоль, а также относительного фенотипа этих Т-клеток показал, что В-клеточная вакцина, нагруженная с использованием SQZ (SQZ), приводила к достоверному увеличению процента опухоль-инфильтрирующих Т-клеток в опухолях, а также к более высокому количеству клеток, нормализованному к массе опухоли 100 мг. В дополнение к общему количеству инфильтрирующих Т-клеток было обнаружено, что как CD8+ T-клетки, так и E7-специфические CD8+ T-клетки в варианте лечения с использованием SQZ достоверно повышались в виде процентов от CD45+ клеток по сравнению с п/к SLP и мин. эпит., и данную тенденцию также наблюдали при нормализации к массе опухоли (фиг. 22B). Все различия между группой с обработкой SQZ и любыми другими группами обработки были статистически значимыми (P <0,001). В совокупности полученные данные подтверждают наблюдение о том, что вакцина BAPC, нагруженная с использованием SQZ, приводит к регрессии опухолей за счет стимуляции инфильтрации Т-клеток в опухоль, особенно антигенспецифичных цитотоксических CD8+ Т-лимфоцитов.
Пример 23
[0638] Для оценки антигенспецифического ответа in vitro на человеческие антигенпрезентирующие клетки (APC), которые были нагружены антигеном с помощью SQZ, B-клетки нагружали с использованием устройства SQZ и определяли уровни индуцированной секреции воспалительных цитокинов с помощью ELISA.
[0639] В частности, человеческие В-клетки выделяли от HLA-A2+ доноров, и ВПЧ Е7 16 SLP (50 мкМ) либо инкубировали с В-клетками (Endo), либо доставляли в В-клетки с помощью SQZ (SQZ). В-клетки Endo или SQZ (60 тыс. клеток/лунку) затем инкубировали с Т-клетками E7-респондерами (30 тыс. клеток/лунку) в соотношении 2:1 и совместно культивировали в присутствии IL-2 (100 Е/мл) и CpG 2006 (1 мкМ) в течение 24 ч. Затем собирали супернатанты и анализировали секрецию IFN-α с помощью ELISA.
[0640] Результаты показывают, что B-клетки, нагруженные с использованием SQZ, могут функционировать в качестве антигенпрезентирующих клеток (BAPC), со стимуляцией антигенспецифического ответа на ВПЧ E7 in vitro. B-клеточные APC, которые были нагружены антигеном, стимулировали E7-специфические клетки-респондеры на секрецию IFN-α на достоверно более высоких уровнях, чем те клетки, которые просто инкубировали с антигеном (P <0,005).
Пример 24
[0641] Для оценки значения адъюванта в возможности вакцины, нагруженной с использованием SQZ, индуцировать антигенспецифические лимфоциты, инфильтрирующие опухоль (TIL), клетки нагружали модельным антигеном, подвергали созреванию с адъювантом и вводили мышам, несущим опухоли. Относительный процент антигенспецифических Т-клеток, рекрутированных в опухоли, измеряли с использованием проточной цитометрии.
[0642] Самкам мышей C57BL/6J прививали в заднюю область правого бока опухолевые клетки TC1 (50 тыс. клеток/мышь) на сутки 0. На сутки 15 (прайм) мышиные Т-клетки получали из селезенки самок мышей-доноров C57BL/6J и нагружали предварительно приготовленным комплексом 5 мкМ E7 SLP (GQAEPDRAHYNIVTFSSKSDSTLRLSVQSTHVDIR; SEQ ID NO: 25) + 5 мкМ сывороточного альбумина мыши (MSA) с использованием SQZ (40 фунтов/кв. дюйм, сужение 3,5 мкм, комнатная температура) и инкубировали в течение 1 ч при 37°C. Самкам мышей-реципиентов C57BL/6J (10 мышей/группу) вводили ретроорбитально на сутки 15 либо 100 мкл носителя (PBS - без обработки), либо Т-клетки, нагруженные E7 (1 тыс. клеток/мышь) +/- CpG 1826 (25 мкг/мышь). На сутки 25 опухоли собирали и измеряли количество E7-специфических TIL с использованием проточной цитометрии.
[0643] Одни только SQZ-нагруженные T APC приводили к незначительному (приблизительно 15%), и статистически недостоверному увеличению числа E7-специфичных TIL, но при совместной инъекции с CpG наблюдали более высокое и достоверное увеличение количества TIL (55 %, ** P <0,01 по сравнению с одним T APC; *** P <0,0005 по сравнению с необработанным контролем). Полученные данные показывают, что совместное введение CpG вместе с T APC, нагруженными E7, приводило к существенно большему рекрутменту TIL по сравнению с одними T APC.
Пример 25
[0644] Для оценки продолжительности действия адъювантной вакцины T APC + в профилактическом опыте, данные, полученные на мышах, которым вводили T APC, сравнивали с необработанными мышами в отношении роста опухолей на опухолевой модели TC1, экспрессирующей ВПЧ E7, как в отношении начального ответа, так и после повторной прививки опухолевых клеток через 60 суток с графиком зависимости площади опухолей во временной динамике.
[0645] На сутки -14 отбирали спленоциты у самок мышей-доноров C57BL/6J и Т-клетки выделяли иммуномагнитным разделением. Затем мышиные Т-клетки нагружали предварительно приготовленным комплексом 20 мкМ E7 SLP (GQAEPDRAHYNIVTFSSKSDSTLRLSVQSTHVDIR; SEQ ID NO: 25) + 20 мкМ сывороточного альбумина мыши (MSA) с использованием SQZ (45 фунт/кв. дюйм; сужение 3,5 мкм) и инкубировали в течение 1 ч при 37°C. Самкам мышей-реципиентов C57BL/6J (10 мышей/группу, за исключением группы I без обработки, которая составляла 20 мышей/группу) вводили ретроорбитально 100 мкл либо носителя (PBS - без обработки), либо Т-клеток, нагруженных E7 (1 тыс. клеток/мышь) + CpG 1826 (25 мкг/мышь) [прайм]. На сутки -7 у самок мышей-доноров C57BL/6J отбирали селезенки, выделяли Т-клетки и подвергали обработке SQZ’d и вводили мышам-реципиентам аналогично тому, как на сутки -14 [буст]. На сутки 0 самкам мышей C57BL/6J прививали в заднюю область правого бока (за исключением 10 необработанных мышей из группы 2, которым не прививали опухолевые клетки до суток 64, опухолевые клетки TC1 (50 тыс. клеток/мышь). Рост опухолей TC-1 измеряли, начиная с 1 недели после прививки опухолей, два раза в неделю и сравнивали с ростом опухолей у необработанных мышей в течение 120 суток.
[0646] Рост опухолей, измеренный по формуле ((длина × ширина2)/2), сравнивали между мышами из необработанной группы и из группы, обработанной T APC, с прививкой опухолевых клеток на сутки 0, и хотя все мыши достигали гуманной конечной точки в группе без обработки, к суткам 47 наблюдали достоверную задержку роста опухолей в группе T APC у всех, кроме 2 мышей с T APC, с остальными 8 мышами, которые оставались без опухолей до повторной прививки опухолей. Интересно отметить, что когда необработанным мышам, которым имплантировали опухоли на сутки 64, и по сравнению с мышами, получавшими Т АРС, у которых опухоли были повторно имплантированы в противоположный бок, все еще наблюдали задержку роста опухолей, при этом у трех мышей рост измеримых опухолей отсутствовал даже после повторной прививки опухолевых клеток. На основе полученных данных можно предположить, что обработка Т-АРС, нагруженных Е7 + адъювантом может не только приводить к антигенспецифическому подавлению роста опухолей, но также к профилактике роста опухолей, которая может продолжаться более 100 суток, несмотря на повторную прививку опухолей.
Пример 26
[0647] Для оценки влияния различной концентрации T APC, а также схем прайм-буст в условиях оценки терапевтической активности вакцины, мышей, получавших T APC (в нескольких концентрациях и схемах прайм-буст), сравнивали с необработанными мышами в отношении роста на модели ВПЧ-ассоциированной опухоли TC1, экспрессирующей E7, с графиком зависимости площади опухолей во временной динамике.
[0648] На сутки 0 самкам мышам C57BL/6J в заднюю область правого бока прививали опухолевые клетки TC1 (50 тыс. клеток/мышь). На сутки 10 (прайм) мышиные Т-клетки получали из селезенки самок мышей-доноров C57BL/6J иммуномагнитным разделением и нагружали 20 мкМ SLP E7 (GQAEPDRAHYNIVTFSSKSDSTLRLSVQSTHVDIR; SEQ ID NO: 25) + 20 мкМ сывороточного альбумина мыши (MSA) через SQZ (45 фунт/кв. дюйм; сужение 3,5 мкм) и инкубировали в течение 1 ч при 37°C. Затем самкам мышей-реципиентов C57BL/6J (10 мышей/группу) вводили ретроорбитально 100 мкл либо носителя (PBS), либо Т-АРС (0,25 или 1 тыс. клеток/мышь) + CpG 1826 (25 мкг/мышь). На сутки 17 мыши из группы со схемой прайм/буст получали вторую инъекцию Т-АРС аналогично тому, как на сутки 10. Рост опухолей TC-1 измеряли два раза в неделю, начиная с 1 недели после прививки опухолей, и сравнивали с ростом опухолей у необработанных мышей до 66 суток.
[0649] Результаты оценки роста опухолей, измеренного по формуле ((длина × ширина2)/2), свидетельствовали о том, что в группе с низкой дозой Т АРС (0,25 тыс. клеток/мышь) + CpG (только прайм) имела место только небольшая задержка скорости роста опухолей по сравнению с необработанными мышами. Включение буст-обработки на сутки 17 с низкой дозой T APC + CpG (0,25 М прайм/буст) приводило к усилению ингибирования роста опухолей по сравнению с той же концентрацией только с прайм-оброботкой и гораздо более сильным ингибированием по сравнению с необработанными мышами. Повышение дозы антиген-нагруженных Т-АРС до 1 тыс. клеток/мышь (только прайм) приводило к незначительному ингибированию роста опухолей по сравнению с более низкой дозой Т-АРС + CpG (только прайм). Интересно отметить, что использование высоких доз T APC + CpG (только прайм) приводило к лучшей защите от роста опухоли, где регрессирование опухолей имело место между 20-40 сутками и наиболее высокому уровню ингибирования роста во всех опытных группах. В совокупности полученные данные подчеркивают, что повышенная доза клеток, включение адъюванта или схемы дозирования «прайм + буст» могут повысить эффективность вакцины Т APC.
Пример 27
[0650] Для сравнения эффективности пептидной вакцины в высокой дозе с B-клетками, инкубированными или нагруженными пептидом с использованием SQZ, мышей обрабатывали либо пептидом E7, либо инкубированными с E7 B-клетками (активированные B-клетки), либо нагруженными E7 B APC после прививки модельных опухолей TC1, экспрессирующих ВПЧ E7, в терапевтических условиях, с графиком площади опухолей и выживаемости во временной динамике.
[0651] На сутки 0 самкам мышей C57BL/6J прививали в заднюю область правого бока опухолевые клетки TC1 (50 тыс. клеток/мышь). На сутки 13 (прайм) В-клетки получали из селезенки самок мышей-доноров C57BL/6J с помощью иммуномагнитного разделения и либо инкубировали (10 мкг/мл), либо нагружали 20 мкМ E7 SLP (GQAEPDRAHYNIVTFSSKSDSTLRLSVQSTHVDIR; SEQ ID NO: 25) + 20 мкМ мышиного сывороточного альбумина (MSA) с использованием SQZ (60 фунтов/кв. дюйм; сужение 4 мкм, комнатная температура) и инкубировали с CpG 1826 (1 мкМ) в течение 16 ч. На сутки 14 самкам мышей-реципиентов C57BL/6J (10 мышей/группу) вводили ретроорбитально 100 мкл носителя (PBS), инкубированных с E7 B APC (5 тыс. клеток/мышь), B APC, нагруженных E7 (5 тыс. клеток/мышь) или вводили подкожно в заднюю область правого бока E7 SLP (450 мкг/мышь) + CpG (50 мкг/мышь). На сутки 28 мышам, которых бустировали только пептидом, вводили подкожно пептид таким же образом, как и на сутки 14 (буст). Рост опухолей TC-1 и выживаемость измеряли, начиная через 1 неделю после имплантации опухоли, два раза в неделю и сравнивали с ростом опухолей у необработанных мышей в течение периода до 80 суток.
[0652] На рост опухоли, измеренный по формуле ((длина × ширина2)/2), не влияла обработка активированными пептидами B APC по сравнению с необработанными мышами (фиг. 27A). Интересно отметить, что мыши, обработанные B APC, которые были нагружены с использованием SQZ, демонстрировали резкое ингибирование роста опухолей по сравнению с необработанными B-клетками и B-клетками, обработанными пептидами. Данный эффект был аналогичен эффекту пептидной вакцины (п/к SLP), несмотря на тот факт, что количество пептида, которое вводили мышам, было намного выше, чем введенное количество нагруженных B APC, и что мыши в группе с пептидной вакциной получали прайм- и буст-дозу пептидной вакцины, тогда как группа SQZ B APC получала только однократную прайм-дозу. Тенденции, наблюдаемые с ростом опухолей, коррелировали с общей выживаемостью, причем у мышей как необработанных, так и обработанных активированных пептидом В-клетами, имела место одинаковая медианная выживаемость (приблизительно 36 суток - справа). Как пептидная вакцина в высокой дозе, так и нагруженные E7 B APC имели почти вдвое большую среднюю выживаемость по сравнению с двумя другими группами (60 суток [пептид] против 65,5 суток [SQZ B APC]) (фиг. 27B). Полученные данные показывают, что B APC, нагруженные с использованием SQZ, могут индуцировать регрессию опухолей на терапевтической модели ВПЧ-ассоциированного рака, и может достигаться аналогичная или даже более высокая эффективность, по сравнению с классической пептидной вакциной в высокой дозе.
Пример 28
[0653] Для определения эндогенного ответа на антигенпрезентирующие клетки (APC), которые были нагружены антигеном с помощью SQZ, полученные спленоциты нагружали, используя устройство SQZ, и уровни воспалительных цитокинов измеряли с помощью внутриклеточного окрашивания цитокинов (ICS).
[0654] Выделяли мышиные спленоциты (Spleno APC) у мышей C56BL/6J и проводили обработку SQZ'd с использованием 400 мкг/мл белка Ova (фиг. 28B) или пептида ВПЧ 16 E7 (20 мкМ - фиг. 28C), затем вводили мышам-донорам вместе с 1 мкМ CpG1826 (5 мышей/группу). На сутки 7 собирали спленоциты, повторно стимулировали Ins B9-23 и проводили внутриклеточное окрашивание цитокинов (ICS) для анализа IFN-α и IL-2 с использованием проточной цитометрии и сравнивали с необработанными мышами.
[0655] Как для модельного антигена Ova (фиг. 28B), так и для ВПЧ E7, ассоциированного с заболеванием (фиг. 28C), было обнаружено, что мыши, получавшие Spleno APC, демонстрировали статистически значимое увеличение уровня как IFN-α, так и IL-2 при повторной стимуляции либо Ova, либо E7 (P <0,005 для всех опытных условий с APC по сравнению с их соответствующими контрольными условиями без обработки). В совокупности полученные данные показывают, что смешанные спленоциты можно сконструировать таким образом, чтобы индуцировать антигенспецифические ответы на несколько антигенов in vivo.
Пример 29
[0656] Для определения способности нагруженных с помощью SQZ B-клеток или смешанных спленоцитов функционировать в качестве антигенпрезентирующих клеток (APC) для терапии опухолей, мышей обрабатывали нагруженными APC спленоцитами с последующей прививкой опухолевых клеток TC-1. Для оценки эффективности вакцины in vivo измеряли ингибирование роста опухолей.
[0657] На сутки 0 опухолевые клетки TC-1 (50 тыс. клеток/ мышь) прививали подкожно в правый бок мышей C56BL/6J (10 мышей/ группу). На сутки 9 мышей праймировали спленоцитами из расчета 1 тыс. клеток/мышь (фиг. 28, SplenoAPC), измеряли объемы опухолей во временной динамике, и мышей подвергали эвтаназии на сутки 48 или когда их опухоли достигали объема > 1500 мм3, в зависимости от того, что наступало раньше.
[0658] Способность терапевтической вакцины на основе спленоцитов с антигеном ВПЧ контролировать рост опухоли TC-1, линии, которая, как известно, экспрессирует антигены ВПЧ E6 и E7, тестировали нагрузкой E7 SLP в B-клетки или спленоциты через 9 суток после прививки опухолей. Рост опухолей резко ингибировался у мышей, получавших SplenoAPC, при этом средний объем опухоли оставался на уровне < 500 мм3 на протяжении исследования (фиг. 29A). Выживаемость мышей, получавших APC, также была достоверно выше (P < 0,0001), при этом ни одна из мышей, получавших SplenoAPC, не достигла гуманной конечной точки до конца исследования (фиг. 29B). В совокупности полученные данные показывают, что спленоциты, нагруженные антигеном с использованием SQZ, могут функционировать в качестве эффективной вакцины на основе APC для антигенспецифического лечения опухолей.
Пример 30
[0659] Для определения антигенспецифического ответа in vitro на человеческие антигенпрезентирующие клетки (APC), которые были нагружены антигеном с помощью SQZ, B-клетки или PBMC нагружали с использованием SQZ, и измеряли уровни воспалительных цитокинов внутриклеточным окрашиванием цитокинов (ICS).
[0660] Человеческие PBMC выделяли от HLA-A2+ доноров, и ВПЧ 16 E7 SLP (50 мкМ) либо инкубировали с PBMC (Endo), либо доставляли с помощью SQZ (SQZ). Затем нагруженные PBMC (60 тыс. клеток/лунку) совместно культивировали с Т-клетками Astarte E7 респондерами (30 тыс. клеток/лунку) в соотношении 2:1 и культивировали в присутствии IL-2 (100 Е/мл) и CpG 2006 (1 мкМ) в течение 24 ч. Затем собирали супернатанты и анализировали на IFN-α с помощью ELISA.
[0661] PBMC тестировали в качестве APC для стимуляции антигенспецифического ответа на ВПЧ E7 in vitro. APC PBMC, которые были нагружены антигеном, стимулировали E7-специфические клетки-респондеры на секрецию IFN-α на гораздо более высоких уровнях, чем клетки, которые просто инкубировали с антигеном (P <0,005).
[0662] В совокупности полученные данные показывают, что PBMC человека могут функционировать в качестве эффективных APC со стимуляцией антигенспецифических ответов, ассоциированных с заболеванием.
Список последовательностей
Основания, указанные заглавными буквами, представляют фосфодиэфир, и основания, указанные строчными буквами - фосфоротиоат
Основания представляют фосфоротиоат
Основания представляют фосфоротиоат
Основания представляют фосфоротиоат
Основания представляют фосфоротиоат
Основания представляют фосфоротиоат
Основания представляют фосфоротиоат
Основания представляют фосфоротиоат
Основания представляют фосфоротиоат
--->
Список последовательностей
<110> SQZ Biotechnologies Company
<120> СПОСОБЫ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, АССОЦИИРОВАННЫХ С ВПЧ
<130> 75032-20016.40
<160> 51
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 10
<212> БЕЛОК
<213> Неизвестно
<220>
<223> Вирус папилломы человека
<400> 1
Thr Ile His Asp Ile Ile Leu Glu Cys Val
1 5 10
<210> 2
<211> 10
<212> БЕЛОК
<213> Неизвестно
<220>
<223> Вирус папилломы человека
<400> 2
Glu Val Tyr Asp Phe Ala Phe Arg Asp Leu
1 5 10
<210> 3
<211> 10
<212> БЕЛОК
<213> Неизвестно
<220>
<223> Вирус папилломы человека s
<400> 3
Tyr Met Leu Asp Leu Gln Pro Glu Thr Thr
1 5 10
<210> 4
<211> 9
<212> БЕЛОК
<213> Неизвестно
<220>
<223> Вирус папилломы человека
<400> 4
Arg Ala His Tyr Asn Ile Val Thr Phe
1 5
<210> 5
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 5
Leu Pro Gln Leu Ser Thr Glu Leu Gln Thr
1 5 10
<210> 6
<211> 8
<212> БЕЛОК
<213> Неизвестно
<220>
<223> Вирус папилломы человека
<400> 6
Gln Leu Cys Thr Glu Leu Gln Thr
1 5
<210> 7
<211> 7
<212> БЕЛОК
<213> Неизвестно
<220>
<223> Вирус папилломы человека
<400> 7
Lys Gln Gln Leu Leu Arg Arg
1 5
<210> 8
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 8
Val Tyr Ser Lys Gln Gln Leu Leu Arg Arg
1 5 10
<210> 9
<211> 10
<212> БЕЛОК
<213> Неизвестно
<220>
<223> Вирус папилломы человека
<400> 9
Met His Gly Asp Thr Pro Thr Leu His Glu
1 5 10
<210> 10
<211> 6
<212> БЕЛОК
<213> Неизвестно
<220>
<223> Вирус папилломы человека
<400> 10
Gly Gln Ala Glu Pro Asp
1 5
<210> 11
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 11
Tyr Ser Lys Gln Gln Leu Leu Arg Arg Glu Val Tyr Asp Phe Ala Phe
1 5 10 15
<210> 12
<211> 7
<212> БЕЛОК
<213> Неизвестно
<220>
<223> Вирус папилломы человека
<400> 12
Tyr Cys Lys Gln Gln Leu Leu
1 5
<210> 13
<211> 8
<212> БЕЛОК
<213> Неизвестно
<220>
<223> Вирус папилломы человека
<400> 13
Cys Ile Val Tyr Arg Asp Gly Asn
1 5
<210> 14
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 14
Ser Ile Val Tyr Arg Asp Gly Asn Pro Tyr Ala Val Ser Asp Lys
1 5 10 15
<210> 15
<211> 15
<212> БЕЛОК
<213> Неизвестно
<220>
<223> Вирус папилломы человека
<400> 15
Asp Leu Tyr Cys Tyr Glu Gln Leu Asn Asp Ser Ser Glu Glu Glu
1 5 10 15
<210> 16
<211> 20
<212> БЕЛОК
<213> Неизвестно
<220>
<223> Вирус папилломы человека
<400> 16
Cys Cys Lys Cys Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His
1 5 10 15
Val Asp Ile Arg
20
<210> 17
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 17
Ser Ser Lys Ser Asp Ser Thr Leu Arg Leu Ser Val Gln Ser Thr His
1 5 10 15
Val Asp Ile Arg
20
<210> 18
<211> 36
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 18
Leu Pro Gln Leu Ser Thr Glu Leu Gln Thr Thr Ile His Asp Ile Ile
1 5 10 15
Leu Glu Cys Val Tyr Ser Lys Gln Gln Leu Leu Arg Arg Glu Val Tyr
20 25 30
Asp Phe Ala Phe
35
<210> 19
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 19
Gln Leu Cys Thr Glu Leu Gln Thr Thr Ile His Asp Ile Ile Leu Glu
1 5 10 15
Cys Val Tyr Cys Lys Gln Gln Leu Leu
20 25
<210> 20
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 20
Lys Gln Gln Leu Leu Arg Arg Glu Val Tyr Asp Phe Ala Phe Arg Asp
1 5 10 15
Leu Cys Ile Val Tyr Arg Asp Gly Asn
20 25
<210> 21
<211> 35
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 21
Val Tyr Ser Lys Gln Gln Leu Leu Arg Arg Glu Val Tyr Asp Phe Ala
1 5 10 15
Phe Arg Asp Leu Ser Ile Val Tyr Arg Asp Gly Asn Pro Tyr Ala Val
20 25 30
Ser Asp Lys
35
<210> 22
<211> 35
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 22
Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu Asp Leu Gln
1 5 10 15
Pro Glu Thr Thr Asp Leu Tyr Cys Tyr Glu Gln Leu Asn Asp Ser Ser
20 25 30
Glu Glu Glu
35
<210> 23
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 23
Gln Leu Cys Thr Glu Leu Gln Thr Tyr Met Leu Asp Leu Gln Pro Glu
1 5 10 15
Thr Thr Tyr Cys Lys Gln Gln Leu Leu
20 25
<210> 24
<211> 35
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 24
Gly Gln Ala Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys
1 5 10 15
Cys Lys Cys Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val
20 25 30
Asp Ile Arg
35
<210> 25
<211> 35
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 25
Gly Gln Ala Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Ser
1 5 10 15
Ser Lys Ser Asp Ser Thr Leu Arg Leu Ser Val Gln Ser Thr His Val
20 25 30
Asp Ile Arg
35
<210> 26
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 26
ggggtcaacg ttgagggggg 20
<210> 27
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 27
gggggacgat cgtcgggggg 20
<210> 28
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 28
ggggacgacg tcgtgggggg g 21
<210> 29
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 29
tccatgacgt tcctgatgct 20
<210> 30
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 30
tccatgacgt tcctgacgtt 20
<210> 31
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 31
tcgtcgtttt gtcgttttgt cgtt 24
<210> 32
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 32
tcgtcgttgt cgttttgtcg tt 22
<210> 33
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 33
tcgacgttcg tcgttcgtcg ttc 23
<210> 34
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 34
tcgcgacgtt cgcccgacgt tcggta 26
<210> 35
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 35
tcgtcgtttt cggcgcgcgc cg 22
<210> 36
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 36
tcgtcgtcgt tcgaacgacg ttgat 25
<210> 37
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 37
tcgcgaacgt tcgccgcgtt cgaacgcgg 29
<210> 38
<211> 35
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 38
Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu Asp Leu Gln
1 5 10 15
Pro Glu Thr Thr Asp Leu Tyr Cys Tyr Glu Gln Leu Asn Asp Ser Ser
20 25 30
Glu Glu Glu
35
<210> 39
<211> 35
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 39
Leu Tyr Cys Tyr Glu Gln Leu Asn Asp Ser Ser Glu Glu Glu Asp Glu
1 5 10 15
Ile Asp Gly Pro Ala Gly Gln Ala Glu Pro Asp Arg Ala His Tyr Asn
20 25 30
Ile Val Thr
35
<210> 40
<211> 35
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 40
Gly Gln Ala Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys
1 5 10 15
Cys Lys Cys Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val
20 25 30
Asp Ile Arg
35
<210> 41
<211> 35
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 41
Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg Thr Leu
1 5 10 15
Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile Cys Ser
20 25 30
Gln Lys Pro
35
<210> 42
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 42
Met His Gln Lys Arg Thr Ala Met Phe Gln Asp Pro Gln Glu Arg Pro
1 5 10 15
Arg Lys Leu Pro Gln Leu Cys Thr Glu Leu Gln Thr Thr Ile His Asp
20 25 30
<210> 43
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 43
Leu Pro Gln Leu Cys Thr Glu Leu Gln Thr Thr Ile His Asp Ile Ile
1 5 10 15
Leu Glu Cys Val Tyr Cys Lys Gln Gln Leu Leu Arg Arg Glu Val Tyr
20 25 30
<210> 44
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 44
Lys Gln Gln Leu Leu Arg Arg Glu Val Tyr Asp Phe Ala Phe Arg Asp
1 5 10 15
Leu Cys Ile Val Tyr Arg Asp Gly Asn
20 25
<210> 45
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 45
Arg Asp Leu Cys Ile Val Tyr Arg Asp Gly Asn Pro Tyr Ala Val Cys
1 5 10 15
Asp Lys Cys Leu Lys Phe Tyr Ser Lys Ile
20 25
<210> 46
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 46
Asp Lys Cys Leu Lys Phe Tyr Ser Lys Ile Ser Glu Tyr Arg His Tyr
1 5 10 15
Cys Tyr Ser Leu Tyr Gly Thr Thr Leu
20 25
<210> 47
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 47
His Tyr Cys Tyr Ser Leu Tyr Gly Thr Thr Leu Glu Gln Gln Tyr Asn
1 5 10 15
Lys Pro Leu Cys Asp Leu Leu Ile Arg
20 25
<210> 48
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 48
Tyr Gly Thr Thr Leu Glu Gln Gln Tyr Asn Lys Pro Leu Cys Asp Leu
1 5 10 15
Leu Ile Arg Cys Ile Asn Cys Gln Lys Pro Leu Cys Pro Glu Glu Lys
20 25 30
<210> 49
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 49
Arg Cys Ile Asn Cys Gln Lys Pro Leu Cys Pro Glu Glu Lys Gln Arg
1 5 10 15
His Leu Asp Lys Lys Gln Arg Phe His Asn Ile Arg Gly Arg Trp Thr
20 25 30
<210> 50
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 50
Asp Lys Lys Gln Arg Phe His Asn Ile Arg Gly Arg Trp Thr Gly Arg
1 5 10 15
Cys Met Ser Cys Cys Arg Ser Ser Arg Thr Arg Arg Glu Thr Gln Leu
20 25 30
<210> 51
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<220>
<221> Вариант
<222> 9, 10, 11, 12, 13, 14, 15, 16, 17
<223> Xaa = любая аминокислота
<400> 51
Gln Leu Cys Thr Glu Leu Gln Thr Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Tyr Cys Lys Gln Gln Leu Leu
20
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ВНУТРИКЛЕТОЧНАЯ ДОСТАВКА БИОМОЛЕКУЛ ДЛЯ МОДУЛЯЦИИ ИММУННОГО ОТВЕТА | 2019 |
|
RU2819143C2 |
| ДОСТАВКА БИОМОЛЕКУЛ В КЛЕТКИ ИММУННОЙ СИСТЕМЫ | 2015 |
|
RU2739794C2 |
| CPG-ОЛИГОНУКЛЕОТИДНЫЕ АНАЛОГИ, СОДЕРЖАЩИЕ ГИДРОФОБНЫЕ Т-АНАЛОГИ С УСИЛЕННОЙ ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ | 2007 |
|
RU2477315C2 |
| CPG АМФИФИЛЫ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2823677C2 |
| ИММУНОСТИМУЛИРУЮЩИЕ ФОСФОРТИОАТНЫЕ CpG-ОЛИГОНУКЛЕОТИДЫ, СОДЕРЖАЩИЕ ФОСФОДИЭФИРНЫЕ СВЯЗИ, СПОСОБ ИММУНОМОДУЛЯЦИИ, СПОСОБ СТИМУЛИРОВАНИЯ ИММУННОГО ОТВЕТА | 2003 |
|
RU2338750C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ПРОИЗВОДСТВА Т-КЛЕТОК | 2018 |
|
RU2793344C2 |
| Иммуногенная композиция на основе рекомбинантных белков E6-CBD И E7-CBD для лечения злокачественных новообразований, ассоциированных с вирусом папилломы человека 16 типа | 2023 |
|
RU2805482C1 |
| РЕКОМБИНАНТНЫЙ БЕЛОК, НЕСУЩИЙ ЭПИТОПЫ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА, ВСТРОЕННЫЕ В БЕЛОК АДЕНИЛАТЦИКЛАЗУ ИЛИ ЕГО ФРАГМЕНТ, ЕГО ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2005 |
|
RU2441022C2 |
| ВАКЦИНА, СОДЕРЖАЩАЯ ЭКСТРАКТ РИБОСОМНОГО БЕЛКА (RPE) И Th1- АКТИВИРУЮЩИЙ АДЪЮВАНТ | 2009 |
|
RU2521499C2 |
| Иммуностимулирующие олигонуклеотиды | 2012 |
|
RU2610690C2 |
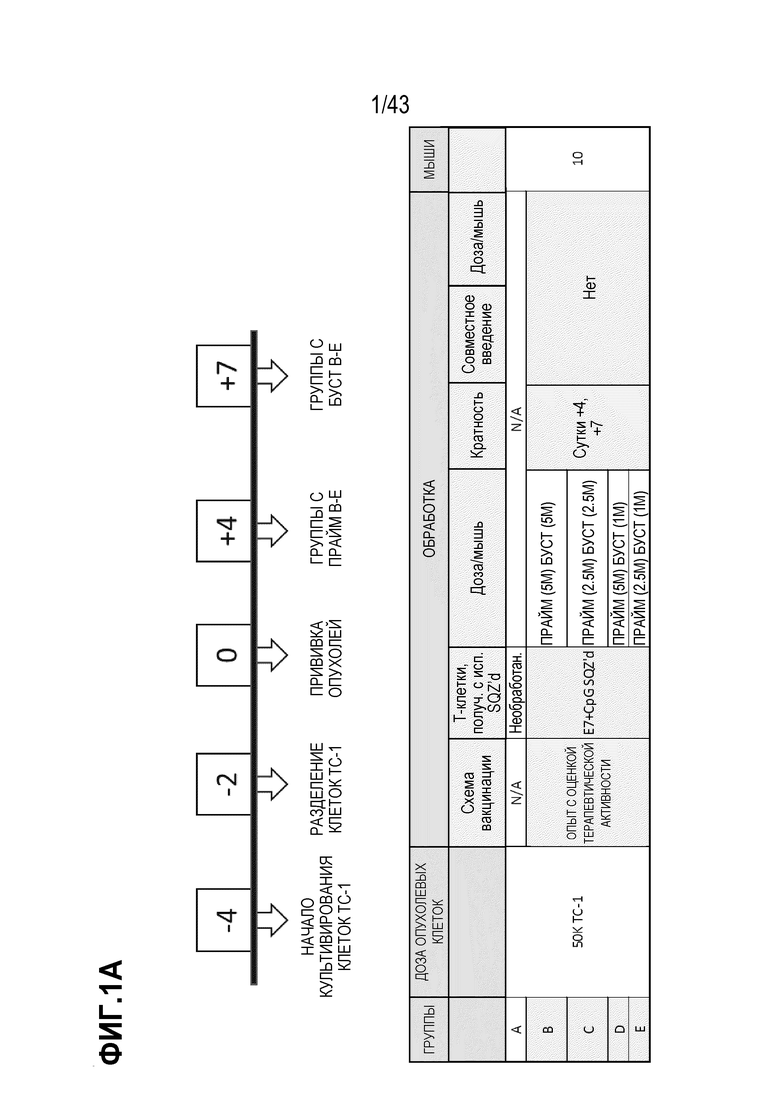
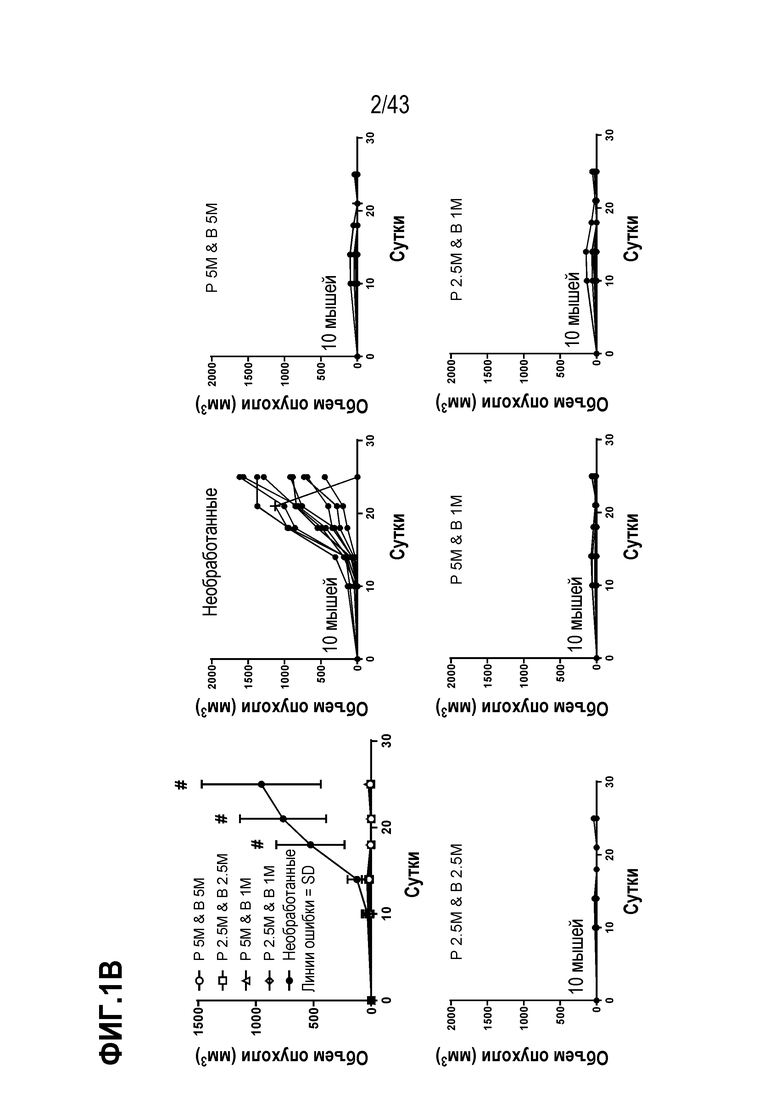
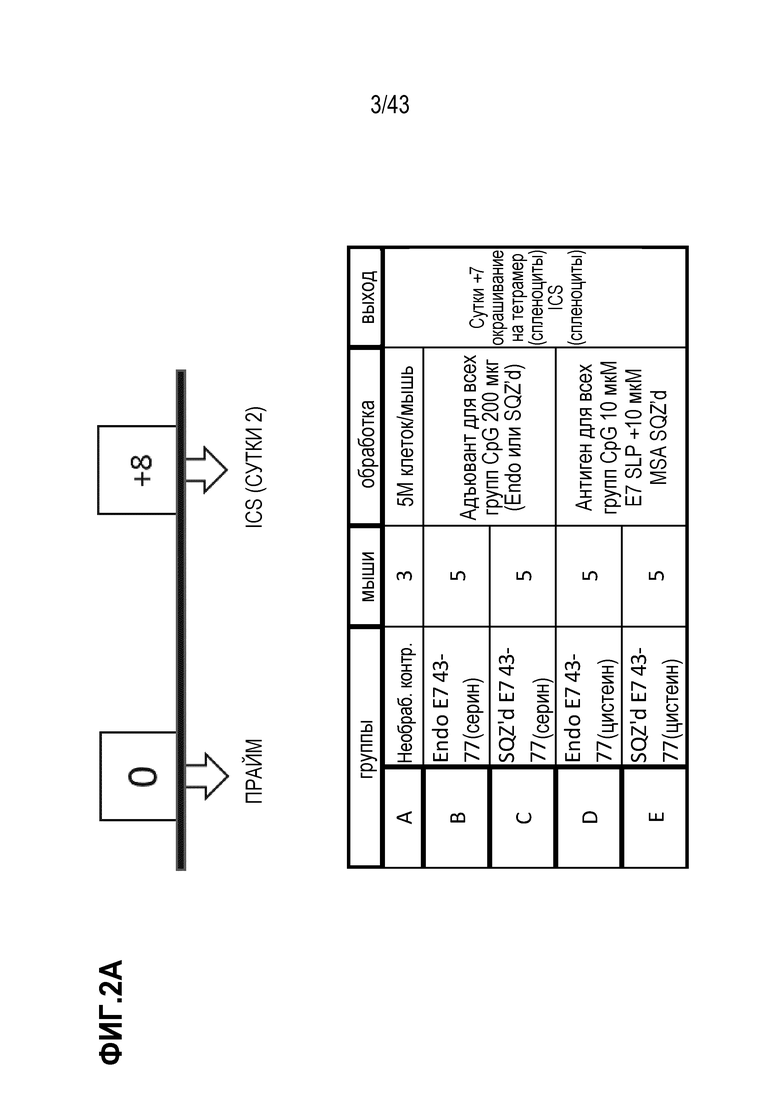
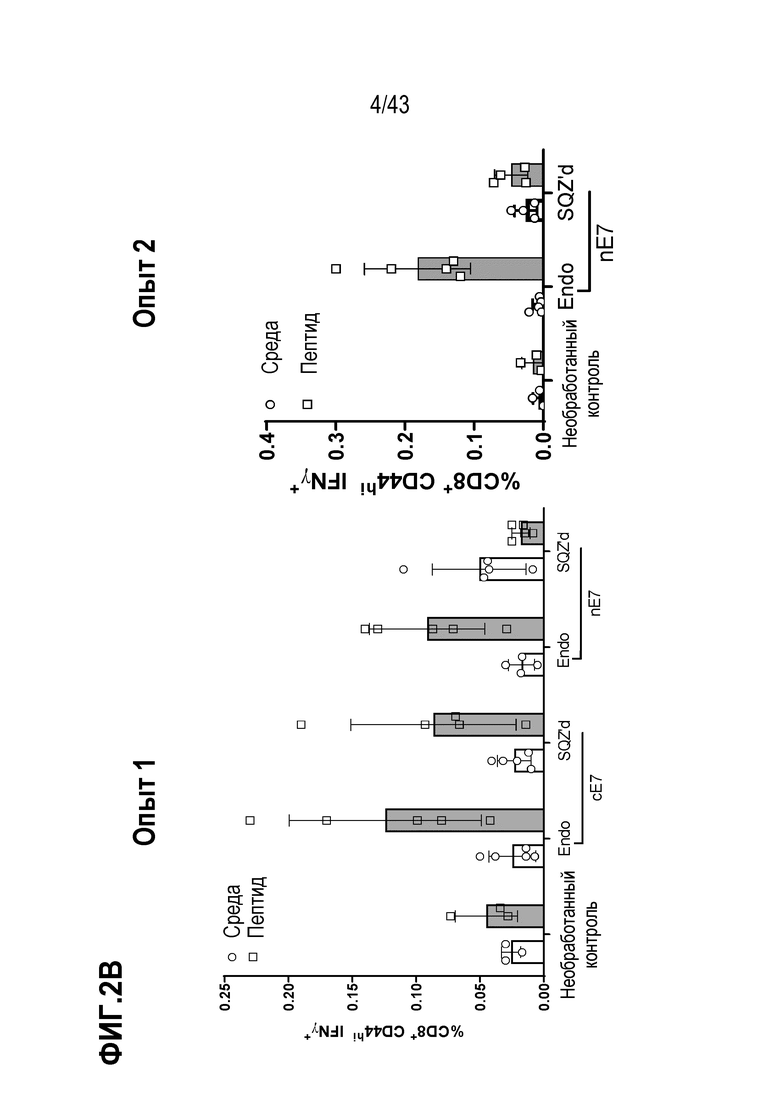
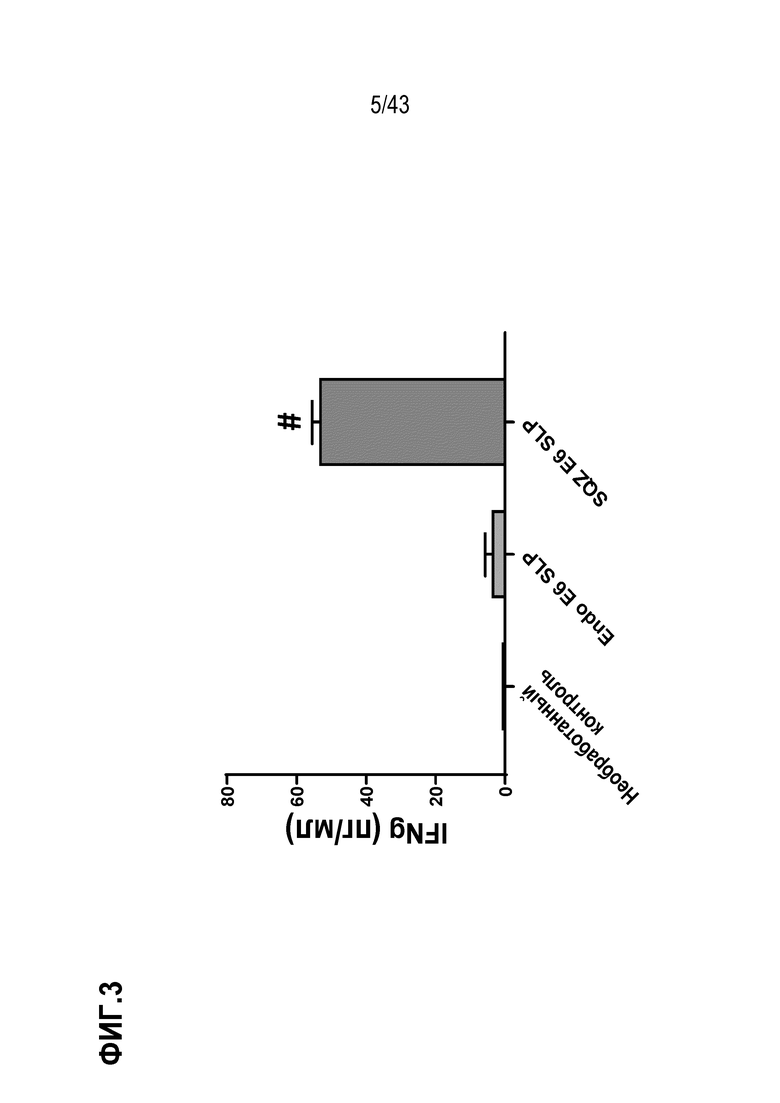
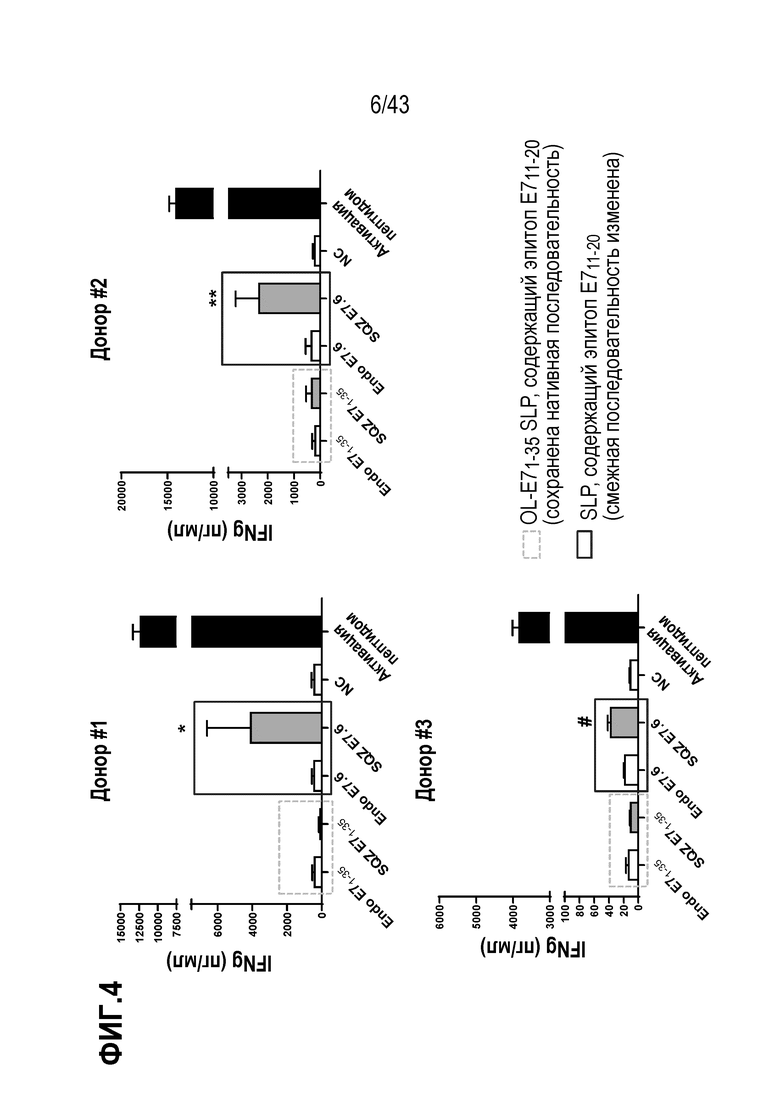
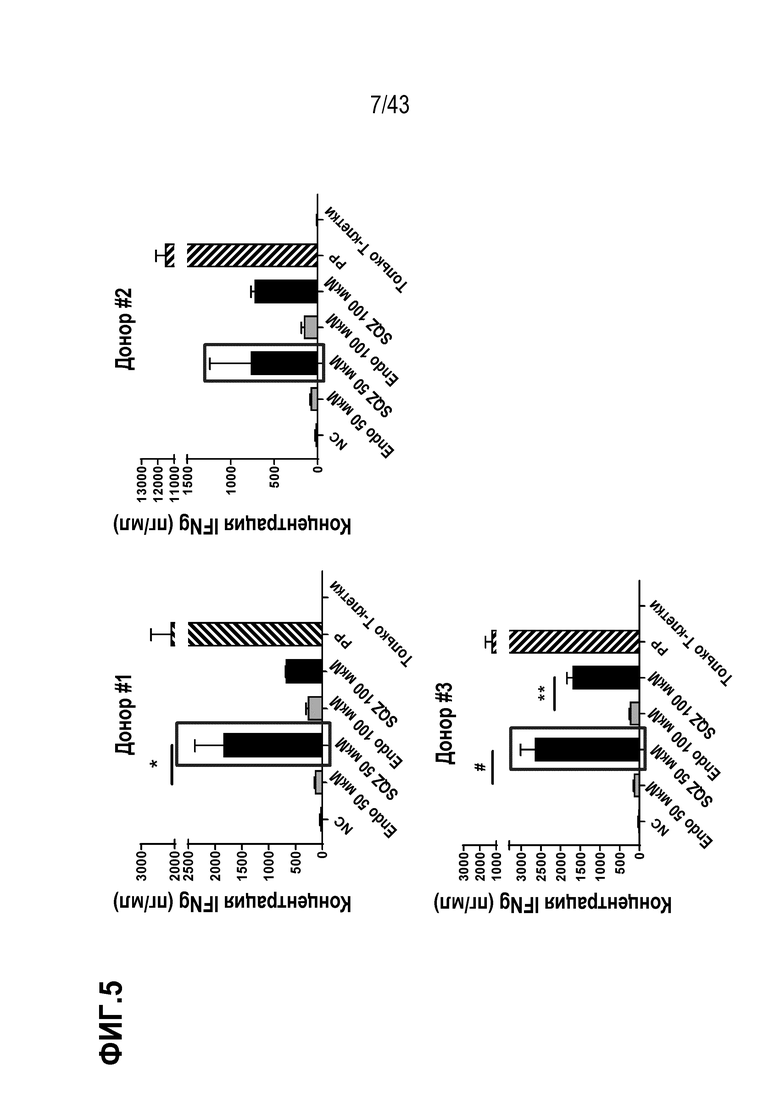
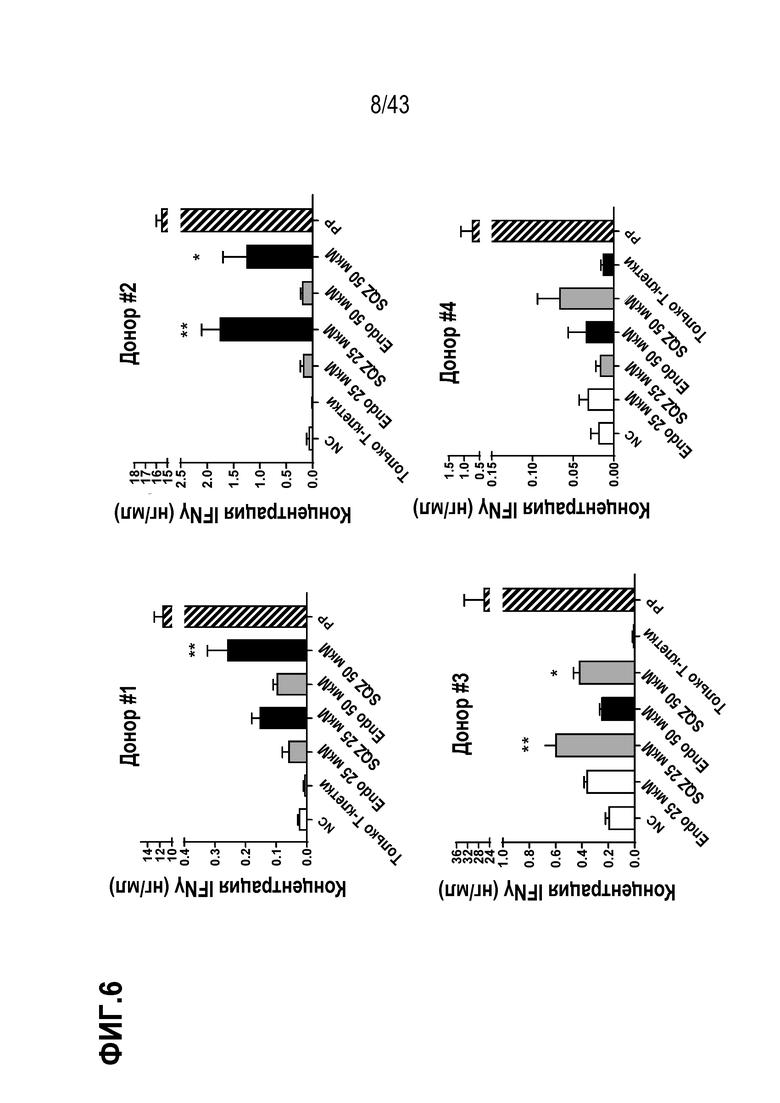
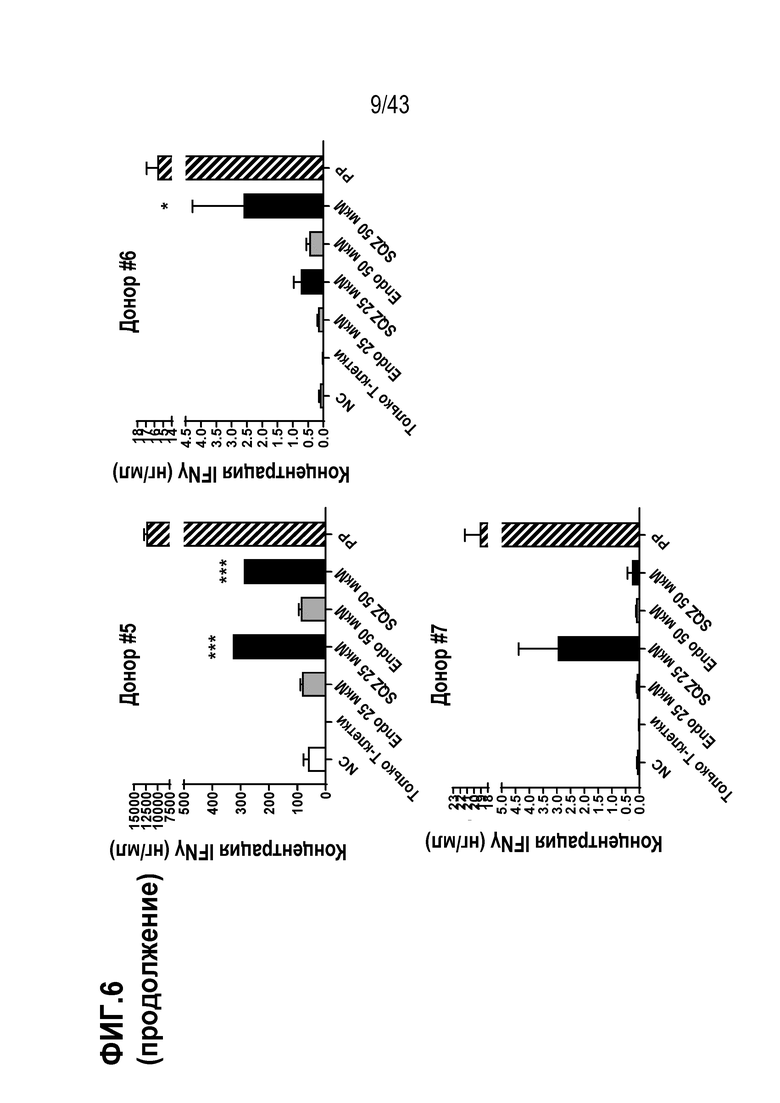
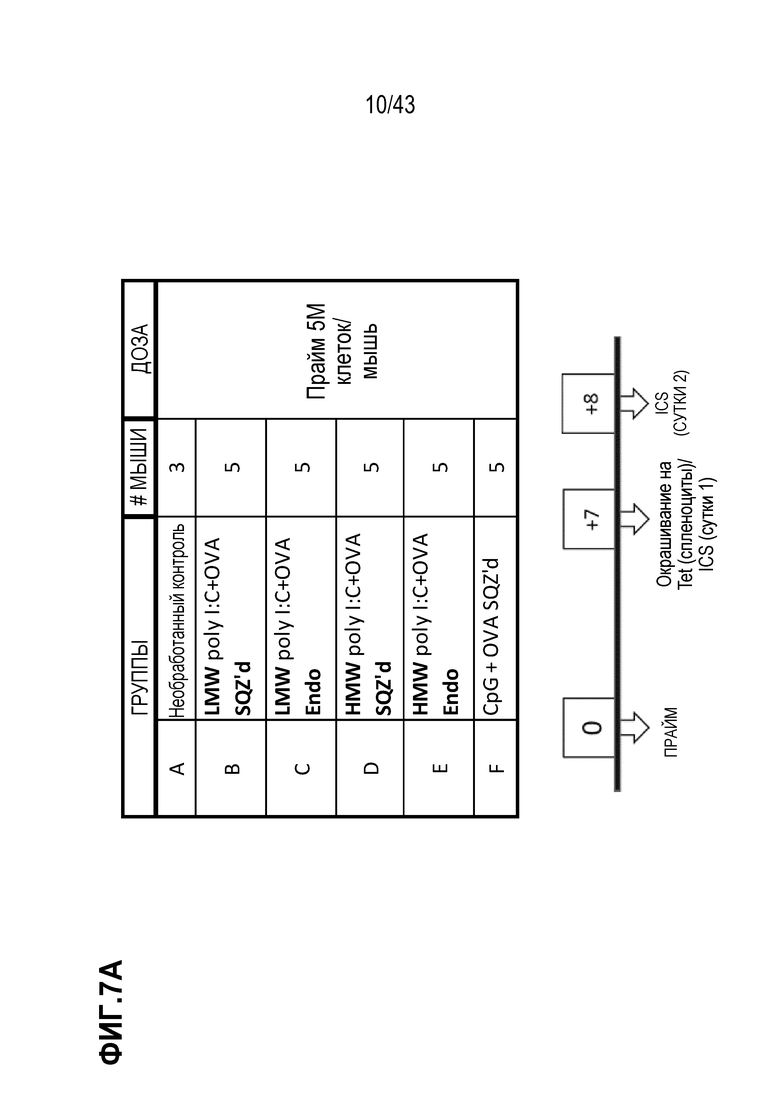
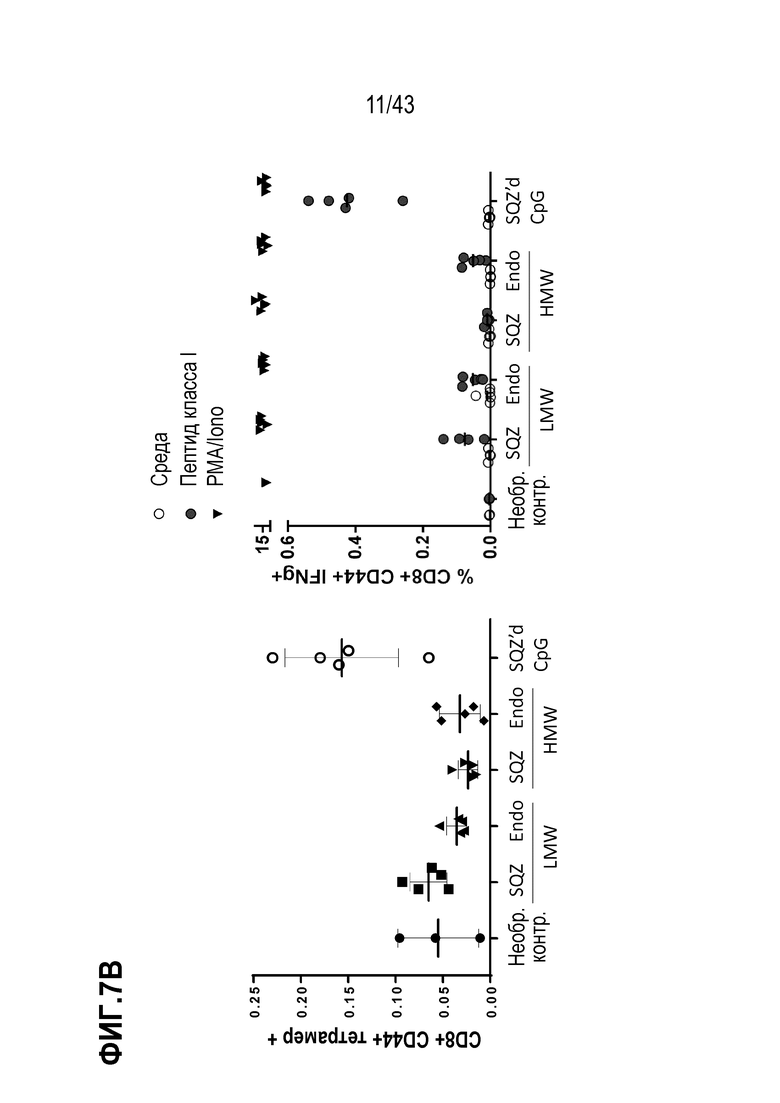
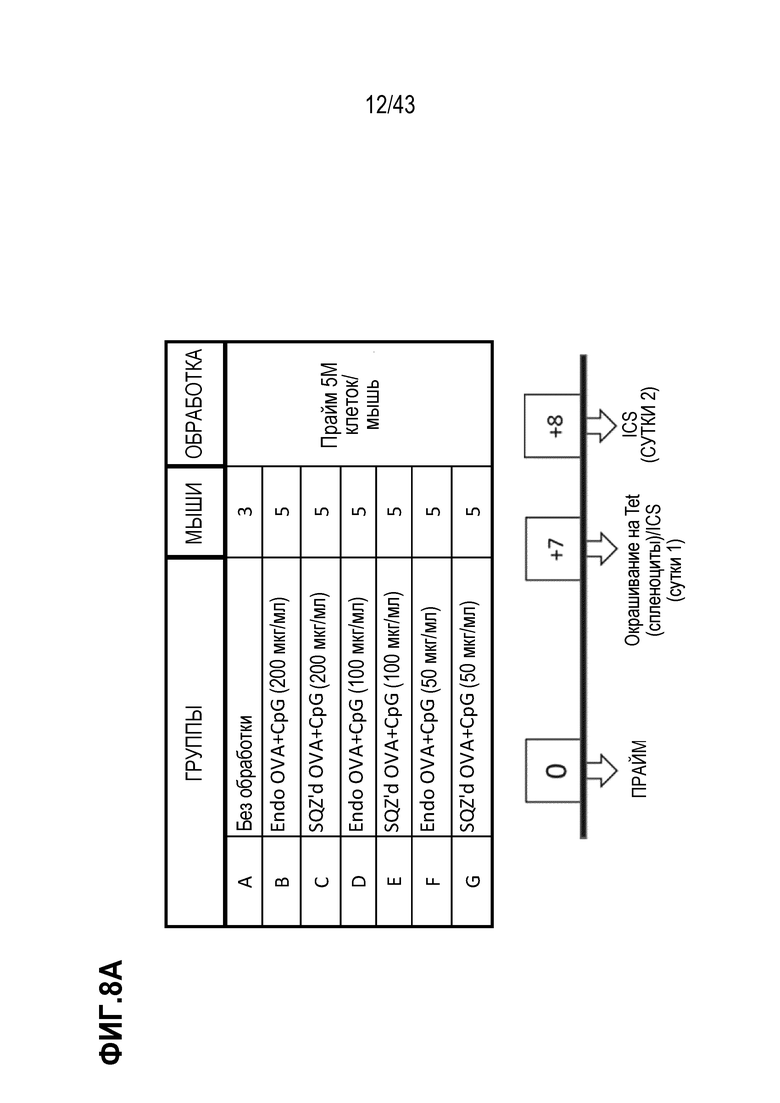
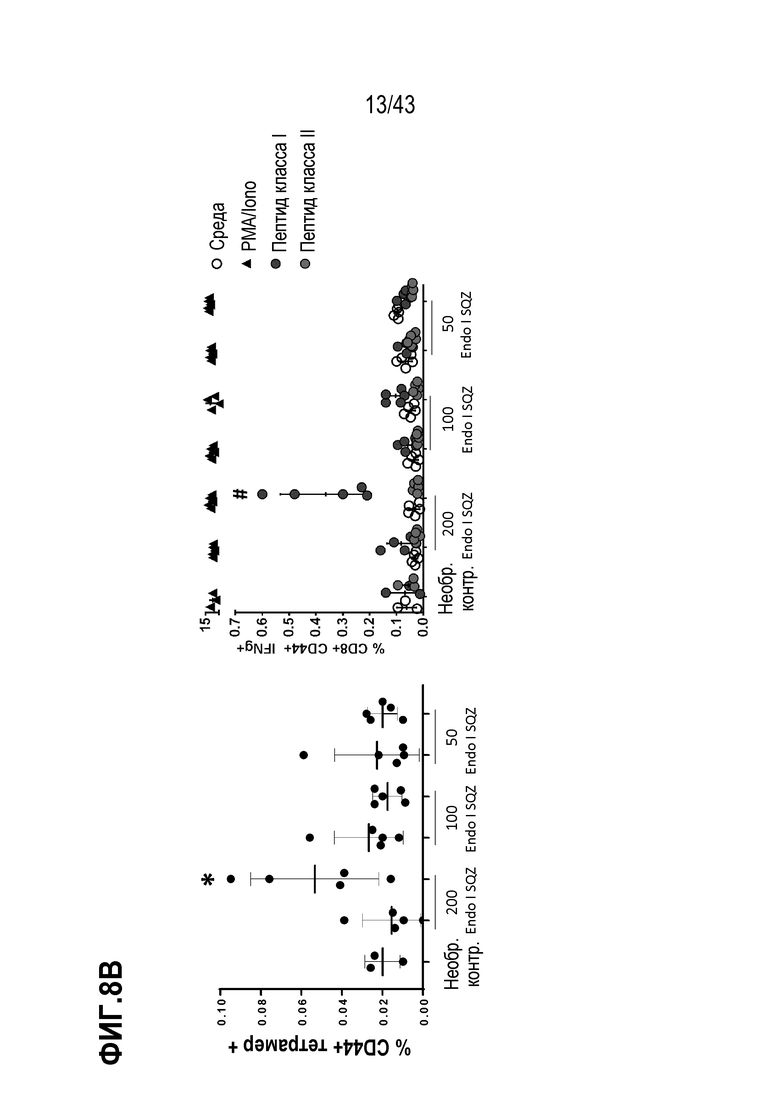
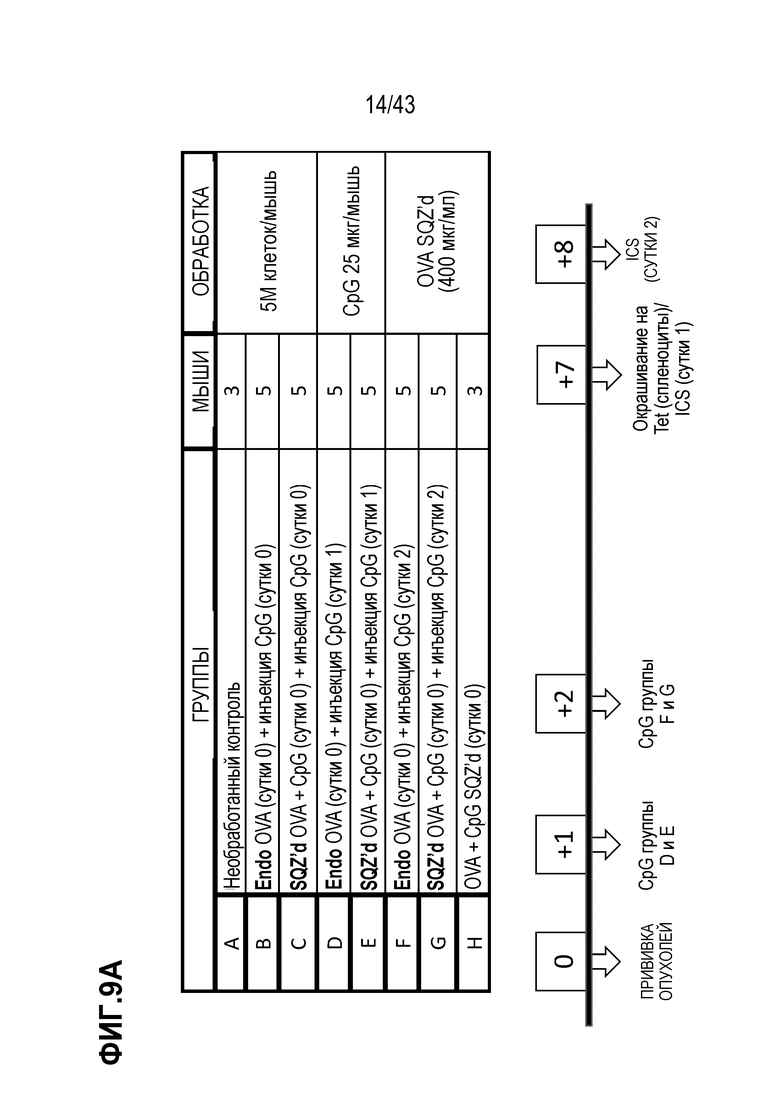
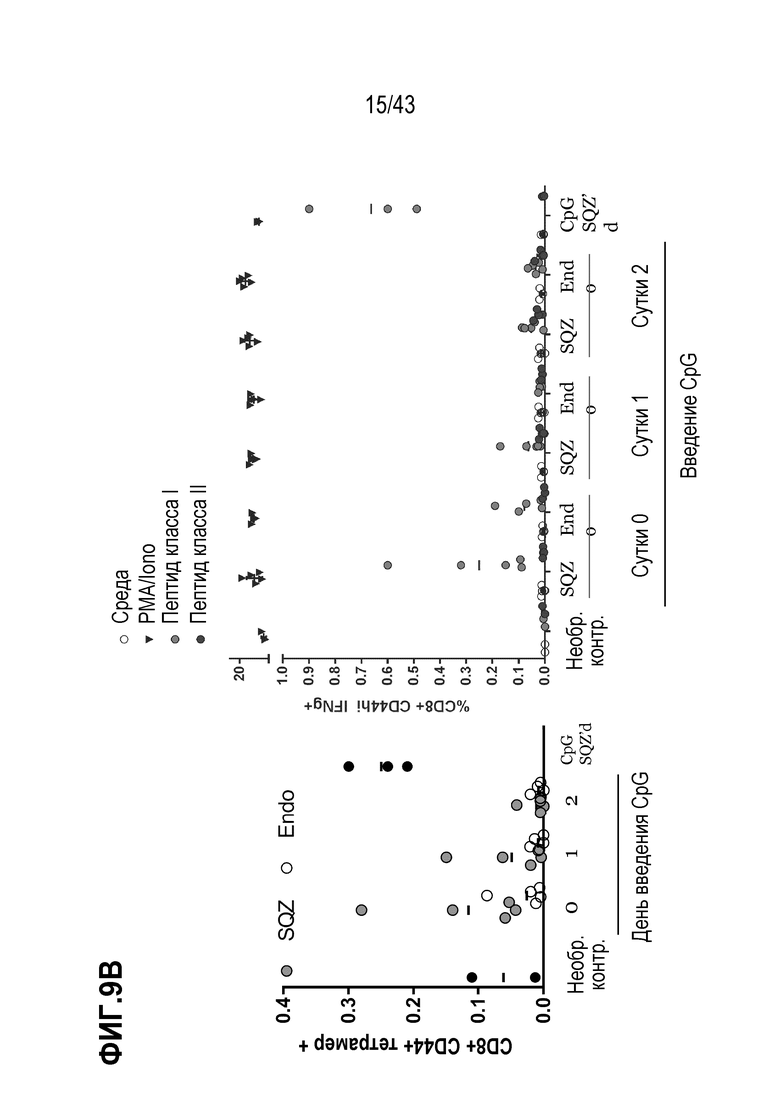
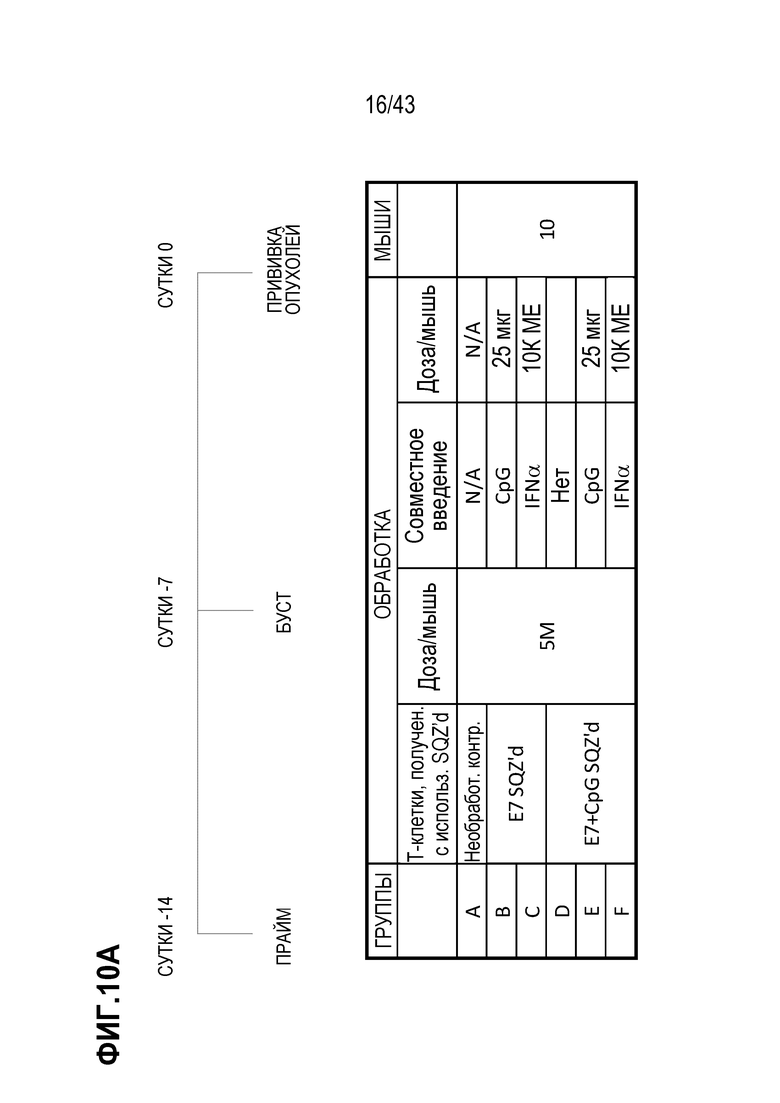
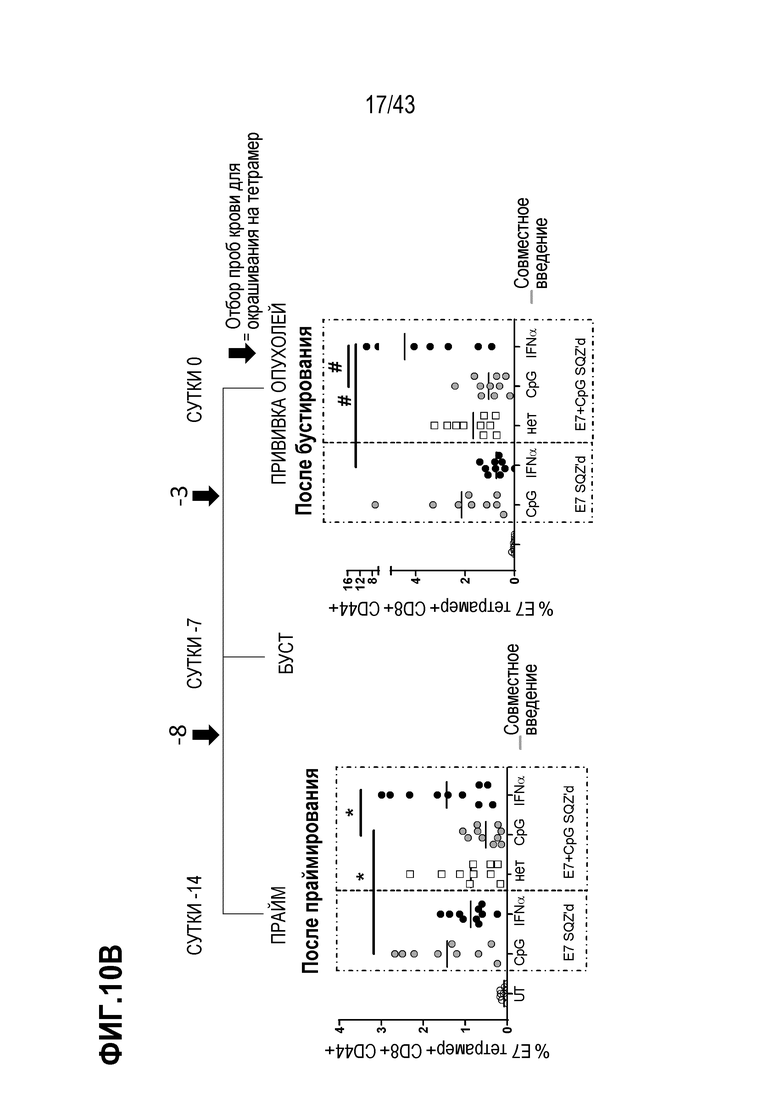
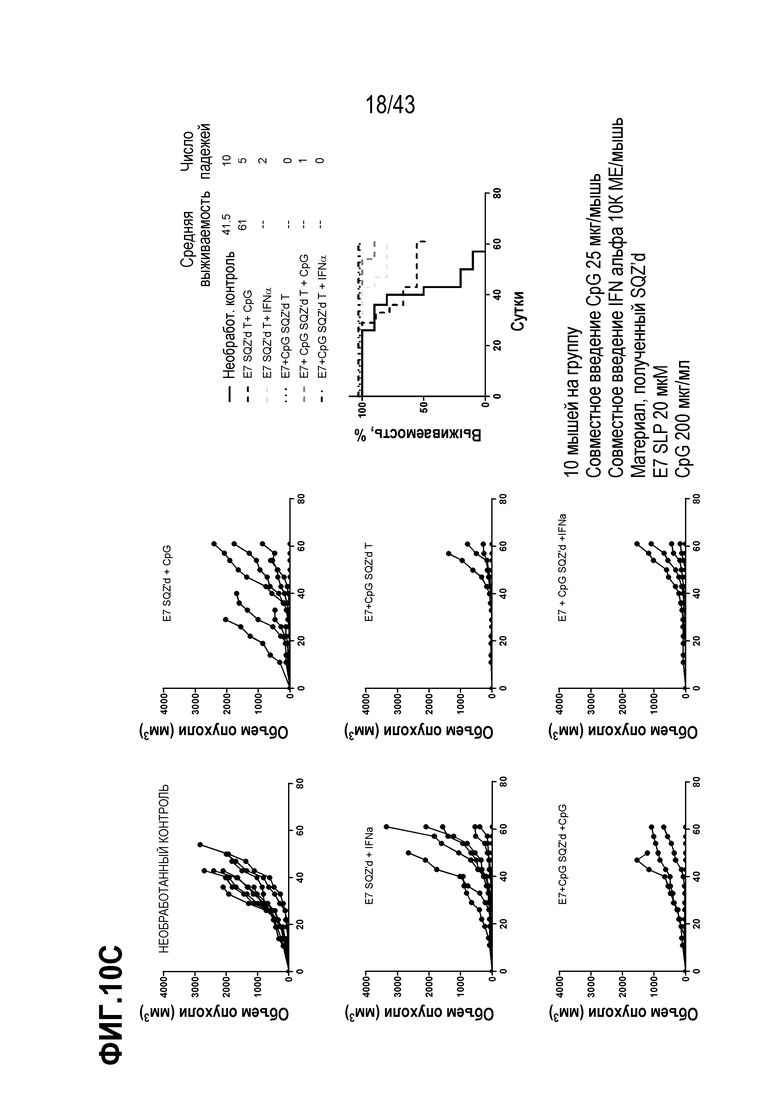
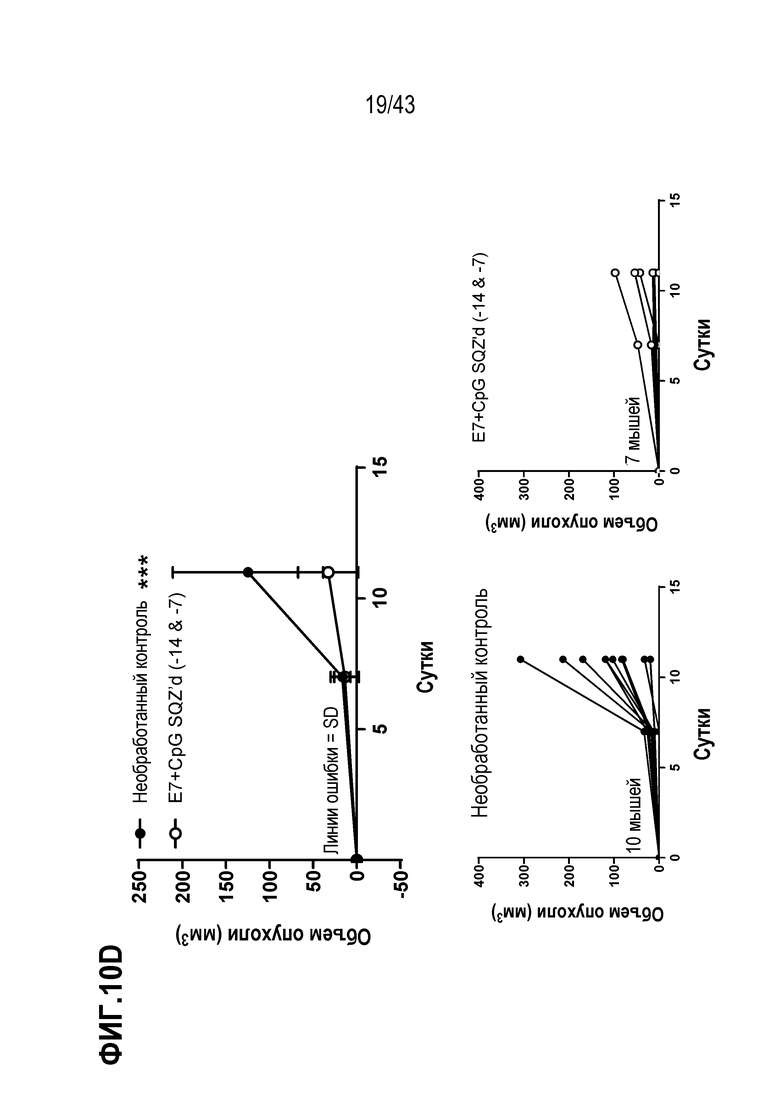
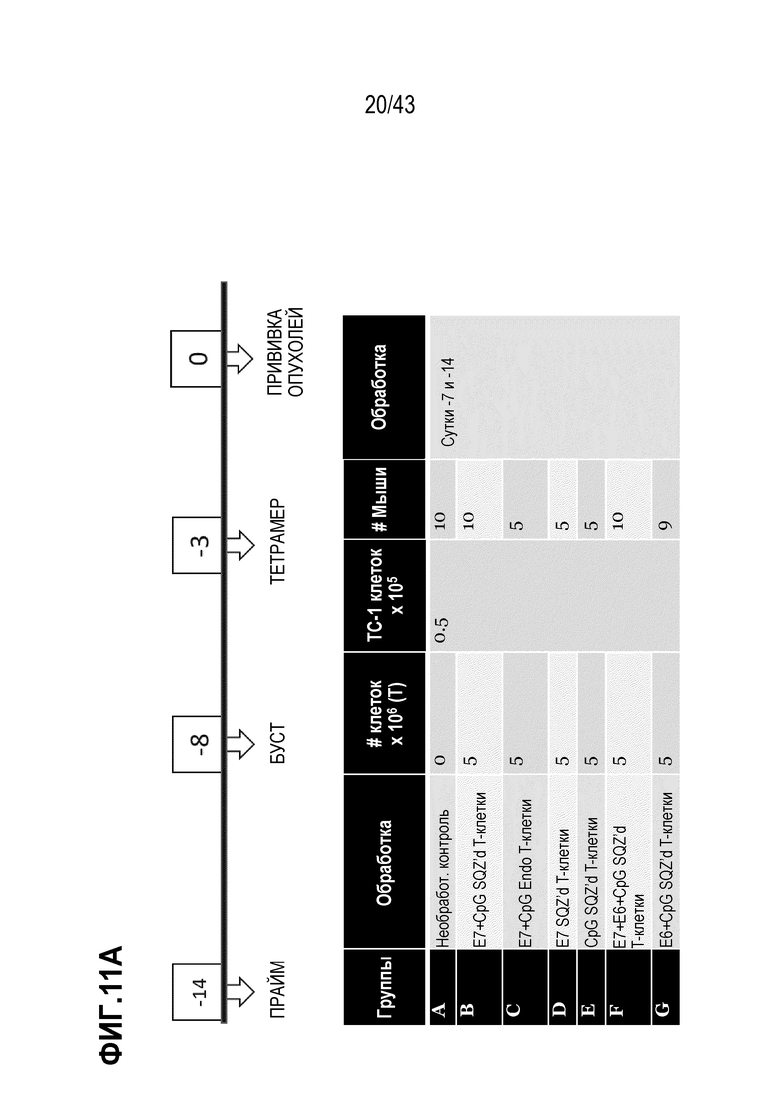
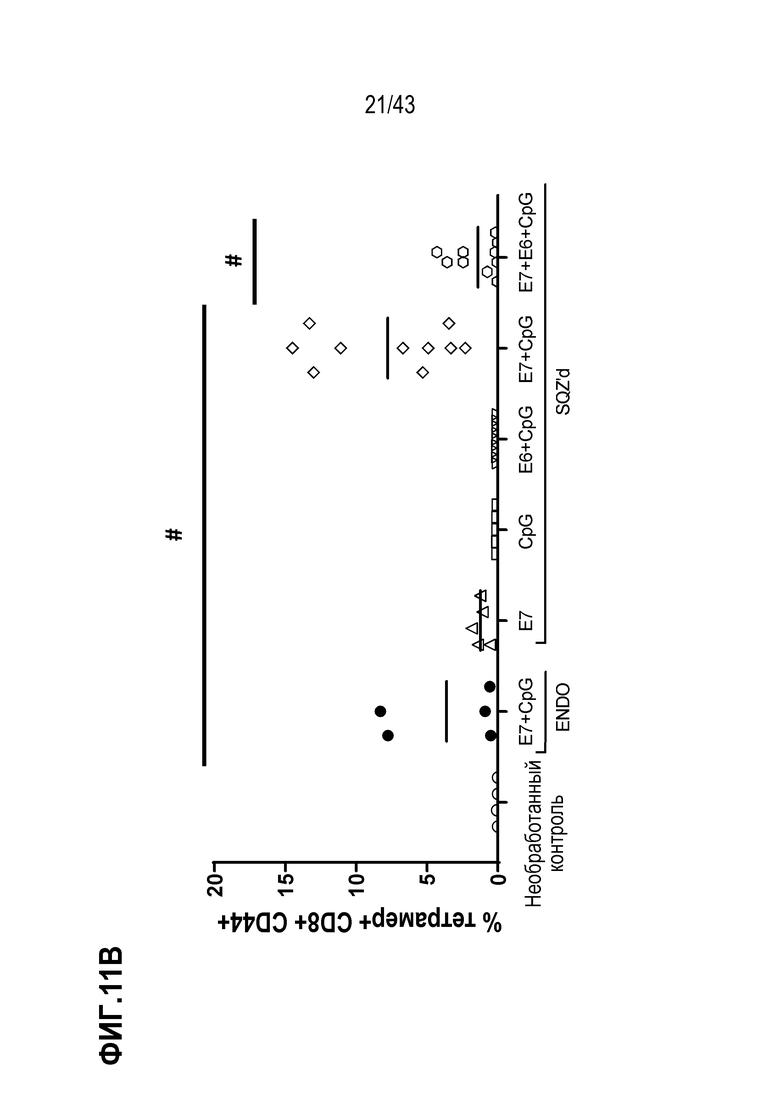
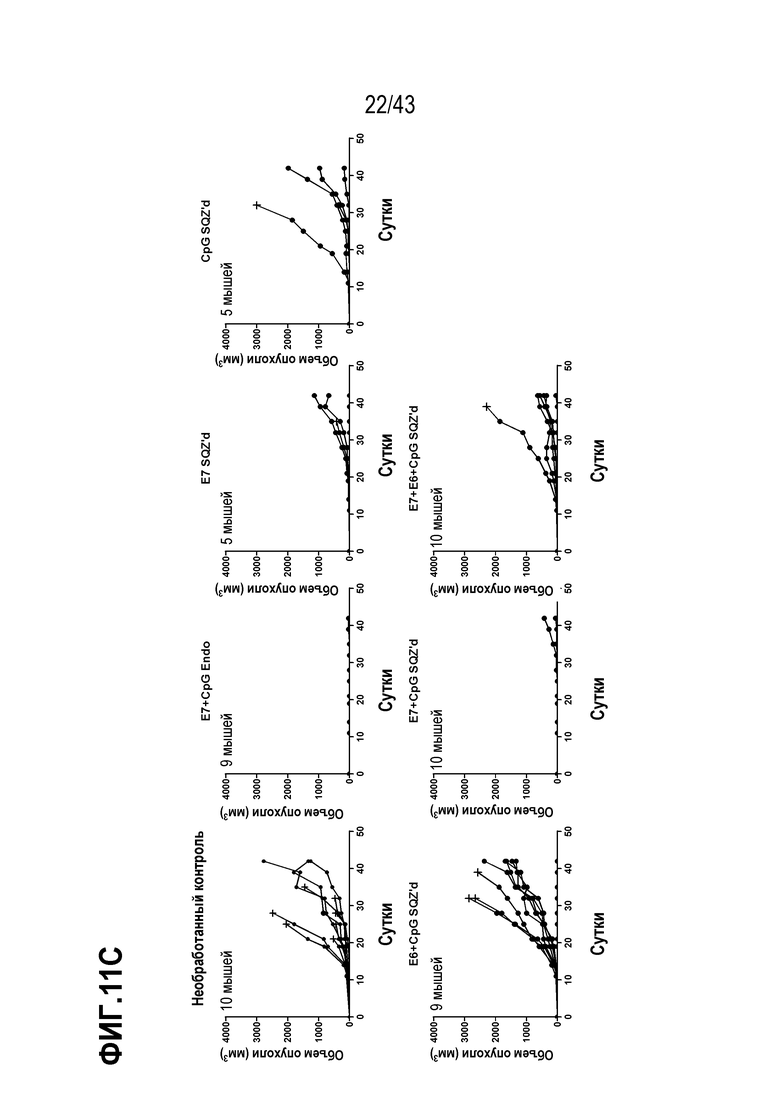
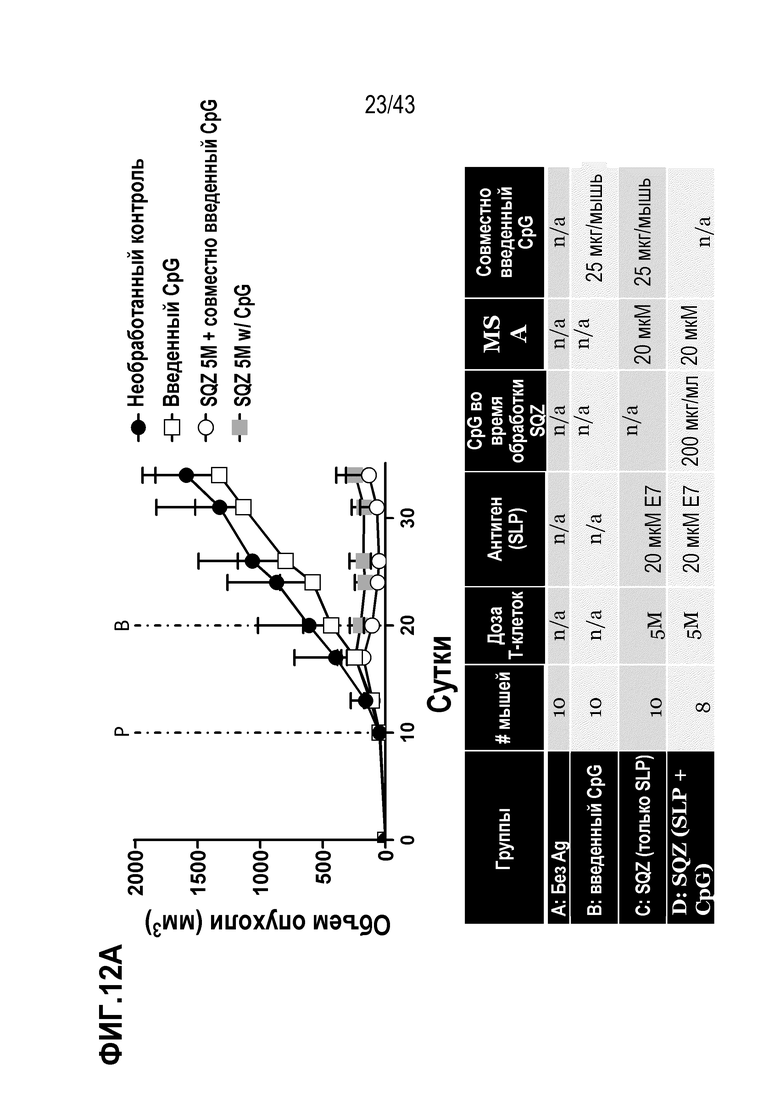
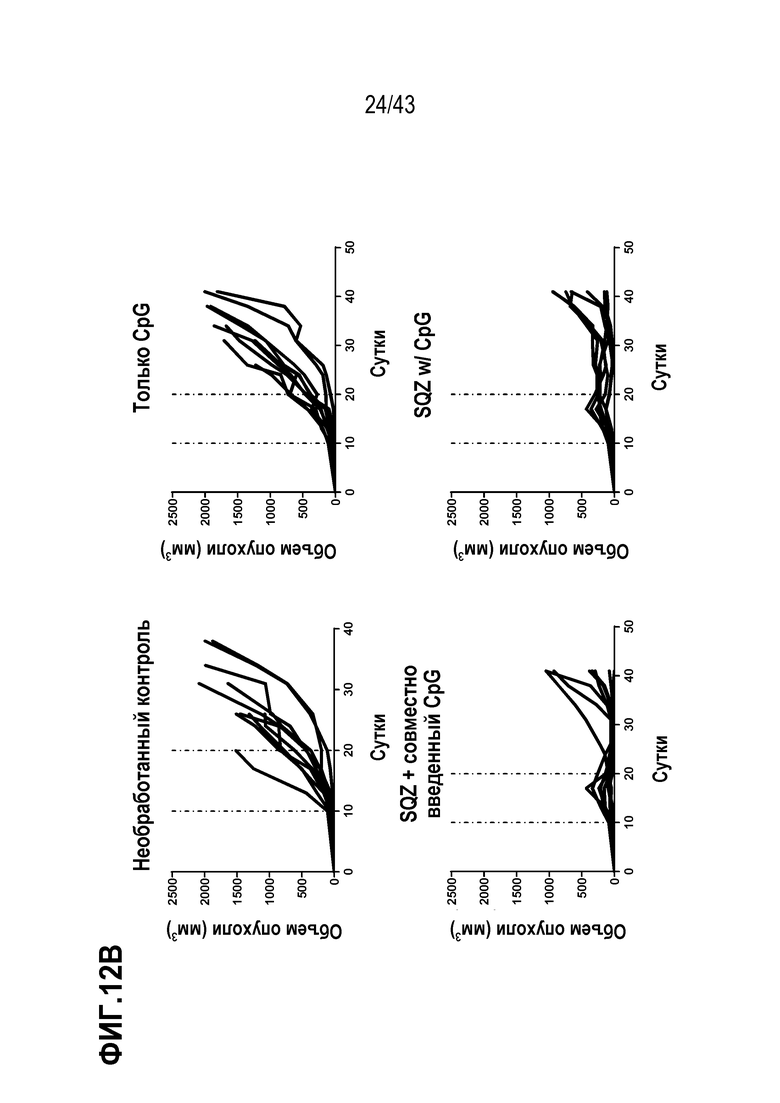
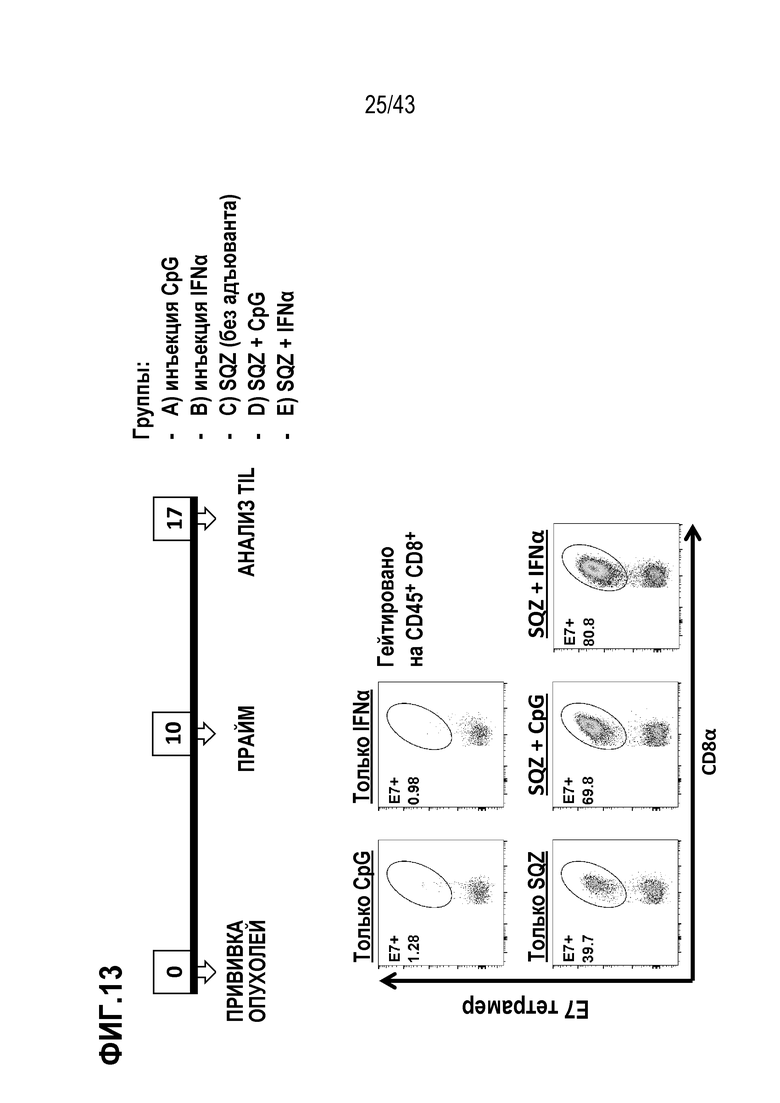
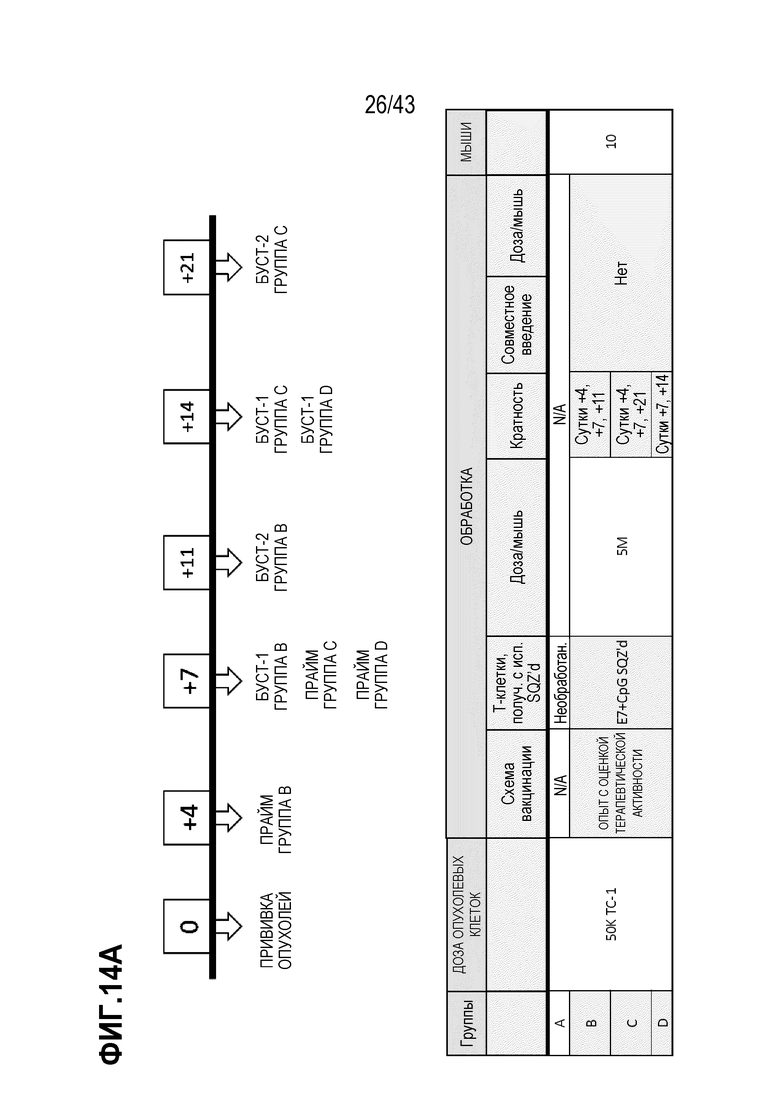
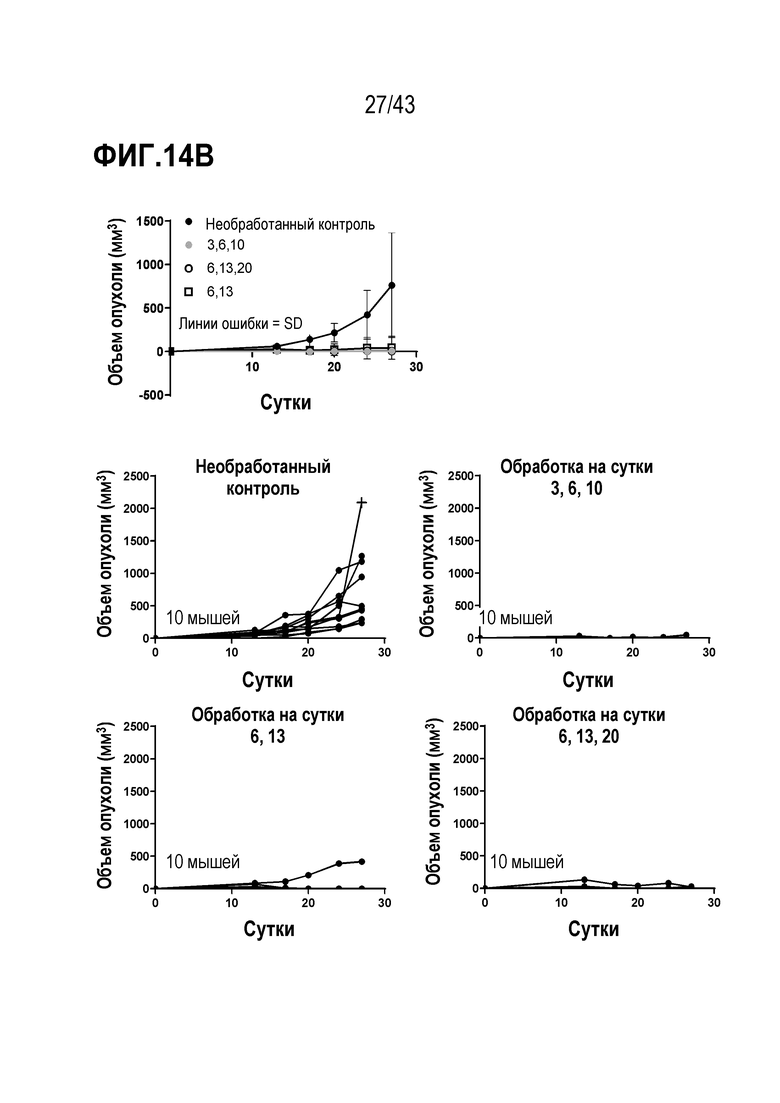
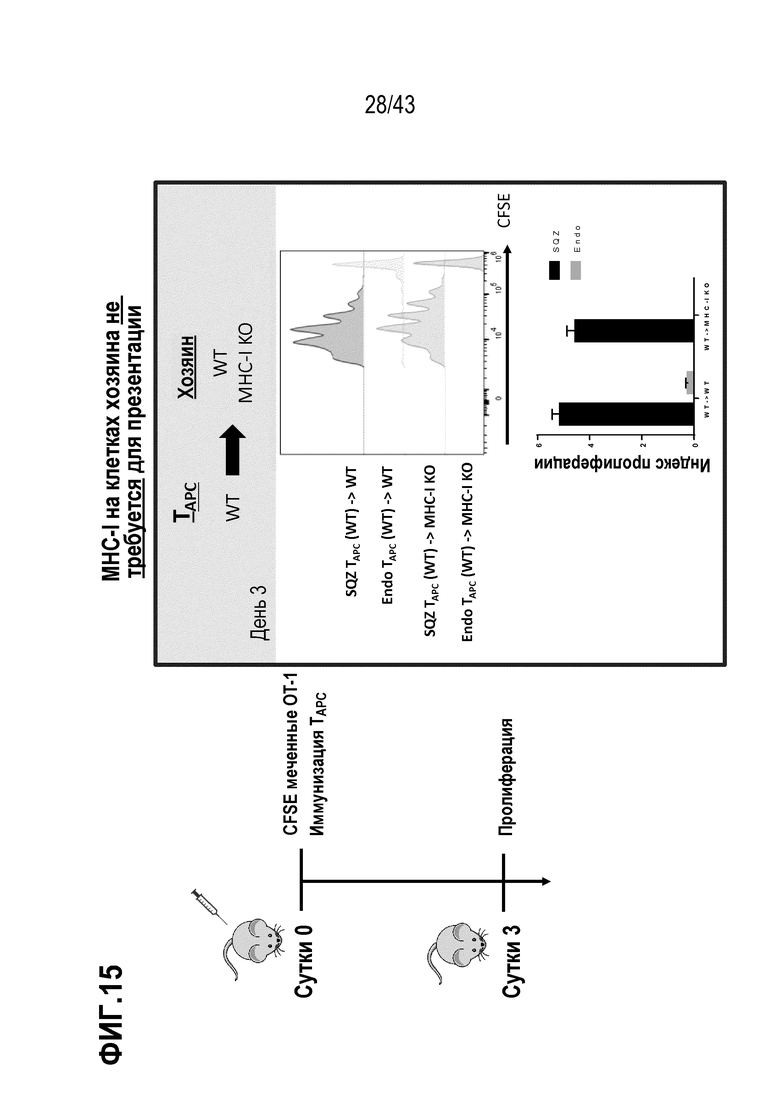
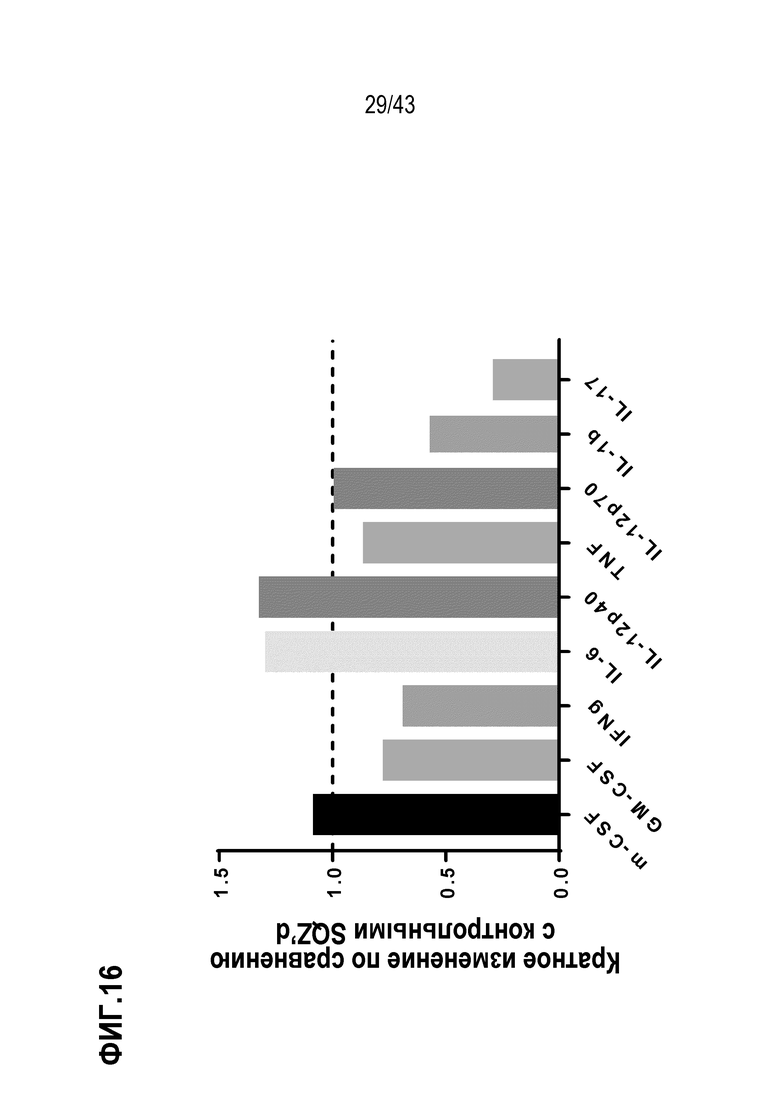
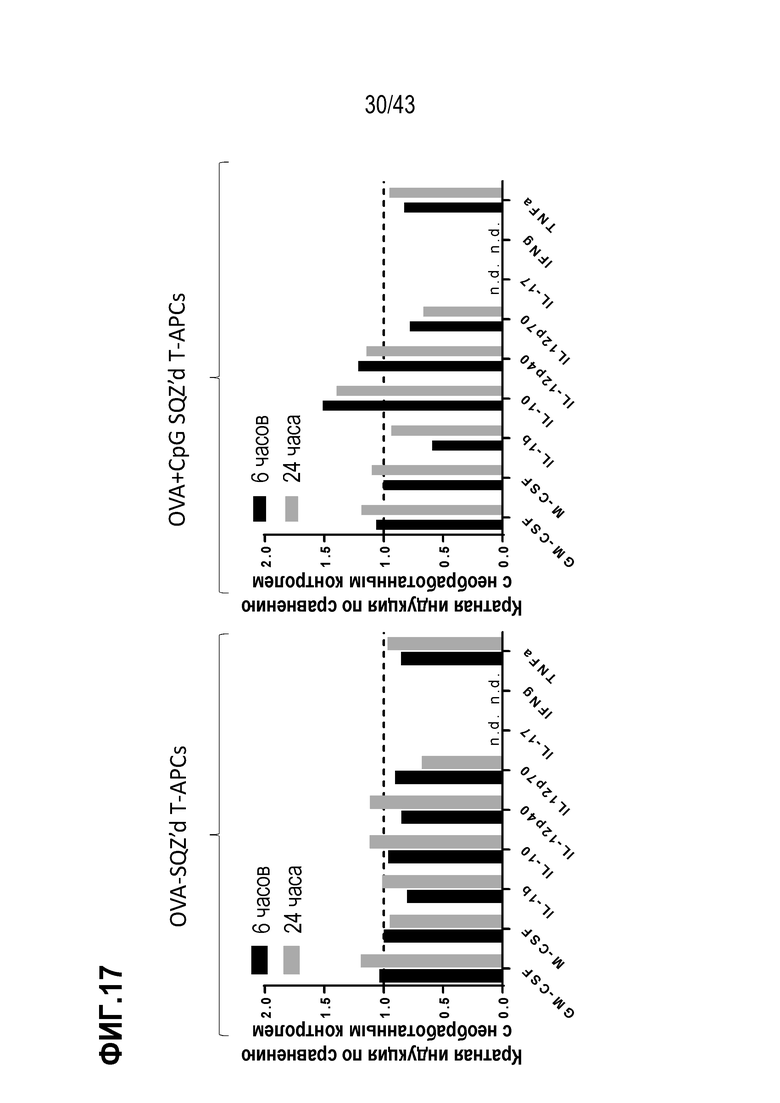
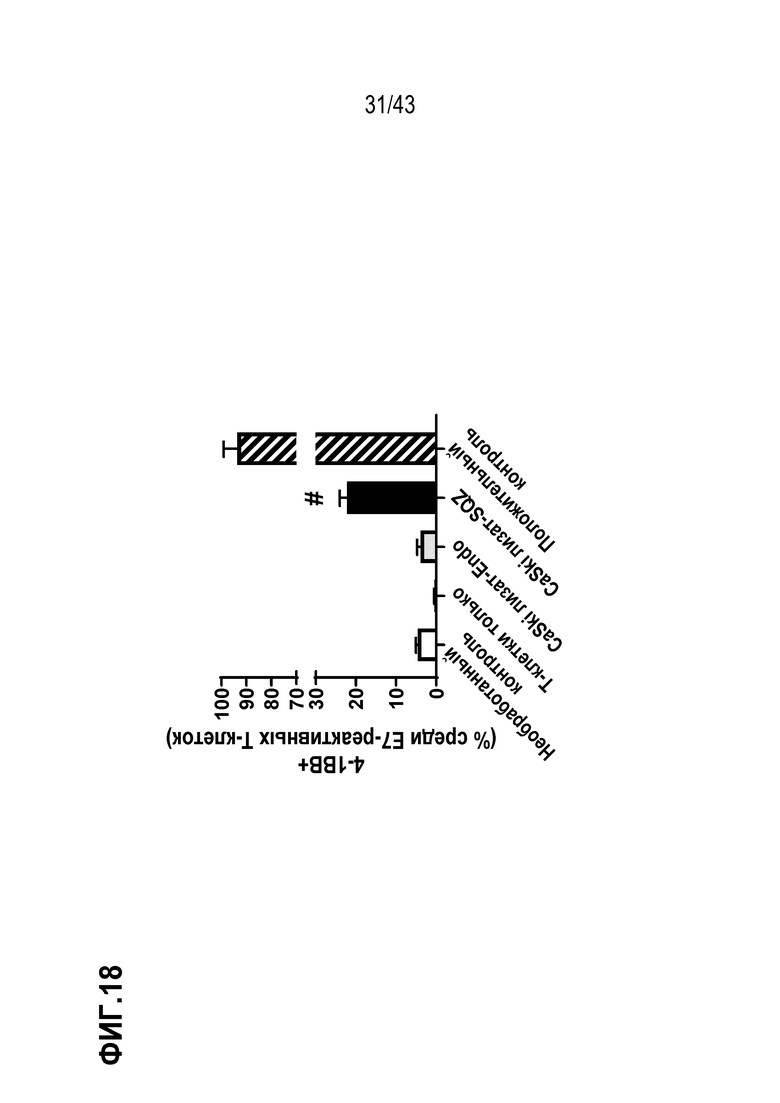
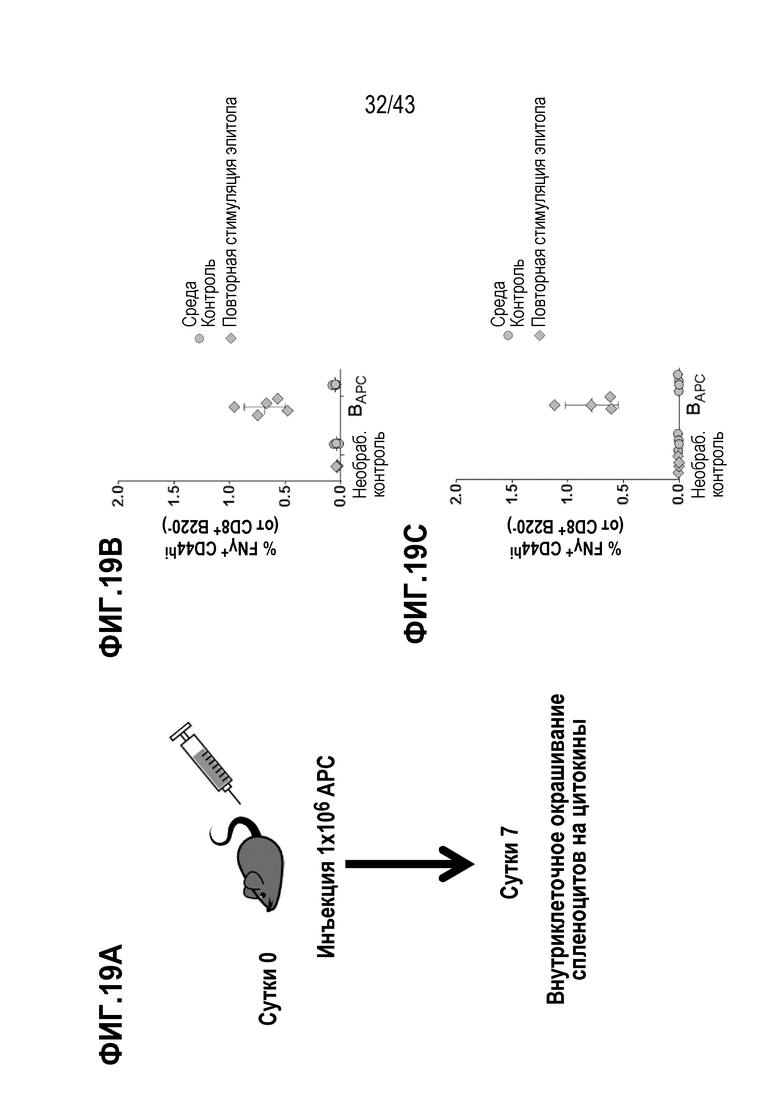
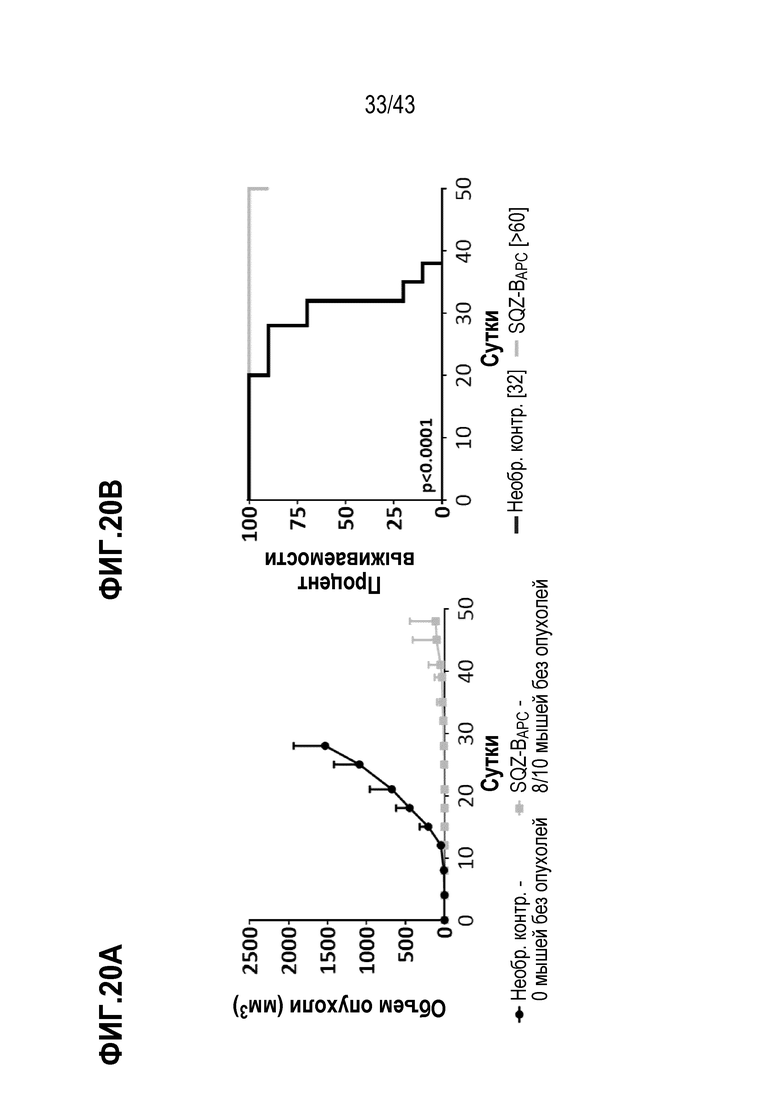
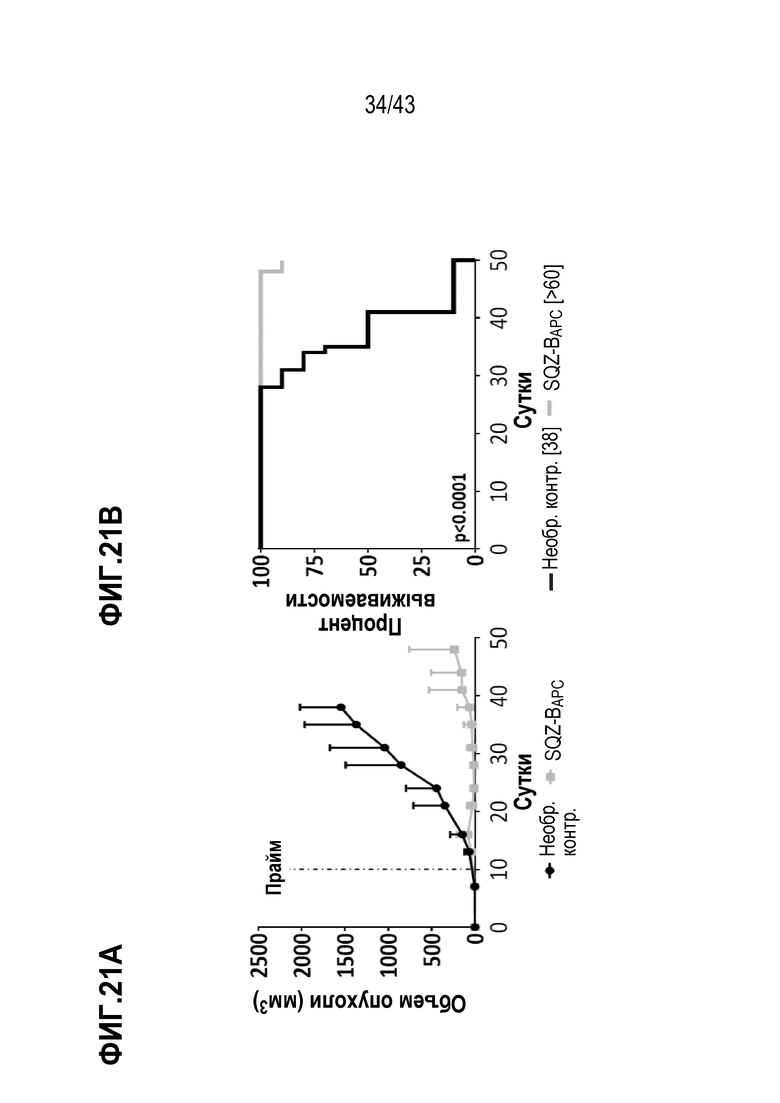
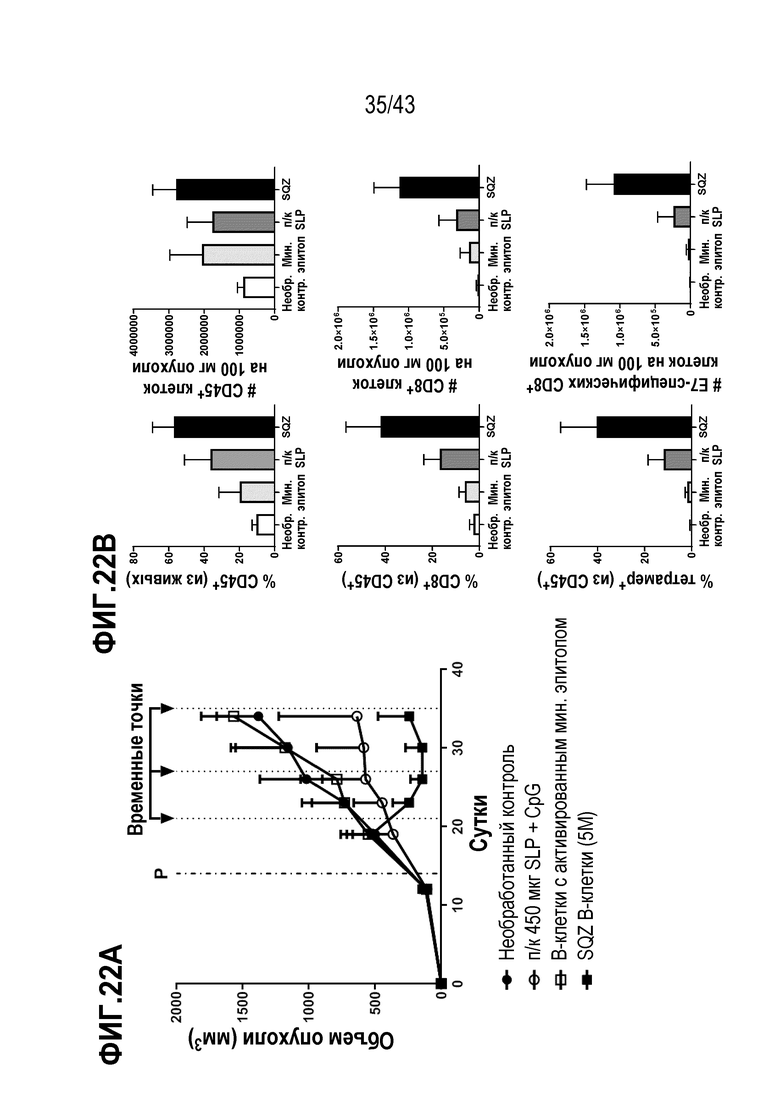
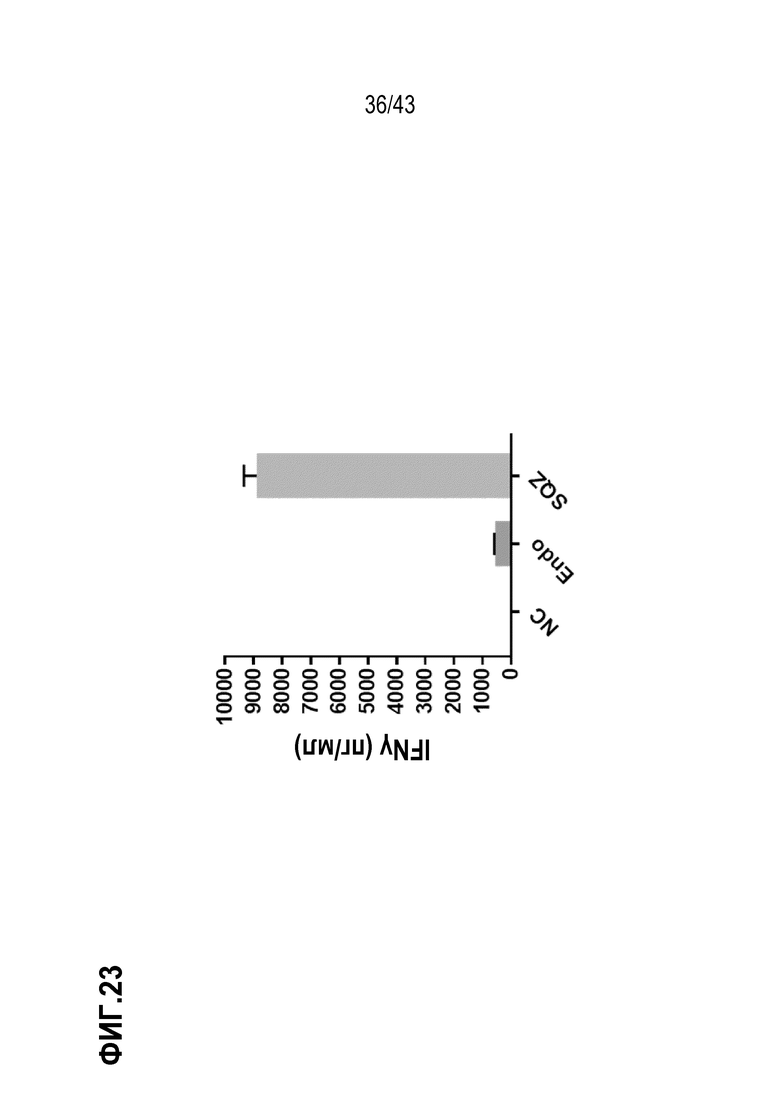
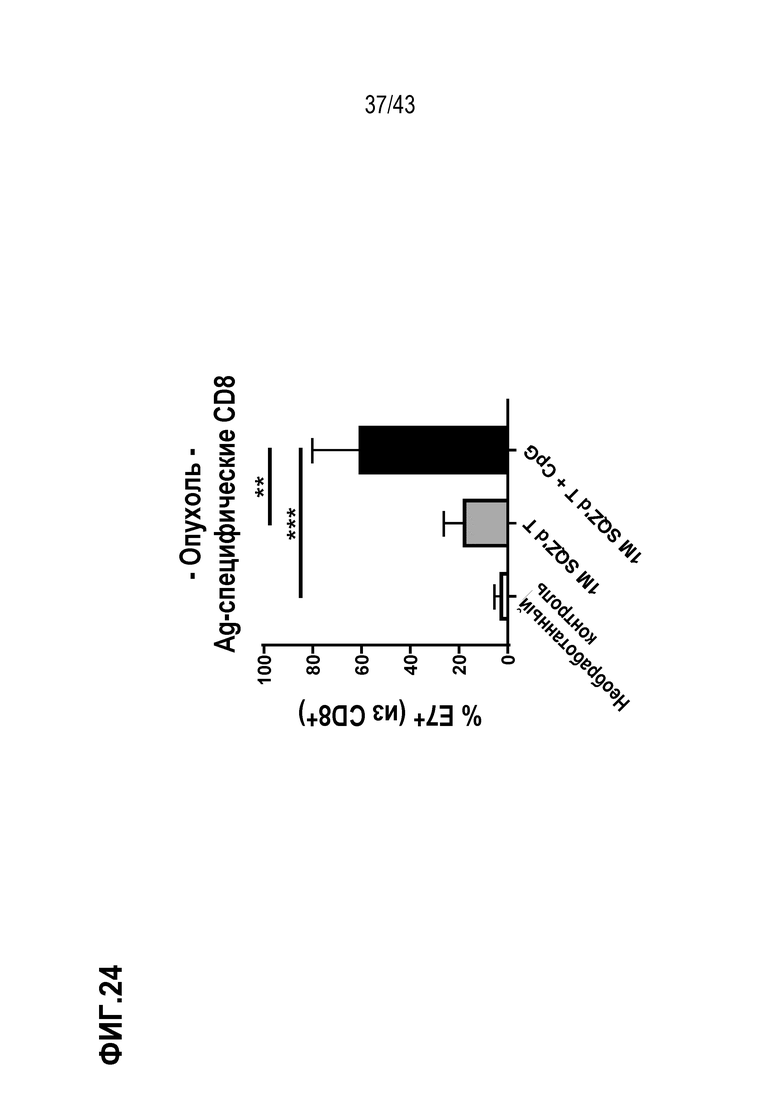
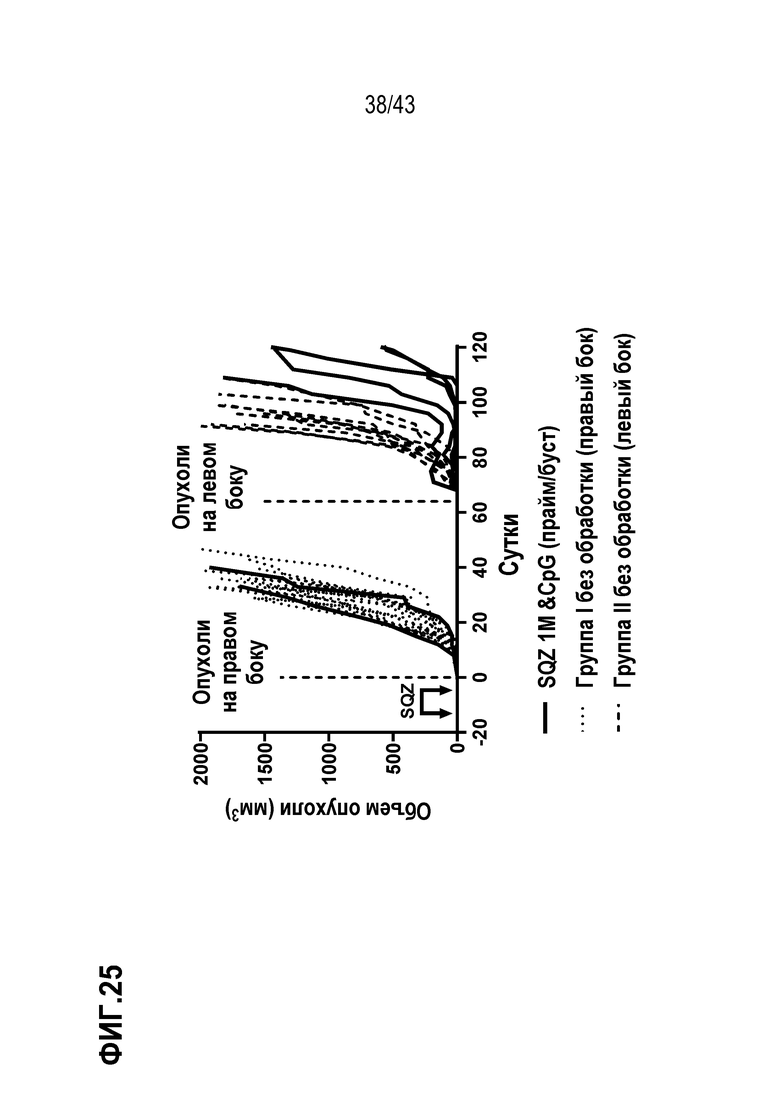
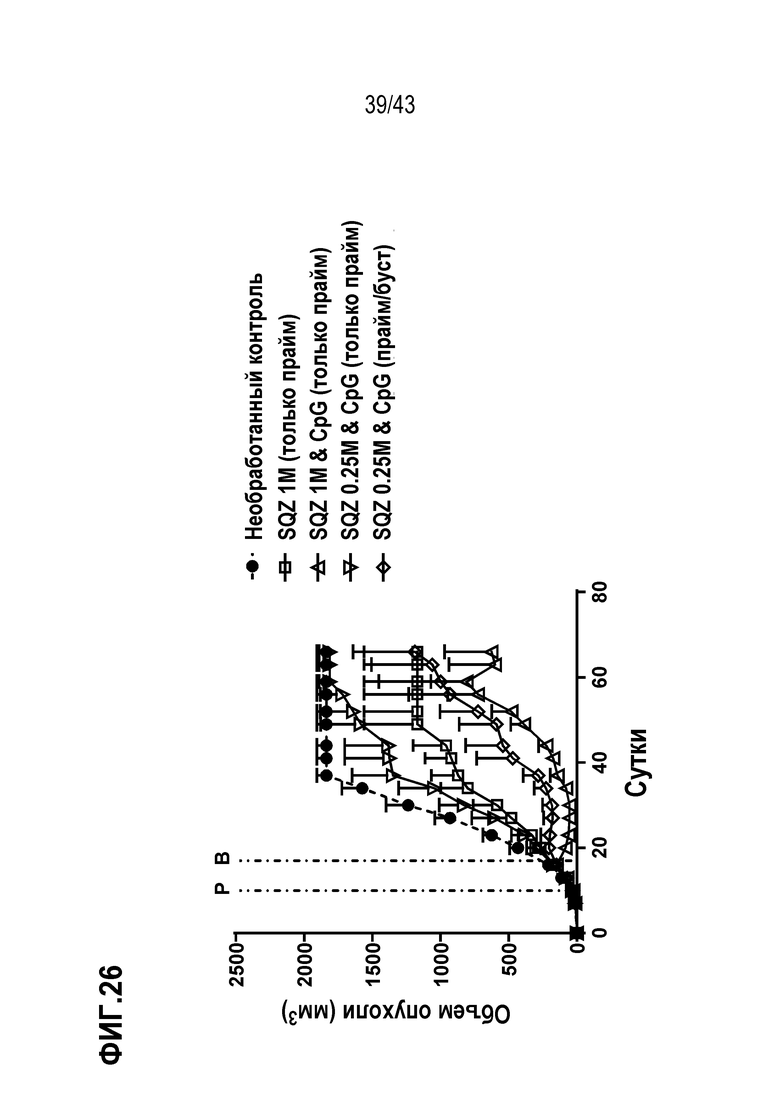
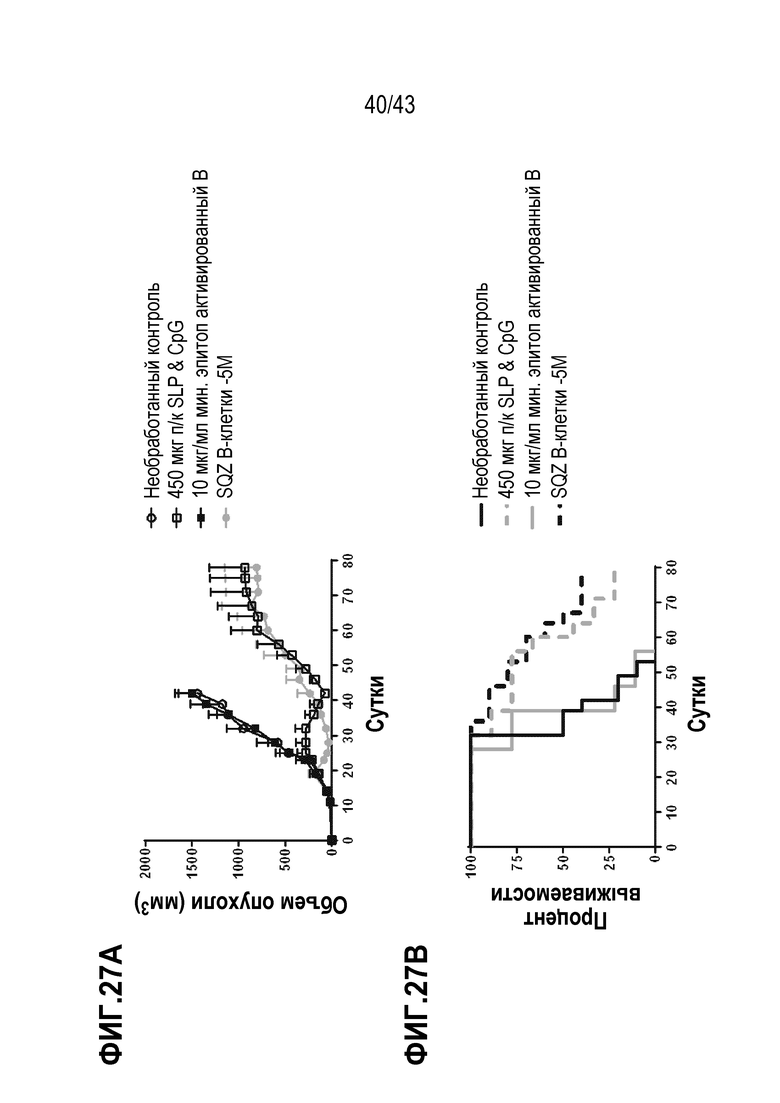
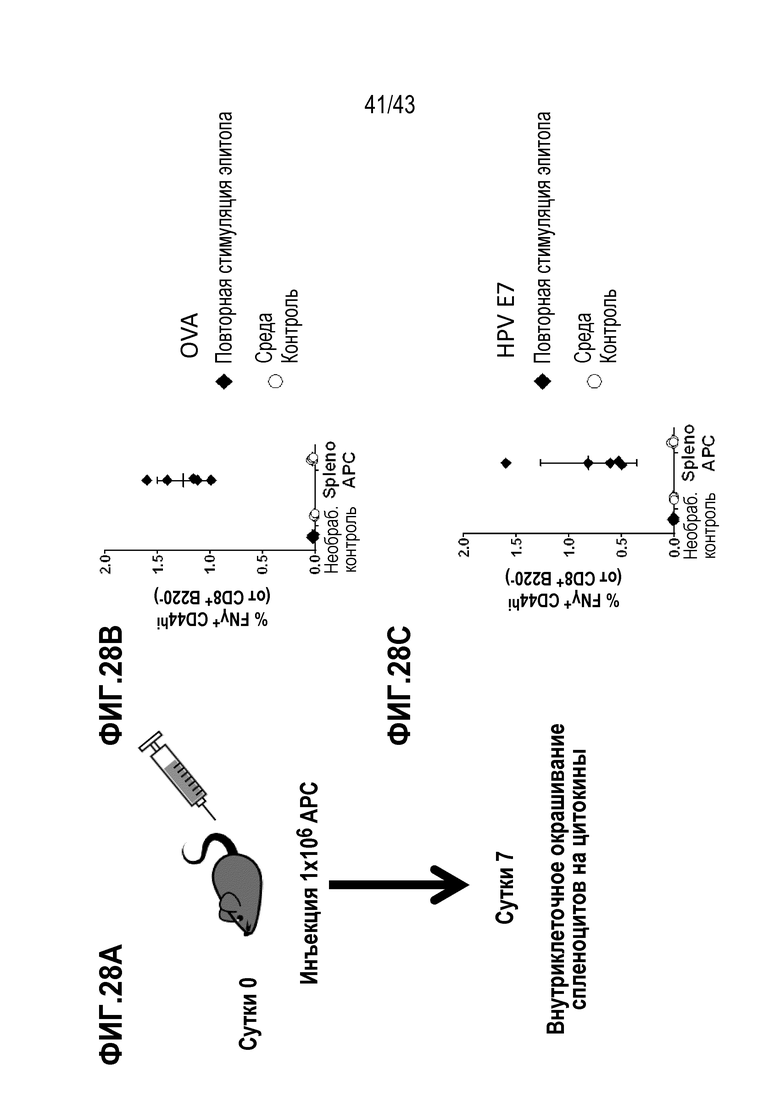
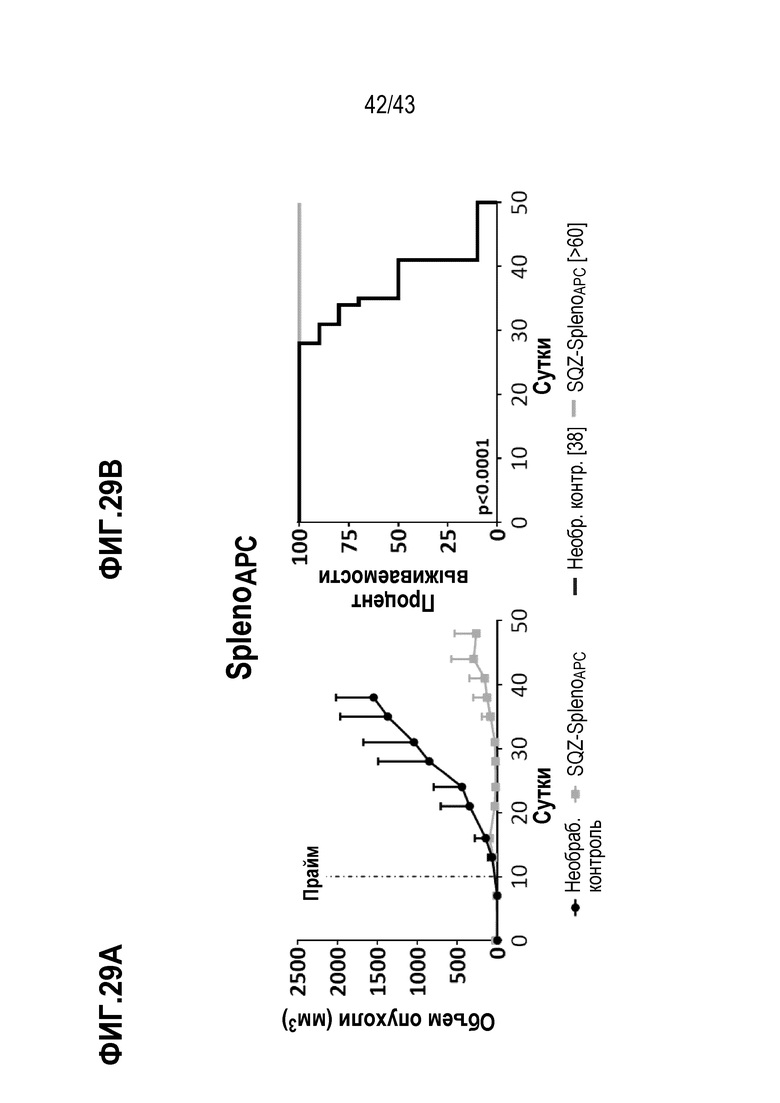
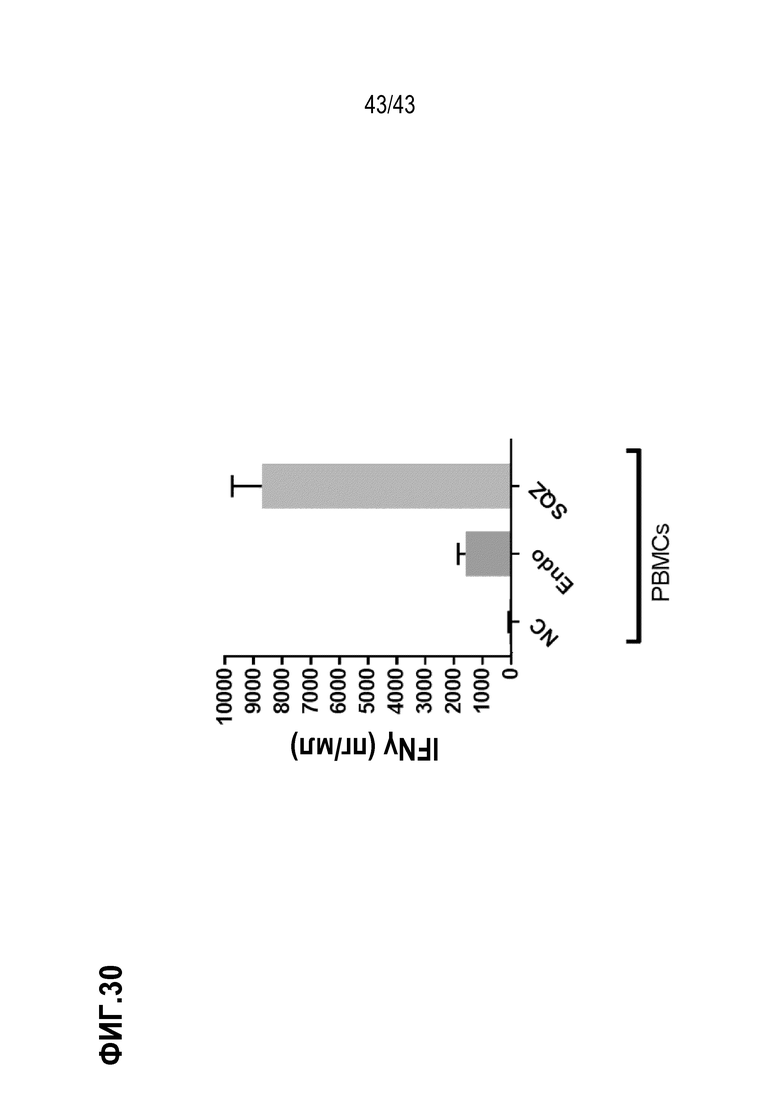
Группа изобретений относится к способу лечения или профилактики заболевания, ассоциированного с ВПЧ, и к композиции, содержащей модифицированные иммунные клетки, для лечения или профилактики заболевания, ассоциированного с ВПЧ. Модифицированные иммунные клетки включают мононуклеарные клетки периферической крови и содержат антиген ВПЧ и адьювант. Антиген ВПЧ не является полноразмерным белком. Антиген ВПЧ и/или адьювант внутриклеточно доставлены во входные иммунные клетки с получением модифицированных иммунных клеток пропусканием входных иммунных клеток через деформирующее клетку сужение, что вызывает пертурбации входных иммунных клеток. Осуществление группы изобретений обеспечивает индукцию сильного Т-клеточного ответа на антигены ВПЧ. 2 н. и 129 з.п. ф-лы, 51 ил., 30 пр.
1. Способ лечения или профилактики заболевания, ассоциированного с ВПЧ, включающий введение субъекту с заболеванием, ассоциированным с ВПЧ, композиции, содержащей модифицированные иммунные клетки, где модифицированные иммунные клетки включают мононуклеарные клетки периферической крови (PBMC), где модифицированные иммунные клетки содержат антиген ВПЧ и адъювант, где антиген ВПЧ не является полноразмерным белком, при этом антиген ВПЧ содержит аминокислотную последовательность, представленную в SEQ ID NO: 1 или SEQ ID NO: 3, где антиген ВПЧ и/или адъювант были внутриклеточно доставлены во входные иммунные клетки с получением модифицированных иммунных клеток пропусканием входных иммунных клеток через деформирующее клетку сужение, что вызывает пертурбации входных иммунных клеток, такие, чтобы антиген ВПЧ и/или адъювант вошли во входные иммунные клетки посредством пертурбаций при контакте с входными иммунными клетками.
2. Способ по п. 1, где диаметр деформирующего клетку сужения меньше диаметра входных иммунных клеток.
3. Способ по п. 1 или 2, где диаметр деформирующего клетку сужения составляет от 20% до 99% от диаметра входных иммунных клеток.
4. Способ по любому из пп. 1-3, где диаметр деформирующего клетку сужения составляет от 20% до менее чем 60% от диаметра входных иммунных клеток.
5. Способ по любому из пп. 1-4, где деформирующее клетку сужение находится внутри канала.
6. Способ по любому из пп. 1-5, где к входным иммунным клеткам была приложена деформирующая сила, когда они проходили через деформирующее клетку сужение.
7. Способ по любому из пп. 1-6, где антиген ВПЧ и/или адъювант находятся в цитозоле и/или эндосомах модифицированных иммунных клеток.
8. Способ по любому из пп. 1-7, где антиген и/или адъювант находятся во многих компартментах модифицированных иммунных клеток.
9. Способ по любому из пп. 1-8, где модифицированные иммунные клетки дополнительно содержат антиген ВПЧ и/или адъювант на внешней поверхности модифицированных иммунных клеток.
10. Способ по любому из пп. 1-9, где после введения иммунный ответ субъекта на антиген ВПЧ усиливается.
11. Способ по любому из пп. 1-10, где адъювант представляет собой CpG ODN, IFN-α, агонисты STING, агонисты RIG-I или поли I:C.
12. Способ по п. 11, где адъювант представляет собой CpG ODN.
13. Способ по п. 11 или 12, где CpG ODN представляет собой CpG ODN 1018, CpG ODN 1826 или CpG ODN 2006.
14. Способ по любому из пп. 1-13, где модифицированные иммунные клетки содержат более одного адъюванта.
15. Способ по любому из пп. 1-14, где антиген ВПЧ представляет собой пул множества полипептидов, которые вызывают ответ против одного и того же и/или разных антигенов ВПЧ.
16. Способ по п. 15, где антиген в пуле множества антигенов не снижает иммунный ответ, направленный на другие антигены в пуле множества антигенов.
17. Способ по любому из пп. 1-16, где антиген ВПЧ представляет собой полипептид, содержащий антигенный эпитоп ВПЧ и одну или более гетерологичных пептидных последовательностей.
18. Способ по любому из пп. 1-17, где антиген ВПЧ образует комплекс с самим собой, с другими антигенами или с адъювантом.
19. Способ по любому из пп. 1-18, где ВПЧ представляет собой антиген, полученный из клеточного лизата.
20. Способ по любому из пп. 1-19, где антиген ВПЧ представляет собой антиген ВПЧ-16.
21. Способ по п. 20, где антиген ВПЧ состоит из HLA-A2-рестриктированного эпитопа.
22. Способ по любому из пп. 1-21, где антиген ВПЧ представляет собой антиген ВПЧ E6 или антиген ВПЧ E7.
23. Способ по любому из пп. 1-22, где модифицированные иммунные клетки содержат антиген ВПЧ E6 и антиген ВПЧ E7.
24. Способ по любому из пп. 1-23, где антиген ВПЧ включает полипептид, содержащий антигенный эпитоп, который фланкирован на N-конце и/или C-конце одной или более гетерологичными пептидными последовательностями.
25. Способ по п. 24, где антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% идентичности последовательности с любой из SEQ ID NO: 18-25.
26. Способ по п. 25, где антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% идентичности последовательности с SEQ ID NO: 23.
27. Способ по любому из пп. 1-26, где антиген ВПЧ способен процессироваться в пептид, рестриктированный классом I MHC.
28. Способ по любому из пп. 1-27, где антиген ВПЧ способен процессироваться в пептид, рестриктированный классом II MHC.
29. Способ по любому из пп. 1-28, где модифицированные иммунные клетки содержат адъювант в концентрации от 0,1 мкМ до 1 мМ.
30. Способ по любому из пп. 1-29, где модифицированные иммунные клетки содержат антиген ВПЧ в концентрации от 0,1 мкМ до 1 мМ.
31. Способ по любому из пп. 1-30, где соотношение антигена ВПЧ и адъюванта в модифицированных иммунных клетках составляет от 10000:1 до 1:10000.
32. Способ по любому из пп. 1-31, где модифицированные иммунные клетки дополнительно содержат агент, который повышает жизнеспособность и/или функцию модифицированных иммунных клеток по сравнению с соответствующими модифицированными иммунными клетками, которые не содержат агента.
33. Способ по п. 32, где агент представляет собой соединение, усиливающее эндоцитоз, стабилизирующий агент или кофактор.
34. Способ по п. 32, где агент представляет собой альбумин.
35. Способ по п. 34, где альбумин представляет собой мышиный, бычий или человеческий альбумин.
36. Способ по п. 32, где агент представляет собой катион двухвалентного металла, глюкозу, АТФ, калий, глицерин, трегалозу, D-сахарозу, PEG1500, L-аргинин, L-глутамин или ЭДТА.
37. Способ по п. 32, где агент включает сывороточный альбумин мыши (MSA).
38. Способ по любому из пп. 1-37, где модифицированные иммунные клетки были дополнительно модифицированы для повышения экспрессии одной или более костимулирующих молекул.
39. Способ по п. 38, где одна или более костимулирующих молекул включает B7-H2, B7-1, B7-2, CD70, LIGHT, HVEM, CD40, 4-1BBL, OX40L, TL1A, GITRL, CD30L, TIM4, SLAM, CD48, CD58, CD155 или CD112.
40. Способ по п. 38 или 39, где модифицированные иммунные клетки были модифицированы таким образом, чтобы они содержали нуклеиновую кислоту, которая способна повышать экспрессию одной или более костимулирующих молекул.
41. Способ по любому из пп. 1-40, где PBMC включают Т-клетку, B-клетку, дендритную клетку, моноцит, макрофаг, миелоидную клетку, тучную клетку, естественную клетку-киллер, врожденную лимфоидную клетку или их комбинации.
42. Способ по любому из пп. 1-41, где PBMC не включают B-клетку.
43. Способ по любому из пп. 1-41, где PBMC представляют собой В-клетки.
44. Способ по любому из пп. 1-42, где PBMC представляют собой Т-клетки.
45. Способ по любому из пп. 1-40, где PBMC представляют собой смешанную популяцию клеток.
46. Способ по п. 44, где Т-клетки содержат дополнительную модификацию для модуляции экспрессии молекул MHC класса I.
47. Способ по п. 44, где Т-клетки содержат дополнительную модификацию для модуляции экспрессии молекул MHC класса II.
48. Способ по п. 46 или 47, где дополнительная модификация включает снижение экспрессии молекул MHC класса I и/или молекул MHC класса II.
49. Способ по п. 48, где экспрессия молекул MHC класса I и/или молекул MHC класса II снижена с использованием siРНК, shРНК, CRISPR/Cas9, ZFN, TALEN, Cre-рекомбиназы или мегануклеазы.
50. Способ по п. 46 или 47, где дополнительная модификация включает повышение экспрессии молекул MHC класса I и/или молекул MHC класса II.
51. Способ по п. 50, где экспрессия молекул МНС класса I и/или молекул МНС класса II повышена с использованием РНК или плазмидной ДНК.
52. Способ по любому из пп. 44 и 46-51, где Т-клетки включают одно или более из Т-хелперов, цитотоксических Т-клеток, Т-клеток памяти, CIK-клеток и естественных Т-клеток-киллеров.
53. Способ по любому из пп. 44 и 46-51, где Т-клетки включают одно или более из CD3+ Т-клеток, CD4+ Т-клеток, CD8+ Т-клеток, CD45RA+ Т-клеток, CD45RO+ Т-клеток и γδ-Т-клеток.
54. Способ по любому из пп. 1-53, где модифицированные иммунные клетки являются аллогенными для субъекта.
55. Способ по любому из пп. 1-53, где модифицированные иммунные клетки являются аутологичными для субъекта.
56. Способ по любому из пп. 1-55, дополнительно включающий введение субъекту дополнительного адъюванта.
57. Способ по п. 56, где дополнительный адъювант представляет собой IFNα или CpG ODN.
58. Способ по п. 56 или 57, где композицию, содержащую модифицированные иммунные клетки, и дополнительный адъювант вводят одновременно.
59. Способ по п. 56 или 57, где композицию, содержащую модифицированные иммунные клетки, и дополнительный адъювант вводят последовательно.
60. Способ по п. 59, где композицию, содержащую модифицированные иммунные клетки, вводят до введения дополнительного адъюванта.
61. Способ по п. 59, где композицию, содержащую модифицированные иммунные клетки, вводят после введения дополнительного адъюванта.
62. Способ по любому из пп. 1-61, дополнительно включающий введение субъекту ингибитора иммунных контрольных точек.
63. Способ по п. 62, где композицию, содержащую модифицированные иммунные клетки, и ингибитор иммунных контрольных точек вводят одновременно.
64. Способ по п. 62, где композицию, содержащую модифицированные иммунные клетки, и ингибитор иммунных контрольных точек вводят последовательно.
65. Способ по п. 64, где композицию, содержащую модифицированные иммунные клетки, вводят до введения ингибитора иммунных контрольных точек.
66. Способ по п. 64, где композицию, содержащую модифицированные иммунные клетки, вводят после введения ингибитора иммунных контрольных точек.
67. Способ по любому из пп. 62-66, где ингибитор иммунных контрольных точек нацелен на одно или более из PD-1, PD-L1, CTLA-4, LAG3, TIM-3, TIGIT, VISTA, TIM1, B7-H4 (VTCN1) или BTLA.
68. Способ по любому из пп. 1-67, дополнительно включающий введение субъекту химиотерапевтического средства.
69. Способ по п. 68, где композицию, содержащую модифицированные иммунные клетки, и химиотерапевтическое средство вводят одновременно.
70. Способ по п. 68, где композицию, содержащую модифицированные иммунные клетки, и химиотерапевтическое средство вводят последовательно.
71. Способ по п. 70, где композицию, содержащую модифицированные иммунные клетки, вводят до введения химиотерапевтического средства.
72. Способ по п. 70, где композицию, содержащую модифицированные иммунные клетки, вводят после введения химиотерапевтического средства.
73. Способ по любому из пп. 68-72, где химиотерапия включает препарат на основе платины.
74. Способ по любому из пп. 68-73, где химиотерапия включает цисплатин.
75. Способ по любому из пп. 1-74, где после введения происходит активация и/или экспансия цитотоксических Т-лимфоцитов (CTL), специфических для антигена ВПЧ.
76. Способ по любому из пп. 1-75, где после введения происходит активация и/или экспансия Т(Th)-хелперов, специфических для антигена.
77. Способ по любому из пп. 1-76, где композиция содержит от приблизительно 1×106 до приблизительно 1×1012 модифицированных иммунных клеток.
78. Способ по любому из пп. 1-77, который включает многократные введения композиции субъекту.
79. Способ по п. 78, где множественные введения включают первое введение композиции и второе введение композиции.
80. Способ по п. 79, где второе введение проводят приблизительно через один месяц после первого введения.
81. Способ по любому из пп. 1-80, где заболевание, ассоциированное с ВПЧ, представляет собой рак, ассоциированный с ВПЧ.
82. Способ по п. 81, где рак, ассоциированный с ВПЧ, представляет собой рак шейки матки, рак анального канала, орофарингеальный рак, рак влагалища, рак вульвы, рак полового члена, рак кожи или опухоли головы и шеи.
83. Способ по любому из пп. 1-80, где заболевание, ассоциированное с ВПЧ, представляет собой инфекционное заболевание, ассоциированное с ВПЧ.
84. Композиция, содержащая модифицированные иммунные клетки, для лечения или профилактики заболевания, ассоциированного с ВПЧ, где модифицированные иммунные клетки включают PBMC, где модифицированные иммунные клетки содержат адъювант и антиген ВПЧ, где антиген ВПЧ не является полноразмерным белком, при этом антиген ВПЧ содержит аминокислотную последовательность, представленную в SEQ ID NO: 1 или SEQ ID NO: 3, где адъювант и/или антиген ВПЧ были внутриклеточно доставлены во входные иммунные клетки с получением модифицированных иммунных клеток пропусканием входных иммунных клеток через деформирующее клетку сужение, что вызывает пертурбации входных иммунных клеток, такие, чтобы CpG ODN и антиген ВПЧ вошли во входные иммунные клетки посредством пертурбаций при контакте с входными иммунными клетками.
85. Композиция по п. 84, где антиген ВПЧ содержит аминокислотную последовательность с по меньшей мере 90% идентичности последовательности с SEQ ID NO: 23.
86. Композиция по п. 84 или 85, где диаметр деформирующего клетку сужения меньше диаметра входных иммунных клеток.
87. Композиция по любому из пп. 84-86, где диаметр деформирующего клетку сужения составляет от 20% до 99% от диаметра входных иммунных клеток.
88. Композиция по любому из пп. 84-87, где диаметр деформирующего клетку сужения составляет от 20% до менее чем 60% от диаметра входных иммунных клеток.
89. Композиция по любому из пп. 84-88, где деформирующее клетку сужение находится внутри канала.
90. Композиция по любому из пп. 84-89, где к входным иммунным клеткам была приложена деформирующая сила, когда они проходили через деформирующее клетку сужение.
91. Композиция по любому из пп. 84-90, где антиген ВПЧ и/или адъювант находится в цитозоле и/или эндосомах модифицированных иммунных клеток.
92. Композиция по любому из пп. 84-91, где антиген и/или адъювант находится во многих компартментах модифицированных иммунных клеток.
93. Композиция по любому из пп. 84-92, где модифицированные иммунные клетки дополнительно содержат антиген ВПЧ и/или адъювант на внешней поверхности модифицированных иммунных клеток.
94. Композиция по любому из пп. 84-93, где адъювант включает CpG ODN.
95. Композиция по п. 94, где CpG ODN представляет собой CpG ODN 1018, CpG ODN 1826 или CpG ODN 2006.
96. Композиция по любому из пп. 84-95, где модифицированные иммунные клетки содержат дополнительный адъювант.
97. Композиция по п. 96, где дополнительный адъювант включает IFN-α, агонисты STING, агонисты RIG-I или поли I:C.
98. Композиция по любому из пп. 84-97, где антиген ВПЧ представляет собой пул множества полипептидов, которые вызывают ответ против одного и того же или разных антигенов ВПЧ.
99. Композиция по п. 98, где антиген в пуле множества антигенов не снижает иммунный ответ, направленный на другие антигены в пуле множества антигенов.
100. Композиция по любому из пп. 84-99, где антиген ВПЧ представляет собой полипептид, содержащий антигенный эпитоп ВПЧ и одну или более гетерологичных пептидных последовательностей.
101. Композиция по любому из пп. 84-100, где антиген ВПЧ образует комплекс с самим собой, с другими антигенами, с адъювантом или с дополнительным адъювантом.
102. Композиция по любому из пп. 84-101, где антиген ВПЧ состоит из HLA-A2-рестриктированного эпитопа.
103. Композиция по любому из пп. 84-102, где антиген ВПЧ включает полипептид, содержащий антигенный эпитоп, фланкированный на N-конце и/или C-конце одной или более гетерологичными пептидными последовательностями.
104. Композиция по любому из пп. 84-103, где модифицированные иммунные клетки содержат CpG ODN в концентрации от 0,1 мкМ до 1 мМ.
105. Композиция по любому из пп. 84-104, где модифицированные иммунные клетки содержат CpG ODN в концентрации от 0,1 мкМ до 1 мМ.
106. Композиция по любому из пп. 84-105, где соотношение антигена ВПЧ и CpG ODN в модифицированных иммунных клетках составляет от 10000:1 до 1:10000.
107. Композиция по любому из пп. 84-106, где антиген ВПЧ способен процессироваться в пептид, рестриктированный классом II MHC.
108. Композиция по любому из пп. 84-107, где модифицированные иммунные клетки дополнительно содержат агент, который повышает жизнеспособность и/или функцию модифицированных иммунных клеток по сравнению с соответствующими модифицированными иммунными клетками, которые не содержат агента.
109. Композиция по п. 108, где агент представляет собой соединение, усиливающее эндоцитоз, стабилизирующий агент или кофактор.
110. Композиция по п. 108, где агент представляет собой альбумин.
111. Композиция по п. 110, где альбумин представляет собой мышиный, бычий или человеческий альбумин.
112. Композиция по п. 108, где агент представляет собой двухвалентный катион металла, глюкозу, АТФ, калий, глицерин, трегалозу, D-сахарозу, PEG1500, L-аргинин, L-глутамин или ЭДТА.
113. Композиция по п. 108, где агент включает мышиный сывороточный альбумин.
114. Композиция по любому из пп. 84-113, где модифицированные иммунные клетки были дополнительно модифицированы для повышения экспрессии одной или более костимулирующих молекул.
115. Композиция по п. 114, где одна или более костимулирующих молекул включают B7-H2 (ICOSL), B7-1 (CD80), B7-2 (CD86), CD70, LIGHT, HVEM, CD40, 4-1BBL, OX40L, TL1A, GITRL, CD30L, TIM4, SLAM, CD48, CD58, CD155 или CD112.
116. Композиция по п. 114 или 115, где модифицированные иммунные клетки были модифицированы таким образом, что они содержат нуклеиновую кислоту, которая способна повышать экспрессию одной или более костимулирующих молекул.
117. Композиция по любому из пп. 84-116, где PBMC включают Т-клетку, B-клетку, дендритную клетку, моноцит, макрофаг, миелоидную клетку, тучную клетку, естественную клетку-киллер, врожденную лимфоидную клетку или их комбинации.
118. Композиция по любому из пп. 84-117, где PBMC не включают В-клетку.
119. Композиция по любому из пп. 84-117, где PBMC представляют собой В-клетку.
120. Композиция по любому из пп. 84-117, где PBMC представляют собой Т-клетки.
121. Композиция по п. 120, где Т-клетки содержат дополнительную модификацию для модуляции экспрессии молекул MHC класса I.
122. Композиция по п. 120, где Т-клетки содержат дополнительную модификацию для модуляции экспрессии молекул MHC класса II.
123. Композиция по п. 121 или 122, где дополнительная модификация включает снижение экспрессии молекул MHC класса I и/или молекул MHC класса II.
124. Композиция по п. 123, где экспрессия молекул MHC класса I и/или молекул MHC класса II снижена с использованием siРНК, shРНК, CRISPR/Cas9, ZFN, TALEN, Cre-рекомбиназы или мегануклеазы.
125. Композиция по п. 121 или 122, где дополнительная модификация включает увеличение экспрессии молекул MHC класса I и/или молекул MHC класса II.
126. Композиция по п. 125, где экспрессия молекул MHC класса I и/или молекул MHC класса II повышена с использованием РНК или плазмидной ДНК.
127. Композиция по любому из пп. 120-126, где Т-клетки включают одно или более из Т-хелперов, цитотоксических Т-клеток, Т-клеток памяти, CIK-клеток и естественных Т-клеток-киллеров.
128. Композиция по любому из пп. 120-127, где Т-клетки включают одно или более из CD3+ Т-клеток, CD4+ Т-клеток, CD8+ Т-клеток, CD45RA+ Т-клеток, CD45RO+ Т-клеток и γδ-Т-клеток.
129. Композиция по любому из пп. 84-128, которая дополнительно содержит ингибитор иммунных контрольных точек.
130. Композиция по п. 129, где ингибитор иммунных контрольных точек нацелен на одно или более из PD-1, PD-L1, CTLA-4, LAG3, TIM-3, TIGIT, VISTA, TIM1, B7-H4 (VTCN1) или BTLA.
131. Композиция по любому из пп. 85-130, где эффективное количество композиции включает от 1×106 до 1×1012 модифицированных иммунных клеток.
| HUA LI WANG et al., "In vitro and in vivo evaluations of human papillomavirus type 16 (HPV16)-derived peptide-loaded dendritic cells (DCs) with a CpG oligodeoxynucleotide (CpG-ODN) adjuvant as tumor vaccines for immunotherapy of cervical cancer", ARCHIVES OF GYNECOLOGY AND OBSTETRICS,Vol | |||
| РЕЛЬСОВАЯ ПЕДАЛЬ | 1920 |
|
SU289A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Канатное устройство для подъема и перемещения сыпучих и раздробленных тел | 1923 |
|
SU155A1 |
| XIAN-ZHEN CHEN et al., | |||
Авторы
Даты
2023-07-11—Публикация
2019-03-11—Подача