Область техники
Изобретение относится к области медицины и генной инженерии, а именно к направляющим РНК и фрагментам ДНК и способам отбора клеток, которые могут быть использованы в системах CRISPR-Cas9 для получения линий клеток натуральных киллеров с нокаутированным геном PD-1 и повышенной продукцией белков TRAIL или Fas-лиганд.
Уровень техники
Способы лечения рака моноклональными антителами, развиваются с конца 1970-х годов, став основным направлением иммунотерапии, в основе которой лежит использование определенных звеньев иммунной системы для борьбы с опухолью. Способ иммунотерапии обладает преимуществами, но разработанные иммунотерапевтические препараты не универсальны и для одних типов рака подходят лучше, чем для других. Одни моноклональные антитела усиливают иммунный ответ на раковые клетки, присоединяясь к ним как сигнальный маячок, например препарат алемтузумаб, который связывается с антигеном CD52, присутствующим на лимфоцитах и который назначают при хроническом лимфоцитарном лейкозе. Другие блокируют опухолевые антигены, нарушая рост и размножение клетки, например, трастузумаб, который является антителом против поверхностного белка HER2 и помогает не разрастаться опухолям желудка и молочной железы, Третья подгруппа моноклональных антител нацелена на иммунные контрольные точки.
Один из наиболее перспективных подходов активации внутренних сил для борьбы с раком связан с применением моноклональных антител, блокирующих взаимодействие белков PD-1 и PD-L1, которое маскирует раковые клетки под здоровые. Известны два лекарственных средства на основе моноклональных антител против PD-1. Один производства компании MSD, другой - Bristol-Myers Sqibb. После нейтрализации PD-1 организм начинает распознавать опухолевые клетки как чужеродные и уничтожать их. Моноклональные антитела к PD-1 обладают большим терапевтическим потенциалом для лечения не только меланомы, но и немелкоклеточного рака легкого, почечно-клеточного рака.
Известен патент Японии №JP6157574, опубликованный 2017-07-05 и заявка Кореи №KR 20180093990, опубликованная 2018-08-22. В них рассматриваются способы изготовления моноклональных антител к PD-1 и новая терапевтическая стратегия для терапии антителом против PD-1 [1].
Другие технические решения основаны на использовании комбинации ингибиторов PD-1. Изобретение US 2016222121 (2016-08-04) описывает способы лечения гематологических раков с использованием комбинации ингибиторов PD-1 или PD-L1 и TIM-3, LAG-3 или CTLA-4. В одном варианте осуществления ингибитор PD-1 или PD-L1 вводят в комбинации с ингибитором TIM-3. В другом варианте осуществления ингибитор PD-1 или PD-L1 вводят в комбинации с ингибитором LAG-3. В еще одном варианте осуществления ингибитор PD-1 или PD-L1 вводят в комбинации с ингибитором CTLA-4 [2].
Другой подход связан с применением биспецифических моноклональных антител. Эти препараты состоят из частей двух разных моноклональных антител, благодаря чему способны одновременно прикрепляться к двум различным белкам. Например, препарат блинатумомаб для лечения редкой формы острого лимфоцитарного лейкоза. Одна часть молекулы препарата соединяется с CD 19, который содержится в некоторых клетках лейкемии и лимфомы, другая часть имеет сродство к белку CD3, обнаруженному в нормальных Т-клетках иммунной системы.
Известна заявка ЕР 3382009 (2018-10-03), в которой химерный антиген - рецептор-модифицированного иммунной эффекторной клетки PD-L1 блокирующий агент может включать в себя: растворимый PD-1; слитый пептид растворимого PD-1 и домен СН3 hIgG4e1-Fc; слитый пептид растворимого PD-1 и hIgG4e1-Fc; или специфическое антитело анти-PD-L1 [3].
В работе Djoke Hendriksa et al. [4] описано получение и исследовано применение белка anti - PD-L1:TRAIL, содержащий фрагмент PD-L1-блокирующего антитела, генетически сплавленного с внеклеточным доменом TRAIL (tumor necrosis factor-related apoptosis-induced ligand), который принадлежит к семейству TNF и представляет собой второй тип мембранных белков. TRAIL осуществляет апопотоз при взаимодействии с рецепторами смерти. В отличие от других цитокинов он взаимодействует с комплексом рецепторов: проапоптическими, рецепторами смерти, антиапоптическими. Проверка действия слитого белка anti - PD-LLTRAIL показала увеличение активации т-клеток, что привело к увеличению умерщвления линий раковой клетки и основных пациент-производных раковых клеток в смешанных экспериментах по культурам Т-клетки/раковой клетки.
Применение моноклональных и бифункциональных антител связано с возникновением множества побочных эффектов, поскольку антитела являются белками, которые вызывают как минимум аллергические реакции.
Известны подходы к лечению опухолей основанных на местном использовании векторов доставки, которые достигают высокого уровня экспрессии в опухолевой среде. В работе Modiano JF [5] рассматривается перспектива применения Fas ligand в иммунотерапии. Fas лиганд (FasL, CD95L) - это 40-КДА типа II трансмембранный белок, который связывается с ФАС (фенотипом CD95) рецептора и способствует запрограммированной клеточной смерти. Показано, что применение FasL вызывает системный противоопухолевый ответ, который задерживает или предотвращает прогрессирование и одновременно атакует отдаленные метастазы.
В настоящее время идет активная разработка Т - клеток, экспрессирующих новые химерные рецепторы третьего поколения. Известна заявка Китая №CN 103820454 (2014-05-28) и статья Su S. et al., опубликованная 2016-01-28 [6, 7], в которых описан способ нокаута гена PD1 человека с помощью системы редактирования генома CRISPR-Cas9 в Т-клетках. Изобретение относится к способу специфического нокаута гена PD1 человека с помощью CRISPR-Cas9 (кластеризованный регулярный промежуточный короткий палиндромный повтор) и sgRNA (однонаправленная РНК) в Т-клетках человека для лечения раковых больных.
Клинические данные, по применению CAR Т-клеток полученные при лечении рака, показали многообещающие результаты [8]. Тем не менее, существует высокий риск для пациента, а некоторые Т-клетки пациентов недостаточно эффективны для лечения даже после перенаправления TCR или CAR, вызывая модификацию аллогенных донорских Т-клеток. Этот подход ограничен временем и затратами на производство специфичных для пациента продуктов Т-клеток. Поэтому существует потребность в более безопасных способах модификации клеток, обойдя время и затраты на производство специфичных для пациента продуктов Т-клеток.
Эти недостатки устраняются при применении клеток натуральных, или естественных киллеров. Натуральные, или естественные киллеры (NK-клетки) охарактеризованы как лимфоциты врожденного иммунитета, обладающие противовирусной и противоопухолевой цитотоксической активностью. Посредством набора рецепторов NK-клетки распознают на поверхности клеток молекулы, экспрессия которых указывает на вирусную инфекцию, опухолеобразование или повреждения, вызванные клеточным стрессом [9, 10, 11].
Известно изобретение O'Dwyer М. Modified natural killer cells and natural killer cell lines having increased cytotoxicity US Patent №10,034,925 (2018-07-31), в котором для повышения цитотоксичности при лечении рака NK-клетки генетически модифицируют для удаления контрольных точек экспрессии выбранных из ингибирующих рецепторов, например PD1 и модифицируют для увеличения экспрессии мутантного варианта TRAIL лиганда [12].
Задачей настоящего изобретения является разработка новых генетических конструкций повышающих эффективность лечения опухолей с помощью новых типов клеток натуральных киллеров расширяющих арсенал новых лечебных средств.
Технический результат состоит в том, что заявленные способы (варианты) получения модифицированной линии NK-клеток, с нокаутированным геном PD-1 позволяют повышать эффективность апоптоза или лизиса раковых клеток млекопитающего.
Заявленные способы применения позволяют расширить спектр использования разработанных генноинженерных конструкций модифицированных линий NK-клеток для повышения эффективности лечения млекопитающих.
Сущность изобретения
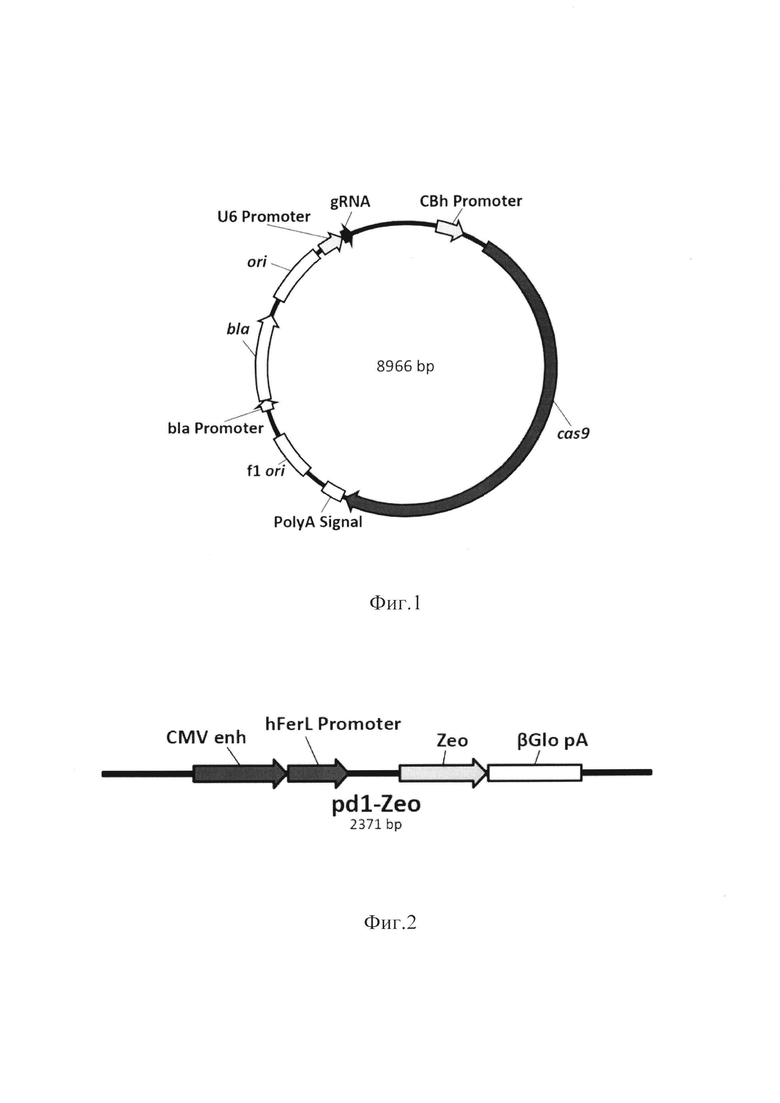
Одним из аспектов изобретения является способ получения модифицированной линии NK-клеток, с нокаутированным геном PD-1 для того, чтобы вызвать апоптоз или лизис раковых клеток млекопитающего. При этом для инактивации экспрессии гена PD-1 осуществляют выбор последовательностей направляющих РНК, специфичных к различным сайтам гена PD-1 входящим в группу SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, конструируют экспрессионные плазмидные вектора, входящие в группу pGR301, pGR302, pGR303, pGR304, кодирующие выбранную направляющую РНК и эндонуклеазу Cas9, проводят трансфекцию культуры NK-клеток одним из плазмидных векторов, окрашивают клетки анти PD-1 антителами, осуществляют клонирование и отбор, затем проводят вторичное культивирование клонов клеток и отбор клеток с помощью иммуноблоттинга с анти PD-1 антителами. При этом, в состав плазмидного вектора с физической картой, представленной на фиг.1 входят: 295-572 bp - CBh promoter; 819-5090 bp - эндонуклеаза Cas9; 5121-5328 bp - PolyA Signal; 5552-6007 bp - f1 ori; 6289-6393 bp - bla promoter; 6394-7254 bp - bla; 7425-8013 bp - ColE1 ori; 8075-8315 bp - U6 promoter; 8322-8419 bp - последовательность, кодирующая направляющую РНК.
Другим аспектом настоящего изобретения является применение модифицированной линии NK-клеток, с нокаутированным геном PD-1 для того, чтобы вызвать апоптоз или лизис раковых клеток млекопитающего, включающее введение млекопитающему эффективного количества клетки-киллера (NK).
Следующим аспектом настоящего изобретения является способ отбора модифицированных NK-клеток с нокаутированным геном PD-1, который проводят с помощью селективного маркера зеоцина, при этом для инактивации экспрессии гена PD-1 осуществляют выбор последовательностей направляющих РНК, специфичных к различным сайтам гена PD-1 входящим в группу SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, конструируют экспрессионные плазмидные вектора, входящие в группу pGR301, pGR302, pGR303, pGR304, кодирующие выбранную направляющую РНК и эндонуклеазу Cas9, осуществляют синтез фрагмента донорской ДНК, кодирующей экспрессионную кассету для устойчивости клеток к зеоцину (SEQ ID NO: 9), проводят трансфекцию культуры NK-клеток смесью плазмидного вектора и фрагмента донорской ДНК, осуществляют культивирование клеток в селективной среде с зеоцином, проводят окрашивание выживших клеток анти PD-1 антителами, осуществляют отбор и клонирование клеток с минимальным сигналом с помощью проточного сортера, проводят вторичное культивирование клонов клеток и отбор клеток с помощью иммуноблоттинга с анти PD-1 антителами. При этом, в состав плазмидного вектора с физической картой, представленной на фиг. 1 входят: 295-572 bp - CBh promoter; 819-5090 bp - эндонуклеаза Cas9; 5121-5328 bp - PolyA Signal; 5552-6007 bp - f1 ori; 6289-6393 bp - bla promoter; 6394-7254 bp - bla; 7425-8013 bp - ColE1 ori; 8075-8315 bp - U6 promoter; 8322-8419 bp - последовательность, кодирующая направляющую РНК.
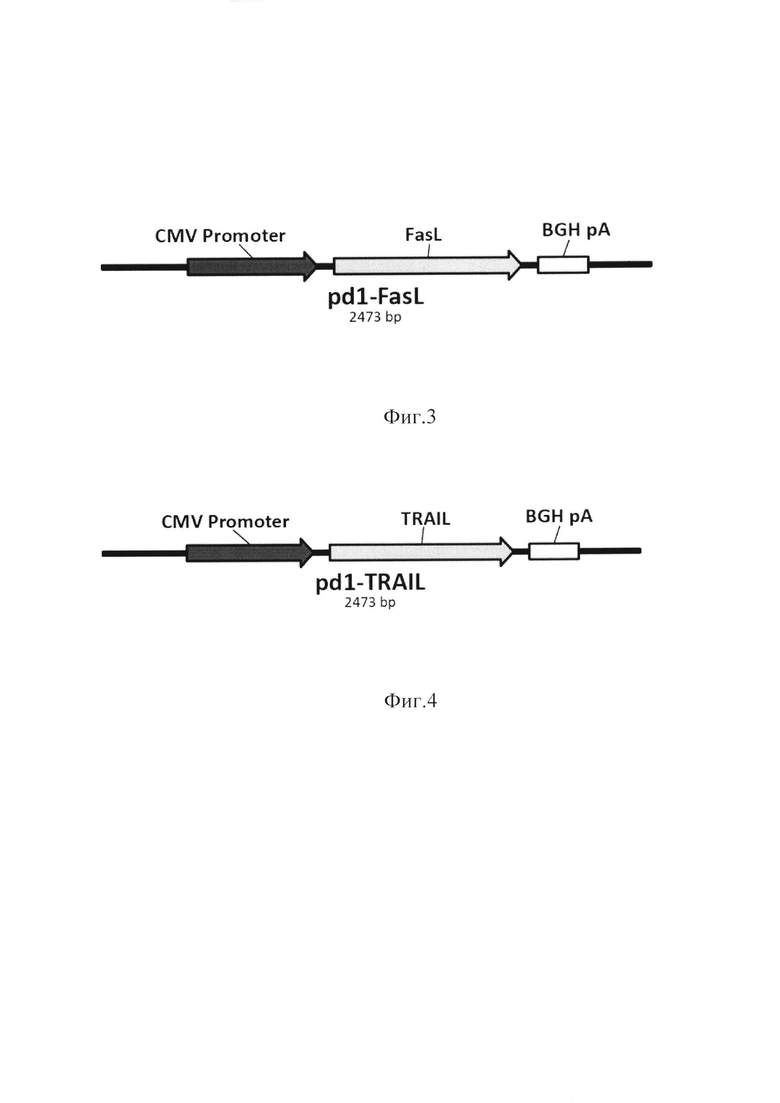
При этом, в состав донорской ДНК размером 2,371 тыс.пар оснований, обеспечивающей инактивацию экспрессии гена PD-1 с одновременной активацией экспрессии в NK-клетке белка зеоцин, входят: фрагмент содержащий последовательность первой части гена pd1 размером 379 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 10; фрагмент содержащий последовательность CMV энхансера размером 405 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 11; фрагмент содержащий последовательность - hFerL Promoter размером 263 пар оснований характеризующий нуклеотидной последовательностью, представленной в SEQ ID NO: 12; фрагмент содержащий последовательность - Zeo - ген резистентности к зеоцину размером 375 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 13; фрагмент содержащий последовательность βGlo poly А Signal размером 401 пара оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 14; фрагмент содержащий последовательность второй части гена pd1 размером 276 пар оснований характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 15.
Другим аспектом настоящего изобретения является способ получения модифицированной линии NK -клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией Fas-лиганда, в котором, для инактивации экспрессии гена PD-1, осуществляют выбор последовательностей направляющих РНК, специфичных к различным сайтам гена PD-1 входящим в группу SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, конструируют экспрессионные плазмидные вектора, входящие в группу pGR301, pGR302, pGR303, pGR304, кодирующие выбранную направляющую РНК и эндонуклеазу Cas9, осуществляют синтез фрагмента донорской ДНК, кодирующей экспрессионную кассету для Fas-лиганда (SEQ ID NO: 16), проводят трансфекцию культуры NK-клеток смесью плазмидного вектора и фрагмента донорской ДНК, осуществляют культивирование клеток, проводят окрашивание выживших клеток анти PD-1 антителами и анти Fas-лиганд антителами, осуществляют отбор и клонирование клеток с минимальным сигналом для PD-1 и максимальным сигналом для Fas-лиганда с помощью проточного сортера, проводят вторичное культивирование клонов клеток и отбор клеток с помощью иммуноблоттинга с анти PD-1 антителами и анти Fas-лиганд антителами.
При этом, в состав плазмидного вектора с физической картой, представленной на фиг.1 входят: 295-572 bp - CBh promoter; 819-5090 bp - эндонуклеаза Cas9; 5121-5328 bp - PolyA Signal; 5552-6007 bp - f1 ori; 6289-6393 bp - bla promoter; 6394-7254 bp - bla; 7425-8013 bp - ColE1 ori; 8075-8315 bp - U6 promoter; 8322-8419 bp - последовательность, кодирующая направляющую РНК. Где в состав донорской ДНК размером 2,473 тыс. пар оснований, обеспечивающей инактивацию экспрессии гена PD-1 с одновременной активацией экспрессии в NK-клетке белка Fas-ligand входят: фрагмент содержащий последовательность первой части гена pd1 размером 379 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 10; фрагмент содержащий последовательность CMV Promoter размером 588 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 17; фрагмент содержащий последовательность - Fas-ligand размером 846 пар оснований характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 18; фрагмент содержащий последовательность - BGH polyA Signal размером 225 пар оснований характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 19; фрагмент содержащий последовательность второй части гена pd1 размером 276 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 15.
Следующим аспектом настоящего изобретения является применение модифицированной линии NK -клеток, с нокаутированным геном PD-1 и конститутивной повышенной экспрессией Fas-лиганда для того, чтобы вызвать апоптоз или лизис раковых клеток млекопитающего, включающее введение млекопитающему эффективного количества клетки-киллера (NK).
Другим аспектом настоящего изобретения является способ получения модифицированной линии NK-клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией TRAIL для того, чтобы вызвать апоптоз или лизис раковых клеток млекопитающего. Где для инактивации экспрессии гена PD-1, осуществляют выбор последовательностей направляющих РНК, специфичных к различным сайтам гена PD-1, входящим в группу SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, конструируют экспрессионные плазмидные вектора, входящие в группу pGR301, pGR302, pGR303, pGR304, кодирующие выбранную направляющую РНК и эндонуклеазу Cas9, осуществляют синтез фрагмента донорской ДНК, кодирующей экспрессионную кассету для TRAIL (SEQ ID NO: 20), проводят трансфекцию культуры NK-клеток смесью плазмидного вектора и фрагмента донорской ДНК, осуществляют культивирование клеток, проводят окрашивание выживших клеток анти PD-1 антителами и анти TRAIL антителами, осуществляют отбор и клонирование клеток с минимальным сигналом для PD-1 и максимальным сигналом для TRAIL с помощью проточного сортера, проводят вторичное культивирование клонов клеток и отбор клеток с помощью иммуноблоттинга с анти PD-1 антителами и анти TRAIL антителами. При этом в состав плазмидного вектора с физической картой, представленной на фиг.1, входят: 295-572 bp - CBh promoter; 819-5090 bp - эндонуклеаза Cas9; 5121-5328 bp - PolyA Signal; 5552-6007 bp - f1 ori; 6289-6393 bp - bla promoter; 6394-7254 bp - bla; 7425-8013 bp - ColE1 ori; 8075-8315 bp - U6 promoter; 8322-8419 bp - последовательность, кодирующая направляющую РНК.
При этом в состав донорской ДНК размером 2,473 тыс. пар оснований, обеспечивающей инактивацию экспрессии гена PD-1 с одновременной активацией экспрессии в NK-клетке белка TRAIL входят: фрагмент, содержащий последовательность первой части гена pd1 размером 379 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 10; фрагмент, содержащий последовательность CMV Promoter размером 588 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 17; фрагмент, содержащий последовательность - TRAIL размером 846 пар оснований, характеризующейся нуклеотидной последовательностью, представленной в SEQ ID NO: 21; фрагмент, содержащий последовательность - BGH polyA Signal размером 225 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 19; фрагмент, содержащий последовательность второй части гена pd1 размером 276 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 15.
Следующим аспектом настоящего изобретения является применение модифицированной линии NK-клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией TRAIL для того, чтобы вызвать апоптоз или лизис раковых клеток млекопитающего, включающее введение млекопитающему эффективного количества клетки-киллера (NK).
Перечень фигур
Фиг. 1. Физическая карта плазмидного вектора, в который входят: 295-572 bp - CBh promoter; 819-5090 bp - эндонуклеаза Cas9; 5121-5328 bp - PolyA Signal; 5552-6007 bp - f1 ori; 6289-6393 bp - bla promoter; 6394-7254 bp - bla; 7425-8013 bp - ColE1 ori; 8075-8315 bp - U6 promoter; 8322-8419 bp - последовательность, кодирующая направляющую РНК (gRNA).
Фиг. 2. Карта фрагмента донорской ДНК pdl-Zeo. Где: 1-379 bp - последовательность части гена pd1 SEQ ID NO: 10; 395-799 bp - CMV enh энхансер SEQ ID NO: 11; 806-1068 bp - hFerL Promoter SEQ ID NO: 12; 1291-1665 bp - Zeo - ген резистентности к зеоцину SEQ ID NO: 13; 1673-2073 bp - βGlo polyA Signal SEQ ID NO: 14; 2096-2371 bp - последовательность части гена pd1 SEQ ID NO:15.
Фиг. 3. Карта фрагмента донорской ДНК pd1-FasL. Где: 1-379 bp - последовательность части гена pd1 SEQ ID NO: 10; 389-976 bp - CMV Promoter SEQ ID NO: 17; 1052-1897 bp - FasL SEQ ID NO: 18; 1969-2193 bp - BGH polyA Signal SEQ ID NO: 19; 2198-2473 bp - последовательность части гена pd1 SEQ ID NO: 15.
Фиг. 4. Карта фрагмента донорской ДНК pd1-TRAIL. Где: 1-379 bp - последовательность части гена pd1 SEQ ID NO: 10; 389-976 bp - CMV Promoter SEQ ID NO: 17; 1052-1897 bp - TRAIL SEQ ID NO: 21; 1969-2193 bp - BGH polyA Signal SEQ ID NO: 19; 2198-2473 bp - последовательность части гена pd1 SEQ ID NO: 15.
Описание изобретения
Настоящее изобретение относится к клетке или NK-клеточной линии природных киллеров (NK), которые были генетически модифицированы, таким образом, чтобы увеличить свою цитотоксичность.
Указанные NK-клетки и NK-клеточные линии, могут быть: а) выделены из периферической крови, б) выделены из пуповинной крови, в) получены из плюрипотентных (pluripotent) и эмбриональных стволовых клеток (stem cells) (т.е. iPSCs и ESC) по методу Galat et al [9.10], г) получены из плюрипотентных стволовых клеток (iPSCs) по методу Kaufman et al. [11]. Указанные NK-клетки и NK-клеточные линии могут быть инфильтрованы в ткани и опухоли. Указанные NK-клетки и NK-клеточные линии могут входить в группу состоящую из KHYG-1/CVCL_2976, NK-92/ CVCL_2142, NK-YS/CVCL_8461, NKL/ CVCL_0466, NK3.3/ CVCL_7994, которая включает, но не ограничивает, других типов NK-клеток и NK-клеточных линий.
Получение NK-клеток с нокаутированным геном PD-1
Способ получения линии NK -клеток, нокаутных по гену PD-1 включает в себя несколько основных этапов:
1. Выбор последовательности направляющей РНК, специфичной к различным сайтам гена PD-1 (SEQ ID NO: 1 или SEQ ID NO: 2 или SEQ ID NO: 3 или SEQ ID NO: 4);
2. Конструирование экспрессионного плазмидного вектора, кодирующего выбранную направляющую РНК и эндонуклеазу Cas9 (pGR301 или pGR302 или pGR303 или pGR304);
В состав плазмидного вектора с физической картой, представленной на фиг. 1 входят: 295-572 bp - CBh promoter; 819-5090 bp - эндонуклеаза Cas9; 5121-5328 bp - PolyA Signal; 5552-6007 bp - f1 ori; 6289-6393 bp - bla promoter; 6394-7254 bp - bla; 7425-8013 bp - ColE1 ori; 8075-8315 bp - U6 promoter; 8322-8419 bp - последовательность, кодирующая направляющую РНК.
3. Трансфекцию культуры NK-леток одним из плазмидных векторов;
4. Окрашивание клеток анти PD-1 антителами, отбор и клонирование клеток с минимальным сигналом с помощью проточного сортера.
5. Культивирование клонов клеток, вторичный отбор клеток с помощью иммуноблоттинга с анти PD-1 антителами.
Для выбора оптимальных последовательностей направляющих РНК проводили анализ нуклеотидных последовательностей с использованием свободно-доступных web-ресурсов: CRISPR Design (http://crispr.mit.edu), СНОРСНОР (http://chopchop.cbu.uib.no), Е-CRISPR (http://www.e-crisp.org/E-CRISP/designcrispr.html). Были выбраны последовательности направляющих РНК (SEQ ID NO: 1-4), специфичных к различным сайтам гена PD-1 (SEQ ID NO: 5-8).
В векторе pGR301 SEQ ID NO: 1
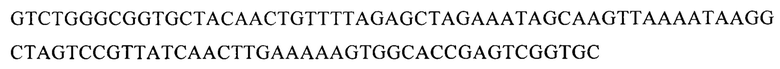
В векторе pGR302 SEQ ID NO: 2
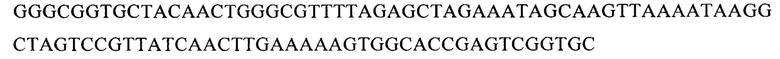
В векторе pGR303 SEQ ID NO: 3

В векторе pGR304 SEQ ID NO: 4
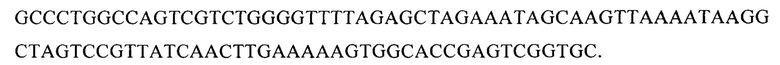
Последовательности ДНК-мишеней (РАМ-последовательности выделены):
Для вектора pGR301 SEQ ID NO: 5
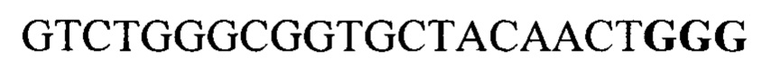
Для вектора pGR302 SEQ ID NO: 6

Для вектора pGR303 SEQ ID NO: 7
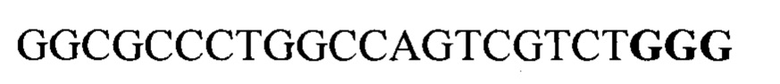
Для вектора pGR304 SEQ ID NO: 8
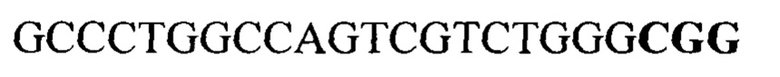
Для получения плазмидных векторов, кодирующих комплексы эндонуклеазы Cas9 и направляющих РНК, проводили синтез фрагментов ДНК, кодирующих направляющие РНК при помощи полимеразной цепной реакции с перекрывающимися олигонуклеотидами. Полученные фрагменты были клонированы в плазмидный вектор, предназначенный для экспрессии компонентов системы CRISPR-Cas9 в клетках млекопитающих. Вектор предварительно гидролизовали по сайту для эндонуклеазы рестрикции BbsI. Отобранные плазмидные вектора pGR301, pGR302, pGR303, pGR304 были секвенированы для подтверждения получения запланированных генетических конструкций.
Трансфекцию NK-клеток векторами pGR301, pGR302, pGR303, pGR304 проводили с помощью липагента Lipofectamine 3000 (Thermo Fisher Scientific), клетки инкубировали в среде RPMI с 20% фетальной бычьей сывороткой до достижения плотности клеток 4 -6×105 клеток/мл. Готовили смесь липагента Lipofectamine 3000 и ДНК (из расчета 3 мкл липагента, 4 мкг pGR301 или pGR302 или pGR303 или pGR304, 8 мкл реагента Р3000™, 100 мкл среды Opti-MEM® Medium на 1 мл суспензии клеток). Инкубировали смесь в течение 5 мин и добавляли в суспензию клеток. Клетки инкубировали в течение 48 ч при 37°С и 5% СO2.
Для отбора клеток, нокаутных по гену PD-1 через 48 ч после трансфекции клетки инкубировали с анти-PD-l антителами, мечеными флуоресцеином в течение 1 ч. Клетки отмывали средой культивирования и разделяли с помощью клеточного сортера. Отбирали единичные клетки с минимальным или отсутствующим флуоресцентным сигналом в лунки 96-луночного планшета со средой RPMI с 20% фетальной бычьей сывороткой. Культивировали клетки в течение 2-4 недель при 37°С и 5% СO2 с заменой культуральной среды через каждые 3-4 сут.
Для получения меченых анти-PD-l антител использовали моноклональные мышиные анти-PD-l антитела, клон NAT105 (Производитель Abeam кат.№аЬ52587) и набор для конъюгирования белков Fluorescein-EX Protein Labeling Kit (Производитель Invitrogen™, кат. №F10240).
Уровень экспрессии PD-1 в клонах оценивали с помощью иммуноблоттинга с anti-PD-1 антителами. В качестве положительного контроля использовали нетрансфицированные NK-клетки. Клетки лизировали с помощью буфера, содержащего 25 мМ Трис-HCl, 150 мМ NaCl, 1 мМЭДТА, 1% Тритон-Х100. Лизаты клеток центрифугировали при 10000 g в течение 10 мин. Определяли концентрацию тотального белка в супернатанте и аликвоты, соответствующие 100 мкг белка разделяли с помощью электрофореза в денатурирующих условиях. Проводили электроперенос белков из геля на нитроцеллюлозную мембрану. Затем нитроцеллюлозную мембрану с иммобилизованными белками промывали буфером I (20 мМ Трис-HCI, рН 7,5; 150 мМ NaCl; 0,05% твин-20) и инкубировали в течение 1 ч в 2% растворе бычьего сывороточного альбумина в буфере I. Затем инкубировали в течение 16 ч с первичными антителами к PD1 в 2% БСА в буфере I. После этого мембрану промывали буфером I и инкубировали в течение 1 ч с вторичными антителами, конъюгированными с пероксидазой хрена (Производитель Bio-Rad) в 1% растворе молока в буфере I. Мембрану промывали буфером I и окрашивали с использованием коммерческого набора ECL™ для хемилюминесцентной детекции. Отбирали клоны, в которых не обнаруживались специфические полосы, соответствующие PD-1.
Получение NK-клеток с нокаутированным геном PD-1 и устойчивостью к антибиотику зеоцину.
Для повышения эффективности процесса создания клеток с нокаутированным геном PD-1 предложен способ отбора NK-клеток с помощью селективного маркера зеоцина.
Процесс включает несколько этапов:
1. Выбор последовательности направляющей РНК, специфичной к гену PD-1 (SEQ ID NO: 1)
2. Конструирование экспрессионного плазмидного вектора, кодирующего выбранную направляющую РНК и эндонуклеазу Cas9 (pGR301);
3. Синтез фрагмента донорской ДНК, кодирующей экспрессионную кассету для устойчивости клеток к зеоцину (SEQ ID NO: 9);
4. Трансфекция культуры NK-клеток смесью плазмидного вектора и фрагмента донорской ДНК;
5. Культивирование клеток в селективной среде с зеоцином.
6. Окрашивание выживших клеток анти PD-1 антителами, отбор и клонирование клеток с минимальным сигналом с помощью проточного сортера.
7. Культивирование клонов клеток, вторичный отбор клеток с помощью иммуноблоттинга с анти PD-1 антителами.
Для трансфекции клеток использовали смесь вектора pGR301 и фрагмента ДНК pd1-Zeo, SEQ ID NO: 9, кодирующего ген резистентности к зеоцину. Для синтеза фрагмента ДНК, pd1-Zeo использовали полимеразную цепную реакцию с перекрывающимися праймерами. Трансфекцию NK-клеток проводили с помощью липагента Lipofectamin 3000 (Thermo Fisher Scientific). Для трансфекции липагентом Lipofectamine 3000 клетки инкубировали в среде RPMI с 20% фетальной бычьей сывороткой до достижения плотности клеток 4 -6×105 клеток/мл. Готовили смесь липагента Lipofectamine 3000 и ДНК (из расчета 3 мкл липагента, 2 мкг вектора pGR301, 2 мкг фрагмента ДНК pd1-Zeo, 8 мкл реагента Р3000™, 100 мкл среды Opti-MEM® Medium на 1 мл суспензии клеток). Инкубировали смесь в течение 5 мин и добавляли в суспензию клеток. Клетки инкубировали в течение 48 ч при 37°С и 5% СO2. Для отбора NK-клеток, нокаутных по гену PD-1 с помощью селективного маркера зеоцина через 48 ч после трансфекции клетки переносили в селективную среду (RPMI с добавлением зеоцина) и культивировали в течение 2-4 недель. Выжившие клетки окрашивали анти-PD-l антителами, мечеными флуоресцеином. Образцы окрашенных клеток разделяли с помощью клеточного сортера. Отбирали единичные клетки с минимальным или отсутствующим флуоресцентным сигналом в лунки 96-луночного планшета со средой RPMI с 20% фетальной бычьей сывороткой. Культивировали клетки в течение 2-4 недель при 37°С и 5% СO2 с заменой культуральной среды через каждые 3-4 сут.
Уровень экспрессии PD-1 в клонах оценивали с помощью иммуноблоттинга с anti-PD-1 антителами, аналогично протоколу, описанному для получения NK-клеток с нокаутированным геном PD-1.
Получение NK-клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией Fas-лиганда.
Для повышения активности NK-клеток предложен способ получения NK-клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией Fas-ligand.
Процесс включает несколько этапов:
1. Выбор последовательности направляющей РНК, специфичной к гену PD-1 (SEQ ID NO: 1)
2. Конструирование экспрессионного плазмидного вектора, кодирующего выбранную направляющую РНК и эндонуклеазу Cas9 (pGR301);
3. Синтез фрагмента донорской ДНК, кодирующей экспрессионную кассету для Fas-лиганда(SEQ ID NO: 16);
4. Трансфекция культуры NK-клеток смесью плазмидного вектора и фрагмента донорской ДНК;
5. Окрашивание клеток анти PD-1 антителами и анти Fas-лиганд антителами. Отбор и клонирование клеток с минимальным сигналом для PD-1 и максимальным сигналом для Fas-лиганда с помощью проточного сортера.
6. Культивирование клонов клеток, вторичный отбор клеток с помощью иммуноблоттинга с анти PD-1 и анти Fas-лиганд антителами.
Для трансфекции клеток использовали смесь вектора pGR301 и фрагмента ДНК pd1-FasL SEQ ID NO: 16, кодирующего экспрессионную кассету для экспрессии Fas-лиганда. Для синтеза фрагмента ДНК, pd1-FasL использовали полимеразную цепную реакцию с перекрывающимися праймерами.
Трансфекцию NK-клеток проводили с помощью липагента Lipofectamin 3000 (Thermo Fisher Scientific). Для трансфекции липагентом Lipofectamine 3000 клетки инкубировали в среде RPMI с 20% фетальной бычьей сывороткой до достижения плотности клеток 4 -6×105 клеток/мл. Готовили смесь липагента Lipofectamine 3000 и ДНК (из расчета 3 мкл липагента, 2 мкг вектора pGR301, 2 мкг фрагмента ДНК pd1-FasL, 8 мкл реагента Р3000™ 100 мкл среды Opti-MEM® Medium на 1 мл суспензии клеток). Инкубировали смесь в течение 5 мин и добавляли в суспензию клеток. Клетки инкубировали в течение 48 ч при 37°С и 5% СO2.
Для отбора клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией Fas-лиганда через 48 ч после трансфекции клетки окрашивали смесью anti-PD-1 антител, меченых флуоресцеином и anti-Fas-лиганд антител, меченых Alexa Fluor® 610-R-phycoerythrin. Отбирали и клонировали клетки с минимальным флуоресцентным сигналом флуоресцеина и максимальным сигналом Alexa Fluor® 610-R-phycoerythrin. Для получения меченых aнти-Fas-лиганд антител использовали моноклональные мышиные анти-Fas-лиганд антитела (Производитель BD Biosciences, клон G-247) и набор Zenon™ Alexa Fluor™ 610-R-Phycoerythrin Mouse IgGl Labeling Kit (Производитель Invitrogen™, кат. №Z25020).
Уровень экспрессии PD-1 в клонах оценивали с помощью иммуноблоттинга с anti-PD-1 антителами, аналогично протоколу, описанному для получения NK-клеток с нокаутированным геном PD-1. В клонах с подтвержденным нокаутом PD-1 оценивали уровень экспрессии Fas-лиганда. Проводили иммуноблоттинг с анти-Fas-лиганд антителами (Производитель BD Biosciences, клон G-247) по методике, аналогичной PD-1. В результате анализа отбирали клетки, в которых детектировался максимальный сигнал полос, соответствующих Fas-лиганду
Получение NK-клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией TRAIL.
Для повышения активности NK-клеток предложен способ получения NK-клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией TRAIL.
Процесс включает несколько этапов:
1. Выбор последовательности направляющей РНК, специфичной к гену PD-1 (SEQ ID NO: 1);
2. Конструирование экспрессионного плазмидного вектора, кодирующего выбранную направляющую РНК и эндонуклеазу Cas9 (pGR301);
3. Синтез фрагмента донорской ДНК, кодирующей экспрессионную кассету для TRAIL (SEQ ID NO: 20);
4. Трансфекция культуры NK-клеток смесью плазмидного вектора и фрагмента донорской ДНК;
5. Окрашивание клеток анти PD-1 антителами и анти TRAIL антителами. Отбор и клонирование клеток с минимальным сигналом для PD-1 и максимальным сигналом для TRAIL с помощью проточного сортера.
6. Культивирование клонов клеток, вторичный отбор клеток с помощью иммуноблоттинга с анти PD-1 и анти TRAIL антителами.
Для трансфекции клеток использовали смесь вектора pGR301 и фрагмента ДНК pd1-TRAIL, SEQ ID NO: 20, кодирующего экспрессионную кассету для экспрессии TRAIL. Для синтеза фрагмента ДНК, pd1-TRAIL использовали полимеразную цепную реакцию с перекрывающимися праймерами. Трансфекцию NK-клеток проводили с помощью липагента Lipofectamin 3000 (Thermo Fisher Scientific). Для трансфекции липагентом Lipofectamine 3000 клетки инкубировали в среде RPMI с 20% фетальной бычьей сывороткой до достижения плотности клеток 4 -6×105 клеток/мл. Готовили смесь липагента Lipofectamine 3000 и ДНК (из расчета 3 мкл липагента, 2 мкг вектора pGR301, 2 мкг фрагмента ДНК pd1-TRAIL, 8 мкл реагента Р3000™, 100 мкл среды Opti-MEM® Medium на 1 мл суспензии клеток). Инкубировали смесь в течение 5 мин и добавляли в суспензию клеток. Клетки инкубировали в течение 48 ч при 37°С и 5% СO2.
Для отбора клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией TRAIL через 48 ч после трансфекции клетки окрашивали смесью anti-PD-1 антител, меченых флуоресцеином и anti-TRAIL антител, меченых Alexa Fluor® 610-R-phycoerythrin. Отбирали и клонировали клетки с минимальным флуоресцентным сигналом флуоресцеина и максимальным сигналом Alexa Fluor® 610-R-phycoerythrin. Для получения меченых анти-TRAIL антител использовали моноклональные мышиные анти-TRAIL антитела (Производитель Abeam, клон 2Е5, кат. №ab2219) и набор Zenon™ Alexa Fluor™ 610-R-Phycoerythrin Mouse IgG1 Labeling Kit (Производитель Invitrogen™, кат. №Z25020).
Уровень экспрессии PD-1 в клонах оценивали с помощью иммуноблоттинга с anti-PD-1 антителами, аналогично протоколу, описанному для получения NK-клеток с нокаутированным геном PD-1. В клонах с подтвержденным нокаутом PD-1 оценивали уровень экспрессии TRAIL. Проводили иммуноблоттинг с анти-TRAIL антителами (Производитель Abeam, клон 75411.11, кат. №ab10516) по методике, аналогичной PD-1. В результате анализа отбирали клетки, в которых детектировался максимальный сигнал полос, соответствующих TRAIL.
В соответствии с объектом изобретения, модифицированные клетки NK, линии клеток NK или их композиции с увеличенной цитотоксичностью предназначены для их использования при лечении рака у пациента. В предпочтительных вариантах осуществления изобретения модифицированная NK-клетка, NK-клеточная линия или их композиция предназначена для использования при лечении рака крови, включая острый лимфобластный лейкоз (ALL), острый миелоидный лейкоз (ОМЛ), хронический лимфоцитарный лейкоз (ХЛЛ), хронический миелоидный лейкоз (ХМЛ). Модифицированная NK-клетка, NK-клеточная линия может быть использована при лечении: лимфомы Ходжкина, неходжкинской лимфомы, включая Т-клеточные лимфомы, В-клеточные лимфомы, бессимптомные миеломы, тлеющие множественные миеломы (SMM), активные миеломы или легкие цепи миеломы.
Источники информации
1. HONJO Т., SHIBAYAMA S. SUBSTANCE SPECIFIC ТО HUMAN PD-1. Патент Японии №JP 6157574 (В2) (2017-07-05).
2. JOHNSON BRYON D., MILLMAN R. METHODS FOR TREATING HEMATOLOGIC CANCERS. Заявка США №US 2016222121 A1 (2016-08-04).
3. LI ZONGHAI P. CHIMERIC ANTIGEN RECEPTOR-MODIFIED IMMUNE EFFECTOR CELL CARRYING PD-L1 BLOCKING AGENT. Европейский патент №EP 3382009 (2018-10-03).
4. Djoke Hendriks et al. Programmed Death Ligand 1 (PD-L1)-targeted TRAIL combines PD-L1-mediated checkpoint inhibition with TRAIL-mediated apoptosis induction. Oncoimmunology. 2016 Aug; 5(8).
5. Modiano JF1, Bellgrau D. Fas ligand based immunotherapy: A potent and effective neoadjuvant with checkpoint inhibitor properties, or a systemically toxic promoter of tumor growth? Discov Med. 2016 Feb; 21(114):109-16.
6. HU BIAN; HUANG XINGXU Method for human PD1 gene specific knockout through CRISPR-Cas9 (clustered regularly interspaced short palindromic repeat) and sgRNA(single guide RNA)for specially targeting PD1 gene. Патент Китая №CN 103820454 (2014-05-28).
7. Su S et al. CRISPR-Cas9 mediated efficient PD-1 disruption on human primary T cells from cancer patients. Sci Rep.2016 Jan 28.
8. Xiuyan Wang, Isabelle Riviere: Clinical manufacturing of CAR T cells: foundation of a promising therapy. Oncolytics 2016.
9. Galat V, Galat Y, Perepitchka M, et al. Transgene reactivation in induced pluripotent stem cell derivatives and reversion to pluripotency of induced pluripotent stem cell-derived mesenchymal stem cells. Stem Cells Dev. 2016; 25:1060-72.
10. Galat, Y., Dambaeva, S., Elcheva, I., Khanolkar, A., Beaman, K., Iannaccone, P.M., Galat, V., Cytokine-free directed differentiation of human pluripotent stem cells efficiently produces hemogenic endothelium with lymphoid potential. Stem Cell Res Ther 8, 67 (2017).
11. Kaufman; Dan S. Knorr; David A. Method for developing natural killer cells from stem cells Патент США №9,260,696 (2016-02-16).
12. O'Dwyer M. Modified natural killer cells and natural killer cell lines having increased cytotoxicity. Патент США №10,034,925 (2018-07-31).
--->
Перечень последовательностей
<110> БЕЛЕЦКИЙ ИГОРЬ ПЕТРОВИЧ
<120> Способ получения генно-модифицированных линий клеток натуральных киллеров с нокаутированным геном PD-1 и повышенной экспрессией белков семейства Фактора Некроза Опухолей для иммунотерапии онкологических заболеваний
<160> 21
<210> 1
<211> 96
<212> DNA
<213> Artificial Sequence
<223> Последовательность направляющей РНК, специфичной к гену PD-1
<400> 1
gtctgggcgg tgctacaact gttttagagc tagaaatagc aagttaaaat aaggctagtc 60 cgttatcaac ttgaaaaagt ggcaccgagt cggtgc 96
<210> 2
<211> 96
<212> DNA
<213> Artificial Sequence
<223> Последовательность направляющей РНК, специфичной к гену PD-1
<400> 2
gggcggtgct acaactgggc gttttagagc tagaaatagc aagttaaaat aaggctagtc 60 cgttatcaac ttgaaaaagt ggcaccgagt cggtgc 96
<210> 3
<211> 96
<212> DNA
<213> Artificial Sequence
<223> Последовательность направляющей РНК, специфичной к гену PD-1
<400> 3
ggcgccctgg ccagtcgtct gttttagagc tagaaatagc aagttaaaat aaggctagtc 60 cgttatcaac ttgaaaaagt ggcaccgagt cggtgc 96
<210> 4
<211> 96
<212> DNA
<213> Artificial Sequence
<223> Последовательность направляющей РНК, специфичной к гену PD-1
<400> 4
gccctggcca gtcgtctggg gttttagagc tagaaatagc aagttaaaat aaggctagtc 60 cgttatcaac ttgaaaaagt ggcaccgagt cggtgc 96
<210> 5
<211> 23
<212> DNA
<213> Artificial Sequence
<223> Последовательность ДНК-мишени для вектора pGR301
<400> 5
gtctgggcgg tgctacaact ggg 23
<210> 6
<211> 23
<212> DNA
<213> Artificial Sequence
<223> Последовательность ДНК-мишени для вектора pGR302
<400> 6
gggcggtgct acaactgggc tgg 23
<210> 7
<211> 23
<212> DNA
<213> Artificial Sequence
<223> Последовательность ДНК-мишени для вектора pGR303
<400> 7
ggcgccctgg ccagtcgtct ggg 23
<210> 8
<211> 23
<212> DNA
<213> Artificial Sequence
<223> Последовательность ДНК-мишени для вектора pGR304
<400> 8
gccctggcca gtcgtctggg cgg 23
<210> 9
<211> 2371
<212> DNA
<213> Artificial Sequence
<223> Донорская ДНК, кодирующая экспрессионную кассету для устойчивости клеток к зеоцину
<400> 9
tgagcagaga cacagaggag gaaggggccc tgagctgggg agacccccac ggggtagggc 60
gtgggggcca cgggcccacc tcctccccat ctcctctgtc tccctgtctc tgtctctctc 120
tccctccccc accctctccc cagtcctacc ccctcctcac ccctcctccc ccagcactgc 180
ctctgtcact ctcgcccacg tggatgtgga ggaagagggg gcgggagcaa ggggcgggca 240
ccctcccttc aacctgacct gggacagttt cccttccgct cacctccgcc tgagcagtgg 300
agaaggcggc actctggtgg ggctgctcca ggcatgcaga tcccacaggc gccctggcca 360
gtcgtctggg cggtgctacc cggtaacctg caggcgttac ataacttacg gtaaatggcc 420
cgcctggctg accgcccaac gacccccgcc cattgacgtc aataatgacg tatgttccca 480
tagtaacgcc aatagggact ttccattgac gtcaatgggt ggagtattta cggtaaactg 540
cccacttggc agtacatcaa gtgtatcata tgccaagtac gccccctatt gacgtcaatg 600
acggtaaatg gcccgcctgg cattatgccc agtacatgac cttatgggac tttcctactt 660
ggcagtacat ctacgtatta gtcatcgcta ttaccatgat gatgcggttt tggcagtaca 720
tcaatgggcg tggatagcgg tttgactcac ggggatttcc aagtctccac cccattgacg 780
tcaatgggag tttgttttga ctagtcaggg ccccaacccc cccaagcccc catttcacaa 840
cacgctggcg ctacaggcgc gtgacttccc cttgctttgg ggcggggggc tgagactcct 900
atgtgctccg gattggtcag gcacggcctt cggccccgcc tcctgccacc gcagattggc 960
cgctaggcct ccccgagcgc cctgcctccg agggccggcg caccataaaa gaagccgccc 1020
tagccacgtc ccctcgcagt tcggcggtcc cgcgggtctg tctcaagctt ctgccttctc 1080
cctcctgtga gtttggtaag tcactgactg tctatgcctg ggaaagggtg ggcaggagat 1140
ggggcagtgc aggaaaagtg gcactatgaa ccctgcagcc ctagtttgac aattaatcat 1200
tggcatagta tatctgcata gtataataca actcactata gcaattgtac taaccttctt 1260
ctctttcctc tcctgacagg aggagccatc atggccaagt tgaccagtgc cgttccggtg 1320
ctcaccgcgc gcgacgtcgc cggagcggtc gagttctgga ccgaccggct cgggttctcc 1380
cgggacttcg tggaggacga cttcgccggt gtggtccggg acgacgtgac cctgttcatc 1440
agcgcggtcc aggaccaggt ggtgccggac aacaccctgg cctgggtgtg ggtgcgcggc 1500
ctggacgagc tgtacgccga gtggtcggag gtcgtgtcca cgaacttccg ggacgcctcc 1560
gggccggcca tgaccgagat cggcgagcag ccgtgggggc gggagttcgc cctgcgcgac 1620
ccggccggca actgcgtgca ctttgtggca gaggagcagg actgaggata agctagaagc 1680
tcgctttctt gctgtccaat ttctattaaa ggttcctttg ttccctaagt ccaactacta 1740
aactggggga tattatgaag ggccttgagc atctggattc tgcctaataa aaaacattta 1800
ttttcattgc aatgatgtat ttaaattatt tctgaatatt ttactaaaaa gggaatgtgg 1860
gaggtcagtg catttaaaac ataaagaaat gaagagctag ttcaaacctt gggaaaatac 1920
actatatctt aaactccatg aaagaaggtg aggctgcaaa cagctaatgc acattggcaa 1980
cagcccctga tgcctatgcc ttattcatcc ctcagaaaag gattcaagta gaggcttgat 2040
ttggaggtta aagttttgct atgctgtatt ttagaattaa ttccatacca ctctagctgg 2100
cggccaggat ggttcttagg taggtggggt cggcggtcag gtgtcccaga gccaggggtc 2160
tggagggacc ttccaccctc agtccctggc aggtcggggg gtgctgaggc gggcctggcc 2220
ctggcagccc aggggtcccg gagcgagggg tctggaggga cctttcactc tcagtccctg 2280
gcaggtcggg gggtgctgtg gcaggcccag ccttggcccc cagctctgcc ccttaccctg 2340
agctgtgtgg ctttgggcag ctcgaactcc t 2371
<210> 10
<211> 379
<212> DNA
<213> Artificial Sequence
<223> Фрагмент содержащий последовательность первой части гена pd1 размером 379 пар оснований
<400> 10
tgagcagaga cacagaggag gaaggggccc tgagctgggg agacccccac ggggtagggc 60
gtgggggcca cgggcccacc tcctccccat ctcctctgtc tccctgtctc tgtctctctc 120
tccctccccc accctctccc cagtcctacc ccctcctcac ccctcctccc ccagcactgc 180
ctctgtcact ctcgcccacg tggatgtgga ggaagagggg gcgggagcaa ggggcgggca 240
ccctcccttc aacctgacct gggacagttt cccttccgct cacctccgcc tgagcagtgg 300
agaaggcggc actctggtgg ggctgctcca ggcatgcaga tcccacaggc gccctggcca 360
gtcgtctggg cggtgctac 379
<210> 11
<211> 405
<212> DNA
<213> Artificial Sequence
<223> Последовательность CMV энхансера размером 405 пар оснований
<400> 11
cgttacataa cttacggtaa atggcccgcc tggctgaccg cccaacgacc cccgcccatt 60
gacgtcaata atgacgtatg ttcccatagt aacgccaata gggactttcc attgacgtca 120
atgggtggag tatttacggt aaactgccca cttggcagta catcaagtgt atcatatgcc 180
aagtacgccc cctattgacg tcaatgacgg taaatggccc gcctggcatt atgcccagta 240
catgacctta tgggactttc ctacttggca gtacatctac gtattagtca tcgctattac 300
catgatgatg cggttttggc agtacatcaa tgggcgtgga tagcggtttg actcacgggg 360
atttccaagt ctccacccca ttgacgtcaa tgggagtttg ttttg 405
<210> 12
<211> 263
<212> DNA
<213> Artificial Sequence
<223> Фрагмент содержащий последовательность – hFerL Promoter размером 263 пары оснований
<400> 12
cagggcccca acccccccaa gcccccattt cacaacacgc tggcgctaca ggcgcgtgac 60
ttccccttgc tttggggcgg ggggctgaga ctcctatgtg ctccggattg gtcaggcacg 120
gccttcggcc ccgcctcctg ccaccgcaga ttggccgcta ggcctccccg agcgccctgc 180
ctccgagggc cggcgcacca taaaagaagc cgccctagcc acgtcccctc gcagttcggc 240
ggtcccgcgg gtctgtctca agc 263
<210> 13
<211> 375
<212> DNA
<213> Artificial Sequence
<223> Фрагмент, содержащий последовательность – Zeo - ген резистентности к зеоцину размером 375 пар оснований
<400> 13
atggccaagt tgaccagtgc cgttccggtg ctcaccgcgc gcgacgtcgc cggagcggtc 60
gagttctgga ccgaccggct cgggttctcc cgggacttcg tggaggacga cttcgccggt 120
gtggtccggg acgacgtgac cctgttcatc agcgcggtcc aggaccaggt ggtgccggac 180
aacaccctgg cctgggtgtg ggtgcgcggc ctggacgagc tgtacgccga gtggtcggag 240
gtcgtgtcca cgaacttccg ggacgcctcc gggccggcca tgaccgagat cggcgagcag 300
ccgtgggggc gggagttcgc cctgcgcgac ccggccggca actgcgtgca ctttgtggca 360
gaggagcagg actga 375
<210> 14
<211> 401
<212> DNA
<213> Artificial Sequence
<223> Фрагмент содержащий последовательность βGlo polyA Signal размером 401 пар оснований
<400> 14
ctagaagctc gctttcttgc tgtccaattt ctattaaagg ttcctttgtt ccctaagtcc 60
aactactaaa ctgggggata ttatgaaggg ccttgagcat ctggattctg cctaataaaa 120
aacatttatt ttcattgcaa tgatgtattt aaattatttc tgaatatttt actaaaaagg 180
gaatgtggga ggtcagtgca tttaaaacat aaagaaatga agagctagtt caaaccttgg 240
gaaaatacac tatatcttaa actccatgaa agaaggtgag gctgcaaaca gctaatgcac 300
attggcaaca gcccctgatg cctatgcctt attcatccct cagaaaagga ttcaagtaga 360
ggcttgattt ggaggttaaa gttttgctat gctgtatttt a 401
<210> 15
<211> 276
<212> DNA
<213> Artificial Sequence
<223> Фрагмент содержащий последовательность второй части гена pd1 размером 276 пар оснований
<400> 15
gctggcggcc aggatggttc ttaggtaggt ggggtcggcg gtcaggtgtc ccagagccag 60
gggtctggag ggaccttcca ccctcagtcc ctggcaggtc ggggggtgct gaggcgggcc 120
tggccctggc agcccagggg tcccggagcg aggggtctgg agggaccttt cactctcagt 180
ccctggcagg tcggggggtg ctgtggcagg cccagccttg gcccccagct ctgcccctta 240
ccctgagctg tgtggctttg ggcagctcga actcct 276
<210> 16
<211> 2473
<212> DNA
<213> Artificial Sequence
<223> Фрагмент донорской ДНК, кодирующей экспрессионную кассету для Fas-лиганда
<400> 16
tgagcagaga cacagaggag gaaggggccc tgagctgggg agacccccac ggggtagggc 60
gtgggggcca cgggcccacc tcctccccat ctcctctgtc tccctgtctc tgtctctctc 120
tccctccccc accctctccc cagtcctacc ccctcctcac ccctcctccc ccagcactgc 180
ctctgtcact ctcgcccacg tggatgtgga ggaagagggg gcgggagcaa ggggcgggca 240
ccctcccttc aacctgacct gggacagttt cccttccgct cacctccgcc tgagcagtgg 300
agaaggcggc actctggtgg ggctgctcca ggcatgcaga tcccacaggc gccctggcca 360
gtcgtctggg cggtgctacc cggtacgcgt tgacattgat tattgactag ttattaatag 420
taatcaatta cggggtcatt agttcatagc ccatatatgg agttccgcgt tacataactt 480
acggtaaatg gcccgcctgg ctgaccgccc aacgaccccc gcccattgac gtcaataatg 540
acgtatgttc ccatagtaac gccaataggg actttccatt gacgtcaatg ggtggactat 600
ttacggtaaa ctgcccactt ggcagtacat caagtgtatc atatgccaag tacgccccct 660
attgacgtca atgacggtaa atggcccgcc tggcattatg cccagtacat gaccttatgg 720
gactttccta cttggcagta catctacgta ttagtcatcg ctattaccat ggtgatgcgg 780
ttttggcagt acatcaatgg gcgtggatag cggtttgact cacggggatt tccaagtctc 840
caccccattg acgtcaatgg gagtttgttt tggcaccaaa atcaacggga ctttccaaaa 900
tgtcgtaaca actccgcccc attgacgcaa atgggcggta ggcgtgtacg gtgggaggtc 960
tatataagca gagctctctg gctaactaga gaacccactg cttactggct tatcgaaatt 1020
aatacgactc actataggga gacccaagct tatgcagcag cccttcaatt acccatatcc 1080
ccagatctac tgggtggaca gcagtgccag ctctccctgg gcccctccag gcacagttct 1140
tccctgtcca acctctgtgc ccagaaggcc tggtcaaagg aggccaccac caccaccgcc 1200
accgccacca ctaccacctc cgccgccgcc gccaccactg cctccactac cgctgccacc 1260
cctgaagaag agagggaacc acagcacagg cctgtgtctc cttgtgatgt ttttcatggt 1320
tctggttgcc ttggtaggat tgggcctggg gatgtttcag ctcttccacc tacagaagga 1380
gctggcagaa ctccgagagt ctaccagcca gatgcacaca gcatcatctt tggagaagca 1440
aataggccac cccagtccac cccctgaaaa aaaggagctg aggaaagtgg cccatttaac 1500
aggcaagtcc aactcaaggt ccatgcctct ggaatgggaa gacacctatg gaattgtcct 1560
gctttctgga gtgaagtata agaagggtgg ccttgtgatc aatgaaactg ggctgtactt 1620
tgtatattcc aaagtatact tccggggtca atcttgcaac aacctgcccc tgagccacaa 1680
ggtctacatg aggaactcta agtatcccca ggatctggtg atgatggagg ggaagatgat 1740
gagctactgc actactgggc agatgtgggc ccgcagcagc tacctggggg cagtgttcaa 1800
tcttaccagt gctgatcatt tatatgtcaa cgtatctgag ctctctctgg tcaattttga 1860
ggaatctcag acgtttttcg gcttatataa gctctaactc gagcatgcat ctagagggcc 1920
ctattctata gtgtcaccta aatgctagag ctcgctgatc agcctcgact gtgccttcta 1980
gttgccagcc atctgttgtt tgcccctccc ccgtgccttc cttgaccctg gaaggtgcca 2040
ctcccactgt cctttcctaa taaaatgagg aaattgcatc gcattgtctg agtaggtgtc 2100
attctattct ggggggtggg gtggggcagg acagcaaggg ggaggattgg gaagacaata 2160
gcaggcatgc tggggatgcg gtgggctcta tggcctagct ggcggccagg atggttctta 2220
ggtaggtggg gtcggcggtc aggtgtccca gagccagggg tctggaggga ccttccaccc 2280
tcagtccctg gcaggtcggg gggtgctgag gcgggcctgg ccctggcagc ccaggggtcc 2340
cggagcgagg ggtctggagg gacctttcac tctcagtccc tggcaggtcg gggggtgctg 2400
tggcaggccc agccttggcc cccagctctg ccccttaccc tgagctgtgt ggctttgggc 2460
agctcgaact cct 2473
<210> 17
<211> 588
<212> DNA
<213> Artificial Sequence
<223> Фрагмент содержащий последовательность CMV Promoter размером 588 пар оснований
<400> 17
gttgacattg attattgact agttattaat agtaatcaat tacggggtca ttagttcata 60
gcccatatat ggagttccgc gttacataac ttacggtaaa tggcccgcct ggctgaccgc 120
ccaacgaccc ccgcccattg acgtcaataa tgacgtatgt tcccatagta acgccaatag 180
ggactttcca ttgacgtcaa tgggtggact atttacggta aactgcccac ttggcagtac 240
atcaagtgta tcatatgcca agtacgcccc ctattgacgt caatgacggt aaatggcccg 300
cctggcatta tgcccagtac atgaccttat gggactttcc tacttggcag tacatctacg 360
tattagtcat cgctattacc atggtgatgc ggttttggca gtacatcaat gggcgtggat 420
agcggtttga ctcacgggga tttccaagtc tccaccccat tgacgtcaat gggagtttgt 480
tttggcacca aaatcaacgg gactttccaa aatgtcgtaa caactccgcc ccattgacgc 540
aaatgggcgg taggcgtgta cggtgggagg tctatataag cagagctc 588
<210> 18
<211> 846
<212> DNA
<213> Artificial Sequence
<223> Фрагмент содержащий последовательность – Fas-ligand размером 846 пар оснований
<400> 18
atgcagcagc ccttcaatta cccatatccc cagatctact gggtggacag cagtgccagc 60
tctccctggg cccctccagg cacagttctt ccctgtccaa cctctgtgcc cagaaggcct 120
ggtcaaagga ggccaccacc accaccgcca ccgccaccac taccacctcc gccgccgccg 180
ccaccactgc ctccactacc gctgccaccc ctgaagaaga gagggaacca cagcacaggc 240
ctgtgtctcc ttgtgatgtt tttcatggtt ctggttgcct tggtaggatt gggcctgggg 300
atgtttcagc tcttccacct acagaaggag ctggcagaac tccgagagtc taccagccag 360
atgcacacag catcatcttt ggagaagcaa ataggccacc ccagtccacc ccctgaaaaa 420
aaggagctga ggaaagtggc ccatttaaca ggcaagtcca actcaaggtc catgcctctg 480
gaatgggaag acacctatgg aattgtcctg ctttctggag tgaagtataa gaagggtggc 540
cttgtgatca atgaaactgg gctgtacttt gtatattcca aagtatactt ccggggtcaa 600
tcttgcaaca acctgcccct gagccacaag gtctacatga ggaactctaa gtatccccag 660
gatctggtga tgatggaggg gaagatgatg agctactgca ctactgggca gatgtgggcc 720
cgcagcagct acctgggggc agtgttcaat cttaccagtg ctgatcattt atatgtcaac 780
gtatctgagc tctctctggt caattttgag gaatctcaga cgtttttcgg cttatataag 840
ctctaa 846
<210> 19
<211> 225
<212> DNA
<213> Artificial Sequence
<223> Фрагмент содержащий последовательность – BGH polyA Signal размером 225 пар оснований
<400> 19
ctgtgccttc tagttgccag ccatctgttg tttgcccctc ccccgtgcct tccttgaccc 60
tggaaggtgc cactcccact gtcctttcct aataaaatga ggaaattgca tcgcattgtc 120
tgagtaggtg tcattctatt ctggggggtg gggtggggca ggacagcaag ggggaggatt 180
gggaagacaa tagcaggcat gctggggatg cggtgggctc tatgg 225
<210> 20
<211> 2473
<212> DNA
<213> Artificial Sequence
<223> Фрагмент донорской ДНК, кодирующей экспрессионную кассету для TRAIL
<400> 20
tgagcagaga cacagaggag gaaggggccc tgagctgggg agacccccac ggggtagggc 60
gtgggggcca cgggcccacc tcctccccat ctcctctgtc tccctgtctc tgtctctctc 120
tccctccccc accctctccc cagtcctacc ccctcctcac ccctcctccc ccagcactgc 180
ctctgtcact ctcgcccacg tggatgtgga ggaagagggg gcgggagcaa ggggcgggca 240
ccctcccttc aacctgacct gggacagttt cccttccgct cacctccgcc tgagcagtgg 300
agaaggcggc actctggtgg ggctgctcca ggcatgcaga tcccacaggc gccctggcca 360
gtcgtctggg cggtgctacc cggtacgcgt tgacattgat tattgactag ttattaatag 420
taatcaatta cggggtcatt agttcatagc ccatatatgg agttccgcgt tacataactt 480
acggtaaatg gcccgcctgg ctgaccgccc aacgaccccc gcccattgac gtcaataatg 540
acgtatgttc ccatagtaac gccaataggg actttccatt gacgtcaatg ggtggactat 600
ttacggtaaa ctgcccactt ggcagtacat caagtgtatc atatgccaag tacgccccct 660
attgacgtca atgacggtaa atggcccgcc tggcattatg cccagtacat gaccttatgg 720
gactttccta cttggcagta catctacgta ttagtcatcg ctattaccat ggtgatgcgg 780
ttttggcagt acatcaatgg gcgtggatag cggtttgact cacggggatt tccaagtctc 840
caccccattg acgtcaatgg gagtttgttt tggcaccaaa atcaacggga ctttccaaaa 900
tgtcgtaaca actccgcccc attgacgcaa atgggcggta ggcgtgtacg gtgggaggtc 960
tatataagca gagctctctg gctaactaga gaacccactg cttactggct tatcgaaatt 1020
aatacgactc actataggga gacccaagct tatggctatg atggaggtcc aggggggacc 1080
cagcctggga cagacctgcg tgctgatcgt gatcttcaca gtgctcctgc agtctctctg 1140
tgtggctgta acttacgtgt actttaccaa cgagctgaag cagatgcagg acaagtactc 1200
caaaagtggc attgcttgtt tcttaaaaga agatgacagt tattgggacc ccaatgacga 1260
agagagtatg aacagcccct gctggcaagt caagtggcaa ctccgtcagc tcgttagaaa 1320
gatgattttg agaacctctg aggaaaccat ttctacagtt caagaaaagc aacaaaatat 1380
ttctccccta gtgagagaaa gaggtcctca gagagtagca gctcacataa ctgggaccag 1440
aggaagaagc aacacattgt cttctccaaa ctccaagaat gaaaaggctc tgggccgcaa 1500
aataaactcc tgggaatcat caaggagtgg gcattcattc ctgagcaact tgcacttgag 1560
gaatggtgaa ctggtcatcc atgaaaaagg gttttactac atctattccc aaacatactt 1620
tcgatttcag gaggaaataa aagaaaacac aaagaacgac aaacaaatgg tccaatatat 1680
ttacaaatac acaagttatc ctgaccctat attgttgatg aaaagtgcta gaaatagttg 1740
ttggtctaaa gatgcagaat atggactcta ttccatctat caagggggaa tatttgagct 1800
taaggaaaat gacagaattt ttgtttctgt aacaaatgag cacttgatag acatggacca 1860
tgaagccagt tttttcgggg cctttttagt tggctaactc gagcatgcat ctagagggcc 1920
ctattctata gtgtcaccta aatgctagag ctcgctgatc agcctcgact gtgccttcta 1980
gttgccagcc atctgttgtt tgcccctccc ccgtgccttc cttgaccctg gaaggtgcca 2040
ctcccactgt cctttcctaa taaaatgagg aaattgcatc gcattgtctg agtaggtgtc 2100
attctattct ggggggtggg gtggggcagg acagcaaggg ggaggattgg gaagacaata 2160
gcaggcatgc tggggatgcg gtgggctcta tggcctagct ggcggccagg atggttctta 2220
ggtaggtggg gtcggcggtc aggtgtccca gagccagggg tctggaggga ccttccaccc 2280
tcagtccctg gcaggtcggg gggtgctgag gcgggcctgg ccctggcagc ccaggggtcc 2340
cggagcgagg ggtctggagg gacctttcac tctcagtccc tggcaggtcg gggggtgctg 2400
tggcaggccc agccttggcc cccagctctg ccccttaccc tgagctgtgt ggctttgggc 2460
agctcgaact cct 2473
<210> 21
<211> 846
<212> DNA
<213> Artificial Sequence
<223> Фрагмент содержащий последовательность – TRAIL размером 846 пар оснований
<400> 21
atggctatga tggaggtcca ggggggaccc agcctgggac agacctgcgt gctgatcgtg 60
atcttcacag tgctcctgca gtctctctgt gtggctgtaa cttacgtgta ctttaccaac 120
gagctgaagc agatgcagga caagtactcc aaaagtggca ttgcttgttt cttaaaagaa 180
gatgacagtt attgggaccc caatgacgaa gagagtatga acagcccctg ctggcaagtc 240
aagtggcaac tccgtcagct cgttagaaag atgattttga gaacctctga ggaaaccatt 300
tctacagttc aagaaaagca acaaaatatt tctcccctag tgagagaaag aggtcctcag 360
agagtagcag ctcacataac tgggaccaga ggaagaagca acacattgtc ttctccaaac 420
tccaagaatg aaaaggctct gggccgcaaa ataaactcct gggaatcatc aaggagtggg 480
cattcattcc tgagcaactt gcacttgagg aatggtgaac tggtcatcca tgaaaaaggg 540
ttttactaca tctattccca aacatacttt cgatttcagg aggaaataaa agaaaacaca 600
aagaacgaca aacaaatggt ccaatatatt tacaaataca caagttatcc tgaccctata 660
ttgttgatga aaagtgctag aaatagttgt tggtctaaag atgcagaata tggactctat 720
tccatctatc aagggggaat atttgagctt aaggaaaatg acagaatttt tgtttctgta 780
acaaatgagc acttgataga catggaccat gaagccagtt ttttcggggc ctttttagtt 840
ggctaa 846
<---
Данная группа изобретений относится к области медицины и генной инженерии. Предложены способы получения модифицированных линий клеток натуральных киллеров (NK) с нокаутированным геном PD-1 или, в других вариантах осуществления, с нокаутированным геном PD-1 и конститутивной повышенной экспрессией Fas-лиганда, либо с нокаутированным геном PD-1 и конститутивной повышенной экспрессией TRAIL. Кроме того, описан способ отбора модифицированных NK-клеток с нокаутированным геном PD-1, который проводят с помощью селективного маркера зеоцина. Также предложено применение полученных линий клеток для того, чтобы вызвать апоптоз или лизис раковых клеток млекопитающего. Настоящая группа изобретений обеспечивает высокий выход модифицированных линий NK-клеток, обладающих высокой активностью по ингибированию роста клеток опухоли. 7 н. и 7 з.п. ф-лы, 4 ил.
1. Способ получения модифицированной линии NK-клеток с нокаутированным геном PD-1 для того, чтобы вызвать апоптоз или лизис раковых клеток млекопитающего, отличающийся тем, что для инактивации экспрессии гена PD-1 осуществляют выбор последовательностей направляющих РНК, специфичных к различным сайтам гена PD-1, входящим в группу SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, конструируют экспрессионные плазмидные вектора, кодирующие выбранную направляющую РНК и эндонуклеазу Cas9, проводят трансфекцию культуры NK-клеток одним из плазмидных векторов, окрашивают клетки анти PD-1 антителами, осуществляют клонирование и отбор, затем проводят вторичное культивирование клонов клеток и отбор клеток с помощью иммуноблоттинга с анти PD-1 антителами.
2. Способ получения модифицированной линии NK-клеток по п. 1, отличающийся тем, что в состав плазмидного вектора с физической картой, представленной на фиг. 1, входят: 295-572 bp - CBh promoter; 819-5090 bp - эндонуклеаза Cas9; 5121-5328 bp - PolyA Signal; 5552-6007 bp - f1 ori; 6289-6393 bp -bla promoter; 6394-7254 bp - bla; 7425-8013 bp - ColEl ori; 8075-8315 bp - U6 promoter; 8322-8419 bp - последовательность, кодирующая направляющую РНК.
3. Применение модифицированной линии NK-клеток с нокаутированным геном PD-1, полученной способом по п. 1, для того, чтобы вызвать апоптоз или лизис раковых клеток млекопитающего, включающее введение млекопитающему эффективного количества клетки-киллера (NK).
4. Способ отбора модифицированных NK-клеток с нокаутированным геном PD-1, который проводят с помощью селективного маркера зеоцина, при этом для инактивации экспрессии гена PD-1 осуществляют выбор последовательностей направляющих РНК, специфичных к различным сайтам гена PD-1, входящим в группу SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, конструируют экспрессионные плазмидные вектора, кодирующие выбранную направляющую РНК и эндонуклеазу Cas9, осуществляют синтез фрагмента донорской ДНК, кодирующей экспрессионную кассету для устойчивости клеток к зеоцину, имеющую последовательность согласно SEQ ID NO: 9, проводят трансфекцию культуры NK-клеток смесью плазмидного вектора и фрагмента донорской ДНК, осуществляют культивирование клеток в селективной среде с зеоцином, проводят окрашивание выживших клеток анти PD-1 антителами, осуществляют отбор и клонирование клеток с минимальным сигналом с помощью проточного сортера, проводят вторичное культивирование клонов клеток и отбор клеток с помощью иммуноблоттинга с анти PD-1 антителами.
5. Способ отбора модифицированных NK-клеток с нокаутированным геном PD-1 по п. 4, отличающийся тем, что в состав плазмидного вектора с физической картой, представленной на фиг. 1, входят: 295-572 bp - CBh promoter; 819-5090 bp - эндонуклеаза Cas9; 5121-5328 bp - PolyA Signal; 5552-6007 bp - f1 ori; 6289-6393 bp - bla promoter; 6394-7254 bp - bla; 7425-8013 bp - ColE1 ori; 8075-8315 bp - U6 promoter; 8322-8419 bp - последовательность, кодирующая направляющую РНК.
6. Способ отбора модифицированных NK-клеток с нокаутированным геном PD-1 по п. 4, отличающийся тем, что в состав донорской ДНК размером 2,371 тыс. пар оснований, обеспечивающей инактивацию экспрессии гена PD-1 с одновременной активацией экспрессии в NK-клетке белка зеоцин, входят: фрагмент содержащий последовательность первой части гена pd1 размером 379 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 10; фрагмент, содержащий последовательность CMV энхансера размером 405 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 11; фрагмент, содержащий последовательность - hFerL Promoter размером 263 пары оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 12; фрагмент, содержащий последовательность - Zeo - ген резистентности к зеоцину размером 375 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 13; фрагмент, содержащий последовательность βGlo polyA Signal размером 401 пара оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 14; фрагмент, содержащий последовательность второй части гена pd1 размером 276 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO:15.
7. Способ получения модифицированной линии NK-клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией Fas-лиганда, в котором для инактивации экспрессии гена PD-1 осуществляют выбор последовательностей направляющих РНК, специфичных к различным сайтам гена PD-1, входящим в группу SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, конструируют экспрессионные плазмидные вектора, кодирующие выбранную направляющую РНК и эндонуклеазу Cas9, осуществляют синтез фрагмента донорской ДНК, кодирующей экспрессионную кассету для Fas-лиганда, имеющую последовательность согласно SEQ ID NO: 16, проводят трансфекцию культуры NK-клеток смесью плазмидного вектора и фрагмента донорской ДНК, осуществляют культивирование клеток, проводят окрашивание выживших клеток анти PD-1 антителами и анти Fas-лиганд антителами, осуществляют отбор и клонирование клеток с минимальным сигналом для PD-1 и максимальным сигналом для Fas-лиганда с помощью проточного сортера, проводят вторичное культивирование клонов клеток и отбор клеток с помощью иммуноблоттинга с анти PD-1 антителами и анти Fas-лиганд антителами.
8. Способ получения модифицированной линии NK-клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией Fas-лиганда по п. 7, отличающийся тем, что в состав плазмидного вектора с физической картой, представленной на фиг. 1, входят: 295-572 bp - CBh promoter; 819-5090 bp -эндонуклеаза Cas9; 5121-5328 bp - PolyA Signal; 5552-6007 bp - f1 ori; 6289-6393 bp - bla promoter; 6394-7254 bp - bla; 7425-8013 bp - ColE1 ori; 8075-8315 bp - U6 promoter; 8322-8419 bp - последовательность, кодирующая направляющую РНК.
9. Способ получения модифицированной линии NK-клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией Fas-лиганда для того, чтобы вызвать апоптоз или лизис раковых клеток млекопитающего, по п. 7, отличающийся тем, что в состав донорской ДНК размером 2,473 тыс. пар оснований, обеспечивающей инактивацию экспрессии гена PD-1 с одновременной активацией экспрессии в NK-клетке белка Fas-ligand, входят: фрагмент, содержащий последовательность первой части гена pdl размером 379 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 10; фрагмент, содержащий последовательность CMV Promoter размером 588 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 17; фрагмент, содержащий последовательность - Fas-ligand размером 846 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO:18; фрагмент, содержащий последовательность - BGH polyA Signal размером 225 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 19; фрагмент, содержащий последовательность второй части гена pd1 размером 276 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 15.
10. Применение модифицированной линии NK-клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией Fas-лиганда, полученной способом по п. 7, для того, чтобы вызвать апоптоз или лизис раковых клеток млекопитающего, включающее введение млекопитающему эффективного количества клетки-киллера (NK).
11. Способ получения модифицированной линии NK-клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией TRAIL для того, чтобы вызвать апоптоз или лизис раковых клеток млекопитающего, отличающийся тем, что для инактивации экспрессии гена PD-1, осуществляют выбор последовательностей направляющих РНК, специфичных к различным сайтам гена PD-1, входящим в группу SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, конструируют экспрессионные плазмидные вектора, кодирующие выбранную направляющую РНК и эндонуклеазу Cas9, осуществляют синтез фрагмента донорской ДНК, кодирующей экспрессионную кассету для TRAIL, имеющую последовательность согласно SEQ ID NO: 20, проводят трансфекцию культуры NK-клеток смесью плазмидного вектора и фрагмента донорской ДНК, осуществляют культивирование клеток, проводят окрашивание выживших клеток анти PD-1 антителами и анти TRAIL антителами, осуществляют отбор и клонирование клеток с минимальным сигналом для PD-1 и максимальным сигналом для TRAIL с помощью проточного сортера, проводят вторичное культивирование клонов клеток и отбор клеток с помощью иммуноблоттинга с анти PD-1 антителами и анти TRAIL антителами.
12. Способ получения модифицированной линии NK-клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией TRAIL по п. 11, отличающийся тем, что в состав плазмидного вектора с физической картой, представленной на фиг. 1, входят: 295-572 bp - CBh promoter; 819-5090 bp - эндонуклеаза Cas9; 5121-5328 bp - PolyA Signal; 5552-6007 bp - f1 ori; 6289-6393 bp - bla promoter; 6394-7254 bp - bla; 7425-8013 bp - ColE1 ori; 8075-8315 bp - U6 promoter; 8322-8419 bp - последовательность, кодирующая направляющую РНК.
13. Способ получения модифицированной линии NK-клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией TRAIL по п. 11, отличающийся тем, что в состав донорской ДНК размером 2,473 тыс. пар оснований, обеспечивающей инактивацию экспрессии гена PD-1 с одновременной активацией экспрессии в NK-клетке белка TRAIL, входят: фрагмент, содержащий последовательность первой части гена pd1 размером 379 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 10; фрагмент, содержащий последовательность CMV Promoter размером 588 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 17; фрагмент, содержащий последовательность - TRAIL размером 846 пар оснований, характеризующейся нуклеотидной последовательностью, представленной в SEQ ID NO: 21; фрагмент, содержащий последовательность - BGH polyA Signal размером 225 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 19; фрагмент, содержащий последовательность второй части гена pd1 размером 276 пар оснований, характеризующийся нуклеотидной последовательностью, представленной в SEQ ID NO: 15.
14. Применение модифицированной линии NK-клеток с нокаутированным геном PD-1 и конститутивной повышенной экспрессией TRAIL, полученной способом по п. 11, для того, чтобы вызвать апоптоз или лизис раковых клеток млекопитающего, включающее введение млекопитающему эффективного количества клетки-киллера (NK).
| EMILY, POMEROY, et al | |||
| "Enhancing Human NK Cell Function and Specificity for Cancer Immunotherapy." Blood, 2018, 132.Supplement 1: 2044-2044 | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| HSU, JOY, et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2020-09-01—Публикация
2019-04-12—Подача