Область, к которой относится изобретение
Настоящее изобретение относится к искусственно сконструированной иммунной системе с повышенной иммунологической эффективностью. Более конкретно, настоящее изобретение относится к искусственно модифицированной иммунной системе, содержащей искусственно сконструированные иммуномодулирующие элементы, и к иммунным клеткам, включающим эти элементы.
Предшествующий уровень техники
Клеточными терапевтическими агентами являются фармацевтические средства, которые индуцируют регенерацию посредством живых клеток для восстановления поврежденных или аномальных клеток/тканей/молекул, и эти средства представляют собой фармацевтические средства, полученные путем физической, химической или биологической модификации, например, путем ex vivo культивирования, пролиферации, отбора или т.п. аутологичных, аллогенных или гетерологичных клеток.
Такими агентами являются терапевтические агенты на основе иммунорегуляторных клеток, которые представляют собой фармацевтические средства, используемые для лечения заболеваний посредством регуляции иммунных ответов в организме под действием иммунных клеток (например, дендритных клеток, природных клеток-киллеров, T-клеток и т.п.).
В настоящее время, терапевтические агенты на основе иммунорегуляторных клеток получают, главным образом, для их применения в качестве терапевтических средств для лечения рака. В отличие от хирургической операции, применение противораковых средств и лучевой терапии, которые в настоящее время используются для лечения рака, терапевтические средства на основе иммунорегуляторных клеток имеют терапевтические механизмы и обладают терапевтическим действием, которое достигается посредством активации иммунных функций при прямом введении иммунных клеток пациентам, при этом, ожидается, что, эти новые биологические препараты найдут преимущественное применение в будущем.
Физические и химические свойства антигенов, вводимых в клетки, варьируются в зависимости от типа терапевтических агентов на основе иммунорегуляторных клеток. При введении экзогенного гена в иммунные клетки в форме вирусного вектора и т.п., эти клетки будут обладать свойствами клеточных терапевтических агентов и генных терапевтических агентов.
Введение терапевтических агентов на основе иммунорегуляторных клеток может быть осуществлено путем активации различных иммунных клеток (например, мононуклеарных клеток периферической крови (МКПК), Т-клеток, NK-клеток и т.п., выделенных у пациентов путем афереза) различными антителами и цитокинами, с последующей их пролиферацией ex vivo и введением пациенту снова; или повторным их введением в иммунные клетки пациента, в которые был введен ген (например, T-клеточных рецепторов (TCR) или химерных антигенных рецепторов (CAR)).
Адоптивная иммунотерапия, которая включает доставку аутологичных антигенспецифических иммунных клеток (например, T-клеток), продуцированных ex vivo, может рассматриваться как перспективная стратегия для лечения различных иммунных заболеваний, а также рака.
Недавно сообщалось, что терапевтические агенты на основе иммунных клеток могут обладать различными функциями, например, они могут быть использованы в качестве аутоиммунного ингибитора и т.п., а также противораковой функцией. Следовательно, терапевтические агенты на основе иммунных клеток могут быть использованы для лечения различных заболеваний посредством модуляции иммунных ответов. В соответствии с этим, необходимость в повышении терапевтической эффективности модифицированных иммунных клеток, используемых в адоптивной иммунотерапии, и в их получении является особенно актуальной.
Раскрытие изобретения
Техническая проблема
В своем репрезентативном варианте, настоящее изобретение относится к искусственно модифицированной иммунной системе с повышенным иммунным эффектом.
В своем репрезентативном варианте, настоящее изобретение относится к искусственно модифицированному иммунорегуляторному фактору и к клетке, содержащей этот фактор.
В своем репрезентативном варианте, настоящее изобретение относится к способу модификации (например, усиления или ингибирования) функции иммунной клетки.
В своем репрезентативном варианте, настоящее изобретение относится к терапии и/или профилактике заболевания, ассоциированного с иммунологическими патологиями, где указанная терапия и/или профилактика включают использование иммунорегуляторного фактора и/или иммунных клеток с модифицированной иммунной функцией, как эффективных компонентов.
В своем репрезентативном варианте, настоящее изобретение относится к сообщению противораковой функции посредством повышения уровня пролиферации, жизнеспособности, цитотоксичности, инфильтрации иммунных клеток и повышения уровня высвобождения цитокинов этими клетками.
В своем репрезентативном варианте, настоящее изобретение относится к иммунорегуляторному гену, такому как PD-1, CTLA-4, A20, DGKα, DGKζ, FAS, EGR2, PPP2R2D, PSGL-1, KDM6A, TET2 и т.п. и/или к продуктам, экспрессируемым этими генами.
В своем репрезентативном варианте, настоящее изобретение относится к композиции для редактирования генома иммунных клеток, включающей комплекс «гидовая нуклеиновая кислота - белок-редактор», применяемый для регуляции активности иммунорегуляторного гена, и к способу применения такой композиции.
В своем репрезентативном варианте, настоящее изобретение относится к комплексу «гидовая нуклеиновая кислота - белок-редактор», который может быть использован для модификации иммунорегуляторного гена, такого как PD-1, CTLA-4, A20, DGKα, DGKζ, FAS, EGR2, PPP2R2D, PSGL-1, KDM6A, TET2 и т.п.
Техническое решение
Для решения этих проблем было разработано настоящее изобретение, которое относится к искусственно сконструированной иммунной системе с улучшенным иммунным эффектом. Более конкретно, настоящее изобретение относится к искусственно сконструированной иммунной системе, содержащей искусственно сконструированный иммунорегуляторный фактор, и к иммунной клетке, включающей этот фактор.
Настоящее изобретение относится к генетически измененному или модифицированному иммунорегуляторному фактору, используемому в конкретных целях.
Термин «иммунорегуляторный фактор» означает вещества, которые функционируют в комбинации с вырабатыванием и действием иммунного ответа, включая все различные вещества, которые могут представлять собой неприродные, то есть, искусственно сконструированные вещества, обладающие функцией, регулирующей иммунный ответ. Так, например, эти вещества могут представлять собой генетически сконструированный или модифицированный ген или белок, экспрессирующийся в иммунной клетке.
Иммунорегуляторный фактор может функционировать как активатор или инактиватор иммунных клеток. Иммунорегуляторный фактор может стимулировать иммунный ответ (например, таким фактором является фактор регуляции роста иммунных клеток, фактор регуляции гибели иммунных клеток, фактор подавления функции иммунных клеток или элемент секреции цитокинов и т.п.).
В репрезентативном варианте осуществления изобретения, иммунорегуляторным фактором может быть, например, генетически сконструированный или модифицированный ген PD-1, ген CTLA-4, ген TNFAIP3(A20), ген DGKA, ген DGKZ, ген FAS, ген EGR2, ген PPP2R2D, ген TET2, ген PSGL-1 или ген KDM6A.
В репрезентативном варианте осуществления изобретения, иммунорегуляторным фактором могут быть два или более генетически измененных или модифицированных генов. Так, например, два или более генов, выбранных из группы, состоящей из гена PD-1, гена CTLA-4, гена TNFAIP3(A20), гена DGKA, гена DGKZ, гена FAS, гена EGR2, гена PPP2R2D, гена TET2, гена PSGL-1 или гена KDM6A, могут быть искусственно изменены или модифицированы.
В предпочтительном примере настоящего изобретения, иммунорегуляторным фактором могут быть ген TNFAIP3(A20), ген DGKA, ген DGKZ, ген FAS, ген EGR2, ген PSGL-1 или ген KDM6A.
Поэтому, в своем репрезентативном варианте, настоящее изобретение относится к одному или более искусственно модифицированным иммунорегуляторным факторам, выбранным из группы, состоящей из гена PD-1, гена CTLA-4, гена TNFAIP3(A20), гена DGKA, гена DGKZ, гена FAS, гена EGR2, гена PPP2R2D, гена TET2, гена PSGL-1 и гена KDM6A, которые имеют модификацию в последовательности нуклеиновой кислоты.
Модификация в последовательности нуклеиновой кислоты может представлять собой, но не ограничивается ею, искусственную модификацию с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор».
Термин «гидовая нуклеиновая кислота - белок-редактор» означает комплекс, образованный посредством взаимодействия между гидовой нуклеиновой кислотой и белком-редактором, где комплекс «нуклеиновая кислота - белок» включает гидовую нуклеиновую кислоту и белок-редактор.
Комплекс «гидовая нуклеиновая кислота - белок-редактор» может служить для модификации рассматриваемого объекта. Таким объектом может быть нуклеиновая кислота, ген, хромосома или белок в качестве мишеней.
Так, например, ген может представлять собой иммунорегуляторный ген, искусственно модифицированный посредством комплекса «гидовая нуклеиновая кислота - белок-редактор»,
где: искусственно модифицированный иммунорегуляторный ген включает одну или более модификаций нуклеиновых кислот, которые представляют собой:
по меньшей мере одну делецию или инсерцию одного или более нуклеотидов; замену одним или более нуклеотидами, отличающимися от гена дикого типа; и инсерцию одного или более чужеродных нуклеотидов в последовательности мотива, смежного с протоспейсером (PAM), в последовательности нуклеиновой кислоты, входящей в состав иммунорегуляторного гена, или в непрерывной последовательности из 1-50 п.о., где указанная область последовательности оснований является смежной с 5'-концом и/или 3'-концом этой последовательности, или
химическую модификацию одного или более нуклеотидов в последовательности нуклеиновой кислоты, входящей в состав иммунорегуляторного гена.
Модификация нуклеиновых кислот может присутствовать в промоторной области гена.
Модификация нуклеиновых кислот может присутствовать в экзонной области гена. В одном репрезентативном варианте осуществления изобретения, 50% модификаций могут присутствовать в области, расположенной выше кодирующих областей гена.
Модификация нуклеиновых кислот может присутствовать в интронной области гена.
Модификация нуклеиновых кислот может присутствовать в энхансерной области гена.
Последовательность PAM может представлять собой, например, одну или более из нижеследующих последовательностей (записанных в направлении 5' → 3'):
NGG (N представляет собой A, T, C или G);
NNNNRYAC (каждый N независимо представляет собой A, T, C или G, R представляет собой A или G, а Y представляет собой C или T);
NNAGAAW (каждый N независимо представляет собой A, T, C или G, а W представляет собой A или T);
NNNNGATT (каждый N независимо представляет собой A, T, C или G);
NNGRR(T) (каждый N независимо представляет собой A, T, C или G, R представляет собой A или G, а Y представляет собой C или T); и
TTN (N представляет собой A, T, C или G).
Кроме того, в другом своем варианте, настоящее изобретение относится к гидовой нуклеиновой кислоте, способной образовывать комплементарную связь с каждой из последовательностей-мишеней SEQ ID NO: 1-289 в последовательностях нуклеиновой кислоты по меньшей мере одного гена, выбранного из группы, состоящей из PD-1, CTLA-4, A20, Dgkα, Dgkζ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и Tet2.
Так, например, настоящее изобретение может относиться к одной или более гидовым нуклеиновым кислотам, выбранным из группы, описанной ниже и состоящей из:
гидовой нуклеиновой кислоты, способной образовывать комплементарную связь с каждой из последовательностей-мишеней SEQ ID NO: 6 и 11 в последовательности нуклеиновой кислоты гена A20;
гидовой нуклеиновой кислоты, способной образовывать комплементарную связь с каждой из последовательностей-мишеней SEQ ID NO: 19, 20, 21 и 23, в последовательности нуклеиновой кислоты гена Dgkα;
гидовой нуклеиновой кислоты, способной образовывать комплементарную связь с последовательностью-мишенью SEQ ID NO: SEQ ID NO: 25 в последовательности нуклеиновой кислоты гена EGR2;
гидовой нуклеиновой кислоты, способной образовывать комплементарную связь с последовательностью-мишенью SEQ ID NO: 64 в последовательности нуклеиновой кислоты гена PPP2R2D;
гидовой нуклеиновой кислоты, способной образовывать комплементарную связь с каждой из последовательностей-мишеней SEQ ID NO: 87 и 89 в последовательности нуклеиновой кислоты гена PD-1;
гидовой нуклеиновой кислоты, способной образовывать комплементарную связь с каждой из последовательностей-мишеней SEQ ID NO: 109, 110, 111, 112 и 113 в последовательности нуклеиновой кислоты гена Dgkζ;
гидовой нуклеиновой кислоты, способной образовывать комплементарную связь с каждой из последовательностей-мишеней SEQ ID NO: 126, 128 и 129 в последовательности нуклеиновой кислоты гена Tet-2;
гидовой нуклеиновой кислоты, способной образовывать комплементарную связь с последовательностью-мишенью SEQ ID NO: 182 в последовательности нуклеиновой кислоты гена PSGL-1;
гидовой нуклеиновой кислоты, способной образовывать комплементарную связь с каждой из последовательностей-мишеней SEQ ID NO: 252, 254, 257 и 264 в последовательности нуклеиновой кислоты гена FAS; и
гидовой нуклеиновой кислоты, способной образовывать комплементарную связь с последовательностью-мишенью SEQ ID NO: 285 в последовательности нуклеиновой кислоты гена KDM6A.
Гидовая нуклеиновая кислота может имть, но не ограничивается ими, 18-25 п.о., 18-24 п.о., 18-23 п.о., 19-23 п.о. или 20-23 п.о. нуклеотидов.
Кроме того, настоящее изобретение относится к искусственно модифицированной иммунной клетке, которая содержит один или более искусственно сконструированных иммунорегуляторных генов и продуктов их экспрессии.
Клеткой является, но не ограничивается ими, иммунная клетка и стволовая клетка. Иммунными клетками являются клетки, участвующие в иммунном ответе, включая все клетки, которые прямо или опосредованно участвуют в иммунном ответе, и эти клетки на стадии дифференцировки.
Стволовыми клетками могут быть эмбриональные стволовые клетки, стволовые клетки взрослых, индуцированные плюрипотентные стволовые клетки (iPS-клетки) или клетки, происходящие от индуцированных плюрипотентных стволовых клеток (например, iPS-клетки, взятые у индивидуума и модифицированные для модификации (например, для индуцирования мутации), где указанная клетка способна к ауторепликации и дифференцировке.
Иммунной клеткой может быть CD3-позитивная клетка. Так, например, такой клеткой может быть T-клетка или CAR-T-клетка.
Иммунной клеткой может быть CD56-позитивная клетка. Так, например, такой клеткой может быть NK-клетка, такая как первичная NK-клетка NK92.
В одном из вариантов осуществления изобретения, иммунной клеткой может быть клетка, позитивная по CD3 и CD56 (клетка, позитивная по двум антигенам CD3/CD56). Так, например, такой клеткой может быть природная T-клетка-киллер (NKT) или клетка-киллер, индуцированная цитокинами (CIK).
В частности, например, такой клеткой является по меньшей мере одна клетка, выбранная из группы, состоящей из Т-клеток, таких как CD8+-T-клетки (например, «необученные» CD8+-T-клетки, эффекторные CD8+-T-клетки, центральные T-клетки памяти или эффекторные T-клетки памяти), CD4+-Т-клетки, природные T-клетки-киллеры (NKT-клетки), регуляторные T-клетки, стволовые T-клетки памяти, лимфоидные клетки-предшественники, гемопоэтические стволовые клетки, природные клетки-киллеры (NK-клетки), дендритные клетки, клетки, индуцированные цитокинами (CIK), мононуклеарные клетки периферической крови (МКПК), моноциты, макрофаги, природные T-клетки-киллеры (NKT-клетки) и т.п. Предпочтительными иммунными клетками могут быть T-клетки, CAR-T- клетки, NK-клетки или NKT-клетки.
Иммунная клетка может быть искусственно модифицирована так, чтобы она подавляла или инактивировала активность иммунорегуляторного гена.
Иммунная клетка может также содержать химерный антигенный рецептор (CAR).
Так, например, T-клетка также содержит химерный антигенный рецептор (CAR) или сконструированный TCR (T-клеточный рецептор).
Иммунная клетка также содержит комплекс «гидовая нуклеиновая кислота - белок-редактор» или последовательность нуклеиновой кислоты, кодирующую этот комплекс.
Белок-редактор представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белка Cas9, происходящего от Streptococcus pyogenes, белка Cas9, происходящего от Campylobacter jejuni, белка Cas9, происходящего от Streptococcus thermophilus, белка Cas9, происходящего от Streptococcus aureus, белка Cas9, происходящего от Neisseria meningitidis, и белка Cpf1. Так, например, этот белок может представлять собой белок Cas9, происходящий от Streptococcus pyogenes, или белок Cas9, происходящий от Campylobacter jejuni.
Гидовая нуклеиновая кислота может образовывать комплементарную связь с частью последовательностей нуклеиновой кислоты одного или более генов, выбранных из группы, состоящей из PD-1, CTLA-4, A20, DGKα, DGKζ, FAS, EGR2, PPP2R2D, PSGL-1, KDM6A и TET2. Эта нуклеиновая кислота может давать 0-5, 0-4, 0-3 или 0-2 ошибочных спариваний. В предпочтительном примере, гидовой нуклеиновой кислотой могут быть нуклеотиды, образующие комплементарную связь с одной или более последовательностями-мишенями SEQ ID NN: 1-289, в Таблице 1.
В репрезентативном примере, гидовой нуклеиновой кислотой могут быть нуклеотиды, образующие комплементарную связь с одной или более последовательностями-мишенями SEQ ID NN: 6-11(A20), SEQ ID NN: 19, 20, 21 и 23 (DGKα), SEQ ID NN: 25(EGR2), SEQ ID NN: 64(PPP2R2D), SEQ ID NN: 87 и 89(PD-1), SEQ ID NN: 109, 110, 111, 112 и 113 (DGKζ), SEQ ID NN: 126, 128 и 129(TET-2), SEQ ID NN: 182(PSGL-1), SEQ ID NN: 252, 254, 257 и 264(FAS), и SEQ ID NN: 285(KDM6A), соответственно.
В репрезентативном варианте осуществления изобретения, иммунная клетка содержит по меньшей мере один искусственно сконструированный ген, выбранный из гена DGKα и гена DGKζ, которые были подвергнуты модификации в последовательности нуклеиновой кислоты.
В другом репрезентативном варианте осуществления изобретения, иммунная клетка содержит искусственно сконструированный ген DGKα и ген DGKζ, которые были подвергнуты модификации в последовательности нуклеиновой кислоты.
В другом своем репрезентативном варианте, настоящее изобретение относится к композиции, индуцирующей нужный иммунный ответ. Такая композиция может называться фармацевтической композицией или терапевтической композицией.
В одном своем репрезентативном варианте, настоящее изобретение относится к композиции для модификации гена, включающей гидовую нуклеиновую кислоту, способную образовывать комплементарную связь с каждой из последовательностей-мишеней SEQ ID NN: 1-289 в последовательности нуклеиновой кислоты одного или более генов, выбранных из PD-1, CTLA-4, A20, Dgkα, Dgkζ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и Tet2, и белок-редактор или нуклеиновую кислоту, кодирующую этот белок.
Описание релевантной конфигурации является таким, как оно приводится выше.
В своем репрезентативном варианте, настоящее изобретение относится к способу искусственной манипуляции с иммунной клеткой, включающему контактирование иммунной клетки, выделенной из организма человека, по меньшей мере с одним из компонентов, выбранных из:
(a) гидовой нуклеиновой кислоты, способной образовывать комплементарную связь с каждой из последовательностей-мишеней SEQ ID NN: 1-289 в последовательности нуклеиновой кислоты по меньшей мере одного гена, выбранного из группы, состоящей из PD-1, CTLA-4, A20, Dgkα, Dgkζ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и Tet2; и
(b) белка-редактора, который представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белка Cas9, происходящего от Streptococcus pyogenes, белка Cas9, происходящего от Campylobacter jejuni, белка Cas9, происходящего от Streptococcus thermophilus, белка Cas9, происходящего от Streptococcus aureus, белка Cas9, происходящего от Neisseria meningitidis, и белка Cpf1.
Гидовая нуклеиновая кислота и белок-редактор могут присутствовать в одном или более векторах, каждый из которых имеет форму последовательности нуклеиновой кислоты, либо они могут присутствовать в виде комплекса, образованного посредством связывания гидовой нуклеиновой кислоты и белка-редактора.
Стадию контактирования осуществляют in vivo или ex vivo.
Стадию контактирования осуществляют одним или более методами, выбранными из метода электропорации, метода с использованием липосом, плазмид, вирусных векторов, наночастиц и метода с использованием гибридного белка, содержащего домен транслокации белка.
Вирусным вектором является по меньшей мере одни вектор, выбранный из группы, состоящей из ретровируса, лентивируса, аденовируса, аденоассоциированного вируса (AAV), вируса коровьей оспы, поксвируса и вируса простого герпеса.
В одном своем репрезентативном варианте, настоящее изобретение относится к способу получения информации о последовательности в положении, которое является мишенью для иммунной клетки у индивидуума, путем секвенирования по меньшей мере одного гена, выбранного из группы PD-1, CTLA-4, A20, Dgkα, Dgkζ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и Tet2.
Кроме того, настоящее изобретение относится к способу конструирования библиотеки с использованием информации, полученной указанным способом.
В одном своем репрезентативном варианте, настоящее изобретение относится к набору для модификации гена, включающему следующие компоненты:
(a) гидовую нуклеиновую кислоту, способную образовывать комплементарную связь с каждой из последовательностей-мишеней SEQ ID NN: 1-289 в последовательности нуклеиновой кислоты по меньшей мере одного гена, выбранного из группы, состоящей из PD-1, CTLA-4, A20, Dgkα, Dgkζ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и Tet2; и
(b) белок-редактор, который включает один или более белков, выбранных из группы, состоящей из белка Cas9, происходящего от Streptococcus pyogenes, белка Cas9, происходящего от Campylobacter jejuni, белка Cas9, происходящего от Streptococcus thermophilus, белка Cas9, происходящего от Streptococcus aureus, белка Cas9, происходящего от Neisseria meningitidis, и белка Cpf1.
Эти наборы могут быть использованы для искусственного манипулирования с нужным геном.
В одном своем репрезентативном варианте, настоящее изобретение относится ко всем аспектам терапевтического лечения заболевания с применением иммунотерапевтического способа, включающего введение индивидууму искусственно модифицированной иммунной клетки, такой как генетически сконструированная иммунная клетка или стволовая клетка. Такой способ является особенно подходящим для адоптивной иммунотерапии.
Мишенями для лечения могут быть млекопитающие, включая приматов (например, человека, обезьян и т.п.) и грызунов (например, мышей, крыс и т.п.).
Преимущественные эффекты изобретения
Результат эффективной терапии на основе иммунных клеток может быть достигнут с использованием иммунной системы, функции которой были искусственно изменены путем искусственной модификации иммунорегуляторных факторов и клеток, содержащих эти факторы.
Так, например, если иммунорегуляторные факторы были подвергнуты искусственной регуляции с применением способа или композиции согласно изобретению, то может быть повышена эффективность иммунного ответа, обеспечивающего выживаемость, пролиферацию, персистентность, цитотоксичность, цитотоксичность иммунных клеток, а также высвобождение цитокинов этими клетками и/или их инфильтрацию и т.п.
Краткое описание чертежей
На фиг. 1 представлен график, иллюстрирующий среднюю интенсивность флуоресценции (MFI) CD25 в клетках, где ген DGK-альфа был подвергнут нокауту с использованием оцрРНК (#11; показано как DGK-альфа #11) для DGK-альфа.
На фиг. 2 представлен график, иллюстрирующий MFI CD25 в клетках, где ген A20 был подвергнут нокауту с использованием оцрРНК (#11; показано как A20 #11) для A20.
На фиг. 3 представлен график, иллюстрирующий MFI CD25 в клетках, где ген EGR2 был подвергнут нокауту с использованием оцрРНК (#1; показано как EGR2 #1) для EGR2.
На фиг. 4 представлен график, иллюстрирующий MFI CD25 в клетках, где ген PPP2R2D был подвергнут нокауту с использованием оцрРНК (#10; показано как PPP2R2D#10) для PPP2R2D.
На фиг. 5 представлен график, иллюстрирующий уровень IFN-гамма в клеточной культуральной среде, где ген DGK-альфа был подвергнут нокауту с использованием оцрРНК (#11; показано как DGK-альфа #11) для DGK-альфа; где ген A20 был подвергнут нокауту с использованием оцрРНК (#11; показано как A20 #11) для A20; и где ген EGR2 был подвергнут нокауту с использованием оцрРНК (#1; показано как EGR2 #1) для EGR2, соответственно (уровень IFN-гамма выражен в пг/мл).
На фиг. 6 представлен график, иллюстрирующий уровень IFN-гамма в клеточной культуральной среде, где ген DGK-альфа был подвергнут нокауту с использованием оцрРНК (#11; показано как DGK-альфа #11) для DGK-альфа; где ген DGK-альфа был подвергнут нокауту с использованием оцрРНК (комбинированное применение #8 и #11; показано как DGK-альфа #8+11) для DGK-альфа; где ген DGK-дзета был подвергнут нокауту с использованием оцрРНК (#5; показано как DGK-дзета #5) для DGK-дзета, и где ген A20 был подвергнут нокауту с использованием оцрРНК (#11; показано как A20#11) для с A20, соответственно (уровень IFN-гамма выражен в пг/мл).
На фиг. 7 представлен график, иллюстрирующий уровень IL-2 в клеточной культуральной среде, где ген DGK-альфа был подвергнут нокауту с использованием DGK-альфа #11; где ген DGK-альфа был подвергнут нокауту с использованием DGK-альфа #8+11; где ген DGK-дзета был подвергнут нокауту с использованием DGK-дзета #5; и где ген A20 был подвергнут нокауту с использованием A20#11, соответственно (уровень IL-2 выражен в пг/мл).
На фиг. 8a показаны результаты нокаута CRISPR/Cas9-опосредованного гена DGK в человеческих первичных T-клетках, где на (A) указано время нокаута гена в человеческих первичных T-клетках (активация клеток с использованием CD3/CD28-сфер, доставка лентивируса посредством 139 CAR, и нокаут гена DGK посредством электропорации d) и (B) указана эффективность инсерции-делеции (indel) для DGKα и DGKζ с использованием системы Mi-seq; а на фиг. 8b представлены графики, иллюстрирующие результаты анализа на нежелательную мишень.
На фиг. 9a показаны графики, иллюстрирующие усиление эффекторных функций и пролиферацию CAR-T-клеток посредством нокаута гена DGK, где на (A) представлены результаты оценки цитолитической активности 139 CAR-T-клеток путем анализа 7-AAD- позитивных клеток U87vIII с помощью проточной цитометрии, а на (B) представлены результаты анализа на способность секретировать цитокины с помощью ELISA (IFN-γ, набор IL-2, Biolegend); и на фиг. 9b представлены результаты оценки на пролиферацию 139 CAR T-клеток с помощью проточной цитометрии.
На фиг. 10 показаны результаты повышения уровня экспрессии 139 CAR и усиления передачи сигнала у CD3-конца после нокаута DGK посредством обработки антигенами, где на (A) показаны результаты вестерн-блот-анализа фосфорилированных сигналов ERK для 139 CAR-T-клеток, стимулированных CD3/CD28-сферами, а на (B) показаны результаты экспрессии 139 CAR, полученные с помощью проточной цитометрии (слева: экспрессия CAR в зависимости от присутствия антигенов; справа: сравнение уровней экспрессии CAR через 3 дня после обработки антигенами).
На фиг. 11 представлены графики, иллюстрирующие результаты, при которых нокаут DGK не индуцирует активацию тонуса и истощение T-клеток, где на (A) показана оценка способности секретировать IFN-γ с помощью ELISA, и на (B) показаны результаты анализов на маркеры истощения в CAR-позитивных T-клетках (то есть PD-1 (слева) и TIM-3 (справа)).
На фиг. 12 показаны графики, иллюстрирующие результаты, при которых T-клетки с DGK-нокаутом предотвращают иммуносупрессорное действие TGF-β и PGE2, где на (A) показана оценка цитолитической активности, способности секретировать IFN-γ и способности секретировать IL-2 139 CAR-T-клетками и 139 DGKαζ CAR-T-клетками в зависимости от присутствия TGF-β (10 нг/мл), а на (B) показана оценка цитолитической активности, способности секретировать IFN-γ и способности секретировать IL-2 139 CAR-T-клетками и 139 DGKαζ- CAR-T-клетками в зависимости от присутствия PGE2 (0,5 мкг/мл).
На фиг. 13 показаны графики, иллюстрирующие результаты эффективности CRISPR/Cas9-опосредуемого нокаута DGKα и влияние на эффекторные функции человеческих NK-клеток, где на (A) и (B) показаны графики, иллюстрирующие анализ на эффективность нокаута в клетках NK-92 и в человеческих первичных NK-клетках с использованием системы Mi-seq, и на (C) показан график, иллюстрирующий цитолитическую активность NK-92 при анализе 7-AAD-позитивных клеток Raji.
На фиг. 14 показаны результаты оценки эффективности CRISPR/Cas9-опосредуемого нокаута DGKα и DGKζ в человеческих NK-Т-клетках, где на (A) показаны результаты оценки на эффективность INDEL, на (B) показаны результаты оценки роста клеток, на (C) показаны результаты оценки жизнеспособности клеток, а на (D) показаны результаты экспериментального вестерн-блот-анализа, проводимого для идентификации наличия экспрессии на белковом уровне.
На фиг. 15 показаны графики, иллюстрирующие влияние DGKα и DGKζ на эффекторные функции в человеческих NKT-клетках, где было подтверждено влияние соответствующего нокаута и одновременного нокаута DGKα и DGKζ на (A) цитолитическую активность и (B) способность секретировать IFN-γ с помощью ELISA (набора для анализа на IFN, Biolegend).
На фиг. 16 показаны графики, иллюстрирующие (A) эффективность INDEL и (B) повышение цитотоксичности (то есть, повышение цитолитической активности) после нокаута PA-1 в NKT-клетках для функциональной оценки нокаута DGKα и DGKζ в человеческих NKT-клетках.
На фиг. 17a-17c показаны графики, иллюстрирующие результаты анализа путем скрининга оцрРНК hPSGL-1 в клетках Jurkat, где на фиг. 17a показаны эффективность INDEL и число клеток Jurkat, в которых PSGL-1 не экспрессировался после нокаута, а на фиг. 17b и 17c представлена степень экспрессии PSGL-1 на поверхности клеток Jurkat после нокаута.
На фиг. 18 показаны графики, иллюстрирующие результаты эксперимента по нокауту (KO) hPSGL-1 в человеческих первичных Т-клетках, где на (A) показана эффективность INDEL, на (B) показано число T-клеток, в которых PSGL-1 не экспрессировался после нокаута, а на (C) показан уровень экспрессии PSGL-1 на поверхности Т-клеток после нокаута.
Наилучший вариант осуществления изобретения
Если это не оговорено особо, то все используемые здесь технические и научные термины имеют общепринятые значения, понятные среднему специалисту в области, к которой относится настоящее изобретение. Хотя для практического осуществления настоящего изобретения или для проведения испытаний могут быть применены методы и материалы, аналогичные или идентичные описанным здесь методам и материалам, однако, подходящие методы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие упоминаемые здесь документы во всей своей полноте вводятся в настоящее описание посредством ссылки. Кроме того, материалы, методы и примеры носят лишь иллюстративный, но не ограничивающий характер.
Настоящее изобретение относится к искусственно модифицированной иммунной системе с улучшенной иммунной эффективностью. Более конкретно, настоящее изобретение относится к искусственно модифицированной иммунной системе, включающей искусственно модифицированный иммунорегуляторный фактор и клетки, содержащие этот фактор.
[Иммунорегуляторный фактор]
Иммунорегуляторный фактор
Термин «иммунорегуляторный фактор» означает соединение, которое функционирует в комбинации с продуцированием и вырабатыванием иммунного ответа, включая все различные соединения, которые могут быть неприродными, то есть искусственно модифицированными, и способны регулировать иммунные ответы. Так, например, этот иммунорегуляторный фактор может представлять собой генетически измененный или модифицированный ген или белок, экспрессирующийся в иммунных клетках.
Термин «искусственно модифицированный» относится к искусственно модифицированному состоянию, которое не является природным.
Термин «генетически модифицированный» означает, что генетическая модификация была искусственно введена в биологические или небиологические вещества, упоминаемые в настоящем изобретении, и такими веществами могут быть, например, ген и/или генный продукт (например, полипептиды, белки и т.п.), геномы которых были искусственно модифицированы в конкретных целях.
В своем предпочтительном примере, настоящее изобретение относится к генетически измененному или модифицированному иммунорегуляторному фактору, применяемому в конкретных целях.
Перечисленные ниже элементы являются лишь примерами иммунорегуляторных факторов и не ограничиваются типами иммунорегуляторных факторов, входящих в объем настоящего изобретения. Перечисленные ниже гены или белки могут обладать не только одним типом иммунорегуляторной функции, но могут включать функции многих типов. Кроме того, настоящее изобретение может относиться, если это необходимо, к двум или более иммунорегуляторным факторам.
Элементы, регулирующие активность иммунных клеток
Термин «элемент, регулирующий активность иммунных клеток» означает элемент, который регулирует степень или активность иммунного ответа, например, он может представлять собой генетически измененный или модифицированный ген или белок, функция которого заключается в регуляции степени или активности иммунного ответа.
Элемент, регулирующий активность иммунных клеток, может осуществлять функции, ассоциированные с активацией или дезактивацией иммунных клеток.
Элемент, регулирующий активность иммунных клеток, может стимулировать или улучшать иммунный ответ.
Элемент, регулирующий активность иммунных клеток, может подавлять иммунный ответ.
Элемент, регулирующий активность иммунных клеток, может связываться с белками каналов клеточных мембран и с рецепторами и может осуществлять функции, ассоциированные с передачей сигнала, который регулирует иммунные ответы, и функции, ассоциированные с синтезом и разложением белков.
Так, например, элемент, регулирующий активность иммунных клеток, может представлять собой белок запрограммированной клеточной гибели (PD-1).
Ген PD-1 (также обозначаемый как ген PDCD1; далее, ген PD-1 и ген PDCD1 используются для обозначения одного и того же гена) означает ген (полноразмерную ДНК, кДНК или мРНК), который кодирует белок PD-1, также называемый кластером дифференцировки 279 (CD279). В одном из вариантов осуществления изобретения, ген PD-1 может представлять собой, но не ограничивается ими, один или более генов, выбранных из группы, состоящей из следующих генов: генов, кодирующих человеческий PD-1 (например, NCBI рег. No. NP_005009.2, и т.п.), например, генов PD-1, представленных в NCBI рег. No. NM_005018.2, NG_012110.1, и т.п.
Элемент, регулирующий активность иммунных клеток, может представлять собой белок 4, ассоциированный с цитотоксическими Т-лимфоцитами (CTLA-4).
Ген CTLA-4 означает ген (полноразмерную ДНК, кДНК или мРНК), который кодирует белок CTLA-4, который также называется кластером дифференцировки 152 (CD152). В одном из вариантов осуществления изобретения, ген CTLA-4 может представлять собой, но не ограничивается ими, один или более генов, выбранных из группы, состоящей из следующих генов: генов, кодирующих человеческий CTLA-4 (например, NCBI рег. No. NP_001032720.1,NP_005205.2, и т.п.), например, генов CTLA-4, представленных в NCBI рег. No. NM_001037631.2, NM_005214.4, NG_011502.1, и т.п.
Элемент, регулирующий активность иммунных клеток, может представлять собой CBLB.
Элемент, регулирующий активность иммунных клеток, может представлять собой PSGL-1.
Элемент, регулирующий активность иммунных клеток, может представлять собой ILT2.
Элемент, регулирующий активность иммунных клеток, может представлять собой KIR2DL4.
Элемент, регулирующий активность иммунных клеток, может представлять собой SHP-1.
Вышеуказанные гены могут происходить от млекопитающих, включая приматов (например, человека, обезьян и т.п.) и грызунов (например, мышей, крыс и т.п.).
В одном из вариантов осуществления изобретения, элемент, регулирующий активность иммунных клеток, может стимулировать иммунный ответ.
Элемент, регулирующий активность иммунных клеток, может представлять собой элемент регуляции роста иммунных клеток.
Термин «элемент регуляции роста иммунных клеток» означает элемент, который регулирует рост иммунных клеток посредством регуляции синтеза белка и т.п. в иммунных клетках, например, ген или белок, экспрессирующийся в иммунных клетках.
Элемент регуляции роста иммунных клеток может функционировать при транскрипции ДНК, трансляции РНК и дифференцировке клеток.
Примерами элементов регуляции роста иммунных клеток могут быть гены или белки, участвующие в путях экспрессии NFAT, IκB/NF-κB, AP-1, 4E-BP1, eIF4E и S6.
Так, например, элемент регуляции роста иммунных клеток может представлять собой DGK-альфа.
Ген DGKA(Dgk-альфа) означает ген (полноразмерную ДНК, кДНК или мРНК), который кодирует белок диацилглицерин-киназу альфа (DGKA). В одном из вариантов осуществления изобретения, ген DGKA может представлять собой, но не ограничивается ими, один или более генов, выбранных из группы, состоящей из следующих генов: генов, кодирующих человеческий DGKA (например, NCBI рег. No. NP_001336.2, NP_958852.1, NP_958853.1, NP_963848.1, и т.п.), например, генов DGKA, представленных в NCBI рег. No. NM_001345.4, NM_201444.2, NM_201445.1, NM_201554.1, NC_000012.12 и т.п.
Элемент регуляции роста иммунных клеток может представлять собой DGK-дзета.
Ген DGKZ (Dgk-дзета) означает ген (полноразмерную ДНК, кДНК или мРНК), который кодирует белок диацилглицерин-киназу дзета (DGKZ). В одном из вариантов осуществления изобретения, ген DGKZ может представлять собой, но не ограничивается ими, один или более генов, выбранных из группы, состоящей из следующих генов: генов, кодирующих человеческий DGKZ (например, NCBI рег. No. NP_001099010.1, NP_001186195.1, NP_001186196.1, NP_001186197.1, NP_003637.2, NP_963290.1, NP_963291.2, и т.п.), например, генов DGKZ, представленных в NCBI рег. No. NM_001105540.1, NM_001199266.1, NM_001199267.1, NM_001199268.1, NM_003646.3, NM_201532.2, NM_201533.3, NG_047092.1 и т.п.
Элемент регуляции роста иммунных клеток может представлять собой EGR2.
Ген EGR2 означает ген (полноразмерную ДНК, кДНК или мРНК), который кодирует ранний белок регуляции роста 2 (EGR2). В одном из вариантов осуществления изобретения, ген EGR2 может представлять собой, но не ограничивается ими, один или более генов, выбранных из группы, состоящей из нижеследующих генов.
Элемент регуляции роста иммунных клеток может представлять собой EGR3.
Элемент регуляции роста иммунных клеток может представлять собой PPP2R2D.
Элемент регуляции роста иммунных клеток может представлять собой A20 (TNFAIP3).
Элемент регуляции роста иммунных клеток может представлять собой PSGL-1.
Вышеуказанные гены могут происходить от млекопитающих, включая приматов (например, человека, обезьян и т.п.) и грызунов (например, мышей, крыс и т.п.)
Элемент регуляции активности иммунных клеток может представлять собой элемент, регулирующий гибель иммунных клеток.
Термин «элемент, регулирующий гибель иммунных клеток» означает элемент, участвующий в функциях, приводящих к гибели иммунных клеток, и такой элемент может представлять собой ген или белок, экспрессирующийся в иммунных клетках, осуществляющих такую функцию.
Элемент регуляции гибели иммунных клеток может осуществлять функции, ассоциированные с апоптозом или некрозом иммунных клеток.
В одном из вариантов осуществления изобретения, элемент регуляции гибели иммунных клеток может представлять собой белок или ген, ассоциированный с каскадом реакций каспазы.
Элемент регуляции гибели иммунных клеток может представлять собой Fas. Что касается описанного далее белка или гена, то для специалиста в данной области очевидно, что рецептор или связывающая область, на которых функционируют белок или ген, могут быть модифицированы.
В другом варианте осуществления изобретения, элемент регуляции гибели иммунных клеток может представлять собой белок или ген, ассоциированный с доменом гибели. В частности, элемент регуляции гибели иммунных клеток может представлять собой Daxx.
Элемент регуляции гибели иммунных клеток может представлять собой белок семейства Bcl-2.
Элемент регуляции гибели иммунных клеток может представлять собой белок, принадлежащий только к семейству BH3.
Элемент регуляции гибели иммунных клеток может представлять собой Bim.
Элемент регуляции гибели иммунных клеток может представлять собой Bid.
Элемент регуляции гибели иммунных клеток может представлять собой BAD.
Элемент регуляции гибели иммунных клеток может представлять собой лиганд или рецептор, локализованный в иммунной внеклеточной мембране.
В частности, элемент регуляции гибели иммунных клеток может представлять собой PD-1.
Кроме того, элемент регуляции гибели иммунных клеток может представлять собой CTLA-4.
Элемент регуляции активности иммунных клеток может представлять собой элемент регуляции истощения иммунных клеток.
Термин «элемент регуляции истощения иммунных клеток» означает элемент, осуществляющий функции, ассоциированные с прогрессирующей потерей функций иммунных клеток, и такой элемент может представлять собой ген или белок, экспрессирующийся в иммунных клетках, осуществляющих такую функцию.
Элемент регуляции истощения иммунных клеток может стимулировать транскрипцию или трансляцию генов, участвующих в инактивации иммунных клеток.
В частности, функцией, стимулирующей транскрипцию, может быть функция деметилирования соответствующих генов.
Кроме того, генами, участвующими в инактивации иммунных клеток, являются гены элемента регуляции активности иммунных клеток.
В частности, элемент регуляции истощения иммунных клеток может представлять собой TET2.
Гены, кодирующие человеческий ген (например, NCBI рег. No NP_001120680.1, NP_060098.3 и т.п.), например, ген TET2, представлены в NCBI рег. No. NM_001127208.2, No. NM_017628.4, NG_028191.1 и т.п.
Элемент регуляции истощения иммунных клеток может участвовать в избыточном росте иммунных клеток. Иммунные клетки, которые не подвергаются избыточному росту и не регенерируются, теряют свои функции.
В частности, элемент регуляции истощения иммунных клеток может представлять собой Wnt. Далее, следует отметить, что при упоминании белка или гена, очевидно, что белок или ген, который участвует в пути передачи сигнала, и рецептор, на который действует ген, и связывающая область, могут быть модифицированы.
Кроме того, элемент регуляции истощения иммунных клеток может представлять собой Akt. Далее, следует отметить, что при упоминании белка или гена, очевидно, что белок или ген, который участвует в пути передачи сигнала, и рецептор, на который действует ген, и связывающая область, могут быть модифицированы.
Элемент регуляции активности иммунных клеток может представлять собой элемент регуляции продуцирования цитокинов.
Термин «элемент регуляции продуцирования цитокинов» означает ген или белок, участвующий в секреции цитокинов иммунных клеток, и такой элемент может представлять собой ген или белок, экспрессирующийся в иммунных клетках, осуществляющих такую функцию.
Цитокин является общим термином, означающим белок, который секретируется иммунными клетками, и представляет собой сигнальный белок, который играет важную роль in vivo. Цитокины участвуют в развитии инфекций, вырабатывании иммунитета, в воспалении, травмах, разрушении органов, развитии рака и т.п. Цитокины могут секретироваться клетками, а затем влиять на другие клетки или клетки, которые секретируют эти цитокины. Так, например, они могут индуцировать пролиферацию макрофагов или стимулировать дифференцировку самих секреторных клеток. Однако, если цитокины секретируются в избыточном количестве, то это может вызывать патологии, такие как атака на нормальные клетки, а поэтому, «правильная» секреция цитокинов также играет важную роль в иммунных ответах.
Элемент регуляции продуцирования цитокинов может представлять собой, например, предпочтительно, ген или белок, участвующих в путях TTNFα, IFN-γ, TGF-β, IL-2, IL-4, IL-10, IL-13, IL-1, IL-6, IL-12, IL-7, IL-15, IL-17 и IFN-α.
Альтернативно, цитокины могут передавать сигнал другим иммунным клеткам для индуцирования уничтожения клеток, несущих известный антиген, иммунными клетками, или для стимуляции дифференцировки. В частности, элемент регуляции продуцирования цитокинов может представлять собой, например, предпочтительно, ген или белок, участвующий в генном пути секреции IL-2.
В одном из вариантов осуществления изобретения, термин «иммунорегуляторный фактор» может означать группу молекул, которые экспрессируются в иммунных клетках. Эти молекулы могут эффективно подавлять/активировать или ингибировать/стимулировать иммунные ответы.
Так, например, в группу молекул, экспрессирующихся T-клетками, входят «иммунные сверочные точки», которыми могут быть, но не ограничиваются ими, белок запрограммированой гибели 1 (PD-1. PDCD1 или CD279, рег. No.: NM_005018), цитотоксический Т-лимфоцитарный антиген 4 (CTLA-4 или CD152, GenBank рег. No.: AF414120.1), LAG3 (CD223, рег. No.: NM_002286.5), Tim3 (HAVCR2, GenBank рег. No.: JX049979.1), BTLA(CD272, рег. No.: NM_181780.3), BY55 (CD160, GenBank рег. No.: CR541888.1), TIGIT(IVSTM3, рег. No.: NM_173799), LAIR1 (CD305, GenBank рег. No.: CR542051.1), SIGLEC10 (GeneBank рег. No.: AY358337.1), 2B4 (CD244, рег. No.: NM_001166664.1), PPP2CA, PPP2CB, PTPN6, PTPN22, CD96, CRTAM, SIGLEC7, SIGLEC9, TNFRSF10B, TNFRSF10A, CASP8, CASP10, CASP3, CASP6, CASP7, FADD, FAS, TGFBRII, TGFRBRI, SMAD2, SMAD3, SMAD4, SMAD10, SKI, SKIL,TGIF1, IL10RA, IL10RB, HMOX2, IL6R, IL6ST,EIF2AK4, CSK, PAG1, SIT1, FOXP3, PRDM1, BATF, GUCY1A2, GUCY1A3, GUCY1B2 и GUCY1B3, которые непосредственно ингибируют иммунные клетки.
В одном из вариантов осуществления изобретения, иммунорегуляторный фактор может представлять собой, например, генетически измененный или модифицированный ген PD-1, ген CTLA-4, ген TNFAIP3 (A20), ген DGKA, ген DGKZ, ген FAS, ген EGR2, ген 2R2D, ген TET2, ген PSGL-1 и ген KDM6A.
В одном из вариантов осуществления изобретения, иммунорегуляторный фактор может включать два или более генетически измененных или модифицированных генов. Так, например, два или более генов, выбранных из группы, состоящей из гена PD-1, гена CTLA-4, гена TNFAIP3 (A20), гена DGKA, гена DGKZ, гена FAS, гена EGR2, гена PPP2R2D, гена TET2, гена PSGL-1 и гена KDM6A, могут быть изменены или модифицированы.
Предпочтительными примерами этих генов согласно изобретению могут быть генетически измененные или модифицированные гены TNFAIP3, DGKA, DGKZ, FAS, EGR2, PSGL-1 и KDM6A.
Генетические изменения или модификации могут быть достигнуты путем индуцирования искусственной инсерции, делеции, замены и инверсионной мутации во всех или в части областей геномной последовательности генов дикого типа. Кроме того, генетические изменения или модификации могут быть также достигнуты путем объединения генетических изменений или модификаций двух или более генов.
Так, например, эти гены могут быть активированы посредством таких генетических изменений или модификаций, и в результате, белки, кодируемые этими генами, не будут экспрессироваться в форме белков, имеющих свои природные функции.
Так, например, эти гены могут быть также активированы посредством таких генетических изменений или модификаций, так, чтобы белки, кодируемые этими генами, экспрессировались в форме белков, имеющих улучшенные функции по сравнению с природными функциями. В одном из примеров, если функцией белка, кодируемого конкретным геном, является функция A, то функция белка, экспрессируемого модифицированным геном, может полностью отличаться от функции A, либо этот белок может иметь дополнительную функцию (A+B), включая A.
Так, например, изменение или модификация гена могут быть осуществлены так, чтобы два или более белков экспрессировались в гибридной форме, с использованием двух или более генов, функции которых отличаются друг от друга или комплементарны друг другу.
Так, например, изменение или модификация гена могут быть осуществлены так, чтобы два или более белков экспрессировались в отдельной независимой форме в клетке, с использованием двух или более генов, функции которых отличаются друг от друга или комплементарны друг другу.
Генетическая информация может быть взята из известной базы данных, такой как GenBank Национального Центра биотехнологической информации (NCBI).
В одном из вариантов осуществления изобретения, изменение или модификация гена могут быть индуцированы путем одной или более из следующих модификаций:
делеции всего или части модифицируемого гена (далее называемого «геном-мишенью»), например, делеции нуклеотидов 1 п.о. или более генов-мишеней (например, 1-30 нуклеотидов, 1-27 нуклеотидов, 1-25 нуклеотидов, 1-23 нуклеотидов, 1-20 нуклеотидов, 1-15 нуклеотидов, 1-10 нуклеотидов, 1-5 нуклеотидов, 1-3 нуклеотидов или 1 нуклеотида); и
замены нуклеотидов 1 п.о. или более генов-мишеней (например, 1-30 нуклеотидов, 1-27 нуклеотидов, 1-25 нуклеотидов, 1-23 нуклеотидов, 1-20 нуклеотидов, 1-15 нуклеотидов, 1-10 нуклеотидов, 1-5 нуклеотидов, 1-3 нуклеотидов, или 1 нуклеотида, отличающихся от природных нуклеотидов (дикого типа)) и инсерции одного или более нуклеотидов (например, 1-30 нуклеотидов, 1-27 нуклеотидов, 1-25 нуклеотидов, 1-23 нуклеотидов, 1-20 нуклеотидов, 1-15 нуклеотидов, 1-10 нуклеотидов, 1-5 нуклеотидов, 1-3 нуклеотидов, или 1 нуклеотида) в любом положении гена-мишени.
Часть модифицируемого гена-мишени («области-мишени») может представлять собой область непрерывной нуклеотидной последовательности в гене, имеющем 1 п.о. или более, 3 п.о. или более, 5 п.о. или более, 7 п.о. или более, 10 п.о. или более, 12 п.о. или более, 15 п.о. или более,17 п.о. или более, 20 п.о. или более (например, 1 п.о.- 30 п.о., 3 п.о. - 30 п.о., 5 п.о. - 30 п.о., 7 п.о. - 30 п.о., 10 п.о. - 30 п.о., 12 п.о. - 30 п.о., 15 п.о. - 30 п.о., 17 п.о. - 30 п.о., 20 п.о. - 30 п.о., 1 п.о. - 27 п.о., 3 п.о. - 27 п.о., 5 п.о. - 27 п.о., 7 п.о. - 27 п.о., 10 п.о. - 27 п.о., 12 п.о. - 27 п.о., 15 п.о. - 27 п.о., 17 п.о. - 27 п.о., 20 п.о. - 27 п.о., 1 п.о. - 25 п.о., 3 п.о. - 25 п.о., 5 п.о. - 25 п.о., 7 п.о. - 25 п.о., 10 п.о. - 25 п.о., 12 п.о. - 25 п.о., 15 п.о. - 25 п.о., 17 п.о. - 25 п.о., 20 п.о. - 25 п.о., 1 п.о. - 23 п.о., 3 п.о. - 23 п.о., 5 п.о. - 23 п.о., 7 п.о. - 23 п.о., 10 п.о. - 23 п.о., 12 п.о. - 23 п.о., 15 п.о. - 23 п.о., 17 п.о. - 23 п.о., 20 п.о. - 23 п.о., 1 п.о. - 20 п.о., 3 п.о. - 20 п.о., 5 п.о. - 20 п.о., 7 п.о. - 20 п.о., 10 п.о. - 20 п.о., 12 п.о. - 20 п.о., 15 п.о. - 20 п.о., 17 п.о. - 20 п.о., 21 п.о. - 25 п.о., 18 п.о. - 22 п.о., или 21 п.о. - 23 п.о.
Клетки, содержащие иммунорегуляторный фактор
В одном из своих аспектов, настоящее изобретение относится к клеткам, включающим искусственно модифицированный иммунорегуляторный фактор.
Клетками являются, но не ограничиваются ими, иммунные клетки и стволовые клетки.
«Иммунная клетка» согласно изобретению представляет собой клетку, участвующую в иммунных ответах, и такими клетками являются все клетки, которые прямо или опосредованно участвуют в иммунном ответе, и клетки на предварительной стадии дифференцировки.
Иммунные клетки могут выполнять функцию секреции цитокинов, дифференцировки в другие иммунные клетки и цитотоксичности. Иммунными клетками также являются клетки, в которые были введены мутации в отличие от природных клеток.
Иммунные клетки дифференцируются из гемопоэтических стволовых клеток костного мозга, и такими клетками являются, главным образом, лимфоидные клетки-предшественники и миелоидные клетки-предшественники, а также все T-клетки и В-клетки, из которых дифференцируются лимфоидные клетки-предшественники, и которые ответственны за приобретенный иммунитет; и макрофаги, эозинофилы, нейтрофилы, базофилы, мегакариоциты, эритроциты и т.п., диференцирующиеся из миелоидных клеток-предшественников.
В частности, такими клетками могут быть по меньшей мере одна клетка, выбранная из группы, состоящей из Т-клеток, например, CD8+-T-клеток (например, «необученных» CD8+-T-клеток, эффекторных CD8+-T-клеток, центральных T-клеток памяти или эффекторных T-клеток памяти), CD4+-Т-клеток, природных T-клеток-киллеров (NKT-клеток), регуляторных T-клеток (Treg), стволовых T-клеток памяти, лимфоидных клеток-предшественников, гемопоэтических стволовых клеток, природных клеток-киллеров (NK-клеток), дендритных клеток, клеток, индуцированных цитокинами (CIK), мононуклеарных клеток периферической крови (МКПК), моноцитов, макрофагов, природных T-клеток-киллеров (NKT-клеток) и т.п. Макрофаги и дендритные клетки могут называться антигенпрезентирующими клетками (АПК), которые представляют собой специализированные клетки, способные активировать T-клетки, если рецепторы главного комплекса гистосовместимости (MHC) на клеточной поверхности взаимодействуют с TCR на поверхности T-клеток. Альтернативно, любые гемопоэтические стволовые клетки или клетки иммунной системы могут быть превращены в АПК путем введения антиген-экспрессирующей молекулы нуклеиновой кислоты, распознаваемой TCR или другим антигенсвязывающим белком (например, CAR).
В одном из вариантов осуществления изобретения, иммунной клеткой может быть клетка, используемая в иммунотерапии путем инактивации или замены гена, который синтезирует белок, ассоциированный с распознаванием МНС и/или иммунными функциями (например, с белком иммунной сверочной точки).
В одном из вариантов осуществления изобретения, иммунная клетка может также включать полинуклеотиды, кодирующие короткоцепочечные и мультисубъединичные рецепторы (например, CAR, TCR и т.п.) для специфического распознавания клетки.
В одном из вариантов осуществления изобретения, иммунная клетка согласно изобретению может происходить от крови (например, периферической крови), стволовых клеток (например, эмбриональных стволовых клеток, индуцированных плюрипотентных стволовых клеток и т.п.), клеток пупочного канатика, костного мозга и т.п., взятых у здорового донора или пациента, либо она может быть модифицирована ex vivo.
В одном из вариантов осуществления изобретения, иммунной клеткой может быть CD3-позитивная клетка, например, T-клетка или CAR-T-клетка. CD3 представляет собой рецептор, в котором TCR и различные белки присутствуют в виде комплекса на поверхности T-клеток. Белки пяти видов, которые обозначаются как цепи γ, δ, ε, ζ и η, составляют CD3 и присутствуют в виде комплекса TCR/CD3 в цепях αβ:γδεζζ или αβ:γδεζη вместе с TCR. Эти белки, как известно, способны передавать сигнал в клетки во время распознавания антигена T-клетками.
В одном из вариантов осуществления изобретения, иммунной клеткой может быть CD56-позитивная клетка, например, NK-клетка (например, клетка NK92 или первичная NK-клетка).
NK-клетки занимают третье место по числу самых крупных иммунных клеток, и приблизительно 10% иммуноцитов периферической крови составляют NK-клетки. NK-клетки имеют CD56 и CD16 и являются зрелыми в печени или в костном мозге. NK-клетки атакуют инфицированные вирусами клетки или опухолевые клетки. При распознавании аномальных клеток NK-клетками, они доставляют перфорин в клеточную мембрану, что приводит к растворению клеточной мембраны на участке доставки, после чего в клеточную мембрану доставляется гранзим, способствующий разделению цитоплазмы и тем самым апоптозу и последующей доставке воды и физиологического раствора в клетки, что приводит к некрозу. NK-клетки способны уничтожать раковые клетки различных видов. В частности, NK-клетки хорошо известны как клетки, в которые трудно ввести экзогенные генетические материалы.
В одном из вариантов осуществления изобретения, NK-клеткой может быть клетка, позитивная по двум антигенам, например, природная T-клетка-киллер (NKT) или индуцированная цитокином клетка-киллер (CIK).
Природная T-клетка-киллер (NKT) или индуцированная цитокином клетка-киллер (CIK) представляет собой иммунную клетку, которая одновременно экспрессирует молекулы CD3 (то есть, маркер T-клеток) и CD56 (то есть, маркер природных клеток-киллеров (NK-клеток). NKT-клетки или CIK-клетки уничтожают опухолевые клетки независимо от главного комплекса гистосовместимости (MHC), поскольку эти клетки происходят от T-клеток и обладают свойствами и функциями NK-клеток. В частности, NKT-клетки представляют собой клетки, которые экспрессируют T-клеточные рецепторы (TCR) и маркер поверхности, специфичный для NK-клеток NK1.1 или NKR-P1A (CD161).
В одном примере, NKT-клетки могут распознавать гликолипиды, презентированные CD1d, мономорфным белком, структура которого аналогична структуре MHC класса I. NKT-клетки секретируют цитокины широкого ряда (например, IL-4, IL-13, IL-10 и IFN-γ) при их активации лигандами, такими как α-GalCer. Кроме того, NKT-клетки обладают противоопухолевой активностью.
В другом примере, CIK-клетки принадлежат к семейству иммунных клеток, которые пролиферируются при обработке собранной крови антителом против интерлейкина 2, а затем эти клетки культивируют в течение 2-3 недель ex vivo, и эти клетки являются CD3- и CD56-позитивными клетками. CIK-клетки продуцируют IFN-γ и TNF-α в больших количествах.
В одном из вариантов осуществления изобретения, клеткой может быть эмбриональная стволовая клетка, стволовая клетка взрослых, индуцированная плюрипотентная стволовая клетка (iPS-клетка) или клетка, происходящая от индуцированной плюрипотентной стволовой клетки (например, клетка, происходящая от iPS-клетки) и способная к ауторепликации и дифференцировке.
В предпочтительных вариантах осуществления изобретения, клетка может включать измененные или модифицированные гены, которые представляют собой иммунорегуляторные факторы.
Клетка может включать все измененные или модифицированные гены или их часть или продукт их экспрессии.
Так, например, клеткой может быть клетка, в которой белок, кодируемый геном, не экспрессируется в форме белка, имеющего исходную функцию, в результате инактивации соответствующего гена посредством генетических изменений или модификаций.
Так, например, клеткой может быть клетка, в которой белок, кодируемый геном, экспрессируется в форме белка, имеющего улучшенную функцию по сравнению с исходной функцией, в результате дополнительной инактивации соответствующего гена посредством таких генетических изменений или модификаций.
Так, например, клеткой может быть клетка, в которой белок, кодируемый геном, экспрессируется в форме белка, имеющего исходную функцию и/или дополнительную функцию, что обусловлено такими генетическими изменениями или модификациями.
Так, например, клеткой может быть клетка, в которой два или более белков экспрессируется в модифицированной форме двумя или более генами, отличающимися друг от друга или комплементарными друг другу, что обусловлено такими генетическими изменениями или модификациями.
Так, например, клеткой может быть иммунная клетка, способная продуцировать цитокины на высоком уровне или секретировать цитокины трех видов (например, IL-2, TNF-α и IFN-γ) после таких генетических изменений или модификаций.
В одном из примеров, клетка согласно изобретению может также включать нижеследующие компоненты.
Рецепторы
Клетка согласно изобретению может включать «иммунный рецептор».
Термин «иммунный рецептор», который представляет собой рецептор, присутствующий на поверхности искусственно измененной или модифицированной иммунной клетки, означает вещество, участвующее в иммунных ответах, например, функциональную молекулу, которая распознает антигены и осуществляет специфическую функцию.
Рецептором может быть рецептор дикого типа или искусственно модифицированный рецептор.
Рецептор может обладать аффинностью к антигенам.
Рецептор может распознавать структуры, образованные структурными белками МНС и антигенами, присутствующими в структурных белках.
Рецептор может продуцировать сигнал иммунного ответа.
Термин «сигнал иммунного ответа» означает любой сигнал, который участвует в механизме иммунного ответа.
Сигнал иммунного ответа может представлять собой сигнал, ассоциированный с ростом и дифференцировкой иммунных клеток.
Сигнал иммунного ответа может представлять собой сигнал, ассоциированный с гибелью иммунных клеток.
Сигнал иммунного ответа может представлять собой сигнал, ассоциированный с активностью иммунных клеток.
Сигнал иммунного ответа может представлять собой сигнал, ассоциированный с дополнительной функцией иммунных клеток
Сигнал иммунного ответа может представлять собой сигнал, который регулирует экспрессию представляющего интерес гена.
Сигнал иммунного ответа может представлять собой сигнал, который стимулирует или ингибирует синтез цитокинов.
Сигнал иммунного ответа может представлять собой сигнал, который стимулирует или ингибирует секрецию цитокинов.
Сигнал иммунного ответа может представлять собой сигнал, который участвует в росте или дифференцировке других иммунных клеток.
Сигнал иммунного ответа может представлять собой сигнал, который регулирует активность других иммунных клеток.
Сигнал иммунного ответа может представлять собой сигнал, который направляет другие иммунные клетки в положение передачи сигнала.
В одном из вариантов осуществления изобретения, рецептором может быть T-клеточный рецептор (TCR).
В одном из вариантов осуществления изобретения, клетка может быть модифицирована так, чтобы она включала конкретный ген T-клеточного рецептора (TCR) (например, ген TRAC или TRBC). В другом варианте осуществления изобретения, TCR может представлять собой TCR, который обладает специфичностью связывания с опухолеассоциированным антигеном (например, антигеном меланомы, распознаваемым T-клетками 1 (MART1), с антигеном 3, ассоциированным с меланомой (MAGEA3), NY-ESOl, NYESOl, карциноэмбриональным антигеном (CEA), GP100 и т.п.).
В одном из вариантов осуществления изобретения, рецептором может быть ловушкоподобный рецептор (TLR).
Рецептором может быть CD4 и CD8, который представляет собой корецепторы, участвующие в МНС-рестриктрированной активации T-клеток.
Рецептором может быть CTLA-4 (CD152).
Рецептором может быть CD28.
Рецептором может быть CD137 и 4-1BB, которые представляют собой рецепторы, усиливающие T-клеточные ответы.
Рецептором может быть CD3ζ, который представляет собой элемент передачи сигнала рецепторов T-клеточного антигена.
Рецептором может быть химерный антигенный рецептор (CAR).
В одном из вариантов осуществления изобретения, рецептором может быть искусственно измененный рецептор.
Термин «искусственный рецептор» означает функциональную молекулу, которая была получена искусственно, не является рецептором дикого типа и обладает способностью специфически распознавать антигены и выполнять специфическую функцию.
Такой искусственный рецептор может продуцировать сигналы иммунного ответа, способные улучшать или усиливать распознавание специфических антигенов и могут участвовать в усилении иммунных ответов.
В одном из примеров, искусственный рецептор может иметь компоненты, указанные ниже.
(i) Антиген-распознающая часть
Искусственный рецептор включает антиген-распознающую часть.
Термин «антиген-распознающая часть», которая представляет собой часть искусственного рецептора, означает область, распознающую антиген.
Антиген-распознающей частью может быть часть, которая обладает способностью улучшать распознавание специфических антигенов по сравнению с рецепторами дикого типа. В частности, специфическим антигеном может быть антиген раковой клетки. Кроме того, специфическим антигеном может быть антиген самых распространенных клеток организма.
Антиген-распознающая часть может обладать аффинностью связывания с антигенами.
Антиген-распознающая часть может генерировать сигнал на связывание с антигеном. Сигналом может быть электрический сигнал. Таким сигналом может быть химический сигнал.
Антиген-распознающая часть может включать сигнальную последовательность.
Сигнальная последовательность означает пептидную последовательность, которая обеспечивает доставку белка в специфический сайт в процессе синтеза белка.
Сигнальная последовательность может быть расположена поблизости от N-конца антиген-распознающей части. В частности, расстояние от N-конца может составлять приблизительно 100 аминокислот. Сигнальная последовательность может быть расположена поблизости от С-конца антиген-распознающей части. В частности, расстояние от С-конца может составлять приблизительно 100 аминокислот.
Антиген-распознающая часть может иметь органическую функциональную взаимосвязь с первой сигнал-передающей частью.
Антиген-распознающая часть может быть гомологичной домену антигенсвязывающего фрагмента (Fab) антитела.
Антиген-распознающая часть может представлять собой одноцепочечный вариабельный фрагмент (scFv).
Антиген-распознающая часть может распознавать антиген непосредственно или посредством образования антиген-распознающей структуры.
Антиген-распознающая структура может распознавать антигены посредством образования специфической структуры, и мономерные звенья, составляющие специфическую структуру, и связывание мономерных звеньев может быть легко установлено специалистами в данной области. Кроме того, антиген-распознающая структура может состоять их одного, двух или более мономерных звеньев.
Антиген-распознающей структурой может быть структура, в которой мономерные звенья соединены последовательно, либо структура, в которой мономерные звенья соединены параллельно.
Термин «структура, соединенная последовательно» означает структуру, в которой два или более мономерных звеньев соединены непрерывно в одном направлении, тогда как «структура, соединенная параллельно» означает структуру, в которой каждое из двух или более мономерных звеньев соединены параллельно у дистального конца одного мономерного звена, например, в различных направлениях.
Так, например, мономерным звеном может быть неорганическое вещество.
Мономерным звеном может быть биохимический лиганд.
Мономерное звено может быть гомологичным антиген-распознающей части рецептора дикого типа.
Мономерное звено может быть гомологичным белку-антителу.
Мономерное звено может представлять собой тяжелую цепь иммуноглобулина, либо оно может быть гомологичным этой цепи.
Мономерное звено может представлять собой легкую цепь иммуноглобулина, либо оно может быть гомологичным этой цепи.
Мономерное звено может включать сигнальную последовательность.
При этом, мономерное звено может быть связано химической связью, либо оно может быть связано посредством специфической объединяющей части.
Термин «часть, объединяющая антиген-распознающее звено» означает область, в которой антиген-распознающие звенья соединены друг с другом, и она может представлять собой структуру, которая присутствует, но необязательно, в том случае, если присутствует антиген-распознающая структура, состоящая из двух или более антиген-распознающих звеньев.
Часть, объединяющая антиген-распознающее звено, может представлять собой пептид. В частности, объединяющая часть может иметь высокие отношения серина и треонина.
Часть, объединяющая антиген-распознающее звено, может быть связана химической связью.
Часть, объединяющая антиген-распознающее звено, может стимулировать экспрессию трехмерной структуры антиген-распознающего звена конкретной длины.
Часть, объединяющая антиген-распознающее звено, может стимулировать функцию антиген-распознающей структуры посредством специфической локальной взаимосвязи между антиген-распознающими звеньями.
(ii) Каркас рецептора
Искусственный рецептор включает каркас рецептора.
Термин «каркас рецептора» означает область, в которой опосредуется взаимодействие между антиген-распознающей частью и сигнал-передающей частью, и такая антиген-распознающая часть и сигнал-передающая часть могут быть физически связаны.
Функция каркаса рецептора может заключаться в передаче сигнала, продуцируемого в антиген-распознающей части или сигнал-передающей части.
Структура каркаса рецептора может выполнять функцию или сигнал-передающей части в одно и то же время в зависимости от условий.
Функция рецептора может заключаться в стимуляции и мобилизации искусственного рецептора на иммунных клетках.
Каркас рецептора может включать аминокислотную спиральную структуру.
Структура каркаса рецептора может включать часть, которая является гомологичной части целого белка рецептора, присутствующей в каркасе рецептора. Такая гомология может составлять в пределах от 50% до 100%.
Структура каркаса рецептора может включать часть, которая является гомологичной белкам на иммунных клетках. Такая гомология может составлять в пределах от 50% до 100%.
Так, например, каркас рецептора может представлять собой трансмембранный домен CD8.
Каркас рецептора может представлять собой трансмембранный домен CD28. В частности, если второй сигнал-передающей частью является CD28, то CD28 может выполнять функции второй сигнал-передающей части и каркаса рецептора.
(iii) Сигнал-передающая часть
Искусственный рецептор может включать сигнал-передающую часть.
Термин «первая сигнал-передающая часть», которая представляет собой часть искусственного рецептора, означает часть, которая продуцирует сигнал иммунного ответа.
Термин «вторая сигнал-передающая часть», которая представляет собой часть искусственного рецептора, означает часть, которая продуцирует сигнал иммунного ответа посредством взаимодействия с первой сигнал-передающей частью или независимо.
Искусственный рецептор может включать первую сигнал-передающую часть и/или вторую сигнал-передающую часть.
Искусственный рецептор может включать две или более первых и/или вторых сигнал-передающих частей, соответственно.
Первая и/или вторая сигнал-передающие части могут включать специфический мотив последовательности.
Мотив последовательности может быть гомологичным мотивам белков кластера дифференцировки (CD).
В частности, белки CD могут представлять собой CD3, CD247 и CD79.
Мотив последовательности может представлять собой аминокислотную последовательность YxxL/I.
Мотив последовательности может быть множественным в первой и/или второй сигнал-передающей части.
В частности, первый мотив последовательности может быть расположен на расстоянии 1-200 аминокислот от исходного положения первой сигнал-передающей части. Второй мотив последовательности может быть расположен на расстоянии 1-200 аминокислот от исходного положения второй сигнал-передающей части.
Кроме того, расстояние между каждым мотивом последовательности может составлять 1-15 аминокислот.
В частности, предпочтительное расстояние между каждым мотивом последовательности составляет 6-8 аминокислот.
Так, например, первая и/или вторая сигнал-передающие части могут представлять собой CD3ζ.
Первая и/или вторая сигнал-передающие части могут представлять собой FcεRIγ.
Первая и/или вторая сигнал-передающие части могут представлять собой части, которые продуцируют иммунный ответ только, если выполняется конкретное условие.
Конкретным условием может быть условие, при котором антиген-распознающая часть распознает антигены.
Конкретным условием может быть условие, при котором антиген-распознающая часть образует связь с антигеном.
Конкретным условием может быть условие, при котором генерируемый сигнал передается в том случае, когда антиген-распознающая часть образует связь с антигеном.
Конкретным условием может быть условие, при котором антиген-распознающая часть распознает антиген или антиген-распознающая часть отделяется от антигена при связывании с антигеном.
Сигнал иммунного ответа может представлять собой сигнал, ассоциированный с ростом и дифференцировкой иммунных клеток.
Сигнал иммунного ответа может представлять собой сигнал, ассоциированный с гибелью иммунных клеток.
Сигнал иммунного ответа может представлять собой сигнал, ассоциированный с активностью иммунных клеток.
Сигнал иммунного ответа может представлять собой сигнал, ассоциированный с дополнительной функцией иммунных клеток.
Сигнал иммунного ответа может быть активирован так, чтобы он был специфичным к сигналу, продуцируемому в антиген-распознающей части.
Сигнал иммунного ответа может представлять собой сигнал, который регулирует экспрессию представляющего интерес гена.
Сигнал иммунного ответа может представлять собой сигнал, который подавляет иммунные ответы.
В одном из вариантов осуществления изобретения, сигнал-передающая часть может включать дополнительную сигнал-передающую часть.
Термин «дополнительная сигнал-передающая часть», которая представляет собой часть искусственного рецептора, означает область, которая продуцирует дополнительный сигнал иммунного ответа помимо сигнала иммунного ответа, продуцируемого первой и/или второй сигнал-передающими частями.
Далее, дополнительная сигнал-передающая часть обозначается как n-я сигнал-передающая часть (n≠1) в указанном порядке.
Искусственный рецептор может включать, помимо первой сигнал-передающей части, дополнительную сигнал-передающую часть.
Две или более дополнительных сигнал-передающих части могут быть включены в искусственный рецептор.
Дополнительной сигнал-передающей частью может быть структура, в которой продуцируются сигналы иммунного ответа 4-1BB, CD27, CD28, ICOS и OX40 или другие их сигналы.
Условия, при которых дополнительная сигнал-передающая часть продуцирует сигнал иммунного ответа, и характеристики продуцируемых ими сигналов иммунного ответа, включают условия и характеристики, которые соответствуют сигналам иммунного ответа первой и/или второй сигнал-передающих частей.
Сигнал иммунного ответа может представлять собой сигнал, который стимулирует синтез цитокинов. Сигнал иммунного ответа может представлять собой сигнал, который стимулирует или ингибирует секрецию цитокинов. В частности, цитокином может быть, предпочтительно, IL-2, TNFα или IFN-γ.
Сигнал иммунного ответа может представлять собой сигнал, который стимулирует рост или дифференцировку других иммунных клеток.
Сигнал иммунного ответа может представлять собой сигнал, который регулирует активность других иммунных клеток.
Сигнал иммунного ответа может представлять собой сигнал, который направляет другие иммунные клетки в положение передачи сигнала.
Настоящее изобретение включает все возможные взаимодействия искусственных рецепторов. В соответствии с этим, типы искусственных рецепторов согласно изобретению не ограничиваются описанными здесь рецепторами.
Искусственный рецептор может состоять из антиген-распознающей части - каркаса рецептора - первой сигнал-передающей части. Каркас рецептора может быть включен, но необязательно.
Искусственный рецептор может состоять из антиген-распознающей части - каркаса рецептора - второй сигнал-передающей части - первой сигнал-передающей части. Каркас рецептора может быть включен, но необязательно. В частности, положения первой сигнал-передающей части и второй сигнал-передающей части могут быть изменены.
Искусственный рецептор может состоять из антиген-распознающей части - каркаса рецептора - второй сигнал-передающей части - третьей сигнал-передающей части - первой сигнал-передающей части. Каркас рецептора может быть включен, но необязательно. В частности, положения от первой сигнал-передающей части до третьей сигнал-передающей части могут быть изменены.
В искусственном рецепторе, число сигнал-передающих частей не ограничивается 1-3, но оно может включать число, превышающее 3.
Помимо вышеописанного варианта, искусственный рецептор может иметь структуру антиген-распознающей части - сигнал-передающей части - каркаса рецептора. Такая структура может оказаться предпочтительной, если необходимо продуцировать сигнал иммунного ответа, который будет действовать за пределами клетки, имеющей искусственный рецептор.
Искусственный рецептор может функционировать по механизму, соответствующему механизму рецептора дикого типа.
Искусственный рецептор может функционировать с образованием специфической позиционной взаимосвязи посредством связывания со специфическим антигеном.
Искусственный рецептор может распознавать антиген и продуцировать сигнал иммунного ответа, который стимулирует иммунный ответ против специфического антигена.
Искусственный рецептор может распознавать антигены наиболее распространенных клеток в организме и ингибирует иммунный ответ против этих клеток в организме.
(iv) Сигнальная последовательность
В одном из вариантов осуществления изобретения, искусственный рецептор может включать, но необязательно, сигнальную последовательность.
Если искусственный рецептор включает сигнальную последовательность специфического белка, то это может облегчать определение локализации искусственного рецептора на мембране иммунной клетки. Предпочтительно, если искусственный рецептор включает сигнальную последовательность трансмембранного белка, то это может облегчать определение локализации искусственного рецептора, проникающего через мембрану иммунной клетки, на внешней мембране иммунной клетки.
Искусственный рецептор может включать одну или более сигнальных последовательностей.
Сигнальная последовательность может включать множество положительно заряженных аминокислот.
Сигнальная последовательность может включать положительно заряженную аминокислоту в положении поблизости от N- или С-конца.
Сигнальная последовательность может представлять собой сигнальную последовательность трансмембранного белка.
Сигнальная последовательность может представлять собой сигнальную последовательность белка, локализованного на внешней мембране иммунной клетки.
Сигнальная последовательность может быть включена в структуру искусственного рецептора, то есть, в антиген-распознающую часть, в каркас рецептора, в первую сигнал-передающую часть и дополнительную сигнал-передающую часть.
В частности, сигнальная последовательность может быть локализована в положении поблизости от N- или С-конца каждой структуры.
В частности, расстояние сигнальной последовательности от N- и/или С-конца может составлять приблизительно 100 аминокислот.
В одном из вариантов осуществления изобретения, клеткой может быть клетка, которая была модифицирована так, чтобы она включала специфический ген T-клеточного рецептора (TCR).
В другом варианте осуществления изобретения, TCR может представлять собой TCR, который обладает специфичностью связывания с опухолеассоциированным антигеном (например, антигеном меланомы, распознаваемым T-клетками 1 (MART1), с антигеном 3, ассоциированным с меланомой (MAGEA3), NY-ESOl, карциноэмбриональным антигеном (CEA), NY-ES-O1, (GP100 и т.п.).
В другом варианте осуществления изобретения, клеткой может быть клетка, которая была модифицирована так, чтобы она включала специфический химерный антигенный рецептор (CAR). В одном из вариантов осуществления изобретения, CAR может представлять собой CAR, который специфически связывается с опухолеассоциированным антигеном (например, с CD19, с CD20, с угольная кислота-ангидразой IX (CAIX), CD171, CEA, ERBB2, GD2, с альфа-фолатным рецептором, антигеном Льюиса Y, мембранным антигеном, специфичным к предстательной железе (PSMA), или с опухолеассоциированным гликопротеином 72 (TAG72)).
В другом варианте осуществления изобретения, клеткой может быть, например, клетка, которая была модифицирована так, чтобы она могла связываться с одним или более из нижеследующих опухолевых антигенов посредством TCR или CAR.
Опухолевыми антигенами могут быть, но не ограничиваются ими, AD034, AKT1, BRAP, CAGE, CDX2, CLP, CT-7, CT8/HOM-TES-85, cTAGE-1, EGFR, EGFRvIII, фибулин-1, HAGE, HCA587/MAGE-C2, hCAP-G, HCE661, HER2/neu, HLA-Cw, HOM-HD-21/галектин-9, HOM-MEEL- 40/SSX2, HOM-RCC-3.1.3/CAXII, HOXA7, HOXB6, Hu, HUB 1, KM-HN-3, KM-KN-1, KOC1, KOC2, KOC3, KOC3, LAGE-1, MAGE-1, MAGE-4a, MPPl 1, MSLN, NNP-1, NY-BR-1, NY-BR-62, NY-BR-85, NY-CO-37, NY-CO-38, NY-ESO-1, NY-ESO-5, NY-LU-12, NY-REN-10, NY-REN-19/LKB/STK1 1, NY-REN-21, NY-REN-26/BCR, NY-REN-3/NY-CO-38, NY-REN-33/SNC6, NY- REN-43, NY-REN-65, NY-REN-9, NY-SAR-35, OGFr, PSMA, PSCA PLU-1, Rab38, RBPJ-каппа, RHAMM, SCP1, SCP-1, SSX3, SSX4, SSX5, TOP2A, TOP2B и тирозиназа.
Элемент, регулирующий связывание с антигеном.
Клетки согласно изобретению могут также включать «элемент, регулирующий связывание с антигеном».
«Элемент, регулирующий связывание с антигеном», который представляет собой элемент, ответственный за связывание рецептора с антигеном, может представлять собой ген или белок, выполняющий такую функцию.
Иммунный ответ может регулироваться под действием такого элемента, регулирующего связывание с антигеном. Так, например, если лечение осуществляют путем добавления клеток, которые подвергались внешней модификации в живом организме, и если развивается БТПХ (Болезнь «Трансплантат Против Хозяина»; отторжение трансплантата, болезнь «трансплантат против хозяина» и реакция «отторжения трансплантата у хозяина), где иммунный ответ на клетки, подвергнутые внешней модификации, был активирован, и эффективность лечения не достигается, то такая проблема может быть решена путем подавления способности рецептора иммунных клеток связываться с антигеном.
Элемент, регулирующий связывание с антигеном, может представлять собой белок или ген, ассоциированный со структурой рецептора.
Элемент, регулирующий связывание с антигеном, может представлять собой белок или ген, гомологичный структуре рецептора.
Так, например, элемент, регулирующий связывание с антигеном, может представлять собой dCK.
Элемент, регулирующий связывание с антигеном, может представлять собой CD52.
Элемент, регулирующий связывание с антигеном, может представлять собой B2M.
Элемент, регулирующий связывание с антигеном, может представлять собой белок или ген, ассоциированный со структурами, которые распознают рецептор.
Так, например, элемент, регулирующий связывание с антигеном, может представлять собой белок MHC.
В одном из своих вариантов, настоящее изобретение относится к иммунной клетке, которая включает искусственно модифицированные иммунорегуляторные гены или белки, экспрессируемые этими генами.
В другом своем варианте, настоящее изобретение относится к иммунной клетке, которая включает искусственно модифицированные иммунорегуляторные гены или белки, экспрессируемые этими генами, и рецептор.
В другом своем варианте, настоящее изобретение относится к иммунной клетке, которая включает искусственно модифицированные иммунорегуляторные гены или белки, экспрессируемые этими генами; рецептор и элемент, регулирующий связывание с антигеном.
Репрезентативным примером клетки согласно изобретению является иммунная клетка.
В некоторых репрезентативных вариантах осуществления изобретения, иммунной клеткой может быть по меньшей мере одна клетка, выбранная из группы, состоящей из мононуклеарных клеток периферической крови (МКПК), природных клеток-киллеров (NK-клеток), моноцитов, T-клеток, CAR-T-клеток, макрофагов, природных Т-клеток-киллеров (NKT-клеток) и т.п., а предпочтительно, T-клеток, CAR-T-клеток, природных клеток-киллеров (NK-клеток) или природных Т-клеток-киллеров (NKT-клеток).
Факторами, которые ограничивают эффективность генетически модифицированных иммунных клеток (например, T-клеток, NK-клеток и NKT-клеток), являются:
(1) пролиферация иммунных клеток (например, ограниченное размножение иммунных клеток после адоптивного переноса);
(2) выживаемость иммунных клеток (например, индуцирование апоптоза иммунных клеток посредством таких факторов в опухолевом окружении); и
(3) функция иммунных клеток (например, ингибирование цитотоксической функции иммунных клеток под действием ингибирующих факторов, секретируемых иммунными клетками и раковыми клетками хозяина).
Для этой цели, вышеуказанные ограничивающие факторы регулируются посредством иммунных клеток, где один или более генов, экспрессируемых в иммунных клетках (например, один или более генов, выбранных из группы, состоящей из PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и TET2), являются инактивированными.
В одном из примеров, один или более генов, экспрессируемых в иммунных клетках (например, один или более генов, выбранных из группы, состоящей из генов PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и/или TET2), могут быть таргетированы и модифицированы путем их независимого нокаута, нокдауна или нокина для подавления пролиферации, выживаемости и функции одной или более иммунных клеток.
В одном из примеров, в иммунной клетке, два или более генов, выбранных из группы, состоящей из генов PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и/или TET2, могут быть таргетированы и модифицированы путем их одновременного нокаута, нокдауна или нокина. В одном из вариантов осуществления изобретения, DGKA и DGKZ были одновременно подвергнуты нокауту.
В одном из примеров, один или более генов, экспрессируемых в иммунных клетках (например, один или более генов, выбранных из группы, состоящей из генов PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и/или TET2), могут быть таргетированы и модифицированы путем их независимого нокаута, нокдауна или нокина для подавления пролиферации, выживаемости и функции одной или более иммунных клеток путем нацеливания на некодирующую или кодирующую область (например, промоторную область, энхансер, 3'UTR и/или последовательность сигнала полиаденилирования или последовательность транскрипции (например, последовательность интрона или экзона)).
В одном из примеров, один или более генов, экспрессируемых в иммунных клетках (например, один или более генов, выбранных из группы, состоящей из генов PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и/или TET2), могут быть таргетированы и модифицированы путем их независимого нокаута, нокдауна или нокина для подавления пролиферации, выживаемости и функции одной или более иммунных клеток путем индуцирования модификаций, включая делецию, замену, инсерцию или мутацию в одной или более областях последовательностей.
В частности, очевидно, что иммунорегуляторные гены, которые не были описаны в настоящей заявке, могут быть объединены и таргетированы.
Иммунная система
Кроме того, в другом своем аспекте, настоящее изобретение относится к иммунной системе, которая формирует механизм иммунного ответа, где участвует искусственно модифицированный иммунорегуляторный фактор и/или клетки, включающие этот фактор.
Термин «иммунная система» согласно изобретению включает все феномены, которые влияют на иммунные ответы in vivo посредством изменения функции модифицированного иммунорегуляторого фактора (например, фактора, участвующего в механизме сообщения новых иммунных функций) и включает все материалы, композиции, способы и применения, которые прямо или опосредованно участвуют в такой иммунной системе. Так, например, этот термин включает все гены, иммунные клетки и иммунные органы/ткани, участвующие в вырабатывании врожденного иммунитета, адаптивного иммунитета, клеточного иммунитета, гуморального иммунитета, активного иммунитета и пассивного иммунного ответа.
Элементы, которые составляют такую иммунную систему, часто называют общим термином «фактор иммунной системы».
Иммунная система согласно изобретению включает модифицированные иммунные клетки.
Термин «модифицированная иммунная клетка» означает иммунную клетку, которая была подвергнута искусственной модификации, но не природную клетку. Недавно было проведено интенсивное исследование методов усиления иммунитета путем экстракции иммунных клеток из организма и применения искусственной модификации. Было показано, что такая модифицированная иммунная клетка может быть использована в новом способе терапии благодаря ее превосходной иммунной эффективности против некоторых заболеваний. В частности, исследования модифицированных иммунных клеток были тщательно проведены в комбинации с противораковой терапией.
Модифицированная иммунная клетка может представлять собой функционально модифицированную иммунную клетку или иммунную клетку, в которую была введена искусственная структура.
Функционально модифицированная иммунная клетка
Термин «функционально модифицированная иммунная клетка» согласно изобретению означает иммунную клетку, в которой рецептор дикого типа или иммунорегуляторный фактор являются модифицированными по своей природе.
Далее, термин «модификация» означает все виды модификаций, включая расщепление, лигирование, удаление, инсерцию и модификацию генов; или удаление, добавление или модификацию белков, и эти модификации могут быть осуществлены специалистом для изменения белков и генов. Далее, термин «иммунные клетки» включает не только дифференцированные иммунные клетки, но также и клетки на предварительной стадии дифференцировки (например, стволовые клетки).
Функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых рецепторы дикого типа являются модифицированными. В частности, рецептором дикого типа может быть TCR.
Функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых рецепторы дикого типа отсутствуют или присутствуют на поверхности на низком уровне.
Функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых рецепторы дикого типа присутствуют на поверхности на более высоком уровне.
Функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых рецепторы дикого типа обладают повышенной способностью распознавать специфические антигены.
Функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых иммунорегуляторные факторы являются модифицированными.
Функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых элементы, регулирующие активность иммунных клеток, являются модифицированными.
В частности, функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых один или более генов, выбранных из группы, состоящей из SHP-1, PD-1, CTLA-4, CBLB, ILT-2, KIR2DL4 и PSGL-1, являются инактивированными.
Функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых элементы, регулирующие рост иммунных клеток, являются модифицированными.
В частности, функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых один или более генов, выбранных из группы, состоящей из DGK-альфа, DGK-дзета, Fas, EGR2, Egr3, PPP2R2D и A20, являются инактивированными. В предпочтительном варианте осуществления изобретения, один или более генов, выбранных из группы, состоящей из DGK-альфа, DGK-дзета, EGR2, PPP2R2D и A20, являются инактивированными.
Функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых элементы, регулирующие гибель иммунных клеток, являются модифицированными.
В частности, функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых один или более генов, выбранных из группы, состоящей из Daxx, Bim, Bid, BAD, PD-1 и CTLA-4, являются инактивированными.
Кроме того, функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которые были встроены элементы, индуцирующие гибель клеток.
Функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых элементы, регулирующие истощение иммунных клеток, являются модифицированными.
В частности, функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых один или более генов, выбранных из группы, состоящей из TET2, Wnt и Akt, являются инактивированными.
Функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых элементы, регулирующие продуцирование цитокинов, являются модифицированными.
Функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых элементы, регулирующие связывание с антигеном, являются модифицированными.
В частности, функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых один или более генов, выбранных из группы, состоящей из dCK, CD52, B2M, и MHC, являются инактивированными.
Функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых иммунорегуляторный фактор, отличающийся от вышеупомянутых факторов, является модифицированным.
Функционально модифицированные иммунные клетки могут представлять собой иммунные клетки, в которых один или более иммунорегуляторных факторов, являются одновременно инактивированными. В частности, иммунорегуляторные факторы одного или более видов могут быть модифицированы.
Функционально модифицированные иммунные клетки могут обладать новыми иммунологическими свойствами благодаря модификации рецепторов дикого типа и иммунорегуляторных факторов.
В частности, при манипуляции одного иммунорегуляторного фактора необязательно должен достигаться новый иммунорегуляторный эффект. Модификация одного иммунорегуляторного фактора может сообщать или ингибировать различные новые иммунные свойства.
Новая иммунологическая эффективность может означать эффективность, при которой регулируется способность распознавать специфический антиген.
Новая иммунологическая эффективность может означать эффективность, при которой улучшается способность распознавать специфический антиген.
В частности, специфическим антигеном может быть антиген, вызывающий заболевание, например, антиген раковых клеток.
Новая иммунологическая эффективность может означать эффективность, при которой нарушается способность распознавать специфический антиген.
Новая иммунологическая эффективность может означать улучшенную иммунологическую эффективность.
Новая иммунологическая эффективность может означать новую улучшенную иммунологическую эффективность, при которой регулируется рост иммунных клеток. Новая иммунологическая эффективность может означать иммунологическую эффективность, при которой стимулируется или замедляется рост и дифференцировка клеток.
Новая иммунологическая эффективность может означать новую улучшенную иммунологическую эффективность, при которой регулируется гибель иммунных клеток. В частности, иммунологическая эффективность может предотвращать гибель иммунных клеток. Кроме того, иммунологическая эффективность может вызывать гибель иммунных клеток по истечении определенного периода времени.
Новая иммунологическая эффективность может означать новую улучшенную иммунологическую эффективность, при которой уменьшается потеря функций иммунных клеток.
Новая иммунологическая эффективность может означать новую улучшенную иммунологическую эффективность, при которой регулируется секреция цитокинов иммунными клетками. В частности, иммунологическая эффективность может стимулировать или ингибировать секрецию цитокинов.
Новая иммунологическая эффективность может регулировать антигенсвязывающую способность рецепторов дикого типа в иммунной клетке. В частности, иммунологическая эффективность может повышать специфичность рецепторов дикого типа к специфическим антигенам.
Иммунная клетка, в которую была введена искусственная структура
Термин «иммунная клетка с введенной искусственной структурой» означает иммунную клетку, в которую была введена искусственная структура.
Так, например, иммунная клетка с введенной искусственной структурой может представлять собой иммунную клетку, в которую был введен искусственный рецептор.
Искусственный рецептор может обладать способностью распознавать определенные антигены. В одном примере, иммунная клетка с введенной искусственной структурой может представлять собой CAR-T-клетку.
Кроме того, искусственный рецептор может представлять собой искусственный рецептор, в который были введены искусственные рецепторы, обладающие способностью распознавать каждый из двух или более антигенов, ответственных за конкретное заболевание. В частности, каждый искусственный рецептор может представлять собой рецептор, который экспрессируется в зависимости от времени и условий.
Так, например, в случае модифицированной иммунной клетки, используемой для лечения рака, первый искусственный рецептор может продуцировать сигнал иммунного ответа, который инициирует экспрессию гена второго искусственного рецептора, а затем может быть экспрессирован второй искусственный рецептор. Второй искусственный рецептор может продуцировать сигнал иммунного ответа, который инициирует иммунный ответ против раковых клеток. В этом случае, может быть повышена способность модифицированной иммунной клетки атаковать раковые клетки.
Искусственным рецептором может быть рецептор, обладающий способностью распознавать модифицированную иммунную клетку.
Искусственным рецептором может быть рецептор, обладающий способностью распознавать основные клетки организма. В одном из примеров, иммунная клетка с введенной искусственной структурой может представлять собой iCAR-T-клетку.
Искусственным рецептором может быть рецептор, обладающий способностью распознавать третье вещество. В частности, это третье вещество может обладать способностью связываться с антигенами, вызывающими конкретное заболевание.
В частности, третье вещество может связываться с искусственным рецептором и одновременно связываться с антигенами, вызывающими конкретное заболевание. Так, например, третье вещество может одновременно связываться с искусственным рецептором и с антигеном раковой клетки.
В другом примере, иммунная клетка с добавленной искусственной структурой может представлять собой иммунную клетку, в которую была введена, помимо искусственных рецепторов, искусственная структура, обладающая специфической функцией.
В случае, когда искусственную структуру, отличающуюся от природной структуры, вводят в иммунную клетку, то такая иммунная клетка с введенной искусственной структурой может обладать новой иммунологической эффективностью.
Так, например, новой иммунологической эффективностью может быть иммунологическая эффективность, при которой иммунная клетка связывается со специфическим антигеном, в результате чего эта иммунная клетка приобретает специфическую локализованную взаимосвязь с антигеном.
Новая иммунологическая эффективность может представлять собой функцию распознавания и стимуляции иммунного ответа против специфического антигена.
Новая иммунологическая эффективность может представлять собой функцию ингибирования избыточного иммунного ответа.
Новая иммунологическая эффективность может представлять собой функцию регуляции пути передачи сигнала иммунного ответа.
Новая иммунологическая эффективность может представлять собой функцию связывания иммунной клетки с третьим веществом и подтверждения конкретного заболевания. В частности, третьим веществом может быть биомаркер конкретного заболевания.
Одним из предпочтительных примеров вышеупомянутого специфического антигена может быть антиген раковых клеток.
Антигенами раковых клеток могут быть, но не ограничиваются ими, AD034, AKT1, BRAP, CAGE, CDX2, CLP, CT-7, CT8/HOM-TES-85, cTAGE-1, EGFR, EGFRvIII, фибулин-1, HAGE, HCA587/MAGE-C2, hCAP-G, HCE661, HER2/neu, HLA-Cw, HOM-HD-21/галектин-9, HOM-MEEL-40/SSX2, HOM-RCC-3.1.3/CAXII, HOXA7, HOXB6, Hu, HUB 1, KM-HN-3, KM-KN- 1, KOC1, KOC2, KOC3, KOC3, LAGE-1, MAGE-1, MAGE-4a, MPPl 1, MSLN, NNP-1, NY-BR-1, NY-BR-62, NY-BR-85, NY-CO-37, NY-CO-38, NY-ESO-1, NY-ESO-5, NY-LU-12, NY-REN-10, NY-REN-19/LKB/STK1 1, NY-REN-21, NY-REN-26/BCR, NY-REN-3/NY-CO-38, NY-REN-33/SNC6, NY- REN-43, NY-REN-65, NY-REN-9, NY-SAR-35, OGFr, PLU-1, PSMA, PSCA, Rab38, RBPJ-каппа, RHAMM, SCP1, SCP-1, SSX3, SSX4, SSX5, TOP2A, TOP2B, ROR-1 и тирозиназа.
Гибридная модифицированная иммунная клетка
Термин «гибридная модифицированная иммунная клетка» означает иммунную клетку, в которой был модифицирован иммунорегуляторный фактор, и в которую была введена искусственная структура.
В гибридной модифицированной иммунной клетке, модификация иммунорегуляторного фактора является такой же, как она описана выше для функционально модифицированной иммунной клетки. Кроме того, введение искусственной структуры является таким же, как описано выше для иммунной клетки с введенной искусственной структурой.
Если модификацией функции иммунной клетки является генетическая модификация, то локализация добавленной искусственной структуры может быть такой же, как локализация гена с модифицированной функцией.
Новая иммунологическая эффективность гибридной модифицированной иммунной клетки может представлять собой иммунологическую эффективность, которая включает новые иммунологические эффективности функционально модифицированной иммунной клетки и иммунной клетки с введенной искусственной структурой, и такая иммунологическая эффективность повышается благодаря взаимодействию этих клеток.
Улучшенная иммунологическая эффективность может означать повышение специфичности и иммунного ответа на конкретное заболевание. В предпочтительном примере, гибридной модифицированной иммунной клеткой может быть клетка с повышенной специфичностью и иммунным ответом на раковое заболевание.
Иммунная система согласно изобретению включает желаемый иммунный ответ и механизм лечения заболевания посредством такого ответа, которые достигаются благодаря модифицированному иммунорегуляторному фактору и/или модифицированной иммунной клетке.
В одном из вариантов осуществления изобретения, иммунорегуляторный фактор и/или модифицированная иммунная клетка, где ген, ингибирующий пролиферацию иммунных клеток, был инактивирован, могут быть использованы для подавления пролиферации иммунных клеток.
В одном из вариантов осуществления изобретения, иммунорегуляторный фактор и/или модифицированная иммунная клетка, где ген, опосредующий гибель иммунных клеток, был инактивирован, могут быть использованы для подавления жизнеспособности иммунных клеток.
В одном из вариантов осуществления изобретения, иммунорегуляторный фактор и/или модифицированная иммунная клетка, где ген, кодирующий фактор передачи сигнала на подавление и ингибирование иммунитета, был инактивирован, могут быть использованы для подавления функции иммунных клеток.
Описанные здесь способы и композиции могут быть использованы отдельно или в комбинации для подавления одного или более факторов, ограничивающих эффективность генетически модифицированной иммунной клетки в качестве терапевтического средства для лечения конкретного заболевания (например, пролиферации иммунных клеток, жизнеспособности иммунных клеток, функции иммунных клеток или любых их комбинаций).
При этом термин «иммунорегуляторная терапия» означает лечение заболевания посредством регуляции иммунного ответа в организме с использованием модифицированного иммунорегуляторного фактора и/или модифицированной иммунной клетки.
Так, например, иммунные клетки (например, дендритные клетки, природные клетки-киллеры, T-клетки и т.п.) могут быть использованы для лечения заболеваний посредством активации или инактивации иммунного ответа в организме.
Такая иммунорегуляторная терапия была разработана, главным образом, для ее применения в целях лечения рака, и такая иммунорегуляторная терапия по своему механизму отличается от хирургической операции, терапии противораковыми средствами или лучевой терапии, применяемых в настоящее время для лечения рака, поскольку иммунная функция активируется путем введения иммунных клеток непосредственно пациенту для достижения терапевтического эффекта.
В варианте иммунорегуляторной терапии, проводимой на основе свойств используемых иммунных клеток и генов, вводимых в клетки для их приготовления, иммунорегуляторная терапия включает использование терапевтических средств на основе дендритных иммунорегуляторных клеток, клеток-киллеров, активированных лимфокинами (LAK), опухоль-инфильтрирующих Т-лимфоцитов (TIL), T-клеток, модифицированных T-клеточным рецептором (TCR-T), T-клеток, модифицированных химерным антигенным рецептором (CAR-T), и т.п.
Генетические манипуляция или модификация
Манипуляция или модификации веществ, используемых в иммунорегуляторном факторе, в иммунных клетках и в иммунной системе согласно изобретению, могут быть предпочтительно достигнуты путем генетической манипуляции.
В одном аспекте изобретения, композиция и способ для генетической манипуляции могут быть разработаны путем таргетинга всех или части некодирующих и кодирующих областей иммунорегуляторных генов, подавляющих пролиферацию, жизнеспособность и/или функцию иммунных клеток.
В одном из вариантов осуществления изобретения, композиция и способ, используемые для формирования желаемой иммунной системы, могут быть применены для манипуляции с или модификации одного или более иммунорегуляторных генов, участвующих в иммунной системе. Это может быть достигнуто путем модификации нуклеиновой кислоты, составляющей ген. В результате модификации были включены все гены с нокдауном, нокаутом и нокином.
В одном из вариантов осуществления изобретения, промоторная область или последовательность транскрипции (например, интронная последовательность, экзонная последовательность) может быть таргетирована. Кодирующая последовательность (например, кодирующая область и исходная кодирующая область) может быть таргетирована для модификации и нокаута экспрессии.
В одном из вариантов осуществления изобретения, модификацией нуклеиновой кислоты может быть, например, замена, делеция и/или инсерция нуклеотидов в пределах 1 п.о. - 30 п.о., 1 п.о. - 27 п.о., 1 п.о. - 25 п.о., 1 п.о. - 23 п.о., 1 п.о. - 20 п.о., 1 п.о. - 15 п.о., 1 п.о. - 10 п.о., 1 п.о.-5 п.о., 1 п.о.-3 п.о. или 1 п.о.
В одном из вариантов осуществления изобретения, для нокаута одного или более генов или для выключения одного или более экспрессий или для нокаута одного или более аллелей или двух аллелей иммунорегуляторного гена, эти гены могут быть таргетированы так, чтобы делеция или мутация могли быть включены в один или более иммунорегуляторных генов.
В одном из вариантов осуществления изобретения, нокдаун гена может быть использован для снижения уровня экспрессии нежелательных аллелей или транскриптов.
В одном из вариантов осуществления изобретения, таргетинг промотора, энхансера, интрона, 3'UTR, и/или некодирующнй последовательности сигнала полиаденилирования может быть использован для модификации иммунорегуляторного гена, изменяющего функцию иммунных клеток.
В одном из вариантов осуществления изобретения, регуляция активности (например, активация, инактивация) иммунорегуляторного гена может быть индуцирована путем модификации нуклеиновой кислоты гена.
В одном из вариантов осуществления изобретения, модификация нуклеиновой кислоты гена может быть введена для инактивации генов-мишеней путем расщепления одиночных цепей или двойных цепей в специфической области гена-мишени под действием комплекса «гидовая нуклеиновая кислота - белок-редактор», то есть, посредством катализации разрывов цепей нуклеиновой кислоты.
В одном из вариантов осуществления изобретения, разрывы цепей нуклеиновой кислоты могут быть репарированы под действием определенных механизмов (например, гомологичной рекомбинации, присоединения негомологичных концов (NHEJ) и т.п.).
В этом случае, если выполняется механизм NHEJ, то модификацию последовательности ДНК индуцируют в сайте расщепления, и ген может быть инактивирован по этому же механизму. Репарация посредством NHEJ может приводить к заменам, инсерциям или делециям коротких генных фрагментов и может быть использована для индуцирования соответствующих нокаутов гена.
В другом своем аспекте, настоящее изобретение может относиться к положению для проведения вышеописанной генетической манипуляции.
В одном из вариантов осуществления изобретения, если модификация достигается посредством NHEJ-опосредованной альтерации, то положение для генетической модификации означает положение в гене, которое способствует снижению уровня или элиминации экспрессии продукта иммунорегуляторного гена.
Так, например, положение модификации в гене может находиться в исходной кодирующей области, на участке, составляющем 50% от вышерасположенной кодирующей области, в промоторной области, в специфической интронной последовательности и в специфической экзонной последовательности.
Таким положением может быть специфическое положение в гене, которое влияет на пролиферацию, жизнеспособность и/или функцию иммунной клетки.
Таким положением может быть специфическое положение в гене, которое влияет на функцию белков, участвующих в иммунном ответе.
Таким положением может быть специфическое положение в гене, которое влияет на способность распознавать специфический антиген.
Таким положением может быть специфическое положение в гене, которое влияет на функцию регуляции секреции цитокинов в иммунной клетке.
Таким положением может быть специфическое положение в гене, которое влияет на функцию регуляции способности рецепторов связываться с антигеном в иммунной клетке.
Генетическая манипуляция может быть осуществлена с учетом механизма регуляции экспрессии гена.
В одном из вариантов осуществления изобретения, генетическая манипулция может быть осуществлена на стадиях регуляции транскрипции, регуляции процессинга РНК, регуляции транспорта РНК, регуляции расщепления РНК, регуляции трансляции или регуляции модификации белка путем выбора подходящего метода модификации для каждой стадии.
В одном из вариантов осуществления изобретения, экспрессия генетической информации может регулироваться путем предотвращения или нарушения стабильности мРНК посредством небольшой РНК (нРНК) с использованием РНК-интерференции (РНКи) или сайленсинга РНК, а в некоторых случаях, путем такого нарушения, которое предотвращало бы доставку информации о синтезе белка в промежуточной стадии.
В одном из вариантов осуществления изобретения может быть использован фермент дикого типа или его вариант, способный катализировать гидролиз (расщепление) молекул ДНК или РНК, а предпочтительно, связей между нуклеиновыми кислотами в молекуле ДНК. Может быть использован комплекс «гидовая нуклеиновая кислота - белок-редактор».
Так, например, экспрессия генетической информации может регулироваться путем манипуляции с генами с использованием одного или более ферментов, выбранных из группы, состоящей из мегануклеазы, нуклеазы «цинковые пальцы», CRISPR/Cas9 (белка Cas9), CRISPR-Cpf1 (белка Cpf1) и TALE-нуклеазы.
В предпочтительном и неограничивающем примере, генетическая манипуляция может быть опосредована путем присоединения негомологичных концов (NHEJ) или гомологичной репарации (HDR) с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор» (например, системы CRISPR/Cas).
В одном из вариантов осуществления изобретения, примерами иммунорегуляторного гена, который влияет на пролиферацию, жизнеспособность и/или функцию иммунных клеток, может быть ген PD-1, ген CTLA-4, ген TNFAIP3, ген DGKA, ген DGKZ, ген Fas, ген EGR2, ген PPP2R2D, ген TET2, ген PSGL-1 или ген KDM6A.
Области последовательностей-мишеней вышеуказанных генов (то есть, в сайтах, в которых может быть осуществлена модификация нуклеиновой кислоты) систематизированы ниже в Таблице 1 (часть последовательностей-мишеней, представленных в таблице 1, описана как часть, содержащая последовательность PAM 5'-NGG-3' у 3'-конца).
Последовательность-мишень, подвергаемая таргетингу, может быть одновременно двух или более видов.
Ген, подвергаемый таргетингу, может быть одновременно двух или более видов.
Две или более последовательностей-мишеней в гомологичном гене или две или более последовательностей-мишеней в гетерологичном гене могут быть таргетированы одновременно.
В репрезентативном варианте осуществления изобретения, DGKa или DGKz могут быть таргетированы соответственно.
В репрезентативном варианте осуществления изобретения, DGKa и DGKz могут быть таргетированы одновременно.
Таблица 1. Последовательность-мишень




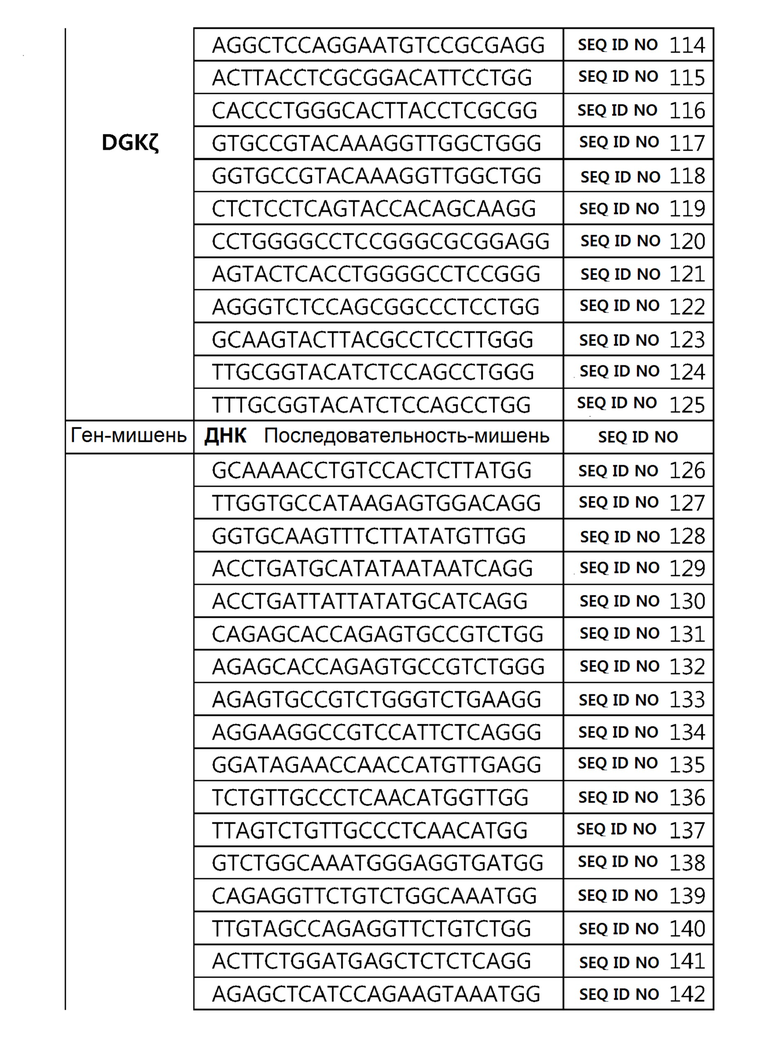





Генетические манипуляции или модификации веществ, используемых в иммунорегуляторных факторах, в иммунных клетках и в иммунной системе согласно изобретению, могут быть достигнуты с использованием «комплекса гидовая нуклеиновая кислота - белок-редактор».
Комплекс «гидовая нуклеиновая кислота - белок-редактор»
Термин «комплекс гидовая нуклеиновая кислота - белок-редактор» означает комплекс, образованный посредством взаимодействия между гидовой нуклеиновой кислотой и белком-редактором, где комплекс «нуклеиновая кислота - белок» включает гидовую нуклеиновую кислоту и белок-редактор.
Термин «гидовая нуклеиновая кислота» означает нуклеиновую кислоту, способную распознавать нуклеиновую кислоту, ген, хромосому или белок в качестве мишеней для комплекса «гидовая нуклеиновая кислота - белок-редактор».
Гидовая нуклеиновая кислота может присутствовать в форме ДНК, РНК или смеси ДНК/РНК и может иметь последовательность нуклеиновой кислоты из 5-150 оснований.
Гидовая нуклеиновая кислота может включать один или более доменов.
Такими доменами могут быть, но не ограничиваются ими, гидовый домен, первый комплементарный домен, линкерный домен, второй комплементарный домен, проксимальный домен или хвостовой домен.
Гидовая нуклеиновая кислота может включать два или более доменов, которые могут представлять собой одинаковые домены с повторами или различные домены.
Гидовая нуклеиновая кислота может иметь непрерывную последовательность нуклеиновой кислоты.
Так, например, одна непрерывная последовательность нуклеиновой кислоты может представлять собой (N)m, где N представляет собой A, T, C или G или A, U, C или G, а m равно целому числу от 1 до 150.
Гидовая нуклеиновая кислота может иметь две или более непрерывных последовательностей нуклеиновой кислоты.
Так, например, две или более непрерывных последовательностей нуклеиновой кислоты могут представлять собой (N)m и (N)o, где N представляет собой A, T, C или G, или A, U, C или G, m и o равны целому числу от 1 до 150, и m и о могут быть одинаковыми или различными.
Термин «белок-редактор» означает пептид, полипептид или белок, способные непосредственно связываться или взаимодействовать без непосредственного связывания с нуклеиновой кислотой. Белок-редактор может также концептуально называться «генами-ножницами» или эндонуклеазой на основе гидовой РНК (RGEN).
Белком-редактором может быть фермент.
Белком-редактором может быть гибридный белок.
В данном описании, термин «гибридный белок» означает белок, полученный путем присоединения фермента к дополнительному домену, пептиду, полипептиду или белку.
Термин «фермент» означает белок, содержащий домен, способный расщеплять нуклеиновую кислоту, ген, хромосому или белок.
Дополнительный домен, пептид, полипептид или белок может представлять собой функциональный домен, пептид, полипептид или белок, функция которого является такой же, как функция фермента или отличается от функции фермента.
Гибридный белок может включать дополнительный домен, пептид, полипептид или белок в одной или более областях у амино-конца (N-конца) фермента или поблизости от него; у карбоксильного конца (C-конца) или поблизости от него; или в средней части фермента; и их комбинацию.
Гибридный белок может включать функциональный домен, пептид, полипептид или белок в одной или более областях у N-конца фермента или поблизости от него; у C-конца или поблизости от него; или в средней части фермента; и их комбинацию.
Комплекс «гидовая нуклеиновая кислота - белок-редактор» может служить для модификации определенного объекта.
Таким объектом может быть нуклеиновая кислота, ген, хромосома или белок в качестве мишени.
Так, например, комплекс «гидовая нуклеиновая кислота - белок-редактор» может осуществлять конечную регуляцию (например, ингибирование, супрессию, снижение, повышение или стимуляцию) экспрессии представляющего интерес белка, удаление белка или экспрессию нового белка.
В данном описании, комплекс «гидовая нуклеиновая кислота - белок-редактор» может действовать на уровне ДНК, РНК, гена или хромосомы.
Комплекс «гидовая нуклеиновая кислота - белок-редактор» может действовать на стадиях транскрипции и трансляции гена.
Комплекс «гидовая нуклеиновая кислота - белок-редактор» может действовать на белковом уровне.
1. Гидовые нуклеиновые кислоты
Гидовой нуклеиновой кислотой является нуклеиновая кислота, способная распознавать нуклеиновую кислоту, ген, хромосому или белок в качестве мишеней и образовывать комплекс «гидовая нуклеиновая кислота - белок».
В данном описании, гидовая нуклеиновая кислота имеет структуру, позволяющую распознавать нуклеиновую кислоту, ген, хромосому или белок или нацеливаться на них посредством комплекса «гидовая нуклеиновая кислота - белок».
Гидовая нуклеиновая кислота может присутствовать в форме ДНК, РНК или смеси ДНК/РНК и иметь последовательность нуклеиновой кислоты из 5-150 оснований.
Гидовая нуклеиновая кислота может присутствовать в линейной или кольцевой форме.
Гидовая нуклеиновая кислота может представлять собой одну непрерывную последовательность нуклеиновой кислоты.
Так, например, одна непрерывная последовательность нуклеиновой кислоты может представлять собой (N)m, где N представляет собой A, T, C или G, или A, U, C или G, а m равно целому числу от 1 до 150.
Гидовая нуклеиновая кислота может представлять собой две или более непрерывных последовательностей нуклеиновой кислоты.
Так, например, две или более непрерывных последовательностей нуклеиновой кислоты могут представлять собой (N)m и (N)o, где N представляет собой A, T, C или G, или A, U, C или G, m и o равны целому числу от 1 до 150, и m и o могут быть одинаковыми или различными.
Гидовая нуклеиновая кислота может включать один или более доменов.
В данном описании, такими доменами могут быть, но не ограничиваются ими, гидовый домен, первый комплементарный домен, линкерный домен, второй комплементарный домен, проксимальный домен или хвостовой домен.
Гидовая нуклеиновая кислота может включать два или более доменов, которые могут представлять собой одинаковые домены с повторами или различные домены.
Эти домены описаны ниже.
i) Гидовый домен
Термин «гидовый домен» означает домен, имеющий комплементарную гидовую последовательность, способную образовывать комплементарную связь с последовательностью-мишенью на гене-мишени или нуклеиновой кислоте-мишени и специфически взаимодействовать с геном- или нуклеиновой кислотой-мишенью.
Гидовая последовательность представляет собой последовательность нуклеиновой кислоты, комплементарную последовательности-мишени на гене- или нуклеиновой кислоте-мишени, и такая последовательность является комплементарной, например, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% или более или полностью комплементарной.
Гидовый домен может представлять собой последовательность из 5-50 оснований.
В одном из примеров, гидовый домен может представлять собой последовательность из 5-50, 10-50, 15-50, 20-50, 25-50, 30-50, 35-50, 40-50 или 45-50 оснований.
В другом примере, гидовый домен может представлять собой последовательность из 1-5, 5-10, 10-15, 15-20, 20-25, 25-30, 30-35, 35-40, 40-45 или 45-50 оснований.
Гидовый домен может иметь гидовую последовательность.
Гидовая последовательность может представлять собой последовательность комплементарных оснований, способную образовывать комплементарную связь с последовательностью-мишенью на гене-мишени или нуклеиновой кислоте-мишени.
Гидовая последовательность может представлять собой последовательность нуклеиновой кислоты, комплементарную последовательности-мишени на гене- или нуклеиновой кислоте-мишени, и такая последовательность является комплементарной, например, по меньшей мере на 70%, 75%, 80%, 85%, 90% или 95% или более или полностью комплементарной.
Гидовая последовательность может представлять собой последовательность из 5-50 оснований.
В одном из примеров, гидовый домен может представлять собой последовательность из 5-50, 10-50, 15-50, 20-50, 25-50, 30-50, 35-50, 40-50 или 45-50 оснований.
В другом примере, гидовая последовательность может представлять собой последовательность из 1-5, 5-10, 10-15, 15-20, 20-25, 25-30, 30-35, 35-40, 40-45 или 45-50 оснований.
Кроме того, гидовый домен может включать гидовую последовательность и дополнительную последовательность оснований.
Дополнительная последовательность оснований может быть использована для улучшения или снижения функции гидового домена.
Дополнительная последовательность оснований может быть использована для улучшения или снижения функции гидовой последовательности.
Дополнительная последовательность оснований может представлять собой последовательность из 1-35 оснований.
В одном из примеров, дополнительная последовательность оснований может представлять собой последовательность из 5-35, 10-35, 15-35, 20-35, 25-35 или 30-35 оснований.
В другом примере, дополнительная последовательность оснований может представлять собой последовательность из 1-5, 5-10, 10-15, 15-20, 20-25, 25-30 или 30-35 оснований.
Дополнительная последовательность оснований может быть локализована у 5'-конца гидовой последовательности.
Дополнительная последовательность оснований может быть локализована у 3'-конца гидовой последовательности.
ii) Первый комплементарный домен
Термин «первый комплементарный домен» означает последовательность нуклеиновой кислоты, включающую последовательность нуклеиновой кислоты, комплементарную второму комплементарному домену, где такая комплементарность является достаточной для образования двойной цепи со вторым комплементарным доменом.
Первый комплементарный домен может представлять собой последовательность из 5-35 оснований.
В одном примере, первый комплементарный домен может представлять собой последовательность из 5-35, 10-35, 15-35, 20-35, 25-35 или 30-35 оснований.
В другом примере, первый комплементарный домен может представлять собой последовательность из 1-5, 5-10, 10-15, 15-20, 20-25, 25-30 или 30-35 оснований.
iii) Линкерный домен
Термин «линкерный домен» означает последовательность нуклеиновой кислоты, соединяющую два или более доменов, которые представляют собой два или более идентичных или различных доменов. Линкерный домен может быть связан с двумя или более доменами посредством ковалентной или нековалентной связи, либо он может соединять два или более доменов посредством ковалентной или нековалентной связи.
Линкерный домен может представлять собой последовательность из 1-30 оснований.
В одном примере, линкерный домен может представлять собой последовательность из 1-5, 5-10, 10-15, 15-20, 20-25 или 25-30 оснований.
В другом примере, линкерный домен может представлять собой последовательность из 1-30, 5-30, 10-30, 15-30, 20-30 или 25-30 оснований.
iv) Второй комплементарный домен
Термин «второй комплементарный домен» означает последовательность нуклеиновой кислоты, включающиую последовательность нуклеиновой кислоты, комплементарную первому комплементарному домену, где такая комплементарность является достаточной для образования двойной цепи с первым комплементарным доменом.
Второй комплементарный домен может иметь последовательность оснований, комплементарную первому комплементарному домену, и последовательность оснований, которая не является комплементарной первому комплементарному домену, например, последовательность оснований, которая не образует двойную цепь с первым комплементарным доменом и может иметь более длинную последовательность оснований, чем первый комплементарный домен.
Второй комплементарный домен может иметь последовательность из 5-35 оснований.
В одном примере, второй комплементарный домен может представлять собой последовательность из 1-35, 5-35, 10-35, 15-35, 20-35, 25-35 или 30-35 оснований.
В другом примере, второй комплементарный домен может представлять собой последовательность из 1-5, 5-10, 10-15, 15-20, 20-25, 25-30 или 30-35 оснований.
v) Проксимальный домен
Термин «проксимальный домен» означает последовательность нуклеиновой кислоты, локализованную рядом со вторым комплементарным доменом.
Проксимальный домен может иметь комплементарную последовательность оснований, посредством которой может образовываться двойная цепь.
Проксимальный домен может представлять собой последовательность из 1-20 оснований.
В одном примере, проксимальный домен может представлять собой последовательность из 1-20, 5-20, 10-20 или 15-20 оснований.
В другом примере, проксимальный домен может представлять собой последовательность из 1-5, 5-10, 10-15 или 15-20 оснований.
vi) Хвостовой домен
Термин «хвостовой домен» означает последовательность нуклеиновой кислоты, локализованную у одного или более концов или у обоих концов гидовой нуклеиновой кислоты.
Хвостовой домен может иметь комплементарную последовательность оснований, посредством которой может образовываться двойная цепь.
Хвостовой домен может представлять собой последовательность из 1-50 оснований.
В одном примере, хвостовой домен может представлять собой последовательность из 5-50, 10-50, 15-50, 20-50, 25-50, 30-50, 35-50, 40-50 или 45-50 оснований.
В другом примере, хвостовой домен может представлять собой последовательность из 1-5, 5-10, 10-15, 15-20, 20-25, 25-30, 30-35, 35-40, 40-45 или 45-50 оснований.
Кроме того, часть или все последовательности нуклеиновой кислоты, включенные в домены, то есть, гидовый домен, первый комплементарный домен, линкерный домен, второй комплементарный домен, проксимальный домен и хвостовой домен могут селективно или дополнительно включать химическую модификацию.
Такой химической модификацией могут быть, но не ограничиваются ими, метилирование, ацетилирование, фосфорилирование, фосфортиоатная связь, блокированная нуклеиновая кислота (LNA), 2'-O-метил-3'-фосфортиоат (MS) или 2'-O-метил-3'-тио-PACE (MSP).
Гидовая нуклеиновая кислота включает один или более доменов.
Гидовая нуклеиновая кислота может включать гидовый домен.
Гидовая нуклеиновая кислота может включать первый комплементарный домен.
Гидовая нуклеиновая кислота может включать линкерный домен.
Гидовая нуклеиновая кислота может включать второй комплементарный домен.
Гидовая нуклеиновая кислота может включать проксимальный домен.
Гидовая нуклеиновая кислота может включать хвостовой домен.
В данном описании могут присутствовать 1, 2, 3, 4, 5, 6 или более доменов.
Гидовая нуклеиновая кислота может включать 1, 2, 3, 4, 5, 6 или более гидовых доменов.
Гидовая нуклеиновая кислота может включать 1, 2, 3, 4, 5, 6 или более первых комплементарных доменов.
Гидовая нуклеиновая кислота может включать 1, 2, 3, 4, 5, 6 или более линкерных доменов.
Гидовая нуклеиновая кислота может включать 1, 2, 3, 4, 5, 6 или более вторых комплементарных доменов.
Гидовая нуклеиновая кислота может включать 1, 2, 3, 4, 5, 6 или более проксимальных доменов.
Гидовая нуклеиновая кислота может включать 1, 2, 3, 4, 5, 6 или более хвостовых доменов.
В данном описании, в гидовой нуклеиновой кислоте, домен одного типа может быть дуплицирован.
Гидовая нуклеиновая кислота может включать несколько доменов с дупликациями или без них.
Гидовая нуклеиновая кислота может включать домены одного типа. В данном описании, домены одного типа могут иметь одну и ту же последовательность нуклеиновой кислоты или различные последовательности нуклеиновой кислоты.
Гидовая нуклеиновая кислота может включать домены двух типов. В данном описании, домены двух различных типов могут иметь различные последовательности нуклеиновой кислоты или одинаковые последовательности нуклеиновой кислоты.
Гидовая нуклеиновая кислота может включать домены трех типов. В данном описании, домены трех различных типов могут иметь различные последовательности нуклеиновой кислоты или одинаковые последовательности нуклеиновой кислоты.
Гидовая нуклеиновая кислота может включать домены четырех типов. В данном описании, домены четырех различных типов могут иметь различные последовательности нуклеиновой кислоты или одинаковые последовательности нуклеиновой кислоты.
Гидовая нуклеиновая кислота может включать домены пяти типов. В данном описании, домены пяти различных типов могут иметь различные последовательности нуклеиновой кислоты или одинаковые последовательности нуклеиновой кислоты.
Гидовая нуклеиновая кислота может включать домены шести типов. В данном описании, домены шести различных типов могут иметь различные последовательности нуклеиновой кислоты или одинаковые последовательности нуклеиновой кислоты
Так, например, гидовая нуклеиновая кислота может состоять из [гидового домена]-[первого комплементарного домена]-[линкерного домена]-[второго комплементарного домена]-[линкерного домена]-[гидового домена]-[первого комплементарного домена]-[линкерного домена]-[второго комплементарного домена]. В данном описании, два гидовых домена могут включать гидовые последовательности для различных или одинаковых мишеней, где два первых комплементарных домена и два вторых комплементарных домена могут иметь одинаковые или различные последовательности нуклеиновой кислоты. Если гидовые домены включают гидовые последовательности для различных мишеней, то гидовые нуклеиновые кислоты могут специфически связываться с двумя различными мишенями, и в этом случае, специфическое связывание может осуществляться одновременно или последовательно. Кроме того, линкерные домены могут расщепляться специфическими ферментами, и гидовые нуклеиновые кислоты могут быть разделены на две или три части в присутствии специфических ферментов.
В качестве конкретного примера гидовой нуклеиновой кислоты согласно изобретению, такая гидовая нуклеиновая кислота описана ниже.
рРНК
Термин «рРНК» означает нуклеиновую кислоту, способную специфически доставлять комплекс «рРНК-фермент CRISPR», то есть, комплекс CRISPR, к гену или нуклеиновой кислоте-мишени. Кроме того, рРНК представляет собой специфичную к нуклеиновой кислоте РНК, которая может связываться с ферментом CRISPR и доставлять этот фермент CRISPR к гену или нуклеиновой кислоте-мишени.
рРНК может включать множество доменов. Благодаря этим доменам могут происходить взаимодействия в трехмерной структуре или в активной форме цепи рРНК или между этими цепями.
рРНК может называться одноцепочечной рРНК (одной молекулой РНК) или двухцепочечной рРНК (включающей более, чем одну, а обычно две дискретных молекулы РНК).
В одном репрезентативном варианте осуществления изобретения, одноцепочечная рРНК может включать гидовый домен, то есть, домен, включающий гидовую последовательность, способную образовывать комплементарную связь с геном или нуклеиновой кислотой-мишенью; первый комплементарный домен; линкерный домен; второй комплементарный домен, то есть, домен, имеющий последовательность, комплементарную последовательности первого комплементарного домена и образующую двухцепочечную нуклеиновую кислоту с первым комплементарным доменом; проксимальный домен и, необязательно, хвостовой домен в направлении 5' → 3'.
В другом варианте осуществления изобретения, двухцепочечная рРНК может включать первую цепь, содержащую гидовый домен, то есть, домен, включающий гидовую последовательность, способную образовывать комплементарную связь с геном или нуклеиновой кислотой-мишенью, и первый комплементарный домен; и вторую цепь, содержащую второй комплементарный домен, то есть, домен, имеющий последовательность, комплементарную последовательности первого комплементарного домена и образующую двухцепочечную нуклеиновую кислоту с первым комплементарным доменом; проксимальный домен и, необязательно, хвостовой домен в направлении 5' → 3'.
В данном описании, первая цепь может обозначаться сr-РНК, а вторая цепь может обозначаться tracr-РНК. cr-РНК может включать гидовый домен и первый комплементарный домен, а tracr-РНК может включать второй комплементарный домен, проксимальный домен и, необязательно, хвостовой домен.
В другом варианте осуществления изобретения, одноцепочечная рРНК может включать гидовый домен, то есть, домен, включающий гидовую последовательность, способную образовывать комплементарную связь с геном или нуклеиновой кислотой-мишенью; первый комплементарный домен; второй комплементарный домен, и домен, имеющий последовательность, комплементарную последовательности первого комплементарного домена и образующую двухцепочечную нуклеиновую кислоту с первым комплементарным доменом в направлении 3' → 5'.
Гидовый домен
Гидовый домен включает комплементарную гидовую последовательность, способную образовывать комплементарную связь с последовательностью-мишенью на гене или нуклеиновой кислоте-мишени. Гидовая последовательность может представлять собой последовательность нуклеиновой кислоты, комплементарную последовательности-мишени на гене или нуклеиновой кислоте-мишени, например, по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% или более или полностью комплементарную. Считается, что гидовый домен позволяет комплексу рРНК-Cas, то есть комплексу CRISPR специфически взаимодействовать с геном или нуклеиновой кислотой-мишенью.
Гидовый домен может представлять собой последовательность из 5-50 оснований.
В репрезентативном варианте осуществления изобретения, гидовый домен может представлять собой последовательность из 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований.
В репрезентативном варианте осуществления изобретения, гидовый домен может включать последовательность из 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований.
В данном описании, гидовый домен может включать гидовую последовательность.
Гидовая последовательность может представлять собой комплементарную последовательность оснований, способную образовывать комплементарную связь с последовательностью-мишенью на гене- или нуклеиновой кислоте-мишени.
Гидовая последовательность может представлять собой последовательность нуклеиновой кислоты, комплементарную последовательности-мишени на гене- или нуклеиновой кислоте-мишени, например, по меньшей мере на 70%, 75%, 80%, 85%, 90% или 95% или более или полностью комплементарную.
Гидовая последовательность может представлять собой последовательность из 5-50 оснований.
В репрезентативном варианте осуществления изобретения, гидовая последовательность может представлять собой последовательность из 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований.
В репрезентативном варианте осуществления изобретения, гидовая последовательность может включать последовательность из 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований.
В данном описании, гидовый домен может включать гидовую последовательность и дополнительную последовательность оснований.
Дополнительная последовательность оснований может представлять собой последовательность из 1-35 оснований.
В одном репрезентативном варианте осуществления изобретения, дополнительная последовательность оснований может представлять собой последовательность из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 оснований.
Так, например, дополнительная последовательность оснований может представлять собой последовательность из одного основания, гуанина (G), или последовательность из двух оснований, GG.
Дополнительная последовательность оснований может быть локализована у 5'-конца гидовой последовательности.
Дополнительная последовательность оснований может быть локализована у 3'-конца гидовой последовательности.
Выборочно, часть или вся последовательность оснований гидового домена может включать химическую модификацию. Такой химической модификацией могут быть, но не ограничиваются ими, метилирование, ацетилирование, фосфорилирование, фосфортиоатная связь, блокированная нуклеиновая кислота (LNA), 2'-O-метил-3'-фосфортиоат (MS) или 2'-O-метил-3'-тио-PACE (MSP).
Первый комплементарный домен
Первый комплементарный домен включает последовательность нуклеиновой кислоты, комплементарную второму комплементарному домену, где такая комплементарность является достаточной для образования двойной цепи со вторым комплементарным доменом.
В данном описании, первый комплементарный домен может представлять собой последовательность из 5-35 оснований. Первый комплементарный домен может включать последовательность из 5-35 оснований.
В одном репрезентативном варианте осуществления изобретения, первый комплементарный домен может представлять собой последовательность из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, или 25 оснований.
В другом варианте осуществления изобретения, первый комплементарный домен может включать последовательность из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, или 25 оснований.
Первый комплементарный домен может быть гомологичен первому природному комплементарному домену, либо он может происходить от этого домена. Кроме того, первый комплементарный домен может иметь последовательность оснований, отличающуюся от первого комплементарного домена в зависимости от вида, существующего в природе, или может происходить от первого комплементарного домена, присутствующего у вида, существующего в природе, или может быть частично или полностью гомологичным первому комплементарному домену, присутствующему у вида, существующего в природе.
В одном репрезентативном варианте осуществления изобретения, первый комплементарный домен может быть частично, то есть, по меньшей мере на 50% или более или полностью гомологичным первому комплементарному домену Streptococcus pyogenes, Campylobacter jejuni, Streptococcus thermophilus, Streptococcus aureus или Neisseria meningitides, или первому комплементарному домену, происходящему от этих видов.
Так, например, если первым комплементарным доменом является первый комплементарный домен Streptococcus pyogenes или первый комплементарный домен, происходящий от него, то первый комплементарный домен может представлять собой 5'-GUUUUAGAGCUA-3' или последовательность оснований, которая частично, то есть, по меньшей мере на 50% или более гомологична последовательности 5'-GUUUUAGAGCUA-3'. В данном описании, первый комплементарный домен может также включать (X)n, входящий в 5'-GUUUUAGAGCUA(X)n-3'. X может быть выбран из группы, состоящей из оснований A, T, U и G, а n может означать число оснований, которое равно 5-15. В данном описании, (X)n может означать n повторов одних и тех же оснований или смесь n оснований A, T, U и G.
В другом варианте осуществления изобретения, если первым комплементарным доменом является первый комплементарный домен Campylobacter jejuni или первый комплементарный домен, происходящий от него, то первый комплементарный домен может представлять собой 5'-GUUUUAGUCCCUUUUUAAAUUUCUU-3', или последовательность оснований, которая частично, то есть, по меньшей мере на 50% или более гомологична последовательности 5'-GUUUUAGUCCCUUUUUAAAUUUCUU-3'. В данном описании, первый комплементарный домен может также включать (X)n, входящий в 5'-GUUUUAGUCCCUUUUUAAAUUUCUU(X)n-3'. X может быть выбран из группы, состоящей из оснований A, T, U и G, а n может означать число оснований, которое равно 5-15. В данном описании, (X)n может означать n повторов одних и тех же оснований или смесь n оснований A, T, U и G.
В другом варианте осуществления изобретения, первый комплементарный домен может быть частично, то есть, по меньшей мере на 50% или более, или полностью гомологичным первому комплементарному домену Parcubacteria bacterium (GWC2011_GWC2_44_17), Lachnospiraceae bacterium (MC2017), Butyrivibrio proteoclasiicus, Peregrinibacteria bacterium (GW2011_GWA_33_10), Acidaminococcus sp. (BV3L6), Porphyromonas macacae, Lachnospiraceae bacterium (ND2006), Porphyromonas crevioricanis, Prevotella disiens, Moraxella bovoculi (237), Smiihella sp. (SC_KO8D17), Leptospira inadai, Lachnospiraceae bacterium (MA2020), Francisella novicida (U112), Candidatus Methanoplasma termitum или Eubacterium eligens, или первому комплементарному домену, происходящему от этих видов.
Так, например, если первым комплементарным доменом является первый комплементарный домен Parcubacteria bacterium или первый комплементарный домен, происходящий от него, то первый комплементарный домен может представлять собой 5'-UUUGUAGAU-3', или последовательность оснований, которая частично, то есть, по меньшей мере на 50% или более гомологична последовательности 5'-UUUGUAGAU-3'. В данном описании, первый комплементарный домен может также включать (X)n, входящий в 5'-(X)nUUUGUAGAU-3'. X может быть выбран из группы, состоящей из оснований A, T, U и G, а n может означать число оснований, которое равно целому числу 1-5. В данном описании, (X)n может означать n повторов одних и тех же оснований или смесь n оснований A, T, U и G.
Выборочно, часть или вся последовательность оснований первого комплементарного домена может иметь химическую модификацию. Такой химической модификацией согласно изобретению могут быть, но не ограничиваются ими, метилирование, ацетилирование, фосфорилирование, фосфортиоатная связь, блокированная нуклеиновая кислота (LNA), 2'-O-метил-3'-фосфортиоат (MS) или 2'-O-метил-3'-тио-PACE (MSP).
Линкерный домен
Линкерный домен представляет собой последовательность нуклеиновой кислоты, соединяющую два или более доменов, и соединяет два или более идентичных или различных доменов. Линкерный домен может быть связан с двумя или более доменами, либо он может соединять два или более доменов посредством ковалентной или нековалентной связи.
Линкерный домен может представлять собой последовательность нуклеиновой кислоты, соединяющую первый комплементарный домен со вторым комплементарным доменом с образованием одноцепочечной рРНК.
Линкерный домен может быть соединен с первым комплементарным доменом и вторым комплементарным доменом посредством ковалентной или нековалентной связи.
Линкерный домен может соединять первый комплементарный домен со вторым комплементарным доменом посредством ковалентной или нековалентной связи.
Линкерный домен может представлять собой последовательность из 1-30 оснований. Линкерный домен может включать последовательность из 1-30 оснований.
В репрезентативном варианте осуществления изобретения, линкерный домен может представлять собой последовательность из 1-5, 5-10, 10-15, 15-20, 20-25 или 25-30 оснований.
В репрезентативном варианте осуществления изобретения, линкерный домен может включать последовательность из 1-5, 5-10, 10-15, 15-20, 20-25 или 25-30 оснований.
Линкерный домен является подходящим для его использования в одноцепочечной молекуле рРНК и может быть использован для продуцирования одноцепочечной рРНК посредством присоединения к первой цепи и второй цепи двухцепочечной рРНК или посредством соединения первой цепи со второй цепью ковалентной или нековалентной связью. Линкерный домен может быть использован для продуцирования одноцепочечной рРНК посредством присоединения к cr-РНК и tracr-РНК двухцепочечной рРНК или посредством соединения cr-РНК с tracr-РНК ковалентной или нековалентной связью.
Линкерный домен может быть гомологичен природной последовательности, например, неполной последовательности tracr-РНК, либо он может происходить от этой последовательности.
Выборочно, часть или вся последовательность оснований линкерного домена может иметь химическую модификацию. Такой химической модификацией согласно изобретению могут быть, но не ограничиваются ими, метилирование, ацетилирование, фосфорилирование, фосфортиоатная связь, блокированная нуклеиновая кислота (LNA), 2'-O-метил-3'-фосфортиоат (MS) или 2'-O-метил-3'-тио-PACE (MSP).
Второй комплементарный домен
Второй комплементарный домен включает последовательность нуклеиновой кислоты, комплементарную первому комплементарному домену, где такая комплементарность является достаточной для образования двойной цепи с первым комплементарным доменом. Второй комплементарный домен может включать последовательность оснований, комплементарную первому комплементарному домену, и последовательность оснований, которая не является комплементарной первому комплементарному домену, например, последовательность оснований, которая не образует двойную цепь с первым комплементарным доменом и может иметь более длинную последовательность оснований, чем первый комплементарный домен.
В данном описании, второй комплементарный домен может представлять собой последовательность из 5-35 оснований. Первый комплементарный домен может включать последовательность из 5-35 оснований.
В репрезентативном варианте осуществления изобретения, второй комплементарный домен может представлять собой последовательность из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований.
В репрезентативном варианте осуществления изобретения, второй комплементарный домен может включать последовательность из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований.
Кроме того, второй комплементарный домен может быть гомологичен второму природному комплементарному домену, либо он может происходить от этого домена. Кроме того, второй комплементарный домен может иметь последовательность оснований, отличающуюся от второго комплементарного домена в зависимости от вида, существующего в природе, и может происходить от второго комплементарного домена, присутствующего у вида, существующего в природе, или может быть частично или полностью гомологичным второму комплементарному домену, присутствующему у вида, существующего в природе.
В репрезентативном варианте осуществления изобретения, второй комплементарный домен может быть частично, то есть, по меньшей мере на 50% или более, или полностью гомологичным второму комплементарному домену Streptococcus pyogenes, Campylobacter jejuni, Streptococcus thermophilus, Streptococcus aureus или Neisseria meningitides, или второму комплементарному домену, происходящему от этих видов.
Так, например, если вторым комплементарным доменом является второй комплементарный домен Streptococcus pyogenes или второй комплементарный домен, происходящий от него, то второй комплементарный домен может представлять собой 5'-UAGCAAGUUAAAAU-3', или последовательность оснований, которая частично, то есть, по меньшей мере на 50% или более гомологична последовательности 5'-UAGCAAGUUAAAAU-3' (последовательность оснований, образующая двойную цепь с первым комплементарным доменом, подчеркнута). В данном описании, второй комплементарный домен может также включать (X)n и/или (X)m, входящий в 5'-(X)n UAGCAAGUUAAAAU(X)m-3'. X может быть выбран из группы, состоящей из оснований A, T, U и G, каждый n и m может означать число оснований, где n может быть равно целому числу 1-15, а m может быть равно целому числу 1-6. В данном описании, (X)n может означать n повторов одних и тех же оснований или смесь n оснований A, T, U и G. Кроме того, (X)m может означать m повторов одних и тех же оснований или смесь m оснований A, T, U и G.
В другом примере, если вторым комплементарным доменом является второй комплементарный домен Campylobacter jejuni или второй комплементарный домен, происходящий от него, то второй комплементарный домен может представлять собой 5'-AAGAAAUUUAAAAAGGGACUAAAAU-3', или последовательность оснований, которая частично, то есть, по меньшей мере на 50% или более гомологична последовательности 5'-AAGAAAUUUAAAAAGGGACUAAAAU-3' (последовательность оснований, образующая двойную цепь с первым комплементарным доменом, подчеркнута). В данном описании, второй комплементарный домен может также включать (X)n и/или (X)m, входящие в 5'-(X)nAAGAAAUUUAAAAAGGGACUAAAAU(X)m-3'. X может быть выбран из группы, состоящей из оснований A, T, U и G, каждый n и m может означать число оснований, где n может быть равно целому числу 1-15, а m может быть равно целому числу 1-6. В данном описании, (X)n может означать n повторов одних и тех же оснований или смесь n оснований A, T, U и G. Кроме того, (X)m может означать m повторов одних и тех же оснований или смесь m оснований A, T, U и G.
В другом варианте осуществления изобретения, второй комплементарный домен может быть частично, то есть, по меньшей мере на 50% или более, или полностью гомологичным первому комплементарному домену Parcubacteria bacterium (GWC2011_GWC2_44_17), Lachnospiraceae bacterium (MC2017), Butyrivibrio proteoclasiicus, Peregrinibacteria bacterium (GW2011_GWA_33_10), Acidaminococcus sp. (BV3L6), Porphyromonas macacae, Lachnospiraceae bacterium (ND2006), Porphyromonas crevioricanis, Prevotella disiens, Moraxella bovoculi (237), Smiihella sp. (SC_KO8D17), Leptospira inadai, Lachnospiraceae bacterium (MA2020), Francisella novicida (U112), Candidatus Methanoplasma termitum или Eubacterium eligens, или второму комплементарному домену, происходящему от этих видов.
Так, например, если вторым комплементарным доменом является второй комплементарный домен Parcubacteria bacterium или второй комплементарный домен, происходящий от него, то второй комплементарный домен может представлять собой 5'-AAAUUUCUACU-3', или последовательность оснований, которая частично, то есть, по меньшей мере на 50% или более гомологична последовательности 5'-AAAUUUCUACU-3' (последовательность оснований, образующая двойную цепь с первым комплементарным доменом, подчеркнута). В данном описании, второй комплементарный домен может также включать (X)n и/или (X)m, входящие в 5'-(X)nAAAUUUCUACU(X)m-3'. X может быть выбран из группы, состоящей из оснований A, T, U и G, каждый n и m может означать число оснований, где n может быть равно целому числу 1-10, а m может быть равно целому числу 1-6. В данном описании, (X)n может означать n повторов одних и тех же оснований или смесь n оснований A, T, U и G. Кроме того, (X)m может означать m повторов одних и тех же оснований или смесь m оснований A, T, U и G.
Выборочно, часть или вся последовательность оснований второго комплементарного домена может иметь химическую модификацию. Такой химической модификацией согласно изобретению могут быть, но не ограничиваются ими, метилирование, ацетилирование, фосфорилирование, фосфортиоатная связь, блокированная нуклеиновая кислота (LNA), 2'-O-метил-3'-фосфортиоат (MS) или 2'-O-метил-3'-тио-PACE (MSP).
Проксимальный домен
Проксимальный домен представляет собой последовательность из 1-20 оснований, локализованных поблизости от второго комплементарного домена, и домена, локализованного у 3'-конца по направлению ко второму комплементарному домену. В данном описании, проксимальный домен может быть использован для образования двойной цепи между комплементарными последовательностями оснований.
В одном репрезентативном варианте осуществления изобретения, проксимальный домен может представлять собой последовательность из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 оснований.
В другом варианте осуществления изобретения, проксимальный домен может включать последовательность из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 оснований.
Кроме того, проксимальный домен может быть гомологичен природному проксимальному домену, либо он может происходить от этого домена. Кроме того, проксимальный домен может иметь последовательность оснований, отличающуюся от проксимального домена вида, существующего в природе, может происходить от проксимального, присутствующего у вида, существующего в природе, или может быть частично или полностью гомологичным проксимальному домену, присутствующему у вида, существующего в природе.
В репрезентативном варианте осуществления изобретения, проксимальный домен может быть частично, то есть, по меньшей мере на 50% или более, или полностью гомологичным проксимальному домену Streptococcus pyogenes, Campylobacter jejuni, Streptococcus thermophilus, Streptococcus aureus или Neisseria meningitides, или проксимальному домену, происходящему от этих видов.
Так, например, если проксимальным доменом является проксимальный домен Streptococcus pyogenes или проксимальный домен, происходящий от него, то проксимальный домен может представлять собой 5'-AAGGCUAGUCCG-3' или последовательность оснований, которая частично, то есть, по меньшей мере на 50% или более гомологична последовательности 5'-AAGGCUAGUCCG-3'. В данном описании, проксимальный домен может также включать (X)n, входящий в 5'-AAGGCUAGUCCG(X)n-3'. X может быть выбран из группы, состоящей из оснований A, T, U и G, а n может означать число оснований, равное целому числу 1-15. В данном описании, (X)n может означать n повторов одних и тех же оснований или смесь n оснований A, T, U и G.
В другом примере, если проксимальным доменом является проксимальный домен Campylobacter jejuni или проксимальный домен, происходящий от него, то проксимальный домен может представлять собой 5'-AAAGAGUUUGC-3' или последовательность оснований, которая по меньшей мере на 50% или более гомологична последовательности 5'-AAAGAGUUUGC-3'. В данном описании, проксимальный домен может также включать (X)n, входящий в 5'-AAAGAGUUUGC(X)n-3'. X может быть выбран из группы, состоящей из оснований A, T, U и G, а n может означать число оснований, равное целому числу 1-40. В данном описании, (X)n может означать n повторов одних и тех же оснований или смесь n оснований A, T, U и G.
Выборочно, часть или вся последовательность оснований проксимального домена может иметь химическую модификацию. Такой химической модификацией согласно изобретению могут быть, но не ограничиваются ими, метилирование, ацетилирование, фосфорилирование, фосфортиоатная связь, блокированная нуклеиновая кислота (LNA), 2'-O-метил-3'-фосфортиоат (MS) или 2'-O-метил-3'-тио-PACE (MSP).
Хвостовой домен
Хвостовой домен представляет собой домен, который может быть селективно присоединен к 3'-концу одноцепочечной рРНК или двухцепочечной рРНК. Хвостовой домен может представлять собой последовательность из 1-50 оснований, или включать последовательность из 1-50 оснований. В данном описании, хвостовой домен может быть использован для образования двойной цепи между комплементарными последовательностями оснований.
В репрезентативном варианте осуществления изобретения, хвостовой домен может представлять собой последовательность из 1-5, 5-10, 10-15, 15-20, 20-25, 25-30, 30-35, 35-40, 40-45, или 45-50 оснований.
В репрезентативном варианте осуществления изобретения, хвостовой домен может включать последовательность из 1-5, 5-10, 10-15, 15-20, 20-25, 25-30, 30-35, 35-40, 40-45, или 45-50 оснований.
Кроме того, хвостовой домен может быть гомологичен природному хвостовому домену, либо он может происходить от этого домена. Кроме того, хвостовой домен может иметь последовательность оснований, отличающуюся от хвостового домена вида, существующего в природе, может происходить от хвостового домена, присутствующего у вида, существующего в природе, или может быть частично или полностью гомологичным хвостовому домену, присутствующему у вида, существующего в природе.
В одном репрезентативном варианте осуществления изобретения, хвостовой домен может быть частично, то есть, по меньшей мере на 50% или более, или полностью гомологичным хвостовому домену Streptococcus pyogenes, Campylobacter jejuni, Streptococcus thermophilus, Streptococcus aureus или Neisseria meningitides, или хвостовому домену, происходящему от этих видов.
Так, например, если хвостовым доменом является хвостовой домен Streptococcus pyogenes или хвостовой домен, происходящий от него, то хвостовой домен может представлять собой 5'-UUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC-3', или последовательность оснований, которая частично, то есть, по меньшей мере на 50% или более гомологична последовательности 5'-UUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC-3'. В данном описании, хвостовой домен может также включать (X)n, входящий в 5'-UUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC(X)n-3'. X может быть выбран из группы, состоящей из оснований A, T, U и G, а n может означать число оснований, равное целому числу 1-15. В данном описании, (X)n может означать n повторов одних и тех же оснований или смесь n оснований A, T, U и G.
В другом примере, если хвостовым доменом является хвостовой домен Campylobacter jejuni или хвостовой домен, происходящий от него, то хвостовой домен может представлять собой 5'-GGGACUCUGCGGGGUUACAAUCCCCUAAAACCGCUUUU-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична последовательности 5'-GGGACUCUGCGGGGUUACAAUCCCCUAAAACCGCUUUU-3'. В данном описании, хвостовой домен может также включать (X)n, входящий в GGGACUCUGCGGGGUUACAAUCCCCUAAAACCGCUUUU(X)n-3'. X может быть выбран из группы, состоящей из оснований A, T, U и G, а n может означать число оснований, равное целому числу 1-15. В данном описании, (X)n может означать n повторов одних и тех же оснований или смесь n оснований A, T, U и G.
В другом варианте осуществления изобретения, хвостовой домен может включать последовательность из 1-10 оснований у 3'-конца, участвующую в транскрипции in vitro или in vivo.
Так, например, если промотор T7 используется для in vitro транскрипции рРНК, то хвостовой домен может представлять собой произвольную последовательность оснований, присутствующую у 3'-конца матричной ДНК. Кроме того, если для транскрипции in vivo используется промотор U6, то хвостовой домен может представлять собой UUUUUU, а если для транскрипции используется промотор H1, то хвостовой домен может представлять собой UUUU, и если используется промотор pol-III, то хвостовой домен может включать несколько урациловых оснований или альтернативных оснований.
Выборочно, часть или вся последовательность оснований проксимального домена может иметь химическую модификацию. Такой химической модификацией согласно изобретению могут быть, но не ограничиваются ими, метилирование, ацетилирование, фосфорилирование, фосфортиоатная связь, блокированная нуклеиновая кислота (LNA), 2'-O-метил-3'-фосфортиоат (MS) или 2'-O-метил-3'-тио-PACE (MSP).
рРНК может включать множество описанных выше доменов, а поэтому, длину последовательности нуклеиновой кислоты можно регулировать в зависимости от домена, содержащегося в рРНК, и взаимодействия могут происходить в цепях трехмерной структуры или в активной форме рРНК или между этими цепями посредством каждого домена.
рРНК может называться одноцепочечной рРНК (одной молекулой РНК); или двухцепочечной рРНК (включающей более, чем одну, а обычно две дискретных молекулы РНК).
Двухцепочечная рРНК
Двухцепочечная рРНК состоит из первой цепи и второй цепи.
В данном описании, первая цепь может состоять из:
5'-[гидового домена]-[первого комплементарного домена]-3', а
вторая цепь может состоять из:
5'-[второго комплементарного домена]-[проксимального домена]-3' или
5'-[второго комплементарного домена]-[проксимального домена]-[хвостового домена]-3'.
В данном описании, первая цепь может быть обозначена cr-РНК, а вторая цепь может быть обозначена tracr-РНК.
Первая цепь
Гидовый домен
В первой цепи, гидовый домен включает комплементарную гидовую последовательность, способную образовывать комплементарную связь с последовательностью-мишенью на гене- или нуклеиновой кислоте-мишени. Гидовая последовательность представляет собой последовательность нуклеиновой кислоты, комплементарную последовательности-мишени на гене или нуклеиновой кислоте-мишени, например, комплементарную по меньшей мере на 70%, 75%, 80%, 85%, 90% или 95% или более или полностью комплементарную. Считается, что гидовый домен позволяет комплексу рРНК-Cas, то есть комплексу CRISPR специфически взаимодействовать с геном или нуклеиновой кислотой-мишенью.
В данном описании, гидовый домен может представлять собой последовательность из 5-50 оснований или включать последовательность из 5-50 оснований. Так, например, гидовый домен может представлять собой или включать последовательность из 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований.
Кроме того, гидовый домен может включать гидовую последовательность.
В данном описании, гидовая последовательность может представлять собой комплементарную последовательность оснований, способную образовывать комплементарную связь с последовательностью-мишенью на гене- или нуклеиновой кислоте-мишени, например, комплементарную по меньшей мере на 70%, 75%, 80%, 85%, 90% или 95% или более или полностью комплементарную.
В данном описании, гидовая последовательность может представлять собой последовательность из 5-50 оснований или включать последовательность из 5-50 оснований. Так, например, гидовая последовательность может представлять собой или включать последовательность из 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований.
Выборочно, гидовый домен может включать гидовую последовательность и дополнительную последовательность оснований.
В данном описании, дополнительная последовательность оснований может представлять собой последовательность из 1-35 оснований. Так, например, дополнительная последовательность оснований может представлять собой последовательность из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 оснований.
В одном репрезентативном варианте осуществления изобретения, дополнительная последовательность оснований может включать одно основание, гуанин (G), или два основания GG.
В данном описании, дополнительная последовательность оснований может быть локализована у 5'-конца гидового домена или у 5'-конца гидовой последовательности.
Дополнительная последовательность оснований может быть локализована у 3'-конца гидового домена или у 3'-конца гидовой последовательности.
Первый комплементарный домен
Первый комплементарный домен включает последовательность нуклеиновой кислоты, комплементарную второму комплементарному домену второй цепи, и представляет собой домен, комплементарность которого является достаточной для образования двойной цепи со вторым комплементарным доменом.
В данном описании, первый комплементарный домен может представлять собой или включать последовательность из 5-35 оснований. Так, например, первый комплементарный домен может представлять собой или включать последовательность из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований.
Первый комплементарный домен может быть гомологичен первому природному комплементарному домену, либо он может происходить от первого природного комплементарного домена. Кроме того, первый комплементарный домен может иметь последовательность оснований, отличающуюся от первого комплементарного домена в зависимости от вида, существующего в природе, или может происходить от первого комплементарного домена, присутствующего у вида, существующего в природе, или он может быть частично или полностью гомологичным первому комплементарному домену, присутствующему у вида, существующего в природе.
В одном репрезентативном варианте осуществления изобретения, первый комплементарный домен может быть частично, то есть, по меньшей мере на 50% или более, или полностью гомологичным первому комплементарному домену Streptococcus pyogenes, Campylobacter jejuni, Streptococcus thermophilus, Streptococcus aureus или Neisseria meningitides, или первому комплементарному домену, происходящему от этих видов.
Выборочно, первый комплементарный домен может включать дополнительную последовательность оснований, которая не подвергается комплементарному связыванию со вторым комплементарным доменом второй цепи.
В данном описании, дополнительная последовательность оснований может представлять собой последовательность из 1-15 оснований. Так, например, дополнительная последовательность оснований может представлять собой последовательность из 1-5, 5-10 или 10-15 оснований.
Выборочно, часть или вся последовательность оснований гидового домена и/или первого комплементарного домена может иметь химическую модификацию. Такой химической модификацией согласно изобретению могут быть, но не ограничиваются ими, метилирование, ацетилирование, фосфорилирование, фосфортиоатная связь, блокированная нуклеиновая кислота (LNA), 2'-O-метил-3'-фосфортиоат (MS) или 2'-O-метил-3'-тио-PACE (MSP).
Следовательно, первая цепь может состоять из 5'-[гидового домена]-[первого комплементарного домена]-3', как описано выше.
Кроме того, первая цепь может включать, но необязательно, дополнительную последовательность оснований.
В одном примере, первая цепь может представлять собой:
5'-(Nмишень)-(Q)m-3'; или
5'-(X)a-(Nмишень)-(X)b-(Q)m-(X)c-3'.
В данном описании, Nмишень представляет собой последовательность оснований, способную образовывать комплементарную связь с последовательностью-мишенью на гене-мишени или нуклеиновой кислоте-мишени и с областью последовательности оснований, которая может быть изменена в соответствии с последовательностью-мишенью на гене-мишени или нуклеиновой кислоте-мишени.
В данном описании, (Q)m представляет собой последовательность оснований, включающую первый комплементарный домен, способный образовывать комплементарную связь со вторым комплементарным доменом второй цепи. (Q)m может представлять собой последовательность, частично или полностью гомологичную первому комплементарному домену вида, существующего в природе, а последовательность оснований первого комплементарного домена может быть изменена в соответствии с последовательностью вида-источника. Каждый Q может быть независимо выбран из группы, состоящей из A, U, C и G, а m может означать число оснований, равное целому числу 5-35.
Так, например, если первый комплементарный домен частично или полностью гомологичен первому комплементарному домену Streptococcus pyogenes или происходящему от Streptococcus pyogenes, то (Q)m может представлять собой 5'-GUUUUAGAGCUA-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-GUUUUAGAGCUA-3'.
В другом примере, если первый комплементарный домен частично или полностью гомологичен первому комплементарному домену Campylobacter jejuni или происходящему от Campylobacter jejuni, то (Q)m может представлять собой 5'-GUUUUAGUCCCUUUUUAAAUUUCUU-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-GUUUUAGUCCCUUUUUAAAUUUCUU-3'.
В другом примере, если первый комплементарный домен частично или полностью гомологичен первому комплементарному домену Streptococcus thermophilus или происходящему от Streptococcus thermophilus, то (Q)m может представлять собой 5'-GUUUUAGAGCUGUGUUGUUUCG-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-GUUUUAGAGCUGUGUUGUUUCG-3'.
Кроме того, каждый из (X)a, (X)b и (X)c представляет собой соответственно выбранную дополнительную последовательность оснований, где каждый X может быть независимо выбран из группы, состоящей из A, U, C и G, а каждый из a, b и c может представлять собой число оснований, равное 0 или целому числу от 1 до 20.
Вторая цепь
Вторая цепь может состоять из второго комплементарного домена и проксимального домена, и если это необходимо, включает хвостовой домен.
Второй комплементарный домен
Во второй цепи, второй комплементарный домен включает последовательность нуклеиновой кислоты, комплементарную первому комплементарному домену первой цепи, где такая комплементарность является достаточной для образования двойной цепи с первым комплементарным доменом. Второй комплементарный домен может включать последовательность оснований, комплементарную первому комплементарному домену, и последовательность оснований, которая не является комплементарной первому комплементарному домену, например, последовательность оснований, которая не образует двойную цепь с первым комплементарным доменом и может иметь более длинную последовательность оснований, чем первый комплементарный домен.
В данном описании, второй комплементарный домен может представлять собой последовательность из 5-35 оснований или включать последовательность из 5-35 оснований. Так, например, второй комплементарный домен может представлять собой или включать последовательность из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований, но настоящее изобретение не ограничивается ими.
Второй комплементарный домен может быть гомологичен второму природному комплементарному домену, либо он может происходить от второго природного комплементарного домена. Кроме того, второй комплементарный домен может иметь отличия в последовательности оснований в зависимости от вида, существующего в природе, может происходить от второго комплементарного домена, присутствующего у вида, существующего в природе, или может быть частично или полностью гомологичным второму комплементарному домену, присутствующему у вида, существующего в природе.
В одном репрезентативном варианте осуществления изобретения, второй комплементарный домен может быть частично, то есть, по меньшей мере на 50% или более, или полностью гомологичным второму комплементарному домену Streptococcus pyogenes, Campylobacter jejuni, Streptococcus thermophilus, Streptococcus aureus или Neisseria meningitides, или второму комплементарному домену, происходящему от этих видов.
Выборочно, второй комплементарный домен может также включать дополнительную последовательность оснований, которая не подвергается комплементарному связыванию с первым комплементарным доменом первой цепи.
В данном описании, дополнительная последовательность оснований может представлять собой последовательность из 1-25 оснований. Так, например, дополнительная последовательность оснований может представлять собой последовательность из 1-5, 5-10, 10-15, 15-20 или 20-25 оснований.
Проксимальный домен
Во второй цепи, проксимальный домен представляет собой последовательность из 1-20 оснований, локализованных у 3'-конца по направлению ко второму комплементарному домену. Так, например, проксимальный домен может представлять собой или включать последовательность из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 оснований.
В данном описании, проксимальный домен может иметь двухцепочечную связь между комплементарными последовательностями оснований.
Кроме того, проксимальный домен может быть гомологичен природному проксимальному домену, либо он может происходить от природного проксимального домена. Кроме того, проксимальный домен может иметь последовательность оснований, отличающуюся от проксимального домена вида, существующего в природе, может происходить от проксимального домена, присутствующего у вида, существующего в природе, или может быть частично или полностью гомологичным проксимальному домену, присутствующему у вида, существующего в природе.
В одном репрезентативном варианте осуществления изобретения, проксимальный домен может быть частично, то есть, по меньшей мере на 50% или более, или полностью гомологичным проксимальному домену Streptococcus pyogenes, Campylobacter jejuni, Streptococcus thermophilus, Streptococcus aureus или Neisseria meningitides, или проксимальному домену, происходящему от этих видов.
Хвостовой домен
Выборочно, во второй цепи, хвостовой домен может представлять собой домен, селективно присоединенный к 3'-концу второй цепи, и этот хвостовой домен может представлять собой или включать последовательность из 1-50 оснований. Так, например, хвостовой домен может представлять собой или включать последовательность из 1-5, 5-10, 10-15, 15-20, 20-25, 25-30, 30-35, 35-40, 40-45 или 45-50 оснований.
В данном описании, хвостовой домен может иметь двухцепочечную связь между комплементарными последовательностями оснований.
Кроме того, хвостовой домен может быть гомологичен природному хвостовому домену, либо он может происходить от природного хвостового домена. Кроме того, хвостовой домен может иметь последовательность оснований, отличающуюся от хвостового домена вида, существующего в природе, может происходить от хвостового домена, присутствующего у вида, существующего в природе, или может быть частично или полностью гомологичным хвостовому домену, присутствующему у вида, существующего в природе.
В одном репрезентативном варианте осуществления изобретения, хвостовой домен может быть частично, то есть, по меньшей мере на 50% или более, или полностью гомологичным хвостовому домену Streptococcus pyogenes, Campylobacter jejuni, Streptococcus thermophilus, Streptococcus aureus или Neisseria meningitides, или хвостовому домену, происходящему от этих видов.
В другом варианте осуществления изобретения, хвостовой домен может включать последовательность из 1-10 оснований у 3'-конца, участвующую в транскрипции in vitro или in vivo.
Так, например, если промотор T7 используется для in vitro транскрипции рРНК, то хвостовой домен может представлять собой произвольную последовательность оснований, присутствующую у 3'-конца матричной ДНК. Кроме того, если для транскрипции in vivo используется промотор U6, то хвостовой домен может представлять собой UUUUUU, а если для транскрипции используется промотор H1, то хвостовой домен может представлять собой UUUU, и если используется промотор pol-III, то хвостовой домен может включать несколько урациловых оснований или альтернативных оснований.
Выборочно, часть или вся последовательность оснований второго комплементарного домена, проксимального домена и/или хвостового домена может иметь химическую модификацию. Такой химической модификацией согласно изобретению могут быть, но не ограничиваются ими, метилирование, ацетилирование, фосфорилирование, фосфортиоатная связь, блокированная нуклеиновая кислота (LNA), 2'-O-метил-3'-фосфортиоат (MS) или 2'-O-метил-3'-тио-PACE (MSP).
Следовательно, вторая цепь может состоять из 5'-[второго комплементарного домена]-[проксимального домена]-3' или 5'-[второго комплементарного домена]-[проксимального домена]-[хвостового домена]-3', описанных выше.
Кроме того, вторая цепь может Выборочно включать дополнительную последовательность оснований.
В одном репрезентативном варианте осуществления изобретения, вторая цепь может представлять собой 5'-(Z)h-(P)k-3'; или 5'-(X)d-(Z)h-(X)e-(P)k-(X)f-3'.
В другом варианте осуществления изобретения, вторая цепь может представлять собой 5'-(Z)h-(P)k-(F)i-3'; или 5'-(X)d-(Z)h-(X)e-(P)k-(X)f-(F)i-3'.
В данном описании, (Z)h представляет собой последовательность оснований, включающую второй комплементарный домен, способный образовывать комплементарную связь с первым комплементарным доменом первой цепи. (Z)h может представлять собой последовательность, частично или полностью гомологичную второму комплементарному домену вида, существующего в природе, а последовательность оснований второго комплементарного домена может быть изменена в соответствии с последовательностью вида-источника. Каждый Z может быть независимо выбран из группы, состоящей из A, U, C и G, а h может означать число оснований, равное целому числу 5-50.
Так, например, если второй комплементарный домен частично или полностью гомологичен второму комплементарному домену Streptococcus pyogenes или второму комплементарному домену, происходящему от Streptococcus pyogenes, то (Z)h может представлять собой 5'-UAGCAAGUUAAAAU-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-UAGCAAGUUAAAAU-3'.
В другом примере, если второй комплементарный домен частично или полностью гомологичен второму комплементарному домену Campylobacter jejuni или второму комплементарному домену, происходящему от Campylobacter jejuni, то (Z)h может представлять собой 5'-AAGAAAUUUAAAAAGGGACUAAAAU-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-AAGAAAUUUAAAAAGGGACUAAAAU-3'.
В другом примере, если второй комплементарный домен частично или полностью гомологичен второму комплементарному домену Streptococcus thermophilus или второму комплементарному домену, происходящему от Streptococcus thermophilus, то (Z)h может представлять собой 5'-CGAAACAACACAGCGAGUUAAAAU-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-CGAAACAACACAGCGAGUUAAAAU-3'.
(P)k представляет собой последовательность оснований, включающую проксимальный домен, который может быть частично или полностью гомологичен проксимальному домену вида, существующего в природе, а последовательность оснований проксимального домена может быть модифицирована в соответствии с видом источника. Каждый P может быть независимо выбран из группы, состоящей из A, U, C и G, а k может означать число оснований, равное целому числу от 1 до 20.
Так, например, если проксимальный домен частично или полностью гомологичен проксимальному домену Streptococcus pyogenes или проксимальному домену, происходящему от Streptococcus pyogenes, то (P)k может представлять собой 5'-AAGGCUAGUCCG-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-AAGGCUAGUCCG-3'.
В другом примере, если проксимальный домен частично или полностью гомологичен проксимальному домену Campylobacter jejuni или проксимальному домену, происходящему от Campylobacter jejuni, то (P)k может представлять собой 5'-AAAGAGUUUGC-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-AAAGAGUUUGC-3'.
В другом примере, если проксимальный домен частично или полностью гомологичен проксимальному домену Streptococcus thermophilus или проксимальному домену, происходящему от Streptococcus thermophilus, то (P)k может представлять собой 5'-AAGGCUUAGUCCG-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-AAGGCUUAGUCCG-3'.
(F)i может представлять собой последовательность оснований, включающую хвостовой домен, который может быть частично или полностью гомологичен хвостовому домену вида, существующего в природе, а последовательность оснований хвостового домена может быть модифицирована в соответствии с видом источника. Каждый F может быть независимо выбран из группы, состоящей из A, U, C и G, а i может означать число оснований, равное целому числу от 1 до 50.
Так, например, если хвостовой домен частично или полностью гомологичен хвостовому домену Streptococcus pyogenes или хвостовому домену, происходящему от Streptococcus pyogenes, то (F)i может представлять собой 5'-UUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-UUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC-3'.
В другом примере, если хвостовой домен частично или полностью гомологичен хвостовому домену Campylobacter jejuni или хвостовому домену, происходящему от Campylobacter jejuni, то (F)i может представлять собой 5'-GGGACUCUGCGGGGUUACAAUCCCCUAAAACCGCUUUU-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-GGGACUCUGCGGGGUUACAAUCCCCUAAAACCGCUUUU-3'.
В другом примере, если хвостовой домен частично или полностью гомологичен хвостовому домену Streptococcus thermophilus или хвостовому домену, происходящему от Streptococcus thermophilus, то (F)i может представлять собой 5'-UACUCAACUUGAAAAGGUGGCACCGAUUCGGUGUUUUU-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-UACUCAACUUGAAAAGGUGGCACCGAUUCGGUGUUUUU-3'.
Кроме того, (F)i может включать последовательность из 1-10 оснований у 3'-конца, участвующую в транскрипции in vitro или in vivo.
Так, например, если промотор T7 используется для in vitro транскрипции рРНК, то хвостовой домен может представлять собой произвольную последовательность оснований, присутствующую у 3'-конца матричной ДНК. Кроме того, если для транскрипции in vivo используется промотор U6, то хвостовой домен может представлять собой UUUUUU, а если для транскрипции используется промотор H1, то хвостовой домен может представлять собой UUUU, и если используется промотор pol-III, то хвостовой домен может включать несколько урациловых оснований или альтернативных оснований.
Кроме того, (X)d, (X)e и (X)f могут представлять собой селективно добавленные последовательности оснований, где каждый X может быть независимо выбран из группы, состоящей из A, U, C и G, а каждый d, e и f может означать число оснований, равное 0 или целому числу от 1 до 20.
Одноцепочечная рРНК
Одноцепочечная рРНК может быть подразделена на два типа.
i) Одноцепочечная рРНК
Сначала была получена одноцепочечная рРНК, в которой первая цепь или вторая цепь двухцепочечной рРНК были связаны посредством линкерного домена, и в данном описании, одноцепочечная рРНК состоит из 5'-[первой цепи]-[линкерного домена]-[второй цепи]-3'.
В частности, одноцепочечная рРНК может состоять из:
5'-[гидового домена]-[первого комплементарного домена]- [линкерного домена]-[второго комплементарного домена]- [проксимального домена]-3', или
5'-[гидового домена]-[первого комплементарного домена]- [линкерного домена]-[второго комплементарного домена]- [проксимального домена]-[хвостового домена]-3'.
Каждый домен, за исключением линкерного домена, является таким же, как он описан для первой и второй цепей двухцепочечной рРНК.
Линкерный домен
В одноцепочечной рРНК, линкерный домен представляет собой домен, соединяющий первую цепь и вторую цепь, а в частности, последовательность нуклеиновой кислоты, которая соединяет первый комплементарный домен и второй комплементарный домен с образованием одноцепочечной рРНК. В данном описании, линкерный домен может быть связан с первым комплементарным доменом и со вторым комплементарным доменом, либо он может соединять первый комплементарный домен со вторым комплементарным доменом посредством ковалентной или нековалентной связи.
Линкерный домен может представлять собой или включать последовательность из 1-30 оснований. Так, например, линкерный домен может представлять собой или включать последовательность из 1-5, 5-10, 10-15, 15-20, 20-25 или 25-30 оснований.
Линкерный домен является подходящим для его использования в одноцепочечной молекуле рРНК и может быть присоединен к первой цепи и второй цепи двухцепочечной рРНК или он может соединять первую цепь со второй цепью посредством ковалентной или нековалентной связи, и такой домен может быть использован для продуцирования одноцепочечной рРНК. Линкерный домен может быть присоединен к cr-РНК и tracr-РНК двухцепочечной рРНК или может соединять cr-РНК с tracr-РНК посредством ковалентной или нековалентной связи, а поэтому он может быть использован для продуцирования одноцепочечной рРНК.
Линкерный домен может быть гомологичен природной последовательности, например, неполной последовательности tracr-РНК, либо он может происходить от этой последовательности.
Выборочно, часть или вся последовательность оснований линкерного домена может иметь химическую модификацию. Такой химической модификацией согласно изобретению могут быть, но не ограничиваются ими, метилирование, ацетилирование, фосфорилирование, фосфортиоатная связь, блокированная нуклеиновая кислота (LNA), 2'-O-метил-3'-фосфортиоат (MS) или 2'-O-метил-3'-тио-PACE (MSP).
Следовательно, одноцепочечная рРНК может состоять из 5'-[гидового домена]-[первого комплементарного домена]- [линкерного домена]-[второго комплементарного домена]- [проксимального домена]-3', или 5'-[гидового домена]-[первого комплементарного домена]-[линкерного домена]-[второго комплементарного домена]-[проксимального домена]-[хвостового домена]-3', как описано выше.
Кроме того, одноцепочечная рРНК может выборочно включать дополнительную последовательность оснований.
В одном репрезентативном варианте осуществления изобретения, одноцепочечная рРНК может представлять собой:
5'-(Nмишень)-(Q)m-(L)j-(Z)h-(P)k-3'; или
5'-(Nмишень)-(Q)m-(L)j-(Z)h-(P)k-(F)i-3'.
В другом варианте осуществления изобретения, одноцепочечная рРНК может представлять собой:
5'-(X)a-(Nмишень)-(X)b-(Q)m-(X)c-(L)j-(X)d-(Z)h-(X)e-(P)k-(X)f-3'; или
5'-(X)a-(Nмишень)-(X)b-(Q)m-(X)c-(L)j-(X)d-(Z)h-(X)e-(P)k-(X)f-(F)i-3'.
В данном описании, Nмишень представляет собой последовательность оснований, способную образовывать комплементарную связь с последовательностью-мишенью на гене-мишнни или нуклеиновой кислоте-мишени и с областью последовательности оснований, которая может быть изменена в соответствии с последовательностью-мишенью на гене-мишени или нуклеиновой кислоте-мишени.
(Q)m представляет собой последовательность оснований, включающую первый комплементарный домен, способный образовывать комплементарную связь со вторым комплементарным доменом. (Q)m может представлять собой последовательность, частично или полностью гомологичную первому комплементарному домену вида, существующего в природе, а последовательность оснований первого комплементарного домена может быть изменена в соответствии с последовательностью вида-источника. Каждый Q может быть независимо выбран из группы, состоящей из A, U, C и G, а m может означать число оснований, равное целому числу 5-35.
Так, например, если первый комплементарный домен частично или полностью гомологичен первому комплементарному домену Streptococcus pyogenes или первому комплементарному домену, происходящему от Streptococcus pyogenes, то (Q)m может представлять собой 5'-GUUUUAGAGCUA-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-GUUUUAGAGCUA-3'.
В другом примере, если первый комплементарный домен частично или полностью гомологичен первому комплементарному домену Campylobacter jejuni или первому комплементарному домену, происходящему от Campylobacter jejuni, то (Q)m может представлять собой 5'-GUUUUAGUCCCUUUUUAAAUUUCUU-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-GUUUUAGUCCCUUUUUAAAUUUCUU-3'.
В другом примере, если первый комплементарный домен частично или полностью гомологичен первому комплементарному домену Streptococcus thermophilus или первому комплементарному домену, происходящему от Streptococcus thermophilus, то (Q)m может представлять собой 5'-GUUUUAGAGCUGUGUUGUUUCG-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-GUUUUAGAGCUGUGUUGUUUCG-3'.
Кроме того, (L)j представляет собой последовательность оснований, включающую линкерный домен и соединяющую первый комплементарный домен со вторым комплементарным доменом с образованием одноцепочечной рРНК. В данном описании, каждый L может быть независимо выбран из группы, состоящей из A, U, C и G, а j может означать число оснований, равное целому числу от 1 до 30.
(Z)h представляет собой последовательность оснований, включающую второй комплементарный домен, способный образовывать комплементарную связь с первым комплементарным доменом. (Z)h может представлять собой последовательность, частично или полностью гомологичную второму комплементарному домену вида, существующего в природе, а последовательность оснований второго комплементарного домена может быть изменена в соответствии с последовательностью вида-источника. Каждый Z может быть независимо выбран из группы, состоящей из A, U, C и G, а h может означать число оснований, равное целому числу 5-50.
Так, например, если второй комплементарный домен частично или полностью гомологичен второму комплементарному домену Streptococcus pyogenes или второму комплементарному домену, происходящему от Streptococcus pyogenes, то (Z)h может представлять собой 5'-UAGCAAGUUAAAAU-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-UAGCAAGUUAAAAU-3'.
В другом примере, если второй комплементарный домен частично или полностью гомологичен второму комплементарному домену Campylobacter jejuni или второму комплементарному домену, происходящему от Campylobacter jejuni, то (Z)h может представлять собой 5'-AAGAAAUUUAAAAAGGGACUAAAAU-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-AAGAAAUUUAAAAAGGGACUAAAAU-3'.
В другом примере, если второй комплементарный домен частично или полностью гомологичен второму комплементарному домену Streptococcus thermophilus или второму комплементарному домену, происходящему от Streptococcus thermophilus, то (Z)h может представлять собой 5'-CGAAACAACACAGCGAGUUAAAAU-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-CGAAACAACACAGCGAGUUAAAAU-3'.
(P)k представляет собой последовательность оснований, включающую проксимальный домен, который может быть частично или полностью гомологичен проксимальному домену вида, существующего в природе, а последовательность оснований проксимального домена может быть модифицирована в соответствии с видом источника. Каждый P может быть независимо выбран из группы, состоящей из A, U, C и G, а k может означать число оснований, равное целому числу от 1 до 20.
Так, например, если проксимальный домен частично или полностью гомологичен проксимальному домену Streptococcus pyogenes или проксимальному домену, происходящему от Streptococcus pyogenes, то (P)k может представлять собой 5'-AAGGCUAGUCCG-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-AAGGCUAGUCCG-3'.
В другом примере, если проксимальный домен частично или полностью гомологичен проксимальному домену Campylobacter jejuni или проксимальному домену, происходящему от Campylobacter jejuni, то (P)k может представлять собой 5'-AAAGAGUUUGC-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-AAAGAGUUUGC-3'.
В другом примере, если проксимальный домен частично или полностью гомологичен проксимальному домену Streptococcus thermophilus или проксимальному домену, происходящему от Streptococcus thermophilus, то (P)k может представлять собой 5'-AAGGCUUAGUCCG-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-AAGGCUUAGUCCG-3'.
(F)i может представлять собой последовательность оснований, включающую хвостовой домен, который может быть частично или полностью гомологичен хвостовому домену вида, существующего в природе, а последовательность оснований хвостового домена может быть модифицирована в соответствии с видом источника. Каждый F может быть независимо выбран из группы, состоящей из A, U, C и G, а i может означать число оснований, равное целому числу от 1 до 50.
Так, например, если хвостовой домен частично или полностью гомологичен хвостовому домену Streptococcus pyogenes или хвостовому домену, происходящему от Streptococcus pyogenes, то (F)i может представлять собой 5'-UUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-UUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGC-3'.
В другом примере, если хвостовой домен частично или полностью гомологичен хвостовому домену Campylobacter jejuni или хвостовому домену, происходящему от Campylobacter jejuni, то (F)i может представлять собой 5'-GGGACUCUGCGGGGUUACAAUCCCCUAAAACCGCUUUU-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-GGGACUCUGCGGGGUUACAAUCCCCUAAAACCGCUUUU-3'.
В другом примере, если хвостовой домен частично или полностью гомологичен хвостовому домену Streptococcus thermophilus или хвостовому домену, происходящему от Streptococcus thermophilus, то (F)i может представлять собой 5'-UACUCAACUUGAAAAGGUGGCACCGAUUCGGUGUUUUU-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-UACUCAACUUGAAAAGGUGGCACCGAUUCGGUGUUUUU-3'.
Кроме того, (F)i может включать последовательность из 1-10 оснований у 3'-конца, участвующую в транскрипции in vitro или in vivo.
Так, например, если промотор T7 используется для in vitro транскрипции рРНК, то хвостовой домен может представлять собой произвольную последовательность оснований, присутствующую у 3'-конца матричной ДНК. Кроме того, если для транскрипции in vivo используется промотор U6, то хвостовой домен может представлять собой UUUUUU, а если для транскрипции используется промотор H1, то хвостовой домен может представлять собой UUUU, и если используется промотор pol-III, то хвостовой домен может включать несколько урациловых оснований или альтернативных оснований.
Кроме того, (X)a, (X)b, (X)c, (X)d, (X)e и (X)f могут представлять собой селективно добавленные последовательности оснований, где каждый X может быть независимо выбран из группы, состоящей из A, U, C и G, а каждый a, b, c, d, e и f может означать число оснований, равное 0 или целому числу от 1 до 20.
ii) Одноцепочечная рРНК
Кроме того, одноцепочечная рРНК может представлять собой одноцепочечную рРНК, состоящую из гидового домена, первого комплементарного домена и второго комплементарного домена, где одноцепочечная рРНК может состоять из:
5'-[второго комплементарного домена]-[первого комплементарного домена]-[гидового домена]-3' или.
5'-[второго комплементарного домена]-[линкерного домена]- [первого комплементарного домена]-[гидового домена]-3'.
Гидовый домен
В одноцепочечной рРНК, гидовый домен включает комплементарную гидовую последовательность, способную образовывать комплементарную связь с последовательностью-мишенью на гене-мишени или нуклеиновой кислоте-мишени. Гидовая последовательность может представлять собой последовательность нуклеиновой кислоты, комплементарную последовательности-мишени на гене-мишени или нуклеиновой кислоте-мишени, например, комплементарную по меньшей мере на 70%, 75%, 80%, 85%, 90% или 95% или более или полностью комплементарную. Считается, что гидовый домен позволяет комплексу рРНК-Cas, то есть, комплексу CRISPR специфически взаимодействовать с геном или нуклеиновой кислотой-мишенью.
В данном описании, гидовый домен может представлять собой или включать последовательность из 5-50 оснований. Так, например, гидовый домен может представлять собой или включать последовательность из 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований.
Кроме того, гидовый домен может включать гидовую последовательность.
В данном описании, гидовая последовательность может представлять собой комплементарную последовательность оснований, способную образовывать комплементарную связь с последовательностью-мишенью на гене-мишени или нуклеиновой кислоте-мишени, например, комплементарную по меньшей мере на 70%, 75%, 80%, 85%, 90% или 95% или более или полностью комплементарную.
В данном описании, гидовая последовательность может представлять собой или включать последовательность из 5-50 оснований. Так, например, гидовая последовательность может представлять собой или включать последовательность из 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований.
Выборочно, гидовый домен может включать гидовую последовательность и дополнительную последовательность оснований.
В данном описании, дополнительная последовательность оснований может представлять собой последовательность из 1-35 оснований. Так, например, дополнительная последовательность оснований может представлять собой последовательность из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 оснований.
В одном репрезентативном варианте осуществления изобретения, дополнительная последовательность оснований может представлять собой последовательность из одного основания, гуанина (G) или последовательность из двух оснований GG.
В данном описании, дополнительная последовательность оснований может быть локализована у 5'-конца гидового домена или у 5'-конца гидовой последовательности.
Дополнительная последовательность оснований может быть локализована у 3'-конца гидового домена или у 3'-конца гидовой последовательности.
Первый комплементарный домен
Первый комплементарный домен представляет собой домен, включающий последовательность нуклеиновой кислоты, комплементарную второму комплементарному домену, и такая комплементарность является достаточной для образования двойной цепи со вторым комплементарным доменом.
В данном описании, первый комплементарный домен может представлять собой или включать последовательность из 5-35 оснований. Так, например, первый комплементарный домен может представлять собой или включать последовательность из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований.
Первый комплементарный домен может быть гомологичен первому природному комплементарному домену, либо он может происходить от этого домена. Кроме того, первый комплементарный домен может иметь последовательность оснований, отличающуюся от первого комплементарного домена в зависимости от вида, существующего в природе, может происходить от первого комплементарного домена, присутствующего у вида, существующего в природе, или может быть частично или полностью гомологичным первому комплементарному домену, присутствующему у вида, существующего в природе.
В одном репрезентативном варианте осуществления изобретения, первый комплементарный домен может быть частично, то есть, по меньшей мере на 50% или более, или полностью гомологичным первому комплементарному домену Parcubacteria bacterium (GWC2011_GWC2_44_17), Lachnospiraceae bacterium (MC2017), Butyrivibrio proteoclasiicus, Peregrinibacteria bacterium (GW2011_GWA_33_10), Acidaminococcus sp. (BV3L6), Porphyromonas macacae, Lachnospiraceae bacterium (ND2006), Porphyromonas crevioricanis, Prevotella disiens, Moraxella bovoculi (237), Smiihella sp. (SC_KO8D17), Leptospira inadai, Lachnospiraceae bacterium (MA2020), Francisella novicida (U112), Candidatus Methanoplasma termitum или Eubacterium eligens, или первому комплементарному домену, происходящему от этих видов.
Выборочно, первый комплементарный домен может включать дополнительную последовательность оснований, которая не подвергается комплементарному связыванию со вторым комплементарным доменом.
В данном описании, дополнительная последовательность оснований может представлять собой последовательность из 1-15 оснований. Так, например, дополнительная последовательность оснований может представлять собой последовательность из 1-5, 5-10 или 10-15 оснований.
Второй комплементарный домен
Второй комплементарный домен включает последовательность нуклеиновой кислоты, комплементарную первому комплементарному домену, где такая комплементарность является достаточной для образования двойной цепи с первым комплементарным доменом. Второй комплементарный домен может включать последовательность оснований, комплементарную первому комплементарному домену, и последовательность оснований, которая не является комплементарной первому комплементарному домену, например, последовательность оснований, которая не образует двойную цепь с первым комплементарным доменом и может иметь более длинную последовательность оснований, чем первый комплементарный домен.
В данном описании, второй комплементарный домен может представлять собой или включать последовательность из 5-35 оснований. Так, например, второй комплементарный домен может представлять собой последовательность из 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований.
Второй комплементарный домен может быть гомологичен второму природному комплементарному домену, либо он может происходить от второго природного комплементарного домена. Кроме того, второй комплементарный домен может иметь отличия в последовательности оснований второго комплементарного домена в зависимости от вида, существующего в природе, и может происходить от второго комплементарного домена, присутствующего у вида, существующего в природе, или может быть частично или полностью гомологичным второму комплементарному домену, присутствующему у вида, существующего в природе.
В одном репрезентативном варианте осуществления изобретения, второй комплементарный домен может быть частично, то есть, по меньшей мере на 50% или более, или полностью гомологичным второму комплементарному домену Parcubacteria bacterium (GWC2011_GWC2_44_17), Lachnospiraceae bacterium (MC2017), Butyrivibrio proteoclasiicus, Peregrinibacteria bacterium (GW2011_GWA_33_10), Acidaminococcus sp. (BV3L6), Porphyromonas macacae, Lachnospiraceae bacterium (ND2006), Porphyromonas crevioricanis, Prevotella disiens, Moraxella bovoculi (237), Smiihella sp. (SC_KO8D17), Leptospira inadai, Lachnospiraceae bacterium (MA2020), Francisella novicida (U112), Candidatus Methanoplasma termitum или Eubacterium eligens, или второму комплементарному домену, происходящему от этих видов.
Выборочно, второй комплементарный домен может включать дополнительную последовательность оснований, которая не подвергается комплементарному связыванию с первым комплементарным доменом.
В данном описании, дополнительная последовательность оснований может представлять собой последовательность из 1-15 оснований. Так, например, дополнительная последовательность оснований может представлять собой последовательность из 1-5, 5-10 или 10-15 оснований.
Линкерный домен
Выборочно, линкерный домен представляет собой последовательность нуклеиновой кислоты, которая соединяет первый комплементарный домен и второй комплементарный домен с образованием одноцепочечной рРНК. В данном описании, линкерный домен может быть связан с первым комплементарным доменом и со вторым комплементарным доменом, либо он может соединять первый и второй комплементарные домены посредством ковалентной или нековалентной связи.
Линкерный домен может представлять собой или включать последовательность из 1-30 оснований. Так, например, линкерный домен может представлять собой или включать последовательность из 1-5, 5-10, 10-15, 15-20, 20-25 или 25-30 оснований.
Выборочно, часть или вся последовательность оснований гидового домена, первого комплементарного домена, второго комплементарного домена и линкерного домена может иметь химическую модификацию. Такой химической модификацией согласно изобретению могут быть, но не ограничиваются ими, метилирование, ацетилирование, фосфорилирование, фосфортиоатная связь, блокированная нуклеиновая кислота (LNA), 2'-O-метил-3'-фосфортиоат (MS) или 2'-O-метил-3'-тио-PACE (MSP).
Следовательно, одноцепочечная рРНК может состоять из 5'-[второго комплементарного домена]-[первого комплементарного домена]-[гидового домена]-3' или 5'-[второго комплементарного домена]-[линкерного домена]-[первого комплементарного домена]-[гидового домена]-3', как описано выше.
Кроме того, одноцепочечная рРНК может выборочно включать дополнительную последовательность оснований.
В одном репрезентативном варианте осуществления изобретения, одноцепочечная рРНК может представлять собой:
5'-(Z)h-(Q)m-(Nмишень)-3'; или
5'-(X)a-(Z)h-(X)b-(Q)m-(X)c-(Nмишень)-3'.
В другом варианте осуществления изобретения, одноцепочечная рРНК может представлять собой:
5'-(Z)h-(L)j-(Q)m-(Nмишень)-3'; или
5'-(X)a-(Z)h-(L)j-(Q)m-(X)c-(Nмишень)-3'.
В данном описании, Nмишень представляет собой последовательность оснований, способную образовывать комплементарную связь с последовательностью-мишенью на гене-мишени или нуклеиновой кислоте-мишени и с областью последовательности оснований, которая может быть изменена в соответствии с последовательностью-мишенью на гене-мишени или нуклеиновой кислоте-мишени.
(Q)m представляет собой последовательность оснований, включающую первый комплементарный домен, способный образовывать комплементарную связь со вторым комплементарным доменом второй цепи. (Q)m может представлять собой последовательность, частично или полностью гомологичную первому комплементарному домену вида, существующего в природе, а последовательность оснований первого комплементарного домена может быть изменена в соответствии с последовательностью вида-источника. Каждый Q может быть независимо выбран из группы, состоящей из A, U, C и G, а m может означать число оснований, равное целому числу 5-35.
Так, например, если первый комплементарный домен частично или полностью гомологичен первому комплементарному домену Parcubacteria bacterium или первому комплементарному домену, происходящему от Parcubacteria bacterium, то (Q)m может представлять собой 5'-UUUGUAGAU-3', или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-UUUGUAGAU-3'.
(Z)h представляет собой последовательность оснований, включающую второй комплементарный домен, способный образовывать комплементарную связь с первым комплементарным доменом первой цепи. (Z)h может представлять собой последовательность, частично или полностью гомологичную второму комплементарному домену вида, существующего в природе, а последовательность оснований второго комплементарного домена может быть изменена в соответствии с последовательностью вида-источника. Каждый Z может быть независимо выбран из группы, состоящей из A, U, C и G, а h может означать число оснований, равное целому числу 5-50.
Так, например, если второй комплементарный домен частично или полностью гомологичен второму комплементарному домену Parcubacteria bacterium или второму комплементарному домену, происходящему от Parcubacteria bacterium, то (Z)h может представлять собой 5'-AAAUUUCUACU-3' или последовательность оснований, которая по меньшей мере на 50% или более гомологична 5'-AAAUUUCUACU-3'.
Кроме того, (L)j представляет собой последовательность оснований, включающую линкерный домен, который соединяет первый комплементарный домен со вторым комплементарным доменом. В данном описании, каждый L может быть независимо выбран из группы, состоящей из A, U, C и G, а j может означать число оснований, равное целому числу от 1 до 30.
Кроме того, каждый (X)a, (X)b и (X)c представляет собой селективно добавленную последовательности оснований, где каждый X может быть независимо выбран из группы, состоящей из A, U, C и G, и a, b и c могут означать число оснований, равное 0 или целому числу от 1 до 20.
2. Белок-редактор
«Белок-редактор» означает пептид, полипептид или белок, способные непосредственно связываться или взаимодействовать с нуклеиновой кислотой без непосредственного связывания с ней. Концептуально, этот белок иногда называется «генными ножницами» или RGEN (эндонуклеазой на основе гидовой РНК).
Нуклеиновой кислотой может быть нуклеиновая кислота, содержащаяся в нуклеиновой кислоте-мишени, гене-мишени или в хромосоме-мишени.
Нуклеиновой кислотой может быть гидовая нуклеиновая кислота.
Белком-редактором может быть фермент.
Белком-редактором может быть гибридный белок.
В данном описании, «гибридный белок» означает белок, полученный путем присоединения фермента к дополнительному домену, пептиду, полипептиду или белку.
«Фермент» означает белок, содержащий домен, способный расщеплять нуклеиновую кислоту, ген, хромосому или белок.
Фермент может представлять собой нуклеазу, протеазу или рестриктирующий фермент.
Дополнительный домен, пептид, полипептид или белок может представлять собой функциональный домен, пептид, полипептид или белок, функция которого является такой же, как функция фермента, или отличается от функции фермента.
Гибридный белок может включать дополнительный домен, пептид, полипептид или белок в одном или более положениях: у N-конца фермента или поблизости от него; у C-конца фермента или поблизости от него; в средней части фермента; и в их комбинации.
Гибридный белок может включать функциональный домен, пептид, полипептид или белок в одном или более положениях: у N-конца фермента или поблизости от него; у C-конца фермента или поблизости от него; в средней части фермента; и в их комбинации.
В данном описании, функциональный домен, пептид, полипептид или белок могут представлять собой домен, пептид, полипептид или белок, обладающий метилазной активностью, деметилазной активностью, активностью активации транскрипции, активностью подавления транскрипции, активностью рилизинг-фактора транскрипции, активностью модификации гистона, активностью расщепления РНК или активностью связывания с нуклеиновой кислотой, или метку или ген-репортер для выделения и очистки белка (включая пептид), однако, настоящее изобретение не ограничивается ими.
Функциональный домен, пептид, полипептид или белок могут представлять собой дезаминазу.
Метка включает гистидиновую (His) метку, V5-метку, FLAG-метку, метку гемаглютинина вируса гриппа (HA), Myc-метку, VSV-G-метку и тиоредоксиновую метку (Trx), а ген-репортер включает ген глутатион-S-трансферазы (GST), пероксидазы хрена (ПХ), хлорамфеникол-ацетилтрансферазы (CAT), β-галактозидазы, β-глюкуронидазы, люциферазы, аутофлуоресцентных белков, включая белок, флуоресцирующий в зеленом диапазоне спектра (GFP), HcRed, DsRed, белок, флуоресцирующий в голубом диапазоне спектра (CFP), белок, флуоресцирующий в желтом диапазоне спектра (YFP) и белок, флуоресцирующий в синем диапазоне спектра (BFP), однако, настоящее изобретение не ограничивается ими.
Кроме того, функциональный домен, пептид, полипептид или белок могут представлять собой последовательность или сигнал локализации в ядре (NLS) или последовательность или сигнал экспорта из ядра (NES).
NLS может представлять собой NLS крупного Т-антигена вируса SV40 с аминокислотной последовательностью PKKKRKV; NLS, происходящий от нуклеоплазмина (например, двухкомпонентного NLS нуклеоплазмина с последовательностью KRPAATKKAGQAKKKK); NLS c-myc с аминокислотной последовательностью PAAKRVKLD или RQRRNELKRSP; NLS hRNPA1 M9 с последовательностью NQSSNFGPMKGGNFGGRSSGPYGGGGQYFAKPRNQGGY; последовательность домена IBB, происходящего от импортина-α, RMRIZFKNKGKDTAELRRRRVEVSVELRKAKKDEQILKRRNV; последовательность T-белка миомы VSRKRPRP и PPKKARED; последовательность человеческого p53, POPKKKPL; последовательность мышиного c-abl IV, SALIKKKKKMAP; последовательность вируса гриппа NS1, DRLRR и PKQKKRK; последовательность антигена вируса гепатита δ, RKLKKKIKKL; последовательность мышиного белка Mx1, REKKKFLKRR; последовательность человеческой поли(АДФ-рибозо)полимеразы, KRKGDEVDGVDEVAKKKSKK; или последовательность глюкокортикоида рецептора стероидного гормона (человеческого), RKCLQAGMNLEARKTKK, однако, настоящее изобретение не ограничивается ими.
Белок-редактор может включать полностью активный фермент.
В данном описании, термин «полностью активный фермент» означает фермент, имеющий такую же функцию, как и фермент дикого типа, и например, фермент дикого типа, расщепляющий двойную цепь ДНК, обладает полной ферментативной активностью, способной полностью расщеплять двойную цепь ДНК.
Кроме того, полный активный фермент включает фермент, обладающий улучшенной функцией по сравнению с функцией фермента дикого типа, и например, специфически модифицированный или измененный фермент дикого типа, расщепляющий двойную цепь ДНК, обладает полной ферментативной активностью, которая превышает активность фермента дикого типа, то есть, активность расщепления двойной цепи ДНК.
Белок-редактор может включать не полностью или частично активный фермент.
Используемый здесь термин «не полностью или частично активный фермент» означает фермент, имеющий некоторые функции фермента дикого типа, и например, специфически модифицированный или измененный фермент дикого типа, расщепляющий двойную цепь ДНК, обладает неполной или частичной ферментативной активностью, расщепляющей часть двойной цепи, то есть, одной цепи ДНК.
Белок-редактор может включать неактивный фермент.
Используемый здесь термин «неактивный фермент» означает фермент, в котором функция фермента дикого типа является полностью инактивированной. Так, например, специфическую модификацию или изменение фермента дикого типа, расщепляющего двойную цепь ДНК, осуществляют так, чтобы этот фермент был неактивным, то есть не мог полностью расщеплять двойную цепь ДНК.
Белок-редактор может представлять собой природный фермент или гибридный белок.
Белок-редактор может присутствовать в форме частично модифицированного природного фермента или гибридного белка.
Белок-редактор может представлять собой искусственно продуцированный фермент или гибридный белок, не существующий в природе.
Белок-редактор может присутствовать в форме частично модифицированного искусственного фермента или гибридного белка, не существующего в природе.
В данном описании, модификация может представлять собой замену, удаление, добавление аминокислот, содержащихся в белке-редакторе или их комбинацию.
Кроме того, модификация может представлять собой замену, удаление, добавление некоторых оснований в последовательности оснований, кодирующей белок-редактор, или их комбинацию.
В одном репрезентативном варианте белка-редактора согласно изобретению, фермент CRISPR описан ниже.
Фермент CRISPR
Термин «фермент CRISPR» означает главный компонент белка системы CRISPR-Cas и, в комплексе с рРНК, образует систему CRISPR-Cas.
Фермент CRISPR представляет собой нуклеиновую кислоту или полипептид (или белок), имеющий последовательность, кодирующую фермент CRISPR, но, при этом, широко используется фермент CRISPR типа II или фермент CRISPR типа V.
Фермент CRISPR типа II представляет собой Cas9, который может происходить от различных микроорганизмов, таких как Actinobacteria (например, Actinomyces naeslundii), Aquificae Cas9, Bacteroidetes Cas 9, Chlamydiae Cas9, Chloroflexi Cas9, Cyanobacteria Cas9, Elusimicrobia Cas9, Fibrobacteres Cas9, Firmicutes Cas9 (например, Streptococcus pyogenes Cas9, Streptococcus thermophilus Cas9, Listeria innocua Cas9, Streptococcus agalactiae Cas9, Streptococcus mutans Cas9 и Enterococcus faecium Cas9), Fusobacteria Cas9, Proteobacteria (e.g., Neisseria meningitides, Campylobacter jejuni) Cas9, и Spirochaetes (например, Treponema denticola) Cas9.
Термин «Cas9» представляет собой фермент, который связывается с рРНК и расщепляет или модифицирует последовательность-мишень в положении на гене-мишени или нуклеиновой кислоте-мишени и может состоять из: домена HNH, способного расщеплять цепь нуклеиновой кислоты с образованием комплементарной связи с рРНК; домена RuvC, способного расщеплять цепь нуклеиновой кислоты с образованием комплементарной связи с рРНК; домена REC, распознающего мишень и домена PI, распознающего PAM. Описание специфических структурных свойств Cas9 можно найти у Hiroshi Nishimasu et al. (2014) Cell 156:935-949.
Кроме того, фермент CRISPR типа V может представлять собой Cpf1, который может происходить от Streptococcus, Campylobacter, Nitratifractor, Staphylococcus, Parvibaculum, Roseburia, Neisseria, Gluconacetobacter, Azospirillum, Sphaerochaeta, Lactobacillus, Eubacterium, Corynebacter, Carnobacterium, Rhodobacter, Listeria, Paludibacter, Clostridium, Lachnospiraceae, Clostridiaridium, Leptotrichia, Francisella, Legionella, Alicyclobacillus, Methanomethyophilus, Porphyromonas, Prevotella, Bacteroidetes, Helcococcus, Letospira, Desulfovibrio, Desulfonatronum, Opitutaceae, Tuberibacillus, Bacillus, Brevibacillus, Methylobacterium или Acidaminococcus.
Cpf1 может состоять из домена RuvC, аналогичного и соответствующего домену RuvC Cas9; домена Nuc, в котором отсутствует домен HNH Cas9; домена REC, распознающего мишень; домена WED и домена PI, распознающего PAM. Описание специфических структурных свойств Cpf1 можно найти у Takashi Yamano et al. (2016) Cell 165:949-962.
Фермент CRISPR, состоящий из белка Cas9 или Cpf1, может быть выделен из микроорганизма, существующего в природе или не существующего в природе, то есть, полученного рекомбинантным методом или методом синтеза.
Фермент CRISPR типа II
Кристаллическая структура фермента CRISPR типа II была определена в исследованиях молекул фермента CRISPR типа II природных микроорганизмов двух или более типов (Jinek et al., Science, 343(6176):1247997, 2014) и в исследованиях Cas9 (SpCas9) Streptococcus pyogenes, образующего комплекс с рРНК (Nishimasu et al., Cell, 156:935-949, 2014; и Anders et al., Nature, 2014, doi: 10.1038/nature13579).
Фермент CRISPR типа II включает две области, то есть, область распознавания (REC) и нуклеазную область (NUC), и каждая из них включает несколько доменов.
Область REC включает богатый аргинином домен мостиковой спирали (BH), домен REC1 и домен REC2.
В данном описании, домен BH представляет собой длинную α-спиральную и богатую аргинином область, а домены REC1 и REC2 играют важную роль в распознавании двойной цепи в рРНК, например, в одноцепочечной рРНК, двухцепочечной рРНК или tracr-РНК.
Область NUC включает домен RuvC, домен HNH и домен взаимодействия с PAM (PI). В данном описании, домен RuvC включает RuvC-подобные домены, либо домен HNH используется для включения HNH-подобных доменов.
В данном описании, домен RuvC имеет структурное сходство с членами семейства микроорганизмов, существующих в природе и имеющих фермент CRISPR типа II, и расщепляет одну цепь, например, некомплементарную цепь гена или нуклеиновой кислоты-мишени, которая представляет собой цепь, не образующую комплементарную связь с рРНК. В литературе, домен RuvC иногда называется доменом RuvCI, RuvCII или RuvCIII, но обычно он обозначается RuvC I, RuvCII или RuvCIII. Так, например, в случае SpCas9, домен RuvC подвергают сборке из каждого из трех отдельных доменов RuvC (RuvC I, RuvCII и RuvCIII), локализованных в последовательностях аминокислот 1-59, 718-769 и 909-1098 SpCas9, соответственно.
Домен HNH имеет структурное сходство с эндонуклеазой HNH и расщепляет одну цепь, например, комплементарную цепь молекулы нуклеиновой кислоты-мишени, то есть, цепь, образующую комплементарную связь с рРНК. Домен HNH локализован между мотивами RuvC II и III. Так, например, в случае SpCas9, домен HNH локализован в аминокислотной последовательности 775-908 SpCas9.
Домен PI распознает специфическую последовательность оснований в гене и в нуклеиновой кислоте-мишени, то есть, мотив, смежный с протоспейсером (PAM), или взаимодействует с PAM. Так, например, в случае SpCas9, домен PI локализован в последовательности аминокислот 1099-1368 SpCas9.
В данном описании, PAM может варьироваться в зависимости от происхождения фермента CRISPR типа II. Так, например, если ферментом CRISPR является SpCas9, то PAM может представлять собой 5'-NGG-3'; если ферментом CRISPR является Cas9 Streptococcus thermophilus (StCas9), то PAM может представлять собой 5'-NNAGAAW-3'(W=A или T); если ферментом CRISPR является Cas9 (NmCas9) Neisseria meningitides (NmCas9), то PAM может представлять собой 5'-NNNNGATT-3', а если ферментом CRISPR является Cas9 Campylobacter jejuni (CjCas9), то PAM может представлять собой 5'-NNNVRYAC-3' (V=G или C или A, R=A или G, Y=C или T), где N может представлять собой A, T, G или C; или A, U, G или C.
Фермент CRISPR типа V
Фермент CRISPR типа V включает аналогичные домены RuvC, соответствующие доменам фермента CRISPR типа II, и может состоять из домена Nuc вместо домена HNH CRISPR типа II; доменов REC и WED, которые распознают мишень; и домена PI, распознающего PAM. Описание специфических структурных свойств фермента CRISPR типа V можно найти у Takashi Yamano et al. (2016) Cell 165:949-962.
Фермент CRISPR типа V может взаимодействовать с рРНК с образованием комплекса рРНК-фермент CRISPR, то есть комплекса CRISPR, и может способствовать присоединению гидовой последовательности к последовательности-мишени, включая последовательность PAM вместе с рРНК. В данном описании, способность фермента CRISPR типа V взаимодействовать с геном или нуклеиновой кислотой-мишенью зависит от последовательности PAM.
Последовательность PAM представляет собой последовательность, присутствующую в гене-мишени или в нуклеиновой кислоте-мишени, и может распознаваться доменом PI фермента CRISPR типа V. Последовательность PAM может варьироваться в зависимости от происхождения фермента CRISPR типа V. То есть, существуют различные последовательности PAM, способные специфически распознаваться в зависимости от вида.
В одном примере, последовательность PAM, распознаваемая Cpf1, может представлять собой 5'-TTN-3' (N представляет собой A, T, C или G).
Активность фермента CRISPR
Фермент CRISPR расщепляет двойную цепь или одну цепь гена или нуклеиновой кислоты-мишени и обладает нуклеазной активностью, способной разрывать или удалять двойную или одиночную цепь. Вообще говоря, фермент CRISPR дикого типа II или фермент CRISPR типа V расщепляет двойную цепь гена-мишени или нуклеиновой кислоты-мишени.
Для изменения или модификации вышеописанной нукдеазной активности фермента CRISPR, этот фермент CRISPR может быть модифицирован или изменен с получением фермента с неполной или частичной активностью или неактивного фермента.
Фермент с неполной или частичной активностью
Фермент CRISPR, модифицированный для изменения ферментативной активности так, чтобы он обладал неполной или частичной активностью, называется никазой.
Термин «никаза» означает фермент CRISPR, измененный или модифицированный так, чтобы он расщеплял только одну цепь двойной цепи гена-мишени или нуклеиновой кислоты-мишени, и такая никаза обладает нуклеазной активностью, способствующей расщеплению одной цепи, например, цепи, которая не является комплементарной или комплементарна рРНК гена-мишени или нуклеиновой кислоте-мишени. Поэтому для расщепления двойной цепи необходима нуклеазная активность двух никаз.
Так, например, никаза может обладать нуклеазной активностью, сообщаемой доменом RuvC. То есть никаза может включать нуклеазную активность домена HNH, и для этой цели, домен HNH может быть изменен или модифицирован.
В одном примере, если ферментом CRISPR является фермент CRISPR типа II, и если гистидиновый остаток 840 в аминокислотной последовательности SpCas9 был заменен на аланин, то нуклеазная активность домена HNH была инактивирована и использована как никаза. Поскольку никаза, продуцированная таким образом, обладает нуклеазной активностью домена RuvC, она способна расщеплять цепь, которая не образует комплементарную связь с некомплементарной цепью гена-мишени или нуклеиновой кислоты-мишени, то есть, рРНК.
В другом репрезентативном варианте осуществления изобретения, если гистидиновый остаток 559 в аминокислотной последовательности CjCas9 был заменен на аланин, то нуклеазная активность домена HNH была инактивирована и использована как никаза. Поскольку никаза, продуцированная таким образом, обладает нуклеазной активностью домена RuvC, она способна расщеплять некомплементарную цепь гена-мишени или нуклеиновой кислоты-мишени, то есть цепь, которая не образует комплементарную связь с рРНК.
Так, например, никаза может обладать нуклеазной активностью, сообщаемой доменом HNH. То есть никаза может включать нуклеазную активность домена RuvC, и для этой цели, домен RuvC может быть изменен или модифицирован.
В одном примере, если ферментом CRISPR является фермент CRISPR типа II, то в одном репрезентативном варианте осуществления изобретения, если остаток аспарагиновой кислоты 10 в аминокислотной последовательности SpCas9 был заменен на аланин, то нуклеазная активность домена RuvC была инактивирована и использована как никаза. Никаза, продуцированная таким образом, обладает нуклеазной активностью домена HNH и способна расщеплять комплементарную цепь гена-мишени или нуклеиновой кислоты-мишени, то есть, цепь, которая образует комплементарную связь с рРНК.
В другом репрезентативном варианте осуществления изобретения, если остаток аспарагиновой кислоты 8 в аминокислотной последовательности CjCas9 был заменен на аланин, то нуклеазная активность домена RuvC была инактивирована и использована как никаза. Никаза, продуцированная таким образом, обладает нуклеазной активностью домена HNH и способна расщеплять комплементарную цепь гена-мишени или нуклеиновой кислоты-мишени, то есть, цепь, которая образует комплементарную связь с рРНК.
Неактивный фермент
Фермент CRISPR, который был модифицирован для полной элиминации ферментативной активности, называется неактивным ферментом CRISPR.
Термин «неактивный фермент CRISPR» означает фермент CRISPR, который был модифицирован так, чтобы он не полностью расщеплял двойную цепь гена-мишени или нуклеиновой кислоты-мишени, и такой неактивный фермент CRISPR не обладает нуклеазной активностью из-за мутации в домене с нуклеазной активностью фермента CRISPR дикого типа. Неактивным ферментом CRISPR может быть фермент, в котором нуклеазные активности RuvC и домена HNH были инактивированы.
Так, например, неактивный фермент CRISPR может быть изменен или модифицирован в домене RuvC и в домене HNH так, чтобы он не обладал нуклеазной активностью.
В одном примере, если ферментом CRISPR является фермент CRISPR типа II, то в одном репрезентативном варианте осуществления изобретения, если остатки аспарагиновой кислоты и гистидина 10 и 840 в аминокислотной последовательности SpCas9 были заменены на аланин, соответственно, то нуклеазная активность домена RuvC и домена HNH была инактивирована так, чтобы этот фермент не мог полностью расщеплять двойную цепь гена-мишени или нуклеиновой кислоты-мишени.
В другом репрезентативном варианте осуществления изобретения, если остатки аспарагиновой кислоты и гистидина 8 и 559 в аминокислотной последовательности CjCas9 были заменены на аланин, то нуклеазная активность домена RuvC и домена HNH была инактивирована так, чтобы этот фермент не мог полностью расщеплять двойную цепь гена или нуклеиновой кислоты-мишени.
Другие активности
Фермент CRISPR может обладать, помимо вышеописанной нуклеазной активности, эндонуклеазной активностью, экзонуклеазной активностью или геликазной активностью, то есть, способностью к гибридизации спиральной структуры двухцепочечной нуклеиновой кислоты.
Кроме того, фермент CRISPR может быть модифицирован для полной, неполной или частичной активации эндонуклеазной активности, экзонуклеазной активности или геликазной активности.
Таргетинг фермента CRISPR
Фермент CRISPR может взаимодействовать с рРНК, и тем самым, образовывать комплекс «рРНК-фермент CRISPR», то есть, комплекс CRISPR, и может способствовать присоединению гидовой последовательности к последовательности-мишени, включая последовательность PAM вместе с рРНК. В данном описании, способность фермента CRISPR взаимодействовать с геном-мишенью или нуклеиновой кислотой-мишенью зависит от последовательности PAM.
Последовательность PAM представляет собой последовательность, присутствующую в гене-мишени или в нуклеиновой кислоте-мишени и может распознаваться доменом PI фермента CRISPR. Последовательность PAM может варьироваться в зависимости от происхождения фермента CRISPR. То есть существуют различные последовательности PAM, способные специфически распознаваться в зависимости от вида.
В одном примере, если ферментом CRISPR явлется фермент CRISPR типа II, то в случае SpCas9, последовательность PAM может представлять собой 5'-NGG-3', 5'-NAG-3' и/или 5'-NGA-3',
в случае StCas9, последовательность PAM может представлять собой 5'-NGGNG-3' и/или 5'-NNAGAAW-3' (W=A или T),
в случае NmCas9, последовательность PAM может представлять собой 5'-NNNNGATT-3' и/или 5'-NNNGCTT-3',
в случае CjCas9, последовательность PAM может представлять собой 5'-NNNVRYAC-3' (V=G, C или A; R=A или G; Y=C или T),
в случае Streptococcus mutans Cas9 (SmCas9), последовательность PAM может представлять собой 5'-NGG-3' и/или 5'-NAAR-3' (R=A или G), и
в случае Staphylococcus aureus Cas9 (SaCas9), последовательность PAM может представлять собой 5'-NNGRR-3', 5'-NNGRRT-3' и/или 5'-NNGRRV-3' (R=A или G; V=G, C или A).
В другом примере, если ферментом CRISPR явлется фермент CRISPR типа V, то
в случае Cpf1, последовательность PAM может представлять собой 5'-TTN-3'.
В данном описании, N может представлять собой A, T, G или C; или A, U, G или C.
Фермент CRISPR, способный распознавать специфическую последовательность PAM, может быть изменен или модифицирован с использованием последовательности PAM, способной специфически распознаваться в зависимости от вида. Так, например, домен PI SpCas9 может быть заменен доменом PI CjCas9 так, чтобы он обладал нуклеазной активностью SpCas9 и распознавал CjCas9-специфическую последовательность PAM, с образованием SpCas9, распознающего CjCas9-специфическую последовательность PAM. Специфически распознаваемая последовательность PAM может быть изменена путем замены или модификации домена PI.
Мутантный фермент CRISPR
Фермент CRISPR может быть модифицирован для улучшения или ингибирования различных свойств, таких как нуклеазная активность, геликазная активность, способность взаимодействовать с рРНК, и способность связываться с геном-мишенью или нуклеиновой кислотой-мишенью, например, способность распознавать PAM.
Кроме того, мутантный фермент CRISPR может представлять собой фермент CRISPR, который взаимодействует с рРНК с образованием комплекса «рРНК-фермент CRISPR», то есть, комплекса CRISPR, и который был модифицирован или изменен для повышения специфичности к мишени при присоединении к гену-мишени или нуклеиновой кислоте-мишени или при его локализации в гене-мишени или нуклеиновой кислоте-мишени так, чтобы расщеплялась только двойная или одиночная цепь гена-мишени или нуклеиновой кислоты-мишени без расщепления двойной или одиночной цепи гена или нуклеиновой кислоты, не являющихся мишенью, которые частично образуют комплементарную связь с рРНК, и гена или нуклеиновой кислоты, не являющихся мишенью, которые не образуют комплементарную связь с рРНК.
В данном описании, эффект расщепления двойной или одиночной цепи гена или нуклеиновой кислоты, не являющихся мишенью, которые частично образуют комплементарную связь с рРНК, и гена или нуклеиновой кислоты, не являющихся мишенью, которые не образуют комплементарную связь с рРНК, рассматривается как нежелательный эффект, а положение или последовательность оснований гена или нуклеиновой кислоты, не являющихся мишенью, которые частично образуют комплементарную связь с рРНК, и гена или нуклеиновой кислоты, не являющихся мишенью, которые не образуют комплементарную связь с рРНК, рассматриваются как нежелательные мишени. В данном описании, могут присутствовать одна или более нежелательных мишеней. С другой стороны, эффект расщепления двойной или одиночной цепи гена или нуклеиновой кислоты, рассматривается как желательный эффект, а положение или последовательность-мишень гена-мишени или нуклеиновой кислоты-мишени рассматриваются как желательная мишень.
Мутантный фермент CRISPR был модифицирован по меньшей мере в одной из аминокислот природного фермента CRISPR, и может быть модифицирован, например, для улучшения или ингибирования одного или более различных свойств, таких как нуклеазная активность, геликазная активность, способность взаимодействовать с рРНК, способность связываться с геном-мишенью или нуклеиновой кислотой-мишенью и сообщать специфичность к мишени по сравнению со свойствами немодифицированного фермента CRISPR. В данном описании, модификацией может быть замена, удаление, добавление аминокислот или их смеси.
В мутантном ферменте CRISPR, модификацией может быть модификация одной, двух или более аминокислот, локализованных в области, состоящей из аминокислот, имеющих положительные заряды и присутствующих в природном ферменте CRISPR.
Так, например, модификацией может быть модификация одной, двух или более аминокислот, имеющих положительный заряд, таких как лизин (K), аргинин (R) и гистидин (H), присутствующих в природном ферменте CRISPR.
Модификацией может быть модификация одной, двух или более аминокислот, локализованных в области, состоящей из аминокислот, не имеющих положительного заряда и присутствующих в природном ферменте CRISPR.
Так, например, модификацией может быть модификация одной, двух или более аминокислот, не имеющих положительного заряда, таких как аспарагиновая кислота (D), глутаминовая кислота (E), серин (S), треонин (T), аспарагин (N), глутамин (Q), цистеин (C), пролин (P), глицин (G), аланин (A), валин (V), изолейцин (I), лейцин (L), метионин (M), фенилаланин (F), тирозин (Y) и триптофан (W), присутствующие в природном ферменте CRISPR.
В другом примере, модификацией может быть модификация одной, двух или более незаряженных аминокислот, таких как серин (S), треонин (T), аспарагин (N), глутамин (Q), цистеин (C), пролин (P), глицин (G), аланин (A), валин (V), изолейцин (I), лейцин (L), метионин (M), фенилаланин (F), тирозин (Y) и триптофан (W), присутствующие в природном ферменте CRISPR.
Кроме того, модификацией может быть модификация одной, двух или более аминокислот, имеющих гидрофобные остатки и присутствующих в природном ферменте CRISPR.
Так, например, модификацией может быть модификация одной, двух или более аминокислот, таких как глицин (G), аланин (A), валин (V), изолейцин (I), лейцин (L), метионин (M), фенилаланин (F), тирозин (Y) и триптофан (W), присутствующие в природном ферменте CRISPR.
Модификацией может быть модификация одной, двух или более аминокислот, имеющих полярные остатки и присутствующих в природном ферменте CRISPR.
Так, например, модификацией может быть модификация одной, двух или более аминокислот, таких как серин (S), треонин (T), аспарагин (N), глутамин (Q), цистеин (C), пролин (P), лизин (K), аргинин (R), гистидин (H), аспарагиновая кислота (D) и глутаминовая кислота (Е), присутствующие в природном ферменте CRISPR.
Кроме того, модификацией может быть модификация одной, двух или более аминокислот, включая лизин (K), аргинин (R) и гистидин (H), присутствующие в природном ферменте CRISPR.
Так, например, модификацией может быть замена одной, двух или более аминокислот, включая лизин (K), аргинин (R) и гистидин (H), присутствующие в природном ферменте CRISPR.
Модификацией может быть модификация одной, двух или более аминокислот, включая аспарагиновую кислоту (D) и глутаминовую кислоту (Е), присутствующие в природном ферменте CRISPR.
Так, например, модификацией может быть замена одной, двух или более аминокислот, включая аспарагиновую кислоту (D) и глутаминовую кислоту (Е), присутствующие в природном ферменте CRISPR.
Модификацией может быть модификация одной, двух или более аминокислот, включая серин (S), треонин (T), аспарагин (N), глутамин (Q), цистеин (C), пролин (P), глицин (G), аланин (A), валин (V), изолейцин (I), лейцин (L), метионин (M), фенилаланин (F), тирозин (Y) и триптофан (W), присутствующие в природном ферменте CRISPR.
Так, например, модификацией может быть замена одной, двух или более аминокислот, включая серин (S), треонин (T), аспарагин (N), глутамин (Q), цистеин (C), пролин (P), глицин (G), аланин (A), валин (V), изолейцин (I), лейцин (L), метионин (M), фенилаланин (F), тирозин (Y) и триптофан (W), присутствующие в природном ферменте CRISPR.
Кроме того, модификацией может быть модификация одной, двух, трех, четырех, пяти, шести, семи или более аминокислот, присутствующих в природном ферменте CRISPR.
Кроме того, в мутантном ферменте CRISPR, модификацией может быть модификация одной, двух или более аминокислот, присутствующих в домене RuvC фермента CRISPR. В данном описании, домен RuvC может представлять собой домен RuvCI, RuvCII или RuvCIII.
Модификацией может быть модификация одной, двух или более аминокислот, присутствующих в домене HNH фермента CRISPR.
Модификацией может быть модификация одной, двух или более аминокислот, присутствующих в домене REC фермента CRISPR.
Модификацией может быть модификация одной, двух или более аминокислот, присутствующих в домене PI фермента CRISPR.
Модификацией может быть модификация двух или более аминокислот, содержащихся по меньшей мере в двух или более доменах REC, RuvC, HNH и PI фермента CRISPR.
В одном примере, модификацией может быть модификация двух или более аминокислот, содержащихся по меньшей мере в двух или более доменах REC и RuvC фермента CRISPR.
В одном репрезентативном варианте осуществления изобретения, в мутанте SpCas9, модификацией может быть модификация по меньшей мере двух или более аминокислот A203, H277, G366, F539, I601, M763, D965 и F1038, содержащихся в доменах REC и RuvC SpCas9.
В другом примере, модификацией может быть модификация двух или более аминокислот, содержащихся в доменах REC и HNH фермента CRISPR.
В одном репрезентативном варианте осуществления изобретения, в мутанте SpCas9, модификацией может быть модификация по меньшей мере двух или более аминокислот A203, H277, G366, F539, I601 и K890, содержащихся в доменах REC и HNH фермента SpCas9.
В одном примере, модификацией может быть модификация двух или более аминокислот, содержащихся в доменах REC и PI фермента CRISPR.
В одном репрезентативном варианте осуществления изобретения, в мутанте SpCas9, модификацией может быть модификация по меньшей мере двух или более аминокислот A203, H277, G366, F539, I601, T1102 и D1127, содержащихся в доменах REC и PI фермента SpCas9.
В другом примере, модификацией может быть модификация трех или более аминокислот, содержащихся в доменах REC, RuvC и HNH фермента CRISPR.
В одном репрезентативном варианте осуществления изобретения, в мутанте SpCas9, модификацией может быть модификация по меньшей мере трех или более аминокислот A203, H277, G366, F539, I601, M763, K890, D965 и F1038, содержащихся в доменах REC, RuvC и HNH фермента SpCas9.
В одном примере, модификацией может быть модификация трех или более аминокислот, содержащихся в доменах REC, RuvC и PI фермента CRISPR.
В одном репрезентативном варианте осуществления изобретения, в мутанте SpCas9, модификацией может быть модификация по меньшей мере трех или более аминокислот A203, H277, G366, F539, I601, M763, D965, F1038, T1102 и D1127, содержащихся в доменах REC, RuvC и PI фермента SpCas9.
В другом примере, модификацией может быть модификация трех или более аминокислот, содержащихся в доменах REC, HNH и PI фермента CRISPR.
В одном репрезентативном варианте осуществления изобретения, в мутанте SpCas9, модификацией может быть модификация по меньшей мере трех или более аминокислот A203, H277, G366, F539, I601, K890, T1102 и D112, содержащихся в доменах REC, RuvC и PI фермента SpCas9.
В одном примере, модификацией может быть модификация трех или более аминокислот, содержащихся в доменах REC, HNH и PI фермента CRISPR.
В одном репрезентативном варианте осуществления изобретения, в мутанте SpCas9, модификацией может быть модификация по меньшей мере трех или более аминокислот M763, K890, D965, F1038, T1102 и D1127, содержащихся в доменах RuvC, HNH и PI SpCas9.
В другом примере, модификацией может быть модификация четырех или более аминокислот, содержащихся в доменах REC, RuvC, HNH и PI фермента CRISPR.
В одном репрезентативном варианте осуществления изобретения, в мутанте SpCas9, модификацией может быть модификация по меньшей мере четырех или более аминокислот A203, H277, G366, F539, I601, M763, K890, D965, F1038, T1102 и D1127, содержащихся в доменах REC, RuvC, HNH и PI SpCas9.
Кроме того, в мутантном ферменте CRISPR, модификацией может быть модификация одной, двух или более аминокислот, участвующих в нуклеазной активности фермента CRISPR.
Так, например, в мутантном SpCas9, модификацией может быть модификация одной, двух или более аминокислот из группы, состоящей из аминокислот D10, E762, H840, N854, N863 и D986 или одной, двух или более аминокислот из группы, состоящей из аминокислот, соответствующих другим ортологам Cas9.
Модификацией может быть модификация, частично инактивирующая нуклеазную активность фермента CRISPR, и такой мутантный фермент CRISPR может представлять собой никазу.
В данном описании, модификацией может быть модификация, инактивирующая нуклеазную активность домена RuvC фермента CRISPR, и такой мутантный фермент CRISPR не может расщеплять некомплементарную цепь гена-мишени или нуклеиновой кислоты-мишени, то есть, цепь, которая не образует комплементарную связь с рРНК.
В одном репрезентативном варианте осуществления изобретения, в случае SpCas9, если остаток аспарагиновой кислоты 10 аминокислотной последовательности SpCas9 был заменен аланином, то есть, если он был заменен на D10A, то нуклеазная активность домена RuvC была инактивирована, и таким образом, SpCas9 может быть использован в качестве никазы. Продуцированная таким образом никаза не может расщеплять некомплементарную цепь гена-мишени или нуклеиновой кислоты-мишени, то есть цепь, которая не образует комплементарную связь с рРНК.
В другом репрезентативном варианте осуществления изобретения, в случае CjCas9, если остаток аспарагиновой кислоты 8 аминокислотной последовательности CjCas9 был заменен аланином, то есть, если он был заменен на D8A, то нуклеазная активность домена RuvC была инактивирована, и таким образом, CjCas9 может быть использован в качестве никазы. Продуцированная таким образом никаза не может расщеплять некомплементарную цепь гена-мишени или нуклеиновой кислоты-мишени, то есть, цепь, которая не образует комплементарную связь с рРНК.
Кроме того, в данном описании, модификацией может быть модификация, инактивирующая нуклеазную активность домена HNH фермента CRISPR, и такой мутантный фермент CRISPR не может расщеплять некомплементарную цепь гена-мишени или нуклеиновой кислоты-мишени, то есть цепь, которая образует комплементарную связь с рРНК.
В одном репрезентативном варианте осуществления изобретения, в случае SpCas9, если гистидиновый остаток 840 аминокислотной последовательности SpCas9 был заменен аланином, то есть, если он был заменен на H840A, то нуклеазная активность домена HNH была инактивирована, и таким образом, SpCas9 может быть использован в качестве никазы. Продуцированная таким образом никаза не может расщеплять некомплементарную цепь гена-мишени или нуклеиновой кислоты-мишени, то есть, цепь, которая образует комплементарную связь с рРНК.
В другом репрезентативном варианте осуществления изобретения, в случае CjCas9, если гистидиновый остаток 559 аминокислотной последовательности CjCas9 был заменен аланином, то есть, если он был заменен на H559A, то нуклеазная активность домена HNH была инактивирована, и таким образом, CjCas9 может быть использован в качестве никазы. Продуцированная таким образом никаза не может расщеплять комплементарную цепь гена-мишени или нуклеиновой кислоты-мишени, то есть, цепь, которая образует комплементарную связь с рРНК.
Кроме того, модификацией может быть модификация, полностью инактивирующая нуклеазную активность фермента CRISPR, и такой мутантный фермент CRISPR может представлять собой неактивный фермент CRISPR.
В данном описании, модификацией может быть модификация, полностью инактивирующая нуклеазную активность доменов RuvC и HNH фермента CRISPR, и такой мутантный фермент CRISPR не может расщеплять двойную цепь гена-мишени или нуклеиновой кислоты-мишени.
В одном репрезентативном варианте осуществления изобретения, в случае SpCas9, если остаток аспарагиновой кислоты 10 и гистидиновый остаток 840 аминокислотной последовательности SpCas9 были заменены аланином, то есть, если они были заменены на D10A и H840A, соответственно, то нуклеазная активность домена RuvC и домена HNH была инактивирована, и таким образом, двойная цепь гена или нуклеиновой кислоты-мишени не может быть полностью расщеплена.
В другом репрезентативном варианте осуществления изобретения, в случае CjCas9, если остаток аспарагиновой кислоты 8 и гистидиновый остаток 559 аминокислотной последовательности CjCas9 были заменены аланином, то есть, если они были заменены на D8A и H559A, соответственно, то нуклеазная активность домена RuvC и домена HNH была инактивирована, и таким образом, двойная цепь гена-мишени или нуклеиновой кислоты-мишени не может быть полностью расщеплена.
Кроме того, мутантный фермент CRISPR, помимо своих природных свойств, может также включать, но необязательно, функциональный домен, и такой мутантный фермент CRISPR, помимо своих природных свойств, может также обладать и дополнительным свойствами.
В данном описании, функциональный домен может представлять собой домен, обладающий метилазной активностью, деметилазной активностью, активностью активации транскрипции, активностью подавления транскрипции, активностью рилизинг-фактора транскрипции, активностью модификации гистона, активностью расщепления РНК или активностью связывания с нуклеиновой кислотой, или метку или ген-репортер для выделения и очистки белка (включая пептид), однако, настоящее изобретение не ограничивается ими.
Функциональный домен, пептид, полипептид или белок могут представлять собой дезаминазу.
Так, например, неполный или частичный фермент CRISPR может дополнительно включать цитидин-дезаминазу в качестве функционального домена. В одном репрезентативном варианте осуществления изобретения, цитидин-дезаминаза, например, комплекс 1, редактирующий аполипопротеин B (APOBEC1), может быть добавлен к никазе SpCas9 с образованием гибридного белка. Образованный таким образом комплекс [никаза SpCas9]-[APOBEC1] может быть использован для репарации или редактирования оснований с заменой C на T или U, или G на A.
Метка включает гистидиновую (His) метку, V5-метку, FLAG-метку, метку гемаглютинина вируса гриппа (HA), Myc-метку, VSV-G-метку и тиоредоксиновую метку (Trx), а ген-репортер включает ген глутатион-S-трансферазы (GST), пероксидазы хрена (ПХ), хлорамфеникол-ацетилтрансферазы (CAT), β-галактозидазы, β-глюкуронидазы, люциферазы, аутофлуоресцентных белков, включая белок, флуоресцирующий в зеленом диапазоне спектра (GFP), HcRed, DsRed, белок, флуоресцирующий в голубом диапазоне спектра (CFP), белок, флуоресцирующий в желтом диапазоне спектра (YFP) и белок, флуоресцирующий в синем диапазоне спектра (BFP), однако, настоящее изобретение не ограничивается ими.
Кроме того, функциональный домен может представлять собой последовательность или сигнал локализации в ядре (NLS) или последовательность или сигнал экспорта из ядра (NES).
В одном примере, фермент CRISPR может включать один или более NLS. В данном описании, один или более NLS могут быть включены у N-конца фермента CRISPR или поблизости от него; у C-конца этого фермента или поблизости от него; или их комбинацию. NLS может представлять собой последовательность NLS согласно изобретению, происходящую, но не ограничивающуюся ими, от нижеследующих NLS: NLS крупного Т-антигена вируса SV40 с аминокислотной последовательностью PKKKRKV; NLS, происходящего от нуклеоплазмина (например, двухкомпонентного NLS нуклеоплазмина с последовательностью KRPAATKKAGQAKKKK); NLS c-myc с аминокислотной последовательностью PAAKRVKLD или RQRRNELKRSP; NLS hRNPA1 M9 с последовательностью NQSSNFGPMKGGNFGGRSSGPYGGGGQYFAKPRNQGGY; последовательности домена IBB, происходящей от импортина-α, RMRIZFKNKGKDTAELRRRRVEVSVELRKAKKDEQILKRRNV; последовательности T-белка миомы VSRKRPRP и PPKKARED; последовательности человеческого p53, POPKKKPL; последовательности мышиного c-abl IV, SALIKKKKKMAP; последовательности вируса гриппа NS1, DRLRR и PKQKKRK; последовательности антигена вируса гепатита дельта, RKLKKKIKKL; последовательности мышиного белка Mx1, REKKKFLKRR; последовательности человеческой поли(АДФ-рибозо)полимеразы, KRKGDEVDGVDEVAKKKSKK; или последовательности RKCLQAGMNLEARKTKK, происходящей от глюкокортикоида рецептора стероидного гормона (человеческого).
Кроме того, мутантный фермент CRISPR может включать фермент CRISPR расщепленного типа, полученный путем разделения фермента CRISPR на две или более частей. Термин «расщепленный» относится к функциональному или структурному разделению белка или рандомизированному разделению белка на две или более частей.
В данном описании, фермент CRISPR расщепленного типа может представлять собой полностью, не полностью или частично активный фермент или неактивный фермент.
Так, например, SpCas9 может быть разделен на две части между тирозиновым остатком 656 и треониновым остатком 657 с образованием расщепленного SpCas9.
Кроме того, фермент CRISPR расщепленного типа может селективно включать дополнительный домен, пептид, полипептид или белок для восстановления.
В данном описании, термин «восстановление» означает образование фермента CRISPR расщепленного типа, структура которого является такой же, как структура фермента CRISPR дикого типа, или аналогичной структуре этого фермента.
Дополнительный домен, пептид, полипептид или белок для восстановления могут представлять собой домены димеризации FRB и FKBP; интеин; домены ERT и VPR; или домены, которые образуют гетеродимер в специфических условиях.
Так, например, SpCas9 может быть разделен на две части между сериновым остатком 713 и глициновым остатком 714 с образованием расщепленного SpCas9. Домен FRB может быть присоединен к одной из двух частей, а домен FKBP может быть присоединен к другой части. При продуцировании расщепленного SpCas9, домен FRB и домен FKBP могут образовывать димер в среде, в которой присутствует рапамицин, в результате чего образуется восстановленный фермент CRISPR.
Фермент CRISPR или мутантный фермент CRISPR, описанные в настоящей заявке, могут представлять собой полипептид, белок или нуклеиновую кислоту, имеющую последовательность, кодирующую такой полипептид или белок, и могут быть оптимизированы по кодонам для введения индивидууму фермента CRISPR или мутантного фермента CRISPR.
Термин «оптимизация по кодонам» означает способ модификации последовательности нуклеиновой кислоты путем сохранения нативной аминокислотной последовательности с заменой по меньшей мере одного кодона нативной последовательности на кодон, который встречается более часто или более часто используется в клетках-хозяевах, в целях повышения уровня экспрессии в клетках-хозяевах. У различных видов наблюдается специфическое смещение кодона специфической аминокислоты, и такое смещение кодонов (различие кодонов у различных организмов) часто коррелирует с эффективностью трансляции мРНК, которая, вероятно зависит от свойств транслированного кодона и доступности специфической молекулы тРНК. Доминирование тРНК, отобранных в клетках, обычно указывает на кодоны, которые наиболее часто используются в пептидном синтезе. Поэтому, ген может быть специально отобран по оптимальной экспрессии генов в данном организме исходя из оптимизации по кодонам.
3. Последовательность-мишень
Термин «последовательность-мишень» означает последовательность оснований, присутствующую в гене-мишени или в нуклеиновой кислоте-мишени и комплементарную гидовой последовательности, содержащейся в гидовом домене гидовой нуклеиновой кислоты. Последовательность-мишень представляет собой последовательность оснований, которая может варьироваться в зависимости от гена-мишени или нуклеиновой кислоты-мишени, то есть, объекта для модификации или коррекции гена, и такая последовательность может быть сконструирована в различных формах в зависимости от гена-мишени или нуклеиновой кислоты-мишени.
Последовательность-мишень может образовывать комплементарную связь с гидовой последовательностью, содержащейся в гидовом домене гидовой нуклеиновой кислоты, и длина последовательности-мишени может быть такой же, как длина гидовой последовательности.
Последовательность-мишень может представлять собой последовательность из 5-50 оснований.
В одном из вариантов осуществления изобретения, последовательность-мишень может представлять собой последовательность из 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 оснований.
Последовательность-мишень может представлять собой последовательность нуклеиновой кислоты, комплементарную гидовой последовательности, содержащейся в гидовом домене гидовой нуклеиновой кислоты, и такая последовательность является, например, по меньшей мере на 70%, 75%, 80%, 85%, 90% или 95% или более комплементарной или полностью комплементарной.
В одном примере, последовательность-мишень может представлять собой или включать последовательность из 1-8 оснований, которая не является комплементарной гидовой последовательности, содержащейся в гидовом домене гидовой нуклеиновой кислоты.
Кроме того, последовательность-мишень может представлять собой последовательность оснований, смежную с последовательностью нуклеиновой кислоты, распознаваемой белком-редактором.
В одном примере, последовательность-мишень может представлять собой непрерывную последовательность из 5-50 оснований, смежную с 5'-концом и/или 3'-концом последовательности нуклеиновой кислоты, распознаваемой белком-редактором.
В одном репрезентативном варианте осуществления изобретения, последовательности-мишени для комплекса рРНК-фермент CRISPR описаны ниже.
Если ген или нуклеиновая кислота-мишень являются мишенью для комплекса рРНК-фермент CRISPR, то последовательность-мишень является комплементарной гидовой последовательности, содержащейся в гидовой домене рРНК. Последовательность-мишень представляет собой последовательность оснований, которая варьируется в зависимости от гена-мишени или нуклеиновой кислоты-мишени, то есть, объекта для модификации или коррекции гена, и такая последовательность может быть сконструирована в различных формах в зависимости от гена-мишени или нуклеиновой кислоты-мишени.
Кроме того, последовательность-мишень может представлять собой последовательность оснований, смежную с последовательностью PAM, которая может распознаваться ферментом CRISPR, то есть Cas9 или Cpf1.
В одном примере, последовательность-мишень может представлять собой непрерывную последовательность из 5-50 оснований, смежную с 5'-концом и/или 3'-концом последовательности PAM, распознаваемой ферментом CRISPR.
В одном репрезентативном варианте осуществления изобретения, если ферментом CRISPR является SpCas9, то последовательность-мишень может представлять собой непрерывную последовательность из 16-25 оснований, смежную с 5'-концом и/или 3'-концом последовательности 5'-NGG-3', 5'-NAG-3' и/или 5'-NGA-3' (N=A, T, G или C; или A, U, G или C).
В другом репрезентативном варианте осуществления изобретения, если ферментом CRISPR является StCas9, то последовательность-мишень может представлять собой непрерывную последовательность из 16-25 оснований, смежную с 5'-концом и/или 3'-концом последовательности 5'-NGGNG-3' и/или 5'-NNAGAAW-3' (W=A или T, и N=A, T, G или C; или A, U, G или C).
В другом репрезентативном варианте осуществления изобретения, если ферментом CRISPR является NmCas9, то последовательность-мишень может представлять собой непрерывную последовательность из 16-25 оснований, смежную с 5'-концом и/или 3'-концом последовательности 5'-NNNNGATT-3' и/или 5'-NNNGCTT-3' (N=A, T, G или C; или A, U, G или C).
В одном репрезентативном варианте осуществления изобретения, если ферментом CRISPR является CjCas9, то последовательность-мишень может представлять собой непрерывную последовательность из 16-25 оснований, смежную с 5'-концом и/или 3'-концом последовательности 5'-NNNVRYAC-3' (V=G, C или A; R=A или G, Y=C или T, N=A, T, G или C; или A, U, G или C).
В другом репрезентативном варианте осуществления изобретения, если ферментом CRISPR является SmCas9, то последовательность-мишень может представлять собой непрерывную последовательность из 16-25 оснований, смежную с 5'-концом и/или 3'-концом последовательности 5'-NGG-3' и/или 5'-NAAR-3'(R=A или G, N=A, T, G или C; или A, U, G или C).
В другом репрезентативном варианте осуществления изобретения, если ферментом CRISPR является SaCas9, то последовательность-мишень может представлять собой непрерывную последовательность из 16-25 оснований, смежную с 5'-концом и/или 3'-концом последовательности 5'-NNGRR-3', 5'-NNGRRT-3' и/или 5'-NNGRRV-3' (R=A или G, V=G, C или A, N=A, T, G или C; или A, U, G или C).
В одном репрезентативном варианте осуществления изобретения, если ферментом CRISPR является Cpf1, то последовательность-мишень может представлять собой непрерывную последовательность из 16-25 оснований, смежную с 5'-концом и/или 3'-концом последовательности 5'-TTN-3' (N=A, T, G или C; или A, U, G или C).
4. Комплекс «гидовая нуклеиновая кислота - белок-редактор» и его применение
Комплекс «гидовая нуклеиновая кислота - белок-редактор» может модифицировать мишень.
Мишень может представлять собой нуклеиновую кислоту, ген, хромосому или белок-мишень.
Так, например, комплекс «гидовая нуклеиновая кислота - белок-редактор» может быть использован для конечной регуляции (например, для ингибирования, супрессии, снижения, повышения или стимуляции) экспрессии представляющего интерес белка, удаления белка, регуляции (например, для ингибирования, супрессии, снижения, повышения или стимуляции) активности белка или экспрессии нового белка.
В данном описании, комплекс «гидовая нуклеиновая кислота - белок-редактор» может действовать на уровне ДНК, РНК, гена или хромосомы.
Так, например, комплекс «гидовая нуклеиновая кислота - белок-редактор» может регулировать (например, ингибировать, подавлять, снижать, повышать или стимулировать) экспрессию белка, кодируемого ДНК-мишенью, удалять белок, регулировать (например, ингибировать, подавлять, снижать, повышать или стимулировать) активность белка или экспрессировать модифицированный белок посредством изменения или модификации ДНК-мишени.
В другом примере, комплекс «гидовая нуклеиновая кислота - белок-редактор» может регулировать (например, ингибировать, подавлять, снижать, повышать или стимулировать) экспрессию белка, кодируемого ДНК-мишенью, удалять белок, регулировать (например, ингибировать, подавлять, снижать, повышать или стимулировать) активность белка или экспрессировать модифицированный белок посредством изменения или модификации РНК-мишени.
В одном примере, комплекс «гидовая нуклеиновая кислота - белок-редактор» может регулировать (например, ингибировать, подавлять, снижать, повышать или стимулировать) экспрессию белка, кодируемого ДНК-мишенью, удалять белок, регулировать (например, ингибировать, подавлять, снижать, повышать или стимулировать) активность белка или экспрессировать модифицированный белок посредством изменения или модификации гена-мишени.
В другом примере, комплекс «гидовая нуклеиновая кислота - белок-редактор» может регулировать (например, ингибировать, подавлять, снижать, повышать или стимулировать) экспрессию белка, кодируемого ДНК-мишенью, удалять белок, регулировать (например, ингибировать, подавлять, снижать, повышать или стимулировать) активность белка или экспрессировать модифицированный белок посредством изменения или модификации хромосомы-мишени.
Комплекс «гидовая нуклеиновая кислота - белок-редактор» может действовать на стадиях транскрипции и трансляции гена.
В одном примере, комплекс «гидовая нуклеиновая кислота - белок-редактор» может стимулировать или подавлять транскрипцию гена-мишени и, тем самым, регулировать (например, ингибировать, подавлять, снижать, повышать или стимулировать) экспрессию белка, кодируемого геном-мишенью.
В другом примере, комплекс «гидовая нуклеиновая кислота - белок-редактор» может стимулировать или подавлять трансляцию гена-мишени и, тем самым, регулировать (например, ингибировать, подавлять, снижать, повышать или стимулировать) экспрессию белка, кодируемого геном-мишенью.
Комплекс «гидовая нуклеиновая кислота - белок-редактор» может действовать на белковом уровне.
В одном примере, комплекс «гидовая нуклеиновая кислота - белок-редактор» может изменять или модифицировать белок-мишень, и, тем самым, удалять белок-мишень или регулировать (например, ингибировать, подавлять, снижать, повышать или стимулировать) активность белка.
Конкретный пример применения комплекса «гидовая нуклеиновая кислота - белок-редактор» согласно изобретению, изменения или модификации ДНК-мишеней, РНК-мишеней, генов-мишеней или хромосом-мишеней с использованием комплекса «рРНК-фермент CRISPR», описан ниже.
Модификация гена
Ген-мишень или нуклеиновая кислота-мишень могут быть модифицированы или скорректированы с использованием вышеописанного комплекса «рРНК-фермент-CRISPR», то есть, комплекса CRISPR. В данном описании, модификация или коррекция гена-мишени или нуклеиновой кислоты-мишени включает все стадии i) расщепления или повреждения гена-мишени или нуклеиновой кислоты-мишени и ii) репарации поврежденных гена-мишени или нуклеиновой кислоты-мишени.
i) Расщепление или повреждение гена-мишени или нуклеиновой кислоты-мишени
i) Расщепление или повреждение гена-мишени или нуклеиновой кислоты-мишени может представлять собой расщепление или повреждение гена-мишени или нуклеиновой кислоты-мишени под действием комплекса CRISPR, а, в частности, расщепление или повреждение последовательности-мишени в гене-мишени или нуклеиновой кислоте-мишени.
В одном примере, расщепление или повреждение гена-мишени или нуклеиновой кислоты-мишени под действием комплекса CRISPR может представлять собой полное расщепление или повреждение двойной цепи последовательности-мишени.
В одном репрезентативном варианте осуществления изобретения, если используется SpCas9 дикого типа, то двойная цепь последовательности-мишени, образующая комплементарную связь с рРНК, может быть полностью расщеплена.
В другом репрезентативном варианте осуществления изобретения, если используется никаза SpCas9 (D10A) и никаза SpCas9 (H840A), то одна комплементарная цепь последовательности-мишени, образующая комплементарную связь с рРНК, может расщепляться под действием никазы SpCas9 (D10A), а одна некомплементарная цепь последовательности-мишени, образующая комплементарную связь с рРНК, может расщепляться под действием никазы SpCas9 (H840A), и такие расщепления могут происходить последовательно или одновременно.
В другом репрезентативном варианте осуществления изобретения, если используется никаза SpCas9 (D10A) и никаза SpCas9 (H840A) и две рРНК, имеющие различные последовательности-мишени, то одна комплементарная цепь последовательности-мишени, образующая комплементарную связь с первой рРНК, может расщепляться под действием никазы SpCas9 (D10A), и одна некомплементарная цепь последовательности-мишени, образующая комплементарную связь со второй рРНК, может расщепляться под действием никазы SpCas9 (H840A), и такие расщепления могут происходить последовательно или одновременно.
В другом примере, расщепление или повреждение гена-мишени или нуклеиновой кислоты-мишени под действием комплекса CRISPR может представлять собой расщепление или повреждение только одной цепи последовательности-мишени. В данном описании, одна цепь может представлять собой одну комплементарную цепь последовательности-мишени, образующую комплементарную связь с рРНК, или одну некомплементарную цепь последовательности-мишени, образующую комплементарную связь с рРНК.
В одном репрезентативном варианте осуществления изобретения, если используется никаза SpCas9 (D10A), то одна комплементарная цепь последовательности-мишени, образующая комплементарную связь с рРНК, может расщепляться под действием никазы SpCas9 (D10A), а одна некомплементарная цепь последовательности-мишени, образующая комплементарную связь с рРНК, не может расщепляться.
В другом репрезентативном варианте осуществления изобретения, если используется никаза SpCas9 (H840A), то одна некомплементарная цепь последовательности-мишени, образующая комплементарную связь с рРНК, может расщепляться под действием никазы SpCas9 (H840A), а одна комплементарная цепь последовательности-мишени, образующая комплементарную связь с рРНК, не может расщепляться.
В другом примере, расщепление или повреждение гена-мишени или нуклеиновой кислоты-мишени под действием комплекса CRISPR, может представлять собой частичное удаление фрагмента нуклеиновой кислоты.
В одном репрезентативном варианте осуществления изобретения, если используются две рРНК, имеющие различные последовательности-мишени и SpCas9 дикого типа, то могут расщепляться двойная цепь последовательности-мишени, образующая комплементарную связь с первой рРНК, и двойная цепь последовательности-мишени, образующая комплементарную связь со второй рРНК, что будет приводить к удалению фрагментов нуклеиновой кислоты под действием первой и второй рРНК и SpCas9.
В другом репрезентативном варианте осуществления изобретения, если используется две рРНК, имеющие различные последовательности-мишени; SpCas9 дикого типа, никаза SpCas9 (D10A) и никаза SpCas9 (H840A), то двойная цепь последовательности-мишени, образующая комплементарную связь с первой рРНК, может расщепляться под действием SpCas9 дикого типа рРНК; одна комплементарная цепь последовательности-мишени, образующая комплементарную связь со второй рРНК, может расщепляться под действием никазы SpCas9 (D10A), а одна некомплементарная цепь может расщепляться под действием никазы SpCas9 (H840A), что будет приводить к удалению фрагментов нуклеиновой кислоты под действием первой и второй рРНК, SpCas9 дикого типа, никазы SpCas9 (D10A) и никазы SpCas9 (H840A).
В другом репрезентативном варианте осуществления изобретения, если используются две рРНК, имеющие различные последовательности-мишени; никаза SpCas9 (D10A) и никаза SpCas9 (H840A), то одна комплементарная цепь последовательности-мишени, образующая комплементарную связь с первой рРНК, может расщепляться под действием никазы SpCas9 (D10A); одна некомплементарная цепь может расщепляться под действием никазы SpCas9 (H840A), двойная комплементарная цепь последовательности-мишени, образующая комплементарную связь со второй рРНК, может расщепляться под действием никазы SpCas9 (D10A), а одна некомплементарная цепь может расщепляться под действием никазы SpCas9 (H840A), что будет приводить к удалению фрагментов нуклеиновой кислоты под действием первой и второй рРНК, никазы SpCas9 (D10A) и никазы SpCas9 (H840A).
В другом репрезентативном варианте осуществления изобретения, если используются три рРНК, имеющие различные последовательности-мишени; SpCas9 дикого типа; никаза SpCas9 (D10A); и никаза SpCas9 (H840A), то двойная цепь последовательности-мишени, образующая комплементарную связь с первой рРНК, может расщепляться под действием SpCas9 дикого типа рРНК; одна комплементарная цепь последовательности-мишени, образующая комплементарную связь со второй рРНК, может расщепляться под действием никазы SpCas9 (D10A), а одна некомплементарная цепь последовательности-мишени, образующая комплементарную связь с третьей рРНК, может расщепляться под действием никазы SpCas9 (H840A), что будет приводить к удалению фрагментов нуклеиновой кислоты под действием первой, второй рРНК, третьей рРНК, SpCas9 дикого типа, никазы SpCas9 (D10A) и никазы SpCas9 (H840A).
В другом репрезентативном варианте осуществления изобретения, если используются четыре рРНК, имеющие различные последовательности-мишени; никаза SpCas9 (D10A) и никаза SpCas9 (H840A), то одна комплементарная цепь последовательности-мишени, образующая комплементарную связь с первой рРНК, может расщепляться под действием никазы SpCas9 (D10A); одна некомплементарная цепь последовательности-мишени, образующая комплементарную связь со второй рРНК, может расщепляться под действием никазы SpCas9 (H840A), одна комплементарная цепь последовательности-мишени, образующая комплементарную связь с третьей рРНК, может расщепляться под действием никазы SpCas9 (D10A), и одна некомплементарная цепь последовательности-мишени, образующая комплементарную связь с четвертой рРНК, может расщепляться под действием никазы SpCas9 (H840A), что будет приводить к удалению фрагментов нуклеиновой кислоты под действием первой рРНК, второй рРНК, третьей рРНК, четвертой рРНК, никазы SpCas9 (D10A) и никазы SpCas9 (H840A).
ii) Репарация или восстановление поврежденного гена-мишени или поврежденной нуклеиновой кислоты-мишени
Ген-мишень или нуклеиновая кислота-мишень, расщепленные или поврежденные под действием комплекса CRISPR, могут быть репарированы или восстановлены посредством NHEJ и гомологичной репарации (HDR).
Присоединение негомологичных концов (NHEJ)
NHEJ представляет собой процесс восстановления или репарации двухцепочечных разрывов в ДНК посредством соединения обоих концов расщепленной двойной и одной цепи вместе, и обычно, если два совместимых конца, образованных посредством разрыва двойной цепи (например, расщепления), часто контактируют друг с другом с полным их соединением, то разорванная двойная цепь восстанавливается. NHEJ представляет собой процесс восстановления, который может происходить во всем клеточном цикле, а обычно, если в клетках присутствует негомологичный геном в качестве матрицы, например, в фазе G1.
В процессе репарации поврежденного гена или поврежденной нуклеиновой кислоты посредством NHEJ, некоторые инсерции и/или делеции (INDEL) в последовательности нуклеиновой кислоты присутствуют в NHEJ-репарированной области, и такие инсерции и/или делеции приводят к сдвигу рамки считывания, и тем самым, к образованию мРНК транскриптомы со сдвигом рамки считывания. В результате этого, природные функции теряются из-за разрушения цепи, опосредуемого нонсенс-мутациями или невозможности синтеза нормальных белков. Кроме того, при сохранении рамки считывания, мутации в которых инсерции или делеции присутствуют в последовательности в значительном количестве, могут вызывать нарушение функциональных свойств белков. Такая мутация зависит от локуса, поскольку мутации в функционально значимом домене, вероятно, менее толерантны, чем мутации в функционально незначимой области белка.
Хотя невозможно предсказать INDEL-мутации, продуцируемые в природе посредством NHEJ, однако, специфическая INDEL-последовательность является предпочтительной в данной области разыва и может происходить от небольшой области с микрогомологией. Обычно делеции имеют длину в пределах от 1 п.о. до 50 п.о., а инсерции имеют тенденцию укорачиваться, и часто включают небольшую повторяющуюся последовательность, непосредственно окружающую область разрыва.
Кроме того, NHEJ представляет собой процесс, приводящий к мутации, и если он не является необходимым для продуцирования специфической конечной последовательности, то он может быть использован для делеции мотива небольшой последовательности.
Специфический нокаут гена, достигаемый посредством комплекса CRISPR, может быть осуществлен с использованием такого NHEJ. Двойная цепь или две одиночных цепи гена-мишени или нуклеиновой кислоты-мишени могут быть расщеплены под действием фермена CRISPR, такого как Cas9 или Cpf1, а двойная цепь с разрывом или две отдельные цепи гена-мишени или нуклеиновой кислоты-мишени могут иметь инсерции-делеции (INDEL) в результате NHEJ, что будет приводить к индуцированию специфического нокаута гена-мишени или нуклеиновой кислоты-мишени. В данном описании, сайт гена-мишени или нуклеиновой кислоты-мишени, расщепленных ферментом CRISPR, может представлять собой некодирующую или кодирующую область, и кроме того, сайт гена-мишени или нуклеиновой кислоты-мишени, восстановленных посредством NHEJ, может представлять собой некодирующую или кодирующую область.
Прямая гомологичная репарация (HDR)
HDR представляет собой метод безошибочной коррекции, в котором используется гомологичная последовательность в качестве матрицы для репарации или восстановления поврежденного гена или поврежденной нуклеиновой кислоты, а обычно для репарации или восстановления ДНК с разрывом, то есть, для восстановления природной клеточной информации, ДНК с разрывом подвергают репарации на основе информации о комплементарной последовательности оснований, которая не была модифицирована, или на основе информации о сестринской хроматиде. Наиболее распространенным типом HDR является гомологичная рекомбинация (HR). HDR представляет собой метод репарации, обычно происходящий в фазе S или G2/M активно делящихся клеток.
Для репарации или восстановления поврежденной ДНК посредством HDR, но не с использованием комплементарной последовательности оснований или сестринского хроматина в клетках, в эти клетки вводят матричную ДНК, искусственно синтезированную на основе информации о комплементарной последовательности оснований или гомологичной последовательности оснований, то есть матричной нуклеиновой кислоты, включающей комплементарную последовательность оснований или гомологичную последовательность оснований, что будет приводить к репарации ДНК с разрывом. В данном описании, при последующем введении последовательности нуклеиновой кислоты или фрагмента нуклеиновой кислоты в матричную нуклеиновую кислоту для репарации ДНК с разрывом, такая последовательность нуклеиновой кислоты или фрагмент нуклеиновой кислоты, дополнительно введенные в ДНК с разрывом, могут подвергаться нокину. Такая дополнительно добавленная последовательность нуклеиновой кислоты или фрагмента нуклеиновой кислоты могут представлять собой, но не ограничиваются ими, последовательность нуклеиновой кислоты или фрагмент нуклеиновой кислоты для коррекции гена-мишени или нуклеиновой кислоты-мишени, модифицированных путем мутации, вводимой в нормальный ген или в нормальную нуклеиновую кислоту или в ген или в нуклеиновую кислоту, экспрессируемые в клетках.
В одном примере, двойная или одиночная цепь гена-мишени или нуклеиновой кислоты-мишени могут быть расщеплены под действием комплекса CRISPR, а затем в клетки может быть введена матричная нуклеиновая кислота, включающая последовательность оснований, комплементарную последовательности оснований, смежной с сайтом расщепления, и такая расщепленная последовательность оснований гена-мишени или нуклеиновой кислоты-мишени может быть подвергнута репарации или восстановлению посредством HDR.
В данном описании, матричная нуклеиновая кислота, включающая комплементарную последовательность оснований, может иметь ДНК с разрывом, то есть, расщепленную двойную или одиночную цепь комплементарной последовательности оснований, а также последовательность нуклеиновой кислоты или фрагмент нуклеиновой кислоты, встроенные в ДНК с разрывом. Дополнительная последовательность нуклеиновой кислоты или фрагмент нуклеиновой кислоты могут быть встроены в сайт расщепления ДНК с разрывом, то есть, в ген-мишень или в нуклеиновую кислоту-мишень с использованием матричной нуклеиновой кислоты, включающей последовательность нуклеиновой кислоты или фрагмент нуклеиновой кислоты, встроенные в комплементарную последовательность оснований. В данном случае встраивают последовательность нуклеиновой кислоты или фрагмент нуклеиновой кислоты, и дополнительной последовательностью нуклеиновой кислоты или фрагментом нуклеиновой кислоты могут быть последовательность нуклеиновой кислоты или фрагмент нуклеиновой кислоты, предназначенные для коррекции гена-мишени или нуклеиновой кислоты-мишени, модифицированных посредством мутации нормального гена или нормальной нуклеиновой кислоты или гена или нуклеиновой кислоты, экспрессирующихся в клетках. Комплементарная последовательность оснований может представлять собой последовательность оснований, имеющую комплементарные связи с ДНК с разрывом, то есть правые и левые последовательности оснований в расщепленной двойной или в одиночной цепи гена-мишени или нуклеиновой кислоты-мишени. Альтернативно, комплементарная последовательность оснований может представлять собой последовательность оснований, имеющую комплементарные связи с ДНК с разрывом, то есть, у 3'- и 5'-концов расщепленной двойной или одиночной цепи гена-мишени или нуклеиновой кислоты-мишени. Комплементарная последовательность оснований может представлять собой последовательность из 15-3000 оснований, где длина или размер комплементарной последовательности оснований могут быть соответствующим образом скорректированы в зависимости от размера матричной нуклеиновой кислоты или гена-мишени. В данном описании, в качестве матричной нуклеиновой кислоты может быть использована двухцепочечная или одноцепочечная нуклеиновая кислота, либо такая нуклеиновая кислота может быть линейной или кольцевой, однако, настоящее изобретение не ограничивается ими.
В другом примере, двухцепочечный или одноцепочечный ген-мишень или нуклеиновую кислоту-мишени расщепляют под действием комплекса CRISPR, а затем в клетки вводят матричную нуклеиновую кислоту, включающую гомологичную последовательность оснований, содержащую последовательность оснований, смежную с сайтом расщепления, и такая расщепленная последовательность оснований гена-мишени или нуклеиновой кислоты-мишени может быть подвергнута репарации или восстановлению посредством HDR.
В данном описании, матричная нуклеиновая кислота, включающая гомологичную последовательность оснований, может представлять собой ДНК с разрывом, то есть двухцепочечную или одноцепочечную гомологичную последовательность оснований, а также последовательность нуклеиновой кислоты или фрагмент нуклеиновой кислоты, встроенные в ДНК с разрывом. Дополнительная последовательность нуклеиновой кислоты или фрагмент нуклеиновой кислоты могут быть встроены в ДНК с разрывом, то есть, в сайт расщепления гена-мишени или нуклеиновой кислоты-мишени с использованием матричной нуклеиновой кислоты, включающей гомологичную последовательность оснований и встроенную последовательность нуклеиновой кислоты или фрагмент нуклеиновой кислоты. В данном случае встраивают последовательность нуклеиновой кислоты или фрагмент нуклеиновой кислоты, и дополнительной последовательностью нуклеиновой кислоты или фрагментом нуклеиновой кислоты могут быть последовательность нуклеиновой кислоты или фрагмент нуклеиновой кислоты, предназначенные для коррекции гена-мишени или нуклеиновой кислоты-мишени, модифицированных посредством мутации нормального гена или нормальной нуклеиновой кислоты или гена или нуклеиновой кислоты, экспрессирующихся в клетках. Гомологичная последовательность оснований может представлять собой ДНК с разрывом оснований, то есть последовательность оснований, гомологичную расщепленной двухцепочечной последовательности оснований или правой и левой одноцепочечной последовательности оснований в гене-мишени или в нуклеиновой кислоте-мишени. Альтернативно, комплементарная последовательность оснований может представлять собой последовательность оснований, гомологичную ДНК с разрывом, то есть у 3'- и 5'-концов расщепленной двойной или одиночной цепи гена-мишени или нуклеиновой кислоты-мишени. Гомологичная последовательность оснований может представлять собой последовательность из 15-3000 оснований, где длина или размер гомологичной последовательности оснований могут быть подходящим образом скорректированы в зависимости от размера матричной нуклеиновой кислоты или гена-мишени или нуклеиновой кислоты-мишени. В данном описании, в качестве матричной нуклеиновой кислоты может быть использована двухцепочечная или одноцепочечная нуклеиновая кислота, либо такая нуклеиновая кислота может быть линейной или кольцевой, однако, настоящее изобретение не ограничивается ими.
Помимо NHEJ и HDR, могут быть использованы и другие методы репарации или восстановления ДНК с разрывом.
Отжиг одноцепочечной нуклеиновой кислоты (SSA)
SSA представляет собой метод репарации разрывов двойной цепи между двумя повторяющимися последовательностями, присутствующими в нуклеиновой кислоте-мишени, и обычно, в этом методе используется повторяющаяся последовательность из более чем 30 оснований. Повторяющуюся последовательность расщепляют (с образованием липких концов) с получением одной цепи, соответствующей двухцепочечной нуклеиновой кислоте-мишени у каждого разорванного конца, и после расщепления, одноцепочечный выступающий конец, содержащий повторяющуюся последовательность, достраивают белком RPA в целях предотвращения несоответствующего отжига повторяющихся последовательность друг с другом. RAD52 связывается с каждой повторяющейся последовательностью на выступающем конце, в результате чего происходит сборка последовательности, способной гибридизоваться с комплементарной повторяющейся последовательностью. После отжига, одноцепочечный выступающий фрагмент отщепляют, и посредством синтеза новой ДНК заполняют определенный гэп для восстановления двухцепочечной ДНК. В результате этой репарации, последовательность ДНК между двумя повторами делетируется, а длина делеции может зависеть от различных факторов, включая участки локализации двух используемых здесь повторов и путь или степень расщепления.
В SSA, аналогично HDR, используется комплементарная последовательность, которая представляет собой комплементарную повторяющуюся последовательность, но в отличие от HDR, в данном описании, для модификации или коррекции последовательности нуклеиновой кислоты-мишени не требуется матричной нуклеиновой кислоты.
Репарация одноцепочечного разрыва (SSBR)
Одноцепочечные разрывы в геноме подвергают репарации по отдельному механизму, SSBR, исходя из вышеописанных механизмов репарации. В случае одноцепочечных ДНК-разрывов, PARP1 и/или PARP2 распознают разрывы и инициируют механизмы репарации. Связывание PARP1 и его активность по отношению к ДНК-разрывам являются временными, а SSBR стимулируется посредством индуцирования стабильности белкового комплекса SSBR в поврежденных областях. Наиболее важным белком в комплексе SSBR является XRCC1, который взаимодействует с белком, стимулирующим процессинг ДНК у 3'- и 5'-концов для стабилизации ДНК. Процессинг по концам обычно приводит к репарации поврежденного 3'-конца с образованием гидроксилированной группы и/или поврежденного 5'-конца с образованием фосфатной группы, и после процессинга этих концов происходит достраивание гэпа ДНК. Существует два метода достраивания гэпа ДНК, то есть, репарация коротких пэтчей и репарация длинных пэтчей, а репарация коротких пэтчей включает инсерцию одного основания. После достраивания гэпа ДНК, ДНК-лигаза стимулирует соединение концов.
Репарация ошибочных спариваний (MMR)
MMR осуществляется на ошибочно спаренных основаниях ДНК. Каждый из комплексов MSH2/6 или MSH2/3 обладает ATФазной активностью, и таким образом, играет важную роль в распознавании ошибочного спаривания и в инициации репарации, где MSH2/6 распознает, главным образом, ошибочные спаривания оснований и идентифицирует одно или два ошибочных спариваний оснований, а MSH2/3 распознает, главным образом, большее число ошибочных спариваний.
Репарация вырезания оснований (BER)
BER представляет собой механизм репарации, который является активным на протяжении всего клеточного цикла и применяется для удаления из генома небольшой поврежденной области оснований, не дестабилизирующих спираль. В поврежденной ДНК, поврежденные основания удаляют путем расщепления N-гликозидной связи, соединяющей основание с остовом «фосфат-дезоксирибоза», с последующим расщеплением фосфодиэфирного остова и генерированием разрывов в одноцепочечной ДНК. Разорванные одноцепочечные концы, продуцированные таким образом, удаляют, а затем гэп, генерируемый посредством удаления одной цепи, достраивают новым комплементарным основанием, и конец только что достроенного комплементарного основания лигируют с остовом под действием ДНК-лигазы, что способствует репарации поврежденной ДНК.
Репарация вырезания нуклеотидов (NER)
NER представляет собой механизм вырезания, играющий важную роль в удалении из ДНК крупного повреждения, разрушающего спираль, и при распознавании такого повреждения, короткий сегмент одноцепочечной ДНК, содержащий поврежденную область, удаляют с образованием одноцепочечного гэпа в 22-30 оснований. Образовавшийся гэп достраивают новым комплементарным основанием, и конец только что достроенного комплементарного основания лигируют с остовом под действием ДНК-лигазы, что способствует репарации поврежденной ДНК.
Эффекты модификации генов
Модификация или коррекция гена-мишени или нуклеиновой кислоты-мишени может давать, главным образом, эффекты нокаута, нокдауна и нокина.
Нокаут
Термин «нокаут» означает инактивацию гена-мишени или нуклеиновой кислоты-мишени, а «инактивация» гена-мишени или нуклеиновой кислоты-мишени означает состояние, при котором не происходит транскрипции и/или трансляции гена-мишени или нуклеиновой кислоты-мишени. Транскрипция и трансляция гена, вызывающего заболевание, или гена, имеющего аномальную функцию, могут быть ингибированы посредством нокаута, что позволяет предотвратить экспрессию белка.
Так, например, при редактировании или коррекции гена-мишени или нуклеиновой кислоты-мишени с использованием комплекса «рРНК- фермент CRISPR», то есть, комплекса CRISPR, ген-мишень или нуклеиновая кислота-мишень могут быть расщеплены с использованием комплекса CRISPR. Поврежденные ген-мишень или нуклеиновая кислота-мишень могут быть подвергнуты репарации посредством NHEJ с использованием комплекса CRISPR. Поврежденные ген-мишень или нуклеиновая кислота-мишень могут иметь инсерции-делеции, вызываемые NHEJ, и тем самым может быть индуцирован специфический нокаут гена-мишени или нуклеиновой кислоты-мишени.
Нокдаун
Термин «нокдаун» означает снижение уровня транскрипции и/или трансляции гена-мишени или нуклеиновой кислоты-мишени или экспрессии белка-мишени. Начало развития заболевания может быть предотвращено, либо заболевание может быть подвергнуто лечению посредством регуляции сверхэкспрессии гена или белка посредством нокдауна.
Так, например, при редактировании или коррекции гена-мишени или нуклеиновой кислоты-мишени с использованием неактивного комплекса рРНК-CRISPR, содержащего домен, обладающий активностью ингибирования транскрипции фермента, то есть, неактивного комплекса рРНК-CRISPR, включающего домен, обладающий активностью ингибирования транскрипции, неактивный комплекс CRISPR может специфически связываться с геном-мишенью или нуклеиновой кислотой-мишенью, а транскрипция гена-мишени или нуклеиновой кислоты-мишени может ингибироваться посредством домена, обладающего активностью ингибирования транскрипции и включенного в неактивный комплекс CRISPR, что будет приводить к индуцированию нокдауна, при котором будет ингибироваться экспрессия соответствующего гена или нуклеиновой кислоты.
Нокин
Термин «нокин» означает инсерцию специфической нуклеиновой кислоты или специфического гена в ген-мишень или нуклеиновую кислоту-мишень, и в данном описании, термин «специфическая нуклеиновая кислота» означает встроенные или экспрессированные представляющие интерес ген или нуклеиновая кислота. Нокин может быть использован для лечения заболеваний посредством точной коррекции мутантного гена, вызывающего заболевание, или индуцирования экспрессии нормального гена путем встраивания нормального гена.
Кроме того, для нокина может также потребоваться дополнительный донор.
Так, например, при редактировании или коррекции гена-мишени или нуклеиновой кислоты-мишени с использованием комплекса «рРНК-фермент CRISPR» (то есть, комплекса CRISPR), ген-мишень или нуклеиновая кислота-мишень могут быть расщеплены с использованием комплекса CRISPR. Поврежденные ген-мишень или нуклеиновая кислота-мишень могут быть репарированы посредством HDR с использованием комплекса CRISPR. В частности, специфическая нуклеиновая кислота может быть встроена в поврежденный ген или в поврежденную нуклеиновую кислоту с использованием донора.
Термин «донор» означает последовательность нуклеиновой кислоты, которая способствует репарации поврежденного гена или поврежденной нуклеиновой кислоты на основе HDR, и в данном описании, донор может включать специфическую нуклеиновую кислоту.
Донором может быть двухцепочечная или одноцепочечная нуклеиновая кислота.
Донор может присутствовать в линейной или в кольцевой форме.
Донор может включать последовательность нуклеиновой кислоты, гомологичную гену-мишени или нуклеиновой кислоте-мишени.
Так, например, донор может включать последовательность нуклеиновой кислоты, гомологичную каждой последовательности оснований в положении, в котором была встроена специфическая нуклеиновая кислота (например, выше и ниже от поврежденной нуклеиновой кислоты), соответственно. В частности, встроенная специфическиая нуклеиновая кислота может быть локализована между последовательностью нуклеиновой кислоты, гомологичной расположенной ниже поврежденной нуклеиновой кислоты, и последовательностью нуклеиновой кислоты, гомологичной вышерасположенной последовательности поврежденной нуклеиновой кислоты. В частности, такая последовательность нуклеиновой кислоты может быть гомологичной по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% или более или полностью гомологичной.
Донор может включать, но необязательно, дополнительную последовательность нуклеиновой кислоты. В частности, дополнительная последовательность нуклеиновой кислоты может играть определенную роль в повышения стабильности донора, эффективности нокина или эффективности HDR донора.
Так, например, дополнительная последовательность нуклеиновой кислоты может представлять собой последовательность нуклеиновой кислоты, богатую основаниями А и Т (то есть A-T-богатый домен). Альтернативно, дополнительная последовательность нуклеиновой кислоты может представлять собой область присоединения каркаса/матрицы (S/MAR).
5. Другие дополнительные компоненты
Дополнительный компонент может быть селективно добавлен для повышения эффективности комплекса «гидовая нуклеиновая кислота - белок-редактор» или для повышения эффективности репарации поврежденного гена или поврежденной нуклеиновой кислоты.
Дополнительный компонент может быть селективно использован для повышения эффективности комплекса «гидовая нуклеиновая кислота - белок-редактор».
Активатор
Дополнительный компонент может быть использован в качестве активатора для повышения эффективности расщепления нуклеиновой кислоты-мишени, гена-мишени или хромосомы-мишени комплекса «гидовая нуклеиновая кислота - белок-редактор».
Термин «активатор» означает нуклеиновую кислоту, служащую для стабилизации связи между комплексом «гидовая нуклеиновая кислота - белок-редактор» и нуклеиновой кислотой-, геном- или хромосомой-мишенью, или для облегчения доставки комплекса «гидовая нуклеиновая кислота - белок-редактор» в нуклеиновую кислоту-, ген- или хромосому-мишень.
Активатором может быть двухцепочечная нуклеиновая кислота или одноцепочечная нуклеиновая кислота.
Активатор может быть линейным или кольцевым.
Активатор может быть подразделен на активатор-«хелпер», который стабилизирует связывание между комплексом «гидовая нуклеиновая кислота - белок-редактор» и нуклеиновой кислотой-мишенью, геном-мишенью или хромосомой-мишенью, и активатор-«шаперон», который служит для облегчения доставки комплекса «гидовая нуклеиновая кислота - белок-редактор» в нуклеиновую кислоту-мишень, ген-мишень или хромосому-мишень.
Хелпер может повышать эффективность расщепления комплекса «гидовая нуклеиновая кислота - белок-редактор» по отношению к нуклеиновой кислоте-мишени, гену-мишени или хромосоме-мишени.
Так, например, хелпер включает последовательность нуклеиновой кислоты, гомологичную нуклеиновой кислоте-мишени, гену-мишени или хромосоме-мишени. Поэтому, если комплекс «гидовая нуклеиновая кислота - белок-редактор» связан с нуклеиновой кислотой-мишенью, геном-мишенью или хромосомой-мишенью, то гомологичная последовательность нуклеиновой кислоты, включенная в этот хелпер, может образовывать дополнительную комплементарную связь с нуклеиновой кислотой-мишенью, геном-мишенью или хромосомой-мишенью, что будет приводить к стабилизации связи между комплексом «гидовая нуклеиновая кислота - белок-редактор» и нуклеиновой кислотой-мишенью, геном-мишенью или хромосомой-мишенью.
Шаперон может повышать эффективность расщепления комплекса «гидовая нуклеиновая кислота - белок-редактор» по отношению к нуклеиновой кислоте-мишени, гену-мишени или хромосоме-мишени.
Так, например, шаперон включает последовательность нуклеиновой кислоты, гомологичную нуклеиновой кислоте-мишени, гену-мишени или хромосоме-мишени. В данном описании, гомологичная последовательность нуклеиновой кислоты, включенная в шаперон, может частично образовывать комплементарную связь с гидовой нуклеиновой кислотой комплекса «гидовая нуклеиновая кислота - белок-редактор». Следовательно, шаперон, частично образующий комплементарную связь с комплексом «гидовая нуклеиновая кислота - белок-редактор», может частично образовывать комплементарную связь с нуклеиновой кислотой-мишенью, геном-мишенью или хромосомой-мишенью, что в результате будет обеспечивать более точную доставку комплекса «гидовая нуклеиновая кислота - белок-редактор» в положение нуклеиновой кислоты-мишени, гена-мишени или хромосомы-мишени.
Гомологичная последовательность нуклеиновой кислоты может иметь гомологию по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% или более или полную гомологию.
Кроме того, дополнительный компонент может быть селективно использован для повышения эффективности репарации поврежденного гена или поврежденной нуклеиновой кислоты.
Адъювант
Дополнительный компонент может быть использован в качестве адъюванта для повышения эффективности репарации поврежденного гена или поврежденной нуклеиновой кислоты.
Термин «адъювант» означает нуклеиновую кислоту, которая участвует в процессе репарации или повышает эффективность репарации поврежденного гена или поврежденной нуклеиновой кислоты, например, гена или нуклеиновой кислоты, расщепленных под действием комплекса «гидовая нуклеиновая кислота - белок-редактор».
Адъювант может представлять собой двухцепочечную нуклеиновую кислоту или одноцепочечную нуклеиновую кислоту.
Адъювант может присутствовать в линейной или кольцевой форме.
Адъювант может быть подразделен на «адъювант NHEJ», который участвует в процессе репарации посредством NHEJ или повышает эффективность репарации, и «адъювант HDR», который участвует в процессе репарации посредством HDR или повышает эффективность репарации по соответствующему механизму репарации.
Адъювант NHEJ может участвовать в процессе репарации или повышать эффективность репарации поврежденного гена или поврежденной нуклеиновой кислоты посредством NHEJ.
Так, например, адъювант NHEJ может включать последовательность нуклеиновой кислоты, гомологичную части поврежденной последовательности нуклеиновой кислоты. В данном описании, гомологичная последовательность нуклеиновой кислоты может включать последовательность нуклеиновой кислоты, гомологичную последовательности нуклеиновой кислоты, у одного конца (например, у 3'-конца) поврежденной последовательности нуклеиновой кислоты, и последовательность нуклеиновой кислоты, гомологичную последовательности нуклеиновой кислоты, у другого конца (например, у 5'-конца) поврежденной последовательности нуклеиновой кислоты. Кроме того, может быть включена последовательность нуклеиновой кислоты, гомологичная каждой последовательности оснований, расположенной выше и ниже поврежденной последовательности нуклеиновой кислоты. Последовательность нуклеиновой кислоты, имеющая такую гомологию, может способствовать помещению двух частей поврежденной последовательности нуклеиновой кислоты в непосредственной близости друг к другу, что будет способствовать повышению эффективности репарации поврежденной последовательности нуклеиновой кислоты посредством NHEJ.
Адъювант HDR может участвовать в процессе репарации или повышать эффективность репарации поврежденного гена или поврежденной нуклеиновой кислоты посредством HDR.
Так, например, адъювант HDR может включать последовательность нуклеиновой кислоты, гомологичную части поврежденной последовательности нуклеиновой кислоты. В данном описании, гомологичная последовательность нуклеиновой кислоты может включать последовательность нуклеиновой кислоты, гомологичную последовательности нуклеиновой кислоты, у одного конца (например, у 3'-конца) поврежденной последовательности нуклеиновой кислоты, и последовательность нуклеиновой кислоты, гомологичную последовательности нуклеиновой кислоты, у другого конца (например, у 5'-конца) поврежденной последовательности нуклеиновой кислоты. Альтернативно, может быть включена последовательность нуклеиновой кислоты, гомологичная каждой последовательности оснований, расположенной выше и ниже поврежденной последовательности нуклеиновой кислоты. Последовательность нуклеиновой кислоты, имеющая такую гомологию, может служить в качестве матрицы поврежденной последовательности нуклеиновой кислоты для повышения эффективности репарации поврежденной последовательности нуклеиновой кислоты посредством HDR.
В другом примере, адъювант HDR может включать последовательность нуклеиновой кислоты, гомологичную части поврежденной последовательности нуклеиновой кислоты и специфической нуклеиновой кислоты, например, встроенной нуклеиновой кислоты или встроенного гена. В данном описании, гомологичная последовательность нуклеиновой кислоты может включать последовательность нуклеиновой кислоты, гомологичную каждой последовательности оснований, расположенной выше и ниже поврежденной последовательности нуклеиновой кислоты. Специфическая нуклеиновая кислота может быть расположена между последовательностью нуклеиновой кислоты, гомологичной последовательности оснований, расположенной ниже поврежденной последовательности нуклеиновой кислоты, и последовательностью нуклеиновой кислоты, гомологичной последовательности оснований, расположенной выше поврежденной последовательности нуклеиновой кислоты. Последовательность нуклеиновой кислоты, имеющая такую гомологию, и специфическая нуклеиновая кислота могут служить в качестве донора для инсерции специфической нуклеиновой кислоты в поврежденную нуклеиновую кислоту, что будет приводить к повышению эффективности нокина посредством HDR.
Гомологичная последовательность нуклеиновой кислоты может иметь гомологию по меньшей мере на 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95% или более или полную гомологию.
6. Индивидуум
Термин «индивидуум» означает организм, в который вводят гидовую нуклеиновую кислоту, белок-редактор или комплекс «гидовая нуклеиновая кислота - белок-редактор»; организм, в котором функционируют гидовая нуклеиновая кислота, белок-редактор или комплекс «гидовая нуклеиновая кислота - белок-редактор», или образец или пробу, взятые у этого организма.
Индивидуумом может быть организм, включающий нуклеиновую кислоту-мишень, ген-мишень, хромосому-мишень или белок-мишень комплекса «гидовая нуклеиновая кислота - белок-редактор».
Организмом могут быть клетки, ткань, растение, животное или человек.
Клетками могут быть прокариотические клетки или эукариотические клетки.
Эукариотическими клетками согласно изобретению могут быть, но не ограничиваются ими, клетки растений, клетки животных или человеческие клетки.
Тканями могут быть ткани животного или человека, такие как ткань кожи, печени, почек, сердца, легких, головного мозга или мышцы.
«Организмом» может быть образец или проба, включающие нуклеиновую кислоту-мишень, ген-мишень, хромосому-мишень или белок-мишень комплекса «гидовая нуклеиновая кислота - белок-редактор».
Образец или проба могут быть взяты у организма, включающего нуклеиновую кислоту-мишень, ген-мишень, хромосому-мишень или белок-мишень, и могут представлять собой слюну, кровь, ткань кожи, раковые клетки или стволовые клетки.
В одном из вариантов осуществления изобретения, индивидуумы согласно изобретению, содержащие ген-мишень или нуклеиновую кислоту-мишень комплекса «гидовая нуклеиновая кислота - белок-редактор», описаны ниже.
Так, например, ген PD-1, ген CTLA-4, ген TNFAIP3, ген DGKA, ген DGKZ, ген Fas, ген EGR2, ген PPP2R2D, ген PSGL-1, ген KDM6A и/или ген TET2 могут быть генами-мишенями.
В одном из вариантов осуществления изобретения, последовательностью-мишенью каждого из вышеописанных генов могут быть одна или более последовательностей, выбранных из последовательностей, описанных в таблице 1, за исключением последовательности PAM (где T заменен на U). Эта последовательность-мишень может служить в качестве основы для конструирования гидовой нуклеиновой кислоты.
То есть, нуклеотидная последовательность области последовательности-мишени для каждого гена и соответствующая область последовательности-мишени гидовой РНК (области последовательности-мишени гидовой РНК и области последовательности-мишени гидовой РНК, имеющей нуклеотидную последовательность, которая может гибридизоваться с областью последовательности-мишени), систематизированы выше в Таблице 1 (области последовательности-мишени, представленные в Таблице 1, описаны в тех случаях, когда последовательность PAM (5'-NGG-3') включена у 3'-конца).
Эти области последовательности-мишени характеризуются тем, что они не имеют каких-либо областей ошибочного спаривания 0 п.о. - 2 п.о. в геноме гена, за исключением последовательности-мишени, и дают несущественный нежелательный эффект и высокоэффективную коррекцию гена.
Последовательность-мишень, подвергаемая таргетингу, может быть одновременно двух или более видов.
Ген, подвергаемый таргетингу, может быть одновременно двух или более видов.
Две или более последовательностей-мишеней в гомологичном гене или две или более последовательностей-мишеней в гетерологичном гене могут быть таргетированы одновременно.
Некодирующая или кодирующая область гена (например, промоторная область, энхансер, 3'UTR и/или последовательность сигнала полиаденилирования или последовательность транскрипции (например, последовательность интрона или экзона)) могут быть таргетированы.
Свыше 50% кодирующих областей генов могут быть таргетированы.
В репрезентативном варианте осуществления изобретения, DGKa или DGKz могут быть таргетированы соответственно.
В репрезентативном варианте осуществления изобретения, DGKa и DGKz могут быть таргетированы одновременно.
В одном из вариантов осуществления изобретения, для искусственной модификации каждого гена использовали последовательности гидовой нуклеиновой кислоты, соответствующие последовательностям-мишеням SEQ ID NN: 1-289.
В одном из вариантов осуществления изобретения, для искусственной модификации каждого гена использовали белки-редакторы (например, белки, образующие комплекс), которые взаимодействуют с последовательностями гидовой нуклеиновой кислоты, соответствующими последовательностям-мишеням SEQ ID NN: 1-289.
В одном из своих вариантов, настоящее изобретение относится к продукту модификации нуклеиновой кислоты каждого гена, которую искусственно осуществляют в областях последовательностей-мишеней SEQ ID NN: 1-289, и к продукту их экспрессии.
В одном из вариантов осуществления изобретения, для искусственной модификации каждого гена использовали комплексы последовательностей гидовых нуклеиновых кислот, соответствующих одной или более последовательностям-мишеням:
SEQ ID NN: 6 и 11 (A20),
SEQ ID NN: 19, 20, 21 и 23 (DGKα)
SEQ ID NO: 25 (EGR2)
SEQ ID NO: 64 (PPP2R2D)
SEQ ID NN: 87 и 89 (PD-1)
SEQ ID NN: 109, 110, 111, 112 и 113 (Dgkζ)
SEQ ID NN: 126, 128 и 129 (Tet-2)
SEQ ID NO: 182 (PSGL-1)
SEQ ID NN: 252, 254, 257 и 264 (FAS); и
SEQ ID NO: 285 (KDM6A),
и белки-редакторы, взаимодействующие с ними.
В одном из своих вариантов, настоящее изобретение относится к продукту модификации нуклеиновой кислоты каждого гена, которую осуществляют в областях последовательностей-мишеней SEQ ID NO: 6 и 11 (A20), SEQ ID NO: 19, 20, 21, и 23 (DGKa), SEQ ID NO: 25 (EGR2), SEQ ID NO: 64 (PPP2R2D), SEQ ID NO: 87 и 89 (PD-1), SEQ ID NO: 109, 110, 111, 112 и 113 (Dgkζ), SEQ ID NO: 126, 128 и 129 (Tet-2), SEQ ID NO: 182 (PSGL-1), SEQ ID NO: 252, 254, 257 и 264 (FAS), и SEQ ID NO: 285 (KDM6A), и к их продукту экспрессии.
7. Доставка
Гидовая нуклеиновая кислота, белок-редактор или комплекс «гидовая нуклеиновая кислота - белок-редактор» могут быть доставлены или введены индивидууму различными методами доставки в различных формах.
Гидовая нуклеиновая кислота может быть доставлена или введена индивидууму в форме ДНК, РНК или их смеси.
Белок-редактор может быть доставлен или введен индивидууму в форме ДНК, РНК или смеси ДНК/РНК, которые кодируют белок-редактор, или в форме пептида, полипептида или белка, содержащего такой белок-редактор.
Комплекс «гидовая нуклеиновая кислота - белок-редактор» может быть доставлен или введен в мишень в форме ДНК, РНК или их смеси, которые кодируют каждый компонент, то есть, гидовую нуклеиновую кислоту или белок-редактор.
Комплекс «гидовая нуклеиновая кислота - белок-редактор» может быть доставлен или введен индивидууму в виде комплекса гидовой нуклеиновая кислоты, имеющей форму ДНК, РНК или их смеси, и белка-редктора, имеющего форму пептида, полипептида или белка.
Кроме того, дополнительный компонент, способный повышать или ингибировать эффективность комплекса «гидовая нуклеиновая кислота - белок-редактор», может быть доставлен или введен индивидууму различными методами доставки и в различных формах.
i) Доставка в форме ДНК, РНК или их смеси
Форма ДНК, РНК или их смесь, которые кодируют гидовую нуклеиновую кислоту и/или белок-редактор, могут быть доставлены или введены индивидууму известным методом.
Или, форма ДНК, РНК или их смесь, которые кодируют гидовую нуклеиновую кислоту и/или белок-редактор, могут быть доставлены или введены индивидууму посредством вектора, не-векторного соединения или их комбинации.
Вектором может быть вирусный или невирусный вектор (например, плазмида).
Не-векторным соединением может быть «оголенная» ДНК, ДНК-комплекс или мРНК.
Введение на основе вектора
Последовательность нуклеиновой кислоты, кодирующая гидовую нуклеиновую кислоту и/или белок-редактор, может быть доставлена или введена индивидууму посредством вектора.
Вектор может включать последовательность нуклеиновой кислоты, кодирующую гидовую нуклеиновую кислоту и/или белок-редактор.
Так, например, вектор может одновременно включать последовательности нуклеиновой кислоты, кодирующие гидовую нуклеиновую кислоту и белок-редактор, соответственно.
Так, например, вектор может включать последовательность нуклеиновой кислоты, кодирующую гидовую нуклеиновую кислоту.
Так, например, домены, включенные в гидовую нуклеиновую кислоту, могут содержаться в одном векторе, либо они могут быть разделены, а затем помещены в различные векторы.
Так, например, вектор может включать последовательность нуклеиновой кислоты, кодирующую белок-редактор.
В одном примере, в случае белка-редактора, последовательность нуклеиновой кислоты, кодирующая белок-редактор, может содержаться в одном векторе, либо она может быть разделена, а затем помещена в несколько векторов.
Вектор может включать один или более регуляторных/контрольных компонентов.
В данном описании, регуляторные/контрольные компоненты могут включать промотор, энхансер, интрон, сигнал полиаденилирования, консенсусную последовательность Козака, внутренний сайт связывания с рибосомой (IRES), акцептор сплайсинга и/или последовательность 2A.
Промотором может быть промотор, распознаваемый РНК-полимеразой II.
Промотором может быть промотор, распознаваемый РНК-полимеразой III.
Промотором может быть индуцибельный промотор.
Промотором может быть промотор, специфичный для индивидуума.
Промотором может быть вирусный или невирусный промотор.
В качестве промотора может быть использован подходящий промотор в зависимости от регуляторной области (то есть, последовательности нуклеиновой кислоты, кодирующей гидовую нуклеиновую кислоту или белок-редактор).
Так, например, промотором, подходящим для гидовой нуклеиновой кислоты, может быть промотор H1, EF-1a, тРНК или U6. Так, например, промотором, подходящим для белка-редактора, может быть промотор CMV, EF-1a, EFS, MSCV, PGK или CAG.
Вектором может быть вирусный вектор или рекомбинантный вирусный вектор.
Вирусом может быть ДНК-вирус или РНК-вирус.
В данном описании, ДНК-вирусом может быть вирус на основе двухцепочечной ДНК (дцДНК) или одноцепочечной ДНК (оцДНК).
В данном описании, РНК-вирусом может быть вирус на основе одноцепочечной РНК (оцРНК).
Вирусом может быть ретровирус, лентивирус, аденовирус, аденоассоциированный вирус (AAV), вирус коровьей оспы, поксвирус или вирус простого герпеса, однако, настоящее изобретение не ограничивается ими.
В общих чертах, вирус может инфицировать хозяина (например, клетки), и, тем самым, вводить нуклеиновую кислоту, кодирующую генетическую информацию вируса, хозяину или встраивать нуклеиновую кислоту, кодирующую генетическую информацию, в геном хозяина. Гидовая нуклеиновая кислота и/или белок-редактор могут быть введены индивидууму с использованием вируса, обладающего таким свойством. Гидовая нуклеиновая кислота и/или белок-редактор, вводимые с использованием вируса, могут временно экспрессироваться у индивидуума (например, в клетках). Альтернативно, гидовая нуклеиновая кислота и/или белок-редактор, вводимые с использованием вируса, могут экспрессироваться у индивидуума (например, в клетках) в течение длительного периода времени (например, в течение 1, 2 или 3 недель, 1, 2, 3, 6 или 9 месяцев, 1 года или 2 лет или постоянно).
Упаковывающая емкость вируса может варьироваться по меньшей мере от 2 т.п.о. до 50 т.п.о. в зависимости от типа вируса. В зависимости от такой упаковывающей емкости может быть сконструирован вирусный вектор, включающий гидовую нуклеиновую кислоту или белок-редактор, или вирусный вектор, включающий гидовую нуклеиновую кислоту и белок-редактор. Альтернативно, может быть сконструирован вирусный вектор, включающий гидовую нуклеиновую кислоту, белок-редактор и дополнительные компоненты.
В одном примере, последовательность нуклеиновой кислоты, кодирующая гидовую нуклеиновую кислоту и/или белок-редактор, может быть доставлена или введена посредством рекомбинантного лентивируса.
В другом примере, последовательность нуклеиновой кислоты, кодирующая гидовую нуклеиновую кислоту и/или белок-редактор, может быть доставлена или введена посредством рекомбинантного аденовируса.
В другом примере, последовательность нуклеиновой кислоты, кодирующая гидовую нуклеиновую кислоту и/или белок-редактор, может быть доставлена или введена посредством рекомбинантного AAV.
В другом примере, последовательность нуклеиновой кислоты, кодирующая гидовую нуклеиновую кислоту и/или белок-редактор, может быть доставлена или введена посредством гибридного вируса, например, одного или более гибридных вирусов, перечисленных в настоящей заявке.
Введение на не-векторной основе
Последовательность нуклеиновой кислоты, кодирующая гидовую нуклеиновую кислоту и/или белок-редактор, может быть доставлена или введена индивидууму с использованием не-векторного соединения.
Не-векторное соединение может включать последовательность нуклеиновой кислоты, кодирующую гидовую нуклеиновую кислоту и/или белок-редактор.
Не-векторным соединением может быть «оголенная» ДНК, ДНК-комплекс, мРНК или их смесь.
Не-векторное соединение может быть доставлено или введено индивидууму путем электропорации, бомбардировки частицами, ультразвуковой обработки, магнитографии, спрессовывания или сжатия транзиентных клеток (например, как описано в литературе [Lee, et al., (2012) Nano Lett., 12, 6322-6327]), трансфекции, опосредованной липидом, с использованием дендримера, наночастиц, фосфата кальция, двуокиси кремния, силиката (Ormosil) или их комбинации.
В одном примере, доставка посредством электропорации может быть осуществлена путем смешивания клеток и последовательности нуклеиновой кислоты, кодирующей гидовую нуклеиновую кислоту и/или белок-редактор, в кассете, в камере или в кювете, и подачи в клетки электрического импульса с предварительно заданной длительностью и амплитудой.
В другом примере, не-векторное соединение может быть доставлено с использованием наночастиц. Наночастицами могут быть неорганические наночастицы (например, магнитные наночастицы, двуокись кремния и т.п.) или органические наночастицы (например, липид, покрытый полиэтиленгликолем (ПЭГ) и т.п.). Внешняя поверхность наночастиц может быть конъюгирована с положительно заряженным полимером, который присоединяют путем связывания (например, с полиэтиленимином, полилизином, полисерином и т.п.).
ii) Доставка в форме пептида, полипептида или белка
Белок-редактор в форме пептида, полипептида или белка может быть доставлен или введен индивидууму известным мотодом.
Белок-редактор в форме пептида, полипептида или белка может быть доставлен или введен индивидууму путем электропорации, микроинжекции, спрессовывания или сжатия транзиентных клеток (например, как описано в литературе [Lee, et al., (2012) Nano Lett., 12, 6322-6327]), трансфекции, опосредованной липидом, с использованием наночастиц или липосомы, путем опосредуемой пептидом доставки или их комбинации.
Пептид, полипептид или белок может быть доставлен с использованием последовательности нуклеиновой кислоты, кодирующей гидовую нуклеиновую кислоту.
В одном примере, перенос посредством электропорации может быть осуществлен путем смешивания клеток, в которые вводят белок-редактор, с гидовой нуклеиновой кислотой или без нее, в кассете, в камере или в кювете, и подачи в клетки электрического импульса с предварительно заданной длительностью и амплитудой.
iii) Доставка в форме смеси нуклеиновой кислоты и белка
Гидовая нуклеиновая кислота и белок-редактор могут быть доставлены или введены индивидууму в форме комплекса «гидовая нуклеиновая кислота - белок-редактор».
Так, например, гидовой нуклеиновой кислотой может быть ДНК, РНК или их смесь. Белком-редактором может быть пептид, полипептид или белок.
В одном примере, гидовая нуклеиновая кислота и белок-редактор могут быть доставлены или введены индивидууму в форме комплекса «гидовая нуклеиновая кислота - белок-редактор», содержащего гидовую нуклеиновую кислоту типа РНК и белок-редактор белкового типа, то есть рибонуклеопротеин (RNP).
В настоящем изобретении, вариант осуществления способа доставки гидовой нуклеиновой кислоты и/или белка-редактора индивидууму, а также доставки рРНК, фермента CRISPR или комплекса «рРНК-фермент CRISPR» описаны ниже.
8. Трансформант
Термин «трансформант» означает организм, которому вводят гидовую нуклеиновую кислоту, белок-редактор или комплекс «гидовая нуклеиновая кислота - белок-редактор»; организм, в котором экспрессируются гидовая нуклеиновая кислота, белок-редактор или комплекс «гидовая нуклеиновая кислота - белок-редактор»; или образец или пробу, взятые у этого организма.
Трансформантом может быть организм, которому вводят гидовую нуклеиновую кислоту, белок-редактор или комплекс «гидовая нуклеиновая кислота - белок-редактор» в форме ДНК, РНК или их смеси.
Так, например, трансформантом может быть организм, которому вводят вектор, включающий последовательность нуклеиновой кислоты, кодирующую гидовую нуклеиновую кислоту и/или белок-редактор. В данном описании, вектором может быть невирусный вектор, вирусный вектор или рекомбинантный вирусный вектор.
В другом примере, трансформантом может быть организм, которому вводят последовательность нуклеиновой кислоты, кодирующую гидовую нуклеиновую кислоту и/или белок-редактор в не-векторной форме. В данном описании, не-векторной формой может быть «оголенная» ДНК, ДНК-комплекс, мРНК или их смесь.
Трансформантом может быть организм, которому вводят гидовую нуклеиновую кислоту, белок-редактор и/или комплекс «гидовая нуклеиновая кислота - белок-редактор» в форме пептида, полипептида или белка.
Трансформантом может быть организм, которому вводят гидовую нуклеиновую кислоту, белок-редактор или комплекс «гидовая нуклеиновая кислота - белок-редактор» в форме ДНК, РНК, пептида, полипептида, белка или их смеси.
Так, например, трансформантом может быть организм, которому вводят комплекс «гидовая нуклеиновая кислота - белок-редактор», включающий гидовую нуклеиновую кислоту типа РНК, и белок-редактор белкового типа.
Трансформантом может быть организм, включающий нуклеиновую кислоту-мишень, ген-мишень, хромосому-мишень или белок-мишень комплекса «гидовая нуклеиновая кислота - белок-редактор».
Организмом могут быть клетки, ткань, растение, животное или человек.
Клетками могут быть прокариотические клетки или эукариотические клетки.
Эукариотическими клетками могут быть клетки растений, клетки животных или человеческие клетки, хотя настоящее изобретение не ограничивается ими.
Тканями могут быть ткани животного или человека, такие как ткань кожи, печени, почек, сердца, легких, головного мозга или мышцы.
Трансформантом может быть организм, в который вводят или в котором экспрессируются гидовая нуклеиновая кислота, белок-редактор или комплекс «гидовая нуклеиновая кислота - белок-редактор», или образец или проба, взятые у этого организма.
Образцом или пробой могут быть слюна, кровь, ткань кожи, раковые клетки или стволовые клетки.
Кроме того, в одном из своих вариантов, настоящее изобретение относится к комплексу «гидовая нуклеиновая кислота - белок-редактор», который используют для модификации нуклеиновой кислоты в сайтах-мишенях генов PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и/или TET2.
В частности, могут быть получены молекулы рРНК, содержащие домен, способный образовывать комплементарную связь с сайтом-мишенью гена (например, выделенные или не-природные молекулы рРНК и ДНК, кодирующие эти молекулы). Последовательности молекул рРНК и ДНК, кодирующих эти молекулы, могут быть сконструированы так, чтобы эти последовательности могли образовывать комплементарную связь с последовательностями сайтов-мишеней Таблицы 1.
Кроме того, сайты-мишени молекул рРНК конструируют так, чтобы третий иммунорегуляторный фактор был ассоциирован с изменением положения мишени иммунной клетки (например, с разрывами в двойных цепях или с разрывами в одиночных цепях) или обладал специфической функцией в положении мишени в гене PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и/или TET2.
Кроме того, если две или более рРНК используют для определения локализации двух или более событий расщепления (например, разрывов в двойных цепях или разрывов в одиночных цепях) в нуклеиновой кислоте-мишени, то два или более событий расщепления могут быть достигнуты с использованием одинаковых или различных белков Cas9.
рРНК может, например:
обладать способностью нацеливаться на два или более генов, выбранных из гена PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и/или TET2;
обладать способностью нацеливаться на два или более сайтов в каждом из генов PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и/или TET2;
обладать способностью независимо индуцировать расщепление двойной цепи и/или одиночной цепи гена PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и/или TET2; или
обладать способностью индуцировать инсерцию одного или более экзогенных нуклеотидов в сайт расщепления гена PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и/или TET2 gene.
Кроме того, в другом варианте осуществления изобретения, нуклеиновая кислота, входящая в состав комплекса «гидовая нуклеиновая кислота - белок-редактор», может включать:
(a) последовательность, кодирующую молекулу рРНК, которая включает гидовый домен, комплементарный последовательности сайта-мишени в описанных здесь генах PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A, и/или TET2; и
(b) последовательность, кодирующую белок-редактор.
В частности, в (а) могут присутствовать две или более последовательности, соответствующие сайту-мишени и гомолигичные им последовательности, а в (b) могут быть использованы два или более белков-редакторов.
В одном из вариантов осуществления изобретения, нуклеиновую кислоту конструируют так, чтобы она была нацелена на ферментативно неактивный белок-редактор и была расположена поблизости от положения мишени нокдауна в иммунной клетке, или на гибридный белок (например, гибрид доменов-репрессоров транскрипции) для уменьшения, снижения или ингибирования экспрессии гена PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и/или TET2.
Кроме того, в одном из вариантов осуществления изобретения, модификация генов, экспрессирующихся в иммунной клетке (например, гена PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и/или TET2) под действием комплекса «гидовая нуклеиновая кислота - белок-редактор» может быть опосредована любым механизмом.
Примерами таких механизмов являются, но не ограничиваются ими, присоединение негомологичных концов (NHEJ), присоединение концов, опосредуемое микрогомологией (MMEJ), гомологичная репарация (HDR), отжиг цепи в зависимости от синтеза (SDSA) или пенетрация одной цепи.
Кроме того, очевидно, что все признаки структуры, функции и утилизации описанного выше комплекса «гидовая нуклеиновая кислота - белок-редактор» могут быть использованы для модификации гена PD-1, CTLA-4, TNFAIP3, DGKA, DGKZ, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и/или TET2.
В одном из вариантов осуществления изобретения, фактором иммунной системы, который представляет собой продукт, полученный с использованием «комплекса «гидовая нуклеиновая кислота - белок-редактор», может быть, например, модифицированный ген, продукт, экспрессируемый модифицированным геном, клетка, композиция, трансформант и т.п., содержащие этот ген.
В одном из вариантов осуществления изобретения, фактором иммунной системы являются иммунорегуляторный ген, искусственно модифицированный с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор», или продукт его экспрессии, и клетка, содержащая этот фактор.
В одном из вариантов осуществления изобретения, фактором иммунной системы являются иммунорегуляторный ген, генетически модифицированный с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор», или экспрессируемый им белок, и клетка, содержащая этот фактор.
В одном из вариантов осуществления изобретения, фактором иммунной системы является последовательность нуклеиновой кислоты или аминокислотная последовательность, кодируемая иммунорегуляторным геном, генетически модифицированным с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор».
В одном из вариантов осуществления изобретения, фактором иммунной системы является иммунорегуляторный ген, генетически модифицированный с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор»; белок, экспрессируемый этим геном; клетка, содержащая модифицированный иммунорегуляторный фактор и/или белок; или композиция, содержащая модифицированный иммунорегуляторный фактор, белок и/или клетку.
В одном из вариантов осуществления изобретения, фактором иммунной системы является трансформант, полученный путем введения одного или более компонентов, выбранных из иммунорегуляторного гена, генетически модифицированного с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор»; белка, экспрессируемого этим геном; клетки, содержащей модифицированный иммунорегуляторный фактор и/или белок; или композиции, содержащей модифицированный иммунорегуляторный фактор, белок и/или клетку.
Иммунный фактор, который представляет собой продукт, полученный с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор, может независимо включать два или более таких факторов и может также включать два или более компонентов на фактор.
Так, например:
иммунный фактор может быть получен в форме, одновременно включающей два или более компонентов, выбранных из искусственно модифицированнго иммунорегуляторного гена, белка, экспрессируемого этим геном, и клетки, содержащей эти компоненты;
искусственно сконструированные иммунорегуляторные гены одного, двух или более видов могут быть получены одновременно;
искусственно модифицированные иммунорегуляторные белки одного, двух или более видов могут быть получены одновременно;
искусственно модифицированные иммунные клетки одного, двух или более видов могут быть получены одновременно; и
комбинации двух или более искусственно модифицированных иммунных факторов могут быть получены одновременно.
Предпочтительными примерами факторов иммунной системы, которые представляют собой продукт, полученный с использованием «комплекса «гидовая нуклеиновая кислота - белок-редактор», могут быть факторы, имеющие нижеследующий состав.
В одном из вариантов осуществления изобретения, если иммунорегуляторными фактором является ген, то состав иммунорегуляторного гена, искусственно модифицированного с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор», может включать:
в последовательности мотива, смежного с протоспейсером (PAM), в последовательности нуклеиновой кислоты, включающей иммунорегуляторный ген, или в непрерывной области нуклеотидной последовательности из 1 п.о. - 50 п.о., 1 п.о. - 40 п.о., 1 п.о. - 30 п.о., а предпочтительно, 3 п.о. - 25 п.о., смежной с 5'-концом и/или 3'-концом, одну или более модификаций нуклеиновой кислоты, выбранных из:
делеции или инсерции одного или более нуклеотидов;
замены одним или более нуклеотидами, отличающимися от гена дикого типа; и
инсерции одного или более чужеродных нуклеотидов.
Кроме того, в состав иммунорегуляторного гена, искусственно модифицированного с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор», может входить химическая модификация одного или более нуклеотидов в последовательности нуклеиновой кислоты, составляющей иммунорегуляторный ген.
В частности, термин «чужеродный нуклеотид» означает концепцию, которая включает все нуклеотиды, полученные экзогенно (например, нуклеотиды, происходящие от гетерологичного биоорганизма или искусственно синтезированные нуклеотиды), но не нуклеотиды, входящие в состав иммунорегуляторного гена. Чужеродный нуклеотид включает не только небольшой олигонуклеотид размером 50 п.о. или менее, но также и крупный полинуклеотид (например, размером в несколько сотен, несколько тысяч или несколько десятков тысяч п.о.), экспрессирующий белок со специфической функцией. Такой «чужеродный нуклеотид» может называться донором.
Химическая модификация включает метилирование, ацетилирование, фосфорилирование, убихитинизацию, АДФ-рибозилирование, миристоилирование и гликозилирование, например, замещение некоторых функциональных групп, содержащихся в нуклеотиде, любым одним из атомов, таких как атом водорода, атом фтора, -O-алкильная группа, -O-ацильная группа и аминогруппа, однако, настоящее изобретение не ограничивается ими. Кроме того, для повышения уровня переноса молекулы нуклеиновой кислоты, часть функциональной группы нуклеотида может быть замещена любым из Br, -Cl, -R, -R'OR, -SH, -SR, -N3 и -CN (R=алкил, арил, алкилен). Кроме того, фосфатный остов по меньшей мере одного нуклеотида замещен любой одной из таких групп, как алкилфосфонатная группа, фосфорамидатная группа и боранофосфатная группа. Кроме того, химической модификацией может быть замена по меньшей мере одного нуклеотида, содержащегося в молекуле нуклеиновой кислоты, любой одной из нуклеиновых кислот, таких как блокированная нуклеиновая кислота (LNA), неблокированная нуклеиновая кислота (UNA), морфолино- и пептид-нуклеиновая кислота (PNA), и такой химической модификацией может быть связывание молекулы нуклеиновой кислоты с одним или более соединениями, выбранными из группы, состоящей из липида, пептида, проникающего в клетку, и лиганда, нацеленного на клетку.
Для создания нужной иммунной системы, нуклеиновая кислота, в которую был искусственно введен иммунорегуляторный ген, может быть модифицирована комплексом «гидовая нуклеиновая кислота - белок-редактор».
Сайт, способный формировать нужную иммунную систему, содержащую модификацию нуклеиновой кислоты иммунорегуляторного гена, называется последовательностью-мишенью или сайтом-мишенью.
Термин «последовательность-мишень» может означать мишень для комплекса «гидовая нуклеиновая кислота - белок-редактор» и такой последовательностью-мишенью может быть, но не ограничивается ею, последовательность мотива, смежного с прото-спейсером (PAM), распознаваемую белком-редактором. Последовательность-мишень может быть выбрана специалистом в соответствии с критериями, играющими важную роль в конструировании гидовой нуклеиновой кислоты.
Такая модификация нуклеиновой кислоты включает «расщепление» нуклеиновой кислоты.
Термин «расщепление» в сайте-мишени означает разрыв ковалентной связи остова полинуклеотида. Такое расщепление может включать, но не ограничиваются ими, ферментативный или химический гидролиз фосфодиэфирной связи, и может быть осуществлено другими различными методами. Может быть осуществлено расщепление одной и двойной цепи, а расщепление двойной цепи может быть результатом расщепления двух отдельных одиночных цепей. Расщепление двойных цепей может приводить к образованию тупых концов или ступенчатых концов.
Если используется инактивированный белок-редактор, то могут быть индуцированы факторы, обладающие специфической функцией и расположенные в непосредственной близости от любой части сайта-мишени или иммунорегуляторного гена без расщепления. В зависимости от такой конкретной функции, химическая модификация одного или более нуклеотидов может быть введена в последовательность нуклеиновой кислоты иммунорегуляторного гена.
В одном из вариантов осуществления изобретения, различные инсерции и делеции (INDEL) могут образовываться благодаря активности мишени и не-мишени после расщепления нуклеиновой кислоты под действием комплекса «гидовая нуклеиновая кислота - белок-редактор».
Термин «INDEL» является общим термином, означающим мутацию, при которой некоторые нуклеотиды были встроены в нуклеотидную последовательность ДНК или делетированы из нее.
Как описано выше, если комплекс «гидовая нуклеиновая кислота - белок-редактор» расщепляет нуклеиновую кислоту (ДНК, РНК) иммунорегуляторного гена, то INDEL могут быть введены в последовательность-мишень в процессе репарации по механизму гомологичной рекомбинации или присоединения негомологичных концов (NHEJ).
Термин «искусственно модифицированный иммунорегуляторный ген» согласно изобретению означает ген, в котором последовательность нуклеиновой кислоты исходного гена была модифицирована посредством расщепления, инсерции-делеции нуклеиновой кислоты и инсерции донора и т.п., где такой искусственно модифицированный иммунорегуляторный ген вносит свой вклад в создание нужной иммунной системы (например, обеспечивающей эффект стимуляции или подавления или добавления специфических иммунных функций).
Так, например, экспрессия и активность специфического белка может быть стимулирована посредством искусственно модифицированного иммунорегуляторного гена.
Специфический белок может быть инактивирован посредством искусственно модифицированного иммунорегуляторного гена.
В одном примере, специфические сайты-мишени иммунорегуляторных генов, которые ингибируют иммунный ответ в геноме (например, гена PD-1, CTLA-4, TNFAIP3, DGKA (Dgkα), DGKAZ (Dgkζ), Fas, EGR2, PPP2R2D, PSGL-1 и/или TET2), могут быть расщеплены для нокдауна или нокаута этих генов.
В другом примере, для модификации транскрипции, например, для блокирования, уменьшения или снижения транскрипции гена PD-1, CTLA-4, TNFAIP3, DGKA (Dgkα), DGKAZ (Dgkζ), Fas, EGR2, PPP2R2D, PSGL-1 и/или TET2, целевой нокдаун может быть опосредован путем нацеливания на белок-редактор, который был присоединен к домену-репрессору транскрипции или к модифицированному белку хроматину и является ферментативно неактивным.
Активность иммунных клеток может регулироваться посредством искусственно модифицированного иммунорегуляторного гена. Таким образом может регулироваться пролиферация, выживаемость, цитотоксичность, инфильтрация иммунных клеток, высвобождение цитокинов иммунными клетками и т.п.
Терапевтические эффекты (например, иммунная функция, ротивоопухолевая функция, противовоспалительная функция и т.п.) может быть достигнуты посредством искусственно модифицированного иммунорегуляторного гена.
В зависимости от состава комплекса «гидовая нуклеиновая кислота - белок-редактор», основные последовательности PAM, присутствующие в сайте-мишени иммунорегуляторного гена, могут варьироваться.
Далее, настоящее изобретение будет описано на репрезентативных примерах белков-редакторов и иммунорегуляторных генов, но эти варианты приводятся лишь в иллюстративных целях и не ограничивают объема изобретения.
Так, например, если белком-редактором является белок Cas9, происходящий от Streptococcus pyogenes, то последовательность PAM может представлять собой 5'-NGG-3' (N представляет собой A, T, G или C); а областью расщепляемой нуклеотидной последовательности (сайтом-мишенью) может быть область нуклеотидной последовательности с непрерывными 1 п.о. - 25 п.о. (например, 17 п.о. - 23 п.о. или 21 п.о. - 23 п.о.), смежными с 5'-концом и/или 3'-концом последовательности 5'-NGG-3' в гене-мишени.
Искусственно модифицированные иммунорегуляторные гены (например, искусственно модифицированный ген PD-1, ген CTLA-4, ген TNFAIP3, ген DGKA, ген DGKZ, ген Fas, ген EGR2, ген PPP2R2D, ген PSGL-1, ген KDM6A и ген TET2) могут быть получены в результате модификаций в иммунорегуляторных генах:
a) делеции одного или более нуклеотидов в непрерывной области нуклеотидной последовательности из 1 п.о. - 25 п.о., (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом последовательности 'NGG' (N представляет собой A, T, C или G);
b) замены одного или более нуклеотидов одним или более нуклеотидами, отличающимися от гена дикого типа, в непрерывной области нуклеотидной последовательности из 1 п.о. - 25 п.о., (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом последовательности 'NGG';
c) инсерции одного или более нуклеотидов в непрерывную область нуклеотидной последовательности из 1 п.о. - 25 п.о., (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом последовательности 'NGG'; или
d) комбинации двух или более стадий, выбранных из a)-c).
Так, например, если белком-редактором является белок Cas9, происходящий от Campylobacter jejuni, то последовательность PAM представляет собой 5'-NNNNRYAC-3' (каждый N независимо представляет собой A, T, C или G, R представляет собой A или G, а Y представляет собой C или T), а областью расщепляемой нуклеотидной последовательности (сайтом-мишенью) может быть область нуклеотидной последовательности с непрерывными 1 п.о. - 25 п.о. (например, 17 п.о. - 23 п.о. или 21 п.о. - 23 п.о.), смежными с 5'-концом и/или 3'-концом последовательности 5'-NNNNRYAC-3' в гене-мишени.
Искусственно модифицированный иммунорегуляторные гены (например, искусственно модифицированный ген PD-1, ген CTLA-4, ген TNFAIP3, ген DGKA, ген DGKZ, ген Fas, ген EGR2, ген PPP2R2D, ген PSGL-1, ген KDM6A н ген TET2) могут быть получены в результате модификаций в иммунорегуляторных генах:
a') делеции одного или более нуклеотидов непрерывной области нуклеотидной последовательности из 1 п.о. - 25 п.о. (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом 'NNNNRYAC' (каждый N независимо представляет собой A, T, C или G, R представляет собой A или G, а Y представляет собой C или T),
b') замены одного или более нуклеотидов одним или более нуклеотидами, отличающимися от гена дикого типа, в непрерывной области нуклеотидной последовательности из 1 п.о. - 25 п.о., (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом последовательности 'NNNNRYAC';
c') инсерции одного или более нуклеотидов в непрерывную область нуклеотидной последовательности из 1 п.о. - 25 п.о., (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом последовательности 'NNNNRYAC'; или
d') комбинации двух или более стадий, выбранных из a')-c').
Так, например, если белком-редактором является белок Cas9, происходящий от Streptococcus thermophilus, то последовательность PAM может представлять собой представляет собой 5'-NNAGAAW-3' (каждый N независимо представляет собой A, T, C или G, R представляет собой A или G, а W представляет собой А или T), а областью расщепляемой нуклеотидной последовательности (сайтом-мишенью) может быть область нуклеотидной последовательности с непрерывными 1 п.о. - 25 п.о. (например, 17 п.о. - 23 п.о. или 21 п.о. - 23 п.о.), смежными с 5'-концом и/или 3'-концом последовательности 5'-NNAGAAW-3' в гене-мишени.
Искусственно модифицированные иммунорегуляторные гены (например, искусственно модифицированный ген PD-1, ген CTLA-4, ген TNFAIP3, ген DGKA, ген DGKZ, ген Fas, ген EGR2, ген PPP2R2D, ген PSGL-1, ген KDM6A н ген TET2) могут быть получены в результате модификаций в иммунорегуляторных генах:
a'') делеции одного или более нуклеотидов непрерывной области нуклеотидной последовательности из 1 п.о. - 25 п.о. (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом 'NNAGAAW' (каждый N независимо представляет собой A, T, C или G, а W представляет собой A или T);
b'') замены одного или более нуклеотидов одним или более нуклеотидами, отличающимися от гена дикого типа, в непрерывной области нуклеотидной последовательности из 1 п.о. - 25 п.о., (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом последовательности 'NNAGAAW';
c'') инсерции одного или более нуклеотидов в непрерывную область нуклеотидной последовательности из 1 п.о. - 25 п.о., (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом последовательности 'NNAGAAW'; или
d'') комбинации двух или более стадий, выбранных из a'')-c'').
Так, например, если белком-редактором является белок Cas9, происходящий от Neisseria meningitidis, то последовательность PAM может представлять собой 5'-NNNNGATT-3' (каждый N независимо представляет собой A, T, C или G), а областью расщепляемой нуклеотидной последовательности (сайтом-мишенью) может быть область нуклеотидной последовательности с непрерывными 1 п.о. - 25 п.о. (например, 17 п.о. - 23 п.о. или 21 п.о. - 23 п.о.), смежными с 5'-концом и/или 3'-концом последовательности 5'- NNNNGATT-3' в гене-мишени.
Искусственно модифицированные иммунорегуляторные гены (например, искусственно модифицированный ген PD-1, ген CTLA-4, ген TNFAIP3, ген DGKA, ген DGKZ, ген Fas, ген EGR2, ген PPP2R2D, ген PSGL-1, ген KDM6A н ген TET2) могут быть получены в результате модификаций в иммунорегуляторных генах:
a''') делеции одного или более нуклеотидов непрерывной области нуклеотидной последовательности из 1 п.о. - 25 п.о. (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом 'NNNNGATT' (каждый N независимо представляет собой A, T, C или G);
b''') замены одного или более нуклеотидов одним или более нуклеотидами, отличающимися от гена дикого типа, в непрерывной области нуклеотидной последовательности из 1 п.о. - 25 п.о., (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом последовательности 'NNNNGATT';
c''') инсерции одного или более нуклеотидов в непрерывную область нуклеотидной последовательности из 1 п.о. - 25 п.о., (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом последовательности 'NNNNGATT'; или
d''') комбинации двух или более стадий, выбранных из a''')-c''').
Так, например, если белком-редактором является белок Cas9, происходящий от Streptococcus aureus, то последовательность PAM может представлять собой 5'-NNGRR(T)-3' (каждый N независимо представляет собой A, T, C или G, R представляет собой A или G, а (Т) представляет собой любую последовательность, которая может быть включена, но необязательно), а областью расщепляемой нуклеотидной последовательности (сайтом-мишенью) может быть область нуклеотидной последовательности с непрерывными 1 п.о. - 25 п.о. (например, 17 п.о. - 23 п.о. или 21 п.о. - 23 п.о.), смежными с 5'-концом и/или 3'-концом последовательности 5'- NNGRR(T)-3' в гене-мишени.
Искусственно модифицированные иммунорегуляторные гены (например, искусственно модифицированный ген PD-1, ген CTLA-4, ген TNFAIP3, ген DGKA, ген DGKZ, ген Fas, ген EGR2, ген PPP2R2D, ген PSGL-1, ген KDM6A н ген TET2) могут быть получены в результате модификаций в иммунорегуляторных генах:
a'''') делеции одного или более нуклеотидов непрерывной области нуклеотидной последовательности из 1 п.о. - 25 п.о. (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом 5'-NNGRR(T)-3' (каждый N независимо представляет собой A, T, C или G, R представляет собой A или G, а Y представляет собой C или Т);
b'''') замены одного или более нуклеотидов одним или более нуклеотидами, отличающимися от гена дикого типа, в непрерывной области нуклеотидной последовательности из 1 п.о. - 25 п.о., (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом последовательности 5'-NNGRR(T)-3';
c'''') инсерции одного или более нуклеотидов в непрерывную область нуклеотидной последовательности из 1 п.о. - 25 п.о., (например, 17 п.о. - 23 п.о.), смежной с 5'-концом и/или 3'-концом последовательности 5'-NNGRR(T)-3'; или
d'''') комбинации двух или более стадий, выбранных из a'''')-c'''').
Так, например, если белок Cpf1 используется в качестве белка-редактора, то последовательность PAM может представлять собой 5'-TTN-3' (N представляет собой A, T, C или G); а областью расщепляемой нуклеотидной последовательности (сайтом-мишенью) может быть область нуклеотидной последовательности с непрерывными 10 п.о. - 30 п.о. (например, 15 п.о. - 26 п.о., 17 п.о. - 30 п.о., или 17 п.о. - 26 п.о, смежными с 5'-концом и/или 3'-концом последовательности 5'-TTN-3' в гене-мишени.
Белок Cpf1 может происходить от микроорганизма, такого как Parcubacteria bacterium (GWC2011_GWC2_44_17), Lachnospiraceae bacterium (MC2017), Butyrivibrio proteoclasiicus, Peregrinibacteria bacterium (GW2011_GWA_33_10), Acidaminococcus sp. (BV3L6), Porphyromonas macacae, Lachnospiraceae bacterium (ND2006), Porphyromonas crevioricanis, Prevotella disiens, Moraxella bovoculi (237), Smiihella sp. (SC_KO8D17), Leptospira inadai, Lachnospiraceae bacterium (MA2020), Francisella novicida (U112), Candidatus Methanoplasma termitum, Eubacterium eligens, и т.п.) и, например, бактерии, происходящие от Parcubacteria bacterium (GWC2011_GWC2_44_17), Peregrinibacteria bacterium (GW2011_GWA_33_10), Acidaminococcus sp. (BV3L6), Porphyromonas macacae, Lachnospiraceae bacterium (ND2006), Porphyromonas crevioricanis, Prevotella disiens, Moraxella bovoculi (237), Leptospira inadai, Lachnospiraceae bacterium (MA2020), Francisella novicida (U112), Candidatus Methanoplasma termitum, или Eubacterium eligens, но эти микроорганизмы не ограничиваются ими.
Искусственно модифицированные иммунорегуляторные гены (например, искусственно модифицированный ген PD-1, ген CTLA-4, ген TNFAIP3, ген DGKA, ген DGKZ, ген Fas, ген EGR2, ген PPP2R2D, ген PSGL-1, ген KDM6A н ген TET2) могут быть получены в результате модификаций в иммунорегуляторных генах:
a''''') делеции одного или более нуклеотидов непрерывной области нуклеотидной последовательности из 10 п.о. - 30 п.о. (например, 15 п.о. - 26 п.о.), смежной с 5'-концом и/или 3'-концом 5'-TTN-3' (N представляет собой A, T, C или G);
b''''') замены одного или более нуклеотидов одним или более нуклеотидами, отличающимися от гена дикого типа, в непрерывной области нуклеотидной последовательности из 10 п.о. - 30 п.о. (например, 15 п.о. - 26 п.о.), смежной с 5'-концом и/или 3'-концом последовательности 5'-TTN-3';
c''''') инсерции одного или более нуклеотидов в непрерывную область нуклеотидной последовательности из 10 п.о. - 30 п.о. (например, 15 п.о. - 26 п.о.), смежной с 5'-концом и/или 3'-концом последовательности 5'-TTN-3'; или
d''''') комбинации двух или более стадий, выбранных из a''''')-c''''').
В другом варианте осуществления изобретения, если иммунорегуляторным фактором является белок, то искусственно модифицированный белок может включать все белки, участвующие в новом или модифицированном иммунном ответе, продуцируемом посредством прямого/непрямого действия комплекса «гидовая нуклеиновая кислота - белок-редактор».
Так, например, иммунорегуляторными факторами могут быть, но не ограничиваются ими, белок, экспрессируемый искусственно модифицированным иммунорегуляторным геном посредством комплекса «гидовая нуклеиновая кислота - белок-редактор», или другие белки, экспрессия которых повышается или снижается благодаря активности белка.
Искусственно модифицированный иммунорегуляторный белок может иметь аминокислотный состав и активность, соответствующие аминокислотному составу и активности искусственно модифицированных иммунорегуляторных генов.
В одном из своих вариантов, настоящее изобретение может относиться (i) к искусственно модифицированному белку с измененными экспрессионными свойствами.
Так, например, модификации белка, обладающие одним из нижеследующих свойств, могут быть включены в область нуклеотидной последовательности с непрерывными 1 п.о. - 50 п.о., 1 п.о. - 40 п.о., 1 п.о. - 30 п.о., а предпочтительно, 3 п.о. - 25 п.о. локализованными в последовательности мотива, смежного с протоспейсером (PAM) или смежного с 5'-концом и/или 3'-концом последовательности РАМ в последовательности нуклеиновой кислоты иммунорегуляторного гена, где указанными модификациями являются:
снижение или увеличение уровня экспрессии благодаря делеции или инсерции одного one или более нуклеотидов;
снижение или увеличение уровня экспрессии благодаря замене одним или более нуклеотидами, отличающимися от нуклеотидов гена дикого типа;
снижение или увеличение уровня экспрессии благодаря инсерции одного или более чужеродных нуклеотидов или экспрессии гибридного белка или независимой экспрессии специфического белка; и
снижение или увеличение уровня экспрессии третьего белка благодаря изменению экспрессионных свойств описанных выше белков.
(ii) Настоящее изобретение может относиться к искусственно модифицированному белку с измененными структурными свойствами.
Так, например, модификации белка, обладающие одним из нижеследующих свойств, могут быть включены в область нуклеотидной последовательности с непрерывными 1 п.о. - 50 п.о., 1 п.о. - 40 п.о., 1 п.о. - 30 п.о., а предпочтительно, 3 п.о. - 25 п.о. локализованными в последовательности мотива, смежного с протоспейсером (PAM) или смежного с 5'-концом и/или 3'-концом последовательности РАМ в последовательности нуклеиновой кислоты иммунорегуляторного гена, где указанными модификациями являются:
замены кодонов, замены аминокислот и замены трехмерных структур путем делеции или инсерции одного или более нуклеотидов;
замены кодонов, замены аминокислот и замены трехмерных структур путем замены одним или более нуклеотидами, отличающимися от нуклеотидов гена дикого типа;
замены кодонов, замены аминокислот и замены трехмерных структур путем инсерции одного или более чужеродных нуклеотидов; или гибридной структуры специфическим белком или независимой структурой, в которой специфический белок является отделенным; и
замены кодонов, замены аминокислот и замены трехмерных структур третьего белка под действием белка с измененными структурными свойствами, описанными выше.
(iii) Настоящее изобретение может относиться к искусственно модифицированному белку с измененными иммунными функциями.
Так, например, модификации белка, обладающие одним из нижеследующих свойств, могут быть включены в область нуклеотидной последовательности с непрерывными 1 п.о. - 50 п.о., 1 п.о. - 40 п.о., 1 п.о. - 30 п.о., а предпочтительно, 3 п.о. - 25 п.о. локализованными в последовательности мотива, смежного с протоспейсером (PAM) или смежного с 5'-концом и/или 3'-концом последовательности РАМ в последовательности нуклеиновой кислоты иммунорегуляторного гена, где указанными модификациями являются:
активация или инактивация специфических иммунных функций или сообщение новых иммунных функций посредством модификации белка, вызываемой делецией или инсерцией одного или более нуклеотидов;
активация или инактивация специфических иммунных функций или сообщение новых иммунных функций посредством модификации белка, вызываемой заменой одним или более нуклеотидами, отличающимися от нуклеотидов гена дикого типа;
активация или инактивация специфических иммунных функций или сообщение новой иммунной функции посредством модификации белка, вызываемой инсерцией одного или более чужеродных нуклеотидов (в частности, уже существующая иммунная функция может быть дополнена третьей функцией посредством гибридной экспрессии или независимой экспрессии специфического белка; и
изменение функции третьего белка под действием вышеописанного белка с измененными функциональными свойствами.
Кроме того, может быть включен белок, искусственно модифицированный посредством химической модификации одного или более нуклеотидов в последовательности нуклеиновой кислоты, входящей в состав иммунорегуляторного гена.
Так, например, одно или более из экспрессионных, структурных свойств и иммунных функций белка, вызываемых посредством метилирования, ацетилирования, фосфорилирования, убихитинизации, АДФ-рибозилирования, миристоилирования и гликозилирования, могут быть изменены.
Так, например, третья структура и функция могут быть сообщены путем связывания третьего белка с последовательностью нуклеиновой кислоты гена после химической модификации нуклеотидов.
В другом своем варианте, настоящее изобретение относится к искусственно модифицированной клетке, которая представляет собой фактор иммунной системы, в качестве продукта, полученного с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор».
Искусственно модифицированной клеткой может быть клетка, которая включает один или более из следующих компонентов:
иммунорегуляторный ген, искусственно модифицированный с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор»; и
белок, участвующий в вырабатывании нового или модифицированного иммунного ответа, формируемого благодаря прямому/непрямому действию комплекса «гидовая нуклеиновая кислота - белок-редактор». В одном из вариантов осуществления изобретения, клеткой может быть иммунная клетка или стволовая клетка.
Эти клетки обладают иммунными функциями, сообщаемыми искусственно модифицированными иммунорегуляторными генами и/или белками, описанными выше, и другими функциями, участвующими во внутриклеточных механизмах.
В другом своем варианте, настоящее изобретение относится к композиции, индуцирующей нужный иммунный ответ, который представляет собой фактор иммунной системы в качестве продукта, полученного с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор». Эта композиция может называться фармацевтической композицией или терапевтической композицией.
Композиция, индуцирующая нужный иммунный ответ, может содержать один или более компонентов в качестве активного ингредиента:
иммунорегуляторный ген, искусственно модифицированный с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор»;
белок, участвующий в вырабатывании нового или модифицированного иммунного ответа, формируемого благодаря прямому/непрямому действию комплекса «гидовая нуклеиновая кислота - белок-редактор»; и
клетку, включающую иммунорегуляторный ген и/или белок.
Эти композиции обладают иммунными функциями, сообщаемыми искусственно модифицированными иммунорегуляторными генами, белками и/или клетками, описанными выше, и другими функциями, участвующими в различных механизмах в организме.
Композиции (например, клеточное терапевтическое средство) могут быть использованы для профилактики и/или лечения иммуноопосредуемых заболеваний (например, рака).
Способ получения
В одном из своих вариантов, настоящее изобретение относится к искусственно модифицированному иммунорегуляторному фактору и к способу получения иммунных клеток, включающих этот фактор.
Описание искусственно модифицированного иммунорегуляторного фактора можно найти выше. Далее, представленный выше метод будет описан на репрезентативных вариантах модифицированных иммунных клеток.
Клеточная культура
Для продуцирования модифицированных иммунных клеток, клетки сначала берут у здорового донора, а затем культивируют. Так, например, иммунные клетки (например, T-клетки, NK-клетки, NKT-клетки и т.п.) берут у донора известным методом и культивируют в подходящей среде для культивирования клеток.
Как будет описано ниже, некоторые иммунорегуляторные факторы, экспрессируемые культивированными иммунными клетками, отбирают и искусственно модифицируют. Так, например, гены PD-1, CTLA-4, TNFAIP3, DGKA (Dgkα), DGKAZ (Dgkζ), Fas, EGR2, PPP2R2D, PSGL-1 и/или TET2 являются генетически модифицированными. Подробное описание генетической модификации можно найти выше.
Альтернативно, иммунные клетки трансфецируют, а затем культивируют для продуцирования модифицированных иммунных клеток.
Способ продуцирования функционально модифицированных иммунных клеток
Функционально модифицированные иммунные клетки могут быть продуцированы путем инсерции или удаления белка, используемого в качестве иммунорегуляторного фактора.
Функционально модифицированные иммунные клетки могут быть продуцированы путем модификации гена, используемого в качестве иммунорегуляторного фактора.
Функционально модифицированные иммунные клетки могут быть продуцированы путем нокдауна (KD) или нокаута (KO) рецептора дикого типа или иммунорегуляторного гена. Нокдаун или нокаут означают подавление экспрессии гена посредством расщепления гена-мишени, ингибитора транскрипции ДНК, и ингибитора трансляции РНК (например, комплементарной микроРНК и т.п.) и т.п.
Нокдаун или нокаут могут быть достигнуты посредством микроРНК.
Нокдаун или нокаут могут быть предпочтительно достигнуты с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор» согласно изобретению.
Нокдаун или нокаут могут быть достигнуты посредством NHEJ с использованием генетических «ножниц».
Нокдаун или нокаут могут быть достигнуты посредством HR с использованием генетических «ножниц» и нуклеотидных матриц.
В одном примере, нокдаун или нокаут могут быть достигнуты посредством расщепления специфических сайтов-мишеней гена PD-1, CTLA-4, TNFAIP3, DGKA (Dgkα), DGKAZ (Dgkζ), Fas, EGR2, PPP2R2D, PSGL-1 и/или TET2.
Функционально модифицированные иммунные клетки могут включать модификацию области-мишени, например,
инсерцию или делецию одного или более нуклеотидов в кодирующей области, которые расположены очень близко к кодирующей области или в кодирующей области гена (например, NHEJ-опосредуемую инсерцию или делецию);
делецию геномной последовательности, содержащей по меньшей мере часть гена (например, NHEJ-опосредуемую делецию); и
модификацию нокдауна или нокаута гена, опосредуемую ферментативно неактивным белком-редактором путем таргетинга некодирующей области гена (например, промоторной области).
Кроме того, функционально модифицированные иммунные клетки могут быть продуцированы путем трансфекции рецептора дикого типа или иммунорегуляторного гена.
Метод трансфекции включает инсерцию эписом, содержащих ген-мишень или гибрид-мишень, в геном.
Трансфекция может быть достигнута путем инсерции эписомы. Эписомный вектор означает вектор, который действует как экзогенный ген в ядре эукариотического организма и не сцеплен с геномом. В частности, эписомой может быть плазмида.
Трансфекция может быть достигнута посредством HR с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор» и нуклеотидных матриц.
Кроме того, функционально модифицированные иммунные клетки могут быть продуцированы путем трансфекции различных рецепторов дикого типа или иммунорегуляторных генов и одновременного нокаута рецептора дикого типа или иммунорегуляторного гена. Методы трансфекции включают введение эписом, содержащих ген или гибрид-мишень, в геном.
В частности, трансфецируемый ген может быть сцеплен с положением нокаутируемого гена.
Трансфекция может быть достигнута путем инсерции эписомы.
Трансфекция может быть достигнута посредством HR с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор» и нуклеотидных матриц.
Способ продуцирования иммунных клеток с введенной искусственной структурой
Иммунные клетки с введенной искусственной структурой могут быть продуцированы путем непосредственного введения искусственной структуры в иммунные клетки в форме белка.
Иммунные клетки с введенной искусственной структурой могут быть продуцированы путем трансфекции гена, кодирующего искусственную структуру.
Метод трансфекции включает инсерцию эписом, содержащих ген или гибрид-мишень, в геном.
Трансфекция может быть достигнута путем инсерции эписомы.
Трансфекция может быть достигнута посредством HR с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор» и нуклеотидных матриц.
В одном из своих вариантов, настоящее изобретение относится к способу инактивации одного или более иммунорегуляторных генов в иммунной клетке, где указанный способ включает введение гидовой нуклеиновой кислоты и белка-редактора в иммунную клетку (путем трансфекции).
В одном из своих вариантов, настоящее изобретение относится к способу получения трансфецированной иммунной клетки, где указанный способ включает введение гидовой нуклеиновой кислоты и белка-редактора в иммунную клетку (путем трансфекции).
Способ продуцирования гибридных модифицированных иммунных клеток
Гибридная модифицированная иммунная клетка может быть получена способом продуцирования функционально модифицированных иммунных клеток и способом модификации белка или гена, описанных в способе продуцирования иммунных клеток с введенной искусственной структурой.
Способ продуцирования гибридной модифицированной иммунной клетки включает нокаут рецептора дикого типа или иммунорегуляторного гена или проведение трансфекции. Эта стадия может быть осуществлена, как описано в способе продуцирования функционально модифицированных иммунных клеток.
Способ продуцирования гибридной модифицированной иммунной клетки включает трансфекцию искусственной структуры. Эта стадия может быть осуществлена как описано в способе продуцирования иммунных клеток с введенной искусственной структурой.
В предпочтительном аспекте способа продуцирования гибридных модифицированных иммунных клеток осуществляют трансфекцию искусственной структуры с одновременным нокаутом рецепторов дикого типа в иммунной клетке.
В одном из примеров, этот способ осуществляют путем трансфекции искусственной структуры с одновременным нокаутом PD-1 и CTLA-4 иммунной клетки.
В другом примере, способ продуцирования гибридных модифицированных иммунных клеток осуществляют путем трансфекции искусственной структуры с нокаутом TNFAIP3(A20), DGK-альфа, DGK-дзета, Fas, EGR2, PPP2R2D, PSGL-1, KDM6A и/или TET2.
В частности, трансфецируемый ген может быть присоединен в таком же положении, как и нокаутированный ген.
Описанная выше модифицированная иммунная клетка может быть получена известным методом, например, методом, в котором обычно используется рекомбинантный вектор.
Рекомбинантный экспрессионный вектор для иммунных клеток
Термин «экспрессионная последовательность-мишень» означает средство для модификации белка или гена клетки-мишени или нуклеотидной последовательности, кодирующей только что экспрессированный ген. В одном из вариантов осуществления изобретения, экспрессионная последовательность-мишень может включать последовательности, кодирующие гидовую нуклеиновую кислоту и белок-редактор и дополнительные последовательности для экспрессии гидовой нуклеиновой кислоты и белка-редактора.
Термин «рекомбинантный вектор» означает транспортный ген, который доставляет экспрессионную последовательность-мишень в клетку-мишень, включая, например, плазмиды, эписомные векторы, вирусные векторы и т.п.
Термин «рекомбинантный экспрессионный вектор», который представляет собой вариант рекомбинантного вектора, означает искусственно сконструированный вектор, который также обладает функцией экспрессионной последовательности-мишени, присоединенной к рекомбинантному вектору, экспрессируемому в клетке-мишени.
Рекомбинантный экспрессионный вектор для иммунных клеток, который представляет собой рекомбинантный экспрессионный вектор, означает средство для модификации белка или гена иммунной клетки, а именно, для экспрессии иммунной клетки как модифицированной иммунной клетки; или рекомбинантный экспрессионный вектор, кодирующий только что экспрессированный ген.
Рекомбинантный экспрессионный вектор для иммунных клеток включает рекомбинантный экспрессионный вектор для экспрессии описанного выше комплекса «гидовая нуклеиновая кислота - белок-редактор».
В одном из вариантов осуществления изобретения, модифицированные иммунные клетки могут быть получены только путем трансфекции одного вида рекомбинантного экспрессионного вектора для иммунных клеток.
Модифицированные иммунные клетки могут быть получены путем трансфекции двух или более видов рекомбинантного экспрессионного вектора для иммунных клеток.
Рекомбинантный экспрессионный вектор для иммунных клеток может быть сконструирован путем разделения рекомбинантного экспрессионного вектора на соответствующее число рекомбинантных экспрессионных векторов, в зависимости от размера нуклеотидной последовательности на конечной стадии экспрессии.
Функционально модифицированный рекомбинантный экспрессионный вектор
В одном из своих вариантов, настоящее изобретение относится к рекомбинантному экспрессионному вектору для получения функционально модифицированных иммунных клеток.
В одном из вариантов осуществления изобретения, функционально модифицированный рекомбинантный экспрессионный вектор включает рекомбинантую нуклеотидную последовательность для нокаута рецептора дикого типа или гена иммунорегуляторного фактора.
Рекомбинантный экспрессионный вектор для нокаута гена включает рекомбинантный экспрессионный вектор для экспрессии описаного выше комплекса «гидовая нуклеиновая кислота - белок-редактор». В частности, последовательность-мишень рРНК может быть комплементарна нуклеотидной последовательности рецептора дикого типа или нуклеотидной последовательности иммунорегуляторного фактора. Кроме того, рекомбинантный экспрессионный вектор может включать, если это необходимо, матричные нуклеотиды, введенные в положение, расщепляемое комплексом «гидовая нуклеиновая кислота - белок-редактор».
В одном из вариантов осуществления изобретения, функционально модифицированный рекомбинантный экспрессионный вектор включает рекомбинантную нуклеотидную последовательность для трансфекции рецептора дикого типа или гена иммунорегуляторного фактора.
В частности, функционально модифицированный рекомбинантный экспрессионный вектор может представлять собой эписомный вектор. Эписомный вектор может включать промотор для экспрессии гена.
В одном из вариантов осуществления изобретения, функционально модифицированный рекомбинантный экспрессионный вектор может представлять собой вектор, который имеет функцию, сцепленную с геномом живого организма. В частности, функционально модифицированный рекомбинантный экспрессионный вектор может представлять собой вирусный вектор. В частности, предпочтительным вирусным вектором может быть аденоассоциированный вирусный вектор.
В одном из вариантов осуществления изобретения, функционально модифицированный рекомбинантный экспрессионный вектор может включать нуклеотидную последовательность, гомологичную инсерционному сайту-мишени. Нуклеотидной последовательностью могут быть матричные нуклеотиды, встроенные в процессе HR. Матричные нуклеотиды могут быть гомологичными последовательности области, расщепляемой комплексом «гидовая нуклеиновая кислота - белок-редактор».
В одном из вариантов осуществления изобретения, функционально модифицированный рекомбинантный экспрессионный вектор может независимо включать последовательность для экспрессии описанного выше комплекса «гидовая нуклеиновая кислота - белок-редактор» либо в одном и том же векторе, либо в различных векторах.
В другом аспекте изобретения, функционально модифицированный рекомбинантный экспрессионный вектор включает рекомбинантную нуклеотидную последовательность для нокаута гена рецептора дикого типа или иммунорегуляторного фактора или для трансфекции другого гена рецептора дикого типа или иммунорегуляторного фактора.
Рекомбинантная нуклеотидная последовательность для нокаута гена включает нуклеотидную последовательность рекомбинантного экспрессионного вектора для экспрессии описанного выше комплекса «гидовая нуклеиновая кислота - белок-редактор». В частности, последовательность-мишень рРНК может быть комплементарна нуклеотидной последовательности иммунорегуляторного фактора.
Рекомбинантный экспрессионный вектор для трансфекции может представлять собой эписомный вектор. В частности, эписомный вектор может включать промотор для экспрессии гена.
Рекомбинантный экспрессионный вектор для трансфекции может иметь функцию, сцепленную с геномом живого организма.
Рекомбинантный экспрессионный вектор для трансфекции может представлять собой вирусный вектор. В частности, предпочтительным вирусным вектором может быть аденоассоциированный вирусный вектор.
Рекомбинантный экспрессионный вектор для трансфекции может включать нуклеотидную последовательность, гомологичную инсерционному сайту-мишени. Нуклеотидной последовательностью могут быть матричные нуклеотиды, встроенные в процессе HR. Матричные нуклеотиды могут быть гомологичными последовательности области, расщепляемой комплексом «гидовая нуклеиновая кислота - белок-редактор».
Кроме того, функционально модифицированный рекомбинантный экспрессионный вектор может включать рекомбинантный экспрессионный вектор для экспрессии описанного выше комплекса «гидовая нуклеиновая кислота - белок-редактор».
Рекомбинантный экспрессионный вектор с введенной искусственной структурой
В одном из своих вариантов, настоящее изобретение относится к рекомбинантному экспрессионному вектору для получения иммунных клеток с введенной искусственной структурой.
Рекомбинантный экспрессионный вектор с введенной искусственной структурой включает рекомбинантую нуклеотидную последовательность для трансфекции гена иммунорегуляторного фактора.
В одном примере, рекомбинантный экспрессионный вектор с введенной искусственной структурой может представлять собой эписомный вектор. Эписомный вектор означает вектор, который действует как экзогенный ген в клеточном ядре эукариотического организма и не сцеплен с геномом. В частности, эписомный вектор может включать промотор для экспрессии гена.
В другом примере, рекомбинантный экспрессионный вектор с введенной искусственной структурой может представлять собой вектор, который имеет функцию, сцепленную с геномом живого организма.
В частности, рекомбинантный экспрессионный вектор с введенной искусственной структурой может представлять собой вирусный вектор. В частности, предпочтительным вирусным вектором может быть аденоассоциированный вирусный вектор.
Кроме того, рекомбинантный экспрессионный вектор с введенной искусственной структурой может включать нуклеотидную последовательность, гомологичную инсерционному сайту. Нуклеотидной последовательностью могут быть матричные нуклеотиды, встроенные в процессе HR. Матричные нуклеотиды могут быть гомологичными последовательности области, расщепляемой комплексом «гидовая нуклеиновая кислота - белок-редактор».
Кроме того, рекомбинантный экспрессионный вектор с введенной искусственной структурой может включать рекомбинантный экспрессионный вектор для экспрессии описанного выше комплекса «гидовая нуклеиновая кислота - белок-редактор».
Гибридный модифицированный рекомбинантный экспрессионный вектор
Гибридный модифицированный рекомбинантный экспрессионный вектор может включать рекомбинантную нуклеотидную последовательность для нокаута гена рецептора дикого типа или иммунорегуляторного фактора и для введения искусственной структуры в другой ген.
Рекомбинантная нуклеотидная последовательность для нокаута гена может включать нуклеотидную последовательность рекомбинантного экспрессионного вектора для экспрессии описанного выше комплекса «гидовая нуклеиновая кислота - белок-редактор». В частности, последовательность-мишень рРНК может быть комплементарна нуклеотидной последовательности иммунорегуляторного фактора.
В одном примере, рекомбинантный экспрессионный вектор для трансфекции может представлять собой эписомный вектор. В частности, эписомный вектор может включать промотор для экспрессии гена.
В другом примере, рекомбинантный экспрессионный вектор для трансфекции может иметь функцию, сцепленную с геномом живого организма.
В частности, рекомбинантный экспрессионный вектор для трансфекции может представлять собой вирусный вектор. В частности, предпочтительным вирусным вектором может быть аденоассоциированный вирусный вектор.
Кроме того, рекомбинантный экспрессионный вектор для трансфекции может включать нуклеотидную последовательность, гомологичную инсерционному сайту-мишени. Нуклеотидной последовательностью могут быть матричные нуклеотиды, встроенные в процессе HR. Матричные нуклеотиды могут быть гомологичными последовательности области, расщепляемой комплексом «гидовая нуклеиновая кислота - белок-редактор».
Кроме того, функционально модифицированный рекомбинантный экспрессионный вектор может включать рекомбинантный экспрессионный вектор для экспрессии описанного выше комплекса «гидовая нуклеиновая кислота - белок-редактор».
Кроме того, в своем конкретном репрезентативном варианте, настоящее изобретение относится к способу получения иммунных клеток, включающих искусственно модифицированной иммунорегуляторный фактор, с использованием комплекса «гидовая нуклеиновая кислота - белок-редактор».
В одном из вариантов осуществления изобретения, указанным способом может быть способ получения модифицированных иммунных клеток с измененной последовательностью нуклеиновой кислоты-мишени, где указанный способ включает контактирование клеток (a) с одной или более гидовыми нуклеиновыми кислотами (например, рРНК), нацеленными на ген PD-1, CTLA-4, TNFAIP3, DGKA (Dgkα), DGKAZ (Dgkζ), Fas, EGR2, PPP2R2D, PSGL-1 и/или TET2; и (b) с белком-редактором (например, белком Cas9).
Способ контактирования может быть проведен для введения гидовой нуклеиновой кислоты и белка-редактора непосредственно в иммунные клетки стандартным методом.
Способ контактирования может быть проведен для введения каждой молекулы ДНК, кодирующей гидовую нуклеиновую кислоту и белок-редактор, в иммунные клетки, в условиях, при которых они будут находиться в одном векторе или в отдельных векторах.
Способ контактирования может быть проведен с использованием вектора. Вектором может быть вирусный вектор. Вмрусным вектором может быть, например, ретровирусный, аденоассоциированный вирусный вектор.
В этом способе, для транспорта в иммунные клетки могут быть применены различные известные методы (например, методы электропорации, методы с использованием липосом, вирусных векторов, наночастиц, а также гибридного белка, содержащего домен транслокации белка (PTD) и т.п.).
Этот способ может также включать введение рРНК для доставки различных генов в клетку или введение нуклеиновой кислоты, кодирующей такую рРНК, в клетку.
Этот способ может быть проведен in vivo или in vitro, например, ex vivo.
Так, например, контактирование может быть осуществлено in vitro, и клетки после их контактирования могут быть возвращены индивидууму.
В этом способе могут быть использованы иммунные клетки или организмы in vivo, например, иммунные клетки, выделенные из человеческого организма, или искусственно продуцированные иммунные клетки. В одном из примеров может быть проведено контактирование клеток, взятых у индивидуума, страдающего раком.
Иммунными клетками, используемыми в вышеописанном способе, могут быть иммунные клетки, происходящие от млекопитающих, включая приматов (например, человека, обезьян и т.п.) и грызунов (например, мышей, крыс и т.п.). Так, например, иммунными клетками могут быть NKT-клетки, NK-клетки, T-клетки и т.п. В частности, например, иммунными клетками могут быть модифицированные иммунные клетки, в которые были добавлены иммунные рецепторы (например, химерные антигенные рецепторы (CAR) или модифицированные Т-клеточные рецепторы (TCR)). Иммунные клетки могут быть модифицированы так, чтобы иммунные рецепторы (например, TCR или CAR) экспрессировались до, во время или после введения мутированных иммунных клеток в положения одного или более генов-мишеней, выбранных из генов PD-1, CTLA-4, TNFAIP3, DGKA (Dgkα), DGKAZ (Dgkζ), Fas, EGR2, PPP2R2D, PSGL-1, и/или TET2.
Этот способ может быть осуществлен в соответствующей среде для иммунных клеток, которая может содержать сыворотку (например, фетальную бычью сыворотку или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-гамма, IL-4, IL-7, GM-CSF, IL-10, IL-15, TGF-бета и TNF-альфа; или в соответствующей среде, которая может содержать факторы, необходимые для пролиферации и жизнеспособности, включая другие добавки для роста клеток, известные специалистам (например, минимальную поддерживающую среду, среду RPMI 1640 или X-vivo-10, -15, -20, (Lonza)), но эти среды не ограничиваются ими.
Применение
В одном из своих вариантов, настоящее изобретение относится к применению иммунотерапевтического способа лечения заболеваний, включающего введение индивидууму искусственно модифицированных клеток (например, генетически модифицированных иммунных клеток или стволовых клеток).
Индивидуумом, подвергаемым лечению, могут быть млекопитающие, включая приматов (например, человека, обезьян и т.п.) и грызунов (например, мышей, крыс и т.п.).
Фармацевтическая композиция
Одним из вариантов осуществления изобретения является композиция, применяемая для лечения заболеваний с использованием иммунного ответа, например, композиция, содержащая искусственно модифицированный иммунорегуляторный ген или иммунную клетку, включающую этот ген. Эта композиция может называться терапевтической композицией, фармацевтической композицией или клеточным терапевтическим средством.
В одном из вариантов осуществления изобретения, композиция модет содержать иммунные клетки.
В одном из вариантов осуществления изобретения, композиция модет содержать искусственно модифицированный иммунорегуляторный ген и/или белок, экспрессируемый этим геном.
Иммунными клетками могут быть иммунные клетки, которые уже прошли стадию дифференцировки.
Иммунные клетки могут быть экстрагированы из костного мозга или крови пупочного канатика.
Иммунными клетками могут быть стволовые клетки. В частности, стволовыми клетками могут быть гемопоэтические стволовые клетки.
Композиция может содержать модифицированные иммунные клетки.
Композиция может содержать функционально модифицированные иммунные клетки.
Композиция может содержать иммунные клетки с введенной искусственной структурой.
В другом варианте осуществления изобретения, композиция может также содержать дополнительные факторы.
Композиция может содержать антигенсвязывающий агент.
Композиция может содержать цитокины.
Композиция может содержать агент, секретирующий цитокины, или ингибитор цитокинов.
Композиция может содержать подходящий носитель для доставки модифицированных иммунных клеток в организм.
Иммунные клетки, содержащиеся в композиции, могут быть аллогенными для пациента.
Способ лечения
Другим вариантом настоящего изобретения является способ лечения заболевания у пациента, включающий введение пациенту, нуждающемуся в этом, композиции, где продуцирование этой композиции и ее эффективное количество описаны выше.
В одном из вариантов осуществления изобретения, указанным способом может быть способ, проводимый посредством адоптивной иммунотерапии.
Заболевание, подвергаемое лечению
Адоптивная иммунотерапия может быть проведена для лечения любого конкретного заболевания.
Любым конкретным заболеванием может быть иммунное заболевание. В частности, иммунным заболеванием может быть заболевание, которое ассоциируется с нарушением иммунологической компетентности.
Иммунным заболеванием может быть аутоиммунное заболевание.
Так, например, аутоиммунным заболеванием могут быть заболевание «трансплантат против хозяина» (GVHD), системная красная волчанка, глютеновая болезнь, сахарный диабет типа 1, болезнь Грейвса, воспалительное заболевание кишечника, псориаз, ревматоидный артрит, рассеянный склероз и т.п.
Иммунным заболеванием может быть гиперплазия.
Так, например, иммунным заболеванием может быть злокачественное заболевание крови или солидная раковая опухоль. Репрезентативными злокачественными опухолями крови являются острый лимфобластный лейкоз (ОЛЛ), острый миелогенный лейкоз (ОМЛ), хронический миелогенный лейкоз (ХМЛ), хронический эозинофильный лейкоз (ХЭЛ), миелодиспластический синдром (МДС), неходжкинская лимфома (НХЛ) и множественная миелома (MM). Примерами солидных опухолей являются рак желчных протоков, рак мочевого пузыря, карцинома кости и мягких тканей, опухоль головного мозга, рак молочной железы, рак шейки матки, рак толстой кишки, аденокарцинома толстой кишки, рак прямой и ододочной кишки, десмоидная опухоль, рак эмбриона, рак эндометрия, рак пищевода, рак желудка, аденокарцинома желудка, мультиформная глиобластома, опухоли женских половых органов, плоскоклеточная карцинома головы и шеи, рак печени, рак легких, злокачественная меланома, остеосаркома, рак яичника, рак поджелудочной железы, аденокарцинома желчных протоков, первичная астроцитоидная опухоль, первичный рак щитовидной железы, рак предстательной железы, рак почек, почечно-клеточная карцинома, рабдомиосаркома, рак кожи, саркома мягких тканей, опухоль зародышевых клеток яичек, рак эпителиальных клеток мочевых путей, саркома матки, рак матки и т.п.
Заболеваниями, подвергаемыми лечению, могут быть раковые опухоли ширококго ряда, включая солидные злокачественные опухоли и злокачественные опухоли крови.
Так, например, типами рака, который может быть подвергнут лечению, являются аденокарцинома молочной железы, предстательной железы, поджелудочной железы, толстой кишки и прямой кишки; бронхогенная карцинома легких во всех формах (включая плоскоклеточную карциному, аденокарциному, мелкоклеточный рак легких и немелкоклеточный рак легких); миелома; меланома; гепатома; нейробластома; папиллома; апудома; хористома; кистоз бронхиальных расщелин; злокачественный карциноидный синдром; карциноидное заболевание сердца; и карцинома (например, карцинома Уолкера, базально-клеточная карцинома, базально-плоскоклеточная карцинома, карцинома Брауна-Пирса, карцинома протоков, опухоль Эрлиха, опухоль Кребса-2, опухоль клеток Меркеля, опухоль муцинозных клеток, немелкоклеточный рак легких, опухоль овсяновидных клеток, опухоль папиллярных клеток, фиброзный рак, опухоль бронхиол, бронхогенная опухоль, плоскоклеточный рак и рак переходных клеток).
Так, например, дополнительными типами рака, который может быть подвергнут лечению, являются: гистоцитоцитарное расстройство; лейкоз; злокачественный гистиоцитоз; болезнь Ходжкина; неходжкинская лимфома; плазмацитома; ретикулоэндотелиома; меланома; почечно-клеточная карцинома; хондробластома; хондрома; хондросаркома; фиброма; фибросаркома; гигантоклеточные опухоли; гистиоцитома; липома; липосаркома; мезотелиома; миксома; миксосаркома; остеома; остеосаркома; хордома; краниофарингиома; дисгерминома; гамартома; мезенхимома; мезонефрома; миосаркома; адамантиома; цементома; одонтома; тератома; тимома и трофобластная опухоль.
Кроме того, нижеследующими типами рака, которые могут также рассматриваться как раковые опухоли, подлежащие лечению, являются: аденома; холангиома; холеостеатома; цилиндрома; цистаденокарцинома; цистаденома; гранулезно-клеточная опухоль; гинандробластома; гепатома; гидроаденома; опухоль клеток панкреатических островков; опухоль клеток Лейдига; папиллома; опухоль клеток Сертоли; опухоль клеток яичника; лейомиома матки; саркома матки; миобластома; миома; миосаркома; рабдомиома; рабдомиосаркома; эпендимома; ганглионеврома; глиома; медуллобластома; менингиома; невролеммома; нейробластома; нейроэпителиома; нейрофиброма; неврома; параганглиома; нехромофинная параганглиома; и мультиформная глиобластома.
Типами рака, который может быть подвергнут лечению, также являются ангиокератома; ангиолимфоидная гиперплазия в комбинации с эозинофилией; сосудистый склероз; ангиоматоз; гломангиома; гемангиоэндотелиома; гемангиома; гемангиоперицитома; гемангиосаркома; лимфангиома; лимфангиомиома; лимфангиосаркома; пинеалома; карциносаркома; хонлросаркома; филлоидная цистосаркома; фибросаркома; гемангиосаркома; лейомиосаркома; лейкосаркома; липосаркома; лимфангиосаркома; миосаркома; миксосаркома; карцинома яичника; рабдомиосаркома; саркома; новообразования; нейрофиброматоз и дисплазия шейки матки.
Кроме того, любым конкретным заболеванием может быть трудноизлечимое заболевание, которое вызывается известными патогенами, но для которого не существует известного способа лечения.
Трудноизлечимым заболеванием может быть вирусное инфекционное заболевание.
Трудноизлечимым заболеванием может быть заболевание, вызываемое патогенными прионами.
Любым конкретным заболеванием может быть бактериальное заболевание.
Любым конкретным заболеванием может быть воспалительное заболевание.
Любым конкретным заболеванием может быть заболевание, ассоциированное со старением.
- Лечение, повышающее иммунитет
У пациентов со значительно ослабленным иммунитетом, даже легкие инфекции могут приводить к летальному исходу. Снижение иммунитета обусловлено нарушением функции иммунных клеток, уменьшением количества продуцируемых иммунных клеток и т.п. Способами повышения иммунитета для восстановления нарушенной иммунной функции могут быть способы перманентного лечения для активации продуцирования нормальных иммунных клеток и способы периодического лечения, включающие периодическое введение иммунных клеток.
Лечение, повышающее иммунитет, может быть проведено путем инъекции терапевтической композиции в организм пациента для перманентного повышения иммунитета.
Способ лечения, повышающего иммунитет, может включать инъекцию терапевтической композиции в конкретный участок организма пациента. В частности, конкретным участком организма может быть участок, имеющий ткани, снабжаемые источниками иммунных клеток.
Лечение, повышающее иммунитет, может быть разаработано для создания нового источника иммунных клеток в организме пациента. В частности, в одном примере, терапевтическая композиция может включать стволовые клетки. В частности, стволовыми клетками могут быть гемопоэтические стволовые клетки.
Лечение, повышающее иммунитет, может быть проведено путем инъекции терапевтической композиции в организм пациента для временного повышения иммунитета.
Лечением, повышающим иммунитет, может быть инъекция терапевтической композиции в организм пациента.
В частности, предпочтительная терапевтическая композиция может содержать дифференцированные иммунные клетки.
Терапевтическая композиция, используемая в способе лечения, повышающего иммунитет, может содержать определенное число иммунных клеток.
Конкретное число иммунных клеток может варьироваться в зависимости от степени снижения иммунитета.
Конкретное число иммунных клеток может варьироваться в зависимости от массы тела.
Конкретное число иммунных клеток может быть скорректировано в зависимости от количества цитокинов, высвобождаемых у пациента.
- Лечение трудноизлечимого заболевания
Мотоды модификации иммунных клеток могут включать способ лечения заболеваний, которые вызываются такими патогенами, как ВИЧ, прионы, и раковых заболеваний, и которые не могут быть вылечены известными способами. Хотя патогены, вызывающие эти заболевания, являются известными, однако, во многих случаях, эти заболевания трудно поддаются лечению, поскольку при таких заболеваниях почти не вырабатываются антитела, и эти заболевания быстро прогрессируют и инактивируют иммунную систему пациента, а указанные патогены имеют латентный период инкубации в организме. Модифицированные иммунные клетки могут представлять собой очень эффективное средство для решения этих проблем.
Лечение трудноизлечимого заболевания может быть осуществлено путем инъекции терапевтической композиции в организм. В частности, предпочтительная терапевтическая композиция может содержать модифицированные иммунные клетки. Кроме того, терапевтическая композиция может быть введена в конкретный участок организма.
Модифицированными иммунными клетками могут быть иммунные клетки, обладающие повышенной способностью распознавать патоген, вызывающий заболевание, требующее лечения.
Модифицированными иммунными клетками могут быть клетки, которые сообщают повышенную интенсивность или активность иммунного ответа.
-Лечение путем коррекции генов
Помимо лечения, проводимого с использованием экзогенно экстрагируемых иммунных клеток, может быть проведено лечение способом, который включает прямое воздействие на экспрессию иммунных клеток посредством модификации гена живого организма. Такой способ лечения может быть проведен путем прямой инъекции композиции для коррекции гена в целях модификации гена в организме.
Композиция для коррекции гена может содержать комплекс «гидовая нуклеиновая кислота - белок-редактор».
Композиция для коррекции гена может быть введена в конкретный участок организма.
Конкретным участком организма может быть источник иммунных клеток, например, костный мозг.
В одном из своих вариантов, настоящее изобретение относится к способу лечения иммуноопосредуемого заболевания путем введения индивидууму эффективного количества композиции, содержащей компоненты описанной выше искусственно модифицированной иммунной системы.
В любом варианте осуществления изобретения, способы лечения включают применение клеточных популяций, измененных или модифицированных рекомбинантным методом ex vivo, например, посредством вирусных векторов. В другом варианте осуществления изобретения, модифицированными клеточными популяциями являются гомологичные, аллогенные или аутологичные клетки. В любых вышеупомянутых вариантах осуществления изобретения, измененные или модифицированные клеточные популяции могут быть также приготовлены с использованием фармацевтически приемлемого носителя, разбавителя или наполнителя, описанных в настоящей заявке.
Индивидуумом, подвергаемым лечению, могут быть млекопитающие, включая приматов, например, человека, обезьян и т.п., и грызунов, например, мышей, крыс и т.п.
Термин «введение» означает доставку препаратов индивидууму независимо от способа или схемы введения. Введение может быть осуществлено парентерально, непрерывно или периодически.
В некоторых вариантах осуществления изобретения, введение вместе с адъювантным терапевтическим средством может включать одновременную и/или последовательную доставку множества агентов в любом порядке и при любой схеме введения доз (например, введение одного или более цитокинов вместе с антигенспецифическими рекомбинантными T-клетками-хозяевами и антиген-экспрессирующими клетками; иммуносупрессорную терапию, например, терапию с использованием ингибиторов кальцинейрина, кортикостероидов, ингибиторов микротрубочек, пролекарств на основе микофеноловой кислоты в низких дозах или любых их комбинаций).
В некоторых вариантах осуществления изобретения, введение может быть осуществлено повторно несколько раз в течение нескольких недель, нескольких месяцев или в течение периода времени до двух лет.
Композиция может быть введена способом, подходящим для лечения или профилактики заболевания или состояния и известным специалистам-медикам. Соответствующая доза, подходящее время введения и частота введения композиции зависят от таких факторов, как состояние здоровья пациента, телосложение пациента (то есть, масса тела и площадь поверхности тела), тип и тяжесть заболевания пациента, конкретная форма активного ингредиента и способ введения.
Так, например, введение композиции может быть осуществлено любым удобным способом, например, путем инъекции, переливания, имплантации, трансплантации и т.п. Способ введения может быть выбран из подкожного, интрадермального, внутриопухолевого, интранодального, интрамедуллярного, внутримышечного, внутривенного, интралимфатического, внутрибрюшинного, интраперитониального введения и т.п.
Разовая доза композиции (количество, фармацевтически эффективное для достижения желаемого эффекта) может быть выбрана из всех целых величин в пределах приблизительно от 104 до 109 клеток/кг массы тела индивидуума (например, приблизительно от 105 до 106 клеток/кг (массы тела)), подвергаемого лечению, и такие дозы не ограничиваются указанными величинами; причем, разовая доза композиции может быть вычислена в зависимости от таких факторов, как возраст, состояние здоровья и масса тела индивидуума, подвергаемого лечению, а также тип одновременно проводимого лечения, если оно проводится, частота проведения лечения и природа желаемого эффекта.
Если искусственно модифицированный иммунорегуляторный фактор регулируется с применением способов и композиций согласно изобретению, то иммунологическая эффективность в отношении выживаемости, пролиферации, персистентности, цитотоксичности, высвобождения цитокинов и/или инфильтрации и т.п. иммунных клеток может быть повышена.
Экспериментальные примеры
Пример 1: Приготовление клеточного препарата (активация и культивирование) и трансфекция
Клетки Jurkat (ATCC TIB-152; иммортализованная клеточная линия человеческих T-клеток) культивировали в среде RPMI 1640 с добавлением 10% (об./об.) фетальной бычьей сыворотки (GeneAll). Клетки инкубировали в инкубаторе при 37°C в присутствии 5% CO2.
Человеческие «необученные» T-клетки (STEMCELL Technology) культивировали в среде X-VIVO 15 (Lonza) с добавлением 10% (об/об) фетальной бычьей сыворотки (GeneAll) и/или IL-2 (50 ед/мл), IL-7 (5 нг/мл) и IL-15 (5 нг/мл) (PEPROTECH). Для активации клеток, концентрацию клеток в среде поддерживали при плотности 1×106 клеток/мл, соответственно.
CD2/CD3/CD28-сферы (анти-CD2/3/CD28 антитела, Dynabeads; Miltenyi Biotec) добавляли в отношении 3:1 (сферы:клетки; число сфер и клеток), и клетки инкубировали в инкубаторе при 37°C в присутствии 5% CO2. После активации клеток в течение 72 часов, CD2/CD3/CD28-сферы удаляли с помощью магнита, и клетки снова культивировали в течение 12-24 часов в отсутствии сфер.
Для идентификации рРНК, способной нокаутировать специфический ген с высокой эффективностью, 1 мкг in vitro транскрибируемой оцрРНК и 4 мкг белка Cas9 (Toolgen, Korea) вводили в 1×106 клеток Jurkat путем электропорации (in vitro) как описано ниже в Примерах 2 и 3. С использованием 10 мкл-пипетки, содержащей систему трансфекции Neon Transfection System (ThermoFisher Scientific, Grand Island, NY), вводили ген в следующих условиях:
Jurkats (Буфер R): 1400 В, 20 мс, 2 импульса.
Аналогичным образом, 1 мкг рРНК и 4 мкг белка Cas9 (Toolgen, Korea) вводили в 1×106 первичных человеческих Т-клеток путем электропорации для нокаута специфических генов в T-клетках. рРНК, используемой в этом исследовании, является in vitro транскрибируемая оцрРНК и оцрРНК, обработанная ЩФ (щелочной фосфатазой); или комплекс химически синтезированных cr-РНК и tracr-РНК (Integrated ДНК Technologies). Для электропорации, 10 мкл-пипетку, содержащую систему трансфекции Neon Transfection System (ThermoFisher Scientific, Grand Island, NY), использовали для введения гена в следующих условиях:
первичные человеческие T-клетки (буфер T): 1550 В, 10 мс, 3 импульса.
Клетки высевали на 500 мкл среды, не содержащей антибиотиков, и культивировали в инкубаторе при 37°C в присутствии 5% CO2.
Пример 2: Конструирование и синтез оцрРНК
2.1. Конструирование оцрРНК
Области-мишени CRISPR/Cas9 человеческого гена PD-1 (PDCD1; NCBI рег. No. NM_005018.2), гена CTLA-4 (NCBI рег. No. NM_001037631.2), гена A20 (TNFAIP3; NCBI рег. No. NM_001270507.1), гена Dgk-альфа (NCBI рег. No. NM_001345.4), гена Dgk-дзета (NCBI рег. No. NM_001105540.1), гена Egr2 (NCBI рег. No. NM_000399.4), гена PPP2r2d (NCBI рег. No. NM_001291310.1), гена PSGL-1 (NCBI рег. No. NP_001193538.1), и гена Tet2 (NCBI рег. No. NM_017628.4) отбирали с использованием компьютерной программы CRISPR RGEN (Институт Фундаментальных наук, Корея) и оценивали с помощью теста на нежелательную мишень. Для областей-мишеней CRISPR/Cas9, последовательности ДНК, в которых отсутствовали сайты с ошибочными спариваниями 0, 1 или 2 п.о., отбирали как области-мишени оцрРНК, за исключением областей последовательности-мишени в человеческом геноме (GRCh38/hg38).
2.2. Синтез оцрРНК
Матрицы для синтеза оцрРНК подвергали ПЦР-амплификации путем отжига и удлинения на два комплементарных олигонуклеотида.
Последовательность областей-мишеней, используемая в этом примере, праймерная последовательность для их амплификации и последовательность ДНК-мишени, на которую нацелена оцрРНК, полученная на их основе, описаны ниже в таблице 2.
In vitro транскрипцию осуществляли с использованием РНК-полимеразы T7 (New England Biolabs) для матричной ДНК (за исключением 'NGG' у 3'-конца последовательности-мишени), и РНК синтезировали в соответствии с инструкциями производителей, а затем использовали ДНКазу (Ambion) для удаления матричной ДНК. Транскрибированную РНК очищали с помощью набора Expin Combo (GeneAll) и осаждали изопропанолом.
В экспериментах, проводимых с использованием T-клеток, для минимизации иммуногенности и расщепления оцрРНК, 5'-концевые фосфатные остатки удаляли из оцрРНК, синтезированной вышеописанным методом с использованием щелочной фосфатазы (New England Biolabs), а затем РНК снова очищали с помощью набора Expin Combo (GeneAll) и осаждали изопропанолом. Кроме того, химически синтезированную оцрРНК (Trilink) использовали в некоторых экспериментах с T-клетками.
Химически синтезированная оцрРНК, используемая в некоторых примерах, представляет собой оцрРНК, модифицированную 2'OMe и фосфортиоатом.
Так, например, оцрРНК DGKα #11, используемая в этом примере, имеет структуру 5'-2'OMe(C(ps)U(ps)C(ps)) UCA AGC UGA GUG GGU CCG UUU UAG AGC UAG AAA UAG CAA GUU AAA AUA AGG CUA GUC CGU UAU CAA CUU GAA AAA GUG GCA CCG AGU CGG UGC 2'OMe(U(ps)U(ps)U(ps)U -3' (2'OMe=2'-метил-РНК и ps=фосфортиоат).
В другом примере, A20 оцрРНК A20 #1, используемая в этом варианте, представляет собой последовательность GCUUGUGGCGCUGAAAACGAAGUUUUAGAGCUAGAAAUAGCAAGUUAAAAUAAGGCUAGUCCGUUAUCAACUUGAAAAAGUGGCACCGAGUCGGUGCUUUUUUU (жирным шрифтом обозначена последовательность, которая гибридизуется с областью последовательности-мишени; оцрРНК для другого гена-мишени или другой последовательности-мишени, которая представляет собой показанную жирным последовательность, имеет последовательность-мишень (T заменен только U)), где три нуклеотида у 3'-конца последовательности и три нуклеотида у 5'-конца последовательности модифицированы путем введения 2'-OMe и фосфортиоатного остова)
Таблица 2
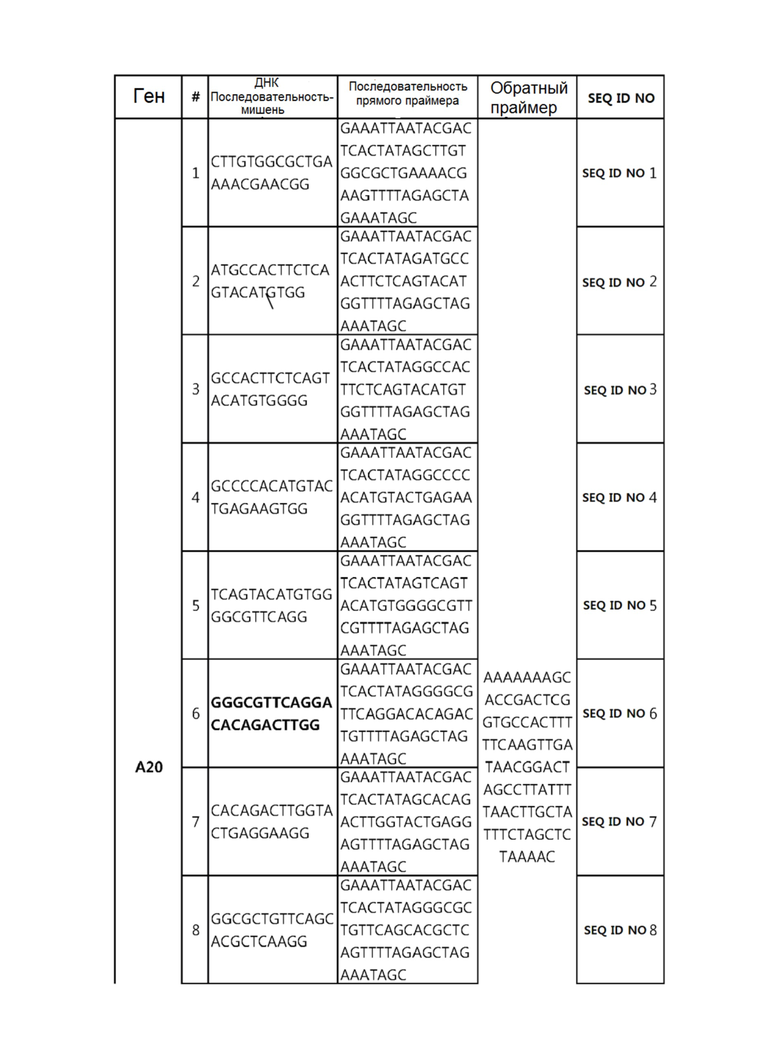
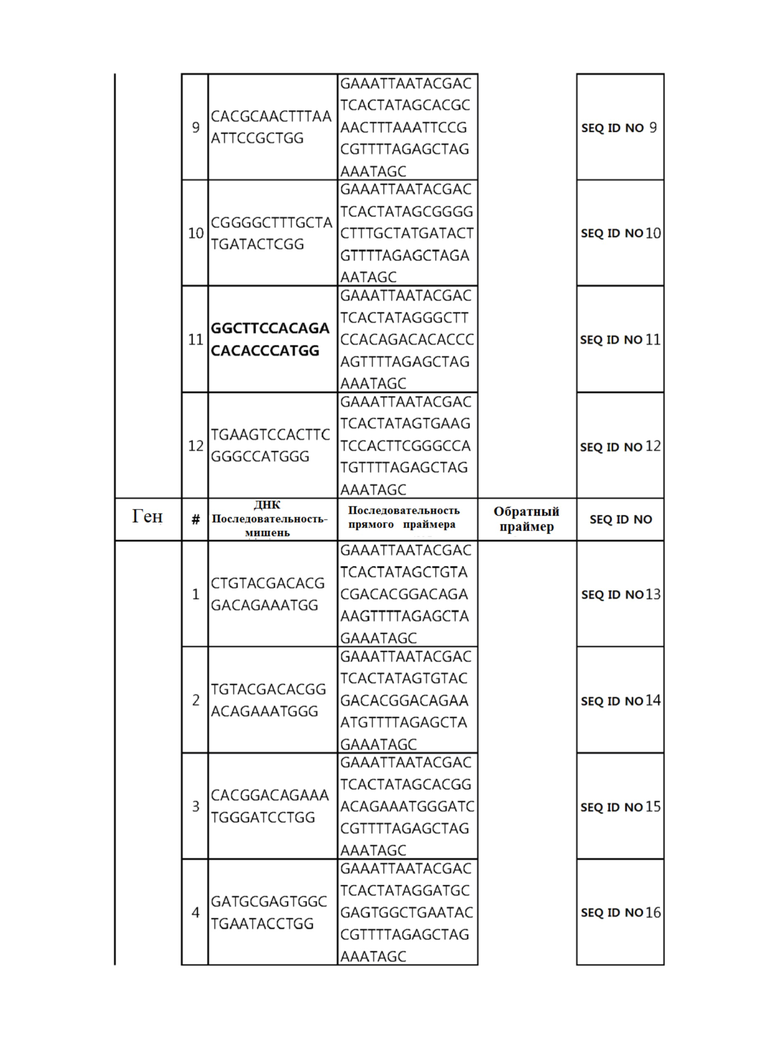
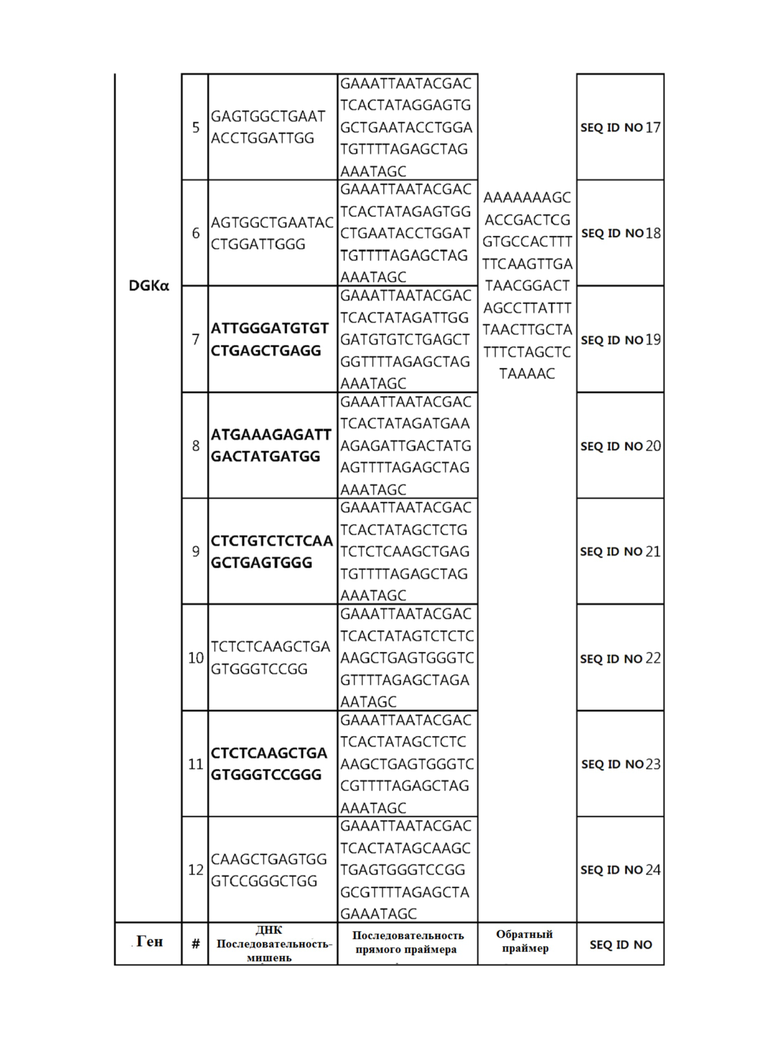
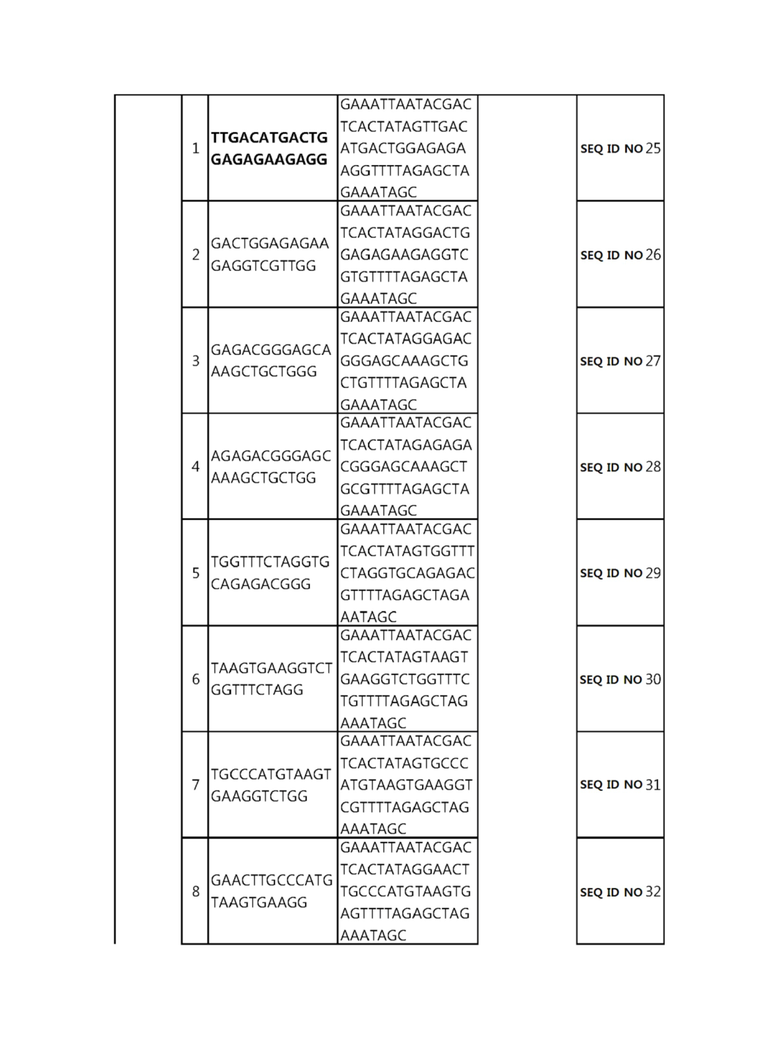
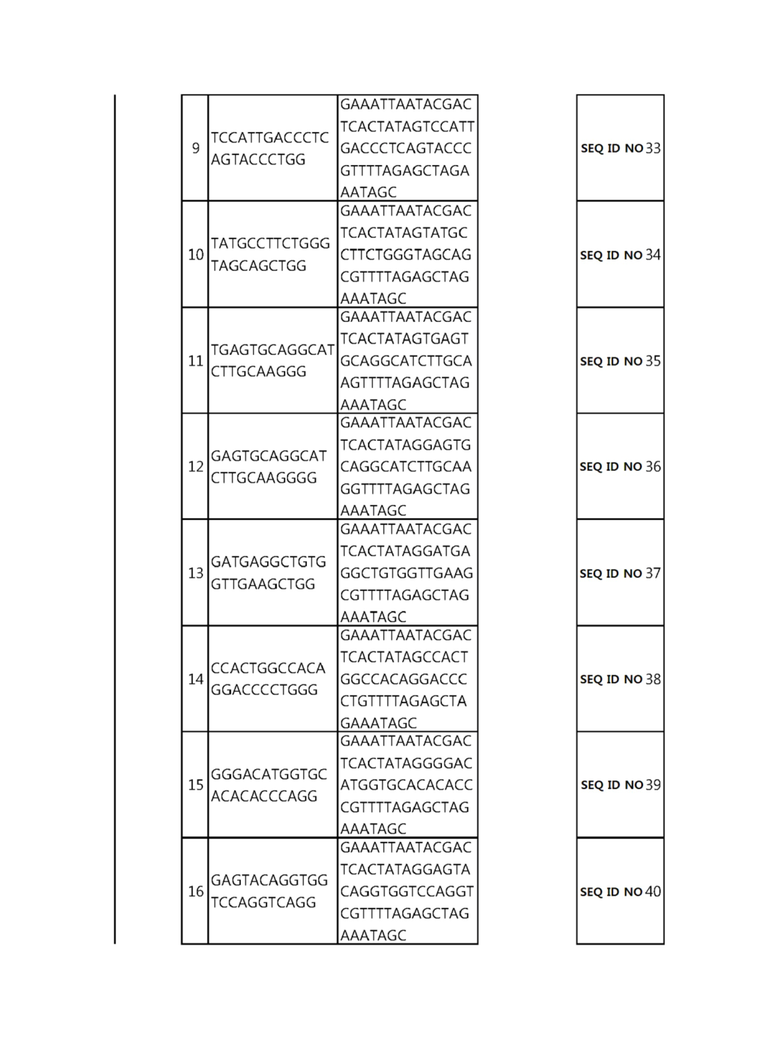
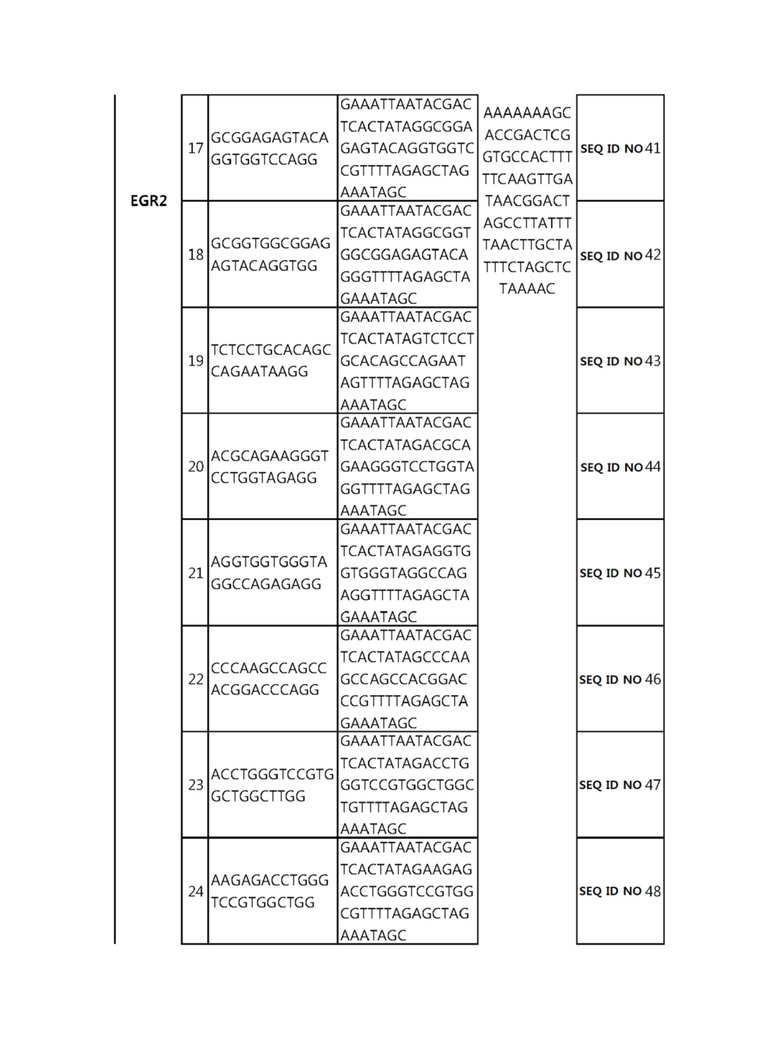
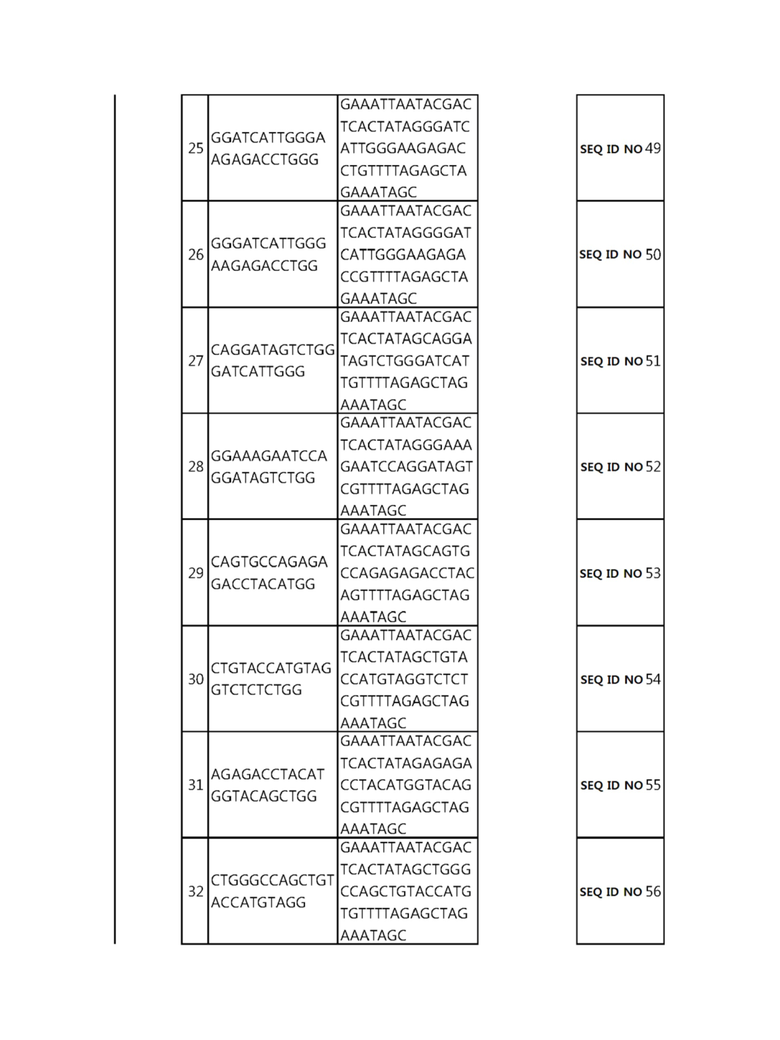
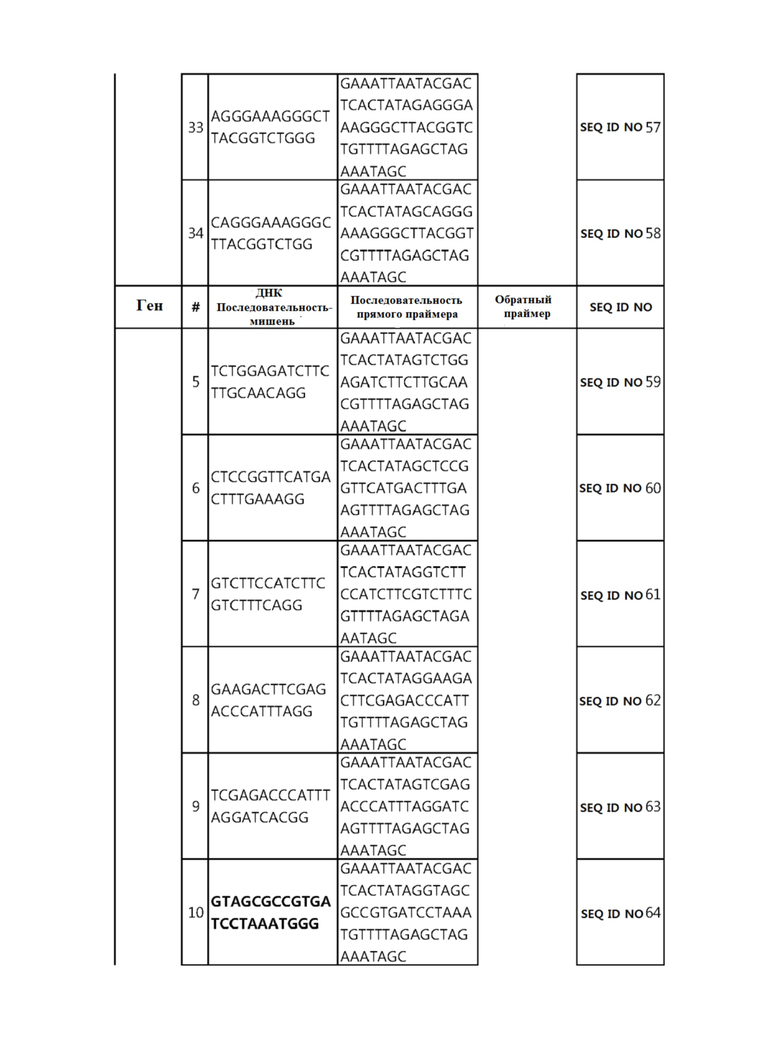

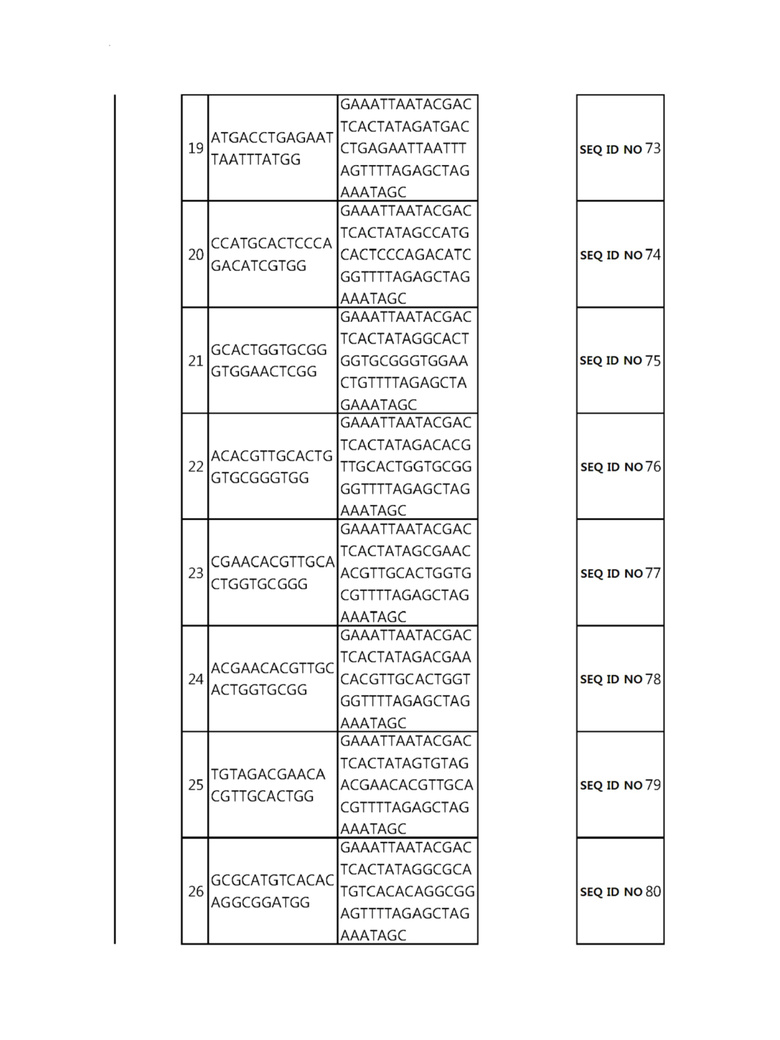
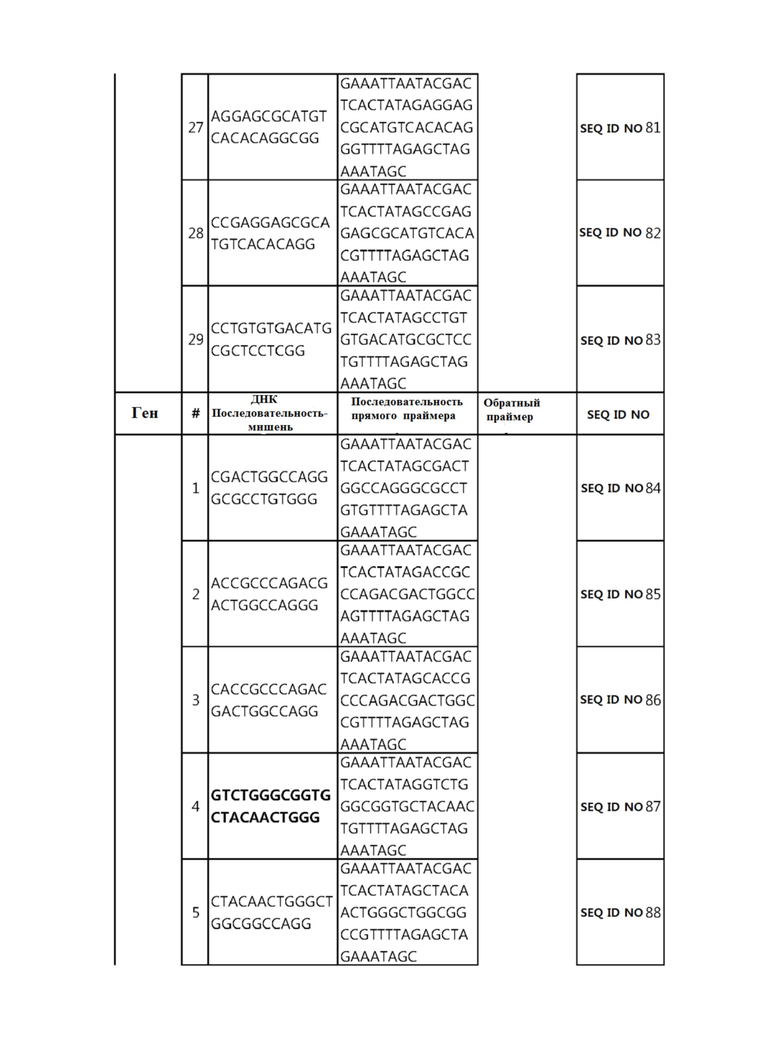
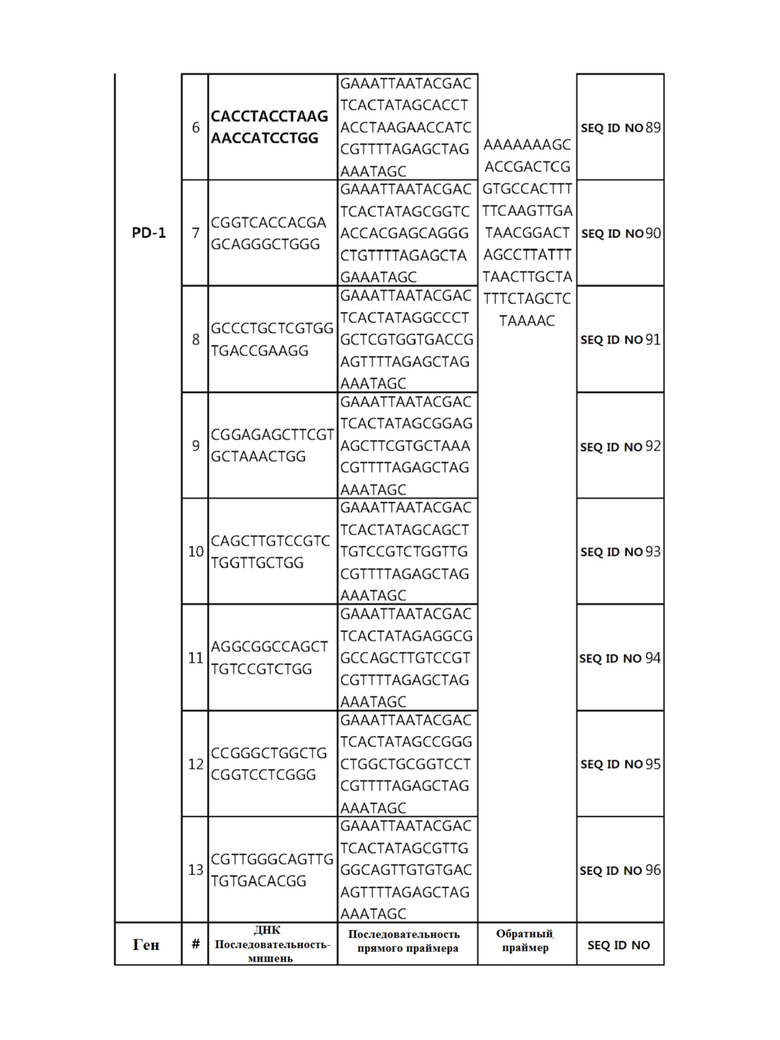
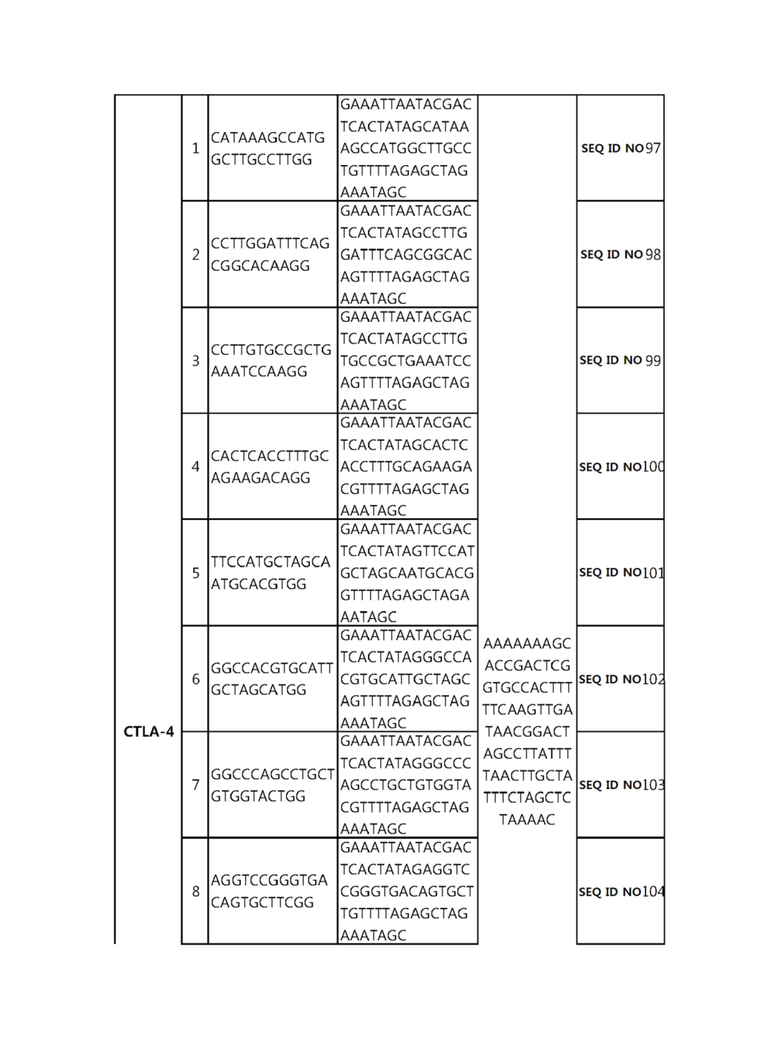
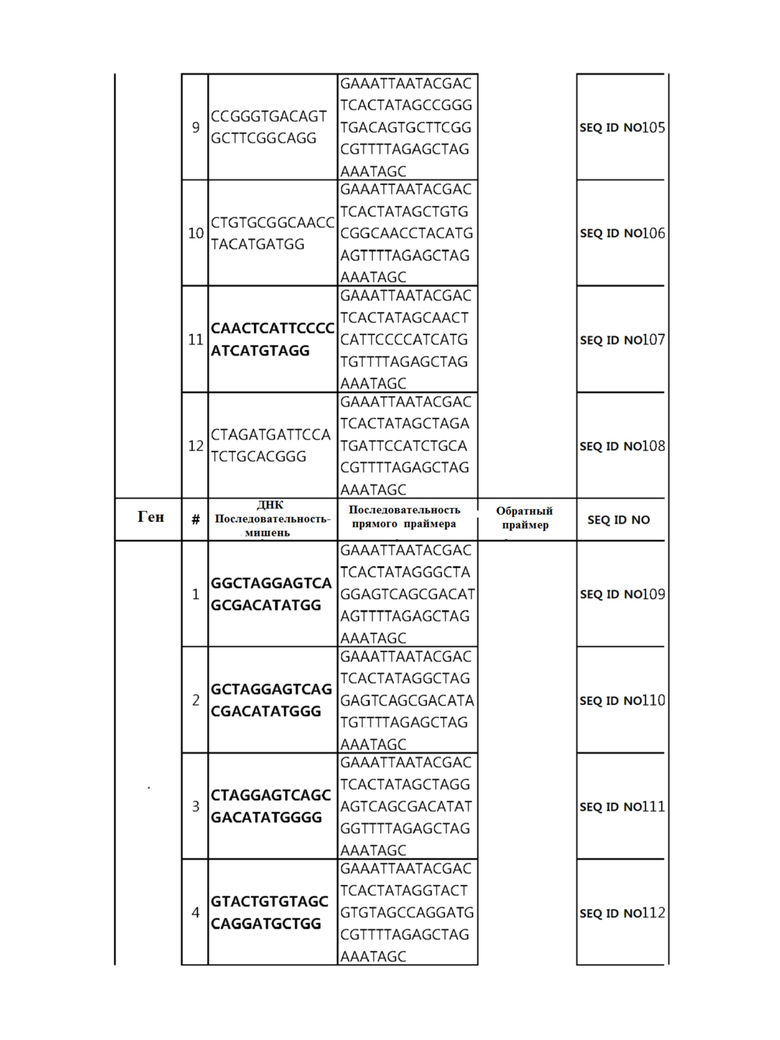
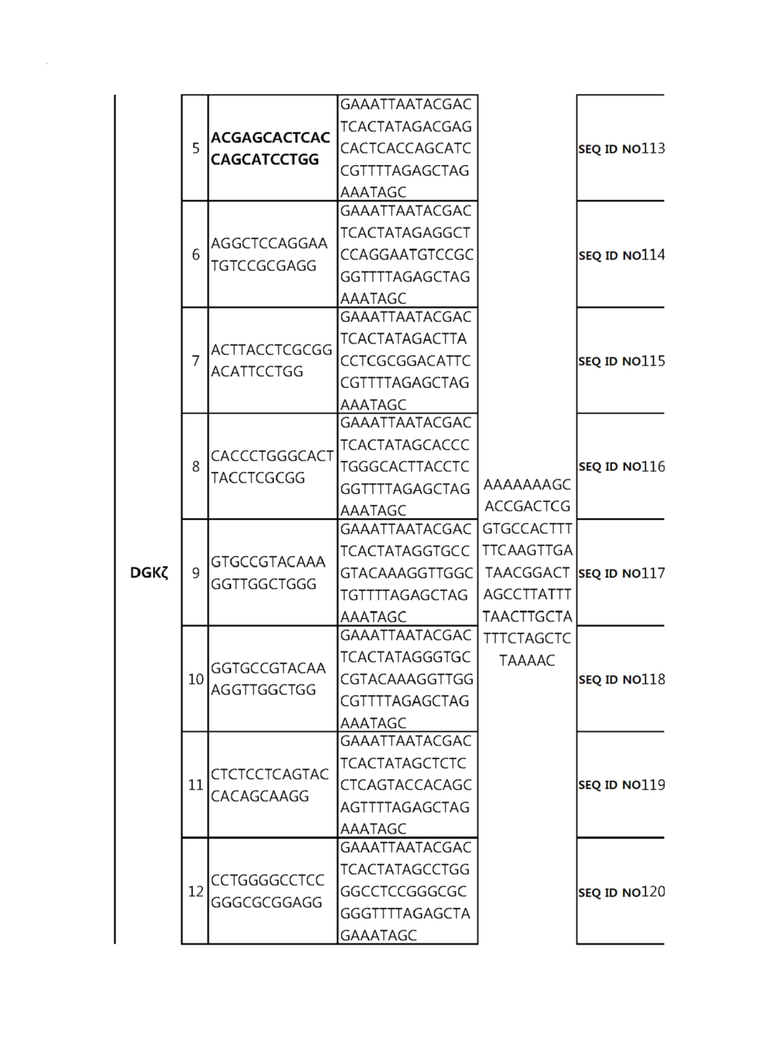
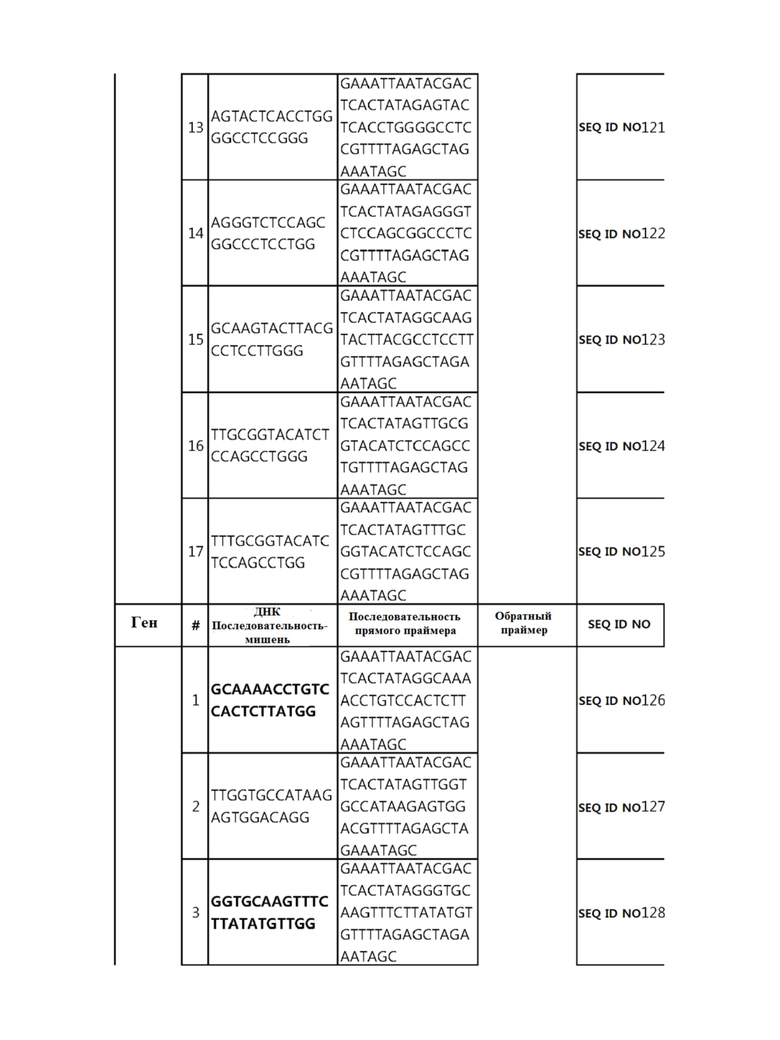
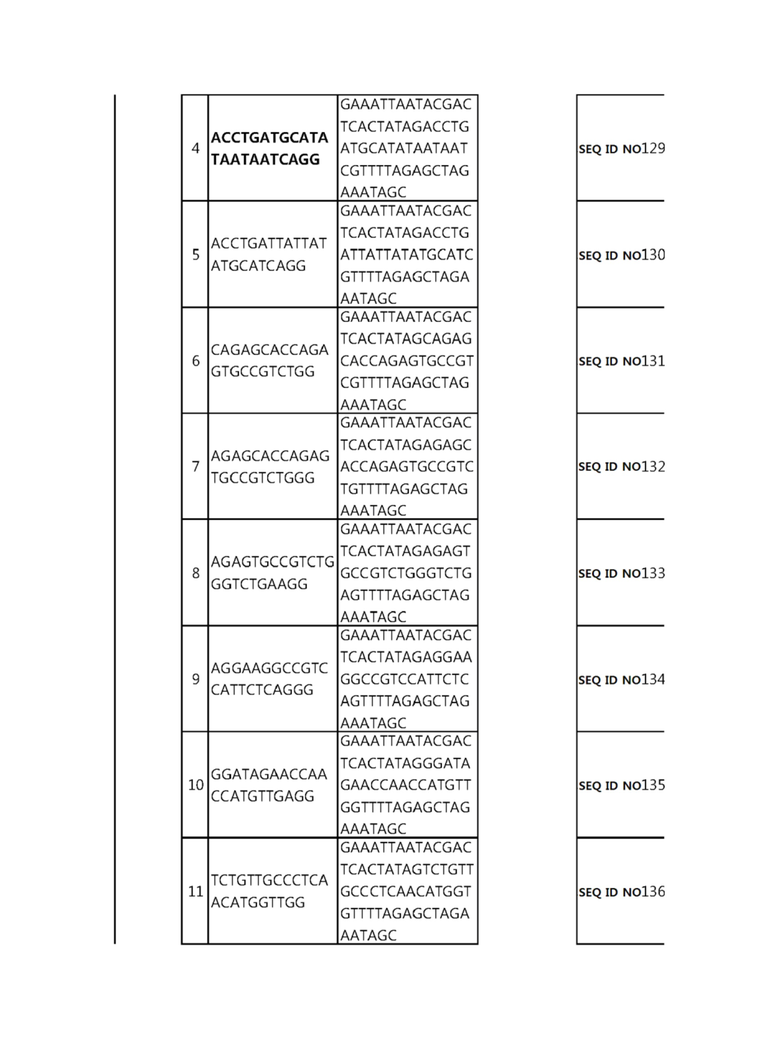
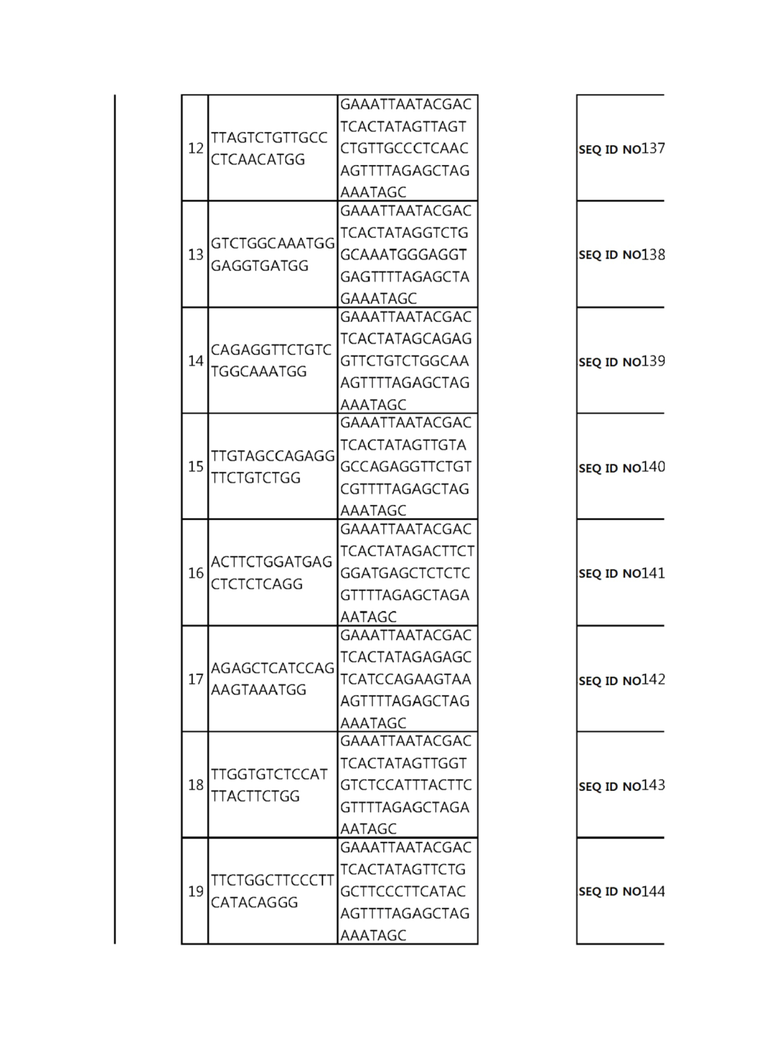
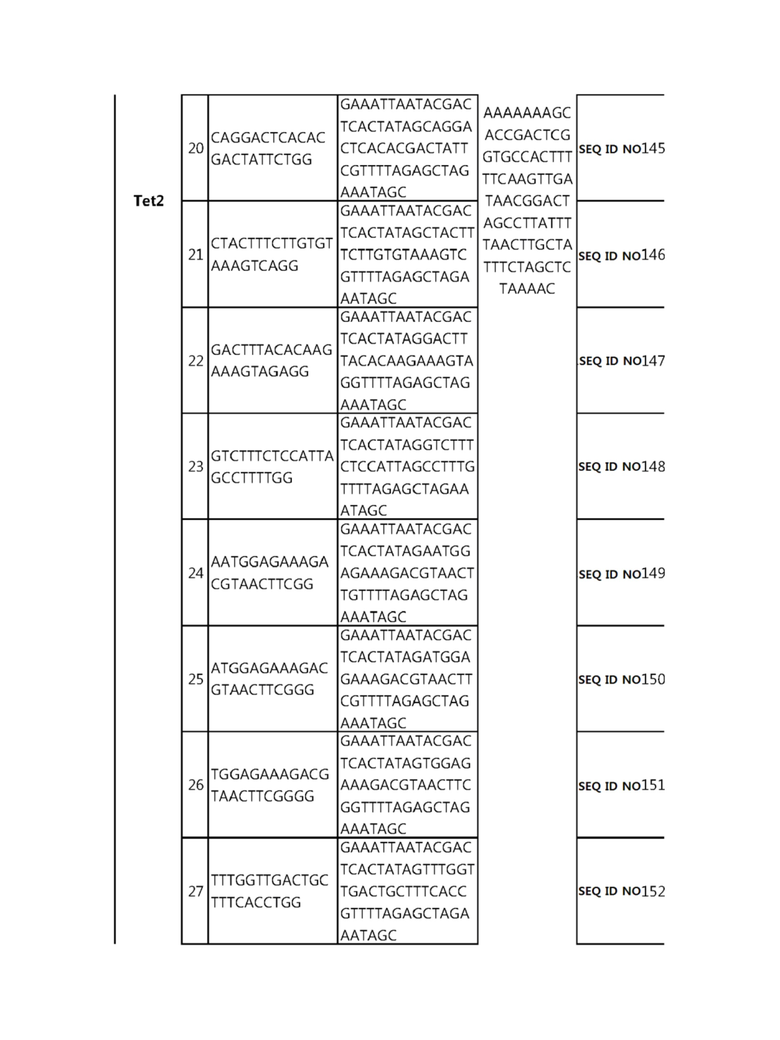
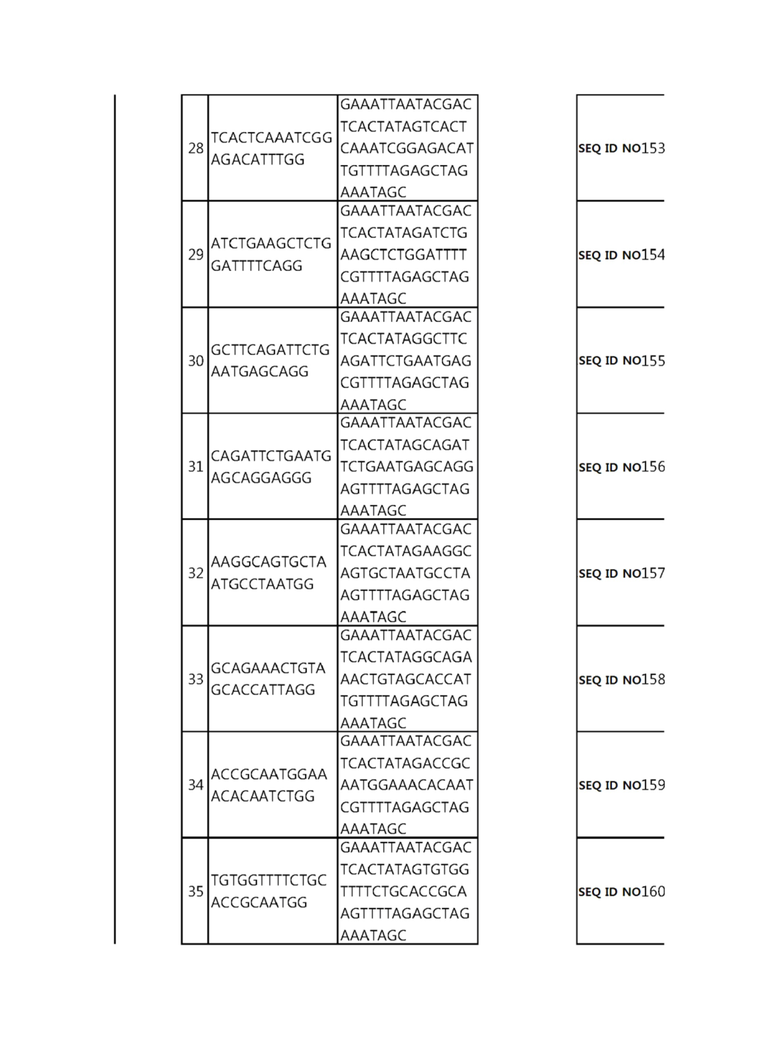
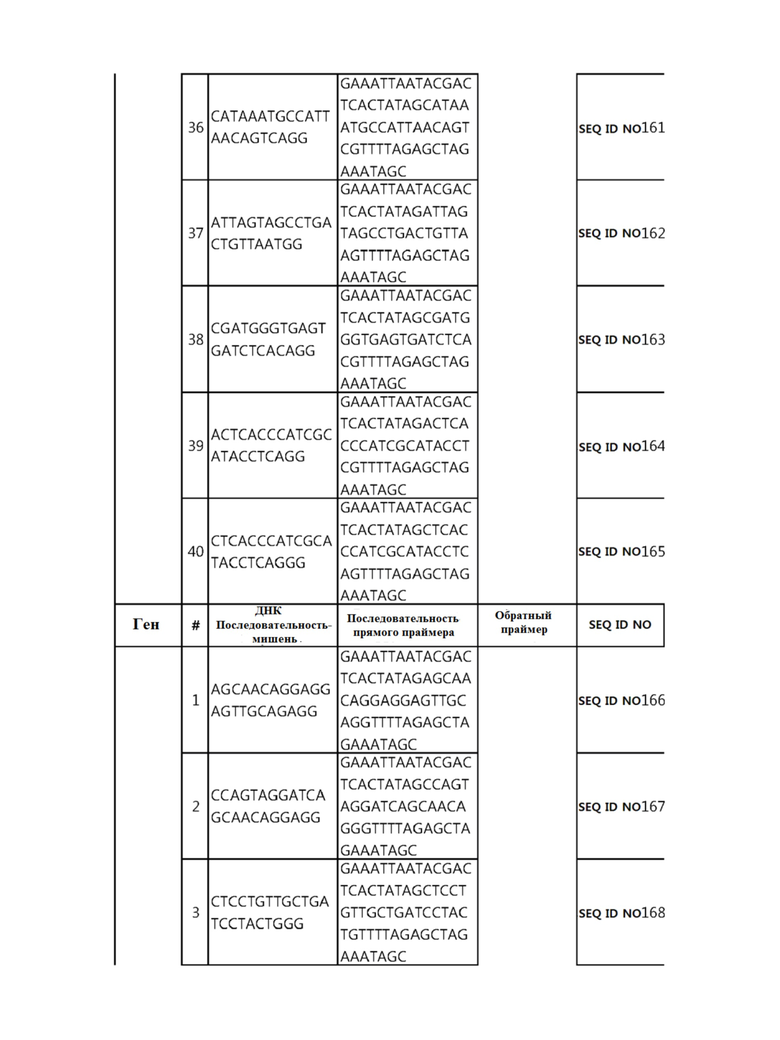
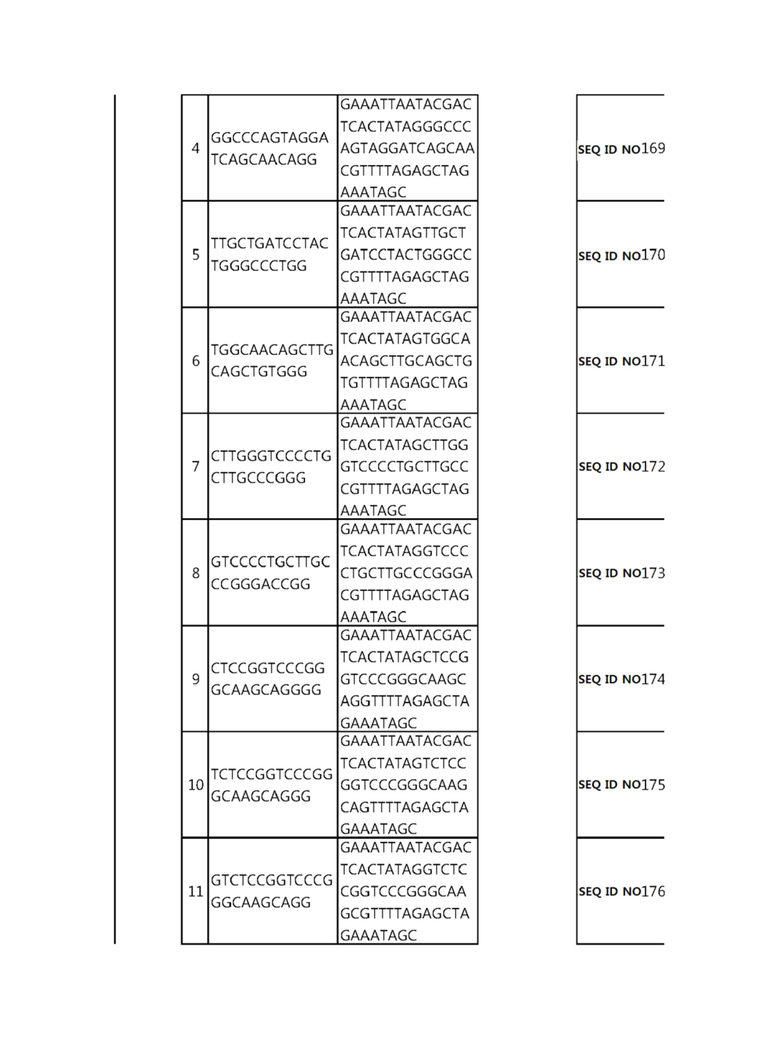
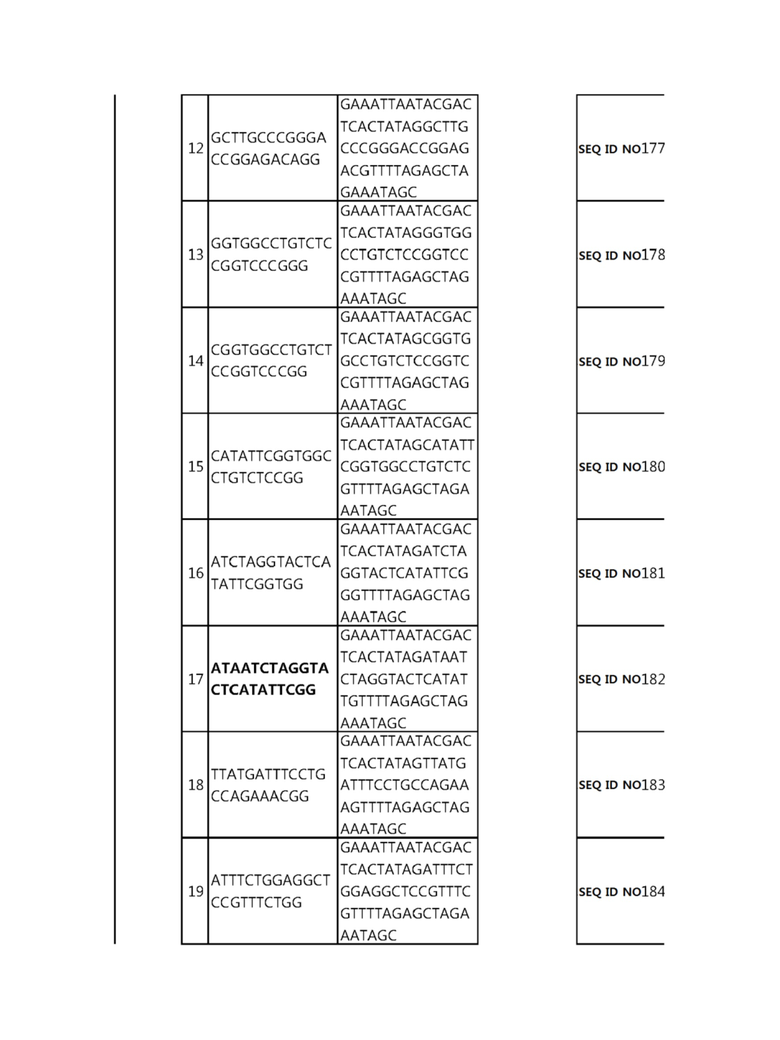

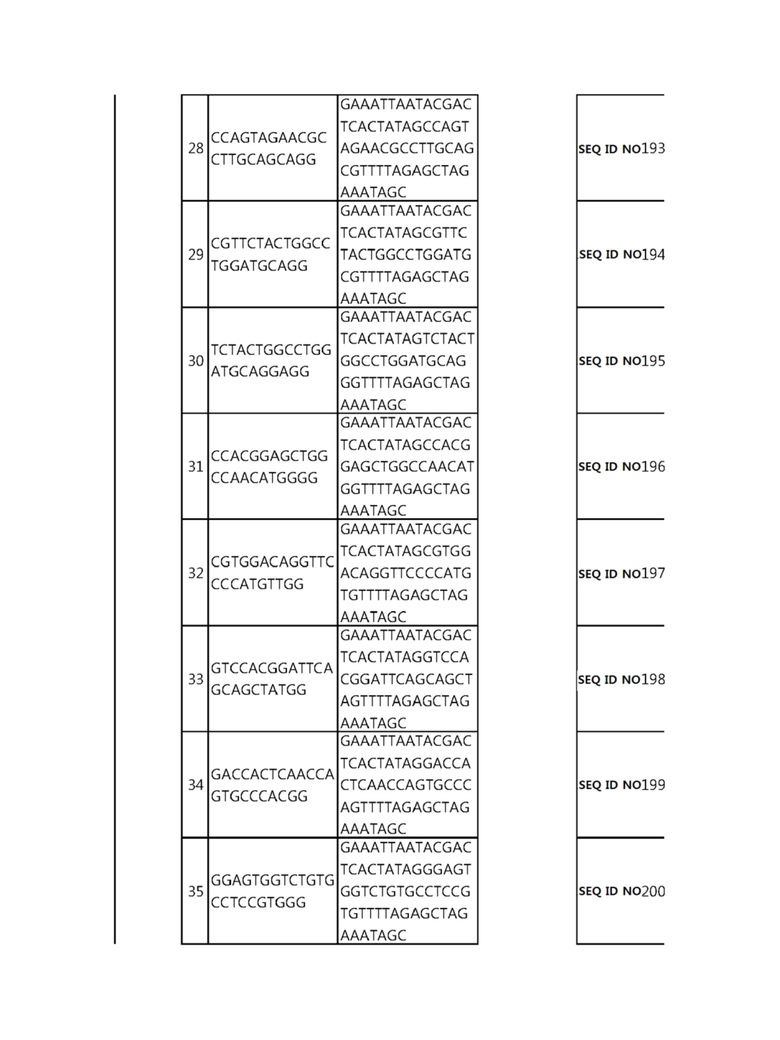
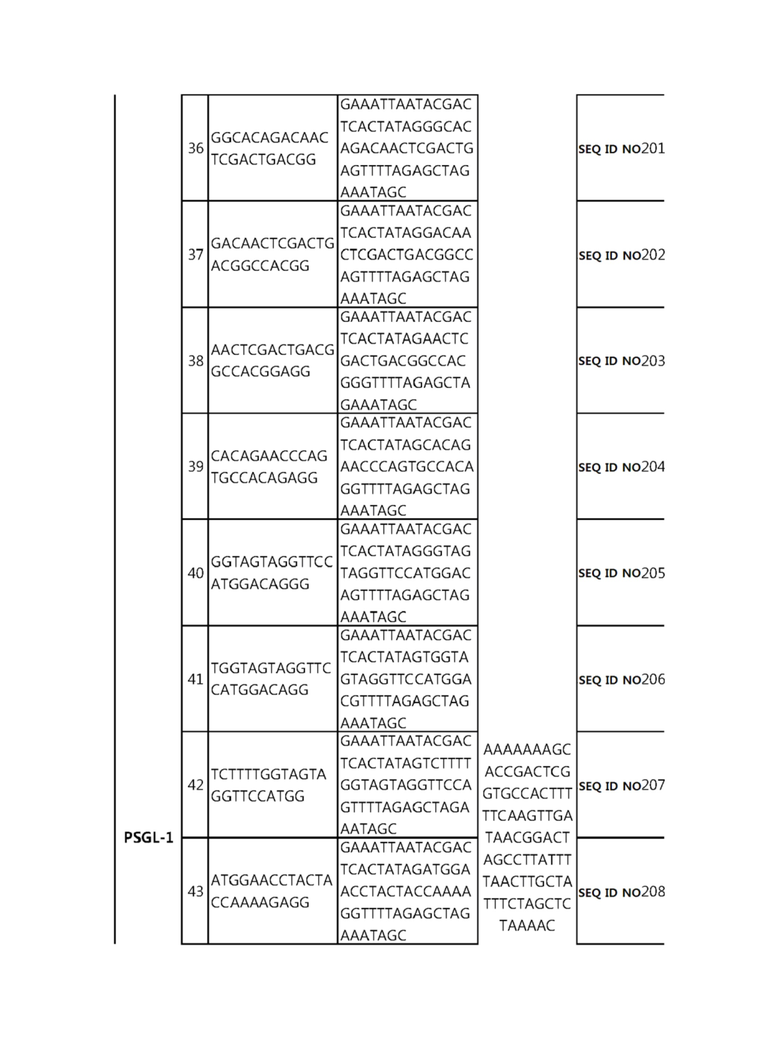
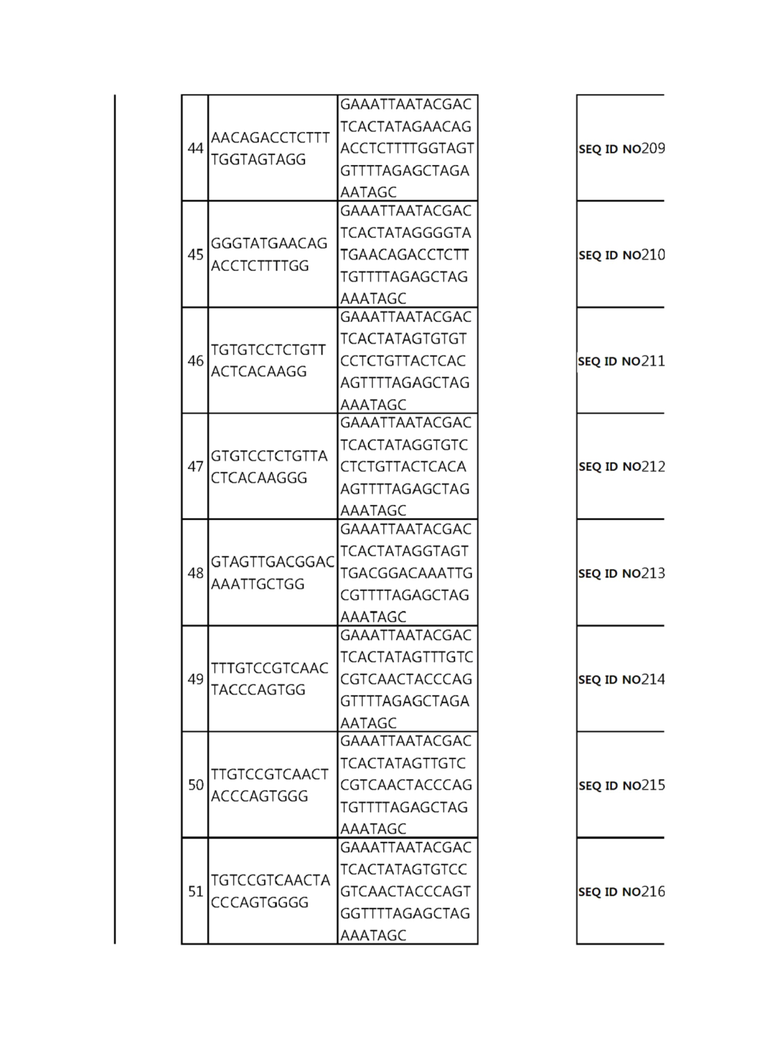
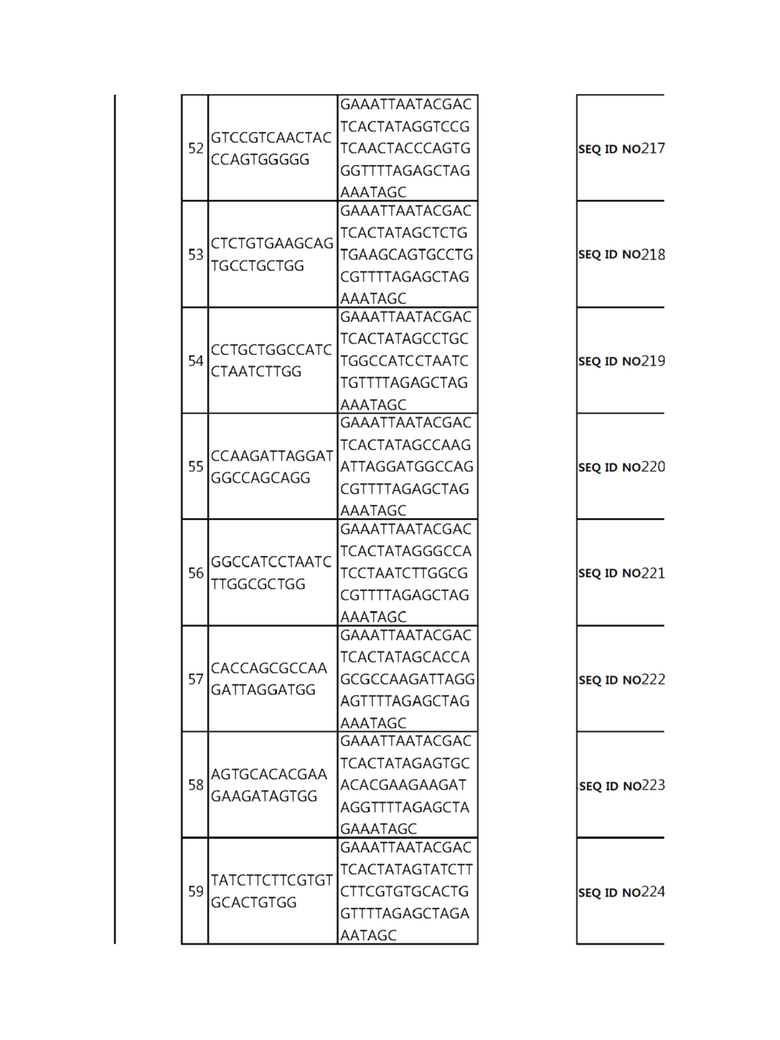
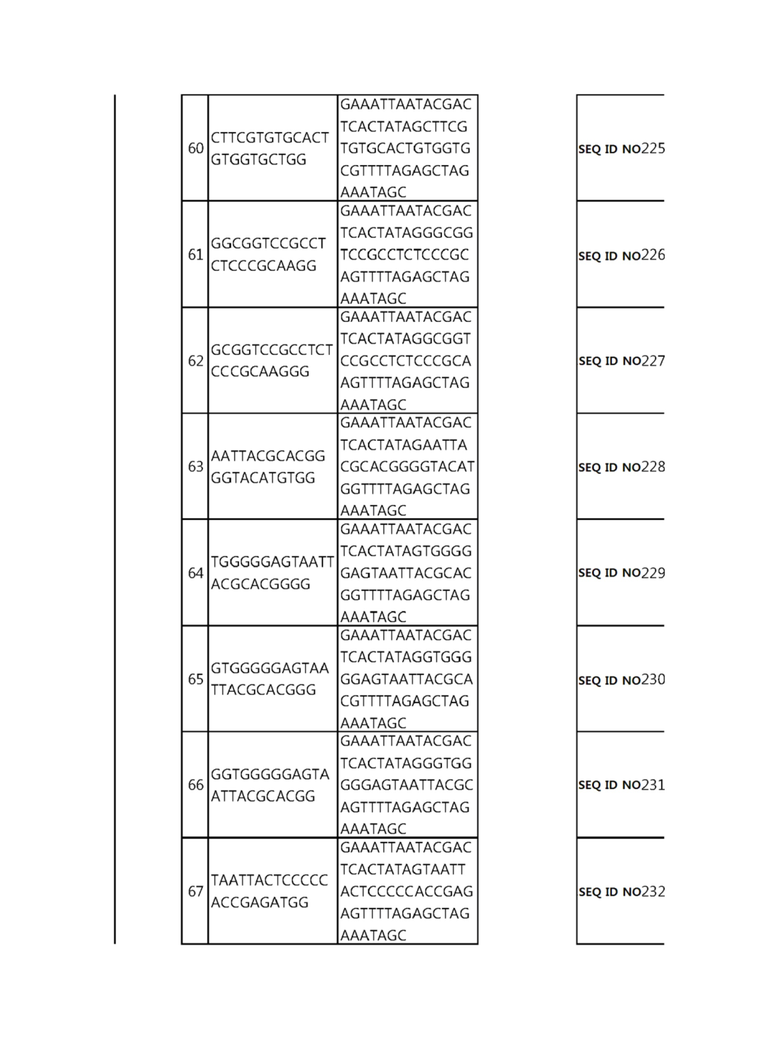
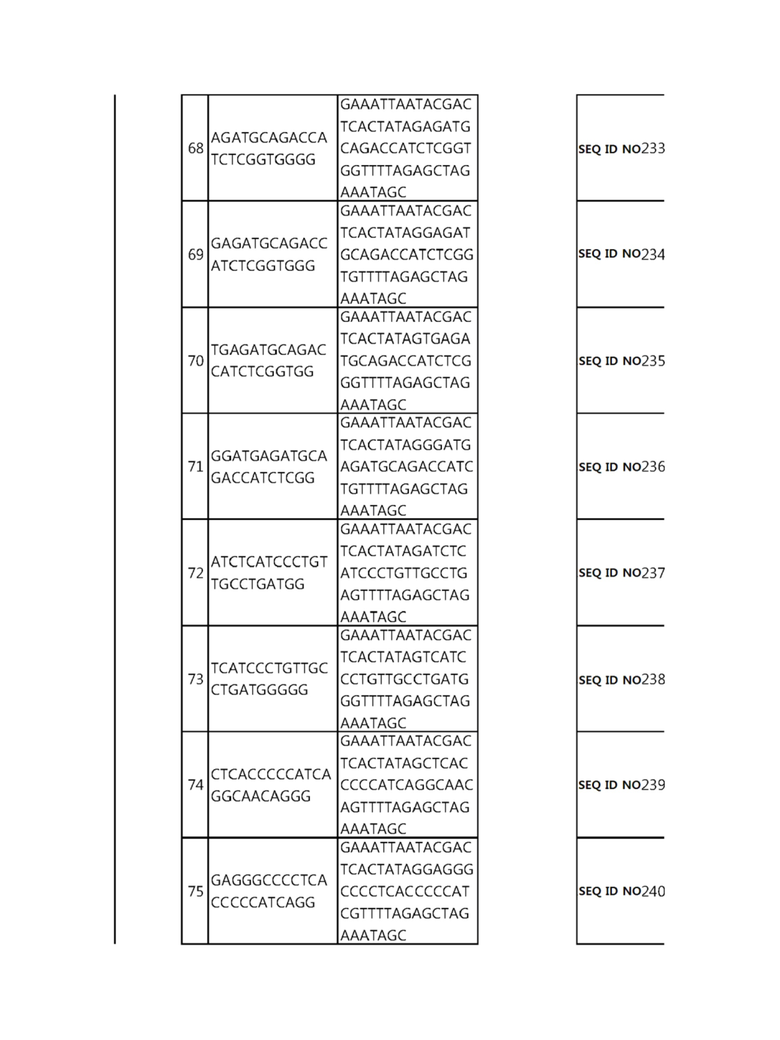
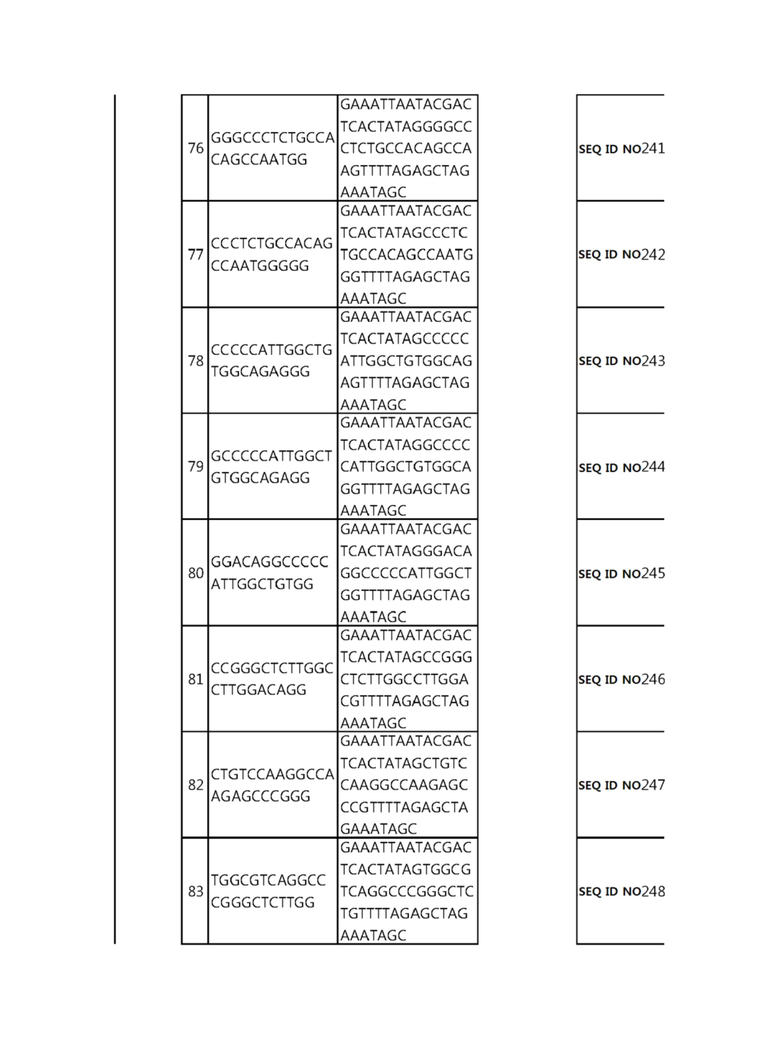
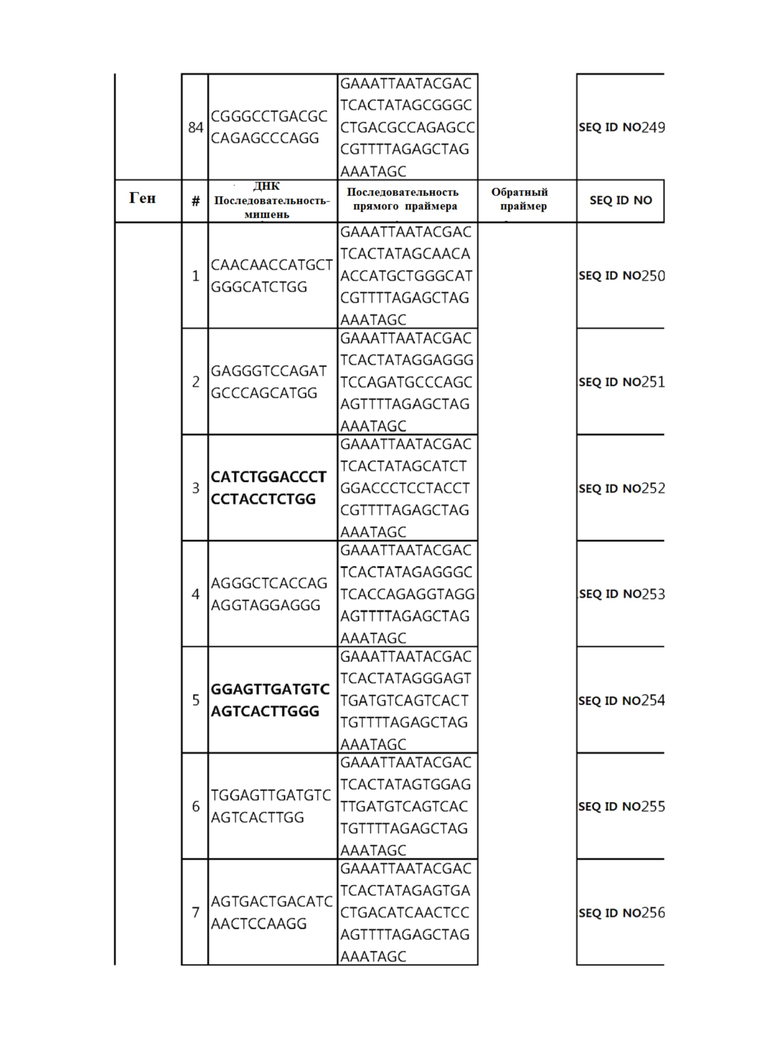
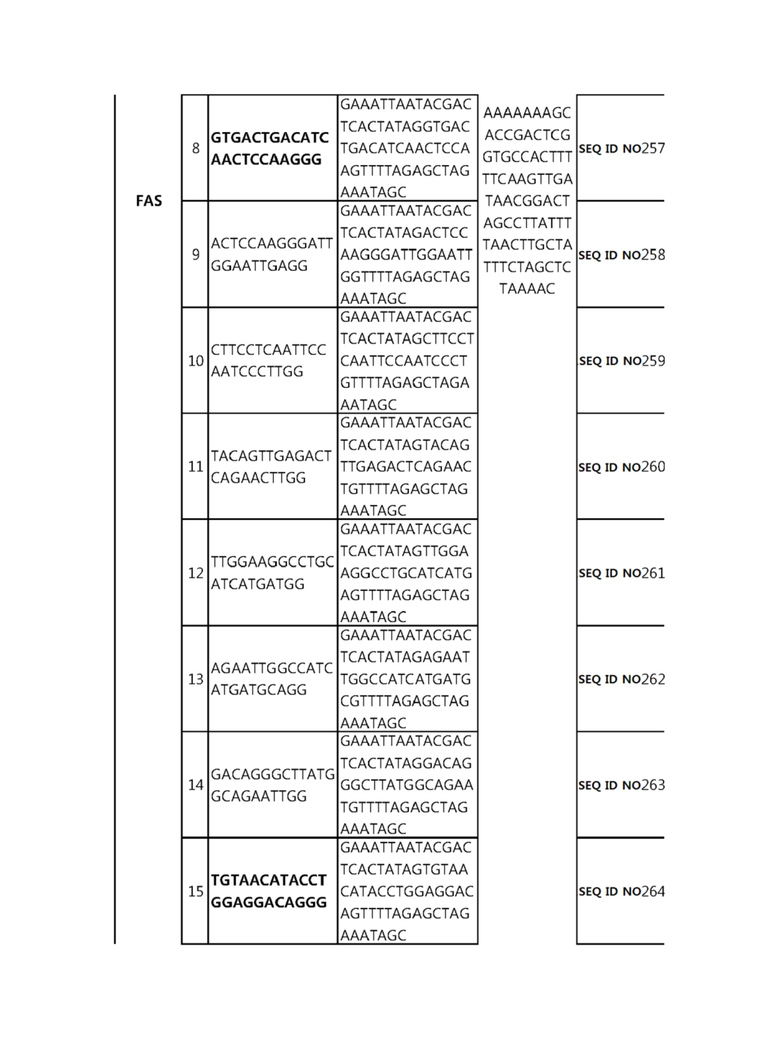
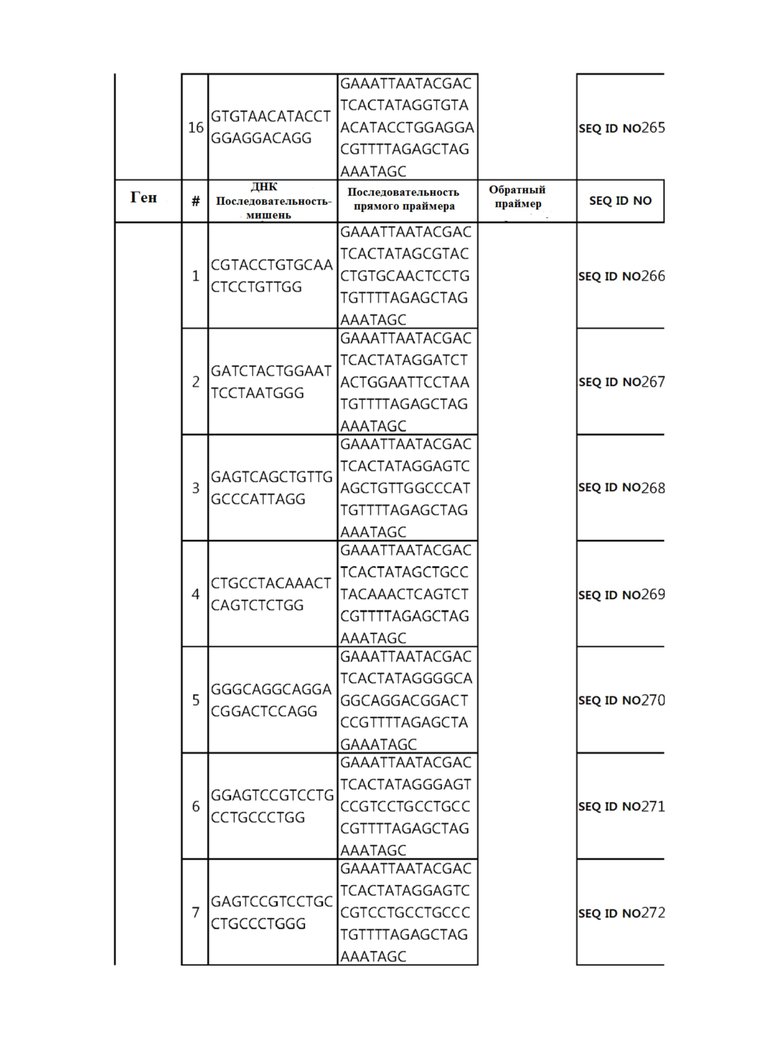
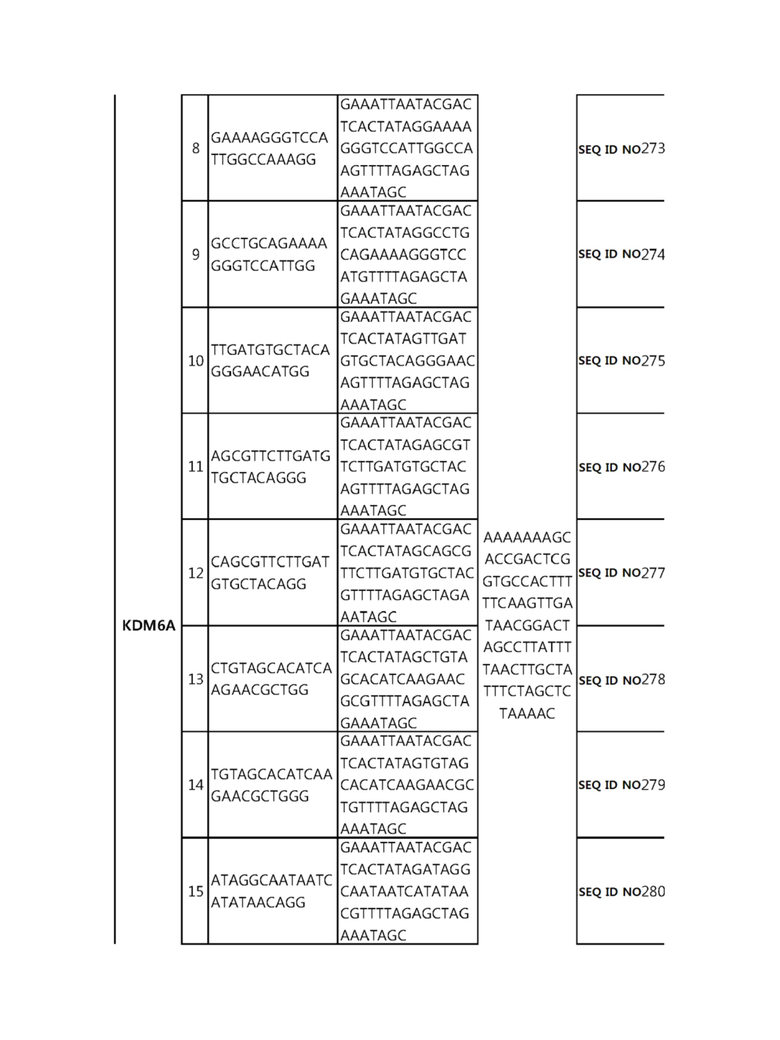
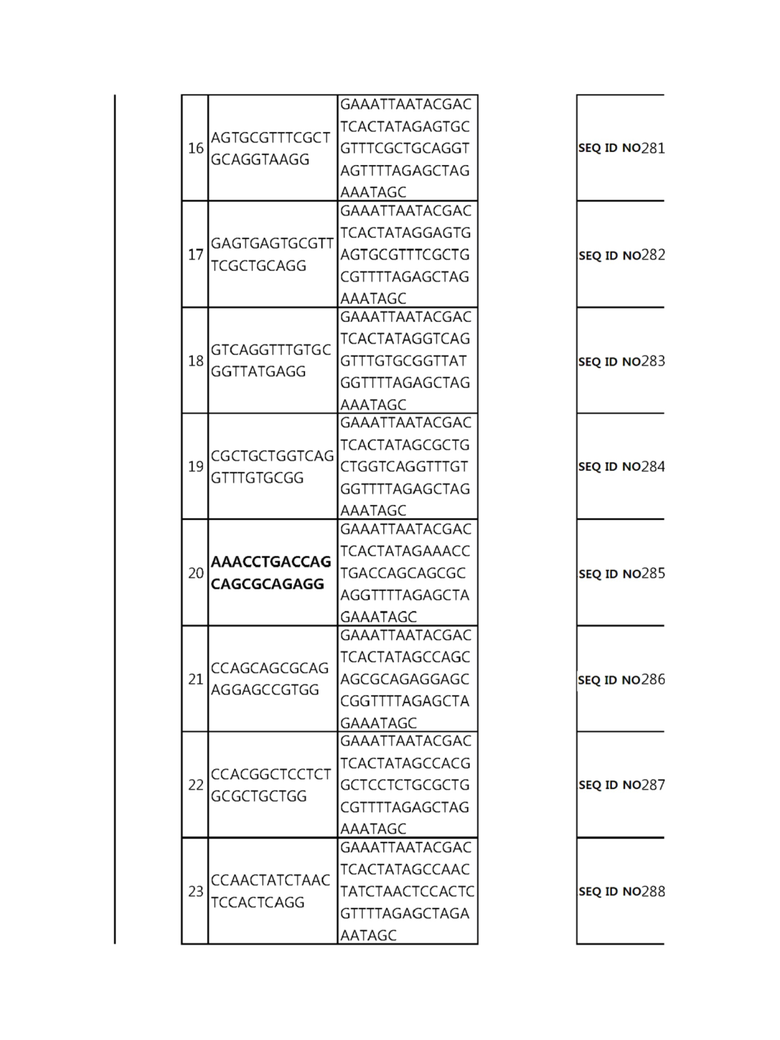

2.3. Глубокое секвенирование
Сайты-мишени и сайты, не являющиеся мишенями, подвергали ПЦР-амплификации до размера 200-300 п.о. с использованием ДНК-полимеразы Hipi Plus (Elpis-bio). ПЦР-продукт, полученный вышеописанным методом, секвенировали на оборудовании Mi-seq. (Illumina) и анализировали с помощью Cas-анализатора CRISPR RGEN (www.rgenome.net). Инсерции/делеции в 5 п.о. от сайта расщепления CRISPR/Cas9, рассматривались как мутация, индуцированная RGEN.
Как показано в Таблице 4 и в Таблице 6, в результате глубокого секвенирования было подтверждено, что при доставке CRISPR-Cas9 в различных иммунных клетках наблюдается высокий уровень мутаций INDEL.
Пример 3: Получение оцрРНК
3.1. Скрининг оцрРНК в клетках Jurkat
Активность оцрРНК, нацеленных на экзоны A20, DGKα, EGR2, PPP2R2D, EGR2, PPP2r2dPPP2R2D, PD-1, CTLA-4, DGKζ, PSGL-1, KDM6A, FAS и TET2TET2TET2, полученные методом, описанным в Примере 2, тестировали в клетках Jurkat.
Каждую оцрРНК, полученную как описано в Примере 2, тестировали путем сравнения отношения INDEL в клетках Jurkat, трансфецированных Cas9 методом, описанным в Примере 1, и в клетках Jurkat без трансдукции. В таблице 3 показано число сайтов ошибочного спаривания, имеющих одинаковые последовательности-мишени в последовательности-мишени CRISPR/Cas9 и в человеческом геноме, а в Таблице 4 показано отношение INDEL для каждой оцрРНК. Из рРНК, нацеленных на каждый ген, область-мишень ДНК этих генов с хорошей активностью показана жирным шрифтом.
Таблица 3
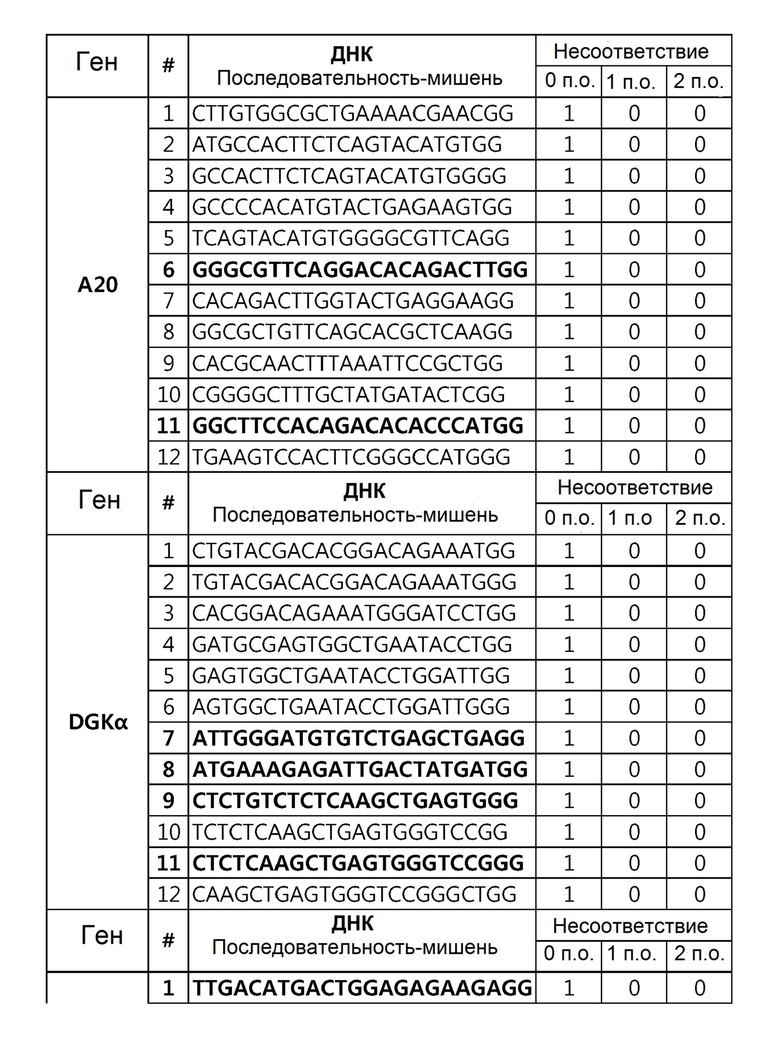
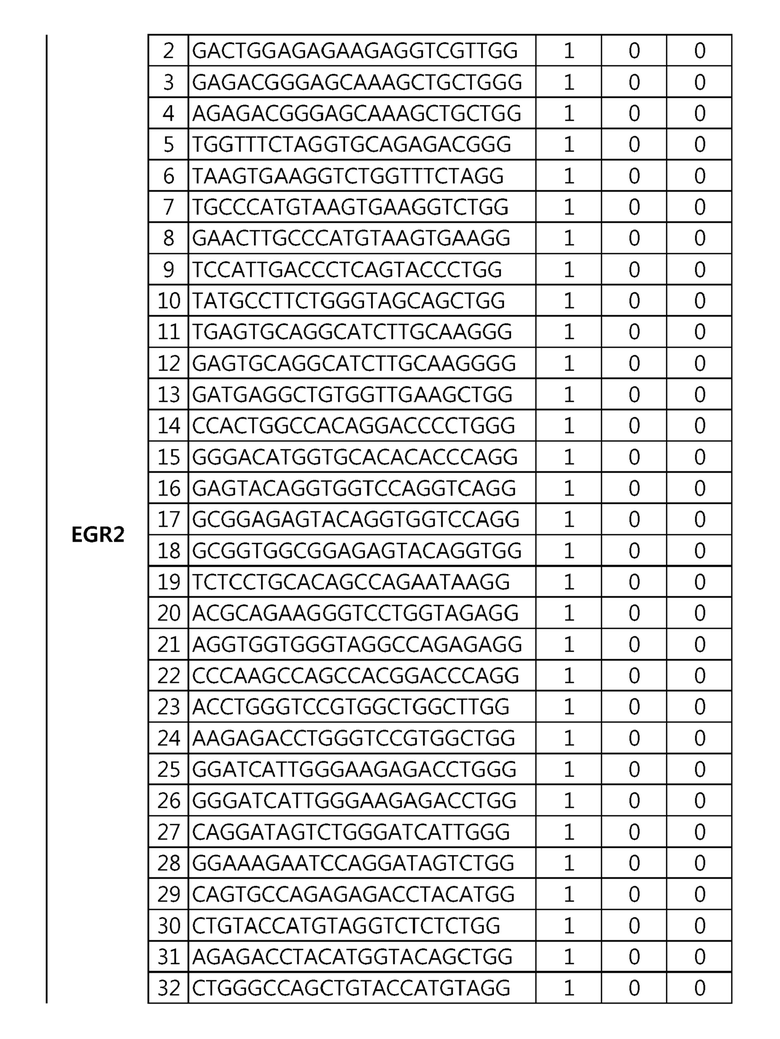
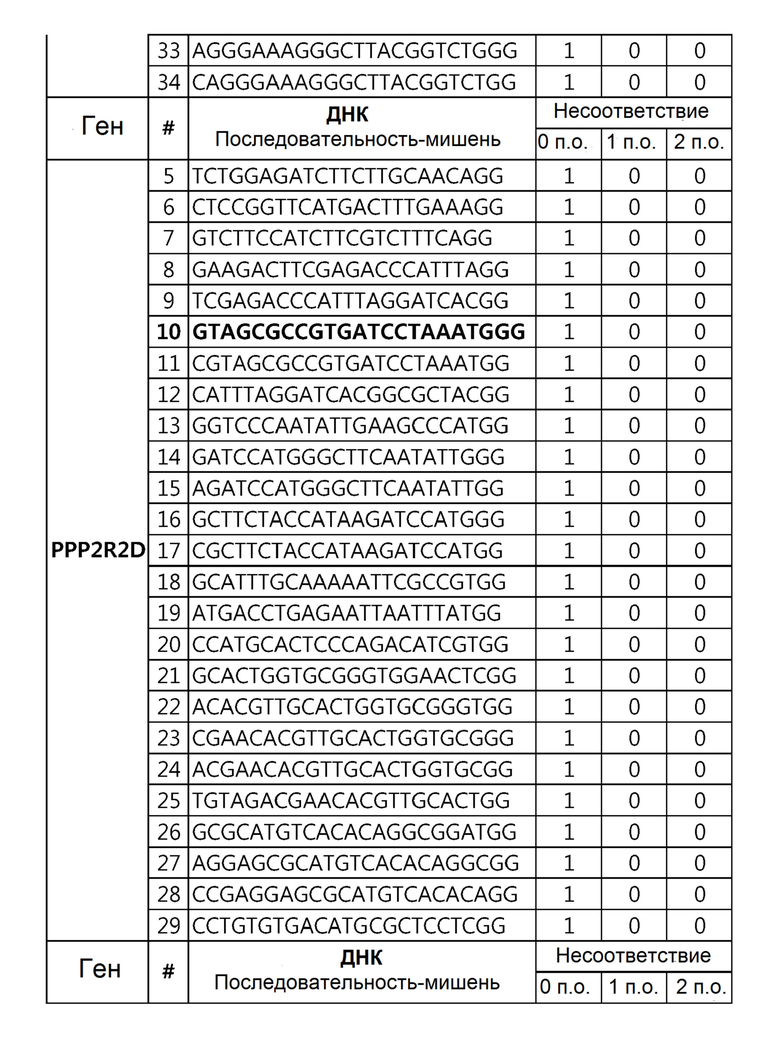

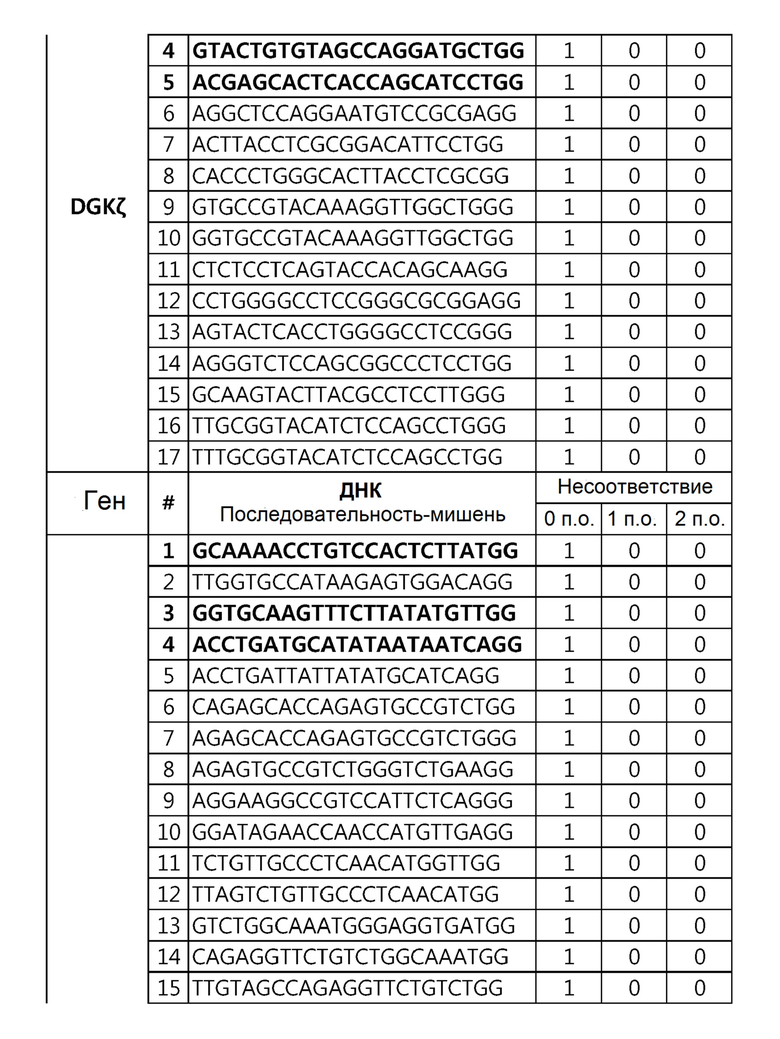
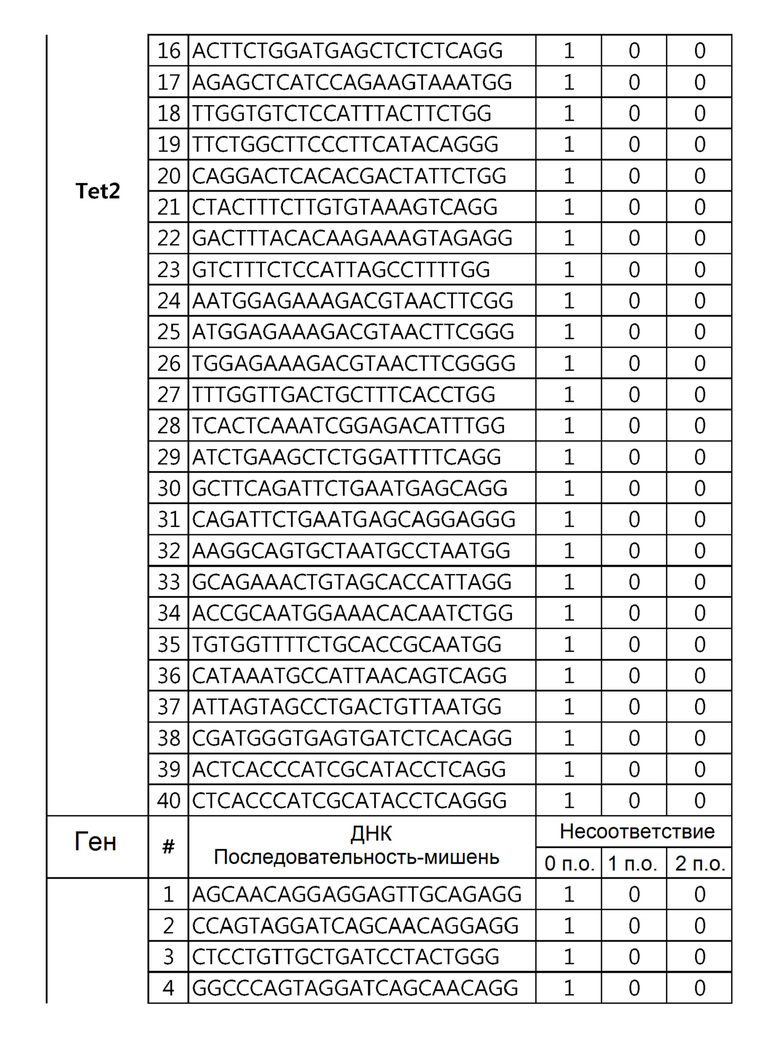
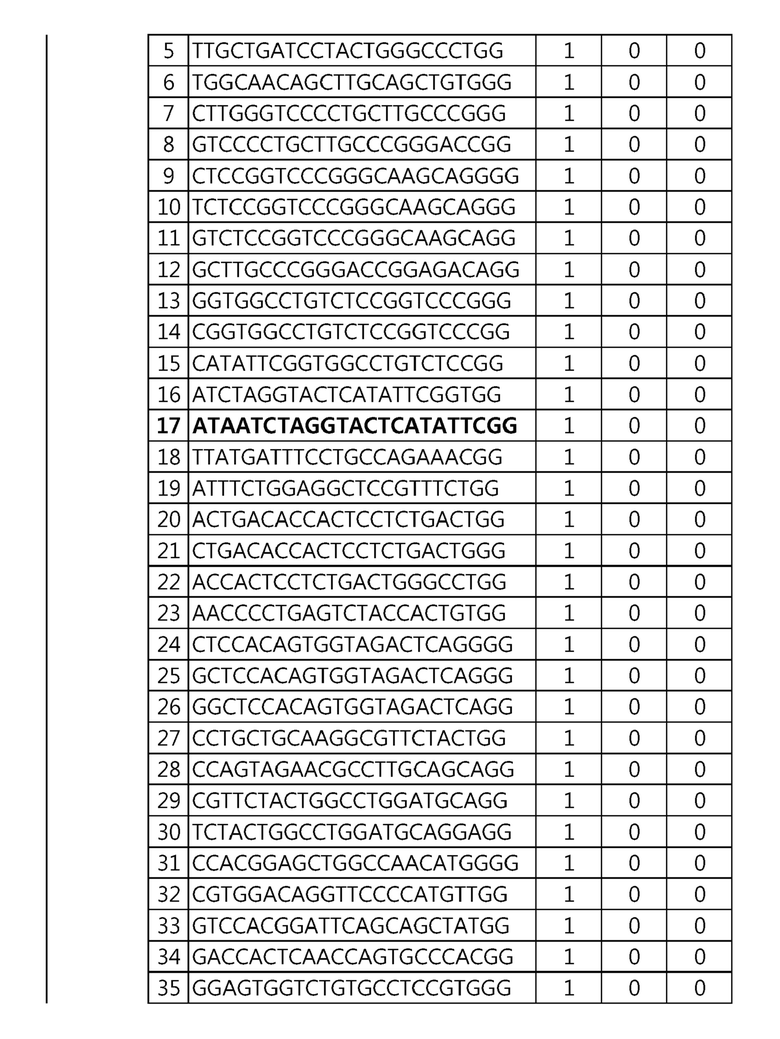
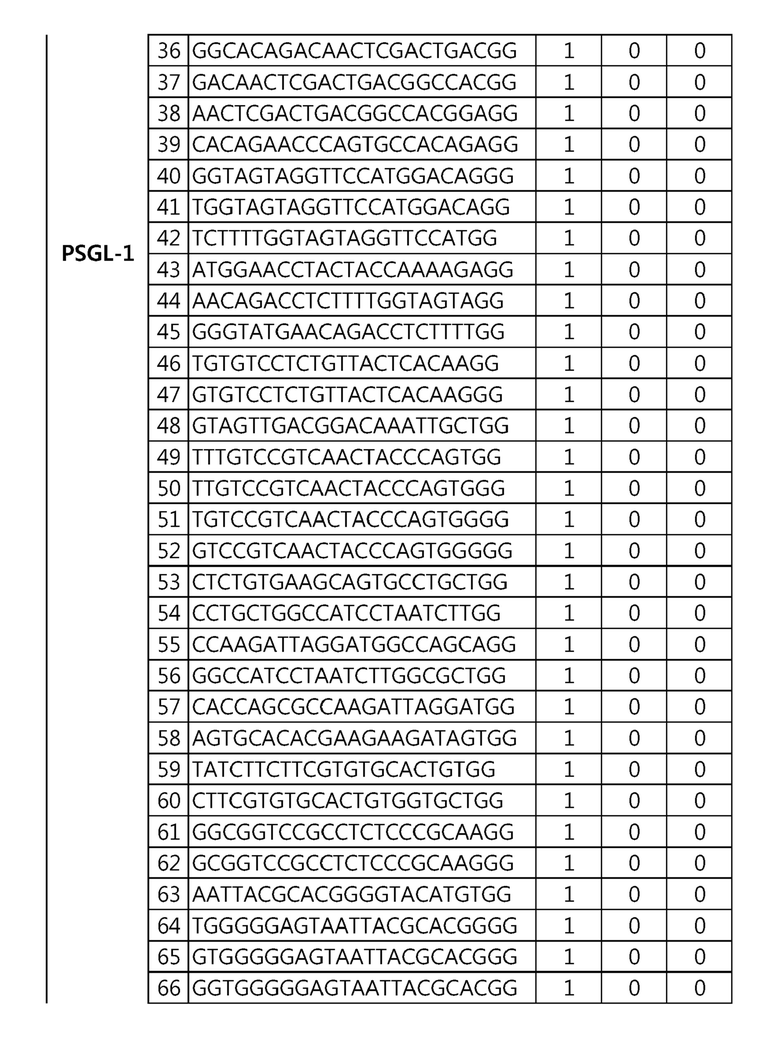
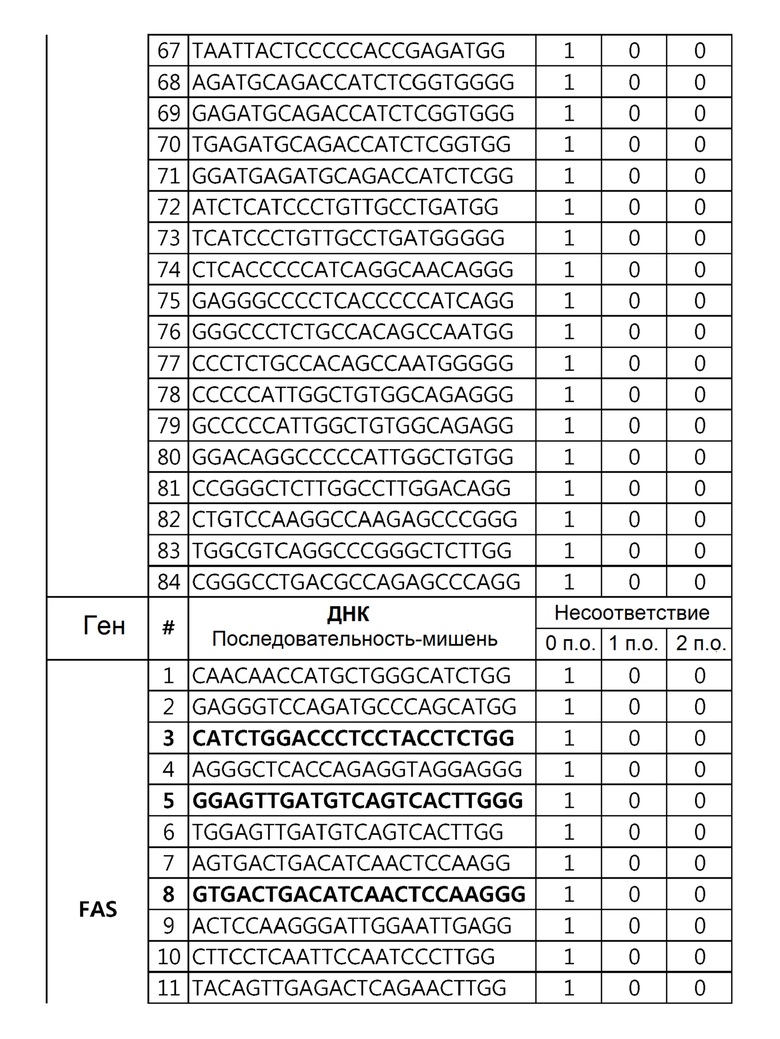
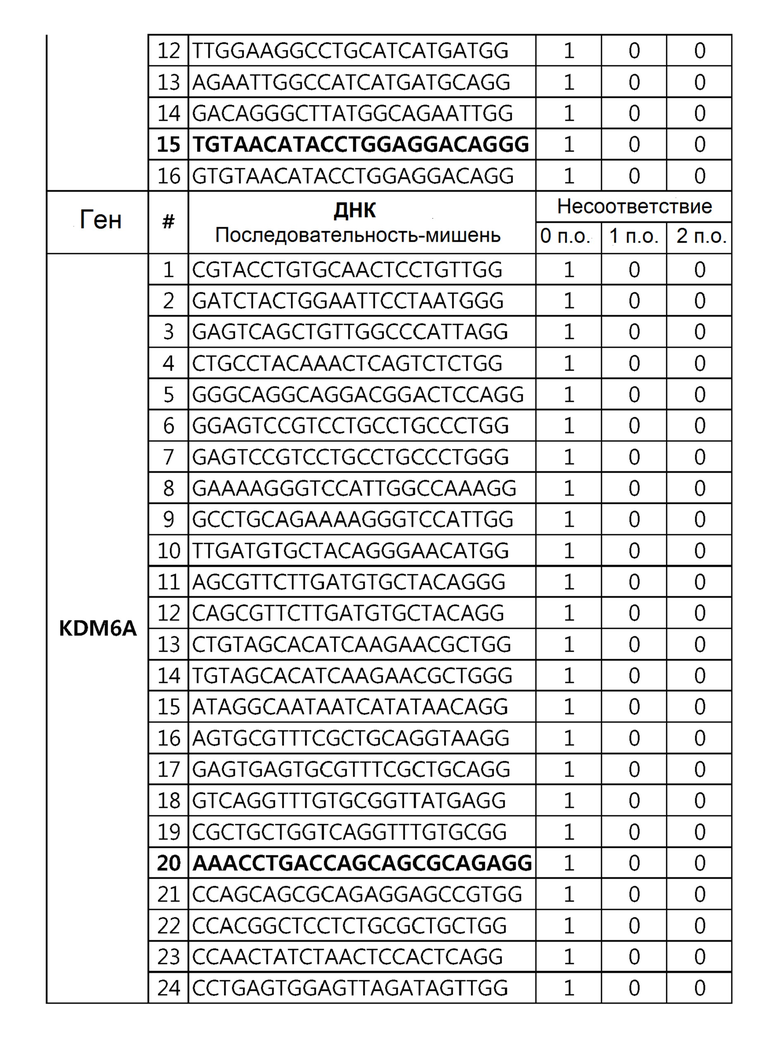
Таблица 4. Активность каждой оцрРНК на клетках Jurkat для последовательности-мишени
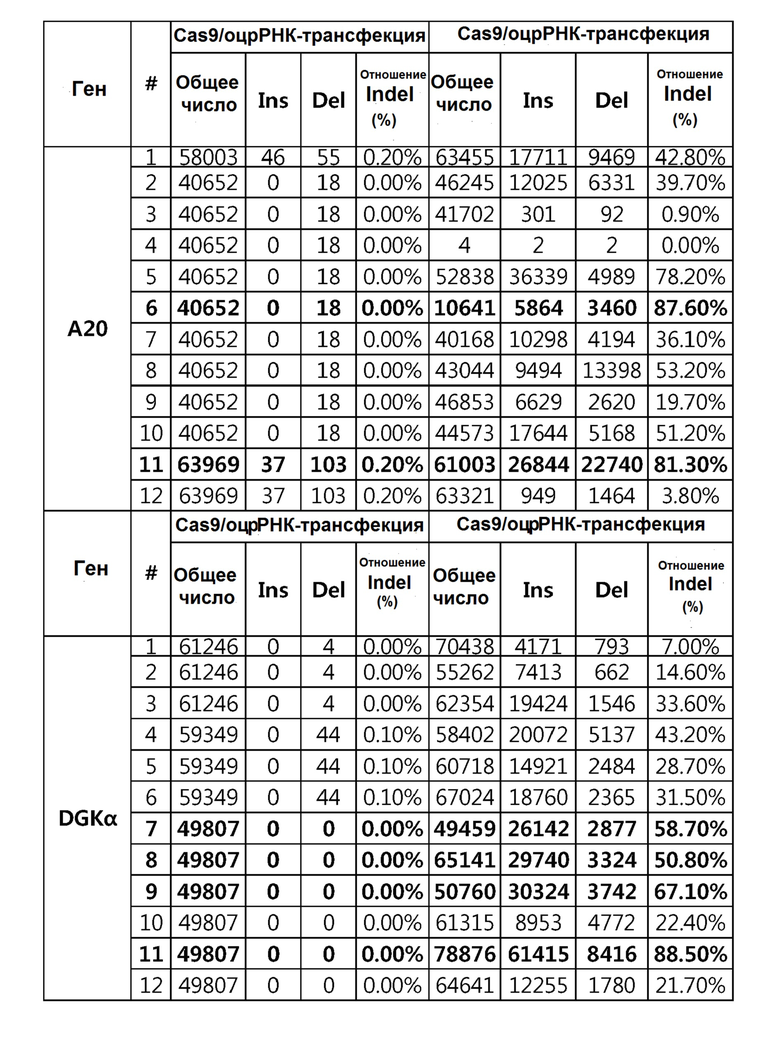
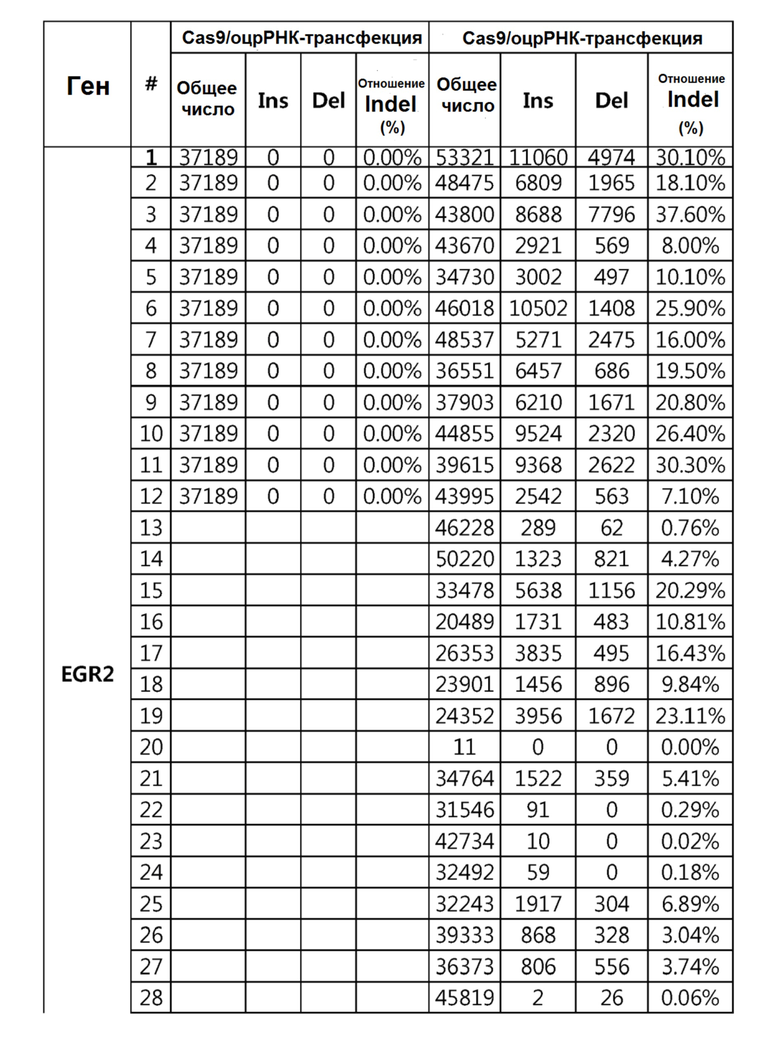
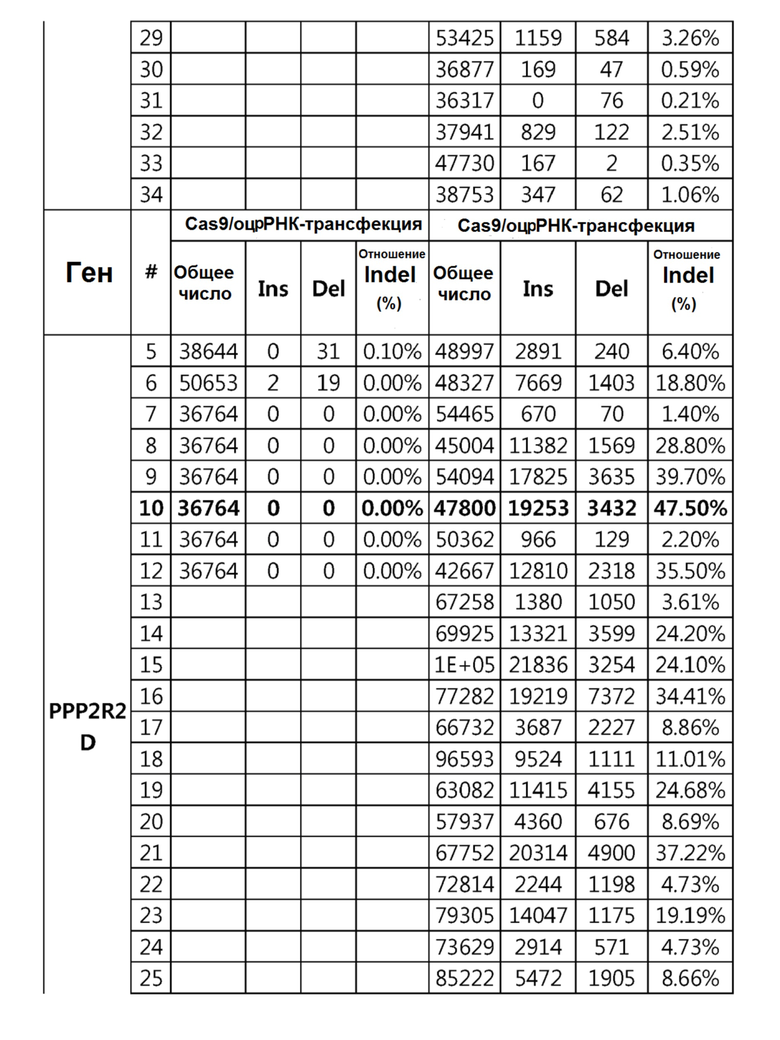


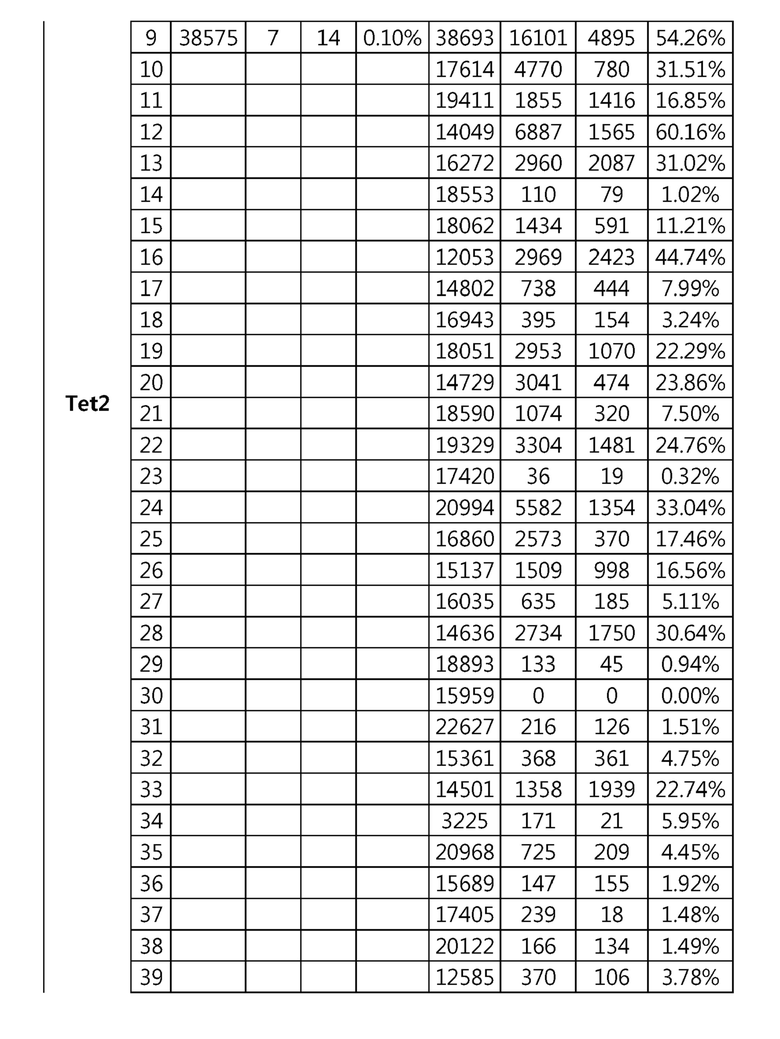
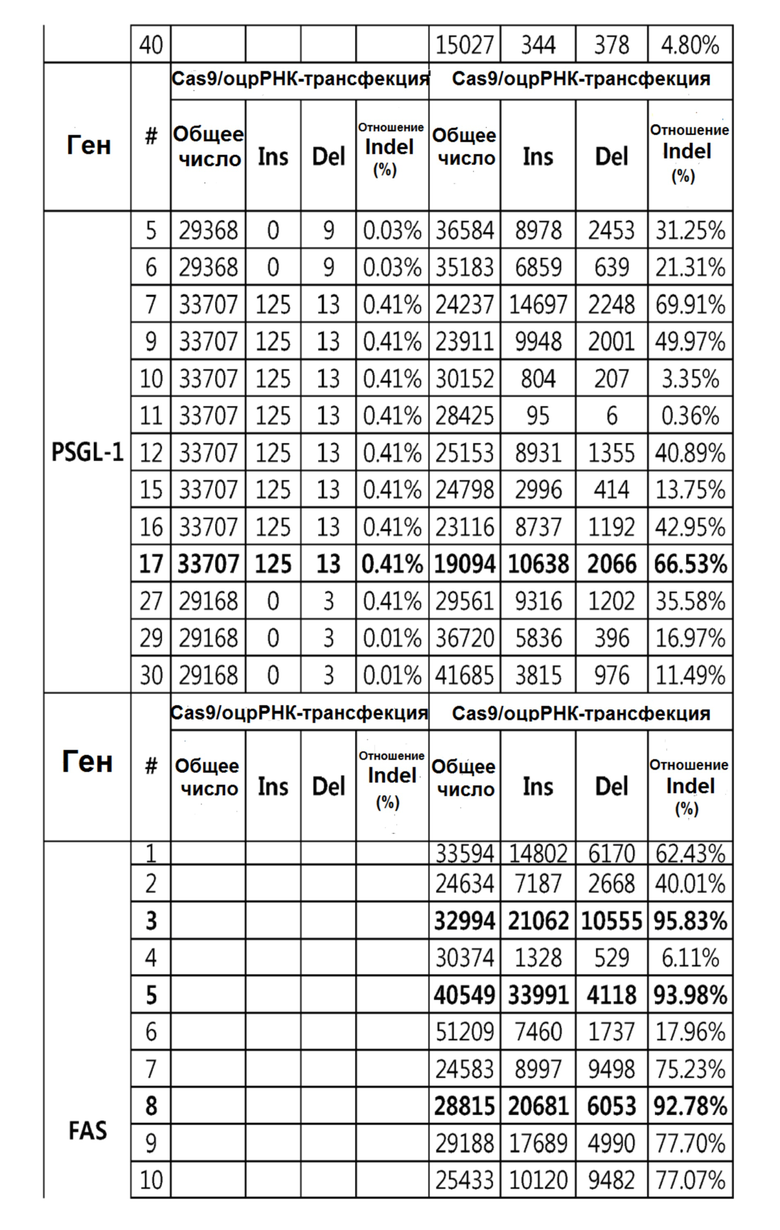
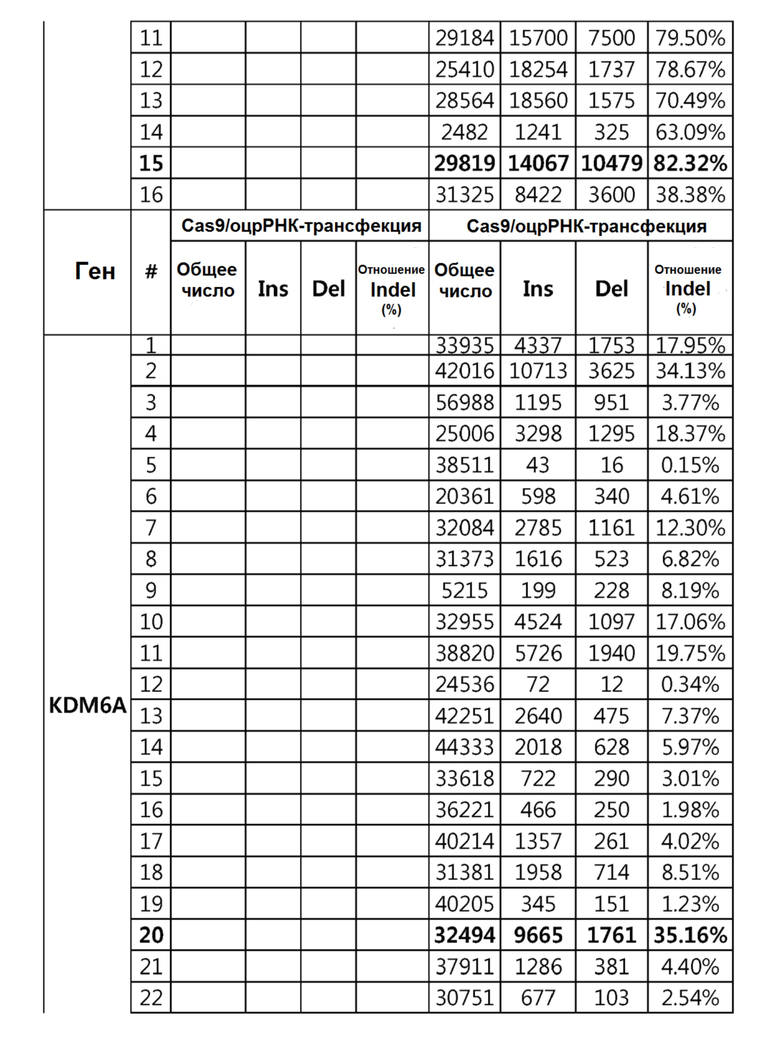
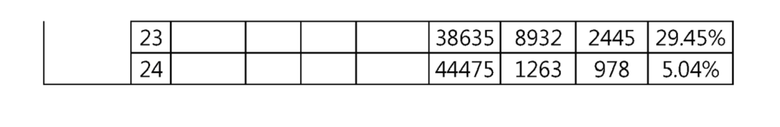
3.2. Отбор оцрРНК в первичных человеческих T-клетках
Исходя из результатов активности оцрРНК в клетках Jurkat, полученных как описано выше в Примере 3.1, оцрРНК с относительно высокой активностью в клетках Jurkat (см., в таблице 3 и в таблице 4 жирным шрифтом) отбирали для тестирования в первичных человеческих T-клетках.
Одиночные или двойные рРНК и Cas9 переносили в первичные человеческие Т-клетки. Протестированные последовательности-мишени CRISPR/Cas9 представлены в Таблице 5, а отношения INDEL в оцрРНК систематизированы в Таблице 6, соответственно.
Таблица 5. Последовательности-мишени и несоответствия в первичных человеческих T-клетках
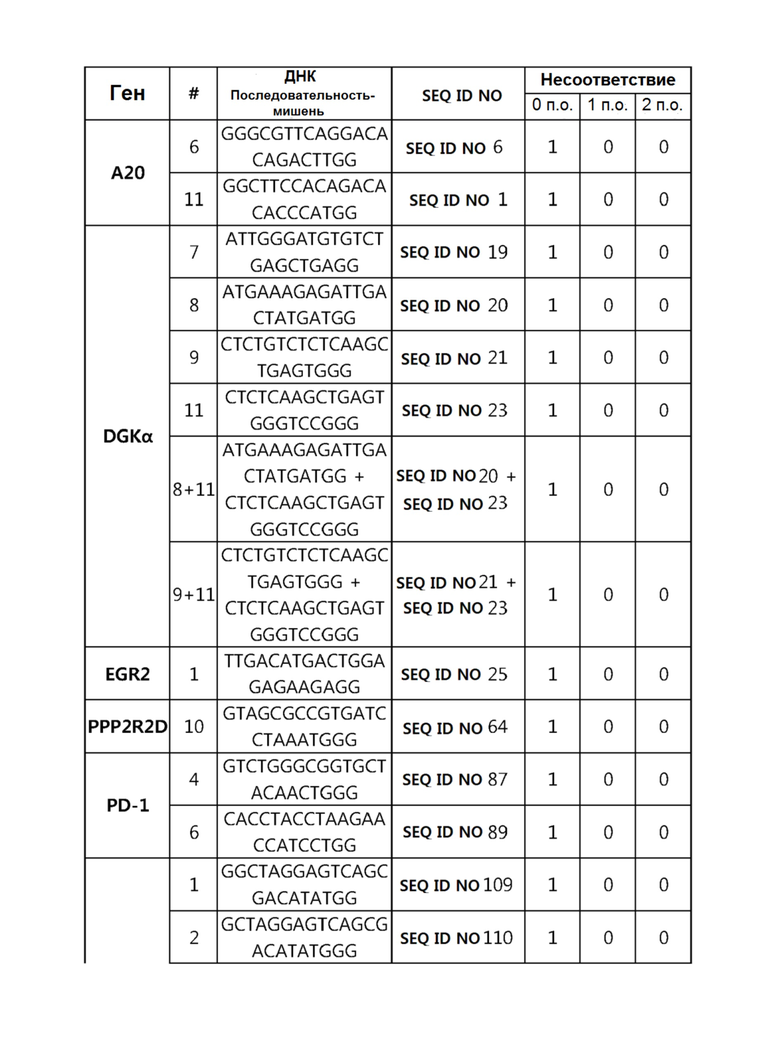

Таблица 6. Активность каждой рРНК на последовательности-мишени в первичных человеческих иммунных T-клетках
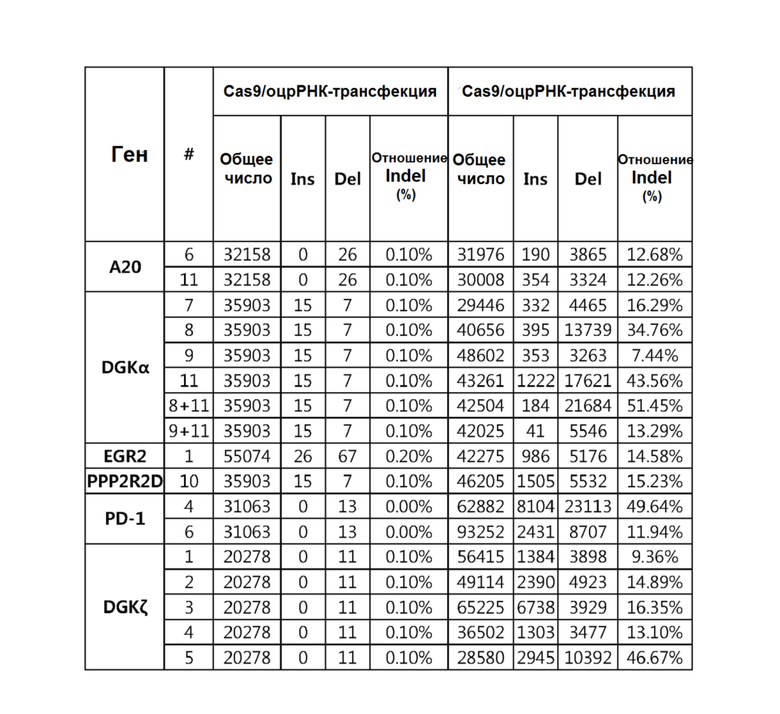
Аналогичным образом, исходя из результатов активности оцрРНК в клетках Jurkat, полученных как описано выше в Примере 3.1, оцрРНК PSGL-1 #17, обладающая относительно высокой активностью в клетках Jurkat, была отобрана для тестирования ее активности в первичных человеческих Т-клетках.
Кроме того, активированные первичные человеческие T-клетки трансфецировали 4 мкг белка SpCas9 и 1 мкг in vitro транскрибированной и ЩФ-обработанной оцрРНК посредством электропорации (Neon, Thermo Scientific). Через пять дней, гДНК выделяли и экстрагировали из каждой T-клетки и эффективность INDEL анализировали путем глубокого секвенирования мишеней (фиг. 18 A). Кроме того, экспрессию PSGL-1 на поверхности T-клеток анализировали с помощью проточной цитометрии (Attune Flow cytometry, Thermo Scientific) для подтверждения нокаута PSGL-1 (фиг. 18 B, C).
На фиг. 17a-17c показаны результаты скрининг-анализа оцрРНК hPSGL-1 в клетках Jurkat. На этих чертежах представлены графики, иллюстрирующие эффективность INDEL и количество клеток Jurkat, не экспрессирующих PSGL-1 (hPSGL-1-негативных клеток) после нокаута (17a); и уровень экспрессии PSGL-1 на поверхности клеток Jurkat после нокаута (17b, 17c).
На фиг. 18 показаны результаты экспериментов по нокауту (KO) hPSGL-1 в первичных человеческих T-клетках, где на (A) показана эффективность INDEL, на (B) показано количество Т-клеток, не экспрессирующих PSGL-1 после нокаута, а на (C) показан уровень экспрессии PSGL-1 на поверхности T-клеток после нокаута. В результате было подтверждено, что PSGL-1 эффективно подвергался нокауту после доставки комплекса белка Cas9 и рРНК, в результате чего, PSGL-1, который представляет собой поверхностный белок, не мог быть идентифицирован с помощью проточной цитометрии.
Пример 4: Активация клеток Jurkat и стимуляция секреции цитокинов
В клетках Jurkat, в которые вводили белок Cas9 и оцрРНК, геномная последовательность ДНК, соответствующая области-мишени введенной оцрРНК, расщеплялась, а область, находящаяся рядом с расщепленной последовательностью ДНК, была мутирована путем делеции, инсерции и/или замены посредством NHEJ, что приводило к нокауту гена, в котором находилась расщепленная последовательность ДНК.
Клетки Jurkat, трансфецированные белком Cas9 и оцрРНК путем электропорации, как описано в Примере 1, культивировали в течение 7 дней после электропорации и активировали с использованием CD3-Dynabeads (Miltenyi Biotec) или CD3/28-Dynabeads (Miltenyi Biotec).
Через 24 часа, экспрессию CD25, который представляет собой рецептор IL-2, и уровень высвобождения IFN-гамма, анализировали с помощью проточной цитометрии и ELISA, соответственно.
Сначала, уровень экспрессии CD25, рецептора IL-2, измеряли с помощью проточной цитометрии. Клетки Jurkat, трансфецированные белком Cas9 и оцрРНК, культивировали в течение 7 дней после каждого введения и повторно стимулировали с использованием CD3- или CD3/28-dynabeads (Miltenyi Biotec) в отношении 3:1 (число сфер:клеток), а затем оценивали уровень экспрессии CD25.
Фенотипический анализ осуществляли через 1 день после активации клеток. Клетки, повторно стимулированные сферами (активированные), промывали PBS (забуференным фосфатом физиологическим раствором), в который добавляли 1% (об/об) фетальную бычью сыворотку (FBS), и окрашивали ФЭ-конъюгированным анти-CD25 антителом (BD Bioscience) в течение 30 минут при 4°C.
Полученные клетки промывали и ресуспендировали в PBS, а затем оценивали с помощью проточной цитометрии на BD ACCURI C6 (BD Biosciences), и уровень экспрессии CD25 определяли по средней интенсивности флуоресценции (MFI).
Для сравнения, проточную цитометрию осуществляли таким же способом на клетках дикого типа, в которые не вводили белок Cas9 и оцрРНК, и на клетках, которые не обрабатывал CD3- или CD3/28- dynabeads.
Полученный уровень экспрессии CD25 (CD25 MFI) представлен на фиг. 1-4.
На фигуре 1 показана MFI CD25 в клетках, где ген DGK-альфа был нокаутирован с использованием оцрРНК (#11; DGK-альфа был обозначен #11) для DGK-альфа.
На фигуре 2 показана MFI CD25 в клетках, где ген A20 был нокаутирован с использованием оцрРНК (#11; A20 был обозначен #11) для А20.
На фигуре 3 показана MFI CD25 в клетках, где ген EGR2 был нокаутирован с использованием оцрРНК (#1; EGR2 был обозначен #1) для EGR2, и
На фигуре 4 показана MFI CD25 в клетках, где ген PPP2R2D был нокаутирован с использованием оцрРНК (#10; PPP2R2D был обозначен #10) для PPP2R2D, соответственно.
Как показано на фиг. 1-4, в случае клеток, которые не были обработаны CD3- или CD3/28-dynabeads, присутствие или отсутствие нокаута генов не влияло на уровень экспрессии CD25, тогда как в случае клеток, обработанных CD3- или CD3/28-dynabeads, было подтверждено, что уровень экспрессии CD25 был значительно выше в случае нокаута гена по сравнению с геном дикого типа.
Кроме того, уровни секреции IFN-гамма, одного из видов цитокинов, тестировали с помощью ELISA.
Как было описано ранее, после активации повторно стимулированных клеток под действием CD3- или CD3/28-dynabeads в течение 36 часов, культуральную среду собирали и разводили до отношения 1/100 или 1/200 (масс/об) с использованием буфера для разведения (поставляемого в наборе для ELISA, Biolegend), а затем проявляли на окрашивание с использованием набора для ELISA (BioLegend), и количественно оценивали на спектрофотометре (MULTISCAN GO, Thermo Scientific).
Для сравнения, ELISA осуществляли таким же образом на клетках дикого типа, в которые не вводили белок Cas9 и оцрРНК.
Полученные результаты представлены на фиг. 5.
На фигуре 5 показаны: уровень IFN-гамма в клеточной культуральной среде, где ген DGK-альфа был нокаутирован с использованием оцрРНК (#11; DGK-альфа был обозначен #11) для DGK-альфа; уровень IFN-гамма в клеточной культуральной среде, где ген A20 был нокаутирован с использованием оцрРНК (#11; A20 был обозначен #11) для А20; и уровень IFN-гамма в клеточной культуральной среде, где ген EGR2 был нокаутирован с использованием оцрРНК (#1; EGR2 был обозначен #1) для EGR2 (уровень IFN-гамма выражен в единицах пг/мл).
Как показано на фиг. 5, было подтверждено, что при нокауте генов, количество серетируемого IFN-гамма значительно повышалось по сравнению с количеством, секретируемым генами дикого типа.
Пример 5: Активация первичных человеческих T-клеток и повышение уровня секреции цитокинов
Как и в методе, описанном выше в Примере 4, первичные человеческие T-клетки, трансфецированные белком Cas9 и оцрРНК, активировали CD3-сферами (отношение сфер:клеток составляло 1:1, 2:1 и 3:1, соответственно). Через 2 дня, уровни секреции IFN-гамма и IL-2 оценивали с помощью ELISA (с использованием набора для ELISA-анализа на IFN-гамма или IL-2; Biolegend).
Полученные результаты представлены на фиг. 6 и фиг. 7.
На фигуре 6 показаны: уровень IFN-гамма в клеточной культуральной среде, где ген DGK-альфа был нокаутирован с использованием оцрРНК (#11; DGK-альфа был обозначен #11) для DGK-альфа; уровень IFN-гамма в клеточной культуральной среде, где ген DGK-альфа был нокаутирован с использованием оцрРНК (с использованием комбинации #8 и #11; DGK-альфа был обозначен #8+#11); уровень IFN-гамма в клеточной культуральной среде, где ген DGK-дзета был нокаутирован с использованием оцрРНК (#5; DGK-дзета был обозначен #5) для DGK-дзета; и уровень IFN-гамма в клеточной культуральной среде, где ген A20 был нокаутирован с использованием оцрРНК (#11; A20 был обозначен как А20 #11) для А20 (уровень IFN-гамма выражен в единицах пг/мл).
На фигуре 7 показаны: уровни IL-2 в клеточной культуральной среде, где ген DGK-альфа был нокаутирован с использованием DGK-альфа #11; уровни IL-2 в клеточной культуральной среде, где ген DGK-альфа был нокаутирован с использованием DGK-альфа #8+#11; уровни IL-2 в клеточной культуральной среде, где ген DGK-дзета был нокаутирован с использованием DGK-дзета #5; и уровни IL-2 (выраженные в единицах пг/мл) в клеточной культуральной среде, где ген A20 был нокаутирован с использованием А20 #11 (уровень IL-2 выражен в единицах пг/мл).
На фигурах 6 и 7, «AAVS1» использовали в качестве негативного контроля для клеток, где сайт AAVS1 был расщеплен под действием системы CRISPR.
Как показано на фиг. 6 и 7, при нокауте генов, уровень секреции цитокинов, таких как IFN-гамма и IL-2, значительно повышался по сравнению с генами дикого типа.
Эти результаты, которые указывали на повышение уровня экспрессии CD25 и секреции цитокинов в клетках Jurkat и в первичных человеческих T-клетках, подтвердили, что TCR-опосредуемый сигнал активации повышался при нокауте генов, а иммунная функция T-клеток могла повышаться благодаря повышению активности.
Пример 6: Активация CAR-T-клеток и повышение уровня секреции цитокинов
T-клетки человеческой периферической крови (все T-клетки) закупали у STEMCELL TECHNOLOGIES. Для культивирования клеток использовали среду X-VIVO 15, в которую добавляли 50 ед/мл hIL-2 и 5 нг/мл hIL-7. Анти-CD3/28 Dynabeads (ThermoFisher Scientific) использовали для активации клеток в отношении сфер:клеток=3:1.
После активации в течение 24 часов, T-клетки смешивали с лентивирусом 139-CAR в течение 48 часов на планшетах, покрытых ретронектином. 139-CAR представляет собой CAR, способный специфически распознавать EGFRvIII и индуцировать иммунный ответ. Затем, в клетки вводили 40 мкг рекомбинантного белка Cas9 S. pyogenes (Toolgen, Korea) и 10 мкг химически синтезированной tracr/cr-РНК (Integrated DNA Technologies) путем электропорации с помощью 4D-нуклеофектора (Lonza).
Для проведения экспериментов in vitro, раковые клетки U87vIII, предварительно окрашенные агентом для мечения клеток (ThermoFisher Scientific), совместно культивировали с 139 CAR-T в соответствующих отношениях. В это время, культивирование осуществляли в присутствии 10 нг/мл TGF-β1 или 0,5 мкг/мл PGE2 или в их отсутствии. После совместного культивирования с раковыми клеточными линиями, клетки окрашивали 7-аминоактиномицином D (7-AAD) для проведения экспериментов на цитотоксичность. Окрашенные образцы собирали на цитометре для акустического фокусирования Attune NxT и анализировали с помощью FlowJo.
Цитотоксичность вычисляли по формуле [(% лизиса образца - % минимального лизиса)/(% максимального лизиса [100%] - % минимального лизиса] × 100%. Кроме того, супернатанты совместных клеточных культур также анализировали с помощью набора для ELISA (Biolegend) для определения содержания IL-2 и IFN-γ. Для проведения эксперимента по пролиферации 139 CAR-T-клеток, 139 CAR-T-клеток, окрашенных реагентом CellTrace, совместно культивировали с раковой клеточной линией-мишенью U87vIII, а затем оценивали степень разведения реагента для мечения клеток с помощью проточной цитометрии для 139 CAR-T-клеток.
В соответствии с протоколом эксперимента (фиг. 8a, A), эффект INDEL для DGKα и DGKζ составлял 75,9% и 93,5%, соответственно, на 139 CAR-T-клетках, доставляемых с использованием одного комплекса «Cas9/рибонуклеопротеин рРНК» (RNP), нацеленного на DGKα или DGKζ (фиг. 8 a, B).
Две рРНК, нацеленные на DGKα или DGKζ, соответственно, вводили в клетки путем электропорации для продуцирования 139 CAR-T-клеток, негативных по двум DGKα или DGKζ. В результате, эффекты INDEL для DGKα и DGKζ составляли 49,2% и 92,4%, соответственно (фиг. 8a, B).
Целевое глубокое секвенирование не подтвердило какого-либо значимого влияния нежелательной мишени на соответствующую рРНК DGKα и DGKζ (фиг. 8b).
Кроме того, было обнаружено, что 139 CAR-T-клеток с нокаутом DGKα, DGKζ и DGKαζ обладали значительно более высокой цитотоксичностью, способностью продуцировать цитокины и способностью к пролиферации по сравнению со 139 CAR-T-клетками, имеющими гены дикого типа (фиг. 9a A,B и фиг. 9b).
Интересно отметить, что 139 CAR-T-клеток с нокаутом DGKαζ обладали более высокой способностью высвобождать цитокины по сравнению со 139 CAR-T-клетками с нокаутом либо DGKα, либо DGKζ, что со всей очевидностью указывает на синергический эффект DGKα и DGKζ. Следует отметить, что повышение эффекторных функций таких 139 CAR-T-клеток с нокаутом DGK можно объяснить повышением уровня передачи CD3-концевого сигнала, а именно, увеличением уровня ERK1/2 и высоким уровнем экспрессии CAR после обработки антигеном (фиг. 10A, B).
Кроме того, несмотря на высокоактивированные сигналы в 139 CAR-T-клетках с нокаутом DGK, какого-либо увеличения уровня базальных цитокинов в отсутствии раковых клеток-мишеней не наблюдалось, в результате чего можно предположить о высокой безопасности нокаута DGK (фиг. 11A). Кроме того, уровень экспрессии PD-11 и TIM-33, которые представляют собой маркеры истощения, не повышался в 139 CAR-T-клетках с нокаутом DGK по сравнению с обычными 139 CAR-T-клетками (фиг. 11B). Эти результаты позволяют предположить, что нокаут DGK не стимулирует истощение T-клеток даже после длительной обработки антигеном (фиг. 11B).
Противораковый эффект 139 CAR-T-клеток был заметно снижен после обработки ингибиторами иммуносупрессорного сигнала 1, такими как TGF-β1 и PGE2, тогда как в случае 139 CAR-T-клеток с нокаутом DGKαζ было подтверждено, что цитотоксичность и высвобождение цитокинов сохранялись даже в присутствии факторов ингибирования цитолиза (фиг. 12A, B).
Эти результаты показали, что функция T-клеток может быть активирована посредством инактивации гена DGK с использованием CRISPR/Cas9.
Другими словами, было подтверждено, что инактивация гена DGK может усиливать передачу CD3-концевого сигнала, и тем самым, повышать противораковую функцию CAR-T-клеток и их способность к пролиферации.
Кроме того, CAR-T-клетки с нокаутом DGKαζ (двух изоформ) не обнаруживали значительного увеличения уровня маркеров истощения и были менее чувствительными к иммуносупрессорным факторам цитолиза, таким как TGF-β и простагландин E2 (PGE2).
Таким образом, было подтверждено, что нокаут DGK посредством CRISPR/Cas9 может еще больше усиливать повышенную эффекторную функцию T-клеток.
Пример 7: Активация NK-клеток (природных киллеров) и повышение уровня секреции цитокинов
7.1. Клеточная линия NK 92 и культура первичных человеческих NK-клеток
Клеточные линии NK92 закупали у ATCC (CRL-2407), а первичные NK-клетки закупали у STEMCELL TECHNOLOGY и культивировали в соответствии с описанным протоколом.
Клетки NK92 культивировали в среде RPMI 1640 (WellGene), содержащей 10% FCS (фетальную телячью сыворотку), с добавлением 100 мкг/мл стрептомицина, 100 ед/мл пенициллина, 2 мМ ультраглутамина I, 200-300 ед/мл IL-2 и 10 ед/мл IL-15.
7.2. Введение путем электропорации
Для нокаута DGKα и DGKζ в клеточной линии NK92 проводили электропорацию с помощью электропоратора Neon (Thermo Fisher Scientific) в условиях: 1200 В, 10 мс и 3 импульса. Для первичных NK-клеток электропорацию проводили в условиях: 1200 В, 20 мс и 3 импульса.
4 мкг рекомбинантного белка Cas9 S. pyogenes (Toolgen, Korea) и 1 мкг химически синтезированной tracr-РНК/cr-РНК (Integrated ДНК Technologies) инкубировали в течение 20 минут с получением комплекса Cas9-RNP.
2 × 105 клеток NK92, ресуспендированных в буфере R, добавляли (подвергали контактированию) к предварительно инкубированному комплексу Cas9-RNP для проведения электропорации. После этого, клетки высевали в среду в концентрации 4 × 105 клеток/мл.
Ниже представлены последовательности, нацеленные на cr-РНК и используемые в экспериментах:
DGKα: CTCTCAAGCTGAGTGGGTCC
DGKζ: ACGAGCACTCACCAGCATCC.
7.3. Анализы на цитолиз in vitro
Для анализа на цитотоксичность клеток NK92 и первичных NK-клеток, эти клетки были совместно культивированы с клетками Raji, окрашенными реагентом для мечения клеток, излучающим в дальнем красном диапазоне спектра (Invitrogen) или с 1 × 105 клеток K562 на 96-луночных планшетах с U-образным дном. После совместного культивирования в течение 18 часов, клетки собирали и окрашивали 7-AAD, а затем анализировали с помощью проточной цитометрии. Все эксперименты для анализа на цитотоксичность проводили 3 раза.
Результаты представлены на фиг. 13. Было подтверждено, что эффективность нокаута DGKα (эффективность КО) в клетках NK92 и в первичных NK-клетках была превосходной (фиг. 13 A и B). Кроме того, цитолитическая активность NK-92 была подтверждена путем оценки 7-AAD-позитиыных клеток Raji, что указывало на то, что цитотоксичность повышалась в результате нокаута DGKα.
В частности, эти результаты подтвердили, что иммунная функция может быть эффективно модифицирована против NK-клеток, которые, как известно, трудно поддаются генетической модификации.
Пример 8: Активация NKТ-клеток (природных киллеров) и повышение уровня секреции цитокинов
8.1. Культура NKТ-клеток
Человеческие МКПК закупали у STEMCELL TECHNOLOGY (Канада). Эти клетки высевали в концентрации 2×106 клеток/мл в среду RPMI с 10% FBS, в которую добавляли 1000 ед/мл интерферона-γ (Pepro Tech). 50 нг/мл антитела против человеческого OKT-3 (Biolegend) добавляли в культуральную среду в течение 5 дней, а 400 ед/мл IL-2 (Pepro Tech) добавляли в течение 20 дней.
8.2. Введение путем электропорации
Для нокаута DGKα, DGKζ и PD1 в клеточной линии NKТ проводили электропорацию с помощью электропоратора Neon (Thermo Fisher Scientific) в условиях: 1550 В, 10 мс и 3 импульса.
4 мкг рекомбинантного белка Cas9 S. pyogenes (Toolgen, Korea) и 1 мкг химически синтезированной tracr/cr-РНК (Integrated ДНК Technologies) инкубировали в течение 20 минут с получением комплекса Cas9-RNP.
2 × 105 NKТ-клеток, ресуспендированных в буфере R, добавляли (подвергали контактированию) к предварительно инкубированному комплексу Cas9-RNP для проведения электропорации. После этого клетки высевали в среду в концентрации 4×105 клеток/мл.
Ниже представлены последовательности, нацеленные на cr-РНК и используемые в экспериментах:
DGKα: CTCTCAAGCTGAGTGGGTCC
DGKζ: ACGAGCACTCACCAGCATCC
PD-11: GTCTGGGCGGTGCTACAACTGGG.
8.3. Анализы на цитолиз in vitro
Для анализа на цитотоксичность NKТ-клеток, эти клетки были совместно культивированы с 2×104 клетками U87vIII, окрашенными реагентом для мечения клеток, излучающим в дальнем красном диапазоне спектра (Invitrogen) на 96-луночных планшетах с U-образным дном. После совместного культивирования в течение 18 часов, клетки собирали и окрашивали 7-AAD, а затем анализировали с помощью проточной цитометрии. Все эксперименты для анализа на цитотоксичность проводили 3 раза.
В результате было подтверждено, что нокаут DGKα и DGKζ в человеческих NKT-клетках был эффективно осуществлен посредством системы CRISPR/Cas9, как показано на фиг. 14.
Эффективность INDEL подтверждали путем глубокого секвенирования (фиг. 14A), и CRISPR/Cas9-обработанные NKT-клетки анализировали путем окрашивания трипановым синим для подтверждения хорошего поддержания роста клеток (фиг. 14B) и их жизнеспособности (жизнеспособность=число жизнеспособных клеток/общее число клеток). Кроме того, Вестерн-блот-анализ подтвердил, что нокаут DGKα и DGKζ также был эффективным на белковом уровне (фиг. 14 D).
Кроме того, как показано на фиг. 15, было подтверждено, что нокаут DGKα и DGKζ повышает эффекторную функцию NKT-клеток.
Клетки U87vIII, H460 и K562 обрабатывали реагентом для мечения клеток (Thermo fisher) и культивировали в течение 19 часов в отношении E:T (эффекторные клетки: клетки-мишени), равном 20:1, в 96-луночном планшете. Анализ уровня апоптоза 7-AAD-позитивных раковых клеток, проводимый с помощью проточной цитометрии, показал, что нокаут DGKα и DGKζ способствовал повышению цитолитической активности соответствующих NKT-клеток. Нокаут каждого DGKα и DGKζ также повышал цитолитическую активность, и кроме того, было подтверждено, что цитолитическая активность еще больше повышалась при одновременном нокауте двух генов (фиг. 15 A).
С другой стороны, секрецию IFN оценивали с помощью ELISA (набора для анализа на IFN, Biolegend), и результаты показали, что нокаут DGKα и DGKζ повышал способность соответствующих клеток к высвобождению IFN. Хотя соответствующий нокаут DGKα и DGKζ также давал хороший эффект в отношении повышения уровня секреции IFN, однако, было подтверждено, что секреция IFN еще больше увеличивалась при одновременном нокауте обоих генов (фиг. 15 B).
Кроме того, как показано на фиг. 16, было подтверждено, что CRISPR/Cas9-опосредуемый нокаут PD-1 в человеческих NKT-клетках повышал эффекторную функцию NKT-клеток. Нокаут PD-1 был индуцирован с использованием CRISPR-Cas9 в NKT-клетках, а эффективность нокаута PD-1 была проанализирована путем целевого глубокого секвенирования. Кроме того, клетки U87vIII и NKT-клетки были совместно культивированы для подтверждения функции NKT-клеток как противораковых эффекторов посредством нокаута PD-1. Клетки U87vIII обрабатывали реагентом для мечения клеток (Thermo fisher) в течение 18 часов в отношении E:T (эффекторные клетки: клетки-мишени)= 50:1 в течение 18 часов в 96-луночном планшете, и 7-AAD-позитивные раковые клетки анализировали с помощью проточной цитометрии на цитолитическую активность.
В результате было подтверждено, что в гене PD-1 наблюдалась высокая эффективность INDEL, достигаемая посредством CRISPR/Cas9 (фиг. 16A), что способствовало повышению цитотоксичности (фиг. 16B).
В целом, полученные выше результаты показали, что CRISPR/Cas9-опосредованный нокаут иммуномодуляторных генов, таких как DGK, может значительно повышать иммунный ответ в иммунных клетках различных типов.
Эти биологические эффекты нокаута гена DGK показали, что иммунные клетки, включая T-клетки, NK-клетки, NKT-клетки и т.п. могут быть получены в виде иммунотерапевтических средств в форме клинически приемлемых клеток, повышающих иммунные функции.
Промышленное применение
Эффективный терапевтический препарат на основе иммунных клеток может быть получен с использованием модифицированной иммунной системы, функции которой были искусственно модифицированы с использованием искусственно модифицированных иммунорегуляторных факторов и клеток, содержащих эти факторы.
Так, например, если иммунорегуляторные факторы были искусственно модифицированы с применением способа или композиции согласно изобретению, то иммунологическая эффективность в отношении жизнеспособности, пролиферации, персистентности, цитотоксичности, высвобождения цитокинов и/или инфильтрации и т.п. иммунных клеток может быть повышена.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ToolGen Incorporation
<120> Модифицированный иммунорегуляторный элемент и изменение
иммунитета посредством этого элемента
<130> OPP17-041
<150> KR 10-2016-0103308
<151> 2016-08-12
<150> US 62/502,822
<151> 2017-05-08
<160> 289
<170> KoPatentIn 3.0
<210> 1
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 1
cttgtggcgc tgaaaacgaa cgg 23
<210> 2
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 2
atgccacttc tcagtacatg tgg 23
<210> 3
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 3
gccacttctc agtacatgtg ggg 23
<210> 4
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 4
gccccacatg tactgagaag tgg 23
<210> 5
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 5
tcagtacatg tggggcgttc agg 23
<210> 6
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 6
gggcgttcag gacacagact tgg 23
<210> 7
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 7
cacagacttg gtactgagga agg 23
<210> 8
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 8
ggcgctgttc agcacgctca agg 23
<210> 9
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 9
cacgcaactt taaattccgc tgg 23
<210> 10
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 10
cggggctttg ctatgatact cgg 23
<210> 11
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 11
ggcttccaca gacacaccca tgg 23
<210> 12
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 12
tgaagtccac ttcgggccat ggg 23
<210> 13
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 13
ctgtacgaca cggacagaaa tgg 23
<210> 14
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 14
tgtacgacac ggacagaaat ggg 23
<210> 15
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 15
cacggacaga aatgggatcc tgg 23
<210> 16
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 16
gatgcgagtg gctgaatacc tgg 23
<210> 17
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 17
gagtggctga atacctggat tgg 23
<210> 18
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 18
agtggctgaa tacctggatt ggg 23
<210> 19
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 19
attgggatgt gtctgagctg agg 23
<210> 20
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 20
atgaaagaga ttgactatga tgg 23
<210> 21
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 21
ctctgtctct caagctgagt ggg 23
<210> 22
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 22
tctctcaagc tgagtgggtc cgg 23
<210> 23
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 23
ctctcaagct gagtgggtcc ggg 23
<210> 24
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 24
caagctgagt gggtccgggc tgg 23
<210> 25
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 25
ttgacatgac tggagagaag agg 23
<210> 26
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 26
gactggagag aagaggtcgt tgg 23
<210> 27
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 27
gagacgggag caaagctgct ggg 23
<210> 28
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 28
agagacggga gcaaagctgc tgg 23
<210> 29
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 29
tggtttctag gtgcagagac ggg 23
<210> 30
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 30
taagtgaagg tctggtttct agg 23
<210> 31
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 31
tgcccatgta agtgaaggtc tgg 23
<210> 32
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 32
gaacttgccc atgtaagtga agg 23
<210> 33
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 33
tccattgacc ctcagtaccc tgg 23
<210> 34
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 34
tatgccttct gggtagcagc tgg 23
<210> 35
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 35
tgagtgcagg catcttgcaa ggg 23
<210> 36
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 36
gagtgcaggc atcttgcaag ggg 23
<210> 37
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 37
gatgaggctg tggttgaagc tgg 23
<210> 38
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 38
ccactggcca caggacccct ggg 23
<210> 39
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 39
gggacatggt gcacacaccc agg 23
<210> 40
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 40
gagtacaggt ggtccaggtc agg 23
<210> 41
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 41
gcggagagta caggtggtcc agg 23
<210> 42
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 42
gcggtggcgg agagtacagg tgg 23
<210> 43
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 43
tctcctgcac agccagaata agg 23
<210> 44
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 44
acgcagaagg gtcctggtag agg 23
<210> 45
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 45
aggtggtggg taggccagag agg 23
<210> 46
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 46
cccaagccag ccacggaccc agg 23
<210> 47
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 47
acctgggtcc gtggctggct tgg 23
<210> 48
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 48
aagagacctg ggtccgtggc tgg 23
<210> 49
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 49
ggatcattgg gaagagacct ggg 23
<210> 50
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 50
gggatcattg ggaagagacc tgg 23
<210> 51
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 51
caggatagtc tgggatcatt ggg 23
<210> 52
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 52
ggaaagaatc caggatagtc tgg 23
<210> 53
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 53
cagtgccaga gagacctaca tgg 23
<210> 54
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 54
ctgtaccatg taggtctctc tgg 23
<210> 55
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 55
agagacctac atggtacagc tgg 23
<210> 56
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 56
ctgggccagc tgtaccatgt agg 23
<210> 57
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 57
agggaaaggg cttacggtct ggg 23
<210> 58
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 58
cagggaaagg gcttacggtc tgg 23
<210> 59
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 59
tctggagatc ttcttgcaac agg 23
<210> 60
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 60
ctccggttca tgactttgaa agg 23
<210> 61
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 61
gtcttccatc ttcgtctttc agg 23
<210> 62
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 62
gaagacttcg agacccattt agg 23
<210> 63
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 63
tcgagaccca tttaggatca cgg 23
<210> 64
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 64
gtagcgccgt gatcctaaat ggg 23
<210> 65
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 65
cgtagcgccg tgatcctaaa tgg 23
<210> 66
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 66
catttaggat cacggcgcta cgg 23
<210> 67
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 67
ggtcccaata ttgaagccca tgg 23
<210> 68
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 68
gatccatggg cttcaatatt ggg 23
<210> 69
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 69
agatccatgg gcttcaatat tgg 23
<210> 70
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 70
gcttctacca taagatccat ggg 23
<210> 71
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 71
cgcttctacc ataagatcca tgg 23
<210> 72
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 72
gcatttgcaa aaattcgccg tgg 23
<210> 73
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 73
atgacctgag aattaattta tgg 23
<210> 74
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 74
ccatgcactc ccagacatcg tgg 23
<210> 75
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 75
gcactggtgc gggtggaact cgg 23
<210> 76
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 76
acacgttgca ctggtgcggg tgg 23
<210> 77
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 77
cgaacacgtt gcactggtgc ggg 23
<210> 78
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 78
acgaacacgt tgcactggtg cgg 23
<210> 79
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 79
tgtagacgaa cacgttgcac tgg 23
<210> 80
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 80
gcgcatgtca cacaggcgga tgg 23
<210> 81
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 81
aggagcgcat gtcacacagg cgg 23
<210> 82
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 82
ccgaggagcg catgtcacac agg 23
<210> 83
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 83
cctgtgtgac atgcgctcct cgg 23
<210> 84
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 84
cgactggcca gggcgcctgt ggg 23
<210> 85
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 85
accgcccaga cgactggcca ggg 23
<210> 86
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 86
caccgcccag acgactggcc agg 23
<210> 87
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 87
gtctgggcgg tgctacaact ggg 23
<210> 88
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 88
ctacaactgg gctggcggcc agg 23
<210> 89
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 89
cacctaccta agaaccatcc tgg 23
<210> 90
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 90
cggtcaccac gagcagggct ggg 23
<210> 91
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 91
gccctgctcg tggtgaccga agg 23
<210> 92
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 92
cggagagctt cgtgctaaac tgg 23
<210> 93
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 93
cagcttgtcc gtctggttgc tgg 23
<210> 94
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 94
aggcggccag cttgtccgtc tgg 23
<210> 95
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 95
ccgggctggc tgcggtcctc ggg 23
<210> 96
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 96
cgttgggcag ttgtgtgaca cgg 23
<210> 97
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 97
cataaagcca tggcttgcct tgg 23
<210> 98
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 98
ccttggattt cagcggcaca agg 23
<210> 99
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 99
ccttgtgccg ctgaaatcca agg 23
<210> 100
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 100
cactcacctt tgcagaagac agg 23
<210> 101
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 101
ttccatgcta gcaatgcacg tgg 23
<210> 102
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 102
ggccacgtgc attgctagca tgg 23
<210> 103
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 103
ggcccagcct gctgtggtac tgg 23
<210> 104
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 104
aggtccgggt gacagtgctt cgg 23
<210> 105
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 105
ccgggtgaca gtgcttcggc agg 23
<210> 106
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 106
ctgtgcggca acctacatga tgg 23
<210> 107
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 107
caactcattc cccatcatgt agg 23
<210> 108
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 108
ctagatgatt ccatctgcac ggg 23
<210> 109
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 109
ggctaggagt cagcgacata tgg 23
<210> 110
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 110
gctaggagtc agcgacatat ggg 23
<210> 111
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 111
ctaggagtca gcgacatatg ggg 23
<210> 112
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 112
gtactgtgta gccaggatgc tgg 23
<210> 113
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 113
acgagcactc accagcatcc tgg 23
<210> 114
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 114
aggctccagg aatgtccgcg agg 23
<210> 115
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 115
acttacctcg cggacattcc tgg 23
<210> 116
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 116
caccctgggc acttacctcg cgg 23
<210> 117
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 117
gtgccgtaca aaggttggct ggg 23
<210> 118
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 118
ggtgccgtac aaaggttggc tgg 23
<210> 119
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 119
ctctcctcag taccacagca agg 23
<210> 120
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 120
cctggggcct ccgggcgcgg agg 23
<210> 121
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 121
agtactcacc tggggcctcc ggg 23
<210> 122
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 122
agggtctcca gcggccctcc tgg 23
<210> 123
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 123
gcaagtactt acgcctcctt ggg 23
<210> 124
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 124
ttgcggtaca tctccagcct ggg 23
<210> 125
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 125
tttgcggtac atctccagcc tgg 23
<210> 126
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 126
gcaaaacctg tccactctta tgg 23
<210> 127
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 127
ttggtgccat aagagtggac agg 23
<210> 128
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 128
ggtgcaagtt tcttatatgt tgg 23
<210> 129
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 129
acctgatgca tataataatc agg 23
<210> 130
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 130
acctgattat tatatgcatc agg 23
<210> 131
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 131
cagagcacca gagtgccgtc tgg 23
<210> 132
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 132
agagcaccag agtgccgtct ggg 23
<210> 133
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 133
agagtgccgt ctgggtctga agg 23
<210> 134
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 134
aggaaggccg tccattctca ggg 23
<210> 135
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 135
ggatagaacc aaccatgttg agg 23
<210> 136
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 136
tctgttgccc tcaacatggt tgg 23
<210> 137
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 137
ttagtctgtt gccctcaaca tgg 23
<210> 138
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 138
gtctggcaaa tgggaggtga tgg 23
<210> 139
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 139
cagaggttct gtctggcaaa tgg 23
<210> 140
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 140
ttgtagccag aggttctgtc tgg 23
<210> 141
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 141
acttctggat gagctctctc agg 23
<210> 142
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 142
agagctcatc cagaagtaaa tgg 23
<210> 143
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 143
ttggtgtctc catttacttc tgg 23
<210> 144
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 144
ttctggcttc ccttcataca ggg 23
<210> 145
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 145
caggactcac acgactattc tgg 23
<210> 146
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 146
ctactttctt gtgtaaagtc agg 23
<210> 147
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 147
gactttacac aagaaagtag agg 23
<210> 148
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 148
gtctttctcc attagccttt tgg 23
<210> 149
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 149
aatggagaaa gacgtaactt cgg 23
<210> 150
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 150
atggagaaag acgtaacttc ggg 23
<210> 151
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 151
tggagaaaga cgtaacttcg ggg 23
<210> 152
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 152
tttggttgac tgctttcacc tgg 23
<210> 153
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 153
tcactcaaat cggagacatt tgg 23
<210> 154
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 154
atctgaagct ctggattttc agg 23
<210> 155
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 155
gcttcagatt ctgaatgagc agg 23
<210> 156
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 156
cagattctga atgagcagga ggg 23
<210> 157
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 157
aaggcagtgc taatgcctaa tgg 23
<210> 158
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 158
gcagaaactg tagcaccatt agg 23
<210> 159
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 159
accgcaatgg aaacacaatc tgg 23
<210> 160
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 160
tgtggttttc tgcaccgcaa tgg 23
<210> 161
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 161
cataaatgcc attaacagtc agg 23
<210> 162
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 162
attagtagcc tgactgttaa tgg 23
<210> 163
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 163
cgatgggtga gtgatctcac agg 23
<210> 164
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 164
actcacccat cgcatacctc agg 23
<210> 165
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 165
ctcacccatc gcatacctca ggg 23
<210> 166
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 166
agcaacagga ggagttgcag agg 23
<210> 167
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 167
ccagtaggat cagcaacagg agg 23
<210> 168
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 168
ctcctgttgc tgatcctact ggg 23
<210> 169
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 169
ggcccagtag gatcagcaac agg 23
<210> 170
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 170
ttgctgatcc tactgggccc tgg 23
<210> 171
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 171
tggcaacagc ttgcagctgt ggg 23
<210> 172
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 172
cttgggtccc ctgcttgccc ggg 23
<210> 173
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 173
gtcccctgct tgcccgggac cgg 23
<210> 174
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 174
ctccggtccc gggcaagcag ggg 23
<210> 175
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 175
tctccggtcc cgggcaagca ggg 23
<210> 176
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 176
gtctccggtc ccgggcaagc agg 23
<210> 177
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 177
gcttgcccgg gaccggagac agg 23
<210> 178
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 178
ggtggcctgt ctccggtccc ggg 23
<210> 179
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 179
cggtggcctg tctccggtcc cgg 23
<210> 180
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 180
catattcggt ggcctgtctc cgg 23
<210> 181
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 181
atctaggtac tcatattcgg tgg 23
<210> 182
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 182
ataatctagg tactcatatt cgg 23
<210> 183
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 183
ttatgatttc ctgccagaaa cgg 23
<210> 184
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 184
atttctggag gctccgtttc tgg 23
<210> 185
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 185
actgacacca ctcctctgac tgg 23
<210> 186
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 186
ctgacaccac tcctctgact ggg 23
<210> 187
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 187
accactcctc tgactgggcc tgg 23
<210> 188
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 188
aacccctgag tctaccactg tgg 23
<210> 189
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 189
ctccacagtg gtagactcag ggg 23
<210> 190
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 190
gctccacagt ggtagactca ggg 23
<210> 191
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 191
ggctccacag tggtagactc agg 23
<210> 192
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 192
cctgctgcaa ggcgttctac tgg 23
<210> 193
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 193
ccagtagaac gccttgcagc agg 23
<210> 194
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 194
cgttctactg gcctggatgc agg 23
<210> 195
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 195
tctactggcc tggatgcagg agg 23
<210> 196
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 196
ccacggagct ggccaacatg ggg 23
<210> 197
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 197
cgtggacagg ttccccatgt tgg 23
<210> 198
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 198
gtccacggat tcagcagcta tgg 23
<210> 199
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 199
gaccactcaa ccagtgccca cgg 23
<210> 200
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 200
ggagtggtct gtgcctccgt ggg 23
<210> 201
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 201
ggcacagaca actcgactga cgg 23
<210> 202
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 202
gacaactcga ctgacggcca cgg 23
<210> 203
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 203
aactcgactg acggccacgg agg 23
<210> 204
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 204
cacagaaccc agtgccacag agg 23
<210> 205
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 205
ggtagtaggt tccatggaca ggg 23
<210> 206
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 206
tggtagtagg ttccatggac agg 23
<210> 207
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 207
tcttttggta gtaggttcca tgg 23
<210> 208
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 208
atggaaccta ctaccaaaag agg 23
<210> 209
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 209
aacagacctc ttttggtagt agg 23
<210> 210
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 210
gggtatgaac agacctcttt tgg 23
<210> 211
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 211
tgtgtcctct gttactcaca agg 23
<210> 212
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 212
gtgtcctctg ttactcacaa ggg 23
<210> 213
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 213
gtagttgacg gacaaattgc tgg 23
<210> 214
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 214
tttgtccgtc aactacccag tgg 23
<210> 215
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 215
ttgtccgtca actacccagt ggg 23
<210> 216
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 216
tgtccgtcaa ctacccagtg ggg 23
<210> 217
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 217
gtccgtcaac tacccagtgg ggg 23
<210> 218
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 218
ctctgtgaag cagtgcctgc tgg 23
<210> 219
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 219
cctgctggcc atcctaatct tgg 23
<210> 220
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 220
ccaagattag gatggccagc agg 23
<210> 221
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 221
ggccatccta atcttggcgc tgg 23
<210> 222
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 222
caccagcgcc aagattagga tgg 23
<210> 223
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 223
agtgcacacg aagaagatag tgg 23
<210> 224
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 224
tatcttcttc gtgtgcactg tgg 23
<210> 225
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 225
cttcgtgtgc actgtggtgc tgg 23
<210> 226
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 226
ggcggtccgc ctctcccgca agg 23
<210> 227
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 227
gcggtccgcc tctcccgcaa ggg 23
<210> 228
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 228
aattacgcac ggggtacatg tgg 23
<210> 229
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 229
tgggggagta attacgcacg ggg 23
<210> 230
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 230
gtgggggagt aattacgcac ggg 23
<210> 231
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 231
ggtgggggag taattacgca cgg 23
<210> 232
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 232
taattactcc cccaccgaga tgg 23
<210> 233
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 233
agatgcagac catctcggtg ggg 23
<210> 234
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 234
gagatgcaga ccatctcggt ggg 23
<210> 235
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 235
tgagatgcag accatctcgg tgg 23
<210> 236
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 236
ggatgagatg cagaccatct cgg 23
<210> 237
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 237
atctcatccc tgttgcctga tgg 23
<210> 238
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 238
tcatccctgt tgcctgatgg ggg 23
<210> 239
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 239
ctcaccccca tcaggcaaca ggg 23
<210> 240
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 240
gagggcccct cacccccatc agg 23
<210> 241
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 241
gggccctctg ccacagccaa tgg 23
<210> 242
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 242
ccctctgcca cagccaatgg ggg 23
<210> 243
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 243
cccccattgg ctgtggcaga ggg 23
<210> 244
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 244
gcccccattg gctgtggcag agg 23
<210> 245
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 245
ggacaggccc ccattggctg tgg 23
<210> 246
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 246
ccgggctctt ggccttggac agg 23
<210> 247
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 247
ctgtccaagg ccaagagccc ggg 23
<210> 248
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 248
tggcgtcagg cccgggctct tgg 23
<210> 249
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 249
cgggcctgac gccagagccc agg 23
<210> 250
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 250
caacaaccat gctgggcatc tgg 23
<210> 251
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 251
gagggtccag atgcccagca tgg 23
<210> 252
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 252
catctggacc ctcctacctc tgg 23
<210> 253
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 253
agggctcacc agaggtagga ggg 23
<210> 254
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 254
ggagttgatg tcagtcactt ggg 23
<210> 255
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 255
tggagttgat gtcagtcact tgg 23
<210> 256
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 256
agtgactgac atcaactcca agg 23
<210> 257
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 257
gtgactgaca tcaactccaa ggg 23
<210> 258
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 258
actccaaggg attggaattg agg 23
<210> 259
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 259
cttcctcaat tccaatccct tgg 23
<210> 260
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 260
tacagttgag actcagaact tgg 23
<210> 261
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 261
ttggaaggcc tgcatcatga tgg 23
<210> 262
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 262
agaattggcc atcatgatgc agg 23
<210> 263
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 263
gacagggctt atggcagaat tgg 23
<210> 264
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 264
tgtaacatac ctggaggaca ggg 23
<210> 265
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 265
gtgtaacata cctggaggac agg 23
<210> 266
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 266
cgtacctgtg caactcctgt tgg 23
<210> 267
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 267
gatctactgg aattcctaat ggg 23
<210> 268
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 268
gagtcagctg ttggcccatt agg 23
<210> 269
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 269
ctgcctacaa actcagtctc tgg 23
<210> 270
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 270
gggcaggcag gacggactcc agg 23
<210> 271
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 271
ggagtccgtc ctgcctgccc tgg 23
<210> 272
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 272
gagtccgtcc tgcctgccct ggg 23
<210> 273
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 273
gaaaagggtc cattggccaa agg 23
<210> 274
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 274
gcctgcagaa aagggtccat tgg 23
<210> 275
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 275
ttgatgtgct acagggaaca tgg 23
<210> 276
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 276
agcgttcttg atgtgctaca ggg 23
<210> 277
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 277
cagcgttctt gatgtgctac agg 23
<210> 278
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 278
ctgtagcaca tcaagaacgc tgg 23
<210> 279
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 279
tgtagcacat caagaacgct ggg 23
<210> 280
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 280
ataggcaata atcatataac agg 23
<210> 281
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 281
agtgcgtttc gctgcaggta agg 23
<210> 282
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 282
gagtgagtgc gtttcgctgc agg 23
<210> 283
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 283
gtcaggtttg tgcggttatg agg 23
<210> 284
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 284
cgctgctggt caggtttgtg cgg 23
<210> 285
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 285
aaacctgacc agcagcgcag agg 23
<210> 286
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 286
ccagcagcgc agaggagccg tgg 23
<210> 287
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 287
ccacggctcc tctgcgctgc tgg 23
<210> 288
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 288
ccaactatct aactccactc agg 23
<210> 289
<211> 23
<212> ДНК
<213> Homo Sapiens
<400> 289
cctgagtgga gttagatagt tgg 23
<---
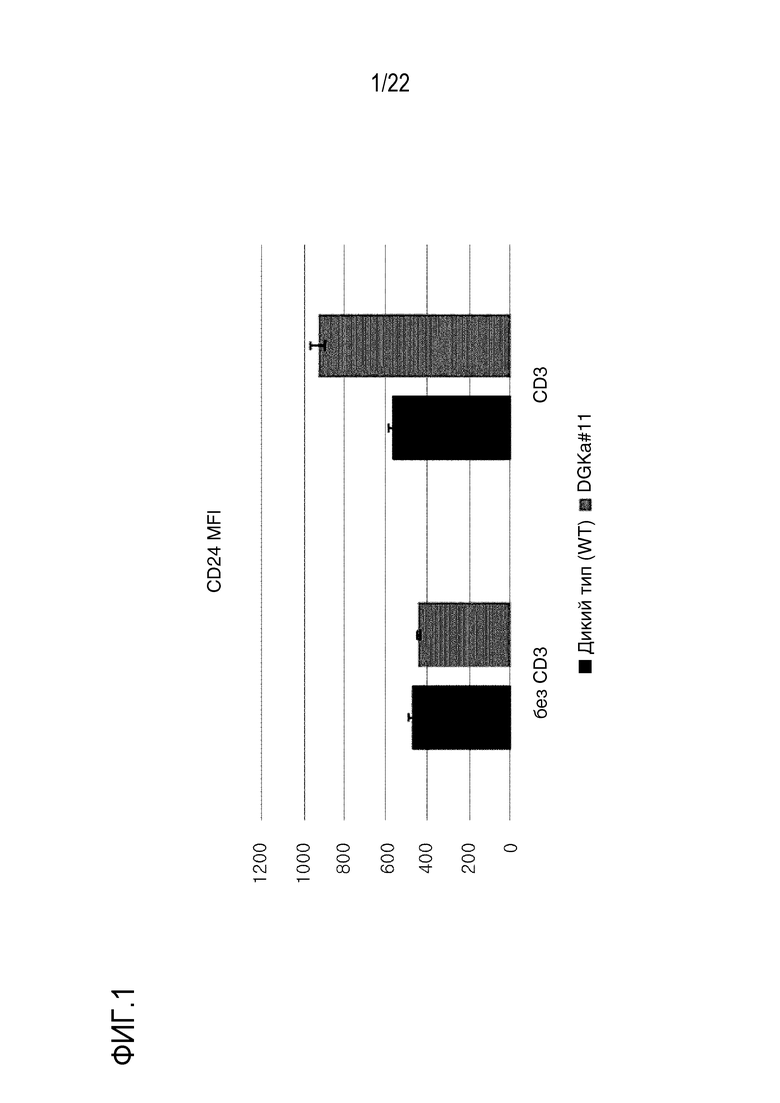
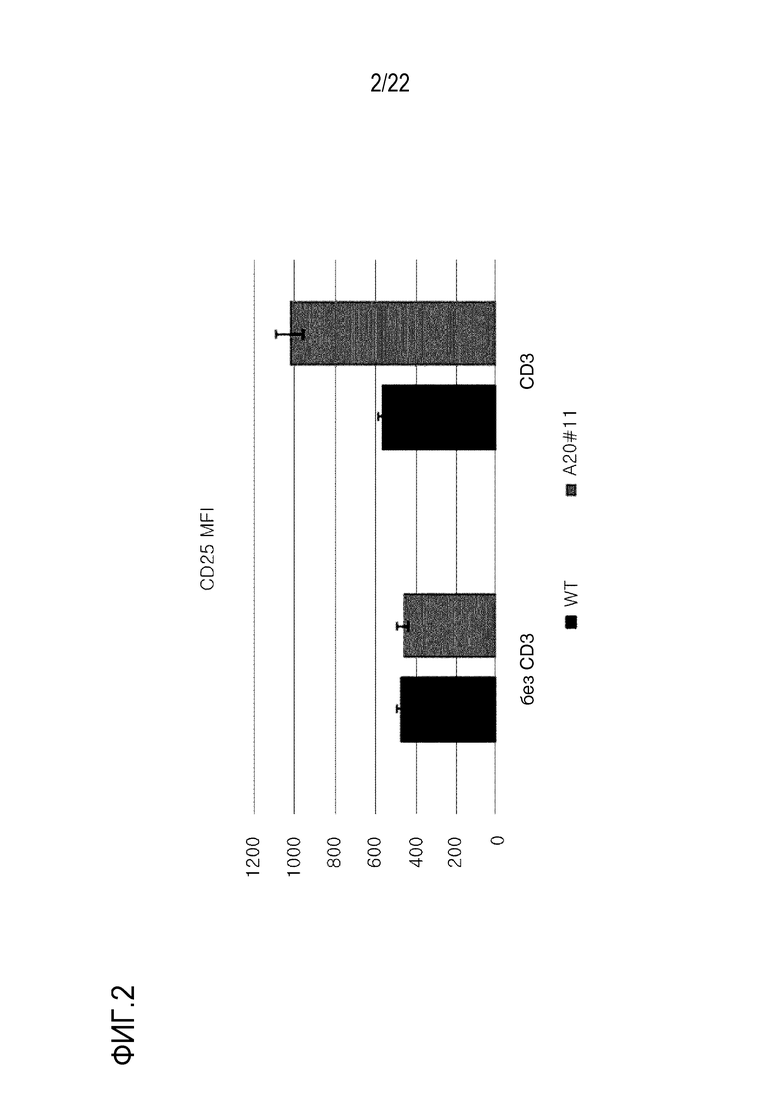
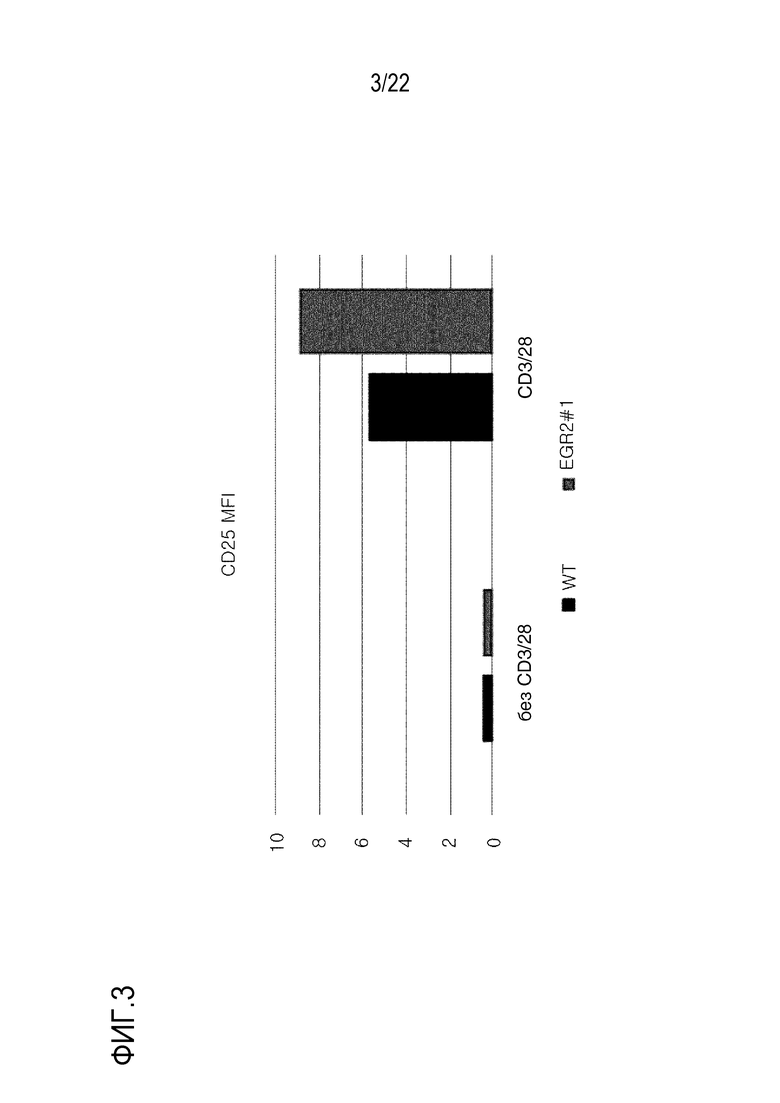

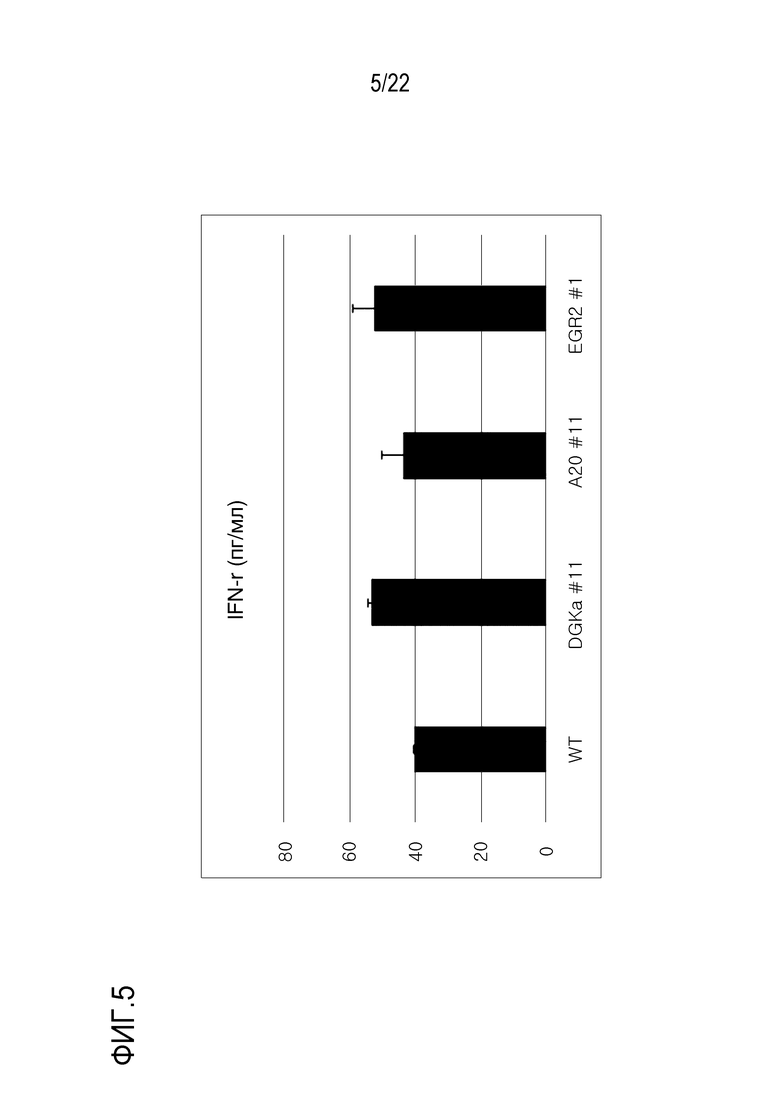

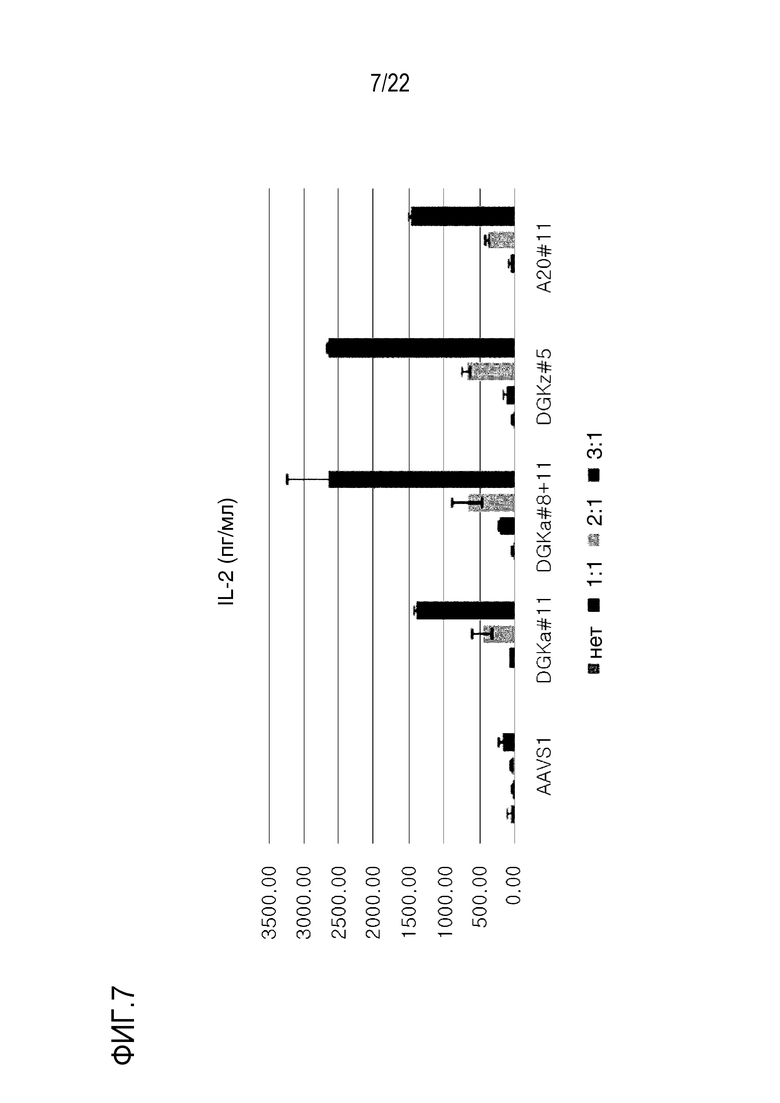
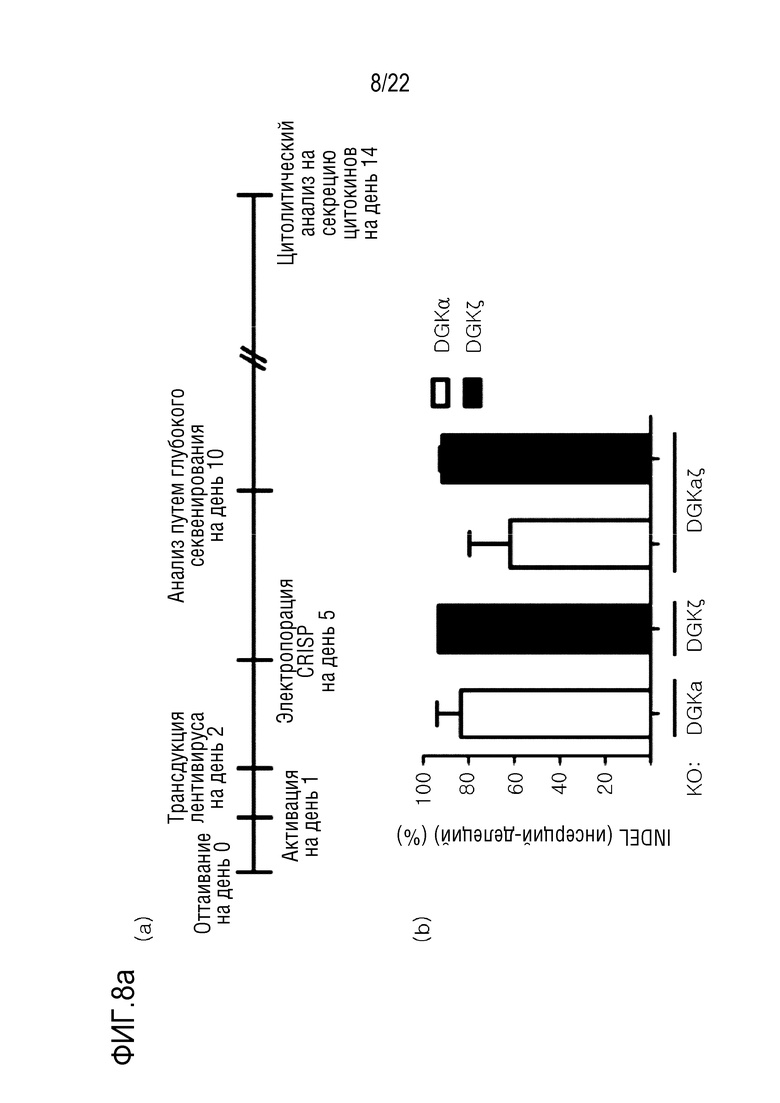
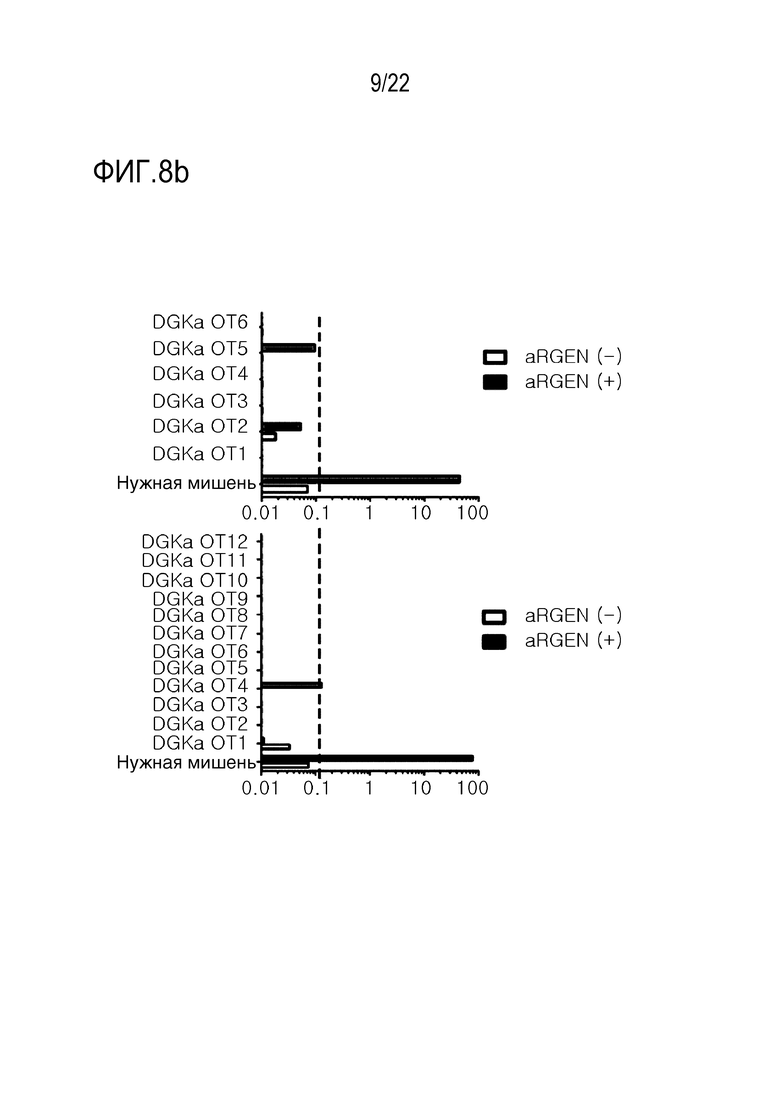
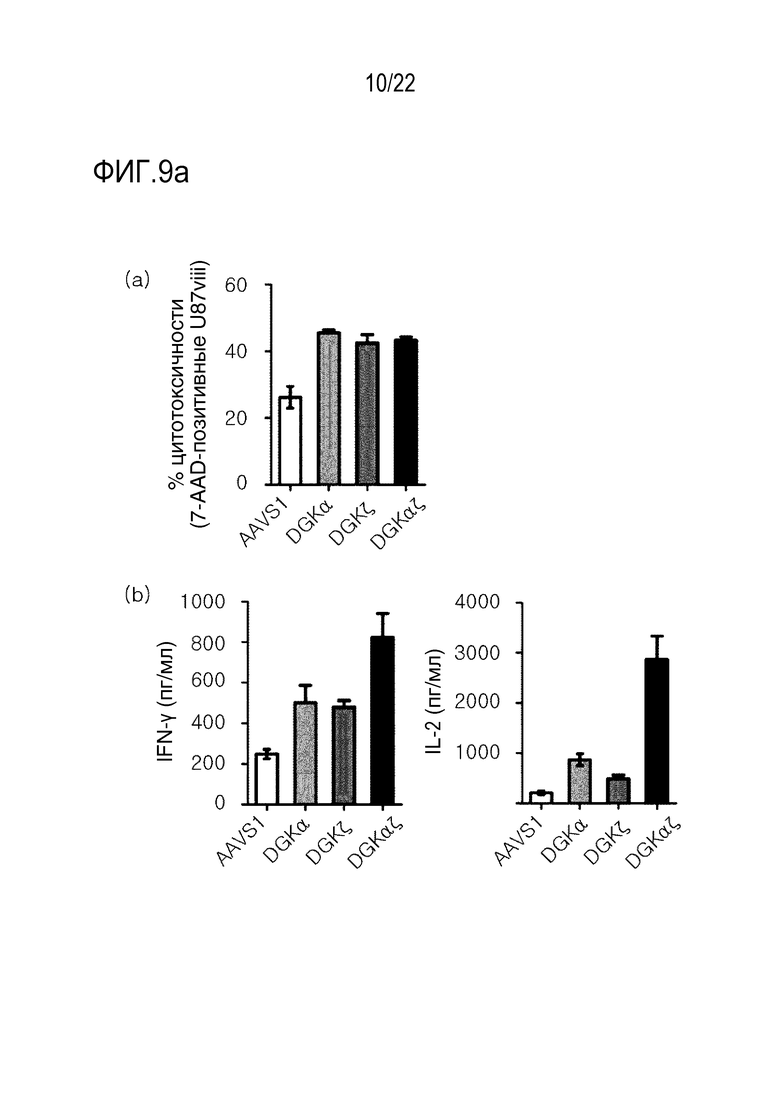
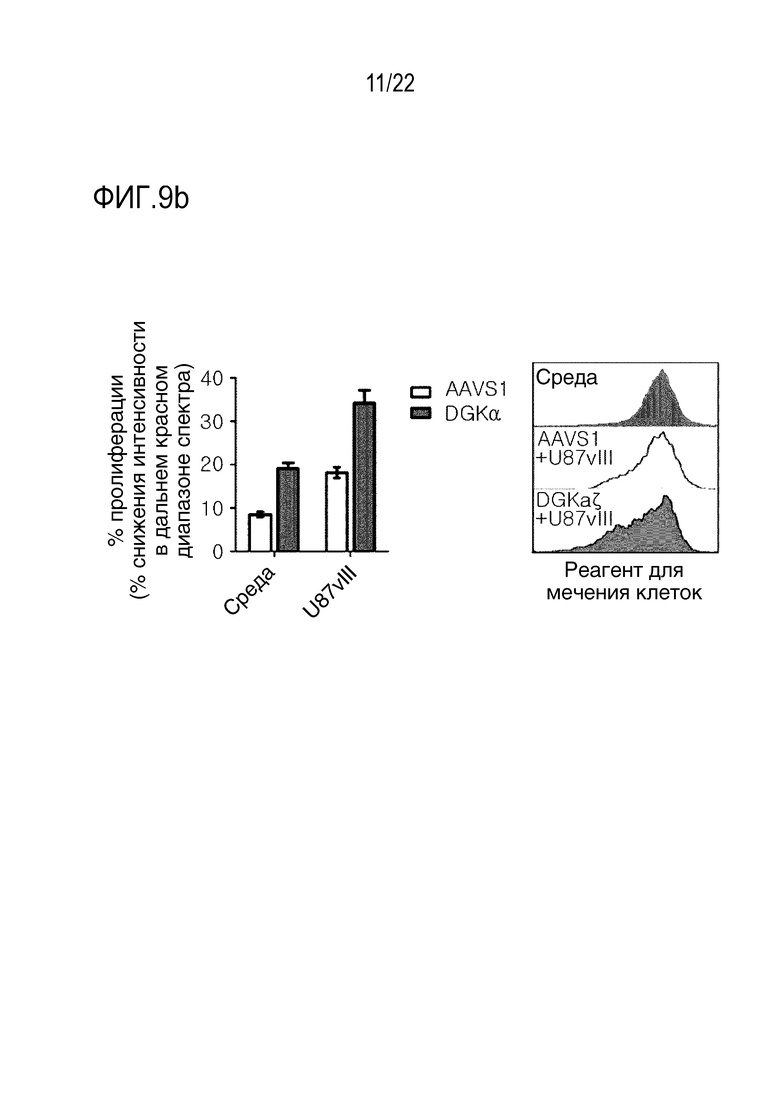
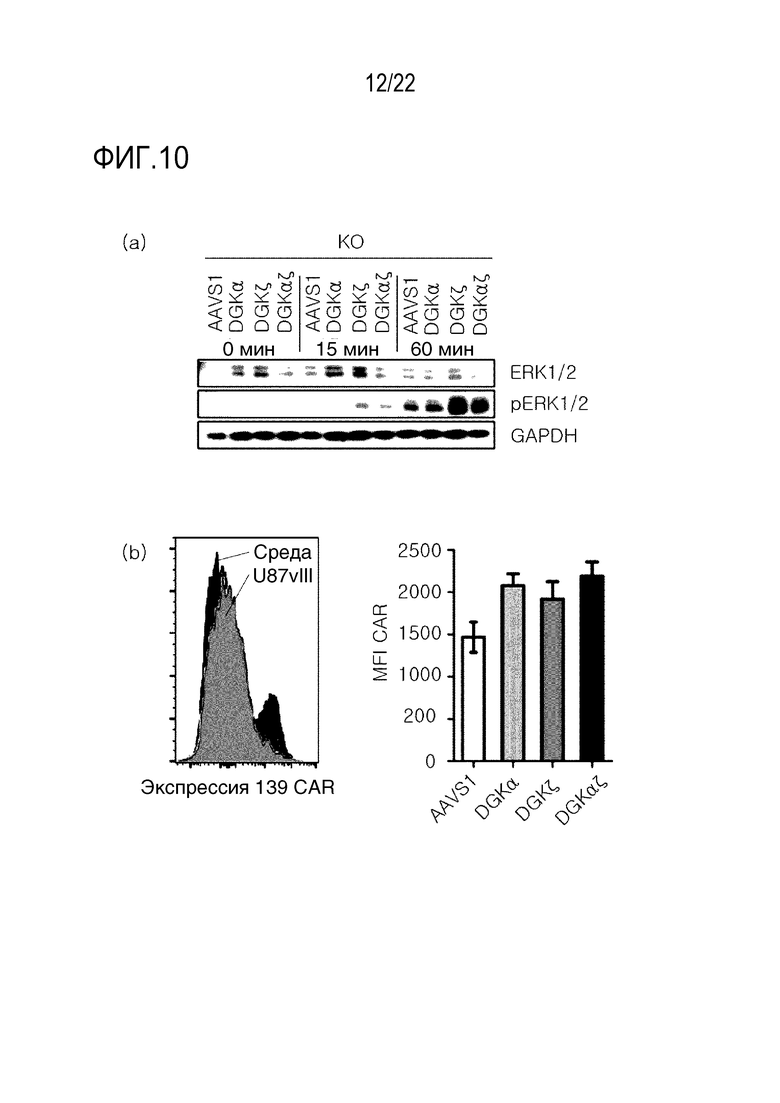
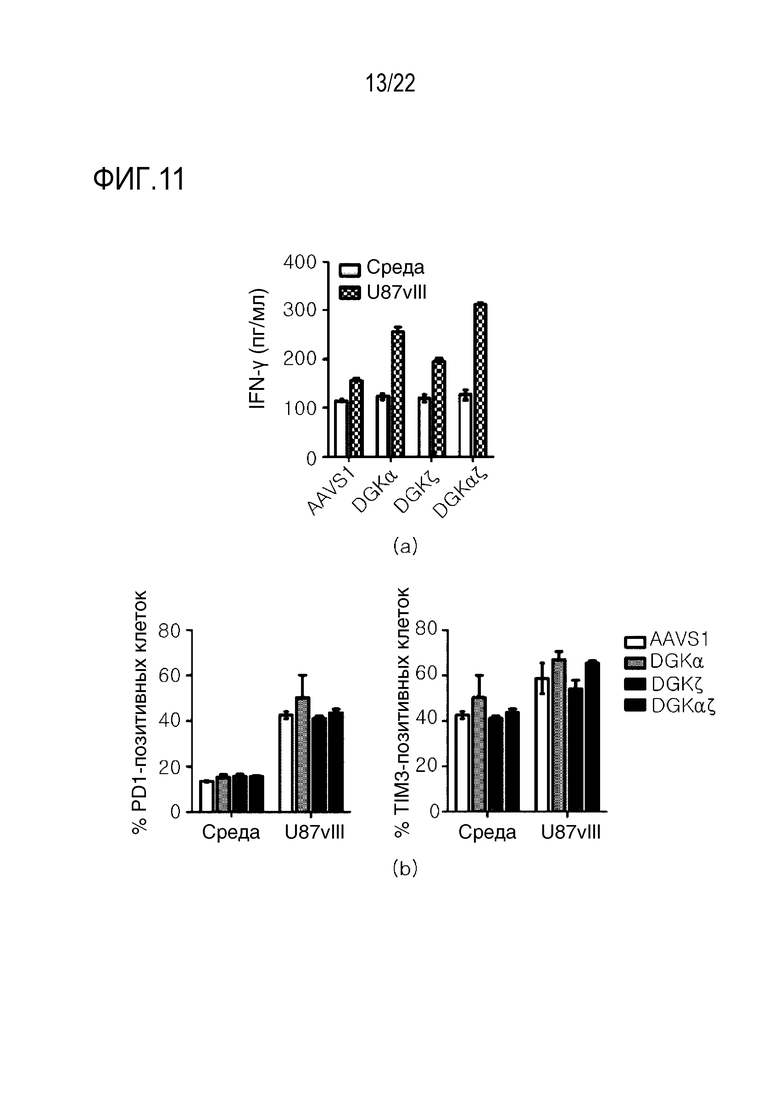
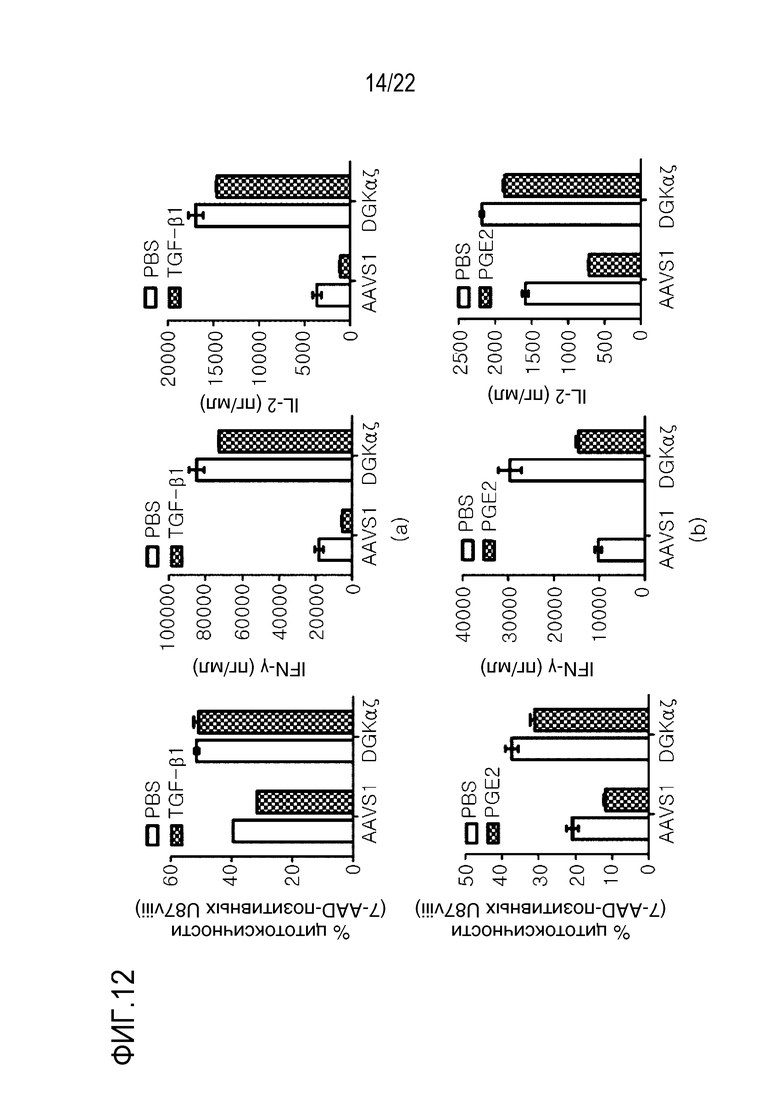
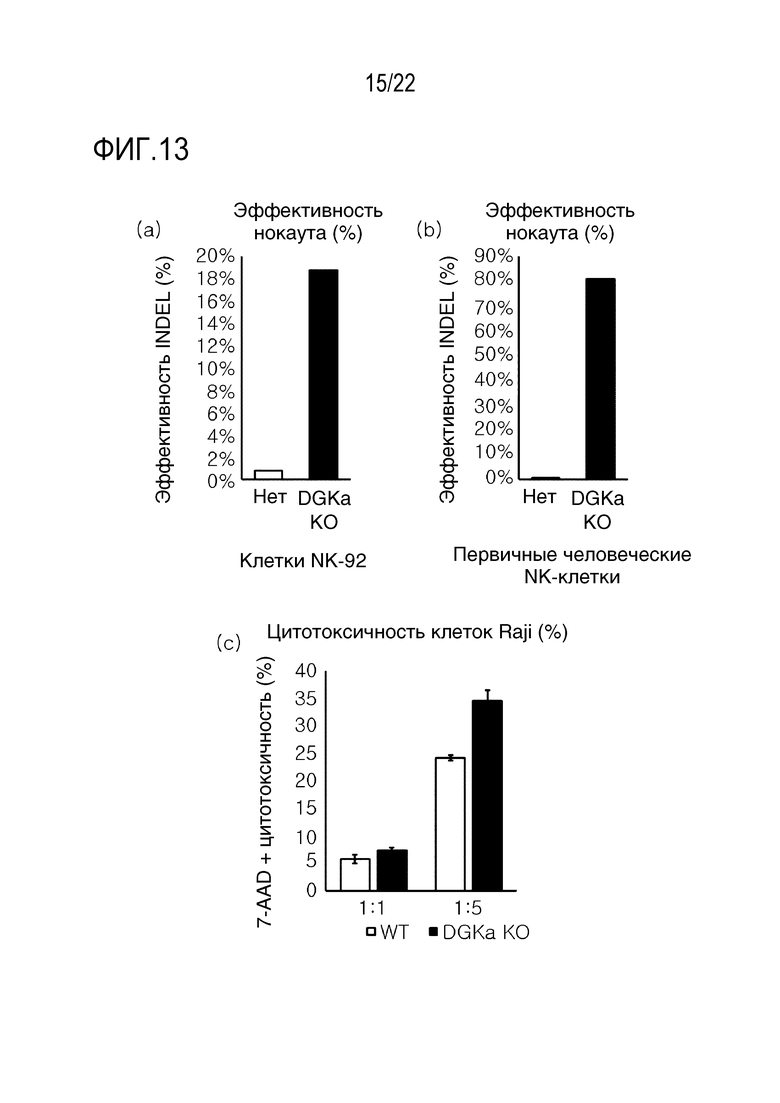

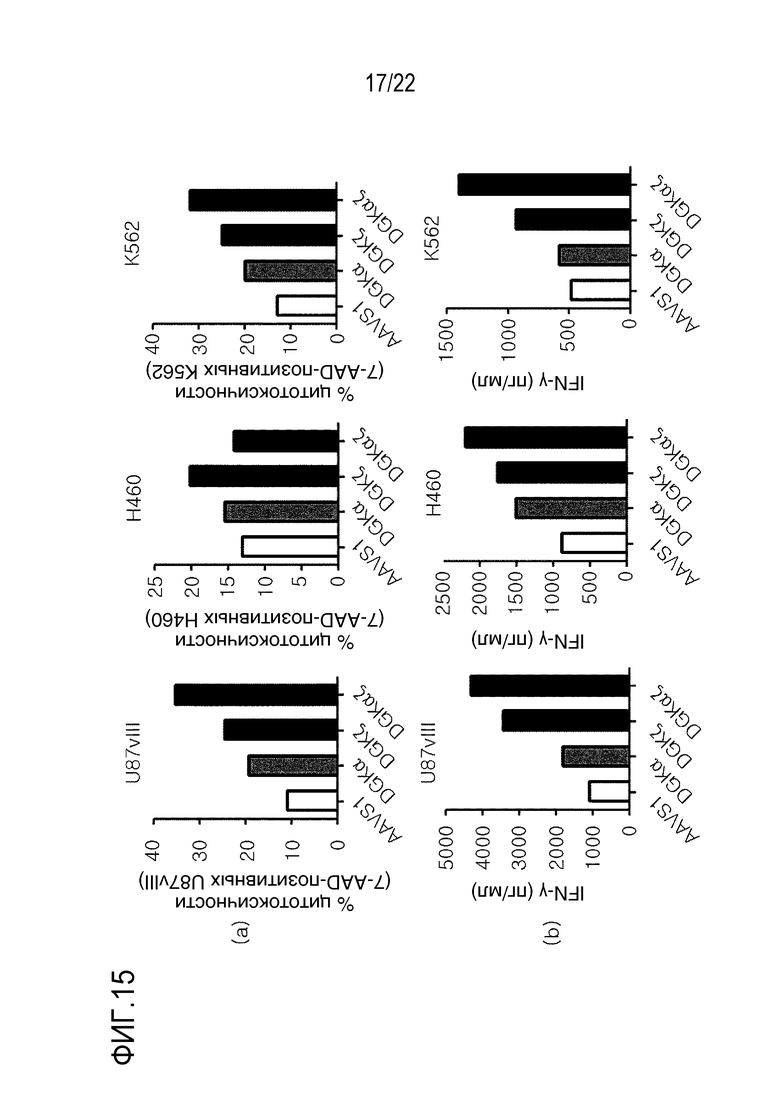
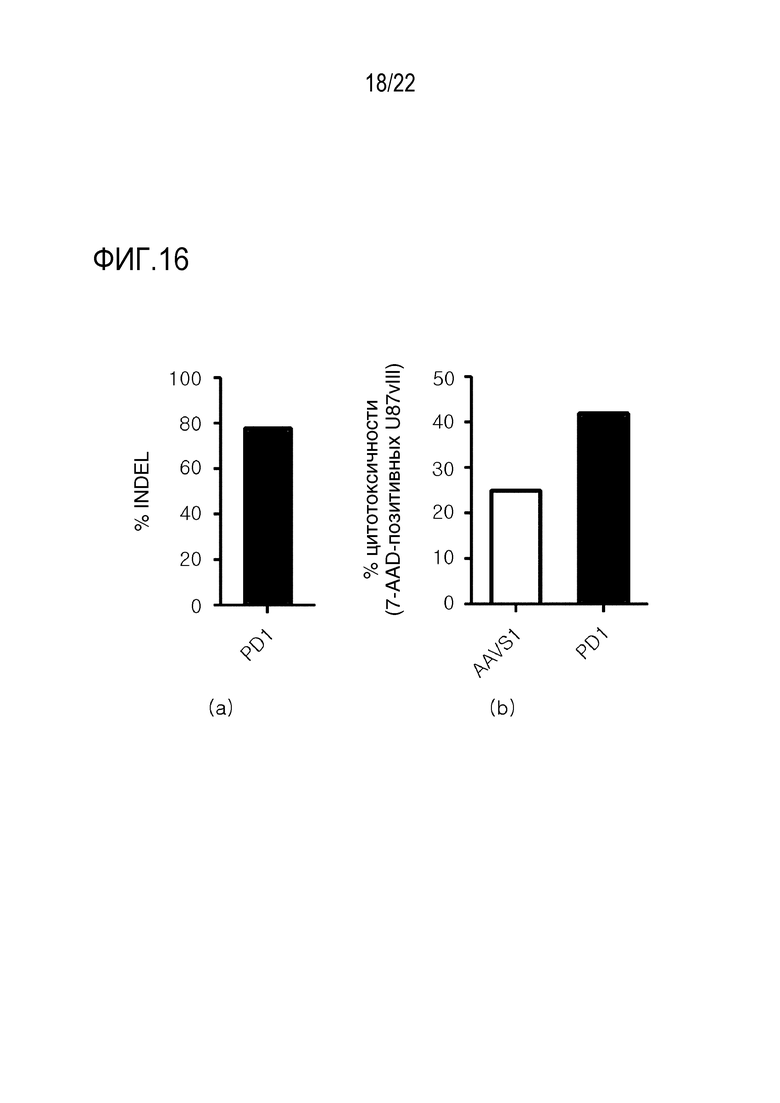
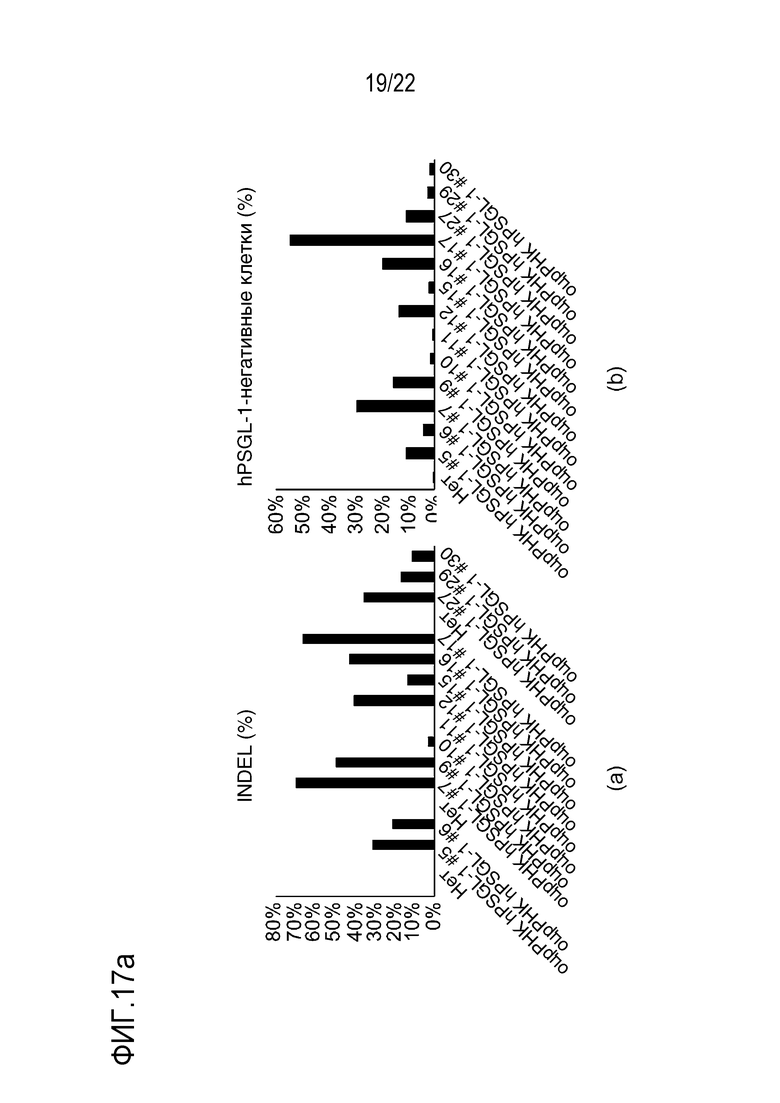
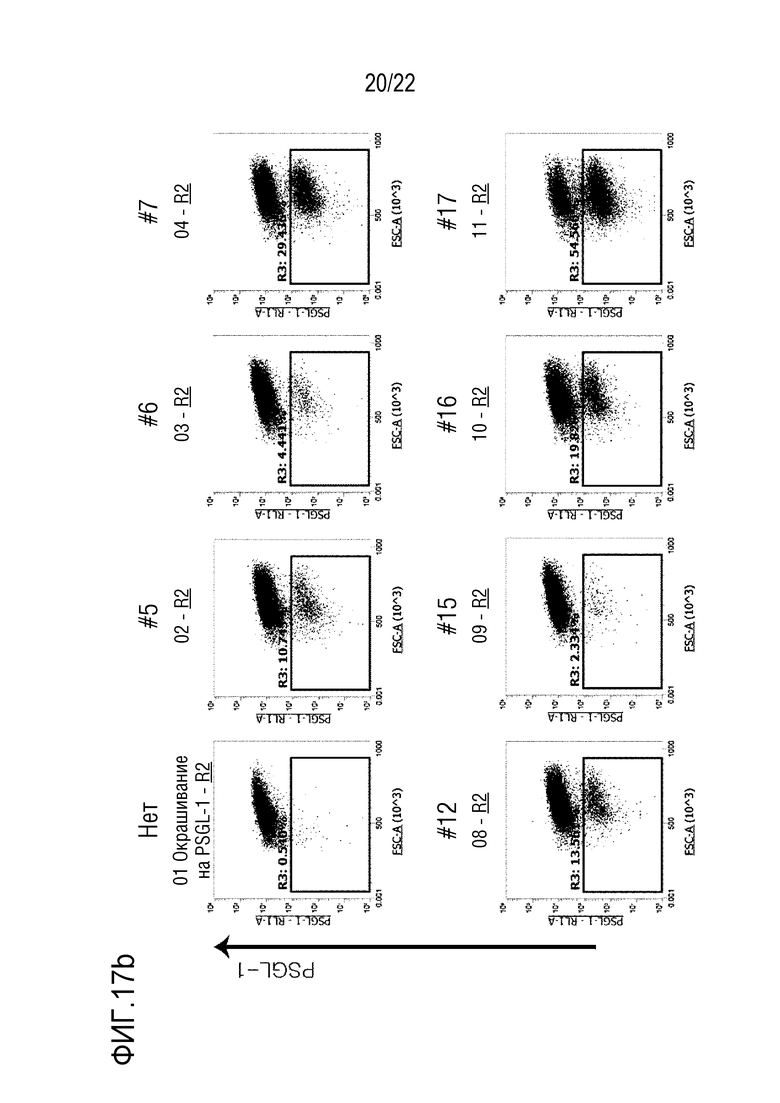
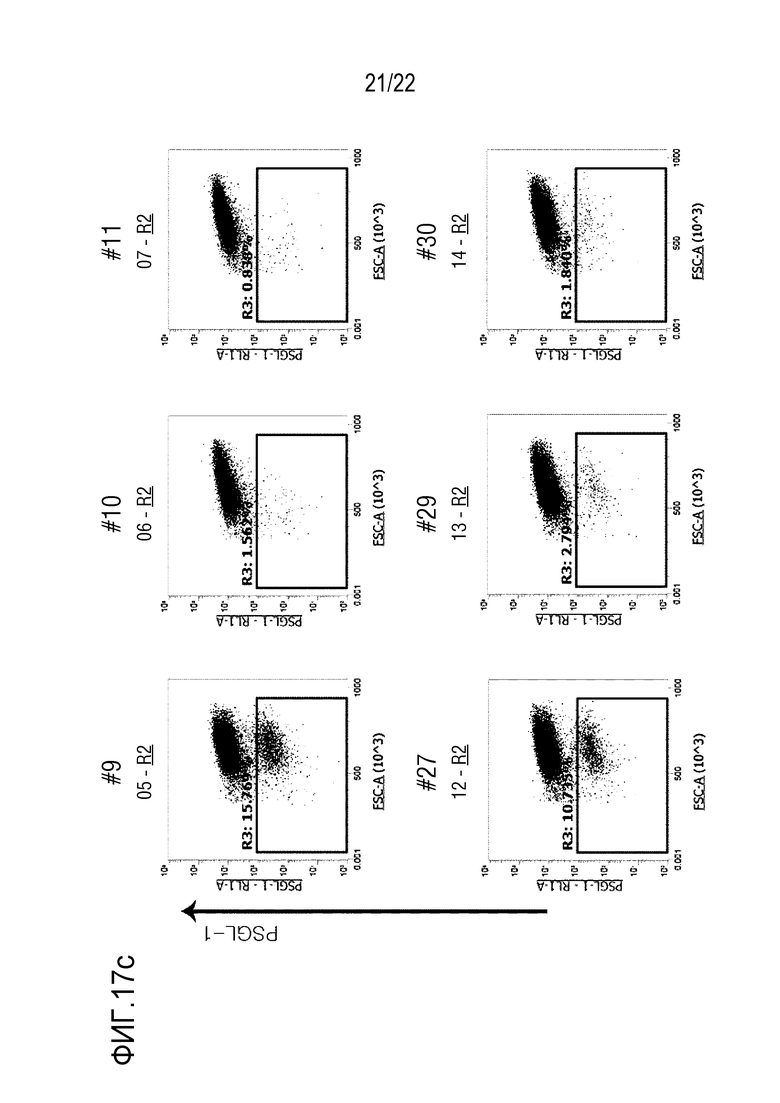
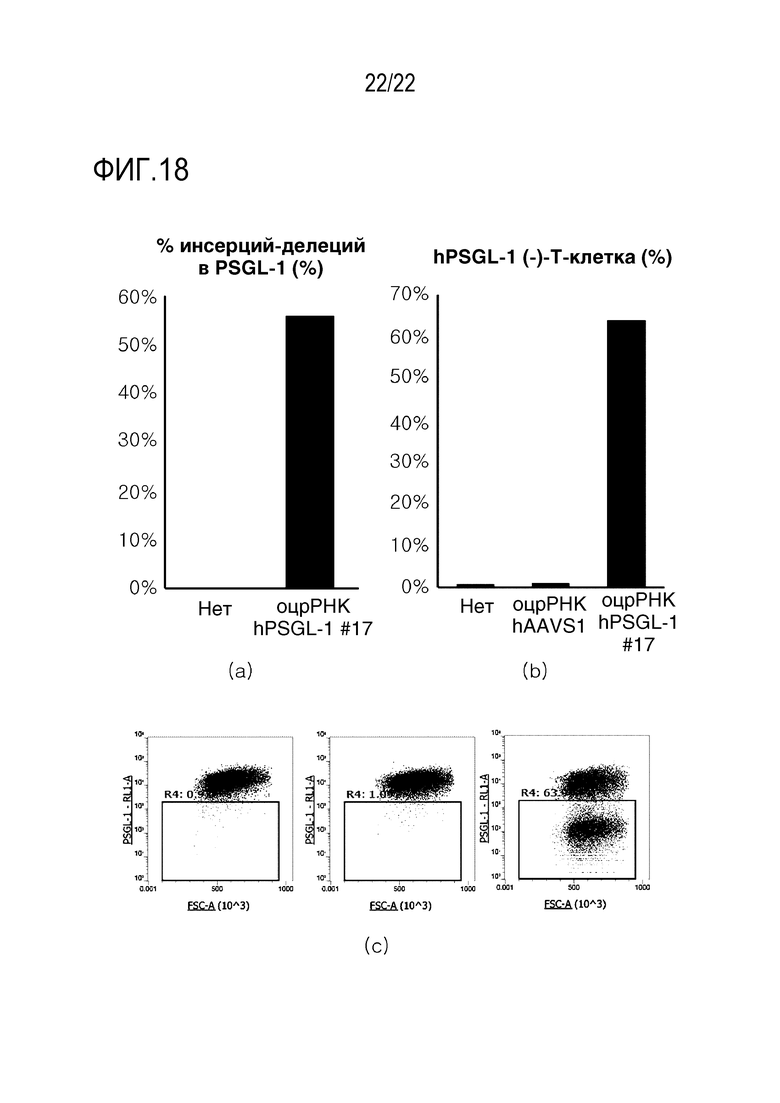
Настоящее изобретение относится к области биотехнологии, в частности к искусственно модифицированной иммунной системе, обладающей повышенным иммунным эффектом. Изобретение позволяет получить иммунную клетку с модифицированными функциями, содержащую модифицированные иммунорегуляторные гены DGKα и DGKζ. Изобретение обладает повышенной терапевтической эффективностью в сравнении с известными аналогами и может быть использовано в медицине, в частности в адаптивной иммунотерапии. 5 н. и 12 з.п. ф-лы, 8 пр., 6 табл., 18 ил.
1. Искусственно сконструированная иммунная клетка для улучшения иммунной эффективности, имеющая
по меньшей мере один искусственно сконструированный иммунорегуляторный ген, выбранный из гена Dgkα и гена Dgkζ,
где искусственно сконструированный иммунорегуляторный ген включает одну или более инсерцию-делецию (indel),
где, по отношению к нуклеотидной последовательности дикого типа иммунорегуляторного гена, indel расположены в последовательности мотива, смежного с протоспейсером (PAM), или расположены в области из непрерывных 1 – 30 п.о., смежной с 5'-концом или 3'-концом последовательности PAM, и indel расположены в последовательности, выбранной из SEQ ID NO: 13-24 в области экзона гена Dgkα и SEQ ID NO: 109-125 в области экзона гена Dgkζ.
2. Искусственно сконструированная иммунная клетка по п. 1, где indels расположены в последовательности, выбранной из SEQ ID NO: 13-24 в экзоне гена Dgkα, и последовательности, выбранной из SEQ ID NO: 109-125 в области экзона гена Dgkζ.
3. Искусственно сконструированная иммунная клетка по п. 1, где indel расположены в последовательности, выбранной из SEQ ID NO: 19, 20, 21 и 23 в экзоне гена Dgkα, и SEQ ID NO: 109-113 в области экзона гена Dgkζ.
4. Искусственно сконструированная иммунная клетка по п. 1, где indel расположены в последовательности, выбранной из SEQ ID NO: 19, 20, 21 и 23 в экзоне гена Dgkα, и последовательности, выбранной из SEQ ID NO: 109-113 в области экзона гена Dgkζ.
5. Искусственно сконструированная иммунная клетка по п. 1, где иммунной клеткой является по меньшей мере одна клетка, выбранная из группы, состоящей из T-клетки, NK-клетки, NKT-клетки и иммунной клетки, дифференцированной из стволовой клетки.
6. Искусственно сконструированная иммунная клетка по п. 1, где T-клетка также содержит химерный антигенный рецептор или сконструированный T-клеточный рецептор.
7. Композиция для получения искусственно сконструированной иммунной клетки, имеющей по меньшей мере один искусственно сконструированный иммунорегуляторный ген, выбранный из гена Dgkα и гена Dgkζ, включающая:
(i) одну или более гидовых нуклеиновых кислот, способных к таргетингу последовательности-мишени, расположенной в области экзона гена Dgkα или гена Dgkζ, или нуклеиновые кислоты, кодирующие их; и
(ii) белок-редактор или нуклеиновую кислоту, кодирующую этот белок, где гидовая нуклеиновая и белок-редактор способны формировать комплекс гидовая нуклеиновая кислота-белок-редактор, и комплекс гидовая нуклеиновая кислота-белок-редактор способен к манипулированию с последовательностью-мишенью,
где гидовые нуклеиновые кислоты независимо содержат:
гидовый домен, первый комплементарный домен, линкерный домен и второй комплементарный домен, где гидовый домен состоит из с 1-го по 20-е основание нуклеотидной последовательности, выбранной из SEQ ID NO: 13-24 и 109-125, в которой гидовый домен содержит U вместо T, присутствующего от 1 до 20 основания выбранной нуклеотидной последовательности в качестве последовательности РНК, и имеет 0 - 5 ошибочных спариваний с от 1 до 20 основания выбранной нуклеотидной последовательности,
где белок-редактор представляет собой белок Cas9.
8. Композиция для получения искусственно сконструированной иммунной клетки по п. 7, где гидовые нуклеиновые кислоты и белок-редактор находятся в форме рибонуклеопротеина.
9. Композиция для получения искусственно сконструированной иммунной клетки по п. 7, где гидовый домен состоит из с 1-го по 20-е основание нуклеотидной последовательности, выбранной из SEQ ID NO: 19, 20, 21, 23, 109, 110, 111, 112 и 113, в которой гидовый домен содержит U вместо T, присутствующего в от 1 до 20 основания выбранной нуклеотидной последовательности.
10. Композиция для получения искусственно сконструированной иммунной клетки по п. 7, где по меньшей мере одна гидовая нуклеиновая кислота содержит гидовый домен, состоящий из с 1-го по 20-е основание нуклеотидной последовательности, выбранной из SEQ ID NO: 13-24, в которой гидовый домен содержит U вместо T, присутствующего в от 1 до 20 основания выбранной нуклеотидной последовательности, и по меньшей мере одна гидовая нуклеиновая кислота содержит гидовый домен, состоящий из с 1-го по 20-е основание нуклеотидной последовательности, выбранной из SEQ ID NO: 109-125, в которой гидовый домен содержит U вместо T, присутствующего в от 1 до 20 основания выбранной нуклеотидной последовательности.
11. Гидовая нуклеиновая кислота для таргетинга последовательности-мишени, расположенной в области эзона в гене Dgkα или гене Dgkζ, содержащая гидовый домен, первый комплементарный домен, линкерный домен и второй комплементарный домен, где гидовый домен состоит из с 1-го по 20-е основание нуклеотидной последовательности, выбранной из SEQ ID NO: 13-24 и 109-125, в которой гидовый домен содержит U вместо T, присутствующего в от 1 до 20 основания выбранной нуклеотидной последовательности.
12. Гидовая нуклеиновая кислота по п. 11, где гидовый домен состоит из с 1-го по 20-е основание нуклеотидной последовательности, выбранной из SEQ ID NO: 19, 20, 21, 23, 109, 110, 111, 112 и 113, в которой гидовый домен содержит U вместо T, присутствующего в от 1 до 20 основания выбранной нуклеотидной последовательности.
13. Способ получения искусственно сконструированной иммунной клетки, имеющей по меньшей мере один искусственно сконструированный иммунорегуляторный ген, выбранный из гена Dgkα и гена Dgkζ, включающий:
контактирование иммунной клетки, выделенной из человеческого организма, с:
(a) одной или более гидовых нуклеиновых кислот, способных к таргетингу последовательности-мишени, расположенной в области экзона гена Dgkα или гена Dgkζ, или нуклеиновыми кислотами, кодирующими их; и
(b) белком-редактором, который представляет собой по меньшей мере один белок, выбранный из группы, состоящей из белка Cas9, происходящего от Streptococcus pyogenes, белка Cas9, происходящего от Campylobacter jejuni, белка Cas9, происходящего от Streptococcus thermophilus, белка Cas9, происходящего от Streptocuccus aureus, белка Cas9, происходящего от Neisseria meningitidis и белка Cpf1, или нуклеиновой кислотой, кодирующей белок-редактор;
и индуцирование одной или более indel в последовательности нуклеиновой кислоты любого одного или более из генов Dgkα и Dgkζ иммунной клетки,
где гидовая нуклеиновая и белок-редактор способны формировать комплекс гидовая нуклеиновая кислота-белок-редактор, и комплекс гидовая нуклеиновая кислота-белок-редактор способен к манипулированию с последовательностью-мишенью,
где, по отношению к нуклеотидной последовательности дикого типа иммунорегуляторного гена, indel расположены в последовательности мотива, смежного с протоспейсером (PAM), или расположены в области из непрерывных 1 – 30 п.о., смежной с 5'-концом или 3'-концом последовательности PAM,
и гидовые нуклеиновые кислоты независимо содержат:
гидовый домен, первый комплементарный домен, линкерный домен и второй комплементарный домен, где гидовый домен состоит из с 1-го по 20-е основание нуклеотидной последовательности, выбранной из SEQ ID NO: 13-24 и 109-125, в которой гидовый домен содержит U вместо T, присутствующего в от 1 до 20 основания выбранной нуклеотидной последовательности в качестве последовательности РНК.
14. Способ по п. 13, где гидовый домен состоит из с 1-го по 20-е основание нуклеотидной последовательности, выбранной из SEQ ID NO: 19, 20, 21, 23, 109, 110, 111, 112 и 113, в которой гидовый домен содержит U вместо T, присутствующего в от 1 до 20 основания выбранной нуклеотидной последовательности.
15. Способ по п. 13, где стадию контактирования осуществляют одним или более методами, выбранными из метода электропорации, метода с использованием липосом, плазмид, вирусных векторов, наночастиц и метода с использованием гибридного белка, содержащего домен транслокации белка.
16. Способ по п. 15, где вирусным вектором является по меньшей мере одни вектор, выбранный из группы, состоящей из ретровируса, лентивируса, аденовируса, аденоассоциированного вируса, вируса коровьей оспы, поксвируса и вируса простого герпеса.
17. Набор для генетической манипуляции, включающий:
(a) гидовую нуклеиновую кислоту по п. 11 или нуклеиновую кислоту, кодирующую ее; и
(b) белок-редактор, который включает один или более белков, выбранных из группы, состоящей из белка Cas9, происходящего от Streptococcus pyogenes, белка Cas9, происходящего от Campylobacter jejuni, белка Cas9, происходящего от Streptococcus thermophilus, белка Cas9, происходящего от Streptococcus aureus, белка Cas9, происходящего от Neisseria meningitidis, и белка Cpf1, или нуклеиновую кислоту, кодирующую белок-редактор.
| AU 2014366047 A1, 16.06.2016 | |||
| WO 2014039513 A2, 13.03.2014 | |||
| PRINZ P.U | |||
| et al., High DGK-α and disabled MAPK pathways cause dysfunction of human tumor-infiltrating CD8+ T cells that is reversible by pharmacologic intervention, J Immunol., 2012, Volume 188, Issue 12, pp | |||
| Обратный клапан | 1927 |
|
SU5990A1 |
| RIESE M.J | |||
| et al., Enhanced effector responses in activated CD8+ T | |||
Авторы
Даты
2022-03-16—Публикация
2017-08-14—Подача