Изобретение относится к химии и медицине, а именно к лекарственному средству формулы I:
 ,
,
у которого выявлена биологическая активность, заключающаяся в ингибировании репродукции вируса Хантаан 76-188. Данное соединение I может использоваться в качестве ингибитора репродукции вируса Хантаан и может быть применено в медицине, вирусологии и фармакологии.
Геморрагическая лихорадка с почечным синдромом (ГЛПС) (синонимы: геморрагический нефрозонефрит, болезнь Чурилова, эпидемический нефрозонефрит, дальневосточная геморрагическая лихорадка, корейская геморрагическая лихорадка, маньчжурская геморрагическая лихорадка, скандинавская эпидемическая нефропатия, тульская лихорадка; hemorrhagic fever with renal syndrome) - острое вирусное природно-очаговое заболевание, характеризующееся системным поражением мелких сосудов, геморрагическим диатезом, гемодинамическими расстройствами и своеобразным поражением почек с развитием острой почечной недостаточности. За последние десятилетия хантавирусные болезни включены в круг весьма актуальных и приоритетных проблем во всем мире, так называемых emerging (непредсказуемых) инфекций, грозящих сложными эпидемическими ситуациями. Это обусловлено изменчивостью генома хантавирусов, а, следовательно, чревато появлением новых типов и генетических вариантов в новых регионах мира с высокой вирулентностью для человека.
Возбудитель ГЛПС относится к семейству буньявирусов (Bunyaviridae) и принадлежит к самостоятельному роду - Hantavirus. Репликация его осуществляется в цитоплазме инфицированных клеток. К настоящему времени известно более 30 серологически и генетически отличающихся друг от друга хантавирусов. Описаны две клинические формы хантавирусной инфекции у людей:
- геморрагическая лихорадка с почечным синдромом, возбудителем которой является вирусы Hantaan, Seul, Puumala, Dobrava/Belgrade, Seoul, Amur;
- хантавирусный пульмональный синдром, впервые описан в США в 1993 г., вызывается хантавирусами Sin-Nombre, BlackCreek, NewYork, Bayou, Andes, LagunaNegra.
В европейском регионе регистрация заболеваемости ГЛПС ведется с 1963 года. Случаи заболевания ГЛПС регистрируются ежегодно, в основном в странах Северной и Центральной Европы, на Балканском полуострове и в Скандинавии. За последнее десятилетие с 2009 по 2018 гг. зарегистрировано 29 472 случая заболевания ГЛПС в 29 странах региона. В среднем, в год регистрировалось 2900 случаев заболевания. Основная доля заболевших зарегистрирована в Финляндии (75,9%) и Германии (12,9%). В Западно-Тихоокеанском регионе болезнь широко распространена в Китае. Эндемична вся территория страны, за исключением тайваньского региона. Ежегодно, на долю Китая приходится 90% от всей заболеваемости ГЛПС в мире. С 2000 года ежегодное число случаев заболевания ГЛПС сократилось более чем в 3 раза - с 37 814 в 2000 году до 11 248 в 2007 году. С 2009 по 2018 гг. ежегодное число случаев заболевания колебалось от 9000 до 25000.
В Российской Федерации в настоящее время ГЛПС является актуальной природно-очаговой болезнью вирусной этиологии. С момента начала официальной регистрации заболевания в стране (1978 г.) по настоящее время, зарегистрировано свыше 265 000 случаев заболевания ГЛПС. Большая часть из которых зарегистрирована на территории Европейской части страны. На европейские очаги России, в разные годы приходилось от 80 до 95% случаев заболевания ГЛПС от общероссийских показателей. Самые активные очаги ГЛПС располагаются в Приволжском федеральном округе, именно на эти регионы ежегодно приходится до 90% от общей заболеваемости ГЛПС по стране.
Границы природных очагов ГЛПС расширяются, постепенно вовлекая в этот процесс территории, ранее считавшиеся свободными от ГЛПС. В настоящее время обнаружены новые очаги хантавирусной инфекции в Республике Алтай, Новосибирской, Иркутской и Кемеровской областях. В 2018 году в Российской Федерации зарегистрировано 5855 случаев заболевания ГЛПС.
Тяжесть течения болезни, и исход зависит от этиологии заболевания. Примерно у четверти больных ГЛПС-Пуумала протекает в легкой форме, у половины больных - в среднетяжелой и еще у четверти - в тяжелой форме. Геморрагический синдром встречается у 14-20% пациентов с ГЛПС-Пуумала. Летальность при ГЛПС-Пуумала составляет 0,4-1%. Заболевание ГЛПС-Хантаан протекает тяжелее, чем ГЛПС-Пуумала: более чем у трети пациентов заболевание протекает в тяжелой форме, геморрагический синдром наблюдается почти у половины пациентов. Летальность при ГЛПС-Хантаан составляет 5-10%. ГЛПС-Сочи регистрируется в субтропической зоне Краснодарского края и представляет собой наиболее тяжелую форму ГЛПС из регистрируемых к настоящему времени этиологических форм болезни. Более половины пациентов с ГЛПС-Сочи переносят заболевание в тяжелой форме и имеют выраженные геморрагические проявления. Летальность при ГЛПС-Сочи составляет 11-14%.
Основным путем заражения является воздушно-пылевой, при котором вирус, содержащийся в биологических выделениях грызунов, в виде аэрозоля попадает через верхние дыхательные пути в легкие человека, где условия для его размножения наиболее благоприятны, и затем с кровью переносится в другие органы и ткани. Заражение возможно также через поврежденную кожу при контакте с экскрементами инфицированных грызунов или со слюной в случае укуса зверьком человека. Случаев заражения и передачи возбудителя ГЛПС от человека к человеку за всю историю изучения этой инфекции не зафиксировано. У человека абсолютная восприимчивость к возбудителю этой инфекции.
Несмотря на тяжесть протекания этой болезни и широкое распространение, специфической противовирусной терапии на данный момент нет. Лечение может проводиться препаратом широкого спектра действия - рибавирином; при этом на ранней стадии болезни двумя препаратами рибавирина - виразолом внутривенно в дозе 16 мг/кг 4 раза в сутки 3 дня (внутривенное введение) с последующим приемом внутрь рибавирина по 1000 мг в сутки до 5 дней [«Геморрагическая лихорадка с почечным синдром у взрослых» Клинические рекомендации. Рассмотрены и рекомендованы к утверждению Профильной комиссией по инфекционным болезням Минздрава России 2014]. В отечественной клинической практике этиотропная терапия ГЛПС не укрепилась, учитывая неэффективность противовирусных препаратов в более поздние сроки болезни, когда госпитализируется большая часть пациентов с тяжелыми формами инфекции, и ее исход определяет не вирусная нагрузка, а полиорганная недостаточность и неотложные состояния. Современные клинические исследования (плацебо-контролируемые, с двойным слепым контролем) показали неэффективность рибаверина в лечении ГЛПС [Mertz, G.J., Miedzinski, L., Goade, D., Pavia, А. Т., Hjelle, В., Hansbarger, С.O., Levy, H., Koster, F.Т., Baum, K., Lindemulder, A., Wang, W., Riser, L., et al. (2004). Placebocontrolled, double-blind trial of intravenous ribavirin for the treatment of hantavirus cardiopulmonary syndrome in North America. Clin. Infect. Dis. 2004, Vol. 39, 1307-1313].
Наиболее близким к заявляемому соединению - прототипом, является Триазаверин II.
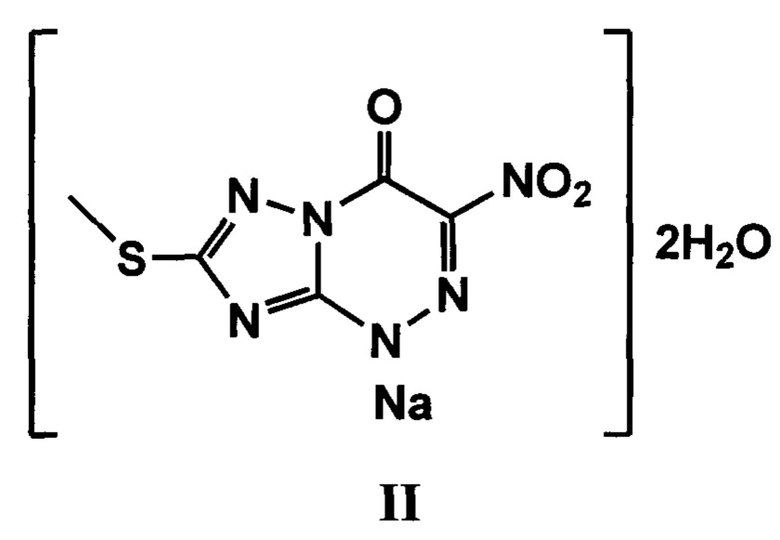
Указанное соединение - натриевая соль 2-метилтио-6-нитро-1,2,4-триазоло[5,1-с]-1,2,4-триазин-7-она дигидрата может использоваться для профилактики и лечения вирусных заболеваний и состояний, вызванных вирусом Хантаан или вирусом восточного энцефаломиелита лошадей («Противовирусное средство и способ профилактики и лечения вирусных инфекций» патент RU №2457844, МПК A61K 31/53, опубл. 10.08.2012 г.). Недостатком известного соединения является невысокая противовирусная активность на животных моделях.
Задачей изобретения является создание нового эффективного ингибитора репродукции вируса Хантаан, вызывающего ГЛПС.
Технический результат: повышение эффективности подавления репродукции вируса Хантаан и расширение ассортимента ингибиторов репродукции данного вируса.
Поставленная задача решается использованием нового соединения формулы I, обладающего выраженными свойствами ингибитора репродукции вируса Хантаан. 
Соединение формулы I после проведения углубленных фармакологических исследований, может быть использовано, как в чистом виде, так и в качестве компонента новых низкотоксичных высокоэффективных против вируса Хантаан лекарственных форм.
Исследования биологической активности агента I, проведенные с использованием МТТ теста в отношении вируса Хантаан штамм 76-188, показали высокую эффективность данного вещества в качестве ингибитора репродукции вируса.
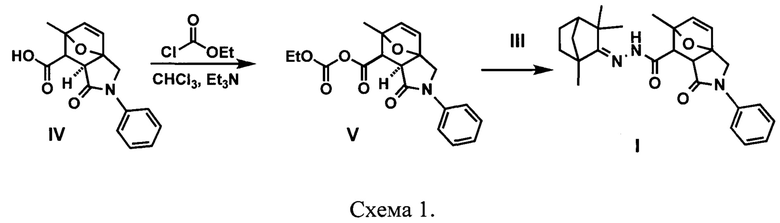
Синтез соединения проводили по схеме 1. Ход реакций отслеживали отбором проб и анализом хромато-масс спектров. По описанной в литературе методике [ ,
,  ,
,  , Rak J.,
, Rak J.,  ,
,  ,
, ,
, ,
,  Synthesis and biological activity evaluation of hydrazone derivatives based on a
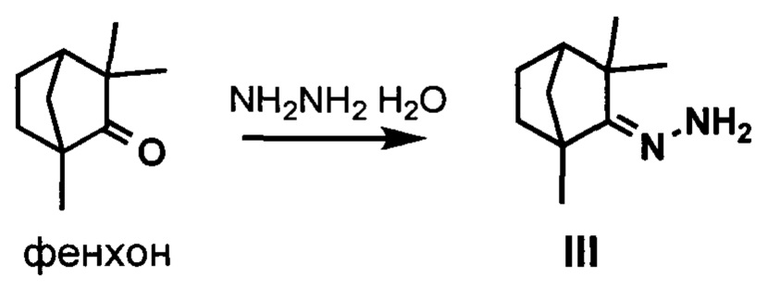
Synthesis and biological activity evaluation of hydrazone derivatives based on a  base skeleton, Bioorg. Med. Chem. 2015, Vol. 23, 1651-1659] получали гидразон фенхона III.Синтез эпоксизоиндольной кислоты формулы IV описан ранее в литературе [F. I. Zubkov, V. P. Zaytsev, Е. V. Nikitina, V. N. Khrustalev, S. V. Gozun, E. V. Boltukhina, A. V. Varlamov. "Skeletal Wagner-Meerwein rearrangement of perhydro-3a,6;4,5-diepoxyisoindoles". Tetrahedron 2011, Vol. 67, №47, 9148-9163], взаимодействие кислоты IV с этилхлорформатом приводит к смешанному ангидриду V, реакция последнего без дополнительного выделения с гидразоном III приводит к целевому агенту I.
base skeleton, Bioorg. Med. Chem. 2015, Vol. 23, 1651-1659] получали гидразон фенхона III.Синтез эпоксизоиндольной кислоты формулы IV описан ранее в литературе [F. I. Zubkov, V. P. Zaytsev, Е. V. Nikitina, V. N. Khrustalev, S. V. Gozun, E. V. Boltukhina, A. V. Varlamov. "Skeletal Wagner-Meerwein rearrangement of perhydro-3a,6;4,5-diepoxyisoindoles". Tetrahedron 2011, Vol. 67, №47, 9148-9163], взаимодействие кислоты IV с этилхлорформатом приводит к смешанному ангидриду V, реакция последнего без дополнительного выделения с гидразоном III приводит к целевому агенту I.
Спектральные исследования выполнены в Химическом Сервисном Центре коллективного пользования СО РАН. Спектры ЯМР 1Н и 13С регистрировали на спектрометрах Bruker AV-400 (1Н: 400.13 МГц, 13С: 100.61 МГц), DRX-500 (1Н: 500.13 МГц, 13С: 125.76 МГц) и AV-600 (1Н: 600.30 МГц, 13С: 150.95 МГц). В качестве внутреннего стандарта использовали остаточные сигналы растворителя - хлороформа (1Н 7.24, 13С 76.90 м.д.). Отнесение сигналов в спектрах ЯМР проводилось с привлечение стандартных одномерных и двумерных экспериментов. Нумерация атомов в соединении дана для отнесения сигналов в спектрах ЯМР и не совпадает с нумерацией атомов в номенклатурном названии. Хромато-масс-спектры записывали на газовом хроматографе Agilent 7890 А с квадрупольным масс-спектрометром Agilent 5975С в качестве детектора, кварцевая колонка НР-5MS 300000.25 мм, газ-носитель - гелий. Растворители перед использованием сушились и перегонялись.
Изобретение иллюстрируется следующими примерами.
Пример 1. Методика синтеза соединения I.
Карбоновую кислоту (3.0 ммоль) IV растворяли в хлороформе (100 мл) с добавлением (0.44 мл, 3.2 ммоль) триэтиламина, затем по каплям добавляли раствор этилхлорформиата (0.28 мл, 3.0 ммоль) в хлороформе (30 мл). Реакционная смесь перемешивалась на магнитной мешалке при комнатной температуре в течение 15 мин, после чего добавляли по каплям раствор гидразона фенхона III (0.5 г, 3.0 ммоль) в хлороформе. Реакционную смесь перемешивали в течение 4 часов, после чего промывали водой (3×10 мл). Органический слой сушили над прокаленным Na2SO4 в течение 5 ч. Растворитель упаривали на ротационном испарителе. Полученный продукт выделяли с помощью колоночной хроматографии на силикагеле, в качестве элюента была использована система хлороформ/метанол.
6-Метил-1-оксо-2-фенил-N'-[(2Z)-1,3,3-триметилбицикло[2.2.1]гепт-2-илиден]-1,2,3,6,7,7а-гексагидро-3а,6-эпоксиизоиндол-7-карбогидразид (I).
Выход 80%.
ЯМР 1Н (400 МГц, CDCl3, δ, м. д.): 1.33-1.58 (2Н, m, 2Н-2), 1.68-1.74 (1H, m, Н-3), 1.60-1.66 (1Н, m, Н-3), 1.64-1.66 (1Н, m, Н-4), 1.23-1.63 (2Н, m, 2Н-7), 1.07 (3Н, s, Ме-8), 1.25 (3Н, s, Ме-9), 1.13 (3Н, s, Ме-10), 3.91-3.96 (1Н, m, Н-12), 2.91 (1Н, d, J=3.9, Н-13), 4.15-4.19 (1Н, m, Н-15), 4.35-4.40 (1Н, m, Н-15), 6.62 (2Н, d J=5.6, Н-17), 6.28 (1Н, d, J=5.6, Н-18), 7.26-7.31 (2Н, m, Н-22, Н-26), 7.54-7.61 (2Н, m, Н-23, Н-25), 7.05-7.10 (1Н, m, Н-24), 1.64, 1.62 (3Н, s, Ме-20). ЯМР 13С (125 МГц, CDCl3, δ, м.д.): 167.31 (С-6), 50.98 (С-1), 33.91 (С-2), 24.83 (С-3), 49.60 (С-4), 42.34 (С-5), 42.59 (С-7), 23.20 (С-8), 23.03 (С-9), 16.98 (С-10), 165.29 (С-11), 43.46 (С-12), 54.73 (С-13), 170.91 (С-14), 50.17 (С-15), 86.75 (С-16), 136.33 (С-17), 140.43 (С-18), 89.39 (С-19), 139.10 (С-21), 128.43 (С-22, С-26), 120.18 (С-23, С-25), 124.28 (С-24), 15.77 (С-20). Найдено: m/z 433.2356 [M]+C26H31O3N3. Вычислено: М=433.2360.
Пример 2.
Определение цитотоксичности соединений на клетках линии 293FT.
Стоковый раствор соединения I в ДМСО (в концентрации 100 мМ) добавлялись в ростовую среду к клеткам-мишеням линии 293FT в различных концентрациях - от 10 мкМ до 500 мкМ - на 48 ч. По окончании инкубации клеток с веществом, к культурам клеток добавляли тетразолиевый краситель МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромид) до рабочей концентрации 0.5 мг/мл и инкубировали в течение 4 ч. Образующийся осадок формазана растворяли добавлением в ростовую среду 10% раствора додецилсульфата натрия с 0.01М соляной кислотой. Количество формазана (пропорциональное количеству жизнеспособных клеток) определяли спектрофотометрически, измеряя абсорбцию при длине волны света 570 нм. Процент жизнеспособных клеток в культурах, содержащих разные концентрации исследуемого вещества I определяли по отношению к контролю (который представлял собой культуру клеток 293FT, инкубируемую в ростовой среде с ДМСО в отсутствие соединений), пользуясь формулой
% жизнеспособных клеток[1]=ОП [1]/ОП[ДМСО].
За величину CD50 (50% цитотоксическая концентрация) принимали концентрацию вещества, при которой выживало 50% клеток по сравнению с контролем.
Пример 3.
Определение противовирусного действия соединения I в отношении вируса Hantaan 76-188 in vitro на культуре клеток Vero.
В работе был использован вирус Hantaan 76-188, полученный из Государственной коллекции возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ БВ «Вектор» Роспотребнадзора в виде культуральной жидкости (титр вируса 2,5 lgTCD50/ml).
Определение эффективных (IC50) концентраций соединений было проведено в тесте снижения цитопатического действия вируса HantaanHa клетки в трех повторах. Метод основан на способности жизнеспособных клеток поглощать и накапливать суправитальный краситель нейтральный красный. Культура клеток Vero была выращена в 96 - луночных культуральных планшетах с конфлюэнтностью не менее 90%. Готовили последовательные трехкратные разведения соединений, начиная с концентрации 150 мкг/мл. В эксперименте использовали вирус Hantaan в дозе 10 TCD50 на лунку.
Определение ингибирующей активности и токсической концентрации соединения проводили одновременно. Для этого в культуральный планшет с монослоем клеток вносили разведения соединений, затем вносили поддерживающую среду без вируса (для определения токсической концентрации соединений) и жидкость содержащую вирус (для определения ингибирующей активности соединений). Культуральные планшеты инкубировали при 37°С в течение 10 суток, затем окрашивали МТТ. Учет результатов проводили на планшетном анализаторе (Thermo Scientific Multiskan FC), обработку данных осуществляли при помощи программы SOFTmax PRO 4.0 с использованием 4-х параметрического метода анализа. Для всех исследованных соединений определены 50% токсическая концентрация (CD50) и концентрации 50% ингибирования (IC50). В дальнейшем, для каждого соединения рассчитывался индекс селективности (SI) - отношение токсичности соединения и ингибирующей активности против вируса Hantaan (CD50 / IC50) (табл.1).

Из таблицы 1 видно, что индекс селективности (SI) заявляемого соединения в 5 раз выше соединения-прототипа (триазаверина).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ ЗАБОЛЕВАНИЯ, ВЫЗЫВАЕМОГО ВИРУСОМ ХАНТААН - ВОЗБУДИТЕЛЕМ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ С ПОЧЕЧНЫМ СИНДРОМОМ, НА ЭКСПЕРИМЕНТАЛЬНОМ ЖИВОТНОМ | 2005 |
|
RU2294563C2 |
| СПОСОБ ПОЛУЧЕНИЯ "ДИАГНОСТИКУМА ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ С ПОЧЕЧНЫМ СИНДРОМОМ КУЛЬТУРАЛЬНОГО, ПОЛИВАЛЕНТНОГО ДЛЯ НЕПРЯМОГО МЕТОДА ИММУНОФЛЮОРЕСЦЕНЦИИ" | 2010 |
|
RU2431148C1 |
| ПРОТИВОВИРУСНОЕ СРЕДСТВО И СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ВИРУСНЫХ ИНФЕКЦИЙ | 2010 |
|
RU2457844C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТЕСТ-СИСТЕМЫ "ХАНТА-N" ДЛЯ ОПРЕДЕЛЕНИЯ СПЕЦИФИЧЕСКОЙ АКТИВНОСТИ ВАКЦИНЫ ПРОТИВ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ С ПОЧЕЧНЫМ СИНДРОМОМ | 2012 |
|
RU2590606C2 |
| ШТАММ ВИРУСА ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИННЫХ ПРЕПАРАТОВ ПРОТИВ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ С ПОЧЕЧНЫМ СИНДРОМОМ (ВАРИАНТЫ) | 2018 |
|
RU2683508C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМБИНИРОВАННОЙ БИВАЛЕНТНОЙ, КУЛЬТУРАЛЬНОЙ, ИНАКТИВИРОВАННОЙ, КОНЦЕНТРИРОВАННОЙ, ОЧИЩЕННОЙ ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ С ПОЧЕЧНЫМ СИНДРОМОМ | 2009 |
|
RU2445117C2 |
| Рекомбинантная плазмида pET21-GST-CD, обеспечивающая синтез и секрецию эктодомена Gc гликопротеина вируса Хантаан, и рекомбинантный штамм Escherichia coli BL21(DE3)pLysE pET21-GST-CD - продуцент белка Gc - эктодомена гликопротеина вируса Хантаан | 2023 |
|
RU2807520C1 |
| Рекомбинантная плазмида pET21-GST-ND, обеспечивающая синтез и секрецию эктодомена Gn гликопротеина вируса Хантаан, и рекомбинантный штамм Escherichia coli BL21(DE3)pLysE pET21-GST-ND - продуцент белка Gn - эктодомена гликопротеина вируса Хантаан | 2023 |
|
RU2809199C1 |
| 3-N-ЗАМЕЩЕННЫЕ БОРНИЛПРОПИОНАТЫ, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ВИРУСА МАРБУРГ | 2017 |
|
RU2649406C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИКУМА ХАНТАВИРУСОВ | 2000 |
|
RU2180754C2 |
Изобретение относится к производному эпоксиизоиндола формулы I и может быть использовано в медицине, фармакологии и вирусологии. Технический результат – соединение формулы I в качестве ингибитора репродукции вируса Хантаан. 1 табл., 3 пр.
N-Ацилгидразон фенхона с фрагментом эпоксиизоиндола формулы I:
 ,
,
используемый в качестве ингибитора репродукции вируса Хантаан 76-188.
| Kovaleva K.S | |||
| et al.: "Synthesis of D-(+)-camphor-based N-acylhydrazones and their antiviral activity" Med | |||
| Chem | |||
| Comm., 2018, vol.9, pp.2072-2082 | |||
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2006 |
|
RU2304443C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКОЙ С ПОЧЕЧНЫМ СИНДРОМОМ (ГЛПС) | 2001 |
|
RU2196576C1 |
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
Авторы
Даты
2020-10-01—Публикация
2020-02-26—Подача