Область техники
Настоящее изобретение относится к области биомедицины и связано с применением специфических ингибиторов гексокиназы-2 для профилактики и лечения острых повреждений центральной нервной системы (ЦНС).
Уровень техники
Инсульт, ишемический или геморрагический, является острым цереброваскулярным заболеванием, сопровождающимся повреждением головного мозга, вызванным разрывом кровеносных сосудов в головном мозге или уменьшением кровоснабжения из-за сосудистой окклюзии. Ишемический инсульт составляет около 85% от общего числа случаев. Тканевой активатор плазминогена (t-PA) представляет собой лекарственное средство, одобренное управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для лечения ишемического инсульта. Однако, t-PA подходит для применения только в первые 3-6 часов после инсульта, кроме того, существует риск церебрального кровотечения и церебрального отека после лечения. Эти недостатки сильно ограничивают применение t-PA, и очень немногие пациенты получают терапевтический эффект от его приема. Поэтому существует потребность в безопасных и эффективных препаратах, которые могут применяться для профилактики и лечения острого ишемического инсульта.
Воспалительная реакция, опосредованная иммунной системой после острого ишемического инсульта, является широко изученной терапевтической мишенью. Однако результаты клинических испытаний препаратов, использующих этот механизм в качестве терапевтических мишеней, не являются удовлетворительными. Например, Финголимод и Натализумаб, оба являющиеся агентами, нацеленными на воспалительный ответ периферической иммунной системы, эффективны в ингибировании проникновения лимфоцитов в паренхиму головного мозга, однако клинические испытания показали, что для пациентов с инсультом такое лечение неэффективно. Таким образом, углубленное изучение воспалительной реакции центральной нервной системы, опосредованной микроглией, после ишемии, как ожидается, обеспечит новые терапевтические цели и стратегии для профилактики и лечения острого ишемического инсульта.
Краткое описание изобретения
Авторы настоящего изобретения провели скрининг ряда генов гликолитического пути и установили, что селективная позитивная регуляция гексокиназы 2 опосредует процесс индуцированной гипоксией активации микроглии. Авторы изобретения подтвердили, что ряд биологически активных веществ, обладающих селективно ингибирующей активностью в отношении гексокиназы 2, может ингибировать вызванную гипоксией активацию микроглии. Кроме того, авторы изобретения также обнаружили, что интерференция обоих ферментов, гексокиназы 1 и 3, не может ингибировать вызванную гипоксией активацию микроглии.
Таким образом, в соответствии с одним аспектом настоящего изобретения предложено применение специфического ингибитора гексокиназы 2 для изготовления лекарственного средства для профилактики и лечения острого повреждения центральной нервной системы.
В соответствии с другим аспектом настоящего изобретения предложено применение фармацевтической композиции, содержащей специфический ингибитор гексокиназы 2, для изготовления лекарственного средства для профилактики и лечения острого повреждения центральной нервной системы.
Согласно еще одному аспекту изобретения предложен способ профилактики и лечения острого повреждения центральной нервной системы, включающий в себя введение субъекту, нуждающемуся в этом, профилактически или терапевтически эффективного количества специфического ингибитора гексокиназы 2 или фармацевтической композиции, содержащей специфический ингибитор гексокиназы 2.
Авторы настоящего изобретения обнаружили нейропротекторное действие специфического ингибитора гексокиназы 2 при профилактике и лечении острого повреждения центральной нервной системы. Цитологические и in vivo эксперименты на животных показали, что селективно повышенная экспрессия гексокиназы 2 регулирует вызванную гипоксией активацию микроглии и опосредованные микроглией нейровоспалительные реакции после ишемии, тогда как селективные ингибиторы гексокиназы 2 и нокдаун генов значительно ингибируют опосредованные микроглией воспалительные реакции и тем самым оказывают нейропротекторное действие.
Краткое описание чертежей
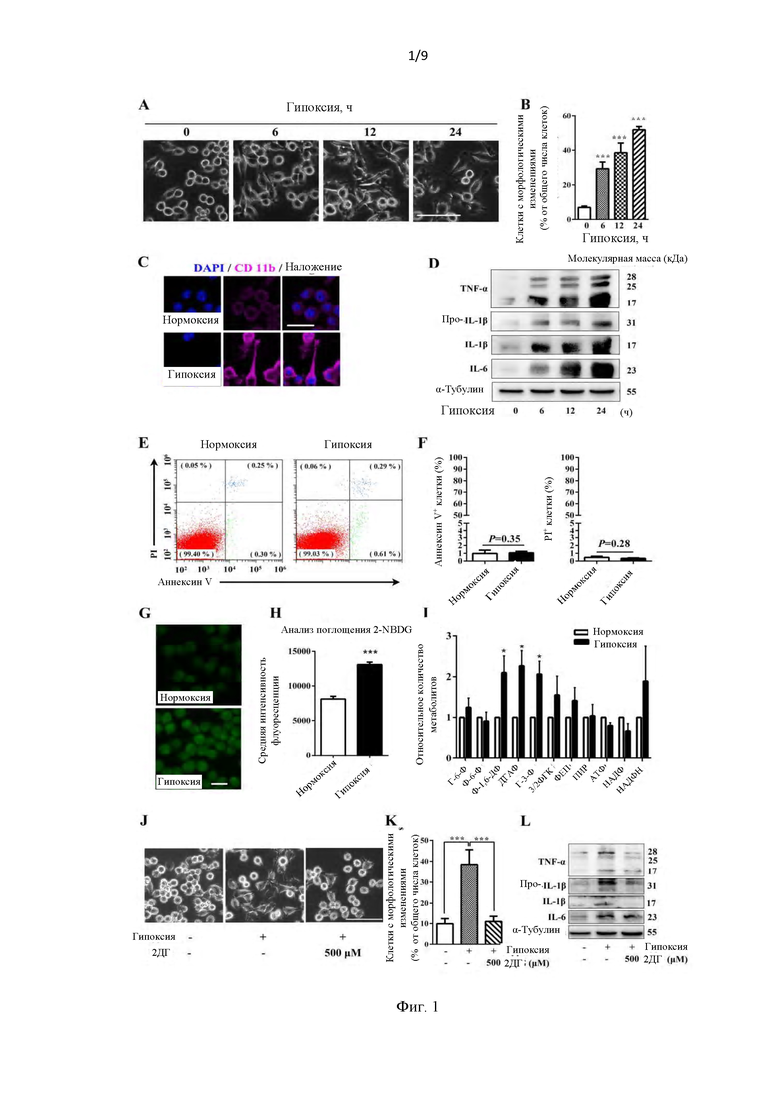
Фиг. 1. Увеличенный гликолитический поток необходим для вызванной гипоксией активации микроглии. (А) Типовые изображения микроглии BV 2, подвергавшейся воздействию гипоксии в течение указанного времени. Масштаб, 100 мкм (n=4). (В) Количественное определение процентного содержания клеток микроглии с морфологическими изменениями, показанными в (А) (n=4). (С) вызванная гипоксией активация микроглии была верифицирована посредством повышения экспрессии молекулярного маркера CD 11b. Масштаб, 25 мкм (n=3). (D) Провоспалительные цитокины были заметно индуцированы гипоксией в клетках BV 2 в зависимости от времени (n=3). (E-F) Гипоксия не оказывала влияния на жизнеспособность клеток BV 2. Анализ по методу проточной цитометрии не показал значительного увеличения количества Аннексии V+ или PI+ клеток после воздействия 1% кислорода в течение 24 часов (n=3). (G) Типовые изображения анализа поглощения 2-[N-(7-нитробенз-2-окса-1,3-диазол-4-ил) амино]-2-дезокси-D-глюкозы (2-NBDG) в клетках, инкубированных с 2-NBDG, подвергавшихся нормоксии или гипоксии в течение 1 часа. Масштаб 100 мкм. (Н) Средняя интенсивность флуоресценции в (G) была количественно определена с помощью считывателя микропланшетов с несколькими детекторами (n=4). (I) Графики, иллюстрирующие ключевые метаболиты в гликолитическом пути; значительно повышенные метаболиты были отмечены после воздействия гипоксии в течение 6 часов (n=4). (J-L) 2-DG, ингибитор гликолитического пути, значительно блокирует активацию микроглии во время гипоксии. (J) Фазово-контрастные изображения клеток BV 2, подвергавшихся воздействию 1% кислорода с 2-DG или без него. (K) Уменьшенный процент активированных клеток после обработки 2-DG в (J). Масштаб, 50 мкм (n=4). (L) Продукция провоспалительных цитокинов была значительно нарушена 2-DG при гипоксии. *<0,05; **<0,01; ***<0,001.
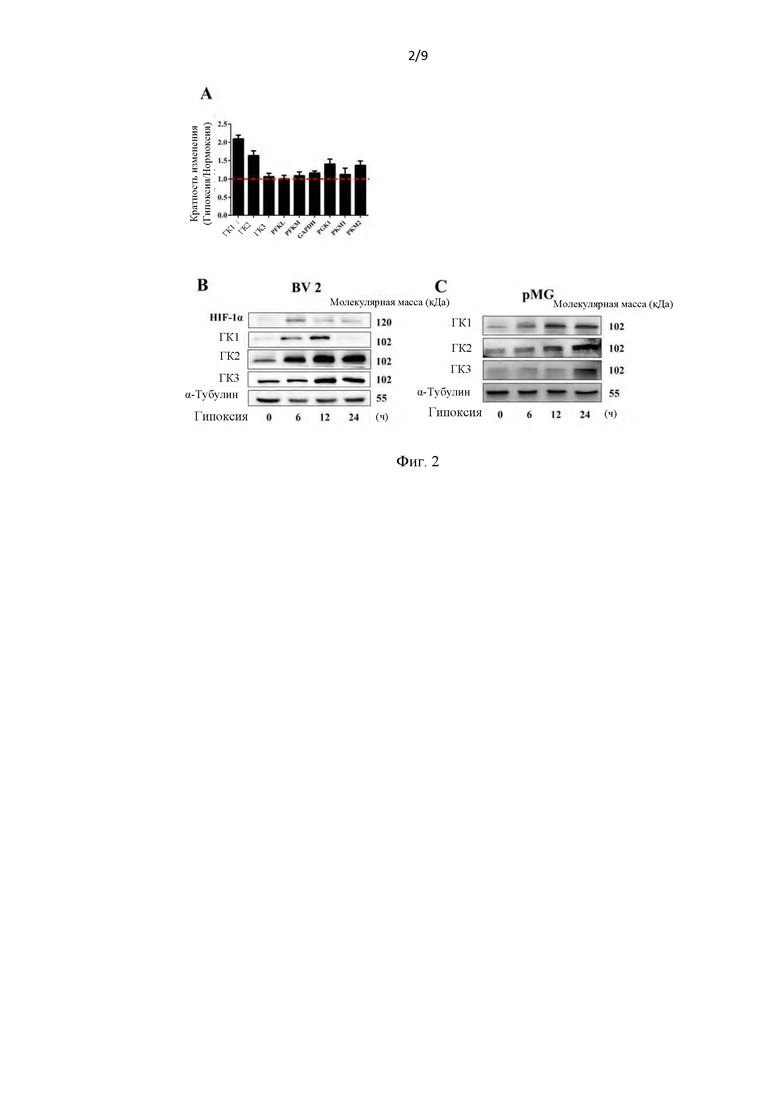
Фиг. 2. Повышенная экспрессия членов семейства гексокиназ была вовлечена в процесс вызванной гипоксией активации микроглии. (А) Анализы уровней мРНК ферментов методом количественной ПЦР с детекцией в реальном времени (qRT-PCR). Графики, показывающие общее повышение уровня мРНК этих генов при гипоксии в течение 6 ч (n=3). (В-С) Уровни белка ГК1 (HK1), ГК2 (HK2) и ГК3 (HK3) в клетках BV 2 и первичной микроглии (pMG), подвергавшихся гипоксии в течение указанного времени (n=4).
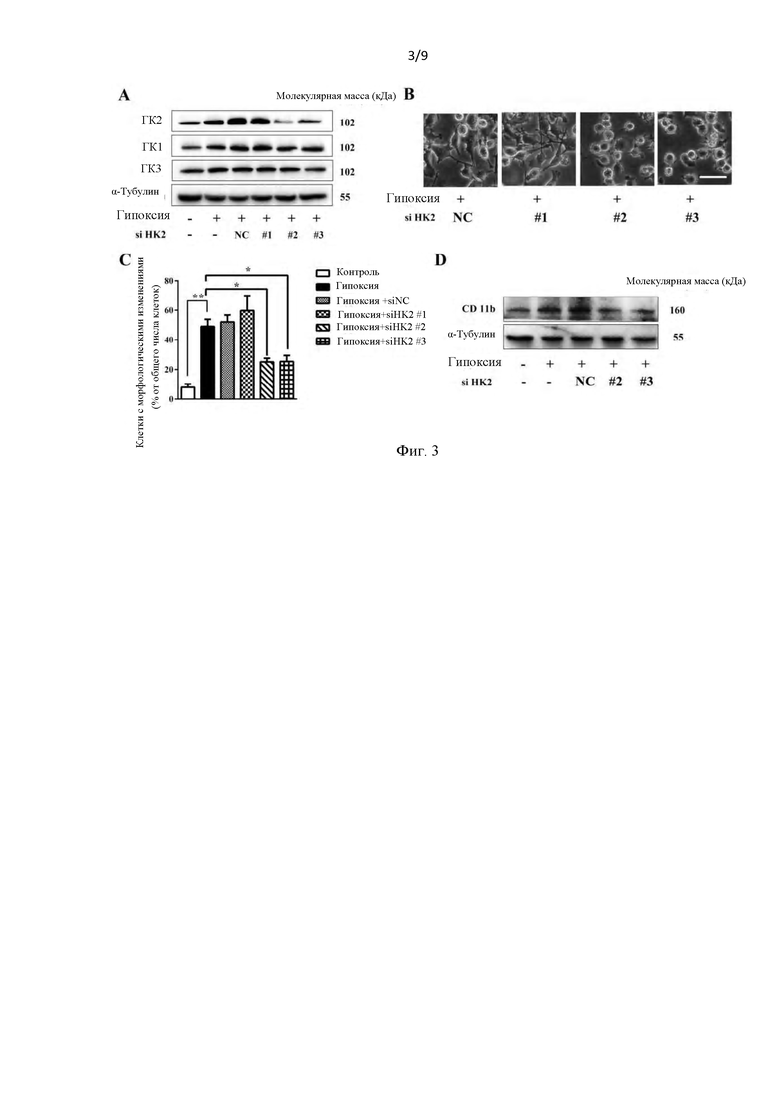
Фиг. 3. Интерференция гексокиназы 2 эффективно ингибировала индуцированную гипоксией активацию микроглии. (А) Специфического нокдауна ГК2 (HK2) было достаточно для блокирования активированного фенотипа микроглии BV 2 (n=3). Указанные уровни белка анализировали с помощью вестерн-блоттинга после того, как клетки BV 2 трансфицировали ГК2 (HK2) киРНК или без в течение 24 ч и стимулировали гипоксией в течение еще 24 часов. (В) Трансфекция клеток BV2 различными интерферирующими фрагментами ГК2 (HK2) эффективно подавляет морфологические изменения, вызванные гипоксией. (С) Сниженный процент активированной морфологии микроглии в клетках с нокдауном ГК2 (HK2) при гипоксии. (D) Нокдаун ГК2 (HK2) заметно подавлял экспрессию CD 11b.
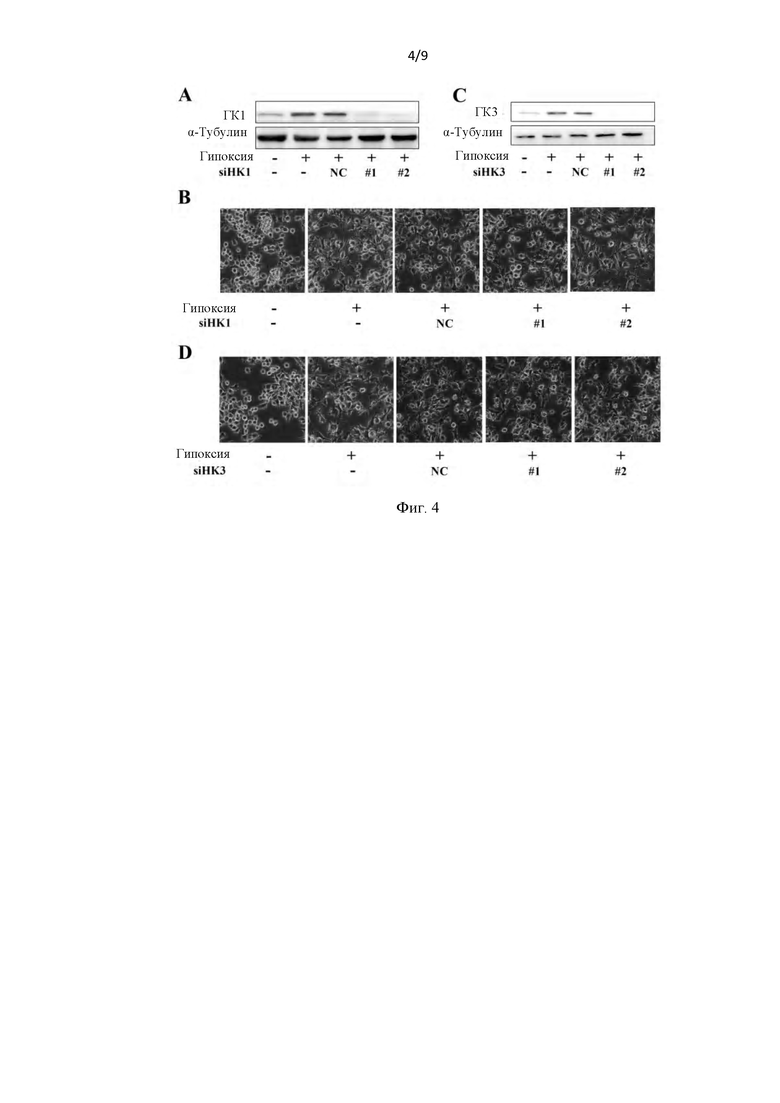
Фиг. 4. Ни интерференция ГК1 (HK1), ни интерференция ГК3 (HK3) не могли подавить вызванную гипоксией активацию микроглии. Вызванная гипоксией активация, связанная с морфологическими изменениями микроглии (В и D, n=3), не могла быть эффективно подавлена интерферирующими фрагментами ГК1 (HK1) и ГК3 (HK3) соответственно (А и С).
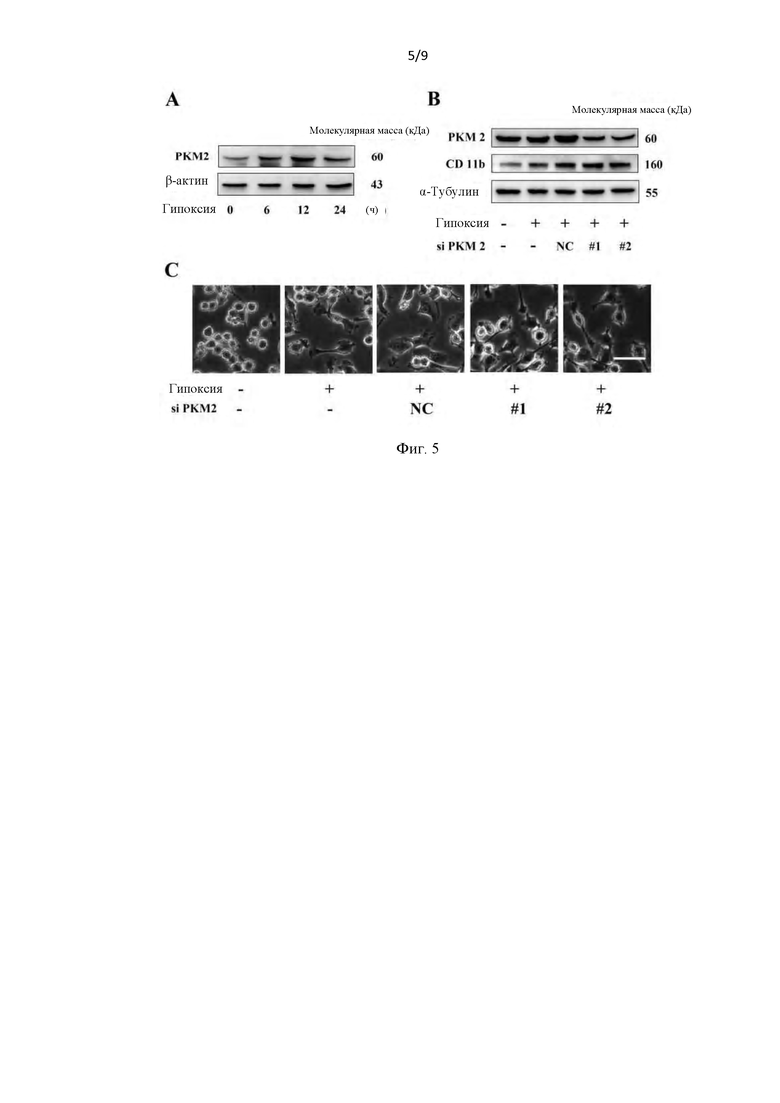
Фиг. 5. Интерференция РКМ2 не могла ингибировать вызванную гипоксией активацию микроглии. (А) Иммуноблот-анализ экспрессии белка РKМ2 в стимулированных гипоксией клетках BV 2. (В) Нокдаун РКМ2 не влиял на индуцированную гипоксией позитивную регуляцию CD 11b. (С) Типовые изображения, показывающие, что нокдаун РKМ2 не мог подавлять морфологические изменения, вызванные гипоксией. Масштаб, 50 мкм.
Фиг. 6. Лонидамин, ингибитор ГК2 (HK2), может эффективно ингибировать вызванную гипоксией активацию микроглии. (А) Активированное состояние культур pMG и BV 2 было заметно ингибировано в присутствии лонидамина (50 мкм) во время гипоксии. Масштаб, 50 мкм. (В) Графики, показывающие снижение процентного содержания активированных клеток микроглии, обработанных лонидамином в (А). (С) Иммунофлуоресцентный анализ, иллюстрирующий снижение экспрессии CD 11b в присутствии лонидамина в клетках BV 2 и pMG при стимуляции гипоксией. Масштаб, 50 мкм. *<0,05; **<0,01; ***<0,001.
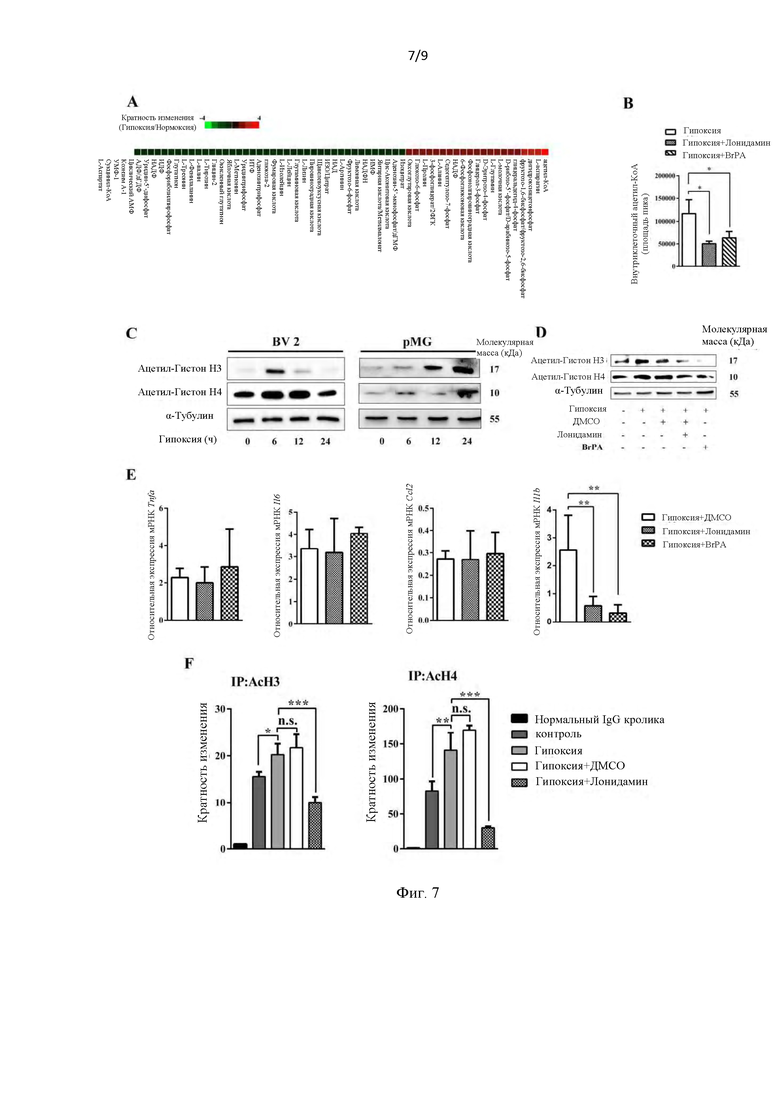
Фиг.7. Индукция ГК2 (HK2) приводит к повышенному уровню ацетилирования гистонов и транскрипционной активации провоспалительного цитокина Il-lb. (А) Метаболическое профилирование цикла гликолиза и ТСА после того, как клетки BV 2 подвергались гипоксии в течение 6 часов. Данные представлены в виде кратности изменений при гипоксии по сравнению с нормоксией. Негативно регулируемые представлены зелеными квадратами, а позитивно регулируемые - красными квадратами (n=4). (В) (D) Ингибирование ГК2 (HK2) обратило внутриклеточное накопление ацетил-КоА и ингибировало положительно регулируемые ацетилированные гистоны в клетках BV 2 (n=4). (С) Уровни экспрессии ацетилирования гистонов после воздействия гипоксии в клетках BV 2 и клетках первичной микроглии (pMG) (n=3). (Е) вызванная гипоксией позитивная регуляция Il 1b на уровне мРНК может быть значительно снижена ингибированием ГК2 (HK2) (n=3). (F) Предварительная обработка Лонидамином уменьшила ассоциацию АсН3 и АсН4 с промотором Il 1b. Содержание промотора Il 1b с АсН3 или АсН4 в каждой лечебной группе соотносилось с исходными образцами с тем же праймером (n=3). *<0,05; **<0,01; ***<0,001.
Фиг. 8. Лонидамин эффективно защищал крыс от повреждения головного мозга, вызванного окклюзией средней мозговой артерии оСМА (МСАо). (А) Типовые изображения 2,3,5-трифенилтетразолий хлорид (ТТХ (ТТС))-окрашенных участков мозга в каждой лечебной группе. (В) Количественное определение размера инфаркта в каждой группе, показывающее, что введение лонидамина значительно уменьшило размер инфарктов, вызванных оСМА (МСАо). (n=6 на группу) *<0,05; **<0,01; ***<0,001.
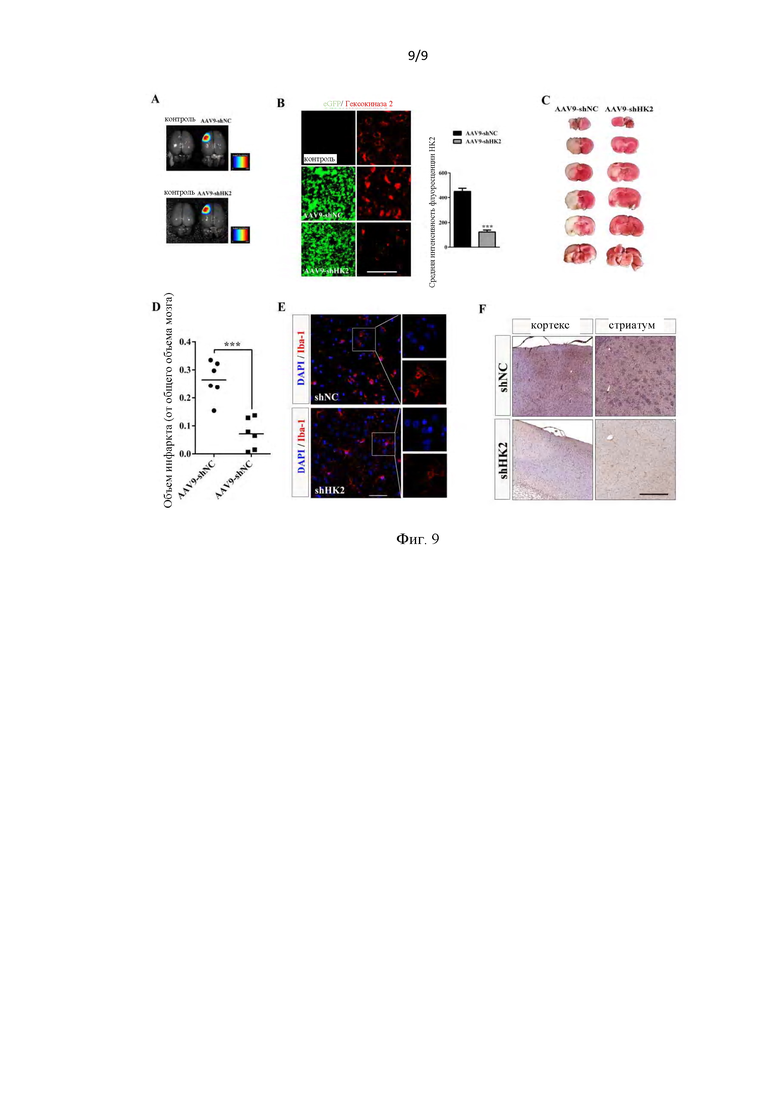
Фиг. 9. Нокдаун ГК2 (HK2) in vivo эффективно защищал крыс от повреждения головного мозга, вызванного окклюзией средней мозговой артерии (оСМА (МСАо)). (А) Распределение вируса контролировали с помощью визуализации всего мозга на основе экспрессии уЗФБ (eGFP) через 21 день после инъекции векторов AAV (n=3). (В) Срезы мозга через стриатум, окрашенные для ГК2 (HK2) и CD 11b, показывающие, что CD 11b положительно коррелирует с экспрессией ГК2 (HK2) в микроглии (n=6/группа). Масштаб, 20 мкм. (С) окрашивание ТТХ (ТТС), показывающее уменьшение размера инфаркта в лечебной группе AAVshHK2 после операции оСМА (МСАо) (n=6/group). (D) Количественное определение размера инфаркта в (С) (n=6/группа). (Е) Иммунореактивность Iba-1 в стриатуме показывает, что обработка AAV-shHK2 существенно блокирует микроглиальную активацию в полушарии инфаркта. Масштаб, 50 мкм. (F) Типовые изображения, полученные из кортекса и стриатума в ишемических полушариях, показывающие снижение продукцию IL-1b после лечения AAV2/9-shHK2 в модели оСМА (МСАо) крыс. *<0,05; **<0,01; ***<0,001.
Подробное описание изобретения
Настоящее изобретение описано со ссылкой на следующие варианты осуществления, которые не следует расценивать как ограничивающие объем изобретения. Любые эквивалентные изменения или варианты, реализованные в соответствии с принципом или сущностью изобретения, рассматриваются в рамках настоящего изобретения.
В соответствии с одним аспектом изобретения предложено применение специфического ингибитора гексокиназы 2 для изготовления лекарственного средства для профилактики и лечения острого повреждения центральной нервной системы. Применяемый здесь специфический ингибитор гексокиназы 2 относится к веществу, способному специфически или селективно ингибировать биологическую активность гексокиназы 2 (также называемой гексокиназой II или HK2 (ГК2)).
В некоторых вариантах осуществления специфический ингибитор гексокиназы 2 содержит антитело к гексокиназе 2 или его фрагмент. Антитело относится к белку, способному специфически связываться с гексокиназой 2 и ингибировать или гасить активность гексокиназы 2. Фрагмент антитела может включать, например, Fab, Fab', (Fab')2, и Fv. Получение и очистка антител или их фрагментов известны в данной области техники.
В некоторых вариантах осуществления антитело к гексокиназе 2 согласно изобретению может быть также представлено в форме аминокислотной или нуклеотидной последовательности, кодирующей антитело, или вектора экспрессии, содержащего нуклеотидную или аминокислотную последовательность. В некоторых вариантах осуществления антитело к гексокиназе 2, описанное в настоящем изобретении, может также присутствовать в экспрессионном векторе или клетке-хозяине в форме слитого белка.
В некоторых вариантах осуществления специфический ингибитор гексокиназы 2 содержит вещество, способное специфически ингибировать трансляцию мРНК гексокиназы 2, или вещество, способное специфически деградировать мРНК гексокиназы 2, такое как киРНК, кшРНК, микроРНК или их модификации, тем самым препятствуя синтезу гексокиназы 2 по механизму РНКи. киРНК, кшРНК или микроРНК могут быть получены методами синтеза in vitro, которые хорошо известны в данной области техники. В некоторых вариантах осуществления киРНК, кшРНК или микроРНК, описанные в настоящем изобретении, присутствуют в конкретном векторе, таком как клетка.
В некоторых вариантах осуществления острое повреждение центральной нервной системы относится к заболеванию или состоянию повреждения центральной нервной системы, вызванного острой ишемией или гипоксией, включая, но не ограничиваясь, повреждение головного/спинного мозга, вызванное острой травмой позвоночника, травмой головного мозга, повреждением сетчатки, гипоксическим повреждением головного мозга, острым ишемическим повреждением головного мозга, ишемическим инсультом, гипоксическим инсультом, неонатальной гипоксической ишемической энцефалопатией, токсической энцефалопатией, острым инфарктом головного мозга, лакунарным инфарктом, транзиторной ишемической атакой, тяжелой черепно-мозговой травмой, цереброспинальной хирургией и лучевой терапией головного/спинного мозга.
В соответствии с другим аспектом изобретения предложено применение композиции, содержащей специфический ингибитор гексокиназы 2, для изготовления лекарственного средства для профилактики и лечения острого повреждения центральной нервной системы.
В некоторых вариантах осуществления специфическими ингибиторами гексокиназы 2, содержащимися в композиции, являются такие, которые описаны выше, и композиция может дополнительно содержать другие ингибиторы гексокиназы 2, включая, но не ограничиваясь, 2-дезоксиглюкозу, Лонидамин, бромпировиноградную кислоту, глюкозо-6-фосфат, Иматиниб, 5-тио-глюкозу и метилжасмонат.
Еще одним аспектом изобретения является способ профилактики и лечения острого повреждения центральной нервной системы, включающий введение субъекту, нуждающемуся в этом, профилактически эффективного количества или терапевтически эффективного количества специфического ингибитора гексокиназы 2 или композиции, содержащей специфический ингибитор гексокиназы 2.
В некоторых вариантах осуществления субъект является млекопитающим, таким как человек. Введение осуществляют подкожно, трансдермально, внутримышечно, внутривенно, внутриартериально, сублингвально, буккально, через желудочно-кишечный тракт или аналогично, например, человеку. В некоторых вариантах осуществления специфический ингибитор гексокиназы 2 (например, в форме нуклеиновой кислоты) может быть введен субъекту в качестве генной терапии для лечения или профилактики.
Согласно еще одному аспекту настоящего изобретения предложен способ профилактики и лечения острого повреждения центральной нервной системы, включающий селективное или специфическое снижение или инактивацию активности гексокиназы 2 у нуждающегося в этом субъекта. Это снижение или инактивация активности гексокиназы может быть достигнуто, например, с помощью генно-инженерных подходов для уменьшения или устранения экспрессии белка гексокиназы 2. Примером такого подхода является изменение последовательности нуклеотидов, кодирующих гексокиназу 2, посредством сайтнаправленного мутагенеза. Другим примером является вмешательство в процесс трансляции мРНК гексокиназы 2 с помощью технологии РНКи. Любой способ, известный специалистам в данной области техники для снижения экспрессии конкретного белка в клетке, рассматривается для применения в способах согласно изобретению.
Примеры
Материалы и методы, применяемые в настоящем изобретении, являются общепринятыми материалами и методами, если не указано иное.
Пример 1. Усиленный гликолитический поток необходим для активации микроглии, индуцированной гипоксией
Материалы
Клетки микроглии мыши BV2, среда Игла в модификации Дульбекко (DMEM, Gibco, 11965-118), фетальная бычья сыворотка (Gibco, 10099-141), 2-дезокси-D-глюкоза (Sigma-Aldrich, D8375), 2-[N-(7-нитробензо-2-окса-1,3-диазол-4-ил)амино]-2-дезокси-D-глюкоза (2-NBDG, Thermo Fisher Scientific, N13195), набор для обнаружения Аннексин/PI (Biotool, В32115), проточный цитометр (CytoFLEX Ы), лазерный сканирующий конфокальный микроскоп (Nikon A1 Spectral Confocal Microscope), бескислородная камера (Coy Laboratory Products).
Антитела, использованные в вестерн-блоттинге и иммунофлюоресценции:
Антитело к CD 11b (Novus biologicals, NB 110-89474);
Антитело к TNF-α (CST, 11498);
Антитело к IL-1β (CST, 12507);
Антитело к IL-6 (Bioss, bs-6309R);
Антитело к α-тубулину (Bioworld, AP0064)
Методы
a) Клеточная культура: Клетки BV2 выращивали в среде Игла в модификации Дульбекко (DMEM), содержащей 10% фетальной бычьей сыворотки (ФБС (FBS)), помещали в 5% СО2, культивировали в инкубаторе при постоянной температуре 37°С (относительная влажность составляла 95%) и наблюдали под инвертированным микроскопом. Пассажи проводили примерно через 2-3 дня, а логарифмическую фазу роста клеток использовали для формальных экспериментов. Клетки в группе гипоксической обработки помещали в бескислородную камеру Coy с 1% О2, 5% СО2 и 94% N2; другие условия были такими же, как и нормальные условия культивирования.
b) Экстракция белка и анализ экспрессии провоспалительных цитокинов: После инкубации на 3 5 мм культуральных чашках и размещения на 24 часа клетки подвергали гипоксии в течение указанного времени. Затем общий клеточный белок экстрагировали для выявления экспрессии белка провоспалительных цитокинов TNF-α, IL-1β и IL-6.
c) Экспрессия CD 11b, обнаруженная при помощи иммунофлуоресценции: Клетки BV2 высевали в лазерную конфокально-специфическую культуральную пластинку и подвергали гипоксии на протяжении 24 часов, фиксировали в 4% параформальдегиде при комнатной температуре в течение 20 минут, а затем трижды промывали ФСБТ (фосфатно-солевой буфер с твином) в течение 5 минут каждый раз. После промывки добавляли антитело к CD 11b, разбавленное разбавителем антител DAKO, и инкубировали в течение ночи при 4°С. На следующий день образцы инкубировали с указанным флуоресцентно меченым вторичным антителом при 37°С в течение 1 часа. После инкубации добавляли рабочий раствор DAPI для окрашивания ядер в течение 10 минут. Затем образцы трижды промывали ФСБТ (фосфатно-солевой буфер с твином) и визуализировали с помощью лазерного конфокального микроскопа.
d) Анализ поглощения 2-NBDG: Клетки BV2 высевали в 96-луночную культуральную пластину (черная по бокам, прозрачная по дну) и через 24 часа клеточную среду заменяли буфером DPBS, содержащим 200 мкм 2-NBDG. Затем клетки культивировали в нормоксических или гипоксических условиях. После 1 часа инкубации среду меняли на свежий ФСБД (фосфатно-солевой буфер Дульбекко). Далее, получали изображения и количественно определяли поглощение 2-NBDG с помощью анализа флуоресценции микропластин.
e) Окрашивание Аннексином/PI: Клетки высевали в 35 мм культуральную чашку и культивировали в течение 24 часов, а затем культивировали в гипоксическом состоянии в течение 24 часов. Клетки собирали с 0,25% трипсином и окрашивали Аннексином и красителем PI в соответствии с инструкциями, предоставленными производителем. Анализ с применением проточной цитометрии проводили через 30 минут, чтобы определить, вызвала ли гипоксия гибель клеток.
f) Экстракция и профилирование метаболитов: Клетки BV2 высевали в 60 мм культуральные чашки и культивировали в течение 24 часов, а затем культивировали в нормоксических или гипоксических условиях в течение 6 часов. Для профилирования метаболитов метаболиты экстрагировали с использованием 1,5 мл ледяного 80% метанола. После инкубации при -80°С в течение 30 минут клетки отбирали и центрифугировали при 14000 g в течение 15 минут при 4°С. Верхнюю метанольно-водную фазу переносили в новые пробирки и инкубировали при -80°С еще 30 минут. Верхние фазы центрифугировали и сушили под азотным газом, а высушенные образцы хранили при -80°С до проведения анализа ЖХ-МС.
Результаты
Как показано на фиг. 1А, стимуляция гипоксией привела к глубоким морфологическим изменениям в клетках BV 2, с увеличением клеточных тел и формированием филоподий или ламеллоподий. Морфологические изменения были зависимыми от времени, и число клеток микроглии с морфологическими изменениями увеличилось примерно до 52% от общего числа клеток после 24 часов воздействия гипоксии (фиг. 1В). Кроме того, наблюдалась повышенная экспрессия CD 11b, молекулярного маркера активации микроглии, после 24 часов воздействия гипоксии. Кроме того, как показано на фиг. 1D, продукция провоспалительных цитокинов TNF-α, IL-1β и IL-6 была заметно индуцирована зависимым от времени образом. Примечательно, что воздействие 1% кислорода в течение 24 часов не вызывало очевидной гибели клеток (фиг. 1Е и 1F). Результаты выше показали, что воздействие гипоксии привело к воспалительному активированному фенотипу микроглии.
Аэробный путь гликолиза в клетках BV2 был значительно повышен после воздействия гипоксии. Как показано на фиг. 1G и 1H, 2 Поглощение NBDG увеличивалось в 1,6 раза после 1 часа гипоксического
воздействия. Метаболическое профилирование также показало значительно повышенное содержание метаболических интермедиатов гликолитического пути после 6 часов гипоксического воздействия, включая фруктозо-1,6-бифосфат, дигидроксиацетонфосфат и глицеральдегид-3-фосфат (Г-3-Ф) (фиг. 1I). В присутствии 500 мкм 2-дезоксиглюкозы (2-ДГ), эффективного ингибитора гликолиза, процент клеток BV 2 с активированными морфологическими изменениями был значительно снижен (фиг. 1J-L). В совокупности эти данные демонстрируют, что усиленный гликолиз необходим для активации микроглии после воздействия гипоксии.
Пример 2. Положительная регуляция членов семейства гексокиназ вовлечена в активации микроглии после воздействия гипоксии
Материалы
Клеточная линия микроглии мыши BV2, культура первичной микроглии мыши, среда Игла в модификации Дульбекко (DMEM) с высоким содержанием глюкозы (Gibco, 11965-118), фетальная бычья сыворотка (Gibco, 10099-141), реагент для экстракции РHK Тризол (TRIzol) (Thermo Fisher Scientific, 15596-018), набор для количественного определения РHK (Thermo Fisher Scientific, Q10211), SuperReal qPCRPreMix (SYBR Green) (Tiangen, FP202-01), система ПЦР в реальном времени (Applied Biosystems), бескислородная камера (Coy Laboratory Products)
Антитела, использованные в вестерн-блоттинге:
Антитело к гексокиназе 1 (Abcam, 150423),
Антитело к гексокиназе 2 (CST, 2867s),
Антитело к гексокиназе 3 (Santa Cruz, sc-28890),
Антитело к α-Тубулину (Bioworld, АР0064).
Для ПЦР в реальном времени использовали следующие последовательности праймеров генов мыши.
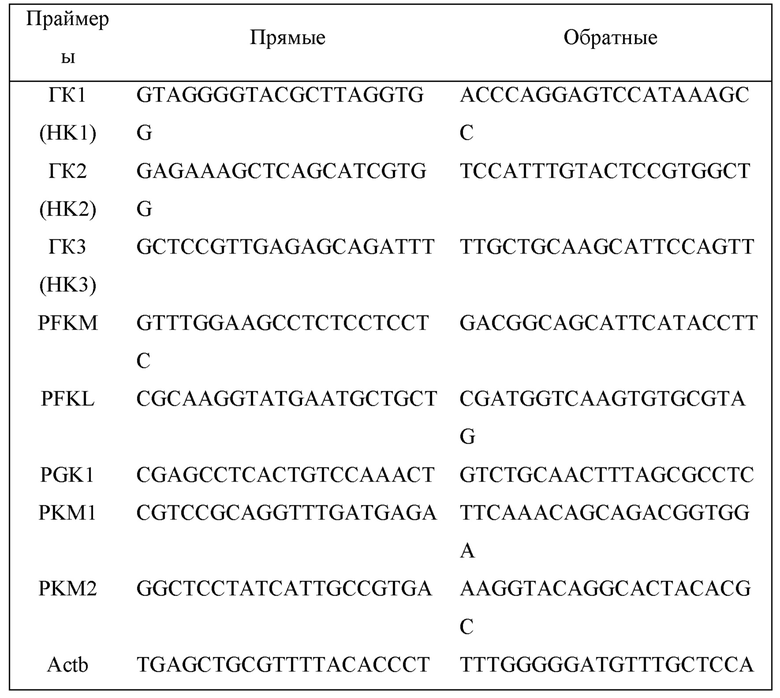
Методы
а) Клеточная культура: Клетки BV2 выращивали в среде Игла в модификации Дульбекко (DMEM), содержащей 10% фетальной бычьей сыворотки (ФБС (FBS)), помещали в 5% СО2, культивировали в инкубаторе при постоянной температуре 37°С (относительная влажность составляла 95%) и наблюдали под инвертированным микроскопом. Пассажи проводили примерно через 2-3 дня, а логарифмическую фазу роста клеток использовали для формальных экспериментов.
Для выделения и культивирования первичной микроглии клетки выделяли из новорожденных мышей C57BL/6J. Вкратце, кора головного мозга мышей Р0-2, лишенная мозговых оболочек и кровеносных сосудов, была отделена и расщеплялась 0,125% трипсином при 37°С в течение 15 минут. Расщепление останавливали добавлением среды Игла в модификации Дульбекко (DMEM), содержащего 10% ФБС (FBS), и изолированные одиночные клетки высевали в культуральные чашки. После слияния смешанных культур микроглию отделяли от других типов клеток легким встряхиванием и очищение определяли по специфичному для микроглии маркеру CD 11b.
b) Полная экстракция белка и анализ экспрессии белков семейства гексокиназ: Клетки высевали в 35 мм культуральные чашки на 24 часа и стимулировали гипоксией в течение указанного времени. Затем общий белок экстрагировали для выявления экспрессии белка семейства гексокиназ.
Результаты
После 6 часов гипоксии была обнаружена общая позитивная регуляция уровней мРНК этих ферментов. Все три тестируемые изоформы ГК (HK) демонстрировали значительно повышенную экспрессию мРНК (фиг. 2А). Дальнейшие результаты показали, что экспрессия белка этих изоформ также демонстрировала транзиторное или устойчивое увеличение в клетках BV 2 (фиг. 2b) и первичных клетках микроглии (фиг. 2С).
Пример 3 Гексокиназа 2, вместо других членов семейства гексокиназ, опосредовала вызванную гипоксией активацию микроглии
(1) Интерференция гексокиназы 2 смогла эффектно заблокировать вызванный гипоксией процесс активации микроглии
Материалы
Клеточная линия микроглии мыши BV2, культура первичной микроглии мыши, среда Игла в модификации Дульбекко (DMEM) с высоким содержанием глюкозы (Gibco, 11965-118), фетальная бычья сыворотка (Gibco, 10099-141), фрагменты киРНК, реагент для трансфекции киРНК (Lipofectamine RNAiMAX Reagent, Thermo Fisher Scientific, 13778-500), инвертированный фазово-контрастный микроскоп (Nikon ECLIPSE Ti Microscope), лазерный конфокальный микроскоп (Nikon Al Spectral Confocal Microscope), бескислородная камера (Coy Laboratory Products).
Антитела, использованные в вестерн-блоттинге:
Антитело к гексокиназе 1 (Abcam, 150423),
Антитело к гексокиназе 2 (CST, 2867s),
Антитело к гексокиназе 3 (Santa Cruz, sc-28890),
Антитело к CD 11b (Novus biologicals, NB 110-89474),
Антитело к α-Тубулину (Bioworld, AP0064).
Методы
a) Клеточная культура: Клетки BV2 выращивали в среде Игла в модификации Дульбекко (DMEM), содержащей 10% фетальной бычьей сыворотки (ФБС (FBS)), помещали в 5% СО2, культивировали в инкубаторе при постоянной температуре 37°С (относительная влажность составляла 95%) и наблюдали под инвертированным микроскопом. Пассажи проводили примерно через 2-3 дня, а логарифмическую фазу роста клеток использовали для формальных экспериментов.
b) РHK-интерференция: Клетки высевали в 35 мм культуральную чашку на 24 часа. Малые интерферирующие РHK (siRNA) были трансфицированы при помощи реактива RNAiMAX. В качестве контроля использовалась скремблированная РHK. Культуры были трансфицированы в общей сложности 50 нм киРНК, и через 12 часов среда была заменена свежей средой. Затем клетки стимулировали гипоксией в течение 24 часов для определения уровня экспрессии указанных белков.
Результаты
Как показано на фиг. 3A-3D, уменьшение экспрессии ГК2 (HK2) с использованием различных фрагментов приводило к значительному ингибированию активированной морфологии микроглии, что также сопровождалось снижением экспрессии CD 11b. Примечательно, что киРНК, нацеленные на ГК2 (HK2), не влияли на экспрессию ГК1 (HK1) и ГК3 (HK3).
(2) взаимодействие гексокиназы 1 и гексокиназы 3 не смогло заблокировать вызванную гипоксией активацию микроглии
Материалы
Клеточная линия микроглии мыши BV2, среда Игла в модификации Дульбекко (DMEM) с высоким содержанием глюкозы (Gibco, 11965-118), фетальная бычья сыворотка (Gibco, 10099-141), фрагменты малых интерферирующих РHK (киРНК), реагент для трансфекции малых интерферирующих РHK (киРНК) (Lipofectamine RNAiMAX Reagent, Thermo Fisher Scientific, 13778-500), инвертированный фазово-контрастный микроскоп (Nikon ECLIPSE Ti Microscope), лазерный конфокальный микроскоп (Nikon Al Spectral Confocal Microscope), бескислородная камера (Coy Laboratory Products).
Антитела, использованные в вестерн-блоттинге: Антитело к гексокиназе 1 (Abcam, 150423), Антитело к гексокиназе 2 (CST, 2867s), Антитело к гексокиназе 3 (Santa Cruz, sc-28890),
Антитело к α-Тубулину (Bioworld, АР0064).
Методы
a) Клеточная культура: Клетки BV2 выращивали в среде Игла в модификации Дульбекко (DMEM), содержащей 10% фетальной бычьей сыворотки (ФБС (FBS)), помещали в 5% СО2, культивировали в инкубаторе при постоянной температуре 37°С (относительная влажность составляла 95%) и наблюдали под инвертированным микроскопом. Пассажи проводили примерно через 2-3 дня, а логарифмическую фазу роста клеток использовали для формальных экспериментов.
b) РHK-интерференция: Клетки инокулировали в 35 мм культуральную чашку на 24 часа. Малые интерферирующие РHK (киРНК) были трансфицированы при помощи реактива RNAiMAX. В качестве контроля использовалась скремблированная РHK. В общей сложности 50 нм киРНК трансфицировали в культуры, и через 12 часов среда была заменена свежей средой. Затем клетки стимулировали гипоксией в течение 24 часов для определения уровня экспрессии указанных белков.
Результаты
Как показано на фиг. 4A-4D, ни нокдаун ГК1 (HK1), ни нокдаун ГКЗ (HKЗ) не были способны блокировать активацию микроглии.
(3) Интерференция пируваткиназы подтипа М2 (РКМ2) не смогла ингибировать вызванную гипоксией активацию микроглии
Материалы
Клеточная линия микроглии мыши BV2, среда Игла в модификации Дульбекко (DMEM) с высоким содержанием глюкозы (Gibco, 11965-118), фетальная бычья сыворотка (Gibco, 10099-141), фрагменты малых интерферирующих РHK (киРНК), реагент для трансфекции малых интерферирующих РHK (киРНК) (Lipofectamine RNAiMAX Reagent, Thermo Fisher Scientific, 13778-500), инвертированный фазово-контрастный микроскоп (Nikon ECLIPSE Ti Microscope), лазерный конфокальный микроскоп (Nikon Al Spectral Confocal Microscope), бескислородная камера (Coy Laboratory Products).
Антитела, используемые в вестерн-блоттинге: Антитело к PKM2 (Abcam, 150423), антитело к CD 11b (Novus biologicals, NB 110-89474), антитело к α-Тубулину (Bioworld, АР0064).
Методы
a) Клеточная культура: Клетки BV2 выращивали в среде Игла в модификации Дульбекко (DMEM), содержащей 10% фетальной бычьей сыворотки (FBS), помещали в 5% СО2, культивировали в инкубаторе с постоянной температурой 37°С (относительная влажность 95%) и наблюдали под инвертированным микроскопом. Пассажи проводили примерно через 2-3 дня, а логарифмическую фазу роста клеток использовали для формальных экспериментов.
b) РHK-интерференция: Клетки инокулировали на 35 мм культуральную чашку на 24 часа. Малые интерферирующие РHK (siRNA) были трансфицированы при помощи реактива RNAiMAX. В качестве контроля использовалась скремблированная РHK. Культуры были трансфицированы в общей сложности 50 нм киРНК, и через 12 часов среда была заменена свежей средой. Затем клетки стимулировали гипоксией в течение 24 часов для определения уровня экспрессии указанных белков.
Результаты
Результаты показали, что экспрессия белка РКМ2 демонстрировала транзиторное увеличение в стимулированных гипоксией клетках BV 2 (Фиг. 5А). Удивительно, но морфологические изменения, вызванные гипоксией, не были ингибированы нокдауном РКМ2 (Фиг. 5В-С).
(4) Лонидамин, ингибитор гексокиназы 2, был эффективен для ингибирования активации микроглии. вызванной гипоксией.
Материалы
Клеточная линия микроглии мыши BV2, культура первичной микроглии мыши, среда Игла в модификации Дульбекко (DMEM) с высоким содержанием глюкозы (Gibco, 11965-118), фетальная бычья сыворотка (Gibco, 10099-141), лонидамин (Selleck, S2610), инвертированный фазово-контрастный микроскоп (Nikon ECLIPSE Ti Microscope), лазерный конфокальный микроскоп (Nikon Al Spectral Confocal Microscope), бескислородная камера (Coy Laboratory Products). Антитела, использованные в вестерн-блоттинге: Антитело к CD 11b (Novus biologicals, NB 110-89474), антитело к α-Тубулину (Bioworld, АР0064).
Методы
a) Клеточная культура: Клетки BV2 выращивали в среде Игла в модификации Дульбекко (DMEM), содержащей 10% фетальной бычьей сыворотки (ФБС (FBS)), помещали в 5% СО2, культивировали в инкубаторе при постоянной температуре 37°С (относительная влажность составляла 95%) и наблюдали под инвертированным микроскопом. Пассажи проводили примерно через 2-3 дня, а логарифмическую фазу роста клеток использовали для формальных экспериментов.
Для выделения и культивирования первичной микроглии клетки выделяли из новорожденных мышей C57BL/6J. Вкратце, кора головного мозга мышей Р0-2, лишенная мозговых оболочек и кровеносных сосудов, была отделена и расщеплялась 0,125% трипсином при 37°С в течение 15 минут.Расщепление останавливали добавлением среды Игла в модификации Дульбекко (DMEM), содержащей 10% ФБС (FBS), и изолированные одиночные клетки высевали в культуральные чашки. После слияния смешанных культур микроглию отделяли от других типов клеток легким встряхиванием и очищение определяли по специфичному для микроглии маркеру CD 11b.
b) экспрессия CD 11b, обнаруженная с помощью иммунофлуоресценции: Клетки BV2 высевали в лазерную конфокально-специфическую культуральную пластинку и подвергали гипоксии на протяжении 24 часов, фиксировали в 4% параформальдегиде при комнатной температуре в течение 20 минут, а затем трижды промывали ФСБТ (фосфатно-солевой буфер с твином) в течение 5 минут каждый раз. После промывки добавляли антитело к CD 11b, разбавленное разбавителем антител DAKO, и инкубировали в течение ночи при 4°С. На следующий день образцы инкубировали с указанным флуоресцентно меченым вторичным антителом при 37°С в течение 1 часа. После инкубации добавляли рабочий раствор DAPI для окрашивания ядер в течение 10 минут. Затем образцы трижды промывали ФСБТ (фосфатно-солевой буфер с твином) и визуализировали с помощью лазерного конфокального микроскопа.
Результаты
Стимуляция гипоксией приводила к глубоким морфологическим изменениям в клетках BV 2 и pMG, а также к усилению экспрессии CD 11b (фиг. 6А-В). Иммунофлуоресцентный анализ иллюстрировал снижение экспрессии CD 11b в присутствии лонидамина (50 мкм, ДМСО в качестве растворителя), в то время как ДМСО в качестве контроля не оказывал влияния на экспрессию CD 11b.
Пример 4 Индукция гексокиназы 2 привела к усилению ацетилирования гистонов и трансляционной активации Il 1b
Материалы
Клеточная линия микроглии мыши BV2, культура первичной микроглии мыши, среда Игла в модификации Дульбекко (DMEM) с высоким содержанием глюкозы (Gibco, 11965-118), фетальная бычья сыворотка (Gibco, 10099-141), лонидамин (Selleck, S2610), 3-бромопируват (Sigma, 16490), реагент для экстракции РHK TRIzol (Thermo Fisher Scientific, 15596-018), набор для количественного определения РHK (Thermo Fisher Scientific, Q10211), SuperReal qPCR PreMix (SYBR Green) (Tiangen, FP202-01), система ПНР в реальном времени (Applied Biosystems), набор для преципитации хроматина (Millipore, 17-245), бескислородная камера (Coy Laboratory Products), инвертированный фазово-контрастный микроскоп (Nikon ECLIPSE Ti Microscope). Антитела, используемые в вестерн-блоттинге: антитело к ацетил-гистону Н3 (Millipore, 06-599); антитело к ацетил-гистону Н4 (Millipore, 06-866); антитело к α-Тубулину (Bioworld, АР0064).
Методы
а) Клеточная культура: Клетки BV2 выращивали в среде Игла в модификации Дульбекко (DMEM), содержащей 10% фетальной бычьей сыворотки (ФБС (FBS)), помещали в 5% СО2, культивировали в инкубаторе при постоянной температуре 37°С (относительная влажность составляла 95%) и наблюдали под инвертированным микроскопом. Пассажи проводили примерно через 2-3 дня, а логарифмическую фазу роста клеток использовали для формальных экспериментов.
Для выделения и культивирования первичной микроглии клетки выделяли из новорожденных мышей C57BL/6J. Вкратце, кора головного мозга мышей Р0-2, лишенная мозговых оболочек и кровеносных сосудов, была отделена и расщеплялась 0,125% трипсином при 37°С в течение 15 минут. Расщепление останавливали добавлением среды Игла в модификации Дульбекко (DMEM), содержащей 10% ФБС (FBS), и изолированные одиночные клетки высевали в культуральные чашки. После слияния смешанных культур микроглию отделяли от других типов клеток легким встряхиванием и очищение определяли по специфичному для микроглии маркеру CD 11b.
б) Экстракция общего белка и анализ экспрессии ацетилированного гистона: Клетки инкубировали в 35 мм культуральной пластине в течение 24 часов и стимулировали гипоксией в течение указанного времени. Затем общий белок экстрагировали для определения экспрессии белка ацетилированного гистона.
c) Профилирование метаболитов: Клетки BV2 высевали в 60 мм культуральную чашку и культивировали в течение 24 часов, а затем культивировали в нормоксических или гипоксических условиях в течение 6 часов. Метаболиты экстрагировали с использованием 1,5 мл ледяного 80% метанола. После инкубации при -80°С в течение 30 минут клетки отбирали и центрифугировали при 14000 g в течение 15 мин при 4°С. Верхнюю метанольно-водную фазу переносили в новые пробирки и инкубировали при -80°С еще 30 минут. Верхние фазы центрифугировали и сушили под азотным газом, а высушенные образцы хранили при -80°С до проведения анализа ЖХ-МС.
d) Анализ иммунопреципитации хроматина (ChIP): Клетки BV 2 обрабатывали диметилсульфоксидом или лонидамином в течение 1 часа перед гипоксическим воздействием длительностью 6 часов. Затем клетки сшивали с 1% раствором формальдегида (Sigma, F8775) в течение 10 минут при 37°С. Клеточные лизаты подвергали ультразвуковому воздействию для получения 100-1000 bp фрагментов ДHK. Образцы разбавляли, и 10% от общего количества оставляли для введения. Оставшиеся части каждого образца предварительно очищали и добавляли антитела к Н3 или к Н4; в качестве отрицательного контроля одновременно использовали нормальное кроличье антитело к IgG. На следующий день добавляли protein G agarose и после 2 часов инкубации образцы промывали. Поперечные связи затем реверсировали путем инкубации при 65°С в течение 4 часов в 0,2 М NaCl. ДHK была извлечена из входных и IP-образцов, и был проведен анализ при помощи количественной ПЦР (qPCR). Последовательности праймеров промотора Il lb были следующими: 5' - AGGTCAAAGGTTTGGAAGCAG-3' (прямой) и 5'-ATGGAAGTCTGTCTGCTCAGTATTG-3' (обратный).
Результаты
Как показано на фиг. 7А, после стимуляции гипоксией в течение 6 часов наблюдались метаболические изменения в гликолизе, ЦТК (ТСА) и пентозофосфатном пути, в которых ацетил-коэнзим А был наиболее значительно подвержен влиянию гипоксии. В присутствии ингибиторов ГК2 (HK2), лонидамина (50 мкм) и 3-Br-пирувата (BrPA, 10 мкм), вызванное гипоксией накопление ацетил-коэнзима А было заметно нарушено (фиг. 7В). Как показано на фиг. 7С, ацетилированные гистоны 3 и 4 временно или непрерывно позитивно регулировались в клетках BV 2 и pMG во время воздействия гипоксии. В клетках BV 2 индуцированное гипоксией накопление ацетилирования гистонов также было инвертировано ингибиторами ГК2 (HK2) (фиг. 7D).
Затем были проведены количественные анализы полимеразной цепной реакции обратной транскрипции для изучения уровней мРНК нескольких провоспалительных цитокинов в присутствии или отсутствии ингибиторов ГК2 (HK2). Лонидамин (50 мкм) и 3-BrPA (10 мкм) существенно ингибировали индуцированную гипоксией экспрессию Il lb на уровне мРHK, но не оказывали влияния на экспрессию Tnfa и Il6. Для изучения эндогенного связывания ацетилированных гистонов с промотором Illb проводили иммунопреципитационный анализ хроматина. Связывание АсН3 и АсН4 с промотором Illb увеличивалось во время гипоксии, при этом его можно было уменьшить путем предварительной обработки лонидамином (фиг. 7F).
Пример 5. Блокада гексокиназы 2 предотвращала ишемическое повреждение головного мозга путем подавления опосредованного микроглией нейровоспаления в экспериментальной модели инсульта
(1) Лонидамин защищает мозг от ишемического повреждения в модели оСМА (МСАо) крысы
Материалы
Лонидамин (Selleck, S2610), здоровые СПФ (SPF) самцы крыс Spague-Dawley (SD), 2,3,5-трифенилтетразолий хлорид (ТТХ) (ТТС)) (аналитически чистый), хлоралгидрат (аналитическая степень чистоты) (приобретен в Tianjin Kemiou Chemical Reagent Co., Ltd.), нейлоновое моноволокно для оСМА (МСАо).
Методы
a) модель окклюзии средней мозговой артерии (оСМА (МСАо)) была получена посредством методики интралюминальной нити из правой внутренней сонной артерии. Перед операцией крысы SD голодали в течение 12 часов, но имели свободный доступ к питьевой воде. Животных анестезировали внутрибрюшинным введением 10% хлоралгидрата и помещали в положение лежа на термостатическом операционном столе при температуре 37°С для поддержания ровного дыхания. Под операционным микроскопом правая общая сонная артерия (ОСА (ССА)) была обнажена через срединный разрез и окклюзирована микрососудистым зажимом. Правая наружная сонная артерия была обнажена и перевязана на дистальном конце. Между бифуркацией правой общей сонной артерии и лигатурой передней наружной сонной артерии был завязан свободный узел. Правую внутреннюю сонную артерию рассекали и зажимали микрососудистым зажимом. Микроскопическими офтальмологическими хирургическими ножницами вырезали небольшое отверстие между двумя лигатурами, а нейлоновую нить вставляли вниз к общей сонной артерии. Затем свободный узел затягивали, и правую наружную сонную артерию перерезали под дистальной перевязкой наружной сонной артерии, но выше места введения нити. Затем микрососудистый зажим на внутренней сонной артерии удаляли, а вставной конец нити помещали в бифуркацию правой общей сонной артерии. Наружная сонная артерия была выведена наружу и вниз так, чтобы она была на одной линии с внутренней сонной артерией. Нейлоновую моноволоконную нить вводили во внутреннюю сонную артерию до тех пор, пока не ощущалось легкое сопротивление. Чтобы предотвратить кровотечение, нить затягивали. Микрососудистый зажим удаляли и разрез зашивали. Через два часа после операции вводили лонидамин или указанный контрольный растворитель в дозе 10 мг/кг, а затем нить отводили, и объем инфаркта головного мозга измеряли через 24 часа после перфузии.
b) Измерение объем инфаркта: Крыс декапитировали, мозг быстро удаляли и помещали в замороженный физиологический раствор на 10 минут.Ткани мозга замораживали и разрезали на коронарные срезы (толщиной 2 мм). Затем срезы инкубировали в 1,0% 2,3,5-трифенилтетразолий хлориде (ТТХ) при 37°С в течение 30 минут и фиксировали в 4,0% растворе параформальдегида в течение ночи. Для каждого коронарного среза ткань инфаркта (неокрашенная область) и общая двухполушарная область были очерчены на сканированном изображении с помощью Adobe Photoshop CS6. Объем инфаркта был рассчитан как отношение общей неокрашенной площади (белого цвета) к общей двухполушарной площади. Результаты
Как показано на фиг. 8А, очевидная зона инфаркта наблюдалась при помощи окрашивания ТТХ через 24 часа после 2 часов церебральной ишемии-реперфузии как у крыс оСМА (МСАо), так и в контрольной группе. Введение лонидамина значительно уменьшало размер инфаркта. 10 мг/кг лонидамина может эффективно защитить мозг крысы от ишемического повреждения (фиг. 8 В).
(2) In vivo нокдаун гексокиназы 2 эффектно защитил крыс от повреждения мозга в крысиной модели оСМА (МСАо)
Материалы
Лонидамин (Selleck, S2610), здоровые СПФ самцы крыс Spague-Dawley (SD), 2,3,5-трифенилтетразолий хлорид (ТТХ) аналитически чистый, хлоралгидрат (аналитическая степень чистоты) (приобретен в Tianjin Kemiou Chemical Reagent Co., Ltd.), нейлоновый шовный материал для оСМА (МСАо), рекомбинантный аденоассоциированный вирус серотипа 9 содержащий shHK2 фрагмент (rAAV-shHK2), рекомбинантный аденоассоциированный вирус серотипа 9 содержащий скремблированные контрольные фрагменты (rAAV-shNC), набор для иммуногистохимии (Abcam, ab80436), стереотаксическая система для головного мозга, инвертированный фазово-контрастный микроскоп (Nikon ECLIPSE Ti Microscop), лазерный конфокальный микроскоп (Nikon Al Spectral Confocal Microscope).
Методы
а) модель окклюзии средней мозговой артерии (оСМА (МСАо)) была установлена методом интралюминальной нити из правой внутренней сонной артерии. Перед операцией крысы SD голодали в течение 12 часов, но имели свободный доступ к питьевой воде. Животных анестезировали внутрибрюшинным введением 10% хлоралгидрата и помещали в положение лежа на термостатическом операционном столе при температуре 37°С для поддержания ровного дыхания. Под операционным микроскопом правая ОСА (ССА) была экспонирована через срединный разрез и окклюзирована микрососудистым зажимом. Правая наружная сонная артерия была обнажена и перевязана на дистальном конце. Между бифуркацией правой общей сонной артерии и лигатурой передней наружной сонной артерии был завязан свободный узел. Правую внутреннюю сонную артерию рассекали и зажимали микрососудистым зажимом. Микроскопическими офтальмологическими хирургическими ножницами вырезали небольшое отверстие между двумя лигатурами, а нейлоновую нить вставляли вниз к общей сонной артерии. Затем свободный узел затягивали, и правую наружную сонную артерию перерезали под дистальной перевязкой наружной сонной артерии, но выше места введения нити. Затем микрососудистый зажим на внутренней сонной артерии удаляли, а вставной конец нити помещали в бифуркацию правой общей сонной артерии. Наружная сонная артерия была вытянута наружу и вниз так, чтобы она была на одной линии с внутренней сонной артерией. Нейлоновую моноволоконную нить вводили во внутреннюю сонную артерию до тех пор, пока не ощущалось легкое сопротивление. Чтобы предотвратить кровотечение, нить затягивали. Микрососудистый зажим удаляли, и разрез зашивали. Через два часа после операции вводили лонидамин или указанный контрольный растворитель в дозе 10 мг/кг, а затем нить отводили, и объем инфаркта головного мозга измеряли через 24 часа после перфузии.
b) Измерение объема инфаркта: Крыс декапитировали, мозг быстро удаляли и помещали в замороженный физиологический раствор на 10 минут. Ткани мозга замораживали и разрезали на коронарные срезы (толщиной 2 мм). Затем срезы инкубировали в 1,0% 2,3,5-трифенилтетразолий хлориде (ТТХ) при 37°С в течение 30 минут и фиксировали в 4,0% растворе параформальдегида в течение ночи. Для каждого коронарного среза ткань инфаркта (неокрашенная область) и общая двухполушарная область были очерчены на сканированном изображении с помощью Adobe Photoshop CS6. Объем инфаркта был рассчитан как отношение общей неокрашенной площади (белого цвета) к общей двухполушарной площади.
c) Рекомбинантные аденоассоциированные вирусные векторы (rAAV) продуцировали в клетках 293Т. При помощи метода количественной ПЦР (qPCR) было определено, что геномные титры вирусов варьировались от 3,2×1012 до 3,5×1012 В.Г./мл. Для построения векторов AAV2/9 использовались следующие последовательности, нацеленные на ГК2 (HK2): 5'-GCGCAACATTCTCATCGATTT-3' и 5' - AAATCGATGAGAATGTTGCGC-3'. Контрольная последовательность кшРНК представляла собой 5' -TTCTCCGAACGTGTCACGT-3'. В общей сложности 2 мкл вирусных векторов вводили с одной стороны в стриатум анестезированных крыс, закрепленных в стереотаксической рамке.
Координаты места инъекции: 1,0 мм рострально к брегме, 3,0 мм латерально к срединной линии и 4,5 мм вентрально к твердой мозговой оболочке, зубную планку устанавливали на ноль. Микроинъекции проводили со скоростью 0,2 мкл/мин. После инъекции микрошприцы оставались in situ еще в течение 5 минут, прежде чем их удаляли.
d) Тканевая иммунофлуоресценция использовалась для выявления распределения вируса в головном мозге (уЗФБ (eGFP)) и экспрессии гексокиназы 2 и Iba-1 (другого молекулярного маркера активации микроглии): после ишемии в течение 2 часов и реперфузии в течение 24 часов интактную мозговую ткань удаляли под наркозом и погружали в парафиновую оболочку для получения срезов. Толщина срезов головного мозга составляла примерно 4 мкм. Срезы мозга депарафинизировали, гидратировали и подвергали извлечению антигена. Образцы инкубировали с указанными антителами при 4°С в течение ночи. На следующий день добавляли флуоресцентно меченое вторичное антитело и образцы инкубировали при 37°С в течение 1 часа. После инкубации добавляли рабочий раствор DAPI для окрашивания ядер в течение 10 минут. В конце обработки образцы промывали три раза ФСБТ (фосфатно-солевой буфер с твином) и визуализировали с помощью лазерного конфокального микроскопа.
e) Иммуногистохимическое определение экспрессии IL-1β: После ишемии в течение 2 часов и реперфузии в течение 24 часов интактную мозговую ткань удаляли под наркозом и погружали в парафиновую оболочку для получения срезов. Толщина срезов головного мозга составляла примерно 4 мкм. Срезы мозга депарафинизировали, гидратировали и подвергали извлечению антигена. Образцы инкубировали с указанными первичными антителами в течение ночи при 4°С. На следующий день образцы промывали в фосфатно-буферном физиологическом растворе, подвергали последовательной инкубации в комплементе и конъюгате пероксидазы хрена (HRP). После инкубации в течение 15 минут при комнатной температуре образцы инкубировали с проявочным раствором DAB в течение 1 минуты. Наконец, образцы окрашивали гематоксилином и визуализировали с помощью микроскопа Nikon.
Результаты
Вес животных контролировали постоянно, и статистическая значимость не была обнаружена через 20 дней после инъекций rAAV9-shHK2 и rAAV9-shNC. (Вес животных в группах AAV2/9-shNC и AAV2/9-shHK2 составил 273,2±6,9 г и 269,3±5,0 г соответственно). Перед операцией собирали цельные ткани головного мозга крыс для выявления распространения AAVs с использованием технологии оптической визуализации in vivo, основанной на экспрессии уЗФБ (eGFP) (фиг. 9А). Окрашивание срезов головного мозга показало, что ГК2 (HK2) значительно регулируется операцией оСМА (МСАо). Изза рассеянного распределения AAVs, однако, позитивная регуляция ГК2 (HK2) операцией оСМА (МСАо) эффективно ингибировалась в группе rAAV9-shHK2, тогда как инъекция rAAV9-shNC не оказывала никакого значительного влияния на ингибирование ГК2 (HK2) (фиг. 9В). Подобно ингибированию ГК2 (HK2), окрашивание ТТХ показало, что размеры инфаркта значительно уменьшились у крыс с нокдауном ГК2 (HK2) по сравнению с аналогичными им, которым вводили AAVs, несущие контрольную кшРНК (фиг. 9С-0).
Как показано на фиг. 9Е, микроглия в группе rAAV9-shNC имела морфологическую характеристику активированной микроглии, с увеличением тел клеток и ретракцией проекций, тогда как их активированная морфология была заметно подавлена в группе обработки shHK2. Нейропротекторный эффект нокдауна ГК2 (HK2) был связан с выраженным ингибированием экспрессии Iba-1 (Рис. 9Е). Как показано на фиг. 9, иммуногистохимическое окрашивание Il-1β в области кортекса и стриатума показало, что нейропротекция, опосредованная нокдауном эндогенной гексокиназы 2, связана со снижением экспрессии Il-1β; в контрольной группе Il-1β распределен в кортексе и стриатуме, тогда как в группе rAAV9-shHK2 экспрессия Ik-1β была значительно ингибирована.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ГУАНЧЖОУ СЕЛЛПРОТЕК ФАРМАСЬЮТИКАЛ КО., ЛТД (GUANGZHOU CELLPROTEK PHARMACEUTICAL CO., LTD)
<120> СПЕЦИФИЧЕСКИЕ ИНГИБИТОРЫ ГЕКСОКИНАЗЫ-2 ДЛЯ ПРИМЕНЕНИЯ ПРИ ОСТРОМ ПОВРЕЖДЕНИИ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ
<130> 191414РУ
<160> 23
<170> Патент версия 3.5
<210> 1
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> прямые праймеры HK1
<400> 1
gtaggggtac gcttaggtgg 20
<210> 2
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> обратные праймеры HK1
<400> 2
acccaggagt ccataaagcc 20
<210> 3
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> прямые праймеры HK2
<400> 3
agcatcgtgg gagaaagctc 20
<210> 4
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> обратные праймеры HK2
<400> 4
tccatttgta ctccgtggct 20
<210> 5
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> прямые праймеры HK3
<400> 5
gctccgttga gagcagattt 20
<210> 6
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> обратные праймеры HK3
<400> 6
ttgctgcaag cattccagtt 20
<210> 7
<211> 21
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> прямые праймеры PFKM
<400> 7
gtttggaagc ctctcctcct с 21
<210> 8
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> обратные праймеры PFKM
<400> 8
gacggcagca ttcatacctt 20
<210> 9
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> прямые праймеры PKKFL
<400> 9
cgcaaggtat gaatgctgct 20
<210> 10
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> обратные праймеры PFKL
<400> 10
cgatggtcaa gtgtgcgtag 20
<210> 11
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
<223> прямые праймеры PGK1
<400> 11
cgagcctcac tgtccaaact 20
<210> 12
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> обратные праймеры PGK1
<400> 12
gtctgcaact ttagcgcctc 20
<210> 13
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> прямые праймеры PKM1
<400> 13
cgtccgcagg tttgatgaga 20
<210> 14
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> обратные праймеры PKM1
<400> 14
ttcaaacagc agacggtgga 20
<210> 15
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> прямые праймеры PKM2
<400> 15
ggctcctatc attgccgtga 20
<210> 16
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> обратные праймеры PKM2
<400> 16
aaggtacagg cactacacgc 20
<210> 17
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> прямые праймеры Actb
<400> 17
tgagctgcgt tttacaccct 20
<210> 18
<211> 20
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> обратные праймеры Actb
<400> 18
tttgggggat gtttgctcca 20
<210> 19
<211> 21
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> промоторный праймер Il1b (прямой)
<400> 19
aggtcaaagg tttggaagca g 21
<210> 20
<211> 25
< 212> ДНК
< 213> Искусственная Последовательность
<220>
< 223> промоторный праймер Il1b (обратный)
<400> 20
atggaagtct gtctgctcag tattg 25
<210> 21
<211> 21
< 212> ДНК
< 213> Искусственная Последовательность
<220>
<223> последовательности, нацеленные на HK2
<400> 21
gcgcaacatt ctcatcgatt t 21
<210> 22
<211> 21
< 212> ДНК
< 213> Искусственная Последовательность
<220>
<223> последовательности, нацеленные на HK2
<400> 22
aaatcgatga gaatgttgcg c 21
<210> 23
<211> 19
< 212> ДНК
< 213> Искусственная Последовательность
<220>
<223 > контрольная последовательность shРНК
<400> 23
ttctccgaac gtgtcacgt 19
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ СОЕДИНЕНИЯ ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ЦЕРЕБРАЛЬНОЙ МИКРОАНГИОПАТИИ | 2018 |
|
RU2752089C1 |
| ПЕПТИДНАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2021 |
|
RU2816119C1 |
| СПОСОБЫ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ СОСТОЯНИЙ С ПРИМЕНЕНИЕМ ГЕМАТОПОЭТИЧЕСКИХ ФАКТОРОВ РОСТА | 2003 |
|
RU2353385C2 |
| СЛИТАЯ МОЛЕКУЛА, СПОСОБНАЯ ИНДУЦИРОВАТЬ НЕВОСПАЛИТЕЛЬНЫЙ ФАГОЦИТОЗ | 2022 |
|
RU2823919C1 |
| РЕКОМБИНАНТНЫЙ ХИМЕРНЫЙ БЕЛОК ФАКТОРА ИНГИБИРОВАНИЯ НЕЙТРОФИЛОВ И ГИРУГЕНА И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2008 |
|
RU2426745C2 |
| ЛЕЧЕНИЕ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С НЕЙТРОФИЧЕСКИМ ФАКТОРОМ ГОЛОВНОГО МОЗГА (BDNF), ПУТЕМ ИНГИБИРОВАНИЯ ПРИРОДНОГО АНТИСМЫСЛОВОГО ТРАНСКРИПТА BDNF | 2013 |
|
RU2661104C2 |
| ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ НЕРВНОЙ СИСТЕМЫ | 2018 |
|
RU2825666C2 |
| СПОСОБ КОРРЕКЦИИ ПОСТИШЕМИЧЕСКОЙ КОГНИТИВНОЙ ДИСФУНКЦИИ | 2006 |
|
RU2315618C1 |
| СПОСОБЫ И ПРИМЕНЕНИЯ, ВКЛЮЧАЮЩИЕ ГЕМСВЯЗЫВАЮЩИЙ БЕЛОК 1 | 2009 |
|
RU2520748C2 |
| КОМПОЗИЦИЯ ДЛЯ НЕЙРОПРОТЕКЦИИ И СТИМУЛЯЦИИ НЕЙРОРЕГЕНЕРАЦИИ ГОЛОВНОГО МОЗГА ПОСЛЕ ПОВРЕЖДЕНИЯ, СРЕДСТВО НА ЕЕ ОСНОВЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2022 |
|
RU2803286C1 |


Группа изобретений относится к лечению острого повреждения центральной нервной системы. Раскрыто применение специфического ингибитора гексокиназы-2 для изготовления лекарственного средства для профилактики или лечения острого повреждения центральной нервной системы, опосредованного активацией микроглии. Также раскрыто применение композиции, содержащей специфический ингибитор гексокиназы-2, для изготовления лекарственного средства для профилактики и лечения острого повреждения центральной нервной системы, опосредованного активацией микроглии. Группа изобретений обеспечивает нейропротекторное действие. 2 н. и 7 з.п. ф-лы, 9 ил., 5 пр.
1. Применение специфического ингибитора гексокиназы-2 для изготовления лекарственного средства для профилактики или лечения острого повреждения центральной нервной системы, опосредованного активацией микроглии.
2. Применение по п. 1, отличающееся тем, что специфическим ингибитором гексокиназы-2 является антитело к гексокиназе 2 или его фрагмент, или киРНК, кшРНК, микроРНК, или их вариант, который интерферирует с мРНК гексокиназы-2.
3. Применение по п. 2, отличающееся тем, что антитело к гексокиназе 2 кодируется нуклеотидной последовательностью, содержащейся в векторе.
4. Применение по п. 2, отличающееся тем, что фрагмент антитела представляет собой Fab, Fab', (Fab')2 или Fv.
5. Применение по п. 2, отличающееся тем, что киРНК, кшРНК, микроРНК или их вариант содержится в векторе.
6. Применение по п. 1, отличающееся тем, что острое повреждение центральной нервной системы, опосредованное активацией микроглии, представляет собой повреждение головного/спинного мозга, вызванное любой причиной из группы, состоящей из острой травмы позвоночника, травмы головного мозга, повреждения сетчатки, гипоксического повреждения головного мозга, острого ишемического повреждения головного мозга, ишемического инсульта, гипоксического инсульта, неонатальной гипоксической ишемической энцефалопатии, токсической энцефалопатии, острого инфаркта головного мозга, лакунарного инфаркта, транзиторной ишемической атаки, тяжелой черепно-мозговой травмы, цереброспинальной хирургии и лучевой терапии головного/спинного мозга.
7. Применение по п. 1, отличающееся тем, что специфическим ингибитором гексокиназы-2 является лонидамин.
8. Применение композиции, содержащей специфический ингибитор гексокиназы-2, для изготовления лекарственного средства для профилактики и лечения острого повреждения центральной нервной системы, опосредованного активацией микроглии.
9. Применение по п. 8, отличающееся тем, что композиция дополнительно содержит одно или более соединений, выбранных из группы, состоящей из 2-дезоксиглюкозы, бромпировиноградной кислоты, глюкозо-6-фосфата, Иматиниба, 5-тио-глюкозы и метилжасмоната.
| US 20100233156 A1, 16.09.2010 | |||
| WO 2016126618 А1, 11.08.2016 | |||
| WO 2016196890 A1, 08.12.2016 | |||
| RU 2010116245 А, 10.11.2011 | |||
| Матвеева Т.В | |||
| и др | |||
| Острые проявления поражений нервной системы в практике врача-терапевта // Вестник современной клинической медицины, Т.7, 2014, с | |||
| Ребристый каток | 1922 |
|
SU121A1 |
Авторы
Даты
2020-11-17—Публикация
2018-02-06—Подача