Область изобретения
Настоящее изобретение относится к мультимерным липопептидам, состоящим из пептидной цепи, содержащей параллельный биспиральный домен, пролин-богатый пептидный антиген и липидную составляющую, все ковалентно связанные, которые агрегируют с синтетическими вирусоподобными частицами. Эти синтетические вирусоподобные частицы, несущие пролин-богатые антигены, можно применять в качестве вакцин против инфекционных заболеваний, вызванных грамположительными бактериями, такими как Streptococcus pneumoniae.
Предпосылки создания изобретения
Грамположительные бактерии, включая Streptococci или Staphylococci, являются важными патогенами и этиологическим фактором ряда серьезных заболеваний, включая пневмонию, сепсис, менингит, раневые инфекции, эндокардит, острый ревматизм, неонатальный сепсис или синдром токсического шока. Поэтому существует потребность в разработке вакцин против этих патогенов. Вакцины уже доступны для некоторых серотипов S. pneumoniae,; у них есть недостатки, такие как очень сложный процесс производства.
S. pneumoniae представляет собой покрытый весьма разнообразной полисахаридной капсулой альфа-гемолитический Streptococcus, который часто колонизирует носоглотку человека и может приводить к неинвазивным пневмококковым заболеваниям, таким как отит среднего уха, синусит и небактериемический пневмония, а также к более тяжелым инвазивным заболеваниям, таким как бактериемия/сепсис, менингит и бактериемическая пневмония, в первую очередь среди детей младшего возраста и пожилых людей.
Полисахаридная капсула является основным фактором, определяющим вирулентность во время инвазии, и препятствует C3b-опсонизации и неопсоническому уничтожению нейтрофилами. В настоящее время лицензированные вакцины содержат капсулярные полисахаридные антигены, сформулированные либо по отдельности, в пневмококковых полисахаридных вакцинах (PPSV), либо конъюгированные с белком-носителем, таким как модифицированный дифтерийный токсин CRM 197, в пневмококковых конъюгированных вакцинах (PCV). Существует более чем 90 различных капсульных серотипов в 40 серогруппах.
Полисахаридные пневмококковые вакцины могут обеспечить серотип-специфическую защиту, однако перекрестная защита низка даже в пределах одной серогруппы. Замена серотипа наблюдалась после введения конъюгированной вакцины Prevnar® 7 в США в 2000 году. Среди новых серотипов также присутствуют капсула-переключающие варианты с множественной лекарственной устойчивостью. Таким образом, существует потребность в пневмококковых вакцинах следующего поколения, которые нацелены на другие антигены, отличные от капсулы.
Одним потенциальным антигеном для включения в пневмококковую вакцину нового поколения является пневмококковый поверхностный белок A (PspA). PspA представляет собой мономерный полиморфный холин-связывающий белок и содержит N-концевую альфа-спиральную часть, которая образует сама с собой антипараллельную биспираль, пролин-богатую область, которая иногда перемежается относительно консервативным непролиновым блоком, и С-концевую область, содержащую несколько повторов холин-связывающего домена.
N-концевая область PspA содержит иммунодоминантные эпитопы. Рекомбинантные белки, содержащие эту область, и бактериальные векторы, экспрессирующие эту область, показали защитный потенциал в различных моделях. Например, Langermann et al. подготовили рекомбинантные векторы бациллы Кальметта-Герена (rBCG), экспрессирующие PspA. Для придания способности PspA заякориваться в бактериальной оболочке PspA-полученный генный сегмент был слит с липопротеином Mtb19 (см Langermann S. et al., J. Exp. Med. 1994, 180, 2277-2286). Существует фактор опасности, связанной с использованием PspA в качестве вакцинного антигена, так как N-концевая область может напоминать человеческий миозин и поэтому иммунизация иммуногеном, включающим эту область, может привести к образованию тканевых перекрестно реагирующих антител. По этой причине в последнее время были предприняты усилия, чтобы использовать другие области PspA в качестве антигена. Другая область PspA, которая может быть пригодна для включения в пневмококковую вакцину нового поколения, представляет собой пролин-богатый участок. Несмотря на то, пролин-богатый участок (PRR) PspA является полиморфным, он содержит несколько консервативных мотивов, в том числе короткие аминокислотные мотивы наподобие PKP, PAPAP, PEKP и высококонсервативной непролиновый блок (NPB), который присутствует в некоторых молекулах PspA (Brooks-Walter, A. et al., Infect Immun 1999, 67, 6533-6542; Hollingshead, S.K. et al., Infect Immun, 2000, 68, 5889-5900; Daniels, C.C. et al., Infect Immun, 2010, 78, 2163-2172.). Хотя PRR не содержит иммуногенные детерминанты, антитела против этой части PspA были обнаружены у детей при помощи иммуноферментного анализа (ИФА) с тиоредоксиновым (Trx) слитым белком в качестве антигена (Melin, M. et al., Vaccine 2012, 30, 7157-7160). Поскольку NPB является высоко консервативным, авторы предполагают, что антитела к PRR могут перекрестно реагировать с большинством штаммов через их узнавание NPB-эпитопов.
PRR из PspA имеет небольшой размер (до примерно 100 аминокислот), и, следовательно, не может быть в достаточной степени иммуногенной при использовании в качестве антигена самого по себе. Escherichia coli Trx-слитые белки были получены, и их потенциал для защиты был продемонстрирован в модели внутривенной инфекции на мышах (WO 2007/089866 and Даniels, C.C. et al., Infect Immun, 2010, 78, 2163-2172). Тем не менее, Trx-слитые белки не могут быть пригодны для применения для людей в качестве вакцины из-за потенциала для индукции иммунного ответа на непротективные TRX-эпитопы и слабого структурного представления нативных PR-эпитопов. К тому же NPB или богатые пролином (PR) последовательности могут также содержать и непротективные эпитопы, и, следовательно, для эффективности может иметь решающее значение сконцентрировать иммунные ответы на защитных эпитопах.
Подобные PR-последовательности могут быть найдены в других пневмококковых белках, включая белки поверхности PspC (также известные как CbpA или Hic), а также PhtX-белки PhtA, PhtB, PhtD и PhtE, и пролин-богатые области, полученные из таких других пневмококковых белков, могут подходить для включения в пневмококковую вакцину нового поколения, наподобие богатых пролином последовательностей из PspA.
Несколько иммуногенных бактериальных поверхностных белков из других грамположительных бактерий содержат богатые пролином последовательности, которые также могут быть мишенью для вакцин против этих патогенных микроорганизмов. Эти белки включают поверхностные белки из других Streptococci, такие как белки M6, SclA и SclB S. pyogenes, CBeta (bac) и BibA S. agalactiae или адгезин P1 S. mutans или белки из S. aureus.
Синтетические аналоги бактериальных липопептидов получили широкое внимание при исследовании вакцин, как по их адъювантным эффектам, так и в качестве носителей для пептидных антигенов (Ghielmetti M. et al., Immunobiology 2005, 210, 211-215). Сообщалось о многих липопептидных конструкциях, в которых липид с известными адъювантными эффектами был соединен с пептидом для создания самоадьювантной кандидатной вакцины. Особенно хорошо изучены трипальмитоил-S-глицерилцистеин(N-пальмитоил-S-(2,3-бис-(О-пальмитоилокси-)-пропил)-цистеинил- или Pam3Cys) и дипалмитоил-S-глицерилцистеин (2,3-бис-(О-пальмитоилокси-)-пропил)-цистеинил- или Pam2Cys). Эти липидные остатки встречаются в липопротеиновых компонентах внутренней и внешней мембраны грамотрицательных бактерий. Заявка на патент WO 98/07752 описывает применение липопептидов для целей направленной доставки лекарственного препарата, причем пептидный участок может представлять собой коллаген-подобную последовательность, способную индуцировать трехспиральные структуры. Заявка на патент WO 2008/068017 описывает синтетические вирусоподобные частицы, включающие спиральные липопептидные пучки и имеющие сферическую или сфероидальную структуру с липидной сердцевиной и пептидной внешней поверхностью. Пептидная цепь липопептидов содержит биспиральный домен. Свойства биспирального домена в пептидной цепи липопептидных структурных блоков определяют количество структурных блоков, объединеннных для формирования синтетической вирусной частицы
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к области липопептидных структурных элементов, состоящих из (1) пептидной цепи, содержащей параллельный биспиральный домен, который, в качестве самостоятельного не содержащего липидов пептида, образует параллельный димерный, тримерный или высшего порядка олигомерный спиральный пучок, (2) пролин-богатого (PR) пептидного антигена, содержащего, по меньшей мере, одну отрицательно и, по меньшей мере, одну положительно заряженную аминокислоту и где, по меньшей мере, 15% аминокислот представляют собой пролин, необязательно связанного с другим антигеном, а также (3) липидной части, состоящей из двух или трех длинных углеводородных цепей; причем пептидная цепь, PR-пептидный антиген и липидная часть ковалентно связаны, либо непосредственно, либо через линкер. Предпочтительно пептидная цепь, содержащая параллельную биспираль, связана одним концом с PR-пептидным антигеном, а другим концом с липидной частью.
Эти липопептидные структурные элементы агрегируют со спиральным липопептидным пучком и синтетическими вирусоподобными частицами (SVLP). Представление PR-антигена на поверхности SVLP усиливает иммунный ответ на PR-эпитопы.
Предпочтительными являются липопептидные структурные элементы, включающие PR-пептидные антигены, полученные из Streptococci и/ или Staphylococci, более предпочтительно из Streptococcus pneumoniae.
Кроме того, изобретение относится к способам продуцирования липопептидных структурных элементов, спиральных липопептидных пучков и синтетических вирусоподобных частиц; к использованию липопептидных структурных элементов, спиральных липопептидных пучков и синтетических вирусоподобных частиц, несущих PR-пептидные антигены, при подготовке вакцин; а также к способам вакцинации с использованием таких вакцин. Изобретение также относится к фармацевтическим препаратам, содержащим синтетические вирусоподобные частицы, несущие PR-антигены.
Композициии по изобретению, содержащие PR-пептидные антигены, полученные из Streptococci и/ или Staphylococci, в частности, из S. pneumoniae, являются полезными для индукции иммунного ответа против S. pneumoniae или других грам-положительных бактерий, а также для профилактики или лечения инфекционных заболеваний, таких как пневмококковые заболевания, вызванные S. pneumoniae.
Краткое описание чертежей
Фигура 1: Титры предельных значений IgG ELISA в сыворотке мышей BALB/с, иммунизированных два раза липопептидом 15 (закрытые круги и квадраты) или рекомбинантным PspA, адъювантный квасцами (rPspA, закрытые треугольники), и в сыворотке неиммунизированных контролей (открытые символы). Символы указывают титры предельных значений сывороток от отдельных мышей, линии показывают средние значения. Титры определяли против пептида, представляющего пролин-богатую область (PR-пептид), и рекомбинантного белка PspA, включающего всю N-концевую альфа-спиральную часть, пролин-богатую область и не-пролиновый элемент (rPspA).
Фигура 2: Время выживания в днях (D) после заражения иммунизированных и неиммунизированных мышей BALB/с увеличивающимися дозами S. pneumoniae серотипа 1. Процент выживаемости (%S) показан на оси у и дозы иммуногенов и заражающие дозы (в КОЕ) указаны справа. Мышей иммунизировали два раза липопептидом 15 или rPspA+квасцы, а затем заражали внутривенно.
Подробное описание изобретения
Изобретение относится к области липопептидных структурных элементов, состоящих из
(1) пептидной цепи (PC), содержащей параллельный биспиральный домен, который, в качестве самостоятельного не содержащего липидов пептида, образует параллельный димерный, тримерный или высшего порядка олигомерный спиральный пучок,
(2) пролин-богатого (PR) пептидного антигена, содержащего, по меньшей мере, одну отрицательно и, по меньшей мере, одну положительно заряженную аминокислоту и где, по меньшей мере, 15% аминокислот представляют собой пролин, необязательно связанного с другим антигеном, и
(3) липидной составляющей (LM), содержащей три или предпочтительно две длинные углеводородные цепи, причем пептидная цепь, PR-пептидный антиген и липидная составляющая ковалентно связаны, либо непосредственно, либо через линкер, в частности, через два различных линкера.
Предпочтительно пептидная цепь, содержащая параллельную биспираль, связана одним концом с PR-пептидным антигеном и другим концом с липидной составляющей.
Пептидная цепь (PC) включает параллельный биспиральный домен. Такие биспиральные домены будут объединяться в определенный спиральный пучок, например, в димерный, тримерный, тетрамерный, пентамерный, гексамерный или гептамерный пучок. Параллельные биспиральные домены отличаются от антипараллельных биспиральных доменов, в которых мономерная пептидная цепь возвращается к началу, чтобы сформировать спиральную подструктуру путем совмещения двух (или более) отдельных доменов мономерного пептида при антипараллельном выравнивании. Параллельный биспиральный домен может содержать от 12 до 120 аминокислотных остатков, предпочтительно от 21 до 80 аминокислотных остатков. Биспиральные домены содержат две или более последовательных повторяющихся структур (обычно семичленные повторы, в которых семь структурных положений маркированы a-g, с а и d, обозначающими гидрофобные остатки), которые, в качестве самостоятельных не содержащих липидов пептидов обладают свойством самосборки в параллельный биспиральный пучок (Lupas A.N., Gruber M.; The structure of alpha-helical coiled coils, Adv. Protein Chem. 2005, 70, 37-78). Пептидная цепь должна мультимеризироваться с образованием параллельного биспирального пучка определенного состояния олигомеризации (например, димер, тример, тетрамер, пентамера, гексамер или гептамер, в частности, димер, тример, тетрамер или пентамер). Предпочтительные пептидные последовательности не являются последовательностями человека, чтобы избежать риска аутоиммунных нарушений при применении во время вакцинации людей.
Липопептидный структурный элемент дополнительно содержит пролин-богатый (PR) пептидный антиген, содержащий, по меньшей мере, одну отрицательно и, по меньшей мере, одну положительно заряженную аминокислоту.
Заряженные аминокислоты, рассматриваемые в настоящем описании, представляют собой аминокислоты с боковыми цепями, которые являются положительно или отрицательно заряженными при физиологическом значении рН. Среди встречающихся в природе аминокислот наиболее часто встречающимися положительно заряженными аминокислотами, рассматриваемыми в настоящем описании, являются лизин, аргинин и гистидин; наиболее часто встречающимися отрицательно заряженными аминокислотами являются глутаминовая кислота и аспарагиновая кислота. Пептид считается "пролин-богатый", если, по меньшей мере, 15% аминокислот являются пролином. Предпочтительными являются богатые пролином пептиды, содержащие, по меньшей мере, один остаток глутаминовой кислоты и, по меньшей мере, один остаток лизина или аргинина.
Предпочтительные PR пептидные антигены получают из Streptococci и/ или Staphylococci, например из грамположительных бактерий, выбранных из группы, состоящей из Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus mutans, Streptococcus suis, Streptococcus equi, Streptococcus dysgalactiae, Peptostreptococcus magnus и Staphylococcus aureus.
Предпочтительно, чтобы этот PR-пептидный антиген был получен из белков PspA и/ или PspC или других белков, которые защищают от пневмококковой инфекции, в том числе белки PhtX.
"Производное" означает, что последовательность аминокислот или существенная часть (то есть 50% или более) аминокислотной последовательности пептидного антигена берет свое начало от одного или более природного белка (ов), в то время как от 0% до 50% аминокислотной последовательности проектируется de novo. Включены также PR пептидные антигены, которые включают комбинации богатых пролином последовательностей из различных молекул PspA/PspC и/ или из других белков, содержащих богатые пролином сегменты. "Богатый пролином сегмент" означает, что, по меньшей мере, 15% содержащихся в сегменте аминокислот представляют собой пролин.
Представляющие интерес пролин-богатые (PR) пептидные антигены получены из S. pneumoniae и расположены сразу после С-терминального конца спиральной области PspA или PspC и перед блоком, не содержащим пролин (если последовательность PspA или PSPC включает блок, не содержащий пролин) или областью повтора. В качестве альтернативы, PR-пептидный антиген расположен в центральной области пневмококкового полигистидинового триадного белка (PhtX). Альтернативно, PR-пептидный антиген находится в области PR-белков грамположительных бактерий, выбранных из группы, состоящей из Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus mutans, Streptococcus suis, Streptococcus equi, Streptococcus dysgalactiae, Peptostreptococcus magnus and Staphylococcus aureus, такой как центральная область P1-адгезина Streptococcus mutans.
Защитные PR-пептидные антигены идентифицируют путем секвенирования PspA и/ или PspC и/ или других генов из клинических изолятов, селекции части PR-области, синтеза PR-пептида и конъюгации его с пептидной цепью (PC), чтобы быть включенным или являться частью липопептида.
Эффективность PR-пептидных антигенов проверяется путем введения липопептидных конъюгатов и синтетических вирусоподобных частиц, полученных из них, и наблюдения за активностью и эффективностью в животных моделях пневмококкового сепсиса или других заболеваний, вызванных стрептококковой инфекцией.
PR-пептидный антиген необязательно связан с другим антигеном. Дополнительные рассмотренные антигены представляют собой другие пневмококковые пептиды или полисахариды, в частности, пептиды с аминокислотной последовательностью SEQ ID NO: 113-119, а также другие антигены, описанные ниже.
PR-пептидный антиген конъюгируют непосредственно или через линкер, либо с N- или С-концом PR-пептидного антигена, и соединен либо с N-, либо с С-концом пептидной цепи (PC), содержащей биспиральный домен, или, необязательно, с боковой цепью аминокислоты. В качестве альтернативы, PR-пептидный антиген конъюгируют с пептидной цепью (PC), содержащей биспиральный домен, через остаток боковой цепи PR-пептидного антигена, такой как боковая цепь концевой или внутренней аспарагиновой кислоты, глутаминовой кислоты, лизина, орнитина или цистеина. Рассматриваемые линкеры представляют собой короткие пептиды от 2 до 20 аминокислот, гидроксиалкил- или аминоалкилкарбоновых кислот, замещенные или незамещенные полиалкиленоксигликоли, предпочтительно содержащие от одного до двенадцати C2 и/ или C3 алкиленокси единиц, полиалкиленоксигликоль блок-сополимеры (например, плуроники), моно-, ди-, три- и олигосахариды, которые могут содержать ацетил, глицеролфосфат или другие заместители в одном или более положениях, полисахариды, такие как поли(сиалиловая кислота) и ее производные этого (например, пептидные конъюгаты), протеиногенные или непротеиногенные аминокислоты, и C1-C8 насыщенные или ненасыщенные углеводороды, и могут содержать одну или несколько из следующих функциональных групп: дисульфидная связь, амин, амид, ацеталь, сложный эфир, простой эфир, тиоэфир, гидразон, гидразид, имин, оксим, мочевину, тиомочевину, карбонат, иминокарбонат, амидин, амид, имид, алкильный сукцинимид, который также может быть гидролизован до амида, сульфонамид, сульфон или гетероциклическое кольцо, содержащее один или несколько атомов, выбранных из азота и кислорода, предпочтительно триазол. Рассматриваются также комбинации вышеуказанных линкеров, в том числе такие, которые используются в Примерах.
Любой способ, используемый для конъюгации пептидов или других антигенов с системой доставки антигена, такой как белок-носитель, полимер, дендример, наночастица или вирусоподобная частица, может быть использован для конъюгации PR-пептидных антигенов с пептидной цепью (PC), содержащей параллельный биспиральный домена. Такие способы хорошо известны специалистам в данной области, смотри, например, Hermanson, G.T, Bioconjugate Techniques, 2nd edition, Academic Press, 2008.
PR-пептидные антигены состоят из 5-200 аминокислот, предпочтительно 8-80 аминокислот. Несколько PR-пептидных конъюгатов могут быть использованы в комбинации в вакцинном составе. PR-пептидные антигены также могут быть слиты друг с другом для того, чтобы произвести больше искусственного PR пептида. PR-конъюгаты могут быть также объединены с конъюгатами, содержащими другие пневмококковые пептиды или полисахариды. Аминокислоты и их производные, содержащие функциональную группу (например, амино-, галоген-, гидразино-, гидроксиламино- или сульфгидрильную группу) могут быть включены в PR-пептид с целью облегчения конъюгации PR-пептида и повышения стабильности.
Пептидная цепь (PC) может дополнительно включать в себя аминокислотную последовательность, которая содержит один или более эпитопов Т-хелперных клеток и/ или цепочки полярных остатков, которые способствуют растворимости липопептидного структурного элемента в воде.
Т-хелперные эпитопы, которые могут быть введены в пептидную цепь (PC), включают такие, которые перечислены ниже в таблице 1, и их варианты, в которых одна, две или три аминокислоты замещены другими аминокислотами или удалены.
Общая длина пептидной цепи (PC) предпочтительно составляет от 21 до 200 аминокислотных остатков, более предпочтительно от 21 до 120 аминокислотных остатков.
Липидная составляющая (LM) содержит липидный якорь с двумя или тремя, предпочтительно двумя длинными углеводородными цепями и структуру, объединяющую эти углеводородные цепи, и соединяет ее с пептидной цепью (PC), либо непосредственно, либо через линкер. Кроме того, липидная составляющая также может быть соединена с PR-пептидом, который, в свою очередь, соединяется с пептидной цепью, содержащей параллельную биспираль, однако предпочтительным является соединение липидного остатка с пептидной цепью. Предпочтительными липидными составляющими являются липиды, содержащие две или три, предпочтительно две протяженные углеводородные цепи.
"Длинный углеводородный остаток" означает линейную алкильную или алкенильную группу, содержащую, по меньшей мере, 7 атомов углерода, например, линейный алкил или алкенил, состоящий из 8-50 атомов углерода, предпочтительно от 8 до 25 атомов углерода. Алкенил предпочтительно имеет одну, две или три двойные связи в цепи, каждая с геометрией Е или Z, как обычно обнаруживается в природых жирных кислотах и жирных спиртах. Также включенным в определение "длинный углеводородный остаток" является разветвленный алкил или алкенил, например, алкил, несущий метиловый или этиловый заместитель во втором или третьем атоме углерода, считая от конца цепи, как, например, в 2-этилгексиле.
Выражение "низший алкил" означает алкил с 1-7 атомами углерода (C1-C7), предпочтительно от 1 до 4 атомов углерода (C1-C4), такой как метил, этил, н-пропил, изо-пропил, н-бутил, втор-бутил, изо-бутил или трет-бутил.
Конкретными предпочтительными липидными частями по изобретению являются таковые с формулой Z1 - Z8
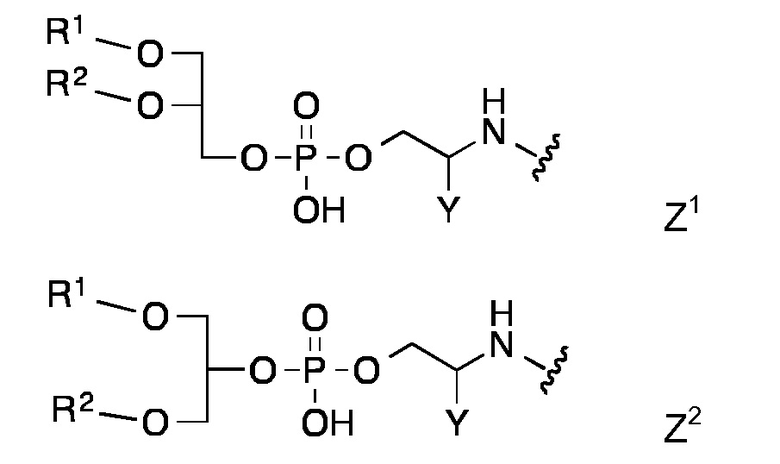
в которой R1 и R2 представляют собой длинный углеводородный остаток или длинный углеводород-C=О и Y представляет собой Н или СООН,
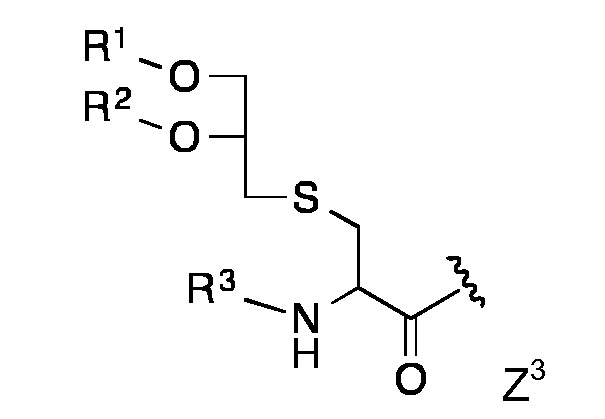
в которой R1, R2 and R3 представляют собой длинный углеводородный остаток или длинный гидрокарбил-C=О или R1 и R2 представляют собой длинный углеводородный остаток или длинный углеводород-C=О и R3 представляет собой Н или ацетил или низший алкил-С=О,
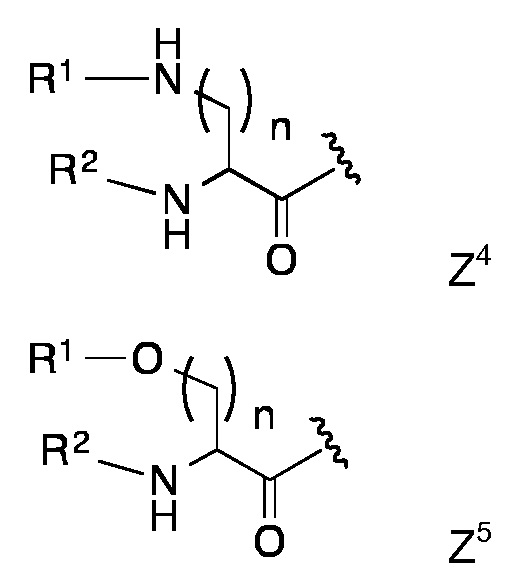
в которой R1 и R2 представляют собой длинный углеводородный остаток или длинный углеводород-C=О и n представляет собой 1, 2, 3 или 4,
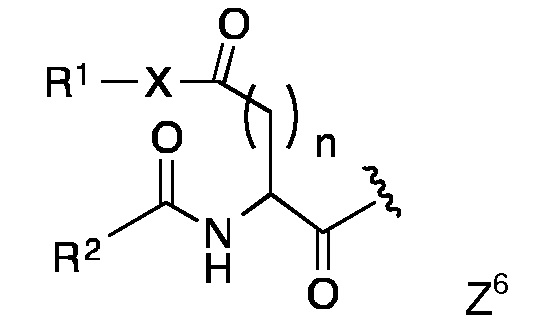
в которой R1 и R2 представляют собой длинный углеводородный остаток, Х представляет собой О или NH, а n представляет собой 1, 2, 3 или 4, или
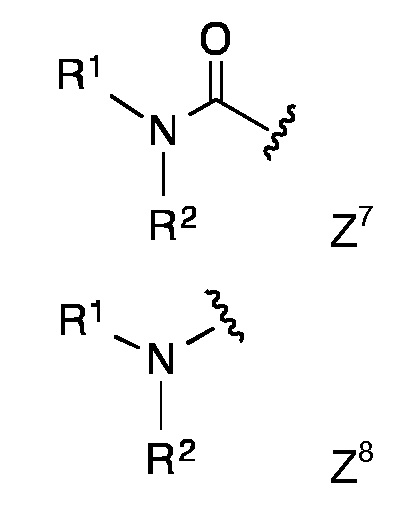
в которой R1 и R2 представляют собой длинный углеводородный остаток.
Липидная составляющая содержит, по меньшей мере, две длинные углеводородные цепи, такие как обнаруживаются в жирных кислотах, например, как и в Z1-Z8. Одна из предпочтительных липидных составляющих представляет собой фосфолипид различных типов, например, с формулой с Z1 или Z2, который обладает либо сложноэфирными или сложноэфирно-сшитыми протяженными алкильными или алкенильными цепями, такими как любой энантиомер 1,2-дипалмитоил-sn-глицеро-3-фосфоэтаноламина, либо ахиральными аналогами, такими как 1,3-дипалмитоил-глицеро-2-фосфоэтаноламин. Предпочтительная липидная составляющая представляет собой три- или ди-пальмитоил-S-глицерилцистеиниловый остаток (тип Z3) или липидные составляющие типов Z4-Z8. Наиболее предпочтительными являются липидные составляющие, описанные в Примерах.
Пептидная цепь (PC) ковалентно связана с липидной составляющей (LM) одним концом или вблизи него, то есть N-концом или С-концом, предпочтительно N-концом. Липидная составляющая может быть непосредственно присоединена, как в
LM-PC (1)
или через линкер (L), как в
LM-L-PC (2).
Если пептидная цепь (PC) и липидная составляющая (LM) непосредственно связаны между собой, это предпочтительно осуществляется посредством амидной связи между карбонильной группой липидной составляющей и аминогруппой, например, функция N-концевой аминогруппы пептидной цепи (PC). Конкретные липидные составляющие Z1, Z2 и Z8 предпочтительно соединены посредством амидной связи своей аминогруппой с карбоксильной группой, например, С-концевой карбоксильной группой пептидной цепи (PC).
Для специалистов в рассматриваемой области является очевидным, что существуют большое разнообразие пригодных линкеров и стратегий соединения, которые включают, в качестве неограничивающих примеров, линкеры на основе производных дикарбоновых кислот, линкеров, содержащих одну или несколько единиц этиленгликоля, аминокислотные остатки (в том числе α-, β-, γ-, δ-аминокислоты) или единицы сахаров (углеводов) или содержащие гетероциклические кольца. Конкретные рассмотренные линкеры представляют собой линкеры L1-L16, в которой n находится в интервале от 1 до 45 и m находится в интервале от 1 до 45, например, где n находится в интервале от 1 до 20 и m находится в интервале от 1 до 20, показанные с соединяющий функциональной группой C=O и/ или X, где Х представляет собой О или NH:
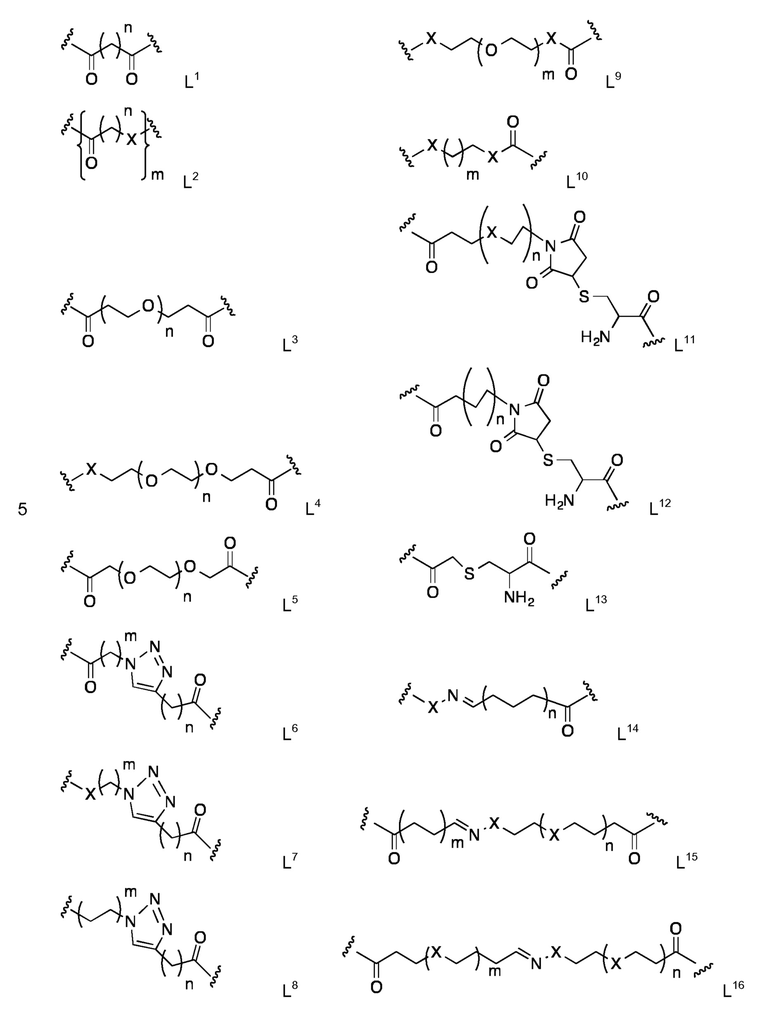
Наиболее предпочтительными являются линкеры, описанные в Примерах.
Конкретные линкеры L1 - L16 могут быть связаны с LM и PC следующим образом:
Карбонильная группа, показанная для L1 - L16, может соединяться с аминогруппой подходящей липидной составляющей (LM) и/ или аминогруппой, например, N-концевой аминогруппой пептидной цепи (PC) посредством амидной связи. В качестве альтернативы, карбонильная группа, показанная для L1 - L16, может соединяться с липидной группой (LM) путем замены соответствующей карбонильной группы в конкретных липидных составляющих Z3 - Z7.
Функциональная группа Х, показанная для L1 - L16 (со значением NH или O), может соединяться с карбонильной группой подходящей липидной составляющей (LM) и/ или карбоксильной группой, например, С-концевой карбоксильной группой (PC) посредством амидной связи (для X=NH), либо с помощью эфирной связи (для Х=О).
Концевая группа CH2 из L8 может быть соединена с аминогруппой подходящей липидной составляющей (LM), с функциональной аминогруппы, например, N-концевой функциональной аминогруппой пептидной цепи (PC), или карбонильной группой подходящей липидной составляющей (LM).
"Рядом с одним концом", как понимается в этой связи означает, что липидная составляющая или линкер связана с первой, второй, третьей, четвертой или пятой аминокислотой, считая от N- или С-терминального конца пептида, соответственно. Липидная составляющая может быть присоединена, непосредственно или через линкер, к каркасу пептидной структуры или боковой цепи одной из этих аминокислот рядом с концом.
"Биспиральные домены" проектируют путем тщательного подбора соответствующих аминокислотных последовательностей, которые образуют термодинамически стабильный, альфа-спиральный параллельный пучок спиралей путем спонтанной самоассоциации.
Биспиральный домен включает пептиды, основанные на канонических тандемных повторах гептадных последовательностей, которые образуют правозакрученные амфипатические α-спирали, которые затем собираются, чтобы образовать спиральные пучки с левозакрученной спиралью второго порядка. Кроме того, включены пептиды, построенные из неканонических повторов, отличных от гептадных повторов, которые образуют биспирали, которые не обязательно являются левозакрученными или даже обычными спиралями второго порядка.
Канонические биспирали широко распространены в природных биологически активных пептидах и белках, а также были разработаны de novo. Был выявлен набор правил для конструирования биспиральных пептидов, которые принимают спиральные пучки определенного состояния олигомеризации, топологии и стабильности (например, димер, тример, тетрамер, пентамера, гексамер или гептамер). Эти правила позволяют разработчикам создавать пептидную последовательность, совместимую с заданной структурой-мишенью. Самое главное, последовательности канонических биспиральных пептидов содержат характерный мотив из семи остатков, который повторяется, как правило, 3-10 раз. Положения в пределах одного гептадного мотива традиционно обозначается abcdefg, с преимущественным (но не исключительным) нахождением гидрофобных остатков происходит в участках a и d и, как правило, полярных, способствующих образованию спирали остатков в других участках. Тандемные гептадные мотивы вдоль пептидной цепи имеют среднее расстояние между остатками a и d, которое позволяет им попадать на одну сторону альфа-спирали. Когда две или более спирали упакованы вместе в биспиральный пучок, гидрофобные стороны спиралей ассоциируются и обвиваются друг вокруг друга, чтобы максимизировать контакты между гидрофобными поверхностями. Тип остатка, который может находиться в каждом положении в пределах гептадного повтора, будет влиять на стабильность и состояние олигомеризации спирального пучка. Как правило, боковые цепи наиболее гидрофобных (Ala, Ile, Leu, Met, Val) или ароматических гидрофобных (Phe, Trp и Tyr) остатков используются в участках a и d. Остальные участки b, c, e, f и g имеют тенденцию быть более пермессивными, чем участки a и d, хотя полярные и способствующие образованию спиралей остатки (Ala, Glu, Lys и Gln) являются предпочтительными. Выбор остатков на участках a и d может влиять на состояние олигомеризации биспирали (т.е. димер vs. тример). Таким образом, димеры являются предпочтительными, когда не-β-разветвленные остатки (например, Leu) находятся в положениях d; в этих участках β-разветвленные остатки (Val и Ile) не способствуют образованию димеров. С другой стороны, в димерах β-разветвленные остатки (Ile, Val) являются предпочтительными в участках a. Другое правило состоит в том, что а=d=Ile или Leu способствует образованию тримеров, что полезно при проектировании биспиралей, которые специфически образуют параллельные тримеры. Эти и другие правила проектирования обсуждаются более подробно в Woolfson, D.N., Adv. Prot. Chem. 2005, 70, 79-112.
Гептадный мотив кодирует амфипатические альфа-спирали, которые олигомеризуются за счет своих гидрофобных поверхностей. Биспиральный домен включает, по меньшей мере, три тандемных гептадных повторяющихся мотива. Верхний ряд гептадных повторов в каждой цепи будет влиять на устойчивость спирального пучка. Это ограничено, главным образом, возможностью химического синтеза длинных пептидов, но последовательности, содержащие более трех гептадных повторов (например, четыре, пять, шесть, семь и восемь гептадных повторов), являются предпочтительными. Примеры, рассматриваемые ниже, образуют тримерные альфа-спиральные биспирали, но изобретение также относится к димерным, тетрамерным, пентамерным, гексамерным и гептамерным биспиральным доменам.
Биспиральные домены в соответствии с настоящим изобретением могут иметь более длинные повторяющиеся звенья, например, повторы из 11 остатков и повторы из 15 остатков, такие как присутствуют в природных биспиралях. Таким образом, спиральные пучки, необходимые для формирования агрегированных структур, также могут возникать при использовании биспиральных мотивов с периодичностями, отличными от семи. Также возможны биспирали с необычными периодичностями. Во многих природных биспиралях ненарушенный шаблон гептадных повторов может содержать различные разрывы. Два наиболее часто встречающихся разрыва представляют собой вставки одного остатка в гептадный шаблон, а также вставки из трех или четырех остатков. Например, вставка одного остатка присутствует в тримерной биспирали гемагглютинина вируса гриппа. Другие встречающиеся в природе биспирали демонстрируют периодичность, отличную от семи, например, нормальная периодичность в 11 остатков (называемых гендекады), присутствующая в тетрабрахионе белков поверхностного слоя из Staphylothermus marinus.
Другими примерами биспиральных пептидных последовательностей, встречающихся в природе в белках вирусных оболочек, являются биспиральные мотивы, образующие тримерные спиральные пучки в белке gp41 оболочки ВИЧ-1 и в F-гликопротеине RSV. Эти биспиральные домены включены в определение биспирального домена в соответствии с настоящим изобретением.
Предпочтительные биспиральные пептиды должны содержать 3-8 тандемно связанных гептадных мотивов. Гептадные мотивы внутри биспирали могут иметь идентичные последовательности, или каждый из них может иметь разные последовательности. Во всех случаях, семь положений семи аминокислотных остатков в пределах одного гептадного мотива обозначаются буквами: a b c d e f g. Биспиральный пептид, следовательно, включает в себя аминокислотную последовательность, имеющую положения (abcdefg)3-8.
Предпочтительными являются биспиральные пептидные последовательности, содержащие 3-8 тандемно соединенных гептадных мотивов, причем положения a и d в каждом гептадном мотиве (abcdefg) содержат альфа-аминокислоты, принадлежащие к группе 1 и/или к группе 2, как определено в настоящем описании ниже. Кроме того, не более двух из всех положений a и d могут быть заняты любым аминокислотным остатком, принадлежащим группе 3, и не более чем одно из всех положений a и d может быть занято любым аминокислотным остатком, принадлежащим группе 4 или группе 5, или глицином. Кроме того, в положениях b, c, e, f и g альфа-аминокислоты, принадлежащие к группам 3, 4 и 5, являются предпочтительными, а аминокислоты, принадлежащие к группам 1 и 2 допускаются, с добавлением, что не более чем одно из этих положений в рамках какого-либо одного гептадного мотива может представлять собой глицин, но ни одно не может являться пролином.
Группа 1 включает в себя альфа-аминокислотные остатки с малыми и средними гидрофобными боковыми цепями. Гидрофобный остаток соотносится с боковой цепью аминокислоты, которая незаряжена при физиологическом значении рН и которая отталкивается водным раствором. Эти боковые цепи, как правило, не содержат групп доноров водородных связей, таких как первичные и вторичные амиды, первичные и вторичные амины и их соответствующие протонированные соли, тиолы, спирты, мочевины или тиомочевины. При этом они могут содержать группы акцепторов водородной связи, таких как простые эфиры, простые тиоэфиры, сложные эфиры, третичные амиды или третичные амины. Генетически кодируемые аминокислоты в этой группе включают аланин, изолейцин, лейцин, метионин и валин. Группа 2 содержит аминокислотные остатки с ароматическими или гетероароматическими боковыми цепями. Остаток ароматической аминокислоты относится к гидрофобной аминокислоте, имеющей боковую цепь, содержащую, по меньшей мере, одно кольцо с конъюгированной ароматической π(пи)-электронной системой. Кроме того, она может содержать дополнительные гидрофобные группы, такие как низший алкил, арил или галоген, группы доноров водородных связей, такие как первичные и вторичные амины, и их соответствующие протонированные соли, первичные и вторичные амиды, спирты и группы акцепторов водородных связей, такие как простые эфиры, тиоэфиры, сложные эфиры, третичные амиды или третичные амины. Генетически кодируемые ароматические аминокислоты включают фенилаланин и тирозин. Остаток гетероароматической аминокислоты относится к гидрофобной аминокислоте, имеющей боковую цепь, содержащую, по меньшей мере, одно кольцо с конъюгированной ароматической π(пи)-системой, включающей, по меньшей мере, один гетероатом, такой как O, S и N. Кроме того, такие остатки могут содержать группы доноров водородных связей, такие как первичные и вторичные амиды, первичные и вторичные амины и их соответствующие протонированные соли, спирты и группы акцепторов водородной связи, такие как простые эфиры, простые тиоэфиры, сложные эфиры, третичные амиды или третичные амины. Генетически кодируемые гетероароматические аминокислоты включают триптофан и гистидин.
Группа 3 содержит аминокислоты, содержащие боковые цепи с полярными незаряженными остатками. Полярный незаряженный остаток относится к гидрофильной боковой цепи, которая является незаряженной при физиологическом значении рН, но которая не отталкивается водными растворами. Такие боковые цепи, как правило, содержат группы доноров водородных связей, такие как первичные и вторичные амиды, первичные и вторичные амины, тиолы и спирты. Эти группы могут образовывать сети водородных связей с молекулами воды. Кроме того, они могут также содержать группы акцепторов водородных связей, такие как простые эфиры, простые тиоэфиры, сложные эфиры, третичные амиды или третичные амины. Генетически кодируемые полярные незаряженные аминокислоты включают аспарагин, цистеин, глутамин, серин и треонин.
Группа 4 содержит аминокислоты, содержащие боковые цепи с полярными катионными остатками и их ацилированными производными, такими как ациламино-производные остатки и мочевина-производные остатки. Полярные катионные боковые цепи относятся к основной боковой цепи, которая протонируется при физиологическом значении рН. Генетически кодируемые полярные катионные аминокислоты включают аргинин, лизин и гистидин. Цитруллин является примером мочевина-производного аминокислотного остатка.
Группа 5 включает аминокислоты, содержащие боковые цепи с полярными анионными остатками. Полярный анионный относится к кислой боковой цепи, которая депротонируется при физиологическом значении рН. Генетически кодируемые полярные анионные аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. Конкретный полярный катионный остаток представляет собой -(CH2)aCOOH, где а представляет собой 1-4.
Более предпочтительными являются биспиральные пептидные последовательности, содержащие от 3 до 8 тандемно связанных гептадных мотивов, в которых каждый гептадный мотив (abcdefg) может содержать любую из следующих последовательностей:
1xx1xxx (со ссылкой соответственно на положения abcdefg);
1xx2xxx (со ссылкой соответственно на положения abcdefg);
2xx1xxx (со ссылкой соответственно на положения abcdefg);
или 2xx2xxx (со ссылкой соответственно на положения abcdefg);
в которых 1 представляет собой генетически кодируемые аминокислоты группы 1, 2 представляет собой генетически кодируемые аминокислоты группы 2 и в которых х представляет собой генетически кодируемые аминокислоты групп 1, 2, 3, 4 или 5 или глицин.
В равной степени предпочтительными являются биспиральные пептидные последовательности, идентифицированные в природных пептидах и белках, но за исключением таковых человеческого происхождения. Такие представляют собой, например, биспирали, идентифицированные в вирусных и бактериальных белках.
Изобретение также относится к синтетическим вирусоподобным частицам, несущим PR-пептидные антигены, и к способу получения таких синтетических вирусных частиц, включающему растворение липопептидных структурных элементов в подходящем носителе, предпочтительно в водной буферной системе (например, забуференный солевой раствор или небуферизованный солевой раствор). Растворитель может быть удален после подготовки синтетических вирусоподобных частиц, например, путем лиофилизации или сушки распылением.
Настоящее изобретение также относится к способу индуцирования иммунного ответа, в котором иммуногенно эффективное количество синтетических вирусоподобных частиц, несущих PR-пептидные антигены, описанные в настоящем документе, вводят животному. Может быть использовано любое животное, хотя теплокровные животные, в частности люди, рассматриваются здесь в наибольшей степени.
Изобретение также относится к вакцине (или, аналогичным образом, к любому другому фармацевтическому препарату или лекарственному препарату), содержащей в качестве основного или дополнительного активного ингредиента одну или более синтетических вирусоподобных частиц, несущих PR-пептидные антигены, по отдельности или в комбинации с фармацевтически приемлемым носителем.
Вакцина может также содержать один или несколько адъювантов, таких как минеральные соли (например, гидроксид алюминия, фосфат алюминия, сульфат алюминия, фосфат кальция), монофосфориллипид А (MPL), растительные экстракты, содержащие сапонины (например, QS-21), имидазохинолина (например имиквимод), мурамиловые дипептиды и трипептиды, липопептиды, эмульсии типа «масло-в-воде» (например, Montanide ISA 720), цитокины (например, IL-2 или GM-CSF), микобактериальные и бактериальные производные (например, полный адъювант Фрейнда), бациллу Кальметта-Герена, производные нуклеиновых кислот (например, polylC) и другие вспомогательные вещества, известные специалистам в данной области техники.
Некоторые компоненты вакцины также могут быть заключены в или присоединены к биологически разлагаемым полимерам, которые могут быть, например, полезны для контролируемого высвобождения, например, полимолочная кислота, поли-эпсилон-капролактон, полигидроксимасляная кислота, полиортоэфиры, полиацетали, полидигидропираны, полицианоакрилаты и поперечно сшитые или амфипатические блок-сополимеры гидрогелей, или могут быть поготовлены в виде липосом.
Вакцину получают способом, известным per se, например, с помощью обычных процессов растворения и лиофилизации и/ или могут содержать наполнители, например, консерванты, стабилизаторы, смачивающие агенты, изотонические агенты регулирующие агенты и/ или эмульгаторы, солюбилизаторы, соли для регулирования осмотического давления и/ или буферные вещества для стабилизации рН.
Вакцина может быть в жидкой форме или в твердой (например, лиофилизированной) форме и может быть стерилизована с помощью обычных, хорошо известных способов стерилизации или стерилизована фильтрованием. Полученный водный раствор может быть упакован для использования таким, как есть, или лиофилизирован, высушен распылением или растворитель может быть удален другим способом. Твердая форма может быть объединена со стерильным разбавителем (например, водой) перед введением или может вводиться, как есть. Точно так же вакцина может содержать эмульсии, дисперсии или суспензии, или любую другую форму, подходящую для предполагаемого способа введения.
Вакцину можно вводить любым подходящим энтеральным или парентеральным способом, таким как интраназальный, пероральный, подъязычный, внутримышечный, внутрикожный, трансдермальный и подкожный или чрескожной способ. Другие способы известны в данной области техники, которые также могут быть использованы.
Устройство может быть использовано для введения, такое как обычные иглы и шприцы, микроиглы, баллистические устройства для введения твердых частиц (например, как в WO 99/27961), пластыри (например, как в WO 98/20734), безыгольчатые системы инъекции (например, как и в WO 01/054539), распылительные устройства и т.п., в зависимости от дозовой формы и способа введения. Устройство может быть предварительно заполнено или покрыто вакциной.
Вакцина содержит от приблизительно 0,05% до приблизительно 50% активного ингредиента в подходящей дозовой форме. Однократные дозовые формы для парентерального введения представляют собой, например, ампулы, предварительно заполненные шприцы или флаконы, например флаконы, содержащие от около 0,0001 мг до около 0,75 г активного ингредиента в объеме дозы от примерно 0,25 мл до 1,5 мл.
Дозировка активного ингредиента зависит от предполагаемого реципиента (например, видов), его возраст, массы и индивидуального состояния, а также от способа введения. Оптимальная доза для конкретного активного ингредиента и конкретной целевой популяции может быть определена с помощью стандартных исследований, включающих наблюдение соответствующих иммунных ответов у индивидуумов.
Количество вакцины, достаточное для придания устойчивости к патогенным pneumococci или других грамположительным бактериям, определяется способами, хорошо известными специалистам в данной области техники. Эта величина определяется на основании характеристик вакцинного реципиента и желаемого уровня иммунитета к заболеванию, вызываемому инфекцией pneumococci или другими грамположительными бактериями.
Вакцину можно вводить в виде однократной дозы или в виде двух или более доз в адекватно разнесенные моменты времени. Вакцина также может быть введена вместе с другими вакцинами. Например, вакцина может быть использована в режимах инициации-поддержания в комбинации с другими вакцинами.
Вакцина используется для профилактических или терапевтических целей, или и того, и другого, для профилактики и/ или лечения бактериемий и других заболеваний, вызванных инфекциями S. pneumoniae, таких как пневмония, острый синусит, отит, менингит, бактериемии, септицемии, остеомиелит, септический артрит, эндокардит, перитонит, перикардит, целлюлит или абсцесс мозга, или носительства. Вакцина также полезна для профилактических или терапевтических целей, или и того, и другого, для профилактики и/ или лечения заболеваний, вызываемых Streptococci группы А или S. mutans, таких как фарингит, пиодермия, ревматизм, гломерулонефрит или кариес. Например, вакцина защищает от бактериемии, пневмонии и менингита, или против инвазивной пневмококковой инфекции (IPD), инфекции, при которой S. pneumoniae могут быть выделены из крови или другого обычно стерильного участка, или от бактериемии, пневмонии и отита. В качестве альтернативы вакцина защищает от фарингита, пиодермии, ревматизма и гломерулонефрита или кариеса.
Вакцина может вводиться различным целевым группам, в том числе группам, которые являются наивными или не смогли ранее ответить на инфекцию или вакцинацию, лицами пожилого возраста подходящего возрасте (например, более 65, 75 или 85 лет), взрослых при повышенных рисках, таких как люди, работающие в медицинских учреждениях, молодых людей с фактором риска, лиц с угрозой иммунной системе или детской популяции.
Кроме того, изобретение относится к способу получения вакцины, включающему смешивание синтетических вирусоподобных частиц, несущих PR-пептидные антигены, с синтетическими вирусоподобными частицами, несущими другие антигены или антигены, которые не несутся синтетическими вирусоподобными частицами.
Изобретение также относится к антителам к синтетическим вирусоподобным частицам, несущим защитные PR-пептидные антигены, особенно к антителам к PR-пептидным антигенам. Антитела к PR-пептидным антигенам могут перекрестно реагировать с широким разнообразием генетически различных штаммов и различных капсульных серотипов, а также удлинять среднюю продолжительность жизни в модели пассивного переноса.
Защитные антитела к PR-пептидные антигены могут иметь опсонофагоцитирующую активность (OPA). Антитела с ОРА можно детектировать in vitro с помощью соответствующего анализа, например анализа опсонофагоцитирующего убийства (OPKA) с использованием линии клеток или цельной крови от донора. Защитные антитела также могут опосредовать защиту с помощью других механизмов, которые не связаны с OPA.
Изобретение также относится к применению защитных антител к PR-пептидам, как описано в настоящем документе, для изготовления фармацевтического препарата или лекарственного средства для терапевтических и/ или профилактических целей, а также для изготовления диагностического набора.
Не все PR-пептиды могут быть в равной степени защитными в качестве вакцинных антигены. Предпочтительными являются защитные PR-пептиды. Они могут быть идентифицированы с использованием хорошо известных способов, таких как исследования заражения в подходящей животной модели стрептококковых заболеваний. Например, в модели пневмококковой сепсиса, мыши могут быть иммунизированы синтетическими вирусоподобными частицами, несущими PR-пептидные антигены, как описано в настоящем документе, и впоследствии заражены внутривенно летальной дозой S. pneumoniae. В этой модели мыши, иммунизированные с применением синтетических вирусоподобных частиц, несущих защитные PR-пептидные антигены, затем имели значительно больше времени выживаемости по сравнению с таковым у иммунизированных контрольных мышей.
PR-пептидные антигены также могут быть получены из других патогенных стрептококков, таких как S. pyogenes, S. agalactiae, S. mutans, S. equi, S. suis, S. dysgalactiae, Peptostreptococcus magnus или других патогенных грамположительных бактерий, таких как Staphylococcus aureus, и синтетические вирусоподобные частицы, несущие эти PR-пептидные антигены, также являются полезными для вакцин против этих бактерий.
Предпочтительные последовательности PR-пептидных антигенов из S. pneumoniae PspA и PspC собраны в таблице 2 ниже. Пептидный антиген Р3 представляет собой синтетический конструкцию, объединяющую две последовательности.
В предпочтительных PR-пептидах с SEQ ID NO: 27-83 один, два или три аминокислоты могут быть заменены другими аминокислотами.
Альтернативные антигенные последовательности PR-пептидов белков S. pneumoniae and from S. pyogenes, S. agalactiae, S. mutans, S. suis, S. equi, S. dysgalactiae, Peptostreptococcus magnus и Staphylococcus aureus собраны в таблице 3 ниже.
Таблица 3
В предпочтительных PR-пептидах с SEQ ID NO: 84-112 один, два или три аминокислоты могут быть заменены другими аминокислотами.
Дополнительные последовательности, которые при введении самих по себе предоставляют ограниченный защитный потенциал, могут быть конъюгированы с PR-пептидными антигенами, в частности последовательности, полученные из областей PspA или PspC, или других белков, которые не содержат пролина в каждом 3-ем или 4-ом положении и/ или содержат менее 15% пролина, в частности последовательности:
QQAEEDYARRSEEEYNRLPQQQPPKAEKP (не-пролиновый блок) (SEQ ID NO: 1 13) и
AEDQKEEDRRNYPTNTYKTLELEIAESDVEV (спиральный пептид из PspC) (SEQ ID NO: 1 14).
Другие последовательности, которые можно комбинировать с PR-пептидными антигенами, включают последовательности, полученные из бактериальных поверхностных белков, которые не содержат богатую пролином область, в том числе:
Последовательности из StkP, предпочтительно С-концевых аминокислоты 79-82,
SVAMPSYIGSSLEFTKNNLIQIVGIKEANIEVVEVTTAPAGSAEGMWEQSPRAGEKVDLNKTRVKISIYKPKTTSATP (SEQ ID NO: 115)
и их фрагменты;
Последовательности из PsaA, предпочтительно аминокислоты 250-309:
SLFVESSVDDRPMKTVSQDTNIPIYAQIFTDSIAEQGKEGDSYYSMMKYNLDKIAEGLAK (SEQ ID NO: 1 16);
Последовательности из холестерин-зависимых цитолизинов, такие, как 4-й домен Ply, аминокислоты 360-471:
NGDLLLDHSGAYVAQYYITWNELSYDHQGKEVLTPKAWDRNGQDLTAHFTTSIPLKGNV RNLSVKIRECTGLAWEWWRTVYEKTDLPLVRKRTISIWGTTLYPQVEDKVEND (SEQ ID NO: 117)
и их фрагменты;
стрептококковые полигистидиновые триадные белки, например, фрагменты из С-концевой половины S. pneumoniae PhtD, например аминокислоты 680-770:
VEHPNERPHSDNGFGNASDHVRKNKVDQDSKPDEDKEHDEVSEPTHPESDEKENHAG LNPSADNLYKPSTDTEETEEEAEDTTDEAEIPQV (SEQ ID NO: 1 18)
или аминокислоты 771-839:
ENSVINAKIADAEALLEKVTDPSIRQNAMETLTGLKSSLLLGTKDNNTISAEVDSLLALLKE SQPAPIQ (SEQ ID NO: 1 19)
или их фрагменты.
В предпочтительных последовательностях SEQ ID NO: 113-119, одна, две или три аминокислоты могут быть заменены другими аминокислотами.
Дополнительные последовательности включают последовательности, описанные в PCT/ US2012/ 022127 или US 2005/0020813 A1. Альтернативные последовательности включают последовательности, описанные в ЕР 0280576 А2.
Дополнительные антигены могут быть объединены с синтетическими вирусоподобными частицами, несущими PR-пептидные антигены. Например, белки S. pneumoniae, идентифицированные в WO 98/18931, WO 98/18930, US 6,699,703, US 6,800,744, WO 97/43303, WO 97/37026 и; белки семейства Lyt (LytX), семейства Pht (PhtX), Sp128 пилей типа 1 или 2 типа, другие стрептококковые антигены, такие как идентифицированные в WO 1993/005155, WO 2002/034771, WO 2002/ 083859, WO 2002/34771, WO 2003/093306, WO 2004/041 157 или WO 2005/ 002619; или другие антигены, такие как SP101, Sp130, Sp125 или Sp133, можно комбинировать с синтетическими вирусоподобными частицами, несущими пневмококковые PR-пептидные антигены.
Сахаридные антигены также можно комбинировать с синтетическими вирусоподобными частицами, несущими PR-пептидные антигены, такие как капсульные сахариды S. pneumoniae серотипов 1, 3, 4, 5, 6А, 6В, 7F, 8, 9V, 14, 18С, 19А, 19F, 22F, 23F или 33F. В качестве альтернативы другие сахариды можно комбинировать с PR-пептидными антигенами, такими как сахариды, полученные из S. pneumoniae других серотипов и/ или сахариды из других грамположительных бактерий (например, сахариды, полученный из S. agalactiae, S. pyogenes и/ или S. aureus).
Точно так же белки из других грамположительных бактерий можно комбинировать с синтетическими вирусоподобными частицами, несущими PR-пептидные антигены, например один или несколько белков из S. pyogenes, в том числе М-белок, фибронектин-связывающий белок (Sfbl), стрептококковый гемм-ассоциированный белок (SHP), или белки, идентифицированные в стрептолизине S (Saga), и/ или один или нескольких белков из S. aureus, таких как альфа-токсин, фактор агрегации A (ClfA), коллаген-связывающий белок (CNA), фибронектин-связывающий белок А (FBA) внеклеточный фибриноген-связывающий белок (EFB), железо-регулируемые поверхностные детерминантные (Isd) белки, пенициллин-связывающий белок 2а (PBP2a), белки серин аспартатных повторов (Sdr) и/ или связующий IgG (Sbi). Подобным образом, также пептидные антигены, полученные из таких белков, можно комбинировать с синтетическими вирусоподобными частицами, несущими PR-пептидные антигены.
Примеры
Сокращения:
BOC, трет-бутоксикарбонил;
BSA, бычий сывороточный альбумин;
DIEA, диизопропилэтиламин;
DMF, N, N-диметилформамид;
EDT, этандитиол;
Fmoc, 9-флуоренилметоксикарбонил;
HATU,2-(1Н-9-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфат;
HBTU, 2-[1Н-бензотриазол-1-ил]-1,1,3,3-тетраметилуроний гексафторфосфат;
HOBt, N-гидроксибензотриазол;
Pbf, 2,2,4,6,7-пентаметил дигидробензофуран-5-сульфонил;
NMP, N-метилпирролидон;
MBHA, метилбензгидриламин;
OD, оптическая плотность;
iPr2O, диизопропиловым эфир;
ПЦР, полимеразная цепная реакция
РуВОР, (бензотриазол-1-илокси)-трипирролидинфосфониум-гексафторфосфат;
PEO6, N-Fmoc-21-амино-4,7,10,13,16,19-гексаокса генэйкозаноевая кислота
r.t., при комнатной температуре;
ОФ-ВЭЖХ, обращенно-фазовая высокоэффективная жидкостная хроматография;
TA, тиоанизол;
TIS, триизопропилсилан;
TRT, тритил;
ТФУ, трифторуксусная кислота;
ТФЭ, 2,2,2-трифтороэтанол;
tR, время удерживания;
SD, стандартное отклонение.
Пример 1: Проектирование и синтез PR-пептидов
Богатая пролином область PspA из высоковирулентного клинического изолята серотипа 1 SP1577 (Leimkugel et al., JID, 2005, 192, 192-199) амплифицировали и секвенировали с использованием двух праймеров (LSM13 и SKH2) в соответствии с Hollingshead, Becker et al., Infect Immun, 2000, 68, 5889-5900.
LSM13: 5ʹ-GCAAGCTTATGATATAGAAATTTGTAAC-3ʹ (SEQ ID NO: 120)
SKH2: 5ʹ-CCACATACCGTTTTCTTGTTTCCAGCC-3ʹ (SEQ ID NO: 121)
Амплификацию богатой пролином области осуществляли с помощью ПЦР с использованием праймеров LSM13 и SKH2 и GoTaq-полимеразы (условия ПЦР: Отжиг при 48°С в течение 1 мин, элонгация при 72°С в течение 3 мин, 30 циклов). Полученные фрагменты, которые составляли около 1,2 т.п.н. по размеру, выделяли из ПЦР-реакции и секвенировали с использованием праймеров LSM13 и SKH2. Около 1ʹ100 оснований гена PspA можно было прочесть. Транслированная нуклеотидная последовательность показана ниже. Богатая пролином область, в том числе не-пролиновый блок, выделена курсивом.
XXLGAGFVXX XPTXXXXXEA PVASQXKAEK DXDAXKRDAE NXKKALEEAK XXQKKYEDDQ KKTEEKXKKE KEASKEEQAA NLKYQQELVK YASEKDSVKK AKILKEVEEA EKEHKKKRAE FEKVRSEVIP SAEELKKTRQ KAEEAKAKEA ELIKKVEEAE KKVTEAKQKL DAERAKEVAL QAKIAELENE VYRLETELKG IDESDSEDYV KEGLRAPLQS ELDAKRTKLS TLEELSDKID ELDAEIAKLE KNVEYFKKTD AEQTEQYLAA AEKDLADKKA ELEKTEADLK KAVNEPEKPA EETPAPAPKP EQPAEQPKPA PAPQPAPAPK PEKTDDQQAE EDYARRSEEE YNRLPQQQPP KAEKPAPAPK PEQPVPAPKT GWKQENGMWC R (SEQ ID NO:122)
Из этой последовательности была выбрана PR-последовательность Р1 (PAPKPEQPAEQPKPAPAPQPAPAPKPEKT, SEQ ID NO: 27). Р1 расположена между спиральной/ биспиральной областью и не-пролиновым блоком SP1577 PspA.
Для обеспечения возможности конъюгации SVLP-липопептидов были разработаны и синтезированы следующие малеидопептиды:
Малеидопептид 1:
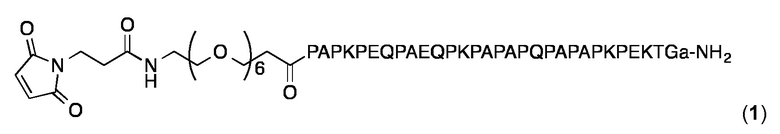
В Малеидопептиде 1 3-малеидопептидпропионовая кислота соединена с N-концом в P1 (SEQ ID NO: 27) через линкер 21-амино-3,6,9,12,15,18-гексаоксагенейкозан-21-оевой кислоты, и глицин добавляют к С-концевой P1, за которым следует остаток D-аланина ("а") в качестве амида ("NH2"), чтобы придать устойчивость по отношению к экзопротеазам.
Синтез Малеидопептида 1 проводили с использованием способов Fmoc-твердофазного пептидного синтеза (SPPS) следующим образом:
Пептид PAPKPEQPAEQPKPAPAPQPAPAPKPEKTGa (SEQ ID NO: 27, удлиненная глицин-D-аланином) собирали на синтезаторе пептидов ABI 433A с использованием смолы Rink Amide MBHA (загрузка: 0,69 ммл/ г) (362 мг, 0,25 ммоль) и стандартных протоколов Fmoc-SppS. Были использованы следующие аминокислоты (в правильном порядке): Fmoc-Ala-OH, Fmoc-D-Ala-OH, Fmoc-Glu(OtBu)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Gly-OH, Fmoc-Lys(Boc)-OH, Fmoc-Pro-OH и Fmoc-Thr(tBu)-OH. После сборки и удаления N-концевой защитной группы Fmoc, смолу промывали N-метил-2-пирролидоном (NMP) и CH2Cl2. Для связывания малеимида, часть смолы (около 0,1 ммоль) промывали ДМФ, и раствор Fmoc-PE06-OH (115 мг, 0,2 ммоль) РуВОР (104 мг, 0,2 ммоль), HOBt (27 мг, 0,2 ммоль) и DIEA (66 Мг, 0,4 ммоль ) в 4,5 мл ДМФ подготавливали, перемешивали в течение 30 секунд, и добавляли к смоле в атмосфере аргона. Смесь встряхивали в течение 16 часов. Смолу отфильтровывали и промывали 4 раза в ДМФ. Группу Fmoc затем удаляли обработкой 20% пиперидина в ДМФА (6 × 2 мин.). Затем смолу снова промывали ДМФ и раствор 3-малеимидпропионовой кислоты (34 мг, 0,2 ммоль), РуВОР (104 мг, 0,2 ммоль), HOBt (27 мг, 0,2 ммоль) и DIEA (66 Мг, 0,4 ммоль) в ДМФ и добавляли к смоле в атмосфере аргона. Смолу встряхивали в течение 3 ч, фильтровали, промывали последовательно 4 раза с помощью ДМФ, CH2Cl2 и MeOH, и высушивали в течение ночи в вакууме над KOH-гранулами. Для отщепления пептида от смолы и удаления защитных групп боковых цепи готовили ТФУ/TIS/ТА/фенол 85:5:5:5 (10 мл) и добавляли к сухой смоле в атмосфере аргона: Смолу встряхивали в течение 3 ч, фильтровали и малеимидoпептид 1 осаждали iPr2O, предварительно охлажденного до -20°С (50 мл). Пептид затем 4 раза промывали iPr2O, высушивали на воздухе в течение ночи и очищали с помощью ОФ-ВЭЖХ с использованием препаративной колонки С18 (Agilent Zorbax SB300 PrepHT, 250 × 21,5 мм) и линейного градиента 10-40% MeCN в H2O (+ 0,1% ТФК) в течение 16 мин. и лиофилизовали с получением 1 в виде белого порошка. Пептид анализировали с помощью аналитической ОФ-ВЭЖХ с использованием колонки Agilent XDB-С18 (250 × 4,6 мм) и линейного градиента 10-100% MeCN в H2O (+ 0,1% ТФК) в течение 25 мин: Чистота > 97%; tR=8,53 мин.
ESI-МС: MW, вычисленная для C163H259N41O51, составляет 3609,1 Да; MW найденная: 3609,7 (± 0,02%).
Малеимидопептид 2:
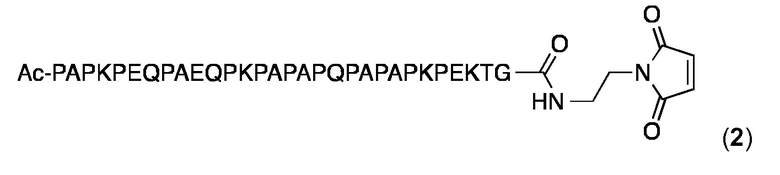
В этот малеимидопептид глицин добавляют к С-концу в P1 (SEQ ID NO: 27) и малеимид соединяется с P1 глицином через аминоэтиловый спейсер. N-конец является ацетилированным.
Пептидную цепь в малеимидопептиде 2 присоединяли с использованием Fmoc SppS на ABI 433A, как описано для 1, за исключением того, что 2-хлортритильную смолу, предварительно загруженную Fmoc-Gly-OH до уровня замещения смолы 0,6 ммоль/ г (416 мг, 0,25 ммоль) использовали вместо смолы Rink amide MBHA в качестве твердофазной подложки. После сборки и удаления N-концевой защитной группы Fmoc смолу ацетилировали путем обработки раствором 0,5 М AC20, 0,05 М HOBt и 0,136 М DIEA в NMP (10 мл) при встряхивании в течение 30 мин. Затем смолу промывали 4 раза ДМФ, 4 раза с помощью CH2Cl2 и обрабатывали TFE/CH2Cl2 2:8 (10 мл) при перемешивании в атмосфере аргона в течение 4 ч, чтобы освободить пептид с полностью защищенной боковой цепью от смолы. Смолу отфильтровывали и промывали дважды 10 мл в TFE/CH2Cl2 2:8, фильтровали, концентрировали, и защищенный пептид осаждали при 4°С в холодном Et2O и промывали 4 раза Et2O. Защищенный пептид затем высушивали в вакууме в течение ночи и хранили при -20 °С.
Для связывания малеимида, часть неочищенного пептида с защищенной боковой цепью (100 мг), HATU (15 мг, 39 ммоль), HOAt (5 мг, 39 ммоль) растворяли в ДМФА (0,8 мл), добавляли DIEA (23 Мг, 142 моль) и смесь перемешивали в течение 1 мин. Добавляли раствор ТФУ-соли N-(2-аминоэтил) малеимида (150 мг, 60 моль) в ДМФА (0,2 мл) и полученную смесь перемешивали в течение 3 часов в атмосфере аргона. ДМФ затем удаляли при пониженном давлении. Пептид с защищенной боковой цепью суспендировали в 0,3 мл CH2Cl2, осаждали при 4 °С в холодном Et2O, 4 раза промывали Et2O и высушивали в вакууме в течение ночи.
Защитные группы боковой цепи затем удаляли и пептид осаждали и очищали, как описано выше для 1, и конечный продукт 2 анализировали с помощью аналитической ОФ-ВЭЖХ с использованием колонки Agilent XDB-С18 (250 × 4,6 мм) и линейного градиента 10-100% MeCN в H2O (+ 0,1% TFA) в течение 25 мин: чистота> 97%; tR=7,06 мин. MALDI-TOF МС: MW, вычисленная для C146H227N39O43: 3216,6 Да; MW найденная: 3215,7 Да (± 0,05%).
Малеимидопептид 3 :
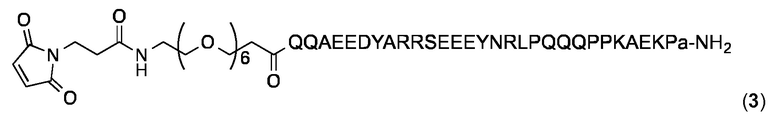
В малеимидопептиде 3, 3-малеимидoпропионовая кислота соединена с N-концом SEQ-ID NO: 113 через линкер 21-амино-3,6,9,12,15,18-гексаоксагенейкозан-21-оевой кислоты, и С-конец кепирован D-аланином ("а") и амидирован. SEQ ID NO: 113 соответствует не-пролиновому блоку P1577 PspA.
Малеимидопептид 3 синтезировали и очищали, как описано выше для малеимидопептида 1 и анализировали с помощью аналитической ОФ-ВЭЖХ с использованием колонки Agilent XDB-С18 (250 × 4,6 мм) и линейного градиента 10-100% MeCN в Н2О (+ 0,1% TFA) в течение 25 мин: чистота> 97%; tR=5,31 мин. MALDI-TOF МС: MW, вычисленная для C174H272N50O63: 4072,3 Дa; MW найденная: 4071,0 Дa (± 0,05%).
Другие PR-последовательности могут быть получены с помощью секвенирования PspA или генов PSPC, или, в качестве альтернативы, могут быть доступны в общедоступных базах данных, таких как UniProtKB. Например, последовательность PspA изолята TCH8431 серотипа 19А (Инвентарный номер D6ZPW2 в UniProtKB) представляет собой:
MNKKKMILTS LASVAILGAG FVTSQPTVVR AEESPVASQS KAEKDYDAAV KKSEAAKKHY EEAKKKAEDA QKKYDEDQKK TEAKAEKERK ASEKIAEATK EVQQAYLAYL QASNESQRKE ADKKIKEATQ RKDEAEAAFA TIRTTIVVPE PSELAETKKK AEEAKAEEKV AKRKYDYATL KLALAKKEVE AKELEIEKLQ YEISTLEQEV ATAQHQVDNL KKLLAGADPD DGTEVIEAKL KKGEAELNAK QAELAKKQTE LEKLLDSLDP EGKTQDELDK EAEEAELDKK ADELQNKVAD LEKEISNLEI LLGGADPEDD TAALQNKLAA KKAELAKKQT ELEKLLDSLD PEGKTQDELD KEAEEAELDK KADELQNKVA DLEKEISNLE ILLGGADSED DTAALQNKLA TKKAELEKTQ KELDAALNEL GPDGDEEETP APAPQPEQPA PAPKPEQPAP APKPEQPAPA PKPEQPAPAP KPEQPAKPEK PAEEPTQPEK PATPKTGWKQ ENGMWYFYNT DGSMATGWLQ NNGSWYYLNA NGSMATGWVK DGDTWYYLEA SGAMKASQWF KVSDKWYYVN SNGAMATGWL QYNGSWYYLN ANGDMATGWL QYNGSWYYLN ANGDMATGWA KVNGSWYYLN ANGAMATGWA KVNGSWYYLN ANGSMATGWV KDGDTWYYLE ASGAMKASQW FKVSDKWYYV NGLGALAVNT TVDGYKVNAN GEW (SEQ ID NO:123)
Из этой последовательности была выбрана последовательность Р2 (PKPEQPAPAPKPEQPAKPEKPA, SEQ ID NO: 28). P2 расположена сразу же после спиральной/ биспиральной области TCH8431 PspA. Для облегчения конъюгации с SVLP-липопептидами были разработаны и синтезированы следующие малеимидoпептиды:
Малеимидопептид 4

Этот малеимидопептид включает 3-малеимидoпропионовую кислоту, присоединенную через линкер 21-амино-3,6,9,12,15,18-гексаоксагенейкозан-21-оевой кислоты к N-концу P2 (SEQ ID NO: 28). "а" обозначает D-аланин. C-конец является амидированным.
Малеимидопептид 4 синтезировали и очищали, как описано выше для малеимидопептида 1 и анализировали с помощью аналитической ОФ-ВЭЖХ с использованием колонки Agilent XDB-С18 (250 × 4,6 мм) и линейного градиента 10-100% MeCN в H2O (+ 0,1% TFA) в течении 25 мин: чистота> 97%; tR=5,21 мин. MALDI-TOF МС: MW, вычисленная для C131H210N32O4: 2889,3 Да, MW найденная: 2888,8 Кa (± 0,05%).
Малеимидопептид 5
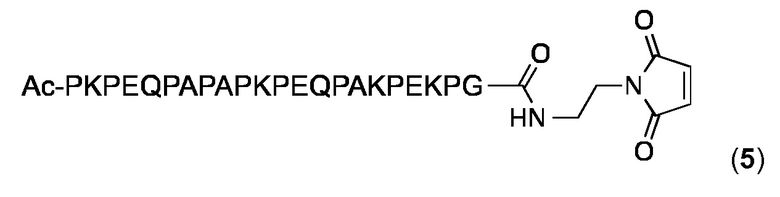
В этом малеимидопептиде глицин добавляют к С-концу P2 (SEQ ID NO: 28), и малеимид соединяется с глицином через аминоэтиловым спейсером. N-конец является ацетилированным.
Малеимидопептид 5 синтезировали и очищали, как описано выше для малеимидопептид 2 и анализировали с помощью аналитической ОФ-ВЭЖХ с использованием колонки Agilent XDB-С18 (250 × 4,6 мм) и линейного градиента 10-100% MeCN в H2O (+ 0,1% TFA) в течение 25 мин: чистота> 97%; tR=6,31 мин. ESI МС: MW, вычисленная для C113H178N30O33: 2484,8 Дa; MW найденная: 2483,2 Да (± 0,02%).
Малеимидопептид 6
Искусственные PR-последовательности могут быть получены путем сплавления коротких PR-последовательностей из двух или более различных PspA белков. Например, последовательность Р3 (SEQ ID NO: 29) был разработана путем слияния N-концевого остатка PAPKPEQPAEQ (SEQ ID NO: 124) в P1 с P2 (SEQ ID NO: 28) и замены С-концевого Ala в Р2 остатком Gly. Для предоставления возможности конъюгации был разработан и синтезирован следующий малеимидопептид:
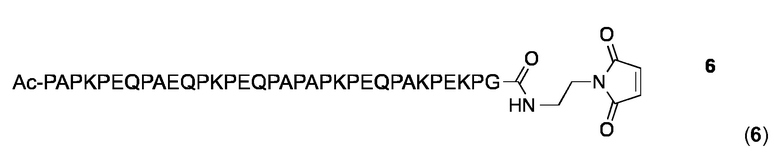
Малеимидопептид 6 синтезировали и очищали, как описано выше для малеимидопептида 2 и анализировали с помощью аналитической ОФ-ВЭЖХ с использованием колонки Agilent XDB-С18 (250×4,6 мм) и линейного градиента 10-100% MeCN в H2O (+ 0,1% TFA) в течение 25 мин: чистота> 97%; tR=10,11 мин. MALDI MS: MW, вычисленная для C164H255N45O50: 3657,1 Дa; MW найденная: 3654,9 Да (± 0,05%).
Дополнительные примеры PR-пептидного антигена описаны ниже:
Малеимидопептид 7
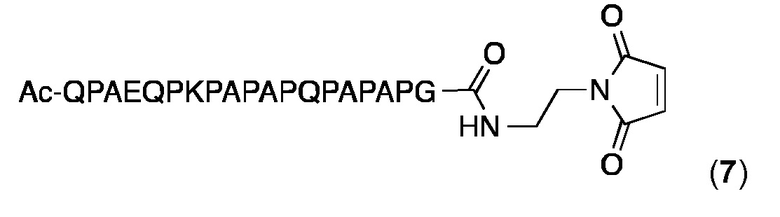
Малеимидопептид 7 синтезировали и очищали, как описано выше для малеимидопептида 2. ESI МС: MW, вычисленная для C91H137N25O27: 2012,0 Да; MW найденная: 2012,4 Да (± 0,05%).
Малеимидопептид 8
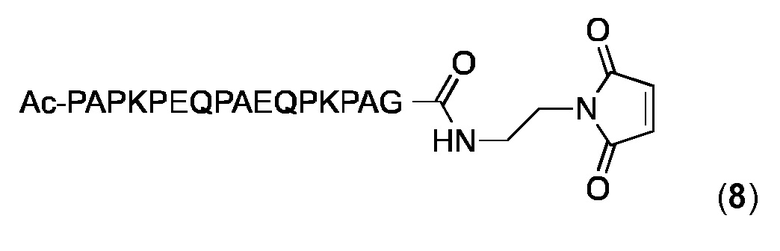
Малеимидопептид 8 синтезировали и очищали, как описано выше для малеимидопептида 2. ESI-МС: MW, рассчитанная для C81H124N22O25: 1804,9 Дa; MW найденная: 1805,4 Да (± 0,05%)
Малеимидопептид 9
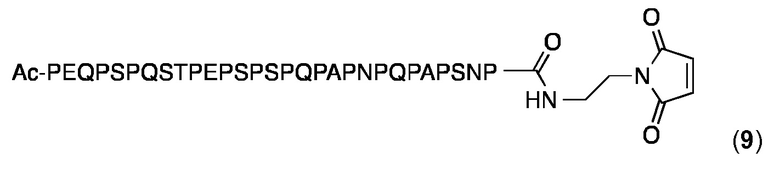
Этот малеимидопептид получен из PR-пептида PhtD (Р60, SEQ ID NO: 86). N-конец является ацетилированным. Малеимидопептид синтезировали и очищали, как описано выше для малеимидопептида 2 и анализировали с помощью аналитической ОФ-ВЭЖХ с использованием колонки Agilent XDB-С18 (250×4,6 мм) и линейного градиента 20-100% MeCN в H2O (+ 0,1% ТФК) в течение 25 мин: Чистоа> 97%; tR=3,41 мин. ESI-МС: MW, вычисленная для C136H201N37O48: 3120,4 Да; MW найденная: 3120,6 Да (± 0,05%).
Пример 2: Конъюгирование PR-пептидных антигенов с липопептидами
Для подготовки липопептидных конъюгатов для вакцинаций были синтезированы следующие четыре липопептидных структурных элемента.
Липопептидный структурный элемент 10
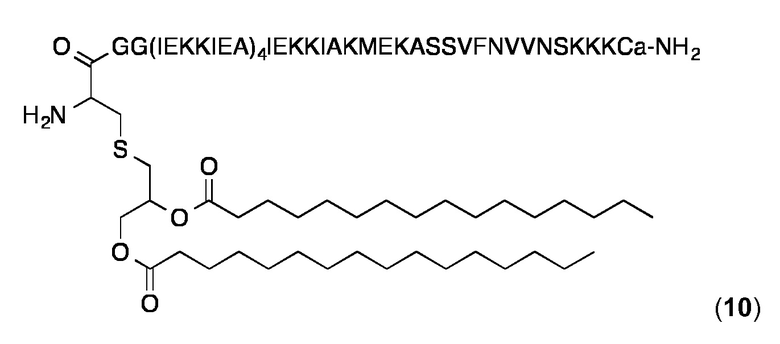
Этот липопептид соответствует примеру 13 в WO 2008/068017. Синтез был проведен и продукт был охарактеризован, как описано в WO 2008/068017 и Ghasparian, Riedel et al., Chembiochem, 2011, 12, 100-109. Аналитическая ОФ-ВЭЖХ (Interchrom UP5WC4-25QS, 25-100% MeCN в H2O (+ 0,1% ТФК) в течение 25 мин.): Чистота> 96%, tR=22,71 мин. MALDI-TOF: MW, вычисленная для C312H552N74O85S3: 6796,4 Да; MW найденная: 6798,2 Да (± 0,05%).
Липопептидный структурный элемент 11
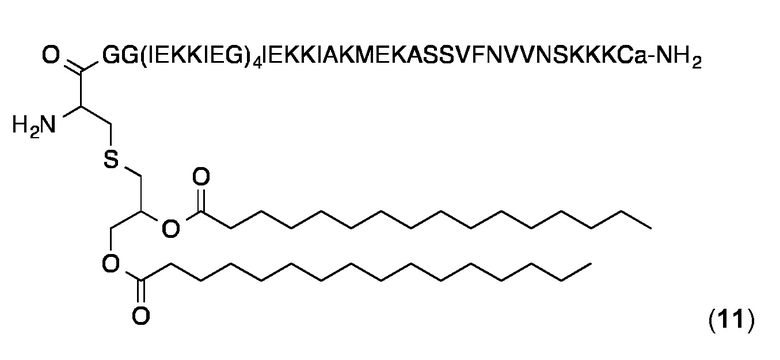
Этот липопептидный структурный элемент содержит модифицированный биспиральный домен, который имеет Gly в положении "с" гептадного повтора "defgabc" IEKKIEG (SEQ ID NO: 125).
Модифицированный липопептидный структурный элемент синтезировали и очищали, как описано в публикации WO 2008/068017. Аналитическая ОФ-ВЭЖХ (Interchrom UP5WC4-25QS, от 25 до 100% MeCN в H2O (+ 0,1% ТФК) в течение 25 мин.): Чистота> 98%, tR=21 0,41 мин. ESI-МС: MW, рассчитанная для C308H544N74O85S3: 6740,3 Да; найденная 6741,7 Да.
Липопептидный структурный элемент 12
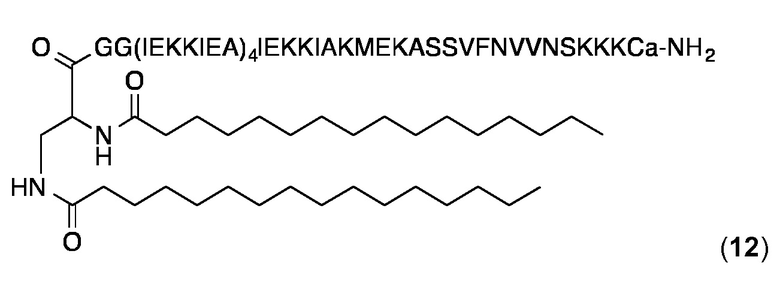
Это липопептидный структурный элемент содержит модифицированный липидный N,Nʹ-дипальмитоил.-2,3-диамино-пропионамид ("Pam2Dap"). "а" обозначает D-аланин.
Липопептидный структурный элемент синтезировали и очищали, как описано в В WO 2008/068017, за исключением того, что Pam2Dap был включен в конце синтеза вместо Pam2Cys. Липопептид анализировали с помощью аналитической ВЭЖХ и МС. Аналитическая ОФ-ВЭЖХ (колонка С4, А=H2O+0,1% ТФК, В=MeCN+0,1% ТФК, от 20 до 100% В в течение 25 мин.): Чистота:> 95%. tR=22,1 мин. ESI-МС: MW рассчитанная: 95940,5 Да, найденная 9596,17 Да.
Липопептидный структурный элемент 13
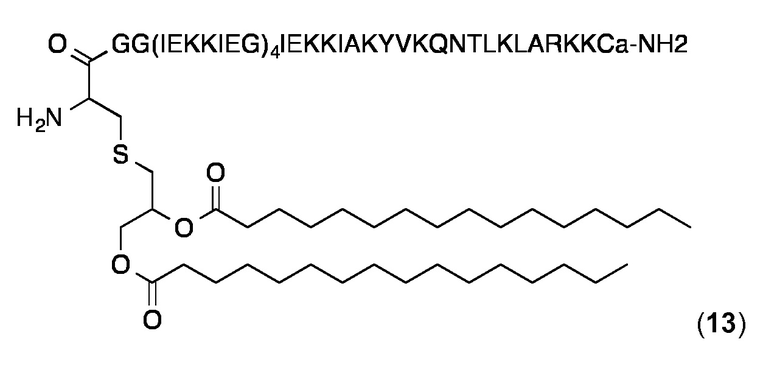
Это липопептидный структурный элемент содержит беспорядочный Т-хелперный эпитоп (KYVKQNTLKLARK, SEQ ID NO: 126), полученный из рестриктирующего эпитопа HLA-DRB 101 из остатков 307-309 гемагглютинина гриппа (SEQ ID NO: 19) (Stern, LJ. et al. Nature 1994, 368, 215). "а" обозначает D-аланин.
Липопептидный структурный элемент синтезировали и очищали, по существу, как описано в WO 2008/068017 и анализировали с помощью аналитической ВЭЖХ и МС. Аналитическую ОФ-ВЭЖХ (колонка С4, А=H2O+0,1% ТФК, В=MeCN+0,1% ТФК, от 20 до 100% В в течение 25 мин.): Чистота:> 95%. tR=22,35 мин. ESI-МС: MW рассчитанная для C302H538N74O79S2: 6530,0 Да; найденная 6530,4 Да (± 0,05%).
Были синтезированы следующие конъюгаты:
Конъюгат 14 (Малеимидопептид 1+липопептид 10)
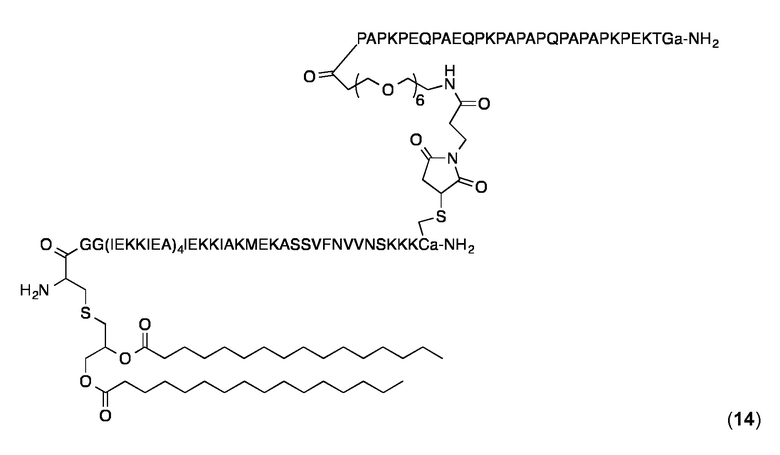
Конъюгирование 1 с 10 проводили, по существу, как описано в публикации WO 2008/068017. К раствору 10 (6,0 мг, 0,9 мкмоль) в H2O/ MeCN, 1:1 (3 мл) добавляли раствор 1 (4,8 мг, 1,3 мкмоль) в H2O/ MeCN 1:1 (2,4 мл). РН осторожно доводили и поддерживали при рН 6,5-7,0 с помощью 0,1 NaOH, и полученную смесь перемешивали в течение 2 ч при комнатной температуре. Конъюгат затем очищали с помощью ОФ-ВЭЖХ с использованием препаративной колонки С4 (Interchrom UP5WC4-25M, 250 × 10 мм) и градиента от 50 до 100% MeCN в H2O (+ 0,1% TFA) в течение 17 мин. Конъюгат 14 анализировали с помощью аналитической ОФ-ВЭЖХ с использованием колонки Interchrom UP5WC4-25QS (250 × 4,6 мм) и градиента от 20 до 100% MeCN в H2O (+ 0,1% TFA) в течение 25 мин: чистота> 97%; tR=22,34 мин. MALDI-TOF МС: MW рассчитанная для C475H811N115O136S3: 10406,6 Дa; найденная 10407,8 Дa (± 0,1%).
Конъюгат суспендировали в PBS, уравновешивали в течение 30 мин., разбавляли до 0,5 мг/ мл и анализировали с помощью динамического рассеяния света (DLS) на приборе Wyatt DynaPro Titan при температуре 4°С, 25°С и 37°С с использованием интенсивности лазера 400000 импульсов/ с и экспозиции 10 с. Распределение по размерам с помощью анализа регуляризации было мономодальным и размер дисперсности был мал. Средний гидродинамический радиус (Rh) составлял 12,0 нм, и % Pd значения - 12,3% при 25 °C. Аналогичные значения Rh и % Pd были получены при других температурах.
Конъюгат 15 (Малеимидопептид 2 +липопептид 10 )
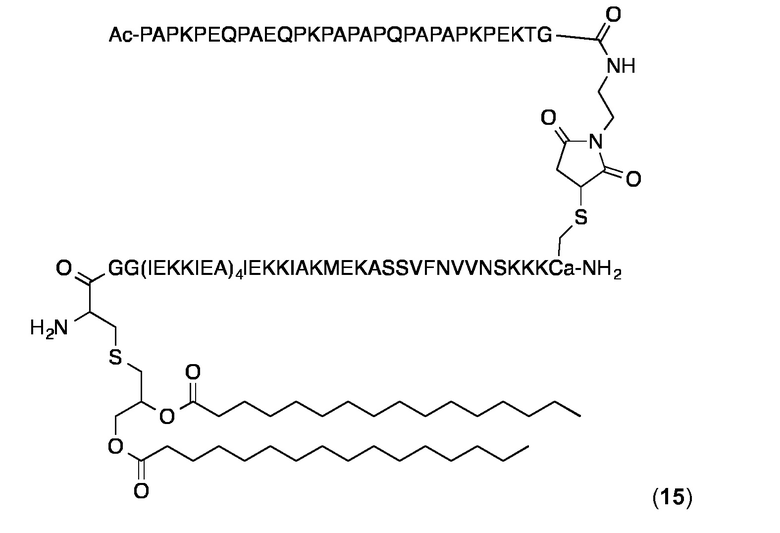
Конъюгирование 2 с 10 и очистку конъюгата проводили, по существу, как описано выше для конъюгата 14. Продукт 15 анализировали с помощью аналитической ОФ-ВЭЖХ с использованием колонки Interchrom UP5WC4-25QS (250 × 4,6 мм) и градиента от 20 до 100% MeCN в H2O (+ 0,1% TFA) в течение 25 мин: чистота> 97%; tR=22,41 мин. ESI-МС: MW рассчитанная для C458H779N113O128S3: 10012,9 Дa; найденная 10011,1 Дa (± 0,1%). Суспензию конъюгата 12 в PBS получали и анализировали с использованием DLS, как описано выше для 14. Значения Rh были в диапазоне 13,2-14,2 нм, а значения % Pd в диапазоне 12,6-18,0% при 25°C.
Конъюгат 16 (Малеимидопептид 3+липопептид 10)
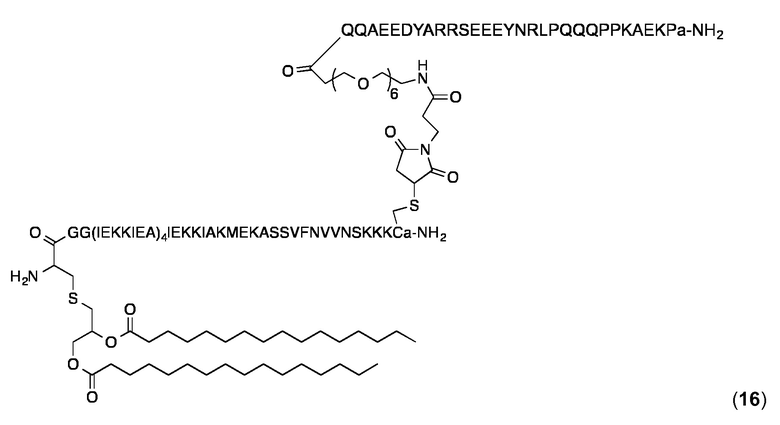
Конъюгирование 3 с 10 и очистку конъюгата проводили, по существу, как описано выше для конъюгата 14. Продукт 16 анализировали с помощью аналитической ОФ-ВЭЖХ с использованием колонки Interchrom UP5WC4-25QS (250 × 4,6 мм) и градиента от 20 до 100% MeCN в H2O (+ 0,1% TFA) в течение 25 мин: чистота> 97%; tR=22,0 мин. MALDI-TOF МС: MW рассчитанная для C475H811N115O136S3: 10869,8 Дa; найденная 10872,3 Дa (± 0,1%).
Суспензию конъюгата 13 в PBS получали и анализировали с использованием DLS, как описано выше для 14. Значения Rh были в диапазоне 14,0-15,0 нм, и значения % Pd в диапазоне 13,0-13,7%. DLS-анализ смеси частиц коньюгата 14 и коньюгата 16 дали Rh 12,3-13,3 нм и значения % Pd около 25-26%, что свидетельствует о том, что смешивание частиц не изменяет общее распределение по размерам.
Конъюгат 17 (Малеимидопептид 4+липопептид 14)
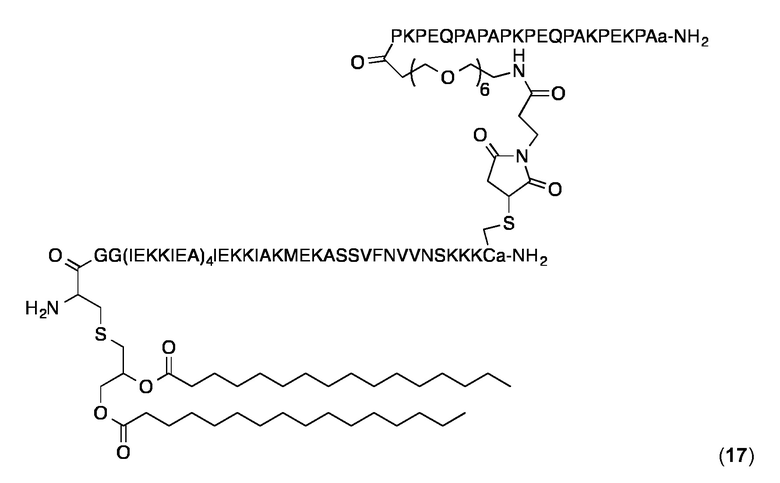
Конъюгирование 4 с 10 и очистку конъюгата проводили, по существу, как описано выше для конъюгата 17. Продукт 17 анализировали с помощью ВЭЖХ с обращенной фазой на аналитической колонке С4 (Interchrom, UP5WC4-25QS, 4,6 мм × 250 мм, 300 Å) и с помощью MALDI-MS. Аналитическая ОФ-ВЭЖХ (колонка С4, А=H2O+0,1% ТФК, В=MeCN+0,1% ТФК, от 20 до 100% В в течение 25 мин.): Чистота:> 95%. tR=18,8 мин. MALDI-TOF МС: MW рассчитанная для C443H762N106O126S3: 9685,6 Да; найденная 9686,2 Да (± 0,1%).
Суспензию конъюгата 17 в PBS получали и анализировали с использованием DLS, как описано выше для 14. Значения Rh находились в диапазоне от 11,1-11,8 нм и значения % Pd около 13%.
Конъюгат 18 (Малеимидопептид 5+липопептидн 10)
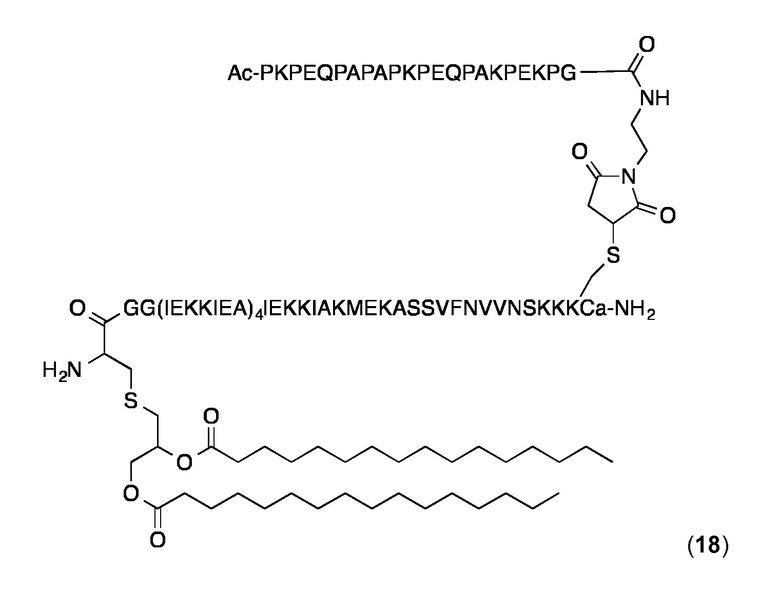
Конъюгирование 5 с 10 и очистку конъюгата проводили, по существу, как описано выше для конъюгата 18. Продукт 18 анализировали с помощью ВЭЖХ с обращенной фазой на аналитической колонке С4 (Interchrom, UP5WC4-25QS, 4,6 мм × 250 мм, 300 Å) и с помощью MALDI-MS. Аналитическая ОФ-ВЭЖХ (колонка С4, А=H2O+0,1% ТФК, В=MeCN+0,1% ТФК, от 20 до 100% В в течение 25 мин.): Чистота:> 96%. tR=22,55 мин. MALDI-TOF МС: MW рассчитанная для C425H728N104O118S3: 9279,2 Да; найденная 9280,2 Да (± 0,1%).
Суспензию конъюгата 18 в PBS получали и анализировали с использованием DLS, как описано выше для 14. Значения Rh находились в диапазоне 10,0-10,5 нм, и значения % Pd около 16%.
Конъюгат 19 (Малеимидопептид 6+липопептид 10)
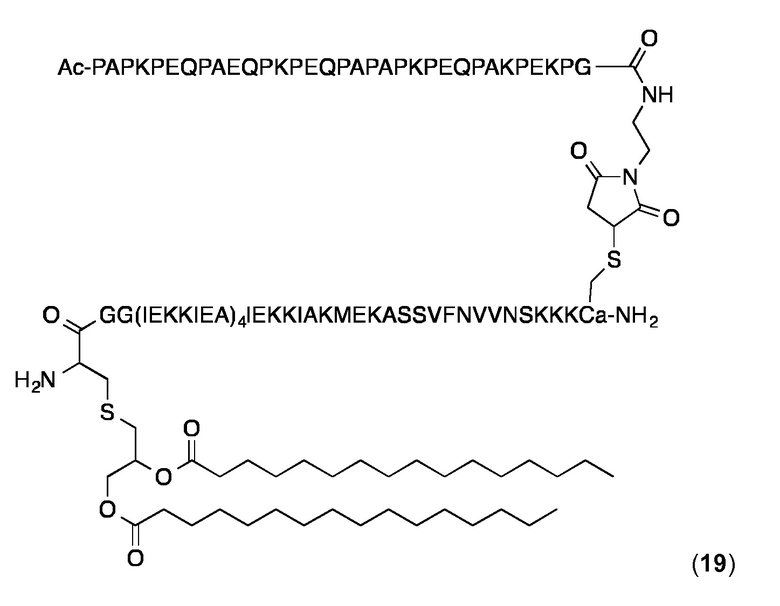
Конъюгирование 6 c 10 и очисткe конъюгата проводили, по существу, как описано выше для конъюгата 14. Продукт 19 анализировали с помощью ВЭЖХ с обращенной фазой на аналитической колонке С4 (Interchrom, UP5WC4-25QS, 4,6 мм × 250 мм, 300 Å) и с помощью MALDI-MS. Аналитическая ОФ-ВЭЖХ (колонка С4, А=H2O+0,1% ТФК, В=MeCN+0,1% ТФК, от 20 до 100% В в течение 25 мин.): Чистота:> 96%. tR=22,34 мин. MALDI-TOF МС: MW рассчитанная для C476H807N119O135S3: 10453,4 Да; найденная 10452,7 Да (± 0,1%).
Суспензию конъюгата 17 в PBS получали и анализировали с использованием DLS, как описано выше для 19. Значения Rh находились в диапазоне 12,1-14,5 нм и значения % Pd - 12-20%.
Конъюгат 20 (Малеимидопептид 6+липопептид 11)
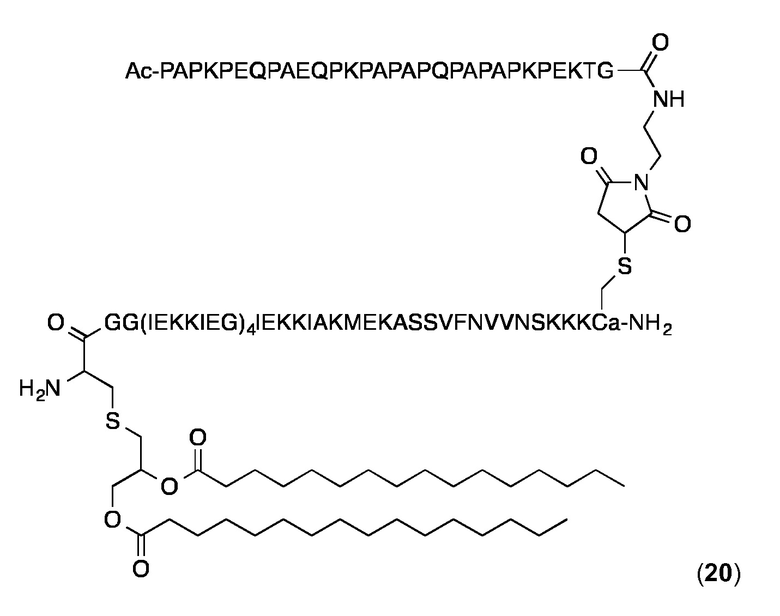
Конъюгирование 6 с 11 и очистки конъюгата проводили, по существу, как описано выше для конъюгата 14. Продукт 20 анализировали с помощью ВЭЖХ с обращенной фазой на аналитической колонке С4 (Interchrom, UP5WC4-25QS, 4,6 мм × 250 мм, 300 Å) и с помощью MALDI-MS. Аналитическая ОФ-ВЭЖХ (колонка С4, А=H2O+0,1% ТФК, В=MeCN+0,1% ТФК, от 20 до 100% В в течение 25 мин.): Чистота:> 98%. tR=22,34 мин. ESI-МС: MW рассчитанная для C454H773N113O129S3 (гидролиз сукцинимидного кольца): 9975,02 Да; найденная 9974,7 Да (± 0,01%).
Суспензию конъюгата 20 в PBS получали и анализировали с использованием DLS, как описано выше для 14. Значения Rh находились в диапазоне от 1 1,7-12,3 нм и значения % Pd составляли около 20%.
Конъюгат 21 (Малеимидопептид 4+липопептид 11)
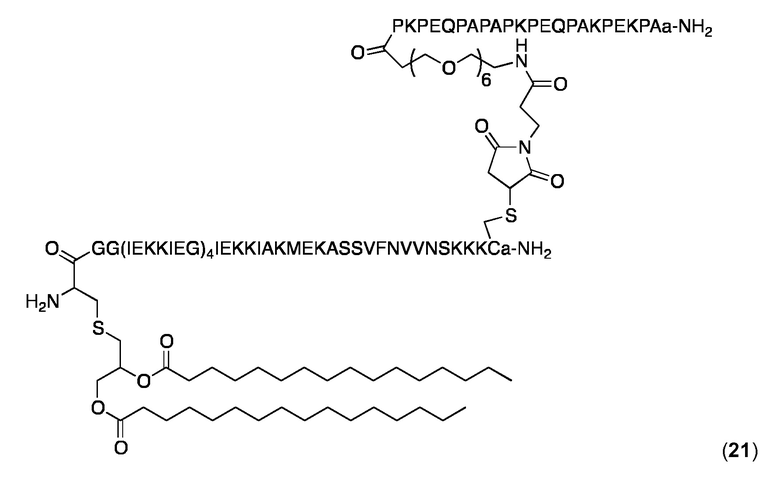
Малеимидопептид 4 конъюгировали с 11 и конъюгат очищали, как описано выше для конъюгата 14. Аналитическая ОФ-ВЭЖХ (колонка С4, А=H2O+0,1% ТФК, В=MeCN+0,1% ТФК, от 20 до 100% В в течение 25 мин.): Чистота:> 95%. tR=17,78 мин. MW рассчитанная для C439H753N105O127S3: 9630,5 Да; найденная 96310,2 Да.
DLS (0,5 мг/мл в PBS, 25 °C): Rh=10,7 нм; % Pd=12-13%.
Конъюгат 22 (Малеимидопептид 6+липопептид 12)
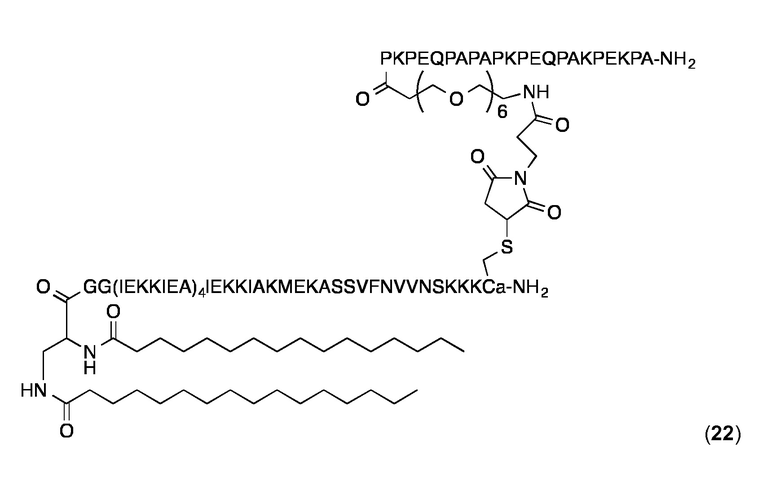
Малеимидопептид 4 конъюгировали с 12 и конъюгат очищали, как описано выше для конъюгата 14. Аналитическая ОФ-ВЭЖХ (колонка С4, А=H2O+0,1% ТФК, В=MeCN+0,1% ТФК, от 20 до 100% В в 25 мин.): Чистота:> 95%. tR=18,37 мин. MALDI-TOF: MW рассчитанная для C440H757N107O124S2: 9594,5 Да, найденная 9595,1 (± 0,1%) Да.
DLS-измерения (0,5 мг в PBS, 25°С) дало Rh 10,4-11,1 нм и значения % Pd - 10-12%.
Конъюгат 23 (Малеимидопептид 6+липопептид 13)
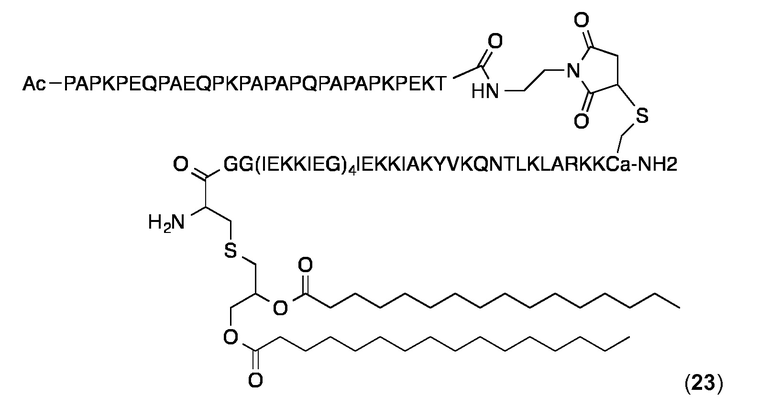
Малеимидопептид 6 конъюгировали с 13 и конъюгат очищали, как описано выше для конъюгата 14. Аналитическая ОФ-ВЭЖХ (колонка С4, А=H2O+0,1% ТФК, В=MeCN+0,1% ТФК, от 20 до 100% В в течение 25 мин.): Чистота:> 95%. tR=18,25 мин. MALDI-TOF: MW рассчитанная для C448H765N113O123S2 (гидролиз сукцинимидного кольца): 9768,7 Да, найденная 9767,0 Да (± 0,1%).
DLS-измерения (0,5 мг в PBS, 25 °С) дали Rh 9,9-10,2 нм и значения % Pd - 15-18%.
Дополнительные липопептиды были получены путем слияния N-конца PR-пептидного антигена с С-концом липопептидной структурной единицы. Были приготовлены следующие ститые липопептиды.
Липопептид (24)
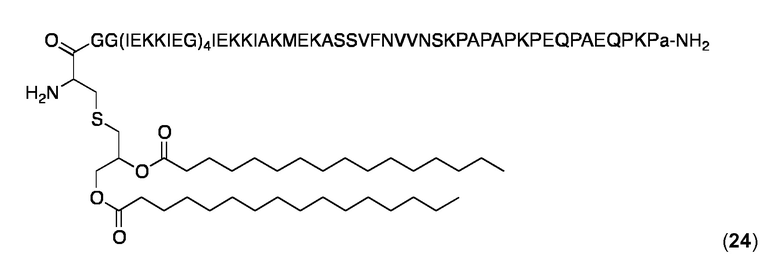
В этом примере PR-последовательность Р7, PAPAPKPEQPAEQPKP (SEQ ID NO: 33) была слита непосредственно с С-концом GG(IEKKIEG)4IEKKIAKMEKASSVFNWNSK (SEQ ID NO: 127) с получением последовательности GG(IEKKIEG)4IEKKIAKMEKASSVFNVVNSKPAPAPKPEQPAEQPKP (SEQ ID NO: 128). N-конец липидоилизировали добавлением Pam2Cys и D-аланин ("а") был добавлен к С-концу в липопептиде 24.
Слитый липопептид 24 синтезировали с использованием стандартных способов твердофазного синтеза пептидов (W.C. Chan, P.D. White, Fmoc Solid Phase Peptide Synthesis: A Practical Approach, Oxford University Press, Oxford, UK, 2000) и очищали, как описано выше для липопептида 10. MALDI-TOF МС: MW рассчитанная для C369H633N89O104S2: 8044+0,6 Да; найденная: 8044,6 Да (± 0,1%). Аналитическую ОФ-ВЭЖХ (Interchrom UP5WC4-25QS, от 25 до 100% MeCN в H2O (+ 0,1% ТФК) в течение 25 мин.): Чистота> 98%, tR=20,48 мин.
DLS (0,5 мг/ мл в PBS, 25 °С): Rh=10,7 нм; % Pd=12-13%.
Липопептид (25)
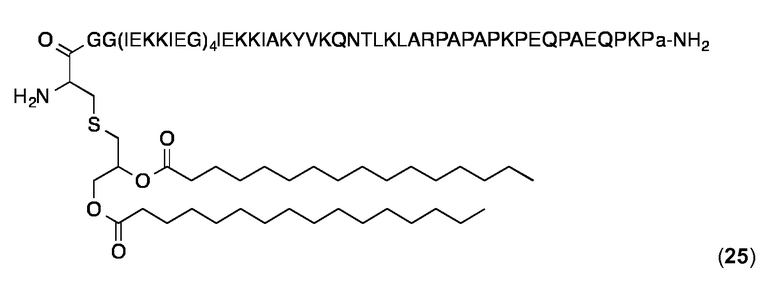
В этом примере PR-последовательность Р7 PAPAPKPEQPAEQPKP (SEQ ID NO: 33) была слита непосредственно с С-концом GG(IEKKIEG)4IEKKIAKYVKQNTLKLAR (SEQ ID NO: 129) с получением последовательности GG(IEKKIEG)4IEKKIAKMEKASSVFNVVNSKPAPAPKPEQPAEQPKP (SEQ ID NO: 130). N-конец был липидоилизирован добавлением Pam2Cys и D-аланин ("а") был добавлен к С-концу в липопептиде 25.
Слитый липопептид 25 синтезировали и очищали, как описано выше для 24. ESI-MS: MW рассчитанная для C360H639N91O99S: 7966,6 Да; найденная: 7967,0 Да (± 0,1%). Аналитическая ОФ-ВЭЖХ (Interchrom UP5WC4-25QS, от 25 до 100% MeCN в H2O (+ 0,1% ТФК) в течение 25 мин.): Чистота> 98%, TR=21 0,41 мин.
DLS (0,5 мг/мл в PBS, 25 °C): Rh=12,2-13,7 нм; % Pd=10-15%.
Пример 3. Получение контролей
Следующие контрольные соединения были подготовлены для иммунизаций и экспериментов по заражению.
Конъюгат 26 (не-PR коньюгат)
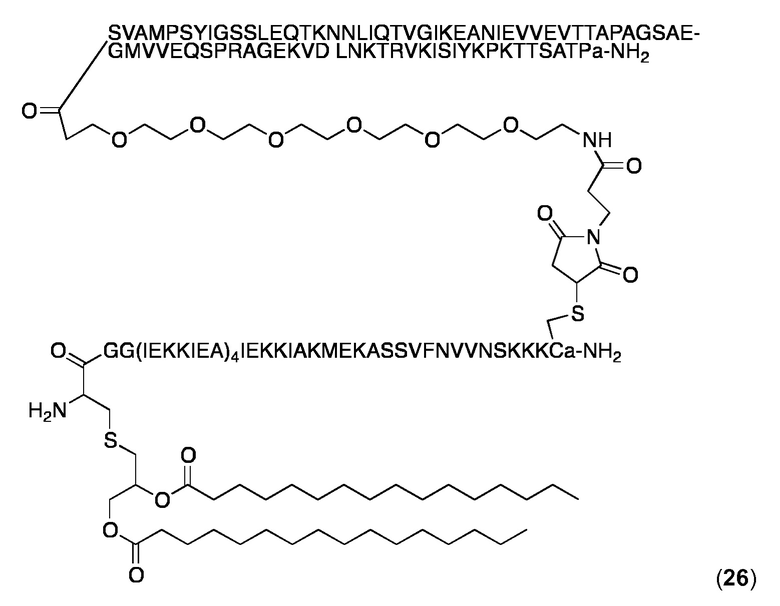
Этот конъюгат содержит С-концевую часть (StkP-C; PASTA+C-конец) StkP (SEQ ID NO: 115), за исключением того, что 2 мутации (F594Q и I602T) были включены в последовательность StkP для удаления экспонированных на поверхности гидрофобных остатков, с получением последовательности SVAMPSYIGSSLEQTKNNLIQTVGIKEANIEWEVTTAPAGSAEGMVVEQSPRAGEKVDL NKTRVKISIYKPKTTSATP (SEQ ID NO: 131). С-конец был блокирован a-NH2, где "а" обозначает D-аланин. Этот StkP-пептид в конъюгате принимает структуру регулярного пенициллин-связывающего белка и Ser/Thr киназа-ассоциированного (PASTA) домена, по данным ЯМР.
Соответствующий малеимидопептид 27 (3-малеимидoпропионил) -21-амино-4,7,10,13,16,19-гексаоксагенеикозаноил-(SEQ ID NO: 131)-a-NH2), был синтезирован и конъюгирован с 10, как описано выше для 14. Конъюгат 26 анализировали с помощью ВЭЖХ, MALDI-MS и DLS. Аналитическая ОФ-ВЭЖХ (Interchrom UP5WC4-25QS, 250 × 4,6 мм, А=H2O+0,1% ТФК, В=MeCN+0,1% ТФК, от 20 до 100% В в течение 25 мин.): Чистота:> 95%. tR=18,41 мин. MALDI-TOF: MW рассчитанная для C700H1201N177O216S5: 15713,41 Да; найденная 15715,4 Да (± 0,1%). DLS (0,5 мг/ мл в PBS, 25 °C): Rh=16,3 нм, % Pd=16,9%.
Липопептид 28
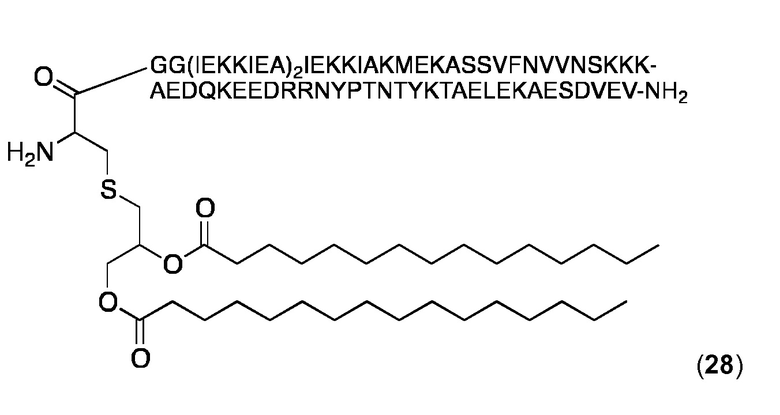
В этом липопептиде 31 аминокислота на С-конце соответствуют аминокислотам с 344 по 377 из PspC TIGR4 (SEQ ID NO: 116), за исключением того, что две мутации были внесены в состав антигена для улучшения растворимости (L366A, I370K; нумерация TIGR4 PSPC), с образованием пептида AEDQKEEDRRNYPTNTYKTAELEKAESDVEV (SEQ ID NO: 132). C-конец был блокирован r-NH2, где "r" обозначает D-аргинин. Этот пептид дополнительно соединен через короткий линкер (ККК) с универсальным эпитопом Т-хелперных клеток CST.3*(SEQ ID NO: 23).
Липопептид 28 синтезировали и очищали, как описано в публикации WO 2008/068017, и анализировали с помощью ВЭЖХ, MALDI-MS и DLS. Аналитическая ОФ-ВЭЖХ (Interchrom UP5WC4- 25QS, 250 × 4,6 мм, А=H2O+0,1% ТФК, В=MeCN+0,1% ТФК, от 20 до 100% В в течение 25 мин.): Чистота:> 95%. tR=18,41 мин. MALDI-TOF: MW рассчитанная для C386H654N100O121S2: 8696,1 Да; найденная 8696,0 Да. DLS (0,5 мг/мл в PBS, 25 °C): Rh=7,9 нм; % Pd=29%.
Рекомбинантный белок PspA (rPspA)
Богатая пролином область PspA из штамма S. pneumoniae SP1577 была клонирована и экспрессирована в виде рекомбинантного слитого белка Trx (rPspA). Клонирование и экспрессия рекомбинантного PR из штамма SP1577 проводили, как описано в заявке WO 2007/ 089866. Чистота и идентичность была подтверждена с помощью SDS-PAGE, дот-блоттингом с использованием антител анти-PspA и масс-спектрометрии. Последовательность белка представляет собой:
MSDKIIHLTD DSFDTDVLKA DGAILVDFWA EWCGPCKMIA PILDEIADEY QGKLTVAKLN IDQNPGTAPK YGIRGIPTLL LFKNGEVAAT KVGALSKGQL KEFLDANLAG SGSGHMHHHH HHSSGLVPRG SGMKETAAAK FERQHMDSPD LGTDDDDKAM ADLKKAVNEP EKPAEETPAP APKPEQPAEQ PKPAPAPQPA PAPKPEKTDD QQAEEDYARR SEEEYNRLPQ QQPPKAEKPA PAPKPEQPVP APKPEQPVPA PKTGWKQE (SEQ ID NO: 133)
PspA пролин-богатая область, включающая не-пролиновый блок, выделена курсивом.
Пример 4: Исследования по иммунизации мышей
Конъюгаты испытывали на иммуногенность против S. pneumoniae на мышах. Все эксперименты проводили в соответствии со швейцарскими правилами и нормами по защите прав животных и были одобрены ответственными органами.
Для анализа реакции антител самок NMRI аутбредных мышей возрастом от шести до восьми недель (10 на группу) подкожно иммунизировали два раза в течение трехнедельных интервалов в дни 0 и 21 0,1 мл составов, показанных в таблице 4. Контрольные животные были иммунизированы PBS или rPspA+квасцы в физиологическом растворе. Кровь собирали перед первым и десятым днями после второй иммунизации и сыворотки анализировали с помощью ELISA для определения титров IgG-антител к богатому пролином пептиду, Вестерн-блоттингом для определения IgG к эндогенным белкам и проточной цитометрии для определения поверхностого связывания IgG с неповрежденными пневмококками.
Препараты, используемые для иммунизации мышей
Для ELISA, 96-луночные микротитровальные планшеты MaxiSorp (Nunc, Fischer Scientific) покрывали при 4°С в течение ночи растворами 5 мг/ мл PR-пептидов или rPspA в PBS, рН 7,2 (50 мкл/ лунку). ELISA проводили, по существу, как описано в WO 2008/068017, с использованием козьих анти-мышиных IgG (γ-цепь специфических) антител (Sigma, St. Louis, МО) и 1 мг/ мл р-нитрофенилфосфата (Sigma) для детекции IgG. Титры предельных значений были определены как наивысшие разбавления сыворотки, для которых OD тестируемых сывороток была больше средней OD PBS плюс два стандартных отклонения.
Для Вестерн-блоттинг анализа иммунных сывороток, SP1577 культивировали в чашках с кровяным агаром при 37°С, 5% CО2 и получали тотальные микробное лизаты. Лизаты разделяли в SDS-PAGE в восстанавливающих условиях и переносили на нитроцеллюлозные мембраны. Блоты инкубировали с иммунными или пред-иммунными сыворотками (1: 500 в PBS) и проявляли с использованием системы ECL. PspA-специфическое моноклональное антитело использовали в качестве положительного контроля.
Для анализа проточной цитометрии (FACS) SP1577 культивировали, как описано выше, инактивированных формалином в течение 30 мин., блокировали 5 мг/ мл не содержащего жирных кислот BSA в PBS и приблизительно 7 × 105 КОЕ инкубировали с иммунными или пред-иммунными сыворотками (1: 100 в PBS) в течение 1 ч при комнатной температуре. Поверхностно-связанные IgG детектировали с помощью Alexafluor 488-конъюгированного вторичного антитела.
Титры ELISA среднегеометрических конечных точек (GMT) ± стандартное отклонение от среднего значения (SEM) и результаты вестерн-блота и FACS-анализа (как положительный по сравнению с отрицательной реактивности) приведены в таблице 5.
IgG-ответ у мышей после двух вакцинаций
(GMT ± SEM)a)
(Полож./Отриц.)
(Полож./Отриц.)
реакционной способности в ELISA, Вестерн-блоттинге и FACS
b) IgG-ответ, определенный способом ELISA, в отношении 14
c) IgG-ответ, определенный способом ELISA, в отношении 16
Несмотря на то, что образование антител варьировала у аутбредных мышей, все мыши развивали высокие титры антиген-специфических IgG, что определено по ELISA, и IgG в большинстве иммунных сывороток связывались с эндогенным PspA и интактными клетками SP1577. Никаких существенных уровней антиген-специфических IgG не удавалось детектировать в пред-иммунных сыворотках и в сыворотках мышей, иммунизированных PBS.
Перекрестная реактивность выявленного IgG оценивали с помощью Вестерн-блоттинга и FACS и панели генетически разнообразных штаммов пневмококков, представляющих различные PspA, принадлежащих к различным кладам из PspA-семейств 1-3, которые определены в Hollingshead, Becker et al., Infect Immun, 2000, 68, 5889-5900, и различных пневмококковых капсульных серотипов, в том числе серотипов, которые не охвачены в настоящее время лицензированными пневмококковыми конъюгированными вакцинами.
Бактерии культивировали, и Вестерн-блот и FACS-анализы проводили с сыворотками от иммунизированных мышей, как описано выше для SP1577. Результаты приведены ниже в таблице 6.
кросс-реактивность IgG в сыворотке крови мышей с генетически разнообразными
Pneumococci
/серотип
Результаты, полученные с генетически разнообразной панелью, указывают на то, что иммунизация PR-пептидными антигенами выявила широко перекрестно реагирующие IgG, хотя некоторые конструкции PR-пептидных антигенов выявляли более широко перекрестно-реагирующие IgG, чем другие.
Для исследований по заражению аутбредных мышей NMRI иммунизировали разными составами, как описано выше. Для сравнения иммуногенности дополнительных животных иммунизировали rPspA+квасцы, конъюгатом 44 или липопептидом 46. У мышей брали кровь через 10 дней после последней иммунизации, сыворотки анализировали с помощью ELISA, как описано выше, для определения сероконверсии. Мышей затем заражали внутривенно (iv) через хвостовую вену 100-кратной заранее прдустановленной смертельной дозой (100×LD100) pneumococci, которые оказались высоко вирулентными при пассировании у мышей до заражения. Бактерии пассировали либо внутрибрюшинной (ip) или внутривенной (iv) инъекцией pneumococci. После заражения, состояние здоровья мышей контролировали в течение 14 дней. Агонирующих животных умерщвляли и регистрировали время до момента умирания. Выживание и время до умирания животных, иммунизированных липопептидами или белком, сравнивали с таковыми у животных, иммунизированных только PBS.
Результаты, полученные с помощью штамма SP1577, приведены в таблице 7 ниже. Штамм SP1577 является высоко вирулентным у мышей. Незащищенные мыши умерли или стали умирающими в течение первых 12-24 ч после заражения. Защита, следовательно, указывает на высокую эффективность.
Защита мышей NMRI от смертельного заражения штаммом SP1577
Мыши, иммунизированные PR-пептидными антигенами, конъюгированными с SVLP, были частично защищены, а средняя продолжительность жизни была продлена по сравнению с мышами, иммунизированными PBS и мышами, иммунизированными rPspA. Распределения выживаемости, полученные для мышей, иммунизированных SVLP или rPspA, сравнивали с таковым для мышей, иммунизированных только PBS (отрицательный контроль) с помощью теста Логранка. Результаты для мышей, иммунизированных PR-конъюгатами, отдельно или в сочетании с другими антигенами, значительно отличались от таковых для PBS-иммунизированных мышей. P-значения находились в диапазоне 0,0027-0,0143. Результаты для мышей, иммунизированных rPspA существенно не отличались (Р=0,1336) по сравнению с PBS-иммунизированными мышами, хотя некоторые мыши были защищены. Разница может стать более значимым для больших групп. Результаты для StkP и PspC- полученных конъюгатов не значительно от таковых для PBS, указывая, что эти антигены не являются защитными в этой модели.
Для экспериментов по пассивной иммунизации/ заражению, чтобы определить, опосредуют ли антитела защиту, у мышей были получены моноклональные антитела. В одном эксперименте мышей BALB/c иммунизировали три раза конъюгатом 17. Семь линий В-клеточных гибридом, продуцирующих антиген-специфичные моноклональные антитела IgG (mAb), были получены из клеток селезенки одной мыши, и испытывали на перекрестную реактивность с различными пневмококковыми штаммами с помощью анализа FACS. Одно mAb (5H8) связывалось с широким кругом штаммов (клинические изоляты), представляющих различные клады и капсульные серотипы PspA. Другие моноклональные антитела связывались с PR-антигеном в ELISA, но не с интактными бактериями. Картирование эпитопов показало, что моноклональное антитело 5H8 узнавало эпитоп в С-концевой части PR-пептида, который имеет место в широком разнообразии различных последовательностей PspA, в то время как другие 6 mAb узнают другие эпитопы, которые менее часто встречаются в различных последовательностях PspA. Для заражения от 0,1 до 0,5 мг очищенного 5H8 или других mAb вводили группам по 5 NMRI мышей путем iv инъекции. Животных пассивно иммунизировали StkP-производным mAb (1А7), и наивные животные были использованы в качестве контролей. После достаточного времени для уравновешивания мышей заражали внутривенно пассированными pneumococci, и состояние здоровья и времени до наступления смерти контролировали, как описано выше. Результаты, полученные с помощью штамма SP1577 приведены в таблице 8 ниже.
Пассивная защита мышей NMRI от летального заражения штаммом SP1577
(мг/мл)
для выжившихa)
Только моноклональное антитело 5H8 показало в значительной степени разные результаты после пассивной иммунизации, по сравнению с наивными мышами. Защита была зависимой от дозы. Моноклональные антитела 3H5 и 1Н9 не показали значительного эффекта в этой модели пассивной защиты. Секвенирование показало, что PspA штамма SP1577 содержит только эпитоп 5H8, но не эпитопы двух других PR-производных антител. Никакой защиты также не было отмечено для StkP-производного mAb 1A7 в этой модели.
Результаты показывают, что иммунизация SVLP-образующими липопептидами, несущими пролин-богатые пептидные антигены, выявляет антитела, сильно перекрестно реагирующие с S. pneumoniae, у мышей при введении по отдельности или в комбинации с другими антигенами, без совместного введения адъюванта.
Пример 5: Исследования иммунизации кроликов
Для того, чтобы охарактеризовать образование антител у животных, отличных от грызунов, новозеландских белых кроликов подкожно иммунизировали три раза в дни 0, 28 и 56 конъюгатами 17, 18 или 19 с различными концентрациями в 0,4 мл PBS, без адъювантом или с ним (R848) (Таблица 9). Образцы крови брали в дни 0, 14, 38 и 66, чтобы определить сероконверсию.
Составы, использованные для иммунизации кроликов
Пред-иммунные сыворотки и сыворотки после третьей иммунизации анализировали с помощью Вестерн-блоттинга и FACS с использованием кроличьих IgG-специфических вторичных антител и различные пневмококковых изолятов, как описано выше для мышей. Развитие IgG-реакции также анализировали с помощью ELISA с использованием моноклонального против кроличьего IgG (γ-цепь специфического) антитела с щелочной фосфатазой с 4-нитрофенил-фосфатом для детектирования IgG, по существу, как описано выше. Результаты приведены в таблице 10. Все иммунизированные кролики проявляли IgG-связывание с эндогенно экспрессируемым PspA и PspA, экспрессируемым в интактных пневмококках в ответ на иммунизацию. Пред-иммунные сыворотки не показали значительной реакционной способности в этих анализах. Высокие титры PR пептид-специфических IgG-антител детектировались в иммунных сыворотках от иммунизированных кроликов, даже после введения малых доз конъюгата без адъюванта.
Развитие IgG-ответа у NZW-кроликов (N=3)
b)Представлены результаты для штамма SP1577.
Результаты показывают, что иммунизация SVLP-образующими липопептидами, несущими пролин-богатые пептидные антигены, выявляет широко перекрестно реагирующие антитела также у животных, отличных от грызунов при введении без адъюванта.
Пример 6: Сравнение ответов антиген-специфических антител у мышей BALB/с
Антиген-специфическое образование антител, вызванное коньюгат 15 SVLP, сравнивали с таковым, вызванным рекомбинантным белком PspA. Шести-восьми недельных самок мышей BALB/с (18 на группу) подкожно иммунизировали два раза в течение трех недель с интервалом в дни 0 и 21 при помощи 0,1 мл конъюгата 15 в PBS, или rPspA+квасцы в физиологическом растворе, полученного, как описано выше в Примере 5. Кровь отбирали через десять дней после второй иммунизации.
Для определения антигенной специфичности образования антител проводили ELISA, как описано в примере 5, с использованием PR-пептида с последовательностью SEQ ID NO: 27 в качестве покрывающего антигена для измерения PR-специфических антител, и rPspA в качестве антигена покрытия для измерения общего количества антител против PspA (т.е. антител к N-концевым эпитопам, NPB и PR). Результаты показаны на Фигуре 1. Сыворотки от неиммунизированных мышей не показали перекрестной реактивности с каким-либо из антигенов в ELISA.
Как и ожидалось, rPspA был в высокой степени иммуногенным (анти-PspA IgG GMT ± SEM=81969 ± 28068), однако не удалось выявить значимые уровни антител анти-PR (анти-PspA IgG GMT ± SEM=213 ± 218). Это не было связано с недостаточностью антител, выработанных против rPspA, для связывания с PR-пептидом, так как антитела, выработанные против конъюгат 15 SVLP, узнавали как PR-пептид (анти-PspA IgG GMT ± SEM=27583 ± 6204), так и антиген rPspA (20919 ± 3444) в тесте ELISA. Поэтому вероятно, что большинство rPspA-выявленных антител связываются с эпитопами в N-концевой альфа-спиральной части.
Для определения того, будет ли PspA без N-концевой альфа-спирали выявлять больше PR-специфических антител, мышей иммунизировали укороченным рекомбинантным слитым белком PspA-Trx (rPspA-delta-N-term, содержит PR и NPB). Удивительно также, что укороченным белком не удалось получить значительные уровни анти-PR-антител: GMT ± SEM составлял 128496 ± 28481 для белка и 213 ± 1094 для PR-антигена. Это было значительно ниже, чем для контрольных животных, иммунизированных конъюгат 15 SVLP (GMT ± SEM составлял 32776 ± 6974 для белка и 47679 ± 23383 для PR-пептида). В совокупности эти результаты указывают на то, что SVLP вызывают значительно более высокие уровни PR-специфических антител, чем рекомбинантный PspA.
Пример 7: Защита от возрастающих доз заражения
Для определения защиты иммунизированных мышей BALB/с от возрастающих доз заражения, мышей иммунизировали конъюгатом 15 или rPspA, как описано выше в примере 6, заражали внутривенно увеличивающимися дозами бактерий серотипа 1 в пределах от 102 до 106 КОЕ и отслеживали выживание. Унифицированный посевной материал пневмококковых бактерий серотипа 1 получали, как описано в Aaberge I.S. et al., Microbial Pathogenesis, 1995, 18, 141-152. LD50 у неиммунизированных мышей проверяли с помощью внутривенно вводимых мышам BALB/с возрастающих доз бактерий и мониторинга выживания.
Защита иммунизированных мышей зависела от доза бактериального заражения и типа иммуногена. При низких дозах заражения защита была сравнима с таковой для животных, иммунизированных rPspA или липопептидный структурный элемент 15 SVLP (смотри Фигуру 2). При более высоких дозах заражения (100-10000×LD50) мыши, иммунизированные с помощью конъюгат 15 SVLP, были лучше защищены, чем мыши, иммунизированные rPspA. В совокупности эти результаты указывают на то, что анти-PR-антитела, индуцированные SVLP, защищают в более широком диапазоне доз бактериального заражения, чем антитела, полученные против rPspA.










































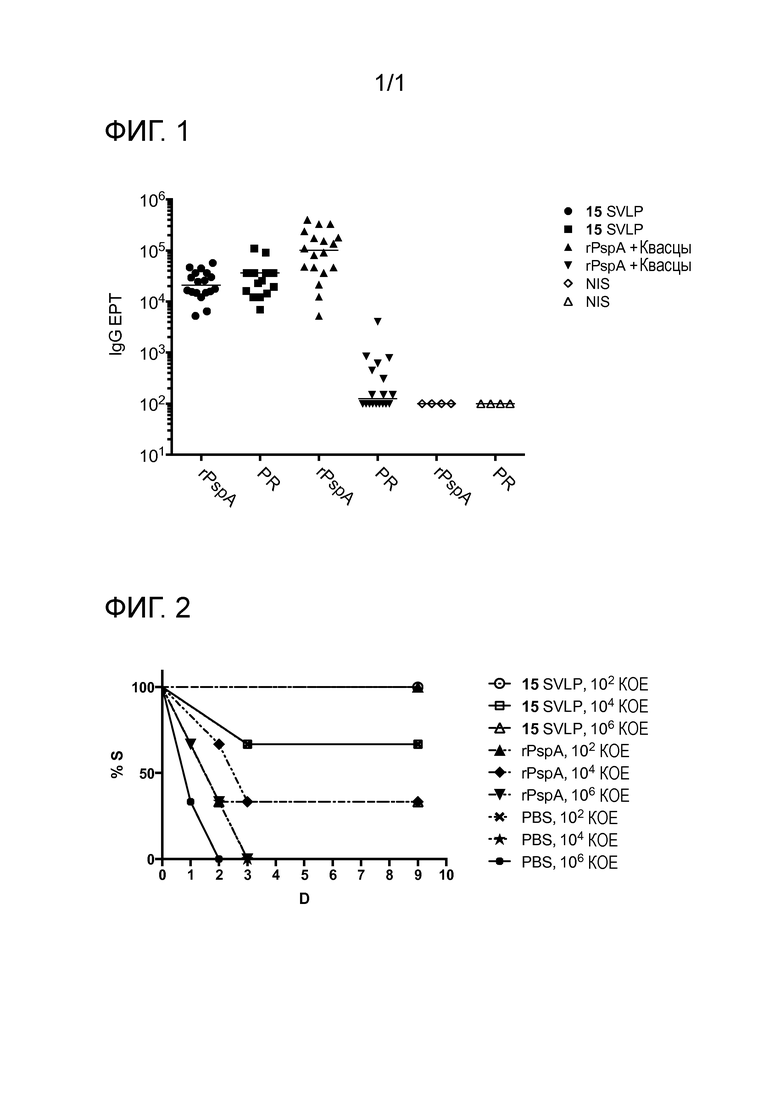
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая липопептидный структурный элемент для индуцирования ответа против Streptococci, Peptostreptococci или Staphylococci, синтетическую вирусоподобную частицу для индуцирования иммунного ответа против Streptococci, Peptostreptococci или Staphylococci, содержащую вышеуказанный липопептидный структурный элемент, вакцину для индуцирования иммунного ответа против Streptococci, Peptostreptococci или Staphylococci, содержащую вышеуказанную вирусоподобную частицу, и способ вакцинации против заболевания, вызываемого Streptococci, Peptostreptococci или Staphylococci, включающий введение вышеуказанной вирусоподобной частицы в эффективном количестве. В одном из вариантов реализации липопептидный структурный элемент состоит из пептидной цепи, пролин-богатого пептидного антигена и липидной составляющей. Изобретение расширяет арсенал средств для индуцирования иммунного ответа против Streptococci, Peptostreptococci или Staphylococci. 4 н. и 8 з.п. ф-лы, 2 ил., 10 табл., 7 пр.
1. Липопептидный структурный элемент для индуцирования иммунного ответа против Streptococci, Peptostreptococci или Staphylococci, состоящий из
(1) пептидной цепи, содержащей параллельный биспиральный домен, который, в качестве самостоятельного не содержащего липидов пептида, образует параллельный димерный, тримерный или высшего порядка олигомерный спиральный пучок, где биспиральный домен состоит из гептадных мотивов, имеющих последовательность (IEKKIEX), где Х представляет собой аминокислоту, выбранную из группы, состоящей из аланина, изолейцина, лейцина, метионина, валина, аспарагина, цистеина, глутамина, серина, треонина и глицина,
(2) пролин-богатого (PR) пептидного антигена, содержащего, по меньшей мере, одну отрицательно и, по меньшей мере, одну положительно заряженную аминокислоту, и где по меньшей мере 15% аминокислот представляют собой пролин, необязательно связанного с другим антигеном,
где указанный пролин-богатый пептидный антиген состоит из 8-80 аминокислот, и
где пролин-богатый пептидный антиген содержит пептид с последовательностью от SEQ ID NO: 27 до 112,
(3) липидной составляющей, содержащей две или три длинных углеводородных цепи, где каждая из указанных длинных углеводородных цепей является линейной или разветвленной алкильной или алкенильной группой, состоящей из 8-50 атомов углерода; причем пептидная цепь ковалентно связана на одном конце с пролин-богатым пептидным антигеном, а на другом конце с липидной частью, либо непосредственно, либо через линкер.
2. Липопептидный структурный элемент по п. 1, в котором пептидная цепь содержит от 21 до 200 аминокислотных остатков.
3. Липопептидный структурный элемент по п. 1 или 2, в котором пептидная цепь содержит биспиральный домен, состоящий из трех - восьми гептадных мотивов.
4. Липопептидный структурный элемент по любому из пп. 1, 2 или 3, в котором пролин-богатый пептидный антиген содержит, по меньшей мере, один остаток глутаминовой кислоты и, по меньшей мере, один остаток лизина или аргинина.
5. Липопептидный структурный элемент по любому из пп. 1, 2 или 3, в котором пролин-богатый пептидный антиген получен из белков Streptococci и/или Staphylococci.
6. Липопептидный структурный элемент по любому из пп. 1, 2 или 3, в котором пролин-богатый пептидный антиген является производным от белков PspA и/или PspC.
7. Липопептидный структурный элемент по любому из пп. 1, 2 или 3, в котором липидная составляющая представляет собой один из типов Z1 - Z8
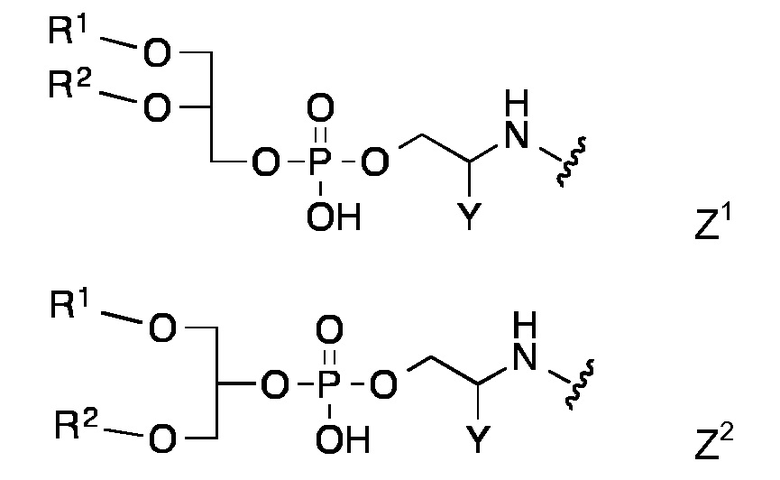
в которых R1 и R2 представляют собой длинный углеводородный остаток или длинный углеводород-C=О и Y представляет собой Н или СООН,
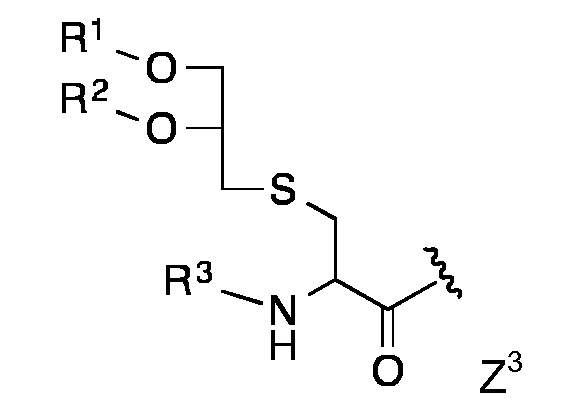
в котором R1, R2 и R3 представляют собой длинный углеводородный остаток или длинный углеводород-C=О или R1 и R2 представляют собой длинный углеводородный остаток или длинный углеводород-C=О и R3 представляет собой Н или ацетил или низший алкил-С=О,

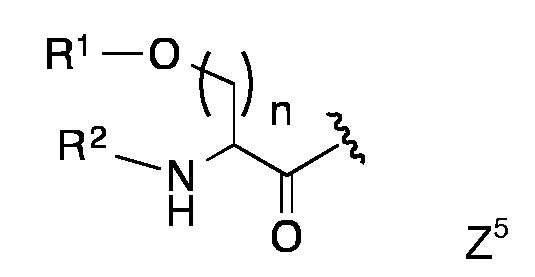
в которых R1 и R2 представляют собой длинный углеводородный остаток или длинный углеводород-C=О и n представляет собой 1, 2, 3 или 4,
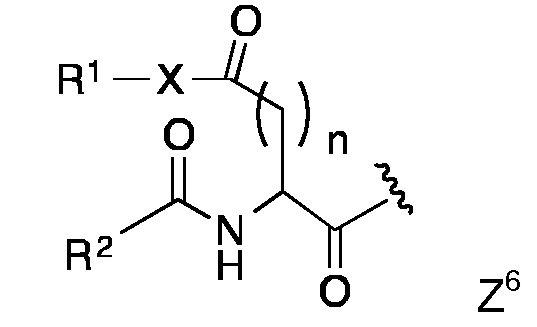
в котором R1 и R2 представляют собой длинный углеводородный остаток, Х представляет собой О или NH, а n представляет собой 1, 2, 3 или 4, или
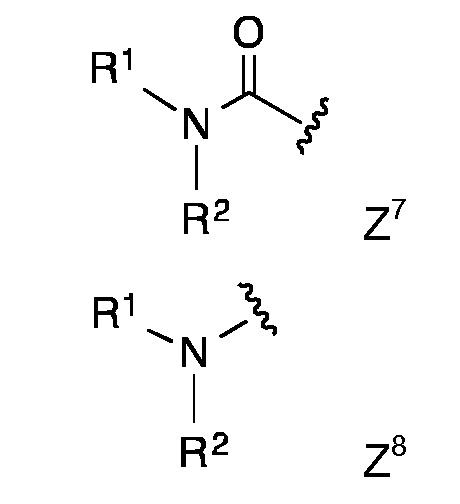
в которых R1 и R2 представляют собой длинный углеводородный остаток,
и в котором длинный углеводородный остаток представляет собой линейный или разветвленный алкил или алкенил, содержащий от 8 до 25 атомов углерода и необязательно одну, две или три двойных связи в цепи.
8. Липопептидный структурный элемент по п. 7, в котором липидная составляющая представляет собой дипальмитоил-S-глицерилцистеинил с формулой Z3, в которой R1 и R2 представляют собой пальмитоил и R3 представляет собой Н или ацетил.
9. Липопептидный структурный элемент по п. 1 или 2, в котором пептидная цепь PC ковалентно связана с липидной составляющей LM на одном конце этой пептидной цепи или рядом с одним концом этой пептидной цепи, либо непосредственно, как в
LM - PC (1)
или через линкер (L), как в
LM - L - PC (2)
где линкер L выбран из
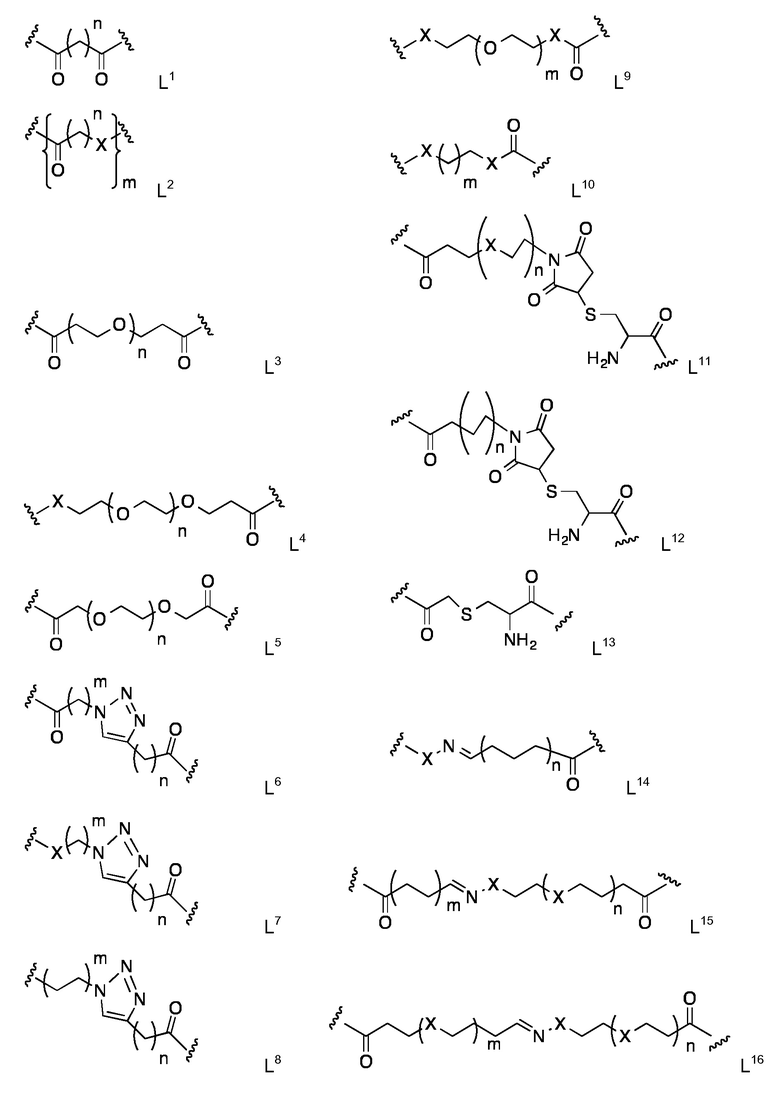
где Х представляет собой O или NH, m составляет от 1 до 45 и n составляет от 1 до 45.
10. Синтетическая вирусоподобная частица для индуцирования иммунного ответа против Streptococci, Peptostreptococci или Staphylococci, состоящая из спиральных липопептидных пучков, содержащих два, три, четыре, пять, шесть или семь липопептидных структурных элементов по любому из пп. 1-9.
11. Вакцина для индуцирования иммунного ответа против Streptococci, Peptostreptococci или Staphylococci, содержащая синтетическую вирусоподобную частицу по п. 10.
12. Способ вакцинации против заболевания, вызываемого Streptococci, Peptostreptococci или Staphylococci, в котором иммуногенно эффективное количество синтетической вирусоподобной частицы по п. 10 вводят пациенту, нуждающемуся в этом.
| WO 2008068017 A1 12.06.2008 | |||
| BOATA F | |||
| et al., Synthetic Virus-Like Particles from Self-Assembling Coiled-Coil Lipopeptides and Their Use in Antigen Display to the Immune System, Angew | |||
| Chem | |||
| Int | |||
| Ed | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| YOTHER J | |||
| et al., Structural Properties and Evolutionary Relationships of PspA, a Surface Protein of Streptococcus | |||
Авторы
Даты
2020-12-01—Публикация
2014-12-02—Подача