Область техники, к которой относится изобретение
Изобретение относится к медицине, а именно к хирургии, эндоскопии, реаниматологии, и может быть использовано для эндоскопического транслюминального лечения инфицированного панкреонекроза.
Уровень техники
В структуре острых хирургических заболеваний органов брюшной полости острый панкреатит (ОП) занимает третье место, составляя от 4,5 до 10% [1, 2, 3] и не имеет тенденции к снижению в настоящее время. Деструктивные формы ОП являются наиболее тяжелыми и встречаются в 25-30% случаях [4]. Сохраняются высокие показатели летальности: при отечной форме она достигает 10%, при стерильном панкреонекрозе - от 10 до 30%, и достигает 62-65% при инфицированном панкреонекрозе. Схема лечения панкреонекрозов заключается в адекватном дренировании зон панкреатогенной деструкции с проведением последующих программных санационных вмешательств. Традиционные способы хирургического лечения сопровождаются высокой послеоперационной летальностью (27-32%) и продолжительным послеоперационным периодом (от 18 до 49 суток) [5, 6, 7], по причине чего на современном этапе используются все реже. Альтернативой «открытому» хирургическому лечению является миниинвазивное чрескожное дренирование под ультразвуковым наведением, которое сопровождается меньшей летальностью (8-15%) и более коротким послеоперационным периодом (от 13 до 19 суток) [8, 9, 10].
Наиболее близким к заявляемому решению является способ лечения инфицированного панкреонекроза, включающий эндоскопическую санацию зон панкреатогенной деструкции при наличии сформированного свищевого отверстия в стенке полого органа [Патент RU 2311873 C2]. Согласно способу пациенту проводят эзофагогастродуоденоскопию (ЭГДС), при обнаружении сформированного свищевого отверстия в стенке полого органа осуществляют санацию полости раствором фурациллина путем введения гастроскопа в свищевое отверстие в стенке полого органа с последующим назодренированием полости.
Однако данный способ имеет ряд существенных недостатков. Способ осуществим только при наличии свищевого отверстия в стенке полого органа, что значительно ограничивает количество пациентов, у которых он может быть применен. При этом в случае, если диаметр свищевого отверстия значительно меньше диаметра рабочей части эндоскопа, провести эндоскоп не представляется возможным, а при попытках расширить свищевое отверстие существует высокий риск осложнений в виде кровотечения или разрыва полого органа. В последующем ухудшить дренирование зон панкреатогенной деструкции может как отхождении крупных фиксированных некротических масс, так и естественное сужение свищевого отверстия. Кроме того, длительное неконтролируемое нахождение назодренажа в полости деструкции может привести к дополнительному формированию пролежней и вызвать аррозивное кровотечение. При этом реализация способа не подразумевает действий, направленных на подавление in situ патогенной микрофлоры, а так же создание условий, способствующих регенерации тканей.
Технической проблемой, решаемой заявляемым изобретением, является разработка способа лечения инфицированного панкреонекроза с использованием эндоскопической техники, обеспечивающего адекватное дренирование и санацию полости панкреатогенной деструкции, выполнение некросеквестрэктомии, местное подавление патогенной микрофлоры и создание благоприятных условий для регенерации тканей и полного регресса полости распада.
Раскрытие изобретения
Достигаемым техническим результатом является повышение эффективности лечения инфицированного панкреонекроза. Заявляемый способ характеризуется улучшением результатов лечения больных с инфицированным панкреонекрозом, снижением летальности, сокращением сроков госпитализации, снижением травматичности.
Технический результат достигается при осуществлении способа эндоскопического транслюминального лечения инфицированного панкреонекроза, включающего введение эндоскопа в область панкреатогенной деструкции с последующим выполнением некросеквестрэктомии и санации полости раствором антисептика, а также введение антибиотика, при этом сначала выявляют локализацию области панкреатогенной деструкции, прилежащей к стенке полого органа - желудка или двенадцатиперстной кишки, определяют точку для безопасного выполнения соустья исходя из минимального расстояния между стенкой полого органа и областью панкреатогенной деструкции и отсутствия на траектории соустья крупных сосудов диаметром более 3 мм, через данную точку под контролем эндоскопической ультрасонографии формируют соустье, проводят эндоскопический катетер, осуществляют аспирацию содержимого из области панкреатогенной деструкции, и определяют объем полости деструкции; после чего в сформированное соустье устанавливают саморасширяющийся стент, через который проводят эндоскоп, при этом санацию полости панкреатогенной деструкции раствором антисептика, некросеквестрэктомию и инстилляцию раствора антибиотика осуществляют через рабочий канал эндоскопа, после чего через рабочий канал эндоскопа в область деструкции вводят аутологичную богатую тромбоцитами плазму и затем раствор аллогенного коллагена 1 типа, при этом на каждые 100 см3 объема полости деструкции вводят 10 мл раствора аллогенного коллагена 1 типа и 3 мл препарата аутологичной богатой тромбоцитами плазмы.
Богатую тромбоцитами плазму вводят в область деструкции посредством распыления плазмы на стенки полости. Введение аутологичной богатой тромбоцитами плазмы и раствора аллогенного коллагена 1 типа выполняют через каждые 48 часов до полного регресса полости панкреатогенной деструкции. Объем полости панкреатогенной деструкции определяют по объему заполнения данной полости водорастворимым контрастным веществом, вводимым в полость через эндоскопический катетер. При реализации способа, как правило, используют саморасширяющийся покрытый нитиноловый стент с воронкообразно расширенными торцами типа «dog bone». Санацию раствором антисептика проводят объемом, трехкратно превышающим объем полости панкреатогенной деструкции. Некросеквестрэктомию проводят под визуальным контролем с использованием эндоскопических щипцов, проведённых через рабочий канал эндоскопа.
Технический результат достигается за счёт:
- транслюминального дренирования зон панкреатогенной деструкции – то есть формирования искусственного соустья между полым органом и зоной панкреатогенной деструкции под контролем эндосонографии с установкой саморасширяющегося покрытого нитинолового стента с воронкообразно расширенными торцами типа «dog bone»
- проведении курса программных эндоскопических санаций полости панкреатогенной деструкции растворами антисептиков с механическим удалением секвестров под визуальным контролем, инстилляций растворов антибиотиков согласно данным предварительно выполненных бактериологических посевов и аппликаций композиции на основе тромбоцитов пациента и аллогенного коллагена 1 типа.
В клинической практике известно использование для стимуляции регенерации эпителиальных тканей изделий медицинского назначения на основе коллагена - фибриллярного белка, составляющего основу соединительной ткани человека, и тромбоцитов - высокодифференцированных клеток, полифункциональность которых обусловлена наличием в них большого количества биологически активных компонентов (тромбоцитарный фактор роста (PDGF), фактор роста фибробластов (FGF), фактор роста эндотелия (EGF), трансформирующий фактор роста (TGF-β1), инсулиноподобный фактор роста (IGF-1), факторы роста сосудов и эндотелия (VEGF, VGF), цитокины (IL-1, IL-6, TNF-α), белков, облегчающих адгезию к коллагену (фибронектин и витронектин). Однако из уровня техники не выявлено способов лечения инфицированного панкреонекроза, использующих приемы по формированию искусственного соустья в комбинации с разработанной схемой лечения комплексом препаратов, включающих тромбоциты пациента и аллогенный коллагена 1 типа, взятых в определенном количестве, и доставляемых непосредственно в полость панкреатогенной деструкции, что обеспечивает повышение эффективности лечения.
Критериями включения пациентов для лечения заявляемым способом являются:
- наличие инструментально подтверждённого (УЗИ органов брюшной полости, компьютерная томография органов брюшной полости) процесса пакреонекроза,
- полость панкретогенной деструкции должна прилежать к стенке желудка или двенадцатиперстной кишки.
Критериями исключения являются: агонирующее состояние пациента или сопутствующие заболевания/состояния, не позволяющие выполнить эндоскопические вмешательства.
Краткое описание чертежей
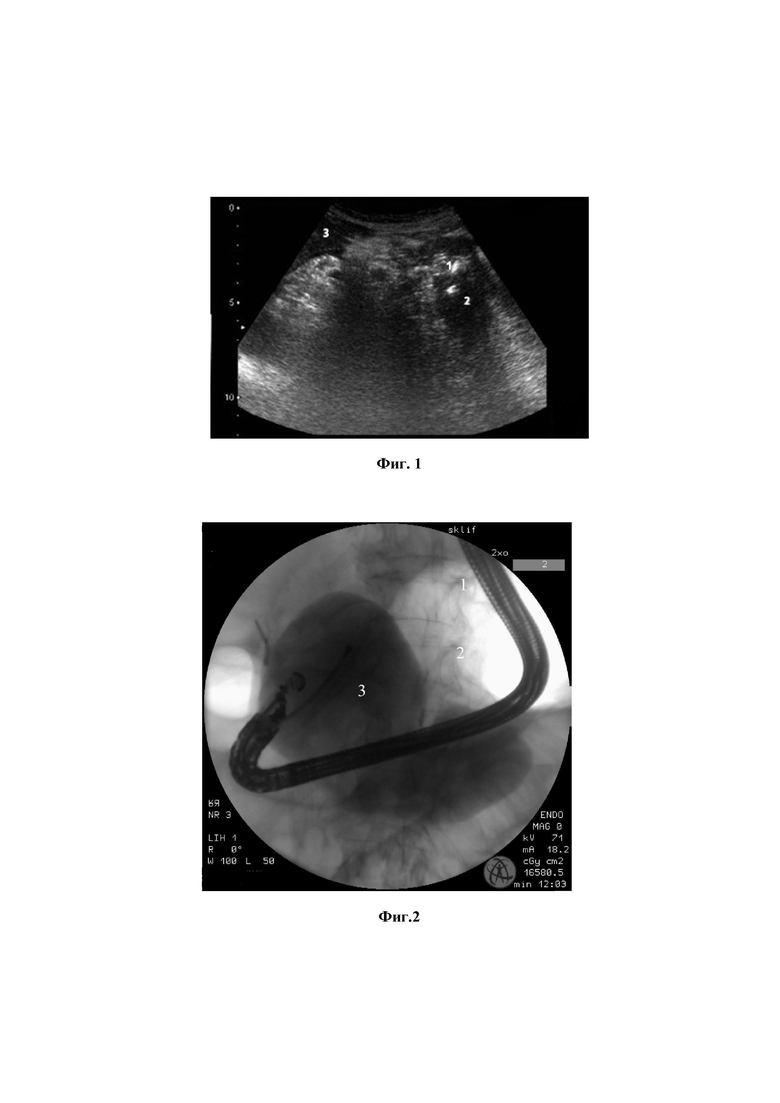
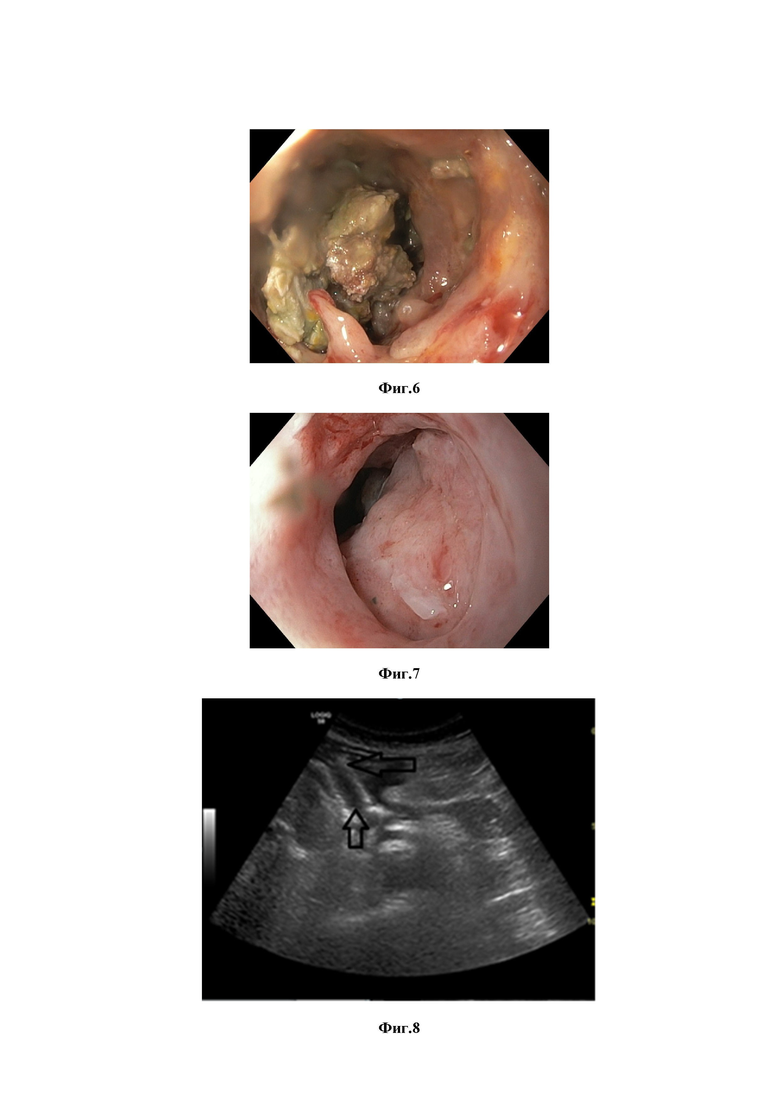
Изобретение поясняется иллюстративными материалами, демонстрирующими результаты проведенных этапов лечения по заявляемому способу у конкретного пациента, где на фиг. 1 представлено ультразвуковое изображение брюшной полости при поступлении пациента (1 – секвестр, 2 – неоднородное жидкостное скопление в сальниковой сумке, 3 – печень); на фиг.2 - рентгенологическая картина контрастирования полости панкреатогенной деструкции контрастом «Тразограф» с визуализацией ограниченной полости панкреатогенной деструкции, фрагмента эндоскопа с катетером; на фиг.3 - покрытый нитиноловый саморасширяющийся стент типа «dog bone» в теле желудка, сообщающийся с зоной панкреатогенной деструкции; на фиг.4 - эндоскопическая некросеквестрэктомия под визуальным контролем, вызуализирующая захват секвестра эндоскопическими щипцами; на фиг.5 - аппликация композиции на основе аллогенных тромбоцитов и коллагена 1 типа стенок полости с визуализацией катетера, через который производится аппликация указанных препаратов; на фиг.6 - очищение полости от гноя, формирование грануляционной ткани на 6 сутки после аппликации композиции аллогенных тромбоцитов и коллагена 1 типа; на фиг.7 - уменьшение полости, отсутствие гноя и секвестров, гранулирование стенок полости на 15 сутки после аппликации композиции аллогенных тромбоцитов и коллагена 1 типа; на фиг.8 - ультразвуковое изображение органов брюшной полости со стентом в области тела ПЖ, демонстрирующее отсутствие полости, отмечаются диффузные изменения в области тела поджелудочной железы.
Осуществление изобретения
1. Транслюминальное дренирование зон панкреатогенной деструкции под контролем эндосонографии.
В рентген-операционной под эндотрахеальным наркозом в положении больного на спине выполняют эндосонографию конвексным эндоскопом с использованием СО2-инсуффлятора. При эндосонографии выявляют локализацию зоны панкретогенной деструкции, прилежащей к стенке полого органа. Затем определяют траекторию для безопасного выполнения соустья, исходя из минимального расстояния между стенкой желудка и зоной деструкции и отсутствия на траектории дренирования крупных сосудов (диаметром более 3 мм). Через намеченную точку под контролем эндосонографии выполняют формирование соустья с помощью цистотома в режиме EndoCut I эффект 3. Затем через канал цистотома в полость деструкции заводят струну. По струне заводят эндоскопический катетер. Содержимое из зоны панкреатогенной деструкции полностью аспирируют через эндоскопический катетер, проведенный через рабочий канал эндоскопа, и отправляют на бактериологическое исследование, для подтверждения инфицирования панкреонекроза и корректировки антибактериальной терапии. Затем через тот же эндоскопический катетер производят тугое наполнение зоны панкреатогенной деструкции водорастворимым контрастным препаратом «Тразограф» в разведение физиологическим раствором 1:3 и определяют объем введенного контраста. Объем полости измеряют для расчета дозировки вводимых препаратов. Контрастирование полости контрастом тразограф позволяет определить точные размеры полости распада, ее границы и герметичность. Затем по струне через сформированное соустье между стенкой полого органа и зоной панкреатогенной деструкции устанавливают саморасширяющийся покрытый нитиноловый стент с воронкообразно расширенными торцами типа «dog bone».
2. Проведение программных эндоскопических санаций полости панкреатогенной деструкции, некросеквестрэктомии и инстилляций раствора антибиотика
Наличие саморасширяющегося стента препятствует уменьшению диаметра соустья между просветом полого органа и полостью распада, а также позволяет многократно проводить гибкий эндоскоп в полость деструкции и под визуальным контролем оценивать динамику процесса репарации тканей и уменьшения полости распада.
Ежедневно в положении больного на левом боку выполняют ЭГДС. Гибкий эндоскоп проводят через нитиноловый стент в просвет полости. Через рабочий канал эндоскопа промывают просвет полости раствором антисептика объемом, трехкратно превышающим объем полости (мирамистин 0,01%, диоксидин 0,5%, хлоргексидин 0,05%). Под визуальным контролем фиксированные фрагменты некротизированной ткани захватывают эндоскопическими щипцами, проведёнными через рабочий канал эндоскопа, и извлекают их в полость полого органа.
Учитывая отсутствие адекватного воздействия на микроорганизмы в полости распада при системном парентеральном использовании антибиотиков и необходимость местной антибактериальной терапии, выполняют введение раствора антибиотика в полость деструкции. В качестве превентивной антибиотикотерапии может быть использован цефалоспориновый антибиотик III поколения – Цефтриаксон.
Объем антибиотика определяют из расчета 0,5мг на 100см3 полости, не превышая максимально разрешенную дозировку. Эндоскопический катетер проводят через рабочий канал эндоскопа. К проксимальному концу стандартного-катетера подсоединяют шприц с раствором антибиотика, к которому чувствительны микроорганизмы на основании полученных результатов бактериологического исследования. Перемещением поршня шприца вводят раствор антибиотика в полость распада. После высевания микроорганизмов из содержимого полости распада и определения их чувствительности к антибиотикам производят коррекцию местной антибактериальной терапии.
При очищении стенок полости от некротизированных тканей переходят к следующему этапу лечения – стимуляции процессов регенерации, способствующему регрессу полости деструкции. Для этого готовят персоницифированную композицию на основе препарата аутологичной богатой тромбоцитами плазмы и раствора аллогенного коллагена 1 типа.
3. Подготовка препарата аутологичной богатой тромбоцитами плазмы
Аутологичная богатая тромбоцитами плазмы (аутоБоТП) может быть получена по стандартной методике с помощью двухэтапного центрифугирования (ссылка???). Для этого у пациента из кубитальной вены в вакутейнеры с ЭДТА забирают 30 мл крови и тщательно перемешивают для предотвращения образования сгустков. Затем вакутейнеры с венозной кровью центрифугируют с ускорением 300 g в течение 5 минут, в стерильных условиях отбирают супернатант с тромбоцитами и помещают его в стерильные одноразовые центрифужные пробирки типа «Falcon». Пробирки с супернатантом центрифугируют с ускорением 700 g в течение 17 минут, из пробирки удаляют излишек плазмы таким образом, чтобы конечный объем составлял 3 мл. Осадок ресуспендируют, в результате в готовой аутоБоТП концентрация тромбоцитов в среднем в 2,5-4 раза больше по сравнению с исходной кровью.
4. Подготовка 0,7-0,9% раствора коллагена
Получение 0,7-0,9% раствора коллагена проводят по стандартной методике кислотной экстракции из сухожилий и связок человека [Silver, F. H., and Garg, A. K., “Chapter 17. Collagen: Characterization, Processing and Medical Applications,” Handbook of Biodegradable Polymers, A. J. Domb, J. Kost, and D. M. Domb, eds., Harwood Academic Publishers, Australia, 1997.]. Для приготовления раствора используют трупный материал, прошедший карантинизацию, с подтверждением безопасности. Выделенный коллаген отмывают дистиллированной водой от кислоты до конечной pH 5,6-6,2 и с помощью водного раствора хлоргексидина 0,05% доводят до указанной концентрации. В заключении полученный раствор стерилизуют УФО в течение 60 минут на расстоянии 5 см от источника.
5. Эндоскопическое введение композиции аутологичной богатой тромбоцитами плазмы и аллогенного коллагена 1 типа.
Как правило, на 4-5 сутки после проведенной санации и начала антибактериальной терапии при выполнении ЭГДС отмечают отсутствие гнойно-некротического секрета и секвестров в полости, что является критерием для начала стимуляции процессов регенерации. Во время ЭГДС эндоскоп через просвет стента проводят в полость распада. В полость распада через рабочий канал эндоскопа заводят эндоскопический спрей-катетер. Затем к проксимальному концу эндоскопического спрей-катетера подсоединяют шприц с аутологичной богатой тромбоцитами плазмой, подводят дистальный конец катетера к очищенной от некротических тканей поверхности полости и, перемещением поршня шприца производят распыление плазмы на стенки полости в объеме 3 мл препарата аутологичной богатой тромбоцитами плазмы на каждые 100 см3 объема полости распада. Далее производят замену спрей-катетера на стандартный катетер, после чего к проксимальному его концу подсоединяют шприц с раствором аллогенного коллагена 1 типа и перемещением поршня шприца производят аппликацию раствора аллогенного коллагена в объеме 10 мл раствора коллагена на каждые 100 см3 объема полости распада. Происходит связывание аллогенных тромбоцитов с коллагеном 1 типа, что приводит к освобождению большого количества тромбоцитарных факторов роста, способствующего активному росту грануляционной ткани и соответственно уменьшению полости панкреатогенной деструкции.
Инстилляцию аутологичной богатой тромбоцитами плазмы и раствора аллогенного коллагена 1 типа выполняют через каждые 48 часов до полного регресса полости.
Таким образом, эндоскопическое транслюминальное дренирование зон панкретогенной деструкции под контролем эндосонографии с установкой саморасширяющегося покрытого нитинолового стента создаёт возможность для проведения программных ежедневных высокоэффективных эндоскопических санаций полости деструкции, удаления секвестров под визуальным эндоскопическим контролем с введением растворов антибиотиков и композиции на основе раствора аллогенных тромбоцитов и коллагена 1 типа. Кроме того, проведение гибкого эндоскопа в полость распада позволяет оценивать динамику эндоскопической картины процессов репарации и созревания грануляционной ткани и контролировать уменьшение объёма полости панкреатогенной деструкции.
Клиническая апробация способа
Заяляемым способом было пролечено 12 пациентов с крупноочаговым панкреонекрозом. Всем пациентам под эндоскопическим контролем проводили санацию полости панкреатогенной деструкции 0,01% раствором Мирамистина и 0,05% раствором хлоргексидина количеством трехкратно превышающим объем полости, что способствовало уменьшению количества гнойного содержимого и секвестров в полости распада уже к 3-4 суткам.
В связи с тем, что зона панкреонекроза практически не кровоснабжается, применение стандартной парентеральной антибиотикотерапии не оказывает достаточного противомикробного действия. В связи с чем, в заявляемом способе была использована местная антибиотикотерапия, которая позволила снизить общую интоксикацию. Всем пациентам при эндоскопическом дренировании выполняли посев содержимого из полости распада для определения микрофлоры и ее чувствительности к антибиотикам.
По результатам бактериологического посева у 5 пациентов было выявлено Klebsiella pneumoniae (42%), у 4 Staphylococcus aureus (33%), у одного Escherichia coli (8,3%), у одного Pseudomonas aeruginosa (8,3%), у одного- Staphylococcus coagulase negative (8,3%). Все эти бактерии оказались чувствительны к цефотаксиму. 4 пациентам была назначена парентеральная антибиотикотерапия, 8 пациентам проводилась местная антибиотикотерапия. Определение оптимальной дозы антибиотика для местного применения производили исходя из размеров полости. Объем антибиотика определяли из расчета 0,5мг на 100см3 полости. У 8 пациентов, которым применялась местная антибиотикотерапия, температура тела и результаты биохимического анализа крови были нормализованы уже на 8-10 сутки, в то же время у пациентов, которым антибиотики назначали парентерально, температура тела и данные биохимического анализа крови нормализовались только на 12-20 сутки. При повторном посеве содержимого из полости распада на 7 сутки после дренирования было отмечено отсутствие микроорганизмов у пациентов, которым применяли местную антибиотикотерапию.
После очищения полости распада от гноя и секвестров на 3-4 сутки выполняли нанесение композиции богатой тромбоцитами плазмы и раствора аллогенного коллагена 1 типа. Коллаген, являясь основным белком соединительной ткани, обеспечивает фиксацию и дегрануляцию тромбоцитов в месте их соединения. Тромбоциты являются источником цитокинов (TGF, EGF, FGF, PDGF, VEGF, TNF, L8 и другие факторы роста) стимулирующих регенерацию.
Определение оптимального объёма композиции аутологичной богатой тромбоцитами плазмы и аллогенного коллагена 1 типа производили исходя из размеров полости. Двум пациентам была выполнена аппликация 5 мл раствора аллогенного коллагена 1 типа и 1 мл препарата аутологичной богатой тромбоцитами плазмы на каждые 100 см3 объема полости распада, что не показало достаточную эффективность на сроки уменьшения полости, которые составили 18-21 сутки. 8 пациентам было выполнено увеличение обьема раствора аллогенного коллагена 1 типа до 10 мл и препарата аутологичной богатой тромбоцитами плазмы до 3 мл на каждые 100 см3 объема полости распада, что позволило сократить сроки уменьшения полости на 13-15 сутки. Еще двум пациентам было выполнено увеличение дозы вводимого коллагена до 20мл, а препарата тромбоцитов плазмы до 5мл на каждые 100 см3 объема полости распада, что не привело к сокращению сроков уменьшения полости и составило также 13-14 суток. Динамика эндоскопической картины уменьшения полости распада у пациентов двух последних групп характеризовалась максимально быстрым очищением стенок полости от гнойно-некротических масс, фибрина, секвестров, ростом грануляционной ткани, которая заполняла полость и способствовала уменьшению её размеров.
Таким образом, было показано, что максимальное сокращение сроков регресса полости распада достигается использованием 10 мл раствора аллогенного коллагена 1 типа и 3 мл препарата аутологичной богатой тромбоцитами плазмы на каждые 100 см3 объема полости.
Клинический пример
Пациентка Д., 42 лет, поступила в приемное отделение ГБУЗ НИИ СП Склифосовского с жалобами на опоясывающие боли в верхних отделах живота, общую слабость, гипертермию до 38.0 С. При поступлении состояние тяжелое. Кожные покровы бледного цвета. Пульс 90 ударов в минуту, АД 130/80 мм рт. ст. Живот вздут, при пальпации болезнен в эпигастрии. На ультразвуковом исследовании органов брюшной полости выявлены неоднородные жидкостные скопления в парадуоденальной клетчатке шириной до 7,2 см, а также гипоэхогенные зоны шириной до 6,5 см с единичными газовыми включениями в парапанкреатической клетчатке (Фиг.1). Клинический диагноз: острый панкреатит, панкреонекроз с образованием инфицированных зон панкреатогенной деструкции в сальниковой сумке. В реанимационном отделении пациентке проводилась инфузионно-детоксикационная терапия, антисекреторная, антибактериальная терапии без положительного эффекта. На 3 сутки от начала заболевания было выполнено эндоскопическое дренирование зон панкреатогенной деструкции. При эндосонографии от антрального отдела желудка до кардиального отдела желудка по задней стенке визуализировали область панкреатогенной деструкции с жидкостными зонами до 8,1 см толщиной. Полость деструкции была негомогенная, в ней определяли детриты и секвестры.
В кардиальном отделе при эндосонографии определена бессосудистая зона. С помощью цистотома в режиме EndoCut I эффект 3 произведено формирование соустья с зоной панкреатогенной деструкции. После чего через катетер выполнена аспирация содержимого.
При тугом контрастирование был определен объем полости в 300см3. Рентгенологическая картина контрастирования зоны панкреатогенной деструкции водорастворимым контрастом «Тразограф» характеризовалась наличием полости неправильной формы размерами 11,5×7,2 см слева на уровне Th11-12 с неровными нечеткими контурами и негомогенной за счет нескольких нечетких дефектов наполнения тенью (Фиг. 2). В просвет отграниченной полости панкреатогенной деструкции был установлен покрытый нитиноловый саморасширяющийся стент (Фиг. 3). По стенту было отмечено поступление мутного гнойного содержимого с секвестрами с выраженным ихорозным запахом. В послеоперационном периоде пациентке выполняли ежедневные эндоскопические санации зон панкреатогенной деструкции до полного регресса полости. Гибкий эндоскоп заводили в полость панкреатогенной деструкции через просвет саморасширяющегося нитинолового стента и выполняли санацию просвета полости 900мл 0,01% раствора мирамистина. После отмывания полости панкреатогенной деструкции от гноя производили некросеквестрэктомию. С помощью эндоскопических щипцов, проведённых через рабочий канал эндоскопа, захватывали секвестры и удаляли их (Фиг. 4). В раннем послеоперационном периоде на 2 сутки после операции и до получения результатов посева выполняли местную привентивную антибиотикотерапию раствором Цефтриаксона 1,5мг. Полученные результаты бактериологического исследования содержимого полости распада позволили скорректировать антибиотикотерапию – выполняли инстилляцию раствора амикацина 1,5 мг до полного регресса полости по результатам эндоскопического исследования (при бактериологическом исследовании посева высеяли pseudomonas aeruginosa, чувствительную к амикацину). На 4 сутки после операции выполняли ЭГДС: при заведении эндоскопа в полость распада гнойно-некротический секрет и секвестры отсутствовали. Стенки полости были представлены гранулирующей поверхностью и покрыты очагами светлого фибрина. Через рабочий канал эндоскопа в полость деструкции заводили эндоскопический спрей-катетер. К проксимальному концу спрей-катетера подсоединяли шприц с 9мл раствора на основе препарата аутологичной богатой тромбоцитами плазмы и выполняли ее распыление на стенки полости. После чего выполняли замену спрей-катетера на стандартный. К проксимальному его концу подсоединяли шприц с 30мл раствора коллагена 1типа, и выполняли аппликацию раствора на стенки полости деструкции (Фиг.5).
Уже на 6 сутки после транслюминального дренирования отмечали значительную положительную динамику: на поверхности стенок полости отмечали формирование множества грануляций (Фиг.6). При ультразвуковом исследовании на 15 сутки после дренирования описанные ранее жидкостные зоны отсутствовали. К этому времени у пациентки полностью купировался болевой синдром, температура тела нормализовалась. Полость распада уменьшилась в размерах, на ее стенках определяются множественные грануляции (Фиг.7).
На 60 сутки при контрольном ультразвуковом исследовании органов брюшной полости зоны панкреатогенной деструкции отсутствовали, отмечались диффузные изменения в области тела поджелудочной железы. Визуализировали стент между просветом желудка и областью тела поджелудочной железы (Фиг.8). Пациентке была выполнена ЭГДС, во время которой с помощью эндоскопических щипцов стент был удален.
Список литературы
1. Yadav D, Lowenfels AB. The epidemiology of pancreatitis and pancreatic cancer. Gastroenterology. 2014; 144(6): 1252-1261. https://doi.org/10.1053/j.gastro.2013.01.068
2. Затевахин И. И., Кириенко А. И., Кубышкин В. А. Абдоминальная хирургия. Национальное руководство: краткое издание. М.: ГЭОТАР-Медиа; 2016. [Zatevahin II, Kirienko AI, Kubyshkin VA. Abdominal surgery. National Leadership: Short Edition. M.: GEHOTAR-Media; 2016. (in Russ.)]
3. Lévy P, Domínguez-Muñoz E, Imrie C, Löhr M Maisonneuve P. Epidemiology of chronic pancreatitis: burden of the disease and consequences. United European Gastroenterol, J. 2014; 2: 345-354
4. Muniraj T, Aslanian HR, Farrell J, Jamidar PA. Chronic pancreatitis, a comprehensive review and update. Part I: epidemiology, etiology, risk factors, genetics, pathophysiology, and clinical features. Dis Mon. 2014; 60(12): 530–550. https://doi.org/10.1016/j.disamonth.2014.11.002
5. Гостищев B.C., Глушко В.А. Панкреонекроз и его осложнения, основные принципы хирургической тактики // Хирургия. – 2003. – № 3. – С. 50–54.
6. Изимбергенов М.Н., Койшибаев А.С., Изимбергенова Г.Н., Иманбаев К.С. Контрольно-санационные лапароскопии сальниковой сумки в послеоперационном периоде в лечении панкреонекрозов, осложненных абдоминальным сепсисом. Клиническая медицина. 2013;4:49-53.
7. Чернядьев С.А., Шестков Н.Г. Особенности распространения и динамика острого панкреатита в современных условиях // Российский медикобиологический вестник им. академика И.П. Павлова. – 2008. – № 4. С. – 64-68.
8. Демин Д.Б., Лайков А.В., Фуныгин М.С., Чегодаева А.А., Солодов Ю.Ю., Бутина К.В. Применение малоинвазивного доступа под ультразвуковым контролем в хирургическом лечении жидкостных образований брюшной полости и забрюшинного пространства. Вестник хирургии. 2014;173:1:81-83.
9. Брискин Б.С., Халидов О.Х., Алияров Ю.Р. и др. Эволюция взглядов на хирургическое лечение острого деструктивного панкреатита. Анналы хир гепатол 2009; 3: 53—60.
10. Бурневич С.З., Гельфанд Б.Р., Орлов Б.Б., Цыденжанов Е.Ц. Деструктивный панкреатит: современное состояние проблемы. Вестник хирургии. 2000;159:2:116-123.
11. Novel collagen/gelatin scaffold with sustained release of basic fibroblast growth factor: clinical trial for chronic skin ulcers [Text] / N. Morimoto, K. Yoshimura, M. Niimi [et al.] // Tissue Eng. Part A. - 2013. - Vol. 19. – P. 1931–1940.
12. Морфологическая оценка влияния коллагеновой повязки на заживление ожоговых ран IIIa степени [Текст] / Е. Г. Колокольчикова, М. В. Сычевский, Е. А. Жиркова [и др.] // Трансплантология. – 2010. - № 3-4. – С. 64-67.
13. Влияние ранней санационной фибробронхоскопии с аппликацией коллагена 1-го типа человека на сроки эпителизации повреждений слизистой оболочки трахеи и бронхов у пациентов с ингаляционной травмой / А.В. Макаров, А.В. Миронов, И.Е. Галанкина, С.В. Смирнов, И.Н. Пономарёв, Н.В. Боровкова // Журнал им. Н.В. Склифосовского «Неотложная медицинская помощь». - 2018.- Т.7, №2.- С.111-116.
14. Эффективность эндоскопической аппликации раствора человеческого коллагена I типа при лечении ингаляционной травмы / И.Е. Галанкина, А.В. Макаров, А.В. Миронов, С.В. Смирнов, Н.В. Боровкова, И.Н. Пономарев, А.М. Гасанов // Общая реаниматология. - 2018. - Т.14, № 3. - С.4-14.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ лечения лимфоцеле ложа нефротрансплантата после аллогенной трансплантации почки | 2020 |
|
RU2739125C1 |
| СПОСОБ ЭНДОСКОПИЧЕСКОГО ЛЕЧЕНИЯ ХИМИЧЕСКИХ ОЖОГОВ ПИЩЕВОДА | 2022 |
|
RU2781332C1 |
| СПОСОБ ЗАБОРА БИОЛОГИЧЕСКОЙ ЖИДКОСТИ ИЗ ТОНКОЙ КИШКИ ЧЕРЕЗ КАНАЛ ЭНДОСКОПА | 2020 |
|
RU2738007C1 |
| СПОСОБ ВЫБОРА ТАКТИКИ ЭНДОСКОПИЧЕСКОГО ЛЕЧЕНИЯ ПАЦИЕНТОВ С ХИМИЧЕСКИМИ ОЖОГАМИ ПИЩЕВОДА | 2022 |
|
RU2802745C1 |
| СПОСОБ ВЫБОРА ТАКТИКИ ЭНДОСКОПИЧЕСКОГО ЛЕЧЕНИЯ ПАЦИЕНТОВ С ОПУХОЛЕВЫМИ СТЕНОЗАМИ БИФУРКАЦИИ ТРАХЕИ И БРОНХОВ 1-3 ПОРЯДКА | 2024 |
|
RU2835734C1 |
| СПОСОБ ВЫБОРА ТАКТИКИ ЛЕЧЕНИЯ ПАЦИЕНТОВ С КОРОТКИМИ РУБЦОВЫМИ СТЕНОЗАМИ ПИЩЕВОДА | 2024 |
|
RU2831904C1 |
| СПОСОБ КОНСЕРВАТИВНОГО ЛЕЧЕНИЯ ПАЦИЕНТОВ СО СФОРМИРОВАННЫМИ КИШЕЧНЫМИ СВИЩАМИ НЕОПУХОЛЕВОГО ГЕНЕЗА | 2024 |
|
RU2839966C1 |
| СПОСОБ БИЛАТЕРАЛЬНОГО ЭНДОПРОТЕЗИРОВАНИЯ НИЖНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ ПРИ БИФУРКАЦИОННОМ СТЕНОЗЕ | 2022 |
|
RU2784980C1 |
| КОМПЛЕКТ СТЕНТОВ ДЛЯ БИЛАТЕРАЛЬНОГО ЭНДОПРОТЕЗИРОВАНИЯ НИЖНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ ПРИ БИФУРКАЦИОННОМ СТЕНОЗЕ | 2022 |
|
RU2796867C1 |
| СПОСОБ ЛЕЧЕНИЯ НАРУЖНОГО СВИЩА ПРОКСИМАЛЬНОГО ОТДЕЛА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ПОСЛЕ ГАСТРЭКТОМИИ ИЛИ РЕЗЕКЦИИ ЖЕЛУДКА С РЕКОНСТРУКЦИЕЙ ПО БИЛЬРОТ-II ПОД КОНТРОЛЕМ УЛЬТРАЗВУКА И РЕНТГЕНОСКОПИИ | 2019 |
|
RU2726603C1 |

Изобретение относится к медицине, а именно к хирургии, эндоскопии, реаниматологии, и может быть использовано для эндоскопического транслюминального лечения инфицированного панкреонекроза. Для этого выявляют область локализации панкреатогенной деструкции, прилежащей к стенке полого органа - желудка или двенадцатиперстной кишки, формируют соустье между областью деструкции и стенкой полого органа под контролем эндоскопической ультрасонографии, проводят эндоскопический катетер, аспирируют содержимое из области панкреатогенной деструкции и определяют объем полости деструкции. Затем в сформированное соустье устанавливают саморасширяющийся стент, через который проводят эндоскоп, и осуществляют санацию полости панкреатогенной деструкции раствором антисептика, некросеквестрэктомию и инстилляцию раствора антибиотика через рабочий канал эндоскопа, после чего через рабочий канал эндоскопа в область деструкции вводят аутологичную богатую тромбоцитами плазму и затем раствор аллогенного коллагена 1 типа, при этом на каждые 100 см3 объема полости деструкции вводят 10 мл раствора аллогенного коллагена 1 типа и 3 мл препарата аутологичной богатой тромбоцитами плазмы. Способ позволяет улучшить результаты лечения больных за счет стимуляции регенерации эпителиальных тканей при снижении летальности, травматичности и сроков госпитализации. 6 з.п. ф-лы, 1 пр., 8 ил.
1. Способ эндоскопического транслюминального лечения инфицированного панкреонекроза, включающий введение эндоскопа в область панкреатогенной деструкции с последующим выполнением некросеквестрэктомии и санации полости раствором антисептика, а также введение антибиотика, отличающийся тем, что сначала выявляют локализацию области панкреатогенной деструкции, прилежащей к стенке полого органа - желудка или двенадцатиперстной кишки, определяют точку для безопасного выполнения соустья исходя из минимального расстояния между стенкой полого органа и областью панкреатогенной деструкции и отсутствия на траектории соустья крупных сосудов диаметром более 3 мм, через данную точку под контролем эндоскопической ультрасонографии формируют соустье, проводят эндоскопический катетер, осуществляют аспирацию содержимого из области панкреатогенной деструкции, и определяют объем полости деструкции; после чего в сформированное соустье устанавливают саморасширяющийся стент, через который проводят эндоскоп, при этом санацию полости панкреатогенной деструкции раствором антисептика, некросеквестрэктомию и инстилляцию раствора антибиотика осуществляют через рабочий канал эндоскопа, после чего через рабочий канал эндоскопа в область деструкции вводят аутологичную богатую тромбоцитами плазму и затем раствор аллогенного коллагена 1 типа, при этом на каждые 100 см3 объема полости деструкции вводят 10 мл раствора аллогенного коллагена 1 типа и 3 мл препарата аутологичной богатой тромбоцитами плазмы.
2. Способ по п.1, отличающийся тем, что богатую тромбоцитами плазму вводят в область деструкции посредством распыления плазмы на стенки полости.
3. Способ по п.1, отличающийся тем, что введение аутологичной богатой тромбоцитами плазмы и раствора аллогенного коллагена 1 типа выполняют через каждые 48 часов до полного регресса полости панкреатогенной деструкции.
4. Способ по п.1, отличающийся тем, что объем полости панкреатогенной деструкции определяют по объему заполнения данной полости водорастворимым контрастным веществом, вводимым в полость через эндоскопический катетер.
5. Способ по п.1, отличающийся тем, что используют саморасширяющийся покрытый нитиноловый стент с воронкообразно расширенными торцами типа «dog bone».
6. Способ по п.1, отличающийся тем, что санацию раствором антисептика проводят объемом, трехкратно превышающим объем полости панкреатогенной деструкции.
7. Способ по п.1, отличающийся тем, что некросеквестрэктомию проводят под визуальным контролем с использованием эндоскопических щипцов, проведённых через рабочий канал эндоскопа.
| СПОСОБ САНАЦИИ ГНОЙНО-НЕКРОТИЧЕСКИХ ОЧАГОВ БРЮШНОЙ ПОЛОСТИ И ЗАБРЮШИННОГО ПРОСТРАНСТВА ПРИ ОСТРОМ ДЕСТРУКТИВНОМ ПАНКРЕАТИТЕ | 2005 |
|
RU2311873C2 |
| WO 2013050049 A1, 11.04.2013 | |||
| СЕДУН В.В | |||
| Роль лапароскопии в диагностике и лечении деструктивного панкреатита// Острый деструктивный панкреатит, 1994, том 4, с.7-29 | |||
| KATO M | |||
| et al | |||
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
Авторы
Даты
2020-12-28—Публикация
2020-07-03—Подача