Изобретение относится к области биохимии, а именно, к получению новой, модифицированной формы термостабильного белка GroEL микроорганизма Т. thermophilus. Может быть использовано в фармакологической промышленности в качестве белка-носителя для биосинтеза рекомбинантных пептидов, синтез которых не рентабелен существующими технологиями, в научно-исследовательских лабораториях для наработки различных пептидов в целях поиска обладающих необходимыми свойствами.
Семейство белков-шаперонов GroEL выглядит привлекательным как белок-носитель для системы слитых белков [Alexey N. Fedorov, and Maria S. Yurkova. Molecular Chaperone GroEL - toward a Nano Toolkit in Protein Engineering, Production and Pharmacy // Nano World J. 2018. T. 4. №1. C. 8-15]. Данный шаперон представляет собой большую частицу, состоящую из двух гептамеров. Полость, образованная протомером, вмещает белковый субстрат. GroEL является хорошо изученным шапероном, его структура и функционирование подробно описаны [Horwich A.L., Farr G.W., Fenton W.A. GroEL-GroES-mediated protein folding // Chem. Rev. 2006. T. 106. №5. C. 1917-1930; Horwich A.L. и др. Two families of chaperonin: physiology and mechanism // Annu Rev Cell Dev Biol. 2007. T. 23. C. 115-145]. Обычно одна молекула белкового субстрата связывается с одним протомером GroEL; что касается всей частицы, обычно между двумя протомерами при связывании субстратного белка наблюдается отрицательная кооперативность. Общая полость, образованная внутри гептамера, достаточна для размещения достаточно большого субстратного белка [Thirumalai D., Lorimer G.H. Chaperonin-mediated protein folding // Annu. Rev. Biophys. Biomol. Struct. 2001. Т. 30. С. 245-269; Saibil Н. Chaperone machines for protein folding, unfolding and disaggregation // Nat. Rev. Mol. Cell Biol. 2013. T. 14. №10. C. 630-642].
Присоединение дополнительных аминокислотных последовательностей к последовательности GroEL влияет на стабильность шаперона. И его N-конец, и С-конец глубоко погружены в белковую глобулу, так что присоединение любых дополнительных последовательностей к любым из концов может повлиять на третичную и четвертичную структуры. Некоторые результаты исследований показывают, что размещение 6His-tag дестабилизирует исходную структуру частиц GroEL и что очистка His-tagged GroEL происходит с низкой эффективностью и в результате дает только мономерную форму. Изучение трехмерной структуры GroEL предполагает, что присоединение любых дополнительных последовательностей к его концам должно дестабилизировать его структуру. Основной целью данного исследования было достижение способности GroEL являться белком-носителем для присоединения целевых пептидов, сохраняя при этом свою третичную и четвертичную структуры. Единственное исследование, которое ранее рассматривало этот вопрос, было основано на анализе случайных вставок транспозонов в геном GroEL. Было обнаружено, что транспозоновые вставки дестабилизировали частицу GroEL, все они приводили к дестабилизации колец гептамера, многие мутанты были нерастворимы [Amatore D., Baneyx F. Insertion mutagenesis of Escherichiacoli GroEL // Biochem. Biophys. Res. Commun. 2003. T. 302. №2. C. 246-252]. Естественное ограничение этого подхода и, как следствие, ограничение его выводов следует из анализа ограниченного числа вариантов транспозонов, которые не были предварительно выбраны для оптимального размещения вставки с учетом третичной структуры. Известно, что случайные вставки транспозона обычно инактивируют белки и влияют на их нативную структуру.
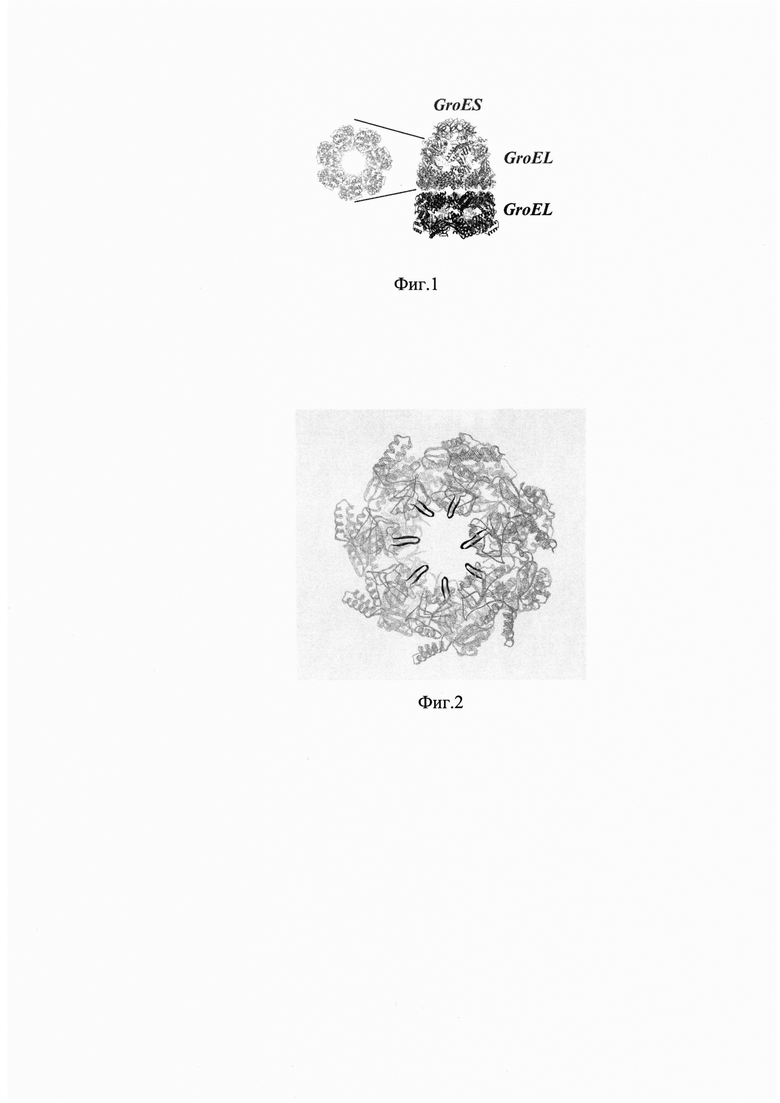
Анализ кристаллической структуры мономера GroEL с разрешением 2,8  показывает, что каждая субъединица имеет три домена. В большинстве организмов GroEL имеет сложную четвертичную структуру, состоящую из двух колец по семь мономеров в каждом, и стабилизированную кольцом из семи мономеров ко-фактора GroES (фиг. 1)
показывает, что каждая субъединица имеет три домена. В большинстве организмов GroEL имеет сложную четвертичную структуру, состоящую из двух колец по семь мономеров в каждом, и стабилизированную кольцом из семи мономеров ко-фактора GroES (фиг. 1)
Технический результат изобретения заключается в повышении стабильности, термостабильности и уровня экспрессиии модифицированного белка GroEL в клетке-хозяине, понижение чувствительности аминокислотной последовательност к протеолизу, а также обязательное содержание в кодирующей части полилинкера для возможности интеграции последовательности целевого пептида.
Технический результат изобретения достигается тем, что создается конструкт версии шаперона GroEL микроорганизма Т. thermophilus, с помощью изменения кодирующей последовательности ДНК GroEL - между кодонами по положениям Ser199 и Tyr201 интегрировали полилинкер с последовательностью GGATCCAAGCTTGAATTC. Эта последовательность содержит рестрикционные сайты BamHI, HindIII и EcoRI и соответствует транскрипции Gly-Ser-Lys-Leu-Glu-Phe. Анализ третичной структуры мономера GroEL показывает, что аминокислотные остатки Ser199 и Tyr201 расположены на субтрат-связывающей поверхности апикального домена GroEL, но не входят в состав жестких структур, образующих субстрат-связывающую поверхность. В стабильной частице GroELS аминокислотные остатки Ser199 и Tyr201 находятся на поверхности, обращенной внутрь полости частицы (фиг. 2), что делает возможным последующее использование модифицированного белка в качестве белка-носителя в слитых конструктах с целевым пептидом. Частица GroELS обладает высокой молекулярной массой (более 850 кДа), что технологически упрощает выделение конструкта из клеточного лизата методами гель-фильтрации и ультрафильтрации. Использование шаперона термофильного микроорганизма, помимо того, позволяет проводить первую стадию очистки с помощью тепловой денатурации эндогенных белков мезофильной бактерии.
Модифицированный белок после вставки полилинкера не должен изменять нативную конформацию, а должен оставаться стабильным и хорошо растворимым.
Существенными признаками, характеризующими изобретение, в отличие от исходной версии белка, является использование модифицированного термостабильного белка GroEL микроорганизма Т. thermophilus с наличием полилинкера для возможности его использования для создания конструктов с целевым пептидом, высокоэкспрессивной, не подверженной протеолизу, с нейтрализацией любой пептидной цитотоксичности.
Краткое описание фигур и чертежей:
Фиг. 1 Структура комплекса GroELS.
Фиг. 2 Протомер GroEL. Выделены места введения полилинкера на субстрат-связывающей поверхности апикального домена.
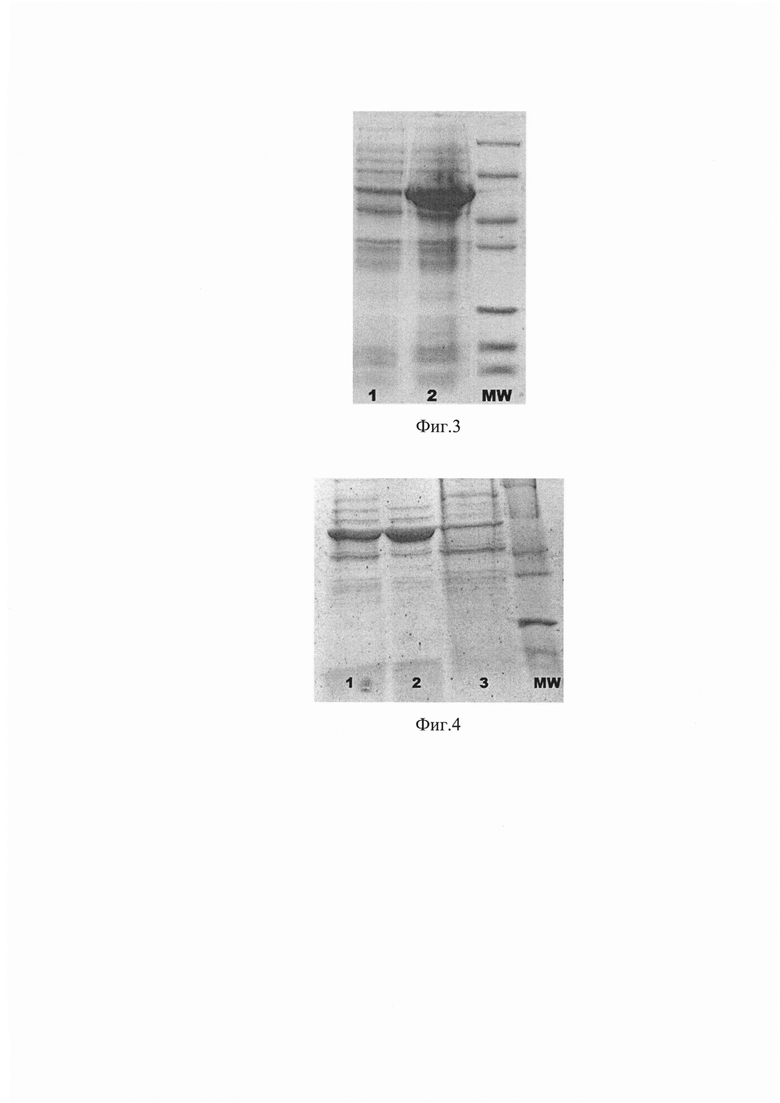
Фиг. 3 Экспрессия GroEL с интегрированной последовательностью полилинкера 1 - до индукции ИПТГ 2 - после индукции ИПТГ.
Фиг. 4 Электрофорез белкового профиля модифицированного GroEL с интегрированным полилинкером. 1 - клеточный лизат до нагревания, 2 - супернатант после прогревания, 3 - осадок после прогревания, MW - белковый маркер молекулярного веса.
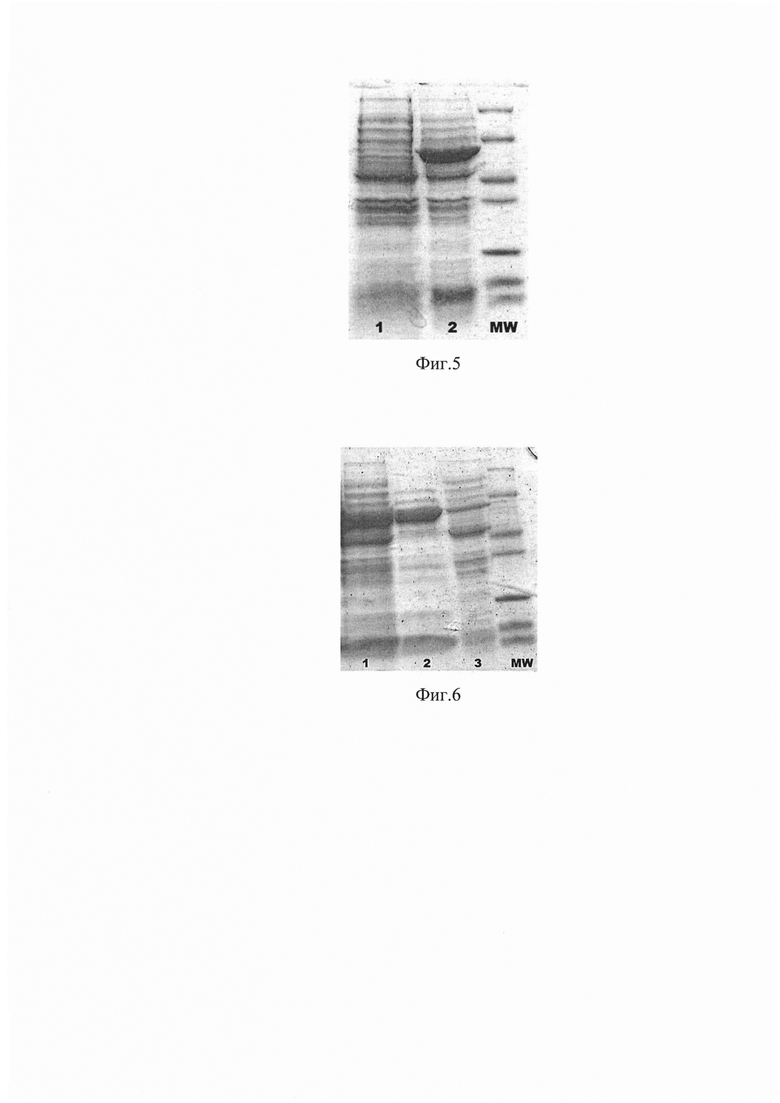
Фиг. 5 Экспрессия GroEL с интегрированной последовательностью полифемузина в положении полилинкера 1 - до индукции ИПТГ 2 - после индукции ИПТГ.
Фиг. 6 Электрофорез белкового профиля модифицированного GroEL с интегрированным полифемузином. 1 - клеточный лизат до нагревания, 2 - супернатант после прогревания, 3 - осадок после прогревания, MW - белковый маркер молекулярного веса.
Предложенный способ поясняется следующими материалами:
Проводили введение полилинкера в ген GroEL. Небольшой полилинкер, содержащий BamHI, HindIII и EcoRI, вводили для клонирования в ген между триплетами, кодирующими аминокислоты Ser199 и Tyr201. На первой стадии два сегмента желаемой генной конструкции отдельно амплифицировали с использованием в качестве матрицы ДНК Т. Thermophilus (RefSeq assembly: GCF_000091545.1; GenBank: AP008226.1). Первый фрагмент амплифицировали с использованием праймеров SeqID №1-2, второй с использованием праймеров SeqID №3-4. Реакции проводили в следующих условиях: Pfu buffer 1x(20 mM Tris-HCl pH=8.8; 10 mM (NH4)SO4, 10 mM KCl, 0.1% Triton X-100 v/v, 0.1 mg/ml BSA), 1.2u Pfu-polymerase, 10 pmol each primers, по следующей схеме ПЦР: 94°C 3 минуты, 40 циклов (94°С 40 сек, 60°С 40 сек, 72°С 2 минуты), 72°С 3 минуты.
Фрагменты очищали методом агарозного гель-электрофореза в 1% агарозном геле в 1x буфере ТБЕ, очищали фрагмент с помощью набора для очистки ДНК из геля «QIAEX II Gel Extraction Kit»
Комбинационная амплификация с использованием очищенных фрагментов, полученных на предыдущей стадии, в виде матриц и двух праймеров SeqID №1 и SeqID №4, продуцировала нуклеотидную последовательность гена, кодирующую GroEL с полилинкером. Реакцию проводили в следующих условиях: Pfu buffer 1x(20 mM Tris-HCl pH=8.8; 10 mM (NH4)SO4, 10 mM KCl, 0.1% Triton X-100 v/v, 0.1 mg/ml BSA), 1.2u Pfu-polymerase, 10 pmol each primers, по следующей схеме ПЦР: 94°C 3 минуты, 40 циклов (94°С 40 сек, 60°С 40 сек, 72°С 2 минуты), 72°С 3 минуты.
Фрагмент очищали методом агарозного гель-электрофореза в 1% агарозном геле в 1x буфере ТБЕ с помощью набора для очистки ДНК из геля «QIAEX II Gel Extraction Kit»
Далее полученный фрагмент расщепляли рестрикционными ферментами NdeI и BglII следующих условиях: 1x буфер О (Orange) (50 mM Tris-HCl рН=7.5, 10 mM MgCl2, 100 mM NaCl, 0.1 mg/ml BSA), по 5 ед.а. каждого фермента BglII и NdeI, 50 нг ДНК и инкубировали при 37°С в течение 16 часов.
GroES амплифицировали с использованием праймеров SeqID №5-6 содержащие сайты рестрикции для NcoI и NotI, соответственно, и генома Т. thermophilus в качестве матрицы в следующих условиях: Pfu buffer 1x(20 mM Tris-HCl pH=8.8; 10 mM (NH4)SO4, 10 mM KCl, 0.1% Triton X-100 v/v, 0.1 mg/ml BSA), 1.2u Pfu-polymerase, 10 pmol каждого праймера, по следующей схеме ПЦР: 94°С 3 минуты, 40 циклов (94°С 40 сек, 60°С 40 сек, 72°С 2 минуты), 72°С 3 минуты. Полученный фрагмент ПЦР расщепляли ферментами NcoI и NotI в следующих условиях: Tango buffer 2x(66 mM Tris-acetate pH=7.9, 20 mM magnesium acetate, 132 mM potassium acetate, 0.2 mg/ml BSA), 5 ед.а. каждого фермента NcoI и NotI; инкубировали при 37°С в течение 16 часов. Далее клонировали в первый полилинкер экспрессии бицистронного вектора рЕТ Duet и получали вектор экспрессии pGroES. Лигирование проводили в следующих условиях: Ligation buffer 1x(40 mM Tris-HCl pH=7.9, 10 mM MgCl2, 10 mM DTT, 0.5 mM ATP), 20 нг плазмиды, 1:5 молярном соотношении вектор-вставка, 2 ед.а. лигазы по Вейсу. Лигирование проводили при 22°С в течении 1 часа.
Затем клонировали фрагмент GroEL с интегрированным целевым полилинкером в полилинкер экспрессирующего бицистронного вектора рЕТ Duet вместе с геном, кодирующим Т. thermophilus GroES. Лигирование проводили в следующих условиях: Ligation buffer 1x(40 mM Tris-HCl pH=7.9, 10 mM MgCl2, 10 mM DTT, 0.5 mM ATP), 20 нг плазмиды, 1:5 молярном соотношении вектор-вставка, 2 ед.а. лигазы по Вейсу. Лигирование проводили при 22°С в течение 1 часа, что дает экспрессирующий вектор ploop/ES.
Химически компетентные клетки штамма E.coli pLysE в объеме 50 мкл размораживали на льду, затем добавляли 5 мкл лигазной смеси и инкубировали 30 минут на льду. Затем проводили термический шок при 42°С в течение 30 сек с последующим инкубированием на льду в течение 5 минут. Далее к трансформантам приливали 1 мл среды SOC предварительно нагретой до 37°С и инкубировали в течение 1 часа при постоянном покачивании в термостате-качалке. Далее 20 мкл проинкубированной смеси рассевали на чашки с твердой питательной средой LB, содержащей 100 мкг/мл ампициллина. Выращивали колонии в течение ночи при 37°С. Далее проводили аналитическую экспрессию по индивидуальным клонам, с индуктором 0.4 мМ ИПТГ (фиг. 3).
Экспрессия генов в экспрессионном штамме E.coli pLysE осуществлялась в среде LB, при 37оС в течение 3 часов; селективный агент - ампициллин 100 мкг/мл.
Для очистки целевого белка проводили лизис с помощью френчпресса в буфере PBS (0.137 M NaCl, 0.0027 М KCl, 0.01 М Na2HPO4, 0.0018 M KH2PO4) при 4°C. Далее разбавляли в 5 раз буфером PBS с последующим прогреванием клеточного лизата при 62°С в течение 5 мин на водяной бане, и далее центрифугировали при 13000g в течение 15 мин. (фиг. 4)
В качестве подтверждения функциональности слитой конструкции, по зонам рестрикции интегрированного полилинкера был вставлен полипептид «Полифемузин», известный своей бактерицидной активностью. Последовательность полифемузина SeqID №7 была оптимизирована для использования в E.coli. Этот вариант полифемузина был гибридизирован из двух олигонуклеотидов SeqID №8-9. Олигонуклеотиды были сконструированы таким образом, что полученный полифемузин имел готовые липкие концы для клонирования по сайтам BamHI/EcoRI полилинкера, введенного в ген GroEL. Бицикронный векторный конструкт был расщеплен рестрикционными ферментами BamHI и EcoRI, и в него заклонировали полифемузин. Все результаты процедур клонирования были подтверждены секвенированием.
Экспрессия генов в экспрессионном штамме E.coli pLysE осуществлялась в среде LB, при 37°С в течение 3 часов; селективный агент - ампициллин 200 мкг/мл. (фиг. 5)
Очищали полипептид нагреванием клеточного лизата при 62°С в течение 5 мин на водяной бане с последующим центрифугированием при 13000g в течение 15 мин. (фиг. 6)
Пример 1. Получение модифицированного белка GroEL
Стадия 1.
Отдельно амплифицировать с использованием в качестве матрицы ДНК Т. Thermophilus (RefSeq assembly: GCF_000091545.1; GenBank: AP008226.1) первый фрагмент с использованием праймеров SeqID №1-2, второй с использованием праймеров SeqID №3-4. Реакцию провести в следующих условиях: Pfu buffer 1x(20 mM Tris-HCl pH=8.8; 10 mM (NH4)SO4, 10 mM KCl, 0.1% Triton X-100 v/v, 0.1 mg/ml BSA), 1.2u Pfu-polymerase, 10 pmol each primers, по следующей схеме ПЦР: 94°C 3 минуты, 40 циклов (94°С 40 сек, 60°С 40 сек, 72°С 2 минуты), 72°С 3 минуты.
Фрагменты очистить методом агарозного гель-электрофореза в 1% агарозном геле в 1х буфере ТБЕ с помощью набора для очистки ДНК из геля «QIAEX II Gel Extraction Kit»
Провести комбинационная амплификацию с использованием очищенных фрагментов, полученных на предыдущей стадии, в виде матриц и двух праймеров SeqID №1 и SeqID №4 в следующих условиях: Pfu buffer 1x(20 mM Tris-HCl pH=8.8; 10 mM (NH4)SO4, 10 mM KCl, 0.1% Triton X-100 v/v, 0.1 mg/ml BSA), 1.2u Pfu-polymerase, 10 pmol each primers, по следующей схеме ПЦР: 94°C 3 минуты, 40 циклов (94°С 40 сек, 60°С 40 сек, 72°С 2 минуты), 72°С 3 минуты.
Фрагмент очистить методом агарозного гель-электрофореза в 1% агарозном геле в 1х буфере ТБЕ с помощью набора для очистки ДНК из геля «QIAEX II Gel Extraction Kit»
Стадия 2.
Полученный фрагмент расщепить рестрикционными ферментами NdeI и BglII следующих условиях: 1х буфер О (Orange) (50 mM Tris-HCl рН=7.5, 10 mM MgCl2, 100 mM NaCl, 0.1 mg/ml BSA), по 5 ед.а. каждого фермента BglII и NdeI, 50 нг ДНК и инкубировать при 37°С в течение 16 часов.
Стадия 3.
GroES амплифицировать с использованием праймеров SeqID №5-6 содержащие сайты рестрикции для NcoI и NotI, соответственно, и генома Т. thermophilus в качестве матрицы в следующих условиях: Pfu buffer 1x(20 mM Tris-HCl pH=8.8; 10 mM (NH4)SO4, 10 mM KCl, 0.1% Triton X-100 v/v, 0.1 mg/ml BSA), 1.2u Pfu-polymerase, 10 pmol каждого праймера, по следующей схеме ПЦР: 94°С 3 минуты, 40 циклов (94°С 40 сек, 60°С 40 сек, 72°С 2 минуты), 72°С 3 минуты. Полученный фрагмент ПЦР расщепить ферментами NcoI и NotI в следующих условиях: Tango buffer 2x(66 mM Tris-acetate pH=7.9, 20 mM magnesium acetate, 132 mM potassium acetate, 0.2 mg/ml BSA), 5 ед.а. каждого фермента NcoI и NotI; инкубировали при 37°С в течение 16 часов. Далее клонировать в первый полилинкер экспрессии бицистронного вектора рЕТ Duet и получить вектор экспрессии pGroES. Лигирование проводить в следующих условиях: Ligation buffer 1x(40 mM Tris-HCl pH=7.9, 10 mM MgCl2, 10 mM DTT, 0.5 mM ATP), 20 нг плазмиды, 1:5 молярном соотношении вектор-вставка, 2 ед.а. лигазы по Вейсу. Лигирование проводить при 22°С в течение 1 часа.
Стадия 4.
Клонировать фрагмент GroEL с интегрированным целевым полилинкером, полученным на стадии 2, в полилинкер экспрессирующего бицистронного вектора рЕТ Duet вместе с геном, кодирующим Т. thermophilus GroES. Лигирование проводить в следующих условиях: Ligation buffer 1x(40 mM Tris-HCl pH=7.9, 10 mM MgCl2, 10 mM DTT, 0.5 mM ATP), 20 нг плазмиды, 1:5 молярном соотношении вектор-вставка, 2 ед.а. лигазы по Вейсу. Лигирование проводить при 22°С в течение 1 часа.
Стадия 5.
Химически компетентные клетки штамма E.coli pLysE в объеме 50 мкл разморозить на льду, затем добавить 5 мкл лигазной смеси, полученной на стадии 4, и инкубировать 30 минут на льду. Затем провести термический шок при 42°С в течение 30 сек с последующим инкубированием на льду в течение 5 минут. Далее к трансформантам добавить 1 мл среды SOC, предварительно нагретой до 37°С, и инкубировать в течение 1 часа при постоянном покачивании в термостате-качалке. Далее 20 мкл проинкубированной смеси рассеить на чашки с твердой питательной средой LB, содержащей 100 мкг/мл ампициллина. Выращивать колонии в течение ночи при 37°С. Далее провести аналитическую экспрессию по индивидуальным клонам, с индуктором 0.4 мМ ИПТГ.
Разработанный вариант GroEL представляет собой белок, состоящий из 548 аминокислотных остатка с молекулярным весом 58370 Дальтон.
| название | год | авторы | номер документа |
|---|---|---|---|
| Слитый белок, содержащий модифицированный безметиониновый белок GroEL и димер полипептида полифемузина I | 2019 |
|
RU2760578C2 |
| Белок GroEL микроорганизма Thermus thermophilus с измененной аминокислотной последовательностью | 2018 |
|
RU2731895C2 |
| Способы получения молекулярных конструкций, содержащих антигенные эпитопы актуальных аллергенов и сигнальные пептиды, обладающие иммунорегуляторными свойствами | 2012 |
|
RU2622004C2 |
| ПЛАЗМИДА pNAN5, ОПРЕДЕЛЯЮЩАЯ СИНТЕЗ L-АСПАРАГИНАЗЫ ЕсА2, ШТАММ BACILLUS CEREUS 1576-pNAN5 - ПРОМЫШЛЕННЫЙ ШТАММ-ПРОДУЦЕНТ РЕКОМБИНАНТНОЙ L-АСПАРАГИНАЗЫ ЕсА2 И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2006 |
|
RU2313575C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pBi101-IL18, КОДИРУЮЩАЯ СИНТЕЗ ИНТЕРЛЕЙКИНА-18 ЧЕЛОВЕКА В ТРАНСГЕННЫХ РАСТЕНИЯХ | 2005 |
|
RU2302460C1 |
| СПОСОБ ПОЛУЧЕНИЯ БЕЗМЕТИОНИНОВОГО ИНТЕРФЕРОНА-АЛЬФА2b ЧЕЛОВЕКА | 2009 |
|
RU2432401C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ЧЕЛОВЕЧЕСКОГО ИНТЕРФЕРОНА АЛЬФА-2B, РЕКОМБИНАНТНАЯ ПЛАЗМИДА И ШТАММ ПРОДУЦЕНТ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2003 |
|
RU2242516C1 |
| СПОСОБ ТЕСТИРОВАНИЯ ВЕЩЕСТВ, ВЛИЯЮЩИХ НА ПРОЦЕСС СТАРЕНИЯ | 2011 |
|
RU2497950C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕНАТУРИРОВАННЫХ МЕМБРАННЫХ БЕЛКОВ | 2005 |
|
RU2306319C1 |
| Рекомбинантная плазмида pUSB2-AmQ, обеспечивающая синтез белка альфа-амилазы Bacillus amyloliquefaciens, и штамм Bacillus subtilis/pUSB2-AmQ - продуцент белка альфа-амилазы Bacillus amyloliquefaciens | 2020 |
|
RU2747627C1 |

Изобретение относится к термостабильному белку GroEL микроорганизма Thermus thermophilus. Предложен термостабильный белок GroEL микроорганизма Thermus thermophilus, используемый в качестве белка-носителя целевых пептидов в слитых белковых конструкциях для экспрессии в клетках микроорганизма хозяина. Кодирующая последовательность ДНК указанного белка содержит полилинкер GGATCCAAGCTTGAATTC между кодонами, соответствующими положениям Ser199 и Tyr201, при этом последовательность полилинкера содержит сайты рестрикции HindIII, BamHI, EcoRI, и соответствует последовательности Gly-Ser-Lys-Leu-Glu-Phe. Изобретение обеспечивает повышение стабильности, термостабильности и уровня экспрессии указанного белка GroEL в клетке-хозяине. 6 ил., 1 пр.
Термостабильный белок GroEL микроорганизма Thermus thermophilus, используемый в качестве белка-носителя целевых пептидов в слитых белковых конструкциях для экспрессии в клетках микроорганизма хозяина, кодирующая последовательность ДНК которого содержит полилинкер GGATCCAAGCTTGAATTC между кодонами, соответствующими положениям Ser199 и Tyr201, при этом последовательность полилинкера содержит сайты рестрикции HindIII, BamHI, EcoRI, и соответствует последовательности Gly-Ser-Lys-Leu-Glu-Phe.
| ЗЕНИН В.А | |||
| И ДР | |||
| Подходы к эффективной стабилизации белков с помощью молекулярных шаперонов и их производных | |||
| АКТУАЛЬНЫЕ ВОПРОСЫ БИОЛОГИЧЕСКОЙ ФИЗИКИ И ХИМИИ, 2016, номер: 1-1, с | |||
| Синхронизирующее устройство для аппарата, служащего для передачи изображений на расстояние | 1920 |
|
SU225A1 |
| FEDOROV A.N | |||
| ET AL | |||
| Molecular Chaperone GroEL - toward a Nano Toolkit in Protein Engineering, Production and Pharmacy | |||
| NanoWorld J | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
Авторы
Даты
2021-01-20—Публикация
2018-11-28—Подача