Изобретение относится к биофамакологии, препаративной биохимии и биотехнологии, а именно к способам промышленного получения рекомбинантного белка L-аспарагиназы ЕсА2 медицинского назначения, а также к плазмидам для его получения и рекомбинантным штаммам Bacillus cereus.
L-аспарагиназа ЕсА2 представляет собой бактериальный (Escherichia coli) полипептид гомотетрамерной структуры с молекулярной массой 130000 Да [1]. Наиболее широко и успешно L-аспарагиназа применяется для лечения острых лимфобластных лейкозов, лимфо- и ретикулосарком, что объясняется специфичностью метаболических процессов в клетках этих форм опухолей. В ряде случаев отмечается положительный эффект при использовании фермента для лечения болезни Ходжкина, хронической лимфоцитарной лейкемии и меланосаркомы.
В настоящее время в онкологической практике нашли практическое применение выпускаемые за рубежом препараты нативных L-аспарагиназ из Е.coli (ASP, Elspare), Erwinia (ERW, Erwinase) и иммобилизованного на полиэтиленгликоле фермента из Е.coli (PEG, Oncaspar).
Известны способы получения рекомбинантного белка L-аспарагиназы с использованием штаммов Escherichia coli и, значительно реже, других микроорганизмов: [2] и RU №2224797, RU №2221868.
Основным недостатком этих способов получения являются высокие технологические затраты, большие потери белка при очистке и трудность отделения правильно свернутого белка от белка с неправильной конформацией, а также сложность удаления ЛПС, обладающего высокой пирогенностью.
Бациллы, в том числе и рекомбинантные, могут синтезировать белки в большом количестве и секретировать их во внешнюю среду культивирования. Это свойство бацилл существенно, так как секретируемые белки правильно свернуты с конформационной точки зрения. Кроме этого, у бацилл отсутствует эндотоксический ЛПС, и отпадает необходимость в его удалении. Все это позволяет резко снизить технологические затраты на производство рекомбинантноого белка. Однако значительный уровень протеолитической активности и слабая проработанность методов генетической инженерии для бацилл осложняет их использование в качестве продуцентов рекомбинантных белков. Это подтверждает интенсивное использование в качестве продуцентов Bacillus subtilis, которое пока не привело к позитивным примерам, так как выявило очень высокий уровень протеолитической активности и широкий спектр белков, синтезируемых во время интенсивного культивирования.
Задачей данного изобретения является конструирование рекомбинантого промышленного штамма-продуцента Bacillus creus с низкой протеазной активностью и плазмиды, кодирующей синтез рекомбинантного белка L-аспарагиназы ЕсА2.
Указанная задача решалась созданием рекомбинантной плазмиды pNAN5 и штамма Bacillus cereus 1576-pNAN5.
Технический результат заявленного изобретения - повышение выхода рекомбинантной L-аспарагиназы с высокой чистотой и упрощение технологии получения.
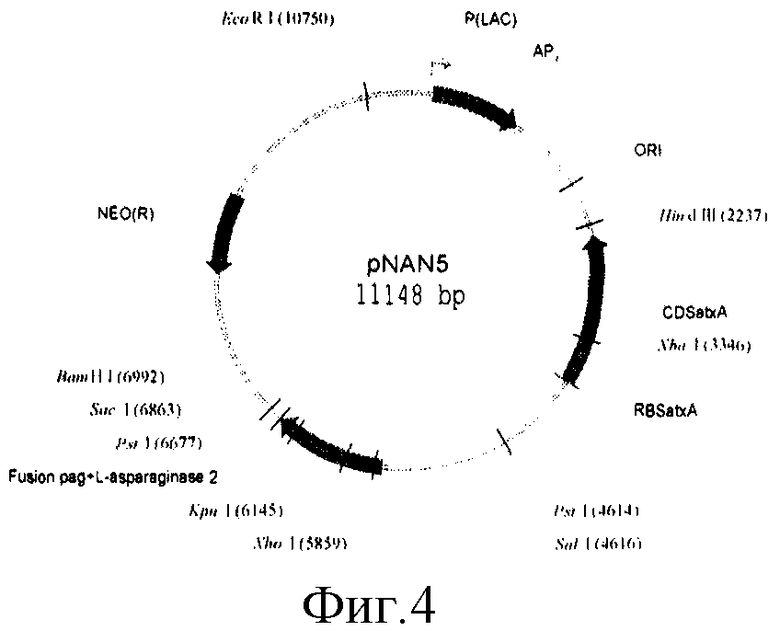
Плазмида pNAN5 имеет 11148 пар оснований (п.о.) и характеризуется наличием следующих фрагментов:
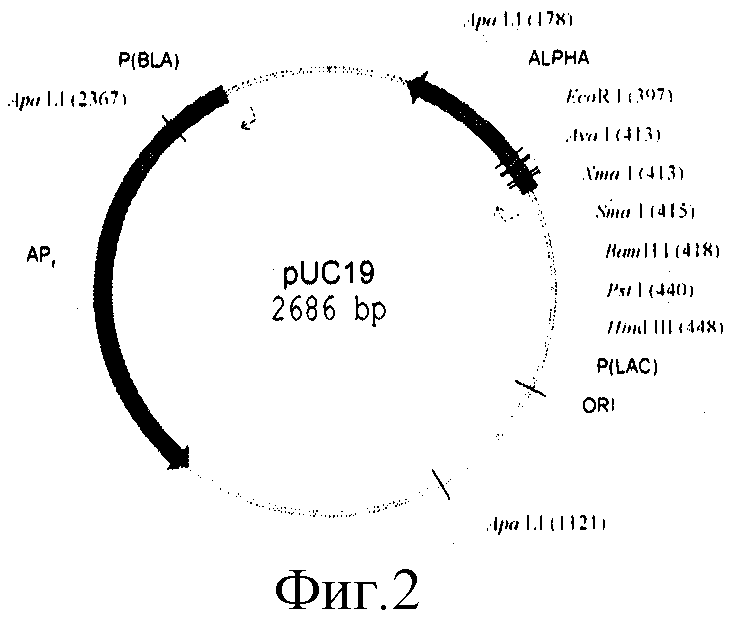
- последовательность с 1 нуклеотида по 2237 нуклеотид (н.) включает фрагмент ДНК плазмиды pUC19 размером 2237 п.о., содержащий промотор гена β-лактамазы (ген устойчивости к ампициллину - AmpR);
- последовательность с 2238 н. по 4614 н. включает фрагмент ДНК размером 2376 п.о., содержащий последовательность полноразмерного гена регулятора транскрипции atxA;
- последовательность с 4615 н. по 4621 н. включает фрагмент ДНК размером 6 п.о., содержащий часть вектора pUC19 сайтом Sail;
- последовательность с 4622 н. по 6858 н. включает фрагмент ДНК размером 2237 п.о., содержащий химерный ген, состоящий из pag промотора с лидерным пептидом и структурной части гена аспарагиназы ЕсА2;
- последовательность с 6859 н. по 6997 н. включает фрагмент ДНК размером 8 п.о. вектора pUC19, содержащий сайты ресктрикции для SacI и BamHI;
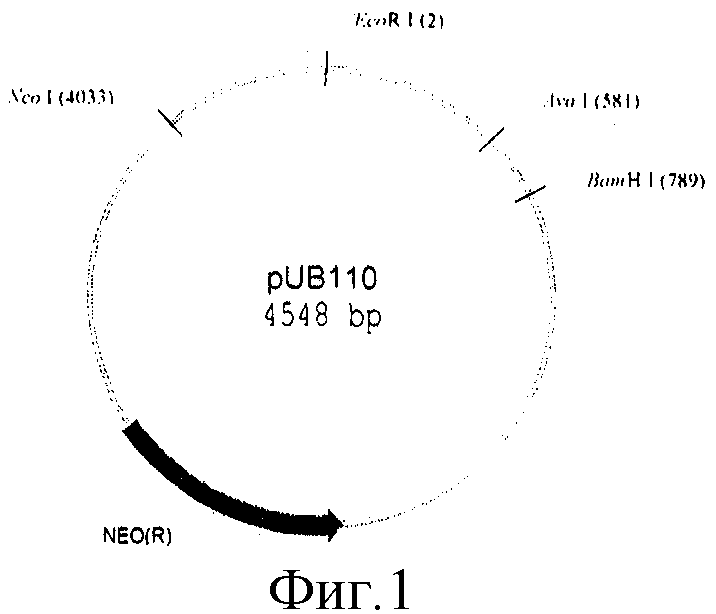
- последовательность с 6998 н. по 10755 н. включает фрагмент ДНК плазмиды pUB110 размером 3757 п.о., содержащий ori- и ген устойчивости к канамицину;
- последовательность с 10756 н. по 11148 н. включает фрагмент ДНК плазмиды pUC19 размером 393 п.о.
Изобретение поясняется чертежами.
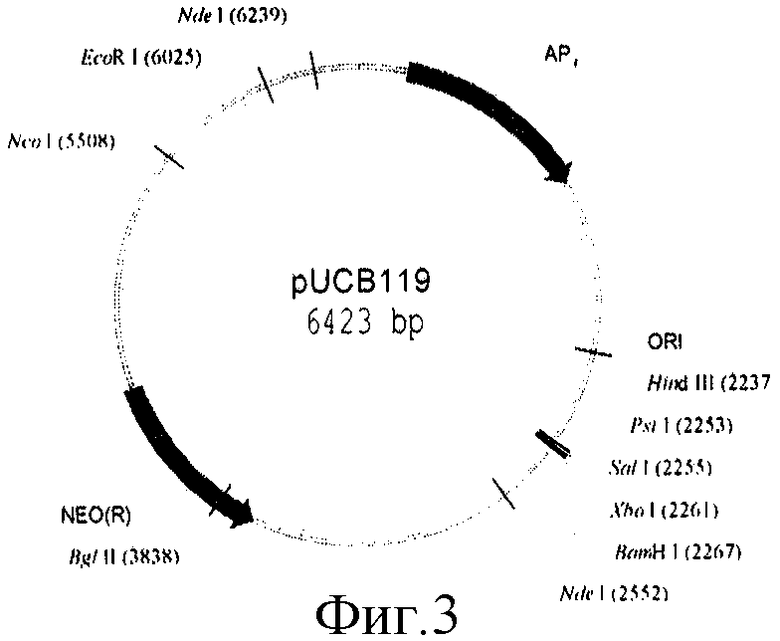
На фиг.1, 2, 3, 4 представлены физические карты плазмид pUB110, pUC19, pUCB119 и pNAN5.
Нуклеотидная последовательность фрагмента плазмиды pNAN5, фланкированная сайтами Xhol и SacI, содержащая последовательность структурного гена L-аспарагиназы ЕсА2.


Штамм Bacillus cereus 1576-pNAN5 получен трансформацией клеток Bacillus cereus 1576 плазмидой pNAN5 с использованием традиционной генно-инженерной технологии.
Штамм Bacillus cereus 1576 (коллекция ГосНИИгенетика г.Москва) характеризуется следующими признаками.
Культурально-морфологические признаки.
Клетки крупные, прямые, грамположительные палочки, образущие цепочки, спорообразующие.
Клетки хорошо растут на простых питательных средах. При росте на агаре "Дифко" образуются шероховатые серые колонии, с неровными краями. При росте в жидких средах (в минимальной среде с глюкозой или в LB-бульоне) образуют интенсивную ровную муть.
Физико-биологические признаки.
Факультативный анаэроб. Температурный диапазон роста 4-45°С при оптимуме рН 6,5-8,0.
В качестве источника азота используют как минеральные соли в аммонийной и нитратной формах, так и органические соединения в виде аминокислот, пептона, триптона, дрожжевого экстракта и т.д.
В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам.
Клетки проявляют спонтанную устойчивость к некоторым антибиотикам (стрептомицину до 5 мкг/мл, тетрациклину до 3 мкг/мл).
Патогенность и токсичность.
Рекомбинантный штамм Bacillus cereus 1576-pNAN5 не обладает остаточной патогенностью и при инфицирующей дозе 109 КОЕ не вызывает гибели беспородных белых мышей. В тестах на токсичность на белых мышах, морских свинках и кроликах не вызывает негативных проявлений в дозе до 109 КОЕ при подкожном введении.
Серологические свойства.
Рекомбинантный штамм теряет свойства секретировать энтеротоксины, протеазы и некоторые другие белки, синтез которых детерминируется инактивированным регулятором транскрипции PIcR.
Способ, условия и состав среды для хранения штамма.
В L-arape под маслом, в виде споровой суспензии с глицерином (до 30%) при -20°С.
Штамм Bacillus cereus 1576-pNAN5 идентифицирован по Определителю Берги (1974) как штамм вида Bacillus cereus.
Особенностью заявляемого способа является разработка технологии, позволяющая выделять рекомбинантный белок L-аспарагиназы ЕсА2 в чистом виде с минимальным количеством стадий.
Способ заключается в культивировании в питательной среде, содержащей на литр 3,6 г казаминовых кислот, 3,0 г дрожжевого экстракта, 8,0 г бикарбоната натрия, 3,0 г натрия хлорида и по 0,1 г 9 аминокислот, штамма Bacillus cereus 1576-pNAN5, удалении бактериальной массы с помощью фильтрации на фильтре МФО-1 (Владипор), концентрировании культуральной жидкости на полых волокнах UP 10 (Amicon), проведением гельфильтрации на ультрагеле Sephacryl S200 (Amersham) и концентрировании на ультрафильтрационной ячейке.
Оптимальными условиями проведения отдельных стадий получения рекомбинантной L-аспарагиназы ЕсА2 являются следующие:
- ферментацию проводят при непрерывном добавлении субстратов в течение 8 часов, что обуславливает высокий уровень экспрессии рекомбинантной L-аспарагиназы ЕсА2;
- удаление бактериальной культуры на фильтре Владипор;
- концентрирование на полых волокнах;
- хроматографическая очистка рекомбинантной L-аспарагиназы ЕсА2 на колонке с Sephacryl S200.
Выход рекомбинантной L-аспарагиназы ЕсА2 в результате применения описанного способа составляет не менее 20 мг рекомбинантной L-аспарагиназы ЕсА2 с 1 л культуральной среды.
Существенными отличиями заявляемого способа от аналогов являются:
- использование конструкции штамма продуцента Bacillus cereus с низкой протеазной активностью, что позволяет получать при биосинтезе большое количество полноразмерной рекомбинантной L-аспарагиназы ЕсА2;
- использование ультрафильтрационного концентрирования и эксклюзивной хроматографии этого фермента из полусинтетической среды микроанаэробного культивирования, что позволяет получать чистый белок рекомбинантной L-аспарагиназы ЕсА2 за короткое время и с малыми потерями;
- использование штамма Bacillus cereus 1576-pNAN5, не имеющего эндотоксичного ЛПС, позволяет получать рекомбинантную L-аспарагиназу ЕсА2 без бактериальных эндотоксинов;
- одностадийная хроматографическая очистка рекомбинантной L-аспарагиназы ЕсА2 позволяет получать белок более 95-98% чистоты по данным электорофореза в редуцирующих условиях.
Сущность и преимущества заявляемой группы изобретений иллюстрируется следующими примерами.
Пример 1. Конструирование штамма Bacillus cereus 1576 с низкой протеазной активностью.
Низкая протеазная активность штамма Bacillus cereus 1576 обусловлена инактивацией регуляторного гена pleR. Инактивация гена pleR была осуществлена с помощью гомологичной рекомбинации. В качестве суицидного вектора использовали вектор pYJ335 [3], содержащий ксилоза-тетрациклин-контролируемый промотор. ПЦР-фрагмент (ΔplcRF GGGGGGCCCGGGTATAGTGGGATGGTGAGTAAG; ΔplcRR GGGGGGCCCGGGAATAGCTTTATTTGCATGACA), содержащий ΔplcR и фланкированный двумя рестрикционными сайтами SmaI, был введен в EcoRV сайт вектора pYJ335. Сконструированная плазмида была электропорирована в штамм Bacillus cereus с селекцией по эритромицину. На среде с эритроцитами были отобраны не гемолитичные трансформанты, которые затем были проверены с помощью полимеразной цепной реакции со специфическими праймерами на гомологичную рекомбинацию (sphVF 5' GTATTCATTCATTATATTCACTGTG 3'; ΔplcRR 5' GGGGGGCCCGGGAATAGCTTTATTTGCATGACA 3').
Пример 2. Конструирование плазмиды pNAN5.
Способ конструирования плазмиды pNAN5 включает следующие этапы:
- конструирование бирепликонной плазмиды pUCB119;
- промежуточной плазмиды, содержащей pag промотор и структурную часть гена аспарагиназы;
- конструирование плазмиды pNANI, состоящей из бирепликонной плазмиды pUCB119 и гена регулятора транскрипции atxA;
- конструирование рекомбинантной плазмиды pNAN5, состоящей из плазмиды pNANI и химерного гена, состоящего из pag промотора и структурной части гена аспарагиназы есА2 (11148 п.о.).
Конструирование бирепликонной плазмиды pUCB119.
Бирепликонная плазмида pUCB119 представляет собой объединенные по сайтам EcoRI and BamHI плазмиды pUB110 и pUC19.
Конструирование плазмиды, содержащей pag промотор и структурную часть гена аспарагиназы.
На первом этапе получают фрагмент, содержащий промотор и лидерный пептид pag гена, при помощи полимеразной цепной реакции с использованием ДНК плазмиды рХО1 в качестве матрицы и праймеров:
pagF - 5' GGATGAGCTCATTCTAGGTGATTTTTAAATTAT 3'
pagR - 5' CTGAGCTCCTCGAGATTACCTGTGCTTGAAACTA 3'
Данную и последующие ПЦР-реакции проводят в следующих условиях: 20 mM Tris-HCl, рН 8.8, 10 mM (NH4)2SO4, 10 mM KCl, 2 mM MgCl2, 0.1% Triton X100, 0.1 mg/ml BSA, 0.2 mM каждого dNTP, 1.25 ед. Pfu ДНК полимеразы, 100 нг ДНК. Процесс амплификации состоит из следующих стадий: прогревание при 95°С 5 мин, 35 циклов ПЦР (30 сек 95°С, 30 сек 56°С, 2 мин 72°С) и инкубация 10 мин при 72°С. После амплификации (и после последующих амплификаций) фрагмент ДНК очищают электрофоретически в 1% агарозном геле. Фрагмент обрабатывают последовательно рестриктазами Xhol и Sall в соответствии с методикой, описанной в работе [4].
Затем получают фрагмент, содержащий структурную часть гена есА2, при помощи полимеразной цепной реакции с использованием ДНК Е.coli К12 в качестве матрицы и праймеров:
asp2F - 5' ACGCTCGAGGTGATTCAGGCAGAATTACCCAATATCACCATTTTAGC 3'
asp2R - 5' GTCGAGCTCAGTACTGATTGAAGATCTGCTG 3'
Данную и последующие ПЦР-реакции проводят в следующих условиях: 20 mM Tris-HCl, рН 8.8, 10 mM (NH4)2SO4, 10 mM KCl, 2 mM MgCl2, 0.1% Triton X100, 0.1 mg/ml BSA, 0.2 mM каждого dNTP, 1.25 ед. Pfu ДНК полимеразы, 100 нг ДНК. Процесс амплификации состоит из следующих стадий: прогревание при 95°С 5 мин, 35 циклов ПЦР (30 сек 95°С, 30 сек 56°С, 2 мин 72°С) и инкубация 10 мин при 72°С. После амплификации (и после последующих амплификаций) фрагмент ДНК очищают электрофоретически в 1% агарозном геле. Фрагмент обрабатывают последовательно рестриктазами Xhol и SacI в соответствии с методикой, описанной в работе [4].
100 мкг плазмидной ДНК pUC19 обрабатывают последовательно рестриктазами Sall и SacI в соответствии с методикой, описанной в работе [4], и из полученного гидролизата выделяют в 1% геле легкоплавкой агарозы векторную часть плазмиды.
Полученные фрагменты и векторную часть плазмиды pUC19 сшивают при помощи лигазной реакции в 50 мкл буфера для лигирования [4]. 10 мкг реакционной смеси используют для трансформации компетентных клеток Е.coli HB 101. Трансформанты высевают на LB-arap, содержащий 50 мкг/мл ампицилина. После инкубирования в течение 16 час при 37°С, клоны отсевают, выделяют плазмидную ДНК и анализируют рестрикционным анализом. Отбирают ДНК, содержащую нужный набор рестрикционных фрагментов. Получают плазмиду pUCpag-asp.
Конструирование pNAN1
Фрагмент, содержащий структурный ген atxA, получают при помощи полимеразной цепной реакции с использованием ДНК плазмиды рХО1 в качестве матрицы и праймеров:
atxA113PF - 5' GCTCTGCAGGTTCTAAATCGTAAGGGGTT 3'
atxA2460HR - 5' CTCCAAGCTTATTCACCGTTCTTTCCTGTA 3'
Данную и последующие ПЦР-реакции проводят в следующих условиях: 20 mM Tris-HCl, рН 8.8, 10 mM (NH4)2SO4, 10 mM KCl, 2 mM MgCl2, 0.1% Triton Х100, 0.1 mg/ml BSA, 0.2 mM каждого dNTP, 1.25 ед. Pfu ДНК полимеразы, 100 нг ДНК. Процесс амплификации состоит из следующих стадий: прогревание при 95°С 5 мин, 35 циклов ПЦР (30 сек 95°С, 30 сек 58°С, 2 мин 72°С) и инкубация 10 мин при 72°С. После амплификации (и после последующих амплификации) фрагмент ДНК очищают электрофоретически в 1% агарозном геле. Фрагмент обрабатывают последовательно рестриктазами HindIII и PstI в соответствии с методикой,описанной в работе[4].
5 мкг плазмидной ДНК pUCB119 обрабатывают последовательно рестриктазами HindIII и PstI в соответствии с методикой, описанной в работе [4], и из полученного гидролизата выделяют в 1% геле легкоплавкой агарозы векторную часть плазмиды.
Полученный фрагмент и векторную часть плазмиды pUC19 сшивают при помощи лигазной реакции в 50 мкл буфера для лигирования [4]. 10 мкг реакционной смеси используют для трансформации компетентных клеток Е.coli HB 101. Трансформанты высевают на LB-агар, содержащий 50 мкг/мл ампицилина. После инкубирования в течение 16 час при 37°С клоны отсевают, выделяют плазмидную ДНК и анализируют рестрикционным анализом. Отбирают ДНК, содержащую нужный набор рестрикционных фрагментов. Получают плазмиду pNAN1.
Конструирование плазмиды pNAN5 (11148 п.о.).
5 мкг плазмидной ДНК pUCpag-asp обрабатывают последовательно рестриктазами Sall и BamHI в соответствии с методикой, описанной в работе [4], и из полученного гидролизата выделяют в 1% геле легкоплавкой агарозы фрагмент 1053 п.о., содержащий pag промотор и структурную части гена есА2.
5 мкг плазмидной ДНК pNAN1 обрабатывают последовательно рестриктазами Sall и BamHI и переосаждают в соответствии с методикой, описанной в работе [4].
Полученный фрагмент и обработанную рестриктазами плазмиду pNAN1 сшивают при помощи лигазной реакции в 50 мкл буфера для лигирования [4]. 1 мкг реакционной смеси используют для трансформации компетентных клеток Е.coli HB101. Трансформанты высевают на LB-агар, содержащий 50 мкг/мл ампицилина. После инкубирования в течение 16 час при 37°С клоны отсевают, выделяют плазмидную ДНК и анализируют рестрикционным анализом. Отбирают ДНК, содержащую нужный набор рестрикционных фрагментов. Получают плазмиду pNAN5 размером 11148 п.о.
Пример 2. Получение штамма Bacillus cereus 1576-pNANS - продуцента рекомбинантного белка L-аспарагиназы ЕсА2
Штамм продуцент рекомбинантной L-аспарагиназы ЕсА2 Bacillus cereus 1576-pNAN5 получают путем трансформации клеток штамма Bacillus cereus 1576 рекомбинантной плазмидой pNAN5. Штамм продуцент рекомбинантной L-аспарагиназы ЕсА2 выращивают в 10-литровом ферментере, заполненным 8 литрами среды, содержащей на литр 3,6 г казаминовых кислот, 3,0 г дрожжевого экстракта, 8,0 г бикарбоната натрия, 3,0 г натрия хлорида и по 0,1 г 9 аминокислот. Культивирование проводят при температуре 37°С в микроанаэробных условиях при перемешивании биомассы со скоростью 100 об./мин в течение 8 часов. Рекомбинантный микроорганизм синтезирует полноценный белок L-аспарагиназы ЕсА2 и секретирует ее в среду культивирования на уровне 15-20 мг/л.
Для определения продуктивности штамма отбирают пробы культуральной среды и анализируют электрофорезом в 15% полиакриламидном геле с додецилсульфатом натрия. Гель окрашивают Кумасси R-250 по стандартной методике и сканируют для определения относительного количества белка в полосе целевого белка. По данным сканирования содержание рекомбинантного белка L-аспарагиназы в культуральной среде составляет не менее 90% от всех секретируемых клеточных белков.
Пример 3. Выделение и характеризация рекомбинантного полипептида со свойствами L-аспарагиназы ЕсА2.
Штамм-продуцент рекомбинантной L-аспарагиназы ЕсА2 выращивают в 10-литровом ферментере, заполненным 8 литрами среды, содержащей на литр 3,6 г казаминовых кислот, 3,0 г дрожжевого экстракта, 8,0 г бикарбоната натрия, 3,0 г натрия хлорида и по 0,1 г 9 аминокислот. Культивирование проводят при температуре 37°С в микроанаэробных условиях при перемешивании биомассы со скоростью 100 об./мин в течение 8 часов. Удаление бактериальной культуры проводят на фильтре Владипор. Концентрирование рекомбинантного полипептида проводят на полых волокнах. После этого проводят хроматографическую очистку рекомбинантного полипептида на колонке с Sephacryl S200. Выход рекомбинантного полипептида в результате применения описанного способа, составляет не менее 20 мг с 1 л культуральной среды.
Подлинность полученного рекомбинантного полипептида определяют по первым 5 аминокислотам, определенным на автоматическом секвенаторе. Проведенное секвенирование препарата рекомбинантной L-аспарагиназы ЕсА2, выделенной из бацилл, выявило аминокислотную последовательность Leu-Pro-Asn-Ile-Thr, соответствующую первым 5 аминокислотам полноразмерного нативного белка L-аспарагиназы ЕсА2 с молекулярным весом 34 kDa.
Биологическую (ферментативную, общую) активность определяют с помощью реагента Несслера. Препарат рекомбинантного белка L-аспарагиназы ЕсА2 (200 мкл) смешивают с 800 мкл 20 mM боратного буферного раствора, содержащего 40 mM L-аспарагина, и инкубируют смесь в течение 30 мин при 72°С. Реакцию останавливают внесением 250 мкл 20% трихлоруксусной кислоты. Одна единица активности фермента равняется 1 μmol аммония, образующегося в результате гидролиза L-аспарагина в течение 1 мин. Удельная активность рекомбинантной L-аспарагиназы ЕсА2 из бацилл составляла 220 Ед/мг.
Полученные данные по характеристике и биологической (ферментативной, общей) активности продукта экспрессии искусственного гена L-аспарагиназы ЕсА2 в клетках штамма Bacillus cereus 1576-pNAN5 свидетельствуют о соответствии исследуемого полипептида его природному аналогу.
Как следует из приведенных примеров, заявляемая группа изобретений позволяет получать рекомбинантную L-аспарагиназу ЕсА2 с высоким выходом при относительно простой и надежной технологии.
Заявленное изобретение позволяет:
- с помощью использования штамма штамма Bacillus cereus 1576-pNAN5, не имеющего эндотоксичного ЛПС, получать рекомбинантную L-аспарагиназу ЕсА2, без бактериальных эндотоксинов, что подтверждает LAL-тест.
- использование штамма-продуцента Bacillus cereus 1576-pNAN5 с низкой протеазной активностью позволяет получать при биосинтезе большое количество полноразмерной рекомбинантной L-аспарагиназы ЕсА2.
использование ультрафильтрационного концентрирования и эксклюзивной хромотографии при очистке фермента из полусинтетической среды в процессе микроаанэробного культивирования позволяет получать фермент с чистотой более 98% за короткое время и с малыми потерями.
Источники информации
1. B.H.Frank, А.Н.Pekar, A.J.Vfros, P.K.Ho / Biol. Chemistry, Vol .245, No.14, Issue of July 26, pp.3716-3724, 1970.
2. J.Krasotkinal, A.Borisova, Y.V.Gervaziev and N.N.Sokolov / Biotechnol. Appl. Biochem. (2004) 39, 215-221.
3. Yinduo J.I., A.Marra, M.Martin, G.Woodnutt / J.Bacteriology 1999, p.6585-6590, Vol.181, No.21.
4. Sambrook J., Fritsch E.F., Maniatis Т. // Molecular Cloning. A. Laboratory Manual. 2bd ed. Cold Spring Harbor, NY, 1989.
5. Meister, A. Methods Enzymol. 1955, 2, 380-385.
Изобретение относится к биофамакологии, препаративной биохимии, биотехнологии, и касается получения рекомбинантного белка L-аспарагиназы ЕсА2. Конструируют плазмиду pNAN5, определяющую синтез L-аспарагиназы ЕсА2. Клетки штамма Bacillus cereus 1576 трансформируют указанной плазмидой, затем штамм-продуцент выращивают в питательной среде, удаляют бактериальную массу путем фильтрации, культуральную жидкость концентрируют на полых волокнах, проводят гельфильтрацию на ультрагеле Sephacryl S200, концентрируют на ультрафильтрационной ячейке. Изобретение позволяет повысить эффективность синтеза L-аспарагиназы ЕсА2. 3 н.п. ф-лы, 4 ил.
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PACYCLANS ДЛЯ ПЕРЕНОСА И ЭКСПРЕССИИ В КЛЕТКАХ ESCHERICHIA COLI ГЕНА L-АСПАРАГИНАЗЫ ERWINIA CAROTOVORA (ECAR-LANS) И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОЙ ECAR-LANS ИЗ БИОМАССЫ ШТАММА E.COLI-ПРОДУЦЕНТА | 2002 |
|
RU2224797C2 |
| Способ получения шенита | 1983 |
|
SU1237633A1 |
| JP 62036194, 17.02.1997. | |||
Авторы
Даты
2007-12-27—Публикация
2006-08-07—Подача