Изобретение относится к медицине, а именно к иммунологии, имплантологии, хирургии и может быть использовано для контроля биосовместимости с организмом полимерных материалов и изделий для эндопротезирования и/или длительного инвазивного использования по их способности провоцировать воспалительную реакцию.
В связи с увеличивающимся использованием новых материалов и изделий, внедряемых в ткани и органы человека с различными целями, особое значение приобретает разработка ускоренных методов для оценки их совместимости с организмом. Способность вызывать состояние сенсибилизации иммунокомпетентных клеток при непосредственном введении во внутреннюю среду организма во многом определяет степень биосовместимости имплантатов. Методы, позволяющие оценивать вживляемые материалы по характеру их влияния на развитие воспаления, используются при выборе полимеров, перспективных для медицины в целом, а также способов модификации их поверхности. Однако оценка индивидуальной реактивности пациента при выборе имплантируемых изделий из полимерных материалов в каждом конкретном случае не предусматривается.
Известен способ оценки биосовместимости матриц, изготовленных из поликапролактона, на основе изучения системных проявлений воспалительной реакции при имплантационных тестах у белых крыс [Тяпкина Д.А., Кустодов С.В., Грабенко Е.П. и др. Оценка воспалительных реакций у белых крыс при субкутанной имплантации поликапролактоновых матриц, минерализованных ватеритом // Bulletin of Medical Internet Conferences (ISSN 2224 - 6150). - 2019. - Vol. 9, Issue 5. - P. 198-199.].
Недостатки прототипа: неэкономичность и высокая трудозатратность, связанные с необходимостью использования большого количества лабораторных животных; продолжительность эксперимента (21 сутки); возможное влияние наркоза, операционной травмы на клеточные реакции; несовпадение результатов при другой локализации имплантатов и/или индивидуальной реактивности конкретного организма.
Технический результат: сокращение сроков исследования; снижение себестоимости и трудозатратности, а также исключение влияния факторов, связанных с имплантацией образцов в организм лабораторных животных (наркоз, операционная травма), благодаря проведению экспериментов ex vivo; обеспечение индивидуализации оценки биосовместимости полимерного материала, из которого изготовлен имплантат, для конкретного пациента.
Сущность метода заключается в том, что для оценки биосовместимости полимерного материала с организмом используют популяцию мононуклеарных лейкоцитов периферической венозной крови конкретного человека и тестируют их реакцию на полимер, из которого изготавливается предполагаемый имплантат, путем определения индекса стимуляции, как отношения удельной продукции основных провоспалительных цитокинов (ИЛ-1β и ИЛ-8) в пробе с полимерным образцом к удельной продукции тех же цитокинов в пробе со стеклом. При этом если индекс стимуляции превышает 1, то констатируют для такого полимерного материала низкую биосовместимость с организмом и высокую вероятность развития осложнений при имплантации.
Способ осуществляют следующим образом:
В предимплантационный период у пациента получают пробу периферической венозной крови и с помощью градиентного (фиколл-верографин; р=1,077 г/см3) центрифугирования выделяют популяцию мононуклеарных лейкоцитов. Клетки трижды отмывают свежим охлажденным раствором Хенкса (ООО «Биолот», Россия) и доводят до 2×106 клеток/мл. После этого клеточную суспензию вносят в лунки кругл о донного планшета с предварительно размещенными там образцами разных полимерных материалов (например, полиуретан, поливинилхлорид) в виде цилиндров длиною 3 мм и диаметром 1 мм. В качестве контролей используют лунки с образцами из стекла и пустые лунки не содержащие полимерных материалов. Планшеты инкубируют при 37°С в условиях 5% CO2 в течение 72 ч. По окончании инкубации в лунках подсчитывают общее число мононуклеарных лейкоцитов в камере Горяева, в том числе количество жизнеспособных, в тесте с трипановым синим [Мельникова Н.А., Шубина О.С., Дуденкова Н.А., Лапшина М.В., Лиференко О.В., Тимошкина О.И. Исследование жизнеспособности клеток при воздействии ацетата свинца на организм крысы // Современные проблемы науки и образования. - 2013. - №5. - С. 495.]. Содержимое лунок после инкубации центрифугируют и надосадочную жидкость используют для определения концентрации провоспалительных цитокинов ИЛ-1β и ИЛ-8 с помощью иммуноферментного метода [Симбирцев А.С, Тотолян А.А. Цитокины в лабораторной диагностике // Инфекционные болезни: новости, мнения, обучение. - 2015. - №2 (11). - С. 82-98.]. Для определения удельной продукции производят пересчет количества цитокинов на 1 жизнеспособную клетку. Для оценки развития воспалительной реакции для каждого провоспалительного цитокина вычисляют индекс стимуляции, как отношение удельной концентрации цитокина в пробе с образцом полимера к концентрации того же цитокина в пробе со стеклом. Для расчета используют следующие формулы:
1. ИС=УП/УС
2. УП=Ц/КЛЦ или УС=С/КЛС, где
УП - удельная продукция цитокина в присутствии полимерного образца, пг/клетка;
Ц - концентрация цитокина в пробе с полимерным образцом, пг/мл;
КЛЦ - количество мононуклеарных лейкоцитов в пробе с полимерным образцом, в 1 мл;
УС - удельная продукция цитокина в присутствии стекла, пг/клетка;
С - концентрация цитокина в пробе со стеклянным образцом, пг/мл;
КЛС - количество мононуклеарных лейкоцитов в пробе со стеклом, в 1 мл;
ИС - индекс стимуляции. При этом если индекс стимуляции превышает 1, то констатируют низкую биосовместимость с организмом и высокую вероятность развития осложнений при имплантации.
Примеры конкретного выполнения
Пример 1. У пациента А. получили пробу периферической венозной крови из кубитальной вены. С помощью градиентного (фиколл-верографин; р=1,077 г/см3) центрифугирования выделили популяцию мононуклеарных лейкоцитов. Клетки трижды отмыли свежим охлажденным раствором Хенкса и довели до 2x106 клеток/мл. После этого клеточную суспензию внесли в лунки круглодонного планшета с предварительно размещенными там образцами разных полимерных материалов, условно обозначенные как «№1» и «№2». Каждый образец был длиною 3 мм и диаметром 1 мм. В качестве контролей использовали лунки с образцами из стекла («Стекло») и лунки, не содержащие полимерных материалов. Планшеты инкубировали при 37°С в условиях 5% CO2 в течение 72 ч. По окончании инкубации в лунках подсчитывали общее число клеток и в том числе количество жизнеспособных в тесте с трипановым синим. Надосадочную жидкость после центрифугирования содержимого лунок использовали для определения концентрации ИЛ-1β и ИЛ-8 с помощью иммуноферментного метода. Уровень цитокинов пересчитали на 1 жизнеспособную клетку. После этого проводили расчет индекса стимуляции, как отношение концентрации цитокина в пробе с полимерным образцом к концентрации того же цитокина в пробе со стеклом.
Получены результаты представлены в таблице 1.
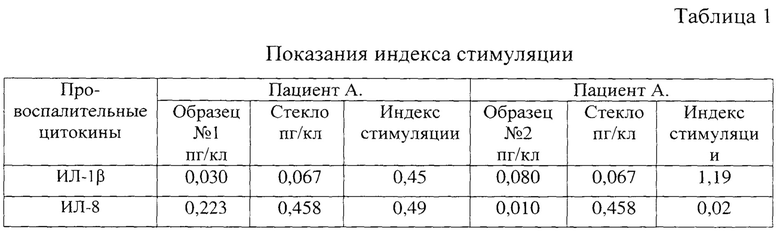
По показателям индекса стимуляции можно предположить, что иммунокомпетентные клетки пациента А. в присутствии образца №1 не сформируют воспалительный ответ, что, обусловлено его большей биосовместимостью. Напротив, присутствие образца №2 стимулирует лейкоциты, что отражается в повышении концентрации ИЛ-1β, и его использование для имплантации представляется нежелательным.
Пример 2. У пациента Б. получили пробу периферической венозной крови из кубитальной вены. С помощью градиентного (фиколл-верографин; р=1,077 г/см3) центрифугирования выделили популяцию мононуклеарных лейкоцитов. Клетки трижды отмыли свежим охлажденным раствором Хенкса и довели до 2×106 клеток/мл. После этого клеточную суспензию внесли в лунки круглодонного планшета с предварительно размещенными там образцами разных синтетических материалов, условно обозначенные как «№1» и «№2». Каждый образец был длиною 3 мм и диаметром 1 мм. В качестве контролей использовали лунки с образцами из стекла («Стекло») и лунки, не содержащие синтетических материалов. Планшеты инкубировали при 37°С в условиях 5% CO2 в течение 72 ч. По окончании инкубации в лунках подсчитывали общее число клеток и в том числе количество жизнеспособных в тесте с трипановым синим. Надосадочную жидкость после центрифугирования содержимого лунок использовали для определения концентрации ИЛ-1β и ИЛ-8 с помощью иммуноферментного метода. Уровень цитокинов пересчитали на 1 жизнеспособную клетку. После этого проводили расчет индекса стимуляции, как отношение концентрации цитокина в пробе с синтетическим образцом к концентрации того же цитокина в пробе со стеклом.
Получены результаты представлены в таблице 2.
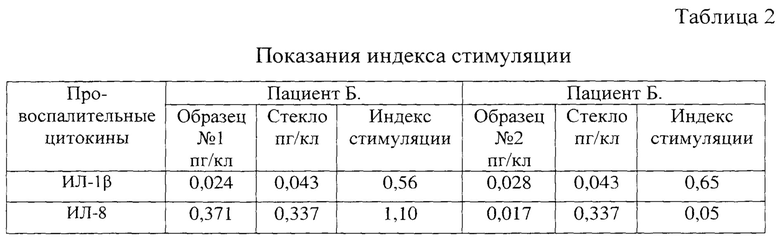
По показателям индекса стимуляции можно предположить, что иммунокомпетентные клетки пациента Б. в присутствии образца №2 не сформируют провоспалительную реакцию, что, обусловлено его большей биосовместимостью.
Пример 3. У пациента В. получили пробу периферической венозной крови из кубитальной вены. С помощью градиентного (фиколл-верографин; р=1,077 г/см3) центрифугирования выделили популяцию мононуклеарных лейкоцитов. Клетки трижды отмыли свежим охлажденным раствором Хенкса и довели до 2×106 клеток/мл. После этого клеточную суспензию внесли в лунки круглодонного планшета с предварительно размещенными там образцами разных синтетических материалов, условно обозначенные как «№1» и «№2». Каждый образец был длиною 3 мм и диаметром 1 мм. В качестве контролей использовали лунки с образцами из стекла («Стекло») и лунки, не содержащие синтетических материалов. Планшеты инкубировали при 37°С в условиях 5% CO2 в течение 72 ч. По окончании инкубации в лунках подсчитывали общее число клеток и в том числе количество жизнеспособных в тесте с трипановым синим. Надосадочную жидкость после центрифугирования содержимого лунок использовали для определения концентрации ИЛ-1β и ИЛ-8 с помощью иммуноферментного метода. Уровень цитокинов пересчитали на 1 жизнеспособную клетку. После этого проводили расчет индекса стимуляции, как отношение концентрации цитокина в пробе с синтетическим образцом к концентрации того же цитокина в пробе со стеклом.
Получены результаты представлены в таблице 3.
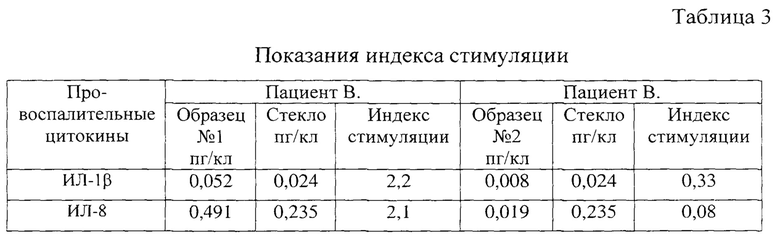
По показателям индекса стимуляции можно предположить, что иммунекомпетентные клетки пациента В. в присутствии образца №2 не сформируют провоспалительную реакцию, что, обусловлено его большей биосовместимостью, а в присутствии образца №1, наоборот, воспалительная реакция будет выраженной.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оценки пригодности использования в медицинских целях разрабатываемых синтетических полимеров | 2021 |
|
RU2761266C1 |
| Применение трис-(2-гидроксиэтил)аммониевой соли 1-бензилиндолил-3-тиоуксусной кислоты в качестве ингибитора активности эндогенного ретровируса человека HERV-E λ 4-1 env | 2022 |
|
RU2801797C1 |
| СПОСОБ СТИМУЛЯЦИИ ЭНДОГЕННОЙ ПРОДУКЦИИ ЦИТОКИНОВ И ГЕМОПОЭТИЧЕСКИХ ФАКТОРОВ | 2012 |
|
RU2498821C1 |
| Способ дифференциальной диагностики абстинентного синдрома при опийной наркомании, сочетанной с ВИЧ-инфекцией | 2016 |
|
RU2646478C1 |
| Способ прогнозирования характера клинического течения постинфекционного гломерулонефрита | 2018 |
|
RU2691402C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОСЛОЖНЕНИЯ ПОСЛЕ COVID-19 У ЛИЦ С КОМОРБИДНЫМ ФОНОМ В АРКТИЧЕСКОМ РЕГИОНЕ | 2023 |
|
RU2812780C1 |
| Средство, обладающее иммуномодулирующей активностью | 2019 |
|
RU2734420C1 |
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ ПРОДУКЦИЮ ГРАНУЛОЦИТАРНО-МАКРОФАГАЛЬНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА В КЛЕТКАХ СИСТЕМЫ МОНОНУКЛЕАРНЫХ ФАГОЦИТОВ | 2010 |
|
RU2438676C1 |
| СПОСОБ ДИАГНОСТИКИ ЗАБОЛЕВАНИЯ ПАРКИНСОНА У БОЛЬНЫХ С НАРУШЕНИЕМ ФУНКЦИИ ОБОНЯНИЯ | 2011 |
|
RU2478209C1 |
| Способ прогнозирования развития воспалительного старения, связанного с возраст-ассоциированными заболеваниями | 2024 |
|
RU2823182C1 |
Изобретение относится к медицине, а именно к иммунологии, имплантологии, хирургии, и может быть использовано для индивидуальной оценки биосовместимости с организмом имплантируемых полимерных материалов. Проводят отбор исследуемого материала у индивидуума. Забор пробы крови у пациента выполняют в предимплантационный период, кровь центрифугируют для получения популяции мононуклеарных лейкоцитов. Полученную клеточную суспензию вносят в лунки планшета с образцами имплантируемых полимерных материалов в виде цилиндров длиной 3 мм и диаметром 1 мм, в количестве 1 штуки на лунку круглодонного планшета, инкубируют при 5% СО2 в течение 72 ч при температуре 37°С. Далее определяют количество мононуклеарных лейкоцитов и концентрацию провоспалительных цитокинов: ИЛ-1β и ИЛ-8. Полученные показатели выражают в виде индекса стимуляции, который рассчитывают по формуле: ИС=УП/УС, предварительно рассчитав удельную продукцию цитокина в присутствии полимерного образца и в присутствии стекла по формулам: УП=Ц/КЛЦ, УС=С/КЛС, где УП - удельная продукция цитокина в присутствии полимерного образца, пг/клетка; Ц - концентрация цитокина в пробе с полимерным образцом, пг/мл; КЛЦ - количество мононуклеарных лейкоцитов в пробе с полимерным образцом, в 1 мл; УС - удельная продукция цитокина в присутствии стекла, пг/клетка; С - концентрация цитокина в пробе со стеклянным образцом, пг/мл; КЛС - количество мононуклеарных лейкоцитов в пробе со стеклом, в 1 мл; ИС - индекс стимуляции. Если индекс стимуляции превышает 1, то констатируют низкую биосовместимость с организмом такого полимерного материала и высокую вероятность развития осложнений при имплантации. Способ обеспечивает возможность индивидуализации оценки биосовместимости полимерного материала, из которого изготовлен имплантат, для конкретного пациента за счет использования популяции мононуклеарных лейкоцитов периферической венозной крови конкретного человека и тестирования их реакции на полимер путем определения индекса стимуляции как отношения удельной продукции основных провоспалительных цитокинов ИЛ-1β и ИЛ-8 в пробе с полимерным образцом к удельной продукции тех же цитокинов в пробе со стеклом. 3 табл., 3 пр.
Способ индивидуальной оценки биосовместимости с организмом имплантируемых полимерных материалов, включающий отбор исследуемого материала у индивидуума, отличающийся тем, что забор пробы крови у пациента выполняют в предимплантационный период, кровь центрифугируют для получения популяции мононуклеарных лейкоцитов, далее полученную клеточную суспензию вносят в лунки планшета с образцами имплантируемых полимерных материалов в виде цилиндров длиной 3 мм и диаметром 1 мм в количестве 1 шт. на лунку круглодонного планшета, инкубируют при 5% СО2 в течение 72 ч при температуре 37°С, далее определяют количество мононуклеарных лейкоцитов и концентрацию провоспалительных цитокинов: ИЛ-1β и ИЛ-8, полученные показатели выражают в виде индекса стимуляции, который рассчитывают по формуле
ИС=УП/УС,
предварительно рассчитав удельную продукцию цитокина в присутствии полимерного образца и в присутствии стекла по формулам
УП=Ц/КЛЦ,
УС=С/КЛС, где
УП - удельная продукция цитокина в присутствии полимерного образца, пг/клетка;
Ц - концентрация цитокина в пробе с полимерным образцом, пг/мл;
КЛЦ - количество мононуклеарных лейкоцитов в пробе с полимерным образцом, в 1 мл;
УС - удельная продукция цитокина в присутствии стекла, пг/клетка;
С - концентрация цитокина в пробе со стеклянным образцом, пг/мл;
КЛС - количество мононуклеарных лейкоцитов в пробе со стеклом, в 1 мл;
ИС - индекс стимуляции,
при этом если индекс стимуляции превышает 1, то констатируют низкую биосовместимость с организмом такого полимерного материала и высокую вероятность развития осложнений при имплантации.
| СПОСОБ ОЦЕНКИ БИОСОВМЕСТИМОСТИ ИМПЛАНТИРУЕМЫХ ИЗДЕЛИЙ | 2015 |
|
RU2605821C1 |
| СПОСОБ ОЦЕНКИ БИОСОВМЕСТИМОСТИ СТОМАТОЛОГИЧЕСКИХ ПОЛИМЕРНЫХ ПЛОМБИРОВОЧНЫХ МАТЕРИАЛОВ | 2011 |
|
RU2477487C2 |
| Способ оценки биосовместимости скаффолдов | 2019 |
|
RU2714461C1 |
| Способ имплантации образцов синтетических материалов медико-биологического назначения при исследовании их биосовместимости | 2018 |
|
RU2701884C1 |
| CN 107921173 A, 17.04.2018 | |||
| BERNARD M | |||
| et al | |||
| Biocompatibility of polymer-based biomaterials and medical devices - regulations, in vitro screening and risk-management | |||
| Biomater | |||
| Sci | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| MIHAI R | |||
| et al | |||
| In vitro | |||
Авторы
Даты
2021-02-16—Публикация
2020-07-14—Подача