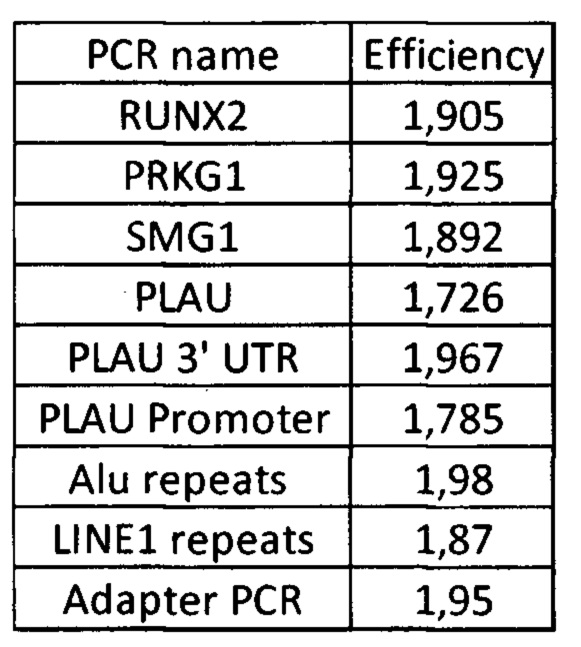
Изобретение относится к биотехнологии и может быть использовано для проверки качества образцов, подготавливаемых для высокопроизводительного секвенирования ДНК.
Известно, что высокопроизводительное секвенирование (NGS) требует подготовки т.н. NGS библиотеки - фрагментов ДНК типичной длины 200-500 п.н. исследуемого генома, фланкированных определенными последовательностями (адаптерами).
В ряде применений (секвенирование полного экзома, секвенирование транскриптома) NGS-библиотека подвергается «обогащению» конкретными участками генома, т.е. ее состав - относительная представленность участков генома - меняется. Так, для обогащения экзома человека, доля генома, включающая экзоны и их окружение, которые являются предметом обогащения, составляет 1-1.5%. Эти области, изначально равнопредставленные с другими участками, после обогащения представляют большую часть фрагментов (порядка 80%) в NGS-библиотеке.
Успешность обогащения зависит от множества факторов и аккуратности проводимой процедуры, и может варьироваться (быть меньше целевого уровня). Существует определенная трудность в определении эффективности обогащения до непосредственного секвенирования.
Во-первых, существует ограниченное количество методов, способных измерить саму эффективность обогащения. Во-вторых, количество обогащенной библиотеки, взятой на тест, должно быть небольшим (в пределах двух нг). Такое ограничение сопровождается общим небольшим количеством всей обогащенной библиотеки, так как наработки больших ее количеств, как правило, понижают качество библиотеки.
Метод кПЦР (ПЦР в режиме реального времени) был предложен для оценки эффективности обогащения при секвенировании экзома (Life tech TargetSeq™ Exome Enrichment System, Revision Date 15 July 2011, Publication Part Number MAN0004396). Метод предполагает вынесение суждения о степени обогащения путем измерения количества целевых фрагментов (экзонов) и фрагментов около экзонов (которые не обогащаются в NGS-библиотеке для секвенирования экзома человека, так называемые отрицательные тесты) методом кПЦР для образца до и после обогащения.
Однако описанный метод имеет несколько недостатков. Во-первых, протокол требует 500 пг ДНК библиотеки на каждую кПЦР реакцию до финальной концентрации в пробирке 25 пг/мкл. Кроме того, этот протокол не предполагает измерение эффективности одного цикла ПЦР реакции, а значит, не позволяет оценить разницу обогащения фрагментов, участвующих в ПЦР, количественно, а только лишь качественно оценить общий уровень обогащения.
Описана похожая панель кЦПР реакций для оценки эффективности обогащения (NimbleGen SeqCap EZ Library SR User's Guide, 2011). Плюсом этой системы является определение эффективности каждой ПЦР реакции, что позволяет количественно оценить и скорректировать разные уровни обогащения для разных ПЦР-таргетов. К недостаткам можно отнести большое количество ДНК на каждую ПЦР реакцию (5 нг, до концентрации 333 пг/мкл в реакции); отсутствие ПЦР реакций на необогащаемые регионы (отрицательные тесты), а наличие кПЦР реакций только для участков экзонов.
Таким образом, для всех подобных систем существует техническое ограничение: если использовать небольшое (~50 пг) количество ДНК на один тест ПЦР, то образец, обогащенный последовательностями экзома до уровня 80%, будет содержать в среднем всего 2 копии необогащенного участка теста. Так как NGS-библиотека представляет собой фрагменты ДНК длиной типично не более 400 н.п., вероятность того, что образец будет содержать хотя бы один фрагмент, полностью содержащий в себе последовательность ПЦР ампликона, значительно ниже 100%.
Другими словами, с большой вероятностью, матрицы ДНК для ПЦР реакции в образце не окажется, и тест не состоится. Именно это обстоятельство и обязывает описанные протоколы использовать сравнительно большое кол-во ДНК на тест.
Известен многоточечный тест на эффективность целевого обогащения (ММТЕ) с разделением на капиллярном электрофорезе (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5341873/). Несмотря на высокую точность самого метода, представленные в статье результаты имеют сильное расхождение с актуальными данными NGS секвенирования, что возможно вызвано необходимой в методе ПЦР амплификацией соединенного лигированием зонда. Также, этот метод предусматривает как покупку готовых наборов, то есть лимитирует адаптацию протоколов, так и требует наличия в лаборатории инструмента капиллярного электрофореза, значительно более дорогостоящего прибора, чем ПЦР амплификатор с детекцией сигнала в реальном времени.
Описан способ, предполагающий проведение кПЦР системы для определения эффективности обогащения, в котором проводится селективное обогащение целевых участков (одного гена на выбор) методом гибридизации и их секвенирование (CN 103667254, В, SHAO YANG et al., 11.01.2017). Изобретение направлено на работу как с геномной ДНК, так и с транскриптомом (с переводом мРНК в кДНК). При этом оценка эффективности обогащения производится методом кПЦР на целевом гене.
Недостаток способа состоит в том, что используемая система имеет только положительный тест на 1 ген (пр. K.RAS, EGFR, BRAF гены), не учитывая все остальные гены. Такой подход может давать неточную оценку обогащения, поскольку не каждый фрагмент библиотеки, содержащий целевой ген, будет иметь в себе последовательность кПЦР ампликона. Это, в свою очередь, вносит искажения в количественное определение эффективности обогащения.
Наиболее близким к патентуемому является способ оценки обогащения NGS-библиотеки целевыми участками (US 8663924, В2, AGILENT TECHNOLOGIES INC [US]; ONG JOSEPH HOANG HAI HAPPE SCOTT, 04.03.2014 - прототип). Используемая система подразумевает использование повторяющихся последовательностей как отрицательный контроль для определения общего уровня обогащения целевыми фрагментами. Для оценки эффективности обогащения предложено проводить кПЦР реакцию на образцах до и после обогащения, используя отрицательный тест на повторяющиеся последовательности. Используются стандартные кривые для калибровки и измерения эффективности ПЦР реакций для каждого ампликона.
Недостаток состоит в том, что известный способ не предполагает конкретный расчет эффективности обогащения, а лишь описывает экспериментальную процедуру как общий принцип, предлагая самим переводить полученную разность циклов отрицательного теста в эффективность обогащения. Кроме того, система использует последовательности заранее неизвестной специфичности к человеку.
Так, праймеры на SINE повторы могут также давать продукт ПЦР на повторах других видов, что понижает специфичность ПЦР реакции в случае контаминации ДНК. Система не демонстрирует лучшую работу на повторяющихся последовательностях, чем на встречающихся один раз в геноме, и не демонстрирует расширенный предел по концентрациям ДНК на один кПЦР тест.
Настоящее изобретение направлено на решение проблемы повышения точности определения эффективности обогащения NGS-библиотек до непосредственного секвенирования. Это позволяет отсеять неудавшиеся обогащения и, таким образом, сэкономить ресурсы. Кроме того, оно позволяет рассчитать необходимое количество данных высокопроизводительного секвенирования на один образец с учетом количественного определения эффективности обогащения.
Технический результат, достигаемый при осуществлении изобретения, заключается в:
- повышении точности оценки эффективности обогащения NGS-библиотеки за счет использования оригинальных праймеров, комплементарных повторяющимся последовательностям генома человека, которые не являются экзонами;
- возможности определения количества целевых фрагментов обогащения NGS-библиотеки для секвенирования экзома человека, измеряемого в процентах от общего числа фрагментов NGS-библиотеки;
- снижении необходимого количества ДНК на тест, что позволяет сэкономить общее количество образца NGS-библиотеки и, таким образом, улучшить общее качество секвенирования.
Предложен метод оценки эффективности обогащения NGS-библиотеки участками экзонов (для секвенирования экзома человека), который подходит по-новому к кПЦР тесту участков, которые не должны обогащаться: вместо ПЦР на уникальные участки генома, не подвергающиеся обогащению, патентуемое изобретение использует повторяющиеся участки генома (повторы, имеющие траспозонную природу). Такие участки из-за их частой представленности в геноме (до 11% генома занимают идентичные повторы Alu) с почти 100% вероятностью остаются в обогащенной библиотеке (даже в случае недостижимой эффективности обогащения 99,9%).
Сущность изобретения заключается в следующем.
Для определения эффективности обогащения NGS-библиотеки участками экзонов для секвенирования экзома человека проводят кПЦР с ДНК человека одной и той же NGS-библиотеки до и после процедуры ее обогащения. При проведении кПЦР реакций используют праймеры 5'-GGTGAAACCCCGTCTCTACTA-3' и 5'-GGTTCAAGCGATTCTCCTGCC-3', комплементарные повторяющимся последовательностям генома человека, которые не являются экзонами.
Каждую кПЦР реакцию проводят, по меньшей мере, с 50 пг ДНК NGS-библиотеки. Определяют эффективность кПЦР реакции и пороговые циклы флуоресцентного сигнала образцов NGS-библиотеки до и после процедуры обогащения. Затем вычисляют эффективность обогащения Э (%) NGS-библиотеки по формуле:
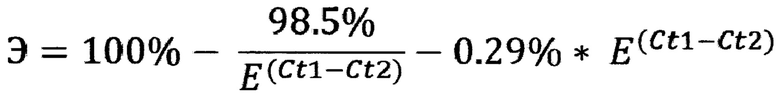
где: Е - эффективность кПЦР реакции с парой указанных праймеров на повторяющиеся последовательности генома человека;
Ct1, Ct2 - значения порогового цикла флуоресцентного сигнала кПЦР реакции для образца NGS-библиотеки после обогащения и до обогащения, соответственно.
Способ осуществляют следующим образом.
ПЦР в режиме реального времени производится в любом кПЦР приборе, способном детектировать канал FAM (метод оптимизирован, но не лимитирован использованием интеркалирующего в ДНК красителя SYBR Green I, длина волны возбуждения - 497 нм, флуоресценции - 521 нм).
В случае демонстрируемых результатов, объем каждой реакции составляет 40 мкл (для минимизации ошибок пипетирования и лучшей чувствительности сигнала). Однако изобретение распространяется и на любые другие объемы ПЦР смеси, так как его принцип от этого не меняется. Приготовление ПЦР смеси производится по принципу общего раствора для всех ПЦР реакций одной ДНК матрицы (одного образца).
Таким образом, достигается одинаковая концентрация всех составляющих ПЦР реакции, включая ПЦР буфер, ДНК, полимеразу, dNTP. Праймеры добавляются отдельно в каждую пробирку одно- или многоканальной пипеткой. Объем праймеров (и концентрация) подбираются таким образом, чтобы минимизировать ошибку пипетирования.
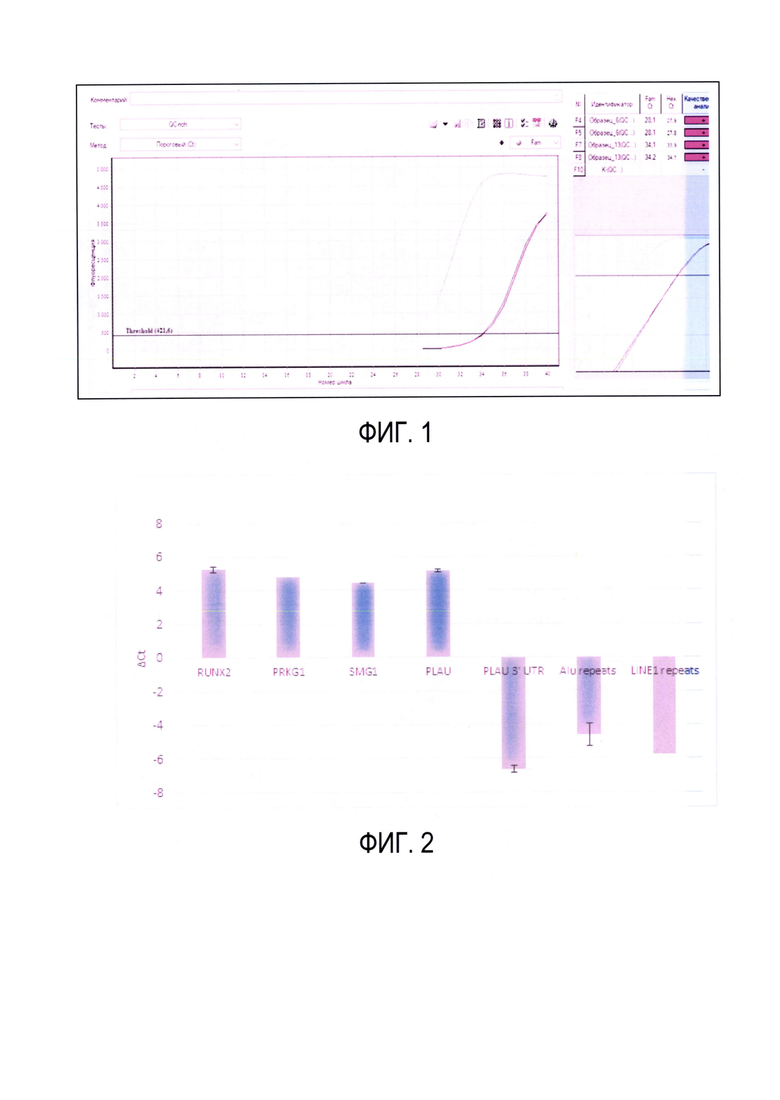
Прямым результатом измерения ПЦР реакции являются пороговые циклы (Ct) образца до и после обогащения (Фиг. 1) и контроль без ДНК матрицы. На фиг. 1 представлен пример результатов кПЦР реакции на паре праймеров для образцов до и после обогащения (по два технических повтора), а также на контроле без ДНК матрицы. Пересечение кривых флуоресцентного сигнала с пороговым уровнем флуоресценции определяет значение пороговых циклов Ct. Видна согласованность технических повторов и разница в средних значениях пороговых циклов для образцов до и после обогащения. Видно отсутствие сигнала для контроля без ДНК матрицы.
Для каждой ПЦР реакции строится стандартная прямая, для определения эффективности реакции в данных условиях, для пересчета разницы циклов в разницу концентраций конкретных участков генома в NGS-библиотеке.
Общим результатом работы системы является конечная оценка эффективности обогащения Э (%) по предложенной формуле.
При этом использующиеся реакции на повторы Alu являются ключевыми для определения уровня необогащенной ДНК с высокой точностью.
Промежуточный результат обогащения представлен в виде разницы циклов и абсолютной разницы (Фиг. 2 и Фиг. 3):
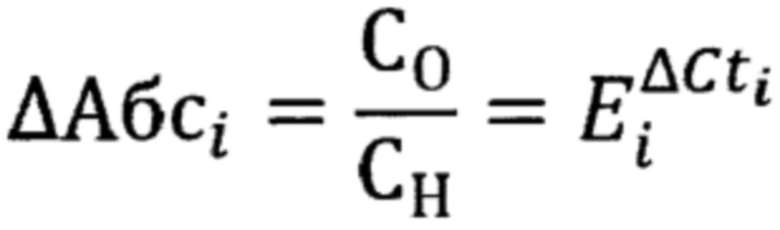
где Со - концентрация фрагментов, амплифицируемых в конкретной кПЦР реакции в обогащенном образце;
Сн - концентрация фрагментов, амплифицируемых в конкретной кПЦР реакции в образце до обогащения;
Еi - эффективность конкретной кПЦР реакции (для конкретной пары праймеров);
ΔCti - разность пороговых циклов флуоресцентного сигнала для обогащенного образца и образца до обогащения.
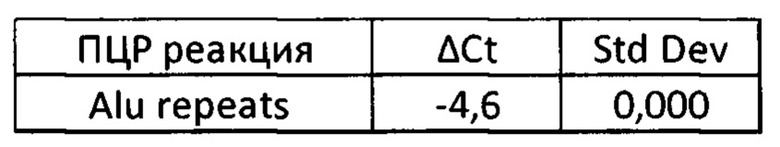
Пределы ошибок - это стандартное отклонение повторов образцов, пересчитанное в общий интервал стандартного отклонения их разности:
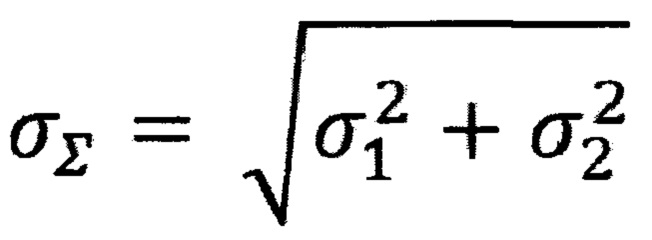
где: σ1 - стандартное отклонение технических повторов пороговых циклов образца до обогащения для конкретной ПЦР реакции;
σ2 - стандартное отклонение технических повторов пороговых циклов образца после обогащения для конкретной ПЦР реакции;
σΣ - суммарный предел погрешности для измерения разности пороговых циклов кПЦР реакции.
Предлагаемый способ включает следующие этапы:
1. Перед проведением обогащения NGS-библиотеки (или смеси библиотек) отбирается образец необогащенной библиотеки (или смеси библиотек), в количестве 100 пг или более.
2. После обогащения, та же библиотека (или смесь библиотек) отбирается в количестве 100 пг или более.
3. Приготавливается кПЦР реакция с использованием
5'-GGTGAAACCCCGTCTCTACTA-3' и 5'-GGTTCAAGCGATTCTCCTGCC-3'.
Общий объем одной реакции 40 мкл. Реакция собирается по рецепту:

Все компоненты кПЦР реакции, кроме праймеров, добавляются сразу на все пробирки ПЦР реакций в технических повторах (не менее двух на один образец). Праймеры добавляются по 5 мкл в каждую пробирку (лунку планшета). V берется из того расчета, чтобы на весь раствор ПЦР реакции добавлялось не менее 3 мкл ДНК матрицы.
4. Заранее вычисляется эффективность реакции кПЦР по стандартной прямой:
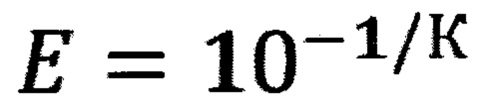
где: Е - эффективность кПЦР реакции (экспоненциальный множитель);
К - коэффициент наклона прямой стандартной калибровочной прямой кПЦР реакции (логарифм концентрации ДНК матрицы по горизонтальной оси, средний пороговый цикл флуоресцентного сигнала по вертикальной оси).
5. кПЦР реакция ставится на программу 95°С 5 минут; 40 циклов: 95°С 20 секунд, 59°С 15 секунд, 72°С 25 секунд; кривая плавления от 45°С до 95°С, повышение на 0.5°С за 15 секунд. Измерение флуоресценции производится после каждой фазы элонгации (72°С). Канал детекции флуоресцентного сигнала FAM.
6. Интерпретация данных начинается с проверки кривых плавления, температура плавления ампликона каждой реакции проверяется с референсной, если температура плавления ниже на более чем 2 градуса, это говорит об амплификации праймер-димеров; если выше, это говорит об амплификации неспецифичного продукта большой длины. Отрицательные контроли ПЦР на повторы могут иметь ту же или большую температуру плавления.
Пример референсных (определенных в заведомо корректной ПЦР реакции) температур плавления:
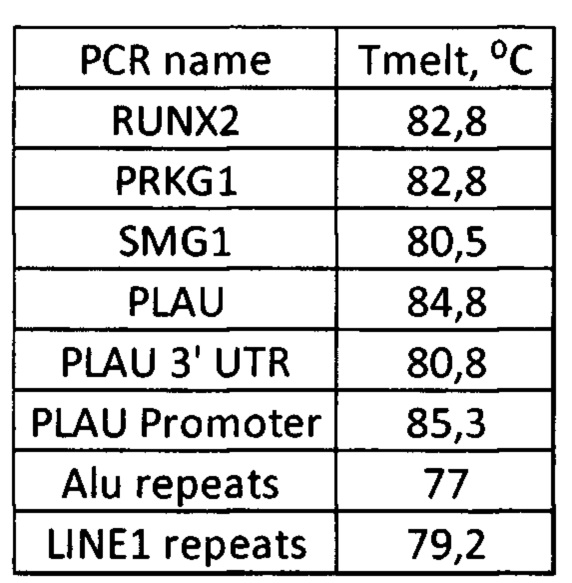
7. Проверка Ct пороговых циклов для тестов и отрицательных контролей (без матрицы ДНК для амплификации). Отрицательный контроль должен либо не выходить ни на каком цикле (не иметь Ct), либо иметь другую температуру плавления на анализе кривой плавления.
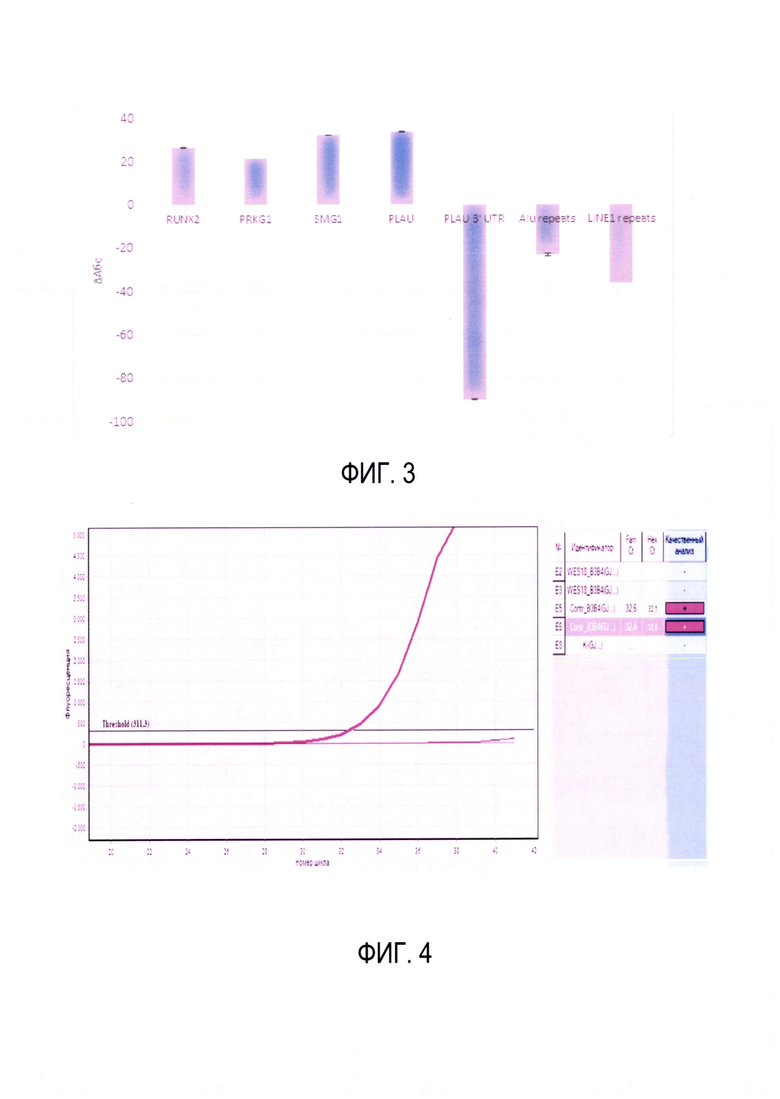
8. Пороговое значение флуоресценции для определения Ct выставляется из соображений выше фона, но на этапе экспоненциального роста сигнала для всех кПЦР реакций. Вычисляется стандартное отклонение каждой ПЦР реакции по техническим повторам, вычисляется разность пороговых циклов для необогащенного и обогащенного образцов и суммарное отклонение по формуле выше. На фиг. 2 представлен пример разностей в пороговых циклах кПЦР реакций в образцах до и после обогащения с диапазоном стандартного отклонения.
9. Подсчитывается абсолютная разница в концентрации фрагментов по формуле, представленной выше. На фиг. 3 представлен пример отношения концентраций амплифицируемых в ходе кПЦР фрагментов в образцах до и после обогащения. Эти значения вычисляются в данном пункте описанной процедуры изобретения. Положительные значения указывают на увеличение концентрации фрагментов после обогащения, а отрицательные значения - на уменьшение.
10. Вычисляется эффективность обогащения Э (%) по формуле:
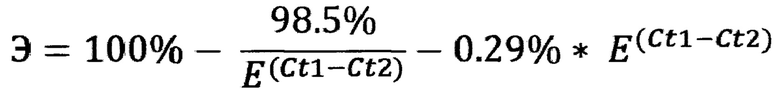
Пример 1
Пункты 1-3, 5-7 не отличаются от описанных выше. Результат 4 пункта:

Результат 8 пункта:
Результат 9 пункта:

Результат 10 пункта: эффективность равна 79%, Реальная эффективность, измеренная после высокопроизводительного секвенирования, равно 80%.
Пример 2
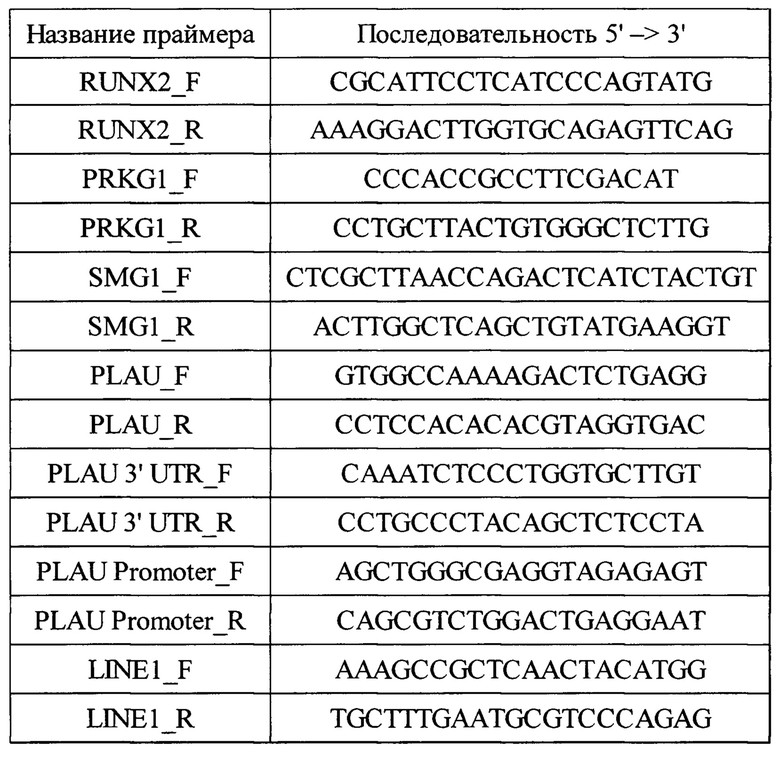
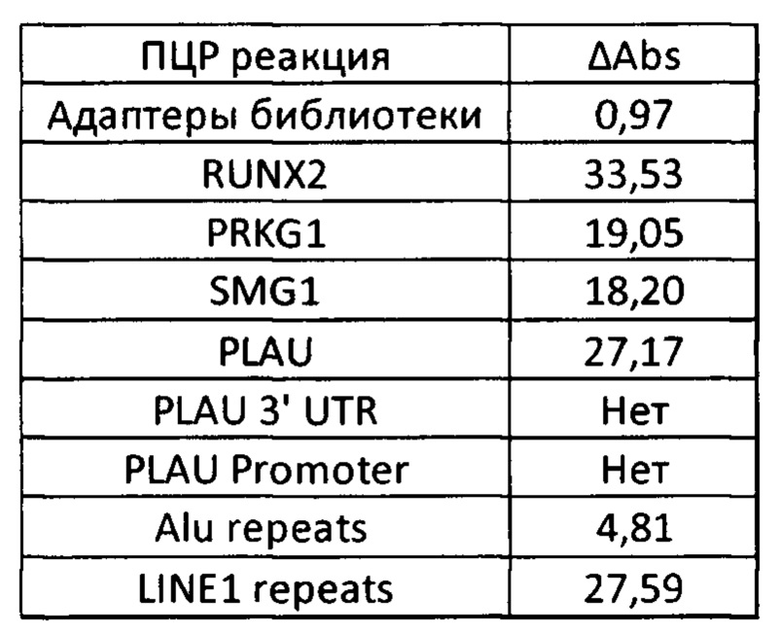
Проведено сравнение патентуемого способа с уже существующими методами, описанными в аналогах. Для этого были использованы дополнительные кПЦР реакции с праймерами, амплифицирующими участки экзонов и участки около экзонов. Используемые для этого пары праймеров, дополнительные к описанным в изобретении:
Пункты 1-3, 5-7 не отличаются от описанных выше. Результат 4 пункта:
Результат 8 пункта:

«Нет» в таблице означает, что реакция не прошла (флуоресцентный сигнал не превзошел пороговое значение за 40 циклов ПЦР). Как видно на фиг. 4, кПЦР на неповторяющиеся (и не являющиеся экзонами) последовательности не прошел для 50 пг ДНК на одну кПЦР реакцию на обогащенной библиотеке (Е2, Е3). Как уже отмечалось, вероятность того, что на 50 пг ДНК обогащенной библиотеки найдется хотя бы 1 фрагмент, содержащий эту область полностью, значительно меньше 100%. Это демонстрирует, что методы, описанные в уровне техники, действительно имеют ограничение по количеству входящего материала, тогда как настоящее изобретение работает при концентрациях 1.2 пг/мкл исходной ДНК в ПЦР смеси.
Результат 9 пункта:
Результат 10 пункта:
Эффективность равна 68%. Реальная эффективность, измеренная после высокопроизводительного секвенирования, равно 70%.
Таким образом, представленные данные подтверждают достижение технического результата в части повышения точности оценки эффективности обогащения NGS-библиотеки, возможности определения количества целевых фрагментов обогащения NGS-библиотеки для секвенирования экзома человека и снижения необходимого количества ДНК на тест.
--->
Список нуклеотидных последовательностей
“Способ определения эффективности обогащения NGS-библиотеки участками
экзонов для секвенирования экзома человека”
Листов 3
Правообладатель:
- Федеральное государственное автономное образовательное учреждение высшего
образования «Российский национальный исследовательский медицинский
университет имени Н.И.Пирогова» Министерства здравоохранения Российской
Федерации (ФГАОУ ВО РНИМУ им. Н.И.Пирогова Минздрава России);
Авторы: Кривой А.А.
Черанев В.В.
Коростин Д.О.
Москва, 2020 г.
Список используемых ДНК праймеров 5' → 3':
Alu_F
GGTGAAACCCCGTCTCTACTA
Alu_R
GGTTCAAGCGATTCTCCTGCC
RUNX2_F
CGCATTCCTCATCCCAGTATG
RUNX2_R
AAAGGACTTGGTGCAGAGTTCAG
PRKG1_F
CCCACCGCCTTCGACAT
PRKG1_R
CCTGCTTACTGTGGGCTCTTG
SMG1_F
CTCGCTTAACCAGACTCATCTACTGT
SMG1_R
ACTTGGCTCAGCTGTATGAAGGT
PLAU_F
GTGGCCAAAAGACTCTGAGG
PLAU_R
CCTCCACACACGTAGGTGAC
PLAU 3' UTR_F
CAAATCTCCCTGGTGCTTGT
PLAU 3' UTR_R
CCTGCCCTACAGCTCTCCTA
PLAU Promoter_F
AGCTGGGCGAGGTAGAGAGT
PLAU Promoter_R
CAGCGTCTGGACTGAGGAAT
LINE1_F
AAAGCCGCTCAACTACATGG
LINE1_R
TGCTTTGAATGCGTCCCAGAG
Adapter_F
TGTGAGCCAAGGAGTTG
Adapter_R
GAACGACATGGCTACGA
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Технология полноэкзомного обогащения на основе гибридизации с нормализованным транскриптомом | 2023 |
|
RU2838569C1 |
| Технология полноэкзомного обогащения на основе различия в кинетике реассоциации фрагментов ДНК | 2023 |
|
RU2839144C1 |
| Технология полноэкзомного обогащения на основе гибридизации с полноэкзомной РНК-библиотекой | 2023 |
|
RU2830886C1 |
| Способ создания кольцевой формы NGS библиотеки для высокопроизводительного секвенирования на платформах технологии DNBSEQ | 2020 |
|
RU2746960C1 |
| Способ секвенирования экзонов гена HLA-DPA1 и набор синтетических олигонуклеотидов для его реализации | 2024 |
|
RU2837865C1 |
| Способ получения молекулярных аутосомных STR-маркеров человека для идентификации неизвестного индивида, набор олигонуклеотидов для его осуществления, способ идентификации неизвестного индивида | 2021 |
|
RU2800087C2 |
| Способ секвенирования экзонов гена HLA-DQA1 и набор синтетических олигонуклеотидов для его реализации | 2024 |
|
RU2833819C1 |
| Способ создания кольцевой формы NGS библиотеки Illumina для высокопроизводительного секвенирования на платформах технологии DNBSEQ | 2021 |
|
RU2781613C1 |
| Способ пробоподготовки образцов изолятов коронавируса SARS-CoV-2 и олигонуклеотидные праймеры для его реализации | 2021 |
|
RU2762759C1 |
| Способ получения молекулярных STR-маркеров Y-хромосомы человека для идентификации неизвестного индивида и определения биологического родства методом мультиплексной амплификации, набор олигонуклеотидов для осуществления способа | 2021 |
|
RU2799797C2 |
Изобретение относится к биотехнологии и может быть использовано для проверки качества образцов, подготавливаемых для высокопроизводительного секвенирования ДНК. Для определения эффективности обогащения NGS-библиотеки участками экзонов для секвенирования экзома человека проводят кПЦР с ДНК человека одной и той же NGS-библиотеки до и после процедуры ее обогащения. Причем каждую ПНР реакцию проводят, по меньшей мере, с 50 пг ДНК NGS-библиотеки. Определяют эффективность кПЦР реакции и пороговые циклы флуоресцентного сигнала образцов NGS-библиотеки до и после процедуры обогащения. Затем вычисляют эффективность обогащения NGS-библиотеки по приведенной формуле. Технический результат состоит в повышении точности оценки эффективности обогащения NGS-библиотеки. 2 пр., 4 ил.
Способ определения эффективности обогащения NGS-библиотеки участками экзонов для секвенирования экзома человека, включающий проведение ПЦР реакций в режиме реального времени (кПЦР) с ДНК человека одной и той же NGS-библиотеки до и после процедуры ее обогащения, отличающийся тем, что при проведении кПЦР реакций используют праймеры 5'-GGTGAAACCCCGTCTCTACTA-3' и 5'-GGTTCAAGCGATTCTCCTGCC-3', комплементарные повторяющимся последовательностям генома человека, которые не являются экзонами, причем каждую кПЦР реакцию проводят, по меньшей мере, с 50 пг ДНК NGS-библиотеки, определяют эффективность кПЦР реакции и пороговые циклы флуоресцентного сигнала образцов NGS-библиотеки до и после процедуры обогащения, после чего эффективность обогащения NGS-библиотеки вычисляют по формуле:
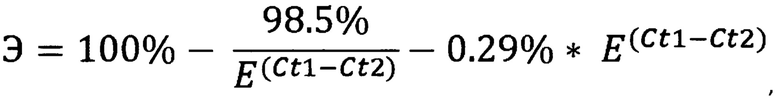
где: Э - эффективность обогащения NGS-библиотеки в %;
Е - эффективность кПЦР реакции с парой праймеров на повторяющиеся последовательности генома человека;
Ct1, Ct2 - значения порогового цикла флуоресцентного сигнала кПЦР реакции для образца NGS-библиотеки после обогащения и до обогащения, соответственно.
| СПОСОБ АМПЛИФИКАЦИИ СПЕЦИФИЧНЫХ ФРАГМЕНТОВ НУКЛЕИНОВЫХ КИСЛОТ С ПОМОЩЬЮ РЕКУРРЕНТНОЙ ЦЕПНОЙ РЕАКЦИИ | 2007 |
|
RU2414510C2 |
| WO 2018165366 A1, 13.09.2018. | |||
Авторы
Даты
2021-02-20—Публикация
2020-04-30—Подача