Обычная противоопухолевая терапия преимущественно предпринимает попытку селективного обнаружения и уничтожения раковых клеток, в основном являющихся быстрорастущими (т.е. клеток, образующих основную массу опухоли), и в большинстве случаев оказывает свое токсичное действие на раковые клетки, вмешиваясь в клеточные механизмы, вовлеченные в клеточный рост и репликацию ДНК. Более того, стандартные режимы лечения онкологических заболеваний главным образом рассчитаны на применение максимальной дозы облучения или химиотерапевтического средства при отсутствии неспецифической токсичности, т.е. дозы, известной под названием "максимально переносимая доза" (MTD).
Кроме того, протоколы химиотерапии часто включают введение комбинации химиотерапевтических средств для увеличения эффективности лечения. Несмотря на доступность целого ряда химиотерапевтических средств, эти варианты лечения имеют много недостатков. Например, химиотерапевтические средства вызывают существенные, а зачастую опасные, побочные действия вследствие неспецифических побочных эффектов на быстрорастущие клетки, как нормальные, так и злокачественные.
Другие типы противоопухолевой терапии включают хирургическое вмешательство, гормональную терапию, иммунотерапию, эпигенетическую терапию, антиангиогенную терапию, таргентную (направленную на мишень) терапию и лучевую терапию для уничтожения неопластических клеток у пациента.
Однако все традиционные подходы к терапии рака имеют существенные недостатки для пациента, включая отсутствие эффективности (в частности, в отношении отдаленных результатов) и токсичность. Соответственно, необходимы новые виды терапии для лечения пациентов со злокачественными новообразованиями.
Появляется все больше данных о том, что в опухоли существует субпопуляция раковых клеток, которая сохраняет свойства, подобные свойствам стволовых клеток. Эта субпопуляция называется раковые стволовые клетки (CSC). Раковые стволовые клетки имеют свойства, сходные с нормальными стволовыми клетками, они обладают способностью к самоподдержанию и образованию всех гетерогенных клеточных типов опухоли. Эффективной проверкой в отношении исследования CSC-подобных свойств опухолевых клеток является анализ колониеобразования. Используя этот анализ, можно легко проверить способность к самоподдержанию и возможность отдельных опухолевых клеток образовывать опухоли.
Считается, что раковые стволовые клетки способны инициировать образование опухоли, поддерживать рост опухоли и возможно приводить к распространению опухоли в отдаленные органы. Раковые стволовые клетки включают уникальную субпопуляцию, которая, относительно остальных клеток опухоли (т.е. основной массы опухоли), является более туморогенной, относительно более медленно растущей или «дремлющей» и часто относительно более хеморезистентной, чем основная масса опухоли. Поскольку общепринятая противоопухолевая терапия нацеливается на быстро пролиферирующие клетки (т.е. клетки, которые образуют основную массу опухоли), полагают, что эти способы лечения являются относительно неэффективными для нацеливания и поражения раковых стволовых клеток. Раковые стволовые клетки могут демонстрировать другие особенности, которые делают их относительно хеморезистентными, такие как множественная лекарственная устойчивость и антиапоптотические пути. Неспособность правильно нацеливаться и уничтожать раковые стволовые клетки является основной причиной неспособности стандартных режимов противоопухолевой терапии обеспечить длительный благоприятный эффект у многих пациентов с раком. Таким образом, раковые стволовые клетки могут не только быть основной причиной рецидива рака после лечения неэффективными лекарственными средствами, но также могут являться главной причиной метастазирования злокачественной опухоли. Итак, одной потенциальной возможностью для излечения рака является уничтожение раковых стволовых клеток.
Клаудины - интегральные мембранные белки, основные компоненты плотных контактов эпителия и эндотелия. Предположительно клаудины имеют четыре трансмембранных сегмента с двумя внеклеточными петлями, при этом N- и С-концы располагаются в цитоплазме. Семейство трансмембранных белков клаудинов (CLDN) играет решающую роль в сохранении эпителиальных и эндотелиальных плотных контактов, кроме того они играют роль в поддержании цитоскелета и передаче клеточного сигнала. CLDN6 экспрессируется в целом ряде раковых клеток человека, тогда как экспрессия в нормальных тканях ограничивается плацентой.
В этой работе мы предоставляем данные, демонстрирующие, что экспрессия CLDN6 активируется в ходе образования плюрипотентных клеток. Кроме того, CLDN6 в значительной мере связан с известными маркерами раковых стволовых клеток, причем CLDN6-положительные опухолевые клетки демонстрируют повышенное образование колоний. Также показано, что терапия с использованием CLDN6-специфических антител может преодолеть резистентность опухолей к химиотерапии, например, рака яичника, причем комбинация химиотерапии и терапии антителами к CLDN6 обладает заметным синергетическим действием.
Представленные в этом документе результаты показывают, что CLDN6 является новым маркером раковых стволовых клеток, и что на раковые стволовые клетки можно нацеливаться с диагностической или терапевтической целью посредством нацеливания на CLDN6.
Раскрытие изобретения
В одном аспекте настоящее изобретение имеет отношение к способу обнаружения раковых стволовых клеток, включающему выявление клеток, экспрессирующих CLDN6.
В одном варианте осуществления наличие клеток, экспрессирующих CLDN6, указывает на наличие раковых стволовых клеток и/или количество клеток, экспрессирующих CLDN6, коррелирует с количеством раковых стволовых клеток. В одном варианте осуществления клетки, экспрессирующие GLDN6, обнаруживают в образце, полученном от пациента с раком, например, до, в ходе и/или после лечения рака. В одном варианте осуществления способ включает количественное и/или качественное установление клеток, экспрессирующих CLDN6. В одном варианте осуществления способ включает сравнение количества клеток, экспрессирующих CLDN6, с количеством клеток, экспрессирующих CLDN6, в эталонном образце или с заранее установленным диапазоном эталонных значений. Эталонный образец может быть образцом, полученным от пациента, у которого не был диагностирован рак. Заранее установленный диапазон эталонных значений может основываться на популяции пациентов, у которых не был диагностирован рак. В одном варианте осуществления способ включает мониторинг количества раковых стволовых клеток у онкологического пациента, при этом мониторинг количества раковых стволовых клеток у онкологического пациента предпочтительно включает сравнение количества раковых стволовых клеток в образце, полученном от данного онкологического пациента, с количеством раковых стволовых клеток в образце, полученном ранее от онкологического пациента. В одном варианте осуществления образец, полученный от онкологического пациента, является образцом, взятым у онкологического пациента в ходе или после проведения противоопухолевой терапии.
В следующем аспекте настоящее изобретение имеет отношение к способу мониторинга эффективности противоопухолевой терапии у онкологического пациента, включающему: (i) определение количества раковых стволовых клеток в образце, полученном от данного онкологического пациента, в ходе или после проведения противоопухолевой терапии; и (ii) сравнение количества раковых стволовых клеток в образце, полученном от онкологического пациента, с количеством раковых стволовых клеток в образце, полученном ранее от данного онкологического пациента, при этом установление количества раковых стволовых клеток в образце, полученном от онкологического пациента, и/или установление количества раковых стволовых клеток в образце, полученном ранее от данного онкологического пациента, включает, определение количества клеток, экспрессирующих CLDN6.
В одном варианте осуществления образец, полученный от онкологического пациента, является образцом, взятым у онкологического пациента до, в ходе или после проведения противоопухолевой терапии.
В одном варианте осуществления способа во всех аспектах изобретения стабилизация или уменьшение количества раковых стволовых клеток показывает, что противоопухолевая терапия является эффективной. В одном варианте осуществления способа во всех аспектах изобретения увеличение количества раковых стволовых клеток показывает, что противоопухолевая терапия является неэффективной. В одном варианте осуществления способа во всех аспектах изобретения противоопухолевая терапия является терапией, направленной против раковых стволовых клеток. В одном варианте осуществления способа во всех аспектах изобретения образец, полученный от онкологического пациента, является биологической жидкостью или образцом опухоли, полученным с помощью биопсии. В одном варианте осуществления способа во всех аспектах изобретения образец подвергается одному или более этапам предварительной обработки. В одном варианте осуществления способа во всех аспектах изобретения клетки, экспрессирующие CLDN6, обнаруживают или их количество определяют путем обнаружения или определения количества белка CLDN6 и/или мРНК CLDN6. В одном варианте осуществления способа во всех аспектах изобретения клетки, экспрессирующие CLDN6, обнаруживают или их количество определяют с помощью иммуноанализа, при этом иммуноанализ предпочтительно выбирают из группы, состоящей из вестерн-блоттинга, иммуногистохимического анализа, радиоиммуноанализа, твердофазного иммуноферментного анализа (ELISA), "сэндвич" иммуноанализа, анализа иммунопреципитации, реакций преципитации, реакций диффузной преципитации в геле, иммунодиффузного анализа, реакций агглютинации, реакций связывания комплемента, количественного радиоиммунного анализа, флуоресцентного иммуноанализа, иммунофлуоресценции, иммуноанализа белка А, проточной цитометрии и FACS-анализа. В одном варианте осуществления способа во всех аспектах изобретения клетки, экспрессирующие CLDN6, обнаруживают или их количество определяют с использованием антитела, обладающего способностью связываться с CLDN6. В одном варианте осуществления способа во всех аспектах изобретения клетки, экспрессирующие CLDN6, представляют собой раковые клетки, экспрессирующие CLDN6, и/или являются клетками, присутствующими в месте локализации опухоли.
В следующем аспекте настоящее изобретение имеет отношение к способу лечения или предотвращения рака, включающему ингибирование и/или уничтожение раковых стволовых клеток путем введения онкологическому пациенту антитела, обладающего способностью связываться с CLDN6.
В одном варианте осуществления раковые стволовые клетки экспрессируют CLDN6. В одном варианте осуществления данный способ дополнительно включает применение химиотерапии и/или лучевой терапии. В одном варианте осуществления ингибирование и/или уничтожение раковых стволовых клеток усиливает противораковое действие химиотерапии и/или лучевой терапии, при этом усиление противоракового действия химиотерапии и/или лучевой терапии предпочтительно включает увеличение продолжительности жизни онкологического пациента, подвергнутого лечению с использованием химиотерапии и/или лучевой терапии.
В следующем аспекте настоящее изобретение имеет отношение к способу лечения или предотвращения рака, включающему введение (i) антитела, обладающего способностью связываться с CLDN6, и (ii) химиотерапию онкологического пациента.
В одном варианте осуществления злокачественная опухоль содержит раковые стволовые клетки, экспрессирующие CLDN6. В одном варианте осуществления введение антитела, обладающего способностью связываться с CLDN6, приводит к ингибированию или устранению раковых стволовых клеток, экспрессирующих CLDN6. В одном варианте осуществления введение антитела, обладающего способностью связываться с GLDN6, усиливает противоопухолевое действие химиотерапии, при этом усиление противоопухолевого действия химиотерапии предпочтительно включает увеличение продолжительности жизни пациентов, имеющих злокачественное образование и подвергнутых лечению с использованием химиотерапии.
В одном варианте осуществления способа во всех аспектах изобретения уничтожение раковых стволовых клеток приводит к излечению рака. В одном варианте осуществления способа во всех аспектах изобретения антитело, обладающее способностью связываться с CLDN6, и химиотерапия вводятся в синергетически эффективных количествах. В одном варианте осуществления способа во всех аспектах изобретения химиотерапия вводится в дозе, меньшей, чем максимально переносимая доза. В одном варианте осуществления способа во всех аспектах изобретения химиотерапия включает введение средства, выбранного из группы, состоящей из таксанов, соединений платины, нуклеозидных аналогов, аналогов камптотецина, антрациклинов, их пролекарств, их солей и их комбинаций. В одном варианте осуществления способа во всех аспектах изобретения химиотерапия включает введение средства, выбранного из группы, состоящей из паклитакселя, цисплатина, карбоплатина, их пролекарств, их солей и их комбинаций. В одном варианте осуществления способа во всех аспектах изобретения раковые стволовые клетки находятся в месте локализации опухоли у пациента. В одном варианте осуществления способа во всех аспектах изобретения злокачественная опухоль является резистентной к химиотерапии, в частности, при использовании монотерапии. В одном варианте осуществления способа во всех аспектах изобретения антитело, обладающее способностью связываться с CLDN6, оказывает ингибирующее и/или цитотоксическое действие на раковые стволовые клетки, при этом антитело, обладающее способностью связываться с CLDN6, проявляет свое ингибирующее и/или цитотоксическое действие на раковые стволовые клетки предпочтительно при помощи одного или более механизмов из числа лизиса, опосредованного комплементзависимой цитотоксичностью (CDC), лизиса, опосредованного антителозависимой клеточноопосредованной цитотоксичностью (ADCC), индукции апоптоза и ингибирования пролиферации. В одном варианте осуществления способа во всех аспектах изобретения антитело, обладающее способностью связываться с CLDN6, соединено с терапевтической молекулой и может быть конъюгатом антитела с лекарственным средством, как описано в данном документе. В одном варианте осуществления терапевтический фрагмент является цитотоксическим средством, химиотерапевтическим средством или радиоактивным изотопом. В одном варианте осуществления терапевтический фрагмент оказывает воздействие на медленно растущие клетки. В одном варианте осуществления способа во всех аспектах изобретения антитело, обладающее способностью связываться с CLDN6, связывается с первой внеклеточной петлей CLDN6. В одном варианте осуществления способа во всех аспектах изобретения антитело, обладающее способностью связываться с CLDN6, содержит вариабельный участок тяжелой цепи (VH), включающий аминокислотную последовательность, представленную в SEQ ID NO: 5, или ее фрагмент, и вариабельный участок легкой цепи (VL), содержащий аминокислотную последовательность, представленную в SEQ ID NO: 4, или ее фрагмент.
В следующем аспекте настоящее изобретение имеет отношение к способу лечения или предотвращения рака, включающему введение онкологическому пациенту конъюгата антитела с лекарственным средством, содержащего антитело, обладающее способностью связываться с CLDN6, ковалентно связанное с помощью линкера, по меньшей мере, с одной молекулой токсичного лекарственного средства.
В одном варианте осуществления молекула токсичного лекарственного средства способна проникать через клеточную мембрану. В одном варианте осуществления, по меньшей мере, одно из токсичных лекарственных средств воздействует на медленно растущие клетки. В одном варианте осуществления токсичное лекарственное средство является майтансиноидом или ауристатином. В одном варианте осуществления майтансиноид выбирают из группы, состоящей из DM1 и DM4. В одном варианте осуществления ауристатин выбирают из группы, состоящей из монометил ауристатина Е (ММАЕ) и монометил ауристатина F (MMAF). В одном варианте осуществления линкер представляет собой расщепляемый линкер, предпочтительно линкер, расщепляемый катепсином. В одном варианте осуществления антитело соединяется с линкером через тиол цистеина антитела.
В одном варианте осуществления злокачественная опухоль содержит раковые стволовые клетки, экспрессирующие CLDN6. В одном варианте осуществления введение конъюгата антитело-лекарственное средство приводит к ингибированию или уничтожению раковых стволовых клеток, экспрессирующих CLDN6. В одном варианте осуществления уничтожение раковых стволовых клеток приводит к излечению рака. В одном варианте осуществления раковые стволовые клетки находятся в месте локализации опухоли у онкологического пациента. В одном варианте осуществления конъюгат антитело-лекарственное средство оказывает ингибирующее и/или цитотоксическое действие на раковые стволовые клетки, причем конъюгат антитело-лекарственное средство оказывает ингибирующее и/или цитотоксическое действие на раковые стволовые клетки предпочтительно путем индукции апоптоза и/или ингибирования пролиферации.
В одном варианте осуществления способ также включает применение химиотерапии и/или лучевой терапии. В одном варианте осуществления введение конъюгата антитело-лекарственное средство усиливает противораковое действие химиотерапии и/или лучевой терапии, при этом усиление противоракового действия химиотерапии и/или лучевой терапии предпочтительно включает увеличение продолжительности жизни онкологического пациента, подвергнутого химиотерапии и/или лучевой терапии.
В одном варианте осуществления конъюгат антитело-лекарственное средство и химиотерапия вводятся в синергетически эффективных количествах. В одном варианте осуществления химиотерапия вводится в дозе, более низкой, чем максимально переносимая доза. В одном варианте осуществления химиотерапия включает введение средства, выбранного из группы, состоящей из таксанов, соединений платины, нуклеозидных аналогов, аналогов камптотецина, антрациклинов, их пролекарств, их солей и их комбинаций. В одном варианте осуществления химиотерапия включает введение средства, выбранного из группы, состоящей из паклитакселя, цисплатина, карбоплатина, их пролекарств, их солей и их комбинаций. В одном варианте осуществления злокачественная опухоль является устойчивой к химиотерапии, в частности, при введении в виде монотерапии.
В одном варианте осуществления антитело, обладающее способностью связываться с CLDN6, в частности, когда оно присутствует в конъюгате антитело-лекарственное средство, обладает аффинностью и/или специфичностью к CLDN6, что обеспечивает возможность эндоцитоза антитела и/или конъюгата антитело-лекарственное средство. В одном варианте осуществления антитело, обладающее способностью связываться с CLDN6 и присутствующее в конъюгате антитело-лекарственное средство, связывается с первой внеклеточной петлей CLDN6. В одном варианте осуществления антитело, обладающее способностью связываться с CLDN6 и присутствующее в конъюгате антитело-лекарственное средство содержит вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность, представленную в SEQ ID NO: 5, или ее фрагмент, и вариабельную область легкой цепи (VL), включающую аминокислотную последовательность, представленную в SEQ ID NO: 4, или ее фрагмент.
В одном варианте осуществления способа во всех аспектах изобретения CLDN6 имеет аминокислотную последовательность в соответствии с SEQ ID NO: 1 или SEQ ID NO: 2. В одном варианте осуществления способа во всех аспектах изобретения злокачественное новообразование включает первичный рак, прогрессирующий рак, метастатический рак, рецидив рака или их сочетание.
В следующем аспекте настоящее изобретение имеет отношение к способу лечения или предотвращения рака, включающему (i) обнаружение раковых стволовых клеток у онкологического пациента способом изобретения и (ii) введение пациенту противоопухолевой химиотерапии, направленной против раковых стволовых клеток. В одном варианте осуществления противоопухолевая химиотерапия, направленная против раковых стволовых клеток, включает осуществление способа изобретения для лечения или предотвращения рака.
В следующем аспекте настоящее изобретение имеет отношение к способу предотвращения хеморезистентности рака, рецидива рака или метастазирования рака, в частности, в ходе или после лечения рака, в том числе лечения рака способом изобретения.
В следующем аспекте настоящее изобретение предоставляет медицинский препарат для лечения или предотвращения рака, содержащий (i) антитело, обладающее способностью связываться с CLDN6, и (ii) химиотерапевтическое средство. Антитело, обладающее способностью связываться с CLDN6, и химиотерапевтическое средство могут присутствовать в медицинском препарате в виде смеси или отдельно друг от друга. Медицинский препарат может иметь форму набора, включающего первый контейнер, содержащий антитело, обладающее способностью связываться с CLDN6, и второй контейнер, содержащий химиотерапевтическое средство. Медицинский препарат может также включать напечатанные инструкции по применению препарата для лечения или предотвращения рака, в частности, по применению препарата в способе изобретения. Различные варианты осуществления медицинского препарата и, в частности, антитела, обладающего способностью связываться с CLDN6, и химиотерапевтического средства описаны в данном документе.
В отдельном аспекте настоящее изобретение предоставляет медицинский препарат, включающий (i) антитело, обладающее способностью связываться с CLDN6, и (ii) паклитаксел. Антитело, обладающее способностью связываться с CLDN6, и паклитаксел могут присутствовать в медицинском препарате в виде смеси или отдельно друг от друга. Медицинский препарат может предназначаться для лечения рака, например, рака яичника. Медицинский препарат может иметь форму набора, включающего первый контейнер, содержащий антитело, обладающее способностью связываться с CLDN6, и второй контейнер, содержащий паклитаксел. Медицинский препарат может также включать напечатанные инструкции по применению препарата для лечения или предотвращения рака, такого как рак яичника, в частности, по применению препарата в способе изобретения. Различные варианты осуществления медицинского препарата и, в частности, антитела, обладающего способностью связываться с CLDN6, описаны в данном документе.
В следующем аспекте настоящее изобретение предоставляет конъюгат антитело-лекарственное средство, содержащий антитело, обладающее способностью связываться с CLDN6, ковалентно связанное линкером, по меньшей мере, с одной молекулой токсичного лекарственного средства.
В одном варианте осуществления токсичное лекарственное средство способно проникать через клеточную мембрану. В одном варианте осуществления, по меньшей мере, одно из токсичных лекарственных средств оказывает воздействие на медленно растущие клетки. В одном варианте осуществления токсичное лекарственное средство является майтансиноидом или ауристатином. В одном варианте осуществления майтансиноид выбирают из группы, состоящей из DM1 и DM4. В одном варианте осуществления ауристатин выбирают из группы, состоящей из монометил ауристатина Е (ММАЕ) и монометил ауристатина F (MMAF). В одном варианте осуществления линкер является расщепляемым линкером, предпочтительно, линкером, расщепляемым катепсином. В одном варианте осуществления антитело соединяется с линкером через тиол цистеина антитела.
В одном варианте осуществления антитело, обладающее способностью связываться с CLDN6, в частности, когда оно присутствует в конъюгате антитело-лекарственное средство, обладает аффинностью и/или специфичностью к CLDN6, что обеспечивает возможность эндоцитоза антитела и/или конъюгата антитело-лекарственное средство. В одном варианте осуществления антитело, обладающее способностью связываться с CLDN6, в конъюгате антитело-лекарственное средство связывается с первой внеклеточной петлей CLDN6. В одном варианте осуществления антитело, обладающее способностью связываться с CLDN6, в конъюгате антитело-лекарственное средство содержит вариабельный участок тяжелой цепи (VH), включающий аминокислотную последовательность, представленную в SEQ ID NO: 5, или ее фрагмент, и вариабельный участок легкой цепи (VL), содержащий аминокислотную последовательность, представленную в SEQ ID NO: 4, или ее фрагмент.
В следующем аспекте настоящее изобретение предоставляет фармацевтическую композицию, содержащую конъюгат антитело-лекарственное средство изобретения и фармацевтически приемлемый разбавитель, носитель или эксципиент.
В следующем аспекте настоящее изобретение предоставляет медицинский препарат, содержащий конъюгат антитело-лекарственное средство изобретения и химиотерапевтическое средство. Предпочтительно, медицинский препарат предназначается для лечения или предотвращения рака. Конъюгат антитело-лекарственное средство и химиотерапевтическое средство могут присутствовать в медицинском препарате в виде смеси или отдельно друг от друга. Медицинский препарат может иметь форму набора, включающего первый контейнер, содержащий конъюгат антитело-лекарственное средство, и второй контейнер, содержащий химиотерапевтическое средство. Медицинский препарат может также включать напечатанные инструкции по применению препарата для лечения или предотвращения рака, в частности, по применению препарата в способе изобретения. Различные варианты осуществления медицинского препарата и, в частности, конъюгата антитело-лекарственное средство, описаны в данном документе.
В отдельном аспекте настоящее изобретение предоставляет медицинский препарат, содержащий конъюгат антитело-лекарственное средство изобретения и паклитаксел. Конъюгат антитело-лекарственное средство и паклитаксел могут присутствовать в медицинском препарате в виде смеси или отдельно друг от друга. Медицинский препарат может предназначаться для лечения или предотвращения рака, такого как рак яичника. Медицинский препарат может иметь форму набора, включающего первый контейнер, содержащий конъюгат антитело-лекарственное средство, и второй контейнер, содержащий паклитаксел. Медицинский препарат может также включать напечатанные инструкции по применению препарата для лечения или предотвращения рака, такого как рак яичника, в частности, по применению препарата в способе изобретения. Различные варианты осуществления медицинского препарата и, в частности, конъюгата антитело-лекарственное средство, описаны в данном документе.
Настоящее изобретение также предоставляет описанные в этом документе средства и композиции, такие как конъюгат антитело-лекарственное средство, антитело, обладающее способностью связываться с CLDN6, и/или химиотерапевтическое средство для применения в описанных в данном документе способах. Например, настоящее изобретение также предоставляет конъюгат антитело-лекарственное средство или антитело, обладающее способностью связываться с CLDN6, для введения в сочетании с химиотерапевтическим средством, таким как паклитаксел.
В одном варианте осуществления антитело, обладающее способностью связываться с CLDN6, является моноклональным, химерным или гуманизированным антителом, или фрагментом антитела. В одном варианте осуществления антитело опосредует лизис клеток при связываний с клеточным CLDN6, в частности, с CLDN6, который экспрессируется клетками на клеточной поверхности, при этом клетки являются предпочтительно раковыми стволовыми клетками, такими как раковые стволовые клетки, описанные в этом документе.
Согласно изобретению рак предпочтительно выбирают из группы, состоящей из рака яичника, в частности, аденокарциномы яичника и тератокарциномы яичника, рака легких, включая мелкоклеточный рак легких (SCLC) и немелкоклеточный рак легких (NSCLC), в частности, плоскоклеточную карциному и аденокарциному легких, крупноклеточного рака (LCC), рака желудка, рака молочной железы, рака печени, рака поджелудочной железы, рака кожи, в частности, базальноклеточной карциномы и плоскоклеточной карциномы, злокачественной меланомы, рака головы и шеи, в частности, злокачественной плеоморфной аденомы, саркомы, в частности, синовиальной саркомы и карциносаркомы, рака желчевыводящих путей, рака мочевого пузыря, в частности, переходно-клеточной карциномы и папиллярной карциномы, рака почки, в частности, почечно-клеточного рака, включая светлоклеточный рак почки и папиллярный рак почки, рак толстой кишки, рак тонкой кишки, включая рак подвздошной кишки, в частности, аденокарциному тонкой кишки и аденокарциному подвздошной кишки, плацентарную аденокарциному, рак шейки матки, рак яичка, в частности, семиному яичка, тератому яичка и эмбриональную карциному яичка, рак матки, герминогенные опухоли, такие как тератокарцинома или эмбриональная карцинома, в частности, герминогенные опухоли яичка и яичника и их метастатические формы.
Согласно изобретению раковые клетки и/или раковые стволовые клетки, экспрессирующие CLDN6, предпочтительно являются клетками рака, описанного в данном документе.
В одном варианте осуществления описанный здесь рак является CLDN6-положительным. В одном варианте осуществления раковые клетки описанного здесь рака являются CLDN6-положительными. В одном варианте осуществления раковые клетки описанного здесь рака экспрессируют CLDN6 на своей клеточной поверхности.
В одном варианте осуществления описанный в этом документе рак включает первичный рак, прогрессирующий рак, метастатический рак, рецидив рака или их сочетание, например, сочетание первичного рака и метастатического рака. В одном варианте осуществления рак является частично или полностью резистентным к химиотерапии, такой как монотерапия паклитакселем. В одном варианте осуществления рак является раком яичника, в частности, раком яичника, частично или полностью резистентным к химиотерапии, такой как монотерапия паклитакселем.
Другие отличительные признаки и преимущества данного изобретения станут очевидными на основе последующего подробного описания изобретения и пунктов формулы изобретения.
Краткое описание чертежей
Фигура 1. мРНК CLDN6 экспрессируется в человеческих клетках iPS
Человеческие фибробласты крайней плоти (HFF) были трансфицированы с использованием липофектамина RNAiMAX (Life Technologies) или без РНК (отсутствие РНК контроля) или с использованием смеси для репрограммирования (немодифицированная смесь OSKMNL+EBK+miR), клетки собирали через 5, 12 и 19 дней после обработки. РНК экстрагировали, транскрибировали в кДНК и после этого анализировали с помощью количественной ПЦР в реальном времени (RT-ПЦР) с использованием секвенатора ABI PRISM 7300 и компьютерного обеспечения (Applied Biosystems с использованием набора QuantiTect SYBR green Kit (Qiagen)). Показана кратная индукция CLDN6-экспрессии клеток, обработанных смесью для репрограммирования (черные столбики) относительно HFF клеток с 1 дня обработки (серые столбики). Экспрессию мРНК CLDN6 нормировали относительно экспрессии мРНК гена «домашнего хозяйства» HPRT1. OSKMNL = факторы транскрипции ОСТ4, SOX2, KLF4, cMYC, NANOG и LIN28, EBK = IFN-escape белки Е3, K3 и B18R, miR-mix = miRNA-302a/b/c/d и 367.
Фигура 2. CLDN6 экспрессируется на клеточной поверхности человеческих iPS клеток
HFF клетки трансфицировали без РНК (без РНК контроля) или с использованием смеси для репрограммирования (немодиф. смесь OSKMNL+EBK+miR), затем клетки собирали на 5 день (А), 12 день (В) и 19 день (С) после обработки. Клетки окрашивали 1 мкг/мл CLDN6-специфическими IMAB027-AF647 и SSEA-4-V450 антителами (2,5 мкл на тест, купленными у компании BD) в течение 30 мин при 4°С и анализировали поверхностную экспрессию с помощью проточной цитометрии. Эксперимент был проведен два раза, представлены характерные точечные диаграммы. OSKMNL = транскрипционные факторы ОСТ4, SOX2, KLF4, cMYC, NANOG и LIN28, EBK = IFN-escape белки Е3, K3 и B18R, miR-mix = miRNA-302a/b/c/d и 367.
Фигура 3. поверхностная экспрессия CLDN6 на линии клеток рака яичника
С целью исследования CLDN6-экспрессии клетки 1Е6 окрашивали 1 мкг/мл IMAB027-AF647 в течение 30 минут при 4°С и анализировали поверхностную экспрессию с помощью проточной цитометрии. На (А) показаны COV318 клетки. Эксперименты проводили по три раза, представлена одна характерная точечная диаграмма. На (В) показаны РА-1 клетки, устойчиво трансфицированные или контрольным вектором (РА-1 76) или вектором, экспрессирующим shRNAs к CLDN6 (клоны РА-1 50 и РА-1 54). Эксперименты проводили по три раза, представлена одна характерная точечная диаграмма. shRNA = небольшая шпилечная РНК.
Фигура 4. CLDN6 имеет большое значение для колониеобразования клеток рака яичника
С целью исследования клоногенного поведения COV318, РА-1 50 и РА-1 54 клетки окрашивали 1 мкг/мл IMAB027-AF647 в течение 30 минут при 4°С, после чего 700 (COV318) или 500 (РА-1 50/54) CLDN6-положительных или CLDN6-отрицательных клеток отсортировали в 6-луночные планшеты. Дали возможность клеткам сформировать колонии в течение 14 дней, после чего окрашивали 0,5% кристаллическим фиолетовым в течение 20 минут. (А) Показано характерное изображение для каждой линии клеток. (В) Количество колоний определяли подсчетом «вручную». Показаны средние значения и среднеквадратичное отклонение, полученные в результате трех независимых экспериментов.
Фигура 5. CLDN6 коэкспрессируется с CSC-маркерами CD24, CD90 и CD44 в клеточной линии рака яичника COV318
1Е6 COV318 клетки окрашивали в течение 30 минут при 4°С антителами против различных поверхностных маркеров согласно FACS-панели, представленной в Таблице 1, и анализировали экспрессию CSC-маркеров с помощью проточной цитометрии. Эксперименты проводили по три раза. На (А) показаны характерные точечные диаграммы колокализации CLDN6 с различными установленными CSC-маркерами. (В) На оси X диаграммы показаны процентные содержания колокализации CD44, CD24, CD90 и CLDN6-положительных клеток, которые были вычислены с использованием различных стратегий. Показаны средние значения из трех повторов и среднеквадратичные отклонения.
Фигура 6. Обогащение клеток, экспрессирующих CLDN6, приводит к накоплению установленных CSC маркеров
COV318 клетки окрашивали 0,5 мкг/мл IMAB027 и вторичными АРС-конъюгированными козьими вторичными антителами к IgG человека (1:300), после этого с помощью FACS-сортировки были выделены CLDN6-положительные и CLDN6-отрицательные фракции. Клетки обеих фракций выращивали в течение 10 дней. 1Е6 клетки каждой фракции окрашивали в течение 30 минут при 4°С антителами к разным поверхностным маркерам согласно FACS-панели, показанной в Таблице 1. Эксперимент проводили три раза. На (А) показаны характерные точечные диаграммы уровней экспрессии различных CSC-маркеров в CLDN6-положительной и CLDN6-отрицательной фракции, а также их колокализация с CLDN6. На (В) показаны процентные содержания уровней экспрессии CSC-маркеров в виде диаграммы, причем коэффициенты обогащения (кратная экспрессия) для характерных маркеров CD44, CD90 и CD24 были вычислены путем сравнения процентных содержаний положительных клеток в CLDN6-положительной и CLDN6-отрицательной фракции.
Фигура 7. Линии клеток с высокой экспрессией CLDN6 демонстрируют накопление CSC-маркеров по сравнению с клетками с низкой экспрессией CLDN6
1Е6 клетки линий рака яичника OV90 (А) и РА-1 (В) с высокой экспрессией CLDN6 или клетки линий карциномы яичка NEC-8 (С) и NEC-14 (D) окрашивали в течение 30 минут при 4°С антителами к различным поверхностным маркерам согласно FACS-панели, показанной в Таблице 1, и анализировали экспрессию CSC-маркеров с помощью проточной цитометрии. Эксперименты повторяли три раза, показаны характерные точечные диаграммы.
Фигура 8. Противоопухолевое действие IMAB027 в комбинации с паклитакселем на ранней ксенотрансплантантной модели опухоли
Подкожные человеческие ксенотрансплантантные опухоли ES-2, эктопически экспрессирующие человеческий CLDN6, лечили 15 мг/кг паклитакселя на 3, 10 и 17 день после трансплантации с помощью внутрибрюшинных (i.p.) инъекций. Поддерживающую терапию антителами начинали на 4 день в виде трех инъекций в неделю IMAB027 в дозе 35 мг/кг (чередуя i.v./i.p./i.p.). (А) Кинетическая кривая среднего роста опухоли (±SEM) после лечения IMAB027 (белые квадраты), паклитакселем (серые кружки), IMAB027 в комбинации с паклитакселем (черные квадраты) или разбавителем в качестве контроля (белые кружки). Стрелки показывают время начала лечения. (В) Кривые выживаемости леченых мышей. Размер группы: n=12.
Фигура 9. Противоопухолевое действие IMAB027 в комбинации с цисплатином на модели развитой ксенотрансплантантной опухоли
Подкожные человеческие ксенотрансплантантные опухоли NEC14 вырастали до среднего размера ~100 мм3 до начала лечения. Мышей лечили цисплатином в дозе 1 мг/кг с помощью i.p. ежедневных инъекций с 6 по 10 день после трансплантации и трех инъекций IMAB027 в дозе 35 мг/кг в неделю (чередуя i.v./i.p./i.p.), начиная с 6 дня в качестве поддерживающей терапии. (А) Кинетическая кривая среднего роста опухоли (±SEM) после лечения IMAB027 (закрашенный кружок), цисплатином (незакрашенный квадрат), IMAB027 в комбинации с цисплатином (закрашенный квадрат) или разбавителем в качестве контроля (незакрашенный кружок). Стрелки показывают время начала лечения. (В) Характерный размер опухоли у мышей через 24 дня после трансплантации (среднее ± среднеквадратическое отклонение). (С) Кривые выживаемости леченых мышей. Размер группы: n=19. Р-значения: *, p<0,05; **, p<0,01 и ***, p<0,001.
Фигура 10. Противоопухолевое действие IMAB027 в комбинации с карбоплатином на модели развитой ксенотрансплантантной опухоли
Развитые человеческие ксенотрансплантантные опухоли NEC14 лечили IMAB027 в отдельности или в комбинации с цитостатическим лекарственным средством, как описано на фигуре 9. Вместо цисплатина мышей лечили 30 мг/кг карбоплатина на 6, 13 и 20 дни внутрибрюшинными болюсными инъекциями. (А) Кинетическая кривая среднего роста опухоли (±SEM) после лечения IMAB027 (закрашенный кружок), карбоплатином (незакрашенный квадрат), IMAB027 в комбинации с карбоплатином (закрашенный квадрат) или разбавителем в качестве контроля (незакрашенный кружок). Стрелки показывают время начала лечения. (В) Характерный размер опухоли у мышей через 24 дня после трансплантации (среднее ± среднеквадратическое отклонение). (С) Кривые выживаемости леченых мышей. Размер группы: n=19. Р-значения: *, p<0,05; **, p<0,01 и ***, p<0,001.
Фигура 11. CLDN6 имеет большое значение для процесса сферообразования клетками рака яичника
Чтобы проанализировать влияние CLDN6 на сферообразование, CLDN6-положительные и CLDN6-отрицательные COV318 клетки были выделены с помощью сортировки флуоресцентно-активированных клеток после окрашивания 0,5 мкг/мл IMAB027. CLDN6-положительные и CLDN6-отрицательные COV318 клетки выращивали в планшетах со сверхнизкой возможностью прикрепления в условиях, подходящих для сферообразования (бессывороточная DMEM/F12 среда, содержащая 0,4% бычьего сывороточного альбумина, 20 нг/мл основного фактора роста фибробластов, 10 нг/мл эпидермального фактора роста и 5 мкг/мл инсулина). (А) Характерные изображения первого поколения сфер CLDN6-положительных (CLDN6+) и CLDN6-отрицательных (CLDN6-) COV318 клеток на 3, 8 и 19 дни после сортировки. (В) Характерные изображения второго поколения сфер, полученных из отдельных клеток CLDN6+ первого поколения сфер от (А) на 22 день после сортировки.
Фигура 12. Накопление CLDN6-положительных клеток после лечения производными платины
COV318 клетки обрабатывали цисплатином 500 нг/мл или карбоплатином 2,000 нг/мл в течение 4 дней. После обработки клетки выращивали при отсутствии цитостатических лекарственных средств в течение 3 дополнительных дней (светлые столбики) и 6 дней (черные столбики), соответственно. Экспрессию CLDN6 исследовали с помощью проточной цитометрии с использованием CLDN6-специфических антител IMAB027 и изотипических контрольных антител. Показана экспрессия обработанных COV318 относительно необработанных клеток. При оценке значения изотипического контроля были вычтены из CLDN6-окрашивания.
Фигура 13. Накопление CLDN6-положительных клеток после внутрибрюшинной трансплантации
COV318-клетки внутрибрюшинно инъецировали бестимусным «голым» мышам. Мышей, у которых образовался асцит, подвергали эвтаназии, а асцитные и солидные опухоли собирали для получения дополнительных характеристик. Изолированные клетки анализировали в отношении экспрессии CLDN6 непосредственно сразу после получения и после проведения нескольких пассажей в культуре клеток. (А) Исследование с помощью проточной цитометрии экспрессии CLDN6 на исходных COV318 клетках с использованием CLDN6-специфических антител IMAB027 и изотопический контроль. (В) экспрессия CLDN6 на клетках, полученных из асцитных и солидных опухолей из яичника, печени, желудка, поджелудочной железы и диафрагмы в разные моменты времени после выделения (*: асциты на дни 5 и 35; **: солидные опухоли на дни 12 и 29). На оси X показана интенсивность флуоресценции. Число событий (счет), показанный на оси Y, пересчитан как процент максимального числа событий.
Фигура 14. CLDN6 коррелирует с маркерами стволовых клеток рака яичника в образцах первичной опухоли
42 образца рака яичника исследовали в отношении уровней экспрессии мРНК CLDN6 и целого ряда описанных маркеров стволовых клеток рака яичника с помощью qRT-ПЦР с использованием системы обнаружения Fluidigm и программного обеспечения. Был выполнен коэффициент ранговой корреляции Спирмена, чтобы проанализировать CLDN6 корреляцию со специфическими маркерами стволовых клеток рака яичника. На (А) показаны диаграммы рассеяния значимых корреляций (Р-значения ≤0,05). На (В) показана сводная информация обо всех корреляциях.
Фигура 15. IMAB027-опосредованная ADCC после лечения карбоплатином и паклитакселем
ADCC-активность IMAB027 в комбинации с химиотерапией анализировали, используя COV362(Luc) клетки-мишени. В связи с чем, клетки обрабатывали в течение 4 дней карбоплатином, гемцитабином, паклитакселем, доксорубицином или топотеканом в указанных концентрациях. После обработки клетки росли в течение 3 (A-D) и 10 дней (Е-J) при отсутствии цитостатических средств, соответственно. Контрольные клетки культивировали без цитостатиков. (А, С, Е, G, I) ADCC эксперименты проводили с использованием IMAB027 (черные линии) или контрольных изотопических антител (серые линии), используя РВМС от здоровых доноров при соотношении эффектор (РВМС) к клетке-мишени ~40:1. Экспериментальные точки (n=4 повторов) показаны в виде среднего ±SD. (В, D, F, Н, J) Экспрессию CLDN6 исследовали с помощью проточной цитометрии, используя IMAB027. Черные пунктирные линии показывают экспрессию CLDN6 в необработанных клетках, серые закрашенные гистограммы показывают экспрессию CLDN6 после лечения.
Фигура 16. Противоопухолевое действие IMAB027 в комбинации с лечением РЕВ на модели запущенной ксенотрансплантантной опухоли
Подкожные человеческие NEC14 ксенотрансплантантные опухоли вырастали у бестимусных мышей до запущенной стадии. Противоопухолевую терапию РЕВ (цисплатин, этопозид и блеомицин) и IMAB027 начинали на 13 день. Мышам в режиме лечения РЕВ внутрибрюшинно вводили 1 мг/кг цисплатина и 5 мг/кг этопозида в дни 13, 14, 15, 16 и 17 и 10 мг/кг блеомицина в дни 13, 17 и 21. Антитело IMAB027 вводили три раза в неделю, чередуя i.v./i.p./i.p. инъекции в дозе 35 мг/кг с 13 дня по 101 день после трансплантации. Группы с разбавителем в качестве контроля получали раствор 0,9% NaCl и буфер вместо лекарственного вещества. В общем, постоянный мониторинг мышей осуществлялся в течение 220 дней. (А), (В) Кинетические кривые среднего роста опухолей (±SEM) у нелеченых мышей и мышей, леченых IMAB027, РЕВ или РЕВ в комбинации с IMAB027. Стрелки показывают время начала лечения (критерий множественного сравнения Данна: ***, p<0,001). (С) Кривые выживаемости нелеченых мышей и мышей, леченых IMAB027, РЕВ или РЕВ в комбинации с IMAB027 (критерий Кокса-Мантеля: *, p<0,05; **, p<0,01). Размер группы: n=14.
Фигура 17. Относительная аффинность связывания и цитотоксичность IMAB027, IMAB027-DM1 и IMAB027-vcMMAE
(А) Связывание IMAB027, IMAB027-DM1 и IMAB027-vcMMAE измеряли с помощью проточно-цитометрического анализа на OV90 клетках, эндогенно экспрессирующих CLDN6. (В) Кривые доза-эффект уменьшения жизнеспособности OV90 клеток, опосредованного IMAB027-DM1 и IMAB027-vcMMAE. Опухолевые клетки инкубировали в течение 72 час с IMAB027-DM1 или IMAB027-vcMMAE. Уменьшение жизнеспособности клеток определяли, используя анализ жизнеспособности на основе ХТТ. Точки на графике (n=3 повтора) показаны в виде среднего ± SD. MFI: средняя интенсивность флуоресценции.
Фигура 18. Противоопухолевое действие конъюгатов IMAB027-DM1 на развитые ксенотрансплантантные опухоли
Бестимусных мышей с развитыми подкожными человеческими OV90 ксенотрансплантантными опухолями лечили через 10 дней после трансплантации однократными внутривенными инъекциями в дозе 1,78, 5,33 или 16 мг/кг IMAB027-DM1 или растворителя в качестве контроля. Размер подкожных опухолей измеряли два раза в неделю (среднее + SEM). Размер группы: n=5, *: p<0,05, **: p<0,01.
Фигура 19. Определение диапазона доз конъюгатов IMAB027-DM1 и IMAB027-vcMMAE при использовании на развитых OV90 ксенотрансплантантных опухолях
Бестимусных мышей с развитыми подкожными человеческими OV90 ксенотрансплантантными опухолями лечили через 10 дней после приживления однократной внутривенной инъекцией IMAB027-DM1, IMAB027-vcMMAE, разбавителем или инъекциями повторных доз IMAB027. (А) Рост опухолей у мышей, обработанных 1,33, 2,67 или 5,33 мг/кг IMAB027-DM1 i.v. (вверху) или 4, 8 или 16 мг/кг IMAB027-vcMMAE i.v. (внизу) по сравнению с растворителем в качестве контроля и IMAB027 (35 мг/кг, еженедельно i.v./i.p./i.p.). Размер подкожных опухолей измеряли два раза в неделю (среднее + SEM). (В) Кривые Каплана-Мейера выживаемости мышей, которых лечили разбавителем или 4, 8 или 16 мг/кг IMAB027-vcMMAE. Мышей умерщвляли, когда опухоли достигали объема 1400 мм3, или если опухоли становились изъязвленными. Размер группы: n=10, *: p<0,05, **: p<0,01, ***: p<0,001.
Фигура 20. Определение диапазона доз конъюгатов IMAB027-vcMMAE при использовании на развитых РА-1 ксенотрансплантантных опухолях
Бестимусных мышей с развитыми подкожными человеческими РА-1 ксенотрансплантантными опухолями лечили через 15 дней после трансплантации однократной внутривенной инъекцией IMAB027-vcMMAE, разбавителя в качестве контроля или инъекциями повторных доз IMAB027. (А) Средний рост опухоли (±SEM) и (В) Кривые Каплана-Мейера выживаемости мышей, которых лечили разбавителем-контролем, IMAB027 (35 мг/кг, еженедельно i.v./i.p./i.p.) или 4, 8 или 16 мг/кг IMAB027-vcMMAE. Мышей умерщвляли, когда опухоли достигали объема 1400 мм3, или если опухоли становились изъязвленными. Размер группы: n=8, *: p<0,05, **: p<0,01. (С) Характерное иммуногистохимическое окрашивание к CLDN6 срезов РА-1 ксенотрансплантантной опухоли в разные моменты времени после приживления.
Фигура 21. Противоопухолевое действие IMAB027-vcMMAE на запущенные MKN74 ксенотрансплантантные опухоли
Бестимусных мышей с развитыми подкожными человеческими MKN74 ксенотрансплантантными опухолями лечили через 7 дней после приживления внутривенной инъекцией 16 мг/кг IMAB027-vcMMAE или разбавителем в качестве контроля. (А) Средний рост опухоли (±SEM) и (В) кривые выживаемости Каплана-Мейера мышей, которых лечили разбавителем или IMAB027-vcMMAE. Мышей умерщвляли, когда опухоли достигали объема 1400 мм3, или если опухоли становились изъязвленными. Размер группы: n=10. (С) Проточный цитометрический анализ экспрессии CLDN6 на опухолевых клетках MKN74 до приживления и характерное иммуногистохимическое окрашивание нелеченой MKN74 ксенотрансплантантной опухоли на 31 день после приживления. **: p<0,01, ***: p<0,001.
Фигура 22. Противоопухолевое действие IMAB027-DM1 и IMAB027-vcMMAE на развитые внутрибрюшинные метастатические опухоли яичника человека
Бестимусным мышам внутрибрюшинно трансплантировали клетки карциномы яичника человека РА-1(Luc), эктопически экспрессирующие люциферазу. После образования внутрибрюшинных метастатических ксенотрансплантантных опухолей животных лечили дозой 16 мг/кг IMAB027-DM1, IMAB027-vcMMAE или разбавителя в качестве контроля с помощью внутрибрюшинной инъекции на 14 день после трансплантации. Рост метастазов определяли после введения люциферина по активности люминесценции, используя систему визуализации IVIS Lumina. (А) Количественное определение метастатической нагрузки у мышей, леченых IMAB027-DM1, IMAB027-vcMMAE или разбавителем. (В) Люминесцентная визуализация in vivo всего тела бестимусных мышей на 28 день после трансплантации. Размер группы; n=8 (разбавитель) или n=9 (IMAB027-DM1, IMAB027-vcMMAE), **: p<0,01, ****: p<0,0001.
Фигура 23. Эндоцитоз CLDN6-связанных антител клетками карциномы человека
Эндоцитоз CLDN6-связанных IMAB027, chimAB5F2D2 или изотопических контрольных антител определяли, используя анализ на основе цитотоксичности, который зависит от коинтернализации мишень-связанных антител и конъюгированного с сапонином Fab-фрагмента против IgG человека (FabZap). РА-1, OV90 или NEC14 клетки карциномы человека инкубировали в течение 72 часов с IMAB027, chimAB5F2D2 или изотопическими контрольными антителами и античеловек FabZap. (А) Кривые доза-эффект опосредованного IMAB027/FabZap и chimAB5F2D2/FabZap уменьшения жизнеспособности РА-1, OV90 и NEC14 клеток, соответственно. Точки на графике (n=3 повтора) показаны как среднее ± SD. (В) Сравнение нормированного значения ЕС50 IMAB027 (относительное ЕС50) и максимума (относительный максимум) проточно-цитометрического связывания и эндоцитоза.
Подробное описание изобретения
Несмотря на то, что настоящее изобретение подробно описано далее, понятно, что это изобретение не ограничивается конкретными методиками, протоколами и реагентами, описанными здесь, поскольку они могут различаться. Также следует понимать, что использованная в описании терминология предназначается только для описания отдельных вариантов осуществления и не предназначается для ограничения объема настоящего изобретения, который будет ограничиваться только прилагаемыми пунктами формулы изобретения. Если не указано иначе, все технические и научные термины, использованные в описании, имеют те же самые значения, которые обычно понятны среднему специалисту в данной области техники.
В дальнейшем будут описаны элементы настоящего изобретения. Эти элементы перечисляются в конкретных вариантах осуществления, однако, должно быть понятно, что они могут объединяться любым образом и в любом количестве для создания дополнительных вариантов осуществления. Различным образом описанные примеры и предпочтительные варианты осуществления не должны истолковываться как ограничивающие настоящее изобретение только точно описанными вариантами осуществления. Следует понимать, что это описание поддерживает и рассматривает варианты осуществления, которые объединяют точно описанные варианты осуществления с любым числом раскрытых и/или предпочтительных элементов. Более того, любые перестановки и комбинации всех описанных элементов в этой, заявке, следует рассматривать как раскрытые описанием настоящей заявки, если контекст не диктует иначе.
Предпочтительно, использованные в описании термины определяются так, как описано в "A multilingual glossary of biotechnological terms: (IUPAC Recommendations)", H.G.W. Leuenberger, B. Nagel, и H.  , Eds., Helvetica Chimica Acta, CH-4010 Basel, Switzerland, (1995).
, Eds., Helvetica Chimica Acta, CH-4010 Basel, Switzerland, (1995).
При осуществлении на практике настоящего изобретения используются, если не указано иначе, обычные методы химии, биохимии, клеточной биологии, иммунологии и методы рекомбинантных ДНК, которые объясняются в литературе, посвященной данной области техники (смотри, например, Molecular Cloning: A Laboratory Manual, 2nd Edition, J. Sambrook et al. eds., Cold Spring Harbor Laboratory Press, Cold Spring Harbor 1989).
На всем протяжении этого подробного описания и последующих пунктов формулы изобретения, если контекст не требует иного, следует понимать, что слово "содержать" и его варианты, такие как "содержит" и "содержащий", предполагает включение определенного члена, целого числа или стадии или группы членов, целых чисел или стадий, а не исключение любого другого члена, целого числа или стадии или группы членов, целых чисел или стадий, хотя в некоторых вариантах осуществления такой другой член, целое число или стадия или группа членов, целых чисел или стадий может исключаться, т.е. объект изобретения заключается во включении установленного члена, целого числа или стадии или группы членов, целых чисел или стадий. Термины "а" и "an" и "the" и подобные ссылки, использованные в контексте описания изобретения (особенно в контексте формулы изобретения) следует истолковывать как включающие и единственное и множественное число, если в описании не указано иначе или иное явно не продиктовано контекстом. Перечисление пределов значений в описании служит только как способ сокращения упоминания в отдельности каждого отдельного значения, попадающего в предел. Если не указано иное, каждое индивидуальное значение включается в подробное описание, как если бы оно было отдельно перечислено в описании. Все описанные здесь методы могут осуществляться в любом подходящем порядке, если в описании не указано иначе или иным образом явно не противоречит контексту. Использование всех без исключения примеров или характерных выражений (например, "такой как"), предоставленных в описании, предназначается только для лучшей иллюстрации изобретения и не ограничивает рамки изобретения, заявленные в иной форме. Формулировки подробного описания не должны быть истолкованы, как означающие какой-либо незаявленный элемент, существенный для осуществления изобретения на практике.
На протяжении текста данной заявки процитировано несколько документов. Каждый из приведенных в описании документов (включая все патенты, патентные заявки, научные публикации, спецификации производителя, инструкции и т.д.), будь то выше или ниже, полностью включается в описание путем отсылки. Ничто в описании не следует рассматривать как допущение, что изобретение не имеет права датировать такое раскрытие в соответствии с предшествующим изобретением.
Клаудины являются семейством белков, являющихся наиболее важными компонентами плотных контактов, где они создают трансклеточный барьер, контролирующий поток молекул в межклеточном пространстве между клетками эпителия. Клаудины являются трансмембранными белками, пересекающими мембрану 4 раза, при этом и N-конец и С-конец располагаются в цитоплазме. Первая внеклеточная петля, называемая ЕС1 или ECL1, состоит в среднем из 53 аминокислот и вторая внеклеточная петля, называемая ЕС2 или ECL2, состоит примерно из 24 аминокислот. Белки клеточной поверхности семейства клаудинов, такие как CLDN6, экспрессируются в опухолях различного происхождения и, в частности, пригодны в качестве целевых структур при использовании антитело-опосредованной иммунотерапии рака вследствие их селективной экспрессии (экспрессия отсутствует в токсикологически релевантной нормальной ткани) и локализации в плазматической мембране.
Установлено, что CLDN6 дифференциально экспрессируется в опухолевых тканях, причем единственной нормальной тканью, экспрессирующей CLDN6, является плацента, в которой низкие количества CLDN6 обнаруживаются на уровне РНК. Было обнаружено, что CLDN6 экспрессируется, например, при раке яичника, раке легких, раке желудка, раке молочной железы, раке печени, раке поджелудочной железы, раке кожи, меланомах, раке головы и шеи, саркомах, раке желчевыводящих путей, почечно-клеточном раке и раке мочевого пузыря.
В различных вариантах осуществления изобретения раковые заболевания, связанные с экспрессией CLDN6, включают рак яичника, в частности, аденокарциному яичника и тератокарциному яичника, рак легкого, включая мелкоклеточный рак легкого (SCLC) и немелкоклеточный рак легкого (NSCLC), в частности, плоскоклеточную карциному легких и аденокарциному, рак желудка, рак молочной железы, рак печени, рак поджелудочной железы, рак кожи, в частности, базальноклеточную карциному и плоскоклеточную карциному, злокачественную меланому, рак головы и шеи, в частности, злокачественную плеоморфную аденому, саркому, в частности, синовиальную саркому и карциносаркому, рак желчных протоков, рак мочевого пузыря, в частности, переходно-клеточную карциному и папиллярную карциному, рак почки, в частности, почечно-клеточную карциному, включая светлоклеточный рак почки и папиллярный рак почки, рака толстой кишки, рака тонкой кишки, включая рак подвздошной кишки, в частности, аденокарциному тонкой кишки и аденокарциному подвздошной кишки, тестикулярную эмбриональную карциному, плацентарную хориокарциному, рак шейки матки, рак яичка, в частности, тестикулярную семиному, тестикулярную тератому, эмбриональный рак яичка, рак матки, герминогенные опухоли, такие как тератокарцинома или эмбриональная карцинома, в частности, герминогенные опухоли яичка, и их метастатические формы. В одном варианте осуществления раковую болезнь, связанную с экспрессией CLDN6, выбирают из группы, состоящей из рака яичника, рака легкого, метастатического рака яичника и метастатического рака легкого. Предпочтительно, рак яичника является карциномой или аденокарциномой. Предпочтительно, рак легкого является карциномой или аденокарциномой, и предпочтительно является бронхиолярным раком, таким как бронхиолярная карцинома или бронхиолярная аденокарцинома.
Использованный в описании термин "CLDN" обозначает клаудин и включает CLDN6. Предпочтительно, клаудин является человеческим клаудином.
Термин "CLDN6" предпочтительно имеет отношение к человеческому CLDN6 и, в частности, к белку, содержащему предпочтительно аминокислотную последовательность SEQ ID NO: 1 или SEQ ID NO: 2 из перечня последовательностей или вариант аминокислотной последовательности. Первая внеклеточная петля CLDN6 предпочтительно содержит аминокислоты с 28 по 80, более предпочтительно аминокислоты с 28 по 76 аминокислотной последовательности, указанной в SEQ ID NO: 1, или аминокислотной последовательности, указанной в SEQ ID NO: 2. Вторая внеклеточная петля CLDN6 предпочтительно содержит аминокислоты с 138 по 160, предпочтительно аминокислоты с 141 по 159, более предпочтительно аминокислоты с 145 по 157 аминокислотной последовательности, указанной в SEQ ID NO: 1, или аминокислотной последовательности, указанной в SEQ ID NO: 2. Указанные первая и вторая внеклеточные петли предпочтительно образуют внеклеточный участок CLDN6.
Термин "вариант" согласно изобретению имеет отношение, в частности, к мутантам, сплайс-вариантам, конформациям, изоформам, аллельным вариантам, видовым вариантам и видовым гомологам, в частности тем, которые присутствуют от природы. Аллельный вариант имеет отношение к изменению в нормальной последовательности гена, значение которой часто является неясным. Полное генетическое секвенирование часто устанавливает многочисленные аллельные варианты для данного гена. Видовой гомолог является нуклеиновой кислотой или аминокислотной последовательностью, происходящей от других видов, чем данная нуклеиновокислотная или аминокислотная последовательность. Термин "вариант" включает любые посттрансляционно модифицированные варианты и конформационные варианты.
Согласно изобретению термин "клаудин-положительный рак" или подобные термины означают рак, содержащий раковые клетки, экспрессирующие клаудин, предпочтительно на поверхности указанных раковых клеток. CLDN6 экспрессируется на поверхности клеток, если он располагается на поверхности указанных клеток и является доступным для связывания CLDN6-специфическими антителами, добавленными к клеткам.
Термин "клеточная поверхность" используется в соответствии с его обычным значением в данной области, и таким образом включает внешнюю поверхность клетки, доступную для связывания с белками и другими молекулами. Например, трансмембранный белок, имеющий один или более внеклеточных участков, рассматривается как экспрессированный на клеточной поверхности.
Термин "внеклеточный участок" в контексте настоящего изобретения относится к части молекулы, например, белка, которая обращена к внеклеточному пространству клетки и предпочтительно является доступной с наружной части указанной клетки, например, для антиген-связывающих молекул, таких как антитела, расположенных с наружной стороны клетки. Предпочтительно, термин относится к одной или более внеклеточным петлям или доменам или их фрагментам.
Термины "часть" или "фрагмент" используются в описании взаимозаменяемым образом и имеют отношение к непрерывному элементу. Например, часть структуры, такой как аминокислотная последовательность или белок, относится к непрерывному элементу указанной структуры. Участок, часть или фрагмент структуры предпочтительно обладает одним или более функциональными свойствами указанной структуры. Например, участок, часть или фрагмент эпитопа или пептида предпочтительно является иммунологически эквивалентным эпитопу или пептиду, из которого он получен. Часть или фрагмент белковой последовательности предпочтительно содержит последовательность, по меньшей мере, из 6, в частности, по меньшей мере, 8, по меньшей мере, 10, по меньшей мере, 12, по меньшей мере, 15, по меньшей мере, 20, по меньшей мере, 30, по меньшей мере, 50, или по меньшей мере, 100 последовательных аминокислот последовательности белка.
Согласно изобретению CLDN6 является незначительно экспрессированным в клетке, если уровень экспрессии является более низким по сравнению с экспрессией в клетках плаценты или в ткани плаценты. Предпочтительно, уровень экспрессии составляет меньше, чем 10%, предпочтительно меньше чем 5%, 3%, 2%, 1%, 0,5%, 0,1% или 0,05% экспрессии в клетках плаценты или в ткани плаценты или даже ниже. Предпочтительно, CLDN6 является незначительно экспрессированным в клетке, если уровень экспрессии превышает уровень экспрессии в нераковой ткани, отличной от плаценты не более чем в 2 раза, предпочтительно в 1,5 раза и предпочтительно не превышает уровень экспрессии в указанной нераковой ткани. Предпочтительно, CLDN6 является незначительно экспрессированным в клетке, если уровень экспрессии является уровнем, ниже предела обнаружения, и/или уровень экспрессии является слишком низким для осуществления связывания CLDN6-специфическими антителами, добавленными к клеткам.
Согласно изобретению CLDN6 экспрессируется в клетке, если уровень экспрессии превышает уровень экспрессии в нераковой ткани, отличной от плаценты, предпочтительно более чем в 2 раза, предпочтительно в 10 раз, 100 раз, 1000 раз или 10000 раз. Предпочтительно, CLDN6 экспрессируется в клетке, если уровень экспрессии находится выше предела обнаружения и/или если уровень экспрессии является достаточно высоким для осуществления связывания CLDN6-специфическими антителами, добавленными к клеткам. Предпочтительно, CLDN6, экспрессированный в клетке, экспрессируется или «выставляется» на поверхности указанной клетки.
Было обнаружено, что экспрессия CLDN6 обнаруживается только в плаценте в виде мРНК, тогда как белок не обнаруживается совсем. Соответственно, в данном документе принимается, что экспрессия CLDN6 в плаценте предпочтительно сопоставляется с экспрессией мРНК.
Согласно изобретению термин "болезнь" относится к любому патологическому состоянию, включая рак, в частности, к описанным в данном документе формам рака. Любые упоминания рака или конкретные формы рака в данном документе также включают его метастазы. В предпочтительном варианте осуществления болезнь, которую необходимо лечить в соответствии с настоящей заявкой, затрагивает клетки, экспрессирующие CLDN6, в частности, раковые стволовые клетки, экспрессирующие CLDN6.
"Болезни, связанные с клетками, экспрессирующими CLDN6" или сходные выражения означают согласно изобретению, что CLDN6 экспрессируется в клетках больной ткани или органа. В одном варианте осуществления экспрессия CLDN6 в клетках больной ткани или органа является повышенной по сравнению с состоянием в здоровой ткани или органе. Повышение имеет в виду повышение, по меньшей мере, на 10%, в частности, по меньшей мере, на 20%, по меньшей мере, на 50%, по меньшей мере, на 100%, по меньшей мере, на 200%, по меньшей мере, на 500%, по меньшей мере, на 1000%, по меньшей мере, на 10000% или даже более. В одном варианте осуществления экспрессия обнаруживается только в пораженной ткани, тогда как экспрессия в здоровой ткани является подавленной. Согласно изобретению болезни, связанные с клетками, экспрессирующими CLDN6, включают раковые заболевания. Более того, согласно изобретению раковые заболевания предпочтительно являются такими, при которых раковые клетки экспрессируют CLDN6.
При использовании в описании термин "раковая болезнь" или "рак" включает болезнь, характеризующуюся неправильно регулируемым клеточным ростом, пролиферацией, дифференцировкой, адгезией и/или миграцией. Под "раковой клеткой" имеется в виду аномальная клетка, которая растет посредством быстрой, неконтролируемой клеточной пролиферации и продолжает расти после стимула (воздействия), инициирующего прекращение нового роста. Предпочтительно "раковая болезнь" характеризуется клетками, экспрессирующими CLDN6, в частности, раковыми стволовыми клетками, экспрессирующими CLDN6.
Термин "рак" согласно изобретению включает лейкоз, семиному, меланому, тератому, лимфому, нейробластому, глиому, рак прямой кишки, рак эндометрия, рак почки, рак надпочечника, рак щитовидной железы, рак кожи, рак головного мозга, рак шейки матки, рак желудочно-кишечного тракта, рак печени, рак толстой кишки, рак желудка, рак кишечника, рак головы и шеи, рак лимфатического узла, рак пищевода, колоректальный рак, рак поджелудочной железы, рак уха, носа и горла (отоларингологический (ENT) рак), рак молочной железы, рак простаты, рак матки, рак яичника, рак легкого и их метастазы. Примерами являются карцинома легкого, карцинома молочной железы, карцинома простаты, карцинома толстого кишечника, почечно-клеточная карцинома, карцинома шейки матки или метастазы типов рака или опухолей, описанных выше. Термин «рак» согласно изобретению также включает метастазы рака.
Согласно изобретению "карцинома" представляет собой злокачественную опухоль, происходящую из эпителиальных клеток. Эта группа представляет наиболее распространенные формы рака, включая обычные формы рака молочной железы, простаты, легких и толстого кишечника.
"Аденокарцинома" представляет собой рак, возникающий в железистой ткани. Эта ткань к тому же является частью большой группы тканей, известных как эпителиальная ткань. Эпителиальная ткань включает кожу, железы и целый ряд других тканей, выстилающих полости и органы тела. С точки зрения эмбриологии эпителий происходит из эктодермы, эндодермы и мезодермы. Чтобы относиться к аденокарциноме, клетки необязательно должны быть частью железы, если только они обладают секреторными свойствами. Эта форма карциномы может возникать у некоторых высших животных, включая людей. Хорошо дифференцированные аденокарциномы имеют тенденцию походить на железистую ткань, из которой они происходят, в то время как плохо дифференцированные не похожи на эту ткань. С помощью окрашивания клеток из биопсийного материала патолог определяет, является ли опухоль аденокарциномой или другим типом рака. Аденокарциномы могут возникать во многих тканях организма вследствие повсеместного распространения желез в организме. Наряду с тем, что каждая железа не может секретировать одно и то же вещество, когда у клетки существует внешнесекреторная функция, она считается железистой, и поэтому ее злокачественная форма называется аденокарциномой. Злокачественные аденокарциномы вторгаются в другие ткани и дают метастазы, также проникающие в другие ткани. Аденокарцинома яичника является наиболее распространенным типом карциномы яичника. Сюда включаются серозные и слизистые аденокарциномы, светлоклеточная аденокарцинома и эндометриоидная аденокарцинома.
Под "метастазированием" имеется в виду распространение раковых клеток из первоначального местоположения в другую часть организма. Образование метастаза является очень сложным процессом и зависит от отделения злокачественных клеток от первичной опухоли, инвазии внеклеточного матрикса, проницаемости эндотелиальных базальных мембран для проникновения в полость тела и сосудов, а затем, после транспортировки кровотоком, инфильтрации органов-мишеней. Наконец, рост новой опухоли в месте-мишени зависит от ангиогенеза. Метастазы опухоли могут возникать даже после удаления первичной опухоли, так как опухолевые клетки или компоненты могут остаться и развить метастатический потенциал. В одном варианте осуществления термин "метастаз" согласно изобретению имеет отношение к "отдаленному метастазу", т.е. метастазу, удаленному от первичной опухоли и системы региональных лимфатических узлов. В одном варианте осуществления термин "метастаз" согласно изобретению имеет отношение к метастазу в лимфатический узел.
Резистентный рак - это злокачественное новообразование, в отношении которого определенное лечение является неэффективным, который или исходно является нечувствительным к лечению, или который становится нечувствительным с течением времени. Термины "рефрактерный", "нечувствительный" или "резистентный" используются в описании взаимозаменяемым образом.
Использованный в описании термин "раковая стволовая клетка" имеет отношение к клетке, которая может быть предшественником высоко пролиферативной раковой клетки. Раковая стволовая клетка обладает способностью к возобновлению роста опухоли, что продемонстрировано ее способностью к образованию опухоли у мышей с нарушенным иммунитетом. Раковые стволовые клетки в большинстве случаев являются медленно растущими относительно общей массы опухоли, т.е. раковые стволовые клетки обычно находятся в состоянии покоя. В некоторых вариантах осуществления, но не во всех, раковые стволовые клетки могут представлять только часть опухоли, например, приблизительно от 0,1 до 10%. Раковые стволовые клетки могут обладать одной или более или всеми из следующих характеристик или свойств: (i) могут обладать скрытой способностью инициировать возникновение опухоли и/или возобновлять опухолевый рост, (ii) могут быть менее мутированными относительно общей массы опухоли (например, вследствие более медленного роста и таким образом меньшего количества ошибок, зависящих от ДНК репликации, лучшей репарации ДНК и/или эпигенетических/немутагенных изменений, способствующих их злокачественности), (iii). могут иметь несколько характерных особенностей (а) нормальной стволовой клетки(ок) (например, сходный профиль поверхностных антигенов и/или внутриклеточной экспрессии, программы самообновления, множественную лекарственную резистентность, незрелый фенотип, и т.д., типичные для нормальных стволовых клеток) и могут происходить от (а) нормальной стволовой клетки(ок), (iv) могут быть источником метастазирования, (v) могут быть медленно растущими или находиться в состоянии покоя, (vi) могут быть туморогенными (например, как установлено с помощью экспериментов с NOD/SCID имплантацией), (vii) могут быть относительно резистентными. к традиционной терапии (т.е. хеморезистентными) и (viii) могут содержать субпопуляцию опухоли (например, относительно общей массы опухоли).
Под термином "лечить" имеется в виду введение субъекту соединения или композиции или комбинации соединений или композиций с целью предотвращения или устранения болезни, включая уменьшение размеров опухоли или количества опухолей у субъекта; задержку или замедление болезни у субъекта; ингибирование или замедление развития новой болезни у субъекта; уменьшение частоты и тяжести симптомов и/или рецидивов у субъекта, имеющего в настоящее время или ранее имевшего заболевание; и/или удлинение, т.е. увеличение продолжительности жизни субъекта. В частности, термин "лечение болезни" включает излечение, уменьшение продолжительности, облегчение, предотвращение, замедление или ингибирование прогрессирования или ухудшения, или предотвращение или задержку начала болезни или ее симптомов.
В контексте настоящего изобретения термины "защищать" или "предотвращать" имеют отношение к предотвращению или лечению или к тому и другому возникновения и/или развития болезни у субъекта, в частности, к сведению к минимуму возможности того, что у субъекта будет развиваться болезнь, или к задержке развития болезни. Например, субъект, подверженный риску появления рака, может быть кандидатом на лечение с целью предотвращения рака.
Под "имеющим риск" подразумевается субъект, имеющий более высокий, чем обычно, шанс развития болезни, в частности, рака, по сравнению с основной популяцией. Кроме того, субъект, имевший или в настоящее время имеющий болезнь, в частности, рак, является субъектом с повышенным риском развития болезни, так как болезнь у субъекта может продолжать развиваться. У субъектов, имеющих рак в настоящее время или имевших рак, также имеется повышенный риск образования метастазов рака.
Согласно изобретению термин "пациент" обозначает субъекта, нуждающегося в лечении, в частности, больного субъекта, включая людей, нечеловекообразных приматов или других животных, в частности, млекопитающих, таких как коровы, лошади, свиньи, овцы, козы, собаки, кошки, или грызунов, таких как мыши и крысы. В особенно предпочтительном варианте осуществления пациент является человеком.
Использованный в описании термин "комбинация" в контексте применения терапии относится к использованию более чем одного вида лечения или терапевтического средства. Использование термина "в комбинации" не ограничивает порядок, в котором терапия или терапевтические средства вводятся субъекту. Терапия или терапевтическое средство может быть введено до, одновременно с или после введения второго вида терапии или терапевтического средства субъекту. Предпочтительно, виды терапии или терапевтические средства вводятся субъекту в такой последовательности, таком количестве и/или в пределах такого временного интервала, что виды терапии или терапевтические средства могут действовать совместно. В отдельном варианте осуществления виды терапии или терапевтические средства вводятся субъекту в такой последовательности, таком количестве и/или в пределах такого временного интервала, что. они обеспечивают большую терапевтическую пользу, чем в том случае, когда они вводятся иначе, в частности, независимо друг от друга. Предпочтительно, большая польза является синергетическим эффектом.
"Клетка-мишень" означает какую-либо нежелательную клетку, такую как раковая клетка, в частности, раковая стволовая клетка. В предпочтительных вариантах осуществления клетка-мишень экспрессирует CLDN6.
Согласно изобретению термин "химиотерапия" имеет отношение к лечению с использованием одного или более химиотерапевтических средств или комбинаций химиотерапевтических средств, таких как цитостатические или цитотоксические средства. Химиотерапевтические средства согласно изобретению включают цитостатические соединения и цитотоксические соединения.
Согласно изобретению термин "химиотерапевтическое средство" включает таксаны, такие как паклитаксел и доцетаксел, и соединения платины, такие как цисплатин и карбоплатин и их комбинации. Предпочтительные комбинации, в частности, для лечения рака яичника, могут содержать комбинацию таксана и соединения платины, например, комбинацию паклитаксела и карбоплатина. Кроме того, предпочтительные комбинации, в частности, для лечения рака яичника, в частности, герминогенных опухолей яичника, и/или для лечения эмбрионально-клеточных опухолей, в частности, рака яичника и опухолей половых клеток яичка, могут включать комбинацию соединения платины, такого как цисплатин с этопозидом и/или блеомицином. Согласно изобретению ссылка на химиотерапевтическое средство включает любое пролекарство, такое как сложный эфир, соль или производное, например, конъюгат указанного средства. Примерами являются конъюгаты указанного средства с веществом-носителем, например, паклитаксел, связанный с протеином, например, паклитаксел, связанный с альбумином. Предпочтительно, соли указанного средства являются фармацевтически приемлемыми солями.
Таксаны - это класс дитерпеновых соединений, полученных первоначально из природных источников, например, растений рода Taxus, а некоторые из них были синтезированы искусственно. Основным механизмом действия лекарственных средств из класса таксанов является нарушение функции микротрубочек, что приводит к ингибированию процесса клеточного деления. Таксаны включают доцетаксел (таксотер) и паклитаксел (таксол).
Согласно изобретению термин "доцетаксел" относится к соединению, имеющему следующую формулу:

В частности, термин "доцетаксел" относится к соединению 1,7β,10β-тригидрокси-9-оксо-5β,20-эпокситакс-11-ен-2α,4,13α-триил 4-ацетат 2-бензоат 13-{(2R,3S)-3-[(трет-бутоксикарбонил)-амино]-2-гидрокси-3-фенилпропаноат}.
Согласно изобретению термин "паклитаксел" относится к соединению, имеющему следующую формулу:
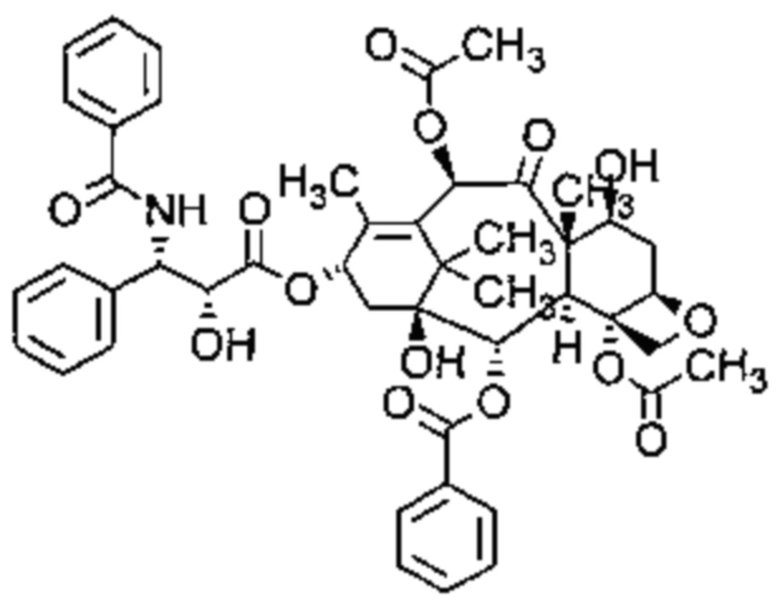
В частности, термин "паклитаксел" относится к соединению (2α,4α,5β,7β,10β,13α)-4,10-бис-(ацетилокси)-13-{[(2R,3S)-3-(бензоиламино)-2-гидрокси-3-фенилпропаноил]окси}-1,7-дигидрокси-9-оксо-5,20-эпоксатакс-11-ен-2-ил бензоат.
Согласно изобретению термин "соединение платины" имеет отношение к соединениям, содержащим платину в своих структурах, таким как платиновые комплексы, и включает такие соединения, как цисплатин, карбоплатин и оксалиплатин.
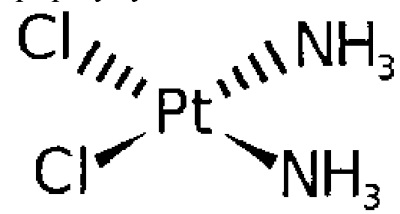
Термин "цисплатин" относится к соединению цис-диамминодихлороплатины (II) (CDDP), имеющему следующую формулу:
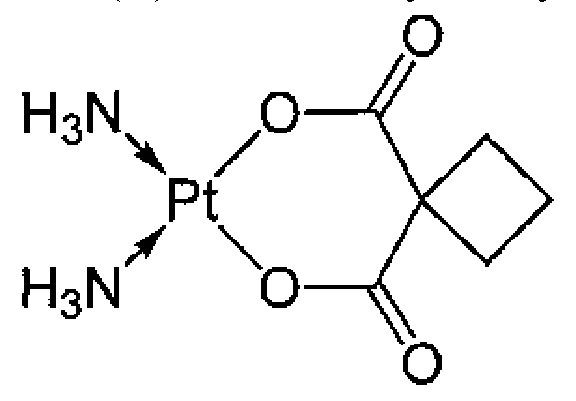
Термин "карбоплатин" относится к соединению цис-диаммино(1,1-циклобутандикарбоксилато)платина (II), имеющему следующую формулу:
Термин "оксалиплатин" относится к соединению платины, в котором атом платины образует комплекс с лигандом диаминоциклогексаном, данное соединение имеет следующую формулу:
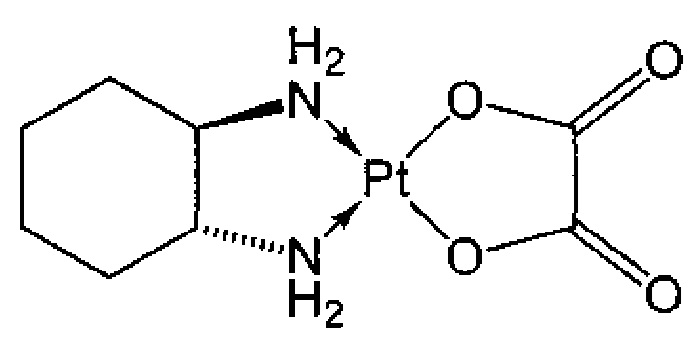
В частности, термин "оксалиплатин" относится к соединению [(1R,2R)-циклогексан-1,2-диамин](этандиоато-O,O')платина(II). Оксалиплатин для инъекций также продается под торговым названием элоксатин.
Дополнительные химиотерапевтические средства, использование которых предусматривается в настоящем изобретении, или по отдельности или в комбинации с другими химиотерапевтическими средствами, такими как таксаны или соединения платины, включают, но не ограничиваются этим, нуклеозидные аналоги, аналоги камптотецина и антрациклины.
Термин "нуклеозидный аналог" относится к структурному аналогу нуклеозида, эта категория включает как аналоги пурина, так и аналоги пиримидина.
Термин "гемцитабин" относится к соединению, являющемуся нуклеозидным аналогом и имеющему следующую формулу:
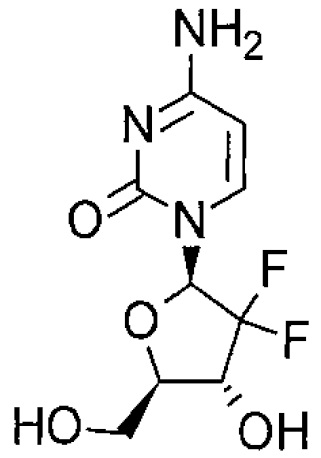
В частности, этот термин относится к соединению 4-амино-1-(2-дезокси-2,2-дифтор-β-D-эритро-пентофуразонил)пиримидин-2(1Н)-он или 4-амино-1-[(2R,4R,5R)-3,3-дифтор-4-гидрокси-5-(гидроксиметил)оксолан-2-ил]-1,2-дигидропиридин-2-он.
Термин "нуклеозидный аналог" включает производные фторпиримидина, такие как фторурацил и его пролекарства. Термин "фторурацил" или "5-фторурацил" (5-FU или f5U) (продается под торговыми наименованиями «Адруцил», «Carac», «Эфудикс», «Эфудекс» и «Флюороплекс») относится к соединению, являющемуся аналогом пиримидина и имеющему следующую формулу:
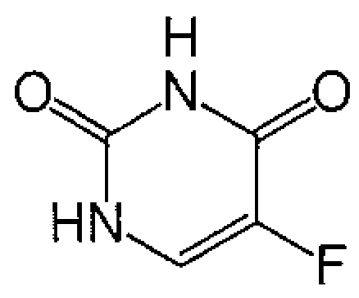
В частности, термин относится к соединению 5-фтор-1Н-пиримидин-2,4-дион.
Термин "капецитабин" (Xeloda, Roche) относится к химиотерапевтическому средству, являющемуся пролекарством, которое превращается в 5-FU в тканях. Капецитабин может вводиться перорально и имеет следующую формулу:
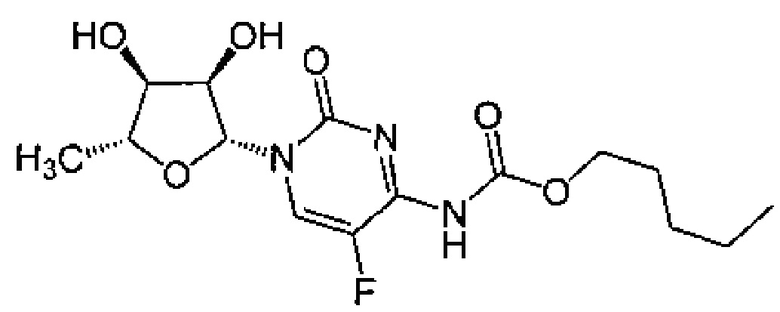
В частности, термин относится к соединению пентил [1-(3,4-дигидрокси-5-метилтетрагидрофуран-2-ил)-5-фтор-2-оксо-1Н-пиримидин-4-ил]карбамат.
Термин "фолиновая кислота" или "лейковорин" относится к соединению, используемому в синергической комбинации с химиотерапевтическим препаратом 5-фторурацилом. Таким образом, если в описании делается ссылка на введение 5-фторурацила или его пролекарства, указанное введение в одном варианте осуществления может включать введение в сочетании с фолиновой кислотой. Фолиновая кислота имеет следующую формулу:
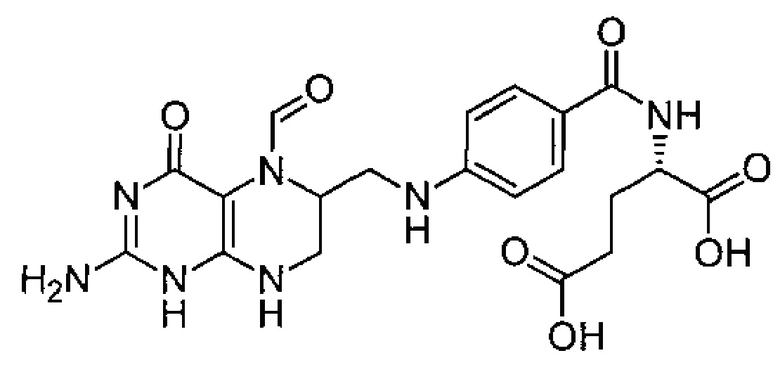
В частности, термин относится к соединению (2S)-2-{[4-[(2-амино-5-формил-4-оксо-5,6,7,8-тетрагидро-1Н-птеридин-6-ил)метиламино]бензоил]амино}пентандиовая кислота.
Согласно изобретению термин "аналог камптотецина" относится к производным соединения камптотецина (СРТ; (S)-4-этил-4-гидрокси-1Н-пирано[3',4':6,7]индолизино[1,2-b]хинолин-3,14-(4Н,12Н)-дион). Предпочтительно, термин "аналог камптотецина" относится к соединениям, содержащим следующую структуру:
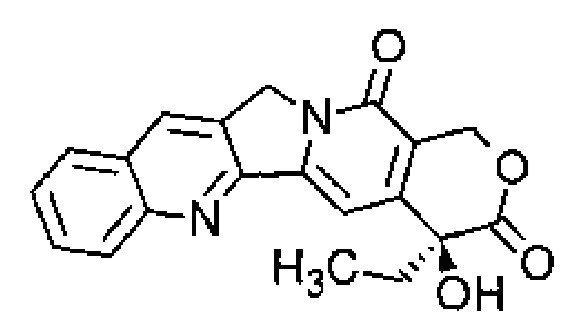
Согласно изобретению предпочтительными аналогами камптотецина являются ингибиторы фермента ДНК-топоизомеразы I (topo I). Предпочтительными аналогами камптотецина согласно изобретению являются иринотекан и топотекан.
Иринотекан является лекарственным средством, предотвращающим раскручивание ДНК путем ингибирования топоизомеразы I. С точки зрения химии, он является полусинтетическим аналогом природного алкалоида камптотецина и имеет следующую формулу:
В частности, термин "иринотекан" относится к соединению (S)-4,11-диэтил-3,4,12,14-тетрагидро-4-гидрокси-3,14-диоксо1H-пирано[3',4':6,7]-индолизино[1,2-b]хинолин-9-ил-[1,4'бипиперидин]-1'-карбоксилат.
Топотекан является ингибитором топоизомеразы и имеет следующую формулу:
В частности, термин "топотекан" относится к соединению (S)-10-[(диметиламино)метил]-4-этил-4,9-дигидрокси-1Н-пирано[3',4':6,7]индолизино[1,2-b]хинолин-3,14(4Н,12Н)-дион моногидрохлорид.
Антрациклины - это класс лекарственных средств, обычно используемых в химиотерапии опухолей, также известный под названием антрациклиновых антибиотиков. В структурном отношении все антрациклины имеют общую структуру содержащую четыре кольца 7,8,9,10-тетрагидротетрацен-5,12-хинона и обычно нуждаются в гликозилировании в специфических сайтах.
Антрациклины преимущественно осуществляют один или более из следующих механизмов действия: 1. Ингибирование синтеза ДНК и РНК путем интеркаляции между парами оснований ДНК/РНК цепочки, что предотвращает репликацию быстрорастущих раковых клеток. 2. Ингибирование фермента топоизомеразы II, что предотвращает релаксацию суперспиральной ДНК и таким образом блокирует транскрипцию и репликацию ДНК. 3. Образование железо-опосредованных свободных кислородных радикалов, повреждающих ДНК и мембраны клеток.
Согласно изобретению термин "антрациклин" предпочтительно имеет отношение к препарату, предпочтительно противоопухолевому препарату, предназначенному для индукции апоптоза, предпочтительно путем ингибирования повторного связывания ДНК с топоизомеразой II.
Примеры антрациклинов и аналогов антрациклинов включают, но не ограничиваются этим, даунорубицин (дауномицин), доксорубицин (адриамицин), эпирубицин, идарубицин, родомицин, пирарубицин, валрубицин, N-трифтор-ацетил доксорубицин-14-валерат, аклациномицин, морфолинодоксорубицин (морфолино-DOX), цианоморфолино-доксорубицин (цианоморфолино-DOX), 2-пирролино-доксорубицин (2-PDOX), 5-иминодауномицин, митоксантрон и аклациномицин А (акларубицин). Митоксантрон является членом класса антрацендионов, аналогов антрациклинов, утративших сахарный компонент антрациклинов, но сохранивших плоскую полициклическую структуру ароматических колец, которая обеспечивает возможность интеркаляции в ДНК.
В частности, предусмотренным в качестве антрациклина в контексте настоящего изобретения является эпирубицин. Эпирубицин является антрациклиновым препаратом, имеющим следующую формулу:
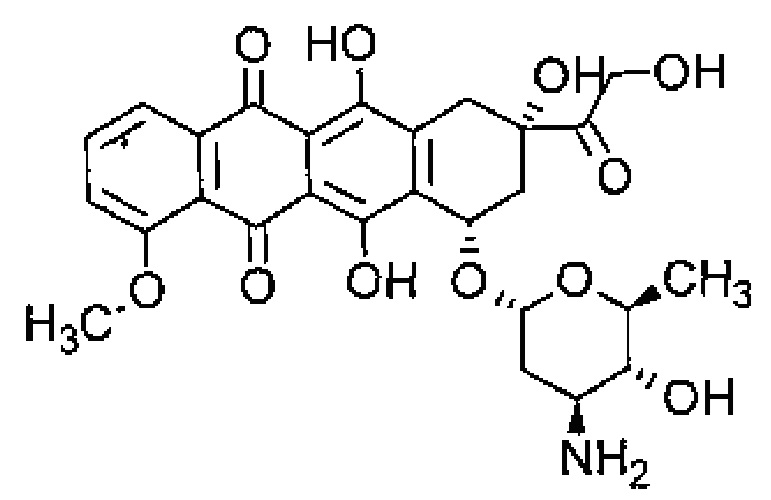
и продается под торговым названием «элленс» в США и под торговым названием «фарморубицин» или «эпирубицин» (Ebewe) в других странах. В частности, термин "эпирубицин" относится к соединению (8R,10S)-10-[(2S,4S,5R,6S)-4-амино-5-гидрокси-6-метил-оксан-2-ил]окси-6,11-дигидрокси-8-(2-гидроксиацетил)-1-метокси-8-метил-9,10-дигидро-7Н-тетрацен-5,12-дион. Эпирубицин является более предпочтительным в некоторых химиотерапевтических режимах по сравнению с доксорубицином, наиболее популярным антрациклином, так как, по-видимому, он вызывает меньше побочных эффектов.
Термин "этопозид" относится к полусинтетическому производному подофиллотоксина, демонстрирующему противоопухолевую активность. Этопозид ингибирует синтез ДНК путем образования комплекса между топоизомеразой II и ДНК. Этот комплекс вызывает появление разрывов в двухцепочечной ДНК и препятствует их репарации посредством связывания с топоизомеразой II. Накопление разрывов в ДНК препятствует входу клетки в митотическую фазу деления и приводит к гибели клетки. Этопозид имеет следующую формулу:
В частности, термин относится к соединению 4'-диметил-эпиподофиллотоксин 9-[4,6-O-(R)-этилиден-бета-D-глюкопиранозид], 4'-(дигидроген фосфат).
Термин "блеомицин" относится к гликопептидному антибиотику, который продуцируется бактерией Streptomyces verticillus. При использовании в качестве противоопухолевого средства, он действует, вызывая разрывы ДНК. Блеомицин предпочтительно включает соединение, имеющее следующую формулу:
Если согласно изобретению химиотерапия вводится в комбинации с антителом, обладающим способностью связываться с CLDN6 (которое может присутствовать в конъюгате, по меньшей мере, с одной молекулой токсичного лекарственного средства, т.е. в виде конъюгата антитело-лекарственное средство), в таком случае является предпочтительным введение химиотерапии до и/или одновременно с введением антитела (в виде смеси или отдельных композиций). Предпочтительно, введение химиотерапии начинается до введения антитела. Предпочтительно, химиотерапия увеличивает экспрессию CLDN6 в раковых клетках, таких как раковые стволовые клетки, причем химиотерапию начинают или вводят до введения антитела, вследствие чего противоопухолевая активность антитела увеличивается. Предпочтительно, введение химиотерапии начинается, по меньшей мере, за 2, по меньшей мере, за 4, по меньшей мере, за 6, по меньшей мере, за 8, по меньшей мере, за 10, по меньшей мере, за 12 или, по меньшей мере, за 14 дней до первого введения антитела. Введение химиотерапии может продолжаться в течение введения антитела или может быть прекращено до или во время введения антитела, например, за 1-3, 1-7, 1-10 или 1-14 дней до введения антитела. Предпочтительно, химиотерапевтическое средство включает таксан, такой как паклитаксел или доцетаксел, и/или соединение платины, такое как цисплатин или карбоплатин.
Термин "антиген" имеет отношение к агенту, такому как белок или пептид, содержащему эпитоп, на который направлен или должен быть направлен иммунный ответ. В предпочтительном варианте осуществления антиген является опухолеассоциированным антигеном, таким как CLDN6, т.е. компонентом раковых клеток, происходящим от цитоплазмы, клеточной поверхности и клеточного ядра, в частности, тех антигенов, которые вырабатываются, предпочтительно в большом количестве, внутриклеточно или как поверхностные антигены на раковых клетках.
В контексте настоящего изобретения термин "опухолеассоциированный антиген" предпочтительно имеет отношение к белкам, которые в нормальных условиях специфически экспрессируются в ограниченном числе тканей и/или органов или во время конкретных стадий развития и экспрессируются или ненормально экспрессируются в одной или более опухолевых или раковых тканях. В контексте настоящего изобретения опухолеассоциированный антиген предпочтительно связан с клеточной поверхностью раковой клетки и предпочтительно не экспрессируется или только крайне редко экспрессируется в нормальных тканях.
Термин "эпитоп" относится к антигенной детерминанте в молекуле, т.е. части в молекуле, которая распознается иммунной системой, например, которая распознается антителом. Например, эпитопы являются отдельными, трехмерными участками на антигене, которые распознаются иммунной системой. Обычно эпитопы состоят из химически активных поверхностных группировок молекул, таких как аминокислоты или боковые цепи сахаров, и обычно имеют специфические трехмерные структурные характеристики, а также специфические характеристики заряда. Конформационные и неконформационные эпитопы различаются тем, что связывание с первым, но не со вторым, утрачивается в присутствии денатурирующих растворителей. Эпитоп белка, такого как CLDN6, предпочтительно содержит непрерывную или прерывистую часть указанного белка и составляет предпочтительно от 5 до 100, предпочтительно от 5 до 50, более предпочтительно от 8 до 30, наиболее предпочтительно от 10 до 25 аминокислот в длину, например, эпитоп может иметь предпочтительно 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 аминокислот в длину.
Термин "антитело" относится к гликопротеину, содержащему, по меньшей мере, две тяжелые (Н) цепи и две легкие (L) цепи, взаимно-соединенные дисульфидными связями, и включает любую молекулу, содержащую антигенсвязывающий участок. Термин "антитело" включает моноклональные антитела и фрагменты или производные антител, включая, без ограничения, человеческие антитела, гуманизированные антитела, химерные антитела, одноцепочечные антитела, например, scFv's и антигенсвязывающие фрагменты антител, такие как Fab и Fab1 фрагменты, а также включает все рекомбинантные формы антител, например, антитела, экспрессированные в прокариотах, негликозилированные антитела и любые антигенсвязывающие фрагменты антител и производные, как описывается здесь. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (обозначается в описании VH) и константной области тяжелой цепи. Каждая легкая цепь состоит из вариабельной области легкой цепи (обозначается в описании VL) и константной области легкой цепи. Области VH и VL можно дополнительно подразделить на области гипервариабельности (сверхизменчивости), называемые гипервариабельными участками (CDR), чередующиеся с участками, являющимися более консервативными, называемыми каркасными участками (FR). Каждая VH и VL состоит из трех CDR и четырех FR, располагающихся от амино-конца до карбокси-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепи содержат домен связывания, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканью или факторами «хозяина», включая разные клетки иммунной системы (например, эффекторные клеток) и первый компонент (Clq) классической системы комплемента.
Использованный в описании термин "моноклональное антитело" относится к препарату молекул антител с единообразным молекулярным составом. Моноклональное антитело обладает одной специфичностью связывания и сродством к одному эпитопу. В одном варианте осуществления моноклональные антитела вырабатываются с помощью гибридомы, которая включает В-клетку, полученную от животного, не являющегося человеком, например, мыши, и соединенную с иммортализованной клеткой.
Использованный в описании термин "рекомбинантное антитело" включает все антитела, которые получаются, экспрессируются, создаются или выделяются с помощью рекомбинантных способов, например, (а) антитела, выделенные из животного (например, мыши), являющегося трансгенным или трансхромосомным в отношении генов иммуноглобулинов или гибридомы, полученной из них, (b) антитела, выделенные из клетки-хозяина, трансформированной для того, чтобы она экспрессировала антитела, например, из трансфектомы, (c) антитела, выделенные из комбинаторной библиотеки рекомбинантных антител, и (d) антитела полученные, экспрессированные, созданные или выделенные любыми другими способами, которые затрагивают сплайсинг последовательностей генов иммуноглобулинов с другими ДНК-последовательностями.
Использованный в описании термин "человеческое антитело" включает антитела, имеющие вариабельную область и константную область, происходящие от человеческих зародышевых последовательностей иммуноглобулина. Человеческие антитела могут содержать остатки аминокислот, некодированные человеческими зародышевыми последовательностями иммуноглобулина (например, мутации, введенные путем случайного или сайт-специфического мутагенеза in vitro или путем соматических мутаций in vivo).
Термин "гуманизированное антитело" относится к молекуле, имеющей участок связывания антигена, полученный в основном от иммуноглобулина вида животного, не являющегося человеком, при этом остальная часть молекулы иммуноглобулина основывается на структуре и/или последовательности иммуноглобулина человека. Участок связывания антигена может содержать или полные вариабельные домены, присоединенные к константным доменам, или только гипервариабельные участки (CDR), присоединенные к подходящим каркасным участкам в вариабельных доменах. Участки связывания антигена могут быть дикого типа или модифицированными с помощью одной или более аминокислотных замен, например, модифицированными для того, чтобы быть более похожими на человеческий иммуноглобулин. Некоторые формы гуманизированных антител сохраняют все CDR-последовательности (например, гуманизированное мышиное антитело, содержащее все шесть CDR от мышиного антитела). Другие формы имеют один или более CDR, измененных относительно первоначального антитела.
Термин "химерное антитело" относится к антителам, в которых одна часть каждой из аминокислотных последовательностей тяжелой и легкой цепей является гомологичной соответствующим последовательностям в антителе, полученном от конкретного вида или принадлежащего к определенному классу, тогда как остальной сегмент цепи является гомологичным соответствующим последовательностям другого вида. Обычно вариабельный участок и легкой и тяжелой цепей копирует вариабельные участки антител, полученных от одного вида млекопитающих, тогда как константные части являются гомологичными последовательностям антител, полученных от другого вида. Одним очевидным преимуществом таких химерных форм является то, что вариабельный участок можно легко получить от известных в настоящее время источников, используя легкодоступные В-клетки или гибридомы от организмов-хозяев, не являющихся человеком, в комбинации с константными областями, полученными, например, из препаратов клеток человека. Притом, что вариабельная область имеет преимущество, заключающееся в легкости получения, а специфичность не подвергается влиянию источника, константная область, будучи человеческой, менее вероятно вызовет иммунный ответ у человека при введении антител, чем вызвала бы константная область из источника, не являющегося человеком. Однако, данное определение не ограничивается этим отдельным примером.
Антитела могут происходить от разных видов, включая, но не ограничиваясь этим, мышь, крысу, кролика, морскую свинку и человека.
Описанные в данном документе антитела включают IgA, такие как IgA1 или IgA2, IgG1, IgG2, IgG3, IgG4, IgE, IgM, и IgD антитела. В различных вариантах осуществления антитело представляет собой IgG1 антитело, конкретнее IgG1, каппа или IgG1, лямбда изотип (т.е. IgG1, κ, λ), IgG2a антитело (например, IgG2a, κ, λ), IgG2b антитело (например, IgG2b, κ, λ), IgG3 антитело (например, IgG3, κ, λ) или IgG4 антитело (например, IgG4, κ, λ).
При использовании в описании "гетерологичное антитело" определяется с точки зрения трансгенного организма, продуцирующего такое антитело. Этот термин относится к антителу, имеющему аминокислотную последовательность или кодированному нуклеиновокислотной последовательностью, соответствующей последовательности, обнаруженной в организме, не содержащем трансгенный организм, и как правило, полученному от вида иного, чем трансгенный организм.
При использовании в описании "гетерогибридное антитело" относится к антителу, имеющему легкую и тяжелую цепи от разных организмов. Например, антитело, имеющее человеческую тяжелую цепь, соединенную с мышиной легкой цепью, является гетерогибридным антителом.
Описанные здесь антитела предпочтительно являются изолированными. "Изолированное антитело" при использовании в описании относится к антителу, которое в основном свободно от других антител, имеющих другие антигенные специфичности (например, изолированное антитело, которое специфично связывается с CLDN6, является в основном свободным от антител, специфично связывающих антигены, отличные от CLDN6). Однако, изолированное антитело, которое специфически связывается с эпитопом, изоформой или вариантом CLDN6 человека, может иметь перекрестную реактивность к другим родственным антигенам, например, от других видов (например, видовыми гомологами CLDN6). Более того, изолированное антитело может быть в основном свободно от другого клеточного материала и/или химических веществ. В одном варианте осуществления изобретения комбинация "изолированных" моноклональных антител имеет отношение к антителам, имеющим разные специфичности и объединенным в четко определенную композицию или смесь.
Термины "антигенсвязывающий участок" антитела (или просто "участок связывания") или "антигенсвязывающий фрагмент" антитела (или просто "связывающий фрагмент") или сходные термины относятся к одному или более фрагментам антитела, которые сохраняют способность к специфическому связыванию с антигеном. Показано, что антигенсвязывающая функция антитела может осуществляться фрагментами полноразмерного антитела. Примеры связывающих фрагментов, охваченные термином "антигенсвязывающий участок" антитела, включают (i) Fab фрагменты, одновалентные фрагменты, состоящие из VL, VH, CL и СН доменов; (ii) F(ab')2 фрагменты, двухвалентные фрагменты, содержащие два Fab-фрагмента, соединенные дисульфидным мостиком в шарнирной области; (iii) Fd фрагменты, состоящие из VH и СН доменов; (iv) Fv фрагменты, состоящие, из VL и VH доменов одноцепочечных антител, (v) dAb фрагменты (Ward et al, (1989) Nature 341: 544-546), состоящие из VH домена; (vi) изолированные гипервариабельные участки (CDR) и (vii) комбинации двух или более изолированных CDR, которые необязательно могут соединяться синтетическим линкером. Кроме того, хотя два домена Fv фрагмента, VL и VH, кодируются отдельными генами, их можно соединить, используя рекомбинантные методы, с помощью синтетических линкеров, что дает им возможность представлять собой единую белковую цепь, в которой VL и VH области располагаются парами, чтобы образовать одновалентные молекулы (известные как одноцепочечный Fv (scFv); смотри, например, Bird et al. (1988) Science 242: 423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). Такие одноцепочечные антитела также включаются в термин "антигенсвязывающий участок" антитела. Дополнительным примером являются домен-связывающие гибридные иммуноглобулины, содержащие (i) полипептидный домен связывания, который присоединяется к шарнирной области иммуноглобулина, (ii) константную область СН2 тяжелой цепи иммуноглобулина, присоединенную к шарнирной области, и (iii) константную область СН3 тяжелой цепи иммуноглобулина, присоединенную к константной области СН2. Связывающий домен полипептида может быть вариабельной областью тяжелой цепи или вариабельной областью легкой цепи. Домен-связывающие иммуноглобулиновые гибридные белки дополнительно раскрываются в США 2003/0118592 и США 2003/0133939. Эти фрагменты антител получают с помощью обычных методов, известных специалистам в данной области техники, при этом фрагменты подвергаются скринингу в отношении пригодности, так же, как и интактные антитела.
Термин "домен связывания", применительно к настоящему изобретению, описывает структуру, например, антитела, которая связывается с/взаимодействует с данной целевой структурой/антигеном/эпитопом. Таким образом, домен связывания согласно изобретению обозначает "участок (сайт) взаимодействия с антигеном".
Изобретение включает все антитела и производные антител, такие как фрагменты антител, описанные здесь, которые для целей изобретения охватываются термином "антитело". Термин "производные антител" относится к любой модифицированной форме антитела, например, конъюгату антитела и другого агента или антитела или фрагмента антитела.
Антитела природного происхождения являются, как правило, моноспецифическими, т.е. они связываются с одним антигеном. Настоящее изобретение включает антитела, связывающиеся с целевой клеткой (путем взаимодействия с CLDN6) и второй частицей, такой как цитотоксическая клетка (например, задействуя CD3 рецептор). Антитела настоящего изобретения могут быть биспецифическими или мультиспецифическими, такими как триспецифические, тетраспецифические и т.д.
Термин "биспецифическая молекула" включает любой агент, который имеет две разных специфичности связывания. Например, молекула может связываться с или взаимодействовать с (а) антигеном клеточной поверхности, и (b) рецептором, таким как Fc-рецептор на поверхности эффекторной клетки. Термин "мультиспецифическая молекула" включает агент, который имеет более чем две разных специфичности связывания. Например, молекула может связываться с или взаимодействовать с (а) антигеном клеточной поверхности и (b) с рецептором, таким как Fc-рецептор на поверхности эффекторной клетки и (c), по меньшей мере, с одним другим компонентом. Соответственно, термин "антитело, обладающее способностью связываться с CLDN6" включает, но не ограничивается этим, биспецифические, триспецифические, тетраспецифические и другие мультиспецифические молекулы, нацеленные на CLDN6, и на другие мишени, такие как Fc-рецепторы на эффекторных клетках. Термин "биспецифические антитела" также включает диатела (диабоди). Диатела являются двухвалентными биспецифическими антителами, в которых VH и VL домены экспрессируются на одной полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы дать возможность располагаться парами между двумя доменами на одной и той же цепи, таким образом, вынуждая домены образовывать пару с комплементарными доменами другой цепи и порождая два антигенсвязывающих участка (смотри, например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448; Poljak, R.J., et al. (1994) Structure 2: 1121-1123).
В контексте настоящего изобретения "антитело, обладающее способностью связываться с CLDN6," предпочтительно способно вызывать иммунные эффекторные функции, как описано в этом документе. Предпочтительно, указанные иммунные эффекторные функции направляются против клеток, таких как раковые стволовые клетки, несущие опухолеассоциированный антиген CLDN6 на своей поверхности.
Термин "иммунные эффекторные функции" в контексте настоящего изобретения включает какую-либо функцию, опосредованную компонентами иммунной системы, которая приводит, например, к ингибированию роста опухоли и/или ингибированию развития опухоли, включая ингибирование диссеминации опухоли и метастазов. Предпочтительно, иммунные эффекторные функции в результате приводят к уничтожению раковых клеток, в частности, раковых стволовых клеток. Такие, функции включают комплементзависимую цитотоксичность (CDC), антителозависимую клеточноопосредованную цитотоксичность (ADCC), антителозависимый клеточноопосредованный фагоцитоз (ADCP), индукцию апоптоза в клетках, несущих опухолеассоциированный антиген, цитолиз клеток, несущих опухолеассоциированный антиген и/или ингибирование пролиферации клеток, несущих опухолеассоциированный антиген. Связывающие агенты также могут оказывать влияние просто путем связывания опухолеассоциированных антигенов на поверхности раковой клетки. Например, антитела могут блокировать функцию опухолеассоциированного антигена или вызывать апоптоз только путем связывания с опухолеассоциированным антигеном на поверхности раковой клетки.
Согласно изобретению антитело может быть конъюгировано с терапевтической молекулой или агентом, таким как, токсичный фрагмент (молекула) лекарственного средства, в частности, цитотоксином, лекарственным средством (например, иммуносупрессорным средством) или радиоизотопом. Цитотоксин или цитотоксическое средство включает любое средство, которое наносит ущерб и, в частности, уничтожает клетки. Примеры включают таксол, цитохалазин В, грамицидин D, этидиум бромид, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин и их аналоги или гомологи. Подходящие для образования конъюгатов с антителами терапевтические средства включают, но не ограничиваются этим, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, флударабин, 5-фторурацил декарбазин), алкилирующие средства (например, мехлорэтамин, тиотепа, хлорамбуцил, мелфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусулфан, дибромманнитол, стрептозотоцин, митомицин С и цис-дихлородиамин платина (II) (DDP) цисплатин), антрациклины (например, даунорубицин (в прошлом даунорубицин) и доксорубицин), антибиотики (например, дактиномицин (в прошлом актиномицин), блеомицин, митрамицин и антрамицин (АМС), и антимитотические средства (например, винкристин и винбластин). В предпочтительном варианте осуществления терапевтическое средство является цитотоксическим средством или радиотоксическим средством. В другом варианте осуществления терапевтическое средство является иммуносупрессорным средством. В другом варианте осуществления терапевтическое средство является GM-CSF. В предпочтительном варианте осуществления терапевтическое средство представляет собой доксорубицин, цисплатин, блеомицин, сульфат, кармустин, хлорамбуцил, циклофосфамид или рицин А. Особенно предпочтительными токсичными лекарственными молекулами согласно изобретению являются соединения, ингибирующие сборку микротрубочек и обладающие антипролиферативным и/или цитотоксическим действиями.
Особенно предпочтительным согласно изобретению является антитело, конъюгированное с терапевтической молекулой или средством, таким как цитотоксин, оказывающим воздействие на медленно растущие или находящиеся в состоянии покоя клетки, такие как раковые стволовые клетки. Такие терапевтические молекулы включают терапевтические молекулы, оказывающие воздействие на мРНК и/или синтез белков. Некоторые ингибиторы транскрипции известны. Например, актиномицин D, являющийся как ингибитором транскрипции, так и агентом, повреждающим ДНК, интеркалирует (вставляется) в ДНК и таким образом ингибирует стадию инициации транскрипции. Флавопиридол «нацелен» на стадию элонгации транскрипции. α-Аманитин связывается непосредственно с РНК-полимеразой II, что приводит к ингибированию обеих стадий и инициации и элонгации.
Антитела также могут быть конъюгированы с радиоизотопом, например, иодом-131, иттрием-90 или индием-111, для получения цитотоксических радиофармацевтических средств.
Конъюгаты антител изобретения можно использовать для того, чтобы модифицировать данный биологический ответ, при этом лекарственная частица не должна рассматриваться как ограничивающая классические химические терапевтические лекарственные средства. Например, лекарственная частица может быть пептидом, белком или полипептидом, обладающим желательной биологической активностью. Такой белок может включать, например, ферментативно активный токсин, или его активный фрагмент, такой как абрин, рицин А, экзотоксин синегнойной палочки или дифтерийный токсин; белок, такой как фактор некроза опухоли или интерферон-γ; или модификаторы биологического ответа такие как, например, лимфокины, интерлейкин-1 ("IL-1"), интерлейкин-2 ("IL-2"), интерлейкин-6 ("IL-6"), гранулоцитарно-моноцитарный колониестимулирующий фактор ("GM-CSF"), гранулоцитарный колониестимулирующий фактор ("G-CSF") или другие факторы роста. Другими предпочтительными лекарственными фрагментами (молекулами) согласно изобретению являются куркумин, салиномицин и сульфорафан.
Методы конъюгирования такой терапевтической частицы с антителом хорошо известны, смотри, например, Arnon et al, "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", in Monoclonal Antibodies and Cancer Therapy, Reisfeld et al. (eds.), pp. 243-56 (Alan R. Liss, Inc. 1985); Hellstrom et al., "Antibodies For Drug Delivery", in Controlled Drug Delivery (2nd Ed.), Robinson et al. (eds.), pp. 623-53 (Marcel Dekker, Inc. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", in Monoclonal Antibodies '84: Biological and Clinical Applications, Pincheraet al. (eds.), pp. 475-506 (1985); "Analysis, Results, and Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy", in Monoclonal Antibodies For Cancer Detection and Therapy, Baldwin et al. (eds.), pp. 303-16 (Academic Press 1985) и Thorpe et al., "The Preparation and Cytotoxic Properties Of Antibody-Toxin Conjugates", Immunol. Rev., 62: 119-58 (1982).
В одном предпочтительном варианте осуществления антитело согласно изобретению конъюгировано с одной или более молекулами майтансиноида.
Майтансиноиды являются сильнодействующими соединениями, нацеленными на микротрубочки, которые ингибируют пролиферацию клеток при митозе. Майтансиноиды являются производными майтансина, который представляет собой 19-членную анса-макролидную структуру, присоединенную к содержащему хлор бензольному кольцу. Майтансин имеет следующую формулу:
Было обнаружено, что некоторые микробы также продуцируют майтансиноиды, такие как майтансинол и С-3 эфиры майтансинола (США патент №4,151,042). О синтетическом майтасиноле и аналогах майтансинола сообщалось, например, в патентах США №4,137,230; 4,248,870; 4,256,746; 4,260,608; 4,265,814; 4,294,757; 4,307,016; 4,308,268; 4,308,269; 4,309,428; 4,313,946; 4,315,929; 4,317,821; 4,322,348; 4,331,598; 4,361,650; 4,364,866; 4,424,219; 4,362,663; и 4,371,533, and Kawai et al (1984) Chem. Pharm. Bull. 3441-3451, включенных в описание путем отсылки.
Майтансиноиды хорошо известны в данной области техники и могут быть синтезированы с помощью известных методов или выделены из природных источников. Особенно предпочтительными майтансиноидами согласно изобретению являются тиол-содержащие производные майтансина, такие как DM1 и DM4. Такие тиол-содержащие производные майтансина включают соединения, в которых метальная группа, связанная с карбонильной группой, замещается группой, содержащей свободную сульфгидрильную группу, такую как группа -R-SH, где R представляет алкиленовую группу или другие группы, содержащие атомы углерода.
DM1, также известный как мертанзин, является майтансиноидом, имеющим следующую формулу:
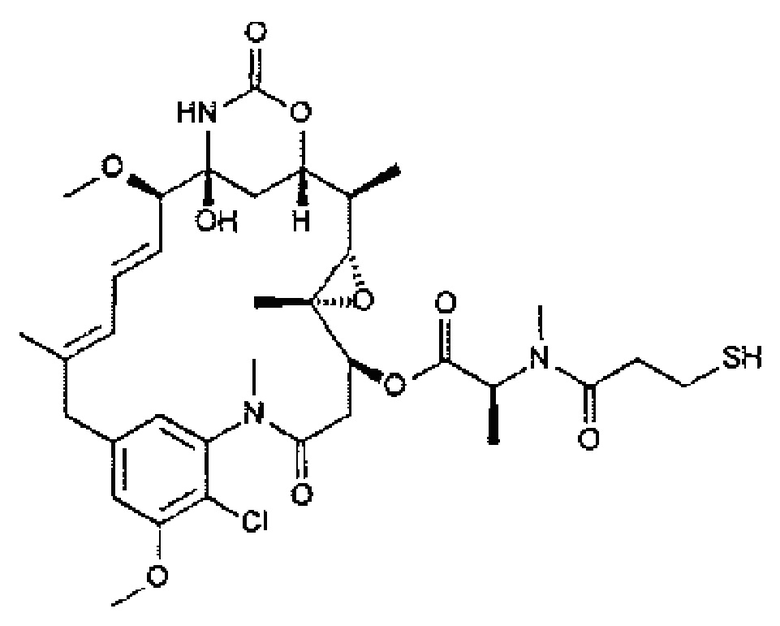
В частности, термин "мертанзин" или "DM1" относится к соединению N2'-деацетил-N2'-(3-меркапто-1-оксопропил)-майтансин.
"DM4" относится к соединению N2'-деацетил-N2'-(4-метил-4-меркапто-1-оксопентил)-майтансин.
Конъюгаты анти-CLDN6 антитело-майтансиноид получают путем химического связывания анти-CLDN6 антитела с молекулой майтансиноида без значительного уменьшения биологической активности или антитела или молекулы майтансиноида. В среднем 3-4 молекулы майтансиноида могут быть конъюгированы в расчете на молекулу антитела, хотя ожидается, что даже одна молекула токсин/антитело усилит цитотоксичность по сравнению с использованием «невооруженного» антитела.
В этом отношении термин "антитело, ковалентно соединенное, по меньшей мере, с одной молекулой токсичного лекарственного средства" включает ситуации, когда одна или более молекул одного лекарственного средства ковалентно соединяется с молекулой антитела, а также когда разные лекарственные средства ковалентно присоединяются к. молекуле антитела. В последней ситуации одна или более молекул каждого из разных лекарственных средств может быть присоединена к молекуле антитела, или их комбинация (например, присоединяется одна молекула одного лекарственного средства, и наряду с тем присоединяются несколько молекул другого лекарственно средства).
В некоторых вариантах осуществления изобретения антитело конъюгировано с доластатинами или пептидными аналогами или производными доластатина, ауристатинами (патенты США №5635483; 5780588, включенные в описание путем отсылки). Ауристатины являются синтетическими аналогами доластатина 10, продукта природного происхождения, полученного из морского моллюска, Dolabela auricularia. Подобно майтансиноидам ауристатины разрушают микротрубочки. Молекула доластатина или ауристатина может присоединяться к антителу на N (амино) конце или С (карбоксильном) конце пептидной молекулы.
Типичные варианты осуществления ауристатина включают молекулы монометил ауристатина, такие как ММАЕ и MMAF, которые предпочтительно присоединяются на N-конце.
ММАЕ, также известный как монометил ауристатин Е, имеет следующую формулу:
В частности, термин "ММАЕ" относится к соединению (S)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((1S,2R)-1-гидрокси-1-фенилпропан-2-ил)амино)-1-метокси-2-метил-3-оксопропил)пирролидин-1-ил)-3-метокси-5-метил-1-оксогептан-4-ил)-N,3-диметил-2-((S)-3-метил-2-(метиламино)бутанамидо)бутанамид. ММАЕ представляет собой фактически дезметил-ауристатин Е, т.е. N-концевая амино-группа имеет только один метальный заместитель вместо двух, как в самом ауристатине Е.
Особенно предпочтительными согласно изобретению являются конъюгаты антитело-vcАуристатин, такие как конъюгаты антитело-vcMMAE. Согласно изобретению термин "антитело-vcАуристатин" или "vcMMAE" относится к конъюгату антитело-лекарственное средство (ADC), содержащему ауристатин, такой как ММАЕ, соединенный с антителом через лизосомально-расщепляемый дипептид, валин-цитруллин (vc).
MMAF, также известный как монометил ауристатин F, относится к соединению (S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-N,3-диметил-2-((S)-3-метил-2-(метиламино)бутанамидо)бутанамидо)-3-метокси-5-метилгептаноил)пирролидин-2-ил)-3-метокси-2-метилпропанамидо)-3-фенилпропановая кислота.
В данной области техники известно множество соединяющих групп, подходящих для получения конъюгатов антитело-лекарственное средство.
В одном варианте осуществления изобретения антитело соединяется с лекарственным средством через бифункциональный сшивающий агент. При использовании в описании "бифункциональный сшивающий агент" относится к реагенту, обладающему двумя реакционно-способными группами, одна из которых способна взаимодействовать с антителом, тогда как другая группа способна взаимодействовать с лекарственным средством, чтобы соединить антитело с лекарственным средством, образовав тем самым конъюгат. Применительно к изобретению может использоваться любой подходящий бифункциональный сшивающий агент, при условии, что линкерный агент обеспечивает сохранение свойств лекарственного средства, например, цитотоксичности, и нацеливающей способности антитела. Предпочтительно, молекула линкера соединяет лекарственное средство с антителом посредством химических связей, благодаря чему лекарственное средство и антитело химически соединяются друг с другом (например, ковалентно связываются).
В одном варианте осуществления бифункциональный сшивающий агент содержит нерасщепляемые линкеры. Нерасщепляемый линкер представляет собой любой химический фрагмент, способный соединять лекарственное средство, такое как майтансиноид, с антителом устойчивой ковалентной связью. Предпочтительно, нерасщепляемый линкер является нерасщепляемым при физиологических условиях, в частности, внутри клетки. Таким образом, нерасщепляемые линкеры в значительной степени являются устойчивыми к расщеплению, индуцированному кислотой, светом, пептидазой, эстеразой и расщеплением дисульфидной связи, при условиях, в которых лекарственное средство или антитело остается активным. Подходящие сшивающие агенты, образующие нерасщепляемые линкеры между лекарственным средством, и антителом, хорошо известны в данной области техники. В одном варианте осуществления лекарственное средство соединяется с антителом посредством тиоэфирной связи. Примеры нерасщепляемых линкеров включают линкеры, имеющие фрагмент на основе малеимида или галоацетила для взаимодействия с лекарственным средством, такой как сульфгидрильная группа майтансиноида. Такие бифункциональные. сшивающие агенты хорошо известны в данной области техники и включают, но без ограничесния, N-сукцинимидил 4-(малеимидометил)циклогексанкарбоксилат (SMCC) и N-сукцинимидил-4-(N-малеимидометил)-циклогексан-1-карбокси-(6-амидокапроат), который является "длинноцепочечным" аналогом SMCC (LC-SMCC). Предпочтительно, бифункциональный сшивающий агент является SMCC. При использовании такого линкера лекарственное средство, такое как мертанзин, могут быть соединены через 4-(3-меркапто-2,5-диоксо-1-пирролидинметил)-циклогексанкарбоновую кислоту с аминогруппами, такими как свободные NH2-группы остатков лизина антитела. Каждая молекула конъюгата антитело-лекарственное средство может содержать одну молекулу антитела, соединенную с несколькими молекулами мертанзина.
В одном особенно предпочтительном варианте осуществления сшивающий агент является расщепляемым линкером. Предпочтительно, расщепляемый линкер является расщепляемым при физиологических условиях, в частности, внутри клетки. Примеры подходящих расщепляемых линкеров включают дисульфидные линкеры, кислотолабильные линкеры, фотолабильные линкеры, линкеры, лабильные к воздействию пептидаз, и линкеры, лабильные к воздействию эстераз. Линкеры, содержащие дисульфид, являются линкерами, расщепляемыми посредством дисульфидного обмена, которые могут существовать при физиологических условиях. Кислотолабильные линкеры являются линкерами, расщепляемыми при кислом значении pH. Например, некоторые внутриклеточные компартменты, такие как эндосомы и лизосомы, имеют кислое значение pH (pH 4-5) и обеспечивают условия, подходящие для расщепления кислотолабильных линкеров. Фотолабильные линкеры используются на поверхности тела и во многих полостях тела, доступных для света. Более того, инфракрасный свет проникает сквозь ткани. Линкеры, лабильные к воздействию пептидаз, могут использоваться для расщепления некоторых пептидов внутри или снаружи клеток. В одном варианте осуществления расщепляемый линкер расщепляется при мягких условиях, т.е. условиях внутри клетки, при которых активность цитотоксического средства не подвергается воздействию.
В одном предпочтительном варианте осуществления линкер является линкером, содержащим или состоящим из дипептида валин (Val) - цитруллин (Cit) (vc), который расщепляется катепсином внутри опухолевых клеток.
Согласно изобретению термин "терапия рака, направленная против раковых стволовых клеток" имеет отношение к любой терапии, которая может использоваться для нацеливания и предпочтительно уничтожения и/или нарушения пролиферации или жизнеспособности раковых стволовых клеток. Такая терапия включает i) антитела, фрагменты антител и белки, являющиеся или «невооруженными» или конъюгированными с терапевтической молекулой, которая нацеливается на определенные мишени на клеточной поверхности раковых стволовых клеток, например, CLDN6, (например, антитела или конъюгаты антител, обладающих способностью связываться с CLDN6, как описано выше) или ii) небольшие молекулы, снижающие пролиферацию или жизнеспособность раковой стволовой клетки. В отдельном варианте осуществления средство связывается с антигеном, который экспрессируется на более высоком уровне на раковых стволовых клетках, чем на нормальных стволовых клетках. В отдельном варианте осуществления средство специфически связывается с антигеном раковой стволовой клетки.
Термин "связывание" согласно изобретению предпочтительно имеет отношение к специфическому связыванию.
Согласно настоящему изобретению антитело является способным связываться с заранее предопределенной мишенью, если оно имеет значительное сродство с указанной предопределенной мишенью и связывается с указанной предопределенной мишенью в стандартных методах исследования. "Сродство" или "сродство связывания" часто оценивается равновесной константой диссоциации (KD). Предпочтительно термин, "значительное сродство" относится к связыванию с предопределенной мишенью с константой диссоциации (KD) 10-5 М или ниже, 10-6 М или ниже, 10-7 М или ниже, 10-8 М или ниже, 10-9 М или ниже, 10-10 М или ниже, 10-11 М или ниже или 10-12 М или ниже.
Антитело не является способным (значительно) связываться с мишенью, если оно не обладает значительным сродством к указанной мишени и не связывается значительно, в частности, не связывается обнаружимым образом с указанной мишенью в стандартных методах. Предпочтительно, антитело необнаружимо связывается с указанной мишенью, если присутствует в концентрации до 2, предпочтительно 10, более предпочтительно 20, в частности, 50 или 100 мкг/мл или выше. Предпочтительно антитело не имеет значительного сродства к мишени, если оно связывается с указанной мишенью с KD, которая является, по меньшей мере, в 10-раз, 100-раз, 103-раз, 104-раз, 105-раз или 106-раз выше, чем KD связывания с предопределенной мишенью, с которой способно связываться антитело. Например, если KD связывания антитела с мишенью, с которой способно связываться антитело, составляет 10-7 М, тогда KD связывания с мишенью, к которой антитело не имеет значительного сродства, составляло бы, по меньшей мере, 10-6 М, 10-5 М, 10-4 М, 10-3 М, 10-2 М или 10-1 М.
Антитело является специфическим для предопределенной мишени, если оно способно связываться с указанной предопределенной мишенью, тогда как оно не способно связываться с другими мишенями, т.е. обладает незначительным сродством к другим мишеням и незначительно связывается с другими мишенями при стандартных методах анализа. Согласно изобретению антитело является специфическим к CLDN6, если оно способно связываться с CLDN6, но практически неспособно связываться с другими мишенями. Предпочтительно антитело является специфическим к CLDN6, если аффинность к и связывание с другими мишенями не превышает значительно аффинность к или связывание с белками, неродственными с CLDN6, такими как бычий сывороточный альбумин (BSA), казеин, человеческий сывороточный альбумин (HSA) или трансмембранные белки, не являющиеся клаудинами, такими как молекулы МНС или рецептор трансферрина или любой другой специфический полипептид. Предпочтительно антитело является специфическим для предопределенной мишени, если оно связывается с указанной мишенью с KD, являющейся, по меньшей мере, в 10 раз, 100 раз, 103 раз, 104 раз, 105 раз или 106 раз ниже, чем KD связывания с мишенью, не являющейся специфической. Например, если KD связывания антитела с мишенью, являющейся специфической, составляет 10-7 М, тогда KD связывания с мишенью, не являющейся специфической, должно быть, по меньшей мере, 10-6 М, 10-5 М, 10-4 М, 10-3 М, 10-2 М или 10-1 М.
Связывание антитела с мишенью можно определить экспериментально, используя любой подходящий метод, смотри, например, Berzofsky et al., "Antibody-Antigen Interactions" In Fundamental Immunology, Paul, W.E., Ed., Raven Press New York, NY (1984), Kuby, Jam's Immunology, W.H. Freeman и Company New York, NY (1992), и описанные здесь методы. Сродство можно легко определить с помощью обычных методов, таких как равновесный диализ; с помощью прибора BIAcore 2000, используя общие методики, предложенные производителем; с помощью радиоиммунологического анализа с использованием меченого радиоактивным изотопом целевого антигена или другими методами, известными специалистам. Данные по сродству можно проанализировать, например, с помощью метода Scatchard et al., Ann N.Y. Acad. ScL, 51:660 (1949). Измеренное сродство отдельного взаимодействия антитело-антиген может варьировать, если измерение проводилось при разных условиях, например, концентрации соли, pH. Таким образом, измерения сродства и других параметров связывания антигена, например, KD, IC50, предпочтительно проводятся с помощью стандартизированных растворов антитела и антигена и стандартизированного буфера.
При использовании в описании "изотип" относится к классу антител (например, IgM или IgG 1), которые кодируются генами константной области тяжелой цепи.
При использовании в описании "переключение изотипа" относится к явлению, посредством которого класс или изотип антитела изменяется от одного класса Ig к одному из других классов Ig.
Термин "природный" при использовании в описании применительно к объекту относится к тому обстоятельству, что объект может быть найден в природе. Например, последовательность полипептида или полинуклеотида, присутствующая в организме (включая вирусы), которая может быть выделена из природного источника, и которая не была намеренно модифицирована человеком в лаборатории, является природной.
Термин "перегруппированная" при использовании в описании относится к конфигурации тяжелой цепи или легкой цепи иммуноглобулинового локуса, в котором V сегмент располагается непосредственно рядом с D-J или J сегментом в конформации, кодирующей фактически полный VH или VL домен, соответственно. Перегруппированный генный локус иммуноглобулина (антитела) может быть установлен путем сравнения с зародышевой ДНК; перегруппированный локус будет иметь, по меньшей мере, один рекомбинированный семичленный/девятичленный гомологичный элемент.
Термин "перегруппированная" или "зародышевая конфигурация" при использовании в описании в отношении V сегмента относится к конфигурации, в которой V сегмент является нерекомбинированным для того, чтобы быть непосредственно рядом с D или J сегментом.
Предпочтительно, связывание антитела, обладающего способностью связываться с CLDN6, с клетками, экспрессирующими CLDN6, вызывает или опосредует уничтожение клеток, экспрессирующих CLDN6. Клетки, экспрессирующие CLDN6, предпочтительно являются раковыми стволовыми клетками и, в частности, являются клетками раковых заболеваний, описанных в данном документе, такими как раковые стволовые клетки рака яичника. Предпочтительно, антитело вызывает или опосредует уничтожение клеток, индуцируя что-либо одно или более из числа опосредованного комплементзависимой цитотоксичностью (CDC) лизиса, опосредованного антителозависимой клеточноопосредованной цитотоксичностью (ADCC) лизиса, апоптоза и ингибирования пролиферации клеток, экспрессирующих CLDN6. Предпочтительно, ADCC-опосредованный лизис происходит в присутствии эффекторных клеток, которые в отдельных вариантах осуществления выбирают из группы, состоящей из моноцитов, мононуклеарных клеток, NK-клеток и PMNs. Ингибирование пролиферации клеток можно измерить in vitro путем определения пролиферации клеток методом анализа с применением бромдезоксиуридина (5-бром-2-дезоксиуридин, BrdU). BrdU является синтетическим нуклеозидом, аналогом тимидина, и может встраиваться во вновь синтезированную ДНК воспроизводящихся путем клеточного деления клеток (в ходе S фазы клеточного цикла), заменяя тимидин во время репликации ДНК. Обнаружение «включенного» химического вещества с помощью, например, антител, специфических к BrdU, указывает на клетки, которые активно воспроизводили свою ДНК.
В предпочтительных вариантах осуществления антитела, описанные в данном документе, могут быть охарактеризованы одним или более из следующих свойств:
a) специфичность к CLDN6;
b) аффинность связывания с CLDN6 около 100 нМ или менее, предпочтительно, около 5-10 нМ или менее, и более предпочтительно около 1-10 нМ или менее,
c) способность вызывать или опосредовать CDC CLDN6-положительных клеток;
d) способность вызывать или опосредовать ADCC CLDN6-положительных клеток;
e) способность ингибировать рост CLDN6-положительных клеток;
f) способность вызывать апоптоз CLDN6-положительных клеток.
В одном варианте осуществления антитело, обладающее способностью связываться с CLDN6, обладает способностью связываться с эпитопом, присутствующим в CLDN6, предпочтительно эпитопом, расположенным в пределах внеклеточных доменов CLDN6, в частности, в первой внеклеточной петле, предпочтительно в положении аминокислот с 28 по 76 CLDN6, или во второй внеклеточной петле, предпочтительно в положении аминокислот со 141 по 159 CLDN6. В отдельных вариантах осуществления антитело, обладающее способностью связываться с CLDN6, связывается с эпитопом на CLDN6, который не присутствует на CLDN9. Предпочтительно, антитело, обладающее способностью связываться с CLDN6, связывается с эпитопом на CLDN6, который не присутствует на CLDN4 и/или CLDN3. Наиболее предпочтительно, антитело, обладающее способностью связываться с CLDN6, связывается с эпитопом на CLDN6, который не присутствует на белке CLDN, отличном от CLDN6.
Антитело, обладающее способностью связываться с CLDN6, предпочтительно связывается с CLDN6, но не с CLDN9, и предпочтительно не связывается с CLDN4 и/или CLDN3. Предпочтительно, антитело, обладающее способностью связываться с GLDN6, является специфическим к CLDN6. Предпочтительно, антитело, обладающее способностью связываться с CLDN6, связывается с CLDN6, экспрессированным на клеточной поверхности. В отдельных предпочтительных вариантах осуществления антитело, обладающее способностью связываться с CLDN6, связывается с нативными эпитопами CLDN6, присутствующего на клеточной поверхности живых клеток.
В предпочтительном варианте осуществления антитело, обладающее способностью связываться с CLDN6, содержит вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 3, 5, 7, 9 и ее фрагмента.
В предпочтительном варианте осуществления антитело, обладающее способностью связываться с CLDN6, включает вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NOs: 4, 6, 8, 10, 11, 12 и их фрагмента.
В некоторых предпочтительных вариантах осуществления антитело, обладающее способностью связываться с CLDN6, содержит комбинацию вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL), выбранную из следующих возможных вариантов (i)-(vii):
(i) VH содержит аминокислотную последовательность, представленную в SEQ ID NO: 3, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную в SEQ ID NO: 4, или ее фрагмент,
(ii) VH содержит аминокислотную последовательность, представленную в SEQ ID NO: 4, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную в SEQ ID NO: 5, или ее фрагмент,
(iii) VH содержит аминокислотную последовательность, представленную в SEQ ID NO: 7, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную в SEQ ID NO: 8, или ее фрагмент,
(iv) VH содержит аминокислотную последовательность, представленную в SEQ ID NO: 9, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную в SEQ ID NO: 10, или ее фрагмент,
(v) VH содержит аминокислотную последовательность, представленную в SEQ ID NO: 5, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную в SEQ ID NO: 4, или ее фрагмент,
(vi) VH содержит аминокислотную последовательность, представленную в SEQ ID NO: 5, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную в SEQ ID NO: 11, или ее фрагмент,
(vii) VH содержит аминокислотную последовательность, представленную в SEQ ID NO: 5, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную в SEQ ID NO: 12, или ее фрагмент.
В особенно предпочтительном варианте осуществления антитело, обладающее способностью связываться с CLDN6, содержит следующую комбинацию вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL):
VH содержит аминокислотную последовательность, представленную в SEQ ID NO: 5, или ее фрагмент, и VL содержит аминокислотную последовательность, представленную в SEQ ID NO: 4, или ее фрагмент.
Термин "фрагмент" имеет отношение, в частности, к одному или более из гипервариабельных участков (CDRs), предпочтительно, по меньшей мере, CDR3 вариабельному участку, вариабельной области тяжелой цепи (VH) и/или вариабельной области легкой цепи (VL). В одном варианте осуществления указанный один или более из гипервариабельных участков (CDRs) выбирают из набора гипервариабельных участков CDR1, CDR2 и CDR3. В особенно предпочтительном варианте осуществления термин "фрагмент" относится к гипервариабельным участкам CDR1, CDR2 и CDR3 вариабельной области тяжелой цепи (VH) и/или вариабельной области легкой цепи (VL).
В одном варианте осуществления антитело, содержащее один или более CDRs, набор CDRs или комбинацию наборов CDRs, как описано здесь, включает указанный CDRs вместе с их промежуточными каркасными участками. Предпочтительно, данный участок будет также включать, по меньшей мере, около 50% любого или обоих из первого и четвертого каркасных участков, 50% представляет собой С-концевые 50% первого каркасного участка и N-концевые 50% четвертого каркасного участка. Создание антител методами рекомбинантных ДНК может приводить к введению N- или С-концевых остатков в вариабельные участки, кодированные линкерами, введенными для облегчения клонирования или других стадий манипуляции, включая введение линкеров для соединения вариабельных областей изобретения с дополнительными белковыми последовательностями, содержащими тяжелые цепи иммуноглобулинов, другие вариабельные домены (например, при получении диабоди) или белковые метки.
В одном варианте осуществления антитело, содержащее один или более CDRs, набор CDRs или комбинацию наборов CDRs, как описано здесь, содержит указанные CDRs в каркасном участке антитела человека.
Ссылка в данном документе на антитело, содержащее в его тяжелой цепи конкретную цепь или конкретную область (участок) или последовательность, предпочтительно относится к ситуации, в которой все тяжелые цепи указанного антитела содержат указанную конкретную цепь, область или последовательность. Это соответственно применимо к легкой цепи антитела.
Должно быть понятно, что описанные в документе антитела могут доставляться пациенту путем введения нуклеиновой кислоты, например, РНК, кодирующей антитело, и/или путем введения клетки-хозяина, содержащей нуклеиновую кислоту, например, РНК, кодирующую антитело. Из этого следует, что нуклеиновая кислота, кодирующая антитело при введении пациенту может находиться в «голой» форме или в подходящей системе доставки, например, в форме липосом или вирусных частиц, или внутри клетки-хозяина. Предоставленная нуклеиновая кислота может продуцировать антитело в течение длительных периодов времени, таким образом, уменьшая нестабильность, по меньшей мере, частично наблюдаемую для терапевтических антител. Нуклеиновые кислоты, предназначенные для доставки пациенту, могут продуцироваться рекомбинантными способами. Если нуклеиновая кислота вводится пациенту, не находясь при этом внутри клетки-хозяина, она предпочтительно захватывается клетками пациента для экспрессии антитела, кодируемого данной нуклеиновой кислотой. Если нуклеиновая кислота вводится пациенту, находясь внутри клетки-хозяина, она преимущественно экспрессируется клеткой-хозяином «внутри пациента», для того чтобы продуцировать антитело, кодируемое данной нуклеиновой кислотой.
Термин "нуклеиновая кислота" при использовании в описании включает ДНК и РНК, такую как геномная ДНК, кДНК, мРНК, полученные рекомбинантным путем или синтезированные химическим путем молекулы. Нуклеиновая кислота может быть одноцепочечной или двухцепочечной. РНК включает in vitro транскрибируемую РНК (IVT RNA) или синтетическую РНК.
Нуклеиновые кислоты могут быть помещены в вектор. Использованный в описании термин "вектор" включает любые векторы, известные специалистам, включая плазмидные векторы, космидные векторы, фаговые векторы, например, фага лямбда, вирусные векторы, например, аденовирусные или бакуловирусные векторы, или искусственные хромосомные векторы, такие как бактериальные искусственные хромосомы (ВАС), искусственные хромосомы дрожжей (YAC) или Р1 искусственные хромосомы (РАС). Указанные векторы включают экспрессионный, а также клонирующий векторы. Экспрессионные векторы включают плазмиды, а также вирусные векторы и обычно содержат желательную кодирующую последовательность и соответствующие последовательности ДНК, необходимые для экспрессии функционально связанной кодирующей последовательности в конкретном организме-хозяине (например, бактерии, дрожжах, растении, насекомом или млекопитающем) или в системах экспрессии in vitro. Клонирующие векторы, как правило, используются для создания и амплификации некоторых желательных фрагментов ДНК и могут не содержать функциональные последовательности, необходимые для экспрессии желательных фрагментов ДНК.
В контексте настоящего изобретения термин "РНК" имеет отношение к молекуле, содержащей остатки рибонуклеотидов, и предпочтительно полностью или в основном состоящей из остатков рибонуклеотидов. "Рибонуклеотиды" имеют отношение к нуклеотиду с гидроксильной группой в 2'-положении β-D-рибофуранозильной группы; Термин включает двухцепочечную РНК, одноцепочечную РНК, изолированную РНК, такую как частично очищенная РНК, практически чистую РНК, синтетическую РНК, полученную рекомбинантным способом РНК, а также модифицированную РНК, которая отличается от природной РНК вставкой, делецией, заменой и/или изменением одного или более нуклеотидов. Такие изменения могут включать добавление ненуклеотидного материала, например, к концу(ам) РНК или внутрь, например, одного или более нуклеотидов РНК. Нуклеотиды в молекулах РНК также могут содержать нестандартные нуклеотиды, такие как нуклеотиды неприродного происхождения или химически синтезированные нуклеотиды или дезоксинуклеотиды. Эти измененные РНК могут называться аналогами или аналогами РНК природного происхождения.
Согласно настоящему изобретению термин "РНК" включает и преимущественно имеет отношение к "мРНК", что означает "матричную РНК", а также относится к "транскрипту", который может продуцироваться с использованием ДНК в качестве матрицы и кодирует пептид или белок. В большинстве случаев мРНК содержит 5' нетранслируемую: область (5'-UTR), область, кодирующую белок или пептид, и 3' нетранслируемую область (3'-UTR). мРНК имеет ограниченное время полужизни в клетках и in vitro. Предпочтительно, мРНК продуцируется путем транскрипции in vitro с использованием ДНК-матрицы. В одном варианте осуществления изобретения РНК получают путем транскрипции in vitro или химического синтеза. Метод транскрипции in vitro известен специалистам. Например, существует целый ряд коммерчески доступных наборов для in vitro транскрипции.
В одном варианте осуществления настоящего изобретения РНК является самореплицирующейся РНК, такой как одноцепочечная самореплицирующаяся РНК. В одном варианте осуществления самореплицирующаяся РНК является одноцепочечной положительно-полярной РНК. В одном варианте осуществления самореплицирующаяся. РНК является вирусной РНК или РНК, полученной из вирусной РНК. В одном варианте осуществления самореплицирующаяся РНК является геномной РНК альфа-вируса или происходит из геномной РНК альфа-вируса. В одном варианте осуществления самореплицирующаяся РНК является экспрессирующим вектором вирусного гена. В одном варианте осуществления вирус является вирусом леса Семлики. В одном варианте осуществления самореплицирующаяся РНК содержит один или более трансгенов, по меньшей мере, один из указанных трансгенов, кодирующих описанное в документе антитело. В одном варианте осуществления в том случае, если РНК является вирусной РНК или происходит из вирусной РНК, трансгены могут частично или полностью замещать вирусные последовательности, такие как вирусные последовательности, кодирующие структурные белки. В одном варианте осуществления самореплицирующаяся РНК является in vitro транскрибируемой РНК.
Геном альфа-вирусов является одноцепочечной положительно-полярной РНК (ssRNA(+)), кодирующей две открытые рамки считывания (ORF) для больших полипротеинов. ORF на 5'-конце генома кодирует неструктурные протеины nSP1-nSP4 (nsP1-4), которые транслируются и процессируются с использованием РНК-зависимой РНК-полимеразы (репликазы); ORF на 3'-конце кодирует структурные белки - капсид и гликопротеины. Обе ORF разделяются так называемым субгеномным промотором (SGP), который управляет транскрипцией структурной ORF. При использовании в качестве генетических векторов структурные протеины позади SGP обычно заменяются трансгенами. Для того, чтобы упаковать такие векторы в вирусные частицы, структурные протеины в большинстве случаев экспрессируются in trans из вспомогательных конструкций. Альфа-вирусы реплицируются в цитоплазме инфицированных клеток исключительно на РНК уровне. После инфицирования ssRNA(+) геном действует как мРНК для трансляции nsP1234 предшественника полибелка, который на ранних стадиях жизненного цикла вируса автопротеолитически процессируется до фрагментов nsP123 и nsP4. Фрагменты nsP123 и nsP4 образуют (-)цепочечный репликазный комплекс, который транскрибирует
(-)цепочечную РНК из геномной матрицы РНК. На более поздних стадиях nsP1234 полипротеин полностью расщепляется до отдельных белков, которые собираются в (+)цепочечный репликазный комплекс, синтезирующий новые (+)цепочечные геномы, а также, субгеномные транскрипты, кодирующие структурные белки или трансгены. Субгеномная РНК, а также новая геномная РНК, кэппируется и полиаденилируется и таким образом распознается, как мРНК, после инфицирования клеток-мишеней. Только новая геномная РНК содержит сигнал упаковки, который обеспечивает особую упаковку геномной РНК в бадинг-вирионы. Привлекательность альфа-вирусных репликонов для векторологии основывается на положительной ориентации «кэппированного» и полиаденилированного РНК генома. Транслируемый репликон РНК может быть легко синтезирован in vitro, при это «кэппирование» можно получить путем добавления кэп-аналога в in vitro реакцию транскрипции, а поли-А хвосты могут кодироваться как поли-Т треки на плазмидньгх матрицах. In vitro транскрибирующиеся (IVT) репликоны трансфицируют с помощью общеизвестных методов трансфекции, причем даже низкие количества исходной IVT РНК увеличиваются быстро. В пределах нескольких часов после переноса трансгены, располагающиеся «ниже» SGP, транскрибируются до очень большого числа копий примерно от 40,000 до 200,000 копий субгеномной РНК на клетку, поэтому неудивительно, что рекомбинантные белки сильно экспрессируются. В зависимости от определенной цели, IVT репликоны могут трансфицироваться непосредственно в клетки-мишени или упаковываться в альфа-вирусные частицы с помощью вспомогательных векторов, которые обеспечивают структурные гены in trans. Перенос в кожу или мышцы приводит к высокой и длительной местной экспрессии, параллельной с сильной индукцией гуморального и клеточного иммунного ответа.
С целью увеличения экспрессии и/или стабильности РНК, используемой согласно настоящему изобретению, она может быть модифицирована, предпочтительно без изменения последовательности экспрессированного пептида или белка.
Термин "модификация" в контексте РНК, используемой согласно настоящему изобретению, включает любую модификацию РНК, которая не существует в естественных условиях в указанной РНК.
В одном варианте осуществления изобретения РНК, используемая согласно изобретению, не имеет «непокрытых» (некэппированных) 5'-трифосфатов. Удаление таких «непокрытых» 5'-трифосфатов может быть достигнуто путем обработки РНК фосфатазой.
Согласно изобретению РНК может содержать модифицированные природные или синтетические рибонуклеотиды для увеличения ее стабильности и/или уменьшения цитотоксичности. Например, в одном варианте осуществления в РНК, используемой согласно изобретению, 5-метилцитидин заменяется частично или полностью, предпочтительно полностью, на цитидин. Альтернативно или дополнительно, в одном варианте осуществления в РНК, используемой согласно изобретению, псевдоуридин заменяется частично или полностью, предпочтительно полностью, на уридин.
В одном варианте осуществления термин "модификация" имеет отношение к обеспечению РНК 5'-кэпом или аналогом 5'-кэпа. Термин "5'-кэп" относится к кэп-структуре, обнаруженной на 5'-конце молекулы мРНК, которая обычно состоит из гуанозинового нуклеотида, соединенного с мРНК посредством необычной 5'-5' трифосфатной связи. В одном варианте осуществления этот гуанозин является метилированным в 7-положении. Термин "обычный 5'-кэп" относится к естественному 5'-кэпу РНК, предпочтительно к 7-метилгуанозиновому кэпу (m7G). В контексте настоящего изобретения термин "5'-кэп" включает аналог 5'-кэпа, который походит на структуру РНК кэпа и подвергается модификации с целью придания способности стабилизировать РНК, в случае присоединения к ней, предпочтительно in vivo и/или в клетке.
Обеспечение РНК 5'-кэпом или аналогом 5'-кэпа может быть достигнуто путем in vitro транскрипции матрицы ДНК в присутствии указанного 5'-кэпа или аналога 5'-кэпа, при этом указанный 5'-кэп котранскрипционно встраивается в образованную цепь РНК, или РНК может быть получена, например, с помощью in vitro транскрипции, и 5'-кэп может быть прикреплен к РНК посттранскрипционно с использованием кэппирующих ферментов, например, кэппирующих ферментов вируса коровьей оспы.
РНК может содержать дополнительные модификации. Например, дополнительной модификацией РНК, используемой в настоящем изобретении, может быть удлинение или сокращение хвоста природного поли(А) или изменение 5'- или 3'-нетранслируемых областей (UTR), например, введение такой UTR, которая не связана с кодирующей областью указанной РНК, например, вставка одной или более, предпочтительно двух копий 3'-UTR, полученных из гена глобина, такого как альфа2-глобин, альфа1-глобин, бета-глобин, предпочтительно бета-глобина, более предпочтительно человеческого бета-глобина.
Следовательно, для увеличения стабильности и/или экспрессии РНК, используемой согласно изобретению, она может быть модифицирована для того, чтобы присутствовать в сочетании с поли-А последовательностью, предпочтительно имеющей длину от 10 до 500, более предпочтительно от 30 до 300, даже более предпочтительно от 65 до 200 и в особенности от 100 до 150 остатков аденозина. В особенно предпочтительном варианте осуществления поли-А последовательность имеет в длину приблизительно 120 остатков аденозина. В дополнение к этому, включение двух или более 3'-нетранслируемых областей (UTR) в 3'-нетранслируемую область молекулы РНК может давать в результате увеличение эффективности трансляции. В одном отдельном варианте осуществления 3'-UTR происходит из гена β-глобина человека.
Предпочтительно, РНК, если она доставлена, т.е. трансфицирована в клетку, в частности, клетку, присутствующую in vivo, экспрессирует закодированный белок или пептид.
Термин "трансфекция" имеет отношение к введению нуклеиновых кислот, в частности, РНК, в клетку. Для целей настоящего изобретения термин "трансфекция" также включает введение нуклеиновой кислоты в клетку или поглощение нуклеиновой кислоты такой. клеткой, при этом данная клетка может присутствовать у субъекта, например, пациента. Таким образом, согласно настоящему изобретению клетка для трансфекции нуклеиновой кислоты, описанной в данном документе, может присутствовать in vitro или in vivo, например, клетка может образовывать часть органа, ткань и/или организм пациента. Согласно изобретению, трансфекция может быть временной или постоянной. В отношении некоторых случаев применения трансфекции, достаточно, если трансфицированный генетический материал экспрессируется только временно. Поскольку нуклеиновая кислота, введенная в процессе трансфекции, обычно не интегрируется в ядерный геном, привнесенная (чужеродная) нуклеиновая кислота будет «разбавлена» в результате митоза или деградирована. Клетки, допускающие эписомальную амплификацию нуклеиновых кислот, значительно уменьшают «степень разбавления». Если желательно, чтобы трансфицированная нуклеиновая кислота действительно оставалась в геноме клетки и ее дочерних клеток, должна происходить стабильная трансфекция. РНК может быть трансфицирована в клетки, чтобы временно экспрессировать кодированный белок.
Термин "стабильность" РНК имеет отношение к "времени полужизни" РНК. "Время полужизни" имеет отношение к периоду времени, которое необходимо, чтобы устранить половину активности, количества или числа молекул. В данном контексте настоящего изобретения время полужизни РНК показывает стабильность указанной РНК. Время полужизни РНК может оказывать влияние на "продолжительность экспрессии" РНК. Можно предполагать, что РНК, имеющая большое время полужизни, будет экспрессироваться в течение длительного периода времени.
В контексте настоящего изобретения термин "трансляция" имеет отношение к процессу, при котором генетический код в ДНК-последовательности транскрибируется в РНК. В дальнейшем РНК может транслироваться в белок. Согласно настоящему изобретению термин "транскрипция" включает "in vitro транскрипцию", при этом термин "in vitro транскрипция" имеет отношение к процессу, при котором РНК, в частности, мРНК, синтезируется in vitro в бесклеточной системе, предпочтительно с использованием подходящих клеточных экстрактов. Предпочтительно, для получения транскриптов используются клонирующие векторы. Эти клонирующие векторы в основном определяются как транскрипционные векторы и согласно настоящему изобретению охватываются термином "вектор".
Термин "трансляция" согласно изобретению имеет отношение к процессу, происходящему в рибосомах клетки, посредством которого цепь матричной РНК направляет сборку последовательности аминокислот, чтобы получить пептид или белок.
Термин "экспрессия" используется согласно изобретению в его наиболее общем значении и включает выработку РНК и/или пептидов или белков, например, путем транскрипции и/или трансляции. В отношении РНК термин "экспрессия" или "трансляция" имеет отношение, в частности, к продуцированию пептидов или белков. Термин также включает частичную (неполную) экспрессию нуклеиновых кислот. Более того, экспрессия может быть временной или постоянной. Согласно изобретению, термин экспрессия также включает "аберрантную экспрессию" или "аномальную экспрессию".
"Аберрантная экспрессия" или "аномальная экспрессия" означает согласно изобретению, что экспрессия является измененной, предпочтительно повышенной, по сравнению с контролем, например, состоянием у субъекта, не имеющего болезни, связанной с аберрантной или аномальной экспрессией определенного белка, например, опухолевого антигена. Повышение экспрессии относится к повышению, по меньшей мере, на 10%, в частности, по меньшей мере, на 20%, по меньшей мере, на 50% или, по меньшей мере, на 100% или более. В одном варианте осуществления экспрессия обнаруживается только в пораженной ткани, в то время как экспрессия в здоровой ткани подавлена.
Термин "специфически экспрессируется" означает, что белок экспрессируется преимущественно в конкретной ткани или органе. Например, выражение «опухолевый антиген специфически экспрессируется в плаценте» означает, что указанный белок преимущественно экспрессируется в плаценте и не экспрессируется в других тканях или не экспрессируется в значительной степени в других типах тканей или других органах. Таким образом, белок, который экспрессируется исключительно в клетках плаценты и в значительно меньшей степени в любой другой ткани, является специфически экспрессированным в клетках плаценты. В некоторых вариантах осуществления опухолевый антиген также может специфически экспрессироваться при нормальных условиях более чем в ткани одного типа или в одном органе, например, в 2 или 3 типах тканей или органах, но предпочтительно не более, чем в 3 разных типах тканей или в 3 органах. В этом случае опухолевый антиген специфически экспрессируется. в этих органах.
Согласно изобретению термин "РНК кодирование" означает, что РНК, если она присутствует в подходящей окружающей среде, предпочтительно внутри клетки, может экспрессироваться, чтобы продуцировать белок или пептид, который она кодирует.
Некоторые аспекты изобретения основываются на адоптивном переносе клеток-хозяев, трансфицированных in vitro нуклеиновой кислотой, например, РНК, кодирующей описанное в документе антитело, и перенесенных реципиентам, например, пациентам, предпочтительно после ex vivo размножения от низкого уровня встречаемости предшественников до клинически значимого количества клеток. Клетки-хозяева, используемые для лечения согласно данному изобретению, могут быть аутологичными, аллогенными или сингенными в отношении реципиента, который подвергается лечению.
Термин "аутологичный" используется для описания всего, что происходит от одного и того же субъекта. Например, "аутологичный трансплантат" относится к трансплантации ткани или органов, происходящих от того же самого субъекта. Такие методы являются предпочтительными, поскольку они позволяют преодолеть иммунологический барьер, который в ином случае приводит к отторжению.
Термин "аллогенный" используется для описания всего, что происходит от разных индивидуумов одного и того же вида. Два или более индивидуумов называются аллогенными друг к другу, когда гены в одном или более локусах не являются идентичными.
Термин "сингенный" используется для описания всего, что происходит от индивидуумов или извлекается из тканей, имеющих идентичные генотипы, т.е. однояйцевых близнецов или животных того же самого имбредного штамма или их тканей.
Термин "гетерологичный" используется для описания чего-либо, состоящего из множества различных элементов. В качестве примера, трансплантация костного мозга одного индивидуума другому индивидууму представляет собой гетерологичную трансплантацию. Гетерологичный ген - это ген, полученный из источника, отличного от данного субъекта.
Термин "пептид" согласно изобретению включает олиго- и полипептиды и относится к веществам, содержащим две или более, предпочтительно 3 или более, предпочтительно 4 или более, предпочтительно 6 или более, предпочтительно 8 или более, предпочтительно 9 или более, предпочтительно 10 или более, предпочтительно 13 или более, предпочтительно 16 или более, предпочтительно 21 или более предпочтительно до 8, 10, 20, 30, 40 или 50, в частности, до 100 аминокислот, ковалентно соединенных пептидными связями. Термин "белок" относится к крупным пептидам, предпочтительно к пептидам, содержащим более 100 аминокислотных остатков, однако, в общем, термины "пептиды" и "белки" являются синонимами и используются взаимозаменяемым образом.
Следует учитывать, что изложенная в документе идея в отношении специфических аминокислотных последовательностей, например, указанных в списке последовательностей, также имеет отношение к вариантам указанных специфических последовательностей, приводящим к образованию последовательностей, которые являются функционально эквивалентными указанным специфическим последовательностям, например, аминокислотным последовательностям, демонстрирующим свойства, идентичные или подобные, свойствам специфических аминокислотных последовательностей. Одним важным свойством является сохранение связывания антитела с его мишенью или подтверждение эффекторных функций антитела. Предпочтительно, последовательность, которая является вариантом относительно специфической последовательности, в том случае, когда она заменяет специфическую последовательность в антителе, сохраняет способность связывания указанного антитела с CLDN6 и предпочтительно функции указанного антитела, как описано здесь, например, CDC-опосредованный лизис или ADCC-опосредованный лизис.
Например, последовательности, представленные в списке последовательностей, могут быть модифицированы для того, чтобы удалить один или более, предпочтительно все свободные остатки цистеина, в частности, путем замещения остатков цистеина аминокислотами, отличными от цистеина, предпочтительно серином, аланином, треонином, глицином, тирозином, глицином, тирозином, лейцином или метионином, наиболее предпочтительно аланином или серином.
Специалистам в данной области ясно, что последовательности CDR, гипервариабельных и вариабельных областей могут быть модифицированы без потери способности связываться с CLDN6. Например, CDR участки будут являться или идентичными или высокогомологичными участкам антитела, определенного в описании. Под "высокогомологичным" имеется в виду, что может быть сделано от 1 до 5, предпочтительно от 1 до 4, например от 1 до 3 замен, или 1 или 2 замены в CDRs. Кроме того, гипервариабельные и вариабельные области могут быть модифицированы так, чтобы они показывали значительную гомологию с областями антитела, в частности, раскрытого в описании.
Для целей настоящего изобретения "варианты" аминокислотной последовательности включают варианты с вставками аминокислот, варианты с добавками аминокислот, варианты с делециями аминокислот и/или варианты с заменами аминокислот. Варианты с делециями аминокислот, содержащие делецию на N-конце и/или С-конце белка, также называются N-концевыми и/или С-концевыми укороченными вариантами.
Варианты со вставкой аминокислот включают вставки одной или двух или более аминокислот в отдельную аминокислотную последовательность. В случае вариантов аминокислотной последовательности, имеющих вставку в отдельный участок аминокислотной последовательности, вставляется один или более аминокислотных остатков, хотя при соответствующем скрининге полученного продукта также можно обнаружить случайные вставки.
Варианты аминокислотных добавок включают амино- и/или карбокси-концевые слияния с одной или более аминокислотами, например, с 1, 2, 3, 5, 10, 20, 30, 50 или более аминокислотами.
Варианты с делецией аминокислот характеризуются удалением одной или более аминокислот из последовательности, например, удалением 1, 2, 3, 5, 10, 20, 30, 50 или более аминокислот. Делеции могут происходить в любом месте белка.
Варианты с заменами аминокислот характеризуются, по меньшей мере, удалением одного остатка в последовательности и вставкой другого остатка на его место. Предпочтение отдается модификациям, находящимся в положениях аминокислотной последовательности, которые не являются консервативными между гомологичными, белками или пептидами, и/или заменам аминокислот на другие аминокислоты, имеющие сходные свойства. Предпочтительно аминокислотные изменения в белковых вариантах являются консервативными аминокислотными изменениями, т.е. заменами аналогично заряженных или незаряженных аминокислот. Консервативное изменение аминокислоты имеет отношение к замене одной аминокислоты из семейства аминокислот, которые являются родственными по структуре боковой цепи. Природные аминокислоты подразделяются на четыре семейства: кислые (аспартат, глутамат), основные (лизин, аргинин, гистидин), неполярные (аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан) и незаряженные полярные (глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин) аминокислоты. Фенилаланин, триптофан и тирозин иногда классифицируются вместе как ароматические аминокислоты.
Предпочтительно степень сходства, предпочтительно идентичности между данной аминокислотной последовательностью и аминокислотной последовательностью, которая является вариантом указанной данной аминокислотной последовательностью, будет составлять, по меньшей мере, около 60%, 65%, 70%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99%. Степень сходства или идентичность предпочтительно предоставляется для аминокислотной области, которая составляет, по меньшей мере, около 10%, по меньшей мере, около 20%, по меньшей мере, около 30%, по меньшей мере, около 40%, по меньшей мере, около 50%, по меньшей мере, около 60%, по меньшей мере, около 70%, по меньшей мере, около 80%, по меньшей мере, около 90% или около 100% полной длины эталонной аминокислотной последовательности. Например, если эталонная аминокислотная последовательность состоит из 200 аминокислот, степень сходства или идентичность предпочтительно предоставляется, по меньшей мере, примерно для 20, по меньшей мере, примерно 40, по меньшей мере, примерно 60, по меньшей мере, примерно 80, по меньшей мере, примерно 100, по меньшей мере, примерно 120, по меньшей мере, примерно 140, по меньшей мере, примерно 160, по меньшей мере, примерно 180 или примерно для 200 аминокислот, предпочтительно последовательных аминокислот. В предпочтительных вариантах осуществления предоставляется степень сходства или идентичность с полной длиной эталонной аминокислотной последовательности. Выравнивание для определения степени сходства последовательности, предпочтительно идентичности последовательности, можно выполнить известными в данной области техники способами, предпочтительно с использованием самого лучшего способа выравнивания последовательности, например, Align с использованием стандартных настроек, предпочтительно EMBOSS::игла, Матрица: Blosum62, открытие гэпа 10,0, продолжение гэпа 0,5.
"Сходство последовательности" указывает процент аминокислот, которые или являются идентичными или которые представляют собой консервативные аминокислотные замены. "Идентичность последовательности" между двумя аминокислотными последовательностями указывает на процент аминокислот, которые являются идентичными между данными последовательностями.
Термин "процент идентичности" предназначается для обозначения процента аминокислотных остатков, идентичных между двумя сравниваемыми последовательностями после выполнения наиболее оптимального выравнивания, этот процент является чисто статистическим, а различия между двумя последовательностями распределяются случайно и в пределах их полной длины. Сравнение последовательностей между двумя аминокислотными последовательностями обычно осуществляется путем сравнения этих последовательностей после их оптимального выравнивания, указанное сравнение проводится посредством сегмента или "окна сравнения" для того, чтобы установить и сравнить локальные области сходства последовательности. Оптимальное выравнивание последовательностей для сравнения может быть проведено, кроме способа «вручную», посредством алгоритма локальной гомологии Smith и Waterman, 1981, Ads Арр. Math. 2, 482, посредством алгоритма локальной гомологии Neddleman и Wunsch, 1970, J. Mol. Biol. 48, 443, посредством метода поиска сходства Pearson and Lipman, 1988, Proc. Natl Acad. Sci. USA 85, 2444, или с помощью компьютерных программ с применением этих алгоритмов (GAP, BESTFIT, FASTA, BLAST Р, BLAST N и TFASTA in Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Drive, Madison, Wis.).
Процент идентичности вычисляется путем определения числа идентичных положений между двумя последовательностями при сравнении, делением этого числа на число сравниваемых положений и умножением полученного результата на 100 для того, чтобы получить процент идентичности между этими двумя последовательностями.
Термин "клетка" или "клетка-хозяин" предпочтительно имеет отношение к интактной клетке, т.е. клетке с интактной мембраной, которая не «выпускает» свои нормальные внутриклеточные компоненты, такие как ферменты, органеллы или генетический материал. Интактная клетка предпочтительно является жизнеспособной клеткой, т.е. живой клеткой, способной осуществлять свои нормальные метаболические функции. Предпочтительно указанный термин согласно изобретению относится к любой клетке, которая может быть трансфицирована экзогенной нуклеиновой кислотой. Предпочтительно, клетка, трансфицированная экзогенной нуклеиновой кислотой и перенесенная реципиенту, может экспрессировать нуклеиновую кислоту у реципиента. Термин "клетка" включает бактериальные клетки; другими подходящими клетками являются клетки дрожжей, клетки грибов или клетки млекопитающих. Подходящие бактериальные клетки включают клетки грамотрицательных бактериальных штаммов, таких как штаммы Escherichia coli, Proteus и Pseudomonas, и грамположительных бактериальных штаммов, таких как штаммы Bacillus, Streptomyces, Staphylococcus и Lactococcus. Подходящие грибковые клетки включают клетки видов Trichoderma, Neurospora и Aspergillus. Подходящие клетки дрожжей включают клетки видов Saccharomyces (например, Saccharomyces cerevisiae), Schizosaccharomyces (например, Schizo saccharomyces pombe), Pichia (например, Pichia pastoris и Pichia methanolicd), и Hansenula. Подходящие клетки млекопитающих включают, например, СНО клетки, ВНК клетки, HeLa клетки, COS клетки, 293 HEK и тому подобное. Однако, равным образом могут использоваться клетки амфибий, насекомых, растений и любые другие клетки, которые используются в данной области техники для экспрессии гетерологичных белков. Клетки млекопитающих являются особенно предпочтительными для адоптивного переноса, например, клетки человека, мыши, хомяка, свиньи, козы и приматов. Клетки могут быть получены из большого числа типов тканей и включают первичные клетки и клеточные линии, такие как клетки иммунной системы, в частности, антиген-презентирующие клетки, такие как дендритные клетки и Т-клетки, стволовые клетки, такие как гематопоэтические стволовые клетки и мезенхимальные стволовые клетки и другие типы клеток. Антиген-презентирующая клетка - это клетка, которая экспонирует антиген в комплексе с молекулами главного комплекса гистосовместимости на своей поверхности. Т-клетки могут распознавать этот комплекс при помощи Т-клеточного рецептора (TCR).
Термин "трансгенное животное" относится к животному, имеющему геном, содержащий один или более трансгенов, предпочтительно трансгенов тяжелой и/или легкой цепи, или трансхромосом (или интегрированных или неинтегрированных в природную геномную ДНК животного), предпочтительно способных экспрессировать трансгены. Например, трансгенная мышь может иметь трансген человеческой легкой цепи и/или трансген человеческой тяжелой цепи или трансхромосому человеческой тяжелой цепи, так что мышь продуцирует человеческие анти-CLDN6 антитела, когда она иммунизирована CLDN6-антигеном и/или клетками, экспрессирующими CLDN6. Трансген человеческой тяжелой цепи может быть интегрирован в хромосомную ДНК мыши, как в случае трансгенной мыши, например, HuMAb мыши, например HCo7 или HCol2 мыши, или трансген человеческой тяжелой цепи может быть сохранен экстрахромосомно, как в случае трансхромосомных (например, KM) мышей, как описано в WO 02/43478. Такие трансгенные и трансхромосомные мыши могут быть способны продуцировать множество изотипов человеческих моноклональных антител к CLDN6 (например, IgG, IgA и/или IgE) при проведении V-D-J рекомбинации и переключения изотипа.
"Уменьшать", "снижать" или "ингибировать" при использовании в описании означает способность вызывать общее уменьшение, предпочтительно на 5% или больше, 10% или больше, 20% или больше, более предпочтительно 50% или больше и наиболее предпочтительно на 75% или больше уровня, например, уровня экспрессии или уровня пролиферации клеток.
Такие термины как "увеличение" или "усиление" предпочтительно относятся к увеличению или усилению, по меньшей мере, примерно на 10%, предпочтительно, по меньшей мере, на 20%, предпочтительно, по меньшей мере, на 30%, более предпочтительно, по меньшей мере, на 40%, более предпочтительно, по меньшей мере, на 50%, даже более предпочтительно, по меньшей мере, на 80%, и наиболее предпочтительно, по меньшей мере, на 100%, по меньшей мере, на 200%, по меньшей мере, на 500%, по меньшей мере, на 1000%, по меньшей мере, на 10000% или даже более.
Несмотря на то, что следующее описание предоставляет обсуждение, касающееся механизма, лежащего в основе терапевтической эффективности антител, оно не должно рассматриваться как ограничивающее изобретение каким бы то ни было образом.
Описанные здесь антитела предпочтительно взаимодействуют с компонентами иммунной системы, предпочтительно через ADCC или CDC. Описанные в этом документе антитела также могут использоваться для «целевой нагрузки» (например, радиоизотопами, лекарственными средствами или токсинами), для того, чтобы непосредственно убивать опухолевые клетки, или могут использоваться синергически вместе с традиционными химиотерапевтическими средствами, воздействуя на опухоли с помощью дополнительных механизмов действия, включая противоопухолевые иммунные ответы, которые могут быть нарушены из-за побочных цитотоксических эффектов химиотерапевтических препаратов на Т-лимфоциты. Однако, описанные здесь антитела также могут оказывать действие просто путем связывания с CLDN6 на клеточной поверхности, таким образом, например, блокируя пролиферацию клеток.
Антителозависимая клеточноопосредованная цитотоксичность
ADCC описывает способность эффекторных клеток, в частности, лимфоцитов, убивать клетки, при этом необходимо, чтобы клетка-мишень была помечена антителом.
Предпочтительно ADCC происходит, когда антитела связываются с антигенами на опухолевых клетках, а Fc-домены антител связывают Fc-рецепторы (FcR) на поверхности иммунных эффекторных клеток. Было установлено несколько семейств Fc-рецепторов, при этом характерно, что специфические популяции клеток экспрессируют определенные Fc-рецепторы. ADCC можно рассматривать как механизм прямого разрушения (различной степени) опухоли, который приводит к презентированию антигена и индукции Т-клеточных ответов, направленных на опухоль. Предпочтительно индукция ADCC in vivo будет приводить к Т-клеточным ответам, направленным на опухолевые клетки, и ответам антител хозяина.
Комплементзависимая цитотоксичность
Другим способом уничтожения клеток, который может опосредоваться антителами, является CDC. Самым эффективным изотипом для активации комплемента является IgM. Также очень эффективными при направлении CDC через классический путь активации комплемента являются IgG1 и IgG3. Предпочтительно, образование комплексов антиген-антитело в этом каскаде приводит к «раскрытию» многочисленных мест связывания C1q в непосредственной близости на СН2 доменах участвующих молекул антител, например, молекул IgG (C1q является одним из трех субкомпонентов комплемента C1). Предпочтительно эти «раскрытые» места связывания C1q превращают взаимодействие C1q-IgG до этого с низким сродством в сродство с высокой авидностью, что запускает каскад событий, вовлекающих ряд других белков комплемента, и приводит к протеолитическому высвобождению хемотаксических/активирующих агентов эффекторных клеток С3а и С5а. Предпочтительно каскад комплемента оканчивается образованием мембрано-атакующего комплекса, который создает поры в клеточной мембране, что способствуют свободному прохождению воды и растворенных веществ в клетку и из клетки.
Описанные в этом документе антитела можно получить с помощью ряда методов, включая обычную методику получения моноклональных антител, например, методом гибридизации стандартных соматических клеток Kohler и Milstein, Nature 256: 495 (1975). Несмотря на то, что методы гибридизации соматических клеток являются предпочтительными, в принципе можно использовать другие методы получения моноклональных антител, например, путем вирусной или онкогенной трансформации В-лимфоцитов, или метод фагового дисплея с использованием библиотек генов антител.
Предпочтительной животной системой для получения гибридомы, секретирующей моноклональные антитела, является мышиная система. Получение гибридомы в мыши является общепринятым методом. Протоколы иммунизации и методики выделения иммунизированных спленоцитов для слияния хорошо известны в данной области техники. Сливающиеся клетки (например, мышиные клетки миеломы) и процедуры слияния также хорошо известны.
Другими предпочтительными животными системами для получения гибридом, секретирующих моноклональные антитела, являются крысы или кролики (например, система, описанная в Spieker-Polet et al., Proc. Natl. Acad. Sci. U.S.A. 92:9348 (1995), смотри также Rossi et al., Am. J. Clin. 35 Pathol. 124:295(2005)).
В другом предпочтительном варианте осуществления человеческие моноклональные антитела можно получить с помощью трансгенных или трансхромосомных мышей, несущих части человеческой иммунной системы, а не мышиной системы. Эти трансгенные или трансхромосомные мыши включают мышей, известных как мыши HuMAb и мыши KM, соответственно, и вместе упоминаются в описании как "трансгенные мыши". Получение человеческих антител в таких трансгенных мышах можно осуществить, как подробно описано для CD20 в WO 2004035607.
Другой стратегией получения моноклональных антител является прямое выделение генов, кодирующих антитела, из лимфоцитов, продуцирующих антитела, например, смотри Babcock et el., 1996; A novel strategy for generating monoclonal antibodies from single, isolated lymphocytes producing antiboies of defined strategy. Подробности разработки рекомбинантных антител смотри также в Welschof и Kraus, Recombinant antibodes for cancer therapy ISBN-0-89603-918-8 и Benny K.C. Lo Антитело Engineering ISBN 1-58829-092-1.
С целью получения антител мышей можно иммунизировать конъюгированными с носителем пептидами, полученными из последовательности антигена, т.е. последовательности, против которой направлены антитела, обогащенным препаратом рекомбинантно экспрессированного антигена или его фрагментов и/или клетками, экспрессирующими антиген, как описано. Альтернативно, мышей можно иммунизировать ДНК, кодирующей антиген или его фрагменты. В том случае, когда иммунизация с использованием очищенного или обогащенного препарата антигена не приводит к образованию антител, мышей также можно иммунизировать клетками, экспрессирующими антиген, например, клеточной линией, чтобы содействовать иммунному ответу.
Иммунный ответ можно контролировать на протяжении выполнения протокола иммунизации, отбирая образцы плазмы и сыворотки из хвостовой вены или путем ретроорбитального кровотечения. Мыши с достаточным титром иммуноглобулина могут использоваться для слияния. Мышей можно подвергнуть стимуляции внутрибрюшинно и внутривенно клетками, экспрессирующими антиген, за 3 дня до забоя и удаления селезенки, для того, чтобы увеличить скорость секретирования специфических антител гибридомами.
Для получения гибридом, продуцирующих моноклональные антитела, из лимфатических узлов или селезенки, полученных от иммунизированных мышей, могут быть выделены клетки и слиты с подходящей иммортализованной клеточной линией, например, линией клеток миеломы мыши. Затем, полученные гибридомы можно отобрать по выработке антиген-специфических антител. Затем с помощью метода ELISA можно отобрать отдельные лунки с гибридомами, секретирующими антитела. С помощью иммунофлуоресценции и FACS-анализа с использованием клеток, экспрессирующих антиген, можно установить антитела со специфичностью к антигену. Гибридомы, секретирующие антитела, можно вновь высеять, провести отбор и положительные по моноклональным антителам можно субклонировать с помощью серийного разведения. Затем стабильные субклоны культивируют in vitro в среде для культуры ткани, чтобы получить и охарактеризовать антитела.
Антитела также можно получить в клетках-хозяевах, таких как, трансфектомы, используя, например, комбинацию методов рекомбинантных ДНК и методов трансфекции генов, хорошо известных в данной области техники (Morrison, S. (1985) Science 229: 1202).
Например, в одном варианте осуществления представляющие интерес гены(ген), например, гены антител, могут быть лигированы в вектор экспрессии, такой как эукариотическая экспрессирующая плазмида, например, используемая системой экспрессии гена GS, раскрытой в WO 87/04462, WO 89/01036 и ЕР 338841, или другие системы экспрессии, хорошо известные в данной области. Очищенная плазмида с клонированными генами антитела может быть введена в эукариотическую клетку-хозяина, такую как СНО-клетки (клетки яичников китайского хомячка), NS/0 клетки, HEK293T клетки или HEK293 клетки или альтернативно в другие эукариотические клетки, такие как клетки растений, грибов или дрожжей. Для введения этих генов могут использоваться методы, описанные в данной области техники, такие как электропорация, липофектин, липофектамин или другие. После введения этих генов антител в клетки-хозяева, клетки, экспрессирующие антитело, могут быть опознаны и отобраны. Эти клетки представляют собой трансфектомы, которые затем можно амплифицировать и масштабировать для выработки антител. Рекомбинантные антитела могут быть изолированы и очищены из этих культуральных супернатантов и/или клеток.
Альтернативно, клонированные гены антитела могут быть экспрессированы в других системах экспрессии, включая прокариотические клетки, такие как микроорганизмы, например, Е. coli. Более того, антитела могут продуцироваться в трансгенных организмах, не являющихся человеком, и присутствовать, например, в молоке овец и кроликов или в яйцах кур, или в трансгенных растениях; смотри, например, Verma, R., et al. (1998) J. Immunol. Meth. 216: 165-181; Pollock, et al. (1999) J. Immunol. Meth. 231: 147-157; и Fischer, R., et al. (1999) Biol. Chem. 380: 825-839.
Химеризация
Мышиные антитела являются высоко иммуногенными для человека, что приводит к уменьшению терапевтического эффекта при повторном применении. Основная иммуногенность опосредуется константными областями тяжелой цепи. Иммуногенность мышиных антител у человека можно уменьшить или полностью ее избежать, если соответствующие антитела сделать химерными или гуманизированными. Химерные антитела являются антителами, разные части которых происходят от разных видов животных, например, антитела имеют вариабельную область, полученную от мышиного антитела, и константную область человеческого иммуноглобулина. Химеризация антител достигается соединением вариабельных областей тяжелой и легкой цепей мышиных антител с человеческой константной областью тяжелой и легкой цепи (например, как описано Kraus et al., в Methods in Molecular Biology series, Recombinant antibodies for cancer therapy ISBN-0-89603-918-8). В предпочтительном варианте осуществления химерные антитела получают соединением человеческой константной области каппа-легкой цепи с мышиной вариабельной областью легкой цепи. В еще одном предпочтительном варианте осуществления химерные антитела получают соединением человеческой константной области лямбда-легкой цепи с мышиной вариабельной областью легкой цепи. Предпочтительными константными областями тяжелой цепи для получения химерных антител являются IgG1, IgG3 и IgG4. Другими предпочтительными константными областями тяжелой цепи для получения химерных антител являются IgG2, IgA, IgD и IgM.
Гуманизация
Антитела взаимодействуют с целевыми антигенами преимущественно через аминокислотные остатки, расположенные в шести гипервариабельных участках (CDR) тяжелой и легкой цепи. По этой причине аминокислотные последовательности в CDR являются более разными между отдельными антителами, чем последовательности вне CDR, Поскольку CDR-последовательности отвечают за большинство взаимодействий антитело-антиген, является возможной экспрессия рекомбинантных антител, подражающих свойствам специфических природных антител, путем конструирования векторов экспрессии, которые включают CDR-последовательности от специфических природных антител, пересаженные на каркасные последовательности от другого антитела с другими свойствами (см., например, Riechmann, L. et al. (1998) Nature 332: 323-327; Jones, P. et al. (1986) Nature 321: 522-525; и Queen, C. et al. (1989) Proc. Natl. Acad. Sci. U.S.A. 86: 10029-10033). Такие каркасные последовательности можно получить из публичных баз данных ДНК, содержащих зародышевые последовательности генов антител. Эти зародышевые последовательности будут отличаться от зрелых последовательностей генов антител, так как они не содержат полностью собранных генов вариабельных областей, которые образуются путем соединения участков V-(D)-J при созревании В-клеток. Зародышевые последовательности генов также отличаются от последовательностей высокоаффинных антител из вторичного репертуара индивидуума равномерно по всей вариабельной области.
Способность антител к связыванию с антигеном можно установить с помощью стандартных методов анализа связывания (например, ELISA, вестерн-блоттинга, иммунофлуоресценции и проточной цитометрии).
Для выделения антител отобранные гибридомы выращивают в двухлитровой роллерной колбе. Альтернативно антитела можно получить в биореакторе, на основе диализа. При необходимости супернатанты можно профильтровать, концентрировать перед проведением аффинной хроматографии с протеин-G-сефарозой или протеин-А-сефарозой. Чистоту элюированного IgG можно проконтролировать с помощью гель-электрофореза и высокоэффективной жидкостной хроматографии. Буферный раствор можно поменять на PBS, а концентрацию можно определить при OD280 с использованием коэффициента экстинции 1,43. Моноклональные антитела можно разделить на аликвоты и хранить при -80°С.
Для того чтобы определить, связываются ли отобранные моноклональные антитела с одним эпитопом, может быть применен сайт-направленный или мульти-сайт-направленный мутагенез.
Для установления изотипа очищенных антител может быть проведен анализ ELISA с разными коммерческими наборами (например, Zymed, Roche Diagnostics). Лунки титрационных микропланшетов покрывали антимышиным Ig. После блокировки (ингибирования) проводили реакцию с моноклональными антителами или очищенными изотипическими контролями при комнатной температуре в течение двух часов. Затем проводили реакцию или с мышиным IgG1, IgG2a, IgG2b или IgG3, IgA или со специфическим мышиным IgM, конъюгированным с пероксидазой. После промывки планшеты обрабатывали ABTS субстратом (1 мг/мл) и исследовали при OD 405-650. Альтернативно, можно использовать набор для изотипирования IsoStrip Mouse Monoclonal Antibody Isotyping Kit (Roche, Cat. No. 1493027), как описано производителем.
Для того чтобы продемонстрировать наличие антител в сыворотке иммунизированных мышей или связывание моноклональных антител с живыми клетками, экспрессирующими антиген, можно использовать проточную цитометрию. Линии клеток, экспрессирующие антиген в норме или после трансфекции, и отрицательные контроли, утратившие экспрессию антигена, (выращенные при стандартных условиях), смешивают с разными концентрациями моноклональных антител в супернатантах от гибридомы или. в PBS, содержащем 1% FBS, и инкубируют при 4°С в течение 30 мин. После промывки меченые АРС или Alexa647 анти-IgG антитела могут связываться с антиген-связанными моноклональными антителами при таких же условиях, как условия для окрашивания первичных антител. Образцы можно проанализировать с помощью проточной цитометрии на приборе FACS, используя параметры прямого и бокового рассеяния света, чтобы пропускать отдельные живые клетки. Для того чтобы отличить антиген-специфические моноклональные антитела от неспецифических связывающих веществ в ходе отдельного измерения, можно использовать метод котрансфекции. Клетки временно трансфицированные плазмидами, кодирующими антиген и флуоресцентный маркер, можно окрасить, как описано выше. Трансфицированные клетки можно обнаружить в другом диапазоне флуоресценции, чем клетки, окрашенные антителом. Так как большинство трансфицированных клеток экспрессирует оба трансгена, антиген-специфические моноклональные антитела связываются предпочтительно с клетками, экспрессирующими флуоресцентный маркер, тогда как неспецифические антитела связываются в сравнимом соотношении с нетрансфицированными клетками. Можно применять альтернативный метод анализа с использованием флуоресцентной микроскопии в дополнение к или вместо проточной цитометрии. Клетки можно окрасить так, как описано выше, и исследовать с помощью флуоресцентной микроскопии.
Для того чтобы продемонстрировать наличие антител в сыворотке иммунизированных мышей или связывание моноклональных антител с живыми клетками, экспрессирующими антиген, можно использовать иммунофлуоресцентную микроскопию. Например, клеточные линии, экспрессирующие антиген или спонтанно или после трансфекции, и отрицательные контроли, утратившие экспрессию антигена, выращивают на предметных стеклах с лунками при стандартных условиях роста в среде DMEM/F12 с добавлением 10% эмбриональной телячьей сыворотки (FCS), 2 мМ L-глутамина, 100 мкг/мл пенициллина и 100 мкг/мл стрептомицина. Затем клетки фиксируют метанолом или параформальдегидом или оставляют необработанными. Затем проводят реакцию клеток с моноклональными антителами к антигену в течение 30 минут при 25°С. После промывки проводят реакцию клеток с мечеными Alexa555 вторичными антителами к IgG мыши (Molecular Probes) при тех же самых условиях. После этого можно исследовать клетки с помощью флуоресцентной микроскопии.
Из клеток, экспрессирующих антиген, и соответствующих отрицательных контролей можно приготовить клеточные экстракты, а затем провести электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS). После электрофореза выделенные антигены переносят на нитроцеллюлозные мембраны, ингибируют и исследуют с помощью моноклональных антител, которые можно протестировать. IgG-связывание можно определить с помощью антимышь IgG, меченого пероксидазой, и обнаружить с помощью ECL субстрата.
Антитела можно дополнительно протестировать на реакционную способность с антигеном с помощью иммуногистохимического анализа хорошо известным специалисту в данной области способом, например, с использованием криосрезов, фиксированных параформальдегидом или ацетоном, или фиксированных параформальдегидом парафиновых срезов образцов нераковых тканей или раковых тканей, взятых у пациента во время обычных хирургических процедур, или у мышей с ксенотрансплантатом опухолей, инокулированных с помощью линий клеток, экспрессирующих антиген спонтанно или после трансфекции. Для иммуноокрашивания антитела, реагирующие с антигеном, могут быть проикубированы, а затем конъюгированы с мечеными пероксидазой хрена козьими антимышь или козьими антикролик антителами (DAKO) согласно инструкциям продавца.
Антитела можно протестировать в отношении их способности опосредовать фагоцитоз и уничтожение клеток, экспрессирующих CLDN6. Проверка активности моноклональных антител in vitro обеспечивает первоначальный скрининг до тестирования на моделях in vivo.
Антителозависимая клеточноопосредованная цитотоксичность (ADCC)
Коротко, полиморфноядерные клетки (PMN), NK-клетки, моноциты, мононуклеарные клетки или другие эффекторные клетки от здоровых доноров можно очистить центрифугированием в градиенте плотности фиколл-гипака, с последующим разрушением загрязняющих эритроцитов. Промытые эффекторные клетки суспендируют в RPMI с добавлением 10% инактивированной нагреванием эмбриональной телячьей сыворотки или альтернативно с 5% инактивированной нагреванием человеческой сыворотки и смешивают с 51Cr-мечеными клетками-мишенями, экспрессирующими CLDN6, в различных соотношениях эффекторных клеток с клетками-мишенями. Альтернативно, клетки-мишени можно пометить лигандом, усиливающим флуоресценцию (BATDA). Высоко флуоресцентный хелат европия с усиливающим лигандом, который высвобождается из мертвых клеток, можно определить с помощью флуориметра. В другом альтернативном способе может использоваться трансфекция клеток-мишеней с использованием люциферазы. При этом добавленный люцифер желтый может окисляться только живыми клетками. Затем можно добавить очищенные анти-CLDN6 IgG в разных концентрациях. В качестве отрицательного контроля можно использовать нерелевантный человеческий IgG. Исследование проводится в течение от 4 до 20 часов при 37°С в зависимости от типа используемых эффекторных клеток. Цитолиз в образцах можно оценить путем измерения высвобождения 51Cr или наличия хелата EuTDA в культуральном супернатанте. Альтернативно, можно измерить люминесценцию живых клеток, являющуюся результатом окисления люцифера желтого.
Также можно проверить различные комбинации анти-CLDN6 моноклональных антител, чтобы определить усиливается ли цитолиз при действии составов моноклональных антител.
Комплементзависимая цитотоксичность (CDC)
Моноклональные анти-CLDN6 антитела можно проверить на их способность опосредовать CDC с помощью ряда известных методов. Например, сыворотку для получения комплемента можно получить из крови известным специалистам способом. Для определения CDC-активности моноклональных антител можно использовать разные методы. Например, можно измерить высвобождение 51Cr или можно оценить повышенную проницаемость мембран с помощью метода исключения пропидиум иодида (PI). Коротко, целевые клетки промывают и 5×105/мл инкубируют с разными концентрациями mMAb в течение 10-30 минут при комнатной температуре или при 37°С. Затем добавляют сыворотку или плазму до окончательной концентрации 20% (об./об.) и клетки инкубируют при 37°С в течение 20-30 минут. Ко всем клеткам каждого образца добавляют раствор PI в пробирку для FACS-анализа. После этого смесь немедленно анализируют с помощью проточной цитометрии, используя FACS-набор.
В альтернативном способе исследования индукцию CDC можно установить на прикрепленных клетках. В одном варианте осуществления этого метода анализа клетки высевают за 24 часа до исследования с плотностью 3×104/лунку в плоскодонные титрационные микропланшеты для культур тканей. На следующий день ростовую среду удаляют и клетки инкубируют с антителами (три повтора). Контрольные клетки инкубируют в ростовой среде или ростовой среде, содержащей 0,2% сапонина, для определения фонового лизиса и максимального лизиса, соответственно. После инкубации в течение 20 минут при комнатной температуре супернатант удаляют, и добавляют к клеткам 20% (об./об.) человеческой плазмы или сыворотки в DMEM (предварительно нагретой до 37°С) и инкубируют в течение следующих 20 минут при 37°С. К клеткам каждого образца добавляют раствор пропидий иодида (10 мкг/мл). Затем супернатанты заменяют PBS, содержащим 2,5 мкг/мл этидиум бромида, и измеряют испускание флуоресценции после возбуждения при 520 нм при 600 нм с помощью Tecan Satire. Процент специфического лизиса вычисляют, как указано далее: % специфического лизиса = (флуоресценция образца - фоновая флуоресценция)/(флуоресценция при максимальном лизисе - фоновая флуоресценция)×100.
Индукция апоптоза и ингибирование клеточной пролиферации моноклональными антителами
Например, чтобы проверить способность моноклональных анти-CLDN6 антител инициировать апоптоз, их можно инкубировать с CLDN6-положительными опухолевыми клетками или CLDN6-трансфицированными опухолевыми клетками при 37°С в течение примерно 20 часов. Клетки собирают, промывают в аннексин-V связывающем буфере (BD biosciences), и инкубируют с аннексином V, соединенным с FITC, или АРС (BD biosciences), в течение 15 минут в темноте. Ко всем клеткам каждого образца добавляют раствор PI (10 мкг/мл в PBS) в пробирку для FACS-анализа и сразу оценивают с помощью проточной цитометрии (как описано выше). Альтернативно, общее ингибирование клеточной пролиферации моноклональными антителами можно определить с помощью коммерчески доступных наборов. С помощью набора для определения клеточной пролиферации DELFIA (Perkin-Elmer, Cat. No. AD0200) можно провести неизотопный иммуноанализ в микропланшетах, основанный на измерении включения 5-бром-2'-дезоксиуридина (BrdU) во время синтеза ДНК пролиферирующими клетками. Включенный BrdU определяют с помощью меченых европием моноклональных антител. Чтобы сделать возможным обнаружение антител, клетки фиксируют и проводят денатурацию ДНК, используя Fix (фиксирующий) раствор. Несвязанные антитела смывают и добавляют в раствор индуктор DELFIA, чтобы отделить ионы европия от меченых антител, где они образуют высоко флуоресцентные хелаты с компонентами индуктора DELFIA. Флуоресценция, измеренная в каждой лунке с помощью флуориметрии с временным разрешением, является пропорциональной синтезу ДНК в клетке.
Доклинические исследования
Связывающие агенты, описанные в этом документе, также могут быть протестированы на модели in vivo (например, на иммунодефицитных мышах с ксенотрансплантатами клеточных линий опухолей, экспрессирующих CLDN6, чтобы определить их эффективность в отношении контролирования роста CLDN-экспрессирующих опухолевых клеток.
Исследование антител изобретения in vivo можно провести после ксенотрансплантации опухолевых клеток, экспрессирующих CLDN18.2, иммунодефицитным мышам или другим животным. Чтобы определить действие антител на предотвращение образования опухолей или симптомов, связанных с опухолью, антитела можно ввести мышам, свободным от опухоли, с последующей инъекцией опухолевых клеток. Чтобы установить терапевтическую эффективность соответствующих антител в отношении уменьшения опухолевого роста или симптомов, связанных с опухолью, антитела можно ввести мышам-опухоленосителям. Применение антител можно комбинировать с применением других веществ, таких как цитостатические средства, ингибиторы факторов роста, блокаторы клеточного цикла, ингибиторы ангиогенеза или другими антителами, чтобы определить синергическую эффективность и потенциальную токсичность комбинаций. Чтобы проанализировать токсичные побочные явления, опосредованные антителами, животным можно инокулировать антитела или контрольные реагенты и тщательно изучить симптомы, возможно связанные с терапией антителами к CLDN6. В частности, возможные побочные явления от применения in vivo CLDN6-антител включают токсическое влияние на ткани, экспрессирующие CLDN6, включая желудок. Антитела, распознающие CLDN6 у человека и у других видов, например, мышей, являются, в частности, пригодными для предсказания возможных побочных явлений, опосредованных применением моноклональных CLDN6-антител, у людей.
Картирование эпитопов, распознаваемых антителами, можно провести, как подробно описано в "Epitope Mapping Protocols (Methods in Molecular Biology) by Glenn E. Morris ISBN-089603-375-9 и в "Epitope Mapping: A Practical Approach" Practical Approach Series, 248 by Olwyn M.R. Westwood, Frank C. Hay.
Соединения и средства, описанные в данном документе, могут быть введены в виде любой подходящей фармацевтической композиции.
Фармацевтические композиции изобретения предпочтительно являются стерильными и содержат эффективное количество антител, описанных в данном документе, и необязательно дополнительных средств, описанных в данном документе, для того, чтобы получить желательную реакцию или желательный эффект.
Фармацевтические композиции в большинстве случаев предоставляются в стандартной лекарственной форме и могут быть получены хорошо известным способом. Например, фармацевтическая композиция может иметь форму раствора или суспензии.
Фармацевтическая композиция может содержать соли, буферные вещества, консервирующие вещества, носители, разбавители и/или эксципиенты, все из которых предпочтительно являются приемлемыми с точки зрения фармацевтики. Термин "фармацевтически приемлемый" относится к нетоксичному веществу, которое не вмешивается в действие активного компонента фармацевтической композиции.
Соли, не являющиеся фармацевтически приемлемыми, могут использоваться для получения фармацевтически приемлемых солей и включаются в изобретение. Фармацевтически приемлемые соли этого типа включают, без ограничения, соли, полученные из следующих кислот: хлористоводородной, бромистоводородной, серной, азотной, фосфорной, малеиновой, уксусной, салициловой, лимонной, муравьиной, малоновой, янтарной и тому подобных. Фармацевтически приемлемые соли также могут быть получены в виде солей щелочных или щелочноземельных металлов, таких как соли натрия, соли калия и соли кальция.
Подходящие для использования в фармацевтической композиции буферные вещества включают уксусную кислоту в виде соли, лимонную кислоту в виде соли, борную кислоту в виде соли и фосфорную кислоту в виде соли.
Подходящие для использования в фармацевтической композиции консервирующие вещества включают бензалкония хлорид, хлорбутанол, парабен и тимеросал.
Предназначенная для инъекций композиция может содержать фармацевтически приемлемый эксципиент, такой как лактат Рингера.
Термин "носитель" имеет отношение к органическому или неорганическому компоненту, природного или синтетического происхождения, с которым активный компонент объединяется, для того, чтобы облегчить, усилить или способствовать применению. Согласно изобретению термин "носитель" также включает один или более совместимых твердых или жидких наполнителей, разбавителей или инкапсулирующих веществ, пригодных для введения пациенту.
Приемлемыми для парентерального введения веществами-носителями являются, например, стерильная вода, раствор Рингера, лактат Рингера, стерильный раствор хлорида натрия, полиалкиленгликоли, гидрогенезированные нафталины и, в частности, биологически совместимые полимеры лактида, сополимеры лактида с гликолидом или сополимеры полиоксиэтилена с полиоксипропиленом.
Использованный в описании термин "эксципиент" обозначает все вещества, которые могут присутствовать в фармацевтической композиции и не являются активными ингредиентами, такие как, например, носители, связывающие вещества, смазывающие вещества, сгущающие вещества, поверхностно-активные вещества, консервирующие вещества, эмульгирующие вещества, буферные вещества, ароматизирующие вещества или красители.
Средства и композиции, описанные в данном документе, могут вводиться любым обычным способом, например, парентеральным путем, включая инъекцию или инфузию. Предпочтительно введение осуществляется парентерально, например, внутривенно, внутриартериально, подкожно, внутрикожно или внутримышечно.
Композиции, пригодные для парентерального введения, обычно включают стерильные водные или неводные препараты активного соединения, предпочтительно изотонические относительно крови реципиента. Примерами совместимых носителей и растворителей являются раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные, жирные масла используются в качестве среды для раствора или суспензии.
Средства и композиции, описанные в данном документе, вводятся в эффективных количествах. "Эффективное количество" относится к количеству, с помощью которого достигается желательная реакция или желательный эффект отдельно или в сочетании с дополнительными дозировками. В случае лечения конкретной болезни или конкретного состояния желательная реакция предпочтительно имеет отношение к ингибированию развития болезни. Сюда включается замедление развития болезни и, в частности, прерывание или обратное развитие болезни. Желательной реакцией при лечении болезни или состояния также может быть задержка начала или предотвращение начала указанной болезни или указанного состояния. В частности, термин "эффективное количество" относится к количеству (объему) терапии, которого достаточно, для того, чтобы привести к предотвращению развития, рецидива или возникновения рака и одного, или более его симптомов, уменьшения тяжести, продолжительности рака, облегчения одного или более симптомов рака, предотвращения развития рака, а также для того, чтобы вызвать регрессию рака и/или предотвратить метастазирование рака. В одном варианте осуществления изобретения количество терапии является эффективным для достижения стабилизации, уменьшения или уничтожения популяции раковых стволовых клеток и/или устранения, уничтожения или контролирования первичного рака, метастатического рака и/или рецидива рака.
Эффективное количество средства или композиции, описанной в данном документе, будет зависеть от состояния, которое необходимо лечить, тяжести заболевания, индивидуальных характеристик пациента, включая возраст, физиологическое состояние, размер и вес, продолжительность лечения, тип сопутствующего лечения (если оно имеется), конкретный способ введения и подобные факторы. Соответственно, вводимые дозировки описанных здесь средств могут зависеть от тех или иных подобных характеристик. В том случае, когда ответ пациента является недостаточным при использовании первоначальной дозировки, могут использоваться более высокие дозы (или эффективно более высокие дозы достигаются с помощью другого более локального способа введения).
Средства и композиции, описанные в этом документе, могут вводиться пациентам с целью лечения или предотвращения ракового заболевания, например, ракового заболевания, характеризующегося наличием раковых стволовых клеток, экспрессирующих CLDN6.
Средства и композиции, предоставленные в этом документе, могут использоваться отдельно или в комбинации с общепринятыми терапевтическими режимами, такими как хирургическое вмешательство, облучение, химиотерапия и/или трансплантация костного мозга (аутологичная, сингенная, аллогенная или неродственная).
Лечение рака представляет собой такую область, в которой стратегий комбинирования являются особенно целесообразными, поскольку нередко комбинированное применение двух, трех, четырех или даже более противоопухолевых лекарственных средств/видов терапии приводит к появлению синергетических эффектов, более сильных по сравнению с эффектами монотерапевтического подхода. Таким образом, в другом варианте осуществления настоящего изобретения противоопухолевая терапия может эффективно сочетаться с различными другими лекарственными средствами. К их числу относятся, например, сочетание с традиционными методами лечения опухолей, мультиэпитопные стратегии, дополнительная иммунотерапия и терапевтические подходы, нацеленные на ангиогенез или апоптоз (смотри, например, Andersen et al. 2008: Cancer treatment: the combination of vaccination with other therapies. Cancer Immunology Immunotherapy, 57(11): 1735-1743.) Последовательное введение различных средств может ингибировать рост раковых клеток в различных контрольных точках, в то время как другие препараты могут, например, ингибировать неоангиогенез, выживание злокачественных клеток или метастазов, в результате чего рак переводится в хроническую форму болезни. Следующий перечень предоставляет несколько неограничивающих примеров противоопухолевых лекарственных средств и видов терапии, которые могут использоваться в комбинации с настоящим изобретением:
1. Химиотерапия
Химиотерапия является стандартом лечения для многих типов рака. Большинство общепринятых химиотерапевтических средств оказывает воздействие, убивая быстро делящиеся клетки (быстрое деление является одним из основных свойств раковых клеток). Таким образом, комбинация с общепринятыми химиотерапевтическими средствами, такими как, алкилирующие средства, антиметаболиты, антрациклиновые антибиотики, растительные алкалоиды, ингибиторы топоизомеразы и другие противоопухолевые средства, оказывающие влияние на клеточное деление или синтез ДНК, может значительно улучшить терапевтические эффекты настоящего изобретения путем устранения супрессорных клеток, «перезагрузки» иммунной системы, путем перевода опухолевых клеток в состояние более чувствительное к иммуноопосредованному уничтожению или путем дополнительной активации клеток иммунной системы. Синергетическое противоопухолевое действие химиотерапевтических препаратов и основанных на вакцинации иммунотерапевтических средств было продемонстрировано в многочисленных исследованиях (смотри, например, Quoix et al. 2011: Therapeutic vaccination with TG4010 and first-line chemotherapy in advanced non-small-cell lung cancer: a controlled phase 2B trial. Lancet Oncol. 12(12): 1125-33.; смотри также Liseth et al. 2010: Combination of intensive chemotherapy and anticancer vaccines in the treatment of human malignancies: the hematological experience. J Biomed Biotechnol. 2010: 6920979; смотри также Hirooka et al 2009: A combination therapy of gemcitabine with immunotherapy for patients with inoperable locally advanced pancreatic cancer. Pancreas 38(3): e69-74). Существуют сотни доступных химиотерапевтических средств, которые в принципе подходят для комбинированной терапии. Некоторыми (неограничивающими) примерами химиотерапевтических средств, которые могут сочетаться с настоящим изобретением, являются карбоплатин (параплатин), цисплатин (платинол, платинол-AQ), кризотиниб (ксалкори), циклофосфамид (цитоксан, Neosar), доцетаксел (таксотер), доксорубицин (адриамицин), эрлотиниб (тарцева), этопозид (вепезид), фторурацил (5-ФУ), гемцитабин (гемзар), иматиниб мезилат (гливек), иринотекан (Camptosar), инкапсулированный в липосомы доксорубицин (Doxil), метотрексат (фолекс, мексат, аметоптерин), паклитаксел (таксол, абраксан), сорафиниб (нексавар), сунитиниб (сунитент), топотекан (гикамтин), трабектидин (йонделис), винкристин (онковин, винкасар PFS) и винбластин (вельбан).
2. Хирургия
Хирургическое лечение рака - оперативное вмешательство с целью удаления опухоли - остается основой противоопухолевой терапии. Хирургическое лечение может быть скомбинировано с другими видами противоопухолевой терапии, для того чтобы удалить оставшиеся опухолевые клетки. Комбинирование хирургических методов с последующим иммунотерапевтическим лечением - это перспективный подход, который был продемонстрирован множество раз.
3. Лучевая терапия
Лучевая терапия остается важным компонентом противоопухолевой терапии, причем приблизительно 50% всех онкологических пациентов получают лучевую терапию во время течения болезни. Основная цель лучевой терапии - лишить раковые клетки возможности размножения (клеточного деления). Типы облучения, используемые для лечения рака, представляют собой фотонное излучение (x-лучи и гамма-лучи) и корпускулярное излучение (пучки электронов, протонов и нейтронов). Существует два метода доставки облучения в место расположения злокачественного образования. Наружная дистанционная лучевая терапия поставляется с наружной стороны организма путем нацеливания высокоэнергетического излучения (фотонов, протонов или корпускулярного излучения) в местоположение опухоли. Внутреннее облучение или брахитерапия поставляется с внутренней стороны организма с помощью радиоактивных источников, содержащихся в катетерах или зернах, непосредственно в местоположение опухоли. Методами лучевой терапии, которые применимы в комбинации с настоящим изобретением, являются, например, фракционирование (лучевая терапия, доставляемая в режиме разделения на фракции, например, ежедневные фракции 1,5-3 Грэй, которые проводятся в течение нескольких недель), 3D конформная лучевая терапия (3DCRT; доставка облучения в макроскопический объем опухоли), лучевая терапия с модулированной интенсивностью (IMRT; управляемая компьютером модуляция интенсивности пучков многократного излучения), лучевая терапия под визуальным контролем (IGRT; метод, включающий предварительную визуализацию перед радиотерапией, обеспечивающий возможность коррекции) и стереотаксическая лучевая терапия тела (SRBT, доставляет очень высокие индивидуальные дозы облучения посредством нескольких фракций). Обзор, касающийся лучевой терапии, смотри Baskar et al. 2012: Cancer and radiation therapy: current advances and future directions. Int. J Med Sci. 9(3): 193-199.
4. Антитела
Антитела (предпочтительно моноклональные антитела) осуществляют свое терапевтическое действие против раковых клеток с помощью различных механизмов. Они оказывают прямое воздействие на индукцию апоптоза или запрограммированной гибели клеток. Они могут блокировать компоненты путей сигнальной трансдукции, например, такие как рецепторы факторов роста, эффективно задерживая пролиферацию опухолевых клеток. В клетках, экспрессирующих моноклональные антитела, они могут приводить к образованию антиидиотипичных антител. Непрямые эффекты включают рекрутинг клеток, обладающих цитотоксичностью, таких как моноциты и макрофаги. Этот тип уничтожения клеток, опосредованный антителами, называется антителозависимой клеточноопосредованной цитотоксичностью (ADCC). Антитела также связываются с комплементом, что приводит к прямой клеточной токсичности, известной как комплементзависимая цитотоксичность (CDC). Сочетание хирургических методов с иммунотерапевтическими средствами или методами является перспективным подходом, как, например, продемонстрировано в Gadri et al. 2009: Synergistic effect of dendritic cell vaccination and anti-CD20 antibody treatment in the therapy of murine lymphoma. J Immunother. 32(4): 333-40. Следующий перечень предоставляет некоторые неограничивающие примеры противоопухолевых антител и потенциальных мишеней для антител (в скобках), которые могут использоваться в комбинации с настоящим изобретением: абаговомаб (СА-125), абциксимаб (CD41), адекатумумаб (ЕрСАМ), афутузумаб (CD20), алацизумаб пегол (VEGFR2), алтумомаб пентетат (СЕА), аматуксимаб (MORAb-009), анатумомаб мафенатокс (TAG-72), аполизумаб (HLA-DR), арцитуномаб (СЕА), бавитуксимаб (фосфатидилсерин), бектумомаб (CD22), белимумаб (BAFF), бевацизумаб (VEGF-A), биватузумаб мертанзин (CD44 v6), блинатумомаб (CD19), брентуксимаб ведотин (CD30 TNFRSF8), кантузумаб мертанзин (муцин CanAg), кантузумаб равтанзин (MUC1), капромаб пендетид (клетки карциномы предстательной железы), карлумаб (CNTO888), катумаксомаб (ЕрСАМ, CD3), цетуксимаб (EGFR), цитатузумаб богатокс (ЕрСАМ), циксутумумаб (IGF-1 рецептор), клаудиксимаб (клаудин), кливатузумаб тетраксетан (MUC1), конатумумаб (TRAIL-R2), дацетузамаб (CD40), далотузумаб (рецептор инсулин-подобного фактора роста I), денозумаб (RANKL), детумомаб (клетки В-лимфомы), дрозитумаб (DR5), экромексимаб (GD3 ганглиозид), эдреколомаб (ЕрСАМ), элотузумаб (SLAMF7), энаватузумаб (PDL192), энситуксимаб (NPC-1C), эпратузумаб (CD22), эртумаксомаб (HER2/neu, CD3), этарацизумаб (интегрин αvβ3), фарлетузумаб (фолатный рецептор 1), FBTA05 (CD20), фиклатузумаб (SCH 900105), фигитумумаб (IGF-1 рецептор), фланвотумаб (гликопротеин 75), фресолимумаб (TGF-β), галиксимаб (CD80), ганитумаб (IGF-I), гемтузумаб озогамицин (CD33), гевокизумаб (IL-1β), гирентуксимаб (карбоангидраза 9 (СА-IX)), глембатумумаб ведотин (GPNMB), ибритумомаб тиуксетан (CD20), икруцумаб (VEGFR-1), иговома (СА-125), индатуксимаб равтанзин (SDC1), интетумумаб (CD51), инотузумаб озогамицин (CD22), ипилимумаб (CD152), иратумумаб (CD30), лабетузумаб (СЕА), лексатумумаб (TRAIL-R2), либивирумаб (поверхностный антиген гепатита В), линтузумаб (CD33), лорвотузумаб мертанзин (CD56), лукатумумаб (CD40), лумиликсимаб (CD23), мапатумумаб (TRAIL-R1), матузумаб (EGFR), меполизумаб (IL-5), милатузумаб (CD74), митумомаб (GD3 ганглиозид), могамулизумаб (CCR4), моксетумомаб пасудотокс (CD22), наколомаб тафенатокс (С242 антиген), наптумомаб эстафенатокс (5Т4), нарнатумаб (RON), нецитумумаб (EGFR), нимотузумаб (EGFR), ниволумаб (IgG4), офатумумаб (CD20), оларатумаб (PDGF-Rα), онартузумаб (человеческий рассеивающий фактор рецепторнрй киназы), опортузумаб монатокс (ЕрСАМ), ореговомаб (СА-125), окселумаб (ОХ-40), панитумумаб (EGFR), патритумаб (HER3), пемтумомаб (MUC1), пертузумаб (HER2/neu), пинтумомаб (антиген аденокарциномы), притумумаб (виментин), ракотумомаб (N-гликолилнейраминовая кислота), радретумаб (экстра домен В фибронектина), рафивирумаб (гликопротеин вируса бешенства), рамуцирумаб (VEGFR2), рилотумумаб (HGF), ритуксимаб (CD20), робатумумаб (рецептор IGF-1), самализумаб (CD200), сибротузумаб (FAP), силтуксимаб (IL-6), табалумаб (BAFF), такатузумаб тетраксетан (альфа-фетопротеин), таплитумомаб паптокс (CD19), тенатумомаб (тенасцин С), тепротумумаб (CD221), тицилимумаб (CTLA-4), тигатузумаб (TRAIL-R2), TNX-650 (IL-13), тозитумомаб (CD20), трастузумаб (HER2/neu), TRBS07 (GD2), тремелимумаб (CTLA-4), тукотузумаб целмолейкин (ЕрСАМ), ублитуксимаб (MS4A1), урелумаб (4-1ВВ), волоциксимаб (интегрин α5β1), волутумумаб (опухолевый антиген СТАА16.88), залутумумаб (EGFR), занолимумаб (CD4).
5. Цитокины, хемокины, костимулирующие молекулы, гибридные белки
Комбинированное использование антиген-кодирующих фармацевтических композиций настоящего изобретения с цитокинами, хемокинами, костимулирующими молекулами и/или их гибридными белками с целью индуцировать полезную иммуномодуляцию или эффекты ингибирования опухолей - это другой вариант осуществления настоящего изобретения. С целью увеличения инфильтрации иммунных клеток в опухоль и облегчения движения антиген-презентирующих клеток в опухоль-дренирующие лимфатические узлы могут использоваться различные хемокины с С, СС, СХС и СХ3С структурами. Некоторыми из наиболее перспективных хемокинов являются, например, CCR7 и его лиганды CCL19 и CCL21, кроме того CCL2, CCL3, CCL5 и CCL16. Другими примерами являются CXCR4, CXCR7 и CXCL12. Более того, используются костимулирующие или регуляторные молекулы, такие как, например, В7 лиганды (В7.1 и В7.2). Также используются другие цитокины, такие как, например, интерлейкины (например, IL-1 - IL17), интерфероны (например, IFNальфа1, IFNальфа8, IFNальфа10, IFNальфа13, IFNальфа14, IFNальфа16, IFNальфа17, IFNальфа21, IFNбета1, IFNW, IFNE1 и IFNK), гематопоэтические факторы, TGFs (например, TGF-α, TGF-β и другие члены семейства TGF) и, наконец, члены семейства рецепторов фактора некроза опухолей и их лиганды, а также другие стимулирующие молекулы, включая, но не ограничиваясь этим, 4-1ВВ, 4-1BB-L, CD137, CD137L, CTLA-4GITR, GITRL, Fas, Fas-L, TNFR1, TRAIL-R1, TRAIL-R2, p75NGF-R, DR6, LT.beta.R, RANK, EDAR1, XEDAR, Fn114, Troy/Trade, TAJ, TNFRII, HVEM, CD27, CD30, CD40, 4-1BB, OX40, GITR, GITRL, TACI, BAFF-R, BCMA, RELT и CD95 (Fas/APO-1), индуцированный глюкокортикоидом TNFR-связанный белок, связанный с рецептором TNF апоптоз-опосредующий белок (TRAMP) и смертельный рецептор 6 (DR6). Особенно важными мишенями для комбинированной иммунотерапии являются CD40/CD40L и OX40/OX40L вследствие их прямого влияния на выживаемость и пролиферацию Т-клеток. Смотри обзор Lechner et al. 2011: Chemokines, costimulatory molecules and fusion proteins for the immunotherapy of solid tumors. Immunotherapy 3 (11), 1317-1340.
6. Антибактериальная обработка
Для уничтожения внутренних опухолей, обедненных кислородом, исследователи используют анаэробные бактерии, такие как Clostridium novyi. В дальнейшем эти бактерии должны погибнуть, когда они входят в контакт с оксигенированными областями опухоли, что означает, что они безопасны для остальной части организма. Другой стратегией является использование анаэробных бактерий, преобразующихся при наличии фермента, который может превратить нетоксичное пролекарство в токсичное лекарственное средство. При пролиферации этих бактерий в некротической и гипоксической областях опухоли, фермент экспрессируется исключительно в опухоли. Таким образом, системно применяемое пролекарство метаболизируется до токсичного лекарственного средства только в опухоли. Продемонстрировано эффективное применение непатогенного анаэроба Clostridium sporogenes.
7. Ингибиторы киназы
Другая большая группа потенциальных мишеней для дополнительной терапии рака включает ингибиторы киназ, поскольку рост и выживаемость раковых клеток тесно связаны с нарушением регулирования активности киназ. Для восстановления нормальной активности киназ и, следовательно, уменьшения роста опухоли используется большое число ингибиторов. Группа киназ-мишеней включает рецепторные тирозинкиназы, например, BCR-ABL, B-Raf, EGFR, HER-2/ErbB2, IGF-IR, PDGFR-α, PDGFR-β, c-Kit, Flt-4, Flt3, FGFR1, FGFR3, FGFR4, CSF1R, c-Met, RON, c-Ret, ALK, цитоплазматические тирозинкиназы, например, c-SRC, с-YES, Abl, JAK-2, серин/треонин киназы, например, ATM, Aurora A & В, CDKs, mTOR, PKCi, PLKs, b-Raf, S6K, STK11/LKB1 и липидкиназы, например, PI3K, SK1. Низкомолекулярными ингибиторами киназ являются, например, РНА-739358, нилотиниб, дазатиниб и PD166326, NSC 743411, лапатиниб (GW-572016), цанертиниб (CI-1033), семаксиниб (SU5416), ваталаниб (PTK787/ZK222584), сутент (SU11248), сорафениб (BAY 43-9006) и лефлуномид (SU101). Для получения дополнительной информации смотри, например, Zhang et al. 2009: Targeting cancer with small molecule kinase inhibitors. Nature Reviews Cancer 9, 28-39.
8. Toll-подобные рецепторы
Члены семейства Toll-подобных рецепторов (TLRs) являются важным связывающим звеном между врожденным и адаптивным иммунитетом, причем эффект многих адъювантов основывается на активации TLRs. Большое число общепринятых вакцин против рака включают лиганды для TLRs для стимулирования ответов на вакцины. Кроме TLR2, TLR3, TLR4, в частности, для лечения рака с использованием пассивной иммунотерапии были исследованы TLR7 и TLR8. Близкородственные TLR7 и TLR8 вносят вклад в противоопухолевые ответы, воздействуя на иммунные клетки, опухолевые клетки и микроокружение опухоли и могут активироваться структурами, аналогичными нуклеозидам. Все TLR используются как отдельные иммунотерапевтические средства или адъюванты для вакцин против рака и могут синергетически сочетаться с композициями и способами настоящего изобретения. Для получения дополнительной информации смотри van Duin et al. 2005: Triggering TLR signaling in vaccination. Trends in Immunology, 27(1):49-55.
9. Ингибиторы антиогенеза
В дополнение к терапии, нацеленной на иммуномодулирующие рецепторы, пораженные опосредованными опухолью механизмами ускользания и подавления иммунитета, существуют виды терапии, нацеленные на среду, окружающую опухоль. Ингибиторы ангиогенеза препятствуют экстенсивному росту кровеносных сосудов (ангиогенезу), которые необходимы для выживания опухоли. Ангиогенез, стимулированный опухолевыми клетками для удовлетворения их возрастающего потребления питательных веществ и кислорода, может быть заблокирован, например, с помощью различных таргентных молекул. Неограничивающими примерами молекул,, опосредующих ангиогенез, или ингибиторов ангиогенеза, которые могут сочетаться с настоящим изобретением, являются растворимый VEGF (VEGF изоформы VEGF121 и VEGF165, рецепторы VEGFR1, VEGFR2 и корецепторы нейропилин-1 и нейропилин-2) 1 и NRP-1, ангиопоэтин 2, TSP-1 и TSP-2, ангиостатин и родственные молекулы, эндостатин, вазостатин, калретикулин, тромбоцитарный фактор-4, TIMP и CDAI, Meth-1 и Meth-2, IFN-α, -β и -γ, CXCL10, IL-4, -12 и -18, протромбин («kringle»-домен-2), фрагмент антитромбина III, пролактин, VEGI, SPARC, остеопонтин, маспин, канстатин, пролиферин-связанный протеин, рестин и такие лекарственные средства, как, например, бевацизумаб, итраконазол, карбоксиамидотриазол, TNP-470, СМ101, IFN-α, тромбоцитарный фактор-4, сурамин, SU5416, тромбоспондин, антагонисты VEGFR, ангиостатические стероиды + гепарин, полученный из хряща ингибирующий фактор ангиогенеза, ингибиторы матриксной металлопротеиназы, 2-метоксиэстрадиол, текогалан, тетратиомолибдат, талидомид, тромбоспондин, ингибиторы пролактина α Vβ3, линомид, тасквинимод. Дополнительную информацию смотри в Schoenfeld and Dranoff 2011: Anti-angiogenesis immunotherapy. Hum Vaccin. (9):976-81.
10. Таргентная терапия низкомолекулярными лекарственными средствами
Низкомолекулярные лекарственные средства для таргентной терапии являются в основном ингибиторами ферментативных доменов на мутированных, сверхэкспрессированных или иных особо важных белках внутри раковой клетки. Известными и неограничивающими примерами являются ингибиторы тирозинкиназ иматиниб (гливек) и гефитиниб (иресса). Использование малых молекул, например, сунитиниб малата и/или сорафениб тозилата, нацеленных на некоторые киназы, в сочетании с вакцинами для лечения рака также описано в предыдущей патентной заявке US 2009004213.
11. Вакцины на основе вирусов
Существует ряд противораковых вакцин на основе вирусов, доступных или разрабатываемых, которые могут использоваться в комбинированном терапевтическом подходе вместе с композициями настоящего изобретения. Одним из преимуществ таких вирусных векторов является присущая им способность инициировать иммунные ответы, вместе с воспалительными реакциями, возникающими в результате вирусной инфекции, вызывающей сигнал опасности, необходимый для активации иммунитета. Идеальный вирусный вектор должен быть безопасным и не должен индуцировать иммунный ответ против вектора, чтобы создать возможность для стимулирования специфических противоопухолевых ответов. Рекомбинантные вирусы, такие как вирусы коровьей оспы, вирусы простого герпеса, аденовирусы, адено-ассоциированные вирусы, ретровирусы и авипоксвирусы используются на животных опухолевых моделях, и, исходя из их обнадеживающих результатов, проводятся клинические испытания на человеке. Особенно важными вакцинами на основе вирусов являются вирусоподобные частицы (VLP), небольшие частицы, содержащие некоторые белки из внешней оболочки вируса. Вирусоподобные частицы не содержат какого-либо генетического материала из вируса и не могут вызвать инфицирование, однако они могут быть сконструированы так, чтобы на их оболочке присутствовал опухолевый антиген. VLP могут быть получены из различных вирусов, например, таких как вирус гепатита В или других семейств вирусов, включая Parvoviridae (например, адено-ассоциированный вирус), Retroviridae (например, HIV) и Flaviviridae (например, вирус гепатита С). Обзор смотри в Sorensen and Thompsen 2007: Virus-based immunotherapy of cancer: what do we know and where are we going? APMIS 115(11): 1177-93; обзор вирусоподобных частиц против рака представлен в Buonaguro et al. 2011: Developments in virus-like particle-based vaccines for infectious diseases and cancer. Expert Rev Vaccines 10(11):1569-83; и в  et al. 2010: Virus-like particles as vaccine antigens and adjuvants: application to chronic disease, cancer immunotherapy and infectious disease preventive strategies. Procedia in Vaccinology 2(2), 128-133.
et al. 2010: Virus-like particles as vaccine antigens and adjuvants: application to chronic disease, cancer immunotherapy and infectious disease preventive strategies. Procedia in Vaccinology 2(2), 128-133.
12. Мультиэпитопные стратегии
Использование множества эпитопов демонстрирует обнадеживающие результаты в отношении вакцинации. Технологии быстрого секвенирования в комбинации с системами интеллектуальных алгоритмов предоставляют возможность использования tumor mutanome и могут обеспечить мультиэпитопы для персонализированных вакцин, которые могут сочетаться с настоящим изобретением. Для получения дополнительной информации смотри 2007: Vaccination of metastatic colorectal patient with cancers with matured dendritic cells loaded with multiple major histocompatibility complex class I peptides. J Immunother 30: 762-772; furthermore Castle et al. 2012: Exploiting the mutanome for rumor vaccination. Cancer Res 72(5):1081-91.
13. Адоптивный Т-клеточный перенос
Например, комбинация вакцинации опухолевого антигена и Т-клеточного переноса описана в: Rapoport et al. 2011: Combination immunotherapy using adoptive T-cell transfer and tumor antigen vaccination on the basis of hTERT and survivin after ASCT for myeloma. Blood 117(3):788-97.
14. Таргентная терапия на основе пептидов
Пептиды могут связываться с рецепторами клеточной поверхности или затронутым внеклеточным матриксом, окружающим опухоль. Радионуклиды, присоединенные к этим пептидам (например, RGDs), в конечном итоге убивают раковую клетку, если нуклид распадается поблизости от клетки. Большой интерес, в частности, представляют олиго- или мультимеры этих связывающих мотивов, поскольку это может приводить к повышенной опухолевой специфичности и авидности. Неограничивающие примеры смотри в Yamada 2011: Peptide-based cancer vaccine therapy for prostate cancer, bladder cancer, and malignant glioma. Nihon Rinsho 69(9): 1657-61.
15. Другие виды терапии
Существуют многочисленные другие виды терапии рака, которые можно комбинировать с настоящим изобретением с целью получения синергетических эффектов. Неограничивающими примерами являются методы лечения, направленные на индукцию апоптоза, гипертермия, гормональная терапия, терапия теломеразой, терапия, усиленная инсулином, генная терапия и фотодинамическая терапия.
Для обнаружения и/или определения количества клеток, экспрессирующих CLDN6, могут использоваться различные методы, известные в данной области техники.
Например, для обнаружения экспрессии белка CLDN6 в клетках или на клеточной поверхности можно использовать иммуноанализ. Согласно настоящему изобретению иммуноанализы включают, но не ограничиваются этим, вестерн-блоттинг, иммуногистохимию, радиоиммуноанализы, твердофазный иммуноферментный анализ (ELISA), "сэндвич" иммуноанализы, анализы иммунопреципитации, реакции преципитации, реакции диффузной преципитации в геле, иммунодиффузные анализы, реакции агглютинации, реакции связывания комплемента, количественный радиоиммунный анализ, флуоресцентные иммуноанализы, иммунофлуоресценция, иммуноанализы белка А, проточная цитометрия или FACS-анализ.
В одном варианте осуществления клетки связываются с одним или более мечеными антителами, обладающими способностью связываться с CLDN6, до обнаружения и/или определения количества.
Альтернативно, может быть обнаружена экспрессия мРНК CLDN6 или может быть определено количество мРНК CLDN6, для того, чтобы обнаружить и/или определить количество клеток, экспрессирующих CLDN6.
В некоторых вариантах осуществления изобретения, образцом, полученным от пациента, для обнаружения и/или определения количества клеток, экспрессирующих CLDN6, является биологическая жидкость, включая, но без ограничения, кровь, костный мозг, сыворотку, мочу или интерстициальную жидкость. В других вариантах осуществления образец, полученный от пациента, является образцом ткани (например, материалом, полученным при проведении биопсии от субъекта, имеющего злокачественное новообразование, или с подозрением на рак). Наиболее предпочтительно, образец является образцом опухоли, полученным с помощью биопсии.
В соответствии с методами изобретения образец может быть биологическим образцом, который подвергается одной или более предварительным стадиям обработки до обнаружения и/или определения количества клеток, экспрессирующих CLDN6. В некоторых вариантах осуществления биологическая жидкость подвергается предварительной обработке центрифугированием, фильтрованием, преципитацией, диализу или хроматографии или комбинацией таких предварительных стадий. В других вариантах осуществления образец ткани подвергается предварительной обработке путем заморозки, химической фиксации, заливки в парафин, дегидратации, пермеабиализации или гомогенизации с последующим центрифугированием, фильтрованием, преципитацией, диализом или хроматографией или комбинацией таких предварительных стадий.
Количество раковых стволовых клеток в образце может быть выражено в виде процента, например, от всех клеток или всех раковых клеток в образце, или может быть произведен количественный анализ относительно площади (например, количество клеток в поле зрения), объема (например, клеток на мл) или веса ((например, клеток на мл).
Количество раковых стволовых клеток в тестируемом образце можно сравнить с количеством раковых стволовых клеток в (а) контрольном образце(ах). В одном варианте осуществления контрольным образцом является образец, полученный от субъекта, подвергнутого терапии в предшествующий момент времени (например, до получения терапии в качестве исходного контрольного образца или в предшествующий момент времени одновременно с получением терапии). В этом варианте осуществления терапия желательно приводит к уменьшению количества раковых стволовых клеток в тестируемом образце по сравнению с контрольным образцом. В другом варианте осуществления контрольный образец получают от здорового субъекта, у которого рак не обнаружен, или от пациента, у которого наблюдается ремиссия рака такого же типа. В этом варианте осуществления в результате лечения желательно получают тестируемый образец, содержащий равное или меньшее, количество раковых стволовых клеток, чем количество раковых стволовых клеток в контрольном образце. В отдельном варианте осуществления стабилизация или уменьшение количества раковых стволовых клеток относительно ранее установленного количества раковых стволовых клеток у субъекта указывает на улучшение прогноза для субъекта или положительный ответ на терапию, в то время как увеличение относительно ранее установленного количества раковых стволовых клеток указывает на тот же самый или худший прогноз и/или отсутствие ответа на терапию.
В некоторых вариантах осуществления для того, чтобы определить количество раковых стволовых клеток в образце, используется комбинация маркеров клеточной поверхности, например, CLDN6 в сочетании с другими маркерами, типичными для раковых стволовых клеток.
Настоящее изобретение также предоставляет набор, содержащий один или более контейнеров, заполненных реагентами, предназначенными для обнаружения, определения количества или мониторинга клеток, экспрессирующих CLDN6. В одном варианте осуществления набор необязательно содержит инструкции, касающиеся применения реагентов, предназначенных для определения раковых стволовых клеток или мониторинга эффективности противоопухолевой терапии путем обнаружения и/или определения количества клеток, экспрессирующих CLDN6, в частности, в отношении использования реагентов в способах изобретения. В одном варианте осуществления набор содержит, средство, которое специфически связывается с белком CLDN6 или CLDN6 мРНК. В некоторых вариантах осуществления данное средство является антителом или фрагментом антитела. В других вариантах осуществления данное средство является нуклеиновой кислотой. Что касается обнаружения нуклеиновой кислоты, наборы обычно содержат (но без ограничения) зонды, специфичные для CLDN6 мРНК. Для проведения количественной ПЦР наборы, как правило, содержат предварительно отобранные праймеры, специфические для последовательностей CLDN6 нуклеиновых кислот. Наборы для проведения количественной ПЦР также могут содержать ферменты, подходящие для амплификации нуклеиновых кислот (например, полимеразы, такие как Taq), дезоксинуклеотиды и буферы, необходимые для реакционной смеси для амплификации, Наборы для проведения количественной ПЦР также могут содержать зонды, специфические для последовательностей CLDN6 нуклеиновых кислот. В некоторых вариантах осуществления наборы для проведения количественной ПЦР также содержат компоненты, подходящие для обратного транскрибирования РНК, включая ферменты (например, обратные транскриптазы) и праймеры для обратной транскрипции вместе с дезоксирибонуклеотидами и буферами, необходимыми для реакции обратной транскрипции.
В некоторых вариантах осуществления средство является меченым обнаружимой меткой. Кроме того, наборы могут содержать инструкции, касающиеся осуществления анализа, и методов интерпретации и анализа данных, полученных в результате проведения исследования.
Исходя из полученных результатов (т.е. присутствуют ли раковые стволовые клетки, или является ли стабильным или уменьшенным количество раковых стволовых клеток), практикующий врач может выбрать ту или иную терапию рака, например, терапию рака, направленную против раковых стволовых клеток, или может продолжать данную терапию. Альтернативно, исходя из того результата, что раковые стволовые клетки отсутствуют или их количество не увеличилось, практикующий врач может выбрать применение терапии рака, не направленной против раковых стволовых клеток, или продолжить, изменить или прекратить терапию.
В некоторых вариантах осуществления настоящего изобретения, если уменьшение популяции раковых стволовых клеток было определено как недостаточное после сравнения популяции раковых стволовых клеток в образце, полученном от пациента, подвергнутого терапии рака, с образцом, полученным ранее от пациента, тогда у практикующего врача имеется некоторое количество вариантов для корректировки лечения. Например, практикующий врач далее может увеличить дозировку противоопухолевой терапии, частоту введения, продолжительность введения или любые их комбинации. В отдельном варианте осуществления после проведения исследования может быть проведено дополнительное лечение рака у пациента или вместо первой терапии или в комбинации с первым видом лечения.
В некоторых других вариантах осуществления, если уменьшение популяции раковых стволовых клеток было определено как приемлемое после сравнения популяции раковых стволовых клеток в образце, полученном от пациента, подвергнутого противоопухолевой терапии, с образцом, полученным ранее от пациента, тогда практикующий врач может отказаться от корректировки терапии. Например, практикующий врач может отказаться от увеличения дозировки противоопухолевой терапии, частоты введения, продолжительности введения или любой их комбинации. Кроме того, практикующий врач может назначить дополнительную терапию или сочетание видов лечения.
Настоящее изобретение дополнительно проиллюстрировано с помощью следующих далее примеров, которые не должны трактоваться как ограничивающие рамки изобретения.
Примеры
Пример 1. CLDN6 экспрессируется на поверхности человеческих индуцированных плюрипотентных стволовых клеток
Чтобы проверить, экспрессируется ли CLDN6 в человеческих индуцированных плюрипотентных стволовых клетках (iPSC), анализировали экспрессию транскриптов CLDN6 в неонатальных HFF (фибробласты крайней плоти человека, System Bioscience) в некоторых временных точках в ходе лечения с использованием смеси для репрограммирования (немодифицированная смесь OSKMNL+EBK+miR; состоящая из in vitro транскрибированной (IVT) РНК OSKMNL = транскрипционных факторов ОСТ4, SOX2, KLF4, cMYC, NANOG и LIN28, IVT-RNA EBK = IFN-escape белков Е3, K3 и B18R и miRNA смеси, состоящей из miR-302a/b/c/d и 367; согласно протоколу, описанному в РСТ/ЕР2012/04673 или ложно-трансфицированных HFFs (без РНК контроля) с помощью количественной ПЦР в реальном времени (qRT-PCR) с использованием секвенатора ABI PRISM 7300 и компьютерного обеспечения (Applied Biosystems) с использованием набора QuantiTect SYBR green Kit (Qiagen)). Клетки культивировали в бессывороточной среде Nutristem (Stemgent, Cambridge (MA)) с добавлением 10 нг/мл bFGF и 0,5 мкМ Thiazovivin. Смесь для репрограммирования была трансфицирована с помощью Lipofectamine RNAiMAX (Life Technologies) в дни 1, 2, 3, 4, 8, 9, 10 и 11 эксперимента. В качестве контроля клетки обрабатывали только Lipofectamine RNAiMAX (без РНК контроля). Мы обнаружили явное почти 6000-кратное увеличение экспрессии CLDN6 по сравнению с необработанными HFF на 19 день после обработки, причем на 12 день после обработки мы наблюдали приблизительно 2000-кратное увеличение экспрессии CLDN6 (фигура 1). Таким образом, CLDN6 экспрессируется в человеческих индуцированных плюрипотентных стволовых клетках (iPSC).
Для проверки наличия экспрессии CLDN6 на клеточной поверхности iPSC использовали проточную цитометрию. Учитывая тот факт, что iPSC растут на фидерных клетках HFF, мы объединили данный анализ с окрашиванием SSEA-4, общепринятым маркером стволовых клеток, чтобы удостовериться в том, что возможно специфическое обнаружение iPSCs. С этой целью, клетки HFF, обработанные смесью для репрограммирования или ложным контролем (без РНК), собирали надень 5, 12 и 19 после лечения и окрашивали 1 мкг/мл CLDN6-специфическими IMAB027-AF647 и 2 мкл SSEA-4 антител в течение 30 минут при 4°С, поверхностную экспрессию анализировали с помощью проточной цитометрии. В протокол окрашивания также был включен краситель для оценки жизнеспособности Viability Dye 7-AAD с целью исключения мертвых клеток из наших анализов. Эксперимент был проведен два раза, с каждого образца было зарегистрировано 50,000 событий с использованием жидкостного цитометра BD Canto II. Анализ зарегистрированных клеток проводили с использованием программного обеспечения FlowJo Software, характерные точечные диаграммы показаны на фигуре 2.
На 5 день CLDN6 не был обнаружен на поверхности HFF, как при использовании смеси для репрограммирования, так и без нее. Неожиданно мы обнаружили, что SSEA-4 экспрессируется на 15% HFF, независимо от того, была ли использована смесь для репрограммирования или нет. Это можно отнести за счет того факта, что использованные HFF являются неонатальными фибробластами и возможно, что эти клетки сохраняют некоторую позитивность в отношении SSEA-4. На 12 день после обработки около 63% обработанных HFF являются позитивными в отношении SSEA-4, кроме того мы обнаружили CLDN6-SSEA-4 двойную положительную фракцию примерно около 15%. На 15 день после обработки 15% обработанных HFF являются позитивными по CLDN6 и SSEA-4, представляя отдельную субпопуляцию. Предполагается, что CLDN6-SSEA-4 позитивная субпопуляция маркирует (отличает) только iPSC, тогда как CLDN6-SSEA-4 негативная субпопуляция рассматривается как HFF фидерные клетки или нерепрограммируемые клетки, a SSEA-4 отдельные положительные клетки представляют собой клетки, находящиеся в начале репрограммирования.
Было обнаружено, что 15% HFF клеток являются позитивными по SSEA-4, но не по CLDN6, можно предположить, что CLDN6 представляет собой более специфический маркер для человеческих iPSC, чем SSEA-4. SSEA-4 также экспрессируется в неонатальных HFF, в то время как CLDN6, по-видимому, специфически экспрессируется только в полностью репрограммированных HFF клетках, которые представляют фракцию iPSC.
Таким образом, CLDN6 специфически экспрессируется на поверхности человеческих iPSC.
Пример 2. CLDN6 имеет важное значение для колониеобразования клеток рака яичника
Анализ колониеобразования является эффективным способом исследования CSC-подобных свойств опухолевых клеток. С помощью этого анализа можно легко проверить способность к самообновлению и потенциальную возможность образования опухоли отдельными опухолевыми клетками. Чтобы проанализировать, играет ли CLDN6 роль в образовании опухоли, мы выбрали, с одной стороны, COV318, клеточную линию рака яичника, которая демонстрирует только субпопуляцию CLDN6-положительных клеток, и с другой стороны, РА-1, однородную экспрессирующую CLDN6 линию клеток, несущих стабильную лентивирусную короткую шпилечную РНК (shRNA), преобразованную нокаутом CLDN6 (клоны РА-1 50, РА-1 54); см. фигура 3.
Клетки окрашивали на CLDN6 с помощью 1 мкг/мл IMAB027-AF647 в течение 30 минут при 4°С и после этого сортировали с помощью FACS (сортировка флуоресцентно-активированных клеток), используя сортер клеток BD FACSAria, по экспрессии CLDN6. 500 (РА-1 50, РА-1 54) или 700 (COV318) клеток CLDN6-положительной или CLDN6-отрицательной субпопуляции сортировали непосредственно в лунках, 6-луночных планшетов, а затем давали клеткам возможность расти в течение 14 дней, до тех пор, пока не образовывалось достаточное количество колоний. Культуральную среду меняли два раза в неделю. Колонии окрашивали и фиксировали 0,5% кристаллическим фиолетовым в 10% этаноле в течение 20 минут, три раза промывали дистиллированной водой и высушивали на воздухе. Делали снимки и подсчитывали количество колоний «вручную». Колонией считалось, по меньшей мере, 50 клеток. На фигуре 4 показано характерное колониеобразование COV318 и CLDN6-нокаутных линий клеток РА-1 50 и 54.
Весьма любопытен тот факт, что CLDN6-отрицательные клетки демонстрируют значительно более низкую способность к колониеобразованию по сравнению с CLDN6-положительными клетками в обеих линиях клеток. На основании этих результатов, мы делаем вывод, что GLDN6 играет важную роль в способности к колониеобразованию, что является основным признаком раковых стволовых клеток.
Пример 3. CLDN6 коэкспрессируется с CSC маркерами CD24, CD90 и CD44 в клеточной линии рака яичника
Использование профилей экспрессии специфических поверхностных маркеров - общепринятая стратегия идентификации и изолирования CSCs из солидных опухолей и клеточных линий. Поверхностные маркеры, согласно литературе используемые для изолирования CSCs из рака яичника, включают CD44, CD24, CD90, CD34, CD117 и CD133. Для того чтобы проанализировать, можем ли мы идентифицировать CSC субпопуляции в клеточных линиях рака яичника, которые содержат небольшую субпопуляцию CLDN6-положительных клеток, мы составили FACS панель, содержащую антитела против этих поверхностных маркеров (Таблица 1). Кроме того, мы также включили антитело для обнаружения CLDN6 в панели, чтобы исследовать процентное соотношение колокализации CLDN6 с надежно установленными CSC-маркерами, тем самым оценивая потенциальную возможность CLDN6 служить в качестве маркера для CSCs. Для этой цели, 1Е6 клетки клеточной линии COV318 окрашивали в течение 30 минут при 4°С указанными количествами антител (смотри Таблицу 1), после чего клетки анализировали с помощью проточной цитометрии в отношения профиля экспрессии поверхностных маркеров. В протокол окрашивания также был включен краситель на жизнеспособность eFluor®506, для того, чтобы исключить мертвые клетки из наших анализов. Эксперимент был проведен трижды, с каждого образца было зарегистрировано 50,000 событий с использованием жидкостного цитометра BD Canto II. Анализ зарегистрированных клеток проводили с использованием программного обеспечения FlowJo Software.
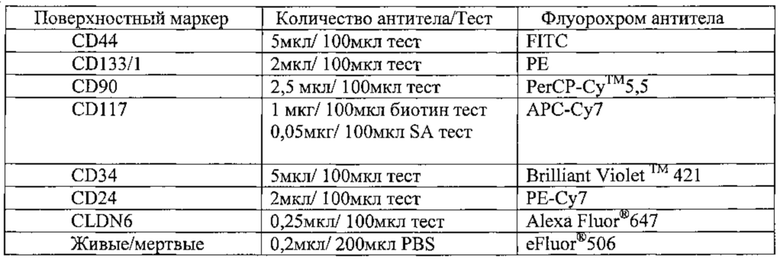
Таблица 1. FACS-панель CSC. Представлена FACS-панель, использованная для анализа CSC маркера и экспрессии CLDN6 в клеточной линии рака яичника. Перечислены количества антител, использованные для соответствующих маркеров, и соответствующие флуорохромы.
FACS-анализ подтвердил, что COV318 клетки экспрессируют субпопуляции CSC маркеров CD44, CD90 и CD24, и что CLDN6 колокализируется, по меньшей мере, частично со всеми тремя маркерами (фигура 5А). Затем мы использовали различные стратегии «гейтирования» для подсчета процентного соотношения колокализации всех четырех маркеров. Во-первых, мы подсчитали процент CD44, CD24, CD90 и CLDN6 положительных клеток во всей популяции жизнеспособных клеток. Мы обнаружили, что 0,18% жизнеспособных клеток являются положительными по отношению ко всем четырем маркерам. Затем, мы подсчитали процент CD44, CD24 и CD90 положительных клеток в популяции жизнеспособных клеток, которые представляют CSC фракцию. Мы обнаружили, что 0,23% клеток являются положительными по всем трем маркерам при определении в отношении всей популяции жизнеспособных клеток, тогда как в том случае, когда они ставятся в соотношение с CLDN6-положительной субпопуляцией, мы обнаружили, что фракция 20,1% клеток является трижды положительной, показывая 87-кратную концентрацию трех маркеров в CLDN6-положительной субфракции. На последнем этапе мы подсчитали процент CLDN6-положительных клеток с одной стороны во всей популяции жизнеспособных клеток и с другой стороны в CD44/CD24/CD90 позитивной субпопуляции. Мы обнаружили, что концентрация CLDN6-экспрессирующих клеток составляет от 0,91% во всей клеточной популяции до 66,87% в CSC фракции, показывая 74-кратное увеличение (фигура 5В).
Вместе взятые, эти данные показывают, что CLDN6 накапливается в CSC фракции и наоборот CSC маркеры присутствуют в обогащенном количестве в CLDN6-положительной субпопуляции. Эти результаты показывают, что CLDN6 является маркером CSCs.
Пример 4. Обогащение CLDN6-экспрессирующих клеток приводит к накоплению общепринятых CSC маркеров CD44, CD24 и CD90
Было показано, что изолированные из клеточных линий и опухолей CSC-фракции часто являются обогащенными CSC маркерами, такими как CD44 и CD24. Чтобы проанализировать потенциальную возможность CLDN6 служить в качестве нового маркера CSCs, мы исследовали, приводит ли изолирование клеток CLDN6-положительных фракций из основной массы клеток к накоплению общепринятых овариальных CSC маркеров.
Для этой цели клетки COV318 окрашивали 0,5 мкг/мл IMAB027 в течение 30 минут при 4°C с последующей инкубацией с козьими вторичными антителами к IgG человека (1:300) в течение 10 минут при 4°С, после этого из COV318 клеток были выделены CLDN6-положительные и CLDN6-отрицательные клеточные фракции с помощью FACS сортировки с использованием клеточного сортера BD FACSAria. Затем отобранные клетки размножались в течение 10 дней в стандартных условиях для роста. 1Е6 клетки двух субпопуляций окрашивали в отношении CSC маркеров CD44, CD24, CD90, CD34, CD117 и CD133 в течение 30 минут при 4°С (детали смотри в Таблице 1) и анализировали профиль экспрессии их поверхностных маркеров с помощью проточной цитометрии. Для каждого образца регистрировали 50,000 событий с использованием проточного цитометра BD Canto II Flow Cytometer, анализ учитываемых клеток проводили, используя программное обеспечение FlowJo Software.
FACS-анализ показал, что около 50% клеток CLDN6-положительной отобранной фракции остаются положительными по CLDN6 после культивирования в стандартных условиях в течение 10 дней, тогда как CLDN6-отрицательные отобранные клетки - полностью отрицательными по CLDN6. Важно отметить, что мы обнаружили, что CLDN6-положительная фракция демонстрировала накопление CSC маркеров CD44, CD24 и CD90 по сравнению с CLDN6-отрицательной клеточной фракцией COV318 клеток. Характерные точечные диаграммы различных образцов показаны на фигуре 6А. Дополнительная количественная оценка уровней экспрессии этих маркеров показала 99-кратное обогащение CD44, 8-кратное обогащение CD90 и 33-кратное обогащение CD24 при сравнении CLDN6-положительной и CLDN6-отрицательной субпопуляций (фигура 6В).
Эти результаты показывают, что CLDN6 может использоваться в качестве селективного маркера для отделения CSC фракций от основной массы клеток, показывая, что CLDN6 является новым CSC маркером.
Пример 5. Линии клеток с высокой экспрессией CLDN6 демонстрируют обогащение CSC маркеров по сравнению с клетками с низкой экспрессией CLDN6
Было показано, что CLDN6 высоко экспрессируется в эмбрионально-клеточных опухолях, аденокарциномах яичника и некоторых видах рака с примитивным фенотипом. В случае, когда CLDN6 является CSC маркером, мы могли ожидать накопления клеток с CSC-подобными характеристиками в подобных клеточных линиях или опухолях и таким образом накопления положительных клеток по CSC маркеру.
Мы исследовали четыре линии клеток, высоко экспрессирующих CLDN6, клеточные линии карциномы яичника OV90 и РА-1 и клеточные линии карциномы яичка NEC-8 и NEC-14, в отношении уровней экспрессии общепринятых CSC маркеров. Для этой цели клетки 1Е6 каждой клеточной линии окрашивали на наличие поверхностных маркеров CD44, CD24, CD90, CD34, CD117 и CD133, а также CLDN6 в течение 30 минут при 4°С (подробности см. в таблице 1), после этого анализировали профили экспрессии в клетках с помощью проточной цитометрии. Эксперименты проводили по три раза. Для каждого образца регистрировали 50,000 событий с использованием проточного цитометра BD Canto II Flow Cytometer, анализ учитываемых клеток проводили, используя программное обеспечение FlowJo Software. Мертвые клетки были исключены из анализа путем Окрашивания жизнеспособных клеток красителем eFluor®506. Характерные точечные диаграммы для каждого образца показаны на фигуре 7.
FACS анализы подтвердили, что все изученные клеточные линии приблизительно на 95% являются положительными по CLDN6. Как и ожидалось, эти высоко экспрессирующие CLDN6 клеточные линии кроме CLDN6 также демонстрируют накопление общепринятых CSC маркеров, причем OV90 клетки показывают высокую экспрессию CD44, CD133, CD24 и CD117, РА-1 клетки показывают высокую экспрессию CD44, CD133, CD90 и CD117, a NEC-8 и NEC-14 клетки показывают повышенные уровни экспрессии маркеров CD133, CD90, CD24 и CD117.
Эти результаты показывают, что высоко экспрессирующие CLDN6 клеточные линии обогащены CSC-подобными клетками, и дополнительно подтверждают, что CLDN6 является CSC маркером.
Пример 6. Лечение развитых человеческих ксенотрансплантантных опухолей комбинацией антител к CLDN6 и химиотерапевтических средств синергетически ингибирует рост опухолевых клеток и увеличивает выживаемость
Мышам Hsd:Athymic Nude-Foxn1nu были перевиты линии клеток рака человека. После того как опухоли сформировались, мышей-опухоленосителей разделили на группы и вводили им CLDN6-специфические моноклональные антитела (IMAB027), химиотерапевтическое средство или их комбинацию. Контрольной группе вводили буфер (разбавитель в качестве контроля).
В частности, для исследования лечения человеческих ES-2(CLDN6) ксенотрансплантантных опухолей, клеточную линию карциномы яичника человека ES-2, стабильно трансфицированную человеческим CLDN6, культивировали в минимальной поддерживающей среде (Life Technologies), содержащей раствор 1 × заменимых аминокислот (Life Technologies), 700 мкг/мл G418 (Life Technologies) и 10% FCS (Life Technologies) при 37°С во влажном инкубаторе с содержанием 5% СО2. Самкам 6-недельного Hsd:Athymic Nude-Foxn1nu мышей подкожно (в бок) инокулировали клетки 5×106 ES-2(CLDN6) клеток в 200 мкл PBS. На 3 день после подкожной инокуляции опухоли мышам вводили или физраствор (контроль), антитело или химиотерапевтическое средство (в виде монотерапии) и комбинацию антитело/цитостатическое средство терапевтическим группам (n=12 на группу), 15 мг/кг паклитакселя или физраствора (контроль) вводили на день 3, 10 и 17 после трансплантации клеток. Поддерживающее лечение антителом начинали на 4 день и вводили 3 раза в неделю 35 мг/кг IMAB027 или разбавитель (контроль) (IMAB027 буфер) в виде болюсных инъекций (чередуя i.v./i.p./i.p.). Опухолевую массу и состояние здоровья регистрировали два раза в неделю. Мышей умерщвляли, когда опухоли достигали объема максимум 1400 мм3 или когда появлялось изъязвление опухолей. Ингибирование роста опухоли анализировали с помощью критерия Краскела-Уоллеса и апостериорного критерия множественного сравнения Данна.
Для исследования лечения развитых человеческих NEC14 ксенотрансплантантных опухолей линию опухоли половых клеток яичка человека NEC14 культивировали согласно инструкциям поставщика в среде RPMI 1640 GlutaMAX™ (Life Technologies), содержащей 10% FCS (Life Technologies) при 37°C во влажном инкубаторе с содержанием 5% СО2. Самкам Hsd:Athymic Nude-Foxn1nu мышей 6-8-недельного возраста подкожно (в бок) инокулировали клетки 2×107 NEC14 клеток в 200 мкл PBS. При изучении лечения развитых опухолей опухоли вырастали до объема 50-150 мм3, затем до начала лечения мышей делили на группы - контроль, антитело или цитостатическое средство в виде монотерапии и антитело/цитостатическое средство в виде комбинированной терапии (n=19 на группу). Через 6 дней после перевивки клеток лекарственные средства по отдельности или в комбинации или разбавитель (физраствор) в качестве контроля вводили, как описано далее: цисплатин 1 мг/кг болюсные i.p. инъекции на 6, 7, 8, 9 и 10 дни; карбоплатин 30 мг/кг болюсные i.p. инъекции на 6, 13 и 20 дни и поддерживающее лечение антителами три раза в неделю 35 мг/кг IMAB027 или контроль-разбавитель (IMAB027 буфер) болюсные инъекции (чередуя i.v./i.p./i.p.). Опухолевую массу и регистрировали два раза в неделю. Мышей умерщвляли, когда опухоли достигали объема максимум 1400 мм3 или когда появлялось изъязвление опухолей. Ингибирование роста опухоли анализировали с помощью критерия Краскела-Уоллеса и апостериорного критерия множественного сравнения Данна.
По сравнению с контрольной группой лечение человеческих ES-2(CLDN6) ксенотрансплантантных опухолей, эктопически экспрессирующих человеческий CLDN6, паклитакселем является неэффективным и не обладает противоопухолевой активностью. В противоположность этому, IMAB027 ингибирует рост опухоли и увеличивает продолжительность жизни мышей. Лечение комбинацией IMAB027 и паклитакселя синергетическим образом ингибирует опухолевый рост (фигура 8).
Более того, и цисплатин и IMAB027 в качестве отдельных средств способны значительно уменьшать рост опухоли у животных с опухолью NEC14. Однако после первоначального ингибирования роста опухолей мы наблюдали рецидивирующий рост опухоли у большинства животных. При использовании в комбинированной терапии цисплатин и IMAB027 действуют синергетическим образом и не только ингибируют рост опухоли, но вызывают полную ремиссию опухоли NEC14. Показатели выживаемости наиболее впечатляющим образом показывают терапевтическую эффективность IMAB027 в комбинации с цисплатином. По сравнению с применением отдельных средств почти все мыши, леченые IMAB027 в сочетании с цисплатином, остаются живыми в течение 90 дней после трансплантации опухоли (фигура 9).
При лечении мышей-опухоленосителей с развитыми NEC14 ксенотрансплантантными опухолями другие производные платины, такие как карбоплатин, продемонстрировали только весьма умеренную противоопухолевую эффективность. Тем не менее, комбинация карбоплатина с IMAB027 дает в результате синергетические эффекты ингибирования опухолей, принимая во внимание высокоэффективное ингибирование опухолевого роста и продление срока выживаемости (фигура 10).
Таким образом, комбинация CLDN6-специфического антитела с химиотерапевтическими средствами увеличивает ингибирование опухолевого роста и увеличивает продолжительность жизни мышей с перевитыми клетками опухолей человека. Комбинация антитела с химиотерапевтическими средствами вызывает синергетическое действие в отношении ингибирования роста опухолевых клеток и увеличения выживаемости.
Пример 7. CLDN6 является маркером CSC
Пример 7.1. CLDN6 имеет важное значение для способности образовывать сферы клеток рака яичника
Другим эффективным способом исследования CSC-подобных свойств опухолевых клеток является анализ сферообразования. С помощью этого анализа можно легко проверить способность клеток к свободному росту, характерному признаку CSCs. Чтобы проанализировать, играет ли роль CLDN6 в свободном росте опухолевых клеток, мы выбрали клетки COV318, клеточная линия рака яичника, которая содержит субпопуляцию CLDN6-положительных клеток. COV318 клетки были отсортированы относительно экспрессии CLDN6, при этом и CLDN6-положительным и отрицательным клеточным популяциям была предоставлена возможность образовывать сферы в течение 21 дня при условиях, специфических для стволовых клеток. Анализ сферообразования показал, что CLDN6-положительные COV318-клетки продемонстрировали способность образовывать сферы при культивировании в специфических для стволовых клеток условиях, в то время как CLDN6-отрицательные клетки почти полностью погибли (фигура 11А). Эти результаты показывают, что CLDN6-положительная фракция представляет собой обогащенную популяцию стволовых клеток, которая проявляет способность к свободному росту.
Для того, чтобы определить способность CLDN6-положительных COV318 клеток проходить через многочисленные циклы клеточного деления, сохраняя свое недифференцированное состояние, мы исследовали «способность» сфер продуцировать второе поколение сфер. Для этой цели сферы первого поколения CLDN6-положительных COV318 клеток (22 день после посева) диссоциировали на отдельные клетки, которые были посеяны вновь. Через 23 дня после повторного высевания мы могли ясно видеть, что формируется второе поколение сфер, причем эти вновь образованные сферы были морфологически более однородными, чем исходные сферы первого поколения (фигура 11В). Эти наблюдения дополнительно подтвердили, что CLDN6-положительная фракция COV318 клеток представляет фракцию стволовых клеток этой клеточной линии.
Взятые вместе, эти результаты явно показывают, что CLDN6 играет большую роль в свободном росте клеток рака яичника, что является основным признаком раковых стволовых клеток.
Пример 7.2. Обогащение CLDN6-положительных COV318 клеток после обработки химиотерапевтическими средствами in vitro
Клеточная линия рака яичника COV318 демонстрирует неоднородную экспрессию CLDN6, причем CLDN6 экспрессирует очень маленькая субпопуляция клеток (~0,3-0,5%). Обработка COV318 клеток производными платины in vitro дает в каждом случае оставшуюся клеточную популяцию с высоким процентом (>2%) CLDN6-положительных клеток (фигура 12). Специфическое накопление CLDN6-положительных клеток после лечения показывает, что эти клетки могут иметь преимущество селективной выживаемости или роста в течение химиотерапии. Резистентность к традиционной химиотерапии является признаком CSCs.
Пример 7.3. Обогащение CLDN6-положительных COV318 клеток in vivo
В более ранних исследованиях мы обнаружили, что COV318 клетки, подкожно введенные в бок бестимусных «голых» мышей, являются слабоканцерогенными. В противоположность этому, у мышей, получивших COV318 клетки путем внутрибрюшинной инъекции, развиваются злокачественные асциты и брюшинные опухоли в пределах более 100 дней. В противоположность родительским COV318 клеткам (фигура 13А), большинство клеток, выделенных из асцитов и опухолей, были CLDN6-положительными (фигура 13В, верхняя панель). Клетки COV318 снова утратили экспрессию CLDN6 in vitro после того, как их культивировали в стандартных условиях (фигура 13В, нижняя панель). Это означает, что CLDN6-положительные клетки COV318 обладают большей способностью к образованию опухолей, показывая, что маленькая CLDN6-положительная субпопуляция содержит CSCs.
Пример 7.4. CLDN6 коррелирует с маркерами стволовых клеток рака яичника в образцах первичных опухолей
Наши предыдущие исследования показали, что CLDN6 колокализуется с некоторыми CSC маркерами в клеточных линиях рака яичника, далее встал вопрос, коррелирует ли экспрессия CLDN6 также с CSC маркерами в образцах первичных опухолей, полученных от пациентов с раком яичника.
С этой целью экспрессия мРНК CLDN6 и выбранных маркеров, описанных в литературе как специфические маркеры при раке яичника (CTCFL, LIN28B, CD24, GNL3, ЕрСАМ, CD44, ABCG2, ALDH1A1, AMACR, ATXN1, BMI1, ВМР4, CD34, CD117, Myd88, Nanog, Notch 1, Pou5F1, CD133, Snail, Sox 2), была проанализирована в 42 образцах рака яичника человека с помощью qRT-ПЦР. Последующий корреляционный анализ CLDN6 с этими маркерами проводили с использованием коэффициента корреляции Спирмена. Диаграмма рассеяния значимых корреляций, а также краткое изложение всех корреляций показаны на фигуре 14.
Положительная корреляция была обнаружена для CLDN6 с CTCFL, LIN28B, CD24, GNL3 и ЕРСАМ, в то время как было обнаружено, что CD44 отрицательно коррелирует с CLDN6 в исследованных образцах рака яичника (фигура 14А). В отношении всех других исследованных маркеров не было обнаружено значимой корреляции (фигура 14В).
Эти результаты дополнительно подтверждают, что CLDN6 является CSC маркером.
Пример 8. Противоопухолевая активность анти-CLDN6 антител увеличивается при использовании комбинации с химиотерапевтическими средствами
Пример 8.1. Влияние химиотерапевтических средств на опосредованную IMAB027 ADCC
Влияние химиотерапевтических средств на IMAB027-опосредованную ADCC было проанализировано с использованием клеток COV362(Luc), которые были предварительно обработаны карбоплатином, гемцитабином, паклитакселем, доксорубицином и топотеканом, соответственно. Предварительная обработка клеток приводит к повышению уровней CLDN6 на клеточной поверхности, что показано с помощью проточной цитометрии (фигура 15В, D, F, Н и J). По сравнению с необработанными клетками максимальный лизис клеток, обработанных химиотерапевтическими средствами, повышается до 3 раз (фигура 15А, С, F, G и I). Итак, противоопухолевая активность IMAB027 может повышаться при использовании в комбинации с химиотерапевтическими средствами.
Пример 8.2. Комбинация мультихимиотерапии РЕВ (цисплатин, этопозид и блеомицин) с IMAB027 с высокой эффективностью увеличивает ингибирование роста опухолей и увеличивает выживаемость мышей с трансплантированной человеческой опухолевой линией клеток NEC14
Мышам Hsd:Athymic Nude-Foxn1nu были подкожно трансплантированы клетки опухоли половых клеток яичка человека - линия клеток NEC14. Мышей с запущенными опухолями распределяли по группам случайным образом и лечили антителом IMAB027, мультихимиотерапией РЕВ (цисплатин, этопозид и блеомицин) или комбинацией IMAB027 и РЕВ.
По сравнению с мышами, которых не лечили или лечили IMAB027, у мышей, получавших мультихимиотерапию, рост опухоли уменьшался весьма значительно (фигура 16А). Однако, после первоначального ответа на РЕВ-лечение, опухоли у большинства животных начинали расти на 30 день. Продолжительное ингибирование опухолевого роста отмечалось только при использовании комбинированного подхода, при котором РЕВ и IMAB027 вместе действуют синергетически (фигура 16В). Медиана выживаемости у нелеченых мышей составляла 30 дней, тогда как медианы выживаемости у мышей, которых лечили IMAB027 и РЕВ, составляли 34 и 97 дней, соответственно. В группе, которую лечили РЕВ, 3/14 (21%) у мышей наблюдалась полная ремиссия опухолей, а у 1/14 (7%) мышей имелась остаточная опухоль ~30 мм3 в конце исследования. Неожиданно было обнаружено, что полная регрессия опухолей наблюдалась у 12/14 (86%) мышей; которых лечили РЕВ в комбинации с IMAB027. 11 мышей было излечено без признаков рецидива в течение 6 месяцев, и одну мышь, не имеющую опухоли, подвергли эвтаназии на 93 день вследствие плохого общего состояния здоровья (фигура 16С). Исследование показало, что у животных с запущенными человеческими опухолями яичка NEC14, получавших РЕВ в комбинации с IMAB027, наблюдалось существенное увеличение выживаемости и показателя ответной реакции по сравнению с животными, которых лечили мультихимиотерапией в отдельности.
Пример 9. Конъюгаты анти-CLDN6-антител с лекарственными средствами являются высоко эффективными при лечении опухолей, экспрессирующих CLDN6
Пример 9.1. Связывание и противоопухолевая активность токсина, конъюгированного с IMAB027, in vitro
Относительные аффинности связывания конъюгатов 1МАВ027-лекарственное средство IMAB027-DM1 и IMAB027-vcMMAE были изучены на клеточной линии рака яичника OV90 с помощью проточной цитометрии. В эксперименте по насыщению связывания концентрацию антител наносили на график в зависимости от средней величины интенсивности флуоресценции (MFI) и значения ЕС50 (концентрация антител, которые связываются с половиной мест связывания при равновесии), причем максимальное связывание было вычислено с помощью нелинейной регрессии. По сравнению с неконъюгированным IMAB027, оба конъюгата IMAB027-лекарственное средство демонстрировали сходные низкие значения ЕС50, при этом насыщение связывания было достигнуто при низких концентрациях (фигура 17А). Цитотоксическую активность конъюгатов IMAB027 - лекарственное средство определяли при помощи OV90 клеток с использованием ХТТ-анализа пролиферации. Кривая зависимости от дозы показывает сходное, ингибирование роста опухолевых клеток для IMAB027-DM1 и IMAB027-vcMMAE in vitro (фигура 17В). Итак, IMAB027, конъюгированное с DM1 или vcMMAE, связывается со сходной относительной аффинностью с CLDN6-положительными клетками-мишенями, что приводит к эффективному уничтожению опухолевых клеток.
Пример 9.2. Лечение прогрессирующих человеческих ксенотрансплантантных опухолей конъюгированным с токсином антителом к CLDN6 IMAB027 ингибирует рост опухолевых клеток, увеличивает выживаемость и опосредует полную регрессию опухоли
Противоопухолевая активность CLDN6-специфического антитела IMAB027, конъюгированного с цитотоксическим лекарственным средством, была протестирована на мышах, которым были трансплантированы CLDN6-положительные клетки линий карциномы человека. В этом таргентном методе IMAB027 присоединили к майтансиноиду DM1 или ауристатину Е (ММАЕ) и контролировали рост опухоли у бестимусных nude-Foxn1nu мышей с развитыми ксенотрансплантантными опухолями.
Лечение с использованием модели развитой ксенотрансплантантной подкожной OV90 опухоли яичника человека:
Противоопухолевый эффект IMAB027, конъюгированного с токсином, исследовали на мышах с развитыми человеческими ксенотрансплантантными опухолями с гомогенной экспрессией CLDN6. Лечение начинали на 10 день после трансплантации опухолевых клеток. После однократной i.v. болюсной инъекции IMAB027-DM1 и IMAB027-vcMMAE значимо ингибировали опухолевый рост ксенотрансплантатов OV90 карциномы яичника, гомогенно экспрессирующих CLDN6 (фигуры 18 и 19А). Более того, однократное применение 16 мг/кг IMAB027-vcMMAE приводило к полной ремиссии опухолей у 60% леченых мышей (фигура 19В).
Лечение с использованием модели прогрессирующей человеческой подкожной ксенотрансплантантной опухоли яичника РА-1
Противоопухолевый эффект конъюгированного с токсином IMAB027 исследовали также на модели прогрессирующей ксенотрансплантантной опухоли с гетерогенной экспрессией CLDN6. Через некоторый промежуток времени после подкожной трансплантации ксенотрансплантантные опухоли РА-1 утрачивают экспрессию CLDN6 (фигура 20С). Лечение начинали на 15 день. В это время ксенотрансплантантные опухоли РА-1 начинают утрачивать экспрессию CLDN6. Животные получали 4, 8 или 16 мг/кг IMAB027-vcMMAE путем однократной i.v. болюсной инъекции. Контрольным животным вводили неконъюгированное IMAB027 или разбавитель (буфер).
Лечение IMAB027-vcMMAE с высокой значимостью ингибировало рост ксенотрансплантатов РА-1 опухоли и увеличивало выживаемость мышей-опухоленосителей, в то время как IMAB027 или IMAB027-DM1 (данные не показаны) не влияют на опухолевый рост РА-1 (фигура 20А и В),
Пониженный уровень CLDN6-положительных опухолевых клеток в опухолевой массе очевидно обуславливает слабую противоопухолевую активность IMAB027 и IMAB027-DM1 в этой опухолевой модели in vivo. IMAB027-DM1 соединяется посредством нерасщепляемого линкера с токсином DM1, не способным проникать через мембрану. В противоположность этому, IMAB027-vcMMAE соединяется с ММАЕ-токсином, проникающим через мембрану, посредством линкера, расщепляемого катепсином. Высвобождение проникающих через мембрану форм ММАЕ после процессинга в клетке способствует уничтожению опухолевых клеток, лишенных определенного эпитопа (эффект «свидетеля»). Следовательно, лечение с помощью IMAB027-vcMMAE является высокоэффективным для устранения РА-1 опухолей, содержащих как CLDN6-положительные, так и CLDN6-отрицательные клетки.
Итак, IMAB027-vcMMAE является высокоэффективным при уничтожении человеческих ксенотрансплантантных опухолей с гетерогенной экспрессией CLDN6 за счет таргентного активированного клетками уничтожения клеток «свидетелей».
Лечение с использованием модели прогрессирующей человеческой подкожной ксенотрансплантантной опухоли MKN74 желудка
В противоположность ксенотрансплантантным РА-1 опухолям, которые утрачивают экспрессию CLDN6 в развитых опухолях, MKN74 ксенотрансплантантные опухоли увеличивают экспрессию CLDN6. Как показано с помощью проточной цитометрии с использованием CLDN6-специфического антитела IMAB027 <0,3% клеток линии рака желудка MKN74 являются CLDN6-положительными in vitro. Интересно, что значительное количество опухолевых клеток демонстрируют экспрессию CLDN6 после подкожной трансплантации бестимусным голым мышам (фигура 21С). Лечение развитых MKN74 ксенотрансплантантных опухолей 16 мг/кг IMAB027-vcMMAE давало в результате значимое ингибирование опухолевого роста и увеличение выживаемости (фигура 21А и В).
Ингибирование роста опухоли, наблюдаемое при использовании IMAB027-vcMMAE, может быть вызвано таргентным активированным клетками уничтожением клеток «свидетелей».
Лечение с использованием модели прогрессирующей человеческой внутрибрюшинной ксенотрансплантантной опухоли яичника РА-1
В дополнение к лечению подкожных (s.c.) ксенотрансплантантных опухолей противоопухолевая активность конъюгированных с токсином IMAB027 антител также была исследована на ксенотрансплантантной внутрибрюшинной (i.p.) опухолевой модели с использованием РА-1 клеток, эктопически экспрессирующих люциферазу, с целью in vivo мониторинга (фигура 22). Мыши получали 16 мг/кг IMAB027-DM1 или 16 мг/кг IMAB027-vcMMAE с помощью однократной i.v. болюсной инъекции на 14 день после приживления опухолевых клеток.
Измерение интенсивности биолюминесценции in vivo показало ингибирование опухолевого роста брюшинных РА-1 метастазов после лечения IMAB027-DM1. Кроме того, IMAB027-vcMMAE показало значимо более высокий противоопухолевый эффект, чем IMAB027-DM1 или разбавитель, при полной регрессии брюшинных опухолей у 100% животных (фигура 22).
Итак, IMAB027-vcMMAE и IMAB027-DM1 являются высокоэффективными и не демонстрируют токсических побочных эффектов in vivo в проверенном диапазоне концентраций. IMAB027-DM1 значительно ингибировал рост подкожных ксенотрансплантантных опухолей и уменьшал рост перитонеальных ксенотрансплантантных опухолей. IMAB027-vcMMAE высоко значимо ингибировал рост опухоли и увеличивал выживаемость животных с подкожными или перитонеальными ксенотрансплантантными опухолями человека с гомогенной или даже гетерогенной экспрессией CLDN6. Самым впечатляющим является то, что большая часть животных-опухоленосителей была излечена после применения ММАЕ-конъюгированных антител. Заметная противоопухолевая активность IMAB027-vcMMAE, в частности, наблюдаемая у животных-опухоленосителей с гетерогенной экспрессией CLDN6, показала, что конъюгаты IMAB027-vcMMAE пригодны для лечения опухолей с низким процентом CLDN6-положительных клеток.
Пример 9.3. Эндоцитоз CLDN6-специфических антител зависит от их аффинности и эпитопа связывания CLDN6
Цитотоксическая эффективность антител, конъюгированных с токсином, явно зависит от опосредованной мишенью возможности их интернализации. Таким образом, получение антител с высокими уровнями эндоцитоза является основным ключевым фактором при разработке антител, конъюгированных с токсином.
Эффективность эндоцитоза была протестирована in vitro путем инкубации клеток карциномы человека, эндогенно экспрессирующих CLDN6, вместе с CLDN6-активными моноклональными химерными антителами и античеловек Fab-фрагментами, конъюгированными с токсином сапонином. Интернализация комплексов CLDN6-связанное антитело/Fab-сапонин приводит к специфическому уничтожению клеток и может измеряться с использованием анализа жизнеспособности клеток. Скрининг различных CLDN6-активных антител показывает, что эндоцитоз зависит не только от аффинности связывания антитела, но также от эпитопа. Мы обнаружили, что связывание CLDN6-специфических антител с эпитопом в первой внеклеточной петле CLDN6 способствует эндоцитозу в клетках карциномы человека OV-90 и РА-1. Примечательно, что CLDN6-реактивное антитело 5F2D2, которое связывается со сходной или более высокой аффинностью, но с другим эпитопом, демонстрирует более низкий цитотоксический потенциал в этом исследовании (фигура 23).
Пример 10. Материалы и методы, использованные в приведенных выше примерах 7-9
Культура клеток
Клетки COV362(Luc) и РА-1(Luc), стабильно экспрессирующие люминесцентный-ген-репортер, были получены путем стабильной трансфекции клеточных линий COV362 (ЕСАСС, 07071910) и РА-1 (АТСС, CRL-1572) люциферазой светлячка, соответственно.
Клетки NEC14 (JCRB, 0162) и MKN74 (JCRB, 0255) культивировали в среде RPMI1640 (Gibco, 61870-010) с добавлением 10% инактивированной нагреванием FCS (Gibco, 10270-106). Клетки COV318 (ЕСАСС, 07071903) и COV362(Luc) культивировали в среде DMEM (Gibco, 41965-039), содержащей 2 мМ GlutaMAX (Gibco, 35050-038) и 10% инактивированной нагреванием FCS. Клетки РА-1 и PA-1(Luc) культивировали в среде MEM (Gibco, 31095-029) с добавлением 1,5 г/л бикарбоната натрия (Invitrogen, 25080), 1 мМ пирувата натрия (Invitrogen, 11360), 1% заменимых аминокислот (Gibco, 11140-035) и 10% инактивированной нагреванием FCS. Клетки OV90 (АТСС, CRL-11732) культивировали в смеси 1:1 МСВ105 (Sigma, М6395) и среды 199 (Sigma, М4530) с добавлением 1,5 г/л бикарбоната натрия и 15% инактивированной нагреванием FCS. Клетки росли при 37°С и 5% СО2.
Определение экспрессии CLDN6 с помощью проточной цитометрии:
Клетки собирали с помощью 0,05% трипсин/EDTA (Gibco, 25300-054), промывали FACS-буфером (PBS, содержащий 2% FCS (Gibco, 10270-106) и 0,1% азида натрия (Applichem, А1430)) и ресуспендировали в FACS-буфере при концентрации 2×106 клеток/мл. 100 мкл клеточной суспензии инкубировали с анти-CLDN6-антителом IMAB027 или изотипическим контрольным антителом к человеческому IgG1 (Sigma, I5154) при концентрации 2,5 мкг/мл в течение 30 минут при 4°С. Клетки три раза промывали FACS-буфером и инкубировали с АРС-конъюгированным F(ab')2 фрагментом козьего античеловек IgG (Jackson ImmunoResearch, 109-136-170), разведенным 1:200 в FACS буфере в течение 30 минут при 4°С. Клетки два раза промывали и ресуспендировали в FACS-буфере. Связывание анализировали с помощью проточной цитометрии, используя BD FACSArray (BD Biosciences) и компьютерное программное обеспечение FlowJo (Tree Star Inc.). Для исключения из анализа мертвых клеток использовали краситель пропидиум иодид (Sigma, Р4864).
Обработка COV318 клеток платиновыми производными
Клетки COV318 (1,2×106 клеток на 100 мм культуральную чашку) выращивали при стандартных условиях. Через 24 часа клетки обработали 0,5 мкг/мл цисплатина или 2 мкг/мл карбоплатина и инкубировали в течение 96 часов. Среду заменили, и обработанные клетки выращивали при стандартных условиях роста. Через 3 и 6 дней клетки анализировали на экспрессию CLDN6 с помощью проточной цитометрии.
Антителозависимая клеточноопосредованную цитотоксичность (ADCC) после обработки цитостатическими веществами
Линия клеток карциномы яичника человека COV362, стабильно трансфицированная люциферазой в качестве репортера, была использована для определения влияния карбоплатина и паклитакселя на IMAB027-опосредованную ADCC.
Клетки COV362(Luc) (3×106 клеток на 150 мм культуральную чашку) выращивали при стандартных условиях. Через 24 часа клетки обработали 5 нг/мл паклитакселя, 20 мкг/мл карбоплатина, 25 нг/мл гемцитабина, 20 нг/мл докорубицина или 7,5 нг/мл топотекана и инкубировали в течение 4 дней. Среду заменили, а обработанные, клетки выращивали при стандартных условиях роста в течение 3 дополнительных дней (при использовании карбоплатина и гемцитабина) или 10 дней (при использовании паклитакселя, доксорубицина или топотекана).
Клетки собирали с помощью 0,05% трипсина/EDTA (Gibco, 25300-054) и регулировали концентрацию до 2×105 клеток/мл в DMEM, содержащей 2 мМ глутамина (Gibco, 25030-081) и 20 мМ HEPES (Gibco, 15630-056). 1×104 клеток на лунку высевали в прозрачный 96-луночный РР-планшет и инкубировали в течение ~5 часов при 37°С и 5% CO2.
РВМС (мононуклеарные клетки периферической крови) выделяли из образцов человеческой донорской крови центрифугированием в градиенте плотности, с использованием фиколл-гипак (GE Healthcare, 17144003). Были выделены РМВС, содержащие интерфазу, клетки два раза промывали PBS, содержащим 2 mM EDTA. РВМС ресуспендировали в Х-Vivo 15 среде (Lonza, BE04-418Q) при концентрации 1,6×107 клеток/мл и хранили при 37°С и 5% СО2 до проведения исследования.
25 мкл IMAB027 и изотипических контрольных антител добавили к клеткам в указанных концентрациях. После этого добавили 25 мкл суспензии РВМС и инкубировали клетки в течение 24 часов при 37°С и 5% СО2.
После добавления 10 мкл 8% Тритон Х-100 (Sigma, Т8787) в PBS к контролям «общий лизис», 10 мкл PBS к контролям «макс, жизнеспособные клетки» и к образцам, добавили 50 мкл люцифериновой смеси (3,84 мг/мл D-люциферин (Sigma Aldrich, 50227) и 160 мМ HEPES в ddH2O) и инкубировали клетки в темноте при комнатной температуре в течение 90 минут. Биолюминесценцию измеряли с помощью люминометра (Infinite М200, TECAN). Результаты даны в виде интегрированных численных относительных световых единиц (RLU).
Специфический лизис вычисляли следующим образом:
Специфический лизис [%] = 100-[(образец - общий лизис)/(максимум жизнеспособных клеток - общий лизис)×100]
максимум жизнеспособных клеток: 10 мкл PBS, без антител
общий лизис: 10 мкл 8% (об./об.) Тритон Х-100 в PBS, без антител
Внутрибрюшинное приживление COV318 клеток у бестимусных «голых» мышей
На мышах in vivo была исследована канцерогенность линии клеток карциномы яичника человека COV318 и накопление CLDN6-положительных клеток. Соответственно, 2×107 COV318 клеток, ресуспендированных в PBS, вводили внутрибрюшинно самкам мышей 6-8-недельного возраста Hsd:Athymic Nude-Foxn1nu. Осуществлялся ежедневный контроль за мышами. Как только опасные для жизни симптомы становились очевидными, животное подвергали эвтаназии. Выделяли опухолевые и асцитные клетки и культивировали их для дополнительного анализа.
Опухоли механически диссоциировали, пропускали через сито и промывали средой DMEM (Gibco, 41965-039). Для получения одноклеточной суспензии опухолевые клетки обрабатывали аккутазой (Life Technologies, All 105-01) в течение 30 минут при 37°С, пропускали через сито с ячейками 40 мкм и промывали средой DMEM. Асциты собирали, загрязняющие эритроциты удаляли с использованием ACK (аммоний-хлорид-калий) лизирующего буфера (Invitrogen, А10492-01). Опухоль и асцитные клетки выращивали в стандартных условиях с использованием стандартной среды COV318 с добавлением пенициллина/стрептомицина (Gibco, 15140). Скрининг клеток в отношении экспрессии CLDN6 проводили с помощью проточной цитометрии.
Лечение запущенных человеческих ксенотрансплантантных NEC14 опухолей
Самкам мышей 6-8-недельного возраста Hsd:Athymic Nude-Foxn1nu подкожно в бок инокулировали 2×107 NEC14 клеток в 200 мкл PBS. При исследовании лечения запущенных опухолей опухоли росли в течение 13 дней до максимального объема 170 мм3, затем мышей разделили на группы контроль, IMAB027, РЕВ (цисплатин, этопозид, блеомицин) и IMAB027/PEB (n=14 на группу) до лечения.
Через 13 дней после перевивки клеток вводили лекарственные средства, как описано далее: 1 мг/кг болюсные i.p. инъекции цисплатина в дни 13, 14, 15, 16 и 17; 5 мг/кг болюсные i.p. инъекции этопозида в дни 13, 14, 15, 16 и 17; 10 мг/кг болюсные i.p. инъекции блеомицина в дни 13, 17 и 21. IMAB027 применяли три раза в неделю с 13 дня по 101 с помощью болюсных чередующихся i.v./i.p./i.p. инъекций 35 мг/кг IMAB027. В качестве разбавителей-контролей мышам вводили буфер для лекарственной субстанции вместо антитела или 0,9% NaCl раствор вместо РЕВ, соответственно.
Опухолевую массу и состояние здоровья животных контролировали два раза в неделю. Мышей забивали, когда опухоль достигала объема 1400 мм3 или когда опухоль становилась изъязвленной. Ингибирование опухолевого роста анализировали с помощью критерия Крускела-Уоллиса и апостериорного критерия множественного сравнения Данна.
Анализ сферообразования
Для проведения анализа сферообразования клетки COV318 окрашивали на CLDN6 с помощью 0,5 мкг/мл IMAB027 в течение 30 минут при 4°С с последующей инкубацией с козьими вторичными антителами к IgG человека (1:300) в течение 10 минут при 4°С и клетки после этого сортировали в отношении экспрессии CLDN6 с использованием клеточного сортера BD FACSAria. Затем 1×106 CLDN6-положительных или CLDN6-отрицательных отсортированных клеток высевали в лунки 6-луночных планшетов со сверхнизким прикреплением Ultra Low Attachment Plate (Corning) в бессывороточной среде DMEM/F12, содержащей 0,4% бычьего сывороточного альбумина, 20 нг/мл основного фактора роста фибробластов, 10 нг/мл эпидермального фактора роста и 5 мкг/мл инсулина и давали возможность клеткам образовать сферы в течение 21 дня при этих специфических для стволовых клеток условиях. Среду меняли каждый второй день, не разрушая сферы, и регулярно делали характерные снимки.
Для получения второго поколения сфер первое поколение сфер CLDN6-положительных COV318 клеток (22 день после высевания) диссоциировали до отдельных клеток и затем повторно высевали в лунки 6-луночных планшетов Ultra Low Attachment Plates. И вновь, среду меняли каждый второй день, не разрушая сферы, и регулярно делали характерные снимки.
Количественный анализ ПЦР в реальном времени с использованием системы Bio Mark™ HP (Fluidigm)
42 образца рака яичника человека исследовали с помощью qRT-ПЦР с использованием смеси для определения уровня экспрессии генов TaqMan® gene expression assays (Life technologies) в отношении выбранных специфических факторов стволовых клеток рака яичника (CTCFL, LIN28B, CD24, GNL3, ЕрСАМ, CD44, ABCG2, ALDH1A1, AMACR, ATXN1, BMI1, ВМР4, CD34, CD117, Myd88, Nanog, Notch 1, Pou5F1, CD133, Snail, Sox 2) с использованием системы Bio Mark™ HD (Fluidigm). Выделение РНК из образцов рака яичника проводили с помощью набора RNeasy Mini Kit (Qiagen), a кДНК синтезировали с использованием набора реагентов PrimeScript RT Reagent Kit (Takara Bio Inc.) согласно соответствующим инструкциям производителя. Образцы подготавливали и анализировали в соответствии с протоколом Fluidigm® Advanced Development Protocol 28 - Fast Gene Expression Analysis с использованием TaqMan® GE Assays rev A2. Загрузка в 96,96 Gene Expression Dynamic Array IFCs осуществлялась с помощью IFC Controller HX. Наборы чипов анализировали с помощью системы Fluidigm BioMark™ HD. TaqMan PreAmp MasterMix покупали от компании Applied Biosystems. Набор данных оценивали согласно методу ΔΔCt. Корреляционный анализ CLDN6 с выбранными маркерами стволовых клеток рака яичника проводили с использованием коэффициента корреляции Спирмена. Значимость корреляционных значений оценивали с помощью теста на коэффициенты корреляции. Р-значения были скорректированы относительно многократного тестирования с использованием метода Benjamini и Hochberg, и скорректированные р-значения ≤0,05 считались значимыми.
Конъюгирование CLDN6-антител с токсином
Конъюгирование с токсином моноклональных антител осуществляли при Piramal Healthcare (Grangemouth, UK).
Для конъюгирования с DM1 «голые» антитела модифицировали посредством вступления в реакцию SMCC (6× молярность) со свободными NH2 остатками лизиновых групп путем инкубации в PBS (pH 7,2) в течение 1 часа при RT. Потом был проведен диализ модифицированных антител в 35 мМ цитратном буфере (pH 5,0), отношение линкера к антителу определяли с помощью обратного анализа Эллмана. DM1 (6× молярность) конъюгировал через его сульфгидрильную группу с фрагментом малеимида SMCC линкера при инкубации в течение 17 часов при RT. Был проведен диализ конъюгированньгх антител в буферной смеси (20 мМ His, 85 мг/мл сахароза, pH 5,8) и хранили при -80°С. Соотношение лекарственного средства и антитела анализировали с помощью УФ-спектрометрии, содержание мономера - с помощью эксклюзионной ВЭЖХ и содержание свободного лекарственного средства - с помощью обращенно-фазовой ВЭЖХ.
Для конъюгирования с ММАЕ «голые» антитела диализировали в PBS (pH 7,2) и модифицировали тиолированием свободных NH2-групп остатков лизина с использованием реагента Трота (2-иминотиолат) (20× молярность) в течение 2 часов при RT. Затем тиолированные антитела диализировали в 35 мМ цитратном буфере (pH 5,5) и отношение линкера к антителу определяли, используя обратный анализ Эллмана. vcMMAE (6× молярность) был конъюгирован через валин линкера, расщепляемого катепсином, с сульфгидрильной группой тиолированных антител путем инкубации в течение 15 часов при RT. Конъюгированные антитела диализировали в буферной смеси (20 мМ His, 85 мг/мл сазарозы, pH 5,8) и хранили при -80°С. Соотношение лекарственного средства и антитела анализировали с помощью УФ-спектрометрии, содержание мономера - с помощью эксклюзионной ВЭЖХ и содержание свободного лекарственного средства - с помощью обращенно-фазовой ВЭЖХ.
Определение относительной аффинности связывания с помощью проточной цитометрии
Клетки собирали с помощью 0,05% трипсина/EDTA (Gibco, 25300-054), промывали FACS буфером (PBS, содержащий 2% FCS (Gibco, 10270-106) и 0,1% азид натрия (Applichem, А1430)) и ресуспендировали в FACS буфере при концентрации 2×106 клеток/мл. 100 мкл. клеточной суспензии инкубировали в течение 30 минут при 4°C с IMAB027, IMAB027-DM1 или IMAB027-vcMMAE (серии титрования от 0,1 нг/мл до 20 мкг/мл). Затем клетки три раза промывали FACS буфером и инкубировали в течение 30 минут при 4°C с античеловек IgG (Jackson ImmunoResearch, 109-136-170) разбавленным в 1:200 в FACS буфере. После этого клетки два раза промыли и ресуспендировали в 100 мкл FACS буфера. Связывание анализировали с помощью проточной цитометрии с использованием BD FACSArray (BD Biosciences) и программного обеспечения FlowJo (Tree Star Inc.).
Оценка жизнеспособности при использовании IMAB027, конъюгированного с токсином
Воздействие IMAB027-DM1 и IMAB027-vcMMAE на жизнеспособность клеточных линий рака человека определяли in vitro с использованием колориметрического анализа, который обнаруживает метаболическую активность клеток (Cell Proliferation Kit ХТТ from AppliChem).
Клетки OV90 собирали с помощью 0,05% трипсина/EDTA (Gibco, 25300-054), затем 2500 клеток высевали в 50 мкл ростовой среды в 96-луночный планшет. Через 24 часа добавляли серии концентраций DM1- и ММАЕ-конъюгированных IMAB027 или изотипических контрольных антител, разведенных в 50 мкл среды. Клетки культивировали в течение 3-7 дней до тех пор, пока необработанные клетки не достигали ~80% слияния. Жизнеспособность клеток анализировали с использованием набора AppliChem Cell Proliferation Kit II (AppliChem, A8088-1000) согласно инструкциям производителя. Через 3-5 часов инкубации с ХТТ реагентом 100 мкл клеточных супернатантов переносили в новый 96-луночный аналитический планшет и измеряли поглощение при 480 нм (стандарт 630 нм) с использованием спектрофотометра (Tecan). Жизнеспособность была вычислена с использованием следующего уравнения:
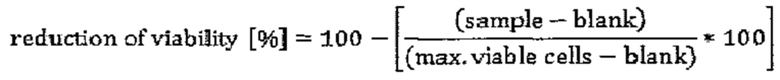
уменьшение жизнеспособности [%] = 100-[(образец - бланк) : (максим. жизнеспособность клеток - бланк)×100].
бланк (пустая проба): среда и ХТТ без клеток
максим. жизнеспособность клеток: клетки, среда и ХТТ
Значения ЕС50 определяли с помощью программного обеспечения GraphPad Prism 6 с помощью нелинейной регрессии.
Лечение развитых подкожных QV90 ксенотрансплантантных опухолей
Клетки линии карциномы яичника человека OV90 культивировали при стандартных условиях. Для перевивки самкам мышей 6-8-недельного возраста Hsd:Athymic Nude-Foxn1nu подкожно инокулировали в бок 1×107 OV90 клеток в 200 мкл PBS. В исследовании с использованием запущенных опухолей опухоли росли в течение 10 дней, затем мышей с развитыми опухолями объемом 50-150 мм3 случайным образом разделили на группы с растворителем и антителом (n=10) до лечения. Объем опухоли (TV = (длина × ширина2)/2) контролировали два раза в неделю. TV выражали в мм3, что позволяло построить кривые роста опухолей в течение времени.
В исследовании по определению начальной дозы животным однократно i.v. вводили разбавитель, IMAB027-DM1 (1,78 мг/кг, 5,33 мг/кг или 16 мг/кг), а на 35 день после трансплантации препарировали. В исследовании по определению второй дозы животным вводили один раз i.v. разбавитель, IMAB027-vcMMAE (4 мг/кг, 8 мг/кг или 16 мг/кг) или IMAB027-DM1 (1,33 мг/кг, 2,67 мг/кг или 5,33 мг/кг). IMAB027 применяли три раза в неделю с помощью болюсных чередующихся i.v./i.p./i.p. инъекций 35 мг/кг IMAB027. Мышей забивали, когда опухоли достигали объема больше, чем 1400 мм3 или когда опухоли изъязвлялись. Ингибирование опухолевого роста анализировали с помощью критерия Крускела-Уоллиса и апостериорного критерия множественного сравнения Данна. Выживаемость анализировали с помощью критерия Кокса-Мантеля.
Лечение развитых подкожных РА-1 ксенотрансплантантных опухолей и иммуногистохимическое исследование срезов опухолей
Клеточную линию карциномы яичника человека РА-1 культивировали при стандартных условиях. Для перевивки самкам мышей 6-8-недельного возраста Hsd:Athymic Nude-Foxn1nu в бок подкожно инокулировали 1×107 РА-1 клеток в 200 мкл PBS. В исследовании на развитых опухолях опухоли выращивали в течение 15 дней, и мышей с развитыми опухолями объемом 40-120 мм3 случайным образом разделили на группы с разбавителем и антителом (n=10) до лечения. Объем опухоли (TV = (длина × ширина2)/2) контролировали два раза в неделю. TV выражали в мм3, что позволяло построить кривые роста опухолей в течение времени.
Животным вводили i.v. однократно разбавитель, IMAB027-vcMMAE (4 мг/кг, 8 мг/кг или 16 мг/кг) или IMAB027-DM1 (4 мг/кг, 8 мг/кг или 16 мг/кг). IMAB027 применяли три раза в неделю с помощью болюсных чередующихся i.v./i.p./i.p. инъекций 35 мг/кг IMAB027. Мышей забивали, когда опухоли достигали объема больше, чем 1400 мм3, или изъязвлялись. Ингибирование опухолевого роста анализировали с помощью критерия Крускела-Уоллиса и апостериорного критерия множественного сравнения Данна. Выживаемость анализировали с помощью критерия Кокса-Мантеля.
Чтобы проанализировать экспрессию CLDN6 в ходе закладки и развития РА-1 опухолей, опухоли нелеченых мышей иссекали на 7, 14 и 56 день, соответственно, фиксировали в формалине и заливали в парафин. Делали срезы тканей 4 мкм от каждого FFPE (зафиксированного в формалине и залитого парафином) блока, помещали на адгезивные слайды (SuperFrost Ultra Plus, Thermo Fisher Scientific) и высушивали в течение 60 минут при 60°С. До окрашивания FFPE срезы тканей депарафинировали. Срезы кипятили в 10 мМ лимонной кислоте с добавлением 0,05% твина-20 (pH 6,0) при 120°С в течение 10 минут. Эндогенные пероксидазы гасили с помощью инкубации в 0,3% Н2О2 в PBS в течение 15 минут. После промывки PBS сайты неспецифического связывания антител блокировали в течение 30 мин блокирующим буфером (10% козьей, сыворотки в PBS) при RT, с последующей инкубацией в течение ночи с 0,2 мкг/мл первичных кроличьих антиклаудин-6 антител (IBL-America, 18865), разведенных в блокирующем буфере. Затем образцы промывали 3 раза PBS и инкубировали с соответствующими вторичными готовыми к использованию антителами (Power Vision HRP козьи антикролик; Immunologic) в течение 30 минут при RT. Визуализацию проводили в течение 4:30 минут с использованием раствора субстрат-хромоген (VectorRed; Vector Laboratories). После докрашивания гематоксилином, дегидратации и приготовления препаратов срезы анализировали с помощью микроскопа Leica DM2000.
Лечение запущенных подкожных MKN74 ксенотрансплантантных опухолей и иммуногистохимический анализ срезов опухолей
Клеточные линии карциномы желудка человека MKN74 культивировали при стандартных условиях. Для перевивки самкам мышей 6-8-недельного возраста Hsd:Athymic Nude-Foxn1nu в бок подкожно инокулировали 1×107 MKN74 клеток в 200 мкл PBS. Для исследования лечения запущенных опухолей опухоли росли в течение 7 дней, затем мышей с развитыми опухолями объемом 200±30 мм3 случайным образом делили на группы с разбавителем и антителом (n=10) до лечения. Объем опухоли (TV = (длина × ширина2)/2) контролировали два раза в неделю. TV выражали в мм, что позволяло построить кривые роста опухолей в течение времени.
Животные получали разбавитель (буфер) в качестве контроля или 16 мг/кг IMAB027-vcMMAE на 8 день с помощью однократной болюсной i.v. инъекции. Мышей забивали, когда опухоли достигали объема больше, чем 1400 мм3, или изъязвлялись. Ингибирование опухолевого роста анализировали с помощью критерия Крускела-Уоллиса и апостериорного критерия множественного сравнения Данна. Выживаемость анализировали с помощью критерия Кокса-Мантеля.
Ингибирование опухолевого роста анализировали с помощью критерия Манна-Уитни и апостериорного критерия множественного сравнения Данна. Выживаемость анализировали с помощью критерия Кокса-Мантеля.
Экспрессию CLDN6 на клетках MKN74 анализировали с помощью проточной цитометрии перед приживлением и с помощью гистохимии на необработанных MKN74 ксенотрансплантатах, иссеченных на 31 день.
Для проведения иммуногистохимического анализа готовили срезы тканей толщиной 3 мкм, помещали на слайды и высушивали на воздухе в течение 90 минут при RT. Все срезы тканей фиксировали в течение 10 минут в ацетоне при -20°С и промывали в течение 5 минут в PBS. Эндогенные пероксидазы гасили с помощью инкубации с 0,03% перекисью водорода (Dakocytomation En Vision System, K4011) в течение 15 минут. После промывки PBS сайты неспецифического связывания антител блокировали в течение 30 мин блокирующим буфером (10% козьей сыворотки в PBS) при RT, с последующей инкубацией в течение 60 минут с 5 мкг/мл IMAB027-FITC при RT. Затем образцы промывали 3 раза PBS и инкубировали с соответствующими вторичными готовыми к использованию антителами (Bright Vision поли-HRP антикролик IgG, Immunologic, DPVR-110HRP) в течение 30 мин при RT. Визуализацию проводили в течение 2:30 минут с использованием раствора субстрат-хромоген (VectorRed; Vector Laboratories). После докрашивания гематоксилином, дегидратации и приготовления препаратов срезы анализировали с помощью микроскопа Leica DM2000.
Лечение прогрессирующих внутрибрюшинных PA-1(Luc) ксенотрансплантантных опухолей
Линию клеток тератокарциномы яичника человека РА-1 (Luc), устойчиво экспрессирующую люциферазу светлячка в качестве люминесцентного гена-репортера, использовали как модель внутрибрюшинной ксенотрансплантантной опухоли для исследования противоопухолевой активности конъюгированных с токсином антител IMAB027 in vivo. Предшествующие эксперименты по трансплантации клеток подтвердили, что внутрибрюшинная инокуляция РА-1(Luc) клеток в результате приводит к образованию внутрибрюшинных опухолевых узлов.
1×107 PA-1(Luc) клеток, ресуспендированных в PBS, вводили внутрибрюшинно самкам мышей Hsd:Athymic Nude-Foxn1nu. Биолюминесцентную визуализацию начинали на 14 день после инокулирования опухолевых клеток, и потом еженедельно до завершения исследования. D-люциферин (PerkinElmer, 122796) растворяли в стерильной воде и вводили внутрибрюшинно (150 мг/кг, инъекционные объемы 200 мкл) за 5 минут до визуализации с помощью системы IVIS Lumina Imaging System (Advanced Molecular Vision). Мышам делали анестезию изофлураном, помещали в темную камеру IVIS Lumina и определяли количество испускаемых фотонов в течение 1 минуты. Интенсивность проходящего света, исходящего из экспрессирующих люциферазу РА-1 клеток в теле животного, представляло собой псевдоцветное изображение, где синий цвет - наименьшая интенсивность, а красный - самая большая интенсивность биолюминесцентного сигнала. Полутоновые фотографические изображения мышей также были получены при LED слабом освещении. Изображения налагались с помощью программного обеспечения Living Image (Xenogen). Для всех изображений использовали сопоставимые настройки освещения. Для количественной оценки биолюминесценции были определены представляющие интерес области представляющие интерес области (ROI) и общий поток из соответствующей ROI измеряли в виде единиц фотон/сек (p/s). Значение исходной биолюминесценции, полученное из области животного, не испускающей сигнал, вычитали из соответствующего значения биолюминесценции для каждого животного.
На 14 день мышей случайным образом распределяли по группам и лечили внутрибрюшинным введением 16 мг/кг IMAB027-DM1 или IMAB027-vcMMAE, соответственно. Контрольным животным вводили разбавитель (буфер). Рост опухолей регистрировали еженедельно с помощью визуализации биолюминесценции видов снизу и последующего анализа общего потока (фотонов/сек) в представляющих интерес областях, покрывающих брюшко мыши.
Эндоцитоз
Эндоцитоз CLDN6-связанных антител определяли с использованием анализа эндоцитоза на основе цитотоксичности, который основывается на ко-интернализации связанного с мишенью антитела и конъюгированного с сапонином Fab-фрагмента против IgG человека (Fab-ZAP human, Advanced Targeting Systems, IT-51). Сапонин представляет собой белок, инактивирующий рибосому, который после интернализации ингибирует биосинтез белка и, следовательно, приводит к смерти клеток.
РА-1 клетки собирали с помощью 0,05% трипсина/EDTA (Gibco, 25300-054) и 2,5×103 клеток/лунку высевали в 50 мкл ростовой среды в 96-луночную культуральную чашку. Через 24 часа добавили Fab-ZAP и потом IMAB027 или изотипическое контрольное антитело в объеме 25 мкл каждого. CLDN6 антител вводили в 6 или 8 серии разведения, при этом применяли постоянные концентрации Fab-ZAP (Fab-ZAP : антитело соотношение 3:1 - 6561:1). Клетки культивировали в течение дополнительных 72 часов в увлажненном инкубаторе при 37°С и СО2. После этого, жизнеспособность клеток анализировали с использованием набора Cell Proliferation Kit II from AppliChem (AppliChem, A8088-1000) согласно инструкциям производителя. Оптическую плотность измеряли с помощью спектрофотометра (Tecan) при 480 нм (стандарт 630 нм).
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> BioNTech AG et al.
<120> DIAGNOSIS AND THERAPY OF CANCER INVOLVING CANCER STEM CELLS
<130> 342-79 PCT
<150> PCT/EP2013/002272
<151> 2013-07-31
<160> 12
<170> PatentIn version 3.5
<210> 1
<211> 220
<212> PRT
<213> Homo sapiens
<400> 1
Met Ala Ser Ala Gly Met Gln Ile Leu Gly Val Val Leu Thr Leu Leu
1 5 10 15
Gly Trp Val Asn Gly Leu Val Ser Cys Ala Leu Pro Met Trp Lys Val
20 25 30
Thr Ala Phe Ile Gly Asn Ser Ile Val Val Ala Gln Val Val Trp Glu
35 40 45
Gly Leu Trp Met Ser Cys Val Val Gln Ser Thr Gly Gln Met Gln Cys
50 55 60
Lys Val Tyr Asp Ser Leu Leu Ala Leu Pro Gln Asp Leu Gln Ala Ala
65 70 75 80
Arg Ala Leu Cys Val Ile Ala Leu Leu Val Ala Leu Phe Gly Leu Leu
85 90 95
Val Tyr Leu Ala Gly Ala Lys Cys Thr Thr Cys Val Glu Glu Lys Asp
100 105 110
Ser Lys Ala Arg Leu Val Leu Thr Ser Gly Ile Val Phe Val Ile Ser
115 120 125
Gly Val Leu Thr Leu Ile Pro Val Cys Trp Thr Ala His Ala Ile Ile
130 135 140
Arg Asp Phe Tyr Asn Pro Leu Val Ala Glu Ala Gln Lys Arg Glu Leu
145 150 155 160
Gly Ala Ser Leu Tyr Leu Gly Trp Ala Ala Ser Gly Leu Leu Leu Leu
165 170 175
Gly Gly Gly Leu Leu Cys Cys Thr Cys Pro Ser Gly Gly Ser Gln Gly
180 185 190
Pro Ser His Tyr Met Ala Arg Tyr Ser Thr Ser Ala Pro Ala Ile Ser
195 200 205
Arg Gly Pro Ser Glu Tyr Pro Thr Lys Asn Tyr Val
210 215 220
<210> 2
<211> 220
<212> PRT
<213> Homo sapiens
<400> 2
Met Ala Ser Ala Gly Met Gln Ile Leu Gly Val Val Leu Thr Leu Leu
1 5 10 15
Gly Trp Val Asn Gly Leu Val Ser Cys Ala Leu Pro Met Trp Lys Val
20 25 30
Thr Ala Phe Ile Gly Asn Ser Ile Val Val Ala Gln Val Val Trp Glu
35 40 45
Gly Leu Trp Met Ser Cys Val Val Gln Ser Thr Gly Gln Met Gln Cys
50 55 60
Lys Val Tyr Asp Ser Leu Leu Ala Leu Pro Gln Asp Leu Gln Ala Ala
65 70 75 80
Arg Ala Leu Cys Val Ile Ala Leu Leu Val Ala Leu Phe Gly Leu Leu
85 90 95
Val Tyr Leu Ala Gly Ala Lys Cys Thr Thr Cys Val Glu Glu Lys Asp
100 105 110
Ser Lys Ala Arg Leu Val Leu Thr Ser Gly Ile Val Phe Val Ile Ser
115 120 125
Gly Val Leu Thr Leu Ile Pro Val Cys Trp Thr Ala His Ala Val Ile
130 135 140
Arg Asp Phe Tyr Asn Pro Leu Val Ala Glu Ala Gln Lys Arg Glu Leu
145 150 155 160
Gly Ala Ser Leu Tyr Leu Gly Trp Ala Ala Ser Gly Leu Leu Leu Leu
165 170 175
Gly Gly Gly Leu Leu Cys Cys Thr Cys Pro Ser Gly Gly Ser Gln Gly
180 185 190
Pro Ser His Tyr Met Ala Arg Tyr Ser Thr Ser Ala Pro Ala Ile Ser
195 200 205
Arg Gly Pro Ser Glu Tyr Pro Thr Lys Asn Tyr Val
210 215 220
<210> 3
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody fragment
<400> 3
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Met Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Thr Met Asn Trp Val Lys Gln Ser His Gly Lys Asn Leu Glu Trp Ile
35 40 45
Gly Leu Ile Asn Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ile Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Gly Tyr Val Leu Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 4
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody fragment
<400> 4
Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly Glu
1 5 10 15
Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Leu His
20 25 30
Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Trp Val Tyr Ser
35 40 45
Thr Ser Asn Leu Pro Ser Gly Val Pro Ala Arg Phe Gly Gly Ser Gly
50 55 60
Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Met Glu Ala Glu Asp
65 70 75 80
Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Ile Tyr Pro Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 5
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody fragment
<400> 5
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Met Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Thr Met Asn Trp Val Lys Gln Ser His Gly Lys Asn Leu Glu Trp Ile
35 40 45
Gly Leu Ile Asn Pro Tyr Asn Gly Gly Thr Ile Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Gly Phe Val Leu Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 6
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody fragment
<400> 6
Ile Val Leu Thr Gln Ser Pro Ser Ile Met Ser Val Ser Pro Gly Glu
1 5 10 15
Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met His
20 25 30
Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Cys Ile Tyr Ser
35 40 45
Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Arg Gly
50 55 60
Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Ala Ala Glu Asp
65 70 75 80
Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Asn Tyr Pro Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 7
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody fragment
<400> 7
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Met Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Thr Met Asn Trp Val Lys Gln Ser His Gly Lys Asn Leu Glu Trp Ile
35 40 45
Gly Leu Ile Asn Pro Tyr Asn Gly Gly Ile Ile Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Phe Tyr Cys
85 90 95
Ala Arg Asp Phe Gly Tyr Val Leu Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 8
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody fragment
<400> 8
Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly Glu
1 5 10 15
Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met His
20 25 30
Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Trp Ile Tyr Ser
35 40 45
Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly
50 55 60
Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Ala Ala Glu Asp
65 70 75 80
Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Thr Tyr Pro Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 9
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody fragment
<400> 9
Glu Val Gln Leu Gln Gln Ser Arg Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Met Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Thr Leu Asn Trp Val Lys Gln Ser His Gly Lys Asn Leu Glu Trp Ile
35 40 45
Gly Leu Ile Asn Pro Tyr Asn Gly Gly Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Gly Tyr Val Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 10
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody fragment
<400> 10
Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly Glu
1 5 10 15
Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Asn Tyr Met His
20 25 30
Trp Phe Gln Leu Lys Pro Gly Thr Ser Pro Lys Leu Leu Ile Tyr Ser
35 40 45
Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Arg Gly
50 55 60
Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Met Glu Ala Glu Asp
65 70 75 80
Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Asn Asn Tyr Pro Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 11
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody fragment
<400> 11
Ile Val Leu Thr Gln Ser Pro Ser Ile Met Ser Val Ser Pro Gly Glu
1 5 10 15
Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met His
20 25 30
Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Gly Ile Tyr Ser
35 40 45
Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Arg Gly
50 55 60
Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Ala Ala Glu Asp
65 70 75 80
Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Asn Tyr Pro Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 12
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Antibody fragment
<400> 12
Ile Val Leu Thr Gln Ser Pro Ser Ile Met Ser Val Ser Pro Gly Glu
1 5 10 15
Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met His
20 25 30
Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Ser Ile Tyr Ser
35 40 45
Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Arg Gly
50 55 60
Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Ala Ala Glu Asp
65 70 75 80
Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Asn Tyr Pro Pro Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА, ПРИГОДНЫЕ В ДИАГНОСТИКЕ РАКА | 2018 |
|
RU2815883C1 |
| АГЕНТЫ ДЛЯ ЛЕЧЕНИЯ ЭКСПРЕССИРУЮЩИХ КЛАУДИН РАКОВЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2798990C2 |
| Модифицированные клетки с химерным антигеновым рецептором для лечения рака, экспрессирующего CLDN6 | 2020 |
|
RU2826058C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛ ПРОТИВ КЛАУДИНА 18.2 ДЛЯ ЛЕЧЕНИЯ РАКА | 2014 |
|
RU2792932C2 |
| АНТИТЕЛА ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ, ПРИ КОТОРЫХ ЭКСПРЕССИРУЕТСЯ КЛАУДИН 6 | 2012 |
|
RU2816850C2 |
| КОНЪЮГАТЫ ЛЕКАРСТВЕННЫХ СРЕДСТВ, СОДЕРЖАЩИЕ АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 | 2016 |
|
RU2841168C2 |
| БИСПЕЦИФИЧЕСКИЕ ТРЕХВАЛЕНТНЫЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С КЛАУДИНОМ 6 ИЛИ КЛАУДИНОМ 18.2, И CD3, ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ С ЭКСПРЕССИЕЙ КЛАУДИНА | 2017 |
|
RU2798988C2 |
| ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, ВКЛЮЧАЮЩАЯ АНТИТЕЛА ПРОТИВ КЛАУДИНА 18.2 | 2014 |
|
RU2832015C2 |
| ТЕРАПЕВТИЧЕСКАЯ РНК ДЛЯ РАКА ЯИЧНИКА | 2020 |
|
RU2832172C2 |
| ПРЕДСКАЗАНИЕ ИММУНОГЕННОСТИ Т-КЛЕТОЧНЫХ ЭПИТОПОВ | 2014 |
|
RU2724370C2 |


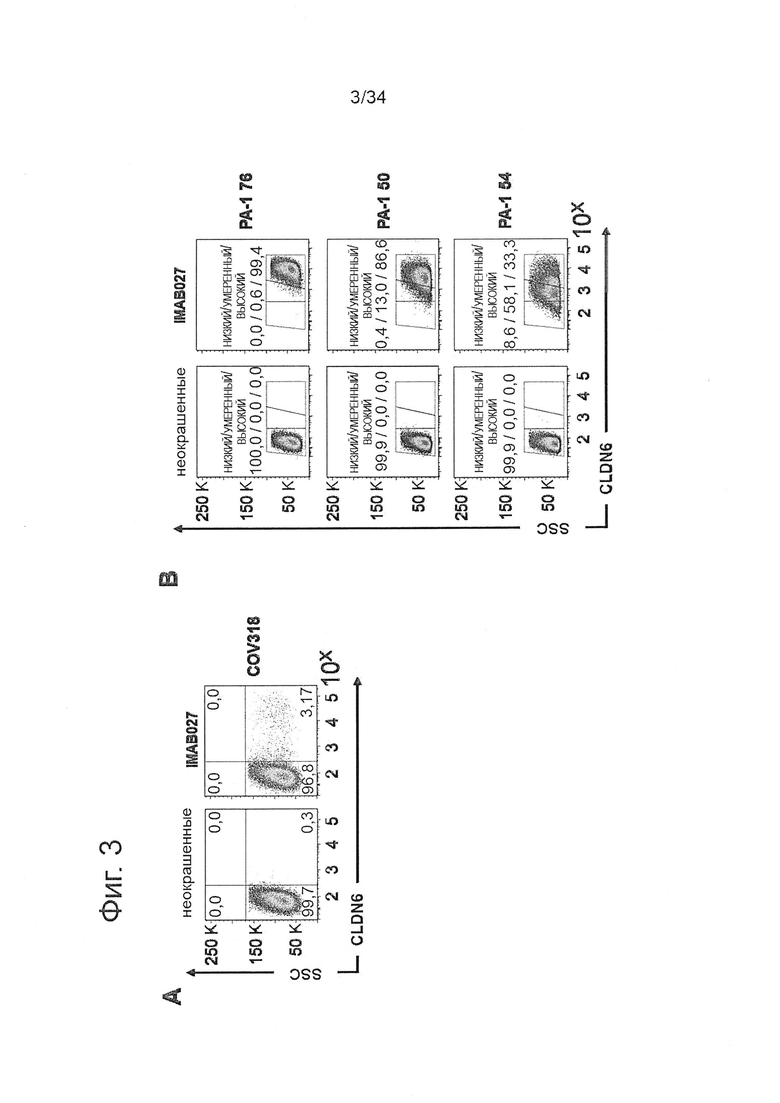
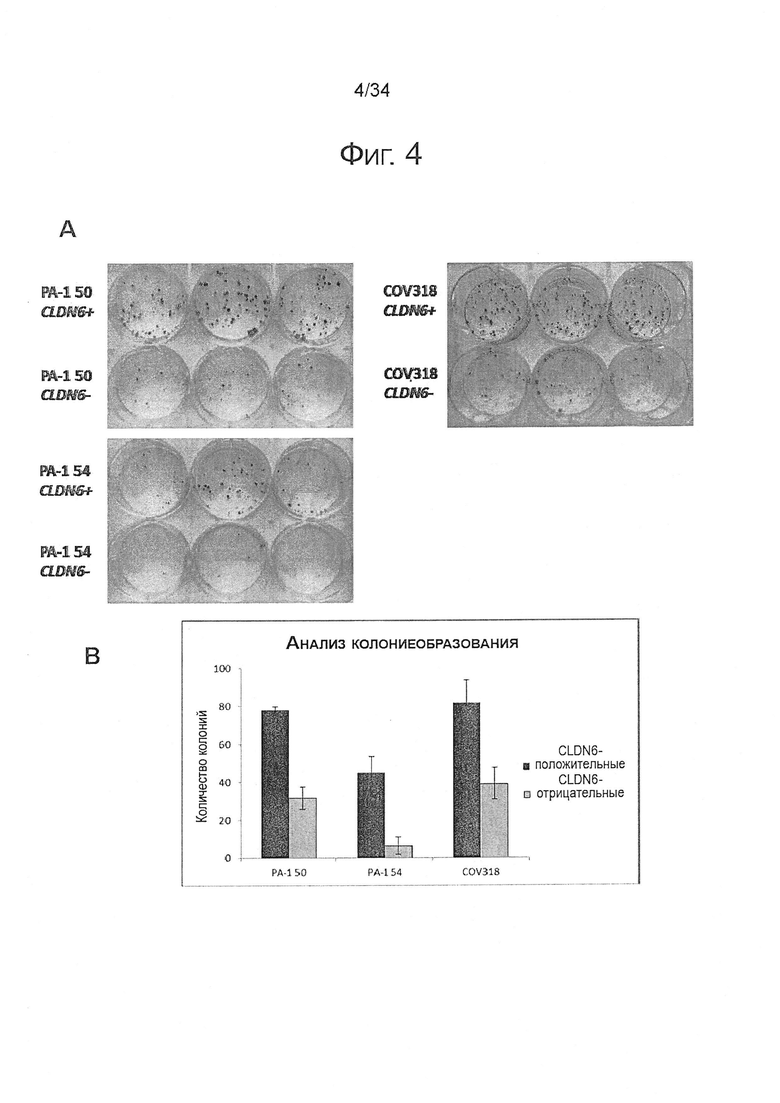
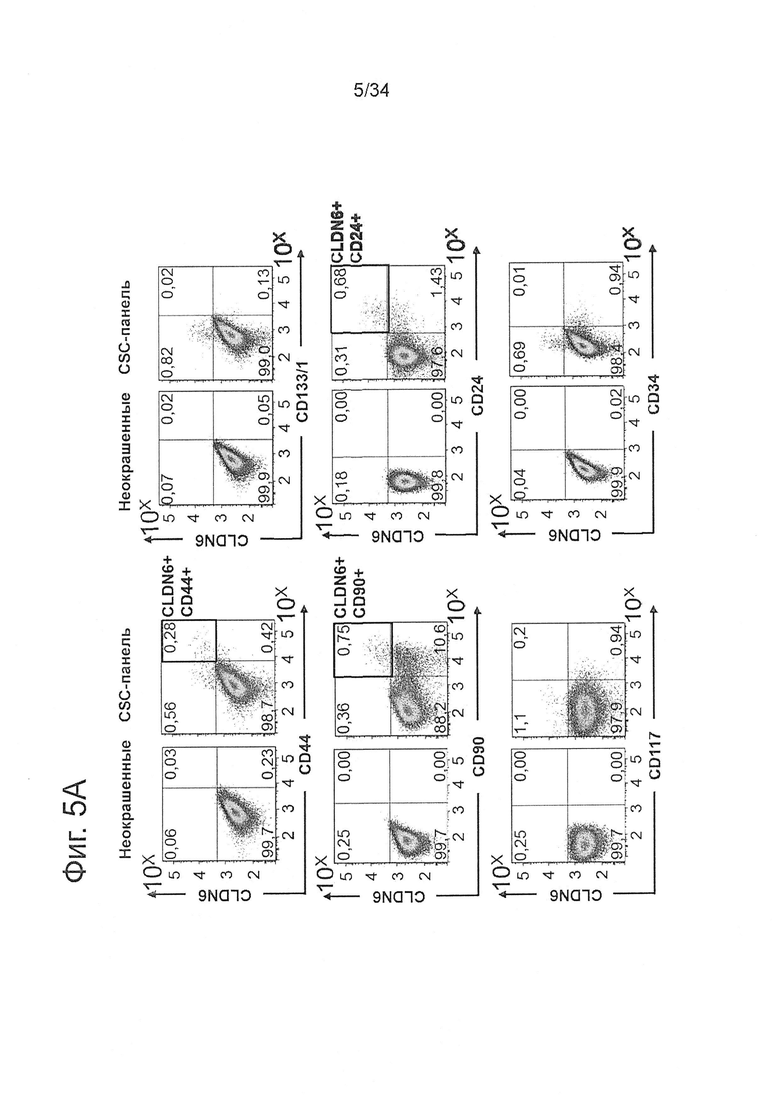
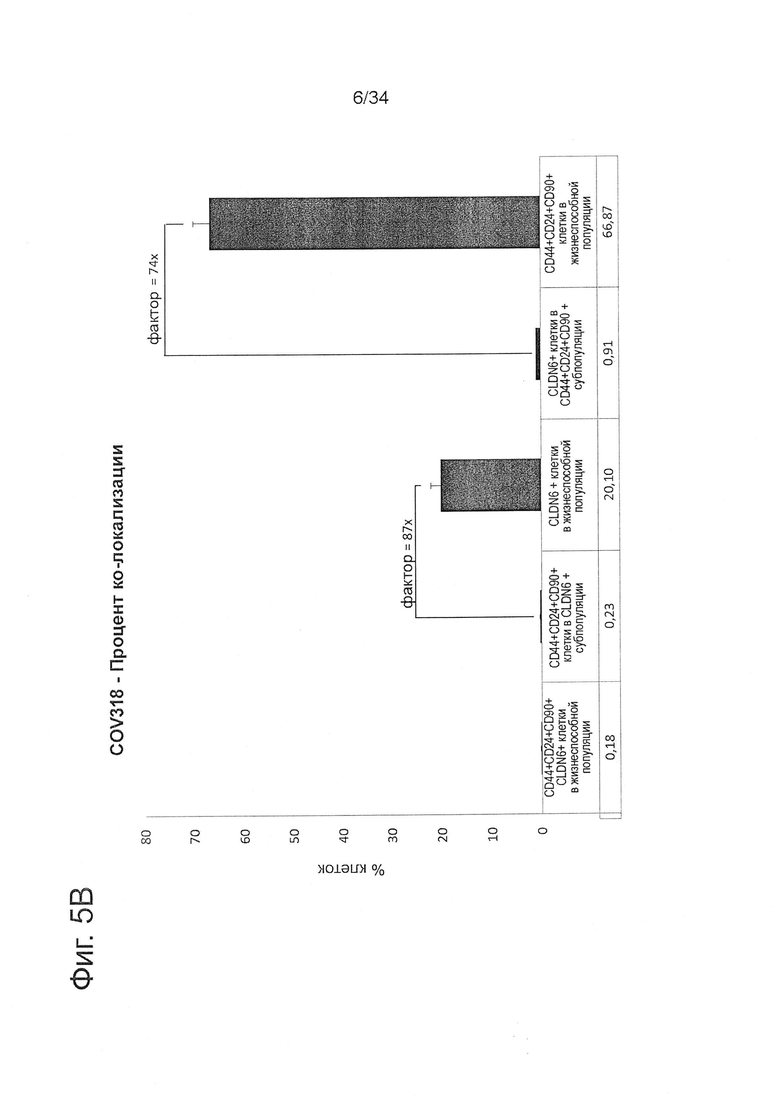
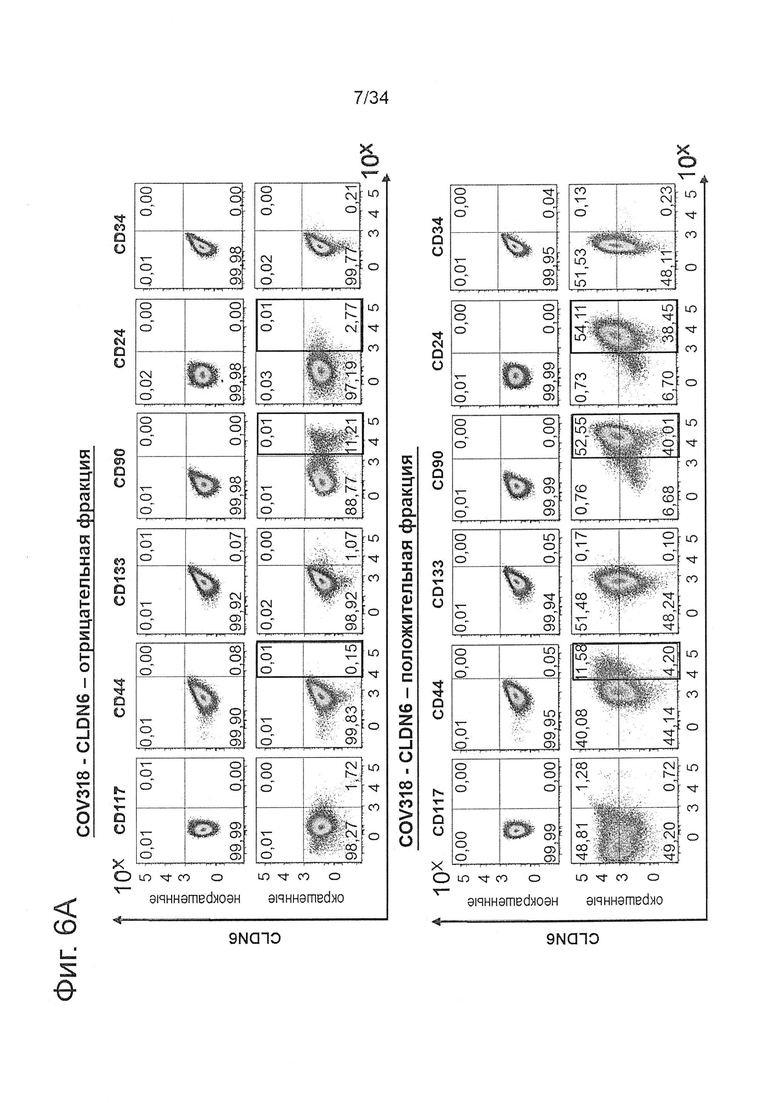
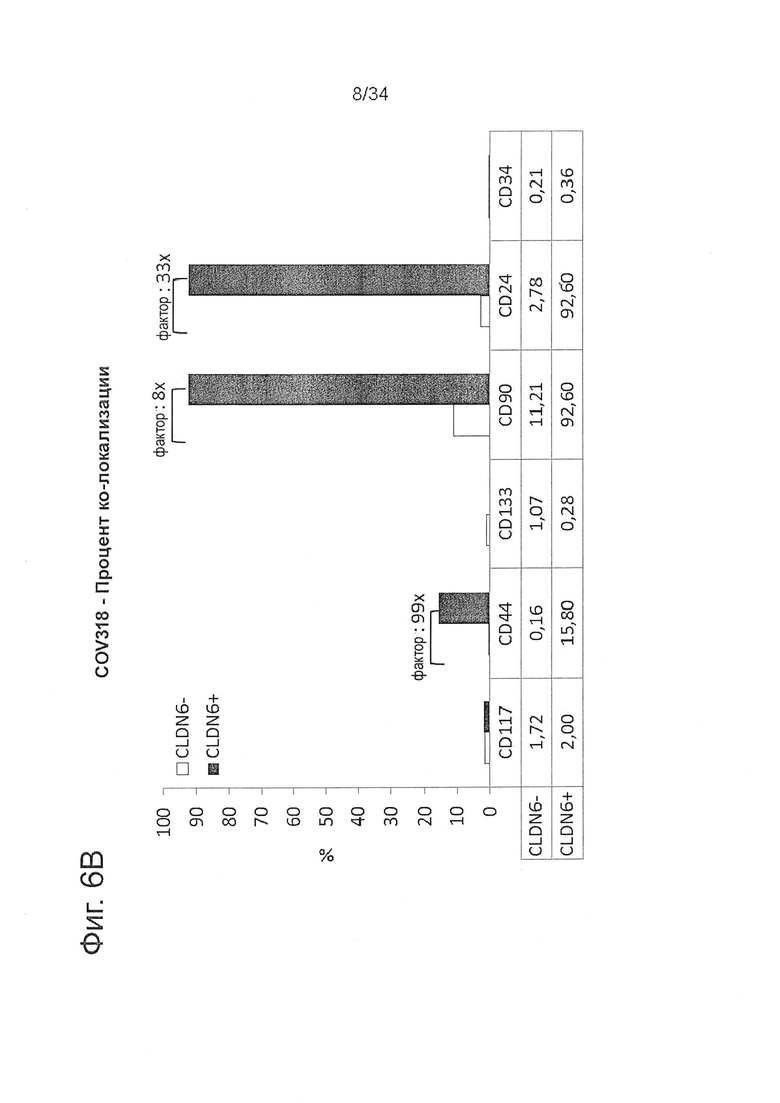
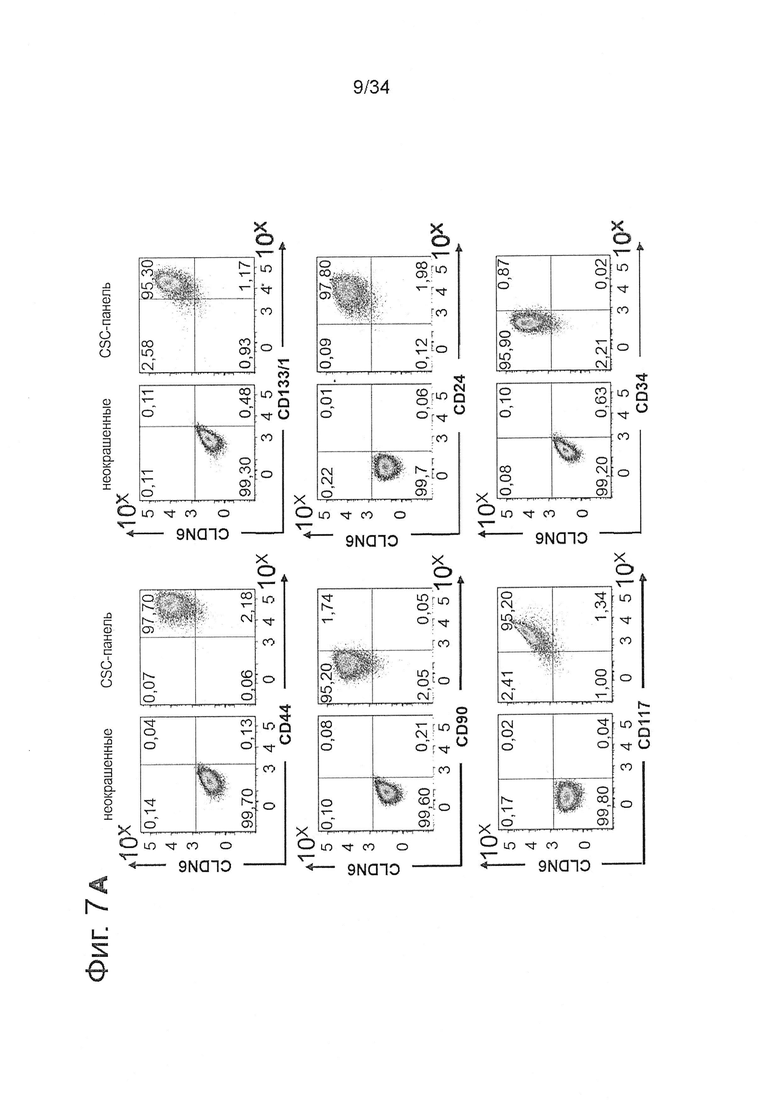
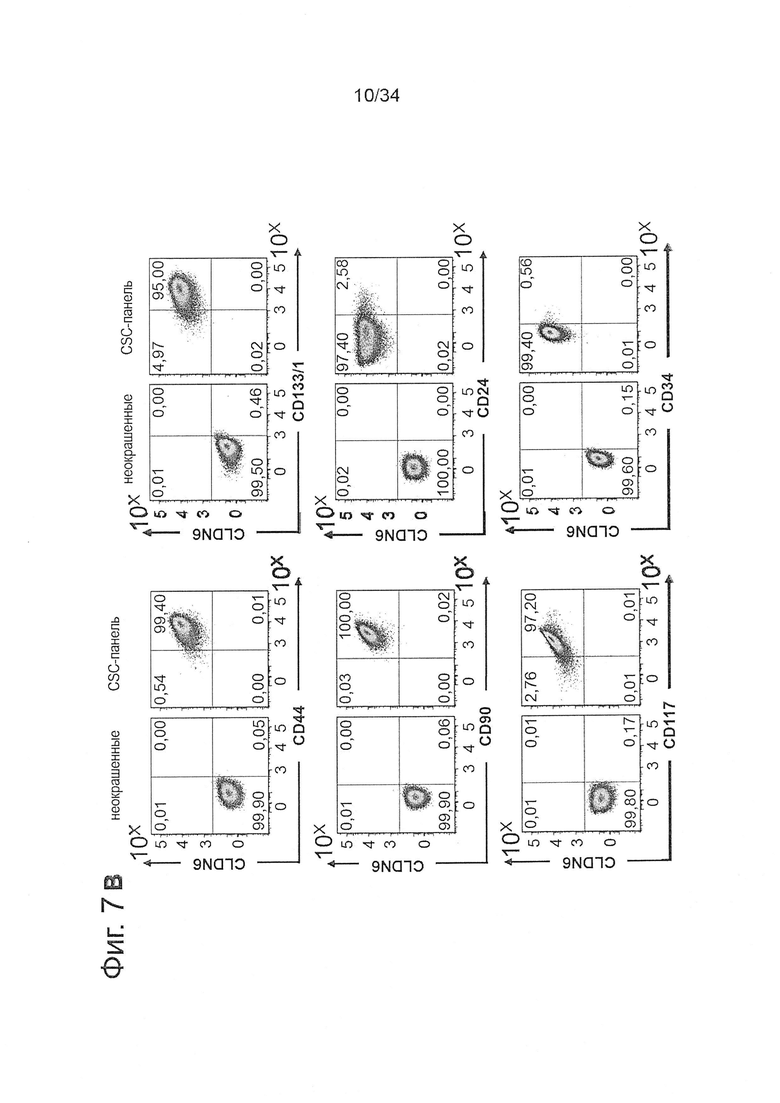
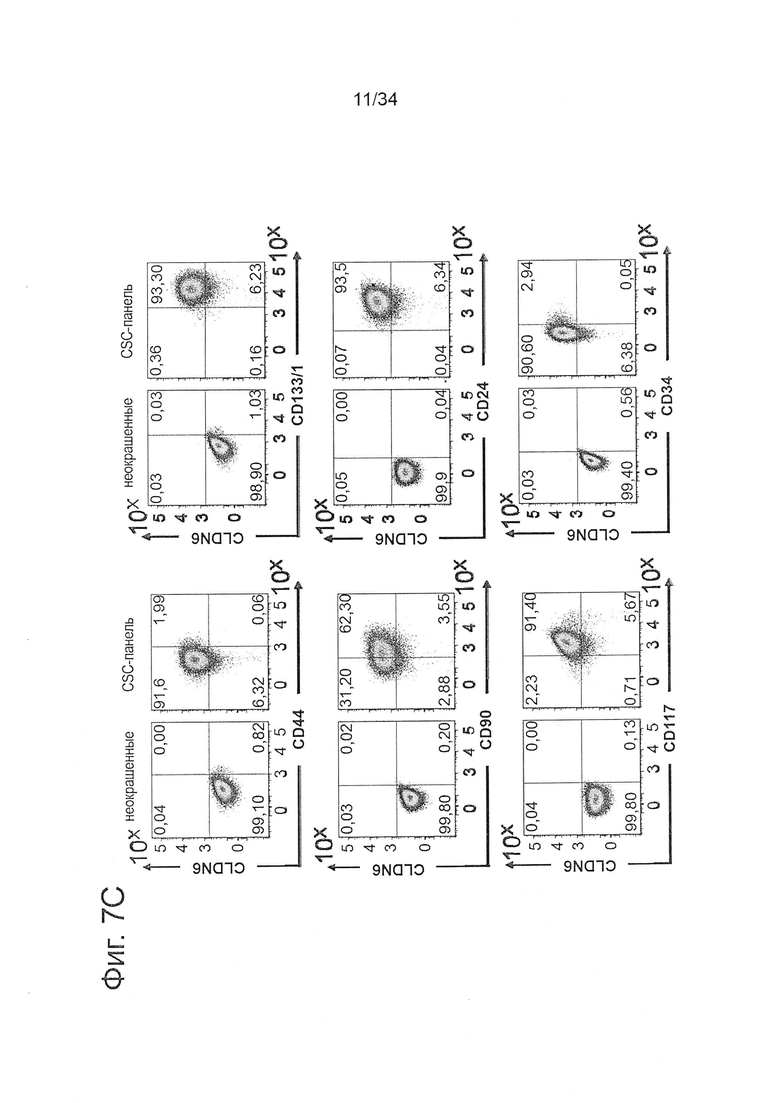

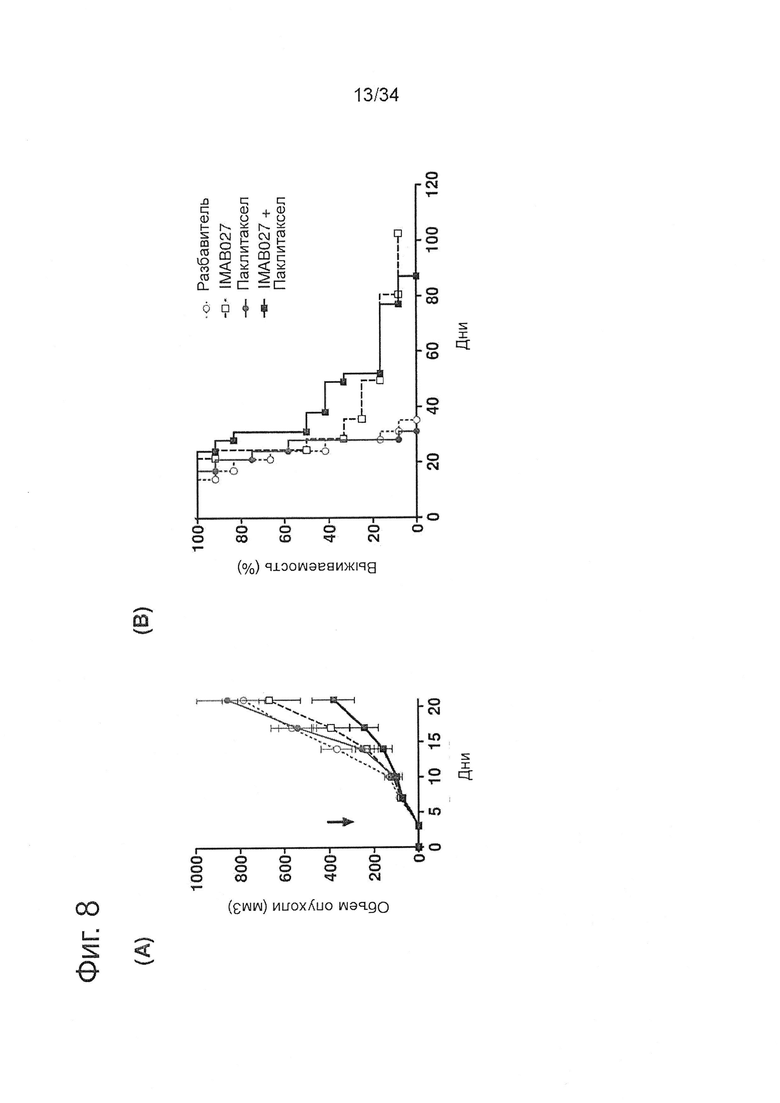
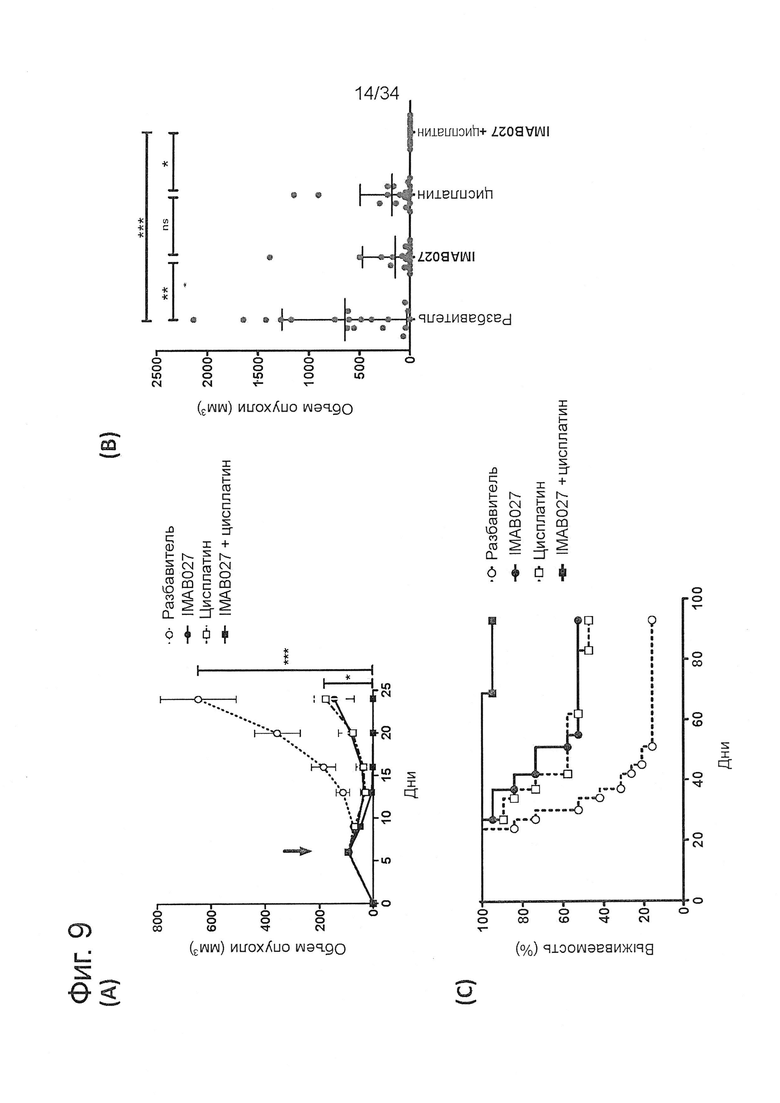
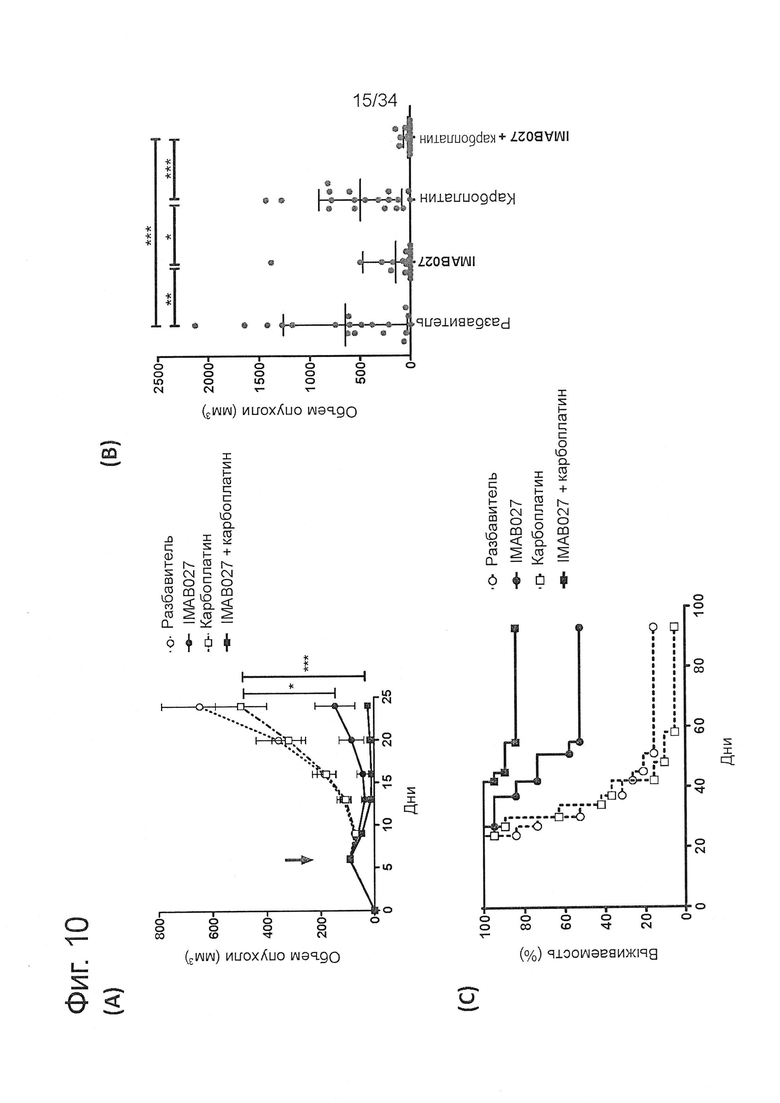
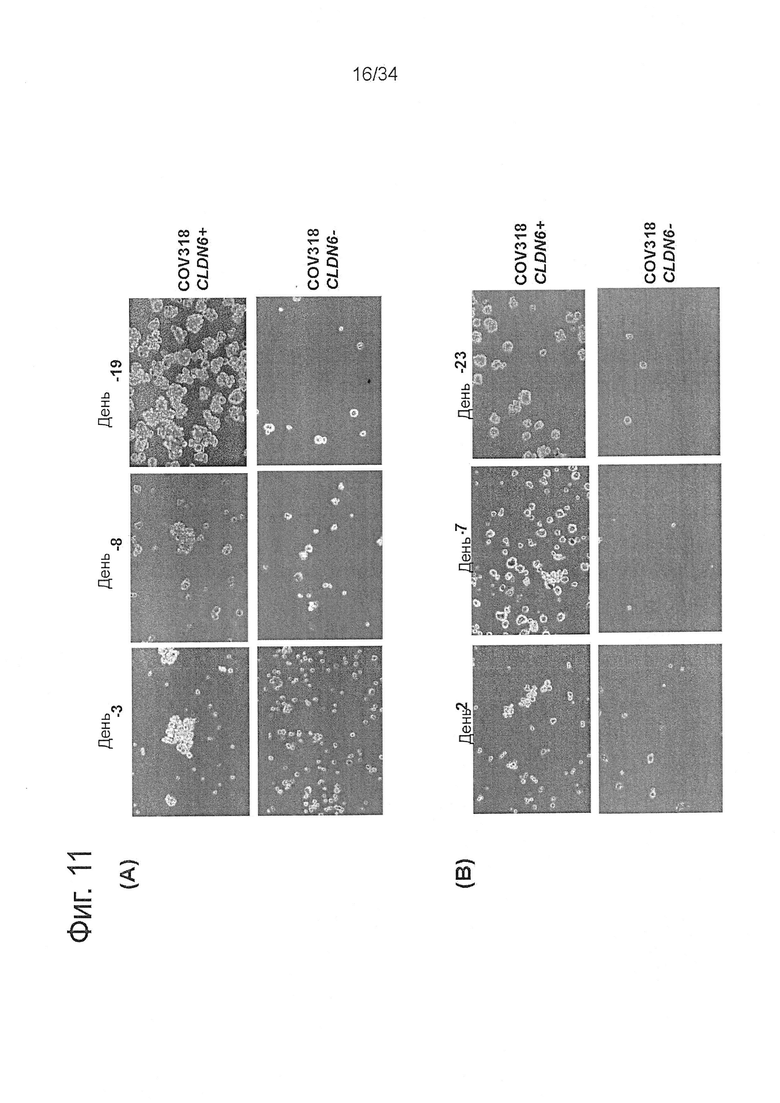
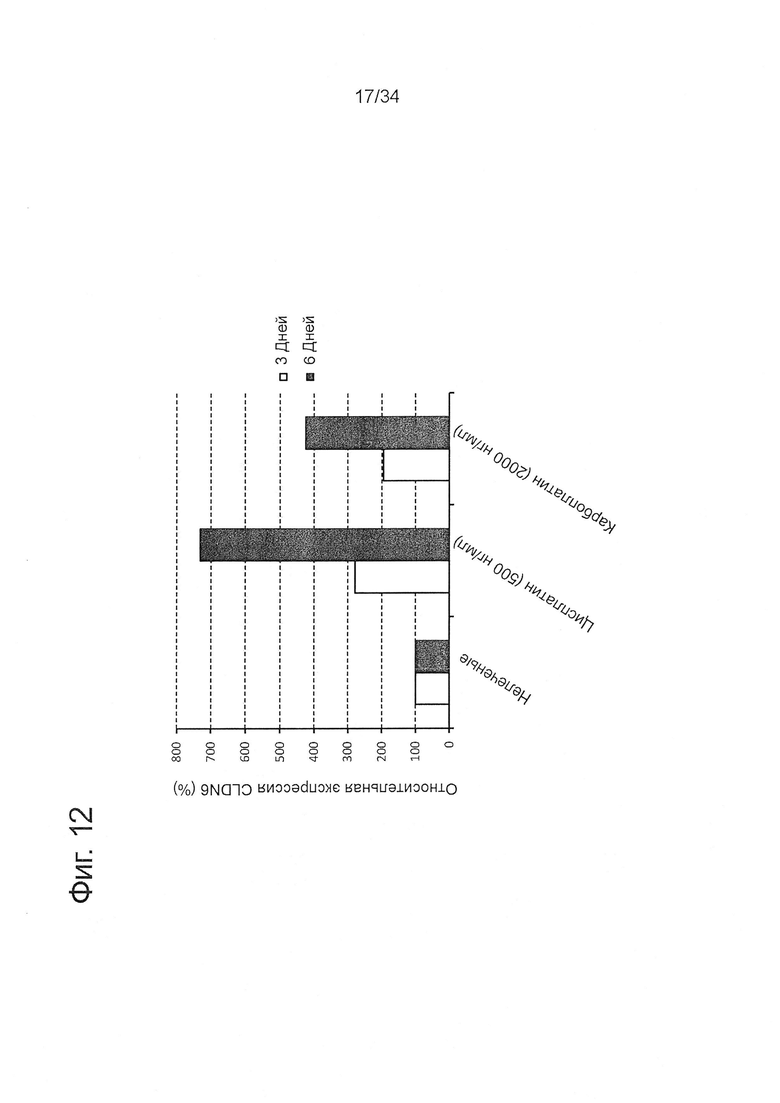
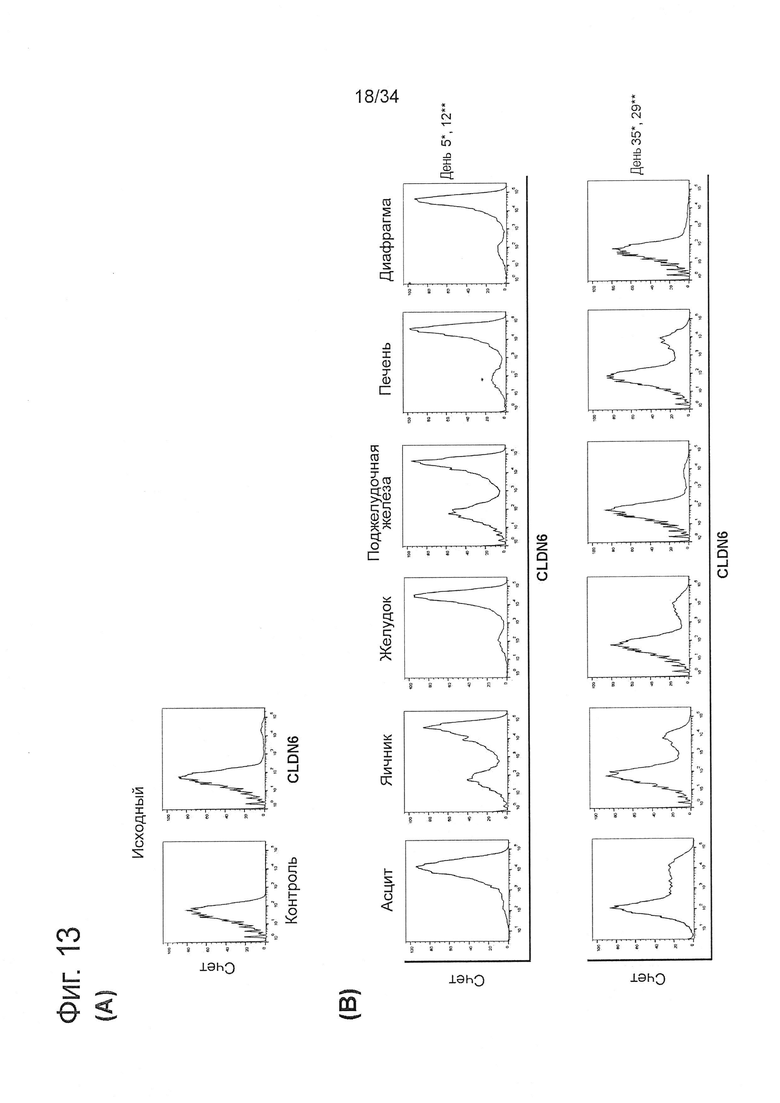
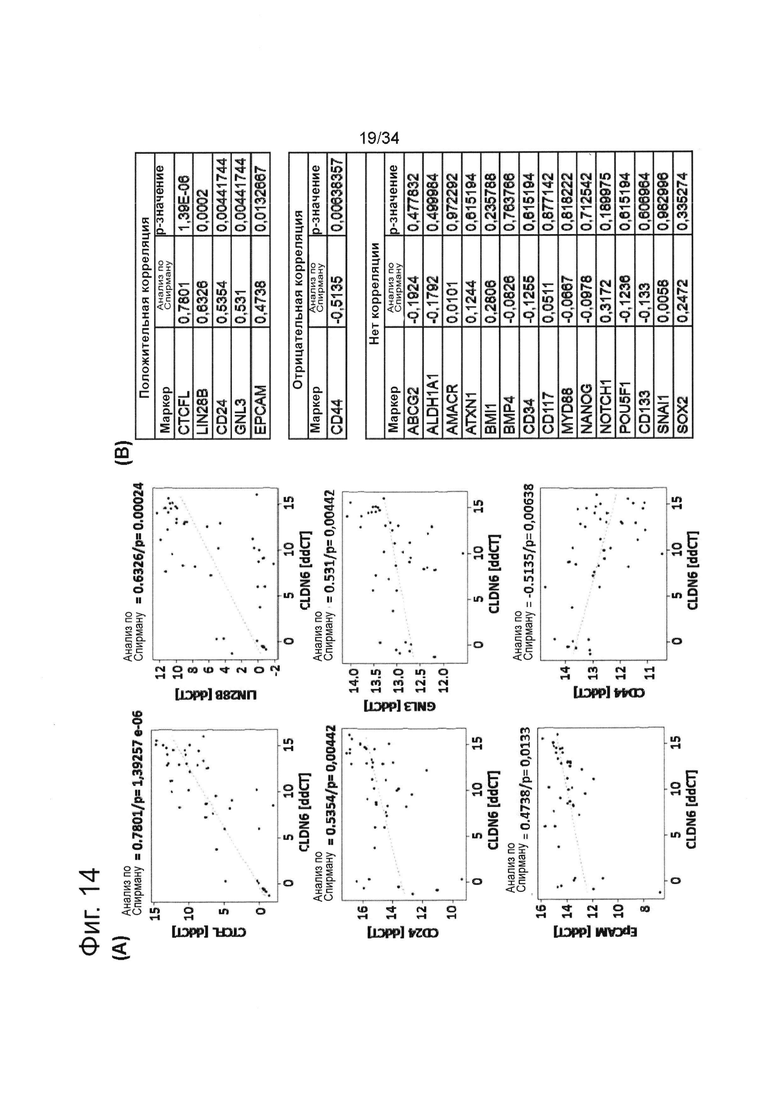
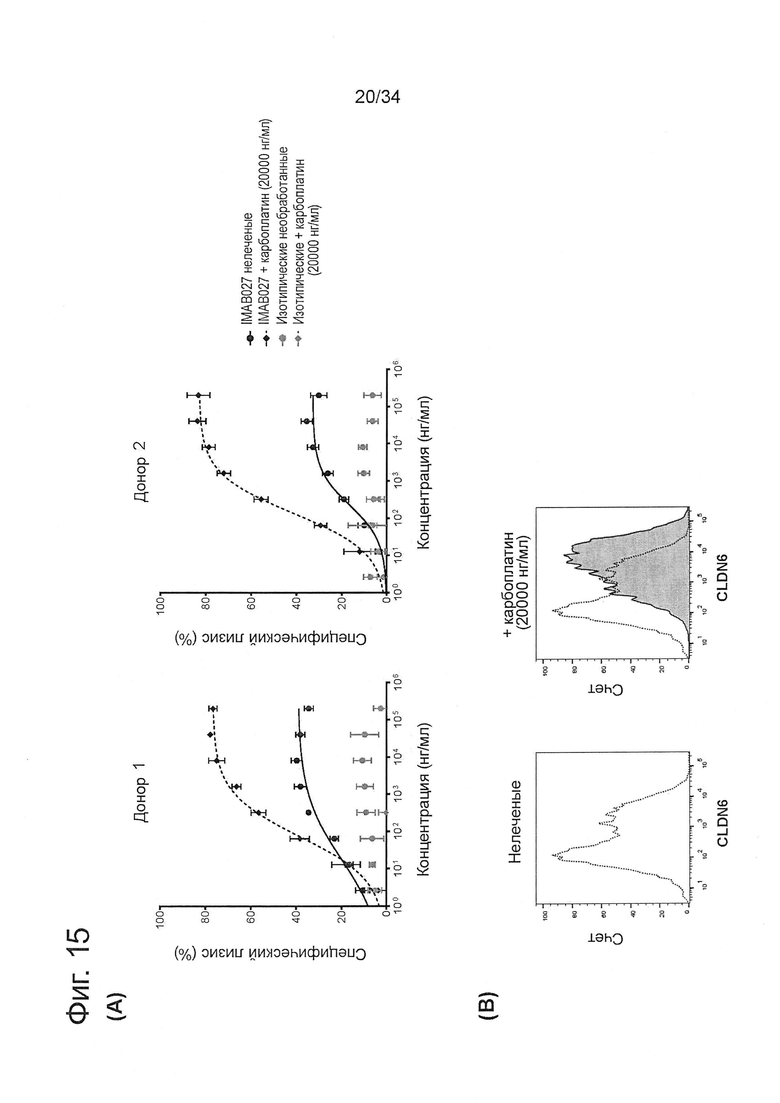
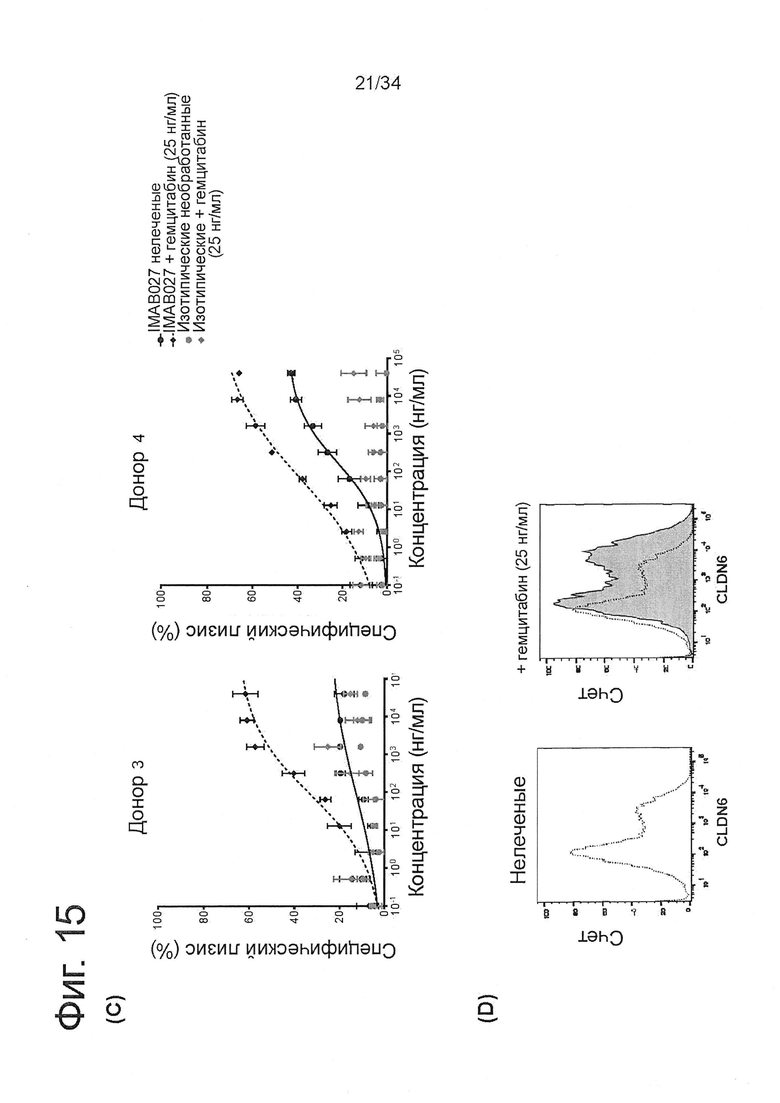
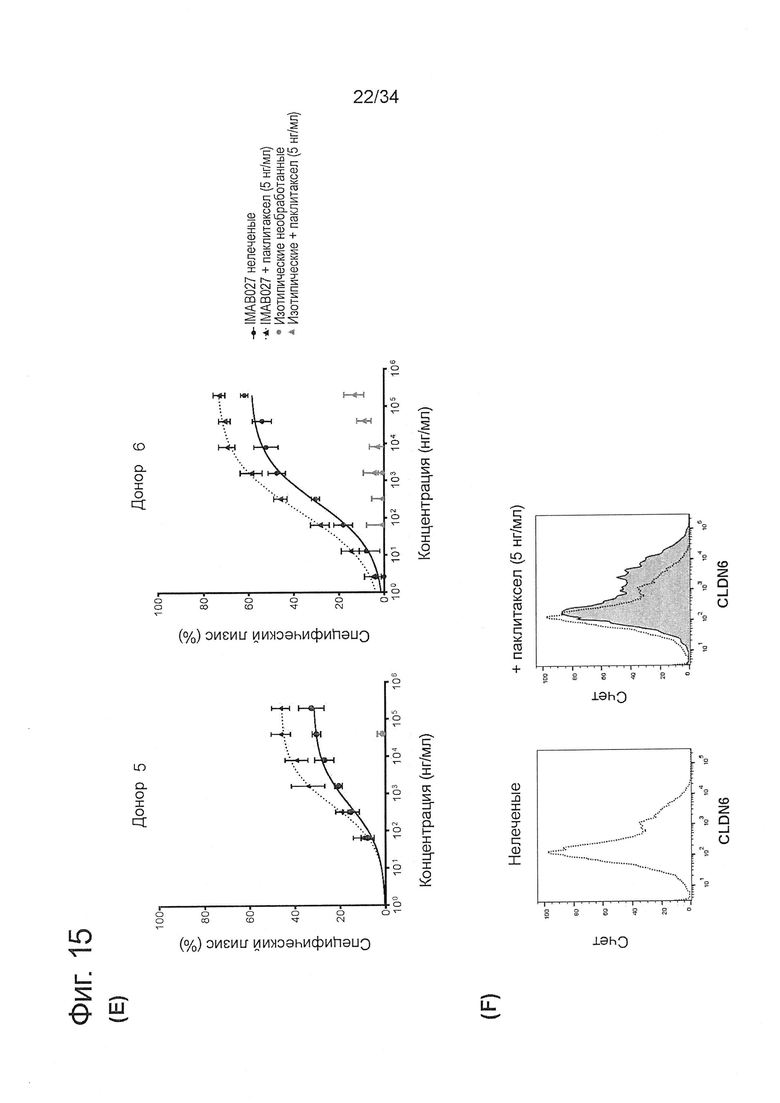
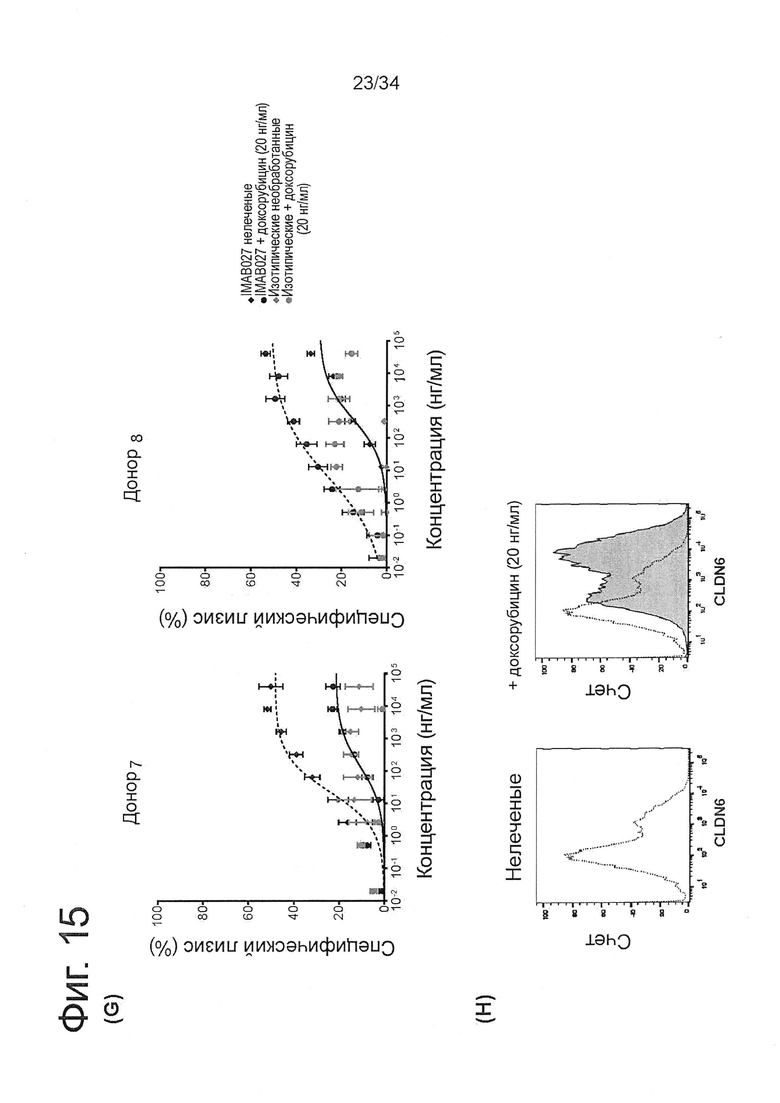
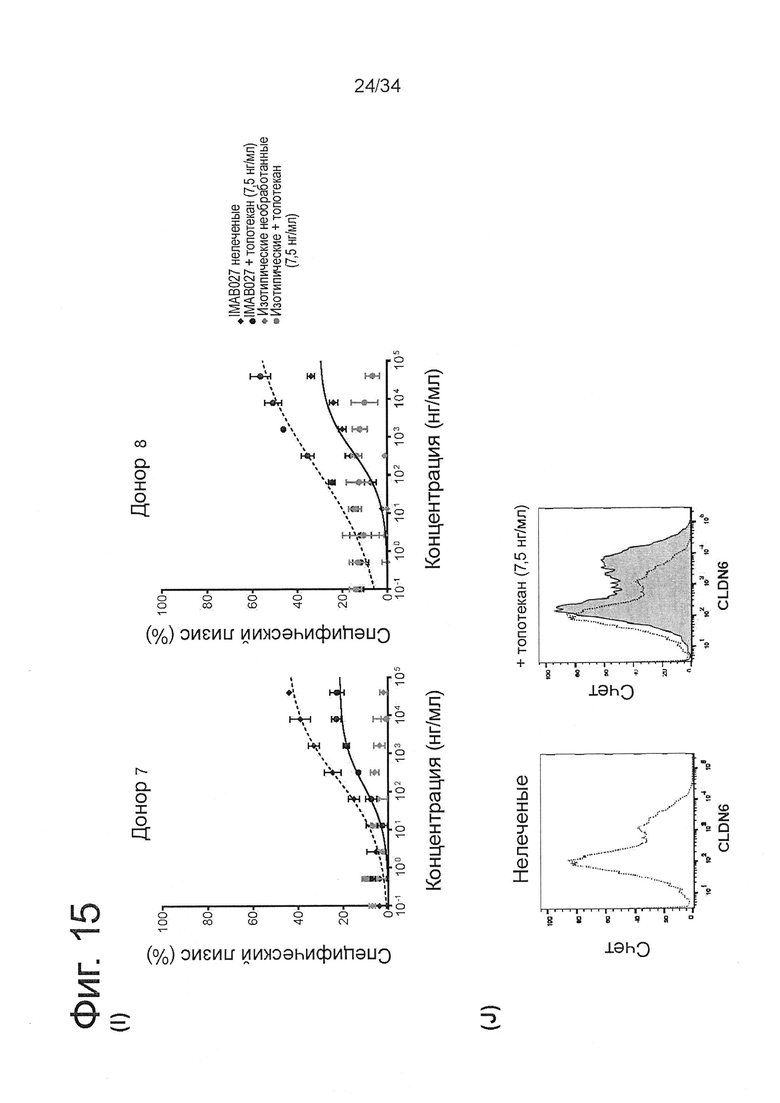
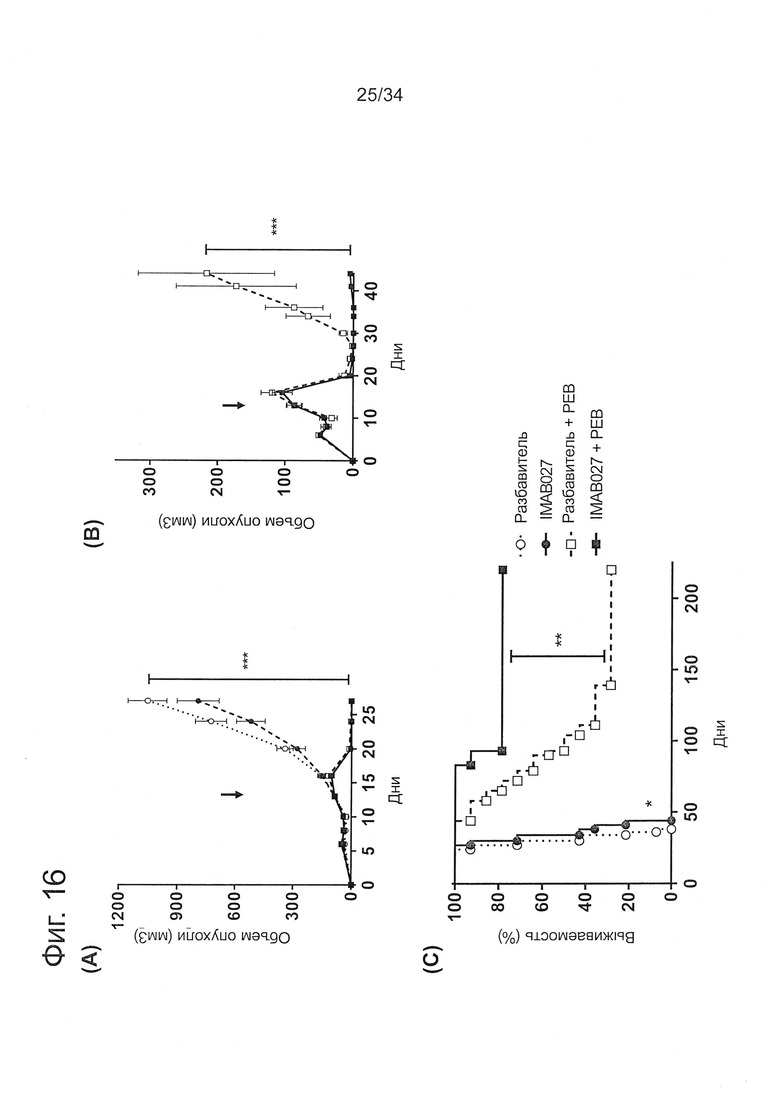
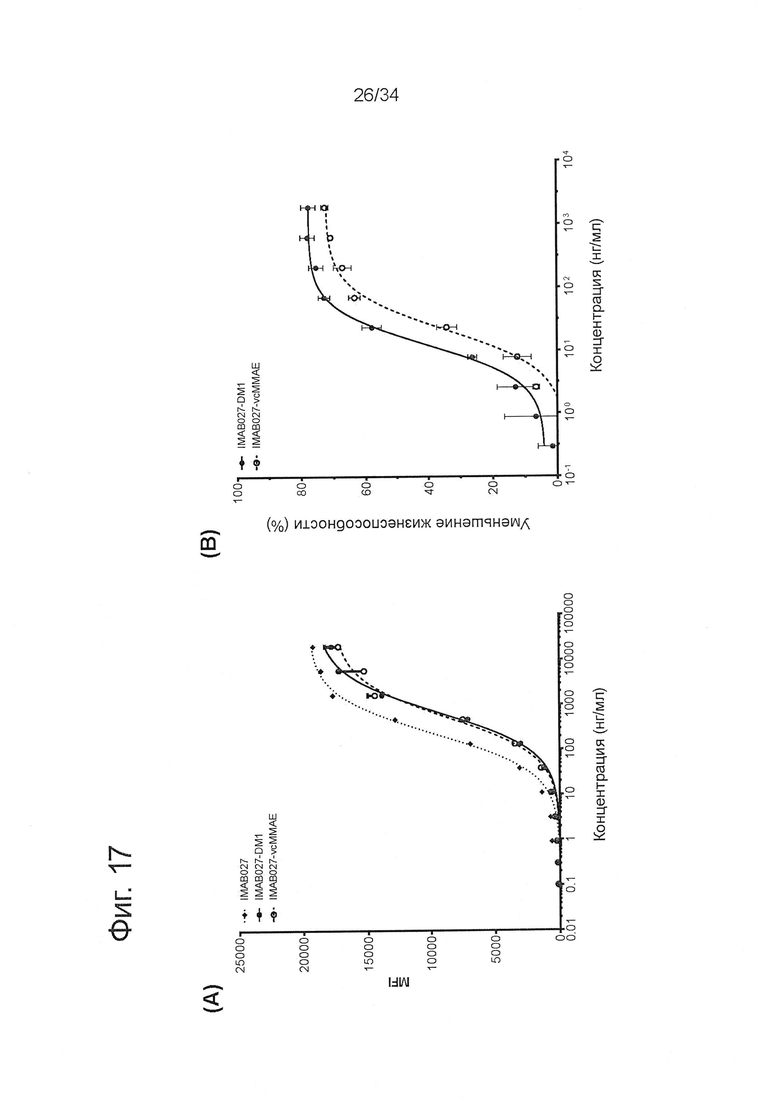
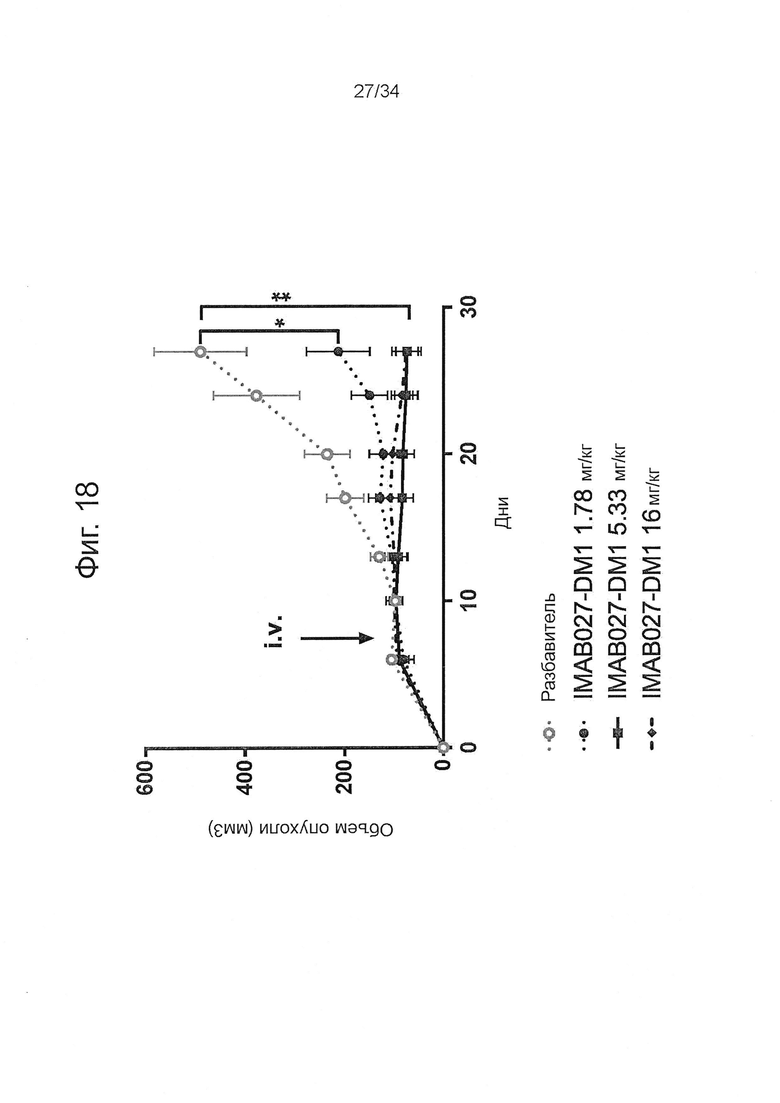
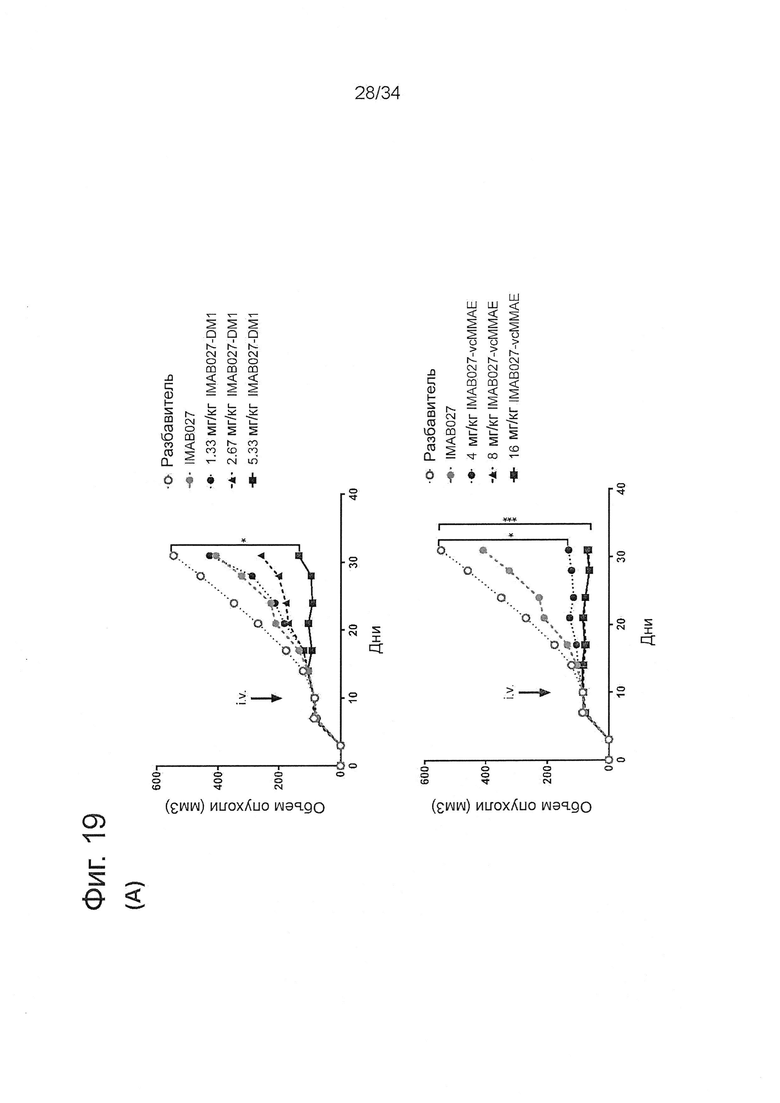
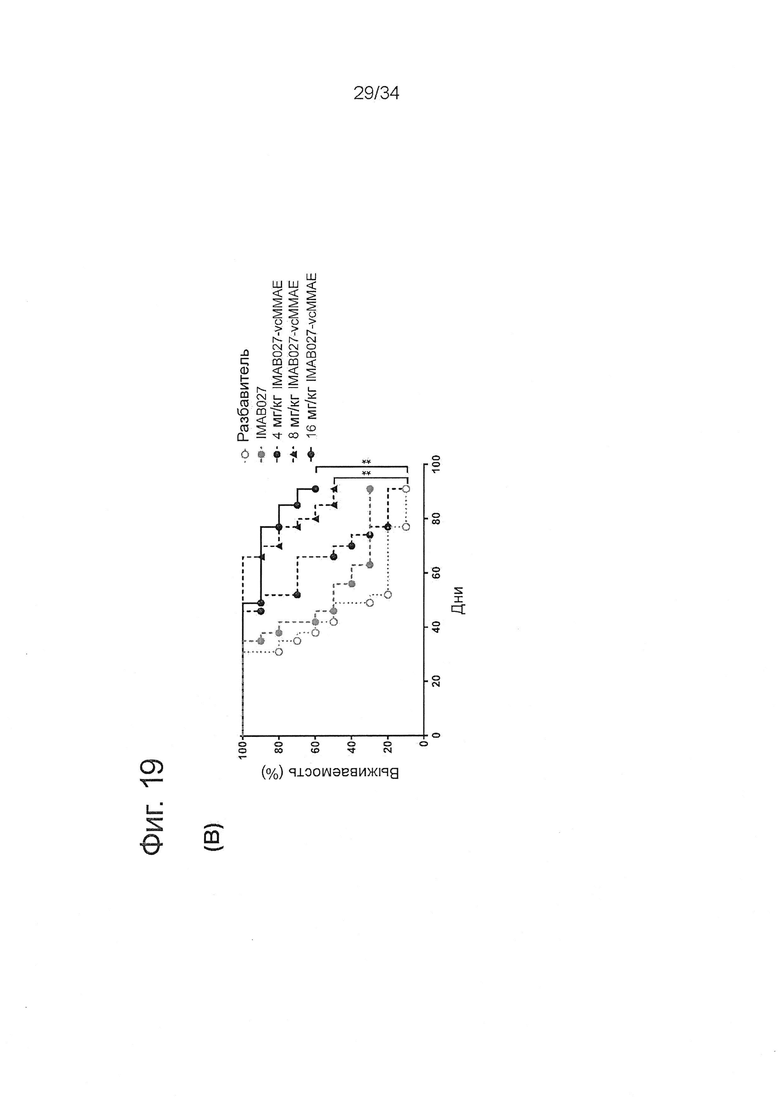
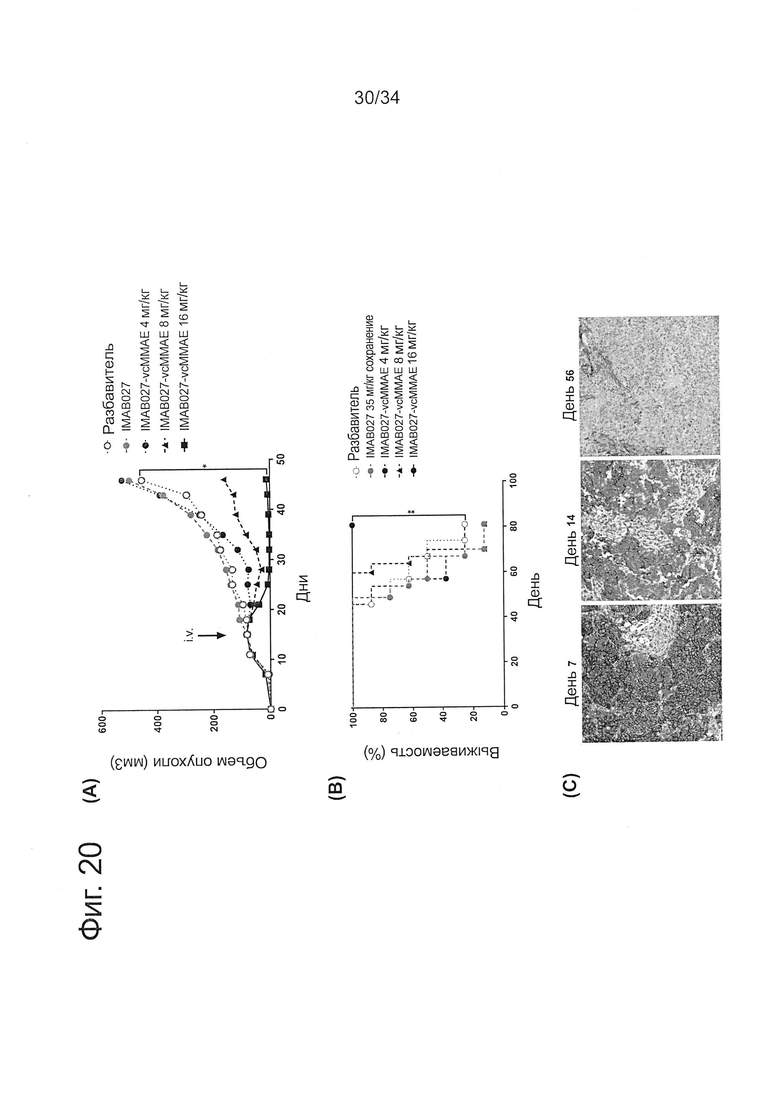
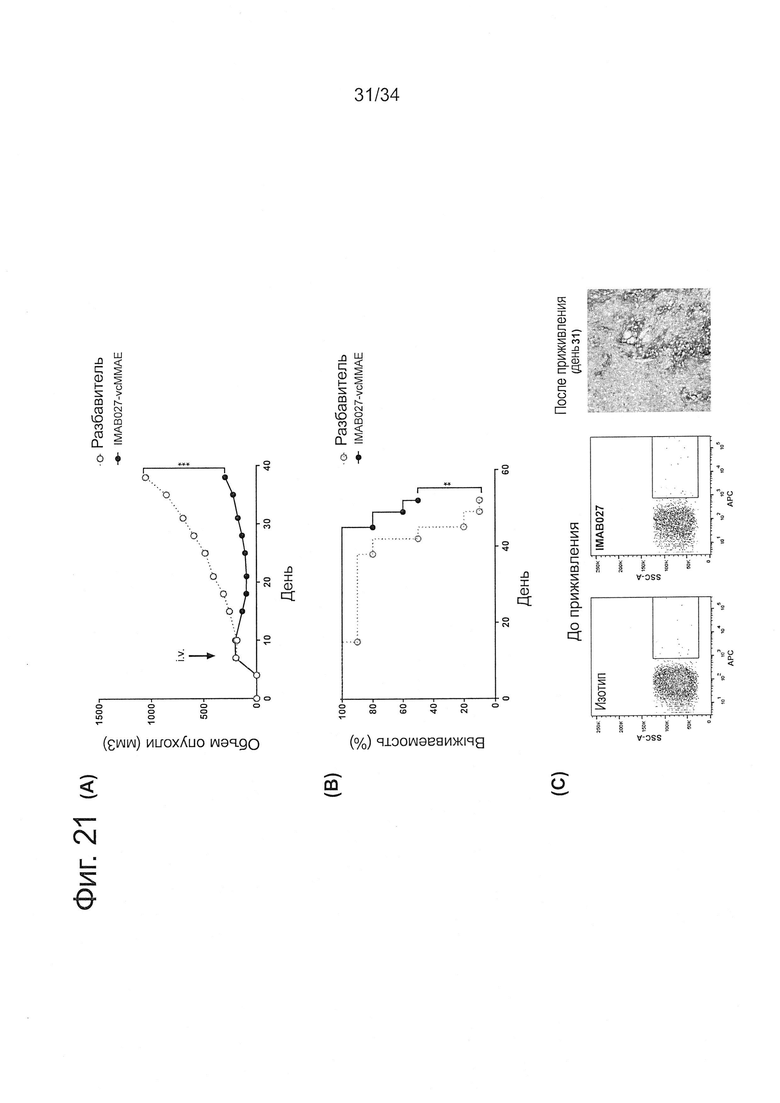
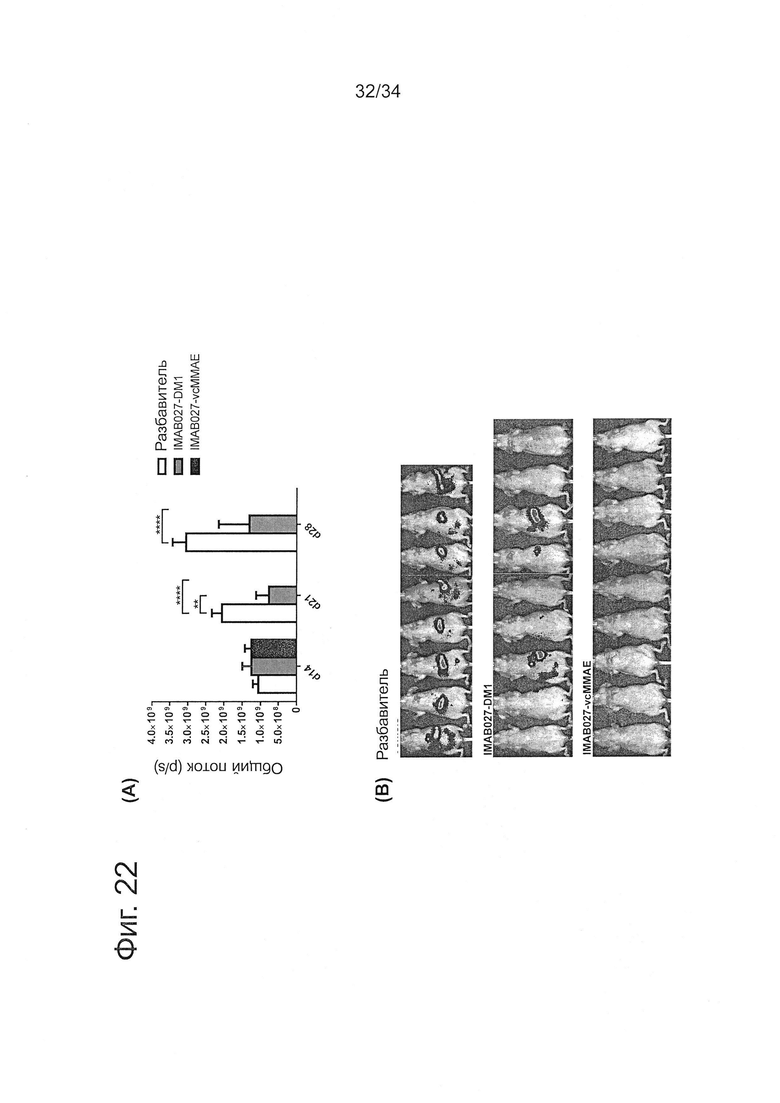
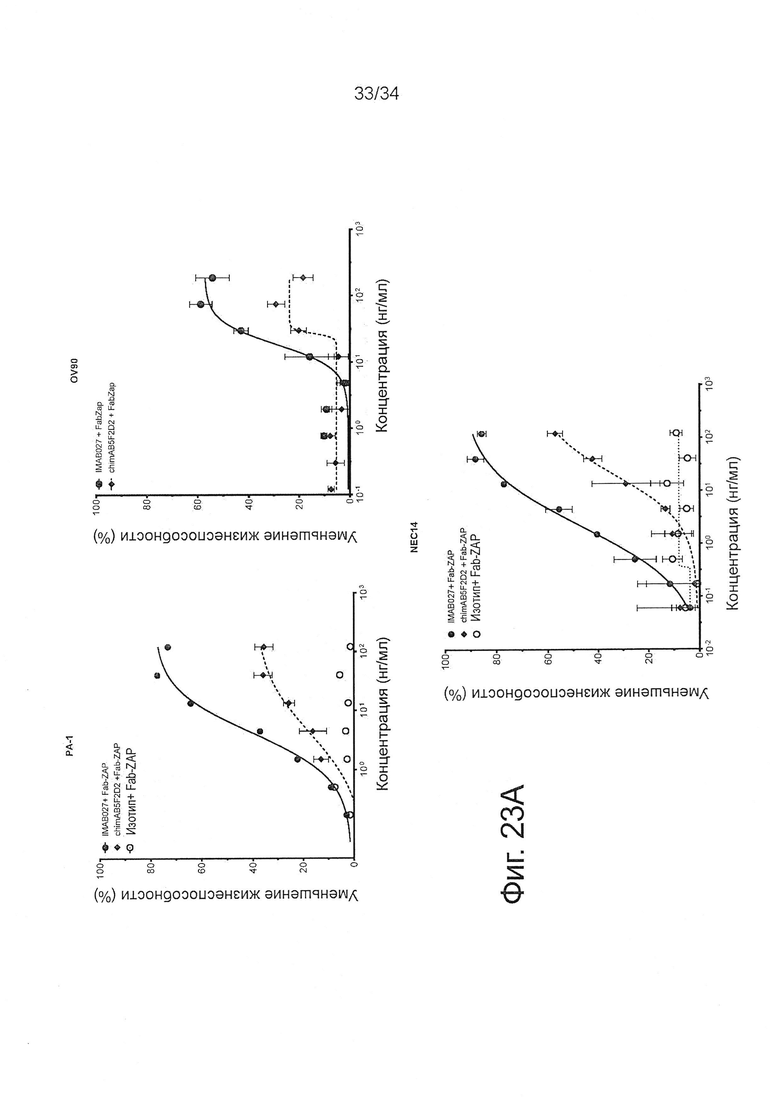
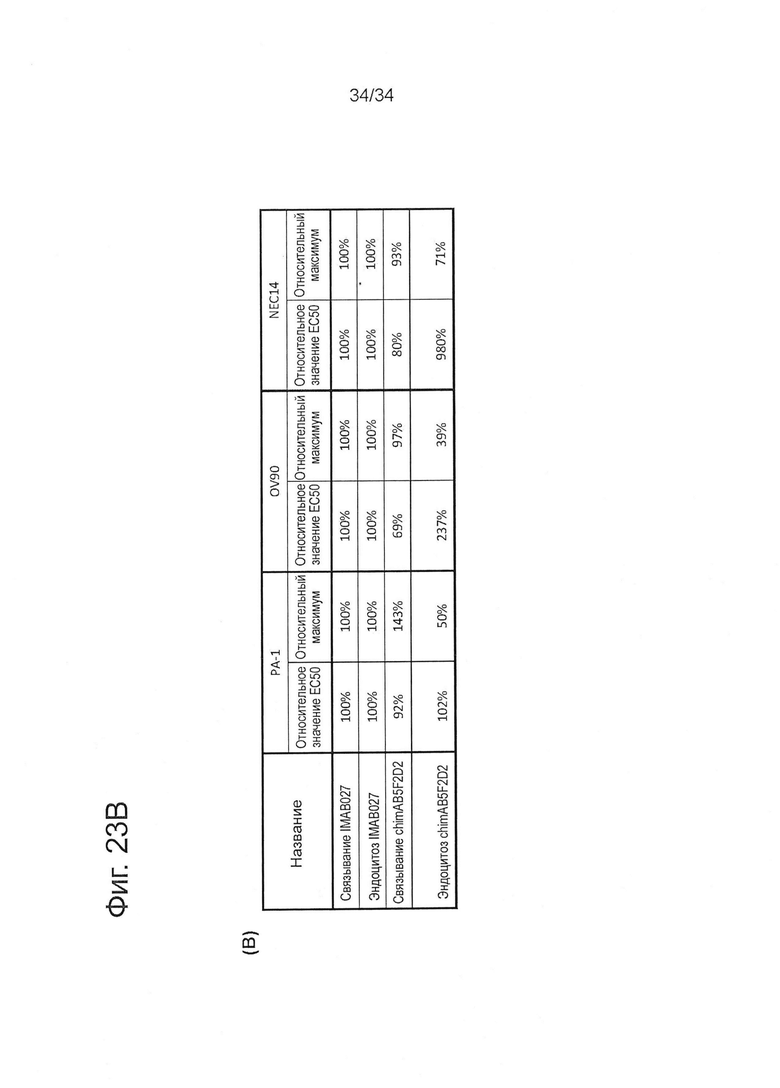
Изобретение относится к области биотехнологии, в частности к способу лечения или предотвращения рака, характеризующегося раковыми клетками, экпрессирующими CLDN6, который включает введение антитела, обладающего способностью связываться с CLDN6, и химиотерапии онкологическому пациенту. Изобретение позволяет эффективно осуществлять лечение или предотвращение рака, характеризующегося раковыми клетками, экпрессирующими CLDN6, за счет синергитического эффекта комбинации химиотерапии и антитела. 16 з.п. ф-лы, 23 ил., 1 табл., 10 пр.
1. Способ лечения или предотвращения рака, характеризующийся раковыми клетками, экпрессирующими CLDN6, который включает введение (i) антитела, обладающего способностью связываться с CLDN6, и (ii) химиотерапии онкологическому пациенту,
где антитело включает вариабельную область тяжелой цепи (VH) антитела, представленную в SEQ ID NO: 5, и вариабельную область легкой цепи (VL) антитела, представленную в SEQ ID NO: 4, и где химиотерапия включает агент, выбранный из группы, состоящей из карбоплатина, гемцитабина, паклитаксела, доксорубицина, топотекана, PEB и цисплатина.
2. Способ по п. 1, согласно которому рак содержит раковые стволовые клетки, экспрессирующие CLDN6.
3. Способ по п. 1, согласно которому введение антитела, обладающего способностью связываться с CLDN6, приводит к ингибированию или уничтожению раковых стволовых клеток, экспрессирующих CLDN6.
4. Способ по п. 1, согласно которому введение антитела, обладающего способностью связываться с CLDN6, усиливает противораковое действие химиотерапии.
5. Способ по п. 4, согласно которому усиление противоракового действия химиотерапии включает увеличение продолжительности жизни онкологического пациента, подвергнутого химиотерапии.
6. Способ по п. 1, согласно которому химиотерапия вводится в дозе, более низкой, чем максимально переносимая доза.
7. Способ по п. 2, согласно которому раковые стволовые клетки находятся в месте расположения опухоли пациента с раком.
8. Способ по п. 1, согласно которому рак является резистентным к химиотерапии, в частности, если вводится в виде монотерапии.
9. Способ по п. 1, согласно которому антитело, обладающее способностью связываться с CLDN6, оказывает ингибирующее и/или цитотоксическое действие на раковые стволовые клетки.
10. Способ по п. 1, согласно которому антитело, обладающее способностью связываться с CLDN6, оказывает ингибирующее и/или цитотоксическое действие на раковые стволовые клетки путем опосредования одного или более из числа лизиса, опосредованного комплементзависимой цитотоксичностью (CDC), лизиса, опосредованного антителозависимой клеточноопосредованной цитотоксичностью (ADCC), индукции апоптоза и ингибирования пролиферации.
11. Способ по п. 1, согласно которому антитело, обладающее способностью связываться с CLDN6, соединено с терапевтической молекулой.
12. Способ по п. 11, согласно которому терапевтическая молекула является цитотоксическим средством, химиотерапевтическим средством или радиоактивным веществом.
13. Способ по п. 11, согласно которому терапевтическая молекула действует на медленно растущие клетки.
14. Способ по п. 1, согласно которому антитело, обладающее способностью связываться с CLDN6, связывается с первой внеклеточной петлей CLDN6.
15. Способ по п. 1, согласно которому антитело, обладающее способностью связываться с CLDN6, содержит вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность, представленную SEQ ID NO: 5, и вариабельную область легкой цепи (VL), включающую аминокислотную последовательность, представленную SEQ ID NO: 4.
16. Способ по п. 1, согласно которому CLDN6 имеет аминокислотную последовательность в соответствии с SEQ ID NO: 1 или SEQ ID NO: 2.
17. Способ по п. 1, согласно которому рак включает первичный рак, прогрессирующий рак, метастатический рак, рецидив рака или их сочетание.
| WO 2011057788 A1, 19.05.2011 | |||
| US 2011044894 A1, 24.02.2011 | |||
| WO 2012156018 A1, 22.11.2012 | |||
| Способ газовой цементации стальных изделий | 1944 |
|
SU67018A1 |
| RU 2010133547 A, 20.02.2012. | |||
Авторы
Даты
2021-06-17—Публикация
2014-07-30—Подача